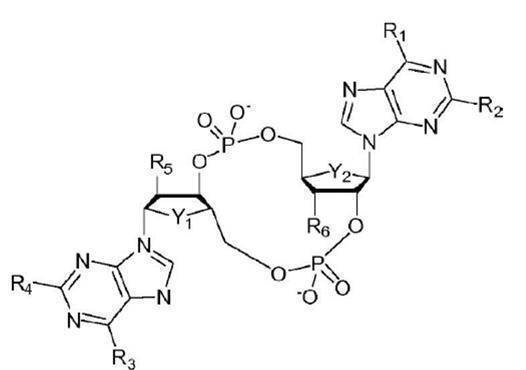
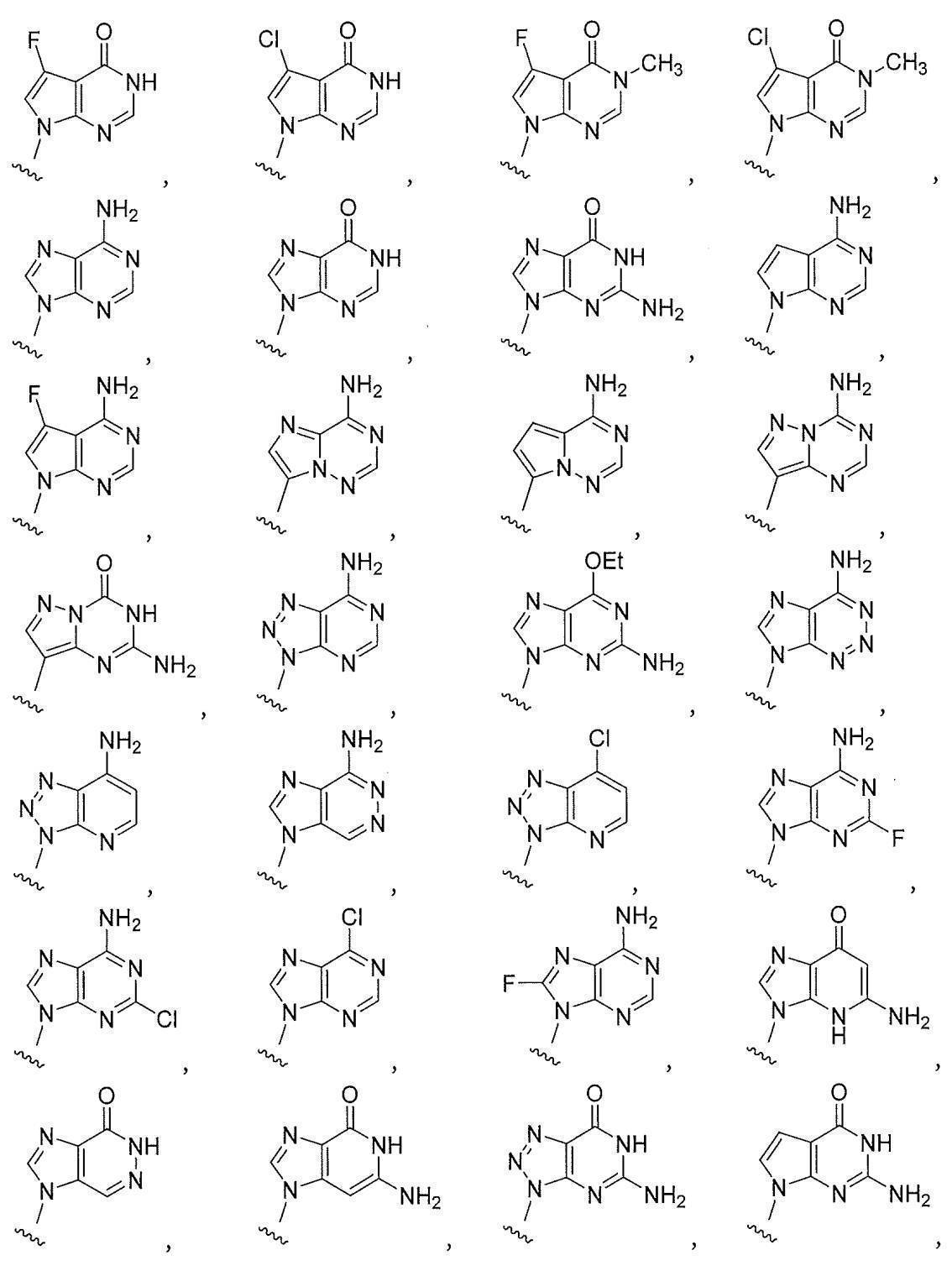
JP7229907B2 - STING (stimulator of interferon genes)アゴニストとしての環状ジヌクレオチド - Google Patents
STING (stimulator of interferon genes)アゴニストとしての環状ジヌクレオチド Download PDFInfo
- Publication number
- JP7229907B2 JP7229907B2 JP2019223919A JP2019223919A JP7229907B2 JP 7229907 B2 JP7229907 B2 JP 7229907B2 JP 2019223919 A JP2019223919 A JP 2019223919A JP 2019223919 A JP2019223919 A JP 2019223919A JP 7229907 B2 JP7229907 B2 JP 7229907B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- compound
- optionally substituted
- pharmaceutically acceptable
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 101000643024 Homo sapiens Stimulator of interferon genes protein Proteins 0.000 title description 26
- 102100035533 Stimulator of interferon genes protein Human genes 0.000 title description 26
- 125000004122 cyclic group Chemical group 0.000 title description 20
- 239000000556 agonist Substances 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims description 433
- 229910052757 nitrogen Inorganic materials 0.000 claims description 307
- -1 thiocarbamoyl group Chemical group 0.000 claims description 283
- 150000003839 salts Chemical class 0.000 claims description 257
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 167
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 104
- 229910052799 carbon Inorganic materials 0.000 claims description 87
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 86
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 83
- 238000012377 drug delivery Methods 0.000 claims description 81
- 125000005843 halogen group Chemical group 0.000 claims description 80
- 229910052717 sulfur Inorganic materials 0.000 claims description 77
- 125000004434 sulfur atom Chemical group 0.000 claims description 77
- 229940124447 delivery agent Drugs 0.000 claims description 71
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims description 68
- 125000003277 amino group Chemical group 0.000 claims description 67
- 206010028980 Neoplasm Diseases 0.000 claims description 66
- 125000001153 fluoro group Chemical group F* 0.000 claims description 61
- 229910052731 fluorine Inorganic materials 0.000 claims description 60
- 201000011510 cancer Diseases 0.000 claims description 52
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 36
- 229910052739 hydrogen Inorganic materials 0.000 claims description 33
- 239000001257 hydrogen Substances 0.000 claims description 33
- 125000000217 alkyl group Chemical group 0.000 claims description 31
- 150000002632 lipids Chemical class 0.000 claims description 27
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 24
- 229910052760 oxygen Inorganic materials 0.000 claims description 23
- 239000001301 oxygen Substances 0.000 claims description 23
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 claims description 20
- 102000004169 proteins and genes Human genes 0.000 claims description 20
- 108090000623 proteins and genes Proteins 0.000 claims description 20
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 19
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 17
- 125000000623 heterocyclic group Chemical group 0.000 claims description 17
- 229920001223 polyethylene glycol Polymers 0.000 claims description 16
- 239000000816 peptidomimetic Substances 0.000 claims description 15
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims description 14
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 14
- 150000002431 hydrogen Chemical class 0.000 claims description 14
- 125000006700 (C1-C6) alkylthio group Chemical group 0.000 claims description 13
- 239000002202 Polyethylene glycol Substances 0.000 claims description 13
- 125000002252 acyl group Chemical group 0.000 claims description 13
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 12
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 claims description 11
- 229940088594 vitamin Drugs 0.000 claims description 11
- 229930003231 vitamin Natural products 0.000 claims description 11
- 235000013343 vitamin Nutrition 0.000 claims description 11
- 239000011782 vitamin Substances 0.000 claims description 11
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 10
- 229920000768 polyamine Polymers 0.000 claims description 10
- 125000003396 thiol group Chemical group [H]S* 0.000 claims description 10
- 125000003545 alkoxy group Chemical group 0.000 claims description 9
- 150000001720 carbohydrates Chemical class 0.000 claims description 9
- 150000001721 carbon Chemical group 0.000 claims description 9
- 125000001475 halogen functional group Chemical group 0.000 claims description 9
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 9
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 8
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 8
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 7
- 239000008194 pharmaceutical composition Substances 0.000 claims description 7
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 claims description 7
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 6
- 150000003431 steroids Chemical class 0.000 claims description 6
- 150000003722 vitamin derivatives Chemical class 0.000 claims description 3
- 125000001183 hydrocarbyl group Chemical group 0.000 claims 4
- 229910052727 yttrium Inorganic materials 0.000 description 143
- 125000001424 substituent group Chemical group 0.000 description 66
- 239000003814 drug Substances 0.000 description 64
- 230000036961 partial effect Effects 0.000 description 56
- 238000000034 method Methods 0.000 description 48
- 102000004196 processed proteins & peptides Human genes 0.000 description 47
- 239000000427 antigen Substances 0.000 description 45
- 108091007433 antigens Proteins 0.000 description 45
- 102000036639 antigens Human genes 0.000 description 45
- 239000003112 inhibitor Substances 0.000 description 42
- 239000000203 mixture Substances 0.000 description 41
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 39
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 39
- 235000001014 amino acid Nutrition 0.000 description 39
- 229940079593 drug Drugs 0.000 description 39
- 229940024606 amino acid Drugs 0.000 description 38
- 150000001413 amino acids Chemical class 0.000 description 38
- 238000006243 chemical reaction Methods 0.000 description 38
- 239000003795 chemical substances by application Substances 0.000 description 38
- 125000005647 linker group Chemical group 0.000 description 33
- 125000006239 protecting group Chemical group 0.000 description 33
- 239000003153 chemical reaction reagent Substances 0.000 description 32
- 210000004027 cell Anatomy 0.000 description 31
- 239000012634 fragment Substances 0.000 description 31
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 24
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 22
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 22
- 235000018102 proteins Nutrition 0.000 description 19
- 239000000243 solution Substances 0.000 description 19
- 239000000126 substance Substances 0.000 description 19
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 18
- 239000002585 base Substances 0.000 description 17
- 239000002904 solvent Substances 0.000 description 17
- 238000009472 formulation Methods 0.000 description 16
- 230000008685 targeting Effects 0.000 description 16
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 15
- IYMAXBFPHPZYIK-BQBZGAKWSA-N Arg-Gly-Asp Chemical class NC(N)=NCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IYMAXBFPHPZYIK-BQBZGAKWSA-N 0.000 description 15
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 15
- 239000002253 acid Substances 0.000 description 15
- 239000000562 conjugate Substances 0.000 description 15
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 15
- 102000005962 receptors Human genes 0.000 description 15
- 108020003175 receptors Proteins 0.000 description 15
- 230000002829 reductive effect Effects 0.000 description 15
- 108060003951 Immunoglobulin Proteins 0.000 description 14
- 102000018358 immunoglobulin Human genes 0.000 description 14
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 13
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 13
- 235000019439 ethyl acetate Nutrition 0.000 description 13
- 125000004916 (C1-C6) alkylcarbonyl group Chemical group 0.000 description 12
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 description 12
- 108091006905 Human Serum Albumin Proteins 0.000 description 12
- 102000008100 Human Serum Albumin Human genes 0.000 description 12
- 229940044665 STING agonist Drugs 0.000 description 12
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- 239000011541 reaction mixture Substances 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 11
- 125000005915 C6-C14 aryl group Chemical group 0.000 description 11
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 11
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 11
- 238000005481 NMR spectroscopy Methods 0.000 description 11
- 229940126864 fibroblast growth factor Drugs 0.000 description 11
- 229920001184 polypeptide Polymers 0.000 description 11
- 238000010898 silica gel chromatography Methods 0.000 description 11
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 10
- 125000005974 C6-C14 arylcarbonyl group Chemical group 0.000 description 10
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 10
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 10
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 10
- 125000003710 aryl alkyl group Chemical group 0.000 description 10
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 10
- 230000000694 effects Effects 0.000 description 10
- 150000002148 esters Chemical class 0.000 description 10
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 10
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 10
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 125000005115 alkyl carbamoyl group Chemical group 0.000 description 9
- 229940049595 antibody-drug conjugate Drugs 0.000 description 9
- 238000003776 cleavage reaction Methods 0.000 description 9
- 239000013078 crystal Substances 0.000 description 9
- 230000000021 endosomolytic effect Effects 0.000 description 9
- 125000000524 functional group Chemical group 0.000 description 9
- 150000002430 hydrocarbons Chemical group 0.000 description 9
- 150000007530 organic bases Chemical class 0.000 description 9
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 9
- 230000007017 scission Effects 0.000 description 9
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 8
- XLYOFNOQVPJJNP-ZSJDYOACSA-N Heavy water Chemical compound [2H]O[2H] XLYOFNOQVPJJNP-ZSJDYOACSA-N 0.000 description 8
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 235000014633 carbohydrates Nutrition 0.000 description 8
- 230000010261 cell growth Effects 0.000 description 8
- 201000010099 disease Diseases 0.000 description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 8
- 229940124597 therapeutic agent Drugs 0.000 description 8
- 108091023037 Aptamer Proteins 0.000 description 7
- 206010009944 Colon cancer Diseases 0.000 description 7
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- 206010025323 Lymphomas Diseases 0.000 description 7
- 241000124008 Mammalia Species 0.000 description 7
- 108091005804 Peptidases Proteins 0.000 description 7
- 108091022873 acetoacetate decarboxylase Proteins 0.000 description 7
- 150000001298 alcohols Chemical class 0.000 description 7
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 description 7
- 239000012300 argon atmosphere Substances 0.000 description 7
- 125000005099 aryl alkyl carbonyl group Chemical group 0.000 description 7
- 239000003054 catalyst Substances 0.000 description 7
- 208000029742 colonic neoplasm Diseases 0.000 description 7
- 238000005886 esterification reaction Methods 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 230000003287 optical effect Effects 0.000 description 7
- 125000006850 spacer group Chemical group 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 210000001519 tissue Anatomy 0.000 description 7
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 6
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical group NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 6
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 102000035195 Peptidases Human genes 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 229920002472 Starch Polymers 0.000 description 6
- 230000002378 acidificating effect Effects 0.000 description 6
- 150000007513 acids Chemical class 0.000 description 6
- 230000003213 activating effect Effects 0.000 description 6
- 239000012190 activator Substances 0.000 description 6
- 150000001350 alkyl halides Chemical class 0.000 description 6
- 230000000735 allogeneic effect Effects 0.000 description 6
- 239000011230 binding agent Substances 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 6
- 239000003102 growth factor Substances 0.000 description 6
- 150000007529 inorganic bases Chemical class 0.000 description 6
- 150000007522 mineralic acids Chemical class 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 229940002612 prodrug Drugs 0.000 description 6
- 239000000651 prodrug Substances 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 239000008107 starch Substances 0.000 description 6
- 235000019698 starch Nutrition 0.000 description 6
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 description 5
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 5
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 5
- 208000023275 Autoimmune disease Diseases 0.000 description 5
- 239000004215 Carbon black (E152) Substances 0.000 description 5
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 5
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- 108090000371 Esterases Proteins 0.000 description 5
- 102000015779 HDL Lipoproteins Human genes 0.000 description 5
- 108010010234 HDL Lipoproteins Proteins 0.000 description 5
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 5
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 5
- 102000007330 LDL Lipoproteins Human genes 0.000 description 5
- 108010007622 LDL Lipoproteins Proteins 0.000 description 5
- 239000002841 Lewis acid Substances 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 108091034117 Oligonucleotide Proteins 0.000 description 5
- 102000013275 Somatomedins Human genes 0.000 description 5
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 5
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 5
- 230000009471 action Effects 0.000 description 5
- 230000000259 anti-tumor effect Effects 0.000 description 5
- 239000002246 antineoplastic agent Substances 0.000 description 5
- 229960002685 biotin Drugs 0.000 description 5
- 235000020958 biotin Nutrition 0.000 description 5
- 239000011616 biotin Substances 0.000 description 5
- 125000002091 cationic group Chemical group 0.000 description 5
- 239000007884 disintegrant Substances 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 230000032050 esterification Effects 0.000 description 5
- 235000019253 formic acid Nutrition 0.000 description 5
- 229930195733 hydrocarbon Natural products 0.000 description 5
- 230000002209 hydrophobic effect Effects 0.000 description 5
- 210000003734 kidney Anatomy 0.000 description 5
- 150000007517 lewis acids Chemical class 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 229910052751 metal Inorganic materials 0.000 description 5
- 239000002184 metal Substances 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 150000007524 organic acids Chemical class 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 102000040430 polynucleotide Human genes 0.000 description 5
- 108091033319 polynucleotide Proteins 0.000 description 5
- 239000002157 polynucleotide Substances 0.000 description 5
- 150000003254 radicals Chemical class 0.000 description 5
- 235000017557 sodium bicarbonate Nutrition 0.000 description 5
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- 125000006717 (C3-C10) cycloalkenyl group Chemical group 0.000 description 4
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 4
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Chemical compound C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 4
- HZNVUJQVZSTENZ-UHFFFAOYSA-N 2,3-dichloro-5,6-dicyano-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(C#N)=C(C#N)C1=O HZNVUJQVZSTENZ-UHFFFAOYSA-N 0.000 description 4
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 4
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 4
- 244000215068 Acacia senegal Species 0.000 description 4
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 4
- 102000003951 Erythropoietin Human genes 0.000 description 4
- 108090000394 Erythropoietin Proteins 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- 229920000084 Gum arabic Polymers 0.000 description 4
- 102000004877 Insulin Human genes 0.000 description 4
- 108090001061 Insulin Proteins 0.000 description 4
- 108010032038 Interferon Regulatory Factor-3 Proteins 0.000 description 4
- 102100029843 Interferon regulatory factor 3 Human genes 0.000 description 4
- 102000014150 Interferons Human genes 0.000 description 4
- 108010050904 Interferons Proteins 0.000 description 4
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 4
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 108010039918 Polylysine Proteins 0.000 description 4
- 102100038192 Serine/threonine-protein kinase TBK1 Human genes 0.000 description 4
- 101710106944 Serine/threonine-protein kinase TBK1 Proteins 0.000 description 4
- 235000010489 acacia gum Nutrition 0.000 description 4
- 239000000205 acacia gum Substances 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 239000002671 adjuvant Substances 0.000 description 4
- 229940100198 alkylating agent Drugs 0.000 description 4
- 239000002168 alkylating agent Substances 0.000 description 4
- 150000001408 amides Chemical class 0.000 description 4
- 230000000890 antigenic effect Effects 0.000 description 4
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 4
- 125000005708 carbonyloxy group Chemical group [*:2]OC([*:1])=O 0.000 description 4
- 229960002173 citrulline Drugs 0.000 description 4
- 239000008367 deionised water Substances 0.000 description 4
- 229910021641 deionized water Inorganic materials 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- 229940105423 erythropoietin Drugs 0.000 description 4
- 235000019152 folic acid Nutrition 0.000 description 4
- 239000011724 folic acid Substances 0.000 description 4
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 4
- 229930182830 galactose Natural products 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 230000001900 immune effect Effects 0.000 description 4
- 239000003999 initiator Substances 0.000 description 4
- 229940125396 insulin Drugs 0.000 description 4
- 229940079322 interferon Drugs 0.000 description 4
- 229910052740 iodine Inorganic materials 0.000 description 4
- 239000011630 iodine Substances 0.000 description 4
- 239000008101 lactose Substances 0.000 description 4
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 238000010172 mouse model Methods 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 150000007523 nucleic acids Chemical class 0.000 description 4
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical class ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 4
- 229920000656 polylysine Polymers 0.000 description 4
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 4
- 229920000053 polysorbate 80 Polymers 0.000 description 4
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 235000019833 protease Nutrition 0.000 description 4
- LEHBURLTIWGHEM-UHFFFAOYSA-N pyridinium chlorochromate Chemical compound [O-][Cr](Cl)(=O)=O.C1=CC=[NH+]C=C1 LEHBURLTIWGHEM-UHFFFAOYSA-N 0.000 description 4
- 238000006722 reduction reaction Methods 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 4
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 4
- 229960005486 vaccine Drugs 0.000 description 4
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 description 3
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 3
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 3
- GONFBOIJNUKKST-UHFFFAOYSA-N 5-ethylsulfanyl-2h-tetrazole Chemical compound CCSC=1N=NNN=1 GONFBOIJNUKKST-UHFFFAOYSA-N 0.000 description 3
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 3
- 239000005695 Ammonium acetate Substances 0.000 description 3
- 239000004475 Arginine Substances 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 102000004506 Blood Proteins Human genes 0.000 description 3
- 108010017384 Blood Proteins Proteins 0.000 description 3
- 206010006187 Breast cancer Diseases 0.000 description 3
- 208000026310 Breast neoplasm Diseases 0.000 description 3
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 3
- QGJOPFRUJISHPQ-UHFFFAOYSA-N Carbon disulfide Chemical compound S=C=S QGJOPFRUJISHPQ-UHFFFAOYSA-N 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 3
- 108010016626 Dipeptides Proteins 0.000 description 3
- 102400001368 Epidermal growth factor Human genes 0.000 description 3
- 101800003838 Epidermal growth factor Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 3
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 3
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 3
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 3
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 3
- 108090001090 Lectins Proteins 0.000 description 3
- 102000004856 Lectins Human genes 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- UEZVMMHDMIWARA-UHFFFAOYSA-N Metaphosphoric acid Chemical compound OP(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-N 0.000 description 3
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 3
- 108010025020 Nerve Growth Factor Proteins 0.000 description 3
- 102000015336 Nerve Growth Factor Human genes 0.000 description 3
- 108010077850 Nuclear Localization Signals Proteins 0.000 description 3
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 3
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 3
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 3
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 3
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 206010060862 Prostate cancer Diseases 0.000 description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 3
- 239000004365 Protease Substances 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 101100434411 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) ADH1 gene Proteins 0.000 description 3
- 206010039491 Sarcoma Diseases 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 3
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 3
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 3
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 3
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 3
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 3
- 150000008065 acid anhydrides Chemical class 0.000 description 3
- 101150102866 adc1 gene Proteins 0.000 description 3
- 230000001270 agonistic effect Effects 0.000 description 3
- 150000004703 alkoxides Chemical class 0.000 description 3
- 230000029936 alkylation Effects 0.000 description 3
- 238000005804 alkylation reaction Methods 0.000 description 3
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 3
- 238000007112 amidation reaction Methods 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 235000019257 ammonium acetate Nutrition 0.000 description 3
- 229940043376 ammonium acetate Drugs 0.000 description 3
- 125000000129 anionic group Chemical group 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 230000001093 anti-cancer Effects 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 3
- 125000005116 aryl carbamoyl group Chemical group 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 229910000019 calcium carbonate Inorganic materials 0.000 description 3
- 239000001768 carboxy methyl cellulose Substances 0.000 description 3
- 150000007942 carboxylates Chemical class 0.000 description 3
- 150000001793 charged compounds Chemical class 0.000 description 3
- 125000001309 chloro group Chemical group Cl* 0.000 description 3
- 235000012000 cholesterol Nutrition 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 3
- 239000000412 dendrimer Substances 0.000 description 3
- 229920000736 dendritic polymer Polymers 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 238000010511 deprotection reaction Methods 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 229940116977 epidermal growth factor Drugs 0.000 description 3
- 239000010408 film Substances 0.000 description 3
- 235000003599 food sweetener Nutrition 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 102000006495 integrins Human genes 0.000 description 3
- 108010044426 integrins Proteins 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- WFKAJVHLWXSISD-UHFFFAOYSA-N isobutyramide Chemical group CC(C)C(N)=O WFKAJVHLWXSISD-UHFFFAOYSA-N 0.000 description 3
- 150000002576 ketones Chemical class 0.000 description 3
- 238000011813 knockout mouse model Methods 0.000 description 3
- 239000002523 lectin Substances 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 239000002105 nanoparticle Substances 0.000 description 3
- 229940053128 nerve growth factor Drugs 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 235000005985 organic acids Nutrition 0.000 description 3
- 229960003104 ornithine Drugs 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 3
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical group [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 description 3
- 239000006187 pill Substances 0.000 description 3
- 229920001308 poly(aminoacid) Polymers 0.000 description 3
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 3
- 229940068968 polysorbate 80 Drugs 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 230000002062 proliferating effect Effects 0.000 description 3
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 3
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 3
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 239000000375 suspending agent Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 239000003765 sweetening agent Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 229920001059 synthetic polymer Polymers 0.000 description 3
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 3
- 125000001544 thienyl group Chemical group 0.000 description 3
- 210000004881 tumor cell Anatomy 0.000 description 3
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 3
- 235000019165 vitamin E Nutrition 0.000 description 3
- 239000011709 vitamin E Substances 0.000 description 3
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- ALBODLTZUXKBGZ-JUUVMNCLSA-N (2s)-2-amino-3-phenylpropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CC1=CC=CC=C1 ALBODLTZUXKBGZ-JUUVMNCLSA-N 0.000 description 2
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 2
- WTSKMKRYHATLLL-UHFFFAOYSA-N (6-benzoyloxy-3-cyanopyridin-2-yl) 3-[3-(ethoxymethyl)-5-fluoro-2,6-dioxopyrimidine-1-carbonyl]benzoate Chemical compound O=C1N(COCC)C=C(F)C(=O)N1C(=O)C1=CC=CC(C(=O)OC=2C(=CC=C(OC(=O)C=3C=CC=CC=3)N=2)C#N)=C1 WTSKMKRYHATLLL-UHFFFAOYSA-N 0.000 description 2
- 125000004738 (C1-C6) alkyl sulfinyl group Chemical group 0.000 description 2
- 125000004845 (C1-C6) alkylsulfonylamino group Chemical group 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N 1,1-dimethoxyethane Chemical group COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 2
- GZTYTTPPCAXUHB-UHFFFAOYSA-N 1,2-benzodithiol-3-one Chemical compound C1=CC=C2C(=O)SSC2=C1 GZTYTTPPCAXUHB-UHFFFAOYSA-N 0.000 description 2
- VDFVNEFVBPFDSB-UHFFFAOYSA-N 1,3-dioxane Chemical group C1COCOC1 VDFVNEFVBPFDSB-UHFFFAOYSA-N 0.000 description 2
- HSVFHSAXCXUCLU-UHFFFAOYSA-N 1-[[bis(4-methoxyphenyl)-phenylmethoxy]-(4-methoxyphenyl)-phenylmethyl]-4-methoxybenzene Chemical group C1=CC(OC)=CC=C1C(C=1C=CC(OC)=CC=1)(C=1C=CC=CC=1)OC(C=1C=CC(OC)=CC=1)(C=1C=CC(OC)=CC=1)C1=CC=CC=C1 HSVFHSAXCXUCLU-UHFFFAOYSA-N 0.000 description 2
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 2
- XRILCFTWUCUKJR-INFSMZHSSA-N 2'-3'-cGAMP Chemical compound C([C@H]([C@H]1O)O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=NC=NC(N)=C5N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H]2N1C=NC2=C1NC(N)=NC2=O XRILCFTWUCUKJR-INFSMZHSSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 2
- VZMUCIBBVMLEKC-UHFFFAOYSA-N 2-chloro-5,5-dimethyl-1,3,2$l^{5}-dioxaphosphinane 2-oxide Chemical compound CC1(C)COP(Cl)(=O)OC1 VZMUCIBBVMLEKC-UHFFFAOYSA-N 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- RKVHNYJPIXOHRW-UHFFFAOYSA-N 3-bis[di(propan-2-yl)amino]phosphanyloxypropanenitrile Chemical compound CC(C)N(C(C)C)P(N(C(C)C)C(C)C)OCCC#N RKVHNYJPIXOHRW-UHFFFAOYSA-N 0.000 description 2
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- SFHYNDMGZXWXBU-LIMNOBDPSA-N 6-amino-2-[[(e)-(3-formylphenyl)methylideneamino]carbamoylamino]-1,3-dioxobenzo[de]isoquinoline-5,8-disulfonic acid Chemical compound O=C1C(C2=3)=CC(S(O)(=O)=O)=CC=3C(N)=C(S(O)(=O)=O)C=C2C(=O)N1NC(=O)N\N=C\C1=CC=CC(C=O)=C1 SFHYNDMGZXWXBU-LIMNOBDPSA-N 0.000 description 2
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical group CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 2
- DEFJQIDDEAULHB-UHFFFAOYSA-N Alanyl-alanine Chemical compound CC(N)C(=O)NC(C)C(O)=O DEFJQIDDEAULHB-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 101800002011 Amphipathic peptide Proteins 0.000 description 2
- 102000009840 Angiopoietins Human genes 0.000 description 2
- 108010009906 Angiopoietins Proteins 0.000 description 2
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- 206010003571 Astrocytoma Diseases 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 239000004342 Benzoyl peroxide Substances 0.000 description 2
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 2
- 101710113962 Bombinin-like peptides Proteins 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 125000005947 C1-C6 alkylsulfonyloxy group Chemical group 0.000 description 2
- 125000005914 C6-C14 aryloxy group Chemical group 0.000 description 2
- SBRWKUBHGIRXGY-QGGAYTEESA-N COC1=CC=C(C=C1)C(OC[C@@H]1[C@H]([C@H]([C@@H](O1)N1C=C(C2=C1N=CNC2=O)F)O)O[Si](C)(C)C(C)(C)C)(C1=CC=CC=C1)C1=CC=C(C=C1)OC Chemical compound COC1=CC=C(C=C1)C(OC[C@@H]1[C@H]([C@H]([C@@H](O1)N1C=C(C2=C1N=CNC2=O)F)O)O[Si](C)(C)C(C)(C)C)(C1=CC=CC=C1)C1=CC=C(C=C1)OC SBRWKUBHGIRXGY-QGGAYTEESA-N 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 239000004380 Cholic acid Substances 0.000 description 2
- 241000699800 Cricetinae Species 0.000 description 2
- 102100031256 Cyclic GMP-AMP synthase Human genes 0.000 description 2
- 108030002637 Cyclic GMP-AMP synthases Proteins 0.000 description 2
- 108010069514 Cyclic Peptides Proteins 0.000 description 2
- 102000001189 Cyclic Peptides Human genes 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- 150000008574 D-amino acids Chemical class 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 2
- 101100481408 Danio rerio tie2 gene Proteins 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 102000001301 EGF receptor Human genes 0.000 description 2
- 108060006698 EGF receptor Proteins 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 102000003746 Insulin Receptor Human genes 0.000 description 2
- 108010001127 Insulin Receptor Proteins 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- QUOGESRFPZDMMT-UHFFFAOYSA-N L-Homoarginine Natural products OC(=O)C(N)CCCCNC(N)=N QUOGESRFPZDMMT-UHFFFAOYSA-N 0.000 description 2
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 2
- QUOGESRFPZDMMT-YFKPBYRVSA-N L-homoarginine Chemical compound OC(=O)[C@@H](N)CCCCNC(N)=N QUOGESRFPZDMMT-YFKPBYRVSA-N 0.000 description 2
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 2
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 2
- 239000002145 L01XE14 - Bosutinib Substances 0.000 description 2
- SMEROWZSTRWXGI-UHFFFAOYSA-N Lithocholsaeure Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 SMEROWZSTRWXGI-UHFFFAOYSA-N 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 101100162020 Mesorhizobium japonicum (strain LMG 29417 / CECT 9101 / MAFF 303099) adc3 gene Proteins 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 101100481410 Mus musculus Tek gene Proteins 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 2
- NSGDYZCDUPSTQT-UHFFFAOYSA-N N-[5-bromo-1-[(4-fluorophenyl)methyl]-4-methyl-2-oxopyridin-3-yl]cycloheptanecarboxamide Chemical compound Cc1c(Br)cn(Cc2ccc(F)cc2)c(=O)c1NC(=O)C1CCCCCC1 NSGDYZCDUPSTQT-UHFFFAOYSA-N 0.000 description 2
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 2
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 description 2
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 2
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Chemical compound IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 2
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 2
- 108090000556 Neuregulin-1 Proteins 0.000 description 2
- 102400000058 Neuregulin-1 Human genes 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- LDPACDIZDAIKCA-UHFFFAOYSA-N O[Si](O[Si](C(C)C)(C(C)C)O[Si](O[Si](O)(C(C)C)C(C)C)(C(C)C)C(C)C)(C(C)C)C(C)C Chemical compound O[Si](O[Si](C(C)C)(C(C)C)O[Si](O[Si](O)(C(C)C)C(C)C)(C(C)C)C(C)C)(C(C)C)C(C)C LDPACDIZDAIKCA-UHFFFAOYSA-N 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- 108091008606 PDGF receptors Proteins 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 2
- 229920002873 Polyethylenimine Polymers 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- 101710149951 Protein Tat Proteins 0.000 description 2
- RADKZDMFGJYCBB-UHFFFAOYSA-N Pyridoxal Chemical compound CC1=NC=C(CO)C(C=O)=C1O RADKZDMFGJYCBB-UHFFFAOYSA-N 0.000 description 2
- 102000009609 Pyrophosphatases Human genes 0.000 description 2
- 108010009413 Pyrophosphatases Proteins 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 102220492414 Ribulose-phosphate 3-epimerase_H35A_mutation Human genes 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 108020000411 Toll-like receptor Proteins 0.000 description 2
- 102000002689 Toll-like receptor Human genes 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- 102000004338 Transferrin Human genes 0.000 description 2
- 108090000901 Transferrin Proteins 0.000 description 2
- 102000006747 Transforming Growth Factor alpha Human genes 0.000 description 2
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 108091008605 VEGF receptors Proteins 0.000 description 2
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 2
- 229930003427 Vitamin E Natural products 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 229910000102 alkali metal hydride Inorganic materials 0.000 description 2
- 150000008046 alkali metal hydrides Chemical class 0.000 description 2
- 125000005194 alkoxycarbonyloxy group Chemical group 0.000 description 2
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- 229950010949 ambamustine Drugs 0.000 description 2
- 230000009435 amidation Effects 0.000 description 2
- 238000005576 amination reaction Methods 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- 230000000340 anti-metabolite Effects 0.000 description 2
- 239000000611 antibody drug conjugate Substances 0.000 description 2
- 229940100197 antimetabolite Drugs 0.000 description 2
- 239000002256 antimetabolite Substances 0.000 description 2
- 239000002257 antimetastatic agent Substances 0.000 description 2
- 125000005098 aryl alkoxy carbonyl group Chemical group 0.000 description 2
- 125000001691 aryl alkyl amino group Chemical group 0.000 description 2
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 2
- 125000001769 aryl amino group Chemical group 0.000 description 2
- 125000004658 aryl carbonyl amino group Chemical group 0.000 description 2
- 125000005199 aryl carbonyloxy group Chemical group 0.000 description 2
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 2
- 125000004657 aryl sulfonyl amino group Chemical group 0.000 description 2
- 125000005279 aryl sulfonyloxy group Chemical group 0.000 description 2
- 229940009098 aspartate Drugs 0.000 description 2
- 229960005261 aspartic acid Drugs 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical group OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 235000019400 benzoyl peroxide Nutrition 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- LUFPJJNWMYZRQE-UHFFFAOYSA-N benzylsulfanylmethylbenzene Chemical group C=1C=CC=CC=1CSCC1=CC=CC=C1 LUFPJJNWMYZRQE-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 2
- 239000003613 bile acid Substances 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 2
- YNHIGQDRGKUECZ-UHFFFAOYSA-L bis(triphenylphosphine)palladium(ii) dichloride Chemical compound [Cl-].[Cl-].[Pd+2].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-L 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 238000010504 bond cleavage reaction Methods 0.000 description 2
- 229960003736 bosutinib Drugs 0.000 description 2
- UBPYILGKFZZVDX-UHFFFAOYSA-N bosutinib Chemical compound C1=C(Cl)C(OC)=CC(NC=2C3=CC(OC)=C(OCCCN4CCN(C)CC4)C=C3N=CC=2C#N)=C1Cl UBPYILGKFZZVDX-UHFFFAOYSA-N 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000004063 butyryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 230000009702 cancer cell proliferation Effects 0.000 description 2
- 230000005907 cancer growth Effects 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 150000001718 carbodiimides Chemical class 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 description 2
- 150000001728 carbonyl compounds Chemical class 0.000 description 2
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 150000001735 carboxylic acids Chemical class 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 230000004700 cellular uptake Effects 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 2
- 235000019416 cholic acid Nutrition 0.000 description 2
- 229960002471 cholic acid Drugs 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 239000003431 cross linking reagent Substances 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 125000000000 cycloalkoxy group Chemical group 0.000 description 2
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- PAFZNILMFXTMIY-UHFFFAOYSA-N cyclohexylamine Chemical compound NC1CCCCC1 PAFZNILMFXTMIY-UHFFFAOYSA-N 0.000 description 2
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- 150000002009 diols Chemical class 0.000 description 2
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 2
- KUMNEOGIHFCNQW-UHFFFAOYSA-N diphenyl phosphite Chemical compound C=1C=CC=CC=1OP([O-])OC1=CC=CC=C1 KUMNEOGIHFCNQW-UHFFFAOYSA-N 0.000 description 2
- MKRTXPORKIRPDG-UHFFFAOYSA-N diphenylphosphoryl azide Chemical compound C=1C=CC=CC=1P(=O)(N=[N+]=[N-])C1=CC=CC=C1 MKRTXPORKIRPDG-UHFFFAOYSA-N 0.000 description 2
- 229950005450 emitefur Drugs 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 210000001163 endosome Anatomy 0.000 description 2
- UESSEMPSSAXQJC-UHFFFAOYSA-N ethanol;methanamine Chemical compound NC.CCO UESSEMPSSAXQJC-UHFFFAOYSA-N 0.000 description 2
- RSIHJDGMBDPTIM-UHFFFAOYSA-N ethoxy(trimethyl)silane Chemical compound CCO[Si](C)(C)C RSIHJDGMBDPTIM-UHFFFAOYSA-N 0.000 description 2
- XPGDODOEEWLHOI-GSDHBNRESA-N ethyl (2s)-2-[[(2s)-2-[[(2s)-2-amino-3-(4-fluorophenyl)propanoyl]amino]-3-[3-[bis(2-chloroethyl)amino]phenyl]propanoyl]amino]-4-methylsulfanylbutanoate Chemical compound C([C@@H](C(=O)N[C@@H](CCSC)C(=O)OCC)NC(=O)[C@@H](N)CC=1C=CC(F)=CC=1)C1=CC=CC(N(CCCl)CCCl)=C1 XPGDODOEEWLHOI-GSDHBNRESA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 2
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 229940014144 folate Drugs 0.000 description 2
- 229960000304 folic acid Drugs 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 2
- 210000004211 gastric acid Anatomy 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 229940014259 gelatin Drugs 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 229960001031 glucose Drugs 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 229960005150 glycerol Drugs 0.000 description 2
- XKUKSGPZAADMRA-UHFFFAOYSA-N glycyl-glycyl-glycine Chemical compound NCC(=O)NCC(=O)NCC(O)=O XKUKSGPZAADMRA-UHFFFAOYSA-N 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 125000003104 hexanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000003707 hexyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 238000001794 hormone therapy Methods 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- IKGLACJFEHSFNN-UHFFFAOYSA-N hydron;triethylazanium;trifluoride Chemical compound F.F.F.CCN(CC)CC IKGLACJFEHSFNN-UHFFFAOYSA-N 0.000 description 2
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 2
- RCBVKBFIWMOMHF-UHFFFAOYSA-L hydroxy-(hydroxy(dioxo)chromio)oxy-dioxochromium;pyridine Chemical compound C1=CC=NC=C1.C1=CC=NC=C1.O[Cr](=O)(=O)O[Cr](O)(=O)=O RCBVKBFIWMOMHF-UHFFFAOYSA-L 0.000 description 2
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 2
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 150000002460 imidazoles Chemical class 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 238000005304 joining Methods 0.000 description 2
- CFHGBZLNZZVTAY-UHFFFAOYSA-N lawesson's reagent Chemical compound C1=CC(OC)=CC=C1P1(=S)SP(=S)(C=2C=CC(OC)=CC=2)S1 CFHGBZLNZZVTAY-UHFFFAOYSA-N 0.000 description 2
- AMXOYNBUYSYVKV-UHFFFAOYSA-M lithium bromide Chemical compound [Li+].[Br-] AMXOYNBUYSYVKV-UHFFFAOYSA-M 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- SMEROWZSTRWXGI-HVATVPOCSA-N lithocholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 SMEROWZSTRWXGI-HVATVPOCSA-N 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 208000020816 lung neoplasm Diseases 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 229960004961 mechlorethamine Drugs 0.000 description 2
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Natural products C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 2
- 239000003094 microcapsule Substances 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 2
- DSWNRHCOGVRDOE-UHFFFAOYSA-N n,n-dimethylmethanimidamide Chemical group CN(C)C=N DSWNRHCOGVRDOE-UHFFFAOYSA-N 0.000 description 2
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 2
- 229950006780 n-acetylglucosamine Drugs 0.000 description 2
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 2
- 229960002009 naproxen Drugs 0.000 description 2
- CMWTZPSULFXXJA-VIFPVBQESA-M naproxen(1-) Chemical compound C1=C([C@H](C)C([O-])=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-M 0.000 description 2
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- QTNLALDFXILRQO-UHFFFAOYSA-N nonadecane-1,2,3-triol Chemical compound CCCCCCCCCCCCCCCCC(O)C(O)CO QTNLALDFXILRQO-UHFFFAOYSA-N 0.000 description 2
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 2
- 239000008191 permeabilizing agent Substances 0.000 description 2
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 2
- 235000021317 phosphate Nutrition 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 125000001476 phosphono group Chemical group [H]OP(*)(=O)O[H] 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 239000000049 pigment Substances 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 108010001062 polysaccharide-K Proteins 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 238000002600 positron emission tomography Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 2
- 125000001325 propanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 2
- ZCCUUQDIBDJBTK-UHFFFAOYSA-N psoralen Chemical compound C1=C2OC(=O)C=CC2=CC2=C1OC=C2 ZCCUUQDIBDJBTK-UHFFFAOYSA-N 0.000 description 2
- 230000005180 public health Effects 0.000 description 2
- NRTYMEPCRDJMPZ-UHFFFAOYSA-N pyridine;2,2,2-trifluoroacetic acid Chemical compound C1=CC=NC=C1.OC(=O)C(F)(F)F NRTYMEPCRDJMPZ-UHFFFAOYSA-N 0.000 description 2
- 125000005554 pyridyloxy group Chemical group 0.000 description 2
- 239000000700 radioactive tracer Substances 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 238000006268 reductive amination reaction Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- VLQLUZFVFXYXQE-USRGLUTNSA-M rigosertib sodium Chemical compound [Na+].COC1=CC(OC)=CC(OC)=C1\C=C\S(=O)(=O)CC1=CC=C(OC)C(NCC([O-])=O)=C1 VLQLUZFVFXYXQE-USRGLUTNSA-M 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- JPJALAQPGMAKDF-UHFFFAOYSA-N selenium dioxide Chemical compound O=[Se]=O JPJALAQPGMAKDF-UHFFFAOYSA-N 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 235000010413 sodium alginate Nutrition 0.000 description 2
- 239000000661 sodium alginate Substances 0.000 description 2
- 229940005550 sodium alginate Drugs 0.000 description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 2
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 235000019345 sodium thiosulphate Nutrition 0.000 description 2
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 238000000638 solvent extraction Methods 0.000 description 2
- 229960002920 sorbitol Drugs 0.000 description 2
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 2
- PFNFFQXMRSDOHW-UHFFFAOYSA-N spermine Chemical compound NCCCNCCCCNCCCN PFNFFQXMRSDOHW-UHFFFAOYSA-N 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 125000000213 sulfino group Chemical group [H]OS(*)=O 0.000 description 2
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 2
- 125000000020 sulfo group Chemical group O=S(=O)([*])O[H] 0.000 description 2
- AKEJUJNQAAGONA-UHFFFAOYSA-N sulfur trioxide Chemical compound O=S(=O)=O AKEJUJNQAAGONA-UHFFFAOYSA-N 0.000 description 2
- 238000005987 sulfurization reaction Methods 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 2
- FGTJJHCZWOVVNH-UHFFFAOYSA-N tert-butyl-[tert-butyl(dimethyl)silyl]oxy-dimethylsilane Chemical group CC(C)(C)[Si](C)(C)O[Si](C)(C)C(C)(C)C FGTJJHCZWOVVNH-UHFFFAOYSA-N 0.000 description 2
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 2
- HJUGFYREWKUQJT-UHFFFAOYSA-N tetrabromomethane Chemical compound BrC(Br)(Br)Br HJUGFYREWKUQJT-UHFFFAOYSA-N 0.000 description 2
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 125000004149 thio group Chemical group *S* 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 2
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 239000012581 transferrin Substances 0.000 description 2
- 229960000575 trastuzumab Drugs 0.000 description 2
- AQRLNPVMDITEJU-UHFFFAOYSA-N triethylsilane Chemical compound CC[SiH](CC)CC AQRLNPVMDITEJU-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- SEDZOYHHAIAQIW-UHFFFAOYSA-N trimethylsilyl azide Chemical compound C[Si](C)(C)N=[N+]=[N-] SEDZOYHHAIAQIW-UHFFFAOYSA-N 0.000 description 2
- CSRZQMIRAZTJOY-UHFFFAOYSA-N trimethylsilyl iodide Chemical compound C[Si](C)(C)I CSRZQMIRAZTJOY-UHFFFAOYSA-N 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 230000014567 type I interferon production Effects 0.000 description 2
- 125000003774 valeryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 229940046009 vitamin E Drugs 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- UAYWVJHJZHQCIE-UHFFFAOYSA-L zinc iodide Chemical compound I[Zn]I UAYWVJHJZHQCIE-UHFFFAOYSA-L 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical group CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical group C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 description 1
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical group C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 1
- NGGMYCMLYOUNGM-UHFFFAOYSA-N (-)-fumagillin Natural products O1C(CC=C(C)C)C1(C)C1C(OC)C(OC(=O)C=CC=CC=CC=CC(O)=O)CCC21CO2 NGGMYCMLYOUNGM-UHFFFAOYSA-N 0.000 description 1
- REPVLJRCJUVQFA-UHFFFAOYSA-N (-)-isopinocampheol Chemical group C1C(O)C(C)C2C(C)(C)C1C2 REPVLJRCJUVQFA-UHFFFAOYSA-N 0.000 description 1
- ILFPCMXTASDZKM-YFKPBYRVSA-N (1s)-2-methylidene-3-oxocyclopentane-1-carboxylic acid Chemical compound OC(=O)[C@H]1CCC(=O)C1=C ILFPCMXTASDZKM-YFKPBYRVSA-N 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- FDKWRPBBCBCIGA-REOHCLBHSA-N (2r)-2-azaniumyl-3-$l^{1}-selanylpropanoate Chemical compound [Se]C[C@H](N)C(O)=O FDKWRPBBCBCIGA-REOHCLBHSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- WDQLRUYAYXDIFW-RWKIJVEZSA-N (2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-4-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxymethyl]oxan-2-yl]oxy-6-(hydroxymethyl)oxane-2,3,5-triol Chemical compound O[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)O1 WDQLRUYAYXDIFW-RWKIJVEZSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- NMDDZEVVQDPECF-LURJTMIESA-N (2s)-2,7-diaminoheptanoic acid Chemical compound NCCCCC[C@H](N)C(O)=O NMDDZEVVQDPECF-LURJTMIESA-N 0.000 description 1
- AGGWFDNPHKLBBV-YUMQZZPRSA-N (2s)-2-[[(2s)-2-amino-3-methylbutanoyl]amino]-5-(carbamoylamino)pentanoic acid Chemical compound CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCCNC(N)=O AGGWFDNPHKLBBV-YUMQZZPRSA-N 0.000 description 1
- LOGFVTREOLYCPF-KXNHARMFSA-N (2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCN LOGFVTREOLYCPF-KXNHARMFSA-N 0.000 description 1
- NAALWFYYHHJEFQ-ZASNTINBSA-N (2s,5r,6r)-6-[[(2r)-2-[[6-[4-[bis(2-hydroxyethyl)sulfamoyl]phenyl]-2-oxo-1h-pyridine-3-carbonyl]amino]-2-(4-hydroxyphenyl)acetyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid Chemical compound N([C@@H](C(=O)N[C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C=1C=CC(O)=CC=1)C(=O)C(C(N1)=O)=CC=C1C1=CC=C(S(=O)(=O)N(CCO)CCO)C=C1 NAALWFYYHHJEFQ-ZASNTINBSA-N 0.000 description 1
- CUKWUWBLQQDQAC-VEQWQPCFSA-N (3s)-3-amino-4-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2s,3s)-1-[[(2s)-1-[(2s)-2-[[(1s)-1-carboxyethyl]carbamoyl]pyrrolidin-1-yl]-3-(1h-imidazol-5-yl)-1-oxopropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amino]-3-methyl-1-ox Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C1=CC=C(O)C=C1 CUKWUWBLQQDQAC-VEQWQPCFSA-N 0.000 description 1
- PDVFSPNIEOYOQL-UHFFFAOYSA-N (4-methylphenyl)sulfonyl 4-methylbenzenesulfonate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)OS(=O)(=O)C1=CC=C(C)C=C1 PDVFSPNIEOYOQL-UHFFFAOYSA-N 0.000 description 1
- SVSFIELZISOJDT-XRZFDKQNSA-N (6r,7r)-7-[[2-(2-amino-1,3-thiazol-4-yl)acetyl]amino]-3-[[1-[2-(dimethylamino)ethyl]tetrazol-5-yl]sulfanylmethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid;hydrochloride Chemical compound Cl.CN(C)CCN1N=NN=C1SCC1=C(C(O)=O)N2C(=O)[C@@H](NC(=O)CC=3N=C(N)SC=3)[C@H]2SC1 SVSFIELZISOJDT-XRZFDKQNSA-N 0.000 description 1
- MWWSFMDVAYGXBV-FGBSZODSSA-N (7s,9s)-7-[(2r,4s,5r,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydron;chloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-FGBSZODSSA-N 0.000 description 1
- ZPHYPKKFSHAVOE-YZIXBPQXSA-N (7s,9s)-7-[(2r,4s,5s,6s)-4-amino-6-methyl-5-[(2r)-oxan-2-yl]oxyoxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;hydrochloride Chemical compound Cl.O([C@H]1[C@@H](N)C[C@@H](O[C@H]1C)O[C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@@H]1CCCCO1 ZPHYPKKFSHAVOE-YZIXBPQXSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- 125000006624 (C1-C6) alkoxycarbonylamino group Chemical group 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- USVVENVKYJZFMW-ONEGZZNKSA-N (e)-carboxyiminocarbamic acid Chemical class OC(=O)\N=N\C(O)=O USVVENVKYJZFMW-ONEGZZNKSA-N 0.000 description 1
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- BYEAHWXPCBROCE-UHFFFAOYSA-N 1,1,1,3,3,3-hexafluoropropan-2-ol Chemical compound FC(F)(F)C(O)C(F)(F)F BYEAHWXPCBROCE-UHFFFAOYSA-N 0.000 description 1
- 125000004504 1,2,4-oxadiazolyl group Chemical group 0.000 description 1
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 1
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 1,2-dihydrophenazine Chemical compound C1=CC=C2N=C(C=CCC3)C3=NC2=C1 ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 0.000 description 1
- 125000004520 1,3,4-thiadiazolyl group Chemical group 0.000 description 1
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Chemical group OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 1
- 229940035437 1,3-propanediol Drugs 0.000 description 1
- FBMZEITWVNHWJW-UHFFFAOYSA-N 1,7-dihydropyrrolo[2,3-d]pyrimidin-4-one Chemical compound OC1=NC=NC2=C1C=CN2 FBMZEITWVNHWJW-UHFFFAOYSA-N 0.000 description 1
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- AZUYLZMQTIKGSC-UHFFFAOYSA-N 1-[6-[4-(5-chloro-6-methyl-1H-indazol-4-yl)-5-methyl-3-(1-methylindazol-5-yl)pyrazol-1-yl]-2-azaspiro[3.3]heptan-2-yl]prop-2-en-1-one Chemical compound ClC=1C(=C2C=NNC2=CC=1C)C=1C(=NN(C=1C)C1CC2(CN(C2)C(C=C)=O)C1)C=1C=C2C=NN(C2=CC=1)C AZUYLZMQTIKGSC-UHFFFAOYSA-N 0.000 description 1
- JBWYRBLDOOOJEU-UHFFFAOYSA-N 1-[chloro-(4-methoxyphenyl)-phenylmethyl]-4-methoxybenzene Chemical compound C1=CC(OC)=CC=C1C(Cl)(C=1C=CC(OC)=CC=1)C1=CC=CC=C1 JBWYRBLDOOOJEU-UHFFFAOYSA-N 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- MNCMBBIFTVWHIP-UHFFFAOYSA-N 1-anthracen-9-yl-2,2,2-trifluoroethanone Chemical group C1=CC=C2C(C(=O)C(F)(F)F)=C(C=CC=C3)C3=CC2=C1 MNCMBBIFTVWHIP-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- 125000006039 1-hexenyl group Chemical group 0.000 description 1
- MCTWTZJPVLRJOU-UHFFFAOYSA-N 1-methyl-1H-imidazole Chemical compound CN1C=CN=C1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 1
- 125000001088 1-naphthoyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- MZMNEDXVUJLQAF-UHFFFAOYSA-N 1-o-tert-butyl 2-o-methyl 4-hydroxypyrrolidine-1,2-dicarboxylate Chemical compound COC(=O)C1CC(O)CN1C(=O)OC(C)(C)C MZMNEDXVUJLQAF-UHFFFAOYSA-N 0.000 description 1
- 125000006023 1-pentenyl group Chemical group 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- PNXSUXRNBHUCSF-HSYVXBRLSA-N 107658-43-5 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)OC(=O)CC[C@@H](C(=O)N[C@@H](C)C(=O)OC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCC(O)=O)NC(=O)[C@H](CCC(=O)OC(=O)[C@H](CCC(=O)OC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)N)C1C=NC=N1 PNXSUXRNBHUCSF-HSYVXBRLSA-N 0.000 description 1
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 1
- DGHHQBMTXTWTJV-BQAIUKQQSA-N 119413-54-6 Chemical compound Cl.C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 DGHHQBMTXTWTJV-BQAIUKQQSA-N 0.000 description 1
- NVKAWKQGWWIWPM-ABEVXSGRSA-N 17-β-hydroxy-5-α-Androstan-3-one Chemical compound C1C(=O)CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 NVKAWKQGWWIWPM-ABEVXSGRSA-N 0.000 description 1
- 125000005955 1H-indazolyl group Chemical group 0.000 description 1
- UTQNKKSJPHTPBS-UHFFFAOYSA-N 2,2,2-trichloroethanone Chemical group ClC(Cl)(Cl)[C]=O UTQNKKSJPHTPBS-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- LTMRRSWNXVJMBA-UHFFFAOYSA-L 2,2-diethylpropanedioate Chemical compound CCC(CC)(C([O-])=O)C([O-])=O LTMRRSWNXVJMBA-UHFFFAOYSA-L 0.000 description 1
- JVSFQJZRHXAUGT-UHFFFAOYSA-N 2,2-dimethylpropanoyl chloride Chemical compound CC(C)(C)C(Cl)=O JVSFQJZRHXAUGT-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- DUDRAKXAVJKRHA-UHFFFAOYSA-N 2,4-disulfido-1,3,2,4-dithiadiphosphetane-2,4-diium Chemical group S=P1SP(=S)S1 DUDRAKXAVJKRHA-UHFFFAOYSA-N 0.000 description 1
- AOTQGWFNFTVXNQ-UHFFFAOYSA-N 2-(1-adamantyl)acetic acid Chemical compound C1C(C2)CC3CC2CC1(CC(=O)O)C3 AOTQGWFNFTVXNQ-UHFFFAOYSA-N 0.000 description 1
- AZUHIVLOSAPWDM-UHFFFAOYSA-N 2-(1h-imidazol-2-yl)-1h-imidazole Chemical compound C1=CNC(C=2NC=CN=2)=N1 AZUHIVLOSAPWDM-UHFFFAOYSA-N 0.000 description 1
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 1
- ZZIZZTHXZRDOFM-UHFFFAOYSA-N 2-(2-ethoxyphenoxy)ethyl-[1-(4-methoxy-3-sulfamoylphenyl)propan-2-yl]azanium;chloride Chemical compound Cl.CCOC1=CC=CC=C1OCCNC(C)CC1=CC=C(OC)C(S(N)(=O)=O)=C1 ZZIZZTHXZRDOFM-UHFFFAOYSA-N 0.000 description 1
- HUHXLHLWASNVDB-UHFFFAOYSA-N 2-(oxan-2-yloxy)oxane Chemical group O1CCCCC1OC1OCCCC1 HUHXLHLWASNVDB-UHFFFAOYSA-N 0.000 description 1
- QCXJFISCRQIYID-IAEPZHFASA-N 2-amino-1-n-[(3s,6s,7r,10s,16s)-3-[(2s)-butan-2-yl]-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-10-propan-2-yl-8-oxa-1,4,11,14-tetrazabicyclo[14.3.0]nonadecan-6-yl]-4,6-dimethyl-3-oxo-9-n-[(3s,6s,7r,10s,16s)-7,11,14-trimethyl-2,5,9,12,15-pentaoxo-3,10-di(propa Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N=C2C(C(=O)N[C@@H]3C(=O)N[C@H](C(N4CCC[C@H]4C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]3C)=O)[C@@H](C)CC)=C(N)C(=O)C(C)=C2O2)C2=C(C)C=C1 QCXJFISCRQIYID-IAEPZHFASA-N 0.000 description 1
- BMUXBWLKTHLRQC-UHFFFAOYSA-N 2-azanylethanoic acid Chemical compound NCC(O)=O.NCC(O)=O.NCC(O)=O BMUXBWLKTHLRQC-UHFFFAOYSA-N 0.000 description 1
- 125000005999 2-bromoethyl group Chemical group 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- ABFPKTQEQNICFT-UHFFFAOYSA-M 2-chloro-1-methylpyridin-1-ium;iodide Chemical compound [I-].C[N+]1=CC=CC=C1Cl ABFPKTQEQNICFT-UHFFFAOYSA-M 0.000 description 1
- RAOZVFGTRXLBTA-UHFFFAOYSA-N 2-chloro-5,5-dimethyl-1,3,2-dioxaphosphinane Chemical compound CC1(C)COP(Cl)OC1 RAOZVFGTRXLBTA-UHFFFAOYSA-N 0.000 description 1
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 1
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- VKIGAWAEXPTIOL-UHFFFAOYSA-N 2-hydroxyhexanenitrile Chemical compound CCCCC(O)C#N VKIGAWAEXPTIOL-UHFFFAOYSA-N 0.000 description 1
- 125000006020 2-methyl-1-propenyl group Chemical group 0.000 description 1
- XWKFPIODWVPXLX-UHFFFAOYSA-N 2-methyl-5-methylpyridine Natural products CC1=CC=C(C)N=C1 XWKFPIODWVPXLX-UHFFFAOYSA-N 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- BZSXEZOLBIJVQK-UHFFFAOYSA-N 2-methylsulfonylbenzoic acid Chemical compound CS(=O)(=O)C1=CC=CC=C1C(O)=O BZSXEZOLBIJVQK-UHFFFAOYSA-N 0.000 description 1
- 125000001216 2-naphthoyl group Chemical group C1=C(C=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000006024 2-pentenyl group Chemical group 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- AXRCEOKUDYDWLF-UHFFFAOYSA-N 3-(1-methyl-3-indolyl)-4-[1-[1-(2-pyridinylmethyl)-4-piperidinyl]-3-indolyl]pyrrole-2,5-dione Chemical compound C12=CC=CC=C2N(C)C=C1C(C(NC1=O)=O)=C1C(C1=CC=CC=C11)=CN1C(CC1)CCN1CC1=CC=CC=N1 AXRCEOKUDYDWLF-UHFFFAOYSA-N 0.000 description 1
- PYSRRFNXTXNWCD-UHFFFAOYSA-N 3-(2-phenylethenyl)furan-2,5-dione Chemical compound O=C1OC(=O)C(C=CC=2C=CC=CC=2)=C1 PYSRRFNXTXNWCD-UHFFFAOYSA-N 0.000 description 1
- WUIABRMSWOKTOF-OYALTWQYSA-N 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS([O-])(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-N 0.000 description 1
- JXEICPOBKSQAIU-UHFFFAOYSA-N 3-bromo-1-[12-(3-bromopropanoyl)-3,12-diaza-6,9-diazoniadispiro[5.2.5^{9}.2^{6}]hexadecan-3-yl]propan-1-one Chemical compound C1CN(C(=O)CCBr)CC[N+]21CC[N+]1(CCN(CC1)C(=O)CCBr)CC2 JXEICPOBKSQAIU-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- 125000006041 3-hexenyl group Chemical group 0.000 description 1
- VXGRJERITKFWPL-UHFFFAOYSA-N 4',5'-Dihydropsoralen Natural products C1=C2OC(=O)C=CC2=CC2=C1OCC2 VXGRJERITKFWPL-UHFFFAOYSA-N 0.000 description 1
- 125000002103 4,4'-dimethoxytriphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)(C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H])C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 1
- BMTZEAOGFDXDAD-UHFFFAOYSA-M 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholin-4-ium;chloride Chemical compound [Cl-].COC1=NC(OC)=NC([N+]2(C)CCOCC2)=N1 BMTZEAOGFDXDAD-UHFFFAOYSA-M 0.000 description 1
- OQVYMXCRDHDTTH-UHFFFAOYSA-N 4-(diethoxyphosphorylmethyl)-2-[4-(diethoxyphosphorylmethyl)pyridin-2-yl]pyridine Chemical compound CCOP(=O)(OCC)CC1=CC=NC(C=2N=CC=C(CP(=O)(OCC)OCC)C=2)=C1 OQVYMXCRDHDTTH-UHFFFAOYSA-N 0.000 description 1
- ZHSKUOZOLHMKEA-UHFFFAOYSA-N 4-[5-[bis(2-chloroethyl)amino]-1-methylbenzimidazol-2-yl]butanoic acid;hydron;chloride Chemical compound Cl.ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 ZHSKUOZOLHMKEA-UHFFFAOYSA-N 0.000 description 1
- HHFBDROWDBDFBR-UHFFFAOYSA-N 4-[[9-chloro-7-(2,6-difluorophenyl)-5H-pyrimido[5,4-d][2]benzazepin-2-yl]amino]benzoic acid Chemical compound C1=CC(C(=O)O)=CC=C1NC1=NC=C(CN=C(C=2C3=CC=C(Cl)C=2)C=2C(=CC=CC=2F)F)C3=N1 HHFBDROWDBDFBR-UHFFFAOYSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- 125000003119 4-methyl-3-pentenyl group Chemical group [H]\C(=C(/C([H])([H])[H])C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- TXLINXBIWJYFNR-UHFFFAOYSA-N 4-phenylpyridine-2-carbonitrile Chemical compound C1=NC(C#N)=CC(C=2C=CC=CC=2)=C1 TXLINXBIWJYFNR-UHFFFAOYSA-N 0.000 description 1
- 239000002677 5-alpha reductase inhibitor Substances 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- 125000006043 5-hexenyl group Chemical group 0.000 description 1
- 102000040125 5-hydroxytryptamine receptor family Human genes 0.000 description 1
- 108091032151 5-hydroxytryptamine receptor family Proteins 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- KAEVHZSIYLATMK-UHFFFAOYSA-N 6-n-[bis(aziridin-1-yl)phosphoryl]-2-n,2-n,7-trimethylpurine-2,6-diamine Chemical compound C=12N(C)C=NC2=NC(N(C)C)=NC=1NP(=O)(N1CC1)N1CC1 KAEVHZSIYLATMK-UHFFFAOYSA-N 0.000 description 1
- NKGPJODWTZCHGF-KQYNXXCUSA-N 6-thioinosinic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(S)=C2N=C1 NKGPJODWTZCHGF-KQYNXXCUSA-N 0.000 description 1
- KABRXLINDSPGDF-UHFFFAOYSA-N 7-bromoisoquinoline Chemical compound C1=CN=CC2=CC(Br)=CC=C21 KABRXLINDSPGDF-UHFFFAOYSA-N 0.000 description 1
- NKGPJODWTZCHGF-UHFFFAOYSA-N 9-[3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound OC1C(O)C(CO)OC1N1C(NC=NC2=S)=C2N=C1 NKGPJODWTZCHGF-UHFFFAOYSA-N 0.000 description 1
- 101150046224 ABAT gene Proteins 0.000 description 1
- GBJVVSCPOBPEIT-UHFFFAOYSA-N AZT-1152 Chemical compound N=1C=NC2=CC(OCCCN(CC)CCOP(O)(O)=O)=CC=C2C=1NC(=NN1)C=C1CC(=O)NC1=CC=CC(F)=C1 GBJVVSCPOBPEIT-UHFFFAOYSA-N 0.000 description 1
- 229920002126 Acrylic acid copolymer Polymers 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 206010068873 Adenosquamous cell carcinoma Diseases 0.000 description 1
- 229940126638 Akt inhibitor Drugs 0.000 description 1
- OMNVYXHOSHNURL-WPRPVWTQSA-N Ala-Phe Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 OMNVYXHOSHNURL-WPRPVWTQSA-N 0.000 description 1
- 241001279686 Allium moly Species 0.000 description 1
- ATXHVCQZZJYMCF-XUDSTZEESA-N Allylestrenol Chemical compound C1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)CC=C)[C@@H]4[C@@H]3CCC2=C1 ATXHVCQZZJYMCF-XUDSTZEESA-N 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 229940122531 Anaplastic lymphoma kinase inhibitor Drugs 0.000 description 1
- 229940127512 Androgen Synthesis Inhibitors Drugs 0.000 description 1
- 229940123200 Angiopoietin inhibitor Drugs 0.000 description 1
- 102400000345 Angiotensin-2 Human genes 0.000 description 1
- 101800000733 Angiotensin-2 Proteins 0.000 description 1
- 108700042778 Antimicrobial Peptides Proteins 0.000 description 1
- 102000044503 Antimicrobial Peptides Human genes 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 108010082340 Arginine deiminase Proteins 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 102100034605 Atrial natriuretic peptide receptor 3 Human genes 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 208000005440 Basal Cell Neoplasms Diseases 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 239000005711 Benzoic acid Chemical group 0.000 description 1
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- KZMGYPLQYOPHEL-UHFFFAOYSA-N Boron trifluoride etherate Chemical compound FB(F)F.CCOCC KZMGYPLQYOPHEL-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 101710172979 Brevinin-2 Proteins 0.000 description 1
- 108010037003 Buserelin Proteins 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- ZYUZLEUJKZZXNN-UHFFFAOYSA-N C1=CC(CC(N)C(O)=O)=CC=C1OS(=O)(=O)C1=CC=C(C=CC=C2)C2=C1 Chemical group C1=CC(CC(N)C(O)=O)=CC=C1OS(=O)(=O)C1=CC=C(C=CC=C2)C2=C1 ZYUZLEUJKZZXNN-UHFFFAOYSA-N 0.000 description 1
- 125000003320 C2-C6 alkenyloxy group Chemical group 0.000 description 1
- UJKPHYRXOLRVJJ-MLSVHJFASA-N CC(O)C1=C(C)/C2=C/C3=N/C(=C\C4=C(CCC(O)=O)C(C)=C(N4)/C=C4\N=C(\C=C\1/N\2)C(C)=C4C(C)O)/C(CCC(O)=O)=C3C Chemical compound CC(O)C1=C(C)/C2=C/C3=N/C(=C\C4=C(CCC(O)=O)C(C)=C(N4)/C=C4\N=C(\C=C\1/N\2)C(C)=C4C(C)O)/C(CCC(O)=O)=C3C UJKPHYRXOLRVJJ-MLSVHJFASA-N 0.000 description 1
- SSUFDOMYCBCHML-UHFFFAOYSA-N CCCCC[S](=O)=O Chemical group CCCCC[S](=O)=O SSUFDOMYCBCHML-UHFFFAOYSA-N 0.000 description 1
- DKENDMYOVNPXAE-QWOIFIOOSA-N COC1=CC=C(C=C1)C(OC[C@@H]1[C@H]([C@H]([C@@H](O1)N1C=C(C2=C1N=CNC2=O)F)O)O)(C1=CC=CC=C1)C1=CC=C(C=C1)OC Chemical compound COC1=CC=C(C=C1)C(OC[C@@H]1[C@H]([C@H]([C@@H](O1)N1C=C(C2=C1N=CNC2=O)F)O)O)(C1=CC=CC=C1)C1=CC=C(C=C1)OC DKENDMYOVNPXAE-QWOIFIOOSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 206010007269 Carcinogenicity Diseases 0.000 description 1
- 206010048610 Cardiotoxicity Diseases 0.000 description 1
- AOCCBINRVIKJHY-UHFFFAOYSA-N Carmofur Chemical compound CCCCCCNC(=O)N1C=C(F)C(=O)NC1=O AOCCBINRVIKJHY-UHFFFAOYSA-N 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 108010084457 Cathepsins Proteins 0.000 description 1
- 102000005600 Cathepsins Human genes 0.000 description 1
- 108050004290 Cecropin Proteins 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 102000009410 Chemokine receptor Human genes 0.000 description 1
- 108050000299 Chemokine receptor Proteins 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- XTEGARKTQYYJKE-UHFFFAOYSA-M Chlorate Chemical class [O-]Cl(=O)=O XTEGARKTQYYJKE-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- QMBJSIBWORFWQT-DFXBJWIESA-N Chlormadinone acetate Chemical compound C1=C(Cl)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 QMBJSIBWORFWQT-DFXBJWIESA-N 0.000 description 1
- 241000251730 Chondrichthyes Species 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- RURLVUZRUFHCJO-UHFFFAOYSA-N Chromomycin A3 Natural products COC(C1Cc2cc3cc(OC4CC(OC(=O)C)C(OC5CC(O)C(OC)C(C)O5)C(C)O4)c(C)c(O)c3c(O)c2C(=O)C1OC6CC(OC7CC(C)(O)C(OC(=O)C)C(C)O7)C(O)C(C)O6)C(=O)C(O)C(C)O RURLVUZRUFHCJO-UHFFFAOYSA-N 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 208000030808 Clear cell renal carcinoma Diseases 0.000 description 1
- 101000904177 Clupea pallasii Gonadoliberin-1 Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 239000005749 Copper compound Substances 0.000 description 1
- QPLDLSVMHZLSFG-UHFFFAOYSA-N Copper oxide Chemical compound [Cu]=O QPLDLSVMHZLSFG-UHFFFAOYSA-N 0.000 description 1
- 239000005751 Copper oxide Substances 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- FDKWRPBBCBCIGA-UWTATZPHSA-N D-Selenocysteine Natural products [Se]C[C@@H](N)C(O)=O FDKWRPBBCBCIGA-UWTATZPHSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Chemical group CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 1
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 208000021994 Diffuse astrocytoma Diseases 0.000 description 1
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 1
- MWWSFMDVAYGXBV-RUELKSSGSA-N Doxorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-RUELKSSGSA-N 0.000 description 1
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 1
- 108700006830 Drosophila Antp Proteins 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 1
- 101710146526 Dual specificity mitogen-activated protein kinase kinase 1 Proteins 0.000 description 1
- 208000006402 Ductal Carcinoma Diseases 0.000 description 1
- 206010061825 Duodenal neoplasm Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 239000012824 ERK inhibitor Substances 0.000 description 1
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 108050009340 Endothelin Proteins 0.000 description 1
- 102000002045 Endothelin Human genes 0.000 description 1
- SAMRUMKYXPVKPA-VFKOLLTISA-N Enocitabine Chemical compound O=C1N=C(NC(=O)CCCCCCCCCCCCCCCCCCCCC)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 SAMRUMKYXPVKPA-VFKOLLTISA-N 0.000 description 1
- OBMLHUPNRURLOK-XGRAFVIBSA-N Epitiostanol Chemical compound C1[C@@H]2S[C@@H]2C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 OBMLHUPNRURLOK-XGRAFVIBSA-N 0.000 description 1
- VAPSMQAHNAZRKC-PQWRYPMOSA-N Epristeride Chemical compound C1C=C2C=C(C(O)=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)NC(C)(C)C)[C@@]1(C)CC2 VAPSMQAHNAZRKC-PQWRYPMOSA-N 0.000 description 1
- 101710198951 Esculentin-1 Proteins 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 229920003134 Eudragit® polymer Polymers 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 208000017259 Extragonadal germ cell tumor Diseases 0.000 description 1
- UKCVAQGKEOJTSR-UHFFFAOYSA-N Fadrozole hydrochloride Chemical compound Cl.C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 UKCVAQGKEOJTSR-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100028412 Fibroblast growth factor 10 Human genes 0.000 description 1
- 108090001047 Fibroblast growth factor 10 Proteins 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 238000005727 Friedel-Crafts reaction Methods 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 108010087294 GALA peptide Proteins 0.000 description 1
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 description 1
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 1
- BJJXHLWLUDYTGC-ANULTFPQSA-N Gestrinone Chemical compound C1CC(=O)C=C2CC[C@@H]([C@H]3[C@@](CC)([C@](CC3)(O)C#C)C=C3)C3=C21 BJJXHLWLUDYTGC-ANULTFPQSA-N 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 101710183768 Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 235000001453 Glycyrrhiza echinata Nutrition 0.000 description 1
- 244000303040 Glycyrrhiza glabra Species 0.000 description 1
- 235000006200 Glycyrrhiza glabra Nutrition 0.000 description 1
- 235000017382 Glycyrrhiza lepidota Nutrition 0.000 description 1
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 238000003747 Grignard reaction Methods 0.000 description 1
- 239000007818 Grignard reagent Substances 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 229940125497 HER2 kinase inhibitor Drugs 0.000 description 1
- 208000008051 Hereditary Nonpolyposis Colorectal Neoplasms Diseases 0.000 description 1
- 208000017095 Hereditary nonpolyposis colon cancer Diseases 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 101000924488 Homo sapiens Atrial natriuretic peptide receptor 3 Proteins 0.000 description 1
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 description 1
- 101000852870 Homo sapiens Interferon alpha/beta receptor 1 Proteins 0.000 description 1
- 101001090860 Homo sapiens Myeloblastin Proteins 0.000 description 1
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 description 1
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 206010071119 Hormone-dependent prostate cancer Diseases 0.000 description 1
- 238000006546 Horner-Wadsworth-Emmons reaction Methods 0.000 description 1
- 108010070875 Human Immunodeficiency Virus tat Gene Products Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 102000038455 IGF Type 1 Receptor Human genes 0.000 description 1
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 1
- 102000038460 IGF Type 2 Receptor Human genes 0.000 description 1
- 108010031792 IGF Type 2 Receptor Proteins 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- JVHPTYWUBOQMBP-RVFAQHLVSA-N Idarubicin hydrochloride Chemical compound Cl.C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 JVHPTYWUBOQMBP-RVFAQHLVSA-N 0.000 description 1
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 1
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- XQGSVNHIIVBMPX-UHFFFAOYSA-N Improsulfan tosylate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1.CS(=O)(=O)OCCC[NH2+]CCCOS(C)(=O)=O XQGSVNHIIVBMPX-UHFFFAOYSA-N 0.000 description 1
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 description 1
- 208000005726 Inflammatory Breast Neoplasms Diseases 0.000 description 1
- 206010021980 Inflammatory carcinoma of the breast Diseases 0.000 description 1
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102000002227 Interferon Type I Human genes 0.000 description 1
- 108010014726 Interferon Type I Proteins 0.000 description 1
- 102100036714 Interferon alpha/beta receptor 1 Human genes 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108090000193 Interleukin-1 beta Proteins 0.000 description 1
- 102000003777 Interleukin-1 beta Human genes 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 208000037396 Intraductal Noninfiltrating Carcinoma Diseases 0.000 description 1
- 206010073094 Intraductal proliferative breast lesion Diseases 0.000 description 1
- 229920001202 Inulin Polymers 0.000 description 1
- 239000003810 Jones reagent Substances 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 238000006000 Knoevenagel condensation reaction Methods 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- DEFJQIDDEAULHB-IMJSIDKUSA-N L-alanyl-L-alanine Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(O)=O DEFJQIDDEAULHB-IMJSIDKUSA-N 0.000 description 1
- ZGUNAGUHMKGQNY-ZETCQYMHSA-N L-alpha-phenylglycine zwitterion Chemical compound OC(=O)[C@@H](N)C1=CC=CC=C1 ZGUNAGUHMKGQNY-ZETCQYMHSA-N 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 1
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 1
- 239000002138 L01XE21 - Regorafenib Substances 0.000 description 1
- 239000002176 L01XE26 - Cabozantinib Substances 0.000 description 1
- 239000002177 L01XE27 - Ibrutinib Substances 0.000 description 1
- XNRVGTHNYCNCFF-UHFFFAOYSA-N Lapatinib ditosylate monohydrate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1.O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 XNRVGTHNYCNCFF-UHFFFAOYSA-N 0.000 description 1
- 101710128836 Large T antigen Proteins 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- 208000018142 Leiomyosarcoma Diseases 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- 206010067125 Liver injury Diseases 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 1
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 1
- 201000005027 Lynch syndrome Diseases 0.000 description 1
- 229940124647 MEK inhibitor Drugs 0.000 description 1
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 108060003100 Magainin Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000009018 Medullary thyroid cancer Diseases 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 108010036176 Melitten Proteins 0.000 description 1
- IVDYZAAPOLNZKG-KWHRADDSSA-N Mepitiostane Chemical compound O([C@@H]1[C@]2(CC[C@@H]3[C@@]4(C)C[C@H]5S[C@H]5C[C@@H]4CC[C@H]3[C@@H]2CC1)C)C1(OC)CCCC1 IVDYZAAPOLNZKG-KWHRADDSSA-N 0.000 description 1
- 101000797092 Mesorhizobium japonicum (strain LMG 29417 / CECT 9101 / MAFF 303099) Probable acetoacetate decarboxylase 3 Proteins 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 238000006845 Michael addition reaction Methods 0.000 description 1
- 238000005654 Michaelis-Arbuzov synthesis reaction Methods 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 102100023482 Mitogen-activated protein kinase 14 Human genes 0.000 description 1
- 238000006751 Mitsunobu reaction Methods 0.000 description 1
- 102000015728 Mucins Human genes 0.000 description 1
- 108010063954 Mucins Proteins 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101100370002 Mus musculus Tnfsf14 gene Proteins 0.000 description 1
- 102100034681 Myeloblastin Human genes 0.000 description 1
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 1
- 241000251752 Myxine glutinosa Species 0.000 description 1
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- GCIKSSRWRFVXBI-UHFFFAOYSA-N N-[4-[[4-(4-methyl-1-piperazinyl)-6-[(5-methyl-1H-pyrazol-3-yl)amino]-2-pyrimidinyl]thio]phenyl]cyclopropanecarboxamide Chemical compound C1CN(C)CCN1C1=CC(NC2=NNC(C)=C2)=NC(SC=2C=CC(NC(=O)C3CC3)=CC=2)=N1 GCIKSSRWRFVXBI-UHFFFAOYSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- 102100031911 NEDD8 Human genes 0.000 description 1
- 108700004934 NEDD8 Proteins 0.000 description 1
- 101150107958 NEDD8 gene Proteins 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 1
- 101710204212 Neocarzinostatin Proteins 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 102100039306 Nucleotide pyrophosphatase Human genes 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 102000043276 Oncogene Human genes 0.000 description 1
- 101100532088 Oryza sativa subsp. japonica RUB2 gene Proteins 0.000 description 1
- 101100532090 Oryza sativa subsp. japonica RUB3 gene Proteins 0.000 description 1
- 208000007571 Ovarian Epithelial Carcinoma Diseases 0.000 description 1
- 206010033268 Ovarian low malignant potential tumour Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 239000012661 PARP inhibitor Substances 0.000 description 1
- 239000012828 PI3K inhibitor Substances 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 description 1
- 206010034811 Pharyngeal cancer Diseases 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 201000007286 Pilocytic astrocytoma Diseases 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 201000005746 Pituitary adenoma Diseases 0.000 description 1
- 206010061538 Pituitary tumour benign Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 108010069381 Platelet Endothelial Cell Adhesion Molecule-1 Proteins 0.000 description 1
- 102100024616 Platelet endothelial cell adhesion molecule Human genes 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 description 1
- 229920002701 Polyoxyl 40 Stearate Polymers 0.000 description 1
- HFVNWDWLWUCIHC-GUPDPFMOSA-N Prednimustine Chemical compound O=C([C@@]1(O)CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)[C@@H](O)C[C@@]21C)COC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 HFVNWDWLWUCIHC-GUPDPFMOSA-N 0.000 description 1
- HCBIBCJNVBAKAB-UHFFFAOYSA-N Procaine hydrochloride Chemical compound Cl.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 HCBIBCJNVBAKAB-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 229940079156 Proteasome inhibitor Drugs 0.000 description 1
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 1
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 1
- 239000004373 Pullulan Substances 0.000 description 1
- 229920001218 Pullulan Polymers 0.000 description 1
- 102000007615 Pulmonary Surfactant-Associated Protein A Human genes 0.000 description 1
- 108010007100 Pulmonary Surfactant-Associated Protein A Proteins 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 108010086344 RALA peptide Proteins 0.000 description 1
- 239000007868 Raney catalyst Substances 0.000 description 1
- NPXOKRUENSOPAO-UHFFFAOYSA-N Raney nickel Chemical compound [Al].[Ni] NPXOKRUENSOPAO-UHFFFAOYSA-N 0.000 description 1
- 229910000564 Raney nickel Inorganic materials 0.000 description 1
- AHHFEZNOXOZZQA-ZEBDFXRSSA-N Ranimustine Chemical compound CO[C@H]1O[C@H](CNC(=O)N(CCCl)N=O)[C@@H](O)[C@H](O)[C@H]1O AHHFEZNOXOZZQA-ZEBDFXRSSA-N 0.000 description 1
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 1
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 206010074268 Reproductive toxicity Diseases 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 229920002305 Schizophyllan Polymers 0.000 description 1
- 238000006223 Seyferth-Gilbert homologation reaction Methods 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 206010054184 Small intestine carcinoma Diseases 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 108010056088 Somatostatin Proteins 0.000 description 1
- 102000005157 Somatostatin Human genes 0.000 description 1
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 241000251576 Styela clava Species 0.000 description 1
- 229920000147 Styrene maleic anhydride Polymers 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- GNVMUORYQLCPJZ-UHFFFAOYSA-M Thiocarbamate Chemical compound NC([S-])=O GNVMUORYQLCPJZ-UHFFFAOYSA-M 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 1
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 1
- IWEQQRMGNVVKQW-OQKDUQJOSA-N Toremifene citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 IWEQQRMGNVVKQW-OQKDUQJOSA-N 0.000 description 1
- 101800001690 Transmembrane protein gp41 Proteins 0.000 description 1
- YCPOZVAOBBQLRI-WDSKDSINSA-N Treosulfan Chemical compound CS(=O)(=O)OC[C@H](O)[C@@H](O)COS(C)(=O)=O YCPOZVAOBBQLRI-WDSKDSINSA-N 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- 240000000581 Triticum monococcum Species 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 238000005874 Vilsmeier-Haack formylation reaction Methods 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 229930003779 Vitamin B12 Natural products 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 238000007239 Wittig reaction Methods 0.000 description 1
- 238000006734 Wohl-Ziegler bromination reaction Methods 0.000 description 1
- 241000269370 Xenopus <genus> Species 0.000 description 1
- 101100020289 Xenopus laevis koza gene Proteins 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- GZOSMCIZMLWJML-VJLLXTKPSA-N abiraterone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CC[C@H](O)CC3=CC2)C)CC[C@@]11C)C=C1C1=CC=CN=C1 GZOSMCIZMLWJML-VJLLXTKPSA-N 0.000 description 1
- 229960000853 abiraterone Drugs 0.000 description 1
- IKHGUXGNUITLKF-XPULMUKRSA-N acetaldehyde Chemical compound [14CH]([14CH3])=O IKHGUXGNUITLKF-XPULMUKRSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- IYKJEILNJZQJPU-UHFFFAOYSA-N acetic acid;butanedioic acid Chemical compound CC(O)=O.OC(=O)CCC(O)=O IYKJEILNJZQJPU-UHFFFAOYSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 1
- 229960004176 aclarubicin Drugs 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 150000001266 acyl halides Chemical class 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 238000007259 addition reaction Methods 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 201000008395 adenosquamous carcinoma Diseases 0.000 description 1
- 229960001686 afatinib Drugs 0.000 description 1
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 1
- 108010056243 alanylalanine Proteins 0.000 description 1
- 108010011559 alanylphenylalanine Proteins 0.000 description 1
- 229960001611 alectinib Drugs 0.000 description 1
- KDGFLJKFZUIJMX-UHFFFAOYSA-N alectinib Chemical compound CCC1=CC=2C(=O)C(C3=CC=C(C=C3N3)C#N)=C3C(C)(C)C=2C=C1N(CC1)CCC1N1CCOCC1 KDGFLJKFZUIJMX-UHFFFAOYSA-N 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000006323 alkenyl amino group Chemical group 0.000 description 1
- 125000005090 alkenylcarbonyl group Chemical group 0.000 description 1
- 125000005108 alkenylthio group Chemical group 0.000 description 1
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 description 1
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 1
- 125000005130 alkyl carbonyl thio group Chemical group 0.000 description 1
- 150000004791 alkyl magnesium halides Chemical class 0.000 description 1
- 125000005103 alkyl silyl group Chemical group 0.000 description 1
- 125000005153 alkyl sulfamoyl group Chemical group 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 229960002692 allylestrenol Drugs 0.000 description 1
- 125000005336 allyloxy group Chemical group 0.000 description 1
- 239000002160 alpha blocker Substances 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229940124308 alpha-adrenoreceptor antagonist Drugs 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 150000001409 amidines Chemical class 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 206010002224 anaplastic astrocytoma Diseases 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- KZOWNALBTMILAP-JBMRGDGGSA-N ancitabine hydrochloride Chemical compound Cl.N=C1C=CN2[C@@H]3O[C@H](CO)[C@@H](O)[C@@H]3OC2=N1 KZOWNALBTMILAP-JBMRGDGGSA-N 0.000 description 1
- 229960003473 androstanolone Drugs 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 229950006323 angiotensin ii Drugs 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 125000002078 anthracen-1-yl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C([*])=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 125000000748 anthracen-2-yl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C([H])=C([*])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- GLGAUBPACOBAMV-DOFZRALJSA-N arachidonylcyclopropylamide Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)NC1CC1 GLGAUBPACOBAMV-DOFZRALJSA-N 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 125000005126 aryl alkyl carbonyl amino group Chemical group 0.000 description 1
- 125000004659 aryl alkyl thio group Chemical group 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 150000001502 aryl halides Chemical class 0.000 description 1
- 150000004792 aryl magnesium halides Chemical class 0.000 description 1
- 125000005135 aryl sulfinyl group Chemical group 0.000 description 1
- 125000005110 aryl thio group Chemical group 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000000065 atmospheric pressure chemical ionisation Methods 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 108010038647 atrial natriuretic factor receptor C Proteins 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 239000005441 aurora Substances 0.000 description 1
- 229960003005 axitinib Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 125000003725 azepanyl group Chemical group 0.000 description 1
- 125000002785 azepinyl group Chemical group 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000004069 aziridinyl group Chemical group 0.000 description 1
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 1
- 229960002707 bendamustine Drugs 0.000 description 1
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- 235000012216 bentonite Nutrition 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 125000000043 benzamido group Chemical group [H]N([*])C(=O)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004604 benzisothiazolyl group Chemical group S1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- RROBIDXNTUAHFW-UHFFFAOYSA-N benzotriazol-1-yloxy-tris(dimethylamino)phosphanium Chemical class C1=CC=C2N(O[P+](N(C)C)(N(C)C)N(C)C)N=NC2=C1 RROBIDXNTUAHFW-UHFFFAOYSA-N 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 125000001231 benzoyloxy group Chemical group C(C1=CC=CC=C1)(=O)O* 0.000 description 1
- MMIMIFULGMZVPO-UHFFFAOYSA-N benzyl 3-bromo-2,6-dinitro-5-phenylmethoxybenzoate Chemical compound [O-][N+](=O)C1=C(C(=O)OCC=2C=CC=CC=2)C([N+](=O)[O-])=C(Br)C=C1OCC1=CC=CC=C1 MMIMIFULGMZVPO-UHFFFAOYSA-N 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- PUJDIJCNWFYVJX-UHFFFAOYSA-N benzyl carbamate Chemical group NC(=O)OCC1=CC=CC=C1 PUJDIJCNWFYVJX-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- 125000000440 benzylamino group Chemical group [H]N(*)C([H])([H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 1
- 229940000635 beta-alanine Drugs 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960002537 betamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-DVTGEIKXSA-N betamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-DVTGEIKXSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 230000002457 bidirectional effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 229960004395 bleomycin sulfate Drugs 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical class B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- 208000012172 borderline epithelial tumor of ovary Diseases 0.000 description 1
- CKDOCTFBFTVPSN-UHFFFAOYSA-N borneol Chemical group C1CC2(C)C(C)CC1C2(C)C CKDOCTFBFTVPSN-UHFFFAOYSA-N 0.000 description 1
- 229940116229 borneol Drugs 0.000 description 1
- UWTDFICHZKXYAC-UHFFFAOYSA-N boron;oxolane Chemical compound [B].C1CCOC1 UWTDFICHZKXYAC-UHFFFAOYSA-N 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 229960000455 brentuximab vedotin Drugs 0.000 description 1
- NYRQVWBYQPGUGZ-NBJPCVDMSA-N brevinin-2 Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CCCCN)NC(=O)CNC(=O)[C@H](CCSC)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(N)=O)C1=CC=CC=C1 NYRQVWBYQPGUGZ-NBJPCVDMSA-N 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- IYYIVELXUANFED-UHFFFAOYSA-N bromo(trimethyl)silane Chemical compound C[Si](C)(C)Br IYYIVELXUANFED-UHFFFAOYSA-N 0.000 description 1
- 239000006189 buccal tablet Substances 0.000 description 1
- CUWODFFVMXJOKD-UVLQAERKSA-N buserelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](COC(C)(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 CUWODFFVMXJOKD-UVLQAERKSA-N 0.000 description 1
- 229960002719 buserelin Drugs 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- PKFDLKSEZWEFGL-MHARETSRSA-N c-di-GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=C(C(NC(N)=N5)=O)N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 PKFDLKSEZWEFGL-MHARETSRSA-N 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- BMQGVNUXMIRLCK-OAGWZNDDSA-N cabazitaxel Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3C[C@@H]([C@]2(C(=O)[C@H](OC)C2=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=3C=CC=CC=3)C[C@]1(O)C2(C)C)C)OC)C(=O)C1=CC=CC=C1 BMQGVNUXMIRLCK-OAGWZNDDSA-N 0.000 description 1
- 229960001573 cabazitaxel Drugs 0.000 description 1
- 229960001292 cabozantinib Drugs 0.000 description 1
- ONIQOQHATWINJY-UHFFFAOYSA-N cabozantinib Chemical compound C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 ONIQOQHATWINJY-UHFFFAOYSA-N 0.000 description 1
- 108700002839 cactinomycin Proteins 0.000 description 1
- 235000008207 calcium folinate Nutrition 0.000 description 1
- 239000011687 calcium folinate Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- KVUAALJSMIVURS-QNTKWALQSA-L calcium;(2s)-2-[[4-[[(6s)-2-amino-5-formyl-4-oxo-1,6,7,8-tetrahydropteridin-6-yl]methylamino]benzoyl]amino]pentanedioate Chemical compound [Ca+2].C([C@@H]1N(C=O)C=2C(=O)N=C(NC=2NC1)N)NC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-QNTKWALQSA-L 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 125000005587 carbonate group Chemical group 0.000 description 1
- 238000003763 carbonization Methods 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 230000007670 carcinogenicity Effects 0.000 description 1
- 231100000260 carcinogenicity Toxicity 0.000 description 1
- 231100000259 cardiotoxicity Toxicity 0.000 description 1
- 229960003261 carmofur Drugs 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- POIUWJQBRNEFGX-XAMSXPGMSA-N cathelicidin Chemical compound C([C@@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(C)C)C1=CC=CC=C1 POIUWJQBRNEFGX-XAMSXPGMSA-N 0.000 description 1
- 108060001132 cathelicidin Proteins 0.000 description 1
- 102000014509 cathelicidin Human genes 0.000 description 1
- 239000003729 cation exchange resin Substances 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 229960001602 ceritinib Drugs 0.000 description 1
- WRXDGGCKOUEOPW-UHFFFAOYSA-N ceritinib Chemical compound CC=1C=C(NC=2N=C(NC=3C(=CC=CC=3)NS(=O)(=O)C(C)C)C(Cl)=CN=2)C(OC(C)C)=CC=1C1CCNCC1 WRXDGGCKOUEOPW-UHFFFAOYSA-N 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 229960001616 chlormadinone acetate Drugs 0.000 description 1
- 125000002668 chloroacetyl group Chemical group ClCC(=O)* 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- IDNJBJJSMDYULP-UHFFFAOYSA-N chlorophosphonamidous acid Chemical compound NP(O)Cl IDNJBJJSMDYULP-UHFFFAOYSA-N 0.000 description 1
- BFPSDSIWYFKGBC-UHFFFAOYSA-N chlorotrianisene Chemical compound C1=CC(OC)=CC=C1C(Cl)=C(C=1C=CC(OC)=CC=1)C1=CC=C(OC)C=C1 BFPSDSIWYFKGBC-UHFFFAOYSA-N 0.000 description 1
- 229960002559 chlorotrianisene Drugs 0.000 description 1
- QBWCMBCROVPCKQ-UHFFFAOYSA-N chlorous acid Chemical class OCl=O QBWCMBCROVPCKQ-UHFFFAOYSA-N 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- RPKLZQLYODPWTM-KBMWBBLPSA-N cholanoic acid Chemical compound C1CC2CCCC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@@H](CCC(O)=O)C)[C@@]1(C)CC2 RPKLZQLYODPWTM-KBMWBBLPSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- ZYVSOIYQKUDENJ-WKSBCEQHSA-N chromomycin A3 Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@@H]1OC(C)=O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@@H](O)[C@H](O[C@@H]3O[C@@H](C)[C@H](OC(C)=O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@@H]1C[C@@H](O)[C@@H](OC)[C@@H](C)O1 ZYVSOIYQKUDENJ-WKSBCEQHSA-N 0.000 description 1
- 230000007665 chronic toxicity Effects 0.000 description 1
- 231100000160 chronic toxicity Toxicity 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 235000013477 citrulline Nutrition 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- AGOYDEPGAOXOCK-KCBOHYOISA-N clarithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@](C)([C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)OC)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 AGOYDEPGAOXOCK-KCBOHYOISA-N 0.000 description 1
- 229960002626 clarithromycin Drugs 0.000 description 1
- 206010073251 clear cell renal cell carcinoma Diseases 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 150000001869 cobalt compounds Chemical class 0.000 description 1
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 description 1
- 238000002288 cocrystallisation Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 229940000425 combination drug Drugs 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 150000001880 copper compounds Chemical class 0.000 description 1
- 229910000431 copper oxide Inorganic materials 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 229960005061 crizotinib Drugs 0.000 description 1
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 1
- 238000012866 crystallographic experiment Methods 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- PDXMFTWFFKBFIN-XPWFQUROSA-N cyclic di-AMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=NC=NC(N)=C5N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 PDXMFTWFFKBFIN-XPWFQUROSA-N 0.000 description 1
- 239000002875 cyclin dependent kinase inhibitor Substances 0.000 description 1
- 229940043378 cyclin-dependent kinase inhibitor Drugs 0.000 description 1
- 125000006310 cycloalkyl amino group Chemical group 0.000 description 1
- 125000006254 cycloalkyl carbonyl group Chemical group 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000005366 cycloalkylthio group Chemical group 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- NKLCHDQGUHMCGL-UHFFFAOYSA-N cyclohexylidenemethanone Chemical group O=C=C1CCCCC1 NKLCHDQGUHMCGL-UHFFFAOYSA-N 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000004410 cyclooctyloxy group Chemical group C1(CCCCCCC1)O* 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 125000000298 cyclopropenyl group Chemical group [H]C1=C([H])C1([H])* 0.000 description 1
- UWFYSQMTEOIJJG-FDTZYFLXSA-N cyproterone acetate Chemical compound C1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 UWFYSQMTEOIJJG-FDTZYFLXSA-N 0.000 description 1
- 229960000978 cyproterone acetate Drugs 0.000 description 1
- 210000004292 cytoskeleton Anatomy 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- POZRVZJJTULAOH-LHZXLZLDSA-N danazol Chemical compound C1[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=CC2=C1C=NO2 POZRVZJJTULAOH-LHZXLZLDSA-N 0.000 description 1
- 229960000766 danazol Drugs 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- 229960003109 daunorubicin hydrochloride Drugs 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 231100001020 decreased hemoglobin concentration Toxicity 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000012024 dehydrating agents Substances 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- CFCUWKMKBJTWLW-UHFFFAOYSA-N deoliosyl-3C-alpha-L-digitoxosyl-MTM Natural products CC=1C(O)=C2C(O)=C3C(=O)C(OC4OC(C)C(O)C(OC5OC(C)C(O)C(OC6OC(C)C(O)C(C)(O)C6)C5)C4)C(C(OC)C(=O)C(O)C(C)O)CC3=CC2=CC=1OC(OC(C)C1O)CC1OC1CC(O)C(O)C(C)O1 CFCUWKMKBJTWLW-UHFFFAOYSA-N 0.000 description 1
- YFHLIDBAPTWLGU-CTKMSOPVSA-N dermaseptin Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O)[C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCSC)NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)N)[C@@H](C)O)[C@@H](C)O)C1=CN=CN1 YFHLIDBAPTWLGU-CTKMSOPVSA-N 0.000 description 1
- 108090000454 dermaseptin Proteins 0.000 description 1
- 229940049701 dermaseptin Drugs 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- ZLRAAUUPULJGTL-UHFFFAOYSA-N diaminophosphinous acid Chemical class NP(N)O ZLRAAUUPULJGTL-UHFFFAOYSA-N 0.000 description 1
- 125000005959 diazepanyl group Chemical group 0.000 description 1
- MHDVGSVTJDSBDK-UHFFFAOYSA-N dibenzyl ether Chemical group C=1C=CC=CC=1COCC1=CC=CC=C1 MHDVGSVTJDSBDK-UHFFFAOYSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- NLORYLAYLIXTID-ISLYRVAYSA-N diethylstilbestrol diphosphate Chemical compound C=1C=C(OP(O)(O)=O)C=CC=1C(/CC)=C(\CC)C1=CC=C(OP(O)(O)=O)C=C1 NLORYLAYLIXTID-ISLYRVAYSA-N 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- 125000000723 dihydrobenzofuranyl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 description 1
- 125000005435 dihydrobenzoxazolyl group Chemical group O1C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004655 dihydropyridinyl group Chemical group N1(CC=CC=C1)* 0.000 description 1
- 125000005072 dihydrothiopyranyl group Chemical group S1C(CCC=C1)* 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- QKIUAMUSENSFQQ-UHFFFAOYSA-N dimethylazanide Chemical group C[N-]C QKIUAMUSENSFQQ-UHFFFAOYSA-N 0.000 description 1
- JMQGGPRJQOQKRT-UHFFFAOYSA-N diphenyl hydrogen phosphate;azide Chemical compound [N-]=[N+]=[N-].C=1C=CC=CC=1OP(=O)(O)OC1=CC=CC=C1 JMQGGPRJQOQKRT-UHFFFAOYSA-N 0.000 description 1
- VDCSGNNYCFPWFK-UHFFFAOYSA-N diphenylsilane Chemical compound C=1C=CC=CC=1[SiH2]C1=CC=CC=C1 VDCSGNNYCFPWFK-UHFFFAOYSA-N 0.000 description 1
- BXLNWOAYQXBHCY-UHFFFAOYSA-N diphenylsilylidene(diphenyl)silane Chemical compound C1=CC=CC=C1[Si](C=1C=CC=CC=1)=[Si](C=1C=CC=CC=1)C1=CC=CC=C1 BXLNWOAYQXBHCY-UHFFFAOYSA-N 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-N dithiophosphoric acid Chemical group OP(O)(S)=S NAGJZTKCGNOGPW-UHFFFAOYSA-N 0.000 description 1
- DTGKSKDOIYIVQL-UHFFFAOYSA-N dl-isoborneol Chemical group C1CC2(C)C(O)CC1C2(C)C DTGKSKDOIYIVQL-UHFFFAOYSA-N 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 229950005454 doxifluridine Drugs 0.000 description 1
- ZWAOHEXOSAUJHY-ZIYNGMLESA-N doxifluridine Chemical compound O[C@@H]1[C@H](O)[C@@H](C)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ZWAOHEXOSAUJHY-ZIYNGMLESA-N 0.000 description 1
- 229960002918 doxorubicin hydrochloride Drugs 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 229950004203 droloxifene Drugs 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 208000028715 ductal breast carcinoma in situ Diseases 0.000 description 1
- 201000007273 ductal carcinoma in situ Diseases 0.000 description 1
- 201000000312 duodenum cancer Diseases 0.000 description 1
- JWJOTENAMICLJG-QWBYCMEYSA-N dutasteride Chemical compound O=C([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)N[C@@H]4CC3)C)CC[C@@]21C)NC1=CC(C(F)(F)F)=CC=C1C(F)(F)F JWJOTENAMICLJG-QWBYCMEYSA-N 0.000 description 1
- 229960004199 dutasteride Drugs 0.000 description 1
- 125000006575 electron-withdrawing group Chemical group 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 239000012156 elution solvent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 201000011523 endocrine gland cancer Diseases 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 229950011487 enocitabine Drugs 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 1
- 229950002189 enzastaurin Drugs 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229960003265 epirubicin hydrochloride Drugs 0.000 description 1
- 229950002973 epitiostanol Drugs 0.000 description 1
- 229950009537 epristeride Drugs 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- IIUMCNJTGSMNRO-VVSKJQCTSA-L estramustine sodium phosphate Chemical compound [Na+].[Na+].ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)OP([O-])([O-])=O)[C@@H]4[C@@H]3CCC2=C1 IIUMCNJTGSMNRO-VVSKJQCTSA-L 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- HQPMKSGTIOYHJT-UHFFFAOYSA-N ethane-1,2-diol;propane-1,2-diol Chemical compound OCCO.CC(O)CO HQPMKSGTIOYHJT-UHFFFAOYSA-N 0.000 description 1
- 125000005949 ethanesulfonyloxy group Chemical group 0.000 description 1
- 150000002168 ethanoic acid esters Chemical group 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 229950001118 ethinylestradiol sulfonate Drugs 0.000 description 1
- KPEUDULLQDHKAZ-VROINQGHSA-N ethinylestradiol sulfonate Chemical compound C1C[C@]2(C)[C@@](C#C)(O)CC[C@H]2[C@@H]2CCC3=CC(OS(=O)(=O)C(C)C)=CC=C3[C@H]21 KPEUDULLQDHKAZ-VROINQGHSA-N 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- GOZRRIWDZQPGMN-UHFFFAOYSA-N ethyl 2-[5-(7h-purin-6-ylsulfanyl)pentanoylamino]acetate Chemical compound CCOC(=O)CNC(=O)CCCCSC1=NC=NC2=C1NC=N2 GOZRRIWDZQPGMN-UHFFFAOYSA-N 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 1
- 229960000752 etoposide phosphate Drugs 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 208000020603 familial colorectal cancer Diseases 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 201000001169 fibrillary astrocytoma Diseases 0.000 description 1
- 239000007941 film coated tablet Substances 0.000 description 1
- DBEPLOCGEIEOCV-WSBQPABSSA-N finasteride Chemical compound N([C@@H]1CC2)C(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](C(=O)NC(C)(C)C)[C@@]2(C)CC1 DBEPLOCGEIEOCV-WSBQPABSSA-N 0.000 description 1
- 229960004039 finasteride Drugs 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- 229960000297 fosfestrol Drugs 0.000 description 1
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 1
- 229960004783 fotemustine Drugs 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 229960002737 fructose Drugs 0.000 description 1
- NGGMYCMLYOUNGM-CSDLUJIJSA-N fumagillin Chemical compound C([C@H]([C@H]([C@@H]1[C@]2(C)[C@H](O2)CC=C(C)C)OC)OC(=O)\C=C\C=C\C=C\C=C\C(O)=O)C[C@@]21CO2 NGGMYCMLYOUNGM-CSDLUJIJSA-N 0.000 description 1
- 229960000936 fumagillin Drugs 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 125000004612 furopyridinyl group Chemical group O1C(=CC2=C1C=CC=N2)* 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 230000000799 fusogenic effect Effects 0.000 description 1
- 150000002256 galaktoses Chemical class 0.000 description 1
- 229950004410 galocitabine Drugs 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 229920000370 gamma-poly(glutamate) polymer Polymers 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 231100000025 genetic toxicology Toxicity 0.000 description 1
- 230000001738 genotoxic effect Effects 0.000 description 1
- 201000008822 gestational choriocarcinoma Diseases 0.000 description 1
- 229960004761 gestrinone Drugs 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 229940049906 glutamate Drugs 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 108010067216 glycyl-glycyl-glycine Proteins 0.000 description 1
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 1
- 229960003690 goserelin acetate Drugs 0.000 description 1
- 239000003966 growth inhibitor Substances 0.000 description 1
- 208000024963 hair loss Diseases 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 229960003569 hematoporphyrin Drugs 0.000 description 1
- 231100000234 hepatic damage Toxicity 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 125000000268 heptanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- GNOIPBMMFNIUFM-UHFFFAOYSA-N hexamethylphosphoric triamide Chemical compound CN(C)P(=O)(N(C)C)N(C)C GNOIPBMMFNIUFM-UHFFFAOYSA-N 0.000 description 1
- 125000005935 hexyloxycarbonyl group Chemical group 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 108091008039 hormone receptors Proteins 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 125000005597 hydrazone group Chemical group 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 1
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 1
- 238000009217 hyperthermia therapy Methods 0.000 description 1
- AQYSYJUIMQTRMV-UHFFFAOYSA-N hypofluorous acid Chemical compound FO AQYSYJUIMQTRMV-UHFFFAOYSA-N 0.000 description 1
- 229960001507 ibrutinib Drugs 0.000 description 1
- XYFPWWZEPKGCCK-GOSISDBHSA-N ibrutinib Chemical compound C1=2C(N)=NC=NC=2N([C@H]2CN(CCC2)C(=O)C=C)N=C1C(C=C1)=CC=C1OC1=CC=CC=C1 XYFPWWZEPKGCCK-GOSISDBHSA-N 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 229960001176 idarubicin hydrochloride Drugs 0.000 description 1
- IFSDAJWBUCMOAH-HNNXBMFYSA-N idelalisib Chemical compound C1([C@@H](NC=2C=3N=CNC=3N=CN=2)CC)=NC2=CC=CC(F)=C2C(=O)N1C1=CC=CC=C1 IFSDAJWBUCMOAH-HNNXBMFYSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000004857 imidazopyridinyl group Chemical group N1C(=NC2=C1C=CC=N2)* 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 229950008097 improsulfan Drugs 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- FMFIFGLHVOZDEL-UHFFFAOYSA-N indotecan Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2C=2C(=O)C3=CC=4OCOC=4C=C3C=2N1CCCN1CCOCC1 FMFIFGLHVOZDEL-UHFFFAOYSA-N 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 201000004653 inflammatory breast carcinoma Diseases 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 239000000138 intercalating agent Substances 0.000 description 1
- 108010045851 interleukin 2 inhibitor Proteins 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 201000002313 intestinal cancer Diseases 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- JYJIGFIDKWBXDU-MNNPPOADSA-N inulin Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)OC[C@]1(OC[C@]2(OC[C@]3(OC[C@]4(OC[C@]5(OC[C@]6(OC[C@]7(OC[C@]8(OC[C@]9(OC[C@]%10(OC[C@]%11(OC[C@]%12(OC[C@]%13(OC[C@]%14(OC[C@]%15(OC[C@]%16(OC[C@]%17(OC[C@]%18(OC[C@]%19(OC[C@]%20(OC[C@]%21(OC[C@]%22(OC[C@]%23(OC[C@]%24(OC[C@]%25(OC[C@]%26(OC[C@]%27(OC[C@]%28(OC[C@]%29(OC[C@]%30(OC[C@]%31(OC[C@]%32(OC[C@]%33(OC[C@]%34(OC[C@]%35(OC[C@]%36(O[C@@H]%37[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O%37)O)[C@H]([C@H](O)[C@@H](CO)O%36)O)[C@H]([C@H](O)[C@@H](CO)O%35)O)[C@H]([C@H](O)[C@@H](CO)O%34)O)[C@H]([C@H](O)[C@@H](CO)O%33)O)[C@H]([C@H](O)[C@@H](CO)O%32)O)[C@H]([C@H](O)[C@@H](CO)O%31)O)[C@H]([C@H](O)[C@@H](CO)O%30)O)[C@H]([C@H](O)[C@@H](CO)O%29)O)[C@H]([C@H](O)[C@@H](CO)O%28)O)[C@H]([C@H](O)[C@@H](CO)O%27)O)[C@H]([C@H](O)[C@@H](CO)O%26)O)[C@H]([C@H](O)[C@@H](CO)O%25)O)[C@H]([C@H](O)[C@@H](CO)O%24)O)[C@H]([C@H](O)[C@@H](CO)O%23)O)[C@H]([C@H](O)[C@@H](CO)O%22)O)[C@H]([C@H](O)[C@@H](CO)O%21)O)[C@H]([C@H](O)[C@@H](CO)O%20)O)[C@H]([C@H](O)[C@@H](CO)O%19)O)[C@H]([C@H](O)[C@@H](CO)O%18)O)[C@H]([C@H](O)[C@@H](CO)O%17)O)[C@H]([C@H](O)[C@@H](CO)O%16)O)[C@H]([C@H](O)[C@@H](CO)O%15)O)[C@H]([C@H](O)[C@@H](CO)O%14)O)[C@H]([C@H](O)[C@@H](CO)O%13)O)[C@H]([C@H](O)[C@@H](CO)O%12)O)[C@H]([C@H](O)[C@@H](CO)O%11)O)[C@H]([C@H](O)[C@@H](CO)O%10)O)[C@H]([C@H](O)[C@@H](CO)O9)O)[C@H]([C@H](O)[C@@H](CO)O8)O)[C@H]([C@H](O)[C@@H](CO)O7)O)[C@H]([C@H](O)[C@@H](CO)O6)O)[C@H]([C@H](O)[C@@H](CO)O5)O)[C@H]([C@H](O)[C@@H](CO)O4)O)[C@H]([C@H](O)[C@@H](CO)O3)O)[C@H]([C@H](O)[C@@H](CO)O2)O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JYJIGFIDKWBXDU-MNNPPOADSA-N 0.000 description 1
- 229940029339 inulin Drugs 0.000 description 1
- 229960004903 invert sugar Drugs 0.000 description 1
- JYJVVHFRSFVEJM-UHFFFAOYSA-N iodosobenzene Chemical compound O=IC1=CC=CC=C1 JYJVVHFRSFVEJM-UHFFFAOYSA-N 0.000 description 1
- 238000000752 ionisation method Methods 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 1
- FBAFATDZDUQKNH-UHFFFAOYSA-M iron chloride Chemical compound [Cl-].[Fe] FBAFATDZDUQKNH-UHFFFAOYSA-M 0.000 description 1
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 125000005929 isobutyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])OC(*)=O 0.000 description 1
- 229940047889 isobutyramide Drugs 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000005928 isopropyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- MXAYKZJJDUDWDS-LBPRGKRZSA-N ixazomib Chemical compound CC(C)C[C@@H](B(O)O)NC(=O)CNC(=O)C1=CC(Cl)=CC=C1Cl MXAYKZJJDUDWDS-LBPRGKRZSA-N 0.000 description 1
- 229960003648 ixazomib Drugs 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 229960004891 lapatinib Drugs 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 238000000608 laser ablation Methods 0.000 description 1
- 150000002611 lead compounds Chemical class 0.000 description 1
- ACKFDYCQCBEDNU-UHFFFAOYSA-J lead(2+);tetraacetate Chemical compound [Pb+2].CC([O-])=O.CC([O-])=O.CC([O-])=O.CC([O-])=O ACKFDYCQCBEDNU-UHFFFAOYSA-J 0.000 description 1
- 229960004942 lenalidomide Drugs 0.000 description 1
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 229960002293 leucovorin calcium Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 201000002364 leukopenia Diseases 0.000 description 1
- 231100001022 leukopenia Toxicity 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 229950002728 levormeloxifene Drugs 0.000 description 1
- XZEUAXYWNKYKPL-WDYNHAJCSA-N levormeloxifene Chemical compound C1([C@H]2[C@@H](C3=CC=C(C=C3OC2(C)C)OC)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1 XZEUAXYWNKYKPL-WDYNHAJCSA-N 0.000 description 1
- UGFHIPBXIWJXNA-UHFFFAOYSA-N liarozole Chemical compound ClC1=CC=CC(C(C=2C=C3NC=NC3=CC=2)N2C=NC=C2)=C1 UGFHIPBXIWJXNA-UHFFFAOYSA-N 0.000 description 1
- 229950007056 liarozole Drugs 0.000 description 1
- 229940010454 licorice Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002634 lipophilic molecules Chemical class 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 1
- GLNWILHOFOBOFD-UHFFFAOYSA-N lithium sulfide Chemical compound [Li+].[Li+].[S-2] GLNWILHOFOBOFD-UHFFFAOYSA-N 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000008818 liver damage Effects 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 229940041033 macrolides Drugs 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 208000006178 malignant mesothelioma Diseases 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 150000002703 mannose derivatives Chemical class 0.000 description 1
- 125000002960 margaryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 229950008001 matuzumab Drugs 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- VDXZNPDIRNWWCW-JFTDCZMZSA-N melittin Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(N)=O)CC1=CNC2=CC=CC=C12 VDXZNPDIRNWWCW-JFTDCZMZSA-N 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 229960000667 mepartricin Drugs 0.000 description 1
- 229950009246 mepitiostane Drugs 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 229960005558 mertansine Drugs 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 229910052987 metal hydride Inorganic materials 0.000 description 1
- 150000004681 metal hydrides Chemical class 0.000 description 1
- AFCCDDWKHLHPDF-UHFFFAOYSA-M metam-sodium Chemical compound [Na+].CNC([S-])=S AFCCDDWKHLHPDF-UHFFFAOYSA-M 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 229920003145 methacrylic acid copolymer Polymers 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical group CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- IZDROVVXIHRYMH-UHFFFAOYSA-N methanesulfonic anhydride Chemical compound CS(=O)(=O)OS(C)(=O)=O IZDROVVXIHRYMH-UHFFFAOYSA-N 0.000 description 1
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical group CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 125000005948 methanesulfonyloxy group Chemical group 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- NSPJNIDYTSSIIY-UHFFFAOYSA-N methoxy(methoxymethoxy)methane Chemical group COCOCOC NSPJNIDYTSSIIY-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 238000006063 methoxycarbonylation reaction Methods 0.000 description 1
- ALPPGSBMHVCELA-WHUUVLPESA-N methyl (19E,21E,23E,25E,27E,29E,31E)-33-[(2R,3S,4S,5S,6R)-4-amino-3,5-dihydroxy-6-methyloxan-2-yl]oxy-17-[7-(4-aminophenyl)-5-hydroxy-7-oxoheptan-2-yl]-1,3,5,7,9,13,37-heptahydroxy-18-methyl-11,15-dioxo-16,39-dioxabicyclo[33.3.1]nonatriaconta-19,21,23,25,27,29,31-heptaene-36-carboxylate methyl (19E,21E,23E,25E,27E,29E,31E)-33-[(2R,3S,4S,5S,6R)-4-amino-3,5-dihydroxy-6-methyloxan-2-yl]oxy-1,3,5,7,9,13,37-heptahydroxy-17-[5-hydroxy-7-[4-(methylamino)phenyl]-7-oxoheptan-2-yl]-18-methyl-11,15-dioxo-16,39-dioxabicyclo[33.3.1]nonatriaconta-19,21,23,25,27,29,31-heptaene-36-carboxylate Chemical compound CC1\C=C\C=C\C=C\C=C\C=C\C=C\C=C\C(O[C@H]2[C@H]([C@@H](N)[C@H](O)[C@@H](C)O2)O)CC(O2)C(C(=O)OC)C(O)CC2(O)CC(O)CC(O)CC(O)CC(O)CC(=O)CC(O)CC(=O)OC1C(C)CCC(O)CC(=O)C1=CC=C(N)C=C1.C1=CC(NC)=CC=C1C(=O)CC(O)CCC(C)C1C(C)/C=C/C=C/C=C/C=C/C=C/C=C/C=C/C(O[C@H]2[C@H]([C@@H](N)[C@H](O)[C@@H](C)O2)O)CC(O2)C(C(=O)OC)C(O)CC2(O)CC(O)CC(O)CC(O)CC(O)CC(=O)CC(O)CC(=O)O1 ALPPGSBMHVCELA-WHUUVLPESA-N 0.000 description 1
- SIGOIUCRXKUEIG-UHFFFAOYSA-N methyl 2-dimethoxyphosphorylacetate Chemical compound COC(=O)CP(=O)(OC)OC SIGOIUCRXKUEIG-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 150000004702 methyl esters Chemical group 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 125000006216 methylsulfinyl group Chemical group [H]C([H])([H])S(*)=O 0.000 description 1
- 190000032366 miboplatin Chemical compound 0.000 description 1
- 229950002777 miboplatin Drugs 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- 229960003539 mitoguazone Drugs 0.000 description 1
- MXWHMTNPTTVWDM-NXOFHUPFSA-N mitoguazone Chemical compound NC(N)=N\N=C(/C)\C=N\N=C(N)N MXWHMTNPTTVWDM-NXOFHUPFSA-N 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- ZAHQPTJLOCWVPG-UHFFFAOYSA-N mitoxantrone dihydrochloride Chemical compound Cl.Cl.O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO ZAHQPTJLOCWVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004169 mitoxantrone hydrochloride Drugs 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 229950007699 mogamulizumab Drugs 0.000 description 1
- 238000009126 molecular therapy Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- ZLVYMPOQNJTFSG-QMMMGPOBSA-N monoiodotyrosine Chemical compound OC(=O)[C@@H](NI)CC1=CC=C(O)C=C1 ZLVYMPOQNJTFSG-QMMMGPOBSA-N 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 229950003968 motesanib Drugs 0.000 description 1
- RAHBGWKEPAQNFF-UHFFFAOYSA-N motesanib Chemical compound C=1C=C2C(C)(C)CNC2=CC=1NC(=O)C1=CC=CN=C1NCC1=CC=NC=C1 RAHBGWKEPAQNFF-UHFFFAOYSA-N 0.000 description 1
- 201000010879 mucinous adenocarcinoma Diseases 0.000 description 1
- 230000036457 multidrug resistance Effects 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical compound C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- YRDSDHFBUHFDPG-ZZXKWVIFSA-N n,n-dimethyl-n'-(5-sulfanylidene-1,2,4-dithiazol-3-yl)methanimidamide Chemical compound CN(C)\C=N\C1=NC(=S)SS1 YRDSDHFBUHFDPG-ZZXKWVIFSA-N 0.000 description 1
- CZFNISFYDPIDNM-UHFFFAOYSA-N n,n-dimethylformamide;oxolane Chemical compound CN(C)C=O.C1CCOC1 CZFNISFYDPIDNM-UHFFFAOYSA-N 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- NKFHKYQGZDAKMX-PPRKPIOESA-N n-[(e)-1-[(2s,4s)-4-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-2,5,12-trihydroxy-7-methoxy-6,11-dioxo-3,4-dihydro-1h-tetracen-2-yl]ethylideneamino]benzamide;hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 NKFHKYQGZDAKMX-PPRKPIOESA-N 0.000 description 1
- TVYPSLDUBVTDIS-FUOMVGGVSA-N n-[1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-methyloxolan-2-yl]-5-fluoro-2-oxopyrimidin-4-yl]-3,4,5-trimethoxybenzamide Chemical compound COC1=C(OC)C(OC)=CC(C(=O)NC=2C(=CN(C(=O)N=2)[C@H]2[C@@H]([C@H](O)[C@@H](C)O2)O)F)=C1 TVYPSLDUBVTDIS-FUOMVGGVSA-N 0.000 description 1
- BLCLNMBMMGCOAS-UHFFFAOYSA-N n-[1-[[1-[[1-[[1-[[1-[[1-[[1-[2-[(carbamoylamino)carbamoyl]pyrrolidin-1-yl]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-[(2-methylpropan-2-yl)oxy]-1-oxopropan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amin Chemical compound C1CCC(C(=O)NNC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)C(COC(C)(C)C)NC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 BLCLNMBMMGCOAS-UHFFFAOYSA-N 0.000 description 1
- QNILTEGFHQSKFF-UHFFFAOYSA-N n-propan-2-ylprop-2-enamide Chemical compound CC(C)NC(=O)C=C QNILTEGFHQSKFF-UHFFFAOYSA-N 0.000 description 1
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 229950007221 nedaplatin Drugs 0.000 description 1
- IXOXBSCIXZEQEQ-UHTZMRCNSA-N nelarabine Chemical compound C1=NC=2C(OC)=NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O IXOXBSCIXZEQEQ-UHTZMRCNSA-N 0.000 description 1
- 229960000801 nelarabine Drugs 0.000 description 1
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 1
- KFBKRCXOTTUAFS-UHFFFAOYSA-N nickel;triphenylphosphane Chemical compound [Ni].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 KFBKRCXOTTUAFS-UHFFFAOYSA-N 0.000 description 1
- 229960001346 nilotinib Drugs 0.000 description 1
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- 229950010203 nimotuzumab Drugs 0.000 description 1
- 229960001420 nimustine Drugs 0.000 description 1
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 1
- PCHKPVIQAHNQLW-CQSZACIVSA-N niraparib Chemical compound N1=C2C(C(=O)N)=CC=CC2=CN1C(C=C1)=CC=C1[C@@H]1CCCNC1 PCHKPVIQAHNQLW-CQSZACIVSA-N 0.000 description 1
- 229950011068 niraparib Drugs 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 229960003301 nivolumab Drugs 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 201000011330 nonpapillary renal cell carcinoma Diseases 0.000 description 1
- 238000001668 nucleic acid synthesis Methods 0.000 description 1
- 239000012038 nucleophile Substances 0.000 description 1
- 238000005935 nucleophilic addition reaction Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 229960003347 obinutuzumab Drugs 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- FAQDUNYVKQKNLD-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC2=C3[CH]C=CC=C3C(=O)N=N2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FAQDUNYVKQKNLD-UHFFFAOYSA-N 0.000 description 1
- 229960000572 olaparib Drugs 0.000 description 1
- 150000002905 orthoesters Chemical class 0.000 description 1
- 239000012285 osmium tetroxide Substances 0.000 description 1
- 229910000489 osmium tetroxide Inorganic materials 0.000 description 1
- 208000021284 ovarian germ cell tumor Diseases 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000005968 oxazolinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003551 oxepanyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 238000006146 oximation reaction Methods 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 108010068338 p38 Mitogen-Activated Protein Kinases Proteins 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 150000002941 palladium compounds Chemical class 0.000 description 1
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 1
- 229940046231 pamidronate Drugs 0.000 description 1
- 230000009996 pancreatic endocrine effect Effects 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 208000004019 papillary adenocarcinoma Diseases 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- CTVQQQPWNOVEAG-QDOPKCMFSA-N pardaxin Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)NCC(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O)[C@@H](C)CC)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)CN)C1=CC=CC=C1 CTVQQQPWNOVEAG-QDOPKCMFSA-N 0.000 description 1
- 229960002621 pembrolizumab Drugs 0.000 description 1
- WBXPDJSOTKVWSJ-ZDUSSCGKSA-N pemetrexed Chemical compound C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 WBXPDJSOTKVWSJ-ZDUSSCGKSA-N 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- MCYTYTUNNNZWOK-LCLOTLQISA-N penetratin Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=CC=C1 MCYTYTUNNNZWOK-LCLOTLQISA-N 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- 125000001148 pentyloxycarbonyl group Chemical group 0.000 description 1
- 239000000863 peptide conjugate Substances 0.000 description 1
- 125000001151 peptidyl group Chemical group 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical class OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical class OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- 150000004965 peroxy acids Chemical class 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 229960002087 pertuzumab Drugs 0.000 description 1
- 229950010588 pevonedistat Drugs 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 125000005954 phenoxathiinyl group Chemical group 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- HKOOXMFOFWEVGF-UHFFFAOYSA-N phenylhydrazine Chemical compound NNC1=CC=CC=C1 HKOOXMFOFWEVGF-UHFFFAOYSA-N 0.000 description 1
- 229940067157 phenylhydrazine Drugs 0.000 description 1
- ANRQGKOBLBYXFM-UHFFFAOYSA-M phenylmagnesium bromide Chemical compound Br[Mg]C1=CC=CC=C1 ANRQGKOBLBYXFM-UHFFFAOYSA-M 0.000 description 1
- 125000004344 phenylpropyl group Chemical group 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- FVZVCSNXTFCBQU-UHFFFAOYSA-N phosphanyl Chemical group [PH2] FVZVCSNXTFCBQU-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 1
- 229940043441 phosphoinositide 3-kinase inhibitor Drugs 0.000 description 1
- 150000004714 phosphonium salts Chemical class 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- CYQAYERJWZKYML-UHFFFAOYSA-N phosphorus pentasulfide Chemical compound S1P(S2)(=S)SP3(=S)SP1(=S)SP2(=S)S3 CYQAYERJWZKYML-UHFFFAOYSA-N 0.000 description 1
- FAIAAWCVCHQXDN-UHFFFAOYSA-N phosphorus trichloride Chemical compound ClP(Cl)Cl FAIAAWCVCHQXDN-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 125000005633 phthalidyl group Chemical group 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 201000007315 pineal gland astrocytoma Diseases 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- 208000021310 pituitary gland adenoma Diseases 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229920002627 poly(phosphazenes) Polymers 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 229920005646 polycarboxylate Polymers 0.000 description 1
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 1
- 229940093429 polyethylene glycol 6000 Drugs 0.000 description 1
- 229920002643 polyglutamic acid Polymers 0.000 description 1
- 229920001855 polyketal Polymers 0.000 description 1
- 229940099429 polyoxyl 40 stearate Drugs 0.000 description 1
- 229920006324 polyoxymethylene Polymers 0.000 description 1
- 239000003910 polypeptide antibiotic agent Substances 0.000 description 1
- 229920000137 polyphosphoric acid Polymers 0.000 description 1
- 229940034049 polysaccharide-k Drugs 0.000 description 1
- 229920000166 polytrimethylene carbonate Chemical group 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229960000688 pomalidomide Drugs 0.000 description 1
- UVSMNLNDYGZFPF-UHFFFAOYSA-N pomalidomide Chemical compound O=C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O UVSMNLNDYGZFPF-UHFFFAOYSA-N 0.000 description 1
- 150000004032 porphyrins Chemical class 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 229960004694 prednimustine Drugs 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 125000001844 prenyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 229960001309 procaine hydrochloride Drugs 0.000 description 1
- 229960001586 procarbazine hydrochloride Drugs 0.000 description 1
- XYWJNTOURDMTPI-UHFFFAOYSA-N procodazole Chemical compound C1=CC=C2NC(CCC(=O)O)=NC2=C1 XYWJNTOURDMTPI-UHFFFAOYSA-N 0.000 description 1
- 229950000989 procodazole Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 239000003207 proteasome inhibitor Substances 0.000 description 1
- 239000003197 protein kinase B inhibitor Substances 0.000 description 1
- 230000005588 protonation Effects 0.000 description 1
- 229950003776 protoporphyrin Drugs 0.000 description 1
- 235000019423 pullulan Nutrition 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 229950007401 pumitepa Drugs 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- GRJJQCWNZGRKAU-UHFFFAOYSA-N pyridin-1-ium;fluoride Chemical compound F.C1=CC=NC=C1 GRJJQCWNZGRKAU-UHFFFAOYSA-N 0.000 description 1
- 229960003581 pyridoxal Drugs 0.000 description 1
- 239000011674 pyridoxal Substances 0.000 description 1
- 235000008164 pyridoxal Nutrition 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000005030 pyridylthio group Chemical group N1=C(C=CC=C1)S* 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 230000000191 radiation effect Effects 0.000 description 1
- 238000007154 radical cyclization reaction Methods 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- 229960002185 ranimustine Drugs 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 229960004836 regorafenib Drugs 0.000 description 1
- FNHKPVJBJVTLMP-UHFFFAOYSA-N regorafenib Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=C(F)C(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 FNHKPVJBJVTLMP-UHFFFAOYSA-N 0.000 description 1
- 208000010639 renal pelvis urothelial carcinoma Diseases 0.000 description 1
- 210000005084 renal tissue Anatomy 0.000 description 1
- 125000006853 reporter group Chemical group 0.000 description 1
- 231100000372 reproductive toxicity Toxicity 0.000 description 1
- 230000007696 reproductive toxicity Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 150000004492 retinoid derivatives Chemical class 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 150000003284 rhodium compounds Chemical class 0.000 description 1
- FCQRKDSALKMOGU-UHFFFAOYSA-K rhodium(3+);triphenylphosphane;trichloride Chemical compound Cl[Rh](Cl)Cl.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 FCQRKDSALKMOGU-UHFFFAOYSA-K 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 101150024074 rub1 gene Proteins 0.000 description 1
- 229910001753 sapphirine Inorganic materials 0.000 description 1
- ILFPCMXTASDZKM-UHFFFAOYSA-N sarkomycin Natural products OC(=O)C1CCC(=O)C1=C ILFPCMXTASDZKM-UHFFFAOYSA-N 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 125000005930 sec-butyloxycarbonyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 229940055619 selenocysteine Drugs 0.000 description 1
- 235000016491 selenocysteine Nutrition 0.000 description 1
- ZKZBPNGNEQAJSX-UHFFFAOYSA-N selenocysteine Natural products [SeH]CC(N)C(O)=O ZKZBPNGNEQAJSX-UHFFFAOYSA-N 0.000 description 1
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 1
- 229950010746 selumetinib Drugs 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 235000020374 simple syrup Nutrition 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 239000007974 sodium acetate buffer Substances 0.000 description 1
- ODZPKZBBUMBTMG-UHFFFAOYSA-N sodium amide Chemical compound [NH2-].[Na+] ODZPKZBBUMBTMG-UHFFFAOYSA-N 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- UKLNMMHNWFDKNT-UHFFFAOYSA-M sodium chlorite Chemical compound [Na+].[O-]Cl=O UKLNMMHNWFDKNT-UHFFFAOYSA-M 0.000 description 1
- 229960002218 sodium chlorite Drugs 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000009518 sodium iodide Nutrition 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- PODWXQQNRWNDGD-UHFFFAOYSA-L sodium thiosulfate pentahydrate Chemical compound O.O.O.O.O.[Na+].[Na+].[O-]S([S-])(=O)=O PODWXQQNRWNDGD-UHFFFAOYSA-L 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- NHXLMOGPVYXJNR-ATOGVRKGSA-N somatostatin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N1)[C@@H](C)O)NC(=O)CNC(=O)[C@H](C)N)C(O)=O)=O)[C@H](O)C)C1=CC=CC=C1 NHXLMOGPVYXJNR-ATOGVRKGSA-N 0.000 description 1
- 229960000553 somatostatin Drugs 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 229940100515 sorbitan Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 229940063673 spermidine Drugs 0.000 description 1
- 229940063675 spermine Drugs 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 201000000270 spindle cell sarcoma Diseases 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 239000006190 sub-lingual tablet Substances 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 239000007940 sugar coated tablet Substances 0.000 description 1
- MPUQHZXIXSTTDU-QXGSTGNESA-N sulfamic acid [(1S,2S,4R)-4-[4-[[(1S)-2,3-dihydro-1H-inden-1-yl]amino]-7-pyrrolo[2,3-d]pyrimidinyl]-2-hydroxycyclopentyl]methyl ester Chemical compound C1[C@H](O)[C@H](COS(=O)(=O)N)C[C@H]1N1C2=NC=NC(N[C@@H]3C4=CC=CC=C4CC3)=C2C=C1 MPUQHZXIXSTTDU-QXGSTGNESA-N 0.000 description 1
- 125000001273 sulfonato group Chemical group [O-]S(*)(=O)=O 0.000 description 1
- 230000006103 sulfonylation Effects 0.000 description 1
- 238000005694 sulfonylation reaction Methods 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 238000009120 supportive therapy Methods 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229940095374 tabloid Drugs 0.000 description 1
- FQZYTYWMLGAPFJ-OQKDUQJOSA-N tamoxifen citrate Chemical compound [H+].[H+].[H+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 FQZYTYWMLGAPFJ-OQKDUQJOSA-N 0.000 description 1
- 229960003454 tamoxifen citrate Drugs 0.000 description 1
- 229960003198 tamsulosin hydrochloride Drugs 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229960003080 taurine Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- WWJZWCUNLNYYAU-UHFFFAOYSA-N temephos Chemical compound C1=CC(OP(=S)(OC)OC)=CC=C1SC1=CC=C(OP(=S)(OC)OC)C=C1 WWJZWCUNLNYYAU-UHFFFAOYSA-N 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 125000006633 tert-butoxycarbonylamino group Chemical group 0.000 description 1
- XKXIQBVKMABYQJ-UHFFFAOYSA-M tert-butyl carbonate Chemical group CC(C)(C)OC([O-])=O XKXIQBVKMABYQJ-UHFFFAOYSA-M 0.000 description 1
- 230000006209 tert-butylation Effects 0.000 description 1
- BCNZYOJHNLTNEZ-UHFFFAOYSA-N tert-butyldimethylsilyl chloride Chemical compound CC(C)(C)[Si](C)(C)Cl BCNZYOJHNLTNEZ-UHFFFAOYSA-N 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- 125000006337 tetrafluoro ethyl group Chemical group 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000004853 tetrahydropyridinyl group Chemical group N1(CCCC=C1)* 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- 125000004632 tetrahydrothiopyranyl group Chemical group S1C(CCCC1)* 0.000 description 1
- DLYUQMMRRRQYAE-UHFFFAOYSA-N tetraphosphorus decaoxide Chemical compound O1P(O2)(=O)OP3(=O)OP1(=O)OP2(=O)O3 DLYUQMMRRRQYAE-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 229960003433 thalidomide Drugs 0.000 description 1
- 125000004305 thiazinyl group Chemical group S1NC(=CC=C1)* 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000002769 thiazolinyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000002053 thietanyl group Chemical group 0.000 description 1
- 125000001730 thiiranyl group Chemical group 0.000 description 1
- DUYAAUVXQSMXQP-UHFFFAOYSA-M thioacetate Chemical group CC([S-])=O DUYAAUVXQSMXQP-UHFFFAOYSA-M 0.000 description 1
- 238000005936 thiocarbonylation reaction Methods 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 206010043554 thrombocytopenia Diseases 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 230000001748 thyrotropin Effects 0.000 description 1
- 229960003723 tiazofurine Drugs 0.000 description 1
- FVRDYQYEVDDKCR-DBRKOABJSA-N tiazofurine Chemical compound NC(=O)C1=CSC([C@H]2[C@@H]([C@H](O)[C@@H](CO)O2)O)=N1 FVRDYQYEVDDKCR-DBRKOABJSA-N 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 229960004167 toremifene citrate Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 229950000185 tozasertib Drugs 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 238000006276 transfer reaction Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 229950007217 tremelimumab Drugs 0.000 description 1
- 229960003181 treosulfan Drugs 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- 229960005294 triamcinolone Drugs 0.000 description 1
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- DBGVGMSCBYYSLD-UHFFFAOYSA-N tributylstannane Chemical compound CCCC[SnH](CCCC)CCCC DBGVGMSCBYYSLD-UHFFFAOYSA-N 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 125000005950 trichloromethanesulfonyloxy group Chemical group 0.000 description 1
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 1
- BDZBKCUKTQZUTL-UHFFFAOYSA-N triethyl phosphite Chemical compound CCOP(OCC)OCC BDZBKCUKTQZUTL-UHFFFAOYSA-N 0.000 description 1
- GGUBFICZYGKNTD-UHFFFAOYSA-N triethyl phosphonoacetate Chemical compound CCOC(=O)CP(=O)(OCC)OCC GGUBFICZYGKNTD-UHFFFAOYSA-N 0.000 description 1
- LALRXNPLTWZJIJ-UHFFFAOYSA-N triethylborane Chemical compound CCB(CC)CC LALRXNPLTWZJIJ-UHFFFAOYSA-N 0.000 description 1
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- WTVXIBRMWGUIMI-UHFFFAOYSA-N trifluoro($l^{1}-oxidanylsulfonyl)methane Chemical group [O]S(=O)(=O)C(F)(F)F WTVXIBRMWGUIMI-UHFFFAOYSA-N 0.000 description 1
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 1
- 125000005951 trifluoromethanesulfonyloxy group Chemical group 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 125000001889 triflyl group Chemical group FC(F)(F)S(*)(=O)=O 0.000 description 1
- XQKBFQXWZCFNFF-UHFFFAOYSA-K triiodosamarium Chemical compound I[Sm](I)I XQKBFQXWZCFNFF-UHFFFAOYSA-K 0.000 description 1
- SIOVKLKJSOKLIF-CMDGGOBGSA-N trimethylsilyl (1e)-n-trimethylsilylethanimidate Chemical compound C[Si](C)(C)OC(/C)=N/[Si](C)(C)C SIOVKLKJSOKLIF-CMDGGOBGSA-N 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- FTVLMFQEYACZNP-UHFFFAOYSA-N trimethylsilyl trifluoromethanesulfonate Chemical compound C[Si](C)(C)OS(=O)(=O)C(F)(F)F FTVLMFQEYACZNP-UHFFFAOYSA-N 0.000 description 1
- HUYHHHVTBNJNFM-UHFFFAOYSA-N trimethylsilylsilicon Chemical compound C[Si](C)(C)[Si] HUYHHHVTBNJNFM-UHFFFAOYSA-N 0.000 description 1
- SJHCUXCOGGKFAI-UHFFFAOYSA-N tripropan-2-yl phosphite Chemical compound CC(C)OP(OC(C)C)OC(C)C SJHCUXCOGGKFAI-UHFFFAOYSA-N 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 238000007039 two-step reaction Methods 0.000 description 1
- 229950009811 ubenimex Drugs 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 201000000334 ureter transitional cell carcinoma Diseases 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 208000037965 uterine sarcoma Diseases 0.000 description 1
- GCILEJUNEYIABW-UHFFFAOYSA-N v5t7s4hp8a Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2C=2C(=O)C3=CC=4OCOC=4C=C3C=2N1CCCN1C=CN=C1 GCILEJUNEYIABW-UHFFFAOYSA-N 0.000 description 1
- 239000012646 vaccine adjuvant Substances 0.000 description 1
- 229940124931 vaccine adjuvant Drugs 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 239000002525 vasculotropin inhibitor Substances 0.000 description 1
- 229950000578 vatalanib Drugs 0.000 description 1
- YCOYDOIWSSHVCK-UHFFFAOYSA-N vatalanib Chemical compound C1=CC(Cl)=CC=C1NC(C1=CC=CC=C11)=NN=C1CC1=CC=NC=C1 YCOYDOIWSSHVCK-UHFFFAOYSA-N 0.000 description 1
- 229950011257 veliparib Drugs 0.000 description 1
- JNAHVYVRKWKWKQ-CYBMUJFWSA-N veliparib Chemical compound N=1C2=CC=CC(C(N)=O)=C2NC=1[C@@]1(C)CCCN1 JNAHVYVRKWKWKQ-CYBMUJFWSA-N 0.000 description 1
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 1
- 229960004982 vinblastine sulfate Drugs 0.000 description 1
- AQTQHPDCURKLKT-JKDPCDLQSA-N vincristine sulfate Chemical compound OS(O)(=O)=O.C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C=O)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 AQTQHPDCURKLKT-JKDPCDLQSA-N 0.000 description 1
- 229960002110 vincristine sulfate Drugs 0.000 description 1
- 229960005212 vindesine sulfate Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 229960004449 vismodegib Drugs 0.000 description 1
- BPQMGSKTAYIVFO-UHFFFAOYSA-N vismodegib Chemical compound ClC1=CC(S(=O)(=O)C)=CC=C1C(=O)NC1=CC=C(Cl)C(C=2N=CC=CC=2)=C1 BPQMGSKTAYIVFO-UHFFFAOYSA-N 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 235000019163 vitamin B12 Nutrition 0.000 description 1
- 239000011715 vitamin B12 Substances 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 229950003081 volasertib Drugs 0.000 description 1
- SXNJFOWDRLKDSF-STROYTFGSA-N volasertib Chemical compound C1CN([C@H]2CC[C@@H](CC2)NC(=O)C2=CC=C(C(=C2)OC)NC=2N=C3N(C(C)C)[C@@H](C(N(C)C3=CN=2)=O)CC)CCN1CC1CC1 SXNJFOWDRLKDSF-STROYTFGSA-N 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 229960001771 vorozole Drugs 0.000 description 1
- XLMPPFTZALNBFS-INIZCTEOSA-N vorozole Chemical compound C1([C@@H](C2=CC=C3N=NN(C3=C2)C)N2N=CN=C2)=CC=C(Cl)C=C1 XLMPPFTZALNBFS-INIZCTEOSA-N 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- 229950009268 zinostatin Drugs 0.000 description 1
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 1
- 229960004276 zoledronic acid Drugs 0.000 description 1
- 125000004933 β-carbolinyl group Chemical group C1(=NC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000003952 β-lactams Chemical class 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7084—Compounds having two nucleosides or nucleotides, e.g. nicotinamide-adenine dinucleotide, flavine-adenine dinucleotide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7076—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines containing purines, e.g. adenosine, adenylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6807—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug or compound being a sugar, nucleoside, nucleotide, nucleic acid, e.g. RNA antisense
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6871—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting an enzyme
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Biochemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Saccharide Compounds (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
Description
ゼ/ホスホジエステラーゼの1種であるENPP1 (ecto-nucleotide pyrophosphatase/phosphodiesterase)によって分解されることや他のCDNはホスホジエステラーゼによって分解さ
れることが報告されている(Nat Chem Biol 10, 1043-1048 (2014); Cell Res 25, 539-550 (2015); Biochemistry 55, 837-849 (2016))。STINGはこれらの天然型リガンドによ
って活性化され、下流でTBK1 (TANK binding kinase 1)のリン酸化を誘導し、その下流でIRF3 (Interferon regulatory factor 3)のシグナルおよびNFkBのシグナルを活性化する
ことによってI型インターフェロン(IFN)応答を誘導する(Trends in Immunology 35, 88-93 (2014))。STINGシグナルのがんにおける重要性はノックアウトマウスを用いた試験によって示されている。STINGおよび下流シグナルのIRF3のノックアウトマウスを用いた
同種腫瘍移植マウスでは、癌免疫系の抑制により、癌細胞が野生型マウスよりも増殖することが報告されている(Immunity 41, 830-842 (2014))。また同種腫瘍移植マウスにお
いて放射線治療を施すとがん細胞の増殖が抑えられるが、STINGおよび下流シグナルで産
生されるI型IFNの受容体IFNAR1 (Interferon (alpha and beta) receptor 1)のノックア
ウトマウスを用いた場合、この放射線による効果が減弱することも報告されている(Immunity 41, 843-852 (2014))。これらのことからSTINGはがん細胞の増殖抑制に対して重要な役割を果たしており、STINGの活性化によって誘導される免疫シグナルの活性化は抗が
ん作用に結びつくと考えられる。よってSTINGアゴニストはがん免疫を狙った抗がん剤と
して使用できる可能性がある。またSTINGの活性化は自然免疫を活性化することからワク
チンの免疫効果に重要な役割を果たすと考えられている(Ther Adv Vaccines 1, 131-143
(2013))。このことからSTINGアゴニストは種々のワクチンのアジュバントとして使用できる可能性がある。
で表される化合物が記載されており、特許文献1によれば、当該化合物はSTING-dependent TBK1活性化剤であり、癌(特に固形癌)等の治療に有用であり、またアジュバントとして有用である。
で表される化合物が記載されており、特許文献2によれば、当該化合物はSTINGを介する
免疫促進剤であり、癌等の治療に有用である。
で表される化合物が記載されており、特許文献3によれば、当該化合物はSTINGアゴニス
トであり、癌等の治療に有用である。
で表される化合物が記載されており、特許文献5によれば、当該化合物はSTING依存シグ
ナル伝達を阻害し、自己免疫疾患等の治療に有用である。
で表される化合物が記載されており、特許文献6によれば、当該化合物はSTINGモジュレ
ーターであり、炎症、アレルギー性自己免疫疾患、癌等の治療に有用であり、また、ワクチンアジュバントとして有用である。
で表される化合物が記載されており、特許文献7によれば、当該化合物はType Iインターフェロン産生を増加し得、癌、自己免疫疾患、アレルギー反応等の治療に有用であり、ま
たアジュバントとして有用である。
で表される化合物が記載されており、特許文献8によれば、当該化合物はType Iインターフェロン産生を増加し得、炎症で特徴付けられる疾患、自己免疫疾患、シェーングレン症候群等の治療に有用である。
ーターであり、癌、自己免疫疾患等の治療に有用であり、また、ワクチンとして有用である。
ストであり、癌 (特に、固形膵臓癌) 等の治療に有用である。
ストである。
ストである。
ストである。
で表される化合物が記載されており、特許文献14によれば、当該化合物はSTINGアゴニ
ストである。
で表される化合物が記載されており、特許文献15によれば、当該化合物はSTINGアゴニ
ストである。
で表される化合物が記載されており、特許文献16によれば、当該化合物はSTINGアゴニ
ストである。
で表される化合物が記載されており、特許文献17によれば、当該化合物はSTINGアゴニ
ストである。
式(A-1):
R1およびR2は、それぞれ独立してヒドロキシ基またはハロゲン原子;
B1は、
R13、R14、R15、R16およびR17は、それぞれ独立して水素原子または置換基;
Y11、Y12、Y13、Y14、Y15およびY16は、それぞれ独立してNまたはCR1a;
Z11、Z12、Z13、Z14、Z15およびZ16は、それぞれ独立してNまたはC;
R1aは、水素原子または置換基;
B2は、
R23、R24、R25、R26およびR27は、それぞれ独立して水素原子または置換基;
Y21、Y22、Y23、Y24、Y25およびY26は、それぞれ独立してNまたはCR2a;
Z21、Z22、Z23、Z24、Z25およびZ26は、それぞれ独立してNまたはC;
R2aは、水素原子または置換基;
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16の少なくとも1つがCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26の少なくとも1つがCR2aであるか、または
iii)Z13、Z16、Z23およびZ26の少なくとも1つが、Cであり;
X1およびX2が、それぞれ独立して酸素原子または硫黄原子;
Q1、Q2、Q3およびQ4が、それぞれ独立して酸素原子または硫黄原子を示す。)
により表される化合物、またはその塩(以下、化合物(I)ともいう)を提供する。
B1およびB2の少なくとも1つが、
R19が、ハロゲン原子
である化合物、またはその塩を提供する。
他の形態において、X1およびX2が、Oである。
B1が、
B2が、
他の形態において、本開示は、7-((2R,5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミ
ノ-9H-プリン-9-イル)-15-フルオロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファ
シクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン、またはその塩を提供する。
他の形態において、本開示は、2-アミノ-9-((5R,7R,8R,12aR,14S,15S,15aS,16R)-14-(4-アミノピラゾロ[1,5-a][1,3,5]トリアジン-8-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン、またはその塩を提供する。
他の形態において、本開示は、7-((2R,5R,7R,8R,10R,12aR,14R,15R,15aR,16R)-14-(6-
アミノ-9H-プリン-9-イル)-15-フルオロ-16-ヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホス
ファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジ
ン-4-オン、またはその塩を提供する。
(CD-L)n-A (XIV)
を有する化合物、またはその医薬上許容される塩であって、式中:
CDは、式(XX)-(XXIX)のいずれか1つで示される基、以下参照;
Lは、リンカー;
Aは、抗体、抗体フラグメント、または抗原結合性フラグメント;
nは、1-10
である化合物、またはその医薬上許容される塩を提供する。
他の形態において、本開示は、Aが、抗原結合性フラグメントである、式(XIV)を有する化合物、またはその医薬上許容される塩を提供する。
他の形態において、本開示は、式(I)の化合物または塩を含む医薬を提供する。他の実施形態では、当該医薬はSTING作動薬である。他の実施形態では、当該医薬は、癌の予防剤または治療剤である。
他の形態において、本開示は、有効量の式(I)を有する化合物、またはその塩を、哺乳動物に投与することを含む、哺乳動物におけるSTINGの活性化方法を提供する。
他の形態において、本開示は、有効量の式(I)を有する化合物、またはその塩を、哺乳動物に投与することを含む、哺乳動物における癌の予防または治療方法を提供する。
他の形態において、本開示は、癌の予防または治療で使用するための、式(I)を有する化合物、またはその塩を提供する。
他の形態において、本開示は、癌の予防剤または治療剤を製造するための、式(I)を有する化合物、またはその塩の使用を提供する。
以下に、本開示を詳細に説明する。
本明細書中、「ハロゲン原子」としては、例えば、フッ素、塩素、臭素、ヨウ素が挙げられる。
本明細書中、「C1-6アルキル基」としては、例えば、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、イソペンチル、ネオペンチル、1-エチルプロピル、ヘキシル、イソヘキシル、1,1-ジメチルブチル、2,2-ジメチルブチル、3,3-ジメチルブチル、2-エチルブチルが挙げられる。
本明細書中、「ハロゲン化されていてもよいC1-6アルキル基」としては、例えば、1ないし7個、好ましくは1ないし5個のハロゲン原子を有していてもよいC1-6アルキル基が挙げられる。具体例としては、メチル、クロロメチル、ジフルオロメチル、トリクロロメチル、トリフルオロメチル、エチル、2-ブロモエチル、2,2,2-トリフルオロエチル、テトラフルオロエチル、ペンタフルオロエチル、プロピル、2,2―ジフルオロプロピル、3,3,3-トリフルオロプロピル、イソプロピル、ブチル、4,4,4-トリフルオロブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、イソペンチル、ネオペンチル、5,5,5-トリフルオロペンチル、ヘキシル、6,6,6-トリフルオロヘキシルが挙げられる。
本明細書中、「C2-6アルケニル基」としては、例えば、エテニル、1-プロペニル、2-プロペニル、2-メチル-1-プロペニル、1-ブテニル、2-ブテニル、3-ブテニル、3-メチル-2-ブテニル、1-ペンテニル、2-ペンテニル、3-ペンテニル、4-ペンテニル、4-メチル-3-ペンテニル、1-ヘキセニル、3-ヘキセニル、5-ヘキセニルが挙げられる。
本明細書中、「C2-6アルキニル基」としては、例えば、エチニル、1-プロピニル、2-プロピニル、1-ブチニル、2-ブチニル、3-ブチニル、1-ペンチニル、2-ペンチニル、3-ペンチニル、4-ペンチニル、1-ヘキシニル、2-ヘキシニル、3-ヘキシニル、4-ヘキシニル、5-ヘキシニル、4-メチル-2-ペンチニルが挙げられる。
本明細書中、「C3-10シクロアルキル基」としては、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、ビシクロ[2.2.1]ヘプチル、ビシクロ[2.2.2]オクチル、ビシクロ[3.2.1]オクチル、アダマンチルが挙げられる。
本明細書中、「ハロゲン化されていてもよいC3-10シクロアルキル基」としては、例えば、1ないし7個、好ましくは1ないし5個のハロゲン原子を有していてもよいC3-10シクロアルキル基が挙げられる。具体例としては、シクロプロピル、2,2-ジフ
ルオロシクロプロピル、2,3-ジフルオロシクロプロピル、シクロブチル、ジフルオロシクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチルが挙げられる。
本明細書中、「C3-10シクロアルケニル基」としては、例えば、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロオクテニルが挙げられる。
本明細書中、「C6-14アリール基」としては、例えば、フェニル、1-ナフチル、2-ナフチル、1-アントリル、2-アントリル、9-アントリルが挙げられる。
本明細書中、「C7-16アラルキル基」としては、例えば、ベンジル、フェネチル、ナフチルメチル、フェニルプロピルが挙げられる。
本明細書中、「ハロゲン化されていてもよいC1-6アルコキシ基」としては、例えば、1ないし7個、好ましくは1ないし5個のハロゲン原子を有していてもよいC1-6アルコキシ基が挙げられる。具体例としては、メトキシ、ジフルオロメトキシ、トリフルオロメトキシ、エトキシ、2,2,2-トリフルオロエトキシ、プロポキシ、イソプロポキシ、ブトキシ、4,4,4-トリフルオロブトキシ、イソブトキシ、sec-ブトキシ、ペンチルオキシ、ヘキシルオキシが挙げられる。
本明細書中、「C3-10シクロアルキルオキシ基」としては、例えば、シクロプロピルオキシ、シクロブチルオキシ、シクロペンチルオキシ、シクロヘキシルオキシ、シクロヘプチルオキシ、シクロオクチルオキシが挙げられる。
本明細書中、「C1-6アルキルチオ基」としては、例えば、メチルチオ、エチルチオ、プロピルチオ、イソプロピルチオ、ブチルチオ、sec-ブチルチオ、tert-ブチルチオ、ペンチルチオ、ヘキシルチオが挙げられる。
本明細書中、「ハロゲン化されていてもよいC1-6アルキルチオ基」としては、例えば、1ないし7個、好ましくは1ないし5個のハロゲン原子を有していてもよいC1-6アルキルチオ基が挙げられる。具体例としては、メチルチオ、ジフルオロメチルチオ、トリフルオロメチルチオ、エチルチオ、プロピルチオ、イソプロピルチオ、ブチルチオ、4,4,4-トリフルオロブチルチオ、ペンチルチオ、ヘキシルチオが挙げられる。
本明細書中、「C1-6アルキル-カルボニル基」としては、例えば、アセチル、プロパノイル、ブタノイル、2-メチルプロパノイル、ペンタノイル、3-メチルブタノイル、2-メチルブタノイル、2,2-ジメチルプロパノイル、ヘキサノイル、ヘプタノイルが挙げられる。
本明細書中、「ハロゲン化されていてもよいC1-6アルキル-カルボニル基」としては、例えば、1ないし7個、好ましくは1ないし5個のハロゲン原子を有していてもよいC1-6アルキル-カルボニル基が挙げられる。具体例としては、アセチル、クロロアセチル、トリフルオロアセチル、トリクロロアセチル、プロパノイル、ブタノイル、ペンタノイル、ヘキサノイルが挙げられる。
本明細書中、「C1-6アルコキシ-カルボニル基」としては、例えば、メトキシカルボニル、エトキシカルボニル、プロポキシカルボニル、イソプロポキシカルボニル、ブトキシカルボニル、イソブトキシカルボニル、sec-ブトキシカルボニル、tert-ブトキシカルボニル、ペンチルオキシカルボニル、ヘキシルオキシカルボニルが挙げられる。
本明細書中、「C6-14アリール-カルボニル基」としては、例えば、ベンゾイル、1-ナフトイル、2-ナフトイルが挙げられる。
本明細書中、「C7-16アラルキル-カルボニル基」としては、例えば、フェニルアセチル、フェニルプロピオニルが挙げられる。
本明細書中、「5ないし14員芳香族複素環カルボニル基」としては、例えば、ニコチ
ノイル、イソニコチノイル、テノイル、フロイルが挙げられる。
本明細書中、「3ないし14員非芳香族複素環カルボニル基」としては、例えば、モルホリニルカルボニル、ピペリジニルカルボニル、ピロリジニルカルボニルが挙げられる。
本明細書中、「モノ-またはジ-C7-16アラルキル-カルバモイル基」としては、例えば、ベンジルカルバモイル、フェネチルカルバモイルが挙げられる。
本明細書中、「C1-6アルキルスルホニル基」としては、例えば、メチルスルホニル、エチルスルホニル、プロピルスルホニル、イソプロピルスルホニル、ブチルスルホニル、sec-ブチルスルホニル、tert-ブチルスルホニルが挙げられる。
本明細書中、「ハロゲン化されていてもよいC1-6アルキルスルホニル基」としては、例えば、1ないし7個、好ましくは1ないし5個のハロゲン原子を有していてもよいC1-6アルキルスルホニル基が挙げられる。具体例としては、メチルスルホニル、ジフルオロメチルスルホニル、トリフルオロメチルスルホニル、エチルスルホニル、プロピルスルホニル、イソプロピルスルホニル、ブチルスルホニル、4,4,4-トリフルオロブチルスルホニル、ペンチルスルホニル、ヘキシルスルホニルが挙げられる。
本明細書中、「C6-14アリールスルホニル基」としては、例えば、フェニルスルホニル、1-ナフチルスルホニル、2-ナフチルスルホニルが挙げられる。
本明細書中、「炭化水素基」(「置換されていてもよい炭化水素基」における「炭化水素基」を含む)としては、例えば、C1-6アルキル基、C2-6アルケニル基、C2-6アルキニル基、C3-10シクロアルキル基、C3-10シクロアルケニル基、C6-14アリール基、C7-16アラルキル基が挙げられる。
「置換基群A:」
(1)ハロゲン原子、
(2)ニトロ基、
(3)シアノ基、
(4)オキソ基、
(5)ヒドロキシ基、
(6)ハロゲン化されていてもよいC1-6アルコキシ基、
(7)C6-14アリールオキシ基(例、フェノキシ、ナフトキシ)、
(8)C7-16アラルキルオキシ基(例、ベンジルオキシ)、
(9)5ないし14員芳香族複素環オキシ基(例、ピリジルオキシ)、
(10)3ないし14員非芳香族複素環オキシ基(例、モルホリニルオキシ、ピペリジニルオキシ)、
(11)C1-6アルキル-カルボニルオキシ基(例、アセトキシ、プロパノイルオキシ)、
(12)C6-14アリール-カルボニルオキシ基(例、ベンゾイルオキシ、1-ナフトイルオキシ、2-ナフトイルオキシ)、
(13)C1-6アルコキシ-カルボニルオキシ基(例、メトキシカルボニルオキシ、エトキシカルボニルオキシ、プロポキシカルボニルオキシ、ブトキシカルボニルオキシ)、(14)モノ-またはジ-C1-6アルキル-カルバモイルオキシ基(例、メチルカルバモイルオキシ、エチルカルバモイルオキシ、ジメチルカルバモイルオキシ、ジエチルカルバモイルオキシ)、
(15)C6-14アリール-カルバモイルオキシ基(例、フェニルカルバモイルオキシ、ナフチルカルバモイルオキシ)、
(16)5ないし14員芳香族複素環カルボニルオキシ基(例、ニコチノイルオキシ)、(17)3ないし14員非芳香族複素環カルボニルオキシ基(例、モルホリニルカルボニルオキシ、ピペリジニルカルボニルオキシ)、
(18)ハロゲン化されていてもよいC1-6アルキルスルホニルオキシ基(例、メチルスルホニルオキシ、トリフルオロメチルスルホニルオキシ)、
(19)C1-6アルキル基で置換されていてもよいC6-14アリールスルホニルオキシ基(例、フェニルスルホニルオキシ、トルエンスルホニルオキシ)、
(20)ハロゲン化されていてもよいC1-6アルキルチオ基、
(21)5ないし14員芳香族複素環基、
(22)3ないし14員非芳香族複素環基、
(23)ホルミル基、
(24)カルボキシ基、
(25)ハロゲン化されていてもよいC1-6アルキル-カルボニル基、
(26)C6-14アリール-カルボニル基、
(27)5ないし14員芳香族複素環カルボニル基、
(28)3ないし14員非芳香族複素環カルボニル基、
(29)C1-6アルコキシ-カルボニル基、
(30)C6-14アリールオキシ-カルボニル基(例、フェニルオキシカルボニル、1-ナフチルオキシカルボニル、2-ナフチルオキシカルボニル)、
(31)C7-16アラルキルオキシ-カルボニル基(例、ベンジルオキシカルボニル、フェネチルオキシカルボニル)、
(32)カルバモイル基、
(33)チオカルバモイル基、
(34)モノ-またはジ-C1-6アルキル-カルバモイル基、
(35)C6-14アリール-カルバモイル基(例、フェニルカルバモイル)、
(36)5ないし14員芳香族複素環カルバモイル基(例、ピリジルカルバモイル、チエニルカルバモイル)、
(37)3ないし14員非芳香族複素環カルバモイル基(例、モルホリニルカルバモイル、ピペリジニルカルバモイル)、
(38)ハロゲン化されていてもよいC1-6アルキルスルホニル基、
(39)C6-14アリールスルホニル基、
(40)5ないし14員芳香族複素環スルホニル基(例、ピリジルスルホニル、チエニルスルホニル)、
(41)ハロゲン化されていてもよいC1-6アルキルスルフィニル基、
(42)C6-14アリールスルフィニル基(例、フェニルスルフィニル、1-ナフチルスルフィニル、2-ナフチルスルフィニル)、
(43)5ないし14員芳香族複素環スルフィニル基(例、ピリジルスルフィニル、チエニルスルフィニル)、
(44)アミノ基、
(45)モノ-またはジ-C1-6アルキルアミノ基(例、メチルアミノ、エチルアミノ、プロピルアミノ、イソプロピルアミノ、ブチルアミノ、ジメチルアミノ、ジエチルアミノ、ジプロピルアミノ、ジブチルアミノ、N-エチル-N-メチルアミノ)、
(46)モノ-またはジ-C6-14アリールアミノ基(例、フェニルアミノ)、
(47)5ないし14員芳香族複素環アミノ基(例、ピリジルアミノ)、
(48)C7-16アラルキルアミノ基(例、ベンジルアミノ)、
(49)ホルミルアミノ基、
(50)C1-6アルキル-カルボニルアミノ基(例、アセチルアミノ、プロパノイルアミノ、ブタノイルアミノ)、
(51)(C1-6アルキル)(C1-6アルキル-カルボニル)アミノ基(例、N-アセチル-N-メチルアミノ)、
(52)C6-14アリール-カルボニルアミノ基(例、フェニルカルボニルアミノ、ナフチルカルボニルアミノ)、
(53)C1-6アルコキシ-カルボニルアミノ基(例、メトキシカルボニルアミノ、エトキシカルボニルアミノ、プロポキシカルボニルアミノ、ブトキシカルボニルアミノ、tert-ブトキシカルボニルアミノ)、
(54)C7-16アラルキルオキシ-カルボニルアミノ基(例、ベンジルオキシカルボニルアミノ)、
(55)C1-6アルキルスルホニルアミノ基(例、メチルスルホニルアミノ、エチルスルホニルアミノ)、
(56)C1-6アルキル基で置換されていてもよいC6-14アリールスルホニルアミノ基(例、フェニルスルホニルアミノ、トルエンスルホニルアミノ)、
(57)ハロゲン化されていてもよいC1-6アルキル基、
(58)C2-6アルケニル基、
(59)C2-6アルキニル基、
(60)C3-10シクロアルキル基、
(61)C3-10シクロアルケニル基、及び
(62)C6-14アリール基。
本明細書中、「複素環基」(「置換されていてもよい複素環基」における「複素環基」を含む)としては、例えば、環構成原子として炭素原子以外に窒素原子、硫黄原子および酸素原子から選ばれる1ないし4個のヘテロ原子をそれぞれ含有する、(i)芳香族複素環
基、(ii)非芳香族複素環基および(iii)7ないし10員複素架橋環基が挙げられる。
該「芳香族複素環基」の好適な例としては、チエニル、フリル、ピロリル、イミダゾリル、ピラゾリル、チアゾリル、イソチアゾリル、オキサゾリル、イソオキサゾリル、ピリジル、ピラジニル、ピリミジニル、ピリダジニル、1,2,4-オキサジアゾリル、1,3,4-オキサジアゾリル、1,2,4-チアジアゾリル、1,3,4-チアジアゾリル、トリアゾリル、テトラゾリル、トリアジニルなどの5ないし6員単環式芳香族複素環基;
ベンゾチオフェニル、ベンゾフラニル、ベンゾイミダゾリル、ベンゾオキサゾリル、ベンゾイソオキサゾリル、ベンゾチアゾリル、ベンゾイソチアゾリル、ベンゾトリアゾリル、イミダゾピリジニル、チエノピリジニル、フロピリジニル、ピロロピリジニル、ピラゾロピリジニル、オキサゾロピリジニル、チアゾロピリジニル、イミダゾピラジニル、イミダゾピリミジニル、チエノピリミジニル、フロピリミジニル、ピロロピリミジニル、ピラゾロピリミジニル、オキサゾロピリミジニル、チアゾロピリミジニル、ピラゾロトリアジニル、ナフト[2,3-b]チエニル、フェノキサチイニル、インドリル、イソインドリル
、1H-インダゾリル、プリニル、イソキノリル、キノリル、フタラジニル、ナフチリジニル、キノキサリニル、キナゾリニル、シンノリニル、カルバゾリル、β-カルボリニル、フェナントリジニル、アクリジニル、フェナジニル、フェノチアジニル、フェノキサジニルなどの8ないし14員縮合多環式(好ましくは2または3環式)芳香族複素環基が挙げられる。
該「非芳香族複素環基」の好適な例としては、アジリジニル、オキシラニル、チイラニル、アゼチジニル、オキセタニル、チエタニル、テトラヒドロチエニル、テトラヒドロフラニル、ピロリニル、ピロリジニル、イミダゾリニル、イミダゾリジニル、オキサゾリニル、オキサゾリジニル、ピラゾリニル、ピラゾリジニル、チアゾリニル、チアゾリジニル、テトラヒドロイソチアゾリル、テトラヒドロオキサゾリル、テトラヒドロイソオキサゾリル、ピペリジニル、ピペラジニル、テトラヒドロピリジニル、ジヒドロピリジニル、ジヒドロチオピラニル、テトラヒドロピリミジニル、テトラヒドロピリダジニル、ジヒドロピラニル、テトラヒドロピラニル、テトラヒドロチオピラニル、モルホリニル、チオモルホリニル、アゼパニル、ジアゼパニル、アゼピニル、オキセパニル、アゾカニル、ジアゾカニルなどの3ないし8員単環式非芳香族複素環基;
ジヒドロベンゾフラニル、ジヒドロベンゾイミダゾリル、ジヒドロベンゾオキサゾリル、ジヒドロベンゾチアゾリル、ジヒドロベンゾイソチアゾリル、ジヒドロナフト[2,3-b]チエニル、テトラヒドロイソキノリル、テトラヒドロキノリル、4H-キノリジニル、インドリニル、イソインドリニル、テトラヒドロチエノ[2,3-c]ピリジニル、テトラヒドロベンゾアゼピニル、テトラヒドロキノキサリニル、テトラヒドロフェナントリジニル、ヘキサヒドロフェノチアジニル、ヘキサヒドロフェノキサジニル、テトラヒドロフタラジニル、テトラヒドロナフチリジニル、テトラヒドロキナゾリニル、テトラヒドロシンノリニル、テトラヒドロカルバゾリル、テトラヒドロ-β-カルボリニル、テトラヒドロアクリジニル、テトラヒドロフェナジニル、テトラヒドロチオキサンテニル、オクタヒドロイソキノリルなどの9ないし14員縮合多環式(好ましくは2または3環式)非芳香族複素環基が挙げられる。
本明細書中、「含窒素複素環基」としては、「複素環基」のうち、環構成原子として少なくとも1個以上の窒素原子を含有するものが挙げられる。
本明細書中、「置換されていてもよい複素環基」としては、例えば、前記した置換基群Aから選ばれる置換基を有していてもよい複素環基が挙げられる。
「置換されていてもよい複素環基」における置換基の数は、例えば、1ないし3個である。置換基数が2個以上の場合、各置換基は同一であっても異なっていてもよい。
また、「アシル基」としては、炭化水素-スルホニル基、複素環-スルホニル基、炭化
水素-スルフィニル基、複素環-スルフィニル基も挙げられる。
ここで、炭化水素-スルホニル基とは、炭化水素基が結合したスルホニル基を、複素環-スルホニル基とは、複素環基が結合したスルホニル基を、炭化水素-スルフィニル基とは、炭化水素基が結合したスルフィニル基を、複素環-スルフィニル基とは、複素環基が結合したスルフィニル基を、それぞれ意味する。
「アシル基」の好適な例としては、ホルミル基、カルボキシ基、C1-6アルキル-カルボニル基、C2-6アルケニル-カルボニル基(例、クロトノイル)、C3-10シクロアルキル-カルボニル基(例、シクロブタンカルボニル、シクロペンタンカルボニル、シクロヘキサンカルボニル、シクロヘプタンカルボニル)、C3-10シクロアルケニル-カルボニル基(例、2-シクロヘキセンカルボニル)、C6-14アリール-カルボニル基、C7-16アラルキル-カルボニル基、5ないし14員芳香族複素環カルボニル基、3ないし14員非芳香族複素環カルボニル基、C1-6アルコキシ-カルボニル基、C6-14アリールオキシ-カルボニル基(例、フェニルオキシカルボニル、ナフチルオキシカルボニル)、C7-16アラルキルオキシ-カルボニル基(例、ベンジルオキシカルボニル、フェネチルオキシカルボニル)、カルバモイル基、モノ-またはジ-C1-6アルキル-カルバモイル基、モノ-またはジ-C2-6アルケニル-カルバモイル基(例、ジアリルカルバモイル)、モノ-またはジ-C3-10シクロアルキル-カルバモイル基(例、シクロプロピルカルバモイル)、モノ-またはジ-C6-14アリール-カルバモイル基(例、フェニルカルバモイル)、モノ-またはジ-C7-16アラルキル-カルバモイル基、5ないし14員芳香族複素環カルバモイル基(例、ピリジルカルバモイル)、チオカルバモイル基、モノ-またはジ-C1-6アルキル-チオカルバモイル基(例、メチルチオカルバモイル、N-エチル-N-メチルチオカルバモイル)、モノ-またはジ-C2-6アルケニル-チオカルバモイル基(例、ジアリルチオカルバモイル)、モノ-またはジ-C3-10シクロアルキル-チオカルバモイル基(例、シクロプロピルチオカルバモイル、シクロヘキシルチオカルバモイル)、モノ-またはジ-C6-14アリール-チオカルバモイル基(例、フェニルチオカルバモイル)、モノ-またはジ-C7-16アラルキル-チオカルバモイル基(例、ベンジルチオカルバモイル、フェネチルチオカルバモイル)、5ないし14員芳香族複素環チオカルバモイル基(例、ピリジルチオカルバモイル)、スルフィノ基、C1-6アルキルスルフィニル基(例、メチルスルフィニル、エチルスルフィニル)、スルホ基、C1-6アルキルスルホニル基、C6-14アリールスルホニル基、ホスホノ基、モノ-またはジ-C1-6アルキルホスホノ基(例、ジメチルホスホノ、ジエチルホスホノ、ジイソプロピルホスホノ、ジブチルホスホノ)が挙げられる。
置換されていてもよいアミノ基の好適な例としては、アミノ基、モノ-またはジ-(ハロゲン化されていてもよいC1-6アルキル)アミノ基(例、メチルアミノ、トリフルオロメチルアミノ、ジメチルアミノ、エチルアミノ、ジエチルアミノ、プロピルアミノ、ジブチルアミノ)、モノ-またはジ-C2-6アルケニルアミノ基(例、ジアリルアミノ)、モノ-またはジ-C3-10シクロアルキルアミノ基(例、シクロプロピルアミノ、シクロヘキシルアミノ)、モノ-またはジ-C6-14アリールアミノ基(例、フェニルア
ミノ)、モノ-またはジ-C7-16アラルキルアミノ基(例、ベンジルアミノ、ジベンジルアミノ)、モノ-またはジ-(ハロゲン化されていてもよいC1-6アルキル)-カルボニルアミノ基(例、アセチルアミノ、プロピオニルアミノ)、モノ-またはジ-C6-14アリール-カルボニルアミノ基(例、ベンゾイルアミノ)、モノ-またはジ-C7-16アラルキル-カルボニルアミノ基(例、ベンジルカルボニルアミノ)、モノ-またはジ-5ないし14員芳香族複素環カルボニルアミノ基(例、ニコチノイルアミノ、イソニコチノイルアミノ)、モノ-またはジ-3ないし14員非芳香族複素環カルボニルアミノ基(例、ピペリジニルカルボニルアミノ)、モノ-またはジ-C1-6アルコキシ-カルボニルアミノ基(例、tert-ブトキシカルボニルアミノ)、5ないし14員芳香族複素環アミノ基(例、ピリジルアミノ)、カルバモイルアミノ基、(モノ-またはジ-C1-6アルキル-カルバモイル)アミノ基(例、メチルカルバモイルアミノ)、(モノ-またはジ-C7-16アラルキル-カルバモイル)アミノ基(例、ベンジルカルバモイルアミノ)、C1-6アルキルスルホニルアミノ基(例、メチルスルホニルアミノ、エチルスルホニルアミノ)、C6-14アリールスルホニルアミノ基(例、フェニルスルホニルアミノ)、(C1-6アルキル)(C1-6アルキル-カルボニル)アミノ基(例、N-アセチル-N-メチルアミノ)、(C1-6アルキル)(C6-14アリール-カルボニル)アミノ基(例、N-ベンゾイル-N-メチルアミノ)が挙げられる。
置換されていてもよいカルバモイル基の好適な例としては、カルバモイル基、モノ-またはジ-C1-6アルキル-カルバモイル基、モノ-またはジ-C2-6アルケニル-カルバモイル基(例、ジアリルカルバモイル)、モノ-またはジ-C3-10シクロアルキル-カルバモイル基(例、シクロプロピルカルバモイル、シクロヘキシルカルバモイル)、モノ-またはジ-C6-14アリール-カルバモイル基(例、フェニルカルバモイル)、モノ-またはジ-C7-16アラルキル-カルバモイル基、モノ-またはジ-C1-6アルキル-カルボニル-カルバモイル基(例、アセチルカルバモイル、プロピオニルカルバモイル)、モノ-またはジ-C6-14アリール-カルボニル-カルバモイル基(例、ベンゾイルカルバモイル)、5ないし14員芳香族複素環カルバモイル基(例、ピリジルカルバモイル)が挙げられる。
置換されていてもよいチオカルバモイル基の好適な例としては、チオカルバモイル基、モノ-またはジ-C1-6アルキル-チオカルバモイル基(例、メチルチオカルバモイル、エチルチオカルバモイル、ジメチルチオカルバモイル、ジエチルチオカルバモイル、N
-エチル-N-メチルチオカルバモイル)、モノ-またはジ-C2-6アルケニル-チオカルバモイル基(例、ジアリルチオカルバモイル)、モノ-またはジ-C3-10シクロアルキル-チオカルバモイル基(例、シクロプロピルチオカルバモイル、シクロヘキシルチオカルバモイル)、モノ-またはジ-C6-14アリール-チオカルバモイル基(例、フェニルチオカルバモイル)、モノ-またはジ-C7-16アラルキル-チオカルバモイル基(例、ベンジルチオカルバモイル、フェネチルチオカルバモイル)、モノ-またはジ-C1-6アルキル-カルボニル-チオカルバモイル基(例、アセチルチオカルバモイル、プロピオニルチオカルバモイル)、モノ-またはジ-C6-14アリール-カルボニル-チオカルバモイル基(例、ベンゾイルチオカルバモイル)、5ないし14員芳香族複素環チオカルバモイル基(例、ピリジルチオカルバモイル)が挙げられる。
置換されていてもよいスルファモイル基の好適な例としては、スルファモイル基、モノ-またはジ-C1-6アルキル-スルファモイル基(例、メチルスルファモイル、エチルスルファモイル、ジメチルスルファモイル、ジエチルスルファモイル、N-エチル-N-メチルスルファモイル)、モノ-またはジ-C2-6アルケニル-スルファモイル基(例、ジアリルスルファモイル)、モノ-またはジ-C3-10シクロアルキル-スルファモイル基(例、シクロプロピルスルファモイル、シクロヘキシルスルファモイル)、モノ-またはジ-C6-14アリール-スルファモイル基(例、フェニルスルファモイル)、モノ-またはジ-C7-16アラルキル-スルファモイル基(例、ベンジルスルファモイル、フェネチルスルファモイル)、モノ-またはジ-C1-6アルキル-カルボニル-スルファモイル基(例、アセチルスルファモイル、プロピオニルスルファモイル)、モノ-またはジ-C6-14アリール-カルボニル-スルファモイル基(例、ベンゾイルスルファモイル)、5ないし14員芳香族複素環スルファモイル基(例、ピリジルスルファモイル)が挙げられる。
置換されていてもよいヒドロキシ基の好適な例としては、ヒドロキシ基、C1-6アルコキシ基、C2-6アルケニルオキシ基(例、アリルオキシ、2-ブテニルオキシ、2-ペンテニルオキシ、3-ヘキセニルオキシ)、C3-10シクロアルキルオキシ基(例、シクロヘキシルオキシ)、C6-14アリールオキシ基(例、フェノキシ、ナフチルオキシ)、C7-16アラルキルオキシ基(例、ベンジルオキシ、フェネチルオキシ)、C1-6アルキル-カルボニルオキシ基(例、アセチルオキシ、プロピオニルオキシ、ブチリ
ルオキシ、イソブチリルオキシ、ピバロイルオキシ)、C6-14アリール-カルボニルオキシ基(例、ベンゾイルオキシ)、C7-16アラルキル-カルボニルオキシ基(例、ベンジルカルボニルオキシ)、5ないし14員芳香族複素環カルボニルオキシ基(例、ニコチノイルオキシ)、3ないし14員非芳香族複素環カルボニルオキシ基(例、ピペリジニルカルボニルオキシ)、C1-6アルコキシ-カルボニルオキシ基(例、tert-ブトキシカルボニルオキシ)、5ないし14員芳香族複素環オキシ基(例、ピリジルオキシ)、カルバモイルオキシ基、C1-6アルキル-カルバモイルオキシ基(例、メチルカルバモイルオキシ)、C7-16アラルキル-カルバモイルオキシ基(例、ベンジルカルバモイルオキシ)、C1-6アルキルスルホニルオキシ基(例、メチルスルホニルオキシ、エチルスルホニルオキシ)、C6-14アリールスルホニルオキシ基(例、フェニルスルホニルオキシ)が挙げられる。
置換されていてもよいスルファニル基の好適な例としては、スルファニル(-SH)基、C1-6アルキルチオ基、C2-6アルケニルチオ基(例、アリルチオ、2-ブテニルチオ、2-ペンテニルチオ、3-ヘキセニルチオ)、C3-10シクロアルキルチオ基(例、シクロヘキシルチオ)、C6-14アリールチオ基(例、フェニルチオ、ナフチルチオ)、C7-16アラルキルチオ基(例、ベンジルチオ、フェネチルチオ)、C1-6アルキル-カルボニルチオ基(例、アセチルチオ、プロピオニルチオ、ブチリルチオ、イソブチリルチオ、ピバロイルチオ)、C6-14アリール-カルボニルチオ基(例、ベンゾイルチオ)、5ないし14員芳香族複素環チオ基(例、ピリジルチオ)、ハロゲン化チオ基(例、ペンタフルオロチオ)が挙げられる。
ノ酸ユニットと、第1アミノ酸のカルボキシラートと第2アミノ酸のアミノ基の間の化学的アミド結合である、ペプチド結合で構成される。カルボキシラートとリジンのα-アミノ酸基の間の結合のような、他のアミド結合は、ペプチド結合ではないと理解され、開裂可能でないと考えられる。
molys);およびN-メチル-バリン-シトルリン(Me-val-cit)が挙げられるが、これらに限定されない。トリペプチドの例としては、グリシン-バリン-シトルリン(gly-val-cit)およびグリシン-グリシン-グリシン(gly-gly-gly)が挙げられるが、これらに限定されない。
合成できる。
、Aに結合している環状ジヌクレオチドの平均の数をいう。例えば、nは、1ないし10の整数または分数である。)。すなわち、例として、Aに対して3つの環状ジヌクレオチドを有する第1のADCと、Aに対して4つの環状ジヌクレオチドを有する第2のADCを含む式(CD-L)n-Aを有する化合物は、3.5のDAR、即ち、「n」を有するだろう。
969-973 (1994)、およびRoguska et al., Protein Eng. 9(10):895-904 (1996)に記述さ
れている。いくつかの実施形態では、「ヒト化抗体」は、再表面化抗体(resurfaced antibody)である。
2つの手法の組合せを、当技術分野において時には使用して、CDRを決定する。
いられる番号付け方式は、Kabat番号付け方式である。
abatのようなアミノ酸位置の番号付けとは、抗体の編集の重鎖可変ドメインまたは軽鎖可変ドメインに使用される番号付け方式をいう。この番号付け方式を使用して、実際の直線状アミノ酸配列は、可変ドメインのFRまたはCDRの短縮もしくはそれへの挿入に対応してより少ないもしくは追加のアミノ酸を含有し得る。例えば、重鎖可変ドメインは、H2の残基52の後に1つのアミノ酸挿入(Kabatによる残基52a)および重鎖FR残基82の後に挿入された残基(例えば、Kabatによる残基82a、82bおよび82cなど)を含むことができる。残基のKabat番号付けは、抗体の配列の相同性の領域で、「標準的な」Kabat番号付けした配列と整列化することによって、所与の抗体に対して決定することができる。Chothiaは、その代わりに構造ループの位置について言及している(Chothia and Lesk J. Mol. Biol. 196:901-917 (1987))。Ch
othia CDR-H1ループの末端は、Kabat番号付け規則を使用して番号付けした場合、ループの長さに応じてH32~H34の間で変動する(これは、Kabat番号付けスキームが、H35AおよびH35Bに挿入を配置し;35Aも35Bも存在しない場合、ループは32で終了し;35Aだけが存在する場合、ループは33で終了し;35Aと35Bの両方が存在する場合、ループは34で終了するからである)。AbM超可変領域は、Kabat CDRとChothia構造ループの折衷案を表し、Oxford MolecularのAbM抗体モデリングソフトウェアによって使用される。
の折衷案を表すAbM超可変領域であり、Oxford MolecularのAbM抗体モデリングソフトウェア(Oxford Molecular Group, Inc.)によって使用される。
られる用語「特異性」は、特定の抗体が特定のエピトープに結合する相対的な親和性を特定することである。例えば、抗体「A」は、所定のエピトープに対して、抗体「B」よりも高い特異性を有し得、あるいは、抗体「A」は、関連するエピトープ「D」に対してよりも高い特異性でエピトープ「C」に結合すると思われ得る。
特異性および多重特異性抗体を包含する。
許、特許出願および公開公報は、全体として、十分に参照により組み込まれる。
成のポリマーまたはオリゴマー、例えば、合成のポリアミノ酸、オリゴヌクレオチド、例えば、アプタマーのような、組み換えのまたは合成の分子であり得る。ポリアミノ酸の例としては、ポリリジン(PLL)、ポリL-アスパラギン酸、ポリL-グルタミン酸が挙げられる。合成のポリマーまたはオリゴマーの他の例としては、スチレン-マレイン酸無水物コポリマー、ポリ(L-ラクチド-コ-グリコール化)コポリマー、ジビニルエーテル-マレイン酸の無水物コポリマー、N-(2-ヒドロキシプロピル)メタクリルアミドコポリマー(HMPA)、ポリエチレングリコール(PEG)、ポリビニルアルコール(PVA)、ポリウレタン、ポリ(2-エチルアクリル酸)、N-イソプロピルアクリルアミドポリマー、またはポリホスファジンが挙げられる。ポリアミンの例としては:ポリエチレンイミン、ポリリジン(PLL)、スペルミン、スペルミジン、ポリアミン、擬ペプチド-ポリアミン、ペプチド模倣のポリアミン、デンドリマーポリアミン、アルギニン、アミジン、プロタミン、カチオン性脂質、カチオン性ポルフィリン、ポリアミン第四級塩、またはアルファらせん状ペプチドが挙げられる。
(XXIX)のいずれか1つの細胞への取り込みを増加させ得る物質であり得る。
可能にし得、式(XX)-(XXIX)のいずれか1つの生体内分布に影響を与え得る。
では、オリゴペプチド模倣体ともいう)は、天然ペプチドと同様の規定の3次元の構造に
フォールディング可能な分子である。ペプチドまたはペプチド模倣体の部分は、約5-50アミノ酸長、例えば、約5、10、15、20、25、30、35、40、45または50アミノ酸長である。ペプチドまたはペプチド模倣体は、例えば、細胞透過性ペプチド、カチオン性ペプチド、両親媒性ペプチド、または疎水性ペプチド(例、Tyr、TrpまたはPheから主に構成している)であり得る。ペプチド部分は、デンドリマーペプチド、拘束性ペプチドまたは架橋ペプチドであり得る。他の実施形態では、ペプチド部分は、疎水性の膜転座配列(membrane translocation sequence MTS)を含み得る。疎水性のMTS含有ペプチドの例は、RFGFである。疎水性のMTSを含むRFGF類似体もまた、ターゲッティング部分であり得る。ペプチド部分は、ペプチド、オリゴヌクレオチドおよびタンパクを含む極性が大きい分子を、細胞膜を介して運ぶことができる、「送達」ペプチドであり得る。例えば、HIV TatタンパクおよびDrosophila Antennapedia由
来の特定の配列は、送達ペプチドとして機能する能力があることがわかっている。ペプチドまたはペプチド模倣体は、ファージディスプレイライブラリー、またはone-bead-one-
化合物(OBOC)コンビナトリアルライブラリーから同定されたペプチドのような、DNAのランダム配列によりエンコードされ得る(Lam et ah, Nature, 354:82-84, 1991)。一実施形態では、ペプチドまたはペプチド模倣体は、アルギニン-グリシン-アスパラギン酸(RGD)-ペプチドまたはRGD模倣体のような細胞ターゲッティングペプチドである。ペプチド部分は、長さが約5アミノ酸から約40アミノ酸の範囲であり得る。ペプチド部分は、安定性または直接的な配座特性を向上させるための構造修飾を有し得る。以下に記載のどの構造修飾も利用し得る。RGDペプチド部分は、内皮系腫瘍細胞または乳癌腫瘍細胞のような腫瘍細胞をターゲッティングするのに使用し得る(Zitzmann et ah, Cancer Res., 62:5139-43, 2002)。RGDペプチドは、式(XX)-(XXIX)のいず
れか1つの、肺、腎臓、脾臓または肝臓を含む種々の他の組織の腫瘍へのターゲッティン
グを容易にし得る(Aoki et ah, Cancer Gene Therapy 8:783-787, 2001)。
る。例えば、ペプチドおよびペプチド模倣体を含むRGDは、癌細胞、特に、インテグリンを示す細胞をターゲッティングし得る。従って、RGDペプチド、RGDを含む環状ペプチド、D-アミノ酸を含むRGDペプチド、並びに合成のRGD模倣体を使用し得る。RGDに加えて、インテグリン薬物送達剤を標的とする他の部分を使用し得る。一般的に、そのような薬物送達剤は、増殖性細胞および血管形成をコントロールするのに使用し得る。このタイプの薬物送達剤の好ましいコンジュゲートは、PECAM-1、VEGF、または他の癌遺伝子、例えば、本明細書に記載の癌遺伝子をターゲッティングする。
細胞透過性ペプチドは、ナノ粒子形成してもよい。
oxin)、パルダキシン、ブフォリン、CPF、ボンビニン様ペプチド(BLP)、カテリシジン、セラトトキシン、S.クラバ(S.Clava)ペプチド、ヌタウナギ腸内抗微生物ペプチド(hagfish intestinal antimicrobial peptide)(HFIAP)、マガイニン、ブレビニン-2(brevinin-2)、デルマセプチン、メリチン、プルロシジン(pleurocidin)、H2Aペプチド、ゼノパスペプチド、エスクレンチン-1、カエリン(caerin)が挙げられ
るが、これらに限定されない。多くの因子は、好ましくはらせん安定性の完全性を維持すると考えられるだろう。例えば、最大数のらせん安定化残基(例、leu、alaまたはlys)が利用され、最小数のらせん不安定化残基(例、プロリン、または環状モノマー単位)が利用されるだろう。キャッピング残基が考慮され(例えば、Glyは代表的なキャッピングである。)、および/またはC-末端アミド化は、らせんを安定化するための余分のH-結合を付与するのに使用され得る。i+3またはi+4位置で分かれた、反対の電荷を有する残基間の塩橋の形成は、安定性を付与し得る。例えば、リジン、アルギニン、ホモ-アルギニン、オルニチンまたはヒスチジンのようなカチオン性残基は、アニオン性残基であるグルタミン酸またはアスパラギン酸と塩橋を形成し得る。
チドもまた、薬物送達剤(例、PK調節薬物送達剤)として本発明に適している。
別の実施態様において、部分構造:
別の実施態様において、R1およびR2は、それぞれ独立して、ヒドロキシ基またはフッ素原子である。
別の実施態様において、R1は、ヒドロキシ基である。
別の実施態様において、R2は、ヒドロキシ基またはフッ素原子である。
別の実施態様において、R13、R14、R15、R16およびR17は、それぞれ独立して、水素原子または置換基である。
別の実施態様において、Y11、Y12、Y13、Y14、Y15およびY16は、それぞれ独立して、NまたはCR1aである。
別の実施態様において、Z11、Z12、Z13、Z14、Z15およびZ16は、それぞれ独立して、NまたはCである。
R1aは、水素原子または置換基である。
別の実施態様において、R14は、水素原子または置換されていてもよいアミノ基である。
別の実施態様において、R14は、水素原子またはアミノ基である。
別の実施態様において、R14は、水素原子である。
別の実施態様において、R15は、好ましくは、水素原子である。
別の実施態様において、R13およびR15が、ともに水素原子であり、かつR14が、水素原子または置換されていてもよいアミノ基(特に、水素原子またはアミノ基)である。
別の実施態様において、R13、R14およびR15が、すべて水素原子である。
別の実施態様において、R17は、水素原子である。
別の実施態様において、Y12は、NまたはCHである。
別の実施態様において、Y12は、Nである。
別の実施態様において、Y13は、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y13は、NまたはCFである。
別の実施態様において、Y13は、CFである。
別の実施態様において、Y11がNであり、Y12がNまたはCHであり、かつY13がNまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y11がNであり、Y12がNまたはCHであり、かつY13がNまたはCFである。
別の実施態様において、Y11がNであり、Y12がNであり、かつY13がCFであるか、Y11がNであり、Y12がNであり、かつY13がNであるか、またはY11がNであり、Y12がCHであり、かつY13がNである。
別の実施態様において、Y11がNであり、Y12がNであり、かつY13がCFである。
別の実施態様において、Y15は、Nである。
別の実施態様において、Y16は、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y16は、NまたはCFである。
別の実施態様において、Y16は、Nである。
別の実施態様において、Y14がNであり、Y15がNであり、かつY16がNまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y14がNであり、Y15がNであり、かつY16がNまたはCFである。
別の実施態様において、Y14がNであり、Y15がNであり、かつY16がNであるか、またはY14がNであり、Y15がNであり、かつY16がCFである。
別の実施態様において、Y14がNであり、Y15がNであり、かつY16がNである。
別の実施態様において、Z12は、Cである。
別の実施態様において、Z13は、Nである。
別の実施態様において、Z11がCであり、Z12がCであり、かつZ13がNである。
別の実施態様において、Z15は、Cである。
別の実施態様において、Z16は、Nである。
別の実施態様において、Z14がCであり、Z15がCであり、かつZ16がNである。
別の実施態様において、R23、R24、R25、R26およびR27は、それぞれ独立して、水素原子または置換基である。
別の実施態様において、Y21、Y22、Y23、Y24、Y25およびY26は、それぞれ独立して、NまたはCR2aである。
別の実施態様において、Z21、Z22、Z23、Z24、Z25およびZ26は、それぞれ独立して、NまたはCである。
別の実施態様において、R2aは、水素原子または置換基である。
別の実施態様において、R24は、水素原子または置換されていてもよいアミノ基である。
別の実施態様において、R24は、水素原子またはアミノ基である。
別の実施態様において、R24は、水素原子である。
別の実施態様において、R25は、水素原子である。
別の実施態様において、R27は、水素原子である。
別の実施態様において、Y22は、Nである。
別の実施態様において、Y23は、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y23は、NまたはCFである。
別の実施態様において、Y23は、CFである。
別の実施態様において、Y21がNであり、Y22がNであり、かつY23がNまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y21がNであり、Y22がNであり、かつY23がNまたはCFである。
別の実施態様において、Y21がNであり、Y22がNであり、かつY23がCFであるか、またはY21がNであり、Y22がNであり、かつY23がNである。
別の実施態様において、Y21がNであり、Y22がNであり、かつY23がCFである。
別の実施態様において、Y25は、NまたはCHである。
別の実施態様において、Y25は、Nである。
別の実施態様において、Y26は、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y26は、NまたはCFである。
別の実施態様において、Y26は、Nである。
別の実施態様において、Y24がNであり、Y25がNまたはCHであり、かつY26がNまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)である。
別の実施態様において、Y24がNであり、Y25がNまたはCHであり、かつY26がNまたはCFである。
別の実施態様において、Y24がNであり、Y25がNであり、かつY26がNであるか;Y24がNであり、Y25がNであり、かつY26がCFであるか;またはY24がNであり、Y25がCHであり、かつY26がNである。
別の実施態様において、Y24がNであり、Y25がNであり、かつY26がNである。
別の実施態様において、Z21は、Cである。
別の実施態様において、Z22は、Cである。
別の実施態様において、Z23は、NまたはCである。
別の実施態様において、Z23は、Nである。
別の実施態様において、Z21がNまたはCであり、Z22がCであり、かつZ23がNまたはCである。
別の実施態様において、
Z21がCであり、Z22がCであり、かつZ23がNであるか、または
Z21がNであり、Z22がCであり、かつZ23がCである。
別の実施態様において、Z21がCであり、Z22がCであり、かつZ23がNである。
別の実施態様において、Z24は、Cである。
別の実施態様において、Z25は、Cである。
別の実施態様において、Z26は、NまたはCである。
別の実施態様において、Z26は、Nである。
別の実施態様において、Z24がNまたはCであり、Z25がCであり、かつZ26がNまたはCである。
別の実施態様において、Z24がCであり、Z25がCであり、かつZ26がNであるか、またはZ24がNであり、Z25がCであり、かつZ26がCである。
別の実施態様において、Z24がCであり、Z25がCであり、かつZ26がNである。
別の実施態様において、B1が、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCである。
別の実施態様において、X1およびX2は、共に酸素原子である。
別の実施態様において、Q1は、酸素原子である。
別の実施態様において、Q3は、酸素原子である。
別の実施態様において、Q1およびQ3が、ともに酸素原子であり、かつ、Q2およびQ4が、それぞれ独立して、酸素原子または硫黄原子である。
別の実施態様として、Q1が、酸素原子であり、Q2が、酸素原子または硫黄原子であり、Q3が、酸素原子であり、かつQ4が、酸素原子または硫黄原子である。
別の実施態様として、Q1が、酸素原子であり、Q2が、硫黄原子であり、Q3が、酸素原子であり、かつQ4が、硫黄原子である。
で表される化合物またはその塩(以下、化合物(Ia)ともいう)である。
で表される化合物またはその塩(以下、化合物(Ib)ともいう)である。
化合物A1は、式(I)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはハロゲン原子(例、フッ素原子)であり;
B1が、
R13が、水素原子であり;
R14が、水素原子または置換されていてもよいアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、それぞれ独立して、酸素原子または硫黄原子であり;かつ
Q1、Q2、Q3およびQ4が、それぞれ独立して、酸素原子または硫黄原子である。
化合物B1は、式(I)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
R13が、水素原子であり;
R14が、水素原子またはアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCFであり;
(例、Y11がNであり、Y12がNであり、かつY13がCFであるか;Y11がNであり、Y12がNであり、かつY13がNであるか;またはY11がNであり、Y12がCHであり、かつY13がNである。);
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCFであり;
(例、Y14がNであり、Y15がNであり、かつY16がNであるか;またはY14がNであり、Y15がNであり、かつY16がCFである。);
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCFであり;
(例、Y21がNであり、Y22がNであり、かつY23がCFであるか;またはY21がNであり、Y22がNであり、かつY23がNである。);
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCFであり;
(例、Y24がNであり、Y25がNであり、かつY26がNであるか;Y24がNであり、Y25がNであり、かつY26がCFであるか;またはY24がNであり、Y25がCHであり、かつY26がNである。);
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
(例、Z21がCであり、Z22がCであり、かつZ23がNであるか;またはZ21がNであり、Z22がCであり、かつZ23がCである。);
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
(例、Z24がCであり、Z25がCであり、かつZ26がNであるか;またはZ24がNであり、Z25がCであり、かつZ26がCである。);
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物A1-aは、式(Ia)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはハロゲン原子(例、フッ素原子)であり;
B1が、
R13が、水素原子であり;
R14が、水素原子または置換されていてもよいアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、それぞれ独立して、酸素原子または硫黄原子であり;かつ
Q1、Q2、Q3およびQ4が、それぞれ独立して、酸素原子または硫黄原子である。
化合物B1-aは、式(Ia)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
R13が、水素原子であり;
R14が、水素原子またはアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCFであり;
(例、Y11がNであり、Y12がNであり、かつY13がCFであるか;Y11がNであり、Y12がNであり、かつY13がNであるか;またはY11がNであり、Y12がCHであり、かつY13がNである。);
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCFであり;
(例、Y14がNであり、Y15がNであり、かつY16がNであるか;またはY14がNであり、Y15がNであり、かつY16がCFである。);
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCFであり;
(例、Y21がNであり、Y22がNであり、かつY23がCFであるか;またはY21がNであり、Y22がNであり、かつY23がNである。);
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCFであり;
(例、Y24がNであり、Y25がNであり、かつY26がNであるか;Y24がNであり、Y25がNであり、かつY26がCFであるか;またはY24がNであり、Y25がCHであり、かつY26がNである。);
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
(例、Z21がCであり、Z22がCであり、かつZ23がNであるか;またはZ21がNであり、Z22がCであり、かつZ23がCである。);
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
(例、Z24がCであり、Z25がCであり、かつZ26がNであるか;またはZ24がNであり、Z25がCであり、かつZ26がCである。);
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物A1-bは、式(Ib)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはハロゲン原子(例、フッ素原子)であり;
B1が、
R13が、水素原子であり;
R14が、水素原子または置換されていてもよいアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)であ
る。)であり;
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、それぞれ独立して、酸素原子または硫黄原子であり;かつ
Q1、Q2、Q3およびQ4が、それぞれ独立して、酸素原子または硫黄原子である。
化合物B1-bは、式(Ib)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
R13が、水素原子であり;
R14が、水素原子またはアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCFであり;
(例、Y11がNであり、Y12がNであり、かつY13がCFであるか;Y11がNであり、Y12がNであり、かつY13がNであるか;またはY11がNであり、Y12がCHであり、かつY13がNである。);
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCFであり;
(例、Y14がNであり、Y15がNであり、かつY16がNであるか;またはY14がNであり、Y15がNであり、かつY16がCFである。);
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCFであり;
(例、Y21がNであり、Y22がNであり、かつY23がCFであるか;またはY21がNであり、Y22がNであり、かつY23がNである。);
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCFであり;
(例、Y24がNであり、Y25がNであり、かつY26がNであるか;Y24がNであり、Y25がNであり、かつY26がCFであるか;またはY24がNであり、Y25がCHであり、かつY26がNである。);
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
(例、Z21がCであり、Z22がCであり、かつZ23がNであるか;またはZ21がNであり、Z22がCであり、かつZ23がCである。);
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
(例、Z24がCであり、Z25がCであり、かつZ26がNであるか;またはZ24がNであり、Z25がCであり、かつZ26がCである。);
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはC
R2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物A2は、式(I)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはハロゲン原子(例、フッ素原子)であり;
B1が、
R13が、水素原子であり;
R14が、水素原子または置換されていてもよいアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子または置換されていてもよいアミノ基であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、それぞれ独立して、酸素原子または硫黄原子であり;かつ
Q1、Q2、Q3およびQ4が、それぞれ独立して、酸素原子または硫黄原子である。
化合物B2は、式(I)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
R13が、水素原子であり;
R14が、水素原子またはアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCFであり;
(例、Y11がNであり、Y12がNであり、かつY13がCFであるか;Y11がNであり、Y12がNであり、かつY13がNであるか;またはY11がNであり、Y12がCHであり、かつY13がNである。);
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCFであり;
(例、Y14がNであり、Y15がNであり、かつY16がNであるか;またはY14がNであり、Y15がNであり、かつY16がCFである。);
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子またはアミノ基であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCFであり;
(例、Y21がNであり、Y22がNであり、かつY23がCFであるか;またはY21がNであり、Y22がNであり、かつY23がNである。);
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCFであり;
(例、Y24がNであり、Y25がNであり、かつY26がNであるか;Y24がNであり、Y25がNであり、かつY26がCFであるか;または
Y24がNであり、Y25がCHであり、かつY26がNである。);
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
(例、Z21がCであり、Z22がCであり、かつZ23がNであるか;またはZ21がNであり、Z22がCであり、かつZ23がCである。);
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
(例、Z24がCであり、Z25がCであり、かつZ26がNであるか;またはZ24がNであり、Z25がCであり、かつZ26がCである。);
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物A2-aは、式(Ia)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはハロゲン原子(例、フッ素原子)であり;
B1が、
R13が、水素原子であり;
R14が、水素原子または置換されていてもよいアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子または置換されていてもよいアミノ基であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、それぞれ独立して、酸素原子または硫黄原子であり;かつ
Q1、Q2、Q3およびQ4が、それぞれ独立して、酸素原子または硫黄原子である。
化合物B2-aは、式(I)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
R13が、水素原子であり;
R14が、水素原子またはアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCFであり;
(例、Y11がNであり、Y12がNであり、かつY13がCFであるか;Y11がNであり、Y12がNであり、かつY13がNであるか;またはY11がNであり、Y12がCHであり、かつY13がNである。);
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCFであり;
(例、Y14がNであり、Y15がNであり、かつY16がNであるか;またはY14がNであり、Y15がNであり、かつY16がCFである。);
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子またはアミノ基であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCFであり;
(例、Y21がNであり、Y22がNであり、かつY23がCFであるか;またはY21がNであり、Y22がNであり、かつY23がNである。);
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCFであり;
(例、Y24がNであり、Y25がNであり、かつY26がNであるか;Y24がNであり、Y25がNであり、かつY26がCFであるか;またはY24がNであり、Y25がCHであり、かつY26がNである。);
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
(例、Z21がCであり、Z22がCであり、かつZ23がNであるか;またはZ21がNであり、Z22がCであり、かつZ23がCである。);
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
(例、Z24がCであり、Z25がCであり、かつZ26がNであるか;またはZ24がNであり、Z25がCであり、かつZ26がCである。);
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物A2-bは、式(Ib)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはハロゲン原子(例、フッ素原子)であり;
B1が、
R13が、水素原子であり;
R14が、水素原子または置換されていてもよいアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCR1a(式中、R1aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子または置換されていてもよいアミノ基であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCR2a(式中、R2aは、ハロゲン原子(例、フッ素原子)である。)であり;
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、それぞれ独立して、酸素原子または硫黄原子であり;かつ
Q1、Q2、Q3およびQ4が、それぞれ独立して、酸素原子または硫黄原子である。
化合物B2-bは、式(Ib)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
R13が、水素原子であり;
R14が、水素原子またはアミノ基であり;
R15が、水素原子であり;
R16が、水素原子であり;
R17が、水素原子であり;
Y11が、Nであり;
Y12が、NまたはCHであり;
Y13が、NまたはCFであり;
(例、Y11がNであり、Y12がNであり、かつY13がCFであるか;Y11がNであり、Y12がNであり、かつY13がNであるか;またはY11がNであり、Y12がCHであり、かつY13がNである。);
Y14が、Nであり;
Y15が、Nであり;
Y16が、NまたはCFであり;
(例、Y14がNであり、Y15がNであり、かつY16がNであるか;またはY14がNであり、Y15がNであり、かつY16がCFである。);
Z11が、Cであり;
Z12が、Cであり;
Z13が、Nであり;
Z14が、Cであり;
Z15が、Cであり;
Z16が、Nであり;
B2が、
R23が、水素原子であり;
R24が、水素原子またはアミノ基であり;
R25が、水素原子であり;
R26が、水素原子であり;
R27が、水素原子であり;
Y21が、Nであり;
Y22が、Nであり;
Y23が、NまたはCFであり;
(例、Y21がNであり、Y22がNであり、かつY23がCFであるか;またはY21がNであり、Y22がNであり、かつY23がNである。);
Y24が、Nであり;
Y25が、NまたはCHであり;
Y26が、NまたはCFであり;
(例、Y24がNであり、Y25がNであり、かつY26がNであるか;Y24がNであり、Y25がNであり、かつY26がCFであるか;またはY24がNであり、Y25がCHであり、かつY26がNである。);
Z21が、NまたはCであり;
Z22が、Cであり;
Z23が、NまたはCであり;
(例、Z21がCであり、Z22がCであり、かつZ23がNであるか;またはZ21がNであり、Z22がCであり、かつZ23がCである。);
Z24が、NまたはCであり;
Z25が、Cであり;
Z26が、NまたはCであり;
(例、Z24がCであり、Z25がCであり、かつZ26がNであるか;またはZ24がNであり、Z25がCであり、かつZ26がCである。);
但し、
i)Y11、Y12、Y13、Y14、Y15およびY16のうち少なくとも一つはCR1aであるか、
ii)Y21、Y22、Y23、Y24、Y25およびY26のうち少なくとも一つはCR2aであるか、または
iii)Z13、Z16、Z23およびZ26のうち少なくとも一つはCであり;
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物C2は、式(I)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1およびB2は、それぞれ独立して、
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物C2-aは、式(Ia)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1およびB2は、それぞれ独立して、
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物C2-bは、式(Ib)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1およびB2は、それぞれ独立して、
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物D2は、式(I)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
B2が、
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物D2-aは、式(Ia)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
B2が、
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
化合物D2-bは、式(Ib)を有する化合物であって、
部分構造:
R1が、ヒドロキシ基であり;
R2が、ヒドロキシ基またはフッ素原子であり;
B1が、
B2が、
X1およびX2が、ともに酸素原子であり;
Q1が、酸素原子であり;
Q2が、酸素原子または硫黄原子であり;
Q3が、酸素原子であり;かつ
Q4が、酸素原子または硫黄原子である。
無機塩基との塩の好適な例としては、ナトリウム塩、カリウム塩等のアルカリ金属塩;カルシウム塩、マグネシウム塩等のアルカリ土類金属塩;アルミニウム塩、アンモニウム塩が挙げられる。
有機塩基との塩の好適な例としては、トリメチルアミン、トリエチルアミン、ピリジン、ピコリン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、トロメタミン[トリス(ヒドロキシメチル)メチルアミン]、tert-ブチルアミン、シクロヘキシルアミン、ベンジルアミン、ジシクロヘキシルアミン、N,N-ジベンジルエチレンジアミンとの塩が挙げられる。
無機酸との塩の好適な例としては、塩酸、臭化水素酸、硝酸、硫酸、リン酸との塩が挙げられる。
有機酸との塩の好適な例としては、ギ酸、酢酸、トリフルオロ酢酸、フタル酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p-トルエンスルホン酸との塩が挙げられる。
塩基性アミノ酸との塩の好適な例としては、アルギニン、リジン、オルニチンとの塩が挙げられる。
酸性アミノ酸との塩の好適な例としては、アスパラギン酸、グルタミン酸との塩が挙げられる。
化合物(I)が塩である場合、トリエチルアミンまたはナトリウムとの塩が好ましく、トリエチルアミンとの塩がより好ましい。
アルコール類:メタノール、エタノール、tert-ブチルアルコール、2-メトキシエタノールなど;
エーテル類:ジエチルエーテル、ジフェニルエーテル、テトラヒドロフラン、1,2-ジメトキシエタンなど;
芳香族炭化水素類:クロロベンゼン、トルエン、キシレンなど;
飽和炭化水素類:シクロヘキサン、ヘキサンなど;
アミド類:N,N-ジメチルホルムアミド、N-メチルピロリドンなど;
ハロゲン化炭化水素類:ジクロロメタン、四塩化炭素など;
ニトリル類:アセトニトリルなど;
スルホキシド類:ジメチルスルホキシドなど;
芳香族有機塩基類:ピリジンなど;
酸無水物類:無水酢酸など;
有機酸類:ギ酸、酢酸、トリフルオロ酢酸など;
無機酸類:塩酸、硫酸など;
エステル類:酢酸エチルなど;
ケトン類:アセトン、メチルエチルケトンなど;
水。
上記溶媒は、二種以上を適宜の割合で混合して用いてもよい。
無機塩基類:水酸化ナトリウム、水酸化マグネシウム、炭酸ナトリウム、炭酸カルシウム、炭酸水素ナトリウムなど;
有機塩基類:トリエチルアミン、ジエチルアミン、ピリジン、4-ジメチルアミノピリジン、N,N-ジメチルアニリン、1,4-ジアザビシクロ[2.2.2]オクタン、1,8-ジアザビシクロ[5.4.0]-7-ウンデセン、イミダゾール、ピペリジンなど;
金属アルコキシド類:ナトリウムエトキシド、カリウムtert-ブトキシドなど;
アルカリ金属水素化物類:水素化ナトリウムなど;
金属アミド類:ナトリウムアミド、リチウムジイソプロピルアミド、リチウムヘキサメチルジシラジドなど;
有機リチウム類:n-ブチルリチウムなど。
無機酸類:塩酸、硫酸、硝酸、臭化水素酸、リン酸など;
有機酸類:酢酸、トリフルオロ酢酸、クエン酸、p-トルエンスルホン酸、10-カンファースルホン酸など;
ルイス酸:三フッ化ホウ素ジエチルエーテル錯体、ヨウ化亜鉛、無水塩化アルミニウム、無水塩化亜鉛、無水塩化鉄など。
Li著、OXFORD UNIVERSITY出版);Comprehensive Heterocyclic Chemistry III、Vol.1~Vol.14(エルゼビア・ジャパン株式会社);人名反応に学ぶ有機合成戦略(富岡清監訳、化学同人発行);コンプリヘンシブ・オーガニック・トランスフォーメーションズ(VCH Publishers Inc.)1989年刊などに記載された方法、あるいは実施例に記載された方法に準じて行われる。
in Organic Synthesis, 4th Ed.”(Theodora
W. Greene, Peter G. M. Wuts著);Thieme社2004年刊“Protecting Groups 3rd Ed.”(P.J.Kocienski著)などに記載された方法、あるいは実施例に記載された方法に準じて行われる。
水酸基(例えば、アルコールなどの水酸基やフェノール性水酸基)の保護基としては、例えば、メトキシメチルエーテル、ベンジルエーテル、tert-ブチルジメチルシリル
エーテル、テトラヒドロピラニルエーテルなどのエーテル型保護基;酢酸エステル、安息香酸エステルなどのカルボン酸エステル型保護基;メタンスルホン酸エステルなどのスルホン酸エステル型保護基;tert-ブチルカルボネートなどの炭酸エステル型保護基が挙げられる。
アルデヒドのカルボニル基の保護基としては、例えば、ジメチルアセタールなどのアセタール型保護基;1,3-ジオキサンなどの環状アセタール型保護基が挙げられる。
ケトンのカルボニル基の保護基としては、例えば、ジメチルケタールなどのケタール型保護基;1,3-ジオキサンなどの環状ケタール型保護基;O-メチルオキシムなどのオキシム型保護基;N,N-ジメチルヒドラゾンなどのヒドラゾン型保護基が挙げられる。
カルボキシル基の保護基としては、例えば、メチルエステルなどのエステル型保護基;N,N-ジメチルアミドなどのアミド型保護基が挙げられる。
チオールの保護基としては、例えば、ベンジルチオエーテルなどのエーテル型保護基;チオ酢酸エステル、チオカルボネート、チオカルバメートなどのエステル型保護基が挙げられる。
アミノ基や、イミダゾール、ピロール、インドールなどの芳香族ヘテロ環の保護基としては、例えば、ベンジルカルバメートなどのカルバメート型保護基;アセトアミド、ベンズアミド、イソブチルアミドなどのアミド型保護基;N-トリフェニルメチルアミンなどのアルキルアミン型保護基;メタンスルホンアミドなどのスルホンアミド型保護基が挙げられる。
保護基の除去は、自体公知の方法、(例えば、酸、塩基、紫外光、ヒドラジン、フェニルヒドラジン、N-メチルジチオカルバミン酸ナトリウム、テトラブチルアンモニウムフルオリド、酢酸パラジウム、トリアルキルシリルハライド(例えば、トリメチルシリルヨージド、トリメチルシリルブロミド)を使用する方法や還元法)を用いて行うことができる。
モニア、メチルアミンなどの1級アミン;ジメチルアミンなどの2級アミンなどが挙げられる。
ヨウ化2-クロロ-1-メチル-ピリジニウム(向山試薬);塩化チオニル;クロロギ酸エチルなどのハロギ酸低級アルキル;O-(7-アザベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウム ヘキサフルオロリン酸塩(HATU);
硫酸;あるいはこれらの組み合わせなどが挙げられる。カルボジイミド系縮合剤を用いる場合、1-ヒドロキシベンゾトリアゾール(HOBt)、N-ヒドロキシコハク酸イミド(HOSu)、ジメチルアミノピリジン(DMAP)などの添加剤をさらに反応に加えてもよい。
。また、トリフェニルホスフィンと四塩化炭素または四臭化炭素などとの作用により、アルコールからハロゲン化アルキル体を得る方法を用いてもよい。あるいは、アルコールをスルホン酸エステルに変換の後、臭化リチウム、塩化リチウムまたはヨウ化ナトリウムと反応させるような2段階の反応を経てハロゲン化アルキル体を合成する方法を用いてもよい。
剤としては、亜リン酸ジフェニルなどが挙げられる。
R1およびR2がそれぞれ水酸基である場合、当該水酸基はそれぞれ保護されていてもよい。好適な水酸基の保護基としては、tert-ブチルジメチルシリルエーテル、3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニルエーテルなどのエーテル型保護基が挙げられる。
R1が水酸基である場合、当該水酸基とPGaで示される水酸基は、1,1,3,3-テトライソプロピルジシロキサニル基:
B1が官能基を有する場合、当該官能基は保護されていてもよい。例えば、B1が
置換基の導入や官能基変換の方法としては公知の一般的方法が用いられるが、例えば、ハロゲン原子(例、フッ素、塩素、臭素、ヨウ素)やハロゲン化されていてもよいC1-6アルキルスルホニル-オキシ基[例、メタンスルホニルオキシ、エタンスルホニルオキシ、トリクロロメタンスルホニルオキシ、トリフルオロメタンスルホニルオキシ(トリフラート)]のメチル基、シクロプロピル基、ビニル基、シアノ基、ホルミル基、カルボニル基、カルボキシル基、水酸基、アミノ基、ボリル基等への変換;ホルミル基のセイファース・ギルバート増炭反応によるエチニル基への変換;エステルの加水分解によるカルボキシ基への変換;カルボキシ基のアミド化によるカルバモイル基への変換;カルボキシ基の還元によるヒドロキシメチル基への変換;カルボニル基の還元やアルキル化によるアルコール体への変換;カルボニル基の還元的アミノ化;カルボニル基のオキシム化;アミノ基のアシル化;アミノ基のウレア化;アミノ基のスルホニル化;アミノ基のアルキル化;アミンによる活性ハロゲンの置換またはアミノ化;ヒドロキシ基のアルキル化;ヒドロキシ基の置換またはアミノ化が挙げられる。
この置換基の導入や官能基変換を行うに際し、目的以外の反応が起きる反応性部位が存在する場合は、必要に応じて自体公知の手段によりその反応性部位に事前に保護基を導入し、目的の反応を行った後にその保護基をやはり自体公知の手段により除去して、本開示の範囲に含まれる化合物を製造することもできる。
例えば、原料化合物や中間体が、置換基としてアミノ基、カルボキシル基または水酸基を有する場合、これらの基は、ペプチド化学などで一般的に用いられるような保護基で保護されていてもよい。この場合、反応後に、必要に応じて保護基を除去することにより目的化合物を得ることができる。
も化合物(I)に包含される。結晶は、自体公知の結晶化法を適用して、結晶化することによって製造し得る。
また、化合物(I)は、薬学的に許容され得る共結晶または共結晶塩であってもよい。ここで、共結晶または共結晶塩とは、各々が異なる物理的性質(例、構造、融点、融解熱、吸湿性、安定性)を持つ、室温で二種またはそれ以上の独特な固体から構成される結晶性物質を意味する。共結晶または共結晶塩は、自体公知の共結晶化法に従い製造し得る。
化合物(I)は、水和物であっても、非水和物であっても、溶媒和物であっても、無溶媒和物であってもよく、いずれも化合物(I)に包含される。
同位元素(例、2H、3H、11C、14C、18F、35S、125I)等で標識ま
たは置換された化合物も、化合物(I)に包含される。同位元素で標識または置換された化合物(I)は、例えば、陽電子断層法(Positron Emission Tomography:PET)におい
て使用するトレーサー(PETトレーサー)として用いることができ、医療診断などの分野
において有用であり得る。
化合物(I)のプロドラッグとは、生体内における生理条件下で酵素や胃酸等による反応により化合物(I)に変換する化合物、すなわち酵素的に酸化、還元、加水分解等を起こして化合物(I)に変化する化合物、胃酸等により加水分解等を起こして化合物(I)に変化する化合物をいう。
(1)化合物(I)のアミノがアシル化、アルキル化、リン酸化された化合物(例えば、化合物(I)のアミノが、エイコサノイル化、アラニル化、ペンチルアミノカルボニル化、(5-メチル-2-オキソ-1,3-ジオキソレン-4-イル)メトキシカルボニル化、テトラヒドロフラニル化、ピロリジルメチル化、ピバロイルオキシメチル化、tert-ブチル化、エトキシカルボニル化、tert-ブトキシカルボニル化、アセチル化、シクロプロピルカルボニル化された化合物);
(2)化合物(I)のヒドロキシが、アシル化、アルキル化、リン酸化、ホウ酸化された化合物(例えば、化合物(I)のヒドロキシが、アセチル化、パルミトイル化、プロパノイル化、ピバロイル化、スクシニル化、フマリル化、アラニル化、ジメチルアミノメチルカルボニル化された化合物);
(3)化合物(I)のカルボキシが、エステル化、アミド化された化合物(例えば、化合物(I)のカルボキシが、エチルエステル化、フェニルエステル化、カルボキシメチルエステル化、ジメチルアミノメチルエステル化、ピバロイルオキシメチルエステル化、エトキシカルボニルオキシエチルエステル化、フタリジルエステル化、(5-メチル-2-オキソ-1,3-ジオキソレン-4-イル)メチルエステル化、シクロヘキシルオキシカルボニルエチルエステル化、メチルアミド化された化合物);
が挙げられる。これらの化合物は、自体公知の方法によって化合物(I)から製造し得る。
本明細書において、プロドラッグは塩を形成していてもよく、かかる塩としては、前述の式(I)で示される化合物の塩として例示したものが挙げられる。
化合物(I)が上記ペイロードとして使用された場合の例として、
(1) B1が、
(2) B2が、
が挙げられる。
(1) 式(I)におけるB1を、
ここで、RaおよびRbは、それぞれ独立して、
(i) C1-6アルキル基、
(ii) アシル基、または
(iii) 式:
(2) 式(I)におけるR1およびR2を、それぞれ独立して、式:-OR3(式中、R3は、
(i) C1-6アルキル基、
(ii) アシル基(好ましくは、C1-6アルコキシ-カルボニル基)、
(iii) 式:
(iv) 式:
(v) 式:
(vi) 式:
(vii) 式:
(viii) 式:
(ix) 式:
(i) 式:-SR4(式中、R4は、
(a) C1-6アルキル基、
(b) アシル基、
(c) 式:-SRで表される基、
(d) 式:
(e) 式:
(f) 式:
(g) 式:
(h) 式:
(i) 式:
(ii) 式:-OR5(式中、R5は、
(a) C1-6アルキル基、
(b) アシル基、
(c) 式:
(d) 式:
(e) 式:
(f) 式:
(iii) 式:-NHR6(式中、R6は、
(a) C1-6アルキル基、
(b) アシル基、
(c) 式:
(d) 式:
(e) 式:
また、化合物(I)をペイロードとして使用する場合、Chem.Rev., 114, 9154-9218 (2014)、Pharma. Res. 32, 3526-3540 (2015)、Bioconjugate Chem. 21, 5-13 (2010)、The
AAPS journal, 17, 339-351 (2015)、国際公開第2011/005761号などに記載
されているようなリンカーを用いてもよい。
実施形態1. 式(I):
式(A-1):
R1およびR2は、それぞれ独立してヒドロキシ基またはハロゲン原子;
B1は、式(B1-A)または式(B1-B):
R13、R14、R15、R16およびR17は、それぞれ独立して水素原子または置換基;
Y11、Y12、Y13、Y14、Y15およびY16は、それぞれ独立してNまたはCR1a;
Z11、Z12、Z13、Z14、Z15およびZ16は、それぞれ独立してNまたはC;
R1aは、水素原子または置換基;
B2は、式(B2-A)または式(B2-B):
R23、R24、R25、R26およびR27は、それぞれ独立して水素原子または置換基;
Y21、Y22、Y23、Y24、Y25およびY26は、それぞれ独立してNまたはCR2a;
Z21、Z22、Z23、Z24、Z25およびZ26は、それぞれ独立してNまたはC
;
R2aは、水素原子または置換基;
X1およびX2は、それぞれ独立して酸素原子または硫黄原子;および
Q1、Q2、Q3およびQ4は、それぞれ独立して酸素原子または硫黄原子であり、
但し:
B1またはB2の少なくとも1つは:
R18は、水素またはC1-6アルキル;および
R19は、ハロゲン原子
である。
実施形態3. 式(X):
容される塩。
、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態14または16~18のいずれか1つの化合物、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態15~18のいずれか1つの化合物、またはその医薬上許容される塩。
(CD-L)n-A (XIV)
を有する化合物、またはその医薬上許容される塩であって、式中:
CDは、式(XX)-(XXIX):
R1およびR2は、それぞれ独立してヒドロキシ基、水素、アミノ基、またはハロゲン原子;
B3およびB4は、独立して置換されていてもよい5~14員芳香族複素環基;
X1およびX2は、それぞれ独立して酸素原子、CH2、または硫黄原子;
Q1、Q2、Q3およびQ4は、それぞれ独立して酸素原子または硫黄原子;
Lは、リンカー;
Aは、抗体、抗体フラグメント、または抗原結合性フラグメント;および
nは、1-10
である。
X3が、-(CH2)o-、
X3が、存在せず;
Tが、ペプチド、または存在せず;
Zが、スペーサー;
Qが、ヘテロ二官能基またはヘテロ三官能基、または存在しない、
実施形態32~45のいずれか1つの化合物、またはその医薬上許容される塩。
R10aおよびR10bが、独立して、水素および置換されていてもよいC1-6アルキルからなる群から選ばれる、
実施形態46~48のいずれか1つの化合物、またはその医薬上許容される塩。
mが、1、2、3、4、5、または6;および
sが、1、2、3、4、5、6、7、8、9、または10
である、実施形態46~50のいずれか1つの化合物、またはその医薬上許容される塩。
Zが、
pが、1、2、3、4、5、6、7、8、9、または10
である、実施形態46~48のいずれか1つの化合物、またはその医薬上許容される塩。
Zが、
rが、1、2、3、4、5、または6
である、実施形態46~48のいずれか1つの化合物、またはその医薬上許容される塩。
R29が、水素またはC1-6アルキル;
R30aおよびR30bは、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれ;
R31aおよびR31bは、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、-N(CH3)2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれ;および
*が、抗体に結合している任意の適用可能な炭素原子、窒素原子、酸素原子、または硫黄原子に対する結合点を示す、
実施形態46~53のいずれか1つの化合物、またはその医薬上許容される塩。
R10aおよびR10bは、独立してC1-3アルキル;および
mは、2、3、4、または5
である。
qは、1、2、または3;および
rは、1、2、または3
である。
R13、R14、R15、R16およびR17が、それぞれ独立して水素原子または置換基;
Y11、Y12、Y13、Y14、Y15およびY16が、それぞれ独立してNまたはCR1a;
Z11、Z12、Z13、Z14、Z15およびZ16が、それぞれ独立してNまたはC;
R1aが、水素原子または置換基;
B4が、式(B4-A)または式(B4-B):
R23、R24、R25、R26およびR27が、それぞれ独立して水素原子または置換基;
Y21、Y22、Y23、Y24、Y25およびY26が、それぞれ独立してNまたはCR2a;
Z21、Z22、Z23、Z24、Z25およびZ26が、それぞれ独立してNまたはC;
R2aが、水素原子または置換基
である、実施形態59の化合物、またはその医薬上許容される塩。
R19が、ハロゲン原子
である、実施形態32~60のいずれか1つの化合物、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態62または64~66のいずれか1つの化合物、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態63~66のいずれか1つの化合物、またはその医薬上許容される塩。
合物、またはその医薬上許容される塩。ヒトグアニル酸シクラーゼC(GCC)に結合する抗体が、例えば、US 20130315923およびWO 2011050242に開示されている。
CD-L1-R28 (XL)
を有する化合物、またはその医薬上許容される塩であって、式中:
CDは、式(XX)-(XXIX):
R1およびR2は、それぞれ独立してヒドロキシ基、水素、アミノ基、またはハロゲン原子;
B3およびB4は、独立して置換されていてもよい5~14員芳香族複素環基;
X1およびX2は、それぞれ独立して酸素原子、CH2、または硫黄原子;
Q1、Q2、Q3およびQ4は、それぞれ独立して酸素原子または硫黄原子;
L1は、リンカー;
R28は、-N3、-ONH2、-OH、-CN、-NO2、-CHO、-NR29C(=O)CH=CH2、-SH、-S(=O)2(CH=CH2)、-NR29C(=O)CH2Br、-NR29C(=O)CH2I、-C(=O)NHNH2、-CO2H、-NH2、-C≡CH、
R29が、水素またはC1-6アルキル;
R30aおよびR30bは、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれ;
R31aおよびR31bは、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、-N(CH3)2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれ;および
当該リンカーは、任意の適用可能な炭素、窒素、酸素、または硫黄原子を介して、環式のジヌクレオチドに結合している。
X3が、-(CH2)o-、
X3が、存在せず;
Tが、ペプチド、または存在せず;および
Zが、スペーサー
である、実施形態101~114のいずれか1つの化合物、またはその医薬上許容される塩。
R10aおよびR10bが、独立して、水素および置換されていてもよいC1-6アルキルからなる群から選ばれる、
実施形態115の化合物、またはその医薬上許容される塩。
mが、1、2、3、4、5、または6;および
sが、1、2、3、4、5、6、7、8、9、または10
である、実施形態115~117のいずれか1つの化合物、またはその医薬上許容される塩。
Zが、
pが、1、2、3、4、5、6、7、8、9、または10
である、実施形態115の化合物、またはその医薬上許容される塩。
Zが、
rが、1、2、3、4、5、または6
である、実施形態115の化合物、またはその医薬上許容される塩。
R13、R14、R15、R16およびR17が、それぞれ独立して水素原子または置換基;
Y11、Y12、Y13、Y14、Y15およびY16が、それぞれ独立してNまたはCR1a;
Z11、Z12、Z13、Z14、Z15およびZ16が、それぞれ独立してNまたはC;
R1aが、水素原子または置換基;
B4が、式(B4-A)または式(B4-B):
R23、R24、R25、R26およびR27が、それぞれ独立して水素原子または置換基;
Y21、Y22、Y23、Y24、Y25およびY26が、それぞれ独立してNまたはCR2a;
Z21、Z22、Z23、Z24、Z25およびZ26が、それぞれ独立してNまたはC;
R2aが、水素原子または置換基
である、実施形態121の化合物、またはその医薬上許容される塩。
R19が、ハロゲン原子
である、実施形態101~122のいずれか1つの化合物、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態124または126~128のいずれか1つの化合物、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態125~128のいずれか1つの化合物、またはその医薬上許容される塩。
(CD-L2)u-DA (XLI)
を有する化合物、またはその医薬上許容される塩であって、式中:
CDは、式(XX)-(XXIX):
R1およびR2は、それぞれ独立してヒドロキシ基、水素、アミノ基、またはハロゲン原子;
B3およびB4は、独立して置換されていてもよい5~14員芳香族複素環基;
X1およびX2は、それぞれ独立して酸素原子、CH2、または硫黄原子;
Q1、Q2、Q3、およびQ4は、それぞれ独立して酸素原子または硫黄原子;
L2は、リンカー;または
L2は、存在せず;
DAは、薬物送達剤;および
uは、1-1000
である。
子である、実施形態144の化合物、またはその医薬上許容される塩。
R13、R14、R15、R16およびR17が、それぞれ独立して水素原子または置換基;
Y11、Y12、Y13、Y14、Y15およびY16が、それぞれ独立してNまたはC
R1a;
Z11、Z12、Z13、Z14、Z15およびZ16が、それぞれ独立してNまたはC;
R1aが、水素原子または置換基;
B4が、式(B4-A)または式(B4-B):
R23、R24、R25、R26およびR27が、それぞれ独立して水素原子または置換基;
Y21、Y22、Y23、Y24、Y25およびY26が、それぞれ独立してNまたはCR2a;
Z21、Z22、Z23、Z24、Z25およびZ26が、それぞれ独立してNまたはC;
R2aが、水素原子または置換基
である、実施形態157の化合物、またはその医薬上許容される塩。
R19が、ハロゲン原子
である、実施形態144~158のいずれか1つの化合物、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態159または162~164のいずれか1つの化合物、またはその医薬上許容される塩。
これらは、それぞれ独立して:
(i)任意の適用可能な炭素原子において、ハロ、C1-6アルキル、C1-6アルコキシ、C1-6アルキルチオ、またはアミノ基で置換されていてもよい;および/または
(ii)任意の適用可能な窒素原子において、C1-6アルキル基で置換されていてもよい、
実施形態161~164のいずれか1つの化合物、またはその医薬上許容される塩。
X4が、-(CH2)v-、
X4が、存在せず;
T1が、ペプチド、または存在せず;
Z1が、スペーサー;
QAが、ヘテロ二官能基またはヘテロ三官能基、または存在しない、
実施形態144~181のいずれか1つの化合物、またはその医薬上許容される塩。
R10cおよびR10dが、独立して、水素および置換されていてもよいC1-6アルキルからなる群から選ばれる、
実施形態182の化合物、またはその医薬上許容される塩。
m1が、1、2、3、4、5、または6;および
s1が、1、2、3、4、5、6、7、8、9、または10
である、実施形態182~184のいずれか1つの化合物、またはその医薬上許容される塩。
Z1が、
p1が、1、2、3、4、5、6、7、8、9、または10
である、実施形態182の化合物、またはその医薬上許容される塩。
Z1が、
r1が、1、2、3、4、5、または6
である、実施形態182の化合物、またはその医薬上許容される塩。
れか1つの化合物、またはその医薬上許容される塩。
R29が、水素またはC1-6アルキル;
R30aおよびR30bが、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれ;
R31aおよびR31bは、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、-N(CH3)2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれ;および
*が、薬物送達剤に結合している任意の適用可能な炭素原子、窒素原子、酸素原子、または硫黄原子に対する結合点を示す、
実施形態182~188のいずれか1つの化合物、またはその医薬上許容される塩。
その医薬上許容される塩。
本開示の化合物は、STING に対する作動活性を示し、かつ、本開示の化合物は、薬効発現、薬物動態(例、吸収性、分布、代謝、排泄)、溶解性(例、水溶性)、他の医薬品との相互作用(例、薬物代謝酵素阻害作用)、安全性(例、急性毒性、慢性毒性、遺伝毒性、生殖毒性、心臓毒性、癌原性、中枢毒性)、安定性(例、化学的安定性、酵素に対する安定性)の点でも優れているので、医薬として有用であり得る。
従って、本開示の化合物は、哺乳動物(例、マウス、ラット、ハムスター、ウサギ、ネコ、イヌ、ウシ、ヒツジ、サル、ヒト)に対して、STING 活性を亢進するために用いることができる。
本開示の化合物は、STING により影響される可能性のある疾患(本明細書中、「STING関連疾患」と略記することがある)、例えば、癌[例、大腸癌(例、結腸癌、直腸癌、肛門癌、家族性大腸癌、遺伝性非ポリポーシス大腸癌、消化管間質腫瘍)、肺癌(例、非小細胞肺癌、小細胞肺癌、悪性中皮腫)、中皮腫、膵臓癌(例、膵管癌、膵内分泌腫瘍)、咽頭癌、喉頭癌、食道癌、胃癌(例、乳頭腺癌、粘液性腺癌、腺扁平上皮癌)、十二指腸癌、小腸癌、乳癌(例、浸潤性乳管癌、非浸潤性乳管癌、炎症性乳癌)、卵巣癌(例、上皮性卵巣癌、性腺外胚細胞腫瘍、卵巣性胚細胞腫瘍、卵巣低悪性度腫瘍)、精巣腫瘍、前立腺癌(例、ホルモン依存性前立腺癌、ホルモン非依存性前立腺癌、去勢療法抵抗性前立腺癌)、肝臓癌(例、肝細胞癌、原発性肝癌、肝外胆管癌)、甲状腺癌(例、甲状腺髄様癌)、腎臓癌(例、腎細胞癌(例、淡明細胞型腎細胞癌)、腎盂と尿管の移行上皮癌)、子宮癌(例、子宮頚部癌、子宮体部癌、子宮肉腫)、妊娠性絨毛癌、脳腫瘍(例、髄芽細胞腫、神経膠腫、松果体星細胞腫瘍、毛様細胞性星細胞腫、びまん性星細胞腫、退形成性星細胞腫、下垂体腺腫)、網膜芽細胞腫、皮膚癌(例、基底細胞腫、悪性黒色腫)、肉腫(例、横紋筋肉腫、平滑筋肉腫、軟部肉腫、紡錘細胞肉腫)、悪性骨腫瘍、膀胱癌、血液癌(例、多発性骨髄腫、白血病(例、急性骨髄性白血病)、悪性リンパ腫、ホジキン病、慢性骨髄増殖性疾患)、原発不明癌]の予防剤または治療剤、癌の増殖阻害剤、癌の転移抑制剤、アポトーシス促進剤、前癌病変(例、骨髄異型性症候群)の治療剤等の医薬として用いられ得る。
以下、本開示の化合物を含有してなる医薬(「本開示の医薬」と略記する場合がある)について詳述する。本開示の医薬の剤形としては、例えば、錠剤(例、糖衣錠、フィルムコーティング錠、舌下錠、バッカル錠、口腔内速崩錠)、丸剤、顆粒剤、散剤、カプセル剤(例、ソフトカプセル剤、マイクロカプセル剤)、シロップ剤、乳剤、懸濁剤、フィル
ム剤(例、口腔内崩壊フィルム、口腔粘膜貼付フィルム)等の経口剤が挙げられる。また、本開示の医薬の剤形としては、例えば、注射剤、点滴剤、経皮剤(例、イオントフォレシス経皮剤)、坐剤、軟膏剤、経鼻剤、経肺剤、点眼剤等の非経口剤も挙げられる。また、本開示の医薬は、速放性製剤、徐放性製剤(例、徐放性マイクロカプセル)などの放出制御製剤であってもよい。
本開示の医薬の剤形として、ナノ粒子製剤や細菌由来膜を用いた製剤を用いることもできる。
結合剤の例としては、5ないし10重量%デンプンのり液、10ないし20重量%アラビアゴム液またはゼラチン液、1ないし5重量%トラガント液、カルボキシメチルセルロース液、アルギン酸ナトリウム液、グリセリンが挙げられる。
崩壊剤の例としては、デンプン、炭酸カルシウムが挙げられる。
滑沢剤の例としては、ステアリン酸マグネシウム、ステアリン酸、ステアリン酸カルシウム、精製タルクが挙げられる。
甘味剤の例としては、ブドウ糖、果糖、転化糖、ソルビトール、キシリトール、グリセリン、単シロップが挙げられる。
界面活性剤の例としては、ラウリル硫酸ナトリウム、ポリソルベート80、ソルビタンモノ脂肪酸エステル、ステアリン酸ポリオキシル40が挙げられる。
懸濁化剤の例としては、アラビアゴム、アルギン酸ナトリウム、カルボキシメチルセルロースナトリウム、メチルセルロース、ベントナイトが挙げられる。
乳化剤の例としては、アラビアゴム、トラガント、ゼラチン、ポリソルベート80が挙げられる。
(例、ベンガラ、二酸化チタン)が用いられ得る。
ール、スルホン酸エチニルエストラジオール、アロマターゼ阻害薬(例、塩酸ファドロゾール、アナストロゾール、レトロゾール、エキセメスタン、ボロゾール、フォルメスタン)、抗アンドロゲン(例、フルタミド、ビカルタミド、ニルタミド、エンザルタミド)、5α-レダクターゼ阻害薬(例、フィナステリド、エプリステリド、デュタステリド)、副腎皮質ホルモン系薬剤(例、デキサメタゾン、プレドニゾロン、ベタメタゾン、トリアムシノロン)、アンドロゲン合成阻害薬(例、アビラテロン)、レチノイドおよびレチノイドの代謝を遅らせる薬剤(例、リアロゾール)、甲状腺ホルモン、およびそれらのDDS(Drug Delivery System)製剤が用いられ得る。
れ得る。
ニボルマブ、ペムブロリズマブ)、抗PD-L1抗体が用いられ得る。
th factor)、FGF-10〕、(4)その他の細胞増殖因子〔例、CSF(c
olony stimulating factor)、EPO(erythropoietin)、IL-2(interleukin-2)、NGF(nerve growt
h factor)、PDGF(platelet-derived growth fa
ctor)、TGFβ(transforming growth factor β)、
HGF(hepatocyte growth factor)、VEGF(vascularendothelial growth factor)、ヘレグリン、アンジオポエチン〕が用いられ得る。
メチル]-1H-ピラゾール-3-イルアミノ]キナゾリン-7-イルオキシ]プロピル]-N-エチルアミノ]エチル エステル(AZD-1152)、4-[9-クロロ-7-(2,6-ジフルオロフェニル)-5H-ピリミド[5,4-d][2]ベンズアゼピン-2-イルアミノ]安息香酸、N-[2-メトキシ-5-[(E)-2-(2,4,6-トリメトキシフェニル)ビニルスルホニルメチル]フェニル]グリシン ナトリウム塩(ON-1910Na)、Volasertib、Selumetinib、Trametinib、N-[2(R),3-ジヒドロキシプロポキシ]-3,4-ジフルオロ-2-(2-フルオロ-4-ヨードフェニルアミノ)ベンズアミド(PD-0325901)、Bosutinib、Regorafenib、Afatinib、Idelalisib、Ceritinib、Dabrafenib等が用いられ得る。
本開示の併用剤の使用に際しては、本開示の化合物と併用薬物の投与時期は限定されず、本開示の化合物と併用薬物とを、投与対象に対し、同時に投与してもよいし、時間差をおいて投与してもよい。時間差をおいて投与する場合、時間差は投与する有効成分、剤形、投与方法により異なるが、例えば、併用薬物を先に投与する場合、併用薬物を投与した後1分ないし3日以内、好ましくは10分ないし1日以内、より好ましくは15分ないし1時間以内に本開示の化合物を投与すればよい。本開示の化合物を先に投与する場合、本開示の化合物を投与した後、1分ないし1日以内、好ましくは10分ないし6時間以内、より好ましくは15分から1時間以内に併用薬物を投与すればよい。併用薬物の投与量は、臨床上用いられている投与量に準ずればよく、投与対象、投与ルート、疾患、組み合わせ等により適宜選択し得る。
別々に製剤化して得られる2種の製剤の異なる投与経路での時間差をおいての投与(例えば、本開示の化合物→併用薬物の順序での投与、あるいは逆の順序での投与)が挙げられる。
併用薬物の投与量は、臨床上用いられている用量を基準として適宜選択し得る。また、本開示の化合物と併用薬物との配合比は、投与対象、投与ルート、対象疾患、症状、組み合わせ等により適宜選択し得る。例えば、投与対象がヒトである場合、本開示の化合物1重量部に対し、併用薬物を0.01ないし100重量部用いればよい。
以下の実施例中の「室温」は通常約 10 ℃ないし約 35 ℃を示す。混合溶媒において示した比は、特に断らない限り容量比を示す。%は、特に断らない限り重量%を示す。
シリカゲルカラムクロマトグラフィーにおいて、Diolと記載した場合は、3-(2,3-ジヒドロキシプロポキシ)プロピルシラン結合シリカゲルを用いた。シリカゲルカラムクロマトグラフィーおよびHPLC (高速液体クロマトグラフィー) において、C18と記載した場合
は、オクタデシル結合シリカゲルを用いた。溶出溶媒の比は、特に断らない限り容量比を示す。
LC/MSの測定においては、以下の条件で実施した[カラム:L-Column2 ODS、3.0 mmI.D.
×50 mm、移動相:アセトニトリル/5 mM 酢酸アンモニウム緩衝液 = 900/100)]。
mp : 融点
MS : マススペクトル
[M+H]+、[M-H]- : 分子イオンピーク
M : モル濃度
N : 規定
CDCl3: 重クロロホルム
DMSO-d6: 重ジメチルスルホキシド
D2O : 重水
1H NMR : プロトン核磁気共鳴
31P NMR : リン核磁気共鳴
LC/MS : 液体クロマトグラフ質量分析計
ESI : エレクトロスプレーイオン化
APCI : 大気圧化学イオン化
THF : テトラヒドロフラン
DMF : N,N-ジメチルホルムアミド
DCM: ジクロロメタン
1H NMR、31P NMRはフーリエ変換型NMRで測定した。解析にはACD/SpecManager (商品名)
などを用いた。水酸基やアミノ基などのプロトンが非常に緩やかなピークについては記
載していない。
MSは、LC/MSにより測定した。イオン化法としては、ESI法、または、APCI法を用いた。データは実測値 (found) を記載した。通常、分子イオンピークが観測されるが、tert-ブトキシカルボニル基を有する化合物の場合、フラグメントイオンとして、tert-ブトキシ
カルボニル基あるいはtert-ブチル基が脱離したピークが観測されることもある。また、
水酸基を有する化合物の場合、フラグメントイオンとして、H2Oが脱離したピークが観測
されることもある。塩の場合は、通常、フリー体の分子イオンピークもしくはフラグメントイオンピークが観測される。
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-2,10,16-トリヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩の合成
ジヒドロキシテトラヒドロフラン-2-イル)-5-フルオロ-3H-ピロロ[2,3-d]ピリミジン-4(7H)-オン
7-((2R,3R,4S,5R)-3,4-ジヒドロキシ-5-(ヒドロキシメチル)テトラヒドロフラン-2-イ
ル)-5-フルオロ-3H-ピロロ[2,3-d]ピリミジン-4(7H)-オン(6.26 g)のピリジン(100 mL)溶液に、4,4'-ジメトキシトリチル クロリド(8.92 g)を室温で加え、アルゴン雰囲気下、室温で終夜撹拌した。反応混合物に飽和炭酸水素ナトリウム水溶液を加え、酢酸エチ
ルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液と飽和食塩水で順次洗浄、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (8.65 g) を得た。MS: [M-H]- 586.0.
シリル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジ
ン-4-オン
7-((2R,3R,4S,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3,4-ジヒドロキシテトラヒドロフラン-2-イル)-5-フルオロ-3H-ピロロ[2,3-d]ピリミジン-4(7H)-オン(2.65 g)のDMF(20 mL)溶液にイミダゾール(0.614 g)およびtert-ブチルジメ
チルクロロシラン(0.816 g)を加え、室温で終夜撹拌した。反応混合物を水で希釈し、
酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/ヘキサン)
で精製して標題化合物 (1.1 g)を得た。MS: [M-H]-700.2.
シリル)-2-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3-O-(tert-ブチル(ジメチル)シリル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (5.43 g) を無水トルエンと3回共沸脱水し、無水DMF (15 mL) に溶解した。この
溶液に3-((ビス(ジイソプロピルアミノ)ホスフィノ)オキシ)プロパンニトリル (3.19 mL)、1H-テトラゾール (0.542 g) 及び1-メチル-1H-イミダゾール(0.306 mL) を加え、アル
ゴン雰囲気下、室温で終夜撹拌した後、飽和炭酸水素ナトリウム水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液と飽和食塩水で順次洗浄、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(DIOL、酢酸エチル/ヘキサン)で精製した。得られた粗生成物を再度 シリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン、0.5%トリエチルアミン含有)で精製することにより、標題化合物 (4.22 g) を2種のジアステレオマーの混合物 として得た。MS: [M-H]-901.2.
ン-7(4H)-イル)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエ
トキシ)ホスホリル)オキシ)メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート
N-ベンゾイル-2'-デオキシ-2'-フルオロ-3'-O-(ヒドロキシ(オキシド)ホスホラニル)アデノシン (1.2 g) と7-(5-O-([ビス(4-メトキシフェニル)(フェニル)メチル)]-3-O-([tert-ブチル(ジメチル)シリル)]-2-O-({(2-シアノエトキシ)([ジイソプロピルアミノ)]ホス
フィノ)}-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (3.4 g) を無水アセトニトリルと共沸脱水した後、無水アセトニトリル (15 mL) および無水THF (5 mL) を加えた。混合物に無水アセトニトリルと共沸脱水した5-(エ
チルスルファニル)-2H-テトラゾール (1.07 g) と無水アセトニトリル (10 mL) の混合物を加え、アルゴン雰囲気下55 ℃で2時間撹拌した後、70% tert-ブチル ヒドロペルオキ
シド水溶液 (1.12 mL) を加え、室温で20分撹拌した。反応混合物にチオ硫酸ナトリウム (5920 mg) と水 (3 mL) の混合物を加えた後、減圧下濃縮した。残渣に80% 酢酸 (30 mL)
を加え、室温で20分撹拌した。反応混合物を減圧下濃縮し、残渣をシリカゲルカラムク
ロマトグラフィー (メタノール/酢酸エチル) で精製して、標題化合物(1.1 g) を得た。MS: [M+H]+ 952.2
シ)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イ
ル)ベンズアミド
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-2-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエト
キシ)ホスホリル)オキシ)メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート (350 mg) を無水アセトニトリルおよび無水ピリジンと共沸脱水した後、無水ピリジン(15 mL) を加えた。混合物に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-
オキシド (238 mg) を加え、アルゴン雰囲気下室温で1時間撹拌した後、水 (232 μL) とヨウ素 (121 mg) を加え、室温でさらに20分撹拌した。反応混合物にチオ硫酸ナトリウム5水和物 (91 mg) と水 (1 mL) の混合物を加えて室温で5分間撹拌した後、トルエンを加
え、減圧下濃縮した。残渣に無水アセトニトリル (15 mL) および 2-メチルプロパン-2-
アミン (5.26 mL) を加え、室温で2時間撹拌した後、減圧下濃縮した。残渣をシリカゲ
ルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製し、標題化合物(332 mg) を得た。MS: [M+H]+ 897.1
テトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-16-((tert-ブチル(ジメチル)シリル)オキシ)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-
イル)-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド (332 mg) に40%メチルアミン エタノール溶液 (7.6 mL) を加え、アルゴン雰囲気下室温で1時間撹拌した後、反応混合物を減圧下濃縮した。残渣をシリカゲルカ
ラムクロマトグラフィー (メタノール/酢酸エチル) で精製した後、得られた残渣をHPLC (L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル) にて精製し、標題化合物 (106.4 mg) を得た。MS: [M+H]+ 793.1
ロ-2,10,16-トリヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-16-((tert-
ブチル(ジメチル)シリル)オキシ)-15-フルオロ-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロ
テトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(106.4 mg) にトリエチルアミン 三フッ化水素酸塩 (1094 μL) を加えた。反応混合物を50℃で1時間撹拌し、室温まで冷却した後、エトキシ(トリメチル)シラン (6266 μL) を加
えて、室温で1時間撹拌した。反応混合物を減圧下濃縮した後、残渣にエトキシ(トリメチル)シラン (6266 μL) およびメタノール (1 mL) を加えて、室温で1時間撹拌した。反応混合物を減圧下濃縮した後、残渣をC18カラムクロマトグラフィー (アセトニトリル/10 mM酢酸トリエチルアンモニウム緩衝液)で精製して、標題化合物 (82 mg) を得た。1H NMR (400 MHz, D2O) δ 1.18 (18H, t, J = 7.3 Hz), 3.11 (12H, q, J = 7.4 Hz), 4.01-4.14 (2H, m), 4.17-4.26 (1H, m), 4.34 (2H, d, J = 3.4 Hz), 4.42-4.50 (1H, m), 4.54
(1H, d, J = 4.2 Hz), 4.86-4.99 (2H, m), 5.38-5.60 (1H, m), 6.30-6.45 (2H, m), 7.24 (1H, d, J = 2.0 Hz), 7.91 (1H, s), 8.05 (1H, s), 8.17 (1H, s). 31P NMR (162 MHz, D2O) δ -2.16, -1.66.
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-2,10,16-トリヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2ナトリウム塩の合成
せたカラムに脱イオン水 (480 mL) を透過させた。更に、1 M水酸化ナトリウム水溶液 (288 mL) および脱イオン水 (540 mL) を透過させた。上記の前処理を実施した樹脂に7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-2,10,16-トリヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩 (1.53 g) を含む脱イオン水
(54 mL) を透過させた後、脱イオン水 (72 mL) を透過させ、得られた水溶液を凍結乾燥することで標題化合物 (1.28 g) を得た。1H NMR (300 MHz, D2O) δ 4.05-4.17 (2H, m), 4.20-4.28 (1H, m), 4.33-4.40 (2H, m), 4.44-4.51 (1H, m), 4.55 (1H, d, J = 4.2 Hz), 4.84-5.01 (2H, m), 5.39-5.61 (1H, m), 6.31-6.40 (2H, m), 7.25 (1H, d, J = 2.0 Hz), 7.91 (1H, s), 8.07 (1H, s), 8.18 (1H, s). 31P NMR (121 MHz, D2O) δ -2.2, -1.6.
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異
性体)の合成
ファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホ
スファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミ
ジン-4-オン (光学異性体)
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-2-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエト
キシ)ホスホリル)オキシ)メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート (700 mg) を無水アセトニトリルおよび無水ピリジンと共沸脱水した後、無水ピリジン(50 mL) を加えた。混合物に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-
オキシド (475 mg) を室温で加え、アルゴン雰囲気下室温で1時間撹拌した後、水 (464
μL) と3H-ベンゾ[c][1,2]ジチオール-3-オン (186 mg) を加え、室温でさらに30分撹拌
した。反応混合物にチオ硫酸ナトリウム (913 mg) と水 (3 mL) の混合物を加えた後、減圧下濃縮した。残渣に無水アセトニトリル (30 mL) および 2-メチルプロパン-2-アミン (10 mL) を加え、室温で1時間撹拌した後、減圧下濃縮した。残渣をシリカゲルカラムク
ロマトグラフィー (メタノール/酢酸エチル) で精製した後、得られた残渣に40%メチル
アミン エタノール溶液 (7.3 mL) を加え、アルゴン雰囲気下室温で30分撹拌した後、反
応混合物を減圧下濃縮した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製した。得られた残渣をHPLC (L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル) にて精製し、2種のジアステレオマー(LC/MSにて保持時間の小さい方から順に tR1, tR2)に分割し、標題化合物 (70 mg, tR1) および標題化合物 (150 mg, tR2) を得た。MS (tR1): [M+H]+809.1 MS (tR2): [M+H]+809.1
ロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-
フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(
光学異性体)
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-16-((tert-
ブチル(ジメチル)シリル)オキシ)-15-フルオロ-10-ヒドロキシ-2,10-ジオキシド-2-スル
ファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホ
スファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミ
ジン-4-オン (光学異性体)(70 mg, tR1由来) にメタノール (3.0 mL) およびトリエチ
ルアミン 三フッ化水素酸塩 (1.41 mL) を加えた。反応混合物を濃縮しメタノールを留去した後55℃で1時間撹拌した。室温まで冷却した後、エトキシ(トリメチル)シラン (7.8 mL) を加えて、室温で2時間撹拌した。反応混合物を減圧下濃縮し残渣をC18カラムクロマ
トグラフィー (アセトニトリル/10 mM酢酸トリエチルアンモニウム緩衝液)で精製して、
標題化合物 (56 mg) を得た。1H NMR (400 MHz, D2O) δ 1.23 (18H, t, J = 7.3 Hz), 3.15 (12H, q, J = 7.3 Hz), 4.15-4.23 (3H, m), 4.37-4.50 (2H, m), 4.54 (1H, d, J =
10.3 Hz), 4.61 (1H, d, J = 3.9 Hz), 4.96 (2H, dt, J = 7.9, 3.9 Hz), 5.77-5.95 (1H, m), 6.36 (1H, d, J = 8.1 Hz), 6.40 (1H, d, J = 15.4 Hz), 7.51 (1H, d, J = 1.7 Hz), 7.99 (2H, d, J = 13.7 Hz), 8.23 (1H, s). 31P NMR (162 MHz, D2O) δ-2.43,
54.03.
7-((2R,5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオ
ロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-
フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 1.7 トリエチルアミン塩
の合成
ブチル(ジメチル)シリル)オキシ)-15-フルオロ-10-ヒドロキシ-2,10-ジオキシド-2-スル
ファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホ
スファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミ
ジン-4-オン(光学異性体)(150 mg, tR2由来) にメタノール (3.0 mL) およびトリエチ
ルアミン 三フッ化水素酸塩 (3.02 mL) を加えた。反応混合物を濃縮しメタノールを留去した後55℃で1時間撹拌した。室温まで冷却した後、エトキシ(トリメチル)シラン (16.4 mL) を加えて、室温で2時間撹拌した。反応混合物を減圧下濃縮し残渣をC18カラムクロマトグラフィー (アセトニトリル/10 mM酢酸トリエチルアンモニウム緩衝液)で精製して、
標題化合物 (155 mg) を得た。1H NMR (400 MHz, D2O) δ 1.23 (15H, t, J = 7.3 Hz), 3.15 (10H, q, J = 7.3 Hz), 4.06 (1H, dd, J = 11.7, 4.9 Hz), 4.18 (1H, dd, J = 11.6, 2.8 Hz), 4.29-4.47 (3H, m), 4.51 (1H, d, J = 8.8 Hz), 4.58 (1H, d, J = 3.9 Hz), 4.93-5.14 (2H, m), 5.44-5.64 (1H, m), 6.33-6.45 (2H, m), 7.32 (1H, d, J = 1.5 Hz), 7.95 (1H, s), 8.06 (1H, s), 8.24 (1H, s). 31P NMR (162 MHz, D2O) δ-2.41,55.33.
7-((2R,5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオ
ロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-
フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2ナトリウム塩の合成
水溶液(240 mL) および脱イオン水 (450 mL) を透過させた。上記の前処理を実施した樹
脂に7-((2R,5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フ
ルオロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メ
タノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩
(1.30 g) を含む脱イオン水 (45 mL) を透過させた後、脱イオン水 (60 mL) を透過させ、標題化合物を含む水溶液を得た。
エンプティーカラムにAG(商品名) 50W-X8 陽イオン交換樹脂 (100-200 mesh, 26.3 g) を充填させたカラムに脱イオン水 (400 mL) を透過させた。更に、1 M水酸化ナトリウム
水溶液(270 mL) および脱イオン水 (540 mL) を透過させた。上記の前処理を実施した樹
脂に7-((2R,5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フ
ルオロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メ
タノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩
(1.18 g) を含む脱イオン水 (54 mL) を透過させた後、脱イオン水 (63 mL) を透過させ、標題化合物を含む水溶液を得た。標題化合物を含む2つの水溶液を混ぜ合わせ、凍結乾燥することで標題化合物 (2.0 g) を得た。1H NMR (300 MHz, D2O) δ 3.97-4.07 (1H, m), 4.11-4.20 (1H, m), 4.27-4.42 (3H, m), 4.43-4.51 (1H, m), 4.55 (1H, d, J = 3.8
Hz), 4.88-5.12 (2H, m), 5.34-5.59 (1H, m), 6.30-6.40 (2H, m), 7.28 (1H, d, J = 1.9 Hz), 7.91 (1H, s), 8.01 (1H, s), 8.18 (1H, s). 31P NMR (121 MHz, D2O) δ -2.38, 55.3.
7-((5R,7R,8R,12aR,14R,15R,15aS,16R)-14-(6-アミノ-9H-プリン-9-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩の合成
オロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-5-(ヒドロキシメチル)テトラ
ヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)テトラヒドロフラン-3-イル 水素 ホスホナート
N-ベンゾイル-2'-O-(tert-ブチル(ジメチル)シリル)-3'-O-(ヒドロキシ(オキシド)ホスホラニル)アデノシン(369 mg)と7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3-O-(tert-ブチル(ジメチル)シリル)-2-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミ
ジン-4-オン(817 mg) を無水アセトニトリル (3回)と共沸脱水し、無水アセトニトリル (3.6 mL)および無水THF(1.2 mL) に懸濁した。混合物に無水アセトニトリルと共沸脱水した5-(エチルスルファニル)-2H-テトラゾール (262 mg) と無水アセトニトリル (2.4 mL) の混合物を加え、アルゴン雰囲気下、室温で1時間半撹拌した。反応液に70%tert-ブチル
ヒドロペルオキシド水溶液 (0.276 mL) を加え、室温でさらに40分撹拌した。反応混合
物をチオ硫酸ナトリウム(636 mg)および水 (2 mL) でクエンチした後、減圧下溶媒を留去した。残渣を80%酢酸(5 mL) に溶解し、室温で2時間半撹拌した。反応混合物を減圧濃縮し、無水アセトニトリル及びトルエンで共沸脱水した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (538 mg) を得た。MS: [M+H]+ 1064.3.
ル)オキシ)-10-(2-シアノエトキシ)-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリ
ル)オキシ)-2-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-2-(5-フル
オロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-5-(ヒドロキシメチル)テトラ
ヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)テトラヒドロフラン-3-イル 水素 ホスホナート(538 mg) を無水アセトニトリル及び無水ピリジンで共沸脱水し、無水ピリジン (12 mL) に懸濁した。2-クロロ-5,5-ジメチル-1,3,2-ジオキ
サホスフィナン 2-オキシド (327 mg) を加え、室温で1時間撹拌した後、水 (0.319 mL) とヨウ素 (167 mg) を加え、室温でさらに30分撹拌した。反応混合物をチオ硫酸ナトリウム(208 mg)および水 (2 mL) でクエンチした後、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (509 mg) を得た。MS: [M+H]+ 1062.3.
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-10-(2-シアノエトキシ)-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフ
ロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-
プリン-6-イル)ベンズアミド (509 mg) を33%メチルアミン エタノール溶液 (10 mL) に溶解し、アルゴン雰囲気下、室温で1時間撹拌した後、溶媒を減圧下留去した。残渣をシ
リカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製した。得られた残渣をHPLC (L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニ
トリル) にて精製し、標題化合物 (227 mg)を得た。MS: [M+H]+ 905.2.
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラ
デシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(227 mg)にトリエチルアミン 三フッ化水素酸塩 (0.818 mL) を加えて、50℃で5時間撹拌した。溶媒を減圧下留去した後、1 M 重炭酸トリエチルアンモニウム水溶液を加えて中和し、再び溶媒を減圧下留去した。残渣をC18シリカゲルカラムクロマトグラフィー (10 mM 酢酸ト
リエチルアンモニウム緩衝液/アセトニトリル)で精製し、得られた固体を凍結乾燥して標題化合物 (103 mg) を得た。1H NMR (300 MHz, D2O) δ1.26 (18H, t, J = 7.4 Hz), 3.18 (12H, q, J = 7.4 Hz), 4.06-4.29 (3H, m), 4.34-4.52 (3H, m), 4.62 (1H, d, J = 3.8 Hz), 4.69-4.83 (1H, m), 4.84-4.95 (1H, m), 4.98-5.09 (1H, m), 6.14 (1H, d, J = 1.5 Hz), 6.41 (1H, dd, J = 8.3, 1.5 Hz), 7.33 (1H, d, J = 1.9 Hz), 7.99 (1H, s), 8.16 (1H, s), 8.25 (1H, s). 31P NMR (121 MHz, D2O) δ-1.96,-1.21.
7-((5R,7R,8R,12aR,14R,15R,15aS,16R)-14-(6-アミノ-9H-プリン-9-イル)-15,16-ジヒド
ロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異性体)
シリル)-2-O-(ヒドロキシ(オキシド)ホスホラニル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3-O-(tert-ブチル(ジメチル)シリル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (835 mg) をピリジン(4 mL) に溶解し、亜リン酸ジフェニル (0.456 mL) を加え
た。室温で2時間撹拌した後、水 (1 mL) および水酸化アンモニウム (2 mL) を加えた。
室温で30分間撹拌した後、反応混合物を水で希釈し、酢酸エチルで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (611 mg) を得た。MS: [M-H]-764.1.
7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3-O-(tert-ブチル(ジメチル)シリル)-2-O-(ヒドロキシ(オキシド)ホスホラニル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (611 mg) および80%酢酸 (4 mL) の混合物を室温で2時間撹拌した。反応混合物をメタノールで希釈し、減圧下溶媒を留去した
。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標
題化合物 (358 mg) を得た。MS: [M+H]+ 464.1.
7-(3-O-(tert-ブチル(ジメチル)シリル)-2-O-(ヒドロキシ(オキシド)ホスホラニル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(358 mg) およびN-ベンゾイル-5'-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-2'-O-(tert-ブチル(ジメチル)シリル)-3'-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホス
フィノ)アデノシン (1.02 g) の混合物を、無水アセトニトリルと共沸脱水し、無水アセ
トニトリル(10 mL) に懸濁した。ピリジン 2,2,2-トリフルオロアセタート (386 mg) を
加え、アルゴン雰囲気下、室温で1時間撹拌した後、((ジメチルアミノ-メチリデン)アミ
ノ)-3H-1,2,4-ジチアゾリン-3-チオン (199 mg) を加え、室温でさらに30分間撹拌した。反応混合物をチオ硫酸ナトリウム (250 mg) の水溶液 (2.5 mL) でクエンチした後、減圧下溶媒を留去した。残渣を1,1,1,3,3,3-ヘキサフルオロプロパン-2-オール (10 mL) に溶解し、室温で30分間撹拌した後、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (328 mg) を得た。MS: [M+H]+ 1080.3.
ル)オキシ)-2-(2-シアノエトキシ)-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10-オキシド-10-スルファニル-2-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド (光学異性体)
(2R,3R,4R,5R)-5-((((((2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリル)オキシ)-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オ
キシ)(2-シアノエトキシ)ホスホロチオイル)オキシ)メチル)-4-((tert-ブチルジメチルシリル)オキシ)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)テトラヒドロフラン-3-イル 水素 ホスホナート (328 mg) および無水ピリジン (10 mL) の混合物に、2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン2-オキシド (196 mg) を加えた。アルゴン雰囲気下、室温で30分間撹拌した後、水 (0.5 mL) および3H-ベンゾ[c][1,2]ジチオール-3-オン (61 mg) を加え、室温で1時間撹拌した。反応混合物を飽和重曹水で希釈し、酢酸エチルで抽出した。抽出液を無水硫酸ナトリウムで乾燥し、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製
し、さらにC18シリカゲルカラムクロマトグラフィー (10 mM 酢酸トリエチルアンモニウ
ム緩衝液/アセトニトリル) で精製して標題化合物(光学異性体) (92 mg、tR4) を得た。MS: [M+H]+ 1094.3.
ヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテ
トラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (光学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2-(2-シアノエトキシ)-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10-オキシド-10-スルファニル-2-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド (光学異性体) (90 mg) を40%メチルアミン-メタ
ノール溶液 (3.0 mL) に溶解し、アルゴン雰囲気下、室温で1時間撹拌した後、溶媒を減
圧下留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル)
で精製して標題化合物 (32 mg) を得た。MS: [M+H]+ 937.1.
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (光学異性体) (32 mg) およびトリエチルアミン三フッ化水素酸塩 (0.12 mL) の混合物を50℃
で3時間撹拌した。室温まで冷却後、反応混合物に1 M 重炭酸トリエチルアンモニウム水
溶液を加えて中和した後、溶媒を減圧下留去した。残渣をC18シリカゲルカラムクロマト
グラフィー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリル) で精製した。
得られた固体を凍結乾燥して標題化合物 (21 mg) を得た。1H NMR (300 MHz, D2O) δ1.23 (18H, t, J = 7.3 Hz), 3.15 (12H, q, J = 7.4 Hz), 3.99-4.09 (1H, m), 4.23-4.30 (2H, m), 4.30-4.41 (2H, m), 4.41-4.45 (1H, m), 4.47-4.54 (1H, m), 4.83-4.88 (2H,
m), 4.96-5.13 (3H, m), 6.11 (1H, d, J = 1.1 Hz), 6.36 (1H, d, J = 7.4 Hz), 7.31
(1H, d, J = 1.9 Hz), 7.95 (1H, s), 8.11 (1H, s), 8.22 (1H, s). 31P NMR (121 MHz, D2O) δ52.25, 54.88.
7-((5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-アミノ-9H-プリン-9-イル)-15,16-ジヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異性体)の合成
シリル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジ
ン-4-オン
7-((2R,3R,4S,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3,4-ジ
ヒドロキシテトラヒドロフラン-2-イル)-5-フルオロ-3H-ピロロ[2,3-d]ピリミジン-4(7H)-オン(2.65 g)のDMF(20 mL)溶液にイミダゾール(0.614 g)およびtert-ブチルジメ
チルクロロシラン(0.816 g)を加え、室温で終夜撹拌した。反応混合物を水で希釈し、
酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/ヘキサン)
で精製して標題化合物(1.2 g)を得た。MS: [M-H]- 700.3.
シリル)-3-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-2-O-(tert-ブチル(ジメチル)シリル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(2.37 g)をDMF(6.75 mL)に溶解し、この溶液に3-((ビス(ジイソプロピルアミノ)ホスフィノ)オキシ)プロパンニトリル (2.15 mL)、1H-テトラゾール(0.237 g) 及び1-メチ
ル-1H-イミダゾール (0.134 mL) を加え、アルゴン雰囲気下、室温で20時間半撹拌した。反応液に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥し、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン、0.5%トリエチルアミン含有) で精製して標題化合物
(2.67 g) を得た。MS: [M-H]- 900.2.
7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-2-O-(tert-ブチル(ジメチル)シリル)-3-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(1.54 g)をアセト
ニトリル(15 mL)に溶解し、ピリジン2,2,2-トリフルオロアセタート (0.396 g)および
水(0.062 mL)を室温で加えて、室温で50分撹拌した。反応液に2-メチルプロパン-2-アミ
ン (8.07 mL)を室温で加えて、室温で30分撹拌した。反応混合物を減圧下濃縮し、残渣に80%酢酸(8.54 mL)を加えて室温で1時間撹拌した。
同様に7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-2-O-(tert-ブチル(ジメ
チル)シリル)-3-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-beta-D-リ
ボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(1.13 g)
をアセトニトリル(10 mL)に溶解し、ピリジン2,2,2-トリフルオロアセタート (0.290 g)および水(0.045 mL)を室温で加えて、室温で50分撹拌した。反応液に2-メチルプロパン-2-アミン (5.92 mL)を室温で加えて、室温で30分撹拌した。反応混合物を減圧下濃縮し、残渣に80%酢酸(6.27 mL)を加えて室温で1時間撹拌した。
反応混合物をあわせて減圧下濃縮し、残渣をシリカゲルカラムクロマトグラフィー(メ
タノール/酢酸エチル) で精製して標題化合物 (961 mg) を得た。MS: [M+H]+ 464.0.
7-(2-O-(tert-ブチル(ジメチル)シリル)-3-O-(ヒドロキシ(オキシド)ホスホラニル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(400 mg)とN-ベンゾイル-5'-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3'-O-(tert-ブチル(ジメチル)シリル)-2'-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)アデノシン(1.02 g) を無水アセトニトリル (3回)と共沸脱水し、無水アセトニトリル (6 mL) に懸濁した。ピリジン 2,2,2-トリフルオロアセタート (333 mg) を加え、アルゴ
ン雰囲気下、室温で1時間撹拌した後、(ジメチルアミノ-メチリデン)アミノ)-3H-1,2,4-
ジチアゾリン-3-チオン (195 mg) を加え、室温でさらに30分撹拌した。反応混合物をチ
オ硫酸ナトリウム(316 mg)および水 (0.5 mL) でクエンチした後、減圧下溶媒を留去した。残渣を1,1,1,3,3,3-ヘキサフルオロプロパン-2-オール(5 mL) に溶解し、室温で1時間
撹拌した。反応混合物を減圧濃縮し、無水アセトニトリル及びトルエンで共沸脱水した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題
化合物 (556 mg) を得た。MS: [M+H]+ 1080.3.
ル)オキシ)-10-(2-シアノエトキシ)-14-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-2,10-ジスルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-9H-プリン-6-イル)ベンズアミド(光学異性体)
((2R,3R,4R,5R)-2-((((((2R,3R,4R,5R)-2-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホロチオイル)オキシ)メチル)-4-((tert-ブチルジメチルシリル)オキシ)-5-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)テトラヒドロフラン-3-イル 水素 ホスホナート (556 mg) を無水アセトニトリルおよび無水ピ
リジンと共沸脱水した後、無水ピリジン(15 mL)に溶解した。混合物に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド(332 mg) を室温で加え、アルゴン雰囲気
下室温で30分撹拌した後、水 (1 mL) と3H-1,2-ベンゾジチオール-3-オン (108 mg) を加え、室温でさらに1時間撹拌した。反応混合物に飽和重曹水を加え、酢酸エチルで抽出し
た。抽出液を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/メタノール) で精製した。得られた残渣をHPLC (L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル) にて精製し、4種のジアステレオマー(LC/MSにて保持時間の小さい方から順に tR1, tR2,tR3, tR4)に分割し、標題化合物 (120 mg, tR2) および標題化合物
(183 mg, tR4) を得た。tR2 MS: [M+H]+1094.3. tR4 MS: [M+H]+1094.3.
ラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (光
学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-10-(2-シアノエトキシ)-14-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-オキシド-2-スルファニル-10-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-9H-プリン-6-イル)ベンズアミド (光学異性体、tR2由来) (120 mg) を33%メチル
アミン エタノール溶液 (5.0 mL) に溶解し、アルゴン雰囲気下、室温で1.5時間撹拌した後、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (84.4 mg) を得た。MS: [M+H]+ 937.2.
ドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩 (光学異性体)
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-アミノ-9H-プリン-9-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジオキシド-2,10-ジスルファニルオクタヒ
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (光学異性体、tR2由来)(84.4 mg)にトリエチルアミン 三フッ化水素酸塩 (0.294 mL) を加
えて、50℃で2時間撹拌した。反応液を室温まで冷却後、1 M 重炭酸トリエチルアンモニ
ウム水溶液を加えて中和した後、溶媒を減圧下留去した。残渣をC18シリカゲルカラムク
ロマトグラフィー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリル)で精製し、得られた固体を凍結乾燥して標題化合物 (58.4 mg) を得た。1H NMR (300 MHz, D2O)
δ 1.26 (18H, t, J = 7.4 Hz), 3.18 (12H, q, J = 7.3 Hz), 3.94-4.05 (1H, m), 4.10-4.20 (1H, m), 4.28-4.45 (2H, m), 4.50 (2H, brs), 4.59 (1H, d, J = 4.2 Hz), 4.71-4.81 (1H, m), 5.32 (2H, d, J = 10.6 Hz), 6.23-6.32 (2H, m), 7.17 (1H, d, J = 2.3 Hz), 8.05 (1H, s), 8.20 (1H, s), 8.66 (1H, s). 31P NMR (121 MHz, D2O) δ55.8
,59.2.
7-((5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-アミノ-9H-プリン-9-イル)-15,16-ジヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異性体)の合成
ラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光
学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-10-(2-シアノエトキシ)-14-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-オキシド-2-スルファニル-10-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-9H-プリン-6-イル)ベンズアミド (光学異性体、tR4由来)(183 mg) を33%メチルアミン エタノール溶液 (5.0 mL) に溶解し、アルゴン雰囲気下、室温で1時間撹拌した後、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (107 mg) を得た。MS: [M+H]+ 937.1.
ドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩 (光学異性
体)
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-アミノ-9H-プリン-9-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジオキシド-2,10-ジスルファニルオクタヒ
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-14-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光
学異性体、tR4由来)(107 mg)にトリエチルアミン 三フッ化水素酸塩 (0.372 mL) を加えて、50℃で2時間半撹拌した。反応液を室温まで冷却後、1 M 重炭酸トリエチルアンモニ
ウム水溶液を加えて中和した後、溶媒を減圧下留去した。残渣をC18シリカゲルカラムク
ロマトグラフィー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリル)で精製し、得られた固体を凍結乾燥して標題化合物 (78 mg) を得た。1H NMR (300 MHz, D2O) δ 1.26 (18H, t, J = 7.4 Hz), 3.18 (12H, q, J = 7.2 Hz), 4.09-4.18 (1H, m), 4.21-4.29 (2H, m), 4.33-4.43 (1H, m), 4.51 (2H, brs), 4.65-4.71 (1H, m), 4.89 (1H, d, J
= 4.2 Hz), 4.99-5.11 (1H, m), 5.29-5.42 (1H, m), 6.23-6.31 (2H, m), 7.00 (1H, d, J = 1.9 Hz), 8.03 (1H, s), 8.17 (1H, s), 8.56 (1H, s). 31P NMR (121 MHz, D2O)
δ52.8,55.1.
2-アミノ-9-((5R,7R,8R,12aR,14R,15R,15aS,16R)-14-(4-アミノ-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン 2トリエチルアミン塩の合成
(2R,3R,4R,5R)-2-((ベンゾイルオキシ)メチル)-5-(4-クロロ-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)テトラヒドロフラン-3,4-ジイル ジベンゾアート(14.09 g)を17
個の封管容器に分け、2 Mアンモニアイソプロパノール溶液(20 mL)をそれぞれに加えた。各々の混合物をマイクロウェーブ照射下130 ℃で5時間撹拌した。得られた各々の混合物
を集約し、減圧濃縮した。得られた残留物をトルエンを用いて2回共沸させた後、ピリジ
ン(100 mL)を加え0 ℃に冷却した。塩化ベンゾイル(26.6 mL)を0 ℃で加え、室温で終夜
撹拌した。反応混合物に水を加え、酢酸エチルで抽出した。抽出液を減圧濃縮し、残留物をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン)で精製した。得られた化
合物にピリジン(350 mL)、エタノール(100 mL)を加え0 ℃に冷却し、1 M水酸化ナトリウ
ム水溶液(103 mL)を加え、0 ℃で1時間撹拌した。さらに1 M水酸化ナトリウム水溶液(45.7 mL)を加え、0 ℃で1時間撹拌した。反応混合物に強酸性陽イオン交換樹脂ダウエックス
TM 50Wx4 100-200 (95 g)を室温で加え、固形物をろ別し、ろ液を減圧濃縮した。残留物
をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル)で精製した。得られた
生成物(5.71 g)にピリジン(60 mL)、4,4'-ジメトキシトリチルクロリド(5.98 g)を加え室温で4時間撹拌した。4,4'-ジメトキシトリチルクロリド(5.98 g)をさらに加え、室温で1時間撹拌した。混合物を減圧濃縮し、水を加え酢酸エチルで抽出した。抽出液を水、飽
和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残留物をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン)で精製して標題化合物(8.50
g)を得た。MS: [M+H]+ 691.2.
ルオロ-7H-ピロロ[2,3-d]ピリミジン-4-イル)ベンズアミド
N-(7-((2R,3R,4S,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3,4-ジヒドロキシテトラヒドロフラン-2-イル)-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-4-イル)ベンズアミド(7.51 g)とDMF(30 mL)の混合物にイミダゾール(1.924 g)とtert-ブチ
ルジメチルクロロシラン(2.13 g)を加え、室温で終夜撹拌した。反応混合物に水を加え、酢酸エチルで抽出した。抽出液を水、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残留物をシリカゲルカラムクロマトグラフィー(酢酸エチ
ル/ヘキサン)で精製して標題化合物(2.94 g)を得た。MS, found: 501.2.
N-(7-((2R,3R,4R,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3-((tert-ブチルジメチルシリル)オキシ)-4-ヒドロキシテトラヒドロフラン-2-イル)-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-4-イル)ベンズアミド(1.03 g)を無水トルエンと共沸
脱水し、アルゴン雰囲気下、無水DMF(5 mL)を加えた。3-((ビス(ジイソプロピルアミノ)
ホスフィノ)オキシ)プロパンニトリル(0.771 g)、1H-テトラゾール(0.090 g)と1-メチル-1H-イミダゾール(0.051 mL)を加え、6時間撹拌した。反応混合液に飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルで抽出した。抽出液を飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残留物をシリカゲルカラムクロマトグラフィー(0.5%トリエチルアミン含有酢酸エチル/ヘキサン)で精製して標題化合物(1.12 g)を得た。1H NMR (300 MHz, CDCl3) δ -0.17 (3H, d, J = 2.6 Hz), -0.04-0.00 (3H, m), 0.78 (9H, s), 1.04 (3H, d, J = 6.8 Hz), 1.13-1.23 (9H, m), 2.32 (1H, t, J = 6.6 Hz), 2.68 (1H, td, J = 6.4, 1.9 Hz), 3.21-3.36 (1H, m), 3.42-3.71 (4H, m), 3.79 (6H, d, J = 1.1 Hz), 3.85-4.05 (1H, m), 4.25-4.45 (2H, m), 4.64-4.82 (1H, m), 6.39 (1H, dd, J = 14.2, 5.9 Hz), 6.74-6.89 (4H, m), 7.19-7.41 (8H, m), 7.43-7.67 (5H, m), 7.98 (2H, d, J = 7.6 Hz), 8.50 (1H, s), 8.64
(1H, d, J = 5.3 Hz).
N-ベンゾイル-7-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-2-O-(tert-ブチ
ル(ジメチル)シリル)-3-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-beta-D-リボフラノシル)-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-4-アミン(1.12 g)にアセトニトリル (5 mL) 、水 (40 μL) とピリジン 2,2,2-トリフルオロアセタート (258 mg)
を加えた。室温で10分間撹拌した後、tert-ブチルアミン (5.43 mL) を加え、室温で1時間撹拌した。反応混合物を減圧濃縮し、80%酢酸 (5.5 mL) を加え、室温でさらに1時間
撹拌した。溶媒を減圧下留去し、残留物をシリカゲルカラムクロマトグラフィー (メタノ
ール/酢酸エチル)で精製し、標題化合物(527 mg) を得た。MS: [M+H]+ 567.2.
チルシリル)オキシ)-5-(ヒドロキシメチル)-2-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)テトラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4R,5R)-5-(4-ベンズアミド-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-4-((tert-ブチルジメチルシリル)オキシ)-2-(ヒドロキシメチル)テトラヒドロフラン-3-
イル 水素 ホスホナート(527 mg)と3'-O-(tert-ブチル(ジメチル)シリル)-2'-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-N-イソブチリルグアノシン(1.083 g)を無水アセトニトリル と3回共沸脱水し、無水アセトニトリル (10 mL)を加えた。ピリジン
2,2,2-トリフルオロアセタート (359 mg) を加え、室温で30分間撹拌した後、70%tert-ブチル ヒドロペルオキシド水溶液 (382 μL) を加え、室温でさらに20分間撹拌した。反応混合物にチオ硫酸ナトリウム (693 mg)と水(1 mL)を加え、減圧濃縮した。残留物に80
%酢酸 (5 mL) を加え、室温で1時間撹拌した。反応混合物を減圧濃縮し、トルエン で3
回共沸脱水した。残留物をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチ
ル)で精製し、標題化合物(175 mg) を得た。MS: [M+H]+ 1149.4.
ル)オキシ)-10-(2-シアノエトキシ)-2-ヒドロキシ-7-(2-((2-メチルプロパノイル)アミノ)-6-オキソ-1,6-ジヒドロ-9H-プリン-9-イル)-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-4-イル)ベンズアミド
(2R,3R,4R,5R)-5-(4-ベンズアミド-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-4-((tert-ブチルジメチルシリル)オキシ)-2-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)-2-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)
メチル)テトラヒドロフラン-3-イル 水素 ホスホナート (175 mg) を無水アセトニトリル
と3回共沸脱水し、無水ピリジン (3 mL)、2-クロロ-5,5-ジメチル-1,3,2-ジオキサホス
フィナン 2-オキシド (98 mg) を加え、室温でアルゴン雰囲気下10分間撹拌した後、水 (96 μL) とヨウ素 (50 mg) を加え、室温でさらに20分間かき混ぜた。反応混合物をチオ
硫酸ナトリウム(98 mg)と水 (0.4 mL)の混合物を加え、5分間撹拌した後、減圧濃縮した
。残留物をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル)で2回精製し、標題化合物 (48 mg) を得た。MS: [M+H]+ 1147.6.
ロ[2,3-d]ピリミジン-7-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン
N-(7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-10-(2-シアノエトキシ)-2-ヒドロキシ-7-(2-((2-メチルプロパノイル)アミノ)-6-オキソ-1,6-ジヒドロ-9H-プリン-9-イル)-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-4-イル)ベンズアミド(48 mg) を無水アセトニ
トリル と2回共沸脱水し、33%メチルアミンエタノール溶液 (2 mL)を加え、アルゴン雰
囲気下室温で終夜撹拌した。得られた混合物を減圧濃縮し、残留物をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル)で精製した後、得られた残渣をHPLC(L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル)で精製し
、得られた画分を減圧濃縮・凍結乾燥することにより標題化合物(5 mg)を得た。MS: [M+H]+ 920.3.
ロ[2,3-d]ピリミジン-7-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒ
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン 2トリエチルアミン塩
2-アミノ-9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(4-アミノ-5-フルオロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-
ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オ
ン(5 mg) とトリエチルアミン 三フッ化水素酸塩 (200 μL) の混合物を50 ℃で1時間撹
拌した。反応混合物を室温まで冷却した後、1 M炭酸水素トリエチルアンモニウム水溶液
で中和した。反応混合物をC18カラムクロマトグラフィー(アセトニトリル/10 mM酢酸トリエチルアンモニウム緩衝液)で精製し、目的画分を減圧濃縮・凍結乾燥することにより、
標題化合物 (3.2 mg) を得た。1H NMR (600 MHz, D2O) δ 1.23 (18H, t, J = 7.3 Hz), 3.15 (12H, q, J = 7.3 Hz), 4.06-4.11 (1H, m), 4.14-4.19 (1H, m), 4.21-4.26 (1H, m), 4.31-4.37 (2H, m),4.40 (1H, d, J = 1.5 Hz), 4.56 (1H, dd, J = 15.2, 4.3 Hz),
4.61-4.68 (1H, m), 5.00 (1H, ddd, J = 8.5, 6.6, 4.5 Hz), 5.60 (1H, td, J = 7.9,
4.1 Hz), 5.93 (1H, d, J = 8.5 Hz), 6.26 (1H, s), 7.14 (1H, d, J = 1.6 Hz), 7.87
(1H, s), 8.10 (1H, s).
1-((5R,7R,8R,12aR,14R,15R,15aS,16R)-14-(6-アミノ-9H-プリン-9-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,5-ジヒドロ-4H-イミダゾ[4,5-c]ピリジン-4-オンの合成
4-クロロ-1H-イミダゾ[4,5-c]ピリジン(20 g)にギ酸(123 mL)および水(30 mL)を室温で加え、100 ℃で2時間攪拌した。混合物を室温に冷却した後、減圧下濃縮した。残渣
に濃塩酸(100 mL)を加え、100 ℃で1時間攪拌した。混合液を減圧下濃縮した後、残渣をMeOH(100 mL)およびジイソプロピルエーテル(100 mL)に懸濁させ、トリエチルアミン(50 mL)を加えた。生じた固体をろ取し、アセトニトリル(600 mL)に溶かした後、トリメチルシリル N-(トリメチルシリル)アセトイミダート(38.2 mL)を室温で加え、10分間撹拌した。反応混合物に、(2S,3R,4R,5R)-2-アセトキシ-5-((ベンゾイルオキシ)メチル)テトラヒ
ドロフラン-3,4-ジイル ジベンゾアート(79.0 g)を室温で加えた後、80 ℃に加熱した
。反応液にトリメチルシリル トリフルオロメタンスルホナート(28.2 mL)を加え、アルゴン雰囲気下80 ℃で終夜撹拌した。室温に冷却後、水(500 mL)を加え生じた固体をろ取
した。その固体をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精
製して標題化合物 (25.9 g) を得た。1H NMR (400 MHz, CDCl3) δ 4.65-4.96 (3H, m), 5.91 (2H, brs), 6.23-6.42 (1H, m), 6.64 (1H, brs), 7.15 (1H, brs), 7.32-7.56 (9H, m), 7.92-8.15 (7H, m), 12.11-12.50 (1H, m). MS: [M+H]+580.1
(2R,3R,4R,5R)-2-((ベンゾイルオキシ)メチル)-5-(4-オキソ-4,5-ジヒドロ-1H-イミダ
ゾ[4,5-c]ピリジン-1-イル)テトラヒドロフラン-3,4-ジイル ジベンゾアート(30.0 g)
に40%メチルアミン メタノール溶液 (200 mL) を加え、アルゴン雰囲気下室温で1時間撹
拌した後、反応混合物を減圧下濃縮した。残渣をヘキサン-酢酸エチルで再結晶し標題化
合物 (11.2 g) を得た。MS: [M+H]+268.1
ジヒドロキシテトラヒドロフラン-2-イル)-1H-イミダゾ[4,5-c]ピリジン-4(5H)-オン
1-((2R,3R,4S,5R)-3,4-ジヒドロキシ-5-(ヒドロキシメチル)テトラヒドロフラン-2-イ
ル)-1H-イミダゾ[4,5-c]ピリジン-4(5H)-オン(18.0 g)のピリジン(140 mL)溶液に、4,4'-ジメトキシトリチル クロリド(18.46 g)を室温で加え、室温で1時間撹拌した。反
応混合物を減圧下濃縮し、残渣に水を加え、酢酸エチルで抽出した。得られた抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (18.2 g)
を得た。MS: [M+H]+ 570.2
ダゾ[4,5-c]ピリジン-4(5H)-オン
1-((2R,3R,4S,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3,4-ジヒドロキシテトラヒドロフラン-2-イル)-1H-イミダゾ[4,5-c]ピリジン-4(5H)-オン(18.02 g)のDMF(158 mL)溶液にイミダゾール(4.30 g)およびtert-ブチルジメチルクロロ
シラン(5.72 g)を加えた後、室温で3時間撹拌した。さらにtert-ブチルジメチルクロロシラン(2.38 g)を追加した後3時間撹拌した。反応混合物を水で希釈し、酢酸エチルで
抽出した。抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/ヘキサン) で精製した
。単離した標題化合物の位置異性体をMeOHとトリエチルアミンに溶かし、終夜室温で撹拌した。その反応液を濃縮し、残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/
ヘキサン) で精製し、標題化合物(11.5 g)を得た。MS: [M+H]+ 684.2
ン-1-イル)テトラヒドロフラン-3-イル 水素 ホスホナート
1-((2R,3R,4S,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-4-((tert-ブチルジメチルシリル)オキシ)-3-ヒドロキシテトラヒドロフラン-2-イル)-1H-イミダゾ[4,5-c]ピリジン-4(5H)-オン (8.0 g) およびピリジン (117 mL) の混合物に、亜リン
酸ジフェニル (4.5 mL) を加えた。室温で1時間撹拌した後、水 (20 mL) を反応混合物に加えた。室温で30分撹拌した後、反応混合物を水で希釈し、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄し、抽出液を無水硫酸マグネシウムで乾燥した後、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製
して標題化合物 (8.5 g) を得た。MS: [M+H]+ 748.3
水素 ホスホナート
(2R,3R,4R,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-4-((tert-ブチルジメチルシリル)オキシ)-2-(4-オキソ-4,5-ジヒドロ-1H-イミダゾ[4,5-c]ピリジン-1-イル)テトラヒドロフラン-3-イル 水素 ホスホナート (8.2 g) および1,1,1,3,3,3-ヘキサフルオロプロパン-2-オール (30 mL) の混合物を室温で2時間撹拌した。メタノール (10 mL)を加えて60 ℃で1時間攪拌した後、減圧下溶媒を留去した。残渣を酢酸エチルと
ジイソプロピルエーテルで再結晶し標題化合物 (4.3 g) を得た。MS: [M+H]+ 446.1
rt-ブチルジメチルシリル)オキシ)-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)-4-((tert-ブチルジメチルシリル)
オキシ)-2-(4-オキソ-4,5-ジヒドロ-1H-イミダゾ[4,5-c]ピリジン-1-イル)テトラヒドロ
フラン-3-イル 水素 ホスホナート
(2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)-2-(4-オキソ-4,5-ジヒドロ-1H-イミダゾ[4,5-c]ピリジン-1-イル)テトラヒドロフラン-3-イル 水素 ホスホナート (250 mg) とN-ベンゾイル-5'-O-(ビス(4-メトキシフェニル)(フェニ
ル)メチル)-2'-O-(tert-ブチル(ジメチル)シリル)-3'-O-((2-シアノエトキシ)(ジイソプ
ロピルアミノ)ホスフィノ)アデノシン(776 mg) を無水アセトニトリルと共沸脱水した後
、無水アセトニトリル (5.61 mL) を加えた。混合物にピリジン 2,2,2-トリフルオロアセタート (271 mg) を加え、室温で40分撹拌した後、70% tert-ブチル ヒドロペルオキシ
ド水溶液 (231 μL) を加え、室温で20分撹拌した。反応混合物にチオ硫酸ナトリウム (1.3 g) と水 (3 mL) の混合物を加えた後、減圧下濃縮した。残渣に1,1,1,3,3,3-ヘキサフルオロプロパン-2-オール (15 mL) を加え、室温で1時間撹拌した。反応混合物を減圧下
濃縮し、残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/ヘキサンおよびメタ
ノール/酢酸エチル) で精製して、標題化合物 (170 mg) を得た。MS: [M+H]+ 1046.3
ル)オキシ)-2-(2-シアノエトキシ)-10-ヒドロキシ-2,10-ジオキシド-7-(4-オキソ-4,5-ジヒドロ-1H-イミダゾ[4,5-c]ピリジン-1-イル)オクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド
(2R,3R,4R,5R)-5-((((((2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリル)オキシ)-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オ
キシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)-4-((tert-ブチルジメチルシリル)
オキシ)-2-(4-オキソ-4,5-ジヒドロ-1H-イミダゾ[4,5-c]ピリジン-1-イル)テトラヒドロ
フラン-3-イル 水素 ホスホナート (160 mg) を無水ピリジンと共沸脱水した後、無水ピ
リジン (3.0 mL) を加えた。混合物に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (99 mg) を室温で加え、室温で1時間撹拌した後、水 (96 μL) とヨウ素 (50.5 mg) を加え、室温でさらに20分撹拌した。反応混合物にチオ硫酸ナトリウム (190 mg) と水 (0.4 mL) の混合物を加えた後、減圧下濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製し、標題化合物 (10.6 mg) を得た。MS: [M+H]+ 1044.3
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-7-イル)-1,5-ジヒドロ-4H-イミダゾ[4,5-c]ピリジン-4-オン
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2-(2-シアノエトキシ)-10-ヒドロキシ-2,10-ジオキシド-7-(4-オキソ-4,5-ジヒドロ-1H-イミダゾ[4,5-c]ピリジン-1-イル)オクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド(10.6 mg)に40%メチルアミン エタノール溶液 (5.0 mL) を加え、アル
ゴン雰囲気下室温で1時間撹拌した後、反応混合物を減圧下濃縮した。残渣をシリカゲル
カラムクロマトグラフィー (メタノール/酢酸エチル) で精製し、標題化合物 (9.0 mg)
を得た。MS: [M+H]+ 887.2
ゾ[4,5-c]ピリジン-4-オン
1-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラ
デシン-7-イル)-1,5-ジヒドロ-4H-イミダゾ[4,5-c]ピリジン-4-オン(9.0 mg) にメタノール (1.0 mL) およびトリエチルアミン 三フッ化水素酸塩 (165 μL) を加えた。反応混合物を濃縮しメタノールを留去した後55℃で1時間撹拌した。室温まで冷却した後、エトキ
シ(トリメチル)シラン (0.90 mL) を加えて、室温で1時間撹拌した。反応混合物を減圧下濃縮し残渣をC18カラムクロマトグラフィー (アセトニトリル/10 mM酢酸トリエチルアン
モニウム緩衝液)で精製して、標題化合物 (0.3 mg) を得た。1H NMR (400 MHz, D2O) a 4.15 (2H, d, J = 11.5 Hz), 4.46 (4H, brs), 4.56-4.62 (1H, m), 4.98-4.99 (2H, m), 6.05-6.20 (2H, m), 6.79-6.87 (1H, m), 7.06-7.12 (1H, m), 8.00 (1H, s), 7.96-8.10
(1H, m), 8.23 (2H, s). 31P NMR (162 MHz, D2O) δ -2.36,-1.94.
2-アミノ-9-((5R,7R,8R,12aR,14R,15R,15aS,16R)-14-(4-アミノ-1H-イミダゾ[4,5-c]ピリジン-1-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メ
タノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン 2トリエチルアミン塩の合成
N-ベンゾイル-1-(beta-D-リボフラノシル)-1H-イミダゾ[4,5-c]ピリジン-4-アミン(2.41 g)をDMF (25 mL)に溶解し、ジ-tert-ブチルシランジイル ビス(トリフルオロメタンス
ルホナート) (2.32 mL)を0 ℃で加え、0 ℃で75分撹拌した。ジ-tert-ブチルシランジイ
ル ビス(トリフルオロメタンスルホナート) (0.63 mL)を0 ℃で加え、0 ℃でさらに30分
撹拌した。ジ-tert-ブチルシランジイル ビス(トリフルオロメタンスルホナート) (0.63 mL)を0 ℃で加え、0 ℃でさらに35分撹拌した。反応混合物に1H-イミダゾール (2.22 g)
を加えて室温で10分撹拌した。tert-ブチルジメチルクロロシラン (1.18 g)を加えて、60
℃で1時間半撹拌した。tert-ブチルジメチルクロロシラン (0.294 g)を加えて、60 ℃で14時間半撹拌した。反応混合物を水で希釈し、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン) で精製して標題化合物 (3.28 g) を得た。MS: [M+H]+ 625.2.
イミダゾ[4,5-c]ピリジン-4-アミン
ピリジニウムポリ(ヒドロゲンフルオリド) (1.86 mL)を0 ℃でピリジン(10 mL)に溶解
し、N-ベンゾイル-1-(2-O-(tert-ブチル(ジメチル)シリル)-3,5-O-(ジ-tert-ブチルシリ
レン)-beta-D-リボフラノシル)-1H-イミダゾ[4,5-c]ピリジン-4-アミン(1.64 g)のTHF(13
mL)溶液に0 ℃で加えて、0 ℃で8分撹拌した。本反応を二回繰り返した。反応液を合わ
せて水で希釈し酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(
酢酸エチル/ヘキサンおよびメタノール/酢酸エチル) で精製して標題化合物 (2.24 g) を得た。MS: [M+H]+ 485.1.
N-ベンゾイル-1-(2-O-(tert-ブチル(ジメチル)シリル)-beta-D-リボフラノシル)-1H-イミダゾ[4,5-c]ピリジン-4-アミン(2.24 g)をピリジン(25 mL)に溶解し、4,4'-ジメトキシトリチル クロリド (2.04 g) を室温で加え、室温で4時間半撹拌した。反応混合物を減圧下濃縮し、残渣に水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン) で精製して標題化合物 (3.29 g) を得た。MS: [M+H]+
787.3.
N-ベンゾイル-1-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-2-O-(tert-ブチ
ル(ジメチル)シリル)-beta-D-リボフラノシル)-1H-イミダゾ[4,5-c]ピリジン-4-アミン (3.29 g) を無水DMF (9.5 mL) に溶解し、この溶液に3-((ビス(ジイソプロピルアミノ)ホ
スフィノ)オキシ)プロパンニトリル (2.98 mL),1H-テトラゾール (0.328 g) 及び1-メチル-1H-イミダゾール(0.185 mL) を加え、アルゴン雰囲気下、室温で2時間半撹拌した。反応液に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥し、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン、0.5%トリエチルアミン含有) で精製して標題化合物 (3.85 g) を得た。MS: [M+H]+ 987.4.
N-ベンゾイル-1-(5-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-2-O-(tert-ブチ
ル(ジメチル)シリル)-3-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-beta-D-リボフラノシル)-1H-イミダゾ[4,5-c]ピリジン-4-アミン (3.85 g)をアセトニトリル(30 mL)に溶解し、ピリジン 2,2,2-トリフルオロアセタート (0.904 g)および水(0.141
mL)を室温で加えて、室温で30分撹拌した。反応液に2-メチルプロパン-2-アミン (9 mL)
を室温で加えて、室温で40分撹拌した。反応混合物を減圧下濃縮し、残渣に1,1,1,3,3,3-ヘキサフルオロプロパン-2-オール(25 mL)を加えて、室温で3時間半撹拌した。反応混合
物を減圧下濃縮し、酢酸(20 mL)および水(5 mL)を加えて室温で1時間撹拌した。反応混合物を減圧下濃縮し、残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物(1.85 g) を得た。MS: [M+H]+ 549.1.
ブチルジメチルシリル)オキシ)-2-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)-2-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)テ
トラヒドロフラン-3-イル 水素 ホスホナート
N-ベンゾイル-1-(2-O-(tert-ブチル(ジメチル)シリル)-3-O-(ヒドロキシ(オキシド)ホ
スホラニル)-beta-D-リボフラノシル)-1H-イミダゾ[4,5-c]ピリジン-4-アミン(300 mg)と5'-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3'-O-(tert-ブチル(ジメチル)シリ
ル)-2'-O-((2-シアノエトキシ)(ジイソプロピルアミノ)ホスフィノ)-N-イソブチリルグアノシン(637 mg) を無水アセトニトリル (3回)と共沸脱水し、無水アセトニトリル (6 mL) に懸濁した。ピリジン 2,2,2-トリフルオロアセタート (264 mg) を加え、アルゴン雰
囲気下、室温で1時間撹拌した後、70%tert-ブチル ヒドロペルオキシド水溶液 (0.225 mL) を加え、室温でさらに1時間撹拌した。反応混合物をチオ硫酸ナトリウム(400 mg)および水 (1.5 mL) でクエンチした後、減圧下溶媒を留去した。残渣を80%酢酸(5 mL) に溶
解し、室温で45分撹拌した。反応混合物を減圧下濃縮し、無水アセトニトリル及びトルエンで共沸脱水した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチ
ル) で精製して標題化合物 (469 mg) を得た。MS: [M+H]+ 1131.4.
ル)オキシ)-10-(2-シアノエトキシ)-2-ヒドロキシ-7-(2-(イソブチリルアミノ)-6-オキソ-1,6-ジヒドロ-9H-プリン-9-イル)-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-1H-イミ
ダゾ[4,5-c]ピリジン-4-イル)ベンズアミド
(2R,3R,4R,5R)-5-(4-ベンズアミド-1H-イミダゾ[4,5-c]ピリジン-1-イル)-4-((tert-ブチルジメチルシリル)オキシ)-2-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)-2-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)
テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)テトラヒドロフラン-3-イル 水素 ホスホナート(469 mg) を無水アセトニトリル及び無水ピリジンで共沸脱水し、無水ピリジン (10 mL) に懸濁した。2-クロロ-5,5-ジメチル-1,3,2-
ジオキサホスフィナン 2-オキシド (268 mg) を加え、アルゴン雰囲気下、室温で15分間
撹拌した後、水 (1 mL) とヨウ素 (158 mg) を加え、室温でさらに13分撹拌した。反応混合物をチオ硫酸ナトリウム(170 mg)および水 (0.5 mL) でクエンチした後、減圧下溶媒を留去し、トルエンで共沸脱水した。残渣をシリカゲルカラムクロマトグラフィー(メタノ
ール/酢酸エチル) で精製して標題化合物 (419 mg) を得た。MS: [M+H]+ 1129.3.
ピリジン-1-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタ
オキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン
N-(1-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-10-(2-シアノエトキシ)-2-ヒドロキシ-7-(2-(イソブチリルアミノ)-6-オキソ-1,6-ジヒドロ-9H-プリン-9-イル)-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-1H-イミダ
ゾ[4,5-c]ピリジン-4-イル)ベンズアミド(419 mg) を33%メチルアミン エタノール溶液
(10.0 mL) に溶解し、アルゴン雰囲気下、室温で18.5時間撹拌した。33%メチルアミン
エタノール溶液 (5 mL)を加えてさらに3時間撹拌した後、溶媒を減圧下留去した。残渣を33%メチルアミン エタノール溶液 (10.0 mL)に溶解し、室温で1時間撹拌した後、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (173 mg) を得た。MS: [M+H]+ 902.3.
ピリジン-1-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン 2トリエチルアミン塩
2-アミノ-9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(4-アミノ-1H-イミダゾ[4,5-c]ピリジン-1-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオ
キサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン(173 mg)
にトリエチルアミン 三フッ化水素酸塩 (0.625 mL) を加えて、50℃で3時間撹拌した。室温まで冷却後、1 M 重炭酸トリエチルアンモニウム水溶液を加えて中和した後、溶媒を減圧下留去した。残渣をC18シリカゲルカラムクロマトグラフィー (10 mM 酢酸トリエチル
アンモニウム緩衝液/アセトニトリル)で精製し、得られた固体を凍結乾燥して標題化合物
(123 mg) を得た。1H NMR (300 MHz, D2O) δ 1.25 (18H, t, J = 7.4 Hz), 3.17 (12H,
q, J = 7.2 Hz), 3.87-4.10 (1H, m), 4.11-4.30 (3H, m), 4.32-4.45 (2H, m), 4.52 (1H, d, J = 3.8 Hz), 4.65 (1H, d, J = 4.2 Hz), 4.97-5.10 (1H, m), 5.79 (1H, brs),
5.94 (2H, d, J = 8.3 Hz), 7.10 (1H, d, J = 6.8 Hz), 7.68-7.78 (1H, m), 7.83 (1H, s), 7.94-8.26 (1H, m). 31P NMR (121 MHz, D2O) δ-1.36.
8-((5R,7R,8R,12aR,14S,15S,15aS,16R)-7-(6-アミノ-9H-プリン-9-イル)-15,16-ジヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン 2トリエチルアミン塩(光学異性体)の合成
ドロフラン-2-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン
4-((2S,3S,4R,5R)-3,4-ビス(ベンジルオキシ)-5-((ベンジルオキシ)メチル)テトラヒドロフラン-2-イル)-1H-ピラゾール-5-アミン(17.3 g)と炭酸カリウム(24.6 g)のDMF(200 mL)溶液にエチル ホルムイミダート ヒドロクロリド(19.5 g)を室温で加えた。反応混合物を室温で終夜撹拌した。反応混合物にジエチル カルボナート(126 g)を室温で加え、反応混合物を100 ℃で1時間攪拌した。反応混合物に室温で20%ナトリウムエトキシドエタノール溶液(60.6 g)を加えた。反応混合物を100 ℃で30分撹拌した。反応混合物を室温で、酢酸を用いて中和し、酢酸エチルで抽出した。抽出液を水および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/ヘキサン) で精製して標題化合物 (5.79 g) を得た。MS: [M+H]+ 539.1.
8-((2S,3S,4R,5R)-3,4-ビス(ベンジルオキシ)-5-((ベンジルオキシ)メチル)テトラヒドロフラン-2-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン(3.49 g)と水酸化パラ
ジウム(1.37 g, 10% Pd)のメタノール(30 mL)溶液を水素雰囲気下、室温で終夜撹拌した
。触媒をろ別し、ろ液を減圧下で濃縮し、標題化合物 (1.72 g) を得た。MS: [M+H]+ 269.0.
ジヒドロキシテトラヒドロフラン-2-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オ
ン
8-((2S,3R,4S,5R)-3,4-ジヒドロキシ-5-(ヒドロキシメチル)テトラヒドロフラン-2-イ
ル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン(1.72 g)の脱水ピリジン(30 mL)溶液
に4,4'-ジメトキシトリチル クロリド(2.39 g)を氷冷下で加えた。反応混合物を室温でアルゴン雰囲気下2時間撹拌した。反応混合物に4,4'-ジメトキシトリチル クロリド(0.217
g)を氷冷下で加えた。反応混合物を室温でアルゴン雰囲気下3時間撹拌した。反応混合物に4,4'-ジメトキシトリチル クロリド(0.217 g)を室温で加えた。反応混合物を室温でア
ルゴン雰囲気下30分間撹拌した。反応混合物に飽和炭酸水素ナトリウム水溶液を室温で加え、酢酸エチルで抽出した。抽出液を水および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (1.62 g) を得た。MS: [M-H]-569.1.
tert-ブチルジメチルクロロシラン(536 mg)と硝酸銀(I)(604 mg)を8-((2S,3R,4S,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3,4-ジヒドロキシテトラヒドロフラン-2-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン(1.69 g)と脱水ピリジ
ン(1.20 mL)の脱水THF(20 mL)溶液に室温、アルゴン雰囲気下で加えた。反応混合物を室
温で8時間撹拌した後、反応混合物にtert-ブチルジメチルクロロシラン(89 mg)と硝酸銀(I)(101 mg)を室温で加えた。反応混合物を室温で終夜撹拌した。不溶物をろ別し、酢酸エチルで洗浄した。ろ液に飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合
物 (740 mg) を得た。MS: [M-H]-683.1.
亜リン酸ジフェニル(0.41 mL)を8-((2S,3R,4R,5R)-5-((ビス(4-メトキシフェニル)(フ
ェニル)メトキシ)メチル)-3-((tert-ブチルジメチルシリル)オキシ)-4-ヒドロキシテトラヒドロフラン-2-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン(740 mg)のピリジ
ン(10 mL)溶液に室温で加えた。反応混合物を室温、アルゴン雰囲気下で1時間撹拌した
。反応混合物に水(20 mL)を加え、1時間撹拌した。反応混合物を水に室温で加え、酢酸エチルで抽出した。抽出液を水および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エ
チル) で精製して標題化合物 (300 mg) を得た。MS: [M-H]-747.1.
(2R,3R,4S,5S)-2-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-4-((tert-ブチルジメチルシリル)オキシ)-5-(4-オキソ-3,4-ジヒドロピラゾロ[1,5-a][1,3,5]トリ
アジン-8-イル)テトラヒドロフラン-3-イル 水素 ホスホナート(300 mg)に80%酢酸水溶液(10 mL)を加え、室温で1時間攪拌した。反応混合物を減圧下で濃縮し、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (170 mg)
を得た。MS: [M+H]+447.0.
トラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4S,5S)-4-((tert-ブチルジメチルシリル)オキシ)-2-(ヒドロキシメチル)-5-(4-オキソ-3,4-ジヒドロピラゾロ[1,5-a][1,3,5]トリアジン-8-イル)テトラヒドロフラン-3-イル 水素 ホスホナート(190 mg)とN-ベンゾイル-5'-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3'-O-(tert-ブチル(ジメチル)シリル)-2'-O-((2-シアノエチル)(ジイソプ
ロピルアミノ)ホスフィノ)アデノシン(505 mg)に脱水アセトニトリルを加え、共沸操作を3回実施した。残渣に脱水アセトニトリル(5 mL)とピリジン 2,2,2-トリフルオロアセタ
ート(164 mg)を加えた。反応混合物を室温、アルゴン雰囲気下で10分間撹拌し、((ジメチルアミノ-メチリデン)アミノ)-3H-1,2,4-ジチアゾリン-3-チオン (96 mg)を反応混合物に加え、室温で20分撹拌した。反応混合物にチオ硫酸ナトリウム(0.2 g)の水溶液(0.2 mL)
を加えた後、減圧下で濃縮した。残渣に80%酢酸水溶液(5 mL)を加え、室温で1時間攪拌した後、反応混合物にアセトニトリルを加えて共沸操作を2度実施した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (260 mg)
を得た。MS: [M+H]+1063.2.
ラデシン-14-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン(光学異性体)
(2R,3R,4S,5S)-2-((((((2R,3R,4R,5R)-2-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オ
キシ)(2-シアノエトキシ)ホスホロチオイル)オキシ)メチル)-4-((tert-ブチルジメチルシリル)オキシ)-5-(4-オキソ-3,4-ジヒドロピラゾロ[1,5-a][1,3,5]トリアジン-8-イル)テ
トラヒドロフラン-3-イル 水素 ホスホナート(260 mg)に脱水アセトニトリルを加え、共
沸操作を2度実施した。残渣に脱水ピリジンを加え、共沸操作を1度実施した。残渣の脱水ピリジン(5 mL)溶液に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド(158 mg)を加え、アルゴン雰囲気下、室温で20分撹拌した。反応混合物に水(0.15 mL)と3H-ベンゾ[c][1,2]ジチオール-3-オン (49.4 mg)を室温で加えた。反応混合物を室温で1時
間撹拌した。反応混合物に飽和炭酸水素ナトリウム水溶液を室温で加え、酢酸エチルで抽出した。抽出液を飽和チオ硫酸ナトリウム水溶液および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製した後、更にHPLC (L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル) にて分取し、保持時間の最も大きい画分を減圧濃縮した。残渣に33%メチルアミンエタノール溶液(5 mL)を加え、室温で1時間撹拌した。反応混合物を減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (25 mg) を得た。MS: [M+H]+920.2.
ドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン 2トリエチルアミン塩(光学異性体)
8-((5R,7R,8R,12aR,14S,15S,15aR,16R)-7-(6-アミノ-9H-プリン-9-イル)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-2,10-ジオキシド-2,10-ジスルファニルオクタヒ
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-14-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4(3H)-オン(光学異性体)(25 mg)
のメタノール(2 mL)溶液にトリエチルアミン 三フッ化水素酸塩 (0.177 mL) を室温で加
えて、50 ℃で2時間撹拌した。反応混合物にエトキシトリメチルシラン(5 mL)を室温で加え、10分撹拌した。反応混合物を減圧下で濃縮し、残渣をC18シリカゲルカラムクロマト
グラフィー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリル)で精製し、凍結乾燥して標題化合物 (13 mg) を得た。1H NMR (300 MHz, D2O) δ 4.02-4.19 (3H, m), 4.32-4.42 (2H, m), 4.44-4.49 (1H, m), 4.59-4.64 (1H, m), 4.76-4.80 (1H, m), 4.95-5.04 (1H, m), 5.16 (1H, d, J = 4.9 Hz), 5.31 (1H, ddd, J = 9.8, 8.7, 4.2 Hz), 6.22 (1H, d, J = 8.3 Hz), 7.99 (1H, s), 8.00 (1H, s), 8.14 (1H, s), 8.49 (1H, s).
2-アミノ-9-((5R,7R,8R,12aR,14S,15S,15aS,16R)-14-(4-アミノピラゾロ[1,5-a][1,3,5]
トリアジン-8-イル)-2,10,15,16-テトラヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-1,9-ジヒドロ-6H-プリン-6-オン 2トリエチルアミン塩の合成
ト
(2S,3R,4S,5R)-2-(4-アミノピラゾロ[1,5-a][1,3,5]トリアジン-8-イル)-5-(ヒドロキ
シメチル)テトラヒドロフラン-3,4-ジオール(2.98 g)およびN,N-ジメチル-4-アミノピリ
ジン(1.36 g)の脱水ピリジン(50 mL)溶液にベンゾイルクロリド(12.5 g)を氷冷下で加え
た。反応混合物をアルゴン雰囲気下で1時間撹拌した。反応混合物にベンゾイルクロリド(3.13 g)を氷冷下で加えた。反応混合物をアルゴン雰囲気下、室温で2時間撹拌した。反応混合物に水を加え、酢酸エチルで抽出した。抽出液を水および飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/ヘキサン) で精製して標題化合物 (6.51 g) を得た。MS: [M+H]+ 788.2.
(2S,3S,4R,5R)-2-(4-(N-ベンゾイルベンズアミド)ピラゾロ[1,5-a][1,3,5]トリアジン-8-イル)-5-((ベンゾイルオキシ)メチル)テトラヒドロフラン-3,4-ジイル ジベンゾアート(6.51 g)のピリジン(50 mL)およびエタノール(25 mL)の混合溶液に1M水酸化ナトリウム水溶液(49.6 mL)を氷冷下で加え、室温で2時間撹拌した。反応混合物に強酸性陽イオン交換樹脂ダウエックスTM 50Wx4 100-200 (40 g)を室温で加え、室温で15分撹拌した。固形物
をろ別し、ろ液を減圧下で濃縮した。残渣にメタノールを加え、得られた固体をろ取して標題化合物(1.82 g)を得た。MS: [M+H]+ 372.1.
N-(8-((2S,3R,4S,5R)-3,4-ジヒドロキシ-5-(ヒドロキシメチル)テトラヒドロフラン-2-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4-イル)ベンズアミド (1.89 g)の脱水ピリジン(30 mL)溶液に4,4'-ジメトキシトリチル クロリド (517 mg)を氷冷下で加えた。反応混合物をアルゴン雰囲気下で室温で3時間撹拌した。反応混合物に4,4'-ジメトキシトリチル
クロリド(517 mg)を室温で加え、アルゴン雰囲気下、室温で終夜撹拌した。反応混合物に4,4'-ジメトキシトリチル クロリド(1035 mg)を室温で加え、アルゴン雰囲気下、室温で1時間撹拌した。反応混合物に飽和炭酸水素ナトリウム水溶液を室温で加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮
した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製し
て標題化合物 (2160 mg) を得た。MS: [M-H]-672.1.
N-(8-((2S,3R,4S,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3,4-ジヒドロキシテトラヒドロフラン-2-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4-イル)
ベンズアミド(2.16 g)の脱水THF(30 mL)溶液に硝酸銀(I)(708 mg)および脱水ピリジン(1.22 g)を加えた。反応混合物をアルゴン雰囲気下で15分撹拌後、tert-ブチルジメチルクロロシラン(628 mg)を加えた。反応混合物をアルゴン雰囲気下、室温で2時間撹拌した。反
応混合物に硝酸銀(I)(163 mg)、tert-ブチルジメチルクロロシラン(145 mg)および 脱水
ピリジン(507 mg)を室温で加えた。反応混合物をアルゴン雰囲気下、室温で終夜撹拌した。反応混合物に硝酸銀(I)(436 mg)、tert-ブチルジメチルクロロシラン(387 mg)および脱水ピリジン(761 mg)を室温で加えた。反応混合物をアルゴン雰囲気下、室温で2時間撹拌
した。反応混合物に飽和炭酸水素ナトリウム水溶液を室温で加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (酢酸エチル/ヘキサン) で精製して標題化合
物 (980 mg) を得た。MS: [M-H]-786.2.
水素 ホスホナート
N-(8-((2S,3R,4R,5R)-5-((ビス(4-メトキシフェニル)(フェニル)メトキシ)メチル)-3-((tert-ブチルジメチルシリル)オキシ)-4-ヒドロキシテトラヒドロフラン-2-イル)ピラゾ
ロ[1,5-a][1,3,5]トリアジン-4-イル)ベンズアミド (980 mg)に脱水トルエンを加え、共
沸操作を2度実施後、脱水DMF(10 mL)に溶解させた。反応混合物に、3-((ビス(ジイソプ
ロピルアミノ)ホスフィノ)オキシ)プロパンニトリル(487 mg)、1H-テトラゾール(87 mg)
および1-メチル-1H-イミダゾール (51 mg)を加えた。反応混合物をアルゴン雰囲気下、室温で5時間撹拌した。反応混合物に飽和炭酸水素ナトリウム水溶液を室温で加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (0.5%トリエチルアミン含有酢酸エチル/ヘキサン) で精製した。得られた混合物のアセトニトリル(10 mL)溶液に水(0.04 mL)およびピリジン 2,2,2-トリフルオロアセタート(256 mg)を室温で加えた。反応混合物を室温で30分撹拌後、tert-ブチルアミン(5.38 mL)を加え、室温で45分撹拌した。減圧下で溶媒を留去した。残渣に80%酢酸水溶液(5.4 mL)を加え、室温で1時間攪拌し、減圧下で溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチ
ル) で精製し、標題化合物(530 mg)を得た。MS: [M+H]+550.2.
リル)オキシ)-5-(ヒドロキシメチル)-2-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチ
ル)テトラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4S,5S)-5-(4-ベンズアミドピラゾロ[1,5-a][1,3,5]トリアジン-8-イル)-4-((tert-ブチルジメチルシリル)オキシ)-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル 水素 ホスホナート(240 mg)と5'-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3'-O-(tert-ブチル(ジメチル)シリル)-2'-O-((2-シアノエチル)(ジイソプロピルアミノ)ホスフィノ)-N-イソブチリルグアノシン(635 mg)の混合物に脱水アセトニトリルを加え、共沸操作を3回実施した。残渣に脱水アセトニトリル(5 mL)、脱水THF(2.5 mL)および、あらかじ
め脱水アセトニトリルと共に共沸操作を実施した5-(エチルチオ)-2H-テトラゾール(171 mg)の脱水アセトニトリル(2.5 mL)溶液を加えた。反応混合物をアルゴン雰囲気下、室温で2時間撹拌した後、70%tert-ブチルヒドロペルオキシド水溶液(0.179 mL)を加え、室温下で20分撹拌した。反応混合物にチオ硫酸ナトリウム5水和物(0.12 g)の水溶液(0.12 mL)
を加え、反応混合物を減圧下で濃縮した。残渣に80%酢酸水溶液(3 mL)を加え、室温で1
時間撹拌した。残渣にアセトニトリルを加え、共沸操作を2回実施した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製し、標題化合物を含む粗
精製物(420 mg)を得た。MS: [M+H]+1132.3.
ル)オキシ)-10-(2-シアノエトキシ)-2-ヒドロキシ-7-(2-((2-メチルプロパノイル)アミノ)-6-オキソ-1,6-ジヒドロ-9H-プリン-9-イル)-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)ピラゾロ[1,5-a][1,3,5]トリアジン-4-イル)ベンズアミド
(2R,3R,4S,5S)-5-(4-ベンズアミドピラゾロ[1,5-a][1,3,5]トリアジン-8-イル)-4-((tert-ブチルジメチルシリル)オキシ)-2-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)-2-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-
イル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホリル)オキシ)メチル)テトラヒドロフラン-3-イル 水素 ホスホナートを含む粗精製物(430 mg)に脱水アセトニトリルを加え、共沸操作を2度実施した。得られた残渣に脱水ピリジンを加え、共沸操作を1度実施した。得られた残渣の脱水ピリジン(3 mL)溶液に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド(245 mg)を加え、室温でアルゴン雰囲気下10分撹拌
した。反応混合物に水(0.239 mL)およびヨウ素(125 mg)を加え、室温で20分撹拌した。反応混合物にチオ硫酸ナトリウム5水和物(245 mg)の水溶液(0.4 mL)を加え、室温で5分撹
拌した後、トルエンを加え、減圧下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製し、標題化合物を含む粗精製物(553 mg)を得た。MS: [M+H]+1130.4.
N-(8-((5R,7R,8R,12aR,14S,15S,15aR,16R)-15,16-ビス((tert-ブチル(ジメチル)シリル)オキシ)-10-(2-シアノエトキシ)-2-ヒドロキシ-7-(2-((2-メチルプロパノイル)アミノ)-6-オキソ-1,6-ジヒドロ-9H-プリン-9-イル)-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)
ピラゾロ[1,5-a][1,3,5]トリアジン-4-イル)ベンズアミド (553 mg)と33%メチルアミンエタノール溶液(20 mL)の混合物を室温で終夜撹拌した。反応混合物を減圧下、濃縮し、残
渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル)で精製した、更にHPLC (ODS、移動相:水/アセトニトリル (5mM 酢酸アンモニウム含有系)) にて分取し、得
られた画分を減圧濃縮した。得られた残渣のメタノール(3 mL)溶液にトリエチルアミン
三フッ化水素酸塩 (0.072 mL) を室温で加えて、50 ℃で4時間撹拌した。反応混合物に
トリエチルアミン 三フッ化水素酸塩 (0.181 mL) を室温で加えて、50℃で終夜攪拌した
。反応混合物にトリエチルアミン 三フッ化水素酸塩 (0.181 mL) を室温で加えて、50℃
で5時間攪拌した。反応混合物にエトキシトリメチルシラン(1.034 mL)を室温で加え、5分撹拌した。反応混合物を減圧下で濃縮し、残渣をC18シリカゲルカラムクロマトグラフィ
ー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリル)で精製し、凍結乾燥して標題化合物 (10 mg) を得た。1H NMR (300 MHz, D2O) δ 3.99-4.08 (1H, m), 4.11-4.31
(4H, m), 4.34-4.42 (1H, m), 4.52-4.60 (2H, m), 4.94-5.05 (1H, m), 5.27-5.35 (1H, m), 5.51-5.62 (1H, m), 5.94 (1H, d, J = 8.3 Hz), 7.89 (1H, s), 8.07 (1H, s), 8
.08 (1H, s).
7-((2R,5R,7R,8R,10R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フ
ルオロ-16-ヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メ
タノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2ナトリウム塩
7-(3-O-(tert-ブチル(ジメチル)シリル)-2-O-(ヒドロキシ(オキシド)ホスホラニル)-beta-D-リボフラノシル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(8.89 g) とN-ベンゾイル-5'-O-(ビス(4-メトキシフェニル)(フェニル)メチル)-3'-O-((2-
シアノエトキシ)(ジイソプロピルアミノ]ホスフィノ)-2'-デオキシ-2'-フルオロアデノシン (18.5 g) に脱水アセトニトリルを加え、共沸操作を3回実施した。残渣に無水アセトニトリル(40 mL) 、無水THF (20 mL) および5-(エチルスルファニル)-2H-テトラゾール(7.49 g) の無水アセトニトリル溶液 (40 mL) を加えた。反応混合物を室温、アルゴン雰囲気下で30分間撹拌し、((ジメチルアミノメチリデン)アミノ)-3H-1,2,4-ジチアゾリン-3-
チオン (4.33 g) を反応混合物に加え、室温で30分撹拌した。反応混合物にチオ硫酸ナトリウム (5.24 g) を含む水溶液 (5 mL) を加えた後、減圧下で濃縮した。残渣に80%酢酸
水溶液 (100 mL) を加え、室温で1時間撹拌した後、反応混合物にトルエンを加えて共沸
操作を実施した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル)
で精製して標題化合物 (14.3 g) を得た。MS: [M+H]+ 968.3.
シ)-2-(2-シアノエトキシ)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10-オキシド-10-スルファニル-2-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデ
シン-14-イル)-9H-プリン-6-イル)ベンズアミド(光学異性体)
(2R,3R,4R,5R)-5-((((((2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-フル
オロ-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホスホロチオイル)オキシ)メチル)-4-((tert-ブチルジメチルシリル)オキシ)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)テトラヒドロフラン-3-イル 水素 ホスホナート (1.07 g) に脱水ピリジンを加え、共沸操作を3度実施した。残渣の無水ピリ
ジン(150 mL)溶液に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (4.66 g) を加え、アルゴン雰囲気下、室温で30分撹拌した。反応混合物に3H-ベンゾ[c][1,2]ジチオール-3-オン(1.46 g) と水 (4.55 mL) を室温で加え、反応混合物を30分撹拌し
た。反応混合物のLCMS 分析は、同じマス ([M+H]+ 971.1)で、4つのジアステレオマーの形成を示す4つのピークを示した。反応混合物を減圧下で濃縮し、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製した後、HPLC (L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル) にて分取し、保持時間の最も大きい画分を減圧濃縮して標題化合物 (379 mg) を得た。MS: [M+H]+ 982.1.
ロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-16-((tert-ブチル(ジメチル)シリル)オキシ)-2-(2-シアノエトキシ)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10-オキシド-10-スルファニル-2-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシ
ン-14-イル)-9H-プリン-6-イル)ベンズアミド (光学異性体)(379 mg) の40%メチルアミンメタノール溶液 (10 mL) をアルゴン雰囲気下室温で3時間撹拌した。反応混合物を減圧下で濃縮し、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で
精製して標題化合物(319 mg) を得た。MS: [M+H]+ 825.1.
メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イ
ル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-16-((tert-
ブチル(ジメチル)シリル)オキシ)-15-フルオロ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシク
ロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体)(319 mg) のメタノール (1 mL) 溶液にトリエチルアミン 三フッ化水素酸塩 (2.52 mL) を室温で加えて、50 ℃で3時間攪拌した後、メタノール (10 mL) で希釈した。反応混合物にエトキシトリメチルシラン (12 mL) を室温で加え、10分撹拌した。反
応混合物を減圧下で濃縮し、残渣をメタノールで希釈した後、再度濃縮した。残渣に酢酸トリエチルアンモニウム緩衝液を加え、固体をろ別し、アセトニトリルで固体を洗浄し、白色固体を得た。得られた白色固体をシリカゲルカラムクロマトグラフィー (ODS、10 mM
酢酸トリエチルアンモニウム緩衝液/アセトニトリル)で精製した。一方、ろ液を減圧下
で濃縮し、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) およ
びシリカゲルカラムクロマトグラフィー (ODS、10 mM 酢酸トリエチルアンモニウム緩衝
液/アセトニトリル)で精製した。シリカゲルカラムクロマトグラフィー (ODS、10 mM 酢
酸トリエチルアンモニウム緩衝液/アセトニトリル) により得られた標題化合物を含む画
分を減圧下で濃縮し、凍結乾燥して標題化合物 (195 mg) を得た。MS: [M+H]+ 711.0.
メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イ
ル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2ナトリウム塩
エンプティーカラムにAG(商品名) 50W-X8 陽イオン交換樹脂 (100-200 mesh, 3.9 g)
を充填させたカラムに脱イオン水 (60 mL) を透過させた。更に、1 M水酸化ナトリウム水溶液(36 mL) および脱イオン水 (68 mL) を透過させた。上記の前処理を実施した樹脂に7-((2R,5R,7R,8R,10R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-16-ヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタ
ノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(195 mg) を含む脱イオン水(15 mL) を透過させた後、脱イオン水 (19 mL) を透過させ、得
られた水溶液を凍結乾燥することで標題化合物 (165 mg) を得た。1H NMR (300 MHz, D2O) δ 4.00-4.08 (1H, m), 4.22-4.45 (4H, m), 4.50-4.57 (1H, m), 4.81-4.84 (1H, m),
4.98-5.14 (2H, m), 5.40-5.61 (1H, m), 6.33-6.43 (2H, m), 7.28 (1H, d, J = 1.9 Hz), 7.94 (1H, s), 8.05 (1H, s), 8.21 (1H, s). 31P NMR (121 MHz, D2O) δ 52.1, 55.3.
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-2,16-ジヒドロキシ-2,10-ジオキシド-10-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異
性体)の合成
ロ[2,3-d]ピリミジン-4-オン
7-((2R,3R,4S,5R)-3,4-ジヒドロキシ-5-(ヒドロキシメチル)テトラヒドロフラン-2-イ
ル)-5-フルオロ-3H-ピロロ[2,3-d]ピリミジン-4(7H)-オン(37.9 g) のピリジン (760 mL)
溶液に1,3-ジクロロ-1,1,3,3-テトライソプロピルジシロキサン(44.4 mL) を加え、アルゴン雰囲気下、室温で3時間撹拌した。溶媒を減圧留去し、残渣に酢酸エチル、水を加え
た。有機層を水、飽和食塩水で洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をジイソプロピルエーテル (IPE) で希釈し室温で終夜撹拌した。固体をろ取し
標題化合物 (32.3 g) を得た。母液を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(ヘキサン/酢酸エチル) で精製して標題化合物(13.3 g) を得た。MS: [M+H]+ 528.2.
ジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル ジイソプロピルホスホロアミダイト
5-フルオロ-7-((6aR,8R,9R,9aS)-9-ヒドロキシ-2,2,4,4-テトライソプロピルテトラヒ
ドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-8-イル)-3,7-ジヒドロ-4H-ピロ
ロ[2,3-d]ピリミジン-4-オン(20 g) を無水アセトニトリルと3回共沸脱水し、無水DMF (100 mL) に溶解した。この溶液に1H-テトラゾール(2.79 g) 、1-メチル-1H-イミダゾール (1.65 mL)、および3-((ビス(ジイソプロピルアミノ)ホスフィノ)オキシ)プロパンニトリ
ル (24.1 mL) を加え、アルゴン雰囲気下、室温で終夜撹拌した後、飽和炭酸水素ナトリ
ウム水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液と飽和食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン,0.5%トリエチルアミン含有)で精製することにより、標題化合物 (20.8 g) を2種のジアステレオマーの混合物 として得た。1H NMR (300 MHz, DMSO-d6) δ 0.91-1.19 (40H, m), 2.69-2.82 (2H, m), 3.46-3.73 (2H, m), 3.78-4.12 (5H, m), 4.47-4.61 (2H, m), 6.02-6.12 (1H, m), 7.14-7.23 (1H, m), 7.84-7.91 (1H, m), 12.00-12.40 (1H, br).
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-フルオロ-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル 水素 ホスホナート(3.48 g) および2-シアノエチル (6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル ジイソプロピルホスホロアミダイト (7.82 g) の混合物を、無水アセトニトリルと共沸脱水し、無水アセトニトリル (25 mL) と無水THF(15 mL)に懸濁した。あらかじめ無
水アセトニトリルで共沸脱水した5-(エチルスルファニル)-2H-テトラゾール (3.11 g) を無水アセトニトリル (6 mL) に溶解して上記懸濁液に加え、アルゴン雰囲気下、室温で1
時間撹拌した後、((ジメチルアミノメチリデン)アミノ)-3H-1,2,4-ジチアゾリン-3-チオ
ン (3.27 g) を加え、室温でさらに30分間撹拌した。減圧下溶媒を留去した後、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物(6.73 g) を得た。MS: [M+H]+ 1096.2.
ラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-2-((((2-シアノエトキシ)(((6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル)オキシ)ホスホロチオイル)オキシ)メチル)-4-フルオロテトラヒドロフラン-3-イ
ル 水素 ホスホナート (6.73 g) をTHF (74.8 mL) と水 (16.6 mL) の混合液に溶解して
氷冷し、トリフルオロ酢酸 (16.6 mL) を加え、0 ℃で2時間撹拌した。反応混合物に重曹
(25.8 g) の水溶液を加えてクエンチした後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (6.43 g) を得
た。MS: [M+H]+ 1114.2.
キサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-2-((((2-シアノエトキシ)(((2R,3R,4R,5R)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-4-((3-
ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホロチオイル)オキシ)メチル)-4-フルオロテト
ラヒドロフラン-3-イル 水素 ホスホナート(6.43 g) を無水アセトニトリル及び無水ピリジンで共沸脱水し、無水ピリジン (130 mL) に懸濁した。2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (3.73 g) を加え、アルゴン雰囲気下、室温で1時間撹拌した後、水 (5.17 mL) とヨウ素 (1.90 g) を加え、室温でさらに1時間撹拌した。反応混合物をチオ硫酸ナトリウム(7.16 g)および水 (3.6 mL) でクエンチした後、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (4.60 g) を得た。MS: [M+H]+ 1112.2.
ロ-2-ヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキ
シ)-2,10-ジオキシド-10-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-10-(2-シアノエトキシ)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトラ(プロパン-2-イル)ジシロキサニル)オキシ)-2-オキシ
ド-10-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオ
キサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド(6.42 g) に40%メチルアミンメタノール溶液 (30 mL)を加え、アルゴン雰囲気下室温で1時間撹拌
した。得られた混合物を減圧濃縮し、残留物をシリカゲルカラムクロマトグラフィー(メ
タノール/酢酸エチル)で精製した後、得られた残渣をHPLC(L-column2 ODS、50×150 mm
、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル)で精製し、得られた画分を減圧濃縮・凍結乾燥することにより標題化合物(420 mg)を得た。MS: [M+H]+ 955.2.
ロ-2,16-ジヒドロキシ-2,10-ジオキシド-10-スルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-
フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリメチルアミン塩 (
光学異性体)
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-2-ヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2,10-ジオキシド-10-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体、tR2由来)(420 mg)にトリエチルアミン 三フッ化水素酸塩 (9.68 mL) を加えて、50℃で7時間半撹拌した。反応混合物にエト
キシトリメチルシラン(36.3 mL)を室温で加え、30分撹拌した。反応混合物を減圧下で濃
縮し、残渣をC18シリカゲルカラムクロマトグラフィー (10 mM 酢酸トリエチルアンモニ
ウム緩衝液/アセトニトリル)で精製し、凍結乾燥して標題化合物 (298 mg) を得た。1H NMR (300 MHz, D2O) δ1.13-1.29 (16H, m), 3.12 (11H, q, J = 7.2 Hz), 3.99-4.29 (4H, m), 4.31-4.43 (2H, m), 4.50 (1H, d, J = 9.1 Hz), 4.81-5.08 (3H, m), 5.39-5.61 (1H, m), 6.30-6.42 (2H, m), 7.24 (1H, d, J = 1.9 Hz), 7.92 (1H, s), 8.09 (1H, s), 8.19 (1H, s). 31P NMR (121 MHz, D2O) δ52.2,1.63.
7-((5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-2,10,18-トリ
ヒドロキシ-2,10-ジオキシドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフ
ロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩
(光学異性体)の合成
イル 水素 ホスホナート
(1S,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-(ヒドロキシメチル)-2,5-ジ
オキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート (2.00 g) と 2-シアノエチ
ル (6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシ
ロシン-9-イル ジイソプロピルホスホロアミダイト (4.23 g) を無水アセトニトリル (約50 mL,3回)で共沸脱水し、無水THF (16 mL) に懸濁した。あらかじめ無水アセトニトリル (約30 mL,3回) で共沸脱水した5-(エチルスルファニル)-2H-テトラゾール (1.75 g) を無水アセトニトリル (16 mL) に溶解して上記懸濁液に加え、アルゴン気流下に室温で15時間かき混ぜた後、70%tert-ブチル ヒドロペルオキシド水溶液 (1.86 mL) を加え、室温でさらに30分間かき混ぜた。反応混合物を10%チオ硫酸ナトリウム水溶液 (13 mL) で
クエンチした後、減圧濃縮した。アセトニトリル (約80 mL) 及びトルエン (約80 mL) で順次共沸脱水した後、残留物をシリカゲルカラムクロマトグラフィーに付し (メタノール/酢酸エチル)、目的画分を減圧濃縮することにより、標題化合物 (5.36 g) を白色アモルファス (2種のジアステレオマーの混合物) として得た。MS: [M+H]+ 1090.2.
テトラヒドロフラン-3-イル)オキシ)ホスホリル)オキシ)メチル)-2,5-ジオキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート
(1R,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-((((2-シアノエトキシ)(((6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル)オキシ)ホスホリル)オキシ)メチル)-2,5-ジオキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート (5.36 g) をTHF (60 mL) と水 (13 mL) の混合液に溶解して氷冷
し、トリフルオロ酢酸 (13.18 mL) を加え、0 ℃で4時間かき混ぜた。反応混合物に重曹 (20.65 g) の水 (250 mL) 溶液を少しずつ加えてクエンチした後、食塩で飽和させ、酢酸エチル-THF (3:1) で抽出した。有機層を飽和食塩水で洗浄、無水硫酸マグネシウムで
乾燥後、溶媒を減圧留去した。残留物をシリカゲルカラムクロマトグラフィーに付し (メタノール/酢酸エチル)、目的画分を減圧濃縮することにより、標題化合物 (3.06 g) を白色アモルファス (2種のジアステレオマーの混合物) として得た。MS: [M+H]+ 1108.3.
ロキシ-1,1,3,3-テトラ(プロパン-2-イル)ジシロキサニル)オキシ)-2,10-ジオキシドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペン
タオキサジホスファシクロテトラデシン-14(12H)-イル)-9H-プリン-6-イル)ベンズアミド
(1R,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-((((2-シアノエトキシ)(((2R,3R,4R,5R)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-4-((3-
ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホリル)オキシ)メチル)-2,5-ジオキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート (3.06 g) を無水アセトニトリル (約100 mL
)及び無水ピリジン (約100 mL)で順次共沸脱水し、無水ピリジン (75 mL) に溶解した
。2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (1.78 g) を加え、
アルゴン気流下に室温で1時間かき混ぜた後、水 (1.74 mL) とヨウ素 (911 mg) を加え、室温でさらに15分間かき混ぜた。反応混合物を10%チオ硫酸ナトリウム水溶液 (7.5 mL) でクエンチした後、減圧濃縮した。残留物を水 (100 mL) で希釈し、酢酸エチル-THF (3:1) で抽出した。有機層を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥後、溶媒を減圧留去した。トルエン (約100 mL) を加えて再度減圧濃縮した後、残留物をシリカゲルカラムクロマトグラフィーに付し (メタノール/酢酸エチル)、目的画分を減圧濃縮することにより、標題化合物 (2.38 g) を白色アモルファス (2種のジアステレオマーの混合物)
として得た。MS: [M+H]+ 1106.3.
ドロキシ-18-((3-ヒドロキシ-1,1,3,3-テトラ(プロパン-2-イル)ジシロキサニル)オキシ)-2,10-ジオキシドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
N-(9-((5R,7R,8R,12aR,14R,15R,15aS,18R)-10-(2-シアノエトキシ)-7-(5-フルオロ-4-
オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-18-((3-ヒド
ロキシ-1,1,3,3-テトラ(プロパン-2-イル)ジシロキサニル)オキシ)-2,10-ジオキシドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペン
タオキサジホスファシクロテトラデシン-14(12H)-イル)-9H-プリン-6-イル)ベンズアミド
(2.38 g) を40%メチルアミン メタノール溶液 (40 mL) に溶解し、室温で1時間かき混
ぜ、反応混合物を減圧濃縮した。トルエン (約80 mL) を加えて再度減圧濃縮した後、残
留物をシリカゲルカラムクロマトグラフィーに付し (メタノール/酢酸エチル)、目的画
分を減圧濃縮することにより、標題化合物 (756 mg) を白色固体として得た。MS: [M+H]+949.2.
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン
塩(光学異性体)
7-((5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-2,10-ジヒドロキシ-18-((3-ヒドロキシ-1,1,3,3-テトラ(プロパン-2-イル)ジシロキサニル)オキシ)-2,10-ジオキシドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(756 mg) をメタノール (2 mL) とトリ
エチルアミン(0.8 mL) に溶解し、トリエチルアミン 三フッ化水素酸塩 (3.90 mL) を加
え、50℃で2時間かき混ぜた。反応混合物を室温まで冷却した後、1 M炭酸水素トリエチルアンモニウム水溶液 (110 mL) で中和し、室温で15分間かき混ぜた。反応混合物を減圧濃縮した後、残留物をODSカラムクロマトグラフィーに付し (アセトニトリル/10 mM酢酸ト
リエチルアンモニウム緩衝液)、目的画分を減圧濃縮・凍結乾燥することにより、標題化
合物 (504 mg) を白色固体として得た。1H NMR (300 MHz, D2O) δ 1.20 (18H, t, J = 7.4 Hz), 3.12 (12H, q, J = 7.2 Hz), 4.02-4.16 (4H, m), 4.23-4.37 (3H, m), 4.55 (1H, d, J = 4.5 Hz), 4.82-4.93 (3H, m), 6.12 (1H, s), 6.39 (1H, dd, J = 8.3, 1.5 Hz), 7.19 (1H, d, J = 1.9 Hz), 7.96 (1H, s), 8.11 (1H, s), 8.17 (1H, s). 31P NMR
(121 MHz, D2O) δ -1.91, -1.80.
7-((5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-10,18-ジヒド
ロキシ-2,10-ジオキシド-2-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリメチ
ルアミン塩(光学異性体)の合成
キサジホスファシクロテトラデシン-14(12H)-イル)-9H-プリン-6-イル)ベンズアミド
(1R,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-((((2-シアノエトキシ)(((2R,3R,4R,5R)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-4-((3-
ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホリル)オキシ)メチル)-2,5-ジオキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート (3.71 g) を無水アセトニトリル及び無水ピ
リジンで共沸脱水し、無水ピリジン(70 mL) に懸濁した。2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (2.15 g) を加え、アルゴン雰囲気下、室温で1時間撹拌した後、3H-ベンゾ[c][1,2]ジチオール-3-オン (674 mg) を加え、室温でさらに1時間
撹拌した。反応混合物に飽和炭酸水素ナトリウム水溶液を加えた後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄、硫酸ナトリウムで乾燥した後、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (2.78 g) を得た。MS: [M+H]+ 1122.2
キシ-18-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2,10-ジ
オキシド-2-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aS,18R)-10-(2-シアノエトキシ)-7-(5-フルオロ-4-
オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-18-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2,10-ジオキシド-2-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオ
キサジホスファシクロテトラデシン-14(12H)-イル)-9H-プリン-6-イル)ベンズアミド (2.78 g) を40%メチルアミン メタノール溶液 (50 mL) に溶解し、アルゴン雰囲気下、室温で1時間撹拌した後、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィ
ー(メタノール/酢酸エチル) で精製した。得られた残渣をHPLC (L-column2 ODS、50×150
mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル) にて精製し、標題化合物 (30 mg)を得た。MS: [M+H]+ 965.3.
チルアミン塩(光学異性体)
7-((5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-10-ヒドロキシ-18-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2,10-ジオ
キシド-2-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体)(30 mg) にトリ
エチルアミン 三フッ化水素酸塩 (0.70 mL) およびメタノール (1 mL) を加えて、50℃で3時間撹拌した。反応液にエトキシ(トリメチル)シラン (2.5 mL) を加え、室温で30分間
撹拌した後、減圧下溶媒を留去した。残渣をC18シリカゲルカラムクロマトグラフィー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリル) で精製し、得られた固体を凍結乾燥して標題化合物 (25 mg) を得た。1H NMR (300 MHz, D2O) δ1.19 (18H, t, J = 7.4 Hz), 3.11 (12H, q, J = 7.2 Hz), 3.99-4.09 (3H, m), 4.09-4.17 (2H, m), 4.22-4.29 (1H, m), 4.34-4.38 (1H, m), 4.50-4.54 (2H, m), 4.90-4.96 (1H, m), 5.06 (1H, s), 6.11 (1H, s), 6.35 (1H, dd, J = 8.3, 1.1 Hz), 7.19 (1H, d, J = 2.3 Hz), 7.94 (1H, s), 8.08 (1H, s), 8.16 (1H, s). 31P NMR (121 MHz, D2O) δ 55.76, -1.56.
7-((5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-2,18-ジヒドロキシ-2,10-ジオキシド-10-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異性体)の合成
(1S,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-(ヒドロキシメチル)-2,5-ジ
オキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート(3.0 g) および2-シアノエチル (6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシ
ロシン-9-イル ジイソプロピルホスホロアミダイト (5.86 g) の混合物を、無水アセトニトリルと共沸脱水し、無水THF(25 mL)に懸濁した。あらかじめ無水アセトニトリルで共沸脱水した5-(エチルスルファニル)-2H-テトラゾール (2.62 g) を無水アセトニトリル (25
mL) に溶解して上記懸濁液に加え、アルゴン雰囲気下、室温で終夜撹拌した後、((ジメ
チルアミノメチリデン)アミノ)-3H-1,2,4-ジチアゾリン-3-チオン (2.75 g) を加え、室
温でさらに30分間撹拌した。減圧下溶媒を留去した後、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物(4.96 g) を得た。MS: [M+H]+ 1106.3.
シクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート
(1R,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-((((2-シアノエトキシ)(((6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル)オキシ)ホスホロチオイル)オキシ)メチル)-2,5-ジオキサビシクロ[2.2.1]ヘプタ
ン-7-イル 水素 ホスホナート (4.96 g) をTHF (60 mL) と水 (12 mL) の混合液に溶解して氷冷し、トリフルオロ酢酸 (12.1 mL) を加え、0 ℃で3時間撹拌した。反応混合物に重曹 (18.8 g) の水(100 mL)溶液を加えてクエンチした後、酢酸エチル-THF (3:1)で抽出した。硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (3.77 g) を得た。MS: [M+H]+ 1124.2.
ロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2-オキシド-10-スルフィドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]
ペンタオキサジホスファシクロテトラデシン-14(12H)-イル)-9H-プリン-6-イル)ベンズアミド
(1R,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-((((2-シアノエトキシ)(((2R,3R,4R,5R)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-4-((3-
ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホロチオイル)オキシ)メチル)-2,5-ジオキサビ
シクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート (3.77 g) を無水アセトニトリル及び無水ピリジンで共沸脱水し、無水ピリジン(70 mL) に懸濁した。2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (2.17 g) を加え、アルゴン雰囲気下、室温で1時間撹拌した後、水 (2.12 mL) とヨウ素 (1.11 g) を加え、室温でさらに1時間撹拌した。反応混合物を10%チオ硫酸ナトリウム水溶液(15 mL)でクエンチした後、溶媒を減圧留去した。残渣を水(100 mL)で希釈し、酢酸エチル-THF (3:1)で抽出した後、有機層を硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (2.21 g) を得た。MS: [M+H]+ 1122.2.
N-(9-((5R,7R,8R,12aR,14R,15R,15aS,18R)-10-(2-シアノエトキシ)-7-(5-フルオロ-4-
オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-18-((3-ヒド
ロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2-オキシド-10-スルフィドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]
ペンタオキサジホスファシクロテトラデシン-14(12H)-イル)-9H-プリン-6-イル)ベンズアミド (2.38 g) に40%メチルアミンメタノール溶液 (40 mL)を加え、アルゴン雰囲気下室温で1時間撹拌した。得られた混合物を減圧濃縮し、残留物をシリカゲルカラムクロマト
グラフィー(メタノール/酢酸エチル)で精製した後、得られた残渣をHPLC(L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル)で精製し、得られた画分を減圧濃縮・凍結乾燥することにより標題化合物(710 mg)を得た。MS: [M+H]+ 965.2.
ドロキシ-2,10-ジオキシド-10-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-
7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異性体)
7-((5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-2-ヒドロキ
シ-18-((3-ヒドロキシ-1,1,3,3-テトラ(プロパン-2-イル)ジシロキサニル)オキシ)-2,10-ジオキシド-10-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフ
ロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体、tR2由来)(710 mg)のメタノール(20 mL)溶液にトリエチルアミン 三フッ化水素酸塩 (4.80 mL) を
加えて、50℃で3時間撹拌した。反応混合物にエトキシトリメチルシラン(2.29 mL)を室温で加え、30分撹拌した。反応混合物を減圧下で濃縮し、残渣をC18シリカゲルカラムクロ
マトグラフィー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリル)で精製し、凍結乾燥して標題化合物 (530 mg) を得た。1H NMR (300 MHz, D2O) δ1.22 (18H, t, J = 7.2 Hz), 3.14 (12H, q, J = 7.6 Hz), 4.03-4.19 (4H, m), 4.25-4.41 (3H, m), 4.65
(1H, d, J = 4.5 Hz), 4.84 (1H, d, J= 4.5 Hz), 4.91 (1H, s), 4.99 (1H, ddd, J = 10.1, 8.2, 4.3 Hz), 6.14 (1H, s), 6.39 (1H, d, J = 7.9 Hz), 7.17 (1H, d, J = 2.3
Hz), 7.97 (1H, s), 8.11 (1H, s), 8.19 (1H, s). 31P NMR (121 MHz, D2O) δ52.5,1.74.
2-アミノ-9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,10,16-トリヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホス
ファシクロテトラデシン-14-イル)-1,9-ジヒドロ-6H-プリン-6-オン 2トリエチルアミ
ン塩(光学異性体)の合成
チル)-4-フルオロ-5-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒド
ロフラン-3-イル 水素 ホスホナート
2'-デオキシ-2'-フルオロ-3'-O-(ヒドロキシ(オキシド)ホスホラニル)-N-イソブチリルグアノシン (680 mg)と2-シアノエチル(6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピ
ロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル ジイソプロピルホスホロアミダイト (1535 mg) を無水アセトニトリル (3回) と共沸脱水し、無水THF (10.00 ml) に懸濁した
。混合物に無水アセトニトリルと共沸脱水した5-(エチルスルファニル)-2H-テトラゾール
(633 mg) と無水アセトニトリル (10 ml) の混合物を加え、アルゴン雰囲気下、室温で7時間撹拌した。混合物に無水アセトニトリルと共沸脱水した2-シアノエチル (6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テト
ライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル ジイソプロピルホスホロアミダイト (1181 mg, 1.62 mmol)と無水アセトニトリル (3 ml)
の混合物および無水アセトニトリルと共沸脱水した5-(エチルスルファニル)-2H-テトラ
ゾール (633 mg) と無水アセトニトリル (3 ml) の混合物を加え、アルゴン雰囲気下、室温で終夜撹拌した。反応混合物に70%tert-ブチル ヒドロペルオキシド水溶液 (0.674 mL) を加え、室温でさらに30分撹拌した。反応混合物にチオ硫酸ナトリウム5水和物 (2817 mg) と水 (4 mL) の混合物を加えた後、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物(1260mg) を得た。MS: [M+H]+ 1062.3.
ルジシロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホリル)オキシ)メチル)-4-フルオロ-5-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4R,5R)-2-((((2-シアノエトキシ)(((6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル)オキシ)ホスホリル)オキシ)メチル)-4-フルオロ-5-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロ
フラン-3-イル 水素 ホスホナート (1.26 g)、THF (16 ml) および水(4 ml) の混合物
に0℃でトリフルオロ酢酸 (3.18 ml)を加え、4時間撹拌した。混合物に炭酸水素ナトリウム (4.98 g) 水溶液を加えた後、塩化ナトリウムで飽和させた。混合物を酢酸エチル/THFで抽出し、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精製して標題化合物 (1000mg) を得た。MS: [M+H]+ 1080.3.
シクロテトラデシン-14-イル)-6-オキソ-6,9-ジヒドロ-1H-プリン-2-イル)-2-メチルプロパンアミド
(2R,3R,4R,5R)-2-((((2-シアノエトキシ)(((2R,3R,4R,5R)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-4-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホリル)オキシ)メチル)-4-フルオロ-5-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル 水素 ホスホナート (1 g)を無水アセトニトリル及び無水ピリジンで共沸脱水し、無水ピリジン (24 mL) に懸濁した。2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (598 mg) を加え、アルゴン雰囲気下、室温で15分撹拌した後、水 (0.584 mL) とヨウ素 (305 mg) を加え、室温でさらに25分撹拌した。反応混合物を減圧下濃縮し、残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物(800 mg) を得た。MS: [M+H]+ 1078.2
ソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,10-ジヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2,10-ジオキシドオクタヒ
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-14-イル)-1,9-ジヒドロ-6H-プリン-6-オン(光学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-10-(2-シアノエトキシ)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2,10-ジオキシ
ドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファ
シクロテトラデシン-14-イル)-6-オキソ-6,9-ジヒドロ-1H-プリン-2-イル)-2-メチルプロパンアミド(800 mg, 0.74 mmol) に33%メチルアミン エタノール溶液 (30 mL) を加え、アルゴン雰囲気下、室温で終夜撹拌した後、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製した。得られた残渣をHPLC (L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル) に
て精製し、標題化合物 (163.4 mg)を得た。MS: [M+H]+ 955.3.
ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジ
ホスファシクロテトラデシン-14-イル)-1,9-ジヒドロ-6H-プリン-6-オン 2トリエチル
アミン塩(光学異性体)
2-アミノ-9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15-フルオロ-7-(5-フルオロ-4-オキ
ソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,10-ジヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ)-2,10-ジオキシドオクタヒ
ドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテト
ラデシン-14-イル)-1,9-ジヒドロ-6H-プリン-6-オン (光学異性体)(21.4 mg)、トリエ
チルアミン 三フッ化水素酸塩 (0.183 mL) およびメタノール (0.07 mL) の混合物をアルゴン雰囲気下50℃で1時間撹拌した。反応混合物にエトキシ(トリメチル)シラン (1.046 mL) を加え、さらに室温で1時間撹拌した後、溶媒を減圧下留去した。残渣をC18シリカゲ
ルカラムクロマトグラフィー (10 mM 酢酸トリエチルアンモニウム緩衝液/アセトニトリ
ル)で精製し、凍結乾燥して標題化合物 (4.6 mg) を得た。1H NMR (300 MHz, D2O) δ 1.20 (18H, t, J = 7.3 Hz), 3.13 (12H, q, J = 7.3 Hz), 4.07 (2H, d, J = 11.1 Hz), 4.25 (2H, d, J = 7.6 Hz), 4.33-4.99 (4H, m), 5.04-5.25 (1H, m), 5.41-5.70 (1H, m), 6.17 (1H, d, J = 19.0 Hz), 6.38 (1H, d, J = 9.2 Hz), 7.32 (1H, s), 7.79 (1H, brs), 7.95 (1H, s). 31P NMR (121 MHz, D2O) δ -1.61, -1.52.
7-((5R,7R,8R,12aR,14R,15R,15aS,16R)-14-(6-アミノ-9H-プリン-9-イル)-2,10,15,16-テトラヒドロキシ-2-オキシド-10-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン 2トリエチルアミン塩(光学異性体)の合成
チル)テトラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリ
ル)オキシ)-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル 水素 ホスホナート(3.0 g) および2-シアノエチル (6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル ジイソプロピルホスホロアミダイト (5.36 g) の混
合物を、無水アセトニトリルと共沸脱水し、無水アセトニトリル (25 mL) と無水THF(15 mL)に懸濁した。あらかじめ無水アセトニトリルで共沸脱水した5-(エチルスルファニル)-2H-テトラゾール (2.13 g) を無水アセトニトリル (15 mL) に溶解して上記懸濁液に加え、アルゴン雰囲気下、室温で終夜撹拌した後、((ジメチルアミノメチリデン)アミノ)-3H-1,2,4-ジチアゾリン-3-チオン (2.24 g) を加え、室温でさらに1時間撹拌した。減圧下溶媒を留去した後、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル)
で精製して標題化合物(5.15 g) を得た。MS: [M+H]+ 1208.3.
ロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホロチオイル)オキシ)メチル)テトラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリ
ル)オキシ)-2-((((2-シアノエトキシ)(((6aR,8R,9R,9aR)-8-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル)オキシ)ホスホロチオイル)オキシ)メ
チル)テトラヒドロフラン-3-イル 水素 ホスホナート (5.15 g) をTHF (48 mL) と水 (10
mL) の混合液に溶解して氷冷し、トリフルオロ酢酸 (11.5 mL) を加え、0 ℃で3時間撹
拌した。反応混合物に重曹(12.5 g) の水(100 mL)溶液を加えてクエンチした後、酢酸エ
チル-THFで抽出した。有機層を飽和食塩水で洗浄、硫酸ナトリウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル) で精
製して標題化合物 (5.13 g) を得た。MS: [M+H]+ 1226.4.
シ)-10-(2-シアノエトキシ)-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトラ(プロパン-2-イル)
ジシロキサニル)オキシ)-2-オキシド-10-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリ
ン-6-イル)ベンズアミド
(2R,3R,4R,5R)-5-(6-ベンズアミド-9H-プリン-9-イル)-4-((tert-ブチルジメチルシリ
ル)オキシ)-2-((((2-シアノエトキシ)(((2R,3R,4R,5R)-2-(5-フルオロ-4-オキソ-3H-ピロロ[2,3-d]ピリミジン-7(4H)-イル)-4-((3-ヒドロキシ-1,1,3,3-テトライソプロピルジシ
ロキサニル)オキシ)-5-(ヒドロキシメチル)テトラヒドロフラン-3-イル)オキシ)ホスホロチオイル)オキシ)メチル)テトラヒドロフラン-3-イル 水素 ホスホナート (5.13 g) を無水アセトニトリル及び無水ピリジンで共沸脱水し、無水ピリジン (100 mL) に懸濁した。2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (2.70 g) を加え、ア
ルゴン雰囲気下、室温で1時間撹拌した後、水 (2.64 g) とヨウ素 (1.38 g) を加え、室
温でさらに1時間撹拌した。反応混合物をチオ硫酸ナトリウム(5.19 g)および水 (2.64 g)
でクエンチした後、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄、無水硫酸
マグネシウムで乾燥後、溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(メタノール/酢酸エチル) で精製して標題化合物 (3.53 g) を得た。MS: [M+H]+ 1224.4.
ロキシ-1,1,3,3-テトラキス(1-メチルエチル)ジシロキサニル)オキシ)-2-オキシド-10-スルファニル-5,8-メタノ-12H-フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン(光学異性体)
N-(9-((5R,7R,8R,12aR,14R,15R,15aR,16R)-15-((tert-ブチル(ジメチル)シリル)オキシ)-10-(2-シアノエトキシ)-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-16-((3-ヒドロキシ-1,1,3,3-テトラ(プロパン-2-イル)ジ
シロキサニル)オキシ)-2-オキシド-10-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル)-9H-プリン-6-イル)ベンズアミド(3.5 g) に40%メチルアミンメタノール溶液 (50 mL)を加え、アル
ゴン雰囲気下室温で1時間撹拌した。得られた混合物を減圧濃縮し、残留物をシリカゲル
カラムクロマトグラフィー(メタノール/酢酸エチル)で精製した後、得られた残渣をHPLC
(L-column2 ODS、50×150 mm、移動相:5 mM 酢酸アンモニウム水溶液/アセトニトリル
)で精製し、得られた画分を減圧濃縮・凍結乾燥することにより標題化合物(210 mg)を得た。MS: [M+H]+ 1067.4.
)
7-((5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-(((1,1-
ジメチルエチル)ジメチルシリル)オキシ)オクタヒドロ-2,10-ジヒドロキシ-16-((3-ヒド
ロキシ-1,1,3,3-テトラキス(1-メチルエチル)ジシロキサニル)オキシ)-2-オキシド-10-スルファニル-5,8-メタノ-12H-フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル)-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
(光学異性体、tR2由来)(210 mg)のメタノール(1.0 mL)-トリエチルアミン(0.4 mL)溶液にトリエチルアミン 三フッ化水素酸塩 (0.962 mL) を加えて、50℃で2時間半撹拌した。反応混合物にエトキシトリメチルシラン(4.59 mL)を室温で加え、30分撹拌した。反応混
合物を減圧下で濃縮し、残渣をC18シリカゲルカラムクロマトグラフィー (10 mM 酢酸ト
リエチルアンモニウム緩衝液/アセトニトリル)で精製し、凍結乾燥して標題化合物 (125 mg) を得た。1H NMR (300 MHz, D2O) δ1.13-1.28 (18H, m), 3.12 (12H, q, J = 7.2 Hz), 4.02-4.11 (1H, m), 4.13-4.25 (2H, m), 4.27-4.40 (2H, m), 4.46 (1H, d, J = 6.4
Hz), 4.73-4.79 (2H, m), 4.80-4.91 (1H, m), 5.02 (1H, td, J = 8.8, 4.2 Hz), 6.08
(1H, d, J = 1.7 Hz), 6.35 (1H, d, J = 8.1 Hz), 7.27 (1H, d, J = 1.7 Hz), 7.93 (1H, s), 8.14 (1H, s), 8.18 (1H, s). 31P NMR (121 MHz, D2O) δ52.4,1.21.
7-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-14-(6-アミノ-9H-プリン-9-イル)-10,15,16-トリヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (光学
異性体 1および2) の合成
チル)シリル]オキシ}-2-({[(2-シアノエトキシ){[(6aR,8R,9R,9aR)-8-(5-フルオロ-3-メ
チル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル]オキシ}ホスホリル]オキシ}メチル)テトラヒドロフラン-3-イル 水素 ホスホナート
(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-4-{[tert-ブチル(ジメチル)シリル]オキシ}-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル 水素 ホスホナー
ト (250 mg)および2-シアノエチル (6aR,8R,9R,9aR)-8-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピルテトラ
ヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル ジイソプロピルホスホロアミダイト (359 mg)(実施例24 工程C)を無水アセトニトリルと共沸脱水し、無水アセ
トニトリル (1.1 mL)および無水テトラヒドロフラン (0.7 mL)をそこに加えた。混合物に、5-(エチルスルファニル)-2H-テトラゾール (175 mg) (無水アセトニトリルと共沸脱水
したもの)の無水アセトニトリル (0.75 mL)溶液を加え、混合物をアルゴン雰囲気下、室
温で2時間攪拌した。ノナン (0.25 mL)中のtert-ブチル ヒドロペルオキシド (5.5 mol/L)をそこに加え、混合物を室温で40分間攪拌した。反応混合物を氷浴中で冷却し、チオ硫
酸ナトリウム (345 mg)の水 (0.275 mL)溶液を加えた。混合物を室温で15分間攪拌し、減圧下濃縮した。粗生成物をシリカゲルカラムクロマトグラフィー (メタノール/ジクロロ
メタン)で精製して、標題化合物(318 mg)をジアステレオマー混合物として得た。MS:[M+H]+1206.3
チル)シリル]オキシ}-2-({[(2-シアノエトキシ)({(2R,3R,4R,5R)-2-(5-フルオロ-3-メチ
ル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-5-(ヒドロキシメチル)-4-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]テトラヒドロフラン-3-イル}オキシ)ホスホリル]オキシ}メチル)テトラヒドロフラン-3-イル 水素 ホス
ホナート
(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-4-{[tert-ブチル(ジメチル)シリル]オキシ}-2-({[(2-シアノエトキシ){[(6aR,8R,9R,9aR)-8-(5-フルオロ-3-メチ
ル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル]オキシ}
ホスホリル]オキシ}メチル)テトラヒドロフラン-3-イル 水素 ホスホナート (315 mg)を
、テトラヒドロフラン (2.8 mL)および水 (0.71 mL)の混合物に溶解し、溶液を攪拌し、
氷浴中で冷却した。トリフルオロ酢酸(0.71 mL)を滴下し、混合物を0-5℃で2時間15分攪
拌した。炭酸水素ナトリウム (1.14 g)を、よく攪拌しながら反応混合物に徐々に加え、
続いて、水 (3 mL)および酢酸エチル (10 mL)を加えた。分離した水層を酢酸エチル(10 mL)で抽出した。合わせた有機物を 食塩水(3 mL)で洗浄し、無水硫酸ナトリウムで乾燥し
、ろ過し、溶媒を減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/塩化メチレン)で精製して、標題化合物(145 mg)を得た。MS:[M+H]+ 1224.3
シ}-10-(2-シアノエトキシ)-7-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル}-9H-プリン-6-イル)ベンズアミド
(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-4-{[tert-ブチル(ジメチル)シリル]オキシ}-2-({[(2-シアノエトキシ)({(2R,3R,4R,5R)-2-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-5-(ヒドロキシメチル)-4-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]テトラヒドロフラ
ン-3-イル}オキシ)ホスホリル]オキシ}メチル)テトラヒドロフラン-3-イル 水素 ホスホ
ナート (143 mg)を無水アセトニトリルと共沸脱水し、無水ピリジン (2.3 mL)をそこに加えた。混合物に2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナン 2-オキシド (75 mg)を加え、混合物をアルゴン雰囲気下、室温で45分間攪拌した。水 (75 μL)および3H-1,2-ベンゾジチオール-3-オン1,1-ジオキシド (29 mg)をそこに加え、混合物を室温でさらに40分間攪拌した。反応混合物に、チオ硫酸ナトリウム ペンタ水和物 (150 mg)の水 (0.35
mL)溶液を加え、混合物を室温で5分間攪拌した。混合物を濃縮し、トルエンをそこに加
え、混合物を減圧下濃縮した(繰り返し4X).粗生成物をシリカゲルカラムクロマトグラフ
ィー (メタノール/ジクロロメタン)で精製して、標題化合物(84 mg)をジアステレオマー
混合物として得た。MS:[M+H]+1238.3
ソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
N-(9-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-{[tert-ブチル(ジメチル)シリル]オキシ}-10-(2-シアノエトキシ)-7-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル}-9H-プリン-6-イル)ベンズアミド(83 mg)に、33%メチルアミン エタノール溶液 (2.0 mL)を加え、混合物
をアルゴン雰囲気下、室温で1時間攪拌し、減圧下濃縮した。粗生成物を、10mM aq NH4OAc中の0ないし70%ACNで溶出する逆相クロマトグラフィー (ISCO RediSepRf Gold HP C18 15.5 g column)で精製して、標題化合物の、2つの単離された単一異性体を得た:ピーク 1
(先のフラクション, 11 mg)およびピーク 2 (後のフラクション, 44.5 mg)。MS:[M+H]+ 1081.3
トリヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (
光学異性体 1)
7-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-{[tert-
ブチル(ジメチル)シリル]オキシ}-10-ヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テトライ
ソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (324 mg,ピーク 2 /工程 Dからの後のフラクション)に、ピリジン (6.0 mL)およびトリエチルアミン トリフッ化水素酸塩 (0.303 mL)を加えた。反応混合物を55℃で16時間攪拌した。LCMS分析は、いくつかのモノ保護された中間体を示した。メタノール (2.0 mL)を加え、反
応混合物を55℃で3時間攪拌した。その時、LCMSは反応の完了を示した。反応混合物を減
圧下濃縮し、水 (6.7 mL)および塩化カルシウム (700 mg)を加えた。得られた懸濁液を1
時間攪拌し、セライトパッド(登録商標)でろ過した。ろ液を減圧下濃縮し、残渣を、10 mM aq トリエチル酢酸アンモニウム中の0ないし15%ACNで溶出する逆相クロマトグラフィー
(ISCO RediSepRf Gold HP C18Aq column)で精製して、標題化合物(195 mg)を得た。MS:[M+H]+ 707.1 1H NMR (400 MHz, D2O) δ 1.27 (18H, t, J = 7.3 Hz), 3.19 (12H, q, J
= 7.3 Hz), 3.35 (3H, s), 4.06-4.10 (1H, m), 4.18-4.26 (1H, m), 4.32~4.37 (1H, m), 4.39-4.54 (3H, m), 4.63 (1H, d, J = 4.0 Hz), 4.80-4.82 (1H, m), 5.03-5.12 (2H, m), 6.15-6.17 (1H, m), 6.35-6.39 (1H, m), 7.33-7.37 (1H, m), 8.13 (1H, s), 8.15 (1H, s), 8.27 (1H, s). 31P NMR (162 MHz, D2O) δ -2.22, 54.80. 19F NMR (376
MHz, D2O) δ -164.6.
トリヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (
光学異性体 2)
光学異性体 1と同様の手順を用いて光学異性体 2を調製した。7-{(5R,7R,8R,12aR,14R,
15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-{[tert-ブチル(ジメチル)シリル]オキシ}-10-ヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)
オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチ
ル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (24.5 mg,ピーク 1 /工程 Dから
の先のフラクション) から標題化合物(11.8 mg)を得た。MS:[M+H]+707.1. 1H NMR (400 MHz, D2O) δ ppm 1.25 (18 H, t, J=7.22 Hz), 3.17 (q, J=7.24 Hz, 12 H), 3.35 (3H,
s), 4.12 - 4.22 (3H, m), 4.40 - 4.53 (3H, m), 4.62 (1H, m), 4.83 - 4.90 (1H, m), 4.93 - 4.98 (1H, m), 5.09 - 5.15 (1H, m), 6.16 (1H, s), 6.28 - 6.36 (1H, m),
7.50 (1H, s), 8.12 (1H, s), 8.15 (1H, s), 8.31 (1H, s). 31P NMR (162 MHz, D2O)
δ -2.42, 54.11. 19F NMR (376 MHz, D2O) δ -165.54
7-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩
(光学異性体 1および2) の合成
7-[(2R,3R,4S,5R)-3,4-ジヒドロキシ-5-(ヒドロキシメチル)テトラヒドロフラン-2-イ
ル]-5-フルオロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (300 mg)をN,N-ジメチルホルムアミド (3.30 mL)に溶解し、炭酸カリウム (192 mg)を加えた。懸濁液を氷浴
中で冷却した。ヨードメタン (0.080 mL)を加えた。混合物を冷却しながら5分間攪拌し、次いで室温で終夜攪拌した。混合物を濃縮し、水を加え、1M HClでpH ~6まで中和した。生じた固体をろ取し、減圧下終夜乾燥して、標題化合物(266 mg)を得た。MS:[M+H]+ 300.1.
7-[(2R,3R,4S,5R)-3,4-ジヒドロキシ-5-(ヒドロキシメチル)テトラヒドロフラン-2-イ
ル]-5-フルオロ-3-メチル-ピロロ[2,3-d]ピリミジン-4-オン (985 mg) (前もってアセト
ニトリルと3回共沸し、5時間減圧乾燥したもの)をピリジン(9.75 mL)およびN,N-ジメチルホルムアミド(4.80 mL)に溶解した。15分間攪拌した後、1,3-ジクロロ-1,1,3,3-テトライソプロピルジシロキサン (1.02 mL)を滴下した。混合物を室温で終夜攪拌した。混合物を減圧下濃縮し、トルエンと共沸した。残渣を EtOAc (120 mL)および水 (50 mL)で分液し
た。分離した有機層を水(2 X 50 mL)および食塩水 (50 mL)で洗浄し、Na2SO4で乾燥し、
ろ過し、減圧下濃縮した。残渣を、EtOAc/ヘキサンを用いたクロマトグラフィーで精製して、標題化合物(1.41 g)を得た。MS:[M+H]+ 542.3.
15 mL 丸底フラスコで、5-フルオロ-7-[(6aR,8R,9R,9aS)-9-ヒドロキシ-2,2,4,4-テト
ライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-8-イル]-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (1.41 g)を乾燥アセトニ
トリル(3 X 5 mL)と共沸し、アルゴン下乾燥N,N-ジメチルホルムアミド (6.17 mL)に溶解した。アセトニトリル (7.05 mL)中の1H-テトラゾール 0.45M、1-メチル-1H-イミダゾー
ル (123 μL)および2-シアノエチルN,N,N',N'-テトライソプロピルホスホロジアミダイト
(1.86 mL)を加えた。混合物を室温で1時間攪拌した。混合物を70 mlのEtOAcで希釈し、
飽和のNaHCO3(X 2)および食塩水で洗浄し、Na2SO4で乾燥し、ろ過し、減圧下濃縮した。
粗残渣をEtOAc/ヘキサン (0.5%Et3N)を用いたシリカゲルクロマトグラフィーで精製して
、標題化合物(1.87 g)を得た。MS:[M+H]+ 742.4.
シ){[(6aR,8R,9R,9aR)-8-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル]オキシ}ホスホリル]オキシ}メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート
100 mL 丸底フラスコで、2-シアノエチル(6aR,8R,9R,9aR)-8-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピ
ルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル ジイソプロピルホスホロアミダイト (937 mg)および(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-4-フルオロ-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル 水素 ホスホ
ナート (425 mg)を乾燥CH3CN(3 X 5 mL)と共沸し、アルゴン下、乾燥テトラヒドロフラン
(1.80 mL)およびアセトニトリル (2.95 mL)に懸濁した。5-(エチルチオ)-1H-テトラゾール(380 mg) (アセトニトリル 3 x 5 mL で前もって共沸したもの)の乾燥アセトニトリル (1.80 mL)溶液を加えた。混合物を室温で1時間攪拌した。ノナン (425 μL)中のtert-ブ
チル ヒドロペルオキシド (5.5 mol/L)を加えた。混合物を40分間室温で攪拌し、次いで
氷浴中冷却した。チオ硫酸ナトリウム (500.0 mg)の水 (700 μL)溶液を加え、混合物を1
0分間攪拌した。混合物を減圧下濃縮し、残渣をシリカゲルカラムクロマトグラフィー (
メタノール/DCM) で精製した。2つの光学異性体の混合物として、標題化合物(1.10 g)を
得た。MS:[M+H]+ 1094.3.
シ)({(2R,3R,4R,5R)-2-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-5-(ヒドロキシメチル)-4-[(3-ヒドロキシ-1,1,3,3-テトライソプロ
ピルジシロキサニル)オキシ]テトラヒドロフラン-3-イル}オキシ)ホスホリル]オキシ}メ
チル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート.
氷浴で冷却した、(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-2-({[(2-シアノエトキシ){[(6aR,8R,9R,9aR)-8-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フ
ロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル]オキシ}ホスホリル]オキシ}メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート (1.10 g)のテトラヒドロフ
ラン (11.0 mL)および水 (2.50 mL)溶液に、トリフルオロ酢酸 (2.50 mL) ゆっくり加え
た。混合物を冷却しながら4時間攪拌した。炭酸水素ナトリウム (3800 mg)、続いて、8 mlの水を加えた。混合物を5分間攪拌し、室温に戻し、EtOAcで二回抽出した。合わせた有
機層を食塩水で洗浄し、Na2SO4で乾燥し、ろ過し、ろ液を減圧下留去して、粗生成物を得た。シリカゲルカラム(メタノール/DCM)を用いたクロマトグラフィーにより、標題化合物(1.14 g)を得た。MS:[M+H]+ 1112.3.
100 mL 丸底フラスコで、(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-2-({[(2-シアノエトキシ)({(2R,3R,4R,5R)-2-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-5-(ヒドロキシメチル)-4-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]テトラヒドロフラン-3-イル}オキシ)
ホスホリル]オキシ}メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート (149 mg)をアセトニトリル(3 X 4 mL)と共沸し、減圧下乾燥し、乾燥ピリジン (2.35 mL)に溶解し、氷浴中冷却した。ピリジン (0.120ml)中の2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスホリナン 2-オキシド (180 mg)を加えた。混合物を室温で1.5 時間攪拌した。水
(70.3 μL)を加え、続いて、3H-1,2-ベンゾジチオール-3-オン (56.2 mg)を加えた。混
合物を室温で40分間攪拌した。水 (1 mL)中のチオ硫酸ナトリウム (135 mg)を加えた。混合物を10分間攪拌し、減圧下濃縮し、トルエンと共沸して、ピリジンを除去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/DCM) で精製して、2つの光学異性体
の混合物として標題化合物 (63.6 mg)を得た。MS:[M+H]+ 1126.3.
ロ-10-ヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
2つの異性体の混合物 N-(9-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-10-(2-シアノエトキシ)-15-フルオロ-7-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピ
リミジン-7-イル)-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル}-9H-プリン-6-イル)ベン
ズアミド (60.7 mg)をエタノール (3.00 mL)中のメチルアミン (33%wt.)中で、室温で1時間攪拌した。揮発性物質を減圧下留去した。粗生成物を、10mM aq NH4OAc中の0ないし50%ACNで溶出する逆相クロマトグラフィー (ISCO RediSepRf Gold HP C18 column)で精製し
て、標題化合物の2つの単離された単一異性体を得た:ピーク 1 (先のフラクション, 12 mg)およびピーク 2 (後のフラクション, 35.6 mg) MS:[M+H]+ 969.3.
ロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-
フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (光学異性体 1)
15 mL ポリプロピレン円すい管に、7-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-10-ヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テトラ
イソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (35.6 mg,ピーク2 /工程 Gからの後のフラクション)を入れた。ピリジン (273 μL)を加え、
続いて、トリエチルアミン トリフッ化水素酸塩 (27.3 μL)およびトリエチルアミン (414 μL)を加えた。混合物を室温で終夜攪拌し、50℃で2時間攪拌した。反応混合物を氷浴
中で冷却し、水 (1.3 mL)で希釈した。塩化カルシウム (146.0 mg)の水 (1.0 mL)溶液を
ゆっくりと加えた。混合物を30分間攪拌し、次いで、セライト(登録商標)ろ過した。ろ液を減圧下濃縮し、残渣を、10mM aq トリエチル酢酸アンモニウム中の0ないし10%ACNで溶
出する逆相クロマトグラフィー (ISCO RediSepRf Gold HP C18Aq column)で精製して、標題化合物(23.9 mg)を得た。MS:[M+H]+ 709.2. 1H NMR (400 MHz, メタノール-d4) δ 8.29 - 8.24 (m, 1H), 8.22 (s, 1H), 8.08 - 8.04 (m, 1H), 7.46 - 7.40 (m, 1H), 6.48
(d, 1H, J=12 Hz), 6.37 (d, 1H, J=16 Hz), 5.80 - 5.57 (m, 1H), 5.33 - 5.12 (m, 1H), 5.05 - 4.95 (m, 1H), 4.50 - 4.42 (m, 2H), 4.41 - 4.34 (m, 1H), 4.34 - 4.24 (m, 2H), 4.08 - 3.96 (m, 1H), 3.57 (s, 3H), 3.52 - 3.48 (m, 1H), 3.25 - 3.11 (m, 12H), 1.39 - 1.24 (m, 18H). 31P NMR (162 MHz, D2O) δ-2.45, 55.32. 19F NMR (376.5 MHz, D2O) δ-164.60, -200.71.
ロ-10,16-ジヒドロキシ-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-
フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (光学異性体 2)
15 mL ポリプロピレン円すい管に、7-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-10-ヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テトラ
イソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2-スルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (12.0 mg, ピーク1 /工程 Gからの先のフラクション)を入れた。ピリジン (92 μL)を加え、
続いて、トリエチルアミン トリフッ化水素酸塩 (9.2 μL)およびトリエチルアミン (140
μL)を加えた。混合物を50℃で 2時間攪拌した。反応混合物を氷浴で冷却し、水 (1.0 mL)で希釈した。塩化カルシウム (6.98 mg)の水 (1.0 mL)溶液をゆっくりと加えた。混合
物を30分間攪拌し、次いで、セライト(登録商標)ろ過した。ろ液を減圧下濃縮し、残渣を、10mM aq トリエチル酢酸アンモニウム中の0ないし10%ACNで溶出する逆相クロマトグラ
フィー (ISCO RediSepRf Gold HP C18Aq column)で精製して、標題化合物(1.94 mg)を得
た。MS:[M+H]+ 709.3. 1H NMR (400 MHz, ジュウテリウムオキシド) δ 8.20 (s, 1H),
8.06 (s, 1H), 7.99 (s, 1H), 7.46 - 7.40 (m, 1H), 6.37 (d, 1H, J=16 Hz), 6.27 (d
, 1H, J=8 Hz), 5.83 (dd, 1H, J1=52 Hz, J2=4 Hz), 4.98 - 4.84 (m, 2H), 4.57 (br d, J = 3.9 Hz, 2H), 4.54 - 4.48 (m, 2H), 4.46 - 4.36 (m, 3H), 4.20 - 4.11 (m, 3H), 3.55 - 3.47 (m, 3H), 3.20 - 3.06 (dd, 12H), 1.28 - 1.12 (t, 18H). 31P NMR (162 MHz, D2O) δ-2.52, 53.94. 19F NMR (376.5 MHz, D2O) δ-165.55, -202.45.
7-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-2,10,16-トリヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩の合成
100 mL 丸底フラスコで、(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-2-({[(2-シアノエトキシ)({(2R,3R,4R,5R)-2-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-5-(ヒドロキシメチル)-4-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]テトラヒドロフラン-3-イル}オキシ)
ホスホリル]オキシ}メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート (1.14 g)をアセトニトリル (3 X 4 mL)と共沸し、減圧下乾燥し、ピリジン (18.0 mL)に
溶解し、氷浴中冷却した。2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスホリナン 2-オキ
シド (586 mg)を2分割で加えた。混合物を室温で40分間攪拌した。水 (0.554 mL)を加え
、続いて、3H-1,2-ベンゾジチオール-3-オン1,1-ジオキシド (251 mg)を加えた。混合物
を室温で40分間攪拌した。チオ硫酸ナトリウム (810 mg)の水(2 mL)溶液を加えた。混合
物を減圧下濃縮し、トルエンと共沸して、ピリジンを除去した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/DCM)で精製して、標題化合物(650 mg)を得た。MS:[M+H]+ 1111.3
ロ-2,10-ジヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペ
ンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン
25 mL 丸底フラスコに、無水エタノール (22.7 mL)中の、N-(9-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-10-(2-シアノエトキシ)-15-フルオロ-7-(5-フルオロ-3-メチル-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2-ヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル}-9H-プリン-6-イル)ベンズアミド (650 mg)およびメチルアミン (33 質量%)を加えた。混合物を室温で3時間攪拌した。反応混合物を減圧下濃縮し、残渣を、10mM aq NH4OAc中の0ないし60%ACNで溶出する逆相クロマトグラフィー (ISCO RediSepRf Gold HP C18 column)で精製して、標題化合物(32.0 mg) を得た。MS:[M+H]+ 953.3.
ロ-2,10,16-トリヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩.
15 mL ポリプロピレン円すい管に、7-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-2,10-ジヒドロキシ-16-[(3-ヒドロキシ-1,1,3,3-テ
トライソプロピルジシロキサニル)オキシ]-2,10-ジオキシドオクタヒドロ-12H-5,8-メタ
ノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-フルオロ-3-メチル-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (32.0 mg)およ
びピリジン(246 μL)を加えた。懸濁液に、トリエチルアミン トリフッ化水素酸塩 (24.6
μL)を加え、続いて、トリエチルアミン(372 μL)を加えた。混合物を室温で終夜攪拌した。反応混合物を氷浴中で冷却し、水 (1mL)で希釈した。塩化カルシウム (18.6 mg)の水
(1 mL)溶液をゆっくりと加えた。混合物を30分間攪拌し、次いでセライト(登録商標)ろ
過した。ろ液を減圧下濃縮し、残渣を、10mM aq トリエチル酢酸アンモニウム中の0ない
し5%ACNで溶出する逆相クロマトグラフィー (ISCO RediSepRf Gold HP C18Aq column)で
精製して、標題化合物(8.3mg)を得た。MS:[M+H]+ 693.2. 1H NMR (400 MHz, メタノー
ル-d4) δ 8.36 (br, 1H), 8.22 (s, 1H), 8.05 (s, 1H), 7.38 (d, 1H, j=2), 6.48 (d,
1H, j=8), 6.37 (d, 1H, J=16 Hz), 5.70 (dd, 1H, J1=52 Hz, J2=4 Hz), 5.20 - 5.07 (m, 1H), 4.98 - 4.92 (m, 1H), 4.53 (d, 1H, J=4 Hz), 4.45 - 4.33 (m, 2H), 4.33 - 4.19 (m, 3H), 4.09 - 4.03 (m, 1H), 3.45 (s, 3H), 3.17 (qt, 12H), 1.28(t, 18H). 31P NMR (162 MHz, D2O) δ-1.66, -2.26. 19F NMR (376.5 MHz, D2O) δ-164.5, -201.7.
7-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-16-ヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-クロロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (光学異性
体 1および 光学異性体 2) の合成:
100 mL 丸底フラスコ中で、5-クロロ-7-[(6aR,8R,9R,9aS)-9-ヒドロキシ-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-8-イル]-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (1.469 g) (実施例15 Aの方法と同
様の方法で合成されたもの))をトルエンと共沸し(3 x)、真空乾燥した。丸底フラスコを
脱気し、アルゴンで満たした(3 x)。無水N,N-ジメチルホルムアミド (5.00 mL)を加えて
、原料を1分間の超音波処理で溶解し、続いて、2-シアノエチル N,N,N’,N’-テトライ
ソプロピルホスホロジアミダイト (2.50 mL)、1-メチルイミダゾール (0.13 mL)および1H-テトラゾール (0.45M in アセトニトリル, 6.70 mL)を加えた。混合物をアルゴン雰囲気下室温で3時間攪拌した。混合物をEtOAc (200 mL)で希釈した。飽和のNaHCO3溶液を加え
た。水層をEtOAcで二回抽出した。合わせたEtOAc層を水、次いで食塩水で洗浄し、無水Na2SO4で乾燥し、ろ過した。ろ液を減圧下濃縮して、油状の粗生成物を得た。粗物質を、EtOAc:ヘキサン (1:9ないし1:1)で溶出するカラムクロマトグラフィー (ISCO RediSepRf DIOL HP Gold 100 g column)で精製して、標題化合物(1.77 g) を得た。生成物の加水分解
されたフラグメントとしてのMS:[M+H]+ 661.3.
キシメチル)テトラヒドロフラン-3-イル 水素 ホスホナート.
N-{9-[(2R,3R,4R,5R)-5-{[ビス(4-メトキシフェニル)(フェニル)メトキシ]メチル}-3-
フルオロ-4-ヒドロキシテトラヒドロフラン-2-イル]-9H-プリン-6-イル}ベンズアミド (2.64 g)をアルゴン下無水ピリジン (18.0 mL)に溶解し、氷浴を用いて冷却した。亜リン酸ジフェニル (1.60 mL)を 1 分かけてゆっくりと加えた。反応溶液を室温まで戻し、1時間攪拌した。2番目部分の亜リン酸ジフェニル (0.35 mL)をゆっくりと加え、混合物を30 分以上攪拌し続けた。混合物を氷浴を用いて冷却した。水 (2.0 mL)を加え、混合物を室温
で30分間攪拌した。混合物を減圧下濃縮し、トルエンと共沸してピリジンおよび水をさらに除去した。残渣を真空ポンプで乾燥した。残渣に酢酸 (10.0 mL)および水 (2.0 mL) を加えた。混合物を室温で30分間攪拌した。混合物を減圧下濃縮し、トルエンと共沸し、次いで 真空ポンプで乾燥して、粗油状物を得た。これを、MeOH/DCM (0/100ないし50 / 50)を用いたシリカカラムのクロマトグラフィーに付して、白色固体の1.33 gの標題生成物を得た。 MS:[M+H]+ 438.1.
テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-
イル]オキシ}(2-シアノエトキシ)ホスホロチオイル]オキシ}メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート.
250 mL 丸底フラスコ中で、(6aR,8R,9R,9aR)-8-(5-クロロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル 2-シアノエチル ジイソプロピルホスホ
ロアミダイト (2.23 g)および(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イ
ル]-4-フルオロ-2-(ヒドロキシメチル)テトラヒドロフラン-3-イル 水素 ホスホナート (1.17 g) の混合物を乾燥アセトニトリル (25 mL x 3)と共沸し、真空ポンプ1時間乾燥し
た。混合物にアルゴン下無水アセトニトリル (20.0 mL)を加え、続いて、5-(エチルチオ)-1H-テトラゾール (1.00 g) (前もって乾燥アセトニトリル(10 mL x 3)と共沸し、真空ポンプで乾燥したもの)の無水アセトニトリル (10.0 mL)溶液を加えた。混合物を室温で1時間20分間攪拌した。((ジメチルアミノ-メチリデン)アミノ)-3H-1,2,4-ジチアゾリン-3-チオン (655 mg)を加え、混合物を室温で40分間攪拌した。混合物を減圧下濃縮した。MeOH/DCM (0/100ないし40/60)を用いたシリカカラムのクロマトグラフィーに付して、2つの光
学異性体の混合物として、標題化合物(1.78 g) を得た。 MS:[M+H]+ 1112.4.
ラヒドロフラン-3-イル}オキシ)(2-シアノエトキシ)ホスホロチオイル]オキシ}メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート.
丸底フラスコ中で、(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-2-({[{[(6aR,8R,9R,9aR)-8-(5-クロロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-2,2,4,4-テトライソプロピルテトラヒドロ-6H-フロ[3,2-f][1,3,5,2,4]トリオキサジシロシン-9-イル]オキシ}(2-シアノエトキシ)ホスホロチオイル]オキシ}メチル)-4-
フルオロテトラヒドロフラン-3-イル 水素 ホスホナート (1.73 g)をテトラヒドロフラン
(16 mL)および水 (4.0 mL) に溶解した。溶液を氷浴を用いて冷却した。トリフルオロ酢酸 (4.0 mL)を滴下した。混合物を冷却しながら4時間攪拌した。0℃で、炭酸水素ナトリ
ウム (7.00 g)を分割して加え、続いて、水およびEtOAcを加えた。混合物を3分間攪拌し
、次いで室温に戻した。層を分離した。水層をEtOAcで抽出した(3 x)。合わせたEtOAc溶
液を食塩水で洗浄し、無水Na2SO4で乾燥し、ろ過した。ろ液を減圧下濃縮し、真空ポンプで乾燥して、粗生成物を得た。粗物質を、MeOH/DCM (0/100ないし40/60)を用いたシリカ
カラムで精製して、2つの光学異性体の混合物として標題生成物 (1.43 g)を得た。 MS:[M+H]+ 1130.3.
ピロロ[2,3-d]ピリミジン-7-イル)-10-(2-シアノエトキシ)-15-フルオロ-16-[(3-ヒドロ
キシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2-オキシド-2-スルファニル-10-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-14-イル}-9H-プリン-6-イル)ベンズアミド (2つの主たる光学異性体の混合物).
丸底フラスコ中で、(2R,3R,4R,5R)-5-[6-(ベンゾイルアミノ)-9H-プリン-9-イル]-2-({[({(2R,3R,4R,5R)-2-(5-クロロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-5-(ヒドロキシメチル)-4-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]テトラヒドロフラン-3-イル}オキシ)(2-シアノエトキシ)ホスホロチオイル]オキシ}メチル)-4-フルオロテトラヒドロフラン-3-イル 水素 ホスホナート (1.20 g)を
乾燥ピリジン (fresh bottle) / アセトニトリルと共沸し(x 2)、次いで乾燥アセトニト
リルと共沸した。得られた白色固体を減圧下乾燥した。アルゴン雰囲気下、無水ピリジン
(20.0 mL) (fresh bottle)を加え、続いて、2-クロロ-5,5-ジメチル-1,3,2-ジオキサホ
スフィナン 2-オキシド (0.700 g)を加えた。透明溶液を室温で1時間 10分攪拌した。水 (0.70 mL)を加え、続いて、3H-1,2-ベンゾジチオール-3-オン 1,1-ジオキシド (0.300 g)を加えた。混合物を室温で20分間攪拌した。混合物を減圧下濃縮し、トルエンと共沸し(x
2)、真空ポンプで乾燥して、粗残渣を得た。粗残渣をMeOH/DCM (0/100ないし20/80)を用いたシリカカラムのクロマトグラフィーに付した。先のフラクションからの標題生成物 (590 mg)を得、LCMSからピーク2および4の主たる異性体の混合物と同定した。一方、後の
フラクションからの2番目のクロップの生成物 (389 mg)は、全ての4つの異性体の混合物
と同定した。 MS:[M+H]+ 1144.2.
ロ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオ
キシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-クロロ-3,7-ジヒドロ-4H-ピロ
ロ[2,3-d]ピリミジン-4-オン (単一の光学異性体 1および2)
N2雰囲気下、N-(9-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(5-クロロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10-(2-シアノエトキシ)-15-フルオロ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2-オキシド-2-スルファニル-10-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペ
ンタオキサジホスファシクロテトラデシン-14-イル}-9H-プリン-6-イル)ベンズアミド (0.584 g, 2つの主たる異性体の混合物, カラムクロマトグラフの先のフラクション)を無水エタノール (15.0 mL)中のメチルアミン (33 質量%)中で、室温で2時間攪拌した。混合物を減圧下濃縮し、真空ポンプで乾燥して、粗固体を得た。MeOH/EtOAc (0/100ないし40/60)を用いたシリカゲルカラムによる2回の連続の精製により、2つの単一の光学異性体の標題化合物を得た:異性体 1 (先のフラクション/ピーク 1, 73 mg)および異性体 2 (後のフラクション/ピーク 2, 304 mg)、およびピーク 1および2の混合フラクション(0.30 g)。MS (光学異性体 1):[M+H]+ 987.2. MS (光学異性体2):[M+H]+ 987.2.
ロ-16-ヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-
クロロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (光
学異性体 1).
ポリプロピレン管に、7-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-クロロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (光学異性体 1, 69.2 mg, カラムクロマ
トグラフィーからの先のフラクション)、ピリジン (0.40 mL)、続いて、トリエチルアミ
ン トリフッ化水素酸塩 (0.060 mL)、次いでトリエチルアミン (0.90 mL)を加えた。シールしたプロピレン管中の反応混合物を50℃で終夜攪拌した。反応混合物を室温まで冷却し、水 (1.30 mL)で希釈した。塩化カルシウム (92.5 mg)の水 (1.30 mL)溶液を加えた。乳白色混合物を室温で1時間攪拌し、次いでプラスチックフィルターロートを用いてセライ
ト(登録商標)ろ過し、水で洗浄した(1 mL x 4)。透明な含水ろ液を減圧下濃縮し、複数回トルエンと共沸した。真空で10分間乾燥して、粗残渣を得た。粗残渣を、C18カラムクロ
マトグラフィー (水-アセトニトリル/10 mM トリエチル酢酸アンモニウム緩衝液)で精製
した。生成物のフラクションを減圧下濃縮し、トルエンと共沸し(x 4)、次いで、エンド
トキシンフリーの水と共沸した(x 5)。最終の残渣をエンドトキシンフリーの水に溶解し
、凍結乾燥して、標題生成物 (光学異性体 1, 29.0 mg)を得た。MS [M+H]+ 727.0. 1H NMR (400 MHz, ジュウテリウムオキシド) δ = 8.19 (s, 1H), 8.16 (s, 1H), 7.96 (s, 1H), 7.63 (s, 1H), 6.39 (br d, J = 15.7 Hz, 1H), 6.34 (br d, J = 8.0 Hz, 1H), 5.60 - 5.41 (m, 1H), 5.22 - 5.14 (m, 1H), 5.14 - 5.02 (m, 1H), 4.55 (br d, J = 3.8 Hz, 1H), 4.51 (br d, J = 8.2 Hz, 1H), 4.42 (br s, 1H), 4.40 (br s, 1H), 4.35 - 4.28 (m, 1H), 4.16 - 4.10 (m, 1H), 4.06 (br dd, J = 4.3, 11.5 Hz, 1H), 3.13 (q, J
= 7.3 Hz, 12H), 1.21 (t, J = 7.3 Hz, 18H). 31P NMR (162 MHz, ジュウテリウムオ
キシド) δ 55.29, 54.54. 19F NMR (376 MHz, ジュウテリウムオキシド) δ -200.90.
ロ-16-ヒドロキシ-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノ
フロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル]-5-
クロロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン ジ-トリエチルアミン塩 (光
学異性体 2).
ポリプロピレン管に、7-{(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-16-[(3-ヒドロキシ-1,1,3,3-テトライソプロピルジシロキサニル)オキシ]-2,10-ジオキシド-2,10-ジスルファニルオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7-イル}-5-クロロ-3,7-ジヒドロ-4H-ピロロ[2,3-d]ピリミジン-4-オン (光学異性体 2, 186 mg, クロマトグラフから後のフラクション) を加えた。ピリジン (1.1 mL)、続いて、トリエチルアミン トリフッ化水素酸塩 (0.161 mL)、次いでトリエチルアミン (2.4 mL)を加えた。シールしたプロピレン管中の反応混合物を50℃で終夜攪拌した。反応混合物を室温まで冷却し、水 (3.50 mL)で希釈した。塩化カルシウム (250 mg)の水 (3.50 mL)溶液を加えた。乳白色の混
合物を室温で1時間攪拌した。混合物を、プラスチックフィルターロートを用いてセライ
ト(登録商標)ろ過し、水(3 mL x 4)で洗浄した。透明の含水ろ液を減圧下濃縮し、複数回トルエンと共沸し、真空で10分間乾燥して、粗残渣を得た、粗残渣をC18カラムクロマト
グラフィー (水-アセトニトリル/10 mM トリエチル酢酸アンモニウム緩衝液) で精製した。生成物のフラクションを減圧下濃縮し、トルエンと共沸し(x 4)、次いでエンドトキシ
ンフリーの水と共沸した(x 5)。最終の残渣をエンドトキシンフリーの水に溶解し、凍結
乾燥して、標題生成物 (光学異性体 2, 109 mg)を得た。MS [M+H]+ 727.0.
1H NMR (400 MHz, ジュウテリウムオキシド) δ 8.10 (s, 1H), 7.89 (s, 1H), 7.86 (s,
1H), 7.55 (s, 1H), 6.30 (d, J = 15.9 Hz, 1H), 6.24 (d, J = 8.2 Hz, 1H), 5.49 - 5.27 (m, 1H), 5.07 - 4.86 (m, 2H), 4.85 (d, J = 3.9 Hz, 1H), 4.44 (br d, J = 9.0
Hz, 1H), 4.33 (br d, J = 14.7 Hz, 2H), 4.28 - 4.16 (m, 2H), 3.98 (br dd, J = 5.0, 11.8 Hz, 1H), 3.04 (q, J = 7.4 Hz, 12H), 1.12 (t, J = 7.3 Hz, 18H). 31P NMR (162 MHz, ジュウテリウムオキシド) δ 55.12, 52.04. 19F NMR (376 MHz, ジュウテリウムオキシド) δ -200.43.
リンカー-ペイロード 1
得た。粗生成物 (mc-Val-Ala-PAB-I)は、さらに精製することなく用いた。
ジナトリウム (5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-16-ヒドロキシ-2-スルフィドオクタヒドロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-10-オラート 2,10-ジオキシド (ペイロ
ード1, 「化合物 Ex. 3a」ともいう, 0.0106 mmol, 7.80 mg)および6-(2,5-ジオキソピロール-1-イル)-N-[(1S)-1-[[(1S)-2-[4-(ヨードメチル)アニリノ]-1-メチル-2-オキソ-エ
チル]カルバモイル]-2-メチル-プロピル]ヘキサンアミド(mc-Val-Ala-PAB-I, 0.0208 mmol, 12.4 mg, クルード)のN,N-ジメチルホルムアミド (5.17 mmol, 0.400 mL, 378 mg)溶
液を充てんしたバイアルをシールし、60 ℃まで加熱した。2h後、反応を室温まで冷却し
、C18カラム(20-60% CH3CN/0.1%ギ酸含有水の連続グラジエント)のクロマトグラフィーで精製して、N-[(2S)-1-{[(2S)-1-{[4-({[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミ
ノ-9H-プリン-9-イル)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10,16-ジヒドロキシ-2,10-ジオキシドオクタヒドロ-12H-5,8-
メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-2-イ
ル]スルファニル}メチル)フェニル]アミノ}-1-オキソプロパン-2-イル]アミノ}-3-メチル-1-オキソブタン-2-イル]-6-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)ヘキサンアミド (5.5mg, 収率45%)を白色固体として得た。1H NMR (400 MHz, メタノール-d4) δ 8.23-8.35 (m, 2H), 8.10 (s, 1H), 7.89-8.02 (m, 1H), 7.84 (s, 1H), 7.52-7.64 (m,
2H), 7.41 (br d, J=8.53 Hz, 2H), 7.22-7.38 (m, 2H), 6.75-6.83 (m, 2H), 6.32~6.43 (m, 2H), 5.71-5.90 (m, 2H), 4.54-4.59 (m, 2H), 4.42-4.51 (m, 2H), 4.07-4.35 (m, 8H), 3.46 (br t, J=7.03 Hz, 2H), 2.27 (br t, J=7.34 Hz, 2H), 2.03-2.15 (m, 2H), 1.53-1.70 (m, 4H), 1.39-1.47 (m, 3H), 1.23-1.37 (m, 2H), 0.92-1.02 (m, 6H). LCMS:m/z 1163, 1164 [M+H].
リンカー-ペイロード 2
2-アミノ-9-((5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-10,18-ジヒドロキシ-2,10-オキシド-2-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル)-1,9-ジヒドロ-6H-プリン-6-オン セスキ-トリエチルアミン塩 (光学
異性体)
キソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホ
スホリル)オキシ)メチル)-2,5-ジオキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート
(1S,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-(ヒドロキシメチル)-2,5-ジ
オキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート (700 mg)および5'-O-[ビス(4-メトキシフェニル)(フェニル)メチル]-3'-O-[tert-ブチル(ジメチル)シリル]-2'-O-{(2-シアノエトキシ)[ジイソプロピルアミノ]ホスファニル}-N-(2-メチルプロパノイル)グアノシン (2280 mg)を無水アセトニトリルと共沸脱水し、無水アセトニトリル (15 mL)および無水テトラヒドロフラン (5 mL)をそこに加えた。混合物に、5-(エチルスルファニル)-2H-テトラゾール (611 mg) (無水アセトニトリルと共沸脱水したもの)および無水アセト
ニトリル (10 mL)の混合物を加え、混合物をアルゴン雰囲気下、室温で終夜攪拌した。70% tert-ブチル ヒドロペルオキシド (643 μL)をそこに加え、混合物を室温で20分間攪拌した。反応混合物に、チオ硫酸ナトリウム (5920 mg)および水 (3 mL)の混合物を加え、
混合物を減圧下濃縮した。残渣に80% 酢酸 (30 mL)を加え、混合物を室温で20分間攪拌し
た。反応混合物を減圧下濃縮し、残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル)で精製して、標題化合物を得た(980 mg)。MS:[M+H]+ 1030.2
(1R,3R,4R,7S)-3-(6-ベンズアミド-9H-プリン-9-イル)-1-((((((2R,3R,4R,5R)-4-((tert-ブチルジメチルシリル)オキシ)-5-(ヒドロキシメチル)-2-(2-イソブチルアミド-6-オキソ-1H-プリン-9(6H)-イル)テトラヒドロフラン-3-イル)オキシ)(2-シアノエトキシ)ホス
ホリル)オキシ)メチル)-2,5-ジオキサビシクロ[2.2.1]ヘプタン-7-イル 水素 ホスホナート (980 mg)を無水アセトニトリルおよび無水ピリジンと共沸脱水し、無水ピリジン (50 mL)をそこに加えた。混合物に室温で2-クロロ-5,5-ジメチル-1,3,2-ジオキサホスフィナ
ン 2-オキシド (615 mg)を加え、混合物をアルゴン雰囲気下、室温で1時間攪拌した。水 (600 μL)および3H-ベンゾ[c][1,2]ジチオール-3-オン (240 mg)をそこに加え、混合物を室温でさらに30 分間攪拌した。反応混合物にチオ硫酸ナトリウム (1180 mg)および水 (3
mL)の混合物を加え、混合物を減圧下濃縮した。残渣に無水アセトニトリル (15 mL)および2-メチルプロパン-2-アミン (5.0 mL) を加え、混合物を室温で1.5 hr攪拌し、減圧下
濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル)で精製し、得られた残渣に40%メチルアミン エタノール溶液 (30 mL)を加えた。混合物をアルゴン雰囲気下、室温で終夜攪拌し、反応混合物を減圧下濃縮した。残渣をシリカゲルカラムクロマトグラフィー (メタノール/酢酸エチル)で精製した。得られた残渣を、HPLC (L-カラム2 ODS, 50×150 mm, 移動相:5 mM 含水酢酸アンモニウム溶液/アセトニトリル)によ
り、2つのジアステレオマー(tR1およびtR2, LC/MSによる保持時間は、この順で、短い方
から長い方)に分割して、標題化合物(38 mg, tR1)および標題化合物(322 mg, tR2)を得た。 MS (tR1):[M+H]+ 817.1. MS (tR2):[M+H]+ 817.1
メタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル]-1,9-ジヒドロ-6H-プリン-6-オン セスキ-トリエチルアミン塩 (光
学異性体)
2-アミノ-9-[(5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-18-{[tert-ブチル(ジメチル)シリル]オキシ}-2,10-ジヒドロキシ-10-オキシド-2-スルフィ
ドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル]-1,9-ジヒドロ-6H-プリン-6-オン (光学異性体) (38 mg, tR1)に、メタノール (3.0 mL)およびトリエチルアミン トリフッ化水素酸塩 (0.76 mL)を加えた。反応混合物を濃縮してメタノールを除去し、残渣を55℃で1時間攪拌した。混合物を室温まで冷却し、エトキシ(トリメチル)シラン (4.2 mL)をそこに加え、混合物を室温で2時間攪拌した。反応混合物を減圧下濃縮し、残渣をC18カラムクロマトグラフィー (アセトニトリル/10 mM トリエチル酢酸アンモニウム緩衝液)で精製して、標題化合物(27 mg)を得た。 1H NMR (400 MHz, D2O) δ 1.23 (13H, t, J = 7.3 Hz), 3.15 (9H, q, J = 7.3 Hz), 4.04 (1H, d, J = 8.3 Hz), 4.08-4.19 (3H, m), 4.28 (1H, d, J = 12.2 Hz), 4.37-4.52 (2H, m), 4.65 (1H, d, J = 4.2 Hz), 4.90 (1H, d, J = 4.6 Hz), 5.36 (1H, s), 5.55 (1H, td, J = 8.5, 4.0 Hz), 5.98 (1H, d, J =
8.3 Hz), 6.16 (1H, s), 7.94 (1H, s), 8.21 (1H, s), 8.25 (1H, s). 31P NMR (162 MHz, D2O) δ-1.45, 53.78.
,18-ジヒドロキシ-2,10-ジオキシド-2-スルファニルヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル]-1,9-ジヒドロ-6H-プリン-6-オン セスキ-トリエチルアミン塩 (光
学異性体;ペイロード 2)の合成
2-アミノ-9-[(5R,7R,8R,12aR,14R,15R,15aS,18R)-14-(6-アミノ-9H-プリン-9-イル)-18-{[tert-ブチル(ジメチル)シリル]オキシ}-2,10-ジヒドロキシ-10-オキシド-2-スルフィ
ドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-7(12H)-イル]-1,9-ジヒドロ-6H-プリン-6-オン (光学異性体) (322 mg, tR2)に、メタノール (3.0 mL)およびトリエチルアミン ト
リフッ化水素酸塩 (3.2 mL) を加えた。反応混合物を濃縮してメタノールを除去し、残渣を55℃で1時間攪拌した。混合物を室温まで冷却し、エトキシ(トリメチル)シラン (14 mL)をそこに加え、混合物を室温で2時間攪拌した。反応混合物を減圧下濃縮し、残渣をC18
カラムクロマトグラフィー (アセトニトリル/10 mM トリエチル酢酸アンモニウム緩衝液)で精製して、標題化合物(266 mg) を得た。 1H NMR (400 MHz, D2O) δ 1.23 (14H, t, J = 7.3 Hz), 3.15 (10H, q, J = 7.3 Hz), 4.02 (1H, d, J = 8.1 Hz), 4.13-4.24 (2H,
m), 4.27-4.42 (4H, m), 4.59 (1H, d, J = 4.4 Hz), 5.01 (1H, s), 5.11 (1H, d, J =
4.2 Hz), 5.61-5.73 (1H, m), 5.95 (1H, d, J = 8.3 Hz), 6.15 (1H, s), 7.87 (1H, s), 8.00 (1H, s), 8.25 (1H, s). 31P NMR (162 MHz, D2O) δ-1.93, 55.44.
一般的なADCコンジュゲーション手順
抗体溶液は、適切な緩衝剤で所望の反応濃度に希釈した。pHは、0.5 M トリス、25 mM EDTA水溶液(pH 8.0)の添加により、7に調整した。TCEP (2.2 equiv, 5mM in 水)を攪拌しながら加えた。室温での1時間のインキュベーション後、5当量のリンカー-ペイロード (5mM in DMA)を加えた。さらに2時間の室温での緩やかな攪拌後、混合物を3mL spinOUT
脱塩カラム (G-Bioscience, 10mM ヒスチジン、7.5%スクロース (w/v)および0.08%ポリソルベート 20 (w/v)含有緩衝剤で前もってpH 5.2で平衡化されている)で二回精製し、次いで Dulbecco’s PBSと交換した緩衝剤で精製し、Vivaspin6 カラム(GE Healthcare)を用
いて、1~3mg/mLまで濃縮した(標準的なIgG1吸光係数を用いたUV 吸収により測定される)。次いで、サンプルは、質量分析により、QTOF薬物抗体比 (DAR)を特徴づけた。ADCのモ
ノマー組成は、サイズ排除クロマトグラフィー (SEC)で測定した。
サンプル調製
HPLC水をHPLCバイアルに加えることにより、ブランク水を調製する。裸の抗体コントロールおよびADCサンプルは、化学者から入手する。コントロールおよびサンプルは、濃度
が5 mg/mLを超える場合は1XPBSで希釈し、濃度が5 mg/mLまたはそれ以下の場合はそのま
ま注入する。
Agilent 1100 HPLCシステムは分析に使用する。システムは、1ポンプチャンネルのシステム洗浄 (HPLC 水中5%アセトニトリル)および異なるポンプチャンネルの移動相 (上記のように)を備える。使用するカラムは、Tosoh Biosep TSK Gel, G3000SWxl;P/N 8541;250A;5um;7.8mm x 300mmである。流速は1 mL/minに設定され、各流入は、100%移動相 [100 mM
リン酸ナトリウム, 300 mM 塩化ナトリウム, pH 6.8, 10%アセトニトリル (v/v)]で20分間単一組成とする。DADは280 nmに設定する。各コントロール、サンプルおよびブランク
の注入体積は、通常 10μLであるが、UV 吸光度に応じて調整し得る。データ分析: 280nm
における適切な時間内の全てのピーク (通常 2-10分)が積分される。
ADC1の調製
合成は、一般的なADCコンジュゲーション手順に従って行った。
抗体: 抗体 1, 抗GCC抗体 (5F9)、50 mM ヒスチジンおよび100 mM アルギニンの緩衝剤(pH 6.0)中の60 mg/mL溶液の100 μL, 受容体ターゲットグアニル酸シクラーゼ C (GCC)
抗体1 重鎖:
QVQLQQWGAGLLKPSETLSLTCAVFGGSFSGYYWSWIRQPPGKGLEWIGEINHRGNTNDNPSLKSRVTISVDTSKNQFALKLSSVTAADTAVYYCARERGYTYGNFDHWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSジAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ. ID No. 1)
抗体1 軽鎖:
EIVMTQSPATLSVSPGERATLSCRASQSVSRNLAWYQQKPGQAPRLLIYガスTRATGIPARFSGSGSGTEFTLTIGSLQSEDFAVYYCQQYKTWPRTFGQGTNVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ. ID No. 2)
リンカー-ペイロード: N-[(2S)-1-{[(2S)-1-{[4-({[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10,16-ジヒドロキシ-2,10-ジオキシドオクタヒド
ロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラ
デシン-2-イル]スルファニル}メチル)フェニル]アミノ}-1-オキソプロパン-2-イル]アミ
ノ}-3-メチル-1-オキソブタン-2-イル]-6-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-
イル)ヘキサンアミド (リンカー-ペイロード1)
生成物ADC: ADC1, 収率 = 1.9 ml at 2.5 mg/mL (79%), DAR 3.5, 99%モノマー (即ち、
凝集していない)
ADC2の調製
合成は、一般的なADCコンジュゲーション手順に従って行った。
抗体: 抗体 2, 肺および乳房を含む特定の固形腫瘍において発現する膜に固定されたタンパクを対象とする非-GCCターゲッティング抗体、25mM 酢酸ナトリウム中の11.8 mg/mLの100 μL, pH 5.5.
緩衝剤: Dulbecco’s PBS, pH 7.4, 200 μL, 最終濃度 4 mg/mL
リンカー-ペイロード: N-[(2S)-1-{[(2S)-1-{[4-({[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-アミノ-9H-プリン-9-イル)-15-フルオロ-7-(5-フルオロ-4-オキソ-3,4-ジヒドロ-7H-ピロロ[2,3-d]ピリミジン-7-イル)-10,16-ジヒドロキシ-2,10-ジオキシドオクタヒド
ロ-12H-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラ
デシン-2-イル]スルファニル}メチル)フェニル]アミノ}-1-オキソプロパン-2-イル]アミ
ノ}-3-メチル-1-オキソブタン-2-イル]-6-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-
イル)ヘキサンアミド (リンカー-ペイロード1)
生成物ADC: ADC2, 収率 = 0.6 ml at 1.4 mg/mL (70%), DAR 2.6, 99%モノマー
ADC3の調製
合成は、一般的なADCコンジュゲーション手順に従って行った。
抗体: 抗体 1, 50 mM ヒスチジンおよび100 mM アルギニンの緩衝剤(pH 6.0)中の60 mg/mLの33 μL
緩衝剤: 50 mM ヒスチジンおよび100 mM アルギニン (pH 6.0), 66 μL,抗体溶液の最終
濃度 20 mg/mL
リンカー-ペイロード: N-[(2S)-1-{[(2S)-1-{[4-({[(5R,7R,8R,12aR,14R,15R,15aS,18R)-7-(2-アミノ-6-オキソ-1,6-ジヒドロ-9H-プリン-9-イル)-14-(6-アミノ-9H-プリン-9-イル)-10,18-ジヒドロキシ-2,10-ジオキシドヘキサヒドロ-14H-15,12a-(エポキシメタノ)-5,8-メタノフロ[3,2-l][1,3,6,9,11,2,10]ペンタオキサジホスファシクロテトラデシン-2(12H)-イル]スルファニル}メチル)フェニル]アミノ}-1-オキソプロパン-2-イル]アミノ}-3-メチル-1-オキソブタン-2-イル]-6-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)
ヘキサンアミド (リンカー-ペイロード 2)
生成物ADC: ADC3, 収率 = 1.9 ml at 1.0 mg/mL (95%),DAR 4.3, 98%モノマー
トリトソームペイロード放出アッセイ-インビトロのリソソームモデルにおける、リンカーペイロード系またはADC由来のペイロード放出の測定
材料:
緩衝剤: 47.9 mg/mlのリン酸二水素カリウム (Sigma-Aldrich Product Number P5379);
6.8 mg/mlのリン酸水素二ナトリウム(Sigma-Aldrich Product Number S0876), 1.7 mg/mlのエチレンジアミン四酢酸 (Sigma-Aldrich Product Number ED4SS)の精製水溶液。pHは、1N HClまたは1N KOHを用いて、6.0に調整した。
XenoTechから購入したよりラット肝臓トリトソーム
リンカー-ペイロード (10 mM DMSO)
ADC (製造に使用した保存緩衝剤中1-40 μM).
リンカー-ペイロード化合物からのペイロード放出の評価のために、120.95 μMのDMSO
希釈標準溶液を、リンカー-ペイロード化合物の10 mM原液から調製した。次いで、この120.95 μMのDMSO 希釈標準溶液を、22.4%ラット肝臓トリトソームを含む225 μL トリトソーム緩衝液中で、1 μMまで希釈した。
ADC分子の評価のために、1.86 μLのADC溶液を、トリトソーム緩衝剤中のラット肝臓トリトソームの混合物223.1 μLで希釈した。
このように調製した溶液を24時間37℃でインキュベートした。40 μLアリコートを0.5,
1, 3, 5、および24 時間で除去し、96-ウェルプレート上で160 μLの0.1%ギ酸メタノー
ル溶液で希釈し、実験の完了まで、-80℃フリーザーで保存した。最後の時点を回収後、
内部標準溶液であるカルブタミド150 nMを含む、フレッシュな200 μLの0.1%ギ酸メタノ
ール溶液を、サンプルに加えた。サンプルをよく混合し、4000 gで10分間遠心分離し、96-ウェルプレートを、LC/MS/MSによるペイロード濃度の分析用に提出した。
5 μLのサンプルを、Waters Xselect C18 CSH 3.5μ 2.1mmID x 30mm 長カラムを有す
るLC/MS/MSに注入した。0.1%ギ酸水溶液を含む水系溶媒の移動相と、5%水および95%アセ
トニトリル中の0.1%ギ酸を含む有機溶媒の移動相。サンプルを、1.5 mL/min 流速で3 分
間のグラジエントに供した。はじめに、装置は、100%水性移動相溶媒で0.5 分間操作し、次いで、次の1.5 分間で100%有機溶媒まで増加した。系は、追加の0.5 分間100%有機溶媒に保持され、次いで、次の0.5 分間で100%水相溶媒に変化するだろう。
ADCからのリンカー-ペイロードおよびペイロードの放出をモニターおよび計算するた
めに、ピーク面積または濃度VS時間の曲線をプロットした。データをExcel-Fit プログラムを用いて解析し、試験分子からのペイロード形成の線形範囲速度およびt1/2を算出する。
図1、図2および図3に示されるように、上記プロトコルに供した場合、ADC1, ADC2およ
びADC3は、予想していたペイロードを放出する。
mAbs抗体 1 (ADC1およびADC3)および抗体 2 (ADC2)の腫瘍-関連細胞表面ターゲット、
およびHEK293細胞 (HEK293-Vect)を発現しないタ-ゲットを発現するように設計されたHEK293細胞を、1.5 × 10E5細胞/ウェル (500 μL/ウェル)でポリ-D-リジンコート24-ウェ
ルプレート(Corning)に播種し、終夜培養した。終夜血清を除去した後、細胞を、種々の
濃度のADCで6時間処理した後、次いでプロテアーゼおよびホスファターゼ阻害薬(ThermoFisher Scientific)を含むRIPA 緩衝剤(ThermoFisher Scientific)に溶解した。細胞 溶解物を、ホスホ-IRF3 (CST)およびIRF3 (BD Biosciences)用のウエスタンブロット分析に供した。ホスホ-IRF3のレベルを全IRF3に対して標準化した。
図4、図5および図6に示されるように、ADC1、ADC2およびADC3でそれぞれ処理したとき
、ADC1、ADC2およびADC3の表面受容体ターゲットを発現させるHEK293細胞は、STING経路
マーカーであるホスホ-IRF3 (pIRF3)の予想していた増加を示す。逆に、pIRF3 応答は、
対応する表面受容体ターゲットを発現しないベクターHEK293細胞におけるADC処理の時に
は上昇しない。
選択された環状ジヌクレオチドの薬理学的プロファイル
選択された環状ジヌクレオチドの薬理学的プロファイルを表6に示す。
THP1-DualTM細胞 (InvivoGen #thpd-nfis)は、5つのインターフェロン (IFN)-刺激性反応エレメントと結合した、ISG54 (インターフェロンで刺激された遺伝子) 最小のプロモ
ーターのコントロール下での、Luciaルシフェラーゼ遺伝子である、分泌性ルシフェラー
ゼレポーター遺伝子の安定した統合によるヒトTHP-1単球細胞株から由来した。実験当日
、細胞を、黒色の384-ウェルプレート (Corning 356697)に、7500細胞/25 μL/ウェル密
度で、増殖培地 (RPMI 1640, 2 mM L-グルタミン, 25 mM HEPES, 10% 熱不活性化ウシ胎
仔血清, 100 μg/mL NormocinTM, 100 U/mL-100 μg/mL Pen-Strep, 10 μg/mL of ブラ
ストサイジン、および100 μg/mL of Zeocin)中にプレートした。細胞プレートに 62.5 nLの試験化合物を加え、次いで37℃で 20時間インキュベートした。インキュベーション終了時、15 μL/ウェルのQUANTI-LucTM (InvivoGen # rep-qlc1)を加え、LeadSeekerを用いて直ちに発光を測定した。
1.5x106THP-1-Dual細胞 (Invivogen catalog # thpd-nfis)をDMSOまたは示された濃度
のEx14で3時間処理した。刺激後、細胞を氷上で回収し、800 RCFで5分間遠心分離し、氷
冷したPBS中で1回洗浄した。
細胞ペレットを、プロテアーゼおよびホスファターゼ阻害剤カクテル(Sigma # P8340およびCalBiochem # 524629,)を含む、1 % Triton X-100 全細胞溶解緩衝剤 (10%グリセロ
ール, 20 mM Tris-HCl pH 7.5, 150 mM NaCl, 1 μM EDTA、および1 μM DTT)に溶解した。16,000 RCFで10分間遠心分離することにより、細胞溶解物から不溶解片を除去した。溶解物のタンパク濃度は、BSA 標準を用いたBradford アッセイにより測定した。
溶解物を、還元剤としてDTTを含むNuPAGETM LDS サンプル緩衝剤 (4X, catalog # NP0008)中で変性した。変性した溶解物を、MES/SDS ランニング緩衝剤中のNuPAGETM 4-12%ビ
ス-トリスゲル剤上で分割(resolve)し、半乾燥プロット法を用いてPVDF 膜に移した。細
胞シグナル伝達技術由来の抗体 (それぞれ# 5483, # 4947および# 5174)を用いて、ホス
ホ-TBK1 S172, ホスホ-IRF3 S396およびGAPDHのために、膜を終夜4℃でプローブした。
終夜の一次プローブ後、膜を広範囲に洗浄し、次いで、Odyssey (登録商標) ブロッキ
ングバッファー (catalog # 927-400000)中の二次抗体 (Alexa Fluor (登録商標) 680 ヤギ 抗ウサギ IgG, Life Technologies # A21109)を用いて、室温でプローブした。広範な洗浄後、膜をLI-COR ODYSSEY CLxを用いて成長させた。
ホスホ-TBK1およびホスホ-IRF3 バンドの相対強度を定量化し、GAPDHのレベルに対して標準化した。GAPDH-標準化ホスホ-TBK1およびホスホ-IRF3 値を、刺激していない(DMSO) コントロールに対する強度の倍数としてグラフにした。図7参照。
化合物を、ヘパリン化されたヒト血漿中で37℃で0, 1, 2, 4, 8および24 時間インキュベートし、化合物濃度の変化をLC/MS/MS法で測定した。消失速度定数 (=k(/h))を、以下
の濃度の指数関数的減少; 時間における濃度 x = 初期濃度*exp(-k*x) を仮定する近似曲線に基づいて計算した。
Ex14およびEx3aをマウスの同系腫瘍モデルで試験した。Ex14およびEx3aを静脈投与したとき(3日ごとに, 3 回)、抗腫瘍作用が観察された。結腸癌CT-26 同種マウスモデルの抗
腫瘍作用の図8および図9、および結腸癌B16F10 同種マウスモデルの抗腫瘍作用の図10お
よび図11を参照。
8x104B16F10および2x105 CT-26 マウス腫瘍細胞を、雌のC57BL/6 (B16F10)およびBalb/C (CT-26)マウス (n=7 per group)の脇腹に皮下移植した。腫瘍体積が100 mm3に到達したとき(Day 0)、ビヒクル(1xPBS)、化合物 Ex3a (30 mg/kg)またはEx14 (1.0 mg/kg)を担がんマウスに静脈内投与した(最終体積は100 μL)。ビヒクル、Ex3aまたはEx14は、3日ごとに合計3回分投与した(q3dx3)。腫瘍および体重の測定は、それぞれノギスおよびメトラースケールを用いて、1週間に三回行った。腫瘍体積は、腫瘍の短軸に沿って測定した幅 (「W」) の2乗と、腫瘍の短軸に沿って測定した長さ (「L」)の半分の乗算(V = W2 x 0.5L)により決定した。
例5と同様の方法で合成した。
STING結合試験
アッセイバッファ(0.01% 脂肪酸不含のウシ血清アルブミン(和光純薬)を含むDulbecco's Phosphate-Buffered Saline (和光純薬))を用いて、2 μLの被験化合物、4 μLのStreptavidin- Terbium (Cisbio)とFluorescein標識した2',3'-cGAMP (c[G(2',5')p-2'-Fluo-AHC-A(3',5')p]) (Biolog, Germany)、2 μLのビオチン化STINGタンパク(野生型、WT)を混合し、3時間室温で静置した(終濃度は、Streptavidin-Terbium 1/1000希釈、FITC-cGAMP 1 μM、ビオチン化STINGタンパク 100 nM)。EnVision (PerkinElmer, Waltham, MA, US)により、520 nmと486 nmの波長でTime-resolved fluorescence resonance energy transfer (TR-FRET)を測定した。520 nmでのカウントを486 nmでのカウントで割った比を用い
て、被験化合物による野生型STINGタンパクと2',3'-cGAMPとの結合阻害率を算出した。その結果を表2および表2Aに示す。
前記ビオチン化STINGタンパク(野生型(WT))は、以下の方法で作成した。
ECOS(商品名) Competent E.coli BL21(DE3)はニッポンジーンから購入した。アンピ
シリン、カナマイシン、NaCl、Glycerol、isopropylthiogalactoside、(+)-Biotin、Imidazole, SEM Nuclease recombinant, BCA protein assay kitは和光純薬から購入した。Tryptone, Bacto、Yeast Extract, Bacto はDifco Laboratories から、Tris Buffered Saline (TBS) Tablets, pH7.6はタカラバイオから、Lysozyme(Egg White),6x Crystは生化学工業株式会社から、cOmplet(商品名), EDTA-free Protease Inhibitor CocktailはRocheから購入した。Ni-NTA Superflow CartridgeはQIAGEN製、HiLoad 26/60 Superdex 200 pgはGE Healthcare製を使用した。
Multiple Cloning Site を改変した pRSF1b (Novagen) に大腸菌BirAを挿入し、ECOS JM109 に導入して pRH8/FLAG-BirAを構築した。実施例36で後述する方法で構築したpET21HH/His-Avi-SUMO-FLAG-hTMEM173(139-379)(H232R)とAviタグビオチン化用のpRH8/FLAG-BirAをECO(商品名) Competent E.coli BL21(DE3)に同時に形質転換し、His-Avi-SUMO-FLAG-hSTING (139-379, H232R)の発現株を作製した。この発現株を100 μg/L アンピシリン及び50 μg/L カナマイシンを含むLB培地 (10 g/L Tryptone, 5 g/L Yeast Extract, 5 g/L
NaCl)に添加し、30℃で前培養を行った後、同様の抗生物質を含むTB培地 (12 g/L Tryptone, 24 g/L Yeast Extract, 4 mL/L Glycerol, 2.3 g/L KH2PO4, 12.5 g/L K2HPO4)に拡張し、37℃で培養した。培養液の濁度が500 KUに達したところで培養温度を16℃に下げ、0.1 mM isopropylthiogalactosideと50 μM (+)-Biotinを添加し、更に16時間培養した。
培養液を遠心し、得られた菌体をLysis Buffer (50 mM TrisHCl, 150 mM NaCl, 20 mM Imidazole, 1 mg/mL Lysozyme, 5 U/mL SEM Nuclease, recombinant, Complete EDTA-free, pH7.6)に懸濁後、超音波破砕によりタンパクを抽出した。抽出液の塩濃度を300 mM NaClとなるよう試薬を添加し、遠心を経て上清を回収した。得られた上清をWash Buffer (50 mM TrisHCl, 300 mM NaCl, 20 mM Imidazole, pH7.6)で平衡化したNiNTA superflowCartridgeに通し、Wash BufferでCartridgeを洗浄後、Elution Buffer (50 mM TrisHCl, 300
mM NaCl, 250 mM Imidazole, pH7.6)で溶出した。この溶出液をStorage Buffer (50 mM TrisHCl, 150 mM NaCl, pH7.6)で平衡化したHiLoad 26/60 Superdex 200 pgカラムに通し、溶出画分をビオチン化His-Avi-SUMO-FLAG-hSTING (139-379, H232R)として回収した。
タンパク濃度はBCA protein assay kitを用いて測定し、使用まで-80℃で凍結保存した。
することが明らかとなった。
レポータージーンアッセイ
各種プラスミドの作成
(i)ヒト TMEM173 などの発現 Plasmid の構築
ヒトSTING (本明細書中、ヒトTMEM173と称することもある) の大腸菌での発現 Plasmid
は、ヒト TMEM173 cDNA Clone (GeneCopoeia) を鋳型として、変異導入のために Overlap Extension PCR を行なって取得した。まず 2 種類の Primer (5'-CCTGGCCCCAGCTGAGATCTCTG-3' (C-hTMEM(139aa)-F) (SEQ. ID No. 3) 及び5'-GTAAACCCGATCCTTGATGCCAGCACGGT
CACCGGTC-3' (hTMEM173(H232R)-R)) (SEQ. ID No. 4) と 2 種類の Primer (5'-CTGCCCCAGCAGACCGGTGACCGTGCTGGCATCAAG-3' (hTMEM173(H232R)-F) (SEQ. ID No. 5) 及び5'-ATAATAGCGGCCGCTCAAGAGAAATCCGTGCGGAGAGG-3' (hTMEM173-st-Not-R)) (SEQ. ID No. 6) を
用いて PCR を行なった。PCR はPrimeStar MAX DNA Polymerase (タカラバイオ) を用い
てそれぞれ、(1)98℃、1 分の後、(2)98℃、10 秒と72℃、10 秒を 25 回繰り返し、(3)72℃、1 分反応した。さらに得られた断片を鋳型として 2 種類の Primer (C-hTMEM(139aa)-F 及びhTMEM173-st-Not-R) を用いて PCR を行なった。PCR は PrimeStar GXL DNA Polymerase (タカラバイオ) を用いて、(1)98℃、1 分の後、(2)98℃、10 秒と72℃、1.5 分を 35 回繰り返し、(3)72℃、1 分反応した。これを Not I (タカラバイオ) で切断後
、pET21a (Novagen) に His-Avi-SUMO Tag を付加したベクターの Stu I/Not I部位に Ligation High (東洋紡) を用いて挿入し、ECOS JM109 (ニッポンジーン) に導入して pET21HH/His-Avi-SUMO-hTMEM173(139-379)(H232R) を構築した。
さらにこの Plasmid を鋳型として 2 種類の Primer (5'-CGACTACAAGGACGACGATGACAAGGGATCCCTGGCCCCAGCTGAGATCTCTG-3' (C-FLAG-Bam-hTMEM173(139aa)-F) (SEQ. ID No. 7)
及びhTMEM173-st-Not-R) を用いて PCR を行なった。PCR は PrimeStar MAX DNA Polymerase を用いて、(1)98℃、1 分の後、(2)98℃、10 秒と72℃、10 秒を 25 回繰り返し、(3)72℃、1 分反応した。これをNot I で切断後、上記と同様に His-Avi-SUMO Tag を付加した pET21a の Stu I/Not I 部位に Ligation High を用いて挿入し、ECOS JM109 に導
入して pET21HH/His-Avi-SUMO-FLAG-hTMEM173(139-379)(H232R)を構築した。
Reporter Assay のための発現 Plasmid は、上記と同様にヒトTMEM173 cDNA Clone を
鋳型として、変異導入ために Overlap Extension PCR を行なって取得した。まず 2 種類の Primer (5'-GTACCCATACGATGTTCCAGATTACGCTGGATCCGCCACCATGCCCCACTCCAGCCTGCATC-3'
(HA-Bam-ko-hTMEM173-F) (SEQ. ID No. 8) 及びhTMEM173(H232R)-R) と 2 種類の Primer (hTMEM173(H232R)-F 及びhTMEM173-st-Not-R) を用いて PCR を行なった。PCR は PrimeStar MAX DNA Polymerase を用いてそれぞれ、(1)98℃、1 分の後、(2)98℃、10 秒
と72℃、10 秒を 25 回繰り返し、(3)72℃、1 分反応した。さらに得られた断片を鋳型として 2 種類の Primer (5'-ATAATATCTAGAATTCGCCACCATGTACCCATACGATGTTCCAGATTACGC-3'
(Xba-Eco-ko-HA-F) (SEQ. ID No. 9) 及び hTMEM173-st-Not-R) を用いて PCR を行な
った。PCR はPrimeStar GXL DNA Polymerase を用いて、(1)98℃、1 分の後、(2)98℃、10 秒と65℃、 5 秒と72℃、1.5 分を 35 回繰り返し、(3)72℃、1 分反応した。これを Xba I (タカラバイオ) 及び Not I で切断後、pcDNA3.3 (Invitrogen) に Multiple Cloning Site を挿入し薬剤耐性を Zeocin に替えたベクターの Nhe I/Not I部位に Ligation High を用いて挿入し、ECOS JM109 に導入して pcDNA3.3zeo/HA-hTMEM173(H232R)を構築
した。
ヒト 変異型TMEM173 (R232H)を発現するPlasmid は、ヒト TMEM173 cDNA Clone (GeneCopoeia) を鋳型として 2 種類の Primer (5'-TTCCAGATTACGCTGGATCCGCCACCATGCCCCACTCCAGCCTGCATC-3' (Bam-ko-hTEME173v1-F) (SEQ. ID No. 10) 及び5'-CCTCTAGACTCGAGCGGCCGCTCAAGAGAAATCCGTGCGGAGAGG-3' (hTMEM173-st-Not-R2)) (SEQ. ID No. 11) を用いた PCR を行なって構築した。PCR はPrimeStar MAX DNA Polymerase (タカラバイオ) を用いて、(1)98℃、1 分の後、(2)98℃、10 秒と68℃、10 秒を 30 回繰り返し、(3)72℃、1
分反応した。得られた断片は Gibson Assembly (NEB) を用いて、pcDNA3.1(+) (ThermoFischer) に HA-Tag を付加したベクターの Bam HI/Not I 部位に挿入し、ECOS JM109 (ニ
ッポンジーン) に導入して pcDNA3.1HA/HA-hTMEM173v1を構築した。
ヒト 野生型TMEM173 (H232R)を発現する Plasmid は、pcDNA3.3zeo/HA-hTMEM173(H232R) plasmid を鋳型として 2 種類の Primer (5'-GGAGACCCAAGCTGGCTAGCGCCACCATGTACCCATACGATG-3' (Nhe-ko-HA-F) (SEQ. ID No. 12) 及び5'-CCTCTAGACTCGAGCGGCCGCTCAAGAGAAATCCGTGCGGAGAGG-3' (hTMEM173-st-Not-R2)) (SEQ. ID No. 11) を用いた PCR を行なって構築した。PCR はPrimeStar MAX DNA Polymerase を用いて、(1)98℃、1 分の後、(2)98
℃、10 秒と72℃、35 秒を 30 回繰り返し、(3)72℃、1 分反応した。得られた断片は、Gibson Assembly を用いて pcDNA3.1zeo (ThermoFischer) の Nhe I/Not I 部位に挿入し
、ECOS JM109 に導入してpcDNA3.1zeo/HA-hTMEM173(H232R) を構築した。
ホタル Luciferase の発現 Plasmid は、CMV Promoter を Reporter ベクターに挿入して構築した。pcDNA3.1(+) ベクター (Invitrogen) を鋳型として 2 種類の Primer (5'-ATAATAAGATCTGTTGACATTGATTATTGACTAGTTATTAATAG-3' (CMVPro-BglII-F) (SEQ. ID No. 13)
及び5'-ATAATAAAGCTTGAGCTCTGCTTATATAGACCTCCC-3' (CMVPro-HindIII-R)) (SEQ. ID No.
14) を用いた PCR を行なった。PCR はPrimeStar MAX DNA Polymerase を用いて、(1)98℃、1 分の後、(2)98℃、10 秒と68℃、3 秒を 25 回繰り返し、(3)72℃、1 分反応した
。これをBgl II 及び Hind III (タカラバイオ) で切断後、Ligation High (東洋紡) を
用いて pGL4.17 (プロメガ) のBgl II/Hind III 部位に挿入し、ECOS JM109 に導入して pGL4.17/CMV Proを構築した。
pNL[NLucP/ISRE/Hygro]vector (Promega, Fitchburg, WI, US)を導入した293T安定発現細胞株を構築した。この細胞に、pcDNA3.3zeo/HA-hTMEM173(H232R)を、FugeneHD(Promega, Fitchburg, WI, US)を用いてトランスフェクトした。10% ウシ胎児血清を含むDulbecco's Modified Eagle's Medium (DMEM)(和光純薬)を用いて1日培養した。細胞を回収し、セルバンカー1(日本全薬工業株式会社)で凍結保存した。
アッセイ当日、白色384ウェルプレート(Corning, NY, US)に、アッセイバッファ(0.1% 脂肪酸不含のウシ血清アルブミンを含むDMEM)で希釈した被験化合物を10 μL/wellで分注した。凍結細胞を融解し、アッセイバッファに懸濁した細胞を10 μL/well(10000 cells/well)で播種した。37℃、5% CO2環境下で20時間培養した後、20 μL のNanoGlo reagent(Promega, Fitchburg, WI, US)溶液を添加した。5分インキュベートした後、EnVision (PerkinElmer, Waltham, MA, US)を用いて発光を測定した。30 μMの2',3'-cGAMPで処理した細胞でのカウントを100%、溶媒で処理した細胞でのカウントを0%として被験化合物の活性値を算出した。その結果を表3に示す。
かとなった。
pNL[NLucP/ISRE/Hygro]vector (Promega, Fitchburg, WI, US)を導入した293T安定発現細胞株を構築した。ホタルLuciferaseの発現プラスミドとともに、pcDNA3.1zeo/HA-hTMEM173(H232R)またはpcDNA3.1HA/HA-hTMEM173v1を、FugeneHD(Promega, Fitchburg, WI, US)を用いてこの細胞にトランスフェクトした懸濁液を、384ウェルプレート(Corning, NY, US)に播種して2日培養した。培養液を除去した後、アッセイバッファ(50 mM HEPES pH 7.0, 100 mM KCl, 3 mM MgCl2, 85 mM Sucrose, 0.1 mM DTT, 0.2% BSA, 1 mM ATP, 0.1 mM GTP, 10 μg/ml Digitonin)で希釈した被験化合物を15 μL/wellで分注した。37℃、5% CO2環境下で30分間培養した後、アッセイバッファを除去した。10% ウシ胎児血清を含むDulbecco's Modified Eagle's Medium (DMEM)(和光純薬)を20 μL/well添加し、37℃、5% CO2環境下で4時間培養した。Nano-Glo Dual-Luciferase Reporter Assay System (Promega, Fitchburg, WI, US)のプロトコルに基づき、ホタルLuciferaseおよびNanoLuc Luciferase由来の発光シグナルを、EnVision (PerkinElmer, Waltham, MA, US)を用いてそれ
ぞれ測定した。NanoLuc LuciferaseのカウントをホタルLuciferaseのカウントで割った比を計算に用いた。30 μMの2',3'-cGAMPで処理した細胞での比を100%、溶媒で処理した細
胞での比を0%として被験化合物の活性値を算出した。その結果を表4に示す。
ト活性を有することが明らかとなった。
FaDu細胞におけるリン酸化IRF3タンパク検出
ヒト咽頭がん細胞株FaDu細胞 (ATCC)を播種し、播種から1日後に培地を無血清培地に置換した。上記置換後1日培養したあと、細胞に天然型リガンド2',3'-cGAMP (最終濃度30μM) ならびに試験化合物(最終濃度15μMまたは 30μM)を添加した。上記添加から6時間
後に細胞をPBSで洗浄した後、細胞抽出液を調製し、ELISA法またはウェスタンブロッティング法によりリン酸化IRF3タンパクを検出した。試験化合物のIRF3タンパクリン酸化活性は、天然型リガンド2',3'-cGAMPを終濃度30μM添加したサンプルでの値を100%として算出した。その結果を表5に示す。
ニストとしてSTING 下流のシグナルを活性化することが明らかとなった。
製剤例
本開示の化合物を有効成分として含有する医薬は、例えば、次のような処方によって製造することができる。
1.カプセル剤
(1)実施例1で得られた化合物 10mg
(2)ラクトース 90mg
(3)微結晶セルロース 70mg
(4)ステアリン酸マグネシウム 10mg
1カプセル 180mg
上記(1)、(2)および(3)の全量と5mgの(4)を混和した後、顆粒化し、これに残りの(4)を5mg加えて、全体をゼラチンカプセルに封入する。
(1)実施例1で得られた化合物 10mg
(2)ラクトース 35mg
(3)コーンスターチ 150mg
(4)微結晶セルロース 30mg
(5)ステアリン酸マグネシウム 5mg
1錠 230mg
上記(1)、(2)および(3)の全量と20mgの(4)および2.5mgの(5)を混和した後、顆粒化し、この顆粒に残りの(4)を10mgおよび(5)を2.5mg加えて加圧成型し、錠剤とする。
有用であり得る。
しているものではなく、また本明細書に存在する請求項は、本明細書に明確に存在するかしないに関わりなく、全ての実施形態および例証を包含することを意図している、と理解されるべきである
Claims (21)
- R1およびR2が、それぞれ独立してヒドロキシ基またはハロゲン原子である、請求項1の化合物、またはその医薬上許容される塩。
- Lが、-X3-T-Z-Q-;
X3が、-(CH2)o-、
oが、1、2、または3;または
X3が、存在せず;
Tが、ペプチド、または存在せず;
Zが、ペプチド、-NH-、-S-、-O-、NHC(=O)CH 2 CH 2 -、-S(=O) 2 -CH 2 CH 2 -、-C(=O)NHNH-、-C(=O)O-、-C(=O)NH-、-CH- 2 -、-CH 2 CH 2 -、-CH 2 CH 2 CH 2 -、-CH 2 =CH 2 -、-C≡C-、-CH=N-O-、ポリエチレングリコール(PEG)、
(式中、「*」は、抗体又は抗体フラグメントに結合している任意の適用可能な炭素原子、窒素原子、酸素原子、または硫黄原子に対する結合点を示す)
である、請求項1~3のいずれか1項の化合物、またはその医薬上許容される塩。 - B3が、式(B3-A)または式(B3-B):
で示される基;
R13、R14、R15、R16およびR17が、それぞれ独立して水素原子、ハロゲン原子、シアノ基、ニトロ基、置換されていてもよい炭化水素基、置換されていてもよい複素環基、アシル基、置換されていてもよいアミノ基、置換されていてもよいカルバモイル基、置換されていてもよいチオカルバモイル基、置換されていてもよいスルファモイル基、置換されていてもよいヒドロキシ基、置換されていてもよいスルファニル(SH)基、または置換されていてもよいシリル基;
Y11、Y12、Y13、Y14、Y15およびY16が、それぞれ独立してNまたはCR1a;
Z11、Z12、Z13、Z14、Z15およびZ16が、それぞれ独立してNまたはC;
R1aが、水素原子、ハロゲン原子、シアノ基、ニトロ基、置換されていてもよい炭化水素基、置換されていてもよい複素環基、アシル基、置換されていてもよいアミノ基、置換されていてもよいカルバモイル基、置換されていてもよいチオカルバモイル基、置換されていてもよいスルファモイル基、置換されていてもよいヒドロキシ基、置換されていてもよいスルファニル(SH)基、または置換されていてもよいシリル基;
B4が、式(B4-A)または式(B4-B):
で示される基;
R23、R24、R25、R26およびR27が、それぞれ独立して水素原子、ハロゲン原子、シアノ基、ニトロ基、置換されていてもよい炭化水素基、置換されていてもよい複素環基、アシル基、置換されていてもよいアミノ基、置換されていてもよいカルバモイル基、置換されていてもよいチオカルバモイル基、置換されていてもよいスルファモイル基、置換されていてもよいヒドロキシ基、置換されていてもよいスルファニル(SH)基、または置換されていてもよいシリル基;
Y21、Y22、Y23、Y24、Y25およびY26が、それぞれ独立してNまたはCR2a;
Z21、Z22、Z23、Z24、Z25およびZ26が、それぞれ独立してNまたはC;
R2aが、水素原子、ハロゲン原子、シアノ基、ニトロ基、置換されていてもよい炭化水素基、置換されていてもよい複素環基、アシル基、置換されていてもよいアミノ基、置換されていてもよいカルバモイル基、置換されていてもよいチオカルバモイル基、置換されていてもよいスルファモイル基、置換されていてもよいヒドロキシ基、置換されていてもよいスルファニル(SH)基、または置換されていてもよいシリル基
である、請求項1の化合物、またはその医薬上許容される塩。 - R19が、フッ素原子である、請求項11の化合物、またはその医薬上許容される塩。
- R18が、水素またはメチルである、請求項10~12のいずれか1項の化合物、またはその医薬上許容される塩。
- 抗体が、抗GCC抗体である、請求項1~15のいずれか1項の化合物、またはその医薬上許容される塩。
- 抗体が、アミノ酸配列SEQ.ID.No.1を含む重鎖領域を含む抗GCC抗体、またはアミノ酸配列SEQ.ID.No.2を含む軽鎖領域を含む抗GCC抗体である、請求項16の化合物、またはその医薬上許容される塩。
- 請求項1~17のいずれか1項の化合物、またはその医薬上許容される塩、および医薬上許容される賦形剤を含む、医薬組成物。
- 癌の治療に用いるための、請求項18の医薬組成物。
- 式(XL):
CD-L1-R28 (XL)
を有する化合物、またはその医薬上許容される塩であって、式中:
CDは、式(XX)、(XXIV)、(XXVIII)または(XXIX):
R1およびR2は、それぞれ独立してヒドロキシ基、水素、アミノ基、またはハロゲン原子;
B3およびB4は、独立して置換されていてもよい5~14員芳香族複素環基;
X1およびX2は、それぞれ酸素原子;
Q1、Q2、Q3、およびQ4は、それぞれ独立して酸素原子または硫黄原子;
L1は、リンカー;
R28は、-N3、-ONH2、-OH、-NO2、-CHO、-NR29C(=O)CH=CH2、-SH、-S(=O)2(CH=CH2)、-NR29C(=O)CH2Br、-NR29C(=O)CH2I、-C(=O)NHNH2、-CO2H、-NH2、-C≡CH、
からなる群から選ばれ;
R29は、水素またはC1-6アルキル;
R30aおよびR30bは、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれ;および
R31aおよびR31bは、独立して、水素、C1-6アルキル、ハロ、-C(=O)OR29、-NH2、-N(CH3)2、C1-6アルコキシ、-CN、-NO2、および-OHからなる群から選ばれる。 - 式(XLI):
(CD-L2)u-DA (XLI)
を有する化合物、またはその医薬上許容される塩であって、式中:
CDは、式(XX)、(XXIV)、(XXVIII)または(XXIX):
のいずれか1つで示される基;
R1およびR2は、それぞれ独立してヒドロキシ基、水素、アミノ基、またはハロゲン原子;
B3およびB4は、独立して置換されていてもよい5~14員芳香族複素環基;
X1およびX2は、それぞれ酸素原子;
Q1、Q2、Q3、およびQ4は、それぞれ独立して酸素原子または硫黄原子;
L2は、リンカー;または
L2は、存在せず;
DAは、薬物送達剤であり、当該薬物送達剤は、脂質類、ステロイド類、ビタミン類、炭水化物類、タンパク類、ペプチド類、ポリアミン類、ポリエチレングリコール類、またはペプチド模倣体、またはそれらの任意の組み合わせを含む;および
uは、1-1000
である。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016234553 | 2016-12-01 | ||
| JP2016234553 | 2016-12-01 | ||
| JP2017107216A JP2018090562A (ja) | 2016-12-01 | 2017-05-30 | 環状ジヌクレオチド |
| JP2017107216 | 2017-05-30 | ||
| US201762589300P | 2017-11-21 | 2017-11-21 | |
| US62/589,300 | 2017-11-21 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019527462A Division JP6633255B1 (ja) | 2016-12-01 | 2017-12-01 | STING (stimulator of interferon genes)アゴニストとしての環状ジヌクレオチド |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020055860A JP2020055860A (ja) | 2020-04-09 |
| JP7229907B2 true JP7229907B2 (ja) | 2023-02-28 |
Family
ID=66179467
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019527462A Active JP6633255B1 (ja) | 2016-12-01 | 2017-12-01 | STING (stimulator of interferon genes)アゴニストとしての環状ジヌクレオチド |
| JP2019223919A Active JP7229907B2 (ja) | 2016-12-01 | 2019-12-11 | STING (stimulator of interferon genes)アゴニストとしての環状ジヌクレオチド |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019527462A Active JP6633255B1 (ja) | 2016-12-01 | 2017-12-01 | STING (stimulator of interferon genes)アゴニストとしての環状ジヌクレオチド |
Country Status (30)
| Country | Link |
|---|---|
| US (3) | US10980825B2 (ja) |
| EP (2) | EP3512861B1 (ja) |
| JP (2) | JP6633255B1 (ja) |
| KR (1) | KR102640802B1 (ja) |
| CN (1) | CN110325543B (ja) |
| AU (1) | AU2017370004B2 (ja) |
| CA (1) | CA3045762A1 (ja) |
| CL (1) | CL2019001485A1 (ja) |
| CO (1) | CO2019007032A2 (ja) |
| CY (1) | CY1124196T1 (ja) |
| DK (1) | DK3512861T3 (ja) |
| EC (1) | ECSP19046507A (ja) |
| ES (1) | ES2866948T3 (ja) |
| HR (1) | HRP20210726T1 (ja) |
| HU (1) | HUE054450T2 (ja) |
| IL (1) | IL267020B (ja) |
| JO (1) | JOP20170192A1 (ja) |
| LT (1) | LT3512861T (ja) |
| MA (1) | MA46245A (ja) |
| MX (1) | MX2019006397A (ja) |
| MY (1) | MY190460A (ja) |
| PE (1) | PE20210255A1 (ja) |
| PH (1) | PH12019501222A1 (ja) |
| PL (1) | PL3512861T3 (ja) |
| PT (1) | PT3512861T (ja) |
| RS (1) | RS61818B1 (ja) |
| SI (1) | SI3512861T1 (ja) |
| UA (1) | UA126390C2 (ja) |
| WO (1) | WO2018100558A2 (ja) |
| ZA (1) | ZA201904311B (ja) |
Families Citing this family (96)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11453697B1 (en) | 2015-08-13 | 2022-09-27 | Merck Sharp & Dohme Llc | Cyclic di-nucleotide compounds as sting agonists |
| WO2017161349A1 (en) | 2016-03-18 | 2017-09-21 | Immune Sensor, Llc | Cyclic di-nucleotide compounds and methods of use |
| US11033569B2 (en) | 2016-07-06 | 2021-06-15 | Sperovie Biosciences, Inc. | Compounds,Compositions, and methods for the treatment of disease |
| EP3526323B1 (en) | 2016-10-14 | 2023-03-29 | Precision Biosciences, Inc. | Engineered meganucleases specific for recognition sequences in the hepatitis b virus genome |
| JOP20170192A1 (ar) | 2016-12-01 | 2019-01-30 | Takeda Pharmaceuticals Co | داي نوكليوتيد حلقي |
| EP3558324A4 (en) * | 2016-12-20 | 2020-08-05 | Merck Sharp & Dohme Corp. | CYCLIC STING DINUCLEOTID AGONISTS FOR CANCER TREATMENT |
| JP7275031B2 (ja) * | 2017-01-27 | 2023-05-17 | ヤンセン バイオテツク,インコーポレーテツド | Stingアゴニストとしての環状ジヌクレオチド |
| US10933078B2 (en) | 2017-02-21 | 2021-03-02 | Board Of Regents, The University Of Texas System | Cyclic dinucleotides as agonists of stimulator of interferon gene dependent signalling |
| WO2019043634A2 (en) | 2017-08-30 | 2019-03-07 | Beijing Xuanyi Pharmasciences Co., Ltd. | CYCLIC DI-NUCLEOTIDES AS STIMULATORS OF INTERFERON GENE MODULATORS |
| WO2019046511A1 (en) | 2017-08-31 | 2019-03-07 | Sperovie Biosciences, Inc. | COMPOUNDS, COMPOSITIONS AND METHODS FOR THE TREATMENT OF DISEASE |
| US11584774B2 (en) | 2017-09-11 | 2023-02-21 | F-star Therapeutics, Inc. | Compounds, compositions, and methods for the treatment of disease |
| US11707531B2 (en) | 2017-09-11 | 2023-07-25 | F-star Therapeutics, Inc. | Compounds, compositions, and methods for the treatment of disease |
| WO2019084060A1 (en) | 2017-10-24 | 2019-05-02 | Silverback Therapeutics, Inc. | CONJUGATES AND METHODS OF USE FOR THE SELECTIVE DELIVERY OF IMMUNOMODULATORY AGENTS |
| AU2018364708A1 (en) | 2017-11-10 | 2020-05-21 | Takeda Pharmaceutical Company Limited | Sting modulator compounds, and methods of making and using |
| US11685761B2 (en) | 2017-12-20 | 2023-06-27 | Merck Sharp & Dohme Llc | Cyclic di-nucleotide compounds as sting agonists |
| AU2018392213B2 (en) | 2017-12-20 | 2021-03-04 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3' cyclic dinucleotides with phosphonate bond activating the STING adaptor protein |
| JP7098748B2 (ja) | 2017-12-20 | 2022-07-11 | インスティチュート オブ オーガニック ケミストリー アンド バイオケミストリー エーエスシーアール,ヴイ.ヴイ.アイ. | Stingアダプタータンパク質を活性化するホスホン酸結合を有する2’3’環状ジヌクレオチド |
| EP3505188A1 (en) | 2017-12-29 | 2019-07-03 | Invivogen | Pro-cyclic dinucleotide conjugates for cytokine induction |
| CN111788204B (zh) | 2018-02-26 | 2023-05-05 | 吉利德科学公司 | 作为hbv复制抑制剂的取代吡咯嗪化合物 |
| AU2019237508A1 (en) | 2018-03-23 | 2020-10-01 | Lonza Sales Ag | Extracellular vesicles comprising STING-agonist |
| WO2019195181A1 (en) | 2018-04-05 | 2019-10-10 | Gilead Sciences, Inc. | Antibodies and fragments thereof that bind hepatitis b virus protein x |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| TWI818007B (zh) | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| TWI833744B (zh) | 2018-04-06 | 2024-03-01 | 捷克科學院有機化學與生物化學研究所 | 3'3'-環二核苷酸 |
| US11142750B2 (en) | 2018-04-12 | 2021-10-12 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the Hepatitis B virus genome |
| WO2019211799A1 (en) | 2018-05-03 | 2019-11-07 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide |
| WO2020028097A1 (en) | 2018-08-01 | 2020-02-06 | Gilead Sciences, Inc. | Solid forms of (r)-11-(methoxymethyl)-12-(3-methoxypropoxy)-3,3-dimethyl-8-0x0-2,3,8,13b-tetrahydro-1h-pyrido[2,1-a]pyrrolo[1,2-c] phthalazine-7-c arboxylic acid |
| EP3841112A1 (en) | 2018-08-24 | 2021-06-30 | Codiak BioSciences, Inc. | Extracellular vesicles targeting dendritic cells and uses thereof |
| AU2019337051B2 (en) | 2018-09-06 | 2023-11-23 | Daiichi Sankyo Company, Limited | Novel cyclic dinucleotide derivative and antibody-drug conjugate thereof |
| CA3111784A1 (en) | 2018-09-12 | 2020-03-19 | Silverback Therapeutics, Inc. | Methods and compositions for the treatment of disease with immune stimulatory conjugates |
| CN110938104B (zh) | 2018-09-21 | 2024-07-12 | 上海迪诺医药科技有限公司 | 环状二核苷酸类似物、其药物组合物及应用 |
| MX2021003295A (es) | 2018-09-27 | 2021-07-16 | Pf Medicament | Enlazadores basados en sulfomaleimida y sus correspondientes conjugados. |
| US11110106B2 (en) | 2018-10-29 | 2021-09-07 | Venenum Biodesign, LLC | Sting agonists for treating bladder cancer and solid tumors |
| EP3873484B1 (en) | 2018-10-29 | 2023-08-23 | Venenum Biodesign, LLC | Novel sting agonists |
| AU2019373221B2 (en) | 2018-10-31 | 2022-05-26 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds having HPK1 inhibitory activity |
| PE20211655A1 (es) | 2018-10-31 | 2021-08-24 | Gilead Sciences Inc | Compuestos de 6-azabencimidazol sustituidos como inhibidores de hpk1 |
| US20220152078A1 (en) | 2019-03-07 | 2022-05-19 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides and prodrugs thereof |
| CA3129011C (en) | 2019-03-07 | 2023-12-19 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| US11766447B2 (en) | 2019-03-07 | 2023-09-26 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| WO2020191377A1 (en) | 2019-03-21 | 2020-09-24 | Codiak Biosciences, Inc. | Extracellular vesicle conjugates and uses thereof |
| EP3941937A2 (en) | 2019-03-21 | 2022-01-26 | Codiak BioSciences, Inc. | Extracellular vesicles for vaccine delivery |
| EP3941607A1 (en) | 2019-03-21 | 2022-01-26 | Codiak BioSciences, Inc. | Process for preparing extracellular vesicles |
| TW202212339A (zh) | 2019-04-17 | 2022-04-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TWI751516B (zh) | 2019-04-17 | 2022-01-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| WO2020227159A2 (en) | 2019-05-03 | 2020-11-12 | Flagship Pioneering Innovations V, Inc. | Methods of modulating immune activity |
| CN114127082A (zh) | 2019-05-09 | 2022-03-01 | 阿里戈斯治疗公司 | 作为sting调节剂的经修饰的环状二核苷化合物 |
| BR112021022514A2 (pt) | 2019-05-10 | 2022-04-19 | Takeda Pharmaceuticals Co | Conjugados de anticorpo e fármaco |
| US11453681B2 (en) | 2019-05-23 | 2022-09-27 | Gilead Sciences, Inc. | Substituted eneoxindoles and uses thereof |
| CR20210687A (es) | 2019-06-25 | 2022-03-03 | Gilead Sciences Inc | PROTEÍNAS DE FUSIÓN FLT3L-Fc Y MÉTODOS DE USO |
| EP3994158A1 (en) | 2019-07-03 | 2022-05-11 | Codiak BioSciences, Inc. | Extracellular vesicles targeting t cells and uses thereof |
| CN114340680A (zh) | 2019-07-05 | 2022-04-12 | 坦博公司 | 反式环辛烯生物正交剂及在癌症和免疫疗法中的用途 |
| TW202116330A (zh) | 2019-07-09 | 2021-05-01 | 日商武田藥品工業股份有限公司 | Sting 促效劑及檢查點抑制劑之投與 |
| KR20220054794A (ko) * | 2019-07-19 | 2022-05-03 | 이뮨센서 테라퓨틱스, 인코포레이티드 | 항체-sting 작용제 접합체 및 면역요법에서의 이의 용도 |
| WO2021034804A1 (en) | 2019-08-19 | 2021-02-25 | Gilead Sciences, Inc. | Pharmaceutical formulations of tenofovir alafenamide |
| WO2021046426A1 (en) * | 2019-09-06 | 2021-03-11 | Sperovie Biosciences, Inc. | Cyclic dinucleotide sting agonists tethered to a pd-1 or ctla-4 antibodies |
| CA3152488A1 (en) | 2019-09-25 | 2021-04-01 | Codiak Biosciences, Inc. | Combination therapy using extracellular vesicles |
| EP4034247A1 (en) | 2019-09-25 | 2022-08-03 | Codiak BioSciences, Inc. | Sting agonist comprising exosomes for treating neuroimmunological disorders |
| CN114727947A (zh) | 2019-09-25 | 2022-07-08 | 科迪亚克生物科学公司 | 细胞外囊泡组合物 |
| EP4034276A1 (en) | 2019-09-25 | 2022-08-03 | Codiak BioSciences, Inc. | Methods of producing extracellular vesicles |
| EP4037708B1 (en) | 2019-09-30 | 2024-09-18 | Gilead Sciences, Inc. | Hbv vaccines and methods treating hbv |
| AU2020358726A1 (en) | 2019-10-01 | 2022-04-07 | Silverback Therapeutics, Inc. | Combination therapy with immune stimulatory conjugates |
| CN116057068A (zh) | 2019-12-06 | 2023-05-02 | 精密生物科学公司 | 对乙型肝炎病毒基因组中的识别序列具有特异性的优化的工程化大范围核酸酶 |
| JP2023514727A (ja) | 2020-02-21 | 2023-04-07 | シルバーバック セラピューティックス インコーポレイテッド | ネクチン-4抗体コンジュゲートおよびその使用 |
| JPWO2021177438A1 (ja) | 2020-03-06 | 2021-09-10 | ||
| WO2021184017A1 (en) | 2020-03-13 | 2021-09-16 | Codiak Biosciences, Inc. | Extracellular vesicles for treating neurological disorders |
| AU2021236763A1 (en) | 2020-03-20 | 2022-10-06 | Lonza Sales Ag | Extracellular vesicles for therapy |
| AU2021237718B2 (en) | 2020-03-20 | 2023-09-21 | Gilead Sciences, Inc. | Prodrugs of 4'-C-substituted-2-halo-2'-deoxyadenosine nucleosides and methods of making and using the same |
| US20230141284A1 (en) | 2020-04-10 | 2023-05-11 | Ono Pharmaceutical Co., Ltd. | Cancer therapeutic method |
| US20230149560A1 (en) | 2020-04-20 | 2023-05-18 | Massachusetts Institute Of Technology | Lipid compositions for delivery of sting agonist compounds and uses thereof |
| WO2021237100A1 (en) | 2020-05-21 | 2021-11-25 | Codiak Biosciences, Inc. | Methods of targeting extracellular vesicles to lung |
| JP2023532680A (ja) * | 2020-06-24 | 2023-07-31 | サプリーム テクノロジーズ,ベー.フェー. | 改善された治療濃度域を有するサポニン誘導体 |
| WO2021261996A2 (en) * | 2020-06-24 | 2021-12-30 | Sapreme Technologies B.V. | Nhs-based saponin conjugates |
| IL299508A (en) | 2020-07-01 | 2023-02-01 | Ars Pharmaceuticals Inc | Anti-asgr1 antibody conjugates and uses thereof |
| AU2021320236B2 (en) | 2020-08-07 | 2024-10-03 | Gilead Sciences, Inc. | Prodrugs of phosphonamide nucleotide analogues and their pharmaceutical use |
| JP2023537066A (ja) | 2020-08-07 | 2023-08-30 | タンボ・インコーポレイテッド | トランス-シクロオクテン生体直交型薬剤並びに癌及び免疫療法における使用 |
| JPWO2022050300A1 (ja) | 2020-09-02 | 2022-03-10 | ||
| KR20230066019A (ko) * | 2020-09-08 | 2023-05-12 | 더 보드 오브 리젠츠 오브 더 유니버시티 오브 텍사스 시스템 | 다가 sting 활성화 조성물 및 이의 용도 |
| WO2022066883A1 (en) | 2020-09-23 | 2022-03-31 | Codiak Biosciences, Inc. | Extracellular vesicles comprising kras antigens and uses thereof |
| WO2022066928A2 (en) | 2020-09-23 | 2022-03-31 | Codiak Biosciences, Inc. | Process for preparing extracellular vesicles |
| WO2022066898A2 (en) | 2020-09-23 | 2022-03-31 | Codiak Biosciences, Inc. | Methods of producing extracellular vesicles |
| WO2022066934A2 (en) | 2020-09-23 | 2022-03-31 | Codiak Biosciences, Inc. | Process for preparing extracellular vesicles |
| KR102558127B1 (ko) * | 2020-10-23 | 2023-07-24 | 아주대학교산학협력단 | 아릴피페라진 유도체를 유효성분으로 포함하는 인터페론 유전자 자극제 조성물 |
| KR20230106606A (ko) | 2020-11-09 | 2023-07-13 | 다케다 야쿠힌 고교 가부시키가이샤 | 항체 약물 접합체 |
| EP4247385A1 (en) | 2020-11-18 | 2023-09-27 | Takeda Pharmaceutical Company Limited | Administration of sting agonist, checkpoint inhibitors, and radiation |
| TW202348237A (zh) | 2021-05-13 | 2023-12-16 | 美商基利科學股份有限公司 | TLR8調節化合物及抗HBV siRNA療法之組合 |
| TW202313094A (zh) | 2021-05-18 | 2023-04-01 | 美商基利科學股份有限公司 | 使用FLT3L—Fc融合蛋白之方法 |
| CA3222277A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| CA3222439A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| WO2022271677A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| JP2024522594A (ja) | 2021-06-23 | 2024-06-21 | ギリアード サイエンシーズ, インコーポレイテッド | ジアシルグリセロールキナーゼ調節化合物 |
| EP4137499A1 (en) | 2021-08-17 | 2023-02-22 | Ustav organicke chemie a biochemie AV CR, v.v.i. | 7-substituted 7-deazaadenine-containing 2,3 -cyclic dinucleotides |
| WO2023056468A1 (en) | 2021-09-30 | 2023-04-06 | Codiak Biosciences, Inc. | Extracellular vesicle comprising cholesterol tagged sting-agonist |
| KR20240155298A (ko) | 2022-03-02 | 2024-10-28 | 다이이찌 산쿄 가부시키가이샤 | Fc 함유 분자의 제조 방법 |
| AU2023310999A1 (en) | 2022-07-21 | 2025-01-23 | Firefly Bio, Inc. | Glucocorticoid receptor agonists and conjugates thereof |
| TW202417056A (zh) | 2022-08-29 | 2024-05-01 | 日商第一三共股份有限公司 | 包含變異Fc區域的抗體藥物結合物 |
| CN118873678A (zh) * | 2023-01-18 | 2024-11-01 | 泰励生物科技(上海)有限公司 | 抗体偶联药物及其用途 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014179335A1 (en) | 2013-04-29 | 2014-11-06 | Memorial Sloan Kettering Cancer Center | Compositions and methods for altering second messenger signaling |
| WO2014189805A1 (en) | 2013-05-18 | 2014-11-27 | Auro Biotech, Inc. | Compositions and methods for activating "stimulator of interferon gene"-dependent signalling |
| WO2016096174A1 (en) | 2014-12-16 | 2016-06-23 | Invivogen | Fluorinated cyclic dinucleotides for cytokine induction |
| JP2016531842A (ja) | 2013-05-18 | 2016-10-13 | アデュロ バイオテック,インコーポレイテッド | 「インターフェロン遺伝子の刺激因子」依存性シグナル伝達を抑制するための組成物および方法 |
| WO2017027646A1 (en) | 2015-08-13 | 2017-02-16 | Merck Sharp & Dohme Corp. | Cyclic di-nucleotide compounds as sting agonists |
| WO2017075477A1 (en) | 2015-10-28 | 2017-05-04 | Aduro Biotech, Inc. | Compositions and methods for activating "stimulator of interferon gene"-dependent signalling |
| WO2017093933A1 (en) | 2015-12-03 | 2017-06-08 | Glaxosmithkline Intellectual Property Development Limited | Cyclic purine dinucleotides as modulators of sting |
| WO2017161349A1 (en) | 2016-03-18 | 2017-09-21 | Immune Sensor, Llc | Cyclic di-nucleotide compounds and methods of use |
Family Cites Families (80)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| IL90359A0 (en) | 1988-05-26 | 1989-12-15 | University Patents Inc | Nucleoside and polynucleotide thiophosphoramidite and phosphorodithioate compounds and their production |
| GB2257704B (en) | 1991-07-18 | 1995-03-01 | Erba Carlo Spa | Cyclic oligonucleotides phosphorothioates |
| EP2298809A3 (en) | 2001-07-12 | 2012-02-15 | FOOTE, Jefferson | Super humanized antibodies |
| EP2669377A3 (en) | 2003-04-17 | 2015-10-14 | Alnylam Pharmaceuticals Inc. | Modified iRNA agents |
| JPWO2005005450A1 (ja) | 2003-07-15 | 2006-08-24 | 三井化学株式会社 | 環状ビスジヌクレオチドの合成方法 |
| WO2005030186A2 (en) | 2003-07-28 | 2005-04-07 | Univ Maryland | Method for attenuating virulence of microbial pathogens and for inhibiting microbial biofilm formation |
| WO2005087238A2 (en) | 2004-03-15 | 2005-09-22 | Karaolis David K R | Method for stimulating the immune, inflammatory or neuroprotective response |
| US7592326B2 (en) | 2004-03-15 | 2009-09-22 | Karaolis David K R | Method for stimulating the immune, inflammatory or neuroprotective response |
| EP1768998A2 (en) | 2004-04-27 | 2007-04-04 | Alnylam Pharmaceuticals Inc. | Single-stranded and double-stranded oligonucleotides comprising a 2-arylpropyl moiety |
| US20090012038A1 (en) | 2004-10-18 | 2009-01-08 | Spormann Alfred M | Methods for microbial biofilm destruction and interference with microbial cellular physiology |
| EP1782826A1 (en) | 2005-11-08 | 2007-05-09 | GBF Gesellschaft für Biotechnologische Forschung mbH | PQS and c-diGMP and its conjugates as adjuvants and their uses in pharmaceutical compositions |
| US8076303B2 (en) * | 2005-12-13 | 2011-12-13 | Spring Bank Pharmaceuticals, Inc. | Nucleotide and oligonucleotide prodrugs |
| US8034921B2 (en) | 2006-11-21 | 2011-10-11 | Alnylam Pharmaceuticals, Inc. | IRNA agents targeting CCR5 expressing cells and uses thereof |
| WO2009133560A1 (en) | 2008-04-29 | 2009-11-05 | Smart Assays | Non-hydrolyzable and permeable cyclic bis-[nucleotide monophosphate] derivatives and uses thereof |
| EP2448954A1 (en) | 2009-07-01 | 2012-05-09 | Rutgers, The State University of New Jersey | Synthesis of cyclic diguanosine monophosphate and thiophosphate analogs thereof |
| IN2012DN00720A (ja) | 2009-07-06 | 2015-06-19 | Ontorii Inc | |
| IN2012DN02604A (ja) | 2009-10-23 | 2015-09-04 | Millennium Pharm Inc | |
| US8450293B2 (en) | 2010-08-10 | 2013-05-28 | Rutgers, The State University Of New Jersey | Synthesis and characterization of C8 analogs of c-di-GMP |
| CA2856243A1 (en) | 2011-11-18 | 2013-05-23 | Alnylam Pharmaceuticals, Inc. | Rnai agents, compositions and methods of use thereof for treating transthyretin (ttr) associated diseases |
| US9156915B2 (en) | 2012-04-26 | 2015-10-13 | Thomas Jefferson University | Anti-GCC antibody molecules |
| SG10201610251PA (en) | 2012-06-08 | 2017-01-27 | Aduro Biotech | Compositions and methods for cancer immunotherapy |
| US9090646B2 (en) | 2012-12-05 | 2015-07-28 | Rutgers, The State University Of New Jersey | Biotinylated compounds |
| JP6333843B2 (ja) * | 2012-12-13 | 2018-05-30 | アデュロ バイオテック,インコーポレイテッド | 明確な立体化学を有する環状プリンジヌクレオチドを含む組成物ならびにそれらの調製および使用方法 |
| RU2015129030A (ru) | 2012-12-19 | 2017-01-26 | Борд Оф Риджентс, Дзе Юниверсити Оф Техас Систем | Фармацевтическое направленное воздействие на путь передачи сигнала циклических динуклеотидов млекопитающих |
| JP6153116B2 (ja) | 2013-01-09 | 2017-06-28 | 国立大学法人東北大学 | トリアゾール連結型環状ジヌクレオチド類縁体 |
| EP2992000B1 (en) | 2013-05-03 | 2020-07-08 | The Regents of The University of California | Cyclic di-nucleotide induction of type i interferon |
| US9549944B2 (en) * | 2013-05-18 | 2017-01-24 | Aduro Biotech, Inc. | Compositions and methods for inhibiting “stimulator of interferon gene”—dependent signalling |
| EP3027227A4 (en) | 2013-07-31 | 2018-05-23 | Memorial Sloan Kettering Cancer Center | Sting crystals and modulators |
| JP2016538344A (ja) | 2013-11-19 | 2016-12-08 | ザ・ユニバーシティ・オブ・シカゴThe University Of Chicago | 癌処置としてのstingアゴニストの使用 |
| EP3071229A4 (en) | 2013-11-22 | 2017-05-10 | Brock University | Use of fluorinated cyclic dinucleotides as oral vaccine adjuvants |
| ES2692226T3 (es) | 2014-06-04 | 2018-11-30 | Glaxosmithkline Intellectual Property Development Limited | Dinucleótidos cíclicos como moduladores de STING |
| US20170340658A1 (en) | 2014-12-16 | 2017-11-30 | Invivogen | Combined use of a chemotherapeutic agent and a cyclic dinucleotide for cancer treatment |
| US11286402B2 (en) * | 2014-12-22 | 2022-03-29 | Basf Se | Use of a chemical mechanical polishing (CMP) composition for polishing of cobalt and / or cobalt alloy comprising substrates |
| GB201501462D0 (en) | 2015-01-29 | 2015-03-18 | Glaxosmithkline Ip Dev Ltd | Novel compounds |
| JP6692826B2 (ja) * | 2015-03-10 | 2020-05-13 | アドゥロ バイオテック,インク. | 「インターフェロン遺伝子刺激因子」依存性シグナル伝達の活性化のための組成物及び方法 |
| FR3037784B1 (fr) * | 2015-06-29 | 2017-12-15 | Gexfix Sa | Dispositif de fixation externe dynamique d'osteosynthese |
| WO2017011444A1 (en) | 2015-07-13 | 2017-01-19 | The Wistar Institute Of Anatomy And Biology | Methods and compositions for treating b cell cancers |
| TW201717968A (zh) | 2015-07-14 | 2017-06-01 | 春季銀行製藥公司 | 誘導rig-i和其他模式辨識受體之化合物及組成物 |
| CN108025051B (zh) | 2015-07-29 | 2021-12-24 | 诺华股份有限公司 | 包含抗pd-1抗体分子的联合疗法 |
| US20170146519A1 (en) | 2015-11-20 | 2017-05-25 | Oregon Health & Science University | Sting agonists and methods of selecting sting agonists |
| DE212016000029U1 (de) | 2015-12-07 | 2017-07-30 | Opi Vi - Ip Holdco Llc | Zusammensetzungen von Antikörperkonstrukt-Agonist-Konjugaten |
| WO2017106740A1 (en) | 2015-12-16 | 2017-06-22 | Aduro Biotech, Inc. | Methods for identifying inhibitors of "stimulator of interferon gene"-dependent interferon production |
| WO2017123657A1 (en) | 2016-01-11 | 2017-07-20 | Gary Glick | Cyclic dinucleotides for treating conditions associated with sting activity such as cancer |
| EP3402801A1 (en) | 2016-01-11 | 2018-11-21 | Innate Tumor Immunity, Inc. | Cyclic dinucleotides for treating conditions associated with sting activity such as cancer |
| WO2017165506A1 (en) | 2016-03-23 | 2017-09-28 | Academia Sinica | Thin-shell polymeric nanoparticles and uses thereof |
| CA3019628A1 (en) | 2016-04-07 | 2017-10-12 | Glaxosmithkline Intellectual Property Development Limited | Heterocyclic amides useful as protein modulators |
| HRP20220936T1 (hr) | 2016-04-07 | 2022-10-28 | Glaxosmithkline Intellectual Property Development Limited | Heterociklički amidi korisni kao modulatori proteina |
| EP3448393A1 (en) | 2016-04-25 | 2019-03-06 | Invivogen | Novel complexes of immunostimulatory compounds, and uses thereof |
| US10464969B2 (en) | 2016-05-05 | 2019-11-05 | Novartis Ag | Amatoxin derivatives and conjugates thereof as inhibitors of RNA polymerase |
| EP3507367A4 (en) | 2016-07-05 | 2020-03-25 | Aduro BioTech, Inc. | CYCLIC DINUCLEOTID COMPOUNDS WITH INCLUDED NUCLEIC ACIDS AND USES THEREOF |
| US11033569B2 (en) | 2016-07-06 | 2021-06-15 | Sperovie Biosciences, Inc. | Compounds,Compositions, and methods for the treatment of disease |
| WO2018009652A1 (en) | 2016-07-06 | 2018-01-11 | Sperovie Biosciences, Inc. | Compounds, compositions, and methods for the treatment of disease |
| WO2018013887A1 (en) | 2016-07-15 | 2018-01-18 | Sperovie Biosciences, Inc. | Compounds, compositions, and methods for the treatment of disease |
| CA3030830A1 (en) | 2016-07-15 | 2018-01-18 | Sperovie Biosciences, Inc. | Compounds, compositions, and methods for the treatment of disease |
| WO2018045204A1 (en) | 2016-08-31 | 2018-03-08 | Ifm Therapeutics, Inc | Cyclic dinucleotide analogs for treating conditions associated with sting (stimulator of interferon genes) activity |
| US10537590B2 (en) | 2016-09-30 | 2020-01-21 | Boehringer Ingelheim International Gmbh | Cyclic dinucleotide compounds |
| CR20190168A (es) | 2016-10-04 | 2019-05-17 | Merck Sharp & Dohme | Compuestos de benzo[b]tiofeno como agonistas de sting |
| EP3523314A1 (de) | 2016-10-07 | 2019-08-14 | Biolog Life Science Institute Forschungslabor Und Biochemica-Vertrieb GmbH | Benzimidazolhaltige cyclische dinukleotide, verfahren zu deren herstellung und ihre verwendung zur aktivierung von stimulator von interferongenen (sting)-abhängigen signalwegen |
| JOP20170188A1 (ar) | 2016-11-25 | 2019-01-30 | Janssen Biotech Inc | ثنائي النوكليوتيدات الحلقية كمنبهات ستينغ (sting) |
| JOP20170192A1 (ar) | 2016-12-01 | 2019-01-30 | Takeda Pharmaceuticals Co | داي نوكليوتيد حلقي |
| JP2018090562A (ja) * | 2016-12-01 | 2018-06-14 | 武田薬品工業株式会社 | 環状ジヌクレオチド |
| EP3558324A4 (en) | 2016-12-20 | 2020-08-05 | Merck Sharp & Dohme Corp. | CYCLIC STING DINUCLEOTID AGONISTS FOR CANCER TREATMENT |
| JP2020511420A (ja) | 2016-12-20 | 2020-04-16 | メルク・シャープ・アンド・ドーム・コーポレーションMerck Sharp & Dohme Corp. | がんの処置のためのpd−1アンタゴニストと環状ジヌクレオチドstingアゴニストとの組み合わせ |
| WO2018119117A1 (en) | 2016-12-22 | 2018-06-28 | The Regents Of The University Of California | Methods of producing cyclic dinucleotides |
| US20190336615A1 (en) | 2017-01-27 | 2019-11-07 | Silverback Therapeutics, Inc. | Tumor targeting conjugates and methods of use thereof |
| CN110234404A (zh) | 2017-01-27 | 2019-09-13 | 詹森生物科技公司 | 作为sting激动剂的环状二核苷酸 |
| JP7275031B2 (ja) | 2017-01-27 | 2023-05-17 | ヤンセン バイオテツク,インコーポレーテツド | Stingアゴニストとしての環状ジヌクレオチド |
| US20200055883A1 (en) | 2017-02-17 | 2020-02-20 | Eisai R&D Management Co., Ltd. | Cyclic di-nucleotides derivative for the treatment of cancer |
| US10933078B2 (en) | 2017-02-21 | 2021-03-02 | Board Of Regents, The University Of Texas System | Cyclic dinucleotides as agonists of stimulator of interferon gene dependent signalling |
| CN106667914B (zh) | 2017-03-13 | 2022-02-01 | 杭州星鳌生物科技有限公司 | 靶向脂质体-环二核苷酸的组成、制备方法及其在抗肿瘤中的应用 |
| JOP20190218A1 (ar) | 2017-03-22 | 2019-09-22 | Boehringer Ingelheim Int | مركبات ثنائية النيوكليوتيدات حلقية معدلة |
| WO2018198084A1 (en) | 2017-04-27 | 2018-11-01 | Lupin Limited | Cyclic di-nucleotide compounds with tricyclic nucleobases |
| AR113224A1 (es) | 2017-04-28 | 2020-02-19 | Novartis Ag | Conjugados de anticuerpo que comprenden un agonista de sting |
| UY37695A (es) | 2017-04-28 | 2018-11-30 | Novartis Ag | Compuesto dinucleótido cíclico bis 2’-5’-rr-(3’f-a)(3’f-a) y usos del mismo |
| WO2019043634A2 (en) | 2017-08-30 | 2019-03-07 | Beijing Xuanyi Pharmasciences Co., Ltd. | CYCLIC DI-NUCLEOTIDES AS STIMULATORS OF INTERFERON GENE MODULATORS |
| US10953032B2 (en) | 2017-08-31 | 2021-03-23 | Bristol-Myers Squibb Company | Cyclic dinucleotides as anticancer agents |
| CN111032672B (zh) | 2017-08-31 | 2024-09-13 | 百时美施贵宝公司 | 作为抗癌剂的环二核苷酸 |
| EP3681888A4 (en) | 2017-09-15 | 2021-07-07 | Aduro Biotech, Inc. | PYRAZOLOPYRIMIDINONE COMPOUNDS AND THEIR USES |
| KR20230106606A (ko) | 2020-11-09 | 2023-07-13 | 다케다 야쿠힌 고교 가부시키가이샤 | 항체 약물 접합체 |
-
2016
- 2016-12-01 JO JOP/2017/0192A patent/JOP20170192A1/ar unknown
-
2017
- 2017-12-01 AU AU2017370004A patent/AU2017370004B2/en active Active
- 2017-12-01 RS RS20210562A patent/RS61818B1/sr unknown
- 2017-12-01 CA CA3045762A patent/CA3045762A1/en active Pending
- 2017-12-01 LT LTEP17817176.5T patent/LT3512861T/lt unknown
- 2017-12-01 PL PL17817176T patent/PL3512861T3/pl unknown
- 2017-12-01 KR KR1020197019077A patent/KR102640802B1/ko active Active
- 2017-12-01 SI SI201730756T patent/SI3512861T1/sl unknown
- 2017-12-01 MY MYPI2019003124A patent/MY190460A/en unknown
- 2017-12-01 EP EP17817176.5A patent/EP3512861B1/en active Active
- 2017-12-01 MA MA046245A patent/MA46245A/fr unknown
- 2017-12-01 JP JP2019527462A patent/JP6633255B1/ja active Active
- 2017-12-01 UA UAA201907162A patent/UA126390C2/uk unknown
- 2017-12-01 CN CN201780074714.9A patent/CN110325543B/zh active Active
- 2017-12-01 HU HUE17817176A patent/HUE054450T2/hu unknown
- 2017-12-01 EP EP21157239.1A patent/EP3868384A1/en active Pending
- 2017-12-01 ES ES17817176T patent/ES2866948T3/es active Active
- 2017-12-01 WO PCT/IB2017/057588 patent/WO2018100558A2/en active Application Filing
- 2017-12-01 PE PE2019001164A patent/PE20210255A1/es unknown
- 2017-12-01 MX MX2019006397A patent/MX2019006397A/es unknown
- 2017-12-01 PT PT178171765T patent/PT3512861T/pt unknown
- 2017-12-01 DK DK17817176.5T patent/DK3512861T3/da active
-
2018
- 2018-11-09 US US16/185,258 patent/US10980825B2/en active Active
-
2019
- 2019-05-30 IL IL267020A patent/IL267020B/en unknown
- 2019-05-31 CL CL2019001485A patent/CL2019001485A1/es unknown
- 2019-05-31 PH PH12019501222A patent/PH12019501222A1/en unknown
- 2019-06-28 CO CONC2019/0007032A patent/CO2019007032A2/es unknown
- 2019-06-28 ZA ZA2019/04311A patent/ZA201904311B/en unknown
- 2019-06-28 EC ECSENADI201946507A patent/ECSP19046507A/es unknown
- 2019-12-11 JP JP2019223919A patent/JP7229907B2/ja active Active
-
2020
- 2020-10-07 US US17/065,242 patent/US11666594B2/en active Active
-
2021
- 2021-05-06 CY CY20211100384T patent/CY1124196T1/el unknown
- 2021-05-10 HR HRP20210726TT patent/HRP20210726T1/hr unknown
-
2023
- 2023-05-01 US US18/310,467 patent/US12171777B2/en active Active
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014179335A1 (en) | 2013-04-29 | 2014-11-06 | Memorial Sloan Kettering Cancer Center | Compositions and methods for altering second messenger signaling |
| WO2014189805A1 (en) | 2013-05-18 | 2014-11-27 | Auro Biotech, Inc. | Compositions and methods for activating "stimulator of interferon gene"-dependent signalling |
| JP2016520085A (ja) | 2013-05-18 | 2016-07-11 | アドゥロ バイオテック,インク. | 「インターフェロン遺伝子の刺激因子」依存性シグナル伝達を活性化するための組成物及び方法 |
| JP2016531842A (ja) | 2013-05-18 | 2016-10-13 | アデュロ バイオテック,インコーポレイテッド | 「インターフェロン遺伝子の刺激因子」依存性シグナル伝達を抑制するための組成物および方法 |
| WO2016096174A1 (en) | 2014-12-16 | 2016-06-23 | Invivogen | Fluorinated cyclic dinucleotides for cytokine induction |
| WO2017027646A1 (en) | 2015-08-13 | 2017-02-16 | Merck Sharp & Dohme Corp. | Cyclic di-nucleotide compounds as sting agonists |
| WO2017075477A1 (en) | 2015-10-28 | 2017-05-04 | Aduro Biotech, Inc. | Compositions and methods for activating "stimulator of interferon gene"-dependent signalling |
| WO2017093933A1 (en) | 2015-12-03 | 2017-06-08 | Glaxosmithkline Intellectual Property Development Limited | Cyclic purine dinucleotides as modulators of sting |
| WO2017161349A1 (en) | 2016-03-18 | 2017-09-21 | Immune Sensor, Llc | Cyclic di-nucleotide compounds and methods of use |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7229907B2 (ja) | STING (stimulator of interferon genes)アゴニストとしての環状ジヌクレオチド | |
| TWI825170B (zh) | 抗體藥物結合物及其應用及用途 | |
| TW202140044A (zh) | 含有新穎環狀雙核苷酸衍生物之抗體藥物共軛物 | |
| TWI769195B (zh) | 環狀二核苷酸 | |
| TW202144011A (zh) | 治療劑及其結合物 | |
| BR112019011120B1 (pt) | Compostos dinucleotídeos cíclicos, composição e uso relacionados | |
| RU2809547C2 (ru) | Новое производное циклического динуклеотида и его конъюгат антитело-лекарственное средство | |
| RU2836814C1 (ru) | Конъюгат антитело-лекарственное средство, содержащий новое производное циклического динуклеотида | |
| TW202506198A (zh) | 抗體藥物結合物之用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201130 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211214 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220210 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220411 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220809 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221003 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230117 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230215 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7229907 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |