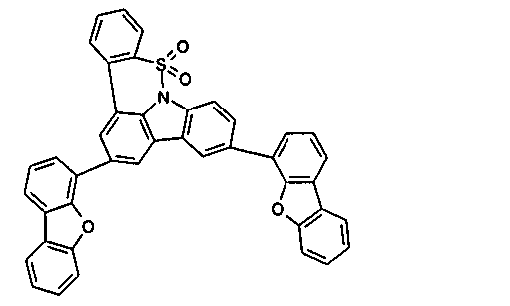
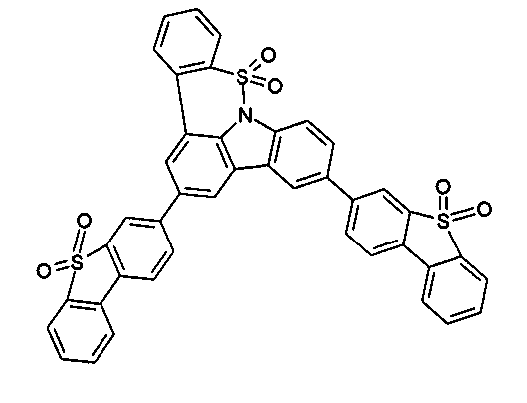
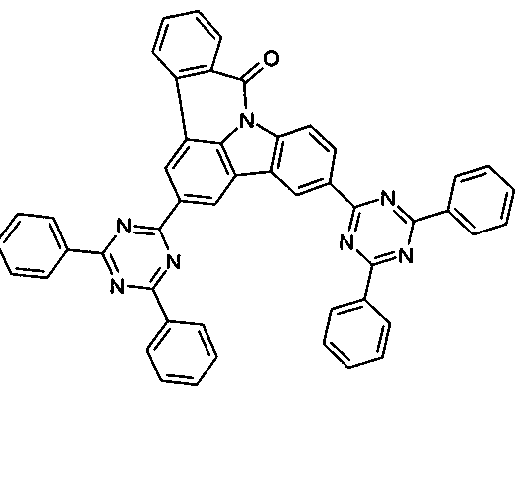
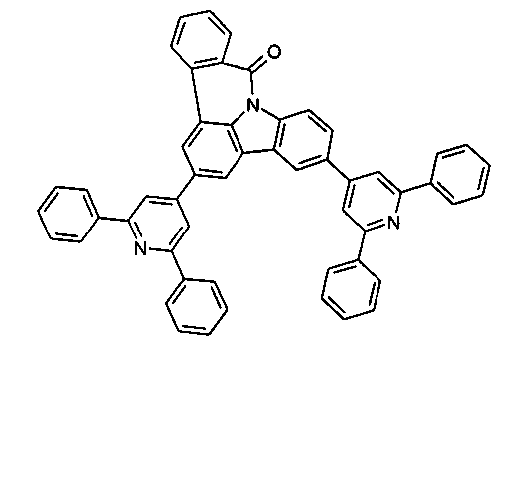
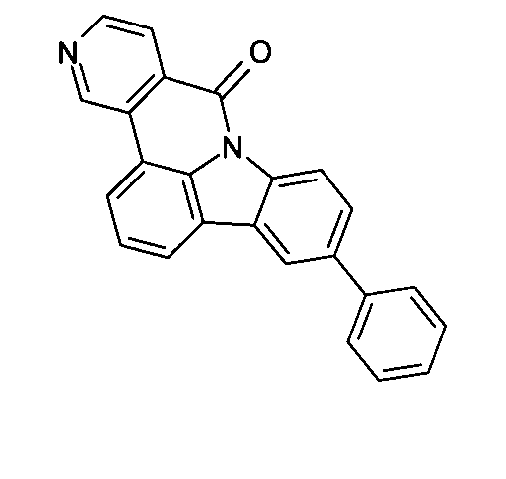
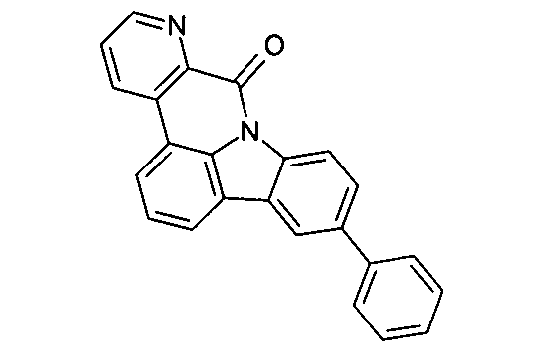
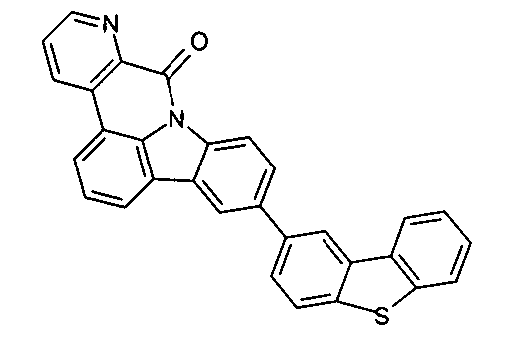
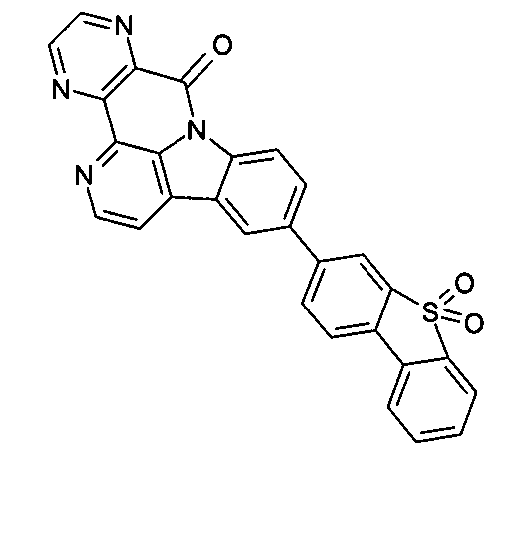
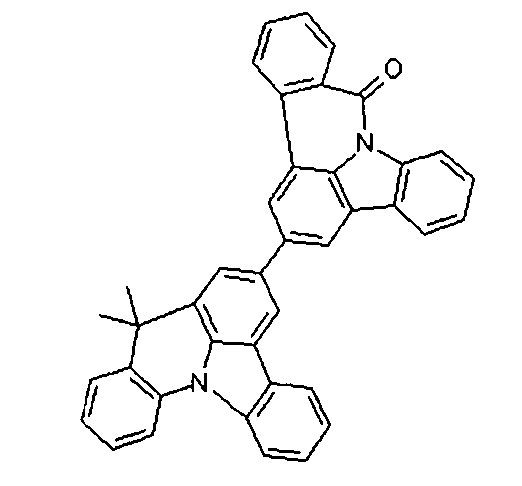
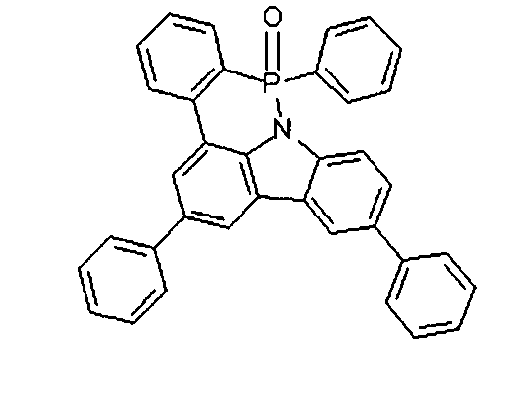
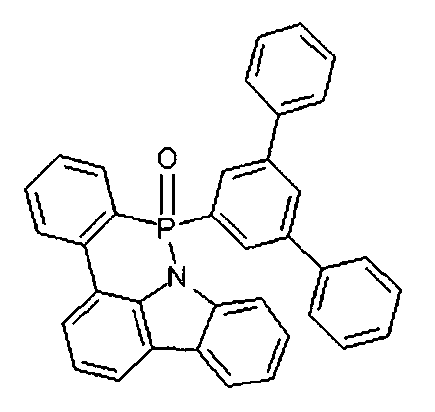
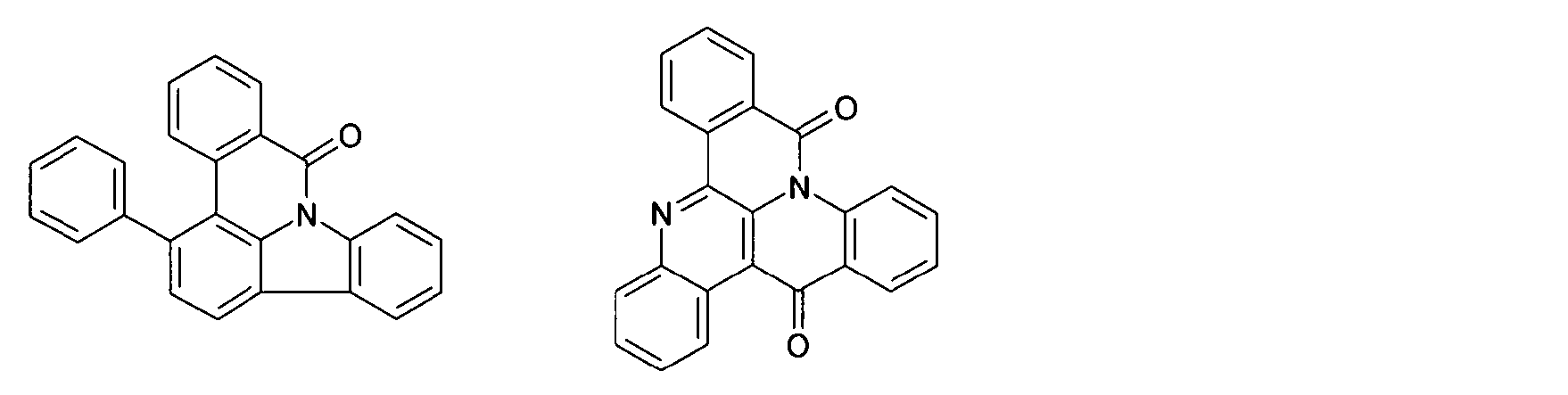
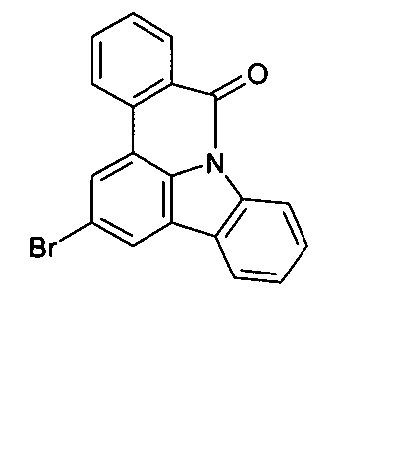
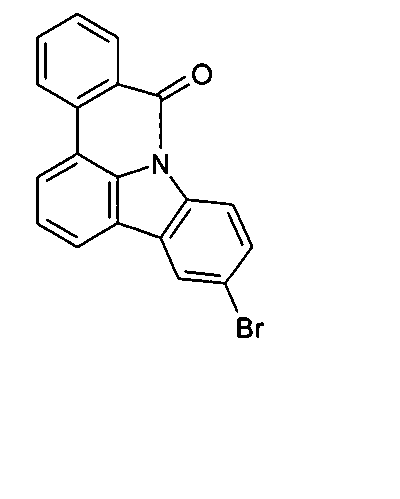
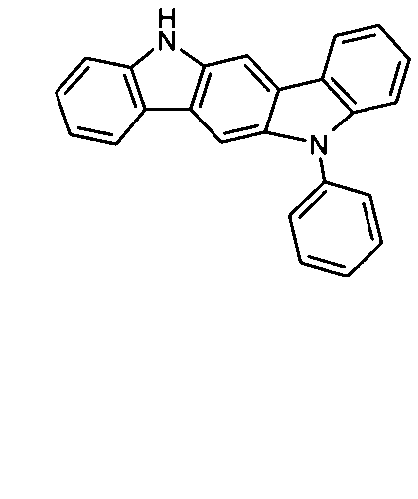
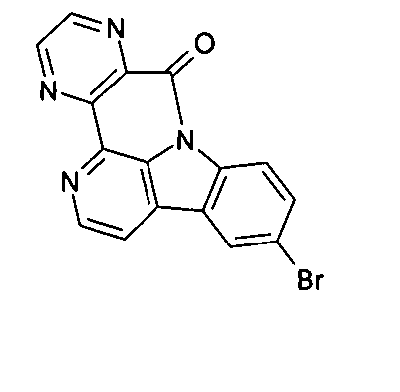
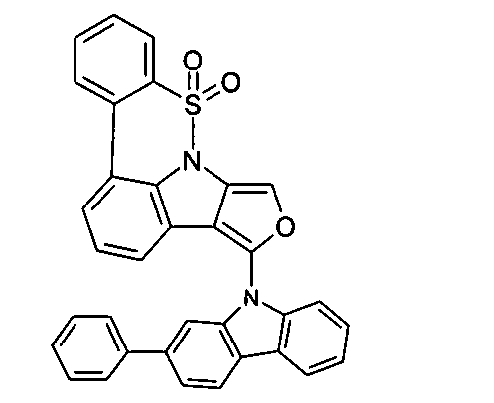
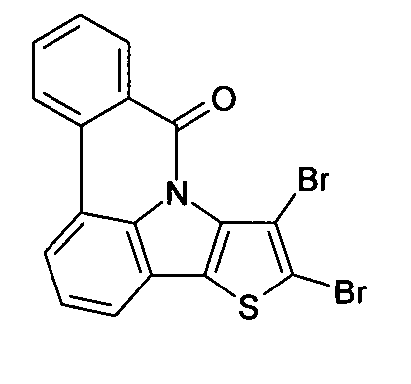
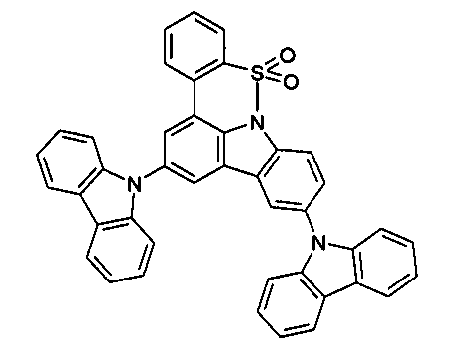
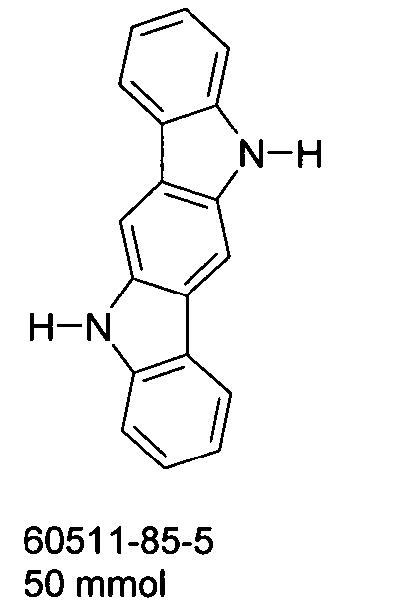
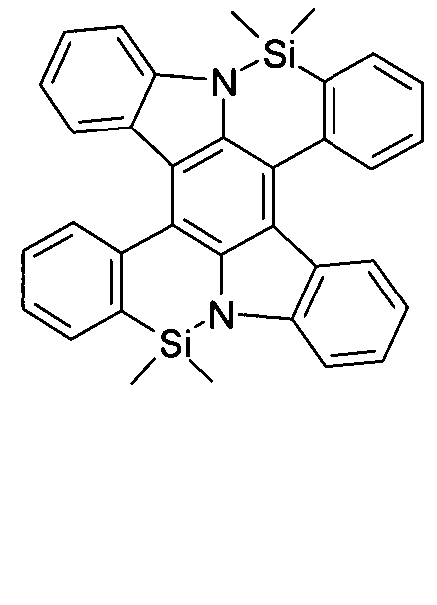
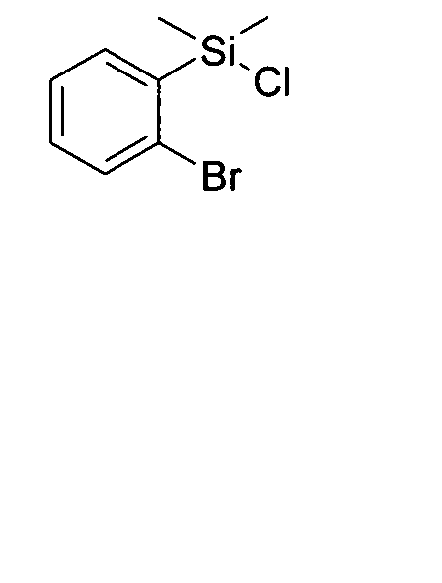
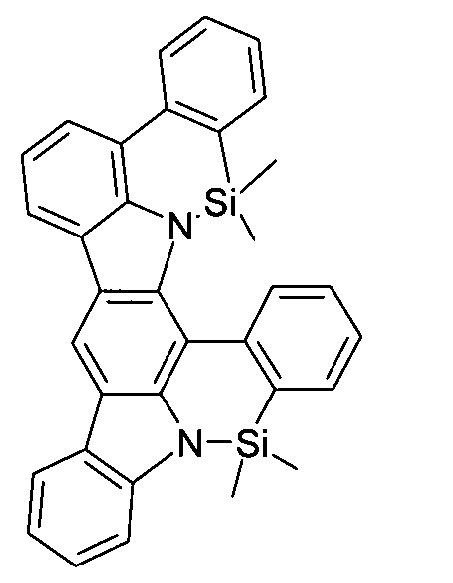
DE102010019306B4 - Organische Elektrolumineszenzvorrichtungen - Google Patents
Organische Elektrolumineszenzvorrichtungen Download PDFInfo
- Publication number
- DE102010019306B4 DE102010019306B4 DE102010019306.2A DE102010019306A DE102010019306B4 DE 102010019306 B4 DE102010019306 B4 DE 102010019306B4 DE 102010019306 A DE102010019306 A DE 102010019306A DE 102010019306 B4 DE102010019306 B4 DE 102010019306B4
- Authority
- DE
- Germany
- Prior art keywords
- formula
- group
- aromatic
- radicals
- substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 125000003118 aryl group Chemical group 0.000 claims abstract description 100
- 150000001875 compounds Chemical group 0.000 claims abstract description 95
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 74
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 58
- 229910052717 sulfur Inorganic materials 0.000 claims abstract description 54
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 53
- 229910052731 fluorine Inorganic materials 0.000 claims abstract description 42
- 229910052801 chlorine Inorganic materials 0.000 claims abstract description 37
- 229910052794 bromium Inorganic materials 0.000 claims abstract description 36
- 229910052740 iodine Inorganic materials 0.000 claims abstract description 32
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 24
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 22
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 22
- 229910052805 deuterium Inorganic materials 0.000 claims abstract description 21
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 18
- 125000004001 thioalkyl group Chemical group 0.000 claims abstract description 18
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 17
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 14
- 125000003367 polycyclic group Chemical group 0.000 claims abstract description 13
- 125000001931 aliphatic group Chemical group 0.000 claims abstract description 12
- 125000002950 monocyclic group Chemical group 0.000 claims abstract description 12
- 229910052698 phosphorus Inorganic materials 0.000 claims abstract description 12
- 125000001424 substituent group Chemical group 0.000 claims abstract description 12
- 125000003342 alkenyl group Chemical group 0.000 claims abstract description 11
- 125000000304 alkynyl group Chemical group 0.000 claims abstract description 11
- 125000006165 cyclic alkyl group Chemical group 0.000 claims abstract description 11
- 125000004104 aryloxy group Chemical group 0.000 claims abstract description 10
- 125000005553 heteroaryloxy group Chemical group 0.000 claims abstract description 10
- 125000004433 nitrogen atom Chemical group N* 0.000 claims abstract description 9
- 125000004437 phosphorous atom Chemical group 0.000 claims abstract description 6
- 239000011159 matrix material Substances 0.000 claims description 32
- -1 NR 2 Inorganic materials 0.000 claims description 26
- 230000000903 blocking effect Effects 0.000 claims description 20
- 230000005525 hole transport Effects 0.000 claims description 10
- 230000003287 optical effect Effects 0.000 claims description 6
- 229910052721 tungsten Inorganic materials 0.000 claims description 5
- 229910052720 vanadium Inorganic materials 0.000 claims description 4
- 230000005669 field effect Effects 0.000 claims description 2
- 108091008695 photoreceptors Proteins 0.000 claims description 2
- 238000010791 quenching Methods 0.000 claims description 2
- 239000010409 thin film Substances 0.000 claims description 2
- 125000000520 N-substituted aminocarbonyl group Chemical group [*]NC(=O)* 0.000 abstract description 3
- 239000010410 layer Substances 0.000 description 80
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 48
- 239000000463 material Substances 0.000 description 43
- 101100533558 Mus musculus Sipa1 gene Proteins 0.000 description 38
- 150000003254 radicals Chemical class 0.000 description 33
- 239000000460 chlorine Substances 0.000 description 30
- 125000004122 cyclic group Chemical group 0.000 description 23
- NAWXUBYGYWOOIX-SFHVURJKSA-N (2s)-2-[[4-[2-(2,4-diaminoquinazolin-6-yl)ethyl]benzoyl]amino]-4-methylidenepentanedioic acid Chemical compound C1=CC2=NC(N)=NC(N)=C2C=C1CCC1=CC=C(C(=O)N[C@@H](CC(=C)C(O)=O)C(O)=O)C=C1 NAWXUBYGYWOOIX-SFHVURJKSA-N 0.000 description 20
- 102100036305 C-C chemokine receptor type 8 Human genes 0.000 description 19
- 101000837299 Euglena gracilis Trans-2-enoyl-CoA reductase Proteins 0.000 description 19
- 101000716063 Homo sapiens C-C chemokine receptor type 8 Proteins 0.000 description 19
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 18
- 101100381920 Arabidopsis thaliana BPA1 gene Proteins 0.000 description 14
- 229920000642 polymer Polymers 0.000 description 14
- 239000000243 solution Substances 0.000 description 13
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 11
- 239000000203 mixture Substances 0.000 description 10
- 238000002347 injection Methods 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 238000000034 method Methods 0.000 description 9
- 239000012074 organic phase Substances 0.000 description 9
- 239000011541 reaction mixture Substances 0.000 description 9
- UJOBWOGCFQCDNV-UHFFFAOYSA-N Carbazole Natural products C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- 150000001716 carbazoles Chemical class 0.000 description 7
- 239000000412 dendrimer Substances 0.000 description 7
- 229920000736 dendritic polymer Polymers 0.000 description 7
- 125000005842 heteroatom Chemical group 0.000 description 7
- 230000006872 improvement Effects 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 239000002019 doping agent Substances 0.000 description 6
- 239000007789 gas Substances 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- 230000001681 protective effect Effects 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 5
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- QYBJUTSQRXNWMP-UHFFFAOYSA-N 3-phenyl-4h-furo[3,4-b]indole Chemical compound C=12NC3=CC=CC=C3C2=COC=1C1=CC=CC=C1 QYBJUTSQRXNWMP-UHFFFAOYSA-N 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 4
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 4
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 4
- 238000007639 printing Methods 0.000 description 4
- 239000011734 sodium Substances 0.000 description 4
- 125000005259 triarylamine group Chemical group 0.000 description 4
- VFTFKUDGYRBSAL-UHFFFAOYSA-N 15-crown-5 Chemical compound C1COCCOCCOCCOCCO1 VFTFKUDGYRBSAL-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 238000006069 Suzuki reaction reaction Methods 0.000 description 3
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 3
- RMBPEFMHABBEKP-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2C3=C[CH]C=CC3=CC2=C1 RMBPEFMHABBEKP-UHFFFAOYSA-N 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- VVVPGLRKXQSQSZ-UHFFFAOYSA-N indolo[3,2-c]carbazole Chemical class C1=CC=CC2=NC3=C4C5=CC=CC=C5N=C4C=CC3=C21 VVVPGLRKXQSQSZ-UHFFFAOYSA-N 0.000 description 3
- 229910052741 iridium Inorganic materials 0.000 description 3
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 3
- 150000002576 ketones Chemical class 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 239000002480 mineral oil Substances 0.000 description 3
- 235000010446 mineral oil Nutrition 0.000 description 3
- 239000000178 monomer Substances 0.000 description 3
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 3
- 230000003647 oxidation Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 3
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 3
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 229930192474 thiophene Natural products 0.000 description 3
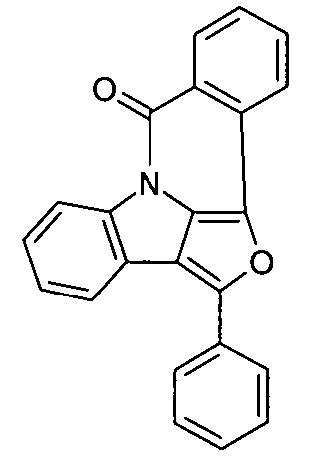
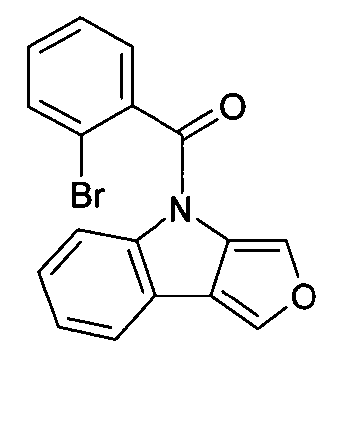
- JSKPHZKTZRJYJN-UHFFFAOYSA-N (2-bromophenyl)-(3-phenylfuro[3,4-b]indol-4-yl)methanone Chemical compound BrC1=CC=CC=C1C(=O)N1C2=C(C=3C=CC=CC=3)OC=C2C2=CC=CC=C21 JSKPHZKTZRJYJN-UHFFFAOYSA-N 0.000 description 2
- ICPSWZFVWAPUKF-UHFFFAOYSA-N 1,1'-spirobi[fluorene] Chemical compound C1=CC=C2C=C3C4(C=5C(C6=CC=CC=C6C=5)=CC=C4)C=CC=C3C2=C1 ICPSWZFVWAPUKF-UHFFFAOYSA-N 0.000 description 2
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 2
- 238000005160 1H NMR spectroscopy Methods 0.000 description 2
- LYTMVABTDYMBQK-UHFFFAOYSA-N 2-benzothiophene Chemical compound C1=CC=CC2=CSC=C21 LYTMVABTDYMBQK-UHFFFAOYSA-N 0.000 description 2
- WLKAKLBTCHRBIR-UHFFFAOYSA-N 4-(benzenesulfonyl)-3-phenylfuro[3,4-b]indole Chemical compound C12=CC=CC=C2C2=COC(C=3C=CC=CC=3)=C2N1S(=O)(=O)C1=CC=CC=C1 WLKAKLBTCHRBIR-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- BPMFPOGUJAAYHL-UHFFFAOYSA-N 9H-Pyrido[2,3-b]indole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=N1 BPMFPOGUJAAYHL-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical group CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 2
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- 235000010290 biphenyl Nutrition 0.000 description 2
- 239000004305 biphenyl Substances 0.000 description 2
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 2
- 150000001642 boronic acid derivatives Chemical class 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical compound C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 2
- 150000004696 coordination complex Chemical class 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 2
- 238000001194 electroluminescence spectrum Methods 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- WUNJCKOTXFSWBK-UHFFFAOYSA-N indeno[2,1-a]carbazole Chemical compound C1=CC=C2C=C3C4=NC5=CC=CC=C5C4=CC=C3C2=C1 WUNJCKOTXFSWBK-UHFFFAOYSA-N 0.000 description 2
- 229960005544 indolocarbazole Drugs 0.000 description 2
- 238000007641 inkjet printing Methods 0.000 description 2
- 229910010272 inorganic material Inorganic materials 0.000 description 2
- 239000011147 inorganic material Substances 0.000 description 2
- 125000002524 organometallic group Chemical group 0.000 description 2
- MPQXHAGKBWFSNV-UHFFFAOYSA-N oxidophosphanium Chemical class [PH3]=O MPQXHAGKBWFSNV-UHFFFAOYSA-N 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- 229950000688 phenothiazine Drugs 0.000 description 2
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 2
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 238000000859 sublimation Methods 0.000 description 2
- 230000008022 sublimation Effects 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 2
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 2
- RONGZXJJMBYJDA-UHFFFAOYSA-N (2-bromophenyl)-chloro-dimethylsilane Chemical compound C[Si](C)(Cl)C1=CC=CC=C1Br RONGZXJJMBYJDA-UHFFFAOYSA-N 0.000 description 1
- YXGNBDOMJCXYGL-UHFFFAOYSA-N (2-bromophenyl)-chloro-diphenylsilane Chemical compound C=1C=CC=CC=1[Si](C=1C(=CC=CC=1)Br)(Cl)C1=CC=CC=C1 YXGNBDOMJCXYGL-UHFFFAOYSA-N 0.000 description 1
- FIARMZDBEGVMLV-UHFFFAOYSA-N 1,1,2,2,2-pentafluoroethanolate Chemical group [O-]C(F)(F)C(F)(F)F FIARMZDBEGVMLV-UHFFFAOYSA-N 0.000 description 1
- HQDYNFWTFJFEPR-UHFFFAOYSA-N 1,2,3,3a-tetrahydropyrene Chemical compound C1=C2CCCC(C=C3)C2=C2C3=CC=CC2=C1 HQDYNFWTFJFEPR-UHFFFAOYSA-N 0.000 description 1
- ZFXBERJDEUDDMX-UHFFFAOYSA-N 1,2,3,5-tetrazine Chemical compound C1=NC=NN=N1 ZFXBERJDEUDDMX-UHFFFAOYSA-N 0.000 description 1
- FNQJDLTXOVEEFB-UHFFFAOYSA-N 1,2,3-benzothiadiazole Chemical compound C1=CC=C2SN=NC2=C1 FNQJDLTXOVEEFB-UHFFFAOYSA-N 0.000 description 1
- UGUHFDPGDQDVGX-UHFFFAOYSA-N 1,2,3-thiadiazole Chemical compound C1=CSN=N1 UGUHFDPGDQDVGX-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- HTJMXYRLEDBSLT-UHFFFAOYSA-N 1,2,4,5-tetrazine Chemical compound C1=NN=CN=N1 HTJMXYRLEDBSLT-UHFFFAOYSA-N 0.000 description 1
- BBVIDBNAYOIXOE-UHFFFAOYSA-N 1,2,4-oxadiazole Chemical compound C=1N=CON=1 BBVIDBNAYOIXOE-UHFFFAOYSA-N 0.000 description 1
- YGTAZGSLCXNBQL-UHFFFAOYSA-N 1,2,4-thiadiazole Chemical compound C=1N=CSN=1 YGTAZGSLCXNBQL-UHFFFAOYSA-N 0.000 description 1
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 1
- UDGKZGLPXCRRAM-UHFFFAOYSA-N 1,2,5-thiadiazole Chemical compound C=1C=NSN=1 UDGKZGLPXCRRAM-UHFFFAOYSA-N 0.000 description 1
- DXBHBZVCASKNBY-UHFFFAOYSA-N 1,2-Benz(a)anthracene Chemical compound C1=CC=C2C3=CC4=CC=CC=C4C=C3C=CC2=C1 DXBHBZVCASKNBY-UHFFFAOYSA-N 0.000 description 1
- WQONPSCCEXUXTQ-UHFFFAOYSA-N 1,2-dibromobenzene Chemical compound BrC1=CC=CC=C1Br WQONPSCCEXUXTQ-UHFFFAOYSA-N 0.000 description 1
- UUSUFQUCLACDTA-UHFFFAOYSA-N 1,2-dihydropyrene Chemical compound C1=CC=C2C=CC3=CCCC4=CC=C1C2=C43 UUSUFQUCLACDTA-UHFFFAOYSA-N 0.000 description 1
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical compound C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 1
- MBIZXFATKUQOOA-UHFFFAOYSA-N 1,3,4-thiadiazole Chemical compound C1=NN=CS1 MBIZXFATKUQOOA-UHFFFAOYSA-N 0.000 description 1
- JIHQDMXYYFUGFV-UHFFFAOYSA-N 1,3,5-triazine Chemical compound C1=NC=NC=N1 JIHQDMXYYFUGFV-UHFFFAOYSA-N 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 1
- AZUYLZMQTIKGSC-UHFFFAOYSA-N 1-[6-[4-(5-chloro-6-methyl-1H-indazol-4-yl)-5-methyl-3-(1-methylindazol-5-yl)pyrazol-1-yl]-2-azaspiro[3.3]heptan-2-yl]prop-2-en-1-one Chemical compound ClC=1C(=C2C=NNC2=CC=1C)C=1C(=NN(C=1C)C1CC2(CN(C2)C(C=C)=O)C1)C=1C=C2C=NN(C2=CC=1)C AZUYLZMQTIKGSC-UHFFFAOYSA-N 0.000 description 1
- DRKHIWKXLZCAKP-UHFFFAOYSA-N 1-bromo-2-(2-bromophenyl)benzene Chemical group BrC1=CC=CC=C1C1=CC=CC=C1Br DRKHIWKXLZCAKP-UHFFFAOYSA-N 0.000 description 1
- IENOQUQIVSMWGP-UHFFFAOYSA-N 12-phenyl-11h-indolo[2,3-a]carbazole Chemical compound C1=CC=CC=C1N1C2=C3NC4=CC=CC=C4C3=CC=C2C2=CC=CC=C21 IENOQUQIVSMWGP-UHFFFAOYSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- AGSGBXQHMGBCBO-UHFFFAOYSA-N 1H-diazasilole Chemical compound N1C=C[SiH]=N1 AGSGBXQHMGBCBO-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- LPHIYKWSEYTCLW-UHFFFAOYSA-N 1h-azaborole Chemical class N1B=CC=C1 LPHIYKWSEYTCLW-UHFFFAOYSA-N 0.000 description 1
- USYCQABRSUEURP-UHFFFAOYSA-N 1h-benzo[f]benzimidazole Chemical compound C1=CC=C2C=C(NC=N3)C3=CC2=C1 USYCQABRSUEURP-UHFFFAOYSA-N 0.000 description 1
- IGHOZKDBCCFNNC-UHFFFAOYSA-N 1h-imidazole;quinoxaline Chemical compound C1=CNC=N1.N1=CC=NC2=CC=CC=C21 IGHOZKDBCCFNNC-UHFFFAOYSA-N 0.000 description 1
- 125000004793 2,2,2-trifluoroethoxy group Chemical group FC(CO*)(F)F 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- UPUWMQZUXFAUCJ-UHFFFAOYSA-N 2,5-dihydro-1,2-thiazole Chemical compound C1SNC=C1 UPUWMQZUXFAUCJ-UHFFFAOYSA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- VFPWGZNNRSQPBT-UHFFFAOYSA-N 2-bromobenzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=CC=C1Br VFPWGZNNRSQPBT-UHFFFAOYSA-N 0.000 description 1
- NZCKTGCKFJDGFD-UHFFFAOYSA-N 2-bromobenzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1Br NZCKTGCKFJDGFD-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- RSEBUVRVKCANEP-UHFFFAOYSA-N 2-pyrroline Chemical compound C1CC=CN1 RSEBUVRVKCANEP-UHFFFAOYSA-N 0.000 description 1
- DMEVMYSQZPJFOK-UHFFFAOYSA-N 3,4,5,6,9,10-hexazatetracyclo[12.4.0.02,7.08,13]octadeca-1(18),2(7),3,5,8(13),9,11,14,16-nonaene Chemical group N1=NN=C2C3=CC=CC=C3C3=CC=NN=C3C2=N1 DMEVMYSQZPJFOK-UHFFFAOYSA-N 0.000 description 1
- CPDDXQJCPYHULE-UHFFFAOYSA-N 4,5,14,16-tetrazapentacyclo[9.7.1.12,6.015,19.010,20]icosa-1(18),2,4,6,8,10(20),11(19),12,14,16-decaene Chemical group C1=CC(C2=CC=CC=3C2=C2C=NN=3)=C3C2=CC=NC3=N1 CPDDXQJCPYHULE-UHFFFAOYSA-N 0.000 description 1
- MDUFDYLJAKVKGE-UHFFFAOYSA-N 4-(2-bromophenyl)sulfonyl-3-phenylfuro[3,4-b]indole Chemical compound BrC1=CC=CC=C1S(=O)(=O)N1C2=C(C=3C=CC=CC=3)OC=C2C2=CC=CC=C21 MDUFDYLJAKVKGE-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- IUKNPBPXZUWMNO-UHFFFAOYSA-N 5,12-diazatetracyclo[6.6.2.04,16.011,15]hexadeca-1(15),2,4,6,8(16),9,11,13-octaene Chemical compound N1=CC=C2C=CC3=NC=CC4=CC=C1C2=C43 IUKNPBPXZUWMNO-UHFFFAOYSA-N 0.000 description 1
- NHWJSCHQRMCCAD-UHFFFAOYSA-N 5,14-diazatetracyclo[6.6.2.04,16.011,15]hexadeca-1(14),2,4,6,8(16),9,11(15),12-octaene Chemical compound C1=CN=C2C=CC3=NC=CC4=CC=C1C2=C43 NHWJSCHQRMCCAD-UHFFFAOYSA-N 0.000 description 1
- PODJSIAAYWCBDV-UHFFFAOYSA-N 5,6-diazatetracyclo[6.6.2.04,16.011,15]hexadeca-1(14),2,4(16),5,7,9,11(15),12-octaene Chemical compound C1=NN=C2C=CC3=CC=CC4=CC=C1C2=C43 PODJSIAAYWCBDV-UHFFFAOYSA-N 0.000 description 1
- OSMYQRSZCAVUTM-UHFFFAOYSA-N 5-amino-7b-azabenzo[e]acephenanthrylen-8-one Chemical compound C12=CC(N)=CC=C1N1C(=O)C3=CC=CC=C3C3=C1C2=CC=C3 OSMYQRSZCAVUTM-UHFFFAOYSA-N 0.000 description 1
- 125000004070 6 membered heterocyclic group Chemical group 0.000 description 1
- YNQTWUKZCHPALP-UHFFFAOYSA-N 7,9-dimethyl-5-phenyl-7h-indeno[2,1-b]carbazole Chemical compound C1=C2C(C)C3=CC(C)=CC=C3C2=CC(C2=CC=CC=C22)=C1N2C1=CC=CC=C1 YNQTWUKZCHPALP-UHFFFAOYSA-N 0.000 description 1
- SNFCXVRWFNAHQX-UHFFFAOYSA-N 9,9'-spirobi[fluorene] Chemical compound C12=CC=CC=C2C2=CC=CC=C2C21C1=CC=CC=C1C1=CC=CC=C21 SNFCXVRWFNAHQX-UHFFFAOYSA-N 0.000 description 1
- 239000005964 Acibenzolar-S-methyl Substances 0.000 description 1
- FMMWHPNWAFZXNH-UHFFFAOYSA-N Benz[a]pyrene Chemical compound C1=C2C3=CC=CC=C3C=C(C=C3)C2=C2C3=CC=CC2=C1 FMMWHPNWAFZXNH-UHFFFAOYSA-N 0.000 description 1
- 238000007125 Buchwald synthesis reaction Methods 0.000 description 1
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 1
- ZPIPUFJBRZFYKJ-UHFFFAOYSA-N C1=NC=C2C=CC3=CN=CC4=CC=C1C2=C34 Chemical compound C1=NC=C2C=CC3=CN=CC4=CC=C1C2=C34 ZPIPUFJBRZFYKJ-UHFFFAOYSA-N 0.000 description 1
- OUUBHFGEOFOKCI-UHFFFAOYSA-N CC1(C)c(c2c(cc3)c(cccc4)c4[n]2-c(cc2-c4c5cccc4)cc(c4c6cccc4)c2[n]6C5=O)c3-c2ccccc12 Chemical compound CC1(C)c(c2c(cc3)c(cccc4)c4[n]2-c(cc2-c4c5cccc4)cc(c4c6cccc4)c2[n]6C5=O)c3-c2ccccc12 OUUBHFGEOFOKCI-UHFFFAOYSA-N 0.000 description 1
- UAVZDBIKIOWDQF-UHFFFAOYSA-N CC1(C)c(cc2[nH]c3ccccc3c2c2)c2-c2c1cccc2 Chemical compound CC1(C)c(cc2[nH]c3ccccc3c2c2)c2-c2c1cccc2 UAVZDBIKIOWDQF-UHFFFAOYSA-N 0.000 description 1
- XVUKKHWXQPJSDG-UHFFFAOYSA-N C[Si]1(C)[n](c2ccccc2c2c3-c(cccc4)c4[Si+](C)(C)[n]4c3c3c5c4cccc5)c2c3-c2c1cccc2 Chemical compound C[Si]1(C)[n](c2ccccc2c2c3-c(cccc4)c4[Si+](C)(C)[n]4c3c3c5c4cccc5)c2c3-c2c1cccc2 XVUKKHWXQPJSDG-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- TYEZTCNUTPNLAQ-UHFFFAOYSA-N Cc([o]nc1-c2cccc3c2[n]2c4c3cccc4)c1C2=O Chemical compound Cc([o]nc1-c2cccc3c2[n]2c4c3cccc4)c1C2=O TYEZTCNUTPNLAQ-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- 101000801643 Homo sapiens Retinal-specific phospholipid-transporting ATPase ABCA4 Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- VGFNYPLESIGMST-UHFFFAOYSA-N Nc(cc1)c(c(cccc2)c2[n]23)c2c1-c(cccc1)c1C3=O Chemical compound Nc(cc1)c(c(cccc2)c2[n]23)c2c1-c(cccc1)c1C3=O VGFNYPLESIGMST-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- BKPPTHNMBPDUJR-UHFFFAOYSA-N O=C(C(C1)c2c(-c3ccccc3)[s]c(Br)c2-2)c3ccccc3-c3c1c-2ccc3 Chemical compound O=C(C(C1)c2c(-c3ccccc3)[s]c(Br)c2-2)c3ccccc3-c3c1c-2ccc3 BKPPTHNMBPDUJR-UHFFFAOYSA-N 0.000 description 1
- JZQRBJPWITYNIU-UHFFFAOYSA-N O=C(c(cccc1)c1-c1cc(-[n]2c3ccccc3c3ccccc23)c2)N(C3C=CC=CC33)c1c2N3c1ccccc1 Chemical compound O=C(c(cccc1)c1-c1cc(-[n]2c3ccccc3c3ccccc23)c2)N(C3C=CC=CC33)c1c2N3c1ccccc1 JZQRBJPWITYNIU-UHFFFAOYSA-N 0.000 description 1
- OVNMBLCFGWFISM-UHFFFAOYSA-N O=C(c(cccc1)c1Br)[n]1c2ccccc2c2c(-c3ccccc3)[o]cc12 Chemical compound O=C(c(cccc1)c1Br)[n]1c2ccccc2c2c(-c3ccccc3)[o]cc12 OVNMBLCFGWFISM-UHFFFAOYSA-N 0.000 description 1
- ULUQBISTQBFZGV-UHFFFAOYSA-N O=C(c1c-2cccc1)[n]1c3c-2[o]c(-c2ccccc2)c3c2c1cccc2 Chemical compound O=C(c1c-2cccc1)[n]1c3c-2[o]c(-c2ccccc2)c3c2c1cccc2 ULUQBISTQBFZGV-UHFFFAOYSA-N 0.000 description 1
- SCDKADXTODALLU-UHFFFAOYSA-N O=C(c1ccccc1)[n](c(cccc1)c1c1cc2nc3ccccc3nc22)c1c2Cl Chemical compound O=C(c1ccccc1)[n](c(cccc1)c1c1cc2nc3ccccc3nc22)c1c2Cl SCDKADXTODALLU-UHFFFAOYSA-N 0.000 description 1
- KZIMGUQPSLWCGH-UHFFFAOYSA-N O=C(c1ccccc1-c1c(cc2)-c(cc3)cc4c3[s]c3c4cccc3)[n]3c1c2c(cc1)c3cc1-c1ccc2[s]c(cccc3)c3c2c1 Chemical compound O=C(c1ccccc1-c1c(cc2)-c(cc3)cc4c3[s]c3c4cccc3)[n]3c1c2c(cc1)c3cc1-c1ccc2[s]c(cccc3)c3c2c1 KZIMGUQPSLWCGH-UHFFFAOYSA-N 0.000 description 1
- DQCUAWPCUIKVTB-UHFFFAOYSA-N O=C(c1ccccc1-c1ncc2)[n]3c1c2c1cc(-c2ccccc2)ccc31 Chemical compound O=C(c1ccccc1-c1ncc2)[n]3c1c2c1cc(-c2ccccc2)ccc31 DQCUAWPCUIKVTB-UHFFFAOYSA-N 0.000 description 1
- NXDOXAYBIDVNFR-UHFFFAOYSA-N O=C1N(c(ccc(-c(cc2)cc(c3c4cccc3)c2[n]4-c2ccccc2)c2)c2Sc2cc(-c(cc3)cc(c4ccccc44)c3[n]4-c3ccccc3)c3)c2c3-c2ccccc12 Chemical compound O=C1N(c(ccc(-c(cc2)cc(c3c4cccc3)c2[n]4-c2ccccc2)c2)c2Sc2cc(-c(cc3)cc(c4ccccc44)c3[n]4-c3ccccc3)c3)c2c3-c2ccccc12 NXDOXAYBIDVNFR-UHFFFAOYSA-N 0.000 description 1
- PJTYMQFTQXSYLE-UHFFFAOYSA-N O=C1[n](c(ccc(-c(cc2)cc3c2[s]c2c3cccc2)c2)c2c2ccc3)c2c3-c2cccnc12 Chemical compound O=C1[n](c(ccc(-c(cc2)cc3c2[s]c2c3cccc2)c2)c2c2ccc3)c2c3-c2cccnc12 PJTYMQFTQXSYLE-UHFFFAOYSA-N 0.000 description 1
- SHKINCUZQGICNQ-UHFFFAOYSA-N O=C1[n](c(ccc(-c2cc(-c3ccccc3)nc(-c3ccccc3)c2)c2)c2c2cc(-c3cc(-c4ccccc4)nc(-c4ccccc4)c3)c3)c2c3-c2ccccc12 Chemical compound O=C1[n](c(ccc(-c2cc(-c3ccccc3)nc(-c3ccccc3)c2)c2)c2c2cc(-c3cc(-c4ccccc4)nc(-c4ccccc4)c3)c3)c2c3-c2ccccc12 SHKINCUZQGICNQ-UHFFFAOYSA-N 0.000 description 1
- DWYQFSFQCSIMDD-UHFFFAOYSA-N O=C1[n](c(ccc(-c2ncccc2)c2)c2c2cc(-c3ncccc3)c3)c2c3-c2c1cccc2 Chemical compound O=C1[n](c(ccc(-c2ncccc2)c2)c2c2cc(-c3ncccc3)c3)c2c3-c2c1cccc2 DWYQFSFQCSIMDD-UHFFFAOYSA-N 0.000 description 1
- ZAWSPRXHMBXAGX-UHFFFAOYSA-N O=C1[n](c(cccc2)c2c2ccc3)c2c3-c2c1cccc2 Chemical compound O=C1[n](c(cccc2)c2c2ccc3)c2c3-c2c1cccc2 ZAWSPRXHMBXAGX-UHFFFAOYSA-N 0.000 description 1
- ANZHIDVDFVJVLC-UHFFFAOYSA-N O=C1[n](c2c(-c3ccccc3)[o]c(-c3ccccc3)c2c2ccc3)c2c3-c2ccccc12 Chemical compound O=C1[n](c2c(-c3ccccc3)[o]c(-c3ccccc3)c2c2ccc3)c2c3-c2ccccc12 ANZHIDVDFVJVLC-UHFFFAOYSA-N 0.000 description 1
- LXHLCJVRSLAJEJ-UHFFFAOYSA-N O=C1[n](c2c(-c3ccccc3)[o]c(Br)c2c2ccc3)c2c3-c2c1cccc2 Chemical compound O=C1[n](c2c(-c3ccccc3)[o]c(Br)c2c2ccc3)c2c3-c2c1cccc2 LXHLCJVRSLAJEJ-UHFFFAOYSA-N 0.000 description 1
- NNOHCYQSYOYKIW-UHFFFAOYSA-N O=C1[n](c2c(c3ccc4)[s]c(Br)c2)c3c4-c2ccccc12 Chemical compound O=C1[n](c2c(c3ccc4)[s]c(Br)c2)c3c4-c2ccccc12 NNOHCYQSYOYKIW-UHFFFAOYSA-N 0.000 description 1
- ZIEVJYXPMAYIOQ-UHFFFAOYSA-N O=S(c1ccccc1-c1c(cc2)-c3c4[o]c(cccc5)c5c4ccc3)([n]3c1c2c(cc1)c3cc1-c1cccc2c1[o]c1ccccc21)=O Chemical compound O=S(c1ccccc1-c1c(cc2)-c3c4[o]c(cccc5)c5c4ccc3)([n]3c1c2c(cc1)c3cc1-c1cccc2c1[o]c1ccccc21)=O ZIEVJYXPMAYIOQ-UHFFFAOYSA-N 0.000 description 1
- PHOSTPUZKMNNCO-UHFFFAOYSA-N O=S1([n](c(cc(c(c2c3cccc2)c2)[n]3-c3ccccc3)c2c2cc(-c3ccccc3)c3)c2c3-c2ccccc12)=O Chemical compound O=S1([n](c(cc(c(c2c3cccc2)c2)[n]3-c3ccccc3)c2c2cc(-c3ccccc3)c3)c2c3-c2ccccc12)=O PHOSTPUZKMNNCO-UHFFFAOYSA-N 0.000 description 1
- HNVAOLYTRRQDDO-UHFFFAOYSA-N O=S1([n](c(ccc(-c2ccccc2)c2)c2c2cc(-c3ccccc3)c3)c2c3-c2c1cc(-c1ccccc1)[s]2)=O Chemical compound O=S1([n](c(ccc(-c2ccccc2)c2)c2c2cc(-c3ccccc3)c3)c2c3-c2c1cc(-c1ccccc1)[s]2)=O HNVAOLYTRRQDDO-UHFFFAOYSA-N 0.000 description 1
- WLRSRBSXRYAPII-UHFFFAOYSA-N O=S1([n](c(ccc(-c2nccnc2)c2)c2c2cc(-c3cnccn3)c3)c2c3-c2ccccc12)=O Chemical compound O=S1([n](c(ccc(-c2nccnc2)c2)c2c2cc(-c3cnccn3)c3)c2c3-c2ccccc12)=O WLRSRBSXRYAPII-UHFFFAOYSA-N 0.000 description 1
- OMTFIEVCPNQOEH-UHFFFAOYSA-N O=S1([n](c(cccc2)c2c2ccc3)c2c3-c2c1cccn2)=O Chemical compound O=S1([n](c(cccc2)c2c2ccc3)c2c3-c2c1cccn2)=O OMTFIEVCPNQOEH-UHFFFAOYSA-N 0.000 description 1
- SVYIYQKRDAJKPH-UHFFFAOYSA-L O[Sc](C1)(c2ccccc2-c2cc(Br)cc3c2[n]1c1ccccc31)O Chemical compound O[Sc](C1)(c2ccccc2-c2cc(Br)cc3c2[n]1c1ccccc31)O SVYIYQKRDAJKPH-UHFFFAOYSA-L 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- 102100033617 Retinal-specific phospholipid-transporting ATPase ABCA4 Human genes 0.000 description 1
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical compound C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 description 1
- SLGBZMMZGDRARJ-UHFFFAOYSA-N Triphenylene Natural products C1=CC=C2C3=CC=CC=C3C3=CC=CC=C3C2=C1 SLGBZMMZGDRARJ-UHFFFAOYSA-N 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- ZYNHZTIMNJKVLK-UHFFFAOYSA-N [O-][N+](c1ccc2[nH]c(cccc3)c3c2c1)=O Chemical compound [O-][N+](c1ccc2[nH]c(cccc3)c3c2c1)=O ZYNHZTIMNJKVLK-UHFFFAOYSA-N 0.000 description 1
- KYIKRXIYLAGAKQ-UHFFFAOYSA-N abcn Chemical compound C1CCCCC1(C#N)N=NC1(C#N)CCCCC1 KYIKRXIYLAGAKQ-UHFFFAOYSA-N 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 150000001336 alkenes Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000008365 aromatic ketones Chemical class 0.000 description 1
- 150000001543 aryl boronic acids Chemical class 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- WMUIZUWOEIQJEH-UHFFFAOYSA-N benzo[e][1,3]benzoxazole Chemical compound C1=CC=C2C(N=CO3)=C3C=CC2=C1 WMUIZUWOEIQJEH-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 1
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 125000005620 boronic acid group Chemical group 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- ZDQZOXLKGHAVLL-UHFFFAOYSA-N c(cc1)cc2c1[nH]c1c2c(cncc2)c2[s]1 Chemical compound c(cc1)cc2c1[nH]c1c2c(cncc2)c2[s]1 ZDQZOXLKGHAVLL-UHFFFAOYSA-N 0.000 description 1
- HNYXVLLKDRNVOM-UHFFFAOYSA-N c(cc1)ccc1-c1nc(-c(cc23)ccc2-c2ccccc2C32[n](c(cccc3)c3c3ccc4)c3c4-c3ccccc23)nc(-c2ccccc2)n1 Chemical compound c(cc1)ccc1-c1nc(-c(cc23)ccc2-c2ccccc2C32[n](c(cccc3)c3c3ccc4)c3c4-c3ccccc23)nc(-c2ccccc2)n1 HNYXVLLKDRNVOM-UHFFFAOYSA-N 0.000 description 1
- QXJJQWWVWRCVQT-UHFFFAOYSA-K calcium;sodium;phosphate Chemical compound [Na+].[Ca+2].[O-]P([O-])([O-])=O QXJJQWWVWRCVQT-UHFFFAOYSA-K 0.000 description 1
- 239000012159 carrier gas Substances 0.000 description 1
- XGRJZXREYAXTGV-UHFFFAOYSA-N chlorodiphenylphosphine Chemical class C=1C=CC=CC=1P(Cl)C1=CC=CC=C1 XGRJZXREYAXTGV-UHFFFAOYSA-N 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 229940125877 compound 31 Drugs 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 150000001879 copper Chemical class 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 125000005266 diarylamine group Chemical group 0.000 description 1
- 150000001987 diarylethers Chemical class 0.000 description 1
- 150000007858 diazaphosphole derivatives Chemical class 0.000 description 1
- OSXYHAQZDCICNX-UHFFFAOYSA-N dichloro(diphenyl)silane Chemical compound C=1C=CC=CC=1[Si](Cl)(Cl)C1=CC=CC=C1 OSXYHAQZDCICNX-UHFFFAOYSA-N 0.000 description 1
- XXPBFNVKTVJZKF-UHFFFAOYSA-N dihydrophenanthrene Natural products C1=CC=C2CCC3=CC=CC=C3C2=C1 XXPBFNVKTVJZKF-UHFFFAOYSA-N 0.000 description 1
- 238000005401 electroluminescence Methods 0.000 description 1
- 239000012039 electrophile Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 238000007306 functionalization reaction Methods 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 150000002367 halogens Chemical group 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- PJULCNAVAGQLAT-UHFFFAOYSA-N indeno[2,1-a]fluorene Chemical class C1=CC=C2C=C3C4=CC5=CC=CC=C5C4=CC=C3C2=C1 PJULCNAVAGQLAT-UHFFFAOYSA-N 0.000 description 1
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 1
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 1
- 239000011229 interlayer Substances 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical group II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- KNVVMNKJHCIPRV-UHFFFAOYSA-M lithium;3-hydroxyquinoline-2-carboxylate Chemical compound [Li+].C1=CC=C2N=C(C([O-])=O)C(O)=CC2=C1 KNVVMNKJHCIPRV-UHFFFAOYSA-M 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 239000008204 material by function Substances 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005244 neohexyl group Chemical group [H]C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 238000007645 offset printing Methods 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 150000002902 organometallic compounds Chemical class 0.000 description 1
- 229910052762 osmium Inorganic materials 0.000 description 1
- SYQBFIAQOQZEGI-UHFFFAOYSA-N osmium atom Chemical compound [Os] SYQBFIAQOQZEGI-UHFFFAOYSA-N 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 150000002921 oxetanes Chemical group 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 150000002987 phenanthrenes Chemical class 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- LEVJVKGPFAQPOI-UHFFFAOYSA-N phenylmethanone Chemical compound O=[C]C1=CC=CC=C1 LEVJVKGPFAQPOI-UHFFFAOYSA-N 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- GDISDVBCNPLSDU-UHFFFAOYSA-N pyrido[2,3-g]quinoline Chemical compound C1=CC=NC2=CC3=CC=CN=C3C=C21 GDISDVBCNPLSDU-UHFFFAOYSA-N 0.000 description 1
- ZVJHJDDKYZXRJI-UHFFFAOYSA-N pyrroline Natural products C1CC=NC1 ZVJHJDDKYZXRJI-UHFFFAOYSA-N 0.000 description 1
- 230000005610 quantum mechanics Effects 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- WUAPFZMCVAUBPE-UHFFFAOYSA-N rhenium atom Chemical compound [Re] WUAPFZMCVAUBPE-UHFFFAOYSA-N 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 239000010948 rhodium Substances 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 150000004756 silanes Chemical class 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000005092 sublimation method Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 238000001931 thermography Methods 0.000 description 1
- 150000003577 thiophenes Chemical class 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000010023 transfer printing Methods 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- DBGVGMSCBYYSLD-UHFFFAOYSA-N tributylstannane Chemical compound CCCC[SnH](CCCC)CCCC DBGVGMSCBYYSLD-UHFFFAOYSA-N 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 125000005580 triphenylene group Chemical group 0.000 description 1
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 1
- 235000019798 tripotassium phosphate Nutrition 0.000 description 1
- YGPLLMPPZRUGTJ-UHFFFAOYSA-N truxene Chemical compound C1C2=CC=CC=C2C(C2=C3C4=CC=CC=C4C2)=C1C1=C3CC2=CC=CC=C21 YGPLLMPPZRUGTJ-UHFFFAOYSA-N 0.000 description 1
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 1
- 239000010937 tungsten Substances 0.000 description 1
- 238000007738 vacuum evaporation Methods 0.000 description 1
- 238000002061 vacuum sublimation Methods 0.000 description 1
- 238000009834 vaporization Methods 0.000 description 1
- 238000001947 vapour-phase growth Methods 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/16—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/22—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed systems contains four or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains three hetero rings
- C07D495/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains three hetero rings
- C07D513/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains three hetero rings
- C07D513/16—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F13/00—Compounds containing elements of Groups 7 or 17 of the Periodic Table
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic Table
- C07F5/02—Boron compounds
- C07F5/025—Boronic and borinic acid compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/10—Compounds having one or more C—Si linkages containing nitrogen having a Si-N linkage
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/12—Organo silicon halides
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B17/00—Azine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B21/00—Thiazine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/40—Organosilicon compounds, e.g. TIPS pentacene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1088—Heterocyclic compounds characterised by ligands containing oxygen as the only heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1092—Heterocyclic compounds characterised by ligands containing sulfur as the only heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/18—Carrier blocking layers
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Electroluminescent Light Sources (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
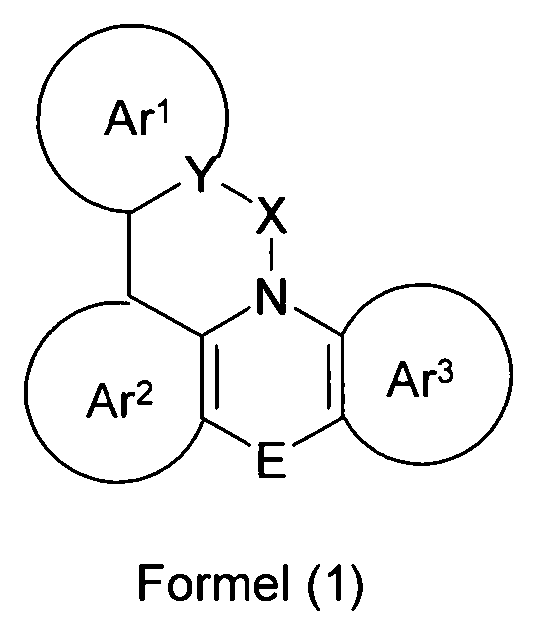
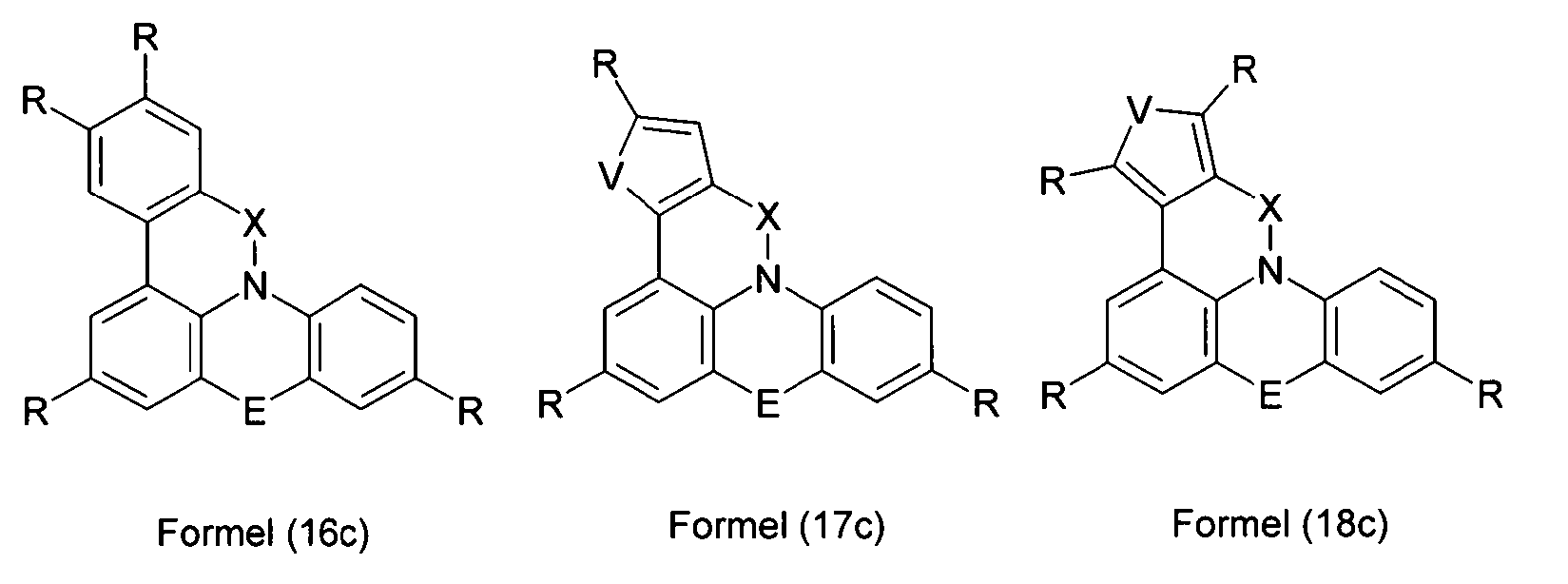
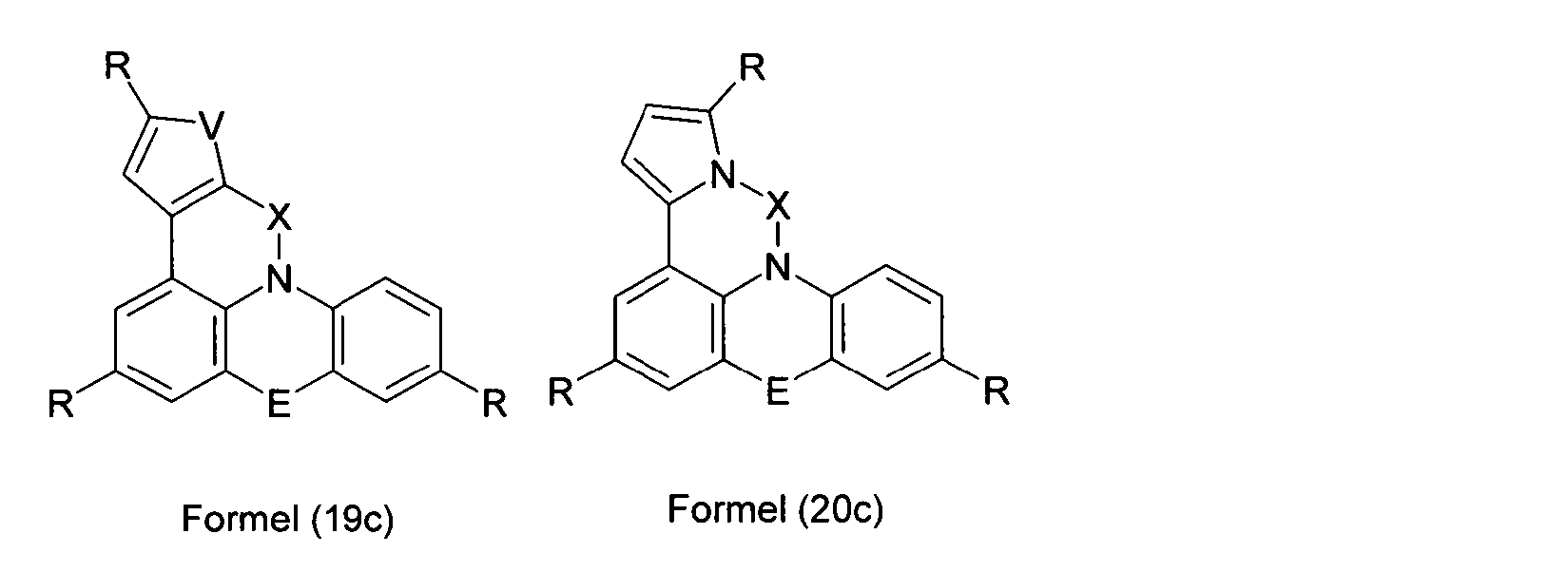
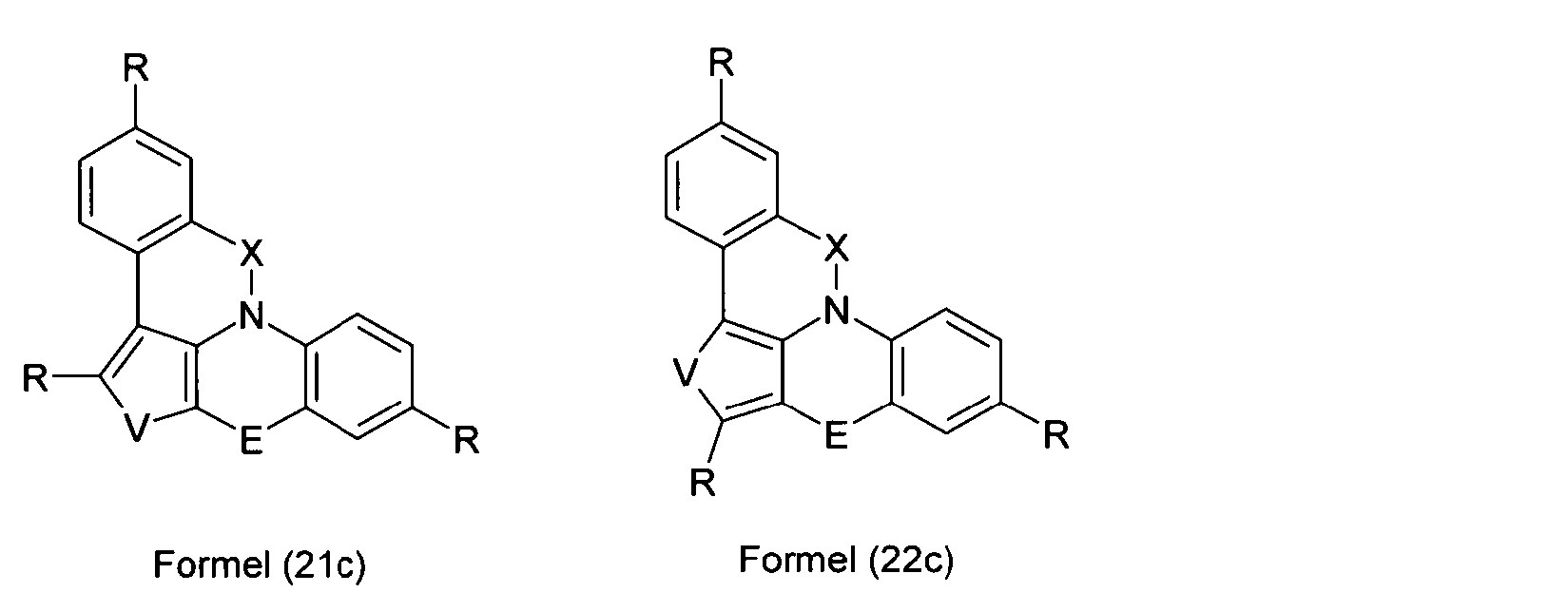
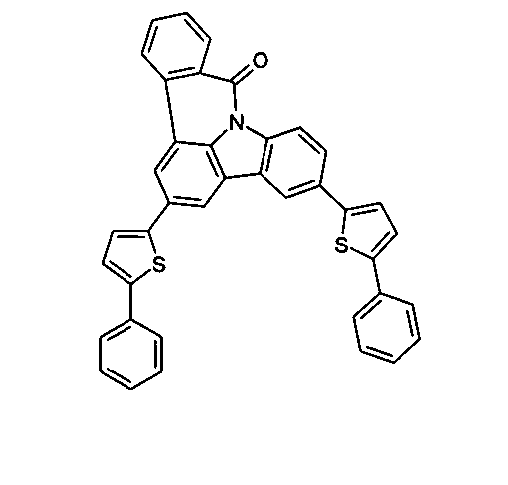
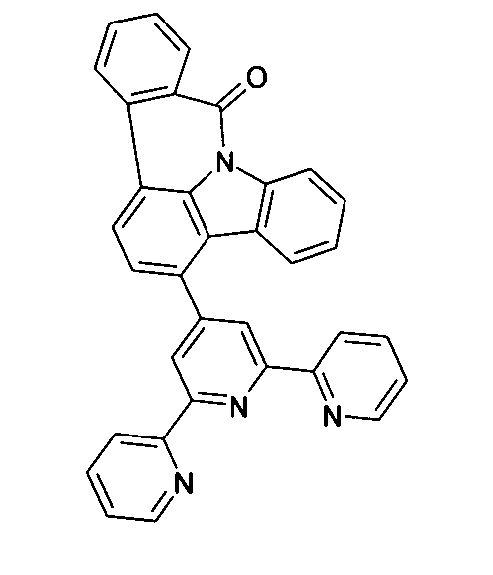
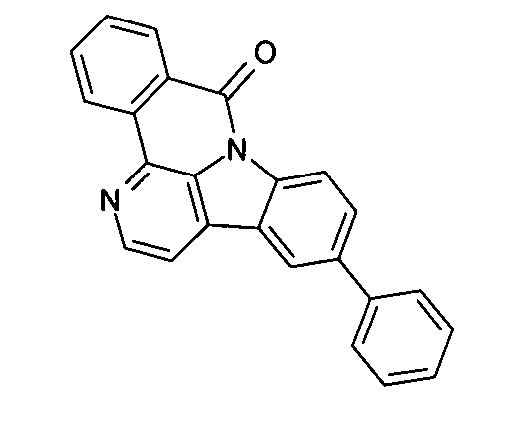
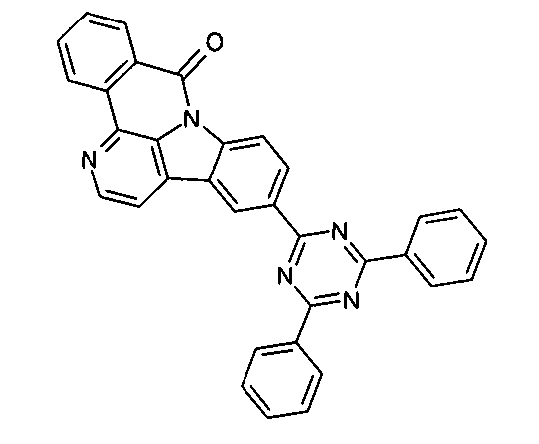
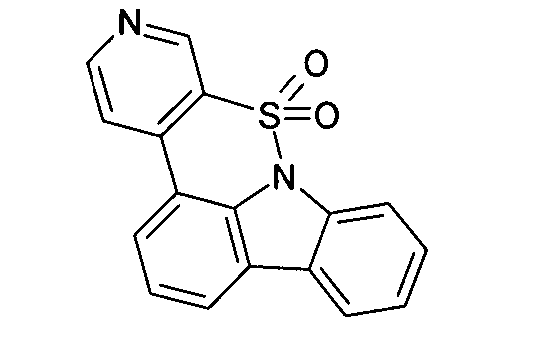
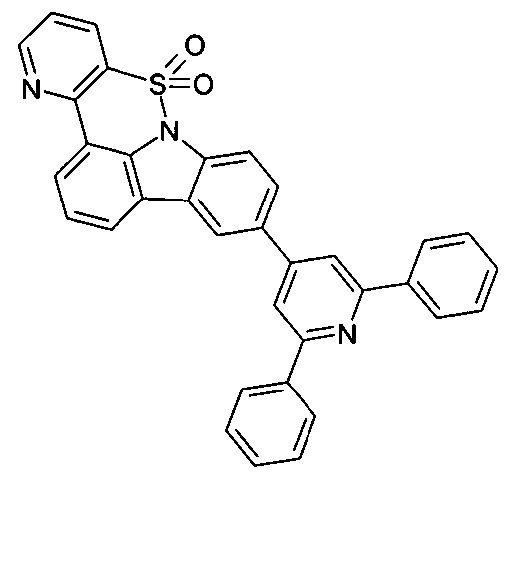
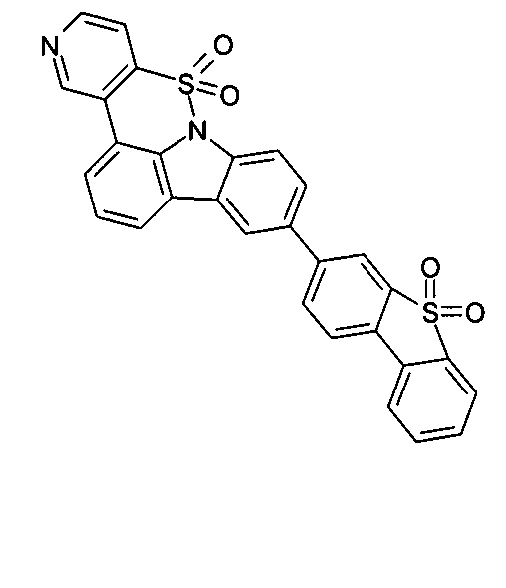
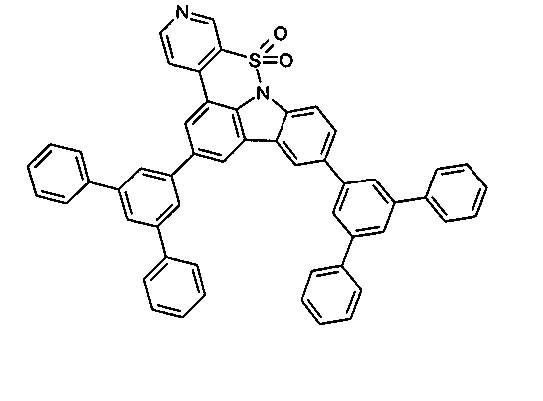
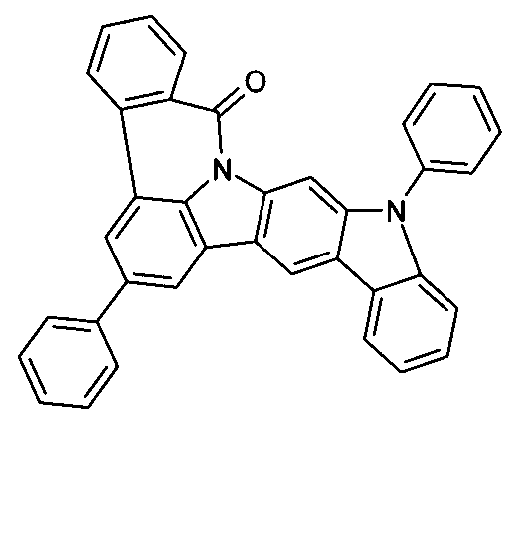
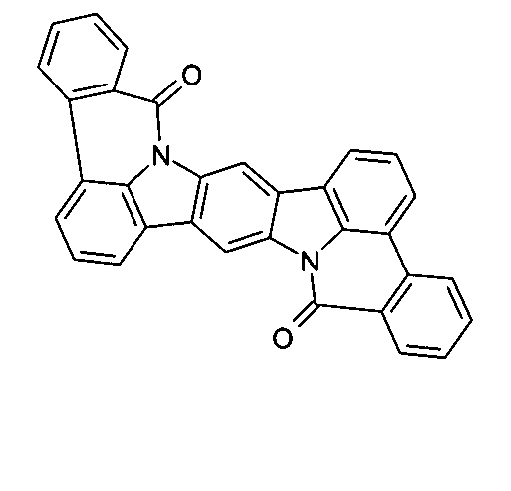
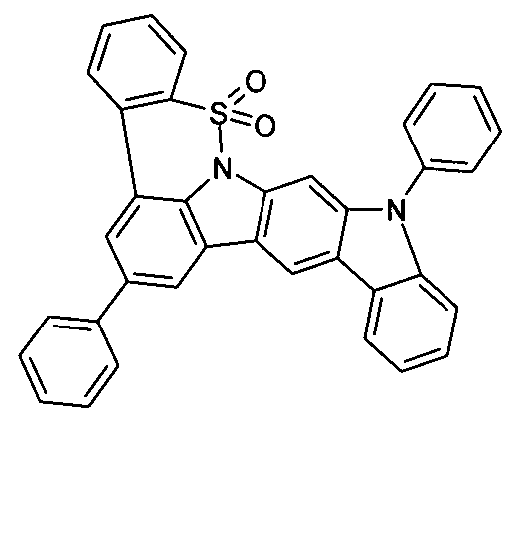
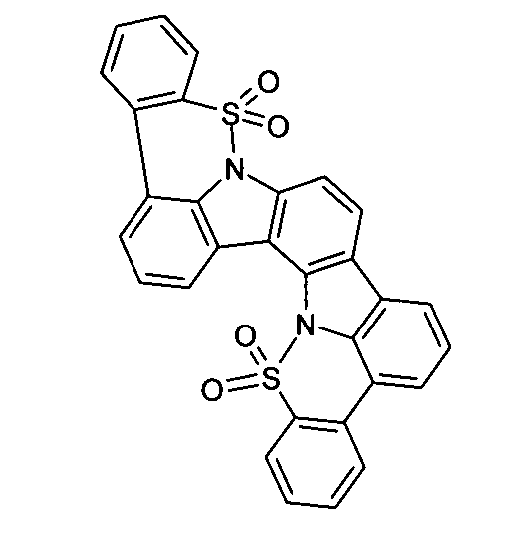
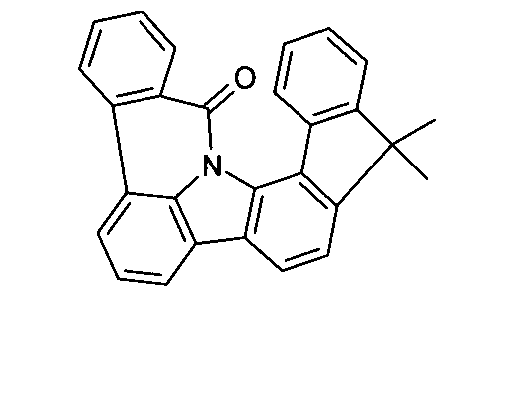
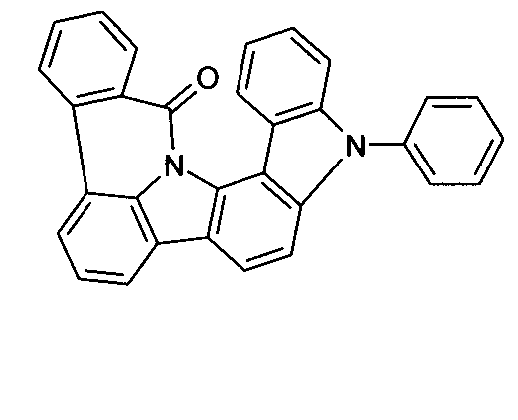
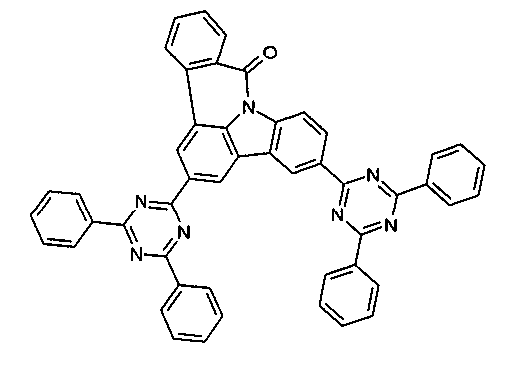
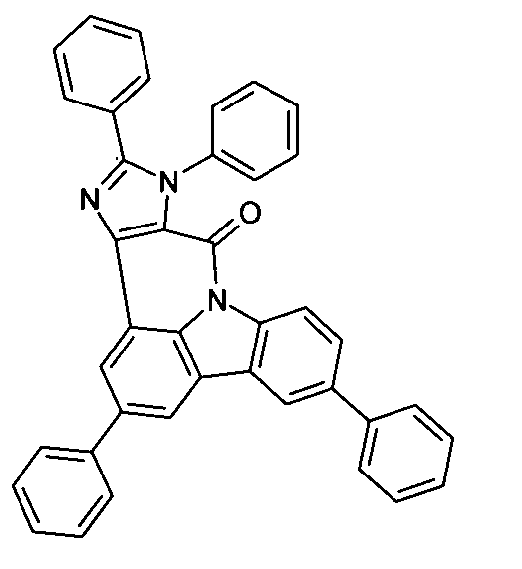
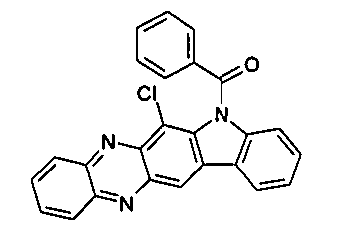
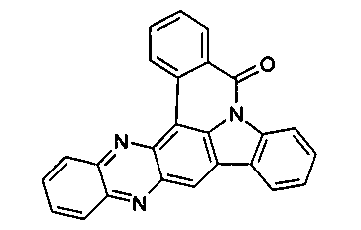
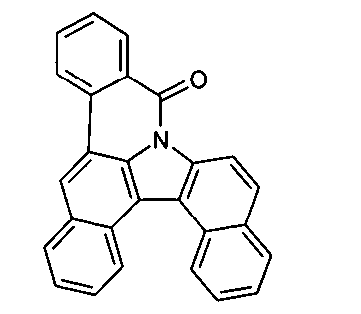
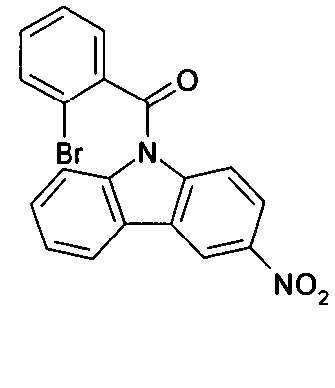
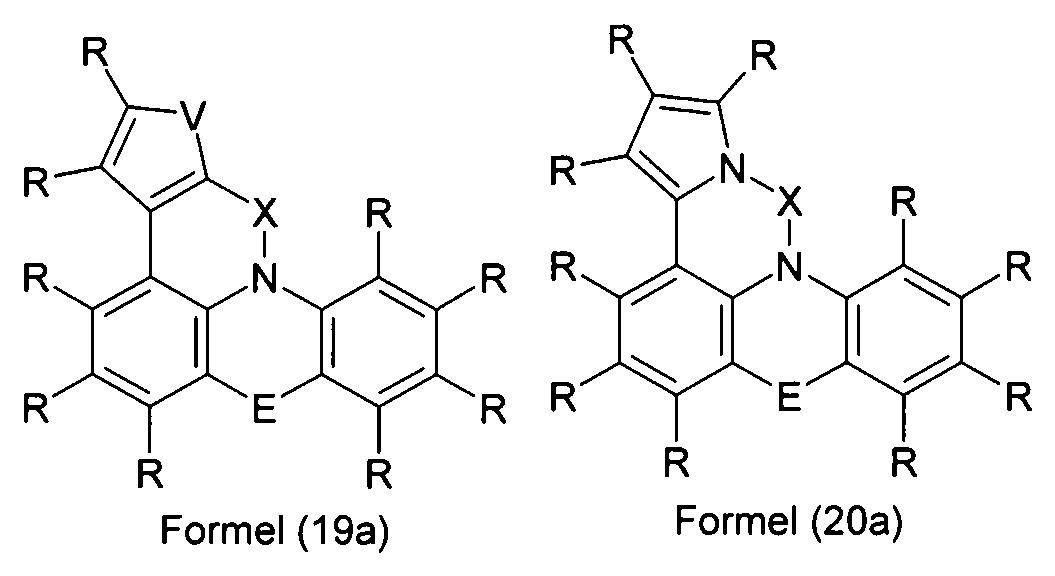
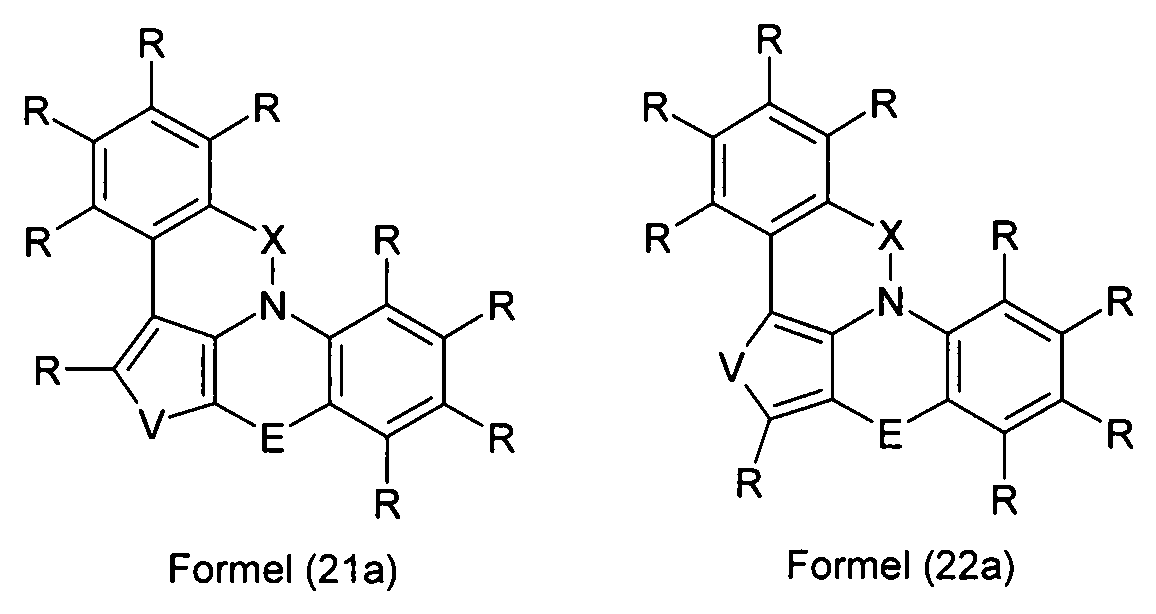
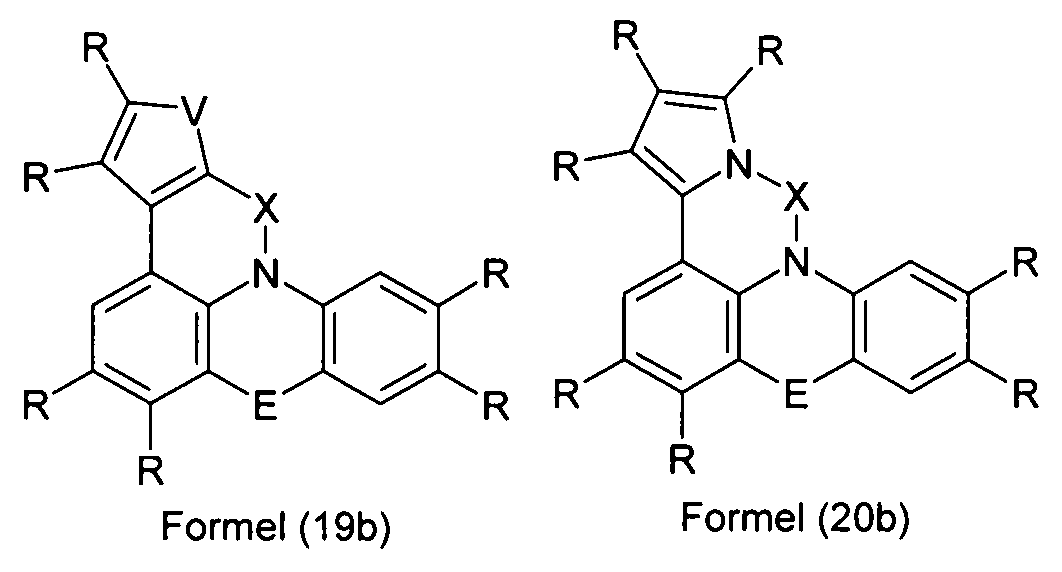
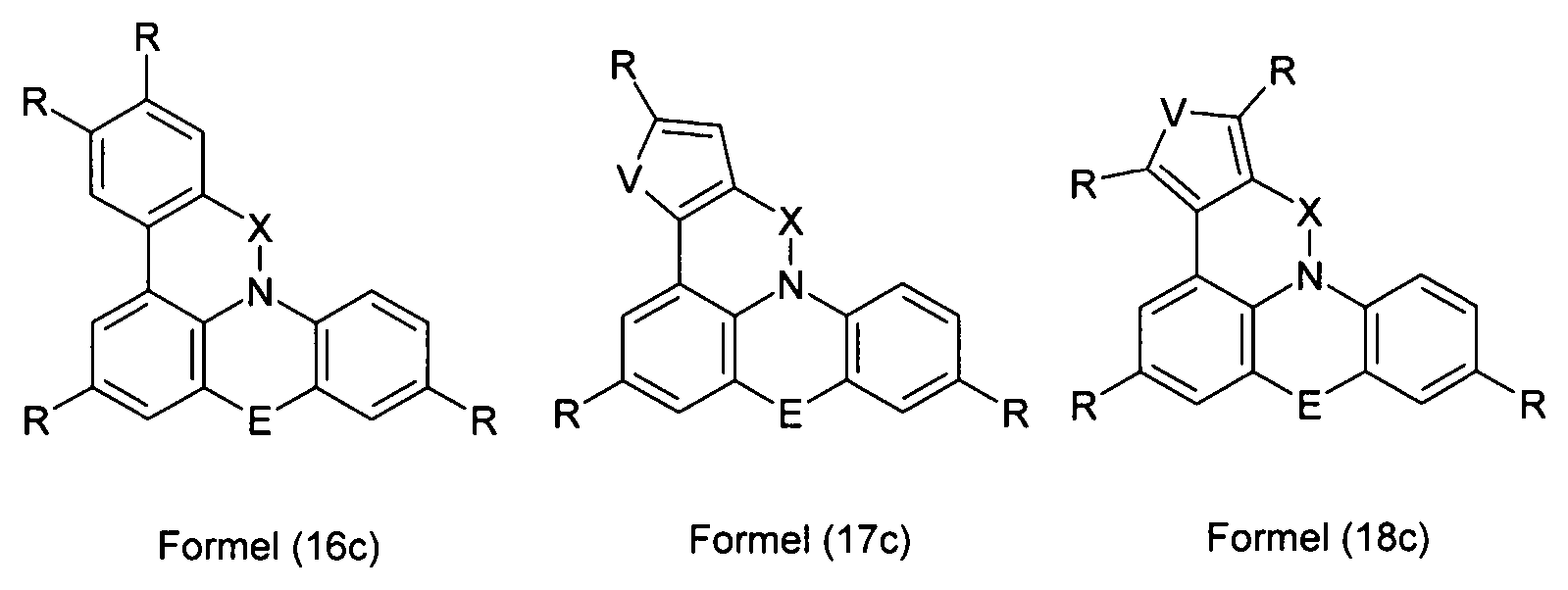
Elektronische Vorrichtung enthaltend mindestens eine Verbindung gemäß der folgenden Formel (1),wobei für die verwendeten Symbole und Indizes gilt:X ist C=O, NR, O, S, C=S, C=NR, C=C(R)2, Si(R)2, BR, PR, P(=O)R, SO oder SO2;Y ist C, wenn Ar1eine 6-Ring-Aryl- oder Heteroarylgruppe darstellt, und ist C oder N, wenn Ar1eine 5-Ring-Heteroarylgruppe darstellt;E ist eine Einfachbindung, C(R)2, NR, O, S, C=O, C=S, C=NR, C=C(R)2, Si(R)2, BR, PR, P(=O)R, SO oder SO2;Ar1, Ar2, Ar3ist gleich oder verschieden bei jedem Auftreten zusammen mit der Gruppe Y und den explizit dargestellten Kohlenstoffatomen ein aromatisches oder heteroaromatisches Ringsystem mit 5 bis 30 aromatischen Ringatomen, welches durch einen oder mehrere Reste R substituiert sein kann;R ist bei jedem Auftreten gleich oder verschieden ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, I, CN, NO2, N(Ar4)2, N(R1)2, C(=O)Ar4, C(=O)R1, P(=O)(Ar4)2, einer geradkettigen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 1 bis 40 C-Atomen oder einer verzweigten oder cyclischen Alkyl-, Alkoxy- oder ThioalkylgruppeR1mit 3 bis 40 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R1substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch R1C=CR1, C≡C, Si(R1)2, Ge(R1)2, Sn(R1)2, C=O, C=S, C=Se, C=NR1, P(=O)(R1), SO, SO2, NR1, O, S oder CONR1ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 80 aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R1substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 60 aromatischen Ringatomen, die mit einem oder mehreren Resten R1substituiert sein kann, oder einer Kombination dieser Systeme, wobei optional zwei oder mehr benachbarte Substituenten R ein monocyclisches oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können, das mit einem oder mehreren Resten R1substituiert sein kann; ist bei jedem Auftreten gleich oder verschieden ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, I, CN, NO2, N(Ar4)2, N(R2)2, C(=O)Ar4, C(=O)R2, P(=O)(Ar4)2, einer geradkettigen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 1 bis 40 C-Atomen oder einer verzweigten oder cyclischen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 3 bis 40 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R2substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch R2C=CR2, C≡C, Si(R2)2, Ge(R2)2, Sn(R2)2, C=O, C=S, C=Se, C=NR2, P(=O)(R2), SO, SO2, NR2, O, S oder CONR2ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 60 aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R2substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 60 aromatischen Ringatomen, die mit einem oder mehreren Resten R2substituiert sein kann, oder einer Kombination dieser Systeme, wobei optional zwei oder mehr benachbarte Substituenten R ein monocyclisches oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können, das mit einem oder mehreren Resten R2substituiert sein kann;Ar4ist bei jedem Auftreten gleich oder verschieden ein aromatisches oder heteroaromatisches Ringsystem mit 5-30 aromatischen Ringatomen, das mit einem oder mehreren nicht-aromatischen Resten R2substituiert sein kann; dabei können zwei Reste Ar4, welche an dasselbe N-Atom oder P-Atom binden, auch durch eine Einfachbindung oder eine Brücke, ausgewählt aus N(R2), C(R2)2oder O, miteinander verbrückt sein;R2ist ausgewählt aus der Gruppe bestehend aus H, D, F, CN, einem aliphatischem Kohlenwasserstoffrest mit 1 bis 20 C-Atomen, einem aromatischem oder heteroaromatischem Ringsystem mit 5 bis 30 aromatischen Ringatomen, in dem ein oder mehrere H-Atome durch D, F, Cl, Br, I oder CN ersetzt sein können, wobei zwei oder mehr benachbarte Substituenten R2miteinander ein mono- oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können.
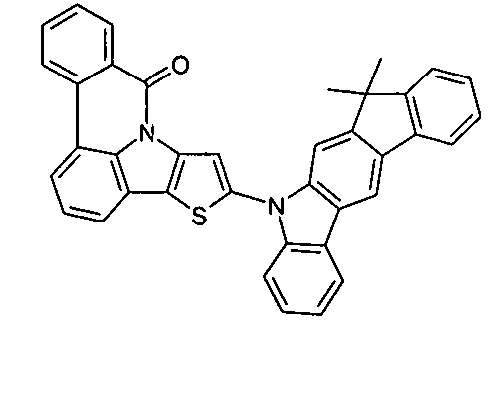
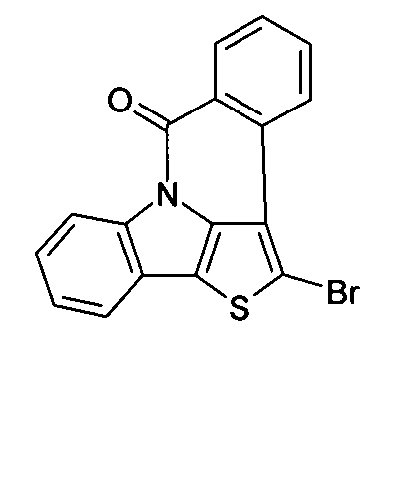
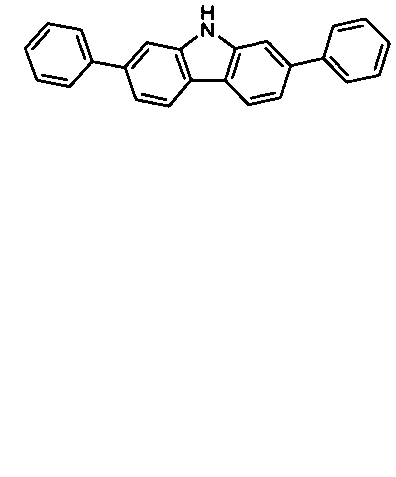
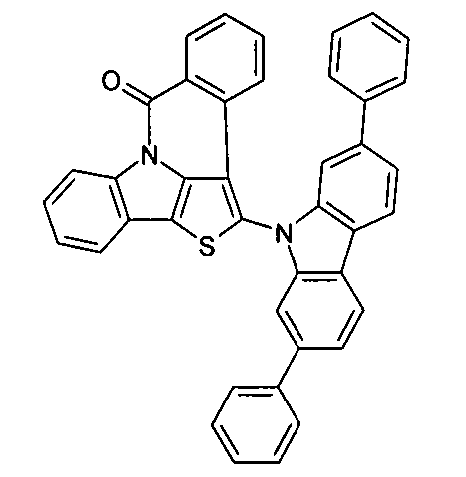
Description
- Die vorliegende Erfindung betrifft elektronische Vorrichtungen, insbesondere organische Elektrolumineszenzvorrichtungen, sowie Materialien für die Verwendung in elektronischen Vorrichtungen, insbesondere in organischen Elektrolumineszenzvorrichtungen.
- Der Aufbau organischer Elektrolumineszenzvorrichtungen (OLEDs), in denen organische Halbleiter als funktionelle Materialien eingesetzt werden, ist beispielsweise in
US 4539507 ,US 5151629 ,EP 0676461 undWO 98/27136 - Die Eigenschaften von phosphoreszierenden OLEDs werden nicht nur von den eingesetzten Triplettemittern bestimmt. Hier sind insbesondere auch die anderen verwendeten Materialien, wie Matrixmaterialien, Lochblockiermaterialien, Elektronentransportmaterialien, Lochtransportmaterialien und Elektronen- bzw. Exzitonenblockiermaterialien von besonderer Bedeutung. Verbesserungen dieser Materialien können somit auch zu deutlichen Verbesserungen der OLED-Eigenschaften führen. Auch für fluoreszierende OLEDs gibt es bei diesen Materialien noch Verbesserungsbedarf.
- Gemäß dem Stand der Technik werden unter anderem Ketone (z. B. gemäß
WO 2004/093207 WO 2010/006680 WO 2005/003253 - Gemäß dem Stand der Technik werden weiterhin Carbazolderivate, z. B. gemäß
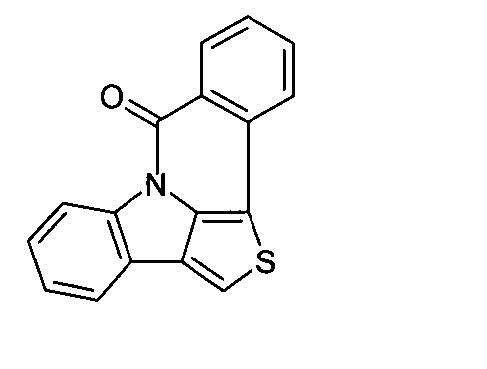
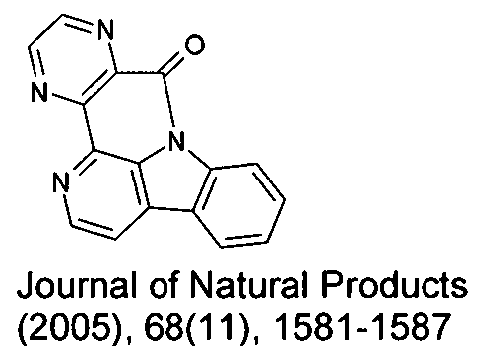
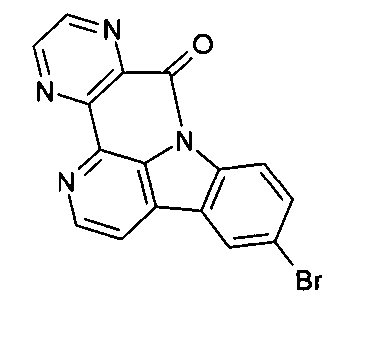
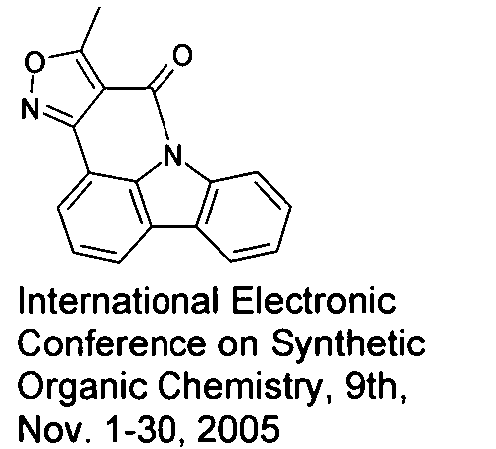
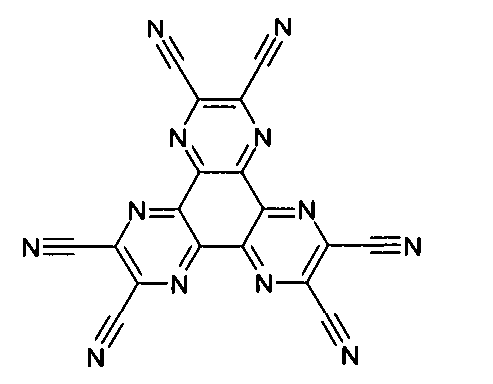
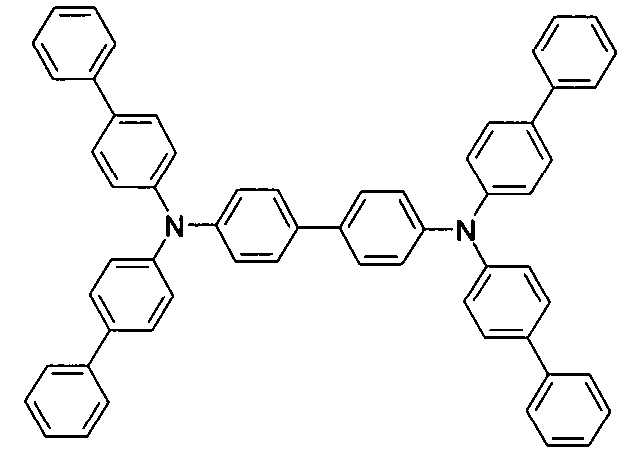
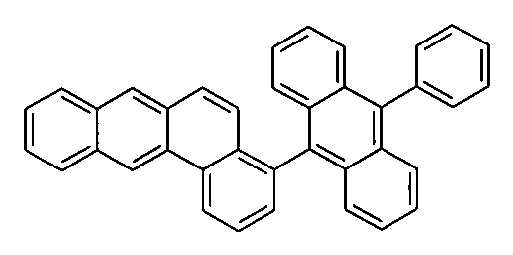
WO 2005/039246 US 2005/0069729 JP 2004/288381 EP 1205527 oderWO 2008/086851 WO 2007/063754 WO 2008/056746 - Gemäß dem Stand der Technik werden weiterhin verbrückte polyzyklische Verbindungen, z. B. gemäß
JP2009033067 JP 008270395 - Aufgabe der vorliegenden Erfindung ist die Bereitstellung von Verbindungen, welche sich für den Einsatz in einer fluoreszierenden oder phosphoreszierenden OLED, insbesondere einer phosphoreszierenden OLED, eignen, beispielsweise als Matrixmaterial oder als Lochtransport-/ Elektronenblockiermaterial bzw. Exzitonenblockiermaterial oder als Elektronentransport- bzw. Lochblockiermaterial. Insbesondere ist es die Aufgabe der vorliegenden Erfindung, Matrixmaterialien bereitzustellen, welche sich für grün und rot phosphoreszierende OLEDs eignen.
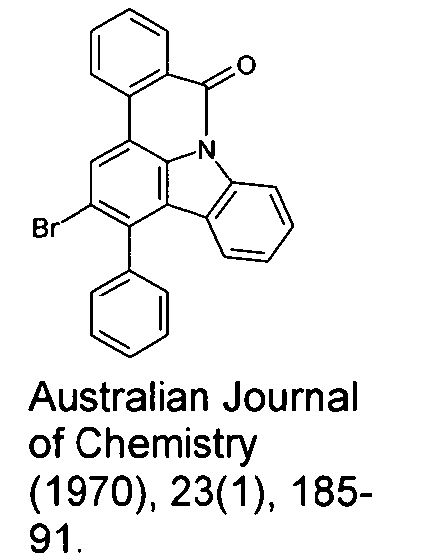
- Überraschend wurde gefunden, dass bestimmte, unten näher beschriebene Verbindungen diese Aufgabe lösen und zu deutlichen Verbesserungen der organischen Elektrolumineszenzvorrichtung führen, insbesondere hinsichtlich der Lebensdauer, der Effizienz und der Betriebsspannung. Dies gilt insbesondere für rot und grün phosphoreszierende Elektrolumineszenzvorrichtungen, vor allem bei Einsatz der erfindungsgemäßen Verbindungen als Matrixmaterial. Die Materialien zeichnen sich weiterhin durch hohe Oxidationsstabilität in Lösung sowie durch eine hohe Temperaturstabilität aus. Elektronische Vorrichtungen, insbesondere organische Elektrolumineszenzvorrichtungen, welche derartige Verbindungen enthalten, sind daher der Gegenstand der vorliegenden Erfindung. Die Synthese von ähnlichen Verbindungen ist in der Literatur beschrieben: z. B. in Tetrahedron, Vol. 45, 1989, No.12, S. 3775-3786, in Australian Journal of Chemistry, Vol. 23, 1970, No. 1, S. 185-191 oder in Organic Letters, Vol. 6, 2004, No. 17, S. 2993-2996.
-
- X
- ist C=O, NR, O, S, C=S, C=NR, C=C(R)2, Si(R)2, BR, PR, P(=O)R, SO oder SO2;
- Y
- ist C, wenn Ar1 eine 6-Ring-Aryl- oder Heteroarylgruppe darstellt, bzw. ist C oder N, wenn Ar1 eine 5-Ring-Heteroarylgruppe darstellt;
- E
- ist eine Einfachbindung, C(R)2, NR, O, S, C=O, C=S, C=NR, C=C(R)2, Si(R)2, BR, PR, P(=O)R, SO oder SO2;
- Ar1
- ist zusammen mit der Gruppe Y und dem explizit dargestellten Kohlenstoffatom ein aromatisches oder heteroaromatisches Ringsystem mit 5 bis 30 aromatischen Ringatomen, welches durch einen oder mehrere Reste R substituiert sein kann;
- Ar2, Ar3
- ist gleich oder verschieden bei jedem Auftreten zusammen mit den explizit dargestellten Kohlenstoffatomen ein aromatisches oder heteroaromatisches Ringsystem mit 5 bis 30 aromatischen Ringatomen, welches durch einen oder mehrere Reste R substituiert sein kann;
- R
- ist bei jedem Auftreten gleich oder verschieden ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, I, CN, NO2, N(Ar4)2, N(R1)2, C(=O)Ar4, C(=O)R1, P(=O)(Ar4)2, einer geradkettigen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 1 bis 40 C-Atomen oder einer verzweigten oder cyclischen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 3 bis 40 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R1 substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch R1C=CR1, C=C, Si(R1)2, Ge(R1)2, Sn(R1)2, C=O, C=S, C=Se, C=NR1, P(=O)(R1), SO, SO2, NR1, O, S oder CONR1 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 80, bevorzugt 5 bis 60, aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R1 substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 60 aromatischen Ringatomen, die mit einem oder mehreren Resten R1 substituiert sein kann, oder einer Kombination dieser Systeme, wobei optional zwei oder mehr benachbarte Substituenten R ein monocyclisches oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können, das mit einem oder mehreren Resten R1 substituiert sein kann;
- R1
- ist bei jedem Auftreten gleich oder verschieden ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, I, CN, NO2, N(Ar4)2, N(R2)2, C(=O)Ar4, C(=O)R2, P(=O)(Ar4)2, einer geradkettigen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 1 bis 40 C-Atomen oder einer verzweigten oder cyclischen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 3 bis 40 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R2
- Ar4
- substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch R2C=CR2, C=C, Si(R2)2, Ge(R2)2, Sn(R2)2, C=O, C=S, C=Se, C=NR2, P(=O)(R2), SO, SO2, NR2, O, S oder CONR2 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 60 aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R2 substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 60 aromatischen Ringatomen, die mit einem oder mehreren Resten R2 substituiert sein kann, oder einer Kombination dieser Systeme, wobei optional zwei oder mehr benachbarte Substituenten R ein monocyclisches oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können, das mit einem oder mehreren Resten R2 substituiert sein kann; ist bei jedem Auftreten gleich oder verschieden ein aromatisches oder heteroaromatisches Ringsystem mit 5-30 aromatischen Ringatomen, das mit einem oder mehreren nicht-aromatischen Resten R2 substituiert sein kann; dabei können zwei Reste Ar4, welche an dasselbe N-Atom oder P-Atom binden, auch durch eine Einfachbindung oder eine Brücke, ausgewählt aus N(R2), C(R2)2 oder O, miteinander verbrückt sein;
- R2
- ist ausgewählt aus der Gruppe bestehend aus H, D, F, CN, einem aliphatischem Kohlenwasserstoffrest mit 1 bis 20 C-Atomen, einem aromatischem oder heteroaromatischem Ringsystem mit 5 bis 30 aromatischen Ringatomen, in dem ein oder mehrere H-Atome durch D, F, Cl, Br, I oder CN ersetzt sein können, wobei zwei oder mehr benachbarte Substituenten R2 miteinander ein mono- oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können.
- Eine elektronische Vorrichtung im Sinne der vorliegenden Erfindung ist eine Vorrichtung, welche mindestens eine Schicht enthält, die mindestens eine organische Verbindung enthält. Das Bauteil kann dabei aber auch anorganische Materialien enthalten oder auch Schichten, welche vollständig aus anorganischen Materialien aufgebaut sind.
- Die elektronische Vorrichtung ist bevorzugt ausgewählt aus der Gruppe bestehend aus organischen Elektrolumineszenzvorrichtungen (OLEDs), organischen integrierten Schaltungen (O-ICs), organischen Feld-Effekt-Transistoren (O-FETs), organischen Dünnfilmtransistoren (O-TFTs), organischen lichtemittierenden Transistoren (O-LETs), organischen Solarzellen (O-SCs), organischen farbstoffsensibilisierten Solarzellen (O-DSSC), organischen optischen Detektoren, organischen Photorezeptoren, organischen Feld-Quench-Devices (O-FQDs), lichtemittierenden elektrochemischen Zellen (LECs), organischen Laserdioden (O-Laser) und „organic plasmon emitting devices“ (D. M. Koller et al., Nature Photonics 2008, 1-4), bevorzugt aber organischen Elektrolumineszenzvorrichtungen (OLEDs), besonders bevorzugt phosphoreszierenden OLEDs.
- Eine Arylgruppe im Sinne dieser Erfindung enthält 6 bis 60 C-Atome; eine Heteroarylgruppe im Sinne dieser Erfindung enthält 2 bis 60 C-Atome und mindestens ein Heteroatom, mit der Maßgabe, dass die Summe aus C-Atomen und Heteroatomen mindestens 5 ergibt. Die Heteroatome sind bevorzugt ausgewählt aus N, O und/oder S. Dabei wird unter einer Arylgruppe bzw. Heteroarylgruppe entweder ein einfacher aromatischer Cyclus, also Benzol, bzw. ein einfacher heteroaromatischer Cyclus, beispielsweise Pyridin, Pyrimidin, Thiophen, etc., oder eine kondensierte (anellierte) Aryl- oder Heteroarylgruppe, beispielsweise Naphthalin, Anthracen, Phenanthren, Chinolin, Isochinolin, etc., verstanden. Miteinander durch Einfachbindung verknüpfte Aromaten, wie zum Beispiel Biphenyl, werden dagegen nicht als Aryl- oder Heteroarylgruppe, sondern als aromatisches Ringsystem bezeichnet.
- Ein aromatisches Ringsystem im Sinne dieser Erfindung enthält 6 bis 80 C-Atome im Ringsystem. Ein heteroaromatisches Ringsystem im Sinne dieser Erfindung enthält 2 bis 60 C-Atome und mindestens ein Heteroatom im Ringsystem, mit der Maßgabe, dass die Summe aus C-Atomen und Heteroatomen mindestens 5 ergibt. Die Heteroatome sind bevorzugt ausgewählt aus N, O und/oder S. Unter einem aromatischen oder heteroaromatischen Ringsystem im Sinne dieser Erfindung soll ein System verstanden werden, das nicht notwendigerweise nur Aryl- oder Heteroarylgruppen enthält, sondern in dem auch mehrere Aryl- oder Heteroarylgruppen durch eine nicht-aromatische Einheit, wie z. B. ein C-, N- oder O-Atom, verbunden sein können. So sollen beispielsweise auch Systeme wie Fluoren, 9,9'-Spirobifluoren, 9,9-Diarylfluoren, Triarylamin, Diarylether, Stilben, etc. als aromatische Ringsysteme im Sinne dieser Erfindung verstanden werden, und ebenso Systeme, in denen zwei oder mehrere Arylgruppen beispielsweise durch eine kurze Alkylgruppe verbunden sind.
- Im Rahmen der vorliegenden Erfindung werden unter einem aliphatischen Kohlenwasserstoffrest bzw. einer Alkylgruppe bzw. einer Alkenyl- oder Alkinylgruppe, die 1 bis 40 C-Atome enthalten kann, und in der auch einzelne H-Atome oder CH2-Gruppen durch die oben genannten Gruppen substituiert sein können, bevorzugt die Reste Methyl, Ethyl, n-Propyl, i-Propyl, n-Butyl, i-Butyl, s-Butyl, t-Butyl, 2-Methylbutyl, n-Pentyl, s-Pentyl, neo-Pentyl, Cyclopentyl, n-Hexyl, neo-Hexyl, Cyclohexyl, n-Heptyl, Cycloheptyl, n-Octyl, Cyclooctyl, 2-Ethylhexyl, Trifluormethyl, Pentafluorethyl, 2,2,2-Trifluorethyl, Ethenyl, Propenyl, Butenyl, Pentenyl, Cyclopentenyl, Hexenyl, Cyclohexenyl, Heptenyl, Cycloheptenyl, Octenyl, Cyclooctenyl, Ethinyl, Propinyl, Butinyl, Pentinyl, Hexinyl, Heptinyl oder Octinyl verstanden. Unter einer Alkoxygruppe mit 1 bis 40 C-Atomen werden bevorzugt Methoxy, Trifluormethoxy, Ethoxy, n-Propoxy, i-Propoxy, n-Butoxy, i-Butoxy, s-Butoxy, t-Butoxy, n-Pentoxy, s-Pentoxy, 2-Methylbutoxy, n-Hexoxy, Cyclohexyloxy, n-Heptoxy, Cycloheptyloxy, n-Octyloxy, Cyclooctyloxy, 2-Ethylhexyloxy, Pentafluorethoxy und 2,2,2-Trifluorethoxy verstanden. Unter einer Thioalkylgruppe mit 1 bis 40 C-Atomen werden insbesondere Methylthio, Ethylthio, n-Propylthio, i-Propylthio, n-Butylthio, i-Butylthio, s-Butylthio, t-Butylthio, n-Pentylthio, s-Pentylthio, n-Hexylthio, Cyclohexylthio, n-Heptylthio, Cycloheptylthio, n-Octylthio, Cyclooctylthio, 2-Ethylhexylthio, Trifluormethylthio, Pentafluorethylthio, 2,2,2-Trifluorethylthio, Ethenylthio, Propenylthio, Butenylthio, Pentenylthio, Cyclopentenylthio, Hexenylthio, Cyclohexenylthio, Heptenylthio, Cycloheptenylthio, Octenylthio, Cyclooctenylthio, Ethinylthio, Propinylthio, Butinylthio, Pentinylthio, Hexinylthio, Heptinylthio oder Octinylthio verstanden. Allgemein können Alkyl-, Alkoxy- oder Thioalkylgruppen gemäß der vorliegenden Erfindung geradkettig, verzweigt oder cyclisch sein, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch die oben genannten Gruppen ersetzt sein können; weiterhin können auch ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2, bevorzugt F, Cl oder CN, weiter bevorzugt F oder CN, besonders bevorzugt CN ersetzt sein.
- Unter einem aromatischen oder heteroaromatischen Ringsystem mit 5 - 80 aromatischen Ringatomen, welches noch jeweils mit den oben genannten Resten R2 oder einem Kohlenwasserstoffrest substituiert sein kann und welches über beliebige Positionen am Aromaten bzw. Heteroaromaten verknüpft sein kann, werden insbesondere Gruppen verstanden, die abgeleitet sind von Benzol, Naphthalin, Anthracen, Benzanthracen, Phenanthren, Pyren, Chrysen, Perylen, Fluoranthen, Naphthacen, Pentacen, Benzpyren, Biphenyl, Biphenylen, Terphenyl, Triphenylen, Fluoren, Spirobifluoren, Dihydrophenanthren, Dihydropyren, Tetrahydropyren, cis- oder trans-Indenofluoren, cis- oder trans-Indenocarbazol, cis- oder trans-Indolocarbazol, Truxen, Isotruxen, Spirotruxen, Spiroisotruxen, Furan, Benzofuran, Isobenzofuran, Dibenzofuran, Thiophen, Benzothiophen, Isobenzothiophen, Dibenzothiophen, Pyrrol, Indol, Isoindol, Carbazol, Pyridin, Chinolin, Isochinolin, Acridin, Phenanthridin, Benzo-5,6-chinolin, Benzo-6,7-chinolin, Benzo-7,8-chinolin, Phenothiazin, Phenoxazin, Pyrazol, Indazol, Imidazol, Benzimidazol, Naphthimidazol, Phenanthrimidazol, Pyridimidazol, Pyrazinimidazol, Chinoxalinimidazol, Oxazol, Benzoxazol, Naphthoxazol, Anthroxazol, Phenanthroxazol, Isoxazol, 1,2-Thiazol, 1,3-Thiazol, Benzothiazol, Pyridazin, Hexaazatriphenylen, Benzopyridazin, Pyrimidin, Benzpyrimidin, Chinoxalin, 1,5-Diazaanthracen, 2,7-Diazapyren, 2,3-Diazapyren, 1,6-Diazapyren, 1,8-Diazapyren, 4,5-Diazapyren, 4,5,9,10-Tetraazaperylen, Pyrazin, Phenazin, Phenoxazin, Phenothiazin, Fluorubin, Naphthyridin, Azacarbazol, Benzocarbolin, Phenanthrolin, 1,2,3-Triazol, 1,2,4-Triazol, Benzotriazol, 1,2,3-Oxadiazol, 1,2,4-Oxadiazol, 1,2,5-Oxadiazol, 1,3,4-Oxadiazol, 1,2,3-Thiadiazol, 1,2,4-Thiadiazol, 1,2,5-Thiadiazol, 1,3,4-Thiadiazol, 1,3,5-Triazin, 1,2,4-Triazin, 1,2,3-Triazin, Tetrazol, 1,2,4,5-Tetrazin, 1,2,3,4-Tetrazin, 1,2,3,5-Tetrazin, Purin, Pteridin, Indolizin und Benzothiadiazol oder Gruppen, die abgeleitet sind von Kombination dieser Systeme.
- In einer bevorzugten Ausführungsform der Erfindung steht X für C=O, SiR2, P(=O)R oder SO2, besonders bevorzugt für C=O, SiR2 oder SO2.
- In einer weiteren bevorzugten Ausführungsform der Erfindung steht E für eine Einfachbindung, CR2, C=O, NR, O oder S, besonders bevorzugt für eine Einfachbindung, CR2, C=O oder NR, ganz besonders bevorzugt für eine Einfachbindung, CR2 oder C=O, insbesondere für eine Einfachbindung.
-
- W
- ist gleich oder verschieden bei jedem Auftreten CR oder N; oder zwei benachbarte Gruppen W stehen für eine Gruppe der folgenden Formel (7) oder (8),
- V
- ist NR, O oder S.
- In einer weiteren bevorzugten Ausführungsform der Erfindung steht die Gruppe Ar2 für eine Gruppe gemäß einer der folgenden Formeln (9), (10) oder (11),
- In einer weiteren bevorzugten Ausführungsform der Erfindung steht die Gruppe Ar3 für eine Gruppe gemäß einer der folgenden Formeln (12), (13), (14) oder (15),
- In einer besonders bevorzugten Ausführungsform der Erfindung treten die oben genannten Bevorzugungen gleichzeitig auf. Besonders bevorzugt sind daher Verbindungen gemäß Formel (1), für die gilt:
- X
- ist C=O, CR2, SiR2, P(=O)R oder SO2;
- E
- ist gleich oder verschieden bei jedem Auftreten eine Einfachbindung, CR2, C=O, NR, O oder S;
- Ar1
- ist ausgewählt aus den Gruppen der oben genannten Formeln (2), (3), (4), (5) oder (6);
- Ar2
- ist ausgewählt aus den Gruppen der oben genannten Formeln (9), (10) oder (11);
- Ar3
- ist ausgewählt aus den Gruppen der oben genannten Formeln (12), (13), (14) oder (15).
- In einer ganz besonders bevorzugten Ausführungsform der Erfindung gilt für Verbindungen der Formel (1):
- X
- ist C=O, SiR2 oder SO2;
- E
- ist gleich oder verschieden bei jedem Auftreten eine Einfachbindung, CR2, C=O oder NR, bevorzugt eine Einfachbindung, CR2 oder C=O, besonders bevorzugt eine Einfachbindung;
- Ar1
- ist ausgewählt aus den Gruppen der oben genannten Formeln (2), (3), (4), (5) oder (6);
- Ar2
- ist ausgewählt aus den Gruppen der oben genannten Formeln (9), (10) oder (11);
- Ar3
- ist ausgewählt aus den Gruppen der oben genannten Formeln (12), (13), (14) oder (15).
- Dabei können die oben genannten bevorzugten Gruppen Ar1, Ar2 und Ar3 beliebig miteinander kombiniert werden. Geeignete Kombinationen sind also die folgenden:
Ar1 Ar2 Ar3 Formel (2) Formel (9) Formel (12) Formel (2) Formel (9) Formel (13) Formel (2) Formel (9) Formel (14) Formel (2) Formel (9) Formel (15) Formel (2) Formel (10) Formel (12) Formel (2) Formel (10) Formel (13) Formel (2) Formel (10) Formel (14) Formel (2) Formel (10) Formel (15) Formel (2) Formel (11) Formel (12) Formel (2) Formel (11) Formel (13) Formel (2) Formel (11) Formel (14) Formel (2) Formel (11) Formel (15) Formel (2) Formel (12) Formel (12) Formel (2) Formel (12) Formel (13) Formel (2) Formel (12) Formel (14) Formel (2) Formel (12) Formel (15) Formel (3) Formel (9) Formel (12) Formel (3) Formel (9) Formel (13) Formel (3) Formel (9) Formel (14) Formel (3) Formel (9) Formel (15) Formel (3) Formel (10) Formel (12) Formel (3) Formel (10) Formel (13) Formel (3) Formel (10) Formel (14) Formel (3) Formel (10) Formel (15) Formel (3) Formel (11) Formel (12) Formel (3) Formel (11) Formel (13) Formel (3) Formel (11) Formel (14) Formel (3) Formel (11) Formel (15) Formel (3) Formel (12) Formel (12) Formel (3) Formel (12) Formel (13) Formel (3) Formel (12) Formel (14) Formel (3) Formel (12) Formel (15) Formel (4) Formel (9) Formel (12) Formel (4) Formel (9) Formel (13) Formel (4) Formel (9) Formel (14) Formel (4) Formel (9) Formel (15) Formel (4) Formel (10) Formel (12) Formel (4) Formel (10) Formel (13) Formel (4) Formel (10) Formel (14) Formel (4) Formel (10) Formel (15) Formel (4) Formel (11) Formel (12) Formel (4) Formel (11) Formel (13) Formel (4) Formel (11) Formel (14) Formel (4) Formel (11) Formel (15) Formel (4) Formel (12) Formel (12) Formel (4) Formel (12) Formel (13) Formel (4) Formel (12) Formel (14) Formel (4) Formel (12) Formel (15) Formel (5) Formel (9) Formel (12) Formel (5) Formel (9) Formel (13) Formel (5) Formel (9) Formel (14) Formel (5) Formel (9) Formel (15) Formel (5) Formel (10) Formel (12) Formel (5) Formel (10) Formel (13) Formel (5) Formel (10) Formel (14) Formel (5) Formel (10) Formel (15) Formel (5) Formel (11) Formel (12) Formel (5) Formel (11) Formel (13) Formel (5) Formel (11) Formel (14) Formel (5) Formel (11) Formel (15) Formel (5) Formel (12) Formel (12) Formel (5) Formel (12) Formel (13) Formel (5) Formel (12) Formel (14) Formel (5) Formel (12) Formel (15) Formel (6) Formel (9) Formel (12) Formel (6) Formel (9) Formel (13) Formel (6) Formel (9) Formel (14) Formel (6) Formel (9) Formel (15) Formel (6) Formel (10) Formel (12) Formel (6) Formel (10) Formel (13) Formel (6) Formel (10) Formel (14) Formel (6) Formel (10) Formel (15) Formel (6) Formel (11) Formel (12) Formel (6) Formel (11) Formel (13) Formel (6) Formel (11) Formel (14) Formel (6) Formel (11) Formel (15) Formel (6) Formel (12) Formel (12) Formel (6) Formel (12) Formel (13) Formel (6) Formel (12) Formel (14) Formel (6) Formel (12) Formel (15) - Besonders bevorzugt stehen mindestens zwei der Gruppen Ar1, Ar2 und Ar3 für eine 6-Ring-Aryl- oder eine 6-Ring-Heteroarylgruppe. Besonders bevorzugt steht also Ar1 für eine Gruppe der Formel (2) und gleichzeitig steht Ar2 für eine Gruppe der Formel (9), oder Ar1 steht für eine Gruppe der Formel (2) und gleichzeitig steht Ar3 für eine Gruppe der Formel (12), oder Ar2 steht für eine Gruppe der Formel (9) und gleichzeitig steht Ar3 für eine Gruppe der Formel (12).
-
- Wie oben bereits ausgeführt, können zwei benachbarte Gruppen W auch für eine Gruppe der oben genannten Formel (7) oder (8) stehen. Wenn zwei benachbarte Gruppen W für eine Gruppe der oben genannten Formel (7) stehen, erhält man Strukturen, wie exemplarisch durch die folgenden Formeln (26) bis (31) dargestellt. Diese Strukturen der Formeln (26) bis (30) leiten sich von der oben genannten Formel (16) ab und die Struktur der Formel (31) leitet sich von der oben genannten Formel (25) ab. Ganz analog lassen sich weitere entsprechende Strukturen von den oben genannten Formeln (17) bis (25) ableiten.
- Dabei haben die verwendeten Symbole die oben genannten Bedeutungen.
- Wenn zwei benachbarte Gruppen W für eine Gruppe der oben genannten Formel (8) stehen, erhält man Strukturen, wie exemplarisch durch die folgenden Formeln (32) bis (37) dargestellt. Diese Strukturen leiten sich von der oben genannten Formel (16) ab. Ganz analog lassen sich entsprechende Strukturen von den oben genannten Formeln (17) bis (25) ableiten.
- Dabei haben die verwendeten Symbole die oben genannten Bedeutungen.
- In einer weiteren bevorzugten Ausführungsform der Verbindungen gemäß Formel (16) bis (25) steht pro Cyclus insgesamt maximal ein Symbol W für N, und die verbleibenden Symbole W, die nicht für eine Gruppe der Formel (7) oder (8) stehen, stehen für CR. In einer besonders bevorzugten Ausführungsform der Erfindung stehen alle Symbole W, die nicht für eine Gruppe der Formel (7) oder (8) stehen, für CR. Besonders bevorzugt sind daher die Verbindungen gemäß den folgenden Formeln (16a) bis (25a),
-
-
- Dabei steht in den Formeln (16) bis (25), (16a) bis (25a), (16b) bis (25b) und (16c) bis (25c) X bevorzugt für C=O, SiR2 oder SO2.
- Weiterhin steht in den Formeln (16) bis (25), (16a) bis (25a), (16b) bis (25b) und (16c) bis (25c) E bevorzugt für eine Einfachbindung, CR2, NR, O oder S.
- Besonders bevorzugt steht in den Formeln (16) bis (25), (16a) bis (25a), (16b) bis (25b) und (16c) bis (25c) X für C=O, SiR2 oder SO2 und gleichzeitig E für eine Einfachbindung, CR2, NR, O oder S.
- Besonders bevorzugte Kombinationen der Symbole X, E und V in den Verbindungen der Formeln (16) bis (25), (16a) bis (25a), (16b) bis (25b) und (16c) bis (25c) sind daher die folgenden Kombinationen:
X E V C=O Einfachbindung N-R C=O Einfachbindung O C=O Einfachbindung S C=O CR2 N-R C=O CR2 O C=O CR2 S C=O C=O N-R C=O C=O O C=O C=O S C=O N-R N-R C=O N-R O C=O N-R S SiR2 Einfachbindung N-R SiR2 Einfachbindung O SiR2 Einfachbindung S SiR2 CR2 N-R SiR2 CR2 O SiR2 CR2 S SiR2 C=O N-R SiR2 C=O O SiR2 C=O S SiR2 N-R N-R SiR2 N-R O SiR2 N-R S SO2 Einfachbindung N-R SO2 Einfachbindung O SO2 Einfachbindunq S SO2 CR2 N-R SO2 CR2 O SO2 CR2 S SO2 C=O N-R SO2 C=O O SO2 C=O S SO2 N-R N-R SO2 N-R O SO2 N-R S - Weiterhin ist es bevorzugt, falls zwei benachbarte Gruppen W für eine Gruppe der Formel (7) oder (8) stehen, dass dann maximal eine Gruppe Z für N steht. Besonders bevorzugt stehen alle Gruppen Z für CR. Weiterhin ist es bevorzugt, wenn zwei benachbarte Gruppen W für eine Gruppe der Formel (8) stehen, dass dann in der Gruppe der Formel (8) E für CR2, C=O oder NR steht.
- In einer bevorzugten Ausführungsform der Erfindung ist R in den oben genannten Formeln gleich oder verschieden bei jedem Auftreten ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, CN, N(Ar1)2, C(=O)Ar1, einer geradkettigen Alkyl- oder Alkoxygruppe mit 1 bis 10 C-Atomen oder einer verzweigten oder cyclischen Alkyl- oder Alkoxygruppe mit 3 bis 10 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 10 C-Atomen, die jeweils mit einem oder mehreren Resten R1 substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch O ersetzt sein können und wobei ein oder mehrere H-Atome durch D oder F ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 30 aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R1 substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 30 aromatischen Ringatomen, die mit einem oder mehreren Resten R1 substituiert sein kann, oder einer Kombination dieser Systeme.
- In einer besonders bevorzugten Ausführungsform der Erfindung ist R in den oben genannten Formeln gleich oder verschieden bei jedem Auftreten ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, CN, einer geradkettigen Alkylgruppe mit 1 bis 10 C-Atomen oder einer verzweigten oder cyclischen Alkylgruppe mit 3 bis 10 C-Atomen, die jeweils mit einem oder mehreren Resten R1 substituiert sein kann, wobei ein oder mehrere H-Atome durch D oder F ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 18 aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R1 substituiert sein kann, oder einer Kombination dieser Systeme.
- Wenn die Verbindungen der Formel (1) bzw. die bevorzugten Ausführungsformen als Elektronentransportmaterial verwendet werden, ist es bevorzugt, wenn die Gruppe X für C=O oder SO2 steht und/oder wenn mindestens einer der Reste R für ein aromatisches Ringsystem oder ein elektronenarmes heteroaromatisches Ringsystem steht. Elektronenarme Heterocyclen sind erfindungsgemäß Fünfringheterocyclen mit mindestens zwei Heteroatomen oder Sechsringheterocyclen, an die jeweils noch ein oder mehrere aromatische oder heteroaromatische Gruppen ankondensiert sein können.
- Wenn die Verbindungen der Formel (1) bzw. die bevorzugten Ausführungsformen als Matrixmaterial für einen phosphoreszierenden Emitter verwendet werden, ist es bevorzugt, wenn die Gruppe X für C=O steht und/oder wenn mindestens einer der Reste R für ein substituiertes oder unsubstituiertes Carbazol, Indenocarbazol oder Indolocarbazol steht, welches jeweils über ein Kohlenstoffatom oder ein Stickstoffatom gebunden sein kann.
- Dabei haben für Verbindungen, die durch Vakuumverdampfung verarbeitet werden, die Alkylgruppen bevorzugt nicht mehr als fünf C-Atome, besonders bevorzugt nicht mehr als 4 C-Atome, ganz besonders bevorzugt nicht mehr als 1 C-Atom. Für Verbindungen, die aus Lösung verarbeitet werden, eignen sich auch Verbindungen, die mit Alkylgruppen mit bis zu 10 C-Atomen substituiert sind oder die mit Oligoarylengruppen, beispielsweise ortho-, meta-, para- oder verzweigten Terphenylgruppen, substituiert sind.
-
- Die organische Elektrolumineszenzvorrichtung enthält Kathode, Anode und mindestens eine emittierende Schicht. Außer diesen Schichten kann sie noch weitere Schichten enthalten, beispielsweise jeweils eine oder mehrere Lochinjektionsschichten, Lochtransportschichten, Lochblockierschichten, Elektronentransportschichten, Elektroneninjektionsschichten, Exzitonenblockierschichten, Elektronenblockierschichten und/oder Ladungserzeugungsschichten (Charge-Generation Layers). Ebenso können zwischen zwei emittierende Schichten Interlayer eingebracht sein, welche beispielsweise eine exzitonenblockierende Funktion aufweisen. Es sei aber darauf hingewiesen, dass nicht notwendigerweise jede dieser Schichten vorhanden sein muss. Dabei kann die organische Elektrolumineszenzvorrichtung eine emittierende Schicht enthalten, oder sie kann mehrere emittierende Schichten enthalten. Wenn mehrere Emissionsschichten vorhanden sind, weisen diese bevorzugt insgesamt mehrere Emissionsmaxima zwischen 380 nm und 750 nm auf, so dass insgesamt weiße Emission resultiert, d. h. in den emittierenden Schichten werden verschiedene emittierende Verbindungen verwendet, die fluoreszieren oder phosphoreszieren können. Insbesondere bevorzugt sind Systeme mit drei emittierenden Schichten, wobei die drei Schichten blaue, grüne und orange oder rote Emission zeigen (für den prinzipiellen Aufbau siehe z. B.
WO 2005/011013 - Die erfindungsgemäße Verbindung gemäß den oben aufgeführten Ausführungsformen kann dabei in unterschiedlichen Schichten eingesetzt werden, je nach genauer Struktur. Bevorzugt ist eine organische Elektrolumineszenzvorrichtung, enthaltend eine Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen als Matrixmaterial für fluoreszierende oder phosphoreszierende Emitter, insbesondere für phosphoreszierende Emitter, und/oder in einer Lochblockierschicht und/oder in einer Elektronentransportschicht und/oder in einer elektronenblockierenden bzw. exzitonenblockierenden Schicht und/oder in einer Lochtransportschicht, je nach genauer Substitution.
- In einer weiteren Ausführungsform der Erfindung enthält die organische Elektrolumineszenzvorrichtung die Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen in einer optischen Auskopplungsschicht. Unter einer optischen Auskopplungsschicht wird dabei eine Schicht verstanden, die nicht zwischen der Anode und der Kathode liegt, sondern die außerhalb der eigentlichen Vorrichtung auf eine Elektrode aufgebracht wird, beispielsweise zwischen einer Elektrode und einem Substrat, um die optische Auskopplung zu verbessern.
- In einer bevorzugten Ausführungsform der Erfindung wird die Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen als Matrixmaterial für eine fluoreszierende oder phosphoreszierende Verbindung, insbesondere für eine phosphoreszierende Verbindung, in einer emittierenden Schicht eingesetzt. Dabei kann die organische Elektrolumineszenzvorrichtung eine emittierende Schicht enthalten, oder sie kann mehrere emittierende Schichten enthalten, wobei mindestens eine emittierende Schicht mindestens eine erfindungsgemäße Verbindung als Matrixmaterial enthält.
- Wenn die Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen als Matrixmaterial für eine emittierende Verbindung in einer emittierenden Schicht eingesetzt wird, wird sie bevorzugt in Kombination mit einem oder mehreren phosphoreszierenden Materialien (Triplettemitter) eingesetzt. Unter Phosphoreszenz im Sinne dieser Erfindung wird die Lumineszenz aus einem angeregten Zustand mit höherer Spinmultiplizität verstanden, also einem Spinzustand > 1, insbesondere aus einem angeregten Triplettzustand. Im Sinne dieser Anmeldung sollen alle lumineszierenden Komplexe mit Übergangsmetallen oder Lanthaniden, insbesondere alle Iridium-, Platin- und Kupferkomplexe als phosphoreszierende Verbindungen angesehen werden.
- Die Mischung aus der Verbindung gemäß Formel (1) bzw. der oben ausgeführten bevorzugten Ausführungsformen und der emittierenden Verbindung enthält zwischen 99 und 1 Vol.-%, vorzugsweise zwischen 98 und 10 Vol.-%, besonders bevorzugt zwischen 97 und 60 Vol.-%, insbesondere zwischen 95 und 80 Vol.-% der Verbindung gemäß Formel (1) bzw. der oben ausgeführten bevorzugten Ausführungsformen bezogen auf die Gesamtmischung aus Emitter und Matrixmaterial. Entsprechend enthält die Mischung zwischen 1 und 99 Vol.-%, vorzugsweise zwischen 2 und 90 Vol.-%, besonders bevorzugt zwischen 3 und 40 Vol.-%, insbesondere zwischen 5 und 20 Vol.-% des Emitters bezogen auf die Gesamtmischung aus Emitter und Matrixmaterial.
- Eine weitere bevorzugte Ausführungsform der vorliegenden Erfindung ist der Einsatz der Verbindung gemäß Formel (1) bzw. der oben ausgeführten bevorzugten Ausführungsformen als Matrixmaterial für einen phosphoreszierenden Emitter in Kombination mit einem weiteren Matrixmaterial. Besonders geeignete Matrixmaterialien, welche in Kombination mit den Verbindungen gemäß Formel (1) bzw. der oben ausgeführten bevorzugten Ausführungsformen eingesetzt werden können, sind aromatische Ketone, aromatische Phosphinoxide oder aromatische Sulfoxide oder Sulfone, z. B. gemäß
WO 2004/013080 WO 2004/093207 WO 2006/005627 WO 2010/006680 WO 2005/039246 US 2005/0069729 JP 2004/288381 EP 1205527 oderWO 2008/086851 WO 2007/063754 WO 2008/056746 WO 2010/136109 WO 2011/000455 EP 1617710 ,EP 1617711 ,EP 1731584 ,JP 2005/347160 WO 2007/137725 WO 2005/111172 WO 2006/117052 WO 2007/063754 WO 2008/056746 WO 2010/015306 DE 102009053382.6 ,DE 102009053644.2 oderDE 102009053645.0 , Zinkkomplexe, z. B. gemäß EP 652273 oderWO 2009/062578 WO 2010/054729 WO 2010/054730 DE 102009048791.3 undDE 102009053836.4 . Ebenso kann ein weiterer phosphoreszierender Emitter, welcher kürzerwellig als der eigentliche Emitter emittiert, als Co-Host in der Mischung vorhanden sein. - Als phosphoreszierende Verbindungen (= Triplettemitter) eignen sich insbesondere Verbindungen, die bei geeigneter Anregung Licht, vorzugsweise im sichtbaren Bereich, emittieren und außerdem mindestens ein Atom der Ordnungszahl größer 20, bevorzugt größer 38 und kleiner 84, besonders bevorzugt größer 56 und kleiner 80 enthalten, insbesondere ein Metall mit dieser Ordnungszahl. Bevorzugt werden als Phosphoreszenzemitter Verbindungen, die Kupfer, Molybdän, Wolfram, Rhenium, Ruthenium, Osmium, Rhodium, Iridium, Palladium, Platin, Silber, Gold oder Europium enthalten, verwendet, insbesondere Verbindungen, die Iridium oder Platin enthalten.
- Beispiele der oben beschriebenen Emitter können den Anmeldungen
WO 00/70655 WO 01/41512 WO 02/02714 WO 02/15645 EP 1191613 ,EP 1191612 ,EP 1191614 ,WO 05/033244 WO 05/019373 US 2005/0258742 - In einer weiteren Ausführungsform der Erfindung enthält die erfindungsgemäße organische Elektrolumineszenzvorrichtung keine separate Lochinjektionsschicht und/oder Lochtransportschicht und/oder Lochblockierschicht und/oder Elektronentransportschicht, d. h. die emittierende Schicht grenzt direkt an die Lochinjektionschicht oder die Anode an, und/ oder die emittierende Schicht grenzt direkt an die Elektronentransportschicht oder die Elektroneninjektionsschicht oder die Kathode an, wie zum Beispiel in
WO 2005/053051 WO 2009/030981 - In einer weiteren bevorzugten Ausführungsform der Erfindung wird die Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen als Elektronentransportmaterial in einer Elektronentransport- oder Elektroneninjektionsschicht eingesetzt. Dabei kann die emittierende Schicht fluoreszierend oder phosphoreszierend sein. Wenn die Verbindung als Elektronentransportmaterial eingesetzt wird, kann es bevorzugt sein, wenn sie dotiert ist, beispielsweise mit Alkalimetallkomplexen, wie z. B. LiQ (Lithiumhydroxychinolinat).
- In nochmals einer weiteren bevorzugten Ausführungsform der Erfindung wird die Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen in einer Lochblockierschicht eingesetzt. Unter einer Lochblockierschicht wird eine Schicht verstanden, die auf Kathodenseite direkt an eine emittierende Schicht angrenzt.
- Es ist weiterhin möglich, die Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen sowohl in einer Lochblockierschicht bzw. Elektronentransportschicht als auch als Matrix in einer emittierenden Schicht zu verwenden.
- In nochmals einer weiteren Ausführungsform der Erfindung wird die Verbindung gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen in einer Lochtransportschicht bzw. in einer Elektronenblockierschicht bzw. Exzitonenblockierschicht eingesetzt.
- In den weiteren Schichten der erfindungsgemäßen organischen Elektrolumineszenzvorrichtung können alle Materialien verwendet werden, wie sie üblicherweise gemäß dem Stand der Technik eingesetzt werden. Der Fachmann kann daher ohne erfinderisches Zutun alle für organische Elektrolumineszenzvorrichtungen bekannten Materialien in Kombination mit den erfindungsgemäßen Verbindungen gemäß Formel (1) bzw. den oben ausgeführten bevorzugten Ausführungsformen einsetzen.
- Weiterhin bevorzugt ist eine organische Elektrolumineszenzvorrichtung, dadurch gekennzeichnet, dass eine oder mehrere Schichten mit einem Sublimationsverfahren beschichtet werden. Dabei werden die Materialien in Vakuum-Sublimationsanlagen bei einem Anfangsdruck kleiner 10-5 mbar, bevorzugt kleiner 10-6 mbar aufgedampft. Es ist aber auch möglich, dass der Anfangsdruck noch geringer ist, beispielsweise kleiner 10-7 mbar.
- Bevorzugt ist ebenfalls eine organische Elektrolumineszenzvorrichtung, dadurch gekennzeichnet, dass eine oder mehrere Schichten mit dem OVPD (Organic Vapour Phase Deposition) Verfahren oder mit Hilfe einer Trägergassublimation beschichtet werden. Dabei werden die Materialien bei einem Druck zwischen 10-5 mbar und 1 bar aufgebracht. Ein Spezialfall dieses Verfahrens ist das OVJP (Organic Vapour Jet Printing) Verfahren, bei dem die Materialien direkt durch eine Düse aufgebracht und so strukturiert werden (z. B. M. S. Arnold et al., Appl. Phys. Lett. 2008, 92, 053301).
- Weiterhin bevorzugt ist eine organische Elektrolumineszenzvorrichtung, dadurch gekennzeichnet, dass eine oder mehrere Schichten aus Lösung, wie z. B. durch Spincoating, oder mit einem beliebigen Druckverfahren, wie z. B. Siebdruck, Flexodruck, Offsetdruck, LITI (Light Induced Thermal Imaging, Thermotransferdruck), Ink-Jet Druck (Tintenstrahldruck) oder Nozzle Printing, hergestellt werden. Hierfür sind lösliche Verbindungen nötig, welche beispielsweise durch geeignete Substitution erhalten werden. Diese Verfahren eignen sich insbesondere auch für Oligomere, Dendrimere und Polymere.
- Weiterhin sind Hybridverfahren möglich, bei denen beispielsweise eine oder mehrere Schichten aus Lösung aufgebracht werden und eine oder mehrere weitere Schichten aufgedampft werden.
- Diese Verfahren sind dem Fachmann generell bekannt und können von ihm ohne erfinderisches Zutun auf organische Elektrolumineszenzvorrichtungen enthaltend die erfindungsgemäßen Verbindungen angewandt werden.
-
- X
- ist C=O, NR, O, S, C=S, C=NR, C=C(R)2, Si(R)2, BR, PR, P(=O)R, SO oder SO2;
- Y
- ist C, wenn Ar1 eine 6-Ring-Aryl- oder Heteroarylgruppe darstellt, bzw. ist C oder N, wenn Ar1 eine 5-Ring-Heteroarylgruppe darstellt;
- E
- ist gleich oder verschieden bei jedem Auftreten eine Einfachbindung, C(R)2, NR, O, S, C=O, C=S, C=NR, C=C(R)2, Si(R)2, BR, PR, P(=O)R, SO oder SO2;
- Ar1
- ist zusammen mit der Gruppe Y und dem explizit dargestellten Kohlenstoffatom ein aromatisches oder heteroaromatisches Ringsystem mit 5 bis 30 aromatischen Ringatomen, welches durch einen oder mehrere Reste R substituiert sein kann;
- Ar2
- ist zusammen mit den explizit dargestellten Kohlenstoffatomen ein aromatisches oder heteroaromatisches Ringsystem mit 5 bis 30 aromatischen Ringatomen, welches durch einen oder mehrere Reste R substituiert sein kann; wenn Ar2 für ein aromatisches Ringsystem mit mindestens einem Stickstoffatom steht, welches mit einem aromatischen oder heteroaromatischen Rest R substituiert ist, dann enthält dieser Rest R mehr als 6 aromatische C-Atome;
- Ar3
- ist zusammen mit den explizit dargestellten Kohlenstoffatomen ein aromatisches oder heteroaromatisches Ringsystem mit 5 bis 30 aromatischen Ringatomen, welches durch einen oder mehrere Reste R substituiert sein kann;
- R
- ist bei jedem Auftreten gleich oder verschieden ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, I, CN, NO2, N(Ar4)2, N(R1)2, C(=O)Ar4, C(=O)R1, P(=O)(Ar4)2, einer geradkettigen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 1 bis 40 C-Atomen oder einer verzweigten oder cyclischen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 3 bis 40 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R1 substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch R1C=CR1, C≡C, Si(R1)2, Ge(R1)2, Sn(R1)2, C=O, C=S, C=Se, C=NR1, P(=O)(R1), SO, SO2, NR1, O, S oder CONR1 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 80, bevorzugt 5 bis 60, aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R1 substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 60 aromatischen Ringatomen, die mit einem oder mehreren Resten R1 substituiert sein kann, oder einer Kombination dieser Systeme, wobei optional zwei oder mehr benachbarte Substituenten R ein monocyclisches oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können, das mit einem oder mehreren Resten R1 substituiert sein kann;
- R1
- ist bei jedem Auftreten gleich oder verschieden ausgewählt aus der Gruppe bestehend aus H, D, F, Cl, Br, I, CN, NO2, N(Ar4)2, N(R2)2, C(=O)Ar4, C(=O)R2, P(=O)(Ar4)2, einer geradkettigen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 1 bis 40 C-Atomen oder einer verzweigten oder cyclischen Alkyl-, Alkoxy- oder Thioalkylgruppe mit 3 bis 40 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R2 substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch R2C=CR2, C≡C, Si(R2)2, Ge(R2)2, Sn(R2)2, C=O, C=S, C=Se, C=NR2, P(=O)(R2), SO, SO2, NR2, O, S oder CONR2 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 60 aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R2 substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 60 aromatischen Ringatomen, die mit einem oder mehreren Resten R2 substituiert sein kann, oder einer Kombination dieser Systeme, wobei optional zwei oder mehr benachbarte Substituenten R ein monocyclisches oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können, das mit einem oder mehreren Resten R2 substituiert sein kann;
- Ar4
- ist bei jedem Auftreten gleich oder verschieden ein aromatisches oder heteroaromatisches Ringsystem mit 5-30 aromatischen Ringatomen, das mit einem oder mehreren nicht-aromatischen Resten R2 substituiert sein kann; dabei können zwei Reste Ar4, welche an dasselbe N-Atom oder P-Atom binden, auch durch eine Einfachbindung oder eine Brücke, ausgewählt aus N(R2), C(R2)2 oder O, miteinander verbrückt sein;
- R2
- ist ausgewählt aus der Gruppe bestehend aus H, D, F, CN, einem aliphatischem Kohlenwasserstoffrest mit 1 bis 20 C-Atomen, einem aromatischem oder heteroaromatischem Ringsystem mit 5 bis 30 aromatischen Ringatomen, in dem ein oder mehrere H-Atome durch D, F, Cl, Br, I oder CN ersetzt sein können, wobei zwei oder mehr benachbarte Substituenten R2 miteinander ein mono- oder polycyclisches, aliphatisches, aromatisches oder heteroaromatisches Ringsystem bilden können;
- Für die erfindungsgemäßen Verbindungen der Formel (1') gelten dieselben Bevorzugungen, wie oben für die Verbindungen der Formel (1) angegeben.
-
- Die funktionalisierten, insbesondere bromierten Verbindungen stellen den zentralen Baustein für die weitere Funktionalisierung dar, wie in Schema 1 bis 3 dargestellt. So lassen sich diese funktionalisierten Verbindungen leicht durch Suzuki-Kupplung oder Kupplung mit Diarylaminen nach Hartwig-Buchwald mit Carbazol-Derivaten oder Triarylamin-Derivaten zu Verbindungen gemäß Formel (1) bzw. Formel (1') umsetzen.
- Die bromierten Verbindungen können weiterhin lithiiert und durch Reaktion mit Elektrophilen wie Benzonitril und anschließender saurer Hydrolyse zu Ketonen oder mit Chlordiphenylphosphinen und anschließender Oxidation zu Phosphinoxiden umgesetzt werden.
- Ein Verfahren zur Herstellung einer Verbindung gemäß Formel (1') kann folgende Reaktionsschritte umfassen:
- a) Synthese des Grundgerüsts, welches statt der Gruppe R eine reaktive Abgangsgruppe trägt; und
- b) Einführung der Gruppe R, bevorzugt durch eine Kupplungsreaktion, beispielsweise Suzuki-Kupplung oder Hartwig-Buchwald-Kupplung.
- Dabei ist die reaktive Abgangsgruppe bevorzugt ausgewählt aus Cl, Br, I, Boronsäure bzw. Boronsäurederivaten, Triflat oder Tosylat oder V steht für NH, d. h. die reaktive Abgangsgruppe ist Wasserstoff, wenn eine Bindung zwischen N und R geknüpft wird.
- Die oben beschriebenen Verbindungen, insbesondere Verbindungen, welche mit reaktiven Abgangsgruppen, wie Brom, lod, Chlor, Boronsäure oder Boronsäureester, oder mit reaktiven, polymerisierbaren Gruppen, wie Olefinen oder Oxetanen, substituiert sind, können als Monomere zur Erzeugung entsprechender Oligomere, Dendrimere oder Polymere Verwendung finden. Die Oligomerisation bzw. Polymerisation erfolgt dabei bevorzugt über die Halogenfunktionalität bzw. die Boronsäurefunktionalität bzw. über die polymerisierbare Gruppe. Es ist weiterhin möglich, die Polymere über derartige Gruppen zu vernetzen. Die Verbindungen und Polymere können als vernetzte oder unvernetzte Schicht eingesetzt werden.
- Es kann Oligomere, Polymere oder Dendrimere enthaltend eine oder mehrere der oben aufgeführten Verbindungen geben, wobei eine oder mehrere Bindungen der oben aufgeführten Verbindung zum Polymer, Oligomer oder Dendrimer vorhanden sind. Je nach Verknüpfung der Verbindung bildet diese daher eine Seitenkette des Oligomers oder Polymers oder ist in der Hauptkette verknüpft. Die Polymere, Oligomere oder Dendrimere können konjugiert, teilkonjugiert oder nicht-konjugiert sein. Die Oligomere oder Polymere können linear, verzweigt oder dendritisch sein. Für die Wiederholeinheiten der oben aufgeführten Verbindungen in Oligomeren, Dendrimeren und Polymeren gelten dieselben Bevorzugungen, wie oben beschrieben.
- Zur Herstellung der Oligomere oder Polymere werden die Monomere homopolymerisiert oder mit weiteren Monomeren copolymerisiert. Bevorzugt sind Homopolymere oder Copolymere, wobei die Einheiten gemäß Formel (1') bzw. die oben ausgeführten bevorzugten Ausführungsformen zu 0.01 bis 99.9 mol%, bevorzugt 5 bis 90 mol%, besonders bevorzugt 20 bis 80 mol% vorhanden sind. Geeignete und bevorzugte Comonomere, welche das Polymergrundgerüst bilden, sind gewählt aus Fluorenen (z. B. gemäß
EP 842208 WO 2000/22026 EP 707020 EP 894107 WO 2006/061181 WO 92/18552 WO 2004/070772 WO 2004/113468 EP 1028136 ), Dihydrophenanthrenen (z. B. gemäßWO 2005/014689 WO 2004/041901 WO 2004/113412 WO 2005/040302 WO 2005/104264 WO 2007/017066 - Weiterhin können die Verbindungen gemäß Formel (1') bzw. die oben ausgeführten bevorzugten Ausführungsformen auch weiter funktionalisiert werden und so zu erweiterten Strukturen umgesetzt werden. Hier ist als Beispiel die Umsetzung mit Arylboronsäuren gemäß Suzuki oder mit primären oder sekundären Aminen gemäß Hartwig-Buchwald zu nennen. So können die Verbindungen gemäß Formel (1') bzw. die oben ausgeführten bevorzugten Ausführungsformen auch direkt an phosphoreszierende Metallkomplexe oder auch an andere Metallkomplexe gebunden werden.
- Ein weiterer Gegenstand der vorliegenden Erfindung ist daher die Verwendung der oben ausgeführten erfindungsgemäßen Verbindungen gemäß Formel (1') in einer elektronischen Vorrichtung, insbesondere in einer organischen Elektrolumineszenzvorrichtung.
- Die erfindungsgemäßen Verbindungen und die erfindungsgemäßen organischen Elektrolumineszenzvorrichtungen zeichnen sich durch folgende überraschende Vorteile gegenüber dem Stand der Technik aus:
- 1. Die erfindungsgemäßen Verbindungen bzw. Verbindungen gemäß Formel (1) bzw. die oben ausgeführten bevorzugten Ausführungsformen, eingesetzt als Matrixmaterial für fluoreszierende oder phosphoreszierende Emitter, führen zu sehr hohen Effizienzen sowie zu langen Lebensdauern. Dies gilt insbesondere, wenn die Verbindungen als Matrixmaterial für einen rot oder grün phosphoreszierenden Emitter eingesetzt werden.
- 2. Die erfindungsgemäßen Verbindungen weisen eine hohe thermische Stabilität auf.
- 3. Die erfindungsgemäßen Verbindungen, eingesetzt in organischen Elektrolumineszenzvorrichtungen, führen zu hohen Effizienzen und zu steilen Strom-Spannungs-Kurven mit niedrigen Einsatzspannungen.
- 4. Auch bei Verwendung als Elektronentransportmaterial führen die erfindungsgemäßen Verbindungen zu sehr guten Eigenschaften in Bezug auf die Effizienz, die Lebensdauer und die Betriebsspannung von organischen Elektrolumineszenzvorrichtungen.
- Diese oben genannten Vorteile gehen nicht mit einer Verschlechterung der weiteren elektronischen Eigenschaften einher.
- Die Erfindung wird durch die nachfolgenden Beispiele näher erläutert, ohne sie dadurch einschränken zu wollen. Der Fachmann kann aus den Schilderungen die Erfindung im gesamten offenbarten Bereich ausführen und ohne erfinderisches Zutun weitere erfindungsgemäße Verbindungen herstellen und diese in elektronischen Vorrichtungen verwenden bzw. das erfindungsgemäße Verfahren anwenden.
- Beispiele:
- Die nachfolgenden Synthesen werden, sofern nicht anders angegeben, unter einer Schutzgasatmosphäre durchgeführt. Die Edukte können von den Firmen ALDRICH bzw. ABCR (Palladium(II)acetat, Tri-o-tolylphosphin, Anorganika, Lösemittel) bezogen werden. Die Synthese von 3-Phenyl-4-(phenylsulfonyl)-4H-Furo[3,4-b]indol kann gemäß der Literatur (Journal of Organic Chemistry 2002, 67(3), 1001-1003) erfolgen. Ebenso sind die Synthesen von 11,12-Dihydro-11-phenyl-indolo[2,3-a]carbazol (
WO 2009/136595 DE 102009023155.2 ) aus der Literatur bekannt. - Beispiel 1a: 3-Phenyl-4H-furo[3,4-b]indol
-
-
- Beispiel 2a: 2-Brom-phenyl-(3-phenyl-furo[3,4-b]indol-4-yl)methanon
-
- Analog werden folgende Verbindungen erhalten:
- Beispiel 2i :(1-Chlor-benzo[4,5]furo[3,2-b]indol-10-yl)phenylmethanon
-
-
- Beispiel 2m: 4-(2-Bromo-benzenesulfonyl)-3-phenyl-4H-furo[3,4b]indol
-
-
- Beispiel 3a: Cyclisierung
-
-
- Beispiel 4a: Monobromierung
-
- Analog werden folgende Verbindungen erhalten:
- Beispiel 4q: Zweifache Bromierung
-
-
- Beispiel 5a: Reduktion
-
-
- Beispiel 6a: Carbazolbildung
-
-
- Beispiel 7a: Hartwig-Buchwald-Reaktion
-
- Analog werden folgende Verbindungen erhalten:
- Beispiel 8a: Suzuki-Reaktion
-
- Analog werden folgende Verbindungen erhalten:
- Beispiel 9a:
- Eine Suspension von 16.7 (100 mmol) Carbazol [86-74-8], 41.1 g (110 mmol) (2-Bromphenyl)-diphenyl-chlorsilan (dargestellt in Analogie zu (2-Bromphenyl)-dimethylchlorsilan aus 1,2-Dibrombenzol und Dichlordiphenylsilan nach Kawachi et al., Organometallics (2007), 26(19), 4697), 22.2 g (200 mmol) Natriumcarbonat, 449 mg (2 mmol) Palladium(II)acetat, 1.6 g (6 mmol) Triphenylphosphin und 100 g Glasperlen (3 mm Durchmesser) in 500 ml Xylol wird unter gutem Rühren 16 h unter Rückfluss erhitzt. Anschließend filtriert man von den Glaskugeln und den Salzen über Celite ab, engt die organische Phase ein, kristallisiert den Rückstand fünfmal aus DMF um und sublimiert zweimal im Hochvakuum. Die Ausbeute beträgt 17.4 g (41 mmol), entsprechend 41 % der Theorie.
-
- Beispiel 10: Herstellung der OLEDs
- Die Herstellung von erfindungsgemäßen OLEDs sowie OLEDs nach dem Stand der Technik erfolgt nach einem allgemeinen Verfahren gemäß
WO 2004/058911 - In den folgenden Beispielen E1 bis E37 (siehe Tabellen 1 und 2) werden die Daten verschiedener OLEDs vorgestellt. Glasplättchen, die mit strukturiertem ITO (Indium Zinn Oxid) der Dicke 150 nm beschichtet sind werden zur verbesserten Prozessierung mit 20 nm PEDOT beschichtet (Poly(3,4-ethylendioxy-2,5-thiophen), aus Wasser aufgeschleudert; bezogen von H. C. Starck, Goslar, Deutschland). Diese beschichteten Glasplättchen bilden die Substrate, auf welche die OLEDs aufgebracht werden. Die OLEDs haben prinzipiell folgenden Schichtaufbau: Substrat / optionale Lochinjektionsschicht (HIL) / Lochtransportschicht (HTL) / optionale Zwischenschicht (IL) / Elektronenblockerschicht (EBL) / Emissionsschicht (EML) / optionale Lochblockierschicht (HBL) / Elektronentransportschicht (ETL) / optionale Elektroneninjektionsschicht (EIL) und abschließend eine Kathode. Die Kathode wird durch eine 100 nm dicke Aluminiumschicht gebildet. Der genaue Aufbau der OLEDs ist Tabelle 1 zu entnehmen. Eine Bezeichnung wie „3a“ bezieht sich hierbei auf die in den Tabellen oben zu dem Beispiel 3a gezeigten Materialien. Die weiteren zur Herstellung der OLEDs benötigten Materialien sind in Tabelle 3 gezeigt.
- Alle Materialien werden in einer Vakuumkammer thermisch aufgedampft. Dabei besteht die Emissionsschicht immer aus mindestens einem Matrixmaterial (Hostmaterial, Wirtsmaterial) und einem emittierenden Dotierstoff (Dotand, Emitter), der dem Matrixmaterial bzw. den Matrixmaterialien durch Coverdampfung in einem bestimmten Volumenanteil beigemischt wird. Eine Angabe wie ST1:9a:TEG1 (30%:60%:10%) bedeutet hierbei, dass das Material ST1 in einem Volumenanteil von 30%, 9a in einem Volumenanteil von 60% und TEG1 in einem Anteil von 10% in der Schicht vorliegt. Analog kann auch die Elektronentransportschicht aus einer Mischung von zwei Materialien bestehen.
- Die OLEDs werden standardmäßig charakterisiert. Hierfür werden die Elektrolumineszenzspektren, die Stromeffizienz (gemessen in cd/A), die Leistungseffizienz (gemessen in Im/W) und die externe Quanteneffizienz (EQE, gemessen in Prozent) in Abhängigkeit der Leuchtdichte, berechnet aus Strom-Spannungs-Leuchtdichte-Kennlinien (IUL-Kennlinien) sowie die Lebensdauer bestimmt. Die Elektrolumineszenzspektrum werden bei einer Leuchtdichte von 1000 cd/m2 bestimmt und daraus die CIE 1931 x und y Farbkoordinaten berechnet. Die Angabe U1000 in Tabelle 2 bezeichnet die Spannung, die für eine Leuchtdichte von 1000 cd/m2 benötigt wird. SE1000 und LE1000 bezeichnen die Strom- bzw. Leistungseffizienz, die bei 1000 cd/m2 erreicht werden. EQE1000 schließlich ist die externe Quanteneffizienz bei einer Betriebsleuchtdichte von 1000 cd/m2.
- Die Daten der verschiedenen OLEDs sind in Tabelle 2 zusammengefasst.
- Im Folgenden werden einige der Beispiele näher erläutert. Es sei jedoch darauf hingewiesen, dass dies nur eine Auswahl der in Tabelle 2 gezeigten Daten darstellt.
- Verwendung von erfindungsgemäßen Verbindungen als Elektronentransportmaterialien
- Bei Einsatz von erfindungsgemäßen Materialien in der Elektronentransportschicht erhält man gute Spannungen, Effizienzen und Lebensdauern. In Kombination mit dem blau fluoreszierenden Dotanden D1 erhält man z.B. eine Spannung von 4.9 V (Beispiel E5). Bei Verwendung einer Misch-Schicht des Materials 8n mit LiQ erhält man eine externe Quanteneffizienz von 5.3 % (Beispiel E6). OLEDs gemäß Beispiels E4 zeigen bei Betrieb mit konstantem Strom einen Abfall der Helligkeit von 6000 auf 3000 cd/m2 („LT50“) nach einer Betriebsdauer von etwa 170 h, was einen sehr guten Wert darstellt. Dies entspricht einer Lebensdauer von etwa 6000h bei 1000 cd/m2.
- Verwendung von erfindungsgemäßen Verbindungen als Matrixmaterialien in phosphoreszierenden OLEDs
- Bei Verwendung von erfindungsgemäßen Materialien als Matrix für phosphoreszente Emitter erhält man ebenfalls sehr gute Leistungsdaten.
- Mit der Verbindung 8o z.B. erhält man in Kombination mit dem grün emittierenden Material TEG1 eine sehr gute externe Quanteneffizienz von 15.2 %, was in Verbindung mit der geringen Spannung von 3.5 V zu einer sehr guten Leistungseffizienz von 49 Im/W führt (Beispiel E16). Die entsprechenden OLEDs zeigen bei Betrieb mit konstantem Strom einen Abfall der Helligkeit von 4000 auf 3200 cd/m2 innerhalb von etwa 340 h („LT80“). Bei Verwendung von erfindungsgemäßen Materialien als zweite Matrixkomponenten erhält man noch bessere LT80 Werte von bis zu 420 h bei einer Starthelligkeit von 4000 cd/m2 (Beispiel E18).
- In Kombination mit dem rot emittierenden Dotanden TER1 ergeben sich ebenfalls gute Leistungsdaten. So erhält man z.B. mit Verbindung 7t als Matrix eine externe Quanteneffizienz von 13.6 %, was mit der Spannung von 4.6 V eine Leistungseffizienz von 5.9 Im/W ergibt. Für diese Kombination erhält man einen LT80 Wert von ca. 410 h bei einer Starthelligkeit von 4000 cd/m2 (Beispiel E35). Noch bessere Lebensdauern lassen sich bei Einsatz der Verbindungen 7k bzw. 71 erzielen. Man erhält hiermit LT80 Werte von etwa 520 bzw. 460 h (Beispiele E29, E30).
- Verwendung von erfindungsgemäßen Verbindungen als Dotand in blau fluoreszierenden OLEDs
- Die Verbindung 31 lässt sich als blau fluoreszierender Dotand einsetzen. Man erhält hierbei tiefblaue Farbkoordinaten mit CIE x/y = 0.14/0.14 sowie eine externe Quanteneffizienz von 4.7% bei einer Spannung von 4.4 V (Beispiel E20).der OLEDs Tabelle 1: Aufbau der OLEDs
Bsp. HIL HTL IL EBL EML HBL ETL EIL Dicke Dicke Dicke Dicke Dicke Dicke Dicke Dicke E1 HATCN SpA1 --- NPB M1:D1 (95%:5%) --- 3j LiQ 5nm 140nm 20nm 30nm 20nm 3nm E2 HATCN SpA1 --- NPB M1:D1 (95%:5%) --- 7m LiQ 5nm 140nm 20nm 30nm 20nm 3nm E3 HATCN SpA1 --- NPB M1:D1 (95%:5%) --- 8d LiQ 5nm 140nm 20nm 30nm 20nm 3nm E4 HATCN SpA1 --- NPB M1:D1 (95%:5%) --- 8e LiF 5nm 140nm 20nm 30nm 20nm 1.5nm E5 HATCN SpA1 --- NPB M1:D1 (95%:5%) --- 8i LiQ 5nm 140nm 20nm 30nm 20nm 3nm E6 HATCN SpA1 --- NPB M1:D1 (95%:5%) --- 8n:LiQ (50%:50%) --- 5nm 140nm 20nm 30nm 20nm E7 --- SpA1 HATCN BPA1 3h:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E8 --- SpA1 HATCN BPA1 6a:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E9 --- SpA1 HATCN BPA1 6c:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E10 --- SpA1 HATCN BPA1 7n:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E11 --- SpA1 HATCN BPA1 7o:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E12 --- SpA1 HATCN BPA1 7w:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E13 --- SpA1 HATCN BPA1 8k:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E14 --- SpA1 HATCN BPA1 8l:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E15 --- SpA1 HATCN BPA1 8m:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E16 --- SpA1 HATCN BPA1 8o:TEG1 (90%:10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E17 --- SpA1 HATCN BPA1 8q:TEG1 (90%: 10%) ST1 ST1:LiQ (50%:50%) --- 70nm 5nm 20nm 30nm 10nm 30 nm E18 --- ST1 :9a:TEG1 --- SpA1 HATCN BPA1 (30%:60%:10%) ST1 ST1:LiQ (50%:50%) 70nm 5nm 20nm 30nm 10nm 30 nm E19 --- ST1 :9e:TEG1 --- SpA1 HATCN BPA1 ST1 ST1:LiQ (50%:50%) 70nm 5nm 20nm (30%:60%:10%) 10nm 30 nm 30nm E20 HATCN SpA1 --- NPB M1:3l (95%:5%) --- ST1 LiQ 5nm 140nm 20nm 30nm 35nm 3nm E21 --- SpA1 HATCN NPB 3a:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E22 --- SpA1 HATCN NPB 6b:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E23 --- SpA1 HATCN NPB 7a:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E24 --- SpA1 HATCN NPB 7b:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E25 --- SpA1 HATCN NPB 7e:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E26 --- SpA1 HATCN NPB 7f:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E27 --- SpA1 HATCN NPB 7g:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E28 --- SpA1 HATCN NPB 7j:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E29 --- SpA1 HATCN NPB 7k:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E30 --- SpA1 HATCN NPB 7l:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E31 --- SpA1 HATCN NPB 7p:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E32 --- SpA1 HATCN NPB 7q:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E33 --- SpA1 HATCN NPB 7r:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E34 --- SpA1 HATCN NPB 7s:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E35 --- SpA1 HATCN NPB 7t:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E36 --- SpA1 HATCN NPB 7v:TER1 (85%:15%) ST1 ST1:LiQ (50%:50%) --- 160nm 5nm 20nm 35nm 10nm 35nm E37 --- ST1 :9f:TER1 --- SpA1 HATCN NPB (30%:60%:10%) ST1 ST1:LiQ (50%:50%) 160nm 5nm 20nm 35nm 10nm 35nm Bsp. U1000 SE1000 LE1000 EQE CIE x/y bei (V) (cd/A) (Im/W) 1000 1000 cd/m2 E1 5.9 4.8 2.6 4.0% 0.14/0.15 E2 6.3 4.5 2.2 3.7% 0.14/0.15 E3 5.8 5.5 3.0 4.5% 0.14/0.15 E4 5.5 5.8 3.3 4.8% 0.14/0.15 E5 4.9 6.3 4.0 5.2% 0.14/0.15 E6 5.1 6.4 3.9 5.3% 0.14/0.15 E7 4.3 46 34 12.7% 0.37/0.61 E8 4.0 43 33 11.9% 0.37/0.61 E9 3.9 49 39 13.7% 0.37/0.60 E10 3.6 39 34 10.8% 0.36/0.59 E11 3.5 44 40 12.3% 0.37/0.60 E12 3.9 51 42 14.2% 0.36/0.60 E13 4.1 48 37 13.4% 0.37/0.60 E14 3.5 41 37 11.5% 0.37/0.61 E15 3.8 36 30 10.1% 0.37/0.61 E16 3.5 55 49 15.2% 0.37/0.60 E17 3.7 44 38 12.2% 0.37/0.61 E18 3.7 49 42 13.6% 0.37/0.61 E19 3.8 46 38 12.9% 0.37/0.61 E20 4.4 5.1 3.6 4.7% 0.14/0.14 E21 4.7 7.3 4.9 11.5% 0.69/0.31 E22 5.3 7.0 4.1 10.9% 0.69/0.31 E23 5.1 5.9 3.6 9.3% 0.69/0.31 E24 5.4 5.5 3.2 8.6% 0.69/0.31 E25 4.5 6.2 4.3 9.7% 0.69/0.31 E26 5.1 6.7 4.1 10.4% 0.69/0.31 E27 4.9 6.4 4.1 10.1% 0.69/0.31 E28 4.3 7.2 5.3 11.5% 0.69/0.31 E29 4.7 8.3 5.6 13.0% 0.69/0.31 E30 4.4 7.8 5.6 12.2% 0.69/0.31 E31 6.3 5.5 2.7 8.6% 0.69/0.31 E32 5.9 5.3 2.8 8.3% 0.69/0.31 E33 5.3 6.1 3.6 9.6% 0.69/0.31 E34 4.8 7.2 4.7 11.3% 0.69/0.31 E35 4.6 8.6 5.9 13.6% 0.69/0.31 E36 4.9 6.8 4.3 10.7% 0.69/0.31 E37 4.1 7.5 5.8 11.9% 0.69/0.31 HATCN SpA1 BPA1 ST1 TER1 TEG1 NPB LiQ M1 D1
Claims (12)
- Elektronische Vorrichtung enthaltend mindestens eine Verbindung gemäß der folgenden Formel (1),
- Elektronische Vorrichtung nach
Anspruch 1 , ausgewählt aus der Gruppe bestehend aus organischen Elektrolumineszenzvorrichtungen (OLEDs), organischen integrierten Schaltungen (O-ICs), organischen Feld-Effekt-Transistoren (O-FETs), organischen Dünnfilmtransistoren (O-TFTs), organischen lichtemittierenden Transistoren (O-LETs), organischen Solarzellen (O-SCs), organischen optischen Detektoren, organischen Photorezeptoren, organischen Feld-Quench-Devices (O-FQDs), lichtemittierenden elektrochemischen Zellen (LECs), organischen Laserdioden (O-Laser) und „organic plasmon emitting devices“. - Elektronische Vorrichtung nach
Anspruch 1 oder2 , dadurch gekennzeichnet, dass die Gruppe Ar1 für eine Gruppe der folgenden Formel (2), (3), (4), (5) oder (6) steht, - Elektronische Vorrichtung nach einem oder mehreren der
Ansprüche 1 bis3 , dadurch gekennzeichnet, dass die Gruppe Ar2 für eine Gruppe gemäß einer der folgenden Formeln (9), (10) oder (11) steht, - Elektronische Vorrichtung nach einem oder mehreren der
Ansprüche 1 bis4 , dadurch gekennzeichnet, dass die Gruppe Ar3 für eine Gruppe gemäß einer der folgenden Formeln (12), (13), (14) oder (15) steht, - Elektronische Vorrichtung nach einem oder mehreren der
Ansprüche 1 bis5 , dadurch gekennzeichnet, dass für die Verbindungen gemäß Formel (1) gilt: X ist C=O, CR2, SiR2, P(=O)R oder SO2; E ist gleich oder verschieden bei jedem Auftreten eine Einfachbindung, CR2, C=O, NR, O oder S; Ar1 ist ausgewählt aus den Gruppen der Formeln (2), (3), (4), (5) oder (6) gemäßAnspruch 3 ; Ar2 ist ausgewählt aus den Gruppen der Formeln (9), (10) oder (11) gemäßAnspruch 4 ; Ar3 ist ausgewählt aus den Gruppen der Formeln (12), (13), (14) oder (15) gemäßAnspruch 5 . - Elektronische Vorrichtung nach einem oder mehreren der
Ansprüche 1 bis10 , dadurch gekennzeichnet, dass R gleich oder verschieden bei jedem Auftreten ausgewählt ist aus der Gruppe bestehend aus H, D, F, Cl, Br, CN, N(Ar1)2, C(=O)Ar1, einer geradkettigen Alkyl- oder Alkoxygruppe mit 1 bis 10 C-Atomen oder einer verzweigten oder cyclischen Alkyl- oder Alkoxygruppe mit 3 bis 10 C-Atomen oder einer Alkenyl- oder Alkinylgruppe mit 2 bis 10 C-Atomen, die jeweils mit einem oder mehreren Resten R1 substituiert sein kann, wobei eine oder mehrere nicht-benachbarte CH2-Gruppen durch O ersetzt sein können und wobei ein oder mehrere H-Atome durch D oder F ersetzt sein können, einem aromatischen oder heteroaromatischen Ringsystem mit 5 bis 30 aromatischen Ringatomen, das jeweils mit einem oder mehreren Resten R1 substituiert sein kann, einer Aryloxy- oder Heteroaryloxygruppe mit 5 bis 30 aromatischen Ringatomen, die mit einem oder mehreren Resten R1 substituiert sein kann, oder einer Kombination dieser Systeme. - Elektronische Vorrichtung nach nach einem oder mehreren der
Ansprüche 1 bis11 , dadurch gekennzeichnet, dass die elektronische Vorrichtung eine organische Elektrolumineszenzvorrichtung ist, und die Verbindung gemäß Formel (1) als Matrixmaterial für fluoreszierende oder phosphoreszierende Emitter und/oder in einer Lochblockierschicht und/oder in einer Elektronentransportschicht und/oder in einer elektronenblockierenden bzw. exzitonenblockierenden Schicht und/oder in einer Lochtransportschicht und/oder in einer optischen Auskopplungsschicht eingesetzt wird.
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102010019306.2A DE102010019306B4 (de) | 2010-05-04 | 2010-05-04 | Organische Elektrolumineszenzvorrichtungen |
| US13/695,933 US9139582B2 (en) | 2010-05-04 | 2011-03-29 | Organic electroluminescent devices |
| PCT/EP2011/001573 WO2011137951A1 (de) | 2010-05-04 | 2011-03-29 | Organische elektrolumineszenzvorrichtungen |
| CN201180022284.9A CN102869662B (zh) | 2010-05-04 | 2011-03-29 | 有机电致发光器件 |
| KR1020127031796A KR101857828B1 (ko) | 2010-05-04 | 2011-03-29 | 유기 전계발광 소자 |
| JP2013508381A JP6009435B2 (ja) | 2010-05-04 | 2011-03-29 | 有機エレクトロルミネッセンス素子 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102010019306.2A DE102010019306B4 (de) | 2010-05-04 | 2010-05-04 | Organische Elektrolumineszenzvorrichtungen |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE102010019306A1 DE102010019306A1 (de) | 2011-11-10 |
| DE102010019306B4 true DE102010019306B4 (de) | 2021-05-20 |
Family
ID=43919961
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE102010019306.2A Active DE102010019306B4 (de) | 2010-05-04 | 2010-05-04 | Organische Elektrolumineszenzvorrichtungen |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9139582B2 (de) |
| JP (1) | JP6009435B2 (de) |
| KR (1) | KR101857828B1 (de) |
| CN (1) | CN102869662B (de) |
| DE (1) | DE102010019306B4 (de) |
| WO (1) | WO2011137951A1 (de) |
Families Citing this family (155)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102011106849A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Verfahren zur Synthese N-N verknüpfter und um die N-N Bindung rotationsgehinderter bis-N-heterocyclische Carbene und deren Einsatz als Liganden für Metallkomplexe |
| KR101967014B1 (ko) | 2011-08-10 | 2019-04-08 | 메르크 파텐트 게엠베하 | 금속 착물 |
| CA2849087A1 (en) | 2011-09-21 | 2013-03-28 | Merck Patent Gmbh | Carbazole derivatives for organic electroluminescent devices |
| EP2768808B1 (de) | 2011-10-20 | 2017-11-15 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP2773721B1 (de) | 2011-11-01 | 2015-11-25 | Merck Patent GmbH | Organische elektrolumineszenzvorrichtung |
| KR102357439B1 (ko) | 2012-02-14 | 2022-02-08 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 스피로비플루오렌 화합물 |
| KR101527275B1 (ko) * | 2012-05-31 | 2015-06-09 | 주식회사 엘지화학 | 유기전계발광소자 |
| KR102125199B1 (ko) | 2012-07-23 | 2020-06-22 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| US9741942B2 (en) | 2012-10-11 | 2017-08-22 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR101963104B1 (ko) | 2012-10-31 | 2019-03-28 | 메르크 파텐트 게엠베하 | 전자 디바이스 |
| JP2014107521A (ja) * | 2012-11-30 | 2014-06-09 | Samsung Display Co Ltd | 有機電界発光素子用電荷輸送材料及びそれを用いた有機電界発光素子 |
| WO2014094964A1 (de) * | 2012-12-18 | 2014-06-26 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| US20150340627A1 (en) | 2013-01-03 | 2015-11-26 | Merck Patent Gmbh | Materials for electronic devices |
| EP2941472B1 (de) | 2013-01-03 | 2018-07-25 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| US10069079B2 (en) | 2013-04-08 | 2018-09-04 | Merck Patent Gmbh | Organic electroluminescent device with thermally activated delayed fluorescence material |
| CN111430557A (zh) * | 2013-04-08 | 2020-07-17 | 默克专利有限公司 | 有机电致发光器件 |
| WO2015000542A1 (de) * | 2013-07-02 | 2015-01-08 | Merck Patent Gmbh | Spirokondensierte lact amverbi ndungen für organische elektrolumineszenzvorrichtungen |
| KR20150058082A (ko) * | 2013-11-20 | 2015-05-28 | 주식회사 동진쎄미켐 | 신규한 발광 화합물 및 이를 포함하는 유기발광소자 |
| US20170012219A1 (en) * | 2014-02-28 | 2017-01-12 | Merck Patent Gmbh | Materials for organic light-emitting devices |
| EP3140302B1 (de) | 2014-05-05 | 2019-08-21 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102014008722B4 (de) | 2014-06-18 | 2024-08-22 | Merck Patent Gmbh | Zusammensetzungen für elektronische Vorrichtungen, Formulierung diese enthaltend, Verwendung der Zusammensetzung, Verwendung der Formulierung sowie organische elektronische Vorrichtung enthaltend die Zusammensetzung |
| CN104109134A (zh) * | 2014-06-26 | 2014-10-22 | 陕西科技大学 | 一种n-酰基吩噻嗪及其制备方法 |
| JP6629291B2 (ja) | 2014-07-21 | 2020-01-15 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 電子素子用材料 |
| KR102502791B1 (ko) * | 2014-10-24 | 2023-02-22 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자 |
| JP2017537085A (ja) | 2014-11-11 | 2017-12-14 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンス素子のための材料 |
| JP6772188B2 (ja) | 2015-02-03 | 2020-10-21 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 金属錯体 |
| US10249831B2 (en) | 2015-02-09 | 2019-04-02 | Merck Patent Gmbh | Electronic device containing cyclic lactams |
| JP6862420B2 (ja) | 2015-08-13 | 2021-04-21 | メルク パテント ゲーエムベーハー | ヘキサメチルインダン |
| JP6786591B2 (ja) | 2015-08-14 | 2020-11-18 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 有機エレクトロルミネッセンス素子のためのフェノキサジン誘導体 |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| KR102851400B1 (ko) | 2016-03-03 | 2025-08-29 | 메르크 파텐트 게엠베하 | 유기 전계 발광 장치용 재료 |
| TWI745361B (zh) | 2016-03-17 | 2021-11-11 | 德商麥克專利有限公司 | 具有螺聯茀結構之化合物 |
| CN108884087A (zh) | 2016-04-11 | 2018-11-23 | 默克专利有限公司 | 包含二苯并呋喃和/或二苯并噻吩结构的杂环化合物 |
| WO2017186760A1 (en) | 2016-04-29 | 2017-11-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US11447464B2 (en) | 2016-09-14 | 2022-09-20 | Merck Patent Gmbh | Compounds with spirobifluorene-structures |
| TW201827425A (zh) | 2016-09-14 | 2018-08-01 | 德商麥克專利有限公司 | 具有咔唑結構之化合物 |
| TWI766884B (zh) | 2016-09-30 | 2022-06-11 | 德商麥克專利有限公司 | 具有二氮雜二苯并呋喃或二氮雜二苯并噻吩結構的化合物、其製法及其用途 |
| US20200028091A1 (en) | 2016-09-30 | 2020-01-23 | Merck Patent Gmbh | Carbazoles with diazadibenzofurane or diazadibenzothiophene structures |
| TWI764942B (zh) | 2016-10-10 | 2022-05-21 | 德商麥克專利有限公司 | 電子裝置 |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| JP2020512273A (ja) | 2016-11-02 | 2020-04-23 | メルク パテント ゲーエムベーハー | 電子デバイス用材料 |
| JP7073388B2 (ja) | 2016-11-08 | 2022-05-23 | メルク パテント ゲーエムベーハー | 電子デバイスのための化合物 |
| US11345687B2 (en) | 2016-11-09 | 2022-05-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI756292B (zh) | 2016-11-14 | 2022-03-01 | 德商麥克專利有限公司 | 具有受體基團與供體基團之化合物 |
| EP3541890B1 (de) | 2016-11-17 | 2020-10-28 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| TW201833118A (zh) | 2016-11-22 | 2018-09-16 | 德商麥克專利有限公司 | 用於電子裝置之材料 |
| TW201829385A (zh) | 2016-11-30 | 2018-08-16 | 德商麥克專利有限公司 | 具有戊內醯胺結構之化合物 |
| TW201831468A (zh) | 2016-12-05 | 2018-09-01 | 德商麥克專利有限公司 | 含氮的雜環化合物 |
| US11261291B2 (en) | 2016-12-22 | 2022-03-01 | Merck Patent Gmbh | Materials for electronic devices |
| KR102504432B1 (ko) | 2016-12-22 | 2023-02-27 | 메르크 파텐트 게엠베하 | 적어도 2종의 유기-기능성 화합물을 포함하는 혼합물 |
| TW201833300A (zh) | 2017-01-25 | 2018-09-16 | 德商麥克專利有限公司 | 咔唑衍生物 |
| CN110291064B (zh) | 2017-02-02 | 2023-04-28 | 默克专利有限公司 | 用于电子器件的材料 |
| KR20190126097A (ko) | 2017-03-01 | 2019-11-08 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스 |
| CN110325524A (zh) | 2017-03-02 | 2019-10-11 | 默克专利有限公司 | 用于有机电子器件的材料 |
| TW201843143A (zh) | 2017-03-13 | 2018-12-16 | 德商麥克專利有限公司 | 含有芳基胺結構之化合物 |
| JP7155142B2 (ja) | 2017-03-15 | 2022-10-18 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセントデバイス用の材料 |
| WO2018189134A1 (de) | 2017-04-13 | 2018-10-18 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| KR102592390B1 (ko) | 2017-05-11 | 2023-10-20 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 카르바졸계 바디피스 |
| EP3621970B1 (de) | 2017-05-11 | 2021-01-13 | Merck Patent GmbH | Bororganische komplexe für organische elektrolumineszente vorrichtungen |
| CN107235990B (zh) * | 2017-06-11 | 2019-01-29 | 湘潭大学 | 多取代吲哚并噻吩及衍生物及其合成方法 |
| TW201920343A (zh) | 2017-06-21 | 2019-06-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| US11767299B2 (en) | 2017-06-23 | 2023-09-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN110770363A (zh) | 2017-06-26 | 2020-02-07 | 默克专利有限公司 | 均质混合物 |
| TW201920070A (zh) | 2017-06-28 | 2019-06-01 | 德商麥克專利有限公司 | 用於電子裝置之材料 |
| WO2019007867A1 (de) * | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| CN110785415A (zh) | 2017-07-05 | 2020-02-11 | 默克专利有限公司 | 用于有机电子器件的组合物 |
| TWI779067B (zh) | 2017-07-28 | 2022-10-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| CN118405981A (zh) | 2017-09-08 | 2024-07-30 | 默克专利有限公司 | 用于电子器件的材料 |
| CN111065640B (zh) | 2017-09-12 | 2023-04-18 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR102418331B1 (ko) * | 2017-09-25 | 2022-07-08 | 삼성디스플레이 주식회사 | 함규소 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| KR102671945B1 (ko) | 2017-10-06 | 2024-06-03 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| CN108675975A (zh) | 2017-10-17 | 2018-10-19 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| TWI785142B (zh) | 2017-11-14 | 2022-12-01 | 德商麥克專利有限公司 | 用於有機電子裝置之組成物 |
| EP4242286A3 (de) | 2017-11-23 | 2023-10-04 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| TWI820057B (zh) | 2017-11-24 | 2023-11-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| TWI838352B (zh) | 2017-11-24 | 2024-04-11 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| KR102638811B1 (ko) | 2017-12-15 | 2024-02-21 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 치환된 방향족 아민 |
| TW201938562A (zh) | 2017-12-19 | 2019-10-01 | 德商麥克專利有限公司 | 雜環化合物 |
| KR20200100699A (ko) | 2017-12-20 | 2020-08-26 | 메르크 파텐트 게엠베하 | 헤테로방향족 화합물 |
| TWI802656B (zh) | 2018-03-06 | 2023-05-21 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| TW201938761A (zh) | 2018-03-06 | 2019-10-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| US20210020843A1 (en) | 2018-03-16 | 2021-01-21 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP3823958B1 (de) | 2018-07-20 | 2023-08-23 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| TWI837167B (zh) | 2018-08-28 | 2024-04-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| KR20210052487A (ko) | 2018-08-28 | 2021-05-10 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| TWI823993B (zh) | 2018-08-28 | 2023-12-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| TW202030902A (zh) | 2018-09-12 | 2020-08-16 | 德商麥克專利有限公司 | 電致發光裝置 |
| JP7459065B2 (ja) | 2018-09-12 | 2024-04-01 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンスデバイス用の材料 |
| TWI826522B (zh) | 2018-09-12 | 2023-12-21 | 德商麥克專利有限公司 | 電致發光裝置 |
| US12178124B2 (en) | 2018-09-27 | 2024-12-24 | Merck Kgaa | Compounds that can be used in an organic electronic device as active compounds |
| WO2020064662A2 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| KR20210088597A (ko) | 2018-10-31 | 2021-07-14 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| EP3877369A1 (de) | 2018-11-05 | 2021-09-15 | Merck Patent GmbH | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| KR20210089205A (ko) * | 2018-11-06 | 2021-07-15 | 메르크 파텐트 게엠베하 | Oled 용 유기 전계 발광 재료로서 5,6-디페닐-5,6-디히드로디벤즈[c,e][1,2]아자포스포린 및 6-페닐-6h-디벤조[c,e][1,2]티아진-5,5-디옥사이드 유도체 및 유사한 화합물 |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| KR20210097741A (ko) * | 2018-11-30 | 2021-08-09 | 메르크 파텐트 게엠베하 | 전자 디바이스용 화합물 |
| TW202039493A (zh) * | 2018-12-19 | 2020-11-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| KR102853461B1 (ko) | 2019-01-16 | 2025-09-02 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| US20220127286A1 (en) | 2019-03-04 | 2022-04-28 | Merck Patent Gmbh | Ligands for nano-sized materials |
| US20220162205A1 (en) | 2019-03-12 | 2022-05-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020193447A1 (de) | 2019-03-25 | 2020-10-01 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020208051A1 (en) | 2019-04-11 | 2020-10-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN112430239B (zh) * | 2019-08-26 | 2022-03-22 | 广州华睿光电材料有限公司 | 基于七元环结构的化合物、高聚物、混合物、组合物及有机电子器件 |
| US12108665B2 (en) | 2019-09-02 | 2024-10-01 | Merck Kgaa | Materials for organic electroluminescent devices |
| EP4031546A1 (de) | 2019-09-16 | 2022-07-27 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| CN114401945A (zh) * | 2019-09-20 | 2022-04-26 | 默克专利有限公司 | 作为用于电子器件的材料的迫位缩合杂环化合物 |
| WO2021078710A1 (en) | 2019-10-22 | 2021-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| CN114641482A (zh) | 2019-11-04 | 2022-06-17 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| TW202134252A (zh) | 2019-11-12 | 2021-09-16 | 德商麥克專利有限公司 | 有機電致發光裝置用材料 |
| KR102391274B1 (ko) * | 2019-12-05 | 2022-04-27 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| EP4110884B1 (de) | 2020-02-25 | 2024-11-20 | Merck Patent GmbH | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| EP4126884B1 (de) | 2020-03-23 | 2025-07-09 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021198213A1 (de) | 2020-04-02 | 2021-10-07 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US20230234937A1 (en) | 2020-06-18 | 2023-07-27 | Merck Patent Gmbh | Indenoazanaphthalenes |
| WO2022017997A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP4192832A1 (de) | 2020-08-06 | 2023-06-14 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| US12433160B2 (en) | 2020-08-18 | 2025-09-30 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN112079833A (zh) * | 2020-09-18 | 2020-12-15 | 吉林奥来德光电材料股份有限公司 | 一种有机电致发光化合物及其制备方法和应用 |
| CN112079834B (zh) * | 2020-09-18 | 2021-07-16 | 吉林奥来德光电材料股份有限公司 | 一种有机电致发光化合物及其应用 |
| CN112062765B (zh) * | 2020-09-18 | 2021-08-31 | 吉林奥来德光电材料股份有限公司 | 一种有机光电致发光化合物及其制备方法 |
| WO2022122682A2 (de) | 2020-12-10 | 2022-06-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| AU2021401996A1 (en) * | 2020-12-14 | 2023-07-13 | Kinoxis Therapeutics Pty Ltd | Oxytocin receptor modulators |
| KR20240075888A (ko) | 2021-09-28 | 2024-05-29 | 메르크 파텐트 게엠베하 | 전자 디바이스용 재료 |
| KR20240075872A (ko) | 2021-09-28 | 2024-05-29 | 메르크 파텐트 게엠베하 | 전자 디바이스용 재료 |
| WO2023052313A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052275A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP4437814A1 (de) | 2021-11-25 | 2024-10-02 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| KR20240128020A (ko) | 2021-12-21 | 2024-08-23 | 메르크 파텐트 게엠베하 | 중수소화 유기 화합물의 제조 방법 |
| US20250163035A1 (en) * | 2022-02-09 | 2025-05-22 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US20250160204A1 (en) | 2022-02-14 | 2025-05-15 | Merck Patent Gmbh | Materials for electronic devices |
| EP4526279A1 (de) | 2022-05-18 | 2025-03-26 | Merck Patent GmbH | Verfahren zur herstellung von deuterierten organischen verbindungen |
| KR20250037489A (ko) | 2022-07-11 | 2025-03-17 | 메르크 파텐트 게엠베하 | 전자 디바이스용 재료 |
| CN115073495B (zh) * | 2022-08-09 | 2024-03-19 | 苏州大学 | 一种吲哚啉类化合物及其制备方法 |
| WO2024105066A1 (en) | 2022-11-17 | 2024-05-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024132993A1 (de) | 2022-12-19 | 2024-06-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024133048A1 (en) | 2022-12-20 | 2024-06-27 | Merck Patent Gmbh | Method for preparing deuterated aromatic compounds |
| WO2024170605A1 (en) | 2023-02-17 | 2024-08-22 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024218109A1 (de) | 2023-04-20 | 2024-10-24 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024240725A1 (de) | 2023-05-25 | 2024-11-28 | Merck Patent Gmbh | Tris[1,2,4]triazolo[1,5-a:1',5'-c:1'',5''-e][1,3,5]triazin-derivate zur verwendung in organischen elektrolumineszenzvorrichtungen |
| CN117362292B (zh) * | 2023-06-15 | 2025-07-22 | 闽都创新实验室 | 酰胺衍生物热活化延迟荧光材料及其制备方法和应用 |
| WO2025012253A1 (en) | 2023-07-12 | 2025-01-16 | Merck Patent Gmbh | Materials for electronic devices |
| WO2025021855A1 (de) | 2023-07-27 | 2025-01-30 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen und organische sensoren |
| WO2025045843A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025045851A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025045842A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025119821A1 (en) | 2023-12-05 | 2025-06-12 | Merck Patent Gmbh | Material composition for organic electroluminescent devices |
| WO2025132547A1 (en) | 2023-12-21 | 2025-06-26 | Merck Patent Gmbh | Mechanochemical method for deuterating organic compounds |
| WO2025132551A1 (de) | 2023-12-22 | 2025-06-26 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2025195961A1 (de) | 2024-03-19 | 2025-09-25 | Merck Patent Gmbh | Organische lichtemittierende vorrichtungen |
| WO2025196145A1 (en) | 2024-03-22 | 2025-09-25 | Merck Patent Gmbh | Materials for organic light emitting devices |
| WO2025210013A1 (de) | 2024-04-04 | 2025-10-09 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen, insbesondere verbindungen für oleds |
| WO2026008710A1 (de) | 2024-07-05 | 2026-01-08 | Merck Patent Gmbh | Cyclische siliciumverbindungen für organische elektrolumineszenzvorrichtungen |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008270395A (ja) * | 2007-04-18 | 2008-11-06 | Mitsui Chemicals Inc | 有機トランジスタ |
| JP2009033067A (ja) * | 2007-07-31 | 2009-02-12 | Mitsui Chemicals Inc | 有機トランジスタ |
Family Cites Families (68)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4539507A (en) | 1983-03-25 | 1985-09-03 | Eastman Kodak Company | Organic electroluminescent devices having improved power conversion efficiencies |
| DE4111878A1 (de) | 1991-04-11 | 1992-10-15 | Wacker Chemie Gmbh | Leiterpolymere mit konjugierten doppelbindungen |
| US5151629A (en) | 1991-08-01 | 1992-09-29 | Eastman Kodak Company | Blue emitting internal junction organic electroluminescent device (I) |
| JPH07133483A (ja) | 1993-11-09 | 1995-05-23 | Shinko Electric Ind Co Ltd | El素子用有機発光材料及びel素子 |
| EP0676461B1 (de) | 1994-04-07 | 2002-08-14 | Covion Organic Semiconductors GmbH | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| DE4436773A1 (de) | 1994-10-14 | 1996-04-18 | Hoechst Ag | Konjugierte Polymere mit Spirozentren und ihre Verwendung als Elektrolumineszenzmaterialien |
| WO1996026186A1 (de) | 1995-02-23 | 1996-08-29 | Hoechst Aktiengesellschaft | Azafullerene, verfahren zu ihrer herstellung sowie ihre verwendung |
| WO1997005184A1 (en) | 1995-07-28 | 1997-02-13 | The Dow Chemical Company | 2,7-aryl-9-substituted fluorenes and 9-substituted fluorene oligomers and polymers |
| DE19614971A1 (de) | 1996-04-17 | 1997-10-23 | Hoechst Ag | Polymere mit Spiroatomen und ihre Verwendung als Elektrolumineszenzmaterialien |
| DE19652261A1 (de) | 1996-12-16 | 1998-06-18 | Hoechst Ag | Arylsubstituierte Poly(p-arylenvinylene), Verfahren zur Herstellung und deren Verwendung in Elektroluminszenzbauelementen |
| DE19846766A1 (de) | 1998-10-10 | 2000-04-20 | Aventis Res & Tech Gmbh & Co | Konjugierte Polymere, enthaltend spezielle Fluorenbausteine mit verbesserten Eigenschaften |
| US6166172A (en) | 1999-02-10 | 2000-12-26 | Carnegie Mellon University | Method of forming poly-(3-substituted) thiophenes |
| WO2000070655A2 (en) | 1999-05-13 | 2000-11-23 | The Trustees Of Princeton University | Very high efficiency organic light emitting devices based on electrophosphorescence |
| KR100946314B1 (ko) | 1999-12-01 | 2010-03-09 | 더 트러스티즈 오브 프린스턴 유니버시티 | 인광성 유기금속화합물을 포함하는 유기 발광 장치 |
| US6660410B2 (en) | 2000-03-27 | 2003-12-09 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence element |
| US20020121638A1 (en) | 2000-06-30 | 2002-09-05 | Vladimir Grushin | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| CN101924190B (zh) | 2000-08-11 | 2012-07-04 | 普林斯顿大学理事会 | 有机金属化合物和发射转换有机电致磷光 |
| JP4154140B2 (ja) | 2000-09-26 | 2008-09-24 | キヤノン株式会社 | 金属配位化合物 |
| JP4154138B2 (ja) | 2000-09-26 | 2008-09-24 | キヤノン株式会社 | 発光素子、表示装置及び金属配位化合物 |
| JP4154139B2 (ja) | 2000-09-26 | 2008-09-24 | キヤノン株式会社 | 発光素子 |
| US6946597B2 (en) * | 2002-06-22 | 2005-09-20 | Nanosular, Inc. | Photovoltaic devices fabricated by growth from porous template |
| ITRM20020411A1 (it) | 2002-08-01 | 2004-02-02 | Univ Roma La Sapienza | Derivati dello spirobifluorene, loro preparazione e loro uso. |
| GB0226010D0 (en) | 2002-11-08 | 2002-12-18 | Cambridge Display Tech Ltd | Polymers for use in organic electroluminescent devices |
| JP2006511939A (ja) | 2002-12-23 | 2006-04-06 | コビオン・オーガニック・セミコンダクターズ・ゲーエムベーハー | 有機エレクトロルミネセンス素子 |
| DE10304819A1 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte Polymere und Blends, deren Darstellung und Verwendung |
| JP4411851B2 (ja) | 2003-03-19 | 2010-02-10 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子 |
| JP5318347B2 (ja) | 2003-04-15 | 2013-10-16 | メルク パテント ゲーエムベーハー | 発光可能な、マトリックス材料と有機半導体との混合物、その使用、ならびに前記混合物を含む電子部品 |
| EP2236579B1 (de) | 2003-04-23 | 2014-04-09 | Konica Minolta Holdings, Inc. | Organische Electrolumineszenz-Einrichtung und -Anzeigevorrichtung |
| EP1491568A1 (de) | 2003-06-23 | 2004-12-29 | Covion Organic Semiconductors GmbH | Halbleitende Polymere |
| DE10328627A1 (de) | 2003-06-26 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Neue Materialien für die Elektrolumineszenz |
| KR101105619B1 (ko) | 2003-07-07 | 2012-01-18 | 메르크 파텐트 게엠베하 | 유기 방출형 반도체 및 매트릭스 물질의 혼합물, 이들의용도 및 상기 물질을 함유하는 전자 부품 |
| DE10333232A1 (de) | 2003-07-21 | 2007-10-11 | Merck Patent Gmbh | Organisches Elektrolumineszenzelement |
| DE10337346A1 (de) | 2003-08-12 | 2005-03-31 | Covion Organic Semiconductors Gmbh | Konjugierte Polymere enthaltend Dihydrophenanthren-Einheiten und deren Verwendung |
| DE10338550A1 (de) | 2003-08-19 | 2005-03-31 | Basf Ag | Übergangsmetallkomplexe mit Carbenliganden als Emitter für organische Licht-emittierende Dioden (OLEDs) |
| DE10345572A1 (de) | 2003-09-29 | 2005-05-19 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| US7795801B2 (en) | 2003-09-30 | 2010-09-14 | Konica Minolta Holdings, Inc. | Organic electroluminescent element, illuminator, display and compound |
| US7659540B2 (en) | 2003-10-22 | 2010-02-09 | Merck Patent Gmbh | Materials for electroluminescence and the utilization thereof |
| JP2007512692A (ja) | 2003-11-25 | 2007-05-17 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネセンス素子 |
| US7790890B2 (en) | 2004-03-31 | 2010-09-07 | Konica Minolta Holdings, Inc. | Organic electroluminescence element material, organic electroluminescence element, display device and illumination device |
| DE102004020298A1 (de) | 2004-04-26 | 2005-11-10 | Covion Organic Semiconductors Gmbh | Elektrolumineszierende Polymere und deren Verwendung |
| DE102004023277A1 (de) | 2004-05-11 | 2005-12-01 | Covion Organic Semiconductors Gmbh | Neue Materialmischungen für die Elektrolumineszenz |
| US7598388B2 (en) | 2004-05-18 | 2009-10-06 | The University Of Southern California | Carbene containing metal complexes as OLEDs |
| JP4862248B2 (ja) | 2004-06-04 | 2012-01-25 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| ITRM20040352A1 (it) | 2004-07-15 | 2004-10-15 | Univ Roma La Sapienza | Derivati oligomerici dello spirobifluorene, loro preparazione e loro uso. |
| WO2006033563A1 (en) | 2004-09-24 | 2006-03-30 | Lg Chem. Ltd. | Organic light emitting device |
| EP1669386A1 (de) | 2004-12-06 | 2006-06-14 | Covion Organic Semiconductors GmbH | Teilkonjugierte Polymere, deren Darstellung und Verwendung |
| CN101171320B (zh) | 2005-05-03 | 2013-04-10 | 默克专利有限公司 | 有机电致发光器件 |
| DE102005037734B4 (de) | 2005-08-10 | 2018-02-08 | Merck Patent Gmbh | Elektrolumineszierende Polymere, ihre Verwendung und bifunktionelle monomere Verbindungen |
| EP1956022B1 (de) | 2005-12-01 | 2012-07-25 | Nippon Steel Chemical Co., Ltd. | Verbindung für organisches elektrolumineszentes element und organisches elektrolumineszentes element |
| DE102006025777A1 (de) | 2006-05-31 | 2007-12-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2360751A1 (de) | 2006-08-07 | 2011-08-24 | Wake Forest University | Organischer Verbundwerkstoff |
| US8062769B2 (en) | 2006-11-09 | 2011-11-22 | Nippon Steel Chemical Co., Ltd. | Indolocarbazole compound for use in organic electroluminescent device and organic electroluminescent device |
| WO2009030981A2 (en) | 2006-12-28 | 2009-03-12 | Universal Display Corporation | Long lifetime phosphorescent organic light emitting device (oled) structures |
| DE102007002714A1 (de) | 2007-01-18 | 2008-07-31 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102007053771A1 (de) | 2007-11-12 | 2009-05-14 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2009136595A1 (ja) | 2008-05-08 | 2009-11-12 | 新日鐵化学株式会社 | 有機電界発光素子用化合物及び有機電界発光素子 |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008036982A1 (de) | 2008-08-08 | 2010-02-11 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| KR20110097612A (ko) | 2008-11-11 | 2011-08-31 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자 |
| JP5615261B2 (ja) * | 2009-03-11 | 2014-10-29 | 学校法人関西学院 | 多環芳香族化合物 |
| DE102009023155A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053645A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtung |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053382A1 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
-
2010
- 2010-05-04 DE DE102010019306.2A patent/DE102010019306B4/de active Active
-
2011
- 2011-03-29 CN CN201180022284.9A patent/CN102869662B/zh active Active
- 2011-03-29 KR KR1020127031796A patent/KR101857828B1/ko active Active
- 2011-03-29 WO PCT/EP2011/001573 patent/WO2011137951A1/de not_active Ceased
- 2011-03-29 JP JP2013508381A patent/JP6009435B2/ja active Active
- 2011-03-29 US US13/695,933 patent/US9139582B2/en active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008270395A (ja) * | 2007-04-18 | 2008-11-06 | Mitsui Chemicals Inc | 有機トランジスタ |
| JP2009033067A (ja) * | 2007-07-31 | 2009-02-12 | Mitsui Chemicals Inc | 有機トランジスタ |
Non-Patent Citations (3)
| Title |
|---|
| GHOSH, Somnath [et al.]: Studies on enamides – Part-2: A novel photochemical synthesis of 9H-indolo [3,2,1-de] phenanthridin-9-one, a benzcanthine analogue. In: Tetrahedron, Vol. 45, 1989, No. 12, S. 3775-3786. - ISSN 0040-4020 * |
| GÓMEZ-LOR, Berta ; ECHAVARREN, Antonio M.: Synthesis of a triaza analogue of crushed-fullerene by intramolecular palladium-catalyzed arylation. In: Organic Letters, Vol. 6, 2004, No. 17, S. 2993-2996. - ISBN 1523-7060 * |
| TEITEI, T.: 7-Phenylindolo[3,2,1-de]phenanthridin-13-one, the Vilsmeier-Haack reaction product of 1,4-diphenylcarbazole. In: Australian Journal of Chemistry, Vol. 23, 1970, No. 1, S. 185-191. - ISSN 0004-9425 * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2011137951A1 (de) | 2011-11-10 |
| CN102869662B (zh) | 2016-08-03 |
| US9139582B2 (en) | 2015-09-22 |
| JP2013531617A (ja) | 2013-08-08 |
| KR101857828B1 (ko) | 2018-05-14 |
| KR20130098173A (ko) | 2013-09-04 |
| CN102869662A (zh) | 2013-01-09 |
| DE102010019306A1 (de) | 2011-11-10 |
| JP6009435B2 (ja) | 2016-10-19 |
| US20130053555A1 (en) | 2013-02-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE102010019306B4 (de) | Organische Elektrolumineszenzvorrichtungen | |
| DE112011101314B4 (de) | Materialien für elektronische Vorrichtungen | |
| DE112010004381B4 (de) | Materialien für elektronische Vorrichtungen | |
| DE112011103450B4 (de) | Materialien auf Basis von Triphenylen für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung, deren Verwendung sowie organische elektronische Vorrichtungen | |
| EP3131901B1 (de) | Materialien für elektronische vorrichtungen | |
| EP2699571B1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| EP2935276B1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| EP2737554B1 (de) | Verbindungen für elektronische vorrichtungen | |
| EP3439065B1 (de) | Materialien für elektronische vorrichtungen | |
| EP2828266B1 (de) | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen | |
| DE102010013806B4 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| EP3016952B1 (de) | Spirokondensierte lactamverbindungen für organische elektrolumineszenzvorrichtungen | |
| DE102009053836A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| WO2011116865A1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| DE102009048791A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| WO2012016630A1 (de) | Materialien für elektronische vorrichtungen | |
| EP2780325A1 (de) | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen | |
| DE102010009903A1 (de) | Verbindungen für elektronische Vorrichtungen | |
| EP2697225B1 (de) | Materialien für elektronische vorrichtungen | |
| DE112011102056B4 (de) | Verbindungen für elektronische Vorrichtungen | |
| DE102010004803A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| EP2697226B1 (de) | Verbindungen für elektronische vorrichtungen | |
| WO2011160758A1 (de) | Materialien für organische elektrolumineszenzvorrichtungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| R012 | Request for examination validly filed | ||
| R016 | Response to examination communication | ||
| R016 | Response to examination communication | ||
| R018 | Grant decision by examination section/examining division | ||
| R079 | Amendment of ipc main class |
Free format text: PREVIOUS MAIN CLASS: C07D0471000000 Ipc: H01L0051540000 |
|
| R020 | Patent grant now final | ||
| R079 | Amendment of ipc main class |
Free format text: PREVIOUS MAIN CLASS: H01L0051540000 Ipc: H10K0085000000 |