ES2736198T3 - Compuestos útiles para tratar el cáncer - Google Patents
Compuestos útiles para tratar el cáncer Download PDFInfo
- Publication number
- ES2736198T3 ES2736198T3 ES10728368T ES10728368T ES2736198T3 ES 2736198 T3 ES2736198 T3 ES 2736198T3 ES 10728368 T ES10728368 T ES 10728368T ES 10728368 T ES10728368 T ES 10728368T ES 2736198 T3 ES2736198 T3 ES 2736198T3
- Authority
- ES
- Spain
- Prior art keywords
- amine
- group
- quinolin
- methylpyridin
- chloro
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 164
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 79
- 201000011510 cancer Diseases 0.000 title claims abstract description 71
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 126
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 66
- 150000003839 salts Chemical class 0.000 claims abstract description 62
- 238000011282 treatment Methods 0.000 claims abstract description 62
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims abstract description 56
- 239000003795 chemical substances by application Substances 0.000 claims abstract description 55
- 230000005764 inhibitory process Effects 0.000 claims abstract description 54
- 230000002265 prevention Effects 0.000 claims abstract description 54
- 125000005843 halogen group Chemical group 0.000 claims abstract description 38
- -1 N-methylpiperazinyl group Chemical group 0.000 claims abstract description 29
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 24
- 125000003709 fluoroalkyl group Chemical group 0.000 claims abstract description 18
- 125000004428 fluoroalkoxy group Chemical group 0.000 claims abstract description 17
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 15
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 12
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims abstract description 11
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims abstract description 7
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 claims abstract description 7
- 125000002757 morpholinyl group Chemical group 0.000 claims abstract description 5
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims abstract description 5
- 125000003118 aryl group Chemical group 0.000 claims abstract description 4
- 125000006274 (C1-C3)alkoxy group Chemical group 0.000 claims description 14
- CTJGXKWQWHICPP-UHFFFAOYSA-N 8-chloro-n-[5-(trifluoromethyl)pyridin-2-yl]quinolin-2-amine Chemical compound N1=CC(C(F)(F)F)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 CTJGXKWQWHICPP-UHFFFAOYSA-N 0.000 claims description 5
- OMAQEXWZVZKBCZ-UHFFFAOYSA-N n-(5-bromo-4-methylpyridin-2-yl)-8-chloroquinolin-2-amine Chemical compound C1=C(Br)C(C)=CC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=N1 OMAQEXWZVZKBCZ-UHFFFAOYSA-N 0.000 claims description 5
- AGJXIRGBYDQMRP-UHFFFAOYSA-N 2-(quinolin-2-ylamino)pyridine-4-carbonitrile Chemical compound N#CC1=CC=NC(NC=2N=C3C=CC=CC3=CC=2)=C1 AGJXIRGBYDQMRP-UHFFFAOYSA-N 0.000 claims description 3
- FXWXPPMZBPDNTC-UHFFFAOYSA-N 2-(quinolin-2-ylamino)pyridine-4-carboxylic acid Chemical compound OC(=O)C1=CC=NC(NC=2N=C3C=CC=CC3=CC=2)=C1 FXWXPPMZBPDNTC-UHFFFAOYSA-N 0.000 claims description 3
- JXMJKMAWRLFXAP-UHFFFAOYSA-N 2-[(4-methylquinolin-2-yl)amino]pyridine-3-carbonitrile Chemical compound N=1C2=CC=CC=C2C(C)=CC=1NC1=NC=CC=C1C#N JXMJKMAWRLFXAP-UHFFFAOYSA-N 0.000 claims description 3
- BKJDCCJYCUPNRL-UHFFFAOYSA-N 2-[(8-chloroquinolin-2-yl)amino]pyridin-3-ol Chemical compound OC1=CC=CN=C1NC1=CC=C(C=CC=C2Cl)C2=N1 BKJDCCJYCUPNRL-UHFFFAOYSA-N 0.000 claims description 3
- UBKNQKFAALWYST-UHFFFAOYSA-N 2-[(8-chloroquinolin-2-yl)amino]pyridine-3-carboxylic acid Chemical compound OC(=O)C1=CC=CN=C1NC1=CC=C(C=CC=C2Cl)C2=N1 UBKNQKFAALWYST-UHFFFAOYSA-N 0.000 claims description 3
- SXYZJVGUCCEKGQ-UHFFFAOYSA-N 2-[(8-chloroquinolin-2-yl)amino]pyridine-4-carboxylic acid Chemical compound OC(=O)C1=CC=NC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 SXYZJVGUCCEKGQ-UHFFFAOYSA-N 0.000 claims description 3
- YFKLMAPHIMPQJI-UHFFFAOYSA-N 2-n-(4-methylpyridin-2-yl)quinoline-2,5-diamine Chemical compound CC1=CC=NC(NC=2N=C3C=CC=C(N)C3=CC=2)=C1 YFKLMAPHIMPQJI-UHFFFAOYSA-N 0.000 claims description 3
- LQYGHYLIGWZTLP-UHFFFAOYSA-N 2-n-(4-methylpyridin-2-yl)quinoline-2,8-diamine Chemical compound CC1=CC=NC(NC=2N=C3C(N)=CC=CC3=CC=2)=C1 LQYGHYLIGWZTLP-UHFFFAOYSA-N 0.000 claims description 3
- VGWOMTPTPCNRSD-UHFFFAOYSA-N 2-n-(8-chloroquinolin-2-yl)-4-methylpyridine-2,3-diamine Chemical compound CC1=CC=NC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1N VGWOMTPTPCNRSD-UHFFFAOYSA-N 0.000 claims description 3
- YRKSELLNQXQCRF-UHFFFAOYSA-N 3-methyl-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2C(=CC3=CC=CC=C3N=2)C)=C1 YRKSELLNQXQCRF-UHFFFAOYSA-N 0.000 claims description 3
- WTXUYUSDSQGBAN-UHFFFAOYSA-N 3-methyl-n-(6-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=CC(NC=2C(=CC3=CC=CC=C3N=2)C)=N1 WTXUYUSDSQGBAN-UHFFFAOYSA-N 0.000 claims description 3
- RUIHEVIZDKFBBX-UHFFFAOYSA-N 3-methyl-n-[5-(trifluoromethyl)pyridin-2-yl]quinolin-2-amine Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CC=C(C(F)(F)F)C=N1 RUIHEVIZDKFBBX-UHFFFAOYSA-N 0.000 claims description 3
- PJKUHBGZFLHCNB-UHFFFAOYSA-N 3-methyl-n-pyridin-2-ylquinolin-2-amine Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CC=CC=N1 PJKUHBGZFLHCNB-UHFFFAOYSA-N 0.000 claims description 3
- KQHZIQRXEWLDJA-UHFFFAOYSA-N 4-methyl-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C=CC=CC3=C(C)C=2)=C1 KQHZIQRXEWLDJA-UHFFFAOYSA-N 0.000 claims description 3
- GHJMOXJEERLACS-UHFFFAOYSA-N 4-methyl-n-(5-nitropyridin-2-yl)quinolin-2-amine Chemical compound N=1C2=CC=CC=C2C(C)=CC=1NC1=CC=C([N+]([O-])=O)C=N1 GHJMOXJEERLACS-UHFFFAOYSA-N 0.000 claims description 3
- BICKHJDFQUBMDX-UHFFFAOYSA-N 4-methyl-n-(6-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=CC(NC=2N=C3C=CC=CC3=C(C)C=2)=N1 BICKHJDFQUBMDX-UHFFFAOYSA-N 0.000 claims description 3
- ADHHGODRRRVYSR-UHFFFAOYSA-N 4-methyl-n-pyridin-2-ylquinolin-2-amine Chemical compound N=1C2=CC=CC=C2C(C)=CC=1NC1=CC=CC=N1 ADHHGODRRRVYSR-UHFFFAOYSA-N 0.000 claims description 3
- LHEPULDUSUAMAY-UHFFFAOYSA-N 6-(quinolin-2-ylamino)pyridine-3-carbonitrile Chemical compound N1=CC(C#N)=CC=C1NC1=CC=C(C=CC=C2)C2=N1 LHEPULDUSUAMAY-UHFFFAOYSA-N 0.000 claims description 3
- VZZOWEGAADNEDX-UHFFFAOYSA-N 6-[(3-methylquinolin-2-yl)amino]pyridine-3-carbonitrile Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CC=C(C#N)C=N1 VZZOWEGAADNEDX-UHFFFAOYSA-N 0.000 claims description 3
- YZUSLURXWJRRKQ-UHFFFAOYSA-N 6-[(4-methylquinolin-2-yl)amino]pyridine-3-carbonitrile Chemical compound N=1C2=CC=CC=C2C(C)=CC=1NC1=CC=C(C#N)C=N1 YZUSLURXWJRRKQ-UHFFFAOYSA-N 0.000 claims description 3
- HYQKEYKCHFZSNV-UHFFFAOYSA-N 6-[(8-chloroquinolin-2-yl)amino]-2-methylpyridine-3-carbonitrile Chemical compound C1=C(C#N)C(C)=NC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 HYQKEYKCHFZSNV-UHFFFAOYSA-N 0.000 claims description 3
- NQUSIBMZMQGZJP-UHFFFAOYSA-N 6-[(8-chloroquinolin-2-yl)amino]pyridine-3-carbonitrile Chemical compound N1=C2C(Cl)=CC=CC2=CC=C1NC1=CC=C(C#N)C=N1 NQUSIBMZMQGZJP-UHFFFAOYSA-N 0.000 claims description 3
- YGTLRZXTQCCYGE-UHFFFAOYSA-N 6-chloro-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C=CC(Cl)=CC3=CC=2)=C1 YGTLRZXTQCCYGE-UHFFFAOYSA-N 0.000 claims description 3
- FDBFJLXCAOZZFL-UHFFFAOYSA-N 6-chloro-n-(5-fluoropyridin-2-yl)quinolin-2-amine Chemical compound N1=CC(F)=CC=C1NC1=CC=C(C=C(Cl)C=C2)C2=N1 FDBFJLXCAOZZFL-UHFFFAOYSA-N 0.000 claims description 3
- CUQCIXHRKSXWOV-UHFFFAOYSA-N 6-chloro-n-(5-methylpyridin-2-yl)quinolin-2-amine Chemical compound N1=CC(C)=CC=C1NC1=CC=C(C=C(Cl)C=C2)C2=N1 CUQCIXHRKSXWOV-UHFFFAOYSA-N 0.000 claims description 3
- GSBHDTFVSXZRQJ-UHFFFAOYSA-N 6-chloro-n-(6-ethylpyridin-2-yl)quinolin-2-amine Chemical compound CCC1=CC=CC(NC=2N=C3C=CC(Cl)=CC3=CC=2)=N1 GSBHDTFVSXZRQJ-UHFFFAOYSA-N 0.000 claims description 3
- XTHMFTROJRWDRJ-UHFFFAOYSA-N 6-chloro-n-(6-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=CC(NC=2N=C3C=CC(Cl)=CC3=CC=2)=N1 XTHMFTROJRWDRJ-UHFFFAOYSA-N 0.000 claims description 3
- FOKFEEOICXUAED-UHFFFAOYSA-N 6-chloro-n-[5-(trifluoromethyl)pyridin-2-yl]quinolin-2-amine Chemical compound N1=CC(C(F)(F)F)=CC=C1NC1=CC=C(C=C(Cl)C=C2)C2=N1 FOKFEEOICXUAED-UHFFFAOYSA-N 0.000 claims description 3
- KLDBYFPTUGYQSF-UHFFFAOYSA-N 8-bromo-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C(Br)=CC=CC3=CC=2)=C1 KLDBYFPTUGYQSF-UHFFFAOYSA-N 0.000 claims description 3
- VXBYNYBZMRMLGW-UHFFFAOYSA-N 8-chloro-n-(3-ethyl-6-methylpyridin-2-yl)quinolin-2-amine Chemical compound CCC1=CC=C(C)N=C1NC1=CC=C(C=CC=C2Cl)C2=N1 VXBYNYBZMRMLGW-UHFFFAOYSA-N 0.000 claims description 3
- FJCJZQGLOMNRHY-UHFFFAOYSA-N 8-chloro-n-(3-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=CN=C1NC1=CC=C(C=CC=C2Cl)C2=N1 FJCJZQGLOMNRHY-UHFFFAOYSA-N 0.000 claims description 3
- WUYJWZJNFJVBQS-UHFFFAOYSA-N 8-chloro-n-(3-nitropyridin-2-yl)quinolin-2-amine Chemical compound [O-][N+](=O)C1=CC=CN=C1NC1=CC=C(C=CC=C2Cl)C2=N1 WUYJWZJNFJVBQS-UHFFFAOYSA-N 0.000 claims description 3
- FPOCSJDULFADOD-UHFFFAOYSA-N 8-chloro-n-(4,6-dimethylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC(C)=NC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 FPOCSJDULFADOD-UHFFFAOYSA-N 0.000 claims description 3
- SVMQCHZHOIOPBT-UHFFFAOYSA-N 8-chloro-n-(4-chloropyridin-2-yl)quinolin-2-amine Chemical compound ClC1=CC=NC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 SVMQCHZHOIOPBT-UHFFFAOYSA-N 0.000 claims description 3
- FELITWFKOKSVOU-UHFFFAOYSA-N 8-chloro-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 FELITWFKOKSVOU-UHFFFAOYSA-N 0.000 claims description 3
- ZZHVQARIQFQEHB-UHFFFAOYSA-N 8-chloro-n-(5-fluoropyridin-2-yl)quinolin-2-amine Chemical compound N1=CC(F)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 ZZHVQARIQFQEHB-UHFFFAOYSA-N 0.000 claims description 3
- VVUYNQGZFMNEFR-UHFFFAOYSA-N 8-chloro-n-(5-methylpyridin-2-yl)quinolin-2-amine Chemical compound N1=CC(C)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 VVUYNQGZFMNEFR-UHFFFAOYSA-N 0.000 claims description 3
- YVQAPMHRGKJEHA-UHFFFAOYSA-N 8-chloro-n-(6-ethylpyridin-2-yl)quinolin-2-amine Chemical compound CCC1=CC=CC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=N1 YVQAPMHRGKJEHA-UHFFFAOYSA-N 0.000 claims description 3
- CGOGWGRRNFBRTN-UHFFFAOYSA-N 8-chloro-n-(6-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=CC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=N1 CGOGWGRRNFBRTN-UHFFFAOYSA-N 0.000 claims description 3
- ZYUBUXKVZUJXAK-UHFFFAOYSA-N 8-chloro-n-[4-(trifluoromethyl)pyridin-2-yl]quinolin-2-amine Chemical compound FC(F)(F)C1=CC=NC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 ZYUBUXKVZUJXAK-UHFFFAOYSA-N 0.000 claims description 3
- ZCIMXMMWBLMIKS-UHFFFAOYSA-N 8-chloro-n-[6-(trifluoromethyl)pyridin-2-yl]quinolin-2-amine Chemical compound FC(F)(F)C1=CC=CC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=N1 ZCIMXMMWBLMIKS-UHFFFAOYSA-N 0.000 claims description 3
- SYIWUYCZJZKWNS-UHFFFAOYSA-N 8-chloro-n-pyridin-2-ylquinolin-2-amine Chemical compound N1=C2C(Cl)=CC=CC2=CC=C1NC1=CC=CC=N1 SYIWUYCZJZKWNS-UHFFFAOYSA-N 0.000 claims description 3
- AZUPXAKEVZEVGM-UHFFFAOYSA-N 8-fluoro-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C(F)=CC=CC3=CC=2)=C1 AZUPXAKEVZEVGM-UHFFFAOYSA-N 0.000 claims description 3
- TZUPDIOVNPBGBH-UHFFFAOYSA-N 8-methoxy-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound N1=C2C(OC)=CC=CC2=CC=C1NC1=CC(C)=CC=N1 TZUPDIOVNPBGBH-UHFFFAOYSA-N 0.000 claims description 3
- YNBADRVTZLEFNH-UHFFFAOYSA-N Methyl nicotinate Natural products COC(=O)C1=CC=CN=C1 YNBADRVTZLEFNH-UHFFFAOYSA-N 0.000 claims description 3
- CXQVSYILQCWPTK-UHFFFAOYSA-O N#CC(C=C1)=C[N+](Cl)=C1NC1=NC2=CC=CC=C2C=C1 Chemical compound N#CC(C=C1)=C[N+](Cl)=C1NC1=NC2=CC=CC=C2C=C1 CXQVSYILQCWPTK-UHFFFAOYSA-O 0.000 claims description 3
- 229960001238 methylnicotinate Drugs 0.000 claims description 3
- ATZADUUVCRSIHI-UHFFFAOYSA-N n-(3-methoxypyridin-2-yl)quinolin-2-amine Chemical compound COC1=CC=CN=C1NC1=CC=C(C=CC=C2)C2=N1 ATZADUUVCRSIHI-UHFFFAOYSA-N 0.000 claims description 3
- FFUWMVQIJWHSKD-UHFFFAOYSA-N n-(3-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=CN=C1NC1=CC=C(C=CC=C2)C2=N1 FFUWMVQIJWHSKD-UHFFFAOYSA-N 0.000 claims description 3
- KBXOKJZDVJGBFH-UHFFFAOYSA-N n-(3-nitropyridin-2-yl)quinolin-2-amine Chemical compound [O-][N+](=O)C1=CC=CN=C1NC1=CC=C(C=CC=C2)C2=N1 KBXOKJZDVJGBFH-UHFFFAOYSA-N 0.000 claims description 3
- RHJPSLQTVHULQZ-UHFFFAOYSA-N n-(4-methylpyridin-2-yl)-5-nitroquinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C=CC=C(C3=CC=2)[N+]([O-])=O)=C1 RHJPSLQTVHULQZ-UHFFFAOYSA-N 0.000 claims description 3
- PTGIPIAIGZEJJI-UHFFFAOYSA-N n-(4-methylpyridin-2-yl)-8-nitroquinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C([N+]([O-])=O)=CC=CC3=CC=2)=C1 PTGIPIAIGZEJJI-UHFFFAOYSA-N 0.000 claims description 3
- KSLQIQYOOVWDEP-UHFFFAOYSA-N n-(5-fluoropyridin-2-yl)-3-methylquinolin-2-amine Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CC=C(F)C=N1 KSLQIQYOOVWDEP-UHFFFAOYSA-N 0.000 claims description 3
- VAQHPHVXGHQBEP-UHFFFAOYSA-N n-(5-fluoropyridin-2-yl)quinolin-2-amine Chemical compound N1=CC(F)=CC=C1NC1=CC=C(C=CC=C2)C2=N1 VAQHPHVXGHQBEP-UHFFFAOYSA-N 0.000 claims description 3
- TZRNPIATCDHHCP-UHFFFAOYSA-N n-(5-methylpyridin-2-yl)quinolin-2-amine Chemical compound N1=CC(C)=CC=C1NC1=CC=C(C=CC=C2)C2=N1 TZRNPIATCDHHCP-UHFFFAOYSA-N 0.000 claims description 3
- URFTWAYRGCNQTE-UHFFFAOYSA-N n-(5-nitropyridin-2-yl)quinolin-2-amine Chemical compound N1=CC([N+](=O)[O-])=CC=C1NC1=CC=C(C=CC=C2)C2=N1 URFTWAYRGCNQTE-UHFFFAOYSA-N 0.000 claims description 3
- VSXGLAGXFHRXQM-UHFFFAOYSA-N n-(6-ethylpyridin-2-yl)-3-methylquinolin-2-amine Chemical compound CCC1=CC=CC(NC=2C(=CC3=CC=CC=C3N=2)C)=N1 VSXGLAGXFHRXQM-UHFFFAOYSA-N 0.000 claims description 3
- ZTKSVFASFFNDNT-UHFFFAOYSA-N n-(6-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=CC(NC=2N=C3C=CC=CC3=CC=2)=N1 ZTKSVFASFFNDNT-UHFFFAOYSA-N 0.000 claims description 3
- FMVVRHSNCORERJ-UHFFFAOYSA-N n-[5-(trifluoromethyl)pyridin-2-yl]quinolin-2-amine Chemical compound N1=CC(C(F)(F)F)=CC=C1NC1=CC=C(C=CC=C2)C2=N1 FMVVRHSNCORERJ-UHFFFAOYSA-N 0.000 claims description 3
- DJQMBIOZCUXCGM-UHFFFAOYSA-N n-[6-(trifluoromethyl)pyridin-2-yl]quinolin-2-amine Chemical compound FC(F)(F)C1=CC=CC(NC=2N=C3C=CC=CC3=CC=2)=N1 DJQMBIOZCUXCGM-UHFFFAOYSA-N 0.000 claims description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims 1
- QIXQMUJFJFOLSP-UHFFFAOYSA-N N1=C(C=CC=C1)C1=CC(=NC2=CC=CC=C12)N.CC1=CC(=NC=C1)NC1=NC2=CC=CC=C2C=C1 Chemical compound N1=C(C=CC=C1)C1=CC(=NC2=CC=CC=C12)N.CC1=CC(=NC=C1)NC1=NC2=CC=CC=C2C=C1 QIXQMUJFJFOLSP-UHFFFAOYSA-N 0.000 claims 1
- 125000001153 fluoro group Chemical group F* 0.000 abstract description 2
- 210000004027 cell Anatomy 0.000 description 67
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 33
- 230000009545 invasion Effects 0.000 description 28
- 238000012360 testing method Methods 0.000 description 28
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 23
- 102000008186 Collagen Human genes 0.000 description 16
- 108010035532 Collagen Proteins 0.000 description 16
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 16
- 229920001436 collagen Polymers 0.000 description 16
- 239000003814 drug Substances 0.000 description 14
- 229940079593 drug Drugs 0.000 description 14
- 238000002360 preparation method Methods 0.000 description 14
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 13
- 239000000243 solution Substances 0.000 description 13
- 239000000203 mixture Substances 0.000 description 12
- 230000035899 viability Effects 0.000 description 9
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 8
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 8
- 230000000144 pharmacologic effect Effects 0.000 description 8
- 239000011541 reaction mixture Substances 0.000 description 8
- 210000002966 serum Anatomy 0.000 description 8
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 8
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 7
- 239000011324 bead Substances 0.000 description 7
- 238000004113 cell culture Methods 0.000 description 7
- 229910052801 chlorine Inorganic materials 0.000 description 7
- 229940095064 tartrate Drugs 0.000 description 7
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- 206010027476 Metastases Diseases 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- VURFVHCLMJOLKN-UHFFFAOYSA-N diphosphane Chemical compound PP VURFVHCLMJOLKN-UHFFFAOYSA-N 0.000 description 6
- 230000001394 metastastic effect Effects 0.000 description 6
- 206010061289 metastatic neoplasm Diseases 0.000 description 6
- 239000013642 negative control Substances 0.000 description 6
- 125000001309 chloro group Chemical group Cl* 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 5
- 239000008194 pharmaceutical composition Substances 0.000 description 5
- 239000013641 positive control Substances 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 5
- FNRTZPDQMOKWEO-UHFFFAOYSA-N 4-n,4-n-dimethyl-7-n-(4-methylpyridin-2-yl)quinoline-4,7-diamine Chemical compound C=1C=C2C(N(C)C)=CC=NC2=CC=1NC1=CC(C)=CC=N1 FNRTZPDQMOKWEO-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 4
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- 208000025500 Hutchinson-Gilford progeria syndrome Diseases 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- 208000007932 Progeria Diseases 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- 229940072107 ascorbate Drugs 0.000 description 4
- 235000010323 ascorbic acid Nutrition 0.000 description 4
- 239000011668 ascorbic acid Substances 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 239000006285 cell suspension Substances 0.000 description 4
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 4
- OZHCMCMAYBRCAZ-UHFFFAOYSA-N methyl 6-[(4-methylquinolin-2-yl)amino]pyridine-3-carboxylate Chemical compound N1=CC(C(=O)OC)=CC=C1NC1=CC(C)=C(C=CC=C2)C2=N1 OZHCMCMAYBRCAZ-UHFFFAOYSA-N 0.000 description 4
- RHSWLGNBNIMYDD-UHFFFAOYSA-N methyl 6-[(8-chloroquinolin-2-yl)amino]pyridine-3-carboxylate Chemical compound N1=CC(C(=O)OC)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 RHSWLGNBNIMYDD-UHFFFAOYSA-N 0.000 description 4
- 239000003586 protic polar solvent Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 4
- 210000004881 tumor cell Anatomy 0.000 description 4
- PRDFBSVERLRRMY-UHFFFAOYSA-N 2'-(4-ethoxyphenyl)-5-(4-methylpiperazin-1-yl)-2,5'-bibenzimidazole Chemical compound C1=CC(OCC)=CC=C1C1=NC2=CC=C(C=3NC4=CC(=CC=C4N=3)N3CCN(C)CC3)C=C2N1 PRDFBSVERLRRMY-UHFFFAOYSA-N 0.000 description 3
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- GBGBPIZOYJCRCB-UHFFFAOYSA-N 5,8-dimethyl-n-[5-(trifluoromethyl)pyridin-2-yl]isoquinolin-6-amine Chemical compound CC=1C2=CC=NC=C2C(C)=CC=1NC1=CC=C(C(F)(F)F)C=N1 GBGBPIZOYJCRCB-UHFFFAOYSA-N 0.000 description 3
- 206010006187 Breast cancer Diseases 0.000 description 3
- 208000026310 Breast neoplasm Diseases 0.000 description 3
- 239000004743 Polypropylene Substances 0.000 description 3
- 206010063493 Premature ageing Diseases 0.000 description 3
- 208000032038 Premature aging Diseases 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 239000000512 collagen gel Substances 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 238000009650 gentamicin protection assay Methods 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 150000007529 inorganic bases Chemical class 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- YFSKNMVMVDRGQL-UHFFFAOYSA-N 1-n-(6-chloroquinolin-2-yl)-4-n,4-n-dimethylbenzene-1,4-diamine Chemical compound C1=CC(N(C)C)=CC=C1NC1=CC=C(C=C(Cl)C=C2)C2=N1 YFSKNMVMVDRGQL-UHFFFAOYSA-N 0.000 description 2
- KROFVRIRTYNLBH-UHFFFAOYSA-N 1-n-(8-chloroquinolin-2-yl)-4-(trifluoromethoxy)benzene-1,2-diamine Chemical compound NC1=CC(OC(F)(F)F)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 KROFVRIRTYNLBH-UHFFFAOYSA-N 0.000 description 2
- SJQBOAPYEWHLJK-UHFFFAOYSA-N 1-n-(8-chloroquinolin-2-yl)-4-n,4-n-dimethylbenzene-1,4-diamine Chemical compound C1=CC(N(C)C)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 SJQBOAPYEWHLJK-UHFFFAOYSA-N 0.000 description 2
- IICVTJMDHNPPOP-UHFFFAOYSA-N 2-chloro-5-nitroquinoline Chemical compound ClC1=CC=C2C([N+](=O)[O-])=CC=CC2=N1 IICVTJMDHNPPOP-UHFFFAOYSA-N 0.000 description 2
- FQULGNZYLGGSSU-UHFFFAOYSA-N 3-methyl-n-[2-methyl-4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound CC1=CC(OC(F)(F)F)=CC=C1NC1=NC2=CC=CC=C2C=C1C FQULGNZYLGGSSU-UHFFFAOYSA-N 0.000 description 2
- APRZHQXAAWPYHS-UHFFFAOYSA-N 4-[5-[3-(carboxymethoxy)phenyl]-3-(4,5-dimethyl-1,3-thiazol-2-yl)tetrazol-3-ium-2-yl]benzenesulfonate Chemical compound S1C(C)=C(C)N=C1[N+]1=NC(C=2C=C(OCC(O)=O)C=CC=2)=NN1C1=CC=C(S([O-])(=O)=O)C=C1 APRZHQXAAWPYHS-UHFFFAOYSA-N 0.000 description 2
- HTXYLYNDCJUKPB-UHFFFAOYSA-N 4-morpholin-4-yl-n-[4-(trifluoromethoxy)phenyl]quinolin-7-amine Chemical compound C1=CC(OC(F)(F)F)=CC=C1NC1=CC=C(C(=CC=N2)N3CCOCC3)C2=C1 HTXYLYNDCJUKPB-UHFFFAOYSA-N 0.000 description 2
- YMWJCWKLKHOUSB-UHFFFAOYSA-N 4-n,4-n-dimethyl-1-n-(3-methylquinolin-2-yl)benzene-1,4-diamine Chemical compound C1=CC(N(C)C)=CC=C1NC1=NC2=CC=CC=C2C=C1C YMWJCWKLKHOUSB-UHFFFAOYSA-N 0.000 description 2
- OWEYRQNNNZFLKZ-UHFFFAOYSA-N 4-n,4-n-dimethyl-7-n-[4-(trifluoromethoxy)phenyl]quinoline-4,7-diamine Chemical compound C=1C=C2C(N(C)C)=CC=NC2=CC=1NC1=CC=C(OC(F)(F)F)C=C1 OWEYRQNNNZFLKZ-UHFFFAOYSA-N 0.000 description 2
- ALVVUWUQQNELGD-UHFFFAOYSA-N 4-pyridin-2-ylquinolin-2-amine Chemical compound C=12C=CC=CC2=NC(N)=CC=1C1=CC=CC=N1 ALVVUWUQQNELGD-UHFFFAOYSA-N 0.000 description 2
- ISYOKIKEVPRGAT-UHFFFAOYSA-N 5,8-dimethylisoquinolin-6-amine Chemical compound C1=NC=C2C(C)=CC(N)=C(C)C2=C1 ISYOKIKEVPRGAT-UHFFFAOYSA-N 0.000 description 2
- CNGZPOQQPLFGFN-UHFFFAOYSA-N 7-chloro-n,n-dimethylquinolin-4-amine Chemical compound ClC1=CC=C2C(N(C)C)=CC=NC2=C1 CNGZPOQQPLFGFN-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- ZXSUGMMMZOMZTD-UHFFFAOYSA-N 8-bromo-2-chloroquinoline Chemical compound C1=CC=C(Br)C2=NC(Cl)=CC=C21 ZXSUGMMMZOMZTD-UHFFFAOYSA-N 0.000 description 2
- DMGALOCEQNYOHP-UHFFFAOYSA-N 8-chloro-n-[2-methyl-4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound CC1=CC(OC(F)(F)F)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 DMGALOCEQNYOHP-UHFFFAOYSA-N 0.000 description 2
- VLWWBNACECPLGM-UHFFFAOYSA-N 8-chloro-n-[3-chloro-4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound C1=C(Cl)C(OC(F)(F)F)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 VLWWBNACECPLGM-UHFFFAOYSA-N 0.000 description 2
- JIJMLBPEQULHTQ-UHFFFAOYSA-N 8-methyl-n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C(C)=CC=CC3=CC=2)=C1 JIJMLBPEQULHTQ-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000001740 anti-invasion Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 235000008504 concentrate Nutrition 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000011261 inert gas Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 238000000034 method Methods 0.000 description 2
- 238000000386 microscopy Methods 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- AULLPZPGEQAVPO-UHFFFAOYSA-N n-(4-methylpyridin-2-yl)quinolin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C=CC=CC3=CC=2)=C1 AULLPZPGEQAVPO-UHFFFAOYSA-N 0.000 description 2
- UFMKHVYZRJLHMM-UHFFFAOYSA-N n-pyrazin-2-ylquinolin-3-amine Chemical compound C=1N=C2C=CC=CC2=CC=1NC1=CN=CC=N1 UFMKHVYZRJLHMM-UHFFFAOYSA-N 0.000 description 2
- 210000004940 nucleus Anatomy 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- MPDDTAJMJCESGV-CTUHWIOQSA-M (3r,5r)-7-[2-(4-fluorophenyl)-5-[methyl-[(1r)-1-phenylethyl]carbamoyl]-4-propan-2-ylpyrazol-3-yl]-3,5-dihydroxyheptanoate Chemical compound C1([C@@H](C)N(C)C(=O)C2=NN(C(CC[C@@H](O)C[C@@H](O)CC([O-])=O)=C2C(C)C)C=2C=CC(F)=CC=2)=CC=CC=C1 MPDDTAJMJCESGV-CTUHWIOQSA-M 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- VAXOCTXTVIVOQE-UHFFFAOYSA-N 2,8-dichloroquinoline Chemical compound C1=CC=C(Cl)C2=NC(Cl)=CC=C21 VAXOCTXTVIVOQE-UHFFFAOYSA-N 0.000 description 1
- PLFPWCLLFOJLBI-UHFFFAOYSA-N 2-(quinolin-3-ylamino)pyridine-4-carboxylic acid Chemical compound OC(=O)C1=CC=NC(NC=2C=C3C=CC=CC3=NC=2)=C1 PLFPWCLLFOJLBI-UHFFFAOYSA-N 0.000 description 1
- YWNJQQNBJQUKME-UHFFFAOYSA-N 2-bromo-5-methylpyridine Chemical compound CC1=CC=C(Br)N=C1 YWNJQQNBJQUKME-UHFFFAOYSA-N 0.000 description 1
- GKQWGUCKPKFKBV-UHFFFAOYSA-N 2-n-quinolin-3-ylpyridine-2,3-diamine Chemical compound NC1=CC=CN=C1NC1=CN=C(C=CC=C2)C2=C1 GKQWGUCKPKFKBV-UHFFFAOYSA-N 0.000 description 1
- HLZQAAVXDMDYFS-UHFFFAOYSA-N 3-methyl-n-[2-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CC=CC=C1OC(F)(F)F HLZQAAVXDMDYFS-UHFFFAOYSA-N 0.000 description 1
- VGMBGEVZRWQBOM-UHFFFAOYSA-N 3-methyl-n-[3-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CC=CC(OC(F)(F)F)=C1 VGMBGEVZRWQBOM-UHFFFAOYSA-N 0.000 description 1
- FWXKBWUMNDDJHT-UHFFFAOYSA-N 3-methyl-n-[4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CC=C(OC(F)(F)F)C=C1 FWXKBWUMNDDJHT-UHFFFAOYSA-N 0.000 description 1
- BFRIMUUKUWOPBW-UHFFFAOYSA-N 3-methyl-n-pyrazin-2-ylquinolin-2-amine Chemical compound CC1=CC2=CC=CC=C2N=C1NC1=CN=CC=N1 BFRIMUUKUWOPBW-UHFFFAOYSA-N 0.000 description 1
- BRBUBVKGJRPRRD-UHFFFAOYSA-N 4,6-dimethylpyridin-2-amine Chemical compound CC1=CC(C)=NC(N)=C1 BRBUBVKGJRPRRD-UHFFFAOYSA-N 0.000 description 1
- XUJFOSLZQITUOI-UHFFFAOYSA-N 4-(trifluoromethoxy)aniline Chemical compound NC1=CC=C(OC(F)(F)F)C=C1 XUJFOSLZQITUOI-UHFFFAOYSA-N 0.000 description 1
- JKWLLRXHEBZOLZ-UHFFFAOYSA-N 4-methoxy-n-(4-methylpyridin-2-yl)quinolin-7-amine Chemical compound C=1C=C2C(OC)=CC=NC2=CC=1NC1=CC(C)=CC=N1 JKWLLRXHEBZOLZ-UHFFFAOYSA-N 0.000 description 1
- PFFGMKJSHDWGGT-UHFFFAOYSA-N 4-methoxy-n-[4-(trifluoromethoxy)phenyl]quinolin-7-amine Chemical compound C=1C=C2C(OC)=CC=NC2=CC=1NC1=CC=C(OC(F)(F)F)C=C1 PFFGMKJSHDWGGT-UHFFFAOYSA-N 0.000 description 1
- GAWOGCFTXVIYQT-UHFFFAOYSA-N 4-methoxy-n-pyridin-2-ylquinolin-7-amine Chemical compound C=1C=C2C(OC)=CC=NC2=CC=1NC1=CC=CC=N1 GAWOGCFTXVIYQT-UHFFFAOYSA-N 0.000 description 1
- OCEOPRHNGQCGSQ-UHFFFAOYSA-N 4-methyl-n-[4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound N=1C2=CC=CC=C2C(C)=CC=1NC1=CC=C(OC(F)(F)F)C=C1 OCEOPRHNGQCGSQ-UHFFFAOYSA-N 0.000 description 1
- WZMXBKQUZOMDOY-UHFFFAOYSA-N 4-methyl-n-pyrazin-2-ylquinolin-2-amine Chemical compound N=1C2=CC=CC=C2C(C)=CC=1NC1=CN=CC=N1 WZMXBKQUZOMDOY-UHFFFAOYSA-N 0.000 description 1
- NZGKKWIIQVXUKY-UHFFFAOYSA-N 4-methyl-n-pyrimidin-2-ylquinolin-2-amine Chemical compound N=1C2=CC=CC=C2C(C)=CC=1NC1=NC=CC=N1 NZGKKWIIQVXUKY-UHFFFAOYSA-N 0.000 description 1
- ORLGLBZRQYOWNA-UHFFFAOYSA-N 4-methylpyridin-2-amine Chemical compound CC1=CC=NC(N)=C1 ORLGLBZRQYOWNA-UHFFFAOYSA-N 0.000 description 1
- YKAUOMYYVJQVGG-UHFFFAOYSA-N 6-(quinoxalin-2-ylamino)pyridine-3-carbonitrile Chemical compound N1=CC(C#N)=CC=C1NC1=CN=C(C=CC=C2)C2=N1 YKAUOMYYVJQVGG-UHFFFAOYSA-N 0.000 description 1
- HPJXFVDJZJVWKH-UHFFFAOYSA-N 6-chloro-n-(4-methylpyridin-2-yl)quinoxalin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C=CC(Cl)=CC3=NC=2)=C1 HPJXFVDJZJVWKH-UHFFFAOYSA-N 0.000 description 1
- ZUSBYXKHPAAGKP-UHFFFAOYSA-N 6-chloro-n-pyrazin-2-ylquinolin-2-amine Chemical compound C1=CC2=CC(Cl)=CC=C2N=C1NC1=CN=CC=N1 ZUSBYXKHPAAGKP-UHFFFAOYSA-N 0.000 description 1
- ZRNNTAQMCOKIDY-UHFFFAOYSA-N 6-methyl-n-naphthalen-2-ylpyridin-2-amine Chemical compound CC1=CC=CC(NC=2C=C3C=CC=CC3=CC=2)=N1 ZRNNTAQMCOKIDY-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- IYLUIBBHBDWNTE-UHFFFAOYSA-N 8-bromo-n-pyrazin-2-ylquinolin-2-amine Chemical compound N1=C2C(Br)=CC=CC2=CC=C1NC1=CN=CC=N1 IYLUIBBHBDWNTE-UHFFFAOYSA-N 0.000 description 1
- RUURRABBFPPQTD-UHFFFAOYSA-N 8-chloro-n-(3-chloro-4-methoxyphenyl)quinolin-2-amine Chemical compound C1=C(Cl)C(OC)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 RUURRABBFPPQTD-UHFFFAOYSA-N 0.000 description 1
- UKMWIGDFVUOYBF-UHFFFAOYSA-N 8-chloro-n-(3-fluorophenyl)quinolin-2-amine Chemical compound FC1=CC=CC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 UKMWIGDFVUOYBF-UHFFFAOYSA-N 0.000 description 1
- ONRLMLQEVUKZKC-UHFFFAOYSA-N 8-chloro-n-(4-methoxyphenyl)quinolin-2-amine Chemical compound C1=CC(OC)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 ONRLMLQEVUKZKC-UHFFFAOYSA-N 0.000 description 1
- QQHGKWJGEQGJGO-UHFFFAOYSA-N 8-chloro-n-[3-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound FC(F)(F)OC1=CC=CC(NC=2N=C3C(Cl)=CC=CC3=CC=2)=C1 QQHGKWJGEQGJGO-UHFFFAOYSA-N 0.000 description 1
- WIZXEYUXFXEMET-UHFFFAOYSA-N 8-chloro-n-pyrazin-2-ylquinolin-2-amine Chemical compound N1=C2C(Cl)=CC=CC2=CC=C1NC1=CN=CC=N1 WIZXEYUXFXEMET-UHFFFAOYSA-N 0.000 description 1
- BYMRPDIGYDXSRD-UHFFFAOYSA-N 8-chloro-n-pyrimidin-2-ylquinolin-2-amine Chemical compound N1=C2C(Cl)=CC=CC2=CC=C1NC1=NC=CC=N1 BYMRPDIGYDXSRD-UHFFFAOYSA-N 0.000 description 1
- JKCVPDYTKRGXRQ-UHFFFAOYSA-N 8-fluoro-n-[4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound N1=C2C(F)=CC=CC2=CC=C1NC1=CC=C(OC(F)(F)F)C=C1 JKCVPDYTKRGXRQ-UHFFFAOYSA-N 0.000 description 1
- XQNWJAZOZPLABG-UHFFFAOYSA-N 8-fluoro-n-pyrazin-2-ylquinolin-2-amine Chemical compound N1=C2C(F)=CC=CC2=CC=C1NC1=CN=CC=N1 XQNWJAZOZPLABG-UHFFFAOYSA-N 0.000 description 1
- AHEAPCRPIGIXST-UHFFFAOYSA-N 8-methoxy-n-[4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound N1=C2C(OC)=CC=CC2=CC=C1NC1=CC=C(OC(F)(F)F)C=C1 AHEAPCRPIGIXST-UHFFFAOYSA-N 0.000 description 1
- MRNHPXYSBYGPDT-UHFFFAOYSA-N 8-methoxy-n-pyrazin-2-ylquinolin-2-amine Chemical compound N1=C2C(OC)=CC=CC2=CC=C1NC1=CN=CC=N1 MRNHPXYSBYGPDT-UHFFFAOYSA-N 0.000 description 1
- PAZITGANORKJQX-UHFFFAOYSA-N 8-methyl-n-[4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound N1=C2C(C)=CC=CC2=CC=C1NC1=CC=C(OC(F)(F)F)C=C1 PAZITGANORKJQX-UHFFFAOYSA-N 0.000 description 1
- DUVUANQFUWEQTA-UHFFFAOYSA-N 8-methyl-n-pyrazin-2-ylquinolin-2-amine Chemical compound N1=C2C(C)=CC=CC2=CC=C1NC1=CN=CC=N1 DUVUANQFUWEQTA-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 101150041968 CDC13 gene Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 208000002177 Cataract Diseases 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 102000012422 Collagen Type I Human genes 0.000 description 1
- 108010022452 Collagen Type I Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 206010064912 Malignant transformation Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 239000012901 Milli-Q water Substances 0.000 description 1
- SYFVXFBDNXMEGN-UHFFFAOYSA-N N(C1=NC=CN=C1)C1=NC2=CC=CC=C2N=C1 Chemical compound N(C1=NC=CN=C1)C1=NC2=CC=CC=C2N=C1 SYFVXFBDNXMEGN-UHFFFAOYSA-N 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 208000010641 Tooth disease Diseases 0.000 description 1
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 1
- 206010064390 Tumour invasion Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 201000011032 Werner Syndrome Diseases 0.000 description 1
- FJWIHTNNFSITSP-UHFFFAOYSA-N [2-(quinoxalin-2-ylamino)pyridin-4-yl]methanol Chemical compound OCC1=CC=NC(NC=2N=C3C=CC=CC3=NC=2)=C1 FJWIHTNNFSITSP-UHFFFAOYSA-N 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 229950011175 aminopicoline Drugs 0.000 description 1
- 235000013361 beverage Nutrition 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 230000009400 cancer invasion Effects 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000008260 defense mechanism Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000008098 formaldehyde solution Substances 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- NGFCTYXFMDWFRQ-UHFFFAOYSA-N isoquinolin-6-amine Chemical compound C1=NC=CC2=CC(N)=CC=C21 NGFCTYXFMDWFRQ-UHFFFAOYSA-N 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 230000036212 malign transformation Effects 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- XAEVJVCCEZTOPK-UHFFFAOYSA-N methyl 6-[(3-methylquinolin-2-yl)amino]pyridine-3-carboxylate Chemical compound N1=CC(C(=O)OC)=CC=C1NC1=NC2=CC=CC=C2C=C1C XAEVJVCCEZTOPK-UHFFFAOYSA-N 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- CUOAGPLCYXTZFB-UHFFFAOYSA-N n-(3,5-dichloro-4-methylpyridin-2-yl)quinoxalin-2-amine Chemical compound CC1=C(Cl)C=NC(NC=2N=C3C=CC=CC3=NC=2)=C1Cl CUOAGPLCYXTZFB-UHFFFAOYSA-N 0.000 description 1
- JSKBVMQTOGGRCE-UHFFFAOYSA-N n-(3-fluorophenyl)quinolin-2-amine Chemical compound FC1=CC=CC(NC=2N=C3C=CC=CC3=CC=2)=C1 JSKBVMQTOGGRCE-UHFFFAOYSA-N 0.000 description 1
- LSRLBKXWOIDDGO-UHFFFAOYSA-N n-(3-methoxypyridin-2-yl)quinolin-3-amine Chemical compound COC1=CC=CN=C1NC1=CN=C(C=CC=C2)C2=C1 LSRLBKXWOIDDGO-UHFFFAOYSA-N 0.000 description 1
- MXQIQAXLTPMUGA-UHFFFAOYSA-N n-(3-methoxypyridin-2-yl)quinolin-6-amine Chemical compound COC1=CC=CN=C1NC1=CC=C(N=CC=C2)C2=C1 MXQIQAXLTPMUGA-UHFFFAOYSA-N 0.000 description 1
- XXDPXWRBTKQMSI-UHFFFAOYSA-N n-(3-nitropyridin-2-yl)quinolin-3-amine Chemical compound [O-][N+](=O)C1=CC=CN=C1NC1=CN=C(C=CC=C2)C2=C1 XXDPXWRBTKQMSI-UHFFFAOYSA-N 0.000 description 1
- JZVGQBIINWZGJR-UHFFFAOYSA-N n-(4,6-dimethylpyridin-2-yl)quinoxalin-2-amine Chemical compound CC1=CC(C)=NC(NC=2N=C3C=CC=CC3=NC=2)=C1 JZVGQBIINWZGJR-UHFFFAOYSA-N 0.000 description 1
- RXKPLHQYESBUJR-UHFFFAOYSA-N n-(4-butoxyphenyl)-3-methylquinolin-2-amine Chemical compound C1=CC(OCCCC)=CC=C1NC1=NC2=CC=CC=C2C=C1C RXKPLHQYESBUJR-UHFFFAOYSA-N 0.000 description 1
- QKBLJZFNGUXODV-UHFFFAOYSA-N n-(4-butoxyphenyl)-8-chloroquinolin-2-amine Chemical compound C1=CC(OCCCC)=CC=C1NC1=CC=C(C=CC=C2Cl)C2=N1 QKBLJZFNGUXODV-UHFFFAOYSA-N 0.000 description 1
- JNSCAEPZOZUIHU-UHFFFAOYSA-N n-(4-ethylpyridin-2-yl)quinoxalin-2-amine Chemical compound CCC1=CC=NC(NC=2N=C3C=CC=CC3=NC=2)=C1 JNSCAEPZOZUIHU-UHFFFAOYSA-N 0.000 description 1
- DAURSXXYUVTURL-UHFFFAOYSA-N n-(4-methoxyphenyl)-3-methylquinolin-2-amine Chemical compound C1=CC(OC)=CC=C1NC1=NC2=CC=CC=C2C=C1C DAURSXXYUVTURL-UHFFFAOYSA-N 0.000 description 1
- XZVNMJHAARVTEN-UHFFFAOYSA-N n-(4-methoxyphenyl)-4-(4-methylpiperazin-1-yl)quinolin-7-amine Chemical compound C1=CC(OC)=CC=C1NC1=CC=C(C(=CC=N2)N3CCN(C)CC3)C2=C1 XZVNMJHAARVTEN-UHFFFAOYSA-N 0.000 description 1
- GQACZYQLUYMKPJ-UHFFFAOYSA-N n-(4-methoxyphenyl)quinolin-2-amine Chemical compound C1=CC(OC)=CC=C1NC1=CC=C(C=CC=C2)C2=N1 GQACZYQLUYMKPJ-UHFFFAOYSA-N 0.000 description 1
- GSRHJQVZZBVVNF-UHFFFAOYSA-N n-(4-methoxyphenyl)quinolin-3-amine Chemical compound C1=CC(OC)=CC=C1NC1=CN=C(C=CC=C2)C2=C1 GSRHJQVZZBVVNF-UHFFFAOYSA-N 0.000 description 1
- VXECRKRPJRAULJ-UHFFFAOYSA-N n-(4-methyl-3-nitropyridin-2-yl)quinoxalin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C=CC=CC3=NC=2)=C1[N+]([O-])=O VXECRKRPJRAULJ-UHFFFAOYSA-N 0.000 description 1
- FZVLZGBHFVRNLB-UHFFFAOYSA-N n-(4-methyl-5-nitropyridin-2-yl)quinoxalin-2-amine Chemical compound C1=C([N+]([O-])=O)C(C)=CC(NC=2N=C3C=CC=CC3=NC=2)=N1 FZVLZGBHFVRNLB-UHFFFAOYSA-N 0.000 description 1
- YPHGFGYLPUODNV-UHFFFAOYSA-N n-(4-methylpyridin-2-yl)-3-(trifluoromethyl)quinoxalin-2-amine Chemical compound CC1=CC=NC(NC=2C(=NC3=CC=CC=C3N=2)C(F)(F)F)=C1 YPHGFGYLPUODNV-UHFFFAOYSA-N 0.000 description 1
- GSPMGXUDYBBILM-UHFFFAOYSA-N n-(4-methylpyridin-2-yl)-4-morpholin-4-ylquinolin-7-amine Chemical compound CC1=CC=NC(NC=2C=C3N=CC=C(C3=CC=2)N2CCOCC2)=C1 GSPMGXUDYBBILM-UHFFFAOYSA-N 0.000 description 1
- BSHNAVOQNSIGLC-UHFFFAOYSA-N n-(4-methylpyridin-2-yl)quinoxalin-2-amine Chemical compound CC1=CC=NC(NC=2N=C3C=CC=CC3=NC=2)=C1 BSHNAVOQNSIGLC-UHFFFAOYSA-N 0.000 description 1
- HMSBPHQTMVDQHH-UHFFFAOYSA-N n-(4-nitrophenyl)quinolin-2-amine Chemical compound C1=CC([N+](=O)[O-])=CC=C1NC1=CC=C(C=CC=C2)C2=N1 HMSBPHQTMVDQHH-UHFFFAOYSA-N 0.000 description 1
- DFNDJRRFQJXVJE-UHFFFAOYSA-N n-(4-phenoxyphenyl)quinolin-2-amine Chemical compound C=1C=C2C=CC=CC2=NC=1NC(C=C1)=CC=C1OC1=CC=CC=C1 DFNDJRRFQJXVJE-UHFFFAOYSA-N 0.000 description 1
- BLOLQFVGPGAZBB-UHFFFAOYSA-N n-(5-bromo-4-methylpyridin-2-yl)quinoxalin-2-amine Chemical compound C1=C(Br)C(C)=CC(NC=2N=C3C=CC=CC3=NC=2)=N1 BLOLQFVGPGAZBB-UHFFFAOYSA-N 0.000 description 1
- JXNPYZYQNALESK-UHFFFAOYSA-N n-(5-methylpyridin-2-yl)quinolin-3-amine Chemical compound N1=CC(C)=CC=C1NC1=CN=C(C=CC=C2)C2=C1 JXNPYZYQNALESK-UHFFFAOYSA-N 0.000 description 1
- UIARFWFFSUIOQX-UHFFFAOYSA-N n-(5-methylpyridin-2-yl)quinolin-6-amine Chemical compound N1=CC(C)=CC=C1NC1=CC=C(N=CC=C2)C2=C1 UIARFWFFSUIOQX-UHFFFAOYSA-N 0.000 description 1
- VVCCKEKCVGLSKU-UHFFFAOYSA-N n-(5-nitropyridin-2-yl)quinolin-3-amine Chemical compound N1=CC([N+](=O)[O-])=CC=C1NC1=CN=C(C=CC=C2)C2=C1 VVCCKEKCVGLSKU-UHFFFAOYSA-N 0.000 description 1
- PKWLZRUXTBCYEG-UHFFFAOYSA-N n-(6-methylpyridin-2-yl)quinolin-3-amine Chemical compound CC1=CC=CC(NC=2C=C3C=CC=CC3=NC=2)=N1 PKWLZRUXTBCYEG-UHFFFAOYSA-N 0.000 description 1
- GQBMESGTPZAJPD-UHFFFAOYSA-N n-(6-methylpyridin-2-yl)quinolin-6-amine Chemical compound CC1=CC=CC(NC=2C=C3C=CC=NC3=CC=2)=N1 GQBMESGTPZAJPD-UHFFFAOYSA-N 0.000 description 1
- RCLQZXYDLVWBFO-UHFFFAOYSA-N n-(6-methylpyridin-2-yl)quinoxalin-2-amine Chemical compound CC1=CC=CC(NC=2N=C3C=CC=CC3=NC=2)=N1 RCLQZXYDLVWBFO-UHFFFAOYSA-N 0.000 description 1
- NOFXAEONSDUIOM-UHFFFAOYSA-N n-[2-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound FC(F)(F)OC1=CC=CC=C1NC1=CC=C(C=CC=C2)C2=N1 NOFXAEONSDUIOM-UHFFFAOYSA-N 0.000 description 1
- DIHJTBLMXALNBS-UHFFFAOYSA-N n-[2-(trifluoromethoxy)phenyl]quinoxalin-2-amine Chemical compound FC(F)(F)OC1=CC=CC=C1NC1=CN=C(C=CC=C2)C2=N1 DIHJTBLMXALNBS-UHFFFAOYSA-N 0.000 description 1
- OXMZVGXPQMUGTF-UHFFFAOYSA-N n-[2-methyl-4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound CC1=CC(OC(F)(F)F)=CC=C1NC1=CC=C(C=CC=C2)C2=N1 OXMZVGXPQMUGTF-UHFFFAOYSA-N 0.000 description 1
- IJZNNUVDSNDKDH-UHFFFAOYSA-N n-[2-methyl-4-(trifluoromethoxy)phenyl]quinoxalin-2-amine Chemical compound CC1=CC(OC(F)(F)F)=CC=C1NC1=CN=C(C=CC=C2)C2=N1 IJZNNUVDSNDKDH-UHFFFAOYSA-N 0.000 description 1
- NVOIOZMCFMHTMV-UHFFFAOYSA-N n-[3-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound FC(F)(F)OC1=CC=CC(NC=2N=C3C=CC=CC3=CC=2)=C1 NVOIOZMCFMHTMV-UHFFFAOYSA-N 0.000 description 1
- BXOAUNVKKPBHQR-UHFFFAOYSA-N n-[3-(trifluoromethoxy)phenyl]quinoxalin-2-amine Chemical compound FC(F)(F)OC1=CC=CC(NC=2N=C3C=CC=CC3=NC=2)=C1 BXOAUNVKKPBHQR-UHFFFAOYSA-N 0.000 description 1
- BCTMSDUZMDOITG-UHFFFAOYSA-N n-[4-(trifluoromethoxy)phenyl]quinolin-2-amine Chemical compound C1=CC(OC(F)(F)F)=CC=C1NC1=CC=C(C=CC=C2)C2=N1 BCTMSDUZMDOITG-UHFFFAOYSA-N 0.000 description 1
- IFKURQMAQPEGBY-UHFFFAOYSA-N n-[4-(trifluoromethoxy)phenyl]quinolin-3-amine Chemical compound C1=CC(OC(F)(F)F)=CC=C1NC1=CN=C(C=CC=C2)C2=C1 IFKURQMAQPEGBY-UHFFFAOYSA-N 0.000 description 1
- KYQIWVOWNUXADS-UHFFFAOYSA-N n-[4-(trifluoromethoxy)phenyl]quinoxalin-2-amine Chemical compound C1=CC(OC(F)(F)F)=CC=C1NC1=CN=C(C=CC=C2)C2=N1 KYQIWVOWNUXADS-UHFFFAOYSA-N 0.000 description 1
- JPVBCHHROCTOAY-UHFFFAOYSA-N n-[5-(trifluoromethyl)pyridin-2-yl]quinolin-3-amine Chemical compound N1=CC(C(F)(F)F)=CC=C1NC1=CN=C(C=CC=C2)C2=C1 JPVBCHHROCTOAY-UHFFFAOYSA-N 0.000 description 1
- UWRDSNDFPLLAEN-UHFFFAOYSA-N n-[5-(trifluoromethyl)pyridin-2-yl]quinolin-6-amine Chemical compound N1=CC(C(F)(F)F)=CC=C1NC1=CC=C(N=CC=C2)C2=C1 UWRDSNDFPLLAEN-UHFFFAOYSA-N 0.000 description 1
- BEEMTSFIVSXCQT-UHFFFAOYSA-N n-naphthalen-2-ylpyridin-2-amine Chemical compound C=1C=C2C=CC=CC2=CC=1NC1=CC=CC=N1 BEEMTSFIVSXCQT-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- UQECIBDLOFNABS-UHFFFAOYSA-N n-pyrazin-2-ylquinolin-2-amine Chemical compound C=1C=C2C=CC=CC2=NC=1NC1=CN=CC=N1 UQECIBDLOFNABS-UHFFFAOYSA-N 0.000 description 1
- NRBSSBDWCJDZTE-UHFFFAOYSA-N n-pyrazin-2-ylquinolin-6-amine Chemical compound C=1C=C2N=CC=CC2=CC=1NC1=CN=CC=N1 NRBSSBDWCJDZTE-UHFFFAOYSA-N 0.000 description 1
- YQZNQAOPVNOFQW-UHFFFAOYSA-N n-pyridin-2-ylquinolin-3-amine Chemical compound C=1N=C2C=CC=CC2=CC=1NC1=CC=CC=N1 YQZNQAOPVNOFQW-UHFFFAOYSA-N 0.000 description 1
- VIOGBDYTMPSFOP-UHFFFAOYSA-N n-pyrimidin-2-ylquinolin-2-amine Chemical compound C=1C=C2C=CC=CC2=NC=1NC1=NC=CC=N1 VIOGBDYTMPSFOP-UHFFFAOYSA-N 0.000 description 1
- QDEITQFFEKGMCH-UHFFFAOYSA-N n-pyrimidin-2-ylquinoxalin-2-amine Chemical compound C=1N=C2C=CC=CC2=NC=1NC1=NC=CC=N1 QDEITQFFEKGMCH-UHFFFAOYSA-N 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 210000002353 nuclear lamina Anatomy 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 125000005010 perfluoroalkyl group Chemical group 0.000 description 1
- 125000005009 perfluoropropyl group Chemical group FC(C(C(F)(F)F)(F)F)(F)* 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000003909 protein kinase inhibitor Substances 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- XFTQRUTUGRCSGO-UHFFFAOYSA-N pyrazin-2-amine Chemical compound NC1=CN=CC=N1 XFTQRUTUGRCSGO-UHFFFAOYSA-N 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 208000034979 restrictive dermopathy Diseases 0.000 description 1
- 102000000568 rho-Associated Kinases Human genes 0.000 description 1
- 108010041788 rho-Associated Kinases Proteins 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000009759 skin aging Effects 0.000 description 1
- 239000007886 soft shell capsule Substances 0.000 description 1
- 238000007711 solidification Methods 0.000 description 1
- 230000008023 solidification Effects 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 231100000747 viability assay Toxicity 0.000 description 1
- 238000003026 viability measurement method Methods 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4985—Pyrazines or piperazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/74—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
- C07D215/42—Nitrogen atoms attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
- C07D215/42—Nitrogen atoms attached in position 4
- C07D215/46—Nitrogen atoms attached in position 4 with hydrocarbon radicals, substituted by nitrogen atoms, attached to said nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/58—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems with hetero atoms directly attached to the ring nitrogen atom
- C07D215/60—N-oxides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/36—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings condensed with carbocyclic rings or ring systems
- C07D241/38—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings condensed with carbocyclic rings or ring systems with only hydrogen or carbon atoms directly attached to the ring nitrogen atoms
- C07D241/40—Benzopyrazines
- C07D241/44—Benzopyrazines with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Quinoline Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Steroid Compounds (AREA)
Abstract
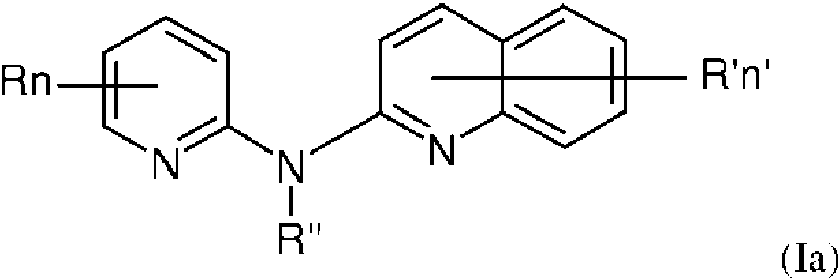
Un compuesto de fórmula (I)**Fórmula** en donde:**Fórmula** significa un anillo aromático en donde V es C, R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo - NO2, un grupo -NR1R2, un grupo alcoxi(C1-C4), un grupo fenoxi y un grupo alquilo(C1-C3), dicho alquilo está opcionalmente monosustituido por un grupo hidroxilo, R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3), n es 1, 2 o 3, n' es 1 o 2, R' es un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo - COOR1, un grupo -NO2, un grupo -NR1R2, un grupo morfolinilo o morfolino, un grupo N-metilpiperazinilo, un grupo fluoroalquilo(C1-C3), un grupo alcoxi(C1-C4) y un grupo -CN, R" es un átomo de hidrógeno o un grupo alquilo(C1-C4), Z es N, V es C, Y es N, X es C, T es C, U es C y W es C, o cualquiera de su sal farmacéuticamente aceptable, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Description
DESCRIPCIÓN
Compuestos útiles para tratar el cáncer
Campo de la invención
La presente invención está generalmente dedicada al uso de compuestos para la fabricación de composiciones útiles para tratar el cáncer.
Antecedentes de la invención
En la mayoría de los cánceres, la mortalidad no se debe al tumor primario, sino que a las metástasis derivadas. Esta progresión maligna que conduce a la invasión tumoral y se define clínicamente por la aparición de metástasis es el resultado final de la pérdida primaria de adhesión celular y el aumento de la movilidad celular que juntas permiten que las células invasoras abandonen el sitio del tumor inicial y colonicen diversos tejidos diana.
Las metástasis se consideran una característica recurrente de la progresión maligna descontrolada del cáncer. Durante este proceso, las células tumorales completan su transformación maligna al aumentar su capacidad migratoria. A continuación, las células cancerosas se pueden diseminar y establecer focos tumorales en sitios alejados. La propagación de las células cancerosas en el organismo es el resultado de una serie de eventos llamados "cascada metastásica": invasión de los tejidos alrededor del tumor, intravasación venosa o linfática, migración y establecimiento en un lugar distante de una nueva colonia que escapa a todos los mecanismos de defensa del organismo.
La invasión metastásica, contra la cual no existe una opción terapéutica eficaz disponible en este momento, es por lejos la principal causa de muerte. Debido a la frecuencia de los cánceres diagnosticados en el estadio metastásico y al estancamiento terapéutico que representan, el desarrollo de moléculas que se dirigen específicamente a la invasión metastásica es, por lo tanto, un requisito esencial para un avance decisivo en los tratamientos del cáncer. La presente invención está en consonancia con la evidencia publicada durante los últimos veinte años de una conexión entre cambios en el empalme alternativo del ARN y la invasión metastásica que ha dado lugar a nuevas estrategias terapéuticas.
Ya se conoce el tratamiento del cáncer mediante el uso de compuestos tales como los descritos, por ejemplo, en la publicación internacional WO2008/115870.
Compendio de la invención
Ahora se halló que derivados de la fórmula (I), según se define en la fórmula (I) más adelante en la presente memoria y, más particularmente, en la fórmula (Ia) más adelante en la presente memoria, son capaces de corregir defectos de empalme alternativo, según se ilustra en los datos experimentales más adelante en la presente memoria, un mecanismo asociado estrechamente con la progresión invasiva de los cánceres metastásicos, y en función de dicha actividad, los compuestos son útiles en el tratamiento del cáncer.
La presente invención, por lo tanto, se refiere a compuestos de fórmula (I), según se define en la reivindicación 1, para su uso como agentes para la prevención, inhibición o tratamiento del cáncer.
La presente solicitud describe, además, algunos derivados particulares como tal, estos derivados no son parte de la invención, según se define más adelante.
El presente texto también describe composiciones farmacéuticas que comprenden al menos uno de dichos compuestos particulares.
Descripción detallada de la invención
El presente texto describe un compuesto de fórmula (I)
en donde:
significa un anillo aromático en donde V es C o N y cuando V es N, V está en orto, meta o para de Z, es decir, forma respectivamente un grupo piridazina, pirimidina o pirazina,
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C4), un grupo fenoxi y un grupo alquilo(C1-C3), dicho alquilo está opcionalmente monosustituido por un grupo hidroxilo,
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
n es 1, 2 o 3,
n' es 1 o 2,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un átomo de halógeno, un grupo hidroxilo, un grupo -COOR1, un grupo -NO2 , un grupo -NR1R2 , un grupo morfolinilo o morfolino, un grupo N-metilpiperazinilo, un grupo fluoroalquilo(C1-C3), un grupo alcoxi(C1-C4) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
Z es N o C,
Y es N o C,
X es N o C,
W es N o C,
T es N o C,
U es N o C,
y en donde como máximo cuatro de los grupos V, T, U, Z, Y, X y W son N,
y al menos uno de los grupos T, U, Y, X y W es N,
o cualquiera de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es C, Y es N, X es C, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es C, V es C, Y es N, X es C, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es C, Y es C, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es C, Y es C, X es C, T es C, U es C y W es N, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es N y está en para de Z, Y es N, X es C, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es C, V es N y está en para de Z, Y es C, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es C, V es N y está en meta de Z y está en para de la unión enlazada a NR", Y es N, X es C, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es C, V es N y está en meta de Z y está en para de la unión enlazada a NR", Y es C, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es C, V es C, Y es C, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es C, V es C, Y es N, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es N y está en meta de Z y en orto de la unión enlazada a NR", Y es N, X es C, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es N y está en para de Z, Y es C, X es C, T es C, U es C y W es N, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es N y está en para de Z, Y es C, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es C, Y es N, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es N y está en meta de Z y está en orto de la unión enlazada a NR", Y es N, X es N, T es C, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es C, V es C, Y es C, X es C, T es N, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es C, Y es C, X es C, T es N, U es C y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (I) según se definió anteriormente, en donde Z es N, V es C, Y es C, X es C, T es C, U es N y W es C, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Según un primer aspecto, un objeto de la presente invención se refiere a un compuesto de fórmula (I):
significa un anillo aromático en donde V es C,
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C4), un grupo fenoxi y un grupo alquilo(C1-C3), dicho alquilo está opcionalmente monosustituido por un grupo hidroxilo,
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
n es 1, 2 o 3,
n' es 1 o 2,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -COOR1, un grupo -NO2, un grupo -NR1R2, un grupo morfolinilo o morfolino, un grupo N-metilpiperazinilo, un grupo fluoroalquilo(C1-C3), un grupo alcoxi(C1-C4) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
Z es N, V es C, Y es N, X es C, T es C, U es C y W es C,
o cualquiera de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Los compuestos de la invención pueden existir en forma de bases libres o de sales de adición con ácidos farmacéuticamente aceptables.
Las sales de adición de ácido adecuadas fisiológicamente aceptables de compuestos de fórmula (I) incluyen bromhidrato, tartrato, citrato, trifluoroacetato, ascorbato, clorhidrato, tartrato, triflato, maleato, mesilato, formiato, acetato y fumarato.
Los compuestos de fórmula (I) y o sales de estos pueden formar solvatos (p. ej., hidratos) y la invención incluye todos dichos solvatos.
En el contexto de la presente invención, el término:
• "halógeno" se entiende que significa cloro, flúor, bromo o yodo y, en particular, denota cloro, flúor o bromo, • "alquilo(C1-C3)", según se usa en la presente memoria, respectivamente, se refiere a hidrocarburo C1-C3 normal, secundario o terciario saturado. Los ejemplos son, pero no se limitan a, metilo, etilo, 1 -propilo, 2-propilo, • "alcoxi(C1-C3)", según se usa en la presente memoria, respectivamente, se refiere al resto O-alquilo(C1-C3), en donde alquilo es según se definió anteriormente. Los ejemplos son, pero no se limitan a, metoxi, etoxi, 1-propoxi, 2-propoxi,
• "grupo fluoroalquilo" y "grupo fluoroalcoxi" se refiere, respectivamente, al grupo alquilo y el grupo alcoxi, según se definieron anteriormente, dichos grupos están sustituidos al menos por un átomo de flúor. Los ejemplos son grupos perfluoroalquilo, tales como trifluorometilo o perfluoropropilo, y
• "paciente" puede extenderse a humanos o mamíferos, tales como gatos o perros.
Según una realización particular, un objeto adicional de la presente invención es un compuesto de fórmula (Ia)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo -NO2 , un grupo -NR1R2 y un grupo alcoxi(C1-C3),
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -NO2, un grupo alcoxi(C1-C3) y un grupo -NR1R2,
R1 y R2 son un átomo de hidrógeno o un grupo alquilo(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ib)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -NR1R2, un grupo fluoroalcoxi(C1-C3), un grupo -NO2 , un grupo fenoxi y un grupo alcoxi(Cr C4),
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, preferiblemente, es 1 o 2,
n' es según se definió anteriormente y, preferiblemente, es 1,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3) y un grupo alcoxi(C1-C4),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ic)
en donde:
R independientemente representa un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo fluoroalquilo(C1-C3), un grupo -NR1R2, un grupo -COOR1, un grupo -NO2 y un grupo alcoxi(C1-C3),
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Id)
R independientemente representa un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo fluoroalquilo(C1-C3) y un grupo alcoxi(C1-C3),
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ie)
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3) y un grupo alcoxi(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (If)
en donde:
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno, n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer. El presente texto describe un compuesto de fórmula (Ig)
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno, n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno o un átomo de halógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer. El presente texto describe un compuesto de fórmula (Ih)
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno, n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ii)
en donde:
R independientemente representa un átomo de hidrógeno o un grupo elegido entre un grupo fluoroalcoxi(C1-C3) y un grupo alcoxi(C1-C3),
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ij)
en donde:
R independientemente representa un átomo de hidrógeno o un grupo elegido entre un grupo fluoroalcoxi(C1-C3) y un grupo alquilo(C1-C3),
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ik)
en donde:
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno, n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo alquilo(C1-C3), o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer. El presente texto describe un compuesto de fórmula (Il)
en donde:
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno, n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer. El presente texto describe un compuesto de fórmula (Im)
en donde:
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno, n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer. El presente texto describe un compuesto de fórmula (Io)
en donde:
R independientemente representa un átomo de hidrógeno o un átomo de halógeno o un grupo elegido entre un grupo -NO2 , un grupo -CN y un grupo alquilo(CrC3), dicho alquilo está opcionalmente monosustituido por un grupo hidroxilo,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo fluoroalquilo(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ip)
en donde:
R representa un átomo de hidrógeno,
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Iq)
en donde:
R independientemente representa un átomo de hidrógeno, un grupo alcoxi(CrC3) o un grupo fluoroalcoxi(C1-C3), R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo -NR1R2 , un grupo N-metilpiperazinilo, un grupo alcoxi(C1-C3) y un grupo morfolino,
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ir)
en donde:
R independientemente representa un átomo de hidrógeno o un grupo alquilo(C1-C3),
R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y, ventajosamente, es 1,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo -NR1R2 , un grupo morfolino y un grupo alcoxi(C1-C3), R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Iee)
R independientemente representa un átomo de hidrógeno, un grupo alquilo(C1-C3) o un grupo fluoroalquilo(C1-C3), R" es según se definió anteriormente y, ventajosamente, es un átomo de hidrógeno,
n es según se definió anteriormente y, ventajosamente, es 1,
n' es según se definió anteriormente y es, ventajosamente, 2,
R' es un átomo de hidrógeno o un grupo alquilo(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Entre las familias de compuestos de las fórmulas (Ia) a (Iee) definidas anteriormente, algunas se prefieren más particularmente para su uso como un agente para la prevención, inhibición o tratamiento del cáncer. Estos
compuestos particularmente preferidos pertenecen a la fórmula (la), según se definió anteriormente o una de sus sales farmacéuticamente aceptables.
Por consiguiente, la presente invención se refiere a un compuesto de fórmulas (Ia) y sus sales farmacéuticamente aceptables para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Según una realización particular, la presente invención se centra más particularmente en un compuesto de fórmula (Ia)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo -COOR1 y un grupo fluoroalquilo(C1-C3),
R" es según se definió anteriormente y, más preferiblemente, es un átomo de hidrógeno,
R1 es según se definió anteriormente,
n es según se definió anteriormente,
n' es según se definió anteriormente,
R' es un átomo de halógeno, un grupo alquilo(C1-C4), un grupo alcoxi(C1-C4) o un grupo -NO2 ,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Ie)
en donde:
R representa un átomo de hidrógeno o un grupo alquilo(C1-C4),
R" es según se definió anteriormente y, más preferiblemente, es un átomo de hidrógeno,
n es según se definió anteriormente,
n' es según se definió anteriormente,
R' es un átomo de halógeno,
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Iq)
en donde:
R', R", n y n' son según se definieron en la fórmula (I), y
R es un grupo fluoroalcoxi(C1-C3),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
El presente texto describe un compuesto de fórmula (Iee)
en donde:
R es independientemente un átomo de hidrógeno o un grupo alquilo(C1-C4),
R', R", n y n' son según se definieron en la fórmula (I),
o una de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
La presente invención se refiere a un compuesto de fórmula (la), según se definió anteriormente, o una de sus sales farmacéuticamente aceptables para su uso como un agente para la prevención, inhibición o tratamiento del cáncer. El presente texto describe que el compuesto para su uso como un agente para la prevención, inhibición o tratamiento del cáncer se elige de:
(1) (8-cloro-quinolin-2-il)-piridin-2-il-amina
(2) ácido 2-(quinolin-2-ilamino)-isonicotínico
(3) (4-metil-piridin-2-il)-quinolin-2-il-amina
(4) piridin-2-il-quinolin-2-il-amina
(5) ácido 2-(8-cloro-quinolin-2-ilamino)-isonicotínico
(6) (8-cloro-quinolin-2-il)-(4-metil-piridin-2-il)-amina
(7) 6-(quinolin-2-ilamino)-nicotinonitrilo
(8) quinolin-2-il-(4-trifluorometoxi-fenil)-amina
(9) piridin-2-il-quinolin-3-il-amina
(10) (3-metoxi-piridin-2-il)-quinolin-3-il-amina
(11) quinolin-3-il-(5-trifluorometil-piridin-2-il)-amina
(12) (5-nitro-piridin-2-il)-quinolin-3-il-amina
(13) (5-metil-piridin-2-il)-quinolin-3-il-amina
(14) ácido 2-(quinolin-3-ilamino)-isonicotínico
(15) quinolin-6-il-(5-trifluorometil-piridin-2-il)-amina
(16) (6-metil-piridin-2-il)-quinolin-6-il-amina
(17) N-(6-metilpiridin-2-il)quinolin-2-amina
(18) 8-cloro-N-(6-metilpiridin-2-il)quinolin-2-amina
(19) 4-metil-N-(piridin-2-il)quinolin-2-amina
(20) 4-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
(21) 3-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
(22) 3-metil-N-(piridin-2-il)quinolin-2-amina
(23) 6-((4-metilquinolin-2-il)amino)nicotinonitrilo
(24) 6-((3-metilquinolin-2-il)amino)nicotinonitrilo
(25) 6-cloro-N-(4-metilpiridin-2-il)quinolin-2-amina
(26) 6-cloro-N-(6-metilpiridin-2-il)quinolin-2-amina
(27) 4-metil-N-(5-nitropiridin-2-il)quinolin-2-amina
(28) N-(3-nitropiridin-2-il)quinolin-2-amina
(29) 8-cloro-N-(3-nitropiridin-2-il)quinolin-2-amina
(30) 2-((4-metilquinolin-2-il)amino)nicotinonitrilo
(31) N-(3-metilpiridin-2-il)quinolin-2-amina
(32) N-(5-metilpiridin-2-il)quinolin-2-amina
(33) 2-(quinolin-2-ilamino)isonicotinonitrilo
(34) N-(5-(trifluorometil)piridin-2-il)quinolin-2-amina
(35) 8-cloro-N-(3-metilpiridin-2-il)quinolin-2-amina
(36) 8-cloro-N-(5-metilpiridin-2-il)quinolin-2-amina
(37) 8-cloro-N-(5-(trifluorometil)piridin-2-il)quinolin-2-amina (38) N-(3-metoxipiridin-2-il)quinolin-2-amina
(39) N-(5-nitropiridin-2-il)quinolin-2-amina
(40) 6-((8-cloroquinolin-2-il)amino)nicotinonitrilo
(41) N-(5-fluoropiridin-2-il)quinolin-2-amina
(42) N-(6-(trifluorometil)piridin-2-il)quinolin-2-amina
(43) 8-cloro-N-(5-fluoropiridin-2-il)quinolin-2-amina
(44) ácido 2-((8-cloroquinolin-2-il)amino)nicotínico
(45) 4-metil-N-(6-metilpiridin-2-il)quinolin-2-amina
(46) 3-metil-N-(6-metilpiridin-2-il)quinolin-2-amina
(47) cloruro de 5-ciano-2-(quinolin-2-ilamino)piridin-1-io
(48) cloruro de 2-((8-cloroquinolin-2-il)amino)-4-metilpiridin-1-io (49) 8-cloro-N-(4-etilpiridin-2-il)quinolin-2-amina
(50) 8-cloro-N-(6-etilpiridin-2-il)quinolin-2-amina
(51) 8-cloro-N-(4,6-dimetilpiridin-2-il)quinolin-2-amina
(52) 6-((8-cloroquinolin-2-il)amino)-2-metilnicotinonitrilo
(53) 8-cloro-N-(4-cloropiridin-2-il)quinolin-2-amina
(54) 8-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
(55) N-(5-bromo-4-metilpiridin-2-il)-8-cloroquinolin-2-amina (56) 8-cloro-N-(3-etil-6-metilpiridin-2-il)quinolin-2-amina
(57) 8-fluoro-N-(4-metilpiridin-2-il)quinolin-2-amina
(58) 8-bromo-N-(4-metilpiridin-2-il)quinolin-2-amina
(59) 6-(quinolin-2-ilamino)nicotinato de metilo
(60) 6-[(8-cloroquinolin-2-il)amino]piridina-3-carboxilato de metilo (61) 6-[(3-metilquinolin-2-il)amino]piridina-3-carboxilato de metilo (62) 2-[(8-cloroquinolin-2-il)amino]piridina-3-carboxilato de metilo
(63) 8-metoxi-N-(4-metilpiridin-2-il)quinolin-2-amina
(64) N-(4-metilpiridin-2-il)-5-nitroquinolin-2-amina
(65) 2-N-(4-metilpiridin-2-il)quinolina-2,8-diamina
(66) N-(4-metilpiridin-2-il)-5-aminoquinolin-2-amina
(67) 6-[(4-metilquinolin-2-il)amino]piridina-3-carboxilato de metilo (68) 8-cloro-N-[4-(trifluorometil)piridin-2-il]quinolin-2-amina
(69) 2-[(8-cloroquinolin-2-il)amino]piridin-3-ol
(70) 8-cloro-N-[6-(trifluorometil)piridin-2-il]quinolin-2-amina
(71) 6-cloro-N-(5-fluoropiridin-2-il)quinolin-2-amina
(72) N-(6-etilpiridin-2-il)-3-metilquinolin-2-amina
(73) N-(5-fluoropiridin-2-il)-3-metilquinolin-2-amina
(74) 3-metil-N-[5-(trifluorometil)piridin-2-il]quinolin-2-amina
(75) 4-N-(8-cloroquinolin-2-il)-1 -N,1-N-dimetilbenceno-1,4-diamina (76) N-(4-metoxifenil)quinolin-2-amina
(77) 8-cloro-N-(4-metoxifenil)quinolin-2-amina
(78) 4-metil-N-[4-(trifluorometoxi)fenil]quinolin-2-amina
(79) N-(4-metoxifenil)-3-metilquinolin-2-amina
(80) 3-metil-N-[4-(trifluorometoxi)fenil]quinolin-2-amina
(81) 1 -N,1-N-dimetil-4-N-(3-metilquinolin-2-il)benceno-1,4-diamina (82) N-[2-metil-4-(trifluorometoxi)fenil]quinolin-2-amina
(83) N-[3-(trifluorometoxi)fenil]quinolin-2-amina
(84) N-[2-(trifluorometoxi)fenil]quinolin-2-amina
(85) N-(4-nitrofenil)quinolin-2-amina
(86) N-(3-fluorofenil)quinolin-2-amina
(87) 8-cloro-N-[3-(trifluorometoxi)fenil]quinolin-2-amina
(88) 8-cloro-N-(3-fluorofenil)quinolin-2-amina
(89) cloruro de 2-{[4-(trifluorometoxi)fenil]amino}quinolin-1-io (90) 8-cloro-N-[4-(trifluorometoxi)fenil]quinolin-2-amina
(91) 3-metil-N-[2-metil-4-(trifluorometoxi)fenil]quinolin-2-amina (92) 3-metil-N-[3-(trifluorometoxi)fenil]quinolin-2-amina
(93) 3-metil-N-[2-(trifluorometoxi)fenil]quinolin-2-amina
(94) 8-cloro-N-[2-metil-4-(trifluorometoxi)fenil]quinolin-2-amina
(95) cloruro de 3-metil-2-{[4-(trifluorometoxi)fenil]amino}quinolin-1-io (96) 6-cloro-N-(4-(trifluorometoxi)fenil)quinolin-2-amina
(97) cloruro de 4-metil-2-{[4-(trifluorometoxi)fenil]amino}quinolin-1-io (98) 8-bromo-N-[4-(trifluorometoxi)fenil]quinolin-2-amina
(99) 8-fluoro-N-[4-(trifluorometoxi)fenil]quinolin-2-amina
(100) 8-metil-N-[4-(trifluorometoxi)fenil]quinolin-2-amina
(101) N-(4-butoxifenil)-8-cloroquinolin-2-amina
(102) N-(4-fenoxifenil)quinolin-2-amina
(103) 8-metoxi-N-[4-(trifluorometoxi)fenil]quinolin-2-amina
(104) 8-cloro-N-[3-cloro-4-(trifluorometoxi)fenil]quinolin-2-amina (105) N-(6-metilpiridin-2-il)quinolin-3-amina
(106) N-(3-nitropiridin-2-il)quinolin-3-amina
(107) N-(5-metilpiridin-2-il)quinolin-6-amina
(108) N-(3-metoxipiridin-2-il)quinolin-6-amina
(109) 6-cloro-N-(pirazin-2-il)quinolin-2-amina
(110) 8-bromo-N-(pirazin-2-il)quinolin-2-amina
(111) 8-metil-N-(pirazin-2-il)quinolin-2-amina
(112) 8-cloro-N-(pirazin-2-il)quinolin-2-amina
(113) N-(pirazin-2-il)quinolin-2-amina
(114) 4-metil-N-(pirazin-2-il)quinolin-2-amina
(115) 3-metil-N-(pirazin-2-il)quinolin-2-amina
(116) 8-fluoro-N-(pirazin-2-il)quinolin-2-amina
(117) 8-metoxi-N-(pirazin-2-il)quinolin-2-amina
(118) N-(pirazin-3-il)quinolin-3-amina
(119) 8-cloro-N-(pirazin-4-il)quinolin-2-amina
(120) N-(pirazin-4-il)quinolin-2-amina
(121) N-(pirazin-4-il)quinolin-3-amina
(122) N-[4-(trifluorometoxi)fenil]quinolin-3-amina
(123) N-(4-metoxifenil)quinolin-3-amina
(124) N-[4-(trifluorometoxi)fenil]quinoxalin-2-amina
(125) N-[2-metil-4-(trifluorometoxi)fenil]quinoxalin-2-amina
(126) N-[3-(trifluorometoxi)fenil]quinoxalin-2-amina
(127) N-[2-(trifluorometoxi)fenil]quinoxalin-2-amina
(128) N-(pirimidin-2-il)quinolin-2-amina
(129) 8-cloro-N-(pirimidin-2-il)quinolin-2-amina
(130) 4-metil-N-(pirimidin-2-il)quinolin-2-amina
(131) N-(pirazin-2-il)quinolin-6-amina
(132) N-(pirazin-2-il)quinolin-3-amina
(133) 6-metil-N-(naftalen-2-il)piridin-2-amina
(134) N-(naftalen-2-il)piridin-2-amina
(135) N-(pirazin-2-il)quinoxalin-2-amina
(136) N-(4-metilpiridin-2-il)quinoxalin-2-amina
(137) 6-(quinoxalin-2-ilamino)piridina-3-carbonitrilo
(138) N-(6-metilpiridin-2-il)quinoxalin-2-amina
(139) N-(4-metilpiridin-2-il)-3-(trifluorometil)quinoxalin-2-amina
(140) N-(3,5-dicloro-4-metilpiridin-2-il)quinoxalin-2-amina
(141) N-(4-metil-3-nitropiridin-2-il)quinoxalin-2-amina
(142) N-(pirimidin-2-il)quinoxalin-2-amina
(143) 4-N,4-N-dimetil-7-N-[4-(trifluorometoxi)fenil]quinolina-4,7-diamina (144) 4-(morfolin-4-il)-N-[4-(trifluorometoxi)fenil] quinolin-7-amina (145) 4-metoxi-N-(piridin-2-il)quinolin-7-amina
(146) 4-metoxi-N-(4-metilpiridin-2-il)quinolin-7-amina
(147) 4-N,4-N-dimetil-7-N-(4-metilpiridin-2-il)quinolina-4,7-diamina (148) 5,8-dimetil-N-(5-metilpiridin-2-il)isoquinolin-6-amina
(149) 5,8-dimetil-N-(5-trifluorometilpiridin-2-il)isoquinolin-6-amina (150) N-(4-metilpiridin-2-il)-8-nitroquinolin-2-amina
(151) 6-cloro-N-(6-etilpiridin-2-il)quinolin-2-amina
(152) 6-cloro-N-(5-metilpiridin-2-il)quinolin-2-amina
(153) 6-cloro-N-[5-(trifluorometil)piridin-2-il]quinolin-2-amina
(154) N2-(8-cloroquinolin-2-il)-4-metilpiridina-2,3-diamina
(155) N-(4-butoxifenil)-3-metilquinolin-2-amina
(156) 4-N-(6-cloroquinolin-2-il)-1 -N,1-N-dimetilbenceno-1,4-diamina (157) 8-cloro-N-(3-cloro-4-metoxifenil)quinolin-2-amina
(158) N1-(8-cloroquinolin-2-il)-4-(trifluorometoxi)benceno-1,2-diamina
(159) N-(3-aminopiridin-2-il)quinolin-3-amina
(160) 6-cloro-N-(4-metilpiridin-2-il)quinoxalin-2-amina
(161) N-(4-etilpiridin-2-il)quinoxalin-2-amina
(162) N-(5-bromo-4-metilpiridin-2-il)quinoxalin-2-amina
(163) N-(4,6-dimetilpiridin-2-il)quinoxalin-2-amina
(164) [2-(quinoxalin-2-ilamino)piridin-4-il]metanol
(165) N-(4-metil-5-nitropiridin-2-il)quinoxalin-2-amina
(166) N-(4-metoxifenil)-4-(4-metilpiperazin-1 -il)quinolin-7-amina
(167) 4-metoxi-N-[4-(trifluorometoxi)fenil]quinolin-7-amina
(168) N-(4-metilpiridin-2-il)-4-(morfolin-4-il)quinolin-7-amina
y sus sales farmacéuticamente aceptables.
Entre dichos compuestos, los compuestos (6), (18), (30), (35), (36), (37), (45), (48), (51), (52), (53), (55), (56), (58), (61), (63), (64), (109), (110), (112), (143), (144) y (148) son de interés particular.
El presente testo, por lo tanto, describe los compuestos (6), (18), (30), (35), (36), (37), (45), (48), (51), (52), (53), (55), (56), (58), (61), (63), (64), (109), (110), (112), (143), (144) y (148) o una de sus sales farmacéuticamente aceptables para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Algunos de dichos compuestos precedentes son nuevos y se describen en el presente texto: (6), (18), (30), (35), (36), (37), (48), (51), (52), (53), (55), (56), (58), (61), (63), (64), (109), (110), (112), (143) y (144).
La presente invención se refiere a un compuesto elegido entre:
(1) (8-cloro-quinolin-2-il)-piridin-2-il-amina
(2) ácido 2-(quinolin-2-ilamino)-isonicotínico
(3) (4-metil-piridin-2-il)-quinolin-2-il-amina
(4) piridin-2-il-quinolin-2-il-amina
(5) ácido 2-(8-cloro-quinolin-2-ilamino)-isonicotínico
(6) (8-cloro-quinolin-2-il)-(4-metil-piridin-2-il)-amina
(7) 6-(quinolin-2-ilamino)-nicotinonitrilo
(17) N-(6-metilpiridin-2-il)quinolin-2-amina
(18) 8-cloro-N-(6-metilpiridin-2-il)quinolin-2-amina
(19) 4-metil-N-(piridin-2-il)quinolin-2-amina
(20) 4-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
(21) 3-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
(22) 3-metil-N-(piridin-2-il)quinolin-2-amina
(23) 6-((4-metilquinolin-2-il)amino)nicotinonitrilo
(24) 6-((3-metilquinolin-2-il)amino)nicotinonitrilo
(25) 6-cloro-N-(4-metilpiridin-2-il)quinolin-2-amina
(26) 6-cloro-N-(6-metilpiridin-2-il)quinolin-2-amina
(27) 4-metil-N-(5-nitropiridin-2-il)quinolin-2-amina
(28) N-(3-nitropiridin-2-il)quinolin-2-amina
(29) 8-cloro-N-(3-nitropiridin-2-il)quinolin-2-amina
(30) 2-((4-metilquinolin-2-il)amino)nicotinonitrilo
(31) N-(3-metilpiridin-2-il)quinolin-2-amina
(32) N-(5-metilpiridin-2-il)quinolin-2-amina
(33) 2-(quinolin-2-ilamino)isonicotinonitrilo
(34) N-(5-(trifluorometil)piridin-2-il)quinolin-2-amina
(35) 8-cloro-N-(3-metilpiridin-2-il)quinolin-2-amina
(36) 8-cloro-N-(5-metilpiridin-2-il)quinolin-2-amina
(37) 8-cloro-N-(5-(trifluorometil)piridin-2-il)quinolin-2-amina (38) N-(3-metoxipiridin-2-il)quinolin-2-amina
(39) N-(5-nitropiridin-2-il)quinolin-2-amina
(40) 6-((8-cloroquinolin-2-il)amino)nicotinonitrilo
(41) N-(5-fluoropiridin-2-il)quinolin-2-amina
(42) N-(6-(trifluorometil)piridin-2-il)quinolin-2-amina
(43) 8-cloro-N-(5-fluoropiridin-2-il)quinolin-2-amina
(44) ácido 2-((8-cloroquinolin-2-il)amino)nicotínico
(45) 4-metil-N-(6-metilpiridin-2-il)quinolin-2-amina
(46) 3-metil-N-(6-metilpiridin-2-il)quinolin-2-amina
(47) cloruro de 5-ciano-2-(quinolin-2-ilamino)piridin-1-io
(48) cloruro de 2-((8-cloroquinolin-2-il)amino)-4-metilpiridin-1-io (49) 8-cloro-N-(4-etilpiridin-2-il)quinolin-2-amina
(50) 8-cloro-N-(6-etilpiridin-2-il)quinolin-2-amina
(51) 8-cloro-N-(4,6-dimetilpiridin-2-il)quinolin-2-amina
(52) 6-((8-cloroquinolin-2-il)amino)-2-metilnicotinonitrilo
(53) 8-cloro-N-(4-cloropiridin-2-il)quinolin-2-amina
(54) 8-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
(55) N-(5-bromo-4-metilpiridin-2-il)-8-cloroquinolin-2-amina (56) 8-cloro-N-(3-etil-6-metilpiridin-2-il)quinolin-2-amina
(57) 8-fluoro-N-(4-metilpiridin-2-il)quinolin-2-amina
(58) 8-bromo-N-(4-metilpiridin-2-il)quinolin-2-amina
(59) 6-(quinolin-2-ilamino)nicotinato de metilo
(60) 6-[(8-cloroquinolin-2-il)amino]piridina-3-carboxilato de metilo
(61) 6-[(3-metilquinolin-2-il)amino]piridina-3-carboxilato de metilo
(62) 2-[(8-cloroquinolin-2-il)amino]piridina-3-carboxilato de metilo
(63) 8-metoxi-N-(4-metilpiridin-2-il)quinolin-2-amina
(64) N-(4-metilpiridin-2-il)-5-nitroquinolin-2-amina
(65) 2-N-(4-metilpiridin-2-il)quinolina-2,8-diamina
(66) N-(4-metilpiridin-2-il)-5-aminoquinolin-2-amina
(67) 6-[(4-metilquinolin-2-il)amino]piridina-3-carboxilato de metilo
(68) 8-cloro-N-[4-(trifluorometil)piridin-2-il]quinolin-2-amina
(69) 2-[(8-cloroquinolin-2-il)amino]piridin-3-ol
(70) 8-cloro-N-[6-(trifluorometil)piridin-2-il]quinolin-2-amina
(71) 6-cloro-N-(5-fluoropiridin-2-il)quinolin-2-amina
(72) N-(6-etilpiridin-2-il)-3-metilquinolin-2-amina
(73) N-(5-fluoropiridin-2-il)-3-metilquinolin-2-amina
(74) 3-metil-N-[5-(trifluorometil)piridin-2-il]quinolin-2-amina
(150) N-(4-metilpiridin-2-il)-8-nitroquinolin-2-amina
(151) 6-cloro-N-(6-etilpiridin-2-il)quinolin-2-amina
(152) 6-cloro-N-(5-metilpiridin-2-il)quinolin-2-amina
(153) 6-cloro-N-[5-(trifluorometil)piridin-2-il]quinolin-2-amina
(154) N2-(8-cloroquinolin-2-il)-4-metilpiridina-2,3-diamina
y sus sales farmacéuticamente aceptables.
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Los compuestos de fórmulas (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik), (Il), (Im), (Io), (Ip), (Iq), (Ir) y (Iee) pueden comprender uno o más átomos de carbono asimétricos. Por lo tanto, pueden existir en forma de enantiómeros o de diaestereoisómeros. Estos enantiómeros, diaestereoisómeros y sus mezclas, incluidas las mezclas racémicas, están abarcados dentro del alcance de la presente invención.
Entre los compuestos de fórmula (I), algunos de ellos son nuevos y se describen en el presente texto, así como sus sales farmacéuticamente aceptables, tales como bromhidrato, tartrato, citrato, trifluoroacetato, ascorbato, clorhidrato, triflato, maleato, mesilato, formiato, acetato y fumarato.
El presente texto describe compuestos de fórmula (Ig)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2 , un grupo -NR1R2 y un grupo alcoxi(C1-C3),
n es 1 o 2,
n' es 1 o 2,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un átomo de halógeno, un grupo hidroxilo, un grupo -COOR1, un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C3) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
con la condición de que R y R' no sean simultáneamente un átomo de hidrógeno,
y cuando n y n' son 1 y R es un átomo de hidrógeno, entonces R' no sea un grupo -COOH,
ni cualquiera de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (If)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2 , un grupo -NR1R2 y un grupo alcoxi(C1-C3),
n es 1 o 2,
n' es 1 o 2,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un átomo de halógeno, un grupo hidroxilo, un grupo -COOR1, un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C3) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
ni cualquiera de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Ih)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2, un grupo -NR1R2 y un grupo alcoxi(C1-C3),
n es 1 o 2,
n' es 1 o 2,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un átomo de halógeno, un grupo hidroxilo, un grupo -COOR1, un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C3) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
ni cualquiera de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Il)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2 , un grupo -NR1R2 y un grupo alcoxi(C1-C3),
n es 1 o 2,
n' es 1 o 2,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un átomo de halógeno, un grupo hidroxilo, un grupo -COOR1, un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C3) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
con la condición de que R y R' no sean simultáneamente un átomo de hidrógeno,
ni cualquiera de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Im)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2 , un grupo -NR1R2 y un grupo alcoxi(C1-C3),
n es 1 o 2,
n' es 1 o 2,
R' es un átomo de hidrógeno o un grupo elegido entre un grupo alquilo(C1-C3), un átomo de halógeno, un grupo hidroxilo, un grupo -COOR1, un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C3) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
con la condición de que cuando n y n' son 1 y R es un átomo de hidrógeno, R' no sea un átomo de cloro,
ni cualquiera de su sal farmacéuticamente aceptable.
Con el fin de simplificar, los siguientes compuestos y sus correspondientes definiciones se denominan "nuevos compuestos".
El presente texto describe compuestos de fórmula (Ia), como tal,
en donde:
R" y n son según se definieron en la fórmula (Ia),
n' es 1,
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo -NO2, un grupo fluoroalcoxi(C1-C3) y un grupo alcoxi(C1-C3),
R' es un átomo de hidrógeno o un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -COOR1 y un grupo -CN,
R1 es un átomo de hidrógeno o un grupo alquilo(C1-C3):
con la condición de que
cuando R y R' no son simultáneamente un átomo de hidrógeno,
cuando n es 1, R no sea un grupo metilo en posición orto ni para con respecto a Z, Z es N,
cuando R' es un átomo de hidrógeno, R no sea un átomo de bromo ni un átomo de cloro,
cuando R es un átomo de hidrógeno, R' no sea un grupo metilo ni etilo, un grupo -COOH, un grupo COOC2H5 ni un átomo de bromo, dicho átomo de bromo está en la posición orto de la unión enlazada a NR",
ni una de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Ia), como tal, en donde,
R independientemente representa un átomo de hidrógeno o un grupo alquilo(C1-C3),
R" es según se definió en la fórmula (Ia),
R' es un átomo de hidrógeno, un átomo de halógeno, un grupo alcoxi(C1-C3) o un grupo -NO2 ,
n' es 1,
n es 1,
con la condición de que
cuando n es 1, R no sea un grupo metilo en posición orto ni para con respecto a Z, Z es N,
ni una de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Ia'), como tal,
R independientemente representa un átomo de hidrógeno, un grupo alquilo(C1-C3), un grupo fluoroalquilo(C1-C3), un átomo de halógeno o un grupo hidroxilo,
R" es según se definió en la fórmula (Ia),
n es 1 o 2,
ni una de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Ie)
en donde:
R, R', R" n y n' son según se definieron en la fórmula (I),
con la condición de que
cuando R es un átomo de hidrógeno, R' no sea un átomo de bromo,
ni una de su sal farmacéuticamente aceptable.
El presente texto describe un compuesto de fórmula (Iq) según se definió anteriormente, como tal
en donde:
R, R', R" y n' son según se definieron en la fórmula (I),
n es 1 o 2,
con la condición de que
R' y R no son simultáneamente un átomo de hidrógeno,
cuando R' es un átomo de hidrógeno, R no sea un grupo -NO2 ni un grupo -NH2 ,
cuando n es 2 y R' es un átomo de hidrógeno, R no sea un grupo COOC2H5 ni átomo de cloro, ni una de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Iq), como tal, en donde,
R', R", n y n' son según se definieron en la fórmula (I), y
R es un grupo fluoroalcoxi(C1-C3),
ni una de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Iq), como tal, en donde,
R, R", n y n' son según se definieron en la fórmula (I), y
R' es un grupo -NR1R2,
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
ni una de su sal farmacéuticamente aceptable.
El presente texto describe compuestos de fórmula (Iq), como tal, en donde,
R, R", n y n' son según se definieron en la fórmula (I), y
R' es un grupo morfolinilo, un grupo morfolino o un grupo N-metilpiperazinilo,
ni una de su sal farmacéuticamente aceptable.
El presente texto describe un compuesto de fórmula (Iee) según se definió anteriormente, como tal
R, R', R", n y n' son según se definieron en la fórmula (I),
o una de su sal farmacéuticamente aceptable,
con la exclusión de los siguientes compuestos
y con la exclusión de compuestos en donde R es un grupo -NO2 no un grupo -NH2 , donde R' es un hidrógeno o un grupo metilo.
El presente texto describe compuestos de fórmula (Iee), como tal, en donde
R', R", n y n' son según se definieron en la fórmula (I), y
R es un grupo fluoroalquilo(C1-C3),
ni una de su sal farmacéuticamente aceptable.
Entre dichos compuestos como tal, los compuestos (1), (2), (5)-(8), (10)-(16), (18), (21)-(44), (46)-(75), (77)-(84), (86)-(119), (121), (124)-(130), (132), (135)-(141), (143)-(147), (149)-(168) y sus sales farmacéuticamente aceptables son de interés particular.
El presente texto describe los compuestos (1), (2), (5)-(8), (10)-(16), (18), (21)-(44), (46)-(75), (77)-(84), (86)-(119), (121), (124)-(130), (132), (135)-(141), (143)-(147), (149)-(168) y sus sales farmacéuticamente aceptables como tal. Más preferiblemente, los compuestos (143), (144), (149), (166), (167) y sus sales farmacéuticamente aceptables son de interés particular.
El presente texto describe los compuestos (143), (144), (149), (166), (167) y sus sales farmacéuticamente aceptables, tales como bromhidrato, tartrato, citrato, trifluoroacetato, ascorbato, clorhidrato, tartrato, triflato, maleato, mesilato, formiato, acetato y fumarato.
El presente texto describe los compuestos (143), (144) y sus sales farmacéuticamente aceptables, tales como bromhidrato, tartrato, citrato, trifluoroacetato, ascorbato, clorhidrato, tartrato, triflato, maleato, mesilato, formiato, acetato y fumarato.
El presente texto describe que los nuevos compuestos, es decir, compuestos de las fórmulas (Ia), (Ie), (Iq) y (Iee) y los compuestos específicos, según se indicaron anteriormente, no son solo útiles como agente para inhibir, prevenir o tratar el cáncer, sino que también pueden ser útiles para inhibir, prevenir o tratar el envejecimiento prematuro o progeria y para inhibir, prevenir o tratar el sida.
El presente texto describe que dichos compuestos pueden ser útiles para inhibir, prevenir y/o tratar enfermedades con envejecimiento prematuro y que probablemente están relacionadas con un empalme aberrante del gen de lámina nuclear A. Entre todas, dicha enfermedad puede incluir el síndrome de progeria de Hutchinson Guilford (HGPS, por sus siglas en inglés), progeria, envejecimiento prematuro asociado con infección por VIH, distrofia muscular, trastorno de Charcot-Marie-Tooth, síndrome de Werner, pero también ateroesclerosis, diabetes tipo II resistente a la insulina, cataratas, osteoporosis y envejecimiento de la piel tal como dermopatía restrictiva.
Los compuestos para uso de la presente invención se pueden preparar mediante métodos convencionales de síntesis orgánica puestos en práctica por los expertos en la técnica. Las secuencias de reacción generales señaladas más adelante representan un método general útil para preparar los compuestos de la presente invención y no se pretende que sean limitantes del alcance ni la utilidad.
Los compuestos de la fórmula general (I) se pueden preparar según el esquema 1 a continuación.
Según figura en dicho esquema, existen dos vías disponibles para recuperar un compuesto de fórmula (I) según la presente invención.
La síntesis se basa en una reacción de acoplamiento que se inicia alternativamente a partir de un halógeno-biciclo de fórmula (III), en donde X, Y, W, T, U, n', R' y R" son según se definieron anteriormente y X' es un átomo de cloro o un átomo de bromo o a partir de un cloro-monociclo de fórmula (V), en donde Z, V, n y R son según se definieron anteriormente y X' es un átomo de cloro o un átomo de bromo.
Según la vía (A), el compuesto de fórmula (III) se coloca en un disolvente prótico tal como ferc-butanol. A continuación, se agrega el compuesto de fórmula (IV) en una relación molar que varía de 1 a 1,5 con respecto al compuesto de fórmula (III) en presencia de una base inorgánica, tal como Cs2CO3 o K2CO3 en una relación molar que varía de 1 a 2, en presencia de una difosfina, tal como Xantphos (4,5-Bis(difenilfosfino)-9,9-dimetilxanteno) o X-Phos (2-Diciclohexilfosfino-2',4',6'-triisopropilbifenil) en una cantidad que varía de 2 %mol a 10 %mol con respecto a la cantidad total de compuesto de fórmula (III), y en presencia de un catalizador, tal como Pd(OAc)2 o Pd2dba3 en una cantidad que varía de 2 %mol a 10 %mol con respecto a la cantidad total de compuesto de fórmula (III). Después, la mezcla de reacción se puede calentar a una temperatura que varía de 80 a 120 °C, por ejemplo, a 90 °C y agitar durante un tiempo que varía de 15 a 25 horas, por ejemplo, durante 20 horas en gas inerte y, por ejemplo, argón. La mezcla de reacción se puede concentrar a presión reducida.
Según la vía (B), el compuesto de fórmula (V) se coloca en un disolvente prótico tal como terc-butanol. A continuación, se agrega el compuesto de fórmula (VI) en una relación molar que varía de 1 a 1,5 con respecto al compuesto de fórmula (V) en presencia de una base inorgánica, tal como Cs2CO3 o K2CO3 en una relación molar
que varía de 1 a 2, en presencia de una difosfina, tal como Xantphos (4,5-Bis(difenilfosfino)-9,9-dimetilxanteno) o X-Phos (2-Diciclohexilfosfino-2',4',6'-triisopropilbifenil) en una cantidad que varía de 2 %mol a 10 %mol con respecto a la cantidad total de compuesto de fórmula (V), y en presencia de un catalizador, tal como Pd(OAc)2 o Pd2dba3 en una cantidad que varía de 2 %mol a 10 %mol con respecto a la cantidad total de compuesto de fórmula (V). Después, la mezcla de reacción se puede calentar a una temperatura que varía de 80 a 120 °C, por ejemplo, a 90 °C y agitar durante un tiempo que varía de 15 a 25 horas, por ejemplo, durante 20 horas en gas inerte y, por ejemplo, argón. La mezcla de reacción se puede concentrar a presión reducida.
Los compuestos de partida de fórmula (III), (IV), (V) y (VI) están comercialmente disponibles o se pueden preparar según métodos conocidos para el experto en la técnica.
Las estructuras químicas y los datos espectroscópicos de algunos compuestos de fórmula (I) de la invención se ilustran respectivamente en las siguientes Tabla I y Tabla II.
Tabla I
Los siguientes ejemplos ilustran en detalle la preparación de los compuestos (51), (64) según la invención, y (110), (143) y (148) fuera de la invención. Las estructuras de los productos obtenidos se han confirmado al menos mediante espectros de NMR.
Ejemplos
Según la vía (A), el compuesto de fórmula (III) se coloca en un disolvente prótico tal como terc-butanol. A continuación, se agrega el compuesto de fórmula (IV) en una relación molar 1,1 con respecto al compuesto de fórmula (III) en presencia de una base inorgánica, tal como Cs2CO3 o K2CO3 en una relación molar 2,8, en presencia de una difosfina, tal como Xantphos (4,5-Bis(difenilfosfino)-9,9-dimetilxanteno) o X-Phos 2-Diciclohexilfosfino-2',4',6'-triisopropilbifenil en una cantidad de 2 %mol con respecto a la cantidad total de compuesto de fórmula (III), y en presencia de un catalizador, tal como Pd(OAc)2 o Pd2dba3 en una cantidad de 2 %mol con respecto a la cantidad total de compuesto de fórmula (III). Después, la mezcla de reacción se calienta 90 °C y se agita durante 20 horas, en argón. La mezcla de reacción se concentra a presión reducida y el residuo resultante se diluye con acetato de etilo. La fase orgánica a continuación se lava dos veces con agua, se seca sobre sulfato de magnesio, se filtra y concentra a presión reducida. El residuo después se podría purificar mediante cromatografía en columna sobre gel de sílice para producir los compuestos puros (51), (64), (110) y (143).
Según la vía (B), el compuesto de fórmula (V) se coloca en un disolvente prótico tal como terc-butanol. A continuación, se agrega el compuesto de fórmula (VI) en una relación molar 1,1 con respecto al compuesto de fórmula (V) en presencia de Cs2CO3 en una relación molar 2,8, en presencia de Xantphos (4,5-Bis(difenilfosfino)-9,9-dimetilxanteno) en una cantidad de 2 %mol con respecto a la cantidad total de compuesto de fórmula (V), y en presencia de un catalizador, tal como Pd(OAc)2 en una cantidad de 2 %mol con respecto a la cantidad total de compuesto de fórmula (V). Después, la mezcla de reacción se calienta 90 °C y se agita durante 20 horas, en argón. La mezcla de reacción se concentra a presión reducida y el residuo resultante se diluye con acetato de etilo. La fase orgánica a continuación se lava dos veces con agua, se seca sobre sulfato de magnesio, se filtra y concentra a
presión reducida. El residuo después se podría purificar mediante cromatografía en columna sobre gel de sílice para producir el compuesto puro (148).
Ejemplo 1: compuesto (51) de la tabla I (invención)
Según la vía (A), una mezcla de 2,8-dicloroquinolina (98,5 mg) y 2-amino-4,6-dimetilpiridina (67,1 mg), Pd(OAc)2 (2,2 mg), XantPhos (5,8 mg) y Cs2CO3 (456 mg) en 2 mL de t-BuOH proporcionó el compuesto (51) (99,7 mg).
Ejemplo 2: compuesto (64) de la tabla I (invención)
Según la vía (A), una mezcla de 2-cloro-5-nitroquinolina (100,0 mg) y 2-amino-4-metilpiridina (57,6 mg), Pd2dba3 (20 mg), XantPhos (30 mg) y K2CO3 (270 mg) en 3mL de t-BuOH proporcionó el compuesto (64) (14,0 mg).
La preparación de 2-cloro-5-nitroquinolina se describe en la solicitud de patente WO2009/23844.
Ejemplo 3: compuesto (110) de la tabla I (fuera de la invención)
Según la vía (A), una mezcla de 8-bromo-2-cloroquinolina (500 mg) y aminopirazina (216 mg), Pd2dba3 (95 mg), XantPhos ( 12 0 mg) y K2CO3 (1,15 g) en 1 2 mL de t-BuOH proporcionó el compuesto (1 1 0 ) (245 mg).
La preparación de 8-bromo-2-cloroquinolina se describe en Cottet, F. et al. Eur. J. Org. Chem. 2003, 8 , 1559.
Ejemplo 4: compuesto (143) de la tabla I (fuera de la invención)
Según la vía (A), una mezcla de 7-cloro-4-(N,N-dimetilamino)quinolina (500 mg), 4-trifluorometoxianilina (0,257 mL), Pd2dba3 (110 mg), XPhos (115 mg) y K2CO3 (1 g) en 10 mL de t-BuOH proporcionó del compuesto (143) (410 mg). La preparación de 7-cloro-4-(N,N-dimetilamino)quinolina se describe en Sanchez-Martin, R. et al. J. Med. Chem.
2005, 48, 3354.
Ejemplo 5: compuesto (148) de la tabla I (fuera de la invención)
Según la vía (B), una mezcla de 5,8-dimetilisoquinolin-6-amina (59 mg) y 2-bromo-5-metilpiridina (86 mg), Pd(OAc)2 (2,2 mg), XantPhos (5,8 mg) y Cs2CO3 (456 mg) en 2mL de t-BuOH proporcionó el compuesto (148) (48 mg).
La preparación de 5,8-dimetilisoquinolin-6-amina se describe en Australian Journal of Chemistry 1969, 22, 2489. 1H NMR (300 MHz, CDC13) 59,32 (s, 1H), 8,52 (d, J = 6,0, 1H), 8,07 (s, 1H), 7,72 (d, J = 6,0, 1H), 7,51 (s, 1H), 7,36 (dd, J = 2,1,8,4, 1H), 6,69 (d, J = 8,3, 2H), 2,72 (s, 3H), 2,48 (s, 3H), 2,26 (s, 3H) MS (ESI) [M+H]+ = 264 Ejemplo 6: Datos farmacológicos
Procedimiento de operación estándar:
Efecto de los compuestos farmacológicos sobre la invasión de células MDA-MB231-D3H2LN en colágeno Antecedentes:
Una etapa clave en la generación de la metástasis tumoral es la invasión de células tumorales en la matriz extracelular, uno de cuyos componentes principales es el colágeno. Por lo tanto, la invasión de células tumorales en colágeno in vitro puede indicar la generación de metástasis in vivo. P. ej., las células cancerosas de mama de ratón MDA-MB231-luc-D3H2LN exhiben de hecho invasión más alta colágeno in vitro y potencial metastásico más alto in vivo en comparación con las células MDA-MB231 (de las cuales derivan). Mediante el uso de estas células MDA-MB231-luc-D3H2LN como modelo, el objetivo del experimento descrito en la presente es identificar compuestos farmacológicos que inhiben la invasión de células tumorales en el colágeno in vitro, para inhibir, por lo tanto, potencialmente también la generación de metástasis tumoral in vivo.
Principio del ensayo:
Etapa 1: Preparación de células en el fondo de un gel de colágeno: Las células se suspenden en una disolución de colágeno líquida (4 °C), se distribuyen en pocillos recubiertos con BSA y después se recogen en el fondo de los pocillos mediante centrifugación. El colágeno después se solidifica mediante incubación a 37 °C. El recubrimiento con BSA mejora la adhesión del gel de colágeno.
Etapa 2: Pretratamiento con los compuestos que se van a evaluar: Las disoluciones de fármaco concentradas después se agregan sobre el colágeno y las células se preincuban durante 24 h con los fármacos en condiciones de suero bajas (FBS al 0,025 %).
Etapa 3: Estimulación de la invasión: A continuación, se agrega medio con 5 % de FBS para estimular la invasión de células en el gel de colágeno.
Etapa 4: Fijación y tinción: Después de otras 24 h de incubación, las células se fijan y los núcleos se tiñen.
Etapa 5: Análisis: Finalmente, se analizan las placas usando un microscopio automatizado. Las perlas fluorescentes que se habían incluido en el recubrimiento de BSA sirven para detectar el fondo de los pocillos. Se toman fotografías de los núcleos teñidos al mismo nivel (0 pm), así como a 25pm y 50pm por encima.
Nota:
Para detectar posibles efectos tóxicos, todos los compuestos se evaluaron en paralelo en un ensayo de viabilidad. El ensayo de viabilidad se lleva a cabo en paralelo en células no expuestas a suero (como en el ensayo de la invasión) con respecto a células en condiciones de cultivo normales (FBS al 10 %).
Materiales:
Equipo general: Congelador (-20 °C), refrigerador (4 °C), máquina de hielo, baño de agua (37 °C), incubadora (37 °C /CO2 al 5 %), campana de cultivo celular, vórtice, bomba de vacío, microscopio, celda Malasse, auxiliar Pipet, micropipetas (para pipetear 1 - 1000 pl), pipetas multicanal (para pipetear 20 - 200pl), centrífuga de cultivo celular estándar, centrífuga refrigerada para placas de 96 pocillos
Productos consumibles generales: Placas de cultivo celular de 96 pocillos estériles (para el ensayo de viabilidad), tubos estériles (1,5 / 15 / 50ml), pipetas estériles (5 / 10 / 25ml), puntas de micropipeta estériles (para pipetear 1 -1000 pl), pipetas Pasteur estériles, depósitos para reactivos estériles
Productos generales: PBS estéril, agua Milli-Q estéril, DMSO, FBS descomplementado (alícuotas congeladas), 0,1 N NaOH, 1 M Hepes, MEM sin suero (con no más de 1 mes), 2,5 x MEM sin suero (con no más de 1 mes), MEM con FBS al 10 % (con no más de un mes), tripsina al 0,25 % / disolución 1 mM EDTA, disolución de formaldehído al 37 %
Equipo específico:
lector de placa: Tecan Infinite F200
microscopio automatizado: Cellomics ArrayScan VTI HCS Reader
Productos consumibles específicos:
placas de 96 pocillos negras estériles (para el ensayo de invasión): Perkin Elmer ViewPlate-96 F TC, ref. 6005225 placas de polipropileno profundas de 96 pocillos estériles (para la preparación del fármaco): Starlab, ref. S1896-5110 Productos específicos:
colágeno de cola de rata, tipo 1: BD Biosciences, ref. 354236 (nota: cada lote nuevo se debe validar)
perlas rojas fluorescentes (diámetro de 1 pm): Invitrogen, ref. F13083
Y-27632 (disolución acuosa 5 mM): Calbiochem, ref. 688001 (en disolución) o 688000 (polvo seco)
BSA sin ácidos grasos (esterilizado por filtración disolución acuosa al 4 %): Sigma, ref. A8806 (polvo seco) Tinción nuclear Hoechst 33342 (10 mg/ml): Invitrogen, ref. H3570
Reactivo MTS: Promega CellTiter 96® AQueous One Solution Reagent, ref. G3581
compuestos farmacológicos para evaluar: generalmente 25 o 50 mM en DMSO al 100 % (las alícuotas se almacenan a -20 °C, después a 4 °C durante un máx. de 3 meses)
Células MDA-MB231-luc-D3H2LN:
Límites para los cultivos celulares que se van a usar en los ensayos:
número de pasadas total: máx. 30
última pasada: entre 2 y 4 días antes, entre 1:3 y 1:20
densidad celular: entre 50 y 90 % (de manera óptima 70 %) (entre 1 y 2 x 106 células por placa de 100 mm)
Procedimientos experimentales:
Consideraciones generales: Testigos y mapas de placa:
Ensayo de invasión: Testigo negativo: Ausencia de fármaco (solo DMSO a concentración equivalente). Testigo positivo: 10 gM de Y-27632. Para evitar efectos de borde, solo se usan los 60 pocillos centrales B2 - G11; las líneas A y H, así como las columnas 1 y 12 permanecen libres. Cada fármaco se evalúa al menos por triplicado. Los testigos positivos y negativos deben evaluarse en triplicados dobles en diferentes posiciones en cada placa. Mapa de placa típico (- = testigo negativo, = testigo positivo, 1 - 16 = 16 compuestos farmacológicos diferentes):
Ensayos de viabilidad: Sin testigos adicionales. El ensayo de viabilidad MTS se basa en la detección colorimétrica de un producto generado mediante la actividad mitocondrial de las células. Cada fármaco se evalúa al menos por duplicado. Para detectar posibles interacciones directas con el sustrato del ensayo, cada fármaco también se evaluó en ausencia de células (señales de fondo). Mapa de placa típico (los testigos y compuestos farmacológicos como en el ensayo de invasión, líneas A - B y E - F: con células, líneas C - D y G - H: sin células; cada 1 placa con: 10 % frente a 0,025 % de FBS):
Los volúmenes u otras cantidades indicados a continuación son necesarios para evaluar 16 compuestos farmacológicos en placa de 96 pocillos cada uno con 5gM (+ testigos) en un ensayo de invasión y cada ensayo de viabilidad con células no expuestas a suero frente a células en condiciones de cultivo normales según los mapas de placa indicados anteriormente. Según la cantidad de compuestos evaluados, se deberán adaptar los volúmenes y otras cantidades para evaluar más o menos compuestos o diferentes concentraciones.
Día 1: Preparación y tratamiento de las células (todas las etapas se llevan a cabo bajo una campana de cultivo celular):
Preparación de disoluciones de fármaco concentradas 100 x en DMSO al 10 %:
prepare DMSO al 10 % en PBS estéril: 1,8 ml de PBS estéril 0,2 ml de DMSO
prepare 100 gl/pocillo de DMSO al 10 % en PBS en 16 pocillos de una placa de polipropileno de 96 pocillos estéril agregue a cada uno 1 o 2 gl de las disoluciones concentradas de compuesto 50 o 25mM, respectivamente mezcla al pipetear hacia arriba y abajo
Preparación de disoluciones de fármaco concentrado y testigo 4 x en DMSO al 0,4 % en MEM FBS al 0,1 %:
prepare MEM FBS al 0,1 %: 12ml MEM sin suero 12pl FBS (alícuota recientemente descongelada) prepare 480 pl/pocillo de MEM FBS al 0,1 % en 20 pocillos de una placa de polipropileno de 96 pocillos estéril profunda
testigos negativos (sin fármaco): agregue a cada uno 20pl de DMSO al 10 % en PBS estéril
testigos positivos (Y-27632): agregue a cada uno 14 pl de PBS estéril 2pl de DMSO 4pl de 5 mM Y-27632 (alícuota recientemente descongelada)
compuestos farmacológicos: agregue a cada uno 20 pl de disoluciones de fármaco concentradas 100 x en DMSO al 10 %
mezcla al pipetear hacia arriba y abajo
almacene a RT hasta el uso
Recubrir las placas para el ensayo de invasión:
mezcle 9,5 ml de MEM sin suero 0,5 ml de BSA al 4 % sin ácidos grasos 1 pl de perlas fluorescentes sometidas a agitación vorticial (es decir, diluidas 1:10000), someta a vórtice, distribuya 100 pl/pocillo en la placa para el ensayo de invasión
centrifugue 30' con 1800 x g a 4 °C (p. ej., 3000 rpm en una centrífuga Jouan GR412)
retire los sobrenadantes por aspiración
Preparación de una suspensión celular 10 x 106 células/ml (durante la centrifugación de las placas):
retire el medio, lave las células con ~ 10 ml/placa de PBS, agregue 1 ml/placa de tripsina al 0,25 % / 1 mM EDTA incube 30 - 60 s a 37°C
agregue 5 - 10ml/placa de MEM precalentado FBS al 10 %
homogenice al pipetear hacia arriba y abajo usando un a pipeta de 10 ml, concentre todo
cuente las células usando una centrífuga de células Malassez 2 x 106 (o más) células durante 5' con 150 x g a RT (850 rpm en una centrífuga de cultivo celular estándar)
retire el sobrenadante, resuspenda el sedimento celular en 0,2 ml (o más, respectivamente) MEM sin suero, que proporciona 10 x 106 células/ml
Preparación del ensayo de invasión (sobre hielo; iniciar durante la centrifugación de las células):
mezcle sobre hielo en un tubo precongelado: ejemplo para una disolución concentrada de colágeno de 3,4 mg/ml; los volúmenes de colágeno y agua se deben adaptar según la concentración del concentrado de cada lote de colágeno:
2,8 ml de 2,5 x MEM
441 pl de agua
140 pl de 1 M Hepes
49 pl de 1 N NaOH
3,5 ml de disolución concentrada de colágeno 3,4 mg/ml (para proporcionar 1,7 mg/ml de colágeno en 7 ml) homogenice al pipetear suavemente hacia arriba y abajo (mantenga sobre hielo)
agregue 70 pl de la suspensión celular 10 x 106 células/ml, homogenice al pipetear suavemente hacia arriba y hacia abajo (proporciona 0,1 x 106 células/ml en 1,7 mg/ml de colágeno en 7ml de 1 x MEM 20pM HEPES) (mantenga sobre hielo)
distribuya 100 pl/pocillo (es decir, 10000 células/pocillo) en los pocillos recubiertos de la placa para el ensayo de invasión (todo sobre hielo)
centrifugue 5' con 200 x g a 4 °C (p. ej., 1000 rpm en una centrífuga Jouan GR412)
agregue 200 gl/pocillo de PBS a todos los pocilios libres
incube 30' a 37 °C / CO2 al 5 % (solidificación del colágeno)
Preparación del ensayo de viabilidad con células no expuestas a suero:
agregue 50 gl de la suspensión celular 10 x 106 células/ml a 5 ml de MEM sin suero (proporciona 0,1 x 106 células/ml)
distribuya 100 gl/pocillo de esta suspensión (es decir, 10000 células/pocillo) o MEM sin suero sin células, respectivamente, en una placa de cultivo tisular estándar de 96 pocillos, según el mapa de placa indicado anteriormente
agregue 200 gl/pocillo de PBS a todos los pocillos libres
incube 30' a 37 °C / CO2 al 5 %
Preparación del ensayo de viabilidad con células en condiciones de cultivo normales:
agregue 30 gl de la suspensión celular 10 x 106 células/ml a 5 ml de MEM FBS al 10 % (proporciona 0,06 x 106 células/ml)
distribuya 100 gl/pocillo de esta suspensión (es decir, 6000 células/pocillo) o MEM FBS al 10 % sin células, respectivamente, en una placa de cultivo tisular estándar de 96 pocillos, según el mapa de placa indicado anteriormente
agregue 200 gl/pocillo de PBS a todos los pocillos libres
incube 30' a 37 °C / CO2 al 5 %
Tratamiento con los fármacos:
agregue a cada uno 33 gl/pocillo de las disoluciones de fármaco concentradas 4 x en MEM FBS al 0,1 % a los pocillos correspondientes en las tres placas, según los mapas de placa indicados anteriormente
incube 24 h a 37 °C / CO2 al 5 %
Día 2: Adición de FBS para estimular la invasión:
Observación microscopia después de 24 h de tratamiento:
examine las células de los ensayos de viabilidad
Adición de FBS (bajo una campana de cultivo celular):
prepare MEM FBS al 5 %: 7,2 ml de MEM sin suero 0,8 ml de FBS (alícuota recientemente descongelada o resto de la alícuota descongelada el día anterior si se mantiene a 4 °C)
agregue 33 gl/pocillo a todos los pocillos de los ensayos de invasión y viabilidad
incube 24 h a 37 °C / CO2 al 5 %
Día 3: Detención:
Observación microscopia después de 48 h de tratamiento:
examine las células de los ensayos de viabilidad
Ensayos de viabilidad: Ensayo MTS:
agregar a cada uno 33 gl/pocillo del reactivo MTS, incubar 2,5 h a 37 °C / CO2 al 5 %, agitar y leer la absorbancia a 490 nm (proporcional a la viabilidad)
calcular las señales corregidas por el fondo al restar las medias de las señales de fondo en ausencia de células de las señales correspondientes en presencia de células
normalizar las señales corregidas por el fondo con respecto a la señal media de los testigos negativos (sin fármaco) (por lo tanto, las viabilidades se expresan en "% de testigo")
Ensayos de invasión: fijación y tinción (el formaldehído se debe manipular debajo de una campana de extracción): preparar poco antes 1 pg/ml de Hoechst 33342 en formaldehído al 18,5 %: 5 ml de PBS (no necesariamente estéril) 5 ml de formaldehído al 37 % 1 pl de 10 mg/ml Hoechst 33342 (nota: para una placa un volumen pequeño sería suficiente, pero el volumen pipeteado mínimo no puede ser menor que 1 pl)
agregue 50 pl/pocillo a todos los pocillos del ensayo de invasión (proporciona formaldehído al 4,3 % final) selle con película negra (proporcionada con las placas)
incube al menos 7 h a RT
Día 3: 17 (mín. 7 h / máx. 2 semanas después fijación y tinción): Análisis del ensayo de invasión:
Lectura usando el Cellomics ArrayScan VTI HCS Reader:
BioApplication: SpotDetector.V3
Tipo de placa: Perkin Elmer 96 pocillos
Parámetros del protocolo de ensayo:
objetivo: 10 x (NA 0,45)
apótome: sí (corte óptico resultante: 11,7 pM)
campos por pocillo: 8
autofoco en cada campo
canal de autofoco: 1
canal 1 (autofoco encendido, y foto de las perlas fluorescentes en el fondo de los pocillos): filtro: XF93 - TRITC; tiempo de exposición: normalmente entre 0 , 0 02 y 0 , 01 s
canal 2 (foto de las células teñidas al mismo nivel que las perlas fluorescentes): filtro: XF100 - Hoechst; tiempo de exposición: normalmente entre 0,02 y 0,1 s; desviación z: 0 pM
canal 3 (foto de las células teñidas 25 pM por encima de las perlas fluorescentes): filtro: XF100 - Hoechst; tiempo de exposición: normalmente entre 0,02 y 0,1 s; desviación z: -25 pM
canal 4 (foto de las células fluorescentes 50 pM por encima de las perlas fluorescentes): filtro: XF100 - Hoechst; tiempo de exposición: normalmente entre 0,02 y 0,1 s; desviación z: -50 pM
Análisis de los resultados del barrido usando vHCS Viewer:
exportar los resultados: para cada pocillo:
cantidad de campos válidos
cantidad de objetivo en cada campo válido en cada uno de los canales 2, 3 y 4 ("detalles de campo") cantidades medias de objetivo por campo válido para cada pocillo, en cada uno de los canales 2, 3 y 4
excluir los pocilios con menos de 6 campos válidos por pocilio del análisis adicional
verificar visualmente todas las fotos para detectar cualquier problema evidente, tal como mal enfoque o estructura de colágeno obviamente no homogénea ("burbujas", ...), ...; en caso de problemas evidentes: documentar, después excluir los pocillos correspondientes del análisis adicional
Análisis adicional de los resultados del ensayo de invasión (usando p. ej., Excel):
para cada pocillo, calcular la distancia de invasión media de las células contadas: (25 pm x cantidad de células a 25pm 50pm x cantidad de células a 50pm) / suma de células a 0, 25 y 50pm
para los cuatro parámetros (cantidad de células a 0 pm, cantidad de células a 25 pm, cantidad de células a 50 pm, distancia de invasión media de las células contadas), calcular las medias, SD y CV de los replicados (n = 6 para los testigos; n = 3 para las muestras)
invalidar cualquier replicado con un CV >50 % (el compuesto se debe reevaluar o el ensayo se debe repetir si CV >50 % para el testigo negativo no tratado o el testigo positivo tratado con el compuesto Y-27632). Y27632 es un inhibidor selectivo de la proteína cinasa asociada a Rho p160ROCK de la siguiente fórmula
validar el ensayo solo si la distancia de invasión media de las células tratadas con 10 pM de Y-27632 (testigo positivo) disminuye un >40 % en comparación con el testigo negativo no tratado
crear gráficas para los cuatro parámetros (cantidad de células a 0 pm, cantidad de células a 25 pm, cantidad de células a 50 pm, distancia de invasión media de las células contadas)
Resultados
Efecto antiinvasivo de 5 pM sobre células cancerosas de mama MDA-MB231 (efecto mayor en comparación con 10pM de compuesto de ref. Y-27632)
Los compuestos según la presente invención demuestran un efecto antiinvasivo predictivo de su actividad contra el cáncer.
Por lo tanto, el resultado de las pruebas que se llevaron a cabo con los compuestos descritos en la presente invención exhibe que dichos compuestos pueden ser útiles para inhibir, prevenir y/o tratar el cáncer. El siguiente tipo de cáncer se puede tratar más particularmente mediante los compuestos según la presente invención: cáncer colorrectal, cáncer pancreático, cáncer de pulmón incluido cáncer de pulmón no microcítico, cáncer de mama, cáncer de vejiga, cáncer de vesícula, cáncer de tiroides, melanoma, cáncer de hígado, cáncer uterino/de cuello de útero, cáncer esofágico, cáncer de riñón, cáncer de ovario, cáncer de próstata, cáncer de vías respiratorias y digestivas altas y cáncer de estómago, etc.
Con este fin, una cantidad eficaz de dicho compuesto se puede administrar a un paciente que padece cáncer.
El presente texto también describe el uso de al menos un compuesto elegido entre un compuesto de cualquiera de la fórmula (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik), (Il), (Im), (Io), (Ip), (Iq), (Ir) o (Iee) según se definieron anteriormente, y los compuestos (1) a (168) según se definieron anteriormente, o una de sus sales farmacéuticamente aceptables para la fabricación de una composición farmacéutica prevista para el tratamiento del cáncer.
El presente texto también describe composiciones farmacéuticas que comprenden al menos un compuesto elegido entre un compuesto nuevo de la fórmula (Iq) o (Iee) según se definieron anteriormente, y los compuestos (143), (144), (149), (166) y (167) según se definieron anteriormente o cualquier sal farmacéuticamente aceptable de estos. Por lo tanto, estas composiciones farmacéuticas contienen una cantidad eficaz de dicho compuesto, y uno o más excipientes farmacéuticos.
Los excipientes mencionados anteriormente se seleccionan según la forma de dosificación y el modo de administración deseado.
En este contexto, pueden estar presentes en cualquier forma farmacéutica que sea adecuada para la administración entérica o parenteral, en asociación con el excipiente adecuado, por ejemplo, en forma de un comprimido simple o recubierto, gelatina dura, cápsulas de cubierta blanda y otras cápsulas, supositorios, o bebibles, tales como suspensiones, jarabes, o disoluciones o suspensiones inyectables, en dosis que permiten la administración diaria de 0,1 a 1000 mg de sustancia activa.
El presente texto también describe el uso de un compuesto de cualquiera de la fórmula (I), (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik), (Il), (Im), (Io), (Ip), (Iq), (Ir) o (Iee) según se definieron anteriormente, y los compuestos (1) a (168) según se definieron anteriormente, o una de sus sales farmacéuticamente aceptables según la presente invención para la fabricación de una composición farmacéutica prevista para inhibir, prevenir y/o tratar el cáncer.
Claims (4)
1. Un compuesto de fórmula (I)
significa un anillo aromático en donde V es C,
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo fluoroalcoxi(C1-C3), un grupo -NO2, un grupo -NR1R2 , un grupo alcoxi(C1-C4), un grupo fenoxi y un grupo alquilo(C1-C3), dicho alquilo está opcionalmente monosustituido por un grupo hidroxilo,
R1 y R2 son independientemente un átomo de hidrógeno o un grupo alquilo(C1-C3),
n es 1, 2 o 3,
n' es 1 o 2,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -COOR1, un grupo -NO2, un grupo -NR1R2 , un grupo morfolinilo o morfolino, un grupo N-metilpiperazinilo, un grupo fluoroalquilo(C1-C3), un grupo alcoxi(C1-C4) y un grupo -CN,
R" es un átomo de hidrógeno o un grupo alquilo(C1-C4),
Z es N, V es C, Y es N, X es C, T es C, U es C y W es C,
o cualquiera de su sal farmacéuticamente aceptable,
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
2. Compuesto de fórmula (I) según la reivindicación 1, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer, que es de fórmula (Ia)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo hidroxilo, un grupo -COOR1, un grupo fluoroalquilo(C1-C3), un grupo -NO2 , un grupo -NR1R2 y un grupo alcoxi(C1-C3),
R" es según se definió en la reivindicación 1 y, ventajosamente, un átomo de hidrógeno,
n es según se definió en la reivindicación 1 y, ventajosamente, es 1,
n' es según se definió en la reivindicación 1 y es ventajosamente 1,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -NO2, un grupo alcoxi(C1-C3) y un grupo -NR1R2,
Ri y R2 son un átomo de hidrógeno o un grupo alquilo(Ci-C3),
ni una de su sal farmacéuticamente aceptable.
3. Un compuesto de fórmula (I) según cualquiera de las reivindicaciones anteriores, para su uso como un agente para la prevención, inhibición o tratamiento del cáncer, que es de fórmula (Ia)
en donde:
R independientemente representa un átomo de hidrógeno, un átomo de halógeno o un grupo elegido entre un grupo alquilo(C1-C3), un grupo -CN, un grupo -COOR1 y un grupo fluoroalquilo(C1-C3),
R1 es un átomo de hidrógeno o un grupo alquilo(C1-C3),
R" es según se definió en la reivindicación 1 y, más preferiblemente, es un átomo de hidrógeno,
n es según se definió en la reivindicación 1 y, más preferiblemente, es 1,
n' es según se definió en la reivindicación 1,
R' es un átomo de hidrógeno, un átomo de halógeno o un grupo alquilo(C1-C3),
ni una de su sal farmacéuticamente aceptable.
4. Un compuesto elegido entre:
-(1) (8-cloro-quinolin-2-il)-piridin-2-il-amina
-(2) ácido 2-(quinolin-2-ilamino)-isonicotínico
-(3) (4-metil-piridin-2-il)-quinolin-2-il-amina
-(4) piridin-2-il-quinolin-2-il-amina
-(5) ácido 2-(8-cloro-quinolin-2-ilamino)-isonicotínico
-(6) (8-cloro-quinolin-2-il)-(4-metil-piridin-2-il)-amina
-(7) 6-(quinolin-2-ilamino)-nicotinonitrilo
-(17) N-(6-metilpiridin-2-il)quinolin-2-amina
-(18) 8-cloro-N-(6-metilpiridin-2-il)quinolin-2-amina
-(19) 4-metil-N-(piridin-2-il)quinolin-2-amina
-(20) 4-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
-(21) 3-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
-(22) 3-metil-N-(piridin-2-il)quinolin-2-amina
-(23) 6-((4-metilquinolin-2-il)amino)nicotinonitrilo
-(24) 6-((3-metilquinolin-2-il)amino)nicotinonitrilo
-(25) 6-cloro-N-(4-metilpiridin-2-il)quinolin-2-amina
-(26) 6-cloro-N-(6-metilpiridin-2-il)quinolin-2-amina
-(27) 4-metil-N-(5-nitropiridin-2-il)quinolin-2-amina
-(28) N-(3-nitropiridin-2-il)quinolin-2-amina
-(29) 8-cloro-N-(3-nitropiridin-2-il)quinolin-2-amina
-(30) 2-((4-metilquinolin-2-il)amino)nicotinonitrilo
-(31) N-(3-metilpiridin-2-il)quinolin-2-amina
-(32) N-(5-metilpiridin-2-il)quinolin-2-amina
-(33) 2-(quinolin-2-ilamino)isonicotinonitrilo
-(34) N-(5-(trifluorometil)piridin-2-il)quinolin-2-amina
-(35) 8-cloro-N-(3-metilpiridin-2-il)quinolin-2-amina
-(36) 8-cloro-N-(5-metilpiridin-2-il)quinolin-2-amina
-(37) 8-cloro-N-(5-(trifluorometil)piridin-2-il)quinolin-2-amina -(38) N-(3-metoxipiridin-2-il)quinolin-2-amina
-(39) N-(5-nitropiridin-2-il)quinolin-2-amina
-(40) 6-((8-cloroquinolin-2-il)amino)nicotinonitrilo
-(41) N-(5-fluoropiridin-2-il)quinolin-2-amina
-(42) N-(6-(trifluorometil)piridin-2-il)quinolin-2-amina
-(43) 8-cloro-N-(5-fluoropiridin-2-il)quinolin-2-amina
-(44) ácido 2-((8-cloroquinolin-2-il)amino)nicotínico
-(45) 4-metil-N-(6-metilpiridin-2-il)quinolin-2-amina
-(46) 3-metil-N-(6-metilpiridin-2-il)quinolin-2-amina
-(47) cloruro de 5-ciano-2-(quinolin-2-ilamino)piridin-1-io
-(48) cloruro de 2-((8-cloroquinolin-2-il)amino)-4-metilpiridin-1-io -(49) 8-cloro-N-(4-etilpiridin-2-il)quinolin-2-amina
-(50) 8-cloro-N-(6-etilpiridin-2-il)quinolin-2-amina
-(51) 8-cloro-N-(4,6-dimetilpiridin-2-il)quinolin-2-amina
-(52) 6-((8-cloroquinolin-2-il)amino)-2-metilnicotinonitrilo
-(53) 8-cloro-N-(4-cloropiridin-2-il)quinolin-2-amina
-(54) 8-metil-N-(4-metilpiridin-2-il)quinolin-2-amina
-(55) N-(5-bromo-4-metilpiridin-2-il)-8-cloroquinolin-2-amina -(56) 8-cloro-N-(3-etil-6-metilpiridin-2-il)quinolin-2-amina
-(57) 8-fluoro-N-(4-metilpiridin-2-il)quinolin-2-amina
-(58) 8-bromo-N-(4-metilpiridin-2-il)quinolin-2-amina
-(59) 6-(quinolin-2-ilamino)nicotinato de metilo
-(60) 6-[(8-cloroquinolin-2-il)amino]piridina-3-carboxilato de metilo -(61) 6-[(3-metilquinolin-2-il)amino]piridina-3-carboxilato de metilo -(62) 2-[(8-cloroquinolin-2-il)amino]piridina-3-carboxilato de metilo
-(63) 8-metoxi-N-(4-metilpiridin-2-il)quinolin-2-amina
-(64) N-(4-metilpiridin-2-il)-5-nitroquinolin-2-amina
-(65) 2-N-(4-metilpiridin-2-il)quinolina-2,8-diamina
-(66) N-(4-metilpiridin-2-il)-5-aminoquinolin-2-amina
-(67) 6-[(4-metilquinolin-2-il)amino]piridina-3-carboxilato de metilo
-(68) 8-cloro-N-[4-(trifluorometil)piridin-2-il]quinolin-2-amina
-(69) 2-[(8-cloroquinolin-2-il)amino]piridin-3-ol
-(70) 8-cloro-N-[6-(trifluorometil)piridin-2-il]quinolin-2-amina
-(71) 6-cloro-N-(5-fluoropiridin-2-il)quinolin-2-amina
-(72) N-(6-etilpiridin-2-il)-3-metilquinolin-2-amina
-(73) N-(5-fluoropiridin-2-il)-3-metilquinolin-2-amina
-(74) 3-metil-N-[5-(trifluorometil)piridin-2-il]quinolin-2-amina
-(150) N-(4-metilpiridin-2-il)-8-nitroquinolin-2-amina
-(151) 6-cloro-N-(6-etilpiridin-2-il)quinolin-2-amina
-(152) 6-cloro-N-(5-metilpiridin-2-il)quinolin-2-amina
-(153) 6-cloro-N-[5-(trifluorometil)piridin-2-il]quinolin-2-amina
-(154) N2-(8-cloroquinolin-2-il)-4-metilpiridina-2,3-diamina
- y sus sales farmacéuticamente aceptables.
para su uso como un agente para la prevención, inhibición o tratamiento del cáncer.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US18655209P | 2009-06-12 | 2009-06-12 | |
| US18654409P | 2009-06-12 | 2009-06-12 | |
| EP20090305540 EP2266972A1 (en) | 2009-06-12 | 2009-06-12 | New chemical molecules that inhibit the splicing mechanism for treating diseases resulting from splicing anomalies |
| EP09162630A EP2261214A1 (en) | 2009-06-12 | 2009-06-12 | Compounds useful to treat premature aging and in particular progeria |
| PCT/IB2010/052650 WO2010143168A2 (en) | 2009-06-12 | 2010-06-14 | Compounds useful for treating cancer |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2736198T3 true ES2736198T3 (es) | 2019-12-26 |
Family
ID=43309298
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES19157827T Active ES2985082T3 (es) | 2009-06-12 | 2010-06-14 | Compuestos útiles para tratar el cáncer |
| ES10757474T Active ES2938532T3 (es) | 2009-06-12 | 2010-06-14 | Nuevas moléculas químicas que inhiben el mecanismo de ayuste para el tratamiento de enfermedades derivadas de defectos de ayuste |
| ES10728368T Active ES2736198T3 (es) | 2009-06-12 | 2010-06-14 | Compuestos útiles para tratar el cáncer |
| ES10728369T Active ES2940885T3 (es) | 2009-06-12 | 2010-06-14 | Compuestos útiles para tratar el envejecimiento prematuro y en particular la progeria |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES19157827T Active ES2985082T3 (es) | 2009-06-12 | 2010-06-14 | Compuestos útiles para tratar el cáncer |
| ES10757474T Active ES2938532T3 (es) | 2009-06-12 | 2010-06-14 | Nuevas moléculas químicas que inhiben el mecanismo de ayuste para el tratamiento de enfermedades derivadas de defectos de ayuste |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES10728369T Active ES2940885T3 (es) | 2009-06-12 | 2010-06-14 | Compuestos útiles para tratar el envejecimiento prematuro y en particular la progeria |
Country Status (24)
| Country | Link |
|---|---|
| US (7) | US20120329796A1 (es) |
| EP (6) | EP2440547B1 (es) |
| JP (8) | JP5826745B2 (es) |
| KR (14) | KR101982463B1 (es) |
| CN (13) | CN104844570B (es) |
| AU (3) | AU2010258214B2 (es) |
| BR (5) | BR122019013686B1 (es) |
| CA (5) | CA2764024C (es) |
| CU (4) | CU24245B1 (es) |
| DK (4) | DK3517534T3 (es) |
| ES (4) | ES2985082T3 (es) |
| FI (3) | FI2440546T3 (es) |
| HK (8) | HK1173153A1 (es) |
| HR (3) | HRP20230248T1 (es) |
| HU (2) | HUE061262T2 (es) |
| LT (1) | LT2440547T (es) |
| MX (10) | MX353776B (es) |
| PL (4) | PL3517534T3 (es) |
| PT (4) | PT2440547T (es) |
| RU (1) | RU2567752C2 (es) |
| SI (1) | SI2440547T1 (es) |
| TR (1) | TR201910781T4 (es) |
| WO (3) | WO2010143168A2 (es) |
| ZA (2) | ZA201109031B (es) |
Families Citing this family (83)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10253020B2 (en) | 2009-06-12 | 2019-04-09 | Abivax | Compounds for preventing, inhibiting, or treating cancer, AIDS and/or premature aging |
| ES2985082T3 (es) | 2009-06-12 | 2024-11-04 | Abivax | Compuestos útiles para tratar el cáncer |
| MX2019008390A (es) * | 2009-06-12 | 2019-09-09 | Abivax | Compuestos utiles para tratar cancer. |
| WO2011028947A2 (en) | 2009-09-03 | 2011-03-10 | Bioenergenix | Heterocyclic compounds for the inhibition of pask |
| GB201007286D0 (en) | 2010-04-30 | 2010-06-16 | Astex Therapeutics Ltd | New compounds |
| GB201020179D0 (en) | 2010-11-29 | 2011-01-12 | Astex Therapeutics Ltd | New compounds |
| EP2465502A1 (en) * | 2010-12-15 | 2012-06-20 | Société Splicos | Compounds useful for treating AIDS |
| JP5980812B2 (ja) | 2011-01-05 | 2016-08-31 | バイオエナジェニックス | Paskの阻害のための複素環化合物 |
| US8916561B2 (en) | 2011-03-02 | 2014-12-23 | Bioenergenix, Llc | Substituted quinoxaline compounds for the inhibition of PASK |
| EP2681207B1 (en) | 2011-03-02 | 2016-12-28 | Bioenergenix | Heterocyclic compounds for the inhibition of pask |
| GB201118652D0 (en) * | 2011-10-28 | 2011-12-07 | Astex Therapeutics Ltd | New compounds |
| GB201118654D0 (en) | 2011-10-28 | 2011-12-07 | Astex Therapeutics Ltd | New compounds |
| GB201118656D0 (en) | 2011-10-28 | 2011-12-07 | Astex Therapeutics Ltd | New compounds |
| GB201118675D0 (en) | 2011-10-28 | 2011-12-14 | Astex Therapeutics Ltd | New compounds |
| FR2987627B1 (fr) | 2012-03-05 | 2016-03-18 | Splicos | Utilisation de rbm39 comme biomarqueur |
| GB201209609D0 (en) | 2012-05-30 | 2012-07-11 | Astex Therapeutics Ltd | New compounds |
| GB201209613D0 (en) | 2012-05-30 | 2012-07-11 | Astex Therapeutics Ltd | New compounds |
| EP2863920B1 (en) | 2012-06-20 | 2023-03-22 | Eutropics Pharmaceuticals, Inc. | Quinoline derivatives for use in the tratment of breast cancer |
| TW201410657A (zh) | 2012-08-02 | 2014-03-16 | Endo Pharmaceuticals Inc | 經取代胺基-嘧啶衍生物 |
| JP6193374B2 (ja) | 2012-08-13 | 2017-09-06 | 武田薬品工業株式会社 | Gpr6モジュレーターとしてのキノキサリン誘導体 |
| JP2014237624A (ja) * | 2012-10-23 | 2014-12-18 | 日本曹達株式会社 | ピリジン化合物またはその塩、有害生物防除剤、殺虫剤または殺ダニ剤、および外部寄生虫防除剤 |
| WO2014081953A1 (en) | 2012-11-21 | 2014-05-30 | Richard David J | Methods and compositions useful for treating diseases involving bcl-2 family proteins with isoquinoline and quinoline derivatives |
| GB201301571D0 (en) * | 2012-11-27 | 2013-03-13 | Fundanci N Pedro Barri De La Maza | Product and use |
| US20140194465A1 (en) * | 2013-01-04 | 2014-07-10 | Novarx Corporation | Compositions for treatment of cancer |
| EP2757161A1 (en) * | 2013-01-17 | 2014-07-23 | Splicos | miRNA-124 as a biomarker of viral infection |
| GB201307577D0 (en) | 2013-04-26 | 2013-06-12 | Astex Therapeutics Ltd | New compounds |
| BR112016000127B1 (pt) * | 2013-07-05 | 2022-02-15 | Abivax | Compostos bicíclicos úteis para tratar doenças causadas por retrovírus |
| JPWO2015005491A1 (ja) * | 2013-07-12 | 2017-03-02 | 国立大学法人京都大学 | 疾病の発症又は進行の一因となる異常スプライシングを抑制できる物質のスクリーニング方法 |
| US10732182B2 (en) | 2013-08-01 | 2020-08-04 | Eutropics Pharmaceuticals, Inc. | Method for predicting cancer sensitivity |
| WO2015066305A1 (en) | 2013-10-30 | 2015-05-07 | Eutropics Pharmaceuticals, Inc. | Methods for determining chemosensitivity and chemotoxicity |
| JO3466B1 (ar) | 2013-12-20 | 2020-07-05 | Takeda Pharmaceuticals Co | مواد ضابطة لتترا هيدرو بيريدوبيرازينات من gpr6 |
| JP6526034B2 (ja) | 2014-02-14 | 2019-06-05 | 武田薬品工業株式会社 | Gpr6のピリドピラジンモジュレーター |
| US10736900B2 (en) | 2014-03-26 | 2020-08-11 | Astex Therapeutics Ltd | Combinations of an FGFR inhibitor and an IGF1R inhibitor |
| MA39784B1 (fr) | 2014-03-26 | 2021-03-31 | Astex Therapeutics Ltd | Combinaisons des inhibiteurs du fgfr et du cmet destinées au traitement du cancer |
| JO3512B1 (ar) | 2014-03-26 | 2020-07-05 | Astex Therapeutics Ltd | مشتقات كينوكسالين مفيدة كمعدلات لإنزيم fgfr كيناز |
| EP2974729A1 (en) | 2014-07-17 | 2016-01-20 | Abivax | Quinoline derivatives for use in the treatment of inflammatory diseases |
| EP2975034A1 (en) | 2014-07-17 | 2016-01-20 | Abivax | A quinoline derivative for the treatment of inflammatory diseases and AIDS |
| MX381238B (es) | 2015-01-30 | 2025-03-12 | Centre National De La Recherche Scient Cnrs | Isoformas delta133p53beta y delta133p53gamma son biomarcadores de células madre cancerosas. |
| JOP20200201A1 (ar) | 2015-02-10 | 2017-06-16 | Astex Therapeutics Ltd | تركيبات صيدلانية تشتمل على n-(3.5- ثنائي ميثوكسي فينيل)-n'-(1-ميثيل إيثيل)-n-[3-(ميثيل-1h-بيرازول-4-يل) كينوكسالين-6-يل]إيثان-1.2-ثنائي الأمين |
| EP3059591A1 (en) * | 2015-02-23 | 2016-08-24 | Abivax | Methods for screening compounds for treating or preventing a viral infection or a virus-related condition |
| EP3059236A1 (en) | 2015-02-23 | 2016-08-24 | Abivax | A new quinoline derivative for use in the treatment and prevention of viral infections |
| EP3058940A1 (en) * | 2015-02-23 | 2016-08-24 | Abivax | Quinoline derivatives for use in the treatment or prevention of viral infection |
| US10478494B2 (en) | 2015-04-03 | 2019-11-19 | Astex Therapeutics Ltd | FGFR/PD-1 combination therapy for the treatment of cancer |
| SI3353164T1 (sl) | 2015-09-23 | 2022-02-28 | Janssen Pharmaceutica, N.V. | Bi-heteroaril substituiran 1,4-benzodiazepini in njihove uporabe za zdravljenje raka |
| EP3353177B1 (en) | 2015-09-23 | 2020-06-03 | Janssen Pharmaceutica NV | Tricyclic heterocycles for the treatment of cancer |
| AU2016371466B2 (en) | 2015-12-17 | 2020-04-09 | Alonbio Ltd | Small Molecules for Inhibiting Chemokine Activity and/or Cancer Cells Growth |
| US10646465B2 (en) | 2015-12-17 | 2020-05-12 | Biokine Therapeutics Ltd. | Small molecules against cancer |
| JP6966456B2 (ja) * | 2016-02-03 | 2021-11-17 | ヤンセン ファーマシューティカ エヌ.ベー. | タウpet画像化リガンド |
| WO2017158201A1 (en) * | 2016-03-18 | 2017-09-21 | Ratiopharm Gmbh | Process for preparing quinolin-2-yl-phenylamine derivatives and their salts |
| ES2846833T3 (es) | 2016-07-18 | 2021-07-29 | Janssen Pharmaceutica Nv | Ligandos de obtención de imágenes de tau por PET |
| CN106496061B (zh) * | 2016-10-20 | 2018-06-05 | 湘潭大学 | 一种萃取分离酰化反应液中乙酰精胺的方法 |
| AR112027A1 (es) * | 2017-06-15 | 2019-09-11 | Biocryst Pharm Inc | Inhibidores de alk 2 quinasa que contienen imidazol |
| CN110996983A (zh) * | 2017-06-26 | 2020-04-10 | 巴斯德研究所 | 清除hiv储库并降低病毒载量的治疗 |
| WO2019045655A1 (en) | 2017-08-29 | 2019-03-07 | Chulabhorn Foundation | DERIVATIVES AND COMPOSITION OF QUINOLINE AND NAPHTHYRIDINE |
| US20200039989A1 (en) * | 2018-03-01 | 2020-02-06 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Small molecule inhibitors of dyrk/clk and uses thereof |
| WO2019186277A1 (en) | 2018-03-28 | 2019-10-03 | Institut Pasteur | Ultrasensitive hiv-1 p24 detection assay |
| EP3594206A1 (en) | 2018-07-09 | 2020-01-15 | Abivax | Phenyl-n-quinoline derivatives for treating a rna virus infection |
| EP3594205A1 (en) * | 2018-07-09 | 2020-01-15 | Abivax | Phenyl-n-aryl derivatives for treating a rna virus infection |
| EP3669873A1 (en) | 2018-12-20 | 2020-06-24 | Abivax | Quinoline derivatives for use ine the traeatment of inflammation diseases |
| WO2020128033A1 (en) | 2018-12-20 | 2020-06-25 | Institut Pasteur | Cellular metabolism of hiv-1 reservoir seeding in cd4+ t cells |
| EP3669874A1 (en) | 2018-12-20 | 2020-06-24 | Abivax | Quinoline derivatives for use in the treatment or prevention of cancer |
| EP4524131A1 (en) | 2019-05-15 | 2025-03-19 | AlonBio Ltd. | Small molecules for treating cancer, inhabiting chemokine activity and/or inducing cell death |
| WO2021152129A1 (en) | 2020-01-31 | 2021-08-05 | Abivax | Amorphous solid dispersion of 8-chloro-n-(4-(trifluoromethoxy)phenyl)quinolin-2-amine |
| EP3858336A1 (en) | 2020-01-31 | 2021-08-04 | Abivax | Amorphous solid dispersion of 8-chloro-n-(4-(trifluoromethoxy)phenyl)quinolin-2-amine |
| EP3858815A1 (en) | 2020-01-31 | 2021-08-04 | Abivax | Co-crystals and salts of 8-chloro-n-(4-(trifluoromethoxy)phenyl)quinolin-2-amine |
| IL296522A (en) | 2020-03-20 | 2022-11-01 | Abivax | Compounds for treating or preventing coronaviridae infection and methods and uses for assessing the occurrence of coronaviridae infection |
| US11691971B2 (en) | 2020-06-19 | 2023-07-04 | Incyte Corporation | Naphthyridinone compounds as JAK2 V617F inhibitors |
| WO2021257863A1 (en) | 2020-06-19 | 2021-12-23 | Incyte Corporation | Pyrrolotriazine compounds as jak2 v617f inhibitors |
| US11767323B2 (en) | 2020-07-02 | 2023-09-26 | Incyte Corporation | Tricyclic pyridone compounds as JAK2 V617F inhibitors |
| BR112023000047A2 (pt) | 2020-07-02 | 2023-03-14 | Incyte Corp | Compostos de ureia tricíclicos como inibidores da v617f da jak2 |
| WO2022046989A1 (en) | 2020-08-27 | 2022-03-03 | Incyte Corporation | Tricyclic urea compounds as jak2 v617f inhibitors |
| TW202237119A (zh) | 2020-12-10 | 2022-10-01 | 美商住友製藥腫瘤公司 | Alk﹘5抑制劑和彼之用途 |
| WO2022140231A1 (en) | 2020-12-21 | 2022-06-30 | Incyte Corporation | Deazaguaine compounds as jak2 v617f inhibitors |
| TW202302589A (zh) | 2021-02-25 | 2023-01-16 | 美商英塞特公司 | 作為jak2 v617f抑制劑之螺環內醯胺 |
| EP4063351A1 (en) | 2021-03-26 | 2022-09-28 | Abivax | Preparation method of quinoline derivative compounds |
| CN117222639A (zh) | 2021-05-27 | 2023-12-12 | 江苏恒瑞医药股份有限公司 | 喹啉胺类化合物、其制备方法及其在医药上的应用 |
| KR20230072900A (ko) | 2021-11-18 | 2023-05-25 | 동우 화인켐 주식회사 | 마이크로 led 구조체 및 이의 제조방법 |
| EP4212156A1 (en) | 2022-01-13 | 2023-07-19 | Abivax | Combination of 8-chloro-n-(4-(trifluoromethoxy)phenyl)quinolin-2-amine and its derivatives with a s1p receptor modulator |
| EP4215196A1 (en) | 2022-01-24 | 2023-07-26 | Abivax | Combination of 8-chloro-n-(4-(trifluoromethoxy)phenyl)quinolin-2-amine and its derivatives with a jak inhibitor |
| WO2023138657A1 (zh) * | 2022-01-24 | 2023-07-27 | 江苏恒瑞医药股份有限公司 | 喹啉胺类化合物、其制备方法及其在医药上的应用 |
| EP4493558A1 (en) | 2022-03-17 | 2025-01-22 | Incyte Corporation | Tricyclic urea compounds as jak2 v617f inhibitors |
| WO2025027388A1 (en) | 2023-08-01 | 2025-02-06 | Abivax | Obefazimod for treatment of ulcerative colitis |
| WO2025045123A1 (zh) * | 2023-08-30 | 2025-03-06 | 江苏正大丰海制药有限公司 | 用于调节微小rna-124活性的化合物 |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR400973A (fr) | 1909-03-19 | 1909-08-13 | Jean Victor Massillon | Nouveau sertisseur à main pour la fabrication des cartouches |
| GB585362A (en) | 1944-08-31 | 1947-02-05 | Francis Henry Swinden Curd | New heterocyclic compounds |
| BE486034A (es) | 1947-11-28 | |||
| DE958647C (de) | 1952-12-28 | 1957-02-21 | Hoechst Ag | Verfahren zur Herstellung von 7-Amino-2-oxy-4-methyl-chinolinen |
| FR2387229A1 (fr) | 1977-04-13 | 1978-11-10 | Anvar | Dipyrido (4,3-b) (3,4-f) indoles, procede d'obtention, application therapeutique et compositions pharmaceutiques les contenant |
| FR2436786A1 (fr) | 1978-09-21 | 1980-04-18 | Anvar | Nouveaux derives des pyrido (4,3-b) carbazoles (ellipticines), substitues en position 1 par une chaine polyaminee, leur obtention et leur application a titre de medicaments |
| FR2627493B1 (fr) * | 1988-02-23 | 1991-10-31 | Sanofi Sa | Procede de preparation de derives d'isoquinoleine |
| FR2645861A1 (fr) * | 1989-04-17 | 1990-10-19 | Inst Nat Sante Rech Med | Utilisation de dipyrido (4,3-b) (3,4-f) indoles pour la preparation de medicaments utiles pour le traitement du sida |
| US6177401B1 (en) | 1992-11-13 | 2001-01-23 | Max-Planck-Gesellschaft Zur Forderung Der Wissenschaften | Use of organic compounds for the inhibition of Flk-1 mediated vasculogenesis and angiogenesis |
| ATE260099T1 (de) | 1999-04-05 | 2004-03-15 | Hope City | Neue hemmern von fortgeschrittenen glykosilierung-endprodukten |
| UA75055C2 (uk) | 1999-11-30 | 2006-03-15 | Пфайзер Продактс Інк. | Похідні бензоімідазолу, що використовуються як антипроліферативний засіб, фармацевтична композиція на їх основі |
| DE10013318A1 (de) * | 2000-03-17 | 2001-09-20 | Merck Patent Gmbh | Formulierung enthaltend Chinoxalinderivate |
| CA2435847A1 (en) | 2001-01-22 | 2002-09-26 | Memory Pharmaceuticals Corporation | Aniline derivatives useful as phosphodiesterase 4 inhibitors |
| ES2355472T3 (es) | 2002-05-22 | 2011-03-28 | Amgen Inc. | Derivados de aminopirimidina para su uso como ligandos del receptor vaniloide para el tratamiento del dolor. |
| AU2002950217A0 (en) * | 2002-07-16 | 2002-09-12 | Prana Biotechnology Limited | 8- Hydroxy Quinoline Derivatives |
| WO2004009552A1 (en) * | 2002-07-19 | 2004-01-29 | Memory Pharmaceuticals Corporation | Phosphodiesterase 4 inhibitors, including n-substituted aniline and diphenylamine analogs |
| FR2849474B3 (fr) | 2002-12-27 | 2004-12-03 | Olivier Jean Noel Juin | Installation de transformation de l'energie cinetique d'un fluide en energie electrique |
| WO2004078731A1 (fr) | 2003-03-06 | 2004-09-16 | 'chemical Diversity Research Institute', Ltd. | Acides quinoline-carboxyliques et leurs derives et bibliotheque focalisee |
| JP2006519846A (ja) * | 2003-03-10 | 2006-08-31 | シェーリング コーポレイション | 複素環式キナーゼインヒビター:使用および合成の方法 |
| FR2859474B1 (fr) | 2003-09-04 | 2006-01-13 | Centre Nat Rech Scient | Utilisation de composes derives d'indole pour la preparation d'un medicament utile pour le traitement de maladies genetiques resultant de l'alteration des processus d'epissage |
| FR2859475A1 (fr) | 2003-09-04 | 2005-03-11 | Centre Nat Rech Scient | Utilisation de composes derives d'ellipticine et d'aza-ellipticine pour la preparation d'un medicament utile pour le traitement de maladies genetiques resultant de l'alteration des processus d'epissage |
| AU2004281154A1 (en) * | 2003-10-16 | 2005-04-28 | Novartis Vaccines And Diagnostics, Inc. | 2,6-disubstituted quinazolines, quinoxalines, quinolines and isoquinolines as inhibitors of Raf kinase for treatment of cancer |
| JP4842137B2 (ja) * | 2003-11-19 | 2011-12-21 | アレイ バイオファーマ、インコーポレイテッド | Mekのヘテロ環系阻害剤及びその使用方法 |
| WO2006051311A1 (en) * | 2004-11-12 | 2006-05-18 | Galapagos Nv | Nitrogen heteroaromatic compounds which bind to the active site of protein kinase enzymes |
| EP1853265B1 (en) | 2005-01-28 | 2016-01-27 | The Government of the United States of America as represented by the Secretary of the Department of Health and Human Services | Farnesyltransferase inhibitors for use in the treatment of laminopathies, cellular aging and atherosclerosis |
| EP1897914A4 (en) * | 2005-06-29 | 2008-07-02 | Adeka Corp | RESIN ADDITIVE COMPOSITION AND RESIN COMPOSITION |
| FR2903312B1 (fr) | 2006-07-05 | 2008-09-26 | Univ Aix Marseille Ii | Utilisation d'inhibiteurs d'hmg-coa reductase et de farnesyl-pyrophosphate synthase dans la preparation d'un medicament |
| WO2008008234A1 (en) * | 2006-07-07 | 2008-01-17 | Targegen, Inc. | 2-amino-5-substituted pyrimidine inhibitors |
| EP2121620B1 (en) * | 2007-01-19 | 2015-06-17 | Ardea Biosciences, Inc. | Inhibitors of mek |
| FR2912745A1 (fr) | 2007-02-19 | 2008-08-22 | Centre Nat Rech Scient | Nouveaux composes derives d'indole et compositions pharmaceutiques les contenant |
| US20100249184A1 (en) * | 2007-03-16 | 2010-09-30 | Mount Sinai School Of Medicine | Induction and/or maintenance of tumor dormancy by disruption of urokinase plasminogen activator receptor-integrin interaction |
| TWI371445B (en) | 2007-05-17 | 2012-09-01 | Lg Chemical Ltd | New anthracene derivatives and organic electronic device using the same |
| UY31272A1 (es) * | 2007-08-10 | 2009-01-30 | Almirall Lab | Nuevos derivados de ácido azabifenilaminobenzoico |
| CA2695456A1 (en) | 2007-08-15 | 2009-02-19 | Robert Dunn | 3' substituted compounds having 5-ht6 receptor affinity |
| WO2009029617A1 (en) * | 2007-08-27 | 2009-03-05 | Kalypsys, Inc. | Diarylamine-substituted quinolones useful as inducible nitric oxide synthase inhibitors |
| KR100974562B1 (ko) * | 2007-12-31 | 2010-08-06 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 |
| FR2926297B1 (fr) | 2008-01-10 | 2013-03-08 | Centre Nat Rech Scient | Molecules chimiques inhibitrices du mecanisme d'epissage pour traiter des maladies resultant d'anomalies d'epissage. |
| US20110311475A1 (en) * | 2009-01-05 | 2011-12-22 | Stephan Borte | Means and method for the treatment of antibody deficiency diseases based on il-21 and il-21 variants |
| JP5828151B6 (ja) * | 2009-01-06 | 2018-09-19 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | アテローム性動脈硬化の処置のためのb細胞枯渇剤 |
| EP2373611A2 (en) * | 2009-01-06 | 2011-10-12 | DSM IP Assets B.V. | Process for resveratrol intermediate |
| MX2019008390A (es) * | 2009-06-12 | 2019-09-09 | Abivax | Compuestos utiles para tratar cancer. |
| EP2266972A1 (en) | 2009-06-12 | 2010-12-29 | Splicos | New chemical molecules that inhibit the splicing mechanism for treating diseases resulting from splicing anomalies |
| ES2985082T3 (es) * | 2009-06-12 | 2024-11-04 | Abivax | Compuestos útiles para tratar el cáncer |
| WO2010151755A2 (en) | 2009-06-25 | 2010-12-29 | The Brigham And Women's Hospital, Inc. | TREATMENT OF INFLAMMATORY DISEASES USING miR-124 |
| EP2465502A1 (en) | 2010-12-15 | 2012-06-20 | Société Splicos | Compounds useful for treating AIDS |
| EP2903611A4 (en) | 2012-10-04 | 2016-11-16 | Oyagen Inc | SMALL MOLECULES AS ANTI-HIV AGENTS FOR INTERRUPTING THE VIF SELF-ASSOCIATION AND METHOD FOR USE THEREOF |
| EP2757161A1 (en) | 2013-01-17 | 2014-07-23 | Splicos | miRNA-124 as a biomarker of viral infection |
| JP2015120566A (ja) * | 2013-12-20 | 2015-07-02 | ニチユ三菱フォークリフト株式会社 | 荷役車両 |
-
2010
- 2010-06-14 ES ES19157827T patent/ES2985082T3/es active Active
- 2010-06-14 KR KR1020187025626A patent/KR101982463B1/ko active Active
- 2010-06-14 DK DK19157827.7T patent/DK3517534T3/da active
- 2010-06-14 KR KR1020197004606A patent/KR102016891B1/ko active Active
- 2010-06-14 KR KR1020187025624A patent/KR101973348B1/ko active Active
- 2010-06-14 CA CA2764024A patent/CA2764024C/en active Active
- 2010-06-14 PL PL19157827.7T patent/PL3517534T3/pl unknown
- 2010-06-14 DK DK10757474.1T patent/DK2440547T3/da active
- 2010-06-14 DK DK10728368.1T patent/DK2440545T3/da active
- 2010-06-14 KR KR1020197004605A patent/KR102016890B1/ko active Active
- 2010-06-14 EP EP10757474.1A patent/EP2440547B1/en active Active
- 2010-06-14 MX MX2011013119A patent/MX353776B/es active IP Right Grant
- 2010-06-14 CA CA2965791A patent/CA2965791C/en active Active
- 2010-06-14 PT PT107574741T patent/PT2440547T/pt unknown
- 2010-06-14 RU RU2011149571/04A patent/RU2567752C2/ru active
- 2010-06-14 CN CN201510023124.6A patent/CN104844570B/zh active Active
- 2010-06-14 PL PL10728368T patent/PL2440545T3/pl unknown
- 2010-06-14 KR KR1020187025625A patent/KR101982462B1/ko active Active
- 2010-06-14 EP EP19157827.7A patent/EP3517534B1/en active Active
- 2010-06-14 KR KR1020197004604A patent/KR102016889B1/ko active Active
- 2010-06-14 HR HRP20230248TT patent/HRP20230248T1/hr unknown
- 2010-06-14 BR BR122019013686-6A patent/BR122019013686B1/pt active IP Right Grant
- 2010-06-14 MX MX2018009425A patent/MX373120B/es unknown
- 2010-06-14 CN CN201080032036.8A patent/CN102574835B/zh active Active
- 2010-06-14 FI FIEP10728369.9T patent/FI2440546T3/fi active
- 2010-06-14 CN CN201410106644.9A patent/CN103948594B/zh active Active
- 2010-06-14 PT PT107283699T patent/PT2440546T/pt unknown
- 2010-06-14 JP JP2012514586A patent/JP5826745B2/ja active Active
- 2010-06-14 HU HUE10757474A patent/HUE061262T2/hu unknown
- 2010-06-14 BR BRPI1010772A patent/BRPI1010772B8/pt active IP Right Grant
- 2010-06-14 DK DK10728369.9T patent/DK2440546T3/da active
- 2010-06-14 FI FIEP10757474.1T patent/FI2440547T3/fi active
- 2010-06-14 EP EP10728368.1A patent/EP2440545B1/en active Active
- 2010-06-14 CN CN201080032055.0A patent/CN102596935B/zh active Active
- 2010-06-14 SI SI201032127T patent/SI2440547T1/sl unknown
- 2010-06-14 TR TR2019/10781T patent/TR201910781T4/tr unknown
- 2010-06-14 EP EP19157824.4A patent/EP3521283B1/en active Active
- 2010-06-14 CN CN201710158473.8A patent/CN106928205B/zh active Active
- 2010-06-14 BR BRPI1010768A patent/BRPI1010768C8/pt active IP Right Grant
- 2010-06-14 PL PL10757474.1T patent/PL2440547T3/pl unknown
- 2010-06-14 CU CUP2015000024A patent/CU24245B1/es unknown
- 2010-06-14 WO PCT/IB2010/052650 patent/WO2010143168A2/en active Application Filing
- 2010-06-14 JP JP2012514587A patent/JP5905385B2/ja active Active
- 2010-06-14 MX MX2015016290A patent/MX364282B/es unknown
- 2010-06-14 EP EP22193611.5A patent/EP4198022A1/en active Pending
- 2010-06-14 FI FIEP19157827.7T patent/FI3517534T3/fi active
- 2010-06-14 KR KR1020177021820A patent/KR101863021B1/ko active Active
- 2010-06-14 KR KR1020127000915A patent/KR101789275B1/ko active Active
- 2010-06-14 KR KR1020127000916A patent/KR101769616B1/ko active Active
- 2010-06-14 CN CN201510020820.1A patent/CN104945378B/zh active Active
- 2010-06-14 EP EP10728369.9A patent/EP2440546B1/en active Active
- 2010-06-14 WO PCT/IB2010/052651 patent/WO2010143169A2/en active Application Filing
- 2010-06-14 CN CN201710158474.2A patent/CN106928194B/zh active Active
- 2010-06-14 ES ES10757474T patent/ES2938532T3/es active Active
- 2010-06-14 JP JP2012514585A patent/JP6041671B2/ja active Active
- 2010-06-14 HU HUE10728368A patent/HUE045548T2/hu unknown
- 2010-06-14 CA CA3070823A patent/CA3070823C/en active Active
- 2010-06-14 WO PCT/IB2010/052652 patent/WO2010143170A2/en active Application Filing
- 2010-06-14 US US13/377,753 patent/US20120329796A1/en not_active Abandoned
- 2010-06-14 PL PL10728369.9T patent/PL2440546T3/pl unknown
- 2010-06-14 LT LTEPPCT/IB2010/052651T patent/LT2440547T/lt unknown
- 2010-06-14 MX MX2015016291A patent/MX364279B/es unknown
- 2010-06-14 CA CA2764026A patent/CA2764026C/en active Active
- 2010-06-14 BR BRPI1012892A patent/BRPI1012892B8/pt active IP Right Grant
- 2010-06-14 CU CUP2011000229A patent/CU24124B1/es active IP Right Grant
- 2010-06-14 CN CN202110307700.5A patent/CN113004249A/zh active Pending
- 2010-06-14 US US13/377,760 patent/US9145367B2/en active Active
- 2010-06-14 KR KR1020127000914A patent/KR20120051643A/ko not_active Ceased
- 2010-06-14 KR KR1020197004607A patent/KR102016892B1/ko active Active
- 2010-06-14 CU CU2011000230A patent/CU24093B1/es active IP Right Grant
- 2010-06-14 CN CN201080032045.7A patent/CN102625804B/zh active Active
- 2010-06-14 ES ES10728368T patent/ES2736198T3/es active Active
- 2010-06-14 CN CN201510021597.2A patent/CN104945379B/zh active Active
- 2010-06-14 MX MX2011013120A patent/MX338823B/es active IP Right Grant
- 2010-06-14 US US13/377,745 patent/US20120277230A1/en not_active Abandoned
- 2010-06-14 MX MX2015016292A patent/MX364280B/es unknown
- 2010-06-14 CA CA2764027A patent/CA2764027C/en active Active
- 2010-06-14 KR KR1020197004608A patent/KR102016893B1/ko active Active
- 2010-06-14 MX MX2016007353A patent/MX367601B/es unknown
- 2010-06-14 AU AU2010258214A patent/AU2010258214B2/en active Active
- 2010-06-14 AU AU2010258295A patent/AU2010258295B2/en active Active
- 2010-06-14 CN CN201710122014.4A patent/CN106905232B/zh active Active
- 2010-06-14 BR BR122019013687A patent/BR122019013687B1/pt active IP Right Grant
- 2010-06-14 KR KR1020177031675A patent/KR101897221B1/ko active Active
- 2010-06-14 MX MX2011013122A patent/MX340095B/es active IP Right Grant
- 2010-06-14 HR HRP20240582TT patent/HRP20240582T1/hr unknown
- 2010-06-14 PT PT10728368T patent/PT2440545T/pt unknown
- 2010-06-14 MX MX2015016293A patent/MX364989B/es unknown
- 2010-06-14 CN CN201510023109.1A patent/CN104844510B/zh active Active
- 2010-06-14 CU CU2011000228A patent/CU24461B1/es unknown
- 2010-06-14 MX MX2016003039A patent/MX359575B/es unknown
- 2010-06-14 HR HRP20230143TT patent/HRP20230143T1/hr unknown
- 2010-06-14 ES ES10728369T patent/ES2940885T3/es active Active
- 2010-06-14 KR KR1020187025623A patent/KR101982461B1/ko active Active
- 2010-06-14 CN CN201910120757.7A patent/CN109776496B/zh active Active
- 2010-06-14 AU AU2010258294A patent/AU2010258294B2/en active Active
- 2010-06-14 PT PT191578277T patent/PT3517534T/pt unknown
-
2011
- 2011-12-08 ZA ZA2011/09031A patent/ZA201109031B/en unknown
- 2011-12-08 ZA ZA2011/09032A patent/ZA201109032B/en unknown
-
2013
- 2013-01-11 HK HK13100514.2A patent/HK1173153A1/xx unknown
- 2013-01-17 HK HK13100736.4A patent/HK1173726A1/zh unknown
- 2013-01-17 HK HK16101079.4A patent/HK1213246A1/zh unknown
- 2013-01-17 HK HK16101080.1A patent/HK1213247A1/zh unknown
- 2013-01-17 HK HK16100761.9A patent/HK1212702A1/zh unknown
- 2013-01-17 HK HK16101060.5A patent/HK1212990A1/zh unknown
- 2013-01-17 HK HK13100731.9A patent/HK1173447A1/zh unknown
- 2013-11-22 US US14/087,762 patent/US9108919B2/en active Active
-
2014
- 2014-04-18 US US14/256,334 patent/US9908869B2/en active Active
-
2015
- 2015-01-30 HK HK15101062.4A patent/HK1200363A1/xx unknown
- 2015-04-27 JP JP2015090437A patent/JP2015155453A/ja active Pending
- 2015-06-15 JP JP2015120566A patent/JP2015187150A/ja not_active Withdrawn
- 2015-06-15 JP JP2015120567A patent/JP6158250B2/ja active Active
- 2015-06-15 JP JP2015120568A patent/JP6158251B2/ja active Active
- 2015-07-01 US US14/789,149 patent/US9637475B2/en active Active
- 2015-07-01 US US14/789,250 patent/US10017498B2/en active Active
-
2019
- 2019-10-18 JP JP2019191500A patent/JP7042245B2/ja active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2736198T3 (es) | Compuestos útiles para tratar el cáncer | |
| JP6336650B2 (ja) | ガンを治療する為に有用な化合物 | |
| AU2015203256B2 (en) | Compounds useful for treating cancer |