Hydrogengass blir danna når ein tilset syre til eit uedelt metall. Difor har gassen sannsynlegvis vorte framstilt tidleg av alkymistane. Det var likevel fyrst briten Henry Cavendish som studerte denne gassen nærare i 1766, og han blir difor vanlegvis rekna som oppdagaren til hydrogenet.
Cavendish løyste sink, jern og tinn i saltsyre og svovelsyre. Han fann at han fekk like mykje gass når same mengd av eit av metalla vart løyste i saltsyre og i svovelsyre. Cavendish trudde på flogistonteorien og på at vatn var eit grunnelement, slik ein hadde trudd frå oldtida. Han gjekk difor fyrst ut frå at hydrogengassen som vart danna var flogiston.
Det var den franske kjemikaren Antoine Laurent Lavoisier som fyrst viste at vatn er eit kjemisk samband mellom to gassar. Han gav dei namna hydrogen og oksygen. Namnet hydrogen kjem frå dei greske orda hydor, som tyder ’vatn’, og genos, som tyder ’slekt’, fordi gassen dannar vatn når han brenn i luft.
Tidleg på 1900-talet brukte ein hydrogen i luftskip på grunn av den låge eigenvekta til hydrogengassen. Luftskip som kunne romme store volum med hydrogen, fekk ei oppdrift som gjorde at dei kunne halde seg svevande. Saman med oksygen dannar hydrogen ein eksplosjonsfarleg gass, knallgass. I 1937 oppstod det ein katastrofal knallgasseksplosjon då luftskipet Hindenburg skulle fortøyast.
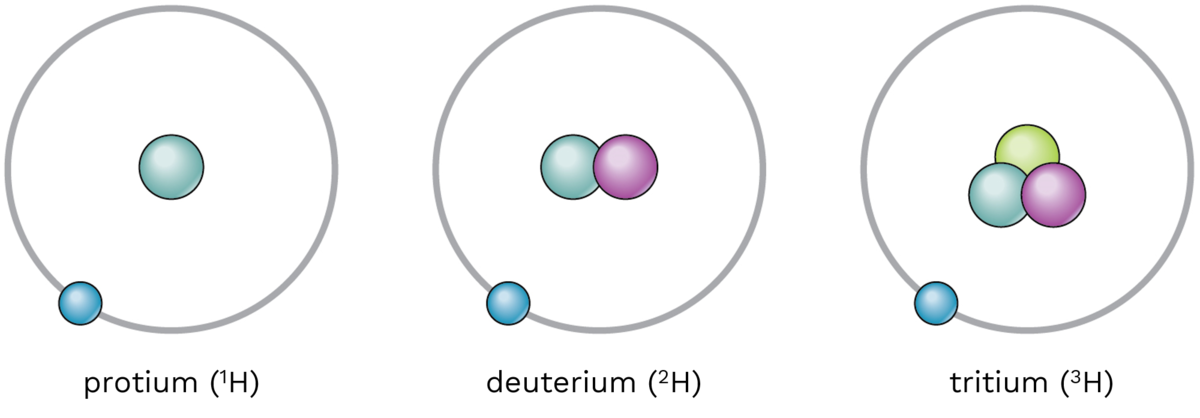
I 1931 vart det føreslått at også hydrogen hadde ein tyngre isotop, deuterium, og alt i desember same år kunne den amerikanske kjemikaren Harold Clayton Urey og medarbeidarar påvise denne isotopen spektroskopisk. I 1932 fann Urey og E. W. Washburn at deuterium vart opprikt ved elektrolyse av vatn, og dersom ein elektrolyserer ein stor nok mengd vatn vil ein til slutt ende opp med nesten reint tungtvatn. Urey fekk i 1934 nobelprisen i kjemi for arbeida sine med deuterium.
Etter oppdaginga av deuterium vart det sett i gang eit kapplaup om å vere den fyrste til å finne isotopen 3H, tritium. I 1934 klarte Ernest Rutherford og medarbeidaren hans å framstille tritium. Beviset for at dei hadde klart det kom fyrst 3 år seinare. I 1950 vart det påvist tritium i naturen.








Kommentarar
Kommentarar til artikkelen blir synleg for alle. Ikkje skriv inn sensitive opplysningar, for eksempel helseopplysningar. Fagansvarleg eller redaktør svarar når dei kan. Det kan ta tid før du får svar.
Du må være logga inn for å kommentere.