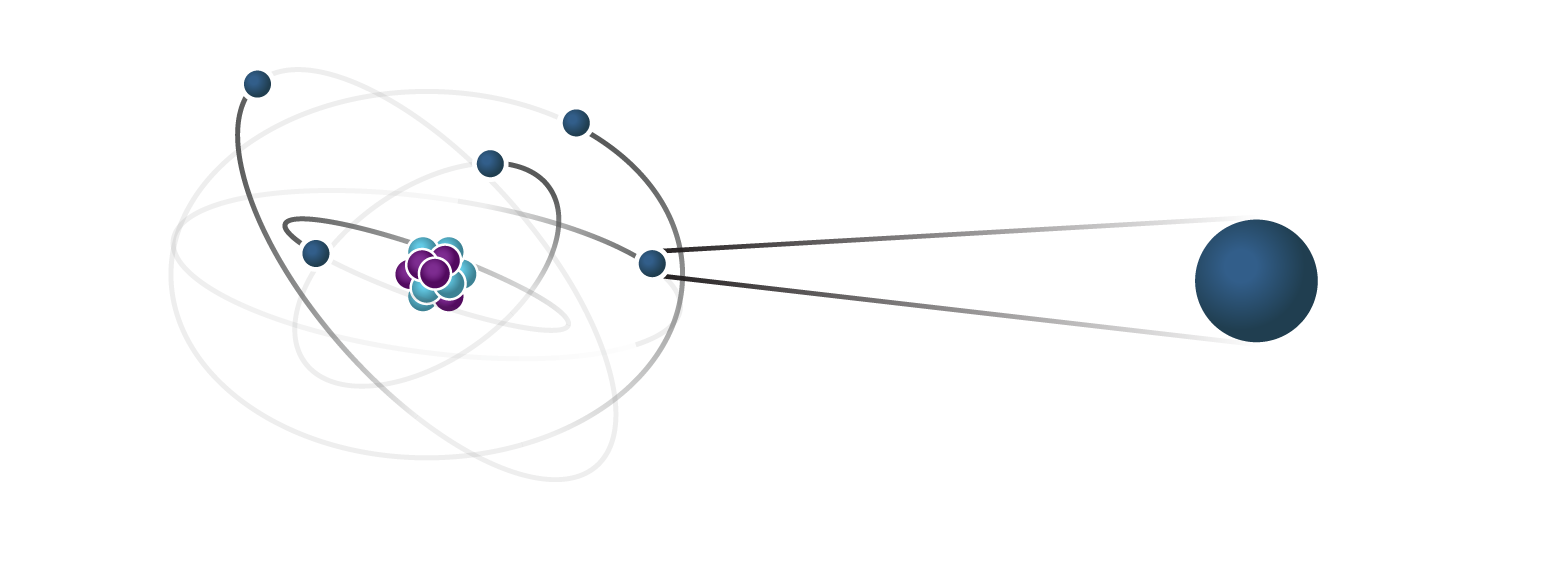
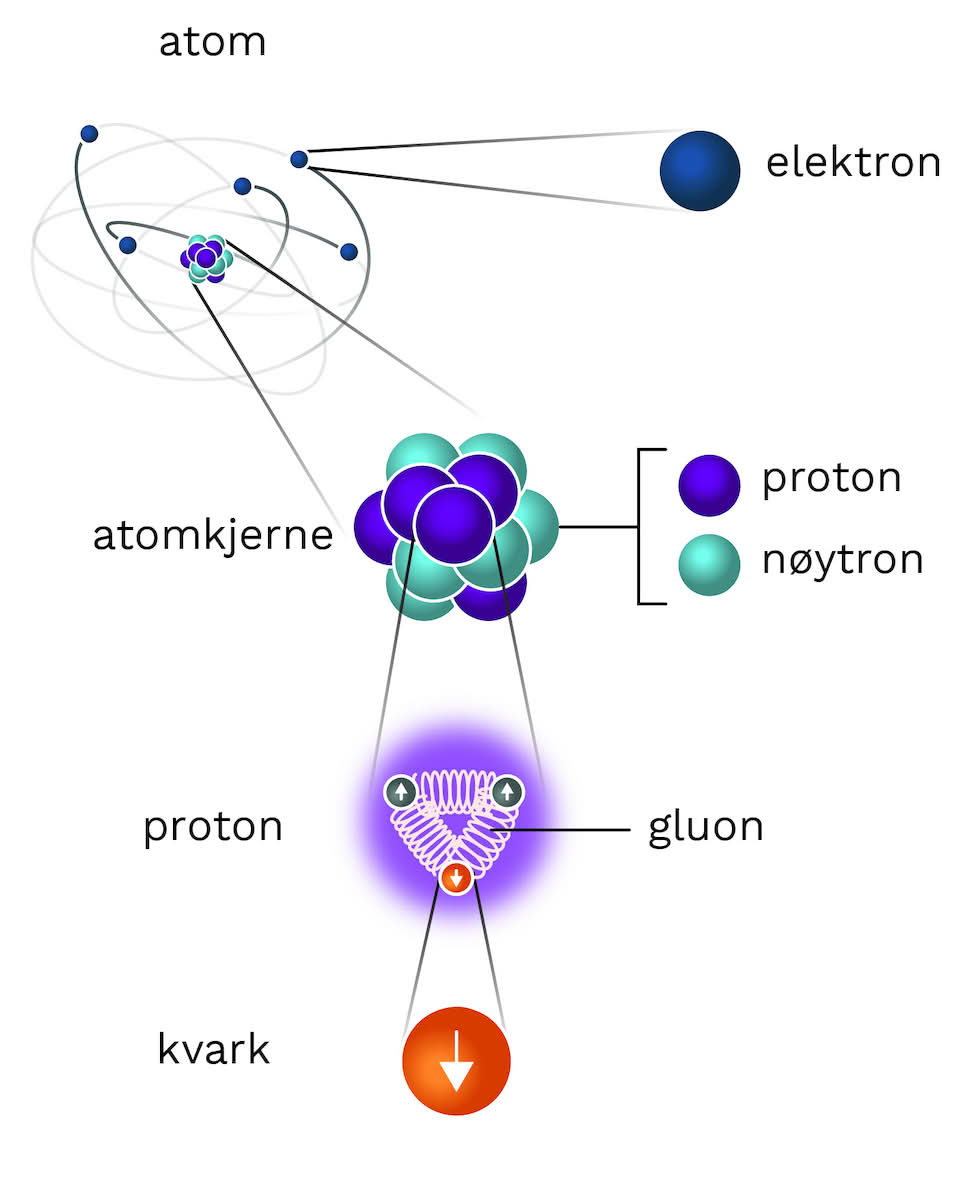
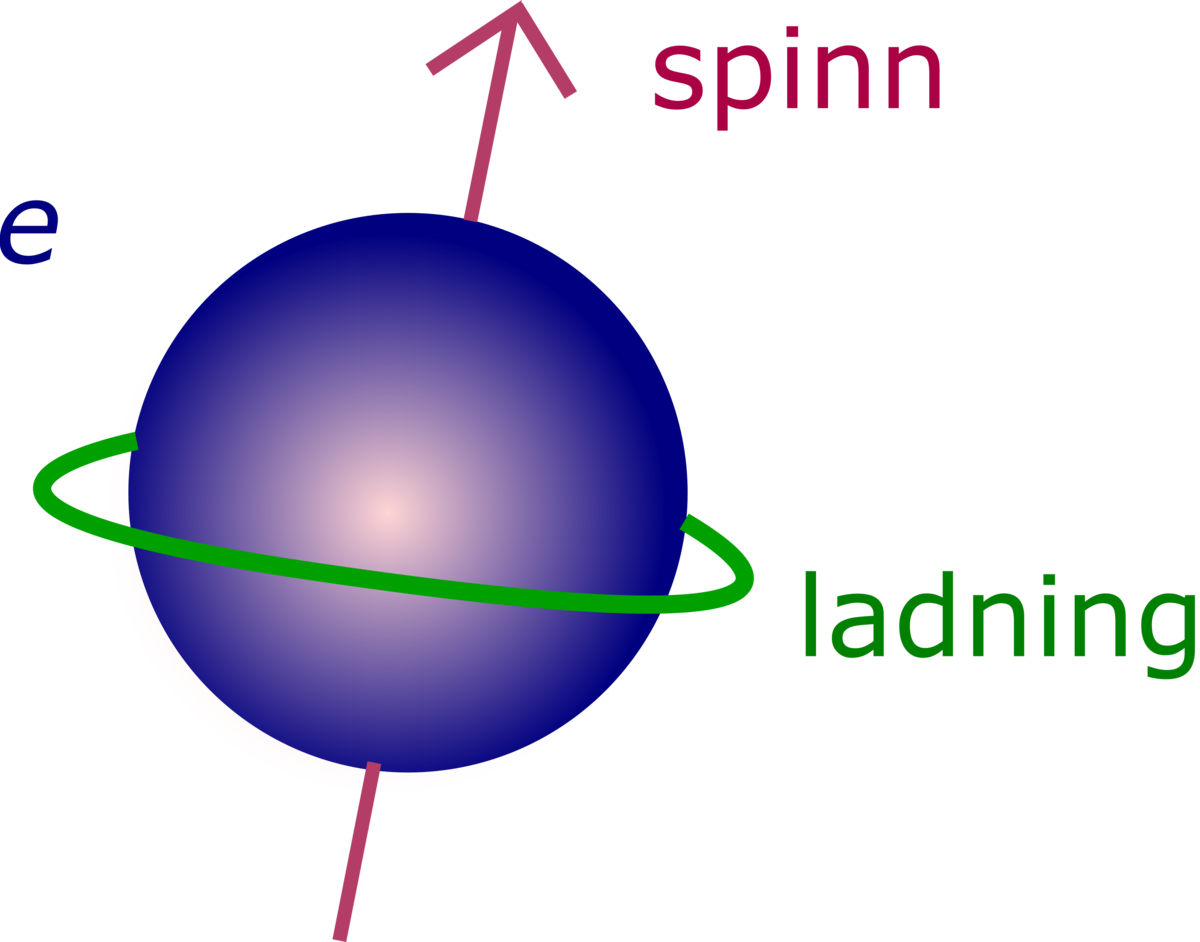
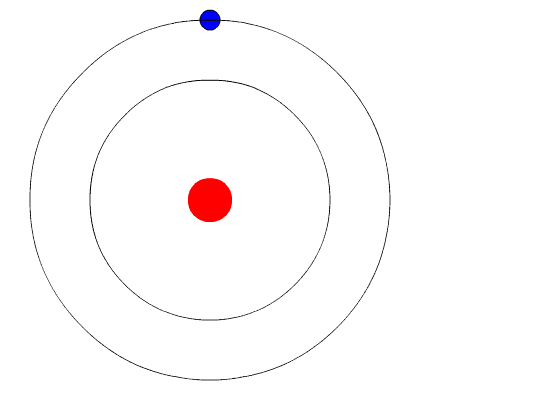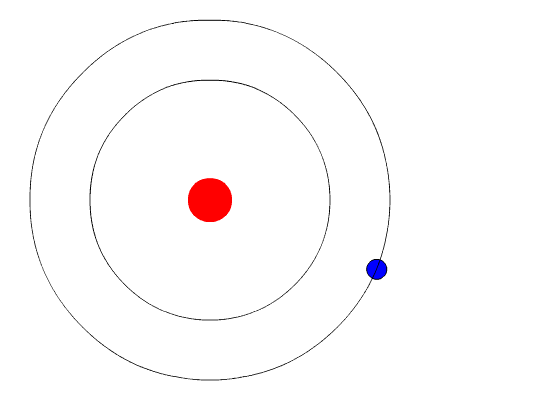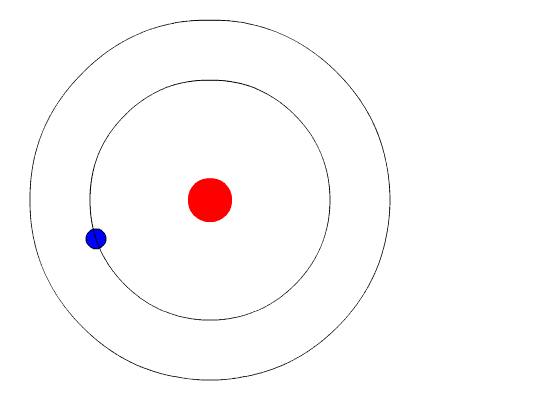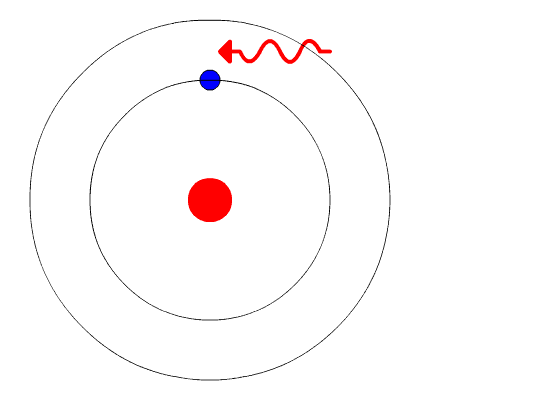
Et elektron er en negativt ladet elementærpartikkel som finnes i alt kjent stoff, og som befinner seg i en sky rundt kjernen av atomet. Elektroner spiller en sentral rolle i mange områder av fysikk.
Elektroner er grunnlag for svært mange teknologiske anvendelser, blant annet innenfor kommunikasjon, belysning og datateknologi. Det er fordi elektroner gjør elektriske strømmer mulig.
Elektronskyen bestemmer sammen med protonene i atomkjernen stoffenes kjemiske og fysiske egenskaper. Kjennskap til et stoffs struktur innebærer en kartlegging av energinivåene til elektronene i stoffet.
Forståelsen av elektronets egenskaper har vært av enorm betydning for den elektroniske og teknologiske utviklingen i moderne tid.
Elektronet hører hjemme i en gruppe av elementærpartikler som kalles leptoner.






Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.