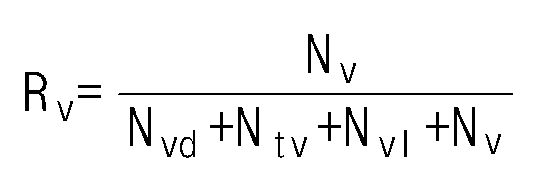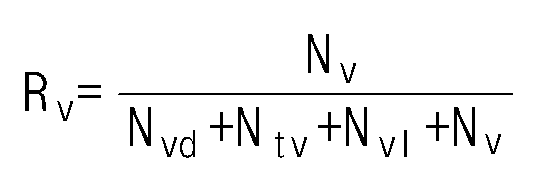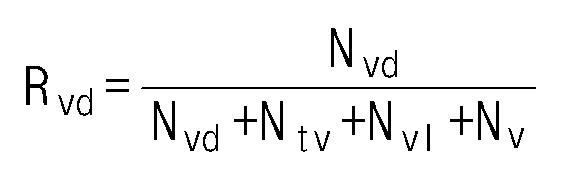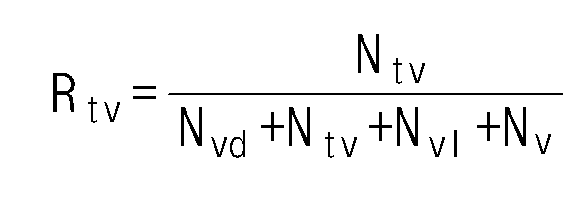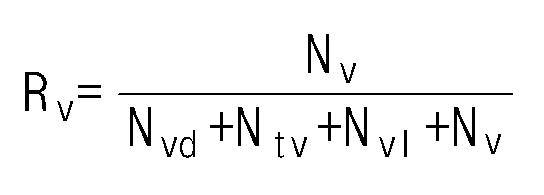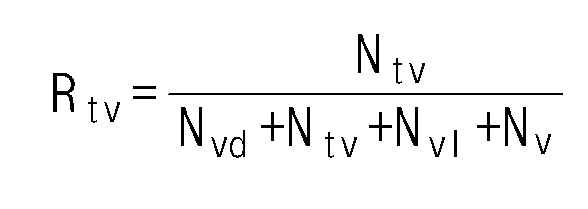WO2019212307A1 - 에틸렌/알파-올레핀 공중합체, 이의 제조방법 - Google Patents
에틸렌/알파-올레핀 공중합체, 이의 제조방법 Download PDFInfo
- Publication number
- WO2019212307A1 WO2019212307A1 PCT/KR2019/005368 KR2019005368W WO2019212307A1 WO 2019212307 A1 WO2019212307 A1 WO 2019212307A1 KR 2019005368 W KR2019005368 W KR 2019005368W WO 2019212307 A1 WO2019212307 A1 WO 2019212307A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- alpha
- ethylene
- formula
- olefin copolymer
- alkyl
- Prior art date
Links
- 0 CC(C1c2c(*)c(C)c(C)c(*)c2NC1C1*(*)(*(*)*2(*)*)c3c(*)c(N)c(*)c(*)c3*)C(*)C12C1(C)CCCCCCCCCC1 Chemical compound CC(C1c2c(*)c(C)c(C)c(*)c2NC1C1*(*)(*(*)*2(*)*)c3c(*)c(N)c(*)c(*)c3*)C(*)C12C1(C)CCCCCCCCCC1 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2/00—Processes of polymerisation
- C08F2/38—Polymerisation using regulators, e.g. chain terminating agents, e.g. telomerisation
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F210/00—Copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond
- C08F210/14—Monomers containing five or more carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F210/00—Copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond
- C08F210/16—Copolymers of ethene with alpha-alkenes, e.g. EP rubbers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F4/00—Polymerisation catalysts
- C08F4/42—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors
- C08F4/44—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides
- C08F4/60—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides together with refractory metals, iron group metals, platinum group metals, manganese, rhenium technetium or compounds thereof
- C08F4/62—Refractory metals or compounds thereof
- C08F4/64—Titanium, zirconium, hafnium or compounds thereof
- C08F4/647—Catalysts containing a specific non-metal or metal-free compound
- C08F4/649—Catalysts containing a specific non-metal or metal-free compound organic
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F4/00—Polymerisation catalysts
- C08F4/42—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors
- C08F4/44—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides
- C08F4/60—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides together with refractory metals, iron group metals, platinum group metals, manganese, rhenium technetium or compounds thereof
- C08F4/62—Refractory metals or compounds thereof
- C08F4/64—Titanium, zirconium, hafnium or compounds thereof
- C08F4/659—Component covered by group C08F4/64 containing a transition metal-carbon bond
- C08F4/6592—Component covered by group C08F4/64 containing a transition metal-carbon bond containing at least one cyclopentadienyl ring, condensed or not, e.g. an indenyl or a fluorenyl ring
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L23/00—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers
- C08L23/02—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers not modified by chemical after-treatment
- C08L23/04—Homopolymers or copolymers of ethene
- C08L23/08—Copolymers of ethene
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B1/00—Optical elements characterised by the material of which they are made; Optical coatings for optical elements
- G02B1/04—Optical elements characterised by the material of which they are made; Optical coatings for optical elements made of organic materials, e.g. plastics
Definitions
- This application is a Korean patent application dated May 4, 2018 2018-0052071, a Korean patent application dated September 18, 2018 2018-0111511, a Korean patent application dated September 18, 2018 2018-0111510, a Korean patent dated May 4, 2018 Claiming the benefit of priority based on application 2018-0052072, Korean Patent Application 2019-0050468 dated April 30, 2019, all the contents disclosed in the literature of those Korean patent applications are incorporated as part of this specification.
- the present invention relates to an ethylene / alpha-olefin copolymer having a narrow molecular weight distribution and having a controlled vinyl group content within a certain range, which exhibits excellent physical properties, and a method for producing the same.
- Olefin polymerization catalyst systems can be classified into Ziegler-Natta and metallocene catalyst systems, and these two highly active catalyst systems have been developed for their respective characteristics.
- the Ziegler-Natta catalyst has been widely applied to existing commercial processes since the invention in the 50s, but is characterized by a wide molecular weight distribution of the polymer because it is a multi-site catalyst having multiple active sites. There is a problem that there is a limit in securing the desired physical properties because the composition distribution is not uniform.
- the metallocene catalyst is composed of a combination of a main catalyst composed mainly of a transition metal compound and a cocatalyst composed of an organometallic compound composed mainly of aluminum, and such a catalyst is a single site catalyst as a homogeneous complex catalyst.
- the polymer has a narrow molecular weight distribution according to the characteristics of a single active site, and a polymer having a uniform composition of the comonomer is obtained, and the stereoregularity, copolymerization characteristics, molecular weight, It has the property to change the crystallinity.
- U.S. Patent No. 5,914,289 describes a method for controlling the molecular weight and molecular weight distribution of a polymer using a metallocene catalyst supported on each carrier, but the amount of solvent used and the time required for preparing the supported catalyst are high. The hassle of having to support the metallocene catalyst to be used on the carrier, respectively.
- Korean Patent Application No. 10-2003-0012308 discloses a method for controlling the molecular weight distribution by supporting a dual-nuclear metallocene catalyst and a mononuclear metallocene catalyst on a carrier together with an activator to polymerize by changing the combination of catalysts in the reactor. Is starting. However, this method is limited in realizing the characteristics of each catalyst at the same time, and also has the disadvantage of freeing the metallocene catalyst portion in the carrier component of the finished catalyst, causing fouling in the reactor.
- linear low density polyethylene is prepared by copolymerizing ethylene and alpha olefin at low pressure using a polymerization catalyst, and has a narrow molecular weight distribution, a short chain branch of a constant length, and a long chain branch.
- the linear low density polyethylene film has high breaking strength and elongation, and excellent tear strength and fall impact strength. Doing.
- linear low density polyethylenes using 1-butene or 1-hexene as comonomers are mostly produced in single gas phase reactors or single loop slurry reactors, and are more productive than processes using 1-octene comonomers, but these products are also used Due to the limitations of catalyst technology and process technology, physical properties are inferior to those of using 1-octene comonomer, and molecular weight distribution is narrow, resulting in poor processability.
- US Pat. No. 4,935,474 reports on the preparation of polyethylenes having a broad molecular weight distribution using two or more metallocene compounds.
- U.S. Patent No. 6,828,394 reports a process for producing polyethylene with good comonomer binding properties and mixtures with and without good comonomer bonding, particularly suitable for films.
- US Pat. No. 6,841,631 and US Pat. No. 6,894,128 produce polyethylene having bimodal or polycrystalline molecular weight distribution with a metallocene catalyst using at least two kinds of metal compounds, for use in films, blow molding, pipes, and the like. It is reported to be applicable.
- these products have improved processability, but there is a problem in that the extrusion appearance is coarse and the physical properties are not stable even under relatively good extrusion conditions because the dispersion state by molecular weight in unit particles is not uniform.
- the present invention is to solve the problems of the prior art, the molecular weight distribution is narrow, the vinyl group content in the polymer is controlled to a certain range, ethylene / alpha-olefin copolymer having excellent physical properties, particularly excellent crosslinking behavior properties And to provide a method of manufacturing the same.
- the present invention is to provide a resin composition for an optical film exhibiting excellent physical properties, in particular excellent crosslinking properties by including the ethylene / alpha -olefin copolymer.
- an object of the present invention is to provide a resin composition for an optical film with improved optical properties such as yellow index (YI), total light transmittance (Tt), and an optical film produced using the resin composition.
- YI yellow index
- Tt total light transmittance
- One embodiment of the present invention provides an ethylene / alpha-olefin copolymer that meets the following conditions (a) to (d):
- N vd , N tv , N vl, and N v are each vinylidene, trivinyl, vinylene, and vinyl per 1000 carbon atoms measured through nuclear magnetic spectroscopic analysis. vinyl) means the number of functional groups.
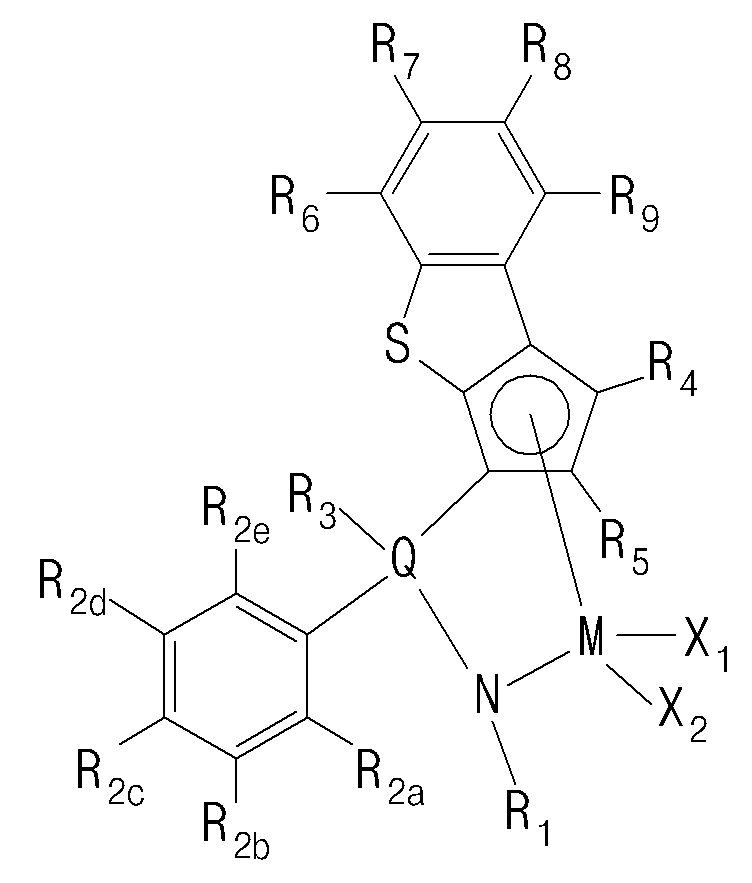
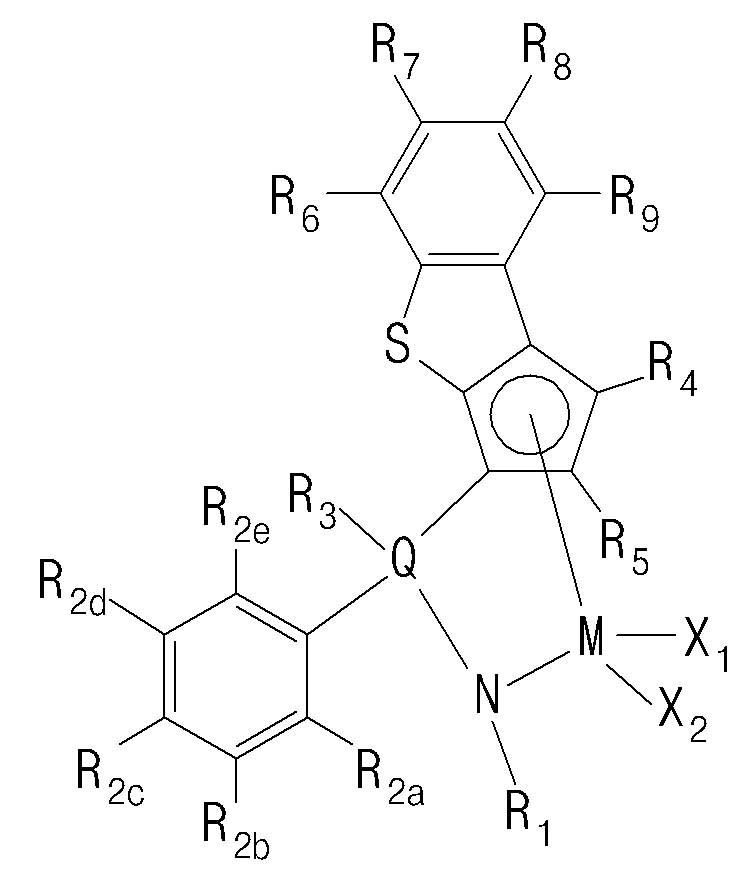
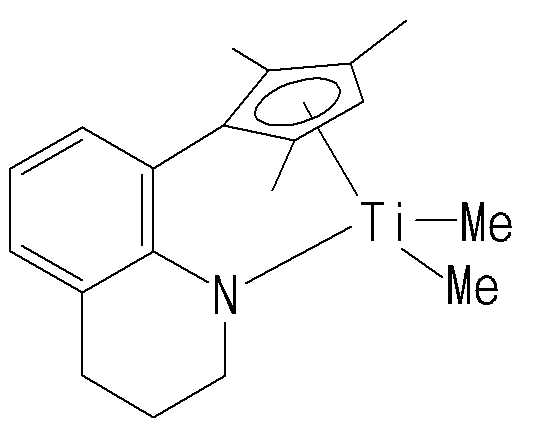
- Another embodiment of the present invention includes the step of polymerizing ethylene and alpha-olefin-based monomers by introducing hydrogen at 5 to 100 cc / min in the presence of a catalyst composition comprising a transition metal compound of Formula 1
- a catalyst composition comprising a transition metal compound of Formula 1
- R 1 is hydrogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C1-20 alkoxy; C6-20 aryl; C7-20 arylalkoxy; C7-20 alkylaryl; Or C7-20 arylalkyl,
- R 2a to R 2e are each independently hydrogen; halogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C1-20 alkoxy; Or C6-20 aryl,
- R 3 is hydrogen; halogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C6-20 aryl; C6-20 alkylaryl; C7-20 arylalkyl; C1-20 alkyl amido; C6-20 aryl amido; C1-20 alkylidene; Or phenyl substituted with one or more selected from the group consisting of halogen, C1-20 alkyl, C3-20 cycloalkyl, C2-20 alkenyl, C1-20 alkoxy and C6-20 aryl,
- R 4 to R 9 are each independently hydrogen; Silyl; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C6-20 aryl; C7-20 alkylaryl; C7-20 arylalkyl; Or a metalloid radical of a Group 14 metal substituted with C 1-20 hydrocarbyl; Two or more adjacent to each other of the R 6 to R 9 may be connected to each other to form a ring,
- Q is Si, C, N, P or S
- M is a Group 4 transition metal
- X 1 and X 2 are each independently hydrogen; halogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C6-20 aryl; C7-20 alkylaryl; C7-20 arylalkyl; C1-20 alkylamino; C6-20 arylamino; Or C1-20 alkylidene.
- Another embodiment of the present invention provides a resin composition for an optical film comprising the ethylene / alpha-olefin copolymer.
- Another embodiment of the present invention provides an optical film including the resin composition.
- the ethylene / alpha-olefin copolymers of the present invention have a narrower molecular weight distribution compared to the prior art, and exhibit excellent crosslinking properties by the vinyl content in the polymer meeting a certain ratio relative to the total unsaturated functional groups.
- the ethylene / alpha-olefin copolymer of the present invention when applied as a resin composition for an optical film, optical properties such as yellow index (YI) and total light transmittance (Tt) are excellent. Therefore, the ethylene / alpha-olefin copolymer of the present invention can be usefully applied to the production of a resin composition for an optical film which requires excellent optical properties.
- YI yellow index
- Tt total light transmittance
- Figure 1 shows the molecular weight distribution diagram of Example 2 and Comparative Example 1 as an embodiment of the present invention.
- Figure 2 shows the crosslinking behavior of Example 1 and Comparative Example 1 according to the crosslinking recipe (a) as an embodiment of the present invention.
- Figure 3 shows the crosslinking behavior of Example 2 and Comparative Example 1 according to the crosslinking recipe (b) as an embodiment of the present invention.
- composition includes a mixture of materials comprising the composition as well as reaction and decomposition products formed from the material of the composition.
- polymer refers to a polymer compound prepared by polymerizing monomers, whether of the same or a different kind.
- the generic term polymer thus encompasses the term homopolymers commonly used to refer to polymers made from only one monomer, and the term interpolymer as defined below.
- interpolymer refers to a polymer prepared by the polymerization of at least two different monomers.
- generic term interpolymer includes copolymers commonly used to refer to polymers made from two different monomers, and polymers made from two or more different monomers.
- Ethylene / alpha-olefin copolymers according to one embodiment of the present invention satisfy the following conditions (a) to (d):
- N vd , N tv , N vl, and N v are each vinylidene, trivinyl, vinylene, and vinyl per 1000 carbon atoms measured through nuclear magnetic spectroscopic analysis. vinyl) means the number of functional groups.
- the present invention uses a catalyst as described below, by introducing an optimum amount of hydrogen during polymerization to simultaneously satisfy the conditions of (a) to (d), thereby physical properties, in particular crosslinking properties of the ethylene / alpha olefin copolymer Can be greatly improved.
- the ethylene / alpha-olefin copolymer of the present invention is a polymer having a low density in the range of 0.850 to 0.910 g / cc, as measured according to ASTM D-792.
- the density may be 0.850 g / cc or more, or 0.855 g / cc or more, or 0.86 g / cc or more, or 0.865 or more, 0.91 g / cc or less, or 0.90 g / cc or less, or 0.89 g / cc It may be:
- the density of the olefin polymer is affected by the type and content of the monomers used in the polymerization, the degree of polymerization, etc., and in the case of the copolymer, the effect of the comonomer is large, and the higher the content of the comonomer, the lower the density of ethylene / alpha- Olefin copolymers can be prepared and the amount by which comonomers can be introduced into the copolymer can depend on the copolymerizability of the catalyst, ie the properties of the catalyst.
- the ethylene / alpha-olefin copolymer according to one embodiment of the present invention may have a low density as described above, and as a result may exhibit excellent processability. More specifically, the ethylene / alpha-olefin copolymer may have a density of 0.850 to 0.910 g / cc, in which case the effect of maintaining mechanical properties and improving the impact strength by the density control is more remarkable.
- the ethylene / alpha-olefin copolymers of the present invention have a narrow molecular weight distribution (MWD) in the range of 1.5 to 3.0.
- the molecular weight distribution may be at least 1.6, or at least 1.7, or at least 1.8, and may be at most 2.7, or at most 2.4, or at most 2.2.
- MWD molecular weight distribution
- impact strength, mechanical properties, and the like decrease, and a blocking phenomenon occurs.
- the present invention by introducing an optimum amount of hydrogen during the polymerization reaction, the molecular weight and molecular weight distribution of the produced ethylene / alpha -olefin copolymer is reduced, and as a result, the crosslinking properties, impact strength, mechanical properties and the like are improved.
- the weight average molecular weight (Mw) and the number average molecular weight (Mn) are polystyrene equivalent molecular weights analyzed by gel permeation chromatography (GPC), and the molecular weight distribution is based on the ratio of Mw / Mn. Can be calculated.
- the ethylene / alpha-olefin copolymer according to one embodiment of the present invention may be a polymer having a weight average molecular weight (Mw) of 40,000 to 150,000 g / mol. More specifically, the weight average molecular weight may be 45,000 g / mol or more, or 49,000 g / mol or more, or 52,000 g / mol or more, and may be 130,000 g / mol or less, or 90,000 g / mol or less, or 65,000 g / mol or less. have.
- Mw weight average molecular weight
- the ethylene / alpha-olefin copolymer of the present invention has a melt index (Melt Index, MI, 190 ° C., 2.16 kg loading conditions) in the range of 0.1 to 100 dg / min.
- the ethylene / alpha-olefin copolymer of the present invention has a melt index (MI) of at least 1 dg / min, or at least 1.5 dg / min, or at least 3 dg / min, or at least 5 dg / min, or 12 or at least dg / min, or at least 16 dg / min, and at most 90 dg / min, or at most 70 dg / min, or at most 40 dg / min, or at most 37 dg / min, or at most 35 dg / min.
- MI melt index
- the ethylene / alpha-olefin copolymer may have a melt index in the range of 5 to 230 dg / min (measured at 190 ° C and 10 kg load conditions by Melt Index, MI, ASTM D1238).
- the ethylene / alpha-olefin copolymer has a MI 10 / MI 2.16 value of 8.5 or less, or 7.9 or less, which is a melt index (190 ° C., 10 kg load condition) to a melt index (190 ° C., 2.16 kg load condition). Or 7.5 or less, and 5.0 or more, or 5.5 or more, or 6.0 or more.
- MI 10 / MI 2.16 is an index of the long chain branching degree of the copolymer, and if the MI 10 / MI 2.16 value is 8.5 or less, it means that the long chain branching is small.
- weight average molecular weight and the melt index to satisfy the above range may be suitable to be applied to the resin composition for an optical film.
- the mechanical properties and impact strength of the ethylene / alpha-olefin copolymer can be controlled by controlling the amount of catalyst used together with the type of catalyst used in the polymerization process, and by satisfying the above conditions, it is possible to improve while maintaining excellent mechanical properties. Exhibited processability.
- the ethylene / alpha-olefin copolymer of the present invention is characterized in that the vinyl group content per 1000 carbon atoms in the copolymer is controlled within a certain range.
- the ethylene / alpha-olefin copolymer of the present invention has an R v value of 0.18 or more and 0.59 or less according to the following formula (1).
- R v is the ratio of the number of vinyl groups to the number of functional groups per 1000 carbon atoms measured by nuclear magnetic spectroscopic analysis.
- the ethylene / alpha-olefin copolymer of the present invention may have an R vd value of 0.25 or less according to the following formula (2).
- R vd is the ratio of the number of vinylidene groups to the number of functional groups per 1000 carbon atoms measured by nuclear magnetic spectroscopic analysis.
- N vd , N tv , N vl and N v are vinylidene, trivinyl, vinylene, and vinylidene per 1,000 carbon atoms, respectively, measured by nuclear magnetic spectroscopic analysis. It means the number of vinyl functional groups.
- the R v value may be 0.55 or less, or 0.50 or less, or 0.46 or less, or 0.40 or less, or 0.39 or less, or 0.35 or less, or 0.32 or less, or 0.30 or less, or 0.29 or less, 0.19 or more, or Or 0.22 or more, or 0.24 or more.
- the content of the vinyl group in the copolymer is possible through the control of the polymerization temperature and the hydrogen input amount during manufacture, when the ethylene / alpha-olefin copolymer according to the present invention satisfies the vinyl group content, by using the resin composition for an optical film When applied to it can exhibit excellent degree of crosslinking and / or optical properties.
- the R vd value may be 0.25 or less, or 0.22 or less, or 0.20 or less, or 0.15 or less, or 0.10 or less, or 0.09 or less, or 0.08 or less, or 0.07 or less, or 0.06 or less, 0.02 or more, or 0.03 or more, or 0.04 or more.
- the vinylidene group content may exhibit narrow molecular weight distribution, excellent crosslinking properties, and optical properties accordingly.
- the ethylene / alpha-olefin copolymer of the present invention is characterized in that the trivinyl content per 1000 carbon atoms in the copolymer is controlled at a certain ratio or more.
- the ethylene / alpha-olefin copolymer of the present invention may have an Rtv value of 0.12 or more according to Equation 3 below.
- Rtv is a ratio of the number of trivinyl groups to the number of functional groups per 1000 carbon atoms measured by nuclear magnetic spectroscopic analysis.
- the content of trivinyl in the copolymer is possible through control of the polymerization temperature and the hydrogen input amount in the preparation.
- the double bond in the copolymer binds to the radicals generated by the crosslinking agent to activate the crosslinking reaction, and the crosslinking properties are excellent as the ratio of the number of trivinyl groups to the number of functional groups per 1000 carbon atoms is higher than a certain ratio.
- the ethylene / alpha-olefin copolymer according to the present invention may exhibit a narrow molecular weight distribution, excellent crosslinking properties and thus optical properties by maintaining the trivinyl content above a certain ratio as described above.
- the Rtv value may be at least 0.08, or at least 0.10, or at least 0.12, or at least 0.15, and may be at most 0.30, at most 0.29, or at most 0.27, or at most 0.26, or at most 0.25.
- the trivinyl content satisfies the numerical range, it may exhibit narrow molecular weight distribution, excellent crosslinking properties, and thus optical properties.
- the ethylene / alpha-olefin copolymer of the present invention is capable of satisfying the R v value, R vd value and / or Rtv value and at the same time the unsaturated functional group comprising vinyl, trivinyl, vinylene and vinylidene in the copolymer. It is preferable that the number is 0.65 or less per 1000 carbon atoms. Specifically, 0.6 or less, or 0.5 or less, or 0.45 or less, or 0.4 or less, and 0.1 or more, or 0.15 or more, or 0.2 or more, or 0.23 or more. When the number of the unsaturated functional groups satisfies the numerical range, it may exhibit a narrow molecular weight distribution, excellent crosslinking properties and thus optical properties.
- the number of vinyl functional groups in the copolymer may be 0.3 or less per 1000 carbon atoms. Specifically 0.29 or less, or 0.25 or less, or 0.2 or less, or 0.15 or less, or 0.1 or less, 0.01 or more, or 0.02 or more, or 0.04 or more, or 0.06 or more.
- the number of the unsaturated functional groups satisfies the numerical range, it may exhibit a narrow molecular weight distribution, excellent crosslinking properties and thus optical properties.
- the number of vinylene functional groups in the copolymer is 0.3 or less, or 0.29 or less, or 0.25 or less, or 0.2 or less, or 0.15 or less, or 0.1 or less, 0.01 or more, or 1000 carbon atoms. Or 0.02 or more, or 0.04 or more, or 0.06 or more.
- the number of the unsaturated functional groups satisfies the numerical range, it may exhibit a narrow molecular weight distribution, excellent crosslinking properties and thus optical properties.
- the number of vinylidene functional groups in the copolymer may be 0.07 or less, or 0.05 or less, 1,000 or more, or 0.02 or more per 1000 carbon atoms.
- the number of the unsaturated functional groups satisfies the numerical range, it may exhibit a narrow molecular weight distribution, excellent crosslinking properties and thus optical properties.
- the number of trivinyl functional groups in the copolymer may be 0.15 or less, or 0.1 or less, or 0.08 or less, 0.01 or more, or 0.02 or more per 1000 carbon atoms.
- the number of the unsaturated functional groups satisfies the numerical range, it may exhibit a narrow molecular weight distribution, excellent crosslinking properties and thus optical properties.
- R, R 'and R may each independently be branched chains according to alpha-olefins which are polymer chains or comonomers.
- the content of each of vinyl, vinylidene, vinylene and trivinyl in the copolymer can be calculated from the results of NMR analysis.
- the copolymer may be dissolved in 1,1,2,2-tetrachloroethane D2 (TCE-d2) solvent and then measured using a Bruker AVANCE III 500 MHz NMR instrument at 393K.
- TCE-d2 peak is corrected to 6.0 ppm in the 1 H NMR spectrum, and the content ratio of the comonomer is calculated using the integrated values of 1.4 ppm and 0.96 ppm.
- the ethylene / alpha-olefin copolymer according to one embodiment of the present invention may have a crystallization temperature (Tc) of 35 ° C to 80 ° C. More specifically, the crystallization temperature may be 40 ° C or more, or 45 ° C or more, 75 ° C or less, or 70 ° C or less, or 65 ° C or less.
- Tc crystallization temperature
- This high crystallization temperature is due to the uniform distribution of comonomers in the ethylene / alpha-olefin copolymer, and can exhibit excellent structural stability by having the above temperature range.
- the ethylene / alpha-olefin copolymer according to one embodiment of the present invention may have a melting temperature (Tm) of 50 to 110 ° C. More specifically, the melting temperature may be 55 ° C or higher, or 60 ° C or higher, or 70 ° C or higher, and may be 110 ° C or lower, or 105 ° C or lower, or 95 ° C or lower. By having a melting temperature of such a temperature range it can exhibit excellent thermal stability.
- Tm melting temperature
- the crystallization temperature and the melting temperature of the ethylene / alpha-olefin copolymer can be measured using a differential scanning calorimeter (DSC). Specifically, the copolymer is heated to 150 ° C and then maintained for 5 minutes, lowered again to 20 ° C and then increased again. At this time, the rising rate and the falling rate of the temperature are respectively adjusted to 10 °C / min, the second temperature is measured in the section of the rising temperature to the melting temperature, and the result measured in the section appearing while reducing the temperature is the crystallization temperature.
- DSC differential scanning calorimeter
- the alpha-olefin monomer as a comonomer is C4-20 It may be an olefin monomer.
- Specific examples include propylene, 1-butene, 1-pentene, 4-methyl-1-pentene, 1-hexene, 1-heptene, 1-octene, 1-decene, 1-undecene, 1-dodecene, 1-tetra Decene, 1-hexadecene, or 1-eicosene, and the like, and one of these alone or a mixture of two or more thereof may be used.
- the alpha-olefin monomer may be 1-butene, 1-hexene or 1-octene, and most preferably 1-butene, considering that the improvement effect is remarkable when applied to the resin composition for an optical film. .
- the content of the comonomer alpha-olefin may be appropriately selected within a range that satisfies the above physical property requirements, specifically, greater than 0 and 99 mol% or less, or It may be 10 to 50 mol%.
- the ethylene comprising the step of polymerizing ethylene and alpha-olefin-based monomer by adding hydrogen at 5 to 100 cc / min in the presence of a catalyst composition comprising a transition metal compound of Formula 1
- a catalyst composition comprising a transition metal compound of Formula 1
- R 1 is hydrogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C1-20 alkoxy; C6-20 aryl; C7-20 arylalkoxy; C7-20 alkylaryl; Or C7-20 arylalkyl,
- R 2a to R 2e are each independently hydrogen; halogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C1-20 alkoxy; Or C6-20 aryl,
- R 3 is hydrogen; halogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C6-20 aryl; C6-20 alkylaryl; C7-20 arylalkyl; C1-20 alkyl amido; C6-20 aryl amido; C1-20 alkylidene; Or phenyl substituted with one or more selected from the group consisting of halogen, C1-20 alkyl, C3-20 cycloalkyl, C2-20 alkenyl, C1-20 alkoxy and C6-20 aryl,
- R 4 to R 9 are each independently hydrogen; Silyl; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C6-20 aryl; C7-20 alkylaryl; C7-20 arylalkyl; Or a metalloid radical of a Group 14 metal substituted with C 1-20 hydrocarbyl; Two or more adjacent to each other of the R 6 to R 9 may be connected to each other to form a ring,
- Q is Si, C, N, P or S
- M is a Group 4 transition metal
- X 1 and X 2 are each independently hydrogen; halogen; C1-20 alkyl; C3-20 cycloalkyl; C2-20 alkenyl; C6-20 aryl; C7-20 alkylaryl; C7-20 arylalkyl; C1-20 alkylamino; C6-20 arylamino; Or C1-20 alkylidene.
- R 1 is hydrogen; C1-20 alkyl; C3-20 cycloalkyl; C1-20 alkoxy; C6-20 aryl; C7-20 arylalkoxy; C7-20 alkylaryl; Or C7-20 arylalkyl,
- R 2a to R 2e are each independently hydrogen; halogen; C1-12 alkyl; C3-12 cycloalkyl; C2-12 alkenyl; C1-12 alkoxy; Or phenyl,
- R 3 is hydrogen; halogen; C1-12 alkyl; C3-12 cycloalkyl; C2-12 alkenyl; C6-20 aryl; C7-13 alkylaryl; C7-13 arylalkyl; Or phenyl substituted with one or more selected from the group consisting of halogen, C1-12 alkyl, C3-12 cycloalkyl, C2-12 alkenyl, C1-12 alkoxy and phenyl,
- R 4 to R 9 are each independently hydrogen; C1-20 alkyl; C3-20 cycloalkyl; C6-20 aryl; C7-20 alkylaryl; Or C7-20 arylalkyl,
- R 6 to R 9 Two or more adjacent to each other of R 6 to R 9 may be connected to each other to form an aliphatic ring of C 5-20 or an aromatic ring of C 6-20;
- the aliphatic ring or aromatic ring may be substituted with halogen, C1-20 alkyl, C2-12 alkenyl, or C6-12 aryl,
- Q may be Si
- M may be Ti
- X 1 and X 2 are each independently hydrogen; halogen; C1-12 alkyl; C3-12 cycloalkyl; C2-12 alkenyl; C6-12 aryl; C7-13 alkylaryl; C7-13 arylalkyl; C1-C13 alkylamino; C6-12 arylamino; Or C1-12 alkylidene.
- R 1 is hydrogen; C1-12 alkyl; C3-12 cycloalkyl; C1-12 alkoxy; C6-12 aryl; C7-13 arylalkoxy; C7-13 alkylaryl; Or C7-13 arylalkyl,
- R 2a to R 2e are each independently hydrogen; halogen; C1-12 alkyl; C3-12 cycloalkyl; C2-12 alkenyl; C1-12 alkoxy; Or phenyl,
- R 3 is hydrogen; halogen; C1-12 alkyl; C3-12 cycloalkyl; C2-12 alkenyl; C7-13 alkylaryl; C7-13 arylalkyl; Phenyl; Or phenyl substituted with one or more selected from the group consisting of halogen, C1-12 alkyl, C3-12 cycloalkyl, C2-12 alkenyl, C1-12 alkoxy and phenyl,
- R 4 to R 9 are each independently hydrogen; C1-12 alkyl; C3-12 cycloalkyl; C6-12 aryl; C7-13 alkylaryl; Or C7-13 arylalkyl,
- R 6 to R 9 Two or more adjacent to each other of R 6 to R 9 may be connected to each other to form an aliphatic ring of C 5-12 or an aromatic ring of C 6-12;
- the aliphatic ring or aromatic ring may be substituted with halogen, C1-12 alkyl, C2-12 alkenyl, or C6-12 aryl,
- Q may be Si
- M may be Ti
- X 1 and X 2 are each independently hydrogen; halogen; C1-12 alkyl group; Or C2-12 alkenyl.
- R 1 may be hydrogen or C1-12 alkyl
- R 2a to R 2e are each independently hydrogen; C1-12 alkyl; Or C1-12 alkoxy,
- R 3 is hydrogen; C1-12 alkyl; Or phenyl,
- R 4 and R 5 are each independently hydrogen; Or C1-12 alkyl,
- R 6 to R 9 may be each independently hydrogen or methyl
- Q may be Si
- M may be Ti
- X 1 and X 2 may be each independently hydrogen or C1-12 alkyl.
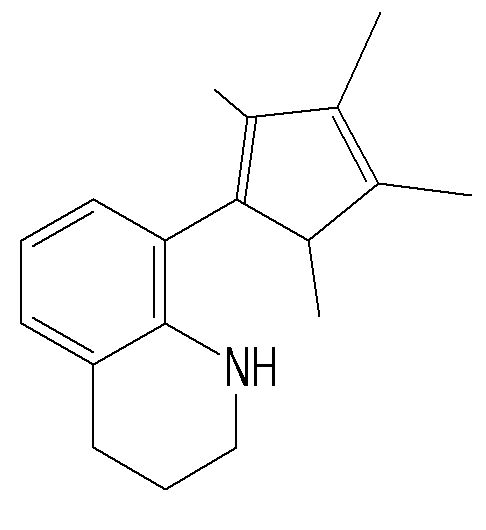
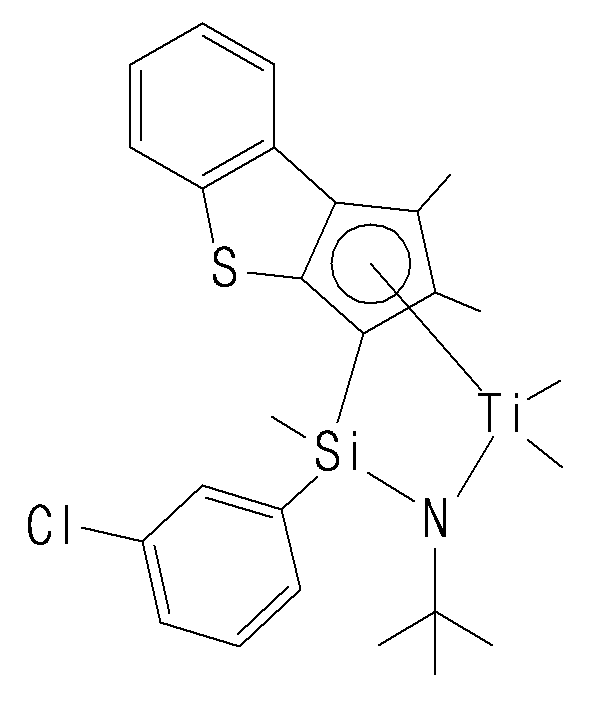
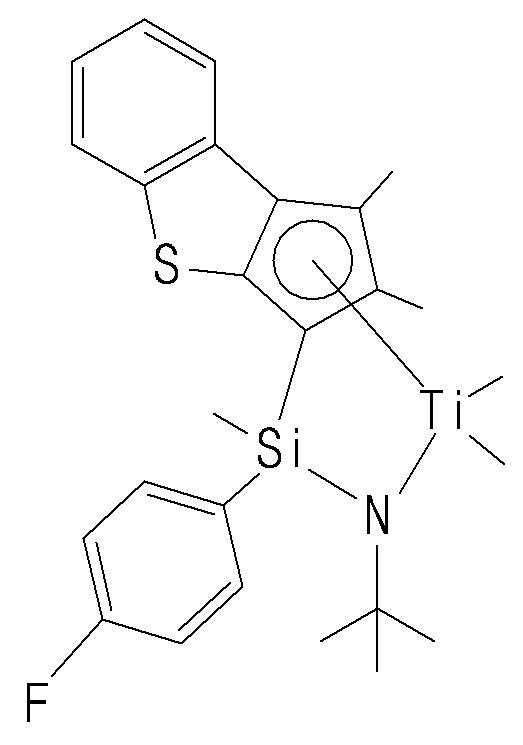
- transition metal compound of Formula 1 cyclopentadiene fused with benzothiophene by cyclic bond, and amido group (NR 1 ) are stably crosslinked by Q (Si, C, N or P), Group 4 transition metals form a coordinated structure.
- Q Si, C, N or P
- the transition metal compound of Formula 1 has a structure in which a substituted or unsubstituted phenyl group is bonded to Q in the amido group (NR 1 ) is crosslinked by Q (Si, C, N, P), It can be more stably crosslinked and can have excellent electronic stability when coordinating with a transition metal.
- the transition metal compound described above by introducing hydrogen in an optimized content during the polymerization reaction, it is possible to provide an ethylene / alpha -olefin copolymer having a narrow molecular weight distribution and excellent crosslinking properties, the transition Due to the electronic / structural stability of the metal compounds, the incorporation of hydrogen is advantageous.
- the initial molecular weight of the polymer formed by the catalyst addition before hydrogen injection is high, it is also possible to produce a product having a high molecular weight while having a narrow molecular weight distribution after hydrogen injection.
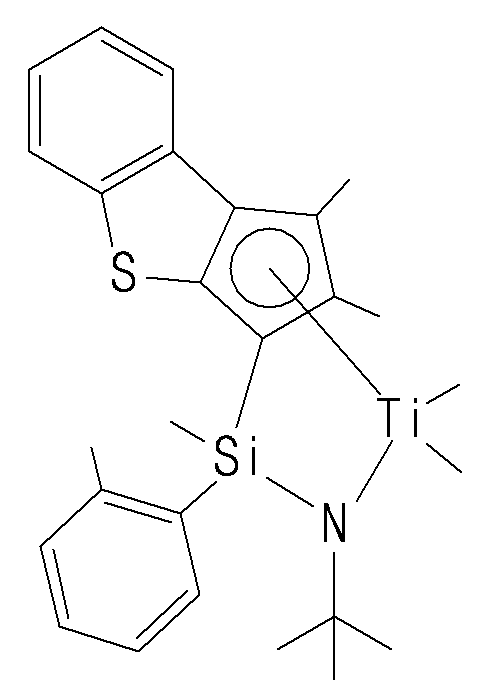
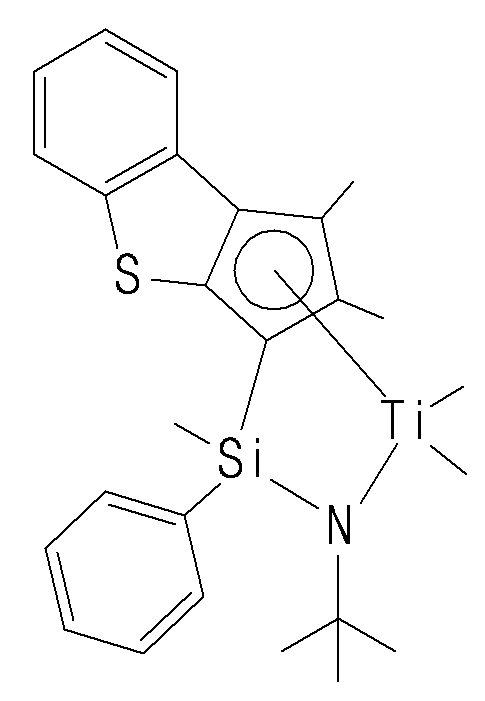
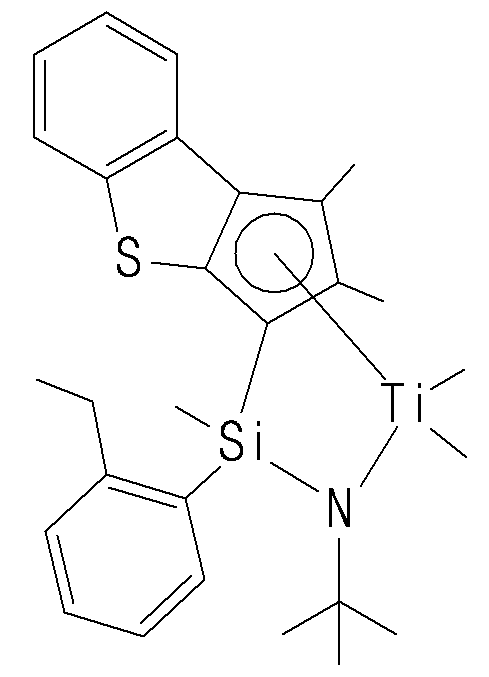
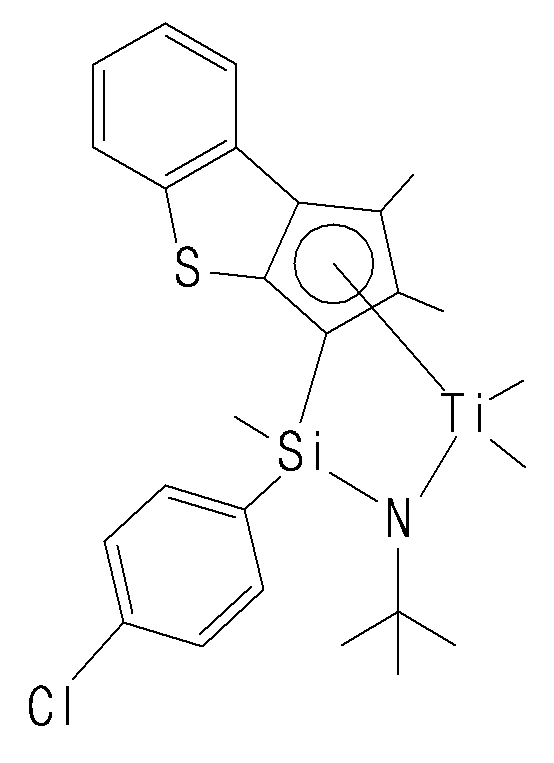
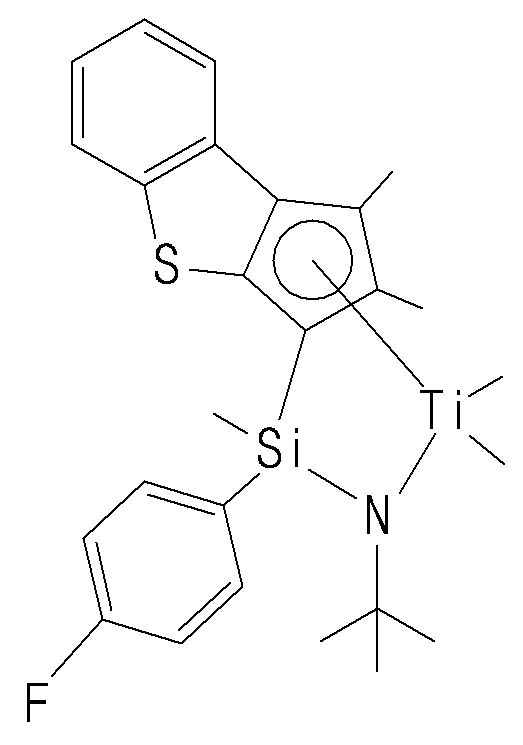
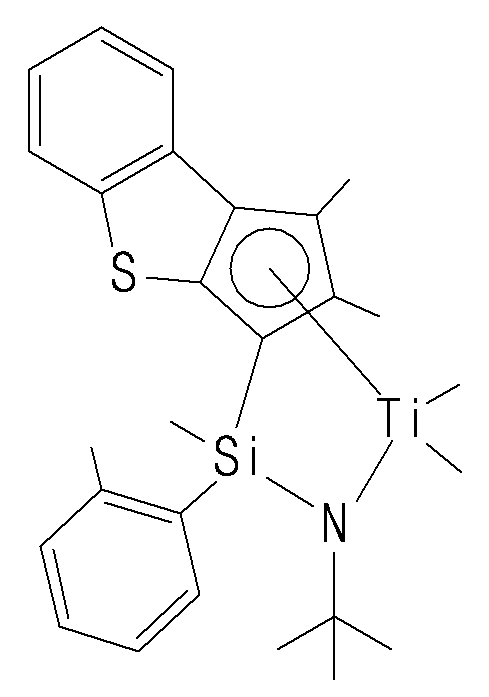
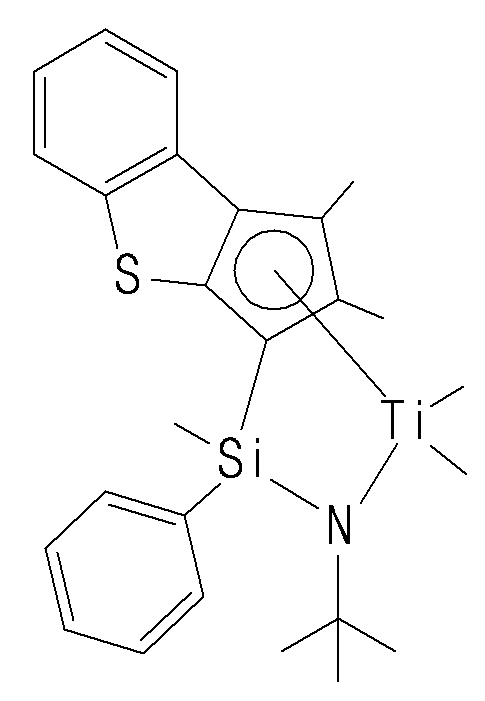
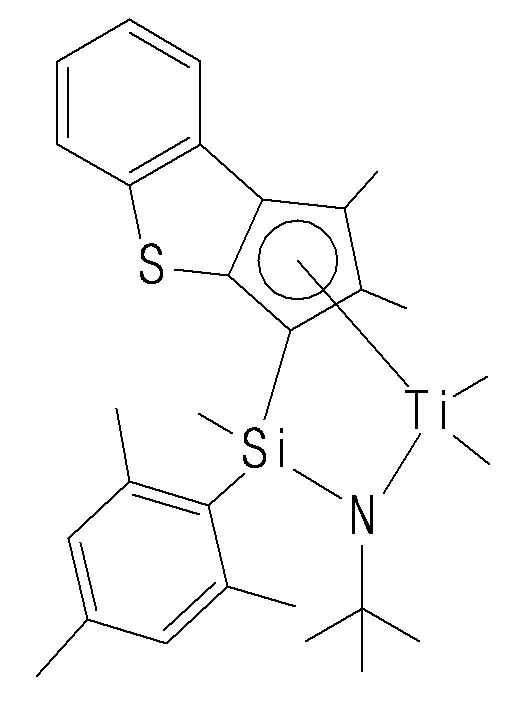
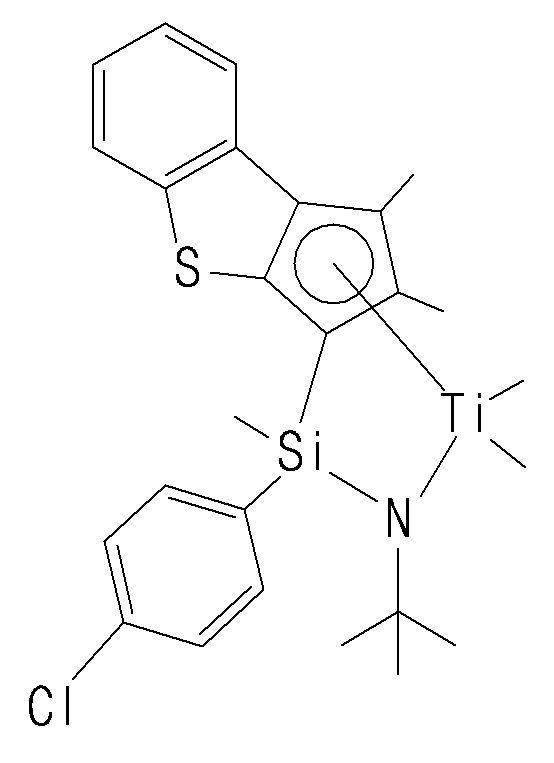
- the compound represented by Chemical Formula 1 may specifically be any one of compounds represented by the following chemical formulas.
- the catalyst composition may further include a promoter for activating the transition metal compound of Chemical Formula 1.
- the promoter is an organometallic compound including a Group 13 metal, and specifically, may include one or more of a compound of Formula 2, a compound of Formula 3, and a compound of Formula 4.
- R 41 , R 42 and R 43 are each independently hydrogen, halogen, a hydrocarbyl group having 1 to 20 carbon atoms and a hydrocarbyl group having 1 to 20 carbon atoms substituted with halogen,
- n is an integer of 2 or more
- D is aluminum or boron
- Each R 44 is independently a halogen, a hydrocarbyl group having 1 to 20 carbon atoms, and a hydrocarbyl group having 1 to 20 carbon atoms substituted with halogen,
- L is a neutral or cationic Lewis base
- H is a hydrogen atom
- Z is a Group 13 element, A each independently represent a hydrocarbyl group having 1 to 20 carbon atoms; Hydrocarbyloxy group having 1 to 20 carbon atoms; And one or more hydrogen atoms of these substituents are substituted with one or more substituents of halogen, a hydrocarbyloxy group having 1 to 20 carbon atoms, and a hydrocarbylsilyl group having 1 to 20 carbon atoms.
- the compound of Formula 2 may be an alkylaluminoxane compound having a repeating unit bonded in a linear, circular, or reticular form.
- alkylaluminoxane compound having a repeating unit bonded in a linear, circular, or reticular form.
- specific examples thereof include methylaluminoxane (MAO), ethylaluminoxane, isobutylaluminoxane or tert-butyl aluminoxane, etc. are mentioned.
- specific examples of the compound of Formula 3 may include trimethylaluminum, triethylaluminum, triisobutylaluminum, tripropylaluminum, tributylaluminum, dimethylchloroaluminum, triisopropylaluminum, tri-s-butylaluminum, tricyclo Pentyl aluminum, tripentyl aluminum, triisopentyl aluminum, trihexyl aluminum, trioctyl aluminum, ethyl dimethyl aluminum, methyl diethyl aluminum, triphenyl aluminum, tri-p-tolyl aluminum, dimethyl aluminum methoxide, dimethyl aluminum ethoxide , Trimethylboron, triethylboron, triisobutylboron, tripropylboron or tributylboron, and the like, in particular, may be selected from trimethylaluminum, triethylaluminum or triisobutylaluminum.
- the compound of Formula 4 may include a borate compound in the form of a trisubstituted ammonium salt, or a dialkyl ammonium salt, a trisubstituted phosphonium salt. More specific examples include trimetalammonium tetraphenylborate, methyldioctadecylammonium tetraphenylborate, triethylammonium tetraphenylborate, tripropylammonium tetraphenylborate, tri (n-butyl) ammonium tetraphenylborate, methyltetracyclo Octadecylammonium tetraphenylborate, N, N-dimethylaninynium tetraphenylborate, N, N-diethylaninynium tetraphenylborate, N, N-dimethyl (2,4,6-trimethylaninium) tetraphenylborate
- the polymerization activity can be improved while the molecular weight distribution of the finally prepared ethylene / alpha-olefin copolymer becomes more uniform.
- the promoter may be used in an appropriate amount so that the activation of the transition metal compound of Formula 1 may proceed sufficiently.
- the catalyst composition may include the transition metal compound of Formula 1 supported on a carrier.
- the weight ratio of the transition metal compound to the carrier may be 1:10 to 1: 1,000, more specifically 1:10 to 1: 500.
- the carrier and the transition metal compound are included in the above-mentioned ratio of rain, the optimum shape can be exhibited.
- the weight ratio of the promoter to the carrier may be 1: 1 to 1: 100, more specifically 1: 1 to 1:50.
- the carrier silica, alumina, magnesia, or a mixture thereof may be used, or by drying the material at a high temperature to remove moisture on the surface, in a state containing a highly reactive hydroxyl group or siloxane group on the surface. May be used.
- the high temperature dried carriers may further include oxides, carbonates, sulfates, or nitrates, such as Na 2 O, K 2 CO 3 , BaSO 4, and Mg (NO 3 ) 2 .
- the amount of hydroxy groups on the surface of the carrier is preferably 0.1 to 10 mmol / g, more preferably 0.5 to 5 mmol / g.
- the amount of hydroxyl groups on the surface of the carrier can be controlled by the method and conditions for preparing the carrier or by drying conditions such as temperature, time, vacuum or spray drying.
- the polymerization of the ethylene / alpha-olefin copolymer may be performed by continuously adding hydrogen in the presence of the catalyst composition described above and continuously polymerizing ethylene and alpha-olefin monomers.
- the hydrogen gas serves to suppress the rapid reaction of the transition metal compound in the initial stage of polymerization, and to terminate the polymerization reaction. Accordingly, by controlling the use and usage of such hydrogen gas, an ethylene / alpha-olefin copolymer having a narrow molecular weight distribution and having a vinyl group content in the copolymer controlled within a certain range can be effectively produced.
- the hydrogen gas may be at least 5 cc / min, or at least 7 cc / min, or at least 10 cc / min, or at least 15 cc / min, or at least 19 cc / min, or at least 22 cc / min, , Up to 100 cc / min, or up to 50 cc / min, or up to 45 cc / min, or up to 35 cc / min, or up to 29 cc / min.
- the produced ethylene / alpha-olefin polymer can realize the physical properties in the present invention.
- the polymerization reaction may be carried out at 80 to 200 °C, it is possible to more easily control the vinyl group content in the ethylene / alpha -olefin copolymer by controlling the polymerization temperature with the hydrogen input amount described above.
- the polymerization reaction temperature may be 100 ° C. or higher, or 120 ° C. or higher, or 140 ° C. or higher, and may be 190 ° C. or lower, or 180 ° C. or lower, or 170 ° C. or lower, or 160 ° C. or lower.
- an organoaluminum compound for removing water in the reactor may be further added, and the polymerization reaction may proceed in the presence thereof.
- organoaluminum compounds include trialkylaluminum, dialkyl aluminum halides, alkyl aluminum dihalides, aluminum dialkyl hydrides or alkyl aluminum sesqui halides, and more specific examples thereof include Al (C 2).
- Such organoaluminum compounds may be continuously added to the reactor and may be added at a rate of about 0.1 to 10 moles per kilogram of reaction medium introduced to the reactor for proper water removal.
- the polymerization pressure may be about 1 to about 100 Kgf / cm 2 , preferably about 70 to about 96 Kgf / cm 2 , more preferably about 80 to about 93 Kgf / cm 2 .
- the transition metal compound when used in a form supported on a carrier, the transition metal compound may be an aliphatic hydrocarbon solvent having 5 to 12 carbon atoms, such as pentane, hexane, heptane, nonane, decane, and isomers thereof, toluene and benzene.
- Aromatic hydrocarbon solvents such as dichloromethane, hydrocarbon solvents substituted with chlorine atoms such as chlorobenzene may be dissolved or diluted and added.
- the solvent used herein is preferably used by removing a small amount of water, air, or the like acting as a catalyst poison by treating a small amount of alkyl aluminum, and may be carried out by further using a promoter.
- the resin composition for an optical film of the present invention can exhibit excellent degree of crosslinking.
- the degree of crosslinking of the resin composition for an optical film may be 55% or more, or 58% or more, or 63% or more, or 67% or more, or 69% or more.
- the resin composition for an optical film of the present invention may have a glass transition temperature of -55 ° C to -45 ° C, or -53 ° C to -42 ° C, or -50 ° C to -40 ° C.
- the yellow index (YI) and the total light transmittance (Tt) were measured before and after crosslinking of the ethylene / alpha olefin copolymer, respectively, and after crosslinking, the yellow index (YI) and total light transmittance (Tt) were measured. ) May satisfy a range suitable for use in an optical film.
- the Yellowness Index (Yellow) value of the resin composition for an optical film of the present invention may be 0.5 or more, or 1.0 or more, or 1.25 or more, or 1.30 or more, 5.5 or less, or 4.9 or less, or 4.5. Or 3.9 or less, or 2.9 or less, or 1.5 or less, or 1.2 or less. The smaller the YI value, the more correct the quality stability of the optical film.
- the yellow index after the crosslinking may be 0.5 or more, or 0.7 or more, or 0.9 or more, or 1.0 or more, and 1.5 or less, or 1.48 or less, or 1.3 or less, or 1.2 or less.
- the yellow index is a value quantifying the yellowing phenomenon of the resin composition when exposed to ultraviolet rays, and may be measured using a UV / Vis spectrometer in accordance with ASTM D1925. For example, by using the UV / Vis spectrometer, the reflectance of the wavelength range of 400 nm to 700 nm of the resin composition may be measured, and the yellow index value may be calculated by using Equation 4 below.
- Equation 4 YI is a value calculated using a color difference analysis program in a UV / VIS / NIR spectrometer, and XCIE, YCIE, and ZCIE are relative values represented by red, green, and blue color coordinates, respectively.
- the resin composition for an optical film of the present invention may have excellent light transmittance.
- the total light transmittance (Tt) measured by a haze meter after crosslinking the sheet-shaped resin composition at a temperature of 150 ° C may satisfy the following Equation 5.
- the total light transmittance of the resin composition for an optical film of the present invention has a value measured after crosslinking the sheet-shaped resin composition at a temperature of 150 ° C of 90% or more, or 90.2% or more, or 90.5% or more, or 90.9% or more, or At least 91%, or at least 92%.
- it can be adjusted to have a total light transmittance in the above-described range.
- a modified resin composition for example, a silane modified resin composition or an amino silane modified resin composition, can be manufactured using the resin composition for optical films of this invention.
- the resin composition for an optical film of the present invention may further include a known unsaturated silane compound, an amino silane compound, a crosslinking agent and a crosslinking aid in addition to the ethylene / alpha-olefin copolymer of the present invention.
- the unsaturated silane compound may be included in a polymerized form in a silane-modified resin composition or an amino silane-modified resin composition by being grafted to a main chain including a polymerized unit of a monomer of the copolymer of the present invention in the presence of a radical initiator or the like.
- the unsaturated silane compound may be vinyl trimethoxy silane, vinyl triethoxy silane, vinyl tripropoxy silane, vinyl triisopropoxy silane, vinyl tributoxy silane, vinyl tripentoxy silane, vinyl triphenoxy Silane, or vinyltriacetoxy silane, and the like, and as one example, vinyltrimethoxy silane or vinyltriethoxy silane may be used, but is not limited thereto.
- the amino silane compound may be a reactive functional group such as an alkoxy group of an unsaturated silane compound grafted on the main chain of the copolymer of the present invention, such as vinyltriethoxysilane, in the grafting modification step of the ethylene / alpha-olefin copolymer.
- an unsaturated silane compound grafted on the main chain of the copolymer of the present invention such as vinyltriethoxysilane
- the amino silane compound may also be involved as a reactant in the direct copolymerization reaction, thereby providing a moiety having an amine functional group in the amino silane-modified resin composition.
- the amino silane compound is not particularly limited as long as it is a amine compound containing an amine group and is a primary amine or a secondary amine.
- aminotrialkoxysilane, aminodiakoxysilane, etc. may be used as the amino silane compound, and examples thereof include 3-aminopropyltrimethoxysilane (APTMS) and 3-aminopropyltriethoxysilane.
- the content of the unsaturated silane compound and / or amino silane compound is not particularly limited.
- the crosslinking agent may act as a radical initiator in the preparation of the silane-modified resin composition to initiate a reaction in which the unsaturated silane compound is grafted to the resin composition.
- the heat resistance durability of the final product such as the encapsulant sheet, can be improved. have.
- crosslinking agent is a crosslinkable compound capable of initiating radical polymerization of the vinyl group or forming a crosslink
- various crosslinking agents known in the art may be variously used.
- organic peroxides and hydroperoxides may be used.
- one or two or more selected from the group consisting of azo compounds can be used.
- t-butyl cumyl peroxide di-t-butyl peroxide, di-cumyl peroxide, 2,5-dimethyl-2,5-di (t-butylperoxy) hexane, 2,5-dimethyl Dialkyl peroxides such as -2,5-di (t-butylperoxy) -3-hexine;
- Hydroperoxides such as cumene hydroperoxide, diisopropyl benzene hydroperoxide, 2,5-dimethyl-2,5-di (hydroperoxy) hexane and t-butylhydroperoxide;
- Diacyl peroxides such as bis-3,5,5-trimethylhexanoyl peroxide, octanoyl peroxide, benzoyl peroxide, o-methylbenzoyl peroxide, and 2,4-dichlorobenzoyl peroxide;
- the organic peroxide is 120 °C to 135 °C, for example, 120 °C to 130 °C, 120 °C? It may be an organic peroxide having a one-hour half-life temperature of to 125 °C, preferably 121 °C.
- the term "1 hour half-life temperature” means a temperature at which the half-life of the crosslinker is 1 hour. Depending on the one-hour half-life temperature, the temperature at which the radical initiation reaction occurs efficiently becomes different.
- the crosslinking agent is included in an amount of 0.01 to 1 parts by weight, for example, 0.05 to 0.55, 0.1 to 0.5 or 0.15 to 0.45 parts by weight, based on 100 parts by weight of the resin composition, when the crosslinking agent is included in less than 0.01 parts by weight,
- the effect of improving heat resistance is insignificant, and when included in an amount exceeding 1 part by weight, the moldability of the encapsulant sheet is reduced, which may cause a problem in the process, and may affect the physical properties of the encapsulant.
- the resin composition of this invention can contain a crosslinking adjuvant besides the said crosslinking agent.
- a crosslinking aid in the resin composition, it is possible to increase the degree of crosslinking between the resin compositions by the above-mentioned crosslinking agent, thereby further improving the heat resistance durability of the final product, for example, the encapsulant sheet.
- the crosslinking aid is included in an amount of 0.01 to 0.5 parts by weight, for example, 0.01 to 0.3, 0.015 to 0.2, or 0.016 to 0.16 parts by weight based on 100 parts by weight of the resin composition, when the crosslinking aid is included in less than 0.01 parts by weight.
- the effect of improving heat resistance is insignificant, and when it is included in an amount exceeding 0.5 parts by weight, problems affecting the physical properties of the final product such as the encapsulant sheet may occur and the production cost may increase.
- the crosslinking aid can be used a variety of crosslinking aids known in the art, for example, a compound containing at least one or more unsaturated groups such as allyl groups or (meth) acryloxy groups can be used as the crosslinking aid.
- the compound containing the allyl group may be exemplified by a polyallyl compound such as triallyl isocyanurate, triallyl cyanurate, diallyl phthalate, diallyl fumarate or diallyl maleate, for example.
- the compound containing a meta) acryloxy group is, for example, ethylene glycol diacrylate, ethylene glycol dimethacrylate, trimethylolpropane trimethacrylate, t-butyl 1- (2-ethylhexyl) monoperoxycarbonate ( TBEC), methacryloxypropyltrimethoxysilane (MEMO) and the like can be exemplified, but is not particularly limited thereto.
- the resin composition of this invention can further contain 1 or more types of additives chosen from a light stabilizer, a UV absorber, a heat stabilizer, etc. as needed.
- the light stabilizer may serve to prevent photooxidation by capturing the active species of the photodegradation start of the resin depending on the use to which the composition is applied.
- the kind of light stabilizer that can be used is not particularly limited, and for example, a known compound such as a hindered amine compound or a hindered piperidine compound can be used.
- the UV absorber may play a role of absorbing ultraviolet rays from sunlight or the like, converting them into harmless thermal energy in the molecule, and preventing the active species of photodegradation initiation in the resin composition from being excited.
- the specific kind of UV absorber that can be used is not particularly limited, and for example, inorganic UV such as benzophenone series, benzotriazole series, acrylonitrile series, metal complex salt system, hindered amine series, ultrafine titanium oxide or ultrafine zinc oxide, etc.
- One kind or a mixture of two or more kinds such as an absorbent may be used.
- heat stabilizer examples include tris (2,4-di-tert-butylphenyl) phosphite, bis [2,4-bis (1,1-dimethylethyl) -6-methylphenyl] ethyl ester phosphorous acid, tetra Keith (2,4-di-tert-butylphenyl) [1,1-biphenyl] -4,4'-diylbisphosphonate and bis (2,4-di-tert-butylphenyl) pentaerythritol diphosphite and the like Phosphorus-based heat stabilizer; Lactone-type heat stabilizers, such as the reaction product of 8-hydroxy-5,7-di-tert- butyl-furan-2-one and o-xylene, are mentioned 1 type, or 2 or more types can be used. have.
- the content of the light stabilizer, UV absorber and / or heat stabilizer is not particularly limited. That is, the content of the additive can be appropriately selected in consideration of the use of the resin composition, the shape and density of the additive, and the like, and is usually suitably within the range of 0.01 parts by weight to 5 parts by weight based on 100 parts by weight of the total solid content of the resin composition. Can be adjusted.
- the resin composition may further appropriately include various additives known in the art, depending on the use to which the resin component is applied.
- the resin composition for an optical film of the present invention may be used as an encapsulant encapsulating a device in various optoelectronic devices, but is not limited thereto.
- an industrial material applied to an elevated temperature lamination process, etc. can also be used as.
- Another embodiment of the present invention provides an optical film including the resin composition.
- the optical film of the present invention can be produced by molding the resin composition into a film or sheet shape.
- a molding method is not particularly limited, and may be produced by sheeting or filming, for example, by a conventional process such as a T die process or extrusion.
- the manufacturing of the optical film may be performed in an in situ process using an apparatus in which a modified resin composition using the resin composition and a filming or sheeting process are connected to each other.
- the thickness of the optical film may be adjusted to about 10 ⁇ m to 2,000 ⁇ m, or about 100 ⁇ m to 1250 ⁇ m in consideration of the support efficiency and the possibility of breakage of the device in the optoelectronic device, the weight reduction or workability of the device, etc. Therefore, it can be changed.
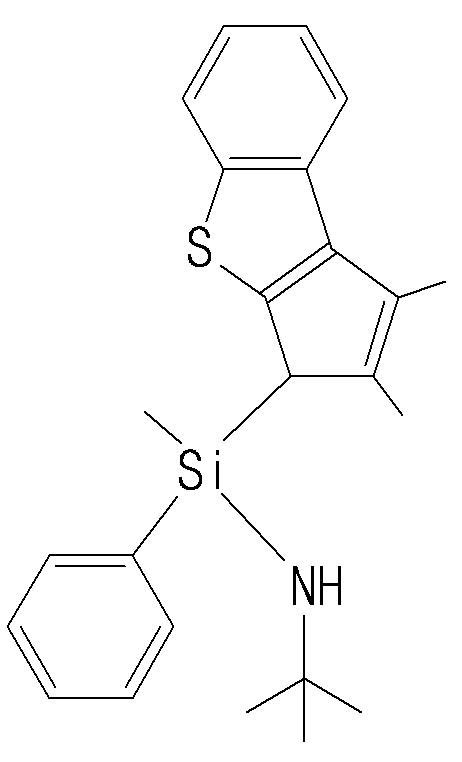
- the stirred Li-complex THF solution was cannulated in a Schlenk flask containing 8.1 mL (1.0 eq, 49.925 mmol) of dichloro (methyl) (phenyl) silane and 70 mL of THF and then stirred at room temperature overnight. After stirring and dried in vacuo, extracted with hexane 100 mL.
- 1,2,3,4-tetrahydroquinoline 13.08 g, 98.24 mmol
- diethyl ether 150 mL
- the Schlenk flask was immersed in a -78 ° C low temperature bath made of dry ice and acetone and stirred for 30 minutes.
- n-BuLi 39.3 mL, 2.5 M, 98.24 mmol
- the flask was heated to room temperature while removing the generated butane gas.
- the lithium carbamate compound (8.47 g, 42.60 mmol) prepared in step (i) was placed in a Schlenk flask. Subsequently, tetrahydrofuran (4.6 g, 63.9 mmol) and 45 mL of diethyl ether were added sequentially. The Schlenk flask was immersed in a -20 ° C. low temperature bath made of acetone and a small amount of dry ice, stirred for 30 minutes, and then t-BuLi (25.1 mL, 1.7 M, 42.60 mmol) was added thereto. At this time the color of the reaction mixture turned red. Stir for 6 hours while maintaining -20 ° C.
- the filtrate was transferred to a separatory funnel and hydrochloric acid (2 N, 80 mL) was added thereto, followed by shaking for 12 minutes. After neutralizing with saturated aqueous sodium hydrogen carbonate solution (160 mL), the organic layer was extracted. Anhydrous magnesium sulfate was added to this organic layer to remove water and filtered, and the filtrate was taken out and the solvent was removed. The obtained filtrate was purified by column chromatography using hexane and ethyl acetate (v / v, 10: 1) solvent to give a yellow oil. Yield 40%.
- LC Chemical's LC885X product was purchased, as a comparative example 2, a Mitsui DF8200 product was purchased, and as a comparative example 3, a Mitsui DF610 product was purchased and used.
- Example 4 0.87 5.5 0.8 20 0.075
- Example 5 0.87 5.5 0.8 20 0.25 0.04 140
- Example 6 0.87 5.5 0.7 22 0.075 0.5
- Example 7 0.87 5.5 0.7 22 0.25 0.04 140
- Example 8 0.87 5.5 0.85 24 0.25 0.375 155
- Example 9 0.87 5.5 0.8 10 0.25 0.375 148
- Example 10 0.87 5.5 0.8 10 0.25 0.375 146
- Example 13 0.87 5.5 0.85 24 0.25 0.375 161
- Example 13 0.87 5.5 0.85 24 0.25 0.375 172
- Example 14 0.87 7.0 0.83 16 0.17 0.34 140 Comparative Example 4 0.87 5.5 0.45 6 0.
- Examples 1 to 14 and Comparative Examples 1 to 7 The number of each functional group of vinylene, trivinyl, vinyl and vinylidene per 1000 carbon atoms in the copolymer was measured by nuclear magnetic spectroscopic analysis according to the following method and shown in Table 2.
- the copolymer was dissolved in 1,1,2,2-tetrachloroethane D2 (TCE-d2) solvent and measured using a Bruker AVANCE III 500 MHz NMR instrument at 393K.
- the TCE-d2 peak was corrected to 6.0 ppm in the 1H NMR spectrum, and the content ratio of the comonomer was calculated using the integral values of 1.4 ppm and 0.96 ppm.
- the content of vinyl group, vinylidene group, vinylene group and trivinylene group observed at 4.7 ppm to 5.6 ppm was calculated (analytical method: AMT-3863). Peak assignment is referred to Macromolecules 2014, 47, 3282-3790 .
- Example 1 0.1 0.04 0.05 0.02 0.2 0.25 0.1 0.20
- Example 2 0.16 0.02 0.06 0.02 0.26 0.23 0.08 0.08
- Example 3 0.19 0.04 0.1 0.03 0.36 0.28 0.08 0.11
- Example 4 0.1 0.02 0.07 0.06 0.25 0.28 0.24 0.08
- Example 5 0.08 0.02 0.05 0.04 0.2 0.25 0.2 0.10
- Example 6 0.07 0.03 0.05 0.04 0.19 0.26 0.21 0.16
- Example 7 0.06 0.02 0.05 0.04 0.17 0.29 0.24 0.12
- Example 8 0.12 0.07 0.07 0.01 0.27 0.26 0.04 0.26
- Example 9 0.11 0.07 0.07 0.01 0.25 0.28 0.04 0.28
- Example 10 0.11 0.06 0.08 0.01 0.25 0.32 0.04 0.24
- Example 11 0.15 0.13 0.14 0.01 0.43 0.33 0.02 0.30
- Example 12 0.13 0.08 0.09 0.02 0.31
- melt index, density, weight average molecular weight (Mw) and molecular weight distribution (MWD) of Examples 1 to 14 and Comparative Examples 1 to 6 were measured and shown in Table 3 below.
- Melt Index Measured by ASTM D-1238 (Condition E, 190 ° C, 2.16 Kg load).
- Melt Index Measured by ASTM D-1238 (Condition E, 190 ° C., 10 Kg load).
- Example 1 0.876 18 102.5 5.69 55,000 1.94
- Example 2 0.879 20 113.8 5.69 55,000 2.1
- Example 3 0.877 14 103.2 7.37 55,000 1.9
- Example 4 0.870 14.5 93.3 6.43 - - Example 5 0.871 13.5 84.1 6.23 - - Example 6 0.876 12.8 82.4 6.44 54,000 1.9
- Example 7 0.876 14 85.2 6.08 52,000 1.9
- Example 8 0.879 18.4 119.7 6.50 55,000 2.14
- Example 9 0.879 2.24 16.3 7.29 89,000 2.04
- Example 10 0.879 0.95 7.3 7.67 112,000 2.1
- Example 11 0.874 33.7 217.8 6.46 47,000 2.06
- Example 12 0.883 25.3 160.8 6.36 50,000 2.01
- Example 13 0.893 11.9 83.3 7.00 58,000 2.12
- Example 14 0.880 16.3 103.0 6.32 50,000 2.14 Comparative Example 1
- Example 2 has a narrower molecular weight distribution than Comparative Example 1.
- TBEC t-butyl 1- (2-ethylhexyl) monoperoxycarbonate
- TAIC triallyl isocyanurate
- MEMO methacryloxypropyltrimethoxysilane
- the film containing the crosslinking assistant composition in (2) was produced in the form of a disc of 5 g diameter 4 cm, and the maximum torque MH until it was scorched at 150 ° C. for 1 hour.
- the resulting values, including the values, are shown in Table 4.
- the top and bottom of the film sample prepared in the process (2) was covered with a Teflon sheet, put into a vacuum laminator, and laminated for 15 minutes to prepare a crosslinked sheet.
- the crosslinked sheet is for measuring the degree of crosslinking and optical properties after crosslinking and is not attached to any substrate such as a glass substrate.
- crosslinked sheet 0.5 g was placed in toluene (non-crosslinked polymer extraction solvent) and aged at 60 ° C. for 15 hours. Toluene was washed and then dried at 80 ° C. for 6 hours. After drying, the weight of the sample was measured, and the degree of crosslinking was measured according to the following equation.
- MH value and Final Torque value means that the higher the value, the higher the crosslinking degree.
- T value is a factor related to the crosslinking rate. For example, T90 represents a time taken until the torque value is 90% saturation, and the smaller the value, the faster the crosslinking speed.
- FIG. 2 shows the crosslinking behavior of Example 1 and Comparative Example 1 according to the crosslinking recipe (a)
- FIG. 3 shows the crosslinking behavior of Example 2 and Comparative Example 1 according to the crosslinking recipe (b), respectively. .
- Example and the comparative example to which the same crosslinking recipe was applied were compared, respectively from the result of Table 4, it can confirm that the resin composition using the polymer of an Example has a high crosslinking degree compared with the comparative example.
- the crosslinking degree of the resin compositions of Examples 1 and 2 is 10% higher than that of Comparative Example 1 to which the same crosslinking recipe is applied.
- Example 14 showed much higher degree of crosslinking than Comparative Examples 4 and 5 to which the same crosslinking recipe (f) was applied.
- the yellow index (YI) and the total light transmittance (Tt) were measured for the crosslinked sheet according to the following method, and are shown in Table 5 below.
- the yellow index (YI) and the total light transmittance (Tt) were measured in Table 5 below as 'pre-crosslinking' data before the cross-linking sheet was manufactured after the [manufacturing of the film] process.
- Yellow index Based on ASTM 1925, using a Colorflex (Hunter lab) to measure the reflectance of the 400 nm to 700 nm region, using this, to obtain a YI value according to the following equation 4.
- the YI is a value calculated using a color difference analysis program in a UV / VIS / NIR spectrometer (ASTM, D1925), and XCIE, YCIE, and ZCIE are relative values represented by red, green, and blue color coordinates, respectively.
- Total light transmittance The total light transmittance with respect to the light of wavelength of 550 nm was measured using the hazemeter. The transmittance was measured three times after the specimen was placed in the specimen holder, and the average value thereof was obtained, and measured under the standard conditions of JIS K 7105.
- the yellow index value after crosslinking is very excellent compared to 1.63 to 3.7 of the comparative example as the range of 0.82 to 1.34.
- the embodiment of the present invention can be seen that the total light transmittance after crosslinking is significantly improved compared to the comparative example showing a maximum value of 99.4 or more 99.4. Therefore, it is expected that the ethylene / alpha-olefin copolymer of the present invention can be applied to the production of an optical film having excellent optical properties.
Landscapes
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Optics & Photonics (AREA)
- General Physics & Mathematics (AREA)
- Crystallography & Structural Chemistry (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
Abstract
본 발명은 하기 (a) 내지 (d) 조건을 만족하는 에틸렌/알파-올레핀 공중합체를 제공한다: (a) 밀도: 0.850 내지 0.910 g/cc (b) 용융지수(Melt Index, MI, 190 ℃, 2.16 kg 하중 조건): 0.1 내지 100 dg/분 (c) 분자량 분포(MWD): 1.5 내지 3.0 (d) Rv 값이 0.18 내지 0.59.
Description
관련 출원과의 상호 인용
본 출원은 2018년 5월 4일자 한국 특허 출원 2018-0052071, 2018년 9월 18일자 한국 특허 출원 2018-0111511, 2018년 9월 18일자 한국 특허 출원 2018-0111510, 2018년 5월 4일자 한국 특허 출원 2018-0052072, 2019년 4월 30일자 한국 특허 출원 2019-0050468에 기초한 우선권의 이익을 주장하며, 해당 한국 특허 출원들의 문헌에 개시된 모든 내용은 본 명세서의 일부로서 포함된다.
기술분야
본 발명은 분자량 분포가 좁고, 중합체 내 비닐기 함량이 일정 범위 내로 조절되어, 우수한 물리적 특성을 나타내는 에틸렌/알파-올레핀 공중합체 및 이의 제조방법에 관한 것이다.
올레핀 중합 촉매계는 지글러 나타 및 메탈로센 촉매계로 분류할 수 있으며, 이 두 가지의 고활성 촉매계는 각각의 특징에 맞게 발전되어 왔다. 지글러 나타 촉매는 50년대 발명된 이래 기존의 상업 프로세스에 널리 적용되어 왔으나, 활성점이 여러 개 혼재하는 다활성점 촉매(multi-site catalyst)이기 때문에, 중합체의 분자량 분포가 넓은 것이 특징이며, 공단량체의 조성 분포가 균일하지 않아 원하는 물성 확보에 한계가 있다는 문제점이 있다.
한편, 메탈로센 촉매는 전이금속 화합물이 주성분인 주촉매와 알루미늄이 주성분인 유기 금속 화합물인 조촉매의 조합으로 이루어지며, 이와 같은 촉매는 균일계 착체 촉매로 단일 활성점 촉매(single site catalyst)이며, 단일 활성점 특성에 따라 분자량 분포가 좁으며, 공단량체의 조성 분포가 균일한 고분자가 얻어지며, 촉매의 리간드 구조 변형 및 중합 조건의 변경에 따라 고분자의 입체 규칙도, 공중합 특성, 분자량, 결정화도 등을 변화시킬 수 있는 특성을 가지고 있다.
미국특허 제5,914,289호에는 각각의 담체에 담지된 메탈로센 촉매를 이용하여 고분자의 분자량 및 분자량 분포를 제어하는 방법이 기재되어 있으나, 담지촉매 제조시 사용된 용매의 양 및 제조시간이 많이 소요되고, 사용되는 메탈로센 촉매를 담체에 각각 담지시켜야 하는 번거로움이 따랐다.
대한민국특허 출원번호 제10-2003-0012308호에는 담체에 이중핵 메탈로센 촉매와 단일핵 메탈로센 촉매를 활성화제와 함께 담지하여 반응기 내 촉매의 조합을 변화시키며 중합함으로써 분자량 분포를 제어하는 방안을 개시하고 있다. 그러나, 이러한 방법은 각각의 촉매의 특성을 동시에 구현하기에 한계가 있으며, 또한 완성된 촉매의 담체 성분에서 메탈로센 촉매 부분이 유리되어 반응기에 파울링(fouling)을 유발하는 단점이 있다.
한편, 선형 저밀도 폴리에틸렌은 중합촉매를 사용하여 저압에서 에틸렌과 알파 올레핀을 공중합하여 제조되어, 분자량 분포가 좁고 일정한 길이의 단쇄분지를 가지며, 장쇄분지가 없는 수지이다. 선형 저밀도 폴리에틸렌 필름은 일반 폴리에틸렌의 특성과 더불어 파단강도와 신율이 높고, 인열강도, 낙추충격강도 등이 우수하여 기존의 저밀도 폴리에틸렌이나 고밀도 폴리에틸렌의 적용이 어려운 스트레치 필름, 오버랩 필름 등에의 사용이 증가하고 있다.
그런데, 1-부텐 또는 1-헥센을 공단량체로 사용하는 선형 저밀도 폴리에틸렌은 대부분 단일 기상반응기 또는 단일 루프 슬러리 반응기에서 제조되며, 1-옥텐 공단량체를 사용하는 공정 대비 생산성은 높으나, 이러한 제품 역시 사용 촉매기술 및 공정기술의 한계로 물성이 1-옥텐 공단량체 사용시보다 크게 열세하고, 분자량 분포가 좁아 가공성이 불량한 문제가 있다.
미국 특허 제4,935,474호에는 2종 또는 그 이상의 메탈로센 화합물이 사용되어 넓은 분자량 분포를 갖는 폴리에틸렌 제조법에 대해 보고되어 있다. 미국 특허 제6,828,394호에는 공단량체 결합성이 좋은 것과 그렇지 않은 것을 혼합 사용해 가공성이 우수하고 특히 필름용에 적합한 폴리에틸렌 제조방법에 대해 보고되어 있다. 또한, 미국 특허 제6,841,631호, 미국 특허 제6,894,128호에는 적어도 2종의 메탈 컴파운드가 사용된 메탈로센계 촉매로 이정 또는 다정 분자량 분포를 갖는 폴리에틸렌을 제조하여, 필름, 블로우 몰딩, 파이프 등의 용도에 적용이 가능하다고 보고되어 있다. 하지만 이러한 제품들은 가공성은 개선되었으나 단위 입자 내의 분자량별 분산상태가 균일하지 못해 비교적 양호한 압출조건에서도 압출외관이 거칠고 물성이 안정적이지 못한 문제가 있다.
이러한 배경에서 물성과 가공성 간의 균형이 이루어진 보다 우수한 제품의 제조가 끊임없이 요구되고 있으며, 특히 가공성이 우수하면서도 광학 물성 등이 우수한 폴리에틸렌 공중합체의 필요성이 요구된다.
[선행기술문헌]
[특허문헌]
미국 특허 제5,914,289호
한국특허공개 제2004-0076965호
미국 특허 제4,935,474호
미국 특허 제6,828,394호
미국 특허 제6,841,631호
미국 특허 제6,894,128호
이에 본 발명은 상기 종래기술의 문제점을 해결하기 위한 것으로, 분자량 분포가 좁고, 중합체 내 비닐기 함량이 일정 범위 내로 조절되어, 우수한 물리적 특성, 특히 우수한 가교 거동 특성을 갖는 에틸렌/알파-올레핀 공중합체 및 그 제조방법을 제공하고자 한다.
또한, 본 발명은 상기 에틸렌/알파-올레핀 공중합체를 포함함으로써, 우수한 물리적 특성, 특히 우수한 가교 특성을 나타내는 광학필름용 수지 조성물을 제공하고자 한다.
또한, 본 발명은 옐로 인덱스(YI), 전광선 투과율(Tt) 등의 광학 물성이 개선된 광학필름용 수지 조성물 및 상기 수지 조성물을 이용하여 제조된 광학필름을 제공하는 것을 목적으로 한다.
본 발명의 일 구현 예는 하기 (a) 내지 (d) 조건을 충족하는 에틸렌/알파-올레핀 공중합체를 제공한다:
(a) 밀도: 0.850 내지 0.910 g/cc
(b) 용융지수(Melt Index, MI, 190℃, 2.16 kg 하중 조건): 0.1 내지 100 dg/분
(c) 분자량 분포(MWD): 1.5 내지 3.0
(d) 하기 식 1에 따른 Rv 값이 0.18 내지 0.59.
[식 1]
상기 식 1에서, Nvd, Ntv, Nvl 및 Nv는 각각 핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 비닐리덴(vinylidene), 트라이비닐(trivinyl), 비닐렌(vinylene) 및 비닐(vinyl) 작용기의 개수를 의미한다.
본 발명의 다른 구현 예는 하기 화학식 1의 전이금속 화합물을 포함하는 촉매 조성물의 존재 하에, 수소를 5 내지 100 cc/min으로 투입하여 에틸렌 및 알파-올레핀계 단량체를 중합하는 단계를 포함하는, 상기 에틸렌/알파-올레핀 공중합체의 제조방법을 제공한다:
[화학식 1]
상기 화학식 1에서,
R1은 수소; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C1~20의 알콕시; C6~20의 아릴; C7~20의 아릴알콕시; C7~20의 알킬아릴; 또는 C7~20의 아릴알킬이고,
R2a 내지 R2e는 각각 독립적으로 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C1~20의 알콕시; 또는 C6~20의 아릴이고,
R3은 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C6~20의 알킬아릴; C7~20의 아릴알킬; C1~20의 알킬 아미도; C6~20의 아릴 아미도; C1~20의 알킬리덴; 또는 할로겐, C1~20의 알킬, C3~20의 사이클로알킬, C2~20의 알케닐, C1~20의 알콕시 및 C6~20의 아릴로 이루어지는 군으로부터 선택된 1종 이상으로 치환된 페닐이고,
R4 내지 R9는 각각 독립적으로, 수소; 실릴; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C7~20의 알킬아릴; C7~20의 아릴알킬; 또는 C1~20의 하이드로카르빌로 치환된 14족 금속의 메탈로이드 라디칼이고; 상기 R6 내지 R9 중 서로 인접하는 2개 이상은 서로 연결되어 고리를 형성할 수 있고,
Q는 Si, C, N, P 또는 S이며,
M은 4족 전이금속이고,
X1 및 X2는 각각 독립적으로 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C7~20의 알킬아릴; C7~20의 아릴알킬; C1~20의 알킬아미노; C6~20의 아릴아미노; 또는 C1~20의 알킬리덴이다.
본 발명의 다른 구현 예는 상기 에틸렌/알파-올레핀 공중합체를 포함하는 광학필름용 수지 조성물을 제공한다.
본 발명의 다른 구현 예는 상기 수지 조성물을 포함하는 광학필름을 제공한다.
본 발명의 에틸렌/알파-올레핀 공중합체는 종래기술에 비해 좁은 분자량 분포를 가지고, 중합체 내 비닐 함량이 전체 불포화 작용기 대비 특정 비율을 충족함으로써, 우수한 가교 특성을 나타낸다.
또한, 본 발명의 에틸렌/알파-올레핀 공중합체를 광학 필름용 수지 조성물로서 적용시 옐로 인덱스(YI) 및 전광선 투과율(Tt)과 같은 광학 물성이 우수하다. 따라서, 본 발명의 에틸렌/알파-올레핀 공중합체는 우수한 광학 물성이 요구되는 광학 필름용 수지 조성물의 제조에 유용하게 적용될 수 있다.
도 1은 본 발명의 일 구현 예로서 실시예 2와 비교예 1의 분자량 분포도를 도시한다.
도 2는 본 발명의 일 구현 예로서 가교 레시피 (a)에 따른 실시예 1과 비교예 1의 가교 거동 특성을 도시한다.
도 3은 본 발명의 일 구현 예로서 가교 레시피 (b)에 따른 실시예 2와 비교예 1의 가교 거동 특성을 도시한다.
본 명세서에서 사용되는 용어는 단지 예시적인 실시예들을 설명하기 위해 사용된 것으로, 본 발명을 한정하려는 의도는 아니다. 단수의 표현은 문맥상 명백하게 다르게 뜻하지 않는 한, 복수의 표현을 포함한다. 본 명세서에서, "포함하다", "구비하다" 또는 "가지다" 등의 용어는 실시된 특징, 단계, 구성 요소 또는 이들을 조합한 것이 존재함을 지정하려는 것이지, 하나 또는 그 이상의 다른 특징들이나 단계, 구성 요소, 또는 이들을 조합한 것들의 존재 또는 부가 가능성을 미리 배제하지 않는 것으로 이해되어야 한다.
본 발명은 다양한 변경을 가할 수 있고 여러 가지 형태를 가질 수 있는 바, 특정 실시예들을 예시하고 하기에서 상세하게 설명하고자 한다. 그러나, 이는 본 발명을 특정한 개시 형태에 대해 한정하려는 것이 아니며, 본 발명의 사상 및 기술 범위에 포함되는 모든 변경, 균등물 내지 대체물을 포함하는 것으로 이해되어야 한다.
본 명세서에서 이용되는 바와 같은 "조성물"이란 용어는, 해당 조성물의 재료로부터 형성된 반응 생성물 및 분해 생성물뿐만 아니라 해당 조성물을 포함하는 재료들의 혼합물을 포함한다.
본 명세서에서 이용되는 바와 같은 "중합체"란 용어는, 동일 혹은 상이한 종류이든지 간에, 단량체들을 중합함으로써 제조된 중합체 화합물을 지칭한다. 이와 같이 해서 일반 용어 중합체는, 단지 1종의 단량체로부터 제조된 중합체를 지칭하는데 통상 이용되는 단독중합체란 용어, 및 이하에 규정된 바와 같은 혼성중합체(interpolymer)란 용어를 망라한다.
본 명세서에서 이용되는 바와 같은 "혼성중합체"란 용어는, 적어도 2종의 상이한 단량체의 중합에 의해 제조된 중합체를 지칭한다. 이와 같이 해서, 일반 용어 혼성중합체는, 2종의 상이한 단량체로부터 제조된 중합체를 지칭하는데 통상 이용되는 공중합체, 및 2종 이상의 상이한 단량체로부터 제조된 중합체를 포함한다.
1. 에틸렌/알파-올레핀 공중합체
이하, 본 발명의 에틸렌/알파-올레핀 공중합체를 상세히 설명한다.
본 발명의 일 구현 예에 따른 에틸렌/알파-올레핀 공중합체는 하기 (a) 내지 (d) 조건을 총족한다:
(a) 밀도: 0.850 내지 0.910 g/cc
(b) 용융지수(Melt Index, MI, 190℃, 2.16 kg 하중 조건): 0.1 내지 100 dg/분
(c) 분자량 분포(MWD): 1.5 내지 3.0
(d) 하기 식 1에 따른 Rv 값이 0.18 내지 0.59.
[식 1]
상기 식 1에서, Nvd, Ntv, Nvl 및 Nv는 각각 핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 비닐리덴(vinylidene), 트라이비닐(trivinyl), 비닐렌(vinylene) 및 비닐(vinyl) 작용기의 개수를 의미한다.
본 발명은 후술하는 바와 같은 촉매를 사용하고, 중합시 최적 함량의 수소를 투입하여 상기 (a) 내지 (d)의 조건을 동시에 충족하도록 함으로써, 에틸렌/알파 올레핀 공중합체의 물리적 특성, 특히 가교 특성을 크게 개선시킬 수 있다.
구체적으로, 본 발명의 에틸렌/알파-올레핀 공중합체는 ASTM D-792에 따라 측정한 밀도가 0.850 내지 0.910 g/cc 범위의 저밀도인 중합체이다. 구체적으로는 상기 밀도는 0.850 g/cc 이상, 또는 0.855 g/cc 이상, 또는 0.86 g/cc 이상, 또는 0.865 이상일 수 있으며, 0.91 g/cc 이하, 또는 0.90 g/cc 이하, 또는 0.89 g/cc 이하일 수 있다.
통상 올레핀계 중합체의 밀도는 중합시 사용되는 단량체의 종류와 함량, 중합도 등의 영향을 받으며, 공중합체의 경우 공단량체의 함량에 의한 영향이 크며, 공단량체의 함량이 많을수록 저밀도의 에틸렌/알파-올레핀 공중합체가 제조될 수 있고, 공단량체가 공중합체 내 도입될 수 있는 함량은 촉매의 공중합성, 즉 촉매의 특성에 의존적일 수 있다.
본 발명에서는 특정 구조를 갖는 전이금속 화합물을 포함하는 촉매 조성물의 사용으로 많은 양의 공단량체 도입이 가능하다. 그 결과, 본 발명의 일 구현예에 따른 에틸렌/알파-올레핀 공중합체는 상기한 바와 같은 저밀도를 가질 수 있으며, 그 결과 우수한 가공성을 나타낼 수 있다. 보다 구체적으로, 상기 에틸렌/알파-올레핀 공중합체는 0.850 내지 0.910 g/cc의 밀도를 가질 수 있으며, 이 경우 밀도 제어에 따른 기계적 물성 유지 및 충격강도 개선 효과가 보다 현저하다.
또한, 본 발명의 에틸렌/알파-올레핀 공중합체는 1.5 내지 3.0 범위의 좁은 분자량 분포(MWD)를 가진다. 일 예로서, 상기 분자량 분포는 1.6 이상, 또는 1.7 이상, 또는 1.8 이상일 수 있으며, 2.7 이하, 또는 2.4 이하, 또는 2.2 이하일 수 있다.
통상 2종 이상의 단량체가 중합될 경우 분자량 분포(MWD; Molecular Weight Distribution)가 증가하고, 그 결과 충격 강도와 기계적 물성 등이 감소하게 되며 블로킹 현상 등이 일어나게 된다. 이에 대해 본 발명에서는 중합 반응시 최적 함량의 수소가 투입됨으로써, 제조되는 에틸렌/알파-올레핀 공중합체의 분자량 및 분자량 분포가 감소되고, 그 결과 가교 특성, 충격 강도, 기계적 물성 등이 개선된다.
한편, 본 발명에 있어서, 중량평균 분자량(Mw)과 수평균 분자량(Mn)은 겔 투과형 크로마토그래피(GPC: gel permeation chromatography)로 분석되는 폴리스티렌 환산 분자량이며, 상기 분자량 분포는 Mw/Mn의 비로부터 계산될 수 있다.
본 발명의 일 구현예 따른 상기 에틸렌/알파-올레핀 공중합체는 중량 평균 분자량(Mw)이 40,000 내지 150,000 g/mol인 중합체일 수 있다. 보다 구체적으로 상기 중량 평균 분자량은 45,000 g/mol 이상, 또는 49,000 g/mol 이상, 또는 52,000 g/mol 이상일 수 있으며, 130,000 g/mol 이하, 또는 90,000 g/mol 이하, 또는 65,000 g/mol 이하일 수 있다.
또한, 본 발명의 에틸렌/알파-올레핀 공중합체는 0.1 내지 100 dg/분 범위의 용융지수(Melt Index, MI, 190 ℃, 2.16 kg 하중 조건)를 갖는다. 일 예로서, 본 발명의 에틸렌/알파-올레핀 공중합체는 용융지수(MI)가 1 dg/분 이상, 또는 1.5 dg/분 이상, 또는 3 dg/분 이상, 또는 5 dg/분 이상, 또는 12 dg/분 이상, 또는 16 dg/분 이상일 수 있으며, 90 dg/분 이하, 또는 70 dg/분 이하, 또는 40 dg/분 이하, 또는 37 dg/분 이하, 또는 35 dg/분 이하일 수 있다.
또한, 상기 에틸렌/알파-올레핀 공중합체는 5 내지 230 dg/분 범위의 용융지수(Melt Index, MI, ASTM D1238에 의해 190 ℃, 10 kg 하중 조건에서 측정)를 가질 수 있다.
또한, 상기 에틸렌/알파-올레핀 공중합체는 용융지수(190 ℃, 2.16 kg 하중 조건)에 대한 용융지수(190 ℃, 10 kg 하중 조건) 값인 MI10/MI2.16 값이 8.5 이하, 또는 7.9 이하, 또는 7.5 이하일 수 있으며, 5.0 이상, 또는 5.5 이상, 또는 6.0 이상일 수 있다. MI10/MI2.16은 공중합체의 장쇄 분기 정도의 지표가 되며, MI10/MI2.16 값이 8.5 이하이면 장쇄 분기가 적은 것을 의미한다.
상기 중량평균 분자량과 용융지수가 상기 범위를 만족하게 되는 경우 광학필름용 수지 조성물에 적용되기에 적합할 수 있다.
즉, 에틸렌/알파-올레핀 공중합체의 기계적 물성 및 충격강도는 그 중합과정에서 사용되는 촉매 종류와 함께 촉매 사용량을 조절함으로써 제어될 수 있고, 상기한 조건들을 충족함으로써, 우수한 기계적 특성을 유지하면서도 개선된 가공성을 나타낼 수 있다.
또한, 본 발명의 에틸렌/알파-올레핀 공중합체는 공중합체 내 탄소원자 1000개당 비닐기 함량이 일정 범위 내로 제어되는 것을 특징으로 한다. 구체적으로, 본 발명의 에틸렌/알파-올레핀 공중합체는 하기 식 1에 따른 Rv 값이 0.18 이상 0.59 이하이다.
[식 1]
상기 식 1에서, Rv는 핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 각 작용기의 개수에 대한 비닐기 개수의 비율이다.
선택적으로, 본 발명의 에틸렌/알파-올레핀 공중합체는 하기 식 2에 따른 Rvd 값이 0.25 이하일 수 있다.
[식 2]
상기 식 2에서, Rvd는 핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 각 작용기의 개수에 대한 비닐리덴기 개수의 비율이다.
상기 식 1 및 2에서, Nvd, Ntv, Nvl 및 Nv는 각각 핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 비닐리덴(vinylidene), 트라이비닐(trivinyl), 비닐렌(vinylene) 및 비닐(vinyl) 작용기의 개수를 의미한다.
일 예로서, 상기 Rv 값은 0.55 이하, 또는 0.50 이하, 또는 0.46 이하, 또는 0.40 이하, 또는 0.39 이하, 또는 0.35 이하, 또는 0.32 이하, 또는 0.30 이하, 또는 0.29 이하일 수 있으며, 0.19 이상, 또는 0.22 이상, 또는 0.24 이상일 수 있다.
공중합체 내 비닐기의 함량은 제조시 중합 온도 및 수소 투입량의 제어를 통해 가능한데, 본 발명에 따른 에틸렌/알파-올레핀 공중합체가 상기 비닐기 함량을 충족하는 경우, 이를 이용하여 광학필름용 수지 조성물에 적용시 우수한 가교도 및/또는 광학물성을 나타낼 수 있다.
일 예로서, 상기 Rvd 값은 0.25 이하, 또는 0.22 이하, 또는 0.20 이하, 또는 0.15 이하, 또는 0.10 이하, 또는 0.09 이하, 또는 0.08 이하, 또는 0.07 이하, 또는 0.06 이하일 수 있으며, 0.02 이상, 또는 0.03 이상, 또는 0.04 이상일 수 있다. 상기 비닐리덴기 함량이 상기 수치범위를 충족하는 경우, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
선택적으로, 본 발명의 에틸렌/알파-올레핀 공중합체는 공중합체 내 탄소원자 1000개당 트라이비닐 함량이 일정 비율 이상으로 제어되는 것을 특징으로 한다. 구체적으로, 본 발명의 에틸렌/알파-올레핀 공중합체는 하기 식 3에 따른 Rtv 값이 0.12 이상일 수 있다.
[식 3]
상기 식 3에서, Rtv는 핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 각 작용기의 개수에 대한 트라이비닐기 개수의 비율이다.
공중합체 내 트라이비닐의 함량은 제조시 중합 온도 및 수소 투입량의 제어를 통해 가능하다. 공중합체 내의 이중 결합은 가교제에 의해 생성된 라디칼과 결합하여 가교반응을 활발하게 해주며, 탄소원자 1000개당 각 작용기의 개수에 대한 트라이비닐기 개수의 비율이 일정 비율 이상 일수록 가교 물성이 우수해진다.
본 발명에 따른 에틸렌/알파-올레핀 공중합체는 상기와 같이 트라이비닐 함량이 일정 비율 이상으로 유지됨으로써, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
예를 들어, 상기 Rtv 값은 0.08 이상, 또는 0.10 이상, 또는 0.12 이상, 또는 0.15 이상일 수 있고, 0.30 이하, 0.29 이하, 또는 0.27 이하, 또는 0.26 이하, 또는 0.25 이하일 수 있다. 상기 트라이비닐 함량이 상기 수치범위를 충족하는 경우, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
또한, 본 발명의 에틸렌/알파-올레핀 공중합체는, 상기 Rv 값, Rvd 값 및/또는 Rtv 값을 충족하면서 동시에 공중합체 내 비닐, 트라이비닐, 비닐렌 및 비닐리덴을 포함하는 불포화 작용기의 개수가 탄소원자 1000개당 0.65개 이하인 것이 바람직하다. 구체적으로 0.6개 이하, 또는 0.5개 이하, 또는 0.45개 이하, 또는 0.4개 이하일 수 있으며, 0.1개 이상, 또는 0.15개 이상, 또는 0.2 개 이상, 또는 0.23개 이상일 수 있다. 상기 불포화 작용기의 개수가 상기 수치범위를 충족하는 경우, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
또한, 공중합체 내 비닐 작용기의 개수는 탄소원자 1000개당 0.3개 이하일 수 있다. 구체적으로 0.29개 이하, 또는 0.25개 이하, 또는 0.2개 이하, 또는 0.15개 이하, 또는 0.1개 이하이고, 0.01개 이상, 또는 0.02개 이상, 또는 0.04 개 이상, 또는 0.06개 이상일 수 있다. 상기 불포화 작용기의 개수가 상기 수치범위를 충족하는 경우, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
또한, 공중합체 내 비닐렌 작용기의 개수는 탄소원자 1000개당 0.3개 이하, 또는 0.29개 이하, 또는 0.25개 이하, 또는 0.2개 이하, 또는 0.15개 이하, 또는 0.1개 이하이고, 0.01개 이상, 또는 0.02개 이상, 또는 0.04 개 이상, 또는 0.06개 이상일 수 있다. 상기 불포화 작용기의 개수가 상기 수치범위를 충족하는 경우, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
또한, 공중합체 내 비닐리덴 작용기의 개수는 탄소원자 1000개당 0.07개 이하, 또는 0.05개 이하이고, 0.01개 이상, 또는 0.02개 이상일 수 있다. 상기 불포화 작용기의 개수가 상기 수치범위를 충족하는 경우, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
또한, 공중합체 내 트라이비닐 작용기의 개수는 탄소원자 1000개당 0.15개 이하, 또는 0.1개 이하, 또는 0.08개 이하이고, 0.01개 이상, 또는 0.02개 이상일 수 있다. 상기 불포화 작용기의 개수가 상기 수치범위를 충족하는 경우, 좁은 분자량 분포, 우수한 가교 물성 및 그에 따른 광학 물성을 나타낼 수 있다.
본 발명에서 상기 비닐기는 R-CH=CH2의 구조이고, 상기 트라이비닐기는 RCH=CR'R" 구조이며, 상기 비닐렌은 RCH=CHR' (E form) 또는 RCH=CHR' (Z form) 구조이며, 상기 비닐리덴은 RR'C=CH2 구조를 의미한다. 여기서, R, R' 및 R"은 각각 독립적으로 중합체 사슬 또는 공단량체인 알파-올레핀에 따른 분지쇄일 수 있다.
본 발명에 있어서, 공중합체 내 비닐, 비닐리덴, 비닐렌 및 트라이비닐 각각의 함량은 NMR 분석 결과로부터 계산될 수 있다. 구체적으로, 공중합체를 1,1,2,2-테트라클로로에탄 D2 (TCE-d2) 용매에 용해시킨 후 393K에서 Bruker AVANCE III 500MHz NMR 장비를 사용하여 측정할 수 있다. 1H NMR 스펙트럼에서 TCE-d2 피크를 6.0 ppm 으로 보정하고, 1.4 ppm과 0.96 ppm 영역의 적분값을 이용하여 공단량체의 함량비를 계산한다. 4.7 ppm ~ 5.6 ppm 에서 관찰되는 비닐기, 비닐리덴기, 비닐렌기 및 트라이비닐렌기 각각의 함량을 계산한다(분석법: AMT-3863). Peak assignment는 문헌 [Macromolecules 2014, 47, 3282-3790] 을 참조한다.
또한, 본 발명의 일 구현예에 따른 에틸렌/알파-올레핀 공중합체는 결정화 온도(Tc)가 35℃ 내지 80℃일 수 있다. 보다 구체적으로, 상기 결정화 온도가 40 ℃ 이상, 또는 45℃ 이상일 수 있으며, 75℃ 이하, 또는 70℃ 이하, 또는 65℃ 이하일 수 있다. 이와 같이 높은 결정화 온도는 에틸렌/알파-올레핀 공중합체 내 공단량체의 균일 분포로 인한 것으로, 상기한 온도 범위를 가짐으로써 우수한 구조 안정성을 나타낼 수 있다.
또한, 본 발명의 일 구현예에 따른 상기 에틸렌/알파-올레핀 공중합체는 용융온도(Tm)가 50 내지 110℃일 수 있다. 보다 구체적으로, 상기 용융 온도가 55℃ 이상, 또는 60℃ 이상, 또는 70℃ 이상일 수 있으며, 110℃ 이하, 또는 105℃ 이하, 또는 95℃ 이하일 수 있다. 이와 같은 온도 범위의 용융온도를 가짐으로써 우수한 열 안정성을 나타낼 수 있다.
본 발명에 있어서, 에틸렌/알파-올레핀 공중합체의 결정화 온도 및 용융 온도는 시차주사열량계(Differential Scanning Calorimeter, DSC)를 이용하여 측정할 수 있다. 구체적으로는 공중합체를 150℃까지 가열한 후 5분 동안 유지하고, 다시 20℃까지 내린 후 다시 온도를 증가시킨다. 이때 온도의 상승속도와 하강속도는 각각 10℃/min으로 조절하며, 두 번째 온도가 상승하는 구간에서 측정한 결과를 용융온도로, 온도를 감소시키면서 나타나는 구간에서 측정한 결과를 결정화 온도로 한다.
또한, 본 발명의 일 구현예 따른 상기 에틸렌/알파-올레핀 공중합체에서, 공단량체인 상기 알파-올레핀계 단량체는 C4~20의 올레핀계 단량체일 수 있다. 구체적인 예로는 프로필렌, 1-부텐, 1-펜텐, 4-메틸-1-펜텐, 1-헥센, 1-헵텐, 1-옥텐, 1-데센, 1-운데센, 1-도데센, 1-테트라데센, 1-헥사데센, 또는 1-에이코센 등을 들 수 있으며, 이들 중 1종 단독 또는 2종 이상의 혼합물이 사용될 수 있다.
이 중에서도 광학필름용 수지 조성물에 적용시 그 개선효과가 현저한 점을 고려할 때 상기 알파-올레핀 단량체는 1-부텐, 1-헥센 또는 1-옥텐일 수 있으며, 가장 바람직하게는 1-부텐일 수 있다.
또한, 상기 에틸렌/알파-올레핀 공중합체에서, 상기 공단량체인 알파-올레핀의 함량은 상기한 물성적 요건을 충족하는 범위 내에서 적절히 선택될 수 있으며, 구체적으로는 0 초과 99 몰% 이하, 또는 10 내지 50몰%일 수 있다.
2. 에틸렌/알파-올레핀 공중합체의 제조방법
본 발명의 다른 구현 예는 하기 화학식 1의 전이금속 화합물을 포함하는 촉매 조성물의 존재 하에, 수소를 5 내지 100 cc/min으로 투입하여 에틸렌 및 알파-올레핀계 단량체를 중합하는 단계를 포함하는, 에틸렌/알파-올레핀 공중합체의 제조방법을 제공한다:
[화학식 1]
상기 화학식 1에서,
R1은 수소; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C1~20의 알콕시; C6~20의 아릴; C7~20의 아릴알콕시; C7~20의 알킬아릴; 또는 C7~20의 아릴알킬이고,
R2a 내지 R2e는 각각 독립적으로 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C1~20의 알콕시; 또는 C6~20의 아릴이고,
R3은 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C6~20의 알킬아릴; C7~20의 아릴알킬; C1~20의 알킬 아미도; C6~20의 아릴 아미도; C1~20의 알킬리덴; 또는 할로겐, C1~20의 알킬, C3~20의 사이클로알킬, C2~20의 알케닐, C1~20의 알콕시 및 C6~20의 아릴로 이루어지는 군으로부터 선택된 1종 이상으로 치환된 페닐이고,
R4 내지 R9는 각각 독립적으로, 수소; 실릴; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C7~20의 알킬아릴; C7~20의 아릴알킬; 또는 C1~20의 하이드로카르빌로 치환된 14족 금속의 메탈로이드 라디칼이고; 상기 R6 내지 R9 중 서로 인접하는 2개 이상은 서로 연결되어 고리를 형성할 수 있고,
Q는 Si, C, N, P 또는 S이며,
M은 4족 전이금속이고,
X1 및 X2는 각각 독립적으로 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C7~20의 알킬아릴; C7~20의 아릴알킬; C1~20의 알킬아미노; C6~20의 아릴아미노; 또는 C1~20의 알킬리덴이다.
본 발명의 일례에 따른 상기 화학식 1의 전이금속 화합물에 있어서,
상기 R1은 수소; C1~20의 알킬; C3~20의 사이클로알킬; C1~20의 알콕시; C6~20의 아릴; C7~20의 아릴알콕시; C7~20의 알킬아릴; 또는 C7~20의 아릴알킬일 수 있고,
상기 R2a 내지 R2e는 각각 독립적으로 수소; 할로겐; C1~12의 알킬; C3~12의 사이클로알킬; C2~12의 알케닐; C1~12의 알콕시; 또는 페닐일 수 있고,
상기 R3은 수소; 할로겐; C1~12의 알킬; C3~12의 사이클로알킬; C2~12의 알케닐; C6~20의 아릴; C7~13의 알킬아릴; C7~13의 아릴알킬; 또는 할로겐, C1~12의 알킬, C3~12의 사이클로알킬, C2~12의 알케닐, C1~12의 알콕시 및 페닐로 이루어지는 군으로부터 선택된 1종 이상으로 치환된 페닐일 수 있고,
상기 R4 내지 R9는 각각 독립적으로, 수소; C1~20의 알킬; C3~20의 사이클로알킬; C6~20의 아릴; C7~20의 알킬아릴; 또는 C7~20의 아릴알킬일 수 있고,
상기 R6 내지 R9 중 서로 인접하는 2개 이상은 서로 연결되어 C5~20의 지방족 고리 또는 C6~20의 방향족 고리를 형성할 수 있으며; 상기 지방족 고리 또는 방향족 고리는 할로겐, C1~20의 알킬, C2~12의 알케닐, 또는 C6~12의 아릴로 치환될 수 있고,
상기 Q는 Si일 수 있고,
상기 M은 Ti일 수 있으며,
상기 X1 및 X2는 각각 독립적으로 수소; 할로겐; C1~12의 알킬; C3~12의 사이클로알킬; C2~12의 알케닐; C6~12의 아릴; C7~13의 알킬아릴; C7~13의 아릴알킬; C1~13의 알킬아미노; C6~12의 아릴아미노; 또는 C1~12의 알킬리덴일 수 있다.
또한, 본 발명의 다른 일례에 따른 상기 화학식 1의 전이금속 화합물에 있어서,
상기 R1은 수소; C1~12의 알킬; C3~12의 사이클로알킬; C1~12의 알콕시; C6~12의 아릴; C7~13의 아릴알콕시; C7~13의 알킬아릴; 또는 C7~13의 아릴알킬일 수 있고,
상기 R2a 내지 R2e는 각각 독립적으로 수소; 할로겐; C1~12의 알킬; C3~12의 사이클로알킬; C2~12의 알케닐; C1~12의 알콕시; 또는 페닐일 수 있고,
상기 R3은 수소; 할로겐; C1~12의 알킬; C3~12의 사이클로알킬; C2~12의 알케닐; C7~13의 알킬아릴; C7~13의 아릴알킬; 페닐; 또는 할로겐, C1~12의 알킬, C3~12의 사이클로알킬, C2~12의 알케닐, C1~12의 알콕시 및 페닐로 이루어지는 군으로부터 선택된 1종 이상으로 치환된 페닐일 수 있고,
상기 R4 내지 R9는 각각 독립적으로, 수소; C1~12의 알킬; C3~12의 사이클로알킬; C6~12의 아릴; C7~13의 알킬아릴; 또는 C7~13의 아릴알킬일 수 있고,
상기 R6 내지 R9 중 서로 인접하는 2개 이상은 서로 연결되어 C5~12의 지방족 고리 또는 C6~12의 방향족 고리를 형성할 수 있으며;
상기 지방족 고리 또는 방향족 고리는 할로겐, C1~12의 알킬, C2~12의 알케닐, 또는 C6~12의 아릴로 치환될 수 있고,
상기 Q는 Si일 수 있고,
상기 M은 Ti일 수 있으며,
상기 X1 및 X2는 각각 독립적으로 수소; 할로겐; C1~12의 알킬기; 또는 C2~12의 알케닐일 수 있다.
또한, 본 발명의 또 다른 일례에 따른 상기 화학식 1의 전이금속 화합물에 있어서,
상기 R1은 수소 또는 C1~12의 알킬일 수 있고,
상기 R2a 내지 R2e는 각각 독립적으로 수소; C1~12의 알킬; 또는 C1~12의 알콕시일 수 있고,
상기 R3은 수소; C1~12의 알킬; 또는 페닐일 수 있고,
상기 R4 및 R5는 각각 독립적으로 수소; 또는 C1~12의 알킬일 수 있고,
상기 R6 내지 R9는 각각 독립적으로 수소 또는 메틸일 수 있고,
상기 Q는 Si일 수 있고,
상기 M은 Ti일 수 있으며,
상기 X1 및 X2는 각각 독립적으로 수소 또는 C1~12의 알킬일 수 있다.
상기 화학식 1의 전이금속 화합물은 고리형태의 결합에 의해 벤조티오펜이 융합된 시클로펜타디엔, 및 아미도 그룹(N-R1)이 Q(Si, C, N 또는 P)에 의해 안정적으로 가교되고, 4족 전이금속이 배위결합된 구조를 형성한다. 상기 촉매 조성물을 이용하여 올리펜 중합에 적용시, 높은 중합 온도에서도 고활성, 고분자량 및 높은 공중합성 등의 특징을 갖는 폴리올레핀을 생성하는 것이 가능하다.
나아가, 상기 화학식 1의 전이금속 화합물은 아미도 그룹(N-R1)이 Q(Si, C, N, P)에 의해 가교됨에 있어서 Q에 치환 또는 비치환된 페닐기가 결합되어 있는 구조를 가짐으로써, 보다 안정적으로 가교될 수 있고, 전이금속과의 배위 시 전자적으로 우수한 안정성을 가질 수 있다.
또한, 중심 금속 주변에 벌키한 치환체인 페닐기가 위치함으로써, β-수소전달(β-Hydrogen transfer)을 억제하기 때문에 더 높은 분자량의 올레핀 고분자를 제조할 수 있고 우수한 공중합성을 가진다.
즉, 본 발명에서는 상기한 전이금속 화합물을 이용하되, 중합 반응시 최적화된 함량으로 수소를 투입함으로써, 좁은 분자량 분포 및 우수한 가교 특성을 갖는 에틸렌/알파-올레핀 공중합체를 제공할 수 있으며, 상기 전이금속 화합물이 갖는 전자적/구조적 안정성으로 인하여, 수소의 혼입이 유리하다. 또한, 수소 투입 전 촉매 투입에 의해 형성된 중합체의 초기 분자량이 높기 때문에, 수소 투입 후 분자량 분포가 좁으면서 동시에 고분자량을 가진 제품의 제조 또한 가능하다.
상기 화학식 1로 표시되는 화합물은 구체적으로 하기 화학식으로 표시되는 화합물 중 어느 하나일 수 있다.
[화학식 1-1]
[화학식 1-2]
[화학식 1-3]
[화학식 1-4]
[화학식 1-5]
[화학식 1-6]
[화학식 1-7]
[화학식 1-8]
[화학식 1-9]
[화학식 1-10]
한편, 본 발명의 일 구현예에 따른 에틸렌/알파-올레핀 공중합체의 제조에 있어서, 촉매 조성물은 상기 화학식 1의 전이금속 화합물을 활성화하기 위하여 조촉매를 더 포함할 수 있다.
상기 조촉매는 13족 금속을 포함하는 유기 금속 화합물로서, 구체적으로는 하기 화학식 2의 화합물, 하기 화학식 3의 화합물, 및 하기 화학식 4의 화합물 중 하나 이상을 포함할 수 있다.
[화학식 2]
R41-[Al(R42)-O]n-R43
상기 화학식 2에서,
R41, R42 및 R43은 각각 독립적으로 수소, 할로겐, 탄소수 1 내지 20의 하이드로카빌기 및 할로겐으로 치환된 탄소수 1 내지 20의 하이드로카빌기 중 어느 하나이고,
n은 2 이상의 정수이며,
[화학식 3]
D(R44)3
상기 화학식 3에서, D는 알루미늄 또는 보론이고,
R44는 각각 독립적으로 할로겐, 탄소수 1 내지 20의 하이드로카빌기, 및 할로겐으로 치환된 탄소수 1 내지 20의 하이드로카빌기 중 어느 하나이며,
[화학식 4]
[L-H]+[Z(A)4]- 또는 [L]+[Z(A)4]-
상기 화학식 4에서,
L은 중성 또는 양이온성 루이스 염기이고, H는 수소 원자이며,
Z는 13족 원소이며, A는 각각 독립적으로 탄소수 1 내지 20의 하이드로카빌기; 탄소수 1 내지 20의 하이드로카빌옥시기; 및 이들 치환기의 1 이상의 수소 원자가 할로겐, 탄소수 1 내지 20의 하이드로카빌옥시기 및 탄소수 1 내지 20의 하이드로카빌실릴기 중 1 이상의 치환기로 치환된 치환기들 중 어느 하나이다.
보다 구체적으로 상기 화학식 2의 화합물은 선형, 원형 또는 망상형으로 반복단위가 결합된 알킬알루미녹산계 화합물일 수 있으며, 구체적인 예로는, 메틸알루미녹산(MAO), 에틸알루미녹산, 이소부틸알루미녹산 또는 tert-부틸알루미녹산 등을 들 수 있다.
또한, 상기 화학식 3의 화합물의 구체적인 예로는, 트리메틸알루미늄, 트리에틸알루미늄, 트리이소부틸알루미늄, 트리프로필알루미늄, 트리부틸알루미늄, 디메틸클로로알루미늄, 트리이소프로필알루미늄, 트리-s-부틸알루미늄, 트리사이클로펜틸알루미늄, 트리펜틸알루미늄, 트리이소펜틸알루미늄, 트리헥실알루미늄, 트리옥틸알루미늄, 에틸디메틸알루미늄, 메틸디에틸알루미늄, 트리페닐알루미늄, 트리-p-톨릴알루미늄, 디메틸알루미늄메톡시드, 디메틸알루미늄에톡시드, 트리메틸보론, 트리에틸보론, 트리이소부틸보론, 트리프로필보론 또는 트리부틸보론 등을 들 수 있으며, 특히 트리메틸알루미늄, 트리에틸알루미늄 또는 트리이소부틸알루미늄 중에서 선택될 수 있다.
또한, 상기 화학식 4의 화합물로는 삼치환된 암모늄염, 또는 디알킬 암모늄염, 삼치환된 포스포늄염 형태의 보레이트계 화합물을 들 수 있다. 보다 구체적인 예로는, 트리메탈암모늄 테트라페닐보레이트, 메틸디옥타데실암모늄 테트라페닐보레이트, 트리에틸암모늄 테트라페닐보레이트, 트리프로필암모늄 테트라페닐보레이트, 트리(n-부틸)암모늄 테트라페닐보레이트, 메틸테트라데사이클로옥타데실암모늄 테트라페닐보레이트, N,N-디메틸아닐늄 테트라페닐보레이트, N,N-디에틸아닐늄 테트라페닐보레이트, N,N-디메틸(2,4,6-트리메틸아닐늄)테트라페닐보레이트, 트리메틸암모늄 테트라키스(펜타플로오로페닐)보레이트, 메틸디테트라데실암모늄 테트라키스(펜타페닐)보레이트, 메틸디옥타데실암모늄 테트라키스(펜타플루오로페닐)보레이트, 트리에틸암모늄, 테트라키스(펜타플루오로페닐)보레이트, 트리프로필암모늄테트라키스(펜타프루오로페닐)보레이트, 트리(n-부틸)암모늄 테트라키스(펜타플루오로페닐)보레이트, 트리(2급-부틸)암모늄테트라키스(펜타플루오로페닐)보레이트, N,N-디메틸아닐늄 테트라키스(펜타플루오로페닐)보레이트, N,N-디에틸아닐늄테트라키스(펜타플루오로페닐)보레이트, N,N-디메틸(2,4,6-트리메틸아닐늄)테트라키스(펜타플루오로페닐)보레이트, 트리메틸암모늄테트라키스(2,3,4,6-테트라플루오로페닐)보레이트, 트리에틸암모늄 테트라키스(2,3,4,6-테트라플루오로페닐)보레이트, 트리프로필암모늄 테트라키스(2,3,4,6-테트라플루오로페닐)보레이트, 트리(n-부틸)암모늄 테트라키스(2,3,4,6-,테트라플루오로페닐)보레이트, 디메틸(t-부틸)암모늄 테트라키스(2,3,4,6-테트라플루오로페닐)보레이트, N,N-디메틸아닐늄 테트라키스(2,3,4,6-테트라플루오로페닐)보레이트, N,N-디에틸아닐늄 테트라키스(2,3,4,6-테트라플루오로페닐)보레이트 또는 N,N-디메틸-(2,4,6-트리메틸아닐늄)테트라키스-(2,3,4,6-테트라플루오로페닐)보레이트 등의 삼치환된 암모늄염 형태의 보레이트계 화합물; 디옥타데실암모늄 테트라키스(펜타플루오로페닐)보레이트, 디테트라데실암모늄 테트라키스(펜타플루오로페닐)보레이트 또는 디사이클로헥실암모늄 테트라키스(펜타플루오로페닐)보레이트 등의 디알킬암모늄염 형태의 보레이트계 화합물; 또는 트리페닐포스포늄 테트라키스(펜타플루오로페닐)보레이트, 메틸디옥타데실포스포늄 테트라키스(펜타플루오로페닐)보레이트 또는 트리(2,6-, 디메틸페닐)포스포늄테트라키스(펜타플루오로페닐)보레이트 등의 삼치환된 포스포늄염 형태의 보레이트계 화합물 등을 들 수 있다.
이러한 조촉매의 사용에 의해, 최종 제조된 에틸렌/알파-올레핀 공중합체의 분자량 분포가 보다 균일하게 되면서, 중합 활성이 향상될 수 있다.
상기 조촉매는 상기 화학식 1의 전이금속 화합물의 활성화가 충분히 진행될 수 있도록 적절한 함량으로 사용될 수 있다.
또한, 상기 촉매 조성물은 상기 화학식 1의 전이금속 화합물을 담체에 담지된 형태로 포함할 수 있다.
상기 화학식 1의 전이금속 화합물이 담체에 담지될 경우, 전이 금속 화합물 대 담체의 중량비는 1:10 내지 1:1,000, 보다 구체적으로는 1:10 내지 1:500일 수 있다. 상기한 범위의 중랑비로 담체 및 전이 금속 화합물을 포함할 때, 최적의 형상을 나타낼 수 있다. 또한, 상기 조촉매가 함께 담체에 담지될 경우, 조촉매 대 담체의 중량비는 1:1 내지 1:100, 보다 구체적으로는 1:1 내지 1:50일 수 있다. 상기 중량비로 조촉매 및 담체를 포함할 때, 촉매 활성을 향상시키고, 또 제조되는 중합체의 미세구조를 최적화할 수 있다.
한편, 상기 담체로는 실리카, 알루미나, 마그네시아 또는 이들의 혼합물 등이 사용될 수 있으며, 또는 이들 물질을 고온에서 건조하여 표면에 수분을 제거함으로써 표면에 반응성이 큰 하이드록시기 또는 실록산기를 포함하는 상태로 사용될 수도 있다. 또한, 상기 고온 건조된 담체들은 Na2O, K2CO3, BaSO4 및 Mg(NO3)2 등의 산화물, 탄산염, 황산염, 또는 질산염 성분을 더 포함할 수도 있다.
상기 담체의 건조 온도는 200 내지 800℃가 바람직하고, 300 내지 600℃가 더욱 바람직하며, 300 내지 400℃가 가장 바람직하다. 상기 담체의 건조 온도가 200℃ 미만인 경우 수분이 너무 많아서 표면의 수분과 조촉매가 반응하게 되고, 800℃를 초과하는 경우에는 담체 표면의 기공들이 합쳐지면서 표면적이 줄어들며, 또한 표면에 하이드록시기가 많이 없어지고 실록산기만 남게 되어 조촉매와의 반응자리가 감소하기 때문에 바람직하지 않다.
또한, 상기 담체 표면의 하이드록시기 양은 0.1 내지 10 mmol/g이 바람직하며, 0.5 내지 5 mmol/g일 때 더욱 바람직하다. 상기 담체 표면에 있는 하이드록시기의 양은 담체의 제조방법 및 조건 또는 건조 조건, 예컨대 온도, 시간, 진공 또는 스프레이 건조 등에 의해 조절할 수 있다.
한편, 상기 에틸렌/알파-올레핀 공중합체의 중합반응은 상기한 촉매 조성물의 존재 하에 수소를 연속적으로 투입하며 에틸렌 및 알파-올레핀계 단량체를 연속중합시킴으로써 수행될 수 있다.
이때, 상기 수소 기체는 중합 초기의 전이금속 화합물의 급격한 반응을 억제하고, 중합반응을 종결하는 역할을 한다. 이에 따라 이러한 수소 기체의 사용 및 사용량의 조절에 의해, 좁은 분자량 분포를 가지고 공중합체 내 비닐기 함량이 일정 범위 내로 조절된 에틸렌/알파-올레핀 공중합체가 효과적으로 제조될 수 있다.
예를 들어, 상기 수소 기체는 5 cc/min 이상, 또는 7 cc/min 이상, 또는 10 cc/min 이상, 또는 15 cc/min 이상, 또는 19 cc/min 이상, 또는 22 cc/min 이상일 수 있으며, 100 cc/min 이하, 또는 50 cc/min 이하, 또는 45 cc/min 이하, 또는 35 cc/min 이하, 또는 29 cc/min 이하로 투입될 수 있다. 상기한 조건으로 투입될 때, 제조되는 에틸렌/알파-올레핀 중합체가 본 발명에서의 물성적 특징을 구현할 수 있다. 만약 수소 기체의 함량이 5 cc/min 미만으로 투입되면, 중합반응의 종결이 균일하게 일어나지 않아 원하는 물성을 갖는 에틸렌/알파-올레핀 공중합체의 제조가 어려워질 수 있고, 또한 100 cc/min 를 초과할 경우 종결반응이 지나치게 빨리 일어나 분자량이 지나치게 낮은 에틸렌/알파-올레핀 공중합체가 제조될 우려가 있다.
또한, 상기 중합 반응은 80 내지 200 ℃에서 수행될 수 있으나, 상기한 수소 투입량과 함께 중합 온도를 제어함으로써 에틸렌/알파-올레핀 공중합체 내 비닐기 함량을 더욱 용이하게 조절할 수 있다. 이에 따라 구체적으로 상기 중합 반응 온도는 100 ℃ 이상, 또는 120 ℃ 이상, 또는 140 ℃ 이상일 수 있으며, 190 ℃ 이하, 또는 180 ℃ 이하, 또는 170 ℃ 이하, 또는 160 ℃ 이하일 수 있다.
또한, 상기 중합반응 시에는 반응기 내의 수분을 제거하기 위한 유기 알루미늄 화합물이 더욱 투입되어, 이의 존재 하에 중합 반응이 진행될 수 있다. 이러한 유기 알루미늄 화합물의 구체적인 예로는, 트리알킬알루미늄, 디알킬 알루미늄 할라이드, 알킬 알루미늄 디할라이드, 알루미늄 디알킬 하이드라이드 또는 알킬 알루미늄 세스퀴 할라이드 등을 들 수 있으며, 이의 보다 구체적인 예로는, Al(C2H5)3, Al(C2H5)2H, Al(C3H7)3, Al(C3H7)2H, Al(i-C4H9)2H, Al(C8H17)3, Al(C12H25)3, Al(C2H5)(C12H25)2, Al(i-C4H9)(C12H25)2, Al(i-C4H9)2H, Al(i-C4H9)3, (C2H5)2AlCl, (i-C3H9)2AlCl 또는 (C2H5)3Al2Cl3 등을 들 수 있다. 이러한 유기 알루미늄 화합물은 반응기에 연속적으로 투입될 수 있고, 적절한 수분 제거를 위해 반응기에 투입되는 반응 매질의 1kg 당 약 0.1 내지 10몰의 비율로 투입될 수 있다.
또한, 중합 압력은 약 1 내지 약 100 Kgf/cm2, 바람직하게는 약 70 내지 약 96 Kgf/cm2, 보다 바람직하게는 약 80 내지 약 93 Kgf/cm2일 수 있다.
또한, 담체에 담지된 형태로 전이금속 화합물이 사용될 경우, 상기 전이금속 화합물은 탄소수 5 내지 12의 지방족 탄화수소 용매, 예를 들면 펜탄, 헥산, 헵탄, 노난, 데칸, 및 이들의 이성질체와 톨루엔, 벤젠과 같은 방향족 탄화수소 용매, 디클로로메탄, 클로로벤젠과 같은 염소원자로 치환된 탄화수소 용매 등에 용해하거나 희석 후 투입될 수 있다. 여기에 사용되는 용매는 소량의 알킬 알루미늄 처리함으로써 촉매 독으로 작용하는 소량의 물 또는 공기 등을 제거하여 사용하는 것이 바람직하며, 조촉매를 더 사용하여 실시하는 것도 가능하다.
3. 광학필름용 수지 조성물
본 발명의 다른 구현 예는 본 발명의 에틸렌/알파-올레핀 공중합체를 포함하는 광학필름용 수지 조성물을 제공한다. 본 발명의 광학필름용 수지 조성물은 시트 또는 필름 등의 형상으로 압출될 수 있으며, 이에 특별히 제한되지 않는다.
본 발명의 광학필름용 수지 조성물은 우수한 가교도를 나타낼 수 있다. 예로서, 상기 광학필름용 수지 조성물의 가교도는 55% 이상, 또는 58% 이상, 또는 63% 이상, 또는 67% 이상, 또는 69% 이상일 수 있다.
본 발명의 광학필름용 수지 조성물은 유리전이온도가 -55℃ 내지 -45℃, 또는 -53℃ 내지 -42℃, 또는 -50℃ 내지 -40℃일 수 있다.
또한, 본 발명의 광학필름용 수지 조성물은 에틸렌/알파 올레핀 공중합체의 가교 전, 후에 옐로 인덱스(YI) 및 전광선 투과율(Tt)을 각각 측정한 결과, 가교 후 상기 옐로 인덱스(YI) 및 전광선 투과율(Tt)의 수치가 광학필름에 사용되기 적합한 범위를 충족할 수 있다.
구체적으로, 본 발명의 광학필름용 수지 조성물의 옐로 인덱스(Yellowness Index, 이하, YI) 값은 0.5 이상, 또는 1.0 이상, 또는 1.25 이상, 또는 1.30 이상일 수 있으며, 5.5 이하, 또는 4.9 이하, 또는 4.5 이하, 또는 3.9 이하, 또는 2.9 이하, 또는 1.5 이하, 또는 1.2 이하일 수 있다. 상기 YI 값이 작을수록, 광학필름의 품질 안정성이 보정된다.
특히, 본 발명의 광학필름용 수지 조성물에 대해 가교 수행 후 옐로 인덱스를 측정한 경우 보다 우수한 수치를 나타낼 수 있다. 예로서, 상기 가교 수행 후 옐로 인덱스는 0.5 이상, 또는 0.7 이상, 또는 0.9 이상, 또는 1.0 이상일 수 있으며, 1.5 이하, 또는 1.48 이하, 또는 1.3 이하, 또는 1.2 이하일 수 있다.
상기 옐로 인덱스란, 자외선에 노출될 경우, 상기 수지 조성물의 황변 현상을 정량화한 값으로서, ASTM D1925에 준거하여, UV/Vis 스펙트로미터를 이용하여 측정될 수 있다. 예를 들어, 상기 UV/Vis 스펙트로미터를 이용하여, 상기 수지 조성물의 400 nm 내지 700 nm의 파장 영역의 반사율을 측정하고, 이를 이용하여 하기 식 4에 의하여 옐로 인덱스 값을 계산할 수 있다.
[식 4]
YI = [100(1.28XCIE - 1.06ZCIE)] / YCIE
상기 식 4에서, YI는 UV/VIS/NIR 스펙트로미터에서 색차 분석 프로그램을 이용하여 계산된 값으로, XCIE, YCIE, ZCIE는 각각 빨강, 초록, 파랑 색 좌표가 나타내는 상대적인 값이다.
또한, 본 발명의 광학필름용 수지 조성물은 우수한 광선 투과율을 가질 수 있다. 일 예로서, 150℃의 온도에서 시트 형상의 상기 수지 조성물을 가교한 후에 헤이즈미터로 측정한 전광선 투과율(Tt)은 하기 식 5를 충족할 수 있다.
[식 5]
Tt ≥ 90.0 %
상기 전광선 투과율은 200 nm 이상의 파장의 빛, 예를 들어, 300 nm, 350 nm, 400 nm, 450 nm, 500 nm, 550 nm 또는 600 nm의 빛의 파장에 대하여, 헤이즈미터로 측정된 값일 수 있으며, 바람직하게는 550 nm 파장의 빛에 대하여, 헤이즈미터로 측정된 값일 수 있다. 상기에서 측정된 상기 수지 조성물의 전광선 투과율은 시트 형상의 수지 조성물이 가교된 후의 전광선 투과율을 나타내며, 상기 시트 형상의 수지 조성물은 진공 라미네이터를 통하여 라미네이트될 수 있다.
본 발명의 광학필름용 수지 조성물의 전광선 투과율은 150℃의 온도에서 상기 시트 형상의 수지 조성물을 가교 후에 측정된 값이 90 % 이상, 또는 90.2 % 이상, 또는 90.5 % 이상, 또는 90.9 % 이상, 또는 91 % 이상, 또는 92 % 이상일 수 있다. 또한, 광학 장치의 광전 효율을 고려하여, 전술한 범위의 전광선 투과율을 가지도록 조절될 수 있다.
또한, 본 발명의 광학필름용 수지 조성물을 이용하여 변성 수지 조성물, 예를 들어, 실란 변성 수지 조성물 또는 아미노 실란 변성 수지 조성물을 제조할 수 있다.
예로서, 본 발명의 광학필름용 수지 조성물은 본 발명의 에틸렌/알파-올레핀 공중합체 외에도 공지의 불포화 실란 화합물, 아미노 실란 화합물, 가교제 및 가교 조제를 추가로 포함할 수 있다.
상기 불포화 실란 화합물은 라디칼 개시제 등의 존재 하에서 본 발명 공중합체의 단량체의 중합단위를 포함하는 주쇄에 그래프팅(grafting)되어 실란 변성 수지 조성물 또는 아미노 실란 변성 수지 조성물에 중합된 형태로 포함될 수 있다.
일 예로서, 상기 불포화 실란 화합물은 비닐트리메톡시 실란, 비닐트리에톡시 실란, 비닐트리프로폭시 실란, 비닐트리이소프로폭시 실란, 비닐트리부톡시 실란, 비닐트리펜톡시 실란, 비닐트리페녹시 실란, 또는 비닐트리아세톡시 실란 등일 수 있고, 일 예로서 이 중 비닐트리메톡시 실란 또는 비닐트리에톡시 실란을 사용할 수 있으나, 이에 제한되는 것은 아니다.
또한, 상기 아미노 실란 화합물은 에틸렌/알파-올레핀 공중합체의 그래프팅 변성 단계에서 본 발명의 공중합체의 주쇄에 그래프팅된 불포화 실란 화합물, 예컨대 비닐트리에톡시실란의 알콕시기와 같은 반응성 관능기를 히드록시기로 전환하는 가수분해 반응을 촉진시키는 촉매로서 작용함으로써, 상 하부의 유리기판 또는 불소 수지 등으로 구성되는 이면 시트와 접착 강도를 보다 향상시킬 수 있다. 또한 이와 동시에, 상기 아미노 실란 화합물은 직접 공중합 반응에 반응물로서도 관여함으로써, 아미노 실란 변성 수지 조성물에 아민 관능기를 가지는 모이어티를 제공할 수 있다.
상기 아미노 실란 화합물로는 아민기를 포함하는 실란 화합물로서, 1차 아민, 2차 아민이면, 특별히 제한되지 아니한다. 예를 들어, 아미노 실란 화합물로는 아미노트리알콕시실란, 아미노디알콕시실란 등을 사용할 수 있으며, 예로는 3-아미노프로필트리메톡시실란(3-aminopropyltrimethoxysilane; APTMS), 3-아미노프로필트리에톡시실란(3-aminopropyltriethoxysilane; APTES), 비스[(3-트리에톡시실릴)프로필]아민, 비스[(3-트리메톡시실릴)프로필]아민, 3-아미노프로필메틸디에톡시실란, 3-아미노프로필메틸디메톡시실란, N-[3-(트리메톡시실릴)프로필]에틸렌디아민 (N-[3-(Trimethoxysilyl)propyl]ethylenediamine; DAS), 아미노에틸아미노프로필트리에톡시실란, 아미노에틸아미노프로필메틸디메톡시실란, 아미노에틸아미노프로필메틸디에톡시실란, 아미노에틸아미노메틸트리에톡시실란, 아미노에틸아미노메틸메틸디에톡시실란, 디에틸렌트리아미노프로필트리메톡시실란, 디에틸렌트리아미노프로필트리에톡시실란, 디에틸렌트리아미노프로필메틸디메톡시실란, 디에틸렌아미노메틸메틸디에톡시실란, (N-페닐아미노)메틸트리메톡시실란, (N-페닐아미노)메틸트리에톡시실란, (N-페닐아미노)메틸메틸디메톡시실란, (N-페닐아미노)메틸메틸디에톡시실란, 3-(N-페닐아미노)프로필트리메톡시실란, 3-(N-페닐아미노)프로필트리에톡시실란, 3-(N-페닐아미노)프로필메틸디메톡시실란, 3-(N-페닐아미노)프로필메틸디에톡시실란, 및 N-(N-부틸)-3-아미노프로필트리메톡시실란으로 이루어진 군에서 선택되는 1종 이상을 들 수 있다. 상기 아미노 실란 화합물은 단독으로 또는 혼합하여 사용할 수 있다.
상기 수지 조성물에서, 상기 불포화 실란 화합물 및/또는 아미노 실란 화합물의 함량은 특별히 한정되지 않는다.
상기 가교제는 실란 변성 수지 조성물의 제조 단계에서는 라디칼 개시제로서, 수지 조성물에 불포화 실란 화합물이 그래프트되는 반응을 개시하는 역할을 할 수 있다. 또한, 광전자 장치의 제조 시에 라미네이션하는 단계에서 상기 실란 변성 수지 조성물 사이 또는 실란 변성 수지 조성물과 비변성 수지 조성물 사이의 가교 결합을 형성함으로써, 최종 제품, 예컨대 봉지재 시트의 내열 내구성을 향상시킬 수 있다.
상기 가교제는, 비닐기의 라디칼 중합을 개시할 수 있거나, 가교 결합을 형성할 수 있는 가교성 화합물이라면, 기술 분야에서 공지된 다양한 가교제를 다양하게 사용할 수 있으며, 예를 들면, 유기 과산화물, 히드로과산화물 및 아조 화합물로 이루어진 군에서 선택되는 1종 또는 2종 이상을 사용할 수 있다.
구체적으로는, t-부필큐밀퍼옥사이드, 디-t-부틸 퍼옥사이드, 디-큐밀 퍼옥사이드, 2,5-디메틸-2,5-디(t-부틸퍼옥시)헥산, 2,5-디메틸-2,5-디(t-부틸퍼옥시)-3-헥신 등의 디알킬 퍼옥사이드류; 큐멘 히드로퍼옥사이드, 디이소프로필 벤젠 히드로 퍼옥사이드, 2,5-디메틸-2,5-디(히드로퍼옥시)헥산, t-부틸히드로퍼옥사이드 등의 히드로 퍼옥사이드류; 비스-3,5,5-트리메틸헥사노일 퍼옥사이드, 옥타노일퍼옥사이드, 벤조일 퍼옥사이드, o-메틸벤조일퍼옥사이드, 2,4-디클로로벤조일 퍼옥사이드 등의 디아실퍼옥사이드류; t-부틸퍼옥시 아이소 부틸레이트, t-부틸퍼옥시 아세테이트, t-부틸퍼옥시-2-에틸헥사노에이트, t-부틸퍼옥시 피바레이트, t-부틸퍼옥시 옥토에이트, t-부틸퍼옥시아이소프로필 카보네이트, t-부틸퍼옥시벤조에이트, 디-t-부틸퍼옥시프탈레이트, 2,5-디메틸-2,5-디(벤조일퍼옥시)헥산, 2,5-디메틸-2,5-디(벤조일퍼옥시)-3-헥신 등의 퍼옥시 에스터류; 및 메틸에틸케톤 퍼옥사이드, 사이클로헥사논 퍼옥사이드 등의 케톤 퍼옥사이드류, 라우릴 퍼옥사이드, 아조비스이소부티로니트릴 및 아조비스(2,4-디메틸발레로니트릴) 등의 아조 화합물로 이루어진 군에서 선택된 1종 이상을 들 수 있으나, 이에 제한되는 것은 아니다.
상기 유기 과산화물은 120℃ 내지 135℃, 예를 들어, 120℃ 내지 130℃, 120℃? 내지 125℃, 바람직하게는 121℃의 1시간 반감기 온도를 가지는 유기 과산화물일 수 있다. 상기에서 "1 시간 반감기 온도"란 상기 가교제의 반감기가 1시간이 되는 온도를 의미한다. 상기 1시간 반감기 온도에 따라, 라디칼 개시 반응이 효율적으로 일어나는 온도가 상이해지며, 따라서, 전술한 범위의 1시간 반감기 온도를 가지는 유기 과산화물을 가교제로서 사용할 경우, 광전자 장치를 제조하기 위한 라미네이션 공정 온도에서 라디칼 개시 반응, 즉, 가교 반응이 효과적으로 진행될 수 있다.
상기 가교제는 상기 수지 조성물 100 중량부에 대하여 0.01 내지 1 중량부, 예를 들면, 0.05 내지 0.55, 0.1 내지 0.5 또는 0.15 내지 0.45 중량부의 함량으로 포함되며, 상기 가교제가 0.01 중량부 미만으로 포함될 경우, 내열 특성의 향상 효과가 미미하며, 1 중량부를 초과하여 포함될 경우 봉지재 시트의 성형성이 감소하여, 공정상 제약이 발생하는 문제가 발생할 수 있으며, 봉지재의 물성에 영향을 줄 수 있다.
또한, 본 발명의 수지 조성물은, 상기 가교제 이외에도, 가교 조제를 포함할 수 있다. 상기 가교 조제가 수지 조성물에 포함됨으로써, 전술한 가교제에 의한 수지 조성물 사이의 가교도를 높일 수 있으며, 이에 따라 최종 제품, 예컨대 봉지재 시트의 내열 내구성을 보다 향상시킬 수 있다.
상기 가교 조제는 수지 조성물 100 중량부에 대하여 0.01 내지 0.5 중량부, 예를 들면, 0.01 내지 0.3, 0.015 내지 0.2 또는 0.016 내지 0.16 중량부의 함량으로 포함되며, 상기 가교 조제가 0.01 중량부 미만으로 포함될 경우, 내열 특성의 향상 효과가 미미하며, 0.5 중량부를 초과하여 포함될 경우 최종 제품, 예컨대 봉지재 시트의 물성에 영향을 미치는 문제가 발생하고 생산 단가가 증가할 수 있다
상기 가교 조제는 기술 분야에서 공지된 다양한 가교 조제를 사용할 수 있으며, 예를 들어, 상기 가교 조제로서, 알릴기 또는 (메타)아크릴옥시기 등의 불포화기를 적어도 하나 이상 함유하는 화합물을 사용할 수 있다.
상기 알릴기를 함유하는 화합물은 예를 들어, 트리알릴이소시아누레이트, 트리알릴 시아누레이트, 디알릴 프탈레이트, 디알릴 푸마레이트 또는 디알릴 말레에이트와 같은 폴리 알릴화합물이 예시될 수 있으며, 상기 (메타)아크릴 옥시기를 함유하는 화합물은 예를 들어, 에틸렌글리콜 디아크릴레이트, 에틸렌글리콜 디메타크릴레이트, 트리메틸올프로판 트라이메타크릴레이트, t-부틸 1-(2-에틸헥실) 모노퍼옥시카보네이트(TBEC), 메타크릴옥시프로필트리메톡시실란(MEMO) 등이 예시될 수 있으나, 특별히 이에 제한되는 것은 아니다.
또한, 본 발명의 수지 조성물은, 필요에 따라 광안정제, UV 흡수제 및 열안정제 등으로부터 선택되는 1종 이상의 첨가제를 추가로 포함할 수 있다.
상기 광안정제는, 상기 조성물이 적용되는 용도에 따라서 수지의 광열화 개시의 활성종을 포착하여, 광산화를 방지하는 역할을 할 수 있다. 사용할 수 있는 광안정제의 종류는 특별히 제한되지 않고, 예를 들면, 힌더드 아민계 화합물 또는 힌더드 피페리딘계 화합물 등과 같은 공지의 화합물을 사용할 수 있다.
상기 UV 흡수제는, 조성물의 용도에 따라서, 태양광 등으로부터의 자외선을 흡수하여, 분자 내에서 무해한 열 에너지로 변환시켜, 수지 조성물 중의 광열화 개시의 활성종이 여기되는 것을 방지하는 역할을 할 수 있다. 사용할 수 있는 UV 흡수제의 구체적인 종류는 특별히 제한되지 않으며, 예를 들면, 벤조페논계, 벤조트리아졸계, 아크릴니트릴계, 금속 착염계, 힌더드 아민계, 초미립자 산화 티탄 또는 초미립자 산화 아연 등의 무기계 UV 흡수제 등의 1종 또는 2종 이상의 혼합물을 사용할 수 있다.
또한, 상기 열안정제의 예로는, 트리스(2,4-디-tert-부틸페닐)포스파이트, 비스[2,4-비스(1,1-디메틸에틸)-6-메틸페닐]에틸에스테르 아인산, 테트라키스(2,4-디-tert-부틸페닐)[1,1-비페닐]-4,4'-디일비스포스포네이트 및 비스(2,4-디-tert-부틸페닐)펜타에리쓰리톨디포스파이트 등의 인계 열안정제; 8-히드록시-5,7-디-tert-부틸-푸란-2-온과 o-크실렌과의 반응 생성물 등의 락톤계 열안정제를 들 수 있고, 상기 중 1종 또는 2종 이상을 사용할 수 있다.
상기 수지 조성물에서, 상기 광안정제, UV 흡수제 및/또는 열안정제의 함량은 특별히 한정되지 않는다. 즉, 상기 첨가제의 함량은, 수지 조성물의 용도, 첨가제의 형상이나 밀도 등을 고려하여 적절히 선택할 수 있고, 통상적으로 수지 조성물의 전체 고형분 100 중량부에 대하여 0.01 중량부 내지 5 중량부의 범위 내에서 적절히 조절될 수 있다.
또한, 상기 수지 조성물은, 상기 성분 외에도, 수지 성분이 적용되는 용도에 따라, 해당 분야에서 공지되어 있는 다양한 첨가제를 적절히 추가로 포함할 수 있다.
또한, 본 발명의 광학필름용 수지 조성물은 다양한 광전자 장치(optoelectronic device)에서 소자를 캡슐화하는 봉지재(Encapsulant)로 사용될 수 있으나, 이에 제한되는 것은 아니며, 예를 들어 승온 라미네이션 공정 등에 적용되는 산업용 소재로도 사용될 수 있다.
4. 광학필름
본 발명의 다른 구현 예는 상기 수지 조성물을 포함하는 광학필름을 제공한다.
본 발명의 광학필름은 상기 수지 조성물을 필름 또는 시트 형상으로 성형함으로써 제조할 수 있다. 이와 같은 성형 방법은 특별히 제한되지 않으며, 예를 들면, T 다이 공정 또는 압출 등과 같은 통상적인 공정으로 시트화 또는 필름화하여 제조할 수 있다. 예를 들어, 상기 광학필름의 제조는 상기 수지 조성물을 이용한 변성 수지 조성물의 제조 및 필름화 또는 시트화 공정이 서로 연결되어 있는 장치를 사용하여 인-시츄(in situ) 공정으로 수행할 수 있다.
상기 광학필름의 두께는 광전자 장치에서 소자의 지지 효율 및 파손 가능성, 장치의 경량화나 작업성 등을 고려하여, 약 10 ㎛ 내지 2,000 ㎛, 또는 약 100 ㎛ 내지 1250 ㎛으로 조절할 수 있으며, 구체적인 용도에 따라서 변경될 수 있다.
실시예
이하, 본 발명의 이해를 돕기 위하여 바람직한 실시예를 제시한다. 그러나 하기의 실시예는 본 발명을 보다 쉽게 이해하기 위하여 제공되는 것일 뿐, 이에 의해 본 발명의 내용이 한정되는 것은 아니다.
[합성예 1: 전이금속 화합물의 제조]
단계 1: 리간드 화합물(1a-1)의 제조
250 mL 쉬렝크 플라스크에 1,2-디메틸-3H-벤조[b]시클로펜타[d]티오펜 10 g(1.0 eq, 49.925 mmol)과 THF 100 mL를 넣고, n-BuLi 22 mL(1.1 eq, 54.918 mmol, 2.5 M in 헥산)을 -30℃에서 적가한 후, 상온에서 3시간 동안 교반하였다. 교반한 Li-complex THF 용액을 디클로로(메틸)(페닐)실란 8.1 mL(1.0 eq, 49.925 mmol)와 THF 70 mL가 담긴 쉬렝크 플라스크에 -78℃에서 캐뉼레이션 한 후 상온에서 밤새 교반하였다. 교반 후 진공건조 한 다음, 헥산 100 mL로 추출하였다.
추출한 클로로-1-(1,2-디메틸-3H-벤조[b]시클로펜타[d]티오펜-3-일)-1,1-(메틸)(페닐)실란 헥산 용액 100 mL에 t-BuNH2 42 mL(8 eq, 399.4 mmol)를 상온에서 투입한 후, 상온에서 밤새 교반하였다. 교반 후 진공건조한 다음, 헥산 150 mL로 추출하였다. 용매 건조 후 노란색 고체 13.36 g(68 %, dr = 1:1)을 얻었다.
(1a-1)
1H NMR(CDCl3, 500 MHz): δ 7.93(t, 2H), 7.79(d,1H), 7.71(d,1H), 7.60(d, 2H), 7.48(d, 2H), 7.40~7.10(m, 10H, aromatic), 3.62(s, 1H), 3.60(s, 1H), 2.28(s, 6H), 2.09(s, 3H), 1.76(s, 3H), 1.12(s, 18H), 0.23(s, 3H), 0.13(s, 3H)
단계 2: 전이금속 화합물(1a)의 제조
100 mL 쉬렝크 플라스크에 상기 화학식 2-4의 리간드 화합물 4.93 g(12.575 mmol, 1.0 eq)과 톨루엔 50 mL(0.2M)를 넣고 n-BuLi 10.3 mL(25.779 mmol, 2.05 eq, 2.5M in 헥산)를 -30℃에서 적가한 후, 상온에서 밤새 교반하였다. 교반 후에 MeMgBr 12.6 mL(37.725 mmol, 3.0 eq, 3.0 M in 디에틸에터)를 적가한 후, TiCl4 13.2 mL(13.204 mmol, 1.05 eq, 1.0 M in 톨루엔)를 순서대로 넣고 상온에서 밤새 교반하였다. 교반 후 진공건조한 다음 헥산 150 mL로 추출하고, 50 mL까지 용매를 제거한 후에 DME 4 mL(37.725 mmol, 3.0eq)를 적가한 후, 상온에서 밤새 교반하였다. 다시 진공건조한 후 헥산 150 mL로 추출하였다. 용매 건조 후 갈색 고체 2.23 g(38 %, dr = 1:0.5)을 얻었다.
(1a)
1H NMR(CDCl3, 500 MHz): δ 7.98(d, 1H), 7.94(d, 1H), 7.71(t, 6H), 7.50~7.30(10H), 2.66(s, 3H), 2.61(s, 3H), 2.15(s, 3H), 1.62(s, 9H), 1.56(s, 9H), 1.53(s, 3H), 0.93(s, 3H), 0.31(s, 3H), 0.58(s, 3H), 0.51(s, 3H), -0.26(s, 3H), -0.39(s, 3H)
[합성예 2: 전이금속 화합물의 제조]
단계 1: 리간드 화합물(2a-1)의 제조
(i) 리튬 카바메이트의 제조
1,2,3,4-테트라히드로퀴놀린(13.08 g, 98.24 mmol)과 디에틸에테르(150 mL)를 쉬렝크(shlenk) 플라스크에 넣었다. 드라이 아이스와 아세톤으로 만든 -78 ℃ 저온조에 상기 쉬렝크 플라스크를 담궈 30분간 교반하였다. 이어서, n-BuLi(39.3 mL, 2.5 M, 98.24 mmol)을 질소 분위기 하에 주사기로 투입하였고, 연한 노란색의 슬러리가 형성되었다. 이어서, 플라스크를 2시간 동안 교반한 후에, 생성된 부탄 가스를 제거하면서 상온으로 플라스크의 온도를 올렸다. 플라스크를 다시 -78℃ 저온조에 담가 온도를 낮춘 후 CO2 가스를 투입하였다. 이산화탄소 가스를 투입함에 따라 슬러리가 없어지면서 투명한 용액이 되었다. 플라스크를 버블러(bubbler)에 연결하여 이산화탄소 가스를 제거하면서 온도를 상온으로 올렸다. 그 후에, 진공 하에서 여분의 CO2 가스와 용매를 제거하였다. 드라이박스로 플라스크를 옮긴 후 펜탄을 가하고 심하게 교반한 후 여과하여 흰색 고체 화합물인 리튬 카바메이트를 얻었다. 상기 흰색 고체 화합물은 디에틸에테르가 배위결합 되어있다. 이때 수율은 100% 이다.
1H NMR(C6D6, C5D5N) : δ 1.90 (t, J = 7.2 Hz, 6H, ether), 1.50 (br s, 2H, quin-CH2), 2.34 (br s, 2H, quin-CH2), 3.25 (q, J = 7.2 Hz, 4H, ether), 3.87 (br, s, 2H, quin-CH2), 6.76 (br d, J = 5.6 Hz, 1H, quin-CH) ppm
13C NMR(C6D6) : δ 24.24, 28.54, 45.37, 65.95, 121.17, 125.34, 125.57, 142.04, 163.09(C=O) ppm
(ii) 8-(2,3,4,5-테트라메틸-1,3-시클로펜타디에닐)-1,2,3,4-테트라하이드로퀴놀린 (8-(2,3,4,5-Tetramethyl-1,3-cyclopentadienyl)-1,2,3,4-tetrahydroquinoline)의 제조
상기 단계 (i)에서 제조된 리튬 카바메이트 화합물(8.47 g, 42.60 mmol)을 쉬렝크 플라스크에 넣었다. 이어서, 테트라히드로퓨란(4.6 g, 63.9 mmol)과 디에틸에테르 45 mL를 차례로 넣었다. 아세톤과 소량의 드라이 아이스로 만든 -20℃ 저온조에 상기 쉬렝크 플라스크를 담가 30분간 교반한 후, t-BuLi(25.1 mL, 1.7 M, 42.60 mmol)을 넣었다. 이때 반응 혼합물의 색깔이 붉은색으로 변했다. -20℃를 계속 유지하면서 6시간 동안 교반하였다. 테트라히드로퓨란에 녹아있는 CeCl3·2LiCl 용액(129 mL, 0.33 M, 42.60 mmol)과 테트라메틸씨클로펜티논(5.89 g, 42.60 mmol)을 주사기 안에서 섞어준 다음, 질소 분위기하에서 플라스크로 투입하였다. 플라스크의 온도를 상온으로 천천히 올리다가 1시간 후에 항온조를 제거하고 온도를 상온으로 유지하였다. 이어서, 상기 플라스크에 물(15 mL)을 첨가한 후, 에틸아세테이트를 넣고 여과해서 여액을 얻었다. 그 여액을 분별 깔때기에 옮긴 후에 염산(2 N, 80 mL)을 넣어서 12분간 흔들어주었다. 그리고, 포화 탄산수소나트륨 수용액(160 mL)를 넣어서 중화한 후에 유기층을 추출하였다. 이 유기층에 무수황산마그네슘을 넣어 수분을 제거하고 여과한 후, 그 여액을 취하고 용매를 제거하였다. 얻어진 여액을 헥산과 에틸아세테이트 (v/v, 10 : 1) 용매를 사용하여 컬럼 크로마토그래피 방법으로 정제하여 노란색 오일을 얻었다. 수율은 40% 이었다.
(2a-1)
1H NMR(C6D6) : δ 1.00 (br d, 3H, Cp-CH3), 1.63 - 1.73 (m, 2H, quin-CH2), 1.80 (s, 3H, Cp-CH3), 1.81 (s, 3H, Cp-CH3), 1.85 (s, 3H, Cp-CH3), 2.64 (t, J = 6.0 Hz, 2H, quin-CH2), 2.84 - 2.90 (br, 2H, quin-CH2), 3.06 (br s, 1H, Cp-H), 3.76 (br s, 1H, N-H), 6.77 (t, J = 7.2 Hz, 1H, quin-CH), 6.92 (d, J = 2.4 Hz, 1H, quin-CH), 6.94 (d, J = 2.4 Hz, 1H, quin-CH) ppm
단계 2: 전이금속 화합물(2a)의 제조
(i) [(1,2,3,4-테트라하이드로퀴놀린-8-일)테트라메틸사이클로펜타디에닐 - η
5, κ-N]디리튬 화합물의 제조
드라이 박스 안에서 상기 단계 (1)을 통하여 제조된 8-(2,3,4,5-테트라메틸-1,3-시클로펜타디에닐)-1,2,3,4-테트라하이드로퀴놀린(8.07 g, 32.0 mmol)과 디에틸에테르 140 mL를 둥근 플라스크에 넣은 후, -30℃로 온도를 낮추고, n-BuLi (17.7 g, 2.5 M, 64.0 mmol)을 교반하면서 천천히 넣었다. 온도를 상온으로 올리면서 6시간동안 반응시켰다. 그 후에, 디에틸에테르로 여러 번 씻어내면서 여과하여 고체를 얻었다. 진공을 걸어 남아 있는 용매를 제거하여 노란색 고체인 디리튬 화합물(9.83 g)을 얻었다. 수율은 95%였다.
1H NMR(C6D6, C5D5N) : δ 2.38 (br s, 2H, quin-CH2), 2.53 (br s, 12H, Cp-CH3), 3.48 (br s, 2H, quin-CH2), 4.19 (br s, 2H, quin-CH2), 6.77 (t, J = 6.8 Hz, 2H, quin-CH), 7.28 (br s, 1H, quin-CH), 7.75 (brs, 1H, quin-CH) ppm
(ii) (1,2,3,4-테트라하이드로퀴놀린-8-일)테트라메틸사이클로펜타디에닐-η
5, κ-N]티타늄 디메틸 ([(1,2,3,4-Tetrahydroquinolin-8-yl)tetramethylcyclopentadienyl-eta5,kapa-N]titanium dimethyl)의 제조
드라이 박스 안에서 TiCl4·DME (4.41 g, 15.76 mmol)와 디에틸에테르(150 mL)를 둥근 플라스크에 넣고 -30℃에서 교반하면서 MeLi(21.7 mL, 31.52 mmol, 1.4 M)을 천천히 넣었다. 15분 동안 교반한 후에 상기 단계 (i)에서 제조된 [(1,2,3,4-테트라하이드로퀴놀린-8-일)테트라메틸사이클로펜타디에닐 - η
5, κ-N]디리튬 화합물(5.30 g, 15.76 mmol)을 플라스크에 넣었다. 온도를 상온으로 올리면서 3시간 동안 교반하였다. 반응이 끝난 후, 진공을 걸어 용매를 제거하고, 펜탄에 녹인 후 여과하여 여액을 취하였다. 진공을 걸어 펜탄을 제거하면 진한 갈색의 화합물(3.70 g)이 얻어졌다. 수율은 71.3% 이었다.
(2a)
1H NMR(C6D6) : δ 0.59 (s, 6H, Ti-CH3), 1.66 (s, 6H, Cp-CH3), 1.69 (br t, J = 6.4 Hz, 2H, quin-CH2), 2.05 (s, 6H, Cp-CH3), 2.47 (t, J = 6.0 Hz, 2H, quin-CH2), 4.53 (m, 2H, quin-CH2), 6.84 (t, J = 7.2 Hz, 1H, quin-CH), 6.93 (d, J =7.6 Hz, quin-CH), 7.01 (d, J =6.8 Hz, quin-CH) ppm
13C NMR(C6D6) : δ 12.12, 23.08, 27.30, 48.84, 51.01, 119.70, 119.96, 120.95, 126.99, 128.73, 131.67, 136.21 ppm.
[에틸렌/알파-올레핀 공중합체의 제조]
실시예 1
1.5L 오토클레이브 연속 공정 반응기에 헥산 용매(5.5 kg/h)와 1-부텐(0.8 kg/h)을 채운 후, 반응기 상단의 온도를 155℃로 예열하였다. 트리이소부틸알루미늄 화합물(0.05 mmol/min), 촉매로서 상기 합성예 1에서 제조한 전이금속 화합물(1a)(0.15μmol/min), 디메틸아닐리늄 테트라키스(펜타플루오로페닐) 보레이트 조촉매(0.15μmol/min)를 동시에 반응기로 투입하였다. 이어서, 상기 오토클레이브 반응기 속으로 에틸렌(0.87 kg/h) 및 수소 가스(25 cc/min)을 투입하여 89 bar의 압력 및 중합 온도 140℃에서 60분 이상 유지하며 공중합 반응을 연속 진행하여 공중합체를 제조하였다.
다음으로, 남은 에틸렌 가스를 빼내고, 결과로 수득된 공중합체 함유 용액을 진공 오븐에서 12시간 이상 건조한 후, 수득한 베일(bale) 형태의 공중합체에 대해 물성을 측정하였다.
실시예 2 내지 14 및 비교예 1 내지 6
하기 표 1에 기재된 함량으로 반응물질들을 투입하는 것을 제외하고는 상기 실시예 1에서와 동일한 방법으로 수행하여 실시예 2 내지 14의 중합체를 제조하였다.
또한, 합성예 2에서 제조한 전이금속 화합물(2a)를 사용하되, 하기 표 1에 기재된 함량으로 반응물질들을 투입하는 것을 제외하고는 상기 실시예 1에서와 동일한 방법으로 비교예 4 내지 6의 중합체를 제조하였다.
한편, 비교예 1로는 엘지화학의 LC885X 제품을 구입하고, 비교예 2로는 Mitsui사의 DF8200 제품을 구입하며, 비교예 3으로는 Mitsui사의 DF610 제품을 구입하여 사용하였다.
| C2 | C6 | 1-C4 | H2 | Cat. | Co-cat. | 중합온도 | |
| Kg/h | sccm | μmol/min | ℃ | ||||
| 실시예 1 | 0.87 | 5.5 | 0.8 | 25 | 0.15 | 0.15 | 140 |
| 실시예 2 | 0.87 | 5.5 | 0.8 | 26 | 0.25 | 0.375 | 144 |
| 실시예 3 | 0.87 | 5.5 | 0.9 | 15 | 0.3 | 0.45 | 160 |
| 실시예 4 | 0.87 | 5.5 | 0.8 | 20 | 0.075 | 1 | 140 |
| 실시예 5 | 0.87 | 5.5 | 0.8 | 20 | 0.25 | 0.04 | 140 |
| 실시예 6 | 0.87 | 5.5 | 0.7 | 22 | 0.075 | 0.5 | 140 |
| 실시예 7 | 0.87 | 5.5 | 0.7 | 22 | 0.25 | 0.04 | 140 |
| 실시예 8 | 0.87 | 5.5 | 0.85 | 24 | 0.25 | 0.375 | 155 |
| 실시예 9 | 0.87 | 5.5 | 0.8 | 10 | 0.25 | 0.375 | 148 |
| 실시예 10 | 0.87 | 5.5 | 0.8 | 10 | 0.25 | 0.375 | 146 |
| 실시예 11 | 0.87 | 5.5 | 0.85 | 24 | 0.25 | 0.375 | 152 |
| 실시예 12 | 0.87 | 5.5 | 0.85 | 24 | 0.25 | 0.375 | 161 |
| 실시예 13 | 0.87 | 5.5 | 0.85 | 24 | 0.25 | 0.375 | 172 |
| 실시예 14 | 0.87 | 7.0 | 0.83 | 16 | 0.17 | 0.34 | 140 |
| 비교예 4 | 0.87 | 5.5 | 0.45 | 6 | 0.30 | 0.90 | 160 |
| 비교예 5 | 0.87 | 5.5 | 0.43 | 6 | 0.24 | 0.72 | 160 |
| 비교예 6 | 0.87 | 5.0 | 0.62 | 0 | 0.32 | 0.96 | 145 |
| 비교예 7 | 0.87 | 5.5 | 0.7 | 0 | 0.33 | 0.74 | 165 |
또한, 실시예 1 내지 14 및 비교예 1 내지 7의 공중합체 내 탄소원자 1000개당 비닐렌, 트라이비닐, 비닐 및 비닐리덴의 각 작용기의 개수를 하기 방법에 따라 핵자기 분광 분석을 통해 측정하여 표 2에 나타냈다.
① 공중합체를 1,1,2,2-테트라클로로에탄 D2 (TCE-d2) 용매에 용해시킨 후 393K에서 Bruker AVANCE III 500MHz NMR 장비를 사용하여 측정하였다.
② 1H NMR 스펙트럼에서 TCE-d2 피크를 6.0 ppm 으로 보정하고, 1.4 ppm과 0.96 ppm 영역의 적분값을 이용하여 공단량체의 함량비를 계산하였다. 4.7 ppm ~ 5.6 ppm 에서 관찰되는 비닐기, 비닐리덴기, 비닐렌기 및 트라이비닐렌기 각각의 함량을 계산하였다(분석법: AMT-3863). Peak assignment는 문헌 [Macromolecules 2014, 47, 3282-3790] 을 참조하였다.
| 상대적 함량 (개수/1000C) | 비닐/Total | 비닐리덴/Total | 트라이비닐/Total (%) | |||||
| 비닐렌 | 트라이비닐 | 비닐 | 비닐리덴 | Total | ||||
| 실시예 1 | 0.1 | 0.04 | 0.05 | 0.02 | 0.2 | 0.25 | 0.1 | 0.20 |
| 실시예 2 | 0.16 | 0.02 | 0.06 | 0.02 | 0.26 | 0.23 | 0.08 | 0.08 |
| 실시예 3 | 0.19 | 0.04 | 0.1 | 0.03 | 0.36 | 0.28 | 0.08 | 0.11 |
| 실시예 4 | 0.1 | 0.02 | 0.07 | 0.06 | 0.25 | 0.28 | 0.24 | 0.08 |
| 실시예 5 | 0.08 | 0.02 | 0.05 | 0.04 | 0.2 | 0.25 | 0.2 | 0.10 |
| 실시예 6 | 0.07 | 0.03 | 0.05 | 0.04 | 0.19 | 0.26 | 0.21 | 0.16 |
| 실시예 7 | 0.06 | 0.02 | 0.05 | 0.04 | 0.17 | 0.29 | 0.24 | 0.12 |
| 실시예 8 | 0.12 | 0.07 | 0.07 | 0.01 | 0.27 | 0.26 | 0.04 | 0.26 |
| 실시예 9 | 0.11 | 0.07 | 0.07 | 0.01 | 0.25 | 0.28 | 0.04 | 0.28 |
| 실시예 10 | 0.11 | 0.06 | 0.08 | 0.01 | 0.25 | 0.32 | 0.04 | 0.24 |
| 실시예 11 | 0.15 | 0.13 | 0.14 | 0.01 | 0.43 | 0.33 | 0.02 | 0.30 |
| 실시예 12 | 0.13 | 0.08 | 0.09 | 0.02 | 0.31 | 0.29 | 0.06 | 0.26 |
| 실시예 13 | 0.1 | 0.05 | 0.05 | 0.02 | 0.22 | 0.23 | 0.09 | 0.23 |
| 실시예 14 | 0.09 | 0.03 | 0.03 | 0 | 0.15 | 0.20 | 0.00 | 0.20 |
| 비교예 1 | 0.46 | 0.05 | 0.1 | 0.08 | 0.69 | 0.14 | 0.12 | 0.07 |
| 비교예 2 | 0.01 | 0 | 0.03 | 0.01 | 0.05 | 0.60 | 0.20 | 0 |
| 비교예 3 | 0.06 | 0.02 | 0.02 | 0.03 | 0.12 | 0.17 | 0.25 | 0.17 |
| 비교예 4 | 0.10 | 0.02 | 0.03 | 0.05 | 0.21 | 0.14 | 0.24 | 0.10 |
| 비교예 5 | 0.08 | 0.02 | 0.03 | 0.04 | 0.18 | 0.17 | 0.22 | 0.11 |
| 비교예 6 | 0.4 | 0.09 | 0.09 | 0.07 | 0.65 | 0.14 | 0.11 | 0.14 |
| 비교예 7 | 0.06 | 0.02 | 0.15 | 0.04 | 0.27 | 0.56 | 0.15 | 0.07 |
또한, 실시예 1 내지 14 및 비교예 1 내지 6의 용융지수, 밀도, 중량평균 분자량(Mw) 및 분자량 분포(MWD)를 측정하여 하기 표 3에 나타냈다.
① 밀도(Density, g/cm3): ASTM D-792에 따라 측정하였다.
② 용융지수(Melt Index, MI): ASTM D-1238(조건 E, 190℃, 2.16 Kg 하중)로 측정하였다.
③ 용융지수(Melt Index, MI10): ASTM D-1238(조건 E, 190℃, 10 Kg 하중)로 측정하였다.
④ 중량평균 분자량(Mw)과 수평균 분자량(Mn)은 생성된 공중합체를 하기 겔 투과 크로마토그래피(GPC: gel permeation chromatography) 분석 조건 하에 측정하였다:
- 컬럼: Agilent Olexis
- 용매 : 트리클로로벤젠(TCB)
- 유속 : 1.0 ml/min
- 시료농도 : 1.0 mg/ml
- 주입량 : 200 ㎕
- 컬럼온도 : 160 ℃
- Detector : Agilent High Temperature RI detector
- Standard : Polystyrene (3차 함수로 보정)
- Data processing : Cirrus
⑤ 분자량 분포는 Mw/Mn의 비로부터 계산하였다.
| 밀도 | MI2.16 | MI10 | MI10/MI2.16 | Mw | MWD | |
| g/cm3 | dg/min | dg/min | - | Da | - | |
| 실시예 1 | 0.876 | 18 | 102.5 | 5.69 | 55,000 | 1.94 |
| 실시예 2 | 0.879 | 20 | 113.8 | 5.69 | 55,000 | 2.1 |
| 실시예 3 | 0.877 | 14 | 103.2 | 7.37 | 55,000 | 1.9 |
| 실시예 4 | 0.870 | 14.5 | 93.3 | 6.43 | - | - |
| 실시예 5 | 0.871 | 13.5 | 84.1 | 6.23 | - | - |
| 실시예 6 | 0.876 | 12.8 | 82.4 | 6.44 | 54,000 | 1.9 |
| 실시예 7 | 0.876 | 14 | 85.2 | 6.08 | 52,000 | 1.9 |
| 실시예 8 | 0.879 | 18.4 | 119.7 | 6.50 | 55,000 | 2.14 |
| 실시예 9 | 0.879 | 2.24 | 16.3 | 7.29 | 89,000 | 2.04 |
| 실시예 10 | 0.879 | 0.95 | 7.3 | 7.67 | 112,000 | 2.1 |
| 실시예 11 | 0.874 | 33.7 | 217.8 | 6.46 | 47,000 | 2.06 |
| 실시예 12 | 0.883 | 25.3 | 160.8 | 6.36 | 50,000 | 2.01 |
| 실시예 13 | 0.893 | 11.9 | 83.3 | 7.00 | 58,000 | 2.12 |
| 실시예 14 | 0.880 | 16.3 | 103.0 | 6.32 | 50,000 | 2.14 |
| 비교예 1 | 0.881 | 22 | 151.8 | 6.9 | 54,000 | 2.4 |
| 비교예 2 | 0.884 | 17 | 108.2 | 6.36 | 55,000 | 1.9 |
| 비교예 3 | 0.863 | 1.32 | 8.6 | 6.52 | 107,000 | 1.98 |
| 비교예 4 | 0.897 | 5.86 | 41.7 | 7.12 | 68,000 | 1.92 |
| 비교예 5 | 0.900 | 2.80 | 20.4 | 7.30 | 77,000 | 2.02 |
| 비교예 6 | 0.862 | 1.20 | 9.3 | 7.72 | 91,000 | 2.18 |
상기 표 3의 결과로부터, 본 발명의 실시예 1 내지 14의 에틸렌/알파-올레핀 공중합체는 비교예 1, 6에 비해 좁은 분자량 분포를 갖는 것을 확인할 수 있다.
또한, 실시예 2와 비교예 1의 분자량 분포도를 도 1에 도시하였다. 이로부터 실시예 2가 비교예 1에 비해 좁은 분자량 분포를 갖는 것을 또한 확인할 수 있다.
실험예 1 - 가교 거동 특성 및 가교도
[필름의 제조]
(1) 실시예 1의 샘플 500 g에 하기 레시피(recipe) (a)에 따라 가교조제 조성물을 투입한 후 40℃ 에서 1시간 동안 Soaking 후 15시간 에이징하였다.
또한, 실시예 2, 8, 14, 비교예 1, 2, 4, 5의 각 샘플에 하기 표 4에 나타낸 바와 같이 각각 상이한 레시피(recipe) (a) 내지 (f)를 적용한 것을 제외하고는 상기와 마찬가지의 방식으로 수지 조성물을 제조 및 적용하였다.
(a) t-부틸 1-(2-에틸헥실) 모노퍼옥시카보네이트(TBEC) 1 phr(parts per hundred rubber), 트리알릴이소시아누레이트(TAIC) 0.5 phr, 메타크릴옥시프로필트리메톡시실란(MEMO) 0.2 phr
(b) TBEC 0.6 phr, TAIC 0.8 phr, MEMO 0.2 phr / 톨루엔
(c) TBEC 0.6 phr, TAIC 0.93 phr, MEMO 0.21 phr / 톨루엔
(d) soaking 시간을 1시간 대신 1.5시간으로 수행한 것을 제외하고는 상기 (c)와 동일하게 적용함.
(e) TBEC 0.6 phr, TAIC 0.93 phr, MEMO 0.21 phr / 자일렌
(f) TBEC 0.6 phr, TAIC 0.8 phr, MEMO 0.3 phr / 자일렌
(2) Soaking된 샘플을 가지고 마이크로 압출기를 이용하여, 고온 가교가 되지 않을 정도의 저온(압출기 배럴 온도 90 ℃ 이하 조건)에서 평균 두께 450 μm 의 필름을 제조하였다.
가교 거동 특성을 파악하기 위해, 상기 (2)에서 가교 조제 조성물이 함유된 필름을 5 g 직경 4 cm의 디스크 형태로 제작하여, 150 ℃에서 1시간 동안 스코치(scorch)될 때까지의 최대 토크 MH 값을 비롯한 결과 값을 표 4에 나타냈다.
이러한 가교 거동 특성은 알파 테크놀로지스 (Alpha Technologies 社)의 Premier MDR 이라는 이동식 다이 레오미터(Moving Die Rheometer)를 이용해 측정하였다.
[가교 시트 제조]
상기 [필름의 제조] 과정 (2)에서 제조된 필름 샘플의 위/아래를 테플론 시트로 덮은 후 진공 라미네이터에 넣고, 150 ℃에서 15분 동안 라미네이션 함으로써 가교된 시트를 제작하였다. 상기 가교 시트는 가교도 및 가교 후 광학 물성을 측정하기 위한 것으로서 유리 기판 등 어떠한 기재에도 부착되어 있지 않은 형태이다.
상기 가교 시트를 0.5 g씩 톨루엔(비가교 고분자 추출 용매)에 넣고 60 ℃에서 15 시간 동안 에이징하였다. 톨루엔을 세척한 다음 80 ℃에서 6시간 동안 건조하였다. 건조 후 샘플의 무게를 측정하여 하기 식에 따라 가교도를 측정하여 표 4에 나타냈다.
* 가교도 = (건조 후 무게 / 톨루엔 처리 전 무게)*100
| 가교도 | ML | MH | Final Torque | T10 | T50 | T90 | T95 | Max Rate | |
| % | dNm | min | dNm/min | ||||||
| (a)실시예1 | 67 | 0.02 | 2.77 | 2.75 | 1.64 | 4.49 | 13.26 | 18.48 | 0.45 |
| (a)비교예1 | 57 | 0.04 | 2.54 | 2.53 | 2.14 | 5.87 | 16.17 | 20.26 | 0.30 |
| (b)실시예2 | 58 | 0.01 | 2.54 | 2.51 | 2.94 | 6.26 | 15.63 | 20.07 | 0.34 |
| (b)비교예1 | 44 | 0.03 | 1.88 | 1.87 | 2.08 | 6.11 | 17.03 | 23.32 | 0.20 |
| (c)실시예 8 | 56 | 0.02 | 2.79 | 2.78 | 3.03 | 6.78 | 17.00 | 22.90 | 0.33 |
| (d)실시예 8 | 60.2 | 0.02 | 2.97 | 2.96 | 2.95 | 6.52 | 16.58 | 20.58 | 0.37 |
| (c)비교예 2 | 49 | 0.01 | 2.80 | 2.79 | 3.09 | 6.07 | 15.07 | 18.95 | 0.41 |
| (e)실시예 14 | 55 | 0.02 | 2.41 | 2.40 | 3.26 | 7.12 | 17.17 | 22.66 | 0.27 |
| (e)비교예 2 | 51 | 0.02 | 2.10 | 2.09 | 3.19 | 6.59 | 15.93 | 19.53 | 0.27 |
| (f)실시예 14 | 56 | 0.01 | 2.51 | 2.49 | 3.08 | 6.62 | 16.82 | 21.45 | 0.30 |
| (f)비교예 4 | 41 | 0.02 | 1.62 | 1.60 | 3.87 | 7.42 | 18.44 | 26.12 | 0.18 |
| (f)비교예 5 | 39 | 0.01 | 1.59 | 1.56 | 3.94 | 7.57 | 18.62 | 26.35 | 0.17 |
(a) TBEC 1 phr, TAIC 0.5 phr, MEMO 0.2 phr / 톨루엔(비가교 고분자 추출 용매)
(b) TBEC 0.6 phr, TAIC 0.8 phr, MEMO 0.2 phr / 톨루엔(비가교 고분자 추출 용매)
(c) TBEC 0.6 phr, TAIC 0.93 phr, MEMO 0.21 phr / 톨루엔(비가교 고분자 추출 용매)
(d) soaking 시간을 1시간 대신 1.5시간으로 수행한 것을 제외하고는 상기 (c)와 동일하게 적용함.
(e) TBEC 0.6 phr, TAIC 0.93 phr, MEMO 0.21 phr / 자일렌(비가교 고분자 추출 용매)
(f) TBEC 0.6 phr, TAIC 0.8 phr, MEMO 0.3 phr / 자일렌(비가교 고분자 추출 용매)
상기 표 4의 가교 거동 특성 결과에서, MH 값과 Final Torque 값은 그 값이 클수록 가교도가 높은 것을 의미한다. 또한, T값은 가교 속도와 관련된 요인으로서, 예를 들어 T90은 토크(Torque) 값이 90% Saturation 될 때까지 걸리는 시간을 나타내며, 그 수치가 작을수록 가교 속도가 빠르다고 할 수 있다.
도 2는 가교 레시피 (a)에 따른 실시예 1과 비교예 1의 상기 가교 거동 특성을, 도 3은 가교 레시피 (b)에 따른 실시예 2와 비교예 1의 상기 가교 거동 특성을 각각 도시한다.
또한 표 4의 결과로부터, 동일한 가교 레시피를 적용한 실시예와 비교예를 각각 비교하였을 때, 실시예의 중합체를 이용한 수지 조성물이 비교예에 비해 가교도가 높은 것을 확인할 수 있다. 특히, 실시예 1, 2의 수지 조성물의 가교도는 각각 동일 가교 레시피를 적용한 비교예 1에 비해 10% 수치 이상 높다. 또한, 실시예 14는 동일 가교 레시피 (f)를 적용한 비교예 4, 5에 비해 훨씬 높은 가교도를 나타냈다.
또한, 실시예 8에 대해 soaking 시간을 늘려준 경우(즉, 레시피 (d)) 가교도가 더욱 향상되는 것을 확인하였다.
실험예 2 - 광학 물성
상기 가교 시트에 대해 하기 방법에 따라 옐로 인덱스(YI) 및 전광선 투과율(Tt)을 측정하여 하기 표 5에 기재하였다.
또한, 상기 [필름의 제조] 과정 후 가교 시트를 제조 전에, 옐로 인덱스(YI) 및 전광선 투과율(Tt)을 측정한 것을 '가교 전' 데이터로서 하기 표 5에 기재하였다.
① 옐로 인덱스(YI): ASTM 1925에 준거하여, Colorflex(Hunter lab)을 이용하여 400 nm 내지 700 nm 영역의 반사율을 측정하고, 이를 이용하여, 하기 식 4에 따라 YI 값을 얻었다.
[식 4]
YI = [100(1.28XCIE-1.06ZCIE)]/YCIE
상기 YI는 UV/VIS/NIR 스펙트로미터에서 색차 분석 프로그램을 이용하여 계산된 값으로(ASTM, D1925), XCIE, YCIE, ZCIE는 각각 빨강, 초록, 파랑 색 좌표가 나타내는 상대적인 값이다.
② 전광선 투과율(Tt): 헤이즈미터(Hazemeter)를 사용하여 550 nm의 파장의 빛에 대한 전광선 투과율을 측정하였다. 투과율은 시편을 시편홀더에 넣고 3회 측정한 후 이들의 평균 값을 구하였으며, JIS K 7105의 규격 조건에서 측정하였다.
| 가교 후 | 가교 전 | |||
| Tt@550nm | YI | Tt@550nm | YI | |
| (a)실시예 1 | 91 | 0.82 | 89.4 | 3.5 |
| (b)실시예 2 | 90.9 | 1.34 | 88.7 | 3.9 |
| (c)실시예 8 | 90.9 | 0.86 | 88.2 | 3.4 |
| (e)실시예 14 | 91.2 | 0.83 | 89.1 | 3.7 |
| (f)실시예 14 | 91.5 | 0.9 | 90.0 | 3.4 |
| (a)비교예 1 | 89.4 | 1.63 | 86 | 6.1 |
| (c)비교예 2 | 89.3 | 1.74 | 85.3 | 5.9 |
| (f)비교예 4 | 89.1 | 3.1 | 88.5 | 7.4 |
| (f)비교예 5 | 88.8 | 3.7 | 88.1 | 8.1 |
상기 표 5에서, 본 발명의 에틸렌/알파-올레핀 공중합체를 포함하여 형성된 필름의 경우, 전광선 투과율 및 옐로 인덱스가 비교예에 비해 매우 우수한 것을 확인할 수 있다.
구체적으로, 본 발명의 실시예의 경우 가교 후 옐로 인덱스 수치가 0.82 내지 1.34 범위로서 비교예의 1.63 내지 3.7에 비해 매우 우수하다. 또한, 본 발명의 실시예는 가교 후 전광선 투과율이 90.9 이상으로서 최대 89.4 수치를 나타내는 비교예에 비해 크게 향상된 것을 확인할 수 있다. 따라서, 우수한 광학 물성을 갖는 광학 필름의 제조에 본 발명의 에틸렌/알파-올레핀 공중합체를 적용할 수 있을 것으로 예상된다.
Claims (22)
- 하기 (a) 내지 (d) 조건을 충족하는 에틸렌/알파-올레핀 공중합체:(a) 밀도: 0.850 내지 0.910 g/cc(b) 용융지수(Melt Index, MI, 190 ℃, 2.16 kg 하중 조건): 0.1 내지 100 dg/분(c) 분자량 분포(MWD): 1.5 내지 3.0(d) 하기 식 1에 따른 Rv 값이 0.18 내지 0.59.[식 1]상기 식 1에서,Nvd, Ntv, Nvl 및 Nv는 각각 핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 비닐리덴(vinylidene), 트라이비닐(trivinyl), 비닐렌(vinylene) 및 비닐(vinyl) 작용기의 개수를 의미한다.
- 청구항 1에 있어서,상기 Rv 값은 0.19 내지 0.46인 에틸렌/알파-올레핀 공중합체.
- 청구항 2에 있어서,상기 Rvd 값은 0.02 내지 0.10인 에틸렌/알파-올레핀 공중합체.
- 청구항 5에 있어서,상기 Rtv 값은 0.12 내지 0.30인 에틸렌/알파-올레핀 공중합체.
- 청구항 1에 있어서,밀도는 0.855 내지 0.90 g/cc인 에틸렌/알파-올레핀 공중합체.
- 청구항 1에 있어서,용융지수(190 ℃, 2.16 kg 하중 조건)는 1.5 내지 37 dg/분인 에틸렌/알파-올레핀 공중합체.
- 청구항 1에 있어서,핵자기 분광 분석을 통해 측정된 탄소원자 1000개당 비닐(vinyl) 작용기의 개수가 0.01 내지 0.3개이고;용융지수(190 ℃, 2.16 kg 하중 조건)에 대한 용융지수(190 ℃, 10 kg 하중 조건) 값인 MI10/MI2.16 값이 8.5 이하인 에틸렌/알파-올레핀 공중합체.
- 청구항 1에 있어서,중량평균분자량(Mw)이 40,000 내지 150,000 g/mol인 에틸렌/알파-올레핀 공중합체.
- 청구항 1에 있어서,분자량 분포는 1.5 내지 2.2인 에틸렌/알파-올레핀 공중합체.
- 청구항 1에 있어서,상기 알파-올레핀은 프로필렌, 1-부텐, 1-펜텐, 4-메틸-1-펜텐, 1-헥센, 1-헵텐, 1-옥텐, 1-데센, 1-운데센, 1-도데센, 1-테트라데센, 1-헥사데센 및 1-에이코센으로 구성되는 군으로부터 선택되는 1종 이상을 포함하는 것인, 에틸렌/알파-올레핀 공중합체.
- 청구항 1에 있어서,상기 알파-올레핀은 공중합체 총 중량에 대하여 0 초과 99몰% 이하의 함량으로 포함되는 에틸렌/알파-올레핀 공중합체.
- 하기 화학식 1로 표시되는 전이금속 화합물을 포함하는 촉매 조성물의 존재 하에, 수소를 5 내지 100 cc/min으로 투입하여 에틸렌 및 알파-올레핀계 단량체를 중합하는 단계를 포함하는, 청구항 1의 에틸렌/알파-올레핀 공중합체의 제조방법:[화학식 1]상기 화학식 1에서,R1은 수소; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C1~20의 알콕시; C6~20의 아릴; C7~20의 아릴알콕시; C7~20의 알킬아릴; 또는 C7~20의 아릴알킬이고,R2a 내지 R2e는 각각 독립적으로 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C1~20의 알콕시; 또는 C6~20의 아릴이고,R3은 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C6~20의 알킬아릴; C7~20의 아릴알킬; C1~20의 알킬 아미도; C6~20의 아릴 아미도; C1~20의 알킬리덴; 또는 할로겐, C1~20의 알킬, C3~20의 사이클로알킬, C2~20의 알케닐, C1~20의 알콕시 및 C6~20의 아릴로 이루어지는 군으로부터 선택된 1종 이상으로 치환된 페닐이고,R4 내지 R9는 각각 독립적으로, 수소; 실릴; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C7~20의 알킬아릴; C7~20의 아릴알킬; 또는 C1~20의 하이드로카르빌로 치환된 14족 금속의 메탈로이드 라디칼이고; 상기 R6 내지 R9 중 서로 인접하는 2개 이상은 서로 연결되어 고리를 형성할 수 있고,Q는 Si, C, N, P 또는 S이며,M은 4족 전이금속이고,X1 및 X2는 각각 독립적으로 수소; 할로겐; C1~20의 알킬; C3~20의 사이클로알킬; C2~20의 알케닐; C6~20의 아릴; C7~20의 알킬아릴; C7~20의 아릴알킬; C1~20의 알킬아미노; C6~20의 아릴아미노; 또는 C1~20의 알킬리덴이다.
- 청구항 14에 있어서,상기 R1은 수소; C1~12의 알킬; C3~12의 사이클로알킬; C1~12의 알콕시; C6~12의 아릴; C7~13의 아릴알콕시; C7~13의 알킬아릴; 또는 C7~13의 아릴알킬이고,상기 R2a 내지 R2e는 각각 독립적으로 수소; 할로겐; C1~12의 알킬; C3~12의 사이클로알킬; C2~12의 알케닐; C1~12의 알콕시; 또는 페닐이고,상기 R3은 수소; 할로겐; C1~12의 알킬; C3~12의 사이클로알킬; C2~12의 알케닐; C7~13의 알킬아릴; C7~13의 아릴알킬; 페닐; 또는 할로겐, C1~12의 알킬, C3~12의 사이클로알킬, C2~12의 알케닐, C1~12의 알콕시 및 페닐로 이루어지는 군으로부터 선택된 1종 이상으로 치환된 페닐이고,상기 R4 내지 R9는 각각 독립적으로, 수소; C1~12의 알킬; C3~12의 사이클로알킬; C6~12의 아릴; C7~13의 알킬아릴; 또는 C7~13의 아릴알킬이고,상기 R6 내지 R9 중 서로 인접하는 2개 이상은 서로 연결되어 C5~12의 지방족 고리 또는 C6~12의 방향족 고리를 형성할 수 있으며,상기 지방족 고리 또는 방향족 고리는 할로겐, C1~12의 알킬, C2~12의 알케닐, 또는 C6~12의 아릴로 치환될 수 있고,상기 Q는 Si이고,상기 M은 Ti이고,상기 X1 및 X2는 각각 독립적으로 수소; 할로겐; C1~12의 알킬기; 또는 C2~12의 알케닐인, 에틸렌/알파-올레핀 공중합체의 제조방법.
- 청구항 14에 있어서,상기 중합은 100 내지 180℃에서 수행되는 것인, 에틸렌/알파-올레핀 공중합체의 제조방법.
- 청구항 1 내지 13 중 어느 한 항의 에틸렌/알파-올레핀 공중합체를 포함하는 광학필름용 수지 조성물.
- 청구항 18에 있어서,가교 수행 후 측정한 옐로 인덱스 값이 1.5 이하인 광학필름용 수지 조성물.
- 청구항 18에 있어서,가교 수행 후 측정한 전광선 투과율(Tt)이 90.0% 이상인 광학필름용 수지 조성물.
- 청구항 18에 있어서,불포화 실란 화합물, 아미노 실란 화합물, 가교제, 가교 조제, 광안정제, UV 흡수제 및 열안정제로 이루어진 군으로부터 선택되는 1종 이상을 더 포함하는 광학필름용 수지 조성물.
- 청구항 18의 광학필름용 수지 조성물을 포함하는 광학필름.
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021512350A JP7086432B2 (ja) | 2018-05-04 | 2019-05-03 | エチレン/α-オレフィン共重合体およびその製造方法 |
| CN201980028472.9A CN112088177B (zh) | 2018-05-04 | 2019-05-03 | 乙烯/α-烯烃共聚物及其制备方法 |
| US17/050,998 US20210238398A1 (en) | 2018-05-04 | 2019-05-03 | Ethylene/Alpha-Olefin Copolymer and Method for Preparing the Same |
| EP19796558.5A EP3778670A4 (en) | 2018-05-04 | 2019-05-03 | ETHYLENE / ALPHA-OLEFIN COPOLYMER AND PROCESS FOR ITS PREPARATION |
Applications Claiming Priority (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2018-0052071 | 2018-05-04 | ||
| KR20180052072 | 2018-05-04 | ||
| KR20180052071 | 2018-05-04 | ||
| KR10-2018-0052072 | 2018-05-04 | ||
| KR1020180111510A KR102527751B1 (ko) | 2018-05-04 | 2018-09-18 | 에틸렌/알파-올레핀 공중합체를 포함하는 광학필름용 수지 조성물 및 이를 포함하는 광학필름 |
| KR1020180111511A KR102421535B1 (ko) | 2018-05-04 | 2018-09-18 | 에틸렌/알파-올레핀 공중합체, 이의 제조방법 |
| KR10-2018-0111510 | 2018-09-18 | ||
| KR10-2018-0111511 | 2018-09-18 | ||
| KR1020190050468A KR102622329B1 (ko) | 2018-05-04 | 2019-04-30 | 에틸렌/알파-올레핀 공중합체, 이의 제조방법 및 이를 포함하는 광학필름용 수지 조성물 |
| KR10-2019-0050468 | 2019-04-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2019212307A1 true WO2019212307A1 (ko) | 2019-11-07 |
Family
ID=68386607
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/KR2019/005368 WO2019212307A1 (ko) | 2018-05-04 | 2019-05-03 | 에틸렌/알파-올레핀 공중합체, 이의 제조방법 |
Country Status (1)
| Country | Link |
|---|---|
| WO (1) | WO2019212307A1 (ko) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112646070A (zh) * | 2020-04-16 | 2021-04-13 | 株式会社Lg化学 | 电绝缘性优秀的乙烯/α-烯烃共聚物 |
| CN112662047A (zh) * | 2020-04-16 | 2021-04-16 | 株式会社Lg化学 | 包含乙烯/α-烯烃共聚物的密封材料膜用组合物及包含其的密封材料膜 |
| WO2021133640A1 (en) * | 2019-12-26 | 2021-07-01 | Dow Global Technologies Llc | Alpha-olefin interpolymers with improved molecular design for photovoltaic encapsulants |
| JP2022545511A (ja) * | 2020-04-16 | 2022-10-27 | エルジー・ケム・リミテッド | 電気絶縁性に優れたエチレン/α-オレフィン共重合体 |
| CN116731231A (zh) * | 2023-06-29 | 2023-09-12 | 浙江大学 | 一种低雾度高透光率聚烯烃共聚物及其应用 |
| US12240926B2 (en) | 2020-04-16 | 2025-03-04 | Lg Chem, Ltd. | Composition for encapsulant film comprising ethylene/alpha-olefin copolymer and encapsulant film comprising the same |
Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4935474A (en) | 1983-06-06 | 1990-06-19 | Exxon Research & Engineering Company | Process and catalyst for producing polyethylene having a broad molecular weight distribution |
| US5914289A (en) | 1996-02-19 | 1999-06-22 | Fina Research, S.A. | Supported metallocene-alumoxane catalysts for the preparation of polyethylene having a broad monomodal molecular weight distribution |
| KR100293574B1 (ko) * | 1992-09-10 | 2001-11-22 | 고사이 아끼오 | 에틸렌-알파올레핀공중합체,및그를이용하여성형된성형체 |
| KR20030012308A (ko) | 2001-07-31 | 2003-02-12 | 주식회사 예스아이비 | 배팅형 복권 시스템 및 배팅 방법 |
| KR20040076965A (ko) | 2003-02-27 | 2004-09-04 | 호남석유화학 주식회사 | 올레핀 중합용 담지 다중핵 메탈로센 촉매 및 이의 제조방법 |
| US6828394B2 (en) | 2001-07-19 | 2004-12-07 | Univation Technologies, Llc | Mixed metallocene catalyst systems containing a poor comonomer incorporator and a good comonomer incorporator |
| US6841631B2 (en) | 1999-10-22 | 2005-01-11 | Univation Technologies, Llc | Catalyst composition, method of polymerization, and polymer therefrom |
| KR20090031355A (ko) * | 2006-06-15 | 2009-03-25 | 다우 글로벌 테크놀로지스 인크. | 관능화된 올레핀 혼성중합체, 조성물 및 이로부터 제조된 제품, 및 이의 제조 방법 |
| US8173828B2 (en) * | 2005-12-14 | 2012-05-08 | Exxonmobil Chemical Patents Inc. | Halogen substituted heteroatom-containing metallocene compounds for olefin polymerization |
| KR20160054849A (ko) * | 2014-11-07 | 2016-05-17 | 주식회사 엘지화학 | 리간드 화합물, 전이금속 화합물 및 이를 포함하는 촉매 조성물 |
| KR20170073385A (ko) * | 2015-12-18 | 2017-06-28 | 주식회사 엘지화학 | 가공성이 우수한 폴리올레핀 |
-
2019
- 2019-05-03 WO PCT/KR2019/005368 patent/WO2019212307A1/ko unknown
Patent Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4935474A (en) | 1983-06-06 | 1990-06-19 | Exxon Research & Engineering Company | Process and catalyst for producing polyethylene having a broad molecular weight distribution |
| KR100293574B1 (ko) * | 1992-09-10 | 2001-11-22 | 고사이 아끼오 | 에틸렌-알파올레핀공중합체,및그를이용하여성형된성형체 |
| US5914289A (en) | 1996-02-19 | 1999-06-22 | Fina Research, S.A. | Supported metallocene-alumoxane catalysts for the preparation of polyethylene having a broad monomodal molecular weight distribution |
| US6841631B2 (en) | 1999-10-22 | 2005-01-11 | Univation Technologies, Llc | Catalyst composition, method of polymerization, and polymer therefrom |
| US6894128B2 (en) | 1999-10-22 | 2005-05-17 | Univation Technologies, Llc | Catalyst composition, method of polymerization, and polymer therefrom |
| US6828394B2 (en) | 2001-07-19 | 2004-12-07 | Univation Technologies, Llc | Mixed metallocene catalyst systems containing a poor comonomer incorporator and a good comonomer incorporator |
| KR20030012308A (ko) | 2001-07-31 | 2003-02-12 | 주식회사 예스아이비 | 배팅형 복권 시스템 및 배팅 방법 |
| KR20040076965A (ko) | 2003-02-27 | 2004-09-04 | 호남석유화학 주식회사 | 올레핀 중합용 담지 다중핵 메탈로센 촉매 및 이의 제조방법 |
| US8173828B2 (en) * | 2005-12-14 | 2012-05-08 | Exxonmobil Chemical Patents Inc. | Halogen substituted heteroatom-containing metallocene compounds for olefin polymerization |
| KR20090031355A (ko) * | 2006-06-15 | 2009-03-25 | 다우 글로벌 테크놀로지스 인크. | 관능화된 올레핀 혼성중합체, 조성물 및 이로부터 제조된 제품, 및 이의 제조 방법 |
| KR20160054849A (ko) * | 2014-11-07 | 2016-05-17 | 주식회사 엘지화학 | 리간드 화합물, 전이금속 화합물 및 이를 포함하는 촉매 조성물 |
| KR20170073385A (ko) * | 2015-12-18 | 2017-06-28 | 주식회사 엘지화학 | 가공성이 우수한 폴리올레핀 |
Non-Patent Citations (2)
| Title |
|---|
| MACROMOLECULES, vol. 47, 2014, pages 3282 - 3790 |
| See also references of EP3778670A4 |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2021133640A1 (en) * | 2019-12-26 | 2021-07-01 | Dow Global Technologies Llc | Alpha-olefin interpolymers with improved molecular design for photovoltaic encapsulants |
| CN114867759A (zh) * | 2019-12-26 | 2022-08-05 | 陶氏环球技术有限责任公司 | 具有用于光伏封装剂的改进的分子设计的α-烯烃互聚物 |
| CN114867759B (zh) * | 2019-12-26 | 2025-02-07 | 陶氏环球技术有限责任公司 | 具有用于光伏封装剂的改进的分子设计的α-烯烃互聚物 |
| CN112646070A (zh) * | 2020-04-16 | 2021-04-13 | 株式会社Lg化学 | 电绝缘性优秀的乙烯/α-烯烃共聚物 |
| CN112662047A (zh) * | 2020-04-16 | 2021-04-16 | 株式会社Lg化学 | 包含乙烯/α-烯烃共聚物的密封材料膜用组合物及包含其的密封材料膜 |
| JP2022545511A (ja) * | 2020-04-16 | 2022-10-27 | エルジー・ケム・リミテッド | 電気絶縁性に優れたエチレン/α-オレフィン共重合体 |
| JP7371228B2 (ja) | 2020-04-16 | 2023-10-30 | エルジー・ケム・リミテッド | 電気絶縁性に優れたエチレン/α-オレフィン共重合体 |
| CN112662047B (zh) * | 2020-04-16 | 2024-02-06 | 株式会社Lg化学 | 包含乙烯/α-烯烃共聚物的密封材料膜用组合物及包含其的密封材料膜 |
| US12240926B2 (en) | 2020-04-16 | 2025-03-04 | Lg Chem, Ltd. | Composition for encapsulant film comprising ethylene/alpha-olefin copolymer and encapsulant film comprising the same |
| CN116731231A (zh) * | 2023-06-29 | 2023-09-12 | 浙江大学 | 一种低雾度高透光率聚烯烃共聚物及其应用 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2019212307A1 (ko) | 에틸렌/알파-올레핀 공중합체, 이의 제조방법 | |
| WO2017188602A1 (ko) | 혼성 담지 메탈로센 촉매 및 이를 이용한 가공성이 우수한 폴리올레핀 수지 | |
| WO2019125050A1 (ko) | 올레핀계 중합체 | |
| WO2019212303A1 (ko) | 에틸렌/알파-올레핀 공중합체 및 이의 제조방법 | |
| WO2011111979A2 (en) | Method for preparing supported metallocene catalyst and method for preparing polyolefin using the same | |
| WO2016072783A1 (ko) | 리간드 화합물, 전이금속 화합물 및 이를 포함하는 촉매 조성물 | |
| WO2017099491A1 (ko) | 올레핀계 중합체 | |
| WO2020171631A1 (ko) | 올레핀계 중합체 | |
| WO2019212308A1 (ko) | 에틸렌/알파-올레핀 공중합체 및 이의 제조방법 | |
| WO2020122562A1 (ko) | 폴리에틸렌 및 이의 염소화 폴리에틸렌 | |
| WO2019212310A1 (ko) | 에틸렌/알파-올레핀 공중합체를 포함하는 접착제 조성물 | |
| WO2019212304A1 (ko) | 에틸렌/알파-올레핀 공중합체 및 이의 제조방법 | |
| WO2020130718A1 (ko) | 폴리올레핀 | |
| WO2019132471A1 (ko) | 올레핀계 중합체 | |
| WO2023075501A1 (ko) | 에틸렌/알파-올레핀 공중합체 및 이를 포함하는 봉지재 필름용 조성물 | |
| WO2022071744A1 (ko) | 시공성 및 가공성이 우수한 에틸렌/1-헥센 공중합체 | |
| WO2021210756A1 (ko) | 에틸렌/알파-올레핀 공중합체를 포함하는 봉지재 필름용 조성물 및 이를 포함하는 봉지재 필름 | |
| WO2021060907A1 (ko) | 폴리에틸렌 및 이의 염소화 폴리에틸렌 | |
| WO2019132477A1 (ko) | 올레핀계 중합체 | |
| WO2022108167A1 (ko) | 폴리올레핀 | |
| WO2020046051A1 (ko) | 폴리에틸렌 및 이의 염소화 폴리에틸렌 | |
| WO2020122563A1 (ko) | 폴리에틸렌 및 이의 염소화 폴리에틸렌 | |
| WO2019212306A1 (ko) | 올레핀계 공중합체 및 이의 제조방법 | |
| WO2019212302A1 (ko) | 올레핀계 공중합체 및 이의 제조방법 | |
| WO2021210749A1 (ko) | 에틸렌/알파-올레핀 공중합체를 포함하는 봉지재 필름용 조성물 및 이를 포함하는 봉지재 필름 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 19796558 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2021512350 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2019796558 Country of ref document: EP Effective date: 20201102 |