JP7164540B2 - 立体的に規定されたホスホロチオエートオリゴヌクレオチドの調製のための直交保護基 - Google Patents
立体的に規定されたホスホロチオエートオリゴヌクレオチドの調製のための直交保護基 Download PDFInfo
- Publication number
- JP7164540B2 JP7164540B2 JP2019553219A JP2019553219A JP7164540B2 JP 7164540 B2 JP7164540 B2 JP 7164540B2 JP 2019553219 A JP2019553219 A JP 2019553219A JP 2019553219 A JP2019553219 A JP 2019553219A JP 7164540 B2 JP7164540 B2 JP 7164540B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- alkyl
- optionally substituted
- substituted
- aryl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/06—Pyrimidine radicals
- C07H19/10—Pyrimidine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Biochemistry (AREA)
- Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Saccharide Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Description
本発明は、立体的に規定された(stereodefined)ホスホロチオエートオリゴヌクレオチドの分野に関し、かつ、アミン含有キラル補助基を含む立体的に規定する(stereodefining)ヌクレオシドモノマー、ならびに、オリゴヌクレオチド合成の最中にキラル補助基の窒素を直交性に保護する方法、伸長後の鎖切断を防止する方法、立体的に規定されたホスホロチオエートオリゴヌクレオチドの収率および純度を増大させる方法に関する。直交保護基はまた、迅速に、典型的には4時間以内に除去される。
オリゴヌクレオチドにおける立体的に規定されたホスホロチオエートヌクレオシド間連結の使用は、治療用オリゴヌクレオチドの薬理特性の最適化を可能にする。しかし、立体的に規定されたホスホロチオエートオリゴヌクレオチドの製造は、現在の所、立体的に規定されていないホスホロチオエートオリゴヌクレオチドに比べてかなり非効率的である。したがって、立体的に規定されたオリゴヌクレオチドの合成の効率を改善する必要がある。
本発明は、立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成のための方法を提供し、該方法は、(i)オキサザホスホリジンキラル補助ホスホラミダイトモノマーをヌクレオシドの5'-OH基にカップリングする段階、続いて(ii)オキサザホスホリジンキラル補助基のアミン基をカルバメート保護基で保護する段階、および(iii)硫化段階を含み、カップリング段階(i)の後でかつアミン保護段階(ii)の前または後に硫化段階(iii)を実施する。
の化合物を提供し、
式中、Xは、固体支持体、または固体支持体に結合した先行のヌクレオシド(末端5'-OH基)のいずれかであり;塩基は核酸塩基であり;
R5およびR6は独立して、水素、アルキル、シクロ-アルキル、アリール、ヘテロアリール、置換アルキル、置換シクロ-アルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、または、R5およびR6は一緒になって、3~16個の炭素原子を含む複素環を式(I)のN原子と共に形成し;
R1は、水素およびC1~3アルキルよりなる群より選択され;R9は水素であり;
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
R3は、CH2ODMTr、CH2-アルキル-O-DMTr、CH-Me-O-DMTr、CH2OMMTr、CH2-アルキル-O-MMTr、CH(Me)-O-MMTr、CH-Ra-O-DMTrRb、およびCH-Ra-O-MMTrRbからなる群より選択され;
R2は、ハロ、例えば-F、アミノ、アジド、-SH、-CN、-OCN、-CF3、-OCF3、-O(Rm)-アルキル、-S(Rm)-アルキル、-N(Rm)-アルキル、-O(Rm)-アルケニル、-S(Rm)-アルケニル、-N(Rm)-アルケニル;-O(Rm)-アルキニル、-S(Rm)-アルキニル、または-N(Rm)-アルキニル;O-アルキレニル-O-アルキル、アルキニル、アルカリール、アラルキル、O-アルカリール、O-アラルキル、O(CH2)2SCH3、O-(CH2)2-O-N(Rm)(Rn)またはO-CH2C(=O)-N(Rm)(Rn)、-O-(CH2)2OCH3、および-O-CH3からなる群より選択され、ここで各RmおよびRnは独立してH、アミノ保護基または置換もしくは無置換C1~10アルキルであり;
R4は、アルキル、シクロ-アルキル、シクロ-ヘテロアルキル、O-アルキル、S-アルキル、NH-アルキル、および水素からなる群より選択されるか;
または、R2およびR4は一緒になって、-C(RaRb)-、-C(Ra)=C(Rb)、-C(Ra)=N、O、-Si(Ra)2-、S-、-SO2-、-N(Ra)-、および>C=Zからなる群より選択される1、2、3つの基/原子からなる二価の架橋を示し;
ここで、Raおよび存在する場合にRbはそれぞれ独立して、水素、置換されていてもよいC1~6-アルキル、置換されていてもよいC2~6-アルケニル、置換されていてもよいC2~6-アルキニル、ヒドロキシ、置換されていてもよいC1~6-アルコキシ、C2~6-アルコキシアルキル、C2~6-アルケニルオキシ、カルボキシ、C1~6-アルコキシカルボニル、C1~6-アルキルカルボニル、ホルミル、アリール、アリールオキシ-カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ-カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ(C1~6-アルキル)アミノおよびジ(C1~6-アルキル)アミノ、カルバモイル、モノ(C1~6-アルキル)-アミノ-カルボニルおよびジ(C1~6-アルキル)-アミノ-カルボニル、アミノ-C1~6-アルキル-アミノカルボニル、モノ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニルおよびジ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニル、C1~6-アルキル-カルボニルアミノ、カルバミド、C1~6-アルカノイルオキシ、スルホノ、C1~6-アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C1~6-アルキルチオ、ハロゲンより選択され、ここでアリールおよびヘテロアリールは置換されていてもよく、かつここで2つのジェミナルの置換基RaおよびRbは一緒になって、置換されていてもよいメチレン(=CH2)を示してもよく、ここですべてのキラル中心について、不斉基はR配向またはS配向のいずれかで見い出されてもよく;かつ、Zはカルバメート保護基である。
[本発明1001]
(i)オキサザホスホリジンキラル補助ホスホラミダイトモノマーをヌクレオシドの5'-OH基にカップリングする段階、続いて(ii)オキサザホスホリジンキラル補助基のアミン基をカルバメート保護基で保護する段階、および(iii)硫化段階
を含む、立体的に規定された(stereodefined)ホスホロチオエートオリゴヌクレオチドの合成のための方法であって、
カップリング段階(i)の後でかつアミン保護段階(ii)の前または後に硫化段階(iii)を実施する、該方法。
[本発明1002]
前記アミン保護段階の前に硫化段階(iii)を実施する、本発明1001の方法。
[本発明1003]
前記アミン保護段階の後に硫化段階(iii)を実施する、本発明1001または1002の方法。
[本発明1004]
アミン保護段階(ii)の後に実施するキャッピング段階(iv)をさらに含む、本発明1001~1003のいずれかの方法。
[本発明1005]
硫化段階(iv)の前または後に前記キャッピング段階を実施する、本発明1004の方法。
[本発明1006]
固体支持体上の前記オリゴヌクレオチドを合成する、本発明1001~1005のいずれかの方法。
[本発明1007]
鎖伸長が完了すると、包括的オリゴヌクレオチド脱保護/前記固体支持体からの切断の最中にアミンカルバメート保護基を除去する、本発明1001~1006のいずれかの方法。
[本発明1008]
鎖伸長が完了すると、包括的脱保護/前記固体支持体からの切断の前にアミンカルバメート保護基を除去する、本発明1001~1006のいずれかの方法。
[本発明1009]
アミンカルバメート保護基を除去した後、包括的脱保護/前記固体支持体からの切断の前に前記キラル補助基を除去する、本発明1008の方法。
[本発明1010]
アミンカルバメート保護基を除去した後、包括的脱保護/前記固体支持体からの切断の最中に前記キラル補助基を除去する、本発明1008の方法。
[本発明1011]
アミンカルバメート保護基除去の段階を8時間未満にわたって実施する、本発明1008~1010のいずれかの方法。
[本発明1012]
アミンカルバメート保護基除去の段階を室温で実施する、本発明1008~1011のいずれかの方法。
[本発明1013]
段階(i)で用いるオキサザホスホリジンキラル補助ホスホラミダイトモノマーが、式A:
のものであり、
式中、Xはヌクレオシドの3'酸素であり;
R 1 は、水素およびC 1~3 アルキルからなる群より選択され;R 9 は水素であり;
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
R 5 およびR 6 は独立して、水素、アルキル、シクロ-アルキル、アリール、ヘテロアリール、置換アルキル、置換シクロ-アルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、またはR 5 およびR 6 は一緒になって、3~16個の炭素原子を含む複素環を式AのN原子と共に形成する、本発明1001~1012のいずれかの方法。
[本発明1014]
前記アミンカルバメート保護基[段階(ii)において言及]が、式:
の置換エチルカルバメート保護基であり、
式中、Nは前記キラル補助基中に存在する窒素であり、かつ、R a 、および任意で、存在する場合にR b は、β脱離による該カルバメート保護基の脱保護を可能にする基、例えば、-CN、-SO 2 R c 、-SiR c 3 、-F、-Cl、-CF 3 、および-CO-R c からなる群より独立して選択される基であり、ここでR c は、水素、置換されていてもよいC 1~10 アルキル基、置換されていてもよいC 2~6 アルケニル基、置換されていてもよいC 2~6 アルキニル基、置換されていてもよいC 3~7 シクロアルキル基、置換されていてもよいC 1~10 アルキルオキシ基、もしくはアリール基からなる群より独立して選択されるか、
または、R b は、水素、置換されていてもよいC 1~10 アルキル基、置換されていてもよいC 2~6 アルケニル基、置換されていてもよいC 2~6 アルキニル基、置換されていてもよいC 3~7 シクロアルキル基、置換されていてもよいC 1~10 アルキルオキシ基、もしくはアリール基からなる群より選択される、本発明1001~1013のいずれかの方法。
[本発明1015]
アミンカルバメート保護基[段階(ii)において言及]が、式:
の置換されていてもよい2'-スルホニルカルバメート保護基であり、
式中、Nは前記キラル補助基中に存在する窒素であり、かつR c は、水素、置換されていてもよいC 1~10 アルキル基、置換されていてもよいC 2~6 アルケニル基、置換されていてもよいC 2~6 アルキニル基、置換されていてもよいC 3~7 シクロアルキル基、置換されていてもよいC 1~10 アルキルオキシ基、もしくはアリール基からなる群より独立して選択されるか;
または、R b は、水素、置換されていてもよいC 1~10 アルキル基、置換されていてもよいC 2~6 アルケニル基、置換されていてもよいC 2~6 アルキニル基、置換されていてもよいC 3~7 シクロアルキル基、置換されていてもよいC 1~10 アルキルオキシ基、もしくはアリール基からなる群より選択される基である、本発明1001~1013のいずれかの方法。
[本発明1016]
アミンカルバメート保護基[段階(ii)において言及]が、
からなる群より選択され、ここで、Nは前記キラル補助基中に存在するNであり、かつR d は、水素、置換されていてもよいC 1~10 アルキル基、置換されていてもよいC 2~6 アルケニル基、置換されていてもよいC 2~6 アルキニル基、置換されていてもよいC 3~7 シクロアルキル基、置換されていてもよいC 1~10 アルキルオキシ基、またはアリール基からなる群より選択される、本発明1001~1013のいずれかの方法。
[本発明1017]
段階(ii)が、前記カルバメート保護基による前記キラル補助基の窒素の置換を可能にする条件下で、カルバメート前駆体と段階(i)で提供されるカップリングしたアミン含有キラル補助ホスホラミダイトモノマーとを反応させることを含む、本発明1001~1016のいずれかの方法。
[本発明1018]
前記カルバメート前駆体が、
からなる群より選択され、ここで、R d が、水素、置換されていてもよいC 1~10 アルキル基、置換されていてもよいC 2~6 アルケニル基、置換されていてもよいC 2~6 アルキニル基、置換されていてもよいC 3~7 シクロアルキル基、置換されていてもよいC 1~10 アルキルオキシ基、またはアリール基からなる群より選択され、かつR'が、
からなる群より選択される脱離基などの脱離基である、本発明1017の方法。
[本発明1020]
前記オキサザホスホリジンキラル補助ホスホラミダイトモノマーが、式1または2:
のものである、本発明1001~1019のいずれかの方法:
式中、塩基は核酸塩基であり;
R 5 およびR 6 は独立して、水素、アルキル、シクロ-アルキル、アリール、ヘテロアリール、置換アルキル、置換シクロ-アルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、またはR 5 およびR 6 は一緒になって、3~16個の炭素原子を含む複素環を式(I)のN原子と共に形成し;
R 1 は、水素およびC 1~3 アルキルからなる群より選択され;R 9 は水素であり;
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
R 3 は、CH 2 ODMTr、CH 2 -アルキル-O-DMTr、CH-Me-O-DMTr、CH 2 OMMTr、CH 2 -アルキル-O-MMTr、CH(Me)-O-MMTr、CH-R a -O-DMTrR b 、およびCH-R a -O-MMTrR b からなる群より選択され;
R 2 は、ハロ、例えば-F、アミノ、アジド、-SH、-CN、-OCN、-CF 3 、-OCF 3 、-O(R m )-アルキル、-S(R m )-アルキル、-N(R m )-アルキル、-O(R m )-アルケニル、-S(R m )-アルケニル、-N(R m )-アルケニル;-O(R m )-アルキニル、-S(R m )-アルキニル、または-N(R m )-アルキニル;O-アルキレニル-O-アルキル、アルキニル、アルカリール、アラルキル、O-アルカリール、O-アラルキル、O(CH 2 ) 2 SCH 3 、O-(CH 2 ) 2 -O-N(R m )(R n )またはO-CH 2 C(=O)-N(R m )(R n )、-O-(CH 2 ) 2 OCH 3 、および-O-CH 3 からなる群より選択され、ここで各R m およびR n は独立して、H、アミノ保護基、または置換もしくは無置換C 1~10 アルキルであり;
R 4 は、アルキル、シクロ-アルキル、シクロ-ヘテロアルキル、O-アルキル、S-アルキル、NH-アルキル、および水素からなる群より選択されるか;
または、R 2 およびR 4 は一緒になって、-C(R a R b )-、-C(R a )=C(R b )、-C(R a )=N、O、-Si(R a )2-、S-、-SO 2 -、-N(R a )-、および>C=Zからなる群より選択される1、2、3つの基/原子からなる二価の架橋を示し;
ここでR a および存在する場合にR b はそれぞれ独立して、水素、置換されていてもよいC 1~6 -アルキル、置換されていてもよいC 2~6 -アルケニル、置換されていてもよいC 2~6 -アルキニル、ヒドロキシ、置換されていてもよいC 1~6 -アルコキシ、C 2~6 -アルコキシアルキル、C 2~6 -アルケニルオキシ、カルボキシ、C 1~6 -アルコキシカルボニル、C 1~6 -アルキルカルボニル、ホルミル、アリール、アリールオキシ-カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ-カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ(C 1~6 -アルキル)アミノおよびジ(C 1~6 -アルキル)アミノ、カルバモイル、モノ(C 1~6 -アルキル)-アミノ-カルボニルおよびジ(C 1~6 -アルキル)-アミノ-カルボニル、アミノ-C 1~6 -アルキル-アミノカルボニル、モノ(C 1~6 -アルキル)アミノ-C 1~6 -アルキル-アミノカルボニルおよびジ(C 1~6 -アルキル)アミノ-C 1~6 -アルキル-アミノカルボニル、C 1~6 -アルキル-カルボニルアミノ、カルバミド、C 1~6 -アルカノイルオキシ、スルホノ、C 1~6 -アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C 1~6 -アルキルチオ、ハロゲンより選択され、ここでアリールおよびヘテロアリールは置換されていてもよく、かつここで2つのジェミナルの置換基R a およびRbは一緒になって、置換されていてもよいメチレン(=CH 2 )を示してもよく、ここですべてのキラル中心について、不斉基はR配向またはS配向のいずれかで見い出されてもよい。
[本発明1021]
R 4 およびR 2 が水素である、本発明1017の方法。
[本発明1022]
前記キラル補助ホスホラミダイトモノマーが、式3または4:
のものであり、
式中、塩基は核酸塩基であり、かつR、R 1 、R 3 、R 5 、R 6 、およびR 9 は本発明1016において定義するとおりである、本発明1017の方法。
[本発明1023]
前記キラル補助ホスホラミダイトモノマーが、式5または6:
のものであり、
式中、塩基は核酸塩基であり、かつR、R 1 、R 3 、R 5 、R 6 、およびR 9 は本発明1016において定義するとおりである、本発明1017の方法。
[本発明1024]
前記キラル補助ホスホラミダイトモノマーが、式7または8:
のものであり、
式中、塩基は核酸塩基であり、かつR、R 1 、R 3 、R 5 、R 6 、およびR 9 は本発明1016において定義するとおりである、本発明1017の方法。
[本発明1025]
カップリング段階(i)が、アセトニトリルおよび芳香族複素環式溶媒と任意で活性化物質とを含むアセトニトリル溶媒組成物中で行われる、本発明1001~1021のいずれかの方法。
[本発明1026]
前記芳香族複素環式溶媒が、20℃の水中で4~7または7~17のpKaを有する、本発明1025の方法。
[本発明1027]
前記芳香族複素環式溶媒が芳香族複素環式塩基である、本発明1025または1026の方法。
[本発明1028]
前記芳香族複素環式溶媒が芳香族複素環式酸である、本発明1025~1027のいずれかの方法。
[本発明1029]
前記芳香族複素環式溶媒が、ピリジン、2-ピコリン、4-ピコリン、3-ピコリン、ルチジン、およびピロールからなる群より選択される、本発明1025~1028のいずれかの方法。
[本発明1030]
アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が約0.1%~約50%(v/v)である、本発明1025~1029のいずれかの方法。
[本発明1031]
アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が、約0.5%~約10%、例えば約1%~約5%、例えば約2~3%、例えば約2.5%である、本発明1025~1030のいずれかの方法。
[本発明1032]
前記活性化物質がN-メチルイミダゾールを含む、本発明1025~1031のいずれかの方法。
[本発明1033]
前記溶媒組成物が、0.01~約1M N-メチルイミダゾール、例えば約0.1M N-メチルイミダゾールの濃度でN-メチルイミダゾールを含む、本発明1025~1032のいずれかの方法。
[本発明1034]
前記活性化物質が、4,5-ジシアノイミダゾール(DCI)、テトラゾール、または5-(ベンジルチオ)-1H-テトラゾールを含む、本発明1025~1033のいずれかの方法。
[本発明1035]
前記溶媒組成物が、約0.5~約2M DCI(または本発明1011の他の活性化物質)、例えば約1M DCM(または本発明1011の他の活性化物質)を含む、本発明1025~1034のいずれかの方法。
[本発明1036]
カップリング段階、硫化段階、および保護段階の本発明1001~1016のいずれかの(i)、(ii)、および(iii)をそれぞれが含む少なくとも2回の合成サイクルを含む、本発明1001~1035のいずれかの方法。
[本発明1037]
前記方法によって合成した前記オリゴヌクレオチドがLNAオリゴヌクレオチドである、本発明1001~1036のいずれかの方法。
[本発明1038]
最も3'側のヌクレオシドがLNAヌクレオシドである、本発明1037の方法。
[本発明1039]
包括的脱保護および固体支持体からの切断の段階を、8時間未満、例えば約4時間の時間で実施する、本発明1038の方法。
[本発明1040]
(a)固体支持体または該固体支持体に結合した先行のヌクレオシドのいずれかに結合したブロックされた末端-OH基(末端5'-OH基)を含む該固体支持体を提供する段階、
(b)該末端-OH基を非ブロック化する段階、
(c)前記本発明のいずれかの方法を実施する段階、
(d)任意で、段階(a)~(c)を1回または複数回のさらなるサイクル数繰り返す段階(鎖伸長)、
(e)前記カルバメート保護基を除去する段階、
(f)前記キラル補助基を除去する段階、
(g)前記オリゴヌクレオチドを該固体支持体から切断する段階
を含み、
段階(e)、(f)、および(g)を連続してもしくは同時に実施するか、または、該キラル補助基を除去する段階および該固体支持体から切断する段階の前に段階(e)を実施する、本発明1001~1039のいずれかの方法。
[本発明1041]
立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成の最中にオリゴヌクレオチドの鎖切断を防止するための、キラル補助基におけるカルバメート直交保護基の使用。
[本発明1042]
式21または22:
の化合物:
式中、Xは、固体支持体、または該固体支持体に結合した先行のヌクレオシド(末端5'-OH基)のいずれかであり;塩基は核酸塩基であり;R、R 1 、R 3 、R 5 、R 6 、およびR 9 は本発明1016において定義するとおりであり、かつZは前記本発明のいずれかのカルバメート保護基である。
[本発明1043]
前記カルバメート保護基が、21の基からなる群より選択される、本発明1042の化合物。
[本発明1044]
R 2 およびR 4 が、水素であるか、または本発明1018、1019、もしくは1020のいずれかのキラル補助モノマーにおいて示すとおりである、本発明1042または1043の化合物。
本明細書において用いられる「アリール」なる用語は、環を形成する各原子が炭素原子である芳香環を意味する。アリール環は、5、6、7、8、9個、または9個を超える炭素原子によって形成される。アリール基は置換または無置換である。1つの局面において、アリールはフェニルまたはナフタレニルである。構造に応じて、アリール基はモノラジカルまたはジラジカル(すなわち、アリーレン基)であり得る。1つの局面において、アリールはC6~10アリールである。いくつかの態様において、アリールはフェニルである。置換されている場合、アリールは、C1~4アルキル基、C6~14アリール基C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリ-ル基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択される基で置換されていてもよい。複数の置換は、C1~4アルキル基、C6~14アリール基C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、もしくはC6~14アリールC1~4アルキル基;またはヨウ化物、フッ化物、臭化物、もしくは塩化物などのハロゲン化物からなる群より選択される基、例えばヨウ化物、フッ化物、臭化物、もしくは塩化物などのハロゲン化物で置換されたフェニルからなる群より依存的にまたは独立して選択されてもよい。
オキサザホスホリジンキラル補助ホスホラミダイトモノマーは、オキサザホスホリジンリンホスホラミダイト、(本明細書においてヌクレオシドモノマー、モノマー、またはアミダイトとも呼ばれる)、例えば、アセトニトリル、ヌクレオシドモノマー、および芳香族複素環式溶媒を含む、式1のヌクレオシドモノマーと呼んでもよい。
のものであり、
式中、Xはヌクレオシドの3'であり;
R5およびR6は独立して、水素、アルキル、シクロ-アルキル、アリール、ヘテロアリール、置換アルキル、置換シクロ-アルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、または、R5およびR6は一緒になって、3~16個の炭素原子を含む複素環を式AのN原子と共に形成し;
R9は水素であり;
R1は、水素およびC1~3アルキルからなる群より選択され;かつ、
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
ここで、置換されている場合、Rは、C1~4アルキル基、C6~14アリール基C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択される基で置換されていてもよい。複数の置換は、C1~4アルキル基、C6~14アリール基C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より依存的にまたは独立して選択されてもよい。
のものであり、
式中、塩基は核酸塩基であり;
R3は、CH2ODMTr、CH2-アルキル-O-DMTr、CH-Me-O-DMTr、CH2OMMTr、CH2-アルキル-O-MMTr、CH(Me)-O-MMTr、CH-Ra-O-DMTrRb、およびCH-Ra-O-MMTrRbからなる群より選択され;R2は、ハロ、例えば-F、アミノ、アジド、-SH、-CN、-OCN、-CF3、-OCF3、-O(Rm)-アルキル、-S(Rm)-アルキル、-N(Rm)-アルキル、-O(Rm)-アルケニル、-S(Rm)-アルケニル、-N(Rm)-アルケニル;-O(Rm)-アルキニル、-S(Rm)-アルキニル、または-N(Rm)-アルキニル;O-アルキレニル-O-アルキル、アルキニル、アルカリール、アラルキル、O-アルカリール、O-アラルキル、O(CH2)2SCH3、O-(CH2)2-O-N(Rm)(Rn)またはO-CH2C(=O)-N(Rm)(Rn)、-O-(CH2)2OCH3、および-O-CH3からなる群より選択され、ここで各RmおよびRnは独立してH、アミノ保護基または置換もしくは無置換C1~10アルキルであり;
R4は、アルキル、シクロ-アルキル、シクロ-ヘテロアルキル、O-アルキル、S-アルキル、NH-アルキル、および水素からなる群より選択されるか;
または、R2およびR4は一緒になって、-C(RaRb)-、-C(Ra)=C(Rb)、-C(Ra)=N、O、-Si(Ra)2-、S-、-SO2-、-N(Ra)-、および>C=Zからなる群より選択される1、2、3つの基/原子からなる二価の架橋などの二価の架橋を示し;
ここでRaおよび存在する場合にRbはそれぞれ独立して、水素、置換されていてもよいC1~6-アルキル、置換されていてもよいC2~6-アルケニル、置換されていてもよいC2~6-アルキニル、ヒドロキシ、置換されていてもよいC1~6-アルコキシ、C2~6-アルコキシアルキル、C2~6-アルケニルオキシ、カルボキシ、C1~6-アルコキシカルボニル、C1~6-アルキルカルボニル、ホルミル、アリール、アリールオキシ-カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ-カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ(C1~6-アルキル)アミノおよびジ(C1~6-アルキル)アミノ、カルバモイル、モノ(C1~6-アルキル)-アミノ-カルボニルおよびジ(C1~6-アルキル)-アミノ-カルボニル、アミノ-C1~6-アルキル-アミノカルボニル、モノ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニルおよびジ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニル、C1~6-アルキル-カルボニルアミノ、カルバミド、C1~6-アルカノイルオキシ、スルホノ、C1~6-アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C1~6-アルキルチオ、ハロゲンより選択され、ここでアリールおよびヘテロアリールは置換されていてもよく、かつここで2つのジェミナルの置換基RaおよびRbは一緒になって、置換されていてもよいメチレン(=CH2)を示してもよく、ここですべてのキラル中心について、不斉基はR配向またはS配向のいずれかで見い出されてもよい。
のもの(β-D-オキシLNA)である。
実施例に示すとおり、DMF保護L-LNA-Gモノマーはアセトニトリル溶媒に難溶性である。
のモノマーではなく、
式中、R、R1、R3、R5、R6、およびR9は式1のモノマーのとおりであり、かつここで式11のモノマーについて、XおよびYは一緒になって、二価の架橋(例えば、本明細書のR2およびR4のとおり、例えば架橋-C(RaRb)-O-、-C(RaRb)C(RaRb)-O-、-CH2-O-、-CH2CH2-O-、-CH(CH3)-O-からなる群より選択される架橋を示す。いくつかの態様において、XおよびYは、二価の架橋-CH2-O-(メチレン-オキシ、オキシ-LNAとしても公知)または-CH(CH3)-O-(メチル-メチレン-オキシ)を示す。-CH(CH3)-O-架橋は架橋内の炭素原子でキラル中心を導入し、いくつかの態様において、これはS位である(例えば、当技術分野において(S)cETとして公知のヌクレオシド-EP1984381参照))。いくつかの態様において、XおよびYは二価の架橋-CH2-O-を示し、ここで架橋はβ-D配置(β-D-オキシLNA)である。いくつかの態様において、XおよびYは二価の架橋-CH2-O-を示し、ここで架橋はα-L配置(α-L-D-オキシLNA)である。いくつかの態様において、XおよびYは二価の架橋-CH2-S-(チオLNA)、または-CH2-NH2-(アミノLNA)を示す。XおよびYが一緒になって二価の架橋を示す態様において、R3は、例えば、CH2-O-DMTr、またはCH2-O-MMTrであってもよい。
のモノマーではなく、
式中、X、Y、R、R1、R9、およびR3は式1のとおりである。グアニン塩基の環外酸素は、例えば、シアノ基で任意で保護してもよい。
のモノマーではなく、
式中、X、Y、R1、およびR3は式1のとおりである。グアニン塩基の環外酸素は、例えば、シアノ基で任意で保護してもよい。式35または66のいくつかの態様において、R1は水素である。式35または36のいくつかの態様において、R3はCH2-O-DMTrまたはCH2-O-MMTrである。いくつかの態様において、本発明のオキサザホスホリジンホスホラミダイトモノマーはアシル保護ヌクレオシド(Z)を含む。
実施例に示すとおり、DMF保護L-LNA-Gモノマーはアセトニトリル溶媒に難溶性である。しかし、本発明者らは、L-LNA-Gモノマーのグアニンヌクレオシド上のアシル保護基の使用は、溶解性の問題を克服することを確認した。
式中、R、R1、R2、R3、R4、R5、R9、およびR6は本発明の化合物のとおりであり、かつ-C(=O)-R7はグアニン塩基の環外窒素上のアシル保護基であり、かつR8は、存在する場合に、グアニン環外酸素上の保護基である。いくつかの態様において、R8はシアノエチルである。いくつかの態様において、Rはフェニルであり、R1は水素またはメチルであり、かつR3は任意でCH2-O-DMTrまたはCH2-O-MMTrである。いくつかの態様において、R7はイソブチリルである。式31および32において、YおよびXは式11のとおりである。
置換されている場合、Rは、C1~4アルキル基、C6~14アリール基C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より選択される基で置換されていてもよい。複数の置換は、C1~4アルキル基、C6~14アリール基C1~4、アルコキシ基、C7~14アラルキル基、C1~4アルキル、C6~14アリール基、C1~4アルコキシ、C6~14アリール基、またはC6~14アリールC1~4アルキル基からなる群より依存的にまたは独立して選択されてもよい。
であり、ここで、G31、G32、およびG33は独立して、C1~4アルキル、C6~14アリールC1~4アルコキシ、C7~14アラルキル、C1~4アルキルC6~14アリール、C1~4アルコキシC6~14アリール、およびC6~14アリールC1~4アルキルからなる群より選択される。
いくつかの態様において、モノマーは二環式オキサザホスホリジンホスホラミダイトモノマーであり、例えば、いくつかの態様において、R5およびR6は一緒になって複素環を形成する。いくつかの態様において、R5およびR6は一緒になって複素環(式1に示す環式窒素と共に)を形成し、これは、4個の炭素原子を含んで複素環中の原子の合計を5個とする(式AまたはA(i)またはA(ii)に示す4個の炭素および窒素。例えば、本発明の化合物は式9、10、11、12、13、14、15、または16のものであってもよい。
いくつかの態様において、Bは、アデニン、グアニン、シトシン、チミジン、ウラシル、キサンチン、ヒポキサンチン、5-メチルシトシン、イソシトシン、プソイドイソシトシン、5-ブロモウラシル、5-プロピニルウラシル、6-アミノプリン、2-アミノプリン、イノシン、ジアミノプリン、および2-クロロ-6-アミノプリンからなる群より選択される核酸塩基である。
いくつかの態様において、オリゴヌクレオチド中に組み込まれている場合、ヌクレオシド(Z)は、等価のDNAヌクレオシドよりも、相補的RNA標的に対する高い結合親和性を付与する。そのようなヌクレオシドは高親和性ヌクレオシドと呼ばれる。高親和性ヌクレオシドの例には、2'-O-MOE、2'-フルオロ、2'-O-メチル、およびLNAヌクレオシドが含まれる。ヌクレオシドが高親和性ヌクレオシドである態様において、R3は、例えば、CH2-O-DMTrまたはCH2-O-MMTrであってもよい。
本発明の立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成のための方法は、先行のヌクレオシドの5'-OH基にカップリングする段階を含む。先行のヌクレオシドは、直接、またはさらなる他のヌクレオチドを介して、固体支持体(オリゴヌクレオチド合成支持体)に結合されていてもよく、かつ、カップリング段階(i)の前に、5'-OH基を脱保護(例えば、3'保護基(これは、DMTr(-CH2-O-DMTr)などの本明細書においてR3として定義されるとおりであってもよい)の除去により)してもよい。適切なオリゴヌクレオチド支持体には、UnyLinker部分またはヌクレオシド3'-スクシネート連結を含むポリスチレンまたは制御細孔ガラス(CPG)支持体(Ravikumar et al., Org. Process Res. Dev., 2008, 12 (3), pp 399-410参照):
が含まれ、ここで、ReはでありReは、アリールまたはC1~10アルキル、例えば、フェニル、イソプロピル、またはメチルであり、かつ黒い丸は、固体支持体マトリックス、例えばポリスチレンまたは制御細孔ガラスを表す。ReがフェニルまたはメチルのいずれかであるUnyLinker支持体は、市販されており、かつオリゴヌクレオチド合成において広く用いられる。
のとおりに表してもよいか、または、固体支持体にすでに結合されたさらなる先行のヌクレオシドがある場合、固体支持体に結合された先行のヌクレオチドは以下:
のとおりに表してもよく、ここで、R2、R4、R3はオキサザホスホリジンキラル補助ホスホラミダイトモノマーにより定義されるとおりであり、ReはでありReはアリールまたはC1~10アルキル、例えばフェニル、イソプロピル、またはメチルであり、RfはHまたはシアノエチルであり、XはOまたはSのいずれかである。かつnは先行のヌクレオチドの数を表す。nは、例えば、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、または25であってもよい。
(例示のみを目的とする)
カップリング段階(i)は、5'-OH基へのオキサザホスホリジンキラル補助ホスホラミダイトモノマー(アミダイト)の先行のモノマーの反応を含む。カップリング段階は、アセトニトリルなどの適切な溶媒中、活性化物質存在下で実施してもよい。
(例示のみを目的とする)
本発明の方法において用いるカップリング溶媒は、アセトニトリルおよび芳香族複素環式塩基溶媒であってもよい。
カップリング段階の後、いくつかの態様において、カップリングしたモノマーに硫化反応を行う。硫化は、アセトニトリルおよび任意で、ピリジンまたは3-メチルピリジンなどの芳香族複素環式溶媒などの適切な溶媒中、3H-1,2-ベンゾジチオル-3-オン-1,1-ジオキシドもしくはフェニルアセチルジスルフィド、またはキサンタンヒドリドなどの硫化試薬で処理することにより実施してもよい。
(例示のみを目的とする)
または、アミン保護段階(ii)の後に硫化を実施してもよい。
本発明の方法の段階(ii)は、オキサザホスホリジンキラル補助基のアミン基のカルバメート保護基による保護を含む。
(例示のみを目的とする)
したがって、段階(ii)は、カルバメート前駆体と段階(i)で提供されるカップリングしたアミン含有キラル補助ホスホラミダイトモノマーとを、塩基、例えば非求核塩基、例えばN,N-ジイソプロピルエチルアミンを任意で含む適切な溶媒中などの、カルバメート保護基によるキラル補助基の窒素の保護を可能にする条件下で、反応させることを含む。
からなる群より選択され、ここで、Rdは、水素、置換されていてもよいC1~10アルキル基、置換されていてもよいC2~6アルケニル基、置換されていてもよいC2~6アルキニル基、置換されていてもよいC3~7シクロアルキル基、置換されていてもよいC1~10アルキルオキシ基、またはアリール基からなる群より選択され、かつR'は、
からなる群より選択される脱離基などの脱離基である。
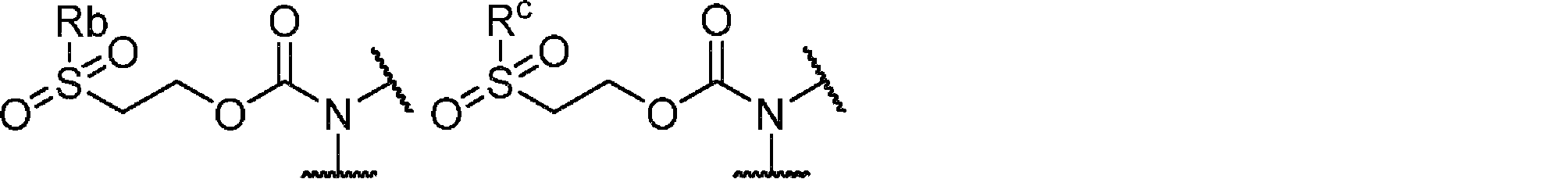
いくつかの態様において、アミンカルバメート保護基は、式:
の置換エチルカルバメート保護基であり、
式中、Nはキラル補助基中に存在する窒素であり、かつ、Ra、および任意で、存在する場合にRbは、-CN、-SO2Rc、-SiRc 3、-F、-Cl、-CF3、および-CO-Rcからなる群より独立して選択される基であり、ここでRcは、水素、置換されていてもよいC1~10アルキル基、置換されていてもよいC2~6アルケニル基、置換されていてもよいC2~6アルキニル基、置換されていてもよいC3~7シクロアルキル基、置換されていてもよいC1~10アルキルオキシ基、もしくはアリール基からなる群より独立して選択されるか;または、Rbは、水素、置換されていてもよいC1~10アルキル基、C2~6アルケニル基、C2~6アルキニル基、C3~7シクロアルキル基、およびアリール基からなる群より選択され;
または、RaおよびRbは一緒になってフルオレニル基を形成する(Fmoc態様によって示すとおり)。
の置換されていてもよい2'-スルホニルカルバメート保護基であり、
式中、Nはキラル補助基中に存在する窒素であり、かつRcは、水素、置換されていてもよいC1~10アルキル基、置換されていてもよいC2~6アルケニル基、置換されていてもよいC2~6アルキニル基、置換されていてもよいC3~7シクロアルキル基、置換されていてもよいC1~10アルキルオキシ基、またはアリール基からなる群より独立して選択され;
いくつかの態様において、Rbは置換されていてもよいC1~10アルキルまたはフェニルなどのアリール基である。
からなる群より選択され、ここで、Nはキラル補助基中に存在するNであり、かつRdは、水素、置換されていてもよいC1~10アルキル基、置換されていてもよいC2~6アルケニル基、置換されていてもよいC2~6アルキニル基、置換されていてもよいC3~7シクロアルキル基、置換されていてもよいC1~10アルキルオキシ、またはアリール基からなる群より選択される。いくつかの態様において、Rdはメチル置換フェニル基である。
キラル補助基のアミン基の保護の後、アミン保護前に実施していない場合には、カップリングおよびアミン保護したモノマーに硫化反応を行う。
いくつかの態様において、キャッピング段階を、キラル補助基アミン保護段階(ii)および硫化段階(iii)の後に、段階(ii)次いで(iii)、または(iii)および次いで(ii)の順序には関係なく実施する。キャッピングは、未反応の先行のヌクレオシド-OH基をさらなる鎖伸長からブロックして、内部塩基欠失(n-1)ショートマーを有するオリゴヌクレオチドの生成を防止するプロセスである。キャッピングは、1つまたは複数の溶媒(典型的にはアセトニトリル、ピリジン、および/またはTHF)中、無水酢酸およびN-メチルイミダゾールの溶液を用いて実施してもよい。
いったん硫化およびキラル補助基アミン保護ならびに任意でキャッピングが完了すると、生成物は、オリゴヌクレオチド合成のさらなる(鎖伸長)サイクルへと継続してもよいか、または伸長後脱保護、キラル補助基除去、および固体支持体からの切断へと進行してもよい。
本発明は、以下の段階:
(a)ブロックされた末端-OH基(末端5'-OH基)を有するヌクレオシド(先行のヌクレオシド)を含む固体支持体を提供する段階;
(b)先行のヌクレオシドの末端-OH基を非ブロック化する段階;
(c)オキサザホスホリジンキラル補助ホスホラミダイトモノマーを先行のヌクレオシドの非ブロック化した5'-OH基にカップリングする段階;
(d)オキサザホスホリジンキラル補助基のアミン基をカルバメート保護基で保護する段階;
(e)保護段階(d)の前または後に、オキサザホスホリジンキラル補助基のリン原子を硫化する段階;
(f)任意で、任意の未反応末端5'-OH基をキャッピングする段階であって、硫化段階(e)の後に実施するか、または、段階(d)の前に硫化を実施する態様では段階(d)の後に実施してもよい、段階;
(g)段階(b)~(f)を任意で繰り返す段階(さらなる鎖伸長サイクル);
(h)カルバメート保護基を除去する段階;
(i)キラル補助基を除去する段階;
(j)オリゴヌクレオチドを固体支持体から切断する段階
を含む、オリゴヌクレオチド合成の方法を提供する。ここで、段階(h)、(i)、および(j)を連続してもしくは同時に実施するか、または、キラル補助基を除去する段階および固体支持体から切断する段階の前に段階(h)を実施する。
鎖伸長が完了すると、キラル補助基のアミン上のカルバメート保護基を除去する。カルバメート保護基の除去は、先行技術(Oka et el)で用いられる方法よりもはるかに速く、低温で達成することができる。典型的には、約4時間またはそれ未満で十分である。実施例に示すとおり、直交カルバメート脱保護は、約3時間未満、例えば約2時間未満または約2時間、例えば約1時間未満または約1時間で日常的に達成することができる。いくつかの態様において、カルバメート保護基の直交脱保護は、約55℃未満、例えば約50℃未満、例えば約40℃未満、例えば約30℃未満、例えば25℃もしくは約25℃の温度または室温で達成される。いくつかの態様において、カルバメート保護基の直交脱保護は、約55℃未満、例えば約50℃未満、例えば約40℃未満、例えば約30℃未満、例えば25℃もしくは約25℃の温度または室温で約4時間未満の時間で達成される。いくつかの態様において、カルバメート保護基の直交脱保護は、約55℃未満、例えば約50℃未満、例えば約40℃未満、例えば約30℃未満、例えば25℃もしくは約25℃の温度または室温で約2時間未満の時間で達成される。いくつかの態様において、カルバメート保護基の直交脱保護は、約55℃未満、例えば約50℃未満、例えば約40℃未満、例えば約30℃未満、例えば25℃もしくは約25℃の温度または室温で約1時間の時間で達成される。
いくつかの態様において、カルバメート保護基の除去は、包括的脱保護およびオリゴヌクレオチドの固体支持体からの切断の最中に実施され(起こり)、本明細書において1ポットプロセスと呼ばれる。包括的脱保護および切断は、ホスホラミダイトオリゴヌクレオチド合成において用いられる標準の手順、例えば約55℃から約60℃での水酸化アンモニウムを用いてもよい。典型的には、水中のNH3の飽和限界によって規定される濃水酸化アンモニウムを用いる(約28~35%)。
いくつかの態様において、カルバメート保護基を包括的脱保護の前に除去する(直交脱保護)。カルバメート保護基の選択的除去は、典型的には有機溶媒中の適切な塩基、例えば、アセトニトリル中20%ジエチルアミン、またはジメチルホルムアミド中20%ピペリジンでの処理によって達成される。しかし、例えば、シリルカルバメートに対して、典型的には溶媒テトラヒドロフラン中フッ化テトラブチルアンモニウムの形態での、フッ化物イオンでの処理により達成してもよい。
いくつかの態様において、カルバメート保護基の直交除去の後で、かつ包括的脱保護および固体支持体からの切断の前に、キラル補助基の切断の段階を実施する。キラル補助基の選択した除去は、例えば、室温で1時間用いてもよい、DBU(1,8-ジアザビシクロ(5.4.0)ウンデカ-7-エン)での処理により実施してもよい。3ポットプロセスは、キラル補助基のアミンからカルバメート保護基を直交脱保護する第一の段階(ポット1)と、続いてキラル補助基を除去する第二の段階(ポット2)と、続いて包括的脱保護および固体支持体からの切断の第三の段階(ポット3)を含む。
いくつかの態様において、本発明の方法によって合成したオリゴヌクレオチドはLNAオリゴヌクレオチドである。いくつかの態様において、本発明のオリゴヌクレオチドの3'末端ヌクレオシドはLNAオリゴヌクレオチドである。実施例において示すとおり、本発明者らは、固体支持体(例えば、本明細書において開示する、UnyLinker部分を含む支持体)に結合した3'末端LNAを有するLNAオリゴヌクレオチドを、固体支持体のUnylinker部分から、包括的脱保護および切断のための条件下、約1~約4時間(例えば、約55℃~約60℃での水酸化アンモニウム)で切断し得ることを見出した。事実、包括的脱保護の約4時間以内に、3'LNAヌクレオシドを有するLNAオリゴヌクレオチド、例えば2'-O-CH2-4'架橋を有するLNAを、UnyLinker固体支持体から効果的に切断および脱保護することができる。
活性化物質は、固体支持体またはオリゴヌクレオチド鎖に結合した5'末端基にモノマーをカップリングさせるためにホスホラミダイトモノマーを活性化する、オリゴヌクレオチド合成のカップリング段階の前または最中に用いる試薬である。
典型的には、オリゴヌクレオチドホスホロチオエートをRpおよびSpホスホロチオエート連結の無作為混合物(ジアステレオマー混合物とも呼ばれる)として合成する。本発明の方法において、オリゴヌクレオチドのホスホロチオエート連結の少なくとも1つが立体的に規定されている、すなわちオリゴヌクレオチド試料中に存在するオリゴヌクレオチド分子の少なくとも75%、例えば少なくとも80%、または少なくとも85%、または少なくとも90%または少なくとも95%、または少なくとも97%、例えば少なくとも98%、例えば少なくとも99%、または(本質的に)すべてでRpまたはSpのいずれかである、ホスホロチオエートオリゴヌクレオチドを提供する。立体的に規定されたオリゴヌクレオチドは、立体的に規定されている少なくとも1つのホスホロチオエート連結を含む。立体的に規定されたなる用語は、1つもしくは複数のホスホロチオエートヌクレオシド間連結のRpもしくはSpのいずれかとして規定されたキラリティを述べるために用いてもよいか、またはそのような1つ(もしくは複数)のホスホロチオエートヌクレオシド間連結を含むオリゴヌクレオチドを述べるために用いてもよい。立体的に規定されたオリゴヌクレオチドは、任意の1つの位置に少量の代わりの立体異性体を含み得ることが理解され、例えば、WanらはNAR, November 2014において報告したギャップマーに対する98%立体選択性を報告している。
LNAオリゴヌクレオチドは、少なくとも1つのLNAヌクレオシドを含むオリゴヌクレオチドである。LNAオリゴヌクレオチドはアンチセンスオリゴヌクレオチドであってもよい。
LNAヌクレオシドは、ヌクレオチドのリボース糖環のC2'とC4'との間にリンカー基(ビラジクルまたは架橋と呼ぶ)を含む修飾ヌクレオシド(すなわち、R2およびR4が一緒になって二価の架橋を示す態様)である。
のものであり得、
式中、Bは核酸塩基を示し;R、R1、R6、R3、R9、R5は、式A、A(i)、A(ii)、または式1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、もしくは16の任意の1つのとおりである。
いくつかの態様において、オキサザホスホリジンホスホラミダイトモノマーは、DNAヌクレオシドであるかまたはそれを含み、例えば、モノマーは式19または式20:
のものであり得、
式中、Bは核酸塩基を示し;R、R1、R6、R3、R9、R5は、式A、A(i)、A(ii)、または式1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、もしくは16の任意の1つのとおりである。式20のいくつかの態様において、Bはアデニン、例えば保護アデニン、例えばBz保護アデニンである。
のとおりであり、
式中、塩基は核酸塩基を示し;R、R1、R3、R9は、式A、A(i)、A(ii)、または式1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、もしくは16の任意の1つのとおりである。式20または22のいくつかの態様において、Bはアデニン、例えば保護アデニン、例えばBz保護アデニンである。式19、20、21、または22のモノマーのいくつかの態様において、Rはフェニルであり、かつR1は水素またはメチルのいずれかである。式19、20、21、または22のモノマーのいくつかの態様において、R3はCH2-O-DMTrまたはCH2-O-MMTrである。
いくつかの態様において、オリゴヌクレオチドはDNAホスホロチオエートオリゴヌクレオチドである。DNAホスホロチオエートオリゴヌクレオチドはDNAヌクレオシドだけを含み、かついくつかの態様において、立体的に規定されたホスホロチオエートヌクレオシド間連結だけを含み得る。DNAホスホロチオエートは、例えば、18~25ヌクレオチド長であってもよい。
本明細書において用いられるギャップマーなる用語は、1つまたは複数の親和性増強修飾ヌクレオシド(隣接部)が5'および3'で隣接しているRNase H動員オリゴヌクレオチドの領域(ギャップ)を含む、アンチセンスオリゴヌクレオチドを意味する。様々なギャップマーデザインを本明細書において記載する。ヘッドマーおよびテイルマーは、隣接部の1つが欠けている、すなわちオリゴヌクレオチドの末端の一方のみが親和性増強修飾ヌクレオシドを含む、RNase Hを動員することができるオリゴヌクレオチドである。ヘッドマーについては、3'隣接部が欠けており(すなわち、5'隣接部が親和性増強修飾ヌクレオシドを含む)、テイルマーについては、5'隣接部が欠けている(すなわち、3'隣接部が親和性増強修飾ヌクレオシドを含む)。
LNAギャップマーなる用語は、親和性増強修飾ヌクレオシドの少なくとも1つがLNAヌクレオシドである、ギャップマーオリゴヌクレオチドである。
混合ウィングギャップマーなる用語は、隣接領域が少なくとも1つのLNAヌクレオシドと、少なくとも1つの非LNA修飾ヌクレオシド、例えば少なくとも1つの2'置換修飾ヌクレオシド、例えば2'-O-アルキル-RNA、2'-O-メチル-RNA、2'-アルコキシ-RNA、2'-O-メトキシエチル-RNA(MOE)、2'-アミノ-DNA、2'-フルオロ-DNA、アラビノ核酸(ANA)、2'-フルオロ-ANAおよび2'-F-ANAヌクレオシドとを含む、LNAギャップマーを意味する。いくつかの態様において、混合ウィングギャップマーは、LNAヌクレオシド(例えば5'または3')を含む一方の隣接部を有し、他方の隣接部(それぞれ3'または5')は2'置換修飾ヌクレオシドを含む。
本明細書において言及するヌクレオチド分子の長さに言及する場合、それらのモノマー単位がヌクレオチドまたはヌクレオチド類縁体のいずれであるかに関わらず、長さはモノマー単位、すなわちヌクレオチドの数に対応する。ヌクレオチドに関して、モノマーおよび単位なる用語は、本明細書において交換可能に用いられる。
1μモルスケールの合成を、T-スクシネートをローディングしたCPG固体支持体を用いて実施した。通常の5'-ジメトキシトリチル-3'-β-シアノエチルデオキシチミジンホスホラミダイトを用いて、9回の立体無作為カップリングを実施し、続いて式23のデオキシチミジンホスホラミダイトを用いて1回の立体的に規定されたカップリングと、続いて再度5'-ジメトキシトリチル-3'-β-シアノエチルデオキシチミジンホスホラミダイトによる5回の立体無作為カップリングを実施した。すべての合成段階を、以下に挙げる試薬を用い、図1に示すサイクルに従って実施する。1回の立体的に規定されたカップリングにおいて、硫化段階の後ではあるがキャッピング段階の前に、ジクロロメタン中0.5M炭酸9-フルオレニルメチルN-スクシンイミジルの溶液を0.5Mジイソプロピルエチルアミンの溶液と、合成機において様々な比率(図4に示すとおり)で混合した。その後、固体支持体を1mLの濃水酸化アンモニウムと混合し、55℃で1時間放置し、続いて減圧下で蒸発させた。
非ブロック化 ジクロロメタン中3%ジクロロ酢酸(v/v)
活性化物質 アセトニトリル中1Mジシアノイミダゾールおよび0.1M N-メチルイミダゾール
キャップA アセトニトリル中20%1-メチルイミダゾール(v/v)
キャップB1 アセトニトリル中40%無水酢酸(v/v)
キャップB2 アセトニトリル中60%ピリジンまたは2,6-ルチジン(v/v)
硫化試薬 1中0.1Mキサンタンヒドリド
以下の完全に立体的に規定されたオリゴヌクレオチドの1μモル合成を、式23の構造のホスホラミダイトを用いて実施した。
5'-Go srP mCo srP asrP asrP gssP cssP assP tsrP cssP csrP tsrP Go ssP To -3'
大文字はLNAヌクレオチドを示し、小文字はDNAヌクレオチドを示し、ヌクレオチド間ホスホロチオエートの立体配置は2つの関連ヌクレオチドの間で示す。「srP」はR配置のホスホロチオエートを示し、「ssP」はS配置のホスホロチオエートを示す。
Claims (41)
- (i)オキサザホスホリジンキラル補助ホスホラミダイトモノマーをヌクレオシドの5'-OH基にカップリングする段階、続いて(ii)オキサザホスホリジンキラル補助基のアミン基をカルバメート保護基で保護する段階、および(iii)硫化段階
を含む、立体的に規定された(stereodefined)ホスホロチオエートオリゴヌクレオチドの合成のための方法であって、
カップリング段階(i)の後でかつアミン保護段階(ii)の前に硫化段階(iii)を実施する、該方法。 - アミン保護段階(ii)の後に実施するキャッピング段階(iv)をさらに含む、請求項1に記載の方法。
- 硫化段階(iii)の前または後に前記キャッピング段階を実施する、請求項2に記載の方法。
- 固体支持体上で前記オリゴヌクレオチドを合成する、請求項1~3のいずれか一項に記載の方法。
- 鎖伸長が完了すると、包括的オリゴヌクレオチド脱保護/前記固体支持体からの切断の最中にアミンカルバメート保護基を除去する、請求項1~4のいずれか一項に記載の方法。
- 鎖伸長が完了すると、包括的脱保護/前記固体支持体からの切断の前にアミンカルバメート保護基を除去する、請求項1~4のいずれか一項に記載の方法。
- アミンカルバメート保護基を除去した後、包括的脱保護/前記固体支持体からの切断の前に前記キラル補助基を除去する、請求項6に記載の方法。
- アミンカルバメート保護基を除去した後、包括的脱保護/前記固体支持体からの切断の最中に前記キラル補助基を除去する、請求項6に記載の方法。
- アミンカルバメート保護基除去の段階を8時間未満にわたって実施する、請求項6~8のいずれか一項に記載の方法。
- アミンカルバメート保護基除去の段階を室温で実施する、請求項6~9のいずれか一項に記載の方法。
- 段階(i)で用いるオキサザホスホリジンキラル補助ホスホラミダイトモノマーが、式A:
のものであり、
式中、
Xはヌクレオシドの3'酸素であり;
R1は、水素およびC1~3アルキルからなる群より選択され;
R9は水素であり;
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
R5およびR6は独立して、水素、アルキル、シクロ-アルキル、アリール、ヘテロアリール、置換アルキル、置換シクロ-アルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、またはR5およびR6は一緒になって、3~16個の炭素原子を含む複素環を式AのN原子と共に形成する、
請求項1~10のいずれか一項に記載の方法。 - 前記アミンカルバメート保護基[段階(ii)において言及]が、式:
の置換エチルカルバメート保護基であり、
式中、
Nは前記キラル補助基中に存在する窒素であり、かつ、
Ra、および任意で、存在する場合にRbは、β脱離による該カルバメート保護基の脱保護を可能にする基、例えば、-CN、-SO2Rc、-SiRc 3、-F、-Cl、-CF3、および-CO-Rcからなる群より独立して選択される基であり、ここでRcは、水素、置換されていてもよいC1~10アルキル基、置換されていてもよいC2~6アルケニル基、置換されていてもよいC2~6アルキニル基、置換されていてもよいC3~7シクロアルキル基、置換されていてもよいC1~10アルキルオキシ基、およびアリール基からなる群より独立して選択されるか、または、
Rbは、水素、置換されていてもよいC1~10アルキル基、置換されていてもよいC2~6アルケニル基、置換されていてもよいC2~6アルキニル基、置換されていてもよいC3~7シクロアルキル基、置換されていてもよいC1~10アルキルオキシ基、およびアリール基からなる群より選択される、
請求項1~11のいずれか一項に記載の方法。 - 段階(ii)が、前記カルバメート保護基による前記キラル補助基の窒素の置換を可能にする条件下で、カルバメート前駆体と段階(i)で提供されるカップリングしたアミン含有キラル補助ホスホラミダイトモノマーとを反応させることを含む、請求項1~14のいずれか一項に記載の方法。
- 前記オキサザホスホリジンキラル補助ホスホラミダイトモノマーが、式1または2:
のものである、請求項1~16のいずれか一項に記載の方法:
式中、
塩基は核酸塩基であり;
R5およびR6は独立して、水素、アルキル、シクロ-アルキル、アリール、ヘテロアリール、置換アルキル、置換シクロ-アルキル、置換アリール、および置換ヘテロアリールからなる群より選択されるか、またはR5およびR6は一緒になって、3~16個の炭素原子を含む複素環を式(I)のN原子と共に形成し;
R1は、水素およびC1~3アルキルからなる群より選択され;
R9は水素であり;
Rは、アリール、ヘテロアリール、置換アリール、置換ヘテロアリール、ニトロ、ハロゲン、シアノ、シリル、置換シリル、スルホン、置換スルホン(アリール置換スルホン)、フルオレン、および置換フッ素からなる群より選択され;
R3は、CH2ODMTr、CH2-アルキル-O-DMTr、CH-Me-O-DMTr、CH2OMMTr、CH2-アルキル-O-MMTr、CH(Me)-O-MMTr、CH-Ra-O-DMTrRb、およびCH-Ra-O-MMTrRbからなる群より選択され;
R2は、ハロ、例えば-F、アミノ、アジド、-SH、-CN、-OCN、-CF3、-OCF3、-O(Rm)-アルキル、-S(Rm)-アルキル、-N(Rm)-アルキル、-O(Rm)-アルケニル、-S(Rm)-アルケニル、-N(Rm)-アルケニル;-O(Rm)-アルキニル、-S(Rm)-アルキニル、または-N(Rm)-アルキニル;O-アルキレニル-O-アルキル、アルキニル、アルカリール、アラルキル、O-アルカリール、O-アラルキル、O(CH2)2SCH3、O-(CH2)2-O-N(Rm)(Rn)またはO-CH2C(=O)-N(Rm)(Rn)、-O-(CH2)2OCH3、および-O-CH3からなる群より選択され、ここで各RmおよびRnは独立して、H、アミノ保護基、または置換もしくは無置換C1~10アルキルであり;
R4は、アルキル、シクロ-アルキル、シクロ-ヘテロアルキル、O-アルキル、S-アルキル、NH-アルキル、および水素からなる群より選択されるか;または、
R2およびR4は一緒になって、-C(RaRb)-、-C(Ra)=C(Rb)、-C(Ra)=N、O、-Si(Ra)2-、S-、-SO2-、-N(Ra)-、および>C=Zからなる群より選択される1、2、3つの基/原子からなる二価の架橋を示し;
ここでRaおよび存在する場合にRbはそれぞれ独立して、水素、置換されていてもよいC1~6-アルキル、置換されていてもよいC2~6-アルケニル、置換されていてもよいC2~6-アルキニル、ヒドロキシ、置換されていてもよいC1~6-アルコキシ、C2~6-アルコキシアルキル、C2~6-アルケニルオキシ、カルボキシ、C1~6-アルコキシカルボニル、C1~6-アルキルカルボニル、ホルミル、アリール、アリールオキシ-カルボニル、アリールオキシ、アリールカルボニル、ヘテロアリール、ヘテロアリールオキシ-カルボニル、ヘテロアリールオキシ、ヘテロアリールカルボニル、アミノ、モノ(C1~6-アルキル)アミノおよびジ(C1~6-アルキル)アミノ、カルバモイル、モノ(C1~6-アルキル)-アミノ-カルボニルおよびジ(C1~6-アルキル)-アミノ-カルボニル、アミノ-C1~6-アルキル-アミノカルボニル、モノ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニルおよびジ(C1~6-アルキル)アミノ-C1~6-アルキル-アミノカルボニル、C1~6-アルキル-カルボニルアミノ、カルバミド、C1~6-アルカノイルオキシ、スルホノ、C1~6-アルキルスルホニルオキシ、ニトロ、アジド、スルファニル、C1~6-アルキルチオ、ハロゲンより選択され、ここでアリールおよびヘテロアリールは置換されていてもよく、かつここで2つのジェミナルの置換基RaおよびRbは一緒になって、置換されていてもよいメチレン(=CH2)を示してもよく、ここですべてのキラル中心について、不斉基はR配向またはS配向のいずれかで見い出されてもよい。 - R4およびR2が水素である、請求項17に記載の方法。
- カップリング段階(i)が、アセトニトリルおよび芳香族複素環式溶媒と任意で活性化物質とを含むアセトニトリル溶媒組成物中で行われる、請求項1~21のいずれか一項に記載の方法。
- 前記芳香族複素環式溶媒が、20℃の水中で4~7または7~17のpKaを有する、請求項22に記載の方法。
- 前記芳香族複素環式溶媒が芳香族複素環式塩基である、請求項22または23に記載の方法。
- 前記芳香族複素環式溶媒が芳香族複素環式酸である、請求項22または23に記載の方法。
- 前記芳香族複素環式溶媒が、ピリジン、2-ピコリン、4-ピコリン、3-ピコリン、ルチジン、およびピロールからなる群より選択される、請求項22~25のいずれか一項に記載の方法。
- アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が約0.1%~約50%(v/v)である、請求項22~26のいずれか一項に記載の方法。
- アセトニトリル中の芳香族複素環式溶媒の濃度(v/v)が、約0.5%~約10%である、請求項22~27のいずれか一項に記載の方法。
- 前記活性化物質がN-メチルイミダゾールを含む、請求項22~28のいずれか一項に記載の方法。
- 前記溶媒組成物が、0.01~約1M N-メチルイミダゾールの濃度でN-メチルイミダゾールを含む、請求項22~29のいずれか一項に記載の方法。
- 前記活性化物質が、4,5-ジシアノイミダゾール(DCI)、テトラゾール、または5-(ベンジルチオ)-1H-テトラゾールを含む、請求項22~30のいずれか一項に記載の方法。
- 前記溶媒組成物が、約0.5~約2M DCI(または請求項22~31に記載の他の活性化物質)を含む、請求項22~31のいずれか一項に記載の方法。
- 請求項1~32のいずれか一項に記載のカップリング段階、硫化段階、および保護段階、(i)、(ii)、および(iii)をそれぞれが含む少なくとも2回の合成サイクルを含む、請求項1~32のいずれか一項に記載の方法。
- 前記方法によって合成した前記オリゴヌクレオチドがLNAオリゴヌクレオチドである、請求項1~33のいずれか一項に記載の方法。
- 最も3'側のヌクレオシドがLNAヌクレオシドである、請求項34に記載の方法。
- 包括的脱保護および固体支持体からの切断の段階を、8時間未満の時間で実施する、請求項35に記載の方法。
- (a)固体支持体または該固体支持体に結合した先行のヌクレオシドのいずれかに結合したブロックされた末端-OH基(末端5'-OH基)を含む該固体支持体を提供する段階、
(b)該末端-OH基を非ブロック化する段階、
(c)請求項1~36のいずれか一項に記載の方法を実施する段階、
(d)任意で、段階(a)~(c)を1回または複数回のさらなるサイクル数繰り返す段階(鎖伸長)、
(e)前記カルバメート保護基を除去する段階、
(f)前記キラル補助基を除去する段階、
(g)前記オリゴヌクレオチドを該固体支持体から切断する段階
を含み、
段階(e)、(f)、および(g)を連続してもしくは同時に実施するか、または、該キラル補助基を除去する段階および該固体支持体から切断する段階の前に段階(e)を実施する、方法。 - 立体的に規定されたホスホロチオエートオリゴヌクレオチドの合成の最中にオリゴヌクレオチドの鎖切断を防止するための、キラル補助基におけるカルバメート直交保護基の使用。
- 前記カルバメート保護基が、請求項12~14のアミンカルバメート保護基からなる群より選択される、請求項39に記載の化合物。
- R2およびR4が、水素であるか、または請求項17に記載のキラル補助モノマーにおいて示すとおりである、請求項39または40に記載の化合物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP17163506 | 2017-03-29 | ||
| EP17163506.3 | 2017-03-29 | ||
| PCT/EP2018/057069 WO2018177825A1 (en) | 2017-03-29 | 2018-03-20 | Orthogonal protecting groups for the preparation of stereodefined phosphorothioate oligonucleotides |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020512360A JP2020512360A (ja) | 2020-04-23 |
| JP2020512360A5 JP2020512360A5 (ja) | 2021-04-08 |
| JP7164540B2 true JP7164540B2 (ja) | 2022-11-01 |
Family
ID=61899189
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019553219A Active JP7164540B2 (ja) | 2017-03-29 | 2018-03-20 | 立体的に規定されたホスホロチオエートオリゴヌクレオチドの調製のための直交保護基 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11591362B2 (ja) |
| EP (1) | EP3601309A1 (ja) |
| JP (1) | JP7164540B2 (ja) |
| KR (1) | KR20190135494A (ja) |
| CN (1) | CN110475784B (ja) |
| WO (1) | WO2018177825A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110831951B (zh) * | 2017-06-28 | 2023-10-27 | 罗氏创新中心哥本哈根有限公司 | 多重偶联和氧化方法 |
| IL274146B2 (en) | 2017-12-01 | 2024-11-01 | The Texas A& M Univ System | Angelman syndrome antisense treatment |
| JP7467457B2 (ja) * | 2018-11-22 | 2024-04-15 | ロシュ イノベーション センター コペンハーゲン エーエス | 立体的に規定されたオリゴヌクレオチドの合成における活性化物質としてのピリジニウム塩 |
| WO2020191252A1 (en) * | 2019-03-20 | 2020-09-24 | Wave Life Sciences Ltd. | Technologies useful for oligonucleotide preparation |
| WO2020212301A1 (en) * | 2019-04-16 | 2020-10-22 | Roche Innovation Center Copenhagen A/S | Novel process for preparing nucleotide p(v) monomers |
| TW202241454A (zh) * | 2021-02-01 | 2022-11-01 | 日商第一三共股份有限公司 | 抗體-免疫賦活化劑共軛物之新穎製造方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015528002A (ja) | 2012-07-13 | 2015-09-24 | ウェイブ ライフ サイエンス プライベート リミテッド | キラル制御 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6465628B1 (en) | 1999-02-04 | 2002-10-15 | Isis Pharmaceuticals, Inc. | Process for the synthesis of oligomeric compounds |
| US6492171B2 (en) | 2000-05-16 | 2002-12-10 | Isis Pharmaceuticals, Inc. | Antisense modulation of TERT expression |
| JP4865544B2 (ja) * | 2004-03-25 | 2012-02-01 | 株式会社キラルジェン | 立体規則性の高いリボヌクレオチド類縁体及びデオキシリボヌクレオチド類縁体の製造法 |
| EP1984381B1 (en) | 2006-01-27 | 2010-09-29 | Isis Pharmaceuticals, Inc. | 6-modified bicyclic nucleic acid analogs |
| JP5198430B2 (ja) | 2006-04-03 | 2013-05-15 | サンタリス ファーマ アー/エス | antimiRNAアンチセンスオリゴヌクレオチドを含む医薬組成物 |
| DK2205737T3 (da) | 2007-10-04 | 2013-05-21 | Santaris Pharma As | Mikromirer |
| DK2285819T3 (da) | 2008-04-04 | 2013-12-02 | Isis Pharmaceuticals Inc | Oligomere forbindelser omfattende neutralt bundne, terminale bicykliske nukleosider |
| DK2356129T3 (da) | 2008-09-24 | 2013-05-13 | Isis Pharmaceuticals Inc | Substituerede alpha-L-bicykliske nukleosider |
| EP2370451B1 (en) | 2008-12-02 | 2016-11-16 | Wave Life Sciences Japan, Inc. | Method for the synthesis of phosphorus atom modified nucleic acids |
| IN2012DN00720A (ja) | 2009-07-06 | 2015-06-19 | Ontorii Inc | |
| WO2012039448A1 (ja) | 2010-09-24 | 2012-03-29 | 株式会社キラルジェン | 不斉補助基 |
| US11267843B2 (en) | 2016-03-18 | 2022-03-08 | Roche Innovation Center Copenhagen A/S | Stereodefining L-monomers |
| JP7097820B2 (ja) | 2016-05-12 | 2022-07-08 | ロシュ イノベーション センター コペンハーゲン エーエス | ヌクレオシドまたはオリゴヌクレオチドへの、立体的に規定されたオキサザホスホリジンホスホルアミダイト単量体のカップリングの増大法 |
| WO2017198775A1 (en) * | 2016-05-18 | 2017-11-23 | Eth Zurich | Stereoselective synthesis of phosphorothioate oligoribonucleotides |
-
2018
- 2018-03-20 JP JP2019553219A patent/JP7164540B2/ja active Active
- 2018-03-20 WO PCT/EP2018/057069 patent/WO2018177825A1/en unknown
- 2018-03-20 CN CN201880022722.3A patent/CN110475784B/zh active Active
- 2018-03-20 EP EP18715527.0A patent/EP3601309A1/en active Pending
- 2018-03-20 US US16/497,952 patent/US11591362B2/en active Active
- 2018-03-20 KR KR1020197030981A patent/KR20190135494A/ko not_active Ceased
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015528002A (ja) | 2012-07-13 | 2015-09-24 | ウェイブ ライフ サイエンス プライベート リミテッド | キラル制御 |
Non-Patent Citations (2)
| Title |
|---|
| OKA,N. et al,Solid-Phase Synthesis of Stereoregular Oligodeoxyribonucleoside Phosphorothioates Using Bicyclic Oxazaphospholidine Derivatives as Monomer Units,Journal of the American Chemical Society,2008年,Vol.130, No.47,p.16031-16037 |
| Protective Groups in Organic Synthesis FIFTH Edition,2014年,pp.895-899, 907-921 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20210179658A1 (en) | 2021-06-17 |
| JP2020512360A (ja) | 2020-04-23 |
| CN110475784A (zh) | 2019-11-19 |
| US11591362B2 (en) | 2023-02-28 |
| KR20190135494A (ko) | 2019-12-06 |
| CN110475784B (zh) | 2024-07-16 |
| EP3601309A1 (en) | 2020-02-05 |
| WO2018177825A1 (en) | 2018-10-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7164540B2 (ja) | 立体的に規定されたホスホロチオエートオリゴヌクレオチドの調製のための直交保護基 | |
| JP7492829B2 (ja) | 多重カップリングおよび酸化の方法 | |
| JP7097820B2 (ja) | ヌクレオシドまたはオリゴヌクレオチドへの、立体的に規定されたオキサザホスホリジンホスホルアミダイト単量体のカップリングの増大法 | |
| EP4098655A1 (en) | Method for producing nucleic acid oligomer | |
| JP7198768B2 (ja) | UnyLinker迅速切断方法 | |
| EP4180442A1 (en) | Method for producing nucleic acid oligomer | |
| EP4097117B1 (en) | Process of preparing nucleic acid oligomer | |
| EP4130018A1 (en) | Method for producing nucleic acid oligomer | |
| JP7467457B2 (ja) | 立体的に規定されたオリゴヌクレオチドの合成における活性化物質としてのピリジニウム塩 | |
| CA3195922A1 (en) | Improved process for preparing imetelstat | |
| EP4410770A1 (en) | Production method for purified dichloroacetic acid | |
| EP4477659A1 (en) | Method for producing oligonucleotide | |
| KR20250042734A (ko) | 올리고뉴클레오티드의 제조 방법 | |
| WO2024019137A1 (ja) | オリゴヌクレオチドの製造方法 | |
| WO2023140040A1 (ja) | アミダイトモノマー |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210225 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210225 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210305 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220316 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220614 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220722 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220921 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20221020 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7164540 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |