JP2023503180A - 抗ヒトクローディン18.2抗体及びその適用 - Google Patents
抗ヒトクローディン18.2抗体及びその適用 Download PDFInfo
- Publication number
- JP2023503180A JP2023503180A JP2022540748A JP2022540748A JP2023503180A JP 2023503180 A JP2023503180 A JP 2023503180A JP 2022540748 A JP2022540748 A JP 2022540748A JP 2022540748 A JP2022540748 A JP 2022540748A JP 2023503180 A JP2023503180 A JP 2023503180A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- amino acid
- acid sequence
- antibody
- identity
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16041—Use of virus, viral particle or viral elements as a vector
- C12N2740/16043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- General Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Oncology (AREA)
- Analytical Chemistry (AREA)
- Hospice & Palliative Care (AREA)
- Pathology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Plant Pathology (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
Description
(1)表面にヒトクローディン18.2タンパク質を発現する細胞を免疫原として用いて、動物を免疫する工程と、
(2)工程(1)で免疫した動物を用いて抗体を産生することができる細胞クローンを調製する工程と、
(3)表面にヒトクローディン18.2タンパク質を発現する細胞を陽性スクリーニング抗原として用い、陽性スクリーニング抗原に対する結合活性を有する抗体、及び抗体を産生する細胞をスクリーニングする工程と、
(4)表面にヒトクローディン18.1タンパク質を発現する細胞を陰性スクリーニング抗原として用い、陰性スクリーニング抗原に対する結合活性を有する抗体、及び抗体を産生する細胞を排除する工程と、
を含む、調製方法を提供する。
(1)配列番号31に示されるVH-CDR1、配列番号32に示されるVH-CDR2、及び配列番号33に示されるVH-CDR3;並びに配列番号34に示されるVL-CDR1、配列番号35に示されるVL-CDR2、及び配列番号36に示されるVL-CDR3;
(2)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号40に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号42に示されるVL-CDR3;
(3)配列番号43に示されるVH-CDR1、配列番号44に示されるVH-CDR2、及び配列番号45に示されるVH-CDR3;並びに配列番号46に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号47に示されるVL-CDR3;
(4)配列番号48に示されるVH-CDR1、配列番号49に示されるVH-CDR2、及び配列番号50に示されるVH-CDR3;並びに配列番号40に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号51に示されるVL-CDR3;
(5)配列番号52に示されるVH-CDR1、配列番号53に示されるVH-CDR2、及び配列番号54に示されるVH-CDR3;並びに配列番号55に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号56に示されるVL-CDR3;
(6)配列番号57に示されるVH-CDR1、配列番号58に示されるVH-CDR2、及び配列番号33に示されるVH-CDR3;並びに配列番号34に示されるVL-CDR1、配列番号59に示されるVL-CDR2、及び配列番号60に示されるVL-CDR3;
(7)配列番号61に示されるVH-CDR1、配列番号62に示されるVH-CDR2、及び配列番号63に示されるVH-CDR3;並びに配列番号46に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号64に示されるVL-CDR3;
(8)配列番号65に示されるVH-CDR1、配列番号66に示されるVH-CDR2、及び配列番号67に示されるVH-CDR3;並びに配列番号68に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号69に示されるVL-CDR3;
(9)配列番号65に示されるVH-CDR1、配列番号70に示されるVH-CDR2、及び配列番号71に示されるVH-CDR3;並びに配列番号72に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号73に示されるVL-CDR3;
(10)配列番号74に示されるVH-CDR1、配列番号75に示されるVH-CDR2、及び配列番号76に示されるVH-CDR3;並びに配列番号77に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号78に示されるVL-CDR3;
(11)配列番号79に示されるVH-CDR1、配列番号80に示されるVH-CDR2、及び配列番号81に示されるVH-CDR3;並びに配列番号82に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号83に示されるVL-CDR3;
(12)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号85に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号42に示されるVL-CDR3;
(13)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号85に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号86に示されるVL-CDR3;
(14)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号85に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号87に示されるVL-CDR3;
(15)配列番号74に示されるVH-CDR1、配列番号75に示されるVH-CDR2、及び配列番号76に示されるVH-CDR3;並びに配列番号89に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号90に示されるVL-CDR3;並びに、
(16)配列番号79に示されるVH-CDR1、配列番号91に示されるVH-CDR2、及び配列番号81に示されるVH-CDR3;並びに配列番号92に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号93に示されるVL-CDR3;
からなる群から選択されるCDR(VH-CDR1、VH-CDR2、VH-CDR3;及びVL-CDR1、VL-CDR2、VL-CDR3)の組合せを含む、抗体又はそのフラグメントを提供する。
(1)配列番号1に示されるアミノ酸配列、又は配列番号1に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号2に示されるアミノ酸配列、又は配列番号2に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(2)配列番号3に示されるアミノ酸配列、又は配列番号3に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号4に示されるアミノ酸配列、又は配列番号4に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(3)配列番号5に示されるアミノ酸配列、又は配列番号5に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号6に示されるアミノ酸配列、又は配列番号6に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(4)配列番号7に示されるアミノ酸配列、又は配列番号7に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号8に示されるアミノ酸配列、又は配列番号8に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(5)配列番号9に示されるアミノ酸配列、又は配列番号9に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号10に示されるアミノ酸配列、又は配列番号10に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(6)配列番号11に示されるアミノ酸配列、又は配列番号11に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号12に示されるアミノ酸配列、又は配列番号12に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(7)配列番号13に示されるアミノ酸配列、又は配列番号13に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号14に示されるアミノ酸配列、又は配列番号14に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(8)配列番号15に示されるアミノ酸配列、又は配列番号15に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号16に示されるアミノ酸配列、又は配列番号16に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(9)配列番号17に示されるアミノ酸配列、又は配列番号17に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号18に示されるアミノ酸配列、又は配列番号18に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(10)配列番号19に示されるアミノ酸配列、又は配列番号19に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号20に示されるアミノ酸配列、又は配列番号20に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(11)配列番号21に示されるアミノ酸配列、又は配列番号21に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号22に示されるアミノ酸配列、又は配列番号22に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(12)配列番号23に示されるアミノ酸配列、又は配列番号23に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号24に示されるアミノ酸配列、又は配列番号24に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(13)配列番号23に示されるアミノ酸配列、又は配列番号23に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号25に示されるアミノ酸配列、又は配列番号25に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(14)配列番号23に示されるアミノ酸配列、又は配列番号23に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号26に示されるアミノ酸配列、又は配列番号26に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(15)配列番号27に示されるアミノ酸配列、又は配列番号27に記載のアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号28に示されるアミノ酸配列、又は配列番号28に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;並びに、
(16)配列番号29に示されるアミノ酸配列、又は配列番号29に示されるアミノ酸配列に対して少なくとも75%の同一性を有するアミノ酸配列;及び配列番号30に示されるアミノ酸配列、又は配列番号30に示されるアミノ酸配列に対して少なくとも75%の同一性を有するアミノ酸配列;
からなる群から選択される重鎖可変領域及び軽鎖可変領域を含む。
他に定義されない限り、本明細書で使用される科学用語及び技術用語の意味は、当業者によって一般的に理解される意味である。本明細書に記載の細胞及び組織培養、分子生物学、並びにタンパク質及びオリゴヌクレオチド又はポリヌクレオチドの化学及びハイブリダイゼーションにおいて使用される命名法及び技術は、当該技術分野においてよく知られており、一般的に使用されている。標準的手法は、組換えDNA、オリゴヌクレオチド合成、並びに組織培養及び形質転換(例えば、エレクトロポレーション、脂質トランスフェクション)に使用される。酵素反応及び精製技術は、当該技術分野において通常使用されるか、又は本明細書に記載される製造業者の仕様又は手順に従って行われる。前述の技術及び手順は、当該技術分野において一般的に知られている多くの包括的でより具体的な文献に記載される通りに使用され、本明細書において引用及び検討される。例えば、Sambrook et al, Molecular Cloning: A Laboratory Manual (2nd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989))を参照されたい。本明細書に記載される分析化学、合成有機化学、並びに医学及び薬学化学において使用される命名法、並びに実験室の手順及び技術は、当該技術分野においてよく知られており、一般的に使用されている。
Balb/cマウスを、細胞表面にヒトCLDN18.2タンパク質を安定に発現するCHOK1細胞で免疫した。1ヶ月後、マウス由来の血清をフローサイトメトリー(FACS)で分析し、血清中の抗体価が高いマウスから脾臓を採取した。標準的な方法で単離した脾臓細胞を、PEG法又は電気融合法を用いて骨髄腫細胞P3X63Ag8.653と融合させた。融合したハイブリドーマ細胞を384ウェルプレートに播種し、10日~14日間培養後、得られた上清をハイブリドーマ細胞による抗体分泌についてFACSで分析した。細胞表面にヒトCLDN18.2タンパク質を安定に発現するCHOK1細胞に結合することができ、細胞表面にヒトCLDN18.1タンパク質を安定に発現するCHOK1細胞には結合できなかったクローンが幾つか得られた。得られたクローンの単一細胞を限界希釈によって取得し、3倍に希釈した後に得られたモノクローナルハイブリドーマ細胞クローンの各々は1つの抗体のみを分泌した。
QVQLKESGPDLVAPSQSLSITCTVSGFSLTNYGVHWVRQPPGKGLEWLVVIWSDGRINYNSALKSRLSITKDNSKRQVFLKMNSLQIDDTAIYYCVRHPAFGPHAMDYWGQGISVTVSS
>11M23_vl(配列番号2)
DIVMTQDAPSIPVTPGESVSISCRSSKSLLNSNGNTYLYWFLQRPGQSPHLLLYRMSNPASGAPDRFSGSGSGTEFTLRISRVEAEDVGVYYCMQYLEYPPTFGAGTRLELK
>16K15_vh(配列番号3)
EVMLVESGGGLVRPGGSLKLSCAGSGITLSTYAMSWVRQTPERRLEWVASIISGGITYYLDSVKGRFTISRDNARNILYLQMSSLRSEDTAIYYCARKYHGNALDYWGQGTSVTVSL
>16K15_vl(配列番号4)
DIVMTQSPSSLPVTAGETVTMRCKSSQSLLNSGNQRNYLTWYQRKPGQPPKKLIYWASTRESGVPDRFTGSGSGTDFTLTISGVQAEDLAVYYCQNNYFYPLTFGAGTKLELK
>18B21_vh(配列番号5)
QIQMVQSGPELKKPGETVRISCKASGYSFTTAGMQWVRKMPGEGLKWIGWIIAHSGEPKYTEDFKGRFAFSLETSASTTYLQISNLKNEDTATYFCARWGKGNTMDYWGQGTSVIVSS
>18B21_vl(配列番号6)
DIVMTQSPSSLTVTAGEKVTMSCKSSQSLLNGGNQRNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFTGSGSGTHFTLTISSVQAEDLAVYYCQNAYFFPLTFGAGTKLELK
>20L17_vh(配列番号7)
DVQLVESGGGLVQPGGSRKLSCAASGFTFSSFGMHWVRQAPEKGLEWVAYISSGSSTIYYPDTVKGRFTVSRDNPKNTLFLQMTSLRSEDTAMYYCVRLGPRGNVMDHWGQGTSVTVSS
>20L17_vl(配列番号8)
DIVMTQSPSSLTVTAGEKVTMSCKSSQSLLNSGNQRNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYYCQNVYFYPLTFGTGTKLELR
>43B5_vh(配列番号9)
DVQLQESGPDLVKPSQSLSLTCTVSGYSISGAYNWHWIRQFPGNKLEWLAYMQYSGSSNYNPSFKSRISISRDTSKNQFFLQLKSVTTEDTATYYCARMYNGNSFLYWGQGTLVTVSA
>43B5_vl(配列番号10)
DIVMTQSPSSLTVTAGEKVTMNCKSSQSLFNSGNQKNYLTWYQQKPGQPPRLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLSLYYCQNSYSYPLTFGAGTKLELK
>43L6_vh(配列番号11)
QVQLKESGPDLVAPSQSLSLTCSVSGFSLTSYGIHWVRQPPGKGLEWLVVIWSDGRTTYNSGLKSRLSISKDNSKSQVLLKMNSLRTDDTAIYYCVRHPAFGPHAMDYWGQGTSVTVSS
>43L6_vl(配列番号12)
DIVMTQAAPSVPVTPGESVSISCRSSKSLLNSNGNTYLYWFLQRPGQSPQLLIYRMSNLASGVPDRFSGSGSGTDFTLRISRVEAGDVGVYYCMQYLEYPVTFGAGTKLELK
>46J05_vh(配列番号13)
DVQLVESGGGLVQPGGSRKLSCAASGFTFSRFGMHWVRQAPKKGLEWVAYISSGSNTIYYADTVKGRFTISRDNPKNTLFLQTTSLRSEDTAIYYCGRLGFYGNSFDHWGQGTLVTVSA
>46J05_vl(配列番号14)
NILMTQSPSSLTVTAGEKVTMNCKSSQSLLNGGNQRNYLTWYQQKAGQPPKLLIYWASTRESGVPDRFTGGGSGTDFTLTISSVQAEDLALYYCQNSYYYPLTFGAGTKLELK
>48G12_vh(配列番号15)
EVQLRQSGPELVKPGASVKMSCKASGYTFTTYIINWVKQKPGQGLEWIGYINPYNDDTRYNERVKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCARFYFGNSFTYWGQGTLVTVSA
>48G12_vl(配列番号16)
DIVMTQSPSSLPVTVGERVTMTCKSSQGLFNSGNQRNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAIYYCQNNYIYPLTFGAGTKLELK
>50C14_vh(配列番号17)
EVQLRQSGPELVKPGASVKMSCKASGYTFTTYIINWVKQKPGQGLEWIGYINPYNDGTRYNERVKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCARFHFGNSFTYWGQGTLVTVSA
>50C14_vl(配列番号18)
DIVMTQSPSSLPVTTGEKVTMTCKSSQGLFNNGNQRNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFIGSGSGTDFTLTISSVQAEDLAIYYCQNNYIFPLTFGAGTKLELK
>52E22_vh(配列番号19)
QIQLVQSGPELKKPGETVKISCKASGYTLTNYGMNWVRQAPGKGLKWMGWIRPNTGEPTYAEDFKGRFVFSLETSAATAYLQITNLKSEDTSTYFCARLYRGNTLDNWGQGTSVIVSS
>52E22_vl(配列番号20)
DIVMTQSPSSLTVTTGEKVTMSCKSSQNLLNSGNQRNYLTWYQQKPGQSPKLLIYWASTRESGVPYRFTGSGSGTDFTLTISSVQTDDLAIYYCQNGYSFPFTFGSGTKLEIK
>8K13_vh(配列番号21)
QVHLQQSGAELVRPGSSVKISCKASGYAFSNYWMNWVRQRPGQGLEWIGQIYPGNGDTKYSGKFNSKDTLTADKSSNTAYMQLNSLTSEDSAVYFCARFYYGNVMDYWGQGTSVTVSS
>8K13_vl(配列番号22)
DIVLTQSPSSLTVTAGEKVTMSCKSSQTLLNGGNQKNYLTWYQQKSGQPPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYYCQNGYSYPLTFGVGTKLELK
各マウス抗ヒトCLDN18.2モノクローナル抗体の重鎖可変領域配列と、公開されたヒトモノクローナル抗体IgG1サブクラスの重鎖定常領域配列(配列番号124を参照されたい)とを共にスプライシングして、哺乳動物細胞発現ベクターへと構築し、また、各マウス抗ヒトCLDN18.2モノクローナル抗体の軽鎖可変領域配列と、公開されたヒトモノクローナル抗体カッパサブクラスの軽鎖定常領域配列(配列番号125を参照されたい)とを共にスプライシングして、哺乳動物細胞発現ベクターへと構築した。構築された抗ヒトCLDN18.2キメラ抗体の重鎖ベクターと軽鎖ベクターとをペアで混合し、ポリエチレンイミン(PEI)を用いてHEK293細胞にベクターをトランスフェクトし、約7日後に細胞上清を回収した。抗ヒトCLDN18.2キメラ抗体タンパク質を、プロテインA精製を介して得た。
キメラ抗ヒトCLDN18.2抗体を初期濃度100nMから勾配で2倍に希釈し、全部で16濃度の各抗体の溶液を得た。各濃度の各抗体の溶液10μlを384ウェルプレートに添加した。細胞表面にCLDN18.2を発現しているCHOK1細胞を室温にて100gで5分間遠心分離により回収し、0.5%BSAを含むPBSで細胞を1回洗浄した後、室温にて100gで5分間遠心分離した。細胞を約2×106細胞/mlの密度で再懸濁し、抗体が添加された384ウェルプレートの各ウェルに10μlを加えた。4℃で1時間インキュベートした後、蛍光標識した二次ヤギ抗ヒトIgG抗体を加えた。4℃で1時間のインキュベーションを継続した後、細胞集団の平均蛍光読み取り値をフローサイトメーターで分析した。
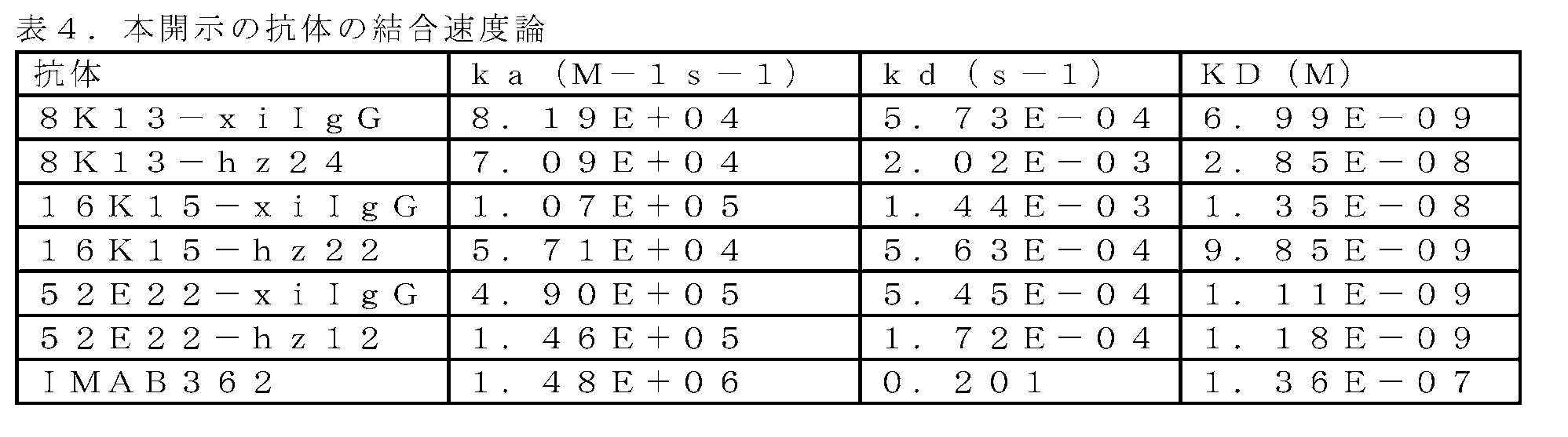
Kabatの包括的な分析、及びChothiaの抗体コードスキームに基づいて、各マウス抗体の重鎖及び軽鎖の6つの相補性決定領域(CDR)のアミノ酸配列領域、並びに保存された三次元立体構造を支持するフレームワーク領域を決定した。続いて、主にIGHVl | IGHJ4*01等のマウス抗体に類似するヒト抗体の重鎖可変領域を、既知のヒト抗体配列について検索し、選択した。フレームワーク領域配列を鋳型として選択し、マウス抗体の重鎖CDRをヒト抗体のフレームワーク領域と合わせ、最終的にヒト化重鎖可変領域配列を生成した。同様にして、ヒト化軽鎖可変領域配列を生成した。
DIVMTQSPDSLAVSLGERATINCKSSQSLLSSGNQRNYLTWYQQKPGQPPKKLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDLAVYYCQNNYFYPLTFGQGTKLEIK
>16K15_vl_hz2_N-S(配列番号25)
DIVMTQSPDSLAVSLGERATINCKSSQSLLSSGNQRNYLTWYQQKPGQPPKKLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDLAVYYCQSNYFYPLTFGQGTKLEIK
>16K15_vl_hz2_N-Q(配列番号26)
DIVMTQSPDSLAVSLGERATINCKSSQSLLSSGNQRNYLTWYQQKPGQPPKKLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDLAVYYCQQNYFYPLTFGQGTKLEIK
>16k15_vh_hz2(配列番号23)
EVQLVESGGGLVQPGGSLRLSCAGSGITLSTYAMSWVRQAPGKGLEWVSSIISGGITYYLDSVKGRFTISRDNAKNTLYLQMSSLRAEDTAVYYCARKYHGNALDYWGQGTLVTVSS
>52E22_vl_hz2(配列番号28)
DIVMTQSPDSLAVSLGERATINCKSSQNLLSSGNQRNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDLAVYYCQQGYSFPFTFGQGTKLEIK
>52E22_vh_hz1(配列番号27)
QIQLVQSGSELKKPGASVKVSCKASGYTLTNYGMNWVRQAPGQGLEWMGWIRPNTGEPTYAEDFKGRFVFSLDTSVATAYLQITSLKAEDTAVYYCARLYRGNTLDNWGQGTLVTVSS
>8K13_vl_hz4_N-S_N-Q(配列番号30)
DIVLTQSPDSLAVSLGERATINCKSSQTLLSGGNQKNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDLAVYYCQQGYSYPLTFGQGTKLEIK
>8K13_vh_hz2(配列番号29)
QVQLVQSGAEVKKPGSSVKVSCKASGYAFSNYWMNWVRQAPGQGLEWMGQIYPGSGDTKYSGKFQSRVTITADKSTNTAYMELSSLRSEDTAVYYCARFYYGNVMDYWGQGTLVTVSS
抗体-抗原相互作用を、GE Healthcare製のBIAcore S200を用いて測定した。
6.1 補体依存性細胞傷害(CDC)
本開示のヒト化抗体について、Quidel, Inc.によって入手可能な市販のヒト血清全補体を用いて、ヒトCLDN18.2を安定して発現するCHOK1細胞、BxPC3細胞及びNCI-N87細胞上の補体依存性細胞傷害(CDC)を誘導する能力を分析した。
FcγRIIIa-FcεRIaγハイブリッド受容体を安定に発現し、NFAT応答エレメントによる駆動下でホタルルシフェラーゼを発現する操作されたJurkat細胞をエフェクター細胞として用いた。ADCC機構における抗体の生物学的活性は、NFAT経路の活性化により産生されるルシフェラーゼにより定量される。1.5E5エフェクター細胞を、33μg/ml~85pg/mlの範囲の最終濃度で試験するために抗体と混合し、次いで2.5E4標的細胞を混合物に添加し(エフェクター対標的E:T比は6:1であった)、次いでこれを37℃で16時間インキュベートした。細胞傷害性を、Promega製のキットBio-Glo(商標)ルシフェラーゼアッセイシステムによって測定し、最終的にMDプレートリーダーによってLUM値を決定した。
ヒトCLDN18.2及びCLDN18.1の遺伝子をそれぞれ真核生物発現ベクターに構築し、ポリエチレンイミン(PEI)を用いてベクターでHEK293細胞にトランスフェクトした。トランスフェクションの3日後、遠心分離により細胞を回収し、PBSで1回洗浄し、細胞密度2×106/mlで再懸濁した。384ウェルプレートの各ウェルに10μlを加え、次いで異なる濃度のヒト化抗体をウェルに加えた。4℃で1時間インキュベートした後、蛍光標識した二次ヤギ抗ヒトIgG抗体を加えた。4℃で1時間のインキュベーションを継続した後、384ウェルプレートの平均蛍光読み取り値をフローサイトメーターで読み取った。データを分析して、抗ヒトCLDN18.2ヒト化抗体に対する細胞の結合特性を得た。実験に使用した陽性対照は市販の抗ヒトCLDN18ウサギmAb 34H14L15(Abcam社から入手可能)であり、陰性アイソタイプ対照は全長の抗CD33 IgG抗体であるリンツズマブであった。
ヒト、マウス及びアカゲザルCLDN18.2の遺伝子をそれぞれ真核生物発現ベクターに構築し、ポリエチレンイミン(PEI)を用いてベクターでHEK293細胞にトランスフェクトした。細胞を2日後に回収した。抗ヒトCLDN18.2ヒト化抗体に対する細胞の結合特異性を、フローサイトメトリーを用いて分析した。フローサイトメトリーの手順については実施例7を参照されたい。
9.1 レンチウイルスのパッケージング
レンチウイルスのパッケージングを、表7に示すグループ分けに従って行った。異なる抗体遺伝子を含むレンチウイルスベクタープラスミドpLTRを最初に構築し、シーケンシングによりDNAが正しいことを確認した後、Qiagen製プラスミド抽出キットを用いてそれらのプラスミドDNAを抽出した。プラスミドDNAを滅菌TEに溶解し、その濃度及び純度をUV光吸収によって決定し、抽出されたプラスミドDNAのA260/A280が1.8~2.0であったことを確認した。2つのヘルパーパッケージングエレメントプラスミドであるpCMV-VSV-G及びpCMV-dR8.2のDNAも抽出した。トランスフェクション用のHEK293T細胞を調製し、約60%の培養密度まで増殖するはずの新たに継代した細胞を得た。3つのプラスミドを、リン酸カルシウムをトランスフェクション試薬として用いてHEK293T細胞に共移入した。トランスフェクションの48時間後、パッケージングされたウイルスを含む細胞上清を低温での遠心分離により回収し、0.45μmフィルターを用いて細胞の残骸を除去した。限外濾過遠沈管を用いてウイルスを濃縮し、サブパッケージを行って、-80℃の冷凍庫で保管した。少量のウイルス濃縮物を取って、ウイルス力価をFACSによって決定した。
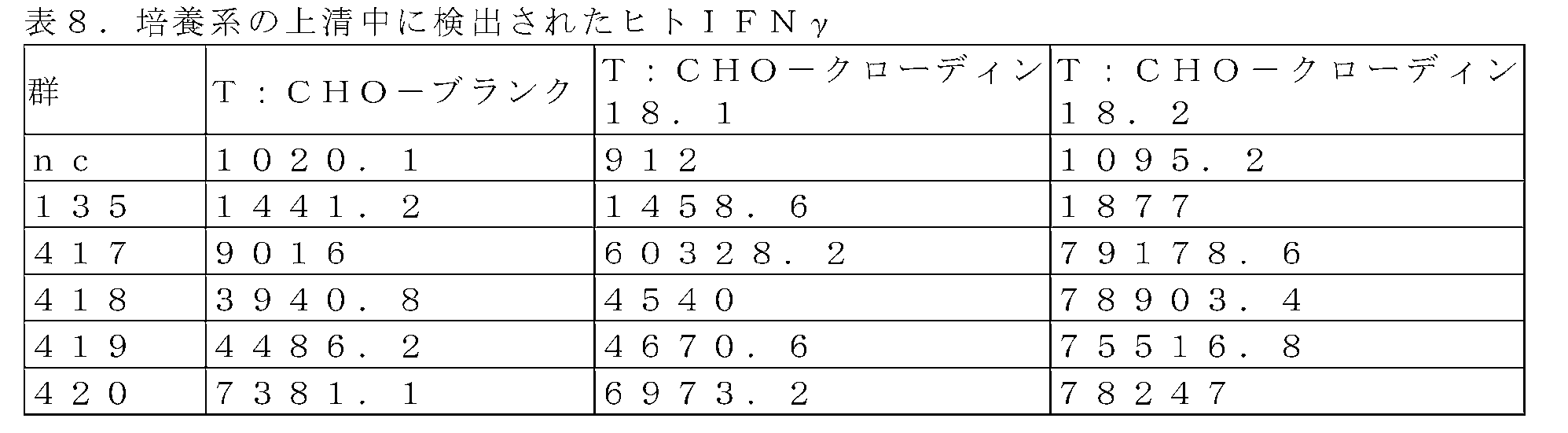
HBV、HCV、HIVについて陰性と検出された健康なドナーを選択した。前肘静脈から100mlの血液を採取し、Ficoll密度勾配遠心分離を実施してPBMCを含む白色層を単離した。CD3+T細胞を、3:1のDynaBeads/CD3+T細胞の比率でDynaBeads CD3/CD28(LifeTechnologies、カタログ番号40203D)を用いて単離した。活性化の24時間後、CD25+CD69+T細胞のパーセンテージをフローサイトメトリーによって検出した。活性化されると、5MOIのレンチウイルスを用いてCD3+T細胞に形質導入を行った。24ウェルプレートを、ノボネクチンを用いて37℃で2時間コーティングし、上記の手順により得られた細胞懸濁液を、各種レンチウイルス(MOI=5)、Synperonic(商標)F108(Sigma、カタログ番号07579-250G-F)及びTscm(2U/ml)とともに、形質導入用の懸濁液に製剤化した。形質導入用の懸濁液を、細胞密度を1.0E+06/mlに調整した24ウェルプレートに添加した。プレートを500gで30分間遠心分離し、37℃、5%CO2のインキュベーターに入れ、48時間静置培養した。形質導入後、細胞を、Tscm(最終濃度2U/ml)を隔日で補充した5%FBS X-vivo15培地(LONZA、カタログ番号04-418Q)で培養した。細胞を計数し、0.5E+06/mlに調整し、培養8日~10日目に採取した。
抗原ヒトCLDN18.1及び抗原ヒトCLDN18.2を発現するCHO細胞を構築し、標的細胞として用いた。
Claims (24)
- 抗ヒトクローディン18.2抗体の調製方法であって、
(1)表面にヒトクローディン18.2タンパク質を発現する細胞を免疫原として用いて、動物を免疫する工程と、
(2)工程(1)で免疫した前記動物を用いて抗体を産生することができる細胞クローンを調製する工程と、
(3)表面にヒトクローディン18.2タンパク質を発現する細胞を陽性スクリーニング抗原として用い、前記陽性スクリーニング抗原に対する結合活性を有する抗体、及び前記抗体を産生する細胞をスクリーニングする工程と、
(4)表面にヒトクローディン18.1タンパク質を発現する細胞を陰性スクリーニング抗原として用い、前記陰性スクリーニング抗原に対する結合活性を有する抗体、及び前記抗体を産生する細胞を排除する工程と、
を含む、調製方法。 - 工程(1)においてヒトクローディン18.2タンパク質を発現する前記細胞が、免疫された動物と同じ種に由来する、好ましくは、ヒトクローディン18.2タンパク質を発現する前記細胞がマウス細胞であり、前記免疫された動物がマウスである、請求項1に記載の調製方法。
- 工程(2)において、抗体を産生することができる前記細胞クローンが、ハイブリドーマ手法及び単一細胞増幅手法からなる群から選択される手法により調製される、請求項1に記載の調製方法。
- 工程(3)における前記陽性スクリーニング抗原が、工程(1)における前記免疫原と同じであり、工程(4)における前記陰性スクリーニング抗原が工程(1)における前記免疫原と異なるのは、発現されるタンパク質がヒトクローディン18.1タンパク質である点のみである、請求項1に記載の調製方法。
- 工程(3)及び工程(4)が、それぞれ、酵素結合免疫吸着測定法(ELISA)及び蛍光共鳴エネルギー移動法(FRET)からなる群から選択される方法により行われる、請求項1に記載の調製方法。
- 請求項1~6のいずれか一項に記載の調製方法に従って得られた抗ヒトクローディン18.2抗体。
- ヒトクローディン18.2のN末端、好ましくは第1の細胞外ループ(ECL1)を含むヒトクローディン18.2のN末端の細胞外領域に特異的に結合する、請求項6に記載の抗ヒトクローディン18.2抗体。
- nMスケールでヒトCLDN18.2に特異的な結合を有し、アイソタイプ陰性抗体(又は無関係な抗体)と比較してヒトCLDN18.1への結合において有意差を有さない、請求項6に記載の抗ヒトクローディン18.2抗体。
- 重鎖可変領域(VH)及び軽鎖可変領域(VL)を含む抗体又はそのフラグメントであって、前記重鎖可変領域(VH)及び前記軽鎖可変領域(VL)が、以下:
(1)配列番号31に示されるVH-CDR1、配列番号32に示されるVH-CDR2、及び配列番号33に示されるVH-CDR3;並びに配列番号34に示されるVL-CDR1、配列番号35に示されるVL-CDR2、及び配列番号36に示されるVL-CDR3;
(2)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号40に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号42に示されるVL-CDR3;
(3)配列番号43に示されるVH-CDR1、配列番号44に示されるVH-CDR2、及び配列番号45に示されるVH-CDR3;並びに配列番号46に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号47に示されるVL-CDR3;
(4)配列番号48に示されるVH-CDR1、配列番号49に示されるVH-CDR2、及び配列番号50に示されるVH-CDR3;並びに配列番号40に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号51に示されるVL-CDR3;
(5)配列番号52に示されるVH-CDR1、配列番号53に示されるVH-CDR2、及び配列番号54に示されるVH-CDR3;並びに配列番号55に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号56に示されるVL-CDR3;
(6)配列番号57に示されるVH-CDR1、配列番号58に示されるVH-CDR2、及び配列番号33に示されるVH-CDR3;並びに配列番号34に示されるVL-CDR1、配列番号59に示されるVL-CDR2、及び配列番号60に示されるVL-CDR3;
(7)配列番号61に示されるVH-CDR1、配列番号62に示されるVH-CDR2、及び配列番号63に示されるVH-CDR3;並びに配列番号46に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号64に示されるVL-CDR3;
(8)配列番号65に示されるVH-CDR1、配列番号66に示されるVH-CDR2、及び配列番号67に示されるVH-CDR3;並びに配列番号68に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号69に示されるVL-CDR3;
(9)配列番号65に示されるVH-CDR1、配列番号70に示されるVH-CDR2、及び配列番号71に示されるVH-CDR3;並びに配列番号72に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号73に示されるVL-CDR3;
(10)配列番号74に示されるVH-CDR1、配列番号75に示されるVH-CDR2、及び配列番号76に示されるVH-CDR3;並びに配列番号77に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号78に示されるVL-CDR3;
(11)配列番号79に示されるVH-CDR1、配列番号80に示されるVH-CDR2、及び配列番号81に示されるVH-CDR3;並びに配列番号82に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号83に示されるVL-CDR3;
(12)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号85に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号42に示されるVL-CDR3;
(13)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号85に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号86に示されるVL-CDR3;
(14)配列番号37に示されるVH-CDR1、配列番号38に示されるVH-CDR2、及び配列番号39に示されるVH-CDR3;並びに配列番号85に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号87に示されるVL-CDR3;
(15)配列番号74に示されるVH-CDR1、配列番号75に示されるVH-CDR2、及び配列番号76に示されるVH-CDR3;並びに配列番号89に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号90に示されるVL-CDR3;並びに、
(16)配列番号79に示されるVH-CDR1、配列番号91に示されるVH-CDR2、及び配列番号81に示されるVH-CDR3;並びに配列番号92に示されるVL-CDR1、配列番号41に示されるVL-CDR2、及び配列番号93に示されるVL-CDR3;
からなる群から選択されるCDR(VH-CDR1、VH-CDR2、VH-CDR3;及びVL-CDR1、VL-CDR2、VL-CDR3)の組合せを含む、抗体又はそのフラグメント。 - 前記重鎖可変領域が、配列番号1、配列番号3、配列番号5、配列番号7、配列番号9、配列番号11、配列番号13、配列番号15、配列番号17、配列番号19、配列番号21、配列番号23、配列番号27、及び配列番号29のいずれか1つに示されるアミノ酸配列、若しくは示される前記アミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列を含み、及び/又は前記軽鎖可変領域が、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号20、配列番号22、配列番号24、配列番号25、配列番号26、配列番号28、及び配列番号30のいずれか1つに示されるアミノ酸配列、若しくは示される前記アミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列を含む、請求項6~9のいずれか一項に記載の抗体又はそのフラグメント。
- 前記抗体又はそのフラグメントが、以下:
(1)配列番号1に示されるアミノ酸配列、又は配列番号1に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号2に示されるアミノ酸配列、又は配列番号2に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(2)配列番号3に示されるアミノ酸配列、又は配列番号3に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号4に示されるアミノ酸配列、又は配列番号4に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(3)配列番号5に示されるアミノ酸配列、又は配列番号5に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号6に示されるアミノ酸配列、又は配列番号6に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(4)配列番号7に示されるアミノ酸配列、又は配列番号7に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号8に示されるアミノ酸配列、又は配列番号8に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(5)配列番号9に示されるアミノ酸配列、又は配列番号9に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号10に示されるアミノ酸配列、又は配列番号10に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(6)配列番号11に示されるアミノ酸配列、又は配列番号11に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号12に示されるアミノ酸配列、又は配列番号12に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(7)配列番号13に示されるアミノ酸配列、又は配列番号13に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号14に示されるアミノ酸配列、又は配列番号14に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(8)配列番号15に示されるアミノ酸配列、又は配列番号15に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号16に示されるアミノ酸配列、又は配列番号16に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(9)配列番号17に示されるアミノ酸配列、又は配列番号17に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号18に示されるアミノ酸配列、又は配列番号18に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(10)配列番号19に示されるアミノ酸配列、又は配列番号19に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号20に示されるアミノ酸配列、又は配列番号20に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(11)配列番号21に示されるアミノ酸配列、又は配列番号21に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号22に示されるアミノ酸配列、又は配列番号22に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(12)配列番号23に示されるアミノ酸配列、又は配列番号23に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号24に示されるアミノ酸配列、又は配列番号24に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(13)配列番号23に示されるアミノ酸配列、又は配列番号23に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号25に示されるアミノ酸配列、又は配列番号25に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(14)配列番号23に示されるアミノ酸配列、又は配列番号23に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号26に示されるアミノ酸配列、又は配列番号26に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;
(15)配列番号27に示されるアミノ酸配列、又は配列番号27に記載のアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;及び配列番号28に示されるアミノ酸配列、又は配列番号28に示されるアミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列;並びに、
(16)配列番号29に示されるアミノ酸配列、又は配列番号29に示されるアミノ酸配列に対して少なくとも75%の同一性を有するアミノ酸配列;及び配列番号30に示されるアミノ酸配列、又は配列番号30に示されるアミノ酸配列に対して少なくとも75%の同一性を有するアミノ酸配列;
からなる群から選択される重鎖可変領域及び軽鎖可変領域を含む、請求項6~10のいずれか一項に記載の抗体又はそのフラグメント。 - 前記抗体又はそのフラグメントが、任意の形態、例えば、モノクローナル抗体、一本鎖抗体、ダイアボディ、単一ドメイン抗体、ナノボディ、完全若しくは部分ヒト化抗体、又はキメラ抗体等であるか、或いは、前記抗体又はそのフラグメントが、ハーフ抗体又はハーフ抗体の抗原結合フラグメント、例えば、scFv、BsFv、dsFv、(dsFv)2、Fab、Fab’、F(ab’)2、又はFvであり、
好ましくは、前記抗体又はそのフラグメントが、ヒト又はマウス定常領域、好ましくはヒト又はマウス軽鎖定常領域(CL)及び/又は重鎖定常領域(CH)を更に含み、
より好ましくは、前記抗体又はそのフラグメントが、IgG、IgA、IgM、IgD及びIgEからなる群から選択される重鎖定常領域及び/又はカッパ型若しくはラムダ型の軽鎖定常領域を含む、
請求項6~11のいずれか一項に記載の抗体又はそのフラグメント。 - 前記抗体がモノクローナル抗体、好ましくはマウスモノクローナル抗体、キメラモノクローナル抗体又はヒト化モノクローナル抗体であり、好ましくは、前記モノクローナル抗体の重鎖定常領域がIgG1又はIgG4サブタイプのものであり、前記モノクローナル抗体の軽鎖定常領域がカッパ型であり、
好ましくは、前記モノクローナル抗体の重鎖定常領域が、配列番号124に示されるアミノ酸配列、又は示される前記アミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列を含み、
好ましくは、前記モノクローナル抗体の軽鎖定常領域が、配列番号125に示されるアミノ酸配列、又は示される前記アミノ酸配列に対して少なくとも75%同一性を有するアミノ酸配列を含む、
請求項6~12のいずれか一項に記載の抗体若しくはそのフラグメント。 - 請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメントをコードする、又は前記抗体若しくはそのフラグメントに含まれる重鎖CDR、軽鎖CDR、重鎖可変領域、軽鎖可変領域、重鎖若しくは軽鎖をコードするヌクレオチド配列を含む核酸分子。
- 請求項14に記載の核酸分子を含むベクター。
- 請求項14に記載の核酸分子及び/又は請求項15に記載のベクターを含む宿主細胞、又は請求項14に記載の核酸分子及び/又は請求項15に記載のベクターで形質転換若しくはトランスフェクトされた宿主細胞。
- 請求項6~13のいずれか一項に記載の抗体又はそのフラグメントを含むコンジュゲート又は融合タンパク質。
- 請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメント、請求項14に記載の核酸分子、請求項15に記載のベクター、請求項16に記載の宿主細胞、及び/又は請求項17に記載のコンジュゲート若しくは融合タンパク質と、任意に薬学的に許容され得る賦形剤とを含む医薬組成物。
- 請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメント、請求項14に記載の核酸分子、請求項15に記載のベクター、請求項16に記載の宿主細胞、請求項17に記載のコンジュゲート若しくは融合タンパク質、及び/又は請求項18に記載の医薬組成物を含む、キット。
- 癌の予防及び/又は治療のための医薬の製造における、請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメント、請求項14に記載の核酸分子、請求項15に記載のベクター、請求項16に記載の宿主細胞、請求項17に記載の医薬組成物、及び/又は請求項18に記載のコンジュゲート若しくは融合タンパク質の使用。
- 癌の診断用薬剤の製造における、請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメント、請求項14に記載の核酸分子、請求項15に記載のベクター、請求項16に記載の宿主細胞、請求項17に記載の医薬組成物、及び/又は請求項18に記載のコンジュゲート若しくは融合タンパク質の使用。
- CAR-T細胞の製造における、請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメント、請求項14に記載の核酸分子、請求項15に記載のベクター、請求項16に記載の宿主細胞、請求項17に記載の医薬組成物、及び/又は請求項18に記載のコンジュゲート若しくは融合タンパク質の使用。
- 癌を予防及び/又は治療する方法であって、請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメント、請求項14に記載の核酸分子、請求項15に記載のベクター、請求項16に記載の宿主細胞、請求項17に記載の医薬組成物、及び/又は請求項18に記載のコンジュゲート若しくは融合タンパク質と、任意に他の薬物又は手段とを、それを必要とする被験体に投与することを含む、方法。
- 癌を診断する方法であって、請求項6~13のいずれか一項に記載の抗体若しくはそのフラグメント、請求項14に記載の核酸分子、請求項15に記載のベクター、請求項16に記載の宿主細胞、請求項17に記載の医薬組成物、及び/又は請求項18に記載のコンジュゲート若しくは融合タンパク質を、被験体に由来する試料と接触させることを含む、方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201910929614.0A CN112574307B (zh) | 2019-09-29 | 2019-09-29 | 抗人Claudin18.2抗体及其应用 |
| CN201910929614.0 | 2019-09-29 | ||
| PCT/CN2020/118424 WO2021058000A1 (zh) | 2019-09-29 | 2020-09-28 | 抗人Claudin18.2抗体及其应用 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2023503180A true JP2023503180A (ja) | 2023-01-26 |
Family
ID=75110273
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022540748A Pending JP2023503180A (ja) | 2019-09-29 | 2020-09-28 | 抗ヒトクローディン18.2抗体及びその適用 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20230250168A1 (ja) |
| EP (1) | EP4063386A4 (ja) |
| JP (1) | JP2023503180A (ja) |
| KR (1) | KR20220110177A (ja) |
| CN (1) | CN112574307B (ja) |
| AU (1) | AU2020352382A1 (ja) |
| CA (1) | CA3156788A1 (ja) |
| TW (1) | TWI845767B (ja) |
| WO (1) | WO2021058000A1 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114904015A (zh) * | 2021-02-09 | 2022-08-16 | 江苏迈威康新药研发有限公司 | 包含抗cldn18.2的抗体或其抗原结合片段的抗体药物偶联物及其用途 |
| CN112940124B (zh) * | 2021-04-14 | 2022-04-05 | 南京凯地医疗技术有限公司 | 靶向Claudin18.2的人源化单克隆抗体及其制备方法和应用 |
| CN113416260B (zh) * | 2021-04-14 | 2022-02-01 | 南京凯地医疗技术有限公司 | 靶向Claudin18.2的特异性嵌合抗原受体细胞及其制备方法和应用 |
| JP2024519650A (ja) * | 2021-05-31 | 2024-05-21 | シージャツァング イーリング ファーマシューティカル カンパニー リミテッド | CLDN18.2に対するモノクローナル抗体及びそのFc操作されたバージョン |
| CN115611983A (zh) * | 2021-07-14 | 2023-01-17 | 三优生物医药(上海)有限公司 | Cldn18.2结合分子及其用途 |
| WO2023045997A1 (zh) * | 2021-09-24 | 2023-03-30 | 盛禾(中国)生物制药有限公司 | 一种抗Claudin18.2抗体及其应用 |
| CN114480504A (zh) * | 2021-12-28 | 2022-05-13 | 宁波熙宁检测技术有限公司 | Claudin18.2报告基因CHO-K1稳转细胞株构建和应用 |
| CN114539410B (zh) * | 2022-03-15 | 2023-09-05 | 苏州量化细胞生物科技有限公司 | Cldn18.2结合抗体、探针及在cldn18.2表达细胞的单细胞测序中的应用 |
| CN114507287B (zh) * | 2022-04-20 | 2022-07-05 | 苏州百道医疗科技有限公司 | 一种抗cldn18.2重组兔单克隆抗体及其应用 |
| CN117777306B (zh) * | 2023-07-04 | 2024-08-20 | 深圳豪石生物科技有限公司 | 一种靶向cldn18.2的增强型嵌合抗原受体及其用途 |
| WO2025034702A1 (en) | 2023-08-07 | 2025-02-13 | Revolution Medicines, Inc. | Rmc-6291 for use in the treatment of ras protein-related disease or disorder |
| CN117777307B (zh) * | 2023-09-26 | 2024-08-20 | 深圳豪石生物科技有限公司 | 一种cldn18.2特异性嵌合t细胞受体、嵌合t细胞受体免疫细胞及其应用 |
| US20250154171A1 (en) | 2023-10-12 | 2025-05-15 | Revolution Medicines, Inc. | Ras inhibitors |
| CN118440198B (zh) * | 2024-04-03 | 2024-11-15 | 武汉爱博泰克生物科技有限公司 | 抗人cd69蛋白的兔单克隆抗体及其应用 |
| CN119350499A (zh) * | 2024-11-07 | 2025-01-24 | 北京荣瑷医学生物科技有限责任公司 | 一种靶向密蛋白18.2的纳米抗体及其应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009517354A (ja) * | 2005-11-24 | 2009-04-30 | ガニメド ファーマシューティカルズ アーゲー | 癌の治療のためのクローディン18に対するモノクローナル抗体 |
| WO2019173420A1 (en) * | 2018-03-08 | 2019-09-12 | Phanes Therapeutics, Inc. | Anti-claudin 18.2 antibodies and uses thereof |
| WO2019174617A1 (en) * | 2018-03-14 | 2019-09-19 | Beijing Xuanyi Pharmasciences Co., Ltd. | Anti-claudin 18.2 antibodies |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2672581A1 (en) * | 2006-12-14 | 2008-06-19 | Forerunner Pharma Research Co., Ltd. | Anti-claudin 3 monoclonal antibody and treatment and diagnosis of cancer using the same |
| EP1997832A1 (en) * | 2007-05-29 | 2008-12-03 | Ganymed Pharmaceuticals AG | Monoclonal antibodies against Claudin-18 for treatment of cancer |
| WO2013167153A1 (en) * | 2012-05-09 | 2013-11-14 | Ganymed Pharmaceuticals Ag | Antibodies useful in cancer diagnosis |
| SG11201503593UA (en) * | 2012-11-13 | 2015-06-29 | Biontech Ag | Agents for treatment of claudin expressing cancer diseases |
| CA3030257A1 (en) | 2016-07-08 | 2018-01-11 | Carsgen Therapeutics Co., Ltd. | Antibody for anti-claudin 18a2 and use thereof |
| CN107219351A (zh) * | 2017-06-08 | 2017-09-29 | 广东省生物资源应用研究所 | 一种基于单细胞芯片技术的抗体筛选方法 |
| CN109762067B (zh) * | 2019-01-17 | 2020-02-28 | 北京天广实生物技术股份有限公司 | 结合人Claudin 18.2的抗体及其用途 |
-
2019
- 2019-09-29 CN CN201910929614.0A patent/CN112574307B/zh active Active
-
2020
- 2020-09-28 KR KR1020227014700A patent/KR20220110177A/ko active Pending
- 2020-09-28 WO PCT/CN2020/118424 patent/WO2021058000A1/zh unknown
- 2020-09-28 AU AU2020352382A patent/AU2020352382A1/en active Pending
- 2020-09-28 EP EP20869539.5A patent/EP4063386A4/en active Pending
- 2020-09-28 CA CA3156788A patent/CA3156788A1/en active Pending
- 2020-09-28 JP JP2022540748A patent/JP2023503180A/ja active Pending
- 2020-09-28 US US17/755,427 patent/US20230250168A1/en active Pending
- 2020-09-29 TW TW109133786A patent/TWI845767B/zh active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009517354A (ja) * | 2005-11-24 | 2009-04-30 | ガニメド ファーマシューティカルズ アーゲー | 癌の治療のためのクローディン18に対するモノクローナル抗体 |
| WO2019173420A1 (en) * | 2018-03-08 | 2019-09-12 | Phanes Therapeutics, Inc. | Anti-claudin 18.2 antibodies and uses thereof |
| WO2019174617A1 (en) * | 2018-03-14 | 2019-09-19 | Beijing Xuanyi Pharmasciences Co., Ltd. | Anti-claudin 18.2 antibodies |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20220110177A (ko) | 2022-08-05 |
| TW202126692A (zh) | 2021-07-16 |
| EP4063386A1 (en) | 2022-09-28 |
| CA3156788A1 (en) | 2021-04-01 |
| WO2021058000A1 (zh) | 2021-04-01 |
| EP4063386A4 (en) | 2023-12-06 |
| CN112574307A (zh) | 2021-03-30 |
| CN112574307B (zh) | 2023-11-28 |
| US20230250168A1 (en) | 2023-08-10 |
| TWI845767B (zh) | 2024-06-21 |
| AU2020352382A1 (en) | 2022-05-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI845767B (zh) | 抗人Claudin18.2抗體及其應用 | |
| CN113015749B (zh) | 靶向cd3的抗体、双特异性抗体及其用途 | |
| TWI866043B (zh) | 細胞毒性t淋巴球相關蛋白4(ctla-4)之新穎單株抗體 | |
| WO2018113258A1 (zh) | 抗pd-1抗体及其用途 | |
| JP7457822B2 (ja) | 抗cd3および抗cd123二重特異性抗体およびその使用 | |
| WO2023151693A1 (zh) | 包含抗tigit抗体和抗pd-1-抗vegfa双特异性抗体的药物组合物及用途 | |
| KR20220167331A (ko) | 항-flt3 항체 및 조성물 | |
| EP4506365A1 (en) | Anti-tigit/anti-pvrig bispecific antibody, and pharmaceutical composition and use thereof | |
| WO2024175093A1 (en) | Antibodies, antigen-binding fragments and methods of use | |
| EP4506360A1 (en) | Anti-pvrig antibody, pharmaceutical composition thereof and use thereof | |
| JP2025503772A (ja) | 抗b7-h7抗体もしくはその抗原結合断片及び製造方法と応用 | |
| CN114276451B (zh) | 靶向CD3e/g的抗体或其抗原结合片段、其制备和应用 | |
| WO2024131846A1 (en) | Antibody, antigen-binding fragment thereof, and pharmaceutical use thereof | |
| RU2836004C1 (ru) | Антитела и композиции против flt3 | |
| RU2808138C1 (ru) | Антитело, нацеливающееся на cd3, биспецифическое антитело и их применение | |
| WO2024012434A1 (en) | Antibody, antigen-binding fragment thereof, and pharmaceutical use thereof | |
| WO2024012513A1 (en) | Antibody, antigen-binding fragment thereof, and pharmaceutical use thereof | |
| WO2023025306A1 (zh) | 靶向pd-l1和cldn18.2的双特异性抗体及其制备方法和应用 | |
| TW202432593A (zh) | 抗體、其抗原結合片段及其藥物用途 | |
| WO2025149029A1 (zh) | 抗cd28抗体及其用途 | |
| CN119285769A (zh) | 多特异性抗体及其医药用途 | |
| HK40048219A (en) | Cd3-targeting antibody, bispecific antibody and use thereof | |
| HK40048219B (en) | Cd3-targeting antibody, bispecific antibody and use thereof | |
| HK40017675B (en) | Epcam-targeting antibody and preparation and application thereof | |
| HK40017675A (en) | Epcam-targeting antibody and preparation and application thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221111 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230920 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240830 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240910 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20250311 |