I.導入
本発明は、がん、肺癌(例えば、非小細胞肺癌(NSCLC))のための治療方法及び診断方法ならびに組成物を提供する。本発明は、がんに罹患している患者の治療において、がんに罹患している患者を診断するため、がんを有する患者がPD-L1軸結合アンタゴニスト(例えば、抗PD-L1抗体、例えば、アテゾリズマブ(MPDL3280A))などの免疫チェックポイント阻害剤を含む抗がん療法での治療に応答する可能性があるかを決定するため、PD-L1軸結合アンタゴニスト(例えば、抗PD-L1抗体、例えば、アテゾリズマブ)などの免疫チェックポイント阻害剤を含む抗がん療法の治療有効性を最適化するため、及び/またはPD-L1軸結合アンタゴニスト(例えば、抗PD-L1抗体、例えば、アテゾリズマブ)などの免疫チェックポイント阻害剤を含む抗がん療法のための患者選択のために、患者から得られる腫瘍組織試料中の体細胞変異のレベルの決定及び組織腫瘍変異負荷(tTMB)スコアの導出を、バイオマーカー(例えば、予測バイオマーカー)として使用することができるという発見に少なくとも部分的に基づく。
II.定義
本明細書に記載の本発明の態様及び実施形態は、態様及び実施形態「を含む」、「からなる」、及び「から本質的になる」を含むことが理解される。本明細書で使用される場合、単数形「a」、「an」、及び「the」は、別途示されない限り、複数の参照対象を含む。
本明細書で使用される場合、「約」という用語は、当業者に容易に知られているそれぞれの値の通常の誤差範囲を指す。本明細書における「約」値またはパラメータへの言及は、その値またはパラメータ自体を対象とする実施形態を含む(かつ説明する)。例えば、「約X」を指す説明には、「X」の説明が含まれる。いくつかの実施形態において、「約」値は、引用される値の最大±10%、例えば、±1%、±2%、±3%、±4%、±5%、±6%、±7%、±8%、±9%、または±10%の値を示す。
本明細書で使用される場合、「変異的荷重」、「変異荷重」、「変異的負荷」、「腫瘍変異負荷スコア」、「TMBスコア」、「組織腫瘍変異負荷スコア」、及び「tTMBスコア」という用語は各々互換的に使用することができ、腫瘍組織試料(例えば、ホルマリン固定及びパラフィン包埋(FFPE)腫瘍試料、保存記録用腫瘍試料、新鮮な腫瘍試料、または凍結腫瘍試料)中で検出される、事前に決定された遺伝子のセットにおける(例えば、事前に決定された遺伝子のセットのコード領域における)事前に選択された単位当たり(例えば、1メガベース当たり)の改変(例えば、1つ以上の改変、例えば、1つ以上の体細胞改変)のレベル(例えば、数)を指す。tTMBスコアは、例えば、全ゲノムもしくはエクソームに基づいて、またはゲノムもしくはエクソームのサブセットに基づいて測定することができる。特定の実施形態において、ゲノムまたはエクソームのサブセットに基づいて測定されるtTMBスコアを外挿して、全ゲノムまたはエクソーム変異荷重を決定することができる。いくつかの実施形態において、tTMBスコアは、個体(例えば、動物(例えば、ヒト))内の累積体細胞変異のレベルを指す。tTMBスコアは、がん(例えば、肺癌、例えば、NSCLC)を有する患者における累積体細胞変異を指してもよい。いくつかの実施形態において、tTMBスコアは、個体の全ゲノムにおける累積変異を指す。いくつかの実施形態において、tTMBスコアは、個体から収集した特定の組織試料(例えば、腫瘍組織試料生検、例えば、肺癌腫瘍試料、例えば、NSCLC腫瘍試料)中の累積変異を指す。
「体細胞変異」または「体細胞改変」という用語は、体細胞組織(例えば、生殖系列外にある細胞)内で生じる遺伝子改変を指す。遺伝子改変の例としては、点変異(例えば、単一ヌクレオチドの別のものへの交換(例えば、サイレント変異、ミスセンス変異、及びナンセンス変異))、挿入及び欠失(例えば、1つ以上のヌクレオチドの付加及び/または除去(例えば、挿入欠失))、増幅、遺伝子複製、コピー数の改変(CNA)、再配列、ならびにスプライスバリアントが挙げられるが、これらに限定されない。特定の変異の存在は、病状(例えば、がん、例えば、肺癌、例えば、NSCLC)に関連し得る。
特定の実施形態において、体細胞改変は、サイレント変異(例えば、同義改変)である。他の実施形態において、体細胞改変は、非同義単一ヌクレオチドバリアント(SNV)である。他の実施形態において、体細胞改変は、パッセンジャー変異(例えば、クローンの適応度に対して検出可能な影響を有しない改変)である。特定の実施形態において、体細胞改変は、意義不明のバリアント(VUS)、例えば、その病原性の確認も除外も不可能な改変である。特定の実施形態において、体細胞改変は、あるがん表現型に関連するとは特定されていない。
特定の実施形態において、体細胞改変は、細胞分裂、成長、または生存に対する影響に関連しないか、またはそれに関連することが既知ではない。他の実施形態において、体細胞改変は、細胞分裂、成長、または生存に対する影響に関連する。
特定の実施形態において、体細胞改変の数は、サブゲノム間隔内の機能的改変を除外する。
いくつかの実施形態において、機能的改変は、基準配列(例えば、野生型配列または未変異配列)と比較して、細胞分裂、成長、または生存に対する影響を有する(例えば、細胞分裂、成長、または生存を促進する)改変である。特定の実施形態において、機能的改変は、機能的改変のデータベース、例えば、COSMICデータベース(その全体が参照により本明細書に組み込まれる、Forbes et al.Nucl.Acids Res.43(D1):D805-D811,2015を参照されたい)への包含によって、それであると特定される。他の実施形態において、機能的改変は、既知の機能状態を有する(例えば、COSMICデータベースにおいて既知の体細胞改変として生じる)改変である。特定の実施形態において、機能的改変は、可能性のある機能状態(例えば、腫瘍抑制遺伝子内の切断)を有する改変である。特定の実施形態において、機能的改変は、ドライバー変異(例えば、細胞生存または複製を増加させることによって、例えば、クローンにその微小環境内での選択的利点を付与する改変)である。他の実施形態において、機能的改変は、クローン増殖を引き起こすことができる改変である。特定の実施形態において、機能的改変は、以下、(a)成長シグナルにおける自己自足、(b)抗成長シグナルに対する、例えば、非感受性の減少、(c)アポトーシスの減少、(d)複製能の増加、(e)血管新生の持続、または(f)組織浸潤もしくは転移のうちの1つ、2つ、3つ、4つ、5つ、または6つ全てを引き起こすことができる改変である。
特定の実施形態において、機能的改変は、パッセンジャー変異ではない(例えば、細胞のクローンの適応度に対して検出可能な影響を有しない改変ではない)。特定の実施形態において、機能的改変は、意義不明のバリアント(VUS)ではない(例えば、その病原性の確認も除外も不可能な改変ではない)。
特定の実施形態において、事前に決定された遺伝子のセットにおける事前に選択された腫瘍遺伝子内の複数(例えば、約10%、20%、30%、40%、50%、60%、70%、80%、90%、またはそれ以上)の機能的改変が除外される。特定の実施形態において、事前に決定された遺伝子のセットにおける事前に選択された遺伝子(例えば、腫瘍遺伝子)中の全ての機能的改変が除外される。特定の実施形態において、事前に決定された遺伝子のセットにおける複数の事前に選択された遺伝子(例えば、腫瘍遺伝子)中の複数の機能的改変が除外される。特定の実施形態において、事前に決定された遺伝子のセットにおける全ての遺伝子(例えば、腫瘍遺伝子)中の全ての機能的改変が除外される。
特定の実施形態において、体細胞改変の数は、サブゲノム間隔内の生殖系列変異を除外する。
特定の実施形態において、生殖系列改変は、SNP、塩基置換、挿入、欠失、挿入欠失、またはサイレント変異(例えば、同義変異)である。
特定の実施形態において、生殖系列改変は、適合した正常な配列との比較を使用しない方法の使用によって除外される。他の実施形態において、生殖系列改変は、アルゴリズムの使用を含む方法によって除外される。特定の実施形態において、生殖系列改変は、生殖系列改変のデータベース、例えば、dbSNPデータベース(その全体が参照により本明細書に組み込まれる、Sherry et al.Nucleic Acids Res.29(1):308-311,2001を参照されたい)への包含によって、それであると特定される。他の実施形態において、生殖系列改変は、ExACデータベース(その全体が参照により本明細書に組み込まれる、Exome Aggregation Consortium et al.bioRxiv preprint,October30,2015を参照されたい)の2つ以上の計数への包含によって、それであると特定される。いくつかの実施形態において、生殖系列改変は、1000Genome Projectデータベース(その全体が参照により本明細書に組み込まれる、McVean et al.Nature491,56-65,2012)への包含によって、それであると特定される。いくつかの実施形態において、生殖系列改変は、ESPデータベース(Exome Variant Server,NHLBI GO Exome Sequencing Project(ESP),Seattle,WA)への包含によって、それであると特定される。
本明細書で使用される場合、「免疫チェックポイント阻害剤」という用語は、少なくとも1つの免疫チェックポイントタンパク質を標的として、免疫応答の制御を改変する、例えば、免疫応答を下方制御または阻害する治療剤を指す。免疫チェックポイントタンパク質は当該技術分野において既知であり、それらには、細胞毒性Tリンパ球抗原4(CTLA-4)、プログラム細胞死1(PD-1)、プログラム細胞死リガンド1(PD-L1)、プログラム細胞死リガンド2(PD-L2)、T細胞活性化のVドメインIg抑制因子(VISTA)、B7-H2、B7-H3、B7-H4、B7-H6、2B4、ICOS、HVEM、CD160、gp49B、PIR-B、KIRファミリー受容体、TIM-1、TIM-3、TIM-4、LAG-3、BTLA、SIRPアルファ(CD47)、CD48、2B4(CD244)、B7.1、B7.2、ILT-2、ILT-4、TIGIT、LAG-3、BTLA、IDO、OX40、及びA2aRが非限定的に含まれる。いくつかの事例では、免疫チェックポイントタンパク質は、活性化T細胞の表面上に発現され得る。本発明の方法において有用な免疫チェックポイント阻害剤として機能し得る治療剤としては、CTLA-4、PD-1、PD-L1、PD-L2、VISTA、B7-H2、B7-H3、B7-H4、B7-H6、2B4、ICOS、HVEM、CD160、gp49B、PIR-B、KIRファミリー受容体、TIM-1、TIM-3、TIM-4、LAG-3、BTLA、SIRPアルファ(CD47)、CD48、2B4(CD244)、B7.1、B7.2、ILT-2、ILT-4、TIGIT、LAG-3、BTLA、IDO、OX40、及びA2aRのうちの1つ以上を標的とする治療剤が挙げられるが、これらに限定されない。いくつかの事例では、免疫チェックポイント阻害剤は、1つ以上の標的とした免疫チェックポイントタンパク質の機能を増強または抑制する。いくつかの事例では、免疫チェックポイント阻害剤は、本明細書に記載のPD-L1軸結合アンタゴニストである。
「PD-L1軸結合アンタゴニスト」という用語は、PD-1シグナル伝達軸上のシグナル伝達に起因するT細胞機能障害を除去するように、PD-L1軸結合パートナーと、その結合パートナーのうちの1つ以上との相互作用を阻害し、結果として、T細胞機能が復元または増強される分子を指す。本明細書で使用される場合、PD-L1軸結合アンタゴニストは、PD-L1結合アンタゴニスト及びPD-1結合アンタゴニスト、ならびにPD-L1とPD-1との間の相互作用を妨害する分子(例えば、PD-L2-Fc融合体)を含む。
免疫機能障害の文脈における「機能障害」という用語は、抗原刺激に対する免疫応答性が低減した状態を指す。この用語には、抗原認識が生じ得るが、後に続く免疫応答が感染または腫瘍成長の制御に無効である「消耗」及び/または「アネルギー」の両方の共通要素が含まれる。
本明細書で使用される場合、「機能障害性」という用語には、抗原認識に対する不応性または無応答性、具体的には、抗原認識を、増殖、サイトカイン産生(例えば、IL-2)、及び/または標的細胞殺滅などの下流T細胞エフェクター機能に翻訳する能力の障害も含まれる。
「アネルギー」という用語は、T細胞受容体を通して送達される不完全または不十分なシグナル(例えば、Ras活性化の不在下での細胞内Ca2+の増加)に起因する、抗原刺激に対する無応答性の状態を指す。T細胞アネルギーはまた共刺激の不在下での抗原による刺激に際しても生じる可能性があり、結果的に、細胞は共刺激の文脈においても抗原によるその後の活性化に不応性になる。無応答状態はしばしば、インターロイキン-2の存在によって覆され得る。アネルギーT細胞は、クローン増殖を受けず、及び/またはエフェクター機能を獲得しない。
「消耗」という用語は、多くの慢性感染症及びがんにおいて生じる持続的TCRシグナル伝達から生じるT細胞機能障害の状態としてのT細胞消耗を指す。これは、不完全なまたは不十分なシグナル伝達を通してではなく、持続的シグナル伝達から生じるという点で、アネルギーとは区別される。これは、不良なエフェクター機能、阻害受容体の持続的発現、及び機能的エフェクターT細胞またはメモリーT細胞の転写状態とは異なる転写状態によって定義される。消耗は、感染症及び腫瘍の最適な制御を妨げる。消耗は、外因性の負の制御経路(例えば、免疫制御サイトカイン)及び細胞内因性の負の制御性(共刺激)経路(PD-1、B7-H3、B7-H4など)の両方に起因し得る。
「T細胞機能の増強」は、持続もしくは増幅された生物学的機能を有するようにT細胞を誘導するか、引き起こすか、もしくは刺激すること、または消耗したT細胞もしくは不活性のT細胞を再生もしくは再活性化することを意味する。T細胞機能の増強の例としては、介入前のそのようなレベルと比較した、CD8+T細胞からのγ-インターフェロンの分泌の増加、増殖の増加、抗原応答性(例えば、ウイルス、病原体、または腫瘍クリアランス)の増加が挙げられる。一実施形態において、増強のレベルは、少なくとも50%、あるいは60%、70%、80%、90%、100%、120%、150%、または200%の増強である。この増強を測定する様式は、当業者にとって既知である。
「腫瘍免疫」は、腫瘍が免疫認識及びクリアランスを回避するプロセスを指す。したがって、治療概念として、腫瘍免疫は、そのような回避が減弱し、腫瘍が免疫系によって認識及び攻撃されるときに「治療される」。腫瘍認識の例としては、腫瘍結合、腫瘍収縮、及び腫瘍クリアランスが挙げられる。
「免疫原性」は、免疫応答を誘発する特定の物質の能力を指す。腫瘍は免疫原性であり、腫瘍免疫原性の増強により、免疫応答による腫瘍細胞のクリアランスが支援される。腫瘍免疫原性の増強の例としては、PD-L1軸結合アンタゴニストでの治療が挙げられる。
本明細書で使用される場合、「PD-L1結合アンタゴニスト」は、PD-L1と、PD-1及び/またはB7-1などのその結合パートナーのうちのいずれか1つ以上との相互作用に起因するシグナル形質導入を減少、遮断、阻害、抑止、または妨害する分子である。いくつかの実施形態において、PD-L1結合アンタゴニストは、PD-L1のその結合パートナーへの結合を阻害する分子である。特定の一態様において、PD-L1結合アンタゴニストは、PD-L1のPD-1及び/またはB7-1への結合を阻害する。いくつかの実施形態において、PD-L1結合アンタゴニストは、抗PD-L1抗体及びそれらの抗原結合断片、イムノアドヘシン、融合タンパク質、オリゴペプチド、小分子アンタゴニスト、ポリヌクレオチドアンタゴニスト、ならびにPD-L1と、PD-1及び/またはB7-1などのその結合パートナーのうちの1つ以上との相互作用に起因するシグナル形質導入を減少、遮断、阻害、抑止、または妨害する他の分子を含む。一実施形態において、PD-L1結合アンタゴニストは、PD-L1またはPD-1を通してTリンパ球及び他の細胞上に発現される細胞表面タンパク質によりまたはそれを通して媒介される負のシグナルを低減し、これにより、機能障害性T細胞の機能障害状態を軽減する。いくつかの実施形態において、PD-L1結合アンタゴニストは、抗PD-L1抗体である。特定の一態様において、抗PD-L1抗体は、本明細書に記載のYW243.55S70である。別の特定の態様において、抗PD-L1抗体は、本明細書に記載のMDX-1105である。なお別の特定の態様において、抗PD-L1抗体は、本明細書に記載のアテゾリズマブ(MPDL3280A)である。なお別の特定の態様において、抗PD-L1抗体は、本明細書に記載のMEDI4736(ドルバルマブ)である。なお別の特定の態様において、抗PD-L1抗体は、本明細書に記載のMSB0010718C(アベルマブ)である。
本明細書で使用される場合、「PD-1結合アンタゴニスト」は、PD-1と、PD-L1及び/またはPD-L2などのその結合パートナーのうちの1つ以上との相互作用に起因するシグナル形質導入を減少、遮断、阻害、抑止、または妨害する分子である。いくつかの実施形態において、PD-1結合アンタゴニストは、PD-1のその結合パートナーへの結合を阻害する分子である。特定の一態様において、PD-1結合アンタゴニストは、PD-1のPD-L1及び/またはPD-L2への結合を阻害する。例えば、PD-1結合アンタゴニストには、抗PD-1抗体及びそれらの抗原結合断片、イムノアドヘシン、融合タンパク質、オリゴペプチド、小分子アンタゴニスト、ポリヌクレオチドアンタゴニスト、ならびにPD-1と、PD-L1及び/またはPD-L2との相互作用に起因するシグナル形質導入を減少、遮断、阻害、抑止、または妨害する他の分子が含まれる。一実施形態において、PD-1結合アンタゴニストは、PD-L1またはPD-1を通してTリンパ球及び他の細胞上で発現される細胞表面タンパク質によりまたはそれを通して媒介される負のシグナルを低減し、これにより、機能不全のT細胞の機能不全状態を軽減する。いくつかの実施形態において、PD-1結合アンタゴニストは、抗PD-1抗体である。特定の一態様において、PD-1結合アンタゴニストは、本明細書に記載のMDX-1106(ニボルマブ)である。別の特定の態様において、PD-1結合アンタゴニストは、本明細書に記載のMK-3475(ペンブロリズマブ)である。別の特定の態様において、PD-1結合アンタゴニストは、本明細書に記載のCT-011(ピディリズマブ)である。別の特定の態様において、PD-1結合アンタゴニストは、本明細書に記載のMEDI-0680(AMP-514)である。別の特定の態様において、PD-1結合アンタゴニストは、本明細書に記載のPDR001である。別の特定の態様において、PD-1結合アンタゴニストは、本明細書に記載のREGN2810である。別の特定の態様において、PD-1結合アンタゴニストは、本明細書に記載のBGB-108である。別の特定の態様において、PD-1結合アンタゴニストは、本明細書に記載のAMP-224である。
「プログラム死リガンド1」及び「PD-L1」という用語は、本明細書において、天然配列PD-L1ポリペプチド、ポリペプチドバリアント、ならびに天然配列ポリペプチド及びポリペプチドバリアントの断片(これらは、本明細書において更に定義される)を指す。本明細書に記載のPD-L1ポリペプチドは、様々な供給源から(ヒト組織型から、もしくは別の供給源からなど)単離されるか、または組み換え方法もしくは合成方法によって調製されたものであり得る。
「天然配列PD-L1ポリペプチド」は、対応する、自然界に由来するPD-L1ポリペプチドと同じアミノ酸配列を有するポリペプチドを含む。
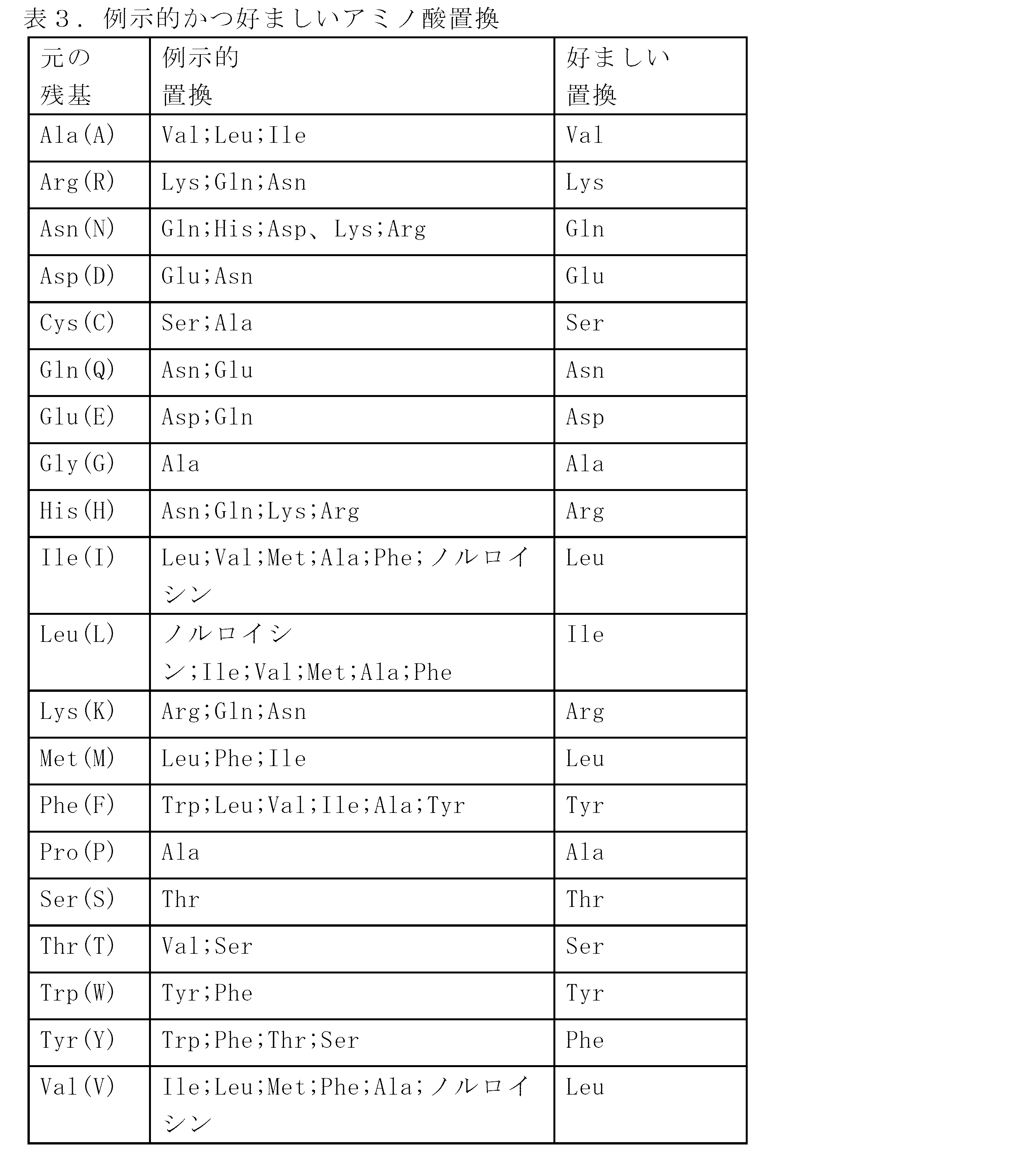
「PD-L1ポリペプチドバリアント」またはその変化形は、本明細書に開示される天然配列PD-L1ポリペプチド配列のいずれかと少なくとも約80%のアミノ酸配列同一性を有する、本明細書で定義されるPD-L1ポリペプチド、一般に活性PD-L1ポリペプチドを意味する。そのようなPD-L1ポリペプチドバリアントには、例えば、天然アミノ酸配列のN末端またはC末端に1つ以上のアミノ酸残基が付加または欠失されたPD-L1ポリペプチドが含まれる。通常、PD-L1ポリペプチドバリアントは、本明細書に開示される天然配列PD-L1ポリペプチド配列と少なくとも約80%のアミノ酸配列同一性、あるいは少なくとも約81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、または99%のアミノ酸配列同一性を有する。通常、PD-L1バリアントポリペプチドは、少なくとも約10アミノ酸長であり、あるいは少なくとも約20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、281、282、283、284、285、286、287、288、もしくは289アミノ酸長、またはそれ以上である。任意で、PD-L1バリアントポリペプチドは、天然PD-L1ポリペプチド配列と比較して1つ以下の保存的アミノ酸置換、あるいは天然PD-L1ポリペプチド配列と比較して2、3、4、5、6、7、8、9、または10個以下の保存的アミノ酸置換を有する。
本明細書で同義に使用される場合、「ポリヌクレオチド」または「核酸」は、任意の長さのヌクレオチドのポリマーを指し、DNA及びRNAを含む。ヌクレオチドは、デオキシリボヌクレオチド、リボヌクレオチド、修飾ヌクレオチドもしくは塩基、及び/またはそれらの類似体、あるいはDNAもしくはRNAポリメラーゼによってまたは合成反応によってポリマーに組み込まれ得る任意の基質であり得る。したがって、例えば、本明細書で定義されるポリヌクレオチドには、一本鎖及び二本鎖DNA、一本鎖及び二本鎖領域を含むDNA、一本鎖及び二本鎖RNA、ならびに一本鎖及び二本鎖領域を含むRNA、一本鎖もしくはより典型的には二本鎖であり得るか、または一本鎖及び二本鎖領域を含むDNA及びRNAを含むハイブリッド分子が非限定的に含まれる。加えて、本明細書で使用される場合、「ポリヌクレオチド」という用語は、RNAもしくはDNAまたはRNA及びDNAの両方を含む三本鎖領域を指す。そのような領域内の鎖は、同じ分子由来であっても異なる分子由来であってもよい。これらの領域は、分子のうちの1つ以上の全てを含み得るが、より典型的には分子のうちのいくつかの一領域のみを伴う。三重らせん領域の分子のうちの1つは、オリゴヌクレオチドであることが多い。「ポリヌクレオチド」という用語はcDNAを含む。
ポリヌクレオチドは、メチル化ヌクレオチド及びそれらの類似体などの修飾ヌクレオチドを含み得る。存在する場合、ヌクレオチド構造に対する修飾は、ポリマーの組み立ての前または後に付与され得る。ヌクレオチドの配列は、非ヌクレオチド構成成分によって中断され得る。ポリヌクレオチドは、標識との複合などによって、合成後に更に修飾され得る。他の種類の修飾には、天然に存在するヌクレオチドのうちの1つ以上を類似体と置換する「キャップ」、ヌクレオチド間修飾、例えば、非電荷性結合(例えば、メチルホスホン酸、ホスホトリエステル、ホスホアミデート、カルバメートなど)によるもの及び電荷性結合(例えば、ホスホロチオエート、ホスホロジチオエートなど)によるもの、懸垂部分、例えば、タンパク質(例えば、ヌクレアーゼ、毒素、抗体、シグナルペプチド、ポリ-L-リシンなど)などを含有するもの、挿入剤(例えば、アクリジン、ソラーレンなど)を有するもの、キレート剤(例えば、金属、放射性金属、ホウ素、酸化金属など)を有するもの、アルキル化剤を含有するもの、修飾結合(例えば、アルファアノマー核酸)を有するもの、ならびにポリヌクレオチド(複数可)の未修飾形態が含まれる。更に、糖に通常存在するヒドロキシル基のいずれかが、例えば、ホスホン酸基、リン酸基により置換されるか、標準的な保護基により保護されるか、もしくは追加のヌクレオチドへの追加の結合に備えて活性化されてもよく、または固体支持体もしくは半固体支持体に複合されてもよい。5’及び3’末端OHをリン酸化しても、アミンもしくは1~20個の炭素原子の有機キャッピング基部分で置換してもよい。他のヒドロキシルもまた、標準的な保護基に誘導体化されてもよい。ポリヌクレオチドはまた、例えば、2’-O-メチル-、2’-O-アリル-、2’-フルオロ-、または2’-アジド-リボース、炭素環糖の類似体、α-アノマー糖、エピマー糖(アラビノース、キシロース、またはリキソースなど)、ピラノース糖、フラノース糖、セドヘプツロース、アクリル酸類似体、及び脱塩基ヌクレオシド類似体(メチルリボシドなど)を含む、当該技術分野において一般に既知であるリボース糖またはデオキシリボース糖の類似形態も含有し得る。1つ以上のホスホジエステル結合が、代替的な連結基によって置換されてもよい。これらの代替的な連結基としては、リン酸がP(O)S(「チオエート」)、P(S)S(「ジチオエート」)、“(O)NR2(「アミデート」)、P(O)R、P(O)OR’、CO、またはCH2(「ホルムアセタール」)によって置換される実施形態が挙げられるが、これらに限定されず、式中、各RまたはR’は独立して、Hであるか、または置換もしくは非置換アルキル(1-20C)(任意でエーテル(-O-)結合を含有する)、アリール、アルケニル、シクロアルキル、シクロアルケニル、もしくはアラルジルである。ポリヌクレオチド内の全ての結合が同一である必要はない。ポリヌクレオチドは、1つ以上の種類の本明細書に記載の修飾、及び/または同じ種類の複数の修飾を含有してもよい。前述の説明は、RNA及びDNAを含む本明細書で言及される全てのポリヌクレオチドに適用される。
本明細書で使用される場合、「オリゴヌクレオチド」は一般に、約250ヌクレオチド長未満であるが、必ずしもそうではない短い一本鎖ポリヌクレオチドを指す。オリゴヌクレオチドは、合成であってもよい。「オリゴヌクレオチド」及び「ポリヌクレオチド」という用語は、相互排他的ではない。ポリヌクレオチドに関する上記の説明は、等しく完全にオリゴヌクレオチドに適用可能である。
「プライマー」という用語は、一般に遊離3’-OH基を提供することによって、核酸にハイブリダイズし、相補的核酸の重合を可能にすることができる一本鎖ポリヌクレオチドを指す。
「小分子」という用語は、約2000ダルトン以下、好ましくは約500ダルトン以下の分子量を有する任意の分子を指す。
「宿主細胞」、「宿主細胞株」、及び「宿主細胞培養物」という用語は互換的に使用され、外因性核酸が中に導入されている細胞を指し、そのような細胞の子孫を含む。宿主細胞には、「形質転換体」及び「形質転換細胞」が含まれ、これらには、初代形質転換細胞及び継代の数に関わらずそれに由来する子孫が含まれる。子孫は、核酸含有量が親細胞と完全に同一ではなくてもよいが、変異を含んでもよい。最初に形質転換された細胞についてスクリーニングまたは選択されたものと同じ機能または生物学的活性を有する変異体子孫が、本明細書に含まれる。
本明細書で使用される場合、「ベクター」という用語は、それが連結している別の核酸を運搬することができる核酸分子を指す。この用語は、自己複製核酸構造としてのベクター、及びそれが導入されている宿主細胞のゲノム内に組み込まれたベクターを含む。特定のベクターは、それらが作動可能に連結している核酸の発現を指向することができる。そのようなベクターは、本明細書で「発現ベクター」と称される。
「単離された」核酸は、その天然環境の構成成分から分離されている核酸分子を指す。単離された核酸は、通常核酸分子を含有する細胞内に含有される核酸分子を含むが、その核酸分子が染色体外に、またはその天然染色体位置とは異なる染色体位置に存在する。
本明細書における「抗体」という用語は、最も広義に使用され、それらが所望の抗原結合活性を呈する限り、モノクローナル抗体、ポリクローナル抗体、多重特異性抗体(例えば、二重特異性抗体)、及び抗体断片を含むが、これらに限定されない様々な抗体構造を包含する。
「単離された」抗体は、その自然環境の構成成分から特定及び分離され、及び/または回収された抗体である。その自然環境の混入構成成分は、抗体の研究的、診断的、及び/または治療的使用を妨害する材料であり、それらには、酵素、ホルモン、及び他のタンパク質性または非タンパク質性溶質が挙げることができる。いくつかの実施形態において、抗体は、(1)例えば、ローリー法によって決定して、抗体の95重量%超、及びいくつかの実施形態において、99重量%超になるまで、(2)例えば、スピニングカップ配列決定装置を使用して、N末端もしくは内部アミノ酸配列の少なくとも15個の残基を得るのに十分な程度まで、または(3)例えば、クマシーブルーまたは銀染色を使用して、還元または非還元条件下でSDS-PAGEによって均質性が得られるまで、精製される。単離された抗体には、組み換え細胞内のin situの抗体が含まれるが、これは、抗体の天然環境の少なくとも1つの構成成分が存在していないためである。しかしながら、通常、単離された抗体は、少なくとも1つの精製ステップによって調製される。
「天然抗体」は通常、2つの同一の軽(L)鎖及び2つの同一の重(H)鎖で構成される約150,000ダルトンのヘテロ四量体糖タンパク質である。各軽鎖は、1つの共有ジスルフィド結合によって重鎖に連結しているが、ジスルフィド結合の数は、異なる免疫グロブリンアイソタイプの重鎖間で変動する。各重鎖及び軽鎖はまた、規則的に離間した鎖内ジスルフィド架橋も有する。各重鎖は、一方の端に可変ドメイン(VH)を有し、いくつかの定常ドメインが続く。各軽鎖は、一方の端に可変ドメイン(VL)を有し、その他方の端に定常ドメインを有し、軽鎖の定常ドメインは、重鎖の第1の定常ドメインと整列し、軽鎖の可変ドメインは、重鎖の可変ドメインと整列する。特定のアミノ酸残基が、軽鎖可変ドメインと重鎖可変ドメインとの間に界面を形成すると考えられている。
任意の哺乳動物種由来の抗体(免疫グロブリン)の「軽鎖」は、それらの定常ドメインのアミノ酸配列に基づいて、カッパ(「κ」)及びラムダ(「λ」)と呼ばれる2つの明らかに異なる種類のうちの1つに割り当てることができる。
「定常ドメイン」という用語は、抗原結合部位を含有する可変ドメインである免疫グロブリンの他方の部分と比較して、より保存されたアミノ酸配列を有する免疫グロブリン分子の部分を指す。定常ドメインは、重鎖のCH1、CH2、及びCH3ドメイン(集合的にCH)、ならびに軽鎖のCHL(またはCL)ドメインを含有する。
抗体の「可変領域」または「可変ドメイン」は、抗体の重鎖または軽鎖のアミノ末端ドメインを指す。重鎖の可変ドメインは、「VH」と称され得る。軽鎖の可変ドメインは、「VL」と称され得る。これらのドメインは一般に、抗体の最も可変の部分であり、抗原結合部位を含有する。
「可変」という用語は、可変ドメインの特定の部分の配列が抗体間で大きく異なり、各特定の抗体のその特定の抗原に対する結合及び特異性に使用されるという事実を指す。しかしながら、可変性は、抗体の可変ドメイン全体を通して均等には分布していない。それは、軽鎖可変ドメイン及び重鎖可変ドメインの両方における超可変領域(HVR)と呼ばれる3つのセグメントに集中している。可変ドメインのより高度に保存された部分は、フレームワーク領域(FR)と呼ばれる。天然の重鎖及び軽鎖の可変ドメインは各々、ベータ-シート構造を接続し、場合によってはその一部を形成するループを形成する、3つのHVRによって接続されたベータシート立体配置を主に採用する、4つのFR領域を含む。各鎖内のHVRは、FR領域によって近接近して一緒に保持されており、他方の鎖のHVRと共に、抗体の抗原結合部位の形成に寄与する(Kabat et al.,Sequences of Proteins of Immunological Interest,Fifth Edition,National Institute of Health,Bethesda,Md.(1991)を参照されたい)。定常ドメインは、抗体の抗原への結合には直接関与しないが、抗体の抗体依存性細胞毒性への関与などの様々なエフェクター機能を呈する。
本明細書で使用される場合、「超可変領域」、「HVR」、または「HV」という用語は、配列が超可変であり、及び/または構造的に定義されたループを形成する抗体可変ドメインの領域を指す。一般に、抗体は、6つのHVRを含み、3つがVHにあり(H1、H2、H3)、3つがVLにある(L1、L2、L3)。天然抗体において、H3及びL3は、これらの6つのHVRのうちで最大の多様性を提示し、特にH3が、抗体に優れた特異性を与える上で特有の役割を果たすと考えられている。例えば、Xu et al.,Immunity13:37-45(2000)、Johnson and Wu,in Methods in Molecular Biology248:1-25(Lo,ed.,Human Press,Totowa,N.J.,2003)を参照されたい。実際に、重鎖のみからなる天然に存在するラクダ科抗体は、軽鎖の不在下で機能的であり、安定している。例えば、Hamers-Casterman et al.,Nature363:446-448(1993)、Sheriff et al.,Nature Struct.Biol.3:733-736(1996)を参照されたい。
いくつかのHVRの描写が本明細書で使用されており、本明細書に包含される。Kabat相補性決定領域(CDR)は、配列可変性に基づくものであり、最も一般的に使用されている(Kabat et al.,Sequences of Proteins of Immunological Interest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,Md.(1991))。代わりに、Chothiaは、構造的ループの位置に言及する(Chothia and LeskJ.Mol.Biol.196:901-917(1987))。AbM HVRは、KabatのHVRとChothiaの構造的ループとの間の折衷物を表し、Oxford MolecularのAbM抗体モデル化ソフトウェアによって使用されている。「接触」HVRは、利用可能な複合体結晶構造の分析に基づく。これらのHVRのうちの各々に由来する残基を、以下に記載する。
HVRは、以下の「伸長HVR」、VLにおいて、24-36または24-34(L1)、46-56または50-56(L2)、及び89-97または89-96(L3)、ならびにVHにおいて、26-35(H1)、50-65または49-65(H2)、及び93-102、94-102、または95-102(H3)を含み得る。可変ドメイン残基は、これらの定義の各々について、Kabatら(上記)に従って番号付けされる。
「フレームワーク」または「FR」残基は、本明細書で定義されるHVR残基以外の可変ドメイン残基である。
「Kabatにあるような可変ドメイン残基番号付け」または「Kabatにあるようなアミノ酸位置番号付け」という用語、及びそれらの変化形は、Kabatら(上記)における抗体の編集物の重鎖可変ドメインまたは軽鎖可変ドメインに使用される番号付けシステムを指す。この番号付けシステムを使用すると、実際の線形アミノ酸配列は、可変ドメインのFRもしくはHVRの短縮、またはそれへの挿入に対応するより少ないアミノ酸または追加のアミノ酸を含有し得る。例えば、重鎖可変ドメインは、H2の残基52の後に単一のアミノ酸挿入断片(Kabatによる残基52a)、及び重鎖FR残基82の後に挿入された残基(例えば、Kabatによる残基82a、82b、及び82cなど)を含み得る。残基のKabat番号付けは、「標準的な」Kabat番号付け配列との抗体の配列の相同性領域での整列によって所与の抗体について決定され得る。
Kabat番号付けシステムは一般に、可変ドメイン内の残基(軽鎖の残基約1~107及び重鎖の残基1~113)に言及する際に使用される(例えば、Kabat et al.,Sequences of Immunological Interest.5th Ed.Public Health Service,National Institutes of Health,Bethesda,Md.(1991))。「EU番号付けシステム」または「EU指標」は一般に、免疫グロブリン重鎖定常領域内の残基に言及する際に使用される(例えば、Kabatら(上記)に報告されるEU指標)。「KabatにあるようなEU指標」は、ヒトIgG1 EU抗体の残基番号付けを指す。
「完全長抗体」、「無傷抗体」、及び「全抗体」という用語は、以下に定義される抗体断片ではなく、その実質的に無傷な形態にある抗体を指すように、本明細書において互換的に使用される。これらの用語は、具体的には、Fc領域を含有する重鎖を有する抗体を指す。
「抗体断片」は、無傷抗体の一部分を含み、好ましくはその抗原結合領域を含む。いくつかの実施形態において、本明細書に記載の抗体断片は、抗原結合断片である。抗体断片の例としては、Fab、Fab’、F(ab’)2、及びFv断片;ダイアボディ;線形抗体;一本鎖抗体分子;ならびに抗体断片から形成される多重特異性抗体が挙げられる。
抗体のパパイン消化は、各々が単一の抗原結合部位を持つ、「Fab」断片と呼ばれる2つの同一の抗原結合断片、及び容易に結晶化する能力を反映する名称を持つ、残りの「Fc」断片を産生する。ペプシン処理は、F(ab’)2断片をもたらし、これは、2つの抗原結合部位を有し、依然として抗原を架橋することができる。
「Fv」は、完全な抗原結合部位を含有する最小抗体断片である。一実施形態において、二本鎖Fv種は、密接に非共有会合している1つの重鎖可変ドメイン及び1つの軽鎖可変ドメインの二量体からなる。一本鎖Fv(scFv)種では、1つの重鎖可変ドメイン及び1つの軽鎖可変ドメインは、軽鎖及び重鎖が二本鎖Fv種における構造に類似した「二量体」構造で会合し得るように、柔軟性ペプチドリンカーによって共有結合し得る。各可変ドメインの3つのHVRが相互作用して、VH-VL二量体の表面上の抗原結合部位を画定するのは、この立体配置においてである。集合的に、6つのHVRが抗体に抗原結合特異性を与える。しかしながら、完全な結合部位よりも低い親和性ではあるが、単一の可変ドメイン(または抗原に特異的な3つのHVRのみを含むFvの半分)でさえも、抗原を認識し、それに結合する能力を有する。
Fab断片は、重鎖可変ドメイン及び軽鎖可変ドメインを含有し、軽鎖の定常ドメイン及び重鎖の第1の定常ドメイン(CH1)もまた含有する。Fab’断片は、抗体ヒンジ領域からの1つ以上のシステインを含む、重鎖CH1ドメインのカルボキシ末端への数個の残基の付加によって、Fab断片とは異なる。Fab’-SHは、定常ドメインのシステイン残基(複数可)が遊離チオール基を持つFab’の本明細書における表記である。F(ab’)2抗体断片は元々、それらの間にヒンジシステインを有するFab’断片の対として産生されたものであった。抗体断片の他の化学共役もまた既知である。
「一本鎖Fv」または「scFv」抗体断片は、抗体のVH及びVLドメインを含み、これらのドメインは、単一のポリペプチド鎖内に存在する。一般に、scFvポリペプチドは、VHドメインとVLドメインとの間にポリペプチドリンカーを更に含み、これにより、scFvが抗原結合に所望される構造を形成することが可能になる。scFvの概説については、例えば、Pluckthun,in The Pharmacology of Monoclonal Antibodies,vol.113,Rosenburg and Moore eds.,(Springer-Verlag,New York,1994),pp.269-315を参照されたい。
「ダイアボディ」という用語は、2つの抗原結合部位を有する抗体断片を指し、これらの断片は、同じポリペプチド鎖内の軽鎖可変ドメイン(VL)に接続した重鎖可変ドメイン(VH)(VH-VL)を含む。同じ鎖の2つのドメイン間の対合を可能にするには短すぎるリンカーを使用することによって、ドメインを別の鎖の相補的ドメインと対合させて、2つの抗原結合部位を作成することが可能になる。ダイアボディは、二価または二重特異性であり得る。ダイアボディは、例えば、EP404,097、WO1993/01161、Hudson et al.,Nat.“Med.”9:129-134(2003)、及びHollinger et al.,Proc.Natl.Acad.Sci.USA90:6444-6448(1993)により詳細に記載されている。トリアボディ及びテトラボディもまた、Hudson et al.,Nat.Med.9:129-134(2003)に記載されている。
抗体の「クラス」は、その重鎖が所有する定常ドメインまたは定常領域の種類を指す。5つの主要な抗体クラス、IgA、IgD、IgE、IgG、及びIgMが存在し、これらのうちのいくつかは、「サブクラス」(アイソタイプ)、例えば、IgG1、IgG2、IgG3、IgG4、IgA1、及びIgA2に更に分けることができる。抗体の異なるクラスに対応する重鎖定常ドメインはそれぞれ、α、δ、ε、γ、及びμと呼ばれる。
本明細書で使用される場合、「モノクローナル抗体」という用語は、実質的に同種の抗体集団から得られる抗体を指し、例えば、その集団を構成する個々の抗体は、少量で存在し得る可能性のある変異(例えば、天然に存在する変異)を除いて同一である。したがって、「モノクローナル」という修飾語は、別々の抗体の混合物ではないという抗体の特徴を示す。特定の実施形態において、そのようなモノクローナル抗体は典型的には、標的に結合するポリペプチド配列を含む抗体を含み、標的結合ポリペプチド配列は、複数のポリペプチド配列からの単一の標的結合ポリペプチド配列の選択を含むプロセスによって得られたものである。例えば、選択プロセスは、ハイブリドーマクローン、ファージクローン、または組み換えDNAクローンのプールなどの複数のクローンからの特有のクローンの選択であり得る。選択された標的結合配列が、例えば、標的に対する親和性を改善するため、標的結合配列をヒト化するため、細胞培養物におけるその産生を改善するため、インビボでのその免疫原性を低減するため、多重特異性抗体を作成するために更に改変されてもよく、かつ改変された標的結合配列を含む抗体が本発明のモノクローナル抗体でもあることを理解されたい。異なる決定基(エピトープ)に対して指向された異なる抗体を典型的に含むポリクローナル抗体調製物とは対照的に、モノクローナル抗体調製物の各モノクローナル抗体は、抗原上の単一の決定基に対して指向される。それらの特異性に加えて、モノクローナル抗体調製物は、それらが典型的に他の免疫グロブリンによって汚染されていないという点で有利である。
「モノクローナル」という修飾語は、実質的に同種の抗体集団から得られるという抗体の特徴を示し、いかなる特定の方法による抗体の産生も必要とするものと解釈されるべきではない。例えば、本発明に従って使用されるモノクローナル抗体は、例えば、ハイブリドーマ法(例えば、Kohler and Milstein,Nature256:495-97(1975)、Hongo et al.,Hybridoma14(3):253-260(1995)、Harlow et al.,Antibodies:A Laboratory Manual(Cold Spring Harbor Laboratory Press,2nd ed.1988)、Hammerling et al.,in:Monoclonal Antibodies and T-Cell Hybridomas563-681(Elsevier,N.Y.,1981))、組み換えDNA法(例えば、米国特許第4,816,567号を参照されたい)、ファージ提示技術(例えば、Clackson et al.,Nature,352:624-628(1991)、Marks et al.,J.Mol.Biol.222:581-597(1992)、Sidhu et al.,J.Mol.Biol.338(2):299-310(2004)、Lee et al.,J.Mol.Biol.340(5):1073-1093(2004)、Fellouse,Proc.Natl.Acad.Sci.USA101(34):12467-12472(2004)、及びLee et al.,J.Immunol.Methods284(1-2):119-132(2004)を参照されたい)、ならびにヒト免疫グロブリン配列をコードするヒト免疫グロブリン遺伝子座または遺伝子の一部または全部を有する動物におけるヒト抗体またはヒト様抗体の産生技術(例えば、WO1998/24893、WO1996/34096、WO1996/33735、WO1991/10741、Jakobovits et al.,Proc.Natl.Acad.Sci.USA90:2551(1993)、Jakobovits et al.,Nature362:255-258(1993)、Bruggemann et al.,Year in Immunol.7:33(1993)、米国特許第5,545,807号、同第5,545,806号、同第5,569,825号、同第5,625,126号、同第5,633,425号、及び同第5,661,016号、Marks et al.,Bio/Technology10:779-783(1992)、Lonberg et al.,Nature368:856-859(1994)、Morrison,Nature368:812-813(1994)、Fishwild et al.,Nature Biotechnol.14:845-851(1996)、Neuberger,Nature Biotechnol.14:826(1996)、及びLonberg et al.,Intern.Rev.Immunol.13:65-93(1995)を参照されたい)を含む様々な技術によって作製され得る。
本明細書のモノクローナル抗体には、具体的には、重鎖及び/または軽鎖の一部分が、特定の種に由来するか、または特定の抗体クラスもしくはサブクラスに属する抗体内の対応する配列と同一または相同である一方で、鎖(複数可)の残りが、別の種に由来するか、または別の抗体クラスもしくはサブクラスに属する抗体内の対応する配列と同一または相同である「キメラ」抗体、ならびにそれらが所望の生物学的活性を呈する限り、そのような抗体の断片を含む(例えば、米国特許第4,816,567号及びMorrison et al.,Proc.Natl.Acad.Sci.USA81:6851-6855(1984)を参照されたい)。キメラ抗体には、PRIMATIZED(登録商標)抗体が含まれ、この抗体の抗原結合領域は、例えば、マカクザルを対象となる抗原で免疫化することによって産生された抗体に由来する。
「ヒト抗体」は、ヒトもしくはヒト細胞により産生された抗体、またはヒト抗体レパートリーもしくは他のヒト抗体コード配列を利用する非ヒト源に由来する抗体のアミノ酸配列に対応するアミノ酸配列を所有するものである。ヒト抗体のこの定義は、非ヒト抗原結合残基を含むヒト化抗体を具体的に除外する。
「ヒト化」抗体は、非ヒトHVR由来のアミノ酸残基及びヒトフレームワーク領域(FR)由来のアミノ酸残基を含むキメラ抗体を指す。特定の実施形態において、ヒト化抗体は、少なくとも1つ、及び典型的には2つの可変ドメインの実質的に全てを含み、そのHVR(例えば、CDR)の全てまたは実質的に全てが非ヒト抗体のものに対応し、FRの全てまたは実質的に全てがヒト抗体のものに対応する。ヒト化抗体は任意で、ヒト抗体由来の抗体定常領域の少なくとも一部分を含み得る。抗体、例えば、非ヒト抗体の「ヒト化形態」は、ヒト化を受けた抗体を指す。
「抗PD-L1抗体」及び「PD-L1に結合する抗体」という用語は、抗体がPD-L1を標的とする上で診断剤及び/または治療剤として有用になるように、十分な親和性でPD-L1に結合することができる抗体を指す。一実施形態において、抗PD-L1抗体の無関係の非PD-L1タンパク質への結合の程度は、例えば放射免疫アッセイ(RIA)によって測定して、抗体のPD-L1への結合の約10%未満である。特定の実施形態において、抗PD-L1抗体は、異なる種由来のPD-L1の間で保存されているPD-L1のエピトープに結合する。
「抗PD-1抗体」及び「PD-1に結合する抗体」という用語は、抗体がPD-1を標的とする上で診断剤及び/または治療剤として有用になるように、十分な親和性でPD-1に結合することができる抗体を指す。一実施形態において、抗PD-1抗体の無関係の非PD-1タンパク質への結合の程度は、例えば放射免疫アッセイ(RIA)により測定して、抗体のPD-1への結合の約10%未満である。特定の実施形態において、抗PD-1抗体は、異なる種由来のPD-1の間で保存されているPD-1のエピトープに結合する。
「遮断」抗体または「アンタゴニスト」抗体は、それが結合する抗原の生物学的活性を阻害または低減する抗体である。好ましい遮断抗体またはアンタゴニスト抗体は、抗原の生物学的活性を実質的にまたは完全に阻害する。
「親和性」は、分子(例えば、抗体)とその結合パートナー(例えば、抗原)との単一結合部位間の非共有結合相互作用の合計の強度を指す。別段示されない限り、本明細書で使用される場合、「結合親和性」は、結合対のメンバー(例えば、抗体及び抗原)間の1:1の相互作用を反映する固有の結合親和性を指す。分子XのそのパートナーYに対する親和性は一般に、解離定数(Kd)によって表すことができる。親和性は、本明細書に記載の方法を含む当該技術分野において既知の一般的な方法によって測定することができる。結合親和性を測定するための具体的な例証的かつ例示的な実施形態を、以下に記載する。
本明細書で使用される場合、「に結合する」、「に特異的に結合する」、または「に特異的な」という用語は、生物学的分子を含む異種分子集団の存在下で標的の存在を決定する標的と抗体との間の結合などの測定可能かつ再現可能な相互作用を指す。例えば、標的(エピトープであり得る)に結合するか、またはそれに特異的に結合する抗体は、それが他の標的に結合するよりも大きな親和性、結合力で、より容易に、及び/またはより長期間、この標的に結合する抗体である。一実施形態において、抗体が無関係の標的に結合する程度は、例えば、放射免疫アッセイ(RIA)によって測定して、抗体の標的への結合の約10%未満である。特定の実施形態において、ある標的に特異的に結合する抗体は、≦1μM、≦100nM、≦10nM、≦1nM、または≦0.1nMの解離定数(Kd)を有する。特定の実施形態において、抗体は、異なる種由来のタンパク質間で保存されているタンパク質上のエピトープに特異的に結合する。別の実施形態において、特異的結合は、排他的結合を含み得るが、それを必要としない。
「親和性成熟」抗体は、そのような改変を所有しない親抗体と比較して、1つ以上の超可変領域(HVR)に1つ以上の改変を有し、そのような改変により抗体の抗原への親和性が改善される抗体を指す。
基準抗体と「同じエピトープに結合する抗体」は、競合アッセイにおいて、基準抗体のその抗原への結合を50%以上遮断する抗体、及び逆に、競合アッセイにおいて、抗体のその抗原への結合を50%以上遮断する基準抗体を指す。
「免疫複合体」は、細胞毒性剤を含むが、これに限定されない1つ以上の異種分子(複数可)に複合される抗体である。
本明細書で使用される場合、「イムノアドヘシン」という用語は、異種タンパク質(「アドヘシン」)の結合特異性と、免疫グロブリン定常ドメインのエフェクター機能とを組み合わせた、抗体様分子を指す。構造的には、イムノアドヘシンは、抗体の抗原認識及び結合部位以外である(すなわち、「異種の」)所望の結合特異性を有するアミノ酸配列と、免疫グロブリン定常ドメイン配列との融合物を含む。イムノアドヘシン分子のアドヘシン部分は典型的に、少なくとも受容体またはリガンドの結合部位を含む連続したアミノ酸配列である。イムノアドヘシン中の免疫グロブリン定常ドメイン配列は、IgG1、IgG2(IgG2A及びIgG2Bを含む)、IgG3、またはIgG4サブタイプ、IgA(IgA1及びIgA2を含む)、IgE、IgD、またはIgMなどの任意の免疫グロブリンから得ることができる。Ig融合物は好ましくは、Ig分子内の少なくとも1つの可変領域の場所に、本明細書に記載のポリペプチドまたは抗体のドメインの置換を含む。特に好ましい一実施形態において、免疫グロブリン融合物は、IgG1分子のヒンジ、CH2、及びCH3、またはヒンジ、CH1、CH2、及びCH3領域を含む。免疫グロブリン融合物の産生に関しては、米国特許第5,428,130号も参照されたい。例えば、本明細書の治療法に有用な医薬品としての有用なイムノアドヘシンとしては、免疫グロブリン配列の定常ドメインに融合された、PD-L1もしくはPD-L2の細胞外ドメイン(ECD)もしくはPD-1結合部分、またはPD-1の細胞外もしくはPD-L1もしくはPD-L2結合部分(それぞれ、PD-L1 ECD-Fc、PD-L2 ECD-Fc、及びPD-1 ECD-Fcなど)を含むポリペプチドが挙げられる。細胞表面受容体のIg FcとECDとのイムノアドヘシンの組み合わせは、可溶性受容体と称されることがある。
「融合タンパク質」及び「融合ポリペプチド」は、一緒に共有結合した2つの部分を有するポリペプチドを指し、これらの部分の各々は、異なる特性を有するポリペプチドである。この特性は、インビトロまたはインビボでの活性などの生物学的特性であり得る。この特性はまた、標的分子への結合、反応の触媒作用などの単純な化学的または物理的特性であり得る。これらの2つの部分は、単一のペプチド結合によって直接的に、またはペプチドリンカーを介して連結され得るが、互いの読み枠内にある。
本明細書で特定されるポリペプチド配列に関する「アミノ酸配列同一性パーセント(%)」は、配列を整列させ、必要に応じてギャップを導入して、最大の配列同一性パーセントを達成した後、かついかなる保存的置換も配列同一性の一部とは見なさずに、候補配列内のアミノ酸残基が、比較されるポリペプチド内のアミノ酸残基と同一であるパーセンテージとして定義される。アミノ酸配列同一性パーセントを決定するための整列は、当該技術分野の範囲内の様々な方法で、例えば、BLAST、BLAST-2、ALIGN、またはMegalign(DNASTAR)ソフトウェアなどの公的に入手可能なコンピュータソフトウェアを使用して達成することができる。当業者であれば、比較される配列の全長にわたって最大の整列を達成するために必要とされる任意のアルゴリズムを含む、整列を測定するための適切なパラメータを決定することができる。しかしながら、本明細書の目的では、アミノ酸配列同一性%値は、配列比較コンピュータプログラムALIGN-2を使用して生成される。ALIGN-2配列比較コンピュータプログラムは、Genentech,Inc.によって記述され、ソースコードは、ユーザ文書と共に米国著作権庁(Washington D.C.,20559)に提出されており、米国著作権番号TXU510087の下に登録されている。ALIGN-2プログラムは、Genentech,Inc.,South San Francisco,Californiaを通して公的に入手可能である。ALIGN-2プログラムは、UNIXオペレーティングシステム、好ましくはデジタルUNIX V4.0Dで使用する場合にはコンパイルすべきである。全ての配列比較パラメータは、ALIGN-2プログラムにより設定されており、変動しない。
ALIGN-2がアミノ酸配列比較に用いられる状況において、所与のアミノ酸配列Bへの、それとの、またはそれに対する、所与のアミノ酸配列Aのアミノ酸配列同一性%(あるいは、所与のアミノ酸配列Bへの、それとの、またはそれに対する特定のアミノ酸配列同一性%を有するか、または含む所与のアミノ酸配列Aと表現され得る)は、以下のように計算され、
100×分数X/Y
式中、Xは、配列整列プログラムALIGN-2によってそのプログラムのAとBとの整列において完全な一致としてスコア化されたアミノ酸残基の数であり、Yは、Bにおけるアミノ酸残基の総数である。アミノ酸配列Aの長さがアミノ酸配列Bの長さと等しくない場合、AのBに対するアミノ酸配列同一性%は、BのAに対するアミノ酸配列同一性%とは等しくないことが理解される。別段具体的に示されない限り、本明細書で使用される全てのアミノ酸配列同一性%値は、直前の段落に記載されるようにALIGN-2コンピュータプログラムを使用して得られる。
「検出」という用語は、直接的及び間接的検出を含む、任意の検出方法を含む。
本明細書で使用される場合、「バイオマーカー」という用語は、試料中で検出され得る指標、例えば、予測指標、診断指標、及び/または予後指標、例えば、特定の遺伝子、もしくは該遺伝子によってコードされたタンパク質、または該特定の遺伝子の1つ以上の体細胞変異を指す。バイオマーカーは、特定の分子的、病理学的、組織学的、及び/または臨床的特徴(例えば、PD-L1軸結合アンタゴニストを含む治療法に対する応答性)を特徴とする疾患または障害(例えば、がん)の特定のサブタイプの指標として機能し得る。いくつかの実施形態において、バイオマーカーは、遺伝子の集合物、または遺伝子の集合物におけるある集合数の変異/改変(例えば、体細胞変異)である。バイオマーカーには、ポリヌクレオチド(例えば、DNA及び/またはRNA)、ポリヌクレオチド改変(例えば、ポリヌクレオチドコピー数の改変(例えば、DNAコピー数の改変)、ポリペプチド、ポリペプチド及びポリヌクレオチド修飾(例えば、翻訳後修飾)、炭水化物、及び/または糖脂質系分子マーカーが挙げられるが、これらに限定されない。
個体への臨床的利益の増加に関連する体細胞変異の「量」または「レベル」は、生物学的試料中で検出可能なレベルである。これらは、当業者にとって既知であり、かつ本明細書にも開示される方法によって測定することができる。評価される体細胞変異の発現レベルまたは量を使用して、治療に対する応答を決定することができる。
「レベル」という用語は、生物学的試料中の体細胞変異の量を指す。
体細胞変異の「増加したレベル」、「増加したレベル(複数)」、または「上昇したレベル」は、疾患もしくは障害(例えば、がん)に罹患していない個体(複数可)または内部対照(例えば、基準遺伝子)などの対照と比較した、個体内の体細胞変異の増加したレベルを指す。いくつかの実施形態において、体細胞変異の増加したレベルは、個体の全ゲノム全体を通して存在する。他の実施形態において、体細胞変異の増加したレベルは、個体から収集された試料(例えば、組織試料)中に存在する。いくつかの実施形態において、個体は、がん(例えば、がん、例えば、肺癌、例えば、非小細胞肺癌(NSCLC))を有する。
体細胞変異の「減少したレベル」、「減少したレベル(複数)」、「低減したレベル」、または「低減したレベル(複数)」は、疾患もしくは障害(例えば、がん)に罹患していない個体(複数可)または内部対照(例えば、基準レベル)などの対照と比較した、個体における体細胞変異のレベルの減少を指す。いくつかの実施形態において、体細胞変異の減少したレベルは、個体の全ゲノム全体を通して存在する。他の実施形態において、体細胞変異の減少したレベルは、個体から収集された試料(例えば、組織試料)中に存在する。いくつかの実施形態において、個体は、がん(例えば、がん、例えば、肺癌、例えば、非小細胞肺癌(NSCLC))を有する。
本明細書で使用される場合、「基準tTMBスコア」という用語は、例えば、診断的、予測的、及び/または治療的決定を行うために、それに対して別のtTMBスコアが比較されるtTMBスコアを指す。例えば、基準tTMBスコアは、基準試料、基準集団、及び/または事前決定された値におけるtTMBスコアであり得る。いくつかの事例では、基準tTMBスコアは、免疫チェックポイント阻害剤(例えば、PD-L1軸結合アンタゴニスト療法)での治療に対する個体の応答性と、カットオフ値以上及び/またはカットオフ値未満の非PD-L1軸結合アンタゴニスト療法での治療に対する個体の応答性との間の有意差に基づいて、ある基準集団内で免疫チェックポイント阻害剤(例えば、PD-L1軸結合アンタゴニスト療法)で治療されている第1のサブセットの個体(例えば、患者)と、同じ基準集団内で免疫チェックポイント阻害剤(例えば、PD-L1軸結合アンタゴニスト)を含まない非PD-L1軸結合アンタゴニスト療法で治療されている第2のサブセットの個体(例えば、患者)とを有意に分離するカットオフ値である。いくつかの事例では、免疫チェックポイント阻害剤(例えば、PD-L1軸結合アンタゴニスト療法)での治療に対する個体の応答性は、カットオフ値以上の非PD-L1軸結合アンタゴニスト療法での治療に対する個体の応答性と比較して、有意に改善している。いくつかの事例では、非PD-L1軸結合アンタゴニスト療法での治療に対する個体の応答性は、カットオフ値未満の免疫チェックポイント阻害剤(例えば、PD-L1軸結合アンタゴニスト療法)での治療に対する個体の応答性と比較して、有意に改善している。
当業者であれば、基準tTMBスコアの数値が、がんの種類(例えば、肺癌(例えば、非小細胞肺癌(NSCLC)もしくは小細胞肺癌)、腎臓癌(例えば、腎臓尿路上皮癌もしくは腎細胞癌(RCC))、膀胱癌(bladder cancer)(例えば、膀胱尿路上皮(移行細胞)癌(例えば、第一選択(1L)もしくは第二選択以上(2L+)の局所進行性もしくは転移性尿路上皮癌を含む、局所進行性もしくは転移性尿路上皮癌))、乳癌(例えば、ヒト上皮増殖因子受容体-2(HER2)+乳癌もしくはホルモン受容体陽性(HR+)乳癌)、結腸直腸癌(例えば、結腸腺癌)、卵巣癌、膵臓癌、胃癌、食道癌、中皮腫、黒色腫(例えば、皮膚黒色腫)、皮膚癌(例えば、皮膚扁平上皮細胞癌)、頭頸部癌(例えば、頭頸部扁平上皮細胞癌(HNSCC))、甲状腺癌、肉腫(例えば、軟部組織肉腫、線維肉腫、粘液肉腫、脂肪肉腫、骨原性肉腫、骨肉腫、軟骨肉腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、平滑筋肉腫、もしくは横紋筋肉腫)、前立腺癌、膠芽腫、子宮頸癌、胸腺癌、白血病(例えば、急性リンパ球性白血病(ALL)、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、慢性好酸球性白血病、もしくは慢性リンパ球性白血病(CLL))、リンパ腫(例えば、ホジキンリンパ腫もしくは非ホジキンリンパ腫(NHL))、骨髄腫(例えば、多発性骨髄腫(MM))、菌状息肉腫、メルケル細胞癌、血液学的悪性腫瘍、血液組織の癌、B細胞癌、気管支癌、胃癌、脳癌もしくは中枢神経系癌、末梢神経系癌、子宮癌もしくは子宮内膜癌、口腔癌もしくは咽頭癌、肝臓癌、精巣癌、胆道癌、小腸癌もしくは虫垂癌、唾液腺癌、副腎癌、腺癌、炎症性筋線維芽細胞性腫瘍、消化管間質腫瘍(GIST)、結腸癌、骨髄異形成症候群(MDS)、骨髄増殖性疾患(MPD)、真性赤血球増加症、脊索腫、滑膜腫、ユーイング腫瘍、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭状腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌(hepatoma)、胆管癌、絨毛癌、精上皮腫、胎児性癌、ウィルムス腫瘍、膀胱癌(bladder carcinoma)、上皮癌、神経膠腫、星細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞腫、聴神経腫瘍、乏突起神経膠腫、髄膜腫、神経芽腫、網膜芽細胞腫、濾胞性リンパ腫、びまん性大細胞型B細胞リンパ腫、マントル細胞リンパ腫、肝細胞癌(hepatocellular carcinoma)、甲状腺癌、小細胞癌、本態性血小板血症、原発性骨髄線維症、好酸球増加症候群、全身性肥満細胞症、家族性過好酸球増加症、神経内分泌癌、またはカルチノイド腫瘍、tTMBスコアを測定するために使用される方法論、及び/またはtTMBスコアを生成するために使用される統計方法に依存し得ることを理解するだろう。
「等価TMB値」という用語は、体細胞バリアント(例えば、体細胞変異)の計数を配列決定された塩基数(例えば、FOUNDATIONONE(登録商標)パネルによって評価して、例えば、約1.1Mb(例えば、約1.125Mb))で除することによって計算することができるtTMBスコアに対応する数値を指す。一般に、tTMBスコアは、配列決定されるゲノム領域のサイズに線形的に関連していることが理解される。そのような等価tTMB値は、tTMBスコアと比較した腫瘍変異負荷の等価の程度を示し、例えば、免疫チェックポイント阻害剤(例えば、抗PD-L1抗体、例えば、アテゾリズマブ)に対するがん患者の応答を予測するために、本明細書に記載の方法において互換的に使用され得る。一例として、いくつかの実施形態において、等価tTMB値は、体細胞バリアント(例えば、体細胞変異)の計数を配列決定された塩基数で除することによって計算することができる正規化されたtTMB値である。例えば、等価tTMB値は、定義された数の配列決定された塩基(例えば、FOUNDATIONONE(登録商標)パネルによって評価して、例えば、約1.1Mb(例えば、約1.125Mb))にわたって計数された体細胞変異数として表すことができる。例えば、(約1.1Mbにわたって計数された体細胞変異数として決定して)約25のtTMBスコアは、約23個の変異/Mbの等価tTMB値に対応する。本明細書に記載のtTMBスコア(例えば、定義された数の配列決定された塩基(例えば、FOUNDATIONONE(登録商標)パネルによって評価して、例えば、約1.1Mb(例えば、約1.125Mb)にわたって計数された体細胞変異数として表されるTMBスコア)は、異なる方法論(例えば、全エクソーム配列決定または全ゲノム配列決定)を使用して得られる等価tTMB値を包含することが理解される。一例として、全エクソームパネルについて、標的領域は、約50Mbであり得、約500個の体細胞変異が検出される試料は、10個の変異/MbのtTMBスコアに等価のtTMB値である。いくつかの実施形態において、ゲノムまたはエクソーム(例えば、事前決定された遺伝子組)のサブセットにおける定義された数の配列決定された塩基(例えば、FOUNDATIONONE(登録商標)パネルによって評価して、例えば、約1.1Mb(例えば、約1.125Mb))にわたって計数された体細胞変異数として決定されるtTMBスコアは、全エクソーム配列決定によって決定されるtTMBスコアから約30%未満(例えば、約30%、約25%、約20%、約15%、約10%、約5%、約4%、約3%、約2%、約1%未満、またはそれ未満)だけ逸脱する。例えば、Chalmers et al.Genome Medicine9:34,2017を参照されたい。
「発現のレベル」または「発現レベル」という用語は一般に互換的に使用され、一般に生物学的試料中のバイオマーカーの量を指す。「発現」は一般に、これにより情報(例えば、遺伝子コード情報及び/またはエピジェネティック情報)が、細胞内に存在し、機能する構造に変換されるプロセスを指す。したがって、本明細書で使用される場合、「発現」は、ポリヌクレオチドへの転写、ポリペプチドへの翻訳、または更にポリヌクレオチド及び/またはポリペプチド修飾(例えば、ポリペプチドの翻訳後修飾)を指し得る。転写されたポリヌクレオチド、翻訳されたポリペプチド、またはポリヌクレオチド及び/またはポリペプチド修飾(例えば、ポリペプチドの翻訳後修飾)の断片もまた、それらが選択的スプライシングによって生成された転写物もしくは分解された転写物に由来するか、または例えば、タンパク質分解によるポリペプチドの翻訳後プロセシングに由来するかに関わらず、発現されたものと見なされるべきである。「発現した遺伝子」は、mRNAとしてポリヌクレオチドに転写され、その後、ポリペプチドに翻訳されるもの、及びまたRNAに転写されるが、ポリペプチドには翻訳されないもの(例えば、転移及びリボソームRNA)を含む。
「増加した発現」、「増加した発現レベル」、「増加したレベル」、「上昇した発現」、「上昇した発現レベル」、または「上昇したレベル」は、疾患もしくは障害(例えば、がん)に罹患していない個体(複数可)または内部対照(例えば、ハウスキーピングバイオマーカー)などの対照と比較した、個体におけるバイオマーカーの増加した発現またはその増加したレベルを指す。
「減少した発現」、「減少した発現レベル」、「減少したレベル」、「低減した発現」、「低減した発現レベル」、または「低減したレベル」は、疾患もしくは障害(例えば、がん)に罹患していない個体(複数可)または内部対照(例えば、ハウスキーピングバイオマーカー)などの対照と比較した、個体におけるバイオマーカーの低減した発現または低減したレベルを指す。
本明細書で使用される場合、「増幅」は一般に、所望の配列の複数のコピーを産出するプロセスを指す。「複数のコピー」は、少なくとも2つのコピーを意味する。「コピー」は、鋳型配列に対する完全な配列相補性または同一性を必ずしも意味しない。例えば、コピーは、デオキシイノシンなどのヌクレオチド類似体、意図的な配列改変(鋳型にハイブリダイズ可能であるが相補的ではない配列を含むプライマーを通して導入される配列改変など)、及び/または増幅中に生じる配列誤差を含み得る。
「多重PCR」という用語は、単一の反応で2つ以上のDNA配列を増幅する目的で、2つ以上のプライマーセットを使用して単一の供給源(例えば、個体)から得られた核酸上で実行される単一のPCR反応を指す。
本明細書で使用される場合、「ポリメラーゼ連鎖反応」または「PCR」の技術は一般に、核酸、RNA、及び/またはDNAの微量の特定の小片が、例えば、米国特許第4,683,195号に記載されるように増幅される手順を指す。一般に、オリゴヌクレオチドプライマーが設計され得るように、対象となる領域の末端またはそれ以降からの配列情報が利用可能である必要があり、これらのプライマーの配列は、増幅される鋳型の反対側の鎖と同一であるか、または類似している。これらの2つのプライマーの5’末端ヌクレオチドは、増幅される材料の末端と一致し得る。PCRを使用して、特定のRNA配列、全ゲノムDNAに由来する特定のDNA配列、及び全細胞RNAから転写されたcDNA、バクテリオファージ、またはプラスミド配列などを増幅することができる。一般に、Mullis et al.,Cold Spring Harbor Symp.Quant.Biol.51:263(1987)及びErlich,ed.,PCR Technology,(Stockton Press,NY,1989)を参照されたい。本明細書で使用される場合、PCRは、プライマーとしての既知の核酸(DNAまたはRNA)の使用を含む、核酸試験試料を増幅するための核酸ポリメラーゼ反応法の一例であると見なされるが、その唯一の例ではなく、核酸の特定の小片を増幅もしくは生成するために、または特定の核酸に相補的な核酸の特定の小片を増幅もしくは生成するために、核酸ポリメラーゼを利用する。
「定量的リアルタイムポリメラーゼ連鎖反応」または「qRT-PCR」は、PCR産物の量がPCR反応の各ステップで測定されるPCRの形態を指す。この技術は、例えば、Cronin et al.,Am.J.Pathol.164(1):35-42(2004)及びMa et al.,Cancer Cell5:607-616(2004)を含む様々な出版物において記載されている。
「マイクロアレイ」という用語は、基質上のハイブリダイズ可能なアレイ要素、好ましくはポリヌクレオチドプローブの規則的な配置を指す。
「診断」という用語は、分子的または病理学的状態、疾患、または病態(例えば、がん)の特定または分類を指すように、本明細書で使用される。例えば、「診断」は、特定の種類のがんの特定を指し得る。「診断」はまた、例えば、病理組織的基準による、または分子特徴による特定のサブタイプのがんの分類も指し得る(例えば、バイオマーカーのうちの1つまたはその組み合わせの発現を特徴とするサブタイプ(例えば、特定の遺伝子、または該遺伝子によってコードされるタンパク質))。
「診断を支援する」という用語は、疾患または障害(例えば、がん)の特定の種類の症状または病態の存在または性質に関して臨床的決定を行う助けとなる方法を指すように、本明細書で使用される。例えば、疾患または病態(例えば、がん)の診断を支援する方法は、個体由来の生物学的試料中の特定の体細胞変異を測定することを含み得る。
本明細書で使用される場合、「試料」という用語は、例えば、物理的、生化学的、化学的、及び/または生理学的特徴に基づいて、特性評価及び/または特定される細胞及び/または他の分子実体を含有する、対象となる対象及び/または個体から得られるか、またはそれに由来する組成物を指す。例えば、「疾患試料」という語句及びその変化形は、特性評価される細胞及び/または分子実体を含有することが期待されるか、またはそれを含有することが既知である、対象となる対象から得られる任意の試料を指す。試料には、組織試料、初代または培養細胞または細胞株、細胞上清、細胞溶解物、血小板、血清、血漿、硝子体液、リンパ液、滑液、卵胞液、精液、羊水、乳、全血、血液由来の細胞、尿、脳脊髄液、唾液、痰、涙、汗、粘液、腫瘍溶解物、及び組織培養培地、組織抽出物(均質化組織、腫瘍組織、細胞抽出物など)、ならびにそれらの組み合わせが挙げられるが、これらに限定されない。
「組織試料」または「細胞試料」は、対象または個体の組織から得られる類似した細胞の集合物を意味する。組織または細胞試料の供給源は、新鮮な、凍結された、及び/または保存された器官、組織試料、生検、及び/または吸引液からなどの固形組織;血液または任意の血液構成物(血漿など);脳脊髄液、羊水、腹水、または間質液などの体液;対象の妊娠または発育における任意の時期の細胞であってもよい。組織試料はまた、初代または培養細胞または細胞株であってもよい。任意で、組織または細胞試料は、疾患組織/器官から得られる。例えば、「腫瘍試料」は、腫瘍または他のがん性組織から得られる組織試料である。組織試料は、混合した細胞型(例えば、腫瘍細胞及び非腫瘍細胞、がん性細胞及び非がん性細胞)の集団を含有し得る。組織試料は、保存剤、抗凝固剤、緩衝液、固定剤、栄養剤、または抗生物質などの天然の組織と天然では混合しない化合物を含有し得る。いくつかの事例では、組織試料または腫瘍組織試料は、血液試料または試料または血液構成物(血漿など)ではない。
本明細書で使用される場合、「腫瘍細胞」は、腫瘍またはその試料中に存在する任意の腫瘍細胞を指す。腫瘍細胞は、当該技術分野で既知である方法及び/または本明細書に記載の方法を使用して、腫瘍試料中に存在し得る他の細胞(例えば、間質細胞及び腫瘍浸潤性免疫細胞)と区別され得る。
本明細書で使用される場合、「基準試料」、「基準細胞」、「基準組織」、「対照試料」、「対照細胞」、または「対照組織」は、比較目的で使用される試料、細胞、組織、標準物、またはレベルを指す。一実施形態において、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、同じ対象または個体の身体の健常及び/または非罹患部分(例えば、組織または細胞)から得られる。例えば、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、罹患細胞または組織に隣接する健常及び/または非罹患細胞または組織(例えば、腫瘍に隣接する細胞または組織)であり得る。別の実施形態において、基準試料は、同じ対象または個体の身体の未治療の組織及び/または細胞から得られる。また別の実施形態において、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、対象または個体ではない個体の身体の健常及び/または非罹患部分(例えば、組織または細胞)から得られる。更に別の実施形態において、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、対象または個体ではない個体の身体の未治療の組織及び/または細胞から得られる。
本明細書の目的では、組織試料の「切片」は、組織試料の単一の部分または小片、例えば、組織試料(例えば、腫瘍試料)から切り取られた組織または細胞の薄切片を意味する。組織試料の複数の切片を採取し、分析に供することができることが理解されるが、但し、組織試料の同じ切片を、形態学的レベル及び分子レベルの両方で分析することができ、またはポリペプチド(例えば、免疫組織化学によって)及び/またはポリヌクレオチド(例えば、in situハイブリダイゼーションによって)に関して分析することができることが理解されることを条件とする。
「相関する」または「相関すること」は、任意の方法で、第1の分析またはプロトコルの性能及び/または結果を第2の分析またはプロトコルの性能及び/または結果と比較することを意味する。例えば、第2のプロトコルを実行する上で第1の分析もしくはプロトコルの結果を使用してもよく、及び/または第1の分析もしくはプロトコルの結果を使用して、第2の分析もしくはプロトコルが実行されるべきかを決定してもよい。ポリペプチド分析またはプロトコルの実施形態に関して、ポリペプチド発現分析またはプロトコルの結果を使用して、特定の治療レジメンが実行されるべきかを決定してもよい。ポリヌクレオチド分析またはプロトコルの実施形態に関して、ポリヌクレオチド発現分析またはプロトコルの結果を使用して、特定の治療レジメンが実行されるべきかを決定してもよい。
「個体応答」または「応答」は、(1)減速もしくは完全抑止を含む、疾患進行(例えば、がんの進行)のある程度の阻害、(2)腫瘍サイズの低減、(3)隣接する末梢器官及び/または組織へのがん細胞浸潤の阻害(すなわち、低減、減速、もしくは完全停止)、(4)転移の阻害(すなわち、低減、減速、もしくは完全停止)、(5)疾患もしくは障害(例えば、がん)に関連する1つ以上の症状のある程度の緩和、(6)全生存期間及び無増悪生存期間を含む生存期間の増加もしくは延長、及び/または(7)治療後の所与の時点での死亡率の減少を含むが、これらに限定されない、個体に対する利益を示す任意のエンドポイントを使用して、評価することができる。
ある医薬品での治療に対する患者の「有効な応答」または患者の「応答性」及び類似の単語は、がんなどの疾患もしくは障害のリスクにあるか、またはそれに罹患している患者に付与される臨床的または治療的利益を指す。一実施形態において、そのような利益は、生存期間の延長(全生存期間及び/または無増悪生存期間を含む)、客観的奏効(完全奏効もしくは部分奏効を含む)をもたらすこと、またはがんの兆候もしくは症状の改善のうちのいずれか1つ以上を含む。一実施形態において、例えば、本明細書に開示される方法を使用して決定される、腫瘍細胞内の体細胞変異のレベル(例えば、腫瘍変異負荷(TMB))を使用して、同じレベルの体細胞変異を有しない患者と比較して、医薬品での治療(例えば、PD-L1軸結合アンタゴニスト、例えば、抗PD-L1抗体を含む治療)に応答性である可能性が増加していると予測される患者を特定する。一実施形態において、例えば、本明細書に開示される方法を使用して決定される、腫瘍細胞内の体細胞変異の増加したレベルを使用して、体細胞変異の増加したレベルを有しない患者と比較して、医薬品での治療(例えば、抗PD-L1抗体)に応答性である可能性が増加していると予測される患者を特定する。別の実施形態において、バイオマーカー(例えば、例えば、IHCを使用して決定されるPD-L1発現)を使用して、そのバイオマーカーを発現しない患者と比較して、医薬品での治療(例えば、PD-L1軸結合アンタゴニスト、例えば、抗PD-L1抗体を含む治療)に応答性である可能性が増加していると予測される患者を特定する。一実施形態において、バイオマーカー(例えば、IHCを使用して決定される、例えば、PD-L1発現)を使用して、そのバイオマーカーを同じレベルで発現しない患者と比較して、医薬品(例えば、抗PD-L1抗体)での治療に応答性である可能性が増加していると予測される患者を特定する。一実施形態において、バイオマーカーの存在を使用して、そのバイオマーカーの存在を有しない患者と比較して、医薬品による治療に応答する可能性がより高い患者を特定する。別の実施形態において、バイオマーカーの存在を使用して、患者が、そのバイオマーカーの存在を有しない患者と比較して、医薬品での治療から利益を受ける可能性が増加していると決定する。
「客観的奏効」は、完全奏効(CR)または部分奏効(PR)を含む測定可能な応答を指す。いくつかの実施形態において、「客観的奏効率(ORR)」は、完全奏効(CR)率及び部分奏効(PR)率の合計を指す。
「完全奏効」または「CR」は、治療に応答したがんの全ての兆候の消滅(例えば、全ての標的病変の消滅)を意図する。これは、必ずしもがんが治癒したことを意味しない。
「持続的応答」は、治療の休止後の腫瘍成長の低減に対する持続的効果を指す。例えば、腫瘍サイズは、医薬品の投与期の開始時のサイズと比較して、同じサイズであっても、より小さくてもよい。いくつかの実施形態において、持続的応答は、治療期間と少なくとも同じか、治療期間の少なくとも1.5倍、2.0倍、2.5倍、もしくは3.0倍か、またはそれ以上の期間を有する。
本明細書で使用される場合、「がんの再発を低減または阻害すること」は、腫瘍もしくはがんの再発、または腫瘍もしくはがんの進行を低減または阻害することを意味する。本明細書に開示される場合、がんの再発及び/またはがんの進行には、がんの転移が含まれるが、これに限定されない。
本明細書で使用される場合、「部分奏効」または「PR」は、治療に応答した、1つ以上の腫瘍もしくは病変のサイズまたは体内のがんの程度の減少を指す。例えば、いくつかの実施形態において、PRは、ベースラインSLDを基準として、標的病変の最長径和(SLD)の少なくとも30%の減少を指す。
本明細書で使用される場合、「安定した疾患」または「SD」は、治療開始以来の最小SLDを基準として、PRと言えるほどの標的病変の十分な収縮も、PDと言えるほどの十分な増加もないことを指す。
本明細書で使用される場合、「進行性疾患」または「PD」は、治療開始以来記録された最小SLD、または1つ以上の新たな病変の存在を基準として、標的病変のSLDの少なくとも20%の増加を指す。
「生存期間」という用語は、患者が生存していることを指し、全生存期間及び無増悪生存期間を含む。
本明細書で使用される場合、「無増悪生存期間」または「PFS」は、その間に治療されている疾患(例えば、がん)が悪化しない、治療中及び治療後の時間の長さを指す。無増悪生存期間は、患者が完全奏効または部分奏効を経験した時間量、ならびに患者が安定した疾患を経験した時間量を含み得る。
本明細書で使用される場合、「全生存期間」または「OS」は、特定の期間後に生存する可能性が高い群における個体のパーセンテージを指す。
「生存期間の延長」は、未治療の患者と比較して(すなわち、医薬品で治療されていない患者と比較して)、または指定のレベルで体細胞変異を有しない患者と比較して、及び/または抗腫瘍剤で治療した患者と比較して、治療した患者において全生存期間または無増悪生存期間が増加することを意味する。
本明細書で使用される場合、「実質的に同じ」という用語は、当業者が、2つの値の間の差異を、該値(例えば、Kd値または変異レベル)によって測定される生物学的特徴の文脈において、生物学的有意性及び/または統計学的有意性がほとんどまたは全くないと見なすような、2つの数値間の十分に程度の高い類似性を意味する。該2つの値の間の差異は、基準/比較値の関数として、例えば、約50%未満、約40%未満、約30%未満、約20%未満、及び/または約10%未満である。
「実質的に異なる」という語句は、本明細書で使用される場合、当業者が、2つの値の間にある差異を、該値(例えば、Kd値または変異レベル)によって測定される生物学的特徴の文脈において、統計学的有意性があると見なすような、2つの数値間の十分に程度の高い差異を意味する。該2つの値の間の差異は、基準/比較分子の値の関数として、例えば、約10%超、約20%超、約30%超、約40%超、及び/または約50%超である。
本明細書で使用される場合、「標識」という単語は、ポリヌクレオチドプローブなどの試薬または抗体に直接的または間接的に複合または融合され、それが複合または融合する試薬の検出を促進する化合物または組成物を指す。標識は、それ自体が検出可能(例えば、放射性同位体標識または蛍光標識)であっても、または酵素標識の場合、検出可能である基質化合物もしくは組成物の化学改変を触媒してもよい。この用語は、検出可能な物質をプローブまたは抗体に共役すること(すなわち、物理的に連結すること)によるプローブまたは抗体の直接的な標識、及び直接的に標識される別の試薬との反応性によるプローブまたは抗体の間接的な標識を包含することが意図される。間接的な標識の例には、蛍光標識された二次抗体を使用する一次抗体の検出、及び蛍光標識されたストレプトアビジンで検出され得るようなビオチンを用いたDNAプローブの末端標識が含まれる。
「治療有効量」は、哺乳動物において疾患または障害を治療または予防するための治療剤の量を指す。がんの場合、治療有効量の治療剤は、がん細胞の数を低減、原発腫瘍サイズを低減、末梢器官へのがん細胞浸潤を阻害(すなわち、ある程度の減速及び好ましくは停止)、腫瘍転移を阻害(すなわち、ある程度の減速及び好ましくは停止)、腫瘍成長をある程度阻害、及び/または障害に関連する症状のうちの1つ以上をある程度緩和し得る。薬物が既存のがん細胞の成長の予防及び/またはそれらの殺滅を行うことができる限り、この薬物は細胞増殖抑制性及び/または細胞毒性であり得る。がん療法に関して、インビボでの有効性は、例えば、生存期間、疾患進行までの期間(TTP)、奏効率(例えば、CR及びPR)、奏効期間、及び/または生活の質を評価することにより測定することができる。
「障害」は、哺乳動物を問題の疾患に罹患しやすくする病理学的状態を含む慢性及び急性の障害または疾患を含むが、これらに限定されない、治療から利益を受ける任意の病態である。
「がん」及び「がん性」という用語は、典型的に未制御の細胞成長を特徴とする哺乳動物における生理学的病態を指すか、または説明する。この定義には、良性がん及び悪性がんが含まれる。「早期がん」または「早期腫瘍」は、浸潤性もしくは転移性ではないか、または病期0、1、もしくは2のがんとして分類されるがんを意味する。がんの例としては、がん腫、リンパ腫、芽細胞腫(髄芽細胞腫及び網膜芽細胞腫を含む)、肉腫(脂肪肉腫及び滑膜細胞肉腫を含む)、神経内分泌腫瘍(カルチノイド腫瘍、ガストリン産生腫瘍、及び島細胞癌を含む)、中皮腫、シュワン細胞腫(聴神経腫瘍を含む)、髄膜腫、腺癌、黒色腫、ならびに白血病またはリンパ系腫瘍が挙げられるが、これらに限定されない。がんの例としては、肺癌(例えば、非小細胞肺癌(NSCLC))、腎臓癌(例えば、腎臓尿路上皮癌もしくはRCC)、膀胱癌(例えば、膀胱尿路上皮(移行細胞)癌(例えば、1Lもしくは2L+の局所進行性もしくは転移性尿路上皮癌を含む、局所進行性もしくは転移性尿路上皮癌)、乳癌、結腸直腸癌(例えば、結腸腺癌)、卵巣癌、膵臓癌、胃癌、食道癌、中皮腫、黒色腫(例えば、皮膚黒色腫)、頭頸部癌(例えば、頭頸部扁平上皮細胞癌(HNSCC))、甲状腺癌、肉腫(例えば、軟部組織肉腫、線維肉腫、粘液肉腫、脂肪肉腫、骨原性肉腫、骨肉腫、軟骨肉腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、平滑筋肉腫、もしくは横紋筋肉腫)、前立腺癌、膠芽腫、子宮頸癌、胸腺癌、白血病(例えば、急性リンパ球性白血病(ALL)、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、慢性好酸球性白血病、もしくは慢性リンパ球性白血病(CLL))、リンパ腫(例えば、ホジキンリンパ腫もしくは非ホジキンリンパ腫(NHL))、骨髄腫(例えば、多発性骨髄腫(MM))、菌状息肉腫、メルケル細胞癌、血液学的悪性腫瘍、血液組織の癌、B細胞癌、気管支癌、胃癌、脳癌もしくは中枢神経系癌、末梢神経系癌、子宮癌もしくは子宮内膜癌、口腔癌もしくは咽頭癌、肝臓癌、精巣癌、胆道癌、小腸癌もしくは虫垂癌、唾液腺癌、副腎癌、腺癌、炎症性筋線維芽細胞性腫瘍、消化管間質腫瘍(GIST)、結腸癌、骨髄異形成症候群(MDS)、骨髄増殖性疾患(MPD)、真性赤血球増加症、脊索腫、滑膜腫、ユーイング腫瘍、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭状腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌(hepatoma)、胆管癌、絨毛癌、精上皮腫、胎児性癌、ウィルムス腫瘍、膀胱癌(bladder carcinoma)、上皮癌、神経膠腫、星細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞腫、聴神経腫瘍、乏突起神経膠腫、髄膜腫、神経芽腫、網膜芽細胞腫、濾胞性リンパ腫、びまん性大細胞型B細胞リンパ腫、マントル細胞リンパ腫、肝細胞癌(hepatocellular carcinoma)、甲状腺癌、小細胞癌、本態性血小板血症、原発性骨髄線維症、好酸球増加症候群、全身性肥満細胞症、家族性過好酸球増加症、神経内分泌癌、またはカルチノイド腫瘍もまた挙げられるが、これらに限定されない。そのようながんのより具体的な例としては、肺癌(NSCLCを含む)、扁平上皮細胞癌(例えば、上皮扁平上皮細胞癌)、肺癌(小細胞肺癌(SCLC)を含む)、ならびに肺の腺癌及び肺の扁平上皮癌が挙げられる。具体的な例では、肺癌は、NSCLC、例えば、局所進行性または転移性NSCLC(例えば、病期IIIBのNSCLC、病期IVのNSCLC、または再発性NSCLC)である。いくつかの実施形態において、肺癌(例えば、NSCLC)は、切除不能/手術不能な肺癌(例えば、切除不能なNSCLC)である。他の例としては、腹膜の癌、肝細胞癌、膀胱癌(例えば、尿路上皮膀胱癌(例えば、移行細胞癌または尿路上皮癌、筋層非浸潤性膀胱癌、筋層浸潤性膀胱癌、及び転移性膀胱癌)及び非尿路上皮膀胱癌)、胃癌(gastric cancer)または胃癌(stomach cancer)(消化管癌を含む)、膵臓癌、膠芽腫、子宮頸癌、卵巣癌、肝臓癌、肝細胞癌、乳癌(転移性乳癌を含む)、結腸癌、直腸癌、結腸直腸癌、子宮内膜癌または子宮癌、唾液腺癌、腎臓癌(kidney cancer)または腎臓癌(renal cancer)、前立腺癌、外陰部癌、甲状腺癌、肝癌、肛門癌、陰茎癌、メルケル細胞癌、菌状息肉腫、精巣癌、食道癌、胆管の腫瘍、ならびに頭頸部癌及び血液学的悪性腫瘍が挙げられる。いくつかの実施形態において、がんは、局所的な再発性または転移性疾患(局所的な再発性疾患が治癒目的で切除を受けられない場合)を有する、任意で組織学的に確認された、三種陰性(ER-、PR-、HER2-)乳腺癌を含む、三種陰性転移性乳癌である。
本明細書で使用される場合、「腫瘍」という用語は、悪性であるか良性であるかに関わらず、全ての新生物細胞の成長及び増殖、ならびに全ての前がん性及びがん性の細胞及び組織を指す。「がん」、「がん性」、及び「腫瘍」という用語は、本明細書で言及されるように相互排他的ではない。
「薬学的製剤」という用語は、その中に含有される活性成分の生物学的活性が有効となるような形態にあり、かつ製剤が投与される対象にとって許容できない毒性を有する追加の構成成分を含有しない、調製物を指す。
「薬学的に許容される担体」は、対象にとって無毒である、活性成分以外の薬学的製剤中の成分を指す。薬学的に許容される担体には、緩衝液、賦形剤、安定剤、または保存剤が含まれるが、これらに限定されない。
本明細書で使用される場合、「治療」(及び「治療する」または「治療すること」などのその文法上の変化形)は、治療されている個体の自然経過を改変することを目的とした臨床介入を指し、予防のために、または臨床病理過程中に実行され得る。治療の所望の効果としては、疾患の発生または再発の予防、症状の緩和、疾患の任意の直接的または間接的病理学的帰結の縮小、転移の予防、疾患進行速度の減少、病状の寛解または緩和、及び緩解または予後の改善が挙げられるが、これらに限定されない。いくつかの実施形態において、抗体(例えば、抗PD-L1抗体及び/または抗PD-1抗体)を使用して、疾患の発症を遅らせるか、または疾患進行を減速させる。
「抗がん療法」という用語は、がんを治療する上で有用な治療法を指す。抗がん治療剤の例としては、細胞毒性剤、化学療法剤、成長阻害剤、放射線療法に使用される薬剤、抗血管新生剤、アポトーシス剤、抗チューブリン剤、及びがんを治療するための他の薬剤、例えば、抗CD20抗体、血小板由来成長因子阻害剤(例えば、GLEEVEC(商標)(メシル酸イマチニブ))、COX-2阻害剤(例えば、セレコキシブ)、インターフェロン、サイトカイン、以下の標的、PDGFR-β、BlyS、APRIL、BCMA受容体(複数可)、TRAIL/Apo2のうちの1つ以上に結合するアンタゴニスト(例えば、中和抗体)、ならびに他の生物活性剤及び有機化学剤などが挙げられるが、これらに限定されない。それらの組み合わせもまた、本発明に含まれる。
本明細書で使用される場合、「細胞毒性剤」という用語は、細胞の機能を阻害もしくは防止する物質、及び/または細胞の破壊を引き起こす物質を指す。この用語は、放射性同位体(例えば、At211、I131、I125、Y90、Re186、Re188、Sm153、Bi212、P32、及びLuの放射性同位体)、化学療法剤、例えば、メトトレキサート、アドリアミシン、ビンカアルカロイド(ビンクリスチン、ビンブラスチン、エトポシド)、ドキソルビシン、メルファラン、ミトマイシンC、クロラムブシル、ダウノルビシン、もしくは他の挿入剤、酵素及びそれらの断片(核酸分解酵素など)、抗生物質、及び細菌、真菌、植物、または動物起源の小分子毒素または酵素的に活性な毒素などの毒素(それらの断片及び/またはバリアントを含む)、ならびに以下に開示される様々な抗腫瘍剤または抗がん剤を含むことが意図される。他の細胞毒性剤を、以下に記載する。殺腫瘍剤は、腫瘍細胞の破壊を引き起こす。
「化学療法剤」は、がんの治療に有用な化学化合物である。化学療法剤の例には、チオテパ及びCYTOXAN(登録商標)シクロスホスファミドなどのアルキル化剤;ブスルファン、インプロスルファン、及びピポスルファンなどのアルキルスルホネート;ベンゾドパ、カルボコン、メツレドパ、及びウレドパなどのアジリジン;アルトレタミン、トリエチレンメラミン、トリエチレンホスホルアミド、トリエチレンチオホスホルアミド、及びトリメチロロメラミン(trimethylolomelamine)を含むエチレンイミン及びメチルアメラミン;アセトゲニン(特にブラタシン及びブラタシノン);デルタ-9-テトラヒドロカンナビノール(ドロナビノール、MARINOL(登録商標));ベータ-ラパコン;ラパコール;コルヒチン;ベツリン酸;カンプトテシン(合成類似体トポテカン(HYCAMTIN(登録商標))、CPT-11(イリノテカン、CAMPTOSAR(登録商標))、アセチルカンプトテシン、スコポレクチン、及び9-アミノカンプトテシンを含む);ブリオスタチン;カリスタチン;CC-1065(そのアドゼレシン、カルゼレシン、及びビゼレシン合成類似体を含む);ポドフィロトキシン;ポドフィリン酸;テニポシド;クリプトフィシン(特にクリプトフィシン1及びクリプトフィシン8);ドラスタチン;デュオカルマイシン(合成類似体、KW-2189及びCB1-TM1を含む);エリュテロビン;パンクラチスタチン;サルコジクチイン;スポンジスタチン;クロラムブシル、クロルナファジン、コロホスファミド、エストラムスチン、イホスファミド、メクロレタミン、メクロレタミンオキシド塩酸塩、メルファラン、ノベムビシン、フェネステリン、プレドニムスチン、トロホスファミド、ウラシルマスタードなどの窒素マスタード;カルムスチン、クロロゾトシン、ホテムスチン、ロムスチン、ニムスチン、及びラニムヌスチンなどのニトロソ尿素;エンジイン抗生物質(例えば、カリケアミシン、特にカリケアミシンγ1I及びカリケアミシンω1I(例えば、Nicolaou et al.,.Angew.Chem Intl.Ed.Engl.,33:183-186(1994)を参照されたい)などの抗生物質;ダイネミシンAを含むダイネミシン;エスペラミシン;ならびにネオカルジノスタチン発色団及び関連色素タンパク質エンジイン抗生物質発色団、アクラノマイシン、アクチノマイシン、アントラマイシン、アザセリン、ブレオマイシン、カクチノマイシン、カラビシン、カルミノマイシン、カルジノフィリン、クロモマイシン、ダクチノマイシン、ダウノルビシン、デトルビシン、6-ジアゾ-5-オキソ-L-ノルロイシン、ADRIAMYCIN(登録商標)ドキソルビシン(モルフォリノ-ドキソルビシン、シアノモルフォリノ-ドキソルビシン、2-ピロリノ-ドキソルビシン、及びデオキシドキソルビシンを含む)、エピルビシン、エソルビシン、イダルビシン、マルセロマイシン、マイトマイシン(マイトマイシンCなど)、ミコフェノール酸、ノガラマイシン、オリボマイシン、ペプロマイシン、ポトフィロマイシン、ピューロマイシン、ケラマイシン、ロドルビシン、ストレプトニグリン、ストレプトゾシン、ツベルシジン、ウベニメクス、ジノスタチン、ゾルビシン;メトトレキサート及び5-フルオロウラシル(5-FU)などの抗代謝剤;デノプテリン、メトトレキサート、プテロプテリン、トリメトレキサートなどの葉酸類似体;フルダラビン、6-メルカプトプリン、チアミプリン、チオグアニンなどのプリン類似体;アンシタビン、アザシチジン、6-アザウリジン、カルモフール、シタラビン、ジデオキシウリジン、ドキシフルリジン、エノシタビン、フロクスウリジンなどのピリミジン類似体;カルステロン、プロピオン酸ドロモスタノロン、エピチオスタノール、メピチオスタン、テストラクトンなどのアンドロゲン;アミノグルテチミド、ミトタン、トリロスタンなどの抗副腎剤;フォリン酸などの葉酸補充剤;アセグラトン;アルドホスファミドグリコシド;アミノレブリン酸;エニルウラシル;アムサクリン;ベストラブシル;ビスアントレン;エダトラキセート;デフォファミン;デメコルチン;ジアジクオン;エルフォルニチン;酢酸エリプチニウム;エポチロン;エトグルシド;硝酸ガリウム;ヒドロキシ尿素;レンチナン;ロニダイニン;マイタンシン及びアンサマイトシンなどのマイタンシノイド;ミトグアゾン;ミトキサントロン;モピダンモール;ニトラエリン;ペントスタチン;フェナメット;ピラルビシン;ロソキサントロン;2-エチルヒドラジド;プロカルバジン;PSK(登録商標)多糖類複合体(JHS Natural Products,Eugene,OR);ラゾキサン;リゾキシン;シゾフィラン;スピロゲルマニウム;テヌアゾン酸;トリアジクオン;2,2’,2”-トリクロロトリエチルアミン;トリコテセン(特に、T-2毒素、ベラクリンA、ロリジンA、及びアングイジン);ウレタン;ビンデシン(ELDISINE(登録商標)、FILDESIN(登録商標));ダカルバジン;マンノムスチン;ミトブロニトール;ミトラクトール;ピポブロマン;ガシトシン;アラビノシド(「Ara-C」);チオテパ;タキソイド、例えば、TAXOL(登録商標)パクリタキセル(Bristol-Myers Squibb Oncology,Princeton,N.J.)、ABRAXANE(商標) Cremophorを含まないアルブミン操作されたパクリタキセルのナノ粒子製剤(American Pharmaceutical Partners,Schaumberg,Illinois)、及びTAXOTERE(登録商標)ドセタキセル(Rhone-Poulenc Rorer,Antony,France)を含むタキサン;クロランブシル;ゲムシタビン(GEMZAR(登録商標));6-チオグアニン;メルカプトプリン;メトトレキサート;白金もしくは白金系化学療法剤及び白金類似体(シスプラチン、カルボプラチン、オキサリプラチン(ELOXATIN(商標))、サトラプラチン、ピコプラチン、ネダプラチン、トリプラチン、及びリポプラチンなど);ビンブラスチン(VELBAN(登録商標));白金;エトポシド(VP-16);イホスファミド;ミトキサントロン;ビンクリスチン(ONCOVIN(登録商標));オキサリプラチン;ロイコボビン;ビノレルビン(NAVELBINE(登録商標));ノバントロン;エダトレキサート;ダウノマイシン;アミノプテリン;イバンドロネート;トポイソメラーゼ阻害剤RFS2000;ジフルオロメチルオルニチン(DMFO);レチノイン酸などのレチノイド;カペシタビン(XELODA(登録商標));上記のいずれかの薬学的に許容される塩、酸、もしくは誘導体;ならびにCHOP(シクロホスファミド、ドキソルビシン、ビンクリスチン、及びプレドニゾロンの併用療法の略称である)及びFOLFOX(オキサリプラチン(ELOXATIN(商標))を5-FU及びロイコボリンと併用する治療レジメンの略称である)などの上記の2つ以上の組み合わせが挙げられる。追加の化学療法剤には、例えば、マイタンシノイド(例えば、DM1)、ならびにオーリスタチンMMAE及びMMAFなどの抗体薬物複合体として有用な細胞毒性剤が含まれる。
「化学療法剤」はまた、がんの成長を促進し得るホルモン作用を制御、低減、遮断、または阻害するように作用する「抗ホルモン剤」または「内分泌治療剤」も含み、しばしば全身性、つまり身体全体の治療の形態にある。それら自体が、ホルモンであってもよい。例としては、例えば、タモキシフェン(NOLVADEX(登録商標)タモキシフェンを含む)、EVISTA(登録商標)ラロキシフェン、ドロロキシフェン、4-ヒドロキシタモキシフェン、トリオキシフェン、ケオキシフェン、LY117018、オナプリストン、及びFARESTON(登録商標)トレミフェンを含む、抗エストロゲン及び選択的エストロゲン受容体制御剤(SERM);抗プロゲステロン;エストロゲン受容体下方制御剤(ERD);卵巣を抑制または活動停止するように機能する薬剤、例えば、LUPRON(登録商標)及びELIGARD(登録商標)酢酸ロイプロリド、酢酸ゴセレリン、酢酸ブセレリン、及びトリプテレリンなどの黄体形成ホルモン放出ホルモン(LHRH)アゴニスト;フルタミド、ニルタミド、及びビカルタミドなどの他の抗アンドロゲン薬;ならびに、例えば、4(5)-イミダゾール、アミノグルテチミド、MEGASE(登録商標)酢酸メゲストロール、AROMASIN(登録商標)エキセメスタン、ホルメスタイン、ファドロゾール、RIVISOR(登録商標)ボロゾール、FEMARA(登録商標)レトロゾール、及びARIMIDEX(登録商標)アナストロゾールなどの、副腎内のエストロゲン産生を制御する酵素アロマターゼを阻害するアロマターゼ阻害剤が挙げられる。加えて、化学療法剤のそのような定義には、クロドロネート(例えば、BONEFOS(登録商標)またはOSTAC(登録商標))、DIDROCAL(登録商標)エチドロネート、NE-58095、ZOMETA(登録商標)ゾレドロン酸/ゾレドロネート、FOSAMAX(登録商標)アレンドロネート、AREDIA(登録商標)パミドロネート、SKELID(登録商標)チルドロネート、またはACTONEL(登録商標)リセドロネートなどのビスホスホネート;ならびにトロキサシタビン(1,3-ジオキソランヌクレオシドシトシン類似体);アンチセンスオリゴヌクレオチド、特に、例えばPKC-アルファ、Raf、H-Ras、及び上皮増殖因子受容体(EGFR)などの異常な(abherant)細胞増殖に関係付けられているシグナル伝達経路における遺伝子の発現を阻害するもの;THERATOPE(登録商標)ワクチン及び遺伝子治療ワクチン、例えば、ALLOVECTIN(登録商標)ワクチン、LEUVECTIN(登録商標)ワクチン、及びVAXID(登録商標)ワクチンなどのワクチン;LURTOTECAN(登録商標)トポイソメラーゼ1阻害剤;ABARELIX(登録商標)rmRH;ジトシル酸ラパチニブ(GW572016としても知られる、ErbB-2及びEGFR二重チロシンキナーゼ小分子阻害剤);ならびに上記のいずれかの薬学的に許容される塩、酸、または誘導体が含まれる。
化学療法剤には、アレムツズマブ(Campath)、ベバシズマブ(AVASTIN(登録商標)、Genentech)、セツキシマブ(ERBITUX(登録商標)、Imclone)、パニツムマブ(VECTIBIX(登録商標)、Amgen)、リツキシマブ(RITUXAN(登録商標)、Genentech/Biogen Idec)、ペルツズマブ(OMNITARG(登録商標)、2C4、Genentech)、トラスツズマブ(HERCEPTIN(登録商標)、Genentech)、トシツモマブ(Bexxar、Corixia)などの抗体、及び抗体薬物複合体、ゲムツズマブオゾガマイシン(MYLOTARG(登録商標)、Wyeth)も含まれる。本発明の化合物と併用して、薬剤として治療潜在性を有する追加のヒト化モノクローナル抗体には、アポリズマブ、アセリズマブ、アトリズマブ、バピネオズマブ、ビバツズマブメルタンシン、カンツズマブメルタンシン、セデリズマブ、セトリズマブペゴール、シドフシツズマブ、シドツズマブ、ダクリズマブ、エクリズマブ、エファリズマブ、エプラツズマブ、エルリズマブ、フェルビズマブ、フォントリズマブ、ゲムツズマブオゾガマイシン、イノツズマブオゾガマイシン、イピリムマブ、ラベツズマブ、リンツズマブ、マツズマブ、メポリズマブ、モタビズマブ、モトビズマブ、ナタリズマブ、ニモツズマブ、ノロビズマブ、ヌマビズマブ、オクレリズマブ、オマリズマブ、パリビズマブ、パスコリズマブ、ペクフシツズマブ、ペクツズマブ、ペキセリズマブ、ラリビズマブ、ラニビズマブ、レスリビズマブ、レスリズマブ、レシビズマブ、ロベリズマブ、ルプリズマブ、シブロツズマブ、シプリズマブ、ソンツズマブ、タカツズマブテトラキセタン、タドシズマブ、タリズマブ、テフィバズマブ、トシリズマブ、トラリズマブ、ツコツズマブセルモロイキン、ツクシツズマブ、ウマビズマブ、ウルトキサズマブ、ウステキヌマブ、ビジリズマブ、及びインターロイキン-12 p40タンパク質を認識するように遺伝子修飾された組み換えヒト配列専用完全長IgG1 λ抗体である、抗インターロイキン-12(ABT-874/J695、Wyeth Research and Abbott Laboratories)が含まれる。
化学療法剤には、EGFRに結合するか、または他の様式でそれと直接相互作用し、そのシグナル伝達活性を防止または低減する化合物を指す「EGFR阻害剤」も含まれ、これは代替的に「EGFRアンタゴニスト」とも称される。そのような薬剤の例には、EGFRに結合する抗体及び小分子が含まれる。EGFRに結合する抗体の例としては、MAb579(ATCC CRL HB8506)、MAb455(ATCC CRL HB8507)、MAb225(ATCC CRL8508)、MAb528(ATCC CRL8509)(Mendelsohnらの米国特許第4,943,533号を参照されたい)、ならびにそれらのバリアント、例えば、キメラ化225(C225またはセツキシマブ、ERBUTIX(登録商標))及び再成形ヒト225(H225)(Imclone Systems Inc.のWO96/40210を参照されたい);IMC-11F8、完全ヒトEGFR標的抗体(Imclone);II型変異体EGFRに結合する抗体(米国特許第5,212,290号);米国特許第5,891,996号に記載のEGFRに結合するヒト化抗体及びキメラ抗体;ならびにEGFRに結合するヒト抗体、例えば、ABX-EGFまたはパニツムマブ(Abgenix/AmgenのWO98/50433を参照されたい);EMD55900(Stragliotto et al.Eur.J.Cancer32A:636-640(1996));EGFR結合についてEGF及びTGF-アルファの両方と競合するEGFRに対して指向されたヒト化EGFR抗体であるEMD7200(マツズマブ)(EMD/Merck);ヒトEGFR抗体HuMax-EGFR(GenMab);E1.1、E2.4、E2.5、E6.2、E6.4、E2.11、E6.3、及びE7.6.3として既知であり、かつUS6,235,883に記載の完全ヒト抗体;MDX-447(Medarex Inc);ならびにmAb806またはヒト化mAb806(Johns et al.,J.Biol.Chem.279(29):30375-30384(2004))が挙げられる。抗EGFR抗体は、細胞毒性剤に複合され、それにより免疫複合体を生成し得る(例えば、Merck Patent GmbHのEP659,439A2を参照されたい)。EGFRアンタゴニストには、米国特許第5,616,582号、同第5,457,105号、同第5,475,001号、同第5,654,307号、同第5,679,683号、同第6,084,095号、同第6,265,410号、同第6,455,534号、同第6,521,620号、同第6,596,726号、同第6,713,484号、同第5,770,599号、同第6,140,332号、同第5,866,572号、同第6,399,602号、同第6,344,459号、同第6,602,863号、同第6,391,874号、同第6,344,455号、同第5,760,041号、同第6,002,008号、及び同第5,747,498号、ならびに以下のPCT公開、WO98/14451、WO98/50038、WO99/09016、及びWO99/24037に記載の化合物などの小分子が含まれる。特定の小分子EGFRアンタゴニストには、OSI-774(CP-358774、エルロチニブ、TARCEVA(登録商法)Genentech/OSI Pharmaceuticals);PD183805(CI1033、2-プロペンアミド、N-[4-[(3-クロロ-4-フルオロフェニル)アミノ]-7-[3-(4-モルフォリニル)プロポキシ]-6-キナゾリニル]-、二塩酸塩、Pfizer Inc.);ZD1839、ゲフィチニブ(IRESSA(登録商標))4-(3’-クロロ-4’-フルオロアニリノ)-7-メトキシ-6-(3-モルフォリノプロポキシ)キナゾリン、AstraZeneca);ZM105180((6-アミノ-4-(3-メチルフェニル-アミノ)-キナゾリン、Zeneca);BIBX-1382(N8-(3-クロロ-4-フルオロ-フェニル)-N2-(1-メチル-ピペリジン-4-イル)-ピリミド[5,4-d]ピリミジン-2,8-ジアミン、Boehringer Ingelheim);PKI-166((R)-4-[4-[(1-フェニルエチル)アミノ]-1H-ピロロ[2,3-d]ピリミジン-6-イル]-フェノール);(R)-6-(4-ヒドロキシフェニル)-4-[(1-フェニルエチル)アミノ]-7H-ピロロ[2,3-d]ピリミジン);CL-387785(N-[4-[(3-ブロモフェニル)アミノ]-6-キナゾリニル]-2-ブチンアミド);EKB-569(N-[4-[(3-クロロ-4-フルオロフェニル)アミノ]-3-シアノ-7-エトキシ-6-キノリニル]-4-(ジメチルアミノ)-2-ブテンアミド)(Wyeth);AG1478(Pfizer)、AG1571(SU5271、Pfizer);及びラパチニブ(TYKERB(登録商標)、GSK572016またはN-[3-クロロ-4-[(3-フルオロフェニル)メトキシ]フェニル]-6[5[[[2-メチルスルホニル)エチル]アミノ]メチル]-2-フラニル]-4-キナゾリンアミン)などの二重EGFR/HER2チロシンキナーゼ阻害剤が含まれる。
化学療法剤には、前段落に記載のEGFR標的薬物などの「チロシンキナーゼ阻害剤」;Takedaから入手可能なTAK165などの小分子HER2チロシンキナーゼ阻害剤;ErbB2受容体チロシンキナーゼの経口選択的阻害剤であるCP-724,714(Pfizer及びOSI);EGFRに優先的に結合するが、HER2過剰発現細胞及びEGFR過剰発現細胞の両方を阻害するEKB-569(Wyethから入手可能)などの二重HER阻害剤;ラパチニブ(GSK572016、Glaxo-SmithKlineから入手可能);経口HER2及びEGFRチロシンキナーゼ阻害剤;PKI-166(Novartisから入手可能);カネルチニブ(CI-1033、Pharmacia)などのpan-HER阻害剤;Raf-1シグナル伝達を阻害するISIS Pharmaceuticalsから入手可能なアンチセンス薬剤ISIS-5132などのRaf-1阻害剤;メシル酸イマチニブ(GLEEVEC(登録商標)、Glaxo SmithKlineから入手可能)などの非HER標的TK阻害剤;スニチニブ(SUTENT(登録商標)、Pfizerから入手可能)などの多標的チロシンキナーゼ阻害剤;バタラニブ(PTK787/ZK222584、Novartis/Schering AGから入手可能)などのVEGF受容体チロシンキナーゼ阻害剤;MAPK細胞外制御キナーゼI阻害剤CI-1040(Pharmaciaから入手可能);PD153035,4-(3-クロロアニリノ)キナゾリンなどのキナゾリン;ピリドピリミジン;ピリミドピリミジン;CGP59326、CGP60261、及びCGP62706などのピロロピリミジン;ピラゾロピリミジン、4-(フェニルアミノ)-7H-ピロロ[2,3-d]ピリミジン;クルクミン(ジフェルロイルメタン、4,5-ビス(4-フルオロアニリノ)フタルイミド);ニトロチオフェン部分を含有するチルホスチン;PD-0183805(Warner-Lamber);アンチセンス分子(例えば、HERコード核酸に結合するもの)、キノキサリン(米国特許第5,804,396号);トリホスチン(米国特許第5,804,396号);ZD6474(Astra Zeneca);PTK-787(Novartis/Schering AG);CI-1033(Pfizer)などのpan-HER阻害剤;Affinitac(ISIS3521、Isis/Lilly);メシル酸イマチニブ(GLEEVEC(登録商標));PKI166(Novartis);GW2016(Glaxo SmithKline);CI-1033(Pfizer);EKB-569(Wyeth);セマキシニブ(Pfizer);ZD6474(AstraZeneca);PTK-787(Novartis/Schering AG);INC-1C11(Imclone)、ラパマイシン(シロリムス、RAPAMUNE(登録商標);または以下の特許公開、米国特許第5,804,396号、WO1999/09016(American Cyanamid)、WO1998/43960(American Cyanamid)、WO1997/38983(Warner Lambert)、WO1999/06378(Warner Lambert)、WO1999/06396(Warner Lambert)、WO1996/30347(Pfizer,Inc)、WO1996/33978(Zeneca)、WO1996/3397(Zeneca)、及びWO1996/33980(Zeneca)のいずれかに記載のものも含まれる。
化学療法剤には、デキサメタゾン、インターフェロン、コルヒチン、メトプリン、シクロスポリン、アンホテリシン、メトロニダゾール、アレムツズマブ、アリトレチノイン、アロプリノール、アミホスチン、三酸化ヒ素、アスパラギナーゼ、BCG生、ベバクジマブ、ベキサロテン、クラドリビン、クロファラビン、ダルベポエチンアルファ、デニロイキン、デクスラゾキサン、エポエチンアルファ、エロチニブ、フィルグラスチム、酢酸ヒストレリン、イブリツモマブ、インターフェロンアルファ-2a、インターフェロンアルファ-2b、レナリドミド、レバミゾール、メスナ、メトキサレン、ナンドロロン、ネララビン、ノフェツモマブ、オプレルベキン、パリフェルミン、パミドロネート、ペガデマーゼ、ペグアスパラガーゼ、ペグフィルグラスチム、ペメトレキセド二ナトリウム、プリカマイシン、ポルフィマーナトリウム、キナクリン、ラスブリカーゼ、サルグラモスチム、テモゾロミド、VM-26、6-TG、トレミフェン、トレチノイン、ATRA、バルルビシン、ゾレドロネート、及びゾレドロン酸、ならびにそれらの薬学的に許容される塩も含まれる。
化学療法剤には、ヒドロコルチゾン、酢酸ヒドロコルチゾン、酢酸コルチゾン、ピバル酸チキソコルトール、トリアムシノロンアセトニド、トリアムシノロンアルコール、モメタゾン、アムシノニド、ブデソニド、デソニド、フルオシノニド、フルオシノロンアセトニド、ベタメタゾン、リン酸ベタメタゾンナトリウム、デキサメタゾン、リン酸デキサメタゾンナトリウム、フルオコルトロン、ヒドロコルチゾン-17-酪酸塩、ヒドロコルチゾン-17-吉草酸塩、ジプロピオン酸アクロメタゾン、吉草酸ベタメタゾン、ジプロピオン酸ベタメタゾン、プレドニカルベート、クロベタゾン-17-酪酸塩、クロベタゾール-17-プロピオン酸塩、カプロン酸フルオコルトロン、ピバル酸フルオコルトロン、及び酢酸フルプレドニデン;フェニルアラニン-グルタミン-グリシン(FEG)及びそのD異性体形態(feG)(IMULAN BioTherapeutics,LLC)などの免疫選択的抗炎症性ペプチド(ImSAID);アザチオプリン、シクロスポリン(シクロスポリンA)、D-ペニシラミン、金塩、ヒドロキシクロロキン、レフルノミドミノサイクリン、スルファサラジン、腫瘍壊死因子アルファ(TNFα)遮断剤(エタネルセプト(ENBREL(登録商標))、インフリキシマブ(REMICADE(登録商標))、アダリムマブ(HUMIRA(登録商標))、セトリズマブペゴール(CIMZIA(登録商標))、ゴリムマブ(SIMPONI(登録商標))など)、インターロイキン1(IL-1)遮断剤(アナキンラ(KINERET(登録商標))など)、T細胞共刺激遮断剤(アバタセプト(ORENCIA(登録商標))など)、インターロイキン6(IL-6)遮断剤(トシリズマブ(ACTEMERA(登録商標))など)などの抗リウマチ薬;レブリキズマブなどのインターロイキン13(IL-13)遮断剤;ロンタリズマブなどのインターフェロンアルファ(IFN)遮断剤;rhuMAbベータ7などのベータ7インテグリン遮断剤;抗M1プライムなどのIgE経路遮断剤;抗リンホトキシンアルファ(LTa)などの分泌型ホモ三量体LTa3及び膜結合ヘテロ三量体LTa1/β2遮断剤;チオプラチン、PS-341、酪酸フェニル、ET-18-OCH3、及びファルネシルトランスフェラーゼ阻害剤(L-739749、L-744832)などの様々な治験薬;ケルセチン、レスベラトロール、ピセタノール、没食子酸エピガロカテキン、テアフラビン、フラバノール、プロシアニジン、ベツリン酸などのポリフェノール及びそれらの誘導体;クロロキンなどのオートファジー阻害剤;デルタ-9-テトラヒドロカンナビノール(ドロナビノール、MARINOL(登録商標));ベータ-ラパコン;ラパコール;コルヒチン;ベツリン酸;アセチルカンプトテシン、スコポレチン、及び9-アミノカンプトテシン);ポドフィロトキシン;テガフール(UFTORAL(登録商標));ベキサロテン(TARGRETIN(登録商標));クロドロネート(例えば、BONEFOS(登録商標)もしくはOSTAC(登録商標))、エチドロネート(DIDROCAL(登録商標))、NE-58095、ゾレドロン酸/ゾレドロネート(ZOMETA(登録商標))、アレンドロネート(FOSAMAX(登録商標))、パミドロネート(AREDIA(登録商標))、チルドロネート(SKELID(登録商標))、またはリセドロネート(ACTONEL(登録商標))などのビスホスフォネート;ならびに上皮増殖因子受容体(EGF-R);THERATOPE(登録商標)ワクチンなどのワクチン;ペリフォシン、COX-2阻害剤(例えば、セレコキシブまたはエトリコキシブ)、プロテオソーム阻害剤(例えば、PS341);CCI-779;ティピファニブ(R11577);オラフェニブ、ABT510;オブリメルセンナトリウム(GENASENSE(登録商標))などのBcl-2阻害剤;ピクサントロン;ロナファーニブ(SCH6636、SARASAR(商標))などのファルネシルトランスフェラーゼ阻害剤;ならびに上記のいずれかの薬学的に許容される塩または誘導体;ならびに上記の2つ以上の組み合わせもまた含まれる。
本明細書で使用される場合、「プロドラッグ」という用語は、親薬物と比較して腫瘍細胞に対する細胞毒性が低く、酵素によってより活性な親形態へと活性化または変換され得る、薬学的に活性な物質の前駆体または誘導体形態を指す。例えば、Wilman,“Prodrugs in Cancer Chemotherapy”Biochemical Society Transactions,14,pp.375-382,615th Meeting Belfast(1986)及びStella et al.,“Prodrugs:A Chemical Approach to Targeted Drug Delivery,”Directed Drug Delivery,Borchardt et al.,(ed.),pp.247-267,Humana Press(1985)を参照されたい。本発明のプロドラッグとしては、リン酸含有プロドラッグ、チオリン酸含有プロドラッグ、硫酸含有プロドラッグ、ペプチド含有プロドラッグ、Dアミノ酸修飾プロドラッグ、グリコシル化プロドラッグ、β-ラクタム含有プロドラッグ、任意で置換されたフェノキシアセトアミド含有プロドラッグまたは任意で置換されたフェニルアセトアミド含有プロドラッグ、5-フルオロシトシン及び他の5-フルオロウリジンプロドラッグが挙げられるが、これらに限定されず、これらは、より活性な細胞毒性遊離薬物へと変換され得る。本発明において使用するためにプロドラッグ形態に誘導体化することができる細胞毒性薬の例としては、上記の化学療法剤が挙げられるが、これらに限定されない。
本明細書で使用される場合、「成長阻害剤」は、インビトロまたはインビボのいずれかで細胞(例えば、その成長がPD-L1発現に依存する細胞)の成長及び/または増殖を阻害する化合物または組成物を指す。したがって、成長阻害剤は、S期にある細胞のパーセンテージを著しく低減するものであってもよい。成長阻害剤の例としては、G1停止及びM期停止を誘導する薬剤などの、細胞周期進行(S期以外の場所で)を遮断する薬剤が挙げられる。古典的なM期遮断剤としては、ビンカ(ビンクリスチン及びビンブラスチン)、タキサン、ならびにトポイソメラーゼII阻害剤(アントラサイクリン抗生物質ドキソルビシン((8S-シス)-10-[(3-アミノ-2,3,6-トリデオキシ-α-L-リキソ-ヘキサピラノシル)オキシ]-7,8,9,10-テトラヒドロ-6,8,11-トリヒドロキシ-8-(ヒドロキシアセチル)-1-メトキシ-5,12-ナフタセンジオン)、エピルビシン、ダウノルビシン、エトポシド、及びブレオマイシンなど)が挙げられる。G1を停止する薬剤、例えば、タモキシフェン、プレドニゾン、ダカルバジン、メクロレタミン、シスプラチン、メトトレキサート、5-フルオロウラシル、及びara-CなどのDNAアルキル化剤はまた、S期停止にも波及する。更なる情報は、“The Molecular Basis of Cancer,”Mendelsohn and Israel,eds.,Chapter1,entitled“Cell cycle regulation,oncogenes,and antineoplastic drugs”by Murakami et al.(WB Saunders:Philadelphia,1995)、特に、13頁に見出すことができる。タキサン(パクリタキセル及びドセタキセル)は、いずれもイチイの木に由来する抗がん薬である。ヨーロッパイチイに由来するドセタキセル(TAXOTERE(登録商標)、Rhone-Poulenc Rorer)は、パクリタキセル(TAXOL(登録商標)、Bristol-Myers Squibb)の半合成類似体である。パクリタキセル及びドセタキセルは、チューブリン二量体に由来する微小管の組み立てを促進し、脱重合を防止することによって微小管を安定させ、細胞内の有糸分裂の阻害をもたらす。
「放射線療法」は、細胞が正常に機能する能力を制限するように、または細胞を完全に破壊するように、細胞に十分な損傷を誘導する指向性γ線またはβ線の使用を意味する。線量及び治療期間を決定するための当該技術分野において既知の方法が多く存在することが理解される。典型的な治療は1回の投与として与えられ、典型的な線量は1日当たり10~200単位(グレイ)の範囲である。
本明細書で使用される場合、「個体」、「患者」、及び「対象」という用語は互換的に使用され、治療が所望される任意の単一の動物、より好ましくは哺乳動物(例えば、イヌ、ネコ、ウマ、ウサギ、動物園の動物、ウシ、ブタ、ヒツジ、及び非ヒト霊長類などの非ヒト動物を含む)を指す。特定の実施形態において、本明細書の個体または患者は、ヒトである。
本明細書で使用される場合、「投与すること」は、対象(例えば、患者)にある投薬量の化合物(例えば、アンタゴニスト)または薬学的組成物(例えば、アンタゴニストを含む薬学的組成物)を与える方法を意味する。投与は、非経口、肺内、及び鼻腔内、ならびに局所治療に所望される場合には病巣内投与を含む、任意の好適な手段により得る。非経口注入には、例えば、筋肉内、静脈内、動脈内、腹腔内、または皮下投与が含まれる。投薬は、投与が短期であるか慢性的であるかに部分的に応じて、任意の好適な経路により、例えば、静脈内注射または皮下注射などの注射により得る。単回または様々な時点にわたる複数回投与、ボーラス投与、及びパルス注入を含むが、これらに限定されない、様々な投薬スケジュールが本明細書で企図される。
「同時に」という用語は、本明細書において、投与の時間が少なくとも部分的に重複している、2つ以上の治療剤の投与を指すように使用される。したがって、同時投与には、1つ以上の薬剤(複数可)の投与が1つ以上の他の薬剤(複数可)の投与を中止した後で継続する投薬レジメンが含まれる。
「低減または阻害する」は、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、またはそれ以上の全体的な減少を引き起こす能力を意味する。低減または阻害は、例えば、治療されている障害の症状、転移の存在もしくはサイズ、または原発腫瘍のサイズに言及し得る。
「添付文書」は、治療製品の市販のパッケージに通例含まれ、そのような治療用製品の使用に関する適応症、用法、投薬量、投与、併用療法、禁忌症、及び/または警告についての情報を含有する説明書を指すように使用される。
「滅菌」製剤は、無菌であるか、または全ての生存微生物及びそれらの胞子を含まない。
「製造品」は、少なくとも1つの試薬、例えば、疾患もしくは障害(例えば、がん)の治療のための医薬品、または本明細書に記載のバイオマーカー(例えば、PD-L1)を特異的に検出するためのプローブを含む、任意の製造物(例えば、パッケージもしくは容器)またはキットである。特定の実施形態において、製造物またはキットは、本明細書に記載の方法を実行するためのユニットとして、販売促進、流通、または販売される。
本明細書で使用される場合、「に基づく」という語句は、1つ以上のバイオマーカーについての情報が、例えば治療決定、添付文書上で提供される情報、またはマーケティング/販売促進指針などを伝えるために使用されることを意味する。
III.方法
A.がん関連遺伝子内での体細胞変異のレベルを反映する組織腫瘍変異負荷(tTMB)スコアに基づく診断方法
がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者が、PD-L1軸結合アンタゴニストなどの免疫チェックポイント阻害剤を含む治療に応答する可能性があるかを決定するための方法が、本明細書に提供される。がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の、PD-L1軸結合アンタゴニストなどの免疫チェックポイント阻害剤を含む治療に対する応答性を予測するための方法もまた、本明細書に提供される。がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の治療法を選択するための方法が、本明細書に更に提供される。前述の方法のいずれも、患者由来の腫瘍組織試料から決定される、決定または事前決定された組織腫瘍変異負荷(tTMB)スコアに基づき得る。したがって、前述の方法はいずれも、腫瘍試料中の、本明細書(例えば、表1及び/または表2)に記載の遺伝子のいずれかにおける体細胞変異のレベルに基づき得る。前述の方法はいずれも、バイオマーカーの発現レベル、例えば、腫瘍試料中(例えば、腫瘍浸潤性免疫細胞内及び/または腫瘍細胞内)のPD-L1発現にも基づき得る。これらの方法はいずれも、患者にPD-L1軸結合アンタゴニスト(例えば、以下の節Dに記載のもの)などの免疫チェックポイント阻害剤を患者に投与することを更に含み得る。これらの方法はいずれも、有効量の第2の治療剤を患者に投与することを更に含み得る。
本発明は、PD-L1軸結合アンタゴニストを含む治療から利益を受け得るがん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)を有する個体を特定するための方法を提供し、本方法は、個体由来の腫瘍試料からtTMBスコアを決定することを含み、基準tTMBスコア以上の腫瘍試料からのtTMBスコアは、個体を、PD-L1軸結合アンタゴニストを含む治療から利益を受け得る個体として特定する。
本方法はまた、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)を有する個体の治療法を選択するための方法も提供し、本方法は、個体由来の腫瘍試料からtTMBスコアを決定することを含み、基準tTMBスコア以上の腫瘍試料からのtTMBスコアは、個体を、PD-L1軸結合アンタゴニストを含む治療から利益を受け得る個体として特定する。
前述の方法のいずれにおいても、腫瘍試料から決定されるtTMBスコアは、基準tTMBスコア以上であり得、本方法は、個体に有効量のPD-L1軸結合アンタゴニストを投与することを更に含み得る。
先行態様のいずれか1つの他の実施形態において、腫瘍試料から決定されるtTMBスコアは、基準tTMBスコア未満であり得る。いくつかの実施形態において、腫瘍試料から決定されるtTMBスコアは、基準tTMBスコア未満であり、本方法は、個体に、PD-L1軸結合アンタゴニスト以外の治療剤またはそれに加えた治療剤を投与することを更に含む。
前述の方法のいずれにおいても、いくつかの事例では、基準tTMBスコアは、がんを有する基準個体集団内のtTMBスコアであり、個体集団は、PD-L1軸結合アンタゴニスト療法で治療されている第1の個体サブセット、及びPD-L1軸結合アンタゴニストを含まない非PD-L1軸結合アンタゴニスト療法で治療されている第2の個体サブセットからなる。いくつかの事例では、基準tTMBスコアは、非PD-L1軸結合アンタゴニスト療法での治療に対する応答性と比較した、PD-L1軸結合アンタゴニスト療法での治療に対する応答性の有意差に基づいて、第1及び第2の個体サブセットの各々を有意に分離する。いくつかの事例では、治療に対する応答性は、無増悪生存期間(PFS)の増加である。いくつかの事例では、治療に対する応答性は、全生存期間(OS)の増加である。いくつかの事例では、治療に対する応答性は、全奏効率(ORR)の増加である。
前述の方法のいずれにおいても、いくつかの事例では、基準tTMBスコアは、事前に割り当てられたtTMBスコアである。いくつかの事例では、基準tTMBスコアは、1Mb当たり約5~約100個の変異(変異/Mb)、例えば、約5、約6、約7、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、約30、約31、約32、約33、約34、約35、約36、約37、約38、約39、約40、約41、約42、約43、約44、約45、約46、約47、約48、約49、約50、約51、約52、約53、約54、約55、約56、約57、約58、約59、約60、約61、約62、約63、約64、約65、約66、約67、約68、約69、約70、約71、約72、約73、約74、約75、約76、約77、約78、約79、約80、約81、約82、約83、約84、約85、約86、約87、約88、約89、約90、約91、約92、約93、約94、約95、約96、約97、約98、約99、または約100個の変異/Mbである。例えば、いくつかの事例では、基準tTMBスコアは、約8~約30個の変異/Mb(例えば、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、または約30個の変異/Mb)である。いくつかの事例では、基準tTMBスコアは、約10~約20個の変異/Mb(例えば、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、または約20個の変異/Mb)である。特定の事例では、基準tTMBスコアは、10個の変異/Mb、16個の変異/Mb、または20個の変異/Mbであり得る。
前述の方法のいずれかのいくつかの事例では、患者由来の腫瘍試料は、約5個以上の変異/MbのtTMBスコアを有する。例えば、いくつかの事例では、腫瘍試料からのtTMBスコアは、約5~約100個の変異/Mb(例えば、約5、約6、約7、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、約30、約31、約32、約33、約34、約35、約36、約37、約38、約39、約40、約41、約42、約43、約44、約45、約46、約47、約48、約49、約50、約51、約52、約53、約54、約55、約56、約57、約58、約59、約60、約61、約62、約63、約64、約65、約66、約67、約68、約69、約70、約71、約72、約73、約74、約75、約76、約77、約78、約79、約80、約81、約82、約83、約84、約85、約86、約87、約88、約89、約90、約91、約92、約93、約94、約95、約96、約97、約98、約99、または約100個の変異/Mb)である。いくつかの事例では、患者由来の腫瘍試料は、約5、約6、約7、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、約30、約31、約32、約33、約34、約35、約36、約37、約38、約39、約40、約41、約42、約43、約44、約45、約46、約47、約48、約49、または約50個以上の変異/MbのtTMBスコアを有する。例えば、いくつかの事例では、患者由来の腫瘍試料は、約10個以上の変異/MbのtTMBスコアを有する。いくつかの実施形態において、基準tTMBスコアは、10個の変異/Mbである。いくつかの事例では、腫瘍試料からのtTMBスコアは、約10~100個の変異/Mbである。いくつかの事例では、腫瘍試料からのtTMBスコアは、約10~20個の変異/Mbである。いくつかの事例では、患者由来の腫瘍試料は、約16個以上の変異/MbのtTMBスコアを有する。いくつかの事例では、患者由来の腫瘍試料は、約16個以上の変異/MbのtTMBスコアを有し、基準tTMBスコアは、16個の変異/Mbである。他の事例では、患者由来の腫瘍試料は、約20個以上の変異/MbのtTMBスコアを有する。いくつかの事例では、患者由来の腫瘍試料は、約20個以上の変異/MbのtTMBスコアを有し、基準tTMBスコアは、約20個の変異/Mbである。
前述の方法のいずれかのいくつかの事例では、tTMBスコアまたは基準tTMBスコアは、配列決定された塩基の定義された数当たりで計数される体細胞変異の数として表される。例えば、いくつかの事例では、配列決定された塩基の定義された数は、約100kb~約10Mbである。いくつかの事例では、配列決定された塩基の定義された数は、例えば、FOUNDATIONONE(登録商標)パネル)によって評価して、約1.1Mb(例えば、約1.125Mb)である。いくつかの事例では、tTMBスコアまたは基準tTMBスコアは、等価TMB値である。いくつかの事例では、等価TMB値は、全エクソーム配列決定(WES)によって決定される。
前述の方法のいずれにおいても、決定されたtTMBスコアは、表1及び/または表2に列挙される遺伝子内で検出される体細胞変異及び/または再配列のレベルを反映し得る。いくつかの事例では、tTMBスコアは、少なくとも約5個以上の変異/Mb(例えば、約5個以上の変異/Mb、約6個以上の変異/Mb、約7個以上の変異/Mb、約8個以上の変異/Mb、約9個以上の変異/Mb、約10個以上の変異/Mb、約11個以上の変異/Mb、約12個以上の変異/Mb、約13個以上の変異/Mb、約14個以上の変異/Mb、約15個以上の変異/Mb、約16個以上の変異/Mb、約17個以上の変異/Mb、約18個以上の変異/Mb、約19個以上の変異/Mb、約20個以上の変異/Mb、約25個以上の変異/Mb、約30個以上の変異/Mb、約35個以上の変異/Mb、約40個以上の変異/Mb、及び約50個以上の変異/Mb)であると決定されている(または決定される)。これは、治療(例えば、PD-L1軸結合アンタゴニストを含む治療)に対する応答性を予測する。いくつかの事例では、治療(例えば、PD-L1軸結合アンタゴニストを含む治療)に対する応答性を予測するtTMBスコアは、約7個の変異/Mb~約20個の変異/Mbであり得る。いくつかの事例では、治療に対する応答性を予測するtTMBスコアは、約10個の変異/Mb~約15個の変異/Mbであり得る。いくつかの事例では、治療に対する応答性を予測するtTMBスコアは、約11個の変異/Mb~約13個の変異/Mbであり得る。いくつかの事例では、治療に対する応答性を予測するtTMBスコアは、約12.5個の変異/Mbであり得る。他の事例では、治療に対する応答性を予測するtTMBスコアは、約10個以上の変異/Mb、例えば、約10個以上の変異/Mb、約11個以上の変異/Mb、約12個以上の変異/Mb、約13個以上の変異/Mb、約14個以上の変異/Mb、約15個以上の変異/Mb、約16個以上の変異/Mb、約17個以上の変異/Mb、約18個以上の変異/Mb、約19個以上の変異/Mb、約20個以上の変異/Mbであり得る。
前述の方法のいずれかのいくつかの事例では、患者から得られる腫瘍試料は、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、表1に明記される少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の遺伝子内体細胞変異の増加したレベルを有することが決定されている。他の事例では、表1に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した体細胞変異を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも2分の1または約50%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも3分の2または約67%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも4分の3または約75%において体細胞変異の増加したレベルを有することが決定されている。
体細胞変異の存在及び/またはレベル(量)は、個体における、DNA、mRNA、cDNA、タンパク質、タンパク質断片、及び/または遺伝子コピー数レベルの測定値を含むが、これらに限定されない、当該技術分野で既知である任意の好適な基準に基づいて、定性的及び/または定量的に決定され得る。いくつかの事例では、個体の包括的ゲノムプロファイルが決定される。いくつかの事例では、個体から収集された試料(例えば、組織試料、ホルマリン固定パラフィン包埋(FFPE)組織試料、コアまたは細針生検)の包括的ゲノムプロファイルが決定される。いくつかの事例では、ゲノムプロファイルの決定は、当該技術分野で既知であるか、または本明細書に記載される次世代配列決定法を適用して、がん(例えば、固形腫瘍)の明確な原動力であることが既知であるゲノム改変(例えば、体細胞変異(例えば、塩基置換、挿入及び欠失(挿入欠失)、コピー数の改変(CNA)、及び再配列))を特定することを含む。
いくつかの事例では、この試験は、少なくとも約0.05Mb~約10Mb(例えば、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、または10Mb)を網羅する約300個の遺伝子(例えば、少なくとも約300~約400個の遺伝子、例えば、約300、310、320、330、340、350、360、370、380、390、または400個の遺伝子の多様なセット)のコード領域を、少なくとも約500倍(例えば、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍、または1,000倍)の典型的なエクソンカバレッジ深度中央値まで同時に配列決定する。他の事例では、この試験は、約400個の遺伝子、約425個の遺伝子、約450個の遺伝子、約475個の遺伝子、約500個の遺伝子、約525個の遺伝子、約550個の遺伝子、約575個の遺伝子、約600個の遺伝子、約625個の遺伝子、約650個の遺伝子、約675個の遺伝子、約700個の遺伝子、約725個の遺伝子、約750個の遺伝子、約775個の遺伝子、約800個の遺伝子、約825個の遺伝子、約850個の遺伝子、約875個の遺伝子、約900個の遺伝子、約925個の遺伝子、約950個の遺伝子、約975個の遺伝子、約1000個の遺伝子、または1000個超の遺伝子のコード領域を同時に配列決定する。いくつかの事例では、遺伝子のセットは、表1に明記される1つ以上の遺伝子(例えば、がん関連遺伝子)を含む。いくつかの事例では、遺伝子のセットは、FOUNDATIONONE(登録商標)パネル(例えば、その全体が参照により本明細書に組み込まれる、Frampton et al.Nat.Biotechnol.31:1023-31,2013を参照されたい)の遺伝子のセットである。いくつかの事例では、遺伝子のセットは、FOUNDATIONONE(登録商標)CD×パネルの遺伝子のセットである。いくつかの実施形態において、この試験は、個体のゲノムのうちの約10Mb超、例えば、約10Mb超、約15Mb超、約20Mb超、約25Mb超、約30Mb超、約35Mb超、約40Mb超、約45Mb超、約50Mb超、約55Mb超、約60Mb超、約65Mb超、約70Mb超、約75Mb超、約80Mb超、約85Mb超、約90Mb超、約95Mb超、約100Mb超、約200Mb超、約300Mb超、約400Mb超、約500Mb超、約600Mb超、約700Mb超、約800Mb超、約900Mb超、約1Gb超、約2Gb超、約3Gb超、または約3.3Gbを配列決定する。いくつかの事例では、この試験は、315個のがん関連遺伝子のコード領域、及びがんにおいてしばしば再配列または改変される28個の遺伝子に由来するイントロンを、500倍超の典型的なカバレッジ深度中央値まで同時に配列決定する。いくつかの事例では、網羅された配列決定の読み取りは各々、腫瘍異種性、低い腫瘍純度、及び小さい組織試料に起因して低頻度で生じるゲノム改変の高度に感受性かつ特異的な検出を可能にする、特有のDNA断面を表す。他の事例では、体細胞変異の存在及び/またはレベルは、全エクソーム配列決定によって決定される。いくつかの事例では、体細胞変異の存在及び/またはレベルは、全ゲノム配列決定によって決定される。
腫瘍試料から決定されるtTMBスコアが基準tTMBスコア未満であるいくつかの事例では、個体由来の腫瘍試料はまた、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、表1に明記される少なくとも1つの遺伝子内で体細胞変異の減少したレベルも有し得る。いくつかの事例では、例えば、いくつかの実施形態において、腫瘍試料は、表1に明記される遺伝子のうちの少なくとも3分の1での体細胞変異の基準レベルと比較して、表1に明記される遺伝子のうちの少なくとも3分の1で体細胞変異の減少したレベルを有することが決定されている。いくつかの事例では、腫瘍試料は、表1に明記される遺伝子のうちの少なくとも2分の1での体細胞変異の基準レベルと比較して、表1に明記される遺伝子のうちの少なくとも2分の1で体細胞変異の減少したレベルを有することが決定されている。いくつかの事例では、腫瘍試料は、表1に明記される遺伝子のうちの少なくとも3分の2での体細胞変異の基準レベルと比較して、表1に明記される遺伝子のうちの少なくとも3分の2で体細胞変異の減少したレベルを有することが決定されている。いくつかの事例では、腫瘍試料は、表1に明記される遺伝子のうちの少なくとも4分の3での体細胞変異の基準レベルと比較して、表1に明記される遺伝子のうちの少なくとも4分の3で体細胞変異の減少したレベルを有することが決定されている。いくつかの事例では、腫瘍試料は、表1に明記される遺伝子内での体細胞変異の基準レベルと比較して、表1に明記される遺伝子内で体細胞変異の減少したレベルを有することが決定されている。いくつかの事例では、腫瘍試料からのtTMBスコアは、約16個の変異/Mb未満である。いくつかの事例では、腫瘍試料からのtTMBスコアは、約16個の変異/Mbであり、基準tTMBスコアは、約16個の変異/Mbである。いくつかの事例では、腫瘍試料からのtTMBスコアは、約20個の変異/Mb未満である。いくつかの事例では、腫瘍試料からのtTMBスコアは、約20個の変異/Mb未満であり、基準tTMBスコアは、約20個の変異/Mbである。腫瘍試料から決定されるtTMBスコアが基準tTMBスコア未満であり、かつ表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、表1に明記される少なくとも1つの遺伝子内で体細胞変異の体細胞変異の減少したレベルを有する、これらの事例のいずれにおいても、本方法は、個体にPD-L1軸結合アンタゴニスト以外の治療剤またはそれに加えた治療剤を投与することを更に含み得る。
本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者が、PD-L1軸結合アンタゴニストを含む治療に応答する可能性があるかを決定するための方法を更に提供し、本方法は、患者から得られる腫瘍試料中の体細胞変異のレベルを決定することを含み、腫瘍試料の表1に明記される少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の遺伝子内での体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。例えば、いくつかの事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約3分の1における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約3分の2における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約4分の3における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、表1に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した体細胞変異を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも2分の1または約50%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも3分の2または約67%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも4分の3または約75%において体細胞変異の増加したレベルを有することが決定されている。
本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の、PD-L1軸結合アンタゴニストを含む治療に対する応答性を予測するための方法を更に提供し、本方法は、患者から得られる腫瘍試料中の体細胞変異のレベルを決定することを含み、腫瘍試料の表1に明記される少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の遺伝子内での体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。例えば、いくつかの事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約3分の1における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約3分の2における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約4分の3における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、表1に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した体細胞変異を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも2分の1または約50%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも3分の2または約67%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも4分の3または約75%において体細胞変異の増加したレベルを有することが決定されている。
本発明はまた、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の治療法を選択するための方法も更に提供し、本方法は、患者から得られる腫瘍試料中の体細胞変異のレベルを決定することを含み、腫瘍試料の表1に明記される少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の遺伝子内での体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。例えば、いくつかの事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約3分の1における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約3分の2における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表1に明記される遺伝子のうちの少なくとも約4分の3における体細胞変異の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、表1に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した体細胞変異を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも2分の1または約50%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも3分の2または約67%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも4分の3または約75%において体細胞変異の増加したレベルを有することが決定されている。
前述の方法のいずれにおいても、表1に明記される遺伝子内での体細胞変異は、表1に明記される遺伝子内での体細胞変異の基準レベルと比較して、約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、または約95%以上)増加していると決定されている。例えば、いくつかの事例では、1つ以上の体細胞変異のレベルは、約1%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約5%以上増加していると決定された。他の事例では、1つ以上の体細胞変異のレベルは、約10%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約15%以上増加していると決定された。また他の事例では、1つ以上の体細胞変異のレベルは、約20%以上増加していると決定された。更なる事例では、1つ以上の体細胞変異のレベルは、約25%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約30%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約35%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約40%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約50%以上増加していると決定された。他の事例では、表1に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した体細胞変異を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも2分の1または約50%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも3分の2または約67%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1に明記される遺伝子のうちの少なくとも4分の3または約75%において体細胞変異の増加したレベルを有することが決定されている。
前述の方法のいずれにおいても、本方法は、患者から得られる腫瘍試料中の腫瘍細胞内のPD-L1の発現レベルを決定することを更に含み得る。いくつかの実施形態において、腫瘍試料中の腫瘍細胞のうちの約1%以上(例えば、約1%、約2%、約3%、約4%、約5%以上、約10%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)におけるPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。例えば、いくつかの事例では、腫瘍試料中の腫瘍細胞のうちの1%以上におけるPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の腫瘍細胞のうちの5%以上におけるPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の腫瘍細胞のうちの10%以上におけるPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の腫瘍細胞のうちの20%以上におけるPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の腫瘍細胞のうちの30%以上におけるPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。また他の事例では、腫瘍試料中の腫瘍細胞のうちの50%以上におけるPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。
前述の方法のいずれかのいくつかの実施形態において、腫瘍試料中の腫瘍細胞のうちの約1%~約99%(例えば、約1%~約99%、約1%~約90%、約1%~約85%、約1%~約80%、約1%~約75%、約1%~約70%、約1%~約65%、約1%~約60%、約1%~約55%、約1%~約50%、約1%~約45%、約1%~約40%、約1%~約35%、約1%~約30%、約1%~約25%、約1%~約20%、約1%~約15%、約1%~約10%、約1%~約5%、約5%~約50%、約5%~約40%、約5%~約30%、約5%~約20%、約5%~約10%、約50%~約99%、約50%~95%、約50%~約90%、約50%~約85%、約50%~約80%、約50%~約75%、約50%~約70%、約50%~約65%、約50%~約60%、または約50%~約55%)におけるPD-L1の検出可能な発現レベルは、患者がPD-L1結合アンタゴニストでの治療に応答する可能性が高いことを示す。
いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料中の腫瘍細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている。
前述の方法のいずれにおいても、本方法は、患者から得られる腫瘍試料(腫瘍面積)中の腫瘍浸潤性免疫細胞内のPD-L1の発現レベルを決定することを更に含み得る。いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料(腫瘍面積)のうちの1%超(例えば、1%超、2%超、3%超、4%超、5%超、6%超、7%超、8%超、9%超、10%超、20%超、30%超、40%超、または50%超)を構成する腫瘍浸潤性免疫細胞内で、PD-L1の検出可能な発現レベルを有する。例えば、いくつかの事例では、例えば、抗PD-L1抗体を使用して、免疫組織化学によって決定して、腫瘍試料の一切片における腫瘍面積のうちの1%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの5%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの20%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの30%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。また他の事例では、腫瘍試料の一切片における腫瘍面積のうちの50%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。
前述の方法のいずれかのいくつかの実施形態において、腫瘍試料の一切片における腫瘍面積のうちの約1%~約50%(例えば、約1%~約50%、約1%~約45%、約1%~約40%、約1%~約35%、約1%~約30%、約1%~約25%、約1%~約20%、約1%~約15%、約1%~約10%、約1%~約5%、約5%~約50%、約5%~約40%、約5%~約30%、約5%~約20%、約5%~約10%、約10%~約50%、約10%~約40%、約10%~約30%、約10%~約20%、または約10%~約15%)を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1結合アンタゴニストでの治療に応答する可能性が高いことを示す。
いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料(腫瘍面積)中の腫瘍浸潤性免疫細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている。
前述の方法のいずれにおいても、患者は、高レベルのマイクロサテライト不安定性を有し得る。例えば、患者は、例えば、MSIならびに2つのペンタヌクレオチド遺伝子座(PentaC及びPendaD)を検出して、正常な試料と腫瘍試料との同一性を確認するための5つの偽性単形性モノヌクレオチド反復配列(BAT-25、BAT-26、NR-21、NR-24、及びMONO-27)で構成されるMSI Analysis System(Promega,Madison,WI)などのPCR系アプローチによって評価して、MSI高(MSI-H)表現型を有し得る。各マイクロサテライト遺伝子座の塩基サイズは、例えば、ゲル電気泳動法によって決定することができ、2つ以上のモノヌクレオチド遺伝子座の長さが生殖系列DNAと比較して変動する場合に、腫瘍は、MSI-Hと表記することができる。例えば、Le et al.NEJM372:2509-2520,2015を参照されたい。他の実施形態において、患者は、低レベルのマイクロサテライト不安定性(例えば、MSI低(MSI-L)を有し得る。
前述の方法のいずれにおいても、本方法は、腫瘍試料中の体細胞変異のレベルに基づいて、患者に治療有効量のPD-L1軸結合アンタゴニストを投与することを更に含み得る。PD-L1軸結合アンタゴニストは、当該技術分野で既知であるか、または本明細書、例えば、以下の節Dに記載されるいずれのPD-L1軸結合アンタゴニストであってもよい。
例えば、いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-L1結合アンタゴニスト、PD-1結合アンタゴニスト、またはPD-L2結合アンタゴニストである。いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-L1結合アンタゴニストである。いくつかの事例では、PD-L1結合アンタゴニストは、PD-L1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する。他の事例では、PD-L1結合アンタゴニストは、PD-L1のPD-1への結合を阻害する。また他の事例では、PD-L1結合アンタゴニストは、PD-L1のB7-1への結合を阻害する。いくつかの事例では、PD-L1結合アンタゴニストは、PD-L1のPD-1及びB7-1の両方への結合を阻害する。いくつかの事例では、PD-L1結合アンタゴニストは、抗体である。いくつかの事例では、抗体は、MPDL3280A(アテゾリズマブ)、YW243.55.S70、MDX-1105、MEDI4736(デュルバルマブ)、またはMSB0010718C(アベルマブ)である。いくつかの事例では、抗体は、配列番号19のHVR-H1配列、配列番号20のHVR-H2配列、及び配列番号21のHVR-H3配列を含む重鎖と、配列番号22のHVR-L1配列、配列番号23のHVR-L2配列、及び配列番号24のHVR-L3配列を含む軽鎖とを含む。いくつかの事例では、抗体は、配列番号25のアミノ酸配列を含む重鎖可変領域と、配列番号4のアミノ酸配列を含む軽鎖可変領域とを含む。
いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-1結合アンタゴニストである。例えば、いくつかの事例では、PD-1結合アンタゴニストは、PD-1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する。いくつかの事例では、PD-1結合アンタゴニストは、PD-1のPD-L1への結合を阻害する。他の事例では、PD-1結合アンタゴニストは、PD-1のPD-L2への結合を阻害する。また他の事例では、PD-1結合アンタゴニストは、PD-1のPD-L1及びPD-L2の両方への結合を阻害する。いくつかの事例では、PD-1結合アンタゴニストは、抗体である。いくつかの事例では、抗体は、MDX-1106(ニボルマブ)、MK-3475(ペンブロリズマブ)、CT-011(ピディリズマブ)、MEDI-0680(AMP-514)、PDR001、REGN2810、またはBGB-108である。いくつかの事例では、PD-1結合アンタゴニストは、Fc融合タンパク質である。例えば、いくつかの事例では、Fc融合タンパク質は、AMP-224である。いくつかの事例では、PD-L1軸結合アンタゴニストは、単独療法として投与される。
いくつかの事例では、本方法は、患者に有効量の第2の治療剤を投与することを更に含む。いくつかの事例では、第2の治療剤は、細胞毒性剤、成長阻害剤、放射線療法剤、血管新生阻害剤、またはそれらの組み合わせである。
前述の方法のいずれにおいても、個体は、例えば、肺癌(例えば、非小細胞肺癌(NSCLC)もしくは小細胞肺癌)、腎臓癌(例えば、腎臓尿路上皮癌もしくはRCC)、膀胱癌(例えば、膀胱尿路上皮(移行細胞)癌(例えば、1Lもしくは2L+の局所進行性もしくは転移性癌を含む、局所進行性もしくは転移性尿路上皮癌)、乳癌(例えば、TNBC、HER2+乳癌、もしくはHR+乳癌)、子宮内膜癌、皮膚癌(例えば、皮膚有棘細胞癌)、結腸直腸癌(例えば、結腸腺癌)、卵巣癌、膵臓癌、胃癌、食道癌、中皮腫、黒色腫(例えば、皮膚黒色腫)、頭頸部癌(例えば、頭頸部扁平上皮細胞癌(HNSCC))、甲状腺癌、肉腫(例えば、軟部組織肉腫、線維肉腫、粘液肉腫、脂肪肉腫、骨原性肉腫、骨肉腫、軟骨肉腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、平滑筋肉腫、もしくは横紋筋肉腫)、前立腺癌、膠芽腫、子宮頸癌、胸腺癌、白血病(例えば、急性リンパ球性白血病(ALL)、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、慢性好酸球性白血病、もしくは慢性リンパ球性白血病(CLL))、リンパ腫(例えば、ホジキンリンパ腫もしくは非ホジキンリンパ腫(NHL))、骨髄腫(例えば、多発性骨髄腫(MM))、菌状息肉腫、メルケル細胞癌、血液学的悪性腫瘍、血液組織の癌、B細胞癌、気管支癌、胃癌、脳癌もしくは中枢神経系癌、末梢神経系癌、子宮癌もしくは子宮内膜癌、口腔癌もしくは咽頭癌、肝臓癌、精巣癌、胆道癌、小腸癌もしくは虫垂癌、唾液腺癌、副腎癌、腺癌、炎症性筋線維芽細胞性腫瘍、消化管間質腫瘍(GIST)、結腸癌、骨髄異形成症候群(MDS)、骨髄増殖性疾患(MPD)、真性赤血球増加症、脊索腫、滑膜腫、ユーイング腫瘍、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭状腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌(hepatoma)、胆管癌、絨毛癌、精上皮腫、胎児性癌、ウィルムス腫瘍、膀胱癌(bladder carcinoma)、上皮癌、神経膠腫、星細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞腫、聴神経腫瘍、乏突起神経膠腫、髄膜腫、神経芽腫、網膜芽細胞腫、濾胞性リンパ腫、びまん性大細胞型B細胞リンパ腫、マントル細胞リンパ腫、肝細胞癌(hepatocellular carcinoma)、甲状腺癌、小細胞癌、本態性血小板血症、原発性骨髄線維症、好酸球増加症候群、全身性肥満細胞症、家族性過好酸球増加症、神経内分泌癌、またはカルチノイド腫瘍から選択されるがんを有し得る。
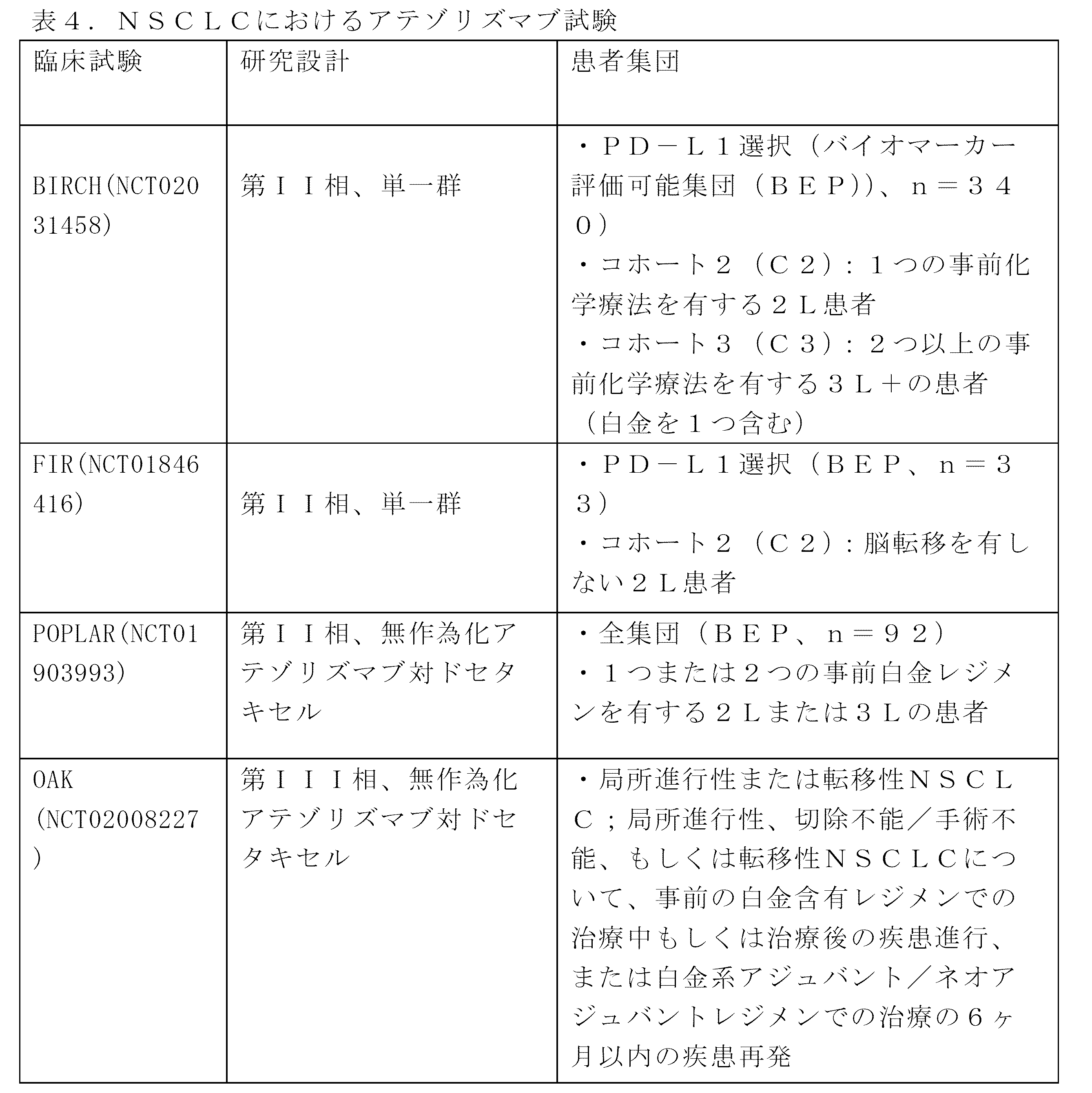
前述の方法のいずれかのいくつかの事例では、個体は、がんの白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療後に進行している。他の事例では、個体は、白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療に不適格であり得る、及び/またはがんの事前治療を受けていない。いくつかの事例では、個体は、免疫チェックポイント阻害剤、例えば、PD-L1軸結合アンタゴニストでの事前治療を受けていない。
例えば、前述の事例のいずれにおいても、肺癌は、局所進行性または転移性(例えば、病期IIIB、病期IV、または再発性)NSCLCを含むが、これらに限定されない、NSCLCであり得る。いくつかの事例では、肺癌(例えば、NSCLC)は、切除不能/手術不能な肺癌(例えば、NSCLC)である。他の事例では、肺癌(例えば、NSCLC)は、事前の白金含有レジメンでの治療中または治療後に進行していてもよい。
体細胞変異の存在及び/またはレベル(量)は、個体における、DNA、mRNA、cDNA、タンパク質、タンパク質断片、及び/または遺伝子コピー数を含むが、これらに限定されない、当該技術分野で既知である任意の好適な基準に基づいて、定性的及び/または定量的に決定することができる。
前述の事例のいずれにおいても、体細胞変異は、置換、欠失、及び/または挿入であり得る。
前述の方法のいずれにおいても、患者から得られる試料は、組織、全血、血漿、血清、及びそれらの組み合わせからなる群から選択される。いくつかの事例では、試料は、組織試料である。いくつかの事例では、組織試料は、腫瘍試料である。いくつかの事例では、腫瘍試料は、腫瘍浸潤性免疫細胞、腫瘍細胞、間質細胞、またはそれらの任意の組み合わせを含む。前述の事例のいずれにおいても、腫瘍試料は、ホルマリン固定及びパラフィン包埋(FFPE)腫瘍試料、保存記録用腫瘍試料、新鮮な腫瘍試料、または凍結腫瘍試料であり得る。
特定の事例では、第1の試料中の体細胞変異の存在及び/またはレベル(量)は、第2の試料中のそのような体細胞変異の存在/不在及び/またはレベル(量)と比較して、増加または上昇する。特定の事例では、第1の試料中の体細胞変異の存在/不在及び/またはレベル(量)は、第2の試料中のそのような体細胞変異の存在及び/またはレベル(量)と比較して、減少または低減する。特定の事例では、第2の試料は、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織である。体細胞変異の存在/不在及び/またはレベル(量)を決定するための追加の開示が、本明細書に記載されている。
特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、試験試料が得られたときとは異なる1つ以上の時点で得られる同じ対象または個体由来の単一の試料または複数の試料の組み合わせである。例えば、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、試験試料が得られたときよりも早い時点で同じ対象または個体から得られる。そのような基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、基準試料ががんの初期診断中に得られ、かつ試験試料がその後がんが転移性となったときに得られる場合に有用であり得る。
特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、患者ではない1つ以上の健常な個体由来の複数の試料の組み合わせである。特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、対象または個体ではない、疾患または障害(例えば、がん)を有する1つ以上の個体由来の複数の試料の組み合わせである。特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、正常な組織由来のプールされたRNA試料、または患者ではない1つ以上の個体由来のプールされた血漿試料もしくは血清試料である。特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、腫瘍組織由来のプールされたRNA試料、または患者ではない、疾患もしくは障害(例えば、がん)を有する1つ以上の個体由来のプールされた血漿試料もしくは血清試料である。
本明細書に記載の方法のいずれかのいくつかの事例では、上昇または増加したレベルは、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織と比較して、本明細書に記載のものなどの標準的な当該技術分野で既知の方法によって検出される、体細胞変異のレベルにおける、約10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%、またはそれ以上の全体的な増加を示す。特定の事例では、上昇したレベルは、試料中の体細胞変異のレベル/量における増加を指し、この増加は、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織中のそれぞれの体細胞変異のレベル/量の少なくとも約1.5倍、1.75倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、25倍、50倍、75倍、または100倍である。いくつかの事例では、上昇したレベルは、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織と比較して、約1.5倍、約1.75倍、約2倍、約2.25倍、約2.5倍、約2.75倍、約3.0倍、または約3.25倍超の全体的な増加を指す。いくつかの事例では、体細胞変異の上昇または増加したレベルは、体細胞変異の1つ以上のクラス(例えば、点変異、挿入及び欠失(例えば、挿入欠失)、増幅、遺伝子複製、コピー数の改変(CNA)、及び再配列)のレベルにおける全体的な増加、及び/または基準レベルと比較した、試料中の特定の体細胞変異のレベルにおける全体的な増加を指す。
本明細書に記載の方法のいずれかのいくつかの事例では、低減したレベルは、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織と比較して、本明細書に記載のものなどの標準的な当該技術分野で既知の方法によって検出される、体細胞変異のレベルにおける、約10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%、またはそれ以上の全体的な低減を指す。特定の事例では、低減したレベルは、試料中の体細胞変異のレベル/量における減少を指し、この減少は、参照試料、参照細胞、参照組織、対照試料、対照細胞、または対照組織中のそれぞれの体細胞変異のレベル/量の少なくとも約0.9倍、0.8倍、0.7倍、0.6倍、0.5倍、0.4倍、0.3倍、0.2倍、0.1倍、0.05倍、または0.01倍である。いくつかの事例では、体細胞変異の低減または減少したレベルは、体細胞変異の1つ以上のクラス(例えば、点変異、挿入及び欠失(例えば、挿入欠失)、増幅、遺伝子複製、コピー数の改変(CNA)、及び再配列)のレベルにおける全体的な減少、及び/または基準レベルと比較した、試料中の特定の体細胞変異のレベルにおける全体的な減少を指す。
B.がんにおいて再配列される遺伝子のレベルに基づく診断方法
個々に、または上記の節Aに提示される前述の方法のいずれかと組み合わせて使用することができる方法であって、表2に列挙される遺伝子のうちのいずれか1つの再配列のレベルに基づいて、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いかを決定するための方法が、本明細書に提供される。例えば、表2に列挙される遺伝子のうちの1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の再配列は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性があるかを決定することができる。他の事例では、例えば、表2に列挙される遺伝子のうちの1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の再配列のレベルにおける増加、それと組み合わせた1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の表1に列挙される遺伝子内での体細胞変異における増加によって、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性があるかを決定することができる。
個々に、または上記の節Aに提示される前述の方法のいずれかと組み合わせて使用することができる方法であって、表2に列挙される遺伝子のうちのいずれか1つの再配列のレベルに基づいて、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の、PD-L1軸結合アンタゴニストを含む治療に対する応答性を予測するための方法もまた、本明細書に提供される。例えば、表2に列挙される遺伝子のうちの1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の再配列は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性があるかを予測することができる。他の事例では、例えば、表2に列挙される遺伝子のうちの1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の再配列のレベルにおける増加、それと組み合わせた1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の表1に列挙される遺伝子内での体細胞変異における増加によって、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性があるかを予測することができる。これらの方法はいずれも、患者にPD-L1軸結合アンタゴニスト(例えば、以下の節Dに記載のもの)を患者に投与することを更に含み得る。これらの方法はいずれも、有効量の第2の治療剤を患者に投与することを更に含み得る。
本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者を治療するための方法を提供し、本方法は、患者に治療有効量のPD-L1軸結合アンタゴニストを投与することを含み、患者から得られる腫瘍試料は、表2に明記される少なくとも1つの遺伝子内での再配列の基準レベルと比較して、少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の表2に明記される遺伝子内での再配列の増加したレベルを有することが決定されている。他の事例では、表2に明記される遺伝子のうちの約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、再配列の増加したレベルを有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも2分の1または約50%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも3分の2または約67%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも4分の3または約75%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、表2に列挙されるいずれかの遺伝子内での再配列の上昇したレベルと組み合わせて、少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の表1に明記される遺伝子が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、体細胞変異の増加したレベルを有することが決定されている。

体細胞変異の存在及び/またはレベル(量)は、個体における、DNA、mRNA、cDNA、タンパク質、タンパク質断片、及び/または遺伝子コピー数レベルの測定値を含むが、これらに限定されない、当該技術分野で既知である任意の好適な基準に基づいて、定性的及び/または定量的に決定され得る。いくつかの事例では、個体の包括的ゲノムプロファイルが決定される。いくつかの事例では、個体から収集された試料(例えば、組織試料、ホルマリン固定パラフィン包埋(FFPE)組織試料、コアまたは細針生検)の包括的ゲノムプロファイルが決定される。いくつかの事例では、ゲノムプロファイルの決定は、当該技術分野で既知であるか、または本明細書に記載される次世代配列決定法を適用して、がん(例えば、固形腫瘍)の明確な原動力であることが既知であるゲノム改変(例えば、体細胞変異(例えば、塩基置換、挿入及び欠失(挿入欠失)、コピー数の改変(CNA)、及び再配列))を特定することを含む。いくつかの事例では、この試験は、315個のがん関連遺伝子のコード領域、及びがんにおいてしばしば再配列される28個の遺伝子に由来するイントロンを、500倍超の典型的なカバレッジ深度中央値まで同時に配列決定する。いくつかの事例では、網羅された配列決定の読み取りは各々、腫瘍異種性、低い腫瘍純度、及び小さい組織試料に起因して低頻度で生じるゲノム改変の高度に感受性かつ特異的な検出を可能にする、特有のDNA断面を表す。
本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者が、PD-L1軸結合アンタゴニストを含む治療に応答する可能性があるかを決定するための方法を提供し、本方法は、患者から得られる腫瘍試料中の再配列のレベルを決定することを含み、腫瘍試料の少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の表2に明記される遺伝子内での再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。例えば、いくつかの事例では、腫瘍試料中の表2に明記される遺伝子のうちの少なくとも約3分の1における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表2に明記される遺伝子のうちの少なくとも約3分の2における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表2に明記される遺伝子のうちの少なくとも約4分の3における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)の表2に明記される遺伝子は、増加した再配列を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも2分の1または約50%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも3分の2または約67%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも4分の3または約75%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、表2に列挙されるいずれかの遺伝子内での体細胞変異の上昇したレベルと組み合わせて、少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の表1に明記される遺伝子が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、体細胞変異の増加したレベルを有することが決定されている。
本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の、PD-L1軸結合アンタゴニストを含む治療に対する応答性を予測するための方法を更に提供し、本方法は、患者から得られる腫瘍試料中の再配列のレベルを決定することを含み、腫瘍試料の少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の表2に明記される遺伝子内での再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。例えば、いくつかの事例では、腫瘍試料中の表2に明記される遺伝子のうちの3分の1における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表2に明記される遺伝子のうちの3分の2における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表2に明記される遺伝子のうちの4分の3における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、表2に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した再配列を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも2分の1または約50%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも3分の2または約67%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも4分の3または約75%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、表2に列挙されるいずれかの遺伝子内での再配列の上昇したレベルと組み合わせて、少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の表1に明記される遺伝子が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、体細胞変異の増加したレベルを有することが決定されている。
本発明はまた、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の治療法を選択するための方法も更に提供し、本方法は、患者から得られる腫瘍試料中の再配列のレベルを決定することを含み、腫瘍試料の表2に明記される少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、またはそれ以上)の遺伝子内での再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。例えば、いくつかの事例では、腫瘍試料中の表2に明記される遺伝子のうちの3分の1における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表2に明記される遺伝子のうちの3分の2における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料中の表2に明記される遺伝子のうちの4分の3における再配列の増加したレベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、表2に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した再配列を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも2分の1または約50%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも3分の2または約67%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも4分の3または約75%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、表2に列挙されるいずれかの遺伝子内での再配列の上昇したレベルと組み合わせて、少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の表1に明記される遺伝子が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、体細胞変異の増加したレベルを有することが決定されている。
前述の方法のいずれにおいても、表2に明記される遺伝子内での再配列は、表2に明記される遺伝子内での再配列の基準レベルと比較して、約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、または約95%以上)増加していると決定されている。例えば、いくつかの事例では、1つ以上の再配列のレベルは、約1%以上増加していると決定された。いくつかの事例では、1つ以上の再配列のレベルは、約5%以上増加していると決定された。他の事例では、1つ以上の再配列のレベルは、約10%以上増加していると決定された。いくつかの事例では、1つ以上の再配列のレベルは、約15%以上増加していると決定された。また他の事例では、1つ以上の再配列のレベルは、約20%以上増加していると決定された。更なる事例では、1つ以上の再配列のレベルは、約25%以上増加していると決定された。いくつかの事例では、1つ以上の再配列のレベルは、約30%以上増加していると決定された。いくつかの事例では、1つ以上の再配列のレベルは、約35%以上増加していると決定された。いくつかの事例では、1つ以上の再配列のレベルは、約40%以上増加していると決定された。いくつかの事例では、1つ以上の再配列のレベルは、約50%以上増加していると決定された。他の事例では、表2に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した再配列を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも2分の1または約50%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも3分の2または約67%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表2に明記される遺伝子のうちの少なくとも4分の3または約75%において再配列の増加したレベルを有することが決定されている。いくつかの事例では、表2に列挙されるいずれかの遺伝子内での再配列の上昇したレベルと組み合わせて、少なくとも1つ以上(例えば、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、またはそれ以上)の表1に明記される遺伝子が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、体細胞変異の増加したレベルを有することが決定されている。
前述の方法のいずれかのいくつかの実施形態において、腫瘍試料中の腫瘍細胞のうちの約1%~約99%(例えば、約1%~約99%、約1%~約90%、約1%~約85%、約1%~約80%、約1%~約75%、約1%~約70%、約1%~約65%、約1%~約60%、約1%~約55%、約1%~約50%、約1%~約45%、約1%~約40%、約1%~約35%、約1%~約30%、約1%~約25%、約1%~約20%、約1%~約15%、約1%~約10%、約1%~約5%、約5%~約50%、約5%~約40%、約5%~約30%、約5%~約20%、約5%~約10%、約50%~約99%、約50%~95%、約50%~約90%、約50%~約85%、約50%~約80%、約50%~約75%、約50%~約70%、約50%~約65%、約50%~約60%、または約50%~約55%)におけるPD-L1の検出可能な発現レベルは、患者がPD-L1結合アンタゴニストでの治療に応答する可能性が高いことを示す。
いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料中の腫瘍細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている。
前述の方法のいずれにおいても、本方法は、患者から得られる腫瘍試料(腫瘍面積)中の腫瘍浸潤性免疫細胞内のPD-L1の発現レベルを決定することを更に含み得る。いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料(腫瘍面積)のうちの1%超(例えば、1%超、2%超、3%超、4%超、5%超、6%超、7%超、8%超、9%超、10%超、20%超、30%超、40%超、または50%超)を構成する腫瘍浸潤性免疫細胞内で、PD-L1の検出可能な発現レベルを有する。例えば、いくつかの事例では、例えば、抗PD-L1抗体を使用して、免疫組織化学によって決定して、腫瘍試料の一切片における腫瘍面積のうちの1%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの5%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの20%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの30%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。また他の事例では、腫瘍試料の一切片における腫瘍面積のうちの50%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。
前述の方法のいずれかのいくつかの実施形態において、腫瘍試料の一切片における腫瘍面積のうちの約1%~約50%(例えば、約1%~約50%、約1%~約45%、約1%~約40%、約1%~約35%、約1%~約30%、約1%~約25%、約1%~約20%、約1%~約15%、約1%~約10%、約1%~約5%、約5%~約50%、約5%~約40%、約5%~約30%、約5%~約20%、約5%~約10%、約10%~約50%、約10%~約40%、約10%~約30%、約10%~約20%、または約10%~約15%)を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1結合アンタゴニストでの治療に応答する可能性が高いことを示す。
いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料(腫瘍面積)中の腫瘍浸潤性免疫細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている。
前述の方法のいずれにおいても、患者は、高レベルのマイクロサテライト不安定性を有し得る。例えば、患者は、例えば、MSIならびに2つのペンタヌクレオチド遺伝子座(PentaC及びPendaD)を検出して、正常な試料と腫瘍試料との同一性を確認するための5つの偽性単形性モノヌクレオチド反復配列(BAT-25、BAT-26、NR-21、NR-24、及びMONO-27)で構成されるMSI Analysis System(Promega,Madison,WI)などのPCR系アプローチによって評価して、MSI高(MSI-H)表現型を有し得る。各マイクロサテライト遺伝子座の塩基サイズは、例えば、ゲル電気泳動法によって決定することができ、2つ以上のモノヌクレオチド遺伝子座の長さが生殖系列DNAと比較して変動する場合に、腫瘍は、MSI-Hと表記することができる。例えば、Le et al.NEJM372:2509-2520,2015を参照されたい。他の実施形態において、患者は、低レベルのマイクロサテライト不安定性(例えば、MSI低(MSI-L)を有し得る。
前述の方法のいずれにおいても、本方法は、腫瘍試料中の体細胞変異のレベルに基づいて、患者に治療有効量のPD-L1軸結合アンタゴニストを投与することを更に含み得る。PD-L1軸結合アンタゴニストは、当該技術分野で既知であるか、または本明細書、例えば、以下の節Dに記載されるいずれのPD-L1軸結合アンタゴニストであってもよい。
例えば、いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-L1結合アンタゴニスト、PD-1結合アンタゴニスト、及びPD-L2結合アンタゴニストからなる群から選択される。いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-L1結合アンタゴニストである。いくつかの事例では、PD-L1結合アンタゴニストは、PD-L1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する。他の事例では、PD-L1結合アンタゴニストは、PD-L1のPD-1への結合を阻害する。また他の事例では、PD-L1結合アンタゴニストは、PD-L1のB7-1への結合を阻害する。いくつかの事例では、PD-L1結合アンタゴニストは、PD-L1のPD-1及びB7-1の両方への結合を阻害する。いくつかの事例では、PD-L1結合アンタゴニストは、抗体である。いくつかの事例では、抗体は、MPDL3280A(アテゾリズマブ)、YW243.55.S70、MDX-1105、MEDI4736(デュルバルマブ)、及びMSB0010718C(アベルマブ)からなる群から選択される。いくつかの事例では、抗体は、配列番号19のHVR-H1配列、配列番号20のHVR-H2配列、及び配列番号21のHVR-H3配列を含む重鎖と、配列番号22のHVR-L1配列、配列番号23のHVR-L2配列、及び配列番号24のHVR-L3配列を含む軽鎖とを含む。いくつかの事例では、抗体は、配列番号25のアミノ酸配列を含む重鎖可変領域と、配列番号4のアミノ酸配列を含む軽鎖可変領域とを含む。
いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-1結合アンタゴニストである。例えば、いくつかの事例では、PD-1結合アンタゴニストは、PD-1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する。いくつかの事例では、PD-1結合アンタゴニストは、PD-1のPD-L1への結合を阻害する。他の事例では、PD-1結合アンタゴニストは、PD-1のPD-L2への結合を阻害する。また他の事例では、PD-1結合アンタゴニストは、PD-1のPD-L1及びPD-L2の両方への結合を阻害する。いくつかの事例では、PD-1結合アンタゴニストは、抗体である。いくつかの事例では、抗体は、MDX1106(ニボルマブ)、MK-3475(ペンブロリズマブ)、CT-011(ピディリズマブ)、MEDI-0680(AMP-514)、PDR001、REGN2810、及びBGB-108からなる群から選択される。いくつかの事例では、PD-1結合アンタゴニストは、Fc融合タンパク質である。例えば、いくつかの事例では、Fc融合タンパク質は、AMP-224である。いくつかの事例では、PD-L1軸結合アンタゴニストは、単独療法として投与される。
いくつかの事例では、本方法は、患者に有効量の第2の治療剤を投与することを更に含む。いくつかの事例では、第2の治療剤は、細胞毒性剤、成長阻害剤、放射線療法剤、血管新生阻害剤、及びそれらの組み合わせからなる群から選択される。
前述の方法のいずれにおいても、個体は、例えば、肺癌(例えば、非小細胞肺癌(NSCLC)もしくは小細胞肺癌)、腎臓癌(例えば、腎臓尿路上皮癌もしくはRCC)、膀胱癌(例えば、膀胱尿路上皮(移行細胞)癌(例えば、1Lもしくは2L+の局所進行性もしくは転移性癌を含む、局所進行性もしくは転移性尿路上皮癌)、乳癌(例えば、TNBC、HER2+乳癌、もしくはHR+乳癌)、子宮内膜癌、皮膚癌(例えば、皮膚有棘細胞癌)、結腸直腸癌(例えば、結腸腺癌)、卵巣癌、膵臓癌、胃癌、食道癌、中皮腫、黒色腫(例えば、皮膚黒色腫)、頭頸部癌(例えば、頭頸部扁平上皮細胞癌(HNSCC))、甲状腺癌、肉腫(例えば、軟部組織肉腫、線維肉腫、粘液肉腫、脂肪肉腫、骨原性肉腫、骨肉腫、軟骨肉腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、平滑筋肉腫、もしくは横紋筋肉腫)、前立腺癌、膠芽腫、子宮頸癌、胸腺癌、白血病(例えば、急性リンパ球性白血病(ALL)、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、慢性好酸球性白血病、もしくは慢性リンパ球性白血病(CLL))、リンパ腫(例えば、ホジキンリンパ腫もしくは非ホジキンリンパ腫(NHL))、骨髄腫(例えば、多発性骨髄腫(MM))、菌状息肉腫、メルケル細胞癌、血液学的悪性腫瘍、血液組織の癌、B細胞癌、気管支癌、胃癌、脳癌もしくは中枢神経系癌、末梢神経系癌、子宮癌もしくは子宮内膜癌、口腔癌もしくは咽頭癌、肝臓癌、精巣癌、胆道癌、小腸癌もしくは虫垂癌、唾液腺癌、副腎癌、腺癌、炎症性筋線維芽細胞性腫瘍、消化管間質腫瘍(GIST)、結腸癌、骨髄異形成症候群(MDS)、骨髄増殖性疾患(MPD)、真性赤血球増加症、脊索腫、滑膜腫、ユーイング腫瘍、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭状腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌(hepatoma)、胆管癌、絨毛癌、精上皮腫、胎児性癌、ウィルムス腫瘍、膀胱癌(bladder carcinoma)、上皮癌、神経膠腫、星細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞腫、聴神経腫瘍、乏突起神経膠腫、髄膜腫、神経芽腫、網膜芽細胞腫、濾胞性リンパ腫、びまん性大細胞型B細胞リンパ腫、マントル細胞リンパ腫、肝細胞癌(hepatocellular carcinoma)、甲状腺癌、小細胞癌、本態性血小板血症、原発性骨髄線維症、好酸球増加症候群、全身性肥満細胞症、家族性過好酸球増加症、神経内分泌癌、またはカルチノイド腫瘍から選択されるがんを有し得る。
前述の方法のいずれかのいくつかの事例では、個体は、がんの白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療後に進行している。他の事例では、個体は、白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療に不適格であり得る、及び/またはがんの事前治療を受けていない。いくつかの事例では、個体は、免疫チェックポイント阻害剤、例えば、PD-L1軸結合アンタゴニストでの事前治療を受けていない。
例えば、前述の事例のいずれにおいても、肺癌は、局所進行性または転移性(例えば、病期IIIB、病期IV、または再発性)NSCLCを含むが、これらに限定されない、NSCLCであり得る。いくつかの事例では、肺癌(例えば、NSCLC)は、切除不能/手術不能な肺癌(例えば、NSCLC)であり得る。他の事例では、肺癌(例えば、NSCLC)は、事前の白金含有レジメンでの治療中または治療後に進行していてもよい。
前述の事例のいずれにおいても、体細胞変異の存在及び/またはレベル(量)は、個体における、DNA、mRNA、cDNA、タンパク質、タンパク質断片、及び/または遺伝子コピー数を含むが、これらに限定されない、当該技術分野で既知である任意の好適な基準に基づいて、定性的及び/または定量的に決定することができる。
前述の事例のいずれにおいても、体細胞変異は、置換、欠失、及び/または挿入であり得る。例えば、いくつかの事例では、体細胞変異は、コピー数の改変及び/または再配列であり得る。
前述の方法のいずれにおいても、患者から得られる試料は、組織、全血、血漿、血清、及びそれらの組み合わせからなる群から選択される。いくつかの事例では、試料は、組織試料である。いくつかの事例では、組織試料は、腫瘍試料である。いくつかの事例では、腫瘍試料は、腫瘍浸潤性免疫細胞、腫瘍細胞、間質細胞、またはそれらの任意の組み合わせを含む。前述の事例のいずれにおいても、腫瘍試料は、ホルマリン固定及びパラフィン包埋(FFPE)腫瘍試料、保存記録用腫瘍試料、新鮮な腫瘍試料、または凍結腫瘍試料であり得る。
特定の事例では、第1の試料中の体細胞変異の存在及び/またはレベル(量)は、第2の試料中のそのような体細胞変異の存在/不在及び/またはレベル(量)と比較して、増加または上昇する。特定の事例では、第1の試料中の体細胞変異の存在/不在及び/またはレベル(量)は、第2の試料中の存在及び/またはレベル(量)と比較して、減少または低減する。特定の事例では、第2の試料は、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織である。体細胞変異の存在/不在及び/またはレベル(量)を決定するための追加の開示が、本明細書に記載されている。
特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、試験試料が得られたときとは異なる1つ以上の時点で得られる同じ対象または個体由来の単一の試料または複数の試料の組み合わせである。例えば、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、試験試料が得られたときよりも早い時点で同じ対象または個体から得られる。そのような基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、基準試料ががんの初期診断中に得られ、かつ試験試料がその後がんが転移性となったときに得られる場合に有用であり得る。
特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、患者ではない1つ以上の健常な個体由来の複数の試料の組み合わせである。特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、対象または個体ではない、疾患または障害(例えば、がん)を有する1つ以上の個体由来の複数の試料の組み合わせである。特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、正常な組織由来のプールされたRNA試料、または患者ではない1つ以上の個体由来のプールされた血漿試料もしくは血清試料である。特定の事例では、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織は、腫瘍組織由来のプールされたRNA試料、または患者ではない、疾患もしくは障害(例えば、がん)を有する1つ以上の個体由来のプールされた血漿試料もしくは血清試料である。
本明細書に記載の方法のいずれかのいくつかの事例では、上昇または増加したレベルは、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織と比較して、本明細書に記載のものなどの標準的な当該技術分野で既知の方法によって検出される、体細胞変異のレベルにおける、約10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%、またはそれ以上の全体的な増加を示す。特定の事例では、上昇したレベルは、試料中の体細胞変異のレベル/量における増加を指し、この増加は、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織中のそれぞれの体細胞変異のレベル/量の少なくとも約1.5倍、1.75倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、25倍、50倍、75倍、または100倍である。いくつかの事例では、上昇したレベルは、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織と比較して、約1.5倍、約1.75倍、約2倍、約2.25倍、約2.5倍、約2.75倍、約3.0倍、または約3.25倍超の全体的な増加を指す。いくつかの事例では、体細胞変異の上昇または増加したレベルは、体細胞変異の1つ以上のクラス(例えば、点変異、挿入及び欠失(例えば、挿入欠失)、増幅、遺伝子複製、コピー数の改変(CNA)、及び再配列)のレベルにおける全体的な増加、及び/または基準レベルと比較した、試料中の特定の体細胞変異のレベルにおける全体的な増加を指す。
本明細書に記載の方法のいずれかのいくつかの事例では、低減したレベルは、基準試料、基準細胞、基準組織、対照試料、対照細胞、または対照組織と比較して、本明細書に記載のものなどの標準的な当該技術分野で既知の方法によって検出される、体細胞変異のレベルにおける、約10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%、またはそれ以上の全体的な低減を指す。特定の事例では、低減したレベルは、試料中の体細胞変異のレベル/量における減少を指し、この減少は、参照試料、参照細胞、参照組織、対照試料、対照細胞、または対照組織中のそれぞれの体細胞変異のレベル/量の少なくとも約0.9倍、0.8倍、0.7倍、0.6倍、0.5倍、0.4倍、0.3倍、0.2倍、0.1倍、0.05倍、または0.01倍である。いくつかの事例では、体細胞変異の低減または減少したレベルは、体細胞変異の1つ以上のクラス(例えば、点変異、挿入及び欠失(例えば、挿入欠失)、増幅、遺伝子複製、コピー数の改変(CNA)、及び再配列)のレベルにおける全体的な減少、及び/または基準レベルと比較した、試料中の特定の体細胞変異のレベルにおける全体的な減少を指す。
C.治療方法
本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者を治療するための方法を提供する。いくつかの事例では、患者は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)の白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療後に進行している。他の事例では、患者は、白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療に不適格であり得る、及び/またはがん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)の事前治療を受けていない。いくつかの事例では、本発明の方法は、患者にPD-L1軸結合アンタゴニストを含む抗がん療法剤を投与することを含む。本明細書に記載される(例えば、以下の節Dを参照されたい)か、または当該技術分野で既知であるPD-L1軸結合アンタゴニストのいずれも、本方法において使用することができる。いくつかの事例では、本方法は、患者由来の腫瘍試料からtTMBスコアを決定することであって、腫瘍試料からのtTMBスコアが、基準tTMBスコア以上である、決定することと、基準tTMBスコアと比較して上昇したtTMBスコアに基づいて、PD-L1軸結合アンタゴニストを含む抗がん療法を患者に投与することとを伴う。そのような方法は、例えば、本明細書に記載される方法(例えば、節A及び節Bまたは以下の実施例に記載のもの)または当該技術分野で既知の方法のいずれかを使用して、試料中の体細胞変異の存在及び/または発現を調べることを含み得る。
本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者を治療する方法を提供し、本方法は、患者由来の腫瘍試料からtTMBスコアを決定することであって、腫瘍試料からのtTMBスコアが、基準tTMBスコア以上である、決定することと、有効量のPD-L1軸結合アンタゴニストを患者に投与することとを含む。
本方法はまた、がんを有する患者を治療する方法も提供し、本方法は、患者に有効量のPD-L1軸結合アンタゴニストを投与することを含み、投与前に、基準tTMBスコア以上であるtTMBスコアが、患者由来の腫瘍試料から決定されている。
いくつかの事例では、患者から得られる腫瘍試料はまた、表1及び/または表2に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、表1及び/または表2に明記される少なくとも1つの遺伝子内で体細胞変異の増加したレベルを有することも決定されている。
前述の方法のいずれにおいても、表1及び/または表2に明記される遺伝子内での体細胞変異は、表1及び/または表2に明記される遺伝子内での体細胞変異の基準レベルと比較して、約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、または約95%以上)増加していると決定されている。例えば、いくつかの事例では、1つ以上の体細胞変異のレベル(例えば、異なるクラス(例えば、挿入、欠失、及び/または再配列)からの1つ以上の体細胞変異のレベル、特定のクラスの体細胞変異のレベル、及び/または特定の体細胞変異のレベル)が、約1%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約5%以上増加していると決定された。他の事例では、1つ以上の体細胞変異のレベルは、約10%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約15%以上増加していると決定された。また他の事例では、1つ以上の体細胞変異のレベルは、約20%以上増加していると決定された。更なる事例では、1つ以上の体細胞変異のレベルは、約25%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約30%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約35%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約40%以上増加していると決定された。いくつかの事例では、1つ以上の体細胞変異のレベルは、約50%以上増加していると決定された。
前述の方法のいずれにおいても、表1及び/または表2に明記される遺伝子の約1%以上(例えば、約2%以上、約3%以上、約4%以上、約5%以上、約6%以上、約7%以上、約8%以上、約9%以上、約10%以上、約11%以上、約12%以上、約13%以上、約14%以上、約15%以上、約20%以上、約25%以上、約30%以上、約35%以上、約40%以上、約45%以上、約50%以上、約55%以上、約60%以上、約65%以上、約70%以上、約75%以上、約80%以上、約85%以上、約90%以上、約95%以上、または約99%以上)が、増加した体細胞変異を有することが決定された。例えば、いくつかの事例では、患者から得られる腫瘍試料は、表1及び/または表2に示される遺伝子のうちの少なくとも2分の1または約50%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1及び/または表2に示される遺伝子のうちの少なくとも3分の2または約67%において体細胞変異の増加したレベルを有することが決定されている。いくつかの事例では、患者から得られる腫瘍試料は、表1及び/または表2に示される遺伝子のうちの少なくとも4分の3または約75%において体細胞変異の増加したレベルを有することが決定されている。
いくつかの事例では、この試験は、少なくとも約0.05Mb~約10Mb(例えば、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、または10Mb)を網羅する約300個の遺伝子(例えば、少なくとも約300~約400個の遺伝子、例えば、約300、310、320、330、340、350、360、370、380、390、または400個の遺伝子の多様なセット)のコード領域を、少なくとも約500倍(例えば、500倍、550倍、600倍、650倍、700倍、750倍、800倍、850倍、900倍、950倍、または1,000倍)の典型的なエクソンカバレッジ深度中央値まで同時に配列決定する。他の事例では、この試験は、約400個の遺伝子、約425個の遺伝子、約450個の遺伝子、約475個の遺伝子、約500個の遺伝子、約525個の遺伝子、約550個の遺伝子、約575個の遺伝子、約600個の遺伝子、約625個の遺伝子、約650個の遺伝子、約675個の遺伝子、約700個の遺伝子、約725個の遺伝子、約750個の遺伝子、約775個の遺伝子、約800個の遺伝子、約825個の遺伝子、約850個の遺伝子、約875個の遺伝子、約900個の遺伝子、約925個の遺伝子、約950個の遺伝子、約975個の遺伝子、約1000個の遺伝子、または1000個超の遺伝子のコード領域を同時に配列決定する。いくつかの事例では、遺伝子のセットは、表1に明記される1つ以上の遺伝子(例えば、がん関連遺伝子)を含む。いくつかの事例では、遺伝子のセットは、FOUNDATIONONE(登録商標)パネル(例えば、その全体が参照により本明細書に組み込まれる、Frampton et al.Nat.Biotechnol.31:1023-31,2013)の遺伝子のセットである。いくつかの事例では、遺伝子のセットは、FOUNDATIONONE(登録商標)CD×パネルの遺伝子のセットである。いくつかの実施形態において、この試験は、個体のゲノムのうちの約10Mb超、例えば、約10Mb超、約15Mb超、約20Mb超、約25Mb超、約30Mb超、約35Mb超、約40Mb超、約45Mb超、約50Mb超、約55Mb超、約60Mb超、約65Mb超、約70Mb超、約75Mb超、約80Mb超、約85Mb超、約90Mb超、約95Mb超、約100Mb超、約200Mb超、約300Mb超、約400Mb超、約500Mb超、約600Mb超、約700Mb超、約800Mb超、約900Mb超、約1Gb超、約2Gb超、約3Gb超、または約3.3Gbを配列決定する。いくつかの事例では、この試験は、315個のがん関連遺伝子のコード領域、及びがんにおいてしばしば再配列または改変される28個の遺伝子に由来するイントロンを、500倍超の典型的なカバレッジ深度中央値まで同時に配列決定する。いくつかの事例では、網羅された配列決定の読み取りは各々、腫瘍異種性、低い腫瘍純度、及び小さい組織試料に起因して低頻度で生じるゲノム改変の高度に感受性かつ特異的な検出を可能にする、特有のDNA断面を表す。他の事例では、体細胞変異の存在及び/またはレベルは、全エクソーム配列決定によって決定される。いくつかの事例では、体細胞変異の存在及び/またはレベルは、全ゲノム配列決定によって決定される。
前述の方法のいずれにおいても、基準tTMBスコアは、がんを有する基準個体集団内のtTMBスコアであり、個体集団は、PD-L1軸結合アンタゴニスト療法で治療されている第1の個体サブセット及び非PD-L1軸結合アンタゴニスト療法で治療されている第2の個体サブセットからなり、非PD-L1軸結合アンタゴニスト療法は、PD-L1軸結合アンタゴニストを含まない。いくつかの事例では、基準tTMBスコアは、非PD-L1軸結合アンタゴニスト療法での治療に対する応答性と比較した、PD-L1軸結合アンタゴニスト療法での治療に対する応答性の有意差に基づいて、第1及び第2の個体サブセットの各々を有意に分離する。いくつかの事例では、治療に対する応答性は、無増悪生存期間(PFS)、全生存期間、及び/または全奏効率(ORR)の増加である。
前述の方法のいずれにおいても、いくつかの事例では、基準tTMBスコアは、事前に割り当てられたtTMBスコアである。いくつかの事例では、基準tTMBスコアは、1Mb当たり約5~約100個の変異(変異/Mb)、例えば、約5、約6、約7、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、約30、約31、約32、約33、約34、約35、約36、約37、約38、約39、約40、約41、約42、約43、約44、約45、約46、約47、約48、約49、約50、約51、約52、約53、約54、約55、約56、約57、約58、約59、約60、約61、約62、約63、約64、約65、約66、約67、約68、約69、約70、約71、約72、約73、約74、約75、約76、約77、約78、約79、約80、約81、約82、約83、約84、約85、約86、約87、約88、約89、約90、約91、約92、約93、約94、約95、約96、約97、約98、約99、または約100個の変異/Mbである。例えば、いくつかの事例では、基準tTMBスコアは、約8~約30個の変異/Mb(例えば、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、または約30個の変異/Mb)である。いくつかの事例では、基準tTMBスコアは、約10~約20個の変異/Mb(例えば、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、または約20個の変異/Mb)である。特定の事例では、基準tTMBスコアは、10個の変異/Mb、16個の変異/Mb、または20個の変異/Mbであり得る。
前述の方法のいずれかのいくつかの事例では、患者由来の腫瘍試料は、約5個以上の変異/MbのtTMBスコアを有する。例えば、いくつかの事例では、腫瘍試料からのtTMBスコアは、約5~約100個の変異/Mb(例えば、約5、約6、約7、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、約30、約31、約32、約33、約34、約35、約36、約37、約38、約39、約40、約41、約42、約43、約44、約45、約46、約47、約48、約49、約50、約51、約52、約53、約54、約55、約56、約57、約58、約59、約60、約61、約62、約63、約64、約65、約66、約67、約68、約69、約70、約71、約72、約73、約74、約75、約76、約77、約78、約79、約80、約81、約82、約83、約84、約85、約86、約87、約88、約89、約90、約91、約92、約93、約94、約95、約96、約97、約98、約99、または約100個の変異/Mb)である。いくつかの事例では、患者由来の腫瘍試料は、約5、約6、約7、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、約30、約31、約32、約33、約34、約35、約36、約37、約38、約39、約40、約41、約42、約43、約44、約45、約46、約47、約48、約49、または約50個以上の変異/MbのtTMBスコアを有する。例えば、いくつかの事例では、患者由来の腫瘍試料は、約10個以上の変異/MbのtTMBスコアを有する。いくつかの実施形態において、基準tTMBスコアは、10個の変異/Mbである。いくつかの事例では、腫瘍試料からのtTMBスコアは、約10~100個の変異/Mbである。いくつかの事例では、腫瘍試料からのtTMBスコアは、約10~20個の変異/Mbである。いくつかの事例では、患者由来の腫瘍試料は、約16個以上の変異/MbのtTMBスコアを有する。いくつかの事例では、患者由来の腫瘍試料は、約16個以上の変異/MbのtTMBスコアを有し、基準tTMBスコアは、16個の変異/Mbである。他の事例では、患者由来の腫瘍試料は、約20個以上の変異/MbのtTMBスコアを有する。いくつかの事例では、患者由来の腫瘍試料は、約20個以上の変異/MbのtTMBスコアを有し、基準tTMBスコアは、約20個の変異/Mbである。
他の事例では、本発明は、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者を治療する方法を提供し、本方法は、患者由来の腫瘍試料からtTMBスコアを決定することを含み、腫瘍試料からのtTMBスコアは、基準tTMBスコア未満であり、本方法は、個体に、PD-L1軸結合アンタゴニスト以外の治療剤またはそれに加えた治療剤を投与することを更に含む。前述の方法のいずれかのいくつかの事例では、tTMBスコアまたは基準tTMBスコアは、配列決定された塩基の定義された数当たりで計数される体細胞変異の数として表される。例えば、いくつかの事例では、配列決定された塩基の定義された数は、約100kb~約10Mbである。いくつかの事例では、配列決定された塩基の定義された数は、例えば、FOUNDATIONONE(登録商標)パネル)によって評価して、約1.1Mb(例えば、約1.125Mb)である。いくつかの事例では、tTMBスコアまたは基準tTMBスコアは、等価TMB値である。いくつかの事例では、等価TMB値は、全エクソーム配列決定(WES)によって決定される。前述の方法のいずれにおいても、決定されたtTMBスコアは、表1及び/または表2に列挙される遺伝子内で検出される体細胞変異及び/または再配列のレベルを反映し得る。いくつかの事例では、tTMBスコアは、少なくとも約5個以上の変異/Mb(例えば、約5個以上の変異/Mb、約6個以上の変異/Mb、約7個以上の変異/Mb、約8個以上の変異/Mb、約9個以上の変異/Mb、約10個以上の変異/Mb、約11個以上の変異/Mb、約12個以上の変異/Mb、約13個以上の変異/Mb、約14個以上の変異/Mb、約15個以上の変異/Mb、約16個以上の変異/Mb、約17個以上の変異/Mb、約18個以上の変異/Mb、約19個以上の変異/Mb、約20個以上の変異/Mb、約25個以上の変異/Mb、約30個以上の変異/Mb、約35個以上の変異/Mb、約40個以上の変異/Mb、及び約50個以上の変異/Mb)であると決定されている(または決定される)。これは、治療(例えば、PD-L1軸結合アンタゴニストを含む治療)に対する応答性を予測する。いくつかの事例では、治療(例えば、PD-L1軸結合アンタゴニストを含む治療)に対する応答性を予測する変異荷重は、約7個の変異/Mb~約20個の変異/Mbであり得る。いくつかの事例では、治療に対する応答性を予測する変異荷重は、約10個の変異/Mb~約15個の変異/Mbであり得る。いくつかの事例では、治療に対する応答性を予測するtTMBスコアは、約11個の変異/Mb~約13個の変異/Mbであり得る。いくつかの事例では、治療に対する応答性を予測するtTMBスコアは、約12.5個の変異/Mbであり得る。他の事例では、治療に対する応答性を予測するtTMBスコアは、約10個以上の変異/Mb、例えば、約10個以上の変異/Mb、約11個以上の変異/Mb、約12個以上の変異/Mb、約13個以上の変異/Mb、約14個以上の変異/Mb、約15個以上の変異/Mb、約16個以上の変異/Mb、約17個以上の変異/Mb、約18個以上の変異/Mb、約19個以上の変異/Mb、約20個以上の変異/Mbであり得る。
前述の方法のいずれかのいくつかの実施形態において、腫瘍試料中の腫瘍細胞のうちの約1%~約99%(例えば、約1%~約99%、約1%~約90%、約1%~約85%、約1%~約80%、約1%~約75%、約1%~約70%、約1%~約65%、約1%~約60%、約1%~約55%、約1%~約50%、約1%~約45%、約1%~約40%、約1%~約35%、約1%~約30%、約1%~約25%、約1%~約20%、約1%~約15%、約1%~約10%、約1%~約5%、約5%~約50%、約5%~約40%、約5%~約30%、約5%~約20%、約5%~約10%、約50%~約99%、約50%~95%、約50%~約90%、約50%~約85%、約50%~約80%、約50%~約75%、約50%~約70%、約50%~約65%、約50%~約60%、または約50%~約55%)におけるPD-L1の検出可能な発現レベルは、患者がPD-L1結合アンタゴニストでの治療に応答する可能性が高いことを示す。
いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料中の腫瘍細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている。
前述の方法のいずれにおいても、本方法は、患者から得られる腫瘍試料(腫瘍面積)中の腫瘍浸潤性免疫細胞内のPD-L1の発現レベルを決定することを更に含み得る。いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料(腫瘍面積)のうちの1%超(例えば、1%超、2%超、3%超、4%超、5%超、6%超、7%超、8%超、9%超、10%超、20%超、30%超、40%超、または50%超)を構成する腫瘍浸潤性免疫細胞内で、PD-L1の検出可能な発現レベルを有する。例えば、いくつかの事例では、例えば、抗PD-L1抗体を使用して、免疫組織化学によって決定して、腫瘍試料の一切片における腫瘍面積のうちの1%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの5%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの20%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。他の事例では、腫瘍試料の一切片における腫瘍面積のうちの30%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。また他の事例では、腫瘍試料の一切片における腫瘍面積のうちの50%以上を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1軸結合アンタゴニストを含む治療に応答する可能性が高いことを示す。
前述の方法のいずれかのいくつかの実施形態において、腫瘍試料の一切片における腫瘍面積のうちの約1%~約50%(例えば、約1%~約50%、約1%~約45%、約1%~約40%、約1%~約35%、約1%~約30%、約1%~約25%、約1%~約20%、約1%~約15%、約1%~約10%、約1%~約5%、約5%~約50%、約5%~約40%、約5%~約30%、約5%~約20%、約5%~約10%、約10%~約50%、約10%~約40%、約10%~約30%、約10%~約20%、または約10%~約15%)を網羅する、腫瘍浸潤性免疫細胞内のPD-L1の検出可能な発現レベルは、患者がPD-L1結合アンタゴニストでの治療に応答する可能性が高いことを示す。
いくつかの実施形態において、患者から得られる腫瘍試料は、腫瘍試料(腫瘍面積)中の腫瘍浸潤性免疫細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている。
前述の方法のいずれにおいても、患者は、高レベルのマイクロサテライト不安定性を有し得る。例えば、患者は、例えば、MSIならびに2つのペンタヌクレオチド遺伝子座(PentaC及びPendaD)を検出して、正常な試料と腫瘍試料との同一性を確認するための5つの偽性単形性モノヌクレオチド反復配列(BAT-25、BAT-26、NR-21、NR-24、及びMONO-27)で構成されるMSI Analysis System(Promega,Madison,WI)などのPCR系アプローチによって評価して、MSI高(MSI-H)表現型を有し得る。各マイクロサテライト遺伝子座の塩基サイズは、例えば、ゲル電気泳動法によって決定することができ、2つ以上のモノヌクレオチド遺伝子座の長さが生殖系列DNAと比較して変動する場合に、腫瘍は、MSI-Hと表記することができる。例えば、Le et al.NEJM372:2509-2520,2015を参照されたい。他の実施形態において、患者は、低レベルのマイクロサテライト不安定性(例えば、MSI低(MSI-L)を有し得る。
前述の方法のいずれにおいても、PD-L1軸結合アンタゴニストは、当該技術分野で既知であるか、または本明細書、例えば、以下の節Dに記載されるいずれのPD-L1軸結合アンタゴニストであってもよい。
例えば、いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-L1結合アンタゴニスト、PD-1結合アンタゴニスト、またはPD-L2結合アンタゴニストである。いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-L1結合アンタゴニストである。いくつかの事例では、PD-L1結合アンタゴニストは、PD-L1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する。他の事例では、PD-L1結合アンタゴニストは、PD-L1のPD-1への結合を阻害する。また他の事例では、PD-L1結合アンタゴニストは、PD-L1のB7-1への結合を阻害する。いくつかの事例では、PD-L1結合アンタゴニストは、PD-L1のPD-1及びB7-1の両方への結合を阻害する。いくつかの事例では、PD-L1結合アンタゴニストは、抗体である。いくつかの事例では、抗体は、MPDL3280A(アテゾリズマブ)、YW243.55.S70、MDX-1105、MEDI4736(デュルバルマブ)、またはMSB0010718C(アベルマブ)である。いくつかの事例では、抗体は、配列番号19のHVR-H1配列、配列番号20のHVR-H2配列、及び配列番号21のHVR-H3配列を含む重鎖と、配列番号22のHVR-L1配列、配列番号23のHVR-L2配列、及び配列番号24のHVR-L3配列を含む軽鎖とを含む。いくつかの事例では、抗体は、配列番号25のアミノ酸配列を含む重鎖可変領域と、配列番号4のアミノ酸配列を含む軽鎖可変領域とを含む。
いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-1結合アンタゴニストである。例えば、いくつかの事例では、PD-1結合アンタゴニストは、PD-1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する。いくつかの事例では、PD-1結合アンタゴニストは、PD-1のPD-L1への結合を阻害する。他の事例では、PD-1結合アンタゴニストは、PD-1のPD-L2への結合を阻害する。また他の事例では、PD-1結合アンタゴニストは、PD-1のPD-L1及びPD-L2の両方への結合を阻害する。いくつかの事例では、PD-1結合アンタゴニストは、抗体である。いくつかの事例では、抗体は、MDX-1106(ニボルマブ)、MK-3475(ペンブロリズマブ)、CT-011(ピディリズマブ)、MEDI-0680(AMP-514)、PDR001、REGN2810、またはBGB-108である。いくつかの事例では、PD-1結合アンタゴニストは、Fc融合タンパク質である。例えば、いくつかの事例では、Fc融合タンパク質は、AMP-224である。
前述の方法のいずれにおいても、個体は、例えば、肺癌(例えば、非小細胞肺癌(NSCLC)もしくは小細胞肺癌)、腎臓癌(例えば、腎臓尿路上皮癌もしくはRCC)、膀胱癌(例えば、膀胱尿路上皮(移行細胞)癌(例えば、1Lもしくは2L+の局所進行性もしくは転移性癌を含む、局所進行性もしくは転移性尿路上皮癌)、乳癌(例えば、TNBC、HER2+乳癌、もしくはHR+乳癌)、子宮内膜癌、皮膚癌(例えば、皮膚有棘細胞癌)、結腸直腸癌(例えば、結腸腺癌)、卵巣癌、膵臓癌、胃癌、食道癌、中皮腫、黒色腫(例えば、皮膚黒色腫)、頭頸部癌(例えば、頭頸部扁平上皮細胞癌(HNSCC))、甲状腺癌、肉腫(例えば、軟部組織肉腫、線維肉腫、粘液肉腫、脂肪肉腫、骨原性肉腫、骨肉腫、軟骨肉腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、平滑筋肉腫、もしくは横紋筋肉腫)、前立腺癌、膠芽腫、子宮頸癌、胸腺癌、白血病(例えば、急性リンパ球性白血病(ALL)、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、慢性好酸球性白血病、もしくは慢性リンパ球性白血病(CLL))、リンパ腫(例えば、ホジキンリンパ腫もしくは非ホジキンリンパ腫(NHL))、骨髄腫(例えば、多発性骨髄腫(MM))、菌状息肉腫、メルケル細胞癌、血液学的悪性腫瘍、血液組織の癌、B細胞癌、気管支癌、胃癌、脳癌もしくは中枢神経系癌、末梢神経系癌、子宮癌もしくは子宮内膜癌、口腔癌もしくは咽頭癌、肝臓癌、精巣癌、胆道癌、小腸癌もしくは虫垂癌、唾液腺癌、副腎癌、腺癌、炎症性筋線維芽細胞性腫瘍、消化管間質腫瘍(GIST)、結腸癌、骨髄異形成症候群(MDS)、骨髄増殖性疾患(MPD)、真性赤血球増加症、脊索腫、滑膜腫、ユーイング腫瘍、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭状腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌(hepatoma)、胆管癌、絨毛癌、精上皮腫、胎児性癌、ウィルムス腫瘍、膀胱癌(bladder carcinoma)、上皮癌、神経膠腫、星細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞腫、聴神経腫瘍、乏突起神経膠腫、髄膜腫、神経芽腫、網膜芽細胞腫、濾胞性リンパ腫、びまん性大細胞型B細胞リンパ腫、マントル細胞リンパ腫、肝細胞癌(hepatocellular carcinoma)、甲状腺癌、小細胞癌、本態性血小板血症、原発性骨髄線維症、好酸球増加症候群、全身性肥満細胞症、家族性過好酸球増加症、神経内分泌癌、またはカルチノイド腫瘍から選択されるがんを有し得る。
前述の方法のいずれかのいくつかの事例では、個体は、がんの白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療後に進行している。他の事例では、個体は、白金含有レジメン(例えば、白金系化学療法剤を含むレジメン、例えば、シスプラチン系化学療法を含むレジメン)での治療に不適格であり得る、及び/またはがんの事前治療を受けていない。いくつかの事例では、個体は、免疫チェックポイント阻害剤、例えば、PD-L1軸結合アンタゴニストでの事前治療を受けていない。
例えば、前述の事例のいずれにおいても、肺癌は、局所進行性または転移性(例えば、病期IIIB、病期IV、または再発性)NSCLCを含むが、これらに限定されない、NSCLCであり得る。いくつかの事例では、肺癌(例えば、NSCLC)は、切除不能/手術不能な肺癌(例えば、NSCLC)であり得る。他の事例では、肺癌(例えば、NSCLC)は、事前の白金含有レジメンでの治療中または治療後に進行していてもよい。
更なる一態様において、本発明は、医薬品の製造または調製におけるPD-L1軸結合アンタゴニストの使用を提供する。一事例では、医薬品は、がんの治療のためのものである。更なる一事例では、医薬品は、がん(例えば、肺癌、例えば、NSCLC)に罹患している患者に有効量の医薬品を投与することを含む、がんの治療方法において使用するためのものである。そのような一事例では、本方法は、個体に有効量の少なくとも1つの追加の治療剤、例えば、以下に記載されるようなものを投与することを更に含む。
本明細書に記載の方法において利用される組成物(例えば、PD-L1軸結合アンタゴニスト)は、例えば、静脈内、筋肉内、皮下、皮内、経皮、動脈内、腹腔内、病変内、頭蓋内、関節内、前立腺内、胸膜内、気管内、髄腔内、鼻腔内、腟内、直腸内、局所的、腫瘍内、腹膜、結膜下、小胞内、粘膜、心膜内、臍帯内、眼内、眼窩内、経口的、局所的、経皮的、硝子体内(例えば、硝子体内注射により)、点眼により、吸入により、注射により、移植により、注入により、持続注入により、標的細胞を直接的に浸す局所灌流により、カテーテルにより、洗浄により、クリーム中、または脂質組成物中を含む、任意の好適な方法により投与され得る。本明細書に記載の方法において利用される組成物はまた、全身または局所投与され得る。投与方法は、様々な要因(例えば、投与される化合物または組成物、及び治療される病態、疾患、または障害の重症度)に応じて変動し得る。いくつかの事例では、PD-L1軸結合アンタゴニストは、静脈内、筋肉内、皮下、局所、経口的、経皮、腹腔内、眼窩内、移植により、吸入により、髄腔内、脳室内、または鼻腔内投与される。投薬は、投与が短期であるか慢性的であるかに部分的に応じて、任意の好適な経路により、例えば、静脈内注射または皮下注射などの注射により得る。単回または様々な時点にわたる複数回投与、ボーラス投与、及びパルス注入を含むが、これらに限定されない、様々な投薬スケジュールが本明細書で企図される。
本明細書に記載のPD-L1軸結合アンタゴニスト(例えば、抗体、結合ポリペプチド、及び/または小分子)(任意の追加の治療剤)は、良好な医療行為と一致した様式で、製剤化、投薬、及び投与され得る。この文脈において考慮すべき要因には、治療されている特定の障害、治療される特定の哺乳動物、個々の患者の臨床病態、障害の原因、薬剤の送達部位、投与方法、投与スケジュール、及び医療従事者にとって既知である他の要因が含まれる。PD-L1軸結合アンタゴニストは、必須ではないが、任意で、問題の障害を予防または治療するために現在使用されている1つ以上の薬剤と共に製剤化され、及び/またはそれらと同時に投与される。そのような他の薬剤の有効量は、製剤中に存在するPD-L1軸結合アンタゴニストの量、障害または治療の種類、及び上記に考察される他の要因に依存する。これらは一般に、本明細書に記載のものと同じ投薬量で、本明細書に記載の投与経路によって、または本明細書に記載の投薬量の約1~99%、または適切であると経験的/臨床的に決定される任意の投薬量及び任意の経路で使用される。
がん(例えば、肺癌、例えば、NSCLC)の予防または治療のために、(単独で、または1つ以上の他の追加の治療剤と組み合わせて使用される場合の)本明細書に記載のPD-L1軸結合アンタゴニストの適切な投薬量は、治療される疾患の種類、疾患の重症度及び経過、PD-L1軸結合アンタゴニストが予防目的で投与されるか治療目的で投与されるか、以前の治療法、患者の臨床歴及びPD-L1軸結合アンタゴニストに対する応答、ならびに主治医の裁量に依存する。PD-L1軸結合アンタゴニストは、一度に、または一連の治療にわたって患者に好適に投与される。1つの典型的な1日投薬は、上記に言及した要因に応じて、約1μg/kg~100mg/kg以上の範囲であり得る。数日以上にわたる反復投与に関して、病態に応じて、治療は一般に、疾患の症状の所望の抑制が生じるまで持続される。そのような用量は、例えば、毎週または3週間毎に(例えば、患者が、PD-L1軸結合アンタゴニストの用量を、例えば、約2回~約20回、または例えば、約6回受けるように)断続的に投与されてもよい。より高い初期負荷用量に続けて、1つ以上のより低い用量を投与してもよい。しかしながら、他の投薬量レジメンが有用であり得る。この治療法の進行は、従来の技術及びアッセイによって容易に監視される。
例えば、一般的な提案として、ヒトに投与される治療有効量のPD-L1軸結合アンタゴニスト抗体は、1回またはそれ以上の投与によるかどうかに関わらず、患者の体重の約0.01~約50mg/kgの範囲内である。いくつかの事例では、使用される抗体は、約0.01mg/kg~約45mg/kg、約0.01mg/kg~約40mg/kg、約0.01mg/kg~約35mg/kg、約0.01mg/kg~約30mg/kg、約0.01mg/kg~約25mg/kg、約0.01mg/kg~約20mg/kg、約0.01mg/kg~約15mg/kg、約0.01mg/kg~約10mg/kg、約0.01mg/kg~約5mg/kg、または約0.01mg/kg~約1mg/kgであり、これらは、例えば、毎日、毎週、2週間毎、3週間毎、または毎月投与される。いくつかの事例では、抗体は、15mg/kgで投与される。しかしながら、他の投薬量レジメンが有用であり得る。一事例では、本明細書に記載の抗PD-L1抗体は、21日間周期の1日目(3週間毎、q3w)に、約100mg、約200mg、約300mg、約400mg、約500mg、約600mg、約700mg、約800mg、約900mg、約1000mg、約1100mg、約1200mg、約1300mg、約1400mg、約1500mg、約1600mg、約1700mg、または約1800mgの用量でヒトに投与される。いくつかの事例では、抗PD-L1抗体アテゾリズマブ(MPDL3280A)は、3週間毎(q3w)に、1200mgで静脈内投与される。用量は、注入物などの、単回用量として、または複数回用量(例えば、2回用量または3回用量)として投与されてもよい。併用治療において投与される抗体の用量は、単独治療と比較して低減されてもよい。この治療法の進行は、従来の技術によって容易に監視される。
いくつかの事例では、本方法は、患者に有効量の第2の治療剤を投与することを更に伴う。いくつかの事例では、第2の治療剤は、細胞毒性剤、化学療法剤、成長阻害剤、放射線療法剤、血管新生阻害剤、及びそれらの組み合わせからなる群から選択される。いくつかの事例では、PD-L1軸結合アンタゴニストは、化学療法または化学療法剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、放射線療法剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、標的療法または標的療法剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、免疫療法または免疫療法剤、例えば、モノクローナル抗体と併せて投与されてもよい。いくつかの事例では、第2の治療剤は、活性化共刺激分子に対して指向されるアゴニストである。いくつかの事例では、第2の治療剤は、阻害性共刺激分子に対して指向されるアンタゴニストである。いくつかの事例では、PD-L1軸結合アンタゴニストは、単独療法として投与される。
上記のそのような併用療法は、(2つ以上の治療剤が同じ製剤または別個の製剤中に含まれる)併用投与、ならびにPD-L1軸結合アンタゴニストの投与が追加の治療剤(複数可)の投与前、それと同時、及び/またはその後に生じ得る、別個投与を包含する。一事例では、PD-L1軸結合アンタゴニストの投与及び追加の治療剤の投与は、互いの約1ヶ月以内、または約1、2、もしくは3週間以内、または約1、2、3、4、5、もしくは6日以内に生じる。
理論に拘束されることを望むものではないが、活性化共刺激分子を促すことによる、または陰性共刺激分子を阻害することによるT細胞刺激の増強は、腫瘍細胞死を促進することができ、それによりがんを治療するか、またはその進行を遅らせると考えられる。いくつかの事例では、PD-L1軸結合アンタゴニストは、活性化共刺激分子に対して指向されるアゴニストと併せて投与されてもよい。いくつかの事例では、活性化共刺激分子は、CD40、CD226、CD28、OX40、GITR、CD137、CD27、HVEM、またはCD127を含み得る。いくつかの事例では、活性化共刺激分子に対して指向されるアゴニストは、CD40、CD226、CD28、OX40、GITR、CD137、CD27、HVEM、またはCD127に結合するアゴニスト抗体である。いくつかの事例では、PD-L1軸結合アンタゴニストは、阻害性共刺激分子に対して指向されるアンタゴニストと併せて投与されてもよい。いくつかの事例では、阻害性共刺激分子は、CTLA-4(CD152としても知られる)、TIM-3、BTLA、VISTA、LAG-3、B7-H3、B7-H4、IDO、TIGIT、MICA/B、またはアルギナーゼを含み得る。いくつかの事例では、阻害性共刺激分子に対して指向されるアンタゴニストは、CTLA-4、TIM-3、BTLA、VISTA、LAG-3、B7-H3、B7-H4、IDO、TIGIT、MICA/B、またはアルギナーゼに結合するアンタゴニスト抗体である。
いくつかの事例では、PD-L1軸結合アンタゴニストは、CTLA-4(CD152としても知られる)に対して指向されるアンタゴニスト、例えば、遮断抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、イピリムマブ(MDX-010、MDX-101、またはYERVOY(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、トレメリムマブ(チシリムマブまたはCP-675,206としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、B7-H3(CD276としても知られる)に対して指向されるアンタゴニスト、例えば、遮断抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、MGA271と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、TGF-ベータに対して指向されるアンタゴニスト、例えば、メテリムマブ(CAT-192としても知られる)、フレソリムマブ(GC1008としても知られる)、またはLY2157299と併せて投与されてもよい。
いくつかの事例では、PD-L1軸結合アンタゴニストは、キメラ抗原受容体(CAR)を発現するT細胞(例えば、細胞毒性T細胞またはCTL)の養子移入を含む治療と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、ドミナントネガティブTGFベータ受容体、例えば、ドミナントネガティブTGFベータII型受容体を含むT細胞の養子移入を含む治療と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、HERCREEMプロトコル(例えば、ClinicalTrials.gov Identifier NCT00889954を参照されたい)を含む治療と併せて投与されてもよい。
いくつかの事例では、PD-L1軸結合アンタゴニストは、CD137(TNFRSF9、4-1BB、またはILAとしても知られる)に対して指向されるアゴニスト、例えば、活性化抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、ウレルマブ(別名、BMS-663513)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CD40に対して指向されるアゴニスト、例えば、活性化抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CP-870893と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、OX40(CD134としても知られる)に対して指向されるアゴニスト、例えば活性化抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、抗OX40抗体(例えば、AgonOX)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CD27に対して指向されるアゴニスト、例えば、活性化抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CDX-1127と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、インドールアミン-2,3-ジオキシゲナーゼ(IDO)に対して指向されるアンタゴニストと併せて投与されてもよい。いくつかの事例では、IDOアンタゴニストは、1-メチル-D-トリプトファン(1-D-MTとしても知られる)である。
いくつかの事例では、PD-L1軸結合アンタゴニストは、抗体薬物複合体と併せて投与されてもよい。いくつかの事例では、抗体薬物複合体は、メルタンシンまたはモノメチルオーリスタチンE(MMAE)を含む。いくつかの事例では、PD-L1軸結合アンタゴニストは、抗NaPi2b抗体-MMAE複合体(DNIB0600AまたはRG7599としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、トラスツズマブエムタンシン(T-DM1、アド-トラスツズマブエムタンシン、またはKADCYLA(登録商標)、Genentechとしても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、DMUC5754Aと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、エンドセリンB受容体(EDNBR)を標的とする抗体薬物複合体、例えば、MMAEに複合されたEDNBRに対して指向される抗体と併せて投与されてもよい。
いくつかの事例では、PD-L1軸結合アンタゴニストは、抗血管新生剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、VEGFに対して指向される抗体、例えば、VEGF-Aと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、ベバシズマブ(AVASTIN(登録商標)、Genentechとしても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、アンジオポエチン2(Ang2としても知られる)に対して指向される抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、MEDI3617と併せて投与されてもよい。
いくつかの事例では、PD-L1軸結合アンタゴニストは、抗新生物剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CSF-1R(M-CSFRまたはCD115としても知られる)を標的とする薬剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、抗CSF-1R(IMC-CS4としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、インターフェロン、例えば、インターフェロンアルファまたはインターフェロンガンマと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、Roferon-A(組み換えインターフェロンアルファ-2aとしても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、GM-CSF(組み換えヒト顆粒球マクロファージコロニー刺激因子、rhu GM-CSF、サルグラモスチム、またはLEUKINE(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、IL-2(アルデスロイキンまたはPROLEUKIN(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、IL-12と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CD20を標的とする抗体と併せて投与されてもよい。いくつかの事例では、CD20を標的とする抗体は、オビヌツズマブ(GA101もしくはGAZYVA(登録商標)としても知られる)またはリツキシマブである。いくつかの事例では、PD-L1軸結合アンタゴニストは、GITRを標的とする抗体と併せて投与されてもよい。いくつかの事例では、GITRを標的とする抗体は、TRX518である。
いくつかの事例では、PD-L1軸結合アンタゴニストは、がんワクチンと併せて投与されてもよい。いくつかの事例では、がんワクチンは、ペプチドがんワクチンであり、いくつかの事例では、個別化されたペプチドワクチンである。いくつかの事例では、ペプチドがんワクチンは、多価長鎖ペプチド、マルチペプチド、ペプチドカクテル、ハイブリッドペプチド、またはペプチドパルス樹状細胞ワクチンである(例えば、Yamada et al.,Cancer Sci.104:14-21,2013を参照されたい)。いくつかの事例では、PD-L1軸結合アンタゴニストは、アジュバントと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、TLRアゴニスト、例えば、Poly-ICLC(HILTONOL(登録商標)としても知られる)、LPS、MPL、またはCpG ODNを含む治療と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、腫瘍壊死因子(TNF)アルファと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、IL-1と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、HMGB1と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、IL-10アンタゴニストと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、IL-4アンタゴニストと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、IL-13アンタゴニストと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、HVEMアンタゴニストと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、例えば、ICOS-Lの投与によってICOSアゴニストと併せて、またはICOSに対して指向されるアゴニスト抗体と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CX3CL1を標的とする治療剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CXCL9を標的とする治療剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CXCL10を標的とする治療剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、CCL5を標的とする治療剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、LFA-1またはICAM1アゴニストと併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、セレクチンアゴニストと併せて投与されてもよい。
いくつかの事例では、PD-L1軸結合アンタゴニストは、標的療法と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、B-Rafの阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、ベムラフェニブ(ZELBORAF(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、ダブラフェニブ(TAFINLAR(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、エルロチニブ(TARCEVA(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、MEK1(MAP2K1としても知られる)またはMEK2(MAP2K2としても知られる)などのMEKの阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、コビメチニブ(GDC-0973またはXL-518としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、トラメチニブ(MEKINIST(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、K-Rasの阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、c-Metの阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、オナルツズマブ(MetMAbとしても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、Alkの阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、AF802(CH5424802またはアレクチニブとしても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、ホスファチジルイノシトール3-キナーゼ(PI3K)の阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、BKM120と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、イデラリシブ(GS-1101またはCAL-101としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、ペリホシン(KRX-0401としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、Aktの阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、MK2206と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、GSK690693と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、GDC-0941と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、mTORの阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、シロリムス(ラパマイシンとしても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、テムシロリムス(CCI-779またはTORISEL(登録商標)としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、エベロリムス(RAD001としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、リダフォロリムス(AP-23573、MK-8669、またはデフォロリムスとしても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、OSI-027と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、AZD8055と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、INK128と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、二重PI3K/mTOR阻害剤と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、XL765と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、GDC-0980と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、BEZ235(NVP-BEZ235としても知られる)と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、BGT226と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、GSK2126458と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、PF-04691502と併せて投与されてもよい。いくつかの事例では、PD-L1軸結合アンタゴニストは、PF-05212384(PKI-587としても知られる)と併せて投与されてもよい。
D.本発明の方法において使用するためのPD-L1軸結合アンタゴニスト
患者におけるがん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)を治療するか、またはその進行を遅らせるための方法であって、患者に治療有効量のPD-L1軸結合アンタゴニストを投与することを含む、方法が、本明細書に提供される。がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者が、PD-L1軸結合アンタゴニストを含む治療に応答する可能性があるかを決定するための方法が、本明細書に提供される。がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の、PD-L1軸結合アンタゴニストを含む治療に対する応答性を予測するための方法が、本明細書に提供される。がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)に罹患している患者の治療法を選択するための方法が、本明細書に提供される。前述の方法のいずれも、本明細書に提供される体細胞変異、例えば、腫瘍試料中の表2の表1に列挙される遺伝子の変異のレベルに基づき得る。前述の方法はいずれも、バイオマーカーの発現レベル、例えば、腫瘍試料中(例えば、腫瘍浸潤性免疫細胞内及び/または腫瘍細胞内)のPD-L1発現にも基づき得る。
例えば、PD-L1軸結合アンタゴニストは、PD-1結合アンタゴニスト、PD-L1結合アンタゴニスト、及びPD-L2結合アンタゴニストを含む。PD-1(プログラム死1)はまた、当該技術分野において「プログラム細胞死1」、「PDCD1」、「CD279」、及び「SLEB2」とも称される。例示的なヒトPD-1は、UniProtKB/Swiss-Prot受託番号Q15116に示される。PD-L1(プログラム死リガンド1)はまた、当該技術分野において「プログラム細胞死1リガンド1」、「PDCD1LG1」、「CD274」、「B7-H」、及び「PDL1」とも称される。例示的なヒトPD-L1は、UniProtKB/Swiss-Prot受託番号Q9NZQ7.1に示される。PD-L2(プログラム死リガンド2)はまた、当該技術分野において「プログラム細胞死1リガンド2」、「PDCD1LG2」、「CD273」、「B7-DC」、「Btdc」、及び「PDL2」とも称される。例示的なヒトPD-L2は、UniProtKB/Swiss-Prot受託番号Q9BQ51に示される。いくつかの事例では、PD-1、PD-L1、及びPD-L2は、ヒトPD-1、PD-L1、及びPD-L2である。
いくつかの事例では、PD-1結合アンタゴニストは、PD-1のそのリガンド結合パートナーへの結合を阻害する分子である。特定の一態様において、PD-1リガンド結合パートナーは、PD-L1及び/またはPD-L2である。別の事例では、PD-L1結合アンタゴニストは、PD-L1のその結合リガンドへの結合を阻害する分子である。特定の一態様において、PD-L1結合パートナーは、PD-1及び/またはB7-1である。別の事例では、PD-L2結合アンタゴニストは、PD-L2のそのリガンド結合パートナーへの結合を阻害する分子である。特定の一態様において、PD-L2結合リガンドパートナーは、PD-1である。アンタゴニストは、抗体、その抗原結合断片、イムノアドヘシン、融合タンパク質、またはオリゴペプチドである。
いくつかの事例では、PD-1結合アンタゴニストは、例えば、以下に記載されるような抗PD-1抗体(例えば、ヒト抗体、ヒト化抗体、またはキメラ抗体)である。いくつかの事例では、抗PD-1抗体は、MDX-1106(ニボルマブ)、MK-3475(ペンブロリズマブ)、CT-011(ピディリズマブ)、MEDI-0680(AMP-514)、PDR001、REGN2810、及びBGB-108からなる群から選択される。MDX-1106-04、ONO-4538、BMS-936558、またはニボルマブとしても知られるMDX-1106は、WO2006/121168に記載の抗PD-1抗体である。ペンブロリズマブまたはランブロリズマブとしても知られるMK-3475は、WO2009/114335に記載の抗PD-1抗体である。hBAT、hBAT-1、またはピディリズマブとしても知られるCT-011は、WO2009/101611に記載の抗PD-1抗体である。いくつかの事例では、PD-1結合アンタゴニストは、イムノアドヘシン(例えば、定常領域(例えば、免疫グロブリン配列のFc領域)に融合したPD-L1またはPD-L2の細胞外またはPD-1結合部分を含むイムノアドヘシン)である。いくつかの事例では、PD-1結合アンタゴニストは、AMP-224である。B7-DCIgとしても知られるAMP-224は、WO2010/027827及びWO2011/066342に記載のPD-L2-Fc融合可溶性受容体である。
いくつかの事例では、抗PD-1抗体は、MDX-1106である。「MDX-1106」の代替名には、MDX-1106-04、ONO-4538、BMS-936558、及びニボルマブが含まれる。いくつかの事例では、抗PD-1抗体は、ニボルマブ(CAS登録番号946414-94-4)である。なお更なる事例では、配列番号1からの重鎖可変領域アミノ酸配列を含む重鎖可変領域、及び/または配列番号2からの軽鎖可変領域アミノ酸配列を含む軽鎖可変領域を含む、単離された抗PD-1抗体が提供される。なお更なる事例では、重鎖配列及び/または軽鎖配列を含む単離された抗PD-1抗体が提供され、
(a)重鎖配列は、重鎖配列、QVQLVESGGGVVQPGRSLRLDCKASGITFSNSGMHWVRQAPGKGLEWVAVIWYDGSKRYYADSVKGRFTISRDNSKNTLFLQMNSLRAEDTAVYYCATNDDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(配列番号1)と少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有し、
(b)軽鎖配列は、軽鎖配列、EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQSSNWPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(配列番号2)と少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有する。
いくつかの事例では、PD-L1軸結合アンタゴニストは、PD-L2結合アンタゴニストである。いくつかの事例では、PD-L2結合アンタゴニストは、抗PD-L2抗体(例えば、ヒト抗体、ヒト化抗体、またはキメラ抗体)である。いくつかの事例では、PD-L2結合アンタゴニストは、イムノアドヘシンである。
いくつかの事例では、PD-L1結合アンタゴニストは、例えば、以下に記載されるような抗PD-L1抗体である。いくつかの事例では、抗PD-L1抗体は、PD-L1とPD-1との間及び/またはPD-L1とB7-1との間の結合を阻害することができる。いくつかの事例では、抗PD-L1抗体は、モノクローナル抗体である。いくつかの事例では、抗PD-L1抗体は、Fab、Fab’-SH、Fv、scFv、及び(Fab’)2断片からなる群から選択される抗体断片である。いくつかの事例では、抗PD-L1抗体は、ヒト化抗体である。いくつかの事例では、抗PD-L1抗体は、ヒト抗体である。いくつかの事例では、抗PD-L1抗体は、YW243.55.S70、MPDL3280A(アテゾリズマブ)、MDX-1105、及びMEDI4736(デュルバルマブ)、及びMSB0010718C(アベルマブ)からなる群から選択される。抗体YW243.55.S70は、WO2010/077634に記載の抗PD-L1である。BMS-936559としても知られるMDX-1105は、WO2007/005874に記載の抗PD-L1抗体である。MEDI4736(デュルバルマブ)は、WO2011/066389及びUS2013/034559に記載の抗PD-L1モノクローナル抗体である。本発明の方法に有用な抗PD-L1抗体の例、及びそれらの作製方法は、PCT特許出願第WO2010/077634号、同第WO2007/005874号、同第WO2011/066389号、米国特許第8,217,149号、及びUS2013/034559に記載されており、これらは参照により本明細書に組み込まれる。
WO2010/077634A1及びUS8,217,149に記載の抗PD-L1抗体が、本明細書に記載の方法において使用され得る。いくつかの事例では、抗PD-L1抗体は、配列番号3の重鎖可変領域配列及び/または配列番号4の軽鎖可変領域配列を含む。なお更なる事例では、重鎖可変領域及び/または軽鎖可変領域配列を含む単離された抗PD-L1抗体が提供され、
(a)重鎖配列は、重鎖配列、
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSS(配列番号3)と少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有し、
(b)軽鎖配列は、軽鎖配列、
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR(配列番号4)と少なくとも85%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有する。
一事例では、抗PD-L1抗体は、HVR-H1、HVR-H2、及びHVR-H3配列を含む重鎖可変領域を含み、
(a)HVR-H1配列は、GFTFSX1SWIH(配列番号5)であり、
(b)HVR-H2配列は、AWIX2PYGGSX3YYADSVKG(配列番号6)であり、
(c)HVR-H3配列は、RHWPGGFDY(配列番号7)であり、
式中、X1は、DまたはGであり、X2は、SまたはLであり、X3は、TまたはSである。特定の一態様において、X1は、Dであり、X2は、Sであり、X3は、Tである。別の態様において、ポリペプチドは、式、(FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4)に従うHVR間に並置された可変領域重鎖フレームワーク配列を更に含む。更に別の態様において、フレームワーク配列は、ヒトコンセンサスフレームワーク配列に由来する。更なる一態様において、フレームワーク配列は、VHサブグループIIIコンセンサスフレームワークである。なお更なる一態様において、フレームワーク配列のうちの少なくとも1つは、以下のものである。
FR-H1は、EVQLVESGGGLVQPGGSLRLSCAAS(配列番号8)であり、
FR-H2は、WVRQAPGKGLEWV(配列番号9)であり、
FR-H3は、RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR(配列番号10)であり、
FR-H4は、WGQGTLVTVSS(配列番号11)である。
なお更なる一態様において、重鎖ポリペプチドは、HVR-L1、HVR-L2、及びHVR-L3を含む可変領域軽鎖と更に組み合わされ、
(a)HVR-L1配列は、RASQX4X5X6TX7X8A(配列番号12)であり、
(b)HVR-L2配列は、SASX9LX10S(配列番号13)であり、
(c)HVR-L3配列は、QQX11X12X13X14PX15T(配列番号14)であり、
式中、X4は、DまたはVであり、X5は、VまたはIであり、X6は、SまたはNであり、X7は、AまたはFであり、X8は、VまたはLであり、X9は、FまたはTであり、X10は、YまたはAであり、X11は、Y、G、F、またはSであり、X12は、L、Y、F、またはWであり、X13は、Y、N、A、T、G、F、またはIであり、X14は、H、V、P、T、またはIであり、X15は、A、W、R、P、またはTである。なお更なる一態様において、X4は、Dであり、X5は、Vであり、X6は、Sであり、X7は、Aであり、X8は、Vであり、X9は、Fであり、X10は、Yであり、X11は、Yであり、X12は、Lであり、X13は、Yであり、X14は、Hであり、X15は、Aである。
なお更なる一態様において、軽鎖は、式、(FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4)に従うHVR間に並置された可変領域軽鎖フレームワーク配列を更に含む。なお更なる一態様において、フレームワーク配列は、ヒトコンセンサスフレームワーク配列に由来する。なお更なる一態様において、フレームワーク配列は、VLカッパIコンセンサスフレームワークである。なお更なる一態様において、フレームワーク配列のうちの少なくとも1つは、以下のものである。
FR-L1は、DIQMTQSPSSLSASVGDRVTITC(配列番号15)であり、
FR-L2は、WYQQKPGKAPKLLIY(配列番号16)であり、
FR-L3は、GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC(配列番号17)であり、
FR-L4は、FGQGTKVEIKR(配列番号18)である。
別の事例では、重鎖及び軽鎖可変領域配列を含む単離された抗PD-L1抗体または抗原結合断片が提供され、
(a)重鎖は、HVR-H1、HVR-H2、及びHVR-H3を含み、更に、
(i)HVR-H1配列は、GFTFSX1SWIH(配列番号5)であり、
(ii)HVR-H2配列は、AWIX2PYGGSX3YYADSVKG(配列番号6)であり、
(iii)HVR-H3配列は、RHWPGGFDY(配列番号7)であり、
(b)軽鎖は、HVR-L1、HVR-L2、及びHVR-L3を含み、更に、
(i)HVR-L1配列は、RASQX4X5X6TX7X8A(配列番号12)であり、
(ii)HVR-L2配列は、SASX9LX10S(配列番号13)であり、
(iii)HVR-L3配列は、QQX11X12X13X14PX15T(配列番号14)であり、
式中、X1は、DまたはGであり、X2は、SまたはLであり、X3は、TまたはSであり、X4は、DまたはVであり、X5は、VまたはIであり、X6は、SまたはNであり、X7は、AまたはFであり、X8は、VまたはLであり、X9は、FまたはTであり、X10は、YまたはAであり、X11は、Y、G、F、またはSであり、X12は、L、Y、F、またはWであり、X13は、Y、N、A、T、G、F、またはIであり、X14は、H、V、P、T、またはIであり、X15は、A、W、R、P、またはTである。特定の一態様において、X1は、Dであり、X2は、Sであり、X3は、Tである。別の態様において、X4は、Dであり、X5は、Vであり、X6は、Sであり、X7は、Aであり、X8は、Vであり、X9は、Fであり、X10は、Yであり、X11は、Yであり、X12は、Lであり、X13は、Yであり、X14は、Hであり、X15は、Aである。また別の態様において、X1は、Dであり、X2は、Sであり、X3は、Tであり、X4は、Dであり、X5は、Vであり、X6は、Sであり、X7は、Aであり、X8は、Vであり、X9は、Fであり、X10は、Yであり、X11は、Yであり、X12は、Lであり、X13は、Yであり、X14は、Hであり、X15は、Aである。
更なる一態様において、重鎖可変領域は、(FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4)のようにHVR間に並置された1つ以上のフレームワーク配列を含み、軽鎖可変領域は、(FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4)のようにHVR間に並置された1つ以上のフレームワーク配列を含む。なお更なる一態様において、フレームワーク配列は、ヒトコンセンサスフレームワーク配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、KabatサブグループI、II、またはIII配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、VHサブグループIIIコンセンサスフレームワークである。なお更なる一態様において、重鎖フレームワーク配列のうちの1つ以上は、配列番号8、9、10、及び11として明記される。なお更なる一態様において、軽鎖フレームワーク配列は、KabatカッパI、II、II、またはIVサブグループ配列に由来する。なお更なる一態様において、軽鎖フレームワーク配列は、VLカッパIコンセンサスフレームワークである。なお更なる一態様において、軽鎖フレームワーク配列のうちの1つ以上は、配列番号15、16、17、及び18として明記される。
なお更なる特定の一態様において、抗体は、ヒトまたはマウス定常領域を更に含む。なお更なる一態様において、ヒト定常領域は、IgG1、IgG2、IgG2、IgG3、及びIgG4からなる群から選択される。なお更なる特定の一態様において、ヒト定常領域は、IgG1である。なお更なる一態様において、マウス定常領域は、IgG1、IgG2A、IgG2B、及びIgG3からなる群から選択される。なお更なる一態様において、IgG2Aにおけるマウス定常領域。なお更なる特定の一態様において、抗体は、低減した、または最小のエフェクター機能を有する。なお更なる特定の一態様において、最小のエフェクター機能は、「無エフェクターFc変異」または非グリコシル化から生じる。なお更なる事例では、無エフェクターFc変異は、定常領域内のN297AまたはD265A/N297A置換である。
また別の事例では、重鎖及び軽鎖可変領域配列を含む抗PD-L1抗体が提供され、
(a)重鎖はそれぞれ、GFTFSDSWIH(配列番号19)、AWISPYGGSTYYADSVKG(配列番号20)、及びRHWPGGFDY(配列番号21)と少なくとも85%の配列同一性を有する、HVR-H1、HVR-H2、及びHVR-H3配列を更に含むか、または
(b)軽鎖はそれぞれ、RASQDVSTAVA(配列番号22)、SASFLYS(配列番号23)、及びQQYLYHPAT(配列番号24)と少なくとも85%の配列同一性を有する、HVR-L1、HVR-L2、及びHVR-L3配列を更に含む。
特定の一態様において、配列同一性は、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%である。
別の態様において、重鎖可変領域は、(FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4)のようにHVR間に並置された1つ以上のフレームワーク配列を含み、軽鎖可変領域は、(FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4)のようにHVR間に並置された1つ以上のフレームワーク配列を含む。更に別の態様において、フレームワーク配列は、ヒトコンセンサスフレームワーク配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、KabatサブグループI、II、またはIII配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、VHサブグループIIIコンセンサスフレームワークである。なお更なる一態様において、重鎖フレームワーク配列のうちの1つ以上は、配列番号8、9、10、及び11として明記される。なお更なる一態様において、軽鎖フレームワーク配列は、KabatカッパI、II、II、またはIVサブグループ配列に由来する。なお更なる一態様において、軽鎖フレームワーク配列は、VLカッパIコンセンサスフレームワークである。なお更なる一態様において、軽鎖フレームワーク配列のうちの1つ以上は、配列番号15、16、17、及び18として明記される。
更なる一態様において、重鎖可変領域は、(FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4)のようにHVR間に並置された1つ以上のフレームワーク配列を含み、軽鎖可変領域は、(FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4)のようにHVR間に並置された1つ以上のフレームワーク配列を含む。なお更なる一態様において、フレームワーク配列は、ヒトコンセンサスフレームワーク配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、KabatサブグループI、II、またはIII配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、VHサブグループIIIコンセンサスフレームワークである。なお更なる一態様において、重鎖フレームワーク配列のうちの1つ以上は、以下のものである。
FR-H1 EVQLVESGGGLVQPGGSLRLSCAASGFTFS(配列番号27)
FR-H2 WVRQAPGKGLEWVA(配列番号28)
FR-H3 RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR(配列番号10)
FR-H4 WGQGTLVTVSS(配列番号11)。
なお更なる一態様において、軽鎖フレームワーク配列は、KabatカッパI、II、II、またはIVサブグループ配列に由来する。なお更なる一態様において、軽鎖フレームワーク配列は、VLカッパIコンセンサスフレームワークである。なお更なる一態様において、軽鎖フレームワーク配列のうちの1つ以上は、以下のものである。
FR-L1 DIQMTQSPSSLSASVGDRVTITC(配列番号15)
FR-L2 WYQQKPGKAPKLLIY(配列番号16)
FR-L3 GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC(配列番号17)
FR-L4 FGQGTKVEIK(配列番号26)。
なお更なる特定の一態様において、抗体は、ヒトまたはマウス定常領域を更に含む。なお更なる一態様において、ヒト定常領域は、IgG1、IgG2、IgG2、IgG3、及びIgG4からなる群から選択される。なお更なる特定の一態様において、ヒト定常領域は、IgG1である。なお更なる一態様において、マウス定常領域は、IgG1、IgG2A、IgG2B、及びIgG3からなる群から選択される。なお更なる一態様において、IgG2Aにおけるマウス定常領域。なお更なる特定の一態様において、抗体は、低減した、または最小のエフェクター機能を有する。なお更なる特定の一態様において、最小のエフェクター機能は、「無エフェクターFc変異」または非グリコシル化から生じる。なお更なる事例では、無エフェクターFc変異は、定常領域内のN297AまたはD265A/N297A置換である。
また別の事例では、重鎖及び軽鎖可変領域配列を含む抗PD-L1抗体が提供され、
(c)重鎖はそれぞれ、GFTFSDSWIH(配列番号19)、AWISPYGGSTYYADSVKG(配列番号20)、及びRHWPGGFDY(配列番号21)と少なくとも85%の配列同一性を有する、HVR-H1、HVR-H2、及びHVR-H3配列を更に含む、及び/または、
(d)軽鎖はそれぞれ、RASQDVSTAVA(配列番号22)、SASFLYS(配列番号23)、及びQQYLYHPAT(配列番号24)と少なくとも85%の配列同一性を有する、HVR-L1、HVR-L2、及びHVR-L3配列を更に含む。
特定の一態様において、配列同一性は、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%である。
別の態様において、重鎖可変領域は、(FR-H1)-(HVR-H1)-(FR-H2)-(HVR-H2)-(FR-H3)-(HVR-H3)-(FR-H4)のようにHVR間に並置された1つ以上のフレームワーク配列を含み、軽鎖可変領域は、(FR-L1)-(HVR-L1)-(FR-L2)-(HVR-L2)-(FR-L3)-(HVR-L3)-(FR-L4)のようにHVR間に並置された1つ以上のフレームワーク配列を含む。更に別の態様において、フレームワーク配列は、ヒトコンセンサスフレームワーク配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、KabatサブグループI、II、またはIII配列に由来する。なお更なる一態様において、重鎖フレームワーク配列は、VHサブグループIIIコンセンサスフレームワークである。なお更なる一態様において、重鎖フレームワーク配列のうちの1つ以上は、配列番号8、9、10、及びWGQGTLVTVSSASTK(配列番号29)として明記される。
なお更なる一態様において、軽鎖フレームワーク配列は、KabatカッパI、II、II、またはIVサブグループ配列に由来する。なお更なる一態様において、軽鎖フレームワーク配列は、VLカッパIコンセンサスフレームワークである。なお更なる一態様において、軽鎖フレームワーク配列のうちの1つ以上は、配列番号15、16、17、及び18として明記される。なお更なる特定の一態様において、抗体は、ヒトまたはマウス定常領域を更に含む。なお更なる一態様において、ヒト定常領域は、IgG1、IgG2、IgG2、IgG3、及びIgG4からなる群から選択される。なお更なる特定の一態様において、ヒト定常領域は、IgG1である。なお更なる一態様において、マウス定常領域は、IgG1、IgG2A、IgG2B、及びIgG3からなる群から選択される。なお更なる一態様において、IgG2Aにおけるマウス定常領域。なお更なる特定の一態様において、抗体は、低減した、または最小のエフェクター機能を有する。なお更なる特定の一態様において、最小のエフェクター機能は、「無エフェクターFc変異」または非グリコシル化から生じる。なお更なる事例では、無エフェクターFc変異は、定常領域内のN297AまたはD265A/N297A置換である。
なお更なる事例では、重鎖及び軽鎖可変領域配列を含む単離された抗PD-L1抗体が提供され、
(a)重鎖配列は、重鎖配列、
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSSASTK(配列番号25)と少なくとも85%の配列同一性を有するか、または
(b)軽鎖配列は、軽鎖配列、
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR(配列番号4)と少なくとも85%の配列同一性を有する。
いくつかの事例では、重鎖及び軽鎖可変領域配列を含む単離された抗PD-L1抗体が提供され、軽鎖可変領域配列は、配列番号4のアミノ酸配列と少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有する。いくつかの事例では、重鎖及び軽鎖可変領域配列を含む単離された抗PD-L1抗体が提供され、重鎖可変領域配列は、配列番号25のアミノ酸配列と少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有する。いくつかの事例では、重鎖及び軽鎖可変領域配列を含む単離された抗PD-L1抗体が提供され、軽鎖可変領域配列は、配列番号4のアミノ酸配列と少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有し、重鎖可変領域配列は、配列番号25のアミノ酸配列と少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%の配列同一性を有する。いくつかの事例では、重鎖及び/または軽鎖のN末端の1、2、3、4、または5個のアミノ酸残基は、欠失、置換、または修飾され得る。
なお更なる事例では、重鎖及び軽鎖配列を含む単離された抗PD-L1抗体が提供され、
(a)重鎖配列は、重鎖配列、
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYASTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG(配列番号30)と少なくとも85%の配列同一性を有し、及び/または
(b)軽鎖配列は、軽鎖配列、
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC(配列番号31)と少なくとも85%の配列同一性を有する。
いくつかの事例では、重鎖及び軽鎖配列を含む単離された抗PD-L1抗体が提供され、軽鎖配列は、配列番号31のアミノ酸配列に対して少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する。いくつかの事例では、重鎖及び軽鎖配列を含む単離された抗PD-L1抗体が提供され、重鎖配列は、配列番号30のアミノ酸配列に対して少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する。いくつかの事例では、重鎖及び軽鎖配列を含む単離された抗PD-L1抗体が提供され、軽鎖配列は、配列番号31のアミノ酸配列と少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有し、重鎖配列は、配列番号30のアミノ酸配列と少なくとも85%、少なくとも86%、少なくとも87%、少なくとも88%、少なくとも89%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する。
いくつかの事例では、単離された抗PD-L1抗体は、非グリコシル化されている。抗体のグリコシル化は典型的には、N結合またはO結合のいずれかである。N結合は、炭水化物部分のアスパラギン残基の側鎖への結合を指す。トリペプチド配列であるアスパラギン-X-セリン及びアスパラギン-X-スレオニン(式中、Xは、プロリンを除く任意のアミノ酸である)は、炭水化物部分のアスパラギン側鎖への酵素結合の認識配列である。したがって、ポリペプチド内でのこれらのトリペプチド配列のいずれかの存在により、潜在的なグリコシル化部位が作成される。O結合グリコシル化は、糖類であるN-アセイルガラクトサミン、ガラクトース、またはキシロースのうちの1つの、ヒドロキシアミノ酸、最も一般的にはセリンまたはスレオニンへの結合を指すが、5-ヒドロキシプロリンまたは5-ヒドロキシリジンもまた使用され得る。抗体からのグリコシル化部位の除去は、上記のトリペプチド配列(N結合グリコシル化部位について)のうちの1つが除去されるようにアミノ酸配列を改変することによって好都合に達成される。この改変は、グリコシル化部位内のアスパラギン、セリン、またはスレオニン残基の別のアミノ酸残基(例えば、グリシン、アラニン、または保存的置換)による置換によって行われ得る。
本明細書の事例のいずれにおいても、単離された抗PD-L1抗体は、ヒトPD-L1、例えば、UniProtKB/Swiss-Prot受託番号Q9NZQ7.1に示されるようなヒトPD-L1、またはそのバリアントに結合することができる。
なお更なる事例では、本明細書に記載の抗体のうちのいずれかをコードする単離された核酸が提供される。いくつかの事例では、核酸は、前述の抗PD-L1抗体のいずれかをコードする核酸の発現に好適なベクターを更に含む。なお更なる特定の一態様において、ベクターは、核酸の発現に好適な宿主細胞内にある。なお更なる特定の一態様において、宿主細胞は、真核細胞または原核細胞である。なお更なる特定の一態様において、真核細胞は、チャイニーズハムスター卵巣(CHO)細胞などの哺乳動物細胞である。
抗体またはその結合断片は、当該技術分野で既知の方法を使用して、例えば、発現に好適な形態にある前述の抗PD-L1抗体または抗原結合断片のいずれかをコードする核酸を含有する宿主細胞を、そのような抗体または断片を産生するのに好適な条件下で培養することと、抗体または断片を回収することとを含むプロセスによって作製することができる。
上記に列挙される事例のいずれかにおける使用のための、そのようなPD-L1軸結合アンタゴニスト抗体(例えば、抗PD-L1抗体、抗PD-1抗体、及び抗PD-L2抗体)または本明細書に記載の他の抗体が、以下の節1~7に記載の特徴のうちのいずれかを、単独でまたは組み合わせて有し得ることが明白に企図される。
1.抗体親和性
特定の事例では、本明細書に提供される抗体(例えば、抗PD-L1抗体または抗PD-1抗体)は、≦1μM、≦100nM、≦10nM、≦1nM、≦0.1nM、≦0.01nM、または≦0.001nM(例えば、10-8M以下、例えば、10-8M~10-13M、例えば、10-9M~10-13M)の解離定数(Kd)を有する。
一事例では、Kdは、放射標識抗原結合アッセイ(RIA)によって測定される。一事例では、RIAは、対象となる抗体及びその抗原のFabバージョンを用いて実行される。例えば、Fabの抗体への溶液結合親和性は、非標識抗原の一連の滴定の存在下で、Fabを最低濃度の(125I)標識抗原と平衡させ、その後抗Fab抗体をコーティングしたプレートで結合した抗原を捕捉することによって測定される(例えば、Chen et al.,J.Mol.Biol.293:865-881(1999)を参照されたい)。アッセイのための条件を確立するために、MICROTITER(登録商標)マルチウェルプレート(Thermo Scientific)を、50mMの炭酸塩(pH9.6)中5μg/mlの捕捉用抗Fab抗体(Cappel Labs)で一晩コーティングし、続いてPBS中2重量体積%のウシ血清アルブミンによって室温(約23℃)で2~5時間遮断する。非吸着性プレート(Nunc番号269620)中で、100pMまたは26pMの[125I]-抗原を、対象となるFabの段階希釈液と混合する(例えば、Presta et al.,Cancer Res.57:4593-4599(1997)における抗VEGF抗体、Fab-12の評価と一致)。その後、対象となるFabを一晩インキュベートするが、このインキュベーションは、平衡が達成されることを確実にするために、より長い期間(例えば、約65時間)継続してもよい。その後、混合物を、室温でのインキュベーション(例えば、1時間)のため、捕捉プレートに移す。その後、溶液を除去し、プレートを、PBS中0.1%のポリソルベート20(TWEEN-20(登録商標))で8回洗浄する。プレートが乾燥したら、150μl/ウェルのシンチラント(MICROSCINT-20(商標)、Packard)を添加し、プレートをTOPCOUNT(商標)ガンマ計数器(Packard)で10分間計数する。20%以下の最大結合をもたらす各Fabの濃度を、競合結合アッセイにおいて使用するために選択する。
別の事例に従うと、Kdは、BIACORE(登録商標)表面プラズモン共鳴アッセイを使用して測定される。例えば、BIACORE(登録商標)2000またはBIACORE(登録商標)3000(BIAcore,Inc.,Piscataway,NJ)を使用するアッセイは、約10応答単位(RU)の固定化抗原CM5チップを用いて25℃で実行される。一事例では、カルボキシメチル化デキストランバイオセンサーチップ(CM5、BIACORE,Inc.)は、供給業者の説明書に従って、N-エチル-N’-(3-ジメチルアミノプロピル)-カルボジイミドヒドロクロリド(EDC)及びN-ヒドロキシスクシンイミド(NHS)を用いて活性化される。抗原を10mMの酢酸ナトリウム(pH4.8)で5μg/ml(約0.2μM)に希釈した後、5μl/分の流量で注射して、約10応答単位(RU)の共役タンパク質を達成する。抗原の注射後、1Mのエタノールアミンを注射して、未反応基を遮断する。動態測定のため、Fabの2倍段階希釈物(0.78nM~500nM)を、25℃、約25μl/分の流量で、0.05%のポリソルベート20(TWEEN-20(商標))界面活性剤(PBST)を有するPBS中に注射する。会合速度(kon)及び解離速度(koff)を、単純な1対1ラングミュア結合モデル(BIACORE(登録商標)Evaluation Softwareバージョン3.2)を使用して、会合センサーグラム及び解離センサーグラムを同時に適合することによって計算する。平衡解離定数(Kd)をkoff/kon比として計算する。例えば、Chen et al.,J.Mol.Biol.293:865-881(1999)を参照されたい。上記の表面プラズモン共鳴アッセイによるオンレートが106M-1s-1を超える場合、オンレートは、ストップトフローを備えた分光光度計(Aviv Instruments)、または撹拌キュベットを備えた8000シリーズSLM-AMINCO(商標)分光光度計(ThermoSpectronic)などの分光計で測定して、増加する抗原濃度の存在下で、25℃でのPBS中20nMの抗-抗原抗体(Fab形態)(pH7.2)の蛍光発光強度(励起=295nm、発光=340nm、16nm帯域通過)の増加または減少を測定する蛍光消光技術を使用することによって決定することができる。
2.抗体断片
特定の事例では、本明細書に提供される抗体(例えば、抗PD-L1抗体または抗PD-1抗体)は、抗体断片である。抗体断片には、Fab、Fab’、Fab’-SH、F(ab’)2、Fv、及びscFv断片、ならびに以下に記載の他の断片が含まれるが、これらに限定されない。特定の抗体断片の概説については、Hudson et al.Nat.“Med.”9:129-134(2003)を参照されたい。scFv断片の概説については、例えば、Pluckthun,in The Pharmacology of Monoclonal Antibodies,vol.113,Rosenburg and Moore eds.,(Springer-Verlag,New York),pp.269-315(1994)を参照されたく、WO93/16185及び米国特許第5,571,894号及び同第5,587,458号も参照されたい。サルベージ受容体結合エピトープ残基を含み、増加したインビボ半減期を有するFab及びF(ab’)2断片の考察については、米国特許第5,869,046号を参照されたい。
ダイアボディは、二価または二重特異性であり得る2つの抗原結合部位を有する抗体断片である。例えば、EP404,097、WO1993/01161、Hudson et al.Nat.“Med.”9:129-134(2003)、及びHollinger et al.Proc.Natl.Acad.Sci.USA90:6444-6448(1993)を参照されたい。トリアボディ及びテトラボディもまた、Hudson et al.Nat.“Med.”9:129-134(2003)に記載されている。
単一ドメイン抗体は、抗体の重鎖可変ドメインの全部もしくは一部、または軽鎖可変ドメインの全部もしくは一部を含む、抗体断片である。特定の事例では、単一ドメイン抗体は、ヒト単一ドメイン抗体である(Domantis,Inc.,Waltham,MA、例えば、米国特許第6,248,516B1号を参照されたい)。
抗体断片は、本明細書に記載の、無傷抗体のタンパク分解及び組み換え宿主細胞(例えば、E.coliまたはファージ)による産生を含むが、これらに限定されない、様々な技術によって作製することができる。
3.キメラ抗体及びヒト化抗体
特定の事例では、本明細書に提供される抗体(例えば、抗PD-L1抗体または抗PD-1抗体)は、キメラ抗体である。特定のキメラ抗体は、例えば、米国特許第4,816,567号及びMorrison et al.Proc.Natl.Acad.Sci.USA,81:6851-6855(1984))に記載されている。一例では、キメラ抗体は、非ヒト可変領域(例えば、マウス、ラット、ハムスター、ウサギ、または非ヒト霊長類(サルなど)に由来する可変領域)及びヒト定常領域を含む。更なる一例では、キメラ抗体は、クラスまたはサブクラスが親抗体のクラスまたはサブクラスから変化した「クラススイッチ」抗体である。キメラ抗体には、それらの抗原結合断片が含まれる。
特定の事例では、キメラ抗体は、ヒト化抗体である。典型的には、非ヒト抗体は、非ヒト親抗体の特異性及び親和性を保持しながら、ヒトに対する免疫原性を低減するために、ヒト化される。一般に、ヒト化抗体は、HVR、例えば、CDR(またはそれらの一部分)が非ヒト抗体に由来し、かつFR(またはその一部分)がヒト抗体配列に由来する1つ以上の可変ドメインを含む。ヒト化抗体はまた、任意で、ヒト定常領域の少なくとも一部分も含む。いくつかの事例では、ヒト化抗体内のいくつかのFR残基は、例えば、抗体特異性または親和性を復元または改善するために、非ヒト抗体(例えば、HVR残基が由来する抗体)由来の対応する残基で置換される。
ヒト化抗体及びそれらの作製方法は、例えば、Almagro and Fransson,Front.Biosci.13:1619-1633(2008)に概説され、例えば、Riechmann et al.,Nature332:323-329(1988)、Queen et al.,Proc.Natl.Acad.Sci.USA86:10029-10033(1989)、米国特許第5,821,337号、同第7,527,791号、同第6,982,321号、及び同第7,087,409号、Kashmiri et al.,Methods36:25-34(2005)(特異性決定領域(SDR)移植について記載)、Padlan,Mol.Immunol.28:489-498(1991)(「リサーフェシング」について記載)、Dall’Acqua et al.,Methods36:43-60(2005)(「FRシャッフリング」について記載)、ならびにOsbourn et al.,Methods36:61-68(2005)及びKlimka et al.,Br.J.Cancer,83:252-260(2000)(FRシャッフリングへの「誘導選択」アプローチについて記載)に更に記載されている。
ヒト化に使用され得るヒトフレームワーク領域には、「最良適合」法を使用して選択されるフレームワーク領域(例えば、Sims et al.J.Immunol.151:2296(1993)を参照されたい)、軽鎖可変領域または重鎖可変領域の特定のサブグループのヒト抗体のコンセンサス配列に由来するフレームワーク領域(例えば、Carter et al.Proc.Natl.Acad.Sci.USA,89:4285(1992)、及びPresta et al.J.Immunol.,151:2623(1993)を参照されたい)、ヒト成熟(体細胞変異)フレームワーク領域またはヒト生殖系列フレームワーク領域(例えば、Almagro and Fransson,Front.Biosci.13:1619-1633(2008)を参照されたい)、ならびにFRライブラリのスクリーニングに由来するフレームワーク領域(例えば、Baca et al.,J.Biol.Chem.272:10678-10684(1997)及びRosok et al.,J.Biol.Chem.271:22611-22618(1996)を参照されたい)が含まれるが、これらに限定されない。
4.ヒト抗体
特定の事例では、本明細書に提供される抗体(例えば、抗PD-L1抗体または抗PD-1抗体)は、ヒト抗体である。ヒト抗体は、当該技術分野で既知の様々な技術を使用して産生することができる。ヒト抗体は一般に、van Dijk and van de Winkel,Curr.Opin.Pharmacol.5:368-74(2001)及びLonberg,Curr.Opin.Immunol.20:450-459(2008)に記載されている。
ヒト抗体は、抗原投与に応答して、無傷ヒト抗体またはヒト可変領域を有する無傷抗体を産生するように修飾されているトランスジェニック動物に免疫原を投与することによって調製され得る。そのような動物は典型的には、内因性免疫グロブリン遺伝子座を置換するか、または染色体外に存在するかもしくは動物の染色体内に無作為に組み込まれている、ヒト免疫グロブリン遺伝子座の全部または一部を含有する。そのようなトランスジェニックマウスにおいて、内因性免疫グロブリン遺伝子座は一般に、不活性化されている。トランスジェニック動物からヒト抗体を得るための方法の概説については、Lonberg,Nat.Biotech.23:1117-1125(2005)を参照されたい。また、例えば、XENOMOUSE(商標)技術を記載する米国特許第6,075,181号及び同第6,150,584号、HUMAB(登録商標)技術を記載する米国特許第5,770,429号、K-M MOUSE(登録商標)技術を記載する米国特許第7,041,870号、ならびにVELOCIMOUSE(登録商標)技術を記載する米国特許出願公開第US2007/0061900号も参照されたい。そのような動物によって生成された無傷抗体由来のヒト可変領域は、例えば、異なるヒト定常領域と組み合わせることにより更に修飾され得る。
ヒト抗体はまた、ハイブリドーマに基づく方法によっても作製され得る。ヒトモノクローナル抗体の産生のためのヒト骨髄腫及びマウス-ヒトヘテロ骨髄腫細胞株が、記載されている。(例えば、KozborJ.Immunol.,133:3001(1984)、Brodeur et al.,Monoclonal Antibody Production Techniques and Applications,pp.51-63(Marcel Dekker,Inc.,New York,1987)、及びBoerner et al.,J.Immunol.,147:86(1991)を参照されたい。)ヒトB細胞ハイブリドーマ技術によって生成されるヒト抗体もまた、Li et al.,Proc.Natl.Acad.Sci.USA,103:3557-3562(2006)に記載されている。追加の方法としては、例えば、米国特許第7,189,826号(ハイブリドーマ細胞株からのモノクローナルヒトIgM抗体の産生について記載)及びNi,Xiandai Mianyixue,26(4):265-268(2006)(ヒト-ヒトハイブリドーマについて記載)に記載の方法が挙げられる。ヒトハイブリドーマ技術(トリオーマ技術)はまた、Vollmers and Brandlein,Histology and Histopathology,20(3):927-937(2005)及びVollmers and Brandlein,Methods and Findings in Experimental and Clinical Pharmacology,27(3):185-91(2005)にも記載されている。
ヒト抗体はまた、ヒト由来ファージ提示ライブラリから選択されるFvクローン可変ドメイン配列を単離することによっても生成され得る。その後、そのような可変ドメイン配列は、所望のヒト定常ドメインと組み合わされ得る。抗体ライブラリからヒト抗体を選択するための技術を、以下に記載する。
5.ライブラリ由来抗体
本発明の抗体(例えば、抗PD-L1抗体及び抗PD-1抗体)は、所望の活性(複数可)を有する抗体についてコンビナトリアルライブラリをスクリーニングすることによって単離され得る。例えば、ファージ提示ライブラリを生成し、所望の結合特徴を所有する抗体についてそのようなライブラリをスクリーニングするための様々な方法が当該技術分野で既知である。そのような方法は、例えば、Hoogenboom et al.in Methods in Molecular Biology178:1-37(O’Brien et al.,ed.,Human Press,Totowa,NJ,2001)に概説され、例えば、McCafferty et al.,Nature348:552-554、Clackson et al.,Nature352:624-628(1991)、Marks et al.,J.Mol.Biol.222:581-597(1992)、Marks and Bradbury,in Methods in Molecular Biology248:161-175(Lo,ed.,Human Press,Totowa,NJ,2003)、Sidhu et al.,J.Mol.Biol.338(2):299-310(2004)、Lee et al.,J.Mol.Biol.340(5):1073-1093(2004)、Fellouse,Proc.Natl.Acad.Sci.USA101(34):12467-12472(2004)、及びLee et al.,J.Immunol.Methods284(1-2):119-132(2004)に更に記載されている。
特定のファージ提示法において、VH及びVL遺伝子のレパートリーが、ポリメラーゼ連鎖反応(PCR)によって別個にクローニングされ、ファージライブラリ内で無作為に組み換えられ、これがその後、Winter et al.,Ann.Rev.Immunol.,12:433-455(1994)に記載されるように、抗原結合ファージについてスクリーニングされ得る。ファージは典型的には、一本鎖Fv(scFv)断片またはFab断片のいずれかとして抗体断片を提示する。免疫化源由来のライブラリは、ハイブリドーマの構築を必要とすることなく、高親和性抗体を免疫原に提供する。あるいは、Griffiths et al.,EMBO J,12:725-734(1993)に記載されるように、ナイーブレパートリーを(例えば、ヒトから)クローニングして、いかなる免疫化もなく、広範な非自己抗原及び自己抗原に対する抗体の単一源を提供することができる。最後に、Hoogenboom and Winter,J.Mol.Biol.,227:381-388(1992)に記載されるように、幹細胞由来の再配列されていないV遺伝子セグメントをクローニングし、無作為配列を含有するPCRプライマーを使用して、高度に可変的なCDR3領域をコードし、インビトロでの再配列を達成することによって、ナイーブライブラリを合成的に作製することもできる。ヒト抗体ファージライブラリを記載している特許公開には、例えば、米国特許第5,750,373号、ならびに米国特許公開第2005/0079574号、同第2005/0119455号、同第2005/0266000号、同第2007/0117126号、同第2007/0160598号、同第2007/0237764号、同第2007/0292936号、及び同第2009/0002360号が挙げられる。
ヒト抗体ライブラリから単離された抗体または抗体断片は、本明細書ではヒト抗体またはヒト抗体断片と見なされる。
6.多重特異性抗体
上記の態様のいずれか1つにおいて、本明細書に提供される抗体(例えば、抗PD-L1抗体または抗PD-1抗体)は、多重特異性抗体、例えば、二重特異性抗体であり得る。多重特異性抗体は、少なくとも2つの異なる部位に対する結合特異性を有するモノクローナル抗体である。特定の事例では、本明細書に提供される抗体は、多重特異性抗体、例えば、二重特異性抗体である。特定の事例では、結合特異性の一方は、PD-L1へのものであり、他方は、任意の他の抗原へのものである。特定の事例では、二重特異性抗体は、PD-L1の2つの異なるエピトープに結合し得る。二重特異性抗体を使用して、PD-L1を発現する細胞に細胞毒性剤を局所化することもできる。二重特異性抗体は、完全長抗体または抗体断片として調製され得る。
多重特異性抗体を作製するための技術としては、異なる特異性を有する2つの免疫グロブリン重鎖-軽鎖対の組み換え同時発現(Milstein and Cuello,Nature305:537(1983))、WO93/08829、及びTraunecker et al.,EMBOJ.10:3655(1991)を参照されたい)ならびに「ノブインホール」操作(例えば、米国特許第5,731,168号を参照されたい)が挙げられるが、これらに限定されない。多重特異性抗体はまた、静電ステアリング効果を遺伝子操作して、抗体Fcヘテロ二量体分子を作製すること(例えば、WO2009/089004A1を参照されたい)、2つ以上の抗体または断片を架橋すること(例えば、米国特許第4,676,980号及びBrennan et al.,Science229:81(1985)を参照されたい)、ロイシンジッパーを使用して、二重特異性抗体を作製すること(例えば、Kostelny et al.,J.Immunol.148(5):1547-1553(1992)を参照されたい)、「ダイアボディ」技術を使用して、二重特異性抗体断片を作製すること(例えば、Hollinger et al.,Proc.Natl.Acad.Sci.USA90:6444-6448(1993)を参照されたい)、一本鎖Fv(sFv)二量体を使用すること(例えば、Gruber et al.,J.Immunol.152:5368(1994)を参照されたい)、ならびに例えば、Tutt et al.J.Immunol.147:60(1991)に記載されるような三重特異性抗体を調製することによっても作製することができる。
「オクトパス抗体」を含む、3つ以上の機能的抗原結合部位を有する操作された抗体もまた、本明細書に含まれる(例えば、US2006/0025576A1を参照されたい)。
本明細書の抗体または断片には、PD-L1及び別の異なる抗原に結合する抗原結合部位を含む「二重作用Fab」または「DAF」も含まれる。
7.抗体バリアント
特定の事例では、本発明の抗体(例えば、抗PD-L1抗体及び抗PD-1抗体)のアミノ酸配列バリアントが企図される。例えば、抗体の結合親和性及び/または他の生物学的特性を改善することが望ましい場合がある。抗体のアミノ酸配列バリアントは、抗体をコードするヌクレオチド配列内に適切な修飾を導入することによって、またはペプチド合成によって調製することができる。そのような修飾には、例えば、抗体のアミノ酸配列内の残基からの欠失、及び/またはそれへの挿入、及び/またはその置換が含まれる。最終構築物に到達するように、欠失、挿入、及び置換を任意に組み合わせることができるが、但し、その最終構築物が、所望の特徴、例えば、抗原結合を所有することを条件とする。
I.置換、挿入、及び欠失バリアント
特定の事例では、1つ以上のアミノ酸置換を有する抗体バリアントが提供される。置換型変異誘発の対象となる部位は、HVR及びFRを含む。保存的置換は、「好ましい置換」という見出しの下、表3に示される。より実質的な変化は、「例示的な置換」という見出しの下、表3に提供され、アミノ酸側鎖クラスを参照して以下に更に記載される通りである。アミノ酸置換は、対象となる抗体内に導入され得、その産物は、所望の活性、例えば、抗原結合の保持/改善、免疫原性の減少、または抗体依存性細胞媒介細胞毒性(ADCC)もしくは補体依存性細胞毒性(CDC)の改善についてスクリーニングされ得る。
アミノ酸は、一般的な側鎖特性に従って群分けされ得る:
(1)疎水性:ノルロイシン、Met、Ala、Val、Leu、Ile;
(2)中性親水性:Cys、Ser、Thr、Asn、Gln;
(3)酸性:Asp、Glu;
(4)塩基性:His、Lys、Arg;
(5)鎖配向に影響を及ぼす残基:Gly、Pro;
(6)芳香族:Trp、Tyr、Phe。
非保存的置換は、これらのクラスのうちの1つのメンバーを別のクラスと交換することを伴う。
1種類の置換型バリアントは、親抗体(例えば、ヒト化抗体またはヒト抗体)の1つ以上の超可変領域残基を置換することを伴う。一般に、更なる研究のために選択される結果として得られるバリアント(複数可)は、親抗体と比較して、特定の生物学的特性(例えば、親和性の増加及び/または免疫原性の低減)における修飾(例えば、改善)を有し、及び/または実質的に保持された親抗体の特定の生物学的特性を有することになる。例示的な置換型バリアントは、例えば、本明細書に記載の技術などのファージ提示に基づく親和性成熟技術を使用して好都合に生成され得る親和性成熟抗体である。簡潔には、1つ以上のHVR残基が変異し、バリアント抗体がファージ上に提示され、特定の生物学的活性(例えば、結合親和性)についてスクリーニングされる。
改変(例えば、置換)は、HVRにおいて、例えば、抗体親和性を改善するために行われ得る。そのような改変は、HVR「ホットスポット」、すなわち、体細胞成熟プロセス中に高頻度で変異を受けるコドンによってコードされる残基(例えば、Chowdhury,Methods Mol.Biol.207:179-196(2008)を参照されたい)、及び/または抗原に接触する残基において行われ得、結果として得られるバリアントVHまたはVLが結合親和性について試験される。二次ライブラリを構築し、そこから再選択することによる親和性成熟は、例えば、Hoogenboom et al.in Methods in Molecular Biology178:1-37(O’Brien et al.,ed.,Human Press,Totowa,NJ,(2001))に記載されている。親和性成熟のいくつかの事例では、様々な方法(例えば、エラープローンPCR、鎖シャッフリング、またはオリゴヌクレオチド指向性変異誘発)のいずれかによって、成熟のために選択される可変遺伝子に多様性が導入される。その後、二次ライブラリが作成される。その後、ライブラリをスクリーニングして、所望の親和性を有する任意の抗体バリアントを特定する。多様性を導入するための別の方法は、いくつかのHVR残基(例えば、一度に4~6個の残基)が無作為化されるHVR指向性アプローチを伴う。抗原結合に関与するHVR残基は、例えば、アラニンスキャニング変異誘発またはモデル化を使用して、具体的に特定され得る。特に、CDR-H3及びCDR-L3が標的とされることが多い。
特定の事例では、置換、挿入、または欠失は、そのような改変が抗体の抗原に結合する能力を実質的に低減しない限り、1つ以上のHVR内で生じ得る。例えば、結合親和性を実質的に低減しない保存的改変(例えば、本明細書に提供されるような保存的置換)が、HVR内で行われ得る。そのような改変は、例えば、HVR内の抗原接触残基の外側であってもよい。上記に提供されるバリアントVH配列及びVL配列の特定の事例では、各HVRは、改変されていないか、または1つ、2つ、もしくは3つ以下のアミノ酸置換を含有するかのいずれかである。
変異誘発の標的とされ得る抗体の残基または領域の特定のための有用な方法は、「アラニンスキャニング変異誘発」と呼ばれ、Cunningham and Wells(1989)Science,244:1081-1085に記載されている。この方法では、標的残基の残基または基(例えば、Arg、Asp、His、Lys、及びGluなどの荷電残基)を特定し、中性または負に荷電したアミノ酸(例えば、アラニンまたはポリアラニン)で置換して、抗体の抗原との相互作用が影響を受けたかを決定する。更なる置換が、最初の置換に対する機能的感受性を示すアミノ酸位置に導入され得る。あるいは、または加えて、抗体と抗原との間の接触点を特定するための抗原-抗体複合体の結晶構造。そのような接触残基及び隣接する残基が、置換の候補として標的とされてもよく、または排除されてもよい。バリアントをスクリーニングして、それらが所望の特性を含有するかを決定することができる。
アミノ酸配列挿入には、長さが1残基から100個以上の残基を含有するポリペプチドの範囲であるアミノ末端及び/またはカルボキシル末端の融合物、ならびに単一または複数のアミノ酸残基の配列内挿入が含まれる。末端挿入の例には、N末端メチオニル残基を有する抗体が含まれる。抗体分子の他の挿入バリアントには、酵素(例えば、ADEPTのための)またはポリペプチドへの抗体のN末端もしくはC末端の融合物が挙げられ、これは抗体の血清半減期を増加させる。
II.グリコシル化バリアント
特定の事例では、本発明の抗体を改変して、抗体がグリコシル化する程度を増加または減少させることができる。本発明の抗体へのグリコシル化部位の付加または欠失は、1つ以上のグリコシル化部位を作成または除去するようにアミノ酸配列を改変することによって、好都合に達成することができる。
抗体がFc領域を含む場合、それに結合した炭水化物が改変され得る。哺乳動物細胞によって産生される天然抗体は典型的には、N結合によってFc領域のCH2ドメインのAsn297に一般に結合する分岐状の二分岐オリゴ糖を含む。例えば、Wright et al.TIBTECH15:26-32(1997)を参照されたい。オリゴ糖には、様々な炭水化物、例えば、マンノース、N-アセチルグルコサミン(GlcNAc)、ガラクトース、及びシアル酸、ならびに二分岐オリゴ糖構造の「幹」のGlcNAcに結合したフコースが含まれ得る。いくつかの事例では、特定の特性が改善された抗体バリアントを作製するために、本発明の抗体内のオリゴ糖の修飾が行われ得る。
一事例では、Fc領域に結合した(直接的にまたは間接的に)フコースを欠く炭水化物構造を有する抗体バリアントが提供される。例えば、そのような抗体内のフコースの量は、1%~80%、1%~65%、5%~65%、または20%~40%であり得る。フコースの量は、例えば、WO2008/077546に記載のMALDI-TOF質量分析法によって測定して、Asn297に結合した全ての糖構造(例えば、複合体、ハイブリッド、及び高マンノース構造)の合計に対する、Asn297での糖鎖内のフコースの平均量を計算することによって決定される。Asn297は、Fc領域内の約297位(Fc領域残基のEU番号付け)に位置するアスパラギン残基を指すが、Asn297はまた、抗体におけるわずかな配列変化に起因して、297位から約±3アミノ酸、上流または下流、すなわち、294~300位の間に位置してもよい。そのようなフコシル化バリアントは、改善されたADCC機能を有し得る。例えば、米国特許公開第US2003/0157108号及び同第US2004/0093621号を参照されたい。「脱フコシル化」または「フコース欠損」抗体バリアントに関する出版物の例としては、US2003/0157108、WO2000/61739、WO2001/29246、US2003/0115614、US2002/0164328、US2004/0093621、US2004/0132140、US2004/0110704、US2004/0110282、US2004/0109865、WO2003/085119、WO2003/084570、WO2005/035586、WO2005/035778、WO2005/053742、WO2002/031140、Okazaki et al.J.Mol.Biol.336:1239-1249(2004)、Yamane-Ohnuki et al.Biotech.Bioeng.87:614(2004)が挙げられる。脱フコシル化抗体を産生することができる細胞株の例には、タンパク質フコシル化が欠損したLec13 CHO細胞(Ripka et al.Arch.Biochem.Biophys.249:533-545(1986)、米国特許出願第US2003/0157108A1号、及びAdamsらのWO2004/056312A1(特に実施例11))、ならびにアルファ-1,6-フコシルトランスフェラーゼ遺伝子、FUT8、ノックアウトCHO細胞などのノックアウト細胞株(例えば、Yamane-Ohnuki et al.Biotech.Bioeng.87:614(2004)、Kanda,Y.et al.,Biotechnol.Bioeng.,94(4):680-688(2006)、及びWO2003/085107を参照されたい)が含まれる。
例えば、抗体のFc領域に結合した二分岐オリゴ糖がGlcNAcによって二分されている、二分されたオリゴ糖を有する抗体バリアントが、更に提供される。そのような抗体バリアントは、低減したフコシル化及び/または改善されたADCC機能を有し得る。そのような抗体バリアントの例は、例えば、WO2003/011878、米国特許第6,602,684号、及びUS2005/0123546に記載されている。Fc領域に結合したオリゴ糖内に少なくとも1つのガラクトース残基を有する抗体バリアントもまた、提供される。そのような抗体バリアントは、改善されたCDC機能を有し得る。そのような抗体バリアントは、例えば、WO1997/30087、WO1998/58964、及びWO1999/22764に記載されている。
III.Fc領域バリアント
特定の事例では、1つ以上のアミノ酸修飾が本発明の抗体のFc領域内に導入され得、それによりFc領域バリアントが生成され得る。Fc領域バリアントは、1つ以上のアミノ酸位置にアミノ酸修飾(例えば、置換)を含むヒトFc領域配列(例えば、ヒトIgG1、IgG2、IgG3、またはIgG4 Fc領域)を含み得る。
特定の事例では、本発明は、全てではないがいくつかのエフェクター機能を所有し、それによりインビボでの抗体の半減期が重要であるが、更に特定のエフェクター機能(補体及びADCCなど)が不要または有害である用途にとって望ましい候補となる、抗体バリアントを企図する。インビトロ及び/またはインビボ細胞毒性アッセイを実行して、CDC及び/またはADCC活性の低減/欠乏を確認することができる。例えば、Fc受容体(FcR)結合アッセイを実行して、抗体がFcγR結合を欠く(故にADCC活性を欠く可能性が高い)が、FcRn結合能力を保持していることを確実にすることができる。ADCCを媒介するための初代細胞であるNK細胞が、FcγRIIIのみを発現する一方で、単球は、FcγRI、FcγRII、及びFcγRIIIを発現する。造血細胞でのFcR発現は、Ravetch and Kinet,Annu.Rev.Immunol.9:457-492(1991)の464頁の表3に要約されている。対象となる分子のADCC活性を評価するためのインビトロアッセイの非限定的な例は、米国特許第5,500,362号(例えば、Hellstrom,I.et al.Proc.Natl.Acad.Sci.USA83:7059-7063(1986)を参照されたい)及びHellstrom,I et al.,Proc.Natl.Acad.Sci.USA82:1499-1502(1985)、米国特許第5,821,337号(Bruggemann,M.et al.,J.Exp.“Med.”166:1351-1361(1987)を参照されたい)に記載されている。あるいは、非放射性アッセイ法を用いてもよい(例えば、フローサイトメトリーのためのACTI(商標)非放射性細胞毒性アッセイ(CellTechnology,Inc.Mountain View,CA)、及びCYTOTOX96(登録商標)非放射性細胞毒性アッセイ(Promega,Madison,WI)を参照されたい)。そのようなアッセイに有用なエフェクター細胞には、末梢血単核細胞(PBMC)及びナチュラルキラー(NK)細胞が含まれる。あるいは、または加えて、対象となる分子のADCC活性は、インビボで、例えば、Clynes et al.Proc.Natl.Acad.Sci.USA95:652-656(1998)に開示されるものなどの動物モデルにおいて評価されてもよい。C1q結合アッセイを実行して、抗体がC1qに結合することができず、故にCDC活性を欠くことを確認することもできる。例えば、WO2006/029879及びWO2005/100402におけるC1q及びC3c結合ELISAを参照されたい。補体活性化を評価するために、CDCアッセイが実行されてもよい(例えば、Gazzano-Santoro et al.,J.Immunol.Methods202:163(1996)、Cragg et al.,Blood.101:1045-1052(2003)、及びCragg et al.,Blood.103:2738-2743(2004)を参照されたい)。FcRn結合及びインビボクリアランス/半減期決定もまた、当該技術分野で既知の方法を使用して実行することができる(例えば、Petkova et al.Int’l.Immunol.18(12):1759-1769(2006)を参照されたい)。
低減したエフェクター機能を有する抗体としては、Fc領域残基238、265、269、270、297、327、及び329のうちの1つ以上の置換を有するものが挙げられる(米国特許第6,737,056号及び同第8,219,149号)。そのようなFc変異体は、アラニンへの残基265及び297の置換を有するいわゆる「DANA」Fc変異体を含む、アミノ酸265位、269位、270位、297位、及び327位のうちの2つ以上において置換を有するFc変異体を含む(米国特許第7,332,581号及び同第8,219,149号)。
FcRへの結合が改善または縮小された特定の抗体バリアントが、記載されている。(例えば、米国特許第6,737,056号、WO2004/056312、及びShields et al.,J.Biol.Chem.9(2):6591-6604(2001)を参照されたい。)
特定の事例では、抗体バリアントは、ADCCを改善する1つ以上のアミノ酸置換、例えば、Fc領域の298位、333位、及び/または334位(残基のEU番号付け)での置換を有するFc領域を含む。
いくつかの事例では、例えば、米国特許第6,194,551号、WO99/51642、及びIdusogie et al.J.Immunol.164:4178-4184(2000)に記載されるように、改変(すなわち、改善または縮小のいずれか)したC1q結合及び/または補体依存性細胞毒性(CDC)をもたらす改変が、Fc領域内で行われる。
半減期が増加し、かつ母体IgGの胎児への移入に関与する新生児型Fc受容体(FcRn)への結合が改善された抗体(Guyer et al.,J.Immunol.117:587(1976)及びKim et al.,J.Immunol.24:249(1994))が、US2005/0014934A1(Hintonら)に記載されている。それらの抗体は、FcRnへのFc領域の結合を改善する、1つ以上の置換を内部に有するFc領域を含む。そのようなFcバリアントは、Fc領域残基、238、256、265、272、286、303、305、307、311、312、317、340、356、360、362、376、378、380、382、413、424、または434のうちの1つ以上での置換、例えば、Fc領域残基434の置換を有するものを含む(米国特許第7,371,826号)。
Fc領域バリアントの他の例に関しては、Duncan&Winter,Nature322:738-40(1988)、米国特許第5,648,260号、米国特許第5,624,821号、及びWO94/29351も参照されたい。
IV.システイン操作された抗体バリアント
特定の事例では、抗体の1つ以上の残基がシステイン残基で置換されているシステイン操作された抗体、例えば、「thioMAb」を作成することが望ましい場合がある。特定の事例では、置換された残基は、抗体のアクセス可能な部位で生じる。それらの残基をシステインで置換することによって、反応性チオール基が抗体のアクセス可能な部位に位置付けられ、それらを使用して、抗体を他の部分(薬物部分またはリンカー-薬物部分など)に複合して、本明細書に更に記載される免疫複合体を作成することができる。特定の事例では、以下の残基のうちのいずれか1つ以上を、システインで置換することができる:軽鎖のV205(Kabat番号付け)、重鎖のA118(EU番号付け)、及び重鎖Fc領域のS400(EU番号付け)。システイン操作された抗体は、例えば、米国特許第7,521,541号に記載されるように生成することができる。
V.抗体誘導体
特定の事例では、本明細書に提供される抗体は、当該技術分野で既知であり、かつ容易に入手可能な追加の非タンパク質性部分を含有するように更に修飾され得る。抗体の誘導体化に好適な部分には、水溶性ポリマーが含まれるが、これらに限定されない。水溶性ポリマーの非限定的な例としては、ポリエチレングリコール(PEG)、エチレングリコール/プロピレングリコールのコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニルアルコール、ポリビニルピロリドン、ポリ-1,3-ジオキソラン、ポリ-1,3,6-トリオキサン、エチレン/無水マレイン酸コポリマー、ポリアミノ酸(ホモポリマーまたはランダムコポリマーのいずれか)、及びデキストランまたはポリ(n-ビニルピロリドン)ポリエチレングリコール、プロプロピレングリコールホモポリマー、プロリプロピレンオキシド/エチレンオキシドコポリマー、ポリオキシエチル化ポリオール(例えば、グリセロール)、ポリビニルアルコール、ならびにこれらの混合物が含まれるが、これらに限定されない。ポリエチレングリコールプロピオンアルデヒドは、水中でのその安定性のため、製造時に有利であり得る。ポリマーは、いずれの分子量のものであってもよく、分岐状であっても非分岐状であってもよい。抗体に結合するポリマーの数は変動し得、2つ以上のポリマーが結合する場合、それらは同じ分子であっても異なる分子であってもよい。一般に、誘導体化に使用されるポリマーの数及び/または種類は、改善される抗体の特定の特性または機能、抗体誘導体が定義された条件下にある治療法に使用されるかなどを含むが、これらに限定されない、考慮すべき要因に基づいて決定され得る。
別の事例では、放射線への曝露によって選択的に加熱され得る抗体及び非タンパク質性部分の複合体が、提供される。一事例では、非タンパク質性部分は、カーボンナノチューブである(Kam et al.,Proc.Natl.Acad.Sci.USA102:11600-11605(2005))。放射線は、いずれの波長のものであってもよく、通常の細胞は傷つけないが、抗体-非タンパク質性部分に近位の細胞が殺滅される温度まで非タンパク質性部分を加熱する波長を含むが、これらに限定されない。
VI.免疫複合体
本方法はまた、化学療法剤もしくは化学療法薬、成長阻害剤、毒素(例えば、タンパク質毒素、細菌、真菌、植物、もしくは動物起源の酵素活性毒素、またはそれらの断片)、あるいは放射性同位体などの1つ以上の細胞毒性剤に複合された、本明細書の抗体(例えば、抗PD-L1抗体または抗PD-1抗体)を含む免疫複合体も提供する。
一事例では、免疫複合体は、抗体が1つ以上の薬物に複合された抗体薬物複合体(ADC)であり、この薬物としては、マイタンシノイド(米国特許第5,208,020号、同第5,416,064号、及び欧州特許第EP0425235B1号を参照されたい);モノメチルオーリスタチン薬物部分DE及びDFなどのオーリスタチン(MMAE及びMMAF)(米国特許第5,635,483号及び同第5,780,588号及び同第7,498,298号を参照されたい);ドラスタチン;カリケアマイシンまたはその誘導体(米国特許第5,712,374号、同第5,714,586号、同第5,739,116号、同第5,767,285号、同第5,770,701号、同第5,770,710号、同第5,773,001号、及び同第5,877,296号、Hinman et al.,Cancer Res.53:3336-3342(1993)、及びLode et al.,Cancer Res.58:2925-2928(1998))を参照されたい);ダウノマイシンまたはドキソルビシンなどのアントラサイクリン(Kratz et al.,Current Med.Chem.13:477-523(2006)、Jeffrey et al.,Bioorganic&Med.Chem.Letters16:358-362(2006)、Torgov et al.,Bioconj.Chem.16:717-721(2005)、Nagy et al.,Proc.Natl.Acad.Sci.USA97:829-834(2000)、Dubowchik et al.,Bioorg.&Med.Chem.Letters12:1529-1532(2002)、King et al.,J.Med.Chem.45:4336-4343(2002)、及び米国特許第6,630,579号を参照されたい);メトトレキサート;ビンデシン;ドセタキセル、パクリタキセル、ラロタキセル、テセタキセル、及びオルタタキセルなどのタキサン;トリコテセン;ならびにCC1065が含まれるが、これらに限定されない。
別の事例では、免疫複合体は、ジフテリアA鎖、ジフテリア毒素の非結合活性断片、外毒素A鎖(Pseudomonas aeruginosa由来)、リシンA鎖、アブリンA鎖、モデシンA鎖、アルファ-サルシン、Aleurites fordiiタンパク質、ジアンシンタンパク質、Phytolaca americanaタンパク質(PAPI、PAPII、及びPAP-S)、momordica charantia阻害剤、クルシン、クロチン、sapaonaria officinalis阻害剤、ゲロニン、ミトゲリン、レストリクトシン、フェノマイシン、エノマイシン、及びトリコテセンを含むが、これらに限定されない、酵素的に活性な毒素またはその断片に複合された、本明細書に記載の抗体を含む。
別の事例では、免疫複合体は、放射性原子に複合されて、放射性複合体を形成する、本明細書に記載の抗体を含む。放射性複合体の産生には、様々な放射性同位体が利用可能である。例としては、At211、I131、I125、Y90、Re186、Re188、Sm153、Bi212、P32、Pb212、及びLuの放射性同位体が挙げられる。放射性複合体が検出に使用される場合、それは、シンチグラフィー研究のための放射性原子、例えば、tc99mもしくはI123、または核磁気共鳴(NMR)画像法(磁気共鳴画像法、mriとしても知られる)のためのスピン標識、例えば、この場合もやはりヨウ素-123、ヨウ素-131、インジウム-111、フッ素-19、炭素-13、窒素-15、酸素-17、ガドリニウム、マンガン、もしくは鉄を含み得る。
抗体及び細胞毒性剤の複合体は、N-スクシンイミジル-3-(2-ピリジルジチオ)プロピオネート(SPDP)、スクシンイミジル-4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレート(SMCC)、イミノチオラン(IT)、イミドエステルの二官能性誘導体(例えば、アジプイミド酸ジメチルHCl)、活性エステル(例えば、スベリン酸ジスクシンイミジル)、アルデヒド(例えば、グルタルアルデヒド)、ビス-アジド化合物(例えば、ビス(p-アジドベンゾイル)ヘキサンジアミン)、ビス-ジアゾニウム誘導体(例えば、ビス-(p-ジアゾニウムベンゾイル)-エチレンジアミン)、ジイソシアネート(例えば、トルエン2,6-ジイソシアネート)、及びビス-活性フッ素化合物(例えば、1,5-ジフルオロ-2,4-ジニトロベンゼン)などの様々な二官能性タンパク質共役剤を使用して作製され得る。例えば、リシン免疫毒素は、Vitetta et al.,Science238:1098(1987)に記載されるように調製され得る。炭素-14で標識された1-イソチオシアナトベンジル-3-メチルジエチレントリアミンペンタ酢酸(MX-DTPA)は、放射性ヌクレオチドの抗体への複合のための例示的なキレート剤である。WO94/11026を参照されたい。リンカーは、細胞内での細胞毒性薬の放出を促進する「切断可能リンカー」であり得る。例えば、酸不安定性リンカー、ペプチダーゼ感受性リンカー、感光性リンカー、ジメチルリンカー、またはジスルフィド含有リンカー(Chari et al.,Cancer Res.52:127-131(1992)、米国特許第5,208,020号)が使用され得る。
本明細書の免疫複合体またはADCは、(例えば、Pierce Biotechnology,Inc.,Rockford,IL.,U.S.Aから)市販されているBMPS、EMCS、GMBS、HBVS、LC-SMCC、MBS、MPBH、SBAP、SIA、SIAB、SMCC、SMPB、SMPH、スルホ-EMCS、スルホ-GMBS、スルホ-KMUS、スルホ-MBS、スルホ-SIAB、スルホ-SMCC、スルホ-SMPB、及びSVSB(スクシンイミジル-(4-ビニルスルホン)安息香酸塩)を含むが、これらに限定されない架橋剤試薬で調製されるそのような複合体を明白に企図するが、これらに限定されない。
V.薬学的製剤
本発明に従って使用されるPD-L1軸結合アンタゴニストなどの免疫チェックポイント阻害剤の治療製剤(例えば、抗PD-L1抗体(例えば、MPDL3280A))は、所望の程度の純度を有するアンタゴニストを、凍結乾燥された製剤または水溶液の形態にある任意の薬学的に許容される担体、賦形剤、または安定剤と混合することによって、保管のために調製される。製剤に関する一般的な情報に関しては、例えば、Gilman et al.(eds.)The Pharmacological Bases of Therapeutics,8th Ed.,Pergamon Press,1990、A.Gennaro(ed.),Remington’s Pharmaceutical Sciences,18th Edition,Mack Publishing Co.,Pennsylvania,1990、Avis et al.(eds.)Pharmaceutical Dosage Forms:Parenteral Medications Dekker,New York,1993、Lieberman et al.(eds.)Pharmaceutical Dosage Forms:Tablets Dekker,New York,1990;Lieberman et al.(eds.),Pharmaceutical Dosage Forms:Disperse Systems Dekker,New York,1990、及びWalters(ed.)Dermatological and Transdermal Formulations(Drugs and the Pharmaceutical Sciences),Vol119,Marcel Dekker,2002を参照されたい。
許容される担体、賦形剤、または安定剤は、用いられる投薬量及び濃度で受容者にとって非毒性であり、リン酸、クエン酸、及び他の有機酸などの緩衝液;アスコルビン酸及びメチオニンを含む抗酸化剤;保存剤(オクタデシルジメチルベンジル塩化アンモニウム;塩化ヘキサメトニウム;塩化ベンザルコニウム;塩化ベンゼトニウム;フェノール、ブチル、またはベンジルアルコール;メチルまたはプロピルパラベンなどのアルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3-ペンタノール;及びm-クレゾールなど);低分子量(約10残基未満)ポリペプチド;血清アルブミン、ゼラチン、もしくは免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン、もしくはリジンなどのアミノ酸;単糖類、二糖類、及びグルコース、マンノース、もしくはデキストリンを含む他の炭水化物;EDTAなどのキレート剤;スクロース、マンニトール、トレハロース、もしくはソルビトールなどの糖;ナトリウムなどの塩形成対イオン;金属錯体(例えば、Zn-タンパク質錯体);及び/またはTWEEN(商標)、PLURONICS(商標)、もしくはポリエチレングリコール(PEG)などの非イオン性界面活性剤を含む。
本明細書の製剤はまた、2つ以上の活性化合物、好ましくは、互いに悪影響を及ぼさない相補的活性を有するものも含有し得る。そのような医薬品の種類及び有効量は、例えば、製剤中に存在するアンタゴニストの量及び種類、ならびに対象の臨床的パラメータに依存する。
活性成分はまた、例えば、コアセルベーション技術または界面重合によって調製されたマイクロカプセル、例えば、それぞれ、ヒドロキシメチルセルロースまたはゼラチンマイクロカプセル及びポリ-(メチルメタシレート)マイクロカプセル内に、コロイド薬物送達系(例えば、リポソーム、アルブミンマイクロスフェア、マイクロ乳濁液、ナノ粒子、及びナノカプセル)中に、またはマクロ乳濁液中にも取り込まれ得る。そのような技術は、Remington’s Pharmaceutical Sciences16th edition,Osol,A.Ed.(1980)に開示されている。
徐放性調製物が調製され得る。徐放性調製物の好適な例としては、アンタゴニストを含有する固体疎水性ポリマーの半透性マトリクスが挙げられ、このマトリクスは、成型物品、例えば、フィルムまたはマイクロカプセルの形態にある。徐放性マトリックスの例としては、ポリエステル、ヒドロゲル(例えば、ポリ(2-ヒドロキシエチル-メタクリレート)またはポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号)、L-グルタミン酸とγエチル-L-グルタメートとのコポリマー、非分解性エチレン酢酸ビニル、分解性乳酸-グリコール酸コポリマー、例えば、LUPRON DEPOT(商標)(乳酸-グリコール酸コポリマー及び酢酸ロイプロリドからなる注射用ミクロスフェア)、及びポリ-D-(-)-3-ヒドロキシ酪酸が挙げられる。
インビボ投与に使用される製剤は、滅菌されなければならない。これは、滅菌濾過膜を通す濾過によって容易に達成される。
上記の製造品のうちのいずれも、PD-L1軸結合アンタゴニストの代わりに、またはそれに加えて本明細書に記載の免疫複合体を含み得ることが理解される。
VI.診断キット及び製造品
本明細書に記載されるように、個体由来の試料(例えば、ホルマリン固定パラフィン包埋(FFPE)腫瘍試料、保存記録用腫瘍試料、新鮮な腫瘍試料、または凍結腫瘍試料)から組織腫瘍変異負荷(tTMB)スコアを決定することによって、免疫チェックポイント阻害剤、例えば、PD-L1軸結合アンタゴニストを含む治療から利益を受け得るがん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)を有する個体を特定するための1つ以上の試薬を含む診断キットが、本明細書に提供される。
任意で、本キットは、個体由来の試料から得られるtTMBスコアが基準tTMBスコア以上である場合に、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)を治療するための薬品(例えば、免疫チェックポイント阻害剤、例えば、PD-L1軸結合アンタゴニスト、例えば、抗PD-L1抗体、例えば、MPDL3280A)を選択するために、キットを使用するための説明書を更に含み得る。別の事例では、説明書は、個体由来の試料から得られるtTMBスコアが基準tTMBスコア未満である場合に、免疫チェックポイント阻害剤、例えば、PD-L1軸結合アンタゴニスト以外の、またはそれに加えた抗がん療法を選択するために本キットを使用するためのものである。
いくつかの事例では、本キットは、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)を有する個体または患者由来の試料中の体細胞変異の存在を決定するための1つ以上の試薬を含み得る。いくつかの事例では、試料中の体細胞変異の存在は、個体をPD-L1軸結合アンタゴニストなどの免疫チェックポイント阻害剤で治療したときに有効である可能性がより高いことを示す。いくつかの事例では、試料中の体細胞変異の不在は、疾患を有する個体をPD-L1軸結合アンタゴニストなどの免疫チェックポイント阻害剤で治療したときに有効である可能性がより低いことを示す。本診断キットはまた、疾患または障害(例えば、非小細胞肺癌を含むがん)を有する個体または患者由来の試料中のバイオマーカー(例えば、腫瘍細胞内及び/または腫瘍浸潤性免疫細胞内の、例えば、PD-L1発現レベル)の存在を決定するための1つ以上の試薬も含み得る。いくつかの事例では、試料中のバイオマーカーの存在は、個体をPD-L1軸結合アンタゴニストなどの免疫チェックポイント阻害剤で治療したときに有効である可能性がより高いことを示す。いくつかの事例では、試料中のバイオマーカーの不在は、疾患を有する個体を免疫チェックポイント阻害剤、例えば、PD-L1軸結合アンタゴニストで治療したときに有効である可能性がより低いことを示す。任意で、本キットには、個体が試料中に体細胞変異を有する場合に、キットを使用して、疾患または障害を治療するための医薬品(例えば、PD-L1軸結合アンタゴニスト、例えば、抗PD-L1抗体、例えば、アテゾリズマブ(MPDL3280A))を選択するための説明書が更に含まれ得る。別の事例では、説明書は、個体が試料中にバイオマーカーを発現しない場合に、キットを使用して、免疫チェックポイント阻害剤(例えば、PD-L1軸結合アンタゴニスト)以外の医薬品を選択するためのものである。
薬学的に許容される担体中のPD-L1軸結合アンタゴニスト(例えば、抗PD-L1抗体)と、PD-L1軸結合アンタゴニスト(例えば、抗PD-L1抗体)が、決定されたtTMBスコア/体細胞変異の存在に基づいて、がん(例えば、肺癌(例えば、NSCLC)、膀胱癌(例えば、UC)、腎臓癌(例えば、RCC)、乳癌(例えば、TNBC)、または黒色腫)を有する患者を治療するものであることを示す添付文書とを同封して含む製造品もまた、本明細書に提供される。治療方法には、本明細書に開示される治療方法のいずれかが含まれる。本発明はまた、PD-L1軸結合アンタゴニスト(例えば、抗PD-L1抗体)を含む薬学的組成物と、その薬学的組成物が、決定されたtTMBスコア/体細胞変異(例えば、腫瘍細胞内の、例えば、表1及び/または表2に列挙される遺伝子内の体細胞変異)の存在に基づいて、がんを有する患者を治療するためのものであることを示す添付文書とをパッケージ中に組み合わせることを含む、製造品を製造するための方法にも関する。
製造品は、例えば、容器、及び容器上のまたは容器に関連する標識または添付文書を含んでもよい。好適な容器には、例えば、ボトル、バイアル、シリンジなどが含まれる。容器は、ガラスまたはプラスチックなどの様々な材料から形成され得る。容器は、がんの医薬品を活性薬剤として含む組成物を保持または収容し、滅菌アクセスポートを有し得る(例えば、容器は、皮下注射針によって穿刺可能なストッパーを有する静脈用溶液袋またはバイアルであり得る)。
製造品は、注射用静菌水(BWFI)、リン酸緩衝食塩水、リンガー溶液、及び/またはデキストロース溶液などの薬学的に許容される希釈緩衝液を含む第2の容器を更に含んでもよい。製造品は、他の緩衝液、希釈剤、フィルター、針、及びシリンジを含む、商業的観点及びユーザの観点から望ましい他の材料を更に含んでもよい。
本発明の製造品はまた、例えば添付文書の形態で、組成物が、個体のtTMBスコア(例えば、体細胞変異(複数可)の存在)に基づいて、及び/または本明細書の異なるバイオマーカーの発現(例えば、腫瘍細胞内及び/または腫瘍浸潤性免疫細胞内の、例えば、PD-L1発現レベル)に基づいて、がんを治療するために使用されることを示す情報も含む。添付文書または標識は、紙面または電子媒体上(磁気記録媒体(例えば、フロッピーディスク)、CD-ROM、汎用シリアルバス(USB)フラッシュドライブなど))などの任意の形態を取ることができる。標識または添付文書は、はまた、キットまたは製造品中の薬学的組成物及び剤形に関する他の情報も含み得る。
実施例1:方法
腫瘍組織試料中で検出される体細胞変異のレベル(例えば、組織腫瘍変異負荷(tTMB)とも称される、変異荷重)と、非小細胞肺癌(NSCLC)腫瘍におけるPD-L1発現及びPD-L1軸結合アンタゴニストでの治療に対するそれらの独立した寄与との間の相関性を評価した。PD-L1軸結合アンタゴニスト(抗PD-L1抗体)であるアテゾリズマブ(MPDL3280A)での治療に対する応答は、単独療法としてアテゾリズマブを投与する第II相及び第III相臨床試験に登録した患者において観察された。これらの臨床試験を、表4及び表5に要約する。
研究設計
単独療法としてアテゾリズマブを投与する3つの第II相臨床試験(BIRCH、FIR、及びPOPLAR;表4及び5)のうちの1つに登録した、2L+のNSCLCを有する465人の患者からの事前治療腫瘍検体を、組織腫瘍変異負荷(tTMB)について評価した。1LのNSCLC患者からの腫瘍検体もまた、BIRCH研究及びFIR研究において評価した。
tTMBについて評価したBIRCH(臨床試験ID番号NCT02031458)患者集団は、340人の患者からなり、アテゾリズマブ治療を受けない2人の患者を含んだ。BIRCH集団の有効性分析は、これら2人の未治療の患者を除外した。患者は、局所進行性または転移性(例えば、病期IIIB、病期IV、または再発性)NSCLC;腫瘍浸潤性免疫細胞(IC)内及び/または腫瘍細胞(TC)内のPD-L1発現に基づいて、免疫組織化学(IHC)アッセイによって決定されるPD-L1陽性腫瘍状態;RECIST v1.1によって定義される測定可能な疾患;ならびに0または1の米国東海岸がん臨床試験グループ(ECOG)の全身状態を有する場合に、BIRCH研究への登録に適格であるものとした。患者が臨床的利益を経験している限り、すなわち、許容できない毒性、または疾患進行に起因する症状の悪化がない限り、患者は3週間毎に1200mgの用量のアテゾリズマブを静脈内に受けた。
tTMBについて評価したFIR(臨床試験ID番号NCT01846416)患者集団は、33人の患者からなった。患者は、病期IIIB(例えば、根治的化学放射線療法による治療に不適格)、病期IV、または再発性NSCLC;IHCアッセイによって決定されるPD-L1陽性状態;0または1のECOGの全身状態;12週間以上の平均余命;RECIST v1.1によって定義される測定可能な疾患;ならびに適切な血液学的機能及び終末器官機能を有する場合に、FIR研究への登録に適格であるものとした。患者は、疾患進行まで、各21日間周期の1日目に1200mgのアテゾリズマブの静脈内用量を受けた。
tTMBについて評価したPOPLAR(臨床試験ID番号NCT01903993)患者集団は、92人の患者からなり、いかなる研究治療も受けない3人の患者を含んだ。患者は、局所進行性または転移性(例えば、病期IIIB、病期IV、または再発性)NSCLC;局所進行性、切除不能/手術不能、もしくは転移性NSCLCについて、事前の白金含有レジメンでの治療中もしくは治療後の疾患進行、または白金系アジュバント/ネオアジュバントレジメンでの治療の6ヶ月以内の疾患再発;RECIST v1.1によって定義される測定可能な疾患;ならびに0または1のECOGの全身状態を有する場合に、POPLAR研究への登録に適格であるものとした。参加者を無作為化して、3週間毎に1200mgの用量のアテゾリズマブを静脈内、または3週間毎に1平方メートル当たり75mg(mg/m2)の用量のドセタキセルを静脈内のいずれかで受けさせた。参加者が臨床的利益を経験している限り、すなわち、許容できない毒性、または疾患進行に起因する症状の悪化がない限り、アテゾリズマブでの治療を継続することができた。第III相OAK試験(臨床試験ID番号NCT02008227)の患者からの事前治療腫瘍試料もまた、tTMBについて評価した。患者は、局所進行性または転移性(例えば、病期IIIB、病期IV、または再発性)NSCLC;局所進行性、切除不能/手術不能、もしくは転移性NSCLCについて、事前の白金含有レジメンでの治療中もしくは治療後の疾患進行、または白金系アジュバント/ネオアジュバントレジメンでの治療の6ヶ月以内の疾患再発;RECIST v1.1によって定義される測定可能な疾患;ならびに0または1のECOGの全身状態を有する場合に、OAK研究への登録に適格であるものとした。参加者を無作為化して、3週間毎に1200mgの用量のアテゾリズマブを静脈内、または3週間毎に1平方メートル当たり75mg(mg/m2)の用量のドセタキセルを静脈内のいずれかで受けさせた。参加者が臨床的利益を経験している限り、すなわち、許容できない毒性、または疾患進行に起因する症状の悪化がない限り、アテゾリズマブでの治療を継続することができた。
これら4つの臨床試験を、以下の表4に要約する。3つの第II相試験の有効性成績を、以下の表5に要約する。単一群PD-L1選択試験であるBIRCH及びFIRからのデータを組み合わせ、分析して、PD-L1に選択された患者間のtTMBと臨床成績との間の関連を試験した。無作為化PD-L1未選択試験であるPOPLARからのデータを別個に分析し、アテゾリズマブ治療群とドセタキセル治療群との間の治療効果を比較した。
組織腫瘍変異負荷(tTMB)分析
体細胞変異を特定するために、腫瘍試料(例えば、保存記録用腫瘍試料)を、Frampton et al.Nat.Biotechnol.31:1023-31,2013に記載されるように処理した。配列決定ライブラリを構築して、試料を配列決定し、分析した。標準的な変異処理に加えて、それぞれ表1または表2の検出された体細胞変異及び/または再配列の数に基づいて、エクソームまたはゲノム全体に外挿する、変異荷重推定アルゴリズムを適用した。変異荷重推定のため、表1及び表2に列挙される遺伝子内で検出された全てのコーディングショートバリアント改変、塩基置換、及び挿入欠失を計数した。更に、既知の発癌性ドライバー変異を除いて、表1及び表2に列挙される遺伝子内の同義改変を含む全てのコーディング改変(塩基置換及び挿入欠失)を計数した。しかしながら、検出された改変の多数のクラス、つまり非コーディング改変;既知の(COSMICデータベース(Forbes et al.(2014) Nucl.Acids Res.43:D805-11)内の既知の体細胞改変として生じる)及び見込みある(腫瘍抑制遺伝子内の切断)機能状態を有する改変;dbSNPデータベース(Sherry et al.(2001)Nucleic Acids Res.29(1):308-11)内の既知の生殖系列改変;ExACデータベース(Exome Aggregation Consortium(ExAC)、Cambridge,MA)内の2つ以上の計数で生じる生殖系列改変;評価される検体において生殖系列であると予測される改変;ならびに60,000超の臨床検体のコホートにおいて生殖系列であると予測される改変は計数しなかった。最後に、メガベース当たりの変異荷重を計算するために、計数した変異の総数を、現在の試験バージョンについては1.110メガベース(Mb)であった本試験のコード領域標的領域で除した。全ての試料の平均中央値カバレッジ値は、490であった。
BEPは、ベースライン腫瘍試料から少なくとも1つのtTMB測定を有する患者として定義した。腫瘍は、それらの変異負荷(例えば、変異荷重)に基づいて、分位サブグループにカテゴリー化した。25%の分位は、分析した集団内の全tTMB値の25%以上のtTMB値によって定義し、50%の分位(すなわち、中央値)は、分析した集団内の全tTMB値の50%以上のtTMB値によって定義し、75%の分位は、分析した集団内の全tTMB値の75%以上のtTMB値によって定義した。腫瘍はまた、tTMBカットオフ、例えば、16個以上の変異/メガベース(変異/Mb)及び20個以上の変異/Mbに基づいて、サブグループにカテゴリー化した。
PD-L1発現分析
PD-L1発現を、VENTANA PD-L1 SP142免疫組織化学(IHC)アッセイを用いてTC及びIC上で評価し、表6にあるようにスコア化した。例えば、IHC分析プロトコルは、抗原を回収し、遮断し、一次抗PD-L1抗体と共にインキュベーションする前に、ホルマリン固定パラフィン包埋組織切片を脱パラフィン化することを必要とした。二次抗体と共にインキュベートし、酵素着色した後、切片を対比染色し、一連のアルコール及びキシレンで脱水した後、カバースリップした。POPLAR集団の長期間の経過観察は、TC及びIC上でのPD-L1発現が低いか、またはそれを有しない患者はまた、アテゾリズマブから臨床的利益を導出することができることを示唆している(図1)。
実施例2:局所進行性及び転移性癌を有する患者におけるアテゾリズマブ治療と、変異荷重との関連の試験
アテゾリズマブ有効性の分析
BIRCH、FIR、及びPOPLAR臨床試験のOS、PFS、及びORRエンドポイントを、定義されたtTMBカットオフ(例えば、25%、50%、及び75%のtTMB四分位、または9個以上、16個以上、もしくは20個以上の変異/MbなどのtTMBカットオフ)に対して評価した。BIRCH研究及びFIR研究について、各tTMBカットオフ超(TMB高)のサブグループ及び各tTMBカットオフ未満(TMB低)のサブグループの有効性結果を比較した。POPLARについて、TMB高サブグループ及びTMB低サブグループのアテゾリズマブ群及びドセタキセル群での有効性結果を比較した。BEPのtTMB中央値は、9.9個/Mb(範囲、0~444;第25~第75分位、5.41~16.22)であった。tTMB中央値は、NSCLCを有するPD-L1未選択患者(POPLAR)ならびにPD-L1選択患者(BIRCH及びFIR)において同じであった。アテゾリズマブ試験による、かつ分位カットオフにわたるtTMB分布を、表7に提示する。
組織TMBは、BIRCH研究及びFIR研究において、NSCLCを有するPD-L1選択2L+の患者におけるアテゾリズマブの有効性の改善に関連することが見出された(図2A~2B及び表8)。より高いtTMBは、応答頻度の増加と相関した(図2A)。各分位カットオフで、TMB低サブグループと比較して、TMB高サブグループにおいてより高いORR(RECIST v1.1に従って確認)が観察された(表8)。PFS及びOS利益の増加の勾配が、tTMBの増加と共に観察された(それぞれ図2B~2C)。
BIRCH及びFIR患者集団におけるtTMBと有効性エンドポイントとの関連の要約を、表8に提示する。
追加のデータは、tTMBが、FIR研究及びBIRCH研究において評価した全ての系統にわたってアテゾリズマブの有効性の改善に関連することを示した。組織TMBは、BIRCH及びFIRの全(すなわち、1L及び2L+の両方)集団における応答に関連した(図6)。例えば、全集団において、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において改善されたPFSの利益が観察された(図7A及び7B)。9個以上の変異/Mb及び16個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の1Lの患者において改善されたPFSの利益に向かう傾向が存在した(図7C及び7D)。改善されたPFSの利益はまた、75%以上の四分位及び85%以上の四分位のカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の2L+の患者でも観察された(図7E及び7F)。加えて、改善されたOSの利益はまた、全集団において、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者でも観察された(図8A及び8B)。9個以上の変異/Mb及び16個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の1Lの患者において改善されたOSの利益に向かう傾向が存在した(図8C及び8D)。改善されたOSの利益はまた、75%以上の四分位及び85%以上の四分位のカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の2L+の患者でも観察された(図8E及び8F)。
この分析は、無作為化POPLAR研究における、ドセタキセルと比較した、NSCLCを有するPD-L1未選択2L+の患者におけるtTMBとアテゾリズマブの有効性の改善との関連に向かう傾向を示す(図3A~3B)。特にPFSについて、利益の勾配が、tTMBの増加と共に観察された(図3A)。POPLAR患者集団におけるtTMBと有効性エンドポイントとの関連の要約を、表9に提示する。より高いORR(RECIST v1.1に従って確認)は、アテゾリズマブで治療した患者におけるtTMBの増加に関連した一方で、ドセタキセルで治療した患者は、tTMBの増加と共にORRの改善を経験しなかった。例えば、より高いORRは、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において観察された(図9B)。更なる分析は、tTMBがPOPLARにおいてPFSの増加に関連することを明らかにした。例えば、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において改善されたPFSの利益が観察された(図10A及び10B)。高TMBはまた、POPLARにおいてOSの増加にも関連した。例えば、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において改善されたOSの利益が観察された(図11A及び11B)。
組織TMBはまた、OAK研究において、アテゾリズマブからの有効性の改善にも関連した。例えば、より高いORRは、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において観察された(図9A)。組織TMBはまた、POPLARにおいてPFSの増加にも関連した。例えば、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において改善されたPFSの利益が観察された(図12A及び12B)。OAKにおいて、高TMBのNSCLCで、OSの増加に向かう傾向もまた存在した。例えば、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において改善されたOSの利益が観察された(図13A及び13B)。図14A~14Cは、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較した、TMB高サブグループ内の患者における奏効期間を示す(図14A~14C)。
表10は、9個以上の変異/Mb及び16個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者が、1LのBIRCH/FIR患者集団及び2L+のOAK患者集団におけるPFS中央値の改善に関して、アテゾリズマブから臨床的利益の改善を有することを示す。表11は、9個以上の変異/Mb及び16個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者が、1LのBIRCH/FIR患者集団及び2L+のOAK患者集団におけるOS中央値の改善に関して、アテゾリズマブから臨床的利益の改善を有することを示す。
既存の免疫を有する腫瘍(例えば、TC及び/またはIC上での高PD-L1発現を有する腫瘍)が、PD-L1/PD-1阻害剤に応答して富化することを考慮して、tTMBとTCまたはIC上でのPD-L1発現との関連もまた試験した。tTMBとTCまたはIC上でのPD-L1発現レベルとの関連を、図4に提示する。BIRCH試験、FIR試験、及びPOPLAR試験からのデータを組み合わせて、tTMBと、PD-L1発現及びアテゾリズマブ応答に対するそれらの独立した寄与との相関性を分析した。アテゾリズマブに対する応答は、TCまたはIC上でのtTMB及び/またはPD-L1発現レベルの増加と共に増加した(図5)。本明細書に提示される結果は、初めて、NSCLCを有する2L+の患者(無作為化設定にあるものを含む)におけるtTMBとアテゾリズマブ単独療法の有効性との関連を示す。この関連は、PD-L1選択患者及びPD-L1未選択患者の両方において観察された。組織TMBは、ドセタキセルの有効性には関連していなかった。加えて、アテゾリズマブに対する応答の増加は、TCまたはIC上でのtTMB及び/またはPD-L1発現レベルの増加と共に観察された。
まとめると、これらのデータは、単独で、またはPD-L1発現(例えば、TCまたはICのPD-L1発現)と組み合わせて使用して、PD-L1軸結合アンタゴニストでの治療から客観的奏効及びPFSの利益を導出する、NSCLCを有する患者を富化することができる、予測バイオマーカーの候補としてのtTMBを更に支持する。
実施例3:高tTMBは、がん適応症にわたって、アテゾリズマブに対する応答に関連する
高tTMBは、一般的及び希少ながん適応症にわたって特定されている(図18)。したがって、高tTMBは、抗PD-L1抗体アテゾリズマブなどのPD-L1軸結合アンタゴニストに応答する可能性がある患者を特定するために使用することができる、がん不可知論バイオマーカーとして機能し得る。
この考えを評価するために、tTMBとアテゾリズマブに対する応答との関連を、いくつかの異なるがん型において評価した。実施例2に記載されるように、高tTMBは、16個以上の変異/Mb及び20個以上の変異/MbのtTMBカットオフを含む、1L及び2L+のNSCLCにおいてアテゾリズマブに対する応答に関連した。加えて、tTMBの増加は、IMvigor210研究(臨床試験ID番号NCT02951767)のコホート1の1Lのシスプラチン不適格の転移性尿路上皮癌(mUC)患者において、ORRの増加(図15A)、PFSの延長(図15B)、及びOSの延長(図15C)に関連した。IMvigor210研究の1Lのシスプラチン不適格のmUC患者において、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において改善されたOSの利益が観察された(図15D及び15E)。tTMBの増加はまた、IMvigor210研究(臨床試験ID番号NCT02108652)のコホート2の2L+のmUC患者において、ORRの増加(図16A)、PFSの延長(図16B)、及びOSの延長(図16C)にも関連した。IMvigor210研究の2L+のmUC患者において、16個以上の変異/Mb及び20個以上の変異/Mbのカットオフで、TMB低サブグループと比較して、TMB高サブグループ内の患者において改善されたOSの利益が観察された(図16D及び6E)。組織TMBは、IMvigor210研究において、16個以上の変異/Mb及び20個以上の変異/Mbカットオフで、1L及び2LのmUC患者においてORRの改善に関連した(図17)。IMvigor210の1Lのシスプラチン不適格の患者及び2L+のmUC患者において、56人/294人(19%)は16個以上の変異/MbのtTMBを有し、6人の患者はTMB高かつマイクロサテライト不安定性高(MSI高)の両方であり、これらの患者は83%のORRを有した(図19)。したがって、1L設定及び2L+設定の両方において、いくつかの異なるがん適応症にわたって、16個以上の変異/Mb及び20個以上の変異/Mbカットオフで、アテゾリズマブからの治療効果の改善が観察された。
まとめると、これらのデータは、抗PD-L1抗体アテゾリズマブなどのPD-L1軸結合アンタゴニストからの治療効果を改善するための、がん不可知論バイオマーカーとしてのtTMBの使用を支持する。
更なる実施形態
[1]PD-L1軸結合アンタゴニストを含む治療から利益を受け得るがんを有する個体を特定する方法であって、前記個体由来の腫瘍試料から組織腫瘍変異負荷(tTMB)スコアを決定することを含み、基準tTMBスコア以上である前記腫瘍試料からのtTMBスコアが、前記個体を、PD-L1軸結合アンタゴニストを含む治療から利益を受け得る個体として特定する、前記方法。
[2]がんを有する個体のための治療法を選択するための方法であって、前記個体由来の腫瘍試料からtTMBスコアを決定することを含み、基準tTMBスコア以上である前記腫瘍試料からのtTMBスコアが、前記個体を、PD-L1軸結合アンタゴニストを含む治療から利益を受け得る個体として特定する、前記方法。
[3]前記腫瘍試料から決定される前記tTMBスコアが、前記基準tTMBスコア以上であり、前記方法が、前記個体に有効量のPD-L1軸結合アンタゴニストを投与することを更に含む、[1]または[2]に記載の方法。
[4]前記腫瘍試料から決定される前記tTMBスコアが、前記基準tTMBスコア未満である、[1]または[2]に記載の方法。
[5]がんを有する個体を治療する方法であって、
(a)前記個体由来の腫瘍試料からtTMBスコアを決定することであって、前記腫瘍試料からのtTMBスコアが、基準tTMBスコア以上である、前記決定することと、
(b)有効量のPD-L1軸結合アンタゴニストを前記個体に投与することと、を含む、前記方法。
[6]がんを有する個体を治療する方法であって、前記個体に有効量のPD-L1軸結合アンタゴニストを投与することを含み、前記投与前に、基準tTMBスコア以上であるtTMBスコアが、前記個体由来の腫瘍試料から決定されている、前記方法。
[7]前記基準tTMBスコアが、前記がんを有する基準個体集団内のtTMBスコアであり、前記個体集団が、PD-L1軸結合アンタゴニスト療法で治療されている第1の個体サブセット及び非PD-L1軸結合アンタゴニスト療法で治療されている第2の個体サブセットからなり、前記非PD-L1軸結合アンタゴニスト療法が、PD-L1軸結合アンタゴニストを含まない、[1]~[6]のいずれか1項に記載の方法。
[8]前記基準tTMBスコアが、前記非PD-L1軸結合アンタゴニスト療法での治療に対する応答性と比較した、前記PD-L1軸結合アンタゴニスト療法での治療に対する応答性の有意差に基づいて、前記第1及び第2の個体サブセットの各々を有意に分離する、[7]に記載の方法。
[9]治療に対する応答性が、無増悪生存期間(PFS)の増加である、[8]に記載の方法。
[10]治療に対する応答性が、全生存期間(OS)の増加である、[8]に記載の方法。
[11]治療に対する応答性が、全奏効率(ORR)の増加である、[8]に記載の方法。
[12]前記腫瘍試料が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較して、表1に明記される前記少なくとも1つの遺伝子内で体細胞変異の増加したレベルを有することが決定されている、[1]~[3]及び[5]~[11]のいずれか1項に記載の方法。
[13]前記腫瘍試料が、表1に明記される遺伝子のうちの少なくとも3分の1での体細胞変異の基準レベルと比較して、表1に明記される前記遺伝子のうちの前記少なくとも3分の1で体細胞変異の増加したレベルを有することが決定されている、[12]に記載の方法。
[14]前記腫瘍試料が、表1に明記される遺伝子のうちの少なくとも2分の1での体細胞変異の基準レベルと比較して、表1に明記される前記遺伝子のうちの前記少なくとも2分の1で体細胞変異の増加したレベルを有することが決定されている、[13]に記載の方法。
[15]前記腫瘍試料が、表1に明記される遺伝子のうちの少なくとも3分の2での体細胞変異の基準レベルと比較して、表1に明記される前記遺伝子のうちの前記少なくとも3分の2で体細胞変異の増加したレベルを有することが決定されている、[14]に記載の方法。
[16]前記腫瘍試料が、表1に明記される遺伝子のうちの少なくとも4分の3での体細胞変異の基準レベルと比較して、表1に明記される前記遺伝子のうちの前記少なくとも4分の3で体細胞変異の増加したレベルを有することが決定されている、[15]に記載の方法。
[17]前記腫瘍試料が、表1に明記される遺伝子内での体細胞変異の基準レベルと比較して、表1に明記される前記遺伝子内で体細胞変異の増加したレベルを有することが決定されている、[16]に記載の方法。
[18]前記体細胞変異が、置換、欠失、及び/または挿入である、[12]~[17]のいずれか1項に記載の方法。
[19]表1に明記される前記少なくとも1つの遺伝子の前記体細胞変異が、タンパク質改変体細胞変異である、[12]~[17]のいずれか1項に記載の方法。
[20]前記置換、欠失、及び/または挿入が、コード領域内にある、[18]または[19]に記載の方法。
[21]前記欠失及び/または挿入が、挿入欠失である、[18]~[20]のいずれか1項に記載の方法。
[22]前記基準tTMBスコアが、事前に割り当てられたtTMBスコアである、[1]~[21]のいずれか1項に記載の方法。
[23]前記基準tTMBスコアが、1メガベース当たり約5~約50個の変異(変異/Mb)である、[1]~[22]のいずれか1項に記載の方法。
[24]前記基準tTMBスコアが、約8~約30個の変異/Mbである、[23]に記載の方法。
[25]前記基準tTMBスコアが、約10~約20個の変異/Mbである、[24]に記載の方法。
[26]前記基準tTMBスコアが、約10個の変異/Mbである、[25]に記載の方法。
[27]前記基準tTMBスコアが、約16個の変異/Mbである、[25]に記載の方法。
[28]前記基準tTMBスコアが、約20個の変異/Mbである、[25]に記載の方法。
[29]前記腫瘍試料からの前記tTMBスコアが、約5個以上の変異/Mbである、[1]~[28]のいずれか1項に記載の方法。
[30]前記腫瘍試料からの前記tTMBスコアが、約5~約100個の変異/Mbである、[29]に記載の方法。
[31]前記腫瘍試料からの前記tTMBスコアが、約10個以上の変異/Mbである、[29]に記載の方法。
[32]前記腫瘍試料からの前記tTMBスコアが、約10~約100個の変異/Mbである、[31]に記載の方法。
[33]前記腫瘍試料からの前記tTMBスコアが、約16個以上の変異/Mbである、[29]~[32]のいずれか1項に記載の方法。
[34]前記基準tTMBスコアが、約16個の変異/Mbである、[33]に記載の方法。
[35]前記腫瘍試料からの前記tTMBスコアが、約20個以上の変異/Mbである、[29]~[32]のいずれか1項に記載の方法。
[36]前記基準tTMBスコアが、約20個の変異/Mbである、[35]に記載の方法。
[37]前記tTMBスコアまたは前記基準tTMBスコアが、配列決定された塩基の定義された数当たりで計数される体細胞変異の数として表される、[1]~[36]のいずれか1項に記載の方法。
[38]前記配列決定された塩基の定義された数が、約100kb~約10Mbである、[37]に記載の方法。
[39]前記配列決定された塩基の定義された数が、約1.1Mbである、[38]に記載の方法。
[40]前記tTMBスコアまたは前記基準tTMBスコアが、等価TMB値である、[1]~[39]のいずれか1項に記載の方法。
[41]前記等価TMB値が、全エクソーム配列決定(WES)によって決定される、[40]に記載の方法。
[42]前記腫瘍試料が、前記腫瘍試料中の前記腫瘍細胞のうちの1%以上で、PD-L1の検出可能な発現レベルを有することが決定されている、[1]~[41]のいずれか1項に記載の方法。
[43]前記腫瘍試料が、前記腫瘍試料中の前記腫瘍細胞のうちの5%以上で、PD-L1の検出可能な発現レベルを有することが決定されている、[42]に記載の方法。
[44]前記腫瘍試料が、前記腫瘍試料中の前記腫瘍細胞のうちの10%以上で、PD-L1の検出可能な発現レベルを有することが決定されている、[43]に記載の方法。
[45]前記腫瘍試料が、前記腫瘍試料中の前記腫瘍細胞のうちの20%以上で、PD-L1の検出可能な発現レベルを有することが決定されている、[44]に記載の方法。
[46]前記腫瘍試料が、前記腫瘍試料中の前記腫瘍細胞のうちの50%以上で、PD-L1の検出可能な発現レベルを有することが決定されている、[45]に記載の方法。
[47]前記腫瘍試料が、前記腫瘍試料中の前記腫瘍細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている、[1]~[41]のいずれか1項に記載の方法。
[48]前記腫瘍試料が、前記腫瘍試料中の腫瘍浸潤性免疫細胞内で、PD-L1の検出可能な発現レベルを有することが決定されている、[1]~[47]のいずれか1項に記載の方法。
[49]前記腫瘍試料が、前記腫瘍試料の1%以上を構成する腫瘍浸潤性免疫細胞内で、PD-L1の検出可能な発現レベルを有することが決定されている、[48]に記載の方法。
[50]前記腫瘍試料が、前記腫瘍試料の5%以上を構成する腫瘍浸潤性免疫細胞内で、PD-L1の検出可能な発現レベルを有することが決定されている、[49]に記載の方法。
[51]前記腫瘍試料が、前記腫瘍試料の10%以上を構成する腫瘍浸潤性免疫細胞内で、PD-L1の検出可能な発現レベルを有することが決定されている、[50]に記載の方法。
[52]前記腫瘍試料が、前記腫瘍浸潤性免疫細胞内で、PD-L1の検出不能な発現レベルを有することが決定されている、[1]~[47]のいずれか1項に記載の方法。
[53]前記PD-L1軸結合アンタゴニストが、PD-L1結合アンタゴニスト、PD-1結合アンタゴニスト、またはPD-L2結合アンタゴニストである、[1]~[52]のいずれか1項に記載の方法。
[54]前記PD-L1軸結合アンタゴニストが、PD-L1結合アンタゴニストである、[53]に記載の方法。
[55]前記PD-L1結合アンタゴニストが、PD-L1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する、[54]に記載の方法。
[56]前記PD-L1結合アンタゴニストが、PD-L1のPD-1への結合を阻害する、[55]に記載の方法。
[57]前記PD-L1結合アンタゴニストが、PD-L1のB7-1への結合を阻害する、[55]に記載の方法。
[58]前記PD-L1結合アンタゴニストが、PD-L1のPD-1及びB7-1の両方への結合を阻害する、[55]~[57]のいずれか1項に記載の方法。
[59]前記PD-L1結合アンタゴニストが、抗体である、[54]~[58]のいずれか1項に記載の方法。
[60]前記抗体が、アテゾリズマブ(MPDL3280A)、YW243.55S70、MDX-1105、MEDI4736(デュルバルマブ)、またはMSB0010718C(アベルマブ)である、[59]に記載の方法。
[61]前記抗体が、配列番号19のHVR-H1配列、配列番号20のHVR-H2配列、及び配列番号21のHVR-H3配列を含む重鎖と、配列番号22のHVR-L1配列、配列番号23のHVR-L2配列、及び配列番号24のHVR-L3配列を含む軽鎖と、を含む、[59]に記載の方法。
[62]前記抗体が、配列番号25のアミノ酸配列を含む重鎖可変領域と、配列番号4のアミノ酸配列を含む軽鎖可変領域と、を含む、[59]に記載の方法。
[63]前記PD-L1軸結合アンタゴニストが、PD-1結合アンタゴニストである、[53]に記載の方法。
[64]前記PD-1結合アンタゴニストが、PD-1のそのリガンド結合パートナーのうちの1つ以上への結合を阻害する、[63]に記載の方法。
[65]前記PD-1結合アンタゴニストが、PD-1のPD-L1への結合を阻害する、[63]に記載の方法。
[66]前記PD-1結合アンタゴニストが、PD-1のPD-L2への結合を阻害する、[63]に記載の方法。
[67]前記PD-1結合アンタゴニストが、PD-1のPD-L1及びPD-L2の両方への結合を阻害する、[64]~[66]のいずれか1項に記載の方法。
[68]前記PD-1結合アンタゴニストが、抗体である、[63]~[67]のいずれか1項に記載の前記方法。
[69]前記抗体が、MDX-1106(ニボルマブ)、MK-3475(ペンブロリズマブ)、CT-011(ピディリズマブ)、MEDI-0680(AMP-514)、PDR001、REGN2810、及びBGB-108である、[68]に記載の方法。
[70]
前記PD-1結合アンタゴニストが、Fc融合タンパク質である、[63]~[67]のいずれか1項に記載の方法。
[71]前記Fc融合タンパク質が、AMP-224である、[70]に記載の方法。
[72]前記個体に有効量の第2の治療剤を投与することを更に含む、[3]及び[5]~[71]のいずれか1項に記載の前記方法。
[73]前記第2の治療剤が、細胞毒性剤、成長阻害剤、放射線療法剤、血管新生阻害剤、またはそれらの組み合わせである、[72]に記載の方法。
[74]前記個体に、PD-L1軸結合アンタゴニスト以外の治療剤またはそれに加えた治療剤を投与することを更に含む、[4]に記載の方法。
[75]前記非PD-L1軸結合アンタゴニスト療法が、細胞毒性剤、成長阻害剤、放射線療法剤、血管新生阻害剤、またはそれらの組み合わせを含む、[7]~[74]のいずれか1項に記載の方法。
[76]前記がんが、肺癌、腎臓癌、膀胱癌、乳癌、結腸直腸癌、卵巣癌、膵臓癌、胃癌、食道癌、中皮腫、黒色腫、頭頸部癌、甲状腺癌、肉腫、前立腺癌、膠芽腫、子宮頸癌、胸腺癌、白血病、リンパ腫、骨髄腫、菌状息肉腫、メルケル細胞癌、子宮内膜癌、皮膚癌、または血液学的悪性腫瘍である、[1]~[75]のいずれか1項に記載の方法。
[77]前記がんが、肺癌、膀胱癌、黒色腫、腎臓癌、結腸直腸癌、または頭頸部癌である、[76]に記載の方法。
[78]前記がんが、肺癌である、[77]に記載の方法。
[79]前記肺癌が、非小細胞肺癌(NSCLC)である、[76]~[78]のいずれか1項に記載の方法。
[80]前記NSCLCが、転移性NSCLCである、[79]に記載の方法。
[81]前記NSCLCが、局所進行性NSCLCである、[79]または[80]に記載の方法。
[82]前記NSCLCが、IIIB期NSCLCである、[79]~[81]のいずれか1項に記載の方法。
[83]前記NSCLCが、IV期NSCLCである、[79]~[81]のいずれか1項に記載の方法。
[84]前記NSCLCが、再発性NSCLCである、[79]~[81]のいずれか1項に記載の方法。
[85]前記個体が、前記NSCLCについて白金含有レジメンで少なくとも1つの事前治療を受けている、[79]~[84]のいずれか1項に記載の方法。
[86]前記個体が、前記NSCLCについて白金含有レジメンで少なくとも2つの事前治療を受けている、[85]に記載の方法。
[87]前記個体が、前記NSCLCについて白金含有レジメンでの事前治療を受けていない、[1]~[84]のいずれか1項に記載の方法。
[88]前記膀胱癌が、局所進行性または転移性尿路上皮癌である、[77]に記載の方法。
[89]前記膀胱癌が、転移性尿路上皮癌である、[88]に記載の方法。
[90]前記個体が、(i)前記膀胱癌について事前治療を受けていないか、または(ii)前記個体が、前記膀胱癌について少なくとも1つの事前治療を受けている、[88]または[89]に記載の方法。
[91]前記腫瘍試料が、ホルマリン固定及びパラフィン包埋(FFPE)腫瘍試料、保存記録用腫瘍試料、新鮮な腫瘍試料、または凍結腫瘍試料である、[1]~[90]のいずれか1項に記載の方法。
[92]前記PD-L1の発現レベルが、タンパク質発現レベルである、[42]~[91]のいずれか1項に記載の方法。
[93]前記PD-L1のタンパク質発現レベルが、免疫組織化学(IHC)、免疫蛍光法、フローサイトメトリー、及びウェスタンブロットからなる群から選択される方法を使用して決定される、[92]に記載の方法。
[94]前記PD-L1のタンパク質発現レベルが、IHCを使用して決定される、[93]に記載の方法。
[95]前記PD-L1のタンパク質発現レベルが、抗PD-L1抗体を使用して検出される、[92]~[94]のいずれか1項に記載の方法。
[96]前記PD-L1の発現レベルが、mRNA発現レベルである、[42]~[91]のいずれか1項に記載の方法。
[97]前記PD-L1のmRNA発現レベルが、定量的ポリメラーゼ連鎖反応(qPCR)、逆転写qPCR(RT-qPCR)、RNA配列決定、マイクロアレイ分析、in situハイブリダイゼーション、及び遺伝子発現の逐次分析法(SAGE)からなる群から選択される方法を使用して決定される、[96]に記載の方法。
[98]がんに罹患している個体を治療する上で使用するためのPD-L1軸結合アンタゴニストであって、前記個体由来の腫瘍試料が、基準tTMBスコア以上であるtTMBスコアを有することが決定されており、任意で、前記腫瘍試料が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較した、表1に明記される前記少なくとも1つの遺伝子内での体細胞変異の増加したレベル、前記腫瘍試料の約1%以上を構成する腫瘍浸潤性免疫細胞内でのPD-L1の検出可能な発現レベル、及び/または前記腫瘍試料の1%以上を構成する腫瘍浸潤性免疫細胞内でのPD-L1の検出可能な発現レベルを有することが決定されている、前記PD-L1軸結合アンタゴニスト。
[99]がんに罹患している個体を治療する上で使用するための医薬品の製造における有効量のPD-L1軸結合アンタゴニストの使用であって、前記個体由来の腫瘍試料が、基準tTMBスコア以上であるtTMBスコアを有することが決定されており、任意で、前記腫瘍試料が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較した、表1に明記される前記少なくとも1つの遺伝子内での体細胞変異の増加したレベル、前記腫瘍試料の約1%以上を構成する腫瘍浸潤性免疫細胞内でのPD-L1の検出可能な発現レベル、及び/または前記腫瘍試料の1%以上を構成する腫瘍浸潤性免疫細胞内でのPD-L1の検出可能な発現レベルを有することが決定されている、前記使用。
[100]がんに罹患している個体を治療する方法において使用するための有効量のPD-L1軸結合アンタゴニストを含む組成物であって、前記個体由来の腫瘍試料が、基準tTMBスコア以上であるtTMBスコアを有することが決定されており、任意で、前記腫瘍試料が、表1に明記される少なくとも1つの遺伝子内での体細胞変異の基準レベルと比較した、表1に明記される前記少なくとも1つの遺伝子内での体細胞変異の増加したレベル、前記腫瘍試料の約1%以上を構成する腫瘍浸潤性免疫細胞内でのPD-L1の検出可能な発現レベル、及び/または前記腫瘍試料の1%以上を構成する腫瘍浸潤性免疫細胞内でのPD-L1の検出可能な発現レベルを有することが決定されている、前記組成物。
他の実施形態
前述の発明は、明確な理解のために例証及び実施例によって幾分詳細に記載されているが、説明及び実施例は、本発明の範囲を限定するものと解釈されるべきではない。本明細書に引用される全ての特許及び科学文献の開示の全体が、参照により明白に組み込まれる。