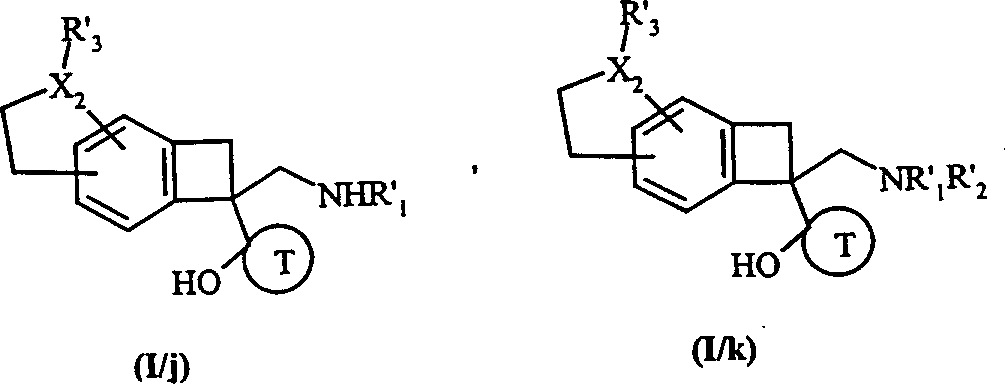CN1323794A - 新型杂环烷基苯并环丁烷和杂环芳基苯并环丁烷化合物,其制备方法和包含它们的药物组合物 - Google Patents
新型杂环烷基苯并环丁烷和杂环芳基苯并环丁烷化合物,其制备方法和包含它们的药物组合物 Download PDFInfo
- Publication number
- CN1323794A CN1323794A CN01116386A CN01116386A CN1323794A CN 1323794 A CN1323794 A CN 1323794A CN 01116386 A CN01116386 A CN 01116386A CN 01116386 A CN01116386 A CN 01116386A CN 1323794 A CN1323794 A CN 1323794A
- Authority
- CN
- China
- Prior art keywords
- formula
- compound
- group
- preceding definition
- expression
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/42—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having amino groups or hydroxy groups bound to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/10—Indoles; Hydrogenated indoles with substituted hydrocarbon radicals attached to carbon atoms of the hetero ring
- C07D209/14—Radicals substituted by nitrogen atoms, not forming part of a nitro radical
- C07D209/16—Tryptamines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/30—Indoles; Hydrogenated indoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to carbon atoms of the hetero ring
- C07D209/40—Nitrogen atoms, not forming part of a nitro radical, e.g. isatin semicarbazone
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/93—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems condensed with a ring other than six-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D317/00—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D317/08—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3
- C07D317/44—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D317/70—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems condensed with ring systems containing two or more relevant rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/14—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/50—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D333/78—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems condensed with rings other than six-membered or with ring systems containing such rings
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Psychiatry (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Pain & Pain Management (AREA)
- Child & Adolescent Psychology (AREA)
- Addiction (AREA)
- Anesthesiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Furan Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Indole Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
下式(Ⅰ)的化合物、它们的异构体和其与可药用酸或碱形成的加成盐:其中:----代表单键或双键,n为1-6的整数,R1和R2表示选自下述的基团:氢原子、直链或支链的(C1-C6)烷基、芳基、芳烷基、环烷基、环烷基烷基、链烯基、链炔基、杂环烷基、杂环烷基烷基、杂芳基和杂芳基烷基,X表示选自如下的基团:-CH=CH-、氧原子、基团S(O)m,其中m为0-2的整数,和NR3,其中R3表示在说明书中定义的基团,Y表示CH或CH2基团,取决于----是代表单键或双键,或当X表示氧原子时具有氧原子的附加含义,T表示单环或多环(C3-C10)环烷基,在环体系内选择性地包含氧原子、硒原子、式S(O)p的基团、NR3或SiR4R5,其中,p、R3、R4和R5如说明书定义。
Description
本发明涉及新型杂环烷基苯并环丁烷和杂环芳基苯并环丁烷化合物,其制备方法和包含它们的药物组合物。
本发明的化合物可用作有效的5-羟色胺和去甲肾上腺素再摄取抑制剂。这样,它们可用作用于治疗抑郁症、惊恐发作、强迫症、恐惧症、冲动障碍、药物滥用、焦虑、肥胖症和贪食症的药物。
的确,本发明的化合物自身显示出在用于抑制5-羟色胺和去甲肾上腺素再摄取的特征实验中的体外活性以及体内活性。因此,在大鼠额皮质中进行的微渗透实验中,本发明的化合物在该区域会增加5-羟色胺、去甲肾上腺素和多巴胺的释放。因此,本申请人所要求保护的化合物完全适宜用于与这两种神经递质传递中的缺陷有关的疾病。本发明化合物特别有价值的作用也由小鼠中弹子-埋藏实验说明。
更具体地,本发明涉及一种式(Ⅰ)的化合物、它们的异构体和其与可药用酸或碱形成的加成盐:其中:代表单键或双键,
n为1-6的整数,
R1和R2可相同或不同,彼此独立地表示选自下述的基团:氢原子、直链或支链的(C1-C6)烷基、芳基、其中烷基部分为直链或支链的芳基-(C1-C6)烷基、环烷基、其中烷基部分为直链或支链的环烷基-(C1-C6)烷基、直链或支链的(C2-C6)链烯基、直链或支链的(C2-C6)链炔基、杂环烷基、其中烷基部分为直链或支链的杂环烷基-(C1-C6)烷基、杂芳基和其中烷基部分为直链或支链的杂芳基-(C1-C6)烷基,
X表示选自如下的基团:-CH=CH-、氧原子、基团S(O)m,其中,m为0-2的整数,和NR3,其中R3表示选自:氢原子、直链或支链的(C1-C6)烷基、芳基、其中烷基部分为直链或支链的芳基-(C1-C6)烷基、环烷基、其中烷基部分为直链或支链的环烷基-(C1-C6)烷基、直链或支链的(C2-C6)链烯基、直链或支链的(C2-C6)链炔基的基团,
Y表示CH或CH2基团,取决于
是代表单键或双键,或当X表示氧原子时具有氧原子的附加含义,
T表示单环或多环(C3-C12)环烷基,其中,环烷基的碳原子之一可选择性地被一种基团取代,所述基团选自:氧原子、硒原子、式S(O)p的基团,其中p为整数0-2,NR3,其中,R3如前定义,和SiR4R5,其中,R4和R5可相同或不同,表示直链或支链的(C1-C6)烷基。
“芳基”是指选自如下的基团:苯基、联苯基、萘基、二氢萘基、四氢萘基、二氢化茚基、茚基和苯并环丁基,这些基团可选择性地被一个或多个相同或不同的基团取代,所述基团选自:卤原子、直链或支链的(C1-C6)烷基、羟基、直链或支链的(C1-C6)烷氧基、硝基、氰基、直链或支链的三卤代-(C1-C6)烷基、氨基、烷基部分具有1至6个碳原子并为直链或支链的单烷基氨基和各烷基部分具有1至6个碳原子并为直链或支链的二烷基氨基。
“杂芳基”是指如前定义的芳基,在其环体系内,包含一至三个相同或不同的选自氧、氮和硫的杂原子,所述的杂芳基可选择性地被一个或多个相同或不同的选自上述对芳基定义的取代基取代。作为杂芳基的非限定性实例,可提及吡啶基、嘧啶基、吲哚基、苯并呋喃基、苯并噻吩基、喹啉基、异喹啉基、苯并[1,4]二噁英基2,3-二氢苯并[1,4]二噁英基等。
“环烷基”是指单或多环体系,其具有3-12个环原子,选择性地包含一个或多个不饱和键,其并不会使所述的环体系带来芳族特性。
“杂环烷基”是指如前定义的环烷基,在其环体系内,包含一至三个相同或不同的选自氧、氮和硫的杂原子。
本发明优选的化合物为其中n为1的式(Ⅰ)化合物。
本发明优选的R1和R2取代基为氢原子、直链或支链的(C1-C6)烷基或2,3-二氢-1,4-苯并二噁英-2-基甲基。
本发明优选的取代基T为饱和的单环(C3-C8)环烷基。
有利地,本发明优选的T为环戊基或环己基。
根据本发明另一个优选的实施方案,本发明优选的化合物为下式(Ⅰ/B)的化合物:其中,X、Y、n、R1、R2、R3和T如式(Ⅰ)定义。
有利地,本发明的优选的化合物为式(Ⅰ/B)的化合物,其中,n为1,X表示基团NR3,其中,R3表示氢原子或直链或支链的(C1-C6)烷基。
根据本发明第四个优选的实施方案,本发明优选的化合物为式(Ⅰ/D)的化合物:
其中,n、R1、R2、X和T如式(Ⅰ)定义,Y20表示CH或CH2基团。
本发明优选的化合物为:
·1-{6-[(二甲基氨基)甲基]-1-甲基-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}环己醇,
·1-{6-[(二甲基氨基)甲基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}-环己醇,
·1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并呋喃-5-基}-环己醇,
·1-{5-[(二甲基氨基)甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环己醇,
·1-{6-[(二甲基氨基)甲基]-1-甲基-5,6-二氢-1H-环丁二烯并[f]吲哚-6-基}-环己醇,
·1-{7-[(二甲基氨基)甲基]-2,3,6,7-四氢-1H-环丁二烯并[e]吲哚-7-基}-环己醇,
·1-{5-[(甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·(+)-1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·(-)-1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·1-{6-[(二甲基氨基)甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-6-基}-环戊醇,
·1-{5-[(二甲基氨基)甲基)-1-甲基-5,6-二氢-1H-环丁二烯并[f]吲哚-5-基}-环戊醇,
·1-{7-[(二甲基氨基)甲基]-6,7-二氢环丁二烯并[g][1]苯并呋喃-7-基}-环戊醇,
·1-{1-[(二甲基氨基)甲基]-1,2-二氢环丁二烯并[b]萘-1-基}环戊醇,
·1-{7-[(二甲基氨基)甲基]-6,7-二氢-3H-环丁二烯并[e]吲哚-7-基}环戊醇,
·1-{1-[(二甲基氨基)甲基]-1,2-二氢环丁二烯并[a]萘-1-基}环戊醇。
本发明优选化合物的异构体和其与可药用酸或碱形成的加成盐构成本发明的一部分。
异构体可理解为是旋光异构体,如非对映异构体和对映异构体。
在可药用酸中,可提及的非限定性实例为:盐酸、氢溴酸、硫酸、磷酸、乙酸、三氟乙酸、乳酸、丙酮酸、丙二酸、琥珀酸、戊二酸、富马酸、酒石酸、马来酸、柠檬酸、抗坏血酸、草酸、甲磺酸、樟脑酸等。
在可药用碱中,可提及的非限定性实例为:氢氧化钠、氢氧化钾三乙胺、叔丁胺等。
本发明还涉及一种式(Ⅰ)的化合物的制备方法,其特征在于,采用下述化合物作为原料:
a)或者,式(Ⅱ)的化合物:其中,Xa表示硫原子、氧原子或NH基团,
式(Ⅱ)的化合物与式(Ⅲ)的化合物反应:
Z-CH(OA)2 (Ⅲ)
其中,A表示直链或支链的(C1-C4)烷基,和Z表示甲酰基(当Xa表示NH基团时),或基团-CH2Hal,其中,Hal表示氯、溴或碘原子,得到式(Ⅳ)的化合物:其中,Xa和A如前定义,
使式(Ⅳ)的化合物:
式(Ⅴ/a)的化合物进行下述处理:
式(Ⅶ/a)的化合物按照有机合成的常规条件用还原剂进行作用,得到式(Ⅰ/a)的化合物,一种式(Ⅰ)化合物的具体情形:其中,X1和T如前定义,
对于式(Ⅰ/a)的化合物:
或者,按照有机合成的常规方法取代伯胺官能团,如用式(Ⅷa)的化合物进行还原胺化或亲核取代:
R’1-Z1(Ⅷa)其中,R’1具有与式(Ⅰ)中R1相同的含义,但不为氢原子,Z1表示在有机化学中常规的离去基团,如卤原子或甲磺酸根或甲苯磺酸根基团,
或者,按照该方法的优选实施方案,用式(Ⅷb)的化合物进行处理:
R″1-COZ2 (Ⅷb)
其中,R″1表示杂环烷基-(C1-C5)烷基,其中,烷基部分为直链或支链的,和Z2表示氯原子或咪唑基团,得到式(Ⅰ/b2)的化合物:其中,X1、T和R″1如前定义,使式(Ⅰ/b2)的化合物用有机化学中常规采用的还原剂进行还原,得到式(Ⅰ/b3)的化合物:其中,X1、R″1和T如前定义,
式(Ⅰ/b1)和(Ⅰ/b3)化合物的总体构成式(Ⅰ/b)的化合物,
式(Ⅰ/b)的化合物按照如前所述相同的条件用式(Ⅷc)的化合物进行处理:
*或者,在强碱存在下,用式(Ⅸ)的胺处理:其中,R1和R2如式(Ⅰ)定义,n1为2-6的整数,和L表示离去基团,如卤原子、甲磺酸根、甲苯磺酸根或三氟甲磺酸根基团,得到式(Ⅹ)的化合物:其中,X1、n1、R1和R2如前定义,
式(Ⅻ)的化合物用式(ⅩⅢ)的化合物进行作用:
(CH3)2N-CH(OG)2 (ⅩⅢ)其中,G表示直链或支链的(C1-C3)烷基、苄基或环己基,得到式(ⅩⅣ)的化合物:其中,X1、n1、R1和R2如前定义,
在当X1表示氧原子或硫原子的具体情形下,式(Ⅰa)、(Ⅰ/b)、(Ⅰ/c)、(Ⅰ/d)化合物与(Ⅰ/f)的化合物的总体构成式(Ⅰ/g)的化合物,其中,X1a表示氧原子或式S(O)p的基团,其中,p如式(Ⅰ)中的定义,和n、R1、R2和T如式(Ⅰ)定义,
·或者,当Xa具有X′2的含义时,表示NH基团时,对化合物用式(ⅩⅥ)的磺酰氯进行作用:
E-SO2Cl (ⅩⅥ)其中,E表示直链或支链的(C1-C4)烷基、苯基或对甲苯酰基,得到式(ⅩⅦ)的化合物:其中,X2表示氮原子,和E和A如前定义,
使式(ⅩⅦ)的化合物通过酸的作用而环化,得到式(Ⅴ/b)的化合物:其中,X2和E如前定义,
对式(Ⅶ/b)的化合物:
◆或者,按照与式(Ⅶ/a)的化合物所述相同的条件进行处理,得到式(Ⅰ/i)的化合物,一种式(Ⅰ)化合物的具体情形:其中,X2和T如前定义,
对式(Ⅰ/i)的化合物依次用如前定义的式(Ⅷa)或(Ⅷb)的化合物,然后用式(Ⅷc)的化合物处理,分别得到式(Ⅰ/j)和(Ⅰ/k)的化合物,为式(Ⅰ)化合物的具体情形:其中,X2、T、R’1和R’2如前定义,和R’3具有与R’1相同的含义和值,
式(Ⅰ/i)、(Ⅰ/j)和(Ⅰ/k)化合物的总体构成了式(Ⅰ/l)化合物:其中,X2、R1、R2、R3和T如前对式(Ⅰ)所定义,
对式(ⅩⅧ)的化合物按照有机合成的常规条件进行还原,得到式(ⅩⅨ)的化合物:其中,T、X2和E如前定义,
式(ⅩⅩ)的化合物可通过如前定义的式(Ⅷb)化合物的作用,转化成叔胺,得到式(ⅩⅪ)的化合物:其中,T、X2、E、R’1和R’2如前定义,
式(Ⅱ/1)的化合物与(EtO)2POCH2CN反应,得到式(Ⅱ/2)的化合物:其中,Hal、Xb和Yb如前定义,
式(Ⅱ/3)的化合物在与式(Ⅴ/a)相同的条件下,
*或者,用式(Ⅸ)的化合物处理,形成的产物再以与式(Ⅹ)和(Ⅺ)相同的方式处理,然后相继用如前所述的(ⅩⅢ)的化合物再用(ⅩⅤ)的化合物处理,得到式(Ⅰ/3d)的化合物:其中,Xb、Yb、n1、R1和R2如前定义,
化合物(Ⅰ/a)至(Ⅰ/o)和(Ⅰ/3a)至(Ⅰ/3d)构成了本发明化合物的总体,如果需要的话,按照常规纯化技术对其进行纯化,如果需要的话,可将其按照常规分离技术分离成不同的异构体,必要时,可用可药用酸或碱将其转化成其加成盐。
式(Ⅱ)、(Ⅱ/1)、(Ⅲ)、(Ⅵ)、(Ⅷa)、(Ⅷb)、(Ⅷc)、(Ⅸ)、(ⅩⅢ)、(ⅩⅤ)和(ⅩⅥ)或者为已知化合物,或者可按照有机化学常规方法由已知物质制得。
本发明的化合物为5-羟色胺、去甲肾上腺素和多巴胺再摄取的抑制剂。它们可用作治疗抑郁症、惊恐发作、强迫症、恐惧症、冲动障碍、药物滥用、焦虑、肥胖症和贪食症的药物。
本发明也涉及一种药物组合物,其单独包含作为活性成分的至少一种式(Ⅰ)化合物或其旋光异构体或其与可药用酸或碱形成的加成盐,或者包含其与一种或多种惰性、无毒的可药用赋形剂或载体的组合。
在本发明的药物组合物中,可更具体地提及那些适用于口服、非肠道(静脉内、肌内或皮下)给药、透皮给药、鼻给药、直肠给药、经舌给药、眼给药或呼吸给药的药物组合物,特别是片剂或糖衣丸、舌下药片、软明胶胶囊、硬明胶胶囊、栓剂、霜剂、软膏剂、皮肤凝胶剂、可注射或可饮用的制剂、气溶胶、眼或鼻滴剂等。
根据患者的年龄和体重、给药方式、疾病及其严重程度、是否联合治疗等改变所使用的剂量,剂量范围为每天1次或多次给药0.5-25mg。
下述实施例用于说明本发明,但无论如何并非对本发明的限制。所采用的原料均为公知化合物或可按照公知方法制备。各制备例生产用于制备本发明化合物的合成中间体。
在实施例中所述化合物的结构均采用常规分光光度测定技术测量(红外、核磁共振、质谱等)。
熔点采用Kofler加热板测量(K.),或者采用显微镜下的加热板测量(M.K.)。当化合物以盐形式存在时,所给出的熔点相应于盐产物的熔点。
步骤1:1-氰基-5-[(2,2-二甲氧基乙基)氨基]苯并环丁烷
向13.5g的1-氰基-5-氨基苯并环丁烷在400ml的1,2-二氯乙烷中的悬浮液中迅速滴加26.5ml的45%的2,2-二甲氧基乙醛的叔丁基甲基醚溶液,然后,加入16ml的乙酸,最后,分几次加入39.7g的三乙酰氧基硼氢化钠。在将温度增至29℃后,再将混合物冷却至室温,然后再搅拌1小时15分钟,倒入500ml饱和碳酸氢钠水溶液中进行水解。分离出有机相,用水洗涤,减压浓缩,得到定量收率的目的产物。
步骤2:1-氰基-5-[(N-(2,2-二甲氧基乙基)-N-甲基磺酰基氨基]-苯并环丁烷
将上一步骤1获得的21.6g的产物、58ml的吡啶和225ml的二氯甲烷作为原料制备的溶液冷却至0℃。在20分钟内滴加入10.8ml的的甲磺酰氯,并在0℃下搅拌40分钟,然后在室温下搅拌20小时。再将反应混合物倒入40ml的饱和碳酸氢钠水溶液中。在倾析后,将水相各用150ml的二氯甲烷萃取两次。合并后的有机相用1N盐酸洗涤,干燥,浓缩,得到定量收率的目的产物。
步骤3:6-氰基-1-甲基磺酰基-5,6-二氢环丁二烯并[f]吲哚
在1小时15分钟内,将10.9ml的氯化钛在450ml的甲苯中的溶液和27.9g的步骤2获得的产物稀释于450ml的甲苯中所获得的溶液同时倒入2.1L回流中的甲苯中。当加完后,将温度降低至40℃,再将混合物倒入1.8L的饱和碳酸氢钠水溶液中。在倾析后,水相用甲苯萃取,合并有机相,洗涤,干燥和浓缩。将残余物用硅胶色谱纯化(二氯甲烷/环己烷:75/25),得到目的产物和其区位异构体。
熔点:142-144℃(MK)制备例2:6-氰基-5,6-二氢环丁二烯并[f]吲哚
将制备例1的产物2.6g加至7.7g的氢氧化钾的190ml的甲醇溶,液中。在回流12小时后,通过蒸发除去甲醇,将残余物吸收于乙醚中。在洗涤后,将有机相干燥,浓缩,得到目的产物。
熔点:126-128℃(MK)制备例3:
6-氰基-2,3,5,6-四氢环丁二烯并[f]吲哚
将制备例2中获得的3.43g产物溶解于55ml的乙酸中。在5分钟内,分批加入3.84g的氰基硼氢化钠加至已被冷却至13℃的反应混合物中。在返回室温后,再搅拌2小时,然后使反应混合物冷却至0℃,再通过加入氢氧化钠溶液(45g,250ml水中)将pH值调节至11。将形成的乳状溶液用乙醚萃取。洗涤有机相,干燥,浓缩,得到白色固体状的目的产物。
熔点:85-87℃(MK)制备例4:4-氰基-1-甲基磺酰基-4,5-二氢环丁二烯并[e]吲哚
制备例1步骤3中获得的区位异构体相应于目的产物。
熔点:118-120℃(MK)制备例5:4-氰基-5,6-二氢环丁二烯并[e]吲哚
该产物按照制备例2的方法制备,采用制备例4的产物作为反应物。
熔点:132-134℃(MK)制备例6:4-氰基-2,3,4,5-四氢环丁二烯并[e]吲哚
该产物按照制备例3的方法制备,采用制备例5的产物作为反应物。制备例7:5-氰基-5,6-二氢环丁二烯并[f]苯并噻吩
步骤1:1-氰基-4-甲硫基苯并环丁烷
在2小时内,向包含催化量的氰亚铁酸钾和三硝酸铁一水合物并处于回流中的3.5L的液氨中加入50.8g钠,再在5分钟内加入153g的3-(2-氯-5-甲硫基苯基)丙腈。将混合物在-33℃下反应1小时,然后加入118.2g的固体氯化铵。在蒸除去氨后,将残余物吸收于乙醚中,滤出盐,将滤液蒸发至干,得到目的产物。
步骤2:1-氰基-4-甲基亚磺酰基苯并环丁烷
将以上步骤1的11g产物溶解于70ml的二氯甲烷中。向已被冷却至-5℃的溶液中倒入15.8g间氯过苯甲酸于80ml二氯甲烷中的溶液。在搅拌10分钟后,将反应混合物倒入100ml水和100ml的1N氢氧化钠水溶液中。进行倾析后,水相再用二氯甲烷萃取。将合并后的有机相用硫酸氢钠洗涤,然后用1N氢氧化钠溶液洗涤,再用碳酸氢钠溶液洗涤,最后用水洗涤至中性。将有机相干燥,浓缩,得到目的产物。
步骤3:1-氰基-4-巯基苯并环丁烷
将溶解于20ml二氯甲烷中的9.76m1三氟乙酸加至上一步骤获得的11g产物的100ml二氯甲烷溶液中。加入过程持续45分钟,在此期间,将温度保持在25℃。再将反应混合物在此温度下搅拌1小时30分钟,然后蒸发至干。将残余物在50/50三乙胺与甲醇的混合物存在下搅拌处理10分钟。在蒸发后,将残余物用二氯甲烷稀释,再用饱和氯化铵溶液洗涤,再用水洗涤,干燥,浓缩,得到油状目的产物。
步骤4:1-氰基-4-(2,2-二乙氧基乙硫基)苯并环丁烷
在20℃下,将3.65g硼氢化钠分批加至步骤3获得的9.1g产物在20ml四氢呋喃和140ml乙醇中的溶液中。在50℃下搅拌1小时后,再加入2.14g的固体硼氢化钠。将反应混合物再加热至80℃,在该温度下,在1小时内倒入39ml的溴代乙醛二乙基缩醛。保持加热12小时,然后将冷却后的反应混合物倒入1L的冰冷却下的水中。将形成的混合物用乙醚萃取,有机相用10%的碳酸氢钠溶液洗涤,再用水洗涤。将乙醚相干燥,真空浓缩,得到油状的目的产物。
步骤5:5-氰基-5,6-二氢环丁二烯并[f]-苯并噻吩
将10g的多磷酸和8.5g步骤4获得的产物于500ml的氯苯中在130℃下加热4小时。在冷却后,将上清液吸出,将残余物用用二氯甲烷漂洗。合并上清液和二氯甲烷相,通过加入粉末状碳酸氢钠使其中和。在搅拌15分钟后,进行过滤,再蒸发至干。将残余物进行硅胶色谱纯化(环己烷/二氯甲烷:50/50),得到目的产物和副产物。熔点:102-103℃(MK)制备例8:6-氰基-5,6-二氢环丁二烯并[f]-苯并噻吩
按照制备例7步骤1-5的方法制备产物,但在步骤1中,采用3-(3-溴-4-甲硫基苯基)丙腈代替3-(2-氯-5-甲硫基苯基)丙腈。制备例9:5-氰基-5,6-二氢环丁二烯并[f]苯并呋喃
步骤1:1-氰基6-(2,2-二乙氧基乙氧基)苯并环丁烷
将16.5g的1-氰基-4-羟基苯并环丁烷在205ml二甲基甲酰胺中的溶液倒入67.8mmol的氢化钠在160ml二甲基甲酰胺中的悬浮液中。将反应混合物搅拌30分钟,然后,在15分钟内,加入10.2ml的1-溴-2,2-二乙氧基乙烷在40ml中的溶液,然后在60℃下保温6小时。将混合物搅拌12小时,蒸发除去二甲基甲酰胺,将残余物吸收于水中,用二氯甲烷萃取,干燥和真空浓缩。将残余物进行硅胶色谱处理(CH2Cl2/AcOEt:95/5),使目的产物分离。
步骤2:5-氰基-5,6-二氢环丁二烯并[f]-苯并呋喃
按照制备例1步骤3的方法制得产物,但采用步骤1的产物,在进行硅胶色谱处理(CH2Cl2/环己烷:80/20)后,得到目的产物和副产物。制备例10:6-氰基-5,6-二氢环丁二烯并[f]苯并呋喃
按照与制备例9的产物相同的方式制备产物,只是在步骤1中采用1-氰基-5-羟基苯并环丁烷和在步骤2中采用混合物CH2Cl2/环己烷:75/25作为洗脱剂用于分离区位异构体。分离出油状的目的产物。制备例11:5-氰基-4,5-二氢环丁二烯并[e]苯并噻吩
在制备例7中步骤5获得的副产物相应于目的产物。制备例12:4-氰基-4,5-二氢环丁二烯并[e]苯并噻吩
在制备例8中步骤5获得的副产物相应于目的产物。制备例13:5-氰基-4,5-二氢环丁二烯并[e]苯并噻吩
在制备例9中步骤2获得的副产物相应于目的产物。制备例14:4-氰基-4,5-二氢环丁二烯并[e]苯并呋喃
在制备例10中色谱过程中分离出的副产物相应于目的产物。制备例15:5,6-二氢环丁二烯并[f][1,3]苯并二氧杂环戊烯-5-腈
将46g的3-(6-溴-1,3-苯并二氧杂环戊烯-5-基)丙腈分批加至1.4L其中溶解有叠氮化钠的液氨中,所述叠氮化钠是预先将16.7g钠加至液氨中获得的。在接触30分钟后,将反应混合物用38.7g氯化铵处理,然后在室温下蒸出氨。将残余物在乙醚中处理并过滤;用乙醚洗涤沉淀。将合并后的乙醚相蒸发,将形成的残余物在异丙醇中进行重结晶,分离出目的产物。
熔点:91℃(M.K.)制备例16:6,7-二氢环丁二烯并[g][1]苯并呋喃-7-腈
步骤1:1-氰基-6-(2,2-二乙氧基乙氧基)苯并环丁烷
按照制备例9步骤1的方法制得产物,采用1-氰基-6-羟基苯并环丁烷作为反应物。
步骤2:6,7-二氢环丁二烯并[g][1]苯并呋喃-7-腈
按照制备例1步骤3的方法制得产物,采用上述步骤1获得的产物作为反应物。制备例17:1,2-二氢环丁二烯并[b]萘-1-腈
按照制备例15的方法制得产物,采用3-(3-碘-2-萘基)丙腈作为反应物。
熔点:98-102℃(M.K.)制备例18:1,2-二氢环丁二烯并[a]萘-1-腈
步骤1:1,1-二乙氧基-1,2-二氢环丁二烯并[a]萘
将9.4g氨基钠加至350ml四氢呋喃中。连续向混合物中加入25.9g的1-溴萘和28g新制备的1,1-二乙氧基乙烯。将反应混合物回流16小时,然后在水和乙醚中处理。在将有机相洗涤至中性pH值并干燥后,分离出目的产物并用硅胶色谱处理(二氯甲烷/环己烷:1/1)。
步骤2:环丁二烯并[a]萘-1(2H)-酮
在室温下,将10g步骤1获得的产物用溶解于170ml四氢呋喃中的42ml 1N盐酸处理。在搅拌1小时30分钟后,将溶剂浓缩,再将残余物倒入170ml的水中,然后分离出6.9g的固体,其相应于目的产物。
熔点:92-94℃(M.K)
步骤3:1,2-二氢环丁二烯并[a]萘-1-醇
在0-5℃下,将1.4g硼氢化钠加至5.2g步骤2获得的产物于150ml甲醇中的悬浮液中。在该温度下15分钟及在室温下1小时后,将反应混合物倒入300g冰中,用二氯甲烷萃取。在进行常规处理后,分离出5.2g的目的产物。
熔点:96-100℃(M.K.)
步骤4:1,2-二氢环丁二烯并[a]萘-1-腈
将步骤3获得的5.1g产物、14.2g的三苯膦和12g的四溴化碳在150ml乙醚中回流2小时。在冷却后,将反应混合物过滤,浓缩,在50ml乙醚中处理,过滤,蒸发。将形成的7.85g残余物用在150ml四氢呋喃中的10.5g四丁基氰化铵处理。在室温下搅拌64小时后,将反应混合物浓缩,并在冰和乙醚中处理。在倾析后,分离出一种油,将其用硅胶色谱纯化(二氯甲烷),分离出目的产物。
熔点:78-84℃制备例19:1-(甲基磺酰基)-5,6-二氢-1H-环丁二烯并[f]吲哚-5-腈
按照制备例1步骤1-3的方法制备产物,在步骤1中采用4-氨基-1-氰基苯并环丁烷。
熔点:164-168℃(M.K.)制备例20:5,6-二氢-1H-环丁二烯并[f]吲哚-5-腈
按照制备例2的方法制备产物,只是采用制备例19的产物作为反应物。
熔点:109-113℃(M.K.)制备例21:2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-5-腈
按照制备例3的方法制备产物,只是采用制备例20的产物作为反应物。
熔点:100-105℃(M.K.)实施例1:1-[6-(氨基甲基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基]环己醇
步骤A:6-(1-羟基环己基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-腈
将4.1g制备例3获得的产物溶解于215ml四氢呋喃中。将反应混合物冷却至-80℃,加入19.25ml的2.5M正丁基锂的己烷溶液。加完后,保持搅拌20分钟,然后在3分钟内倒入6.2ml环己酮。在80℃下接触2小时后,让反应混合物恢复室温,然后加入23ml饱和氯化铵水溶液,再加入135ml的水。在倾析后,有机相用饱和氯化钠溶液洗涤,干燥并浓缩。将形成的残余物用异丙基醚固化,过滤,得到目的产物,将滤液用硅胶色谱纯化(CH2Cl2/AcOEt:90/10),分离出另一批目的产物。
熔点:168-170℃
步骤B:1-[6-(氨基甲基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基]环己醇
将4g以上步骤A获得的产物溶解于200ml含2ml阮内镍的3.6N氨的甲醇溶液中。将反应混合物在30巴及60℃下氢化24小时。在过滤并通过蒸发除去溶剂后,将残余物在二氯甲烷中处理,用水洗涤至中性,干燥,浓缩,分离出油状的目的产物。
实施例2:1-{6-[(二甲基氨基)甲基]-1-甲基-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}环己醇
将实施例1的659mg产物溶解于20ml乙腈中。向冷却至0℃的溶液中加入608mg氰基硼氢化钠和1.5ml的37%甲醛水溶液,同时保持温度在0℃。在室温下20小时后,采用33ml的1N盐酸进行水解,搅拌3小时。将反应混合物用30ml乙醚洗涤,然后用20%的氢氧化钠溶液碱化。将水相用二氯甲烷萃取。在干燥和蒸发后,将残余物用硅胶色谱纯化(CH2Cl2/EtOH:95/5),得到目的产物。
熔点:121-124℃(MK)实施倒3:1-{6-[(二甲基氨基)甲基]-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}环己醇
步骤A:6-(1-羟基环己基)-1-(甲基磺酰基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-腈
按照制备例1步骤A的方法进行,采用实施例1步骤A的产物。从乙醚中固化紫色固体状的目的产物。
熔点:174-176℃
步骤B:1-[6-(氨基甲基)-1-(甲基磺酰基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}环己醇
按照制备例1步骤B的方法进行,采用上述步骤A的产物。获得黄色蛋糖霜状的目的产物。
步骤C:1-[6-[(二甲基氨基)甲基]-1-(甲基磺酰基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基]环己醇
按照制备例2的方法进行,只是采用上述步骤B的产物。获得黄色固体状的目的产物。
熔点:156-156℃(MK)
步骤D:1-{6-[(二甲基氨基)甲基]-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}环己醇
将40ml的液氨加入三颈烧瓶中,再加入溶解于10ml四氢呋喃中的步骤C获得的产物380mg。将混合物冷却至-50℃,再分几次向反应混合物中加入100mg的钠。在接触15分钟后,分批加入430mg的粉末氯化铵。让反应混合物恢复室温。在通过蒸发除去所有的氨后,将残余物吸收于水中,用乙醚萃取,干燥,浓缩,得到目的产物。
熔点:159-161℃(MK)
实施例4:1-[5-(氨基甲基)-5,6-二氢环丁二烯并[f][1]苯并呋喃-5-基]环己醇
步骤A:5-(1-羟基环己基)-5,6-二氢环丁二烯并[f][1]苯并呋喃-5-腈
按照实施例1步骤A进行,只是采用制备例9的产物并将反应混合物在-75℃下进行水解。分离出固体状的目的产物。
熔点:154-158℃(MK)
步骤B:1-[5-(氨基甲基)-5,6-二氢环丁二烯并[f][1]苯并呋喃-5-基]环己醇
将上述步骤A获得的520mg产物于10ml四氢呋喃中的溶液在氮气氛下,于0℃下滴加于177mg氢化钠铝于10ml乙醚中的悬浮液中。将反应混合物在室温下搅拌1小时,然后用0.26ml的水、0.79ml的20%氢氧化钠溶液和1.05ml的水水解。在室温下搅拌15分钟后,进行过滤,再蒸发至干。获得粘稠蛋糖霜状目的产物。
实施例5:1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f]苯并呋喃-5-基}-环己醇
将400mg实施例4的产物溶解于12ml乙腈中。在冷却至0℃后,依次加入0.55ml的37%甲醛水溶液和185mg的氰基硼氢化钠。在0℃下1小时及在室温下2小时后,再加入0.55ml的37%甲醛水溶液和185mg的氰基硼氢化钠,在20℃下搅拌12小时。在室温下用22.3ml的盐酸(1N)进行水解,将混合物搅拌1小时,在0℃下用20%的氢氧化钠溶液碱化,用二氯甲烷萃取,用水洗涤,干燥和浓缩。经硅胶色谱处理(CH2Cl2/EtOH:90/10),分离出白色结晶的目的产物。
熔点:127-136℃(M.K)
实施例6:1-[5-(氨基甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基]环己醇
按照实施例4步骤A至B的方法进行反应,采用制备例7步骤A的产物。
实施例7:1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f]苯并噻吩-5-基}-环己醇
按照实施例5的方法进行反应,采用实施例6的产物作为反应物。
熔点:151-155℃(MK)
实施例8:1-{6-[(二甲基氨基)甲基]-1-甲基-5,6-二氢-1H-环丁二烯并[f]吲哚-6-基}-环己醇
将0.44g实施例1的产物和1.23g二氧化锰加至15ml甲苯中。将反应混合物在室温下搅拌24小时,然后,再加入0.6g的二氧化锰,再搅拌24小时。在用硅藻土过滤后,蒸发除去溶剂,将残余物用快速硅胶色谱纯化(CH2Cl2/MeOH/NH4OH:98/20/0.2%),得到目的产物。
熔点:148-150℃(MK)
实施例9:1-{7-[(二甲基氨基)甲基]-2,3,6,7-四氢-1H-环丁二烯并[e]吲哚-7-基}-环己醇
步骤A:7-(1-羟基环己基)-2,3,6,7-四氢-1H-环丁二烯并[e]吲哚-7-腈
按照实施例1步骤A的方法获得产物,只是采用制备例6的产物代替制备例3的产物。
步骤B:1-{7-[(二甲基氨基)甲基]-2,3,6,7-四氢-1H-环丁二烯并[e]吲哚-7-基}-环己醇
按照实施例3步骤A至D的方法进行反应,只是在该实施例的步骤A中采用上述步骤A的产物。
实施例10:1-[6-(氨基甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-6-基]环己醇
按照实施例4步骤A至B的方法获得产物,采用制备例8的化合物作为步骤A的反应物。
实施例11:1-[6-(氨基甲基)-5,6-二氢环丁二烯并[f][1]苯并呋喃-6-基]环己醇
按照实施例4步骤A至B的方法获得产物,采用制备例10的化合物作为步骤A的反应物。
实施例12:1-{6-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并呋喃-6-基}-环己醇
按照实施例5的方法获得产物,采用实施例11的化合物作为反应物。实施例13:1-[6-(氨基甲基)-6,7-二氢环丁二烯并[e][1]苯并噻吩-6-基]环己醇
按照实施例4步骤A至B的方法获得产物,采用制备例11的化合物作为步骤A的反应物。
实施例14:1-[7-(氨基甲基)-6,7-二氢环丁二烯并[e][1]苯并噻吩-7-基]环己醇
按照实施例4步骤A至B的方法获得产物,采用制备例12的化合物作为步骤A的反应物。
实施例15:1-[6-(氨基甲基)-6,7-二氢环丁二烯并[e][1]苯并呋喃-6-基]环己醇
按照实施例4步骤A至B的方法获得产物,采用制备例13的化合物作为步骤A的反应物。
实施例16:1-[7-(氨基甲基)-6,7-二氢环丁二烯并[e][1]苯并呋喃-7-基]环己醇
按照实施例4步骤A至B的方法获得产物,采用制备例14的化合物作为步骤A的反应物。
实施例17:1-{6-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-6-基}-环己醇
按照实施例2的方法获得产物,采用实施例10的化合物作为反应物。
熔点:161-166℃(M.K.)
实施例18:1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1,3]苯并二氧杂环戊烯-5-基}-环己醇
按照实施例1步骤A至B的方法和实施例2的方法获得产物,采用制备例15的产物作为实施例1步骤A的反应物代替制备例3的产物。
熔点:94-96℃(M.K.)
实施例19:1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并呋喃-5-基}-环戊醇和其盐酸盐
按照实施例4步骤A至B的方法,然后按照实施例5的方法获得产物,在步骤A中采用环戊酮代替环己酮。通过用氯化氢乙醚溶液作用使游离碱转化成其盐酸盐。
熔点:258-262℃(M.K.)
实施例20:1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1,3]苯并二氧杂环戊烯-5-基}-环戊醇
按照实施倒4步骤A至B的方法,然后按照实施例5的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例15的产物代替制备例9的产物。
熔点:71-74℃(M.K.)
实施例21:1-[5-(氨基甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基]环戊醇
按照实施例4步骤A至B的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例7的产物代替制备例9的产物。
熔点:149-153℃(M.K.)
实施例22:1-{5-[(甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇
在0℃下,将0.29ml氯代甲酸乙酯在40ml二氯甲烷中的溶液加至1g实施例21的产物、1.2ml三乙胺和60ml二氯甲烷的混合物中。在恢复至室温后,将反应混合物用0.1N的盐酸洗涤,再用饱和碳酸氢钠水溶液洗涤,干燥并蒸发。将形成的残余物溶解于20ml的四氢呋喃中。将溶液加至1.3g的AlLiH4在60ml四氢呋喃中的混合物中。将反应混合物回流3小时,然后用0.65ml的水、0.45ml的20%氢氧化钠溶液和2.1ml的水水解。在过滤和浓缩后,将残余物用硅胶色谱纯化(二氯甲烷/乙醇/NH4OH:95/5/0.5),在异丙醚中进行重结晶,得到目的产物。
熔点:166-169℃(M.K.)
实施例23:1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇
按照实施例5的方法获得产物,采用实施例21的产物代替实施例4的产物。
熔点:93-98℃(M.K.)
实施例24:(+)-1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇
将实施例23的产物注入手性柱中,流动相包含甲醇/二乙胺:1000/1。首先洗脱的产物相应于(+)异构体。
熔点:122-126℃(M.K.)
实施例25:(-)-1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇
将实施例23的产物注入手性柱中,流动相包含甲醇/二乙胺:1000/1。第二批洗脱的产物相应于(-)异构体。
熔点:123-127℃(M.K.)
实施例26:1-[6-(氨基甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-6-基]环戊醇
按照实施例4步骤A至B的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例8的产物代替制备例9的产物。
熔点:141-143℃(M.K.)
实施例27:1-{6-[(甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-6-基}-环戊醇
按照实施例22的方法获得产物,采用实施例26的产物代替实施例21的产物。
熔点:117-120℃(M.K.)
实施例28:1-{6-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-6-基}-环戊醇
按照实施例5的方法获得产物,采用实施例26的产物代替实施例4的产物。
熔点:94-96℃(M.K.)
实施例29:1-{6-[(二甲基氨基)甲基]-1-甲基-5,6-二氢-1H-环丁二烯并[f][1]吲哚-6-基}-环戊醇
依次按照实施例1、2和8的方法获得产物,在实施例1的步骤A中采用环戊酮代替环己酮。
熔点:108-111℃(M.K.)
实施例30:1-{5-[(二甲基氨基)甲基]-1-甲基-5,6-二氢-1H-环丁二烯并[f][1]吲哚-5-基}-环戊醇
依次按照实施例1、2和8的方法获得产物,在实施例1的步骤A中采用环戊酮代替环己酮,并采用制备例21的产物代替制备例3的产物。
熔点:100-104℃(M.K.)
实施例31:1-{7-[(二甲基氨基)甲基]-6,7-二氢环丁二烯并[g][1]苯并呋喃-7-基}-环戊醇
按照实施例4步骤A至B的方法,然后按照实施例5的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例16的产物代替制备例9的产物。
熔点:135-137℃(M.K.)
实施例32:1-{6-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并呋喃-6-基}-环戊醇和其盐酸盐
按照实施例4步骤A至B的方法,然后按照实施例5的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例10的产物代替制备例9的产物。通过氯化氢乙醚溶液作用制备盐酸盐。
熔点(盐酸盐):225-235℃(M.K.)
实施例33:1-{6-[(二甲基氨基)甲基]-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}-环戊醇
按照实施例3步骤A至B的方法获得产物,在步骤A中,采用由环戊酮而非环己酮为原料在实施例1步骤A中制备的产物。
熔点:105-108℃(M.K.)
实施例34:1-{6-[(二甲基氨基)甲基]-5,6-二氢-1H-环丁二烯并[f]吲哚-6-基}-环戊醇
按照实施例8的方法获得产物,采用实施例33的产物作为反应物。
熔点:180-184℃(M.K.)
实施例35:1-{1-[(二甲基氨基)甲基]-1,2-二氢环丁二烯并[b]萘-1-基}-环戊醇
按照实施例4步骤A至B的方法,然后按照实施例5的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例17的产物代替制备例9的产物。
熔点(盐酸盐):133-135℃(M.K.)实施例36:1-{7-[(二甲基氨基)甲基]-6,7-二氢-3H-环丁二烯并[e]吲哚-7-基}-环戊醇
按照实施例3步骤A至D的方法,然后按照实施例8的方法获得产物,在实施例3的步骤A中采用实施例1步骤A制备的产物,但一方面采用制备例9的产物,另一方面采用环戊酮。
熔点:200-204℃(M.K.)
实施例37:1-{1-[(二甲基氨基)甲基]-1,2-二氢环丁二烯并[a]萘-1-基}-环戊醇和其盐酸盐
按照实施例4步骤A至B的方法,然后按照实施例5的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例18的产物代替制备例9的产物。通过氯化氢乙醚溶液获得盐酸盐。
熔点(盐酸盐):258-262℃(M.K.)
实施例38:1-(7-{[((2S)-2,3-二氢-1,4-苯并二噁英-2-基甲基)氨基]甲基}-6,7-二氢环丁二烯并[g][1]苯并呋喃-7-基)环戊醇和其盐酸盐
步骤A:1-[7-(氨基甲基)-6,7-二氢环丁二烯并[g][1]苯并呋喃-7-基]环戊醇
按照实施例4步骤A至B的方法获得产物,在步骤A中采用环戊酮代替环己酮作为反应物,并采用制备例16的产物代替制备例9的产物。
步骤B:(2R)-N-{[7-(1-羟基环戊基)-6,7-二氢环丁二烯并[g][1]-苯并呋喃-7-基]甲基}-2,3-二氢-1,4-苯并二噁英-2-甲酰胺
在0℃下,将762mg的(2R)-2,3-二氢苯并[1,4]二噁英-2-基甲酰氯的溶液加至在30ml二氯甲烷和1.2ml二异丙基乙基胺中的900mg步骤A中获得的化合物中。在室温下48小时后,将反应混合物用水稀释,再用二氯甲烷萃取。在减压蒸发后,对有机相进行常规处理,分离出蛋糖霜状的目的产物。
步骤C:1-(7-{[((2S)-2,3-二氢-1,4-苯并二噁英-2-基甲基)氨基]甲基}-6,7-二氢环丁二烯并[g][1]苯并呋喃-7-基)环戊醇和其盐酸盐
将500mg氢化锂铝在20ml四氢呋喃中回流,然后加入溶解于20ml四氢呋喃中的步骤B中获得的产物。在回流3小时30分钟后,通过加入0.45ml的水、0.31ml的20%氢氧化钠溶液和1.67ml的水使反应混合物水解。在过滤和蒸发后,通过硅胶色谱处理(二氯甲烷/乙醇:98/2),分离出目的产物,通过氯化氢乙醚溶液的作用将其转化成盐酸盐。
熔点(盐酸盐):213-235℃
实施例39:1-(5-{[((2R)-2,3-二氢-1,4-苯并二噁英-2-基甲基)氨基]甲基}-5,6-二氢环丁二烯并[f][1,3]苯并二氧杂环戊烯-5-基)环戊醇和其盐酸盐
按照实施例38步骤A至C的方法获得产物,在步骤A中采用制备例15的产物,在步骤B中采用(2S)-2,3-二氢苯并[1,4]二噁英-2-基甲酰氯。
熔点(盐酸盐):109-119℃(M.K.)
实施例40:1-(1-{[[2-(5-氟-1H-吲哚-3-基)乙基](甲基)氨基]甲基}-1,2-二氢环丁二烯并[b]萘-1-基)环戊醇
步骤A:1-{[(甲基)氨基]甲基}-1,2-二氢环丁二烯并[b]萘-1-基)环戊醇
按照实施例22的方法获得产物,采用1-[1-(氨基甲基)-1,2-二氢环丁二烯并[b]萘-1-基)环戊醇作为反应物,其由制备例17获得。
步骤B:2-(5-氟-1H-吲哚-3-基)-N-[[1-(1-羟基环戊基)-1,2-二氢环丁二烯并[b]萘-1-基]甲基]-N-甲基乙酰胺
将溶解于30ml二氯甲烷中的0.652g(5-氟-吲哚-3-基)乙酸用0.61g的羰基二咪唑在室温下处理30分钟。向溶液中倒入溶解于5ml二氯甲烷中的步骤A获得的0.95g产物。当反应完成后,将反应混合物吸收于水中,倾析,干燥和蒸发,得到目的产物。
步骤C:1-(1-{[[2-(5-氟-1H-吲哚-3-基)乙基](甲基)氨基]甲基}-1,2-二氢环丁二烯并[b]萘-1-基)环戊醇
按照实施例39的方法获得产物,采用上述步骤B获得的产物作为反应物。本发明化合物的药理学研究A.体外研究
实施例41:测量对5-羟色胺再摄取位点的亲和性
通过采用[3H]-帕罗西汀(NEN,Les Ulis,法国)的竞争性实验测量亲和性。由大鼠额皮质制备膜,将其与1.0nM的[3H]-帕罗西汀和冷配体在25℃下一式三份培养2小时,最终体积为0.4ml。培养缓冲液包含50nM的TRIS-HCl(pH7.4)、120mM NaCl和5mM KCl。采用10μm的西酞普兰测量非特异性结合。在培养结束时,将培养基过滤,并各用5ml冷却的缓冲液洗涤3次。在过滤器上留下的放射性用液体闪烁记数器测量。通过非线性回归法分析结合等温线,以测定IC50值。采用Cheng-Prusoff方程式将这些值转化成解离常数(Ki):
Ki=IC50/(1+L/Kd)其中,L为[3H]-帕罗西汀的浓度,Kd为[3H]-帕罗西汀对5-羟色胺再摄取位点(0.13nM)的解离常数。结果以pKi(-logKi)表示。
本发明的化合物显示出其对5-羟色胺再摄取位点优良的亲和性,其pKi值≥7。
实施例42:测量对去甲肾上腺素再摄取位点的亲和性
通过采用[3H]-尼索西汀(Amersham,Les Ulis,法国)的竞争性实验测量亲和性。由大鼠额皮质制备膜,将其用2nM的[3H]-尼索西汀和冷却的配体在4℃下一式三份地培养4小时,终体积为0.5ml。培养缓冲液包含50mM的TRIS-HCl(pH7.4)、300mM NaCl和5 mM KCl。采用10μm的地昔帕明测量非特异性结合。在培养结束时,将培养基过滤,并用5ml冷却的过滤缓冲液(50mM TRIS-HCl,pH7.4,300mM NaCl和5mM KCl)洗涤3次。在过滤器上留下的放射性用液体闪烁记数器测量。通过非线性回归法分析结合等温线,以测定IC50值。采用Cheng-Prusoff方程式将这些值转化成解离常数(Ki):
Ki=IC50/(1+L/Kd)其中,L为[3H]-尼索西汀的浓度,Kd为[3H]-尼索西汀对去甲肾上腺素再摄取位点(1.23nM)的解离常数。结果以pKi(-logKi)表示。
本发明的化合物的pKi值≥6。
B.体内研究
实施例43:在大鼠中进行的微透析实验
用戊巴比妥将大鼠麻醉(60mg/kg i.p.)。将它们放置在Kopf立体定位装置中,按照Paxinos和Watson atlas(1982)所述的下述坐标在扣带额皮质中植入套管导丝:AP=+2.2;L=±0.6;DV=-0.2。将大鼠放置于不同的笼内,5天后再用于透析。在透析的当天,将探针缓慢地向下插入并固定。在1μl/mn的流速下灌注探针,所用溶液为147.2mM NaCl、4mM KCl和2.3mM CaCl2,用磷酸盐缓冲液(0.1M)调节pH值至7.3。在植入2小时后,每隔20分钟收集一次样品,持续4小时。在给予被测试的产物之前取三份基线样品。在整个实验期间,大鼠单个地关在笼中。当完成实验后,将大鼠断头,取出大脑并在异戊烷中冷冻。切下厚度为100μm的切片,并用甲酚紫染色,以此检验探针的位置。
按如下所述同时对多巴胺、去甲肾上腺素和5-羟色胺进行定量:20μ1的透析样品分别用20μ1的流动相(NaH2PO4:75mM,EDTA:20μm,1-癸烷磺酸钠:1mM,甲醇:17.5%,三乙胺:0.01%,pH:5.70)稀释,将33μl的样品通过HPLC进行分析,采用恒温保持在45℃的反相柱,并通过电量检测器定量分析。在检测器的第一个电极上的电位设置在-90mV(还原),第二个电极则设置在+280mV(氧化)。采用泵以2ml/mn的流速注入流动相。对多巴胺、去甲肾上腺素和5-羟色胺的灵敏度极限为0.55fmo1/样品。所有本发明的产物均经皮下注入,体积量为1.0ml/kg。产物溶解于蒸馏水中,必要时向其中加入几滴乳酸。结果:
作为实例以及为说明本发明的产物(如实施例5的化合物)的活性,以剂量为10mg/kg皮下给药,使5-羟色胺的含量增加了250±15%,去甲肾上腺素的含量增加500±13%和多巴胺含量增加400±50%(与定义为0%的基础水平相比效果的最大%)。
实施例44:小鼠中的弹子埋藏实验
该实验用于评价药理活性试剂抑制小鼠自发性弹子埋藏行为,该抑制可预测抗抑郁和/或抗冲动作用。在实验的当天,将重量为20-25g的NMRI品系雄性小鼠(Iffa-Credo,I’Arbresle,法国)单个地放置于Macrolon箱(30×18×19cm)中,箱内包含5cm的锯末并覆盖着开孔的有机玻璃板。在箱子的外周于锯末上均匀分布24个“虎眼”玻璃弹子。在自由探察30分钟的末期,将小鼠从箱中取出,并计算埋藏的弹子数。
结果:
作为实例,下表给出了与参照抗抑郁剂氟西汀相比,本发明化合物的作用。
ID50=抑制剂量50剂量用mg/kg s.c.表示。
| 实施例 | 小鼠,弹子-埋藏,ID50 |
| 氟西汀5 | 8.030.6 |
实施例45:药物组合物:片剂
用于制备1000片包含5mg剂量的制剂
实施例5的化合物 5g
羟丙基甲基纤维素 5g
小麦淀粉 10g
乳糖 100g
硬脂酸镁 2g
Claims (16)
1、下式(Ⅰ)的化合物、它们的异构体和其与可药用酸或碱形成的加成盐:
n为1-6的整数,
R1和R2可相同或不同,彼此独立地表示选自下述的基团:氢原子、直链或支链的(C1-C6)烷基、芳基、其中烷基部分为直链或支链的芳基-(C1-C6)烷基、环烷基、其中烷基部分为直链或支链的环烷基-(C1-C6)烷基、直链或支链的(C2-C6)链烯基、直链或支链的(C2-C6)链炔基、杂环烷基、其中烷基部分为直链或支链的杂环烷基-(C1-C6)烷基、杂芳基和其中烷基部分为直链或支链的杂芳基-(C1-C6)烷基,
Ⅹ表示选自如下的基团:-CH=CH-、氧原子、基团S(O)m,其中,m为0-2的整数,和NR3,其中R3表示选自:氢原子、直链或支链的(C1-C6)烷基、芳基、其中烷基部分为直链或支链的芳基-(C1-C6)烷基、环烷基、其中烷基部分为直链或支链的环烷基-(C1-C6)烷基、直链或支链的(C2-C6)链烯基、直链或支链的(C2-C6)链炔基的基团,Y表示CH或CH2基团,取决于
是代表单键或双键,或当X表示氧原子时具有氧原子的附加含义,
T表示单环或多环(C3-C12)环烷基,其中,环烷基的碳原子之一可选择性地被一种基团取代,所述基团选自:氧原子、硒原子、式S(O)p的基团,其中p为整数0-2,NR3,其中R3如前定义,和SiR4R5,其中R4和R5可相同或不同,表示直链或支链的(C1-C6)烷基,
应理解:·“芳基”是指选自如下的基团:苯基、联苯基、萘基、二氢萘基、四氢萘基、二氢化茚基、茚基和苯并环丁基,这些基团可选择性地被一个或多个相同或不同的基团取代,所述基团选自:卤原子、直链或支链的(C1-C6)烷基、羟基、直链或支链的(C1-C6)烷氧基、硝基、氰基、直链或支链的三卤代-(C1-C6)烷基、氨基、烷基部分具有1至6个碳原子并为直链或支链的单烷基氨基和各烷基部分具有1至6个碳原子并为直链或支链的二烷基氨基,·“杂芳基”是指如前定义的芳基,在其环体系内包含一至三个相同或不同的选自氧、氮和硫的杂原子,所述的杂芳基可选择性地被一个或多个相同或不同的选自上述对芳基定义的取代基取代,·“环烷基”是指单或多环体系,其具有3-12个环原子,选择性地包含一个或多个不饱和键,其并不会给所述的环体系带来芳族特性,·“杂环烷基”是指如前定义的环烷基,在其环体系内包含一至三个相同或不同的选自氧、氮和硫的杂原子。
2、根据权利要求1的式(Ⅰ)化合物、它们的异构体和其与可药用酸或碱形成的加成盐,其特征在于,n为1。
3、根据权利要求1的式(Ⅰ)化合物、它们的异构体和其与可药用酸或碱形成的加成盐,其特征在于,R1和R2可相同或不同,表示氢原子、直链或支链的(C1-C6)烷基或2,3-二氢-1,4-苯并二噁英-2-基甲基。
4、根据权利要求1的式(Ⅰ)化合物、它们的异构体和其与可药用酸或碱形成的加成盐,其特征在于,T表示饱和的单环(C3-C8)环烷基。
5、根据权利要求1-4任一项的式(Ⅰ)化合物、它们的异构体和其与可药用酸或碱形成的加成盐,其特征在于,T表示环戊基或环己基。
8、根据权利要求7的式(Ⅰ/B)化合物、它们的异构体和其与可药用酸或碱形成的加成盐,其特征在于,n为1,X表示基团NR3,其中,R3表示氢原子或直链或支链的(C1-C6)烷基。
13、根据权利要求1的式(Ⅰ)化合物、它们的异构体和其与可药用酸或碱形成的加成盐,其为:
·1-{6-[(二甲基氨基)甲基]-1-甲基-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}环己醇,
·1-{6-[(二甲基氨基)甲基)-2,3,5,6-四氢-1H-环丁二烯并[f]吲哚-6-基}-环己醇,
·1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并呋喃-5-基}-环己醇,
·1-{5-[(二甲基氨基)甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环己醇,
·1-{6-[(二甲基氨基)甲基]-1-甲基-5,6-二氢-1H-环丁二烯并[f]吲哚-6-基}-环己醇,
·1-{7-[(二甲基氨基)甲基]-2,3,6,7-四氢-1H-环丁二烯并[e]吲哚-7-基}-环己醇,
·1-{5-[(甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·(+)-1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·(-)-1-{5-[(二甲基氨基)甲基]-5,6-二氢环丁二烯并[f][1]苯并噻吩-5-基}-环戊醇,
·1-{6-[(二甲基氨基)甲基)-5,6-二氢环丁二烯并[f][1]苯并噻吩-6-基}-环戊醇,
·1-{5-[(二甲基氨基)甲基)-1-甲基-5,6-二氢-1H-环丁二烯并[f]吲哚-5-基}-环戊醇,
·1-{7-[(二甲基氨基)甲基]-6,7-二氢环丁二烯并[g][1]苯并呋喃-7-基}-环戊醇,
·1-{1-[(二甲基氨基)甲基]-1,2-二氢环丁二烯并[b]萘-1-基}环戊醇,
·1-{7-[(二甲基氨基)甲基]-6,7-二氢-3H-环丁二烯并[e]吲哚-7-基}环戊醇,
·1-{1-[(二甲基氨基)甲基]-1,2-二氢环丁二烯并[a]萘-1-基}环戊醇。
14、式(Ⅰ)化合物的制备方法,其特征在于,采用下述化合物作为原料:
a)或者,式(Ⅱ)的化合物:其中,Xa表示硫原子、氧原子或NH基团,
式(Ⅱ)的化合物与式(Ⅲ)的化合物反应:
Z-CH(OA)2 (Ⅲ)
式(Ⅳ)的化合物:
·或者,当Xa具有X1的含义时,表示氧原子或硫原子,使该化合物通过酸如多磷酸或路易斯酸的作用而承受环化条件而得到式(Ⅴ/a)的化合物:其中,X1表示氧原子或硫原子,
式(Ⅴ/a)的化合物进行下述处理:
*或者,在强碱存在下,用式(Ⅵ)的环酮处理:其中,T具有与式(Ⅰ)相同的含义,得到式(Ⅶ/a)的化合物其中,Xa和T如前定义,
对于式(Ⅰ/a)的化合物:
或者,按照有机合成的常规方法取代伯胺官能团,如用式(Ⅷa)的化合物进行还原胺化或亲核取代:
R’1-Z1(Ⅷa)其中,R’1具有与式(Ⅰ)中R1相同的含义,但不为氢原子,Z1表示在有机化学中常规的离去基团,如卤原子或甲磺酸根或甲苯磺酸根基团,
或者,按照该方法的优选实施方案,用式(Ⅷb)的化合物进行处理:
R″1-COZ2 (Ⅷb)
其中,R″1表示杂环烷基-(C1-C5)烷基,其中,烷基部分为直链或支链的,Z2表示氯原子或咪唑基团,得到式(Ⅰ/b2)的化合物:其中,X1、T和R″1如前定义,对式(Ⅰ/b2)的化合物用有机化学中常规采用的还原剂进行还原,得到式(Ⅰ/b3)的化合物:其中,X1、R″1和T如前定义,
式(Ⅰ/b1)和(Ⅰ/b3)化合物的总体构成式(Ⅰ/b)的化合物,
式(Ⅰ/b)的化合物按照如前所述相同的条件用式(Ⅷc)的化合物进行处理:
R’2-Z1 (Ⅷc)其中,Z1如前定义,和R’2具有与式(Ⅰ)中R2相同的定义,只是不为氢原子,得到式(Ⅰ/c)的化合物,一种式(Ⅰ)化合物的具体情形:其中,X1、T、R’1和R’2如前定义,
其中,R1和R2如式(Ⅰ)定义,n1为2-6的整数,且
L表示离去基团,如卤原子、甲磺酸根、甲苯磺酸根或三氟甲磺酸根基团,得到式(Ⅹ)的化合物:其中,X1、n1、R1和R2如前定义,
式(Ⅺ)的化合物在10%Pd/C存在下用甲酸铵进行还原,得到式(Ⅻ)的化合物:其中,X1、n1、R1和R2如前定义,
对式(Ⅻ)的化合物用式(ⅩⅢ)的化合物进行作用:
(CH3)2N-CH(OG)2 (ⅩⅢ)其中,G表示直链或支链的(C1-C6)烷基、苄基或环己基,得到式(ⅩⅣ)的化合物:其中,X1、n1、R1和R2如前定义,
其中X1表示氧原子或硫原子的式(Ⅰa)、(Ⅰ/b)、(Ⅰ/c)、(Ⅰ/d)化合物与(Ⅰ/f)的化合物的总体构成式(Ⅰ/g)的化合物,其中,X1a表示氧原子或式S(O)p的基团,其中,p如式(Ⅰ)中的定义,和n、R1、R2和T如式(Ⅰ)定义,
式(Ⅰ/g)的化合物按照有机合成中的常规条件用还原剂作用,得到式(Ⅰ/h)的化合物,一种式(Ⅰ)化合物的具体情形:其中,X1a、n、R1、R2和T如前定义,
·或者,当Xa具有X′2的含义时,表示NH基团时,对该化合物用式(ⅩⅥ)的磺酰氯进行作用:
E-SO2Cl(ⅩⅥ)其中,E表示直链或支链的(C1-C4)烷基、苯基或对甲苯酰基,
得到式(ⅩⅦ)的化合物:其中,X2表示氮原子,且E和A如前定义,
式(ⅩⅦ)的化合物通过酸的作用而环化,得到式(Ⅴ/b)的化合物:其中,X2和E如前定义,
使式(Ⅶ/b)的化合物:
◆或者,按照与式(Ⅶ/a)的化合物所述相同的条件进行处理,得到式(Ⅰ/i)的化合物,一种式(Ⅰ)化合物的具体情形:其中,X2和T如前定义,
使式(Ⅰ/i)的化合物依次用如前定义的式(Ⅷa)或(Ⅷb)的化合物,然后用式(Ⅷc)的化合物处理,分别得到式(Ⅰ/j)和(Ⅰ/k)的化合物,为式(Ⅰ)化合物的具体情形:其中,X2、T、R’1和R’2如前定义,和R’3具有与R’1相同的含义和值,
式(Ⅰ/l)的化合物用氧化剂如二氧化锰作用,得到式(Ⅰ/m)的化合物,一种式(Ⅰ)化合物的具体情形:其中,X2、R1、R2、R3和T如前定义,
◆或者,用如前定义的式(ⅩⅥ)化合物进行处理,得到式(ⅩⅧ)的化合物:其中,T、X2和E如前定义,
式(ⅩⅧ)的化合物按照有机合成的常规条件进行还原,得到式(ⅩⅨ)的化合物:其中,T、X2和E如前定义,
式(Ⅱ/1)的化合物与(EtO)2POCH2CN反应,得到式(Ⅱ/2)的化合物:其中,Hal、Xb和Yb如前定义,
式(Ⅱ/2)的化合物首先用有机化学中常规采用的还原剂处理,然后与NaNH2反应,得到式(Ⅱ/3)的化合物:其中,Xb和Yb如前定义,
使式(Ⅱ/3)的化合物在与式(Ⅴ/a)相同的条件下,
*或者,用式(Ⅸ)的化合物处理,形成的产物再以与式(Ⅹ)和(Ⅺ)相同的方式处理,然后相继用如前所述的(ⅩⅢ)的化合物再用(ⅩⅤ)的化合物处理,得到式(Ⅰ/3d)的化合物:其中,Xb、Yb、n1、R1和R2如前定义,
化合物(Ⅰ/a)至(Ⅰ/o)和(Ⅰ/3a)至(Ⅰ/3d)构成了本发明化合物的总体,如果需要的话,按照常规纯化技术对其进行纯化,如果需要的话,可将其按照常规分离技术分离成不同的异构体,必要时,可用可药用酸或碱将其转化成其加成盐。
15、一种药物组合物,其包含作为活性成分的至少一种权利要求1至13任一项的式(Ⅰ)化合物本身或其与一种或多种惰性、无毒的可药用赋形剂或载体组合。
16、根据权利要求15的包含至少一种权利要求1至13任一项的化合物作为活性成分的药物组合物,用作治疗抑郁症、惊恐发作、强迫症、恐惧症、冲动障碍、药物滥用、焦虑、肥胖症和贪食症的药物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0004742A FR2807753B1 (fr) | 2000-04-13 | 2000-04-13 | Nouveaux derives d'heterocycloalkylbenzocyclobutane et d'heteroarylbenzocyclobutane, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| FR0004742 | 2000-04-13 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1323794A true CN1323794A (zh) | 2001-11-28 |
| CN1166659C CN1166659C (zh) | 2004-09-15 |
Family
ID=8849212
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB011163860A Expired - Fee Related CN1166659C (zh) | 2000-04-13 | 2001-04-13 | 新型杂环烷基苯并环丁烷和杂环芳基苯并环丁烷化合物,其制备方法和包含它们的药物组合物 |
Country Status (25)
| Country | Link |
|---|---|
| US (1) | US6420413B2 (zh) |
| EP (1) | EP1146041B1 (zh) |
| JP (1) | JP3761796B2 (zh) |
| KR (1) | KR100456795B1 (zh) |
| CN (1) | CN1166659C (zh) |
| AR (1) | AR028324A1 (zh) |
| AT (1) | ATE254102T1 (zh) |
| AU (1) | AU777825B2 (zh) |
| BR (1) | BR0101444A (zh) |
| CA (1) | CA2344255C (zh) |
| DE (1) | DE60101177T2 (zh) |
| DK (1) | DK1146041T3 (zh) |
| EA (1) | EA004473B1 (zh) |
| ES (1) | ES2210104T3 (zh) |
| FR (1) | FR2807753B1 (zh) |
| HK (1) | HK1042477B (zh) |
| HU (1) | HUP0101503A3 (zh) |
| MX (1) | MXPA01003553A (zh) |
| NO (1) | NO318158B1 (zh) |
| NZ (1) | NZ511092A (zh) |
| PL (1) | PL347056A1 (zh) |
| PT (1) | PT1146041E (zh) |
| SI (1) | SI1146041T1 (zh) |
| TR (1) | TR200302002T4 (zh) |
| ZA (1) | ZA200103065B (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105541662A (zh) * | 2015-12-28 | 2016-05-04 | 云南大学 | 二氢萘类化合物的固相合成方法 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1572647B1 (en) * | 2002-12-20 | 2016-09-21 | Basf Se | Synthesis of amines and intermediates for the synthesis thereof |
| US7803894B2 (en) * | 2003-12-05 | 2010-09-28 | 3M Innovatie Properties Company | Coating compositions with perfluoropolyetherisocyanate derived silane and alkoxysilanes |
| CN107445835B (zh) * | 2017-07-05 | 2020-09-22 | 江苏师范大学 | 一种1,2-二氢环丁烯并[a]萘衍生物及其前体的合成方法 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2273764T3 (es) * | 1993-06-28 | 2007-05-16 | Wyeth | Nuevos tratamientos que utilizan derivados de fenetilamina. |
| US5530013A (en) * | 1994-02-14 | 1996-06-25 | American Home Products Corporation | Venlafaxine in the inducement of cognition enhancement |
| JPH09512025A (ja) * | 1994-04-23 | 1997-12-02 | スミスクライン・ビーチャム・パブリック・リミテッド・カンパニー | 5ht▲下2c▼および5ht▲下2b▼アンタゴニストとしての三環式誘導体 |
| US5506270A (en) * | 1995-01-30 | 1996-04-09 | American Home Products Corporation | Venlafaxine in the treatment of hypothalamic amenorrhea in non-depressed women |
| FR2775687B1 (fr) * | 1998-03-04 | 2000-04-14 | Adir | Nouveaux composes du benzocyclobutane, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
-
2000
- 2000-04-13 FR FR0004742A patent/FR2807753B1/fr not_active Expired - Fee Related
-
2001
- 2001-04-06 MX MXPA01003553A patent/MXPA01003553A/es unknown
- 2001-04-10 JP JP2001111169A patent/JP3761796B2/ja not_active Expired - Fee Related
- 2001-04-11 AR ARP010101713A patent/AR028324A1/es unknown
- 2001-04-11 BR BR0101444-7A patent/BR0101444A/pt not_active Application Discontinuation
- 2001-04-11 NO NO20011862A patent/NO318158B1/no unknown
- 2001-04-12 AT AT01400940T patent/ATE254102T1/de not_active IP Right Cessation
- 2001-04-12 PT PT01400940T patent/PT1146041E/pt unknown
- 2001-04-12 SI SI200130044T patent/SI1146041T1/xx unknown
- 2001-04-12 KR KR10-2001-0019542A patent/KR100456795B1/ko not_active IP Right Cessation
- 2001-04-12 ES ES01400940T patent/ES2210104T3/es not_active Expired - Lifetime
- 2001-04-12 EA EA200100343A patent/EA004473B1/ru not_active IP Right Cessation
- 2001-04-12 US US09/833,827 patent/US6420413B2/en not_active Expired - Fee Related
- 2001-04-12 ZA ZA200103065A patent/ZA200103065B/xx unknown
- 2001-04-12 EP EP01400940A patent/EP1146041B1/fr not_active Expired - Lifetime
- 2001-04-12 DE DE60101177T patent/DE60101177T2/de not_active Expired - Fee Related
- 2001-04-12 TR TR2003/02002T patent/TR200302002T4/xx unknown
- 2001-04-12 DK DK01400940T patent/DK1146041T3/da active
- 2001-04-12 AU AU35187/01A patent/AU777825B2/en not_active Ceased
- 2001-04-12 HU HU0101503A patent/HUP0101503A3/hu unknown
- 2001-04-12 NZ NZ511092A patent/NZ511092A/xx unknown
- 2001-04-13 PL PL01347056A patent/PL347056A1/xx not_active Application Discontinuation
- 2001-04-13 CN CNB011163860A patent/CN1166659C/zh not_active Expired - Fee Related
- 2001-04-17 CA CA002344255A patent/CA2344255C/fr not_active Expired - Fee Related
-
2002
- 2002-03-22 HK HK02102196.6A patent/HK1042477B/zh not_active IP Right Cessation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105541662A (zh) * | 2015-12-28 | 2016-05-04 | 云南大学 | 二氢萘类化合物的固相合成方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1240701C (zh) | 用作5HT2C激动剂的2,3,4,4a-四氢-1H-吡嗪并(1,2-a)喹喔啉-5(6H)酮衍生物 | |
| CN1092643C (zh) | 用于增强记忆的氨甲基苯基咪唑衍生物 | |
| CN1077574C (zh) | 托烷衍生物,其制备和应用 | |
| CN1165537C (zh) | 作为5-ht2c兴奋剂的吡咯并吲哚、吡啶并吲哚和氮杂�并吲哚 | |
| CN1084748C (zh) | 氨基甲基-2,3,8,9-四氢-7H-1,4-二氧杂环己烯并[2,3-e]吲哚-8-酮及其衍生物和用途 | |
| CN1042133C (zh) | N-取代的氮杂双环庚烷衍生物及其用途 | |
| CN1167681C (zh) | 稠合二氢吲哚衍生物及其作为5ht特别是5ht2c受体配体的用途 | |
| CN1045781A (zh) | N-(3-羟基-4-哌啶基)(二氢苯并呋喃,二氢-2h-苯并吡喃或二氢苯并二英)甲酰胺衍生物 | |
| CN1133043A (zh) | 双环芳族化合物用作治疗剂 | |
| CN1230432C (zh) | 取代的苯基-哌嗪衍生物及其制备和用途 | |
| CN1620290A (zh) | 作为5-羟色胺-6配体的吲哚基烷基胺衍生物 | |
| CN1332168A (zh) | 3-取代的吡啶并[4′,3′∶4,5]噻吩并[2,3-d]嘧啶衍生物,它们的制备和应用 | |
| CN1222521A (zh) | 1,3,8-三氮杂螺[4,5]癸-4-酮衍生物 | |
| CN1114957A (zh) | 新(硫代)环烷基[b]吲哚化合物及制法和药物组合物 | |
| CN100338074C (zh) | 杂环化合物和以其为有效成分的脑机能改善剂 | |
| CN1153766C (zh) | 新的硝酮化合物,其制备方法以及含有它们的药物组合物 | |
| CN1267434C (zh) | 抗抑郁的(SSSRI)7,8-二氢-3H-6,9-二氧杂-1,3-二氮杂环戊二烯并[a]萘的氮杂环基甲基衍生物 | |
| CN1058495C (zh) | 在治疗识别障碍中用作神经递质释放增强剂的多环体系类化合物及其衍生物和含有它们的药物组合物及其用途 | |
| CN1487831A (zh) | 用作mGluR1拮抗剂的四氢-(苯并或噻吩并)-氮杂�-吡嗪和三嗪衍生物 | |
| CN1323794A (zh) | 新型杂环烷基苯并环丁烷和杂环芳基苯并环丁烷化合物,其制备方法和包含它们的药物组合物 | |
| CN1216856C (zh) | 具有亚环烷基链的新环状化合物,其制备方法和含有它们的药物组合物 | |
| CN1437598A (zh) | 新吲哚衍生物 | |
| CN1257864A (zh) | 新的咪唑啉化合物、其制备方法和含有它们的药物组合物 | |
| CN1187336C (zh) | 咪唑类衍生物 | |
| CN1028531C (zh) | 1-氧杂-2-氧代-8-氮杂螺[4,5]癸烷衍生物及其盐的制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C06 | Publication | ||
| PB01 | Publication | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1042477 Country of ref document: HK |
|
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20040915 |