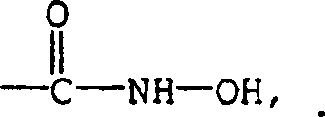
CN1161341C - cGMP磷酸二酯酶的稠合吡啶并哒嗪抑制剂 - Google Patents
cGMP磷酸二酯酶的稠合吡啶并哒嗪抑制剂 Download PDFInfo
- Publication number
- CN1161341C CN1161341C CNB008053766A CN00805376A CN1161341C CN 1161341 C CN1161341 C CN 1161341C CN B008053766 A CNB008053766 A CN B008053766A CN 00805376 A CN00805376 A CN 00805376A CN 1161341 C CN1161341 C CN 1161341C
- Authority
- CN
- China
- Prior art keywords
- alkyl group
- low alkyl
- compound
- group
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 title claims abstract description 35
- 239000003112 inhibitor Substances 0.000 title abstract description 7
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 title description 5
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 title description 5
- 150000001875 compounds Chemical class 0.000 claims abstract description 203
- 125000000217 alkyl group Chemical group 0.000 claims description 220
- -1 methoxyl group Chemical group 0.000 claims description 108
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 94
- 238000006243 chemical reaction Methods 0.000 claims description 59
- 229910052739 hydrogen Inorganic materials 0.000 claims description 56
- 239000001257 hydrogen Substances 0.000 claims description 51
- 239000012442 inert solvent Substances 0.000 claims description 49
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 46
- 238000002360 preparation method Methods 0.000 claims description 44
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 40
- 150000003839 salts Chemical class 0.000 claims description 39
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 38
- 239000002585 base Substances 0.000 claims description 34
- 229910052799 carbon Inorganic materials 0.000 claims description 34
- 239000000460 chlorine Substances 0.000 claims description 31
- 238000000034 method Methods 0.000 claims description 31
- 229910052757 nitrogen Inorganic materials 0.000 claims description 30
- 239000003513 alkali Substances 0.000 claims description 27
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 27
- 150000002431 hydrogen Chemical class 0.000 claims description 25
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 24
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 23
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 claims description 19
- 229910052801 chlorine Inorganic materials 0.000 claims description 19
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 17
- 150000001412 amines Chemical class 0.000 claims description 16
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 16
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 15
- 201000010099 disease Diseases 0.000 claims description 15
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 15
- LSDPWZHWYPCBBB-UHFFFAOYSA-N Methanethiol Chemical compound SC LSDPWZHWYPCBBB-UHFFFAOYSA-N 0.000 claims description 14
- 125000005270 trialkylamine group Chemical group 0.000 claims description 14
- 229910052760 oxygen Inorganic materials 0.000 claims description 12
- QQVIHTHCMHWDBS-UHFFFAOYSA-N perisophthalic acid Natural products OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 claims description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N methyl alcohol Substances OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 11
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 10
- CFHIDWOYWUOIHU-UHFFFAOYSA-N oxomethyl Chemical compound O=[CH] CFHIDWOYWUOIHU-UHFFFAOYSA-N 0.000 claims description 10
- 125000001424 substituent group Chemical group 0.000 claims description 9
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 claims description 8
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 8
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical group BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 8
- 229910052794 bromium Inorganic materials 0.000 claims description 8
- 239000011630 iodine Chemical group 0.000 claims description 8
- 229910052740 iodine Chemical group 0.000 claims description 8
- 125000000468 ketone group Chemical group 0.000 claims description 8
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Natural products C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 claims description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 5
- 125000000538 pentafluorophenyl group Chemical group FC1=C(F)C(F)=C(*)C(F)=C1F 0.000 claims description 5
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 claims description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 4
- 239000008194 pharmaceutical composition Substances 0.000 claims description 4
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 239000011737 fluorine Substances 0.000 claims description 3
- 229910052731 fluorine Inorganic materials 0.000 claims description 3
- PAMIQIKDUOTOBW-UHFFFAOYSA-N N-methylcyclohexylamine Natural products CN1CCCCC1 PAMIQIKDUOTOBW-UHFFFAOYSA-N 0.000 claims description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 2
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 claims description 2
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 claims description 2
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 claims description 2
- 125000001309 chloro group Chemical group Cl* 0.000 claims 2
- 125000004432 carbon atom Chemical group C* 0.000 claims 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims 1
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 74
- 239000007787 solid Substances 0.000 description 49
- 125000000753 cycloalkyl group Chemical group 0.000 description 46
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 45
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 39
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 37
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 36
- 239000003795 chemical substances by application Substances 0.000 description 33
- ZOOGRGPOEVQQDX-UHFFFAOYSA-N cyclic GMP Natural products O1C2COP(O)(=O)OC2C(O)C1N1C=NC2=C1NC(N)=NC2=O ZOOGRGPOEVQQDX-UHFFFAOYSA-N 0.000 description 33
- 150000001721 carbon Chemical group 0.000 description 30
- 239000000243 solution Substances 0.000 description 30
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 28
- 229910052736 halogen Inorganic materials 0.000 description 28
- 239000000725 suspension Substances 0.000 description 28
- 150000002367 halogens Chemical class 0.000 description 27
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 26
- 238000004128 high performance liquid chromatography Methods 0.000 description 26
- 239000000203 mixture Substances 0.000 description 26
- 125000003545 alkoxy group Chemical group 0.000 description 25
- 125000004433 nitrogen atom Chemical group N* 0.000 description 25
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 24
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 22
- 238000003756 stirring Methods 0.000 description 22
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 21
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 21
- 125000001072 heteroaryl group Chemical group 0.000 description 20
- 125000004414 alkyl thio group Chemical group 0.000 description 19
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 18
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 18
- 238000005406 washing Methods 0.000 description 18
- 239000002904 solvent Substances 0.000 description 17
- 125000003118 aryl group Chemical group 0.000 description 16
- 239000011541 reaction mixture Substances 0.000 description 15
- 235000014347 soups Nutrition 0.000 description 15
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 14
- 150000002460 imidazoles Chemical class 0.000 description 14
- 125000001544 thienyl group Chemical group 0.000 description 14
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 13
- 239000000463 material Substances 0.000 description 13
- 238000012544 monitoring process Methods 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 12
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- 125000004415 heterocyclylalkyl group Chemical group 0.000 description 12
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 12
- 230000002829 reductive effect Effects 0.000 description 12
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 11
- 125000003710 aryl alkyl group Chemical group 0.000 description 11
- 150000003217 pyrazoles Chemical class 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 10
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 10
- 235000019439 ethyl acetate Nutrition 0.000 description 10
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 10
- 239000003921 oil Substances 0.000 description 10
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 10
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 9
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 9
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 9
- 125000000623 heterocyclic group Chemical group 0.000 description 9
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 9
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 9
- 229920006395 saturated elastomer Polymers 0.000 description 9
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 8
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- 230000002378 acidificating effect Effects 0.000 description 8
- 230000003213 activating effect Effects 0.000 description 8
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 8
- 239000002994 raw material Substances 0.000 description 8
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 8
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 7
- 208000010228 Erectile Dysfunction Diseases 0.000 description 7
- 239000002253 acid Substances 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 7
- 201000001881 impotence Diseases 0.000 description 7
- 238000006722 reduction reaction Methods 0.000 description 7
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 6
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 230000005587 bubbling Effects 0.000 description 6
- 239000003054 catalyst Substances 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 6
- 125000004430 oxygen atom Chemical group O* 0.000 description 6
- 238000001556 precipitation Methods 0.000 description 6
- 230000009467 reduction Effects 0.000 description 6
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 6
- 125000004434 sulfur atom Chemical group 0.000 description 6
- 229910052723 transition metal Inorganic materials 0.000 description 6
- 150000003624 transition metals Chemical class 0.000 description 6
- 238000009834 vaporization Methods 0.000 description 6
- 230000008016 vaporization Effects 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 5
- 125000000664 diazo group Chemical group [N-]=[N+]=[*] 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 239000012065 filter cake Substances 0.000 description 5
- 238000010438 heat treatment Methods 0.000 description 5
- 125000003884 phenylalkyl group Chemical group 0.000 description 5
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 5
- 235000015320 potassium carbonate Nutrition 0.000 description 5
- 235000010288 sodium nitrite Nutrition 0.000 description 5
- 150000003852 triazoles Chemical class 0.000 description 5
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 4
- AMFYRKOUWBAGHV-UHFFFAOYSA-N 1h-pyrazolo[4,3-b]pyridine Chemical compound C1=CN=C2C=NNC2=C1 AMFYRKOUWBAGHV-UHFFFAOYSA-N 0.000 description 4
- FPVWZJJMZVXNKS-UHFFFAOYSA-N 2,3,4,5,6-pentafluorophenol;2,2,2-trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC1=C(F)C(F)=C(F)C(F)=C1F FPVWZJJMZVXNKS-UHFFFAOYSA-N 0.000 description 4
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 4
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 4
- 229910002651 NO3 Inorganic materials 0.000 description 4
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 4
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 150000001408 amides Chemical class 0.000 description 4
- 239000012736 aqueous medium Substances 0.000 description 4
- 239000007864 aqueous solution Substances 0.000 description 4
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 4
- 229910000024 caesium carbonate Inorganic materials 0.000 description 4
- 239000011575 calcium Substances 0.000 description 4
- 229910052791 calcium Inorganic materials 0.000 description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 4
- KXZJHVJKXJLBKO-UHFFFAOYSA-N chembl1408157 Chemical compound N=1C2=CC=CC=C2C(C(=O)O)=CC=1C1=CC=C(O)C=C1 KXZJHVJKXJLBKO-UHFFFAOYSA-N 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- NQMRYBIKMRVZLB-UHFFFAOYSA-N methylamine hydrochloride Chemical compound [Cl-].[NH3+]C NQMRYBIKMRVZLB-UHFFFAOYSA-N 0.000 description 4
- 239000012044 organic layer Substances 0.000 description 4
- XQYZDYMELSJDRZ-UHFFFAOYSA-N papaverine Chemical compound C1=C(OC)C(OC)=CC=C1CC1=NC=CC2=CC(OC)=C(OC)C=C12 XQYZDYMELSJDRZ-UHFFFAOYSA-N 0.000 description 4
- UHZYTMXLRWXGPK-UHFFFAOYSA-N phosphorus pentachloride Chemical compound ClP(Cl)(Cl)(Cl)Cl UHZYTMXLRWXGPK-UHFFFAOYSA-N 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 239000012265 solid product Substances 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 4
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 3
- LTMRRSWNXVJMBA-UHFFFAOYSA-L 2,2-diethylpropanedioate Chemical compound CCC(CC)(C([O-])=O)C([O-])=O LTMRRSWNXVJMBA-UHFFFAOYSA-L 0.000 description 3
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 101100296726 Caenorhabditis elegans pde-5 gene Proteins 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical group [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 description 3
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 3
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N acetaldehyde dimethyl acetal Natural products COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 3
- 229960000583 acetic acid Drugs 0.000 description 3
- 235000010443 alginic acid Nutrition 0.000 description 3
- 229920000615 alginic acid Polymers 0.000 description 3
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 3
- VZTDIZULWFCMLS-UHFFFAOYSA-N ammonium formate Chemical compound [NH4+].[O-]C=O VZTDIZULWFCMLS-UHFFFAOYSA-N 0.000 description 3
- 125000002619 bicyclic group Chemical group 0.000 description 3
- 210000001772 blood platelet Anatomy 0.000 description 3
- 238000006193 diazotization reaction Methods 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 239000006260 foam Substances 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 3
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 description 3
- 210000003205 muscle Anatomy 0.000 description 3
- 229910017604 nitric acid Inorganic materials 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- NXJCBFBQEVOTOW-UHFFFAOYSA-L palladium(2+);dihydroxide Chemical compound O[Pd]O NXJCBFBQEVOTOW-UHFFFAOYSA-L 0.000 description 3
- NCCBCEHAGCSKEA-UHFFFAOYSA-N pentaiodo-$l^{5}-phosphane Chemical compound IP(I)(I)(I)I NCCBCEHAGCSKEA-UHFFFAOYSA-N 0.000 description 3
- UXCDUFKZSUBXGM-UHFFFAOYSA-N phosphoric tribromide Chemical compound BrP(Br)(Br)=O UXCDUFKZSUBXGM-UHFFFAOYSA-N 0.000 description 3
- 229910001392 phosphorus oxide Inorganic materials 0.000 description 3
- 239000000376 reactant Substances 0.000 description 3
- 230000001568 sexual effect Effects 0.000 description 3
- 238000010898 silica gel chromatography Methods 0.000 description 3
- 235000017550 sodium carbonate Nutrition 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- VSAISIQCTGDGPU-UHFFFAOYSA-N tetraphosphorus hexaoxide Chemical compound O1P(O2)OP3OP1OP2O3 VSAISIQCTGDGPU-UHFFFAOYSA-N 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- BRNULMACUQOKMR-UHFFFAOYSA-N thiomorpholine Chemical compound C1CSCCN1 BRNULMACUQOKMR-UHFFFAOYSA-N 0.000 description 3
- 238000001291 vacuum drying Methods 0.000 description 3
- 239000008096 xylene Substances 0.000 description 3
- OGFAWKRXZLGJSK-UHFFFAOYSA-N 1-(2,4-dihydroxyphenyl)-2-(4-nitrophenyl)ethanone Chemical compound OC1=CC(O)=CC=C1C(=O)CC1=CC=C([N+]([O-])=O)C=C1 OGFAWKRXZLGJSK-UHFFFAOYSA-N 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- AVRPFRMDMNDIDH-UHFFFAOYSA-N 1h-quinazolin-2-one Chemical compound C1=CC=CC2=NC(O)=NC=C21 AVRPFRMDMNDIDH-UHFFFAOYSA-N 0.000 description 2
- FSJOLBAFVKSQQJ-UHFFFAOYSA-N 2-ethylpyrazol-3-amine Chemical class CCN1N=CC=C1N FSJOLBAFVKSQQJ-UHFFFAOYSA-N 0.000 description 2
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 description 2
- VRJHQPZVIGNGMX-UHFFFAOYSA-N 4-piperidinone Chemical compound O=C1CCNCC1 VRJHQPZVIGNGMX-UHFFFAOYSA-N 0.000 description 2
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- 229930008281 A03AD01 - Papaverine Natural products 0.000 description 2
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 2
- POILLXWMOBVQAX-UHFFFAOYSA-N CCN(C(N=C1)=C2C3=C1C=NN=C3)N=C2Cl Chemical class CCN(C(N=C1)=C2C3=C1C=NN=C3)N=C2Cl POILLXWMOBVQAX-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 208000021663 Female sexual arousal disease Diseases 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical group C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 2
- GQPLMRYTRLFLPF-UHFFFAOYSA-N Nitrous Oxide Chemical compound [O-][N+]#N GQPLMRYTRLFLPF-UHFFFAOYSA-N 0.000 description 2
- 208000018262 Peripheral vascular disease Diseases 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 241000405119 Virga Species 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- 238000013019 agitation Methods 0.000 description 2
- 229940072056 alginate Drugs 0.000 description 2
- 150000001447 alkali salts Chemical class 0.000 description 2
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 2
- 125000006350 alkyl thio alkyl group Chemical group 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 229960004046 apomorphine Drugs 0.000 description 2
- VMWNQDUVQKEIOC-CYBMUJFWSA-N apomorphine Chemical compound C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3 VMWNQDUVQKEIOC-CYBMUJFWSA-N 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- HQABUPZFAYXKJW-UHFFFAOYSA-N butan-1-amine Chemical group CCCCN HQABUPZFAYXKJW-UHFFFAOYSA-N 0.000 description 2
- BQFCCCIRTOLPEF-UHFFFAOYSA-N chembl1976978 Chemical compound CC1=CC=CC=C1N=NC1=C(O)C=CC2=CC=CC=C12 BQFCCCIRTOLPEF-UHFFFAOYSA-N 0.000 description 2
- 210000003029 clitoris Anatomy 0.000 description 2
- 210000005226 corpus cavernosum Anatomy 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 230000000994 depressogenic effect Effects 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- 230000002526 effect on cardiovascular system Effects 0.000 description 2
- 230000005611 electricity Effects 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 239000012362 glacial acetic acid Substances 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine hydrate Chemical compound O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 2
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 2
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 2
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Substances C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 239000007943 implant Substances 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 125000005956 isoquinolyl group Chemical group 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 235000010755 mineral Nutrition 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- 238000000643 oven drying Methods 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 229960001789 papaverine Drugs 0.000 description 2
- 210000003899 penis Anatomy 0.000 description 2
- 239000002590 phosphodiesterase V inhibitor Substances 0.000 description 2
- XUWHAWMETYGRKB-UHFFFAOYSA-N piperidin-2-one Chemical compound O=C1CCCCN1 XUWHAWMETYGRKB-UHFFFAOYSA-N 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- NNFCIKHAZHQZJG-UHFFFAOYSA-N potassium cyanide Chemical compound [K+].N#[C-] NNFCIKHAZHQZJG-UHFFFAOYSA-N 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 208000012201 sexual and gender identity disease Diseases 0.000 description 2
- 208000015891 sexual disease Diseases 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- NHGXDBSUJJNIRV-UHFFFAOYSA-M tetrabutylammonium chloride Chemical compound [Cl-].CCCC[N+](CCCC)(CCCC)CCCC NHGXDBSUJJNIRV-UHFFFAOYSA-M 0.000 description 2
- AXZWODMDQAVCJE-UHFFFAOYSA-L tin(II) chloride (anhydrous) Chemical compound [Cl-].[Cl-].[Sn+2] AXZWODMDQAVCJE-UHFFFAOYSA-L 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- COWZNYTZVVEEKO-UHFFFAOYSA-N (4-methoxyphenyl)methylazanium;chloride Chemical compound Cl.COC1=CC=C(CN)C=C1 COWZNYTZVVEEKO-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- IDPURXSQCKYKIJ-UHFFFAOYSA-N 1-(4-methoxyphenyl)methanamine Chemical compound COC1=CC=C(CN)C=C1 IDPURXSQCKYKIJ-UHFFFAOYSA-N 0.000 description 1
- VUQPJRPDRDVQMN-UHFFFAOYSA-N 1-chlorooctadecane Chemical compound CCCCCCCCCCCCCCCCCCCl VUQPJRPDRDVQMN-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- HIYWOHBEPVGIQN-UHFFFAOYSA-N 1h-benzo[g]indole Chemical compound C1=CC=CC2=C(NC=C3)C3=CC=C21 HIYWOHBEPVGIQN-UHFFFAOYSA-N 0.000 description 1
- WLAMNBDJUVNPJU-UHFFFAOYSA-N 2-methylbutyric acid Chemical compound CCC(C)C(O)=O WLAMNBDJUVNPJU-UHFFFAOYSA-N 0.000 description 1
- 229940080296 2-naphthalenesulfonate Drugs 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000004638 2-oxopiperazinyl group Chemical group O=C1N(CCNC1)* 0.000 description 1
- WMPPDTMATNBGJN-UHFFFAOYSA-N 2-phenylethylbromide Chemical compound BrCCC1=CC=CC=C1 WMPPDTMATNBGJN-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- JMTMSDXUXJISAY-UHFFFAOYSA-N 2H-benzotriazol-4-ol Chemical compound OC1=CC=CC2=C1N=NN2 JMTMSDXUXJISAY-UHFFFAOYSA-N 0.000 description 1
- 102000001707 3',5'-Cyclic-AMP Phosphodiesterases Human genes 0.000 description 1
- 108010054479 3',5'-Cyclic-AMP Phosphodiesterases Proteins 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N 3-phenylpropionic acid Chemical class OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- KJMFQJFNQYWQAV-UHFFFAOYSA-N 3h-imidazo[4,5-h]quinazoline Chemical compound C1=NC=NC2=C(NC=N3)C3=CC=C21 KJMFQJFNQYWQAV-UHFFFAOYSA-N 0.000 description 1
- RHKWIGHJGOEUSM-UHFFFAOYSA-N 3h-imidazo[4,5-h]quinoline Chemical class C1=CN=C2C(N=CN3)=C3C=CC2=C1 RHKWIGHJGOEUSM-UHFFFAOYSA-N 0.000 description 1
- CNPURSDMOWDNOQ-UHFFFAOYSA-N 4-methoxy-7h-pyrrolo[2,3-d]pyrimidin-2-amine Chemical compound COC1=NC(N)=NC2=C1C=CN2 CNPURSDMOWDNOQ-UHFFFAOYSA-N 0.000 description 1
- XDKUKGIJDNUFGK-UHFFFAOYSA-N 4-methylimidazole Chemical compound CC1=CN=C[N]1 XDKUKGIJDNUFGK-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical group N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 102000005862 Angiotensin II Human genes 0.000 description 1
- 101800000733 Angiotensin-2 Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 238000006418 Brown reaction Methods 0.000 description 1
- 239000002083 C09CA01 - Losartan Substances 0.000 description 1
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 1
- 239000002947 C09CA04 - Irbesartan Substances 0.000 description 1
- 239000002053 C09CA06 - Candesartan Substances 0.000 description 1
- UXYHZIYEDDINQH-UHFFFAOYSA-N C1=CNC2=C3C=NN=C3C=CC2=C1 Chemical compound C1=CNC2=C3C=NN=C3C=CC2=C1 UXYHZIYEDDINQH-UHFFFAOYSA-N 0.000 description 1
- 206010008190 Cerebrovascular accident Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- 102100028712 Cytosolic purine 5'-nucleotidase Human genes 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 101100189582 Dictyostelium discoideum pdeD gene Proteins 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 238000005698 Diels-Alder reaction Methods 0.000 description 1
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- 206010013786 Dry skin Diseases 0.000 description 1
- 208000032928 Dyslipidaemia Diseases 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 208000011514 Familial renal glucosuria Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 208000010412 Glaucoma Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- CZGUSIXMZVURDU-JZXHSEFVSA-N Ile(5)-angiotensin II Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C([O-])=O)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=[NH2+])NC(=O)[C@@H]([NH3+])CC([O-])=O)C(C)C)C1=CC=C(O)C=C1 CZGUSIXMZVURDU-JZXHSEFVSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 241001313288 Labia Species 0.000 description 1
- 208000017170 Lipid metabolism disease Diseases 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 206010057672 Male sexual dysfunction Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- XUYPXLNMDZIRQH-LURJTMIESA-N N-acetyl-L-methionine Chemical compound CSCC[C@@H](C(O)=O)NC(C)=O XUYPXLNMDZIRQH-LURJTMIESA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical class OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical class [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical class OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 101150098694 PDE5A gene Proteins 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 208000028017 Psychotic disease Diseases 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical class C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- GBFLZEXEOZUWRN-VKHMYHEASA-N S-carboxymethyl-L-cysteine Chemical compound OC(=O)[C@@H](N)CSCC(O)=O GBFLZEXEOZUWRN-VKHMYHEASA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 1
- 208000020339 Spinal injury Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 239000005864 Sulphur Substances 0.000 description 1
- NSOXQYCFHDMMGV-UHFFFAOYSA-N Tetrakis(2-hydroxypropyl)ethylenediamine Chemical group CC(O)CN(CC(C)O)CCN(CC(C)O)CC(C)O NSOXQYCFHDMMGV-UHFFFAOYSA-N 0.000 description 1
- 240000006474 Theobroma bicolor Species 0.000 description 1
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- BLGXFZZNTVWLAY-CCZXDCJGSA-N Yohimbine Natural products C1=CC=C2C(CCN3C[C@@H]4CC[C@@H](O)[C@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-CCZXDCJGSA-N 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- FYJKEHKQUPSJDH-UHFFFAOYSA-N [dimethyl-(trimethylsilylamino)silyl]methane;potassium Chemical compound [K].C[Si](C)(C)N[Si](C)(C)C FYJKEHKQUPSJDH-UHFFFAOYSA-N 0.000 description 1
- 206010000059 abdominal discomfort Diseases 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 150000001243 acetic acids Chemical class 0.000 description 1
- CGIHPACLZJDCBQ-UHFFFAOYSA-N acibenzolar Chemical compound SC(=O)C1=CC=CC2=C1SN=N2 CGIHPACLZJDCBQ-UHFFFAOYSA-N 0.000 description 1
- 229920006243 acrylic copolymer Polymers 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 239000000400 angiotensin II type 1 receptor blocker Substances 0.000 description 1
- 229950006323 angiotensin ii Drugs 0.000 description 1
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical class NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 229940127088 antihypertensive drug Drugs 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 230000037007 arousal Effects 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 125000003289 ascorbyl group Chemical class [H]O[C@@]([H])(C([H])([H])O*)[C@@]1([H])OC(=O)C(O*)=C1O* 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- MOTJMGVDPWRKOC-QPVYNBJUSA-N atrasentan Chemical compound C1([C@H]2[C@@H]([C@H](CN2CC(=O)N(CCCC)CCCC)C=2C=C3OCOC3=CC=2)C(O)=O)=CC=C(OC)C=C1 MOTJMGVDPWRKOC-QPVYNBJUSA-N 0.000 description 1
- QHYIGPGWXQQZSA-UHFFFAOYSA-N azane;methanesulfonic acid Chemical compound [NH4+].CS([O-])(=O)=O QHYIGPGWXQQZSA-UHFFFAOYSA-N 0.000 description 1
- DXZDEAJXVCLRLE-UHFFFAOYSA-N azepin-2-one Chemical class O=C1C=CC=CC=N1 DXZDEAJXVCLRLE-UHFFFAOYSA-N 0.000 description 1
- 150000001538 azepines Chemical class 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 229960004217 benzyl alcohol Drugs 0.000 description 1
- BLGXFZZNTVWLAY-UHFFFAOYSA-N beta-Yohimbin Natural products C1=CC=C2C(CCN3CC4CCC(O)C(C4CC33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-UHFFFAOYSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- GJPICJJJRGTNOD-UHFFFAOYSA-N bosentan Chemical compound COC1=CC=CC=C1OC(C(=NC(=N1)C=2N=CC=CN=2)OCCO)=C1NS(=O)(=O)C1=CC=C(C(C)(C)C)C=C1 GJPICJJJRGTNOD-UHFFFAOYSA-N 0.000 description 1
- 229960003065 bosentan Drugs 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-M bromate Inorganic materials [O-]Br(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-M 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-N bromic acid Chemical compound OBr(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-N 0.000 description 1
- IJJURYQDEVNZCW-UHFFFAOYSA-N bromophosphane Chemical compound BrP IJJURYQDEVNZCW-UHFFFAOYSA-N 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 150000007516 brønsted-lowry acids Chemical class 0.000 description 1
- 150000007528 brønsted-lowry bases Chemical class 0.000 description 1
- 150000004648 butanoic acid derivatives Chemical class 0.000 description 1
- DVECBJCOGJRVPX-UHFFFAOYSA-N butyryl chloride Chemical compound CCCC(Cl)=O DVECBJCOGJRVPX-UHFFFAOYSA-N 0.000 description 1
- 102100029175 cGMP-specific 3',5'-cyclic phosphodiesterase Human genes 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229950005953 camsilate Drugs 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 229960000932 candesartan Drugs 0.000 description 1
- SGZAIDDFHDDFJU-UHFFFAOYSA-N candesartan Chemical compound CCOC1=NC2=CC=CC(C(O)=O)=C2N1CC(C=C1)=CC=C1C1=CC=CC=C1C1=NN=N[N]1 SGZAIDDFHDDFJU-UHFFFAOYSA-N 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- OTAFHZMPRISVEM-UHFFFAOYSA-N chromone Chemical compound C1=CC=C2C(=O)C=COC2=C1 OTAFHZMPRISVEM-UHFFFAOYSA-N 0.000 description 1
- 208000023819 chronic asthma Diseases 0.000 description 1
- 208000020832 chronic kidney disease Diseases 0.000 description 1
- 208000022831 chronic renal failure syndrome Diseases 0.000 description 1
- 125000000259 cinnolinyl group Chemical class N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 239000007891 compressed tablet Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- BALGDZWGNCXXES-UHFFFAOYSA-N cyclopentane;propanoic acid Chemical compound CCC(O)=O.C1CCCC1 BALGDZWGNCXXES-UHFFFAOYSA-N 0.000 description 1
- 238000006298 dechlorination reaction Methods 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000006356 dehydrogenation reaction Methods 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- WGLUMOCWFMKWIL-UHFFFAOYSA-N dichloromethane;methanol Chemical compound OC.ClCCl WGLUMOCWFMKWIL-UHFFFAOYSA-N 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 1
- 229960005156 digoxin Drugs 0.000 description 1
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 1
- 125000004611 dihydroisoindolyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 150000007520 diprotic acids Chemical class 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 229940043264 dodecyl sulfate Drugs 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000002308 endothelin receptor antagonist Substances 0.000 description 1
- 238000010336 energy treatment Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 229950007655 esilate Drugs 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- GCFHZZWXZLABBL-UHFFFAOYSA-N ethanol;hexane Chemical compound CCO.CCCCCC GCFHZZWXZLABBL-UHFFFAOYSA-N 0.000 description 1
- ZRSDQBKGDNPFLT-UHFFFAOYSA-N ethanol;oxolane Chemical compound CCO.C1CCOC1 ZRSDQBKGDNPFLT-UHFFFAOYSA-N 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 208000024711 extrinsic asthma Diseases 0.000 description 1
- 229940050411 fumarate Drugs 0.000 description 1
- UPBDXRPQPOWRKR-UHFFFAOYSA-N furan-2,5-dione;methoxyethene Chemical compound COC=C.O=C1OC(=O)C=C1 UPBDXRPQPOWRKR-UHFFFAOYSA-N 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-M heptanoate Chemical compound CCCCCCC([O-])=O MNWFXJYAOYHMED-UHFFFAOYSA-M 0.000 description 1
- ULLYUYLDAISRDE-SSPAHAAFSA-N heptanoic acid (2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhexanal Chemical compound C(CCCCCC)(=O)O.O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO ULLYUYLDAISRDE-SSPAHAAFSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- PQNFLJBBNBOBRQ-UHFFFAOYSA-N indane Chemical class C1=CC=C2CCCC2=C1 PQNFLJBBNBOBRQ-UHFFFAOYSA-N 0.000 description 1
- 150000002475 indoles Chemical class 0.000 description 1
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000008991 intestinal motility Effects 0.000 description 1
- 238000003402 intramolecular cyclocondensation reaction Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 229960002198 irbesartan Drugs 0.000 description 1
- YCPOHTHPUREGFM-UHFFFAOYSA-N irbesartan Chemical compound O=C1N(CC=2C=CC(=CC=2)C=2C(=CC=CC=2)C=2[N]N=NN=2)C(CCCC)=NC21CCCC2 YCPOHTHPUREGFM-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical class CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical group CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 description 1
- 229960004773 losartan Drugs 0.000 description 1
- 238000005461 lubrication Methods 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229940057948 magnesium stearate Drugs 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 230000009245 menopause Effects 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- XLSZMDLNRCVEIJ-UHFFFAOYSA-N methylimidazole Natural products CC1=CNC=N1 XLSZMDLNRCVEIJ-UHFFFAOYSA-N 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 239000007932 molded tablet Substances 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- SEEYREPSKCQBBF-UHFFFAOYSA-N n-methylmaleimide Chemical compound CN1C(=O)C=CC1=O SEEYREPSKCQBBF-UHFFFAOYSA-N 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-M naphthalene-2-sulfonate Chemical class C1=CC=CC2=CC(S(=O)(=O)[O-])=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-M 0.000 description 1
- 230000003533 narcotic effect Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000007383 nerve stimulation Effects 0.000 description 1
- 230000001272 neurogenic effect Effects 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Chemical class 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 230000002536 noncholinergic effect Effects 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002905 orthoesters Chemical class 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 229920003175 pectinic acid Chemical class 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L persulfate group Chemical group S(=O)(=O)([O-])OOS(=O)(=O)[O-] JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 239000003444 phase transfer catalyst Substances 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- MRBDMNSDAVCSSF-UHFFFAOYSA-N phentolamine Chemical compound C1=CC(C)=CC=C1N(C=1C=C(O)C=CC=1)CC1=NCCN1 MRBDMNSDAVCSSF-UHFFFAOYSA-N 0.000 description 1
- 229960001999 phentolamine Drugs 0.000 description 1
- PLAQCTQHPKVDAY-UHFFFAOYSA-N phenylmethanamine;dihydrochloride Chemical compound Cl.Cl.NCC1=CC=CC=C1 PLAQCTQHPKVDAY-UHFFFAOYSA-N 0.000 description 1
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229940075930 picrate Drugs 0.000 description 1
- OXNIZHLAWKMVMX-UHFFFAOYSA-M picrate anion Chemical compound [O-]C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O OXNIZHLAWKMVMX-UHFFFAOYSA-M 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- HDOWRFHMPULYOA-UHFFFAOYSA-N piperidin-4-ol Chemical compound OC1CCNCC1 HDOWRFHMPULYOA-UHFFFAOYSA-N 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 229950010765 pivalate Drugs 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- NTTOTNSKUYCDAV-UHFFFAOYSA-N potassium hydride Chemical compound [KH] NTTOTNSKUYCDAV-UHFFFAOYSA-N 0.000 description 1
- 229910000105 potassium hydride Inorganic materials 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 201000011264 priapism Diseases 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 229940127293 prostanoid Drugs 0.000 description 1
- 150000003814 prostanoids Chemical class 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 150000004892 pyridazines Chemical class 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- GGZRVXCSRWTOME-UHFFFAOYSA-N pyridine;toluene Chemical compound C1=CC=NC=C1.CC1=CC=CC=C1 GGZRVXCSRWTOME-UHFFFAOYSA-N 0.000 description 1
- OHZYAOYVLLHTGW-UHFFFAOYSA-N pyrido[3,2-c]pyridazine Chemical compound C1=CN=NC2=CC=CN=C21 OHZYAOYVLLHTGW-UHFFFAOYSA-N 0.000 description 1
- IHYJXEQIZYROGA-UHFFFAOYSA-N pyrido[3,4-d]pyridazine Chemical compound N1=NC=C2C=NC=CC2=C1 IHYJXEQIZYROGA-UHFFFAOYSA-N 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000002787 reinforcement Effects 0.000 description 1
- 208000007278 renal glycosuria Diseases 0.000 description 1
- 239000002461 renin inhibitor Substances 0.000 description 1
- 229940086526 renin-inhibitors Drugs 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 230000036332 sexual response Effects 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- AWUCVROLDVIAJX-GSVOUGTGSA-N sn-glycerol 3-phosphate Chemical compound OC[C@@H](O)COP(O)(O)=O AWUCVROLDVIAJX-GSVOUGTGSA-N 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- QPILZZVXGUNELN-UHFFFAOYSA-M sodium;4-amino-5-hydroxynaphthalene-2,7-disulfonate;hydron Chemical compound [Na+].OS(=O)(=O)C1=CC(O)=C2C(N)=CC(S([O-])(=O)=O)=CC2=C1 QPILZZVXGUNELN-UHFFFAOYSA-M 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 235000011150 stannous chloride Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 210000001562 sternum Anatomy 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000005062 synaptic transmission Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- RBNBDIMXFJYDLQ-UHFFFAOYSA-N thieno[3,2-d]pyrimidine Chemical compound C1=NC=C2SC=CC2=N1 RBNBDIMXFJYDLQ-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N thiocyanic acid Chemical compound SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 238000007039 two-step reaction Methods 0.000 description 1
- ZDPHROOEEOARMN-UHFFFAOYSA-M undecanoate Chemical compound CCCCCCCCCCC([O-])=O ZDPHROOEEOARMN-UHFFFAOYSA-M 0.000 description 1
- 229960004699 valsartan Drugs 0.000 description 1
- SJSNUMAYCRRIOM-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=N[N]1 SJSNUMAYCRRIOM-QFIPXVFZSA-N 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- 229960000317 yohimbine Drugs 0.000 description 1
- BLGXFZZNTVWLAY-SCYLSFHTSA-N yohimbine Chemical compound C1=CC=C2C(CCN3C[C@@H]4CC[C@H](O)[C@@H]([C@H]4C[C@H]33)C(=O)OC)=C3NC2=C1 BLGXFZZNTVWLAY-SCYLSFHTSA-N 0.000 description 1
- AADVZSXPNRLYLV-UHFFFAOYSA-N yohimbine carboxylic acid Natural products C1=CC=C2C(CCN3CC4CCC(C(C4CC33)C(O)=O)O)=C3NC2=C1 AADVZSXPNRLYLV-UHFFFAOYSA-N 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Gynecology & Obstetrics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Abstract
适于用作cGMP PDE、特别是cGMP PDE 5抑制剂的式(I)化合物。
Description
发明领域
本发明涉及稠合吡啶并哒嗪类化合物,用这些化合物治疗与cGMP有关的疾病例如性机能障碍包括勃起机能障碍和女性性唤起障碍的方法,含有这些化合物的药物组合物,以及制备该类化合物的中间体和方法。
发明背景
勃起机能障碍是无力达到和保持足以进行性交或其他性表达的阴茎勃起。许多因素可以使个体处于患该疾病的危险之中,例如,外伤、骨盆手术、血胆甾醇过多、局部缺血性心脏病、外周血管疾病、慢性肾衰竭、糖尿病、或者使用某些药物包括一些抗高血压药如地高辛、以及过分使用麻醉药、酒精、烟草等。治疗勃起机能障碍的方法包括使用真空装置和阴茎植入物,以及服用药物例如育亨宾、罂粟碱和阿朴吗啡。然而上述方法不能提供足够的效能和/或伴随有一些缺陷或副作用例如糜烂、疼痛、阴茎异常勃起或胃肠不适,因此需要寻求治疗该疾病的改进的方法。
由于阴茎勃起取决于环3’,5’-一磷酸鸟嘌呤核苷(cGMP)的适当含量、特别是取决于海绵体组织中的cGMP的适当含量,因此施用cGMP磷酸二酯酶(cGMP PDE)抑制剂、特别是5型cGMP PDE(cGMP PDE 5)的选择性抑制剂提供了达到和保持勃起的方法,从而可以治疗勃起机能障碍。参见Trigo Rocha等,“一氧化氮和cGMP:在狗中骨盆神经刺激勃起的介质(Nitric Oxide and cGMP:mediators of pelvicnerve-stimulated erection in dogs),”Am.J.Physiol.,Vol.264(1993年2月);Bowman等,“在牛缩肌阴茎肌肉中环GMP介导的神经松弛(Cyclic GMP mediates neurogenic relaxation in thebovine retractor penis muscle),”Br.J.Pharmac.,81,665-674(1984);和Rajfer等,″Nitric Oxide as a Mediator ofRelaxation of the Corpus Cavernosum in Response toNonadrenergic,Noncholinergic Neurotransmission,″NewEngland J.Med.,326,2,90-94(1992年1月)。例如西地那非已经被描述为适用于治疗勃起机能障碍的V型磷酸二酯酶抑制剂。参见Drugs of the Future,22,138-143(1997)。
女性性唤起是女性性反应周期的一部分,其特征是阴道润滑性增加以及阴蒂和阴唇充血和感觉增加。研究提示一氧化氮具有作为阴蒂海绵体和阴道壁平滑肌松弛介质的潜在作用。近来,已经从人阴蒂平滑肌培养物中分离出PDE 5。因此,cGMP PDE5的选择性抑制剂提供了使生理机能上的唤起变化减少和改善绝经前和绝经后妇女主观参数的恢复方法。
本发明提供了新的化合物,它们是cGMP PDE 5的有效和选择性抑制剂。这些化合物可用于治疗性机能障碍包括勃起机能障碍和女性性唤起障碍。鉴于其活性,这些化合物还可以用于治疗其他对抑制cGMP PDE有反应的疾病,例如各种心血管疾病。
发明概述
本发明涉及适于用作cGMP PDE、特别是5型cGMP PDE抑制剂的式I的稠合吡啶并哒嗪化合物及其盐
其中:
Y是氮或-C(R5)-;
Z是氮或-C(R6)-,条件是Y和Z中至少一个是氮;
R1和R2独立地选自下列一组基团:氢、氯、-SR7、-OR7、-NR8R9、和
条件是R1或R2中至少一个是-SR7、-OR7、-NR8R9或
R3是氢、烷基、取代的烷基、芳基烷基或取代的芳基烷基;
R4是氢、卤素、烷基、取代的烷基、-OR10或-NR11R12;
R5和R6独立地选自下列一组基团:氢、卤素、烷基和取代的烷基;
R7、R8和R9独立地选自下列一组基团:氢、烷基、取代的烷基、环烷基、取代的环烷基、环烷基烷基、取代的环烷基烷基、芳基、取代的芳基、芳基烷基、取代的芳基烷基、杂环基、杂环烷基、杂芳基和杂芳基烷基;
R8和R9与和它们相连的N原子一起可以形成杂环基环、取代或未取代的咪唑、取代或未取代的吡唑、或者取代或未取代的三唑;
R10、R11和R12独立地选自下列一组基团:氢、烷基、取代的烷基、环烷基、取代的环烷基、环烷基烷基、取代的环烷基烷基、芳基、取代的芳基、芳基烷基、取代的芳基烷基、杂环基、杂环烷基、杂芳基和杂芳基烷基;
R13是烷基、取代的烷基、环烷基、取代的环烷基、环烷基烷基、取代的环烷基烷基、芳基、取代的芳基、芳基烷基、取代的芳基烷基、杂环基、杂环烷基、杂芳基或杂芳基烷基。
发明详述
下面是本说明书中所用术语的定义。除非另外指明,开始的定义是对基团或者使用该基团的术语或者贯穿本说明书始终的术语的规定。
术语″烷基″是指具有1-12个碳原子、优选1-8个碳原子的直链或支链烃基。低级烷基是1-4个碳原子的烷基,它们是最优选的。术语烷基当用于术语如环烷基
烷基,芳基
烷基,杂环
烷基的结尾时,是指1-12个碳原子、优选1-8个碳原子、最优选1-4个碳原子的直链或支链碳桥,例如-CH2-,
-(CH2)4-,等。
术语″烷氧基″是指如上定义的、通过氧(-O-)结合的烷基。术语″烷硫基″是指如上定义的、通过硫(-S-)结合的烷基。
术语″环烷基″是指完全饱和或部分不饱和的3-9、优选3-7个碳原子的烃环以及具有稠合芳环的该环例如2,3-二氢茚。
术语″取代的环烷基″是指具有一、二或三个取代基,优选具有一个取代基的环,所述取代基选自下列一基团:烷基、烷氧基、烷硫基、卤素、羟基、氰基、氨基、-NH(烷基)、-NH(环烷基)、-N(烷基)2、
羧基、-CO2-低级烷基、芳基、取代的芳基、芳基烷基、取代的芳基烷基、杂环基、杂环烷基、杂芳基、杂芳基烷基、酮基、=N-OH、=N-O-低级烷基和5或6元酮缩醇即1,3-二氧戊环或1,3-二噁烷。
术语″取代的烷基″是指具有一、二或三个取代基的如上定义的烷基,所述取代基选自:卤素、氨基、氰基、-(CH2)m-羟基、烷氧基、烷硫基、-NH(烷基)、-NH(环烷基)、-N(烷基)2、
羧基和-CO2-烷基。
术语″卤素″是指氯、溴、氟和碘。
术语″芳基″是指苯基、1-萘基和2萘基,优选苯基。术语″取代的芳基″是指具有一、二或三个取代基的该环,所述取代基选自:烷基、取代的烷基、烷氧基、烷硫基、环烷基、卤素、羟基、硝基、氰基、氨基、-NH(烷基)、-NH(环烷基)、-N(烷基)2、羧基、-CO2-烷基、
-NH-CH2-羧基、-NH-CH2-CO2-烷基、苯基、苄基、苯乙基、苯氧基、苯硫基、杂环基、杂环烷基、杂芳基和杂芳基烷基、以及五氟苯基。
术语″杂环基″是指取代和未取代的、饱和或部分饱和的3-7元单环基、7-11元双环基和10-15元三环基,它们在至少一个环中具有至少一个杂原子(O、S或N)。含有杂原子的杂环基的每个环可以含有一个或两个氧原子或硫原子和/或1-4个氨原子,条件是在每个环中杂原子的总数为4或小于4,并且条件是该环含有至少一个碳原子。构成双环和三环基的稠环可以只含有碳原子,并且可以是饱和、部分饱和或不饱和的。氮原子和硫原子可以任选地被氧化,并且氮原子可以任选地季铵化。该杂环基可以在任一环的任何允许的氮原子或碳原子上连接。该杂环基环可以含有一、二或三个取代基,所述取代基选自下列一组基团:卤素、甲酰基、氨基、氰基、烷基、取代的烷基、环烷基、取代的环烷基、-NH(烷基)、-NH(环烷基)、-NH(取代的烷基)、-N(烷基)2、烷氧基、烷硫基、羟基、硝基、苯基、取代的苯基、苯基-烷基、取代的苯基-烷基、苯氧基、苯硫基、羧基、-CO2-烷基、
-NH-CH2-羧基、-NH-CH2-CO2-烷基、杂环基、杂环烷基、杂芳基、杂芳基烷基、酮基、=N-OH、=N-O-低级烷基和5或6元酮缩醇即1,3-二氧戊环或1,3-二噁烷。
单环基的实例包括氮杂环丁烷基、吡咯烷基、氧杂环丁烷基、咪唑啉基、噁唑烷基、异噁唑啉基、噻唑烷基、异噻唑烷基、四氢呋喃基、哌啶基、哌嗪基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、2-氧代吖庚因基、吖庚因基、4-哌啶酮基、四氢吡喃基、吗啉基、硫吗啉基、硫吗啉基亚砜、硫吗啉基砜、1,3-二氧戊环和四氢1,1-二氧代噻吩基等。双环杂环基的实例包括奎宁环基。
术语″杂茅基″是指取代和未取代的芳族5或6元单环基、9或10元双环基和11-14元三环基,它们在至少一个环中具有至少一个杂原子(O、S或N)。含有杂原子的杂芳基的每个环可以含有一个或两个氧原子或硫原子和/或1-4个氮原子,条件是在每个环中杂原子的总数为4或小于4。构成双环和三环基的稠环可以只含有碳原子,并且可以是饱和、部分饱和或不饱和的。氮原子和硫原子可以任选地被氧化,并且氮原子可以任选地季铵化。双环或三环杂芳基必须包括至少一个完全的芳环、而其他稠合的环可以是芳族或非芳族的。该杂芳基可以在任一环的任何允许的氮原子或碳原子上连接。该杂芳基环可以含有一、二或三个取代基,所述取代基选自下列一组基团:卤素、甲酰基、氨基、氰基、烷基、取代的烷基、-NH(烷基)、-NH(环烷基)、-NH(取代的环烷基)、-NH(取代的烷基)、-NH(杂环烷基)、-N(烷基)2、烷氧基、烷硫基、环烷基、取代的环烷基、羟基、硝基、苯基、苯基烷基、取代的苯基、取代的苯基-烷基、苯氧基、苯硫基、羧基、-CO2-烷基、
-CO2-芳基、-CO2-(取代的芳基)、
-CH=N-羟基、-CH=N-O-烷基、-CH=N-NH2、
-CH=N-NH(烷基)、-CH=N-N(烷基)2、
杂环基、杂环烷基、杂芳基和杂芳基烷基。
单环杂芳基的实例包括吡咯基、吡唑基、吡唑啉基、咪唑基、噁唑基、异噁唑基、噻唑基、噻二唑基、异噻唑基、呋喃基、噻吩基、噁二唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基等。
双环杂芳基的实例包括吲哚基、苯并噻唑基、苯并间二氧杂环戊烯基、苯并噁唑基、苯并噻吩基、喹啉基、四氢异喹啉基、异喹啉基、苯并咪唑基、苯并吡喃基、吲嗪基、苯并呋喃基、色酮基、香豆素基、苯并吡喃基、噌啉基、喹喔啉基、吲唑基、吡咯并吡啶基、呋喃并吡啶基、二氢异吲哚基和四氢喹啉基等。
三环杂芳基的实例包括咔唑基、苯并吲哚基、菲咯啉基、吖啶基、菲啶基和呫吨基等。
术语″取代的咪唑″是指咪唑、芳基稠合的咪唑例如苯并咪唑或者杂芳基稠合的咪唑例如吡啶并咪唑,它们具有一或两个取代基,所述取代基选自下列一组基团:氢、烷基、取代的烷基、烷氧基、烷硫基、环烷基、取代的环烷基、卤素、甲酰基、羟基、硝基、氰基、氨基、-NH(烷基)、-NH(环烷基)、-NH(杂环烷基)、-NH(取代的环烷基)、-NH(取代的烷基)、-N(烷基)2、羧基、-CO2-烷基、
苯基、取代的苯基、苯基烷基、(取代的苯基)-烷基、-CH=N-羟基、-CH=N-O-烷基、-CH=N-NH2、-CH=N-NH(烷基)、-CH-N-N(烷基)2、
苯氧基、苯硫基、杂环基、杂环烷基、杂芳基和杂芳基烷基。
术语″取代的吡唑″是指吡唑、芳基稠合的吡唑例如苯并吡唑或者-CO2-芳基、-CO2-取代的芳基、
杂芳基稠合的吡唑例如吡唑并吡啶,它们具有一或两个取代基,所述取代基选自下列一组:氢、烷基、取代的烷基、烷氧基、烷硫基、烷氧基烷基、羟基烷基、烷硫基烷基、卤素、羟基、硝基、氰基、氨基、-NH(烷基)、-NH(环烷基)、-N(烷基)2、羧基、-CO2-烷基、
-NH-CH2-羧基、-NH-CH2-CO2-烷基、苯基、苄基、苯乙基、苯氧基、苯硫基、杂环基、杂环烷基、杂芳基和杂芳基烷基。
术语″取代的三唑″是指可以含有一个取代基的三唑,所述取代基选自下列一组:烷基、取代的烷基、烷氧基、烷硫基、烷氧基烷基、羟基烷基、烷硫基烷基、卤素、羟基、硝基、氰基、氨基、-NH(烷基)、-NH(环烷基)、-N(烷基)2、羧基、-CO2-烷基、
-NH-CH2-羧基、-NH-CH2-CO2-烷基、苯基、苄基、苯乙基、苯氧基、苯硫基、杂环基、杂环烷基、杂芳基和杂芳基烷基。
m是0或1-4的整数。
在整个说明书中,可以选择能提供稳定部分和化合物的基团和取代基。
式I化合物形成的盐也在本发明范围内。应该理解,除非另外指明,本文中的式I化合物包括其盐。本文所用术语″盐″是指与无机和/或有机酸和碱形成的酸性和/或碱性盐。此外,当式I化合物既含碱性部分例如、但不限于吡啶或咪唑,又含酸性部分例如、但不限于羧酸时,可以形成两性离子(″内盐″),并且该两性离子包括在本文所用术语″盐″中。优选可药用的(即无毒、生理上可接受的)盐,当然,其他盐也是适用的,例如在制备过程中用于分离或纯化。例如,通过式I化合物与一定量例如等量的酸或碱、在介质例如其中盐沉淀的介质中或者在含水介质中反应,然后冻干,可以形成式I化合物的盐。
含有碱性部分例如、但不限于胺或吡啶或咪唑环的式I化合物可以与各种有机酸或无机酸形成盐。酸加成盐的实例包括乙酸盐(例如那些与乙酸或三卤代乙酸例如三氟乙酸形成的盐)、己二酸盐、藻酸盐、抗坏血酸盐、天门冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、硼酸盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡糖庚酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐(与盐酸形成的盐)、氢溴酸盐(与溴化氢形成的盐)、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐(与马来酸形成的盐)、甲磺酸盐(与甲磺酸形成的盐)、2-萘磺酸盐、烟酸盐、硝酸盐、草酸盐、果胶酯酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、水杨酸盐、琥珀酸盐、硫酸盐(例如与硫酸形成的盐)、磺酸盐(例如本文中提及的那些盐)、酒石酸盐、硫氰酸盐、甲苯磺酸盐和十一酸盐等。
含有酸性部分例如、但不限于羧酸的式I化合物可以与各种有机和无机碱形成盐。碱性盐的实例包括铵盐,碱金属盐例如钠、锂和钾盐,碱土金属盐例如钙和镁盐,与有机碱(例如有机胺)例如苯乍生、二环己基胺、hydrabamines[与N,N-二(去氢松香基)乙二胺形成的]、N-甲基-D-葡糖胺、N-甲基-D-葡糖酰胺、叔丁基胺形成的盐以及与氨基酸例如精氨酸和赖氨酸等形成的盐。碱性含氮基可以用试剂季铵化,所述试剂是例如低级烷基卤(如甲基、乙基、丙基和丁基氯、溴和碘)、二烷基硫酸脂(如二甲基、二乙基、二丁基和二戊基硫酸脂)、长链卤化物(如癸基、十二烷基、十四烷基和硬脂基氯、溴和碘)、芳烷基卤化物(例如苄基和苯乙基溴)等。
本发明化合物的前药和溶剂化物也包括在本发明范围内。本文所用术语″前药″是指一经给受体施用,即通过代谢或化学过程进行化学转化,形成式I化合物或其盐或其溶剂化物的化合物。式I化合物的溶剂化物优选水合物。
式I化合物及其盐可以以其互变异构形式存在(例如酰胺或亚氨v基醚)。所有互变异构形式均作为本发明的一部分包括在本发明之中。
本发明化合物的所有立体异构体均包括在本发明范围内,例如由于R1至R12取代基上的不对称碳所存在的那些立体异构体,包括对映体形式(当不存在不对称碳时可以存在这种形式)和非对映体形式。本发明化合物的单个立体异构体可以例如以基本上不含其他异构体的形式存在,或者可以例如混合在一起,以外消旋体形式存在,或者与所有其他的或与所有其他选择的立体异构体混合在一起。根据IUPAC1974 Recommendations的定义,本发明化合物的手性中心可以具有S或R构型。
制备方法
本发明化合物可以通过例如下列反应方案I-VII说明的方法进行制备。本领域普通技术人员可以容易地选择溶剂、温度、压力和其他反应条件。原料是市售的或者可以容易地由本领域普通技术人员按照已知方法进行制备。对于下面的所有反应方法和所述化合物,Y、Z、R1、R2、R3、R4、R5和R6如对式I化合物所描述。
在化合物的制备中,可以使用高速模拟方法(High SpeedAnaloging(HSA)),例如,当中间体具有活性芳基部分,如卤化的哒嗪的3或6位时。以同样的方式,在稠合5元环例如吡唑、咪唑和三唑上的取代基也可以通过HAS获得。
反应方案I
该反应方案描述了式Ia化合物[即其中Y是氮并且Z是-C(R6)-的式I化合物]的制备方法。Et表示乙基(C2H5)。
式Ia化合物可以如下制备:使用合适的碱,在惰性溶剂中,在升高的温度下,将胺、硫醇或醇与式II化合物反应。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺和1,8-二氮杂双环[5.4.0]十一-7-烯(DBU)。惰性溶剂的实例包括N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
式II化合物可以如下制备:在惰性溶剂和合适的碱中,将胺、硫醇或醇与式III化合物反应。该反应可以在约0℃至约110℃的温度范围内进行。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺、DBU和碳酸盐例如碳酸钾、碳酸钠和碳酸铯。惰性溶剂的实例包括四氢呋喃(THF)、乙醇、N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
其中W是氯(优选)、溴或碘的式III化合物可以如下制备:通常在升高的温度下,将式IV化合物与合适的脱水剂反应。脱水剂的实例包括磷酰氯、五氯化磷、亚硫酰氯、草酰氯、五溴化磷、三溴氧化磷、五碘化磷、三碘氧化磷等。该反应可以在助溶剂例如苯、甲苯、二甲苯等存在下进行。任选地,可以存在碱例如吡啶或三烷基胺。
式IV化合物可以由式V化合物制备。通过在酸性含水介质中、在升高的温度下进行水解或重氮化(diazatization),可以将式V化合物转化为式IV化合物。酸的实施例包括盐酸、硫酸和硝酸。重氮化试剂的实例包括亚硝酸钠和有机亚硝酸酯例如亚硝酸叔丁酯。
可以如下制备式IV化合物:在惰性溶剂中,将式VI化合物仅与肼或者与肼和羧酸活化剂一起反应。羧酸活化剂的实例包括羰基二咪唑、二环己基碳二亚胺、五氟苯酚三氟乙酸酯和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺。惰性溶剂的实例包括醇、四氢呋喃、二氯甲烷、乙醚和N,N-二甲基甲酰胺。
通过式VII化合物与肼在惰性溶剂中反应,可以制备式V化合物。惰性溶剂的实例包括四氢呋喃、乙醇和N,N-二甲基甲酰胺。
通过式VII化合物与氢氧化物源反应可以制备式VI化合物。氢氧化物源的实例包括氢氧化钠和氢氧化锂。溶剂的实例包括水、醇以及醚/水混合物。
在惰性溶剂中、通常在升高的温度下,通过式VIII化合物与氰化物供体反应可以制备式VII化合物。氰化物供体的实例包括无机氰化物如氰化钠、氰化钾和氰化铜(I)以及有机氰化物例如氰化四丁基铵。也可以使用无机氰化物与相转移剂例如四丁基铵盐的组合物。惰性溶剂包括N,N-二甲基甲酰胺、乙醇和四氢呋喃(THF)。
通常在升高的温度下,通过式IX或者XI化合物与合适的脱水剂反应,可以制备式VIII化合物。脱水剂的实例包括磷酰氯、五氯化磷、亚硫酰氯和草酰氯。
通常在升高的温度下,在惰性溶剂例如二苯基醚中,或者以纯净的形式,经过式XI化合物的分子内环化反应,可以制备式IX化合物。
通常在升高的温度下,通过将式XII和XIII化合物以纯净的方式结合,或者在惰性溶剂例如二苯基醚中反应,可以制备式XI化合物。
式XII和式XIII化合物是市售的或者可以按照本领域技术人员已知的方法获得。例如,式XII化合物可以按照法国专利FR1,403,372[Chemical Abstracts,1965,Volume 63,14871a]中描述的方法制备。
反应方案II
作为合成式Ia化合物的合适中间体的式IV化合物还可以如下进行制备:将肼与其中R15是-O-烷基的式XIVa化合物反应,或者将肼与其中E是氧原子、-NH-或-N(烷基)-的式XIVb化合物反应。这些反应在惰性溶剂中、通常在升高的温度下进行。惰性溶剂的实例包括醇、醚例如四氢呋喃、或者N,N二甲基甲酰胺。
可以如下制备式XIVa和XIVb化合物:将其中LG是-O-烷基或-N(烷基)2的式XV化合物与合适的电子贫乏的亲双烯体在质子溶剂中进行Diels-Alder反应。亲双烯体的实例包括乙炔二羧酸二甲酯、马来酸酐、马来酰亚胺和N-甲基马来酰亚胺。对于基于烯烃的亲双烯体,则同时发生由氧介导的芳构化。质子溶剂的实例包括水、乙酸和三氟乙酸。
可以如下制备其中LG是-O-烷基或-N(烷基)2的式XV化合物:在惰性溶剂中,或者以纯净的形式,在升高的温度下,将式XIII化合物与N,N-二烷基酰胺二烷基缩醛例如N,N--二甲基甲酰胺二甲基缩醛,或者与原酸酯例如原甲酸三甲酯反应。惰性溶剂的实例包括醚例如四氢呋喃、二氯甲烷或N,N-二甲基甲酰胺。
反应方案III
该反应方案说明了式Ib化合物(即其中Y和Z均为氮的式I化合物)的制备方法。R30是烷基。
可以如下制备式Ib化合物:使用合适的碱,在惰性溶剂中、在升高的温度下,将胺、硫醇或醇与式XVI化合物反应。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺,以及DBU。惰性溶剂的实例包括N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
可以如下制备式XVI化合物:使用合适的碱,在惰性溶剂中,将胺、硫醇或醇与式XVII化合物反应。该反应可以在约0℃至约110℃的温度范围内进行。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺、DBU和碳酸盐例如碳酸钾、碳酸钠和碳酸铯。惰性溶剂的实例包括四氢呋喃(THF)、乙醇、N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
其中W是氯(优选)、溴或碘的式XVII化合物可以如下制备:通常在升高的温度下,将式XVIII化合物与合适的脱水剂反应。脱水剂的实例包括磷酰氯、五氯化磷、亚硫酰氯、草酰氯、五溴化磷、三溴氧化磷、五碘化磷、三碘氧化磷等。该反应可以在助溶剂例如苯、甲苯、二甲苯等存在下进行。任选地,可以存在碱例如吡啶或三烷基胺。
可以由式XIX化合物制备式XVIII化合物。通过在酸性含水介质中、在升高的温度下进行水解或重氮化,可以将式XIX化合物转化为式XVIII化合物。酸的实例包括盐酸、硫酸和硝酸。重氮化试剂的实例包括亚硝酸钠和有机亚硝酸酯例如亚硝酸叔丁酯。
可以如下制备式XVIII化合物:在惰性溶剂中,将式XX化合物仅与肼或者与肼和羧酸活化剂一起反应。羧酸活化剂的实例包括羰基二咪唑、二环己基碳二亚胺、五氟苯酚三氟乙酸酯和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺。惰性溶剂的实例包括四氢呋喃、二氯甲烷、乙醚和N,N-二甲基甲酰胺。
通过式XXI化合物与肼在惰性溶剂中反应,可以制备式XIX化合物。惰性溶剂的实例包括四氢呋喃、乙醇和N,N-二甲基甲酰胺。
通过式XXI化合物与氢氧化物源反应,可以制备式XX化合物。氢氧化物源的实例包括氢氧化钠和氢氧化锂。溶剂的实例包括水、醇以及醚/水混合物。
可以如下制备式XXI化合物:在酸性含水介质中,用重氮化试剂处理式XXII化合物。亚硝酸钠是重氮化试剂的实例,稀盐酸(1N)是反应溶剂的实例。
在惰性溶剂中,通过将式XXIII化合物还原,可以制备式XXII化合物。该还原反应可以例如如下进行:使用铂或钯/碳、氢和惰性溶剂例如乙醇或甲醇,通过铂或钯催化的氢化完成,或者在惰性溶剂例如乙酸乙酯中,使用化学计量的还原剂例如氯化亚锡(II)进行。
通过式XXIV化合物与式R3NH2的胺反应,可以制备式XXIII化合物。根据需要,该反应可以在惰性溶剂例如乙醇中,在合适的碱例如三乙胺存在下,以及通常在升高的温度下进行。
可以如下制备式XXIV化合物:在惰性溶剂中、通常在升高的温度下,将式XXV化合物与氰化物供体反应。氰化物供体的实例包括无机氰化物例如氰化钠、氰化钾和氰化铜(I)和有机氰化物例如氰化四丁基铵。也可以将无机氰化物与相转移催化剂例如四丁基铵盐结合使用。惰性溶剂包括N,N-二甲基甲酰胺、乙醇和THF。
式XXI、XXII、XXIII、XXIV、XXV和XXVI化合物的合成方法是本领域技术人员已知的。例如该方法可见于US 4,070,362、4,003,908和4,048,182。式XXVI化合物是市售的,或者可以按照本领域技术人员已知的方法制备。
反应方案IV
该反应方案说明了式Ic化合物(即其中Y是-C(R5)-和Z是氮的式I化合物)的制备方法。R30是烷基。
可以如下制备式Ic化合物:使用合适的碱,在惰性溶剂中、在升高的温度下,将胺、硫醇或醇与式XXVII化合物反应。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺以及DBU。惰性溶剂的实例包括N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
可以如下制备式XXVII化合物:使用合适的碱,在惰性溶剂中,将胺、硫醇或醇与式XXVIII化合物反应。该反应可以在约0℃至约110℃的温度范围内进行。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺、DBU和碳酸盐例如碳酸钾、碳酸钠和碳酸铯。惰性溶剂的实例包括四氢呋喃(THF)、乙醇、N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
可以如下制备其中W是氯(优选)、溴或碘的式XXVIII化合物:通常在升高的温度下,将式XXIX化合物与合适的脱水剂反应。脱水剂的实例包括磷酰氯、五氯化磷、亚硫酰氯、草酰氯、溴化磷、三溴氧化磷、五碘化磷、三碘氧化磷等。该反应可以在助溶剂例如苯、甲苯、二甲苯等存在下进行。任选地可以存在碱例如吡啶或三烷基胺。
式XXIX化合物可以由式XXX或式XXXI化合物制备。通过在酸性含水介质中、在升高的温度下水解或重氮化,可以将式XXX化合物转化为式XXIX化合物。在惰性溶剂中,通过仅与肼或者与肼和羧酸活化剂的混合物反应,可以将式XXXI化合物转化为式XXIX化合物。酸的实例包括盐酸、硫酸和硝酸。重氮化试剂的实例包括亚硝酸钠和有机亚硝酸酯例如亚硝酸叔丁酯。羧酸活化剂的实例包括羰基二咪唑、二环己基碳二亚胺、五氟苯酚三氟乙酸酯和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺。惰性溶剂的实例包括四氢呋喃、二氯甲烷、乙醚和N,N-二甲基甲酰胺。
可以如下制备式XXX化合物:在惰性溶剂中,将式XXXII化合物与肼反应。惰性溶剂的实例包括四氢呋喃、乙醇和N,N-二甲基甲酰胺。
通过将式XXXII化合物与氢氧化物源反应,可以制备式XXXI化合物。氢氧化物源的实例包括氢氧化钠和氢氧化锂。溶剂的实例包括水、醇以及醚/水混合物。
可以如下制备式XXXII化合物:在碱性条件或酸性条件下,在惰性溶剂中,通常在升高的温度下,将式XXII化合物与衍生自式R7-CO2H酸的活化酯衍生物缩合。活化酯的实例包括衍生自R7-CO2H的酰氯、N,N-二烷基酰胺二烷基缩醛例如N,N-二甲基甲酰胺二甲基缩醛和由R7-CO2H与例如羧酸活化剂反应衍生的活化酯,羧酸活化剂是例如羰基二咪唑、二环己基碳二亚胺、五氟苯酚三氟乙酸酯和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺。碱的实例包括氢化钠、氢化钾、碳酸铯、碳酸钾、六甲基二硅氮烷钾(potassium hexamethyldisilazide)和叔丁醇钾。酸或路易斯酸的实例包括盐酸和氯化锌。惰性溶剂的实例包括醚、N,N-二甲基甲酰胺和乙腈。
在反应方案III中讨论了式XXII化合物的制备。
反应方案V
该反应方案说明了式Id化合物[其中Y是氮、Z是-C(R6)-并且-R1是氯的式I化合物]和式Ie化合物[其中Y是氮、Z是-C(R6)-并且-R1是氢的式I化合物]的制备方法。
可以如下制备式Id化合物:使用合适的碱,在惰性溶剂中、在升高的温度下,将胺、硫醇或醇与式III化合物反应。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺以及DBU。惰性溶剂的实例包括N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
可以如下制备式Ie化合物:用氢源和过渡金属催化剂将式Id化合物还原。氢源的实例包括氢和甲酸铵。过渡金属催化剂的实例包括钯/碳和氢氧化钯/碳。
反应方案VI
该反应方案说明了式If化合物[其中Y是氮、Z是氮并且-R1是氯的式I化合物]和式Ig化合物[其中Y是氮、Z是氮并且-R1是氢的式I化合物]的制备方法。
可以如下制备式If化合物:使用合适的碱,在惰性溶剂中、在升高的温度下,将胺、硫醇或醇与式XVII化合物反应。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺以及DBU。惰性溶剂的实例包括N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
可以如下制备式Ig化合物:用氢源和过渡金属催化剂将式If化合物还原。氢源的实例包括氢和甲酸铵。过渡金属催化剂的实例包括钯/碳和氢氧化钯/碳。
反应方案VII
该反应方案说明了式Ih化合物[其中Y是-C(R5)-、Z是氮并且-R1是氯的式I化合物]和式Ij化合物[其中Y是-C(R5)-、Z是氮并且-R1是氢的式I化合物]的制备方法。
可以如下制备式Ih化合物:使用合适的碱,在惰性溶剂中、在升高的温度下,将胺、硫醇或醇与式XXVIII化合物反应。碱的实例包括三烷基胺例如二异丙基乙胺和三乙胺以及DBU。惰性溶剂的实例包括N-甲基吡咯烷酮和N,N-二甲基甲酰胺。
可以如下制备式Ij化合物:用氢源和过渡金属催化剂将式Ih化合物还原。氢源的实例包括氢和甲酸铵。过渡金属催化剂的实例包括钯/碳和氢氧化钯/碳。
优选化合物
本发明优选的化合物是具有下列定义的式I化合物,包括其可药用盐:
Y是氮或-C(R5)-。
Z是氮或-C(R6)-,条件是Y和Z中至少一个是氮。
R1和R2独立地选自下列一组基团:-NR8R9、氢和氯,条件是R1或R2中至少一个是-NR8R9。
R3是氢、烷基、取代的烷基、-(CH2)n-苯基或-(CH2)n-取代的苯基。
R4是氢、卤素、取代的烷基、-OR10或-NR11R12。
R5和R6独立地选自下列一组基团:氢、卤素、烷基和取代的烷基。
R8和R9独立地选自下列一组基团:氢、烷基、取代的烷基、-(CH2)m-环烷基、-(CH2)m-取代的环烷基、-(CH2)m-苯基、-(CH2)m-取代的苯基、-(CH2)m-杂环基和-(CH2)m-杂芳基,或者R8和R9与和它们相连的N原子一起可以形成杂环基环、取代或未取代的咪唑、取代或未取代的吡唑、或者取代或未取代的三唑。
R10、R11和R12独立地选自下列一组基团:氢、烷基、-(CH2)m-苯基、-(CH2)m-取代的苯基和-(CH2)m-杂芳基。
m是0或1-4的整数。
n是1-4的整数。
在上面优选的基团中使用下列定义:
术语″烷基″是指具有1-8个碳原子的直链或支链基团。
术语″取代的烷基″和″取代的低级烷基″是指具有一、二或三个取代基的烷基和低级烷基,所述取代基选自:卤素、-(CH2)m-羟基、氰基、低级烷氧基、低级烷硫基、氨基、-NH(低级烷基)、-N(低级烷基)2、低级烷硫基、
羧基和-CO2-低级烷基。
术语″环烷基″是指未取代的完全饱和的3-7个碳原子的环。
术语″取代的环烷基″是指具有一、二或三个取代基、优选一个取代基的环烷基环,所述取代基选自下列基团:低级烷基、低级烷氧基、低级烷硫基、卤素、-(CH2)m-羟基、氰基、氨基、-NH(低级烷基)、-NH(环烷基)、-N(低级烷基)2、
羧基、-CO2-低级烷基、-(CH2)m-苯基、-(CH2)m-取代的苯基、-(CH2)m-杂环基、-(CH2)m-杂芳基、酮基、=N-OH、=N-O-低级烷基和5或6元酮缩醇即1,3-二氧戊环或1,3-二噁烷。
术语″取代的苯基″是指具有一、二或三个取代基的苯基环,所述取代基选自:低级烷基、低级烷氧基、低级烷硫基、卤素、氰基、羟基、取代的低级烷基、硝基、氨基、-NH(低级烷基)、-NH(环烷基)和-N(低级烷基)2,和/或一个选自下列的取代基:苯基、苄基、苯乙基、苯氧基、苯硫基、羧基、-CO2-低级烷基、
-NH-CH2-羧基、-NH-CH2-CO2-低级烷基和-(CH2)m-杂芳基、以及五氟苯基。
术语″杂环基″是指取代和未取代的、饱和或部分饱和的3-7元单环基,它们具有一或两个O或S原子和/或1-4个氮原子,条件是杂原子的总数为4或小于4,并且条件是该杂环含有至少一个碳原子,氮原子和硫原子可以任选地被氧化,并且氮原子可以任选地季铵化。该杂环取代基是一、二或三个可以与任何允许的碳原子或氮原子连接的取代基,并且所述取代基选自下列一组基团:卤素、羟基、氰基、低级烷基、环烷基、取代的低级烷基、低级烷氧基、低级烷硫基、酮基、甲酰基、硝基、氨基、-NH(低级烷基)、-NH(环烷基)和-N(低级烷基)2,和/或一个选自下列的取代基:苯基、苄基、苯乙基、苯氧基、苯硫基、羧基、取代的苯基、取代的苯基-CH2-、取代的苯基-CH2-CH2-、-CO2-低级烷基、
-NH-CH2-羧基、-NH-CH2-CO2-低级烷基、-(CH2)m-杂环基、-(CH2)m-杂芳基、=N-OH、=N-O-低级烷基、和5或6元酮缩醇即1,3-二氧戊环或1,3-二噁烷以及例如与苯基环稠合的杂环。
术语″杂芳基″是指取代或未取代的5或6元单环芳环基,它们具有一或两个O或S原子和/或1-4个氮原子,条件是环中杂原子的总数为4或小于4,以及9或10元取代或未取代的双环,其中至少一个环是芳族的并且其中至少一个环含有一或两个O或S原子和/或1-4个氮原子,条件是每个环中杂原子的总数为4或小于4。氮原子和硫原子可以任选地被氧化,并且氮原子可以任选地季铵化。该杂芳基取代基与允许的碳原子连接,并且是一、二或三个选自下列一组的取代基:卤素、氰基、低级烷基、环烷基、取代的低级烷基、低级烷氧基、低级烷硫基、羟基、硝基、甲酰基、氨基、-NH(低级烷基)、-NH(环烷基)和-N(低级烷基)2,和/或一个选自下列的取代基:苯基、苄基、苯乙基、苯氧基、苯硫基、羧基、取代的苯基、取代的苯基-CH2-、取代的苯基-CH2-CH2-、-CO2-低级烷基、
-NH-CH2-羧基、-NH-CH2-CO2-低级烷基、-(CH2)m-杂环基和-(CH2)m-杂芳基。
术语″取代的咪唑″是指咪唑、芳基稠合的咪唑例如苯并咪唑或者杂芳基稠合的咪唑例如吡啶并咪唑,它们具有一或两个取代基,所述取代基选自下列一组基团:氢、低级烷基、环烷基、取代的低级烷基、低级烷氧基、低级烷硫基、硝基、卤素、氰基、甲酰基、氨基、-NH(低级烷基)、-NH(环烷基)、-NH(取代的低级烷基)和-N(低级烷基)2,和/或一个选自下列的取代基:苯基、苄基、苯乙基、取代的苯基、取代的苯基-CH2-、取代的苯基-CH2-CH2-、苯氧基、苯硫基、羧基、-CO2-低级烷基、
-CH=N-羟基、-CH=N-O-低级烷基、
-CH=N-NH2、-CH=N-NH(低级烷基)、
-CO2-取代的苯基、
-CH=N-OH、
-NH-CH2-羧基、-NH-CH2-CO2-低级烷基、-(CH2)m-杂环基和-(CH2)m-杂芳基。
术语″取代的吡唑″是指吡唑、芳基稠合的吡唑例如苯并吡唑或者杂芳基稠合的吡唑例如吡唑并吡啶,它们具有一或两个取代基,所述取代基选自下列一组:氢、低级烷基、取代的低级烷基、低级烷氧基、低级烷硫基、-(CH2)n-低级烷氧基、-(CH2)m-羟基、硝基、卤素、氰基、氨基、-NH(低级烷基)、-NH(环烷基)和-N(低级烷基)2,和/或一个选自下列基团的取代基:苯基、苄基、取代的苯基、取代的苯基-CH2-、取代的苯基-CH2-CH2-、苯乙基、苯氧基、苯硫基、羧基、-CO2-低级烷基、
-NH-CH2-羧基、-NH-CH2-CO2-低级烷基、-(CH2)m-杂环基和-(CH2)m-杂芳基。
术语″取代的三唑″是指具有一个取代基的三唑,所述取代基选自下列一组:低级烷基、取代的低级烷基、低级烷氧基、低级烷硫基、-(CH2)n-低级烷氧基、-(CH2)m-羟基、卤素、氰基、氨基、-NH(低级烷基)、-NH(环烷基)、-N(低级烷基)2、苯基、苄基、苯乙基、取代的苯基、取代的苯基-CH2-、取代的苯基-CH2-CH2-、苯氧基、苯硫基、羧基、-CO2-低级烷基、
-NH-CH2-羧基、-NH-CH2-CO2-低级烷基、-(CH2)m-杂环基和-(CH2)m-杂芳基。
更优选的化合物是具有下列定义的式I化合物及其可药用盐:
Y是氮。
Z是-C(R6)-。
R1和R2独立地选自下列一组基团:-NR8R9、氢和氯,条件是R1或R2中至少一个是-NR8R9。
R3是氢、低级烷基、-(CH2)n-苯基或-(CH2)n-取代的苯基。
R4是氢。
R6是氢。
R8和R9独立地选自下列一组基团:氢、低级烷基、取代的低级烷基、-(CH2)m-环己基、-(CH2)m-取代的环己基、-(CH2)m-苯基、-(CH2)m-取代的苯基、-(CH2)m-杂环基、-(CH2)m-杂芳基,或者R8和R9与和它们相连的N原子一起可以形成杂环基环或者取代或未取代的咪唑。
m是0或1-4的整数。
n是1-4的整数。
在上面更优选的基团中使用下列定义:
术语″低级烷基″是指具有1-4个碳原子的直链和支链基团。
术语″取代的低级烷基″是指具有单个取代基的这样的低级烷基,所述取代基选自:卤素、-(CH2)m-羟基、低级烷氧基、氨基、-NH(低级烷基)、-NH(3-6个碳原子的环烷基)、-N(低级烷基)2、羧基、-CO2-低级烷基、
术语″取代的苯基″是指具有一、二或三个取代基的苯基环,所述取代基选自:卤素、氰基、低级烷基、低级烷氧基、-(CH2)m-羟基、三氟甲基、氨基、-NH(低级烷基)、-NH(3-6个碳原子的环烷基)和-N(低级烷基)2,和/或一个选自下列的取代基:羧基、-CO2-低级烷基、
和
以及五氟苯基。
术语″杂环基″是指取代或未取代的、饱和或部分饱和的3-7元单环基,它们具有一或两个O或S原子和/或1-4个氮原子,条件是环中杂原子的总数为4或小于4,并且条件是该杂环含有至少一个碳原子。氮原子和硫原子可以任选地被季铵化。该杂环取代基与允许的碳原子或氮原子连接,并且是一或二个选自下列一组基团的取代基:卤素、酮基、羟基、氰基、低级烷基、取代的低级烷基、3-6个碳原子的环烷基、低级烷氧基、三氟甲基、氨基、-NH(低级烷基)、-NH(3-6个碳原子的环烷基)和-N(低级烷基)2,或一个选自下列的取代基:羧基、-CO2-低级烷基、
=N-OH,
=N-O-低级烷基、
1,3-二氧戊环或1,3-二噁烷以及例如与苯基环稠合的环。
术语″杂芳基″是指取代或未取代的5或6元单环芳环基,它们具有一或两个O或S原子和/或1-4个氮原子,条件是环中杂原子的总数为4或小于4。氮原子和硫原子可以任选地被氧化,并且氮原子可以任选地季铵化。该杂芳基取代基与允许的碳原子连接,并且是一或二个选自下列一组的取代基:卤素、羟基、氰基、低级烷基、取代的低级烷基、3-6个碳原子的环烷基、低级烷氧基、三氟甲基、氨基、-NH(低级烷基)、-N(低级烷基)2和-NH(3-6个碳原子的环烷基),或一个选自下列的取代基:羧基、-CO2-低级烷基、
术语″杂芳基″还包括取代或未取代的9或10元双环基,其中至少一个环是芳族的并且其中至少一个环含有一或两个O或S原子和/或1-4个氮原子,条件是每个环中杂原子的总数为4或小于4。
术语″取代的环己基″是指一或二个选自下列一组基团的取代基:低级烷基、低级烷氧基、低级烷硫基、卤素、酮基、-(CH2)m-羟基、氰基、氨基、-NH(低级烷基)和-N(低级烷基)2,和/或一个选自下列的取代基:羧基、-CO2-低级烷基、=N-OH、=N-O-低级烷基、1,3-二氧戊环、1,3-二噁烷、
术语″取代的咪唑″是指具有一或两个取代基的咪唑,所述取代基选自下列一组基团:低级烷基、取代的低级烷基、低级烷氧基、卤素、-(CH2)m-羟基、氰基、甲酰基、三氟甲基、氨基、-NH(低级烷基)、-N(低级烷基)2、和-NH(3-6个碳原子的环烷基),或一个选自下列的取代基:羧基、-CO2-低级烷基、
-CO2-(取代的苯基)、
-CH=N-NH-(低级烷基)、-CH=N-N(低级烷基)2、
最优选的是具有以下定义的式I化合物及其可药用盐:
Y是氮。
Z是-C(R6)-。
R1是-NH(低级烷基)、-N(低级烷基)2、-NH-(CH2)n-OH、-NH-(CH2)n-N(低级烷基)2、-NH-(CH2)n-取代的苯基、
R2是-NH-(CH2)n-取代的苯基、
R3是氢、乙基或-(CH2)n-取代的苯基。
R4是氢。
R6是氢。
m是0或1-4的整数。
n是1-4的整数。
R20和R21独立地选自氢、低级烷基、甲氧基、氯、-(CH2)m-羟基、氰基、甲酰基、环戊基、环己基、氨基、-NH(低级烷基)、和-N(低级烷基)2,或者R21是氢并且R20选自下列一组基团:羧基、
-NH-环丙基、
或者R20和R21与相同的碳原子结合在一起形成选自下列一组的基团:酮基、=N-OCH3、=N-OH、和
Q是O或N-R23。
R22是氢、甲酰基、-CO2-低级烷基、取代的低级烷基、
-CH=N-OH、-CH=N-O-低级烷基、
-CH=N-N(低级烷基)2、
或
在最优选的基团中,使用下列定义:
术语″取代的苯基″是指一或二个选自甲氧基、氯和氟以及五氟苯基的取代基。
术语″低级烷基″是指1-4个碳原子的直链或支链基团。
术语″取代的低级烷基″是指如上定义的具有选自下列的取代基的低级烷基:羟基、羧基、氨基、-NH(低级烷基)、-N(低级烷基)2、-CO2-低级烷基、
术语杂环基是指下列基团:
R24是氢、氨基、-NH-CO2-低级烷基、-N(低级烷基)2、-NH(低级烷基)、甲氧基甲基、羟基、羟基甲基、或
在最优选的本发明化合物中,下列化合物是尤为引人注目的:
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺甲磺酸盐(1∶1);
N9-[(3-氯-4-甲氧基苯基)甲基]-3-乙基-N6-(4-吡啶基甲基)-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6,9-二胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-甲醇;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-(N,N-二甲基亚乙基)甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-(N-甲基哌啶基)甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基]氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-吡咯烷基甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-1H-咪唑-4-[R-1-氨基-2-(甲氧基甲基)吡咯烷基]酰肼;和
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-1H-咪唑-4-乙酸;特别是上述前两个化合物。
实用性
本发明化合物抑制cGMP PDE,并且尤其是有效的和选择性的cGMPPDE V抑制剂。因此,这些化合物适用于治疗与cGMP-有关的疾病。本文所用″与cGMP有关的疾病″是指可以通过抑制治疗对象中的cGMPPDE或提高cGMP水平而治疗的疾病,其中所述治疗包括预防、部分缓解或治愈病症。可以在接受治疗组织的局部或者在对这种疾病接受治疗的对象中更广泛地抑制cGMP PDE或提高cGMP的水平。如果提高cGMP水平加强附加的有益治疗作用,例如当提高cGMP水平加强内皮-产生的松弛因子的作用时,可以促进治疗。
本发明化合物适用于治疗各种心血管疾病,包括、但不限于高血压、绞痛(稳定的、不稳定的和变型的)、(充血性)心力衰竭、再狭窄、动脉粥样硬化和dyslipidemia,以及静脉和动脉血管开放减少、血栓、心肌梗塞、外周血管疾病、中风、支气管炎、慢性哮喘、变应性哮喘、变应性鼻炎、青光眼、具有以下症状特征的疾病:肠能动性、糖尿病、良性前列腺增生(BPH)和抑制cGMP PDE所导致的癌形成。此外,这些化合物适用于通过改善流经生殖器、特别是海绵体的血流,治疗男性性机能障碍(勃起机能障碍,例如由糖尿病、脊髓损伤、前列腺根除术、精神性疾病或其他原因导致的)和女性性机能障碍。
因此,本发明提供了治疗与cGMP有关疾病的方法,包括给需要该治疗的对象施用治疗有效量的至少一种式I化合物或其盐。在本发明方法中,可以将其他治疗剂例如下面所述的治疗剂与式I化合物联合使用。在本发明方法中,可以在施用本发明化合物之前、同时或之后施用其他治疗剂。
本发明还提供了药物组合物,该组合物含有治疗有效量的至少一种能治疗与cGMP有关疾病的式I化合物或其盐以及可药用载体或稀释剂。本发明组合物可以含有如下所述的其他治疗剂,并且可以按照例如药物制剂领域公知的技术,例如使用常规固体或液体载体或稀释剂以及适于所需给药方式的药物添加剂(如赋形剂、粘合剂、防腐剂、稳定剂、矫味剂等)进行配制。
式I化合物可以以含有无毒、可药用载体或稀释剂的剂量单位制剂形式,以任何适合的方式给药,例如口服,如以片剂、胶囊、粒剂或粉末的形式口服给药;舌下给药;经颊给药;经非肠道给药,例如皮下、静脉内、肌内或胸骨内注射或输注技术(例如无菌注射水溶液或非水容易或悬浮液);经鼻给药例如以吸入喷雾剂给药;局部给药例如以乳膏或软膏的形式给药;或者经直肠给药例如以栓剂形式给药。例如,这些化合物可以以适于即刻释放或缓释的形式给药。即刻释放或缓释可以通过使用合适的药物组合物达到,或者特别是对于缓释,可以使用例如皮下植入物或渗透泵等装置实现。本发明化合物还可以以脂质体形式给药。
口服组合物的实例包括悬浮液,该悬浮液可以含有例如增量用的微晶纤维素、作为悬浮剂的藻酸或藻酸钠、作为粘度增强剂的甲基纤维素以及甜味剂或矫味剂例如本领域已知的那些;以及即刻释放片剂,该片剂可以含有例如微晶纤维素、磷酸氢二钙、淀粉、硬脂酸镁和/或乳糖和/或其他赋形剂、粘合剂、膨胀剂、崩解剂、稀释剂和润滑剂例如本领域已知的那些。式I化合物还可以通过口腔、经舌下和/或颊给药。可以采用例如模压片、压缩片或冻干片。组合物的实例包括将本发明化合物与速溶稀释剂例如甘露糖醇、乳糖、蔗糖和/或环糊精一起配制的那些。该制剂中还可以包括高分子量赋形剂例如纤维素(Avicel)或聚乙二醇(PEG)。该制剂还可以包括有助于粘膜粘附的赋形剂例如羟丙基纤维素(HPC)、羟丙基甲基纤维素(HPMC)、羧甲基纤维素钠(SCMC)、马来酸酐共聚物(例如Gantrez)和控释剂例如聚丙烯酸共聚物(如Carbopol 934)。还可以加入润滑剂、助流剂、矫味剂、着色剂和稳定剂以便于制造和使用。
鼻气溶胶或吸入给药组合物的实例包括盐水溶液,其中可以含有例如苄醇或其他合适的防腐剂、吸收促进剂以提高生物利用率,和/或其他增溶剂或分散剂例如本领域已知的那些。
非肠道给药组合物的实例包括注射溶液或悬浮液,其中可以含有例如合适的无毒、非肠道可接受的稀释剂或溶剂例如甘露糖醇、1,3-丁二醇、水、林格氏溶液(一种等渗氯化钠溶液),或其他合适的分散剂或润湿剂和悬浮剂,包括合成的一-或二-甘油酯,以及脂肪酸,包括油酸。
直肠给药组合物的实例包括栓剂,其中可以含有例如合适的非刺激性赋形剂例如可可脂、合成甘油酯或聚乙二醇,它们在常温是固体、但是在直肠腔中液化和/或溶解,从而释放出药物。
局部给药组合物的实例包含局部用载体例如Plastibase(用聚乙烯胶凝的矿物油)。
本发明化合物的有效量可以由本领域普通技术人员确定,并且包括例如对于成人约0.05-100mg活性成分/kg体重/天的剂量,该剂量可以单次给药,或者分成多次剂量给药,例如每天1-4次。应该理解,对于任何具体患者所采用的特定剂量水平和给药频率将取决于各种因素,包括所用具体化合物的活性、该化合物的代谢稳定性和作用时间、患者的物种、年龄、体重、一般健康状况、性别、饮食情况、给药方式和时间、排泄速度、药物组合和具体疾病的严重程度。优选的治疗对象包括患有与cGMP有关疾病的动物,最优选哺乳动物例如人和驯养动物如狗、猫和马等。
本发明化合物可以单独使用或者相互和/或与其他用于治疗与cGMP有关疾病的合适治疗剂联合使用,其他治疗剂是例如其他cGMPPDE抑制剂、特别是其他cGMP PDE V抑制剂、大电导钙活化的钾(BK)通道调节剂(modulators of the large-conductance calcium-activated potassium(BK)channels)、前列腺素类激素、α-肾上腺素能兴奋剂、内皮素拮抗剂、血管紧张肽II(特别是AT1亚型)拮抗剂、血管紧张肽转化酶(ACE)抑制剂、肾素抑制剂和5-羟色胺(5-HT2c)兴奋剂。
其他治疗剂的实例如下:酚妥拉明、育亨宾碱、罂粟碱、阿朴吗啡、西地那非、如US 5,272,147;5,250,534;5,426,107和5,346,901中所述的吡唑并嘧啶酮,如US 5,482,941中所述的喹唑啉酮;AT1拮抗剂例如洛沙坦,依贝沙坦,缬沙坦和坎地沙坦;ETA拮抗剂例如bosentan、ABT-627和US 5,612,359以及美国专利申请60/035,832(1997年1月30日提交)中所述的那些;选自下列的PDE V抑制剂:咪唑并喹唑啉(参见WO 98/08848)、咔唑(参见WO 97/03675、WO97/03985和WO 95/19978)、咪唑并6-羟基嘌呤(参见WO 97/19947)、苯并咪唑(参见WO 97/24334)、吡唑并喹啉(参见US 5,488,055)、如美国专利申请60/088,538(1998年6月8日提交)中所述的喹唑啉酮、如美国专利申请60/100,655(1998年9月16日提交)中所述的吡啶、邻氨基苯甲酸衍生物(参见WO 95/18097)、稠合的杂环(参见WO 98/07430)和噻吩并嘧啶(参见DE 19632423);和选自吲哚(参见J.Med.Chem.,40,2762-2769(1997),EP 655440和EP657426)和大电导钙活化的钾(BK)通道调节剂(如US 5,565,483和5,602,169以及WO 98/04135和WO98/23273中所述)的5-HT2c兴奋剂。
当上述其他治疗剂与本发明化合物联合使用时,其用量可以是例如Physicians’Desk Reference(PDR)中指出的用量或者是由该领域普通技术人员确定的量。
下面的分析可用于确定化合物作为cGMP PDE抑制剂的活性程度。在下列实施例中所述的化合物已经在该分析中检验,并表明具有活性。
PDE闪烁近似分析方案
按照Seiler等的方法(Seiler,S.,Gillespie,E.,Arnold,A.J.,Brassard,C.L.,Meanwell,N.A.和Fleming,J.S.,″Imidazoquinoline derivatives:potent inhibitors ofplatelet cAMP phosphodiesterase which elevate cAMP levels andactivate protein kinase in platelets,″Thrombosis Research,62:31-42(1991))制备声处理的人血小板匀浆。在人血小板中存在大量的PDE V,并且PDE V占匀浆中cGMP水解活性的约90%。如果需要,通过在快速蛋白液体色谱系统(FPLC)中进行阴离子交换色谱(使用Mono Q阴离子交换柱(Pharmacia),用10mM-450mM NaCl线性梯度洗脱),PDE V可以从匀浆中其他PDE活性中分出。
采用市售磷酸二酯酶[3H]cGMP闪烁近似(SPA)分析试剂盒(Amersham)分析磷酸二酯酶活性。直接采用制造商提供的方案,不同的是反应在室温进行,并且在SPA珠悬浮液中包括3mM无放射活性的cGMP以防止任何其他放射性产物的合成。
本说明书中引用的所有文献均全文结合在本发明中作为参考。
下列实施例说明了本发明的具体实施方案,而非限制权利要求的范围。
缩写
DMF=二甲基甲酰胺
DMSO=二甲基亚砜
Et=乙基
HPLC=高压液相色谱
LRMS=低分辨质谱
Me=甲基
MeOH=甲醇
mp=熔点
THF=四氢呋喃
tlc=薄层色谱
rt=室温
h=小时
H2O=水
EtOH=乙醇
H3PO4=磷酸
NaOH=氢氧化钠
EtOAc=乙酸乙酯
<=小于
>=大于
EDAC·HCl=乙基-3-(二甲基氨基)丙基碳二亚胺,盐酸盐
HOBT=羟基苯并三唑
K2CO3=碳酸钾
制备原料
制备1
(1-乙基吡唑-5-基氨基)亚甲基丙二酸二乙酯
将纯净的5-氨基-1-乙基吡唑(20.0g,180mmol)和乙氧基亚甲基丙二酸二乙酯(42.8g,198mmol)的溶液在120℃加热5小时。该原料无需进一步纯化即直接使用。如果需要,可以在154-160℃(0.1mm Hg)蒸馏产物,得到标题化合物,为液体,该液体固化得到标题化合物,为灰白色固体:mp 50-53℃。
制备2
1-乙基-4-羟基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯
将(1-乙基吡唑-5-基氨基)亚甲基丙二酸二乙酯(180mmol,由前一反应制备)溶解在二苯基醚(200mL)中,将所得溶液置于预热至255℃的油浴中。将反应溶液加热5小时,然后蒸馏除去二苯基醚。将所得棕色反应混合物冷却至室温,并倒入己烷(1L)中。将该溶液冷却至-78C,过滤所得沉淀,得到标题化合物,为米色针状固体,经HPLC证明纯度>90%,并直接使用(25g,60%,2步所得)。将一部分产物从乙醇-水中重结晶,得到白色固体:mp 85-86℃;LRMS(m/z)236(MH+)。
制备3
4-氯-1-乙基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯
将1-乙基-4-羟基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯(15g,63.8mmol)溶解在磷酰氯(100mL)中,并将所得溶液加热回流4小时。减压蒸发除去剩余的磷酰氯。所得淡棕色固体从乙醇-己烷中重结晶,得到标题化合物,为白色固体(14g,55.3mmol,87%):HPLC(YMC S5 ODS 4.6×50mm柱,4分钟梯度-0%B至100%B,流速为4mL/分钟,溶剂A:10%MeOH-90%水-0.2%H3PO4,溶剂B:90%MeOH-10%水-0.2%H3PO4),保留时间3.84分钟显示纯度为96%;LRMS(m/z)254(MH+)。
制备4
4-氯-1-乙基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯
将(1-乙基吡唑-5-基氨基)亚甲基丙二酸二乙酯(10.0g,42.6mmol)溶解在磷酰氯(50mL)中。将该溶液加热回流10小时,然后减压蒸发除去磷酰氯。所得棕色残余物用乙醇(5mL)稀释,并用热己烷(200mL×3)萃取。减压蒸发合并的有机层,得到标题化合物,为油状,该油状产物一经在室温放置即形成淡绿色针状结晶(5.4g,21.3mmol,产率50%)。该物质与制备3得到的产物一致(1H NMR,13C,MS和HPLC)。
制备5
(3-氯-4-甲氧基苯基)甲胺盐酸盐
方法A.将(4-甲氧基苯基)甲胺(75.0g,0.55mol)溶解在乙醚(400mL)中。在剧烈搅拌下滴加盐酸(4.0M二噁烷溶液,1.1mol)。添加完成后,将所得盐酸盐过滤并用乙醚充分洗涤。所得盐经空气干燥过夜(95.0g,100%)。
在搅拌下,将氯气鼓泡通入冰醋酸(400mL)中,直至乙酸中的氯含量占乙酸原始重量的7%。在2L圆底烧瓶中,在剧烈搅拌下,将4-甲氧基苄胺盐酸盐(32.0g,0.18mol)悬浮在冰醋酸(400mL)中。在室温,用30分钟,迅速滴加氯溶液(1.5当量Cl2)。再搅拌所得悬浮液20分钟,然后向反应溶液中鼓泡通入氮气,以除去氯和HCl(使用6N NaOH捕集)。减压蒸发乙酸至100mL体积。向该白色浆状物中加入乙醚(300mL),过滤所得固体。将该固体再悬浮于50mL乙酸中,然后加入50mL乙醚,并再次过滤。重复该方法两次。然后将白色固体转入1L锥形瓶,并悬浮在THF(400mL)中。将该悬浮液加热回流10分钟,然后过滤。然后滤出未溶解的固体,两次再悬浮于煮沸的THF(100mL)中并过滤,得到标题化合物(27.0g,71%),为白色固体。该物质含有<2%原料和<2%二氯化原料。
方法B.在装有机械搅拌器、温度计、滴液漏斗和氩气入口的5L三颈圆底烧瓶中加入4-甲氧基苄胺(105.5g,0.770mol),然后在氩气氛和冰冷却下加入乙酸(1000mL)以保持温度在约20℃。然后在剧烈搅拌下,用20分钟加入磺酰氯(92.7mL,1.16mol),同时保持温度低于25℃。移去冷浴,并在室温搅拌所得混合物(浆状)5小时。反应混合物用乙醚(1500mL)稀释并在室温搅拌1小时。过滤收集所得白色结晶固体,用乙醚(1000mL)洗涤,在真空炉中干燥(40℃)18小时,得到标题化合物(93.2g,产率70%),为白色固体。HPLC表明所需产物为97.9面积%,原料为1.8%,而二氯化苄胺为0.3%。
制备6
4-氰基-1-乙基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯
向4-氯-1-乙基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯(10.0g,39.5mmol)在DMF(50mL)和乙醇(10mL)中的溶液中加入氰化钠(3.9g,80.0mmol)或氰化四丁基铵(11.8g,1.1eq)或氯化四丁基铵(14.7g,1.0eq)和氰化钠(2.4g,1.2eq)。使该溶液或悬浮液温热至60℃直至经TLC监测反应完全。然后用水(200mL)稀释反应混合物,并在室温轻轻搅拌10分钟。形成大量沉淀。将固体过滤并用水彻底淋洗,得到标题化合物,干燥后为米色固体:产率40-80%。经HPLC测定该物质的纯度>95%,并且无需进一步纯化即直接使用。
制备7
1-乙基-1H-吡唑并[3,4-b]吡啶-4,5-二甲酸
将4-氰基-1-乙基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯(2.0g,8.2mmol)悬浮在乙醇(20mL)中,并加入氢氧化钠水溶液(6N,3eq)。将反应混合物加热回流2小时,然后用水(100mL)稀释。该水溶液用乙醚(50mL×2)萃取并弃去有机提取液。水层用磷酸酸化,并用乙酸乙酯(50mL×3)萃取。减压蒸发浓缩提取液,得到标题化合物(纯度>90%,产率50-90%)。该物质无需进一步纯化即直接使用。
制备8
9-氨基-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6
(7H)-酮
向4-氰基-1-乙基-1H-吡唑并[3,4-b]吡啶-5-甲酸乙酯(10.0g,40.1mmol)在乙醇(100mL)中的悬浮液中加入无水肼(5eq)。然后在80℃加热该悬浮液直至原料消耗完。使反应物冷却至室温,用水(200mL)稀释。过滤所得固体,并用水充分洗涤,直至滤液无色。将该固体真空干燥,得到标题化合物,为黄色固体(5.5g,60%)。经HPLC测定该物质的纯度>90%,并且直接使用。
制备9
3-乙基-7,8-二氢-3H-吡唑并[4’,3’:5,6]吡啶并[3,4 d]哒嗪-
6,9-二酮
向9-氨基-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6(7H)-酮(5.0g,21.7mmol)和亚硝酸钠(15.0g,10eq)在水(200mL)中的悬浮液中加入浓硫酸,直至pH<2。剧烈搅拌该悬浮液,并使一些一氧化氮-二氧化氮挥发。然后将该悬浮液置于热板上并加热煮沸。根据需要加入硫酸以保持反应的pH<2。经HPLC监测反应完全时,将所得反应混合物冷却至室温。过滤收集沉淀的白色固体,用水充分洗涤,并真空干燥,得到标题化合物,为米色固体(4.6g,92%,经HPLC监测纯度>95%)。
可以使用的另一种方法是由1-乙基-1H-吡唑并[3,4-b]吡啶-4,5-二甲酸开始。将该二元酸溶解在含EDAC·HCl(1.2eq)、HOBT(1.2eq)和三乙胺(5.0eq)的无水THF中。向该溶液中加入无水肼(2.0eq)。所得溶液在室温搅拌5小时,并用水稀释。过滤收集沉淀的固体,得到标题化合物,为白色固体。
制备10
6,9-二氯-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪
将3-乙基-7,8-二氢-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6,9-二酮(5.0g,21.6mmol)悬浮在磷酰氯(30mL)中,并将所得混合物加热回流3小时。减压蒸发除去过量的磷酰氯。将棕色残余物溶解在EtOAc(100mL)中,并在搅拌下将所得混合物倒入冰(100g)中。分离有机层,用水(100mL×3)充分洗涤。然后用硫酸钠干燥有机层,并减压蒸发除去溶剂,得到标题化合物,为灰白色固体(5.5g,产率95%,经HPLC监测纯度>90%)。
还按照下列方法制备上述化合物。
在室温,向3-乙基-7,8-二氢-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6,9-二酮(20g,0.087mol)在甲苯中的浆状物中加入吡啶(14ml,0.17mol)和磷酰氯(17.7ml,0.19mol)。该浆状物在室温搅拌20分钟,并在80-85℃搅拌10小时。使反应混合物冷却后,滤出固体并用甲苯洗涤。向滤液中加入水,并将pH从1-2调节至pH10-11。分离有机层,并用硫酸镁干燥。减压除去溶剂后得到产物,为淡黄色固体。产量18.8g(81%),HPLC AP>99%。
实施例1
1-(9-氯-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-
d]哒嗪-6-基)-4-哌啶醇
在100mL压力管中,向6,9-二氯-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪(3.2g,12.0mmol)在THF/乙醇(40mL,1∶1)中的悬浮液中依次加入三乙胺(5eq)和4-羟基哌啶(1.1eq)。在60℃油浴中加热反应混合物2小时。通过HPLC监测反应进程。将反应混合物转入200mL圆底烧瓶中,并减压蒸发除去溶剂。将淡棕色残余物再悬浮于饱和碳酸氢钠(100mL)中,过滤收集沉淀的固体。该橙色固体用水充分洗涤,并在40℃真空炉中干燥过夜,得到标题化合物(3.2g,产率80%)。该物质的纯度>93%,并且无需进一步纯化即直接使用。
实施例2
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并
[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-4-哌啶醇
在100mL压力管中,将1-(9-氯-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基)-4-哌啶醇(2.4g,7.2mmol)和(3-氯-4-甲氧基苯基)甲胺盐酸盐(7.5g,5eq)悬浮在N-甲基吡咯烷酮(20mL)和二异丙基乙胺(5eq)中。使反应管潜入170℃预热的油浴中2h。HPLC分析表明原料消耗完了。使反应物冷却至室温,并用EtOAc(250mL)稀释。该溶液依次用水(200mL×3)和盐水(200mL×2)洗涤,并用硫酸钠干燥。减压蒸发除去溶剂,得到棕色泡沫。该泡沫经硅胶柱色谱纯化,用二氯甲烷-甲醇(30∶1)洗脱,得到标题化合物,为橙色固体(2.0g,60%):mp 109-110.5℃。该物质经HPLC分析,结果表明纯度为95%:HPLC(YMC S5 ODS 4.6×50mm柱,4分钟梯度-0%B至100%B,流速为4mL/分钟,溶剂A:10%MeOH-90%水-0.2%H3PO4,溶剂B:90%MeOH-10%水-0.2%H3PO4),保持时间为3.22分钟;LRMS(m/z)468(MH+)。
实施例3
9-氯-6-取代的吡唑并吡啶并哒嗪的一般制备方法
在100mL压力管中,向合适的6,9-二氯吡唑并吡啶并哒嗪在THF-乙醇(1∶1)(终浓度:~200mM)中的悬浮液中加入三乙胺(5eq),然后加入合适的胺、醇或硫醇(R1H)。反应混合物在60-100℃油浴中加热,直至TLC或HPLC监测反应完全。然后将反应混合物转入200mL圆底烧瓶中,并减压蒸发除去溶剂。将残余物再悬浮于饱和NaHCO3(100mL)中,过滤收集沉淀的固体。所收集的固体用水充分洗涤,并在40℃真空炉中干燥过夜。如果该物质的纯度>85%,则无需进一步纯化即直接使用,否则,经硅胶色谱进行纯化。
实施例4
6,9-二取代的吡唑并吡啶并哒嗪的一般制备方法
在100mL压力管中,将合适的9-氯-6-取代的吡唑并吡啶并哒嗪和合适的胺、醇或硫醇(R2H,5eq)与二异丙基乙胺(5eq)一起悬浮在N-甲基吡咯烷酮中(制成~200mM的终浓度)。将反应管潜入在170℃预热的油浴中,直至HPLC监测反应完全。使反应物冷却至室温,并用EtOAc稀释。该溶液依次用水和盐水洗涤,并用硫酸钠干燥。减压蒸发除去溶剂,得到棕色泡沫。进行硅胶柱色谱,用CH2Cl2-CH3OH(30∶1)洗脱,得到标题化合物。
按照上述实施例3和实施例4中的一般方法,制备下表1中列出的化合物。
表1
实施例170
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,
3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺
a)
(1-乙基吡唑-5-基氨基)-N,N-二甲基甲脒
将纯净的5-氨基-1-乙基吡唑(60.0g,540.5mmol)和N,N-二甲基甲酰胺-二甲氧基缩醛(84.0mL,594.5mmol)溶液加热回流5小时。所得棕色溶液100%转化,并且直接用于下面的反应。
b)
3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]琥珀酰亚胺- 6,8-二酮
在烧杯(2.0L)中,向(1-乙基吡唑-5-基氨基)-N, N二甲基甲脒(540.5mmol)在水(200mL)中的溶液中加入溶解在水(700mL)中的马来酰亚胺(131.0g,1350.0mmol)。该溶液在室温剧烈搅拌12小时,同时迅速鼓泡通入空气。过滤收集淡黄色固体并用水彻底淋洗。经HPLC监测,该物质的纯度>97%(79.0g,65%,两步反应的产率,经烘箱干燥后),并且直接用于下面的反应中。
c)
3-乙基-7,8-二氢-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪 -6,9-二酮(见制备9和10)
向3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]琥珀酰亚胺-6,8-二酮(79.0g,366.0mmol)在1∶1乙醇-水(1L)中的悬浮液中加入肼一水合物(50mL,1000mmol)。将所得黄色溶液加热回流0.5小时,并冷却至~40℃。该黄色溶液用浓盐酸酸化至pH~4。得到白色悬浮液。将该浓稠的悬浮液冷却至室温,然后过滤。所得白色固体在真空炉中于40℃干燥24小时(72.0g,311.0mmol)。如制备10所述将该物质转化为6,9-二氯-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]哒嗪,然后直接用于下面的反应中。
d)
N-甲基-1-(9-氯-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d] 哒嗪-6-基)咪唑-4-甲酰胺
在1L压力玻璃反应器中,向6,9-二氯吡唑并吡啶并哒嗪(30.0g,112.0mmol)在N-甲基吡咯烷酮(300mL)中的混合物中加入4-甲基咪唑甲酰胺(14.7g,118.0mmol)和二异丙基乙胺(58.0mL,336.0mmol)。将反应混合物置于预热的油浴中于105℃保持2小时。将内容物倒入冰(约1kg)中。未反应的6,9-二氯吡唑并吡啶并哒嗪以淡黄色固体形式沉淀出来,过滤收集。用乙醚(500mL)萃取水溶液一次,以进一步除去6,9-二氯吡唑并吡啶并哒嗪。用硫酸铵使水溶液饱和,之后用乙酸乙酯(3×1L)萃取。合并的有机部分用水(2×1L)洗涤,并用无水硫酸钠干燥。然后减压除去溶剂。经反相HPLC和LC-MS(m/z 358)监测,所得固体的纯度为80%,并且无需进一步纯化即可使用。经纯度校正后,产率为20%。
e)
1-[9-[[(3-氯-4-甲氧基苯基)甲基]氨基]-3-乙基-3H-吡唑并- [4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰 胺
在1L压力玻璃反应器中,向步骤(d)的产物(26.5g,74.0mmol)在N-甲基吡咯烷酮(265mL)中的悬浮液中加入(3-氯-4-甲氧基苯基)甲胺盐酸盐(18.7g,89.0mmol)和二异丙基乙胺(43.0mL,244.0mmol)。将反应混合物置于预热的油浴中于120℃保持2小时。将内容物倒入冰(约1kg)中,形成淡黄色固体。该水悬浮液在室温放置20分钟,然后过滤。固体用水彻底洗涤。将该湿的固体溶解在乙醇(75mL)中,然后加热至沸。开始形成白色固体,并且变为稠的浆状物。将该悬浮液简单地在室温冷却,并过滤。将该固体再悬浮于乙醇(50mL)中,加热煮沸10分钟并过滤。得到产物,为白色固体(22.5g,产率62%),经HPLC监测纯度为99%:熔点181-183℃和206-207℃;LRMS m/z 491;13C NMR(CDCl3),δ162.7,154.2,149.3,146.2,143.0,138.4,137.3,131.1,130.6,129.9,127.6,122.8,122.5,118.1,113.8,112.3,104.1,99.9,56.2,45.6,43.3,25.8,15.0。C23H22ClN9O2的分析,计算值:C,56.16;H,4.51;N,25.63;Cl,7.21。实测值:C,55.72;H,4.32;N,25.94;Cl,7.23。
上述合成中的步骤b)、d)和e)还可以通过下列优选的方法进行。
b’)
3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d]琥珀酰亚胺- 6,8-二酮
在烧杯(2.0L)中,向(1-乙基吡唑-5-基氨基)-N,N-二甲基甲脒(540.5mmol)在水(200mL)中的溶液中加入溶解在水(700mL)中的马来酰亚胺(131.0g,1350.0mmol)。该溶液在室温剧烈搅拌12小时,同时迅速鼓泡通入空气。过滤收集淡黄色固体并用水彻底淋洗。经HPLC监测,该物质的纯度>97%(79.0g,65%,2步反应的产率,经烘箱干燥后),并且直接用于下面的反应中。
c’)该步骤与上述步骤c)相同。
d’)
N-甲基-1-(9-氯-3-乙基-3H-吡唑并[4’,3’:5,6]吡啶并[3,4-d] 哒嗪-6-基)咪唑-4-甲酰胺
制备4-甲基咪唑甲酰胺(5.3g,42.1mmol)在N,N-二甲基甲酰胺(20mL)中的溶液。在一只1升3-颈夹套反应瓶中,将6,9-二氯吡唑并-吡啶并哒嗪(10.0g,37.3mmol)在N,N-二甲基甲酰胺(40mL)中的浆状物冷却至0-2℃。用15分钟,向上述混合物中加入10%4-甲基咪唑甲酰胺溶液,然后加入325目K2CO3(15.3g,111.7mmol)。所得混合物在2-4℃剧烈搅拌。用6小时,加入剩余的4-甲基咪唑甲酰胺溶液,并以3小时的间隔,分两次加入另外的325目K2CO3(2×7.6g,111.7mmol)。在2-4℃搅拌7小时后,使反应混合物温热至10℃,并在此温度再搅拌16小时。形成稠的浆状物。当剩余的6,9-二氯吡唑并吡啶并哒嗪少于8%时终止反应,经HPLC定量分析样品滤液。向搅拌着的反应混合物中缓缓加入冷水(120ml)。在整个添加过程中保持该混合物的温度低于25℃。搅拌1小时后,该混合物经中等孔隙率玻璃料过滤。固体滤饼通过与DMF/H2O(1/4,3×30mL)和H2O(50mL)一起制浆进行洗涤。滤饼在真空炉(25″Hg真空,50℃)干燥1-2天至恒重。粗品固体的重量是8.7g,纯度85%。
在120-123℃,将粗品固体溶解在中N,N-二甲基甲酰胺(60mL)中。该溶液缓缓冷却至90℃,并在此温度搅拌2小时以形成种子床。在65-70℃,用30分钟,向该混合物中加入EtOAc(60mL)。用3-4小时使该混合物缓缓冷却至25℃,并在室温搅拌16-20小时。该固体经中等孔隙率玻璃料过滤,并用EtOAc(2×30mL)洗涤,得到米色固体5.8g,产率43%。经HPLC分析和LC-MS(m/z 358)监测,该物质的纯度为97.4%。
e’)
1-[9-[[(3-氯-4-甲氧基苯基)-甲基]氨基]-3-乙基-3H-吡唑并 [4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰 胺
在1升压力玻璃反应器中,向步骤(d)的产物(26.5g,74.0mmol)在N-甲基吡咯烷酮(185mL)中的悬浮液中加入(3-氯-4-甲氧基苯基)甲胺盐酸盐(18.7g,89.0mmol)和二异丙基乙胺(43.0mL,244.0mmol)。将反应混合物置于预热的油浴中于110℃保持4小时。使反应混合物冷却至室温,用30分钟缓缓加入370ml水。在室温搅拌该水悬浮液2小时,然后过滤。该固体用水彻底洗涤并吸滤干燥过夜。使该固体悬浮在乙醇(330ml)中,并加热煮沸5小时。使该悬浮液冷却至0-5℃,搅拌2小时并过滤。得到淡黄色固体产物(33.2g,产率91%),经反相HPLC监测纯度为99%:熔点181-183℃和206-207℃;LRMS m/z 491;13C NMR(CDCl3),δ162.7,154.2,149.3,146.2,143.0,138.4,137.3,131.1,130.6,129.9,127.6,122.8,122.5,118.1,113.8,112.3,104.1,99.9,56.2,45.6,43.3,25.8,15.0。C23H22ClN9O2的分析,计算值:C,56.16;H,4.51;N,25.63;Cl,7.21。实测值:C,55.72;H,4.32;N,25.94;Cl,7.23。
实施例171
1-[9-[[(3-氯-4-甲氧基苯基)甲基]氨基]-3-乙基-3H-吡唑并
[4’,3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰
胺甲磺酸盐(1∶1)
在20℃和搅拌下,向实施例170的产物(10.0g,20.3mmol)在乙醇(200mL)中的悬浮液中加入甲磺酸(4.5mL,69.3mmol)。黄色浆状物首先变稀,并逐渐转化为稠的米色浆状物。在25℃搅拌该浆状物15小时,对过滤的湿样品进行的DSC分析显示在~235℃有一个熔融吸热线。在室温搅拌该浆状物0.5小时并过滤。滤饼用300mL乙醇洗涤,并在45℃真空炉中干燥24小时。得到淡黄色固体产物(11.4g,产率95%),经HPLC分析表明纯度为99%;熔点233-235℃;含水量LOD为3.9%;C23H22ClN9O2·CH4SO3的分析,计算值:C,49.02;H,4.46;N,21.44;Cl,6.03;S,5.45。实测值:C,47.44;H,4.81;N,21.51;Cl,5.78;S,5.38.
实施例172
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4’,
3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺氢
溴酸盐(1∶1)
在20℃和搅拌下,向实施例170的产物(1.0g,2.0mmol)在乙醇(16.6mL)中的悬浮液中加入氢溴酸溶液(30wt%乙酸溶液,2.0mL,10.0mmol)。在室温搅拌该黄色浆状物3小时,对过滤的湿样品进行的DSC分析表明在~260℃有一个熔融吸热线。将该浆状物过滤,滤饼用40mL乙醇洗涤,并在45℃真空干燥24小时。得到淡黄色固体产物(1.1g,产率92%),经HPLC分析表明纯度为99%;熔点244-248℃;C23H22ClN9O2·HBr的分析,计算值:C,48.22;H,4.05;N,22.01;Cl,6.19;Br,13.95。实测值:C,48.02;H,3.98;N,21.87;Cl,6.13;Br,13.83。
实施例173
1-[9-[[(3-氯-4-甲氧基苯基)甲基]氨基]-3-乙基-3H-吡唑并[4’,
3’:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺盐
酸盐(1∶1)
在20℃和搅拌下,向实施例170的产物(1.7g,3.5mmol)在乙醇(35mL)中的悬浮液中加入盐酸溶液(37wt%水溶液,1.4mL,16.9mmol)。将黄色浆状物加热回流1小时。逐渐形成稠的米色浆状物。使该浆状物冷却至室温,搅拌20小时并过滤。滤饼用40mL乙醇洗涤,并在45℃真空炉中干燥24小时。得到淡黄色固体产物(1.8g,产率95%),经HPLC分析表明纯度为99%;熔点202-208℃;C23H22ClN9O2·HCl的分析,计算值:C,52.28;H,4.39;N,23.86;Cl,13.42。实测值:C,52.05;H,4.41;N,23.61;Cl,13.09。
Claims (12)
1.式I化合物或其可药用盐,
(I)
其中:
Y是氮;
Z是-C(R6)-;
R1是-NH(低级烷基)、-N(低级烷基)2、-NH-(CH2)n-OH、-NH-(CH2)n-N(低级烷基)2、-NH-(CH2)n-取代的苯基、
R2是-NH-(CH2)n-取代的苯基、
R3是氢、乙基或-(CH2)n-取代的苯基;
R4是氢;
R6是氢;
m是0或1-4的整数;
n是1-4的整数;
R20和R21独立地选自氢、低级烷基、甲氧基、氯、-(CH2)m-羟基、氰基、甲酰基、环戊基、环己基、氨基、-NH(低级烷基)和-N(低级烷基)2,或者R21是氢并且R20选自下列一组基团:羧基、
低级烷基、四唑基、
或者R20和R21与相同的碳原子结合在一起形成选自下列一组的基团:
酮基、=N-OCH3、=N-OH、和
Q是O或N-R23;
R23是氢、低级烷基、或
低级烷基;
R22是氢、甲酰基、-CO2-低级烷基、取代的低级烷基、
-CH=N-OH,-CH=N-O-低级烷基、
杂环基、-CO2-:取代的苯基、
低级烷基、
或
(取代的低级烷基);
术语″取代的低级烷基″是指具有选自下列的取代基的低级烷基:
羟基、羧基、氨基、-NH(低级烷基)、-N(低级烷基)2、-CO2-低级烷基、
术语“取代的苯基”是指具有一个或两个选自甲氧基、氯和氟的取代基的苯基环,或五氟苯基;
术语杂环基是指下列基团:
R24是氢、氨基、-NH-CO2-低级烷基、-N(低级烷基)2、-NH(低级烷基)、甲氧基甲基、羟基、羟基甲基、或
在上述各定义中,“低级烷基”是指C1-4烷基。
5.权利要求1的化合物,为
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺甲磺酸盐(1∶1);
N9-[(3-氯-4-甲氧基苯基)甲基]-3-乙基-N6-(4-吡啶基甲基)-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6,9-二胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-甲醇;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-(N,N-二甲基亚乙基)甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-(N-甲基哌啶基)甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基]氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-1H-咪唑-4-吡咯烷基甲酰胺;
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-1H-咪唑-4-[R-1-氨基-2-(甲氧基甲基)吡咯烷基]酰肼;或
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-1H-咪唑-4-乙酸。
6.权利要求5的化合物,为
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺。
7.权利要求5的化合物,为
1-[9-[[(3-氯-4-甲氧基苯基)甲基)氨基]-3-乙基-3H-吡唑并[4′,3′:5,6]吡啶并[3,4-d]哒嗪-6-基]-N-甲基-1H-咪唑-4-甲酰胺甲磺酸盐(1∶1)。
8.用于治疗与cGMP有关的疾病的药物组合物,含有一种或多种权利要求1的化合物,包括其可药用盐,以及可药用载体。
9.下式化合物,
其中:
W是氯、溴或碘;
Y是氮;
Z是-C(R6)-;
R1、R3、R4和R6各如权利要求1中所定义。
10.权利要求9的化合物,其中:
W是氯。
11.制备权利要求1的化合物的方法,该方法包括:在惰性溶剂和碱存在下,向下式化合物中依次加入式R1H和R2H的胺、硫醇或醇,
其中,R1、R2、Y、Z、R3和R4如权利要求1中所定义,而W是氯、溴或碘。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12548899P | 1999-03-22 | 1999-03-22 | |
| US60/125488 | 1999-03-22 | ||
| US14800999P | 1999-08-10 | 1999-08-10 | |
| US60/148009 | 1999-08-10 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1344257A CN1344257A (zh) | 2002-04-10 |
| CN1161341C true CN1161341C (zh) | 2004-08-11 |
Family
ID=26823624
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB008053766A Expired - Fee Related CN1161341C (zh) | 1999-03-22 | 2000-03-09 | cGMP磷酸二酯酶的稠合吡啶并哒嗪抑制剂 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US6316438B1 (zh) |
| EP (1) | EP1165521A4 (zh) |
| JP (1) | JP2002540102A (zh) |
| KR (1) | KR20020015030A (zh) |
| CN (1) | CN1161341C (zh) |
| AU (1) | AU765128B2 (zh) |
| CA (1) | CA2368023A1 (zh) |
| ID (1) | ID30182A (zh) |
| UY (1) | UY26071A1 (zh) |
| WO (1) | WO2000056719A1 (zh) |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6548490B1 (en) * | 1997-10-28 | 2003-04-15 | Vivus, Inc. | Transmucosal administration of phosphodiesterase inhibitors for the treatment of erectile dysfunction |
| US6403597B1 (en) | 1997-10-28 | 2002-06-11 | Vivus, Inc. | Administration of phosphodiesterase inhibitors for the treatment of premature ejaculation |
| US20040014761A1 (en) * | 1997-10-28 | 2004-01-22 | Place Virgil A. | Treatment of female sexual dysfunction with phosphodiesterase inhibitors |
| CA2365782A1 (en) * | 1999-04-30 | 2000-11-09 | William E. Pullman | Treatment of female arousal disorder |
| CN1446084A (zh) * | 2000-08-11 | 2003-10-01 | 辉瑞大药厂 | 胰岛素抗性综合症的治疗 |
| US6576644B2 (en) * | 2000-09-06 | 2003-06-10 | Bristol-Myers Squibb Co. | Quinoline inhibitors of cGMP phosphodiesterase |
| PT1644021E (pt) * | 2003-06-13 | 2013-01-30 | Ironwood Pharmaceuticals Inc | Métodos e composições para o tratamento de distúrbios gastrointestinais |
| TW200534879A (en) * | 2004-03-25 | 2005-11-01 | Bristol Myers Squibb Co | Coated tablet formulation and method |
| US20050256314A1 (en) * | 2004-05-04 | 2005-11-17 | Soojin Kim | Process employing controlled crystallization in forming crystals of a pharmaceutical |
| US7829720B2 (en) * | 2004-05-04 | 2010-11-09 | Bristol-Myers Squibb Company | Process for preparing atazanavir bisulfate and novel forms |
| US20050288343A1 (en) * | 2004-05-19 | 2005-12-29 | Andrew Rusowicz | Process of preparing substituted carbamates and intermediates thereof |
| TWI415635B (zh) * | 2004-05-28 | 2013-11-21 | 必治妥施貴寶公司 | 加衣錠片調製物及製備彼之方法 |
| AU2006237300B2 (en) | 2005-04-19 | 2011-10-13 | Takeda Gmbh | Roflumilast for the treatment of pulmonary hypertension |
| SI2178513T1 (sl) * | 2007-06-22 | 2011-05-31 | Bristol Myers Squibb Co | Tabletni sestavki vsebujoäśi atazanavir |
| DE602008005462D1 (de) * | 2007-06-22 | 2011-04-21 | Bristol Myers Squibb Co | Tablettierte atazanavirhaltige zusammensetzungen |
| JP2010530888A (ja) * | 2007-06-22 | 2010-09-16 | ブリストル−マイヤーズ スクイブ カンパニー | アタザナビルを含む錠剤組成物 |
| CN101801348A (zh) * | 2007-06-22 | 2010-08-11 | 百时美施贵宝公司 | 含有阿扎那韦的压片组合物 |
| RU2010126622A (ru) | 2007-11-30 | 2012-01-10 | УАЙТ ЭлЭлСи (US) | Конденсированные с арилом и гетероарилом имидазо[1, 5-а]пиразины в качестве ингибиторов фосфодиэстеразы 10 |
| US20090143361A1 (en) * | 2007-11-30 | 2009-06-04 | Elbion Gmbh | Pyrido[3,2-E]Pyrazines, Process For Preparing The Same, And Their Use As Inhibitors Of Phosphodiesterase 10 |
| WO2010114904A1 (en) | 2009-03-31 | 2010-10-07 | Arqule, Inc. | Pyrazolo-pyrrolopyridine-dione derivatives useful in the treatment of cancer |
| CN103547580B (zh) * | 2011-03-22 | 2016-12-07 | 阿迪维纳斯疗法有限公司 | 取代的稠合三环化合物、其组合物及医药用途 |
| EP3138830A4 (en) * | 2014-04-30 | 2018-05-30 | Air Water Inc. | Composition containing 3-chloro-4-methoxybenzylamine hydrochloride, and method for producing same |
| WO2017168174A1 (en) | 2016-04-02 | 2017-10-05 | N4 Pharma Uk Limited | New pharmaceutical forms of sildenafil |
| WO2018002673A1 (en) | 2016-07-01 | 2018-01-04 | N4 Pharma Uk Limited | Novel formulations of angiotensin ii receptor antagonists |
| CN108395377A (zh) * | 2018-01-16 | 2018-08-14 | 吴江信凯医药科技有限公司 | 一种3-氯-4-甲氧基苄胺盐酸盐的制备方法 |
| US11618751B1 (en) | 2022-03-25 | 2023-04-04 | Ventus Therapeutics U.S., Inc. | Pyrido-[3,4-d]pyridazine amine derivatives useful as NLRP3 derivatives |
| US11319319B1 (en) | 2021-04-07 | 2022-05-03 | Ventus Therapeutics U.S., Inc. | Compounds for inhibiting NLRP3 and uses thereof |
| US12331048B2 (en) | 2022-10-31 | 2025-06-17 | Ventus Therapeutics U.S., Inc. | Pyrido-[3,4-d]pyridazine amine derivatives useful as NLRP3 inhibitors |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3669950A (en) | 1970-12-01 | 1972-06-13 | Squibb & Sons Inc | DIPYRAZOLO{8 3,4-b:3,4d{9 -PYRIDIN-3-ONES |
| US3787430A (en) | 1972-07-13 | 1974-01-22 | Squibb & Sons Inc | Derivatives of dipyrazolo(3,4-b;3',4'-d)pyridines |
| US4072681A (en) | 1977-03-02 | 1978-02-07 | E. R. Squibb & Sons, Inc. | 3,7-Dihydro- and 1,7-dihydro-4H-pyrazolo[4',3':5,6]pyrido[4,3-d]pyrimidin-4-ones |
| US5055465A (en) * | 1989-05-31 | 1991-10-08 | Berlex Laboratories, Inc. | Imidazoquinoxalinones, their aza analogs and process for their preparation |
| US5250534A (en) | 1990-06-20 | 1993-10-05 | Pfizer Inc. | Pyrazolopyrimidinone antianginal agents |
| CA2056142A1 (en) | 1990-11-27 | 1992-05-28 | Hirotomo Masuya | Pyridopyridazine compounds and their use |
| JP3477651B2 (ja) * | 1993-01-28 | 2003-12-10 | 武田薬品工業株式会社 | スーパーオキシドラジカルの検出・定量法 |
| GB9301192D0 (en) | 1993-06-09 | 1993-06-09 | Trott Francis W | Flower shaped mechanised table |
| JP3919835B2 (ja) * | 1994-08-09 | 2007-05-30 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 縮合ピリダジン系化合物 |
| US5849741A (en) * | 1994-08-09 | 1998-12-15 | Eisai Co., Ltd. | Fused pyridazine compounds |
| JPH08143558A (ja) * | 1994-11-21 | 1996-06-04 | Fujisawa Pharmaceut Co Ltd | アミノピペラジン誘導体の新規医薬用途 |
| GB9423910D0 (en) * | 1994-11-26 | 1995-01-11 | Pfizer Ltd | Therapeutic agents |
| US5488055A (en) * | 1995-03-10 | 1996-01-30 | Sanofi Winthrop Inc. | Substituted N-cycloalkylmethyl-1H-pyrazolo(3,4-b)quinolin-4 amines and compositions and methods of use thereof |
| US5614530A (en) * | 1995-03-10 | 1997-03-25 | Sterling Winthrop Inc. | Substituted N-arylmethyl and heterocyclmethyl-1H-pyrazolo[3,4-b]quinolin-4-amines and compositions and methods of use thereof |
| AU722710B2 (en) * | 1996-08-20 | 2000-08-10 | Eisai Co. Ltd. | Remedies for erectile dysfunction containing fused pyridazine compounds |
| JPH10114657A (ja) * | 1996-08-20 | 1998-05-06 | Eisai Co Ltd | 縮合ピリダジン系化合物の勃起機能不全症治療剤 |
| US5874437A (en) | 1996-11-01 | 1999-02-23 | Nitromed, Inc. | Nitrosated and nitrosylated phosphodiesterase inhibitor compounds, compositions and their uses |
| AU7553198A (en) * | 1997-06-12 | 1998-12-30 | Sumitomo Pharmaceuticals Company, Limited | Pyrazole derivatives |
| US6087368A (en) | 1998-06-08 | 2000-07-11 | Bristol-Myers Squibb Company | Quinazolinone inhibitors of cGMP phosphodiesterase |
| US6326379B1 (en) * | 1998-09-16 | 2001-12-04 | Bristol-Myers Squibb Co. | Fused pyridine inhibitors of cGMP phosphodiesterase |
-
2000
- 2000-03-09 CA CA002368023A patent/CA2368023A1/en not_active Abandoned
- 2000-03-09 CN CNB008053766A patent/CN1161341C/zh not_active Expired - Fee Related
- 2000-03-09 KR KR1020017012014A patent/KR20020015030A/ko not_active Withdrawn
- 2000-03-09 AU AU37327/00A patent/AU765128B2/en not_active Ceased
- 2000-03-09 EP EP00916180A patent/EP1165521A4/en not_active Withdrawn
- 2000-03-09 JP JP2000606580A patent/JP2002540102A/ja active Pending
- 2000-03-09 WO PCT/US2000/006100 patent/WO2000056719A1/en not_active Application Discontinuation
- 2000-03-09 ID IDW00200102056A patent/ID30182A/id unknown
- 2000-03-15 US US09/526,162 patent/US6316438B1/en not_active Expired - Lifetime
- 2000-03-22 UY UY26071A patent/UY26071A1/es not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| AU3732700A (en) | 2000-10-09 |
| UY26071A1 (es) | 2000-10-31 |
| WO2000056719A1 (en) | 2000-09-28 |
| EP1165521A1 (en) | 2002-01-02 |
| ID30182A (id) | 2001-11-08 |
| CN1344257A (zh) | 2002-04-10 |
| CA2368023A1 (en) | 2000-09-28 |
| KR20020015030A (ko) | 2002-02-27 |
| EP1165521A4 (en) | 2002-05-22 |
| JP2002540102A (ja) | 2002-11-26 |
| AU765128B2 (en) | 2003-09-11 |
| US6316438B1 (en) | 2001-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1161341C (zh) | cGMP磷酸二酯酶的稠合吡啶并哒嗪抑制剂 | |
| CN1178938C (zh) | 1,2-稠合的喹啉衍生物 | |
| CN1237060C (zh) | 用作α1A/B肾上腺素能受体拮抗剂的喹唑酮衍生物 | |
| CN1165535C (zh) | 抑制胃酸分泌的咪唑并吡啶衍生物 | |
| CN1165536C (zh) | 与六元杂环稠合的取代的吡唑衍生物 | |
| CN1053668C (zh) | 新型化合物及其制法和抗肿瘤剂 | |
| CN1038511C (zh) | 咪唑并吡啶及其制备方法和制药的应用 | |
| CN1694704A (zh) | (1h-苯并咪唑-2-基)-(哌嗪基)-甲酮衍生物及其相关化合物作为组胺h4受体拮抗剂用于治疗炎性和过敏性疾病 | |
| CN1688583A (zh) | 用作治疗醛固酮介导的病症的药物的有机化合物 | |
| CN1278819A (zh) | 作为促肾上腺皮质素释放激素拮抗剂、可用于治疗cns障碍和紧张相关性疾病的杂环基取代的环稠合吡啶和嘧啶 | |
| CN1950371A (zh) | 用作组胺h3受体配体的四氢萘啶衍生物 | |
| CN1217945C (zh) | Crf受体拮抗剂以及与其有关的方法 | |
| CN1092771A (zh) | 氨基亚甲基取代的非芳香杂环化合物 | |
| CN1784409A (zh) | 具有crf活性的稠合的嘧啶衍生物 | |
| CN1694889A (zh) | 用于调节lgE和抑制细胞增殖的苯基-氮杂-苯并咪唑化合物 | |
| CN1842526A (zh) | 苯并二氮杂䓬cgrp受体拮抗剂 | |
| CN1701068A (zh) | 新颖的化合物和它们的用途 | |
| CN1284076A (zh) | 2-芳基-8-氧代二氢嘌呤衍生物及其制备方法、含有该衍生物的药物组合物、及其中间体 | |
| CN1071164A (zh) | 含氮杂环化合物 | |
| CN1033380A (zh) | 化合物 | |
| CN1328560A (zh) | [1,2,4]三唑并[1,5-c]嘧啶衍生物 | |
| CN1839135A (zh) | 三环δ阿片样物质调节剂 | |
| CN1646528A (zh) | 作为有效的α2-肾上腺素受体拮抗剂的多环化合物 | |
| CN1309561A (zh) | 勃起机能障碍治疗剂 | |
| CN1918160A (zh) | 用作趋化因子受体活性调节剂的新颖三环螺环衍生物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C19 | Lapse of patent right due to non-payment of the annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |