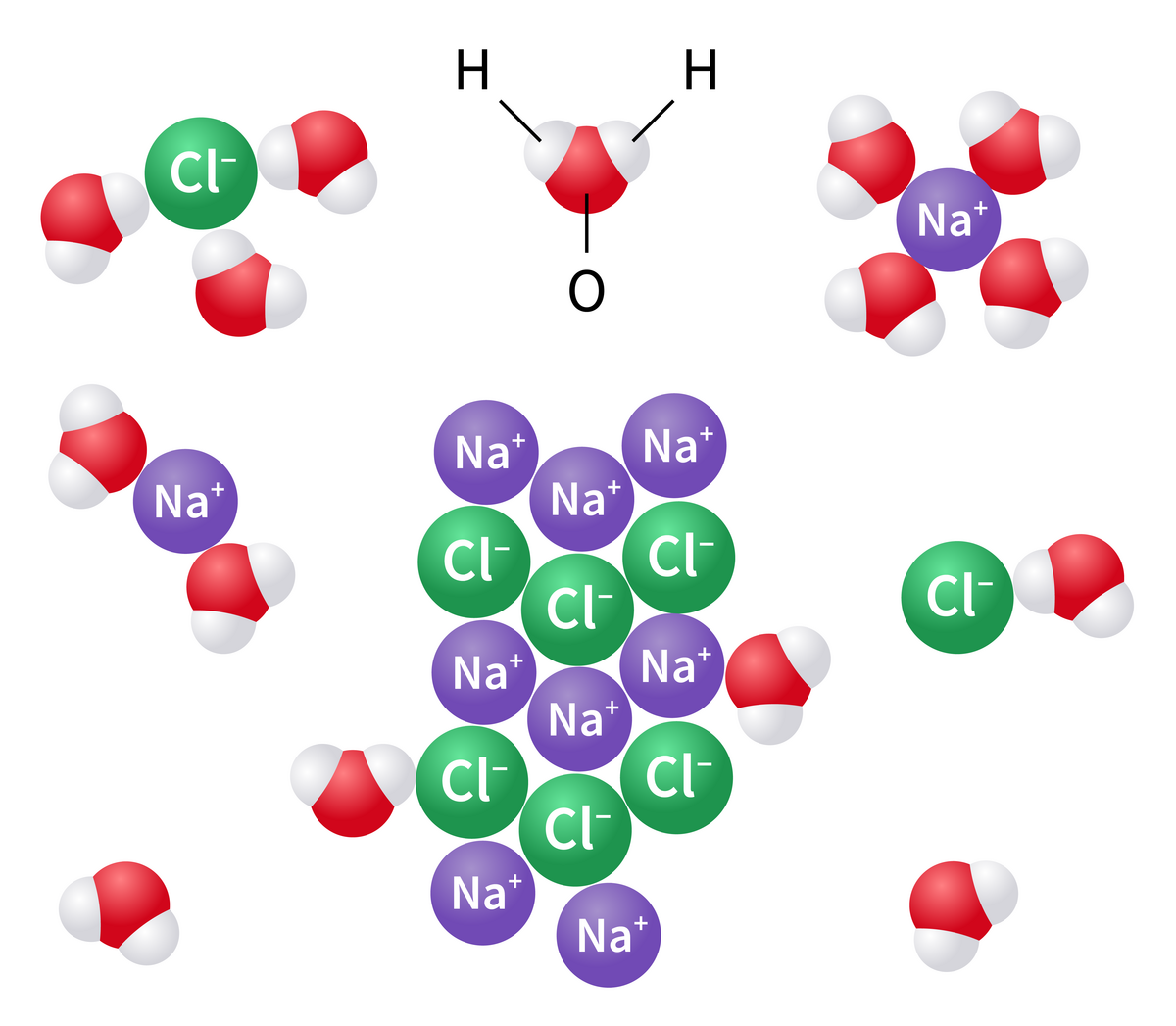
Når et salt løses opp i vann, brytes ionebindingene og ionene frigjøres i løsningen. Det kalles dissosiasjon. Vanlig bordsalt, natriumklorid, danner natriumioner (Na+) og kloridioner (Cl–) når det løses i vann. Na+ er da kationer, mens Cl- er anioner.
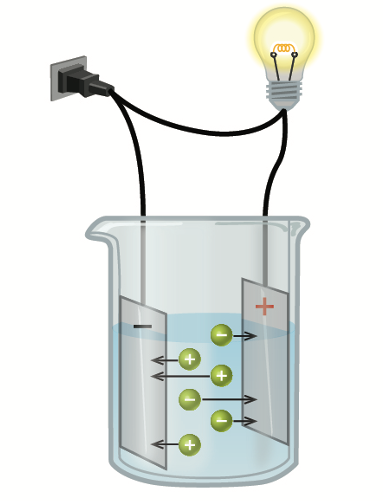
Dersom en slik saltløsning plasseres i et elektrisk felt, som ved elektrolyse, vil de positivt ladete natriumionene (kationene) vandre mot den negative elektroden (katoden), mens de negativt ladde kloridionene (anionene) vil vandre mot den positive elektroden (anoden). Det er denne vandringen som har gitt opphavet til begrepet ion.
En rekke kjemiske forbindelser som syrer, baser og salter, dissosierer til ioner i vann. Natriumklorid dissosierer fullstendig:
\[\ce{NaCl -> Na^{+} + Cl^{-}}\]
Fullstendig dissosiasjon betyr at det i løsningen ikke finnes noe natriumklorid. Alle atomene er løst fra gitterstrukturen.
Sterke syrer, som saltsyre, dissosierer også fullstendig til ionene H:
\[\ce{HCl -> H^{+} + Cl^{-}}\]
Svake syrer, som eddiksyre, dissosierer bare delvis:
\[\ce{CH3COOH -> H^{+} + CH3COO^{-}}\]
CH3COO–-ionet kalles acetat, etter det latinske navnet for eddiksyre, acetum. Delvis dissosiasjon vil si at i løsningen foreligger det både eddiksyre og acetat.
En sterk base, som natriumhydroksid, dissosierer fullstendig:
\[\ce{NaOH -> Na^{+} + OH^{-}}\]
Rent vann (H2O) er meget svakt dissosiert i hydrogenioner (H+) og hydroksylioner (OH–). Konsentrasjonen av \(\ce{H^{+}}\)-ionene er da 10-7 molar, det vil si at pH er 7.



Kommentarer (2)
skrev Jakob Breyholtz
Hei, hvordan blir et ion dannet?
svarte Anne Eilertsen
Hei! Ioner dannes når syrer, baser og salter blir løst opp i vann eller et annet løsemiddel (dissosiasjon). De kan også for eksempel dannes på grunn av ioniserende stråling, som vi har egen artikkel om: https://snl.no/ioniserende_str%C3%A5ling
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.