RU2772214C2 - Функционализированные сахариды в качестве противовоспалительных средств - Google Patents
Функционализированные сахариды в качестве противовоспалительных средств Download PDFInfo
- Publication number
- RU2772214C2 RU2772214C2 RU2019136874A RU2019136874A RU2772214C2 RU 2772214 C2 RU2772214 C2 RU 2772214C2 RU 2019136874 A RU2019136874 A RU 2019136874A RU 2019136874 A RU2019136874 A RU 2019136874A RU 2772214 C2 RU2772214 C2 RU 2772214C2
- Authority
- RU
- Russia
- Prior art keywords
- inflammatory
- group
- compound
- disease
- cytokine
- Prior art date
Links
- 229940121363 anti-inflammatory agent Drugs 0.000 title claims abstract description 10
- 239000002260 anti-inflammatory agent Substances 0.000 title claims abstract description 10
- 150000001720 carbohydrates Chemical class 0.000 title abstract description 19
- 150000001875 compounds Chemical class 0.000 claims abstract description 124
- 102000004127 Cytokines Human genes 0.000 claims abstract description 61
- 108090000695 Cytokines Proteins 0.000 claims abstract description 61
- 230000004054 inflammatory process Effects 0.000 claims abstract description 49
- 206010061218 Inflammation Diseases 0.000 claims abstract description 48
- 230000014509 gene expression Effects 0.000 claims abstract description 32
- 238000000034 method Methods 0.000 claims abstract description 25
- 241000124008 Mammalia Species 0.000 claims abstract description 19
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 19
- 230000007246 mechanism Effects 0.000 claims abstract description 9
- 238000001727 in vivo Methods 0.000 claims abstract description 5
- 230000003110 anti-inflammatory effect Effects 0.000 claims description 107
- -1 oncostatin Proteins 0.000 claims description 30
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 26
- 150000003839 salts Chemical class 0.000 claims description 25
- 201000010099 disease Diseases 0.000 claims description 24
- 102100037850 Interferon gamma Human genes 0.000 claims description 23
- 108010074328 Interferon-gamma Proteins 0.000 claims description 23
- 102000004890 Interleukin-8 Human genes 0.000 claims description 22
- 108090001007 Interleukin-8 Proteins 0.000 claims description 22
- 239000000203 mixture Substances 0.000 claims description 21
- 208000007882 Gastritis Diseases 0.000 claims description 20
- 208000007107 Stomach Ulcer Diseases 0.000 claims description 13
- 208000027866 inflammatory disease Diseases 0.000 claims description 13
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims description 10
- 102000003814 Interleukin-10 Human genes 0.000 claims description 10
- 108090000174 Interleukin-10 Proteins 0.000 claims description 10
- 102000013264 Interleukin-23 Human genes 0.000 claims description 10
- 108010065637 Interleukin-23 Proteins 0.000 claims description 10
- 102000004388 Interleukin-4 Human genes 0.000 claims description 10
- 108090000978 Interleukin-4 Proteins 0.000 claims description 10
- 102000004889 Interleukin-6 Human genes 0.000 claims description 10
- 108090001005 Interleukin-6 Proteins 0.000 claims description 10
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 10
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims description 10
- 230000002401 inhibitory effect Effects 0.000 claims description 10
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 9
- 102000013691 Interleukin-17 Human genes 0.000 claims description 9
- 108050003558 Interleukin-17 Proteins 0.000 claims description 9
- 208000023652 chronic gastritis Diseases 0.000 claims description 8
- 230000028709 inflammatory response Effects 0.000 claims description 8
- 239000002552 dosage form Substances 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 7
- 102100021943 C-C motif chemokine 2 Human genes 0.000 claims description 6
- 101710155857 C-C motif chemokine 2 Proteins 0.000 claims description 6
- 102100032367 C-C motif chemokine 5 Human genes 0.000 claims description 6
- 102100036150 C-X-C motif chemokine 5 Human genes 0.000 claims description 6
- 241000283707 Capra Species 0.000 claims description 6
- 108010055166 Chemokine CCL5 Proteins 0.000 claims description 6
- 108010014419 Chemokine CXCL1 Proteins 0.000 claims description 6
- 102000016950 Chemokine CXCL1 Human genes 0.000 claims description 6
- 102000019034 Chemokines Human genes 0.000 claims description 6
- 108010012236 Chemokines Proteins 0.000 claims description 6
- 101000947186 Homo sapiens C-X-C motif chemokine 5 Proteins 0.000 claims description 6
- 102100026720 Interferon beta Human genes 0.000 claims description 6
- 108090000467 Interferon-beta Proteins 0.000 claims description 6
- 102000003815 Interleukin-11 Human genes 0.000 claims description 6
- 108090000177 Interleukin-11 Proteins 0.000 claims description 6
- 102000013462 Interleukin-12 Human genes 0.000 claims description 6
- 108010065805 Interleukin-12 Proteins 0.000 claims description 6
- 102000000588 Interleukin-2 Human genes 0.000 claims description 6
- 108010002350 Interleukin-2 Proteins 0.000 claims description 6
- 102000000646 Interleukin-3 Human genes 0.000 claims description 6
- 108010002386 Interleukin-3 Proteins 0.000 claims description 6
- 102000000704 Interleukin-7 Human genes 0.000 claims description 6
- 108010002586 Interleukin-7 Proteins 0.000 claims description 6
- 102000000585 Interleukin-9 Human genes 0.000 claims description 6
- 108010002335 Interleukin-9 Proteins 0.000 claims description 6
- 241000283973 Oryctolagus cuniculus Species 0.000 claims description 6
- 201000005917 gastric ulcer Diseases 0.000 claims description 6
- 230000000770 proinflammatory effect Effects 0.000 claims description 6
- 239000000725 suspension Substances 0.000 claims description 6
- 201000000596 systemic lupus erythematosus Diseases 0.000 claims description 6
- 108010047761 Interferon-alpha Proteins 0.000 claims description 5
- 102000006992 Interferon-alpha Human genes 0.000 claims description 5
- 102000003810 Interleukin-18 Human genes 0.000 claims description 5
- 108090000171 Interleukin-18 Proteins 0.000 claims description 5
- 101710151805 Mitochondrial intermediate peptidase 1 Proteins 0.000 claims description 5
- 102000004887 Transforming Growth Factor beta Human genes 0.000 claims description 5
- 108090001012 Transforming Growth Factor beta Proteins 0.000 claims description 5
- 239000002775 capsule Substances 0.000 claims description 5
- 230000001404 mediated effect Effects 0.000 claims description 5
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 claims description 5
- 239000000843 powder Substances 0.000 claims description 5
- 239000003826 tablet Substances 0.000 claims description 5
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 claims description 5
- 208000011231 Crohn disease Diseases 0.000 claims description 4
- 102000004083 Lymphotoxin-alpha Human genes 0.000 claims description 4
- 108090000542 Lymphotoxin-alpha Proteins 0.000 claims description 4
- 208000001647 Renal Insufficiency Diseases 0.000 claims description 4
- 238000011161 development Methods 0.000 claims description 4
- 201000006370 kidney failure Diseases 0.000 claims description 4
- 206010002556 Ankylosing Spondylitis Diseases 0.000 claims description 3
- 208000003017 Aortic Valve Stenosis Diseases 0.000 claims description 3
- 201000001320 Atherosclerosis Diseases 0.000 claims description 3
- 206010007559 Cardiac failure congestive Diseases 0.000 claims description 3
- 206010009900 Colitis ulcerative Diseases 0.000 claims description 3
- 206010010744 Conjunctivitis allergic Diseases 0.000 claims description 3
- 201000004624 Dermatitis Diseases 0.000 claims description 3
- 206010012689 Diabetic retinopathy Diseases 0.000 claims description 3
- 208000001640 Fibromyalgia Diseases 0.000 claims description 3
- 206010016654 Fibrosis Diseases 0.000 claims description 3
- 208000018522 Gastrointestinal disease Diseases 0.000 claims description 3
- 206010018364 Glomerulonephritis Diseases 0.000 claims description 3
- 206010019280 Heart failures Diseases 0.000 claims description 3
- 206010020751 Hypersensitivity Diseases 0.000 claims description 3
- 206010024229 Leprosy Diseases 0.000 claims description 3
- 208000019693 Lung disease Diseases 0.000 claims description 3
- 206010033645 Pancreatitis Diseases 0.000 claims description 3
- 201000004681 Psoriasis Diseases 0.000 claims description 3
- 241000283984 Rodentia Species 0.000 claims description 3
- 206010039710 Scleroderma Diseases 0.000 claims description 3
- 208000021386 Sjogren Syndrome Diseases 0.000 claims description 3
- 208000006011 Stroke Diseases 0.000 claims description 3
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 3
- 201000006704 Ulcerative Colitis Diseases 0.000 claims description 3
- 206010046851 Uveitis Diseases 0.000 claims description 3
- 208000002205 allergic conjunctivitis Diseases 0.000 claims description 3
- 230000007815 allergy Effects 0.000 claims description 3
- 206010002906 aortic stenosis Diseases 0.000 claims description 3
- 206010003246 arthritis Diseases 0.000 claims description 3
- 208000024998 atopic conjunctivitis Diseases 0.000 claims description 3
- 238000002512 chemotherapy Methods 0.000 claims description 3
- 208000016097 disease of metabolism Diseases 0.000 claims description 3
- 230000004761 fibrosis Effects 0.000 claims description 3
- 210000001035 gastrointestinal tract Anatomy 0.000 claims description 3
- 208000002551 irritable bowel syndrome Diseases 0.000 claims description 3
- 208000019423 liver disease Diseases 0.000 claims description 3
- 208000030159 metabolic disease Diseases 0.000 claims description 3
- 201000006417 multiple sclerosis Diseases 0.000 claims description 3
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 3
- 239000006187 pill Substances 0.000 claims description 3
- 238000001959 radiotherapy Methods 0.000 claims description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 3
- 241000283690 Bos taurus Species 0.000 claims description 2
- 241000282836 Camelus dromedarius Species 0.000 claims description 2
- 241000282326 Felis catus Species 0.000 claims description 2
- 241000282849 Ruminantia Species 0.000 claims description 2
- 208000026935 allergic disease Diseases 0.000 claims description 2
- 239000007943 implant Substances 0.000 claims description 2
- 238000007911 parenteral administration Methods 0.000 claims description 2
- 239000000829 suppository Substances 0.000 claims description 2
- 230000000747 cardiac effect Effects 0.000 claims 1
- 208000019553 vascular disease Diseases 0.000 claims 1
- 241001465754 Metazoa Species 0.000 abstract description 31
- 239000003814 drug Substances 0.000 abstract description 19
- 230000000694 effects Effects 0.000 abstract description 14
- 239000000126 substance Substances 0.000 abstract description 6
- 230000004044 response Effects 0.000 abstract description 4
- 230000001629 suppression Effects 0.000 abstract description 3
- 230000005764 inhibitory process Effects 0.000 abstract 2
- 230000002884 effect on inflammation Effects 0.000 abstract 1
- PERZMHJGZKHNGU-JGYWJTCASA-N bambermycin Chemical compound O([C@H]1[C@H](NC(C)=O)[C@@H](O)[C@@H]([C@H](O1)CO[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O[C@@H]1O[C@@H]([C@H]([C@H](O)[C@H]1NC(C)=O)O[C@H]1[C@@H]([C@@H](O)[C@@H](O)[C@H](O1)C(=O)NC=1C(CCC=1O)=O)O)C)[C@H]1[C@@H](OP(O)(=O)OC[C@@H](OC\C=C(/C)CC\C=C\C(C)(C)CCC(=C)C\C=C(/C)CCC=C(C)C)C(O)=O)O[C@H](C(O)=O)[C@@](C)(O)[C@@H]1OC(N)=O PERZMHJGZKHNGU-JGYWJTCASA-N 0.000 description 66
- 229910052739 hydrogen Inorganic materials 0.000 description 62
- 125000000217 alkyl group Chemical group 0.000 description 47
- 125000003118 aryl group Chemical group 0.000 description 44
- 125000001931 aliphatic group Chemical group 0.000 description 42
- 235000019374 flavomycin Nutrition 0.000 description 39
- 125000001072 heteroaryl group Chemical group 0.000 description 35
- 239000004181 Flavomycin Substances 0.000 description 34
- 241001490623 Helicobacter suis Species 0.000 description 28
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 28
- 125000006239 protecting group Chemical group 0.000 description 27
- 108020004414 DNA Proteins 0.000 description 21
- 241000699670 Mus sp. Species 0.000 description 19
- 230000000052 comparative effect Effects 0.000 description 19
- 125000004432 carbon atom Chemical group C* 0.000 description 18
- 210000004027 cell Anatomy 0.000 description 17
- 238000002474 experimental method Methods 0.000 description 17
- 108091034117 Oligonucleotide Proteins 0.000 description 15
- 125000003342 alkenyl group Chemical group 0.000 description 14
- 229910052799 carbon Inorganic materials 0.000 description 14
- 210000001744 T-lymphocyte Anatomy 0.000 description 13
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 13
- 235000005911 diet Nutrition 0.000 description 13
- 230000037213 diet Effects 0.000 description 13
- 208000015181 infectious disease Diseases 0.000 description 13
- 210000002540 macrophage Anatomy 0.000 description 12
- 210000001711 oxyntic cell Anatomy 0.000 description 12
- 230000002441 reversible effect Effects 0.000 description 12
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 11
- WQZGKKKJIJFFOK-SVZMEOIVSA-N (+)-Galactose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-SVZMEOIVSA-N 0.000 description 10
- 238000011529 RT qPCR Methods 0.000 description 10
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 10
- 125000000753 cycloalkyl group Chemical group 0.000 description 10
- 229940079593 drug Drugs 0.000 description 10
- 230000002055 immunohistochemical effect Effects 0.000 description 10
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 10
- 210000002784 stomach Anatomy 0.000 description 10
- 239000002253 acid Substances 0.000 description 9
- 210000003719 b-lymphocyte Anatomy 0.000 description 9
- 125000000304 alkynyl group Chemical group 0.000 description 8
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 7
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 7
- 239000002585 base Substances 0.000 description 7
- 230000002496 gastric effect Effects 0.000 description 7
- 150000002430 hydrocarbons Chemical class 0.000 description 7
- 150000002632 lipids Chemical class 0.000 description 7
- 230000001338 necrotic effect Effects 0.000 description 7
- 108090000623 proteins and genes Proteins 0.000 description 7
- 239000012453 solvate Substances 0.000 description 7
- 239000004480 active ingredient Substances 0.000 description 6
- PYMYPHUHKUWMLA-LMVFSUKVSA-N aldehydo-D-ribose Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 6
- 125000003545 alkoxy group Chemical group 0.000 description 6
- 125000003277 amino group Chemical group 0.000 description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 6
- 230000037456 inflammatory mechanism Effects 0.000 description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 6
- 229910052757 nitrogen Inorganic materials 0.000 description 6
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 230000009467 reduction Effects 0.000 description 6
- 230000009469 supplementation Effects 0.000 description 6
- WQZGKKKJIJFFOK-IVMDWMLBSA-N D-allopyranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@H](O)[C@@H]1O WQZGKKKJIJFFOK-IVMDWMLBSA-N 0.000 description 5
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 5
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 5
- 102100029098 Hypoxanthine-guanine phosphoribosyltransferase Human genes 0.000 description 5
- GZCGUPFRVQAUEE-ZXXMMSQZSA-N aldehydo-D-idose Chemical compound OC[C@@H](O)[C@H](O)[C@@H](O)[C@H](O)C=O GZCGUPFRVQAUEE-ZXXMMSQZSA-N 0.000 description 5
- GZCGUPFRVQAUEE-KAZBKCHUSA-N aldehydo-D-talose Chemical compound OC[C@@H](O)[C@H](O)[C@H](O)[C@H](O)C=O GZCGUPFRVQAUEE-KAZBKCHUSA-N 0.000 description 5
- 229950007118 bambermycin Drugs 0.000 description 5
- 239000012634 fragment Substances 0.000 description 5
- 108020004999 messenger RNA Proteins 0.000 description 5
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 5
- 238000010186 staining Methods 0.000 description 5
- 235000000891 standard diet Nutrition 0.000 description 5
- 125000001424 substituent group Chemical group 0.000 description 5
- 229910052717 sulfur Inorganic materials 0.000 description 5
- 206010002091 Anaesthesia Diseases 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- WQZGKKKJIJFFOK-RSVSWTKNSA-N D-altro-hexose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O WQZGKKKJIJFFOK-RSVSWTKNSA-N 0.000 description 4
- ZAQJHHRNXZUBTE-UHFFFAOYSA-N D-threo-2-Pentulose Natural products OCC(O)C(O)C(=O)CO ZAQJHHRNXZUBTE-UHFFFAOYSA-N 0.000 description 4
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 4
- SHZGCJCMOBCMKK-PQMKYFCFSA-N L-Fucose Natural products C[C@H]1O[C@H](O)[C@@H](O)[C@@H](O)[C@@H]1O SHZGCJCMOBCMKK-PQMKYFCFSA-N 0.000 description 4
- ZAQJHHRNXZUBTE-UCORVYFPSA-N L-ribulose Chemical compound OC[C@H](O)[C@H](O)C(=O)CO ZAQJHHRNXZUBTE-UCORVYFPSA-N 0.000 description 4
- 150000001299 aldehydes Chemical class 0.000 description 4
- 230000037005 anaesthesia Effects 0.000 description 4
- 239000000427 antigen Substances 0.000 description 4
- 108091007433 antigens Proteins 0.000 description 4
- 102000036639 antigens Human genes 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 150000004820 halides Chemical class 0.000 description 4
- 210000000987 immune system Anatomy 0.000 description 4
- 238000011532 immunohistochemical staining Methods 0.000 description 4
- 230000009545 invasion Effects 0.000 description 4
- 229960002725 isoflurane Drugs 0.000 description 4
- 150000002576 ketones Chemical class 0.000 description 4
- 230000007774 longterm Effects 0.000 description 4
- 230000007170 pathology Effects 0.000 description 4
- 238000011002 quantification Methods 0.000 description 4
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 3
- YTBSYETUWUMLBZ-UHFFFAOYSA-N D-Erythrose Natural products OCC(O)C(O)C=O YTBSYETUWUMLBZ-UHFFFAOYSA-N 0.000 description 3
- RFSUNEUAIZKAJO-VRPWFDPXSA-N D-Fructose Natural products OC[C@H]1OC(O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-VRPWFDPXSA-N 0.000 description 3
- WQZGKKKJIJFFOK-CBPJZXOFSA-N D-Gulose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@H](O)[C@H]1O WQZGKKKJIJFFOK-CBPJZXOFSA-N 0.000 description 3
- YTBSYETUWUMLBZ-IUYQGCFVSA-N D-erythrose Chemical compound OC[C@@H](O)[C@@H](O)C=O YTBSYETUWUMLBZ-IUYQGCFVSA-N 0.000 description 3
- UQPHVQVXLPRNCX-GSVOUGTGSA-N D-erythrulose Chemical compound OC[C@@H](O)C(=O)CO UQPHVQVXLPRNCX-GSVOUGTGSA-N 0.000 description 3
- SHZGCJCMOBCMKK-SVZMEOIVSA-N D-fucopyranose Chemical compound C[C@H]1OC(O)[C@H](O)[C@@H](O)[C@H]1O SHZGCJCMOBCMKK-SVZMEOIVSA-N 0.000 description 3
- 125000002353 D-glucosyl group Chemical group C1([C@H](O)[C@@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 3
- BJHIKXHVCXFQLS-PUFIMZNGSA-N D-psicose Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)C(=O)CO BJHIKXHVCXFQLS-PUFIMZNGSA-N 0.000 description 3
- LKDRXBCSQODPBY-IANNHFEVSA-N D-sorbose Chemical compound OCC1(O)OC[C@@H](O)[C@H](O)[C@H]1O LKDRXBCSQODPBY-IANNHFEVSA-N 0.000 description 3
- YTBSYETUWUMLBZ-QWWZWVQMSA-N D-threose Chemical compound OC[C@@H](O)[C@H](O)C=O YTBSYETUWUMLBZ-QWWZWVQMSA-N 0.000 description 3
- ZAQJHHRNXZUBTE-WUJLRWPWSA-N D-xylulose Chemical compound OC[C@@H](O)[C@H](O)C(=O)CO ZAQJHHRNXZUBTE-WUJLRWPWSA-N 0.000 description 3
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 3
- 101150059913 H2az1 gene Proteins 0.000 description 3
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 3
- SRBFZHDQGSBBOR-OWMBCFKOSA-N L-ribopyranose Chemical compound O[C@H]1COC(O)[C@@H](O)[C@H]1O SRBFZHDQGSBBOR-OWMBCFKOSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- BQDKZHDWNDUYAG-UHFFFAOYSA-N N-nitramidooxynitramide Chemical compound [O-][N+](=O)NON[N+]([O-])=O BQDKZHDWNDUYAG-UHFFFAOYSA-N 0.000 description 3
- 101150056612 PPIA gene Proteins 0.000 description 3
- 238000010240 RT-PCR analysis Methods 0.000 description 3
- 208000025865 Ulcer Diseases 0.000 description 3
- SRBFZHDQGSBBOR-STGXQOJASA-N alpha-D-lyxopyranose Chemical compound O[C@@H]1CO[C@H](O)[C@@H](O)[C@H]1O SRBFZHDQGSBBOR-STGXQOJASA-N 0.000 description 3
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 208000020832 chronic kidney disease Diseases 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 125000000392 cycloalkenyl group Chemical group 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 229910052736 halogen Inorganic materials 0.000 description 3
- 150000002367 halogens Chemical class 0.000 description 3
- 125000004404 heteroalkyl group Chemical group 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 3
- 230000008595 infiltration Effects 0.000 description 3
- 238000001764 infiltration Methods 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 3
- 230000000813 microbial effect Effects 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 229940126409 proton pump inhibitor Drugs 0.000 description 3
- 239000000612 proton pump inhibitor Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 231100000397 ulcer Toxicity 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- AQQSXKSWTNWXKR-UHFFFAOYSA-N 2-(2-phenylphenanthro[9,10-d]imidazol-3-yl)acetic acid Chemical compound C1(=CC=CC=C1)C1=NC2=C(N1CC(=O)O)C1=CC=CC=C1C=1C=CC=CC=12 AQQSXKSWTNWXKR-UHFFFAOYSA-N 0.000 description 2
- 108091006112 ATPases Proteins 0.000 description 2
- 102000057290 Adenosine Triphosphatases Human genes 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 108020000946 Bacterial DNA Proteins 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- 102000003952 Caspase 3 Human genes 0.000 description 2
- 108090000397 Caspase 3 Proteins 0.000 description 2
- LKDRXBCSQODPBY-OEXCPVAWSA-N D-tagatose Chemical compound OCC1(O)OC[C@@H](O)[C@H](O)[C@@H]1O LKDRXBCSQODPBY-OEXCPVAWSA-N 0.000 description 2
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 241000589989 Helicobacter Species 0.000 description 2
- 206010019375 Helicobacter infections Diseases 0.000 description 2
- 241000590002 Helicobacter pylori Species 0.000 description 2
- 102100023919 Histone H2A.Z Human genes 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000905054 Homo sapiens Histone H2A.Z Proteins 0.000 description 2
- 101001067833 Homo sapiens Peptidyl-prolyl cis-trans isomerase A Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 102100034539 Peptidyl-prolyl cis-trans isomerase A Human genes 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- GPKUGWDQUVWHIC-UHFFFAOYSA-N [4-(4-hydrazinylphenyl)phenyl]hydrazine tetrahydrochloride Chemical compound Cl.Cl.Cl.Cl.NNC1=CC=C(C=C1)C1=CC=C(NN)C=C1 GPKUGWDQUVWHIC-UHFFFAOYSA-N 0.000 description 2
- LXKFVPKKRVKNIJ-MCDZGGTQSA-N [K].C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O Chemical compound [K].C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O LXKFVPKKRVKNIJ-MCDZGGTQSA-N 0.000 description 2
- 125000002015 acyclic group Chemical group 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 229940124599 anti-inflammatory drug Drugs 0.000 description 2
- 230000001640 apoptogenic effect Effects 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- GZUXJHMPEANEGY-UHFFFAOYSA-N bromomethane Chemical compound BrC GZUXJHMPEANEGY-UHFFFAOYSA-N 0.000 description 2
- 125000002843 carboxylic acid group Chemical group 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 208000037976 chronic inflammation Diseases 0.000 description 2
- 230000006020 chronic inflammation Effects 0.000 description 2
- 125000006165 cyclic alkyl group Chemical group 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 230000002526 effect on cardiovascular system Effects 0.000 description 2
- 230000008029 eradication Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 150000002892 organic cations Chemical class 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000011574 phosphorus Chemical group 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 229930195734 saturated hydrocarbon Natural products 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 239000011593 sulfur Chemical group 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- CFXAVQUXSYFPDE-ZDVKUAOASA-N (2r,3r,4s,5s,6r)-2-[(2s,3s,4r,5r)-4-hydroxy-2,5-bis(hydroxymethyl)-2-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxolan-3-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol;hydrate Chemical compound O.O([C@@]1(O[C@@H]([C@H]([C@@H]1O[C@@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O)CO)CO)[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O CFXAVQUXSYFPDE-ZDVKUAOASA-N 0.000 description 1
- 125000006727 (C1-C6) alkenyl group Chemical group 0.000 description 1
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 1
- FTNJQNQLEGKTGD-UHFFFAOYSA-N 1,3-benzodioxole Chemical compound C1=CC=C2OCOC2=C1 FTNJQNQLEGKTGD-UHFFFAOYSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- ALKYHXVLJMQRLQ-UHFFFAOYSA-M 3-carboxynaphthalen-2-olate Chemical compound C1=CC=C2C=C(C([O-])=O)C(O)=CC2=C1 ALKYHXVLJMQRLQ-UHFFFAOYSA-M 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 108091093088 Amplicon Proteins 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 238000011725 BALB/c mouse Methods 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 208000027932 Collagen disease Diseases 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- SRBFZHDQGSBBOR-SOOFDHNKSA-N D-ribopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@@H]1O SRBFZHDQGSBBOR-SOOFDHNKSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 206010054272 Helicobacter gastritis Diseases 0.000 description 1
- 241000069681 Helicobacter suis HS5 Species 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- LKDRXBCSQODPBY-AMVSKUEXSA-N L-(-)-Sorbose Chemical compound OCC1(O)OC[C@H](O)[C@@H](O)[C@@H]1O LKDRXBCSQODPBY-AMVSKUEXSA-N 0.000 description 1
- YTBSYETUWUMLBZ-DMTCNVIQSA-N L-erythrose Chemical compound OC[C@H](O)[C@H](O)C=O YTBSYETUWUMLBZ-DMTCNVIQSA-N 0.000 description 1
- UQPHVQVXLPRNCX-VKHMYHEASA-N L-erythrulose Chemical compound OC[C@H](O)C(=O)CO UQPHVQVXLPRNCX-VKHMYHEASA-N 0.000 description 1
- LKDRXBCSQODPBY-NSHGFSBMSA-N L-fructose Chemical compound OCC1(O)OC[C@H](O)[C@H](O)[C@H]1O LKDRXBCSQODPBY-NSHGFSBMSA-N 0.000 description 1
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 1
- WQZGKKKJIJFFOK-DHVFOXMCSA-N L-galactose Chemical compound OC[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O WQZGKKKJIJFFOK-DHVFOXMCSA-N 0.000 description 1
- WQZGKKKJIJFFOK-ZZWDRFIYSA-N L-glucose Chemical compound OC[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@H]1O WQZGKKKJIJFFOK-ZZWDRFIYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QRXFDPRISA-N L-gulose Chemical compound OC[C@@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QRXFDPRISA-N 0.000 description 1
- WQZGKKKJIJFFOK-ZNVMLXAYSA-N L-idopyranose Chemical compound OC[C@@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-ZNVMLXAYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-JFNONXLTSA-N L-mannopyranose Chemical compound OC[C@@H]1OC(O)[C@H](O)[C@H](O)[C@H]1O WQZGKKKJIJFFOK-JFNONXLTSA-N 0.000 description 1
- BJHIKXHVCXFQLS-ZXEDONINSA-N L-psicose Chemical compound OC[C@H](O)[C@H](O)[C@H](O)C(=O)CO BJHIKXHVCXFQLS-ZXEDONINSA-N 0.000 description 1
- YTBSYETUWUMLBZ-IMJSIDKUSA-N L-threose Chemical compound OC[C@H](O)[C@@H](O)C=O YTBSYETUWUMLBZ-IMJSIDKUSA-N 0.000 description 1
- ZAQJHHRNXZUBTE-WVZVXSGGSA-N L-xylulose Chemical compound OC[C@H](O)[C@@H](O)C(=O)CO ZAQJHHRNXZUBTE-WVZVXSGGSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 101100117488 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) mip-1 gene Proteins 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 206010029719 Nonspecific reaction Diseases 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000008469 Peptic Ulcer Diseases 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 238000011530 RNeasy Mini Kit Methods 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 241001646618 Streptomyces ederensis Species 0.000 description 1
- 241000971019 Streptomyces geysiriensis Species 0.000 description 1
- 241000946809 Streptomyces prasinus Species 0.000 description 1
- 241000948169 Streptomyces viridosporus Species 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 239000008049 TAE buffer Substances 0.000 description 1
- 229920002253 Tannate Polymers 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 1
- HGEVZDLYZYVYHD-UHFFFAOYSA-N acetic acid;2-amino-2-(hydroxymethyl)propane-1,3-diol;2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetic acid Chemical compound CC(O)=O.OCC(N)(CO)CO.OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O HGEVZDLYZYVYHD-UHFFFAOYSA-N 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229920002877 acrylic styrene acrylonitrile Polymers 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000038016 acute inflammation Diseases 0.000 description 1
- 230000006022 acute inflammation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- PYMYPHUHKUWMLA-VPENINKCSA-N aldehydo-D-xylose Chemical compound OC[C@@H](O)[C@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-VPENINKCSA-N 0.000 description 1
- GZCGUPFRVQAUEE-MOJAZDJTSA-N aldehydo-L-allose Chemical compound OC[C@H](O)[C@H](O)[C@H](O)[C@H](O)C=O GZCGUPFRVQAUEE-MOJAZDJTSA-N 0.000 description 1
- GZCGUPFRVQAUEE-AZGQCCRYSA-N aldehydo-L-altrose Chemical compound OC[C@H](O)[C@H](O)[C@H](O)[C@@H](O)C=O GZCGUPFRVQAUEE-AZGQCCRYSA-N 0.000 description 1
- PYMYPHUHKUWMLA-YUPRTTJUSA-N aldehydo-L-lyxose Chemical compound OC[C@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-YUPRTTJUSA-N 0.000 description 1
- PNNNRSAQSRJVSB-BXKVDMCESA-N aldehydo-L-rhamnose Chemical compound C[C@H](O)[C@H](O)[C@@H](O)[C@@H](O)C=O PNNNRSAQSRJVSB-BXKVDMCESA-N 0.000 description 1
- PYMYPHUHKUWMLA-MROZADKFSA-N aldehydo-L-ribose Chemical compound OC[C@H](O)[C@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-MROZADKFSA-N 0.000 description 1
- GZCGUPFRVQAUEE-OMMKOOBNSA-N aldehydo-L-talose Chemical compound OC[C@H](O)[C@@H](O)[C@@H](O)[C@@H](O)C=O GZCGUPFRVQAUEE-OMMKOOBNSA-N 0.000 description 1
- PYMYPHUHKUWMLA-WISUUJSJSA-N aldehydo-L-xylose Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WISUUJSJSA-N 0.000 description 1
- 229930195726 aldehydo-L-xylose Natural products 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 239000003674 animal food additive Substances 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000004596 appetite loss Effects 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 238000010805 cDNA synthesis kit Methods 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 239000013043 chemical agent Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000022831 chronic renal failure syndrome Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 235000020940 control diet Nutrition 0.000 description 1
- 150000004696 coordination complex Chemical class 0.000 description 1
- 125000002592 cumenyl group Chemical group C1(=C(C=CC=C1)*)C(C)C 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- GZCGUPFRVQAUEE-ARQDHWQXSA-N d-altrose Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)[C@H](O)C=O GZCGUPFRVQAUEE-ARQDHWQXSA-N 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 208000010643 digestive system disease Diseases 0.000 description 1
- 239000001177 diphosphate Substances 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 1
- 235000011180 diphosphates Nutrition 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 229950005627 embonate Drugs 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002327 eosinophilic effect Effects 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 208000018685 gastrointestinal system disease Diseases 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 244000144993 groups of animals Species 0.000 description 1
- 229940037467 helicobacter pylori Drugs 0.000 description 1
- 125000005549 heteroarylene group Chemical group 0.000 description 1
- 125000004366 heterocycloalkenyl group Chemical group 0.000 description 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 1
- XGIHQYAWBCFNPY-AZOCGYLKSA-N hydrabamine Chemical compound C([C@@H]12)CC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC[C@@]1(C)CNCCNC[C@@]1(C)[C@@H]2CCC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC1 XGIHQYAWBCFNPY-AZOCGYLKSA-N 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000012678 infectious agent Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- BJHIKXHVCXFQLS-PQLUHFTBSA-N keto-D-tagatose Chemical compound OC[C@@H](O)[C@H](O)[C@H](O)C(=O)CO BJHIKXHVCXFQLS-PQLUHFTBSA-N 0.000 description 1
- BJHIKXHVCXFQLS-LFRDXLMFSA-N keto-L-tagatose Chemical compound OC[C@H](O)[C@@H](O)[C@@H](O)C(=O)CO BJHIKXHVCXFQLS-LFRDXLMFSA-N 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229940099584 lactobionate Drugs 0.000 description 1
- JYTUSYBCFIZPBE-AMTLMPIISA-N lactobionic acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O JYTUSYBCFIZPBE-AMTLMPIISA-N 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 235000021266 loss of appetite Nutrition 0.000 description 1
- 208000019017 loss of appetite Diseases 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229940102396 methyl bromide Drugs 0.000 description 1
- LRMHVVPPGGOAJQ-UHFFFAOYSA-N methyl nitrate Chemical compound CO[N+]([O-])=O LRMHVVPPGGOAJQ-UHFFFAOYSA-N 0.000 description 1
- JZMJDSHXVKJFKW-UHFFFAOYSA-M methyl sulfate(1-) Chemical compound COS([O-])(=O)=O JZMJDSHXVKJFKW-UHFFFAOYSA-M 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229950006327 napsilate Drugs 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 230000000242 pagocytic effect Effects 0.000 description 1
- 210000001819 pancreatic juice Anatomy 0.000 description 1
- 229940014662 pantothenate Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 231100000915 pathological change Toxicity 0.000 description 1
- 230000036285 pathological change Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 235000019371 penicillin G benzathine Nutrition 0.000 description 1
- 208000011906 peptic ulcer disease Diseases 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- LYKMMUBOEFYJQG-UHFFFAOYSA-N piperoxan Chemical compound C1OC2=CC=CC=C2OC1CN1CCCCC1 LYKMMUBOEFYJQG-UHFFFAOYSA-N 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 239000006041 probiotic Substances 0.000 description 1
- 230000000529 probiotic effect Effects 0.000 description 1
- 235000018291 probiotics Nutrition 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 201000000306 sarcoidosis Diseases 0.000 description 1
- 230000037390 scarring Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 229910052710 silicon Chemical group 0.000 description 1
- 239000010703 silicon Chemical group 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 239000004575 stone Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- 235000011178 triphosphate Nutrition 0.000 description 1
- UNXRWKVEANCORM-UHFFFAOYSA-N triphosphoric acid Chemical compound OP(O)(=O)OP(O)(=O)OP(O)(O)=O UNXRWKVEANCORM-UHFFFAOYSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- PIEPQKCYPFFYMG-UHFFFAOYSA-N tris acetate Chemical compound CC(O)=O.OCC(N)(CO)CO PIEPQKCYPFFYMG-UHFFFAOYSA-N 0.000 description 1
- 150000004043 trisaccharides Chemical class 0.000 description 1
- 101150004326 ureA gene Proteins 0.000 description 1
- 101150030895 ureAB gene Proteins 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 125000005023 xylyl group Chemical group 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Abstract
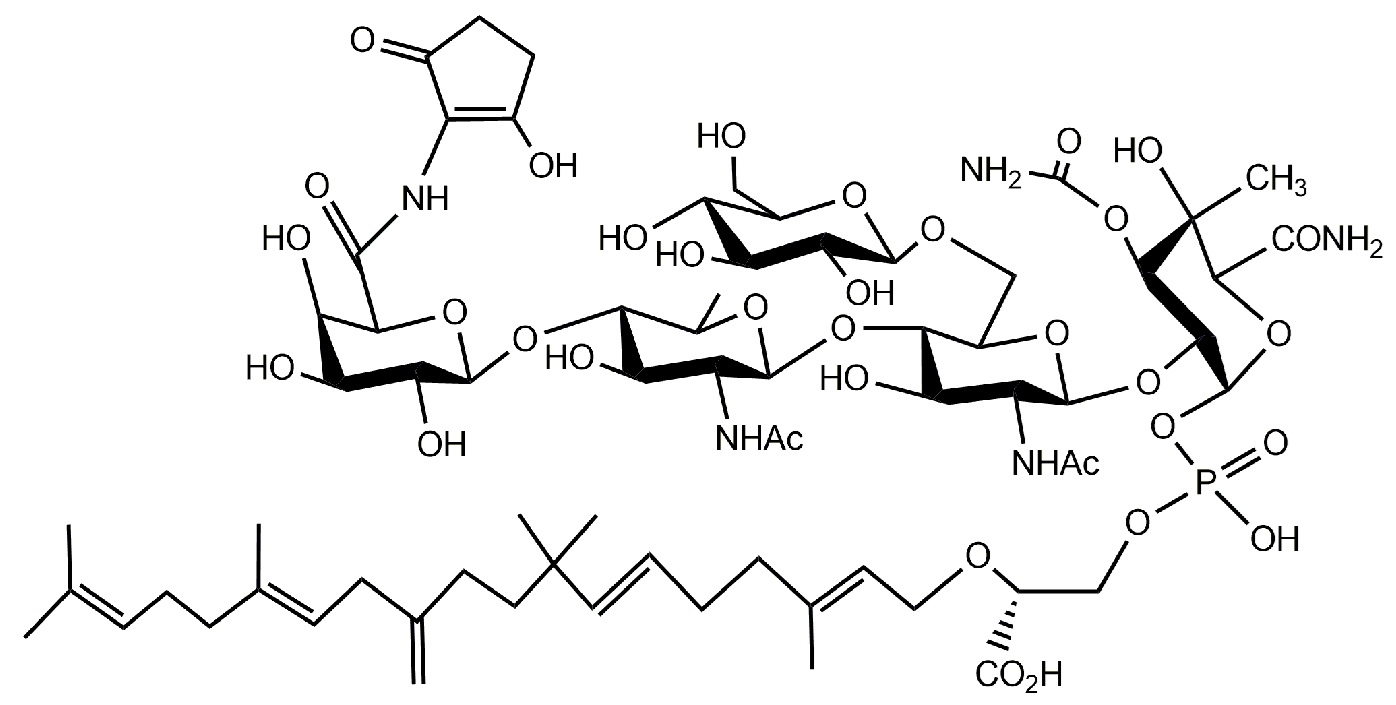
Группа изобретений относится к области фармакологии и медицины и предназначена для воздействия на механизмы воспаления у млекопитающих. В частности, описано применение соединения формулы (Ib), а также фармацевтической композиции на основе этого соединения в качестве противовоспалительного средства, которое воздействует на механизмы воспаления у животных. Кроме того, группа изобретений относится к способу (in vivo) подавления или торможения ответных воспалительных реакций путем применения соединения (Ib) и к способу подавления или торможения экспрессии по меньшей мере одного цитокина путем введения соединения (Ib). Настоящее изобретение относится к соединениям функционализированных сахаридов, применяемых в качестве противовоспалительных средств, которые оказывают воздействие на механизмы воспаления у млекопитающих. Технический результат: обеспечение эффективного воздействия на механизмы воспаления у млекопитающих. 4 н. и 7 з.п. ф-лы, 8 табл., 6 пр.
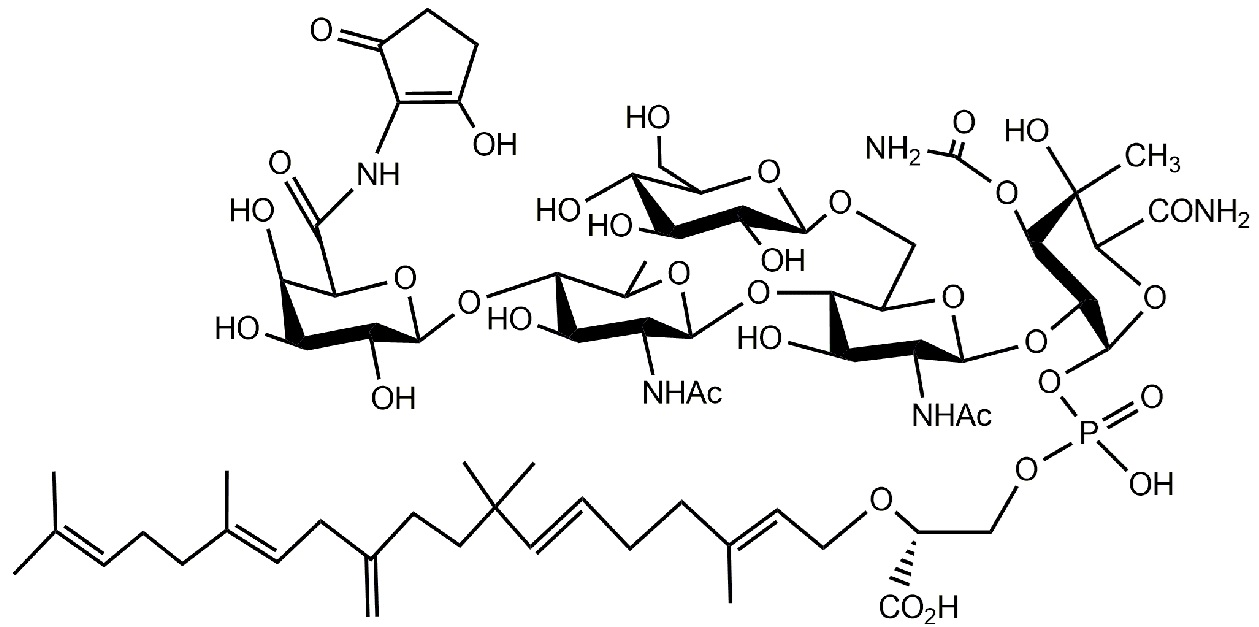
Формула (Ib)
Description
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к соединениям функционализированных сахаридов, применяемых в качестве противовоспалительных средств, которые оказывают воздействие на механизмы воспаления у млекопитающих.
УРОВЕНЬ ТЕХНИКИ
Воспаление представляет собой сложную ответную биологическую реакцию иммунной системы, направленную на защиту организма от вредных для здоровья веществ, от повреждения и разрушения тканей. Ответная воспалительная реакция может быть инициирована физическими, химическими и инфекционными средствами, такими как бактерии, вирусы и другие патогенные микроорганизмы. Цель появления воспаления заключается в устранении первопричины повреждения, в очистке поврежденных клеток и тканей и в инициировании восстановления тканей.
Воспаление может быть острым или хроническим. Острое воспаление относится к начальной ответной реакции иммунной системы организма на вредные раздражающие воздействия. Хроническое воспаление представляет собой форму длительного воспаления, которое приводит к рекрутменту макрофагов и Т-лимфоцитов. Макрофаги представляют собой крупные фагоцитарные лейкоциты, и вместе с Т-лимфоцитами, которые, как известно, продуцируют цитокины и ферменты, они вызывают более длительное повреждение клеток. Несмотря на то, что для организма необходимо иметь должным образом функционирующую иммунную систему, тем не менее, важно контролировать эти воспалительные механизмы, так как хроническое воспаление может приводить к различным патологиям и даже к раку.
Вместе с тем, термин "воспаление" не является синонимом термина "инфекция". Инфекция относится всего лишь к взаимодействию инвазии микроорганизма с ответной воспалительной реакцией организма на эту инвазию. С другой стороны, воспаление описывает воспалительный механизм, возникающий независимо от возбудителя. Несмотря на это, в медицине воспаление или органоспецифическое воспаление часто называют инфекцией, поскольку микробная инвазия обычно наблюдается во взаимосвязи с воспалением. Тем не менее, важно проводить различие между ними, поскольку многие патологические состояния включают воспалительные процессы, которые не обусловлены микробной или вирусной инвазией, и наоборот, не все микробные или вирусные инфекции приводят к воспалению.
Смешение понятий инфекции и воспаления особенно характерно в случаях гастрита или наличия воспаления в желудке. Многие врачи считают хронический гастрит эквивалентным инфекции Helicobacter pylori (H. pylori). Однако известно, что существует множество других причин этого заболевания. Кроме того, желудочная патология также сохраняться даже после успешной эрадикации H. Pylori. В публикации Genta et al., American Journal of Gastroenterology, совсем недавно было сообщено, что примерно у 20% пациентов, у которых был взят гастробиоптат, был поставлен диагноз не связанного с инфекцией Helicobacter pylori гастрита. Учитывая его распространенность, в публикации Borkman et al., New England Journal Of Medicine было предложено рассматривать не связанный с инфекцией Helicobacter pylori гастрит как отдельную нозологическую форму. Известные причины воспаления желудка при отсутствии бактериальной инфекции, в частности, инфекции H. pylori, включают:
(i) вирусную инфекцию (цитомегаловирус, простой герпес);
(ii) химическое или реактивное воспаление, вызванное рефлюксом желчи и панкреатического сока в желудок или экзогенными веществами, такими как NSAID (нестероидные противовоспалительные препараты), ASA (ацетилсалициловая кислота), алкоголь или химиотерапевтические препараты;
(iii) аутоиммунное воспаление, характеризующееся наличием антител против париетальных клеток;
(iv) лучевое и эозинофильное воспаление;
(v) воспаление в процессе коллагеноза;
(vi) воспаление при болезни Крона;
(vii) воспаление при саркоидозе;
(viii) вызванное стрессом воспаление;
(ix) желудочные виды бактерий у людей, не относящиеся к H. Pylori Helicobacter (NHPH), из которых H. Suis являются наиболее распространенными. Они связаны с хроническим гастритом, язвой желудка и другими патологическими изменениями желудка, как у животных, так и у людей (G. Zhang et al., Vet Res (2016) 47: 101, с. 1 1. 1 -3);
(x) идиопатические: все случаи гастрита, при которых не удается выявить причины заболевания.
Помимо проблемы не связанного с бактериями Helicobacter гастрита, при лечении людей и сельскохозяйственных животных остается проблемой рецидив язвы желудка, даже после успешной эрадикации бактерий Helicobacter. Например, в случае свиней, несмотря на то, что у подвергнутых лечению животных может происходить рубцевания язвы, тем не менее, рецидив язвенной болезни у них является распространенной проблемой. Рецидив язвенной болезни вызывает у животного дискомфорт и потерю аппетита, что приводит к потере веса и к негативным экономическим последствиям. Но и при лечении людей, рецидив язвы желудка представляет собой серьезную угрозу для здоровья. В настоящее время, страдающие хроническим гастритом и/или язвенной болезнью желудка пациенты вынуждены длительно применять ингибиторы протонной помпы (PPI) для блокирования образования кислоты в желудке. Известно, что указанное длительное применение ингибиторов протонной помпы сопровождается многими побочными эффектами и повышает риск развития хронического заболевания почек, почечной недостаточности и повышенного риска сердечно-сосудистых осложнений.
В качестве варианта, вместо блокирования продукции кислоты в желудке, язву желудка и гастрит лечат путем целенаправленного воздействия на бактерии Helicobacter pylori.
Кроме того, для облегчения состояния воспаления желудка противопоказано применение нестероидных противовоспалительных препаратов (NSAID), поскольку известно, что эти препараты являются фактором риска возникновении патологии желудка.
На основании вышеизложенного, можно сделать вывод о том, что существует потребность в противовоспалительных средствах, в результате применения которых могут быть преодолены недостатки современных методов противовоспалительного лечения, такие как большое количество побочных эффектов, а именно повышенный риск возникновения хронического заболевания почек, почечной недостаточности, повышенный риск возникновения сердечно-сосудистых осложнений и другие подобные негативные побочные эффекты, ограниченная область применения, несоблюдение пациентом инструкций по приему препарата, и в результате применения которых могут быть преодолены проблемы рецидивов язвы, в частности, рецидивов язвы желудка.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
К удивлению заявителя настоящего изобретения, оказалось, что можно создать противовоспалительные лекарственные средства, которые бы удовлетворяли упомянутым выше требованиям.
Целью настоящего изобретения является создание альтернативного противовоспалительного средства вместо нестероидных противовоспалительных средств (NSAID) для устранения воспаления в желудке млекопитающих, страдающих от гастрита, язвы желудка, или млекопитающих с риском развития этих заболеваний.
Целью настоящего изобретения является создание альтернативы длительному применению ингибиторов протонной помпы (PPI) у субъектов, страдающих от язвенной болезни желудка и хронического гастрита.
Целью настоящего изобретения является создание противовоспалительного средства, которое может воздействовать на механизмы воспаления, лежащие в основе язвенной болезни желудка и гастрита у млекопитающих.
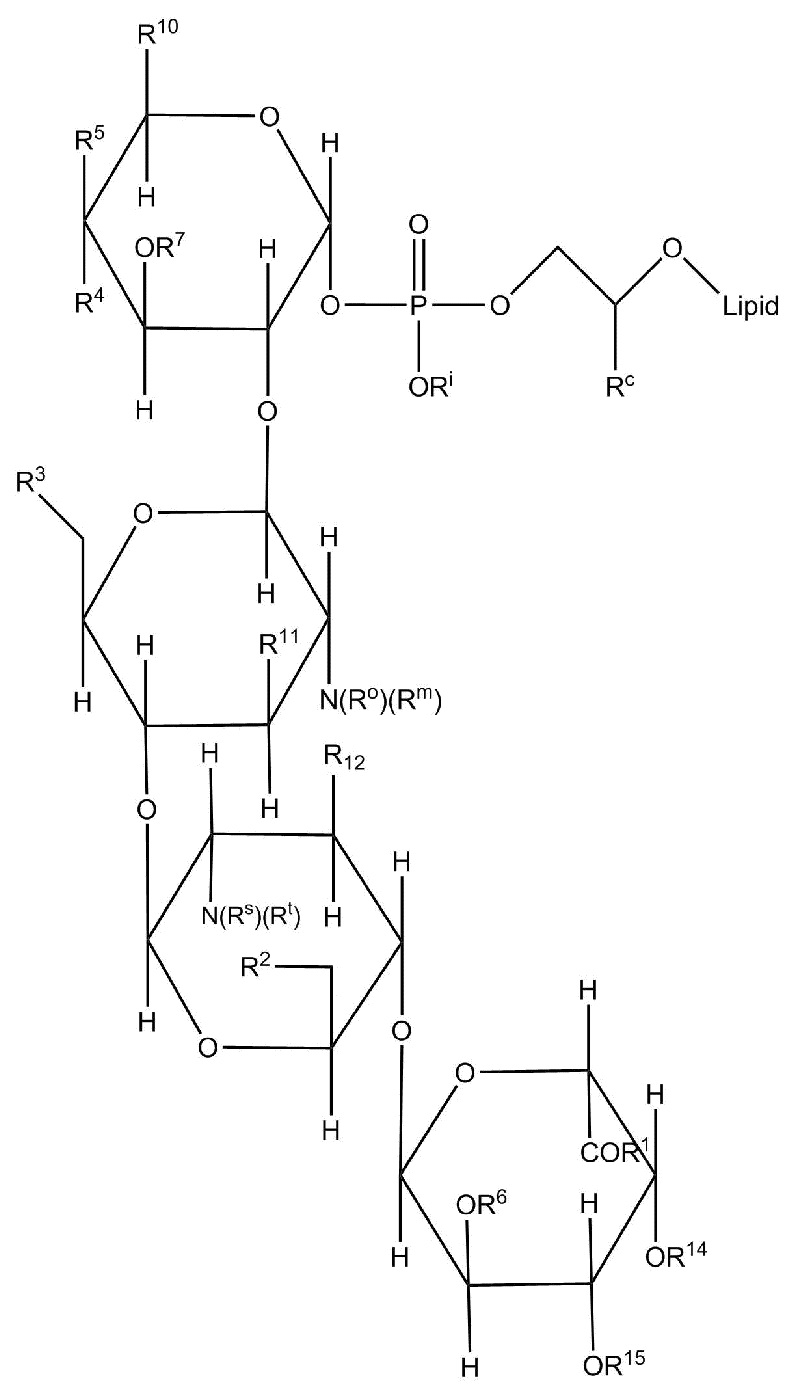
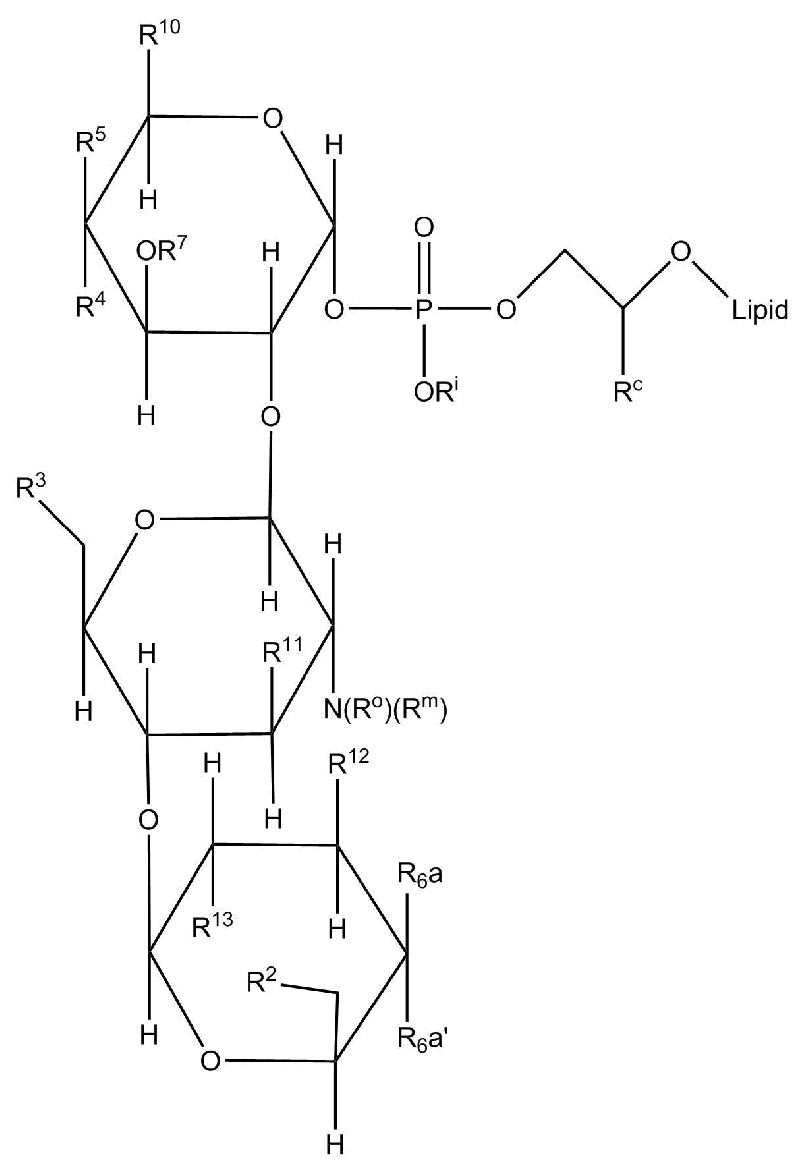
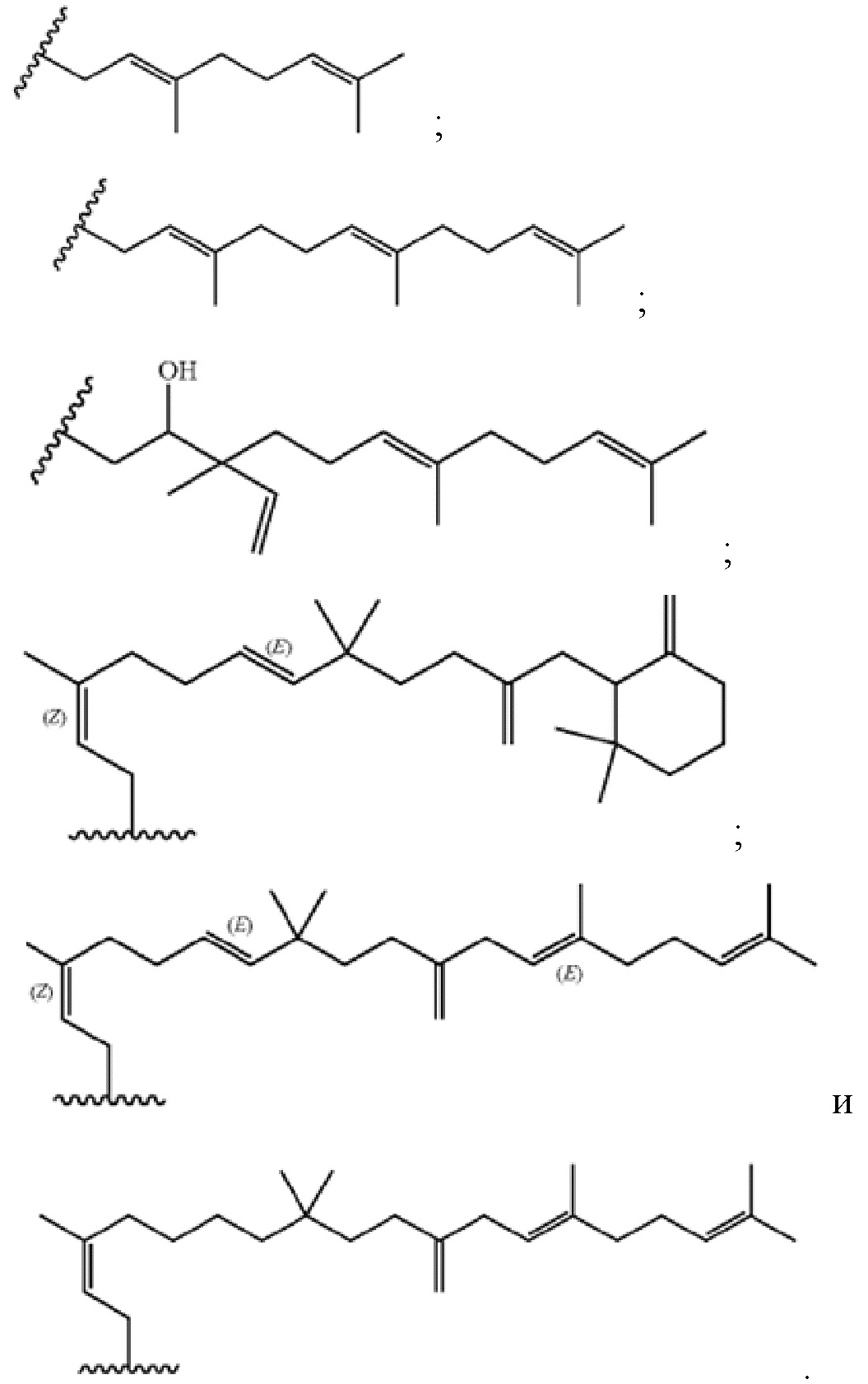
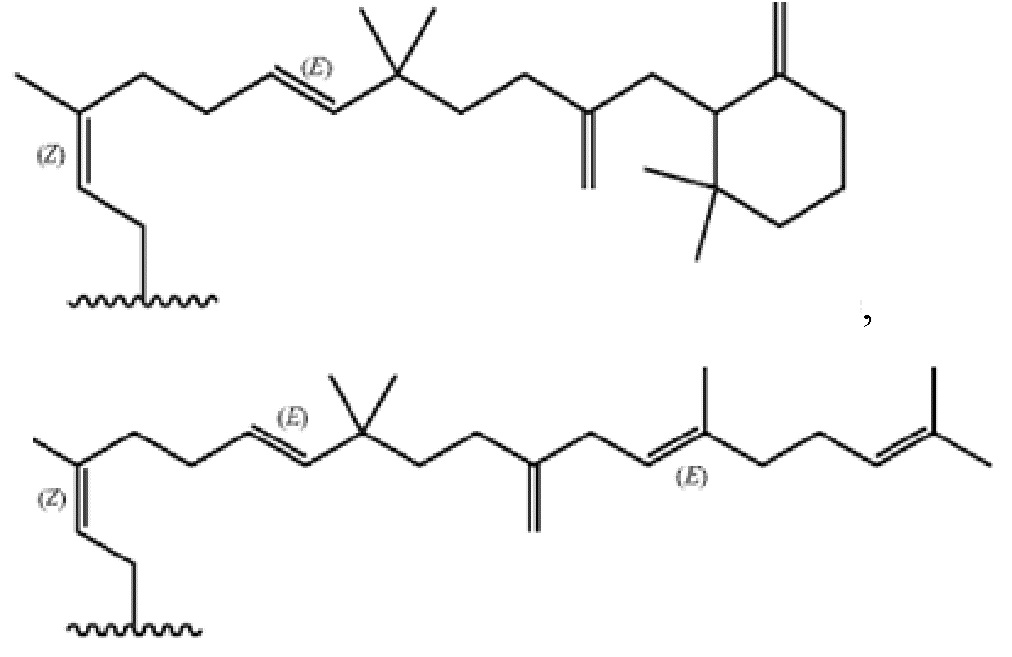
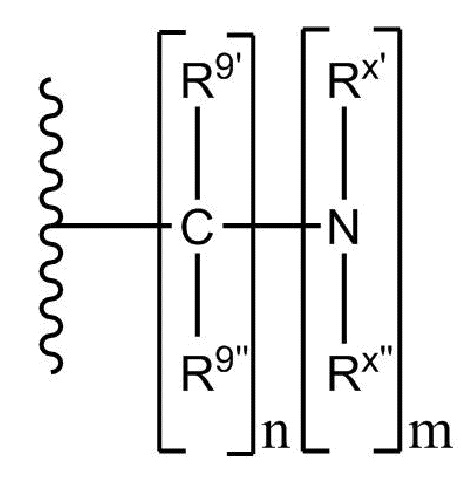
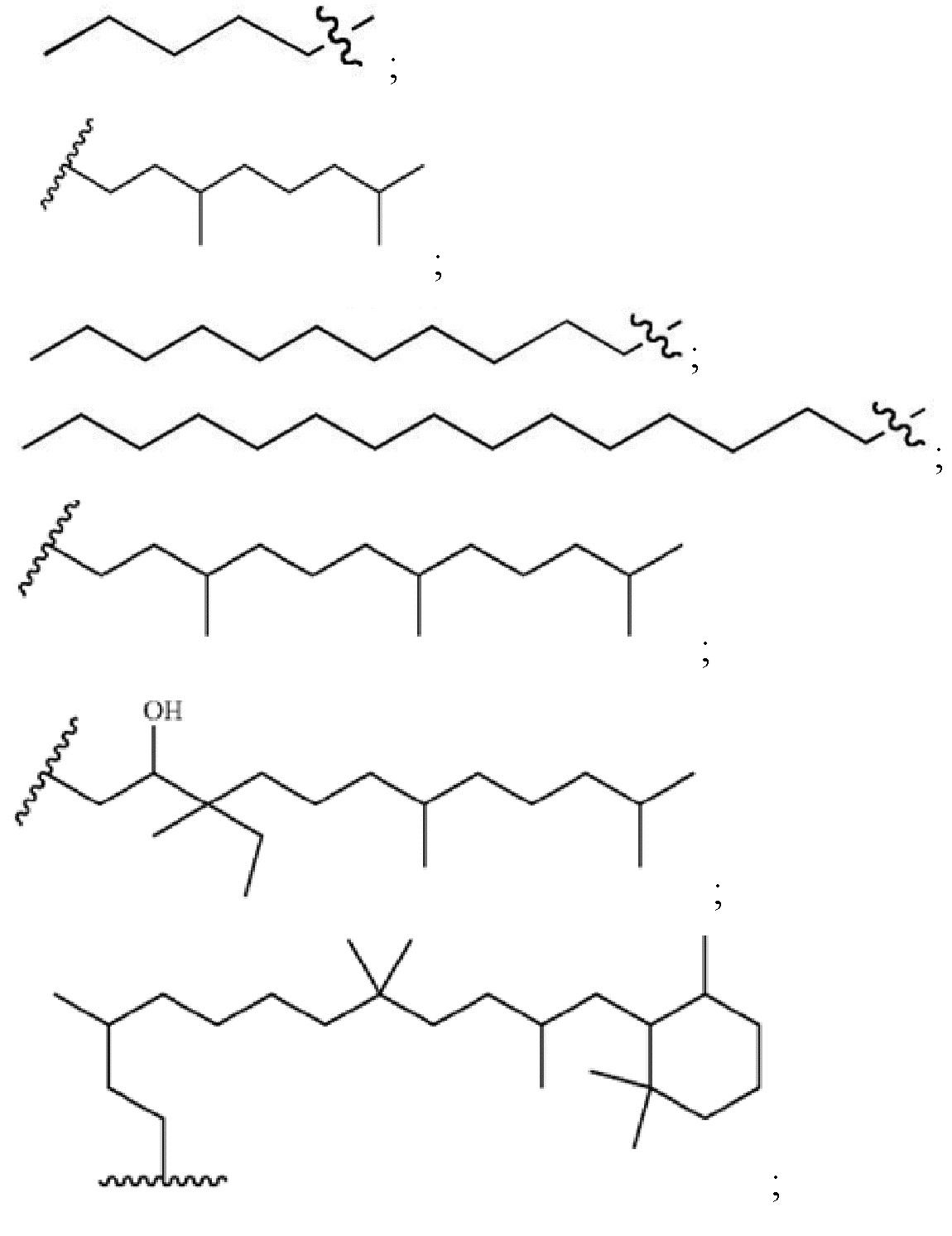
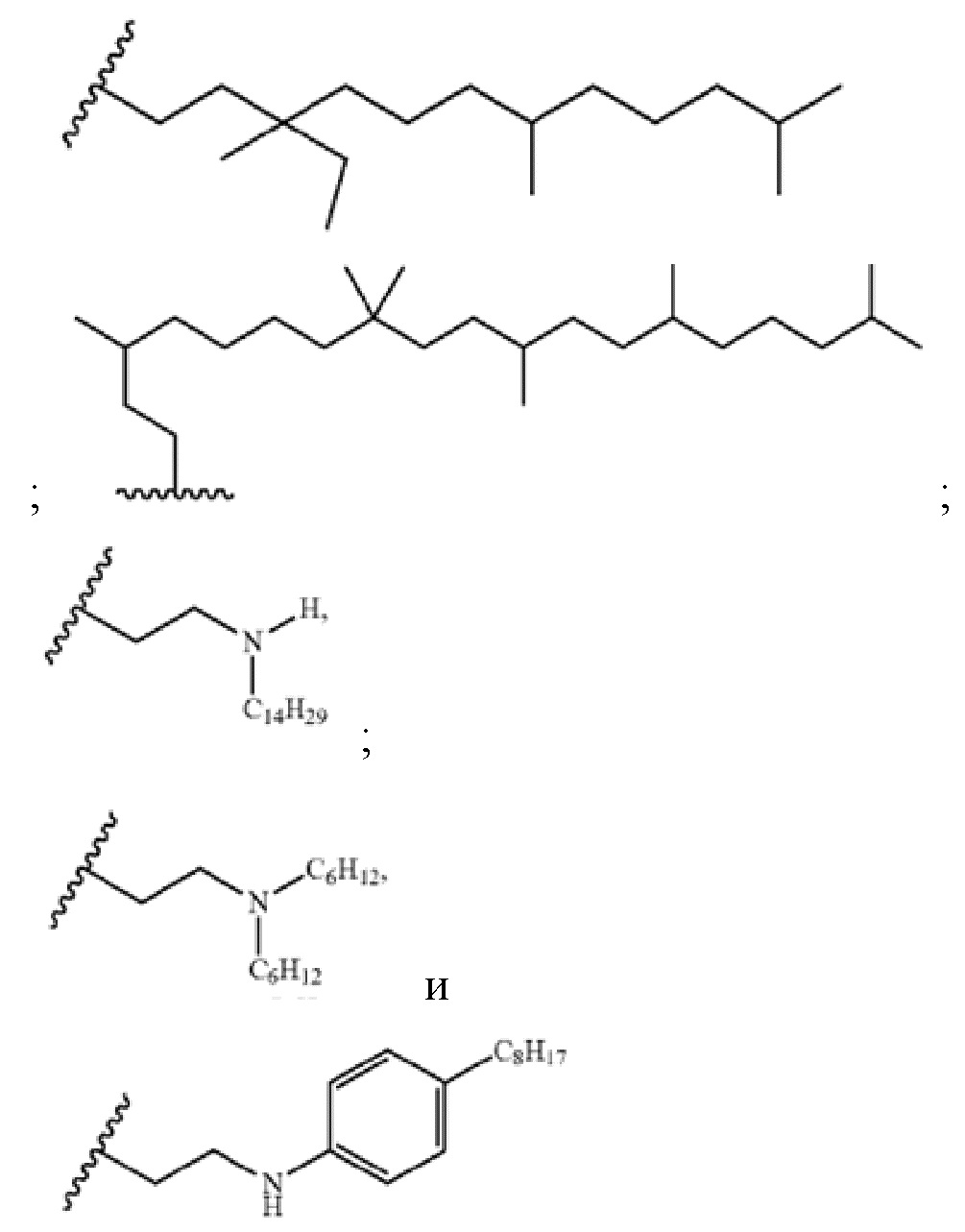
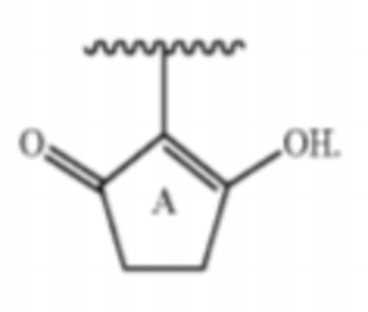
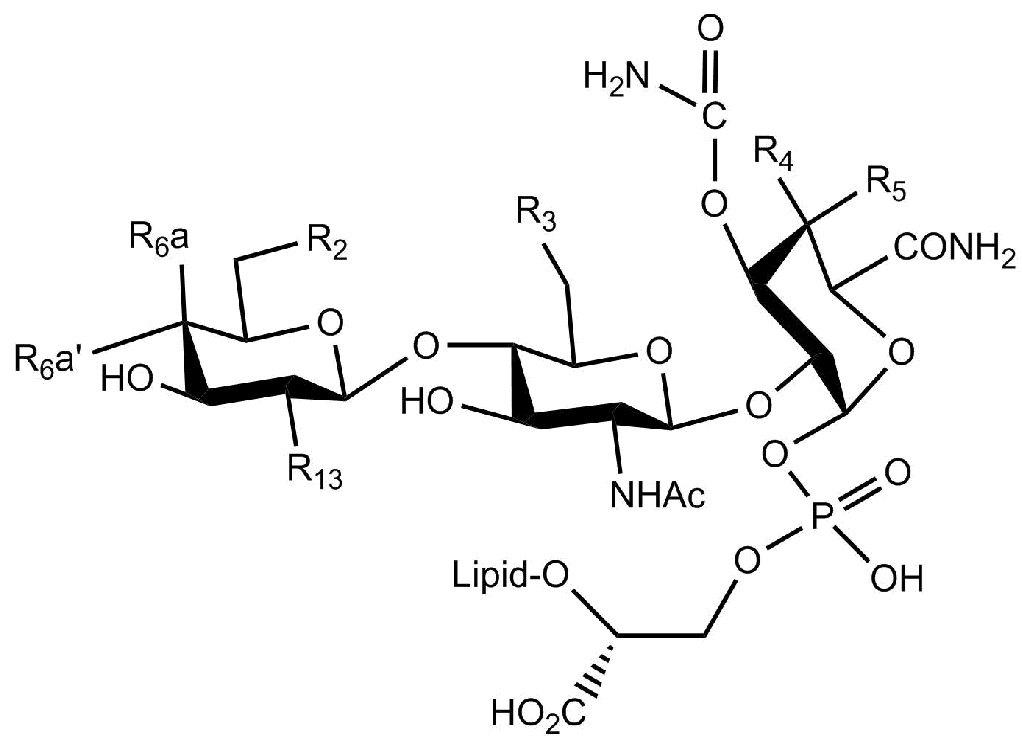
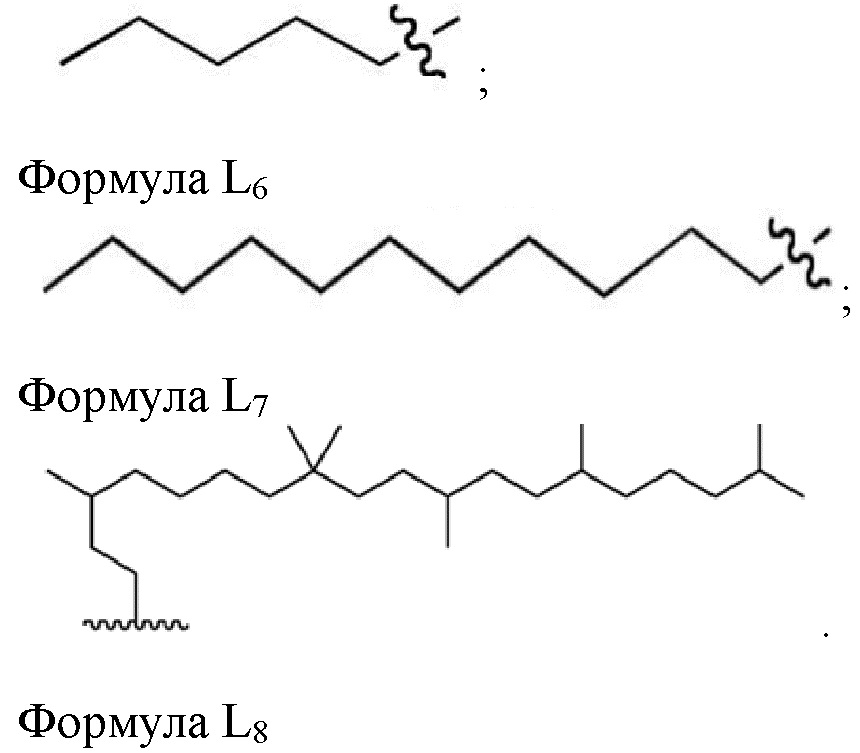
Настоящее изобретение относится к соединениям, применяемым в качестве противовоспалительного средства, которые воздействуют на механизмы воспаления у млекопитающих [обозначаемые далее как противовоспалительное соединение (C)], где указанное противовоспалительное соединение (C) представляет собой, по меньшей мере, одно из соединений, представленных общими формулами (I), (II), (III) или (IV), или его фармацевтически приемлемую соль, фармацевтически приемлемый сольват, изомер или их смесь:
формула (I)
формула (II)
где
- каждый из R1 независимо выбирают из -OH или -N(R1a)(R1b), где каждый из R1a и R1b, независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, защитной группы для аминогруппы, арильной, гетероарильной, алифатической и гетероалифатической группы,
- каждый из R2, R4, R5, R11 и R12, независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, -ORz, -N(Rz)2, арильной, гетероарильной, алифатической и гетероалифатической группы, где Rz независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, защитной группы для аминогруппы, арильного, гетероарильного, алифатического, гетероалифатического и карбогидратного фрагмента,
- каждый из R3 независимо выбирают из группы, состоящей из H, -OH, -NH2, -SH, ORw, -NH(Rw), -N(Rw)2, -SRw, -O(C=O)Rw, -NH(C=O)Rw, -O(C=NH)Rw, -NH(C=NH)Rw, -S(C=NH))Rw, -NH(C=S)Rw, -S(C=O)Rw, -O(C=S)Rw, -S(=S)Rw, арильной, гетероарильной, алифатической и гетероалифатической группы, где Rw выбирают из группы, состоящей из карбогидратного фрагмента, арильной, гетероарильной, алифатической и гетероалифатической группы,
- каждый из R6, R14 и R15, независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, арильной, гетероарильной, алифатической, гетероалифатической группы и карбогидратного фрагмента,
- каждый из R7 независимо выбирают из группы, состоящей из H, C(=O)N(Rz')2, -C(=O)ORz', защитной группы для гидроксильной группы, арильной, гетероарильной, алифатической, гетероалифатической группы и карбогидратного фрагмента, где Rz' независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, защитной группы для аминогруппы, арильной, гетероарильной, алифатической и гетероалифатической группы,
- каждый из R10 независимо выбирают из группы, состоящей из -C(=O)N(Rl)(Rp), -C(=O)ORk и -CH2ORk, где Rl и Rp независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, защитной группы для аминогруппы, арильной, гетероарильной, алифатической, гетероалифатической группы и карбогидратного фрагмента, где Rk независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, арильной, гетероарильной, алифатической, гетероалифатической группы и карбогидратного фрагмента,
- каждый из R13 независимо выбирают из группы, состоящей из -OH и -N(Ro'')(Rm''), где Ro'' и Rm'', независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, -C(=O)Rh, защитной группы для аминогруппы, арильной, гетероарильной, алифатической и гетероалифатической группы, где Rh выбирают из группы, состоящей из карбогидратного фрагмента, арильной, гетероарильной, алифатической и гетероалифатической группы,
- каждый из (Ro) и (Rm), независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, -C(=O)Rw', защитной группы для аминогруппы, арильной, гетероарильной, алифатической и гетероалифатической группы, где Rw' выбирают из группы, состоящей из карбогидратного фрагмента, арильной, гетероарильной, алифатической и гетероалифатической группы;
- каждый из (Rs) и (Rt), независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, -C(=O)Rw'', защитной группы для аминогруппы, арильной, гетероарильной, алифатической и гетероалифатической группы, где Rw'' выбирают из группы, состоящей из карбогидратного фрагмента, арильной, гетероарильной, алифатической и гетероалифатической группы;
- каждый из R6a и R6a', независимо друг от друга и в каждом случае их присутствия, выбирают из H или -OH, предпочтительно, чтобы R6a представлял собой H, и R6a' представлял собой -OH;
- каждый из Rc независимо выбирают из группы, состоящей из H, галогена, гетероарила, -ORq, -N(Rq)2, -SRq, NO2, -NC, -CN, -N3, -N(Rq)=NRq, -CHO, -C(=O)Rq, -C(=S)Rq, C(=NRq)Rq, -C(=O)ORq, -C(=NRq)ORq, -C(=NRq)N(Rq)2, -C(=O)N(Rq)2, -C(=S)ORq, -C(=O)SRq, -C(=S)SRq, -P(=O)(ORq)2, -S(=O)(ORq), -S(=O)2(ORq), -P(=O)N(Rq)2, -P(=O)2N(Rq)2, -C(=O)NR'S(=O)2Rq, -S(=O)N(Rq)2 and -S(=O)2N(Rq)2, где каждый из Rq независимо выбирают из группы, состоящей из H, алифатической, гетероалифатической группы, арильной, гетероарильной группы и защитной группы для гидроксильной группы,
- каждый из Ri независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, алифатической, гетероалифатической группы, арила и гетероарила,
- каждый Lipid независимо выбирают из H или C1–30 алифатического фрагмента, в котором от 0 до 10 метиленовых звеньев необязательно заменены на -O-, -NRx-, -S-, -C(=O)-, -C(=NRx)-, -S(=O)-, -S(=O)2-, -N=N-, -C=N-, -C(Ry)=C(Ry')-, -N–O–, арилен или гетероариленовый фрагмент, где каждый из Rx независимо выбирают из группы, состоящей из H, алифатической, гетероалифатической группы, арильной, гетероарильной группы или защитной группы для аминогруппы, и где каждый из Ry и Ry', независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, алифатической, гетероалифатической, арильной и гетероарильной группы.
Кроме того, настоящее изобретение относится к фармацевтической композиции, применяемой в качестве противовоспалительного средства, которые воздействуют на механизмы воспаления у млекопитающих, которая включает носитель и, в качестве активного ингредиента, эффективное количество противовоспалительного соединения (C), определяемого в любом одном из представленных в изобретении вариантов осуществления.
Кроме того, настоящее изобретение относится к способу приготовления указанной фармацевтической композиции.
Кроме того, настоящее изобретение относится к противовоспалительному соединению (C), определяемому в любом одном из представленных в изобретении вариантов осуществления, для применения в качестве лекарственного препарата.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей носитель и, в качестве активного ингредиента, эффективное количество противовоспалительного соединения (C), определяемого в любом одном из представленных в изобретении вариантов осуществления, для применения в качестве лекарственного препарата.
Кроме того, настоящее изобретение относится к противовоспалительному соединению (C), определяемому в любом одном из представленных в изобретении вариантов осуществления, для применения при лечении воспалительных заболеваний или связанных с воспалением заболеваний.
Кроме того, настоящее изобретение относится к противовоспалительному соединению (C), определяемому в любом одном из представленных в изобретении вариантов осуществления, для применения при лечении заболевания, опосредованного, по меньшей мере, одним цитокином.
Кроме того, настоящее изобретение относится к in vivo способу подавления или торможения ответных воспалительных реакций путем применения противовоспалительного соединения (C), определяемого в любом одном из представленных в изобретении вариантов осуществления.
Кроме того, настоящее изобретение относится к способу подавления или торможения экспрессии, по меньшей мере, одного цитокина у млекопитающего.
Кроме того, настоящее изобретение относится к способу лечения связанных с воспалением заболеваний, ассоциированных с уровнями экспрессии цитокина у млекопитающих.
ПРОТИВОВОСПАЛИТЕЛЬНОЕ СОЕДИНЕНИЕ (C) И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ
Далее следует иметь в виду, что все определения и преимущества, описанные выше для противовоспалительного соединения (C), в равной степени применимы к этому варианту осуществления и ко всем дополнительным вариантам осуществления, описанным ниже.
Используемые выше и ниже в изобретении определения имеют следующие значения, если не указано иное.
Термин "алифатическая" включает как насыщенную, так и ненасыщенную, неароматическую линейную цепь (то есть, неразветвленную), разветвленную, ациклическую и циклическую углеводородную цепь, имеющую от 1 до 30 углеродных атомов, которые необязательно замещены с помощью одной или более групп, включающих, но этим не ограничивая, алкил, алкинил, алкенил, арил, галогенид, нитро, амино, эфир, кетон, альдегид, гидрокси, карбоновая кислота, или алкокси. Согласно конкретным вариантам осуществления, используемая в изобретении CF–G алифатическая группа определяет CF–G алифатическую группу, имеющую от F до G углеродных атомов, например C1–12 алифатическая группа определяет алифатическую группу, содержащую от 1 до 12 углеродных атомов, C1–10 алифатическая группа определяет алифатическую группу, содержащую от 1 до 12 углеродных атомов.
Для обычного специалиста в этой области является очевидным, что "алифатический", как предполагается в изобретении, включает, но этим не ограничивая, алкильный, алкенильный и алкинильный фрагменты. Используемые в изобретении термины "алкил", "алкенил" и "алкинил" имеют обширный диапазон общепринятых значений, и они могут включать фрагмент, который представляет линейный, разветвленный, циклический (циклооалкильный, циклоалкенильный, циклоалкинильный) фрагменты или их комбинацию.
Термин "алкил", применяемый отдельно или в комбинации, обозначает образованный из алкана радикал, который может представлять собой линейный алкил, разветвленный алкил или циклический алкил, содержащий от 1 до 30 углеродных атомов, если не указано иначе. Линейная или разветвленная алкильная группа присоединяется в любой доступной точке для получения стабильного соединения. Алкил также включает линейную или разветвленную алкильную группу, которая содержит циклоалкильную часть или прерывается циклоалкильной частью. Согласно конкретным вариантам осуществления, CA–B алкил обозначает линейный или разветвленный алкильный радикал, имеющий от A до B углеродных атомов, например C1–15 алкил обозначает линейный или разветвленный алкильный радикал, имеющий от 1 до 15 углеродных атомов, C1–12 алкил обозначает линейный или разветвленный алкильный радикал, имеющий от 1 до 12 углеродных атомов, C1–6 алкил обозначает линейный или разветвленный алкильный радикал, имеющий от 1 до 6 углеродных атомов, такой как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил. Согласно конкретным вариантам осуществления, циклический CC–D алкил обозначает циклический алкильный радикал, имеющий от C до D углеродных атомов, например C3–6 циклический алкил.
Термин "алкенил", применяемый отдельно или в комбинации, обозначает линейный или разветвленный углеводород, содержащий 1-30 углеродных атомов, если не указано иначе, и, по меньшей мере, одну двойную связь углерод-углерод. Примеры алкенильных групп включают этенил, пропенил, изопропенил, бутенил, циклогексенил, циклогексенилалкил и другие подобные алкенильные группы. Алкенил также включает линейную или разветвленную алкенильную группу, которая содержит циклоалкильную часть или прерывается циклоалкильной частью. Двойные связи углерод-углерод могут содержаться или в циклоалкильной части, или в линейной цепи или в разветвленной части. Согласно конкретным вариантам осуществления, CH–I алкенил обозначает линейный или разветвленный алкенильный радикал, имеющий от H до I углеродных атомов, например, C1–6 алкенил обозначает линейный или разветвленный алкенильный радикал, имеющий от 1 до 6 углеродных атомов.
Термин "алкинил", применяемый отдельно или в комбинации, обозначает линейный, разветвленный или циклический углеводород, содержащий от 1 до 30 углеродных атомов, содержащих, по меньшей мере, одну тройную связь углерод-углерод. Примеры алкинильных групп включают этинил, пропинил, бутинил и другие подобные алкинилы.
Используемый в изобретении термин "гетероалифатический" относится к определенному в изобретении алифатическому фрагменту, который включает как насыщенные и ненасыщенные, неароматические, линейные (то есть, неразветвленные), разветвленные, ациклические, циклические (то есть, гетероциклические) или полициклические углеводороды, имеющие от 1 до 30 углеродных атомов, если не указано иначе, которые необязательно замещены с помощью одной или более групп, включающих, но этим не ограничивая, алкильную, алкинильную, алкенильную, арильную, галогенидную группы, нитрогруппу, аминогруппу, эфирную, кетоновую, альдегидную, гидроксильную группы, группу карбоновой кислоты или алкоксильную группу, и которые содержат один или более гетероатомов, таких как атомы кислорода, серы, азота, фосфора или кремния, например, вместо углеродных атомов. В конкретных вариантах осуществления, гетероалифатические фрагменты замещены путем независимой замены одного или более из атомов водорода в них на один или более заместителей. Для обычного специалиста в этой области является очевидным, что "гетероалифатический", как предполагается в изобретении, включает гетероалкильный, гетероциклоалкильный, гетероциклоалкенильный и гетероциклоалкинильный фрагменты. Поэтому, используемый в изобретении термин "гетероалкил" включает линейные, разветвленные и циклические алкильные группы, которые содержат один или более гетероатомов, таких как атомы кислорода, серы, азота, фосфора или кремния, например, вместо углеродных атомов. Аналогичное определение применяется к другим номенклатурным терминам, таким как "гетероалкенил", "гетероалкинил" и другим подобным терминам. Кроме того, используемые в изобретении термины "гетероалкил", "гетероалкенил", "гетероалкинил" и другие подобные термины охватывают как замещенные, так и незамещенные группы.
Используемый в изобретении термин "арил", применяемый отдельно или в комбинации, обозначает любую ароматическую группу на основе углеродных атомов, включающую, но этим не ограничивая, фенил, толил, ксилил, куменил, нафтил, антраценил и другие подобные группы, необязательно конденсированную с циклоалкилом или гетероциклилом, содержащими, предпочтительно, 5-7, более предпочтительно, 5-6, атомов в кольце, и/или необязательно замещенную с помощью от 1 до 5 групп или заместителей. Арил может быть необязательно замещен с помощью одной или более групп, включающих, но этим не ограничивая, алкильную, алкинильную, алкенильную, арильную, галогенидную группы, нитрогруппу, аминогруппу, эфирную, кетоновую, альдегидную, гидроксильную группы, группу карбоновой кислоты или алкоксильную группу, при условии, что заместитель присоединяют в одной точке к арилу, или при условии, что заместитель присоединяют в двух точках к арилу, с образованием бициклической системы, например, бензодиоксола, бензодиоксана, бензимидазола.
Термин "гетероарил", применяемый отдельно или в комбинации, обозначает моноциклическую ароматическую кольцевую структуру, содержащую 5 или 6 атомов в кольце, или бициклическую ароматическую группу, имеющую от 8 до 10 атомов, содержащую один или более, предпочтительно, 1-4, более предпочтительно 1-3, гетероатомов, независимо выбранных из группы O, S и N, и необязательно замещенную с помощью от 1 до 5 групп или заместителей, включающих, но этим не ограничивая, алкильную, алкинильную, алкенильную, арильную, галогенидную группы, нитрогруппу, аминогруппу, эфирную, кетоновую, альдегидную, гидроксильную группы, группу карбоновой кислоты или алкоксильную группу. Предполагается, что гетероарил также включает окисленные формы S или N, такие как сульфинил, сульфонил и N-оксид атома третичного азота в кольце. Атом углерода или азота присоединяют к гетероарильной кольцевой структуре таким образом, чтобы сохранялась стабильность ароматического кольца. Более конкретно, термин "гетероарил" включает, но этим не ограничивая, пиридил, фуранил, тиофенил, тиазолил, изотиазолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиримидил, бензофуранил, изобензофуранил, бензотиазолил, бензоизотиазолил, бензотриазолил, индолил, изоиндолил, бензоксазолил, хинолил, изохинолил, бензимидазолил, бензизоксазолил, бензотиофенил, дибензофуран и бензодиазепин-2-он-5-ил и другие подобные гетероарильные группы.
Согласно конкретному варианту осуществления настоящего изобретения, Lipid представляет собой ненасыщенную C4–20 углеводородную цепь, в которой от 1 до 10 метиленовых звеньев заменены на -C(Ry)=C(Ry')-, где каждый из Ry и Ry', независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, алифатической, гетероалифатической, арильной или гетероарильной группы; и где указанная углеводородная цепь необязательно замещена с помощью C1–6 алкила, C3–6 циклического алкила, C1–6 алкенила или гидроксильной группы, предпочтительно, чтобы Lipid представлял собой C4–20 углеводородную цепь, в которой от 1 до 5 метиленовых звеньев заменены на -C(Ry)=C(Ry')-, где каждый из Ry и Ry', независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, C1–6 алкила и C1–6 алкенила, и где указанная углеводородная цепь необязательно замещена с помощью C1–6 алкила, C3–6 циклического алкила, C1–6 алкенила или гидроксильной группы, более предпочтительно, чтобы Lipid выбирали из фрагментов, имеющих следующие формулы:
Еще более предпочтительно, чтобы Lipid выбирали из фрагментов, имеющих следующие формулы:
Согласно конкретному варианту осуществления настоящего изобретения, Lipid представляет собой насыщенную углеводородную цепь, имеющую общую Z:
Формула Z
где
- каждый из R9' и R9'', независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, -OH и C1–6 алкила,
- каждый из Rx' и Rx'', независимо друг от друга и в каждом случае их присутствия, выбирают из H, C1–15 алкила и арила, где указанный арил необязательно дополнительно замещен с помощью C1–15 алкила, и где n=4-30, и m=0 или 1
Предпочтительно, чтобы насыщенную углеводородную цепь выбирали из фрагментов, имеющих следующие формулы:
Согласно конкретному варианту осуществления настоящего изобретения, R1 независимо выбирают из -OH или -N(R1a)(R1b), где каждый из R1a и R1b, независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, C1–20 алифатической и C1–20 гетероалифатической группы, предпочтительно, чтобы R1 представлял собой OH, NH2, или NH(R1b), где R1b представляет собой C1–10 циклоалкильную группу или C1–10 циклоалкенил, который необязательно замещен с помощью галогена, гидроксила или алкокси, более предпочтительно, чтобы R1 представлял собой -NH(R1b), где R1b имеет следующую формулу:
Согласно конкретному варианту осуществления настоящего изобретения, R3 независимо выбирают из группы, состоящей из H, -OH и -ORw, где Rw выбирают из группы, состоящей из карбогидратного фрагмента, где указанный карбогидратный фрагмент независимо выбирают из группы, состоящей из D- и L- моносахаридов, таких как, в частности, D-эритроза, L-эритроза, D-треоза, L-треоза, L-эритрулоза, D-эритрулоза, D-арабиноза, L-арабиноза, D-дезоксирибоза, L-дезоксирибоза, D-ликсоза, L-ликсоза, D-рибоза, L-рибоза, D-рибулоза, L-рибулоза, D-ксилоза, L-ксилоза, D-ксилулоза, L-ксилулоза, D-аллоза, L-аллоза, D-альтроза, L-альтроза, D-галактоза, L-галактоза, D-глюкоза, L-глюкоза, D-гулоза, L-гулоза, D-идоза, L-идоза, D-манноза, L-манноза, D-талоза, L-талоза, D-фруктоза, L-фруктоза, D-псикоза, L-псикоза, D-сорбоза, L-сорбоза, D-тагатоза, L-тагатоза, D-фукоза, L-фукоза, D-рамноза и L-рамноза, дисахаридов, таких как, в частности, сахароза, лактоза, трегалоза и мальтоза, трисахаридов, таких как, в частности, акарбоза, рафиноза и мелицитоза, более предпочтительно, чтобы R3 представлял собой -ORw, где Rw представляет собой D-моносахарид, такой как, в частности, D-эритроза, D-треоза, D-эритрулоза, D-арабиноза, D-дезоксирибоза, D-ликсоза, D-рибоза, D-рибулоза, D-ксилоза, D-ксилулоза, D-аллоза, D-альтроза, D-галактоза, D-глюкоза, D-гулоза, D-идоза, D-манноза, D-талоза, D-фруктоза, D-псикоза, D-сорбоза D-тагатоза, D-фукоза и D-рамноза, еще более предпочтительно, чтобы R3 представлял собой -ORw, где Rw независимо выбирают из группы, состоящей из D-глюкозы, D-галактозы, D-аллозы, D-альтрозы, D-маннозы, D-идозы, D-галозы или D-талозы, наиболее предпочтительно, чтобы R3 представлял собой -ORw, где Rw представляет собой D-глюкозу.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из R2, R4, R5, R11 и R12, независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, ORz, C1–12 алифатического, C1–12 гетероалифатического и карбогидратного фрагмента, где Rz выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, C1–12 алифатической группы, C1–12 гетероалифатической группы, арила и гетероарила, и где указанный карбогидратный фрагмент выбирают из группы, состоящей из D-моносахаридов, таких как, в частности, D-эритроза, D-треоза, D-эритрулоза, D-арабиноза, D-дезоксирибоза, D-ликсоза, D-рибоза, D-рибулоза, D-ксилоза, D-ксилулоза, D-аллоза, D-альтроза, D-галактоза, D-глюкоза, D-гулоза, D-идоза, D-манноза, D-талоза, D-фруктоза, D-псикоза, D-сорбоза D-тагатоза, D-фукоза и D-рамноза, предпочтительно, чтобы каждый R2, R4, R5, R11 и R12, независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H, ORz, защитной группы для гидроксильной группы, C1–6 алкила и карбогидратного фрагмента, где Rz выбирают из группы, состоящей из H, защитной группы для гидроксильной группы и C1–6 алкила, и где указанный карбогидратный фрагмент выбирают из группы, состоящей из D-глюкозы, D-галактозы, D-аллозы, D-альтрозы, D-маннозы, D-идозы, D-галозы и D-талозы, более предпочтительно, чтобы R2, R4, R11 и R12, независимо друг от друга и в каждом случае их присутствия, выбирали из H или ORz, где Rz выбирают из H или C1–6 алкила, более предпочтительно, чтобы R5 представлял собой C1–6 алкил, еще более предпочтительно, чтобы R2 представлял собой H, R4, R11, и R12 представлял собой -OH, и R5 представлял собой -CH3.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из R6, R14 и R15, независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, C1–12 алифатической и C1–12 гетероалифатической группы, предпочтительно, чтобы R6, R14 и R15, независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H или защитной группы для гидроксильной группы, более предпочтительно, чтобы R6, R14 и R15, независимо друг от друга и в каждом случае их присутствия, представляли собой H.
Согласно конкретному варианту осуществления настоящего изобретения, R7 представляет собой группу -C(=O)N(Rz')2, где каждый из Rz' независимо выбирают из группы, состоящей из H, арила, гетероарила и C1–12 алкила, предпочтительно, чтобы каждый из Rz' независимо выбирали из H или C1–12 алкила, более предпочтительно, чтобы каждый из Rz' независимо выбирали из группы, состоящей из H, метила, этила и пропила, наиболее предпочтительно, чтобы каждый из Rz' независимо представлял собой H.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из R10 независимо выбирают из -C(=O)N(Rl)(Rp) или -C(=O)ORk, где Rl и Rp, независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, защитной группы для аминогруппы, арильной, гетероарильной, C1–12 алифатической и C1–12 гетероалифатической группы, и где Rk независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, арильной, гетероарильной, C1–30 алифатической и C1–30 гетероалифатической группы, предпочтительно, чтобы каждый из R10 независимо выбирали из -C(=O)N(Rl)(Rp) или -C(=O)ORk, где Rl и Rp, независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, защитной группы для аминогруппы, арила, гетероарила и C1–6 алкила, где каждый из Rk независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы и C1–6 алкила, более предпочтительно, чтобы каждый из R10 независимо выбирали из -C(=O)N(Rl)(Rp) или -C(=O)ORk, где Rl и Rp, независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, защитной группы для аминогруппы, метила, этила и пропила, где каждый из Rk независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, метила, этила и пропила, наиболее предпочтительно, чтобы R10 представлял собой -C(=O)NH2 или -C(=O)OH.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из R13 независимо выбирают из группы, состоящей из -OH и -N(Ro'')(Rm''), где Ro'' и Rm'', независимо друг от друга в каждом случае их присутствия, выбирают из группы, состоящей из H, –C(=O)Rh, защитной группы для аминогруппы, C1–12 алифатической и C1–12 гетероалифатической группы, где Rh независимо выбирают из C1–12 алифатической или C1–12 гетероалифатической группы, предпочтительно, чтобы Ro'' и Rm', независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H, -C(=O)Rh и C1–12 алкила, где Rh представляет собой C1–12 алкил, более предпочтительно, чтобы Ro'' и Rm'', независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H, -C(=O)Rh и C1–6 алкила, где Rh представляет собой C1–6 алкил, наиболее предпочтительно, чтобы Ro'' представлял собой H, и Rm' представлял собой -C(=O)CH3.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из (Ro) и (Rm), независимо друг от друга в каждом случае их присутствия выбирают из группы, состоящей из H, -C(=O)Rw', защитной группы для аминогруппы, C1–12 алифатической и C1–12 гетероалифатической группы, где Rw' независимо выбирают из группы, состоящей из C1–12 алифатической и C1–12 гетероалифатической группы, предпочтительно, чтобы (Ro) и (Rm), независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H, -C(=O)Rw', защитной группы для аминогруппы и C1–12 алкила, где Rw' представляет собой C1–12 алкил, более предпочтительно, чтобы (Ro) и (Rm), независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H, -C(=O)Rw' и C1–6 алкила, где Rw' представляет собой C1–6 алкил, наиболее предпочтительно, чтобы (Ro) представлял собой H, и (Rm) представлял собой -C(=O)CH3.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из (Rs) и (Rt), независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, -C(=O)Rw'', защитной группы для аминогруппы, C1–12 алифатической и C1–12 гетероалифатической группы, где Rw'' независимо выбирают из C1–12 алифатической или C1–12 гетероалифатической группы, предпочтительно, чтобы (Rs) и (Rt), независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H, -C(=O)Rw'', защитной группы для аминогруппы и C1–12 алкила, где Rw'' представляет собой C1–12 алкил, более предпочтительно, чтобы (Rs) и (Rt), независимо друг от друга в каждом случае их присутствия, выбирали из группы, состоящей из H, -C(=O)Rw'' и C1–6 алкила, где Rw'' представляет собой C1–6 алкил, наиболее предпочтительно, чтобы (Rs) представлял собой H, и (Rt) представляют собой -C(=O)CH3.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из Rc независимо выбирают из группы, состоящей из H, -C(=O)ORq, -C(=O)SRq, -C(=S)ORq, -C(=O)SRq, -C(=S)SRq, где каждый из Rq независимо выбирают из группы, состоящей из H, C1–12 алкила, арила, гетероарила и защитной группы для гидроксильной группы, предпочтительно, чтобы каждый из Rc независимо выбирали из группы, состоящей из H, -C(=O)ORq, -C(=O)SRq и -C(=O)SRq, где каждый из Rq независимо выбирают из группы, состоящей из H, C1–6 алкила и защитной группы для гидроксильной группы, более предпочтительно, чтобы каждый из Rc независимо выбирали из H или -C(=O)ORq, где каждый из Rq независимо выбирают из группы, состоящей из H, метила, этила и пропила, наиболее предпочтительно, чтобы Rc представлял собой -C(=O)OH.
Согласно конкретному варианту осуществления настоящего изобретения, каждый из Ri независимо выбирают из группы, состоящей из H, защитной группы для гидроксильной группы, C1–12 алифатической, C1–12 гетероалифатической группы, арила и гетероарила, предпочтительно, чтобы Ri независимо выбирали из группы, состоящей из H, защитной группы для гидроксильной группы, C1–12 алкила, арила и гетероарила, более предпочтительно, чтобы Ri независимо выбирали из группы, состоящей из H, защитной группы для гидроксильной группы и C1–6 алкила, еще более предпочтительно, чтобы Ri независимо выбирали из группы, состоящей из H, защитной группы для гидроксильной группы, метила, этила и пропила, наиболее предпочтительно, чтобы Ri представлял собой H.
Подробно описанные выше противовоспалительные соединения (C) по настоящему изобретению имеют несколько центров хиральности и существуют в стереохимически изомерных формах. Используемый в изобретении термин "стереохимически изомерные формы" обозначает все возможные соединения, состоящие из одних и тех же атомов, связанных одной и той же последовательностью химических связей, но имеющих различные пространственные структуры, которые не являются равнозначными, которыми могут обладать указанные в изобретении противовоспалительные соединения (C).
Если не упомянуто или не указано иное, то химическое обозначение подробно описанных выше противовоспалительных соединений (C) охватывает смесь всех возможных стереохимически изомерных форм, которыми могут обладать указанные противовоспалительные соединения (C). Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанных противовоспалительных соединений (C). Предполагается, что все стереохимически изомерные формы соединений по настоящему изобретению, как в чистой форме, так и в смеси друг с другом, входят в объем настоящего изобретения.
Предпочтительные противовоспалительные соединения (C) представляют собой соединения с формулой (Ia) [далее обозначаемые в изобретении как противовоспалительные соединения (C) класса I] или их фармацевтически приемлемую соль, фармацевтически приемлемый сольват, изомер или их смесь,
Формула (Ia)
где
- каждый из R1 независимо выбирают из OH, NH2 или NH(R1b), где R1b представляет собой C1-10 циклоалкильную группу или C1-10 циклоалкенил, который необязательно замещен с помощью галогена, гидроксила или алкокси, более предпочтительно, чтобы R1 представлял собой -NH(R1b), где R1b имеет следующую формулу:
- каждый из R3 независимо выбирают из группы, состоящей из H, -OH и -ORw, где Rw представляет собой D-глюкозу;
- каждый из R2 и R4, независимо друг от друга и в каждом случае их присутствия, выбирают из H или -OH;
- каждый из R5 независимо выбирают из группы, состоящей из H, -OH и -CH3;
- Lipid выбирают из следующих фрагментов, имеющих формулу L1 или формулу L2:
Формула L1
Формула L2
Более предпочтительно, чтобы противовоспалительное соединение (C) представляло собой смесь подробно описанных выше противовоспалительных соединений (C) класса I.
Неограничивающие примеры выпускаемых промышленностью противовоспалительных соединений (C), подходящих для применения в изобретении, включают флавомицин®.
Выпускаемый промышленностью флавомицин® также хорошо известен под его синонимическим названием бамбермицин.
Бамбермицин или Флавомицин® представляют собой известный комплекс соединений, в основном состоящий из моеномицина A и C, в частности, основным соединением является моеномицин A, имеющим формулу (Ib), описанную подробно ниже, а минорные соединения обозначают как A12, C1, C3 и C4. Моеномицин A и минорные соединения, обозначаемые как A12, C1, C3 и C4, представляют собой подробно описанные выше соединения формулы (Ia).
В моеномицине A, имеющим формулу (Ib), подробно описанную ниже, и в минорных соединения A12, C1, C3 и C4, Lipid имеет формулу L2, R2 представляет собой H, R1 представляет собой -NH(R1b), где R1b имеет следующую формулу:
В моеномицине A, R3 представляет собой ORw, где Rw представляет собой D-глюкозу, R4 представляет собой OH, и R5 представляет собой CH3. В моеномицине A12, R3 представляет собой ORw, где Rw представляет собой D-глюкозу, R4 представляет собой H, и R5 представляет собой OH.
В моеномицине C1, R3 представляет собой H, R4 представляет собой H, и R5 представляет собой OH. В моеномицине C3, R3 представляет собой H, R4 представляет собой OH, и R5 представляет собой CH3. В моеномицине C4, R3 представляет собой OH, R4 представляет собой OH, и R5 представляет собой CH3.
Бамбермицин или флавомицин® может быть получен из стрептомицетов Streptomyces bambergiensis и Streptomyces ghanaensis, Streptomyces ederensis, Streptomyces geysiriensis и родственных штаммов, или биосинтезирован с образованием в результате описанного выше комплекса соединений. Так как комплекс не подвергают тщательной очистке, флавомицин® также содержит исходные используемые в биосинтезе компоненты и различные промежуточные соединения биосинтеза.
Бамбермицин также известен под названием флавофосфолипол. Бамбермицин, флавофосфолипол и флавомицин® в изобретении применяют взаимозаменяемо.
Предпочтительным противовоспалительным соединением (C) класса I является, в частности, моеномицин A, имеющий формулу (Ib), или его фармацевтически приемлемую соль, фармацевтически приемлемый сольват, изомер или их смесь:
Формула (Ib)
Согласно альтернативному варианту осуществления настоящего изобретения, противовоспалительные соединения (C) представляют собой соединения формулы (IIa) [далее обозначаемые в изобретении как противовоспалительные соединения (C) класса II] или их фармацевтически приемлемую соль, фармацевтически приемлемый сольват, изомер или их смесь:
Формула (IIa)
где
- R3 представляет собой H или -OH;
- каждый из R2 и R4, независимо друг от друга и в каждом случае их присутствия, выбирают из H или -OH;
- каждый из R6a и R6a', независимо друг от друга и в каждом случае их присутствия, выбирают из H или -OH, предпочтительно, чтобы R6a представлял собой H, и R6a' представлял собой -OH;
- R5 представляет собой H, -OH или CH3;
- R13 представляет собой -OH или -NHC(=O)CH3;
- Lipid выбирают из следующих фрагментов, имеющих формулу L3, формулу L4 или формулу L5:
Согласно альтернативному варианту осуществления настоящего изобретения, противовоспалительные соединения (C) представляют собой соединения формулы (IIIa) [далее обозначаемые в изобретении как противовоспалительные соединения (C) класса III] или их фармацевтически приемлемую соль, фармацевтически приемлемый сольват, изомер их смесь:
Формула (IIIa)
где
- каждый из R4 и R5, независимо друг от друга и в каждом случае их присутствия, выбирают из группы, состоящей из H, -CH3 и -OH;
- R7 независимо выбирают из H или -C(=O)NH2, предпочтительно, чтобы R7 представлял собой C(=O)NH2;
- R10 независимо выбирают из -C(=O)NH2 или -C(=O)OH, предпочтительно, чтобы R10 представлял собой C(=O)NH2;
- R13 независимо выбирают из группы, состоящей из -OH или -NHC(=O)CH3, предпочтительно, чтобы R13 представлял собой --NHC(=O)CH3
- Lipid выбирают из следующих фрагментов, имеющих формулу L6, формулу L7 или формулу L8:
С точки зрения терапевтического применения, соли подробно описанного выше противовоспалительного соединения (C) по настоящему изобретению представляют собой соли, в которых противоион является фармацевтически приемлемым, и соли которого могут быть названы фармацевтически приемлемыми солями присоединения кислоты и присоединения основания. Однако, соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также находить применение, например, при получении или очистки фармацевтически приемлемого соединения. Все соли, независимо от того, являются ли они фармацевтически приемлемыми, или нет, входят в объем настоящего изобретения.
Подразумевается, что фармацевтически приемлемые соли присоединения кислоты и основания включают активные нетоксичные формы солей присоединения кислоты и основания, которые способны образовывать подробно описанные выше противовоспалительные соединения (C) по настоящему изобретению. Фармацевтически приемлемые соли присоединения кислоты могут быть легко получены путем обработки основной формы с помощью такой соответствующей кислоты в анионной форме. Соответствующие анионы включают, например, трифторацетат, ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, кальция эдетат, камсилат, карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эсилат, фумарат, глюцептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, изетионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат (эмбонат), пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, бумацетат, сукцинат, сульфат, таннат, тартрат, теоклат, триэтиодид и другие подобные анионы. Выбранный противоион сожет быть введен, используя ионообменные смолы. И наоборот, указанные солевые формы могут быть превращены в результате обработки соответствующим основанием в форму свободного основания.
Указанные в изобретении противовоспалительные соединения (C), содержащие кислотный протон, могут быть также превращены в их формы нетоксичных солей присоединения металла или амина путем обработки соответствующими органическими и неорганическими основаниями в катионной форме. Соответствующие основные соли включают соли, образованные органическими катионами, такими как бензатин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглюумин, прокаин и другие подобные органические катионы; и соли, образованные катионами металлов, таких как алюминий, кальций, литий, магний, калий, натрий, цинк и другие подобные металлы. И наоборот, указанные солевые формы могут быть превращены путем обработки соответствующей кислотой в свободную форму.
Используемый выше термин "соль присоединения" также включает сольваты, которые способны образовывать указанное в изобретении противовоспалительное соединение (C), а также его соли. Такие сольваты представляют собой, например, гидраты, алкоголяты и другие подобные сольваты.
Общеизвестно, что связанные с воспалением заболевания вовлекают в патологический процесс сложно организованную "систему" сети цитокинов, вследствие чего функционирование иммунной системы тонко сбалансирована за счет действия провоспалительных и противовоспалительных медиаторов или цитокинов.
Подробно описанное выше указанное противовоспалительное соединение (C) по настоящему изобретению воздействует на воспалительные механизмы у млекопитающих. Предпочтительно, чтобы подробно описанное выше противовоспалительное соединение (C) по настоящему изобретению воздействовало на воспалительные механизмы у не принадлежащих к человеческому роду млекопитающих. Не принадлежащее к человеческому роду млекопитающее может представлять собой свинью; жвачное животное, такое как, в частности, крупный рогатый скот, лошади; верблюда, овцу, козу, кошку, собаку; или грызуна, такого как, в частности, мышь, кролик или крыса, предпочтительно, свинью.
Заявитель с удивлением обнаружил, что подробно описанное выше противовоспалительное соединение (C) по настоящему изобретению может воздействовать на экспрессию, по меньшей мере, одного цитокина путем подавления или торможения экспрессии, по меньшей мере, одного цитокина, где указанный цитокин выбирают из группы, состоящей из провоспалительных цитокинов, противовоспалительных цитокинов и хемокинов.
В контексте настоящего изобретения, предполагается, что выражения "по меньшей мере, один цитокин" означают один или более, чем один, цитокин. Другими словами, противовоспалительное соединение (C) по настоящему изобретению может подавлять или тормозить экспрессию одного, двух, трех или более цитокинов, и при этом в результате позволяет достигать более высокой терапевтической эффективности при меньшем количестве побочных эффектов.
Кроме того, заявителем было обнаружено, что в результате подавления или торможения экспрессии, по меньшей мере, одного цитокина путем применения противовоспалительного соединения (C) по настоящему изобретению, наблюдается существенное снижение инфильтрации макрофагов, B-клеток и T-клеток. Это говорит о том, что противовоспалительное соединение (C) по настоящему изобретению обладает свойствами подавления или торможения воспаления.
Примеры заболеваний, опосредуемых цитокинами (C), и которые поддаются лечению путем применения противовоспалительного соединения (C) по настоящему изобретению, в частности, включают воспалительные заболевания и связанные с воспалением заболевания.
Неограничивающие примеры воспалительных заболеваний, в частности, включают артрит, ревматоидный артрит, воспалительное заболевание кишечника, псориаз, множественный склероз, системную эритематозную волчанку (SLE), панкреатит, склеродермию, диабет типа I, воспалительное заболевание желудочно-кишечного тракта, аллергический конъюнктивит, гломерулонефрит, синдром Шегрена, увеит, дерматит, анкилозирующий спондилоартрит и фибромиалгию.
Следует иметь в виду, что термин "воспалительное заболевание желудочно-кишечного тракта" относится к таким заболеваниям, как острый гастрит, хронический гастрит, развитие и рецидив язвы желудка, болезнь Крона, воспалительное заболевание кишечника, синдром раздраженного кишечника и язвенный колит.
Неограничивающие примеры связанных с воспалением заболеваний, в частности, включают нейродегенеративное нарушение, застойная сердечная недостаточность, инсульт, стеноз аортального клапана, почечную недостаточность, аллергию, фиброз, атеросклероз, метаболическое заболевание, сердечно-сосудистое заболевание, осложнение, связанное с применением химиотерапии/лучевой терапии, заболевание печени, нарушение работы желудочно-кишечного тракта, офтальмологическое заболевание, диабетическую ретинопатию, легочное заболевание и проказу.
Провоспалительные цитокины, в частности, включают IL-1α, IL-1β, IL-2, IL-3, IL-6, IL-7, IL-9, IL-12, IL-17, IL-18, IL-23, TNF-α, LT, LIF, онкостатин и IFN-α, IFN-β и IFN-γ.
Противовоспалительные цитокины, в частности, включают IL-4, IL-10, IL-11, W-13 и TGF-β.
Хемокины, в частности, включают IL-8, Gro-α, MIP-1, MCP-1, ENA-78 и RANTES (хемокин, экспрессируемый и секретируемый T-клетками при активации).
Если не упомянуто или не указано иное, то подробно описанные выше обозначенные цитокины включают в себя все возможные гомологические формы, которые могут быть подавлены указанными противовоспалительными соединениями (C). Гомологию определяют как взаимную схожесть между биологическими структурами, белками или последовательностями ДНК, которая проистекают от общего предшественника. Например, термин "IL-8" относится к IL-8 и всем гомологам IL-8, в частности, таким как IL-8Kc, IL-8MIP, IL-8LIX и другие подобные цитокины.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей терапевтически эффективное количество противовоспалительного соединения (C), определенного выше и определенного в любом одном из представленных в изобретении вариантов осуществления, в частности, противовоспалительного соединения (C) любого из определенных выше классов (I) - (III), и фармацевтически приемлемый носитель.
Далее по тексту, выражение "противовоспалительное соединение (C)" подразумевает, применительно к целям настоящего изобретения, как множественное число, так и единственное число, то есть это означает, что композиция по изобретению может включать одно или более чем одно противовоспалительное соединение (C)"
В еще одном аспекте, это изобретение относится к способу приготовления подробно описанной выше фармацевтической композиции, который включает тщательное смешение фармацевтически приемлемого носителя с терапевтически эффективным количеством противовоспалительного соединения (C), определенного выше и определенного в любом одном из представленных в изобретении вариантах осуществления, в частности, противовоспалительным соединением (C) любого из определенных выше классов (I) - (III).
Поэтому, указанные противовоспалительные соединения (C) по настоящему изобретению, в частности, противовоспалительные соединения (C) любого из определенных выше классов (I) - (III), могут быть приготовлены с целью их введения в виде различных лекарственных форм. В качестве подходящих композиций могут быть упомянуты все композиции, обычно применяемые для системного введения лекарственных средств. Для приготовления фармацевтических композиций по этому изобретению, эффективное количество конкретного соединения, необязательно в форме соли присоединения или комплекса с металлом, в качестве активного ингредиента объединяют путем тщательного смешения с фармацевтически приемлемым носителем, который может принимать большое разнообразие форм, в зависимости от формы препарата, требуемой для введения. Желательно, чтобы эти фармацевтические композиции представляли собой лекарственную форму с разовой дозой, в частности, для перорального, ректального, чрескожного или парентерального введения. Например, при приготовлении композиций в лекарственной форме для перорального введения, могут быть использованы общепринятые фармацевтические среды, такие как, например, вода, гликоли, масла, спирта и другие подобные среды, в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, разрыхлители и другие подобные вещества в случае порошков, пилюль, капсул и таблеток.
В силу легкости введения, таблетки и капсулы представляют собой наиболее удобные пероральные лекарственные формы с разовой дозой, в случае которых конечно используют твердые фармацевтические носители. Для парентеральных композиций, носитель обычно включает стерильную воду, по меньшей мере, в значительной степени, хотя могут быть включены в состав и другие ингредиенты, например, для улучшения растворимости. Могут быть приготовлены инъецируемые растворы, в которых, например, носитель включает физиологический раствор, раствор глюкозы или раствор смеси физиологического раствор и глюкозы. Могут быть приготовлены также инъецируемые суспензии, в случае которых могут использоваться соответствующие жидкие носители, суспендирующие средства и другие подобные вещества. Кроме того, к ним относятся препараты в твердой форме, которые предназначены для превращения, непосредственно перед применением, в препараты в жидкой форме. В композициях, применяемых для чрескожного введения, носитель необязательно включает вещество для усиления проникновения лекарственного средства, и/или подходящее увлажняющее средство, необязательно объединенные с подходящими добавками любой природы в минорных количествах, которые не оказывают существенного вредного воздействия на кожу.
Противовоспалительное соединение (C), определенное выше и определенное в любом одном из представленных в изобретении вариантов осуществления, в частности, противовоспалительные соединения (C) любого из определенных выше классов (I) - (III), могут быть также введены путем пероральной ингаляции или инсуффляции с помощью методов и препаратов, используемых в фармацевтике для введения таким путем. Так, обычно, указанное в изобретении противовоспалительное соединение (C), в частности, противовоспалительные соединения (C) любого из определенных выше классов (I) - (III), могут быть введены в легкие в форме раствора, суспензии или сухого порошка, причем раствор является предпочтительной формой. Для введения соединений по настоящему изобретению подходит любая система, разработанная для доставки растворов, суспензий или сухих порошков путем пероральной ингаляции или инсуффляции.
Особенно удобно приготавливать упомянутые выше фармацевтические композиции в виде лекарственной формы с разовой дозой с точки зрения простоты введения и равномерности дозирования. Используемая в изобретении лекарственная форма с разовой дозой относится к физически дискретным элементам, подходящим в качестве разовых доз, при этом каждый элемент содержит заданное количество активного ингредиента, рассчитанное для продуцирования требуемого терапевтического эффекта, вместе с требуемым фармацевтическим носителем. Примерами таких лекарственных форм с разовой дозой являются таблетки (включающие таблетки с насечкой или таблетки, покрытые оболочкой), капсулы, пилюли, суппозитории, пакетики с порошком, капсулы-имплантаты, инъецируемые растворы или суспензии и другие подобные формы, и их разделенные кратные количества.
Следует иметь в виду, что термин "терапевтически эффективное количество" обычно относится к количеству активного соединения или компонента или лекарственного средства, которое позволяет достигнуть биологического или лекарственного ответа в ткани, системе, у животного или у человека, искомого, в свете настоящего изобретения, исследователем, ветеринаром, лечащим врачом или другим клиническим врачом, который включает облегчение симптомов заболевания, подвергаемого лечению.
В настоящем изобретении предполагается, что терапевтически эффективное количество определенного выше противовоспалительного соединения (C), в частности, противовоспалительного соединения (C) любого из определенных выше классов (I) - (III), относится к количеству, достаточному для профилактического действия, стабилизации или облегчения заболевания, опосредованного, по меньшей мере, одним цитокином, выбранным из группы, состоящей из подробно описанных выше провоспалительных цитокинов, противовоспалительных цитокинов и хемокинов, в частности, по меньшей мере, одного цитокина, выбранных из группы, состоящей из IL-8, Gro-α, MIP-1, MCP-1, ENA-78 и RANTES, IL-1α, IL-1β, IL-2, IL-3, IL-6, IL-7, IL- 9, IL-12, IL-17, IL-18, IL-23, TNF-α, LT, LIF, онкостатина, IFN-α, IFN-β, IFN-γ, IL-4, IL-10, IL-11, W-13 и TGF-β, более предпочтительно, чтобы, по меньшей мере, один цитокин выбирали из группы, состоящей из IL-8, IL-4, IL-6, IL-10, TNF-α, TNF-β, IL-17, IL-23 и IFN-γ, еще более предпочтительно, чтобы, по меньшей мере, один из указанных цитокинов выбирали из группы, состоящей из IL-8, IL-1β и IFN-γ.
ПРИМЕНЕНИЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СОЕДИНЕНИЙ (C) И ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ
Настоящее изобретение относится к определенному выше противовоспалительному соединению (C), в частности, к противовоспалительному соединению (C) любого из определенных выше классов (I) - (III), которое применяют в качестве лекарственного препарата.
Настоящее изобретение также относится к фармацевтической композиции, включающей терапевтически эффективное количество противовоспалительного соединения (C), определенного выше и определенного в любом одном из представленных в изобретении вариантах осуществления, в частности, противовоспалительного соединения (C) любого из определенных выше классов (I) - (III), и фармацевтически приемлемый носитель, которую применяют в качестве лекарственного препарата.
Настоящее изобретение относится к определенному выше противовоспалительному соединению (C), в частности, к противовоспалительному соединению (C) любого из определенных выше классов (I) - (III), которое применяют при лечении воспалительных заболеваний, выбранных из группы артрита, ревматоидного артрита, воспалительного заболевания кишечника, псориаза, множественного склероза, системной эритематозной волчанки (SLE), панкреатита, склеродермии, диабета типа I, воспалительного заболевания желудочно-кишечного тракта, аллергического конъюнктивита, гломерулонефрита, синдрома Шегрена, увеита, дерматита, анкилозирующего спондилоартрита и фибромиалгии, предпочтительно, для применения при лечении воспалительных заболеваний желудочно-кишечного тракта, таких как острый гастрит, хронический гастрит, развитие и рецидив язвы желудка, болезнь Крона, воспалительное заболевание кишечника, синдром раздраженного кишечника и язвенный колит, более предпочтительно, для применения при лечении острого гастрита, хронического гастрита, развития и рецидива язвы желудка.
Настоящее изобретение относится к определенному выше противовоспалительному соединению (C), в частности, к противовоспалительному соединению (C) любого из определенных выше классов (I) - (III), которое применяют при лечении связанных с воспалением заболеваний, выбранных из группы нейродегенеративного нарушения, застойной сердечной недостаточности, инсульта, стеноза аортального клапана, почечной недостаточности, аллергии, фиброза, атеросклероза, метаболического заболевания, сердечно-сосудистого заболевания, осложнения, связанного с применением химиотерапии/лучевой терапии, заболевания печени, нарушения работы желудочно-кишечного тракта, офтальмологического заболевания, диабетической ретинопатии, легочного заболевания и проказы.
Следовательно, определенное выше противовоспалительное соединение (C), в частности, противовоспалительное соединение (C) любого из определенных выше классов (I) - (III), и определенная выше фармацевтическая композиция могут использоваться при производстве лекарственного препарата, применяемого для лечения, профилактики или противодействия расстройству или заболеванию, ассоциированного с экспрессией цитокинов, включая определенные выше воспалительные заболевания и определенные выше связанные с воспалением заболевания.
Настоящее изобретение относится к определенному выше противовоспалительному соединению (C), в частности, к противовоспалительному соединению (C) любого из определенных выше классов (I) - (III), которое применяют при лечении заболевания, опосредованного, по меньшей мере, одним цитокином.
По меньшей мере, один цитокин предпочтительно выбирать из группы, состоящей из подробно описанных выше провоспалительных цитокинов, противовоспалительных цитокинов и хемокинов, предпочтительно, чтобы, по меньшей мере, один цитокин выбирали из группы, состоящей из IL-8, Gro-α, MIP-1, MCP-1, ENA-78 и RANTES, IL-1α, IL-1β, IL-2, IL-3, IL-6, IL-7, IL- 9, IL-12, IL-17, IL-18, IL-23, TNF-α, LT, LIF, онкостатина, IFN-α, IFN-β, IFN-γ, IL-4, IL-10, IL-11, W-13 и TGF-β, более предпочтительно, чтобы, по меньшей мере, один цитокин выбирали из группы, состоящей из IL-8, IL-4, IL-6, IL-10, TNF-α, TNF-β, IL-17, IL-23 и IFN-γ, еще более предпочтительно, чтобы, по меньшей мере, один из указанных цитокинов выбирали из группы, состоящей из IL-8, IL-1β и IFN-γ.
Для специалистов в области медицины хорошо известно, что величина точной дозы и частота введения зависят от используемого указанного в изобретении конкретного противовоспалительного соединения (C), конкретного состояния, подвергаемого лечению, тяжести состояния, подвергаемого лечению, возраста, массы тела, пола, степени расстройства и общего физического состояния конкретного пациента, а также от другого лекарственного препарата, который пациент может принимать. Кроме того, очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от ответа подвергаемого лечению субъекта и/или в зависимости от оценки лечащего врача, прописавшего применение соединений по настоящему изобретению.
Как было указано выше, подробно описанное выше противовоспалительное соединение (C) по настоящему изобретению может воздействовать на воспалительные механизмы у животных.
В случае введения животным, определенное выше противовоспалительное соединение (C), в частности, противовоспалительное соединение (C) любого из определенных выше классов (I) - (III), и определенная выше фармацевтическая композиция, включающая, по меньшей мере, одно из указанных противовоспалительных соединений (C) в качестве активного ингредиента, могут быть добавлены в корм или питьевую воду для животного, могут быть введены путем обрызгивания в качестве пробиотика самке, кормящей молоком детенышей, могут быть введены в форме болюса с замедленным высвобождением или в форме камня для лизания.
Эффективное количество определенного выше противовоспалительного соединения (C), в частности, противовоспалительного соединения (C) любого из определенных выше (I) - (III), которое специфически подавляет или тормозит экспрессию, по меньшей мере, одного подробно описанного выше цитокина, для лечения животных составляет, предпочтительно, по меньшей мере, 1 ppm, предпочтительно, по меньшей мере, 2 ppm, более предпочтительно, по меньшей мере, 3 ppm, в расчете на суммарную массу корма для животного. С другой стороны, эффективное количество определенного выше противовоспалительного соединения (C), в частности, противовоспалительного соединения (C) любого из определенных выше (I) - (III), композиции (C) составляет, предпочтительно, менее чем 130 ppm, предпочтительно, менее чем 70 ppm, более предпочтительно, менее чем 35 ppm, в расчете на суммарную массу корма для животного, где животное в этом случае представляет собой грызуна, в частности, мышь. Следует иметь в виду, что, применительно к целям настоящего изобретения, величина верхнего предела не является критически важной, и эффективное количество зависит от конкретного вида животного, подвергаемого лечению. Изобретение, кроме того, относится к корму для животного, включающему определенное выше противовоспалительное соединение (C), в частности, противовоспалительное соединение (C) любого из определенных выше классов (I) - (III), фармацевтическую композицию, включающую указанное противовоспалительное соединение (C) в качестве активного ингредиента.
СПОСОБЫ ЛЕЧЕНИЯ воспалительныХ заболеваниЙ С ПРИМЕНЕНИЕМ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СОЕДИНЕНИЙ (C)
Настоящее изобретение относится к in vivo способу подавления или торможения ответных воспалительных реакций путем применения, по меньшей мере, одного определенного выше противовоспалительного соединения (C), в частности, противовоспалительного соединения (C) любого из классов (I) - (III), определенных выше и определенных в любом одном из представленных в изобретении вариантов осуществления.
Кроме того, настоящее изобретение относится к способу подавления или торможения экспрессии, по меньшей мере, одного цитокина, у млекопитающего, где указанный способ включает введение млекопитающему, нуждающемуся в этом, количества противовоспалительного соединения (C), определенного выше и определенного в любом одном из представленных в изобретении вариантах осуществления, достаточного для торможения или подавления экспрессии, по меньшей мере, одного цитокина, где цитокин выбирают из группы, состоящей из IL-8, Gro-α, MIP-1, MCP-1, ENA-78 и RANTES, IL-1α, IL-1β, IL-2, IL-3, IL-6, IL-7, IL-9, IL-12, IL-17, IL-18, IL-23,TNF-α, LT, LIF, онкостатина, IFN-α, IFN-β, IFN-γ, IL-4, IL-10, IL-11, W-13 and TGF-β, более предпочтительно, чтобы, по меньшей мере, один цитокин выбирали из группы, состоящей из IL-8, IL-4, IL-6, IL-10, TNF-α, TNF-β, IL-17, IL-23 и IFN-γ, еще более предпочтительно, чтобы, по меньшей мере, один из указанных цитокинов выбирали из группы, состоящей из IL-8, IL-1β и IFN-γ.
Кроме того, настоящее изобретение относится к способу лечения связанных с воспалением заболеваний, ассоциированных с уровнями экспрессии цитокинов у млекопитающих, где указанный способ включает введение млекопитающему, нуждающемуся в этом, количества противовоспалительного соединения (C), определенного выше и определенного в любом одном из представленных в изобретении вариантах осуществления, эффективного для лечения указанного связанного с воспалением заболевания.
Приведенные далее примеры являются только иллюстрациями неограничивающих вариантов осуществления настоящего изобретения.
ПРИМЕРЫ
МАТЕРИАЛЫ
а) Постановка эксперимента
Эксперименты проводили на экспериментальной модели на мышах с целью оценки влияния кормовых добавок с флавомицином® в качестве противовоспалительного соединения (C).
Для in vivo экспериментов был выбран штамм мышей BALB/c в связи с тем, что у этого штамма мышей более выражена патология желудка по сравнению с другими штаммами мышей. Мышей подразделяли на 4 группы по 8 животных в каждой. 4 группы имеют следующие характеристики:
1) инфицированная + стандартный рацион: сравнительный пример 1
Мышам группы "сравнительного примера 1" дважды инокулировали внутрижелудочно 108 жизнеспособных бактерий штамма Helicobacter Suis (H.suis) HS1 в течение 48 часов (в день 8 и день 9). В день 17, мышам представляли неограниченный доступ к контрольному рациону (стандартному рациону без флавомицина®). Через 73 дня, мышей умерщвляли путем смещения шейных позвонков при глубокой анестезии с помощью изофлурана. Брали полоску желудочной ткани для выполнения описанных ниже экспериментальных процедур.
2) инфицированная + рацион с добавлением флавомицина® (количество флавомицина® <100 ppm в расчете на суммарное количество предоставляемого рациона): пример 1
Мышам группы "примера 1" дважды инокулировали внутрижелудочно 108 жизнеспособных бактерий штамма Helicobacter Suis (H.suis) HS1 в течение 48 часов (в день 8 и день 9). В день 17, мышам представляли неограниченный доступ к рациону с добавкой флавомицина® (количество флавомицина® <100 ppm в расчете на суммарное количество предоставляемого рациона). Через 73 дня, мышей умерщвляли путем смещения шейных позвонков при глубокой анестезии с помощью изофлурана. Брали полоску желудочной ткани для выполнения описанных ниже экспериментальных процедур.
3) неинфицированная + стандартный рацион: сравнительный пример 2
Мышей группы "сравнительного примера 2" не подвергали внутрижелудочной инокуляции, и им представляли неограниченный доступ к контрольному корму, стандартному рациону без флавомицина®. Через 73 дня, мышей умерщвляли путем смещения шейных позвонков при глубокой анестезии с помощью изофлурана. Брали полоску желудочной ткани для выполнения описанных ниже экспериментальных процедур.
4) неинфицированная + рацион с добавлением флавомицина® (количество флавомицина® <100 ppm в расчете на суммарное количество предоставляемого корма): пример 2
Мышей группы "примера 2" не подвергали внутрижелудочной инокуляции, и им представляли неограниченный доступ к рациону с добавлением флавомицина® (количество флавомицина® <100 ppm в расчете на суммарное количество предоставляемого рациона). Через 73 дня, мышей умерщвляли путем смещения шейных позвонков при глубокой анестезии с помощью изофлурана. Брали полоску желудочной ткани для выполнения описанных ниже экспериментальных процедур.
b) Верификация постановки эксперимента - количественное определение H. suis
Наличие инфекции H.suis определяли методом полимеразной цепной реакции в реальном времени (qRT-PCR). Эксперименты проводили так, как это подробно описано ниже. В таблице 1 показано, что группы "сравнительного примера 1" и "примера 1" инфицированы бактериями H.suis. Группы "сравнительного примера 2" и "примера 2" не инфицированы, как показано в таблице 1, поскольку у этих животных бактерии H.suis не были обнаружены.
Таблица 1. Определение наличия инфекции H.suis методом qRT-PCR, выраженного в логарифмических соотношениях H. Suis на мг ткани (абсолютное количественное определение нуклеиновой кислоты (количество бактериальной ДНК) на данное количество образца (мг ткани).
| ПРИМЕР | Log H.suis/мг ткани |
| Сравнительный пример 1 | 7,880 |
| Пример 1 | 36,900 |
| Сравнительный пример 2 | 0 |
| Пример 2 | 0 |
МЕТОДЫ
Анализ методом полимеразной цепной реакции в реальном времени (qRT-PCR)
1) Количественное определение H.suis
Количественное определение образования колоний H. suis в желудке проводили в соответствии с публикациями Blaecher C. et al. (2013) и J.L. et al. (2004). Присутствие ДНК H.suis в экстрактах определяли с использованием специфичного для H. suis метода qRT-PCR с абсолютной количественной оценкой, основанной на гене ureA (Blaecher C. et al. (2013)). Сначала генерировали стандарт путем амплификации части кластера генов ureAB (1236 п.о.) из штамма H.suis HS5 с использованием праймеров U430F и U1735R ( J.L. et al. (2004)). Вкратце, реакции амплификации PCR включали 1 × реакционный буфер [67 мМ Tris/HCl, 16 мМ (NH4)2SO4, 0,45% Triton Х-100, 0,2% желатин], одну единицу ДНК-полимеразы Taq (Biotech International), 200 мкМ каждого дезоксинуклеотидтрифосфата, 2 мМ MgCl2, 10 пмоль каждого олигонуклеотидного праймера и 1 мкл разведенной ДНК (обычно разведение исходного образца в соотношении 1:10, содержащее приблизительно 20-100 нг/мкл) в конечном объеме 50 мкл. Условиями циклирования были начальная денатурация при 94°С в течение 3 минут, затем 35 циклов при 94°С в течение 10 секунд, 52°С в течение 30 секунд и 72°С в течение 1,5 минут с последующей конечной стадией элонгации при 72°С в течение 5 минут. Все реакции проводили с использованием термоциклера Perkin Elmer PE2400. Продукты PCR разделяли на мини-гелях с агарозой в буфере TAE (40 мМ Tris/ацетат, 1 мМ ЭДТА) и фотографировали при УФ-трансиллюминации после окрашивания бромидом этидия. Продукты PCR очищали перед секвенированием с помощью системы очистки Wizard PCR Preps DNA Purification System (Promega) или фильтров Centricon-100 (Amicon). Затем амплифицированную ДНК непосредственно секвенировали с использованием набора для секвенирования циклов ABI PRISM Ready Reaction DyeDeoxy Terminator Cycle Sequencing Kit (PE Applied Biosystems) и системы GeneAmp® PCR System 2400 (Perkin Elmer) в соответствии с протоколами фирм-производителей. Продукты секвенирования разделяли на секвенаторах model 377 DNA Sequencer и анализировали с использованием программ, содержащихся в прилагаемом пакете (PE Applied Biosystems). Во всех случаях, обе цепи ДНК секвенировали с помощью непрерывных перекрытий. После получения стандарта, были сделаны 10-кратные разведения, начиная с 108 ампликонов PCR, для каждого 9 мкл реакционной смеси. Один микролитр экстрагированной ДНК-матрицы добавляли к 9 мкл реакционной смеси, состоящей из 0,25 мкл обоих праймеров, расположенных внутри фрагмента 1236 п.о. (для получения продукта PCR 150 п.о.), 3,5 мкл воды хроматографической чистоты и 5 мкл SensiMix™ SYBR No-ROX (Bioline Reagents Ltd, London, UK). Смысловой праймер представлял собой BF_HsuisF1: 5'-AAA ACA MAG GCG ATC GCC CTG TA-3'. Антисмысловой праймер представлял собой BF_Hsuis R1: 5'-TTT CTT CGC CAG GTT CAA AGC G-3'. Температура отжига составила 62°С. Оба стандарта и образцы были подвергнуты двум параллельным анализам на системе CFX96™ RT-PCR System с термоциклером C1000 Thermal Cycler (Bio-Rad, Hercules, CA, USA). Результаты выражены в единицах абсолютного количества нуклеиновой кислоты (количества бактериальной ДНК) на данное количество образца (мг ткани).
2). Уровни экспрессии цитокинов
Оценку уровней экспрессии цитокинов проводили методом qRT-PCR в соответствии с публикациями Flahou B. et al. (2012) и Liu C. et al. (2016). РНК экстрагировали с использованием набора RNeasy Mini Kit® (Qiagen, Hilden, Germany) в соответствии с инструкциями фирмы-производителя. Полученные концентрации РНК измеряли с использованием спектрофотометра NanoDrop® (Isogen Life Science, Utrecht, The Netherlands)), после чего концентрацию всех образцов, взятых у всех мышей, принадлежащих к 4 группам, определенным выше в разделе постановка эксперимента, доводили до 1 мкг/мкл, затем синтезировали кДНК с использованием набора iScript™ cDNA Synthesis Kit (Bio-Rad, California, USA). Затем проводили анализ экспрессии для генов, кодирующих факторы хозяина, вовлеченные в воспаление. Конститутивные гены PPIa, H2afz и HPRT были включены в качестве эталонных генов. Все используемые последовательности праймеров приведены в таблице 2. Уровни экспрессии мРНК эталонного и целевого генов определяли количественно с использованием метода полимеразной цепной реакции с обратной транскриптазой (RT-PCR), описанного ранее (Flahou B. et al. (2012)). Использовали контролируемые без применения матрицы реакционные смеси, и все указанные образцы подвергали двум параллельным анализам. Значения порогового цикла (Ct) сначала нормализовали по среднему геометрическому значению Ct из эталонных генов. Кратность изменений рассчитывали методом ΔΔCT (72) по средним значениям Ct у мышей с отрицательным результатом на присутствие H. suis. И наконец, для каждого целевого гена, выражали результаты в виде кратности изменений уровней экспрессии мРНК у мышей, положительных по H.suis, относительно уровней экспрессии мРНК у мышей, отрицательных по H.suis. Результаты приведены в таблицах 3 и 4 ниже.
Таблица 2. Последовательности праймеров, использованных в методе qRT-PCR
| Последовательность (5'-3') | Праймер |
| CTGACCTAGAGAAGACACAT | IFN-γ - прямой |
| GGTCAGTGAAGTAAAGGTAC | IFN-γ - обратный |
| CACCTCACAAGCAGAGCACAAG | IL-1β - прямой |
| GCATTAGAAACAGTCCAGCCCATAC | IL-1β - обратный |
| TGCCTGAAGACCCTGCCAAGG | IL-8MIP - прямой |
| GTTAGCCTTGCCTTTGTTCAG | IL8MIP - обратный |
| Конститутивные гены | |
| GGTATCACCCCTCGTCACTT | H2afz - прямой |
| TCAGCGATTTGTGGATGTGT | H2afz - обратный |
| CAGGCCAGACTTTGTTGGAT | HPRT - прямой |
| TTGCGCTCATCTTAGGCTTT | HPRT - обратный |
| AGCATACAGGTCCTGGCATC | PPIa - прямой |
| TTCACCTTCCCAAAGACCAC | PPIa- обратный |
Иммуногистохимические исследования - определение иммуногистохимии Т-клеток, В-клеток, париетальных клеток, некротических клеток и инфильтрации макрофагов
Иммуногистохимические исследования проводили в соответствии с публикацией Flahou B. et al. (2010). Изготавливали следующие друг за другом гистологические срезы толщиной 5 мкм из залитых в парафин тканей. После регидратации и депарафинизации, проводили индуцированное нагреванием демаскирование антигена в цитратном буфере (рН 6,0) с использованием микроволновой печи. Микроскопические препараты инкубировали с 3% H2O2 в метаноле (5 минут) и 30% козьей сывороткой (30 минут) для блокирования активности эндогенной пероксидазы и неспецифических реакций, соответственно. Дифференцирование между Т- и В-лимфоцитами проводили путем окрашивания антигенов CD3 и CD20. Антигены CD3 обнаруживали с использованием поликлонального кроличьего антитела против CD3 (1/100; DakoCytomation). Антигены CD20 обнаруживали с использованием поликлонального кроличьего антитела против CD20 (1/100; Thermo Scientific, Fremont, USA), соответственно. За инкубацией с первичными антителами против CD3 и CD20, следовала инкубация с биотинилированным козьим анти-кроличьим антителом IgG (1/500; DakoCytomation). После промывания, срезы инкубировали с комплексом стрептавидин-биотин-HRP (DakoCytomation) и окрашивали с помощью тетрагидрохлорида диаминобензидина (DAB) и H2O2. Для выделения зрелых макрофагов использовали первичное антитело против маркера клеточной поверхности F4/80 (1/50; Santa Cruz Biotechnology, Inc., Santa Cruz, USA). Обнаружение проводили с использованием системы окрашивания ABC для крыс (Santa Cruz Biotechnology, Inc.). Апоптозные клетки идентифицировали путем иммуногистохимического окрашивания с использованием кроличьего поликлонального антитела против активной каспазы-3 и анти-кроличьего набора для окрашивания клеток и тканей HRP-AEC (R & D Systems, Minneapolis, USA). Париетальные клетки идентифицировали путем иммуногистохимического окрашивания для водородно-калиевой аденозинтрифосфатазы с использованием мышиного моноклонального антитела (1/200; Abcam Ltd, Кембридж, Великобритания) и биотинилированного козьего антимышиного IgG-антитела (1/200; DakoCytomation). Апоптозные клетки идентифицировали путем иммуногистохимического окрашивания с использованием кроличьего поликлонального антитела против активной каспазы-3 и анти-кроличьего набора для окрашивания клеток и тканей HRP-AEC (R & D Systems, Minneapolis, USA). Париетальные клетки идентифицировали путем иммуногистохимического окрашивания для водородно-калиевой аденозинтрифосфатазы с использованием мышиного моноклонального антитела (1/200; Abcam Ltd, Cambridge, UK) и биотинилированного козьего анти-мышиного IgG-антитела (1/200; DakoCytomation). И наконец, подсчитывали положительные клетки в пяти случайно выбранных полях зрения микроскопа под большим увеличением (увеличение: х400). Затем для каждой мыши определяли среднее число положительных клеток. Все результаты представлены в таблицах 5, 6, 7 и 8.
РЕЗУЛЬТАТЫ
Эксперимент 1
Измерение уровней экспрессии цитокинов у H.suis инфицированных животных путем использования подробно описанного выше метода qRT-PCR.
Таблица 3. Результаты эксперимента по проведению исследования qRT-PCR для определения воздействия добавки флавомицинаи на уровни цитокинов у H.Suis инфицированных животных, выраженные в виде кратности изменения уровней экспрессии мРНК.
| Экспрессия (кратность изменения) | ||
| Цитокин | Сравнительный пример 1 | Пример 1 |
| IL - 1β | 0,82 | -1,38 |
| IL-8MIP | 2,65 | 1,60 |
| IFN-γ | 2,15 | -3,88 |
В таблице 3 показано снижение уровней экспрессии IL-1β, IL-8MIP и IFN-γ у инфицированных животных, получавших рацион с добавкой флавомицина® (пример 1) по сравнению с контрольной группой, получавшей стандартный рацион (сравнительный пример 1).
Эксперимент 2
Измерение уровней экспрессии цитокина в отсутствии инфекции H.suis путем использования подробно описанного выше метода qRT-PCR.
Таблица 4. Результаты эксперимента по проведению исследования qRT-PCR для определения воздействия добавки флавомицина® на уровни цитокинов у неинфицированных животных, выраженные в виде кратности изменения уровней экспрессии мРНК.
| Экспрессия (кратность изменения) | ||
| Цитокин | Сравнительные пример 2 | Пример 2 |
| IL - 1β | 1,08 | -1,42 |
| IL-8MIP | 2,47 | 2,34 |
| IFN-γ | 1,25 | 1,99 |
В таблице 4 показано снижение экспрессии IL-1β даже в отсутствии инфекции. Уровни экспрессии IL-8MIP остаются стабильными, при этом наблюдается небольшое повышение экспрессии IFN-γ.
Эксперимент 3
Оценка ответной воспалительной реакции у H.suis инфицированных животных путем проведения подробно описанных выше иммуногистохимических исследований.
Таблица 5. Результаты иммуногистохимических исследований по определению воздействия добавки флавомицина® на число инфильтрирующих T-клеток, B-клеток и макрофагов у H.Suis инфицированных животных, выраженные в виде среднего числа подсчитанных положительных клеток.
| Показатель воспаления | Сравнительный пример 1 | Пример 1 |
| T-клетки | 60,28 | 21,38 |
| B-клетки | 3,08 | 0,48 |
| Макрофаги | 4,75 | 1,35 |
В таблице 5 показано сильное уменьшение числа инфильтрирующих T-клеток, B-клеток и макрофагов у мышей, инфицированных H. suis и подвергнутых лечению с помощью флавомицина® (пример 1) по сравнению со сравнительным примером 1.
Эксперимент 4
Оценка ответной воспалительной реакции при отсутствии инфекции H.suis путем проведения подробно описанных выше иммуногистохимических исследований.
Таблица 6. Результаты иммуногистохимических исследований по определению воздействия добавки флавомицина® на число инфильтрирующих T-клеток, B-клеток и макрофагов у неинфицированных животных, выраженные в виде среднего числа подсчитанных положительных клеток.
| Показатель воспаления | Сравнительный пример 2 | Пример 2 |
| T-клетки | 54,00 | 14,10 |
| B-клетки | 0,85 | 1,65 |
| Макрофаги | 1,15 | 0,18 |
В таблице 6 показан противовоспалительное действие флавомицина® в группе неинфицированных мышей, получавших рацион с добавкой (пример 2), по сравнению со сравнительным примером 2. В частности, наблюдалось снижение числа T-клеток и макрофагов.
На основании полученных результатов экспериментов 3 и 4, показано, что флавомицин® обладает противовоспалительным действием вне зависимости от наличия инфицирования H.suis.
Эксперимент 5
Физиологическая оценка H.suis инфицированных животных путем проведения подробно описанных выше иммуногистохимических исследований.
Таблица 7. Результаты иммуногистохимических исследований по определению воздействия добавки флавомицина® на число некротических и париетальных клеток у H.Suis инфицированных животных, выраженные в виде среднего числа подсчитанных положительных клеток.
| Физиологический показатель | Сравнительный пример 1 | Пример 1 |
| Некротические клетки | 0,95 | 0,50 |
| Париетальные клетки | 151,25 | 213,25 |
В таблице 7 показано снижение числа некротических клеток для группы инфицированных животных, получавших рацион с добавкой флавомицина® (пример 1) по сравнению со сравнительным примером 1. Это указывает на то, что животные, получавшие рацион с добавкой флавомицина®, испытывают в меньшей степени клеточный некроз, чем тот, который можно было бы объяснить за счет подавления ответных воспалительных реакций. Что касается числа париетальных клеток, то обнаруживается более высокое число клеток, измеренное в группе животных, получавшие рацион с добавкой флавомицина®. Это можно объяснить тем фактом, что уменьшение воспаления в результате введения флавомицина®, вызывает меньшее повреждение париетальных клеток желудка.
Эксперимент 6
Физиологическая оценка H.suis не инфицированных животных путем проведения подробно описанных выше иммуногистохимических исследований.
Таблица 8. Результаты иммуногистохимических исследований по определению воздействия добавки флавомицина® на число некротических и париетальных клеток у неинфицированных животных, выраженные в виде среднего числа подсчитанных положительных клеток.
| Физиологический показатель | Сравнительный пример 1 | Пример 1 |
| Некротические клетки | 2,18 | 0,60 |
| Париетальные клетки | 214,63 | 211,38 |
В таблице 8 показано снижение числа некротических клеток, являющееся результатом уменьшения воспаления. Число париетальных клеток составляет приблизительно одну и ту же величину, как в примере 2, так и в сравнительном примере 2. Это указывает на то, что лечение с помощью флавомицина не оказывает негативного воздействия на число париетальных клеток.
Принимая во внимание все полученные результаты, можно сделать вывод о том, что введение флавомицина® оказывает противовоспалительной действие, так как инфильтрация B-клеток, T-клеток и макрофагов, а также уровни IL-1β, IL-8MIP и IFN-γ понижались в группах животных, получавших рацион с добавкой флавомицина®. Более того, показано, что противовоспалительное действие не зависит от наличия H. suis инфицирования.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> HuVePharma
<120> Функционализированные сахариды в качестве противовоспалительных
средств
<130> PAT2523104EP01
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> BF_HsuisF1 / SEQ ID NO: 1
aaaacamagg cgatcgccct gta 23
<210> 2
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> BF_HsuisR1 / SEQ ID NO: 2
tttcttcgcc aggttcaaag cg 22
<210> 3
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> IFN-gamma - прямой / SEQ ID NO: 3
ctgacctaga gaagacacat 20
<210> 4
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> IFN-gamma - обратный / SEQ ID NO: 4
ggtcagtgaa gtaaaggtac 20
<210> 5
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> IL-1beta - прямой / SEQ ID NO: 5
cacctcacaa gcagagcaca ag 22
<210> 6
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> IL-1beta - обратный / SEQ ID NO: 6
gcattagaaa cagtccagcc catac 25
<210> 7
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> IL-8MIP - прямой / SEQ ID NO: 7
tgcctgaaga ccctgccaag g 21
<210> 8
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> IL-8MIP - обратный / SEQ ID NO: 8
gttagccttg cctttgttca g 21
<210> 9
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> H2AFZ - прямой / SEQ ID NO: 9
ggtatcaccc ctcgtcactt 20
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> H2AFZ - обратный / SEQ ID NO: 10
tcagcgattt gtggatgtgt 20
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> HPRT - прямой / SEQ ID NO: 11
caggccagac tttgttggat 20
<210> 12
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> HPRT - обратный / SEQ ID NO: 12
ttgcgctcat cttaggcttt 20
<210> 13
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> PPIA - прямой / SEQ ID NO: 13
agcatacagg tcctggcatc 20
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтезированный олигонуклеотид
<400> PPIA - обратный / SEQ ID NO: 14
ttcaccttcc caaagaccac 20
<---
Claims (13)
1. Применение соединения, обозначаемого далее как противовоспалительное соединение (C), в качестве противовоспалительного средства, которое воздействует на механизмы воспаления у млекопитающих, где указанное противовоспалительное соединение (C) представляет собой соединение, представленное формулой (Ib) или его фармацевтически приемлемой солью, фармацевтически приемлемым гидратом или их смесью:
Формула (Ib).
2. Применение противовоспалительного соединения (C) по п. 1, где указанное противовоспалительное соединение (C) воздействует на механизмы воспаления у не принадлежащих к человеческому роду млекопитающих, в частности не принадлежащее к человеческому роду млекопитающее представляет собой свинью; жвачное животное, такое как, в частности, крупный рогатый скот, лошади; верблюда; овцу; козу; кошку; собаку; или грызуна, такого как, в частности, мышь, кролик или крыса; предпочтительно свинью.
3. Применение противовоспалительного соединения (C) по любому одному из пп. 1 или 2, где указанное противовоспалительное соединение (C) воздействует на экспрессию по меньшей мере одного цитокина путем подавления или торможения экспрессии по меньшей мере одного цитокина, где указанный цитокин выбирают из группы, состоящей из провоспалительных цитокинов, в частности IL–1α, IL–1β, IL–2, IL–3, IL–6, IL–7, IL–9, IL–12, IL–17, IL–18, IL–23, TNF–α, LT, LIF, онкостатина и IFN–α, IFN–β, IFN–γ или их смесей; из противовоспалительных цитокинов, в частности IL–4, IL–10, IL–11, W–13, TGF–β или их смесей; и из хемокинов, в частности IL–8, Gro–α, MIP–1, MCP–1, ENA–78, RANTES или их смесей.
4. Применение противовоспалительного соединения (C) по любому одному из пп. 1–3 при лечении воспалительных заболеваний или связанных с воспалением заболеваний, где указанные воспалительные заболевания или связанные с воспалением заболевания опосредуются по меньшей мере одним цитокином, определенным в п. 3.
5. Применение противовоспалительного соединения (C) по п. 4, где воспалительное заболевание выбирают из группы, состоящей из артрита, ревматоидного артрита, воспалительного заболевания кишечника, псориаза, множественного склероза, системной эритематозной волчанки (SLE), панкреатита, склеродермии, диабета типа I, воспалительного заболевания желудочно–кишечного тракта, аллергического конъюнктивита, гломерулонефрита, синдрома Шегрена, увеита, дерматита, анкилозирующего спондилоартрита и фибромиалгии.
6. Применение противовоспалительного соединения (C) по п. 5, где воспалительное заболевание выбирают из группы, состоящей из воспалительных заболеваний желудочно–кишечного тракта, таких как острый гастрит, хронический гастрит, развитие и рецидив язвы желудка, болезнь Крона, воспалительное заболевание кишечника, синдром раздраженного кишечника и язвенный колит.
7. Применение противовоспалительного соединения (C) по п. 4, где связанное с воспалением заболевание выбирают из группы, состоящей из нейродегенеративного нарушения, застойной сердечной недостаточности, инсульта, стеноза аортального клапана, почечной недостаточности, аллергии, фиброза, атеросклероза, метаболического заболевания, сердечно–сосудистого заболевания, осложнения, связанного с применением химиотерапии/лучевой терапии, заболевания печени, нарушения работы желудочно–кишечного тракта, офтальмологического заболевания, диабетической ретинопатии, легочного заболевания и проказы.
8. Применение фармацевтической композиции в качестве противовоспалительного средства, где фармацевтическая композиция включает терапевтически эффективное количество противовоспалительного соединения (C), определенного по п. 1, и фармацевтически приемлемый носитель.
9. Применение фармацевтической композиции по п. 8, где указанная фармацевтическая композиция находится в виде лекарственной формы с разовой дозой, подходящей для перорального, ректального, чрескожного или парентерального введения, в частности в форме таблеток, капсул, пилюль, суппозиториев, пакетиков с порошком, капсул–имплантатов, инъецируемых растворов или суспензий и в других подобных формах, и их разделенных кратных количествах.
10. In vivo способ подавления или торможения ответных воспалительных реакций путем применения противовоспалительного соединения (C), определенного по п. 1.
11. Способ подавления или торможения экспрессии по меньшей мере одного цитокина у млекопитающего, где указанный способ включает введение млекопитающему, нуждающемуся в этом, количества противовоспалительного соединения (C), определенного по п. 1, достаточного для торможения или подавления по меньшей мере одного цитокина, где указанный цитокин выбирают из группы, состоящей из IL–8, Gro–α, MIP–1, MCP–1, ENA–78 и RANTES, IL–1α, IL–1β, IL–2, IL–3, IL–6, IL–7, IL–9, IL–12, IL–17, IL–18, IL–23, TNF–α, LT, LIF, онкостатина, IFN–α, IFN–β, IFN–γ, IL–4, IL–10, IL–11, W–13 и TGF–β, или чтобы по меньшей мере один цитокин выбирали из группы, состоящей из IL–8, IL–4, IL–6, IL–10, TNF–α, TNF–β, IL–17, IL–23 и IFN–γ, или чтобы по меньшей мере один из указанных цитокинов выбирали из группы, состоящей из IL–8, IL–1β и IFN–γ.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP17169794 | 2017-05-05 | ||
| EP17169794.9 | 2017-05-05 | ||
| EP17173119 | 2017-05-26 | ||
| EP17173119.3 | 2017-05-26 | ||
| PCT/EP2018/061510 WO2018202855A1 (en) | 2017-05-05 | 2018-05-04 | Functionalized saccharides as anti-inflammatory agents |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2019136874A RU2019136874A (ru) | 2021-06-07 |
| RU2019136874A3 RU2019136874A3 (ru) | 2021-08-27 |
| RU2772214C2 true RU2772214C2 (ru) | 2022-05-18 |
Family
ID=
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2289410C2 (ru) * | 2001-04-04 | 2006-12-20 | Корикса Корпорейшн | Профилактика и лечение инфекционных и других заболеваний с помощью соединений, основанных на моно- и дисахаридах |
| FR2908658A1 (fr) * | 2006-11-20 | 2008-05-23 | Centre Nat Rech Scient | Composition pour la prevention et/ou le traitement des maladies associees a la surexpression du tnf et/ou de l'il-12 |
| RU2346463C2 (ru) * | 2007-03-20 | 2009-02-20 | Нина Александровна Ушакова | Способ получения биологически активной кормовой добавки |
| WO2009046314A2 (en) * | 2007-10-04 | 2009-04-09 | President And Fellows Of Harvard College | Moenomycin analogs, methods of synthesis, and uses thereof |
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2289410C2 (ru) * | 2001-04-04 | 2006-12-20 | Корикса Корпорейшн | Профилактика и лечение инфекционных и других заболеваний с помощью соединений, основанных на моно- и дисахаридах |
| FR2908658A1 (fr) * | 2006-11-20 | 2008-05-23 | Centre Nat Rech Scient | Composition pour la prevention et/ou le traitement des maladies associees a la surexpression du tnf et/ou de l'il-12 |
| RU2346463C2 (ru) * | 2007-03-20 | 2009-02-20 | Нина Александровна Ушакова | Способ получения биологически активной кормовой добавки |
| WO2009046314A2 (en) * | 2007-10-04 | 2009-04-09 | President And Fellows Of Harvard College | Moenomycin analogs, methods of synthesis, and uses thereof |
Non-Patent Citations (1)
| Title |
|---|
| AINGE G D ET AL. Phosphatidylinositol mannosides: Synthesis and suppression of allergic airway disease, Bioorganic & Medicinal Chemistry,15.08.2006, Vol. 14, No. 16, page 5632-5642. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11602530B2 (en) | CRM1 inhibitors for treating epilepsy | |
| CN110167918A (zh) | 新型苯基衍生物 | |
| JP7214247B2 (ja) | 肝疾患治療又は予防のための化合物 | |
| KR20140082842A (ko) | 항염증제로서 보론함유 소분자 | |
| WO2019024776A1 (zh) | 药物组合物及其用途 | |
| KR20190069607A (ko) | 감마-케토알데하이드 소거제로 염증 및 고혈압을 치료하기 위한 방법 | |
| US20220387397A1 (en) | Compounds and compositions for treating conditions associated with nlrp activity | |
| JP7202892B2 (ja) | 非アルコール性脂肪性肝疾患の予防及び治療薬 | |
| US20050153985A1 (en) | Methods of treating acute inflammation in animals with p38 map kinase inhibitors | |
| KR102091464B1 (ko) | 항염증용 조성물 | |
| US20230059136A1 (en) | The compounds and compositions for treating conditions associated with nlrp activity | |
| US20250223264A1 (en) | Estrogen receptor beta ligands for the prevention and treatment of multiple sclerosis (ms) and other demyelinating, inflammatory and neurodegenerative diseases | |
| RU2772214C2 (ru) | Функционализированные сахариды в качестве противовоспалительных средств | |
| AU2018262790B2 (en) | Functionalized saccharides as anti-inflammatory agents | |
| JP4556009B2 (ja) | 抗炎症剤、アレルギー性疾患予防又は改善剤及び機能性食品 | |
| JPH08502295A (ja) | 悪液質の治療およびil−6活性の阻害 | |
| US12064405B2 (en) | Immunosuppressant comprising TSAHC or a pharmaceutically acceptable salts thereof as an active ingredient | |
| US20230136177A1 (en) | Immunomodulating o-het/aryl azalides | |
| JP2006509756A (ja) | 炎症性疾患の治療におけるcrh(副腎皮質刺激ホルモン放出ホルモン)−ucn(ウロコルチン)系の使用 | |
| WO2020247758A1 (en) | Compounds and methods for the treatment of parasitic infections | |
| JP2022502501A (ja) | 新規使用 | |
| KR20200049361A (ko) | 피라졸-온 유도체를 유효성분으로 포함하는 자가면역질환의 예방, 개선 또는 치료용 조성물 | |
| JP2021530512A (ja) | 体重増加を抑制するためのロイテリサイクリンまたはラクトバチルス・ロイテリ | |
| KR101192063B1 (ko) | 염증성 질환의 예방 및 치료용 약제학적 조성물 | |
| TW202104204A (zh) | 用於肝病治療或預防的化合物 |