KR20220143732A - 고양이과에서 심장 질환을 예방 및/또는 치료하기 위한 sglt-2 억제제의 사용 - Google Patents
고양이과에서 심장 질환을 예방 및/또는 치료하기 위한 sglt-2 억제제의 사용 Download PDFInfo
- Publication number
- KR20220143732A KR20220143732A KR1020227032316A KR20227032316A KR20220143732A KR 20220143732 A KR20220143732 A KR 20220143732A KR 1020227032316 A KR1020227032316 A KR 1020227032316A KR 20227032316 A KR20227032316 A KR 20227032316A KR 20220143732 A KR20220143732 A KR 20220143732A
- Authority
- KR
- South Korea
- Prior art keywords
- formula
- cardiomyopathy
- hydroxy
- sglt
- inhibitor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/351—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom not condensed with another ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/34—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide
- A61K31/341—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide not condensed with another ring, e.g. ranitidine, furosemide, bufetolol, muscarine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
- A61K31/381—Heterocyclic compounds having sulfur as a ring hetero atom having five-membered rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/401—Proline; Derivatives thereof, e.g. captopril
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4422—1,4-Dihydropyridines, e.g. nifedipine, nicardipine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/501—Pyridazines; Hydrogenated pyridazines not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/554—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having at least one nitrogen and one sulfur as ring hetero atoms, e.g. clothiapine, diltiazem
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/58—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids containing heterocyclic rings, e.g. danazol, stanozolol, pancuronium or digitogenin
- A61K31/585—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids containing heterocyclic rings, e.g. danazol, stanozolol, pancuronium or digitogenin containing lactone rings, e.g. oxandrolone, bufalin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/60—Salicylic acid; Derivatives thereof
- A61K31/612—Salicylic acid; Derivatives thereof having the hydroxy group in position 2 esterified, e.g. salicylsulfuric acid
- A61K31/616—Salicylic acid; Derivatives thereof having the hydroxy group in position 2 esterified, e.g. salicylsulfuric acid by carboxylic acids, e.g. acetylsalicylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/7056—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing five-membered rings with nitrogen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/726—Glycosaminoglycans, i.e. mucopolysaccharides
- A61K31/727—Heparin; Heparan
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/545—Heterocyclic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Cardiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Heart & Thoracic Surgery (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Hospice & Palliative Care (AREA)
- Dermatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은, 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태의 사용에 관한 것이다.
Description
본 발명은, 의학 분야, 특히 수의학 분야에 관한 것이다. 본 발명은, 고양이과의 심장 질환의 예방 및/또는 치료에서의, SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태의 사용에 관한 것이다.
심장 질환은 애완 고양이의 가장 흔한 질환 중 하나이며, 모든 고양이의 10 내지 15%에 영향을 미친다(Freeman et al., Cardiol Res. 2017, 8(4): 139-142; Payne JR et al., J Vet Cardiol 2015, 17(Suppl1): S244-S257).
고양이과의 심장 질환은 선천성 심장 질환과 후천성 심장 질환으로 나뉜다. 대부분의 심장 질환은 만성이고, 치료가 불가능하며, 시간이 지남에 따라 진행된다. 무증상 단계 후, 심부전의 임상 징후 및 궁극적으로는 심장 사망이 발생할 수 있다. 심장 질환의 일반적인 증상은 불량한 일반 상태, 허약, 혼수, 우울증, 거식증, 빈맥, 빈호흡, 호흡 곤란, 울혈, 부종, 낮은 말초 혈압 및 급성 후방 불완전 마비 또는 마비이다. 심근병증은 고양이에서 가장 흔한 심장 질환이다. 심근병증은 원발성 심근병증(비대성 심근병증(HC/HCM/HOCM), 제한성 심근병증(RCM), 분류되지 않은 심근병증(UCM), 부정맥성 우심실 심근병증(ARVC) 및 확장성 심근병증(DCM)(이는 고양이에서 매우 드묾), 및 영양 장애(타우린 결핍), 대사 장애(갑상선기능 항진증, 말단 비대증), 침윤성 과정(신생물, 아밀로이드증) 및 염증 과정(독소, 면역 반응, 감염원)으로 인한 이차 심근병증으로 분류된다. 심근병증의 분류는 심장초음파 계측에 기초한다. 고양이는 가장 일반적으로는 비대성 심근병증(HCM)에 영향을 받으며, 일반 애완용 고양이 집단에서 10 내지 15%의 유병률을 보인다. 그러나, 유전 형태로 인해 메인 쿤 고양이, 페르시안, 랙돌 및 스핑크스와 같은 품종은 위험이 더 높다.
심장 질환은 고양이에서 흔하지만, 인간의 심부전 발병의 주요 위험 요소인 죽상 동맥 경화증은 고양이에게 현저히 부재한다. 이는 적어도 부분적으로는 이러한 종들이 높은 고밀도 지단백질 농도를 갖는다는 사실과 관련이 있다(Freeman et al., Cardiol Res. 2017, 8(4): 139-142). 인간과 달리, 고양이의 심근병증은 고양이과의 심부전의 주요 원인으로 생각되지만, 상이한 형태의 질환의 원인에 대해서는 알려진 바가 많지 않다.
임상 연구에 따르면 HCM이 있는 고양이의 중간 생존 시간은 연구된 집단의 주요 임상 징후(즉, 무증상 vs. 울혈성 심부전(CHF) vs. 동맥 혈전색전증(ATE))에 따라 92일 내지 2,153일의 범위이다(Atkins CE et al., J Am Vet Med Assoc. 1992, 201(4): 613-618; Rush JE et al., J Am Vet Med Assoc. 2002, 220(2): 202-207; Payne JR et al., J Vet Intern Med. 2013, 27(6): 1427-1436). HCM 및 심부전이 있는 고양이의 보고된 중간 생존 시간은 예를 들면 92일 내지 563일이다.
WO 2011/153953은 벤질벤젠 SGLT-2 억제제의 결정성 형태를 개시하며, 무엇보다도 인간의 만성 심부전 치료에 대해 언급한다.
그러나, SGLT2 억제제는 심부전으로 고통받는 인간 환자의 상이한 하위 집합들에 대한 임상 시험에서 사용되었다. 그러나, 인간 환자의 심근병증의 이러한 형태들은 시험 참여에 대한 제외 기준으로 정의된다(McMurray JJV et al., Eur. J. Heart Fail. 2019; 21: 665-675; page 667, table 1, item 9 참조).
추가의 선행 기술은 다음과 같다.
US 2019/076395는 제2형 또는 제1형 진성 당뇨병이 없는 동물, 당뇨병 전증이 있는 동물 또는 제2형 또는 제1형 진성 당뇨병 또는 당뇨병 전증이 있는 동물에서 심부전, 심근 경색증, 심혈관 질환 또는 심혈관 사망을 치료, 이의 위험의 감소 및/또는 이를 예방하기 위한 특정 SGLT-2 억제제, 예를 들면 에르투글리플로진 또는 이의 약제학적으로 허용되는 염 또는 공결정의 용도를 개시한다.
US 2015/164856은 고양이과 동물의 대사 장애의 치료 및/또는 예방에 사용하기 위한 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태를 개시하며, 상기 대사 장애는 케톤산증, 당뇨병 전증, 제1형 또는 제2형 진성 당뇨병, 인슐린 저항성, 비만, 고혈당증, 내당능 장애, 고인슐린혈증, 이상지질혈증, 이상아디포킨혈증(dysadipokinemia), 무증상 염증, 전신 염증, 저등급 전신 염증, 간 지질증, 동맥 경화증, 췌장의 염증, 신경병증 및/또는 증후군 X(대사 증후군) 및/또는 췌장 베타 세포 기능의 상실로 이루어지는 그룹으로부터 선택되는 하나 이상이고/이거나 대사 장애의 완화, 바람직하게는 당뇨병 완화가 달성 및/또는 유지된다.
회니크 엠(Hoenig M) 등(J Vet Pharmacol Therapeutics 2018, 41(2): 266-273)은 고양이의 당뇨병의 치료에 대한 치료 가능성이 있는 SGLT-2 억제제 벨라글리플로진의 효과를 개시한다.
US 2016/000816은, 예를 들면, 제1형 또는 제2형 당뇨병 환자의 산화 스트레스를 치료 및/또는 예방하기 위한 특정 SGLT-2 억제제, 및 예를 들면, 제1형 또는 제2형 당뇨병 환자의 심혈관 질환의 치료 및/또는 예방에서의 상기 SGLT-2 억제제의 용도를 개시한다.
US 2017/266152는 환자에게 엠파글리플로진을 투여함으로써, 박출률이 보존되거나 감소된 환자에서, 급성 또는 만성 심부전을 예방 또는 치료하고, 심혈관 사망, 심부전으로 인한 입원 및 기타 병태의 위험을 감소시키는 방법을 개시한다.
US 2011/098240은 SGLT2 억제제를 DPP IV 억제제와 병용하여 포함하는 약제학적 조성물을 개시하며, 이는 1형 진성 당뇨병, 2형 진성 당뇨병, 내당능 장애 및 고혈당증으로부터 선택되는 하나 이상의 병태의 치료 또는 예방에 적합하다.
산토스-갈레고 씨쥐(Santos-Gallego CG) 등(J American College Cardiol 2019, 73(15): 1931-1944)은 엠파글리플로진이 심근 에너지학(energetic)을 향상시켜 비당뇨병성 심부전에서 좌심실 재형성을 역으로 개선한다고 개시한다.
마쓰무라 케이(Matsumura K) 등(Cardiovascular Ultrasound 2019, 17(1): 26)은 SGLT-2 억제제의 심장 기능 및 심혈관 결과에 대한 효과를 개시한다.
실바 쿠스토디오 주니어 제이(Silva Custodio Jr J) 등(Heart Failure Reviews 2018, 23(3): 409-418)은 SGLT-2의 억제 및 심부전의 현재 개념을 개시한다.
리틀 씨제이엘(Little CJL) 등(J Small Anim Prac 2008, 49(1): 17-25)은, 심부전이 당뇨병 고양이에서 흔하다고 개시하며, 이는 초기 진단 실시(first opinion practice)에서의 회고적 사례 대조 연구로부터의 소견이다.
따라서, 선행 기술의 문제를 극복하는, 고양이과의 심장 질환의 예방 및/또는 치료에 대한 의학적 요구가 있다.
본 발명은, 고양이과 동물의 하나 이상의 심장 질환의 예방 및/또는 치료 방법에 사용하기 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약(medicament)을 제조하기 위한 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
일 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 하나 이상의 심장 질환은 심부전, 하나 이상의 심근병증으로 인한 심부전, 비대성 심근병증(HCM)으로 인한 심부전, 제한성 심근병증(RCM)으로 인한 심부전, 확장성 심근병증(DCM)으로 인한 심부전, 분류되지 않은 심근병증(UCM)으로 인한 심부전, 부정맥성 우심실 심근병증(ARVC)으로 인한 심부전, 비대성 심근병증(HCM), 제한성 심근병증(RCM), 확장성 심근병증(DCM), 분류되지 않은 심근병증(UCM) 및/또는 부정맥성 우심실 심근병증(ARVC)으로 이루어지는 그룹으로부터; 바람직하게는 하나 이상의 심근병증으로 인한 심부전, 비대성 심근병증(HCM)으로 인한 심부전, 비대성 심근병증(HCM)으로 이루어지는 그룹으로부터 선택된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
일 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 하나 이상의 심장 질환은 하나 이상의 심근병증으로 인한 심부전, 비대성 심근병증(HCM)으로 인한 심부전, 제한성 심근병증(RCM)으로 인한 심부전, 확장성 심근병증(DCM)으로 인한 심부전, 분류되지 않은 심근병증(UCM)으로 인한 심부전, 부정맥성 우심실 심근병증(ARVC)으로 인한 심부전, 비대성 심근병증(HCM), 제한성 심근병증(RCM), 확장성 심근병증(DCM), 분류되지 않은 심근병증(UCM) 및/또는 부정맥성 우심실 심근병증(ARVC)으로 이루어지는 그룹으로부터 선택된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
일 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 하나 이상의 심장 질환은 비대성 심근병증(HCM)으로 인한 심부전 및 비대성 심근병증(HCM)으로 인한 심부전으로 이루어지는 그룹으로부터 선택된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
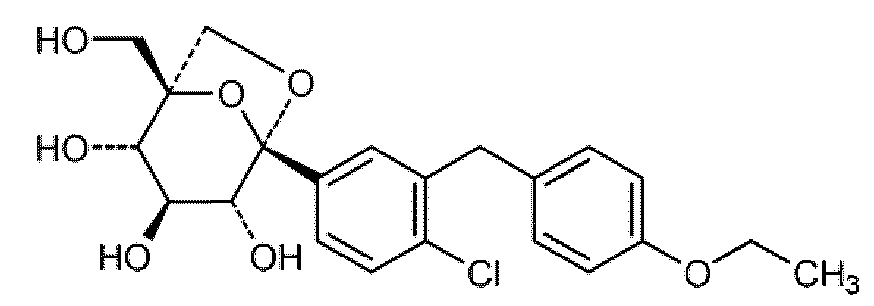
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 하나 이상의 SGLT-2 억제제는 글루코피라노실-치환된 벤젠 유도체이다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 하나 이상의 SGLT-2 억제제는 다음으로 이루어지는 그룹으로부터 선택된다:
(1) 화학식 (1)의 글루코피라노실-치환된 벤젠 유도체
[화학식 (1)]
(상기 화학식 (1)에서,
R1은 시아노, Cl 또는 메틸(가장 바람직하게는 시아노)을 나타내고;
R2는 H, 메틸, 메톡시 또는 하이드록시(가장 바람직하게는 H)를 나타내고;
R3는 사이클로프로필, 수소, 불소, 염소, 브롬, 요오드, 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, 이소-부틸, tert-부틸, 3-메틸-부트-1-일, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 1-하이드록시-사이클로프로필, 1-하이드록시-사이클로부틸, 1-하이드록시-사이클로펜틸, 1-하이드록시-사이클로헥실, 에티닐, 에톡시, 디플루오로메틸, 트리플루오로메틸, 펜타플루오로에틸, 2-하이드록시-에틸, 하이드록시메틸, 3-하이드록시-프로필, 2-하이드록시-2-메틸-프로프-1-일, 3-하이드록시-3-메틸-부트-1-일, 1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-트리플루오로메틸-에틸, 2-메톡시-에틸, 2-에톡시-에틸, 하이드록시, 디플루오로메틸옥시, 트리플루오로메틸옥시, 2-메틸옥시-에틸옥시, 메틸설파닐, 메틸설피닐, 메틸설포닐, 에틸설피닐, 에틸설포닐, 트리메틸실릴, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시 또는 시아노를 나타내고,
R3는 바람직하게는 사이클로프로필, 에틸, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시로부터 선택되고,
가장 바람직하게는 R3는 사이클로프로필이다)
또는
이의 유도체
(여기서, β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화된다)
(2) 화학식 (2)로 나타내어지는 벨라글리플로진
[화학식 (2)]
(3) 화학식 (3)으로 나타내어지는 다파글리플로진
[화학식 (3)]
(4) 화학식 (4)로 나타내어지는 카나글리플로진
[화학식 (4)]
(5) 화학식 (5)로 나타내어지는 엠파글리플로진
[화학식 (5)]
(6) 화학식 (6)으로 나타내어지는 루세오글리플로진
[화학식 (6)]
(7) 화학식 (7)로 나타내어지는 토포글리플로진
[화학식 (7)]
(8) 화학식 (8)로 나타내어지는 이프라글리플로진
[화학식 (8)]
(9) 화학식 (9)로 나타내어지는 에르투글리플로진
[화학식 (9)]
(10) 화학식 (10)으로 나타내어지는 아티글리플로진
[화학식 (10)]
(11) 화학식 (11)로 나타내어지는 레모글리플로진
[화학식 (11)]
(11A) 화학식 (11A)로 나타내어지는 레모글리플로진 에타보네이트
[화학식 (11A)]
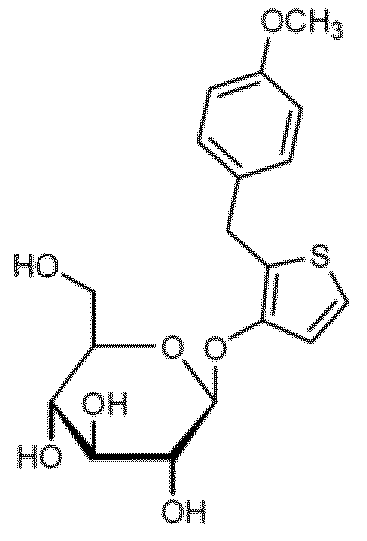
(12) 화학식 (12)의 티오펜 유도체
[화학식 (12)]
상기 화학식 (12)에서,
R은 메톡시 또는 트리플루오로메톡시를 나타낸다.
(13) 화학식 (13)으로 나타내어지는 1-(β-D-글루코피라노실)-4-메틸-3-[5-(4-플루오로페닐)-2-티에닐메틸]벤젠
[화학식 (13)]
(14) 화학식 (14)의 스피로케탈 유도체
[화학식 (14)]
상기 화학식 (14)에서,
R은 메톡시, 트리플루오로메톡시, 에톡시, 에틸, 이소프로필 또는 tert. 부틸을 나타낸다.
(15) 화학식 (15)의 피라졸-O-글루코사이드 유도체
[화학식 (15)]
상기 화학식 (15)에서,
R1은 C1-3-알콕시를 나타내고;
L1 및 L2는 서로 독립적으로, H 또는 F를 나타내고;
R6은 H, (C1-3-알킬)카보닐, (C1-6-알킬)옥시카보닐, 페닐옥시카보닐, 벤질옥시카보닐 또는 벤질카보닐을 나타낸다.
(16) 화학식 (16)으로 나타내어지는 소타글리플로진
[화학식 (16)]
(17) 화학식 (17)로 나타내어지는 세르글리플로진
[화학식 (17)]
(18) 화학식 (18)로 나타내어지는 화합물
[화학식 (18)]
(상기 화학식 (18)에서,
R3는 사이클로프로필, 수소, 불소, 염소, 브롬, 요오드, 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, 이소-부틸, tert-부틸, 3-메틸-부트-1-일, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 1-하이드록시-사이클로프로필, 1-하이드록시-사이클로부틸, 1-하이드록시-사이클로펜틸, 1-하이드록시-사이클로헥실, 에티닐, 에톡시, 디플루오로메틸, 트리플루오로메틸, 펜타플루오로에틸, 2-하이드록시-에틸, 하이드록시메틸, 3-하이드록시-프로필, 2-하이드록시-2-메틸-프로프-1-일, 3-하이드록시-3-메틸-부트-1-일, 1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-트리플루오로메틸-에틸, 2-메톡시-에틸, 2-에톡시-에틸, 하이드록시, 디플루오로메틸옥시, 트리플루오로메틸옥시, 2-메틸옥시-에틸옥시, 메틸설파닐, 메틸설피닐, 메틸설포닐, 에틸설피닐, 에틸설포닐, 트리메틸실릴, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시 또는 시아노를 나타내고,
R3는 바람직하게는 사이클로프로필, 에틸, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시이고,
R3는 가장 바람직하게는 사이클로프로필이다)
또는
이의 유도체
(여기서, β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화된다)
(19) 화학식 (19)로 나타내어지는 벡사글리플로진
[화학식 (19)]
(20) 화학식 (20)으로 나타내어지는 자나글리플로진
[화학식 (20)]
(21) 롱글리플로진 및
(22) 완파글리플로진.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 SGLT-2 억제제의 약제학적으로 허용되는 형태는 하나 이상의 SGLT2 억제제와 하나 이상의 아미노산, 바람직하게는 프롤린, 보다 바람직하게는 L-프롤린과의 사이의 결정성 복합체이고; 가장 바람직하게는 하나 이상의 SGLT2 억제제, L-프롤린 및 결정성 물의 공결정이다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이며, 여기서, 고양이과 동물은 이러한 예방 및/또는 치료를 필요로 하는 고양이과 환자이고; 바람직하게는 이러한 예방 및/또는 치료를 필요로 하는 고양이이고, 보다 바람직하게는 이러한 예방 및/또는 치료를 필요로 하는 비당뇨병 고양이이다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 하나 이상의 SGLT-2 억제제는 경구, 비경구, 정맥내, 피하 또는 근육내 투여되고, 바람직하게는 경구 투여된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 하나 이상의 SGLT-2 억제제는 0.01 내지 10mg/kg 체중, 바람직하게는 0.01 내지 5mg/kg 체중, 보다 바람직하게는 0.01 내지 4mg/kg 체중, 보다 더 바람직하게는 0.01 내지 3mg/kg 체중, 보다 더 바람직하게는 0.01 내지 2mg/kg 체중, 보다 더 바람직하게는 0.01 내지 1mg/kg 체중, 보다 더 바람직하게는 0.1 내지 1mg/kg 체중, 가장 바람직하게는 0.5 내지 1mg/kg 체중의 용량으로 투여된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태는 1일 1회만 또는 2회 투여된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 하나 이상의 SGLT-2 억제제는 벨라글리플로진이고, 벨라글리플로진은, 단일 SGLT-2 억제제로서, 바람직하게는 경구로, 보다 바람직하게는 0.1 내지 1mg/kg 체중의 용량으로, 보다 더 바람직하게는 0.5 내지 1mg/kg 체중의 용량으로 1일 1회 또는 2회 투여된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 하나 이상의 SGLT-2 억제제는 하나 이상의 다른 활성 약제학적 성분, 바람직하게는 이뇨제, 예를 들면, 푸로세미드, 토라세미드 또는 스피로노락톤; 베타-차단제, 예를 들면, 아테놀롤 또는 프로프라놀롤; 칼슘 채널 차단제, 예를 들면, 딜티아젬; ACE 억제제, 예를 들면, 베나제프릴, 라미프릴 또는 에날라프릴; 안지오텐신 수용체 차단제, 예를 들면, 텔미사르탄; 항부정맥제, 예를 들면, 플레카이나이드; 혈소판 응집 억제제, 예를 들면, 클로피도그렐; 비스테로이드성 항염증제(NSAID), 예를 들면, 아스피린; 항응고제, 예를 들면, 쿠마린(비타민 K 길항제), (저분자량) 헤파린, 인자 Xa의 합성 오당류 억제제, 및 직접 인자 Xa 억제제 및/또는 직접 트롬빈 억제제; 및/또는 칼슘 채널 증감제 및/또는 양성 수축제, 예를 들면, 피모벤단 및/또는 디기탈리스 알칼로이드를 투여하기 전에, 후에 또는 이와 동시에 투여된다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
다른 측면에서, 본 발명은 또한, 본원에 개시되고/되거나 청구되는 용도를 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태에 관한 것이고, 여기서, 상기 예방 및/또는 치료 효과는 다음 임상적 파라미터 및/또는 생화학적 파라미터들 중 하나 이상을 특징으로 한다:
- [심박출량/소모된 대사 기질]의 증가된 비를 특징으로 하고/하거나 [심박출량/소비된 산소]의 증가된 비를 특징으로 하는, 개선된 심장대사 효율;
- 3-하이드록시부티르산 및/또는 상응하는 아실카르니틴, 즉 하이드록시부티릴카르니틴의 증가된 혈장 수준 및 분지쇄 아미노산 발린, 류신 및/또는 이소류신 중 하나 이상의 증가된 혈장 수준을 특징으로 하는, 간에서의 케톤체 생성의 증가;
- 감소된 전부하 및/또는 후부하, 개선된 동맥 벽 구조 기능을 달성함에 의한, 개선된 심장 기능;
- 개선된 심장초음파 파라미터, 예를 들면, 감소된 LA(우측 흉골 단축으로 계측되는 좌심방 치수), LA/Ao(좌심방 대 대동맥 비; Ao = 대동맥 뿌리 직경), IVSd(심실 중격 말단 이완기 치수, 즉 심실 중격의 두께) 및/또는 LAD(우측 흉골 장축으로 계측되는 좌심방), 및 개선된 심장 바이오마커, 예를 들면, 감소된 NT-proBNP(뇌 나트륨 이뇨 펩티드의 N-말단 프로호르몬) 및/또는 감소된 cTnI(심장 트로포닌 I), 및 개선된 심장 잡음;
- 상이한 표현형들의 심근병증의, 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상의 발병 지연, 또는 심지어 상이한 표현형들의 심근병증의 진행 중단;
- 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상 더 길어진 생존 시간, 및/또는 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상의 다음 에피소드의 지연 및/또는 더 낮은 수준의 심장 사망률 및/또는 이환율 또는
- 삶의 질 향상.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 본원에 개시되고/되거나 청구되는 바와 같이 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 본원에 개시되고/되거나 청구되는 바와 같이 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
본 발명은 또한, 본원에 개시되고/되거나 청구되는 바와 같이 사용하기 위한, 본원에 개시되고/되거나 청구되는 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태를 포함하는 약제학적 조성물에 관한 것이다.
고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하는 상응하는 방법으로서, 하나 이상의 SGLT-2 억제제를 상기 고양이과 동물에 투여함을 포함하는 상기 방법, 및 고양이과 동물에서 하나 이상의 심장 질환을 예방 및/또는 치료하기 위한 의약을 제조하기 위한, 하나 이상의 SGLT-2 억제제의 상응하는 용도도 본 발명에 포함하고자 한다.
본 발명에 따른 이점은 다음 이점들 중 하나 이상이다:
- 고양이의 간에서 케톤체(심장 세포의 에너지원으로 사용될 수 있음) 생성의 예상치 못한 증가로 인한 심장 질환이 있는 고양이에서의 SGLT-2 억제에 의하고, 다른 종, 예를 들면, 말에서의 동일한 화합물의 경우와는 다르며, 심부전의 원인 및 심근병증의 표현형과 관계없이 쇠약해진 고양이과 심장이 손상된 심장 기능에 대해 대처하도록 돕는, 향상된 심장 대사 효율
- 감소된 전부하 및/또는 후부하, 개선된 동맥 벽 구조 기능을 달성함에 의해, 궁극적으로는 심부전 및 심장사를 초래하는 수 있는 상이한 표현형들의 심근병증의 진행을 지연시키거나 심지어 정지시키는, 심장 질환이 있는 고양이의 심장 기능의 개선
- 개선된 심장초음파 파라미터, 예를 들면, 감소된 LA(우측 흉골 단축으로 계측되는 좌심방 치수), LA/Ao(좌심방 대 대동맥 비; Ao = 대동맥 뿌리 직경), IVSd(심실 중격 말단 이완기 치수, 즉 심실 중격의 두께) 및/또는 LAD(우측 흉골 장축으로 계측되는 좌심방), 및 개선된 심장 바이오마커, 예를 들면, 감소된 NT-proBNP(뇌 나트륨 이뇨 펩티드의 N-말단 프로호르몬) 및/또는 감소된 cTnI(심장 트로포닌 I), 및 개선된 심장 잡음
- 심상 질환이 있는 고양이의, 상이한 표현형들의 심근병증의 임상 징후가 감소된 또는 심지어 임상 징후가 없이, 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상 더 길어진 생존 시간, 및/또는 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상의 심부전의 다음 에피소드의 지연 및/또는 더 낮은 수준의 심장 사망률 및/또는 이환율
- 심상 질환이 있는 고양이의, 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상의 임상 증상의 발병 지연, 또는 심지어 상이한 표현형들의 심근병증의 진행 중단
- 심상 질환이 있는 고양이의 삶의 질 향상.
본 발명의 실시예를 더욱 상세히 설명하기 전에, 본 명세서 및 첨부된 청구범위에 사용되는 단수 형태 "a", "an" 및 "the"는, 문맥이 달리 명확하게 지시하지 않는 한, 복수의 대상을 포함한다는 점에 유의해야 한다.
달리 정의하지 않는 한, 본원에서 사용되는 모든 기술 용어 및 과학 용어는 본 발명이 속하는 기술 분야의 당업자에 의해 일반적으로 이해되는 것과 동일한 의미를 갖는다. 모든 주어진 범위들 및 값들은 달리 표시되지 않거나 당업자에 의해 달리 공지되지 않는 한, 1 내지 5% 변할 수 있으므로, 용어 "약"은 일반적으로 본 명세서 및 청구범위에서 생략되었다. 본원에 기술된 것과 유사하거나 등가인 임의의 방법 및 재료가 본 발명의 실시 또는 시험에서 사용될 수 있지만, 바람직한 방법, 장치 및 재료가 지금부터 기술된다. 본원에 언급되는 모든 간행물은, 본 발명과 관련하여 사용될 수 있는 간행물에 보고된 물질, 부형제, 담체 및 방법론을 설명하고 개시하기 위해 인용에 의해 본원에 포함된다. 본 명세서의 어떠한 내용도, 본 발명이 선행 발명으로 인해 이의 개시보다 선행할 자격이 없음을 인정하는 것으로 해석되어서는 안 된다.
고양이에서 가장 흔히 볼 수 있는 심부전의 징후는 호흡 문제(difficult breathing)(호흡 곤란) 및/또는 빠른 호흡(빈호흡)이다. 이는 일반적으로 폐 주변의 흉강의 체액 축적(흉막 삼출이라고 함)에 의해 또는 폐 자체 내부의 체액 축적(폐 부종이라고 함)으로 인해 발생한다. 호흡 문제와 함께, 고양이는 말단(예를 들면, 귀 및 발)이 차가울 수 있고, 창백한 점막(잇몸 및 눈)이 있을 수 있으며, 이는 혈액 순환이 좋지 않은 것을 암시한다. 종종 입과 눈의 점막, 심지어 피부에도 청색증(푸르스름한 색상)의 징후가 나타날 수 있다. 심부전의 이러한 모든 임상 징후는, SGLT2 억제제로 치료한 후, 고양이에서 개선되거나, 치료되지 않은 질환 발달 과정에 비해 발병이 임상적으로 지연된다.
심근병증과 같은 심장 질환의 영향을 받는 고양이에서 발생할 수 있으며, 종종 근본적인 심장 질환의 첫 번째 지표가 될 수 있는 다른 징후는 '고양이과 대동맥 혈전색전증(FATE)'으로 알려진 발병이다. 심근병증이 있는 고양이의 심장의 방(chamber)들 중 하나(일반적으로 좌심방) 내에 혈전(혈액 응고(clot))이 발생할 수 있다. 이는 주로 혈액이 심장을 정상적으로 통과하여 유동하지 않기 때문에 발생한다. 혈전 또는 응고는 처음에는 심장 벽에 부착되지만, 분리되어(dislodged) 심장을 떠나는 혈액 내로 이동될 수 있다. 혈액 순환 내로 이동하는 혈전을 색전이라고 하므로, '혈전색전증'이라는 용어가 사용된다. 이러한 색전은, 혈액 순환에 들어가면 소동맥에 머물어 신체 영역으로의 혈액 유동을 방해할 수 있다. 이는 여러 상이한 부위들에서 발생할 수 있지만, 심장을 떠나는 주 동맥(대동맥)의 말단으로 향할 때, 뒷다리에 혈액을 공급하기 위해 분할되기 때문에, 보다 더 일반적으로 발생한다. 이러한 합병증은 HCM에서 가장 흔히 볼 수 있으며, 한쪽 또는 양쪽 뒷다리에 갑자기 마비가 발생하여 심한 통증과 상당한 고통을 느끼게 된다. 또한, 이러한 심부전의 임상 징후는 SGLT2 억제제로 치료한 후의 고양이에서 개선되거나, 치료되지 않은 질환 발달 과정에 비해 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상 발병이 임상적으로 지연된다. 전반적으로, SGLT2 억제제 치료 후 고양이의 생존 시간은, 심근병증이 있는 치료를 받지 않은 고양이와 비교하여, 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상, 바람직하게는 적어도 6개월 임상적으로 관련하여 증가했다.
본 발명에서, 용어 "고양이과 동물" 또는 "고양이과"는 고양이과(Felidae family)(즉, 고양이과 동물)의 모든 구성원을 나타낸다. 따라서, 상기 용어는 고양이아과 또는 표범아과에 속할 수 있다. 용어 고양이과 동물은 용어 고양이, 예를 들면, 집 고양이를 포함한다. 용어 집 고양이는 용어 펠리스 카투스(Felis catus) 및 펠리스 실베스트리스 카투스(Felis silvestris catus)를 포함한다. 가장 바람직하게는, 고양이과 동물 또는 고양이과는 고양이, 특히 집 고양이이다.
본 발명에서, 용어 "심장 질환(heart disease)"은 "심장 질환(cardiac disease)"과 동의어로, 심장의 구조 및 기능에 영향을 미치는 심장 자체의 모든 장애 및 기형을 나타낸다. 장기의 상이한 부분들에 영향을 미치고, 선천성 심장 질환(예를 들면, 중격 결손, 폐색 결손), 부정맥(예를 들면, 빈맥, 서맥 및 세동) 및 심근병증을 포함하여 상이한 방식들로 발생하는 많은 유형의 심장 질환이 있다.
본 발명에서, 울혈성 심부전(congestive heart failure) 및 울혈성 심부전(congestive cardiac failure)으로도 알려진 용어 "심부전"은, 심장이, 말초 조직 및 기관의 대사 요구 사항(산소 및 기질)을 충족시키도록 신체를 통과하는 혈류를 충분히 펌핑할 수 없는 병태생리학적 과정을 나타낸다. 또한, 심장의 비정상적인 구조 또는 기능에 기초하며, 운동 불내성, 호흡 곤란, 피로, 체액 저류 및 감소된 수명과 같은 증상을 특징으로 하는 복합 임상 증후군으로 정의될 수 있다. 심부전은, 수축기의 심장 밖으로의 혈액의 분출이 영향을 받는 수축기 부전과, 심장이, 이완기 동안 낮은 압력의 심실 강으로 충분한 혈액을 공급받을 수 없는 이완기 부전으로 나눌 수 있다. 심부전은 주로 심장의 만성적인 작업 과부하로 인한 만성 질환이거나, 체액 과부하, 판막 기능 장애 또는 심근 경색으로 인한 급성 혈역학적 스트레스 후에 발생한다.
본 발명에서, 용어 "심근병증"은 심장 근육에 영향을 미치는 질환 그룹을 나타내며, 이는 고양이에게서 가장 흔히 볼 수 있는 심장 질환이며, 심부전의 가장 흔한 원인이다. 심근병증은 심장 근육의 구조 및 기능에 미치는 영향에 따라 설명된다. 심근병증의 유형은 비대성 심근병증(HCM), 제한성 심근병증(RCM), 분류되지 않은 심근병증(UCM), 부정맥성 우심실 심근병증(ARVC) 및 확장성 심근병증(DCM)을 포함한다. 분류는 심장초음파 계측에 기초한다.
비대성 심근병증(HCM)은 가장 흔한 고양이과 심장 장애이다. 비대성 심근병증은 가장 일반적으로는 중년 고양이(평균 6.5세)에 영향을 미치지만, 모든 연령대가 영향을 받는다. 수컷 소인이 있다(>75%). 인간에서는, 사례 중 55%에서 HCM에 대한 주요한 유전적 소인이 있다. 사람들에서, 이러한 장애는 선천적일 수 있거나 후천적일 수 있으며, 아마도 질환들의 그룹을 나타낸다. 고양이과의 HCM의 병인은 알려져 있지 않지만, 페르시안 및 메인 쿤 고양이는 일부 일련의 경우에서 소인이 있는 것으로 보이며, 이는 유전적 영향을 시사한다. 전신성 고혈압, 갑상선 기능 항진증 및 대동맥 협착증이 있는 경우와 마찬가지로, HCM은 현저한 좌심실 비대와 관련이 있지만, 이 경우 근본적인 원인을 확인할 수 없다. 심장 병변은 심한 좌심실 동심 비대 및 이차 좌심방 확장으로 대표된다. HCM이 있는 개 및 인간 대부분에서 나타나는 비대칭 중격 비대(ASH)는 HCM이 있는 고양이의 30%에서만 나타난다. 조직학적 심장 근섬유 이상배열(disarray)은 영향을 받은 고양이 중 27%에서 보고되며, 비대칭 중격 비대가 있는 고양이에서만 보고된다. 고양이과 HCM의 다른 조직학적 특징은 심근 및 심내막 섬유증 및 좁아진 관상 동맥을 포함한다. 동적 대동맥 유출 폐색, 이차 승모판 기능 부족, 심근 허혈 및 전신 동맥 색전증(SAE)이 이러한 증후군을 복잡하게 만들 수 있다. 좌측 심장이 주로 영향을 받으며, 임상 징후는 돌연사, 또는 더 일반적으로는 이완기 기능 장애로 인한 급성 좌심부전으로 나타난다. 흉막 삼출은 때때로 HCM과 관련이 있다. 수축기 기능은 일반적으로 적절하거나 향상된다. 스트레스가 많은 사건, 예를 들면, 자동차 타기, ECG를 위한 결박, 개와의 대면 또는 색전증 사건은 좌심부전 및 폐 부종을 촉발할 수 있다.
비대성 폐색성 심근병증(HOCM)은 좌심실의 대동맥 내로의 출류(outflow) 폐색이 동반된 좌심실 비대를 특징으로 한다. 폐색의 정도 및 임상적 표현은 비대의 정도에 따른다. 좌심실의 모든 부분이 영향을 받을 수 있지만, 가장 일반적으로는 심실 중격에 영향을 미친다.
제한성 심근병증(RCM)은, 섬유 조직 또는 다른 요소(component)에 의한 심근 내막, 심내막하 또는 심근의 침윤에 의해 심실 이완기 순응도가 손상되는 경우(즉, 강성이 증가하는 경우) 발생한다. 아밀로이드증 및 호산구성 침윤과 같은 특정 원인이 RCM의 원인인 인간의 의학과 달리, 고양이에서는 RCM의 특정 원인이 명확하게 정의되지 않았다. 좌심실 이완기 기능, DTI, 이완기 기능의 기타 간접적 계측을 직접 계측하기 위한 침습적 진단 절차, 또는 부검 검사를 사용하지 않으면서, 상기 장애를, 특발성인 분류되지 않은 심근병증의 형태 또는 형태들과 구별하는 것은 종종 불가능하다. 고양이과 RCM의 정확한 병인은 알려져 있지 않다. 그러나, 본질적으로 염증성일 수 있다는 약간의 증거가 있다.
확장성 심근병증(DCM)은 확장되거나 확대된(enlarged) 심장의 방들 및 감소된 수축능을 특징으로 한다. 1987년 이전에, DCM은 고양이에게 가장 흔한 심장 질환 중 하나였다. 이는 아미노산 타우린의 식이 결핍과 관련이 있는 것으로 추측된다. 오늘날 고양이에서의 DCM은 상대적으로 드문데, 이는 대부분의 고양이 사료 제조업체가 이들의 사료에 타우린 보충제를 추가하기 시작하여, 관계를 더욱 확고히 하기 시작했기 때문이다. 버미즈, 아비시니안 및 샴과 같은 일부 품종은 DCM의 영향을 보다 더 많이 받지만, 대부분의 경우 근본적인 원인은 알려져 있지 않다. 상기 질환은 일반적으로 2 내지 20세의 고양이에게 영향을 미치지만, 평균 발병 연령은 10세이다.
분류되지 않은 심근병증(UCM): 최근 몇 년 동안, 심장초음파 및 병리학적 기준을 사용해도 어떠한 인식된 질환 분류에도 맞지 않는 고양이의 수가 증가하고 있다. 일반적으로, 이러한 고양이는 심각한 양심방(biatrial)의 확대, 정상적인 좌심실 또는 약간의 비대, 및 정상적인 또는 약간 감소된 수축기 기능을 갖지만, 제한성 심근병증에서 볼 수 있는 전형적인 사후 섬유증 소견은 없다. 많은 고양이는 우심실이 확대되어 있다. 이러한 고양이가 다른 알려진 심근병증 상태의 진행성 또는 퇴행성 형태를 나타내는지는 알려져 있지 않다.
부정맥성 우심실 심근병증(ARVC): 이러한 형태의 심근병증이 최근 고양이에게서 보고되어 왔다. 병인은 알려져 있지 않지만, 가족성 형태가 인간에서 보고되어 있다. 심각한 우심방 및 심실 확대 및 삼첨판의 왜곡으로 인한 현저한 삼첨판 역류를 특징으로 하며; 부정맥이 일반적이다. ARVC의 경우는 이전에 삼첨판막 이형성증으로 오진되었을 수 있다.
본 발명에 따라 사용하기 위한 SGLT-2 억제제는, 예를 들면, WO 01/27128, WO 03/099836, WO 2005/092877, WO 2006/034489, WO 2006/064033, WO 2006/117359, WO 2006/117360, WO 2007/025943, WO 2007/028814, WO 2007/031548, WO 2007/093610, WO 2007/128749, WO 2008/049923, WO 2008/055870, WO 2008/055940, WO 2009/022020 또는 WO 2009/022008에 기재된 바와 같은 글루코피라노실-치환된 벤젠 유도체를 포함하지만 이에 제한되지 않는다.
또한, 본 발명에 따라 사용하기 위한 하나 이상의 SGLT-2 억제제는 다음 화합물 또는 이의 약제학적으로 허용되는 형태로 이루어지는 그룹으로부터 선택될 수 있다:
(1) 화학식 (1)의 글루코피라노실-치환된 벤젠 유도체
[화학식 (1)]
(상기 화학식 (1)에서,
R1은 시아노, Cl 또는 메틸(가장 바람직하게는 시아노)을 나타내고;
R2는 H, 메틸, 메톡시 또는 하이드록시(가장 바람직하게는 H)를 나타내고;
R3는 사이클로프로필, 수소, 불소, 염소, 브롬, 요오드, 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, 이소-부틸, tert-부틸, 3-메틸-부트-1-일, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 1-하이드록시-사이클로프로필, 1-하이드록시-사이클로부틸, 1-하이드록시-사이클로펜틸, 1-하이드록시-사이클로헥실, 에티닐, 에톡시, 디플루오로메틸, 트리플루오로메틸, 펜타플루오로에틸, 2-하이드록시-에틸, 하이드록시메틸, 3-하이드록시-프로필, 2-하이드록시-2-메틸-프로프-1-일, 3-하이드록시-3-메틸-부트-1-일, 1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-트리플루오로메틸-에틸, 2-메톡시-에틸, 2-에톡시-에틸, 하이드록시, 디플루오로메틸옥시, 트리플루오로메틸옥시, 2-메틸옥시-에틸옥시, 메틸설파닐, 메틸설피닐, 메틸설포닐, 에틸설피닐, 에틸설포닐, 트리메틸실릴, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시 또는 시아노를 나타내고,
R3는 바람직하게는 사이클로프로필, 에틸, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시로부터 선택되고,
가장 바람직하게는 R3는 사이클로프로필이다)
또는
이의 유도체
(여기서, β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화된다)
(2) 화학식 (2)로 나타내어지는 벨라글리플로진
[화학식 (2)]
(3) 화학식 (3)으로 나타내어지는 다파글리플로진
[화학식 (3)]
(4) 화학식 (4)로 나타내어지는 카나글리플로진
[화학식 (4)]
(5) 화학식 (5)로 나타내어지는 엠파글리플로진
[화학식 (5)]
(6) 화학식 (6)으로 나타내어지는 루세오글리플로진
[화학식 (6)]
(7) 화학식 (7)로 나타내어지는 토포글리플로진
[화학식 (7)]
(8) 화학식 (8)로 나타내어지는 이프라글리플로진
[화학식 (8)]
(9) 화학식 (9)로 나타내어지는 에르투글리플로진
[화학식 (9)]
(10) 화학식 (10)으로 나타내어지는 아티글리플로진
[화학식 (10)]
(11) 화학식 (11)로 나타내어지는 레모글리플로진
[화학식 (11)]
(11A) 화학식 (11A)로 나타내어지는 레모글리플로진 에타보네이트
[화학식 (11A)]
(12) 화학식 (12)의 티오펜 유도체
[화학식 (12)]
상기 화학식 (12)에서,
R은 메톡시 또는 트리플루오로메톡시를 나타낸다.
(13) 화학식 (13)으로 나타내어지는 1-(β-D-글루코피라노실)-4-메틸-3-[5-(4-플루오로페닐)-2-티에닐메틸]벤젠
[화학식 (13)]
(14) 화학식 (14)의 스피로케탈 유도체
[화학식 (14)]
상기 화학식 (14)에서,
R은 메톡시, 트리플루오로메톡시, 에톡시, 에틸, 이소프로필 또는 tert. 부틸을 나타낸다.
(15) 화학식 (15)의 피라졸-O-글루코사이드 유도체
[화학식 (15)]
상기 화학식 (15)에서,
R1은 C1-3-알콕시를 나타내고;
L1 및 L2는 서로 독립적으로, H 또는 F를 나타내고;
R6은 H, (C1-3-알킬)카보닐, (C1-6-알킬)옥시카보닐, 페닐옥시카보닐, 벤질옥시카보닐 또는 벤질카보닐을 나타낸다.
(16) 화학식 (16)으로 나타내어지는 소타글리플로진
[화학식 (16)]
(17) 화학식 (17)로 나타내어지는 세르글리플로진
[화학식 (17)]
(18) 화학식 (18)로 나타내어지는 화합물
[화학식 (18)]
(상기 화학식 (18)에서,
R3는 사이클로프로필, 수소, 불소, 염소, 브롬, 요오드, 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, 이소-부틸, tert-부틸, 3-메틸-부트-1-일, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 1-하이드록시-사이클로프로필, 1-하이드록시-사이클로부틸, 1-하이드록시-사이클로펜틸, 1-하이드록시-사이클로헥실, 에티닐, 에톡시, 디플루오로메틸, 트리플루오로메틸, 펜타플루오로에틸, 2-하이드록시-에틸, 하이드록시메틸, 3-하이드록시-프로필, 2-하이드록시-2-메틸-프로프-1-일, 3-하이드록시-3-메틸-부트-1-일, 1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-트리플루오로메틸-에틸, 2-메톡시-에틸, 2-에톡시-에틸, 하이드록시, 디플루오로메틸옥시, 트리플루오로메틸옥시, 2-메틸옥시-에틸옥시, 메틸설파닐, 메틸설피닐, 메틸설포닐, 에틸설피닐, 에틸설포닐, 트리메틸실릴, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시 또는 시아노를 나타내고,
R3는 바람직하게는 사이클로프로필, 에틸, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시이고,
R3는 가장 바람직하게는 사이클로프로필이다)
또는
이의 유도체
(여기서, β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화된다)
(19) 화학식 (19)로 나타내어지는 벡사글리플로진
[화학식 (19)]
(20) 화학식 (20)으로 나타내어지는 자나글리플로진
[화학식 (20)]
(21) 롱글리플로진 및
(22) 완파글리플로진.
본원에서 사용되는 용어 "벨라글리플로진"은 상기 구조의 화학식의 벨라글리플로진, 및 이의 수화물 및 용매화물을 포함하는 이의 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물, 이의 합성 방법 및 이의 공결정은 예를 들면, WO 2007/128749, WO 2014/016381 및 WO 2019/121509에 기재되어 있다.
본원에서 사용되는 용어 "다파글리플로진"은 상기 구조의 화학식의 다파글리플로진, 및 이의 수화물 및 용매화물을 포함하는 이의 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물 및 이의 합성 방법은 예를 들면, WO 03/099836에 기재되어 있다. 바람직한 수화물, 용매화물 및 결정성 형태는 예를 들면, 특허출원 WO 2008/116179 및 WO 2008/002824에 기재되어 있다.
본원에서 사용되는 용어 "카나글리플로진"은 상기 구조의 화학식의 카나글리플로진, 및 이의 수화물 및 용매화물을 포함하는 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물 및 이의 합성 방법은 예를 들면, WO 2005/012326 및 WO 2009/035969에 기재되어 있다. 바람직한 수화물, 용매화물 및 결정성 형태는 예를 들면, 특허출원 WO 2008/069327에 기재되어 있다.
본원에서 사용되는 용어 "엠파글리플로진"은 상기 구조의 화학식의 엠파글리플로진, 및 이의 수화물 및 용매화물을 포함하는 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물 및 이의 합성 방법은 예를 들면, WO 2005/092877, WO 2006/120208 및 WO 2011/039108에 기재되어 있다. 바람직한 결정성 형태는 예를 들면, 특허출원 WO 2006/117359 및 WO 2011/039107에 기재되어 있다.
본원에서 사용되는 용어 "아티글리플로진"은 상기 구조의 화학식의 아티글리플로진, 및 이의 수화물 및 용매화물을 포함하는 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물 및 이의 합성 방법은 예를 들면, WO 2004/007517에 기재되어 있다.
본원에서 사용되는 용어 "이프라글리플로진"은 상기 구조의 화학식의 이프라글리플로진, 및 이의 수화물 및 용매화물을 포함하는 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물 및 이의 합성 방법은 예를 들면, WO 2004/080990, WO 2005/012326 및 WO 2007/114475에 기재되어 있다.
본원에서 사용되는 용어 "토포글리플로진"은 상기 구조의 화학식의 토포글리플로진, 및 이의 수화물 및 용매화물을 포함하는 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물 및 이의 합성 방법은 예를 들면, WO 2007/140191 및 WO 2008/013280에 기재되어 있다.
본원에서 사용되는 용어 "루세오글리플로진"은 상기 구조의 화학식의 루세오글리플로진, 및 이의 수화물 및 용매화물을 포함하는 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다.
본원에서 사용되는 용어 "에르투글리플로진"은 상기 구조의 화학식의 에르투글리플로진, 및 이의 수화물 및 용매화물을 포함하는 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 상기 화합물은 예를 들면, WO 2010/023594에 기재되어 있다.
본원에서 사용되는 용어 "레모글리플로진"은 상기 구조의 화학식의 레모글리플로진, 및 레모글리플로진의 프로드럭, 특히 레모글리플로진 에타보네이트를 포함하고, 이의 수화물 및 용매화물을 포함하는 이의 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 이의 합성 방법은 예를 들면, 특허출원 EP 1 213 296 및 EP 1 354 888에 기재되어 있다.
본원에서 사용되는 용어 "세르글리플로진"은 상기 구조의 화학식의 세르글리플로진, 및 세르글리플로진의 프로드럭, 특히 세르글리플로진 에타보네이트를 포함하고, 이의 수화물 및 용매화물을 포함하는 이의 약제학적으로 허용되는 형태, 및 이의 결정성 형태를 나타낸다. 이의 제조방법은 예를 들면, 특허출원 EP 1 344 780 및 EP 1 489 089에 기재되어 있다.
상기 화학식 (16)의 화합물, 즉 소타글리플로진 및 이의 제조는 예를 들면, WO 2008/042688 또는 WO 2009/014970에 기재되어 있다.
바람직한 SGLT-2 억제제는 글루코피라노실-치환된 벤젠 유도체이다. 임의로, 상기 하나 이상의 SGLT-2 억제제의 글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화될 수 있다.
상기 본원에 개시된 바와 같은 화학식 (1)의 글루코피라노실-치환된 벤조니트릴 유도체가 보다 바람직하다. 화학식 (18)의 글루코피라노실-치환된 벤조니트릴 유도체:
[화학식 (18)]
(상기 화학식 (18)에서,
R3는 사이클로프로필, 수소, 불소, 염소, 브롬, 요오드, 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, 이소-부틸, tert-부틸, 3-메틸-부트-1-일, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 1-하이드록시-사이클로프로필, 1-하이드록시-사이클로부틸, 1-하이드록시-사이클로펜틸, 1-하이드록시-사이클로헥실, 에티닐, 에톡시, 디플루오로메틸, 트리플루오로메틸, 펜타플루오로에틸, 2-하이드록시-에틸, 하이드록시메틸, 3-하이드록시-프로필, 2-하이드록시-2-메틸-프로프-1-일, 3-하이드록시-3-메틸-부트-1-일, 1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-트리플루오로메틸-에틸, 2-메톡시-에틸, 2-에톡시-에틸, 하이드록시, 디플루오로메틸옥시, 트리플루오로메틸옥시, 2-메틸옥시-에틸옥시, 메틸설파닐, 메틸설피닐, 메틸설포닐, 에틸설피닐, 에틸설포닐, 트리메틸실릴, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시 또는 시아노를 나타내고,
R3는 바람직하게는 사이클로프로필, 에틸, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시로부터 선택되고,
가장 바람직하게는 R3는 사이클로프로필이다)
또는
이의 유도체
(여기서, β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화된다)
가 보다 더 바람직하다.
바람직하게는, 상기 SGLT-2 억제제는 화학식 (2)에 나타낸 바와 같은 벨라글리포진이다. 임의로, 벨라글리플로진의 β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화될 수 있다.
따라서, 바람직한 양태에서, 본 발명에 따른 적어도 하나의 SGLT-2 억제제는 글루코피라노실-치환된 벤젠 유도체 SGLT-2 억제제, 바람직하게는 화학식 (1)의 SGLT-2 억제제, 보다 바람직하게는 화학식 (18)의 SGLT-2 억제제, 보다 더 바람직하게는 화학식 (2)의 SGLT-2 억제제, 즉 벨라글리플로진이며, 각각의 경우에 상기 정의된 바와 같다.
본원에서, 본 발명에 따른 SGLT-2 억제제 및/또는 이의 용도에 대한 언급은, 달리 언급되지 않는 한, SGLT-2 억제제의 약제학적으로 허용되는 형태를 포함한다.
본 발명에 따르면, SGLT-2 억제제, 예를 들면, 화학식 (1)의 SGLT-2 억제제, 바람직하게는 화학식 (18)의 SGLT-2 억제제, 보다 바람직하게는 화학식 (2)의 SGLT-2 억제제의 임의의 약제학적으로 허용되는 형태, 예를 들면 결정성 형태가 사용될 수 있다. 프로드럭 형태도 본 발명에 포함된다.
프로드럭 형태는 예를 들면, 에스테르 및/또는 수화물을 포함할 수 있다. 용어 "프로드럭"은, 프로드럭이 포유동물 대상체에게 투여되는 경우, 본 발명의 활성 화합물을 생체내에서 방출하는 임의의 공유 결합된 담체를 포함하는 것도 의미한다. 본 발명의 화합물의 프로드럭은, 통상적인 조작에서 또는 생체내에서 개질물이 본 발명의 모 화합물로 절단되는 방식으로 본 발명의 화합물 중에 존재하는 관능 그룹을 개질함으로써 제조될 수 있다.
본 발명에 따라 사용하기 위한 결정성 형태는 SGLT-2 억제제와 하나 이상의 아미노산의 복합체(예를 들면, WO 2014/016381 참조), 일명 공결정을 포함한다. 이러한 용도를 위한 아미노산은 천연 아미노산일 수 있다. 아미노산은 단백질 생성 아미노산(L-하이드록시프롤린 포함) 또는 비단백질 생성 아미노산일 수 있다. 아미노산은 D- 또는 L-아미노산일 수 있다. 일부 바람직한 양태에서, 아미노산은 프롤린(L-프롤린 및/또는 D-프롤린, 바람직하게는 L-프롤린)이다. 예를 들면, 벨라글리플로진 및 프롤린(예를 들면, L-프롤린) 및 결정성 물의 결정성 복합체/공결정이 바람직하다.
따라서, 본원에서는 하나 이상의 천연 아미노산과 SGLT-2 억제제 사이의 결정성 복합체/공결정, 예를 들면 하나 이상의 천연 아미노산과 글루코피라노실-치환된 벤젠 유도체 SGLT-2 억제제, 바람직하게는 화학식 (1)의 SGLT-2 억제제, 보다 바람직하게는 화학식 (18)의 SGLT-2 억제제, 보다 더 바람직하게는 화학식 (2)의 SGLT-2 억제제(벨라글리플로진)와의 사이의 결정성 복합체/공결정을 개시한다.
특정 약제학적 활성은, 약제학적 활성제가 시장에서 의약으로서 승인되기 전에 충족해야 하는 기본 전제 조건이다. 그러나, 약제학적 활성제가 준수해야 하는 다양한 추가의 요구 사항이 있다. 이러한 요구 사항은 활성 물질 자체의 특성과 관련된 다양한 파라미터에 기초한다. 제한적인 것은 아니지만, 이러한 파라미터의 예는 다양한 환경 조건 하에서의 활성제의 안정성, 약제학적 제형의 제조 동안의 활성제의 안정성 및 최종 의약 조성물 중 활성제의 안정성이다. 약제학적 조성물의 제조에 사용되는 약제학적 활성 물질은 가능한 한 순수해야 하며, 다양한 환경 조건 하에 장기간 저장시 안정성이 보장되어야 한다. 이는 예를 들면, 실제 활성 물질 이외에 이의 분해 생성물(breakdown product)을 함유하는 약제학적 조성물의 사용을 예방하는 데 필수적이다. 이 경우, 의약 중 활성 성분의 함량이 명시된 것보다 적을 수 있다.
의약의 제형 중에서의 균일한 분포는 특히 의약이 저용량으로 제공되어야 하는 경우 중요한 요소이다. 균일한 분포를 보장하기 위해, 활성 물질의 입자 크기를 예를 들면, 그라인딩하여 적절한 수준으로 줄일 수 있다. 그라인딩(또는 미분화)의 부작용인 약제학적 활성 물질의 분해는 가능한 한 피해야 하므로, 공정 동안 필요한 어려운 조건에도 불구하고, 활성 물질이 그라인딩 공정 전반에 걸쳐 매우 안정적이어야 한다. 활성 물질이 그라인딩 공정 동안 충분히 안정한 경우에만 지정된 양의 활성 물질을 항상 함유하는 균질한 약제학적 제형을 재생 가능한 방식으로 생산할 수 있다.
원하는 약제학적 제형을 제조하기 위한 그라인딩 공정에서 발생할 수 있는 다른 문제는, 상기 공정으로 인한 에너지 유입 및 결정 표면 상의 응력이다. 이는 특정 상황에서 다형성 변화, 비결정화, 또는 결정 격자의 변화로 이어질 수 있다. 약제학적 제형의 약제학적 품질은, 활성 물질이 항상 동일한 결정성 형태를 가져야 하기 때문에, 이러한 관점에서 결정성 활성 물질의 안정성 및 성질이 엄격한 요구 사항에 적용된다.
약제학적 활성 물질의 안정성은 특정 의약의 저장 수명을 결정하는 약제학적 조성물에서도 중요하며; 저장 수명은 어떠한 위험도 없이 의약을 투여할 수 있는 시간 길이이다. 따라서, 다양한 저장 조건 하에 상기 언급된 약제학적 조성물인 의약의 높은 안정성은 환자 및 제조자 모두에게 추가적인 이점이다.
수분의 흡착(absorption)은, 물의 흡수(uptake)로 인해 증가된 중량으로 인해 약제학적 활성 물질의 함량을 감소시킨다. 수분을 흡착하는 경향이 있는 약제학적 조성물은, 예를 들면, 적절한 건조제를 추가하여 또는 약물을 수분으로부터 보호되는 환경에 저장하여 저장 동안 수분으로부터 보호되어야 한다. 따라서, 바람직하게는, 약제학적 활성 물질은 좋아도 약간만 흡습성이어야 한다.
또한, 잘 정의된 결정성 형태의 이용 가능성은 재결정화에 의한 약물 물질을 정제할 수 있게 한다.
상기 나타낸 요구 사항 이외에, 약제학적 조성물의 물리적 안정성 및 화학적 안정성을 향상시킬 수 있는, 약제학적 조성물의 고체 상태로의 임의의 변화는, 일반적으로 덜 안정한 형태의 동일한 의약에 비해 상당한 이점을 제공한다는 점을 염두에 두어야 한다.
천연 아미노산과 SGLT-2 억제제(예를 들면, 글루코피라노실-치환된 벤젠 유도체 또는 화학식 (1) 또는 화학식 (18)의 SGLT-2 억제제 또는 특히, 화학식 (2)의 SGLT-2 억제제, 즉 벨라글리포진) 사이의 결정성 복합체/공결정은 상기 언급된 중요한 요건들을 충족한다.
본 발명에 따라 사용하기 위한 SGLT-2 억제제는 약제학적 조성물로 제조될 수 있다. 이는 고체로 또는 액상 제형으로 제조될 수 있다. 어느 경우든, 이는 바람직하게는 경구 투여용으로, 바람직하게는 경구 투여용 액체 형태로 제조된다(예를 들면, WO 2017/032799 참조). 그러나, SGLT-2 억제제는, 예를 들면, 비경구 투여를 위해 제조될 수도 있다. 고형 제형은 정제, 과립 형태 및 기타 고체 형태, 예를 들면, 좌약을 포함한다. 고형 제형 중 정제 및 과립 형태가 바람직하다.
본 발명의 의미 내의 약제학적 조성물은 본 발명에 따른 SGLT-2 억제제 및 하나 이상의 부형제를 포함할 수 있다. 의도된 의학적 효과를 허용하거나 지원하는 모든 부형제를 사용할 수 있다. 이러한 부형제는 당업자에게 제공될 수 있다. 유용한 부형제는 예를 들면, 접착 방지제(분말(과립)과 펀치 면(punch face) 사이의 접착을 감소시켜 정제 펀치에 달라붙는 것을 방지하는 데 사용됨), 결합제(성분들을 함께 고정시키는 용액 결합제 또는 건식 결합제), 코팅제(정제 성분이 공기 중 수분에 의해 변질되지 않도록 보호하고, 크거나 불쾌한 맛이 나는 정제를 삼키기 쉽게 함), 붕해제(희석시 정제가 분해되게 함), 충전제, 희석제, 향미료, 색소, 활택제(유동 조절제 - 입자간 마찰 및 응집을 감소시켜 분말 유동을 촉진), 윤활제(성분들이 함께 뭉치는 것을 방지하고, 정제 펀치 또는 캡슐 충전 기계에 달라붙는 것을 방지함), 보존제, 흡착제, 감미료 등이다.
본 발명에 따른 제형, 예를 들면 고형 제형은 당 및 당 알코올의 그룹으로부터 선택되는 담체 및/또는 붕해제, 예를 들면, 만니톨, 락토스, 전분, 셀룰로스, 미세결정성 셀룰로스 및 셀룰로스 유도체, 예를 들면, 메틸셀룰로오스 등을 포함할 수 있다.
고양이과에 적합한 제형의 제조 절차는 당업자에게 공지되어 있으며, 고형 제형의 경우, 예를 들면 직접 압축, 건식 과립화 및 습식 과립화를 포함한다. 직접 압축 공정에서, 활성 성분과 다른 모든 부형제가, 상기 재료를 정제로 타정하기 위해 직접 적용되는 압축 장치에 함께 배치된다. 생성되는 정제는 상기 정제를 물리적으로 그리고/또는 화학적으로 보호하기 위해, 예를 들면, 최신 기술로부터 알려진 재료에 의해 이후에 임의로 코팅될 수 있다.
투여 단위, 예를 들면, 단일 액체 용량 또는 단위 고형 제형, 예를 들면 정제는 0.1 내지 10mg, 예를 들면 0.3 내지 1mg, 1 내지 3mg, 3 내지 10mg; 또는 5 내지 2,500mg, 예를 들면, 5 내지 2,000mg, 5 내지 1,500mg, 10 내지 1,500mg, 10 내지 1,000mg 또는 10 내지 500mg의 본 발명에 따라 사용하기 위한 SGLT-2 억제제를 포함할 수 있다. 숙련가가 이해하는 바와 같이, 고형 제제 중 또는 고양이과 동물에 투여하기 위한 본원에 개시된 임의의 제제 중 SGLT-2 억제제의 함량은, 치료되는 고양이과 동물의 체중에 비례하여 적절하게 증가 또는 감소될 수 있다.
일 양태에서, 본 발명에 따라 사용하기 위한 약제학적 조성물은 경구 또는 비경구 투여용으로, 바람직하게는 경구 투여용으로 디자인된다. 특히 경구 투여는, 예를 들면, 설명된 바와 같은 의도된 환자를 위한 약제학적 조성물의 후각 및/또는 촉각 성질을 개질시키는 부형제에 의해 개선된다.
본 발명에 따라 사용하기 위한 SGLT-2 억제제가 경구 투여용으로 제형화되는 경우, 부형제가, 예를 들면, 상기 제형을 고양이과 동물에 투여하기에 적합하게 만드는 기호성 및/또는 저작성과 같은 성질들을 부여하는 것이 바람직하다.
액상 제형도 바람직하다. 액상 제형은 예를 들면 용액, 시럽 또는 현탁액일 수 있다. 액상 제형은 고양이과 동물에 직접 투여될 수 있거나, 고양이과 동물의 사료 및/또는 음료(예를 들면, 식수 등)와 혼합될 수 있다. 액상 제형(과립 형태의 제형과 유사)의 한 가지 이점은 이러한 투여 형태가 정확한 투여를 할 수 있게 한다는 것이다. 예를 들면, SGLT-2 억제제는 고양이과 동물의 체질량에 비례하여 정확하게 투여될 수 있다. 액상 제형의 일반적인 조성은 당업자에게 공지되어 있다.
당업자는 본 발명의 용도에 적합한 용량을 결정할 수 있다. 바람직한 단위 투여 단위는 mg/kg 체중, 즉 고양이과 동물의 체질량당 mg SGLT-2 억제제를 포함한다. 본 발명의 SGLT-2 억제제는 예를 들면, 1일 0.01 내지 10mg/kg 체중, 예를 들면, 1일 0.01 내지 5mg/kg 체중, 예를 들면, 1일 0.01 내지 4mg/kg 체중, 예를 들면, 1일 0.01 내지 3mg/kg 체중, 예를 들면, 0.01 내지 2mg/kg 체중, 예를 들면, 1일 0.01 내지 1.5mg/kg 체중, 예를 들면, 1일 0.01 내지 1mg/kg 체중, 예를 들면, 1일 0.01 내지 0.75mg/kg 체중, 예를 들면, 1일 0.01 내지 0.5mg/kg 체중, 예를 들면, 1일 0.01 내지 0.4mg/kg 체중; 또는 1일 0.1 내지 3.0mg/kg 체중, 바람직하게는 1일 0.2 내지 2.0mg/kg 체중, 보다 바람직하게는 1일 0.1 내지 1mg/kg 체중 또는 1일 0.5 내지 1mg/kg 체중의 용량으로 투여될 수 있다. 다른 바람직한 양태에서, 용량은 1일 0.01 내지 0.5mg/kg 체중, 보다 바람직하게는 1일 0.02 내지 0.4mg/kg 체중, 예를 들면, 1일 0.03 내지 0.3mg/kg 체중이다.
당업자는 원하는 용량에 따른 투여를 위해 본 발명의 SGLT-2 억제제를 제조할 수 있다.
도면의 간단한 설명
도 1: 도 1은 벨라글리플로진으로 치료 시작 전(전) 고양이 또는 대조군 및 4주 치료 기간 종료 시(후) 고양이의 개별 데이터인, 혈장 비-에스테르화된 지방산(NEFA), 콜레스테롤 및 베타-하이드록시부티레이트(BHB)를 보여준다. 상당한 치료 효과, 혈중 지질(NEFA, 콜레스테롤) 및 BHB의 혈장 농도의 증가가 주목된다.
실시예
하기 실시예들은 본 발명을 추가로 설명하는 역할을 하지만, 하기 실시예들이 본원에 개시된 본 발명의 범위를 제한하는 것으로 해석되어서는 안 된다.
실시예 1 임상 현장 연구
임상 증상(예를 들면, 울혈성 심부전)이 있거나 없는 모든 가능한 표현형의 심근병증(HCM, RCM, UCM, DCM 및 ARVC)이 있는 고객 소유 고양이 환자(1세 초과)를 1mg/kg 체중의 벨라글리플로진 투여량으로 1일 1회 경구 치료한다.
연구 기간 동안, 조사자가 현장을 방문하는 동안 체중, 신체 상태 점수, 혈압 및 심혈관계(심박수, 리듬, 말발굽음 또는 잡음 및 강도 포함)를 정기적으로 검사한다. 또한, 흉부 방사선 사진(우측 측면 및 등의 복부측 보기), 심장초음파 촬영(LV 중격 및 자유 벽 두께, LVIDD, LVIDS(FS%), LA/Ao, LAD, 박출률 포함) 및 심전도를 수행한다. 가능한 한 완전한 개요를 얻기 위해, 일반 혈액 검사는 완전한 혈액학(백혈구(WBC), WBC 감별, 적혈구 세포, 헤모글로빈, 헤마토크릿, 하인즈 소체, 혈소판 수), 생화학 패널(총 단백질, 알부민, 글로불린, 알칼리 포스파타제(ALP), 알라닌 트랜스아미나제(ALT), 아스파르테이트 트랜스아미나제(AST), 총 빌리루빈, 크레아티닌, 혈액 요소 질소 또는 요소(BUN), 칼슘, 나트륨, 칼륨, 클로라이드, 인, 포도당, 콜레스테롤, 트리글리세리드, 프룩토사민), 총 T4, 케톤체 및 심장 바이오마커(혈장 NT-pro BNP, 심장 트로포닌 I, ST2)의 계측을 포함한다.
관심 변수는 심장 사망, 심장 관련 안락사, 및 울혈성 심부전의 (재)발생으로 정의된 사건의 수 및 사건까지의 시간(고양이 환자의 생존 시간)이다.
임상 현장 시험의 결과는, 표준 치료(SoC) 이외에 위약에 비해 생존 시간 및 사건까지의 시간(사건은 심장 사망/안락사 및 울혈성 심부전의 (재)발생으로 정의됨)의 유의하고 임상적으로 관련된 연장을 보여준다. 또한, SoC 이외에 위약과 비교하여 임상 파라미터(예를 들면, 식욕, 활동 수준 및 호흡)가 크게 개선된다.
실시예 2 탐색적 임상 현장 연구
소개, 재료 및 방법:
실제 조건 하의 탐색적 임상 현장 연구(전향적, 기저선 통제, 공개 표지 및 다중-부위)에서, 4마리의 고양이가 고양이의 심근병증 및 심부전 치료를 위한 벨라글리플로진의 동정적 사용을 위한 적격성에 대해 스크리닝되었다. 비대성 심근병증(HCM) 및 최근의 심부전이 있는 2마리의 고양이가 포함 기준을 충족하는 것으로 확인되었으며, 1mg/kg 체중의 투여량의 SGLT-2-억제제 벨라글리플로진을 1일 1회 경구 치료받았다. 1명의 애완 동물 주인이 치료 레짐(regime)을 준수하지 않았기 때문에, 90일의 전체 계획 시간 기간 동안 연구에는 단 1마리의 고양이만 남았다. 임상 증상(굿 수의학 실습(Good veterinary practice)에 따라 신체 검사에서 평가됨), 심장초음파 파라미터(각각의 방문시 항상 동일한 인간이 수행하며, 고양이의 심근병증의 분류, 진단 및 관리에 대한 ACVIM 합의 선언문 지침에 따라 수행), 혈액 파라미터(독일의 IDEXX Bioresearch Laboratories에서 평가), 사건 수(심부전, 심장 관련 사망 또는 안락사의 재발) 및 사건 발생까지의 시간(일)을 각각의 방문 시 각각의 사례 보고서 양식에 기록했다.
결과:
사례 101은 비대성 심근병증(HCM) 및 이전에 울혈성 심부전 진단을 받은 10세 암컷 메인 쿤 고양이였다. 0일(연구 시작)에 고양이는 소유자 관리 하에 임상적으로 안정적이었고, 추가의 의약을 받지 않았다. 치료 기간 동안(1일부터 90일까지) 고양이는 부작용을 경험하지 않았고, 심부전 또는 폐 부종이 재발하지 않았다. 고양이는 일반적인 건강 상태에서 연구를 종료했다.
결론:
스크리닝 방문(치료 전)시 고양이 101의 병태생리학적 특성은 비대성 심근병증(HCM)을 나타냈다. HCM 표현형은, 유사한 정도의 심실 비후 및 심실 중격(IVSd)의 비후를 생성할 수 있는 비정상적인 부하 조건의 부재시, 증가된 좌심실 벽 두께(LVWT)를 특징으로 한다. 이러한 질환의 추가의 특징은 스크리닝시 고양이 101에서도 나타난 바와 같이 증가된 좌심방(LA)이다.
심장 바이오마커인 뇌 나트륨 이뇨 펩티드의 N-말단 프로호르몬(NT-pro BNP)은 스크리닝시 스트레스를 받은 심근을 나타냈다.
표 2의 모든 심장초음파 파라미터 및 표 3에 나타낸 심장 바이오마커 및 비정상적인 심장 잡음은 치료 기간 동안 지속적으로 개선되었으며, 따라서 벨라글리플로진으로의 치료가 고양이의 비대성 심근병증(HCM) 및/또는 비대성 심근병증(HCM)으로 인한 심부전에 유익한 치료 효과가 있음을 분명히 보여준다.
참고문헌
(1)
Atkins CE et al., J Am Vet Med Assoc. 1992, 201(4): 613-618
(2)
Freeman LM et al., Cardiol Res. 2017, 8(4): 139-142
(3)
Hoenig M et al., J Vet Pharmacol Therapeutics 2018, 41(2): 266-273
(4)
Little CJL et al., J Small Anim Prac 2008, 49(1): 17-25
(5)
Matsumura K et al, Cardiovascular Ultrasound 2019, 17(1): 26
(6)
McMurray JJV et al., Eur. J. Heart Fail. 2019; 21: 665-675
(7)
Payne JR et al., J Vet Intern Med. 2013, 27(6): 1427-1436
(8)
Payne JR et al., J Vet Cardiol. 2015, 17(Suppl1): S244-S257
(9)
Rush JE et al., J Am Vet Med Assoc. 2002, 220(2): 202-207
(10)
Santos-Gallego CG et al., J American College Cardiol 2019, 73(15): 1931-1944
(11)
Silva Custodio Jr J et al., Heart Failure Reviews 2018, 23(3): 409-418
(12)
US 2011/098240
(13)
US 2015/164856
(14)
US 2016/000816
(15)
US 2017/266152
(16)
US 2019/076395
(17)
WO 2011/153953
Claims (15)
- 고양이과 동물의 하나 이상의 심장 질환의 예방 및/또는 치료 방법에서 사용하기 위한, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항에 있어서, 상기 하나 이상의 심장 질환이 심부전, 하나 이상의 심근병증으로 인한 심부전, 비대성 심근병증(HCM)으로 인한 심부전, 제한성 심근병증(RCM)으로 인한 심부전, 확장성 심근병증(DCM)으로 인한 심부전, 분류되지 않은 심근병증(UCM)으로 인한 심부전, 부정맥성 우심실 심근병증(ARVC)으로 인한 심부전, 비대성 심근병증(HCM), 제한성 심근병증(RCM), 확장성 심근병증(DCM), 분류되지 않은 심근병증(UCM) 및/또는 부정맥성 우심실 심근병증(ARVC)으로 이루어지는 그룹으로부터; 바람직하게는 하나 이상의 심근병증으로 인한 심부전, 비대성 심근병증(HCM)으로 인한 심부전, 비대성 심근병증(HCM)으로 이루어지는 그룹으로부터 선택되는, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제2항에 있어서, 상기 하나 이상의 심장 질환이 하나 이상의 심근병증으로 인한 심부전, 비대성 심근병증(HCM)으로 인한 심부전, 제한성 심근병증(RCM)으로 인한 심부전, 확장성 심근병증(DCM)으로 인한 심부전, 분류되지 않은 심근병증(UCM)으로 인한 심부전, 부정맥성 우심실 심근병증(ARVC)으로 인한 심부전, 비대성 심근병증(HCM), 제한성 심근병증(RCM), 확장성 심근병증(DCM), 분류되지 않은 심근병증(UCM) 및/또는 부정맥성 우심실 심근병증(ARVC)으로 이루어지는 그룹으로부터 선택되는, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제3항에 있어서, 상기 하나 이상의 심장 질환이 비대성 심근병증(HCM)으로 인한 심부전 및 비대성 심근병증(HCM)으로 이루어지는 그룹으로부터 선택되는, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 하나 이상의 SGLT-2 억제제가 글루코피라노실-치환된 벤젠 유도체인, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 하나 이상의 SGLT-2 억제제가 다음으로 이루어지는 그룹으로부터 선택되는, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태:
(1) 화학식 (1)의 글루코피라노실-치환된 벤젠 유도체
[화학식 (1)]
(상기 화학식 (1)에서,
R1은 시아노, Cl 또는 메틸(가장 바람직하게는 시아노)을 나타내고;
R2는 H, 메틸, 메톡시 또는 하이드록시(가장 바람직하게는 H)를 나타내고;
R3는 사이클로프로필, 수소, 불소, 염소, 브롬, 요오드, 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, 이소-부틸, tert-부틸, 3-메틸-부트-1-일, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 1-하이드록시-사이클로프로필, 1-하이드록시-사이클로부틸, 1-하이드록시-사이클로펜틸, 1-하이드록시-사이클로헥실, 에티닐, 에톡시, 디플루오로메틸, 트리플루오로메틸, 펜타플루오로에틸, 2-하이드록시-에틸, 하이드록시메틸, 3-하이드록시-프로필, 2-하이드록시-2-메틸-프로프-1-일, 3-하이드록시-3-메틸-부트-1-일, 1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-트리플루오로메틸-에틸, 2-메톡시-에틸, 2-에톡시-에틸, 하이드록시, 디플루오로메틸옥시, 트리플루오로메틸옥시, 2-메틸옥시-에틸옥시, 메틸설파닐, 메틸설피닐, 메틸설포닐, 에틸설피닐, 에틸설포닐, 트리메틸실릴, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시 또는 시아노를 나타내고,
R3는 바람직하게는 사이클로프로필, 에틸, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시로부터 선택되고,
가장 바람직하게는 R3는 사이클로프로필이다)
또는
이의 유도체
(여기서, β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화된다)
(2) 화학식 (2)로 나타내어지는 벨라글리플로진
[화학식 (2)]
(3) 화학식 (3)으로 나타내어지는 다파글리플로진
[화학식 (3)]
(4) 화학식 (4)로 나타내어지는 카나글리플로진
[화학식 (4)]
(5) 화학식 (5)로 나타내어지는 엠파글리플로진
[화학식 (5)]
(6) 화학식 (6)으로 나타내어지는 루세오글리플로진
[화학식 (6)]
(7) 화학식 (7)로 나타내어지는 토포글리플로진
[화학식 (7)]
(8) 화학식 (8)로 나타내어지는 이프라글리플로진
[화학식 (8)]
(9) 화학식 (9)로 나타내어지는 에르투글리플로진
[화학식 (9)]
(10) 화학식 (10)으로 나타내어지는 아티글리플로진
[화학식 (10)]
(11) 화학식 (11)로 나타내어지는 레모글리플로진
[화학식 (11)]
(11A) 화학식 (11A)로 나타내어지는 레모글리플로진 에타보네이트
[화학식 (11A)]
(12) 화학식 (12)의 티오펜 유도체
[화학식 (12)]
상기 화학식 (12)에서,
R은 메톡시 또는 트리플루오로메톡시를 나타낸다.
(13) 화학식 (13)으로 나타내어지는 1-(β-D-글루코피라노실)-4-메틸-3-[5-(4-플루오로페닐)-2-티에닐메틸]벤젠
[화학식 (13)]
(14) 화학식 (14)의 스피로케탈 유도체
[화학식 (14)]
상기 화학식 (14)에서,
R은 메톡시, 트리플루오로메톡시, 에톡시, 에틸, 이소프로필 또는 tert. 부틸을 나타낸다.
(15) 화학식 (15)의 피라졸-O-글루코사이드 유도체
[화학식 (15)]
상기 화학식 (15)에서,
R1은 C1-3-알콕시를 나타내고;
L1 및 L2는 서로 독립적으로, H 또는 F를 나타내고;
R6은 H, (C1-3-알킬)카보닐, (C1-6-알킬)옥시카보닐, 페닐옥시카보닐, 벤질옥시카보닐 또는 벤질카보닐을 나타낸다.
(16) 화학식 (16)으로 나타내어지는 소타글리플로진
[화학식 (16)]
(17) 화학식 (17)로 나타내어지는 세르글리플로진
[화학식 (17)]
(18) 화학식 (18)로 나타내어지는 화합물
[화학식 (18)]
(상기 화학식 (18)에서,
R3는 사이클로프로필, 수소, 불소, 염소, 브롬, 요오드, 메틸, 에틸, 프로필, 이소프로필, 부틸, sec-부틸, 이소-부틸, tert-부틸, 3-메틸-부트-1-일, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 1-하이드록시-사이클로프로필, 1-하이드록시-사이클로부틸, 1-하이드록시-사이클로펜틸, 1-하이드록시-사이클로헥실, 에티닐, 에톡시, 디플루오로메틸, 트리플루오로메틸, 펜타플루오로에틸, 2-하이드록시-에틸, 하이드록시메틸, 3-하이드록시-프로필, 2-하이드록시-2-메틸-프로프-1-일, 3-하이드록시-3-메틸-부트-1-일, 1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-메틸-에틸, 2,2,2-트리플루오로-1-하이드록시-1-트리플루오로메틸-에틸, 2-메톡시-에틸, 2-에톡시-에틸, 하이드록시, 디플루오로메틸옥시, 트리플루오로메틸옥시, 2-메틸옥시-에틸옥시, 메틸설파닐, 메틸설피닐, 메틸설포닐, 에틸설피닐, 에틸설포닐, 트리메틸실릴, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시 또는 시아노를 나타내고,
R3는 바람직하게는 사이클로프로필, 에틸, 에티닐, 에톡시, (R)-테트라하이드로푸란-3-일옥시 또는 (S)-테트라하이드로푸란-3-일옥시이고,
R3는 가장 바람직하게는 사이클로프로필이다)
또는
이의 유도체
(여기서, β-D-글루코피라노실 그룹의 하나 이상의 하이드록실 그룹은 (C1-18-알킬)카보닐, (C1-18-알킬)옥시카보닐, 페닐카보닐 및 페닐-(C1-3-알킬)-카보닐로부터 선택되는 그룹으로 아실화된다)
(19) 화학식 (19)로 나타내어지는 벡사글리플로진
[화학식 (19)]
(20) 화학식 (20)으로 나타내어지는 자나글리플로진
[화학식 (20)]
(21) 롱글리플로진 및
(22) 완파글리플로진. - 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 SGLT-2 억제제의 약제학적으로 허용되는 형태가, 상기 하나 이상의 SGLT2 억제제와 하나 이상의 아미노산, 바람직하게는 프롤린, 보다 바람직하게는 L-프롤린과의 사이의 결정성 복합체이고; 가장 바람직하게는 상기 하나 이상의 SGLT2 억제제, L-프롤린 및 결정성 물의 공결정인, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 고양이과 동물이 상기 예방 및/또는 치료를 필요로 하는 고양이과 환자이고; 바람직하게는 상기 예방 및/또는 치료를 필요로 하는 고양이이고, 보다 바람직하게는 상기 예방 및/또는 치료를 필요로 하는 비당뇨병 고양이인, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 하나 이상의 SGLT-2 억제제가 경구, 비경구, 정맥내, 피하 또는 근육내 투여되고, 바람직하게는 경구 투여되는, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 하나 이상의 SGLT-2 억제제가 0.01 내지 10mg/kg 체중, 바람직하게는 0.01 내지 5mg/kg 체중, 보다 바람직하게는 0.01 내지 4mg/kg 체중, 보다 더 바람직하게는 0.01 내지 3mg/kg 체중, 보다 더 바람직하게는 0.01 내지 2mg/kg 체중, 보다 더 바람직하게는 0.01 내지 1mg/kg 체중, 보다 더 바람직하게는 0.1 내지 1mg/kg 체중, 가장 바람직하게는 0.5 내지 1mg/kg 체중의 용량으로 투여되는, 하나 이상의 SGLT-2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태가 1일 1회만 또는 1일 2회 투여되는, 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 하나 이상의 SGLT-2 억제제가 벨라글리플로진이고, 벨라글리플로진이, 단일 SGLT-2 억제제로서, 바람직하게는 경구로, 보다 바람직하게는 0.1 내지 1mg/kg 체중의 용량으로, 보다 더 바람직하게는 0.5 내지 1mg/kg 체중의 용량으로 1일 1회 또는 2회 투여되는, 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 하나 이상의 SGLT-2 억제제가 하나 이상의 다른 활성 약제학적 성분, 바람직하게는 이뇨제, 예를 들면, 푸로세미드, 토라세미드 또는 스피로노락톤; 베타-차단제, 예를 들면, 아테놀롤 또는 프로프라놀롤; 칼슘 채널 차단제, 예를 들면, 암로디핀 및 딜티아젬; ACE 억제제, 예를 들면, 베나제프릴, 라미프릴 또는 에날라프릴; 안지오텐신 수용체 차단제, 예를 들면, 텔미사르탄; 항부정맥제, 예를 들면, 플레카이나이드; 혈소판 응집 억제제, 예를 들면, 클로피도그렐; 비스테로이드성 항염증제(NSAID), 예를 들면, 아스피린; 항응고제, 예를 들면, 쿠마린(비타민 K 길항제), (저분자량) 헤파린, 인자 Xa의 합성 오당류 억제제, 및 직접 인자 Xa 억제제 및/또는 직접 트롬빈 억제제; 및/또는 칼슘 채널 증감제 및/또는 양성 수축제, 예를 들면, 피모벤단 및/또는 디기탈리스 알칼로이드를 투여하기 전에, 후에 또는 이와 동시에 투여되는, 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 예방 및/또는 치료 효과가 다음 임상적 파라미터들 및/또는 생화학적 파라미터들 중 하나 이상을 특징으로 하는, 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태:
- 심박출량/소모된 대사 기질의 증가된 비를 특징으로 하고/하거나 심박출량/소비된 산소의 증가된 비를 특징으로 하는, 개선된 심장대사 효율;
- 3-하이드록시부티르산 및/또는 상응하는 아실카르니틴, 즉 하이드록시부티릴카르니틴의 증가된 혈장 수준 및 분지쇄 아미노산 발린, 류신 및/또는 이소류신 중 하나 이상의 증가된 혈장 수준을 특징으로 하는, 간에서의 케톤체 생성의 증가;
- 감소된 전부하 및/또는 후부하, 개선된 동맥 벽 구조 기능을 달성함에 의한, 개선된 심장 기능;
- 개선된 심장초음파 파라미터, 예를 들면, 감소된 LA(우측 흉골 단축으로 계측되는 좌심방 치수), LA/Ao(좌심방 대 대동맥 비; Ao = 대동맥 뿌리 직경), IVSd(심실 중격 말단 이완기 치수, 즉 심실 중격의 두께) 및/또는 LAD(우측 흉골 장축으로 계측되는 좌심방), 및 개선된 심장 바이오마커, 예를 들면, 감소된 NT-proBNP(뇌 나트륨 이뇨 펩티드의 N-말단 프로호르몬) 및/또는 감소된 cTnI(심장 트로포닌 I), 및 개선된 심장 잡음;
- 상이한 표현형들의 심근병증의, 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상의 발병 지연, 또는 심지어 상이한 표현형들의 심근병증의 진행 중단;
- 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상 더 길어진 생존 시간, 및/또는 바람직하게는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15개월 또는 그 이상의 다음 에피소드의 지연 및/또는 더 낮은 수준의 심장 사망률 및/또는 이환율 또는
- 삶의 질 향상. - 제1항 내지 제14항 중 어느 한 항에 따라 사용하기 위한, 제1항 내지 제14항 중 어느 한 항에 기재된 하나 이상의 SGLT2 억제제 또는 이의 약제학적으로 허용되는 형태를 포함하는 약제학적 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP20157761 | 2020-02-17 | ||
| EP20157761.6 | 2020-02-17 | ||
| PCT/EP2021/053585 WO2021165177A1 (en) | 2020-02-17 | 2021-02-15 | Use of sglt-2 inhibitors for the prevention and/or treatment of cardiac diseases in felines |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20220143732A true KR20220143732A (ko) | 2022-10-25 |
Family
ID=69645897
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227032316A Pending KR20220143732A (ko) | 2020-02-17 | 2021-02-15 | 고양이과에서 심장 질환을 예방 및/또는 치료하기 위한 sglt-2 억제제의 사용 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US11826378B2 (ko) |
| EP (1) | EP4106744A1 (ko) |
| JP (2) | JP7423800B2 (ko) |
| KR (1) | KR20220143732A (ko) |
| CN (2) | CN118615450A (ko) |
| AR (1) | AR122380A1 (ko) |
| AU (1) | AU2021222297B2 (ko) |
| BR (1) | BR112022016360A2 (ko) |
| CA (1) | CA3167531A1 (ko) |
| MX (1) | MX2022010090A (ko) |
| TW (1) | TW202143979A (ko) |
| WO (1) | WO2021165177A1 (ko) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111494357A (zh) * | 2013-12-17 | 2020-08-07 | 勃林格殷格翰动物保健有限公司 | 猫科动物中代谢紊乱的治疗 |
| AU2020394498A1 (en) | 2019-11-28 | 2022-06-09 | Boehringer Ingelheim Vetmedica Gmbh | Use of SGLT-2 inhibitors in the drying-off of non-human mammals |
| JP2024525981A (ja) * | 2021-07-28 | 2024-07-12 | ベーリンガー インゲルハイム フェトメディカ ゲーエムベーハー | ヒト以外の哺乳動物における腎疾患の予防及び/又は治療のためのsglt-2阻害剤の使用 |
| CN116785268A (zh) * | 2022-03-14 | 2023-09-22 | 江苏万邦生化医药集团有限责任公司 | 一种sglt-2抑制剂的药物组合物 |
| WO2023220930A1 (en) * | 2022-05-17 | 2023-11-23 | Increvet, Inc. | Veterinary pharmaceutical formulations cross-references to related applications |
| US20230381101A1 (en) | 2022-05-25 | 2023-11-30 | Boehringer Ingelheim Vetmedica Gmbh | Aqueous pharmaceutical compositions comprising sglt-2 inhibitors |
| TW202500160A (zh) | 2023-03-06 | 2025-01-01 | 德商百靈佳殷格翰維美迪加股份有限公司 | 用於遞送特別是包含一或多種sglt—2抑制劑之液體醫藥組合物之系統及方法 |
| WO2024240632A1 (en) | 2023-05-24 | 2024-11-28 | Boehringer Ingelheim Vetmedica Gmbh | Combination treatment and/or prevention of cardiac diseases in non-human mammals comprising one or more sglt-2 inhibitors and pimobendan and/or telmisartan |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UA71994C2 (en) | 1999-08-31 | 2005-01-17 | Kissei Pharmaceutical | Glucopyranosyloxypyrazole derivatives, a pharmaceutical composition containing these derivatives and intermediate compounds for the preparation thereof |
| PH12000002657B1 (en) | 1999-10-12 | 2006-02-21 | Bristol Myers Squibb Co | C-aryl glucoside SGLT2 inhibitors |
| US6515117B2 (en) | 1999-10-12 | 2003-02-04 | Bristol-Myers Squibb Company | C-aryl glucoside SGLT2 inhibitors and method |
| US7053060B2 (en) | 2000-11-30 | 2006-05-30 | Kissei Pharmaceutical Co., Ltd. | Glucopyranosyloxybenzylbenzene derivatives, medicinal compositions containing the same and intermediates in the production thereof |
| KR100701437B1 (ko) | 2000-12-28 | 2007-03-30 | 깃세이 야쿠힌 고교 가부시키가이샤 | 글루코피라노실옥시피라졸 유도체 및 그 의약 용도 |
| KR100945455B1 (ko) | 2002-03-22 | 2010-03-05 | 깃세이 야쿠힌 고교 가부시키가이샤 | 글루코피라노실옥시벤질 벤젠 유도체의 결정 |
| DE10231370B4 (de) | 2002-07-11 | 2006-04-06 | Sanofi-Aventis Deutschland Gmbh | Thiophenglycosidderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zur Herstellung dieser Arzneimittel |
| WO2004080990A1 (ja) | 2003-03-14 | 2004-09-23 | Astellas Pharma Inc. | C-グリコシド誘導体又はその塩 |
| EA015104B1 (ru) | 2003-08-01 | 2011-06-30 | Мицубиси Танабе Фарма Корпорейшн | Новые соединения, обладающие ингибирующей активностью в отношении натрийзависимого транспортера |
| JP4181605B2 (ja) | 2004-03-16 | 2008-11-19 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | グルコピラノシル置換フェニル誘導体、該化合物を含有する医薬品及びその使用と製造方法 |
| AR051446A1 (es) | 2004-09-23 | 2007-01-17 | Bristol Myers Squibb Co | Glucosidos de c-arilo como inhibidores selectivos de transportadores de glucosa (sglt2) |
| JP2008524162A (ja) | 2004-12-16 | 2008-07-10 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | グルコピラノシル置換ベンゼン誘導体、該化合物を含む薬物、その使用及びその製造方法 |
| UA91546C2 (uk) | 2005-05-03 | 2010-08-10 | Бьорінгер Інгельхайм Інтернаціональ Гмбх | КРИСТАЛІЧНА ФОРМА 1-ХЛОР-4-(β-D-ГЛЮКОПІРАНОЗ-1-ИЛ)-2-[4-((S)-ТЕТРАГІДРОФУРАН-3-ІЛОКСИ)-БЕНЗИЛ]-БЕНЗОЛУ, СПОСІБ ЇЇ ОДЕРЖАННЯ ТА ЇЇ ЗАСТОСУВАННЯ ПРИ ПРИГОТУВАННІ ЛІКАРСЬКИХ ЗАСОБІВ |
| US7723309B2 (en) | 2005-05-03 | 2010-05-25 | Boehringer Ingelheim International Gmbh | Crystalline forms of 1-chloro-4-(β-D-glucopyranos-1-yl)-2-[4-((R)-tetrahydrofuran-3-yloxy)-benzyl]-benzene, a method for its preparation and the use thereof for preparing medicaments |
| US7772191B2 (en) | 2005-05-10 | 2010-08-10 | Boehringer Ingelheim International Gmbh | Processes for preparing of glucopyranosyl-substituted benzyl-benzene derivatives and intermediates therein |
| JP5175191B2 (ja) | 2005-08-30 | 2013-04-03 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | グリコピラノシル置換ベンジルベンゼン誘導体、該化合物を含有する医薬品及びその使用と製造方法 |
| TW200745075A (en) | 2005-09-08 | 2007-12-16 | Boehringer Ingelheim Int | Crystalline forms of 1-chloro-4-(β-D-glucopyranos-1-yl)-2-(4-ethynyl-benzyl)-benzene, methods for its preparation and the use thereof for preparing medicaments |
| AR056195A1 (es) | 2005-09-15 | 2007-09-26 | Boehringer Ingelheim Int | Procedimientos para preparar derivados de (etinil-bencil)-benceno sustituidos de glucopiranosilo y compuestos intermedios de los mismos |
| US7745414B2 (en) | 2006-02-15 | 2010-06-29 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted benzonitrile derivatives, pharmaceutical compositions containing such compounds, their use and process for their manufacture |
| TWI370818B (en) | 2006-04-05 | 2012-08-21 | Astellas Pharma Inc | Cocrystal of c-glycoside derivative and l-proline |
| PE20080697A1 (es) | 2006-05-03 | 2008-08-05 | Boehringer Ingelheim Int | Derivados de benzonitrilo sustituidos con glucopiranosilo, composiciones farmaceuticas que contienen compuestos de este tipo, su uso y procedimiento para su fabricacion |
| EP2019679B1 (en) | 2006-05-23 | 2018-06-20 | Theracos, Inc. | Glucose transport inhibitors and methods of use |
| US7919598B2 (en) | 2006-06-28 | 2011-04-05 | Bristol-Myers Squibb Company | Crystal structures of SGLT2 inhibitors and processes for preparing same |
| TWI403516B (zh) | 2006-07-27 | 2013-08-01 | Chugai Pharmaceutical Co Ltd | To replace spirocyclic alcohol derivatives, and its use as a therapeutic agent for diabetes |
| TWI499414B (zh) | 2006-09-29 | 2015-09-11 | Lexicon Pharmaceuticals Inc | 鈉與葡萄糖第2型共同運輸體(co-transporter 2)的抑制物與其應用方法 |
| EP2086991A1 (en) | 2006-10-27 | 2009-08-12 | Boehringer Ingelheim International GmbH | CRYSTALLINE FORM OF 4-(ß-D-GLUCOPYRANOS-1-YL)-1-METHYL-2-[4-((S)-TETRAHYDROFURAN-3-YLOXY)-BENZYL]-BENZENE, A METHOD FOR ITS PREPARATION AND THE USE THEREOF FOR PREPARING MEDICAMENTS |
| US7879806B2 (en) | 2006-11-06 | 2011-02-01 | Boehringer Ingelheim International Gmbh | Glucopyranosyl-substituted benzyl-benzonitrile derivates, medicaments containing such compounds, their use and process for their manufacture |
| AR063627A1 (es) | 2006-11-09 | 2009-02-04 | Boehringer Ingelheim Int | Terapia combinada con inhibidores de sgl t-2 y sus composiciones farmaceuticas |
| UY30730A1 (es) | 2006-12-04 | 2008-07-03 | Mitsubishi Tanabe Pharma Corp | Forma cristalina del hemihidrato de 1-(b (beta)-d-glucopiranosil) -4-metil-3-[5-(4-fluorofenil) -2-tienilmetil]benceno |
| AR065809A1 (es) | 2007-03-22 | 2009-07-01 | Bristol Myers Squibb Co | Formulaciones farmaceuticas que contienen un inhibidor sglt2 |
| JP5653213B2 (ja) | 2007-07-26 | 2015-01-14 | レクシコン ファーマシューティカルズ インコーポレイテッド | ナトリウム・グルコース共輸送体2阻害剤の調製に有用な方法及び化合物 |
| PE20090603A1 (es) * | 2007-08-16 | 2009-06-11 | Boehringer Ingelheim Int | Composicion farmaceutica que comprende un inhibidor de sglt2 y un inhibidor de dpp iv |
| UY31291A1 (es) | 2007-08-16 | 2009-03-31 | Composicion farmacéutica que comprende un derivado de pirazol-0-glucosido | |
| FR2920045B1 (fr) | 2007-08-16 | 2010-03-12 | Valeo Systemes Thermiques | Evaporateur a nappes multiples, en particulier pour un circuit de climatisation de vehicule automobile |
| CN101801371B (zh) | 2007-09-10 | 2012-11-28 | 詹森药业有限公司 | 可用作sglt抑制剂的化合物的制备方法 |
| EP2334687B9 (en) | 2008-08-28 | 2012-08-08 | Pfizer Inc. | Dioxa-bicyclo[3.2.1.]octane-2,3,4-triol derivatives |
| CN102316875A (zh) * | 2009-02-13 | 2012-01-11 | 贝林格尔.英格海姆国际有限公司 | 用于治疗i型糖尿病、ii型糖尿病、葡萄糖耐量降低或高血糖症的sglt-2抑制剂 |
| ES2546762T3 (es) | 2009-09-30 | 2015-09-28 | Boehringer Ingelheim International Gmbh | Procedimientos para preparar derivados de bencil-benceno sustituidos con glucopiranosilo |
| EA020798B1 (ru) | 2009-09-30 | 2015-01-30 | Бёрингер Ингельхайм Интернациональ Гмбх | СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОЙ ФОРМЫ 1-ХЛОР-4-(β-D-ГЛЮКОПИРАНОЗ-1-ИЛ)-2-[4-((S)-ТЕТРАГИДРОФУРАН-3-ИЛОКСИ)БЕНЗИЛ]БЕНЗОЛА |
| WO2011153712A1 (en) | 2010-06-12 | 2011-12-15 | Theracos, Inc. | Crystalline form of benzylbenzene sglt2 inhibitor |
| US9145434B2 (en) | 2012-07-26 | 2015-09-29 | Boehringer Ingelheim International Gmbh | Crystalline complex of 1-cyano-2-(4-cyclopropyl-benzyl)-4-(ss-d-glucopyranos-1-yl)-benzene, methods for its preparation and the use thereof for preparing medicaments |
| US20160000816A1 (en) * | 2013-04-05 | 2016-01-07 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition, methods for treating and uses thereof |
| CN111494357A (zh) * | 2013-12-17 | 2020-08-07 | 勃林格殷格翰动物保健有限公司 | 猫科动物中代谢紊乱的治疗 |
| BR112018003749B1 (pt) | 2015-08-27 | 2023-10-31 | Boehringer Ingelheim Vetmedica Gmbh | Composições farmacêuticas líquidas compreendendo inibidores sglt-2, kit de peças e processo para a produção da composição farmacêutica líquida |
| WO2017155841A1 (en) | 2016-03-11 | 2017-09-14 | Merck Sharp & Dohme Corp. | Methods of treating or reducing the risk of cardiovascular events and related diseases using sglt-2 inhibitors |
| CN118286237A (zh) | 2016-03-16 | 2024-07-05 | 勃林格殷格翰国际有限公司 | 包含恩格列净的药物组合物及其用途 |
| EA202091466A1 (ru) | 2017-12-19 | 2020-10-23 | Бёрингер Ингельхайм Ветмедика Гмбх | Синтез сокристалла 1:1:1 1-циано-2-(4-циклопропилбензил)-4-(-d-глюкопираноз-1-ил)бензола, l-пролина и воды |
| US20230000816A1 (en) * | 2019-11-07 | 2023-01-05 | Increvet, Inc. | Sodium-glucose linked transporter inhibitors for the management of chronic kidney disease, hypertension, and heart failure in companion animals |
-
2021
- 2021-02-15 KR KR1020227032316A patent/KR20220143732A/ko active Pending
- 2021-02-15 MX MX2022010090A patent/MX2022010090A/es unknown
- 2021-02-15 BR BR112022016360A patent/BR112022016360A2/pt unknown
- 2021-02-15 JP JP2022548175A patent/JP7423800B2/ja active Active
- 2021-02-15 CN CN202410790544.6A patent/CN118615450A/zh active Pending
- 2021-02-15 CN CN202180014355.4A patent/CN115087441B/zh active Active
- 2021-02-15 CA CA3167531A patent/CA3167531A1/en active Pending
- 2021-02-15 EP EP21705190.3A patent/EP4106744A1/en active Pending
- 2021-02-15 WO PCT/EP2021/053585 patent/WO2021165177A1/en not_active Ceased
- 2021-02-15 AU AU2021222297A patent/AU2021222297B2/en active Active
- 2021-02-16 US US17/176,285 patent/US11826378B2/en active Active
- 2021-02-17 AR ARP210100410A patent/AR122380A1/es unknown
- 2021-02-17 TW TW110105274A patent/TW202143979A/zh unknown
-
2023
- 2023-10-06 US US18/482,334 patent/US20240050456A1/en active Pending
-
2024
- 2024-01-17 JP JP2024005423A patent/JP2024040196A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| TW202143979A (zh) | 2021-12-01 |
| US20240050456A1 (en) | 2024-02-15 |
| JP2024040196A (ja) | 2024-03-25 |
| WO2021165177A1 (en) | 2021-08-26 |
| US20210260090A1 (en) | 2021-08-26 |
| CN118615450A (zh) | 2024-09-10 |
| AU2021222297A1 (en) | 2022-08-04 |
| AR122380A1 (es) | 2022-09-07 |
| CA3167531A1 (en) | 2021-08-26 |
| BR112022016360A2 (pt) | 2022-10-04 |
| CN115087441B (zh) | 2024-07-12 |
| AU2021222297B2 (en) | 2026-01-22 |
| CN115087441A (zh) | 2022-09-20 |
| EP4106744A1 (en) | 2022-12-28 |
| JP2023512839A (ja) | 2023-03-29 |
| US11826378B2 (en) | 2023-11-28 |
| MX2022010090A (es) | 2022-09-02 |
| JP7423800B2 (ja) | 2024-01-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20220143732A (ko) | 고양이과에서 심장 질환을 예방 및/또는 치료하기 위한 sglt-2 억제제의 사용 | |
| CN117715640A (zh) | Sglt-2抑制剂用于在不包括猫科动物的非人哺乳动物,特别是犬科动物中预防和/或治疗心脏疾病的用途 | |
| TW201202238A (en) | 1-[(3-cyano-pyridin-2-yl)methyl]-3-methyl-7-(2-butyn-1-yl)-8-[3-(R)-amino-piperidin-1-yl]-xanthine for the treatment of a metabolic disorder of a predominantly carnivorous non-human animal | |
| KR20180059582A (ko) | 폐의 용태에 따른 치료 방법 | |
| KR20240040106A (ko) | 비-사람 포유류에서 신장 질환의 예방 및/또는 치료를 위한 sglt-2 억제제의 용도 | |
| CN121175053A (zh) | 包含一或多种sglt-2抑制剂及替米沙坦的非人类哺乳动物中肾脏疾病和/或高血压的组合治疗和/或预防 | |
| TWI469785B (zh) | 用於治療代謝性疾病之膳食纖維組成物 | |
| CN121218995A (zh) | 包含一或多种sglt-2抑制剂及匹莫苯丹和/或替米沙坦的非人类哺乳动物中心脏疾病的组合治疗和/或预防 | |
| KR20230136627A (ko) | 포유 동물에서 체중 감소를 유도하기 위한 외인성 케톤 에스테르의 용도 | |
| KR102165805B1 (ko) | 기호성이 증진된 개과 동물용 경구 투여 제제 | |
| EA049395B1 (ru) | Применение ингибиторов sglt-2 для профилактики и/или лечения сердечных заболеваний у кошачьих | |
| WO2016132483A1 (ja) | ヒトキマーゼ阻害剤及びヒトキマーゼの活性が関与する疾患の予防治療用薬剤 | |
| BR122024003011A2 (pt) | Uso de inibidores de sglt-2 para a prevenção e/ou tratamento de doenças cardíacas em felinos | |
| KR20260018892A (ko) | 하나 이상의 sglt-2 억제제 및 피모벤단 및/또는 텔미사르탄을 포함하는 비인간 포유류의 심장 질환의 병용 치료 및/또는 예방 | |
| KR20240139551A (ko) | 허혈-재관류 손상의 예방 또는 치료용 약학 조성물 | |
| JP2016150915A (ja) | ヒトキマーゼ阻害剤およびヒトキマーゼの活性が関与する疾患の予防治療用薬剤 | |
| JP2013049670A (ja) | アスコルビン酸製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20220916 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application |