JP7588593B2 - 3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 - Google Patents
3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 Download PDFInfo
- Publication number
- JP7588593B2 JP7588593B2 JP2021545847A JP2021545847A JP7588593B2 JP 7588593 B2 JP7588593 B2 JP 7588593B2 JP 2021545847 A JP2021545847 A JP 2021545847A JP 2021545847 A JP2021545847 A JP 2021545847A JP 7588593 B2 JP7588593 B2 JP 7588593B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- acid
- group
- solvent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C201/00—Preparation of esters of nitric or nitrous acid or of compounds containing nitro or nitroso groups bound to a carbon skeleton
- C07C201/06—Preparation of nitro compounds
- C07C201/12—Preparation of nitro compounds by reactions not involving the formation of nitro groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C205/00—Compounds containing nitro groups bound to a carbon skeleton
- C07C205/06—Compounds containing nitro groups bound to a carbon skeleton having nitro groups bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C205/00—Compounds containing nitro groups bound to a carbon skeleton
- C07C205/49—Compounds containing nitro groups bound to a carbon skeleton the carbon skeleton being further substituted by carboxyl groups
- C07C205/56—Compounds containing nitro groups bound to a carbon skeleton the carbon skeleton being further substituted by carboxyl groups having nitro groups bound to carbon atoms of six-membered aromatic rings and carboxyl groups bound to acyclic carbon atoms of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C227/00—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C227/04—Formation of amino groups in compounds containing carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/40—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino groups bound to carbon atoms of at least one six-membered aromatic ring and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C229/42—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino groups bound to carbon atoms of at least one six-membered aromatic ring and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton with carboxyl groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by saturated carbon chains
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/02—Preparation of carboxylic acid amides from carboxylic acids or from esters, anhydrides, or halides thereof by reaction with ammonia or amines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/10—Preparation of carboxylic acid amides from compounds not provided for in groups C07C231/02 - C07C231/08
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/16—Preparation of optical isomers
- C07C231/18—Preparation of optical isomers by stereospecific synthesis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/45—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups
- C07C233/53—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by a carbon atom of a six-membered aromatic ring
- C07C233/54—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by a carbon atom of a six-membered aromatic ring having the carbon atom of the carboxamide group bound to a hydrogen atom or to a carbon atom of a saturated carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C303/00—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides
- C07C303/26—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of esters of sulfonic acids
- C07C303/28—Preparation of esters or amides of sulfuric acids; Preparation of sulfonic acids or of their esters, halides, anhydrides or amides of esters of sulfonic acids by reaction of hydroxy compounds with sulfonic acids or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/63—Esters of sulfonic acids
- C07C309/64—Esters of sulfonic acids having sulfur atoms of esterified sulfo groups bound to acyclic carbon atoms
- C07C309/65—Esters of sulfonic acids having sulfur atoms of esterified sulfo groups bound to acyclic carbon atoms of a saturated carbon skeleton
- C07C309/66—Methanesulfonates
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
ペルオキシソーム増殖因子活性化受容体(PPAR)は、遺伝子発現を調節するリガンド活性化転写因子である核ホルモン受容体スーパーファミリーのメンバーである。特定のPPARは、高等生物の細胞分化、発育および代謝の調節において役割を果たす。
本開示は、例えば、PPAR受容体の調節物質であり得る化合物の調製方法を提供する。
ここで、本開示の特徴および他の詳細についてより詳細に説明する。本開示のさらなる説明の前に、本明細書、実施例および添付の特許請求の範囲で使用される特定の用語がここにまとめられている。これらの定義は、本開示の残りの部分に照らして読まれるべきであり、当業者によって理解されるべきである。別段の定義がなければ、本明細書において使用される全ての技術用語および科学用語は、当業者によって一般的に理解されているものと同じ意味を有する。
本明細書で使用される「アルケニル」という用語は、少なくとも1つの炭素-炭素二重結合を有する不飽和直鎖または分枝炭化水素、例えば本明細書において、それぞれC2~C12アルケニル、C2~C10アルケニルおよびC2~C6アルケニルと呼ばれる2~12個、2~10個または2~6個の炭素原子の直鎖または分枝基を指す。例示的なアルケニル基には、ビニル、アリル、ブテニル、ペンテニル、ヘキセニル、ブタジエニル、ペンタジエニル、ヘキサジエニル、2-エチルヘキセニル、2-プロピル-2-ブテニル、4-(2-メチル-3-ブテン)-ペンテニルなどが含まれるが、これらに限定されない。
1つには、実質的に光学的に純粋な式(VII)の化合物:
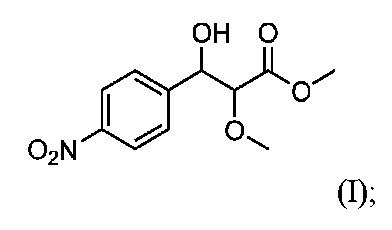
式(I)の化合物:
を形成することと、
アルコール溶媒の存在下で、前記式(I-A)の中間体を塩基溶液で処理して、前記脱離基を除去し、それにより式(I-B)の中間体:
前記式(I-B)の中間体を加水分解して、式(IV)の化合物:
前記式(IV)の化合物を水素化して、式(V)の化合物:
必要に応じて前記式(V)の化合物を分割して、実質的に光学的に純粋な式(VI)の化合物:
前記式(VI)の化合物をアシル化して、式(VII)の化合物を形成することと、
を含む方法が本明細書において提供される。
a)キラル酸の存在下で式(V)の化合物を分割し、それにより式(VI)の化合物のキラル塩を形成すること、および
b)式(VI)の化合物のキラル塩を中和し、それにより式(VI)の化合物を形成すること。
a)エナンチオマーの混合物を(分割剤のキラル塩として)母液から回収し、キラル塩を中和して式(V)の化合物を形成し、式(V)の化合物を分割して、さらなる実質的に光学的に純粋な式(VI)の化合物を提供し、それによって全過程収率を増加させること、または
b)母液の一部を蒸留し、キラル分割剤の塩として母液から所望のエナンチオマーを沈殿させ、それによって全過程収率を増加させること、
を必要に応じてさらに含み得る。
a)キラル塩基の存在下で3-(4-アセトアミドフェニル)-2-メトキシプロピオン酸のラセミ混合物を分割し、それにより化合物のキラル塩を形成すること、および
b)該化合物のキラル塩を中和し、それにより式(VII)の化合物を形成すること、
を含み得る。
式(II)の化合物:
前記混合物を(例えば、テトラヒドロフランなどの溶媒中で)塩基と接触させ、それによって式(I)の化合物を形成することと、を含む方法を提供する。
式(I)の化合物:
を形成することと、
アルコール溶媒の存在下で、前記式(I-A)の中間体を塩基溶液で処理して、前記脱離基を除去し、それにより式(I-B)の中間体:
前記式(I-B)の中間体を加水分解して、式(IV)の化合物:
前記式(IV)の化合物を水素化して、式(V)の化合物:
前記式(V)の化合物を分割して、実質的に光学的に純粋な式(VI)の化合物を形成することと、を含み、方法および変数が本明細書に定義されているとおりである、方法も本明細書において提供される。
全般:
APCI 大気圧化学イオン化
DSC 示差走査熱量測定
EA 元素分析
ESI エレクトロスプレーイオン化
GC ガスクロマトグラフィー
HPLC 高速液体クロマトグラフィー
ICP-AES 誘導結合プラズマ原子発光分光法
LC 液体クロマトグラフィー
MHz メガヘルツ
MS 質量分析
NMR 核磁気共鳴
TLC 薄層クロマトグラフィー
Me メチル
Ph フェニル
Et エチル
溶媒および試薬
CSA カンファースルホン酸
DMF N,N-ジメチルホルムアミド
EtOAc 酢酸エチル
メシル メタンスルホニル
NaOMe ナトリウムメトキシド
THF テトラヒドロフラン
200MHzまたは600MHzで動作するVarian Gemini 200NMR分光光度計を使用して、1H NMRスペクトルを記録した。プロトンの化学シフトは、溶媒残留ピーク(DMSO-d6:2.50ppm)を内部標準として使用してδスケールで百万分率として報告した。データは以下のように表される:化学シフト(δ)、多重度(s=一重線、d=二重線、t=三重線、q=四重線、qn=五重線、sx=六重線、sp=七重線、m=多重線、br=ブロード、dd=二重線の二重線、dt=三重線の二重線、qd=二重線の四重線、dquin=五重線の二重線)、カップリング定数(J、Hz)および積分(#H)。
キラル純度(HPLC)は、以下のように決定した。
(S)-(-)-3-(4-アミノフェニル)-2-メトキシプロピオン酸(VI)および(S)-(-)-3-(4-アセトアミドフェニル)-2-メトキシプロピオン酸(VII)の調製
スキーム2.
(S)-(-)-3-(4-アミノフェニル)-2-メトキシプロピオン酸(VI)および(S)-(-)-3-(4-アセトアミドフェニル)-2-メトキシプロピオン酸(VII)の調製方法
スキーム9.
(S)-(-)-3-(4-アミノフェニル)-2-メトキシプロピオン酸
(VI)および(S)-(-)-3-(4-アセトアミドフェニル)-2-メトキシプロピオン酸(VII)の調製方法
スキーム16.
式(VII)の化合物のX線結晶構造決定
実験式 C17H24N2O6
式量 352.38
温度 296(2)K
回折計 Bruker Smart-Apex(エリア検出器)
波長 0.71073Å
結晶系 斜方晶系
空間群 P212121
単位格子寸法 a=7.7813(5)Å α=90°
b=9.5414(6)Å β=90°
c=49.006(3)Å γ=90°
体積 3638.4(4)Å3
Z 8
密度(計算値) 1.287 Mg/m3
吸収係数 0.098 mm-1
F(000) 1504
結晶サイズ 0.49×0.25×0.08mm3
データ収集のためのシータ範囲 0.83~28.75°。
指数範囲 -10<=h<=8,-12<=k<=12,-54<=l<=63
収集された反射 19513
独立した反射 8598 [R(int)=0.0437]
シータへの完全性=25.00° 99.7%
吸収補正 等価物から半経験的
最大および最小透過 0.992および0.777
精密化方法 F2に対する全行列最小二乗
データ/抑制/パラメータ 8598/0/474
F2に対する適合度 0.984
最終R指数[I>2シグマ(I)] R1=0.0623、wR2=0.1517
R指数(全てのデータ) R1=0.1217、wR2=0.1843
絶対構造パラメータ -0.8(13)
最大回折ピークおよびホール 0.382および-0307 e.Å-3
計算プログラム(Bruker) Smart 5.6/Saint 5.0/Shelxtl-NT 6.1
以下に列挙される項目を含む本明細書で言及される全ての刊行物および特許は、あたかも各個々の刊行物または特許が具体的かつ個別的に参照により組み込まれているかのように、全ての目的のためにその全体が参照により本明細書に組み込まれる。矛盾する場合には、本明細書における任意の定義を含む本出願が優先する。
本開示の特定の実施形態を説明したが、上記の明細書は例示的なものであり、限定的なものではない。本明細書を検討することにより、本開示の様々な変形が当業者に自明となるであろう。本開示の全範囲は、その均等物の全範囲と併せた特許請求の範囲、およびこのような変形と併せた本明細書を参照することによって決定されるべきである。
例えば、本発明は、以下の項目を提供する。
(項目1)
実質的に光学的に純粋な式(VII)の化合物:
を調製するための方法であって、
式(I)の化合物:
を、必要に応じて塩基の存在下で、活性化剤と反応させて、式(I-A)の中間体:
(式中、LGは脱離基である)
を形成することと、
アルコール溶媒の存在下で、前記式(I-A)の中間体を塩基溶液で処理して、前記脱離基を除去し、それにより式(I-B)の中間体:
を形成することと、
前記式(I-B)の中間体を加水分解して、式(IV)の化合物:
を形成することと、
前記式(IV)の化合物を水素化して、式(V)の化合物:
を形成することと、
前記式(V)の化合物を分割して、実質的に光学的に純粋な式(VI)の化合物:
を形成することと、
前記式(VI)の化合物をアシル化して、式(VII)の化合物を形成することと、
を含む、方法。
(項目2)
式(I)の化合物を活性化剤と反応させることが、塩基および溶媒の存在下で反応させることを含む、項目1に記載の方法。
(項目3)
前記溶媒が、トルエン、ジクロロメタン、テトラヒドロフラン、ジエチルエーテル、2-メチルテトラヒドロフランおよびアセトニトリルからなる群から選択される、項目2に記載の方法。
(項目4)
前記溶媒がトルエンである、項目2または3に記載の方法。
(項目5)
前記塩基がアミン塩基である、項目1~4のいずれか一項に記載の方法。
(項目6)
前記アミン塩基が、トリエチルアミン、N,N-ジイソプロピルエチルアミンおよびピリジンからなる群から選択される、項目5に記載の方法。
(項目7)
前記アミン塩基がトリエチルアミンである、項目5~6のいずれか一項に記載の方法。
(項目8)
前記活性化剤がスルホニル化剤またはハロゲン化剤である、項目1~7のいずれか一項に記載の方法。
(項目9)
前記活性化剤が、メタンスルホニルクロリド、p-トルエンスルホニルクロリド、p-ブロモベンゼンスルホニルクロリド、フェニルトリフルイミド、トリフルオロメタンスルホン酸無水物およびノナフルオロブタンスルホン酸無水物からなる群から選択される、項目1~8のいずれか一項に記載の方法。
(項目10)
前記活性化剤がメタンスルホニルクロリドである、項目1~9のいずれか一項に記載の方法。
(項目11)
前記脱離基が、-OSO 2 -アリール、-OSO 2 -C 1~4 アルキル、クロロ、ブロモおよびヨードからなる群から選択され、式中、C 1~4 アルキルおよびアリールは、出現ごとに、フルオロ、ブロモおよび-CH 3 からなる群からそれぞれ独立して選択される1またはそれを超える置換基で必要に応じて置換され得る、項目1~7のいずれか一項に記載の方法。
(項目12)
前記脱離基が-OSO 2 -フェニルまたは-OSO 2 -C 1~4 アルキルである、項目11のいずれか一項に記載の方法。
(項目13)
前記脱離基が、-OSO 2 Me、
、-OSO 2 CF 3
および-OSO 2 CF 2 CF 2 CF 2 CF 3 からなる群から独立して選択される、項目11または12のいずれか一項に記載の方法。
(項目14)
前記脱離基が-OSO 2 Meである、項目1~13のいずれか一項に記載の方法。
(項目15)
前記アルコール溶媒が、メタノール、エタノール、イソプロパノールおよびブタノールの少なくとも1つを含む、項目1~14のいずれか一項に記載の方法。
(項目16)
前記アルコール溶媒がメタノールを含む、項目15に記載の方法。
(項目17)
前記塩基溶液が、水酸化ナトリウム、水酸化リチウムおよび水酸化カリウムの少なくとも1つを含む、項目1~16のいずれか一項に記載の方法。
(項目18)
前記塩基溶液が水酸化ナトリウムを含む、項目17に記載の方法。
(項目19)
前記塩基溶液が約30%の水酸化ナトリウムを含む、項目1~18のいずれか一項に記載の方法。
(項目20)
前記式(I-B)の中間体を加水分解して式(IV)の化合物を形成することが、
(i)前記式(I-B)の中間体を水酸化アルカリおよび水と接触させることと、
(ii)中和して、前記式(IV)の化合物を形成することと、
を含む、項目1~19のいずれか一項に記載の方法。
(項目21)
前記水酸化アルカリが水酸化ナトリウムである、項目20に記載の方法。
(項目22)
中和することが、酸を添加することによって3未満または3に等しいpHに酸性化することを含む、項目20または21に記載の方法。
(項目23)
前記酸が、リン酸もしくは塩酸またはこれらの混合物である、項目22に記載の方法。
(項目24)
前記式(IV)の化合物を水素化して式(V)の化合物を形成することが、前記式(IV)の化合物を水素および触媒と接触させることを含む、項目1~23のいずれか一項に記載の方法。
(項目25)
前記触媒が約5%Pd/Cである、項目24に記載の方法。
(項目26)
水素化が、約60~80℃の間に維持される反応温度で、および約3~5atmの圧力で行われる、項目1~25のいずれか一項に記載の方法。
(項目27)
前記式(V)の化合物を分割して、実質的に光学的に純粋な式(VI)の化合物を形成することが、
(a)キラル酸の存在下で式(V)の化合物を分割し、それにより式(VI)の化合物のキラル塩を形成することと、
(b)前記式(VI)の化合物の前記キラル塩を中和し、それにより前記式(VI)の化合物を形成することと、
を含む、項目1~26のいずれか一項に記載の方法。
(項目28)
前記キラル酸が、(S)-(+)-カンファー-10-スルホン酸、(2R,3R)-(+)-酒石酸、(S)-(-)-リンゴ酸および(R)-(-)-マンデル酸またはこれらのエナンチオマーからなる群から選択される、項目27に記載の方法。
(項目29)
前記キラル酸が、(S)-(+)-カンファー-10-スルホン酸である、項目27または28に記載の方法。
(項目30)
前記式(VI)の化合物の前記キラル塩が、
である、項目27~29のいずれか一項に記載の方法。
(項目31)
分割することが、撹拌しながら55~60℃の温度を維持することをさらに含む、項目1~30のいずれか一項に記載の方法。
(項目32)
中和することが、前記式(VI)の化合物の前記キラル塩を(i)塩基水溶液と接触させることと、次いで、(ii)酸を添加することによって前記溶液を酸性化することと、を含む、項目27~31のいずれか一項に記載の方法。
(項目33)
前記塩基水溶液が水酸化アンモニウム水溶液を含む、項目32に記載の方法。
(項目34)
アシル化することが、前記式(VI)の化合物を、酢酸エチル、テトラヒドロフラン、ジエチルエーテル、ジクロロメタンおよびトルエンからなる群から選択される有機溶媒の存在下でアシル化剤と接触させることを含む、項目1~33のいずれか一項に記載の方法。
(項目35)
前記アシル化剤が無水酢酸である、項目34に記載の方法。
(項目36)
前記有機溶媒が酢酸エチルである、項目34または35に記載の方法。
(項目37)
アシル化が60~70℃の温度で起こる、項目1~36のいずれか一項に記載の方法。
(項目38)
前記式(VII)の化合物が、マルチキログラム規模で製造される、項目1~37のいずれか一項に記載の方法。
(項目39)
少なくとも約130kgの前記式(VII)の化合物が得られる、項目38に記載の方法。
(項目40)
前記実質的に光学的に純粋な式(VII)の化合物が、少なくとも98%のエナンチオマー:
である(両エナンチオマーの百分率として表される)、項目1~39のいずれか一項に記載の方法。
(項目41)
(S)-(-)-3-(4-アミノフェニル)-2-メトキシプロピオン酸の含有量がHPLCによると0.15%以下である、項目40に記載の式(VII)の精製された化合物。
(項目42)
式(I)の化合物:
を調製するための方法であって、
式(II)の化合物:
と式(III)の化合物:
の混合物を準備することと、前記混合物を塩基と接触させ、それによって式(I)の化合物を形成することと、を含む、方法。
(項目43)
接触させることが溶媒中で行われる、項目42に記載の方法。
(項目44)
前記溶媒がテトラヒドロフランである、項目42または43に記載の方法。
(項目45)
接触させることが0℃未満または0℃に等しい温度で行われる、項目42~44のいずれか一項に記載の方法。
(項目46)
接触させることが、約5分間撹拌することを含み、および/または-5~0℃に維持される反応温度で行われる、項目42~45のいずれか一項に記載の方法。
(項目47)
前記塩基がアルカリ金属アルコキシドである、項目42~46のいずれか一項に記載の方法。
(項目48)
前記アルカリ金属アルコキシドが、ナトリウムメトキシド、リチウムメトキシドおよびカリウムメトキシドからなる群から選択される、項目47に記載の方法。
(項目49)
前記アルカリ金属アルコキシドがナトリウムメトキシドである、項目47または48に記載の方法。
(項目50)
によって表される化合物またはその薬学的に許容され得る塩。
(項目51)
項目1~40のいずれか一項に記載の方法によって取得可能な式(VII)の精製された化合物:
であって、HPLCによると0.15%以下の(S)-(-)-3-(4-アミノフェニル)-2-メトキシプロピオン酸の含有量を有する、式(VII)の精製された化合物。
Claims (49)
- 実質的に光学的に純粋な式(VII)の化合物:
を調製するための方法であって、
式(I)の化合物:
を、活性化剤と反応させて、式(I-A)の中間体:
(式中、LGは脱離基である)
を形成することと、
アルコール溶媒の存在下で、前記式(I-A)の中間体を塩基溶液で処理して、前記脱離基を除去し、それにより式(I-B)の中間体:
を形成することと、
前記式(I-B)の中間体を加水分解して、式(IV)の化合物:
を形成することと、
前記式(IV)の化合物を水素化して、式(V)の化合物:
を形成することと、
前記式(V)の化合物を分割して、実質的に光学的に純粋な式(VI)の化合物:
を形成することと、
前記式(VI)の化合物をアシル化して、式(VII)の化合物を形成することと、
を含む、方法。 - 式(I)の化合物を活性化剤と反応させることが、塩基および溶媒の存在下で反応させることを含む、請求項1に記載の方法。
- 前記溶媒が、トルエン、ジクロロメタン、テトラヒドロフラン、ジエチルエーテル、2-メチルテトラヒドロフランおよびアセトニトリルからなる群から選択される、請求項2に記載の方法。
- 前記溶媒がトルエンである、請求項2または3に記載の方法。
- 前記アミン塩基が、トリエチルアミン、N,N-ジイソプロピルエチルアミンおよびピリジンからなる群から選択される、請求項5に記載の方法。
- 前記アミン塩基がトリエチルアミンである、請求項5~6のいずれか一項に記載の方法。
- 前記活性化剤がスルホニル化剤またはハロゲン化剤である、請求項1~7のいずれか一項に記載の方法。
- 前記活性化剤が、メタンスルホニルクロリド、p-トルエンスルホニルクロリド、p-ブロモベンゼンスルホニルクロリド、フェニルトリフルイミド、トリフルオロメタンスルホン酸無水物およびノナフルオロブタンスルホン酸無水物からなる群から選択される、請求項1~8のいずれか一項に記載の方法。
- 前記活性化剤がメタンスルホニルクロリドである、請求項1~9のいずれか一項に記載の方法。
- 前記脱離基が、-OSO2-アリール、-OSO2-C1~4アルキル、クロロ、ブロモおよびヨードからなる群から選択され、式中、C1~4アルキルおよびアリールは、出現ごとに、フルオロ、ブロモおよび-CH3からなる群からそれぞれ独立して選択される1またはそれを超える置換基で必要に応じて置換され得る、請求項1~7のいずれか一項に記載の方法。
- 前記脱離基が-OSO2-フェニルまたは-OSO2-C1~4アルキルである、請求項11のいずれか一項に記載の方法。
- 前記脱離基が-OSO2Meである、請求項1~13のいずれか一項に記載の方法。
- 前記アルコール溶媒が、メタノール、エタノール、イソプロパノールおよびブタノールの少なくとも1つを含む、請求項1~14のいずれか一項に記載の方法。
- 前記アルコール溶媒がメタノールを含む、請求項15に記載の方法。
- 前記塩基溶液が、水酸化ナトリウム、水酸化リチウムおよび水酸化カリウムの少なくとも1つを含む、請求項1~16のいずれか一項に記載の方法。
- 前記塩基溶液が水酸化ナトリウムを含む、請求項17に記載の方法。
- 前記塩基溶液が約30%の水酸化ナトリウムを含む、請求項1~18のいずれか一項に記載の方法。
- 前記式(I-B)の中間体を加水分解して式(IV)の化合物を形成することが、
(i)前記式(I-B)の中間体を水酸化アルカリおよび水と接触させることと、
(ii)中和して、前記式(IV)の化合物を形成することと、
を含む、請求項1~19のいずれか一項に記載の方法。 - 前記水酸化アルカリが水酸化ナトリウムである、請求項20に記載の方法。
- 中和することが、酸を添加することによって3未満または3に等しいpHに酸性化することを含む、請求項20または21に記載の方法。
- 前記酸が、リン酸もしくは塩酸またはこれらの混合物である、請求項22に記載の方法。
- 前記式(IV)の化合物を水素化して式(V)の化合物を形成することが、前記式(IV)の化合物を水素および触媒と接触させることを含む、請求項1~23のいずれか一項に記載の方法。
- 前記触媒が約5%Pd/Cである、請求項24に記載の方法。
- 水素化が、約60~80℃の間に維持される反応温度で、および約3~5atmの圧力で行われる、請求項1~25のいずれか一項に記載の方法。
- 前記式(V)の化合物を分割して、実質的に光学的に純粋な式(VI)の化合物を形成することが、
(a)キラル酸の存在下で式(V)の化合物を分割し、それにより式(VI)の化合物のキラル塩を形成することと、
(b)前記式(VI)の化合物の前記キラル塩を中和し、それにより前記式(VI)の化合物を形成することと、
を含む、請求項1~26のいずれか一項に記載の方法。 - 前記キラル酸が、(S)-(+)-カンファー-10-スルホン酸、(2R,3R)-(+)-酒石酸、(S)-(-)-リンゴ酸および(R)-(-)-マンデル酸またはこれらのエナンチオマーからなる群から選択される、請求項27に記載の方法。
- 前記キラル酸が、(S)-(+)-カンファー-10-スルホン酸である、請求項27または28に記載の方法。
- 分割することが、撹拌しながら55~60℃の温度を維持することをさらに含む、請求項1~30のいずれか一項に記載の方法。
- 中和することが、前記式(VI)の化合物の前記キラル塩を(i)塩基水溶液と接触させることと、次いで、(ii)酸を添加することによって前記溶液を酸性化することと、を含む、請求項27~31のいずれか一項に記載の方法。
- 前記塩基水溶液が水酸化アンモニウム水溶液を含む、請求項32に記載の方法。
- アシル化することが、前記式(VI)の化合物を、酢酸エチル、テトラヒドロフラン、ジエチルエーテル、ジクロロメタンおよびトルエンからなる群から選択される有機溶媒の存在下でアシル化剤と接触させることを含む、請求項1~33のいずれか一項に記載の方法。
- 前記アシル化剤が無水酢酸である、請求項34に記載の方法。
- 前記有機溶媒が酢酸エチルである、請求項34または35に記載の方法。
- アシル化が60~70℃の温度で起こる、請求項1~36のいずれか一項に記載の方法。
- 前記式(VII)の化合物が、マルチキログラム規模で製造される、請求項1~37のいずれか一項に記載の方法。
- 少なくとも約130kgの前記式(VII)の化合物が得られる、請求項38に記載の方法。
- 接触させることが溶媒中で行われる、請求項41に記載の方法。
- 前記溶媒がテトラヒドロフランである、請求項41または42に記載の方法。
- 接触させることが0℃未満または0℃に等しい温度で行われる、請求項41~43のいずれか一項に記載の方法。
- 接触させることが、約5分間撹拌することを含み、および/または-5~0℃に維持される反応温度で行われる、請求項41~44のいずれか一項に記載の方法。
- 前記塩基がアルカリ金属アルコキシドである、請求項41~45のいずれか一項に記載の方法。
- 前記アルカリ金属アルコキシドが、ナトリウムメトキシド、リチウムメトキシドおよびカリウムメトキシドからなる群から選択される、請求項46に記載の方法。
- 前記アルカリ金属アルコキシドがナトリウムメトキシドである、請求項46または47に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024197426A JP2025015586A (ja) | 2019-02-08 | 2024-11-12 | 3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962802802P | 2019-02-08 | 2019-02-08 | |
| US62/802,802 | 2019-02-08 | ||
| PCT/EP2020/053369 WO2020161362A1 (en) | 2019-02-08 | 2020-02-10 | Process of making 3-(4'-aminophenyl)-2-methoxypropionic acid, and analogs and intermediates thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024197426A Division JP2025015586A (ja) | 2019-02-08 | 2024-11-12 | 3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022519654A JP2022519654A (ja) | 2022-03-24 |
| JP7588593B2 true JP7588593B2 (ja) | 2024-11-22 |
Family
ID=69582097
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021545847A Active JP7588593B2 (ja) | 2019-02-08 | 2020-02-10 | 3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 |
| JP2024197426A Pending JP2025015586A (ja) | 2019-02-08 | 2024-11-12 | 3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024197426A Pending JP2025015586A (ja) | 2019-02-08 | 2024-11-12 | 3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US11905232B2 (ja) |
| EP (2) | EP3921299B1 (ja) |
| JP (2) | JP7588593B2 (ja) |
| KR (1) | KR20210125047A (ja) |
| AU (1) | AU2020217884B2 (ja) |
| CA (1) | CA3128302A1 (ja) |
| DK (1) | DK3921299T3 (ja) |
| EA (1) | EA202192207A1 (ja) |
| FI (1) | FI3921299T3 (ja) |
| IL (1) | IL285339B1 (ja) |
| LT (1) | LT3921299T (ja) |
| MX (1) | MX2021009498A (ja) |
| PL (1) | PL3921299T3 (ja) |
| PT (1) | PT3921299T (ja) |
| SM (1) | SMT202500054T1 (ja) |
| WO (1) | WO2020161362A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9682923B2 (en) | 2012-02-09 | 2017-06-20 | Nogra Pharma Limited | Methods of treating fibrosis |
| EP3921299B1 (en) | 2019-02-08 | 2024-11-20 | Nogra Pharma Limited | Process of making 3-(4'-aminophenyl)-2-methoxypropionic acid, and analogs and intermediates thereof |
| WO2022069701A1 (en) | 2020-10-01 | 2022-04-07 | Nogra Pharma Limited | Methods of treating pulmonary fibrosis |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020042545A1 (en) | 2000-10-02 | 2002-04-11 | The Scripps Research Institute | Second cycle asymmetric dihydroxylation reaction |
| JP2005505617A (ja) | 2001-10-16 | 2005-02-24 | ドクター・レディーズ・ラボラトリーズ・リミテッド | 新規のβ−フェニル−α−オキシ置換型プロピオニック誘導体、その製造方法および薬剤的に重要な化合物の製造におけるその使用 |
| JP2009502777A (ja) | 2005-07-22 | 2009-01-29 | ジュリアーニ インターナショナル リミテッド | Ppar受容体及びegf受容体に特異的な化合物及びそれらの塩並びに医療分野におけるそれらの使用 |
| JP2012517968A (ja) | 2009-02-16 | 2012-08-09 | ジュリアーニ インターナショナル リミテッド | アルキルアミド化合物およびその使用 |
| JP2015528479A (ja) | 2012-09-13 | 2015-09-28 | ノグラ ファーマ リミテッド | 毛に関連した状態を処置する方法 |
Family Cites Families (116)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB767788A (en) | 1953-12-28 | 1957-02-06 | Schering Corp | Polyiodinated phenyl fatty acid compounds and process for their manufacture |
| US3211610A (en) | 1961-09-29 | 1965-10-12 | Merck & Co Inc | Benzoic acid ester derivatives for treating coccidiosis and method of using same |
| US3444232A (en) | 1966-05-18 | 1969-05-13 | Squibb & Sons Inc | O-alkyl or phenylalkyl benzohydroxamic acids |
| GB1359560A (en) | 1972-02-25 | 1974-07-10 | Merck & Co Inc | Preparation of pyrrylsalicylic acid |
| US4036951A (en) | 1973-03-12 | 1977-07-19 | Synergistics, Inc. | Ultra-violet filtration with certain aminosalicylic acid esters |
| FR2440353A1 (fr) | 1978-11-03 | 1980-05-30 | Science Union & Cie | Nouveaux arylethanols, leurs procedes d'obtention et leur emploi comme medicament |
| US4348223A (en) | 1980-12-05 | 1982-09-07 | Ppg Industries, Inc. | N-Alkyl-N-[3-(alkoxyalkyl)phenyl]-2-haloacetamide herbicides |
| DE3164618D1 (en) | 1980-12-22 | 1984-08-09 | Schering Ag | 3-substituted 2,4,6-trihalogenobenzamides and their salts, their preparation and their use as substitutes for natural sweetening agents, and sweeteners containing them |
| JPS58194814A (ja) | 1982-05-11 | 1983-11-12 | Nippon Shinyaku Co Ltd | 免疫調節作用を有する薬剤 |
| IL69282A (en) | 1982-09-02 | 1988-06-30 | Euro Celtique Sa | Method for the carboxylation of potassium phenoxide with carbon dioxide |
| GB8302708D0 (en) | 1983-02-01 | 1983-03-02 | Efamol Ltd | Pharmaceutical and dietary composition |
| EP0279096B1 (en) | 1987-02-05 | 1993-07-07 | Kureha Kagaku Kogyo Kabushiki Kaisha | Benzyl ether compound and process for producing the same |
| AU1388388A (en) | 1987-04-01 | 1988-10-06 | Dak-Laboratoriet A/S | Benzoic acid derivatives and use thereof |
| ATE113209T1 (de) | 1988-05-05 | 1994-11-15 | Tillotts Pharma Ag | Verwendung von 5-amino-salicylsäure für die behandlung von hautkrankheiten. |
| US5519014A (en) | 1990-10-22 | 1996-05-21 | Borody; Thomas J. | Treatment of non-inflammatory and non-infectious bowel disorders |
| ATE256468T1 (de) | 1990-10-22 | 2004-01-15 | Gastro Services Pty Ltd | Behandlung von nicht-entzündlichen darmerkrankungen |
| US5262549A (en) | 1991-05-30 | 1993-11-16 | Polaroid Corporation | Benzpyrylium dyes, and processes for their preparation and use |
| US5302751A (en) | 1992-01-21 | 1994-04-12 | Ethyl Corporation | Profen resolution |
| DE122005000058I1 (de) | 1992-03-17 | 2006-04-27 | Astellas Pharma Inc | Depsipeptide, Herstellung und Anwendung |
| WO1994000135A1 (en) | 1992-06-30 | 1994-01-06 | Shapiro Howard K | Composition containing amine and amine-related derivatives of benzoic acid and uses therefor including treating inflammatory diseases |
| US5594151A (en) | 1994-01-28 | 1997-01-14 | Prolinx, Inc. | Phenylboronic acid complexing reagents derived from aminosalicylic acid |
| CA2190107A1 (en) | 1994-05-11 | 1995-11-23 | Howard K. Shapiro | Compositions for treatment of chronic inflammatory diseases |
| US5594015A (en) | 1994-06-22 | 1997-01-14 | Regents Of The University Of California | Thiazolidine derivatives for the treatment of psoriasis |
| HUP9900309A3 (en) | 1995-03-28 | 1999-11-29 | Janssen Pharmaceutica Nv | Use of ridogrel for producing pharmaceutical compositions for the treatment of inflammatory bowel diseases |
| GB9600464D0 (en) | 1996-01-09 | 1996-03-13 | Smithkline Beecham Plc | Novel method |
| GB9617001D0 (en) | 1996-08-13 | 1996-09-25 | Tillotts Pharma Ag | Oral composition |
| DE19647582A1 (de) | 1996-11-18 | 1998-05-20 | Hoechst Ag | Verfahren zur Herstellung von aromatischen Olefinen mittels Katalyse durch Palladaphosphacyclobutane |
| AU6773598A (en) | 1997-03-26 | 1998-10-20 | Institut Pasteur | Treatment of gastrointestinal disease with ppar modulators |
| WO1999005161A1 (en) | 1997-07-25 | 1999-02-04 | Ligand Pharmaceuticals Incorporated | HUMAN PEROXISOME PROLIFERATOR ACTIVATED RECEPTOR GAMMA (PPARη) GENE REGULATORY SEQUENCES AND USES THEREFOR |
| AU9002798A (en) | 1997-09-19 | 1999-04-12 | Ono Pharmaceutical Co. Ltd. | Fused or nonfused benzene compounds |
| JP2001525364A (ja) | 1997-12-12 | 2001-12-11 | パーデュー・リサーチ・ファンデーション | 糖尿病を治療する方法及び組成物 |
| US7015249B1 (en) | 1997-12-12 | 2006-03-21 | Purdue Research Foundation | Methods and compositions for treating diabetes |
| FR2773075B1 (fr) | 1997-12-31 | 2000-05-05 | Cird Galderma | Utilisation d'activateurs de ppar-gamma en dermatologie |
| US6114382A (en) | 1998-11-11 | 2000-09-05 | Moretti; Itagiba G. | Methods for treating inflammatory bowel disease |
| US6326364B1 (en) | 1999-02-08 | 2001-12-04 | Cedars-Sinai Medical Center | Use of 5-aminosalicylates as antimicrobial agents |
| FR2791671B1 (fr) | 1999-04-01 | 2001-05-11 | Oreal | Nouveaux composes derives d'esters d'acide benzoique, composition les comprenant et utilisation |
| GB9908647D0 (en) | 1999-04-15 | 1999-06-09 | Smithkline Beecham Plc | Novel compounds |
| US20040034067A1 (en) | 1999-04-15 | 2004-02-19 | Macphee Colin Houston | Novel method of treatment |
| GB9914371D0 (en) | 1999-06-18 | 1999-08-18 | Smithkline Beecham Plc | Novel compounds |
| TWI262185B (en) | 1999-10-01 | 2006-09-21 | Eisai Co Ltd | Carboxylic acid derivatives having anti-hyperglycemia and anti-hyperlipemia action, and pharmaceutical composition containing the derivatives |
| US6369098B1 (en) | 1999-10-05 | 2002-04-09 | Bethesda Pharmaceuticals, Inc. | Dithiolane derivatives |
| US7736661B1 (en) | 2000-03-07 | 2010-06-15 | Avon Products, Inc | Method of treating skin conditions |
| EP1274675B1 (en) | 2000-04-19 | 2004-09-01 | Neurotech Co., Ltd. | Compounds, compositions and methods for preventing neurodegeneration in acute and chronic injuries in the central nervous system |
| US7049342B2 (en) | 2000-05-29 | 2006-05-23 | Kyorin Pharmaceutical Co., Ltd. | Substituted phenylpropionic acid derivatives |
| CA2410647C (en) | 2000-05-29 | 2010-02-09 | Kyorin Pharmaceutical Co., Ltd. | Substituted phenylpropanoic acid derivatives |
| EP1642885B1 (en) | 2000-08-29 | 2009-11-11 | Biocon Limited | Use of a pharmaceutical composition containing a para-aminophenyl acetic acid derivative for treating inflammatory conditions of the gastrointestinal tract |
| AU2002222574A1 (en) | 2000-12-05 | 2002-06-18 | Kyorin Pharmaceutical Co. Ltd. | Substituted carboxylic acid derivatives |
| FR2822955B1 (fr) | 2001-03-27 | 2003-10-03 | Chru Lille | Methode de diagnostic de maladies inflammatoires chroniques de l'intestin |
| US7312247B2 (en) | 2001-03-27 | 2007-12-25 | Errant Gene Therapeutics, Llc | Histone deacetylase inhibitors |
| CA2443935A1 (en) | 2001-04-18 | 2002-10-31 | Merck & Co., Inc. | Ppar-alpha-gamma ligands or agonists for the treatment of inflammation |
| CA2354921A1 (en) | 2001-05-24 | 2002-11-24 | Yasuo Konishi | Drug evolution: drug design at hot spots |
| AU2002357729A1 (en) | 2001-11-16 | 2003-06-10 | Nutrition 21, Inc. | Trans-10, cis-12 conjugated linoleic acid isomer for the treatment of diseases |
| GB0127916D0 (en) | 2001-11-21 | 2002-01-16 | Rowett Res Inst | Method |
| WO2003045383A1 (en) | 2001-11-26 | 2003-06-05 | Arachnova Therapeutics Ltd. | Use of ppar activators for the treatment of pulmonary fibrosis |
| UA82835C2 (en) * | 2001-12-03 | 2008-05-26 | Reddys Lab Ltd Dr | ?-aryl-?-oxysubstituted propionuc acid derivatives and pharmaceutical composition based thereon |
| US20030113815A1 (en) | 2001-12-19 | 2003-06-19 | Pfizer Inc. | Canine peroxisome proliferator activated receptor gamma |
| WO2003053974A1 (en) | 2001-12-21 | 2003-07-03 | Dr. Reddy's Laboratories Ltd. | Novel compounds and their use in medicine, process for their preparation and pharmaceutical compositions containing them |
| US20030220374A1 (en) | 2002-01-14 | 2003-11-27 | Pharmacia Corporation | Compositions and methods of treatment involving peroxisome proliferator-activated receptor-gamma agonists and cyclooxygenase-2 selective inhibitors |
| US20040115127A1 (en) | 2002-04-12 | 2004-06-17 | Wright Samuel D. | Ppar-alpha-gamma ligands or agonists for the treatment of inflammation |
| US8492438B2 (en) | 2002-04-26 | 2013-07-23 | Asan Laboratories Company (Cayman), Limited | Treatment skin disorders |
| WO2003093498A1 (en) | 2002-04-29 | 2003-11-13 | The Ohio State University | Inhibition of protein tyrosine phosphatases and sh2 domains by a neutral phosphotyrosine mimetic |
| DE10250080A1 (de) | 2002-10-25 | 2004-05-13 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Ausgewählte CGRP-Antagonisten, Verfahren zu deren Herstellung sowie deren Verwendung als Arzneimittel |
| GB0303609D0 (en) | 2003-02-17 | 2003-03-19 | Glaxo Group Ltd | Novel therapeutic method and compositions |
| US20060159648A1 (en) | 2003-02-17 | 2006-07-20 | Davis Adrian F | Novel therapeutic method and compositions for topical administration |
| EP1607103A1 (en) | 2003-03-20 | 2005-12-21 | Eisai Co., Ltd. | Concomitant drug as therapeutic agent for inflammatory bowel disease |
| ES2337150T3 (es) | 2003-07-21 | 2010-04-21 | Merck Serono Sa | Alquinilaril carboxamidas. |
| WO2005039590A1 (en) | 2003-10-21 | 2005-05-06 | Inspire Pharmaceuticals, Inc. | Non-nucleotide compositions and method for treating pain |
| EP1680397A2 (en) | 2003-10-28 | 2006-07-19 | Dr. Reddy's Laboratories Ltd. | Novel compounds and their use as antidiabetic and hypolipidemic agents, process for their preparation and pharmaceutical compositions containing them |
| FR2862870A1 (fr) | 2003-12-01 | 2005-06-03 | Galderma Res & Dev | Utilisation d'activateurs de recepteurs ppar en cosmetique et dermatologie. |
| WO2005055933A2 (en) | 2003-12-03 | 2005-06-23 | Smithkline Beecham Corporation | Treatment of psoriasis with rosiglitazone |
| WO2005072113A2 (en) | 2004-01-20 | 2005-08-11 | Harty Richard F | Compositions and methods of treatment for inflammatory diseases |
| WO2005084658A1 (en) | 2004-03-04 | 2005-09-15 | Arakis Ltd. | Derivatives of actarit and their therapeutic use |
| US20050277693A1 (en) | 2004-06-10 | 2005-12-15 | Dr. Reddy's Laboratories Limited | Basic salts and monohydrates of certain alpha, beta-propionic acid derivative |
| AR050631A1 (es) | 2004-09-09 | 2006-11-08 | Novartis Ag | Combinacion de compuestos organicos |
| AU2005289453A1 (en) | 2004-09-27 | 2006-04-06 | Government of the United States of America, as represented by the Secretary of the Department of Health and Human Services, National Institutes of Health | Modulating MxA expression |
| US20060286046A1 (en) | 2005-01-05 | 2006-12-21 | Haber C Andrew | Skin care compositions |
| EP1719543A1 (en) | 2005-05-04 | 2006-11-08 | Asan Labs., Ltd. | Use of histone deacetylase inhibitors for the treatment of gastrointestinal distress |
| US20060270635A1 (en) | 2005-05-27 | 2006-11-30 | Wallace John L | Derivatives of 4- or 5-aminosalicylic acid |
| ITRM20050390A1 (it) | 2005-07-22 | 2007-01-23 | Giuliani Spa | Composti e loro sali specifici per i recettori ppar ed i recettori per l'egf e loro uso in campo medico. |
| US20070093524A1 (en) | 2005-10-25 | 2007-04-26 | Wyeth | 5-Lipoxygenase modulators |
| DE102005061472A1 (de) | 2005-12-22 | 2007-07-05 | Saltigo Gmbh | Verfahren zur Herstellung von enantiomerenangereicherten 2-Alkoxy-3-phenylpropionsäuren |
| WO2007096148A1 (en) | 2006-02-23 | 2007-08-30 | Lipid Nutrition B.V. | Immunoregulation |
| US7645801B2 (en) | 2007-01-29 | 2010-01-12 | Alaven Pharmaceutical Llc | Reduced irritant enema for treatment of inflammatory bowel disease (IBD) |
| IE20070129A1 (en) | 2007-02-28 | 2008-12-24 | Giuliani Int Ltd | Ppar-gamma agonists stimulate enteric defensin expression |
| US8796282B2 (en) | 2007-03-28 | 2014-08-05 | Case Western Reserve University | Method of treating dermatological disorders |
| WO2009025854A1 (en) | 2007-08-22 | 2009-02-26 | Burnham Institute For Medical Research | Smips: small molecule inhibitors of p27 depletion in cancers and other proliferative diseases |
| IE20070928A1 (en) | 2007-12-21 | 2009-09-30 | Giuliani Int Ltd | Multi target ligands |
| ITMI20072429A1 (it) | 2007-12-24 | 2009-06-25 | Giuliani Int Ltd | Composti per il trattamento selettivo della componente immuno-infiammatoria intestinale della malattia celiaca |
| US8030520B2 (en) | 2008-03-31 | 2011-10-04 | Saltigo Gmbh | Process for preparing organic compounds by a transition metal-catalysed cross-coupling reaction of an aryl-X, heteroaryl-X, cycloalkenyl-X or alkenyl-X compound with an alkyl, alkenyl, cycloalkyl or cycloalkenyl halide |
| US20090264520A1 (en) | 2008-04-21 | 2009-10-22 | Asha Lipid Sciences, Inc. | Lipid-containing compositions and methods of use thereof |
| FR2938338B1 (fr) | 2008-11-13 | 2012-10-05 | Galderma Res & Dev | Modulateurs de l'acetyl-coenzyme a acyltransferase 1 ou 2 dans le traitement de l'acne, d'une dermatite seborrheique ou de l'hyperseborrhee |
| UA107562C2 (uk) | 2008-12-05 | 2015-01-26 | Спосіб лікування псоріазу | |
| EP2298321A1 (en) | 2009-08-26 | 2011-03-23 | Nordic Pharma | Novel pharmaceutical compositions for treating IBD |
| AU2011356598B2 (en) | 2011-01-28 | 2017-06-01 | William A. Shaver | Method, composition and package for bowel cleansing |
| US20140256661A1 (en) | 2011-07-15 | 2014-09-11 | David Nigel Armstrong | Pharmaceutical compositions for rectal administration |
| MX351878B (es) | 2011-10-17 | 2017-11-01 | The Regents Of Univ Of California | Metodos para evaluar la calidad del repelente de materiales organicos y metodos y composiciones para repeler artropodos. |
| US9809557B2 (en) | 2011-10-31 | 2017-11-07 | Claus Selch Larsen | Prodrugs of non-steroid anti-inflammatory agents (NSAIDS) |
| US9044304B2 (en) | 2011-12-23 | 2015-06-02 | Alcon Lensx, Inc. | Patient interface with variable applanation |
| US9682923B2 (en) | 2012-02-09 | 2017-06-20 | Nogra Pharma Limited | Methods of treating fibrosis |
| BR112014026160A2 (pt) * | 2012-04-18 | 2017-07-18 | Nogra Pharma Ltd | métodos para tratar intolerância à lactose |
| WO2013168438A1 (ja) | 2012-05-10 | 2013-11-14 | 国立大学法人岩手大学 | ラクターゼ活性を有するタンパク質、該タンパク質をコードする遺伝子、該遺伝子を含有する組み換えベクター、形質転換体、及びその製造方法並びに用途 |
| KR20150016377A (ko) | 2012-06-01 | 2015-02-11 | 노그라 파마 리미티드 | T-세포 반응을 조절할 수 있는 비시클릭 헤테로사이클 및 그의 사용 방법 |
| US9013997B2 (en) | 2012-06-01 | 2015-04-21 | Broadcom Corporation | System for performing distributed data cut-through |
| CA2985787A1 (en) | 2012-06-07 | 2013-12-12 | Georgia State University Research Foundation, Inc. | Seca inhibitors and methods of making and using thereof |
| CN104736149A (zh) | 2012-09-13 | 2015-06-24 | 诺格拉制药有限公司 | 抑制毛发生长的方法 |
| WO2014150377A1 (en) | 2013-03-15 | 2014-09-25 | Embry-Riddle Aeronautical University, Inc. | Electrically coupled counter-rotation for gas turbine compressors |
| US20160045523A1 (en) | 2013-03-26 | 2016-02-18 | Lipid Therapeutics Gmbh | Pharmaceutical formulation comprising phosphatidylcholine for the treatment of ulcerative colitis |
| KR101423005B1 (ko) | 2013-10-17 | 2014-07-28 | 강윤식 | 장 세정용 조성물 |
| CN105566153B (zh) | 2014-10-14 | 2019-05-31 | 中国医学科学院药物研究所 | 偶氮苯衍生物及其制法和药物组合物与用途 |
| US20180193361A1 (en) | 2015-04-02 | 2018-07-12 | University Health Network | Gut anti-inflammatory agents for regulation of high blood glucose levels |
| MX2017016424A (es) | 2015-06-15 | 2019-08-01 | Nmd Pharma Aps | Compuestos para su uso en el tratamiento de trastornos neuromusculares. |
| WO2017046343A1 (en) | 2015-09-17 | 2017-03-23 | Nogra Pharma Limited | Compositions for rectal administration in the treatment of ulcerative colitis and methods of using same |
| WO2017093444A1 (en) | 2015-12-01 | 2017-06-08 | Nogra Pharma Limited | Compositions for oral administration in the treatment of inflammatory bowel disease |
| CA3014575A1 (en) | 2016-02-26 | 2017-08-31 | Nogra Pharma Limited | Methods of treating lactose intolerance |
| WO2020152350A1 (en) | 2019-01-25 | 2020-07-30 | Nogra Pharma Limited | Compositions for use in preventing acne |
| EP3921299B1 (en) | 2019-02-08 | 2024-11-20 | Nogra Pharma Limited | Process of making 3-(4'-aminophenyl)-2-methoxypropionic acid, and analogs and intermediates thereof |
-
2020
- 2020-02-10 EP EP20706375.1A patent/EP3921299B1/en active Active
- 2020-02-10 SM SM20250054T patent/SMT202500054T1/it unknown
- 2020-02-10 KR KR1020217028317A patent/KR20210125047A/ko active Pending
- 2020-02-10 JP JP2021545847A patent/JP7588593B2/ja active Active
- 2020-02-10 FI FIEP20706375.1T patent/FI3921299T3/fi active
- 2020-02-10 WO PCT/EP2020/053369 patent/WO2020161362A1/en unknown
- 2020-02-10 EP EP24212730.6A patent/EP4495101A2/en active Pending
- 2020-02-10 CA CA3128302A patent/CA3128302A1/en active Pending
- 2020-02-10 PL PL20706375.1T patent/PL3921299T3/pl unknown
- 2020-02-10 IL IL285339A patent/IL285339B1/en unknown
- 2020-02-10 PT PT207063751T patent/PT3921299T/pt unknown
- 2020-02-10 US US17/429,183 patent/US11905232B2/en active Active
- 2020-02-10 EA EA202192207A patent/EA202192207A1/ru unknown
- 2020-02-10 MX MX2021009498A patent/MX2021009498A/es unknown
- 2020-02-10 DK DK20706375.1T patent/DK3921299T3/da active
- 2020-02-10 LT LTEPPCT/EP2020/053369T patent/LT3921299T/lt unknown
- 2020-02-10 AU AU2020217884A patent/AU2020217884B2/en active Active
-
2024
- 2024-01-10 US US18/409,063 patent/US20240409498A1/en active Pending
- 2024-11-12 JP JP2024197426A patent/JP2025015586A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020042545A1 (en) | 2000-10-02 | 2002-04-11 | The Scripps Research Institute | Second cycle asymmetric dihydroxylation reaction |
| JP2005505617A (ja) | 2001-10-16 | 2005-02-24 | ドクター・レディーズ・ラボラトリーズ・リミテッド | 新規のβ−フェニル−α−オキシ置換型プロピオニック誘導体、その製造方法および薬剤的に重要な化合物の製造におけるその使用 |
| JP2009502777A (ja) | 2005-07-22 | 2009-01-29 | ジュリアーニ インターナショナル リミテッド | Ppar受容体及びegf受容体に特異的な化合物及びそれらの塩並びに医療分野におけるそれらの使用 |
| JP2012517968A (ja) | 2009-02-16 | 2012-08-09 | ジュリアーニ インターナショナル リミテッド | アルキルアミド化合物およびその使用 |
| JP2015528479A (ja) | 2012-09-13 | 2015-09-28 | ノグラ ファーマ リミテッド | 毛に関連した状態を処置する方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2025015586A (ja) | 2025-01-30 |
| IL285339B1 (en) | 2025-01-01 |
| LT3921299T (lt) | 2025-01-10 |
| EA202192207A1 (ru) | 2021-10-27 |
| US20220194894A1 (en) | 2022-06-23 |
| EP4495101A2 (en) | 2025-01-22 |
| PL3921299T3 (pl) | 2025-03-24 |
| MX2021009498A (es) | 2021-09-08 |
| EP3921299A1 (en) | 2021-12-15 |
| AU2020217884A1 (en) | 2021-08-12 |
| CA3128302A1 (en) | 2020-08-13 |
| JP2022519654A (ja) | 2022-03-24 |
| SMT202500054T1 (it) | 2025-03-12 |
| DK3921299T3 (da) | 2025-01-27 |
| IL285339A (en) | 2021-09-30 |
| CN113825739A (zh) | 2021-12-21 |
| AU2020217884B2 (en) | 2025-02-20 |
| PT3921299T (pt) | 2025-02-17 |
| KR20210125047A (ko) | 2021-10-15 |
| WO2020161362A1 (en) | 2020-08-13 |
| US20240409498A1 (en) | 2024-12-12 |
| US11905232B2 (en) | 2024-02-20 |
| FI3921299T3 (fi) | 2025-02-12 |
| WO2020161362A9 (en) | 2021-09-10 |
| EP3921299B1 (en) | 2024-11-20 |
| BR112021015609A2 (pt) | 2021-10-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2025015586A (ja) | 3-(4’-アミノフェニル)-2-メトキシプロピオン酸、ならびにその類似体および中間体を作製する方法 | |
| JP3340409B2 (ja) | 2−アミノ−ビシクロ〔3.1.0〕ヘキサン−2,6−ジカルボン酸誘導体類及びそれらの製造方法 | |
| CN101094836A (zh) | 制备吲唑化合物的方法 | |
| CN102153559A (zh) | 一种合成磷酸西他列汀及其衍生物的新方法 | |
| CN104557572A (zh) | 左旋沙丁胺醇中间体及左旋沙丁胺醇盐酸盐的合成方法 | |
| JP2019218384A (ja) | ピリミジニルシクロペンタン化合物の調製方法 | |
| CN110256496B (zh) | 一种β-硫代吲哚酮类衍生物及其制备方法 | |
| AU2017200463A1 (en) | The process for the preparation of metaraminol | |
| CN113825739B (zh) | 制备3-(4’-氨基苯基)-2-甲氧基丙酸及其类似物和中间体的方法 | |
| JP2012509267A (ja) | (R)−3−(2,3−ジヒドロキシプロピル)−6−フルオロ−5−(2−フルオロ−4−ヨードフェニルアミノ)−8−メチルピリド[2,3−d]ピリミジン−4,7(3H,8H)−ジオン及びその中間体を製造するためのプロセス | |
| JPH0421691A (ja) | ホスファチジルコリン誘導体の製造方法 | |
| Yang et al. | Synthesis of novel chiral 1, 3-aminophenols and application for the enantioselective addition of diethylzinc to aldehydes | |
| BR112021015609B1 (pt) | PROCESSOS PARA PREPARAR COMPOSTOS CAPAZES DE MODULAR A ATIVIDADE DOS RECEPTORES PPARs, DITOS COMPOSTOS E USO TERAPÊUTICO DOS MESMOS | |
| EA046346B1 (ru) | Способ получения 3-(4'-аминофенил)-2-метоксипропионовой кислоты и ее аналогов и промежуточных соединений | |
| US20090259066A1 (en) | Method for preparing prostaglandin F analogue | |
| JP2021525784A (ja) | チエノ[2,3−c]ピリダジン−4(1H)−オン系誘導体及びその使用 | |
| DE69932269T2 (de) | Herstellung optisch aktiver Cyclohexylphenylglykolsäureester | |
| CN109641934A (zh) | 胆酸衍生物游离碱,晶型及其制备方法和应用 | |
| MX2014007879A (es) | Composiciones, sintesis, y metodos para usar derivados de fenilcicloalquilmetilamina. | |
| Davies et al. | Asymmetric synthesis of anti‐α‐alkyl‐β‐amino carboxamides | |
| JP7303618B2 (ja) | スフィンゴリン脂質前駆体及びその製造方法、並びに、スフィンゴリン脂質の製造方法 | |
| EP2855421B1 (en) | Process for the preparation of optically active 3,3-diphenylpropylamines | |
| CN104592250B (zh) | 一种低成本的普拉格雷的环保制备方法 | |
| CN107652269A (zh) | 甲磺酸氟马替尼中间体纯化方法 | |
| WO2022199578A1 (zh) | 氟代乙烯基联苯衍生物及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230208 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20231128 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231218 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240315 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240517 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240617 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20240617 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240913 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20241010 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241112 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7588593 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |