JP6505705B2 - 経口投与用製剤の製造方法 - Google Patents
経口投与用製剤の製造方法 Download PDFInfo
- Publication number
- JP6505705B2 JP6505705B2 JP2016536250A JP2016536250A JP6505705B2 JP 6505705 B2 JP6505705 B2 JP 6505705B2 JP 2016536250 A JP2016536250 A JP 2016536250A JP 2016536250 A JP2016536250 A JP 2016536250A JP 6505705 B2 JP6505705 B2 JP 6505705B2
- Authority
- JP
- Japan
- Prior art keywords
- microparticles
- nanoparticles
- solution
- solvent
- cellulose
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000002360 preparation method Methods 0.000 title description 9
- 238000004519 manufacturing process Methods 0.000 title description 8
- 239000011859 microparticle Substances 0.000 claims description 350
- 239000002105 nanoparticle Substances 0.000 claims description 347
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 claims description 228
- 229920000642 polymer Polymers 0.000 claims description 193
- 239000002904 solvent Substances 0.000 claims description 148
- 239000002245 particle Substances 0.000 claims description 125
- 239000003814 drug Substances 0.000 claims description 118
- 239000000203 mixture Substances 0.000 claims description 117
- 238000000034 method Methods 0.000 claims description 106
- 238000003756 stirring Methods 0.000 claims description 95
- 229940124597 therapeutic agent Drugs 0.000 claims description 80
- -1 C1-C3 alkyl acetate Chemical compound 0.000 claims description 62
- 239000011159 matrix material Substances 0.000 claims description 59
- 239000004094 surface-active agent Substances 0.000 claims description 52
- 229920002678 cellulose Polymers 0.000 claims description 50
- 229920001577 copolymer Polymers 0.000 claims description 35
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 35
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 claims description 34
- 150000003839 salts Chemical group 0.000 claims description 33
- CTPDSKVQLSDPLC-UHFFFAOYSA-N 2-(oxolan-2-ylmethoxy)ethanol Chemical compound OCCOCC1CCCO1 CTPDSKVQLSDPLC-UHFFFAOYSA-N 0.000 claims description 31
- 229920003086 cellulose ether Polymers 0.000 claims description 30
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 claims description 26
- 150000004676 glycans Chemical class 0.000 claims description 26
- 229920001282 polysaccharide Polymers 0.000 claims description 26
- 239000005017 polysaccharide Substances 0.000 claims description 26
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 claims description 25
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 claims description 25
- 229960005370 atorvastatin Drugs 0.000 claims description 25
- 229920003145 methacrylic acid copolymer Polymers 0.000 claims description 25
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 claims description 24
- 239000011248 coating agent Substances 0.000 claims description 24
- 239000001913 cellulose Substances 0.000 claims description 21
- 235000010980 cellulose Nutrition 0.000 claims description 21
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 claims description 21
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 claims description 21
- 239000001856 Ethyl cellulose Substances 0.000 claims description 20
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 claims description 20
- 235000019325 ethyl cellulose Nutrition 0.000 claims description 20
- 229920001249 ethyl cellulose Polymers 0.000 claims description 20
- 238000000576 coating method Methods 0.000 claims description 19
- 150000002148 esters Chemical class 0.000 claims description 19
- 125000005395 methacrylic acid group Chemical group 0.000 claims description 19
- 229920001661 Chitosan Polymers 0.000 claims description 18
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 claims description 17
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 15
- 239000002253 acid Substances 0.000 claims description 15
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 claims description 14
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 claims description 14
- 229920000623 Cellulose acetate phthalate Polymers 0.000 claims description 13
- 229940081734 cellulose acetate phthalate Drugs 0.000 claims description 13
- 230000008569 process Effects 0.000 claims description 13
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 claims description 13
- 229960004622 raloxifene Drugs 0.000 claims description 12
- BPRHUIZQVSMCRT-VEUZHWNKSA-N rosuvastatin Chemical compound CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC(O)=O BPRHUIZQVSMCRT-VEUZHWNKSA-N 0.000 claims description 12
- 229960000672 rosuvastatin Drugs 0.000 claims description 12
- ZEUITGRIYCTCEM-KRWDZBQOSA-N (S)-duloxetine Chemical compound C1([C@@H](OC=2C3=CC=CC=C3C=CC=2)CCNC)=CC=CS1 ZEUITGRIYCTCEM-KRWDZBQOSA-N 0.000 claims description 11
- 229960002866 duloxetine Drugs 0.000 claims description 11
- VSWBSWWIRNCQIJ-GJZGRUSLSA-N (R,R)-asenapine Chemical compound O1C2=CC=CC=C2[C@@H]2CN(C)C[C@H]2C2=CC(Cl)=CC=C21 VSWBSWWIRNCQIJ-GJZGRUSLSA-N 0.000 claims description 10
- CEUORZQYGODEFX-UHFFFAOYSA-N Aripirazole Chemical compound ClC1=CC=CC(N2CCN(CCCCOC=3C=C4NC(=O)CCC4=CC=3)CC2)=C1Cl CEUORZQYGODEFX-UHFFFAOYSA-N 0.000 claims description 10
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 10
- 229960004372 aripiprazole Drugs 0.000 claims description 10
- 229960005245 asenapine Drugs 0.000 claims description 10
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 10
- 239000011877 solvent mixture Substances 0.000 claims description 9
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 claims description 8
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 claims description 8
- 150000001253 acrylic acids Chemical class 0.000 claims description 8
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 claims description 8
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 claims description 8
- URKOMYMAXPYINW-UHFFFAOYSA-N quetiapine Chemical compound C1CN(CCOCCO)CCN1C1=NC2=CC=CC=C2SC2=CC=CC=C12 URKOMYMAXPYINW-UHFFFAOYSA-N 0.000 claims description 8
- 229960004431 quetiapine Drugs 0.000 claims description 8
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 claims description 7
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 claims description 7
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 claims description 7
- 229960000684 cytarabine Drugs 0.000 claims description 7
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 7
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 claims description 6
- 239000002053 C09CA06 - Candesartan Substances 0.000 claims description 6
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 claims description 6
- 150000001252 acrylic acid derivatives Chemical class 0.000 claims description 6
- 235000010443 alginic acid Nutrition 0.000 claims description 6
- 229920000615 alginic acid Polymers 0.000 claims description 6
- SGZAIDDFHDDFJU-UHFFFAOYSA-N candesartan Chemical compound CCOC1=NC2=CC=CC(C(O)=O)=C2N1CC(C=C1)=CC=C1C1=CC=CC=C1C1=NN=N[N]1 SGZAIDDFHDDFJU-UHFFFAOYSA-N 0.000 claims description 6
- 229960000932 candesartan Drugs 0.000 claims description 6
- 229920000639 hydroxypropylmethylcellulose acetate succinate Polymers 0.000 claims description 6
- 229960001680 ibuprofen Drugs 0.000 claims description 6
- HRWCVUIFMSZDJS-SZMVWBNQSA-N spirapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2(C1)SCCS2)C(O)=O)CC1=CC=CC=C1 HRWCVUIFMSZDJS-SZMVWBNQSA-N 0.000 claims description 6
- 229960002909 spirapril Drugs 0.000 claims description 6
- 108700035424 spirapril Proteins 0.000 claims description 6
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 claims description 5
- 229940072056 alginate Drugs 0.000 claims description 5
- 229960004195 carvedilol Drugs 0.000 claims description 5
- 235000010944 ethyl methyl cellulose Nutrition 0.000 claims description 5
- 239000001761 ethyl methyl cellulose Substances 0.000 claims description 5
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 claims description 5
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 claims description 5
- 229920000609 methyl cellulose Polymers 0.000 claims description 5
- 235000010981 methylcellulose Nutrition 0.000 claims description 5
- 239000001923 methylcellulose Substances 0.000 claims description 5
- XWTYSIMOBUGWOL-UHFFFAOYSA-N (+-)-Terbutaline Chemical compound CC(C)(C)NCC(O)C1=CC(O)=CC(O)=C1 XWTYSIMOBUGWOL-UHFFFAOYSA-N 0.000 claims description 4
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 claims description 4
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 claims description 4
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 claims description 4
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 claims description 4
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 claims description 4
- OGSPWJRAVKPPFI-UHFFFAOYSA-N Alendronic Acid Chemical compound NCCCC(O)(P(O)(O)=O)P(O)(O)=O OGSPWJRAVKPPFI-UHFFFAOYSA-N 0.000 claims description 4
- 108010006654 Bleomycin Proteins 0.000 claims description 4
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 claims description 4
- 239000002083 C09CA01 - Losartan Substances 0.000 claims description 4
- 239000002080 C09CA02 - Eprosartan Substances 0.000 claims description 4
- 239000002947 C09CA04 - Irbesartan Substances 0.000 claims description 4
- 229920001287 Chondroitin sulfate Polymers 0.000 claims description 4
- 229920002307 Dextran Polymers 0.000 claims description 4
- 102000051325 Glucagon Human genes 0.000 claims description 4
- 108060003199 Glucagon Proteins 0.000 claims description 4
- 229920002907 Guar gum Polymers 0.000 claims description 4
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 claims description 4
- 239000004354 Hydroxyethyl cellulose Substances 0.000 claims description 4
- 229920001479 Hydroxyethyl methyl cellulose Polymers 0.000 claims description 4
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 claims description 4
- 229920001202 Inulin Polymers 0.000 claims description 4
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 claims description 4
- 108010007859 Lisinopril Proteins 0.000 claims description 4
- UWWDHYUMIORJTA-HSQYWUDLSA-N Moexipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CC2=CC(OC)=C(OC)C=C2C1)C(O)=O)CC1=CC=CC=C1 UWWDHYUMIORJTA-HSQYWUDLSA-N 0.000 claims description 4
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 claims description 4
- 239000005480 Olmesartan Substances 0.000 claims description 4
- VXFJYXUZANRPDJ-WTNASJBWSA-N Trandopril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@H]2CCCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 VXFJYXUZANRPDJ-WTNASJBWSA-N 0.000 claims description 4
- GXBMIBRIOWHPDT-UHFFFAOYSA-N Vasopressin Natural products N1C(=O)C(CC=2C=C(O)C=CC=2)NC(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C1CC1=CC=CC=C1 GXBMIBRIOWHPDT-UHFFFAOYSA-N 0.000 claims description 4
- 102000002852 Vasopressins Human genes 0.000 claims description 4
- 108010004977 Vasopressins Proteins 0.000 claims description 4
- 229960004343 alendronic acid Drugs 0.000 claims description 4
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 claims description 4
- 229960001561 bleomycin Drugs 0.000 claims description 4
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 claims description 4
- 229960003065 bosentan Drugs 0.000 claims description 4
- GJPICJJJRGTNOD-UHFFFAOYSA-N bosentan Chemical compound COC1=CC=CC=C1OC(C(=NC(=N1)C=2N=CC=CN=2)OCCO)=C1NS(=O)(=O)C1=CC=C(C(C)(C)C)C=C1 GJPICJJJRGTNOD-UHFFFAOYSA-N 0.000 claims description 4
- 229960004436 budesonide Drugs 0.000 claims description 4
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 claims description 4
- 229960001736 buprenorphine Drugs 0.000 claims description 4
- 229960000830 captopril Drugs 0.000 claims description 4
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 claims description 4
- 229940045110 chitosan Drugs 0.000 claims description 4
- 229940059329 chondroitin sulfate Drugs 0.000 claims description 4
- HHHKFGXWKKUNCY-FHWLQOOXSA-N cilazapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H]1C(N2[C@@H](CCCN2CCC1)C(O)=O)=O)CC1=CC=CC=C1 HHHKFGXWKKUNCY-FHWLQOOXSA-N 0.000 claims description 4
- 229960005025 cilazapril Drugs 0.000 claims description 4
- 229960002286 clodronic acid Drugs 0.000 claims description 4
- ACSIXWWBWUQEHA-UHFFFAOYSA-N clodronic acid Chemical compound OP(O)(=O)C(Cl)(Cl)P(O)(O)=O ACSIXWWBWUQEHA-UHFFFAOYSA-N 0.000 claims description 4
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 claims description 4
- 229960003957 dexamethasone Drugs 0.000 claims description 4
- 229960002086 dextran Drugs 0.000 claims description 4
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 claims description 4
- 229960001259 diclofenac Drugs 0.000 claims description 4
- HSUGRBWQSSZJOP-RTWAWAEBSA-N diltiazem Chemical compound C1=CC(OC)=CC=C1[C@H]1[C@@H](OC(C)=O)C(=O)N(CCN(C)C)C2=CC=CC=C2S1 HSUGRBWQSSZJOP-RTWAWAEBSA-N 0.000 claims description 4
- 229960004166 diltiazem Drugs 0.000 claims description 4
- 229960003668 docetaxel Drugs 0.000 claims description 4
- 229960004563 eprosartan Drugs 0.000 claims description 4
- OROAFUQRIXKEMV-LDADJPATSA-N eprosartan Chemical compound C=1C=C(C(O)=O)C=CC=1CN1C(CCCC)=NC=C1\C=C(C(O)=O)/CC1=CC=CS1 OROAFUQRIXKEMV-LDADJPATSA-N 0.000 claims description 4
- 229960005309 estradiol Drugs 0.000 claims description 4
- 229930182833 estradiol Natural products 0.000 claims description 4
- OLNTVTPDXPETLC-XPWALMASSA-N ezetimibe Chemical compound N1([C@@H]([C@H](C1=O)CC[C@H](O)C=1C=CC(F)=CC=1)C=1C=CC(O)=CC=1)C1=CC=C(F)C=C1 OLNTVTPDXPETLC-XPWALMASSA-N 0.000 claims description 4
- 229960000815 ezetimibe Drugs 0.000 claims description 4
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 claims description 4
- 229960004666 glucagon Drugs 0.000 claims description 4
- 239000000665 guar gum Substances 0.000 claims description 4
- 235000010417 guar gum Nutrition 0.000 claims description 4
- 229960002154 guar gum Drugs 0.000 claims description 4
- 229920002674 hyaluronan Polymers 0.000 claims description 4
- 229960003160 hyaluronic acid Drugs 0.000 claims description 4
- 229960000890 hydrocortisone Drugs 0.000 claims description 4
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 claims description 4
- 229920013819 hydroxyethyl ethylcellulose Polymers 0.000 claims description 4
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 claims description 4
- 239000001863 hydroxypropyl cellulose Substances 0.000 claims description 4
- JYJIGFIDKWBXDU-MNNPPOADSA-N inulin Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)OC[C@]1(OC[C@]2(OC[C@]3(OC[C@]4(OC[C@]5(OC[C@]6(OC[C@]7(OC[C@]8(OC[C@]9(OC[C@]%10(OC[C@]%11(OC[C@]%12(OC[C@]%13(OC[C@]%14(OC[C@]%15(OC[C@]%16(OC[C@]%17(OC[C@]%18(OC[C@]%19(OC[C@]%20(OC[C@]%21(OC[C@]%22(OC[C@]%23(OC[C@]%24(OC[C@]%25(OC[C@]%26(OC[C@]%27(OC[C@]%28(OC[C@]%29(OC[C@]%30(OC[C@]%31(OC[C@]%32(OC[C@]%33(OC[C@]%34(OC[C@]%35(OC[C@]%36(O[C@@H]%37[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O%37)O)[C@H]([C@H](O)[C@@H](CO)O%36)O)[C@H]([C@H](O)[C@@H](CO)O%35)O)[C@H]([C@H](O)[C@@H](CO)O%34)O)[C@H]([C@H](O)[C@@H](CO)O%33)O)[C@H]([C@H](O)[C@@H](CO)O%32)O)[C@H]([C@H](O)[C@@H](CO)O%31)O)[C@H]([C@H](O)[C@@H](CO)O%30)O)[C@H]([C@H](O)[C@@H](CO)O%29)O)[C@H]([C@H](O)[C@@H](CO)O%28)O)[C@H]([C@H](O)[C@@H](CO)O%27)O)[C@H]([C@H](O)[C@@H](CO)O%26)O)[C@H]([C@H](O)[C@@H](CO)O%25)O)[C@H]([C@H](O)[C@@H](CO)O%24)O)[C@H]([C@H](O)[C@@H](CO)O%23)O)[C@H]([C@H](O)[C@@H](CO)O%22)O)[C@H]([C@H](O)[C@@H](CO)O%21)O)[C@H]([C@H](O)[C@@H](CO)O%20)O)[C@H]([C@H](O)[C@@H](CO)O%19)O)[C@H]([C@H](O)[C@@H](CO)O%18)O)[C@H]([C@H](O)[C@@H](CO)O%17)O)[C@H]([C@H](O)[C@@H](CO)O%16)O)[C@H]([C@H](O)[C@@H](CO)O%15)O)[C@H]([C@H](O)[C@@H](CO)O%14)O)[C@H]([C@H](O)[C@@H](CO)O%13)O)[C@H]([C@H](O)[C@@H](CO)O%12)O)[C@H]([C@H](O)[C@@H](CO)O%11)O)[C@H]([C@H](O)[C@@H](CO)O%10)O)[C@H]([C@H](O)[C@@H](CO)O9)O)[C@H]([C@H](O)[C@@H](CO)O8)O)[C@H]([C@H](O)[C@@H](CO)O7)O)[C@H]([C@H](O)[C@@H](CO)O6)O)[C@H]([C@H](O)[C@@H](CO)O5)O)[C@H]([C@H](O)[C@@H](CO)O4)O)[C@H]([C@H](O)[C@@H](CO)O3)O)[C@H]([C@H](O)[C@@H](CO)O2)O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JYJIGFIDKWBXDU-MNNPPOADSA-N 0.000 claims description 4
- 229940029339 inulin Drugs 0.000 claims description 4
- 229960002198 irbesartan Drugs 0.000 claims description 4
- YCPOHTHPUREGFM-UHFFFAOYSA-N irbesartan Chemical compound O=C1N(CC=2C=CC(=CC=2)C=2C(=CC=CC=2)C=2[N]N=NN=2)C(CCCC)=NC21CCCC2 YCPOHTHPUREGFM-UHFFFAOYSA-N 0.000 claims description 4
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 claims description 4
- 229960002394 lisinopril Drugs 0.000 claims description 4
- RLAWWYSOJDYHDC-BZSNNMDCSA-N lisinopril Chemical compound C([C@H](N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(O)=O)C(O)=O)CC1=CC=CC=C1 RLAWWYSOJDYHDC-BZSNNMDCSA-N 0.000 claims description 4
- 229960004773 losartan Drugs 0.000 claims description 4
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical compound CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 claims description 4
- 229960000485 methotrexate Drugs 0.000 claims description 4
- IUBSYMUCCVWXPE-UHFFFAOYSA-N metoprolol Chemical compound COCCC1=CC=C(OCC(O)CNC(C)C)C=C1 IUBSYMUCCVWXPE-UHFFFAOYSA-N 0.000 claims description 4
- 229960002237 metoprolol Drugs 0.000 claims description 4
- 229960005170 moexipril Drugs 0.000 claims description 4
- 229960005181 morphine Drugs 0.000 claims description 4
- VTRAEEWXHOVJFV-UHFFFAOYSA-N olmesartan Chemical compound CCCC1=NC(C(C)(C)O)=C(C(O)=O)N1CC1=CC=C(C=2C(=CC=CC=2)C=2NN=NN=2)C=C1 VTRAEEWXHOVJFV-UHFFFAOYSA-N 0.000 claims description 4
- 229960005117 olmesartan Drugs 0.000 claims description 4
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 claims description 4
- 229960003978 pamidronic acid Drugs 0.000 claims description 4
- 229960005489 paracetamol Drugs 0.000 claims description 4
- 229920001277 pectin Polymers 0.000 claims description 4
- 235000010987 pectin Nutrition 0.000 claims description 4
- 239000001814 pectin Substances 0.000 claims description 4
- 229960000292 pectin Drugs 0.000 claims description 4
- IPVQLZZIHOAWMC-QXKUPLGCSA-N perindopril Chemical compound C1CCC[C@H]2C[C@@H](C(O)=O)N(C(=O)[C@H](C)N[C@@H](CCC)C(=O)OCC)[C@H]21 IPVQLZZIHOAWMC-QXKUPLGCSA-N 0.000 claims description 4
- 229960002582 perindopril Drugs 0.000 claims description 4
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 claims description 4
- 229960004618 prednisone Drugs 0.000 claims description 4
- 229960003387 progesterone Drugs 0.000 claims description 4
- 239000000186 progesterone Substances 0.000 claims description 4
- RAPZEAPATHNIPO-UHFFFAOYSA-N risperidone Chemical compound FC1=CC=C2C(C3CCN(CC3)CCC=3C(=O)N4CCCCC4=NC=3C)=NOC2=C1 RAPZEAPATHNIPO-UHFFFAOYSA-N 0.000 claims description 4
- 229960001534 risperidone Drugs 0.000 claims description 4
- MEZLKOACVSPNER-GFCCVEGCSA-N selegiline Chemical compound C#CCN(C)[C@H](C)CC1=CC=CC=C1 MEZLKOACVSPNER-GFCCVEGCSA-N 0.000 claims description 4
- 229960003946 selegiline Drugs 0.000 claims description 4
- 229960001603 tamoxifen Drugs 0.000 claims description 4
- 229960000195 terbutaline Drugs 0.000 claims description 4
- 229960002051 trandolapril Drugs 0.000 claims description 4
- 229960003726 vasopressin Drugs 0.000 claims description 4
- 229960001722 verapamil Drugs 0.000 claims description 4
- MVWVFYHBGMAFLY-UHFFFAOYSA-N ziprasidone Chemical compound C1=CC=C2C(N3CCN(CC3)CCC3=CC=4CC(=O)NC=4C=C3Cl)=NSC2=C1 MVWVFYHBGMAFLY-UHFFFAOYSA-N 0.000 claims description 4
- 229960000607 ziprasidone Drugs 0.000 claims description 4
- 229960004276 zoledronic acid Drugs 0.000 claims description 4
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 claims description 4
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 claims description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 claims description 3
- DKJJVAGXPKPDRL-UHFFFAOYSA-N Tiludronic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)SC1=CC=C(Cl)C=C1 DKJJVAGXPKPDRL-UHFFFAOYSA-N 0.000 claims description 3
- HXHWSAZORRCQMX-UHFFFAOYSA-N albendazole Chemical compound CCCSC1=CC=C2NC(NC(=O)OC)=NC2=C1 HXHWSAZORRCQMX-UHFFFAOYSA-N 0.000 claims description 3
- 229960002669 albendazole Drugs 0.000 claims description 3
- IEJIGPNLZYLLBP-UHFFFAOYSA-N dimethyl carbonate Chemical compound COC(=O)OC IEJIGPNLZYLLBP-UHFFFAOYSA-N 0.000 claims description 3
- 229960002949 fluorouracil Drugs 0.000 claims description 3
- 229960004127 naloxone Drugs 0.000 claims description 3
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 3
- HDACQVRGBOVJII-JBDAPHQKSA-N ramipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 HDACQVRGBOVJII-JBDAPHQKSA-N 0.000 claims description 3
- 229960003401 ramipril Drugs 0.000 claims description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 3
- 229960005324 tiludronic acid Drugs 0.000 claims description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims 1
- NPAKNKYSJIDKMW-UHFFFAOYSA-N carvedilol Chemical compound COC1=CC=CC=C1OCCNCC(O)COC1=CC=CC2=NC3=CC=C[CH]C3=C12 NPAKNKYSJIDKMW-UHFFFAOYSA-N 0.000 claims 1
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 claims 1
- 239000000243 solution Substances 0.000 description 428
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 294
- 239000008351 acetate buffer Substances 0.000 description 189
- 239000004372 Polyvinyl alcohol Substances 0.000 description 182
- 229920002451 polyvinyl alcohol Polymers 0.000 description 182
- 229930006000 Sucrose Natural products 0.000 description 157
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 157
- 239000005720 sucrose Substances 0.000 description 157
- 239000000725 suspension Substances 0.000 description 130
- 238000005119 centrifugation Methods 0.000 description 89
- 238000001914 filtration Methods 0.000 description 82
- 239000012071 phase Substances 0.000 description 52
- 238000000605 extraction Methods 0.000 description 46
- 239000011521 glass Substances 0.000 description 45
- 239000000825 pharmaceutical preparation Substances 0.000 description 43
- 238000012546 transfer Methods 0.000 description 43
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 34
- 238000000338 in vitro Methods 0.000 description 31
- 229940079593 drug Drugs 0.000 description 29
- 210000001072 colon Anatomy 0.000 description 24
- 229920003141 Eudragit® S 100 Polymers 0.000 description 23
- 239000008362 succinate buffer Substances 0.000 description 22
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 22
- 239000008194 pharmaceutical composition Substances 0.000 description 19
- 239000011575 calcium Substances 0.000 description 18
- 238000009472 formulation Methods 0.000 description 17
- 239000011780 sodium chloride Substances 0.000 description 17
- 239000000872 buffer Substances 0.000 description 16
- 238000002441 X-ray diffraction Methods 0.000 description 13
- 241000700159 Rattus Species 0.000 description 12
- 238000001727 in vivo Methods 0.000 description 11
- 239000001384 succinic acid Substances 0.000 description 11
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 10
- CTKXFMQHOOWWEB-UHFFFAOYSA-N Ethylene oxide/propylene oxide copolymer Chemical compound CCCOC(C)COCCO CTKXFMQHOOWWEB-UHFFFAOYSA-N 0.000 description 10
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 10
- 229920001993 poloxamer 188 Polymers 0.000 description 10
- 229940044519 poloxamer 188 Drugs 0.000 description 10
- 229940002612 prodrug Drugs 0.000 description 10
- 239000000651 prodrug Chemical group 0.000 description 10
- ABFPKTQEQNICFT-UHFFFAOYSA-M 2-chloro-1-methylpyridin-1-ium;iodide Chemical compound [I-].C[N+]1=CC=CC=C1Cl ABFPKTQEQNICFT-UHFFFAOYSA-M 0.000 description 9
- 229960005197 quetiapine fumarate Drugs 0.000 description 9
- 239000007787 solid Substances 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 8
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 8
- BKXVVCILCIUCLG-UHFFFAOYSA-N raloxifene hydrochloride Chemical compound [H+].[Cl-].C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 BKXVVCILCIUCLG-UHFFFAOYSA-N 0.000 description 8
- 229960002119 raloxifene hydrochloride Drugs 0.000 description 8
- 239000002775 capsule Substances 0.000 description 7
- 235000019441 ethanol Nutrition 0.000 description 7
- 239000000178 monomer Substances 0.000 description 7
- 239000000546 pharmaceutical excipient Substances 0.000 description 7
- 238000000634 powder X-ray diffraction Methods 0.000 description 7
- 230000002265 prevention Effects 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 229920003159 Eudragit® RS 100 Polymers 0.000 description 6
- 239000013543 active substance Substances 0.000 description 6
- 230000037396 body weight Effects 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000012377 drug delivery Methods 0.000 description 6
- 125000005208 trialkylammonium group Chemical group 0.000 description 6
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 5
- 239000007979 citrate buffer Substances 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 229960002496 duloxetine hydrochloride Drugs 0.000 description 5
- 125000004185 ester group Chemical group 0.000 description 5
- 125000001033 ether group Chemical group 0.000 description 5
- 125000004494 ethyl ester group Chemical group 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 210000001035 gastrointestinal tract Anatomy 0.000 description 5
- 150000004702 methyl esters Chemical class 0.000 description 5
- JFTURWWGPMTABQ-UHFFFAOYSA-N n,n-dimethyl-3-naphthalen-1-yloxy-3-thiophen-2-ylpropan-1-amine Chemical compound C=1C=CC2=CC=CC=C2C=1OC(CCN(C)C)C1=CC=CS1 JFTURWWGPMTABQ-UHFFFAOYSA-N 0.000 description 5
- 239000008363 phosphate buffer Substances 0.000 description 5
- 208000020401 Depressive disease Diseases 0.000 description 4
- 229920003135 Eudragit® L 100-55 Polymers 0.000 description 4
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 4
- 150000005215 alkyl ethers Chemical class 0.000 description 4
- 125000003277 amino group Chemical group 0.000 description 4
- OGHNVEJMJSYVRP-UHFFFAOYSA-N carvedilol Chemical compound COC1=CC=CC=C1OCCNCC(O)COC1=CC=CC2=C1C1=CC=CC=C1N2 OGHNVEJMJSYVRP-UHFFFAOYSA-N 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- GDCRSXZBSIRSFR-UHFFFAOYSA-N ethyl prop-2-enoate;2-methylprop-2-enoic acid Chemical compound CC(=C)C(O)=O.CCOC(=O)C=C GDCRSXZBSIRSFR-UHFFFAOYSA-N 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 238000010579 first pass effect Methods 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 239000006104 solid solution Substances 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 208000020925 Bipolar disease Diseases 0.000 description 3
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical group Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 3
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 125000005396 acrylic acid ester group Chemical group 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 229920002301 cellulose acetate Polymers 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical class OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 3
- POLCUAVZOMRGSN-UHFFFAOYSA-N dipropyl ether Chemical compound CCCOCCC POLCUAVZOMRGSN-UHFFFAOYSA-N 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 229960004667 ethyl cellulose Drugs 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 238000004108 freeze drying Methods 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 229920001983 poloxamer Polymers 0.000 description 3
- 229960000502 poloxamer Drugs 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 229940106777 quetiapine 100 mg Drugs 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 201000000980 schizophrenia Diseases 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 238000012384 transportation and delivery Methods 0.000 description 3
- 229920000428 triblock copolymer Polymers 0.000 description 3
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 208000032928 Dyslipidaemia Diseases 0.000 description 2
- JIGUQPWFLRLWPJ-UHFFFAOYSA-N Ethyl acrylate Chemical group CCOC(=O)C=C JIGUQPWFLRLWPJ-UHFFFAOYSA-N 0.000 description 2
- 229920003134 Eudragit® polymer Polymers 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- RMOUBSOVHSONPZ-UHFFFAOYSA-N Isopropyl formate Chemical compound CC(C)OC=O RMOUBSOVHSONPZ-UHFFFAOYSA-N 0.000 description 2
- 208000017170 Lipid metabolism disease Diseases 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 229920001214 Polysorbate 60 Polymers 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 125000004423 acyloxy group Chemical group 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 230000000112 colonic effect Effects 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 150000002016 disaccharides Chemical class 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 239000012737 fresh medium Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 229920000578 graft copolymer Polymers 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 125000005397 methacrylic acid ester group Chemical group 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 150000002762 monocarboxylic acid derivatives Chemical class 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- RGPDIGOSVORSAK-STHHAXOLSA-N naloxone hydrochloride Chemical compound Cl.O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C RGPDIGOSVORSAK-STHHAXOLSA-N 0.000 description 2
- 238000005580 one pot reaction Methods 0.000 description 2
- 235000021317 phosphate Nutrition 0.000 description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 230000005588 protonation Effects 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 238000001694 spray drying Methods 0.000 description 2
- 229920001897 terpolymer Polymers 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- FRASJONUBLZVQX-UHFFFAOYSA-N 1,4-naphthoquinone Chemical compound C1=CC=C2C(=O)C=CC(=O)C2=C1 FRASJONUBLZVQX-UHFFFAOYSA-N 0.000 description 1
- TURGQPDWYFJEDY-UHFFFAOYSA-N 1-hydroperoxypropane Chemical compound CCCOO TURGQPDWYFJEDY-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical class CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- BNNMDMGPZUOOOE-UHFFFAOYSA-N 4-methylbenzenesulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1 BNNMDMGPZUOOOE-UHFFFAOYSA-N 0.000 description 1
- 102100033350 ATP-dependent translocase ABCB1 Human genes 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 208000004881 Amebiasis Diseases 0.000 description 1
- 206010001980 Amoebiasis Diseases 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- ZNIFSRGNXRYGHF-UHFFFAOYSA-N Clonidine hydrochloride Chemical compound Cl.ClC1=CC=CC(Cl)=C1NC1=NCCN1 ZNIFSRGNXRYGHF-UHFFFAOYSA-N 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 1
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical class NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 229920003143 Eudragit® FS 30 D Polymers 0.000 description 1
- 229920003139 Eudragit® L 100 Polymers 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical class NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 108010047230 Member 1 Subfamily B ATP Binding Cassette Transporter Proteins 0.000 description 1
- 108090000301 Membrane transport proteins Proteins 0.000 description 1
- 102000003939 Membrane transport proteins Human genes 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical class CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical class OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Chemical class CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- XSVMFMHYUFZWBK-NSHDSACASA-N Rivastigmine Chemical compound CCN(C)C(=O)OC1=CC=CC([C@H](C)N(C)C)=C1 XSVMFMHYUFZWBK-NSHDSACASA-N 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- BCKXLBQYZLBQEK-KVVVOXFISA-M Sodium oleate Chemical compound [Na+].CCCCCCCC\C=C/CCCCCCCC([O-])=O BCKXLBQYZLBQEK-KVVVOXFISA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 206010066218 Stress Urinary Incontinence Diseases 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 150000001266 acyl halides Chemical class 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 150000001483 arginine derivatives Chemical class 0.000 description 1
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- QSRFYFHZPSGRQX-UHFFFAOYSA-N benzyl(tributyl)azanium Chemical class CCCC[N+](CCCC)(CCCC)CC1=CC=CC=C1 QSRFYFHZPSGRQX-UHFFFAOYSA-N 0.000 description 1
- YOUGRGFIHBUKRS-UHFFFAOYSA-N benzyl(trimethyl)azanium Chemical class C[N+](C)(C)CC1=CC=CC=C1 YOUGRGFIHBUKRS-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 150000004648 butanoic acid derivatives Chemical class 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical class OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000003093 cationic surfactant Substances 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- 229960002925 clonidine hydrochloride Drugs 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- BALGDZWGNCXXES-UHFFFAOYSA-N cyclopentane;propanoic acid Chemical compound CCC(O)=O.C1CCCC1 BALGDZWGNCXXES-UHFFFAOYSA-N 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000012738 dissolution medium Substances 0.000 description 1
- 238000011978 dissolution method Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000009506 drug dissolution testing Methods 0.000 description 1
- 238000009513 drug distribution Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- WBJINCZRORDGAQ-UHFFFAOYSA-N formic acid ethyl ester Natural products CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 1
- 229940050411 fumarate Drugs 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical class CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical class CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical class I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 208000028774 intestinal disease Diseases 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 150000002537 isoquinolines Chemical class 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 230000009061 membrane transport Effects 0.000 description 1
- KBOPZPXVLCULAV-UHFFFAOYSA-N mesalamine Chemical compound NC1=CC=C(O)C(C(O)=O)=C1 KBOPZPXVLCULAV-UHFFFAOYSA-N 0.000 description 1
- 229960004963 mesalazine Drugs 0.000 description 1
- ZUZLIXGTXQBUDC-UHFFFAOYSA-N methyltrioctylammonium Chemical class CCCCCCCC[N+](C)(CCCCCCCC)CCCCCCCC ZUZLIXGTXQBUDC-UHFFFAOYSA-N 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 125000006203 morpholinoethyl group Chemical group [H]C([H])(*)C([H])([H])N1C([H])([H])C([H])([H])OC([H])([H])C1([H])[H] 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical class C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000002077 nanosphere Substances 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical compound CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- 229920002113 octoxynol Polymers 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- SBQLYHNEIUGQKH-UHFFFAOYSA-N omeprazole Chemical compound N1=C2[CH]C(OC)=CC=C2N=C1S(=O)CC1=NC=C(C)C(OC)=C1C SBQLYHNEIUGQKH-UHFFFAOYSA-N 0.000 description 1
- 229960000381 omeprazole Drugs 0.000 description 1
- 229940126701 oral medication Drugs 0.000 description 1
- 239000013588 oral product Substances 0.000 description 1
- 229940023486 oral product Drugs 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229940039748 oxalate Drugs 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical class OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 229920001987 poloxamine Polymers 0.000 description 1
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- FASDKYOPVNHBLU-ZETCQYMHSA-N pramipexole Chemical compound C1[C@@H](NCCC)CCC2=C1SC(N)=N2 FASDKYOPVNHBLU-ZETCQYMHSA-N 0.000 description 1
- 229960003089 pramipexole Drugs 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical class CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- ZTHJULTYCAQOIJ-WXXKFALUSA-N quetiapine fumarate Chemical compound [H+].[H+].[O-]C(=O)\C=C\C([O-])=O.C1CN(CCOCCO)CCN1C1=NC2=CC=CC=C2SC2=CC=CC=C12.C1CN(CCOCCO)CCN1C1=NC2=CC=CC=C2SC2=CC=CC=C12 ZTHJULTYCAQOIJ-WXXKFALUSA-N 0.000 description 1
- 150000003248 quinolines Chemical class 0.000 description 1
- 239000004627 regenerated cellulose Substances 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 229960004136 rivastigmine Drugs 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000007962 solid dispersion Substances 0.000 description 1
- 238000003797 solvolysis reaction Methods 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 208000022170 stress incontinence Diseases 0.000 description 1
- 150000003445 sucroses Chemical class 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 230000001839 systemic circulation Effects 0.000 description 1
- 238000012385 systemic delivery Methods 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229920006027 ternary co-polymer Polymers 0.000 description 1
- DZLFLBLQUQXARW-UHFFFAOYSA-N tetrabutylammonium Chemical class CCCC[N+](CCCC)(CCCC)CCCC DZLFLBLQUQXARW-UHFFFAOYSA-N 0.000 description 1
- CBXCPBUEXACCNR-UHFFFAOYSA-N tetraethylammonium Chemical class CC[N+](CC)(CC)CC CBXCPBUEXACCNR-UHFFFAOYSA-N 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical class C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000007723 transport mechanism Effects 0.000 description 1
- ODLHGICHYURWBS-LKONHMLTSA-N trappsol cyclo Chemical compound CC(O)COC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)COCC(O)C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1COCC(C)O ODLHGICHYURWBS-LKONHMLTSA-N 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- USFMMZYROHDWPJ-UHFFFAOYSA-N trimethyl-[2-(2-methylprop-2-enoyloxy)ethyl]azanium Chemical compound CC(=C)C(=O)OCC[N+](C)(C)C USFMMZYROHDWPJ-UHFFFAOYSA-N 0.000 description 1
- RRHXZLALVWBDKH-UHFFFAOYSA-M trimethyl-[2-(2-methylprop-2-enoyloxy)ethyl]azanium;chloride Chemical group [Cl-].CC(=C)C(=O)OCC[N+](C)(C)C RRHXZLALVWBDKH-UHFFFAOYSA-M 0.000 description 1
- ZDPHROOEEOARMN-UHFFFAOYSA-N undecanoic acid Chemical compound CCCCCCCCCCC(O)=O ZDPHROOEEOARMN-UHFFFAOYSA-N 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-M valerate Chemical class CCCCC([O-])=O NQPDZGIKBAWPEJ-UHFFFAOYSA-M 0.000 description 1
- ACWBQPMHZXGDFX-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=NN1 ACWBQPMHZXGDFX-QFIPXVFZSA-N 0.000 description 1
- 229960004699 valsartan Drugs 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
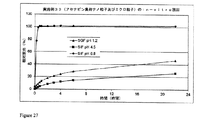
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4535—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a heterocyclic ring having sulfur as a ring hetero atom, e.g. pizotifen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1635—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
- A61K31/381—Heterocyclic compounds having sulfur as a ring hetero atom having five-membered rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/407—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with other heterocyclic ring systems, e.g. ketorolac, physostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4168—1,3-Diazoles having a nitrogen attached in position 2, e.g. clonidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/428—Thiazoles condensed with carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/554—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having at least one nitrogen and one sulfur as ring hetero atoms, e.g. clothiapine, diltiazem
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
- A61K9/1694—Processes resulting in granules or microspheres of the matrix type containing more than 5% of excipient
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5138—Organic macromolecular compounds; Dendrimers obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5192—Processes
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Optics & Photonics (AREA)
- Nanotechnology (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
a)a1)溶解形態の上記1又は複数の治療剤と、
a2)溶解形態の上記1又は複数のポリマーと、
a3)(i)水と完全に混和可能であり、上記1又は複数の治療剤に対する溶媒であるとともに、上記1又は複数のポリマーに対する溶媒である少なくとも1つの溶媒S1と、(ii)溶媒S1と完全に混和可能であり、水と部分的に混和可能である少なくとも1つの溶媒S2とを含有する溶媒混合物と、
を含有する溶液を提供する工程と、
b)工程a)で提供された上記溶液を撹拌しながら、工程a)で提供された上記溶液の体積の少なくとも2倍の体積の水性界面活性剤溶液を工程a)で提供された上記溶液に添加する工程と、
c)溶媒S1及び溶媒S2を上記水性界面活性剤溶液へと抽出することにより、上記ナノ粒子及び/又はミクロ粒子を形成させる工程と、
を含む、方法に関する。
(i)セルロースエーテル及びセルロースエステル、
(ii)メタクリル酸と1又は複数の(メタ)アクリル酸エステルとのコポリマー、
(iii)2以上の(メタ)アクリル酸エステルのコポリマー、
及びそれらの混合物から選択される1又は複数のポリマーを含有する。上記マトリクスは、更なるマトリクス成分として、他のポリマー及び/又は非ポリマーの賦形剤を含有してもよい。典型的には、マトリクス中の上に定義される1又は複数のポリマー(i)〜(iii)の含量は、マトリクスの総重量ベースで(すなわち、治療剤及び任意のコーティング剤の重量を除いて)50重量%以上、好ましくは70重量%以上、より好ましくは80重量%以上、特に90重量%以上である。さらに、上に定義される1又は複数のポリマー(i)〜(iii)は上記マトリクス中の唯一のポリマーであることが好ましい。上記マトリクスは、ポリマー(i)〜(iii)から選択される1又は複数のポリマーからなることがより好ましく、上記ナノ粒子及び/又はミクロ粒子は、ポリマー(i)〜(iii)から選択される1若しくは複数のポリマー及び治療剤からなること、又はポリマー(i)〜(iii)から選択される1若しくは複数のポリマー、治療剤、及びポリマー(i)〜(iii)から選択されるポリマーの表面に塗布されるコーティング剤からなることが特に好ましい。
(i)ナノ粒子及び/又はミクロ粒子と1又は複数の薬学的に許容可能な賦形剤とを合わせる工程、
(ii)ヒト又は動物の患者による飲み込みが可能な固体形態、特に錠剤又はカプセル剤の医薬製剤又は医薬品を提供する工程、
を含んでもよい。
a)a1)溶解形態の上記1又は複数の治療剤と、
a2)溶解形態の上記1又は複数のポリマーと、
a3)(i)水と完全に混和可能であり、上記1又は複数の治療剤に対する溶媒であるとともに、上記1又は複数のポリマーに対する溶媒である少なくとも1つの溶媒S1と、(ii)溶媒S1と完全に混和可能であり、水と部分的に混和可能である少なくとも1つの溶媒S2とを含有する溶媒混合物と、
を含有する溶液を提供する工程と、
b)工程a)で提供された上記溶液を撹拌しながら、工程a)で提供された上記溶液の体積の少なくとも2倍の体積の水性界面活性剤溶液を工程a)で提供された上記溶液に添加する工程と、
c)溶媒S1及び溶媒S2を上記水性界面活性剤溶液へと抽出することにより、上記ナノ粒子及び/又はミクロ粒子を形成させる工程と、
を含む、方法。
(i)ナノ粒子及び/又はミクロ粒子と1又は複数の薬学的に許容可能な賦形剤とを合わせる工程、
(ii)ヒト又は動物の患者による飲み込みが可能な固体形態の医薬製剤又は医薬品を提供する工程、
を含む、項29に記載の方法。
2.0gのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。500mgのラロキシフェン塩酸塩を含有する1.5mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2500rpmで10分間、及び3000rpmで6分間に亘りポリマー溶液中に分散させる。
1.0gのポリマーEudragit S100及び1.0gのポリマーEudragit FS 30Dを酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのラロキシフェン塩酸塩を含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。
750mg gのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))10mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのラロキシフェン塩酸塩を含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40(体積/体積))10ml中のポリマーエチルセルロース250mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用いて3000rpmで更に10分間ポリマー溶液中に分散させる。
1500mg gのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)(60/40%(体積/体積))の混合物10mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのラロキシフェン塩酸塩を含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40%(体積/体積))10ml中のポリマーエチルセルロース500mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用いて3000rpmで更に10分間ポリマー溶液中に分散させる。
3.0gのポリマーEudragit RS100を酢酸エチルとジメチルスルホキシド(DMSO)(60/40%(体積/体積))の混合物15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。500mgのラロキシフェン塩酸塩を含有する1.5mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit RS100を10mlの酢酸エチルに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit RS100を10mlの酢酸エチルに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit RS100を10mlの酢酸エチルに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで30分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit RS100を10mlの酢酸エチルに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのTHF溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit RS100を10mlの酢酸エチルに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのアセトン溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit L100−55を酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで5分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit L100−55を酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで5分間に亘り上記ポリマー溶液中に分散させる。
2.0gのポリマーEudragit L100を酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで7分間及び3000rpmで11分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで7分間及び3000rpmで11分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーエチルセルロースを酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーHPMC AS_HGのポリマーを酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーCAPを酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアトルバスタチンCa塩三水和物を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100をギ酸イソプロピルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのロスバスタチンCa塩を含有する1.0mLのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーエチルセルロースを酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのロスバスタチンCa塩を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に上記ポリマー溶液中に分散させる。
1.5gのポリマーEudragit S100を酢酸エチルとDMSOとの混合物(60/40(体積/体積))10mlに溶解し、ポリマー溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのロスバスタチンCa塩を含有する1.5mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで7分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40(体積/体積))10ml中のポリマーエチルセルロース500mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、3000rpmで更に8分間に亘りポリマー溶液中に分散させる。
1.5gのポリマーEudragit S100及び500mgのHPMC AS−HGを酢酸エチルとDMSOとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのロスバスタチンCa塩を含有する1.5mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。
1.5gのポリマーEudragit S100を酢酸エチルとDMSOとの混合物(60/40(体積/体積))10mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのロスバスタチンCa塩を含有する1.5mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40(体積/体積))10ml中のポリマーエチルセルロース500mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、3000rpmで更に10分間に亘りポリマー溶液中に分散させる。
2.5gのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(70/30(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。500mgのクエチアピンフマル酸塩を含有する2.0mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで13分間、及び3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーHPMCP HP 55Sを酢酸エチルとDMSOとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクエチアピンフマル酸塩を含有するDMSO溶液2.0mlを機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
0.5gのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))5mlに溶解し、1.5gのHPMC HP 55Sを酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))10mlに溶解する。両方のポリマー溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクエチアピンフマル酸塩を含有するDMSO溶液2.0mlを機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。
0.5gのEudragitポリマーFS30Dを酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))5mlに溶解する。1.5gのポリマーHPMCP HP55Sを酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))10mlに溶解し、両方の溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクエチアピンフマル酸塩を含有する2.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーCAPを酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクエチアピンフマル酸塩を含有する2.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーHPMCP HP 55Sを酢酸エチルとジメチルスルホキシド(DMSO)との混合物(70/30(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのデュロキセチン塩酸塩を含有する3.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで22分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit L100−55を酢酸エチルとDMSOとの混合物(70/30(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。700mgのデュロキセチン塩酸塩を含有する1.2mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで25分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとDMSOとの混合物(70/30(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのデュロキセチン塩酸塩を含有する1.0mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとグリコフロールとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのデュロキセチン塩酸塩を含有する1.0mlのグリコフロール溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとDMSOとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアセナピンマイレン塩酸塩を含有するDMSO溶液1.0mlを機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとDMSOとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアセナピンマイレン塩を含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとNMPとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアリピプラゾールを含有する1.0mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit L100−55を酢酸エチルとNMPとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのアリピプラゾールを含有する1.0mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとDMSOとの混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。500mgのラロキシフェン塩酸塩を含有する1.5mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで20分間に亘りポリマー溶液中に分散させる。
1.0gのポリマーエチルセルロースS100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのラロキシフェン塩酸塩及び100mgのポリマーHPMC AS−HGを含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(70/30(体積/体積))15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクエチアピンフマル酸塩及び100mgのポリマーHPMC AS−HGを含有する1.0mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで13分間、及び3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーエチルセルロースを酢酸エチルとジメチルスルホキシド(DMSO)との混合物15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクエチアピンフマル酸塩及び100mgのポリマーHPMC AS−HGを含有する1.0mlのNMP溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで13分間、及び3000rpmで15分間に亘りポリマー溶液中に分散させる。
2.0gのポリマーエチルセルロースを酢酸エチルとジメチルスルホキシド(DMSO)との混合物15mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクエチアピンフマル酸塩及び100mgのポリマーHPMC AS−HGを含有する2mlのジメチルスルホキシド(DMSO)1.0mlを機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて2000rpmで13分間、及び3000rpmで15分間に亘りポリマー溶液中に分散させる。
1500mgのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))10mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのクロニジン塩酸塩を含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40(体積/体積))10ml中のポリマーエチルセルロース500mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用いて3000rpmで更に10分間ポリマー溶液中に分散させる。
1500mgのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))10mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのカルベジロールを含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40(体積/体積))10ml中のポリマーエチルセルロース500mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用いて3000rpmで更に10分間ポリマー溶液中に分散させる。
1500mgのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))10mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのカンデサルタンシレテキシルを含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40(体積/体積))10ml中のポリマーエチルセルロース500mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用いて3000rpmで更に10分間ポリマー溶液中に分散させる。
1500mgのポリマーEudragit S100を酢酸エチルとジメチルスルホキシド(DMSO)との混合物(60/40(体積/体積))10mlに溶解し、溶液を二重壁のガラス容器(内側の高さ16.0cm、内径3.4cm)に移す。350mgのプラミペキソールを含有する1.0mlのDMSO溶液を機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用い、室温にて3000rpmで10分間に亘りポリマー溶液中に分散させる。さらに、酢酸エチルとDMSOとの混合物(60/40(体積/体積))10ml中のポリマーエチルセルロース500mgを添加した後、機械撹拌装置(2.5cmの溶解機ディスクを備えた、ドイツのVMA-Getzmann GmbH製Dispermat FT)を用いて3000rpmで更に10分間ポリマー溶液中に分散させる。
Claims (11)
- ナノ粒子及び/又はミクロ粒子を製造する方法であって、該粒子が、セルロースエーテル、セルロースエステル、メタクリル酸と1又は複数の(メタ)アクリル酸エステルとのコポリマー、2以上の(メタ)アクリル酸エステルのコポリマー、及びそれらの混合物から選択される1又は複数のポリマーを含有するマトリクス中に非結晶形態で分散された1又は複数の治療剤を含有し、前記方法が、
a)a1)溶解形態の前記1又は複数の治療剤と、
a2)溶解形態の前記1又は複数のポリマーと、
a3)(i)水と完全に混和可能であり、前記1又は複数の治療剤に対する溶媒であるとともに、前記1又は複数のポリマーに対する溶媒である少なくとも1つの溶媒S1と、(ii)溶媒S1と完全に混和可能であり、水と部分的に混和可能である少なくとも1つの溶媒S2とを含有する溶媒混合物と、
を含有する溶液を提供する工程と、
b)工程a)で提供された前記溶液を撹拌しながら、工程a)で提供された前記溶液の体積の少なくとも2倍の体積の水性界面活性剤溶液を工程a)で提供された前記溶液に添加する工程と、
c)溶媒S1及び溶媒S2を前記水性界面活性剤溶液へと抽出することにより、前記ナノ粒子及び/又はミクロ粒子を形成させる工程と、
を含み、
前記溶媒S1は、アセトン、ジメチルスルホキシド(DMSO)、N−メチルピロリドン(NMP)、グリコフロール、テトラヒドロフラン、エタノール、及び2以上のそれらの混合物から選択され、
前記溶媒S2は、C1〜C3酢酸アルキル、C1〜C3ギ酸アルキル、炭酸ジメチル、エチルメチルケトン、及び2以上のそれらの混合物から選択される、方法。 - 前記ナノ粒子及び/又はミクロ粒子の前記マトリクスが、メチルセルロース、エチルセルロース、プロピルセルロース、エチルメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルメチルセルロース、ヒドロキシエチルエチルセルロース、セルロースアセテートフタレート(CAP)、セルロースアセテート、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、ヒドロキシプロピルメチルセルロースアセテートスクシネート(HPMC AS)、及びそれらの混合物から選択されるセルロースエーテル又はセルロースエステルを含有する、請求項1に記載の方法。
- 前記ナノ粒子及び/又はミクロ粒子の前記マトリクスが、メタクリル酸と、ポリ(メタクリル酸−コ−メタクリル酸メチル)、ポリ(メタクリル酸−コ−アクリル酸メチル)、ポリ(メタクリル酸−コ−アクリル酸エチル)、ポリ(メタクリル酸−コ−メタクリル酸エチル)、ポリ(アクリル酸メチル−コ−メタクリル酸メチル−コ−メタクリル酸)、及びそれらの混合物から選択される1又は複数の(メタ)アクリル酸エステルとのコポリマーを含有する、請求項1又は2に記載の方法。
- 前記ナノ粒子及び/又はミクロ粒子の前記マトリクスが、ポリ(アクリル酸エチル−コ−メタクリル酸メチル)、ポリ(アクリル酸エチル−コ−メタクリル酸メチル−コ−トリメチルアンモニオエチルメタクリレートクロリド)、又はそれらの混合物から選択される2以上の(メタ)アクリル酸エステルのコポリマーを含有する、請求項1〜3のいずれか1項に記載の方法。
- 前記治療剤がラロキシフェン、アトルバスタチン、ロスバスタチン、クエチアピン、デュロキセチン、アセナピン、アリピプラゾール、メトトレキサート、グルカゴン、バソプレッシン、アレンドロン酸、クロドロン酸、エゼチミブ、バルサルタン、オルメサルタン、テルミサルタン、イルベサルタン、カンデサルタン、ボセンタン、シタラビン、ドキソルビシン、イリノテカン、ジルチアゼム、ベラパミル、コルチゾール、エストラジオール、プロゲステロン、タモキシフェン、モルヒネ、ブプレノルフィン、セレギリン、リセドロン酸、テルブタリン、チルドロン酸、ゾレドロン酸、ジプラシドン、ナロキソン、パミドロン酸、エチドロン酸、アルベンダゾール、アミドリン、カルベジロール、パクリタキセル、ドセタキセル、メサラジン、ブデソニド、プレドニソン、パラセタモール、デキサメタゾン、オメプラゾール、リスペリドン、L−ドーパ、ジクロフェナク、メトプロロール、ブレオマイシン、ペリンドプリル、トランドラプリル、ラミプリル、シラザプリル、モエキシプリル、スピラプリル、フルオロウラシル、イブプロフェン、ニフェジピン、オンダンセトロン、リバスチグミン、シンバスタチン、ロサルタン、エプロサルタン、リシノプリル、及びカプトプリルから、又は適宜、それらの薬学的に許容可能な塩形態から選択される、請求項1〜4のいずれか1項に記載の方法。
- 前記治療剤が、ラロキシフェン、アトルバスタチン、ロスバスタチン、クエチアピン、デュロキセチン、アリピプラゾール、及びアセナピン、又はそれらの薬学的に許容可能な塩形態から選択される、請求項5に記載の方法。
- 工程a)で提供された前記溶液中の前記1又は複数のポリマーの濃度が、工程a)で提供された前記溶液の総重量ベースで1重量%〜40重量%である、請求項1〜6のいずれか1項に記載の方法。
- 前記水性界面活性剤溶液中の前記界面活性剤の濃度が、前記界面活性剤の総体積ベースで0.1%(重量/体積)〜30%(重量/体積)の範囲であり、前記界面活性剤溶液が6以下のpH値を有する、請求項1〜7のいずれか1項に記載の方法。
- 前記水性界面活性剤溶液が溶解した塩又は溶解した糖を含有する、請求項1〜8のいずれか1項に記載の方法。
- 前記ナノ粒子及び/又はミクロ粒子が多糖により形成されたコーティングを持ち、前記方法が工程c)で形成されるナノ粒子及び/又はミクロ粒子と多糖の溶液とを接触させ、前記溶媒を除去して前記コーティングを形成する工程を更に含む、請求項1〜9のいずれか1項に記載の方法。
- 前記多糖が、キトサン、アルギン酸塩、ペクチン、イヌリン、グアーガム、デキストラン、コンドロイチン硫酸塩、ヒアルロン酸、及び2以上のそれらの組合せから選択される、請求項10に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP13195835 | 2013-12-05 | ||
| EP13195835.7 | 2013-12-05 | ||
| PCT/EP2014/076455 WO2015082562A1 (en) | 2013-12-05 | 2014-12-03 | Process for the production of drug formulations for oral administration |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016539953A JP2016539953A (ja) | 2016-12-22 |
| JP2016539953A5 JP2016539953A5 (ja) | 2017-12-28 |
| JP6505705B2 true JP6505705B2 (ja) | 2019-04-24 |
Family
ID=49759055
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016536250A Expired - Fee Related JP6505705B2 (ja) | 2013-12-05 | 2014-12-03 | 経口投与用製剤の製造方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20160303102A1 (ja) |
| EP (1) | EP3076951B1 (ja) |
| JP (1) | JP6505705B2 (ja) |
| KR (1) | KR20160093611A (ja) |
| CA (1) | CA2928772A1 (ja) |
| WO (1) | WO2015082562A1 (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2451274B1 (en) | 2009-07-08 | 2017-10-04 | Charleston Laboratories, Inc. | Pharmaceutical compositions |
| WO2016198113A1 (en) | 2015-06-11 | 2016-12-15 | Alrise Biosystems Gmbh | Process for the preparation of drug loaded microparticles |
| US10736855B2 (en) | 2016-02-25 | 2020-08-11 | Dexcel Pharma Technologies Ltd. | Compositions comprising proton pump inhibitors |
| EP3423041A4 (en) | 2016-03-04 | 2019-09-11 | Charleston Laboratories, Inc. | PHARMACEUTICAL COMPOSITIONS |
| CN109152375A (zh) * | 2016-03-31 | 2019-01-04 | 图蒂食品公司 | 颗粒 |
| GB201609222D0 (en) | 2016-05-25 | 2016-07-06 | F2G Ltd | Pharmaceutical formulation |
| RU2764443C2 (ru) | 2016-12-20 | 2022-01-17 | Лтс Ломанн Терапи-Систем Аг | Трансдермальная терапевтическая система, содержащая азенапин и полисилоксан или полиизобутилен |
| CN110087640A (zh) | 2016-12-20 | 2019-08-02 | 罗曼治疗系统股份公司 | 包含阿塞那平的透皮治疗系统 |
| JP2020525545A (ja) | 2017-06-26 | 2020-08-27 | エルテーエス ローマン テラピー−ジステーメ アーゲー | アセナピンおよびシリコーンアクリルハイブリッドポリマーを含有する経皮治療システム |
| TR201719919A2 (tr) * | 2017-12-08 | 2019-06-21 | Sanovel Ilac Sanayi Ve Ticaret Anonim Sirketi | The pharmaceutical combination comprising raloxifene and aripiprazole |
| KR102066402B1 (ko) * | 2017-12-22 | 2020-01-15 | 대화제약 주식회사 | 이리노테칸 또는 그의 약제학적으로 허용가능한 염을 포함하는 경구투여용 약제학적 조성물 |
| CA3101420A1 (en) | 2018-06-20 | 2019-12-26 | Lts Lohmann Therapie-Systeme Ag | Transdermal therapeutic system containing asenapine |
| CN108938588B (zh) * | 2018-08-16 | 2021-06-22 | 广州维奥康药业科技有限公司 | 一种依折麦布片 |
| US11819503B2 (en) | 2019-04-23 | 2023-11-21 | F2G Ltd | Method of treating coccidioides infection |
| KR102185475B1 (ko) * | 2019-06-20 | 2020-12-02 | 대화제약 주식회사 | 이리노테칸 자유 염기를 포함하는 경구투여용 약학 조성물 |
| JP2023514874A (ja) | 2019-10-31 | 2023-04-11 | エボニック オペレーションズ ゲーエムベーハー | キャリアポリマーおよび1つ以上の生物学的に活性な成分を含むナノ粒子またはマイクロ粒子を製造する方法 |
| WO2022033743A1 (en) | 2020-08-14 | 2022-02-17 | Re-Organic As | Method to disperse nano-cellulose in polymers, and derived products |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5102668A (en) * | 1990-10-05 | 1992-04-07 | Kingaform Technology, Inc. | Sustained release pharmaceutical preparation using diffusion barriers whose permeabilities change in response to changing pH |
| US5650173A (en) * | 1993-11-19 | 1997-07-22 | Alkermes Controlled Therapeutics Inc. Ii | Preparation of biodegradable microparticles containing a biologically active agent |
| US5792477A (en) * | 1996-05-07 | 1998-08-11 | Alkermes Controlled Therapeutics, Inc. Ii | Preparation of extended shelf-life biodegradable, biocompatible microparticles containing a biologically active agent |
| US6350786B1 (en) * | 1998-09-22 | 2002-02-26 | Hoffmann-La Roche Inc. | Stable complexes of poorly soluble compounds in ionic polymers |
| EP1027887B1 (en) * | 1999-02-10 | 2008-08-13 | Pfizer Products Inc. | Matrix controlled release device |
| US7838037B2 (en) * | 1999-11-17 | 2010-11-23 | Tagra Biotechnologies Ltd. | Method of microencapsulation |
| US6824822B2 (en) * | 2001-08-31 | 2004-11-30 | Alkermes Controlled Therapeutics Inc. Ii | Residual solvent extraction method and microparticles produced thereby |
| CA2432904C (en) * | 2000-12-21 | 2007-09-11 | Nektar Therapeutics | Induced phase transition method for the production of microparticles containing hydrophobic active agents |
| JP5123452B2 (ja) * | 2001-09-19 | 2013-01-23 | 帝三製薬株式会社 | 徐放性外用剤 |
| EP1469830A2 (en) * | 2002-02-01 | 2004-10-27 | Pfizer Products Inc. | Method for making homogeneous spray-dried solid amorphous drug dispersions using pressure nozzles |
| ATE374598T1 (de) * | 2002-03-15 | 2007-10-15 | Alrise Biosystems Gmbh | Mikropartikel und verfahren zur deren herstellung |
| MXPA05011299A (es) * | 2003-04-30 | 2006-01-24 | Debiopharm Sa | Metodos y composiciones utilizando la hormona liberadora de la hormona gonadotropina. |
| WO2008075320A2 (en) * | 2006-12-21 | 2008-06-26 | Ranbaxy Laboratories Limited | Antilipidemic pharmaceutical compositions and process for preparation thereof |
| RU2010135831A (ru) * | 2008-03-07 | 2012-04-20 | Пфайзер Инк. (US) | Способы, лекарственные формы и наборы для введения зипрасидона без пищи |
| JP4856752B2 (ja) * | 2009-11-30 | 2012-01-18 | ホソカワミクロン株式会社 | 薬物含有ナノ粒子の製造方法 |
| US8927619B2 (en) * | 2011-12-21 | 2015-01-06 | Jorg Thomas Wilken | Color-stabilized iodopropynyl butylcarbamate |
| CN102579362B (zh) * | 2012-02-23 | 2014-09-10 | 浙江工业大学 | 一种非洛地平缓释微球及其制备方法 |
| CN102579368B (zh) * | 2012-03-28 | 2013-07-10 | 广州万泽医药科技有限公司 | 美托洛尔缓释微球、缓释药用组合物及其制备方法 |
-
2014
- 2014-12-03 KR KR1020167013757A patent/KR20160093611A/ko not_active Application Discontinuation
- 2014-12-03 JP JP2016536250A patent/JP6505705B2/ja not_active Expired - Fee Related
- 2014-12-03 US US15/101,873 patent/US20160303102A1/en not_active Abandoned
- 2014-12-03 EP EP14808594.7A patent/EP3076951B1/en active Active
- 2014-12-03 WO PCT/EP2014/076455 patent/WO2015082562A1/en active Application Filing
- 2014-12-03 CA CA2928772A patent/CA2928772A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP3076951B1 (en) | 2020-09-30 |
| EP3076951A1 (en) | 2016-10-12 |
| KR20160093611A (ko) | 2016-08-08 |
| WO2015082562A1 (en) | 2015-06-11 |
| US20160303102A1 (en) | 2016-10-20 |
| JP2016539953A (ja) | 2016-12-22 |
| CA2928772A1 (en) | 2015-06-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6505705B2 (ja) | 経口投与用製剤の製造方法 | |
| US10034854B2 (en) | Pharmaceutical composition with improved bioavailability | |
| TWI706793B (zh) | 包含紫杉烷之非晶形固體分散體、包含其之錠劑及其等之製備方法 | |
| AU2014221630B2 (en) | Suspension for oral administration comprising amorphous tolvaptan | |
| JP2007504266A (ja) | ジプラシドンの持続放出剤形 | |
| CN1244796A (zh) | 具有外涂一种杀真菌剂和一种聚合物的核心的药丸 | |
| WO2012013088A1 (zh) | 决奈达隆固体分散体及其制备方法 | |
| CN102655856A (zh) | 纳米粒状奥美沙坦酯组合物、其制备方法及含有它们的药物组合物 | |
| JP6666352B2 (ja) | デュタステリド含有固体分散体及びこれを含む組成物 | |
| EP2701689B1 (en) | Pharmaceutical compositions of raltegravir, methods of preparation and use thereof | |
| ES2929730T3 (es) | Dispersión sólida | |
| EP3981469B1 (en) | Therapeutic for gout or hyperuricemia | |
| WO2007064084A1 (en) | Granules containing pranlukast and processes for the preparation thereof | |
| WO2007064083A1 (en) | Spray-dried granules and processes for the preparation thereof | |
| CA2854612C (en) | Delivery systems for improving oral bioavailability of fenobam, its hydrates, and salts | |
| WO2020246526A1 (ja) | キサンチンオキシダーゼ阻害剤含有腸溶性製剤 | |
| TWI520752B (zh) | 決奈達隆固體分散體及其製備方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20160805 |
|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20160805 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171115 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20171115 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180718 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180814 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181113 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190226 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190327 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6505705 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |