JP2021172638A - 外用医薬製剤 - Google Patents
外用医薬製剤 Download PDFInfo
- Publication number
- JP2021172638A JP2021172638A JP2020080454A JP2020080454A JP2021172638A JP 2021172638 A JP2021172638 A JP 2021172638A JP 2020080454 A JP2020080454 A JP 2020080454A JP 2020080454 A JP2020080454 A JP 2020080454A JP 2021172638 A JP2021172638 A JP 2021172638A
- Authority
- JP
- Japan
- Prior art keywords
- external pharmaceutical
- pharmaceutical preparation
- coating
- external
- container body
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 239000000825 pharmaceutical preparation Substances 0.000 title claims description 151
- 229930003658 monoterpene Natural products 0.000 claims abstract description 40
- 150000002773 monoterpene derivatives Chemical class 0.000 claims abstract description 40
- 235000002577 monoterpenes Nutrition 0.000 claims abstract description 40
- 229960002373 loxoprofen Drugs 0.000 claims abstract description 36
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims abstract description 35
- YKPUWZUDDOIDPM-SOFGYWHQSA-N capsaicin Chemical compound COC1=CC(CNC(=O)CCCC\C=C\C(C)C)=CC=C1O YKPUWZUDDOIDPM-SOFGYWHQSA-N 0.000 claims abstract description 34
- 150000003839 salts Chemical class 0.000 claims abstract description 30
- 238000002360 preparation method Methods 0.000 claims abstract description 13
- BAZQYVYVKYOAGO-UHFFFAOYSA-M loxoprofen sodium hydrate Chemical compound O.O.[Na+].C1=CC(C(C([O-])=O)C)=CC=C1CC1C(=O)CCC1 BAZQYVYVKYOAGO-UHFFFAOYSA-M 0.000 claims abstract 5
- 239000011248 coating agent Substances 0.000 claims description 94
- 238000000576 coating method Methods 0.000 claims description 94
- 239000007788 liquid Substances 0.000 claims description 29
- RGOVYLWUIBMPGK-UHFFFAOYSA-N nonivamide Chemical compound CCCCCCCCC(=O)NCC1=CC=C(O)C(OC)=C1 RGOVYLWUIBMPGK-UHFFFAOYSA-N 0.000 claims description 20
- 229940127557 pharmaceutical product Drugs 0.000 claims description 20
- 238000000034 method Methods 0.000 claims description 18
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 claims description 11
- 229940041616 menthol Drugs 0.000 claims description 11
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 claims description 8
- 150000001298 alcohols Chemical class 0.000 claims description 6
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical group CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 claims 1
- 239000003814 drug Substances 0.000 abstract description 2
- 229940079593 drug Drugs 0.000 abstract 1
- YMBXTVYHTMGZDW-UHFFFAOYSA-N loxoprofen Chemical compound C1=CC(C(C(O)=O)C)=CC=C1CC1C(=O)CCC1 YMBXTVYHTMGZDW-UHFFFAOYSA-N 0.000 description 33
- -1 alkali metal salts Chemical class 0.000 description 13
- NOOLISFMXDJSKH-KXUCPTDWSA-N (-)-Menthol Chemical group CC(C)[C@@H]1CC[C@@H](C)C[C@H]1O NOOLISFMXDJSKH-KXUCPTDWSA-N 0.000 description 12
- 239000000203 mixture Substances 0.000 description 12
- 206010006784 Burning sensation Diseases 0.000 description 11
- 239000000463 material Substances 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 8
- 230000002093 peripheral effect Effects 0.000 description 8
- 230000035807 sensation Effects 0.000 description 8
- 238000009472 formulation Methods 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- 229920003002 synthetic resin Polymers 0.000 description 6
- 239000000057 synthetic resin Substances 0.000 description 6
- 239000000654 additive Substances 0.000 description 5
- 230000035597 cooling sensation Effects 0.000 description 5
- 229920001971 elastomer Polymers 0.000 description 5
- 230000000144 pharmacologic effect Effects 0.000 description 5
- 239000000341 volatile oil Substances 0.000 description 5
- 239000004698 Polyethylene Substances 0.000 description 4
- 239000004743 Polypropylene Substances 0.000 description 4
- 230000003110 anti-inflammatory effect Effects 0.000 description 4
- KVYGGMBOZFWZBQ-UHFFFAOYSA-N benzyl nicotinate Chemical compound C=1C=CN=CC=1C(=O)OCC1=CC=CC=C1 KVYGGMBOZFWZBQ-UHFFFAOYSA-N 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 4
- 229920000573 polyethylene Polymers 0.000 description 4
- 229920001155 polypropylene Polymers 0.000 description 4
- MSXVEPNJUHWQHW-UHFFFAOYSA-N 2-methylbutan-2-ol Chemical compound CCC(C)(C)O MSXVEPNJUHWQHW-UHFFFAOYSA-N 0.000 description 3
- 241000208293 Capsicum Species 0.000 description 3
- 235000002566 Capsicum Nutrition 0.000 description 3
- 206010015535 Euphoric mood Diseases 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 239000001390 capsicum minimum Substances 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 3
- 208000006820 Arthralgia Diseases 0.000 description 2
- GLZPCOQZEFWAFX-UHFFFAOYSA-N Geraniol Chemical compound CC(C)=CCCC(C)=CCO GLZPCOQZEFWAFX-UHFFFAOYSA-N 0.000 description 2
- AKDLSISGGARWFP-UHFFFAOYSA-N Homodihydrocapsaicin Chemical compound COC1=CC(CNC(=O)CCCCCCCC(C)C)=CC=C1O AKDLSISGGARWFP-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- AMQJEAYHLZJPGS-UHFFFAOYSA-N N-Pentanol Chemical compound CCCCCO AMQJEAYHLZJPGS-UHFFFAOYSA-N 0.000 description 2
- VQEONGKQWIFHMN-UHFFFAOYSA-N Nordihydrocapsaicin Chemical compound COC1=CC(CNC(=O)CCCCCC(C)C)=CC=C1O VQEONGKQWIFHMN-UHFFFAOYSA-N 0.000 description 2
- 208000002193 Pain Diseases 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- 125000002252 acyl group Chemical group 0.000 description 2
- 230000036592 analgesia Effects 0.000 description 2
- 230000000202 analgesic effect Effects 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 229950004580 benzyl nicotinate Drugs 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- BTANRVKWQNVYAZ-UHFFFAOYSA-N butan-2-ol Chemical compound CCC(C)O BTANRVKWQNVYAZ-UHFFFAOYSA-N 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- PHTQWCKDNZKARW-UHFFFAOYSA-N isoamylol Chemical compound CC(C)CCO PHTQWCKDNZKARW-UHFFFAOYSA-N 0.000 description 2
- 239000001525 mentha piperita l. herb oil Substances 0.000 description 2
- KPSSIOMAKSHJJG-UHFFFAOYSA-N neopentyl alcohol Chemical compound CC(C)(C)CO KPSSIOMAKSHJJG-UHFFFAOYSA-N 0.000 description 2
- NJPPVKZQTLUDBO-UHFFFAOYSA-N novaluron Chemical compound C1=C(Cl)C(OC(F)(F)C(OC(F)(F)F)F)=CC=C1NC(=O)NC(=O)C1=C(F)C=CC=C1F NJPPVKZQTLUDBO-UHFFFAOYSA-N 0.000 description 2
- 230000036407 pain Effects 0.000 description 2
- JYVLIDXNZAXMDK-UHFFFAOYSA-N pentan-2-ol Chemical compound CCCC(C)O JYVLIDXNZAXMDK-UHFFFAOYSA-N 0.000 description 2
- 235000019477 peppermint oil Nutrition 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- SGAWOGXMMPSZPB-UHFFFAOYSA-N safranal Chemical compound CC1=C(C=O)C(C)(C)CC=C1 SGAWOGXMMPSZPB-UHFFFAOYSA-N 0.000 description 2
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical compound C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 description 1
- REPVLJRCJUVQFA-UHFFFAOYSA-N (-)-isopinocampheol Natural products C1C(O)C(C)C2C(C)(C)C1C2 REPVLJRCJUVQFA-UHFFFAOYSA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 229920000298 Cellophane Polymers 0.000 description 1
- 241000723346 Cinnamomum camphora Species 0.000 description 1
- WTEVQBCEXWBHNA-UHFFFAOYSA-N Citral Natural products CC(C)=CCCC(C)=CC=O WTEVQBCEXWBHNA-UHFFFAOYSA-N 0.000 description 1
- 208000034656 Contusions Diseases 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- WEEGYLXZBRQIMU-UHFFFAOYSA-N Eucalyptol Chemical compound C1CC2CCC1(C)OC2(C)C WEEGYLXZBRQIMU-UHFFFAOYSA-N 0.000 description 1
- 206010072132 Fracture pain Diseases 0.000 description 1
- 239000005792 Geraniol Substances 0.000 description 1
- GLZPCOQZEFWAFX-YFHOEESVSA-N Geraniol Natural products CC(C)=CCC\C(C)=C/CO GLZPCOQZEFWAFX-YFHOEESVSA-N 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- 244000043261 Hevea brasiliensis Species 0.000 description 1
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical group CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 1
- 206010024453 Ligament sprain Diseases 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- 239000004909 Moisturizer Substances 0.000 description 1
- 206010028391 Musculoskeletal Pain Diseases 0.000 description 1
- 208000000112 Myalgia Diseases 0.000 description 1
- 206010029155 Nephropathy toxic Diseases 0.000 description 1
- 206010033425 Pain in extremity Diseases 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 229920005830 Polyurethane Foam Polymers 0.000 description 1
- 208000007613 Shoulder Pain Diseases 0.000 description 1
- 208000010040 Sprains and Strains Diseases 0.000 description 1
- 208000000491 Tendinopathy Diseases 0.000 description 1
- 206010043255 Tendonitis Diseases 0.000 description 1
- 208000002240 Tennis Elbow Diseases 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 239000010775 animal oil Substances 0.000 description 1
- 210000003423 ankle Anatomy 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000001754 anti-pyretic effect Effects 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000003908 antipruritic agent Substances 0.000 description 1
- 239000002221 antipyretic Substances 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 239000003899 bactericide agent Substances 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- CKDOCTFBFTVPSN-UHFFFAOYSA-N borneol Natural products C1CC2(C)C(C)CC1C2(C)C CKDOCTFBFTVPSN-UHFFFAOYSA-N 0.000 description 1
- 229940116229 borneol Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 210000001217 buttock Anatomy 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 229930008380 camphor Natural products 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- 229960002504 capsaicin Drugs 0.000 description 1
- 235000017663 capsaicin Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 229960005233 cineole Drugs 0.000 description 1
- RFFOTVCVTJUTAD-UHFFFAOYSA-N cineole Natural products C1CC2(C)CCC1(C(C)C)O2 RFFOTVCVTJUTAD-UHFFFAOYSA-N 0.000 description 1
- 229940043350 citral Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- XJQPQKLURWNAAH-UHFFFAOYSA-N dihydrocapsaicin Chemical compound COC1=CC(CNC(=O)CCCCCCC(C)C)=CC=C1O XJQPQKLURWNAAH-UHFFFAOYSA-N 0.000 description 1
- RBCYRZPENADQGZ-UHFFFAOYSA-N dihydrocapsaicin Natural products COC1=CC(COC(=O)CCCCCCC(C)C)=CC=C1O RBCYRZPENADQGZ-UHFFFAOYSA-N 0.000 description 1
- DTGKSKDOIYIVQL-UHFFFAOYSA-N dl-isoborneol Natural products C1CC2(C)C(O)CC1C2(C)C DTGKSKDOIYIVQL-UHFFFAOYSA-N 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000000806 elastomer Substances 0.000 description 1
- 208000024764 elbow pain Diseases 0.000 description 1
- 230000003631 expected effect Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- WTEVQBCEXWBHNA-JXMROGBWSA-N geranial Chemical compound CC(C)=CCC\C(C)=C\C=O WTEVQBCEXWBHNA-JXMROGBWSA-N 0.000 description 1
- 229940113087 geraniol Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 210000001624 hip Anatomy 0.000 description 1
- MLJGZARGNROKAC-VQHVLOKHSA-N homocapsaicin Chemical compound CCC(C)\C=C\CCCCC(=O)NCC1=CC=C(O)C(OC)=C1 MLJGZARGNROKAC-VQHVLOKHSA-N 0.000 description 1
- JKIHLSTUOQHAFF-UHFFFAOYSA-N homocapsaicin Natural products COC1=CC(CNC(=O)CCCCCC=CC(C)C)=CC=C1O JKIHLSTUOQHAFF-UHFFFAOYSA-N 0.000 description 1
- JZNZUOZRIWOBGG-UHFFFAOYSA-N homocapsaicin-II Natural products COC1=CC(CNC(=O)CCCCC=CCC(C)C)=CC=C1O JZNZUOZRIWOBGG-UHFFFAOYSA-N 0.000 description 1
- GOBFKCLUUUDTQE-UHFFFAOYSA-N homodihydrocapsaicin-II Natural products CCC(C)CCCCCCC(=O)NCC1=CC=C(O)C(OC)=C1 GOBFKCLUUUDTQE-UHFFFAOYSA-N 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 210000002414 leg Anatomy 0.000 description 1
- CDOSHBSSFJOMGT-UHFFFAOYSA-N linalool Chemical compound CC(C)=CCCC(C)(O)C=C CDOSHBSSFJOMGT-UHFFFAOYSA-N 0.000 description 1
- 239000003589 local anesthetic agent Substances 0.000 description 1
- 229960005015 local anesthetics Drugs 0.000 description 1
- 230000007721 medicinal effect Effects 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 230000001333 moisturizer Effects 0.000 description 1
- 208000013465 muscle pain Diseases 0.000 description 1
- 229920003052 natural elastomer Polymers 0.000 description 1
- 229920001194 natural rubber Polymers 0.000 description 1
- 230000007694 nephrotoxicity Effects 0.000 description 1
- 231100000417 nephrotoxicity Toxicity 0.000 description 1
- 208000004296 neuralgia Diseases 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 239000011505 plaster Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920006327 polystyrene foam Polymers 0.000 description 1
- 239000011496 polyurethane foam Substances 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 235000017509 safranal Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 201000004415 tendinitis Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 229940098465 tincture Drugs 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 238000010792 warming Methods 0.000 description 1
- 238000003466 welding Methods 0.000 description 1
- 210000000707 wrist Anatomy 0.000 description 1
Images
Landscapes
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Description
項1. (A)ロキソプロフェン及び/又はその塩と、(B)モノテルペン及び/又はカプサイシノイドと、(C)1価低級アルコールとを含み、
1回当たりの投与量が2.0g以下に設定されている、外用医薬製剤。
項2. 前記(B)成分が、モノテルペンとカプサイシノイドの組み合わせである、項1に記載の外用医薬製剤。
項3. 前記モノテルペンがメントールである、項1又は2に記載の外用医薬製剤。
項4. 前記カプサイシノイドがノナン酸バニリルアミドである、項1〜3のいずれかに記載の外用医薬製剤。
項5. 前記(C)成分が、エタノール及び/又はイソプロパノールである、項1〜4のいずれかに記載の外用医薬製剤。
項6. 外用医薬製剤が液剤であり、塗布部材を有する塗布容器に収容されている、項1〜5のいずれかに記載の外用医薬製剤。
項7. 前記塗布容器が、
口部を有し、前記外用医薬製剤を収容し、前記外用医薬製剤の残量を外部から視認可能な程度の透明性を有する領域を少なくとも部分的に含む容器本体と、
前記口部に取り付けられ、前記容器本体内から供給される前記外用医薬製剤を保持可能であり、患部に接触することにより、前記外用医薬製剤を前記患部に塗布する塗布部材と
を備え、
前記容器本体には、前記外用医薬製剤の残量を計量するための目盛りが設けられている、項6に記載の外用医薬製剤。
項8. (A)ロキソプロフェン及び/又はその塩と(C)1価低級アルコールを含む外用医薬製剤において、1回当たりの投与量が2.0gを超えて過剰投与されるのを抑制する方法であって、
前記外用医薬製剤において、(A)ロキソプロフェン及び/又はその塩と(C)1価低級アルコールと共に、(B)モノテルペン及び/又はカプサイシノイドを共存させる、前記方法。
本発明の外用医薬製剤は、ロキソプロフェン及び/又はその塩((A)成分と表記することがある)と、モノテルペン及び/又はカプサイシノイド((B)成分と表記することがある)と、1価低級アルコール((C)成分と表記することがある)を含み、1回当たりの投与量が2.0g以下に設定されていることを特徴とする。以下、本発明の外用医薬製剤について詳述する。
本発明の外用医薬製剤は、(A)成分としてロキソプロフェン及び/又はその塩を含有する。
本発明の外用医薬製剤は、(B)成分としてモノテルペン及び/又はカプサイシノイドを含有する。モノテルペン及び/又はカプサイシノイドを含有させることにより、本発明の外用医薬製剤の1回当たりの経皮投与量が2.0g以下の場合でも、強い冷感、熱感又は灼熱感により使用者に十分な使用実感を与えることができるので、本発明の外用医薬製剤が2.0gを超えて過剰投与されるのを抑制することが可能になる。
モノテルペンを使用する場合:0.1〜10重量%、好ましくは1〜8重量%、より好ましくは1.5〜5重量%、更に好ましくは3〜5重量%。
カプサイシノイドを使用する場合:0.0001〜0.1重量%、好ましく0.001〜0.05重量%、より好ましくは0.01〜0.015重量%、更に好ましくは0.012〜0.015重量%。
本発明の外用医薬製剤は、(C)成分として1価低級アルコールを含有する。本発明において、1価低級アルコールとは炭素数1〜5の1価アルコールを指す。
本発明の外用医薬製剤は、前記(A)〜(C)成分に加えて、更に水を含んでいてもよい。
本発明の外用医薬製剤は、前述する成分の他に、必要に応じて、通常使用される他の添加剤が含まれていてもよい。このような添加剤としては、例えば、界面活性剤、植物油、動物油、鉱物油、脂肪酸アルキルエステル、脂肪酸、高級アルコール、pH調節剤、緩衝剤、可溶化剤、防腐剤、保存剤、酸化防止剤、安定化剤、香料、着色料等が挙げられる。本発明の外用医薬製剤において、これらの添加剤を含有させる場合、その含有量については、使用する添加剤の種類等に応じて適宜設定すればよい。
本発明の外用医薬製剤の製剤形態については、経皮投与可能であることを限度として特に制限されず、例えば、液剤(ローション剤、スプレー剤、エアゾール剤、乳液剤等を含む)、フォーム剤、軟膏剤、クリーム剤、ゲル剤等が挙げられる。これらの中でも、好ましくは液剤又はゲル剤、より好ましくは液剤が挙げられる。これらの製剤形態への調製は、第十七改正日本薬局方 製剤総則等に記載の公知の方法に従って、製剤形態に応じた添加剤を用いて製剤化することにより行うことができる。
本発明の外用医薬製剤は、消炎鎮痛が求められる局所(皮膚)に経皮投与することにより使用される。本発明の外用医薬製剤は、外用消炎鎮痛剤として、肩こりに伴う肩の痛み、関節痛、腰痛、筋肉痛、腱鞘炎(手・手首の痛み)、肘の痛み(テニス肘等)、打撲痛、ねんざ痛、骨折痛、神経痛、変形性関節症、関節炎等に対する治療目的で使用することができる。
本発明の外用医薬製剤を収容する容器については、特に制限されず、製剤形態に応じて適宜設定すればよい。
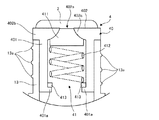
図1は、塗布容器100の正面図であり、図2は、その左側面図であり、図3は、その背面図である。なお、以下の説明においては、特に断らない限り、「上(天面)」「下(底面)」「左」「右」「前(正面)」「後(背面)」は、図1〜図3に示す通りに定義される。
次に、本発明の外用医薬製剤(液剤)が収容された塗布容器100の典型的な使用方法について説明する。
以上、本発明の外用医薬製剤が液剤である場合に使用される塗布容器の好適な一例について説明したが、本発明は前記塗布容器の構成に限定されるものではなく、その趣旨を逸脱しない限りにおいて、種々の変更が可能である。例えば、以下の変更が可能である。また、以下の変形例の要旨は、適宜組み合わせることができる。
前記で説明した塗布容器では、容器本体1は、その全体が、外用医薬製剤の残量を外部から視認可能な程度の透明性を有するように構成された。しかしながら、容器本体1は、同様の透明性を有する領域を部分的に含むように構成されてもよい。例えば、目盛り5の近傍に同様の透明性を有する窓を配置し、その他の部位を不透明に形成してもよい。或いは、目盛り5の部分のみに同様の透明性を付与してもよい。
前記で説明した塗布容器では、塗布部材2が、多孔質構造を有するように構成された。しかしながら、塗布部材2の構成は、これに限定されず、塗布容器100を、所謂ロール・オン・タイプの容器としてもよい。すなわち、塗布部材2を、容器本体1の口部(首部13)に回転可能に固定され、その表面に外用医薬製剤を保持可能な球体(ボール部材)としてもよい。
前記で説明した塗布容器では、目盛り5のしるし部5a及び数量表示部5bは、容器本体1においてこれらの部5a及び5bが配置される部分に対し、外方に突出するように形成された。しかしながら、しるし部5a及び数量表示部5bの少なくとも一部又は全部は、同部分に対し、内方に窪んでいてもよい。
本発明の過剰投与の抑制方法は、(A)ロキソプロフェン及び/又はその塩と(C)1価低級アルコールを含む外用医薬製剤において、1回当たりの投与量が2.0gを超えて過剰投与されるのを抑制する方法であって、前記外用医薬製剤において、(A)ロキソプロフェン及び/又はその塩と(C)1価低級アルコールと共に、(B)モノテルペン及び/又はカプサイシノイドを共存させることを特徴とする。
表1〜4に示す組成の外用医薬製剤(液剤)を調製し、図1に記載の塗布容器に収容した。塗布容器の塗布部材は、多孔質構造を有するラバースポンジ部材からなり、多孔質体の孔の平均経は180μm、連続気泡率は100%、厚さは1.8mm、液体保持量は0.2gであり、液体保持量R1(0.2g)と容器の目盛りの計量単位R2(0.5g)とは、R1/R2=0.4の関係であった。各外用医薬製剤の経皮投与時に感じる「冷感、熱感又は灼熱感」及び「使用実感」について、10名の被験者によって以下の方法で評価した。
<冷感、熱感又は灼熱感の評価基準>
○:8.0〜10.0点
△:4.0〜7.9点
×:0〜3.9点
<使用実感の評価基準>
+++:5.0〜6.0点
++ :3.0〜4.9点
+ :1.0〜2.9点
± :−0.9〜0.9点
− :−2.9〜−1.0点
−− :−4.9〜−3.0点
−−−:−6.0〜−5.0点
点)を使用者に与えることができ、実施例1〜28よりもさらに過剰投与されにくい優れた外用医薬製剤であった。
1 容器本体
11 胴部
13 首部(口部)
2 塗布部材
3 キャップ
4 接続部材
40 筐体
402c 弁座
41 弁構造体
411 弁体
412 付勢部材
5 目盛り
5a しるし部
Claims (8)
- (A)ロキソプロフェン及び/又はその塩と、(B)モノテルペン及び/又はカプサイシノイドと、(C)1価低級アルコールとを含み、
1回当たりの投与量が2.0g以下に設定されている、外用医薬製剤。 - 前記(B)成分が、モノテルペンとカプサイシノイドの組み合わせである、請求項1に記載の外用医薬製剤。
- 前記モノテルペンがメントールである、請求項1又は2に記載の外用医薬製剤。
- 前記カプサイシノイドがノナン酸バニリルアミドである、請求項1〜3のいずれかに記載の外用医薬製剤。
- 前記(C)成分が、エタノール及び/又はイソプロパノールである、請求項1〜4のいずれかに記載の外用医薬製剤。
- 外用医薬製剤が液剤であり、塗布部材を有する塗布容器に収容されている、請求項1〜5のいずれかに記載の外用医薬製剤。
- 前記塗布容器が、
口部を有し、前記外用医薬製剤を収容し、前記外用医薬製剤の残量を外部から視認可能な程度の透明性を有する領域を少なくとも部分的に含む容器本体と、
前記口部に取り付けられ、前記容器本体内から供給される前記外用医薬製剤を保持可能であり、患部に接触することにより、前記外用医薬製剤を前記患部に塗布する塗布部材と
を備え、
前記容器本体には、前記外用医薬製剤の残量を計量するための目盛りが設けられている、
請求項6に記載の外用医薬製剤。 - (A)ロキソプロフェン及び/又はその塩と(C)1価低級アルコールを含む外用医薬製剤において、1回当たりの投与量が2.0gを超えて過剰投与されるのを抑制する方法であって、
前記外用医薬製剤において、(A)ロキソプロフェン及び/又はその塩と(C)1価低級アルコールと共に、(B)モノテルペン及び/又はカプサイシノイドを共存させる、前記方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020080454A JP7646298B2 (ja) | 2020-04-30 | 2020-04-30 | 外用医薬製剤 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020080454A JP7646298B2 (ja) | 2020-04-30 | 2020-04-30 | 外用医薬製剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021172638A true JP2021172638A (ja) | 2021-11-01 |
| JP7646298B2 JP7646298B2 (ja) | 2025-03-17 |
Family
ID=78279503
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020080454A Active JP7646298B2 (ja) | 2020-04-30 | 2020-04-30 | 外用医薬製剤 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7646298B2 (ja) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017200909A (ja) * | 2016-04-27 | 2017-11-09 | 第一三共ヘルスケア株式会社 | ロキソプロフェン配合皮膚用外用剤 |
| JP2018188429A (ja) * | 2017-04-28 | 2018-11-29 | 第一三共ヘルスケア株式会社 | ロキソプロフェン配合皮膚用外用剤 |
| JP2019119686A (ja) * | 2017-12-28 | 2019-07-22 | 小林製薬株式会社 | 外用製剤 |
| JP2020059665A (ja) * | 2018-10-09 | 2020-04-16 | 小林製薬株式会社 | 水性外用医薬組成物 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR200338767Y1 (ko) | 2003-08-29 | 2004-01-16 | 임준국 | 자외선차단용 화장품용기 |
| JP6925140B2 (ja) | 2017-02-28 | 2021-08-25 | 株式会社吉野工業所 | 計量塗布容器 |
-
2020
- 2020-04-30 JP JP2020080454A patent/JP7646298B2/ja active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017200909A (ja) * | 2016-04-27 | 2017-11-09 | 第一三共ヘルスケア株式会社 | ロキソプロフェン配合皮膚用外用剤 |
| JP2018188429A (ja) * | 2017-04-28 | 2018-11-29 | 第一三共ヘルスケア株式会社 | ロキソプロフェン配合皮膚用外用剤 |
| JP2019119686A (ja) * | 2017-12-28 | 2019-07-22 | 小林製薬株式会社 | 外用製剤 |
| JP2020059665A (ja) * | 2018-10-09 | 2020-04-16 | 小林製薬株式会社 | 水性外用医薬組成物 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP7646298B2 (ja) | 2025-03-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8177449B2 (en) | Spreading implement | |
| ES2325951T3 (es) | Dispositivo de administracion topica. | |
| CA2931144C (en) | Anti-infective methods, compositions, and devices | |
| JP2006143750A (ja) | 離層の少ない改良された経皮デバイス | |
| JP2015526480A (ja) | 治療剤の経皮送達を増強するための化学組成物および方法 | |
| NO333292B1 (no) | Topiske farmasoytiske formuleringer samt anvendelse av et terapeutisk middel for fremstilling av slike | |
| JP2000504697A (ja) | 皮膚浸透増強剤及びそれを含む薬剤デリバリーシステム | |
| JP6738120B2 (ja) | 外用医薬組成物 | |
| US20050014823A1 (en) | Topical anesthetic composition and method of administration | |
| JP2022009982A (ja) | ロキソプロフェンを含有する医薬製剤(さん) | |
| JP2021172638A (ja) | 外用医薬製剤 | |
| EP4121027A1 (en) | Repeated topical application of capsaicin patch for treating initial non-responders | |
| US11278511B2 (en) | Sports health performance composition | |
| JP2013215448A (ja) | 皮膚外用製品 | |
| JP2024037972A (ja) | 外用製剤 | |
| JP7186024B2 (ja) | 外用医薬組成物 | |
| JP4176858B2 (ja) | エアゾール製剤 | |
| JP6186117B2 (ja) | 皮膚外用製品 | |
| US20240050361A1 (en) | Topical product hands-free applicator drug delivery system and methods of making and using the same | |
| US9737603B1 (en) | Alcohol-based local anesthesia and associated use thereof | |
| JP2020002045A (ja) | 外用医薬組成物 | |
| JP4176859B2 (ja) | エアゾール製剤 | |
| JP2017197537A (ja) | ロキソプロフェン含む医薬の製剤 | |
| JP2017155042A (ja) | ロキソプロフェン含有的医薬製剤 | |
| US20220118236A1 (en) | Roll-on applicators and methods for treating dermal conditions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20221219 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231121 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20231122 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240122 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240301 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240625 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240826 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241021 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250204 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250305 |