JP2017514438A - 携帯型核酸分析システム及び高性能マイクロ流体電気活性ポリマーアクチュエータ - Google Patents
携帯型核酸分析システム及び高性能マイクロ流体電気活性ポリマーアクチュエータ Download PDFInfo
- Publication number
- JP2017514438A JP2017514438A JP2016562513A JP2016562513A JP2017514438A JP 2017514438 A JP2017514438 A JP 2017514438A JP 2016562513 A JP2016562513 A JP 2016562513A JP 2016562513 A JP2016562513 A JP 2016562513A JP 2017514438 A JP2017514438 A JP 2017514438A
- Authority
- JP
- Japan
- Prior art keywords
- actuator
- chamber
- flow path
- pcr
- detection
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229920001746 electroactive polymer Polymers 0.000 title claims abstract description 39
- 150000007523 nucleic acids Chemical class 0.000 title abstract description 33
- 238000004458 analytical method Methods 0.000 title abstract description 19
- 108020004707 nucleic acids Proteins 0.000 title abstract description 19
- 102000039446 nucleic acids Human genes 0.000 title abstract description 19
- 238000000034 method Methods 0.000 claims abstract description 74
- 239000012530 fluid Substances 0.000 claims abstract description 63
- 239000002245 particle Substances 0.000 claims abstract description 48
- 229920002595 Dielectric elastomer Polymers 0.000 claims abstract description 13
- 230000001052 transient effect Effects 0.000 claims description 12
- 229920001296 polysiloxane Polymers 0.000 claims description 9
- 238000009652 hydrodynamic focusing Methods 0.000 claims description 7
- 229920001971 elastomer Polymers 0.000 claims description 3
- 239000000806 elastomer Substances 0.000 claims description 3
- 238000001917 fluorescence detection Methods 0.000 claims description 3
- 238000001514 detection method Methods 0.000 abstract description 97
- 238000009396 hybridization Methods 0.000 abstract description 55
- 238000002493 microarray Methods 0.000 abstract description 55
- 238000003199 nucleic acid amplification method Methods 0.000 abstract description 53
- 230000003321 amplification Effects 0.000 abstract description 52
- 238000000746 purification Methods 0.000 abstract description 42
- 230000009089 cytolysis Effects 0.000 abstract description 36
- 239000000523 sample Substances 0.000 description 126
- 238000003752 polymerase chain reaction Methods 0.000 description 102
- 210000004027 cell Anatomy 0.000 description 43
- 239000000243 solution Substances 0.000 description 42
- 239000003153 chemical reaction reagent Substances 0.000 description 41
- 108020004414 DNA Proteins 0.000 description 40
- 239000010410 layer Substances 0.000 description 35
- 238000013459 approach Methods 0.000 description 31
- 239000011324 bead Substances 0.000 description 30
- 239000012528 membrane Substances 0.000 description 29
- 238000012360 testing method Methods 0.000 description 29
- 230000008569 process Effects 0.000 description 28
- 239000000203 mixture Substances 0.000 description 25
- 230000003287 optical effect Effects 0.000 description 24
- 238000004519 manufacturing process Methods 0.000 description 22
- 108090000623 proteins and genes Proteins 0.000 description 21
- 238000003556 assay Methods 0.000 description 20
- 108091093088 Amplicon Proteins 0.000 description 18
- 229910052782 aluminium Inorganic materials 0.000 description 18
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 18
- 239000011521 glass Substances 0.000 description 18
- 239000000758 substrate Substances 0.000 description 18
- 230000006870 function Effects 0.000 description 17
- 108020004999 messenger RNA Proteins 0.000 description 17
- 238000006243 chemical reaction Methods 0.000 description 16
- 238000002156 mixing Methods 0.000 description 16
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 15
- 239000012491 analyte Substances 0.000 description 15
- 238000013461 design Methods 0.000 description 15
- 102000004169 proteins and genes Human genes 0.000 description 15
- 239000000872 buffer Substances 0.000 description 12
- 239000007788 liquid Substances 0.000 description 11
- 239000000463 material Substances 0.000 description 11
- 108091034117 Oligonucleotide Proteins 0.000 description 10
- 238000003384 imaging method Methods 0.000 description 10
- 238000002372 labelling Methods 0.000 description 10
- 238000012545 processing Methods 0.000 description 10
- 238000005406 washing Methods 0.000 description 10
- 238000011049 filling Methods 0.000 description 9
- 229910052751 metal Inorganic materials 0.000 description 9
- 239000002184 metal Substances 0.000 description 9
- 238000000926 separation method Methods 0.000 description 9
- 238000000018 DNA microarray Methods 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 230000010354 integration Effects 0.000 description 8
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 7
- 108010079723 Shiga Toxin Proteins 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 239000012149 elution buffer Substances 0.000 description 7
- 239000012139 lysis buffer Substances 0.000 description 7
- 230000001717 pathogenic effect Effects 0.000 description 7
- 230000004044 response Effects 0.000 description 7
- 238000010839 reverse transcription Methods 0.000 description 7
- 239000000377 silicon dioxide Substances 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 230000001276 controlling effect Effects 0.000 description 6
- 238000011161 development Methods 0.000 description 6
- 230000018109 developmental process Effects 0.000 description 6
- 230000005284 excitation Effects 0.000 description 6
- 244000052769 pathogen Species 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 108091028043 Nucleic acid sequence Proteins 0.000 description 5
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 238000004925 denaturation Methods 0.000 description 5
- 230000036425 denaturation Effects 0.000 description 5
- 230000009977 dual effect Effects 0.000 description 5
- 238000010828 elution Methods 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 238000005286 illumination Methods 0.000 description 5
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 5
- 210000002700 urine Anatomy 0.000 description 5
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 4
- 102000053602 DNA Human genes 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 208000037065 Subacute sclerosing leukoencephalitis Diseases 0.000 description 4
- 206010042297 Subacute sclerosing panencephalitis Diseases 0.000 description 4
- 102000006943 Uracil-DNA Glycosidase Human genes 0.000 description 4
- 108010072685 Uracil-DNA Glycosidase Proteins 0.000 description 4
- 108020000999 Viral RNA Proteins 0.000 description 4
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 4
- 239000012298 atmosphere Substances 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 230000027455 binding Effects 0.000 description 4
- 238000004891 communication Methods 0.000 description 4
- 238000012864 cross contamination Methods 0.000 description 4
- 238000004090 dissolution Methods 0.000 description 4
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- 239000004005 microsphere Substances 0.000 description 4
- 238000012544 monitoring process Methods 0.000 description 4
- 239000004417 polycarbonate Substances 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 238000002331 protein detection Methods 0.000 description 4
- 210000003296 saliva Anatomy 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 238000002174 soft lithography Methods 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 230000003612 virological effect Effects 0.000 description 4
- 239000002699 waste material Substances 0.000 description 4
- 241001552669 Adonis annua Species 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 241000408659 Darpa Species 0.000 description 3
- 241000059459 Escherichia coli O104 Species 0.000 description 3
- 101710154606 Hemagglutinin Proteins 0.000 description 3
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 3
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 3
- 238000002944 PCR assay Methods 0.000 description 3
- 101710176177 Protein A56 Proteins 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 229910052804 chromium Inorganic materials 0.000 description 3
- 239000011651 chromium Substances 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 238000002405 diagnostic procedure Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 230000007613 environmental effect Effects 0.000 description 3
- 239000011888 foil Substances 0.000 description 3
- 238000005194 fractionation Methods 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- 229960000789 guanidine hydrochloride Drugs 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 238000003018 immunoassay Methods 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 206010022000 influenza Diseases 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000001746 injection moulding Methods 0.000 description 3
- 238000011068 loading method Methods 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 238000002844 melting Methods 0.000 description 3
- 230000008018 melting Effects 0.000 description 3
- 238000000465 moulding Methods 0.000 description 3
- 229920000515 polycarbonate Polymers 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 238000003757 reverse transcription PCR Methods 0.000 description 3
- 230000001932 seasonal effect Effects 0.000 description 3
- 239000002356 single layer Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 201000010740 swine influenza Diseases 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 244000063299 Bacillus subtilis Species 0.000 description 2
- 235000014469 Bacillus subtilis Nutrition 0.000 description 2
- 208000035473 Communicable disease Diseases 0.000 description 2
- 241000711573 Coronaviridae Species 0.000 description 2
- 230000004544 DNA amplification Effects 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 206010069767 H1N1 influenza Diseases 0.000 description 2
- 238000012773 Laboratory assay Methods 0.000 description 2
- 238000012408 PCR amplification Methods 0.000 description 2
- 108010004729 Phycoerythrin Proteins 0.000 description 2
- 238000012300 Sequence Analysis Methods 0.000 description 2
- 230000006978 adaptation Effects 0.000 description 2
- 238000000137 annealing Methods 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000001444 catalytic combustion detection Methods 0.000 description 2
- 230000006037 cell lysis Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 230000007123 defense Effects 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 241001493065 dsRNA viruses Species 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000010195 expression analysis Methods 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 238000001502 gel electrophoresis Methods 0.000 description 2
- 238000012252 genetic analysis Methods 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 2
- 230000036512 infertility Effects 0.000 description 2
- 208000037797 influenza A Diseases 0.000 description 2
- 238000009434 installation Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 238000002032 lab-on-a-chip Methods 0.000 description 2
- 239000002346 layers by function Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000007769 metal material Substances 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 238000001053 micromoulding Methods 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 230000002974 pharmacogenomic effect Effects 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- -1 polypropylene Polymers 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- 238000003908 quality control method Methods 0.000 description 2
- 238000002310 reflectometry Methods 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 208000023504 respiratory system disease Diseases 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000007789 sealing Methods 0.000 description 2
- 238000000638 solvent extraction Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 239000006163 transport media Substances 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 101150072531 10 gene Proteins 0.000 description 1
- PXFBZOLANLWPMH-UHFFFAOYSA-N 16-Epiaffinine Natural products C1C(C2=CC=CC=C2N2)=C2C(=O)CC2C(=CC)CN(C)C1C2CO PXFBZOLANLWPMH-UHFFFAOYSA-N 0.000 description 1
- 239000012114 Alexa Fluor 647 Substances 0.000 description 1
- PIGFYZPCRLYGLF-UHFFFAOYSA-N Aluminum nitride Chemical compound [Al]#N PIGFYZPCRLYGLF-UHFFFAOYSA-N 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- OHOQEZWSNFNUSY-UHFFFAOYSA-N Cy3-bifunctional dye zwitterion Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCN1C2=CC=C(S(O)(=O)=O)C=C2C(C)(C)C1=CC=CC(C(C1=CC(=CC=C11)S([O-])(=O)=O)(C)C)=[N+]1CCCCCC(=O)ON1C(=O)CCC1=O OHOQEZWSNFNUSY-UHFFFAOYSA-N 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- AHCYMLUZIRLXAA-SHYZEUOFSA-N Deoxyuridine 5'-triphosphate Chemical compound O1[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C[C@@H]1N1C(=O)NC(=O)C=C1 AHCYMLUZIRLXAA-SHYZEUOFSA-N 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 208000009620 Orthomyxoviridae Infections Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 108091036333 Rapid DNA Proteins 0.000 description 1
- 229910052581 Si3N4 Inorganic materials 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000000712 assembly Effects 0.000 description 1
- 238000000429 assembly Methods 0.000 description 1
- 238000011953 bioanalysis Methods 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000003990 capacitor Substances 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000001010 compromised effect Effects 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000005530 etching Methods 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 238000005429 filling process Methods 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 239000005350 fused silica glass Substances 0.000 description 1
- 238000011223 gene expression profiling Methods 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 238000013007 heat curing Methods 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 238000007901 in situ hybridization Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000005865 ionizing radiation Effects 0.000 description 1
- 238000003475 lamination Methods 0.000 description 1
- 238000001499 laser induced fluorescence spectroscopy Methods 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 238000003754 machining Methods 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 238000010208 microarray analysis Methods 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- 238000011527 multiparameter analysis Methods 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 239000002077 nanosphere Substances 0.000 description 1
- 238000007857 nested PCR Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000002572 peristaltic effect Effects 0.000 description 1
- 239000002985 plastic film Substances 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 238000005086 pumping Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 238000011897 real-time detection Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 230000011218 segmentation Effects 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- HQVNEWCFYHHQES-UHFFFAOYSA-N silicon nitride Chemical compound N12[Si]34N5[Si]62N3[Si]51N64 HQVNEWCFYHHQES-UHFFFAOYSA-N 0.000 description 1
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 description 1
- 229910000342 sodium bisulfate Inorganic materials 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000011885 synergistic combination Substances 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/686—Polymerase chain reaction [PCR]
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502715—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by interfacing components, e.g. fluidic, electrical, optical or mechanical interfaces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502723—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by venting arrangements
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502738—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by integrated valves
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502746—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means for controlling flow resistance, e.g. flow controllers, baffles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L7/00—Heating or cooling apparatus; Heat insulating devices
- B01L7/52—Heating or cooling apparatus; Heat insulating devices with provision for submitting samples to a predetermined sequence of different temperatures, e.g. for treating nucleic acid samples
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/416—Systems
- G01N27/447—Systems using electrophoresis
- G01N27/44704—Details; Accessories
- G01N27/44717—Arrangements for investigating the separated zones, e.g. localising zones
- G01N27/4473—Arrangements for investigating the separated zones, e.g. localising zones by electric means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/416—Systems
- G01N27/447—Systems using electrophoresis
- G01N27/44756—Apparatus specially adapted therefor
- G01N27/44791—Microapparatus
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/02—Adapting objects or devices to another
- B01L2200/028—Modular arrangements
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0684—Venting, avoiding backpressure, avoid gas bubbles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/10—Integrating sample preparation and analysis in single entity, e.g. lab-on-a-chip concept
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0654—Lenses; Optical fibres
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0816—Cards, e.g. flat sample carriers usually with flow in two horizontal directions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0819—Microarrays; Biochips
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/087—Multiple sequential chambers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0887—Laminated structure
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/16—Surface properties and coatings
- B01L2300/168—Specific optical properties, e.g. reflective coatings
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/18—Means for temperature control
- B01L2300/1805—Conductive heating, heat from thermostatted solids is conducted to receptacles, e.g. heating plates, blocks
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/18—Means for temperature control
- B01L2300/1805—Conductive heating, heat from thermostatted solids is conducted to receptacles, e.g. heating plates, blocks
- B01L2300/1822—Conductive heating, heat from thermostatted solids is conducted to receptacles, e.g. heating plates, blocks using Peltier elements
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0487—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/08—Regulating or influencing the flow resistance
- B01L2400/082—Active control of flow resistance, e.g. flow controllers
-
- C—CHEMISTRY; METALLURGY
- C40—COMBINATORIAL TECHNOLOGY
- C40B—COMBINATORIAL CHEMISTRY; LIBRARIES, e.g. CHEMICAL LIBRARIES
- C40B60/00—Apparatus specially adapted for use in combinatorial chemistry or with libraries
- C40B60/12—Apparatus specially adapted for use in combinatorial chemistry or with libraries for screening libraries
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Analytical Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Molecular Biology (AREA)
- Dispersion Chemistry (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Electrochemistry (AREA)
- Pathology (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
複数の配列増幅及び同時ハイブリダイゼーション読み出しによる一セットの別個の核酸配列の並列検出のためのデバイス、システム、及び方法。自動核酸分析システムは、試料溶解モジュールと、精製モジュールと、PCRモジュールと、複数の配列増幅及び同時マイクロアレイハイブリダイゼーション読み出しによって、並行して別個の核酸配列を検出するように構成された検出モジュールと、をマイクロ流体接続内に備える。行き止まり流体チャンバを備える、高性能マイクロ流体電気活性ポリマー(μEAP)アクチュエータが、粒子分取のために構成され、上記チャンバの表面は誘電性エラストマのEAP層で覆われた電極を備える。
Description
本出願は、2014年11月18日出願の米国特許第62/081525号、2014年8月25日出願の米国特許第62/041430号、及び2014年4月14日出願の米国特許第61/979377号に対する優先権を主張するものである。
本発明は、米国国防総省高等研究計画局によって契約番号HR0011−14−C−0082の下、政府の支援により行われた。政府は、本発明の特定の権利を有する。
導入
使用しやすいシステムにおける増幅及び検出と試料調製との統合は、核酸診断に対する重要な課題のままである(非特許文献1)。CepheidのGeneXpertプラットフォーム、NanosphereのVerigeneプラットフォーム、Becton,Dickinson and CompanyのBD Max System、及びLiatの「lab−in−a−tube」使い捨てデバイスを含む、多数のシステムが、近接POC用途に使用される「moderate complexity」デバイスとして、FDAの認可を得ている(非特許文献2)。
使用しやすいシステムにおける増幅及び検出と試料調製との統合は、核酸診断に対する重要な課題のままである(非特許文献1)。CepheidのGeneXpertプラットフォーム、NanosphereのVerigeneプラットフォーム、Becton,Dickinson and CompanyのBD Max System、及びLiatの「lab−in−a−tube」使い捨てデバイスを含む、多数のシステムが、近接POC用途に使用される「moderate complexity」デバイスとして、FDAの認可を得ている(非特許文献2)。
研究文献は、病原体検出技術及びデバイスの例で溢れているが;生の生体試料を受容するように構成された、多重、自動、統合型「sample to result」システムを開発することは誰もできなかった(非特許文献3)。初期の例では、電気泳動分離及びレーザ誘起蛍光を使用して、全血から抽出及び増幅された病原性DNAの存在を検出していた(非特許文献4)。Xu et al.(非特許文献5)は、増幅の間にリアルタイム蛍光読み出しを使用して、僅かに100コピー/μlを検出した。Ferguson et al.(非特許文献6)は、電極触媒緩衝剤の存在下で、ナノ構造電極上のPNAプローブにハイブリダイズされたウイルスRNAを電気化学的に検出し、Lam et al.(非特許文献7)は、金電極上に堆積された、レドックス標識化された分子プローブに対する増幅されたssDNAのハイブリダイゼーションを検出した。Ferguson(非特許文献6)は、10のTCID50(組織培養感染量)に相当するLODを実証したが、これは臨床力価より4桁小さかった。Lam(非特許文献7)は、1細菌/μlのLODを実証したが、スパイク尿試料の分析を行うときには、100CFU/μlの濃度が使用された。2つのグループは、核酸検出の基礎として横方向流サンドイッチアッセイを使用し(非特許文献8、9)、Fraunhofer Institutes ivD−Platform(非特許文献10)は、モジュール式プラットフォームを使用した。
何十年もの間、国防総省(DoD)は、野外携帯型生物学的分析の必要性を認識していた。最初は、生物学的脅威を識別するための需要であったが;患者に合わせた医療の出現により、DoDは、環境監視に加えて、さらに日常的な健康状態監視の価値及び診療現場(POC)診断の有効性を認識した。実際に、DARPAは、迅速な介在を可能にするために生物学的システムの監視を目的とした多数のプログラムを有する。しかしながら、数十年の投資にもかかわらず、必要な点で核酸処理を行う市販の機器は入手不可能である。この隔たりを埋めるために、「試料入力から回答出力まで」分析を行う、携帯型かつ統合型の、迅速に再構成可能な、自動バイオ検出システムを、SRIは開発し、我々は本明細書で開示する。
Niemz, A., T.M. Ferguson, and D.S. Boyle, Point-of-care nucleic acid testing for infectious diseases. Trends Biotechnol, 2011. 29(5): p. 240-50.
Bissonnette, L. and M.G. Bergeron, Infectious Disease Management through Point-of-Care Personalized Medicine Molecular Diagnostic Technologies. Journal of Personalized Medicine, 2012. 2(4): p. 50-70.
Foudeh, A.M., et al., Microfluidic designs and techniques using lab-on-a-chip devices for pathogen detection for point-of-care diagnostics. Lab Chip, 2012. 12(18): p. 3249-66.
Easley, C.J., et al., A fully integrated microfluidic genetic analysis system with sample-in-answer-out capability. Proc Natl Acad Sci U S A, 2006. 103(51): p. 19272-7.
Xu, G., et al., A self-contained all-in-one cartridge for sample preparation and real-time PCR in rapid influenza diagnosis. Lab Chip, 2010. 10(22): p. 3103-3111.
Ferguson, B.S., et al., Genetic analysis of H1N1 influenza virus from throat swab samples in a microfluidic system for point-of-care diagnostics. J Am Chem Soc, 2011. 133(23): p. 9129-35.
Lam, B., et al., Polymerase chain reaction-free, sample-to-answer bacterial detection in 30 minutes with integrated cell lysis. Anal Chem, 2012. 84(1): p. 21-5.
Chen, D., et al., An integrated, self-contained microfluidic cassette for isolation, amplification, and detection of nucleic acids. Biomed Microdevices, 2010. 12(4): p. 705-19.
Chen, Z., et al., Development of a generic microfluidic device for simultaneous detection of antibodies and nucleic acids in oral fluids. Biomed Res Int, 2013. 2013: p. 543294.
Schumacher, S., et al., Highly-integrated lab-on-chip system for point-of-care multiparameter analysis. Lab Chip, 2012. 12(3): p. 464-73.
本発明は、複数の配列増幅及び同時ハイブリダイゼーション読み出しによる一セットの別個の核酸配列の並列検出のためのデバイス、システム、及び方法を提供する。
一態様では、本発明は、試料溶解モジュールと、精製モジュールと、PCRモジュールと、複数の配列増幅及び同時マイクロアレイハイブリダイゼーション読み出しによって、並行して別個の核酸配列を検出するように構成された検出モジュールと、をマイクロ流体接続内に備える、自動核酸分析システムを提供する。
複数の実施形態において、本発明は:
上記検出モジュールが、エバネッセント波励起を利用したマイクロアレイスキャナを備えるマイクロアレイ検出光学素子を備え;
上記検出モジュールが、温度によって複数のストリンジェンシーを提供するように構成された自動ハイブリダイゼーションプロセッサを備え;及び/又は
上記PCRモジュールが、単一の反応で逆転写及びPCRを行うように構成される、
システムを提供する。
上記検出モジュールが、エバネッセント波励起を利用したマイクロアレイスキャナを備えるマイクロアレイ検出光学素子を備え;
上記検出モジュールが、温度によって複数のストリンジェンシーを提供するように構成された自動ハイブリダイゼーションプロセッサを備え;及び/又は
上記PCRモジュールが、単一の反応で逆転写及びPCRを行うように構成される、
システムを提供する。
複数の実施形態において、本発明は、上記モジュールを備える統合型マイクロ流体カードと、上記カードを受容するように構成されたソケット、上記カードを操作するように構成された操作装置、上記操作装置を電子制御するように構成されたコントローラを備えるアナライザと、を備えるシステムを提供し、上記操作装置は、流体アクチュエータと、PCRサーマルサイクラと、自動ハイブリダイゼーションプロセッサ及びマイクロアレイ検出光学素子とを備える。
複数の実施形態において、本発明は、試薬を収容し、溶解、精製、PCR、及び検出モジュールに試薬を送達するように構成された、試薬モジュールを更に備えるシステムを提供する。
複数の実施形態において、本発明は:
携帯型:1000in3未満及び10lb未満であり;
迅速:分析が120分未満であり;
多重:50より多い標的配列の同時分析を実施し;及び/又は
自動:試料導入と結果表示との間にユーザの介入を必要としない、システムを提供する。
携帯型:1000in3未満及び10lb未満であり;
迅速:分析が120分未満であり;
多重:50より多い標的配列の同時分析を実施し;及び/又は
自動:試料導入と結果表示との間にユーザの介入を必要としない、システムを提供する。
複数の実施形態において、本発明は:
試料がタンパク質分析物を含み、システムが更に、タンパク質分析物に核酸配列を含むタグを付けるように構成され;
固定されたプローブが、上記配列を、その空間的配置によって定義し;
増幅が、分析される配列の数より少ない多数のプライマ対によって、実施され;
別個の核酸配列が、複数の種/生物のものであり;
PCRモジュールが、金属(例えばアルミニウム)製PCR反応チャンバを備え;
マイクロ流体接続が、気泡除去のために構成された通気膜を備え、上記通気膜はチャネル層の下方にあるため、チャネル全体が大気圧に曝露され(特定の実施形態では、独立した複数の片としてよりも1つの層として上記膜を製造する方が容易であるため、上記膜は上記カード全体に広がるものの、チャネル層の下側でのみ機能する);
増幅が、消耗品内に完全に包含され(開放管などではなく);及び/又は
検出が、プライマセットではなくプローブセットに基づくものである(新しい試験の構築が容易である)、
システムを提供する。
試料がタンパク質分析物を含み、システムが更に、タンパク質分析物に核酸配列を含むタグを付けるように構成され;
固定されたプローブが、上記配列を、その空間的配置によって定義し;
増幅が、分析される配列の数より少ない多数のプライマ対によって、実施され;
別個の核酸配列が、複数の種/生物のものであり;
PCRモジュールが、金属(例えばアルミニウム)製PCR反応チャンバを備え;
マイクロ流体接続が、気泡除去のために構成された通気膜を備え、上記通気膜はチャネル層の下方にあるため、チャネル全体が大気圧に曝露され(特定の実施形態では、独立した複数の片としてよりも1つの層として上記膜を製造する方が容易であるため、上記膜は上記カード全体に広がるものの、チャネル層の下側でのみ機能する);
増幅が、消耗品内に完全に包含され(開放管などではなく);及び/又は
検出が、プライマセットではなくプローブセットに基づくものである(新しい試験の構築が容易である)、
システムを提供する。
複数の実施形態において、本発明は:
単一の容器において増幅を実施し(試料区分がなく);
血液、唾液、GI試料、尿、創傷用綿棒、脊髄穿剌、鼻腔用綿棒、獣医及び農業ソースの分析物試料を受容して処理し;
検体収集ツール若しくは搬送媒体を介して試料を受容し;
1〜100μlの試料体積を処理し;
モジュール式であり(モジュールを交換することによって異なる用途をサポートでき);
(チャネル寸法及び気泡除去によって行われる)計量が可能であり;並びに/又は
一方向性及び自己封止型である(試料の相互汚染を防止する)
ように構成された、システムを提供する。
単一の容器において増幅を実施し(試料区分がなく);
血液、唾液、GI試料、尿、創傷用綿棒、脊髄穿剌、鼻腔用綿棒、獣医及び農業ソースの分析物試料を受容して処理し;
検体収集ツール若しくは搬送媒体を介して試料を受容し;
1〜100μlの試料体積を処理し;
モジュール式であり(モジュールを交換することによって異なる用途をサポートでき);
(チャネル寸法及び気泡除去によって行われる)計量が可能であり;並びに/又は
一方向性及び自己封止型である(試料の相互汚染を防止する)
ように構成された、システムを提供する。
複数の実施形態において、本発明は、モジュールを備える統合型マイクロ流体カードと、ハウジング(ボックス)及び上記ハウジング内でカードを受容するように構成されたソケットを備えるアナライザとを備える、システムを提供し、ここで上記アナライザは:
上記カードと連動して、溶解、精製、PCT(増幅及び標識化)、並びに検出を実施し;
圧力(例えば試料搬送)、磁場(例えば試料混合)、温度(例えば、増幅、ストリンジェンシー、ハイブリダイゼーション)、及び/若しくは光(例えばハイブリダイゼーション検出)によって試料と相互作用し;並びに/又は
リアルタイムでハイブリダイゼーションを観察するためにエバネッセント波を試料と結合させること、並びに/若しくは配列情報をもたらす反応速度及び起こり得る塩基対不適合を決定することによって、検出を実施する。
上記カードと連動して、溶解、精製、PCT(増幅及び標識化)、並びに検出を実施し;
圧力(例えば試料搬送)、磁場(例えば試料混合)、温度(例えば、増幅、ストリンジェンシー、ハイブリダイゼーション)、及び/若しくは光(例えばハイブリダイゼーション検出)によって試料と相互作用し;並びに/又は
リアルタイムでハイブリダイゼーションを観察するためにエバネッセント波を試料と結合させること、並びに/若しくは配列情報をもたらす反応速度及び起こり得る塩基対不適合を決定することによって、検出を実施する。
複数の実施形態において、本発明は、モジュールを備える統合型マイクロ流体カード(カートリッジ)を備えるシステムを提供し、ここでカードは:
疾患タイプ(例えば、呼吸器疾患)に固有であり;
患者タイプ(例えば、小児)に固有であり;
病原体タイプ(例えば、生物兵器剤)に固有であり;
個体(例えば、薬理ゲノム学)に固有であり;
患者固有の情報のためにユニーク識別子を含有し;
無菌性を維持して相互汚染を最小化するために、単回使用用であり;
ロールツーロール製造ステップを使用して生産され;並びに/又は、
ポリカーボネートシャーシ、金属箔PCRチャンバ、アクリル構成要素、通気膜材料、及び/若しくはポリウレタンシールから生産される
ように構成される。
疾患タイプ(例えば、呼吸器疾患)に固有であり;
患者タイプ(例えば、小児)に固有であり;
病原体タイプ(例えば、生物兵器剤)に固有であり;
個体(例えば、薬理ゲノム学)に固有であり;
患者固有の情報のためにユニーク識別子を含有し;
無菌性を維持して相互汚染を最小化するために、単回使用用であり;
ロールツーロール製造ステップを使用して生産され;並びに/又は、
ポリカーボネートシャーシ、金属箔PCRチャンバ、アクリル構成要素、通気膜材料、及び/若しくはポリウレタンシールから生産される
ように構成される。
複数の実施形態において、本発明は、粒子又は細胞整列のための流体力学的集束及び/又は慣性集束を提供するように構成され、分取のために構成されたマイクロスケール電気活性ポリマー(EAP)アクチュエータを備える、蛍光活性化細胞分取器(FACS)などのマイクロ流体粒子分取器と、機能的に統合されたシステムを提供する。
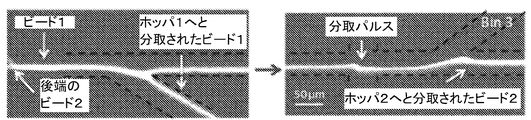
EAPμ−分取器は、iMFCシステムの粒子−濃度/分取モジュールと機能的に統合されるか又は粒子−濃度/分取モジュールとして組み込むことができ、また、大きな体積中の希釈粒子濃度(例えば、ml当たり数細胞で環境試料に存在する細菌)を濃縮することによって、又は多くの細胞の背景から選択された細胞(例えば、末梢血単核細胞の集団から活性T細胞)を分取することによって、システムが動作エンベロープを増加させることができるように構成できる。加えて、マイクロスケール電気活性ポリマーアクチュエータは、細胞捕獲、流体混合、ポンピングを含む、分取以外の代替的な用途に好適であり、従って、本主題の自動核酸分析システムから独立して提供、構成及び/又は操作できる。
本発明はまた、本開示のシステムを使用して、複数の配列増幅及び同時マイクロアレイハイブリダイゼーション読み出しによって並行して別個の分析物核酸配列を検出する方法を提供する。
別の態様では、本発明は、流路周辺に構成された高性能マイクロ流体電気活性ポリマー(μEAP)アクチュエータを提供し、ここで、上記アクチュエータに印加される電圧パルスは、流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、上記流路を横切って生成するように、上記アクチュエータを誘導し、上記アクチュエータは行き止まり流体チャンバを備え、上記チャンバの1つ以上の表面(例えば壁、床、天井)は誘電性エラストマのEAP層で覆われた電極を備える。
単一のμEAPアクチュエータは、アクチュエータによって駆動された流体噴射を受容するコンプライアントチャンバ(すなわち「蛇腹」)と対にすることができる。この構成は、動作中のアクチュエータを1つしか必要としないが、依然として交差流を生成できる。コンプライアントチャンバは、単に電気接続のない上記アクチュエータのうちの1つとしてよく、又は多チャネル/段階分取器のために使用する場合は、異なる幾何学的形状を有するチャンバとしてよい。
上記電極の主な例は固体電極(例えば、ガラススライド上のインジウムスズ酸化物(ITO)電極)であるが、上記電極はまた、又は代替的に、隣接するチャネル内の導電性流体などの流体を含む。
別の態様では、本発明は、流路周辺に互いに異なる位相で構成された複数のこのようなアクチュエータを提供し、ここで上記アクチュエータに印加される電圧パルスは、流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、流路を横切って生成するように、上記アクチュエータを誘導し、各アクチュエータは行き止まり流体チャンバを備え、上記チャンバの表面は誘電性エラストマのEAP層で覆われた電極である。
別の態様では、上記複数のアクチュエータは、互いに180°異なる位相で構成された一対のこのようなアクチュエータである。
複数の実施形態において:
−上記チャンバ(単数若しくは複数)の複数の表面は、誘電性エラストマのEAP層で覆われた電極を備え;
−上記流路は、粒子の水平整列のための流体力学的集束と垂直整列のための慣性集束との組み合わせを提供するように構成され;
−上記新しい流線は、分取出口に至り;
−上記流路は、試料投入チャネルと、分取済み及び未分取排出チャネルとを備え、上記新しい流線は、上記分取済み排出チャネルに至り;
−上記流路は、蛍光検出のために構成され、標的粒子が検出されるとすぐに、電圧パルスが、μEAPアクチュエータに印加され;
−上記EAP層は、厚さ1〜50(若しくは2〜25、若しくは5〜15μm)であり;
−上記エラストマは、シリコーンであり;
−上記アクチュエータ(単数若しくは複数)は、多チャネルデバイスにおいて並列分取を提供するように構成され;
−上記アクチュエータ(単数若しくは複数)は、複数の出口への多段階連続分取を提供するように構成され;並びに/又は
−上記アクチュエータ(単数若しくは複数)は、標識活性化粒子分取器において機能的に統合される。
本発明はまた、流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、流路を横切って生成するように、新しい流線上へアクチュエータ(単数又は複数)を誘導するために、電圧パルスを印加するステップを含むものなどの、上記アクチュエータを作製及び使用する方法を提供する。
本発明は、以上の実施形態のあらゆる組み合わせを、各組み合わせが詳細かつ個別に記載されているかのように、具体的に提供する。
特定の実施形態及びその実施例の詳細な説明
我々の発明は、人の介入なしで結果を生成することが可能な携帯型の安価な分子診断システムを提供し、人の介入は、試料を投入して結果を読み取るために必要とされるだけである。結果はまた、上で説明された種々の技術により、非常に高速で生成される。システムは、iMFCと呼ばれる、使い捨て部材と連結する方法を含む。方法及びシステムによって、iMFCは、基礎のハードウェアを修正する必要なく異なるタイプの試験を容易に実行するように構成される。最後に、カード自体は、モジュール式で、異なるタイプの試験を実行するために容易に修正可能である。
我々の発明は、人の介入なしで結果を生成することが可能な携帯型の安価な分子診断システムを提供し、人の介入は、試料を投入して結果を読み取るために必要とされるだけである。結果はまた、上で説明された種々の技術により、非常に高速で生成される。システムは、iMFCと呼ばれる、使い捨て部材と連結する方法を含む。方法及びシステムによって、iMFCは、基礎のハードウェアを修正する必要なく異なるタイプの試験を容易に実行するように構成される。最後に、カード自体は、モジュール式で、異なるタイプの試験を実行するために容易に修正可能である。
一態様では、本発明は、投入として試料を採取し、分子診断ステップを行い、診断試験の結果を表示できる自己完結型システムを提供する。典型的に、ステップは、(i)例えば、DNA試料が、血液、組織、尿、唾液、又は他の体液であり得る投入試料から抽出される、抽出及び精製と;(ii)例えば、試料の所定の配列が増幅される、増幅及び標識化と;(iii)ハイブリダイゼーションと;(iv)標的配列に結合される不必要な分子を除去するストリンジェンシー洗浄と、(v)識別ステップが完了し所定の配列が識別される読み出しと、を含む。システムは、一般に、統合型マイクロ流体カード(iMFC)と呼ばれる使い捨て部材と、非使い捨てベースユニットと、を備える。統合型マイクロ流体カードは、連結方式によりベースユニットに結合され得る。iMFCにおける流体流は、カードの構造の一部を形成するバルブを制御することによって、達成され得る。各々のカードは、生物学的マーカの特定のセットを検出及び識別するように設計され得る。
複数の実施形態において、試料投入と読み出しとの間のステップは、何らかの人の介入を必要とせずに実行され、システムは試料を区分せず、システムは少なくとも1,000の標的を識別でき、システムは実行毎に50を超える標的を識別でき及び/若しくは単一のシステムにおいてすべての試験ステップを実施し、並びに/又はリアルタイムハイブリダイゼーションを使用して、システムは、ハイブリダイゼーションが完了する前に結果を予測でき、標的濃度に関する情報を提供できる。
図1は、システム10全体を示す。システムは、ユニットベース20、ユニット蓋30、及び使い捨て統合型マイクロ流体カード(iMFC)40を備える。カードの設計はモジュール式であり、これによりカードは、血液の滴、鼻腔用綿棒、痰などを含むがこれらに限定されない種々の形態の試料投入を受容するためにカスタマイズできる、又はいろいろな試験を行うためにカスタマイズできる。一般に、試験工程は、最初に適切なカードを選択し、カードの投入チャンバに試料を配置し、ユニットベースにカードを配置し、蓋を閉じ、実行する適切なソフトウェアを選択することで、始まる。試験工程が開始すると、人の介入は必要ない。結果は、システムの一部として統合できるスクリーンに表示されても、又はコンピュータ若しくはスマートフォンなどの外部デバイスに送信されてもよい。試験が終結した後、カードは処分され、異なるカードが次の試験のために選択され得る。これらのステップの順序は、必要に応じて変化させることができる。
使い捨て統合型マイクロ流体カード:カードは一般に、1枚のカードに、溶解、精製、増幅、標識化、及び検出などの、複数の機能を組み合わせる。典型的な市販のシステムでは、これらの機能は複数の機器で達成される。我々は、気泡除去及び精密な計量、エバネッセント場撮像システムの統合、種々のステップにおける反応物及び化学反応の選択並びに迅速な増幅並びにリアルタイムハイブリダイゼーションなどの多数の技術及び特性を統合することによって、機能の統合を達成した。1枚のカードへの複数の機能の統合は、CLIA放棄を可能にすることができる。図2Aはカードの斜視図であり、図2Bは平面図である。図2Bはまた、カード内で種々の機能を行うことができるエリア(破線で示される)を示す。例えば、ブロック100は溶解ブロックであり、ブロック110は精製ブロックであり、ブロック120はポリメラーゼ連鎖反応(PCR)工程が行われるところであり、ブロック130は検出が行われるところであり得る。試験試料を含有する流体は、カード内に組み込まれるチャネルによって上で説明された順序で1つのブロックから別のブロックへと流れる。1つのブロックから別のブロックへのこれらのチャネルを通る液体の流れは、バルブでかかる圧力に応じて開閉され得るマイクロバルブによって制御される。
溶解ブロック:試料投入はまた、ブロック100、図2A及び2B、溶解ブロックで行われ得る。血液の滴及び鼻腔用綿棒を使用するなどの、種々の方法が、試料の投入のために使用され得る。一実施形態では、カードは、試料を収集するために使用されるツールを直接受容する。典型的に、市販のシステムでは、試料を収集するために使用されるツールは、試験機器と直結しない。試験機器とツールの直結を可能にすることによって、汚染及びユーザエラーの原因は排除され得る。カードがモジュール式であるので、溶解ブロックは、種々の方法の投入を受けるために修正され得る。図2A及び図2Bを参照すると、部材102は、1滴の血液などの、試料を受容する投入チャンバであり得る。図2Cは、モジュール式の利点を示し、溶解ブロックは、鼻腔用綿棒250を投入として受容するように構成される。血液の滴又は鼻腔用綿棒を使用するこれらの両方の場合のために、カード40の基礎の設計は、同じであり;投入モジュールだけが、異なることができる。
種々様々な投入の方法に加えて、溶解モジュールは、機械的、化学的、又は他のタイプなどの、異なるタイプの溶解を実行するように構成され得る。図2A及び図2Bを参照すると、溶解ブロックは、ビーズビータ104を有するものとして示されており、ビーズビータは、ビーズが充填されたビーズチャンバ、及びビーズを互いに衝突させるビーズチャンバの頂上に取り付けられた小型モータを備える。機械的溶解の一例は、衝突ビーズの間に位置する細胞が、溶解緩衝液にその内容物を解放して、溶解する。他のモジュールは、他のタイプの溶解を行うように構成され、これらのモジュールは、図2A及び図2Bに示されるものとは異なるか又は少ないチャンバ又はサブモジュールを有することができる。例えば、化学的溶解を行うことが可能なモジュールは、ビーズビータの代わりに、試料を含有する溶解緩衝液と(恐らくは試薬ブロックに保存されて、適切な時にチャンバ内にパイプで搬送される)化学物質とを混合できる、他のチャンバを有することができる。従って、異なるタイプの溶解に、同じ基本設計のカードで対応できる。
溶解の工程を開始するために、試薬ブロック140の溶解緩衝剤ウェル142に保存された溶解緩衝液が、チャンバ108にパイプで搬送される。カード内で流体流を制御する方法は、マイクロバルブを制御することによって達成され得る。液体が孔に触れる際に、孔がチャンバと大気との間の圧力差によりエアロックし、チャンバが充填される間にチャンバの空気を逃すように、チャンバ108は、頂部に気体透過性の孔を有することができる。この孔は、テフロンなどの種々の材料から作製され得る。チャンバ108が充填されるときに、チャンバ108と投入チャンバ102との間のバルブが開かれ、緩衝液が投入試料と混合される。溶解緩衝剤と投入試料が混合されると、投入チャンバ102とビーズビータ104との間の別のバルブが、混合物をビーズビータに入れるために開かれ得る。次いで、ビーズビータの頂上のモータが、所定時間オンにされ、その後、ビーズビータ104とチャンバ106との間のバルブが開かれて、溶液が、すぐにチャンバ106内に流れ込む。チャンバ106は、グアニジン塩酸塩などの試薬で予め充填され、溶解された溶液と混合される。試薬との混合が完了した後、チャンバ106と精製ブロック110との間のバルブが、精製ブロック内にこの混合物を導くために開かれ得る。グアニジン塩酸塩により、試料のDNAは、精製の工程において役立つ精製ブロックのシリカ系構造と結合できる。
異なるタイプの溶解を行い、種々の方法の投入を受け、投入方法のための実際のツールを受け入れる能力を提供する構成は、有利な特徴であり、この特徴が、デバイス10において相乗的に組み合わせられ得る。
精製ブロック:チャンバ106と精製ブロックとの間のバルブが開かれるとき、溶液は、精製ブロック内に配設されたシリカフリットと接触する。フリット及びフリットを保持する構造としては、それぞれ、図2A及び図2Bの112及び114が挙げられる。フリットを横切る溶液の流れが、図3に示されている。この図は、シリカフリット112周辺のカードの断面図を示す。シリカフリットは、ベース層400と頂部キャップ層430との間に挟まれるチャネル410内に着座するメッシュの形態であり得る。ベース層、頂部キャップ層は、フリットを保持する構造114の一部を形成する。矢印は、チャネル410内の流体の流れを示す。グアニジン塩酸塩を収容するチャンバ106からの溶液中の核酸を含有する溶液は、フリットと結合して、矢印の方向に流れることになる。フリットを越えた後の溶液の流れは、マイクロバルブによって、残渣チャンバ内へ流れるように、又は更なる処理のために、方向付けられ得る。従って、溶液のDNAは、フリットと結合するが、タンパク質及び脂質などの溶液の他の成分は、フリットを越えたフリット流と結合せず、チャネルによって残渣収集チャンバ144内へ方向付けられ得る。DNA結合ステップの後、洗浄ステップが行われる。エタノールリザーバ146に収容されるエタノールは、DNAに結合されたままの溶解物の不要な成分を洗い落とす洗浄ステップを行うために、フリットを越えて流れることができる。次いで、エタノールは、乾燥させられる。精製工程における次のステップは、溶離緩衝ウェル148に保存された溶離緩衝液にフリットを洗浄させることである。このステップは、核酸をフリットから分離させる。溶液は、すぐにPCR工程ブロック120に入れられる。このステップで、更なる処理ステップ(PCR工程)に対するバルブが開かれるが、残渣チャンバに対するバルブは閉じられる。
PCRブロック:精製ブロックの後に、ポリメラーゼ連鎖反応(PCR)が、好ましくは下で説明されるようなシステム適合によって実施され得る。PCRは、120として列挙されるPCRブロックにおいて実行され、図2A及び図2Bに示されるように、複数のステップで実行され得る。精製ステップの溶離洗浄が完了した後、核酸を含有する精製された溶液は、PCRマスタ混合物チャンバ122内に流れ込む。ここで、精製された溶液は、マスタ混合物チャンバの構造内に担持される凍結乾燥された(冷凍乾燥された)酵素と混合される。これらの酵素は、処理チェーンの更に下に存在する増幅ステップのために必要とされる。マスタ混合物チャンバは、ウェルを備えることができ、ウェルを充填する溶液の体積が制御されて、溶液の正確な体積を可能にし、気泡を回避又は除去できる。処理の種々の段階の正確な体積は、結果の精度に結びつく。
酵素との混合が完了した後、溶液は、PCRプライマチャンバ124内に流れ込み、そこで溶液は、凍結乾燥されたプライマと混合される。プライマチャンバはまた、溶液に混入される気泡を回避又は除去するだけでなく体積が正確に制御されるウェルであり得る。マスタ混合物及びプライマとの混合を伴うステップの分離は、一般に入手可能なマスタ混合物モジュールの使用を可能にし、デバイスのコスト全体を低減させるので、いくつかの状況において有利であり得る。加えて、例えば異なる標的分子の存在についてチェックするために使用され得る異なるプライマを有した複数のカードを作製することが可能であり得るので、2つのステップへの分離により、新たな脅威を試験するキットの迅速な配備がまた可能となる。プライマ(オリゴヌクレオチド)の凍結乾燥の工程は、高速かつ簡単であり、デバイス10の外部の実験室において実行され得る。従って、好ましい場合には混合工程を1つのステップで行うこともできるが、2つの混合ステップを分離することによって、カードは、異なる物質に対して試験するように修正され得る。
プライマとの混合が完了した後、溶液は、次いでPCRチャンバ126へと流れる。PCRチャンバが非金属材料から作製され得る従来の市販のアプローチとは異なり、iMFCカードのPCRチャンバは、アルミニウムなどであるがこれらに限定されない、不動態化された金属から作製され得る。アルミニウムチャンバ内の溶液の温度の迅速な制御を可能にするので、金属の、特にアルミニウムの、使用は有利である。この迅速な制御は、アルミニウムチャンバの頂部及び底部と密着する熱電クーラ(TEC)を有することによって達成される。PCRチャンバとTECとの密着は、PCRチャンバの上下に2つのTECを位置づけることによって得られる。PCRチャンバより上のTECは、デバイス10の蓋30(図1)上のTECハウジングユニット200内に配設される。蓋が閉じられるときにTEC面がPCRチャンバの頂部表面上に直接位置することができるように、TEC210の面の形状とPCRチャンバ126の形状は合わせられる。PCRチャンバより下のTECは、ユニットベース20内に簡単に配設される。図2Dは、PCRチャンバが2つのTEC(TEC面210を有する)220と(図において視認されないTEC面240を有する)230との間にどのように挟まれ得るかを示す。従って、TECのこの配列及びアルミニウムPCRチャンバの使用は、PCR混合の迅速な温度サイクルを可能にする。測定により、この組み合わせが±1℃の精度で>15℃/秒の温度傾斜を可能にすることが見出された。次いで、この構成は、試料投入と結果出力との間の時間の短縮に直接寄与する。不動態化されたアルミニウムの使用による溶液の迅速な温度制御で得られる利点に加えて、非金属材料がPCRチャンバのために使用される場合と比較して、溶液を加熱及び冷却するために必要なエネルギ量が低いという点で、更に別の利点が実現され得る。低いエネルギ量は、デバイスを実行するために必要な全体の電力が低いことを直接意味し、任意のバッテリ操作及びフィールド携帯性を可能にする。
PCRチャンバ126の別の態様が、PCRチャンバ及び検出ブロック130周辺のカードのセクションを示す、図2Eを参照してここで説明される。溶液の濃度を維持するために、PCR工程が行われる間、空気混入はPCRチャンバ内で回避又は最小化されなければならない。頂部及び底部セクションPCRチャンバは、説明されたように、不動態化されたアルミニウムから作製され;従って、通気膜はここで使用されない。従って、別のチャネル257により大気へと順番に開くリザーバ255へと導かれるPCRチャンバからの出口チャネル250が、提供される。従って、チャンバ126が溶液で充填される際に、空気は、押し出され大気に放出される。チャンバ126が充填される間に、チャネル260のバルブは閉じられ得る。充填工程の間、チャネル250及びリザーバ255もまた溶液で充填され、溶液は、空気がチャンバ126内に戻るのを防止する。また、溶液が6psiの定圧により動かされるので、チャネル250又はリザーバ255からの逆流は発生しない。チャンバが充填された後、PCR工程が開始される。PCR工程の終了後、必要な標的配列は、検出ブロック内での検出のために増幅及び標識化される。
検出ブロックの一般的説明:PCR工程が完了した後、図2Eを参照すると、チャネル260のバルブ262が開かれ、PCRチャンバ126内の増幅された成分(アンプリコン)を有する溶液が混合チャンバ275内に流され得る。ここで、溶液は、試薬ブロックのハイブリダイゼーション緩衝剤ウェル150に保存され得るハイブリダイゼーション緩衝剤と混合される。ハイブリダイゼーション緩衝剤の溶液は、PCR生成物と混合される前に測量される。混合チャンバ275の混合工程が完了した後、溶液は、チャネル330を介して検出チャンバ325内に流される。検出チャンバ325、混合チャンバ275、チャンバ内に及びチャンバ外に溶液を搬送するチャネルはすべて、図2Bに示す検出ブロック130の一部を形成する。次に、検出チャンバ内で、ハイブリダイゼーション緩衝剤と混合されたPCR生成物は、DNAマイクロアレイを越えて流れされ得る。これは、ウェルが溶液を保持しマイクロアレイ315がウェルの底部に配設される図2Fに見られるような検出ウェル317で行われる。従って、この構成では、溶液は、マイクロアレイの頂部に位置する。図2Fは、DNAマイクロアレイ315の配列を示し、光がどのようにマイクロアレイ内に結合されるのかを説明し、この光はマイクロアレイを読み取るために使用される光学システムの一部を形成する。DNAマイクロアレイは、ガラス基板310上にグリッドパターンで配列されたいくつかのプローブを含有できる。各々のプローブは、DNA(又はRNA)の鎖を含有でき、プローブの配列と相補的である試料溶液のヌクレオチド配列の存在を検出するために使用される。上述のように、これらのプローブは、ガラス基板310の頂部にグリッドパターンで位置する。光は、ガラス内にエッチングされた格子305を介して、ガラス基板内に結合される。
図2Gを参照すると、格子が、入射光306と共に示されている。入射光306は、所定の波長であり得る。格子の存在により、入射光は、複数の方向に進むことができ;いくつかの光は、307で示されるように通り抜けて伝送され、いくつかの光は、308及び309で示されるように、所定の角度で伝送され得る。光は、光307に対して追加的かつ鋭い角度で伝送され得るが、鋭い角度の光の強度は低くなる傾向にあるので、これらの角度は、本開示では無視される。光が伝送される(直線状に伝送されない光の)角度は、周知の格子方程式によって決定される。光308及び309の角度は、入射光306の波長を調整することによって、及び格子のパターン構成によって、調整され得る。次に、ガラス基板内に光を結合させるために、内部全反射の工程が使用される。この概念は、図2Hに示されている。この図では、直進して伝送される光307及び一つの角度で伝送される光309は、無視される。光308は、格子305のサイズの制約を受けたビームで示されている。従って、光ビーム308は、格子の左端から発せられる実線308Lと、格子の右端から発せられる破線308Rとで示されている。実線及び破線は、ビームの2つの端を区別するために使用され;他のいかなる差も示さない。ビーム308の角度並びにガラス基板及び周囲環境(本質的に空気)の屈折率に応じて、内部全反射は、R1とマークされたガラス基板領域1の頂部表面にセットされ得る。この反射光は、ガラス基板の底部表面に到達でき、(R2とマークされた)領域2で、再び内部全反射され得る。従って、内部全反射により、光は、マイクロアレイ315の下で検出ウェル317の後ろに向けて進められ得る。上述のように、マイクロアレイ315は、検出ウェル317の底部に位置する。光がマイクロアレイの位置に向けて進むため、エバネッセント場と呼ばれる別の現象を利用して、DNAマイクロアレイの感光性分子が励起される。内部全反射が発生する境界で、エバネッセント場が境界の他の側にセットされることは光学では周知である。これらのエバネッセント場は近接場現象であり、強度は境界から遠く離れて指数関数的に低下する。しかしながら、境界の直近では、エバネッセント場は感光性分子を励起することが可能であり、検出ウェル317の溶液が境界及び境界の近くに位置するので、エバネッセント場を使用する検出方法が可能となる。図2Hへ戻ると、検出ウェルが、包囲層320内に配設されるのが確認され;この包囲層は、クロムから作製される。クロム層はまた、図2Fにも示され、4つのすべての側部で検出ウェルを取り囲む。検出ウェルのすぐ近くからの迷光が低減又は除去されるように、クロムは、設計の一部として含まれる。誤った光の可能性は、検出ウェル上に黒いプラスチックシート327を結合させることによって、更に除去される。プラスチック以外の材料が、同様に使用され得る。
格子設計及び続く光308の角度、ガラス基板の厚さ、ガラス基板の屈折率、格子と検出ウェルとの間の距離は、我々がこのデバイスのために最適化したパラメータであり、相乗的な機能性を提供する。加えて、光308が、R1及びR2などの領域から(本質的にガラス−空気境界から)だけでなく、検出ウェルのガラス−溶液境界からも、内部全反射するように、光308の角度を選択できる。検出ウェルの溶液の屈折率はおよそ1.33であり、空気の屈折率はおよそ1である。格子ピッチ、格子材料、及び基板指標は、異なる波長のレーザ光を使用するために変更できる。一例では、633nmの波長の光が、750マイクロメートルの溶融シリカ基板上の195nmピッチの150nmの窒化ケイ素格子と共に使用された。光は、10°開いて基板内に結合される。マイクロアレイが整数の全内部反射率はね返りに対応した距離で位置づけられるように、格子とマイクロアレイとの間の距離は選択される。上で定められたすべてのパラメータは、必要に応じて調整され得る。例えば、上で定められたものとは異なる格子間隔を必要とする他の光の波長が使用され得る。
TEC365は、溶液の温度を制御するために、検出ウェル317を覆って配設され得る。最後に、マイクロアレイの一対一画像がカメラ検出器上に形成され得るように、CCDカメラ360がマイクロアレイの下に配設され得る。カメラシステムは、マイクロアレイ上の溶液の写真を撮影する。写真は、蛍光を発するマイクロアレイ内のエリアを明らかにする。この情報は、識別及び検出工程で使用される。
本発明は、検出機能を実施するために、説明された改良及び適合の相乗的な組み合わせを活用する。
検出ブロック−品質制御:試料内の標的配列を識別することに加えて、マイクロアレイは、ステップ(溶解、精製、酵素及びプライマとの混合など)を要求通りに確実に行うためにも、使用され得る。マーカが各々のステップで加えられ、マーカの有無がマイクロアレイ内で光学的に試験され得る。従って、マーカの有無を分析することによって、品質制御が、試験を適切に実行できたかどうか及び実行できなかった場所を識別するために、達成され得る。
検出ブロック−汎増幅:デバイス10は、種々の核酸配列に対する試験のための試料区分を回避するために使用され得る。試料区分は、市販のシステムにおいて共通に使用され;試料は複数の試料に分割する必要があり、各々の分割された試料が特定の配列のために試験され得る。原試料が複数の試料に区分されるので、この方法は、試料区分の数に等しい数に検出限界を減少させる。試料区分を使用する代わりに、我々は、汎増幅と呼ばれる工程を実施し、これにより、細菌又はウイルスの種の変異が、試料を区分せずに識別され得る。種の変異体のDNAのいくつかのセクションが同じか又は類似し得るので、このタイプの試験が可能となる。特定の配列が存在することを知って、プライマが、次いで、変異体を識別するために設計され得る。
典型的に、PCRは、約20の異なるプライマセットに制限され、市販のシステムが検出できる標的の数を制限する。我々のシステムは汎増幅によって制限を克服し、PCRプライマセットは多くの生物に共通なDNA配列を標的とし、プライマ間の領域は生物間で非常に多様なDNA配列を含有する。汎増幅アプローチは、高多重化が可能であるマイクロアレイでの試料タイプの差異化を可能にする。例えば、コロナウイルスポリメラーゼ遺伝子の保存領域は、単一のプライマセットで6つの異なるコロナウイルス血清型の増幅を可能にし、各々の血清型が、プライマセット間の増幅された多様な領域を分析することによって、マイクロアレイ上で区別可能である。
汎増幅の1つの利点は、PCRを行う典型的な市販のデバイスよりも少ないプライマが必要とされることである。20より多いプライマの使用は、プライマ分子がプライマの相補的な塩の列により互いにハイブリダイズする「プライマ二量体」と呼ばれる現象につながるが、我々の汎増幅工程は、少ないプライマの使用を可能にし、有利な構成をもたらす。
検出ブロック−リアルタイムハイブリダイゼーション:別の有利な構成では、試料投入と結果出力との間の時間を短縮することになるリアルタイムハイブリダイゼーションアプローチが、デバイス10内で実施される。典型的な市販のアプローチでは、試験される試料(単数又は複数)の安定した濃度が実現されるまで、ハイブリダイゼーションは続けられる。これに対して、デバイス10では、リアルタイムアプローチが実施され、ハイブリダイゼーションの開始直後の試料(単数又は複数)の濃度が上昇している間に、試料(単数又は複数)の濃度が繰り返し推定される。この技術は、CCDカメラからの信号の強さが反応速度曲線方程式に従って濃度に関連付けられ得るという観察に基づく(上記参照)。反応速度モデルを使用して、時間に対する蛍光信号増加が、監視され得る。この信号は、時定数が推定され得る指数関数としてモデル化又はフィッティングされ得る。時定数の推定により、分析物濃度が推定され得る。
検出ブロック−多段階温度制御の使用:典型的な市販のハイブリダイゼーション手順では、ハイブリダイゼーションが完了した後、結合されないプローブが洗い落とされ得るように、ストリンジェンシー洗浄が行われる。典型的に、ストリンジェンシー洗浄は、塩濃度を変化させることによって行われるが、しかしながら、デバイス10では、類似の効果が、一定の塩濃度を維持しながら、TECを使用して試料の温度を変化させることによって達成され得る。従って、ハイブリダイゼーションが完了し、画像の初期セットが撮影された後、結合されない分子のいくらかが除去され得るように、TECの温度は増加させられ得る。溶液の温度を変化させるほうがハイブリダイゼーション緩衝剤の塩濃度を変化させるよりも容易であるので、これにより、結果のチェックを行う有利な手法が可能となる。
体積制御:試験手順は、正確な体積を必要とするが、正確な体積は、充填チャンバに存在する気泡によって損なわれ得る。典型的な市販のシステムでは、蠕動ポンプなどの種々のデバイスが使用されるが、これらのデバイスの追加はデバイスのコスト及び複雑さを増加させる。我々のデバイスは、高い精度及び確度(好ましくは10%以下)を達成し、実施が安価な体積制御を提供する。
図4は、充填チャンバ周辺の構造と共に、充填チャンバ450を断面図で示す。充填チャンバは、ベース層490の頂部に位置することができる。チャンバの側部は、460で表される。流体は、矢印480に沿ってチャンバに入ることができる。充填チャンバの出口は、破線の矢印495でマークされる。部材470は、バルブであり;バルブが閉じられる場合には、流れは破線の矢印495に沿って発生しない。通気膜440は、図示されているように充填チャンバの頂部に取り付けられ得る。バルブが閉鎖されると、流体は、480の方向に充填チャンバ450内へ流れ込むことができる。通気膜は混入した空気を逃すことができ、充填チャンバが充填される際に、すべての空気が追い出される。通気膜は、チャンバと大気との間の圧力差により空気を逆流させず;従って、バルブ470が閉鎖されると、正確な量の流体が、充填チャンバ内に収集され得る。充填チャンバ内の体積の精度は、チャンバの寸法の精度により決定され、チャンバの寸法は、限定されないが機械加工及びエッチングなどの、周知の技術を使用して制御され得る。通気膜は、限定されないが微多孔ポリプロピレンなどの、材料から作製され得る。従って、精密に作製されたチャンバと通気膜の組み合わせにより、精密かつ正確な体積制御が、達成され得る。
膜を伴う充填チャンバは、iMFCカード内の種々の場所に位置する。従って、例えば、通気膜を有する充填チャンバは、PCRマスタ混合物チャンバ122及びPCRプライマチャンバ124のために使用され得る。特にこれらの2つの位置において、凍結乾燥された化合物は、チャンバ内にペレットとして位置することができ;従って、これらのチャンバ内の再水和工程は、体積制御環境で行われ得る。
バルブ制御:図5A及び図5Bは、流体流路520及び空気流路540を備えるiMFCカード、並びに可撓性膜530内で、バルブ及び流体の流れがどのように制御され得るかを示す。図5Aは、流体が流体流路520を通って流れることができることを示すために、2つの追加的な矢印550を示す。流体は、6psiなどの特定の圧力で、システムを通ってポンプ圧送され得る。膜530が、図5Aに示すように、変形しない場合には、チャネル520は流体の自由な流れを可能にすることができる。しかしながら、18psiなどの高い圧力が空気流路に印加される場合には、図5Bに示すように膜を変形させて、チャネル520を通る流れを効果的に停止させることができる。従って、膜の両側の圧力を制御することによって、流路を通る流れは制御され得る。差圧を印加する空圧システムは、下で説明される。
iMFC層:上述のように、iMFCカードは使い捨てであり、ポリカーボネート、アクリル、及びポリエチレンテレフタル酸塩などの、安価な材料で構成され得る。例えば、カードが異なる投入の方法を収容するために種々の異なるタイプの投入モジュールを有するように設計され得るなど、カードは異なるモジュールが収容され得る「マザーボード」と考えられ得る。カードが種々のモジュールを収容できるだけでなく、チャネル構成が、異なる診断試験を収容するか又は診断試験からステップを追加若しくは減少させるために、補正され得る。従って、各々のカードは、基礎となるハードウェアを変化させることを必要とせずに、所定の試験又は一連の試験を収容するように設計され得る。各々のカードは、1つ又は複数の層から作製され得る。カードの主要な機能の1つは、カードに内蔵された流体流路及び空気流路のシステムを通って、適切な時間に1つの場所から別の場所へ流体のルートを定めることである。他の機能としては、流れを計量すること、及び温度制御された環境を提供することが挙げられるが、これらに限定されない。
図6は、iMFCカードのすべての層の複合「投写」画像を示す。一般に、カードは、600のような1つ又は複数のチャネルを有し、その結果、流体は、これらのチャネル内の1つの位置から別の位置へ流れることができる。チャネルは、カード内の層の材料に溝を切ることによって、形成され得る。加えて、カードはまた、630のような1つ又は複数のバルブ、及び容積が計量され得る620のような1つ又は複数のチャネル若しくはリザーバを有することができる。いくつかの層又は層のセクションは、通気膜から構成され得る。カードは、610のような多数のポートを含有できる。ポートは、ハードウェアとカードとの間の連結を形成できる。これらのポートは、(流体を動かすために)駆動圧を又は(バルブを制御するために)バルブ圧を印加するために使用される。これらのポートの位置は、複数のカードで同じままであり、基礎のハードウェアを修正する必要が全くない。しかしながら、カードは任意の簡便な方式で設計され、カード上の機能は任意の簡便な方式で配設され得る。カードが基礎のハードウェアを変化させる必要なく種々の試験を行うために設計され得るので、この態様は、カードを汎用化する。
空圧システム:空圧システム(図7)は、カード内の流れの調節を司る。空圧システムは、ユニットベース内に位置することができるポンプを有することができる。このポンプは、16psiなどの、所望の圧力へとアキュムレータ内の空気を圧縮する。図はまた、アキュムレータからポンプまでのフィードバックループを示しており、これによりアキュムレータ内の圧力が一定に保たれる。アキュムレータから、アキュムレータの比較的高い圧力が6psiなどの低い圧力まで調節されるレギュレータへ、1つの通路は通じる。この低い圧力は、システム全体内で流体を動かすために使用される。電磁バルブは、流体駆動をオンにするために、レギュレータの出力に含まれ得る。アキュムレータからの別の通路は、バルブの開閉を制御するために、1つ又は複数の電磁バルブを通過できる。従って、アキュムレータの比較的高い圧力(16psi)は、バルブを制御するために使用され得る。図示されるように、各々の電磁バルブは、1つ又は複数のバルブを制御できる。図5A及び図5Bは、流体の流れがどのように流体チャネル及び空気流路の設計により制御されるかを図示する。図7のコンテキストでは、流体チャネルは、「駆動」出力に接続され、空気流路は「バルブ」出力のうちの1つに接続され得る。
空圧システムは、ハードウェアの一部であり;従って、流体流のための又はバルブ制御のための圧力を供給する経路のいくつかは、容易に修正できない。しかしながら、カードの設計の柔軟性を達成するために、ポートのみは、同じ位置にある必要があり;これらのポートは、バルブを制御するために空気流路に、又は流体駆動チャネルに、圧力を供給するための手段である。これらのポートは、図6の610によって示される。従って、カードが同じ位置にポートを有する必要から、同じハードウェアユニットが使用され得るが、カード自体は、異なる目的のために設計され得る。
ハードウェア:図1に示すように、説明される試験システムは、携帯型ボックスに内蔵され、ユニットベース20及びユニット蓋30を備える。種々の機能及び能力が、ベース及び蓋内に物理的に構成され得る。図8は、ハードウェアの機能ブロック図を示す。ハードウェアは、プロセッサ及びバッテリなどの電源を備えることができる。プロセッサは、TEC、モータ、光学システム、空圧システム、ディスプレイ、及び通信システムなどの、他の部材と連結され得る。ディスプレイシステムに関しては、デバイス10は、メッセージ又は結果を中継できるスクリーンを有することができる。通信システムに関しては、ユニット10は、イーサネット及びbluetoothなどの、任意の好適な通信方法によって、外部のコンピュータに連結され得る。ディスプレイ及び通信サブシステムは、周知の技術を使用して実施され得る。図8はまた、カードが例えばTEC、モータなどのサブシステムのいくつかと機械的に連結され得ることを示す。これらの連結は、破線で示される。
我々の請求項に係る発明の実施形態としては、以下が挙げられる:
1.試料を注入又は挿入し、結果を読み取る目的以外は、試験工程を実行するための人の介入なしで、大きなセット(>6、>10、>20、又は>50)の核酸配列を検出する、分子診断デバイス、システム、又は方法。
2.溶解、精製、PCR、及びハイブリダイゼーションのステップが、1つのシステムに統合され、これらのステップが、使い捨てカードで実行される、本明細書におけるデバイス、システム、又は方法。
3.モジュールを変化させることによって、カードが異なる試験のために構成され得るように、使い捨てカードが、モジュールを含有できる、本明細書におけるデバイス、システム、又は方法。
4.分析物が、例えば、血液、唾液、GI試料、尿、創傷用綿棒、脊髄穿剌、鼻腔用綿棒、獣医及び農業ソースを含む様々なソースからの試料から検出され得る、本明細書におけるデバイス、システム、又は方法。
5.試料を収集するために使用されるツールが、カードに直接投入され得る、本明細書におけるデバイス、システム、又は方法。
6.PCR工程の増幅ステップが、試料区分ではなく汎増幅と呼ばれる工程によって行われる、本明細書におけるデバイス、システム、又は方法。
7.検出ステップが、マイクロアレイを使用する、本明細書におけるデバイス、システム、又は方法。
8.マイクロアレイが、試験工程の各々のステップが適切に行われたかを検証する制御を含む、本明細書におけるデバイス、システム、又は方法。
9.検出ステップが、反応速度モデルに基づいて、試料の濃度を予測するリアルタイムハイブリダイゼーション方法を使用し、読み出し時間が、低減される、本明細書におけるデバイス、システム、又は方法。
10.TECと隣接及び接触して金属チャンバを位置づけることによってチャンバ内の温度が迅速に制御され得るように、PCR工程が、不動態化された金属チャンバにおいて実行され、好ましくは使用される金属が、アルミニウムである、本明細書におけるデバイス、システム、又は方法。
11.チャネル又はチャンバが充填される際に、空気が通気膜から追い出されるように、溶液の体積が、通気膜と結合されたチャネル又はチャンバを使用することによって計量され;従って、空気を有することによる計量された体積の誤差が、最小化又は除去され得る、本明細書におけるデバイス、システム、又は方法。
12.空圧システムが、流体を動かし、バルブを制御するために、異なる圧力を印加することによって流体流を制御する、本明細書におけるデバイス、システム、又は方法。
追加的な実施形態及びその実施例の詳細な説明
様々な試料の核酸配列含有量を分析できる携帯型システムが、開示される。システムは、様々な生試料(診断又は環境)を採取し、自己完結型ユニットのマイクロアレイによって核酸抽出、精製、増幅、標識化、及び配列分析を行うことが可能である。システムは、自動化され、訓練された実験技師ではないユーザによる迅速な試料の現場分析を可能にする。
様々な試料の核酸配列含有量を分析できる携帯型システムが、開示される。システムは、様々な生試料(診断又は環境)を採取し、自己完結型ユニットのマイクロアレイによって核酸抽出、精製、増幅、標識化、及び配列分析を行うことが可能である。システムは、自動化され、訓練された実験技師ではないユーザによる迅速な試料の現場分析を可能にする。
複数の実施形態において:
システムは、(1)再使用可能なハードウェアプラットフォームと、(2)行われるアッセイを決定する消耗統合型マイクロ流体カード(iMFC)と、を備え;
システムは、小さく(<150、<250、又は<400in3)、軽量で(<3、5、又は10lb)、高速、かつ直観的に使用され;
再使用可能なハードウェアが、空圧、圧力調節、温度制御、レーザ制御、及び最終的なマイクロアレイの撮像を制御かつ提供し;
MFC消耗品が、試料溶解、精製、PCR、及び検出を行い、必要とされるすべての乾燥試薬を貯蔵するカードを備え;及び/又は
iMFCが、乾燥試薬の完全性を悪化させないように、すべての液体試薬を別々に保持する試薬保存要素を更に備える。
システムは、(1)再使用可能なハードウェアプラットフォームと、(2)行われるアッセイを決定する消耗統合型マイクロ流体カード(iMFC)と、を備え;
システムは、小さく(<150、<250、又は<400in3)、軽量で(<3、5、又は10lb)、高速、かつ直観的に使用され;
再使用可能なハードウェアが、空圧、圧力調節、温度制御、レーザ制御、及び最終的なマイクロアレイの撮像を制御かつ提供し;
MFC消耗品が、試料溶解、精製、PCR、及び検出を行い、必要とされるすべての乾燥試薬を貯蔵するカードを備え;及び/又は
iMFCが、乾燥試薬の完全性を悪化させないように、すべての液体試薬を別々に保持する試薬保存要素を更に備える。
複数の実施形態において、システムは、以下のものを提供する:
使用しやすさ:訓練されていないオペレータによる現場使用のための、操作しやすさ及び解釈が簡単な結果;これは、「臨床検査室改善法(CLIA)‐放棄(weived)」となるように構成され;及び/又はユーザの介入を要しない試料投入から回答出力までの能力を提供する。
構成可能性:iMFCはモジュール式であり、主要なiMFCの保管、及び最終生成物アッセイの機能性を定める、分離した、高速で生成される、低コストモジュールの取着を可能にし;主要なiMFCが同じままであるので、新たな脅威が現れる際に、システムは、新しいアッセイのジャストインタイム開発を提供する。
アッセイ柔軟性:試料タイプ(丈夫な胞子から容易に断裂する哺乳動物細胞まで)並びに/又は分析物種(DNA、RNA、及びタンパク質)の柔軟性。
製造可能性及びコスト:iMFC及びモジュール式の構成要素は、低コスト射出成形又は高度な製造レーザ変換工程を使用して製造可能で;高速レーザ変換及び正確な積層は、1分に50フィートに近い生産速度で125μm程度の小ささと50μm未満の公差の特徴を有するiMFCの製造を可能にし;従来の射出成形技法と高度なレーザ変換技法との組み合わせは、1カードにつき総計10ドル未満で、複雑な使い捨てカートリッジの生産を可能にする。
複数の実施形態において、我々のシステムは、生試料投入から回答出力まで完全に自動化され、及び/又は複数の分析タイプを可能にするように構成可能である。
複数の実施形態において、我々のシステムは、微生物、典型的に細菌、ウイルス、又は真菌検出、並びにmRNA及びタンパク質検出による健康監視、並びに細胞選択及び濃縮などの、核酸、典型的にDNA又はRNA、の検出のために、携帯型バイオ分析プラットフォームを提供する。一実施形態では、システムは、(1)再使用可能なハードウェアプラットフォーム、及び(2)行われるアッセイを決定する消耗統合型マイクロ流体カード(iMFC)の2つの要素からなる。
複数の実施形態において、我々のシステムは、多種の用途に確実に適合可能である:
生菌剤検出:我々のDNA検出iMFCは、実験室でのワークフロー:溶解、DNA精製、DNA増幅及び標識化、並びにハイブリダイゼーションと、類似の方式で動作する。各々のステップへの我々のマイクロ流体技術的アプローチは、下で強調される。
溶解は、丈夫な胞子から哺乳動物細胞までの、試料タイプの確固とした溶解のためにシリカビーズ及び低コスト使い捨てモータを使用して達成される。
我々は、DNAをシリカフリットに結合し、不純物を洗い落とし、ポリメラーゼ連鎖反応(PCR)においてすぐに使える溶液を溶離することによって、DNAを精製する。我々のDNA精製モジュール及び手順は、ユーザの介入なしで、〜5分で最初の6μl中の高いDNA濃度の溶離を可能にする。これに対して、胞子溶解及びDNA精製のための実験室ベンチアプローチは、7つのステップ全体で30分かかり、実験室遠心機を必要とする。
我々は、2つのカスタム熱電クーラ(TEC)間のアルミニウム壁のチャンバにおいてDNA増幅を行う。TEC及びアルミニウムチャンバは、TECとPCR混合物との間の迅速な伝熱を可能にする。我々は、12分で大腸菌O104 H4病原体と関連した2つの遺伝子(AGG及びSTX2)のPCR二重化を実証し、10の遺伝子コピーまで検出した。
我々は、カスタムDNAマイクロアレイ及び光学システムを使用してDNAをハイブリダイズする。光は、格子を使用してガラス厚板内に結合され、内部全反射率によって閉じ込められたままとなる。表面上のエバネッセント波は、マイクロアレイの表面上のそれらの相補体にハイブリダイズされた標的配列を励起するために使用される。エバネッセント波の使用により、我々は、リアルタイムのハイブリダイゼーションを視覚化できる。カスタム光中継及びCCDは、マイクロアレイの表面を撮像するために使用される。
我々は、複数の潜在的な生物兵器剤の多重検出を検証し、我々のアッセイ及びハードウェアプラットフォームのための受信者動作特性(ROC)曲線を定めることができる。
ウイルスRNA検出:ウイルスRNAを検出する我々の技術的アプローチは、単一の逆転写/PCR混合を使用することを除き、DNA検出への我々のアプローチと同じである。我々は、インフルエンザH3N2及びH1N1ウイルスに対する30分未満の単一のマスタ混合物逆転写及びPCRを実証した。フィールド携帯能力により、DARPAのProphecyプログラムから得られる情報を直接活用でき、家畜の牛又は羊のウイルス集団において突然変異を引き起こす潜在的な大流行の早期検出が可能となる。
mRNA検出:我々は、同じハードウェアを使用して、mRNA分析に対処でき、反応速度データを捕捉するために、ポリTビーズ及びリアルタイムのマイクロアレイの撮像を使用してmRNA捕捉を可能にするようにiMFCを更新する。反応速度測定値の使用により、我々は、平衡に達する前に、各々の分析物ウェルの濃度を決定ことができ、それにより、遺伝子発現分析を典型的に行うハイブリダイゼーション時間を低減させる。mRNAが必要な点で血液試料を迅速に分析する我々の能力は、Predicting Health and DiseaseプログラムにおけるDARPA投資を活用する。
タンパク質検出:我々は、タンパク質結合事象を核酸読み出しに変換でき、それにより、同じプラットフォームに核酸及びタンパク質の両方をアッセイする力を与える。血漿タンパク質濃度は、健康状態又は環境曝露を示す。我々は、電離放射線曝露を示す4−ホスト−反応タンパク質パネルを開発し;他の環境曝露診断のための類似のパネルがまた、プラットフォームに統合され得る。我々は、ビーズ上のタンパク質分析物を捕捉するために、mRNA検出のためのモジュールと同じビーズ捕捉マイクロ流体モジュールを使用した。ビーズは、ポリTオリゴヌクレオチドの代わりに特定のタンパク質分析物のための抗体で官能化される。オリゴヌクレオチドで標識化された第2の抗体が、従来の免疫アッセイと同様にレポーター分子として使用される。サンドイッチアッセイがストリンジェント洗浄を受けると、レポーターオリゴヌクレオチドは、DNA検出用と同じモジュールを使用して増幅、標識化、及びハイブリダイズされる。我々は、このアプローチを「微小球−免疫−PCR」(MSiPCR)と呼ぶ。
細胞選択及び濃縮:我々のフロントエンドモジュールは、実験室スケール蛍光活性化細胞分取器(FACS)に似た、マイクロ流体電気活性ポリマー(EAP)細胞分取器を使用した所定の細胞選択及び濃縮を可能にする。モジュールは、大きな体積中の希釈細胞濃度(ml当たり数細菌細胞)を濃縮するか、又は多くの細胞の背景から選択された細胞(すべての末梢血単核細胞から活性T細胞だけ)を分取することによって、システムの動作可能なエンベロープを増加させる。このモジュールにおいて、我々は、流体力学的集束及び/又は慣性集束を使用して細胞を整列させ、次いでEAPアクチュエータを使用して蛍光トリガに基づいて分取する。我々は、25,000細胞/秒を超える速さで分取する技法の潜在性を実証した。
ベースライン手持ちアナライザ
ハードウェアプラットフォームは、微生物DNA試料のiMFC処理を支援するために必要とされるすべての必要なハードウェア操作を提供する。ユーザは、コンピュータUSBポートを介してハードウェアプラットフォームと相互作用する。iMFCがハードウェアに挿入され蓋が閉鎖されると、ユーザは、所望のアッセイのための所定の処理スクリプトを選択する。スクリプトが開始された後、手持ち装置は、完了まで、ユーザ相互作用なしで稼働する。稼働の間、画像が、手持ち装置からホストPCへ転送され、ホストPCで、それらは分析される。稼働の完了時に、分析及び結果が、ユーザレビューのためにスクリーン上に表示される。
ハードウェアプラットフォームは、微生物DNA試料のiMFC処理を支援するために必要とされるすべての必要なハードウェア操作を提供する。ユーザは、コンピュータUSBポートを介してハードウェアプラットフォームと相互作用する。iMFCがハードウェアに挿入され蓋が閉鎖されると、ユーザは、所望のアッセイのための所定の処理スクリプトを選択する。スクリプトが開始された後、手持ち装置は、完了まで、ユーザ相互作用なしで稼働する。稼働の間、画像が、手持ち装置からホストPCへ転送され、ホストPCで、それらは分析される。稼働の完了時に、分析及び結果が、ユーザレビューのためにスクリーン上に表示される。
ハードウェアは、好ましくは1ft3未満、好ましくは200in3未満、の総体積を有する小さな携帯型デバイスで細胞溶解、精製、増幅、及び検出を可能にするように設計される。一実施形態では、ハードウェア寸法は、148in3の総体積で、深さ4.75inx幅6.25in×高さ5inである。
iMFC上で、膜バルブ及び液体流は、正圧によって制御される。空圧サブシステムは、手持ちアナライザ(HHA)のすべての空圧構成要素を相互接続して、iMFC上の投入ポートへそれらの構成要素出力のルートを定めるカスタムアクリルマニホールドを中心とする。このマニホールドは、iMFC上のマイクロ流体バルブ膜操作に適切な調節された圧力(18psi)で空気の体積を保持するためにアキュムレータを含有する。単一のソレノイドが、アッセイ処理の間、好きな時にiMFCに駆動圧をトリガするために使用される。この駆動圧ポートは、(統合型マニホールドに取り付けられた)圧力レギュレータを通ってルートを定められ、その結果、駆動圧は、任意のHHAのために0〜10psi間に調整され得る。
表1は、機能要素及びその目的並びにベースラインシステムにおける実施を示す。増幅(PCR)及び検出モジュールを支援するハードウェアは、ベースラインiMFCの説明の一部として下で詳細に説明される。第2の列は、機能要素の目的を列挙し、最後の列は、所望の能力を達成するためにハードウェアプラットフォーム上で実施される我々の技術的アプローチを列挙する。
ベースラインiMFC及びiMFCモジュール
iMFC消耗品は、(1)試料溶解、精製、PCR、及び検出を行い、必要とされるすべての乾燥試薬を貯蔵するカードと、(2)乾燥試薬の完全性を悪化させないようにすべての液体試薬を別々に保持する試薬保存要素と、を備える。iMFCがモジュール形式で設計された、すなわち特定用途向けのモジュールが汎用カード上へ組み立てられるので、新しい用途のためのiMFCが、モジュールを簡単に交換することによって容易に高速で開発され得る。この融通特性は、新しいカード、すなわち最も複雑な構成要素、の再設計、開発、及び製造の必要性を除去する。成型されると、同じカードが広範囲の用途のために使用され、それにより、コスト及び開発時間が低減される。
iMFC消耗品は、(1)試料溶解、精製、PCR、及び検出を行い、必要とされるすべての乾燥試薬を貯蔵するカードと、(2)乾燥試薬の完全性を悪化させないようにすべての液体試薬を別々に保持する試薬保存要素と、を備える。iMFCがモジュール形式で設計された、すなわち特定用途向けのモジュールが汎用カード上へ組み立てられるので、新しい用途のためのiMFCが、モジュールを簡単に交換することによって容易に高速で開発され得る。この融通特性は、新しいカード、すなわち最も複雑な構成要素、の再設計、開発、及び製造の必要性を除去する。成型されると、同じカードが広範囲の用途のために使用され、それにより、コスト及び開発時間が低減される。
マイクロ流体カード:カードは、正圧駆動流を利用し、(1)流体チャネルと、(2)流体流を制御する22の膜バルブと、(3)流体チャネルからの気泡除去のための孔と、を含有する3つの機能層からなる。これらの機能層は共に、2つの射出成形部品によって取り囲まれた9つのラミネート層から構成される。7つのモジュールが、カード上に、4つ(溶解モジュール、精製フィルタ、PCRマスタ混合物チャンバ、及びプライマチャンバ)が頂部表面上、3つ(PCRチャンバ、撹拌棒ミキサチャンバ、及び検出チャンバ)が底部表面上に、予め取り付けられる。対象の標的を検知するためにDNAマイクロアレイを含有する光導波路チップが、検出チャンバに固着される。
試薬ブロック:ユーザがプログラムを開始するときに、手持ちハードウェアの膨脹可能なブラダは、箔シールを突き刺すために試薬ブロックを鋭利物上へ押圧し、次に、液体試薬を放出させる。正圧駆動流により、空気は、試薬ブロックの各々のチャンバに入り、出口ビアを通ってカード内へ液体試薬を動かす。カード上の圧縮性ガスケットは、試薬ブロック−カード連結部で、流体又は空気漏れを防止する。表2は、DNA分析のために試薬ブロックに保存され得る液体を確認する。異なる用途(mRNA又はタンパク質分析)のために設計されるカードは、異なる試薬を有することになる。試薬ブロックはまた、カードを通って流れる試薬を収集するために吸収性材料を収容する廃棄リザーバを備える。試薬ブロックは、好ましくは、生物学的アッセイ分析のために必要とされる単一のパッケージ済みフォーマットのすべての液体試薬を収容する。表は、DNA分析のために現在使用される試薬を列挙する。緩衝剤名が、緩衝剤の目的及び正確な化学処方と共に定められる。試薬ブロックは、多目的であり、必要とされる試薬は、iMFCによって行われる生物学的アッセイに応じて変化することになる。我々の技術的アプローチは、同じパッケージを使用し、RNAウイルス検出、mRNA検出、及びタンパク質検出のための新しいアッセイ能力を支持するためにそのパッケージに異なる試薬を充填することである。
溶解:試薬ブロックからの液体の放出に続く、自動プログラムにおける次のステップは、溶解である。溶解モジュールは、胞子試料でさえも扱うことができ、試料チャンバ、(胞子溶解のための)ビーズビートチャンバ、及び結合剤チャンバの、3つのチャンバからなる。試薬ブロックからの溶解緩衝剤が試料チャンバ内に流れ込んだ後、モータは、溶解緩衝剤を試料と混合するためにオンになる。混合された試料は、次いで、ビーズビートチャンバ内に流れ込み、そこで、第2のモータが、ガラスビーズを攪拌してビーズビートを介して胞子試料を溶解させるために、3分間稼働する。溶解された試料は、次いで、結合剤チャンバに入り、そこで、塩酸グアニジウムと重硫酸ナトリウムとの固体混合物(結合剤)が、次のステップにおける精製フィルタへのDNAの結合を容易にするために、試料に溶かされる。
このアプローチの概念の証明として、我々は、溶解モジュールによって溶解された枯草菌胞子の試料から溶解効率データを得た。胞子は、最も難しい溶解状況を代表する。非胞子への適用のために、ビーズビートチャンバは、設計を単純化してコストを低減させるために、モータのないチャンバモジュールと取り換えられ得る。
精製:我々は、マイクロ流体DNA精製のための技術的アプローチを開発する際にいくつかの難問に直面した。例えば、我々は、胞子試料を良好に溶解して精製するために、複数の遠心分離ステップを含む、7つのステップ、及び30分の時間を必要とする、実験室手順を複製したアプローチを開発する必要があった。更に我々は、最初の6μL断片にDNAを溶離する必要があった。実験室アッセイでは、精製されたDNAは、典型的に、大きい体積(例えば20μL)で溶離され、次いで、小さい体積分量(1〜3μL)が、PCR増幅のために使用される。この状況では、DNAが混合され、従って、溶離速度は、20μL全体にわたって平均化される;大部分の流れが層流であるので、マイクロ流体アプローチは、ほとんど混合されず、従って、溶離されたDNAの最も高い濃度は、最初の断片にあることが必要である。
溶解の後のiMFC上で、試料は、精製モジュールを通って流れ、DNAは、フィルタに結合し、残留する溶解された試料の内容物は、廃棄リザーバへと流れる。試薬ブロックからの洗浄緩衝剤が、次いで、残留不純物を除去するためにフィルタを通って流れ、同様に廃棄リザーバに集まる。空気が、フィルタを乾燥させるために、精製モジュールを通って伝送され、次いで試薬ブロックからの溶離緩衝剤が続き(第1の断片において重要な溶離を達成するキーとなる態様は溶離緩衝剤pHである)、溶離緩衝剤は、流れる際に、PCRに備えてフィルタから精製されたDNAを除去する。表4は、マイクロ流体カード上で精製された大腸菌試料の3つの複製のデータを提示し、標準精製フィルタからの結果とそれらの結果を比較する。いずれの場合も、最も高い濃度が第1の断片において現れていることは明らかである。各々の断片は、溶離緩衝剤の〜6μlのDNAを表す。
PCR増幅及び標識化:フィルタから精製されたDNAを搬送した後、溶離緩衝剤は、PCRマスタ混合物チャンバを充填し、PCRマスタ混合物チャンバは、凍結乾燥されたマスタ混合物を収容する。次いで、再水和されたマスタ混合物は、プライマチャンバ内に流れ込んで、乾燥されたプライマを再水和する。我々は、汎用PCRマスタ混合物モジュールの再使用を可能にするために、プライマ及びマスタ混合物を分離した。オリゴヌクレオチドの凍結乾燥は高速であり、このアプローチによって、我々は、新たな脅威に対して試験するためのキットの迅速な配備を支援できる。再水和ステップの後、試料は、マスタ混合物及びプライマと共に、PCRチャンバに入り、そこで、試料DNAは次いで増幅される。
2つのキーとなる特性:(1)アルミニウムPCRモジュール表面、及び(2)±1℃の精度で>15℃/秒の傾斜をつけることができる新規TECアセンブリにより、我々は、迅速なPCRを達成できる。
PCRモジュールは、2つのTECアセンブリの間に挟まれる。PCRマスタ混合物は、2つの25μmアルミニウム壁で包囲された高さ1mmのアクリルチャンバに保持される。PCRチャンバのアルミニウム表面は、TECアセンブリへの及びTECアセンブリから液体PCR混合物への熱の高速な伝導度を可能にする。比較として、厚さ50μmのプラスチックは、〜3Xだけ傾斜速度が遅くなる。
SRIは、カスタムTECアセンブリを設計及び試験した。我々は、製作のためにRMT社に設計図を移行した。カスタムSRIアセンブリは、ヒートシンク、TEC、フィードバックセンサ(サーミスタ)、及びセンサを取り囲む窒化アルミニウム(AlN)熱スプレッダを組み合わせる。各々のサーミスタセンサは、HHAが任意のセンサ製造誤差耐性を補償できるように、較正される。
我々のPCRシステムの概念の証明として、我々は、2011年ドイツで発生した大腸菌O104 H4病原体と関連した凝集型接着線毛(AGG)及び志賀毒素(STX2)遺伝子のための二重PCRアッセイを作り出した。プライマ及びプローブは、発生が始まった直後にBGIによってアップロードされた配列分析に基づいて、特異領域のために選択された。卓上設備を使用した実験室アッセイが、AGG及びSTX2標的のためのプローブ選択及びプライマ最適化の確立のために使用された。確立されると、アッセイは、SRIマイクロ流体PCRシステムに移行された。SRI PCRシステムは、熱伝導及び温度均一性のために最適化されたアルミニウムPCRチャンバ、及び迅速な温度サイクルのための新規サーミスタ駆動TEC設計を利用するので、アルミニウムチャンバを不動態化するために使用される補助剤を伴ったカスタムマスタ混合物製剤は、16分でのAGG及びSTX2標的の二重増幅を可能にした。
結果は、40PCRサイクル(95℃変性ステップ、62℃アニーリング、及び73℃伸長)のオーバレイを提供した。各々のサイクルは、40サイクル間に21秒で、合計で14分のPCR熱サイクルとなる。残りは、初期変性、及びウラシル−DNAグリコシラーゼ(UNG)処理のための時間である。我々のカスタムマスタ混合物は、増幅の一部としてdUTPを含有し、UNGステップにより、ハードウェアプラットフォームの異なる使用の間に確実に汚染が存在しない。我々は、5つの異なる投入コピー数(10、50、100、500、及び1,000)で16分のPCRを試験し、AGG及びSTX2遺伝子のための増幅率を定量化した。更に我々は、12分のPCRプロトコルを使用して500のコピー投入を試験して、サイクル時間が1サイクルにつき21秒から15秒まで低減されたことを観察した。また、2分のUNG処理及び初期変性が、わずか10分のサイクル時間に使用された。表5は、各々の試料のアンプリコンを定量化して増幅率を決定するために、アンプリコン標準に対するネステッドPCRの結果を示す。全体として、我々は、モジュール式PCRに対して1.6x109から3.4x1011の増幅範囲を有した。加えて、モジュール式PCRシステムによって生成されたアンプリコンは、SRIモジュール式ハイブリダイゼーションシステムによって検出された。
検出:所定の標的の存在を検出するために、増幅された試料は、光導波路チップ上のマイクロアレイにハイブリダイズされる。ハイブリダイゼーションを容易にするために、試薬ブロックからのSSPE緩衝剤が、増幅された試料に最初に添加される。2つの計量チャンバが、SSPE緩衝剤に対する試料の最適な比率を得るために利用される。
SSPE及びPCR生成物は、混合されて、次いで検出チャンバに押し込まれ、検出チャンバは、光導波路チップ上のマイクロアレイより上の試料を培養する。我々のカスタムTECアセンブリを使用した5分の温度制御されたハイブリダイゼーションの後に、試料を洗い落としてハイブリダイズされなかったアンプリコンを除去するために追加的なSSPE緩衝剤が検出チャンバ内に流れ込み、続いて、クロスハイブリダイゼーション又は間違ったプローブに非特異的に結合された任意のアンプリコンを除去するために昇温される。
最後に、DNAマイクロアレイは、カスタム照射、収集、及び撮像光学ブロックを使用して撮像される。光学ブロックは、マイクロアレイハイブリダイゼーションをレーザ照射し撮像するために必要なすべてを備えるスタンドアロンサブ構成要素として設計される。光学ブロックは、HHA内への設置の前に、予め整列及び調整され得る。この整列が行われると、設置の時に更なる調整の必要がない。
レーザ照射光学素子は、線生成レーザダイオードモジュール及び回転鏡からなる。レーザ照射の標的は、マイクロアレイチップ上の格子である。線生成レーザダイオードは、マイクロアレイにハイブリダイゼーションを視覚化するために使用されるAlexa Fluor 647nm色素分子を励起するために、矩形パターンで635nm、10mWのビームを発する。線生成ダイオードモジュールは、既成のパッケージ(Coherent)内に統合された合焦及び線生成光学素子を有する。
マイクロアレイ撮像光学素子は、折り畳み1:1中継レンズ及び干渉フィルタを備える。カスタム設計された中継レンズ群は、最大集光能のために高感度である(f/1.5)。中継レンズ群は、サイズが小さい(直径12mm及び長さ<27mm)。レーザ励起光及び散乱光が我々のモノクロCCD撮像器に到達することを避けるために使用される(誘電体スタックから作製された)2つの干渉フィルタ内に十分に光の照準が合わせられるように、中継レンズは設計される。
CCDチップ及び電子部品は、ノイズを低減させ信号損失を最小化するために、マイクロアレイ撮像光学素子に直接接続される。CCDは、CCD冷却を必要としない、マイクロアレイ分析のために十分な読み出し速さ(4フレーム/秒)及びマイクロアレイ撮像のために十分な信号対ノイズを可能にする。
光学システムの概念の証明として、我々は、SRIアルミニウムPCRチャンバ及びTECアセンブリによって生成されたPCRアンプリコンをハイブリダイズし、説明された光学システムを使用して結果を読み出した。試験プロトコルは、(我々の迅速なDNA合成機器によって識別されるような)スポットされたプローブ、5分間37℃でのオンボード培養、37℃から60℃への増加温度での複数のストリンジェンシー洗浄、及び自動画像捕捉のための光学パッケージを含んでいた。我々は、対照(A3)分析物だけを有する陰性対照、PCRへの10のコピーから結果として生じるアンプリコン、及びPCRへの50のコピーからのアンプリコンをハイブリダイズした。アッセイ結果は、陰性対照試料、並びにAGG及びSTX2のための個々のプライマから増幅された試料をハイブリダイズすることにより、選択性を証明した。ハイブリダイゼーションの画像は、標的プローブが、10−及び50−投入テンプレートの場合には明らかに視認可能であるが、A3対照の場合には存在しないことを実証した。
iMFC消耗品の低コスト大量製造:我々は、大量生産のためにiMFC成型のコストを引き下げる製造工程計画を開発した。射出成形は部品を作り出す単純かつ安価な方法であるので、我々は、カードの最上及び最下層、並びに溶解モジュール及び試薬ブロックを射出成形した。カードの残りのラミネート層は、自動ロールツーロール工程において成型され、ロールツーロール工程では、材料のロールが、共に積層され、レーザ切断され、次いで別のロールに巻き戻され、そのすべてが迅速なパイプライン形式の設備システム上にある。およそ数百万ものカードの高い生産量により、コストは、1カードにつき10ドルの低さとすることができる。
DNA検出アプローチ:我々が、適切なプローブを選択して、約2週間でベンチPCRアッセイを我々のプラットフォームに移行できるように、我々のシステムは、10時間未満ですべての可能なプローブを有するオリゴヌクレオチドアレイをアンプリコンへフォトリソグラフィ的に合成する能力を有する。本明細書において示されるように、我々は、増幅アッセイを開発し、iMFC PCRに増幅アッセイを移行し、及び大腸菌O104 H4のためのプローブ選択するこの能力の実証に成功した。
ウイルスRNA検出アプローチ:RNAウイルス検出は、RNAウイルスゲノムの逆転写及び増幅のためのマイクロ流体アッセイを有した、DNA検出に対するものとすべて同じモジュールを使用する。我々は、季節性インフルエンザと豚インフルエンザとを区別できるアッセイを使用してこのアプローチの概念を実証した。インフルエンザアッセイを開発するためにとられたアプローチは、一般化可能であり、選択剤RNAウイルスに対して同じアプローチを使用できる。
インフルエンザの識別のための、我々の第1のステップは、インフルエンザA型マトリックス遺伝子のセグメント、並びにH1(豚)及びH3(季節性)株を区別する血球凝集素遺伝子の部分を選択的に増幅するプライマを識別することであった。我々のRT−PCRプロトコルは、42℃5分の逆転写(RT)ステップを伴い、このステップで、リバースプライマが、RNA標的にアニーリングし、第1のDNA鎖の合成を開始する。次いで、2分の逆転写酵素非活性化及び同時Taqポリメラーゼ「ホットスタート」によって、フォワードプライマが、第1のDNA鎖にアニーリングされて、第2のDNA鎖を合成することが可能である。この時点で、40サイクルのPCRが、95℃10秒の変性、62℃20秒のアニーリング、及び75℃5秒の伸長を伴って、開始する。良好な増幅が卓上機器において達成されると、我々は、モジュール式増幅システムへ移動し、システムが、iMFCにおいて増幅をシミュレートする。このシステムにおける速い温度傾斜のため、上で説明されたRT−PCRプロトコルは<33分であり、RT−PCR生成物は、最初にゲル電気泳動を使用して、次いでマイクロアレイ上で評価される。CA 2009豚インフルエンザ株(H1N1)及びHK 68季節性株H3N2(三重増幅)のマトリックス及び血球凝集素遺伝子のモジュール式の増幅に対するゲル電気泳動結果が得られた。244bpアンプリコンは、インフルエンザA型マトリックス遺伝子を示す。H1株の血球凝集素アンプリコンは、173塩基対であり、H3アンプリコンは、177塩基対である。DNAマイクロアレイ上の配列特異的プローブに対するハイブリダイゼーションは、H1及びH3株の明確な差異化をもたらす。
マイクロアレイ上で高感度な選択的検出を達成する際の第1のステップは、我々の対象の標的のためにアンプリコン全体を覆う20〜25merのプローブを含有するフォトリソグラフ的に合成されたプローブ選択チップを準備することである。対象のアンプリコンに1日未満ですべての可能なプローブを合成する我々の力は、我々が、高感度で特異的なプローブに対して経験的に試験できることを意味する。次に、我々は、最も高感度で特異的なプローブを選択するために、マイクロアレイにハイブリダイゼーション実験を行った。H1とH3とを容易に区別するプローブの選択が、2つのアンプリコンを容易に差異化するアンプリコンのいくつかの領域が存在するかによって、識別された。最高のプローブが、我々の手持ちデバイスで使用されるように、エポキシ官能基化顕微鏡スライド又は導波路チップ上でスポットするためにアミン修飾で付けられ得る。
mRNA検出アプローチ:末梢単核球細胞(PBMC)の遺伝子発現プロファイリングは、病態、環境曝露、及び感染の発症前診断を監視する有用な方法である。mRNA発現分析が可能な我々のiMFCは、ハードウェアプラットフォームの僅かに修正されたバージョン、特別なTEC、及びマイクロアレイ上の増加した照射均一性−を使用し、
−PBMC選択及び溶解:全血からPBMC精製するための市販サイズの排除フィルタ、及び本明細書において説明される細胞選択器モジュールを使用する。
−mRNA精製:ポリTオリゴヌクレオチドで被覆された微小球を使用して溶解された細胞からmRNAを捕捉する。
−T7線形増幅及び標識化:T7増幅及び標識化のための現在のPCRチャンバ並びに市販のキットを使用する。
−迅速なハイブリダイゼーション:分析物濃度を決定するために、ハイブリダイゼーションの反応速度測定値を使用し;遺伝子発現ハイブリダイゼーションのために必要な時間を数時間から数分まで削減する。
−T7増幅:既存のiMFC PCRモジュール及び市販のキットを活用する。
を行うことができる。
−PBMC選択及び溶解:全血からPBMC精製するための市販サイズの排除フィルタ、及び本明細書において説明される細胞選択器モジュールを使用する。
−mRNA精製:ポリTオリゴヌクレオチドで被覆された微小球を使用して溶解された細胞からmRNAを捕捉する。
−T7線形増幅及び標識化:T7増幅及び標識化のための現在のPCRチャンバ並びに市販のキットを使用する。
−迅速なハイブリダイゼーション:分析物濃度を決定するために、ハイブリダイゼーションの反応速度測定値を使用し;遺伝子発現ハイブリダイゼーションのために必要な時間を数時間から数分まで削減する。
−T7増幅:既存のiMFC PCRモジュール及び市販のキットを活用する。
を行うことができる。
mRNA精製:mRNA精製のために、我々は、ポリT被覆されたビーズにmRNAをハイブリダイズして、包含物を洗い落として、次いでポリTビーズからmRNAを解放できるマイクロ流体精製モジュールを使用する。我々は、〜5μm微小球ビーズを溶液内に保つミキサ、及び洗浄ステップの後にビーズから捕捉されたmRNAを溶かすための新しいTECを使用する。我々は、5μmビーズが蛇腹混合チャンバとフィルタとの間でよく動くかを検証するために、デバイスを試験した。我々はまた、流体が、ポリT:mRNA二重鎖の変性を可能にするために、〜80℃まで加熱され得ることを実証した。
迅速なハイブリダイゼーション:ハイブリダイゼーション時間を減少させて反復性を改善するために、我々は、反応速度パラメータから濃度を推量する。標的転写の数がプローブの数を超える状況では、信号値対時間は、以下の反応速度曲線をたどることになる:
Y=C(1−e−rt),r=koff+[A]kon
Y=C(1−e−rt),r=koff+[A]kon
式中、Yは、背景減算された信号であり;koff及びkonは、温度、遺伝子配列、及びプローブシフトに依存した反応速度パラメータであり;[A]は、溶液中の標的遺伝子の濃度であり;Cは、光強度、プローブ密度、標的濃度、及び反応速度パラメータを含む複数の因子に依存するスケール係数である。我々のプローブ選択技術は、複数の濃度にわたって数式をハイブリダイゼーション信号の時系列に当てはめることによって、koff及びkonを推定する。これらの推定値は、保存されて、[A]を推定するためにリアルタイムで使用され得る。光強度及びプローブ合成密度の変動は、パラメータCに影響を及ぼすが指数関数内の変数ではないので、この反応速度技術は、チップ間の及び同じチップの複製反復性を著しく改善する。
概念の証明として、我々は、合成された25塩基対オリゴマ標的から開始して、反応速度アプローチで実験を行った。1つのプローブのA3対照に対する反応速度応答において、オリゴヌクレオチドを標識化した。各々の線は、A3の異なる濃度:50nM、100nM、300nMに対する応答を表す。非線形最小二乗当てはめが、時系列ごとにパラメータC及びrを推定するために、使用される。次いで、複数の濃度[A]での実験が、rと[A]との間のアフィン関係を明らかにする。
我々は、rと[A]との間に高感度で反復可能な関係をもたらす状態を識別する。我々のデータは、[A]=(50、100、300)nMに対してr=(0.0031、0.0033、及び0.0058)s−1で、関係が正しい方向に発生し得ることを示す。反応速度曲線当てはめの追加的な恩恵は、平衡値Cが反応速度rより良好であると判明する場合であっても、当てはめ工程が短期ノイズを平均するということである。反応速度パラメータを測定する力が、チップ表面に結合される蛍光分子だけを励起するためのエバネッセント波のiMFCの使用に依存し、標的溶液が適所にある間でも高い信号対背景比をもたらすことに、我々はまた留意する。
タンパク質検出アプローチ:タンパク質バイオマーカを含むようにiMFCプラットフォームの検出能力を拡張する1つの手法は、微小球免疫アッセイであり、微小球免疫アッセイは、標的抗原が存在するときに、非線形増幅可能DNA標的を生成するためにオリゴヌクレオチドで標識化された抗体を使用し、我々は、SRIの実証された微小球免疫PCRアッセイ(MSiPCR)に基づいたiMFCプラットフォームを有する免疫アッセイモジュールを開発した。ビオチン化された標的特異的抗体は、標的抗原の最初の捕捉のためにストレプトアビジン被覆された6μmポリスチレンビーズ上へ抱合される。分離標的特異的抗体は、標的タンパク質の第2の捕捉事象のために1つのオリゴヌクレオチドと化学的に抱合される。2つのタンパク質捕捉事象の間の広範な洗浄は、任意の結合されない標的並びに遊離抱合体を洗い落とす。残りのビーズ部分は、次いで、taqmanプローブと共に標識化された特異的プライマセットを使用して、増幅される。増幅された核酸信号は、続いて、検出及び読み出しのためにマイクロアレイ上へハイブリダイズされる。我々は、卓上アッセイをiMFCプラットフォームに移動させた:我々の概念の証明のためのiMFCプラットフォーム用のモジュール式システムは、核酸増幅後にビーズを捕えるフィルタと共に、洗浄及び培養ステップのための蛇腹ミキサを組み込む。
システム改善:光学ブロックは、より均一なパターンをマイクロアレイ格子に提供して、検出信号対ノイズ比を改善するために532nm励起を使用するように、修正され得る。635nmから532nmへの励起光源の切り替え工程は、格子ピッチを変化させることだけが問題である。
この修正された光学ブロックは、レーザ標的照射光学素子及びマイクロアレイ撮像光学素子からなる。レーザ標的照射光学素子は、小型ダイオード励起固体(DPSS)レーザモジュール、走査及び合焦光学素子、並びに2D走査微小電子機械システム(MEMS)鏡を使用する。DPSSレーザモジュールは、Cy3色素分子を励起するために532nmで40mWのレーザビームを出力できる。ビームは、合焦光学素子を使用してMEMS鏡上に合焦させることができる。2D MEMS鏡は、矩形上のスポットを走査し、格子にビームを向けることができる。走査鏡で反射した後に、ビームは走査レンズと衝突し、走査レンズは、ビームがマイクロアレイチップ上の格子に入る前に、ビームの照準を合わせる。
このシステムは、格子全体上の、従ってマイクロアレイ全体上の、同じレーザスポットを走査する。これは、25%の強度を変化させることができる線生成光学素子からの照射不均一を除去する。ビームがマイクロアレイチップ格子に入る前に、走査レンズにより、我々は、ビームの照準を合わせることも可能である。我々は、概念の証明により、新しい走査技術的アプローチを確証した。マイクロアレイ撮像光学素子は、異なる励起(532nm)及び発射(570nm)波長のためのフィルタを除き、現在の光学ブロックと変わらない。
我々の請求項に係る発明の実施形態としては、以下が挙げられる:
1.試料溶解モジュールと、精製モジュールと、PCRモジュールと、複数の配列増幅及び同時マイクロアレイハイブリダイゼーション読み出しによって、並行して別個の核酸配列を検出するように構成された検出モジュールと、をマイクロ流体接続内に備える、自動核酸分析システム。
2.上記検出モジュールが、エバネッセント波励起を利用したマイクロアレイスキャナを備えるマイクロアレイ検出光学素子を備え;
上記検出モジュールが、温度によって複数のストリンジェンシーを提供するように構成された自動ハイブリダイゼーションプロセッサを備え;及び/又は
上記PCRモジュールが、単一の反応で逆転写及びPCRを行うように構成される、
前述又は後述の請求項のシステム。
上記検出モジュールが、温度によって複数のストリンジェンシーを提供するように構成された自動ハイブリダイゼーションプロセッサを備え;及び/又は
上記PCRモジュールが、単一の反応で逆転写及びPCRを行うように構成される、
前述又は後述の請求項のシステム。
3.上記モジュールを備える統合型マイクロ流体カードと、上記カードを受容するように構成されたソケット、上記カードを操作するように構成された操作装置、上記操作装置を電子制御するように構成されたコントローラを備えるアナライザとを備えるシステムであって、上記操作装置は、流体アクチュエータと、PCRサーマルサイクラと、自動ハイブリダイゼーションプロセッサ及びマイクロアレイ検出光学素子とを備える、前述又は後述の請求項のシステム。
4.試薬を収容し、溶解、精製、PCR、及び検出モジュールに試薬を送達するように構成された、試薬モジュールを更に備える、前述又は後述の請求項のシステム。
5.携帯型:1000in3未満及び10lb未満であり;
迅速:分析が120分未満であり;
多重:50より多い標的配列の同時分析を実施し;及び/又は
自動:試料導入と結果表示との間にユーザの介入を必要としない、前述又は後述の請求項のシステム。
迅速:分析が120分未満であり;
多重:50より多い標的配列の同時分析を実施し;及び/又は
自動:試料導入と結果表示との間にユーザの介入を必要としない、前述又は後述の請求項のシステム。
6.試料がタンパク質分析物を含み、システムが更に、タンパク質分析物に核酸配列を含むタグを付けるように構成され;
固定されたプローブが、上記配列を、その空間的配置によって定義し;
増幅が、分析される配列の数より少ない多数のプライマ対によって、実施され;
別個の核酸配列が、複数の種/生物のものであり;
PCRモジュールが、金属(例えばアルミニウム)製PCR反応チャンバを備え;
マイクロ流体接続が、気泡除去のために構成された通気膜を備え、上記通気膜はチャネル層の下方にあるため、チャネル全体が大気圧に曝露され(特定の実施形態では、独立した複数の片としてよりも1つの層として上記膜を製造する方が容易であるため、上記膜は上記カード全体に広がるものの、チャネル層の下側でのみ機能する);
増幅が、消耗品内に完全に包含され(開放管などではなく);及び/又は
検出が、プライマセットではなくプローブセットに基づくものである(新しい試験の構築が容易である)、
前述又は後述の請求項のシステム。
固定されたプローブが、上記配列を、その空間的配置によって定義し;
増幅が、分析される配列の数より少ない多数のプライマ対によって、実施され;
別個の核酸配列が、複数の種/生物のものであり;
PCRモジュールが、金属(例えばアルミニウム)製PCR反応チャンバを備え;
マイクロ流体接続が、気泡除去のために構成された通気膜を備え、上記通気膜はチャネル層の下方にあるため、チャネル全体が大気圧に曝露され(特定の実施形態では、独立した複数の片としてよりも1つの層として上記膜を製造する方が容易であるため、上記膜は上記カード全体に広がるものの、チャネル層の下側でのみ機能する);
増幅が、消耗品内に完全に包含され(開放管などではなく);及び/又は
検出が、プライマセットではなくプローブセットに基づくものである(新しい試験の構築が容易である)、
前述又は後述の請求項のシステム。
7.単一の容器において増幅を実施し(試料区分がなく);
血液、唾液、GI試料、尿、創傷用綿棒、脊髄穿剌、鼻腔用綿棒、獣医及び農業ソースの分析物試料を受容して処理し;
検体収集ツール若しくは搬送媒体を介して試料を受容し;
1〜100μlの試料体積を処理し;
モジュール式であり(モジュールを交換することによって異なる用途をサポートでき);
(チャネル寸法及び気泡除去によって行われる)計量が可能であり;並びに/又は
一方向性及び自己封止型である(試料の相互汚染を防止する)
ように構成された、前述又は後述の請求項のシステム。
血液、唾液、GI試料、尿、創傷用綿棒、脊髄穿剌、鼻腔用綿棒、獣医及び農業ソースの分析物試料を受容して処理し;
検体収集ツール若しくは搬送媒体を介して試料を受容し;
1〜100μlの試料体積を処理し;
モジュール式であり(モジュールを交換することによって異なる用途をサポートでき);
(チャネル寸法及び気泡除去によって行われる)計量が可能であり;並びに/又は
一方向性及び自己封止型である(試料の相互汚染を防止する)
ように構成された、前述又は後述の請求項のシステム。
8.モジュールを備える統合型マイクロ流体カードと、ハウジング(ボックス)及び上記ハウジング内でカードを受容するように構成されたソケットを備えるアナライザとを備える、システムであって、ここで上記アナライザは:
上記カードと連動して、溶解、精製、PCT(増幅及び標識化)、並びに検出を実施し;
圧力(例えば試料搬送)、磁場(例えば試料混合)、温度(例えば、増幅、ストリンジェンシー、ハイブリダイゼーション)、及び/若しくは光(例えばハイブリダイゼーション検出)によって試料と相互作用し;並びに/又は
リアルタイムでハイブリダイゼーションを観察するためにエバネッセント波を試料と結合させること、並びに/若しくは配列情報をもたらす反応速度及び起こり得る塩基対不適合を決定することによって、検出を実施する、前述又は後述の請求項のシステム。
上記カードと連動して、溶解、精製、PCT(増幅及び標識化)、並びに検出を実施し;
圧力(例えば試料搬送)、磁場(例えば試料混合)、温度(例えば、増幅、ストリンジェンシー、ハイブリダイゼーション)、及び/若しくは光(例えばハイブリダイゼーション検出)によって試料と相互作用し;並びに/又は
リアルタイムでハイブリダイゼーションを観察するためにエバネッセント波を試料と結合させること、並びに/若しくは配列情報をもたらす反応速度及び起こり得る塩基対不適合を決定することによって、検出を実施する、前述又は後述の請求項のシステム。
9.モジュールを備える統合型マイクロ流体カード(カートリッジ)を備えるシステムを提供し、ここでカードは:
疾患タイプ(例えば、呼吸器疾患)に固有であり;
患者タイプ(例えば、小児)に固有であり;
病原体タイプ(例えば、生物兵器剤)に固有であり;
個体(例えば、薬理ゲノム学)に固有であり;
患者固有の情報のためにユニーク識別子を含有し;
無菌性を維持して相互汚染を最小化するために、単回使用用であり;
ロールツーロール製造ステップを使用して生産され;並びに/又は、
ポリカーボネートシャーシ、金属箔PCRチャンバ、アクリル構成要素、通気膜材料、及び/若しくはポリウレタンシールから生産される
ように構成される、前述又は後述の請求項のシステム。
疾患タイプ(例えば、呼吸器疾患)に固有であり;
患者タイプ(例えば、小児)に固有であり;
病原体タイプ(例えば、生物兵器剤)に固有であり;
個体(例えば、薬理ゲノム学)に固有であり;
患者固有の情報のためにユニーク識別子を含有し;
無菌性を維持して相互汚染を最小化するために、単回使用用であり;
ロールツーロール製造ステップを使用して生産され;並びに/又は、
ポリカーボネートシャーシ、金属箔PCRチャンバ、アクリル構成要素、通気膜材料、及び/若しくはポリウレタンシールから生産される
ように構成される、前述又は後述の請求項のシステム。
10.粒子又は細胞整列のための流体力学的集束及び/又は慣性集束を提供するように構成され、分取のために構成されたマイクロスケール電気活性ポリマー(EAP)アクチュエータを備える、蛍光活性化細胞分取器(FACS)などのマイクロ流体粒子分取器と、機能的に統合された、前述の請求項のシステム。
11.前述の請求項のシステムを使用して、複数の配列増幅及び同時マイクロアレイハイブリダイゼーション読み出しによって並行して別個の分析物核酸配列を検出することを含む、方法。
追加的な実施形態及びその実施例の詳細な説明:
新規のポイントオブケア用、携帯型、かつ高統合型の用途のための高性能蛍光活性化分取(FACS)。
最高級の市販のFACS機器は、帯電液滴内に含有される細胞を静電的に検出することによって、10,000から40,000種類/秒の分取速度を達成する[1、2]。それらは、応範囲の用途、例えば、免疫治療のための癌−標的T細胞の単離、組織工学のための幹細胞の富化、及び操作又は更なる分析のための所定の細胞の分離(例えば、DNA配列決定、RNA発現、及び蛍光in situハイブリダイゼーション)に適用され得る。しかしながら、それらは、専門のオペレータを必要とする大きい高価な機器であり、従って、ポイントオブケア用又は携帯型の用途に好適ではない。加えて、それらのモノリシック性は、他の機器又は工程と容易に統合できないことを意味する。
新規のポイントオブケア用、携帯型、かつ高統合型の用途のための高性能蛍光活性化分取(FACS)。
最高級の市販のFACS機器は、帯電液滴内に含有される細胞を静電的に検出することによって、10,000から40,000種類/秒の分取速度を達成する[1、2]。それらは、応範囲の用途、例えば、免疫治療のための癌−標的T細胞の単離、組織工学のための幹細胞の富化、及び操作又は更なる分析のための所定の細胞の分離(例えば、DNA配列決定、RNA発現、及び蛍光in situハイブリダイゼーション)に適用され得る。しかしながら、それらは、専門のオペレータを必要とする大きい高価な機器であり、従って、ポイントオブケア用又は携帯型の用途に好適ではない。加えて、それらのモノリシック性は、他の機器又は工程と容易に統合できないことを意味する。
これらの制限に対処しようとして、研究者たちは、多くの種類のマイクロ流体FACSを開発した。最近まで、これらのデバイスは遅く(従来のFACSより桁違いに遅く)、ほとんどは、成型が困難で又は製造及び実際の適用に不適当であった。パルスレーザ活性化細胞分取(PLACS)の開発により、現行のマイクロ流体技術は、高純度で〜10,000細胞/秒へと増加した[3]。PLACSでは、細胞は、プラズマ泡を迅速に拡大及び縮小させることによって生成される流体噴射を使用して分取される。流体デバイスは単純であり、安価であり、かつ使い捨てであるが、システムは高反復速度パルスレーザを必要とし、パルスレーザは高価で大きい。従って、PLACSは、スケール及び費用の難問に対処することに失敗する。
我々は、電気刺激に応答して形状を変化させるポリマーであるEAPに基づいた流体操作への単純なアプローチを開示する。それらは、チャネルの断面の幾何学的形状を変化させるために、マイクロ流体デバイスにおいて使用され、電気泳動分離のための小さな注入を発生させ[4]、チャネルの流体抵抗を修正して遮断物を清浄にした[5]。我々は、新規な高性能マイクロ流体EAP(μEAP)アクチュエータを開発して、マイクロFACS内に統合した。
電気活性ポリマー操作:我々の流体アクチュエータは、1つ又は複数の表面がEAPを備える行き止まり流体チャンバを備える。一実施態様では、チャンバの床は、誘電性エラストマ(シリコーン)の薄い(〜12μm)EAP層で覆われた電極である。概念的には、シリコーンは、可撓性コンデンサのように機能する。電圧が電極に印加されるときに、それは歪み、チャンバ体積を増加させてチャンバ内に流体を引き込む。電圧が解放されるときに、シリコーンは緩み、チャンバから流体を押し出す。
EAPアクチュエータは、実証済みのマイクロスケール製造技術を使用して、容易に成型される。アクチュエータを作り出すために、我々は、ベース基板になるインジウムスズ酸化物被覆されたスライド上へ電極をパターン化する。我々は、次いで、スライド上へ未硬化シリコーンの層をスピンさせて、それを熱硬化させる。チャネル層を作り出すために、我々は、従来のソフトリソグラフィを使用してマイクロ流体チャネルを成形する。我々は、次いで、チャネル層を整列しシリコーン被覆されたスライドにプラズマボンディングすることによって、デバイスを完成させる。ソフトリソグラフィによるアクチュエータの互換性は、アクチュエータをマイクロ流体デバイスの大きな既存のライブラリ内に容易に統合できることを意味する。これはまた、迅速な試作を可能にする。デバイスは、操作のための電圧源しか必要としないため安価であり、成型アプローチは低コスト製造が容易である。
特定の実例において、我々は、10μsの応答時間を実証するアクチュエータ<1mm2を成型した。しかしながら、アクチュエータサイズはまた、ミクロンスケール(例えば1、10、又は100μm2未満)であり、応答時間は、より短い10、1、0.1μs未満であり得る。これらのサイズオプションは、ハンドヘルド型及び統合型の両方の用途に特に適しており、また並列動作の増加にも適している。
これらの例示的なEAPアクチュエータの迅速な応答速度(<20μs)はまた、それらが>25,000細胞/秒の分取速度であることを示す。デバイスは、操作のための電圧源しか必要とせず、低コストマイクロ成型技術を使用して構築されるため、安価である。ポリマーとしてのシリコーンの使用は、ソフトリソグラフィによるマイクロ流体チャネルとのEAPアクチュエータの単純な統合を可能にする。これにより、迅速な試作、及び製造量までのスケールアップが可能となる。EAPμFACSは、手持ちフォーマットの卓上FACSにスループット等価物を送達する。
我々は、EAPμFACSの性能を最適化し、iMFCシステムと統合された細胞濃縮/分取モジュールに改善されたデバイスを組み込む。モジュールは、大きな体積中の希釈細胞濃度(例えば、ml当たり数細胞で環境試料に存在する細菌)を濃縮することによって、又は多くの細胞の背景から選択された細胞(例えば、末梢血単核細胞の集団から活性T細胞)を分取することによって、システムが、動作エンベロープを増加させることを可能にする。マイクロ分取器の実施形態は、更に、下で説明される。
分取器設計:分取器は、3つのキーとなる機能:整列、検出、及び分取を行う。我々の設計(例えば図9)は、整列のための流体力学的及び慣性集束の組み合わせ、並びに迅速な分取のためのEAP操作の使用を含む、複数の革新を組み込む。従来の細胞分取器では、粒子又は細胞は、タイトな線の試料流を挟む同軸のシース流を使用して、水平かつ垂直に集束される。大部分のマイクロ流体デバイスは平らであるので、一方向(すなわち水平)に粒子を集束させることができるだけであり;多層デバイスは、その上縦又は横に粒子を集束させることができるが、製造が著しく複雑である。垂直集束がないと、粒子は、チャネルの高さにわたって分布し、速度及び重なりの変動をもたらす。我々の設計では、流体力学的集束によって交差領域において水平に、また慣性集束によって長い「ネック」において垂直に整列する。流体速度が粒子に上揚力を発生させるほど十分に高いときに、慣性集束は行われる[6]。組み合わせによって、我々は、我々の単純な製造アプローチを保つ単層デバイスにおいて効果的に粒子を整列させることができる。
分取のために、我々は、最初に、蛍光を使用して粒子を検出し、標的粒子が検出されるとすぐに、電圧パルスが1つ又は複数のEAPアクチュエータに印加される。アクチュエータは、図9に示されるように、分取出口に至る新しい流線上へ標的粒子を偏らせる過渡的な交差流を生成する。
図9は、μEAP FACSのチャネルレイアウトを概略的に示した(a)EAPマイクロ分取器を図示する。挿入画像は、チャネルの主要な機能を示す。水平整列は、流体力学的集束(左)によって達成され、垂直整列は、慣性集束(中央)によって達成される。最後に、標的粒子が、μEAPアクチュエータ(右)によって分取される。長期露出画像は、分取されない及び分取された粒子からの筋を示す。流速は、8μl/分(107mm/秒)で、操作パルスは400Vで1msであった。
180°異なる位相で動作する対アクチュエータの使用は、流体に印加される力を2倍にして、チャネル長と比例する流体抵抗を低減させることによって、性能を著しく改善する。2つのアクチュエータでは、一方が流体を「引き」他方が流体を「押して」、流体は、アクチュエータの間の短い距離に沿ってのみ変位する(典型的に〜2mm)。これに対して、単一のアクチュエータでは、流体変位は、アクチュエータからデバイス出口まで行われる(〜30mm)。
我々のμFACSデバイスを試験するために、我々は、検出及び制御システムを使用し、システムは、落射蛍光顕微鏡、電荷結合デバイス(CCD)カメラ、光電子倍増管、フィールド−プログラム可能ゲートアレイ(FPGA)ベースデータ取得システム、及び電圧増幅器からなる。
初期粒子分離の実証:μEAP分取器の分離能力を実証するために、我々は、緑色蛍光信号をゲートオンして、620V、500μsパルスをEAPアクチュエータに印加することによって、緑色(7μm)及び赤色(5μm)蛍光粒子の混合物を分取した。流体流速は10μl/分であり、結果として133mm/秒の平均線速度となった。分取されない細胞は、廃棄チャネルへのそれらのデフォルト通路を辿り、分取された細胞は、分取チャネルを通って出る流線に偏った(図10)。我々は、分取不能及び分取可能の両方のチャネル出口から10μlの流体体積を捕捉した。体積は、別個の手動血球計算器において撮像された。血球計算器の結果に基づいて、我々は、100%の純度及び93%の収率を算定した。
アクチュエータ性能最適化:我々の概念の初期の証明の後、我々は、分取スループットを改善するために、EAP流体アクチュエータの設計研究を開始した。我々は、COMSOL Multiphysicsを使用してアクチュエータの簡易電気機械モデルを開発した。我々の結果は、大部分の操作がデバイスの周辺で行われることを示した。これらの結果に基づいて、我々は、様々なアクチュエータ設計を開発して、それらの性能を経験的に試験した。印加される電圧を増加させて、アクチュエータの幾何学的形状を修正することによって、我々は、EAPアクチュエータの性能を改善することが可能であった。我々は、25μs、800Vパルス、30μl/分(400mm/秒)の流速で、我々の初期粒子分離の実証において使用された分取器よりも20倍改善して、粒子の分取に成功した。
細胞分取の実証:μEAP FACS内での細胞分離を実証するために、我々は、蛍光標識されたB細胞を有するマウスリンパ球の試料を調製した。白血球は、遠心分離によって分離されて、次いでフィコエリスリン抱合型B220抗体で標識化する前に固定された。試料が、FACSに投入された。図11は、分取されたB細胞の画像である。分取は、100μs、800Vパルス、11μl/分(147mm/秒)で行われた。蛍光筋が中央で最も明るいことに留意されたい。標識化された細胞が蛍光粒子より著しく暗いので、我々は、検出領域の細胞を照射するために、488nmダイオードレーザを使用し、減光発光ダイオード(LED)ランプが全視野照射を提供した。右の明るいスポットは、汚染フィラメントによって壁に取り残された細胞である。
多分取器の統合:直接成型及びソフトリソグラフィによる互換性のため、μEAP分取器は、より複雑なデバイスに容易に統合できる。我々のEAPアクチュエータの統合能力を示すために、我々は、複数の独立した分取器を特性とする追加的なデバイスを開発した。図12は、二重チャネルデバイスにおける並列分取を示し、長期露出は、並列チャネルにおいて独立して分取される2つの粒子を示し、図13は、複数の出口への二重段階連続分取を示し、長期露出は、2つの連続分取器によって3つのホッパのうちの1つに分取される2つの粒子を示す。注:ホッパ3は、デフォルト(分取されない)ホッパであった。高次複数チャネル並列及び多段階連続分取構成は、類似して構成される。
我々のマイクロ流体蛍光活性化細胞分取器(μFACS)は、粒子を分取するために必要なすべての機能:粒子の整列、粒子の蛍光信号の検出、蛍光に基づいた分取決定、続く適切な分取、を提供する。実証された能力としては:20μsと低い複数のアクチュエータパルス長での粒子分取;複数の及び単一のアクチュエータ構成を有する分取;複数のチャネル分取器における独立した並列分取;多段階分取器における順次分取;が挙げられ、マイクロ電気活性ポリマー(μEAP)分取器の恩恵としては:(a)分取が、単一の電気入力によって迅速にトリガされること(20μ秒の分取が実証された);(b)μEAPアクチュエータが、様々なマイクロ成型技術と互換性を持つこと;及び、(c)μEAP分取器が容易に統合され。並列可能で、携帯型スケールデバイスに適していること、が挙げられる。
参考文献
[1]H. M. Shapiro, Practical Flow Cytometry, John Wiley & Sons, 2003.
[2] M. E. Piyasena and S. W. Graves, “The intersection of flow cytometry with microfluidics and microfabrication,” Lab on a Chip, 14, 1044-1059, 2014.
[3] Y. Chen, T.-H. Wu, Y.-C. Kung, M. A. Teitell, and P.-Y. Chiou, “3D pulsed laser-triggered high-speed microfluidic fluorescence-activated cell sorter,” Analyst, 138, 7308-7315, 2013.
[4] A. K. Price, K. M. Anderson, and C. T. Culberson, “Demonstration of an integrated electroactive polymer actuator on a microfluidic electrophoresis device,” Lab on a Chip, 9, 2076-2084, 2009.
[5] C. Murray, D. McCoul, E. Sollier, T. Ruggiero, X. Niu, Q. Pei, D. Di Carlo, “Electro-adaptive microfluidics for active tuning of channel geometry using polymer actuators,” Microfluidics and Nanofluidics, 14, 345-358, 2013.
[6] D. Di Carlo, D. Irimia, R.G. Tompkins, and M. Toner, “Continuous inertial focusing, ordering, and separation of particles in microchannels,” Proceedings of the National Academy of Sciences, 104, 18892-18897, 2007.
[1]H. M. Shapiro, Practical Flow Cytometry, John Wiley & Sons, 2003.
[2] M. E. Piyasena and S. W. Graves, “The intersection of flow cytometry with microfluidics and microfabrication,” Lab on a Chip, 14, 1044-1059, 2014.
[3] Y. Chen, T.-H. Wu, Y.-C. Kung, M. A. Teitell, and P.-Y. Chiou, “3D pulsed laser-triggered high-speed microfluidic fluorescence-activated cell sorter,” Analyst, 138, 7308-7315, 2013.
[4] A. K. Price, K. M. Anderson, and C. T. Culberson, “Demonstration of an integrated electroactive polymer actuator on a microfluidic electrophoresis device,” Lab on a Chip, 9, 2076-2084, 2009.
[5] C. Murray, D. McCoul, E. Sollier, T. Ruggiero, X. Niu, Q. Pei, D. Di Carlo, “Electro-adaptive microfluidics for active tuning of channel geometry using polymer actuators,” Microfluidics and Nanofluidics, 14, 345-358, 2013.
[6] D. Di Carlo, D. Irimia, R.G. Tompkins, and M. Toner, “Continuous inertial focusing, ordering, and separation of particles in microchannels,” Proceedings of the National Academy of Sciences, 104, 18892-18897, 2007.
我々の請求項に係る発明の実施形態としては、以下が挙げられる:
1.流路周辺に構成された高性能マイクロ流体電気活性ポリマー(μEAP)アクチュエータであって、ここで、上記アクチュエータに印加される電圧パルスは、流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、上記流路を横切って生成するように、上記アクチュエータを誘導し、上記アクチュエータは行き止まり流体チャンバを備え、上記チャンバの1つ又は複数の表面は誘電性エラストマのEAP層で覆われた電極を備える、アクチュエータ。
2.流路周辺に互いに異なる位相で構成された、請求項1の複数のアクチュエータであって、ここで上記アクチュエータに印加される電圧パルスは、流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、流路を横切って生成するように、上記アクチュエータを誘導し、各アクチュエータは行き止まり流体チャンバを備え、上記チャンバの表面は誘電性エラストマのEAP層で覆われた電極を備える、請求項1の複数のアクチュエータ。
3.流路周辺に互いに180°異なる位相で構成された、請求項1の一対のアクチュエータであって、ここで上記アクチュエータに印加される電圧パルスは、流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、流路を横切って生成するように、上記アクチュエータを誘導し、各アクチュエータは行き止まり流体チャンバを備え、上記チャンバの表面は誘電性エラストマのEAP層で覆われた電極を備える、請求項1の一対のアクチュエータ。
4.上記チャンバ(単数又は複数)の複数の表面は、誘電性エラストマのEAP層で覆われた電極を備える、前述又は後述の請求項のアクチュエータ(単数又は複数)。
5.上記流路は、粒子の水平整列のための流体力学的集束と垂直整列のための慣性集束との組み合わせを提供するように構成される、前述又は後述の請求項のアクチュエータ(単数又は複数)。
6.上記新しい流線は、分取出口に至る、前述又は後述の請求項のアクチュエータ(単数又は複数)。
7.上記流路は、試料投入チャネルと、分取済み及び未分取排出チャネルとを備え、上記新しい流線は、上記分取済み排出チャネルに至る、前述又は後述の請求項のアクチュエータ(単数又は複数)。
8.上記流路は、蛍光検出のために構成され、標的粒子が検出されるとすぐに、電圧パルスが、μEAPアクチュエータに印加される、前述又は後述の請求項のアクチュエータ(単数又は複数)。
9.上記EAP層は、厚さ1〜50(若しくは2〜25、若しくは5〜15μm)である、前述又は後述の請求項のアクチュエータ(単数又は複数)。
10.上記エラストマは、シリコーンである、前述又は後述の請求項のアクチュエータ(単数又は複数)。
11.多チャネルデバイスにおいて並列分取を提供するように構成された、前述又は後述の請求項のアクチュエータ(単数又は複数)。
12.複数の出口への多段階連続分取を提供するように構成された、前述又は後述の請求項のアクチュエータ(単数又は複数)。
13.標識活性化粒子分取器において機能的に統合された、前述の請求項のアクチュエータ(単数又は複数)。
14.流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、流路を横切って生成するように、新しい流線上へアクチュエータ(単数又は複数)を誘導するために、電圧パルスを印加するステップを含む、前述の請求項のアクチュエータ(単数又は複数)を使用する方法。
本発明は、詳述された特定の及び好ましい実施形態のすべての組み合わせを包含する。本明細書に記載の例及び実施形態は例示目的にすぎず、これらに関する種々の修正又は変更が当業者に提案され、本出願の趣旨及び範囲、並びに添付の特許請求の範囲内に含まれることになることが理解される。本明細書中の引用文献を含む、本明細書において引用されるすべての刊行物、特許及び特許出願は、あらゆる目的のためにその全体が参照により本明細書に援用される。
Claims (14)
- 流路周辺に構成された高性能マイクロ流体電気活性ポリマー(μEAP)アクチュエータであって、
前記アクチュエータに印加される電圧パルスは、前記流路内の前記標的粒子を新しい流線上へ偏らせる過渡的な交差流を、前記流路を横切って生成するように、前記アクチュエータを誘導し、
前記アクチュエータは行き止まり流体チャンバを備え、
前記チャンバの1つ又は複数の表面は誘電性エラストマのEAP層で覆われた電極を備える、アクチュエータ。 - 前記流路周辺に互いに異なる位相で構成された、請求項1に記載の複数のアクチュエータであって、
前記アクチュエータに印加される電圧パルスは、前記流路内の前記標的粒子を新しい流線上へ偏らせる過渡的な交差流を、前記流路を横切って生成するように、前記アクチュエータを誘導し、
各前記アクチュエータは行き止まり流体チャンバを備え、
前記チャンバの表面は誘電性エラストマのEAP層で覆われた電極を備える、請求項1に記載の複数のアクチュエータ。 - 前記流路周辺に互いに180°異なる位相で構成された、請求項1に記載の一対のアクチュエータであって、
前記アクチュエータに印加される電圧パルスは、前記流路内の前記標的粒子を新しい流線上へ偏らせる過渡的な交差流を、前記流路を横切って生成するように、前記アクチュエータを誘導し、
各前記アクチュエータは行き止まり流体チャンバを備え、
前記チャンバの表面は誘電性エラストマのEAP層で覆われた電極を備える、請求項1に記載の一対のアクチュエータ。 - 前記チャンバ(単数又は複数)の複数の表面は、誘電性エラストマのEAP層で覆われた電極を備える、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。
- 前記流路は、粒子の水平整列のための流体力学的集束と垂直整列のための慣性集束との組み合わせを提供するように構成される、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。
- 前記新しい流線は、分取出口に至る、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。
- 前記流路は、試料投入チャネルと、分取済み及び未分取排出チャネルとを備え、
前記新しい流線は、前記分取済み排出チャネルに至る、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。 - 前記流路は、蛍光検出のために構成され、
前記標的粒子が検出されるとすぐに、電圧パルスが、μEAPアクチュエータに印加される、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。 - 前記EAP層は、厚さ1〜50(若しくは2〜25、若しくは5〜15μm)である、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。
- 前記エラストマは、シリコーンである、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。
- 多チャネルデバイスにおいて並列分取を提供するように構成された、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。
- 複数の出口への多段階連続分取を提供するように構成された、前述又は後述の請求項に記載のアクチュエータ(単数又は複数)。
- 標識活性化粒子又は細胞分取器において機能的に統合された、前述の請求項に記載のアクチュエータ(単数又は複数)。
- 流路内の標的粒子を新しい流線上へ偏らせる過渡的な交差流を、前記流路を横切って生成するように、新しい流線上へアクチュエータ(単数又は複数)を誘導するために、電圧パルスを印加するステップを含む、前述の請求項に記載のアクチュエータ(単数又は複数)を使用する方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461979377P | 2014-04-14 | 2014-04-14 | |
| US61/979,377 | 2014-04-14 | ||
| US201462041430P | 2014-08-25 | 2014-08-25 | |
| US62/041,430 | 2014-08-25 | ||
| US201462081525P | 2014-11-18 | 2014-11-18 | |
| US62/081,525 | 2014-11-18 | ||
| PCT/US2015/025836 WO2015160864A1 (en) | 2014-04-14 | 2015-04-14 | Portable nucleic acid analysis system and high-performance microfluidic electroactive polymer actuators |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2017514438A true JP2017514438A (ja) | 2017-06-01 |
Family
ID=54324515
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016562512A Pending JP2017519485A (ja) | 2014-04-14 | 2015-04-14 | 携帯型核酸分析システム及び高性能マイクロ流体電気活性ポリマーアクチュエータ |
| JP2016562513A Pending JP2017514438A (ja) | 2014-04-14 | 2015-04-14 | 携帯型核酸分析システム及び高性能マイクロ流体電気活性ポリマーアクチュエータ |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016562512A Pending JP2017519485A (ja) | 2014-04-14 | 2015-04-14 | 携帯型核酸分析システム及び高性能マイクロ流体電気活性ポリマーアクチュエータ |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US20170058324A1 (ja) |
| EP (2) | EP3132069A4 (ja) |
| JP (2) | JP2017519485A (ja) |
| KR (2) | KR20230031971A (ja) |
| CN (1) | CN106460233A (ja) |
| AU (1) | AU2015247747A1 (ja) |
| ES (1) | ES2891303T3 (ja) |
| SG (1) | SG11201608600YA (ja) |
| WO (2) | WO2015160863A1 (ja) |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10195610B2 (en) | 2014-03-10 | 2019-02-05 | Click Diagnostics, Inc. | Cartridge-based thermocycler |
| PE20170757A1 (es) | 2014-10-13 | 2017-07-04 | Tri Alpha Energy Inc | Sistemas y metodos para fusionar y comprimir toroides compactos |
| AU2015373998A1 (en) | 2014-12-31 | 2017-06-29 | Visby Medical, Inc. | Devices and methods for molecular diagnostic testing |
| USD771834S1 (en) * | 2015-04-28 | 2016-11-15 | University Of British Columbia | Microfluidic cartridge |
| US10214772B2 (en) | 2015-06-22 | 2019-02-26 | Fluxergy, Llc | Test card for assay and method of manufacturing same |
| WO2016209734A1 (en) | 2015-06-22 | 2016-12-29 | Fluxergy, Llc | Device for analyzing a fluid sample and use of test card with same |
| US10519493B2 (en) | 2015-06-22 | 2019-12-31 | Fluxergy, Llc | Apparatus and method for image analysis of a fluid sample undergoing a polymerase chain reaction (PCR) |
| CN105567676B (zh) * | 2016-02-01 | 2018-06-26 | 博奥生物集团有限公司 | 一种核酸提取方法及其专用试剂盒 |
| EP3433017A4 (en) * | 2016-03-25 | 2020-01-01 | Bioceryx Inc. | APPARATUSES AND METHODS FOR EVALUATING NUMBERS OF TARGET SEQUENCES |
| US10987674B2 (en) | 2016-04-22 | 2021-04-27 | Visby Medical, Inc. | Printed circuit board heater for an amplification module |
| WO2017197040A1 (en) | 2016-05-11 | 2017-11-16 | Click Diagnostics, Inc. | Devices and methods for nucleic acid extraction |
| EP3478857A1 (en) | 2016-06-29 | 2019-05-08 | Click Diagnostics, Inc. | Devices and methods for the detection of molecules using a flow cell |
| JP2019162035A (ja) * | 2016-07-29 | 2019-09-26 | 富士フイルム株式会社 | 細胞処理装置 |
| SG10202103252VA (en) * | 2016-09-30 | 2021-05-28 | Tel Array Diagnostics Inc | Microfluidic device |
| EP3338889A1 (en) * | 2016-12-23 | 2018-06-27 | IMEC vzw | Combined extraction and pcr systems |
| CN107603866B (zh) * | 2017-08-07 | 2020-06-16 | 南京岚煜生物科技有限公司 | 检测10种呼吸道感染病原体的微流控芯片试剂盒及其使用方法 |
| CN107502544B (zh) * | 2017-09-20 | 2023-12-15 | 杭州梓晶生物有限公司 | 一种微流控芯片检测控制系统 |
| CN111655866A (zh) | 2017-11-09 | 2020-09-11 | 维斯比医学公司 | 便携式分子诊断装置和检测靶病毒的方法 |
| EP3658841B1 (en) | 2017-11-22 | 2024-03-27 | Hewlett-Packard Development Company, L.P. | Temperature-controlling microfluidic devices |
| WO2019133756A1 (en) | 2017-12-29 | 2019-07-04 | Clear Labs, Inc. | Automated priming and library loading device |
| WO2019209308A1 (en) | 2018-04-27 | 2019-10-31 | Hewlett-Packard Development Company, L.P. | Thermally controlled reagent release |
| DE102018111834A1 (de) * | 2018-05-16 | 2019-11-21 | Mildendo Gesellschaft für mikrofluidische Systeme mbH | Mikrofluidische Vorrichtung und Verfahren zur Nutzung derselben zur Trennung, Aufreinigung und Konzentration von Komponenten von fluidischen Medien, |
| WO2020014296A1 (en) | 2018-07-12 | 2020-01-16 | Luminex Corporation | Systems and methods for performing variable sample preparation and analysis processes |
| US10307755B1 (en) | 2018-07-19 | 2019-06-04 | Bioceryx Inc. | Apparatuses and methods for sample-specific self-configuration |
| EP3846940A4 (en) | 2018-09-03 | 2022-07-27 | Visby Medical, Inc. | DEVICES AND METHODS FOR TESTING ANTIBIOTIC SUSCEPTIBILITY |
| CN109613288A (zh) * | 2018-12-27 | 2019-04-12 | 宁波大学 | 一种定性/定量生物芯片检测系统 |
| WO2020179053A1 (ja) * | 2019-03-07 | 2020-09-10 | 株式会社日立ハイテク | 温度制御装置用送液カートリッジ |
| CN110257245A (zh) * | 2019-07-16 | 2019-09-20 | 东莞博识生物科技有限公司 | 核酸检测试剂卡 |
| WO2021134511A1 (zh) * | 2019-12-31 | 2021-07-08 | 苏州缔因安生物科技有限公司 | 一种全集成小型化的芯片式数字pcr检测系统及检测方法 |
| US11352675B2 (en) | 2020-01-03 | 2022-06-07 | Visby Medical, Inc. | Devices and methods for antibiotic susceptability testing |
| JP7348094B2 (ja) | 2020-01-29 | 2023-09-20 | 株式会社Jvcケンウッド | 検出装置及びダンパ構造 |
| KR102449073B1 (ko) * | 2020-05-18 | 2022-09-30 | 성균관대학교산학협력단 | TiO2 나노구조 기반 핵산 검출장치 및 롤투롤 공정을 이용한 이의 제조방법 |
| WO2021235797A1 (ko) * | 2020-05-18 | 2021-11-25 | 성균관대학교산학협력단 | Tio2 나노구조 기반 핵산 검출장치 및 롤투롤 공정을 이용한 이의 제조방법 |
| CN114107032A (zh) * | 2021-11-19 | 2022-03-01 | 福州大学 | 平行型光路设计的手持核酸检测微流控装置及其工作方法 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000512744A (ja) * | 1996-05-16 | 2000-09-26 | アフィメトリックス,インコーポレイテッド | 標識材料を検出するシステムおよび方法 |
| WO1998050147A1 (en) * | 1997-05-09 | 1998-11-12 | The Regents Of The University Of California | Peltier-assisted microfabricated reaction chambers for thermal cycling |
| US7537197B2 (en) | 1999-07-20 | 2009-05-26 | Sri International | Electroactive polymer devices for controlling fluid flow |
| EP1611353B1 (en) * | 2003-02-24 | 2012-07-11 | Medipacs, Inc. | Pulse activated actuator pump system |
| WO2005108571A1 (ja) * | 2004-05-07 | 2005-11-17 | Konica Minolta Medical & Graphic, Inc. | 検査用マイクロリアクタおよび遺伝子検査装置ならびに遺伝子検査方法 |
| KR101214780B1 (ko) * | 2004-09-15 | 2012-12-21 | 인터젠엑스 인크. | 미세유동 장치 |
| WO2006127967A2 (en) | 2005-05-25 | 2006-11-30 | Massachusetts Institute Of Technology | Multifocal scanning microscopy systems and methods |
| WO2006132666A1 (en) * | 2005-06-06 | 2006-12-14 | Decision Biomarkers, Inc. | Assays based on liquid flow over arrays |
| US7397232B2 (en) | 2005-10-21 | 2008-07-08 | The University Of Akron | Coulter counter having a plurality of channels |
| WO2007142692A2 (en) * | 2005-11-14 | 2007-12-13 | The Government Of The Usa, As Represented By The Secretary Of The Navy | Automated sample-to-microarray system |
| EP2155393B1 (en) | 2007-04-04 | 2019-09-04 | ANDE Corporation | Systems for rapid multiplexed amplification of target nucleic acids |
| CN102239409A (zh) * | 2008-12-05 | 2011-11-09 | 纳诺维德公司 | 用于及时护理分析仪的基于微流的实验室测试卡 |
| WO2010123820A2 (en) | 2009-04-20 | 2010-10-28 | Kansas State University Research Foundation | Electroactive polymer actuators and their use on microfluidic devices |
| WO2011156845A1 (en) | 2010-06-17 | 2011-12-22 | Geneasys Pty Ltd | Loc device with parallel incubation and parallel dna and rna amplification functionality |
| WO2012020257A1 (en) * | 2010-08-10 | 2012-02-16 | Forensic Science Service Limited | Method and system for analyzing a sample |
| KR20120063162A (ko) * | 2010-12-07 | 2012-06-15 | 삼성전자주식회사 | 유전자 분석 장치 및 이를 이용한 유전자 분석 방법 |
| US10933417B2 (en) * | 2013-03-15 | 2021-03-02 | Nanobiosym, Inc. | Systems and methods for mobile device analysis of nucleic acids and proteins |
| WO2015138696A1 (en) * | 2014-03-13 | 2015-09-17 | Genapsys, Inc. | Microfluidic devices, systems and methods for sample preparation and analysis |
-
2015
- 2015-04-14 WO PCT/US2015/025835 patent/WO2015160863A1/en active Application Filing
- 2015-04-14 JP JP2016562512A patent/JP2017519485A/ja active Pending
- 2015-04-14 US US15/304,033 patent/US20170058324A1/en not_active Abandoned
- 2015-04-14 EP EP15780486.5A patent/EP3132069A4/en not_active Withdrawn
- 2015-04-14 AU AU2015247747A patent/AU2015247747A1/en not_active Abandoned
- 2015-04-14 CN CN201580031953.7A patent/CN106460233A/zh active Pending
- 2015-04-14 KR KR1020237005477A patent/KR20230031971A/ko not_active Ceased
- 2015-04-14 JP JP2016562513A patent/JP2017514438A/ja active Pending
- 2015-04-14 US US15/304,030 patent/US10626453B2/en active Active
- 2015-04-14 EP EP15780660.5A patent/EP3132073B1/en active Active
- 2015-04-14 WO PCT/US2015/025836 patent/WO2015160864A1/en active Application Filing
- 2015-04-14 KR KR1020167031337A patent/KR102502083B1/ko active Active
- 2015-04-14 SG SG11201608600YA patent/SG11201608600YA/en unknown
- 2015-04-14 ES ES15780660T patent/ES2891303T3/es active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2015160863A1 (en) | 2015-10-22 |
| WO2015160864A1 (en) | 2015-10-22 |
| EP3132069A1 (en) | 2017-02-22 |
| ES2891303T3 (es) | 2022-01-27 |
| SG11201608600YA (en) | 2016-11-29 |
| EP3132073A4 (en) | 2017-12-20 |
| KR20230031971A (ko) | 2023-03-07 |
| US20170058324A1 (en) | 2017-03-02 |
| KR102502083B1 (ko) | 2023-02-21 |
| EP3132073A1 (en) | 2017-02-22 |
| WO2015160863A8 (en) | 2016-11-17 |
| KR20160143795A (ko) | 2016-12-14 |
| CN106460233A (zh) | 2017-02-22 |
| AU2015247747A1 (en) | 2016-11-03 |
| EP3132069A4 (en) | 2018-03-21 |
| US10626453B2 (en) | 2020-04-21 |
| JP2017519485A (ja) | 2017-07-20 |
| US20170030859A1 (en) | 2017-02-02 |
| EP3132073B1 (en) | 2021-06-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10626453B2 (en) | Portable nucleic acid analysis system and high-performance microfluidic electroactive polymer actuators | |
| Kong et al. | Lab-on-a-CD: A fully integrated molecular diagnostic system | |
| CN102803147B (zh) | 通用样品准备系统以及在一体化分析系统中的用途 | |
| Zhang et al. | Single-molecule DNA amplification and analysis using microfluidics | |
| US9752185B2 (en) | Microfluidic devices | |
| Eicher et al. | Microfluidic devices for diagnostic applications | |
| US10933417B2 (en) | Systems and methods for mobile device analysis of nucleic acids and proteins | |
| US8431340B2 (en) | Methods for processing and analyzing nucleic acid samples | |
| US8338166B2 (en) | Sorting, amplification, detection, and identification of nucleic acid subsequences in a complex mixture | |
| US20120077260A1 (en) | Reservoir-buffered mixers and remote valve switching for microfluidic devices | |
| Lien et al. | A microfluidic-based system using reverse transcription polymerase chain reactions for rapid detection of aquaculture diseases | |
| US20230234050A1 (en) | Microfluidic chip and system | |
| Mondal et al. | Microfluidics application for detection of biological warfare agents | |
| CN116536147A (zh) | Pcr检测设备 | |
| Xu | Microfluidic devices for gene preparation and detection |