ES2753777T3 - Compuestos novedosos de sulfonimidoilpurinona y derivados para el tratamiento y la profilaxis de infecciones víricas - Google Patents
Compuestos novedosos de sulfonimidoilpurinona y derivados para el tratamiento y la profilaxis de infecciones víricas Download PDFInfo
- Publication number
- ES2753777T3 ES2753777T3 ES16720421T ES16720421T ES2753777T3 ES 2753777 T3 ES2753777 T3 ES 2753777T3 ES 16720421 T ES16720421 T ES 16720421T ES 16720421 T ES16720421 T ES 16720421T ES 2753777 T3 ES2753777 T3 ES 2753777T3
- Authority
- ES
- Spain
- Prior art keywords
- purin
- methyl
- amino
- compound
- propylsulfonimidoyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 748
- 238000011282 treatment Methods 0.000 title claims description 36
- 238000011321 prophylaxis Methods 0.000 title claims description 5
- 208000036142 Viral infection Diseases 0.000 title description 10
- 230000009385 viral infection Effects 0.000 title description 10
- -1 haloC1-6alkyl Chemical group 0.000 claims abstract description 227
- 150000003839 salts Chemical class 0.000 claims abstract description 59
- 125000003884 phenylalkyl group Chemical group 0.000 claims abstract description 19
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 13
- 150000002367 halogens Chemical class 0.000 claims abstract description 13
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims abstract description 11
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 claims abstract description 11
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims abstract description 10
- 125000001424 substituent group Chemical group 0.000 claims abstract description 10
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims abstract description 7
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 claims abstract description 5
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 claims abstract description 4
- 238000002360 preparation method Methods 0.000 claims description 290
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 247
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 claims description 56
- 125000000217 alkyl group Chemical group 0.000 claims description 52
- 238000006243 chemical reaction Methods 0.000 claims description 33
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 claims description 26
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 26
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 22
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 claims description 20
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 18
- 208000015181 infectious disease Diseases 0.000 claims description 16
- 239000003153 chemical reaction reagent Substances 0.000 claims description 14
- 238000007866 imination reaction Methods 0.000 claims description 13
- 238000000034 method Methods 0.000 claims description 13
- 125000004803 chlorobenzyl group Chemical group 0.000 claims description 11
- KFDGFNQIYSAVAY-UHFFFAOYSA-N 6-amino-9-benzyl-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=CC=C1)=O KFDGFNQIYSAVAY-UHFFFAOYSA-N 0.000 claims description 10
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 10
- 125000006178 methyl benzyl group Chemical group 0.000 claims description 10
- 239000008194 pharmaceutical composition Substances 0.000 claims description 10
- BRSQFEYCEJEYCJ-UHFFFAOYSA-N 6-amino-2-(ethylsulfonimidoyl)-9-[(4-methylphenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CC)CC1=CC=C(C=C1)C)=O BRSQFEYCEJEYCJ-UHFFFAOYSA-N 0.000 claims description 9
- 125000004183 alkoxy alkyl group Chemical group 0.000 claims description 9
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 claims description 9
- 229910052739 hydrogen Inorganic materials 0.000 claims description 9
- UTHROXJUYVNHHL-DEOSSOPVSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-(ethylsulfonimidoyl)-7H-purin-8-one Chemical compound CC[S@](=N)(=O)C1=NC(N)=C2NC(=O)N(CC3=CC=C(Cl)C=C3)C2=N1 UTHROXJUYVNHHL-DEOSSOPVSA-N 0.000 claims description 8
- 125000003545 alkoxy group Chemical group 0.000 claims description 8
- 239000007800 oxidant agent Substances 0.000 claims description 8
- 230000001590 oxidative effect Effects 0.000 claims description 8
- 125000004175 fluorobenzyl group Chemical group 0.000 claims description 7
- 125000001188 haloalkyl group Chemical group 0.000 claims description 7
- 125000004205 trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 claims description 7
- LUXRVHGJZAYSCL-UHFFFAOYSA-N 4-[[6-amino-8-oxo-2-(propylsulfonimidoyl)-7H-purin-9-yl]methyl]benzoic acid Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C(=O)O)C=C1)=O LUXRVHGJZAYSCL-UHFFFAOYSA-N 0.000 claims description 6
- GVKDJOFFPHLPOW-UHFFFAOYSA-N 6-amino-9-[(4-bromophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C=C1)Br)=O GVKDJOFFPHLPOW-UHFFFAOYSA-N 0.000 claims description 6
- WLAWDJREXFPHPH-VWLOTQADSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound C(C1=CC=C(Cl)C=C1)N1C2=C(C(=NC([S@](=O)(=N)CCC)=N2)N)NC1=O WLAWDJREXFPHPH-VWLOTQADSA-N 0.000 claims description 6
- YXFJJQUVGAPZKB-UHFFFAOYSA-N 6-amino-9-[(4-methylphenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C=C1)C)=O YXFJJQUVGAPZKB-UHFFFAOYSA-N 0.000 claims description 6
- OMOVBYAITFNLQV-UHFFFAOYSA-N 6-amino-9-[(6-chloropyridin-3-yl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=NC(=CC=1)Cl)=O OMOVBYAITFNLQV-UHFFFAOYSA-N 0.000 claims description 6
- BQGJLGCRAYYVSZ-UHFFFAOYSA-N 6-amino-9-[(6-methylpyridin-3-yl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=NC(=CC=1)C)=O BQGJLGCRAYYVSZ-UHFFFAOYSA-N 0.000 claims description 6
- GJZZDPHTUXZRDP-UHFFFAOYSA-N 6-amino-9-benzyl-2-(methylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)C)CC1=CC=CC=C1)=O GJZZDPHTUXZRDP-UHFFFAOYSA-N 0.000 claims description 6
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 6
- 125000006287 difluorobenzyl group Chemical group 0.000 claims description 6
- GJWKQSSMTVBHRA-UHFFFAOYSA-N methyl 4-[[6-amino-8-oxo-2-(propylsulfonimidoyl)-7H-purin-9-yl]methyl]benzoate Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C(=O)OC)C=C1)=O GJWKQSSMTVBHRA-UHFFFAOYSA-N 0.000 claims description 6
- 125000004916 (C1-C6) alkylcarbonyl group Chemical group 0.000 claims description 5
- LHRAYRPXCNIOOH-UHFFFAOYSA-N 1-[6-amino-9-benzyl-8-oxo-2-(propylsulfonimidoyl)purin-7-yl]ethyl acetate Chemical compound C(C)(=O)OC(C)N1C(N(C2=NC(=NC(=C12)N)S(=O)(=N)CCC)CC1=CC=CC=C1)=O LHRAYRPXCNIOOH-UHFFFAOYSA-N 0.000 claims description 5
- UOCHSLAWCBRFAO-UHFFFAOYSA-N 6-amino-2-(ethylsulfonimidoyl)-9-[(4-fluorophenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CC)CC1=CC=C(C=C1)F)=O UOCHSLAWCBRFAO-UHFFFAOYSA-N 0.000 claims description 5
- GMEXKXFTVMLTOL-UHFFFAOYSA-N 6-amino-2-(methylsulfonimidoyl)-9-(pyridin-4-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)C)CC1=CC=NC=C1)=O GMEXKXFTVMLTOL-UHFFFAOYSA-N 0.000 claims description 5
- KZXZEGLHTOJPOP-UHFFFAOYSA-N 6-amino-9-[(2-chlorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=C(C=CC=C1)Cl)=O KZXZEGLHTOJPOP-UHFFFAOYSA-N 0.000 claims description 5
- OZGLMHHFCJLROC-UHFFFAOYSA-N 6-amino-9-[(4-fluorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C=C1)F)=O OZGLMHHFCJLROC-UHFFFAOYSA-N 0.000 claims description 5
- MXYRBJOFSGLHBL-UHFFFAOYSA-N 6-amino-9-benzyl-2-(2,2,2-trifluoroethylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CC(F)(F)F)CC1=CC=CC=C1)=O MXYRBJOFSGLHBL-UHFFFAOYSA-N 0.000 claims description 5
- HXSLBQAQKGKHPJ-UHFFFAOYSA-N 6-amino-9-benzyl-2-(cyclohexylmethylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CC1CCCCC1)CC1=CC=CC=C1)=O HXSLBQAQKGKHPJ-UHFFFAOYSA-N 0.000 claims description 5
- BCXKQQHBMBXTLH-UHFFFAOYSA-N N-[9-benzyl-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]pentanamide Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(CCCC)=O)S(=O)(=N)CCC BCXKQQHBMBXTLH-UHFFFAOYSA-N 0.000 claims description 5
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 5
- 229910052799 carbon Inorganic materials 0.000 claims description 5
- 125000002946 cyanobenzyl group Chemical group 0.000 claims description 5
- 229910052740 iodine Inorganic materials 0.000 claims description 5
- 125000000719 pyrrolidinyl group Chemical group 0.000 claims description 5
- MRIWBJKYLHNMRZ-UHFFFAOYSA-N 3-[[6-amino-8-oxo-2-(propylsulfonimidoyl)-7H-purin-9-yl]methyl]benzamide Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=C(C(=O)N)C=CC=1)=O MRIWBJKYLHNMRZ-UHFFFAOYSA-N 0.000 claims description 4
- YUCCBADIVGNCIC-UHFFFAOYSA-N 4-[[6-amino-8-oxo-2-(propylsulfonimidoyl)-7H-purin-9-yl]methyl]benzamide Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C(=O)N)C=C1)=O YUCCBADIVGNCIC-UHFFFAOYSA-N 0.000 claims description 4
- OOTVBBLVGZVFGS-UHFFFAOYSA-N 4-[[6-amino-8-oxo-2-(propylsulfonimidoyl)-7H-purin-9-yl]methyl]benzonitrile Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C#N)C=C1)=O OOTVBBLVGZVFGS-UHFFFAOYSA-N 0.000 claims description 4
- CCVSDUKQNMVXAV-UHFFFAOYSA-N 6-(ethylamino)-9-[(6-methylpyridin-3-yl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound C(C)NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=NC(=CC=1)C)=O CCVSDUKQNMVXAV-UHFFFAOYSA-N 0.000 claims description 4
- MJRDPVUQHOCHAV-UHFFFAOYSA-N 6-amino-2-(3-chloropropylsulfonimidoyl)-9-[(4-methoxyphenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCCCl)CC1=CC=C(C=C1)OC)=O MJRDPVUQHOCHAV-UHFFFAOYSA-N 0.000 claims description 4
- WJVVXYFIAALPNG-UHFFFAOYSA-N 6-amino-2-(methylsulfonimidoyl)-9-(pyridin-2-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)C)CC1=NC=CC=C1)=O WJVVXYFIAALPNG-UHFFFAOYSA-N 0.000 claims description 4
- MSSWBOIWSSIBHI-UHFFFAOYSA-N 6-amino-2-(methylsulfonimidoyl)-9-(pyridin-3-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)C)CC=1C=NC=CC=1)=O MSSWBOIWSSIBHI-UHFFFAOYSA-N 0.000 claims description 4
- MBQBYGUMANOLRF-UHFFFAOYSA-N 6-amino-9-[(3,4-dichlorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC(=C(C=C1)Cl)Cl)=O MBQBYGUMANOLRF-UHFFFAOYSA-N 0.000 claims description 4
- JXBUDGCMKVLNEW-UHFFFAOYSA-N 6-amino-9-[(3,4-difluorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC(=C(C=C1)F)F)=O JXBUDGCMKVLNEW-UHFFFAOYSA-N 0.000 claims description 4
- YNGIHTJQHZVVFN-UHFFFAOYSA-N 6-amino-9-[(3-chloro-4-methylphenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC(=C(C=C1)C)Cl)=O YNGIHTJQHZVVFN-UHFFFAOYSA-N 0.000 claims description 4
- FQRMTGZFXMHCSC-UHFFFAOYSA-N 6-amino-9-[(3-chlorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC(=CC=C1)Cl)=O FQRMTGZFXMHCSC-UHFFFAOYSA-N 0.000 claims description 4
- IYZZWMCSHFSKJC-UHFFFAOYSA-N 6-amino-9-[(4-chloro-3-methylphenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC(=C(C=C1)Cl)C)=O IYZZWMCSHFSKJC-UHFFFAOYSA-N 0.000 claims description 4
- WVHPAEYDRFCAKO-UHFFFAOYSA-N 6-amino-9-[(4-methoxyphenyl)methyl]-2-(methylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)C)CC1=CC=C(C=C1)OC)=O WVHPAEYDRFCAKO-UHFFFAOYSA-N 0.000 claims description 4
- MSMGQARGIFSWGQ-UHFFFAOYSA-N 6-amino-9-[[4-(piperidine-1-carbonyl)phenyl]methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C=C1)C(=O)N1CCCCC1)=O MSMGQARGIFSWGQ-UHFFFAOYSA-N 0.000 claims description 4
- XVAXOGSGLHCPMT-UHFFFAOYSA-N 6-amino-9-benzyl-2-(2-methoxyethylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCOC)CC1=CC=CC=C1)=O XVAXOGSGLHCPMT-UHFFFAOYSA-N 0.000 claims description 4
- XFDVJIPIVPRMJX-UHFFFAOYSA-N 6-amino-9-benzyl-2-(ethylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CC)CC1=CC=CC=C1)=O XFDVJIPIVPRMJX-UHFFFAOYSA-N 0.000 claims description 4
- CARHRXYETPUULC-UHFFFAOYSA-N 6-methyl-9-[(2-methylpyrimidin-5-yl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound CC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=NC(=NC=1)C)=O CARHRXYETPUULC-UHFFFAOYSA-N 0.000 claims description 4
- AWEYWRZATBLERV-UHFFFAOYSA-N 9-[(4-chlorophenyl)methyl]-6-(ethylamino)-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NCC)S(=O)(=N)CCC AWEYWRZATBLERV-UHFFFAOYSA-N 0.000 claims description 4
- XYCHAVDXFFLWQJ-UHFFFAOYSA-N 9-benzyl-6-(cyclopropylamino)-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC1CC1)S(=O)(=N)CCC XYCHAVDXFFLWQJ-UHFFFAOYSA-N 0.000 claims description 4
- QNJDNDBLKCNKGH-UHFFFAOYSA-N 9-benzyl-6-(ethylamino)-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NCC)S(=O)(=N)CCC QNJDNDBLKCNKGH-UHFFFAOYSA-N 0.000 claims description 4
- QXOBPBVKQCQQAI-UHFFFAOYSA-N 9-benzyl-6-(propylamino)-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NCCC)S(=O)(=N)CCC QXOBPBVKQCQQAI-UHFFFAOYSA-N 0.000 claims description 4
- 241000700721 Hepatitis B virus Species 0.000 claims description 4
- PQNPXVINORKDLR-UHFFFAOYSA-N N-[9-benzyl-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]-2-propylpentanamide Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(C(CCC)CCC)=O)S(=O)(=N)CCC PQNPXVINORKDLR-UHFFFAOYSA-N 0.000 claims description 4
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 4
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 claims description 4
- 125000006278 bromobenzyl group Chemical group 0.000 claims description 4
- 125000006286 dichlorobenzyl group Chemical group 0.000 claims description 4
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 claims description 4
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 claims description 4
- IPWFJLQDVFKJDU-UHFFFAOYSA-N pentanamide Chemical compound CCCCC(N)=O IPWFJLQDVFKJDU-UHFFFAOYSA-N 0.000 claims description 4
- 125000006513 pyridinyl methyl group Chemical group 0.000 claims description 4
- HMLYDPXOOQGKTP-UHFFFAOYSA-N 3-[[6-amino-8-oxo-2-(propylsulfonimidoyl)-7H-purin-9-yl]methyl]benzonitrile Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=C(C#N)C=CC=1)=O HMLYDPXOOQGKTP-UHFFFAOYSA-N 0.000 claims description 3
- XEIFQSWWZYZIMI-UHFFFAOYSA-N 4-[[6-amino-8-oxo-2-(propylsulfonimidoyl)-7H-purin-9-yl]methyl]-N-(2-methoxyethyl)benzamide Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C(=O)NCCOC)C=C1)=O XEIFQSWWZYZIMI-UHFFFAOYSA-N 0.000 claims description 3
- ZUOHLJLBZUSZLB-UHFFFAOYSA-N 6-amino-2-(propylsulfonimidoyl)-9-[[4-(pyrrolidine-1-carbonyl)phenyl]methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C=C1)C(=O)N1CCCC1)=O ZUOHLJLBZUSZLB-UHFFFAOYSA-N 0.000 claims description 3
- APBICSQRGKTYKB-UHFFFAOYSA-N 6-amino-2-(propylsulfonimidoyl)-9-[[4-(trifluoromethyl)phenyl]methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C=C1)C(F)(F)F)=O APBICSQRGKTYKB-UHFFFAOYSA-N 0.000 claims description 3
- YEPVOOTXMQFLJF-UHFFFAOYSA-N 6-amino-9-(2-methylpropyl)-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC(C)C)=O YEPVOOTXMQFLJF-UHFFFAOYSA-N 0.000 claims description 3
- OYDTTXSWKNTOFY-UHFFFAOYSA-N 6-amino-9-[(2,4-difluorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=C(C=C(C=C1)F)F)=O OYDTTXSWKNTOFY-UHFFFAOYSA-N 0.000 claims description 3
- RXVPTJHAOBJTOO-UHFFFAOYSA-N 6-amino-9-[(4-chloro-3-fluorophenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC(=C(C=C1)Cl)F)=O RXVPTJHAOBJTOO-UHFFFAOYSA-N 0.000 claims description 3
- YOKSITUASXLPJK-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-(methylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)C)CC1=CC=C(C=C1)Cl)=O YOKSITUASXLPJK-UHFFFAOYSA-N 0.000 claims description 3
- WVXMROKBYNVSDX-UHFFFAOYSA-N 6-amino-9-[(4-methylsulfonylphenyl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC=C(C=C1)S(=O)(=O)C)=O WVXMROKBYNVSDX-UHFFFAOYSA-N 0.000 claims description 3
- CDMVZHHOTBQWJC-UHFFFAOYSA-N 6-amino-9-benzyl-2-(3-methoxypropylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCCOC)CC1=CC=CC=C1)=O CDMVZHHOTBQWJC-UHFFFAOYSA-N 0.000 claims description 3
- GBEBBMFAEQUXKE-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]-2-propylpentanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(CCC)CCC)=O)S(=O)(=N)CCC GBEBBMFAEQUXKE-UHFFFAOYSA-N 0.000 claims description 3
- YJXYKDUWIFDOMI-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]-3-methylbutanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(CC(C)C)=O)S(=O)(=N)CCC YJXYKDUWIFDOMI-UHFFFAOYSA-N 0.000 claims description 3
- OSSHGUPKKOUUGT-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]acetamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C)=O)S(=O)(=N)CCC OSSHGUPKKOUUGT-UHFFFAOYSA-N 0.000 claims description 3
- VWICUQQUYQWFGE-UHFFFAOYSA-N [6-amino-9-benzyl-2-(methylsulfonimidoyl)-8-oxopurin-7-yl]methyl acetate Chemical compound C(C)(=O)OCN1C(N(C2=NC(=NC(=C12)N)S(=O)(=N)C)CC1=CC=CC=C1)=O VWICUQQUYQWFGE-UHFFFAOYSA-N 0.000 claims description 3
- JITYDGRQWOQCGT-UHFFFAOYSA-N [6-amino-9-benzyl-8-oxo-2-(propylsulfonimidoyl)purin-7-yl]methyl 2,2-dimethylpropanoate Chemical compound CC(C(=O)OCN1C(N(C2=NC(=NC(=C12)N)S(=O)(=N)CCC)CC1=CC=CC=C1)=O)(C)C JITYDGRQWOQCGT-UHFFFAOYSA-N 0.000 claims description 3
- OEOSDGACEVTXNN-UHFFFAOYSA-N [6-amino-9-benzyl-8-oxo-2-(propylsulfonimidoyl)purin-7-yl]methyl acetate Chemical compound C(C)(=O)OCN1C(N(C2=NC(=NC(=C12)N)S(=O)(=N)CCC)CC1=CC=CC=C1)=O OEOSDGACEVTXNN-UHFFFAOYSA-N 0.000 claims description 3
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 3
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 3
- 125000006493 trifluoromethyl benzyl group Chemical group 0.000 claims description 3
- CGOHLAKYSFQURM-UHFFFAOYSA-N 6-amino-9-[(4-methoxyphenyl)methyl]-2-(3-pyrrolidin-1-ylpropylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCCN1CCCC1)CC1=CC=C(C=C1)OC)=O CGOHLAKYSFQURM-UHFFFAOYSA-N 0.000 claims description 2
- WJLOTTAIZSVTCY-UHFFFAOYSA-N 6-methyl-2-(propylsulfonimidoyl)-9-(pyrimidin-5-ylmethyl)-7H-purin-8-one Chemical compound CC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=NC=NC=1)=O WJLOTTAIZSVTCY-UHFFFAOYSA-N 0.000 claims description 2
- MSSXPOADQWRGGF-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]-2,2-dimethylpropanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(C)(C)C)=O)S(=O)(=N)CCC MSSXPOADQWRGGF-UHFFFAOYSA-N 0.000 claims description 2
- OCLKTSCMYMCMJQ-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]-2-ethylbutanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(CC)CC)=O)S(=O)(=N)CCC OCLKTSCMYMCMJQ-UHFFFAOYSA-N 0.000 claims description 2
- ZKJRMYURRTVASS-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-(propylsulfonimidoyl)-7H-purin-6-yl]-2-methylpentanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(CCC)C)=O)S(=O)(=N)CCC ZKJRMYURRTVASS-UHFFFAOYSA-N 0.000 claims description 2
- 239000013543 active substance Substances 0.000 claims description 2
- 230000008569 process Effects 0.000 claims description 2
- 125000005119 alkyl cycloalkyl group Chemical group 0.000 claims 1
- 238000001819 mass spectrum Methods 0.000 description 304
- 239000007787 solid Substances 0.000 description 298
- 238000005160 1H NMR spectroscopy Methods 0.000 description 97
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 60
- 239000000243 solution Substances 0.000 description 55
- 125000004182 2-chlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(*)C([H])=C1[H] 0.000 description 51
- 239000000203 mixture Substances 0.000 description 48
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 45
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 44
- IDPURXSQCKYKIJ-UHFFFAOYSA-N 1-(4-methoxyphenyl)methanamine Chemical compound COC1=CC=C(CN)C=C1 IDPURXSQCKYKIJ-UHFFFAOYSA-N 0.000 description 39
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 38
- 239000011541 reaction mixture Substances 0.000 description 34
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 28
- RYWCQJDEHXJHRI-XJMXIVSISA-N 2-[3-[5-[6-[3-[3-(carboxymethyl)phenyl]-4-[(2r,3s,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyphenyl]hexyl]-2-[(2r,3s,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyphenyl]phenyl]acetic acid Chemical compound O[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC(C(=C1)C=2C=C(CC(O)=O)C=CC=2)=CC=C1CCCCCCC(C=C1C=2C=C(CC(O)=O)C=CC=2)=CC=C1O[C@@H]1[C@@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 RYWCQJDEHXJHRI-XJMXIVSISA-N 0.000 description 27
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 27
- 210000004027 cell Anatomy 0.000 description 27
- KDDNKZCVYQDGKE-UHFFFAOYSA-N (2-chlorophenyl)methanamine Chemical compound NCC1=CC=CC=C1Cl KDDNKZCVYQDGKE-UHFFFAOYSA-N 0.000 description 26
- ZNSPHKJFQDEABI-NZQKXSOJSA-N Nc1nc(O[C@H](c2ccc(Cl)cc2-c2ccccc2)C(F)(F)F)cc(n1)N1CCC2(CN[C@@H](C2)C(O)=O)CC1 Chemical compound Nc1nc(O[C@H](c2ccc(Cl)cc2-c2ccccc2)C(F)(F)F)cc(n1)N1CCC2(CN[C@@H](C2)C(O)=O)CC1 ZNSPHKJFQDEABI-NZQKXSOJSA-N 0.000 description 26
- 229940125876 compound 15a Drugs 0.000 description 26
- TZSZZENYCISATO-WIOPSUGQSA-N rodatristat Chemical compound CCOC(=O)[C@@H]1CC2(CN1)CCN(CC2)c1cc(O[C@H](c2ccc(Cl)cc2-c2ccccc2)C(F)(F)F)nc(N)n1 TZSZZENYCISATO-WIOPSUGQSA-N 0.000 description 26
- 238000010828 elution Methods 0.000 description 25
- DVWOYOSIEJRHKW-UIRZNSHLSA-M sodium (2S)-2-[[(2S)-2-[[(4,4-difluorocyclohexyl)-phenylmethoxy]carbonylamino]-4-methylpentanoyl]amino]-1-hydroxy-3-[(3S)-2-oxopyrrolidin-3-yl]propane-1-sulfonate Chemical compound FC1(CCC(CC1)C(OC(=O)N[C@H](C(=O)N[C@H](C(S(=O)(=O)[O-])O)C[C@H]1C(NCC1)=O)CC(C)C)C1=CC=CC=C1)F.[Na+] DVWOYOSIEJRHKW-UIRZNSHLSA-M 0.000 description 25
- GNMOFFHKLDZUBH-UHFFFAOYSA-N 6-chloro-9-[(2-chlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=C(C=CC=C1)Cl)=O GNMOFFHKLDZUBH-UHFFFAOYSA-N 0.000 description 24
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 24
- 238000000926 separation method Methods 0.000 description 24
- 239000002253 acid Substances 0.000 description 23
- UTKOWHRNPQDYNX-UHFFFAOYSA-N 6-amino-9-[(2-chlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=C(C=CC=C1)Cl)=O UTKOWHRNPQDYNX-UHFFFAOYSA-N 0.000 description 22
- 239000000651 prodrug Substances 0.000 description 22
- 229940002612 prodrug Drugs 0.000 description 22
- 235000019439 ethyl acetate Nutrition 0.000 description 21
- 238000012360 testing method Methods 0.000 description 20
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 19
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 19
- 230000006698 induction Effects 0.000 description 19
- UJMGBGIFVTZJHH-UHFFFAOYSA-N 6-amino-9-benzyl-2-methylsulfanyl-7h-purin-8-one Chemical compound C12=NC(SC)=NC(N)=C2N=C(O)N1CC1=CC=CC=C1 UJMGBGIFVTZJHH-UHFFFAOYSA-N 0.000 description 18
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 description 18
- PHDIJLFSKNMCMI-ITGJKDDRSA-N (3R,4S,5R,6R)-6-(hydroxymethyl)-4-(8-quinolin-6-yloxyoctoxy)oxane-2,3,5-triol Chemical compound OC[C@@H]1[C@H]([C@@H]([C@H](C(O1)O)O)OCCCCCCCCOC=1C=C2C=CC=NC2=CC=1)O PHDIJLFSKNMCMI-ITGJKDDRSA-N 0.000 description 17
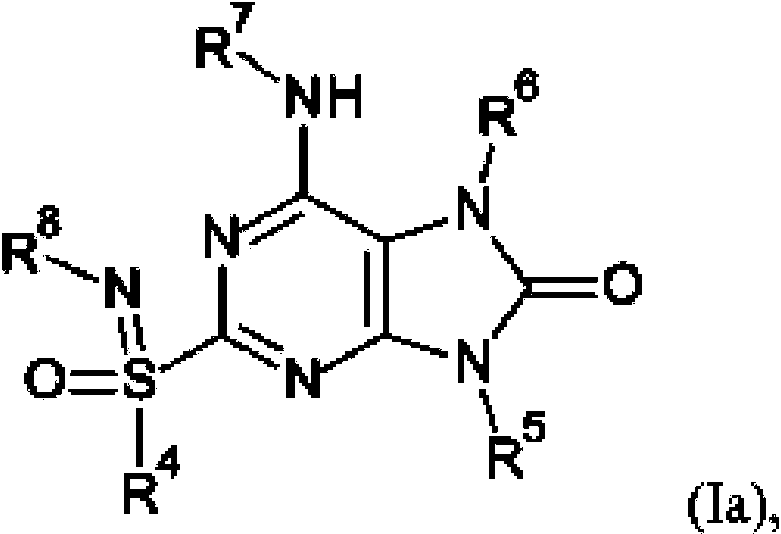
- 0 *Nc(nc(nc1N2*)S(*)(=N*)=O)c1N(*)C2=O Chemical compound *Nc(nc(nc1N2*)S(*)(=N*)=O)c1N(*)C2=O 0.000 description 17
- HIHOEGPXVVKJPP-JTQLQIEISA-N 5-fluoro-2-[[(1s)-1-(5-fluoropyridin-2-yl)ethyl]amino]-6-[(5-methyl-1h-pyrazol-3-yl)amino]pyridine-3-carbonitrile Chemical compound N([C@@H](C)C=1N=CC(F)=CC=1)C(C(=CC=1F)C#N)=NC=1NC=1C=C(C)NN=1 HIHOEGPXVVKJPP-JTQLQIEISA-N 0.000 description 17
- 239000003814 drug Substances 0.000 description 17
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 16
- 229940079593 drug Drugs 0.000 description 16
- GTYRLXXHXBTNQV-UHFFFAOYSA-N 6-amino-9-[(2-chlorophenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=C(C=CC=C1)Cl)=O GTYRLXXHXBTNQV-UHFFFAOYSA-N 0.000 description 15
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 15
- 230000000694 effects Effects 0.000 description 15
- 239000012044 organic layer Substances 0.000 description 15
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 14
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 14
- 238000000746 purification Methods 0.000 description 14
- 238000003556 assay Methods 0.000 description 13
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 12
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 12
- 238000004296 chiral HPLC Methods 0.000 description 12
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 12
- 229960003180 glutathione Drugs 0.000 description 12
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 12
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 11
- 150000001412 amines Chemical class 0.000 description 11
- HONIKIYFGCHQSJ-UHFFFAOYSA-N 6-amino-9-benzyl-2-methylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C)CC1=CC=CC=C1)=O HONIKIYFGCHQSJ-UHFFFAOYSA-N 0.000 description 10
- YVHWMATXRMXZJI-UHFFFAOYSA-N 6-amino-9-benzyl-2-sulfanylidene-1,7-dihydropurin-8-one Chemical compound OC1=NC=2C(N)=NC(S)=NC=2N1CC1=CC=CC=C1 YVHWMATXRMXZJI-UHFFFAOYSA-N 0.000 description 10
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 10
- 239000012267 brine Substances 0.000 description 10
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 10
- 230000002503 metabolic effect Effects 0.000 description 10
- 239000002244 precipitate Substances 0.000 description 10
- 239000000523 sample Substances 0.000 description 10
- 239000011734 sodium Substances 0.000 description 10
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 10
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 description 10
- HBENZIXOGRCSQN-VQWWACLZSA-N (1S,2S,6R,14R,15R,16R)-5-(cyclopropylmethyl)-16-[(2S)-2-hydroxy-3,3-dimethylpentan-2-yl]-15-methoxy-13-oxa-5-azahexacyclo[13.2.2.12,8.01,6.02,14.012,20]icosa-8(20),9,11-trien-11-ol Chemical compound N1([C@@H]2CC=3C4=C(C(=CC=3)O)O[C@H]3[C@@]5(OC)CC[C@@]2([C@@]43CC1)C[C@@H]5[C@](C)(O)C(C)(C)CC)CC1CC1 HBENZIXOGRCSQN-VQWWACLZSA-N 0.000 description 9
- MCBGAVARLDFVPY-UHFFFAOYSA-N 6-amino-9-benzyl-2-propylsulfanyl-7h-purin-8-one Chemical compound C12=NC(SCCC)=NC(N)=C2N=C(O)N1CC1=CC=CC=C1 MCBGAVARLDFVPY-UHFFFAOYSA-N 0.000 description 9
- 101100456896 Drosophila melanogaster metl gene Proteins 0.000 description 9
- 230000004913 activation Effects 0.000 description 9
- 238000001914 filtration Methods 0.000 description 9
- 150000002500 ions Chemical class 0.000 description 9
- 239000002609 medium Substances 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- 239000003981 vehicle Substances 0.000 description 9
- 210000001853 liver microsome Anatomy 0.000 description 8
- 108020004999 messenger RNA Proteins 0.000 description 8
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 8
- JHNLZOVBAQWGQU-UHFFFAOYSA-N 380814_sial Chemical compound CS(O)(=O)=O.O=P(=O)OP(=O)=O JHNLZOVBAQWGQU-UHFFFAOYSA-N 0.000 description 7
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 7
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 7
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 7
- XJLXINKUBYWONI-DQQFMEOOSA-N [[(2r,3r,4r,5r)-5-(6-aminopurin-9-yl)-3-hydroxy-4-phosphonooxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [(2s,3r,4s,5s)-5-(3-carbamoylpyridin-1-ium-1-yl)-3,4-dihydroxyoxolan-2-yl]methyl phosphate Chemical compound NC(=O)C1=CC=C[N+]([C@@H]2[C@H]([C@@H](O)[C@H](COP([O-])(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](OP(O)(O)=O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 XJLXINKUBYWONI-DQQFMEOOSA-N 0.000 description 7
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 7
- 230000001684 chronic effect Effects 0.000 description 7
- 238000011534 incubation Methods 0.000 description 7
- 238000001990 intravenous administration Methods 0.000 description 7
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 7
- 229910052757 nitrogen Inorganic materials 0.000 description 7
- 238000002953 preparative HPLC Methods 0.000 description 7
- 229910052708 sodium Inorganic materials 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- YMVFJGSXZNNUDW-UHFFFAOYSA-N (4-chlorophenyl)methanamine Chemical compound NCC1=CC=C(Cl)C=C1 YMVFJGSXZNNUDW-UHFFFAOYSA-N 0.000 description 6
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 6
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 6
- PIUCBAFXLHFCIE-UHFFFAOYSA-N 4-[(6-amino-8-oxo-2-propylsulfinyl-7H-purin-9-yl)methyl]benzamide Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C(=O)N)C=C1)=O PIUCBAFXLHFCIE-UHFFFAOYSA-N 0.000 description 6
- CBMWXHQXHJQKDE-UHFFFAOYSA-N 4-[(6-amino-8-oxo-2-propylsulfinyl-7H-purin-9-yl)methyl]benzonitrile Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C#N)C=C1)=O CBMWXHQXHJQKDE-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 239000000556 agonist Substances 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 238000004440 column chromatography Methods 0.000 description 6
- 239000000706 filtrate Substances 0.000 description 6
- 235000019253 formic acid Nutrition 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- PFGVNLZDWRZPJW-OPAMFIHVSA-N otamixaban Chemical compound C([C@@H](C(=O)OC)[C@@H](C)NC(=O)C=1C=CC(=CC=1)C=1C=C[N+]([O-])=CC=1)C1=CC=CC(C(N)=N)=C1 PFGVNLZDWRZPJW-OPAMFIHVSA-N 0.000 description 6
- DUCKXCGALKOSJF-UHFFFAOYSA-N pentanoyl pentanoate Chemical compound CCCCC(=O)OC(=O)CCCC DUCKXCGALKOSJF-UHFFFAOYSA-N 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 239000000741 silica gel Substances 0.000 description 6
- 229910002027 silica gel Inorganic materials 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- JQSHBVHOMNKWFT-DTORHVGOSA-N varenicline Chemical compound C12=CC3=NC=CN=C3C=C2[C@H]2C[C@@H]1CNC2 JQSHBVHOMNKWFT-DTORHVGOSA-N 0.000 description 6
- 229950003036 vesatolimod Drugs 0.000 description 6
- 125000004215 2,4-difluorophenyl group Chemical group [H]C1=C([H])C(*)=C(F)C([H])=C1F 0.000 description 5
- GYIUDLLQLVWKPP-UHFFFAOYSA-N 2-propylpentanoyl 2-propylpentanoate Chemical compound CCCC(CCC)C(=O)OC(=O)C(CCC)CCC GYIUDLLQLVWKPP-UHFFFAOYSA-N 0.000 description 5
- 125000004189 3,4-dichlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(Cl)C([H])=C1* 0.000 description 5
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 5
- AEVQYQZGVSLRES-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-methylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SC)CC1=CC=C(C=C1)Cl)=O AEVQYQZGVSLRES-UHFFFAOYSA-N 0.000 description 5
- XNENYEMLFACNFU-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-sulfanylidene-1,7-dihydropurin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S)CC1=CC=C(C=C1)Cl)=O XNENYEMLFACNFU-UHFFFAOYSA-N 0.000 description 5
- LANQXZNXIDTWRX-UHFFFAOYSA-N 6-amino-9-benzyl-2-(butylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCCC)CC1=CC=CC=C1)=O LANQXZNXIDTWRX-UHFFFAOYSA-N 0.000 description 5
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 5
- WPYNEOHJXNKMSR-UHFFFAOYSA-N 9-[(2-chlorophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C(C=CC=C1)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC WPYNEOHJXNKMSR-UHFFFAOYSA-N 0.000 description 5
- CMYNXPLOCPEGOY-UHFFFAOYSA-N 9-benzyl-6-chloro-2-propylsulfanyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)Cl)SCCC CMYNXPLOCPEGOY-UHFFFAOYSA-N 0.000 description 5
- 108091006146 Channels Proteins 0.000 description 5
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 5
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 5
- 241000711549 Hepacivirus C Species 0.000 description 5
- OTRGZTCSPCNJCQ-UHFFFAOYSA-N N-(9-benzyl-8-oxo-2-propylsulfanyl-7H-purin-6-yl)-2-propylpentanamide Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(C(CCC)CCC)=O)SCCC OTRGZTCSPCNJCQ-UHFFFAOYSA-N 0.000 description 5
- 102000002689 Toll-like receptor Human genes 0.000 description 5
- 108020000411 Toll-like receptor Proteins 0.000 description 5
- 230000008484 agonism Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- SMJYMSAPPGLBAR-UHFFFAOYSA-N chloromethyl acetate Chemical compound CC(=O)OCCl SMJYMSAPPGLBAR-UHFFFAOYSA-N 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 208000035475 disorder Diseases 0.000 description 5
- 208000002672 hepatitis B Diseases 0.000 description 5
- 239000000411 inducer Substances 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 239000002207 metabolite Substances 0.000 description 5
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 5
- 239000008363 phosphate buffer Substances 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 description 5
- 229910000342 sodium bisulfate Inorganic materials 0.000 description 5
- 229910052938 sodium sulfate Inorganic materials 0.000 description 5
- 235000011152 sodium sulphate Nutrition 0.000 description 5
- 230000000638 stimulation Effects 0.000 description 5
- ASQOQJYHIYYTEJ-GBESFXJTSA-N (1r,7s,9as)-7-decyl-2,3,4,6,7,8,9,9a-octahydro-1h-quinolizin-1-ol Chemical compound O[C@@H]1CCCN2C[C@@H](CCCCCCCCCC)CC[C@H]21 ASQOQJYHIYYTEJ-GBESFXJTSA-N 0.000 description 4
- DPRJPRMZJGWLHY-HNGSOEQISA-N (e,3r,5s)-7-[5-(4-fluorophenyl)-3-propan-2-yl-1-pyrazin-2-ylpyrazol-4-yl]-3,5-dihydroxyhept-6-enoic acid Chemical compound OC(=O)C[C@H](O)C[C@H](O)/C=C/C=1C(C(C)C)=NN(C=2N=CC=NC=2)C=1C1=CC=C(F)C=C1 DPRJPRMZJGWLHY-HNGSOEQISA-N 0.000 description 4
- LBJHPOUSJLRRIE-UHFFFAOYSA-N 4-[(6-amino-8-oxo-2-propylsulfanyl-7H-purin-9-yl)methyl]benzonitrile Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C#N)C=C1)=O LBJHPOUSJLRRIE-UHFFFAOYSA-N 0.000 description 4
- SAZGJPXEDWRWQT-UHFFFAOYSA-N 4-amino-3-[(4-chlorophenyl)methyl]-2-oxo-1H-imidazole-5-carbonitrile Chemical compound NC=1N(C(NC=1C#N)=O)CC1=CC=C(C=C1)Cl SAZGJPXEDWRWQT-UHFFFAOYSA-N 0.000 description 4
- 125000004199 4-trifluoromethylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C(F)(F)F 0.000 description 4
- AWMRXUUYVORZPB-UHFFFAOYSA-N 6-amino-9-[(3,4-difluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)F)F)=O AWMRXUUYVORZPB-UHFFFAOYSA-N 0.000 description 4
- HMWSWNCISULJJJ-UHFFFAOYSA-N 6-amino-9-[(3-chloro-4-methylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)C)Cl)=O HMWSWNCISULJJJ-UHFFFAOYSA-N 0.000 description 4
- FBFBHKHVBSHQDY-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)Cl)=O FBFBHKHVBSHQDY-UHFFFAOYSA-N 0.000 description 4
- KIHSDTHJQITPOC-UHFFFAOYSA-N 6-amino-9-[(4-methoxyphenyl)methyl]-2-sulfanylidene-1,7-dihydropurin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S)CC1=CC=C(C=C1)OC)=O KIHSDTHJQITPOC-UHFFFAOYSA-N 0.000 description 4
- FGGHMITXKSUZKF-UHFFFAOYSA-N 6-amino-9-benzyl-2-(cyclohexylmethylsulfanyl)-7h-purin-8-one Chemical compound N=1C=2N(CC=3C=CC=CC=3)C(O)=NC=2C(N)=NC=1SCC1CCCCC1 FGGHMITXKSUZKF-UHFFFAOYSA-N 0.000 description 4
- VGSBMDOWAWHTIU-UHFFFAOYSA-N 6-amino-9-benzyl-2-ethylsulfanyl-7h-purin-8-one Chemical compound C12=NC(SCC)=NC(N)=C2N=C(O)N1CC1=CC=CC=C1 VGSBMDOWAWHTIU-UHFFFAOYSA-N 0.000 description 4
- BCCIMILKWSTHDD-UHFFFAOYSA-N 6-chloro-9-[(3-chloro-4-methylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)C)Cl)=O BCCIMILKWSTHDD-UHFFFAOYSA-N 0.000 description 4
- HGNGKXBOLIGONP-UHFFFAOYSA-N 9-benzyl-6-(propylamino)-2-propylsulfanyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NCCC)SCCC HGNGKXBOLIGONP-UHFFFAOYSA-N 0.000 description 4
- QUMCIHKVKQYNPA-RUZDIDTESA-N C1(CCCCC1)CN1[C@@H](C=2N(C=3C=NC(=NC1=3)NC1=C(C=C(C(=O)NC3CCN(CC3)C)C=C1)OC)C(=NN=2)C)CC Chemical compound C1(CCCCC1)CN1[C@@H](C=2N(C=3C=NC(=NC1=3)NC1=C(C=C(C(=O)NC3CCN(CC3)C)C=C1)OC)C(=NN=2)C)CC QUMCIHKVKQYNPA-RUZDIDTESA-N 0.000 description 4
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 4
- 208000005176 Hepatitis C Diseases 0.000 description 4
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- TZYWCYJVHRLUCT-VABKMULXSA-N N-benzyloxycarbonyl-L-leucyl-L-leucyl-L-leucinal Chemical compound CC(C)C[C@@H](C=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)OCC1=CC=CC=C1 TZYWCYJVHRLUCT-VABKMULXSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- YLEIFZAVNWDOBM-ZTNXSLBXSA-N ac1l9hc7 Chemical compound C([C@H]12)C[C@@H](C([C@@H](O)CC3)(C)C)[C@@]43C[C@@]14CC[C@@]1(C)[C@@]2(C)C[C@@H]2O[C@]3(O)[C@H](O)C(C)(C)O[C@@H]3[C@@H](C)[C@H]12 YLEIFZAVNWDOBM-ZTNXSLBXSA-N 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 125000004432 carbon atom Chemical group C* 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 239000007789 gas Substances 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 239000001257 hydrogen Substances 0.000 description 4
- 230000001965 increasing effect Effects 0.000 description 4
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- LBVOQOIJQBTHOE-UHFFFAOYSA-N methyl 4-[(6-amino-8-oxo-2-propylsulfanyl-7H-purin-9-yl)methyl]benzoate Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C(=O)OC)C=C1)=O LBVOQOIJQBTHOE-UHFFFAOYSA-N 0.000 description 4
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 4
- 239000012299 nitrogen atmosphere Substances 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- 230000000144 pharmacologic effect Effects 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- AQLJVWUFPCUVLO-UHFFFAOYSA-N urea hydrogen peroxide Chemical compound OO.NC(N)=O AQLJVWUFPCUVLO-UHFFFAOYSA-N 0.000 description 4
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 3
- FANCTJAFZSYTIS-IQUVVAJASA-N (1r,3s,5z)-5-[(2e)-2-[(1r,3as,7ar)-7a-methyl-1-[(2r)-4-(phenylsulfonimidoyl)butan-2-yl]-2,3,3a,5,6,7-hexahydro-1h-inden-4-ylidene]ethylidene]-4-methylidenecyclohexane-1,3-diol Chemical compound C([C@@H](C)[C@@H]1[C@]2(CCCC(/[C@@H]2CC1)=C\C=C\1C([C@@H](O)C[C@H](O)C/1)=C)C)CS(=N)(=O)C1=CC=CC=C1 FANCTJAFZSYTIS-IQUVVAJASA-N 0.000 description 3
- LAJAFFLJAJMYLK-CVOKMOJFSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[[(7s)-4-methoxy-7-morpholin-4-yl-6,7,8,9-tetrahydro-5h-benzo[7]annulen-3-yl]amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound N1([C@H]2CCC3=CC=C(C(=C3CC2)OC)NC=2N=C(C(=CN=2)Cl)N[C@H]2[C@H]([C@@]3([H])C[C@@]2(C=C3)[H])C(N)=O)CCOCC1 LAJAFFLJAJMYLK-CVOKMOJFSA-N 0.000 description 3
- KSOVGRCOLZZTPF-QMKUDKLTSA-N (1s,2s,3r,4r)-3-[[5-fluoro-2-[3-methyl-4-(4-methylpiperazin-1-yl)anilino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound N([C@H]1[C@H]([C@@]2([H])C[C@@]1(C=C2)[H])C(N)=O)C(C(=CN=1)F)=NC=1NC(C=C1C)=CC=C1N1CCN(C)CC1 KSOVGRCOLZZTPF-QMKUDKLTSA-N 0.000 description 3
- OYRGKUTZSTXSQS-UHFFFAOYSA-N (2-methylpyrimidin-5-yl)methanamine Chemical compound CC1=NC=C(CN)C=N1 OYRGKUTZSTXSQS-UHFFFAOYSA-N 0.000 description 3
- HOBMGFDJYBEWLS-UHFFFAOYSA-N (2-methylpyrimidin-5-yl)methanol Chemical compound CC1=NC=C(CO)C=N1 HOBMGFDJYBEWLS-UHFFFAOYSA-N 0.000 description 3
- SHAHPWSYJFYMRX-GDLCADMTSA-N (2S)-2-(4-{[(1R,2S)-2-hydroxycyclopentyl]methyl}phenyl)propanoic acid Chemical compound C1=CC([C@@H](C(O)=O)C)=CC=C1C[C@@H]1[C@@H](O)CCC1 SHAHPWSYJFYMRX-GDLCADMTSA-N 0.000 description 3
- DAAXYQZSKBPJOX-FQEVSTJZSA-N (2S)-2-amino-3-[4-[5-[3-(4-hydroxyphenyl)-4-methoxyphenyl]-1,2,4-oxadiazol-3-yl]phenyl]propanoic acid Chemical compound COC1=C(C=C(C=C1)C2=NC(=NO2)C3=CC=C(C=C3)C[C@@H](C(=O)O)N)C4=CC=C(C=C4)O DAAXYQZSKBPJOX-FQEVSTJZSA-N 0.000 description 3
- SLTBMTIRYMGWLX-XMMPIXPASA-N (2r)-2-[(4-chloroanilino)carbamoylamino]-3-(1h-indol-3-yl)-n-(2-phenylethyl)propanamide Chemical compound C1=CC(Cl)=CC=C1NNC(=O)N[C@@H](C(=O)NCCC=1C=CC=CC=1)CC1=CNC2=CC=CC=C12 SLTBMTIRYMGWLX-XMMPIXPASA-N 0.000 description 3
- KAFZOLYKKCWUBI-HPMAGDRPSA-N (2s)-2-[[(2s)-2-[[(2s)-1-[(2s)-3-amino-2-[[(2s)-2-[[(2s)-2-(3-cyclohexylpropanoylamino)-4-methylpentanoyl]amino]-5-methylhexanoyl]amino]propanoyl]pyrrolidine-2-carbonyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]butanediamide Chemical compound N([C@@H](CC(C)C)C(=O)N[C@@H](CCC(C)C)C(=O)N[C@@H](CN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC(N)=O)C(N)=O)C(=O)CCC1CCCCC1 KAFZOLYKKCWUBI-HPMAGDRPSA-N 0.000 description 3
- LJIOTBMDLVHTBO-CUYJMHBOSA-N (2s)-2-amino-n-[(1r,2r)-1-cyano-2-[4-[4-(4-methylpiperazin-1-yl)sulfonylphenyl]phenyl]cyclopropyl]butanamide Chemical compound CC[C@H](N)C(=O)N[C@]1(C#N)C[C@@H]1C1=CC=C(C=2C=CC(=CC=2)S(=O)(=O)N2CCN(C)CC2)C=C1 LJIOTBMDLVHTBO-CUYJMHBOSA-N 0.000 description 3
- AEVBPXDFDKBGLT-YOUFYPILSA-N (2s,3s,4r,5r)-n-[2-[4-(diethoxyphosphorylmethyl)anilino]-2-oxoethyl]-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolane-2-carboxamide Chemical compound C1=CC(CP(=O)(OCC)OCC)=CC=C1NC(=O)CNC(=O)[C@@H]1[C@@H](O)[C@@H](O)[C@H](N2C(NC(=O)C=C2)=O)O1 AEVBPXDFDKBGLT-YOUFYPILSA-N 0.000 description 3
- TWYYFYNJOJGNFP-CUXYNZQBSA-N (2s,4r,5s,6s)-2-[(4s,5r)-4-acetyloxy-5-methyl-3-methylidene-6-phenylhexyl]-2-carbamoyl-4-[[(e,4s,6s)-4,6-dimethyloct-2-enoyl]oxymethyl]-5-hydroxy-1,3-dioxane-4,5,6-tricarboxylic acid Chemical compound O1[C@H](C(O)=O)[C@](C(O)=O)(O)[C@](COC(=O)/C=C/[C@@H](C)C[C@@H](C)CC)(C(O)=O)O[C@]1(C(N)=O)CCC(=C)[C@@H](OC(C)=O)[C@H](C)CC1=CC=CC=C1 TWYYFYNJOJGNFP-CUXYNZQBSA-N 0.000 description 3
- ZXGVFUKWWWNTTQ-VSGBNLITSA-N (3r,5r)-7-[4-[[3-(2-amino-2-oxoethyl)phenyl]sulfamoyl]-2,3-bis(4-fluorophenyl)-5-propan-2-ylpyrrol-1-yl]-3,5-dihydroxyheptanoic acid Chemical compound OC(=O)C[C@H](O)C[C@H](O)CCN1C(C(C)C)=C(S(=O)(=O)NC=2C=C(CC(N)=O)C=CC=2)C(C=2C=CC(F)=CC=2)=C1C1=CC=C(F)C=C1 ZXGVFUKWWWNTTQ-VSGBNLITSA-N 0.000 description 3
- VUDZSIYXZUYWSC-DBRKOABJSA-N (4r)-1-[(2r,4r,5r)-3,3-difluoro-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-4-hydroxy-1,3-diazinan-2-one Chemical compound FC1(F)[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N[C@H](O)CC1 VUDZSIYXZUYWSC-DBRKOABJSA-N 0.000 description 3
- FRJJJAKBRKABFA-TYFAACHXSA-N (4r,6s)-6-[(e)-2-[6-chloro-4-(4-fluorophenyl)-2-propan-2-ylquinolin-3-yl]ethenyl]-4-hydroxyoxan-2-one Chemical compound C(\[C@H]1OC(=O)C[C@H](O)C1)=C/C=1C(C(C)C)=NC2=CC=C(Cl)C=C2C=1C1=CC=C(F)C=C1 FRJJJAKBRKABFA-TYFAACHXSA-N 0.000 description 3
- BSGIKRCNMBTGEB-UHFFFAOYSA-N (5-bromo-1-methylpyrrolo[2,3-c]pyridin-2-yl)-[6-[(dimethylamino)methyl]-4-methyl-3,4-dihydro-1h-isoquinolin-2-yl]methanone Chemical compound BrC1=NC=C2N(C)C(C(=O)N3CC(C4=CC(CN(C)C)=CC=C4C3)C)=CC2=C1 BSGIKRCNMBTGEB-UHFFFAOYSA-N 0.000 description 3
- JHLIGYPHPBLDDL-UHFFFAOYSA-N (5-pyridin-3-ylthiophen-2-yl)methanamine Chemical compound S1C(CN)=CC=C1C1=CC=CN=C1 JHLIGYPHPBLDDL-UHFFFAOYSA-N 0.000 description 3
- RXNPEQZHMGFNAY-GEALJGNFSA-N (5R)-4-[(1S,6R)-5-[(2S)-2-(4-chlorophenyl)-3-(propan-2-ylamino)propanoyl]-2,5-diazabicyclo[4.1.0]heptan-2-yl]-5-methyl-6,8-dihydro-5H-pyrido[2,3-d]pyrimidin-7-one Chemical compound C[C@@H]1CC(=O)NC2=C1C(=NC=N2)N3CCN([C@H]4[C@@H]3C4)C(=O)[C@H](CNC(C)C)C5=CC=C(C=C5)Cl RXNPEQZHMGFNAY-GEALJGNFSA-N 0.000 description 3
- IGVKWAAPMVVTFX-BUHFOSPRSA-N (e)-octadec-5-en-7,9-diynoic acid Chemical compound CCCCCCCCC#CC#C\C=C\CCCC(O)=O IGVKWAAPMVVTFX-BUHFOSPRSA-N 0.000 description 3
- VICOOSNNZUPVHM-IGPZRPDBSA-M (e,3r,5s)-7-[2-(4-fluorophenyl)-4-(3-phenylpentan-3-yl)phenyl]-3,5-dihydroxyhept-6-enoate Chemical compound C=1C=C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)C(C=2C=CC(F)=CC=2)=CC=1C(CC)(CC)C1=CC=CC=C1 VICOOSNNZUPVHM-IGPZRPDBSA-M 0.000 description 3
- MXPCZHSTOIKVST-UHFFFAOYSA-N 1-[3-amino-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-4-[3-(2-hydroxyethoxy)phenyl]-2-oxo-1,8-naphthyridin-3-yl]urea;hydrochloride Chemical compound Cl.CC(C)C=1C=CC(N)=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C1=CC=CC(OCCO)=C1 MXPCZHSTOIKVST-UHFFFAOYSA-N 0.000 description 3
- OXTVBHDILDPYAS-UHFFFAOYSA-N 1-[4-(aminomethyl)-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-4-[3-(3-hydroxypropoxy)phenyl]-2-oxo-1,8-naphthyridin-3-yl]urea;hydrochloride Chemical compound Cl.CC(C)C=1C=C(CN)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C1=CC=CC(OCCCO)=C1 OXTVBHDILDPYAS-UHFFFAOYSA-N 0.000 description 3
- YRTFLDFDKPFNCJ-UHFFFAOYSA-N 1-[4-amino-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-2-oxo-4-[3-(3-pyrrolidin-1-ylpropoxy)phenyl]-1,8-naphthyridin-3-yl]urea;dihydrochloride Chemical compound Cl.Cl.CC(C)C=1C=C(N)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C(C=1)=CC=CC=1OCCCN1CCCC1 YRTFLDFDKPFNCJ-UHFFFAOYSA-N 0.000 description 3
- ZFNNBIMQDHBELV-UHFFFAOYSA-N 1-[4-amino-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-4-[3-(3-cyclohexylpropoxy)phenyl]-2-oxo-1,8-naphthyridin-3-yl]urea;dihydrochloride Chemical compound Cl.Cl.CC(C)C=1C=C(N)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C(C=1)=CC=CC=1OCCCC1CCCCC1 ZFNNBIMQDHBELV-UHFFFAOYSA-N 0.000 description 3
- CGKKDGMMKSOGLM-UHFFFAOYSA-N 1-chloroethyl acetate Chemical compound CC(Cl)OC(C)=O CGKKDGMMKSOGLM-UHFFFAOYSA-N 0.000 description 3
- YKYWUHHZZRBGMG-JWTNVVGKSA-N 1-methyl-2-[[(1r,5s)-6-[[5-(trifluoromethyl)pyridin-2-yl]methoxymethyl]-3-azabicyclo[3.1.0]hexan-3-yl]methyl]benzimidazole Chemical compound C1([C@@H]2CN(C[C@@H]21)CC=1N(C2=CC=CC=C2N=1)C)COCC1=CC=C(C(F)(F)F)C=N1 YKYWUHHZZRBGMG-JWTNVVGKSA-N 0.000 description 3
- FJMQJSUOOGOWBD-UHFFFAOYSA-N 2-(2-chlorophenyl)-3-(4-chlorophenyl)-7-(2,2-difluoropropyl)-5,6-dihydropyrazolo[3,4-f][1,4]oxazepin-8-one Chemical compound O=C1N(CC(F)(F)C)CCOC=2C1=NN(C=1C(=CC=CC=1)Cl)C=2C1=CC=C(Cl)C=C1 FJMQJSUOOGOWBD-UHFFFAOYSA-N 0.000 description 3
- XZORQADPEUSNQJ-UHFFFAOYSA-N 2-(3-piperidin-4-yloxy-1-benzothiophen-2-yl)-5-[(1,3,5-trimethylpyrazol-4-yl)methyl]-1,3,4-oxadiazole Chemical compound CC1=NN(C)C(C)=C1CC1=NN=C(C2=C(C3=CC=CC=C3S2)OC2CCNCC2)O1 XZORQADPEUSNQJ-UHFFFAOYSA-N 0.000 description 3
- CJLZUKCACMUYFP-GOSISDBHSA-N 2-[(5R)-4-[2-[3-(3-methylbutanoyloxy)phenyl]acetyl]-8-(trifluoromethyl)-1,2,3,5-tetrahydropyrido[2,3-e][1,4]diazepin-5-yl]acetic acid Chemical compound CC(C)CC(=O)OC1=CC=CC(CC(=O)N2[C@@H](C3=CC=C(N=C3NCC2)C(F)(F)F)CC(O)=O)=C1 CJLZUKCACMUYFP-GOSISDBHSA-N 0.000 description 3
- PFOQIHIIOLBCEQ-UHFFFAOYSA-N 2-[4-[2-(2,6-dimethoxyphenyl)-7-methyl-3h-benzimidazol-5-yl]piperidin-1-yl]-n-methylethanamine Chemical compound C1CN(CCNC)CCC1C1=CC(C)=C(NC(=N2)C=3C(=CC=CC=3OC)OC)C2=C1 PFOQIHIIOLBCEQ-UHFFFAOYSA-N 0.000 description 3
- AXHVEQQLKVIZLO-UHFFFAOYSA-N 2-[4-[2-[5-(2,2-dimethylbutyl)-1h-imidazol-2-yl]ethyl]phenyl]benzoic acid Chemical compound CCC(C)(C)CC1=CNC(CCC=2C=CC(=CC=2)C=2C(=CC=CC=2)C(O)=O)=N1 AXHVEQQLKVIZLO-UHFFFAOYSA-N 0.000 description 3
- WGABOZPQOOZAOI-UHFFFAOYSA-N 2-[4-[[(3,5-dimethoxy-4-methylbenzoyl)-(3-phenylpropyl)amino]methyl]phenyl]acetic acid Chemical compound COC1=C(C)C(OC)=CC(C(=O)N(CCCC=2C=CC=CC=2)CC=2C=CC(CC(O)=O)=CC=2)=C1 WGABOZPQOOZAOI-UHFFFAOYSA-N 0.000 description 3
- BCSHRERPHLTPEE-NRFANRHFSA-N 2-[[5-chloro-2-[[(6s)-6-[4-(2-hydroxyethyl)piperazin-1-yl]-1-methoxy-6,7,8,9-tetrahydro-5h-benzo[7]annulen-2-yl]amino]pyrimidin-4-yl]amino]-n-methylbenzamide Chemical compound CNC(=O)C1=CC=CC=C1NC1=NC(NC=2C(=C3CCC[C@@H](CC3=CC=2)N2CCN(CCO)CC2)OC)=NC=C1Cl BCSHRERPHLTPEE-NRFANRHFSA-N 0.000 description 3
- MEUWQVWJLLBVQI-UHFFFAOYSA-N 2-aminopropanedinitrile;4-methylbenzenesulfonic acid Chemical compound N#CC([NH3+])C#N.CC1=CC=C(S([O-])(=O)=O)C=C1 MEUWQVWJLLBVQI-UHFFFAOYSA-N 0.000 description 3
- ASUDFOJKTJLAIK-UHFFFAOYSA-N 2-methoxyethanamine Chemical compound COCCN ASUDFOJKTJLAIK-UHFFFAOYSA-N 0.000 description 3
- XUXJHBAJZQREDB-UHFFFAOYSA-N 2-methylbutanamide Chemical compound CCC(C)C(N)=O XUXJHBAJZQREDB-UHFFFAOYSA-N 0.000 description 3
- NCYCWNILADFMPI-UHFFFAOYSA-N 2-methylpentanoyl 2-methylpentanoate Chemical compound CCCC(C)C(=O)OC(=O)C(C)CCC NCYCWNILADFMPI-UHFFFAOYSA-N 0.000 description 3
- SBWJLHPCEHEABR-UHFFFAOYSA-N 2-methylpyridine-4-carbonitrile Chemical compound CC1=CC(C#N)=CC=N1 SBWJLHPCEHEABR-UHFFFAOYSA-N 0.000 description 3
- IJBONYUNKRDIFC-UHFFFAOYSA-N 2-methylpyrimidine-5-carbaldehyde Chemical compound CC1=NC=C(C=O)C=N1 IJBONYUNKRDIFC-UHFFFAOYSA-N 0.000 description 3
- VGOALPIDEXVYQI-UHFFFAOYSA-N 3-(2-imidazo[1,2-b]pyridazin-3-ylethynyl)-n-[3-imidazol-1-yl-5-(trifluoromethyl)phenyl]-4-methylbenzamide Chemical compound C1=C(C#CC=2N3N=CC=CC3=NC=2)C(C)=CC=C1C(=O)NC(C=C(C=1)C(F)(F)F)=CC=1N1C=CN=C1 VGOALPIDEXVYQI-UHFFFAOYSA-N 0.000 description 3
- HNFMVVHMKGFCMB-UHFFFAOYSA-N 3-[3-[4-(1-aminocyclobutyl)phenyl]-5-phenylimidazo[4,5-b]pyridin-2-yl]pyridin-2-amine Chemical compound NC1=NC=CC=C1C1=NC2=CC=C(C=3C=CC=CC=3)N=C2N1C1=CC=C(C2(N)CCC2)C=C1 HNFMVVHMKGFCMB-UHFFFAOYSA-N 0.000 description 3
- UNSHMXUHOHBLIQ-UHFFFAOYSA-N 3-[4-chloro-3-(2-methylphenoxy)naphthalen-1-yl]-6-(trifluoromethyl)-1H-pyrimidine-2,4-dione Chemical compound ClC1=C(C=C(C2=CC=CC=C12)N1C(NC(=CC1=O)C(F)(F)F)=O)OC1=C(C=CC=C1)C UNSHMXUHOHBLIQ-UHFFFAOYSA-N 0.000 description 3
- HCLQARMRCPEALF-DNQXCXABSA-N 3-[[(2r)-2-[(1r)-2-[[1-(1-benzothiophen-2-yl)-2-methylpropan-2-yl]amino]-1-hydroxyethyl]pyrrolidin-1-yl]methyl]benzonitrile Chemical compound C([C@@H]1[C@H](O)CNC(C)(CC=2SC3=CC=CC=C3C=2)C)CCN1CC1=CC=CC(C#N)=C1 HCLQARMRCPEALF-DNQXCXABSA-N 0.000 description 3
- 125000004179 3-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(Cl)=C1[H] 0.000 description 3
- NVVPMZUGELHVMH-UHFFFAOYSA-N 3-ethyl-4-[4-[4-(1-methylpyrazol-4-yl)imidazol-1-yl]-3-propan-2-ylpyrazolo[3,4-b]pyridin-1-yl]benzamide Chemical compound CCC1=CC(C(N)=O)=CC=C1N1C2=NC=CC(N3C=C(N=C3)C3=CN(C)N=C3)=C2C(C(C)C)=N1 NVVPMZUGELHVMH-UHFFFAOYSA-N 0.000 description 3
- GHAWBARMICSLQS-UHFFFAOYSA-N 4,6-dichloro-2-methylsulfanyl-5-nitropyrimidine Chemical compound CSC1=NC(Cl)=C([N+]([O-])=O)C(Cl)=N1 GHAWBARMICSLQS-UHFFFAOYSA-N 0.000 description 3
- TXEBWPPWSVMYOA-UHFFFAOYSA-N 4-[3-[(1-amino-2-chloroethyl)amino]propyl]-1-[[3-(2-chlorophenyl)phenyl]methyl]-5-hydroxyimidazolidin-2-one Chemical compound NC(CCl)NCCCC1NC(=O)N(Cc2cccc(c2)-c2ccccc2Cl)C1O TXEBWPPWSVMYOA-UHFFFAOYSA-N 0.000 description 3
- WCDLCPLAAKUJNY-UHFFFAOYSA-N 4-[4-[3-(1h-pyrazol-4-yl)pyrazolo[1,5-a]pyrimidin-6-yl]phenyl]morpholine Chemical compound C1COCCN1C1=CC=C(C2=CN3N=CC(=C3N=C2)C2=CNN=C2)C=C1 WCDLCPLAAKUJNY-UHFFFAOYSA-N 0.000 description 3
- MFLMXRSHJVIMRF-DHIUTWEWSA-L 4-[[[5-[(3r,5r)-6-carboxylato-3,5-dihydroxyhexyl]-1-ethyl-4-(4-fluorophenyl)-3-methylpyrrole-2-carbonyl]amino]methyl]benzoate Chemical compound CCN1C(CC[C@@H](O)C[C@@H](O)CC([O-])=O)=C(C=2C=CC(F)=CC=2)C(C)=C1C(=O)NCC1=CC=C(C([O-])=O)C=C1 MFLMXRSHJVIMRF-DHIUTWEWSA-L 0.000 description 3
- VFRQJCXMZAJFNM-UHFFFAOYSA-N 4-amino-3-[(4-methylphenyl)methyl]-2-oxo-1h-imidazole-5-carbonitrile Chemical compound C1=CC(C)=CC=C1CN1C(=O)NC(C#N)=C1N VFRQJCXMZAJFNM-UHFFFAOYSA-N 0.000 description 3
- JJNLGGQLCGZEIB-UHFFFAOYSA-N 4-amino-3-benzyl-2-oxo-1h-imidazole-5-carbonitrile Chemical compound NC1=C(C#N)N=C(O)N1CC1=CC=CC=C1 JJNLGGQLCGZEIB-UHFFFAOYSA-N 0.000 description 3
- DLJHMBHVBDEAOX-UHFFFAOYSA-N 4-chloro-n,3-dimethylaniline Chemical compound CNC1=CC=C(Cl)C(C)=C1 DLJHMBHVBDEAOX-UHFFFAOYSA-N 0.000 description 3
- MVXAKOGJWVQPKC-UHFFFAOYSA-N 5-(3-ethynyl-5-fluorophenyl)-2-pyridin-2-yl-4,6,7,8-tetrahydro-[1,3]oxazolo[4,5-c]azepine Chemical compound FC1=CC(C#C)=CC(N2CC=3N=C(OC=3CCC2)C=2N=CC=CC=2)=C1 MVXAKOGJWVQPKC-UHFFFAOYSA-N 0.000 description 3
- ZDHQVQVNOIWLNX-UHFFFAOYSA-N 5-(7-chloro-10h-benzo[1,2]cyclohepta[2,4-c][1,3]thiazol-10-yl)-1-methyl-4-sulfanylidenepyrimidin-2-one Chemical compound S=C1NC(=O)N(C)C=C1C1C2=CC=C(Cl)C=C2C=CC2=C1N=CS2 ZDHQVQVNOIWLNX-UHFFFAOYSA-N 0.000 description 3
- OXVHQOPLGOPEQO-UHFFFAOYSA-N 5-(azidomethyl)-2-methylpyrimidine Chemical compound CC1=NC=C(CN=[N+]=[N-])C=N1 OXVHQOPLGOPEQO-UHFFFAOYSA-N 0.000 description 3
- WRRFKRBECKNCGX-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-9-(2-methylpropyl)-2-propylsulfanyl-7H-purin-8-one Chemical compound C(C(C)C)N1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC WRRFKRBECKNCGX-UHFFFAOYSA-N 0.000 description 3
- XDBHURGONHZNJF-UHFFFAOYSA-N 6-[2-(3,4-diethoxyphenyl)-1,3-thiazol-4-yl]pyridine-2-carboxylic acid Chemical compound C1=C(OCC)C(OCC)=CC=C1C1=NC(C=2N=C(C=CC=2)C(O)=O)=CS1 XDBHURGONHZNJF-UHFFFAOYSA-N 0.000 description 3
- GHUKPLITXIFSRK-UHFFFAOYSA-N 6-amino-2-ethylsulfanyl-9-[(4-fluorophenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCC)CC1=CC=C(C=C1)F)=O GHUKPLITXIFSRK-UHFFFAOYSA-N 0.000 description 3
- KAPQRBANZCFAFB-UHFFFAOYSA-N 6-amino-2-ethylsulfinyl-9-[(4-fluorophenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CC)CC1=CC=C(C=C1)F)=O KAPQRBANZCFAFB-UHFFFAOYSA-N 0.000 description 3
- OWHOVQKHZCNMAL-UHFFFAOYSA-N 6-amino-2-methylsulfanyl-9-(pyridin-3-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SC)CC=1C=NC=CC=1)=O OWHOVQKHZCNMAL-UHFFFAOYSA-N 0.000 description 3
- GJZIAFLOUZRSMO-UHFFFAOYSA-N 6-amino-2-methylsulfinyl-9-(pyridin-3-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C)CC=1C=NC=CC=1)=O GJZIAFLOUZRSMO-UHFFFAOYSA-N 0.000 description 3
- FWOGSCODNNTDOW-UHFFFAOYSA-N 6-amino-2-propylsulfanyl-9-[[4-(trifluoromethyl)phenyl]methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)C(F)(F)F)=O FWOGSCODNNTDOW-UHFFFAOYSA-N 0.000 description 3
- COTFBCNBTRCHOI-UHFFFAOYSA-N 6-amino-9-(2-methylpropyl)-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC(C)C)=O COTFBCNBTRCHOI-UHFFFAOYSA-N 0.000 description 3
- REAXDVUVMGLJJT-UHFFFAOYSA-N 6-amino-9-[(2,4-difluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=C(C=C(C=C1)F)F)=O REAXDVUVMGLJJT-UHFFFAOYSA-N 0.000 description 3
- GHNZGJFSLUTYGY-UHFFFAOYSA-N 6-amino-9-[(2-methylpyridin-4-yl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC1=CC(=NC=C1)C)=O GHNZGJFSLUTYGY-UHFFFAOYSA-N 0.000 description 3
- ZMNFFJHJNOPQLT-UHFFFAOYSA-N 6-amino-9-[(2-methylpyrimidin-5-yl)methyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=NC(=NC=1)C)=O ZMNFFJHJNOPQLT-UHFFFAOYSA-N 0.000 description 3
- CMOPSXCJQWZWNI-UHFFFAOYSA-N 6-amino-9-[(3,4-dichlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)Cl)Cl)=O CMOPSXCJQWZWNI-UHFFFAOYSA-N 0.000 description 3
- NXUYFJDQVXISPX-UHFFFAOYSA-N 6-amino-9-[(3-chlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=CC=C1)Cl)=O NXUYFJDQVXISPX-UHFFFAOYSA-N 0.000 description 3
- RIACPLVJPWLPJW-UHFFFAOYSA-N 6-amino-9-[(3-chlorophenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC(=CC=C1)Cl)=O RIACPLVJPWLPJW-UHFFFAOYSA-N 0.000 description 3
- YEOAWWOBFYFPBW-UHFFFAOYSA-N 6-amino-9-[(4-bromophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)Br)=O YEOAWWOBFYFPBW-UHFFFAOYSA-N 0.000 description 3
- SITQWHVVXNSHSG-UHFFFAOYSA-N 6-amino-9-[(4-chloro-3-fluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)Cl)F)=O SITQWHVVXNSHSG-UHFFFAOYSA-N 0.000 description 3
- LCZPJVDNHFISPW-UHFFFAOYSA-N 6-amino-9-[(4-chloro-3-methylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)Cl)C)=O LCZPJVDNHFISPW-UHFFFAOYSA-N 0.000 description 3
- PAAMUPBWXLCXNH-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-ethylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCC)CC1=CC=C(C=C1)Cl)=O PAAMUPBWXLCXNH-UHFFFAOYSA-N 0.000 description 3
- JAOGLXMHMAGPSB-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-ethylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CC)CC1=CC=C(C=C1)Cl)=O JAOGLXMHMAGPSB-UHFFFAOYSA-N 0.000 description 3
- NBHMULUYJAUPGF-UHFFFAOYSA-N 6-amino-9-[(4-fluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)F)=O NBHMULUYJAUPGF-UHFFFAOYSA-N 0.000 description 3
- WFPGKBGNSQAKOR-UHFFFAOYSA-N 6-amino-9-[(4-methylphenyl)methyl]-2-sulfanylidene-1,7-dihydropurin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S)CC1=CC=C(C=C1)C)=O WFPGKBGNSQAKOR-UHFFFAOYSA-N 0.000 description 3
- XTYSOULVGVCCTL-UHFFFAOYSA-N 6-amino-9-[(6-methylpyridin-3-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC(=CC=1)C)=O XTYSOULVGVCCTL-UHFFFAOYSA-N 0.000 description 3
- DFPKSCBPNVPRIY-UHFFFAOYSA-N 6-amino-9-benzyl-2-(cyclohexylmethylsulfinyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CC1CCCCC1)CC1=CC=CC=C1)=O DFPKSCBPNVPRIY-UHFFFAOYSA-N 0.000 description 3
- UYYSNQIRKWLHAD-UHFFFAOYSA-N 6-amino-9-benzyl-2-butylsulfanyl-7h-purin-8-one Chemical compound C12=NC(SCCCC)=NC(N)=C2N=C(O)N1CC1=CC=CC=C1 UYYSNQIRKWLHAD-UHFFFAOYSA-N 0.000 description 3
- AYHFCRLYOXQOIM-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-9-(pyridin-2-ylmethyl)-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SC)CC1=NC=CC=C1)=O AYHFCRLYOXQOIM-UHFFFAOYSA-N 0.000 description 3
- LJGIPYPDOABDLJ-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-9-(pyridin-3-ylmethyl)-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SC)CC=1C=NC=CC=1)=O LJGIPYPDOABDLJ-UHFFFAOYSA-N 0.000 description 3
- YPWGGFUUDUCVMW-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-9-(pyridin-4-ylmethyl)-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SC)CC1=CC=NC=C1)=O YPWGGFUUDUCVMW-UHFFFAOYSA-N 0.000 description 3
- WLQUEKUHGFEFBK-UHFFFAOYSA-N 6-chloro-2-propylsulfanyl-9-[[4-(trifluoromethyl)phenyl]methyl]-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)C(F)(F)F)=O WLQUEKUHGFEFBK-UHFFFAOYSA-N 0.000 description 3
- VVUGFKRMHUVWKW-UHFFFAOYSA-N 6-chloro-9-(2-methylpropyl)-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC(C)C)=O VVUGFKRMHUVWKW-UHFFFAOYSA-N 0.000 description 3
- VMRLPDGYMSGDAJ-UHFFFAOYSA-N 6-chloro-9-[(2,4-difluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=C(C=C(C=C1)F)F)=O VMRLPDGYMSGDAJ-UHFFFAOYSA-N 0.000 description 3
- ICHLHUJTUCTZOV-UHFFFAOYSA-N 6-chloro-9-[(3,4-dichlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)Cl)Cl)=O ICHLHUJTUCTZOV-UHFFFAOYSA-N 0.000 description 3
- BCVOPHQQQAQPJC-UHFFFAOYSA-N 6-chloro-9-[(3,4-difluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)F)F)=O BCVOPHQQQAQPJC-UHFFFAOYSA-N 0.000 description 3
- FELAQEZHOPNTLG-UHFFFAOYSA-N 6-chloro-9-[(3-chlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=CC=C1)Cl)=O FELAQEZHOPNTLG-UHFFFAOYSA-N 0.000 description 3
- RSSUZYSUKRLKJD-UHFFFAOYSA-N 6-chloro-9-[(4-chloro-3-fluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)Cl)F)=O RSSUZYSUKRLKJD-UHFFFAOYSA-N 0.000 description 3
- JDOBRVSTRUYTDL-UHFFFAOYSA-N 6-chloro-9-[(4-chloro-3-methylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=C(C=C1)Cl)C)=O JDOBRVSTRUYTDL-UHFFFAOYSA-N 0.000 description 3
- JMVGWDKXXPHGBQ-UHFFFAOYSA-N 6-chloro-9-[(4-chlorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)Cl)=O JMVGWDKXXPHGBQ-UHFFFAOYSA-N 0.000 description 3
- AFWDOXBIZKOMKO-UHFFFAOYSA-N 6-chloro-9-[(4-fluorophenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)F)=O AFWDOXBIZKOMKO-UHFFFAOYSA-N 0.000 description 3
- PBLOYQAQGYUPCM-UHFFFAOYSA-N 6-methylpyridine-3-carbonitrile Chemical compound CC1=CC=C(C#N)C=N1 PBLOYQAQGYUPCM-UHFFFAOYSA-N 0.000 description 3
- XTJZKALDRPVFSN-HNNXBMFYSA-N 8-n-[(2s)-3,3-dimethylbutan-2-yl]-2-n-[2-methoxy-4-(1-methylpyrazol-4-yl)phenyl]pyrido[3,4-d]pyrimidine-2,8-diamine Chemical compound C=1C=C(NC=2N=C3C(N[C@@H](C)C(C)(C)C)=NC=CC3=CN=2)C(OC)=CC=1C=1C=NN(C)C=1 XTJZKALDRPVFSN-HNNXBMFYSA-N 0.000 description 3
- MCMSJVMUSBZUCN-UHFFFAOYSA-N 9,10-dimethoxy-3-methyl-2-(2,4,6-trimethylphenyl)imino-6,7-dihydropyrimido[6,1-a]isoquinolin-4-one Chemical compound C1=2C=C(OC)C(OC)=CC=2CCN(C(N2C)=O)C1=CC2=NC1=C(C)C=C(C)C=C1C MCMSJVMUSBZUCN-UHFFFAOYSA-N 0.000 description 3
- JUQMATGKETVMOU-UHFFFAOYSA-N 9-[(4-bromophenyl)methyl]-6-chloro-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)Br)=O JUQMATGKETVMOU-UHFFFAOYSA-N 0.000 description 3
- IFWBZWHYVNRMMC-UHFFFAOYSA-N 9-benzyl-6-(cyclopropylamino)-2-propylsulfanyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC1CC1)SCCC IFWBZWHYVNRMMC-UHFFFAOYSA-N 0.000 description 3
- ATJCVTPFAIOTFI-UHFFFAOYSA-N 9-benzyl-6-(ethylamino)-2-propylsulfanyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NCC)SCCC ATJCVTPFAIOTFI-UHFFFAOYSA-N 0.000 description 3
- YSCLHWJXXFOWHI-UHFFFAOYSA-N 9-benzyl-6-(propan-2-ylamino)-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(C)C)S(=O)(=N)CCC YSCLHWJXXFOWHI-UHFFFAOYSA-N 0.000 description 3
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 3
- VWVKUNOPTJGDOB-BDHVOXNPSA-N Anhydrous tofogliflozin Chemical compound C1=CC(CC)=CC=C1CC1=CC=C(CO[C@@]23[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O3)O)C2=C1 VWVKUNOPTJGDOB-BDHVOXNPSA-N 0.000 description 3
- JAOGFYSXDYNYSX-UHFFFAOYSA-N CC(C)(C(N=CC(Cl)=C1)=C1C(C=CC(Cl)=C1)=C1N1C(C=C2)=CC=C2N(C2)CC2(CNC(CC2)CCC2C(O)=O)F)C1=O Chemical compound CC(C)(C(N=CC(Cl)=C1)=C1C(C=CC(Cl)=C1)=C1N1C(C=C2)=CC=C2N(C2)CC2(CNC(CC2)CCC2C(O)=O)F)C1=O JAOGFYSXDYNYSX-UHFFFAOYSA-N 0.000 description 3
- QCMHGCDOZLWPOT-FMNCTDSISA-N COC1=C(CC[C@@H]2CCC3=C(C2)C=CC(=C3)[C@H]2CC[C@](N)(CO)C2)C=CC=C1 Chemical compound COC1=C(CC[C@@H]2CCC3=C(C2)C=CC(=C3)[C@H]2CC[C@](N)(CO)C2)C=CC=C1 QCMHGCDOZLWPOT-FMNCTDSISA-N 0.000 description 3
- WUZBOJXXYMKMMF-UHFFFAOYSA-N COC1=CC2=NC=3N(C(N(C(C=3N2C=C1)=O)CCC)=O)CCCCNC(=O)C1=CC=C(C=C1)S(=O)(=O)F Chemical compound COC1=CC2=NC=3N(C(N(C(C=3N2C=C1)=O)CCC)=O)CCCCNC(=O)C1=CC=C(C=C1)S(=O)(=O)F WUZBOJXXYMKMMF-UHFFFAOYSA-N 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 229940126657 Compound 17 Drugs 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 101100501444 Escherichia phage P1 17 gene Proteins 0.000 description 3
- 101000652482 Homo sapiens TBC1 domain family member 8 Proteins 0.000 description 3
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 3
- 102000010168 Myeloid Differentiation Factor 88 Human genes 0.000 description 3
- 108010077432 Myeloid Differentiation Factor 88 Proteins 0.000 description 3
- WXCATEWRWJKDJL-UHFFFAOYSA-N N-(9-benzyl-8-oxo-2-propylsulfanyl-7H-purin-6-yl)pentanamide Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(CCCC)=O)SCCC WXCATEWRWJKDJL-UHFFFAOYSA-N 0.000 description 3
- XJEVQCHAETXVIB-UHFFFAOYSA-N N-(9-benzyl-8-oxo-2-propylsulfinyl-7H-purin-6-yl)pentanamide Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(CCCC)=O)S(=O)CCC XJEVQCHAETXVIB-UHFFFAOYSA-N 0.000 description 3
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 3
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 3
- HPKJGHVHQWJOOT-ZJOUEHCJSA-N N-[(2S)-3-cyclohexyl-1-oxo-1-({(2S)-1-oxo-3-[(3S)-2-oxopyrrolidin-3-yl]propan-2-yl}amino)propan-2-yl]-1H-indole-2-carboxamide Chemical compound C1C(CCCC1)C[C@H](NC(=O)C=1NC2=CC=CC=C2C=1)C(=O)N[C@@H](C[C@H]1C(=O)NCC1)C=O HPKJGHVHQWJOOT-ZJOUEHCJSA-N 0.000 description 3
- OHVIRCSJFFPEGC-XMMPIXPASA-N N-[3-[[4-[[(2R)-2-(hydroxymethyl)pyrrolidin-1-yl]methyl]phenyl]methoxy]phenyl]benzamide Chemical compound OC[C@H]1CCCN1Cc1ccc(COc2cccc(NC(=O)c3ccccc3)c2)cc1 OHVIRCSJFFPEGC-XMMPIXPASA-N 0.000 description 3
- KISZAGQTIXIVAR-UHFFFAOYSA-N OC(=O)c1ccc2c(CCCC(c3ccc(Cl)cc3Cl)=C2c2ccc(OC3CCN(CCCF)C3)cc2)c1 Chemical compound OC(=O)c1ccc2c(CCCC(c3ccc(Cl)cc3Cl)=C2c2ccc(OC3CCN(CCCF)C3)cc2)c1 KISZAGQTIXIVAR-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 238000011529 RT qPCR Methods 0.000 description 3
- 102100030302 TBC1 domain family member 8 Human genes 0.000 description 3
- KZVWEOXAPZXAFB-BQFCYCMXSA-N Temocaprilat Chemical compound C([C@H](N[C@H]1CS[C@@H](CN(C1=O)CC(=O)O)C=1SC=CC=1)C(O)=O)CC1=CC=CC=C1 KZVWEOXAPZXAFB-BQFCYCMXSA-N 0.000 description 3
- NPUXORBZRBIOMQ-RUZDIDTESA-N [(2R)-1-[[4-[[3-(benzenesulfonylmethyl)-5-methylphenoxy]methyl]phenyl]methyl]-2-pyrrolidinyl]methanol Chemical compound C=1C(OCC=2C=CC(CN3[C@H](CCC3)CO)=CC=2)=CC(C)=CC=1CS(=O)(=O)C1=CC=CC=C1 NPUXORBZRBIOMQ-RUZDIDTESA-N 0.000 description 3
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 3
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 3
- 230000003213 activating effect Effects 0.000 description 3
- SRVFFFJZQVENJC-IHRRRGAJSA-N aloxistatin Chemical compound CCOC(=O)[C@H]1O[C@@H]1C(=O)N[C@@H](CC(C)C)C(=O)NCCC(C)C SRVFFFJZQVENJC-IHRRRGAJSA-N 0.000 description 3
- 230000000840 anti-viral effect Effects 0.000 description 3
- CPEKAXYCDKETEN-UHFFFAOYSA-N benzoyl isothiocyanate Chemical compound S=C=NC(=O)C1=CC=CC=C1 CPEKAXYCDKETEN-UHFFFAOYSA-N 0.000 description 3
- AJRQIXBBIDPNGK-BVSLBCMMSA-N benzyl n-[(2s)-1-[[(2s)-1-(1,3-benzothiazol-2-yl)-1-oxo-3-[(3s)-2-oxopyrrolidin-3-yl]propan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]carbamate Chemical compound N([C@@H](CC(C)C)C(=O)N[C@@H](C[C@H]1C(NCC1)=O)C(=O)C=1SC2=CC=CC=C2N=1)C(=O)OCC1=CC=CC=C1 AJRQIXBBIDPNGK-BVSLBCMMSA-N 0.000 description 3
- OSVHLUXLWQLPIY-KBAYOESNSA-N butyl 2-[(6aR,9R,10aR)-1-hydroxy-9-(hydroxymethyl)-6,6-dimethyl-6a,7,8,9,10,10a-hexahydrobenzo[c]chromen-3-yl]-2-methylpropanoate Chemical compound C(CCC)OC(C(C)(C)C1=CC(=C2[C@H]3[C@H](C(OC2=C1)(C)C)CC[C@H](C3)CO)O)=O OSVHLUXLWQLPIY-KBAYOESNSA-N 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- AEULIVPVIDOLIN-UHFFFAOYSA-N cep-11981 Chemical compound C1=C2C3=C4CNC(=O)C4=C4C5=CN(C)N=C5CCC4=C3N(CC(C)C)C2=CC=C1NC1=NC=CC=N1 AEULIVPVIDOLIN-UHFFFAOYSA-N 0.000 description 3
- JQXXHWHPUNPDRT-BQVAUQFYSA-N chembl1523493 Chemical compound O([C@](C1=O)(C)O\C=C/[C@@H]([C@H]([C@@H](OC(C)=O)[C@H](C)[C@H](O)[C@H](C)[C@@H](O)[C@@H](C)/C=C\C=C(C)/C(=O)NC=2C(O)=C3C(O)=C4C)C)OC)C4=C1C3=C(O)C=2C=NN1CCN(C)CC1 JQXXHWHPUNPDRT-BQVAUQFYSA-N 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 229940127206 compound 14d Drugs 0.000 description 3
- 229940126212 compound 17a Drugs 0.000 description 3
- 229940126209 compound 43b Drugs 0.000 description 3
- 229940126211 compound 54c Drugs 0.000 description 3
- 229940125873 compound 60b Drugs 0.000 description 3
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 238000003818 flash chromatography Methods 0.000 description 3
- KUCDOJMOTMEEOF-UHFFFAOYSA-N gtpl6345 Chemical compound C1=CC(OC)=CC=C1N1C(=O)C(SC=2C3=C4NCCOC4=CN=2)=C3N=C1 KUCDOJMOTMEEOF-UHFFFAOYSA-N 0.000 description 3
- FODONWGPMXPGNC-UHFFFAOYSA-N gtpl6346 Chemical compound C1=CC(Cl)=CC=C1N1C(=O)C(SC=2C3=C4NCCOC4=CN=2)=C3N=C1 FODONWGPMXPGNC-UHFFFAOYSA-N 0.000 description 3
- 210000003494 hepatocyte Anatomy 0.000 description 3
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical compound CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 3
- UIBNRGRUBIMSKX-UHFFFAOYSA-N methyl 4-[(6-chloro-8-oxo-2-propylsulfanyl-7H-purin-9-yl)methyl]benzoate Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C(=O)OC)C=C1)=O UIBNRGRUBIMSKX-UHFFFAOYSA-N 0.000 description 3
- LVDLXEFCWOMUGO-UHFFFAOYSA-N n,6-dimethylpyridin-3-amine Chemical compound CNC1=CC=C(C)N=C1 LVDLXEFCWOMUGO-UHFFFAOYSA-N 0.000 description 3
- SKEAGJWUKCNICJ-LSDHHAIUSA-N n-[(4-fluoro-3-methoxyphenyl)methyl]-6-[2-[[(2s,5r)-5-(hydroxymethyl)-1,4-dioxan-2-yl]methyl]tetrazol-5-yl]-2-methylpyrimidine-4-carboxamide Chemical compound C1=C(F)C(OC)=CC(CNC(=O)C=2N=C(C)N=C(C=2)C2=NN(C[C@@H]3OC[C@@H](CO)OC3)N=N2)=C1 SKEAGJWUKCNICJ-LSDHHAIUSA-N 0.000 description 3
- NFPUARSXIMWASK-GOEBONIOSA-N n-[(5r,7s)-2-(3-chlorophenyl)-1-oxa-3-azaspiro[4.5]dec-2-en-7-yl]acetamide Chemical compound C1[C@@H](NC(=O)C)CCC[C@@]11OC(C=2C=C(Cl)C=CC=2)=NC1 NFPUARSXIMWASK-GOEBONIOSA-N 0.000 description 3
- PHVXTQIROLEEDB-UHFFFAOYSA-N n-[2-(2-chlorophenyl)ethyl]-4-[[3-(2-methylphenyl)piperidin-1-yl]methyl]-n-pyrrolidin-3-ylbenzamide Chemical compound CC1=CC=CC=C1C1CN(CC=2C=CC(=CC=2)C(=O)N(CCC=2C(=CC=CC=2)Cl)C2CNCC2)CCC1 PHVXTQIROLEEDB-UHFFFAOYSA-N 0.000 description 3
- MUJNAWXXOJRNGK-UHFFFAOYSA-N n-[3-(6-methyl-1,2,3,4-tetrahydrocarbazol-9-yl)propyl]cyclohexanamine Chemical compound C1=2CCCCC=2C2=CC(C)=CC=C2N1CCCNC1CCCCC1 MUJNAWXXOJRNGK-UHFFFAOYSA-N 0.000 description 3
- CJPMSUUANYLPET-UHFFFAOYSA-N n-[3-[[5-cyclopropyl-2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]amino]propyl]cyclobutanecarboxamide Chemical compound C1CCC1C(=O)NCCCNC(C(=CN=1)C2CC2)=NC=1NC(C=C1)=CC=C1N1CCOCC1 CJPMSUUANYLPET-UHFFFAOYSA-N 0.000 description 3
- MUWDEQLPHWVPPA-GOTSBHOMSA-N n-[6-oxo-6-[(3s,4s)-3-[(4-phenoxyphenyl)sulfonylamino]-4-sulfanylpyrrolidin-1-yl]hexyl]acetamide Chemical compound C1N(C(=O)CCCCCNC(=O)C)C[C@H](S)[C@H]1NS(=O)(=O)C(C=C1)=CC=C1OC1=CC=CC=C1 MUWDEQLPHWVPPA-GOTSBHOMSA-N 0.000 description 3
- YRCHYHRCBXNYNU-UHFFFAOYSA-N n-[[3-fluoro-4-[2-[5-[(2-methoxyethylamino)methyl]pyridin-2-yl]thieno[3,2-b]pyridin-7-yl]oxyphenyl]carbamothioyl]-2-(4-fluorophenyl)acetamide Chemical compound N1=CC(CNCCOC)=CC=C1C1=CC2=NC=CC(OC=3C(=CC(NC(=S)NC(=O)CC=4C=CC(F)=CC=4)=CC=3)F)=C2S1 YRCHYHRCBXNYNU-UHFFFAOYSA-N 0.000 description 3
- LVBWRNKEBGYENR-UHFFFAOYSA-N n-cyclopropyl-4-[8-(oxan-4-ylmethylamino)-6-[(1,1,1-trifluoro-2-methylpropan-2-yl)amino]imidazo[1,2-b]pyridazin-3-yl]benzamide Chemical compound C12=NC=C(C=3C=CC(=CC=3)C(=O)NC3CC3)N2N=C(NC(C)(C)C(F)(F)F)C=C1NCC1CCOCC1 LVBWRNKEBGYENR-UHFFFAOYSA-N 0.000 description 3
- ASOADIZOVZTJSR-UHFFFAOYSA-N opicapone Chemical compound CC1=C(Cl)C(C)=[N+]([O-])C(Cl)=C1C1=NOC(C=2C=C(C(O)=C(O)C=2)[N+]([O-])=O)=N1 ASOADIZOVZTJSR-UHFFFAOYSA-N 0.000 description 3
- 239000012074 organic phase Substances 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 3
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 239000011591 potassium Substances 0.000 description 3
- 229910052700 potassium Inorganic materials 0.000 description 3
- WGYKZJWCGVVSQN-UHFFFAOYSA-N propylamine Chemical compound CCCN WGYKZJWCGVVSQN-UHFFFAOYSA-N 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- RWWYLEGWBNMMLJ-YSOARWBDSA-N remdesivir Chemical compound NC1=NC=NN2C1=CC=C2[C@]1([C@@H]([C@@H]([C@H](O1)CO[P@](=O)(OC1=CC=CC=C1)N[C@H](C(=O)OCC(CC)CC)C)O)O)C#N RWWYLEGWBNMMLJ-YSOARWBDSA-N 0.000 description 3
- 229960001225 rifampicin Drugs 0.000 description 3
- 238000007363 ring formation reaction Methods 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 239000011550 stock solution Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- HHVIBTZHLRERCL-UHFFFAOYSA-N sulfonyldimethane Chemical compound CS(C)(=O)=O HHVIBTZHLRERCL-UHFFFAOYSA-N 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- YKEGUYTXACKXKS-IRXDYDNUSA-N tert-butyl (1s,5s)-3-[5-methyl-6-(2-methylpyridin-3-yl)oxypyrimidin-4-yl]oxy-8-azabicyclo[3.2.1]octane-8-carboxylate Chemical compound CC1=NC=CC=C1OC1=NC=NC(OC2C[C@@H]3CC[C@H](N3C(=O)OC(C)(C)C)C2)=C1C YKEGUYTXACKXKS-IRXDYDNUSA-N 0.000 description 3
- JYRWUSXRTGACLY-UHFFFAOYSA-N tert-butyl 4-[[3-(4-methylsulfonylphenyl)-[1,2]oxazolo[4,5-d]pyrimidin-7-yl]oxy]piperidine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)CCC1OC1=NC=NC2=C1ON=C2C1=CC=C(S(C)(=O)=O)C=C1 JYRWUSXRTGACLY-UHFFFAOYSA-N 0.000 description 3
- FRACPXUHUTXLCX-BELIEFIBSA-N tert-butyl N-{1-[(1S)-1-{[(1R,2S)-1-(benzylcarbamoyl)-1-hydroxy-3-[(3S)-2-oxopyrrolidin-3-yl]propan-2-yl]carbamoyl}-2-cyclopropylethyl]-2-oxopyridin-3-yl}carbamate Chemical compound CC(C)(C)OC(=O)NC1=CC=CN(C1=O)[C@@H](CC2CC2)C(=O)N[C@@H](C[C@@H]3CCNC3=O)[C@H](C(=O)NCC4=CC=CC=C4)O FRACPXUHUTXLCX-BELIEFIBSA-N 0.000 description 3
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 3
- 125000003774 valeryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 239000003643 water by type Substances 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 2
- GCTFTMWXZFLTRR-GFCCVEGCSA-N (2r)-2-amino-n-[3-(difluoromethoxy)-4-(1,3-oxazol-5-yl)phenyl]-4-methylpentanamide Chemical compound FC(F)OC1=CC(NC(=O)[C@H](N)CC(C)C)=CC=C1C1=CN=CO1 GCTFTMWXZFLTRR-GFCCVEGCSA-N 0.000 description 2
- HMTSWYPNXFHGEP-UHFFFAOYSA-N (4-methylphenyl)methanamine Chemical compound CC1=CC=C(CN)C=C1 HMTSWYPNXFHGEP-UHFFFAOYSA-N 0.000 description 2
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 2
- CYNYIHKIEHGYOZ-UHFFFAOYSA-N 1-bromopropane Chemical compound CCCBr CYNYIHKIEHGYOZ-UHFFFAOYSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- JEXYCADTAFPULN-UHFFFAOYSA-N 1-propylsulfonylpropane Chemical compound CCCS(=O)(=O)CCC JEXYCADTAFPULN-UHFFFAOYSA-N 0.000 description 2
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- WOXFMYVTSLAQMO-UHFFFAOYSA-N 2-Pyridinemethanamine Chemical compound NCC1=CC=CC=N1 WOXFMYVTSLAQMO-UHFFFAOYSA-N 0.000 description 2
- KDSNLYIMUZNERS-UHFFFAOYSA-N 2-methylpropanamine Chemical compound CC(C)CN KDSNLYIMUZNERS-UHFFFAOYSA-N 0.000 description 2
- OVBFMEVBMNZIBR-UHFFFAOYSA-N 2-methylvaleric acid Chemical compound CCCC(C)C(O)=O OVBFMEVBMNZIBR-UHFFFAOYSA-N 0.000 description 2
- LBJANQPGPWNJTJ-UHFFFAOYSA-N 4-[(6-amino-8-oxo-2-propylsulfanyl-7H-purin-9-yl)methyl]benzamide Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C(=O)N)C=C1)=O LBJANQPGPWNJTJ-UHFFFAOYSA-N 0.000 description 2
- WBQWVGJKURKLHU-UHFFFAOYSA-N 4-amino-3-[(4-methoxyphenyl)methyl]-2-oxo-1h-imidazole-5-carbonitrile Chemical compound C1=CC(OC)=CC=C1CN1C(=O)NC(C#N)=C1N WBQWVGJKURKLHU-UHFFFAOYSA-N 0.000 description 2
- NHWTUJPCXDRQNF-UHFFFAOYSA-N 4-chloro-3-methylbenzamide Chemical compound CC1=CC(C(N)=O)=CC=C1Cl NHWTUJPCXDRQNF-UHFFFAOYSA-N 0.000 description 2
- MMZMROHDQCJAJT-UHFFFAOYSA-N 4-chloro-4-oxobutanoic acid Chemical compound OC(=O)CCC(Cl)=O MMZMROHDQCJAJT-UHFFFAOYSA-N 0.000 description 2
- VLWRKVBQUANIGI-UHFFFAOYSA-N 4-fluoro-n-methylaniline Chemical compound CNC1=CC=C(F)C=C1 VLWRKVBQUANIGI-UHFFFAOYSA-N 0.000 description 2
- SUBDBMMJDZJVOS-UHFFFAOYSA-N 5-methoxy-2-{[(4-methoxy-3,5-dimethylpyridin-2-yl)methyl]sulfinyl}-1H-benzimidazole Chemical compound N=1C2=CC(OC)=CC=C2NC=1S(=O)CC1=NC=C(C)C(OC)=C1C SUBDBMMJDZJVOS-UHFFFAOYSA-N 0.000 description 2
- DBMPIOFKGCJGNJ-UHFFFAOYSA-N 6-amino-2-(3-chloropropylsulfanyl)-9-[(4-methoxyphenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCCCl)CC1=CC=C(C=C1)OC)=O DBMPIOFKGCJGNJ-UHFFFAOYSA-N 0.000 description 2
- WZLWMPJFCVDACR-UHFFFAOYSA-N 6-amino-2-(3-chloropropylsulfinyl)-9-[(4-methoxyphenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCCCl)CC1=CC=C(C=C1)OC)=O WZLWMPJFCVDACR-UHFFFAOYSA-N 0.000 description 2
- KSYPYLZXEACSIR-UHFFFAOYSA-N 6-amino-2-(propylsulfonimidoyl)-9-(pyrimidin-5-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CC=1C=NC=NC=1)=O KSYPYLZXEACSIR-UHFFFAOYSA-N 0.000 description 2
- LHRSFBRLPAJSMK-UHFFFAOYSA-N 6-amino-2-ethylsulfanyl-9-[(4-methylphenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCC)CC1=CC=C(C=C1)C)=O LHRSFBRLPAJSMK-UHFFFAOYSA-N 0.000 description 2
- IXERKOMQMNLWAX-UHFFFAOYSA-N 6-amino-2-ethylsulfinyl-9-[(4-methylphenyl)methyl]-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CC)CC1=CC=C(C=C1)C)=O IXERKOMQMNLWAX-UHFFFAOYSA-N 0.000 description 2
- YMHLABHVGRFDEB-UHFFFAOYSA-N 6-amino-2-methylsulfanyl-9-(pyridin-2-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SC)CC1=NC=CC=C1)=O YMHLABHVGRFDEB-UHFFFAOYSA-N 0.000 description 2
- CTOBGOYAJNXTEK-UHFFFAOYSA-N 6-amino-2-methylsulfanyl-9-(pyridin-4-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SC)CC1=CC=NC=C1)=O CTOBGOYAJNXTEK-UHFFFAOYSA-N 0.000 description 2
- DKVUFKHNPXDUEA-UHFFFAOYSA-N 6-amino-2-methylsulfinyl-9-(pyridin-2-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C)CC1=NC=CC=C1)=O DKVUFKHNPXDUEA-UHFFFAOYSA-N 0.000 description 2
- XQIXBJPSZOOHPE-UHFFFAOYSA-N 6-amino-2-methylsulfinyl-9-(pyridin-4-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C)CC1=CC=NC=C1)=O XQIXBJPSZOOHPE-UHFFFAOYSA-N 0.000 description 2
- XZRDJQIOVPPCBM-UHFFFAOYSA-N 6-amino-9-(2-methylpropyl)-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC(C)C)=O XZRDJQIOVPPCBM-UHFFFAOYSA-N 0.000 description 2
- JYEGCOQQEWQOMI-UHFFFAOYSA-N 6-amino-9-[(2,4-difluorophenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=C(C=C(C=C1)F)F)=O JYEGCOQQEWQOMI-UHFFFAOYSA-N 0.000 description 2
- AKYNQXFQVZXKTE-UHFFFAOYSA-N 6-amino-9-[(2-methylpyridin-4-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=NC=C1)C)=O AKYNQXFQVZXKTE-UHFFFAOYSA-N 0.000 description 2
- HJPNICYHBIWMIN-UHFFFAOYSA-N 6-amino-9-[(3-chloro-4-methylphenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC(=C(C=C1)C)Cl)=O HJPNICYHBIWMIN-UHFFFAOYSA-N 0.000 description 2
- YBRNOHZENVVILZ-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-methylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C)CC1=CC=C(C=C1)Cl)=O YBRNOHZENVVILZ-UHFFFAOYSA-N 0.000 description 2
- MRXWPJFERAESDD-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C=C1)Cl)=O MRXWPJFERAESDD-UHFFFAOYSA-N 0.000 description 2
- CIJFULQSEGMRNI-UHFFFAOYSA-N 6-amino-9-[(4-fluorophenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C=C1)F)=O CIJFULQSEGMRNI-UHFFFAOYSA-N 0.000 description 2
- FXQAYXPLOMMSDA-UHFFFAOYSA-N 6-amino-9-[(4-fluorophenyl)methyl]-2-sulfanylidene-1,7-dihydropurin-8-one Chemical compound OC1=NC=2C(N)=NC(S)=NC=2N1CC1=CC=C(F)C=C1 FXQAYXPLOMMSDA-UHFFFAOYSA-N 0.000 description 2
- FLASPAQGZOEWHF-UHFFFAOYSA-N 6-amino-9-[(4-methoxyphenyl)methyl]-2-methylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SC)CC1=CC=C(C=C1)OC)=O FLASPAQGZOEWHF-UHFFFAOYSA-N 0.000 description 2
- FATSPKACVVCXGN-UHFFFAOYSA-N 6-amino-9-[(4-methylphenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C=C1)C)=O FATSPKACVVCXGN-UHFFFAOYSA-N 0.000 description 2
- CDHYXPUAMUVANH-UHFFFAOYSA-N 6-amino-9-[(4-methylsulfonylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)S(=O)(=O)C)=O CDHYXPUAMUVANH-UHFFFAOYSA-N 0.000 description 2
- QMUUHLBGKXHOMV-UHFFFAOYSA-N 6-amino-9-[(6-chloropyridin-3-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC(=CC=1)Cl)=O QMUUHLBGKXHOMV-UHFFFAOYSA-N 0.000 description 2
- TWIUELNOSZKELU-UHFFFAOYSA-N 6-amino-9-[(6-chloropyridin-3-yl)methyl]-2-sulfanylidene-1,7-dihydropurin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S)CC=1C=NC(=CC=1)Cl)=O TWIUELNOSZKELU-UHFFFAOYSA-N 0.000 description 2
- KOWJQKOPIUCLLW-UHFFFAOYSA-N 6-amino-9-[(6-methylpyridin-3-yl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC=1C=NC(=CC=1)C)=O KOWJQKOPIUCLLW-UHFFFAOYSA-N 0.000 description 2
- BMIUMQBNFDNIMK-UHFFFAOYSA-N 6-amino-9-benzyl-2-(2-methoxyethylsulfanyl)-7h-purin-8-one Chemical compound C12=NC(SCCOC)=NC(N)=C2N=C(O)N1CC1=CC=CC=C1 BMIUMQBNFDNIMK-UHFFFAOYSA-N 0.000 description 2
- QJEZJZYVQKNOII-UHFFFAOYSA-N 6-amino-9-benzyl-2-butan-2-ylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C(C)CC)CC1=CC=CC=C1)=O QJEZJZYVQKNOII-UHFFFAOYSA-N 0.000 description 2
- RVOTWKKVMSPCLK-UHFFFAOYSA-N 6-amino-9-benzyl-2-propan-2-ylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C(C)C)CC1=CC=CC=C1)=O RVOTWKKVMSPCLK-UHFFFAOYSA-N 0.000 description 2
- QXUVSSHJGKGJNJ-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-4-N-(pyridin-3-ylmethyl)pyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SC)NCC=1C=NC=CC=1)N QXUVSSHJGKGJNJ-UHFFFAOYSA-N 0.000 description 2
- WNRUNFGVYGGGEW-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-4-N-(pyridin-4-ylmethyl)pyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SC)NCC1=CC=NC=C1)N WNRUNFGVYGGGEW-UHFFFAOYSA-N 0.000 description 2
- CXIZBZRUTNLIFN-UHFFFAOYSA-N 6-chloro-9-[(4-methylsulfonylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)S(=O)(=O)C)=O CXIZBZRUTNLIFN-UHFFFAOYSA-N 0.000 description 2
- WNIFXTZUXYGFQT-UHFFFAOYSA-N 6-chloro-9-[(6-methylpyridin-3-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC(=CC=1)C)=O WNIFXTZUXYGFQT-UHFFFAOYSA-N 0.000 description 2
- HUEILCRXENNYJE-UHFFFAOYSA-N 6-chloro-N-[(2,4-difluorophenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=C(C=C(C=C1)F)F)[N+](=O)[O-] HUEILCRXENNYJE-UHFFFAOYSA-N 0.000 description 2
- YPDSIEMYVQERLJ-UHFFFAOYSA-N 8-Hydroxypurine Chemical compound C1=NC=C2NC(O)=NC2=N1 YPDSIEMYVQERLJ-UHFFFAOYSA-N 0.000 description 2
- GCKJISLYRYLNAR-UHFFFAOYSA-N 9-benzyl-6-(cyclopropylamino)-2-propylsulfinyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC1CC1)S(=O)CCC GCKJISLYRYLNAR-UHFFFAOYSA-N 0.000 description 2
- TWWIKYSVNRCTOK-UHFFFAOYSA-N 9-benzyl-6-(ethylamino)-2-propylsulfinyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NCC)S(=O)CCC TWWIKYSVNRCTOK-UHFFFAOYSA-N 0.000 description 2
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical compound CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 206010048610 Cardiotoxicity Diseases 0.000 description 2
- 102000004328 Cytochrome P-450 CYP3A Human genes 0.000 description 2
- 108010081668 Cytochrome P-450 CYP3A Proteins 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 101710142246 External core antigen Proteins 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 2
- 229930182566 Gentamicin Natural products 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 239000007821 HATU Substances 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 102000007576 Interferon Regulatory Factor-7 Human genes 0.000 description 2
- 108010032036 Interferon Regulatory Factor-7 Proteins 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 229930182816 L-glutamine Natural products 0.000 description 2
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- 101000574441 Mus musculus Alkaline phosphatase, germ cell type Proteins 0.000 description 2
- SZOLEYUWCQFUIF-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-propylsulfanyl-7H-purin-6-yl]-2-propylpentanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(CCC)CCC)=O)SCCC SZOLEYUWCQFUIF-UHFFFAOYSA-N 0.000 description 2
- 102000003945 NF-kappa B Human genes 0.000 description 2
- 108010057466 NF-kappa B Proteins 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 239000007832 Na2SO4 Substances 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 2
- NPXOKRUENSOPAO-UHFFFAOYSA-N Raney nickel Chemical compound [Al].[Ni] NPXOKRUENSOPAO-UHFFFAOYSA-N 0.000 description 2
- 108700008625 Reporter Genes Proteins 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229940124614 TLR 8 agonist Drugs 0.000 description 2
- 108010060825 Toll-Like Receptor 7 Proteins 0.000 description 2
- 102000008236 Toll-Like Receptor 7 Human genes 0.000 description 2
- 229940123384 Toll-like receptor (TLR) agonist Drugs 0.000 description 2
- 208000018452 Torsade de pointes Diseases 0.000 description 2
- 208000002363 Torsades de Pointes Diseases 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 150000001263 acyl chlorides Chemical class 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 125000004457 alkyl amino carbonyl group Chemical group 0.000 description 2
- 230000029936 alkylation Effects 0.000 description 2
- 238000005804 alkylation reaction Methods 0.000 description 2
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical compound NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 2
- 150000001244 carboxylic acid anhydrides Chemical class 0.000 description 2
- 231100000259 cardiotoxicity Toxicity 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 229940125900 compound 59 Drugs 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 125000004093 cyano group Chemical group *C#N 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 229960002518 gentamicin Drugs 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 229940093915 gynecological organic acid Drugs 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 230000035876 healing Effects 0.000 description 2
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 2
- 229960002885 histidine Drugs 0.000 description 2
- 102000045715 human TLR7 Human genes 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 239000005457 ice water Substances 0.000 description 2
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 2
- 238000000099 in vitro assay Methods 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 230000015788 innate immune response Effects 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000004310 lactic acid Substances 0.000 description 2
- 235000014655 lactic acid Nutrition 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 238000002514 liquid chromatography mass spectrum Methods 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- 235000011147 magnesium chloride Nutrition 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000001630 malic acid Substances 0.000 description 2
- 235000011090 malic acid Nutrition 0.000 description 2
- 229960002510 mandelic acid Drugs 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- IRHUOBBBQIWSET-UHFFFAOYSA-N methyl 4-[(6-amino-8-oxo-2-propylsulfinyl-7H-purin-9-yl)methyl]benzoate Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C(=O)OC)C=C1)=O IRHUOBBBQIWSET-UHFFFAOYSA-N 0.000 description 2
- 229940095102 methyl benzoate Drugs 0.000 description 2
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 2
- 230000003228 microsomal effect Effects 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 230000007886 mutagenicity Effects 0.000 description 2
- 231100000299 mutagenicity Toxicity 0.000 description 2
- HCUFKIUYBRJORR-UHFFFAOYSA-N n,2-dimethylpyridin-4-amine Chemical compound CNC1=CC=NC(C)=C1 HCUFKIUYBRJORR-UHFFFAOYSA-N 0.000 description 2
- GVOISEJVFFIGQE-YCZSINBZSA-N n-[(1r,2s,5r)-5-[methyl(propan-2-yl)amino]-2-[(3s)-2-oxo-3-[[6-(trifluoromethyl)quinazolin-4-yl]amino]pyrrolidin-1-yl]cyclohexyl]acetamide Chemical compound CC(=O)N[C@@H]1C[C@H](N(C)C(C)C)CC[C@@H]1N1C(=O)[C@@H](NC=2C3=CC(=CC=C3N=CN=2)C(F)(F)F)CC1 GVOISEJVFFIGQE-YCZSINBZSA-N 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 229960000381 omeprazole Drugs 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- DDBREPKUVSBGFI-UHFFFAOYSA-N phenobarbital Chemical compound C=1C=CC=CC=1C1(CC)C(=O)NC(=O)NC1=O DDBREPKUVSBGFI-UHFFFAOYSA-N 0.000 description 2
- 229960002695 phenobarbital Drugs 0.000 description 2
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 230000036470 plasma concentration Effects 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000011533 pre-incubation Methods 0.000 description 2
- 238000002541 precursor ion scan Methods 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 238000007423 screening assay Methods 0.000 description 2
- 238000013207 serial dilution Methods 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 125000001302 tertiary amino group Chemical group 0.000 description 2
- YAPQBXQYLJRXSA-UHFFFAOYSA-N theobromine Chemical compound CN1C(=O)NC(=O)C2=C1N=CN2C YAPQBXQYLJRXSA-UHFFFAOYSA-N 0.000 description 2
- 239000003970 toll like receptor agonist Substances 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 1
- IXHNFOOSLAWRBQ-UHFFFAOYSA-N (3,4-dichlorophenyl)methanamine Chemical compound NCC1=CC=C(Cl)C(Cl)=C1 IXHNFOOSLAWRBQ-UHFFFAOYSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- XPARFBOWIYMLMY-UHFFFAOYSA-N (6-chloropyridin-3-yl)methanamine Chemical compound NCC1=CC=C(Cl)N=C1 XPARFBOWIYMLMY-UHFFFAOYSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- RKOUFQLNMRAACI-UHFFFAOYSA-N 1,1,1-trifluoro-2-iodoethane Chemical compound FC(F)(F)CI RKOUFQLNMRAACI-UHFFFAOYSA-N 0.000 description 1
- ATUOYWHBWRKTHZ-QDNHWIQGSA-N 1,3-dideuteriopropane Chemical compound [2H]CCC[2H] ATUOYWHBWRKTHZ-QDNHWIQGSA-N 0.000 description 1
- DJMOXMNDXFFONV-UHFFFAOYSA-N 1,3-dimethyl-7-[2-(n-methylanilino)ethyl]purine-2,6-dione Chemical compound C1=NC=2N(C)C(=O)N(C)C(=O)C=2N1CCN(C)C1=CC=CC=C1 DJMOXMNDXFFONV-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- FBFJOZZTIXSPPR-UHFFFAOYSA-N 1-(4-aminobutyl)-2-(ethoxymethyl)imidazo[4,5-c]quinolin-4-amine Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CCCCN)C3=C(N)N=C21 FBFJOZZTIXSPPR-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- YZUPZGFPHUVJKC-UHFFFAOYSA-N 1-bromo-2-methoxyethane Chemical compound COCCBr YZUPZGFPHUVJKC-UHFFFAOYSA-N 0.000 description 1
- CEVMYGZHEJSOHZ-UHFFFAOYSA-N 1-bromo-3-methoxypropane Chemical compound COCCCBr CEVMYGZHEJSOHZ-UHFFFAOYSA-N 0.000 description 1
- MPPPKRYCTPRNTB-UHFFFAOYSA-N 1-bromobutane Chemical compound CCCCBr MPPPKRYCTPRNTB-UHFFFAOYSA-N 0.000 description 1
- VSTXCZGEEVFJES-UHFFFAOYSA-N 1-cycloundecyl-1,5-diazacycloundec-5-ene Chemical compound C1CCCCCC(CCCC1)N1CCCCCC=NCCC1 VSTXCZGEEVFJES-UHFFFAOYSA-N 0.000 description 1
- KEFWGYBCLBXCDA-UHFFFAOYSA-N 1-methoxy-3-(3-methoxypropylsulfonyl)propane Chemical compound COCCCS(=O)(=O)CCCOC KEFWGYBCLBXCDA-UHFFFAOYSA-N 0.000 description 1
- ZBONBGOYILUGCL-UHFFFAOYSA-N 2,2-dimethylpropanoate Chemical compound CC(C)([CH2+])C([O-])=O ZBONBGOYILUGCL-UHFFFAOYSA-N 0.000 description 1
- RPGDVPAENGWKAO-UHFFFAOYSA-N 2,4-difluoro-n-methylaniline Chemical compound CNC1=CC=C(F)C=C1F RPGDVPAENGWKAO-UHFFFAOYSA-N 0.000 description 1
- FALRKNHUBBKYCC-UHFFFAOYSA-N 2-(chloromethyl)pyridine-3-carbonitrile Chemical compound ClCC1=NC=CC=C1C#N FALRKNHUBBKYCC-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- NPRYCHLHHVWLQZ-TURQNECASA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynylpurin-8-one Chemical compound NC1=NC=C2N(C(N(C2=N1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C NPRYCHLHHVWLQZ-TURQNECASA-N 0.000 description 1
- QRXBTPFMCTXCRD-UHFFFAOYSA-N 2-chloropyridine-4-carbonitrile Chemical compound ClC1=CC(C#N)=CC=N1 QRXBTPFMCTXCRD-UHFFFAOYSA-N 0.000 description 1
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 1
- 229940013085 2-diethylaminoethanol Drugs 0.000 description 1
- YCURDTPXHPXCKH-UHFFFAOYSA-N 2-ethylbutanoyl 2-ethylbutanoate Chemical compound CCC(CC)C(=O)OC(=O)C(CC)CC YCURDTPXHPXCKH-UHFFFAOYSA-N 0.000 description 1
- 125000004777 2-fluoroethyl group Chemical group [H]C([H])(F)C([H])([H])* 0.000 description 1
- WRTPVONNQPWNRH-UHFFFAOYSA-N 2-methylbutanoyl 2-methylbutanoate Chemical compound CCC(C)C(=O)OC(=O)C(C)CC WRTPVONNQPWNRH-UHFFFAOYSA-N 0.000 description 1
- WLJVXDMOQOGPHL-PPJXEINESA-N 2-phenylacetic acid Chemical compound O[14C](=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-PPJXEINESA-N 0.000 description 1
- SULGSLUIIZBEEN-UHFFFAOYSA-N 3,4-difluoro-n-methylaniline Chemical compound CNC1=CC=C(F)C(F)=C1 SULGSLUIIZBEEN-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- ODZCKFNCAFHXRG-UHFFFAOYSA-N 3-[(6-amino-8-oxo-2-propylsulfanyl-7H-purin-9-yl)methyl]benzonitrile Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=C(C#N)C=CC=1)=O ODZCKFNCAFHXRG-UHFFFAOYSA-N 0.000 description 1
- UGLXOFQQLROLFX-UHFFFAOYSA-N 3-[(6-amino-8-oxo-2-propylsulfinyl-7H-purin-9-yl)methyl]benzonitrile Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC=1C=C(C#N)C=CC=1)=O UGLXOFQQLROLFX-UHFFFAOYSA-N 0.000 description 1
- WSFZCPSHUKUTFD-UHFFFAOYSA-N 3-[(6-chloro-8-oxo-2-propylsulfanyl-7H-purin-9-yl)methyl]benzonitrile Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=C(C#N)C=CC=1)=O WSFZCPSHUKUTFD-UHFFFAOYSA-N 0.000 description 1
- GRUPMMBRLDBTDD-UHFFFAOYSA-N 3-[2-(2-methyl-1,3-thiazol-4-yl)ethynyl]benzonitrile Chemical compound S1C(C)=NC(C#CC=2C=C(C=CC=2)C#N)=C1 GRUPMMBRLDBTDD-UHFFFAOYSA-N 0.000 description 1
- XYLHEQDKJGBQSZ-UHFFFAOYSA-N 3-[[(5-amino-6-chloro-2-propylsulfanylpyrimidin-4-yl)amino]methyl]benzonitrile Chemical compound NC=1C(=NC(=NC=1Cl)SCCC)NCC=1C=C(C#N)C=CC=1 XYLHEQDKJGBQSZ-UHFFFAOYSA-N 0.000 description 1
- HBVIITUOCCASKD-UHFFFAOYSA-N 3-[[(6-chloro-5-nitro-2-propylsulfanylpyrimidin-4-yl)amino]methyl]benzonitrile Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC=1C=C(C#N)C=CC=1)[N+](=O)[O-] HBVIITUOCCASKD-UHFFFAOYSA-N 0.000 description 1
- VIDVDRAYLLBTEI-UHFFFAOYSA-N 3-[[6-[(4-methoxyphenyl)methylamino]-8-oxo-2-propylsulfanyl-7H-purin-9-yl]methyl]benzonitrile Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=C(C#N)C=CC=1)=O VIDVDRAYLLBTEI-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- UFBWOBPUOXILAT-UHFFFAOYSA-N 3-chloro-4-methylbenzamide Chemical compound CC1=CC=C(C(N)=O)C=C1Cl UFBWOBPUOXILAT-UHFFFAOYSA-N 0.000 description 1
- JDGUVFZDTYKQJS-UHFFFAOYSA-N 3-chloro-n,4-dimethylaniline Chemical compound CNC1=CC=C(C)C(Cl)=C1 JDGUVFZDTYKQJS-UHFFFAOYSA-N 0.000 description 1
- DDEDQHVHVPJFAC-UHFFFAOYSA-N 4,6-dichloro-5-nitro-2-propylsulfanylpyrimidine Chemical compound CCCSC1=NC(Cl)=C([N+]([O-])=O)C(Cl)=N1 DDEDQHVHVPJFAC-UHFFFAOYSA-N 0.000 description 1
- JLOFVZKCYFDECG-UHFFFAOYSA-N 4-N-[(4-bromophenyl)methyl]-6-chloro-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)Br)N JLOFVZKCYFDECG-UHFFFAOYSA-N 0.000 description 1
- DNCQUWBSWUTJPX-UHFFFAOYSA-N 4-N-benzyl-6-chloro-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound C(C1=CC=CC=C1)NC1=NC(=NC(=C1N)Cl)SCCC DNCQUWBSWUTJPX-UHFFFAOYSA-N 0.000 description 1
- LALNEYRQNPHKNY-UHFFFAOYSA-N 4-[(6-chloro-8-oxo-2-propylsulfanyl-7H-purin-9-yl)methyl]benzonitrile Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C#N)C=C1)=O LALNEYRQNPHKNY-UHFFFAOYSA-N 0.000 description 1
- NGASIZRYYFJUCS-UHFFFAOYSA-N 4-[[(5-amino-6-chloro-2-propylsulfanylpyrimidin-4-yl)amino]methyl]benzonitrile Chemical compound NC=1C(=NC(=NC=1Cl)SCCC)NCC1=CC=C(C#N)C=C1 NGASIZRYYFJUCS-UHFFFAOYSA-N 0.000 description 1
- WCDJOBJYEDOSQS-UHFFFAOYSA-N 4-[[(6-chloro-5-nitro-2-propylsulfanylpyrimidin-4-yl)amino]methyl]benzonitrile Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C#N)C=C1)[N+](=O)[O-] WCDJOBJYEDOSQS-UHFFFAOYSA-N 0.000 description 1
- ZMXIMWNANZYPQP-UHFFFAOYSA-N 4-[[6-[(4-methoxyphenyl)methylamino]-8-oxo-2-propylsulfanyl-7H-purin-9-yl]methyl]benzonitrile Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C#N)C=C1)=O ZMXIMWNANZYPQP-UHFFFAOYSA-N 0.000 description 1
- KQXAFVQKMMSRFL-UHFFFAOYSA-N 4-amino-3-[(4-fluorophenyl)methyl]-2-oxo-1h-imidazole-5-carbonitrile Chemical compound NC1=C(C#N)N=C(O)N1CC1=CC=C(F)C=C1 KQXAFVQKMMSRFL-UHFFFAOYSA-N 0.000 description 1
- VTFFVSSBNRTWCJ-UHFFFAOYSA-N 4-amino-3-[(6-chloropyridin-3-yl)methyl]-2-oxo-1H-imidazole-5-carbonitrile Chemical compound NC=1N(C(NC=1C#N)=O)CC=1C=NC(=CC=1)Cl VTFFVSSBNRTWCJ-UHFFFAOYSA-N 0.000 description 1
- AYVPVDWQZAAZCM-UHFFFAOYSA-N 4-bromo-n-methylaniline Chemical compound CNC1=CC=C(Br)C=C1 AYVPVDWQZAAZCM-UHFFFAOYSA-N 0.000 description 1
- MRUKIIWRMSYKML-UHFFFAOYSA-N 4-chloro-3-methylbenzoic acid Chemical compound CC1=CC(C(O)=O)=CC=C1Cl MRUKIIWRMSYKML-UHFFFAOYSA-N 0.000 description 1
- JHJXDGMATBLARH-UHFFFAOYSA-N 6-(ethylamino)-9-[(6-methylpyridin-3-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound C(C)NC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC(=CC=1)C)=O JHJXDGMATBLARH-UHFFFAOYSA-N 0.000 description 1
- AOIPJFRADPKAFS-UHFFFAOYSA-N 6-(ethylamino)-9-[(6-methylpyridin-3-yl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound C(C)NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC=1C=NC(=CC=1)C)=O AOIPJFRADPKAFS-UHFFFAOYSA-N 0.000 description 1
- OQCBZUQZGVEIGQ-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-2-methylsulfanyl-9-(pyridin-2-ylmethyl)-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SC)CC1=NC=CC=C1)=O OQCBZUQZGVEIGQ-UHFFFAOYSA-N 0.000 description 1
- VDOPMXYXDRHECX-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-2-methylsulfanyl-9-(pyridin-3-ylmethyl)-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SC)CC=1C=NC=CC=1)=O VDOPMXYXDRHECX-UHFFFAOYSA-N 0.000 description 1
- NMXGUZXVUKGKIR-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-2-methylsulfanyl-9-(pyridin-4-ylmethyl)-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SC)CC1=CC=NC=C1)=O NMXGUZXVUKGKIR-UHFFFAOYSA-N 0.000 description 1
- BJFRWQNIMZVQCT-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-9-(pyrimidin-5-ylmethyl)-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC=NC=1)=O BJFRWQNIMZVQCT-UHFFFAOYSA-N 0.000 description 1
- UIBHXZITWIPTPT-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-2-propylsulfinyl-9-(pyrimidin-5-ylmethyl)-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC=1C=NC=NC=1)=O UIBHXZITWIPTPT-UHFFFAOYSA-N 0.000 description 1
- OSYCZRISWVFFMJ-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-9-[(2-methylpyridin-4-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=NC=C1)C)=O OSYCZRISWVFFMJ-UHFFFAOYSA-N 0.000 description 1
- QBXKHAIAWWJEDP-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-9-[(2-methylpyrimidin-5-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC(=NC=1)C)=O QBXKHAIAWWJEDP-UHFFFAOYSA-N 0.000 description 1
- XVEYGRNBLXCEPN-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-9-[(2-methylpyrimidin-5-yl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC=1C=NC(=NC=1)C)=O XVEYGRNBLXCEPN-UHFFFAOYSA-N 0.000 description 1
- XKRVQTQQYGDWKO-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-9-[(4-methylsulfonylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)S(=O)(=O)C)=O XKRVQTQQYGDWKO-UHFFFAOYSA-N 0.000 description 1
- LPOIXDRFQWIDSA-UHFFFAOYSA-N 6-[(4-methoxyphenyl)methylamino]-9-[(6-methylpyridin-3-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC(=CC=1)C)=O LPOIXDRFQWIDSA-UHFFFAOYSA-N 0.000 description 1
- QGZQLFVPRLVEJR-UHFFFAOYSA-N 6-[(4-methylphenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound C1(=CC=C(C=C1)CC1=C(C(=NC(=N1)SCCC)N)[N+](=O)[O-])C QGZQLFVPRLVEJR-UHFFFAOYSA-N 0.000 description 1
- QJWPPRMYXGFYES-UHFFFAOYSA-N 6-amino-2-propylsulfanyl-9-(pyridin-2-ylmethyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=NC=CC=C1)=O QJWPPRMYXGFYES-UHFFFAOYSA-N 0.000 description 1
- AABAIKFHSWQIFO-UHFFFAOYSA-N 6-amino-9-(3,4-dichlorophenyl)-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)C1=CC(=C(C=C1)Cl)Cl)=O AABAIKFHSWQIFO-UHFFFAOYSA-N 0.000 description 1
- HJWKAYBROIQCQP-UHFFFAOYSA-N 6-amino-9-[(2-methylpyridin-4-yl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC(=NC=C1)C)=O HJWKAYBROIQCQP-UHFFFAOYSA-N 0.000 description 1
- SKXREALOLSMPMS-UHFFFAOYSA-N 6-amino-9-[(4-bromophenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C=C1)Br)=O SKXREALOLSMPMS-UHFFFAOYSA-N 0.000 description 1
- HSPYZCQLXFXJLM-UHFFFAOYSA-N 6-amino-9-[(4-chloro-3-fluorophenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC(=C(C=C1)Cl)F)=O HSPYZCQLXFXJLM-UHFFFAOYSA-N 0.000 description 1
- ICPOUPIDKAVXEK-UHFFFAOYSA-N 6-amino-9-[(4-chloro-3-methylphenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC(=C(C=C1)Cl)C)=O ICPOUPIDKAVXEK-UHFFFAOYSA-N 0.000 description 1
- CNXUNUPEYODHAD-UHFFFAOYSA-N 6-amino-9-[(4-chlorophenyl)methyl]-2-propylsulfonyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=O)CCC)CC1=CC=C(C=C1)Cl)=O CNXUNUPEYODHAD-UHFFFAOYSA-N 0.000 description 1
- QRYTZSJRGCPRGO-UHFFFAOYSA-N 6-amino-9-[(4-methoxyphenyl)methyl]-2-methylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)C)CC1=CC=C(C=C1)OC)=O QRYTZSJRGCPRGO-UHFFFAOYSA-N 0.000 description 1
- PPVXJMYJMODOPW-UHFFFAOYSA-N 6-amino-9-[(4-methylphenyl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C=C1)C)=O PPVXJMYJMODOPW-UHFFFAOYSA-N 0.000 description 1
- ZTYJONMNFGRHOV-UHFFFAOYSA-N 6-amino-9-[(4-methylsulfonylphenyl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=C(C=C1)S(=O)(=O)C)=O ZTYJONMNFGRHOV-UHFFFAOYSA-N 0.000 description 1
- RGODUQNFWRVDPN-UHFFFAOYSA-N 6-amino-9-[(6-chloropyridin-3-yl)methyl]-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC=1C=NC(=CC=1)Cl)=O RGODUQNFWRVDPN-UHFFFAOYSA-N 0.000 description 1
- IUTPEKYCPYPRHG-UHFFFAOYSA-N 6-amino-9-[2-(4-chlorophenyl)ethyl]-2-(propylsulfonimidoyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)(=N)CCC)CCC1=CC=C(C=C1)Cl)=O IUTPEKYCPYPRHG-UHFFFAOYSA-N 0.000 description 1
- OKXDMOOKPVCQGS-UHFFFAOYSA-N 6-amino-9-[2-(4-methylphenyl)ethyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCC)CCC1=CC=C(C=C1)C)=O OKXDMOOKPVCQGS-UHFFFAOYSA-N 0.000 description 1
- VFZUVWZQMMOSCU-UHFFFAOYSA-N 6-amino-9-benzyl-2-(2,2,2-trifluoroethylsulfanyl)-7h-purin-8-one Chemical compound OC1=NC=2C(N)=NC(SCC(F)(F)F)=NC=2N1CC1=CC=CC=C1 VFZUVWZQMMOSCU-UHFFFAOYSA-N 0.000 description 1
- FDLPDJHVEKXWLI-UHFFFAOYSA-N 6-amino-9-benzyl-2-(2,2,2-trifluoroethylsulfinyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CC(F)(F)F)CC1=CC=CC=C1)=O FDLPDJHVEKXWLI-UHFFFAOYSA-N 0.000 description 1
- RKOAQZHSBQHMDM-UHFFFAOYSA-N 6-amino-9-benzyl-2-(2-methoxyethylsulfinyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCOC)CC1=CC=CC=C1)=O RKOAQZHSBQHMDM-UHFFFAOYSA-N 0.000 description 1
- ILDXPPZRFKYDCQ-UHFFFAOYSA-N 6-amino-9-benzyl-2-(2-methoxypropylsulfanyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCC(C)OC)CC1=CC=CC=C1)=O ILDXPPZRFKYDCQ-UHFFFAOYSA-N 0.000 description 1
- BYCVOHQIYWOEQU-UHFFFAOYSA-N 6-amino-9-benzyl-2-(3-methoxypropylsulfanyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)SCCCOC)CC1=CC=CC=C1)=O BYCVOHQIYWOEQU-UHFFFAOYSA-N 0.000 description 1
- XDLSAEMIECHJEI-UHFFFAOYSA-N 6-amino-9-benzyl-2-(3-methoxypropylsulfinyl)-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCCOC)CC1=CC=CC=C1)=O XDLSAEMIECHJEI-UHFFFAOYSA-N 0.000 description 1
- RYANVUBTQQMWTQ-UHFFFAOYSA-N 6-amino-9-benzyl-2-butylsulfinyl-7h-purin-8-one Chemical compound C12=NC([S+]([O-])CCCC)=NC(N)=C2N=C(O)N1CC1=CC=CC=C1 RYANVUBTQQMWTQ-UHFFFAOYSA-N 0.000 description 1
- PYDXLEOHCQSCCE-UHFFFAOYSA-N 6-amino-9-benzyl-2-ethylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CC)CC1=CC=CC=C1)=O PYDXLEOHCQSCCE-UHFFFAOYSA-N 0.000 description 1
- XJZJHVOQISEZRS-UHFFFAOYSA-N 6-amino-9-benzyl-2-propan-2-ylsulfanyl-7h-purin-8-one Chemical compound C12=NC(SC(C)C)=NC(N)=C2N=C(O)N1CC1=CC=CC=C1 XJZJHVOQISEZRS-UHFFFAOYSA-N 0.000 description 1
- XMBWXMCTNHNBEU-UHFFFAOYSA-N 6-amino-9-benzyl-2-propylsulfinyl-7H-purin-8-one Chemical compound NC1=C2NC(N(C2=NC(=N1)S(=O)CCC)CC1=CC=CC=C1)=O XMBWXMCTNHNBEU-UHFFFAOYSA-N 0.000 description 1
- KRZHDKNRAJEVTE-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-4-N-(pyridin-2-ylmethyl)pyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SC)NCC1=NC=CC=C1)N KRZHDKNRAJEVTE-UHFFFAOYSA-N 0.000 description 1
- RUCNHSPYGHWHHI-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-5-nitro-N-(pyridin-2-ylmethyl)pyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SC)NCC1=NC=CC=C1)[N+](=O)[O-] RUCNHSPYGHWHHI-UHFFFAOYSA-N 0.000 description 1
- UJASXHABCYKAAY-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-5-nitro-N-(pyridin-3-ylmethyl)pyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SC)NCC=1C=NC=CC=1)[N+](=O)[O-] UJASXHABCYKAAY-UHFFFAOYSA-N 0.000 description 1
- ZUWKQLJELLHMNF-UHFFFAOYSA-N 6-chloro-2-methylsulfanyl-5-nitro-N-(pyridin-4-ylmethyl)pyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SC)NCC1=CC=NC=C1)[N+](=O)[O-] ZUWKQLJELLHMNF-UHFFFAOYSA-N 0.000 description 1
- NMFIDGJEOBNXRX-UHFFFAOYSA-N 6-chloro-2-propylsulfanyl-4-N-(pyrimidin-5-ylmethyl)pyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC=1C=NC=NC=1)N NMFIDGJEOBNXRX-UHFFFAOYSA-N 0.000 description 1
- AYNPKJQFAPISAZ-UHFFFAOYSA-N 6-chloro-2-propylsulfanyl-4-N-[[4-(trifluoromethyl)phenyl]methyl]pyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)C(F)(F)F)N AYNPKJQFAPISAZ-UHFFFAOYSA-N 0.000 description 1
- WRAPBXXZFBVXPB-UHFFFAOYSA-N 6-chloro-2-propylsulfanyl-9-(pyrimidin-5-ylmethyl)-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC=NC=1)=O WRAPBXXZFBVXPB-UHFFFAOYSA-N 0.000 description 1
- XEAFUKUFFYDCJW-UHFFFAOYSA-N 6-chloro-4-N-(2-methylpropyl)-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC(C)C)N XEAFUKUFFYDCJW-UHFFFAOYSA-N 0.000 description 1
- JGJZMBYOSLNMPD-UHFFFAOYSA-N 6-chloro-4-N-[(2,4-difluorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=C(C=C(C=C1)F)F)N JGJZMBYOSLNMPD-UHFFFAOYSA-N 0.000 description 1
- SRMFHHGQKBMKFJ-UHFFFAOYSA-N 6-chloro-4-N-[(2-chlorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=C(C=CC=C1)Cl)N SRMFHHGQKBMKFJ-UHFFFAOYSA-N 0.000 description 1
- ZCPVHVBGHGLDMY-UHFFFAOYSA-N 6-chloro-4-N-[(2-methylpyridin-4-yl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=NC=C1)C)N ZCPVHVBGHGLDMY-UHFFFAOYSA-N 0.000 description 1
- FACAHUFBMGKRCZ-UHFFFAOYSA-N 6-chloro-4-N-[(2-methylpyrimidin-5-yl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC=1C=NC(=NC=1)C)N FACAHUFBMGKRCZ-UHFFFAOYSA-N 0.000 description 1
- TUVQTRGKVDPLDU-UHFFFAOYSA-N 6-chloro-4-N-[(3,4-dichlorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)Cl)Cl)N TUVQTRGKVDPLDU-UHFFFAOYSA-N 0.000 description 1
- LSGHMFVUOHSPAY-UHFFFAOYSA-N 6-chloro-4-N-[(3,4-difluorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)F)F)N LSGHMFVUOHSPAY-UHFFFAOYSA-N 0.000 description 1
- SGBUPHFNZJHTSW-UHFFFAOYSA-N 6-chloro-4-N-[(3-chloro-4-methylphenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)C)Cl)N SGBUPHFNZJHTSW-UHFFFAOYSA-N 0.000 description 1
- CIONPFPQYXHPEX-UHFFFAOYSA-N 6-chloro-4-N-[(3-chlorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=CC=C1)Cl)N CIONPFPQYXHPEX-UHFFFAOYSA-N 0.000 description 1
- RBZBVXCLOKTTQT-UHFFFAOYSA-N 6-chloro-4-N-[(4-chloro-3-fluorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)Cl)F)N RBZBVXCLOKTTQT-UHFFFAOYSA-N 0.000 description 1
- POOOKUXMUVRWEZ-UHFFFAOYSA-N 6-chloro-4-N-[(4-chloro-3-methylphenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)Cl)C)N POOOKUXMUVRWEZ-UHFFFAOYSA-N 0.000 description 1
- PGAZPPBBUCHVLC-UHFFFAOYSA-N 6-chloro-4-N-[(4-chlorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)Cl)N PGAZPPBBUCHVLC-UHFFFAOYSA-N 0.000 description 1
- QZDNOLMTPVUQHZ-UHFFFAOYSA-N 6-chloro-4-N-[(4-fluorophenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)F)N QZDNOLMTPVUQHZ-UHFFFAOYSA-N 0.000 description 1
- AOKMWWYZIJZZPG-UHFFFAOYSA-N 6-chloro-4-N-[(4-methylsulfonylphenyl)methyl]-2-propylsulfanylpyrimidine-4,5-diamine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)S(=O)(=O)C)N AOKMWWYZIJZZPG-UHFFFAOYSA-N 0.000 description 1
- QKYJEBSTOJMWSP-UHFFFAOYSA-N 6-chloro-5-nitro-2-propylsulfanyl-N-(pyrimidin-5-ylmethyl)pyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC=1C=NC=NC=1)[N+](=O)[O-] QKYJEBSTOJMWSP-UHFFFAOYSA-N 0.000 description 1
- LXXRXUXKBMMOND-UHFFFAOYSA-N 6-chloro-5-nitro-2-propylsulfanyl-N-[[4-(trifluoromethyl)phenyl]methyl]pyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)C(F)(F)F)[N+](=O)[O-] LXXRXUXKBMMOND-UHFFFAOYSA-N 0.000 description 1
- VHLMRZXQXOAKFV-UHFFFAOYSA-N 6-chloro-9-[(2-methylpyridin-4-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC(=NC=C1)C)=O VHLMRZXQXOAKFV-UHFFFAOYSA-N 0.000 description 1
- ADSPKPCBBNTTHA-UHFFFAOYSA-N 6-chloro-9-[(2-methylpyrimidin-5-yl)methyl]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C2NC(N(C2=NC(=N1)SCCC)CC=1C=NC(=NC=1)C)=O ADSPKPCBBNTTHA-UHFFFAOYSA-N 0.000 description 1
- ORDPCCHDEXLZTD-UHFFFAOYSA-N 6-chloro-N-(2-methylpropyl)-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC(C)C)[N+](=O)[O-] ORDPCCHDEXLZTD-UHFFFAOYSA-N 0.000 description 1
- BNOSSHBESCFNTN-UHFFFAOYSA-N 6-chloro-N-[(2-methylpyridin-4-yl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=NC=C1)C)[N+](=O)[O-] BNOSSHBESCFNTN-UHFFFAOYSA-N 0.000 description 1
- FDLQLLZNIHGIRR-UHFFFAOYSA-N 6-chloro-N-[(3,4-dichlorophenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)Cl)Cl)[N+](=O)[O-] FDLQLLZNIHGIRR-UHFFFAOYSA-N 0.000 description 1
- ZDZWHRKMDNGFPZ-UHFFFAOYSA-N 6-chloro-N-[(3,4-difluorophenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)F)F)[N+](=O)[O-] ZDZWHRKMDNGFPZ-UHFFFAOYSA-N 0.000 description 1
- MUYFKRZEPDBDKF-UHFFFAOYSA-N 6-chloro-N-[(3-chlorophenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=CC=C1)Cl)[N+](=O)[O-] MUYFKRZEPDBDKF-UHFFFAOYSA-N 0.000 description 1
- WOQFKWOLHQNZSN-UHFFFAOYSA-N 6-chloro-N-[(4-chloro-3-methylphenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC(=C(C=C1)Cl)C)[N+](=O)[O-] WOQFKWOLHQNZSN-UHFFFAOYSA-N 0.000 description 1
- VVSKHEUAQMVQFU-UHFFFAOYSA-N 6-chloro-N-[(4-chlorophenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)Cl)[N+](=O)[O-] VVSKHEUAQMVQFU-UHFFFAOYSA-N 0.000 description 1
- CQVGRZRTSHHQAQ-UHFFFAOYSA-N 6-chloro-N-[(4-fluorophenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)F)[N+](=O)[O-] CQVGRZRTSHHQAQ-UHFFFAOYSA-N 0.000 description 1
- KUISQZDVMKSVNP-UHFFFAOYSA-N 6-chloro-N-[(4-methylsulfonylphenyl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)S(=O)(=O)C)[N+](=O)[O-] KUISQZDVMKSVNP-UHFFFAOYSA-N 0.000 description 1
- HHHPGQBUWHNQDE-UHFFFAOYSA-N 6-chloro-N-[(6-methylpyridin-3-yl)methyl]-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC=1C=NC(=CC=1)C)[N+](=O)[O-] HHHPGQBUWHNQDE-UHFFFAOYSA-N 0.000 description 1
- RZOKQIPOABEQAM-UHFFFAOYSA-N 6-methylpyridine-3-carboxylic acid Chemical compound CC1=CC=C(C(O)=O)C=N1 RZOKQIPOABEQAM-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- LPWKFUVWWQYLOD-UHFFFAOYSA-N 9-(dimethylamino)-3-(4-methylphenyl)pyrido[2,3]thieno[2,4-d]pyrimidin-4-one Chemical compound C1=2C(N(C)C)=CN=CC=2SC(C2=O)=C1N=CN2C1=CC=C(C)C=C1 LPWKFUVWWQYLOD-UHFFFAOYSA-N 0.000 description 1
- XYUIZXKZMNNNJW-UHFFFAOYSA-N 9-[(2,4-difluorophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound FC1=C(C=CC(=C1)F)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC XYUIZXKZMNNNJW-UHFFFAOYSA-N 0.000 description 1
- LTHOHQUDPIEOKR-UHFFFAOYSA-N 9-[(3,4-dichlorophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC=1C=C(C=CC=1Cl)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC LTHOHQUDPIEOKR-UHFFFAOYSA-N 0.000 description 1
- KSNWHZKBCNEOCV-UHFFFAOYSA-N 9-[(3,4-difluorophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound FC=1C=C(C=CC=1F)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC KSNWHZKBCNEOCV-UHFFFAOYSA-N 0.000 description 1
- WHPIOZVTTVHXBK-UHFFFAOYSA-N 9-[(3-chloro-4-methylphenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC=1C=C(C=CC=1C)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC WHPIOZVTTVHXBK-UHFFFAOYSA-N 0.000 description 1
- YMCQCKIZSFHFFM-UHFFFAOYSA-N 9-[(3-chlorophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC=1C=C(C=CC=1)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC YMCQCKIZSFHFFM-UHFFFAOYSA-N 0.000 description 1
- LASYSHUXPGRDMN-UHFFFAOYSA-N 9-[(4-bromophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound BrC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC LASYSHUXPGRDMN-UHFFFAOYSA-N 0.000 description 1
- SAZWRDWEJQCTOS-UHFFFAOYSA-N 9-[(4-chloro-3-fluorophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C(C=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC)F SAZWRDWEJQCTOS-UHFFFAOYSA-N 0.000 description 1
- AZUYFCZSTRNRJG-UHFFFAOYSA-N 9-[(4-chloro-3-methylphenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=C(C=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC)C AZUYFCZSTRNRJG-UHFFFAOYSA-N 0.000 description 1
- MGHINPRYGWYVFO-UHFFFAOYSA-N 9-[(4-chlorophenyl)methyl]-6-(ethylamino)-2-propylsulfanyl-7H-purin-8-one Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NCC)SCCC MGHINPRYGWYVFO-UHFFFAOYSA-N 0.000 description 1
- NVMDIWOICAPQTA-UHFFFAOYSA-N 9-[(4-chlorophenyl)methyl]-6-(ethylamino)-2-propylsulfinyl-7H-purin-8-one Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NCC)S(=O)CCC NVMDIWOICAPQTA-UHFFFAOYSA-N 0.000 description 1
- WOUHLAXHUODHMZ-UHFFFAOYSA-N 9-[(4-fluorophenyl)methyl]-6-[(4-methoxyphenyl)methylamino]-2-propylsulfanyl-7H-purin-8-one Chemical compound FC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NCC1=CC=C(C=C1)OC)SCCC WOUHLAXHUODHMZ-UHFFFAOYSA-N 0.000 description 1
- BEACBILQFFTGQE-UHFFFAOYSA-N 9-benzyl-6-(propan-2-ylamino)-2-propylsulfanyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(C)C)SCCC BEACBILQFFTGQE-UHFFFAOYSA-N 0.000 description 1
- IRMPAYQHUIXYHY-UHFFFAOYSA-N 9-benzyl-6-(propan-2-ylamino)-2-propylsulfinyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(C)C)S(=O)CCC IRMPAYQHUIXYHY-UHFFFAOYSA-N 0.000 description 1
- OWUFMTCUOJNOCA-UHFFFAOYSA-N 9-benzyl-6-(propylamino)-2-propylsulfinyl-7H-purin-8-one Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NCCC)S(=O)CCC OWUFMTCUOJNOCA-UHFFFAOYSA-N 0.000 description 1
- 102100032814 ATP-dependent zinc metalloprotease YME1L1 Human genes 0.000 description 1
- OQLZINXFSUDMHM-UHFFFAOYSA-N Acetamidine Chemical compound CC(N)=N OQLZINXFSUDMHM-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- KWIUHFFTVRNATP-UHFFFAOYSA-N Betaine Natural products C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- JIHOMLCFQUPTQI-UHFFFAOYSA-N C(C(C)(C)C)(=O)O.CC(C)(C)C Chemical compound C(C(C)(C)C)(=O)O.CC(C)(C)C JIHOMLCFQUPTQI-UHFFFAOYSA-N 0.000 description 1
- DYZHAGOFOBOPJC-MHBAEANFSA-N C/C=C\C=C(/CC#C)\C[N](C)(c1nc(S(C)(=NC=O)=O)nc(N)c1N1)C1=O Chemical compound C/C=C\C=C(/CC#C)\C[N](C)(c1nc(S(C)(=NC=O)=O)nc(N)c1N1)C1=O DYZHAGOFOBOPJC-MHBAEANFSA-N 0.000 description 1
- DIEPCGMINUKNDB-UHFFFAOYSA-N CCCC(CCC)C(N(C)c(nc(nc1N2Cc3ccccc3)S(CCC)(=N)=O)c1NC2=O)=O Chemical compound CCCC(CCC)C(N(C)c(nc(nc1N2Cc3ccccc3)S(CCC)(=N)=O)c1NC2=O)=O DIEPCGMINUKNDB-UHFFFAOYSA-N 0.000 description 1
- VZUZSTAHFWXVQJ-UHFFFAOYSA-N CCCS(c(nc1N2CC(C)C)nc(N)c1NC2O)(=N)=O Chemical compound CCCS(c(nc1N2CC(C)C)nc(N)c1NC2O)(=N)=O VZUZSTAHFWXVQJ-UHFFFAOYSA-N 0.000 description 1
- XMHYHSKQEHLLOK-UHFFFAOYSA-N CCCSc(nc1Cl)nc(NCc(cc2)ccc2C(OC)=O)c1N Chemical compound CCCSc(nc1Cl)nc(NCc(cc2)ccc2C(OC)=O)c1N XMHYHSKQEHLLOK-UHFFFAOYSA-N 0.000 description 1
- JJGRPZNRJBBDDL-UHFFFAOYSA-N CCCSc(nc1N2Cc3cc([I]=[IH])ccc3)nc(Cl)c1NC2=O Chemical compound CCCSc(nc1N2Cc3cc([I]=[IH])ccc3)nc(Cl)c1NC2=O JJGRPZNRJBBDDL-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 208000000419 Chronic Hepatitis B Diseases 0.000 description 1
- 208000006154 Chronic hepatitis C Diseases 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 102000012422 Collagen Type I Human genes 0.000 description 1
- 108010022452 Collagen Type I Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 229940126639 Compound 33 Drugs 0.000 description 1
- 229940127007 Compound 39 Drugs 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- HTJDQJBWANPRPF-UHFFFAOYSA-N Cyclopropylamine Chemical compound NC1CC1 HTJDQJBWANPRPF-UHFFFAOYSA-N 0.000 description 1
- 102000008144 Cytochrome P-450 CYP1A2 Human genes 0.000 description 1
- 108010074922 Cytochrome P-450 CYP1A2 Proteins 0.000 description 1
- 102000009666 Cytochrome P-450 CYP2B6 Human genes 0.000 description 1
- 108010020070 Cytochrome P-450 CYP2B6 Proteins 0.000 description 1
- NBSCHQHZLSJFNQ-GASJEMHNSA-N D-Glucose 6-phosphate Chemical compound OC1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H](O)[C@H]1O NBSCHQHZLSJFNQ-GASJEMHNSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 230000009946 DNA mutation Effects 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- OIFBSDVPJOWBCH-UHFFFAOYSA-N Diethyl carbonate Chemical compound CCOC(=O)OCC OIFBSDVPJOWBCH-UHFFFAOYSA-N 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 241001649081 Dina Species 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 101100322888 Escherichia coli (strain K12) metL gene Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- VFRROHXSMXFLSN-UHFFFAOYSA-N Glc6P Natural products OP(=O)(O)OCC(O)C(O)C(O)C(O)C=O VFRROHXSMXFLSN-UHFFFAOYSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 206010019799 Hepatitis viral Diseases 0.000 description 1
- 206010019851 Hepatotoxicity Diseases 0.000 description 1
- 208000001688 Herpes Genitalis Diseases 0.000 description 1
- 101000855342 Homo sapiens Cytochrome P450 1A2 Proteins 0.000 description 1
- 101000957383 Homo sapiens Cytochrome P450 2B6 Proteins 0.000 description 1
- 101000745711 Homo sapiens Cytochrome P450 3A4 Proteins 0.000 description 1
- 101000831496 Homo sapiens Toll-like receptor 3 Proteins 0.000 description 1
- 101000800483 Homo sapiens Toll-like receptor 8 Proteins 0.000 description 1
- 101001057508 Homo sapiens Ubiquitin-like protein ISG15 Proteins 0.000 description 1
- 241000701806 Human papillomavirus Species 0.000 description 1
- MFESCIUQSIBMSM-UHFFFAOYSA-N I-BCP Chemical compound ClCCCBr MFESCIUQSIBMSM-UHFFFAOYSA-N 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 102000006835 Lamins Human genes 0.000 description 1
- 108010047294 Lamins Proteins 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 102000012777 Metabotropic Glutamate 5 Receptor Human genes 0.000 description 1
- 108010065028 Metabotropic Glutamate 5 Receptor Proteins 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- KWIUHFFTVRNATP-UHFFFAOYSA-O N,N,N-trimethylglycinium Chemical compound C[N+](C)(C)CC(O)=O KWIUHFFTVRNATP-UHFFFAOYSA-O 0.000 description 1
- YWVAUZDITDUOIK-UHFFFAOYSA-N N-(9-benzyl-8-oxo-2-propylsulfinyl-7H-purin-6-yl)-2-propylpentanamide Chemical compound C(C1=CC=CC=C1)N1C2=NC(=NC(=C2NC1=O)NC(C(CCC)CCC)=O)S(=O)CCC YWVAUZDITDUOIK-UHFFFAOYSA-N 0.000 description 1
- LVDRREOUMKACNJ-BKMJKUGQSA-N N-[(2R,3S)-2-(4-chlorophenyl)-1-(1,4-dimethyl-2-oxoquinolin-7-yl)-6-oxopiperidin-3-yl]-2-methylpropane-1-sulfonamide Chemical compound CC(C)CS(=O)(=O)N[C@H]1CCC(=O)N([C@@H]1c1ccc(Cl)cc1)c1ccc2c(C)cc(=O)n(C)c2c1 LVDRREOUMKACNJ-BKMJKUGQSA-N 0.000 description 1
- TWTXTWSFXYSAGO-UHFFFAOYSA-N N-[(4-bromophenyl)methyl]-6-chloro-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C=C1)Br)[N+](=O)[O-] TWTXTWSFXYSAGO-UHFFFAOYSA-N 0.000 description 1
- IWRSPXMJFKGXRG-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-propylsulfanyl-7H-purin-6-yl]-2-ethylbutanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(CC)CC)=O)SCCC IWRSPXMJFKGXRG-UHFFFAOYSA-N 0.000 description 1
- WSLPWOKZOATGMZ-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-propylsulfanyl-7H-purin-6-yl]acetamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C)=O)SCCC WSLPWOKZOATGMZ-UHFFFAOYSA-N 0.000 description 1
- PWULVKSLTGNTHD-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-propylsulfinyl-7H-purin-6-yl]-2-ethylbutanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(CC)CC)=O)S(=O)CCC PWULVKSLTGNTHD-UHFFFAOYSA-N 0.000 description 1
- TYOKNHSCNCBJSB-UHFFFAOYSA-N N-[9-[(4-chlorophenyl)methyl]-8-oxo-2-propylsulfinyl-7H-purin-6-yl]-2-propylpentanamide Chemical compound ClC1=CC=C(C=C1)CN1C2=NC(=NC(=C2NC1=O)NC(C(CCC)CCC)=O)S(=O)CCC TYOKNHSCNCBJSB-UHFFFAOYSA-N 0.000 description 1
- ZVDOSPMSDOICBO-UHFFFAOYSA-N N-benzyl-6-chloro-5-nitro-2-propylsulfanylpyrimidin-4-amine Chemical compound C(C1=CC=CC=C1)NC1=NC(=NC(=C1[N+](=O)[O-])Cl)SCCC ZVDOSPMSDOICBO-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 1
- 101100030361 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pph-3 gene Proteins 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 1
- QQCGKIZHTJLRNN-NBRVCOCJSA-N Pipericine Chemical compound CCCCCCCCCCCCC\C=C\C=C\C(=O)NCC(C)C QQCGKIZHTJLRNN-NBRVCOCJSA-N 0.000 description 1
- 102000004257 Potassium Channel Human genes 0.000 description 1
- 101800000795 Proadrenomedullin N-20 terminal peptide Proteins 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 229940124615 TLR 7 agonist Drugs 0.000 description 1
- 229940124613 TLR 7/8 agonist Drugs 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 108010060818 Toll-Like Receptor 9 Proteins 0.000 description 1
- 102100024324 Toll-like receptor 3 Human genes 0.000 description 1
- 102100033117 Toll-like receptor 9 Human genes 0.000 description 1
- 108091005906 Type I transmembrane proteins Proteins 0.000 description 1
- 102100027266 Ubiquitin-like protein ISG15 Human genes 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- HOOMGTNENMZAFP-NYNCVSEMSA-N [(2r,3r,5s)-2-(5-amino-2-oxo-[1,3]thiazolo[4,5-d]pyrimidin-3-yl)-5-(hydroxymethyl)oxolan-3-yl] acetate Chemical compound CC(=O)O[C@@H]1C[C@@H](CO)O[C@H]1N1C(=O)SC2=CN=C(N)N=C21 HOOMGTNENMZAFP-NYNCVSEMSA-N 0.000 description 1
- DGYIJVNZSDYBOE-UHFFFAOYSA-N [CH2]C1=CC=NC=C1 Chemical group [CH2]C1=CC=NC=C1 DGYIJVNZSDYBOE-UHFFFAOYSA-N 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical class C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 102000035181 adaptor proteins Human genes 0.000 description 1
- 108091005764 adaptor proteins Proteins 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 229940060265 aldara Drugs 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 229960004977 anhydrous lactose Drugs 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960003121 arginine Drugs 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000013096 assay test Methods 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- CHIHQLCVLOXUJW-UHFFFAOYSA-N benzoic anhydride Chemical compound C=1C=CC=CC=1C(=O)OC(=O)C1=CC=CC=C1 CHIHQLCVLOXUJW-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960003237 betaine Drugs 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- KDPAWGWELVVRCH-UHFFFAOYSA-N bromoacetic acid Chemical compound OC(=O)CBr KDPAWGWELVVRCH-UHFFFAOYSA-N 0.000 description 1
- RDHPKYGYEGBMSE-UHFFFAOYSA-N bromoethane Chemical compound CCBr RDHPKYGYEGBMSE-UHFFFAOYSA-N 0.000 description 1
- UUWSLBWDFJMSFP-UHFFFAOYSA-N bromomethylcyclohexane Chemical compound BrCC1CCCCC1 UUWSLBWDFJMSFP-UHFFFAOYSA-N 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 238000010805 cDNA synthesis kit Methods 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 108091092328 cellular RNA Proteins 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- GGRHYQCXXYLUTL-UHFFFAOYSA-N chloromethyl 2,2-dimethylpropanoate Chemical compound CC(C)(C)C(=O)OCCl GGRHYQCXXYLUTL-UHFFFAOYSA-N 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 208000016350 chronic hepatitis B virus infection Diseases 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940126086 compound 21 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940127573 compound 38 Drugs 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 1
- 229960001259 diclofenac Drugs 0.000 description 1
- PQZTVWVYCLIIJY-UHFFFAOYSA-N diethyl(propyl)amine Chemical compound CCCN(CC)CC PQZTVWVYCLIIJY-UHFFFAOYSA-N 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000007831 electrophysiology Effects 0.000 description 1
- 238000002001 electrophysiology Methods 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- IXZFDJXHLQQSGQ-UHFFFAOYSA-N ethyl 4-chloro-4-oxobutanoate Chemical compound CCOC(=O)CCC(Cl)=O IXZFDJXHLQQSGQ-UHFFFAOYSA-N 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 229940083124 ganglion-blocking antiadrenergic secondary and tertiary amines Drugs 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 201000004946 genital herpes Diseases 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 244000144993 groups of animals Species 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 208000010710 hepatitis C virus infection Diseases 0.000 description 1
- 231100000304 hepatotoxicity Toxicity 0.000 description 1
- 230000007686 hepatotoxicity Effects 0.000 description 1
- 125000001072 heteroaryl group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 102000057459 human CYP1A2 Human genes 0.000 description 1
- 102000047894 human CYP2B6 Human genes 0.000 description 1
- 102000044284 human CYP3A4 Human genes 0.000 description 1
- 102000045720 human TLR8 Human genes 0.000 description 1
- XGIHQYAWBCFNPY-AZOCGYLKSA-N hydrabamine Chemical compound C([C@@H]12)CC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC[C@@]1(C)CNCCNC[C@@]1(C)[C@@H]2CCC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC1 XGIHQYAWBCFNPY-AZOCGYLKSA-N 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 238000005040 ion trap Methods 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- WFKAJVHLWXSISD-UHFFFAOYSA-N isobutyramide Chemical compound CC(C)C(N)=O WFKAJVHLWXSISD-UHFFFAOYSA-N 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- YDNLNVZZTACNJX-UHFFFAOYSA-N isocyanatomethylbenzene Chemical compound O=C=NCC1=CC=CC=C1 YDNLNVZZTACNJX-UHFFFAOYSA-N 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 210000004731 jugular vein Anatomy 0.000 description 1
- 229960000448 lactic acid Drugs 0.000 description 1
- 210000005053 lamin Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000012931 lyophilized formulation Substances 0.000 description 1
- 229960003646 lysine Drugs 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 229940099690 malic acid Drugs 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- AQBJGAUQEJFPKZ-UHFFFAOYSA-N methyl 4-(aminomethyl)benzoate Chemical compound COC(=O)C1=CC=C(CN)C=C1 AQBJGAUQEJFPKZ-UHFFFAOYSA-N 0.000 description 1
- WMLAZUKQQASVQF-UHFFFAOYSA-N methyl 4-[[(6-chloro-5-methyl-2-propylsulfanylpyrimidin-4-yl)amino]methyl]benzoate Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C(=O)OC)C=C1)C WMLAZUKQQASVQF-UHFFFAOYSA-N 0.000 description 1
- GYDHDHHCACIZIC-UHFFFAOYSA-N methyl 4-[[(6-chloro-5-nitro-2-propylsulfanylpyrimidin-4-yl)amino]methyl]benzoate Chemical compound ClC1=C(C(=NC(=N1)SCCC)NCC1=CC=C(C(=O)OC)C=C1)[N+](=O)[O-] GYDHDHHCACIZIC-UHFFFAOYSA-N 0.000 description 1
- KTFYBDJCUFOZHM-UHFFFAOYSA-N methyl 4-[[6-[(4-methoxyphenyl)methylamino]-8-oxo-2-propylsulfanyl-7H-purin-9-yl]methyl]benzoate Chemical compound COC1=CC=C(C=C1)CNC1=C2NC(N(C2=NC(=N1)SCCC)CC1=CC=C(C(=O)OC)C=C1)=O KTFYBDJCUFOZHM-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 210000001589 microsome Anatomy 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 231100000219 mutagenic Toxicity 0.000 description 1
- 230000003505 mutagenic effect Effects 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- UTUYWZJPVLDHJJ-UHFFFAOYSA-N n-methyl-4-(trifluoromethyl)aniline Chemical compound CNC1=CC=C(C(F)(F)F)C=C1 UTUYWZJPVLDHJJ-UHFFFAOYSA-N 0.000 description 1
- RQEYQVCVGXCQQN-UHFFFAOYSA-N n-methyl-4-methylsulfonylaniline Chemical compound CNC1=CC=C(S(C)(=O)=O)C=C1 RQEYQVCVGXCQQN-UHFFFAOYSA-N 0.000 description 1
- VRBKIVRKKCLPHA-UHFFFAOYSA-N nefazodone Chemical compound O=C1N(CCOC=2C=CC=CC=2)C(CC)=NN1CCCN(CC1)CCN1C1=CC=CC(Cl)=C1 VRBKIVRKKCLPHA-UHFFFAOYSA-N 0.000 description 1
- 229960001800 nefazodone Drugs 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000003002 pH adjusting agent Substances 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- PIRWNASAJNPKHT-SHZATDIYSA-N pamp Chemical compound C([C@@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)N)C(C)C)C1=CC=CC=C1 PIRWNASAJNPKHT-SHZATDIYSA-N 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- XIPFMBOWZXULIA-UHFFFAOYSA-N pivalamide Chemical compound CC(C)(C)C(N)=O XIPFMBOWZXULIA-UHFFFAOYSA-N 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 108020001213 potassium channel Proteins 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 239000008057 potassium phosphate buffer Substances 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000002540 product ion scan Methods 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical compound CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- BOUNFBOFBGBYBT-UHFFFAOYSA-N purin-8-one Chemical compound C1=NC=NC2=NC(=O)N=C21 BOUNFBOFBGBYBT-UHFFFAOYSA-N 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- TXQWFIVRZNOPCK-UHFFFAOYSA-N pyridin-4-ylmethanamine Chemical compound NCC1=CC=NC=C1 TXQWFIVRZNOPCK-UHFFFAOYSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 1
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 231100000161 signs of toxicity Toxicity 0.000 description 1
- 206010040882 skin lesion Diseases 0.000 description 1
- 231100000444 skin lesion Toxicity 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical class [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 1
- 229910001495 sodium tetrafluoroborate Inorganic materials 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 229940014800 succinic anhydride Drugs 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000001839 systemic circulation Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000004885 tandem mass spectrometry Methods 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- DLYUQMMRRRQYAE-UHFFFAOYSA-N tetraphosphorus decaoxide Chemical compound O1P(O2)(=O)OP3(=O)OP1(=O)OP2(=O)O3 DLYUQMMRRRQYAE-UHFFFAOYSA-N 0.000 description 1
- 229960004559 theobromine Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- JLTRXTDYQLMHGR-UHFFFAOYSA-N trimethylaluminium Chemical compound C[Al](C)C JLTRXTDYQLMHGR-UHFFFAOYSA-N 0.000 description 1
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- GXPHKUHSUJUWKP-UHFFFAOYSA-N troglitazone Chemical compound C1CC=2C(C)=C(O)C(C)=C(C)C=2OC1(C)COC(C=C1)=CC=C1CC1SC(=O)NC1=O GXPHKUHSUJUWKP-UHFFFAOYSA-N 0.000 description 1
- 229960001641 troglitazone Drugs 0.000 description 1
- GXPHKUHSUJUWKP-NTKDMRAZSA-N troglitazone Natural products C([C@@]1(OC=2C(C)=C(C(=C(C)C=2CC1)O)C)C)OC(C=C1)=CC=C1C[C@H]1SC(=O)NC1=O GXPHKUHSUJUWKP-NTKDMRAZSA-N 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 229940005605 valeric acid Drugs 0.000 description 1
- 229960001930 valpromide Drugs 0.000 description 1
- 201000001862 viral hepatitis Diseases 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/24—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 one nitrogen and one sulfur atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
- A61K31/52—Purines, e.g. adenine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
- A61K31/52—Purines, e.g. adenine
- A61K31/522—Purines, e.g. adenine having oxo groups directly attached to the heterocyclic ring, e.g. hypoxanthine, guanine, acyclovir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Un compuesto de fórmula (I), **Fórmula** en la que R1 es alquilo C1-6, haloalquilo C1-6, cicloalquilo C3-7 alquilo C1-6, alcoxialquilo C1-6 o pirrolidinilalquilo C1-6; R2 es alquilo C1-6, fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6, dicho fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6 están sin sustituir o sustituidos por uno, dos o tres sustituyentes seleccionados independientemente de halógeno, alquilo C1-6, alcoxi C1-6, ciano, carboxi, carbamoílo, haloalquilo C1-6, alquilsulfonilo C1-6, alcoxicarbonilo C1-6, alcoxialquilaminocarbonilo C1-6, pirrolidinilcarbonilo y piperidinilcarbonilo; R3 es H; o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Description
DESCRIPCIÓN
Compuestos novedosos de sulfonimidoilpurinona y derivados para el tratamiento y la profilaxis de infecciones víricas.
La presente invención se refiere a sulfonimidoilpurinonas novedosas y sus derivados que tienen actividad agonista de receptores de tipo Toll y profármacos de los mismos, así como a su fabricación, composiciones farmacéuticas que los contienen y a aquellos compuestos para su uso como medicamentos.
CAMPO DE LA INVENCIÓN
La presente invención se refiere a compuestos de fórmula (I)
y sus profármacos, fórmula (Ia),
en la que R1 a R8 son como se describe a continuación, o sales farmacéuticamente aceptables, enantiómeros o diastereómeros de los mismos.
Los receptores de tipo Toll (TLR) detectan una amplia gama de patrones moleculares asociados a patógenos conservados (PAMP). Desempeñan un papel importante en la detección de patógenos invasores y el inicio posterior de respuestas inmunitarias innatas. Existen 10 miembros conocidos de la familia de TLR en humanos, que son proteínas transmembranarias de tipo I que presentan un dominio extracelular rico en leucina y una cola citoplasmática que contiene un dominio conservado de receptor Toll/de interleucina (IL)-1 (TIR). Dentro de esta familia, TLR3, TLR7 TLR8 y TLR9 se localizan dentro de los endosomas. TLR7 se puede activar mediante la unión a un ligando de molécula pequeña específico (es decir, agonista de TLR7) o su ligando natural (es decir, ARN monocatenario, ARNmc). Después de la unión del ARNmc a TLR7, se cree que el receptor en su forma dimerizada sufre un cambio estructural que da lugar al posterior reclutamiento de proteínas adaptadoras en su dominio citoplasmático, incluyendo el gen de respuesta principal de diferenciación mieloide 88 (MyD88). Después del inicio de la cascada de señalización del receptor por medio de la vía MyD88, se activan factores de transcripción citoplasmáticos tales como el factor regulador de interferones 7 (IRF-7) y el factor nuclear kappa B (NF- k B ) . A continuación, estos factores de transcripción se translocan al núcleo e inician la transcripción de diversos genes, por ejemplo, IFN-a y otros genes de atocinas antivíricas. TLR7 se expresa predominantemente en células plasmocitoides, y también en linfocitos B. La capacidad de reactividad alterada de las células inmunitarias podría contribuir a la reducción de las respuestas inmunitarias innatas durante las infecciones víricas crónicas. Por lo tanto, la activación inducida por agonistas de TLR7 podría representar un novedoso enfoque para el tratamiento de infecciones víricas crónicas. (D. J Connolly y L. AJ O'Neill, Current Opinion in Pharmacology 2012, 12:510-518, P. A. Roethle et al, J. Med. Chem. 2013, 56, 7324-7333).
El tratamiento actual de la infección crónica por el VHB se basa en dos tipos diferentes de fármacos: los análogos nucleos(t)ídicos antivíricos tradicionales y el IFN-a pegilado (PEG-IFN-a) más reciente. Los análogos
nucleos(t)ídicos orales actúan inhibiendo la replicación del VHB. Este es un curso de tratamiento de por vida durante el cual a menudo se produce resistencia farmacológica. Como una opción alternativa, se ha usado el IFN-a pegilado (PEG-IFN-a) para tratar a algunos pacientes con infección crónica por el VHB dentro de una duración limitada del tratamiento. Aunque ha logrado la seroconversión en HBeAg al menos en un pequeño porcentaje de pacientes con infección por el VHB, el efecto adverso lo hace poco tolerable. En particular, la curación funcional definida como seroconversión de HBsAg es muy rara con los dos tratamientos actuales. Por lo tanto, es una necesidad urgente una opción terapéutica de nueva generación para tratar a los pacientes con infección por el VHB para una curación funcional. El tratamiento con un agonista oral TLR7 representa una solución prometedora para proporcionar una mayor eficacia con una mejor tolerabilidad. El IFN-a pegilado (PEG-IFN-a) se usa actualmente para tratar la infección crónica por el VHB y es una alternativa al tratamiento potencialmente de por vida con análogos nucleos(t)ídicos antivíricos. En un subconjunto de pacientes con infección crónica por el VHB, el tratamiento con PEG-IFN-a puede inducir un control inmunológico sostenido del virus después de una duración limitada del tratamiento. Sin embargo, el porcentaje de pacientes con infección por el VHB que logran la seroconversión con el tratamiento con interferón es bajo (hasta un 27 % en pacientes con HBeAg positivo) y, típicamente, el tratamiento es mal tolerado. Además, la curación funcional (definida como pérdida de HBsAg y seroconversión) también es muy infrecuente con el tratamiento tanto con PEG-IFN-a como con nucleós(t)idos. Dadas estas limitaciones, existe una necesidad urgente de opciones terapéuticas mejoradas para tratar e inducir una curación funcional de la infección crónica por el VHB. El tratamiento con un agonista oral de TLR7 de molécula pequeña es un enfoque prometedor que tiene el potencial de proporcionar una mayor eficacia y tolerabilidad (T. Asselah et al., Clin Liver Dis 2007, 11, 839-849).
De hecho, varios agonistas de TLR7 identificados se han considerado para fines terapéuticos. Hasta la fecha, el imiquimod (ALDARA™) es un fármaco agonista de TLR7 aprobado por la FDA estadounidense para su uso tópico para tratar lesiones cutáneas causadas por el papilomavirus humano. El agonista dual de TLR7/8 resiquimod (R-848) y el agonista de TLR7 852A han sido evaluados para tratar el herpes genital humano y el melanoma metastásico resistente a quimioterapia, respectivamente. ANA773 es un profármaco oral agonista de TLR7, desarrollado para el tratamiento de pacientes con infección crónica por el virus de la hepatitis C (VHC) e infección crónica por hepatitis B. GS-9620 es un agonista de TLR7 disponible por vía oral. Un estudio de fase Ib demostró que el tratamiento con GS-9620 era seguro, bien tolerado y daba como resultado la inducción de ARNm de ISG15 dependiente de la dosis en pacientes con hepatitis B crónica (E. J. Gane et al, Annu Meet Am Assoc Study Liver Dis (1-5 de noviembre, Washington, D.C.) 2013, Abst 946). Por lo tanto, existe una gran necesidad clínica no cubierta de desarrollar agonistas de TLR7 potentes y seguros como nuevo tratamiento contra la infección por el VHB para ofrecer más soluciones terapéuticas o reemplazar el tratamiento existente parcialmente eficaz.
SUMARIO DE LA INVENCIÓN
La presente invención proporciona una serie de novedosos compuestos de 6-amino-2-sulfonimidoil-9-sustituido-7H-purin-8-ona que tienen actividad agonista del receptor de tipo Toll y sus profármacos. La invención también proporciona la bioactividad de dichos compuestos para inducir un incremento del nivel de SEAP mediante la activación de receptores de tipo Toll, tales como el receptor TLR7, la conversión metabólica de profármacos en compuestos originales en presencia de hepatocitos humanos, y el uso terapéutico o profiláctico de dichos compuestos y sus composiciones farmacéuticas que comprenden estos compuestos y sus profármacos para tratar o prevenir enfermedades infecciosas como la infección por el VHB o el VHC. La presente invención también proporciona compuestos con actividad superior. Además, los compuestos de fórmula (I) y/o (Ia) también muestran buenos perfiles de solubilidad, selectividad sobre TLR8, aclaramiento in vitro e in vivo, Ames, hERG, GSH, PK y seguridad.
La presente invención se refiere a compuestos novedosos de fórmula (I),
en la que
R1 es alquilo C1-6, haloalquilo C1-6, cicloalquilo C3-7 alquilo C1-6, alcoxialquilo C1-6 o pirrolidinilalquilo C1-6;
R2 es alquilo Ci-6, fenilalquilo Ci-6, piridinilalquilo Ci-6 o pirimidinilalquilo Ci-6, dicho fenilalquilo Ci-6, piridinilalquilo Ci-6 o pirimidinilalquilo Ci-6 están sin sustituir o sustituidos por uno, dos o tres sustituyentes seleccionados independientemente de halógeno, alquilo Ci-6, alcoxi Ci-6, ciano, carboxi, carbamoílo, haloalquilo Ci-6, alquilsulfonilo Ci-6, alcoxicarbonilo Ci-6, alcoxialquilaminocarbonilo Ci-6, pirrolidinilcarbonilo y piperidinilcarbonilo;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
La presente invención se refiere también a los profármacos de fórmula (la),
en la que
R4 es alquilo Ci-6, haloalquilo Ci-6, cicloalquilo C3-7 alquilo Ci-6, alcoxialquilo Ci-6 o pirrolidinilalquilo Ci-6;
R5 es alquilo Ci-6, fenilalquilo Ci-6, piridinilalquilo Ci-6 o pirimidinilalquilo Ci-6, dicho fenilalquilo Ci-6, piridinilalquilo Ci-6 o pirimidinilalquilo Ci-6 están sin sustituir o sustituidos por uno, dos o tres sustituyentes seleccionados independientemente de halógeno, alquilo Ci-6, alcoxi Ci-6, ciano, carboxi, carbamoílo, haloalquilo Ci-6, alquilsulfonilo Ci-6, alcoxicarbonilo Ci-6, alcoxialquilaminocarbonilo Ci-6, pirrolidinilcarbonilo y piperidinilcarbonilo;
R6 es H o alquilo Ci-C6-C(O)O-alquilo C1-6-;
R7 es H, alquilo Ci-6, cicloalquilo C3-7 o alquilcarbonilo Ci-i0;
R8 es H, alquilcarbonilo Ci-6, carboxialquilcarbonilo Ci-6, alquioxicarbonilalquilcarbonilo Ci-6 o benzoilo;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
La invención también se refiere a su fabricación, medicamentos basados en un compuesto de acuerdo con la invención y su producción, así como al uso de compuestos de fórmula (I) o sus profármacos, fórmula (la), de los mismos como agonista de TLR7. En consecuencia, los compuestos de fórmula (I) o sus profármacos, fórmula (la), son útiles para el tratamiento o la profilaxis de la infección por el VHB y/o el VHC con agonismo de los receptores de tipo Toll.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN
A menos que se definan de otro modo, todos los términos técnicos y científicos usados en el presente documento tienen el mismo significado entendido comúnmente por un experto en la técnica a la que pertenece la presente invención. Además, las siguientes definiciones se exponen para ilustrar y definir el significado y alcance de los diversos términos usados para describir la invención.
DEFINICIONES
El término "alquilo Ci-6" indica un grupo alquilo de cadena lineal o ramificada saturado que contiene de i a 6, en particular de i a 4 átomos de carbono, por ejemplo metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, ferc-butilo y similares. Grupos "alquilo Ci-6" particulares son metilo, etilo y n-propilo.
El término "alquilo Ci-i0 " indica un grupo alquilo de cadena lineal o ramificada saturado que contiene de i a i0, en particular de i a 7 átomos de carbono. El grupo "alquilo Ci-W' particular es propilbutilo.
El término "cicloalquilo C3 -7" indica un anillo de carbono saturado que contiene de 3 a 7 átomos de carbono, en
particular de 3 a 6 átomos de carbono, por ejemplo, ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo, cicloheptilo y similares. Un grupo "cicloalquilo C3 -7" particular es ciclopropilo.
El término "alcoxi C1-6" indica un grupo de la fórmula alquilo C1-6-O-. Los ejemplos de grupo alcoxi C1-6 incluyen, pero sin limitarse a, metoxi, etoxi, n-propoxi, isopropoxi, n-butoxi, isobutoxi y ferc-butoxi. Grupos "alcoxi C1-6" particulares son metoxi, etoxi e isopropoxi. Un grupo alcoxi C1-6 más particular es etoxi.
Los términos “halógeno” y “halo” se usan de manera intercambiable en el presente documento e indican flúor, cloro, bromo o yodo.
El término "haloalquilo C1-6" indica un grupo alquilo en el que al menos uno de los átomos de hidrógeno del grupo alquilo se ha reemplazado por los mismos o diferentes átomos de halógeno, en particular átomos de flúor. Los ejemplos de haloalquilo C1-6 incluyen monofluoro-, difluoro- o trifluorometilo, -etilo o -propilo, por ejemplo, 3,3,3-trifluoropropilo, 2-fluoroetilo, 2,2,2-trifluoroetilo, fluorometilo, difluorometilo, trifluorometilo y trifluoroetilo.
El término “amino” indica un grupo de la fórmula -NR'R” en la que R' y R” son independientemente hidrógeno, alquilo C1-6, alcoxi C1-6, cicloalquilo C3-7, heterocicloalquilo C3-7, arilo o heteroarilo. De forma alternativa, R 'y R”, conjuntamente con el nitrógeno al que están unidos, pueden formar un heterocicloalquilo C3-7. El término "amino primario" indica un grupo en el que tanto R' como R" son hidrógeno. El término "amino secundario" indica un grupo en el que R' es hidrógeno y R" no lo es. El término "amino terciario" indica un grupo en el que tanto R' como R" no son hidrógeno. Amino secundario y terciario particular son metilamino, etilamino, propilamino, isopropilamino, fenilamino, bencilamino dimetilamino, dietilamino, dipropilamino, diisopropilamino, metoxietilamino, metiletilamino, clorobutilmetilamino, dibutilamino y metilbutilamino.
El término "carbonilo" solo o en combinación se refiere al grupo -C(O)-.
El término "alquilcarbonilo C1-6" se refiere a un grupo alquilo C1 -6-C(O)-, en el que el "alquilo C1-6" es como se define anteriormente. Un grupo "alquilcarbonilo C1-6" particular es acetilo.
El término "enantiómero" indica dos estereoisómeros de un compuesto que son imágenes especulares no superponibles entre sí.
El término "diastereómero" indica un estereoisómero con dos o más centros de quiralidad y en el que sus moléculas no son imágenes especulares entre sí. Los diastereómeros tienen diferentes propiedades físicas, por ejemplo, puntos de fusión, puntos de ebullición, propiedades espectrales y reactividades.
El término “sales farmacéuticamente aceptables” indica sales que no sean indeseables biológicamente o de otro modo. Las sales farmacéuticamente aceptables incluyen tanto sales de adición de ácido como de base.
El término "sal de adición de ácido farmacéuticamente aceptable" indica las sales farmacéuticamente aceptables formadas con ácidos inorgánicos, tales como ácido clorhídrico, ácido bromhídrico, ácido sulfúrico, ácido nítrico, ácido carbónico, ácido fosfórico, y ácidos orgánicos seleccionados de las clases alifática, cicloalifática, aromática, aralifática, heterocíclica, carboxílica y sulfónica de ácidos orgánicos, tales como ácido fórmico, ácido acético, ácido propiónico, ácido glicólico, ácido glucónico, ácido láctico, ácido pirúvico, ácido oxálico, ácido málico, ácido maleico, ácido malónico, ácido succínico, ácido fumárico, ácido tartárico, ácido cítrico, ácido aspártico, ácido ascórbico, ácido glutámico, ácido antranílico, ácido benzoico, ácido cinámico, ácido mandélico, ácido embónico, ácido fenilacético, ácido metanosulfónico, ácido etanosulfónico, ácido p-toluenosulfónico y ácido salicíclico.
El término “sal de adición de base farmacéuticamente aceptable” indica las sales farmacéuticamente aceptables formadas con una base orgánica o inorgánica. Los ejemplos de bases inorgánicas aceptables incluyen sales de sodio, potasio, amonio, calcio, magnesio, hierro, cinc, cobre, manganeso y aluminio. Las sales derivadas de bases orgánicas no tóxicas farmacéuticamente aceptables incluyen sales de aminas primarias, secundarias y terciarias, aminas sustituidas, incluyendo aminas sustituidas naturales, aminas cíclicas y resinas básicas de intercambio iónico, tales como isopropilamina, trimetilamina, dietilamina, trietilamina, tripropilamina, etanolamina, 2-dietilaminoetanol, trimetamina, diciclohexilamina, lisina, arginina, histidina, cafeína, procaína, hidrabamina, colina, betaína, etilendiamina, glucosamina, metilglucamina, teobromina, purinas, pipericina, piperidina, W-etilpiperidina y resinas de poliamina.
Los compuestos de la fórmula general (I) y sus profármacos que contienen uno o varios centros quirales pueden estar presentes como racematos, mezclas diastereoméricas o bien isómeros individuales ópticamente activos. Los racematos se pueden separar de acuerdo con procedimientos conocidos en los enantiómeros. En particular, las sales diastereoméricas que se pueden separar por cristalización se forman a partir de mezclas racémicas por reacción con un ácido ópticamente activo tal como ácido D- o L-tartárico, ácido mandélico, ácido málico, ácido láctico o ácido alcanforsulfónico.
El término "profármaco" indica una forma o derivado de un compuesto que se metaboliza in vivo, por ejemplo, por
fluidos biológicos o enzimas por un sujeto después de la administración, en una forma farmacológicamente activa del compuesto para producir el efecto farmacológico deseado. Los profármacos se describen, por ejemplo, en "The Organic Chemistry of Drug Design and Drug Action", por Richard B. Silverman, Academic Press, San Diego, 2004, Capítulo 8 Prodrugs and Drug Delivery Systems, págs. 497-558.
Un “metabolito farmacéuticamente activo” pretende significar un producto farmacológicamente activo producido a través del metabolismo en el cuerpo de un compuesto especificado o sal del mismo. Después de ingresar al cuerpo, la mayoría de los fármacos son sustratos para reacciones químicas que pueden cambiar sus propiedades físicas y sus efectos biológicos. Estas conversiones metabólicas, que normalmente afectan a la polaridad de los compuestos de la invención, alteran la forma en que los fármacos se distribuyen y excretan del cuerpo. Sin embargo, en algunos casos, se requiere el metabolismo de un fármaco para el efecto terapéutico.
El término "cantidad terapéuticamente eficaz" indica una cantidad de un compuesto o molécula de la presente invención que, cuando se administra a un sujeto, (i) trata o evita la enfermedad, afección o trastorno particular, (ii) atenúa, mejora o elimina uno o más síntomas de la enfermedad, afección o trastorno particular, o (iii) evita o retrasa la aparición de uno o más síntomas de la enfermedad, afección o trastorno particular descrito en el presente documento. La cantidad terapéuticamente eficaz variará dependiendo del compuesto, el estado de enfermedad que se está tratando, la gravedad de la enfermedad tratada, la edad y salud relativa del sujeto, la vía y forma de administración, el juicio del médico especialista o veterinario, y otros factores.
El término “composición farmacéutica” indica una mezcla o solución que comprende una cantidad terapéuticamente eficaz de un ingrediente farmacéutico activo conjuntamente con excipientes farmacéuticamente aceptables que se va a administrar a un mamífero, por ejemplo, un ser humano que lo necesite.
AGONISTA DE TLR7 Y PROFÁRMACO
La presente invención se refiere a un compuesto de fórmula (I)
en la que
R1 es alquilo C1-6, haloalquilo C1-6, cicloalquilo C3-7 alquilo C1-6, alcoxialquilo C1-6 o pirrolidinilalquilo C1-6;
R2 es alquilo C1-6, fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6, dicho fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6 están sin sustituir o sustituidos por uno, dos o tres sustituyentes seleccionados independientemente de halógeno, alquilo C1-6, alcoxi C1-6, ciano, carboxi, carbamoílo, haloalquilo C1-6, alquilsulfonilo C1-6, alcoxicarbonilo C1-6, alcoxialquilaminocarbonilo C1-6, pirrolidinilcarbonilo y piperidinilcarbonilo;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (ii) un compuesto de fórmula (I), en la que
R1 es metilo, etilo, propilo, butilo, cloropropilo, ciclohexilmetilo, metoxietilo, metoxipropilo, pirrolidinilpropilo o trifluoroetilo;
R2 es isobutilo, bencilo, clorobencilo, fluorobencilo, bromobencilo, clorofluorobencilo, clorometilbencilo, diclorobencilo, difluorobencilo, metilbencilo, metoxibencilo, cianobencilo, carbamoilbencilo, trifluorometilbencilo, metilsulfonilbencilo, metoxicarbonilbencilo, carboxibencilo, metoxietilaminocarbonilbencilo, piperindinilcarbonilbencilo, pirrolidinilcarbonilbencilo, piridinilmetilo, cloropiridinilmetilo, metilpiridinilmetilo, pirimidinilmetilo o metilpirimidinilmetilo;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (iii) un compuesto de fórmula (I), en la que R1 es alquilo Ci-6, haloalquilo Ci-6 o alcoxialquilo Ci-6; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es un compuesto de fórmula (I), en la que R1 es metilo, propilo, cloropropilo, metoxietilo o trifluoroetilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es un compuesto de fórmula (I), en la que R1 es metilo, etilo, propilo, butilo, cloropropilo, trifluoroetilo, metoxietilo o metoxipropilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (v) un compuesto de fórmula (I), en la que R1 es alquilo Ci-6; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es un compuesto de fórmula (I), en la que R1 es metilo, etilo o propilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (vii) un compuesto de fórmula (I), en la que R1 es etilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es un compuesto de fórmula (I), en la que R2 es fenilalquilo C1-6, estando dicho fenilalquilo C1-6 sin sustituir o sustituido con uno a tres sustituyentes seleccionados independientemente de halógeno, alquilo C1 -6 , carboxi y alcoxicarbonilo C1 -6 ; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (viii) un compuesto de fórmula (I), en la que R2 es fenilalquilo C1-6, estando dicho fenilalquilo C1-6 sin sustituir o sustituido con halógeno, carbamoilo, alquilo C1-6, carboxi, ciano, alcoxi C1-6, alquilsulfonilo C1-6 y alcoxi C1-6 alquilaminocarbonilo C1-6; piridinilalquilo C1-6, estando dicho piridinilalquilo C1-6 sin sustituir o sustituido con alquilo C1-6; o pirimidinilalquilo C1-6, estando dicho pirimidinilalquilo C1-6 sin sustituir o sustituido con alquilo C1-6; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (ix) un compuesto de fórmula (I), en la que R2 es bencilo, metilbencilo, clorobencilo, fluorobencilo, difluorobencilo, cianobencilo, carboxibencilo, metoxibencilo, metilsulfonilbencilo, metoxietilaminocarbonilbencilo, piridinilmetilo, metilpiridinilmetilo, pirimidinilmetilo o metilpirimidinilmetilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es un compuesto de fórmula (I), en la que R2 es bencilo, metilbencilo, clorobencilo, fluorobencilo, bromobencilo, clorofluorobencilo, clorometilbencilo, diclorobencilo, difluorobencilo, carboxibencilo o metoxicarbonilbencilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (x) un compuesto de fórmula (I), en la que R2 es bencilo, metilbencilo, clorobencilo, fluorobencilo, difluorobencilo, carboxibencilo o metilpiridinilmetilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xi) un compuesto de fórmula (I), en la que R2 es metilbencilo o clorobencilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xii) un compuesto de fórmula (I), en la que
R1 es alquilo C1-6 o alcoxialquilo C1-6;
R2 es fenilalquilo C1-6, estando dicho fenilalquilo C1-6 sin sustituir o sustituido con halógeno, carbamoílo, alquilo C1-6, carboxi, ciano y alcoxi C1-6 alquilaminocarbonilo C1-6; o pirimidinilalquilo C1-6, estando dicho pirimidinilalquilo C1-6 sin sustituir o sustituido con alquilo C1-6;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xiii) un compuesto de fórmula (I), en la que
R1 es metilo, etilo, propilo, butilo o metoxietilo;
R2 es bencilo, metilbencilo, clorobencilo, fluorobencilo, cianobencilo, carboxibencilo, metoxietilaminocarbonilbencilo, pirimidinilmetilo o metilpirimidinilmetilo;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xiv) un compuesto de fórmula (I), en la que
R1 es alquilo C1-6 ;
R2 es fenilalquilo C1-6, dicho fenilalquilo C1-6 está sin sustituir o sustituido con halógeno o alquilo C1-6 ;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xv) un compuesto de fórmula (I), en la que
R1 es etilo o propilo;
R2 es bencilo, clorobencilo o metilbencilo;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es que (xvi) compuestos particulares de fórmula (I) son los siguientes:
6-amino-9-bencil-2-(metilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(etilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(2-metoxietilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(butilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(3-metoxipropilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(2,2,2-trifluoroetilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(ciclohexilmetilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-metoxifenil)metil]-2-(metilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(3-cloropropilsulfonimidoil)-9-[(4-metoxifenil)metil]-7H-purin-8-ona;
6-amino-9-[(4-metoxifenil)metil]-2-(3-pirrolidin-1-ilpropilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(metilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(6-cloro-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(2-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(metilsulfonimidoil)-9-(3-piridilmetil)-7H-purin-8-ona;
3-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo;
3-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida;
6-amino-2-(metilsulfonimidoil)-9-(2-piridilmetil)-7H-purin-8-ona;
6-amino-2-(metilsulfonimidoil)-9-(4-piridilmetil)-7H-purin-8-ona;
6-amino-9-isobutil-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(3-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(propilsulfonimidoil)-9-[[4-(trifluorometil)fenil]metil]-7H-purin-8-ona;
6-amino-9-[(4-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-bromofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(3,4-diclorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-(3,4-difluorofenilmetil)-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-cloro-3-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(propilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona;
6-amino-9-[(4-cloro-3-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(2,4-difluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida;
6-amino-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(2-metil-4-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(3-cloro-4-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-metilsulfonilfenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoato de metilo;
ácido 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoico;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]-N-(2-metoxietil)benzamida;
6-amino-9-[[4-(piperidina-1-carbonil)fenil]metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(S-propilsulfonimidoil)-9-[[4-(pirrolidina-1-carbonil)fenil]metil]-7H-purin-8-ona;
6-metil-2-(propilsulfonimidoil)-9-(pirimidin-5-ilmetil)-7H-purin-8-ona;
6-metil-9-[(2-metilpirimidin-5-il)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona; y
6-amino-2-(etilsulfonimidoil)-9-[(4-fluorofenil)metil]-7H-purin-8-ona;
o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es que (xvii) compuestos más particulares de fórmula (I) son los siguientes:
6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(6-cloro-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-bromofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(propilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona;
6-amino-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoato de metilo;
ácido 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoico;
6-metil-9-[(2-metilpirimidin-5-il)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona; y
6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es que (xvii) los compuestos más particulares de fórmula (I) son los siguientes:
6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona; y
6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xix) un compuesto de fórmula (Ia)
en la que
R4 es alquilo C1-6, haloalquilo C1-6, cicloalquilo C3-7 alquilo C1-6, alcoxialquilo C1-6 o pirrolidinilalquilo C1-6;
R5 es alquilo C1-6, fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6, dicho fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6 están sin sustituir o sustituidos por uno, dos o tres sustituyentes seleccionados independientemente de halógeno, alquilo C1-6, alcoxi C1-6, ciano, carboxi, carbamoílo, haloalquilo C1-6, alquilsulfonilo C1-6, alcoxicarbonilo C1-6, alcoxialquilaminocarbonilo C1-6, pirrolidinilcarbonilo y piperidinilcarbonilo;
R6 es H o alquilo C1-C6-C(O)O-alquilo C1-6-;
R7 es H, alquilo C1-6, cicloalquilo C3-7 o alquilcarbonilo C1-10;
R8 es H, alquilcarbonilo C1-6, carboxialquilcarbonilo C1-6, alquioxicarbonilalquilcarbonilo C1-6 o benzoilo;
siempre que R6, R7 y R8 no sean H simultáneamente;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xx) un compuesto de fórmula (Ia), en la que
R4 es metilo, etilo, propilo, butilo, cloropropilo, ciclohexilmetilo, metoxietilo, metoxipropilo, pirrolidinilpropilo o trifluoroetilo;
R5 es isobutilo, bencilo, clorobencilo, fluorobencilo, bromobencilo, clorofluorobencilo, clorometilbencilo, diclorobencilo, difluorobencilo, metilbencilo, metoxibencilo, cianobencilo, carbamoilbencilo, trifluorometilbencilo, metilsulfonilbencilo, metoxicarbonilbencilo, carboxibencilo, metoxietilaminocarbonilbencilo, piperindinilcarbonilbencilo, pirrolidinilcarbonilbencilo, piridinilmetilo, cloropiridinilmetilo, metilpiridinilmetilo, pirimidinilmetilo o metilpirimidinilmetilo;
R6 es H, acetoximetilo, acetoxietilo o dimetilpropanoiloximetilo;
R7 es H, etilo, propilo, isopropilo, ciclopropilo, acetilo, pentanoilo, metilpentanoilo, propilpentanoilo, etilbutanoilo, metilbutanoilo o dimetilpropanoilo;
R8 es H, acetilo, pentanoilo, carboxipropanoilo, etoxicarbonilpropanoilo o benzoilo; siempre que R6, R7 y R8 no sean H simultáneamente; o una sal, enantiómero o diastereómero farmacéuticamente aceptable del mismo.
Otro modo de realización de la presente invención es (xxi) un compuesto de fórmula (Ia), en la que R4 es alquilo Ci-a; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xxii) un compuesto de fórmula (Ia), en la que R4 es metilo o propilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xxiii) un compuesto de fórmula (Ia), en la que R5 es fenilalquilo C1-6 o piridinilalquilo C1-6, dicho fenilalquilo C1-6 y piridinilalquilo C1-6 están sin sustituir o sustituidos con uno a tres sustituyentes independientemente seleccionados de halógeno o alquilo C1-6; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es un compuesto de fórmula (Ia), en la que R5 es bencilo, metilbencilo, clorobencilo o metilpiridinilmetilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xxiv) un compuesto de fórmula (Ia), en la que R5 es bencilo, clorobencilo o metilpiridinilmetilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo. Otro modo de realización de la presente invención es (xxv) un compuesto de fórmula (Ia), en la que R7 es H, alquilo Ci-a o alquicarbonilo C1-10; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xxvi) un compuesto de fórmula (Ia), en la que R7 es H, etilo, propilo, metilpentanoilo o propilpentanoilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xxvii) un compuesto de fórmula (Ia), en la que R8 es H, alquilcarbonilo C1-6 o carboxialquilcarbonilo Ci-a; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
Otro modo de realización de la presente invención es (xxviii) un compuesto de fórmula (Ia), en la que R8 es H, pentanoilo o carboxipropanoilo; o una sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo. Otro modo de realización de la presente invención es que (xix) compuestos particulares de fórmula (Ia) son los siguientes:
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]pentanamida;
N-[[6-amino-9-[(4-clorofenil)metil]-8-oxo-7H-purin-2-il]-oxo-propil-A4-sulfanilideno]acetamida;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-metil-oxo-A4-sulfanilideno]acetamida;
ácido 4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico;
ácido 4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico;
ácido 4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico;
4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-3-oxo-butanoato de etilo;
4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoato de etilo;
4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoato de etilo;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanylidene]benzamida;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]benzamida;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]benzamida;
9-bencil-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-(etilamino)-9-[(6-metil-3-piridil)metil]-2-(S-propilsulfonimidoil)-7H-purin-8-ona;
9-[(4-clorofenil)metil]-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
9-bencil-6-(propilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
9-bencil-6-(isopropilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
9-bencil-6-(ciclopropilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]acetamida;
N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il] pentanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-etil-butanamida;
N-[9-[(4-clorofenil) metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-3-metil-butanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-metil-pentanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2,2-dimetil-propanamida;
N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida;
acetato de [6-amino-9-bencil-2-(metilsulfonimidoil)-8-oxo-purin-7-il]metilo;
acetato de [6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]metilo;
[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]metil2,2-dimetilpropanoato;
y
acetato de 1 -[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]etilo;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
En algunos modos de realización, se sometieron a prueba compuestos de la presente invención y se compararon con los siguientes compuestos de referencia:
Los compuestos P-2 y P-5 se divulgaron en el documento WO2006117670 como ejemplo 2 y 5 respectivamente, el compuesto GS-9620 se divulgó en el documento US20100143301 como ejemplo 49, el compuesto S-1 se divulgó en el documento JP1999193282.
SÍNTESIS
Los compuestos de la presente invención se pueden preparar por cualquier medio convencional. Los procedimientos adecuados para sintetizar estos compuestos así como sus materiales de partida se proporcionan en los esquemas a continuación y en los ejemplos. Todos los sustituyentes, en particular, R1 a R11 son como se define anteriormente a menos que se indique de otro modo. Además, y a menos que se establezca explícitamente de otro modo, todas las reacciones, condiciones de reacción, abreviaturas y símbolos tienen los significados bien conocidos para un experto en química orgánica.
Esquema 1
Un compuesto de fórmula VI se prepara por ciclación de isocianato VII con aminomalononitrilo p-toluenosulfonato. A continuación, se sintetiza el biciclo IV por reacción del compuesto de fórmula VI con isotiocianato de benzoilo con base inorgánica, tal como hidróxido de sodio o hidróxido de potasio. La alquilación del biciclo IV con haluro de alquilo V en presencia de una base tal como K2CO3 , NaH o CS2CO3 da el compuesto de fórmula IIIa. A continuación, el compuesto de fórmula IIa se prepara por oxidación del compuesto de fórmula IIIa con un oxidante, tal como ácido meta-cloroperoxibenzoico, aducto de urea-peróxido de hidrógeno o HIO4. Un compuesto de fórmula Ie se obtiene por iminación del compuesto de fórmula IIa con reactivo de iminación, tal como acida de sodio en ácido, dicho ácido es, por ejemplo, reactivo de Eaton o PPA.
Un compuesto de fórmula X se prepara por reacción del compuesto de fórmula XI con Rb NH2. La reducción del compuesto X da el compuesto de fórmula IX. La ciclación del compuesto de fórmula IX con reactivos de ciclación, tales como fosgeno, carbonil diimidazol, carbonato de dietilo o trifosgeno proporciona el compuesto de fórmula VIII. Un compuesto de fórmula IIIb se prepara tratando el compuesto de fórmula VIII con R7 NH2 tras calentamiento. Un compuesto de fórmula Ie se prepara por desprotección del compuesto de fórmula IIIb, mientras que R7 es PMB con ácido, tal como CF3COOH, seguido de oxidación con un oxidante, tal como ácido mefa-cloroperoxibenzoico, aducto de urea-peróxido de hidrógeno o HIO4 e iminación con reactivo de iminación, tal como acida de sodio en ácido, dicho ácido es, por ejemplo, reactivo de Eaton o PPA. Un compuesto de fórmula Ic se obtiene por oxidación directa del compuesto de fórmula IIIb para dar el compuesto IIb mientras que R7 es alquilo o cicloalquilo, seguido de iminación con reactivo de iminación, tal como acida de sodio en ácido, dicho ácido es, por ejemplo, reactivo de Eaton o PPA. Un compuesto de fórmula Id se obtiene por acilación del compuesto de fórmula IIIa para dar el compuesto IIIc, seguido de oxidación con un oxidante, tal como ácido mefa-cloroperoxibenzoico, aducto de urea-peróxido de hidrógeno o HIO4 , e iminación con reactivo de iminación, tal como acida de sodio en ácido, dicho ácido es, por ejemplo, reactivo de Eaton o PPA.
Esquema 3
Ra es R1, R4 o R9; Rb es R2, R5 o R10.
Los profármacos de fórmula XIII o XIV se pueden preparar de acuerdo con el Esquema 3.
Un compuesto de fórmula XIII se sintetiza por alquilación de compuestos originales activos de fórmula Ie con haloéster, tal como acetato de clorometilo. Un compuesto de fórmula XIV se sintetiza por reacción del compuesto original activo de fórmula Ie con anhídrido carboxílico, tal como anhídrido acético, o cloruro de acilo, tal como 4-cloro-4-oxo-butanoato.
La presente invención también se refiere a un procedimiento para la preparación de un compuesto de fórmula (I) o (Ia) que comprende la reacción de:
(a) la reacción de un compuesto de fórmula (IIa),
(b) la reacción de un compuesto de fórmula (I Ib),
con un reactivo de iminación; en la que Ra es R1 o R4, Rb es R2 o R5, R7 es alquilo C1-6 o cicloalquilo C3-7;
(c) la reacción de un compuesto de fórmula (IIIc),
con un oxidante seguido de un reactivo de iminación, en la que Ra es R1 o R4, Rb es R2 o R5, R12 es alquilo C1-10; (d) la reacción de un compuesto de fórmula (IIIa),
con un oxidante seguido de un reactivo de iminación en la que Ra es R1 o R4, Rb es R2 o R5;
(e) la reacción de un compuesto de fórmula (Ie),
(f) la reacción de un compuesto de fórmula (le),
en la que Ra, Rb, R1, R2, R4, R5, R7 y R12 son como se define anteriormente.
En las etapas (a), (b), (c) y (d), el reactivo de iminación puede ser, por ejemplo, acida de sodio en ácido, dicho ácido puede ser, por ejemplo, reactivo de Eaton o PPA.
En las etapas (c) y (d), el oxidante puede ser, por ejemplo, ácido mefa-cloroperoxibenzoico, aducto de urea-peróxido de hidrógeno o HIO4.
En la etapa (e), el haloéster puede ser, por ejemplo, acetato de clorometilo.
En la etapa (f), el anhídrido carboxílico puede ser, por ejemplo, anhídrido acético; el cloruro de acilo puede ser 4-cloro-4-oxo-butanoato.
Cuando se fabrica un compuesto de fórmula (I) e (Ia) de acuerdo con el procedimiento anterior también es un objetivo de la invención.
COMPOSICIONES FARMACÉUTICAS Y ADMINISTRACIÓN
Otro modo de realización proporciona composiciones farmacéuticas o medicamentos que contienen los compuestos de la invención y un vehículo, diluyente o excipiente terapéuticamente inerte, así como procedimientos de uso de los compuestos de la invención para preparar dichas composiciones y medicamentos. En un ejemplo, se pueden formular los compuestos de fórmula (I) o sus profármacos mezclando a temperatura ambiente al pH apropiado, y al grado de pureza deseado, con vehículos fisiológicamente aceptables, es decir, vehículos que no son tóxicos para los receptores en las dosificaciones y concentraciones empleadas en una forma de administración galénica. El pH de la formulación depende principalmente del uso particular y de la concentración del compuesto, pero preferentemente varía en cualquier valor desde aproximadamente 3 a aproximadamente 8. En un ejemplo, un compuesto de fórmula (I) o sus profármacos se formulan en un tampón de acetato, a pH 5. En otro modo de realización, los compuestos de fórmula (I) o sus profármacos son estériles. El compuesto se puede almacenar, por ejemplo, como una composición sólida o amorfa, como una formulación liofilizada o como una solución acuosa.
Las composiciones se formulan, dosifican y administran de una manera consistente con la buena práctica médica. Los factores que se deben tener en consideración en este contexto incluyen el trastorno particular que se trata, el mamífero particular que se trata, la afección clínica del paciente individual, la causa del trastorno, el sitio de administración del agente, el procedimiento de administración, la pauta de administración y otros factores conocidos por los médicos. La "cantidad eficaz" del compuesto que se va a administrar se regirá por dichas consideraciones, y
es la cantidad mínima necesaria para activar el receptor TLR7 y dar lugar a producir INF-a y otras citocinas, que se pueden usar, pero no están limitadas, para el tratamiento o la prevención de pacientes con infección vírica por hepatitis B y/o C.
En un ejemplo, la cantidad farmacéuticamente eficaz del compuesto de la invención administrado parenteralmente por dosis estará en el intervalo de aproximadamente 0,1 a 50 mg/kg, de forma alternativa de aproximadamente 0,1 a 30 mg/kg de peso corporal del paciente al día, siendo el intervalo inicial típico del compuesto usado de 0,3 a 15 mg/kg/día. En otro modo de realización, las formas de dosificación unitaria orales, tales como comprimidos y cápsulas, contienen preferentemente de aproximadamente 20 hasta aproximadamente 1000 mg del compuesto de la invención.
Los compuestos de la invención se pueden administrar por cualquier medio adecuado, incluyendo administración oral, tópica (incluyendo bucal y sublingual), rectal, vaginal, transdérmica, parenteral, subcutánea, intraperitoneal, intrapulmonar, intradérmica, intratecal y epidural e intranasal y, si se desean para tratamiento local, intralesional. Las infusiones parenterales incluyen administración intramuscular, intravenosa, intrarterial, intraperitoneal o subcutánea. Los compuestos de la presente invención se pueden administrar en cualquier forma de administración conveniente, por ejemplo, comprimidos, polvos, cápsulas, soluciones, dispersiones, suspensiones, jarabes, pulverizadores, supositorios, geles, emulsiones, parches, etc. Dichas composiciones pueden contener componentes convencionales en preparaciones farmacéuticas, por ejemplo, diluyentes, vehículos, modificadores del pH, edulcorantes, agentes de carga y otros agentes activos.
Una formulación típica se prepara mezclando un compuesto de la presente invención y un vehículo o excipiente. Los vehículos y excipientes adecuados son bien conocidos por los expertos en la técnica y se describen con detalle, por ejemplo, en Ansel, Howard C., et al., Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems. Filadelfia: Lippincott, Williams & Wilkins, 2004; Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Filadelfia: Lippincott, Williams & Wilkins, 2000; y Rowe, Raymond C. Handbook of Pharmaceutical Excipients. Chicago, Pharmaceutical Press, 2005. Las formulaciones también pueden incluir uno o más tampones, agentes estabilizantes, tensioactivos, agentes humectantes, agentes lubricantes, emulsionantes, agentes de suspensión, conservantes, antioxidantes, agentes opacificantes, deslizantes, coadyuvantes tecnológicos, colorantes, edulcorantes, agentes perfumantes, agentes saborizantes, diluyentes y otros aditivos conocidos para proporcionar una presentación elegante del fármaco (es decir, un compuesto de la presente invención o composición farmacéutica del mismo) o para ayudar en la fabricación del producto farmacéutico (es decir, medicamento).
Un ejemplo de una forma farmacéutica oral adecuada es un comprimido que contiene aproximadamente de 20 a 1000 mg del compuesto de la invención compuesto con aproximadamente de 30 a 90 mg de lactosa anhidra, aproximadamente de 5 a 40 mg de croscarmelosa de sodio, aproximadamente de 5 a 30 mg de polivinilpirrolidona (PVP) K30, y aproximadamente de 1 a 10 mg de estearato de magnesio. En primer lugar, se mezclan los ingredientes en polvo y, a continuación, se mezclan con una solución de PVP. La composición resultante se puede secar, granular, mezclar con el estearato de magnesio y comprimir en una forma de comprimido usando un equipo convencional. Un ejemplo de una formulación en aerosol se puede preparar disolviendo el compuesto, por ejemplo, de 20 a 1000 mg, de la invención en una solución tampón adecuada, por ejemplo, un tampón de fosfato, añadiendo un tonificador, por ejemplo, una sal tal como cloruro de sodio, si se desea. La solución se puede filtrar, por ejemplo, usando un filtro de 0,2 micrones, para eliminar impurezas y contaminantes.
Un modo de realización, por lo tanto, incluye una composición farmacéutica que comprende un compuesto de fórmula (I) o sus profármacos, fórmula (Ia), o sales farmacéuticamente aceptables o enantiómeros o diastereómeros del mismo.
Otro modo de realización incluye una composición farmacéutica que comprende un compuesto de fórmula (I) o sus profármacos, fórmula (Ia), o sales farmacéuticamente aceptables o enantiómeros o diastereómeros del mismo, conjuntamente con un vehículo o excipiente farmacéuticamente aceptable.
Otro modo de realización incluye una composición farmacéutica que comprende un compuesto de fórmula (I) o sus profármacos, fórmula (Ia), o sales farmacéuticamente aceptables o enantiómeros o diastereómeros del mismo para su uso en el tratamiento de la infección por el virus de la hepatitis B.
INDICACIONES Y PROCEDIMIENTOS DE TRATAMIENTO
La presente invención proporciona compuestos para su uso en el tratamiento de una infección vírica por hepatitis B y/o una infección vírica por hepatitis C en un paciente que lo necesite.
La presente invención divulga además procedimientos para introducir una cantidad terapéuticamente eficaz de un compuesto de fórmula (I) o sus profármacos u otros compuestos de la invención en la circulación sanguínea de un paciente para el tratamiento y/o la prevención de una infección vírica por hepatitis B y/o C.
Los compuestos de la presente invención son adecuados en particular para su uso en el tratamiento de pacientes humanos. En particular, los compuestos y dosis de la presente invención pueden ser útiles para, pero sin limitarse a, el tratamiento de pacientes infectados por el VHB y/o VHC. Los compuestos y dosis de la presente invención también son útiles para el tratamiento de pacientes sometidos a otros tratamientos antivíricos. Los compuestos de la presente invención son útiles en particular para el tratamiento profiláctico de pacientes con riesgo de infección vírica. Estos pacientes incluyen, pero no se limitan a, profesionales sanitarios, por ejemplo, médicos, personal de enfermería, cuidadores de unidades de cuidados paliativos; personal militar; maestros trabajadores de cuidado infantil; pacientes que viajan o viven en lugares extranjeros, en particular lugares del tercer mundo, incluyendo trabajadores sociales, misioneros y diplomáticos extranjeros. Finalmente, los compuestos para su uso y composiciones incluyen el tratamiento de pacientes refractarios o pacientes resistentes al tratamiento tal como resistencia a inhibidores de la retrotranscriptasa, inhibidores de la proteasa, etc.
Otro modo de realización incluye compuestos de fórmula (I), o enantiómeros, diastereómeros, profármacos o sales farmacéuticamente aceptables de los mismos para su uso en el tratamiento de una infección vírica por hepatitis B y/o una infección vírica por hepatitis C en un mamífero que necesita dicho tratamiento, en el que el procedimiento comprende administrar a dicho mamífero una cantidad terapéuticamente eficaz de un compuesto.
EJEMPLOS
La invención se entenderá mejor con referencia a los siguientes ejemplos. Sin embargo, estos no se deben interpretar como limitantes del alcance de la invención.
ABREVIATURAS
ac. acuoso
BSA: N,0-bis(trimet¡lsilil)acetamida
CDCb: cloroformo deuterado
CD3OD: metanol deuterado
CDI: N,N'-carbonil diimidazol
DIEPA: N,N-dietilpropilamina
DMF: dimetilformamida
DMSO: dimetilsulfóxido
DBU: 1,8-diazabicicloundec-7-eno
DPPA difenilfosforilacida
CE50: la concentración molar de un agonista, que produce un 50 % de la respuesta máxima posible para ese agonista.
EDC: N1-((etilimino)metileno)- N3,N3-dimetilpropano-1,3-diamina
EtOAc o EA: acetato de etilo
HATU: hexafluorofosfato de 3-óxido-1-[bis(dimetilamino)metileno]-1H-1,2,3-triazolo[4,5-b]pmd¡mo h: hora(s)
HPLC: cromatografía de líquidos de alto rendimiento
HOBt: N-hidroxibenzotriazol
MS (ESI): espectroscopia de masas (ionización por pulverización electrónica)
m-CPBA: ácido 3-cloroperbenzoico
min minuto(s)
MTEB: metil ferc-butil éter
RMN: resonancia magnética nuclear
NMP: N-metilpirrolidona
obsd. observado
PE: éter de petróleo
PMB: p-metoxibencilo
PPA: poli(ácido fosfórico)
TA o ta: temperatura ambiente
sat. saturado
TFA: ácido trifluoroacético
THF: tetrahidrofurano
TEA: trietilamina
v/v proporción en volumen
CONDICIONES EXPERIMENTALES GENERALES
Los intermedios y los compuestos finales se purificaron por cromatografía ultrarrápida usando uno de los siguientes instrumentos: i) sistema Biotage SP1 y el módulo de cartucho Quad 12/25, ii) instrumento de cromatografía CombiFlash de ISCO. Marca de gel de sílice y tamaño de poro: i) KP-SIL 60 A, tamaño de partícula: 40-60 pm; ii) n.° de registro de CAS: gel de sílice: 63231-67-4, tamaño de partícula: gel de sílice de 47-60 micrones; iii) ZCX de Qingdao Haiyang Chemical Co., Ltd, poro: 200-300 o 300-400.
Los intermedios y los compuestos finales se purificaron por HPLC preparativa en columna de fase inversa usando una columna X Bridge™ Perp C18 (5 pm, OBD™ 30 * 100 mm) o una columna SunFire™ Perp C18 (5 pm, OBD™ 30 * 100 mm).
Los espectros de LC/MS se obtuvieron usando una Waters UPLC-SQD Mass. Las condiciones estándar de LC/MS fueron como sigue (tiempo de ejecución 3 minutos):
condición ácida: A: ácido fórmico al 0,1 % y acetonitrilo al 1 % en H2O; B: ácido fórmico al 0,1 % en acetonitrilo; condición básica: A: NH3H2O al 0,05 % en H2O; B: acetonitrilo;
Espectros de masas (EM): en general solo se informa de los iones que indican la masa original, y a menos que se establezca de otro modo el ion de masa citado es el ion de masa positivo (M+H)+.
Los espectros de RMN se obtuvieron usando un sistema Avance de Bruker de 400 MHz.
Todas las reacciones que implican reactivos sensibles al aire se realizaron en atmósfera de argón. Los reactivos se usaron como se recibieron de los proveedores comerciales sin purificación adicional a menos que se mencione de otro modo.
EJEMPLOS PREPARATIVOS
Ejemplo 1
6-Amino-9-bencil-2-(metilsulfonimidoil)-7H -purin-8-ona
Etapa 1: Preparación de 4-amino-3-bencil-2-oxo-1H-imidazol-5-carbonitrilo
A una solución de p-toluenosulfonato de aminomalononitrilo (25 g, 98,5 mmol, TCI, número de catálogo: A1119-25G) en THF seco (100 ml) se le añadió isocianato de bencilo (13,2 g, 98,5 mmol) y TEA (10,2 g, 79,0 mmol) a TA. Después de agitar a ta durante 24 h, la reacción se concentró a vacío y el residuo se repartió entre EtOAc (500 ml) y agua (250 ml). La capa orgánica separada se lavó con salmuera (50 ml) dos veces y se extrajo con solución de hidróxido de sodio (50 ml, 1 N) dos veces. La capa combinada de solución de hidróxido de sodio se neutralizó con una solución de hidrogenosulfato de sodio al 10 % en peso y se extrajo con EtOAc. La capa orgánica separada se lavó con salmuera, se secó sobre Na2SO4 anhidro, se filtró y se concentró a vacío. El residuo se trituró en 2
isopropoxipropano y, a continuación, la suspensión se filtró para dar 4-amino-3-bencil-2-oxo-1H-imidazol-5-carbonitrilo (compuesto 1a) como un sólido amarillo (15 g), el producto se usó en la siguiente etapa sin purificación adicional. MS obsd. (ESI+) [(M+H)+]: 215.
Etapa 2: Preparación de 6-amino-9-bencil-2-sulfanil-7H-purin-8-ona
A una solución de 4-amino-3-bencil-2-oxo-1H-imidazol-5-carbonitrilo (15,0 g, 70,0 mmol, compuesto 1a) en THF (700 ml) se le añadió benzoilisotiocianato (28,6 g, 175,1 mmol, TCI, número de catálogo: A11596-100G) gota a gota. Después de agitar a TA durante 12 h, se concentró la mezcla de reacción a vacío. El residuo se trituró en éter dietílico (100 ml) y el precipitado resultante se recogió por filtración.
A una solución del precipitado obtenido en THF (700 ml) se le añadió hidróxido de sodio (70 ml, 2 N). La mezcla se calentó a reflujo durante 50 h y, a continuación, se acidificó a pH 3 con una solución acuosa de hidrogenosulfato de sodio al 10 % en peso. El precipitado resultante se recogió por filtración para dar un producto en bruto 6-amino-9-bencil-2-sulfanil-7H-purin-8-ona (8,1 g, compuesto 1b) como un sólido amarillo. El producto se usó en la siguiente etapa sin purificación adicional. Ms obsd. (ESI+) [(M+H)+]: 274.
Etapa 3: Preparación de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona
A una solución de 6-amino-9-bencil-2-sulfanil-7H-purin-8-ona (5,46 g, 20,0 mmol, compuesto 1b) en DMF se le añadió carbonato de potasio (2,76 g, 20,0 mmol). Además, a continuación, a la solución anterior se le añadió lentamente yoduro de metilo (2,84 g, 20,0 mmol) en DMF (5,0 ml). Después de agitar a TA durante 12 h, la mezcla de reacción se vertió en agua (200 ml), a continuación se acidificó con solución acuosa de hidrogenosulfato de sodio al 10 % en peso y se extrajo con EtOAc (100 ml) dos veces. La capa orgánica se lavó con salmuera, se secó y se concentró a vacío para dar el producto en bruto, que se purificó por cromatografía ultrarrápida sobre gel de sílice para dar 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (4,9 g, compuesto 1c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 288.
Etapa 4: Preparación de 6-amino-9-bencil-2-metilsulfinilo-7H-purin-8-ona
A una suspensión del compuesto 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (2,5 g, 8,7 mmol, compuesto 1c) en DCM/MeOH (500 ml, v/v = 1:1) se le añadió ácido 3-cloroperbenzoico (2,15 g, 8,7 mmol, 70 % de pureza, Aldrich, número de catálogo: 273031-100G). Después de agitar la reacción durante 2 h, el volumen de la mezcla de reacción se redujo a vacío hasta aproximadamente 50 ml. El precipitado resultante se recogió por filtración, se lavó con metanol y se secó para dar 6-amino-9-bencil-2-metilsulfinilo-7H-purin-8-ona (1,0 g, compuesto 1d) como un sólido blanco. El producto se usó en la siguiente etapa sin purificación adicional. MS obsd. (ESI+) [(M+H)+]: 304.
Etapa 5: Preparación de 6-amino-9-bencil-2-(metilsulfonimidoil)-7H-purin-8-ona
A una solución de 6-amino-9-bencil-2-metilsulfinilo-7H-purin-8-ona (1,4 g, 4,6 mmol, compuesto 1d) en reactivo de Eaton (40 ml, pentóxido de fósforo, 7,5 % en peso en ácido metanosulfónico, Aldrich, número de catálogo: 380814-100ML) se le añadió acida de sodio (360 mg, 5,5 mmol) a 50 °C. Después de agitarse a esta temperatura durante 30 minutos, la mezcla de reacción se enfrió a TA y se vertió en solución acuosa sat. de bicarbonato de sodio. La mezcla de reacción se extrajo con n-BuOH (100 ml) dos veces, y la fase orgánica se concentró a vacío. El residuo se sometió a purificación por HPLC para dar 6-amino-9-bencil-2-(metilsulfonimidoil)-7H-purin-8-ona (900 mg, compuesto 1) como un sólido blanco. r Mn de 1H (400 MHz, DMSO-de) 5 ppm: 10,6 (s. a., 1 H), 7,26-7,34 (m, 5H), 7,07 (s. a., 2H), 4,96 (s, 2H), 4,04 (s, 1H), 3,18 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 319.
La separación del compuesto del ejemplo 1 por HPLC quiral proporcionó el ejemplo 1-A (elución más rápida, 7,1 mg) y el ejemplo 1-B (elución más lenta, 9,1 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak o J-3).
Ejemplo 1-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,06 (s. a., 1H), 7,27-7,36 (m, 5H), 6,98 (s. a., 2H), 4.97 (s, 2H), 4,06 (s. a., 1H), 3,18 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 319.
Ejemplo 1B: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,06 (s. a., 1H), 7,26-7,36 (m, 5H), 6,98 (s. a., 2H), 4,96 (s, 2H), 4,07 (s. a., 1H), 3,18 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 319.
Ejemplo 2
6-amino-9-bencil-2-(etilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-bencil-2-etilsulfanil-7H-purin-8-ona
El compuesto 2a se preparó de forma análoga al ejemplo 1, etapa 3 usando bromuro de etilo en lugar de yoduro de metilo. Se obtuvo 6-am¡no-9-benc¡l-2-et¡lsulfan¡l-7H-pur¡n-8-ona (500 mg, compuesto 2a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 302.
Etapa 2: Preparación de 6-amino-9-bencil-2-metilsulfinilo-7H-purin-8-ona
Se preparó compuesto 2b de forma análoga al ejemplo 1, etapa 4 usando 6-am¡no-9-benc¡l-2-et¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 2a) en lugar de 6-am¡no-9-benc¡l-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se obtuvo 6-am¡no-9-benc¡l-2-etMsulf¡nM-7H-pur¡n-8-ona (300 mg, compuesto 2b) como un sól¡do blanco. Ms obsd. (ESI+) [(M+H)+]: 318.
Etapa 3: Preparación de 6-amino-9-bencil-2-(etilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-benc¡l-2-et¡lsulf¡nil-7H-purin-8-ona (compuesto 2b) en lugar de 6-amino-9-benc¡l-2-met¡lsulfin¡l-7H-pur¡n-8-ona (compuesto 1d). Se obtuvo -amino-9-benc¡l-2-(et¡lsulfon¡m¡doil)-7H-pur¡n-8-ona (12 mg, compuesto 2) como un sólido blanco. RMN de 1H (400 MHz, CD3OD) 5 ppm: 7,43 (d, J = 7,03 Hz, 2H), 7,27-7,36 (m, 3H), 5,11 (s, 2H), 3,44-3,62 (m, 2H), 1,30 (t, J = 7,40 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 333.
Ejemplo 3
6-amino-9-bencil-2-(2-metoxietilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-bencil-2-(2-metoxietilsulfanil)-7H-purin-8-ona
Se preparó compuesto 3a de forma análoga al ejemplo 1, etapa 3 usando 2-bromoetil metil éter (TCI, número de catálogo: B1242-250G) en lugar de yoduro de metilo. Se obtuvo 6-amino-9-benc¡l-2-(2-metox¡etilsulfan¡l)-7H-pur¡n-8-ona (600 mg, compuesto 3a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 332.
Etapa 2: Preparación de 6-amino-9-bencil-2-(2-metoxietilsulfinil)-7H-purin-8-ona
Se preparó compuesto 3b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-benc¡l-2-(2-metox¡et¡lsulfan¡l)-7H-purin-8-ona (compuesto 3a) en lugar de 6-amino-9-bencil-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se obtuvo 6-amino-9-benc¡l-2-(2-metox¡et¡lsulf¡nil)-7H-pur¡n-8-ona (350 mg, compuesto 3b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+j: 348.
Etapa 3: Preparación de 6-amino-9-bencil-2-(2-metoxietilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-bencil-2-metoxietilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 3b) en lugar de 6-amino-9-benc¡l-2-met¡lsulfin¡l-7H-pur¡n-8-ona (compuesto 1d). Se obtuvo 6-amino-9-benc¡l-2-(2-metox¡et¡lsulfon¡m¡do¡l)-7H-purin-8-ona (21 mg, ejemplo 3) como un sólido blanco. RMN de 1H (400 MHz, CD3OD) 5 ppm: 7,44 (d, J = 7,15 Hz, 2H), 7,25-7,36 (m, 3H), 5,12 (s, 2H), 3,75-3,82 (m, 4H), 3,17 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 363.
La separación del compuesto del ejemplo 3 por HPLC quiral proporcionó el ejemplo 3-A (elución más rápida, 7,0 mg) y el ejemplo 3-B (elución más lenta, 5,0 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak a S-3).
Ejemplo 3-A: RMN de 1H (400 MHz, CD3OD) 5 ppm: 7,43 (d, J = 7,15 Hz, 2H), 7,25-7,36 (m, 3H), 5,12 (s, 2H), 3,75 3,82 (m, 4H), 3,17 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 363.
Ejemplo 3-B: RMN de 1H (400 MHz, CD3OD) 5 ppm: 7,44 (d, J = 7,15 Hz, 2H), 7,24-7,35 (m, 3H), 5,12 (s, 2H), 3,75 3,82 (m, 4H), 3,17 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 363.
Ejemplo 4
6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-bencil-2-(2-propilsulfanil)-7H-purin-8-ona
Se preparó compuesto 4a de forma análoga al ejemplo 1, etapa 3. usando 1-bromopropano (TCI, número de catálogo: B0638-500G) en lugar de yoduro de metilo. Se obtuvo 6-amino-9-bencil-2-propilsulfanil-7H-purin-8-ona (240 mg, compuesto 4a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 316.
Etapa 2: Preparación de 6-amino-9-bencil-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 4b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-bencil-2-propilsulfanil-7H-purin-8-ona (compuesto 4a) en lugar de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (compuesto 1c). Se obtuvo 6-amino-9-bencil-2-(2-propilsulfinil)-7H-purin-8-ona (210 mg, compuesto 4b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 332.
Etapa 3: Preparación de 6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-bencil-2-(2-propilsulfinil)-7H-purin-8-ona (compuesto 4b) en lugar de 6-amino-9-bencil-2-(2methylsulfinyl)-7H-purin-8-ona (compuesto 1d). Se obtuvo 6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona (80 mg, ejemplo 4) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm:10,65 (s. a., 1H), 7,26-7,37 (m, 5H), 6,98 (s. a., 2H), 4,97 (s, 2H), 4,02 (s, 1H), 3,33 (t, J = 7,53 Hz, 2H), 1,55-1,74 (m, 2H), 0,92 (t, J = 7,53 Hz, 3H) MS obsd. (ESI+) [(M+H)+j: 347. La separación del compuesto del ejemplo 4 por HPLC quiral proporcionó el ejemplo 4-A (elución más lenta, 500 mg) y el ejemplo 4-B (elución más rápida, 490 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CÜ2 en columna ChiralPak AS-3).
Ejemplo 4-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,52 (s. a., 1H), 7,25-7,41 (m, 5H), 6,96 (s. a., 2H), 4,96 (s, 2H), 4,03 (s, 1H), 3,24-3,42 (m, 2H), 1.52-1.75 (m, 2H), 0,92 (t, J = 7,53 Hz, 3H).
Ejemplo 4-B: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,01 (s. a., 1H), 7,26-7,36 (m, 5H), 6,97 (s. a., 2H), 4,96 (s, 2H), 4,03 (s, 1H), 3,26-3,41 (m, 2H), 1.56-1.73 (m, 2H), 0,92 (t, J = 7,53 Hz, 3H).
Ejemplo 5
6-amino-9-bencil-2-(butilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-bencil-2-butilsulfanil-7H-purin-8-ona
Se preparó compuesto 5a de forma análoga al ejemplo 1, etapa 3 usando 1-bromobutano (TCI, número de catálogo: B560-500G) en lugar de yoduro de metilo. Se obtuvo 6-amino-9-bencil-2-butilsulfanil-7H-purin-8-ona (600 mg, compuesto 5a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 330.
Etapa 2: Preparación de 6-amino-9-bencil-2-butilsulfinil-7H-purin-8-ona
Se preparó compuesto 5b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-bencil-2-butilsulfanil-7H-purin-8-ona (compuesto 5a) en lugar de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (compuesto 1c). Se obtuvo 6-amino-9-bencil-2-(2-butilsulfinil)-7H-purin-8-ona (400 mg, compuesto 5b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 346.
Etapa 3: Preparación de 6-amino-9-bencil-2-(butilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-bencil-2-(2-butilsulfinil)-7H-purin-8-ona (compuesto 5b) en lugar de 6-amino-9-bencil-2-(2-metilsulfinil)-7H-purin-8-ona (compuesto 1d). Se obtuvo 6-amino-9-bencil-2-(butilsulfonimidoil)-7H-purin-8-ona (40 mg, ejemplo 5) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,59 (s, 1H), 7,24-7,39 (m, 5H), 6,97 (s. a., 2H), 4,96 (s, 2H), 4,03 (s, 1H), 3,35-3,46 (m, 2H),1,51-1,61 (m, 2H), 1,27-1,39 (m, 2H), 0,84 (t, J = 7,34 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 361.
Ejemplo 6
6-amino-9-bencil-2-(3-metoxipropilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-bencil-2-(3-metoxipropilsulfanil)-7H-purin-8-ona
Se preparó el compuesto 6a de forma análoga al ejemplo 1, etapa 3 usando 1-bromo-3-metoxilpropano (TCI, número de catálogo: B3499-25G) en lugar de yoduro de metilo. Se obtuvo 6-amino-9-bencil-2-metoxipropilsulfanil-7H-purin-8-ona (220 mg, compuesto 6a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 346.
Etapa 2: Preparación de 6-amino-9-bencil-2-(3-metoxipropilsulfinil)-7H-purin-8-ona
Se preparó compuesto 6b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-bencil-2-propilsulfanil-7H-purin-8-ona (compuesto 6a) en lugar de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (compuesto 1c). Se obtuvo 6-amino-9-bencil-2-(2-metoxipropilsulfanil)-7H-purin-8-ona (110 mg, compuesto 6b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 362.
Etapa 3: Preparación de 6-amino-9-bencil-2-(butilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-bencil-2-(2-metox¡propilsulf¡n¡l)-7H-pur¡n-8-ona (compuesto 6b) en lugar de 6-amino-9-bencil-2-(2-metilsulfinil)-7H-purin-8-ona (compuesto 1d). Se obtuvo 6-am¡no-9-benc¡l-2-(metox¡prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (20 mg, ejemplo 6) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,59 (s, 1H), 7,29-7,34 (m, 5H), 7,00 (s. a., 2H), 4,96 (s, 2H), 4,13 (s, 1H), 4,10 (m, 4H), 3,20 (s, 3H), 1,86 (m, 2H). MS obsd. (ESI+) [(M+H)+]: 377.
Ejemplo 7
6-amino-9-bencil-2-(2,2,2-trifluoroetilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-bencil-2-(2,2,2-trifluoroetilsulfanil)-7H-purin-8-ona
Se preparó compuesto 7a de forma análoga al ejemplo 1, etapa 3 usando yoduro de 2,2,2-trifluoroetilo (TCI, número de catálogo: T1148-25G) en lugar de yoduro de metilo. Se obtuvo 6-amino-9-bencil-2-(2,2,2-trifluoroetil)sulfanil-7W-purin-8-ona (compuesto 7a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 356.
Etapa 2: Preparación de 6-amino-9-bencil-2-(2,2,2-trifluoroetilsulfinil)-7H-purin-8-ona
Se preparó compuesto 7b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-bencil-2-2,2,2-trifluoroet¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 7a) en lugar de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (compuesto 1c). Se obtuvo 6-amino-9-bencil-2-(2-2,2,2-trifluoroetilsulfinil)-7H-purin-8-ona (compuesto 7b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 372.
Etapa 3: Preparación de 6-amino-9-bencil-2-(2,2,2-trifluoroetilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-bencil-2-(2-2,2,2-trifluoroetilsulfinil)-7H-purin-8-ona (compuesto 7b) en lugar de 6-amino-9-bencil-2-(2-metilsulfinil)-7H-purin-8-ona (compuesto 1d). Se obtuvo 6-amino-9-bencil-2-(2,2,2-trifluoroetilsulfonimidoil)-7H-purin-8-ona (20 mg, ejemplo 7) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfó) 5 ppm: 10,59 (s. a., 1H), 7,25-7,37 (m, 5H), 7,06 (s. a., 2H), 4,95-5,01 (m, 3H), 4,85 (qd, J = 10,02, 15,37 Hz, 1H), 4,63 (qd, J = 9,92, 15,40 Hz, 1H). MS obsd. (ESI+) [(M+H)+]: 387.
Ejemplo 8
6-amino-9-bencil-2-(ciclohexilmetilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-bencil-2-(ciclohexilmetilsulfanil)-7H-purin-8-ona
Se preparó compuesto 8a de forma análoga al ejemplo 1, etapa 3 usando bromuro de ciclohexilmetilo (TCI, número de catálogo: B1708-25G) en lugar de yoduro de metilo. Se obtuvo 6-amino-9-bencil-2-ciclohexilmetilsulfanil-7H-purin-8-ona (260 mg. compuesto 8a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 370.
Etapa 2: Preparación de 6-amino-9-bencil-2-(ciclohexilmetilsulfinil)-7H-purin-8-ona
Se preparó compuesto 8b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-bencil-2-ciclohexilmetilsulfanil-7H-purin-8-ona (compuesto 8a) en lugar de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (compuesto 1c). Se obtuvo 6-amino-9-bencil-2-(2-ciclohexilmetilsulfinil)-7H-purin-8-ona (120 mg, compuesto 8b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 386.
Etapa 3: Preparación de 6-amino-9-bencil-2-(ciclohexilmetilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-bencil-2-(2-ciclohexilmetilsulfinil)-7H-purin-8-ona (compuesto 8b) en lugar de 6-amino-9-bencil-2-metilsulfinil-7H-purin-8-ona (compuesto 1d). Se obtuvo 6-amino-9-bencil-2-(ciclohexilmetilsulfonimidoil)-7H-purin-8-ona (40 mg, ejemplo 8) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm: 10,59 (s. a., 1H), 7,27-7,33 (m, 5H), 6,97 (s. a., 2H), 4,97 (s, 2H), 4,03 (s, 1H), 3,26-3,29 (m, 2H), 1,54-1,86 (m, 5H), 0,89-1,12 (m, 6H). MS obsd. (ESI+) [(M+H)+]: 401. Ejemplo 9
6-amino-9-[(4-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 4-amino-3-[(4-clorofenil)metil]-2-oxo-1H-imidazol-5-carbonitrilo
A una solución de trifosgeno (5,9 g, 20 mmol) en THF seco (40 ml) se le añadió (4-clorofen¡l)met¡lam¡na (8,5 g, 60 mmol, Accela ChemBio Inc, número de catálogo: SY004062-25g) y DIPEA (12,4 g, 96 mmol) en THF seco (80 ml) a -80 °C. La solución se agitó a -80 °C durante 15 min. Se le añadió una solución de p-toluenosulfonato de aminomalononitrilo (15,2 g, 60 mmol, TCI, número de catálogo: A1119-25G) y DIPEA (6,2 g, 48 mmol) en THF seco (40 ml) a -80 °C. Después de agitar a TA durante 24 h, la reacción se concentró a vacío y el residuo se repartió entre EtOAc (300 ml) y agua (150 ml). La capa orgánica separada se lavó con salmuera (50 ml) dos veces y se extrajo con solución de hidróxido de sodio (50 ml, 1 N) dos veces. La capa combinada de solución de hidróxido de sodio se neutralizó con una solución de hidrogenosulfato de sodio al 10 % en peso y se extrajo con EtOAc. A continuación, las fases orgánicas combinadas se lavaron con salmuera, se secaron sobre sulfato de sodio anhidro, se filtraron y se concentraron a vacío. El residuo se trituró con éter dietílico y, a continuación, la mezcla se filtró para dar 4-amino-3-[(4-clorofenil)metil]-2-oxo-1H-imidazol-5-carbonitrilo (8,0 g, compuesto 9a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 249.
Etapa 2: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-sulfanil-7H-purin-8-ona
A una solución de 4-amino-3-[(4-clorofenil)metil]-2-oxo-1H-imidazol-5-carbonitrilo (8,0 g, 32,0 mmol, compuesto 9a) en THF (100 ml) se le añadió benzoilisotiocianato (11,5 g, 70,4 mmol, TCI, número de catálogo: A11596-100G) gota a gota. Después de agitar a TA durante 12 h, se concentró la mezcla de reacción a vacío. El residuo se trituró en éter dietílico (100 ml) y el precipitado resultante se recogió por filtración.
A una solución del precipitado obtenido en THF (300 ml) se le añadió hidróxido de sodio (30 ml, 2 N). La mezcla se calentó a reflujo durante 50 h y, a continuación, se acidificó a pH 3 con una solución acuosa de hidrogenosulfato de sodio al 10 % en peso. El precipitado resultante se recogió por filtración para dar un producto en bruto 6-amino-9-[(4-clorofenil)metil]-2-sulfanil-7H-purin-8-ona (compuesto 9b) como un sólido amarillo (6,4 g) El producto se usó en la siguiente etapa sin purificación adicional. MS obsd. (ESI+) [(M+H)+]: 308.
Etapa 3: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 9c de forma análoga al ejemplo 1, etapa 3 usando bromuro de n-propilo y 6-amino-9-[(4-clorofenil)metil]-2-sulfanil-7H-purin-8-ona (compuesto 9b) en lugar de yoduro de metilo y 6-amino-9-fenilmetil-2-sulfanil-7H-purin-8-ona (compuesto 1b). Se obtuvo 6-amino-9-[(4-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (800 mg, compuesto 9c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 350.
Etapa 4: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 9d de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-[(4-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 9c) en lugar de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (compuesto 1c). Se obtuvo 6-amino-9-[(4-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (150 mg, compuesto 9d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 366.
Etapa 5: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-[(4-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 9d) en lugar de 6-amino-9-benc¡l-2-met¡lsulfin¡l)-7H-pur¡n-8-ona (compuesto 1d). Se obtuvo 6-amino-9-[(4-clorofen¡l)met¡l]-2-(prop¡lsulfon¡m¡do¡l)-7H-purin-8-ona (25 mg, ejemplo 9) como un sól¡do blanco.
RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,60 (s. a., 1H), 7,32-7,42 (m, 4H), 6,98 (s. a., 2H), 4,96 (s, 2H), 4,03 (s, 1H), 3,25-3,41 (m, 2H), 1,56-1,68 (m, 2H), 0,91 (t, J = 8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 381.
La separación del compuesto del ejemplo 9 por HPLC quiral proporcionó el ejemplo 9-A (elución más rápida, 21 mg) y el ejemplo 9-B (elución más lenta, 10 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak OJ-3).
Ejemplo 9-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,63 (s. a., 1H), 7,34-7,41 (m, 4H), 6,99 (s. a., 2H), 4,96 (s, 2H), 4,05 (s. a., 1H), 3,29-3,38 (m, 2H), 1,58-1,66 (m, 2H), 0,91 (t, J = 8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 381.
Ejemplo 9-B: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,63 (s. a., 1H), 7,34-7,41 (m, 4H), 6,99 (s. a., 2H), 4,96 (s, 2H), 4,05 (s. a., 1H), 3,29-3,38 (m, 2H), 1,58-1,66 (m, 2H), 0,91 (t, J = 8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 381.
Ejemplo 10
6-amino-9-[(4-metoxifenil)metil]-2-(metilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 4-amino-3-[(4-metoxifenil)metil]-2-oxo-1H-imidazol-5-carbonitrilo
Se preparó compuesto 10a de forma análoga al ejemplo 9, etapa 1 usando (4-metoxifen¡l)met¡lam¡na en lugar de 4-clorofenilmetilamina. Se preparó 4-am¡no-3-[(4-metox¡fen¡l)met¡l]-2-oxo-1H-im¡dazol-5-carbon¡tr¡lo (7,5 g, compuesto 10a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 245.
Etapa 2: Preparación de 6-amino-9-[(4-metoxifenil)metil]-2-sulfanil-7H-purin-8-ona
Se preparó compuesto 10b de forma análoga al ejemplo 9, etapa 2 usando 4-amino-3-[(4-metox¡fen¡l)metil]-2-oxo-1H-im¡dazol-5-carbon¡tr¡lo (compuesto 10a) en lugar de 4-amino-3-[(4-clorofenil)met¡l]-2-oxo-1H-¡m¡dazol-5-carbonitrilo (compuesto 9a). Se preparó 6-amino-9-[(4-metox¡fen¡l)metil]-2-sulfan¡l-7H-pur¡n-8-ona (11,4 g, compuesto 10b) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 304.
Etapa 3: Preparación de 6-amino-9-[(4-metoxifenil)metil]-2-metilsulfanil-7H-purin-8-ona
Se preparó compuesto 10c de forma análoga al ejemplo 1, etapa 3 usando 6-amino-9-[(4-metoxifen¡l)met¡l]-2-sulfanil-7H-purin-8-ona (compuesto 10b) en lugar de 6-amino-9-bencil-2-sulfan¡l-7H-pur¡n-8-ona (compuesto 1b). Se preparó 6-amino-9-[(4-metox¡fen¡l)met¡l]-2-met¡lsulfanil-7H-pur¡n-8-ona (2,3 g, compuesto 10c) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 318.
Etapa 4: Preparación de 6-amino-9-[(4-metoxifenil)metil]-2-metilsulfinil-7H-purin-8-ona
Se preparó compuesto 10d de forma análoga al ejemplo 1, etapa 4 usando 6-am¡no-9-[(4-metoxifen¡l)met¡l]-2-met¡lsuifan¡l-7H-purin-8-ona (compuesto 10c) en lugar de 6-amino-9-bencil-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se preparó 6-am¡no-9-[(4-metox¡fen¡l)met¡l]-2-metilsulf¡n¡l-7H-pur¡n-8-ona (130 mg, compuesto 10d) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 334.
Etapa 5: Preparación de 6-amino-9-[(4-metoxifenil)metil]-2-(metilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-[(4-metox¡fen¡l)metil]-2-metilsulf¡n¡l-7H-purin-8-ona (compuesto 10d) en lugar de 6-am¡no-9-bencil-2-met¡lsulf¡n¡l)-7H-pur¡n-8-ona (compuesto 1d). Se preparó 6-am¡no-9-[(4-metox¡fen¡l)met¡l]-2-(metilsulfon¡m¡do¡l)-7H-pur¡n-8-ona (10 mg, ejemplo 0) como un sólido amarillo. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm: 10,53 (s. a., 1H), 7,32 (t, J = 6,41 Hz, 2H), 6,95 (s. a., 2H), 6,89 (t, J = 6,38 Hz, 2H), 4,89 (s, 2H), 4,07 (s, 1H), 3,72 (s, 3H), 3,21 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 349.
Ejemplo 11
6-amino-2-(3-cloropropilsulfonimidoil)-9-[(4-metoxifenil)metil]-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-2-(3-cloropropilsulfanil)-9-[(4-metoxifenil)metil]-7H-purin-8-ona
Se preparó compuesto 11a de forma análoga al ejemplo 1, etapa 3 usando 1-bromo-3-cloro-propano y 6-amino-9-[(4-metox¡fenil)met¡l]-2-sulfan¡l-7H-pur¡n-8-ona (compuesto 10b) en lugar de yoduro de metilo y 6-amino-9-bencil-2-sulfanil-7H-purin-8-ona (compuesto 1b). Se obtuvo 6-am¡no-2-(3-cloroprop¡lsulfan¡l)-9-[(4-metox¡fen¡l)met¡l]-7H-pur¡n-8-ona (3,2 g, compuesto 11a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+j: 380.
Etapa 2: Preparación de 6-amino-2-(3-cloropropilsulfinil)-9-[(4-metoxifenil)metil]-7H-purin-8-ona
Se preparó compuesto 11b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-2-(3-cloropropilsulfanil)-9-[(4-metoxifeni^metilj^H-purin^-ona (compuesto 11a) en lugar de 6-am¡no-9-benc¡l-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se obtuvo 6-am¡no-2-(3-cloroprop¡lsulf¡n¡l)-9-[(4-metox¡fen¡l)met¡l]-7H-pur¡n-8-ona (1,3 g, compuesto 11b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+j: 396.
Etapa 3: Preparación de 6-amino-2-(3-cloropropilsulfonimidoil)-9-[(4-metoxifenil)metil]-7H-purin-8-ona
Se preparo el compuesto del titulo de forma analoga al ejemplo 1, etapa 5 usando 6-amino-2-(3-cloropropilsulfinil)-9-[(4-metoxifen¡l)met¡l]-7H-pur¡n-8-ona (compuesto 11b) en lugar de 6-am¡no-9-benc¡l-2-(2-metilsulf¡n¡l)-7H-pur¡n-8-ona (compuesto 1d). Se obtuvo 6-am¡no-2-(3-cloroprop¡lsulfon¡m¡do¡l)-9-[(4-metox¡fen¡l)met¡l]-7H-pur¡n-8-ona (40 mg, ejemplo 11) como un sól¡do blanco. RMN de 1H (400 MHz, DIVISOR) 5 ppm: 10,53 (s. a., 1H), 7,32 (t, J = 6,41 Hz, 2H), 6,95 (s. a., 2H), 6,89 (t, J = 6,38 Hz, 2H), 4,89 (s, 2H), 4,07 (s, 1H), 3,89 (m, 2H), 3,72 (s, 3H), 3,52 (m, 2H), 2,13 (m, 2H). MS obsd. (ESI+) [(M+H)+]: 411.
Ejemplo 12
6-amino-9-[(4-metoxifenil)metM]-2-(3-pirroMdin-1 -MpropilsulfonimidoM)-7H-purin-8-ona
A una soluc¡ón de 6-am¡no-2-(3-chloroprop¡lsulfon¡m¡do¡l)-9-[(4-metox¡fen¡l)met¡l]-7H-pur¡n-8-ona (150 mg, compuesto 11) en DMSO (5 ml) se le añad¡ó plrrolidina (0,9 ml, 11,0 mmol) gota a gota. Se agitó la mezcla a 80 °C durante 2 h. La mezcla resultante se diluyó con salmuera (60 ml), se extrajo con EtOAc (60 ml) tres veces. La capa organ¡ca se comb¡nó, se lavó con salmuera, se secó sobre sulfato de sod¡o y se concentró a vacío. El res¡duo se punAcó por HPLC preparat¡va para dar 6-am¡no-9-[(4-metox¡fen¡l)met¡l]-2-(3-p¡rrol¡d¡n-1-¡lprop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (26 mg, ejemplo 12) como un sól¡do marrón claro. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm: 10,88 (s. a., 1H), 7,29 (t, J = 6,41 Hz, 2H), 7,05 (s. a., 2H), 6,88 (t, J = 6,38 Hz, 2H), 4,88 (s, 2H), 3,72 (m, 4H), 2,52 (m, 4H), 2,45 (m, 4H), 1,84 (m, 2H), 1,67 (m, 4H). MS obsd. (ESI+) [(M+H)+]: 446.
Ejemplo 13
6 -a m in o -9 -[(4 -c lo ro fe n il)m e til]-2 -(m e tils u lfo n im id o il)-7 H -p u r in -8 -o n a
Etapa 1: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-metilsulfanil-7H-purin-8-ona
Se preparó compuesto 13a de forma análoga al ejemplo 1, etapa 3 usando 6-amino-9-[(4-clorofen¡l)met¡l]-2-sulfan¡l-7H-purin-8-ona (compuesto 9b) en lugar de 6-amino-9-bencil-2-sulfan¡l-7H-pur¡n-8-ona (compuesto 1b). Se obtuvo 6-amino-9-[(4-clorofen¡l)met¡l]-2-metilsulfan¡l-7H-pur¡n-8-ona (1,2 g, compuesto 13a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 322.
Etapa 2: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-metilsulfinil-7H-purin-8-ona
Se preparó compuesto 13b de forma análoga al ejemplo 1, etapa 4 usando 6-am¡no-9-[(4-clorofen¡l)met¡l]-2-metilsulfanil-7H-purin-8-ona (compuesto 13a) en lugar de 6-amino-9-bencil-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se obtuvo 6-amino-9-[(4-clorofen¡l)met¡l]-2-metilsulfan¡l-7H-pur¡n-8-ona (148 mg, compuesto 13b) como un sólido blanco. MS obsd. (ESI+) [(m+H)+]: 338.
Etapa 3: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-(metilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-[(4-clorofen¡l)met¡l]-2-metilsulfan¡l-7H-purin-8-ona (compuesto 13b) en lugar de usar 6-amino-9-bencil-2-met¡lsulfan¡l)-7H-pur¡n-8-ona (compuesto 1d). Se obtuvo 6-amino-9-[(4-clorofen¡l)met¡l]-2-met¡lsulf¡nil-7H-pur¡n-8-ona (7 mg, ejemplo 13) como un sólido blanco. RMN de 1H (400 MHz, DIVISOR) 5 ppm: 10,53 (s. a., 1H), 7,36-7,51 (m, 4H), 6,98 (s. a., 2H), 4,96 (s, 2H), 4,07 (s, 1H), 3,18 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 353.
Ejemplo 14
6-amino-9-[(6-cloro-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 4-amino-3-[(6-cloro-3-piridil)metil]-2-oxo-1H-imidazol-5-carbonitrilo
Se preparó compuesto 14a de forma análoga al ejemplo 9, etapa 1 usando (6-cloro-3-pirid¡l)metanam¡na (Alfa Aesar (China) Co., Ltd., número de catálogo: L19283-25 g) en lugar de (4-clorofenil)metilamina. Se preparó 4-amino-3-[(6-cloro-3-pir¡d¡l)met¡l]-2-oxo-1H-¡m¡dazol-5-carbon¡trilo (7,8 g, compuesto 14a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 250.
Etapa 2: Preparación de 6-amino-9-[(6-cloro-3-piridil)metil]-2-sulfanil-7H-purin-8-ona
Se preparó compuesto 14b de forma análoga al ejemplo 9, etapa 2 usando 4-amino-3-[(6-cloro-3-p¡r¡d¡l)met¡l]-2-oxo-1H-im¡dazol-5-carbon¡tr¡lo (compuesto 14a) en lugar de 4-amino-3-[(4-clorofen¡l)met¡l]-2-oxo-1H-¡m¡dazol-5-carbonitrilo (compuesto 9a). Se obtuvo 6-am¡no-9-[(6-cloro-3-p¡rid¡l)met¡l]-2-sulfan¡l-7H-pur¡n-8-ona (1,1 g, compuesto 14b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 309.
Etapa 3: Preparación de 6-amino-9-[(6-cloro-3-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 14c de forma análoga al ejemplo 1, etapa 3 usando 6-amino-9-[(6-cloro-3-pir¡d¡l)met¡l]-2-sulfanil-7H-purin-8-ona (compuesto 14b) en lugar de 6-amino-9-bencil-2-sulfan¡l-7H-pur¡n-8-ona (compuesto 1b). Se obtuvo 6-amino-9-[(6-cloro-3-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (750 mg, compuesto 14c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 351.
Etapa 4: Preparación de 6-amino-9-[(6-cloro-3-piridil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 14d de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-[(6-cloro-3-pir¡d¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 14c) en lugar de 6-amino-9-bencil-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se obtuvo 6-am¡no-9-[(6-cloro-3-pir¡d¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (750 mg, compuesto 14d). MS obsd. (ESI+) [(M+H)+]: 367.
Etapa 5: Preparación de 6-amino-9-[(6-cloro-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-[(6-cloro-3-p¡r¡d¡l)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 14d) en lugar de 6-amino-9-bencil-2-metilsulfinil-7H-purin-8-ona (compuesto 1d). Se obtuvo 6-am¡no-9-[(6-cloro-3-pir¡d¡l)met¡l]-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (4 mg, ejemplo 14) como un sólido blanco. RMN de 1H (400 MHz, DlVlSo-cfe) 5 ppm: 10,80 (s. a., 1H), 8,45 (d, J = 2,4 Hz, 1H), 7,81 (dd, J = 2,4, 8,0 Hz, 1H), 7,49 (d, J = 8,0 Hz, 1H), 7,04 (s. a., 2H), 5,01 (s, 2H), 4,06 (s, 1H), 3,24-3,43 (m, 2H), 1,53-1,73 (m, 2H), 0,92 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 382.
Ejemplo 15
6-amino-9-[(2-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(2-clorofenil)metil]-N-nitro-2-propilsulfanil-pirimidin-4-amina
A una solución de 4,6-dicloro-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡na (10 g, 37,0 mmol, J & K scientific, número de catálogo: J92_090911_25G) y DIPEA (5,8 g, 45 mmol) en THF (200 ml) se le añadió una solución de (2-clorofenil)metilamina (5,5 g, 39 mmol) en THF (50 ml) a -78 °C. Después de la adición, se agitó la mezcla a esta temperatura durante 2 h. La mezcla resultante se concentró, se extrajo con EtOAc. La fase orgánica se lavó con salmuera, se secó sobre sulfato de sodio anhidro, se filtró y se evaporó a vacío. El residuo se purificó por
cromatografía en columna eluido con PE/EtOAc de 20/1 a 5/1 (v/v) para dar 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (11 g, compuesto 15a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 373. Etapa 2: Preparación de 6-cloro-N4-[(2-clorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
A una solución de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (11 g, 29,5 mmol, compuesto 15a) y HOAc (17,7 g, 295 mmol) en THF (400 ml) a 0 °C se le añadió polvo de Zn (9,5 g, 147 mmol) en pequeñas partes. Después de la adición, se agitó la mezcla resultante a temperatura ambiente durante 12 h y se filtró. El filtrado se basificó con NaHCO3, se extrajo con DCM, se secó sobre sulfato de sodio anhidro y se concentró a vacío para dar 6-cloro-W4-[(2-clorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina (9,0 g, compuesto 15b). MS obsd. (ESI+) [(M+H)+]: 343.
Etapa 3: Preparación de 6-cloro-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
A una solución de 6-cloro-W4-[(2-clorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina (9,0 g, 26,2 mmol, compuesto 5b) en THF (800 mg) se le añadió CDI (21 g, 131 mmol). La reacción se mantuvo a 80 °C durante 12 h. La mezcla de reacción se enfrió a TA y, a continuación, se concentró a vacío. El residuo se diluyó con agua (100 ml), se extrajo con EtOAc (125 ml) dos veces, se secó sobre sulfato de sodio anhidro y se concentró a vacío. El residuo se purificó por columna eluído con PE/EtOAc de 10/1 a 1:1 (v/v) para dar 6-cloro-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (9,5 g, compuesto 15c) como un sólido gris. m S obsd. (ESI+) [(M+h )+]: 369.
Etapa 4: Preparación de 9-[(2-clorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
A una solución de 6-cloro-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (9,0 g, 26,2 mmol, compuesto 15c) en n-BuOH (200 ml) se le añadió PMBNH2 (36 g, 262 mmol). La reacción se agitó a 130 °C durante 12 h. La mezcla de reacción se enfrió a 20 °C, se vertió en PE. El precipitado formado se recogió por filtración para dar 9-[(2-clorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona como un sólido blanco (10,2 g, compuesto 15d). MS obsd. (ESI+) [(M+H)+]: 470.
Etapa 5: Preparación de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se disolvió 9-[(2-clorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona (2,0 g, 4,2 mmol, compuesto 15d) en TEA (10 ml) y se agitó a 60 °C durante 12 h. La mezcla de reacción se concentró a vacío, y se basificó con solución de NaHCO3. El precipitado resultante se recogió por filtración y se purificó para dar 6-amino-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (600 mg, compuesto 15e). MS obsd. (ESI+) [(M+H)+]: 350.
Etapa 6: Preparación de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona
A una solución de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (300 mg, 0,86 mmol, compuesto 15e) en THF (7 ml) se le añadió m-CPBA (221 mg, 1,29 mmol) a 0 °C y se agitó la mezcla de reacción a 25 °C durante 15 min. La mezcla se filtró y se lavó con THF (1 ml) tres veces. El sólido obtenido se coevaporó con tolueno dos veces para dar 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinilo-7H-purin-8-ona (150 mg, compuesto 15f) como un sólido blanco. Se usó en la siguiente etapa sin purificación adicional. Ms obsd. (ESI+) [(M+H)+]: 366.
Etapa 7: Preparación de 6-amino-9-[(2-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
A una solución de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (100 mg, 0,27 mmol, compuesto 15f) en reactivo de Eaton (1 ml) se le añadió NaN3 (53 mg, 0,81 mmol) y la mezcla se agitó a 60 °C durante 0,5 h. La mezcla de reacción se le añadió a agua con hielo y se basificó con solución de hidróxido de amonio 0,88 N, se extrajo con n-BuOH (10 ml) cuatro veces y se concentró a vacío. El residuo se purificó por HPLC preparativa para dar 6-amino-9-[(2-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona (35 mg, ejemplo 15) como un sólido blanco. RMN de 1H (400 MHz DMSO-de) 5 ppm: 10,78 (s. a., 1H), 7,51-7,49 (m, 1H), 7,33-7,28 (m, 2H), 7,14-7,12 (m, 1H), 7,04 (s. a., 2H), 5,05 (s, 2H), 3,98 (s, 1H), 3,35-3,24 (m, 2H), 1,62-1,55 (m, 2H), 0,86 (t, J = 7,3 Hz, 3H). MS obsd.
(ESI+) [(M+H)+j: 381.
Ejemplo 16
6-amino-2-(metilsulfonimidoil)-9-(3-piridilmetil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-2-metilsulfanil-5-nitro-N-(3-piridilmetil)pirimidin-4-amina
Se preparó compuesto 16a de forma análoga al ejemplo 15, etapa 1 usando 4-piridilmetilamina y 4,6-dicloro-2-metilsulfanil-5-nitro-pirimidina (J & K scientific. Numero de catalogo: J92-058972-5G) en lugar de (2-clorofenil)metilamina y 4,6-dicloro-2-propilsulfanil-5-nitro-pirimidina. 6-cloro-2-metilsulfanil-5-nitro-W-(3-piridilmetil)pirimidin-4-amina (compuesto 16a), que se usó en la siguiente etapa sin purificación adicional. MS obsd. (ESI+) [(M+H)+]: 312.
Etapa 2: Preparación de 6-cloro-2-metilsulfanil-N4-(3-piridilmetil)pirimidina-4,5-diamina
Se preparó compuesto 16b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-2-metilsulfanil-5-nitro-W-(3-piridilmetil)pirimidin-4-amina (compuesto 16a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanilpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-2-metilsulfanil-W4-(3-piridilmetil)pirimidina-4,5-diamina (700 mg, compuesto 16b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 282.
Etapa 3: Preparación de 6-cloro-2-metilsulfanil-9-(3-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 16c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-2-metilsulfan¡l-W4-(3-p¡r¡d¡lmet¡l)p¡r¡mid¡na-4,5-d¡am¡na (compuesto 16b) en lugar de 6-cloro-W-4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-2-metilsulfan¡l-9-(3-p¡r¡d¡lmetil)-7H-pur¡n-8-ona (600 mg, compuesto 16c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 308.
Etapa 4: Preparación de 6-[(4-metoxifenil)metilamino]-2-metilsulfanil-9-(3-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 16d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-2-metilsulfan¡l-9-(3-p¡rid¡lmet¡l)-7H-purin-8-ona (compuesto 16c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)metilam¡no]-2-met¡lsulfan¡l-9-(3-p¡r¡d¡lmet¡l)-7H-pur¡n-8-ona (620 mg, compuesto 16d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 409.
Etapa 5: Preparación de 6-amino-2-metilsulfanil-9-(3-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 16e de forma análoga al ejemplo 15, etapa 5 usando 6-[(4-metoxifenil)met¡lam¡no]-2-metilsulfan¡l-9-(3-p¡r¡d¡lmetil)-7H-pur¡n-8-ona (compuesto 16d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-2-metilsulfanil-9-(3-pirid¡lmet¡l)-7H-pur¡n-8-ona (380 mg, compuesto 16e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 289.
Etapa 6: Preparación de 6-amino-2-metilsulfinil-9-(3-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 16f de forma análoga al ejemplo 15, etapa 6 mediante 6-amino-2-metilsulfan¡l-9-(3-p¡rid¡lmet¡l)-7H-pur¡n-8-ona (compuesto 16e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 15e). Se obtuvo 6-am¡no-2-met¡lsulf¡n¡l-9-(3-p¡r¡d¡lmetil)-7H-pur¡n-8-ona (105 mg, compuesto 16f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 305.
Etapa 7: Preparación de 6-amino-2-(metilsulfonimidoil)-9-(3-piridilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-2-metilsulf¡n¡l-9-(3-pirid¡lmet¡l)-7H-pur¡n-8-ona (200 mg, compuesto 16f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-am¡no-2-(metilsulfon¡m¡do¡l)-9-(3-p¡r¡d¡lmet¡l)-7H-pur¡n-8-ona (38,2 mg, ejemplo 16) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) ó ppm: 8,63 (s, 1H), 8,50 (d, J = 4,52 Hz, 1H), 7,77 (d, J = 8,03 Hz, 1H), 7,38 (dd, J = 7,78, 5,02 Hz, 1H), 7,00 (s. a., 2H), 5,01 (s, 2H), 4,11 (s. a., 1H), 3,19 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 320.
La separación del compuesto del ejemplo 16 por HPLC quiral proporcionó el ejemplo 16-A (elución más rápida, 5,0 mg) y el ejemplo 16-B (elución más lenta, 7,1 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak OJ-3).
Ejemplo 16-A: RMN de 1H (400 MHz, DMSO-de) ó ppm: 8,63 (s, 1H), 8,50 (d, J = 4,52 Hz, 1H), 7,77 (d, J = 8,03 Hz, 1H), 7,38 (dd, J = 7,78, 5,02 Hz, 1H), 7,00 (s. a., 2H), 5,01 (s, 2H), 4,11 (s. a., 1H), 3,19 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 320.
Ejemplo 16-B: RMN de 1H (400 MHz, DMSO-de) ó ppm: 8,63 (s, 1H), 8,50 (d, J = 4,52 Hz, 1H), 7,77 (d, J = 8,03 Hz, 1H), 7,38 (dd, J = 7,78, 5,02 Hz, 1H), 7,00 (s. a., 2H), 5,01 (s, 2H), 4,11 (s. a., 1H), 3,19 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 320.
Ejemplo 17 y ejemplo 18
3 -[[6-Amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo (compuesto 17) y 3-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida (compuesto 18)
Etapa 1: Preparación de 3-[[(6-cloro-5-nitro-2-propilsulfanil-pirimidin-4-il)amino]metil]benzonitrilo
Se preparó el compuesto 17a de forma análoga al ejemplo 15, etapa 1 usando 3-(aminomet¡l)benzon¡tr¡lo en lugar de (2-clorofenil)metilamina. Se obtuvo 3-[[(6-cloro-5-n¡tro-2-prop¡lsulfan¡l-pir¡m¡d¡n-4-¡l)am¡no]met¡l]benzon¡tr¡lo (2,75 g, compuesto 17a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 364.
Etapa 2: Preparación de 3-[[(5-amino-6-cloro-2-propilsulfanil-pirimidin-4-il)amino]metil]benzonitrilo
Se preparó compuesto 17b de forma análoga al ejemplo 15, etapa 2 usando 3-[[(6-cloro-5-nitro-2-prop¡lsulfan¡lp¡r¡m¡d¡n-4-¡l)amino]met¡l]benzon¡tr¡lo (compuesto 17a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-n¡tro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 3-[[(5-amino-6-cloro-2-prop¡lsulfan¡l-p¡r¡mid¡n-4-¡l)amino]met¡l]benzon¡tr¡lo (1,1 g, compuesto 17b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 334.
Etapa 3: Preparación de 3-[(6-cloro-2-propilsulfanil-8-oxo-7H-purin-9-il)metil]benzonitrilo
Se preparó compuesto 17c de forma análoga al ejemplo 15, etapa 3 usando 3-[[(5-amino-6-cloro-2-metilsulfanilpir¡m¡d¡n-4-¡l)am¡no]met¡l]benzon¡tr¡lo (compuesto 17b) en lugar de 6-cloro-W-4-[(2-clorofenil)met¡l]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 3-[(6-cloro-2-met¡lsulfan¡l-8-oxo-7H-pur¡n-9-¡l)met¡l]benzonitr¡lo (700 mg, compuesto 17c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 360.
Etapa 4: Preparación de 3-[[6-[(4-metoxifenil)metilamino]-2-propilsulfanil-8-oxo-7H-purin-9-il]metil]benzonitrilo
Se preparó compuesto 17d de forma análoga al ejemplo 15, etapa 4 usando 3-[(6-cloro-2-metilsulfan¡l-8-oxo-7H-purin-9-il)met¡l]benzon¡tr¡lo (compuesto 17c) en lugar de 6-cloro-9-[(2-clorofenil)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 3-[[6-[(4-metox¡fen¡l)metilam¡no]-8-oxo-2-prop¡lsulfan¡l-7H-pur¡n-9-¡l]met¡l]benzon¡tr¡lo (900 mg, compuesto 17d) como un sólido blanco. m S obsd. (ESI+) [(M+H)+]: 461.
Etapa 5: Preparación de 3-[(6-amino-8-oxo-2-propilsulfanil-7H-purin-9-il)metil]benzonitrilo
Se preparó compuesto 17e de forma análoga al ejemplo 15, etapa 5 usando 3-[[6-[(4-metoxifenil)met¡lam¡no]-2-propilsulfan¡l-8-oxo-7H-pur¡n-9-¡l]met¡l]benzonitr¡lo (compuesto 17d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 3-[(6-amino-8-oxo-2-propilsulfan¡l-7H-pur¡n-9-¡l)met¡l]benzonitr¡lo (600 mg, compuesto 17e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 341.
Etapa 6: Preparación de 3-[(6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il)metil]benzonitrilo
Se preparó compuesto 17f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-2-propilsulfan¡l-9-(2-p¡rid¡lmet¡l)-7H-pur¡n-8-ona (compuesto 17e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 15e). Se obtuvo 3-[(6-amino-8-oxo-2-prop¡lsulf¡n¡l-7H-pur¡n-9-¡l)met¡l]benzon¡tr¡lo (6l0 mg, compuesto 17f) como un sólido blanco. MS obsd. (ESI+) [(M+h )+]: 357.
Etapa 7: Preparación de 3-[[6-<mino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo (compuesto 17) y 3-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida (compuesto 18)
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-2-metilsulf¡n¡l-9-(2-pirid¡lmet¡l)-7H-pur¡n-8-ona (270 mg, compuesto 17f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 3 -[[6-Am¡no-8-oxo-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-9-¡l]met¡l]benzonitr¡lo (5 mg, ejemplo 17) y 3-[[6-am¡no-8-oxo-2-(prop¡lsulfon¡m¡do¡l)-7H-purin-9-¡l]met¡l]benzam¡da (41 mg, ejemplo 18) como un sól¡do blanco.
Compuesto 17: RMN de 1H (400 MHz, DMSO-de) ó ppm: 10,62 (s. a., 1H), 7,76-7,80 (m, 2H), 7,66 (d, J = 8 Hz, 1H), 7,53-7,57 (m, 1H), 6,99 (s. a., 2H), 5,02 (s, 2H), 4,05 (s, 1H), 3,28-3,31 (m, 2H), 1,57-1,65 (m, 2H), 0,89 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 372.
Compuesto 18: RMN de 1H (400 MHz, DMSO-de) ó ppm: 10,85 (s. a., 1H), 7,97 (s, 1H), 7,84 (s, 1H), 7,77 (d, J = 8 Hz, 1H), 7,47 (d, J = 8 Hz, 1H), 7,37-7,42 (m, 2H), 7,06 (s. a., 2H), 5,00 (s, 2H), 4,01 (s, 1H), 3,28-3,30 (m, 2H), 1,55-1,67 (m, 2H), 0,88 (t, J = 8,0 Hz, 3H). MS obsd. (ESI ) [(M H) ]: 390.
Ejemplo 19
6-amino-2-(metilsulfonimidoil)-9-(2-piridilmetil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-2-metilsulfanil-5-nitro-N-(2-piridilmetil)pirimidin-4-amina
Se preparó compuesto 19a de forma análoga al ejemplo 15, etapa 1 usando 2-piridilmetilamina y 4,6-dicloro-2-metilsulfanil-5-nitro-pirimidina en lugar de (2-clorofenil)metilamina y 2-clorofenilmetilamina y 4,6-dicloro-2-propilsulfanil-5-nitro-pirimidina. Se obtuvo 6-cloro-2-metilsulfanil-5-nitro-W-(2-piridilmetil)pirimidin-4-amina (4,64 g, compuesto 19a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 312.
Etapa 2: Preparación de 6-cloro-2-metilsulfanil-N4-(2-piridilmetil)pirimidina-4,5-diamina
Se preparó compuesto 19b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-2-metilsulfanil-5-nitro-W-(2-piridilmetil)pirimidin-4-amina (compuesto 19a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanilpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-2-metilsulfanil-W4-(2-piridilmetil)pirimidina-4,5-diamina (2,3 g, compuesto 19b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 282.
Etapa 3: Preparación de 6-cloro-2-metilsulfanil-9-(2-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 19c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-2-metilsulfan¡l-W4-(2-p¡r¡d¡lmet¡l)p¡r¡mid¡na-4,5-d¡am¡na (compuesto 19b) en lugar de 6-cloro-W-4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-2-metilsulfan¡l-9-(2-p¡r¡d¡lmetil)-7H-pur¡n-8-ona (2,0 g, compuesto 19c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 308.
Etapa 4: Preparación de 6-[(4-metoxifenil)metilamino]-2-metilsulfanil-9-(2-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 19d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-2-metilsulfan¡l-9-(2-p¡rid¡lmet¡l)-7H-purin-8-ona (compuesto 19c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)met¡lam¡no]-2-met¡lsulfan¡l-9-(2-p¡r¡dilmet¡l)-7H-pur¡n-8-ona (2,0 g, compuesto 19d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 409.
Etapa 5: Preparación de 6-amino-2-metilsulfanil-9-(2-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 19e de forma análoga al ejemplo 15, etapa 5 usando 6-[(4-metoxifenil)met¡lam¡no]-2-metilsulfan¡l-9-(2-p¡r¡d¡lmetil)-7H-pur¡n-8-ona (compuesto 19d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-2-metilsulfanil-9-(2-pirid¡lmet¡l)-7H-pur¡n-8-ona (1,14 g, compuesto 19e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 289.
Etapa 6: Preparación de 6-amino-2-metilsulfinil-9-(2-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 19f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-2-met¡lsulfan¡l-9-(2-p¡r¡dilmet¡l)-7H-purin-8-ona (compuesto 19e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-2-met¡lsulf¡n¡l-9-(2-p¡rid¡lmet¡l)-7H-pur¡n-8-ona (280 mg, compuesto 19f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 305.
Etapa 7: Preparación de 6-amino-2-(metilsulfonimidoil)-9-(2-piridilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-2-met¡lsulf¡n¡l-9-(2-p¡rid¡lmet¡l)-7H-pur¡n-8-ona (compuesto 19f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-am¡no-2-(metilsulfon¡m¡do¡l)-9-(2-p¡r¡d¡lmet¡l)-7H-pur¡n-8-ona (50 mg, ejemplo 19) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) ó ppm: 8,47 (d, J = 4,27 Hz, 1H), 7,77 (td, J = 7,65, 1,51 Hz, 1H), 7,24-7,33 (m, 2H), 7,19 (s. a., 2H), 5,09 (s, 2H), 4,00 (s. a., 1H), 3,11 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 320.
Ejemplo 20
6-amino-2-(metilsulfonimidoil)-9-(4-piridilmetil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-2-metilsulfanil-5-nitro-N-(4-piridilmetil)pirimidin-4-amina
Se preparó compuesto 20a de forma análoga al ejemplo 15, etapa 1 usando 2-piridilmetilamina y 4,6-dicloro-2-metilsulfanil-5-nitro-pirimidina en lugar de (2-clorofenil)metilamina y 4,6-dicloro-2-prop¡lsulfan¡l-5-n¡tro-p¡r¡m¡dina. Se obtuvo 6-cloro-2-met¡lsulfan¡l-5-n¡tro-W-(4-pir¡d¡lmet¡l)p¡r¡m¡d¡n-4-am¡na (1,0 g, compuesto 20a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 312.
Etapa 2: Preparación de 6-cloro-2-metilsulfanil-N4-(4-piridilmetil)pirimidina-4,5-diamina
Se preparó compuesto 20b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-2-metilsulfan¡l-5-n¡tro-W-(4-p¡r¡d¡lmet¡l)p¡rim¡d¡n-4-am¡na (compuesto 20a) en lugar de 6-cloro-W-[(2-clorofenil)met¡l]-5-n¡tro-2-prop¡lsulfan¡lpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-2-met¡lsulfan¡l-W4-(4-p¡r¡d¡lmet¡l)p¡rim¡d¡na-4,5-d¡am¡na (900 mg, compuesto 20b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 282.
Etapa 3: Preparación de 6-cloro-2-metilsulfanil-9-(4-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 20c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-2-metilsulfanil-W4-(4-p¡rid¡lmet¡l)p¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 20b) en lugar de 6-cloro-W-4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-2-metilsulfan¡l-9-(4-p¡r¡d¡lmetil)-7H-pur¡n-8-ona (620 mg, compuesto 20c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 308.
Etapa 4: Preparación de 6-[(4-metoxifenil)metilamino]-2-metilsulfanil-9-(4-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 20d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-2-metilsulfan¡l-9-(4-p¡rid¡lmet¡l)-7H-purin-8-ona (compuesto 20c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)metilam¡no]-2-met¡lsulfan¡l-9-(4-p¡r¡d¡lmet¡l)-7H-pur¡n-8-ona (700 mg, compuesto 20d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 409.
Etapa 5: Preparación de 6-amino-2-metilsulfanil-9-(4-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 20e de forma análoga al ejemplo 15, etapa 5 usando 6-[(4-metoxifen¡l)met¡lamino]-2-met¡lsulfan¡l-9-(4-p¡rid¡lmet¡l)-7H-pur¡n-8-ona (compuesto 20d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-2-metilsulfanil-9-(4-pirid¡lmet¡l)-7H-pur¡n-8-ona (450 mg, compuesto 20e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 289.
Etapa 6: Preparación de 6-amino-2-metilsulfinil-9-(4-piridilmetil)-7H-purin-8-ona
Se preparó compuesto 20f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-2-met¡lsulfan¡l-9-(4-p¡r¡dilmet¡l)-7H-purin-8-ona (compuesto 20e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-2-met¡lsulf¡n¡l-9-(4-p¡r¡d¡lmet¡l)-7H-pur¡n-8-ona (160 mg, compuesto 20f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 305.
Etapa 7: Preparación de 6-amino-2-(metilsulfonimidoil)-9-(4-piridilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-2-metilsulf¡n¡l-9-(4-pirid¡lmet¡l)-7H-pur¡n-8-ona (200 mg, compuesto 20f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-am¡no-2-(metilsulfon¡m¡do¡l)-9-(4-p¡r¡d¡lmet¡l)-7H-pur¡n-8-ona (27 mg, ejemplo 20) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm: 8,52 (d, J = 5,77 Hz, 2H), 7,29 (d, J = 5,52 Hz, 2H), 7,05 (s. a., 2H), 5,01 (s, 2H), 4,06 (s, 1H), 3,16 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 320.
Ejemplo 21
6-amino-9-isobutil-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-isobutil-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 21a de forma análoga al ejemplo 15, etapa 1 usando 2-metilpropan-1-amina en lugar de (2-clorofenil)met¡lam¡na. Se obtuvo 6-cloro-W-isobutil-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 21a) como un sólido amarillo claro. MS obsd. (ESI+) [(M+H)+j: 305.
Etapa 2: Preparación de 6-cloro-N4-isobutil-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 21b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-isobutil-5-nitro--2-propilsulfanil-pirimidin-4-amina (compuesto 21a) en lugar de 6-cloro-Ñ-[(2-clorofenil)metil]-5-nitro-2-propilsulfanilpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-isobutil-2-propilsulfanil-pirimidina-4,5-diamina (4,5 g, compuesto 21b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 275.
Etapa 3: Preparación de 6-cloro-9-isobutil-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 21c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-isobutil-2-propilsulfanil
pirimidina-4,5-diamina (compuesto 21b) en lugar de 6-cloro-W-4-[(2-clorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina (compuesto 15b). Se obtuvo 6-cloro-9-isobutil-2-propilsulfanil-7H-purin-8-ona (850 mg, compuesto 21c) como un sólido blanco. mS obsd. (ESI+) [(M+H)+]: 301.
Etapa 4: Preparación de 9-isobutil-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 21d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-isobutil-2-propilsulfanil-7H-purin-8-ona (compuesto 21c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 15c). Se obtuvo 9-isobutil-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona (570 mg, compuesto 21d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 402.
Etapa 5: Preparación de 6-amino-9-isobutil-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 21e de forma análoga al ejemplo 15, etapa 5 usando 9-isobutil-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona (compuesto 21d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona (compuesto 15d). Se obtuvo 6-amino-9-isobutil-2-propilsulfanil-7H-purin-8-ona (300 mg, compuesto 21e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 282.
Etapa 6: Preparación de 6-amino-9-isobutil-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 21f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-isobutil-2-propilsulfanil-7H-purin-8-ona (compuesto 21e) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 15e). Se obtuvo 6-amino-9-isobutil-2-propilsulfinil-7H-purin-8-ona (125 mg, compuesto 21 f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 298.
Etapa 7: Preparación de 6-amino-2-(metilsulfonimidoil)-9-(4-piridilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-isobut¡lo-2-propilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 21f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-9-¡sobut¡l-2-(prop¡lsulfon¡m¡do¡l)-7H-purin-8-ona (65,8 mg, ejemplo 21) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,46 (s, 1H), 6,92 (s. a., 2H), 4,00 (s, 1H), 3,59 (d, J = 1,6 Hz, 2H), 3,32-3,38 (m, 2H), 2,15 (m, 1H), 1,65-1,73 (m, 2H), 0,97 (t, J = 73 Hz, 3H), 0,86 (m, 6H). MS obsd. (ESI+) [(M+H)+]: 313.
Ejemplo 22
6-amino-9-[(3-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(3-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 22a de forma análoga al ejemplo 15, etapa 1 usando 3-(clorofenil)metilamina en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W-[(3-clorofen¡l)metil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (13,9 g, compuesto 22a) como un sól¡do amar¡llo. MS obsd. (ESI+) [(M+H)+]: 373.
Etapa 2: Preparación de 6-cloro-N4-[(3-clorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 22b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(3-clorofenil)met¡l]-5-n¡tro-2-propilsulfanil-pirimidin-4-amina (compuesto 22a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-n¡tro-2-prop¡lsulfan¡lpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(3-clorofen¡l)metil]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (13,0 g, compuesto 22b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 343.
Etapa 3: Preparación de 6-cloro-9-[(3-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 22c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-4-[(3-clorofenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 22b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(3-clorofenil)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (13,0 g, compuesto 22c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 369.
Etapa 4: Preparación de 9-[(3-clorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 22d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(3-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 22c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(3-clorofenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (6,0 g, compuesto 22d) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 470.
Etapa 5: Preparación de 6-amino-9-[(3-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 22e de forma análoga al ejemplo 15, etapa 5 usando 9-[(3-clorofenil)met¡l]-6-[(4-metox¡fen¡l)metilam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 22d) en lugar de 9-[(2-clorofen¡l)met¡l]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(3-clorofen¡l)metil]-2-propilsulfan¡l-7H-pur¡n-8-ona (300 mg, compuesto 22e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 350.
Etapa 6: Preparación de 6-amino-9-[(3-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 22f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(3-clorofenil)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 22e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-9-[(3-clorofen¡l)met¡l]-2-prop¡lsulf¡nil-7H-pur¡n-8-ona (150 mg, compuesto 22f) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 366.
Etapa 7: Preparación de 6-amino-9-[(3-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(3-clorofenil)metil]-2-propilsulfin¡l-7H-pur¡n-8-ona (100 mg, compuesto 22f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-9-[(3-clorofen¡l)met¡l]-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (43 mg, ejemplo 22) como un sólido blanco. RMN de 1H (400 MHz DMSO-cfe) 5 ppm: 7,41-7,36 (m, 3H), 7,030-7,28 (m, 1H), 7,01 (s. a., 2H), 4,96 (s, 2H), 4,03 (s, 1H), 3,34-3,27 (m, 2H), 1,67-1,59 (m, 2H), 0,91 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 381.
Ejemplo 23
6-amino-2-(propilsulfonimidoil)-9-[[4-(trifluorometil)fenil]metil]-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(4-trifluorometilfenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 23a de forma análoga al ejemplo 15, etapa 1 usando (4-tr¡fluorometilfen¡l)met¡lam¡na en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W-[(4-tr¡fluoromet¡lfen¡lmetil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-amina (7,0 g, compuesto 23a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 407.
Etapa 2: Preparación de 6-cloro-2-propilsulfanil-N4-[[4-(trifluorometil)fenil]metil]pirimidina-4,5-diamina
Se preparó compuesto 23b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(4-trifluoromet¡lfen¡l)met¡l]-5-n¡tro-2-prop¡lsulfanil-p¡rim¡din-4-amina (compuesto 23a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(4-trifluoromet¡lfen¡l)met¡l]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (3,1 g, compuesto 23b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 377.
Etapa 3: Preparación de 6-cloro-9-[(4-trifluorometilfenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 23c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-4-[(4-trifluoromet¡lfen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡mid¡na-4,5-d¡am¡na (compuesto 23b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(4-trifluoromet¡lfen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (1,8 g, compuesto 23c) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 403.
Etapa 4: Preparación de 6-[(4-metoxifenil)metilamino]-2-propilsulfanil-9[[4-trifluorometil)fenil]metil]-7H-purin-8-ona
Se preparó compuesto 23d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(4-trifluorometilfen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 23c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(4-tr¡fluoromet¡lfen¡l)met¡l]-6-[(4-metox¡fen¡l)metilam¡no]-2-prop¡lsulfan¡l- 7H-purin-8-ona (1,2 g, compuesto 23d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 504.
Etapa 5: Preparación de 6-amino-9-[(4-trifluorometilfenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 23e de forma análoga al ejemplo 15, etapa 5 usando 9-[(4-trifluorometilfen¡l)met¡l]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 23d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(4-trifluoromet¡lfen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (900 mg, compuesto 23e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 384.
Etapa 6: Preparación de 6-amino-2-propilsulfanil-9-[[4-trifluorometil)fenil]metil]-7H-purin-8-ona
Se preparó compuesto 23f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(4-trifluoromet¡lfen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 23e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-2-prop¡lsulf¡n¡l-9-[(4-tr¡fluoromet¡l)fen¡l]met¡l]-7H-pur¡n-8-[200 mg, compuesto 23f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 400.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-[[4-trifluorometil)fenil]metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(4-tr¡fluoromet¡lfen¡l)met¡l]-2-propilsulf¡n¡l-7H-pur¡n-8-ona (200 mg, compuesto 23f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-2-(prop¡lsulfon¡mido¡l)-9-[(4-tr¡fluorometil)fen¡l]met¡l]-7H-pur¡n-8-[57 mg, ejemplo 23) como un sólido blanco. RMN de 1H (400 MHz , DMSO-cfó,) 5 ppm: 7,70 (d, J = 8,0 Hz, 2H), 7,53 (d, J = 8,0 Hz, 2H), 7,01 (s. a., 2H), 5,07 (s, 2H), 4,06 (s, 1H), 3,41-3,27 (m, 2H), 1,6-1,57 (m, 2H), 0,86 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 415.
Ejemplo 24
6-amino-9-[(4-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(4-fluorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 24a de forma análoga al ejemplo 15, etapa 1 usando (4-fluorofenil)metilamina en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W-[(4-fluorofen¡lmetil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (6,4 g, compuesto 24a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 357.
Etapa 2: Preparación de 6-cloro-N4-[(4-fluorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 24b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(4-fluorofenil)met¡l]-5-n¡tro-2-propilsulfanil-pirimidin-4-amina (compuesto 24a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-n¡tro-2-prop¡lsulfan¡lpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(4-fluorofen¡l)metil]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (6,0 g, compuesto 24b) como un sólido blanco. MS obsd. (eS|+) [(M+H)+]: 327.
Etapa 3: Preparación de 6-cloro-9-[(4-fluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 24c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-4-[(4-fluorofenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 24b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(4-fluorofenil)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (5,0 g, compuesto 24c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 353.
Etapa 4: Preparación de 9-[(4-fluorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 24d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(4-fluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 24c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(4-fluorofenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (5,5 g, compuesto 24d) como un sólido blanco. MS obsd. (eS|+) [(M+H)+]: 454.
Etapa 5: Preparación de 6-amino-9-[(4-fluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 24e de forma análoga al ejemplo 15, etapa 5 usando 9-[(4-fluorofenil)metil]-6-[(4-metox¡fen¡l)metilam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 24d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(4-fluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (600 mg, compuesto 24e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 334.
Etapa 6: Preparación de 6-amino-2-propilsulfinil-9-[4-fluorofenilmetil]-7H-purin-8-ona
Se preparó compuesto 24f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(4-fluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 24e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-2-prop¡lsulf¡n¡l-9-[(4-fluorofen¡l]metil]-7H-pur¡n-8-[530 mg, compuesto 24f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 350.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-[[4-trifluorometil)fenil]metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 5 usando 6-amino-9-[(4-fluorofenil)metil]-2-propilsulfin¡l-7H-pur¡n-8-ona (250 mg, compuesto 24f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-2-(prop¡lsulfon¡m¡do¡l)-9-[(4-fluorofen¡l]met¡l]-7H-purin-8-[41,6 mg, ejemplo 24) como un sólido gris. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm: 10,62 (s. a., 1H), 7,40-7,38 (m, 2H), 7,18 7,16 (m, 2H), 7,00 (s. a., 2H), 4,95 (s, 2H), 4,05 (s, 1H), 3,33-3,30 (m, 2H), 1,74-1,55 (m, 2H), 0,92 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 365.
Ejemplo 25
6-amino-9-[(4-bromofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(4-bromofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 25a de forma análoga al ejemplo 15, etapa 1 usando (4-bromofenil)met¡lamina en lugar de (2-clorofenil)met¡lam¡na. Se obtuvo 6-cloro-W-[(4-bromofen¡lmetil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (7,0 g, compuesto 25a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 417.
Etapa 2: Preparación de 6-cloro-N4-[(4-bromofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 25b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(4-bromofenil)metil]-5-nitro-2-propilsulfan¡l-p¡r¡m¡din-4-am¡na (compuesto 25a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-n¡tro-2-prop¡lsulfan¡lpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(4-bromofen¡l)metil]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (3,2 g, compuesto 25b) como un sólido blanco. MS obsd. (Es I+) [(M+H)+]: 387.
Etapa 3: Preparación de 6-cloro-9-[(4-bromofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 25c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-4-[(4-bromofenil)met¡l]-2-prop¡lsulfan¡l-p¡r¡mid¡na-4,5-d¡am¡na (compuesto 25b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(4-bromofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (2,5 g, compuesto 25c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 413.
Etapa 4: Preparación de 9-[(4-bromofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 25d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(4-bromofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 25c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(4-bromofenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (3,1 g, compuesto 25d) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 514.
Etapa 5: Preparación de 6-amino-9-[(4-bromofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 25e de forma análoga al ejemplo 15, etapa 5 usando 9-[(4-bromofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 25d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(4-bromofenil)metil]-2-propilsulfanil-7H-purin-8-ona (1,1 g, compuesto 25e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 394.
Etapa 6: Preparación de 6-amino-2-propilsulfinil-9-[4-bromofenilmetil]-7H-purin-8-ona
Se preparó compuesto 25f de forma análoga al ejemplo 15, etapa 5 usando 6-amino-9-[(4-bromofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 25e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-2-prop¡lsulf¡n¡l-9-[(4-bromofenil]met¡l]-7H-pur¡n-8-[250 mg, compuesto 25f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 410.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-[[4-bromofenil]metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 5 usando 6-amino-9-[(4-bromofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (260 mg, compuesto 25f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-am¡no-2-(prop¡lsulfon¡m¡do¡l)-9-[(4-bromofenil]met¡l]-7H-pur¡n-8-[70 mg, ejemplo 25) como un sólido gris. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,62 (s. a., 1H), 7,53 (d, J = 8,0 Hz, 2H), 7,29 (d, J = 8,0 Hz, 2H), 6,99 (s. a., 2H), 4,94 (s, 2H), 4,04 (s, 1H), 3,35-3,25 (m, 2H), 1,67-1,56 (m, 2H), 0,90 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 425.
Ejemplo 26
6-amino-9-[(3,4-diclorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(3,4-diclorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 26a de forma análoga al ejemplo 15, etapa 1 usando (3,4-diclorofenil)met¡lam¡na en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W-[(4-bromofen¡lmetil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (3,6 g, compuesto 26a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 425.
Etapa 2: Preparación de 6-cloro-N4-[(3,4-diclorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 26b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(3,4-diclorofen¡l)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡rim¡d¡n-4-am¡na (compuesto 26a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(3,4-diclorofenil)met¡l]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (3,1 g, compuesto 26b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 377.
Etapa 3: Preparación de 6-cloro-9-[(3,4-diclorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 26c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-4-[(3,4-diclorofenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 26b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(3,4-diclorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (1,8 g, compuesto 26c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 403.
Etapa 4: Preparación de 9-[(3,4-diclorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 26d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(3,4-diclorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 26c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(3,4-d¡clorofenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (1,6 g, compuesto 26d) como un sólido blanco. mS obsd. (ESI+) [(M+H)+]: 504.
Etapa 5: Preparación de 6-amino-9-[(3,4-diclorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 26e de forma análoga al ejemplo 15, etapa 5 usando 9-[(3,4-diclorofenil)met¡l]-6-[(4-metox¡fen¡l)met¡lamino]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 26d) en lugar de 9-[(2-clorofen¡l)met¡l]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(3,4-d¡clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (900 mg, compuesto 26e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 384.
Etapa 6: Preparación de 6-amino-2-propilsulfinil-9-[3,4-diclorofenil]-7H-purin-8-ona
Se preparó compuesto 26f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(3,4-diclorofen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 26e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-2-prop¡lsulf¡n¡l-9-[(3,4-d¡clorofenil]met¡l]-7H-pur¡n-8-ona (2l0 mg, compuesto 26f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 40l.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-(3,4-diclorofenilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(3,4-diclorofen¡lmet¡l]-2-prop¡lsulf¡nil-7H-pur¡n-8-ona (compuesto 26f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfin¡l-7H-pur¡n-8-ona (compuesto 15f). Se obtuvo 6-amino-2-(prop¡lsulfon¡m¡do¡l)-9-(3,4-d¡clorofen¡lmetil)-7H-purin-8-ona (47 mg, ejemplo 26) como un sólido blanco. RMN de 1H (400 MHz, DMSO-Ó6) 5 ppm: 10,67 (s. a., 1H), 7,63-7,59 (m, 2H), 7,32-7,29 (m, 1H), 7,01 (s. a., 2H), 4,98 (s, 2H), 4,05 (s, 1H), 3,35-3,30 (m, 2H), 1,67-1,56 (m, 2H), 0,90 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 415.
Ejemplo 27
6-amino-9-(3,4-difluorofenilmetil)-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(3,4-difluorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 27a de forma análoga al ejemplo 15, etapa 1 usando (3,4-difluorofen¡l)met¡lamina en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-Ñ-[(3,4-d¡fluorofen¡l)metil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (3,1 g, compuesto 27a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 375.
Etapa 2: Preparación de 6-cloro-N4-[(3,4-difluorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 27b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(3,4-difluorofenil)metil]-5-n¡tro-2-prop¡lsulfanil-p¡rim¡din-4-amina (compuesto 27a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W-4-[(3,4-difluorofenil)met¡l]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (2,2 g, compuesto 27b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 345.
Etapa 3: Preparación de 6-cloro-9-[(3,4-difluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 27c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(3,4-difluorofen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡mid¡na-4,5-d¡am¡na (compuesto 27b) en lugar de 6-cloro-W-4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(3,4-difluorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (1,6 g, compuesto 27c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 371.
Etapa 4: Preparación de 9-[(3,4-difluorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 27d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(3,4-difluorofenil)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 27c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(3,4-d¡fluorofen¡l)met¡l]-6-[(4-metox¡fen¡l)met¡lamino]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (1,5 g, compuesto 27d) como un sólido blanco. mS obsd. (ESI+) [(M+H)+]: 472.
Etapa 5: Preparación de 6-amino-9-[(3,4-difluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 27e de forma análoga al ejemplo 15, etapa 5 usando 9-[(3,4-difluorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 27d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(3,4-difluorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (600 mg, compuesto 27e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 352.
Etapa 6: Preparación de 6-amino-2-propilsulfinil-9-[3,4-difluorofenil)metil]-7H-purin-8-ona
Se preparó compuesto 27f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(3,4-difluorofen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 27e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-2-prop¡lsulf¡n¡l-9-[(3,4-d¡fluorofen¡l]met¡l]-7H-purin-8-ona (150 mg, compuesto 27f) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 3 6 8.
Etapa 7: Preparación de 6-amino-9-[(3,4-difluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(3,4-d¡fluorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 27f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-2-(prop¡lsulfon¡m¡do¡l)-9-[(3,4-d¡fluorofen¡l)metil]-7H-purin-8-ona (60 mg, ejemplo 27) como un sólido blanco. RMN de 1H (400 MHz, DMSO-d6) 5 ppm: 10,65 (s. a., 1H), 7,46-7,36 (m, 2H), 7,19-7,18 (m, 1H), 6,98 (s. a., 2H), 4,96 (s, 2H), 4,04 (s, 1H), 3,35-3,26 (m, 2H), 1,67-1,57 (m, 2H), 0,91 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 383.
Ejemplo 28
6-amino-9-[(4-cloro-3-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 4-cloro-3-metilbenzamida
28a
A una solución enfriada en hielo de ácido 4-cloro 3-metilbenzoico (20,0 g, 117,2 mmol), HOBt (15,8 g, 117,2 mmol) y NH4Cl (18,8 g, 351,7 mmol) en DMF anhidro (200 ml) se le añadió DIPEA (45,5 g, 351,7 mmol) seguido de EDC HCl (27,4 g, 152,4 mmol), a continuación la mezcla se calentó a 25 °C y se agitó durante 20 h. La mezcla de reacción se diluyó con agua (1,2 l) y se extrajo con EtOAC (200 ml) tres veces. La capa orgánica combinada se lavó con HCl ac.
1 N, Na2CO3 ac. sat., salmuera, se secó sobre sulfato de sodio anhidro, se filtró y se concentró a vacío. El residuo se trituró con MTBE para dar 4-cloro-3-metilbenzamida (15 g, compuesto 28a) como un sólido amarillo claro. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 8,00 (s, 1H), 7,86 (s, 1H), 7,71 (dd, J = 8,3 Hz, 1,5 Hz, 1H), 7,49 (d, J = 8,3 Hz, 1H), 7,42 (s, 1H), 2,37 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 170.
Etapa 2: Preparación de (4-cloro-3-metilfenil)metilamina
A una suspensión de LiAlH (11,2 g, 294,8 mmol) en THF anhidro (100 ml) se le añadió 3-cloro-4-metil-benzamida (10 g, 58,96 mmol) en THF (100 ml) gota a gota. Después de la adición, se agitó la mezcla a 28 °C durante 2 h y a continuación se calentó a 60 °C durante 12 h. Después de enfriar la mezcla de reacción a 0 °C, se le añadió secuencialmente 11,2 ml de agua, 11,2 ml de NaOH ac. al 15 % y 33,6 ml de agua. Se le añadió sulfato de sodio anhidro (20 g), y la suspensión resultante se agitó durante 30 min y se filtró. El filtrado se concentró a vacío para obtener (4-cloro-3-metil-fenil)metilamina como un aceite incoloro (8 g, compuesto 28b). MS obsd. (ESI+) [(M+H)+]: 156.
Etapa 3: Preparación de 6-cloro-N-[(4-cloro-3-metil-fenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 28c de forma análoga al ejemplo 15, etapa 1 usando (4-cloro-3-metil-fenil)metilamina en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W-[(4-cloro-3-metilfenilmetil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (8,0 g, compuesto 28c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 3 8 7.
Etapa 4: Preparación de 6-cloro-N4-[(4-cloro-3-metil-fenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 28d de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(4-cloro-3-metilfenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 28c) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W-4-[(4-cloro-3-metilfenil)metil]-2-propilsulfanilpirimidina-4,5-diamina (4,4 g, compuesto 28d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 357.
Etapa 5: Preparación de 6-cloro-9-[(4-cloro-3-metil-fenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 28e de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(4-cloro-3-metilfen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡mid¡na-4,5-d¡am¡na (compuesto 28d) en lugar de 6-cloro-W-4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(4-cloro-3-metil-fen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (4,6 g, compuesto 28e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 383.
Etapa 6: Preparación de 9-[(4-cloro-3-metil-fenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 28f de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(4-cloro-3-metilfenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 28e) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(3-cloro-4-met¡l-fenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (9 g, compuesto 28f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 4 8 4.
Etapa 7: Preparación de 6-amino-9-[(4-cloro-3-metil-fenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 28g de forma análoga al ejemplo 15, etapa 5 usando 9-[(4-cloro-3-metil-fenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 28f) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(4-cloro-3-metilfenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (4,5 g, compuesto 28g) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 364.
Etapa 8: Preparación de 6-amino-2-propilsulfanil-9-[4-cloro-3-metil-fenilmetil]-7H-purin-8-ona
Se preparó compuesto 28h de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(3-cloro-4-met¡l-fen¡l)met¡l]-2-propilsulfan¡l-7H-purin-8-ona (compuesto 28g) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-2-prop¡lsulf¡n¡l-9-[(4-cloro-3-met¡l-fen¡l]met¡l]-7H-pur¡n-8-ona (340 mg, compuesto 28h) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 380.
Etapa 9: Preparación de 6-amino-9-[(4-cloro-3-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(4-cloro-3-metilfenil)met¡l]-2-prop¡lsulfin¡l-7H-pur¡n-8-ona (compuesto 28h) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-2-(prop¡lsulfon¡m¡do¡l)-9-[[4-cloro-3-met¡l-fen¡l]met¡l]-7H-pur¡n-8-ona (80 mg, ejemplo 28) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm: 7,37-7,33 (m, 2H), 7,18 7,16 (m, 2H), 6,97 (s. a., 2H), 4,92 (s, 2H), 4,04 (s, 1H), 3,33-3,31 (m, 2H), 2,29 (s, 3H), 1,65-1,61 (m, 2H), 0,90 (t, J = 7,6 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 395.
Ejemplo 29
6-amino-2-(propilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(p-tolilmetil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó compuesto 29a de forma análoga al ejemplo 15, etapa 1 usando p-tolilmetilamina en lugar de (2-clorofenil)met¡lam¡na. Se obtuvo 6-cloro-W-[(p-tolilmetil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (3,9 g, compuesto 29a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 353.
Etapa 2: Preparación de 6-cloro-N4-[(p-tolilmetil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 29b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(p-tolilmetil-5-nitro--2-propilsulfanil-pirimidin-4-amina (compuesto 29a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanilpirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-(p-tolilmetil)-2-propilsulfanil-pirimidina-4,5-diamina (2,2 g, compuesto 29b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 323.
Etapa 3: Preparación de 6-cloro-9-[(p-tolilmetil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 29c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(p-tolilmetil]-2-propilsulfanil-pirimidina-4,5-diamina (compuesto 29b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-propilsulfanilpirimidina-4,5-diamina (compuesto 15b). Se obtuvo 6-cloro-9-[(p-tolilmetil]-2-propilsulfanil-7H-purin-8-ona (2,2 g, compuesto 29c) como un sólido blanco. Ms obsd. (ESI+) [(M+H)+]: 349.
Etapa 4: Preparación de 9-[(p-tolilmetil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona:
Se preparó compuesto 29d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(p-tolilmet¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 29c) en lugar de 6-cloro-9-[(2-clorofenil)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(p-tol¡lmet¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-propilsulfan¡l-7H-pur¡n-8-ona (2,0 g, compuesto 29d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 450.
Etapa 5: Preparación de 6-amino-2-propilsulfanil-9-(p-tolilmetil)-7H-purin-8-ona
Se preparó compuesto 29e de forma análoga al ejemplo 15, etapa 5 usando 9-[(p-tolilmet¡l]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 29d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(p-tolilmetil]-2-propilsulfanil-7H-purin-8-ona (1,0 g, compuesto 29e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 330.
Etapa 6: Preparación de 6-amino-2-propilsulfinil-9-[p-tolilmetil]-7H-purin-8-ona
Se preparó compuesto 29f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(p-tolilmet¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 29e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-2-prop¡lsulf¡nil-9-[p-tol¡lmei¡l]-7H-pur¡n-8-ona (220 mg, compuesto 29f) como un sólido blanco MS obsd. (ESI+) [(M+H)+]: 345.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(p-tol¡lmet¡l)met¡l]-2-propilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 29f) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulf¡nil-7H-pur¡n-8-ona (compuesto 15f). Se obtuvo 6-am¡no-2-(prop¡lsulfon¡mido¡l)-9-[[p-tol¡lmet¡l]-7H-pur¡n-8-ona (127 mg, ejemplo 29) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,67 (s. a., 1H), 7,23 (d, J = 8,0 Hz, 2H), 7,13 (d, J = 8,0 Hz, 2H), 6,98 (s. a., 2H), 4,91 (s, 2H), 4,05 (s, 1H), 3,34-3,27 (m, 2H), 2,26 (s, 3H), 1,67-1,62 (m, 2H), 0,92 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 361.
La separación del compuesto del ejemplo 29 por HPLC quiral proporcionó el ejemplo 29-A (elución más rápida, 50 mg) y el ejemplo 29-B (elución más lenta, 49 mg) como un sólido blanco. (Condición de separación: isopropanol al 30 % (DEA al 0,05 %)/cO2 en la columna ChiralPak AD-3.
Ejemplo 29-A: RMN de 1H: (400 MHz , DMSO-de) 5 ppm: 10,51 (s, 1H), 7,22 (d, J = 8,0 Hz, 2H), 7,12 (d, J = 8,0 Hz, 2H), 7,00 (s, 2H), 4,91 (s, 2H), 4,03 (s, 1H), 3,35-3,31 (m, 2H), 2,26 (s, 3H), 1,70-1,58 (m, 2H), 0,93 (t, J = 7,40 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 361.
Ejemplo 29-B: RMN de 1H: (400 MHz , DMSO-de) 5 ppm: 10,54 (s, 1H), 7,23 (d, J = 8,0 Hz, 2H), 7,13 (d, J = 8,0 Hz, 2H), 6,97 (s, 2H), 4,91 (s, 2H), 4,04 (s, 1H), 3,34-3,30 (m, 2H), 2,26 (s, 3H), 1,72-1,57 (m, 2H), 0,93 (t, J = 7,40 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 361.
Ejemplo 30
6-amino-9-[(4-cloro-3-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-W-[(4-cloro-3-fluoro-fenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 30a de forma análoga al ejemplo 15, etapa 1 usando 4-cloro-3-fluorofenil)metilam¡na en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-Ñ-[(4-cloro-3-fluoro-fenil)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-amina (6,2 g, compuesto 30a). MS obsd. (ESI+) [(M+H)+]: 391.
Etapa 2: Preparación de 6-cloro-N4-[(4-cloro-3-fluoro-fenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 30b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(4-cloro-3-fluoro-fenil)metil]-5-nitro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-amina (compuesto 30a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-n¡tro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(4-cloro-3-fluoro-fenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (4,7 g, compuesto 30b) como un sólido marrón. MS obsd. (ESI+) [(M+H)+]: 361.
Etapa 3: Preparación de 6-cloro-9-[(4-cloro-3-fluoro-fenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 30c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-4-[(4-cloro-3-fluorofen¡l)metil]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 30b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 15b). Se obtuvo 6-cloro-9-[(4-cloro-3-fluoro-fenil)metil]-2-propilsulfanil-7H-pur¡n-8-ona (3,8 g, compuesto 30c) como un sólido gris. MS obsd. (ESI+) [(M+H)+]: 387.
Etapa 4: Preparación de 9-[(4-cloro-3-fluorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 30d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(4-cloro-3-fluoro-fenil)met¡l]-2-propilsulfanil-7H-pur¡n-8-ona (compuesto 30c) en lugar de 6-cloro-9-[(2-clorofen¡l)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(4-cloro-3-fluoro-fenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l- 7H-purin-8-ona (2,3 g, compuesto 30d) como un sólido amarillo claro. MS obsd. (ESI+) [(M+H)+]: 488.
Etapa 5: Preparación de 6-amino-9-[(4-cloro-3-fluoro-fenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 30e de forma análoga al ejemplo 15, etapa 5 usando 9-[(4-cloro-3-fluoro-fenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 30d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(4-cloro-3-fluorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (1,4 g, compuesto 30e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 368.
Etapa 6: Preparación de 6-amino-2-propilsulfanil-9-[4-cloro-3-fluoro-fenilmetil]-7H-purin-8-ona
Se preparó compuesto 30f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(4-cloro-3-fluoro-fenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 30e) en lugar de 6-am¡no-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-2-prop¡lsulf¡n¡l-9-[(4-cloro-3-fluoro-fen¡l)met¡l]-7H-purin-8-ona (300 mg, compuesto 3üf) como un sólido blanco MS obsd. (ESl+) [(M+H)+]: 384.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-[[4-cloro-3-fluoro-fenil)metil]metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(4-cloro-3-fluorofen¡l)met¡l]-2-prop¡lsulfin¡l-7H-pur¡n-8-ona (compuesto 30f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (ejemplo 30). Se obtuvo 6-amino-2-(prop¡lsulfon¡m¡do¡l)-9-[[4-cloro-3-fluoro-fen¡l)met¡l]-7H-purin-8-ona (63 mg, ejemplo 3o) como un sólido blanco. RMN de 1H (400 MHz, DMSo-cfó) 5 ppm: 10,67 (s. a., 1H), 7,45-7.
34 (m, 1H)), 7,31-7,22 (m, 1H), 7,09-7,03 (m, 1H), 7,00 (s. a., 2H), 4,99 (s, 2H), 3,98 (s, 1H), 3,31-3,26 (m, 2H), 1,72 1,50 (m, 2H), 0,91 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 399.
Ejemplo 31
6-amino-9-[(2,4-difluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(2,4-difluorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 31a de forma análoga al ejemplo 15, etapa 1 usando (2,4-difluorofenil)met¡lam¡na en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-Ñ-[(2,4-d¡fluorofen¡l)metil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (5,0 g, compuesto 31a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 375.
Etapa 2: Preparación de 6-cloro-N4-[(2,4-difluorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 31b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(2,4-difluorofen¡l)metil]-5-n¡tro-2-prop¡lsulfan¡l-p¡rim¡d¡n-4-am¡na (compuesto 31a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(2,4-difluorofenil)met¡l]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (4,0 g, compuesto 31b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 345.
Etapa 3: Preparación de 6-cloro-9-[(2,4-difluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 31c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-4-[(2,4-difluorofenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 31b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(2,4-difluorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (4,0 g, compuesto 31c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 371.
Etapa 4: Preparación de 9-[(2,4-difluorofenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 31d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(2,4-difluorofenil)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 31c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(2,4-d¡fluorofenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (2,9 g, compuesto 31d) como un sólido blanco. mS obsd. (ESI+) [(M+H)+]: 472.
Etapa 5: Preparación de 6-amino-9-[(2,4-difluorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 31e de forma análoga al ejemplo 15, etapa 5 usando 9-[(2,4-difluorofenil)met¡l]-6-[(4-metox¡fen¡l)metilam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 3 ld ) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(2,4-difluorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (1,4 g, compuesto 31e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 352.
Etapa 6: Preparación de 6-amino-2-propilsulfinil-9-[(2,4-difluorofenil)metil]-7H-purin-8-ona
Se preparó compuesto 31f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(2,4-difluorofen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 31e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-2-prop¡lsulf¡n¡l-9-[((2,4-d¡fluorofen¡l]metil]-7H-pur¡n-8-ona (290 mg, compuesto 31f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 368.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-[[(2,4-difluorofenil)metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(2,4-difluorofen¡l)met¡l]-2-prop¡lsulf¡nil-7H-pur¡n-8-ona (compuesto 31f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfin¡l-7H-pur¡n-8-ona (compuesto 15f). Se obtuvo 6-amino-2-(prop¡lsulfon¡m¡do¡l)-9-[((2,4-d¡fluorofen¡l]metil]-7H-purin-8-ona (33 mg, compuesto 31) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm: 10,68 (s. a., 1H), 7,56 (t, J = 8,0 Hz, 1H), 7,40 (d, J = 8,0 Hz, 1H), 7,24-7,14 (m, 1H), 7,01 (s. a., 2H), 4,98 (s, 2H), 4,05 (s, 1H), 3,32-3,24 (m, 2H), 1,71-1,52 (m, 2H), 0,90 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 383.
Ejemplo 32 y ejemplo 33
4 -[[6-Amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo (compuesto 32) y 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida (compuesto 33)
Etapa 1: Preparación de 4-[[(6-cloro-5-nitro-2-propilsulfanil-pirimidin-4-il)amino]metil]benzonitrilo
Se preparó el compuesto 32a de forma análoga al ejemplo 15, etapa 1 usando 4-(aminomet¡l)benzon¡tr¡lo en lugar de (2-clorofenil)metilamina. Se obtuvo 4-[[(6-cloro-5-n¡tro-2-prop¡lsulfan¡l-pir¡m¡d¡n-4-¡l)am¡no]met¡l]benzon¡tr¡lo (5,5 g, compuesto 32a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 364.
Etapa 2: Preparación de 4-[[(5-amino-6-cloro-2-propilsulfanil-pirimidin-4-il)amino]metil]benzonitrilo
Se preparó compuesto 32b de forma análoga al ejemplo 15, etapa 2 usando 4-[[(6-cloro-5-nitro-2-propilsulfanilpir¡m¡d¡n-4-¡l)am¡no]met¡l]benzon¡tr¡lo (compuesto 32a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 4-[[(5-amino-6-cloro-2-prop¡lsulfan¡l-p¡r¡mid¡n-4-¡l)amino]met¡l]benzon¡tr¡lo (2,7 g, compuesto 32b) como un aceite marrón. MS obsd. (ESI+) [(M+H)+]: 334.
Etapa 3: Preparación de 4-[(6-cloro-8-oxo-2-propilsulfanil-7H-purin-9-il)metil]benzonitrilo
Se preparó compuesto 32c de forma análoga al ejemplo 15, etapa 3 usando 4-[[(5-amino-6-cloro-2-prop¡lsulfanilp¡r¡m¡d¡n-4-¡l)amino]met¡l]benzon¡tr¡lo (2,7 g, compuesto 32b) en lugar de 6-cloro-W-4-[(2-clorofenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 15b). Se obtuvo 4-[(6-cloro-8-oxo-2-propilsulfan¡l-7H-pur¡n-9-¡l)metil]benzonitr¡lo (2,5 g, compuesto 32c) como un sólido amarillo claro. RMN de 1H (400 MHz, DMSO-cfó) 5 ppm: 10,14 (s. a., 1H), 7,82 (d, J = 8,0 Hz, 2H), 7,51 (d, J = 8,0 Hz, 2 H), 5,06 (s, 2H), 3,01 (t, J = 8,0 Hz, 2H), 1,68-1,53 (m, 2H), 0,91 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 360.
Etapa 4: Preparación de 4-[[6-[(4-metoxifenil)metilamino]-8-oxo-2-propilsulfanil-7H-purin-9-il]metil]benzonitrilo
Se preparó compuesto 32d de forma análoga al ejemplo 15, etapa 4 usando 4-[(6-cloro-8-oxo-2-propilsulfan¡l-7H-purin-9-il)met¡l]benzon¡tr¡lo (compuesto 32c) en lugar de 6-cloro-9-[(2-clorofenil)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 4-[[6-[(4-metox¡fen¡l)metilam¡no]-8-oxo-2-prop¡lsulfan¡l-7H-pur¡n-9-¡l]met¡l]benzon¡tr¡lo (3,0 g, compuesto 32d) como un sólido rojo claro. mS obsd. (ESI+) [(M+H)+]: 461.
Etapa 5: Preparación de 4-[[6-amino-8-oxo-2-(propilsulfanil)-7H-purin-9-il]metil]benzonitrilo (compuesto 32e) y 4-[[6-amino-8-oxo-2-(propilsulfanil)-7H-purin-9-il]metil]benzamida (compuesto 33a)
Se prepararon los compuestos 32e, 33a de forma análoga al ejemplo 15, etapa 5 usando 4-[[6-[(4-metox¡fen¡l)metilam¡no]-8-oxo-2-prop¡lsulfan¡l-7H-pur¡n-9-¡l]met¡l]benzon¡tr¡lo (compuesto 32d) en lugar de 9-[(2-clorofenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo como una mezcla (1,5 g) 4-[[6-amino-8-oxo-2-(prop¡lsulfan¡l)-7H-pur¡n-9-¡l]met¡l]benzon¡trilo (compuesto 32e) y 4-[[6-amino-8-oxo-2-propilsulfan¡l-7H-pur¡n-9-il]met¡l]benzam¡da (compuesto 33a).
Etapa 6: Preparación de 4-[[6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il)metil]benzonitrilo (compuesto 32f) y 4-[(6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il]metil]benzamida (compuesto 33b)
Se prepararon los compuestos 32f, 33b de forma análoga al ejemplo 15, etapa 6 usando la mezcla de 4-[(6-amino-8-oxo-2-propilsulfan¡l-7H-pur¡n-9-¡l)met¡l]benzonitr¡lo (compuesto 32e) y 4-[(6-amino-8-oxo-2-propilsulfan¡l-7H-pur¡n-9
il)metil]benzamida (compuesto 33a) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 15e). Se obtuvo como una mezcla de sólido blanco 4-[(6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il)metil]benzonitrilo (compuesto 32f) y 4-[(6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il)metil]benzamida (250 mg, compuesto 33b).
Etapa 7: Preparación de 4-[[6-<mino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo (compuesto 32) y 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida (compuesto 33)
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando la mezcla de 4-[(6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il)metil]benzonitrilo (compuesto 32f) y 4-[(6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il)metil]benzamida (compuesto 33b) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 15f). El residuo se purificó por HPLC preparativa para dar 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo (24,7 mg, ejemplo 32) y 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida (18,8 mg, ejemplo 33).
Ejemplo 32: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,82 (d, J = 8,0 Hz, 2H), 7,50 (d, J = 8,0 Hz, 2H), 7,04 (s. a., 2H), 5,06 (s, 2H), 4,02 (s, 1H), 3,29-3,26 (m, 2H), 1,66-1,54 (m, 2H), 0,89 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 372.
Ejemplo 33: RMN de 1H (400 MHz , DMSO-de) 5 ppm: 10,73 (s. a., 1H), 7,94 (s, 1H), 7,82 (d, J = 8,0 Hz, 2H), 7,38 (d, J = 8,0 Hz, 2H), 7,34 (s, 1H), 7,02 (s. a., 2H), 5,01 (s, 2H), 4,03 (s, 1H), 3,31-3,27 (m, 2H), 1,68-1,56 (m, 2H), 0,90 (t, J = 8,0 Hz, 3H) MS obsd. (ESI+) [(M+H)+]: 390.
Ejemplo 34
6-amino-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-metilpiridina-3-carbonitrilo
34a
A una suspensión de ácido 6-metilpiridin-3-carboxílico (17,0 g, 125 mmol) en tolueno (200 ml) se le añadió tricloruro de fosforilo (84,24 g, 708 mmol) gota a gota. Después de la adición, se agitó la mezcla de reacción a 100 °C durante 12 h. La mezcla se enfrió a TA y el disolvente se retiró a vacío. El residuo se suspendió en EtOAc (400 ml), se basificó con NaHCO3 sat. (400 ml), y se extrajo con EtOAc (300 ml) dos veces. La capa orgánica combinada se secó sobre sulfato de sodio anhidro, se filtró y concentró a vacío. El residuo se purificó por cromatografía en columna sobre gel de sílice eluido con (PE/EtOAc de 10/1 a 5/1) para dar 6-metilpiridina-3-carbonitrilo (10,5 g, compuesto 34a) como un sólido amarillo claro. MS obsd. (ESI+) [(M+H)+]: 119.
Etapa 2: Preparación de (6-metil-3-piridil)metilamina
A una solución de 6-metilpiridin-3-carbonitrilo (10,5 g, 25,7 mmol) en MeOH (80 ml) y NH3/MeOH (20 ml, 7 M) se le añadió Raney-Ni (2,0 g) bajo atmósfera de N2. La suspensión se desgasificó a vacío y se rellenó con H2. Se agitó la mezcla durante 12 h a 40 °C en atmósfera de H2 (50 psi). La mezcla de reacción se filtró y el filtrado se concentró a vacío para dar (6-metil-3-piridil)metilamina (9,5 g, compuesto 34b) como un aceite ligero. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 8,36 (s, 1H), 7,62 (d, J = 8,0 Hz, 1H), 7,18 (d, J = 8,0 Hz, 1H), 3,69 (s, 2H), 2,42 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 123.
Etapa 3: Preparación de 6-cloro-N-[(6-metil-3-piridil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 34c de forma análoga al ejemplo 15, etapa 1 usando (6-metil-3-piridil)metilamina (compuesto 34b) en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W-[(6-metil-3-piridil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (15,5 mg, compuesto 34c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 354. Etapa 4: Preparación de 6-cloro-N-4-[(6-metil-3-piridil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 34d de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(6-met¡l-3-pir¡d¡l)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡rim¡d¡n-4-am¡na (compuesto 34c) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W-4-[(6-metil-3-p¡r¡d¡l)met¡l]-2-propilsulfan¡lpir¡m¡dina-4,5-d¡am¡na (10,9 g, compuesto 34d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 324.
Etapa 5: Preparación de 6-cloro-9-[(6-metil-3-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 34e de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W-[(6-metil-3-pir¡d¡l)met¡l]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 34d) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(6-metil-3-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (12,0 g, compuesto 34e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 350.
Etapa 6: Preparación de 6-[(4-metoxifenil)metilamino]-9-[(6-metil-3-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 34f de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(6-metil-3-pir¡d¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 34e) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)met¡lamino]-9-[(6-met¡l-3-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (15,0 g, compuesto 34f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 451.
Etapa 7: Preparación de 6-amino-9-[(6-metil-3-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 34g de forma análoga al ejemplo 15, etapa 5 usando 6-[(4-metoxifen¡l)met¡lam¡no]-9-[(6-met¡l-3-p¡r¡d¡l)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 34f) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(6-metil-3-pir¡d¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (7,9 g, compuesto 34g) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 331.
Etapa 8: Preparación de 6-amino-9-[(6-metil-3-piridil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 34h de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(6-met¡l-3-p¡rid¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 34g) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-9-[(6-metil-3-p¡r¡d¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (300 mg, compuesto 34h) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 347.
Etapa 9: Preparación de 6-amino-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del titulo de forma análoga al ejemplo 15, etapa 7 usando 6-am¡no-9-[(6-met¡l-3-pir¡d¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 34h) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-am¡no-9-[(6-met¡l-3-pir¡d¡l)met¡l]-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (13 mg, ejemplo 34) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfe) ódppm: 8,47 (s, iH), 7,63 (dd, J = 8,0 Hz, 2,0 Hz, 1H), 7,21 (d, J = 8,0 Hz, 1H), 7,07 (s, 2H), 4,95 (s, 2H), 4,06 (s, 1H), 3,32-3,29 (m, 2H), 2,42 (s, 3H), 1,71-1,57 (m, 2H), 0,92 (t, J = 7,4 Hz, 3H) MS obsd. (ESI+) [(M+H)+]: 363.
Ejemplo 35
6-amino-9-[(2-metil-4-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 2-metilpiridina-4-carbonitrilo
35a
Una mezcla de 2-cloropiridina-4-carbonitrilo (30,0 g, 216,0 mol), AlMe3 (11 ml, 220 mmol, 2 M en tolueno) y Pd (PPh3)4 (2,3 g, 2,0 mmol) en dioxano (400 ml) se calentó a 130 °C durante 10 h bajo atmósfera de N2. La mezcla se enfrió a TA, a continuación se vertió en agua con hielo (1000 ml), se extrajo con EtOAc. La capa orgánica combinada se secó sobre sulfato de sodio anhidro y se concentró a vacío. El residuo se purificó por cromatografía en columna eluido con PE/EtOAc (2/1) para proporcionar 2-metilpiridina-4-carbonitrilo (compuesto 35a) como un cristal amarillo. (5,2 g). RMN de 1H (400 MHz, DMSO-de) 6 ppm: 8,68 (d, J = 5,0 Hz, 1H), 7,39 (s, 1H), 7,33 (d, J = 5,0 Hz, 1H), 2,63 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 119.
Etapa 2: Preparación de (2-metil-4-piridil)metilanamina
A una solución de 2-metilpiridin-4-carbonitrilo (1,6 g, 13 mmol, compuesto 35a) en MeOH (30 ml) y NH3/MeOH (20 ml, 7 M) se le añadió Raney-Ni (2,0 g) bajo atmósfera de N2. Se desgasificó la suspensión a vacío y se purgó con H2 dos veces. Se agitó la mezcla bajo atmósfera de H2 (50 psi) a 40 °C durante 12 h. A continuación, la mezcla de reacción se filtró y el filtrado se concentró a vacío para dar (2-metil-4-piridil)metilanamina (1,6 g, compuesto 35b) como un aceite marrón. RMN de 1H (400 MHz, DMSO-de) 6 ppm: 8,41 (J = 5,0 Hz, 1H), 7,12-7,04 (m, 2H), 3,86 (s, 2H), 2,54 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 123.
Etapa 3: Preparación de 6-cloro-N-[(2-metil-4-piridil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 35c de forma análoga al ejemplo 15, etapa 1 usando (2-met¡l-4-p¡rid¡l)met¡lam¡na (compuesto 35b) en lugar de (2-clorofen¡l)metanam¡na. Se obtuvo 6-cloro-W-[(2-met¡l-4-p¡r¡d¡l)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (4,3 g, compuesto 35c) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 354.
Etapa 4: Preparación de 6-cloro-N4-[(2-metil-4-piridil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 35d de forma análoga al ejemplo 15, etapa 2 med¡ante 6-cloro-W-[(2-met¡l-4-p¡r¡d¡l)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (compuesto 35c) en lugar de 6-cloro-W-[(2-clorofen¡l)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (compuesto 15a). Se obtuvo 6-cloro-W-4-[(2-met¡l-4-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡lp¡r¡m¡d¡na-4,5-d¡am¡na (2,0 g, compuesto 35d) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 324.
Etapa 5: Preparación de 6-cloro-9-[(2-metil-4-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 35e de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(2-met¡l-4-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 35d) en lugar de 6-cloro-W-4-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡lp¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(2-met¡l-4-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (2,5 g, compuesto 35e) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 350.
Etapa 6: Preparación de 6-[(4-metoxifenil)metilamino]-9-[(2-metil-4-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 35f de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(2-metil-4-p¡r¡d¡l)met¡l]-2-propilsulfan¡l-7H-purin-8-ona (compuesto 35e) en lugar de 6-cloro-9-[(2-metil-4-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)met¡lamino]-9-[(2-met¡l-4-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (3,3 g, compuesto 35f) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 450.
Etapa 7: Preparación de 6-amino-9-[(2-metil-4-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 35g de forma análoga al ejemplo 15, etapa 5 usando 6-[(4-metoxifenil)met¡lam¡no]-9-[(2-metil-4-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 35f) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 6-amino-9-[(2-metil-4-pir¡d¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 35g) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 331.
Etapa 8: Preparación de 6-amino-9-[(2-metil-4-piridil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 35h de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(2-met¡l-4-p¡rid¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 35g) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-9-[(2-metil-4-p¡r¡d¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (180 mg, compuesto 35h) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 347.
Etapa 9: Preparación de 6-amino-9-[(2metil-4-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(2-metil-4-p¡r¡d¡l)met¡l]-2-propilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 35h) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-am¡no-2-(prop¡lsulfon¡m¡do¡l)-9-[[(2,4-difluorofen¡l)met¡l]-7H-pur¡n-8-ona (21 mg, ejemplo 35) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfó) 5 ppm: 10,68 (s. a., 1H), 7,56 (t, J = 8,0 Hz, 1H), 7,40 (d, J = 8,0 Hz, 1H), 7,24-7,14 (m, 1H), 7,01 (s. a., 2H), 4,98 (s, 2H), 4,05 (s, 1H), 3,32-3,24 (m, 2H), 2,45 (s, 3H), 1,71-1,52 (m, 2H), 0,90 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 362.
Ejemplo 36
6-amino-9-[(3-cloro-4-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(2,4-difluorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 36a de forma análoga al ejemplo 15, etapa 1 usando (3-cloro-4-metil-fenil)met¡lam¡na en lugar de (2-clorofenil)met¡lam¡na. Se obtuvo 6-cloro-W-[(3-cloro-4-met¡l-fen¡l)metil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-amina (5,0 g, compuesto 36a) como un sólido amarillo. Ms obsd. (ESI+) [(M+H)+]: 387.
Etapa 2: Preparación de 6-cloro-N4-[(3-cloro-4-metil-fenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 36b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(3-cloro-4-metil-fen¡l)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡rim¡d¡n-4-am¡na (compuesto 36a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-n¡tro-2-propilsulfanil-pirimidin-4-amina (compuesto l5a ). Se obtuvo 6-cloro-W4-[(3-cloro-4-metilfenil)met¡l]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (4,0 g, compuesto 36b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 357.
Etapa 3: Preparación de 6-cloro-9-[(3-cloro-4-metil-fenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 36c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(3-cloro-4-metil-fenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 36b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(3-cloro-4-metil-fen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 36c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 383.
Etapa 4: Preparación de 9-[(3-cloro-4-metil-fenil)metil]-6-[(4-metoxifenil)metilamino]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 36d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(3-cloro-4-metil-fenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 36c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 9-[(3-cloro-4-met¡l-fenil)met¡l]-6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (4,0 g, compuesto 36d) como un sólido blanco. m S obsd. (Es I+) [(M+H)+]: 484.
Etapa 5: Preparación de 6-amino-9-[(3-cloro-4-metil-fenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 36e de forma análoga al ejemplo 15, etapa 5 usando 9-[(3-cloro-4-metil-fen¡l)met¡l]-6-[(4-metox¡fen¡l)metilam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 36d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona. Se obtuvo 6-amino-9-[(3-cloro-4-metil-fen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (230 mg, compuesto 36e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 364.
Etapa 6: Preparación de 6-amino-9-[(3-cloro-4-metil-fenil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 36f de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(3-cloro-4-metil-fen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 36e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-amino-9-[(3-cloro-4-met¡l-fen¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (155 mg, compuesto 36f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 380.
Etapa 7: Preparación de 6-amino-9-[(3-cloro-4-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(3-cloro-4-metilfenil)met¡l]-2-prop¡lsulfin¡l-7H-pur¡n-8-ona (155 mg, compuesto 36f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfin¡l-7H-pur¡n-8-ona (compuesto 15f). Se obtuvo 6-amino-9-[(3-cloro-4-met¡l-fen¡l)met¡l]-2-(propilsulfonim¡do¡l)-7H-pur¡n-8-ona (34 mg, ejemplo 36) como un sólido gris. RMN de 1H (400 MHz , DMSO-cfe) 5 ppm: 7,39 (s, 1H), 7,31 (d, J = 8,0 Hz, 1H), 7,20 (d, J = 8,0 Hz, 1H), 7,03 (s. a., 2H), 4,93 (s, 2H), 4,02 (s, 1H), 3,30 3,27 (m, 2H), 1,72-1,54 (m, 2H), 0,91 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 395.
Ejemplo 37
6-amino-9-[(4-metilsulfonilfenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(4-metilsulfonilfenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 37a de forma análoga al ejemplo 15, etapa 1 usando (4-met¡lsulfonilfen¡l)met¡lam¡na en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W-[(4-met¡lsulfon¡lfenil)met¡l]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-amina (3,6 g, compuesto 37a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 4l7.
Etapa 2: Preparación de 6-cloro-N4-[(4-metilsulfonilfenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 37b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W-[(4-metilsulfon¡lfen¡l)met¡l]-5-n¡tro-2-prop¡lsulfanil-p¡rim¡din-4-amina (compuesto 37a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-W4-[(4-metilsulfon¡lfen¡l)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (3,2 g, compuesto 37b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 387.
Etapa 3: Preparación de 6-cloro-9-[(4-metilsulfonilfenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 37c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(4-metilsulfon¡lfen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡mid¡na-4,5-d¡am¡na (compuesto 37b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-prop¡lsulfan¡lpir¡m¡dina-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(4-metilsulfon¡lfen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (2,0 g, compuesto 37c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 413.
Etapa 4: Preparación de 6-[(4-metoxifenil)metilamino]-9-[(4-metilsulfonilfenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 37d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(4-metilsulfonilfen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 37c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)metilam¡no]-9-[(4-met¡lsulfon¡lfen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (2,2 g, compuesto 37d) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 514.
Etapa 5: Preparación de 6-amino-9-[(4-metilsulfonilfenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 37e de forma análoga al ejemplo 15, etapa 5 usando 6-[(4-metoxifenil)met¡lam¡no]-9-[(4-metilsulfon¡lfen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 36d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulfanil-7H-pur¡n-8-ona. Se obtuvo 6-amino-9-[(4-metilsulfon¡lfen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (1,2 g, compuesto 37e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 394.
Etapa 6: Preparación de 6-amino-9-[(4-metilsulfonilfenil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 37d de forma análoga al ejemplo 15, etapa 6 usando 6-amino-9-[(4-metilsulfon¡lfen¡l)met¡l]-2-propilsulfanil-7H-purin-8-ona (compuesto 37e) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfanil-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-am¡no-9-[(4-met¡lsulfon¡lfen¡l)met¡l]-2-propilsulf¡n¡l-7H-pur¡n-8-ona (200 mg, compuesto 37f) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 410.
Etapa 7: Preparación de 6-amino-2-(propilsulfonimidoil)-9-[[(2,4-difluorofenil)metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-amino-9-[(4-met¡lsulfon¡lfen¡l)met¡l]-2-propilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 37f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-9-[(4-met¡lsulfon¡lfen¡l)met¡l]-2-(prop¡lsulfon¡m¡do¡l)-7H-purin-8-ona (l7 mg, ejemplo 37) como un sólido gris. RMN de 1H (400 MHz, DMSO-cfó) 5 ppm: 7,89 (d, J = 8,0 Hz, 2H), 7,57 (d, J = 8,0 Hz, 2H), 7,11 (s. a., 2H), 5,08 (s, 2H), 4,07 (s, 1H), 3,34- 3,28 (m, 2H), 3,18 (s, 3H), 1,65-1,57 (m, 2H), 0,89 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 425.
Ejemplo 38
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoato de metilo
Etapa 1: Preparación de 4-[[(6-cloro-5-nitro-2-propilsulfanil-pirimidin-4-il)amino]metil]benzoato de metilo
Se preparó el compuesto 38a de forma análoga al ejemplo 15, etapa 1 usando 4-(aminometil)benzoato de metilo en lugar de (2-clorofenil)metilamina. Se obtuvo 4-[[(6-cloro-5-n¡tro-2-propilsulfan¡l-p¡r¡m¡d¡n-4-¡l)am¡no]met¡l]benzoato de metilo (compuesto 38a) como un sólido blanco. Ms obsd. (ESI+) [(M+H)+]: 397.
Etapa 2: Preparación de 4-[[(6-cloro-5-metil-2-propilsulfanil-pirimidin-4-il)amino]metil]benzoato de metilo
Se preparó compuesto 38b de forma análoga al ejemplo 15, etapa 2 usando 4-[[(6-cloro-5-nitro-2-prop¡lsulfan¡lp¡r¡m¡din-4-¡l)am¡no]met¡l]benzoato de metilo (compuesto 38a) en lugar de 6-cloro-W-[(2-clorofenil)met¡l]-5-n¡tro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 4-[[(6-cloro-5-metil-2-prop¡lsulfan¡l-p¡r¡mid¡n-4-il)amino]metil]benzoato de metilo (compuesto 38b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 366.
Etapa 3: Preparación de 4-[(6-cloro-8-oxo-2-propilsulfanil-7H-purin-9-il)metil]benzoato de metilo
Se preparó compuesto 38c de forma análoga al ejemplo 15, etapa 3 usando 4-[[(6-cloro-5-metil-2-propilsulfanilpir¡m¡d¡n-4-¡l)amino]met¡l]benzoato de metilo (compuesto 38b) en lugar de 6-cloro-W4-[(2-clorofenil)metil]-2-propilsulfan¡l-p¡r¡m¡d¡na-4,5-d¡amina (compuesto 15b). Se obtuvo 4-[(6-cloro-8-oxo-2-propilsulfan¡l-7H-pur¡n-9-il)metil]benzoato de metilo (compuesto 38c) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 39.
Etapa 4: Preparación de 4-[[6-[(4-metoxifenil)metilamino]-8-oxo-2-propilsulfanil-7H-purin-9-il]metil]benzoato de metilo
Se preparó compuesto 38d de forma análoga al ejemplo 15, etapa 4 usando 4-[(6-cloro-8-oxo-2-propilsulfan¡l-7H-purin-9-il)metil]benzoato de metilo (compuesto 38c) en lugar de 6-cloro-9-[(2-clorofenil)metil]-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 15c). Se obtuvo 4-[[6-[(4-metoxifen¡l)met¡lam¡no]-8-oxo-2-prop¡lsulfanil-7H-pur¡n-9-il]metil]benzoato de metilo (compuesto 38d) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 494.
Etapa 5: Preparación de 4-[(6-amino-8-oxo-2-propilsulfanil-7H-purin-9-il)metil]benzoato de metilo
Se preparó compuesto 38e de forma análoga al ejemplo 15, etapa 5 usando 4-[[6-[(4-metoxifen¡l)met¡lamino]-8-oxo-2-propilsulfan¡l-7H-pur¡n-9-¡l]metil]benzoato de metilo (compuesto 38d) en lugar de 9-[(2-clorofenil)metil]-6-[(4-metox¡fen¡l)metilam¡no]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15d). Se obtuvo 4-[(6-amino-8-oxo-2-propilsulfanil-7H-pur¡n-9-¡l)met¡l]benzoato de metilo (compuesto 38e) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 374.
Etapa 6: Preparación de 4-[(6-amino-8-oxo-2-propilsulfinil-7H-purin-9-il)metil]benzoato de metilo
Se preparó compuesto 38f de forma análoga al ejemplo 15, etapa 6 usando 4-[(6-amino-8-oxo-2-propilsulfanil-7H-purin-9-il)metil]benzoato de metilo (compuesto 38e) en lugar de 6-amino-9-[(2-clorofenil)met¡l]-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 15e). Se obtuvo 4-[(6-amino-8-oxo-2-prop¡lsulf¡n¡l-7H-pur¡n-9-il)met¡l]benzoato de metilo (compuesto 38f) como un sólido blanco MS obsd. (ESI+) [(M+H)+]: 390.
Etapa 7: Preparación de 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoato de metilo
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 4-[(6-amino-8-oxo-2
propilsulfanil-7H-purin-9-il)metil]benzoato de metilo (compuesto 38f) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona. Se obtuvo 4-[(6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il)metil]benzoato de metilo (127 mg, ejemplo 38) como un sólido blanco. RMN de 1H (400 MHz DMSO-cfó) 5 ppm: 10,75 (s. a., 1H), 7,92 (d, J = 8,0 Hz, 2H), 7,45 (d, J = 8,0 Hz, 2H), 6,99 (s. a., 2H), 5,05 (s, 2H), 4,00 (s, 1H), 3,84 (s, 3H), 3,32-3,27 (m, 2H), 1,64-1,56 (m, 2H), 0,88 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 405.
Ejemplo 39
Ácido 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoico
A una solución de 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoato de metilo (70 mg, compuesto 38) en THF/MeOH (2 / 1 , v/v, 3 ml) se le añadió LiOH acuoso (0,34 ml, 0,34 mmol, 1 M) y se agitó la mezcla a 25 °C durante 3 h. A continuación, la mezcla de reacción se acidificó mediante la adición de HCl 1 N. El sólido formado se recogió por filtración y se purificó por HPLC preparativa para dar ácido 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoico (38 mg, ejemplo 39). RMN de 1H (400 MHz DMSO-cfó) 5 ppm: 10,76 (s. a., 1H), 7,89 (d, J = 8,0 Hz, 2H), 7,41 (d, J = 8,0 Hz, 2H), 7,03 (s. a., 2H), 5,04 (s, 2H), 4,05 (s, 1H), 3,32-3,27 (m, 2H), 1,63-1,55 (m, 2H), 0,88 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 391.
Ejemplo 40
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]-W-(2-metoxietil)benzamida
A una solución de ácido 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoico (100 mg, compuesto 39), HATU (146 mg, 0,38 mmol) y DIPEA anhidro (89 pl, 0,51 mmol) en DMF anhidro (5 ml) se le añadió 2-metoxietanamina (44 pl, 0,51 mmol). Se agitó la mezcla de reacción a ta durante la noche y a continuación se concentró a vacío. El residuo se purificó por HPLC preparativa para dar 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]-N-(2-metoxietil)benzamida (18 mg, ejemplo 40) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,59 (s, 1H), 8,44-8,61 (m, 1H), 7,80 (d, J = 7,50 Hz, 2H), 7,40 (d, J = 7,49 Hz, 2H), 6,98 (s., 2H), 5,01 (s, 2H), 4,04 (s. a., 1H), 3,38-3,44 (m, 4H), 3,29-3,30 (m, 2H), 3,25 (s, 3H), 1,58-1,66 (m, 2H), 0,91 (t, J = 7,53 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 448
Ejemplo 41
6-amino-9-[[4-(piperidina-1-carbonil)fenil]metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 40 usando piperidina en lugar de 2-metoxietanamina. Se obtuvo 6-amino-9-[[4-(piperidina-1-carbonil)fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona (6,5 mg, ejemplo 41) como un sólido blanco. Rm N de 1H (400 MHz, DMSO-cfó) 5 ppm: 10,80 (s, 1 H), 7,31-7,39 (m, 4H), 7,04 (s. a., 2H), 5,00 (s, 2H), 4,03 (s, 1H), 3,55 (s. a., 2H), 3,26-3,39 (m, 4H), 1,43-1,68 (m, 8H), 0,93 (t, J = 7,40 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 458.
Ejemplo 42
6-amino-2-(propilsulfonimidoil)-9-[[4-(pirrolidina-1-carbonil)fenil]metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 40 usando pirrolidina en lugar de 2-metoxietanamina. Se obtuvo 6-amino-2-(propilsulfonimidoil)-9-[[4-pirrolidina-1-carbonilo)fenil)metil]-7H-purin-8-ona (8,0 mg, ejemplo 42) como un sólido blanco. RMN de 1H (400 Mhz, DMSO-cfó) 5 ppm: 10,60 (s, 1H), 7,48 (d, J = 7,31 Hz, 2H), 7,37 (d, J = 8,03 Hz, 2H), 6,99 (s. a., 2H), 5,00 (s, 2H), 4,10 (s, 1H), 3,40-3,46 (m, 2H), 3,31-3,34 (m, 4H), 1,62-1,67 (m, 4H), 1,62-1,67 (m, 2H), 0,91 (t, J = 7,40 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 444
Ejemplo 43
6-amino-2-(propilsulfonimidoil)-9-(pirimidin-5-ilmetil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-5-nitro-2-propilsulfanil-N-(pirimidin-5-ilmetil)pirimidin-4-amina
Se preparó el compuesto 43a de forma análoga al ejemplo 15, etapa 1 usando 4,6-dicloro-5-nitro-2-(propMtio)pirimidina en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-5-nitro-2-(propiltio)-W-(pirimidin-5-ilmetil)-pirimidin-4-amina (4,0 g, compuesto 43a) como un aceite amarillo claro. MS obsd. (ESI+) [(M+H)+]: 341.
Etapa 2: Preparación de 6-cloro-2-propilsulfanil-N4-(pirimidin-5-ilmetil)pirimidina-4,5-diamina
Se preparó compuesto 43b de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-5-nitro-2-(propiltio)-W-(pirimidin-5-ilmetil)pirimidin-4-amina (compuesto 43a) en lugar de 6-cloro-Ñ-[(2-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (compuesto 15a). Se obtuvo 6-cloro-2-propilsulfanil-W4-(pirimidin-5-ilmetil)pirimidina-4,5-diamina (1,0 g, compuesto 43b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 311.
Etapa 3: Preparación de 6-cloro-2-propilsulfanil-9-(pirimidin-5-ilmetil)-7H-purin-8-ona
Se preparó compuesto 43c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-2-prop¡lsulfan¡l-W4-(pir¡m¡d¡n-5-¡lmet¡l)p¡r¡mid¡na-4,5-d¡am¡na (compuesto 43b) en lugar de 6-cloro-W4-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-2-prop¡lsulfan¡l-9-(p¡r¡m¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (0,5 g, compuesto 43c) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 337.
Etapa 4: Preparación de 6-[(4-metoxifenil)metilamino]-2-propilsulfanil-9-(pirimidin-5-ilmetil)-7H-purin-8-ona
Se preparó compuesto 43d de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-2-prop¡lsulfan¡l-9-(p¡r¡m¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (compuesto 43c) en lugar de 6-cloro-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-9-(p¡r¡m¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (300 mg, compuesto 43d) como un sól¡do blanco. m S obsd. (ESI+) [(m+H)+]: 438.
Etapa 5: Preparación de 6-[(4-metoxifenil)metilamino]-2-propilsulfinil-9-(pirimidin-5-ilmetil)-7H-purin-8-ona
Se preparó compuesto 43e de forma análoga al ejemplo 15, etapa 6 usando 6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-9-(p¡r¡m¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (compuesto 43d) en lugar de 6-am¡no-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulf¡n¡l-9-(p¡r¡m¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (280 mg, compuesto 43e) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 454.
Etapa 6: Preparación de 6-amino-2-(propilsulfonimidoil)-9-(pirimidin-5-ilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-[(4-metoxifen¡l)met¡lam¡no]-2-prop¡lsulf¡n¡l-9-(p¡r¡m¡din-5-¡lmet¡l)-7H-pur¡n-8-ona (compuesto 43e) en lugar de 6-am¡no-9-[(2-clorofen¡l)met¡l]-2-propilsulfin¡l-7H-pur¡n-8-ona (compuesto 15f). Se obtuvo 6-am¡no-2-(prop¡lsulfon¡m¡do¡l)-9-(p¡rim¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (70 mg, ejemplo 43) como un sólido blanco. RMN de 1H (40o MHz, DMSO-cfó) 5 ppm: 9,13 (s, 1H), 8,83 (s, 2H), 7,07 (s. a., 2H), 5,04 (s, 2H), 4,08 (s, 1H), 3,27-3,34 (m, 2H), 1,50-1,69 (m, 2H), 0,92 (t, J = 7,2 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 349.
Ejemplo 44
6-amino-9-[(2-metilpirimidin-5-il)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de N,N'-[2-[1-(dimetilamino)metilideno]propano-1,3-diilideno]bis(N-metilmetanaminio)bis(tetrafluoroborato)
A DMF enfriado (400 ml) en un matraz de fondo redondo se le añadió POCb (165,5 g) a -10 °C. Se agitó la mezcla de reacción a 0 °C durante 3 h. A esta mezcla de reacción se le añadió ácido 2-bromoacético (50 g, 360 mmol) a 0 °C. La mezcla de reacción resultante se agitó a 80 °C durante 16 h, a continuación se retiró el DMF a vacío. El residuo rojo oscuro se enfrió a temperatura ambiente y se le añadió tetrafluoroborato de sodio (100 g, 911 mmol) al residuo. Después de enfriar la mezcla de reacción en un baño de hielo, se obtuvo N,N'-[2-[1-(d¡met¡lam¡no)met¡l¡deno]propano-1,3-d¡¡l¡deno]b¡s(N-met¡lmetamin¡o)b¡s(tetrafluoroborato) (120 g, compuesto 44a) por filtración como un sólido marrón y se usó en la siguiente etapa sin purificación.
Etapa 2: Preparación de 2-metilpirimidina-5-carbaldehído
A una mezcla de W,W-[2-[1-(dimetilamino)metilideno]propano-1,3-diilideno]bis(W-metilmetanaminio)bis(tetrafluoroborato) (70 g, 196 mmol, compuesto 44a) y HCl acetamidina (37 g, 392 mmol) en MeCN/H2O (400 ml, v/v = 1/1) se le añadió NaOH (120 g, 3,0 mmol) a 15 °C, y la mezcla de reacción resultante se agitó a 15 °C durante 16 h. La mezcla de reacción se neutralizó a pH 6-7 con AcOH, se extrajo con acetato de etilo (100 ml) tres veces. La capa orgánica separada se secó sobre sulfato de sodio, se filtró y se concentró a vacío. El residuo se purificó mediante cromatografía en columna para proporcionar 2-metilpirimidina-5-carbaldehído (10 g, compuesto 44b) como un sólido amarillo.
Etapa 3: Preparación de (2-metilpirimidin-5-il)metanol
A una mezcla de 2-metilpirimidina-5-carbaldehído (8 g, 66 mmol, compuesto 44b) en MeOH (100 ml) se le añadió NaBH4 (7,5 g, 197 mmol) a 0 °C, y la mezcla de reacción resultante se agitó a 15 °C durante 3 h. A continuación, la mezcla de reacción se inactivó con solución saturada de NH4Cl (30 ml), se extrajo con acetato de etilo (20 ml) tres veces. La capa orgánica separada se secó sobre sulfato de sodio, se filtró y se concentró a vacío. El residuo se purificó por cromatografía en columna para proporcionar (2-metilpirimidin-5-il)metanol (4,1 g, 51 %, compuesto 44c) como un sólido blanco.
Etapa 4: Preparación de 5-(azidometil)-2-metilpirimidina
A una mezcla de (2-metilpirimidin-5-il)metanol (4,1 g, 33 mmol, compuesto 44c) en CHCb (40 ml) y tolueno (40 ml) se le añadió DPpA (27 g, 83 mmol) y DBU (25 g, 164 mmol) a 0 °C y se agitó a 15 °C durante 16 h. La mezcla de reacción se diluyó con DCM (100 ml) y se lavó con agua (50 ml). La capa orgánica separada se secó sobre sulfato de sodio anhidro, se filtró y se concentró a vacío. El residuo se purificó mediante cromatografía en columna para proporcionar 5-(azidometil)-2-metilpirimidina (2,8 g, compuesto 44d) como un aceite ligero.
Etapa 5: Preparación de (2-metilpirimidin-5-il)metanamina.
Una mezcla de 5-(azidometil)-2-metilpirimidina (2,8 g, 18,8 mmol, compuesto 44d) y Pd/C (500 mg) en MeOH (100 ml) se agitó bajo 1 atm de H2 a 15 °C durante 1 hora. A continuación, la mezcla de reacción se filtró y el filtrado se concentró a vacío para proporcionar (2-metilpirimidin-5-il)metanamina (1,8 g, 78 %, compuesto 44e) como un sólido blanco.
Etapa 6: 6-cloro-W4-[(2-metilpirimidin-5-il)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 44f de forma análoga al ejemplo 15, etapa 1 usando (2-metilpirimidin-5-il)metanamina (compuesto 44e) en lugar de (2-clorofenil)metilamina. Se obtuvo 6-cloro-W4-[(2-metilpirimidin-5-il)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina (2,8 g, compuesto 44f) como un sólido amarillo claro. MS obsd. (ESI+) [(M+H)+]: 355.
Etapa 7: Preparación de 6-cloro-N4-[(2-metilpirimidin-5-il)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 44g de forma análoga al ejemplo 15, etapa 2 usando 6-cloro-W4-[(2-metilpirimidin-5-il)metil]-2-propilsulfanil-pirimidina-4,5-amina (compuesto 44f) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanilpirimidin-4-amina (compuesto 15a). Se obtuvo y se usó 6-cloro-W4-[(2-metilpirimidin-5-il)metil]-2-propilsulfanilpirimidina-4,5-diamina (2,1 g, compuesto 44g) en la siguiente etapa sin purificación adicional. Ms obsd. (ESI+) [(M+H)+]: 325.
Etapa 8: Preparación de 6-cloro-9-[(2-metilpirimidin-5-il)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 44h de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(2-met¡lp¡r¡mid¡n-5-¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡mid¡na-4,5-d¡am¡na (compuesto 44g) en lugar de 6-cloro-W4-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡lp¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(2-met¡lp¡r¡m¡d¡n-5-¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (1,8 g, compuesto 44h) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 351.
Etapa 9: Preparación de 6-[(4-metoxifenil)metilamino]-9-[(2-metilpirimidin-5-il)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 44i de forma análoga al ejemplo 15, etapa 4 usando 6-cloro-9-[(2-met¡lp¡r¡m¡d¡n-5-¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 44h) en lugar de 6-cloro-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15c). Se obtuvo 6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-9-(p¡r¡m¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (500 mg, compuesto 44i) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 452.
Etapa 10: Preparación de 6-[(4-metoxifenil)metilamino]-9-[(2-metilpirimidin-5-il)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 44j de forma análoga al ejemplo 15, etapa 6 usando 6-[(4-metox¡fen¡l)met¡lam¡no]-2-prop¡lsulfan¡l-9-(p¡r¡m¡d¡n-5-¡lmet¡l)-7H-pur¡n-8-ona (compuesto 43i) en lugar de 6-am¡no-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 15e). Se obtuvo 6-[(4-metox¡fen¡l)met¡lam¡no]-9-[(2-met¡lp¡r¡m¡d¡n-5-¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (420 mg, compuesto 44j) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 468. Etapa 11: Preparación de 6-amino-9-[(2-metilpirimidin-5-il)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-[(4-metox¡fen¡l)met¡lam¡no]-9-[(2-met¡lp¡r¡m¡d¡n-5-¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (compuesto 44j) en lugar de 6-am¡no-9-[(2-clorofen¡l)met¡l]
2-propilsulfinil-7H-purin-8-ona (compuesto 15f). Se obtuvo 6-amino-9-[(2-metilpirimidin-5-il)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona (16,5 mg, ejemplo 44) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 8,71 (s, 2H), 6,98 (s, 2H), 4,99 (s, 2H), 4,10 (s, 1H), 3,35 (m, 2H), 2,59 (s, 3H), 1,65-1,62 (m, 2H), 0,95-0,91 (t, J = 7,2 Hz, 3H).MS obsd. (ESI+) [(M+H)+]: 363.
Ejemplo 46
W-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]pentanamida
A la solución de 6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona (70 mg, 0,21 mmol, compuesto 4) en piridina (2 ml) se le añadió anhídrido de ácido valérico (41 mg), 0,22 mmol). Se agitó la mezcla de reacción a TA durante 6 h. Después de la reacción, se retiró el disolvente a vacío. El residuo se purificó por HPLC preparativa para dar N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]pentanamida (13,7 mg, ejemplo 46). RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,29-7,32 (m, 5H), 7,19 (s. a., 2H), 4,90 (m, 2H), 3,48-3,50 (m, 2H), 2,17 (t, J = 7,2 Hz, 2H), 1,50-1,70 (m, 2H), 1,39-1,47 (m, 2H), 1,61-1,76 (m, 1H), 1,47-1,59 (m, 1H), 0,89 (t, J = 7,40Hz, 3H), 0,80 (t, J = 7,39 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 431.
Ejemplo 47
W-[[6-amino-9-[(4-clorofenil)metil]-8-oxo-7H-purin-2-il]-oxo-propil-A4-sulfanilideno]acetamida
Se preparó el compuesto del título de forma análoga al ejemplo 46 usando anhídrido acético y 6-amino-9-(4-clorobencilmetil)-2-(propilsulfonimidoil)-7H-purin-8-ona (compuesto 9) en lugar de anhídrido de ácido valérico y 6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona (ejemplo 4). Se obtuvo N-[[6-amino-9-[(4-clorofenil)metil]-8-oxo-7H-purin-2-il]-oxo-propil-A4-sulfanilideno]acetamida (2 mg, ejemplo 47) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,31-7,40 (m, 4H), 7,29 (s. a., 2H), 4,95 (s, 2H), 3,42-3,57 (m, 2H), 1,90 (s, 3H), 1,61 1,76 (m, 1H), 1,47-1,59 (m, 1H), 0,89 (t, J = 7,40 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 423.
Ejemplo 48
W-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-metil-oxo-A4-sulfanilideno]acetamida
Se preparó el compuesto del título de forma análoga al ejemplo 46 usando anhídrido acético en lugar de anhídrido de ácido valérico. Se obtuvo W-[[6-amino-9-bencil-8-oxo-7H-purin-2-il]-metil--oxo-A4-sulfanilideno]acetamida (44 mg, ejemplo 48) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,80 (s. a., 1H), 7.,26-7,36 (m, 5H), 7,18 (s. a., 2H), 4,96 (s, 2H), 3,39 (s, 3H), 1,91 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 361.
Ejemplo 49
Ácido 4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico
Se preparó el compuesto del título de forma análoga al ejemplo 46 usando anhídrido succínico en lugar de anhídrido de ácido valérico. Se obtuvo ácido 4-[[[6-amino-9-[(4-clorofenil)metil]-8-oxo-7H-purin-2-il]-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico (500 mg, ejemplo 49) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,31-7,41 (m, 5H), 7,21 (s. a., 2H), 4,88-5,00 (m, 2H), 3,40-3,64 (m, 2H), 2,41-2,46 (m, 2H), 2,30-2,36 (m, 2H), 1,56-1,66 (m, 2H), 0,89 (t, J = 7,4 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 481.
La separación del compuesto del ejemplo 49 por HPLC quiral proporcionó el ejemplo 49-A (elución más rápida, 105 mg) y el ejemplo 49-B (elución más lenta, 106,1 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak IC-3).
Ejemplo 49-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,40 (m, 2H), 7,27-7,30 (m, 5H), 4,95 (s, 2H), 3,44-3,55 (m, 2H), 2,42-2,45 (m, 2H), 2,28-2,32 (m, 2H), 1,55-1,69 (m, 2H), 0,87-0,910,87 (t, J = 7,8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 481
Ejemplo 49-B: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,46 (s, 2H), 7,26-7,32 (m, 5H), 4,95 (s, 2H), 3,48-3,53 (m, 2H), 2,42-2,45 (m, 2H), 2,28-2,31 (m, 2H), 1,55-1,69 (m, 2H), 0,87-0,90 (t, J = 7,8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 481
Ejemplo 50
4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoato de etilo
Se preparó el compuesto del título de forma análoga al ejemplo 46 usando 4-cloro-4-oxo-butanoato de etilo en lugar de anhídrido de ácido valérico. Se obtuvo W-[[6-amino-9-bencil-8-oxo-7H-purin-2-il]-oxo-propil-A4-sulfanilideno]benzamida (30 mg, ejemplo 50) como un sólido blanco.
La separación del compuesto del ejemplo 50 por HPLC quiral proporcionó el ejemplo 50-A (elución más rápida, 11 mg) y el ejemplo 50-B (elución más lenta, 12 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (Dea al 0,05 %)/CO2 en columna ChiralPak OD-3).
Ejemplo 50-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,28-7,35 (m, 5H), 7,22 (s. a., 2H), 4,94 (s, 2H), 3,98-4,03 (m, 2H), 3,48-3,51 (m, 2H), 2,33-2,40 (m, 4H), 1,55-1,69 (m, 2H), 1,14 (t, J = 7,2 Hz, 3H), 0,90 (t, J = 7,6 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 475.
Ejemplo 50-B: RMN de 1H (400 MHz, DMSO-de) 5Dppm: 7,28-7,35 (m, 5H), 7,22 (s. a., 2H), 4,94 (s, 2H), 3,98-4,03 (m, 2H), 3,48-3,51 (m, 2H), 2,33-2,40 (m, 4H), 1,55-1,69 (m, 2H), 1,14 (t, J = 7,2 Hz, 3H), 0,90 (t, J = 7,6 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 475.
Ejemplo 51
W-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]benzamida
Se preparó el compuesto del título de forma análoga al ejemplo 46 usando benzoato de benzoílo en lugar de anhídrido de ácido valérico. Se obtuvo W-[[6-amino-9-bencil-8-oxo-7H-purin-2-il]-oxo-propil-A4-sulfanilideno]benzamida (220 mg, ejemplo 51) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,77 (s a., 1H), 8,08-7,89 (m, 2H), 7,61-7,41 (m, 3H), 7,31-7,07 (m, 7H), 4,88 (d, J = 3,8 Hz, 2H), 3,72-3,56 (m, 2H), 1,84-1,61 (m, 2H), 0,97 (t, J = 7,8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 451.
La separación del compuesto del ejemplo 51 por HPLC quiral proporcionó el ejemplo 51-A (elución más rápida, 50 mg) y el ejemplo 51-B (elución más lenta, 50,5 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak OD-3S).
Ejemplo 51-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,77 (s. a., 1H), 7,89-8,08 (m, 2H), 7,41-7,61 (m, 3H), 7.07- 7,31 (m, 7H), 4,88 (d, J = 3,8 Hz, 2H), 3,56-3,72 (m, 2H), 1,61-1,84 (m, 2H), 0,97 (t, J = 7,8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 451.
Ejemplo 51-B: RMN de 1H (400 MHz, DMSO-de) ó ppm: 10,78 (s. a., 1H), 7,94-8,05 (m, 2H), 7,42-7,62 (m, 3H), 7.07- 7,31 (m, 7H), 4,88 (d, J = 3,8 Hz, 2H), 3,60-3,73 (m, 2H), 1,61-1,90 (m, 2H), 0,97 (t, J = 7,8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 451.
Ejemplo 52
9-bencil-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de N-bencil-6-cloro-5-nitro-2-(propiltio)pirimidin-4-amina
Se preparó compuesto 52a de forma análoga al ejemplo 15, etapa 1 usando bencilamina en lugar de (2-clorofenil)met¡lam¡na. Se obtuvo W-bencil-6-cloro-5-nitro-2-(propiltio)pirimidin-4-amina (35 g, compuesto 52a) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+j: 339.
Etapa 2: Preparación de N4-bencil-6-cloro-2-propilsulfanil-pirimidina-4,5-diamina
52 b
Se preparó compuesto 52b de forma análoga al ejemplo 15, etapa 2 usando W-bencil-6-cloro-5-nitro-2-(propiltio)pirimidin-4-amina (compuesto 52a) en lugar de 6-cloro-W-[(2-clorofenil)metil]-5-nitro-2-propilsulfanilpirimidin-4-amina (compuesto 15a). Se obtuvo W4-bencil-6-cloro-2-propilsulfanil-pirimidina-4,5-diamina (28,0 g, compuesto 52b) como un sólido marrón. MS obsd. (ESI+) [(M+H)+]: 309.
Etapa 3: Preparación de 9 bencil-6-cloro-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 52c de forma análoga al ejemplo 15, etapa 3 usando W4-bencil-6-cloro-2-prop¡lsulfan¡lp¡r¡mid¡na-4,5-d¡am¡na (compuesto 52b) en lugar de 6-cloro-W-4-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 15b). Se obtuvo 9-benc¡l-6-cloro-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (24,0 g, compuesto 52c) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 335.
Etapa 4: Preparación de 9 bencil-6-(etilamino)-2-propilsulfanil-7H-purin-8-ona
A una soluc¡ón de 9-benc¡l-6-cloro-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (2,3 g, 6,9 mmol, compuesto 52c) en n-BuOH (8 ml) se le añad¡ó EtNH2 HCl (1,7 g, 20,6 mmol) y W-et¡l-W-¡soprop¡lpropan-2-am¡na (5,4 g, 41,4 mmol). El rec¡p¡ente de reacc¡ón se selló y se calentó en m¡croondas a 130 °C durante 2 h. El d¡solvente se ret¡ró a vacío. El res¡duo se suspend¡ó en EtOAc (20 ml), se lavó con agua (15 ml) dos veces y salmuera (30 ml). La capa orgán¡ca separada se secó sobre sulfato de sod¡o anh¡dro y se concentró a vacío para dar 9-benc¡l-6-(et¡lam¡no)-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (1,2 g, compuesto 52d) como un sól¡do amar¡llo claro. Ms obsd. (ESI+) [(M+H)+]: 344
Etapa 5: Preparación de 9-bencil-6-(etilamino)-2-propilsulfinil-7H-purin-8-ona
A una soluc¡ón de 9-benc¡l-6-(et¡lam¡no)-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (682 mg, 2,0 mmol, compuesto 51d) en THF (8 ml) se le añad¡ó m-CPBA (415 mg, 2,4 mmol) en THF (2 ml) a 0 °C bajo atmósfera de N2. Después de la ad¡c¡ón, se ag¡tó la mezcla a esta temperatura durante 30 m¡n hasta que se formó una soluc¡ón transparente. La reacc¡ón se ¡nact¡vó med¡ante la ad¡c¡ón de Na2SO3 saturado (5 ml), se extrajo con /-PrOH/DCM (20 ml, v/v = 1/3) dos veces. La capa orgán¡ca comb¡nada se secó sobre Na2SO4 y se concentró para dar 9-benc¡l-6-(et¡lam¡no)-2-prop¡lsulf¡n¡lo-7H-pur¡n-8-ona (580 mg, compuesto 52e) como un sól¡do amar¡llo claro. MS obsd. (ESI+) [(M+H)+]: 360.
Etapa 6: Preparación de 9-bencil-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparo el compuesto del titulo de forma analoga al ejemplo 15, etapa 7 usando 9-bencil-6-(etilamino)-2-prop¡lsulf¡nil-7H-pur¡n-8-ona (280 mg, compuesto 52e) en lugar de 6-am¡no-9-[(2-clorofen¡l)metil]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 9-benc¡l-6-(et¡lam¡no)-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (94 mg, ejemplo 52) como un sól¡do blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,65 (s, 1H), 7,50-7. 22 (m, 5H), 7,14-6,97 (m, 1H), 4,97 (s, 2H), 4,07 (s, 1H), 3,58-3,44 (m, 2H), 3,36-3,28 (m, 2H), 1,78-1,54 (m, 2H), 1,21 (t, J = 7,2 Hz, 3H), 0,93 (t, J = 7,2 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 375.
Ejemplo 53
6-(Etilamino)-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-(etilamino)-9-[(6-metil-3-piridil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 53a de forma analoga al ejemplo 52, etapa 4 usando 6-cloro-9-[(6-met¡l-3-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 34e) en lugar de 9-benc¡l-6-cloro-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 52c). Se obtuvo 6-(et¡lam¡no)-9-[(6-met¡l-3-p¡r¡d¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (810 mg, compuesto 53a) como un sól¡do amar¡llo claro. MS obsd. (ESI+) [(M+H)+]: 359.
Etapa 2: Preparación de 6-(etilamino)-9-[(6-metil-3-piridil)metil]-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 53b de forma análoga al ejemplo 52, etapa 5 usando 6-cloro-9-[(6-metil-3-p¡r¡d¡l)met¡l]-2-propilsulfan¡l-7H-purin-8-ona (compuesto 53a) en lugar de 9-bencil-6-cloro-2-prop¡lsulfan¡l-7H-purin-8-ona (compuesto 52d). Se obtuvo 6-(et¡lam¡no)-9-[(6-metil-3-p¡r¡d¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (380 mg, compuesto 53b) como un sólido amarillo claro. mS obsd. (ESI+) [(M+H)+]: 375.
Etapa 3: Preparación de 6-(etilamino)-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 6-(etilamino)-9-[(6-metil-3-pir¡d¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (280 mg, compuesto 53b) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfin¡l-7H-pur¡n-8-ona (compuesto 15f). Se obtuvo 6-(et¡lam¡no)-9-[(6-met¡l-3-pir¡d¡l)met¡l]-2-(propilsulfonim¡do¡l)-7H-pur¡n-8-ona (78 mg, ejemplo 53) como un sólido amarillo claro. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,56 (s, 1H), 8,47 (s, 1H), 7,62-7,64 (dd, J = 8,0, 2,4 Hz, 1H), 7,20-7,22 (d, J = 8,0 Hz, 1H), 7,00 (m, 1H), 4,95 (s, 2H), 4,21 (s, 1H), 3,50-3,45 (m, 2H), 3,39-3,35 (m, 2H), 2,42 (s, 3H), 1,61-1,71 (m, 2H), 1,18-1,21 (t, J = 7,2 Hz, 3H), 0,95-0,95 (t, J = 7,2 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 390.
Ejemplo 54
9-[(4-clorofenil)metil]-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-cloro-N-[(4-clorofenil)metil]-5-nitro-2-propilsulfanil-pirimidin-4-amina
Se preparó el compuesto 54a de forma análoga al ejemplo 15, etapa 1 usando (4-clorofenil)met¡lam¡na en lugar de (2-clorofenil)met¡lam¡na. Se obtuvo 6-cloro-W-[(4-clorofen¡l)metil]-5-n¡tro-2-prop¡lsulfan¡l-p¡r¡m¡d¡n-4-am¡na (11 g, compuesto 54a) como un sól¡do amar¡llo. MS obsd. (ESI+) [(M+H)+]: 373.
Etapa 2: Preparación de 6-cloro-N4-[(4-clorofenil)metil]-2-propilsulfanil-pirimidina-4,5-diamina
Se preparó compuesto 54b de forma análoga al ejemplo 15, etapa 2 usando W-4-clorobenc¡l-6-cloro-5-n¡tro-2-(prop¡lt¡o)p¡r¡m¡d¡n-4-am¡na (compuesto 54a) en lugar de 6-cloro-W-[(2-clorofen¡l)met¡l]-5-n¡tro-2-prop¡lsulfan¡lp¡r¡m¡d¡n-4-am¡na (compuesto 15a). Se obtuvo 6-cloro-W4-[(4-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (4,8 g, compuesto 54b) como un sól¡do blanco. MS obsd. (ESl+) [(M+H)+]: 343.
Etapa 3: Preparación de 6-cloro-9-[(4-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 54c de forma análoga al ejemplo 15, etapa 3 usando 6-cloro-W4-[(4-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-p¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 54b) en lugar de 6-cloro-W-4-[(2-clorofen¡l)met¡l]-2-prop¡lsulfan¡lp¡r¡m¡d¡na-4,5-d¡am¡na (compuesto 15b). Se obtuvo 6-cloro-9-[(4-clorofen¡l)met¡l]-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (4,5 g, compuesto 54c) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 369.
Etapa 4: Preparación de 9-[(4-clorofenil)metil]-6-(etilamino)-2-propilsulfanil-7H-purin-8-ona
Se preparó compuesto 54d de forma análoga al ejemplo 52, etapa 4 usando 6-cloro-9-[(4-clorofenil)met¡l]-2-propilsulfan¡l-7H-purin-8-ona (compuesto 54c) en lugar de 9-bencil-6-cloro-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 52c). Se obtuvo 9-[(4-clorofen¡l)met¡l]-6-(et¡lam¡no)-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (400 mg, compuesto 54d) como un sólido amarillo claro. MS obsd. (ESI+) [(M+H)+]: 378.
Etapa 5: Preparación de 9-[(4-clorofenil)metil]-6-(etilamino)-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 54e de forma análoga al ejemplo 52, etapa 5 usando 9-[(4-clorofen¡l)met¡l]-6-(et¡lam¡no)-2-propilsulfanil-7H-purin-8-ona (compuesto 54d) en lugar de 9-benc¡l-6-cloro-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 52d). Se obtuvo 9-[(4-clorofen¡l)met¡l]-6-(et¡lam¡no)-2-prop¡lsulf¡n¡l-7H-pur¡n-8-ona (300 mg, compuesto 54e) como un sólido amarillo claro. MS obsd. (ESI+) [(M+H)+]: 394.
Etapa 6: Preparación de 9-[(4-clorofenil)metil]-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 9-[(4-clorofenil)metil]-6-(etilamino^-propilsulfinil^H-purin^-ona (compuesto 54e) en lugar de 6-am¡no-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 15e). Se obtuvo 9-[(4-clorofen¡l)met¡l]-6-(et¡lam¡no)-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (86 mg, ejemplo 54) como un sólido amarillo claro. RMN de 1H (400 MHz, DMSO-cfó,) ó^cpm: 10,50 (s, 1H), 7,31 -7,42 (m, 3H), 6,97 (t, J = 5,4 Hz, 1H), 4,96 (s, 2H), 4,18 (s, 1H), 3,42-3,59 (m, 2H), 3,30-3,39 (m, 2H), 1,54-1,76 (m, 2H), 1,15-1,28 (m, 3H), 0,86-0,99 (m, 3H). MS obsd. (ESI+) [(M+H)+]: 409.
Ejemplo 55
9-bencil-6-(propilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 9 bencil-6-(propilamino)-2-propilsulfanil-7H-purin-8-ona
Se preparó el compuesto 55a de forma análoga al ejemplo 52, etapa 4 usando propan-1-amina en lugar de EtNhteHCl. Se obtuvo 9-bencil-6-(propilamino)-2-propilsulfanil-7H-purin-8-ona (820 mg, compuesto 55a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 358.
Etapa 2: Preparación de 9-bencil-6-(propilamino)-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 55b de forma análoga al ejemplo 52, etapa 5 usando 9-bencil-6-(propilamino)-2-propilsulfanil-7H-purin-8-ona (compuesto 55a) en lugar de 9-bencil-6-(etilamino)-2-propilsulfanil-7H-purin-8-ona (compuesto 52d). Se obtuvo 9-bencil-6-(propilamino)-2-propilsulfanil-7H-purin-8-ona (400 mg, compuesto 55b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 374.
Etapa 3: Preparación de 9-bencil-6-(propilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 9-bencil-6-(propilam¡no)-2-propilsulf¡n¡l-7H-pur¡n-8-ona (compuesto 55b) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 9-bencil-6-(prop¡lam¡no)-2-(prop¡lsulfon¡m¡do¡l)-7H-purin-8-ona (113,5 mg, ejemplo 55) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,67 (s, 1H), 7,45-7,19 (m, 5H), 7,16-7,01 (m, 1H), 4,97 (s, 2H), 4,17 (s, 1H), 3,52-3,40 (m, 2H), 3,36- 3,28 (m, 2H), 1,81-1,44 (m, 4H), 1,06-0,79 (m, 6H). MS obs. (ESI+) [(M+H)+]: 389.
Ejemplo 56
9-bencil-6-(isopropilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 9 bencil-6-(isopropilamino)-2-propilsulfanil-7H-purin-8-ona
Se preparó el compuesto 56a de forma análoga al ejemplo 52, etapa 4 usando propan-2-amina en lugar de EtNH2 HCl. Se obtuvo 9-bencil-6-(¡soprop¡lam¡no)-2-prop¡lsulfanil-7H-pur¡n-8-ona (1,5 g, compuesto 56a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 358.
Etapa 2: Preparación de 9 bencil-6-(isopropilamino)-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 56b de forma análoga al ejemplo 52, etapa 5 usando 9-bencil-6-(¡sopropilam¡no)-2-propilsulfanil-7H-pur¡n-8-ona (compuesto 56a) en lugar de 9-bencil-6-(et¡lam¡no)-2-propilsulfan¡l-7H-pur¡n-8-ona (compuesto 52d). Se obtuvo 9-bencil-6-(¡soprop¡lam¡no)-2-prop¡lsulf¡n¡l-7H-purin-8-ona (1,35 g, compuesto 56b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+j: 373.
Etapa 3. Preparación de 9-bencil-6-(isopropilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 9-bencil-6-(isoprop¡lam¡no)-2-propilsulfin¡l-7H-pur¡n-8-ona (compuesto 56b) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 9-bencil-6-(¡soprop¡lam¡no)-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (100 mg, ejemplo 56) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,45 (s. a., 1H), 7,47-7,21 (m, 5H), 6,93-6,80 (m, 1H), 4,95 (s, 2H), 4,26-4,17 (m, 1H), 4,14 (s, 1H), 3,38-3,37 (m, 2H), 1,65-1,55 (m, 2H), 1,23 (dd, J = 6,4, 2,1 Hz, 6H), 0,92 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 389.
Ejemplo 57
9-bencil-6-(ciclopropilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 9 bencil-6-(ciclopropilamino)-2-propilsulfanil-7H-purin-8-ona
Se preparó el compuesto 57a de forma análoga al ejemplo 52, etapa 4 usando ciclopropanamina en lugar de EtNhteHCl. Se obtuvo 9-bencil-6-(ciclopropilamino)-2-propilsulfanil-7H-purin-8-ona (1,35 g, compuesto 57a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 356.
Etapa 2: Preparación de 9 bencil-6-(ciclopropilamino)-2-propilsulfinil-7H-purin-8-ona
Se preparó compuesto 57b de forma análoga al ejemplo 52, etapa 5 usando 9-bencil-6-(ciclopropilamino)-2-propilsulfanil-7H-purin-8-ona en lugar de 9-bencil-6-(etilamino)-2-propilsulfanil-7H-purin-8-ona (52d). Se obtuvo 9-bencil-6-(ciclopropilamino)-2-propilsulfinil-7H-purin-8-ona (1,35 g, compuesto 57b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 372
Etapa 3: Preparación de 9-bencil-6-(ciclopropilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando 9-bencil-6-(c¡clopropilam¡no)-2-propilsulfin¡l-7H-pur¡n-8-ona (compuesto 57b) en lugar de 6-amino-9-[(2-clorofen¡l)met¡l]-2-prop¡lsulf¡n¡l-7H-purin-8-ona (compuesto 15f). Se obtuvo 9-bencil-6-(c¡cloprop¡lam¡no)-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (30,5 mg, ejemplo 57) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 7,40-7,57 (m, 1H), 7,28-7,34 (m, 5H), 4,97 (s, 2H), 4,12 (s, 1H), 3,38-3,40 (m, 2H), 1,65-1,70 (m, 2H), 0,94 (t, J = 8,0 Hz, 3H), 0,80-0,81 (m, 2H), 0,52-0,59 (m, 2H). MS obsd. (ESI+) [(M+H)+]: 387.
Ejemplo 58
W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida
Etapa 1: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil)-7H-purin-6-il]-2-propil-pentanamida
A un vial de microondas de 50 ml se le añadió 6-amino-9-[(4-clorofenil)metil]-2-propilsulfanil-7H-8-ona (2,2 g, 6,29 mmol, compuesto 9c), anhídrido 2-propilpentanoico (17 g 62,9 mmol) y ácido sulfúrico (308 mg, 3,14 mmol). Se selló el vial y se calentó en el microondas a 70 °C durante 10 min. A continuación, la mezcla de reacción se diluyó con H2O (50 ml) y se neutralizó con solución de bicarbonato de sodio saturado. La mezcla se extrajo con DCM. La capa orgánica se secó sobre Na2SO4 y se concentró a vacío. El material en bruto se purificó por cromatografía ultrarrápida (gel de sílice, 40 g, DCM al 100 %) para dar W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil-7H-purin-6- il]-2-propil-pentanamida (2,9 g, compuesto 58a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 476.
Etapa 2: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil)-7H-purin-6-il]-2-propil-pentanamida
Se preparó compuesto 58b de forma análoga al ejemplo 15, etapa 6 usando W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil-7H-purin-6-il]-2-propil-pentamida (2,9 g, compuesto 58a) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 15e). Se obtuvo W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil-7H-purin-6-il]-2-propil-pentanamida (2,8 g, compuesto 58b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 492.
Etapa 3: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propilpentanamida
Se preparó el compuesto del título de forma análoga al ejemplo 15, etapa 7 usando N-9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil-7H-purin-6-il]-2-propil-pentanamida (compuesto 58b) en lugar de 6-amino-9-[(2-clorofenil)metil]-2-propilsulfinil-7H-purin-8-ona (compuesto 15f). Se obtuvo N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida (21 mg, ejemplo 58) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfe) 5 ppm. 11,15 (s, 1H), 10,45 (s. a., 1H), 7,39 (s, 4H), 5,04 (s, 2H), 4,27 (s, 1H), 3,37-3,44 (m, 2H), 2,68-2,73 (m, 1H), 1,56-1,65 (m, 4H), 1,24-1,42 (m, 6H), 0,90 (t, J = 8 Hz, 3H), 0,88 (t, J = 8 Hz, 6H). MS obsd. (ESI+) [(M+H)+]: 507. Ejemplo 59
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]acetamida
Etapa 1: Preparación de N-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil)-7H-purin-6-il]acetamida
Se preparó compuesto 59a de forma análoga al ejemplo 58, etapa 1 usando acetato de acetilo en lugar de anhídrido 2-propilpentanoico. Se obtuvo N-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil-7H-purin-6-il]acetamida (300 mg, compuesto 59 bis) como un sólido blanco. Ms obsd. (ESI+) [(M+H)+]: 392.
Etapa 2: Preparación de N-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil)-7H-purin-6-il]acetamida
Se preparó compuesto 59b de forma análoga al ejemplo 58, etapa 2 usando W-[9-[(4-clorofenil)met¡l]-8-oxo-2-prop¡lsulfan¡l-7H-purin-6-¡l]acetam¡da (300 mg, 0,76 mmol, compuesto 59a) en lugar de W-[9-[(4-clorofenil)metil] -8-oxo-2-prop¡lsulfanil-7H-pur¡n-6-¡l]-2-prop¡l-pentanam¡da (compuesto 58a). Se obtuvo W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulf¡n¡l-7H-purin-6-¡l]acetam¡da (260 mg, compuesto 59b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 408.
Etapa 3: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]acetamida
Se preparó compuesto 59 de forma análoga al ejemplo 50, etapa 3 usando W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulf¡n¡l-7H-purin-6-¡l]acetam¡da (250 mg, 0,61 mmol, compuesto 59b) en lugar de W-[9-[(4-clorofenil)metil] -8-oxo-2-propilsulf¡n¡l-7H-pur¡n-6-¡l]-2-propil-pentanam¡da (compuesto 58b). Se obtuvo W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfon¡m¡do¡l)-7H-pur¡n-6-il]acetam¡da (47 mg, ejemplo 59) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 11,04 (s. a., 1H), 10,34 (s, 1H), 7,40 (s, 4H), 5,03 (s, 2H), 4,29 (s, 1H), 3,37-3,44 (m, 2H), 2,16 (s, 3H), 1,60-1,66 (m, 2H), 0,91 (t, J = 8 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 423.
Ejemplo 60
N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]pentanamida
Etapa 1: Preparación de N-[9-bencil-8-oxo-2-propilsulfanil-7H-purin-6-il)pentanamida
Se preparó compuesto 60a de forma análoga al ejemplo 58, etapa 1 usando pentanoato de pentanoilo (TCI, número de catálogo: V0006-25ML) y 6-amino-9-bencil-2-propilsulfanil-7H-purin-8-ona (ejemplo 50) en lugar de anhídrido 2-propilpentanoico y 6-amino-9-[(4-clorofenil)metil]-2-propilsulfanil-7H-purin-8-ona (compuesto 9c). Se obtuvo N-(9-bencil-8-oxo-2-propilsulfanil-7H-purin-6-il)pentanamida (320 mg, compuesto 60a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 400.
Etapa 2: Preparación de N-[9-bencil-8-oxo-2-propilsulfinil-7H-purin-6-il)pentanamida
Se preparó compuesto 60b de forma análoga al ejemplo 58, etapa 2 usando N-(9-bencil-8-oxo-2-propilsulfanil-7H-purin-6-il)pentanamida (310 mg, 0,77 mmol, compuesto 60a) en lugar de N-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil-7H-purin-6-il]-2-propil-pentanamida (compuesto 58a). Se obtuvo N-(9-bencil-8-oxo-2-propilsulfinil-7H-purin-6-il)pentanamida (276 mg, compuesto 60b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 416.
Etapa 3: Preparación de N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]pentanamida
Se preparó compuesto 60 de forma análoga al ejemplo 58, etapa 3 usando N-(9-bencil-8-oxo-2-propilsulfinil-7H-purin-6-il)pentanamida (200 mg, 0,48 mmol, compuesto 60b) en lugar de N-[9-[(4-clorofenil)metil] -8-oxo-2-propilsulfinil-7H-purin-6-il]-2-propil-pentanamida (compuesto 58b). Se obtuvo N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]pentanamida (28 mg, ejemplo 60) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,98 (s, 1H), 7,27-7,39 (m, 5H), 5,04 (s, 2H), 4,27 (s. a., 1H), 3,24-3,44 (m, 2H), 2,46 (t, J = 8,0 Hz, 2H), 1,58-1,71 (m, 4H), 1,32-1,37 (m, 2H), 0,90-0,93 (m, 6H). MS obsd. (ESI+) [(M+H)+]: 431.
Ejemplo 61
W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-etil-butanamida
Etapa 1: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil)-7H-purin-6-il]-2-etil-butanamida
Se preparó compuesto 61a de forma análoga al ejemplo 58, etapa 1 usando 2-etilbutanoato de 2-etilbutanoílo en lugar de anhídrido 2-propilpentanoico. Se obtuvo W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil-7H-purin-6-il]-2-etilbutanamida (150 mg, compuesto 61a) como un sólido blanco. MS obsd. (ESl+) [(M+H)+]: 448.
Etapa 2: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil)-7H-purin-6-il]-2-etil-butanamida
Se preparó compuesto 61b de forma análoga al ejemplo 58, etapa 2 usando N-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil-7H-purin-6-il]-2-etil-butanamida (136 mg, 0,30 mmol, compuesto 61a) en lugar de N-[9-[(4-clorofenil)metil] -8-oxo-2-propilsulfanil-7H-purin-6-il]-2-propil-pentanamida (compuesto 58a). Se obtuvo N-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil-7H-purin-6-il]-2-etil-butanamida (126 mg, compuesto 61b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 464.
Etapa 3: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-etil-
butanamida
Se preparó compuesto 61 de forma análoga al ejemplo 58, etapa 3 usando W-[9-[(4-clorofenil)met¡l]-8-oxo-2-prop¡lsulf¡n¡l-7H-purin-6-¡l]-2-et¡l-butanam¡da (200 mg, 0,43 mmol, compuesto 61b) en lugar de W-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulf¡n¡lo-7H-pur¡n-6-¡l]-2-prop¡l-pentanam¡da (compuesto 58b). Se obtuvo N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-6-¡l]-2-et¡l-butanam¡da (39 mg. ejemplo 61) como un sól¡do blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 11,15 (s. a., 1H), 10,50 (s. a., 1H), 7,36-7,41 (m, 4H), 5,05 (s, 2H), 4,22-4,36 (m, 1H), 3,29-3,40 (m, 2H), 2,67 (d, J = 1,8 Hz, 1H), 1,43-1,69 (m, 4H), 1,15-1,38 (m, 2H), 0,86-0,94 (m, 9H). MS obsd. (ESI+) [(M+H)+]: 479.
Ejemplo 62
W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-3-metil-butanamida
Etapa 1: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil)-7H-purin-6-il]-3-metil-butanamida
Se preparó compuesto 62a de forma análoga al ejemplo 58, etapa 1 usando 2-met¡lbutanoato de 2-met¡lbutanoílo (J&K, número de catálogo: j20-038361-25g) en lugar de anhídr¡do 2-prop¡lpentano¡co. Se obtuvo N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulf¡n¡l-7H-pur¡n-6-¡l]-2-met¡l-butanam¡da (390 mg, compuesto 62a) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 434.
Etapa 2: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil-7H-purin-6-il]-3-metil-butanamida
Se preparó compuesto 62b de forma análoga al ejemplo 58, etapa 2 usando W-[9-[(4-clorofenil)met¡l]-8-oxo-2-prop¡lsulfan¡l-7H-purin-6-¡l]-2-met¡l-butanam¡da (390 mg, 0,90 mmol, compuesto 62a) en lugar de W-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulfanil-7H-pur¡n-6-¡l]-2-prop¡l-pentanam¡da (compuesto 58a). Se obtuvo N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulfin¡l-7H-pur¡n-6-¡l]-2- metil-butanamida (390 mg, compuesto 62b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 450.
Etapa 3: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-3-metilbutanamida
Se preparó el ejemplo 62 de forma análoga al ejemplo 58, etapa 3 usando N-[9-[(4-clorofenil)met¡l]-8-oxo-2-prop¡lsulf¡nil-7H-pur¡n-6-¡l]-2-met¡l-butanam¡da (390 mg, 0,87 mmol, compuesto 62b) en lugar de N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulf¡n¡l-7H-purin-6-¡l]-2-prop¡l-pentanam¡da (compuesto 58b). Se obtuvo N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-(prop¡lsulfon¡m¡do¡l)-7H-purin-6-¡l]-2-met¡l-butanam¡da (89 mg, ejemplo 62) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfe) ólüppm: 11,07 (s. a., 1H), 10,58 (s. a., 1H), 7,36-7,43 (m, 4H), 5,05 (s, 2H), 4,29 (s, 1H), 3,30-3,37 (m, 2H), 2,36 (d, J = 7,0 Hz, 2H), 2,05-2,19 (m, 1H), 1,63 (sxt, J = 7,6 Hz, 2H), 0,89-0,99 (m, 9H). MS obsd. (ESI+) [(M+H)+]: 465.
Ejemplo 63
W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-metil-pentanamida
Etapa 1: Preparación de 2-metilpentanoato de 2-metilpentanoilo
En un matraz de tres bocas de 250 ml, se disolvieron ácido 2-metilpentanoico (116 g, 99,9 mmol), dicarbonato de diferc-butilo (10,9 g, 49,9 mmol) y cloruro de magnesio (951 mg, 9,99 mmol) en THF (100 ml) para dar una solución incolora. La mezcla de reacción se agitó a 25 °C durante 20 h. La mezcla de reacción se vertió en H2O (100 ml) y se extrajo con EtOAc (50 ml) tres veces. La capa orgánica se secó sobre MgSO4 y se concentró a vacío para dar 2-metilpentanoil-2-metilpentanoato (19 g, compuesto 63a) como un aceite amarillo claro que se usó en la siguiente etapa sin purificación adicional.
Etapa 2: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil)-7H-purin-6-il]-2-metil-pentanamida
Se preparó el compuesto 63b de forma análoga al ejemplo 58, etapa 1 usando 2-metilpentanoato de 2-metilpentanoilo (compuesto 63b) en lugar de anhídrido 2-propilpentanoico. Se obtuvo W-[9-[(4-clorofenil)met¡l]-8-oxo-2-propilsulfanil-7H-purin-6-il]-2-metil-pentanamida (330 mg, compuesto 63b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 448.
Etapa 3: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil)-7H-purin-6-il]-2-metil-pentanamida
Se preparó compuesto 63c de forma análoga al ejemplo 58, etapa 2 usando W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil-7H-purin-6-il]-2-metil-pentanamida (compuesto 63b) en lugar de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil-7H-purin-6-il]-2-propil-pentanamida (compuesto 58a). W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil-7H-purin-6-il]-2-metil-pentanamida (250 mg, compuesto 63c) como un sólido blanco. MS obsd. (ESI+) [(M+h )+]: 464. Etapa 4: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-metilpentanamida
Se preparó el ejemplo 63 de forma análoga al ejemplo 58, etapa 3 usando N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulf¡n¡l-7H-pur¡n-6-¡l]-2-met¡l-pentanam¡da (250 mg, 0,87 mmol, compuesto 63c) en lugar de N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulf¡n¡l-7H-pur¡n-6-¡l]-2-prop¡l-pentanam¡da (compuesto 58b). N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-6-¡l]-2-met¡l-pentanam¡da (122 mg. ejemplo 63) como un sól¡do blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 11,1 (s, 1H), 10,6 (s, 1H), 7,40 (m, 4H), 5,05 (s, 2H), 4,30 (s, 1H), 3,32-3,42 (m, 2H), 2,68-2,82 (m, 1H), 1,54-1,74 (m, 2H), 1,23-1,43 (m, 4H), 1,13 (d, J = 8,0 Hz, 3H), 0,91 (t, J = 7,2 Hz, 6H). MS obsd. (ESI+) [(M+H)+]: 479.
Ejemplo 64
W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2,2-dimetil-propanamida
Etapa 1: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfanil)-7H-purin-6-il]-2,2-dimetilpropanamida
Se preparó el compuesto 64a de forma análoga al ejemplo 58, etapa 1 usando 2,2-d¡met¡lpropanoato de 2,2-d¡met¡lpropano¡lo (TCI, número de catálogo: P1414-25ML) en lugar de anhídr¡do 2-prop¡lpentano¡co. Se obtuvo N-[9-[(4-clorofen¡l)met¡l]-8-oxo-2-prop¡lsulf¡n¡l-7H-pur¡n-6-¡l]-2,2-d¡met¡l-propanam¡da (400 mg, compuesto 64a) como un sól¡do blanco. MS obsd. (ESI+) [(M+H)+]: 434.
Etapa 2: Preparación de N-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfinil)-7H-purin-6-il]-2,2-metil-butanamida
Se preparó compuesto 64b de forma análoga al ejemplo 58, etapa 2 usando W-[9-[(4-clorofenil)met¡l]-8-oxo-2-prop¡lsulfan¡l-7H-purin-6-¡l]-2,2-d¡met¡l-propanam¡da (compuesto 64a) en lugar de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulfan¡l-7H-pur¡n-6-il]-2-prop¡l-pentanam¡da (compuesto 58a). Se obtuvo W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulf¡n¡l-7H-pur¡n-6-¡l]-2,2-d¡met¡l-propanamida (250 mg, compuesto 64b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 450.
Etapa 3: Preparación de W-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2,2-dimetilpropanamida (64)
Se preparó el ejemplo 64 de forma análoga al ejemplo 58, etapa 3 usando W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulf¡n¡l-7H-pur¡n-6-¡l]-2,2-d¡met¡l-propanamida (compuesto 64b) en lugar de W-[9-[(4-clorofenil)metil]-8-oxo-2-propilsulf¡n¡l-7H-pur¡n-6-¡l]-2-propil-pentanam¡da (compuesto 58b). Se obtuvo W-[9-[(4-clorofenil)metil]-8-oxo-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-6-il]-2,2-d¡met¡l-propanam¡da (33,5 mg, ejemplo 64) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,96 (s, 1H), 10,60 (s, 1H), 7,41 (m, 4H), 5,06 (s, 2H), 4,31 (s, 1H), 3,35-3,47 (m, 2H), 1,57-1,65 (m, 2H), 1,26 (m, 9H, 0,91 (t, J = 8,0 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 465.
Ejemplo 65
N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida
Etapa 1: Preparación de N-[9-bencil-8-oxo-2-propilsulfanil-7H-purin-6-il)-2-propil-pentanamida (65a)
Se preparó compuesto 65a de forma análoga al ejemplo 58, etapa 1 usando 6-amino-9-benc¡l-2-prop¡lsulfanil-7H-purin-8-ona (compuesto 4a) en lugar de 6-amino-9-bencil-2-prop¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 9c). Se obtuvo W-(9-benc¡l-8-oxo-2-prop¡lsulfan¡l-7H-purin-6-¡l)-2-prop¡l-pentanam¡da (500 mg, compuesto 65a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+j: 442.
Etapa 2: Preparación de N-[9-bencil-8-oxo-2-propilsulfinil-7H-purin-6-il)-2-propil-pentanamida
Se preparó compuesto 65b de forma análoga al ejemplo 58, etapa 2 usando W-(9-bencil-8-oxo-2-propilsulfan¡l-7H-purin-6-il)-2-prop¡l-pentanam¡da (compuesto 65a) en lugar de W-[9-[(4-clorofenil)metil]-8-oxo-2-prop¡lsulfan¡l-7H-pur¡n-6-¡l]-2-propil-pentanamida (compuesto 50a). Se obtuvo W-(9-bencil-8-oxo-2-prop¡lsulf¡n¡l-7H-pur¡n-6-il)-2-prop¡lpentanamida (400 mg, compuesto 65b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 458.
Etapa 3: Preparación de N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida
Se preparó el ejemplo 65 de forma análoga al ejemplo 58, etapa 3 usando W-(9-bencil-8-oxo-2-prop¡lsulfin¡l-7H-purin-6-¡l)-2-prop¡l-pentanam¡da (compuesto 65b) en lugar de W-[9-[(4-clorofenil)metil] -8-oxo-2-prop¡lsulfin¡l-7H-pur¡n-6-¡l]-2-propil-pentanamida (compuesto 58b). Se obtuvo W-[9-benc¡l-8-oxo-2-(prop¡lsulfonim¡do¡l)-7H-pur¡n-6-¡l]-2-propil-pentanamida (25 mg, ejemplo 65) como un sólido blanco. RMN de 1H (400 MHz, DMSO-cfó) 5 ppm: 11,15 (s. a., 1H), 10,45 (s. a., 1H), 7,27-7,39 (m, 5H), 5,06 (s, 2H), 4,29 (s, 1H), 3,31-3,37 (m, 2H), 2,61-2,87 (m, 1H), 1,50 1,75 (m, 4H), 1,23-1,43 (m, 6H), 0,81-0,97 (m, 9H). MS obsd. (ESI+) [(M+H)+]: 473.
Ejemplo 66
Acetato de [6-amino-9-bencil-2-(metilsulfonimidoil)-8-oxo-purin-7-il]metilo
A una solución de 6-amino-9-benc¡l-2-(met¡lsulfonim¡do¡l)-7H -purin-8-ona (300 mg, 0,94 mmol, ejemplo 1) en DMF (5 ml) se le añadió NaH (45 mg, 1,13 mmol). Se agitó la reacción durante 10 min, a continuación se le añadió acetato de clorometilo (123 mg, 1,13 mmol). Se agitó la mezcla de reacción a TA durante 0,5 h, a continuación se inactivó con NH4Cl sat. y se concentró a vacío. El residuo se purificó por HPLC preparativa para dar acetato de [6-amino-9-benc¡l-2-(met¡lsulfon¡m¡do¡l)-8-oxo-pur¡n-7-¡l]met¡lo (8,3 mg, ejemplo 66) como un sólido blanco. RMN de 1H (400 MHz, CD3OD) 5 ppm: 7,48-7,35 (m, 2H), 7,33-7,26 (m, 3H), 6,01 (s, 2H), 5,12 (s, 2H), 3,35-3,33 (m, 3H), 2,11 (s, 3H). MS obsd. (ESI+) [(M+H)+]: 391.
Ejemplo 67
Acetato de [6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]metilo
Se preparó el compuesto del título de forma análoga al ejemplo 66 usando 6-am¡no-9-benc¡l-2-(prop¡lsulfon¡m¡do¡l)-7H-purin-8-ona (ejemplo 4) en lugar de 6-am¡no-9-benc¡l-2-(met¡lsulfon¡m¡do¡l)-7H -pur¡n-8-ona (ejemplo 1). Se obtuvo [6-am¡no-9-benc¡l-2-(prop¡lsulfon¡m¡do¡l) pur¡n-8-¡l]W-et¡l-W-met¡l-carbamato (15 mg, ejemplo 67) como un sól¡do blanco. RMN de 1H (400 MHz, CD3OD) 5 ppm: 7,45-7,43 (m, 2H), 7,35-7,28 (m, 3H), 6,01 (s, 2H), 5,12 (s, 2H), 3,55-3,44 (m, 2H), 2,12 (s, 3H), 1,81- 1,74 (m, 2H), 1,02 (t, J = 7,2 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 419.
Ejemplo 68
[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]metil2,2-dimetilpropanoato
Se preparó el compuesto del título de forma análoga al ejemplo 66 usando 6-am¡no-9-benc¡l-2-(prop¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (ejemplo 4) y 2,2-d¡met¡lpropanoato de cloromet¡lo en lugar de 6-am¡no-9-benc¡l-2-(met¡lsulfon¡m¡do¡l)-7H-pur¡n-8-ona (ejemplo 1) y acetato de cloromet¡lo. Se obtuvo 2,2-d¡met¡lpropanoato de [6-am¡no-9-benc¡l-8-oxo-2-(prop¡lsulfon¡m¡do¡l)pur¡n-7-¡l]met¡lo (15,8 mg, ejemplo 68) como un sól¡do blanco. RMN de 1H (400 MHz, CDCb) 5 ppm: 7,48-7,50 (m, 2H), 7,31-7,36 (m, 3H), 6,01 (s, 2H), 5,95 (s, 2H), 5,12 (s, 2H), 3,58-3,44 (m, 2H), 1,85- 1,94 (m, 2H), 1,24 (s, 9H), 1,07 (t, J = 7,12 Hz, 3H). MS obsd. (ESI+) [(M+H)+]:461.
Ejemplo 69
Acetato de 1-[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]etilo
Etapa 1: Preparación de acetato de 1-cloroetilo
A un matraz que contiene una cantidad catalítica recién secada de ZnCl2 (680 mg, 5 mmol) bajo nitrógeno se ñe añadió cloruro de acetilo (3,9 g, 50 mmol) y la mezcla se enfrió de -5 °C a -10 °C. Se le añadió acetaldehído (2,4 g, 55 mmol) gota a gota y la mezcla de reacción resultante se agitó a 22-33 °C durante 1 h. La mezcla se concentró a vacío para dar acetato de 1 -cloroetilo, que se usó en la siguiente etapa sin purificación adicional.
Etapa 2: Preparación de Acetato de 1-[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]etilo
Se preparó el compuesto del título de forma análoga al ejemplo 66 usando 6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona (ejemplo 4) y acetato de 1 -cloroetilo en lugar de 6-amino-9-bencil-2-(metilsulfonimidoil)-7H-purin-8-ona (ejemplo 1) y acetato de clorometilo. Se obtuvo acetato de 1-[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]etilo (9,3 mg, ejemplo 69) como un sólido blanco. RMN de 1H (400 MHz, CD3OD) 5 ppm: 7,44-7,30 (m, 5H), 7,05-7,03 (m, 1H), 5,12 (s, 2H), 3,33 (s. a., 2H), 2,14 (s, 3H), 1,74 (m, 2H), 1,72 (d, J = 6,8 Hz, 3H), 1,04-1,00 (m, 3H). MS obsd. (ESI+) [(M+H)+]: 433.
Ejemplo 70
6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona
Etapa 1: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-etilsulfanil-7H-purin-8-ona
Se preparó compuesto 70a de forma análoga al ejemplo 1, etapa 3 usando yodoetano y 6-amino-9-[(4-clorofenil)metil]-2-sulfanil-7H-purin-8-ona (compuesto 9b) en lugar de yoduro de metilo y 6-amino-9-fenilmetil-2-sulfanil-7H-purin-8-ona (compuesto 1b). Se obtuvo 6-amino-9-[(4-clorofenil)metil]-2-etilsulfanil-7H-purin-8-ona (2,5 g, compuesto 70a) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 336.
Etapa 2: Preparación de 6-amino-9-(4-clorobencil)-2-etilsulfinil-7H-purin-8-ona
Se preparó compuesto 70b de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-[(4-clorofen¡l)metil]-2-etilsulfan¡l-7H-purin-8-ona (compuesto 70a) en lugar de 6-amino-9-bencil-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se obtuvo 6-amino-9-(4-clorobenc¡l)-2-et¡lsulfin¡l-7H-pur¡n-8-ona (1,94 g, compuesto 70b) como un sólido blanco. MS obsd. (ESI+) [(M+H)+]: 352.
Etapa 3: Preparación de 6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-9-(4-clorobencil)-2-etilsulfin¡l-7H-pur¡n-8-ona (compuesto 70b) en lugar de 6-amino-9-benc¡l-2-(-2-met¡lsulfin¡l)-7H-pur¡n-8-ona (compuesto 1d). Se obtuvo 6-amino-9-[(4-clorofen¡l)met¡l]-2-(et¡lsulfon¡m¡do¡l)-7H-purin-8-ona (217 mg, ejemplo 70) como un sólido blanco. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,61 (s, 1 H), 7,42-7,35 (m, 4 H), 6,98 (s, 2 H), 4,96 (s, 2 H), 4,05 (s, 1 H), 3,42-3,37 (m, 2 H), 1,16 (t, J = 7,4 Hz, 3 H). MS obsd. (ESI+) [(M+H)+]: 367.
La separación del compuesto del ejemplo 70 por HPLC quiral proporcionó el ejemplo 70-A (elución más rápida, 31,8 mg) y el ejemplo 70-B (elución más lenta, 10 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak IC-3).
Ejemplo 70-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,76 (s, 1 H), 7,45-7,33 (m, 4 H), 7,01 (s, 2 H), 4,96 (s, 2 H), 4,03 (s, 1 H), 3,40-3,34 (m, 2 H), 1,17 (t, J = 7,4 Hz, 3 H). MS obsd. (ESI+) [(M+H)+]: 367.
Ejemplo 70-B: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,70 (s, 1 H), 7,46-7,28 (m, 4 H) 7,01 (s, 2 H), 4,96 (s, 2 H), 4,03 (s, 1 H), 3,44-3,36 (m, 2 H), 1,17 (t, J = 7,4 Hz, 3 H). MS obsd. (ESI+) [(M+H)+]: 367.
Ejemplo 71
6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona
Etapa 1: Preparación de 4-amino-2-oxo-3-(p-tolilmetil)-1H-imidazol-5-carbonitrilo
Se preparó compuesto 71a de forma análoga al ejemplo 9, etapa 1 usando p-tolilmetanamina en lugar de 4-clorofenilmetilamina. Se obtuvo 4-amino-2-oxo-3-(p-tolilmetil)-1H-imidazol-5-carbonitrilo (26,6 g, compuesto 71a) como un sólido gris y se usó directamente en la siguiente etapa sin purificación adicional. MS obsd. (ESI+) [(M+H)+]: 229.
Etapa 2: Preparación de 6-amino-9-(p-tolilmetil)-2-sulfanil-7H-purin-8-ona
Se preparó compuesto 71b de forma análoga al ejemplo 9, etapa 2 usando 4-amino-2-oxo-3-(p-tolilmetil)-1H-imidazol-5-carbonitrilo (compuesto 71a) en lugar de 4-amino-3-[(4-clorofenil)metil]-2-oxo-1H-imidazol-5-carbonitrilo (compuesto 9a). Se obtuvo 6-amino-9-(p-tolilmetil)-2-sulfanil-7H-purin-8-ona (20,0 g, compuesto 71b) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 288.
Etapa 3: Preparación de 6-amino-2-etilsulfanil-9-(p-tolilmetil)-7H-purin-8-ona
Se preparó compuesto 71c de forma análoga al ejemplo 1, etapa 3 usando 6-amino-9-(p-tolilmetil)-2-sulfanil-7H-purin-8-ona (compuesto 71b) y yodoetano en lugar de 6-amino-9-bencil-2-etilsulfanil-7H-purin-8-ona (compuesto 2a) y yoduro de metilo. Se obtuvo 6-amino-2-etilsulfanil-9-(p-tolilmetil)-7H-purin-8-ona (13 g, compuesto 71c) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 316.
Etapa 4: Preparación de 6-amino-2-etilsulfinil-9-(p-tolilmetil)-7H-purin-8-ona
Se preparó compuesto 71d de forma análoga al ejemplo 1, etapa 4 usando 6-amino-9-et¡lsulfan¡l-9-(p-tol¡lmet¡l)-7H-purin-8-ona (compuesto 71c) en lugar de 6-amino-9-bencil-2-met¡lsulfan¡l-7H-pur¡n-8-ona (compuesto 1c). Se obtuvo 6-am¡no-2-et¡lsulf¡nil-9-(p-tol¡lmet¡l)-7H-pur¡n-8-ona (3,5 g, compuesto 71d) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+j: 332.
Etapa 5: Preparación de 6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-2-et¡lsulf¡n¡l-9-(ptolilmetil)-7H-purin-8-ona (compuesto 71d) en lugar de 6-amino-9-benc¡l-2-met¡lsulfin¡l-7H-pur¡n-8-ona (compuesto 1d). Se obtuvo 6-amino-2-(et¡lsulfon¡m¡do¡l)-9-(p-tol¡lmet¡l)-7H-purin-8-ona (530 mg, ejemplo 71) como un sólido amarillo. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,53 (s, 1 H), 7,24 (d, J = 8,03 Hz, 2 H), 7,13 (d, J = 8,03 Hz, 2 H), 6,94 (s. a., 2 H), 4,91 (s, 2 H), 4,03 (s, 1 H), 3,36-3,41 (m, 2 H), 2,26 (s, 3 H), 1,18 (t, J = 7,28 Hz, 3 H). MS obsd.
(ESI+) [(M+H)+]: 347.
La separación del compuesto del ejemplo 71 por HPLC quiral proporcionó el ejemplo 71-A (elución más rápida, 56,8 mg) y el ejemplo 71-B (elución más lenta, 56,7 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak AD-3).
Ejemplo 71-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,52 (s. a., 1 7,24 (d, J = 8,0 Hz, 2 H), 7,13 (d, J = 7,9 Hz, 2 H), 6,94 (s. a., 2 H), 4,91 (s, 2 H), 4,02 (s, 1 H), 3,43-3,33 (m, 2 2,26 (s, 3 H), 1,18 (t, J = 7,3 Hz, 3 H). MS obsd. (ESI+) [(M+H)+]: 347.
Ejemplo 71-B: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,52 (s. a., 1 H), 7,24 (d, J = 8,0 Hz, 2 H), 7,13 (d, J = 8,0 Hz, 2 H), 6,94 (s. a., 2 H), 4,91 (s, 2 H) 4,02 (s, 1 H), 3,42-3,33 (m, 2 H), 2,26 (s, 3 H), 1,18 (t, J = 7,3 Hz, 3 H). MS obsd. (ESI+) [(M+H)+]: 347.
Ejemplo 72
6-amino-2-(etilsulfonimidoil)-9-[(4-fluorofenil)metil]-7H-purin-8-ona
Etapa 1: Preparación de 4-amino-3-[(4-fluorofenil)metil]-2-oxo-1H-imidazol-5-carbonitrilo
Se preparó compuesto 72a de forma análoga al ejemplo 9, etapa 1 usando (4-fluorofenil)met¡lamina en lugar de 4-clorofenilmetilamina. Se obtuvo 4-am¡no-3-[(4-fluorofen¡l)met¡l]-2-oxo-1H-¡midazol-5-carbon¡tr¡lo (48 g, compuesto 72a) como un sólido amarillo claro y se usó directamente en la siguiente etapa sin purificación adicional. MS obsd. (ESI+) [(M+H)+]: 233.
Etapa 2: Preparación de 6-amino-9-[(4-fluorofenil)metil]-2-sulfanil-7H-purin-8-ona
Se preparó compuesto 72b de forma análoga al ejemplo 9, etapa 2 usando 4-amino-3-[(4-fluorofen¡l)metil]-2-oxo-1H-im¡dazol-5-carbon¡tr¡lo (compuesto 72a) en lugar de 4-amino-3-[(4-clorofenil)met¡l]-2-oxo-1H-¡m¡dazol-5-carbonitrilo (compuesto 9a). Se obtuvo 6-amino-9-[(4-fluorofen¡l)met¡l]-2-sulfin¡l-7H-pur¡n-8-ona (32,0 g, compuesto 72b) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 292.
Etapa 3: Preparación de 6-amino-2-etilsulfanil-9-[(4-fluorofenil)metil]-7H-purin-8-ona
Se preparó compuesto 72c de forma análoga al ejemplo 1, etapa 3 usando 6-amino-9-[(4-fluorofenil)metil]-2-sulfanil-7H-purin-8-ona (compuesto 72b) y yodoetano en lugar de 6-amino-9-bencil-2-sulfan¡l-7H-pur¡n-8-ona (compuesto 1b) y yoduro de metilo. Se obtuvo 6-amino-2-et¡lsulfan¡l-9-[(4-fluorofenil)met¡l]-7H-pur¡n-8-ona (5,6 g, compuesto 72c) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 320.
Etapa 4: Preparación de 6-amino-2-etilsulfinil-9-[(4-fluorofenil)metil]-7H-purin-8-ona
Se preparó compuesto 72d de forma análoga al ejemplo 1, etapa 4 usando 6-amino-2-etilsulfanil-9-[(4-fluorofenil)metil]-7H-purin-8-ona (compuesto 72c) en lugar de 6-amino-9-bencil-2-metilsulfanil-7H-purin-8-ona (compuesto 1c). Se obtuvo 6-amino-2-etilsulfinil-9-[(4-fluorofenil)metil]-7H-purin-8-ona (4,8 g, compuesto 72d) como un sólido amarillo. MS obsd. (ESI+) [(M+H)+]: 332.
Etapa 5: Preparación de 6-amino-2-(etilsulfonimidoil)-9-[(4-fluorofenil)metil]-7H-purin-8-ona
Se preparó el compuesto del título de forma análoga al ejemplo 1, etapa 5 usando 6-amino-2-etilsulfinil-9-[(4-fluorofenil)metil]-7H-purin-8-ona (compuesto 72d) en lugar de 6-amino-9-bencil-2-metilsulfinil-7H-purin-8-ona (compuesto 1d). Se obtuvo 6-amino-2-(etilsulfonimidoil)-9-[(4-fluorofenil)metil]-7H-purin-8-ona (2,9 g, ejemplo 72) como un sólido amarillo. RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,57 (s. a., 1H), 7,40 (dd, J = 8,5, 5,5 Hz, 2H), 7,16 (t, J = 8,9 Hz, 2H), 6,97 (s. a., 2H), 4,94 (s, 2H), 4,07 (s, 1H), 3,43-3,36 (m, 2H), 1,17 (t, J = 7,4 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 351.
La separación del compuesto del ejemplo 72 por HPLC quiral proporcionó el ejemplo 72-A (elución más rápida, 85,4 mg) y el ejemplo 72-B (elución más lenta, 36,4 mg) como un sólido blanco. (Condición de separación: metanol 5 % -40 % (DEA al 0,05 %)/CO2 en columna ChiralPak AD-3).
Ejemplo 72-A: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,53 (s. a., 1H), 7,41 (dd, J = 8,5, 5,5 Hz, 2H), 7,17 (t, J = 8.9 Hz, 2H), 6,98 (s. a., 2H), 4,95 (s, 2H), 4,07 (s, 1H), 3,45-3,36 (m, 2H) 1,17 (t, J = 7,3 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 351.
Ejemplo 72-B: RMN de 1H (400 MHz, DMSO-de) 5 ppm: 10,53 (s. a., 1H), 7,41 (dd, J = 8,5, 5,5 Hz, 2H), 7,17 (t, J = 8.9 Hz, 2H), 6,98 (s. a., 2H), 4,95 (s, 2H), 4,07 (s, 1H), 3,44-3,37 (m, 2H) 1,17 (t, J = 7,3 Hz, 3H). MS obsd. (ESI+) [(M+H)+]: 351.
Ejemplo 73: Ensayo de células HEK-Blue-hTLR 7:
Se adquirió una línea celular estable HEK-Blue-hTLR7 de InvivoGen (n.° de cat. Hkb-htlr7, San Diego, California, EE. UU.). Estas células se diseñaron para estudiar la estimulación de TLR7 humano realizando un seguimiento de la activación de NF-kB. Se dispuso un gen indicador de SEAP (fosfatasa alcalina embrionaria secretada) bajo el control del promotor mínimo de IFN-p fusionado a cinco sitios de unión a AP-1 y NF-kB. El SEAP se indujo activando NF-kB y AP-1 por medio de la estimulación de células HEK-Blue-hTLR7 con ligandos de TLR7. Por lo tanto, la expresión del indicador se reguló por el promotor de NF-kB tras la estimulación de TLR7 humano durante 20 h. La actividad del indicador de SEAP del sobrenadante de cultivo celular se determinó usando el kit QUANTI-Blue™ (n.° de cat.: repqb1, Invivogen, San Diego, Ca, EE. UU.) a una longitud de onda de 640 nm, un medio de detección que se vuelve púrpura o azul en presencia de fosfatasa alcalina.
Las células HEK-Blue-hTLR7 se incubaron a una densidad de 250000~450000 células/ml en un volumen de 180 pL en una placa de 96 pocillos en medio de Eagle modificado por Dulbecco (DMEM) que contenía 4,5 g/l de glucosa, 50 U/ml de penicilina, 50 mg/ml de estreptomicina, 100 mg/ml de normocina, L-glutamina 2 mM, suero fetal bovino inactivado por calor al 10 % (v/v) durante 24 h. A continuación, las células HEK-Blue-hTLR-7 se incubaron con adición de 20 pl de compuesto de prueba en una dilución en serie en presencia de DMSO final al 1 % y se realiza la
incubación a 37 °C en una incubadora con CO2 durante 20 h. A continuación, se incubaron 20 |jl del sobrenadante de cada pocilio con 180 j l de solución de sustrato Quanti-blue a 37 °C durante 2 h y se leyó la absorbancia a 620~655 nm usando un espectrofotómetro. La vía de señalización por la que la activación de TLR7 da lugar a la activación posterior de NF- k B se ha aceptado ampliamente y, por lo tanto, también se usó un ensayo de indicador similar para evaluar el agonista de TLR7 (Tsuneyasu Kaisho y Takashi Tanaka, Trends in Immunology, Volumen 29, Número 7, julio de 2008, páginas 329,sci; Hiroaki Hemmi et al, Nature Immunology 3, 196-200 (2002)).
Los compuestos de la presente invención se sometieron a prueba en el ensayo de HEK-Blue-hTLR7 para determinar su actividad de agonismo de TLR7 como se describe en el presente documento y los resultados se enumeran en la tabla 1. Se descubrió que los ejemplos tenían una CE50 de aproximadamente 0,01 jM hasta aproximadamente 0,7 jM. Se descubrió que compuestos particulares de la presente invención tenían una CE50 de aproximadamente 0,01 jM hasta aproximadamente 0,1 jM.
Tabla 1: Actividad de los compuestos en el ensayo de HEK-Blue-hTLR7 in vitro
Ejemplo 74: Ensayo de células HEK-Blue-hTLR8 e índice de selectividad (CE
50(tlr8)
/CE
50(tlr7)
):
Se adquirió una línea celular estable HEK-Blue-hTLR8 de InvivoGen (n.° de cat.: HEK-Blue-htlr8, San Diego, California, EE. UU.). Estas células se diseñaron para estudiar la estimulación de TLR8 humano realizando un seguimiento de la activación de NF- k B . Se dispuso un gen indicador de SEAP (fosfatasa alcalina embrionaria secretada) bajo el control del promotor mínimo de IFN-p fusionado a cinco sitios de unión a AP-1 y NF- k B . El SEAP se indujo activando NF- k B y AP-1 por medio de la estimulación de células HEK-Blue-hTLR8 con ligandos de TLR8. Por lo tanto, la expresión del indicador se reguló por el promotor de NF- k B tras la estimulación de TFR8 humano durante 20 h. La actividad del indicador de SEAP del sobrenadante de cultivo celular se determinó usando el kit QUANTI-Blue™ (n.° de cat.: rep-qb1, Invivogen, San Diego, Ca, EE. UU.) a una longitud de onda de 640 nm, un medio de detección que se vuelve púrpura o azul en presencia de fosfatasa alcalina.
Las células HEK-Blue-hTLR8 se incubaron a una densidad de 250000~450000 células/ml en un volumen de 180 jL en una placa de 96 pocillos en medio de Eagle modificado por Dulbecco (DMEM) que contenía 4,5 g/l de glucosa, 50 U/ml de penicilina, 50 mg/ml de estreptomicina, 100 mg/ml de normocina, L-glutamina 2 mM, suero fetal bovino inactivado por calor al 10 % (v/v) durante 24 h. A continuación, las células HEK-Blue-hTLR8 se incubaron con
adición de 20 |jl de compuesto de prueba en una dilución en serie en presencia de DMSO final al 1 % y se realiza la incubación a 37 °C en una incubadora con CO2 durante 20 h. A continuación, se incubaron 20 j l del sobrenadante de cada pocillo con 180 j l de solución de sustrato Quanti-blue a 37 °C durante 2 horas y se leyó la absorbancia a 620~655 nm usando un espectrofotómetro. La vía de señalización por la que la activación de TLR8 da lugar a la activación posterior de NF- k B se ha aceptado ampliamente y, por lo tanto, también se usó un ensayo de indicador similar para evaluar el agonista de TLR8 (Tsuneyasu Kaisho y Takashi Tanaka, Trends in Immunology, Volumen 29, Número 7, julio de 2008, páginas 329,sci; Hiroaki Hemmi et al, Nature Immunology 3, 196-200 (2002)).
Los compuestos de la presente invención se sometieron a prueba en el ensayo de HEK-Blue-hTLR8 para determinar su actividad de agonismo de TLR8 como se describe en el presente documento y los resultados se enumeran en la tabla 2. La proporción de actividad de agonismo de TLR8 en comparación con la actividad de agonismo de TLR7 se definió como el índice de selectividad (valor de CE50(TLR8)/valor de CE50(tlr7)) y se calculó en consecuencia. Dado que los agonistas de TLR7 y TLR8 difieren en su selectividad por las células diana y perfil de inducción de citocinas, y los agonistas específicos de TLR7 activan las CD plasmocitoides y los linfocitos B e inducen principalmente citocinas reguladas por IFN-a e IFN, que pueden ser potencialmente beneficiosas como tratamiento de la infección por el VHB. Cuanto mayor índice de selectividad muestra el compuesto, más específico de TLR7 es el compuesto. Los compuestos de la presente invención mostraron un índice de selectividad comparable o mejor con respecto a los compuestos de referencia.
Tabla 2: Actividad de los compuestos en el ensayo de HEK Blue-hTLR-8 in vitro e índice selectivo
Ejemplo 75: Solubilidad por Lysa
El ensayo de solubilidad LYSA se usa para determinar la solubilidad acuosa de un compuesto.
Se prepararon muestras por duplicado a partir de una solución madre de DMSO 10 mM. Después de la evaporación de DMSO con un evaporador de vacío centrífugo, se disolvieron los compuestos en tampón de fosfato 0,05 M (pH 6,5), se agitó durante una hora y se sacudió durante dos horas. Después de una noche, se filtraron las soluciones usando una placa de filtro de microvaloración. A continuación, se analizaron el filtrado y su dilución 1/10 por HPLC-UV. Además, se preparó una curva de calibración de cuatro puntos a partir de soluciones madre 10 mM y se usó para la determinación de la solubilidad de los compuestos. Los resultados se expresan en jg/ml y se resumen en la tabla 3. Los compuestos con mayor solubilidad podrían ampliar su idoneidad para diferentes formas farmacéuticas e incrementar la probabilidad de lograr la concentración deseada en la circulación sistémica, que a su vez puede reducir potencialmente la dosis requerida. Los compuestos ejemplificados de la presente invención mostraron una solubilidad mucho mejor en comparación con S-1, P-2 y P-5.
Tabla 3: Datos de solubilidad de los compuestos de la presente invención.
Ejemplo 76: Estabilidad metabólica en microsomas hepáticos humanos
El ensayo de estabilidad en microsomas humanos se usa para la evaluación temprana de la estabilidad metabólica de un compuesto de prueba en microsomas hepáticos humanos.
Se preincubaron microsomas hepáticos humanos (n.° de cat.: 452117, Corning, EE. UU.; n.° de cat.: H2610, Xenotech, EE. UU.) con el compuesto de prueba durante 10 minutos a 37 °C en tampón de fosfato de potasio 100 mM, pH 7,4. Se iniciaron las reacciones añadiendo el sistema de regeneración NADPH. Las mezclas de incubación finales contenían compuesto de prueba 1 pM, 0,5 mg/ml de proteína microsomal de hígado, MgCl21 mM, NADP 1 mM, 1 unidad/ml de deshidrogenasa isocítrica y ácido isocítrico 6 mM en tampón de fosfato de potasio 100 mM, pH 7,4. Después de tiempos de incubación de 0, 3, 6, 9, 15 y 30 minutos a 37 °C, se le añadió 300 pl de ACN frío (incluyendo el patrón interno) a 100 pl de la mezcla de incubación para terminar la reacción. Tras la precipitación y centrifugación, se determinó la cantidad de compuesto restante en las muestras por CL-EM/EM. También se prepararon y analizaron controles sin sistema de regeneración NADPH a cero y 30 minutos. Los resultados se clasificaron en: bajo (<7,0 ml/min/kg), medio (7,0-16,2 ml/min/kg) y alto (16,2-23,2 ml/min/kg). Los resultados del estudio de estabilidad metabólica en microsomas hepáticos humanos se dan en la tabla 4. Los compuestos ejemplificados de la presente invención mostraron un bajo aclaramiento en los microsomas hepáticos humanos, mientras que los compuestos de referencia GS-9620 y P-2 se clasificaron como altos y medios, respectivamente.
Tabla 4. Estabilidad metabólica en microsomas hepáticos humanos de los compuestos de la presente invención.
* 6,15 ml/min/kg es la limitación de la sensibilidad del ensayo.
Ejemplo 77: Ensayo de cribado de inducción del citocromo P450 (Cyp450) - inducción de ARNm
La inducción de enzimas del citocromo P450 se asocia con una mayor prevalencia de interacciones farmacológicas clínicas. Las consecuencias clínicas de la inducción pueden ser un fracaso terapéutico causado por una disminución de la exposición sistémica del propio fármaco o un tratamiento administrado conjuntamente, o toxicidad como resultado de una mayor bioactivación. El ensayo de inducción del citocromo P450 (CYP450) se ha utilizado para comprender las posibles responsabilidades de la interacción farmacológica en la fase de descubrimiento de fármacos.
Cultivo celular
Se descongelaron y cultivaron hepatocitos crioconservados humanos (Life Technologies, Carlsbad, EE. UU.) en placas de 96 pocillos recubiertas con colágeno I con una densidad de 52000 células/pocillo. Después de la unión, se cambió el medio de mantenimiento de hepatocitos (HMM; Lonza, Suiza) después de que las células se cultivaran previamente durante la noche.
Se administraron los compuestos de prueba a las células a la mañana siguiente a una concentración indicada (de hasta 10 pM) en medio de cultivo HMM que contenían gentamicina y un DMSO al 0,1 % constante. De forma similar, se prepararon diluciones de los compuestos inductores positivos omeprazol (inductor prototípico de CYP1A2 humana; concentraciones finales: 1 y 10 pM), fenobarbital (inductor prototípico de CYP2B6 humana; concentraciones finales: 100 y 1000 pM) y rifampicina (inductor prototípico de CYP3A4 humana; concentraciones finales: 1 y 10 pM) a partir de soluciones madre de 1000 veces de DMSO en HMM que contenía gentamicina. A continuación, se realizó un cambio de medio y las células se expusieron durante 24 horas a los compuestos de prueba, compuestos inductores positivos o vehículo (DMSO al 0,1 %), respectivamente.
Al final del período de exposición del compuesto, se retiró el medio y se lisaron las células usando 100 pl/pocillo de tampón de lisis de tejido de aislamiento MagNA Pure LC RNA (Roche Diagnostics AG, Rotkreuz, Suiza). A continuación, se sellaron las placas y se congelaron a -80 °C hasta su análisis posterior.
Aislamiento, procesamiento y qRT-PCR de ARNm
El aislamiento del ARNm se realizó usando el sistema MagNA Pure 96 (Roche Diagnostics AG, Rotkreuz, Suiza) y el kit de gran volumen de ARN celular respectivo (Roche Diagnostics AG, Rotkreuz, Suiza) de muestras descongeladas diluidas 1:1 con PBS. Se usaron el volumen de la lisis celular y un volumen de elución de 100 pl. A continuación, se usaron 20 pl de la suspensión de ARNm resultante para la transcripción inversa usando 20 pl del transcrito o kit de síntesis de ADNc de primera hebra (Roche prime Supply, Mannheim, Alemania). El ADNc resultante se diluyó con 40 pl de H2O antes de que se usara para qRT-PCR. Se realizó qRT-PCR usando el cebador directo e inverso, el banco de sondas universales correspondiente (todos de Microsynth, Balgach, Suiza) y la mezcla maestra avanzada rápida Taqman (Applied Biosystems), en una máquina ABI 7900 (Applied Biosystems).
Cálculos
Los valores Ct de qRT-PCR para los P450 respectivos se pusieron en relación con el valor Ct de RN18S1 (microsynth, Balgach, Suiza) de la misma muestra. Al hacerlo, se calculó un valor de Act respectivo. Usando el promedio de todos los valores de Act para las muestras de control de vehículo, se calculó un valor de AAct para cada muestra (valor de AAct(muestra) = valor de Act(muestra) - promedio del valor de Act de todos los controles de vehículo). El factor de multiplicación de la inducción de la muestra respectiva se calculó como 2A(-AAct). A continuación, se promediaron los valores del factor de multiplicación de la inducción individuales por condición de tratamiento (normalmente n = 3 repeticiones biológicas).
A continuación, se calcularon los valores de inducción relativa con respecto a la condición del compuesto inductor positivo respectivo (omeprazol 10 pM para CYP1A2; fenobarbital 1000 pM para CYP2B6; rifampicina 10 pM para CYP3A4) a partir de los valores de inducción múltiple como sigue:
Inducción relativa (%) = 100 * (T-V)/(P-V)
T: factor de multiplicación de la inducción de la condición del compuesto de prueba
P: factor de multiplicación de la inducción del compuesto inductor positivo
V: factor de multiplicación de la inducción de controles de vehículo
Los resultados de la inducción de CYP3A4 se dan en la tabla 5. Los compuestos ejemplificados de la presente invención no causaron un cambio significativo en el ARNm de CYP 3A4 a ninguna concentración. Los resultados indicaron que los compuestos ejemplificados no tenían responsabilidad en la inducción de CYP, lo que puede evitar la posible interacción farmacológica en la aplicación clínica.
Tabla 5. Valores de inducción relativos de los compuestos de la presente invención para rifampicina 10 pM
Ejemplo 78: Ensayo de microsuspensión de Ames
El ensayo de microsuspensión de Ames examina si un compuesto causa mutaciones de ADN. El procedimiento se basó en una versión modificada previa a la incubación descrita por Kado et al (véanse referencias: B.N. Ames, J. McCann, E. Yamasaki, Mutation Res. 1975, 31, 347-364 N.Y. Kado, D. Langley, and E. Eisenstadt, Mutation Res.
1983, 121, 25-32). Cinco cepas de prueba de Salmonella typhimurium (TA1535, TA97, TA98, TA100 y TA102) se trataron con el compuesto de prueba en ausencia y en presencia de un sistema de activación metabólica exógeno (S9). Las bacterias se incubaron previamente durante 1 h, el volumen de incubación previa es de 210 pl (100 pl de cultivo durante la noche, 100 pl de mezcla S9 (S9 al 10 %) o 100 pl de tampón de fosfato y 10 pl de solución de compuesto de prueba). Los cultivos durante la noche se resuspendieron para la prueba en tampón de fosfato frío. La mezcla S9 contiene cloruro de potasio, cloruro de magnesio, solución salina tamponada con fosfato de sodio, NADP+ y glucosa-6-fosfato. Los tubos de ensayo se incuban y se agitan durante 60 minutos a 37 °C. Posteriormente se añadió 2,2 ml de agar blando complementado con L-histidina y biotina y el contenido de los tubos se mezcló y se vertió en placas de agar mínimo Vogel-Bonner.
Se incubaron tres placas replicadas para el compuesto de prueba y el control negativo o dos placas replicadas para los controles positivos a 37 °C, boca abajo, durante 2 días. Las colonias se contaron electrónicamente usando un sistema de análisis de imagen automático después de haber inspeccionado el césped bacteriano en busca de signos de toxicidad. Las placas que presentan precipitado o contaminación se contaron manualmente.
S9 es un sistema metabólico in vitro que se obtiene de los homogeneizados de hígado mediante centrifugación a 9000 g durante 20 minutos. Contiene isoformas de CYP450, enzimas metabólicas de fase II, etc. En la prueba de ensayo de microsuspensión de Ames, se usa S9 para evaluar la mutagenicidad de los compuestos, algunos de los cuales requieren activación metabólica para convertirse en mutagénicos.
Criterios del ensayo de microsuspensión de Ames: un resultado positivo se define como un incremento reproducible, relacionado con la dosis, del número de colonias retromutadas en al menos una de las cepas. Para TA1535 y TA98, el umbral positivo es un incremento de 2 veces respecto al control. Para TA97, TA100 y TA102, el umbral es un incremento de 1,5 veces.
Los resultados del ensayo de microsuspensión de Ames se dan en la tabla 6. Los compuestos ejemplificados de la presente invención mostraron resultados negativos que sugieren que no había indicación de mutagenicidad de los compuestos sometidos a prueba en el ensayo de microsuspensión de Ames.
Tabla 6: Resultados del ensayo de microsuspensión de Ames
Ejemplo 79: ensayo de inhibición del canal hERG
El ensayo de inhibición del canal hERG es una medición altamente sensible que identifica compuestos que presentan inhibición de hERG relacionada con cardiotoxicidad in vivo. Los canales de K+ hERG se clonaron en
humanos y se expresaron de forma estable en una línea celular CHO (ovario de hámster chino). Se usaron células CHOhERG para experimentos de pinzamiento zonal (pinza de voltaje, célula completa). Se estimularon las células por un patrón de voltaje para activar los canales hERG y conducir las corrientes Ikierg (corriente rectificadora de salida de potasio retardada rápida del canal hERG). Después de que las células se estabilizaron durante unos minutos, se registraron la amplitud y la cinética de Ikierg a una frecuencia de estimulación de 0,1 Hz (6 lpm). Después de esto, se le añadió el compuesto de prueba a la preparación a concentraciones crecientes. Para cada concentración, se hizo un intento de alcanzar un efecto de estado de equilibrio; normalmente, esto se logró en 3-10 minutos, momento en el cual se aplicó la siguiente concentración más alta. La amplitud y la cinética de Ikierg se registran en cada concentración del fármaco que se compararon con los valores de control (tomados como 100 %). (referencias: Redfern WS, Carlsson L, Davis AS, Lynch WG, MacKenzie I, Palethorpe S, Siegl PK, Strang I, Sullivan AT, Wallis R, Camm AJ, Hammond TG. 2003; Relationships between preclinical cardiac electrophysiology, clinical QT interval prolongation and torsade de pointes for a broad range of drugs: evidence for a provisional safety margin in drug development. Cardiovasc. Res. 58:32-45, Sanguinetti MC, Tristani-Firouzi M. 2006; hERG potassium channels and cardiac arrhythmia. Nature 440:463-469, Webster R, Leishman D, Walker D. 2002; Towards a drug concentration effect relationship for QT prolongation and torsades de pointes. Curr. Opin. Drug Discov. Devel. 5:116-26).
Los resultados de Lysa se dan en la tabla 7. Una proporción de seguridad (CI20/CE50 de hERG) >30 sugiere un bajo potencial de cardiotoxicidad relacionada con hERG.
Tabla 7: Resultados de hERG y proporción de seguridad.
Ejemplo 80: Ensayo de cribado de aductos GSH
La formación de metabolitos reactivos es una propiedad farmacológica no deseada debido al efecto adverso clínico idiosincrásico. La formación de aductos de GSH se usa para evaluar la formación de metabolitos reactivos in vitro. Los controles positivos fueron diclofenaco, troglitazona, nefazodona y mGluR5. El control de disolvente fue DMSO.
Incubación
Todos los compuestos, incluyendo el control positivo y el disolvente, se incubaron usando una placa de 96 pocillos (Eppendorf) a 20 pM (adición de 1 pl de solución madre de DMSO 10 mM) en 450 pl de tampón de fosfato de sodio 0,1 M a pH 7,4 que contiene microsomas de hígado de rata (RLM) y microsomas hepáticos humanos (HLM). La concentración de proteína microsomal es de 1 mg/ml. Se realizó el pipeteo usando un robot de pipeteo TECAN. El tampón se preparó a temperatura ambiente mediante la combinación de 2,62 g de NaH2PO4 1 H2O y 14,43 g de Na2HPO4 2 H2O disueltos en H2O (Millipore, >18 MQ) a un peso de 1000 g (pH 7,4) Después de 5 minutos de incubación previa a 37 °C, se inició la reacción mediante la adición de 50 pl de tampón que contenía GSH (100 mM) y NADPH (20 mM). Se prepararon soluciones madre frescas de GSH y NADPH directamente antes de cada experimento. Las concentraciones finales fueron 5 mM para GSH y 1 mM para NADPH. Después de 60 minutos de incubación a 37 °C (agitación a 800 rpm), la reacción se inactiva con 500 pl de acetonitrilo frío y se centrifuga a 5000 x g a 25 °C durante 11 minutos. Antes del análisis por LC-MS/m S, se dividió el sobrenadante en dos fracciones, 450 pl y 400 pl cada uno seguido de evaporación usando una corriente de N2 a 35 °C hasta un volumen de aproximadamente 150 pl.
Cromatografía de líquidos
La limpieza de la muestra y la cromatografía de analitos se realizaron en línea mediante una configuración de cambio de columna de dos columnas de HPLC. De cada muestra se inyectaron 50 pl (Shimadzu SilHTC) y se cargaron con agua que contenía ácido fórmico al 0,1% en una columna de captura (Waters Oasis HLB 2,1 x 10 mm, 25 pm) con un caudal de 0,3 ml/min. Después de 1,5 min, los analitos atrapados se enjuagaron a continuación (incluido un cambio en la dirección del flujo en la columna de captura) en una columna analítica (Waters Atlantis T3 2,1 x 10 0 mm, 3 pm) con un flujo total de 0,2 ml/min a partir de 95/5 % de agua que contiene ácido fórmico al
0,1%/acetonitrilo. La fracción de acetonitrilo se incrementó a acetonitrilo al 20 % entre 2 y 2,5 minutos, al 70 % a los 10 minutos y al 98 % a los 11 minutos. Después de 12 minutos, la columna analítica se equilibró para comenzar las condiciones (acetonitrilo al 5 %). La columna de captura se lavó con acetonitrilo durante 1 minuto a un caudal de 1.5 ml/min y se equilibró durante 1,25 minutos con agua que contenía ácido fórmico al 0,1 % a un caudal de 1.5 ml/min. El tiempo total de ejecución fue de 14 min por muestra.
Espectrometría de masas
Se usó un espectrómetro de masas de trampa de iones de triple cuadrupolo lineal 4000 Qtrap equipado con una fuente de ionización por electropulverización (Turbo V), ambos de Applied Biosystems/MDS Sciex. Basado en un procedimiento publicado de Dieckhaus et al. (2005) se usó un procedimiento de escaneo de exploración de iones precursores (PreIS) para detectar conjugados GSH en modo de iones negativos. En resumen, a medida que se escanean los iones de exploración (400 a 900 amu en 2 segundos) en busca de precursores de m/z 272 amu, el voltaje de pulverización iónica fue -4200 V, la temperatura de la fuente 500 °C, se usó nitrógeno como gas de cortina y colisión. Si la molécula original excede de una masa molecular de 500, el intervalo de exploración se cambió de 500 a 1000 amu en 2 segundos. Para las señales en el escaneo de exploración que excedieron los 7500 cts (que era aproximadamente 5 veces la señal de fondo), se activaron el escaneo de resolución potenciado y el escaneo de iones de producto potenciado que permitía la determinación de isótopos y la confirmación de un aducto de GSH positivo por la presencia de iones de fragmentos de diagnóstico. Otros ajustes del instrumento fueron los siguientes: Gas de cortina: 30 psi, gas CAD: 10 psi Gas 1: 30 psi, Gas 2: 50 psi, potencial de reducción: -70 V, potencial de entrada: -10 V, energía de colisión: -24 V, y potencial de salida de células -15 V. La adquisición de datos se realizó usando Analyst 1,4.2, el análisis de datos, es decir, las comparaciones con el control de la muestra (disolvente) se realizaron con Metabolite ID 1,3 (Applied Biosystems/MDS Sciex) (referencia: Dieckhaus, C.M., Femandez-Metzler, C.L., King, R., Krolikowski, P.H., and Baillie, T.A. (2005). Negative ion tandem mass spectrometry for the detection of glutathione conjugates. Chem Res Toxicol 18, 630-638).
Los resultados de GSH se dan en la tabla 8. Los compuestos ejemplificados de la presente invención no mostraron señal en el ensayo de GSH, lo que indica que no existe formación potencial de metabolitos reactivos que pudiera dar lugar a una hepatotoxicidad idiosincrásica.
Tabla 8: Resultados de GSJ
* Sin señal: no se observa formación de aductos de GSH en comparación con el control (DMSO).
Ejemplo 81: Comparación de la concentración plasmática media y los parámetros FC después de la administración intravenosa de 1 mg/kg a rata
La FC de dosis única en ratas Wister-Han macho se realizó para evaluar las propiedades farmacocinéticas de los compuestos sometidos a prueba. Se dosificaron dos grupos de animales por medio de un bolo intravenoso (IV) del compuesto respectivo. Se recogieron muestras de sangre (aproximadamente 20 pl) a través de la vena yugular o un sitio alternativo a los 5 min, 15 min, 30 min, 1 h, 2 h, 4 h, 7 h y 24 h después de la dosis para el grupo IV. Las muestras de sangre se colocaron en tubos que contenían anticoagulante EDTA-K2 y se centrifugaron a 5000 rpm durante 6 min a 4 °C para separar el plasma de las muestras. Después de la centrifugación, el plasma resultante se transfirió a tubos limpios para bioanálisis en LC/MS/MS. Los parámetros farmacocinéticos se calcularon usando el módulo no compartimental de WinNonlin® Professional 6.2.
Los resultados de los parámetros FC se dan en la tabla 9. Los compuestos ejemplificados de la presente invención mostraron claramente un perfil de FC superior inesperado en C0, CL y AUC en comparación con GS-9620 y S-1 en un estudio de FC en ratas con una C0 5-10 veces mayor, un aclaramiento sistémico (CL) 3-5 veces menor y una exposición (AUC) 5-10 veces mayor. Por lo tanto, los compuestos de la presente invención podrían dar lugar potencialmente a una frecuencia de dosis menor y a una dosis menor en la aplicación clínica.
Tabla 9: la concentración plasmática media y los parámetros FC
* Los datos de GS-9620 estaban disponibles en el documento WO2016023511. ** 7 h para el ejemplo 70-A, el ejemplo 70-B y el ejemplo 71-A.
Claims (15)
1. Un compuesto de fórmula (I),
en la que
R1 es alquilo C1-6 , haloalquilo C1-6 , cicloalquilo C3-7 alquilo C1-6 , alcoxialquilo C1-6 o pirrolidinilalquilo C1-6 ;
R2 es alquilo C1-6 , fenilalquilo C1-6 , piridinilalquilo C1-6 o pirimidinilalquilo C1-6 , dicho fenilalquilo C1-6 , piridinilalquilo C1-6 o pirimidinilalquilo C1-6 están sin sustituir o sustituidos por uno, dos o tres sustituyentes seleccionados independientemente de halógeno, alquilo C1-6 , alcoxi C1-6 , ciano, carboxi, carbamoílo, haloalquilo C1-6 , alquilsulfonilo C1-6 , alcoxicarbonilo C1-6 , alcoxialquilaminocarbonilo C1-6 , pirrolidinilcarbonilo y piperidinilcarbonilo;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
2. Un compuesto de acuerdo con la reivindicación 1, en el que:
R1 es metilo, etilo, propilo, butilo, cloropropilo, ciclohexilmetilo, metoxietilo, metoxipropilo, pirrolidinilpropilo o trifluoroetilo;
R2 es isobutilo, bencilo, clorobencilo, fluorobencilo, bromobencilo, clorofluorobencilo, clorometilbencilo, diclorobencilo, difluorobencilo, metilbencilo, metoxibencilo, cianobencilo, carbamoilbencilo, trifluorometilbencilo, metilsulfonilbencilo, metoxicarbonilbencilo, carboxibencilo, metoxietilaminocarbonilbencilo, piperindinilcarbonilbencilo, pirrolidinilcarbonilbencilo, piridinilmetilo, cloropiridinilmetilo, metilpiridinilmetilo, pirimidinilmetilo o metilpirimidinilmetilo;
R3 es H;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
3. Un compuesto de acuerdo con la reivindicación 1, en el que R1 es alquilo C1-6 , haloalquilo C1-6 o alcoxialquilo C1-6.
4. Un compuesto de acuerdo con la reivindicación 3, en el que R1 es metilo, etilo, propilo, butilo, cloropropilo, trifluoroetilo, metoxietilo o metoxipropilo.
5. Un compuesto de la reivindicación 3, en el que R1 es alquilo C1-6.
6. Un compuesto de acuerdo con la reivindicación 2 o 5, en el que R1 es metilo, etilo o propilo.
7. Un compuesto de acuerdo con la reivindicación 1 o 2, seleccionado de:
6-amino-9-bencil-2-(metilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(etilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(2-metoxietilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-am ino-9-bencil-2-(butilsulfonim idoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(3-metoxipropilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(2,2,2-trifluoroetilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-bencil-2-(ciclohexilmetilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-metoxifenil)metil]-2-(metilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(3-cloropropilsulfonimidoil)-9-[(4-metoxifenil)metil]-7H-purin-8-ona;
6-amino-9-[(4-metoxifenil)metil]-2-(3-pirrolidin-1-ilpropilsulfonimidoil)-7H-purin-8-ona; 6-amino-9-[(4-clorofenil)metil]-2-(metilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(6-cloro-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(2-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(metilsulfonimidoil)-9-(3-piridilmetil)-7H-purin-8-ona;
3-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo;
3- [[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida;
6-amino-2-(metilsulfonimidoil)-9-(2-piridilmetil)-7H-purin-8-ona;
6-amino-2-(metilsulfonimidoil)-9-(4-piridilmetil)-7H-purin-8-ona;
6-amino-9-isobutil-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(3-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(propilsulfonimidoil)-9-[[4-(trifluorometil)fenil]metil]-7H-purin-8-ona;
6-amino-9-[(4-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-bromofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(3,4-diclorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-(3,4-difluorofenilmetil)-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-cloro-3-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(propilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona;
6-amino-9-[(4-cloro-3-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(2,4-difluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
4- [[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzonitrilo;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzamida;
6-amino-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(2-metil-4-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(3-cloro-4-metil-fenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-metilsulfonilfenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
4-[[6-am ino-8-oxo-2-(propilsulfonim idoil)-7H-purin-9-il]m etil]benzoato de metilo;
ácido 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoico;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]-N-(2-metoxietil)benzamida;
6-amino-9-[[4-(piperidina-1-carbonil)fenil]metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(S-propilsulfonimidoil)-9-[[4-(pirrolidina-1-carbonil)fenil]metil]-7H-purin-8-ona;
6-metil-2-(propilsulfonimidoil)-9-(pirimidin-5-ilmetil)-7H-purin-8-ona;
6-metil-9-[(2-metilpirimidin-5-il)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona; y
6-amino-2-(etilsulfonimidoil)-9-[(4-fluorofenil)metil]-7H-purin-8-ona.
8. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1, 2 o 7, seleccionado de: 6-amino-9-bencil-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(6-cloro-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-fluorofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-bromofenil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-2-(propilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona;
6-amino-9-[(6-metil-3-piridil)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoato de metilo;
ácido 4-[[6-amino-8-oxo-2-(propilsulfonimidoil)-7H-purin-9-il]metil]benzoico;
6-metil-9-[(2-metilpirimidin-5-il)metil]-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona; y
6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona.
9. Un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 8 seleccionado de: 6-amino-9-[(4-clorofenil)metil]-2-(etilsulfonimidoil)-7H-purin-8-ona; y
6-amino-2-(etilsulfonimidoil)-9-(p-tolilmetil)-7H-purin-8-ona.
10. Un compuesto de fórmula (Ia),
en la que
R4 es alquilo Ci-6, haloalquilo Ci-6, cicloalquilo C3-7 alquilo C1-6, alcoxialquilo C1-6 o pirrolidinilalquilo C1-6;
R5 es alquilo C1-6, fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6, dicho fenilalquilo C1-6, piridinilalquilo C1-6 o pirimidinilalquilo C1-6 están sin sustituir o sustituidos por uno, dos o tres sustituyentes seleccionados independientemente de halógeno, alquilo C1-6, alcoxi C1-6, ciano, carboxi, carbamoílo, haloalquilo C1-6, alquilsulfonilo C1-6, alcoxicarbonilo C1-6, alcoxialquilaminocarbonilo C1-6, pirrolidinilcarbonilo y piperidinilcarbonilo;
R6 es H o alquilo C1-C6-C(O)O-alquilo C1-6-;
R7 es H, alquilo C1-6, cicloalquilo C3-7 o alquilcarbonilo C1-10;
R8 es H, alquilcarbonilo C1-6, carboxialquilcarbonilo C1-6, alquioxicarbonilalquilcarbonilo C1-6 o benzoilo;
siempre que R6, R7 y R8 no sean H simultáneamente;
o la sal farmacéuticamente aceptable, enantiómero o diastereómero del mismo.
11. Un compuesto de acuerdo con la reivindicación 10 seleccionado de:
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]pentanamida;
N-[[6-amino-9-[(4-clorofenil)metil]-8-oxo-7H-purin-2-il]-oxo-propil-A4-sulfanilideno]acetamida;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-metil-oxo-A4-sulfanilideno]acetamida;
ácido 4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico;
ácido 4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico;
ácido 4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoico;
4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-3-oxo-butanoato de etilo;
4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoato de etilo;
4-[[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]amino]-4-oxo-butanoato de etilo;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanylidene]benzamida;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]benzamida;
N-[(6-amino-9-bencil-8-oxo-7H-purin-2-il)-oxo-propil-A4-sulfanilideno]benzamida;
9-bencil-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
6-(etilamino)-9-[(6-metil-3-piridil)metil]-2-(S-propilsulfonimidoil)-7H-purin-8-ona;
9-[(4-clorofenil)metil]-6-(etilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
9-bencil-6-(propilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
9-bencil-6-(isopropilam ino)-2-(propilsulfonim idoil)-7H-purin-8-ona;
9-bencil-6-(ciclopropilamino)-2-(propilsulfonimidoil)-7H-purin-8-ona;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]acetamida;
N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il] pentanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-etilbutanamida;
N-[9-[(4-clorofenil) metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-3-metil-butanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-metil-pentanamida;
N-[9-[(4-clorofenil)metil]-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2,2-dimetil-propanamida;
N-[9-bencil-8-oxo-2-(propilsulfonimidoil)-7H-purin-6-il]-2-propil-pentanamida;
acetato de [6-amino-9-bencil-2-(metilsulfonimidoil)-8-oxo-purin-7-il]metilo;
acetato de [6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]metilo;
[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]metil2,2-dimetilpropanoato; y
acetato de 1 -[6-amino-9-bencil-8-oxo-2-(propilsulfonimidoil)purin-7-il]etilo.
12. Un procedimiento para la preparación de un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 11 que comprende las siguientes etapas:
(a) la reacción de un compuesto de fórmula (IIa),
(b) la reacción de un compuesto de fórmula (IIb),
con un reactivo de iminación; en la que Ra es R1 o R4, Rb es R2 o R5, R7 es alquilo C1-6 o cicloalquilo C3-7;
(c) la reacción de un compuesto de fórmula (IIIc),
con un oxidante seguido de un reactivo de iminación, en la que Ra es R1 o R4, Rb es R2 o R5, R12 es alquilo C1-10; (d) la reacción de un compuesto de fórmula (I IIa),
con un oxidante seguido de un reactivo de iminación, en la que Ra es R1 o R4, Rb es R2 o R5;
(e) la reacción de un compuesto de fórmula (Ie),
(f) la reacción de un compuesto de fórmula (Ie),
en la que R1, R2, R4 y R5 se definen como en una cualquiera de las reivindicaciones 1 a 29.
13. Un compuesto o sal farmacéuticamente aceptable, enantiómero o diastereómero de acuerdo con una cualquiera de las reivindicaciones 1 a 11 para su uso como sustancia terapéuticamente activa.
14. Una composición farmacéutica que comprende un compuesto de acuerdo con una cualquiera de las reivindicaciones 1 a 11 y un vehículo terapéuticamente inerte.
15. Un compuesto o sal farmacéuticamente aceptable, enantiómero o diastereómero de acuerdo con una cualquiera de las reivindicaciones 1 a 11 para su uso en el tratamiento o profilaxis de la infección por el virus de la hepatitis B.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2015078507 | 2015-05-08 | ||
| CN2016078785 | 2016-04-08 | ||
| PCT/EP2016/059961 WO2016180695A1 (en) | 2015-05-08 | 2016-05-04 | Novel sulfonimidoylpurinone compounds and derivatives for the treatment and prophylaxis of virus infection |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2753777T3 true ES2753777T3 (es) | 2020-04-14 |
Family
ID=55910966
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES16720421T Active ES2753777T3 (es) | 2015-05-08 | 2016-05-04 | Compuestos novedosos de sulfonimidoilpurinona y derivados para el tratamiento y la profilaxis de infecciones víricas |
Country Status (33)
| Country | Link |
|---|---|
| US (3) | US9708325B2 (es) |
| EP (1) | EP3294740B1 (es) |
| JP (1) | JP6738352B2 (es) |
| KR (1) | KR102690131B1 (es) |
| CN (1) | CN107580596B (es) |
| AR (1) | AR104528A1 (es) |
| AU (3) | AU2016260683B2 (es) |
| BR (1) | BR112017023959B1 (es) |
| CA (1) | CA2982704C (es) |
| CL (1) | CL2017002745A1 (es) |
| CO (1) | CO2017009994A2 (es) |
| CR (1) | CR20170496A (es) |
| DK (1) | DK3294740T3 (es) |
| ES (1) | ES2753777T3 (es) |
| HK (1) | HK1247925A1 (es) |
| HR (1) | HRP20191942T1 (es) |
| HU (1) | HUE045906T2 (es) |
| IL (2) | IL254947B (es) |
| LT (1) | LT3294740T (es) |
| MX (2) | MX376761B (es) |
| MY (1) | MY182353A (es) |
| NZ (2) | NZ775222A (es) |
| PE (1) | PE20171620A1 (es) |
| PH (1) | PH12017502009A1 (es) |
| PL (1) | PL3294740T3 (es) |
| PT (1) | PT3294740T (es) |
| RS (1) | RS59435B1 (es) |
| RU (1) | RU2745269C2 (es) |
| SG (1) | SG10202108841YA (es) |
| SI (1) | SI3294740T1 (es) |
| TW (2) | TWI768467B (es) |
| UA (1) | UA120450C2 (es) |
| WO (1) | WO2016180695A1 (es) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ775222A (en) | 2015-05-08 | 2024-09-27 | Hoffmann La Roche | Novel sulfonimidoylpurinone compounds and derivatives for the treatment and prophylaxis of virus infection |
| MX2019002129A (es) * | 2016-08-29 | 2019-06-20 | Hoffmann La Roche | Nuevos compuestos sulfonimidoilpurinona 7-sustituidos y derivados para el tratamiento y la profilaxis de la infeccion virica. |
| CA3034185A1 (en) * | 2016-09-13 | 2018-03-22 | F. Hoffmann-La Roche Ag | Combined treatment with a tlr7 agonist and an hbv capsid assembly inhibitor |
| JP7328977B2 (ja) | 2018-02-12 | 2023-08-17 | エフ. ホフマン-ラ ロシュ アーゲー | ウイルス感染の処置および予防のための新規のスルホン化合物および誘導体 |
| BR112020016509A2 (pt) * | 2018-02-28 | 2020-12-15 | F. Hoffmann-La Roche Ag | Composto, composto para uso no tratamento ou profilaxia do câncer de fígado, composição farmacêutica ou medicamento, uso e método para o tratamento ou profilaxia do câncer de fígado |
| CN111072667A (zh) * | 2018-10-22 | 2020-04-28 | 罗欣药业(上海)有限公司 | 五元或六元杂环并嘧啶类化合物及其用途 |
| US20220226488A1 (en) * | 2019-02-12 | 2022-07-21 | Ambrx, Inc. | Compositions containing, methods and uses of antibody-tlr agonist conjugates |
| CN114450280B (zh) | 2019-09-20 | 2025-02-25 | 先正达农作物保护股份公司 | 具有含硫和亚砜亚胺取代基的杀有害生物活性杂环衍生物 |
| CN119604517A (zh) | 2022-07-14 | 2025-03-11 | 豪夫迈·罗氏有限公司 | 用于治疗癌症的磷酰基嘌呤酮化合物 |
| CN118724963A (zh) * | 2023-03-30 | 2024-10-01 | 浙江养生堂天然药物研究所有限公司 | 含磷或含硫的大环化合物及其用途 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4189048B2 (ja) | 1997-12-26 | 2008-12-03 | 大日本住友製薬株式会社 | 複素環化合物 |
| EA200702235A1 (ru) | 2005-05-04 | 2008-04-28 | Пфайзер Лимитед | Производные 2-амидо-6-амино-8-оксопурина в качестве модуляторов toll-подобных рецепторов для лечения рака и вирусных инфекций, таких как гепатит с |
| CN101239980B (zh) | 2008-02-18 | 2011-06-22 | 靳广毅 | 免疫受体调节剂偶联体前体和偶联体及其应用 |
| AP2011005745A0 (en) * | 2008-12-09 | 2011-06-30 | Gilead Sciences Inc | Modulators of toll-like receptors. |
| WO2011079016A1 (en) | 2009-12-22 | 2011-06-30 | Gilead Sciences, Inc. | Methods of treating hbv and hcv infection |
| TW201636330A (zh) * | 2011-05-24 | 2016-10-16 | 拜耳知識產權公司 | 含有硫醯亞胺基團之4-芳基-n-苯基-1,3,5-三氮雜苯-2-胺 |
| AU2012334127B2 (en) | 2011-11-09 | 2017-05-18 | Janssen Sciences Ireland Uc | Purine derivatives for the treatment of viral infections |
| JP6336036B2 (ja) | 2013-03-29 | 2018-06-06 | ヤンセン・サイエンシズ・アイルランド・ユーシー | ウイルス感染治療のための大環状デアザプリノン |
| PT3190113T (pt) | 2014-08-15 | 2021-06-17 | Chai Tai Tianqing Pharmaceutical Group Co Ltd | Compostos pirrolopirimidina utilizados como agonistas de tlr7 |
| NZ775222A (en) * | 2015-05-08 | 2024-09-27 | Hoffmann La Roche | Novel sulfonimidoylpurinone compounds and derivatives for the treatment and prophylaxis of virus infection |
| MX2019002129A (es) * | 2016-08-29 | 2019-06-20 | Hoffmann La Roche | Nuevos compuestos sulfonimidoilpurinona 7-sustituidos y derivados para el tratamiento y la profilaxis de la infeccion virica. |
-
2016
- 2016-05-04 NZ NZ775222A patent/NZ775222A/en unknown
- 2016-05-04 PE PE2017002102A patent/PE20171620A1/es unknown
- 2016-05-04 PL PL16720421T patent/PL3294740T3/pl unknown
- 2016-05-04 LT LT16720421T patent/LT3294740T/lt unknown
- 2016-05-04 BR BR112017023959-0A patent/BR112017023959B1/pt active IP Right Grant
- 2016-05-04 PT PT167204213T patent/PT3294740T/pt unknown
- 2016-05-04 CR CR20170496A patent/CR20170496A/es unknown
- 2016-05-04 KR KR1020177035298A patent/KR102690131B1/ko active Active
- 2016-05-04 AU AU2016260683A patent/AU2016260683B2/en active Active
- 2016-05-04 EP EP16720421.3A patent/EP3294740B1/en active Active
- 2016-05-04 MX MX2017014033A patent/MX376761B/es active IP Right Grant
- 2016-05-04 UA UAA201712023A patent/UA120450C2/uk unknown
- 2016-05-04 WO PCT/EP2016/059961 patent/WO2016180695A1/en active Application Filing
- 2016-05-04 ES ES16720421T patent/ES2753777T3/es active Active
- 2016-05-04 HU HUE16720421A patent/HUE045906T2/hu unknown
- 2016-05-04 DK DK16720421T patent/DK3294740T3/da active
- 2016-05-04 MY MYPI2017704175A patent/MY182353A/en unknown
- 2016-05-04 RU RU2017142577A patent/RU2745269C2/ru active
- 2016-05-04 CN CN201680026493.3A patent/CN107580596B/zh active Active
- 2016-05-04 SG SG10202108841YA patent/SG10202108841YA/en unknown
- 2016-05-04 MX MX2020010949A patent/MX2020010949A/es unknown
- 2016-05-04 RS RSP20191351 patent/RS59435B1/sr unknown
- 2016-05-04 CA CA2982704A patent/CA2982704C/en active Active
- 2016-05-04 JP JP2017558397A patent/JP6738352B2/ja active Active
- 2016-05-04 NZ NZ735648A patent/NZ735648A/en not_active IP Right Cessation
- 2016-05-04 SI SI201630473T patent/SI3294740T1/sl unknown
- 2016-05-05 AR ARP160101278A patent/AR104528A1/es unknown
- 2016-05-06 TW TW109131169A patent/TWI768467B/zh active
- 2016-05-06 TW TW105114192A patent/TWI706954B/zh active
- 2016-05-06 US US15/148,309 patent/US9708325B2/en active Active
-
2017
- 2017-06-13 US US15/621,080 patent/US10399983B2/en active Active
- 2017-09-29 CO CONC2017/0009994A patent/CO2017009994A2/es unknown
- 2017-10-09 IL IL254947A patent/IL254947B/en active IP Right Grant
- 2017-10-30 CL CL2017002745A patent/CL2017002745A1/es unknown
- 2017-11-03 PH PH12017502009A patent/PH12017502009A1/en unknown
-
2018
- 2018-06-07 HK HK18107428.7A patent/HK1247925A1/zh unknown
-
2019
- 2019-08-02 US US16/530,229 patent/US11242345B2/en active Active
- 2019-10-24 HR HRP20191942TT patent/HRP20191942T1/hr unknown
-
2020
- 2020-10-14 AU AU2020256348A patent/AU2020256348B2/en active Active
-
2021
- 2021-02-09 IL IL280769A patent/IL280769B2/en unknown
-
2022
- 2022-06-29 AU AU2022204666A patent/AU2022204666A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2753777T3 (es) | Compuestos novedosos de sulfonimidoilpurinona y derivados para el tratamiento y la profilaxis de infecciones víricas | |
| US10604527B2 (en) | Pyrazine compounds for the treatment of hepatitis B infection | |
| JP6936848B2 (ja) | 感染症の治療のための新規テトラヒドロピラゾロピリジン化合物 | |
| US10457687B2 (en) | Aminoacid derivatives, a process for their preparation and pharmaceutical compositions containing them | |
| RU2380101C2 (ru) | Бициклические пиримидины, ингибирующие hcv | |
| RU2540332C2 (ru) | Бициклические азотсодержащие гетероциклические соединения, полезные при лечении гепатита с | |
| ES2622583T3 (es) | 4-(Orto)-fluorofenil-5-fluoropirimidin-2-ilaminas que contienen un grupo sulfoximina | |
| AU2011269788B2 (en) | Imidazo[1,2-b][1,2,4]triazines as c-Met inhibitors | |
| KR20150092279A (ko) | 암의 치료를 위한 신규한 2-고리 페닐-피리딘/피라진 | |
| CN105418616B (zh) | 一种含有 4‑氨基吡唑结构的jak 激酶抑制剂及其制备方法和应用 | |
| WO2021063852A1 (en) | Substituted pyrimidine for the treatment and prophylaxis of hepatitis b virus infection | |
| KR20230074762A (ko) | 사이클린-의존성 키나제 7(cdk7) 비-공유 저해제 | |
| KR20180025928A (ko) | 인간 면역결핍 바이러스 복제의 억제제로서 피리딘-3-일 아세트산 유도체 | |
| CN107406452B (zh) | 吡唑并[3,4-d]嘧啶衍生物及其治疗利什曼病的用途 | |
| JP2021512927A (ja) | ウイルス感染の処置および予防のための新規のスルホン化合物および誘導体 |