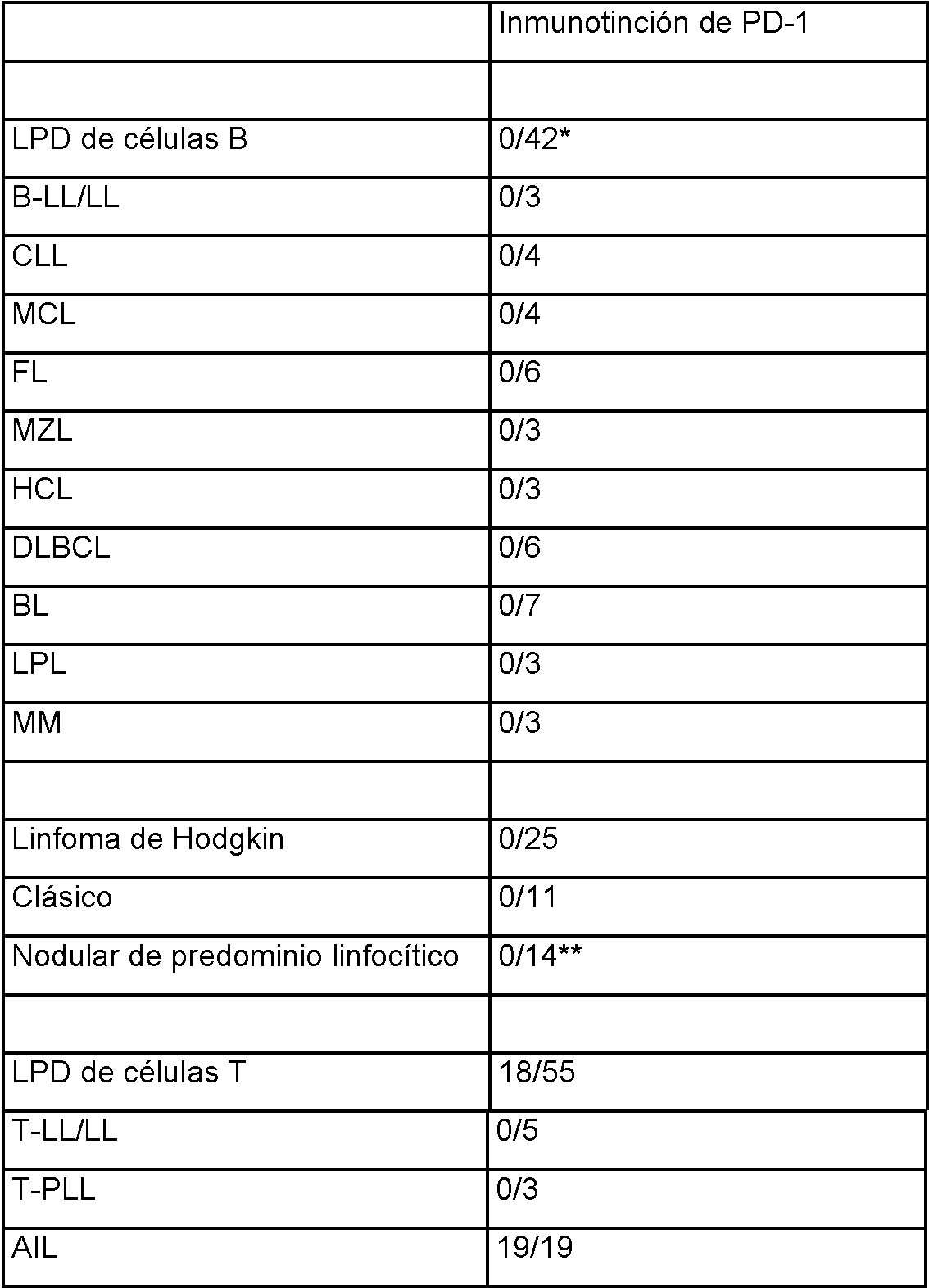
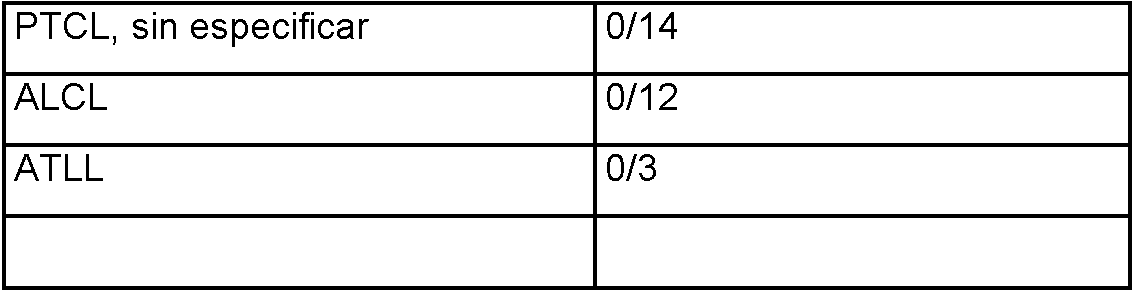
ES2397355T5 - Métodos y composiciones para el tratamiento de infecciones persistentes y cáncer por inhibición de la vía de muerte celular programada (PD-1) - Google Patents
Métodos y composiciones para el tratamiento de infecciones persistentes y cáncer por inhibición de la vía de muerte celular programada (PD-1) Download PDFInfo
- Publication number
- ES2397355T5 ES2397355T5 ES06784684T ES06784684T ES2397355T5 ES 2397355 T5 ES2397355 T5 ES 2397355T5 ES 06784684 T ES06784684 T ES 06784684T ES 06784684 T ES06784684 T ES 06784684T ES 2397355 T5 ES2397355 T5 ES 2397355T5
- Authority
- ES
- Spain
- Prior art keywords
- compound
- cells
- lymphocytes
- infection
- expression
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/06—Antibacterial agents for tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5011—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing antineoplastic activity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5047—Cells of the immune system
- G01N33/505—Cells of the immune system involving T-cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57492—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving compounds localized on the membrane of tumor or cancer cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55516—Proteins; Peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/74—Inducing cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/26—Infectious diseases, e.g. generalised sepsis
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Cell Biology (AREA)
- Biochemistry (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Genetics & Genomics (AREA)
- Food Science & Technology (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Tropical Medicine & Parasitology (AREA)
- Biophysics (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Mycology (AREA)
- Toxicology (AREA)
- Hospice & Palliative Care (AREA)
Description
DESCRIPCIÓN
Métodos y composiciones para el tratamiento de infecciones persistentes y cáncer por inhibición de la vía de muerte celular programada (PD-1)
Declaración relativa al Patrocinio federal de la investigación
La presente invención se realizó con las ayudas del Gobierno de los Estados Unidos de América, en virtud de las subvenciones de los Institutos Nacionales de la Salud (NIH) siguientes: AI39671 y CA84500. El Gobierno posee determinados derechos sobre la invención.
Campo de la invención
En general, la presente invención se refiere a métodos y composiciones para el tratamiento de infecciones persistentes.
Antecedentes de la invención
A pesar de que el desarrollo de vacunas preventivas ha reducido notablemente el índice de mortalidad por infecciones víricas, el uso de estas vacunas frente a virus que causan infecciones persistente (por ejemplo, el virus de la hepatitis C) ha tenido un éxito limitado. A diferencia de los virus que causan infecciones agudas y autolimitadas, la respuesta inmunitaria que se produce contra los microbios que provocan infecciones persistentes suele ser transitoria e insuficiente para erradicar la infección. Como resultado, el microbio infeccioso permanece en el sujeto infectado durante largos períodos de tiempo, sin causar necesariamente daños constantes en el huésped. Un importante impedimento para la erradicación de microbios que causan infecciones persistentes es la capacidad de estos microbios para eludir el sistema inmunitario del organismo hospedador. Por ejemplo, determinados virus y parásitos regulan a la baja la expresión de moléculas del huésped necesarias para un eficiente reconocimiento de los linfocitos T de las células infectadas. Las infecciones persistentes también provocan una alteración funcional de los linfocitos T CD8+ específicos de antígeno, que son fundamentales para el control y la erradicación de las infecciones víricas. A pesar de que la combinación de vacunas terapéuticas con citoquinas adyuvantes ha sido prometedora, las respuestas inmunitarias resultantes no han erradicado con éxito el patógeno.
Por tanto, se necesitan métodos mejores para tratar las infecciones persistentes.
Resumen de la invención
La presente invención proporciona compuestos para su uso en el tratamiento de una infección persistente por VIH. La invención se basa en el descubrimiento de que los linfocitos T CD8+ específicos de antígeno se vuelven funcionalmente tolerantes («se agotan») frente al agente infeccioso tras la introducción del polipéptido de muerte programada 1 (PD-1). Por consiguiente, al reducir la actividad de PD-L1, la proliferación de linfocitos T CDS+ funcionalmente tolerantes, la producción de citoquinas y la tasa de eliminación de VIH se incrementan de forma que la respuesta inmunitaria específica para el agente infeccioso mejora.
La divulgación proporciona un método para aliviar un síntoma de una infección persistente (por ejemplo, una infección vírica, una infección bacteriana, una infección fúngica, una infección micoplásmica y una infección parasitaria) o del cáncer, administrando a un sujeto que lo necesita (por ejemplo, un ser humano) un compuesto que reduce la actividad o la expresión de un miembro de la familia similar a CD28 (por ejemplo, PD-1, CTLA-4, BTLA y un fragmento o variante funcional de los mismos) o ligandos de la familia similar a c D28 (por ejemplo, PD-L1 o PD-L2). Alternativamente, al sujeto se le administra un linfocito B o un linfocito T específico de antígeno que ha estado en contacto con un compuesto que reduce la expresión o la actividad de un polipéptido PD-1 de la célula. Por ejemplo, el linfocito B o el linfocito T específico de antígeno es específico de un antígeno vírico. El linfocito B o el linfocito T se obtiene de una fuerte autóloga o de otro sujeto de la misma especie o de una especie diferente que el sujeto a tratar.
Por otra parte, la divulgación incluye un método para incrementar la actividad citotóxica de un linfocito T (por ejemplo, un linfocito T anérgico o un linfocito T que presenta una tolerancia mayor a los antígenos), poniendo en contacto el linfocito T con un compuesto que reduce la actividad o la expresión de un polipéptido PD-1.
En todos los aspectos anteriores, las infecciones víricas persistentes resultan de infecciones como un virus de la hepatitis, un virus de la inmunodeficiencia humana (VIH), un virus linfotrópico de células T humano (HTLV), un herpesvirus, un virus de Epstein-Barr o un virus del papiloma humano. Las infecciones víricas persistentes también pueden incluir infecciones causadas por un virus latente. Los cánceres incluyen trastornos linfoproliferativos como el linfoma angioinmunoblástico y el linfoma de Hodgkin nodular de predominio linfocítico. Es conveniente que el compuesto aumente la respuesta inmunitaria específica del antígeno mediante un incremento de la actividad de los linfocitos T citotóxicos (por ejemplo, un incremento de la producción de citoquinas citotóxicas como IFNy, TNFa, o IL-2, un incremento de la proliferación de células T o un incremento de la eliminación vírica) en el sujeto a tratar. Por ejemplo, el compuesto reduce la expresión o actividad de un ligando PD de tipo 1 (PD-L1) o un ligando PD de tipo 2
(PD-L2) o reduce la interacción entre PD-1 y PD-L1 o la interacción entre PD-1 y PD-L2. Algunos ejemplos de compuestos incluyen anticuerpos (como un anticuerpo contra PD-1, un anticuerpo contra PD-L1 y un anticuerpo contra PD-L2), moléculas de ARNi (por ejemplo, moléculas de ARNi contra PD-1, ARNi contra PD-L1 y ARNi contra PD-L2), moléculas antisentido (por ejemplo un ARN antisentido contra PD-1, un ARN antisentido contra PD-L1 y un ARN antisentido contra PD-L2), proteínas dominantes negativas (por ejemplo, una proteína dominante negativa de PD-1, una proteína dominante negativa de PD-L1 y una proteína dominante negativa de PD-L2) y moléculas pequeñas inhibidoras. Los anticuerpos incluyen anticuerpos monoclonales, anticuerpos humanizados, anticuerpos desinmunizados y proteínas de fusión de Ig. Un ejemplo de anticuerpo contra PD-L1 incluye el clon EH12.
Además del compuesto que reduce la actividad o expresión de PD-1, al sujeto a tratar también se le administra una vacuna que puede incluir o no un adyuvante o una dosis de refuerzo principal. Opcionalmente, al sujeto se le administra un segundo compuesto, como un compuesto antivírico (por ejemplo, vidarabina, aciclovir, ganciclovir, valganciclovir, inhibidor de la transcriptasa inversa análogo de los nucleótidos (NRTI), como AZT (zidovudina), ddI (didanosina), ddC (zalcitabina), d4T (estavudina) o 3TC (lamivudina), inhibidor de la transcriptasa inverso no análogo de los nucleótidos (NNRTI), como nevirapina o delavirdina, inhibidor de la proteasa como saquinavir, ritonavir, indinavir o nelfinavir, ribavirina e interferón), un compuesto antibacteriano, un compuesto antifúngico, un compuesto antiparasitario, un compuesto antiinflamatorio, compuestos antineoplásicos o un analgésico. El segundo compuesto también puede ser un compuesto que reduce la expresión o actividad del antígeno 4 asociado al linfocito T citotóxico (CTLA-4) o del atenuador de los linfocitos B y T (BTLA). Otros ejemplos de compuestos que se pueden administrar al sujeto son anticuerpos contra CTLA-4, anticuerpos contra BTLA, anticuerpos contra CD28, anticuerpos contra ICOS, anticuerpos contra ICOS-L, anticuerpos contra B7-I, anticuerpos contra B7-2, anticuerpos contra B7-H3, anticuerpos contra B7-H4.
La presente divulgación proporciona también un método para identificar un compuesto candidato que modula la actividad o expresión de un polipéptido PD-1 que incluye los pasos siguientes: (a) poner en contacto una célula que expresa un gen PD-1 (por ejemplo, un gen de fusión de PD-1) con un compuesto candidato; (b) medir la expresión o actividad de PD-1 en la célula (por ejemplo, midiendo la expresión de la proteína o el ARNm de PD-1); y (c) comparando la expresión o actividad de PD-1 en la célula con esa expresión o actividad en una célula de control que no ha estado en contacto con el compuesto. Un incremento o una disminución de la expresión o actividad de PD-1 indica que el compuesto candidato es útil para modular la actividad o expresión de un polipéptido PD-1.
Alternativamente, el método de detección puede implicar los pasos siguientes: (a) poner en contacto un linfocito T que presenta una sobreexpresión de un gen PD-1 con un compuesto candidato; y (b) determinar la actividad citotóxica del linfocito T; (c) comparando la actividad citotóxica del linfocito T con respecto a la actividad en una célula de control que no ha estado en contacto con el compuesto. Un incremento o una disminución de esta actividad indica que el compuesto candidato es útil para modular la actividad o expresión de un polipéptido PD-1. La actividad citotóxica incluye la producción de citoquina, la proliferación de linfocitos T y la eliminación vírica.
La divulgación proporciona también un método de detección que implica los pasos siguientes: (a) poner en contacto un polipéptido PD-1 con un compuesto candidato; (b) determinar si el compuesto candidato interactúa con el polipéptido PD-1; y (c) identificar si un compuesto candidato es útil para modular la actividad o expresión de PD-1. Es conveniente que el compuesto candidato identificado interactúe con el polipéptido PD-1 y que reduzca su actividad.
El compuesto candidato identificado mediante los métodos de detección descritos en el presente puede reducir la interacción entre PD-1 y PD-L1 o la interacción entre PD-1 y PD-L2. La célula empleada en cualquiera de los métodos de detección descritos en el presente incluye células de mamíferos, como células de roedores o células humanas. La célula es una célula inmunitaria, como un linfocito T. Es recomendable que el polipéptido PD-2 empleado en estos métodos de detección sea un polipéptido PD-1 humano.
En el presente también se proporciona un método para diagnosticar que un sujeto presenta o corre el riesgo de presentar una infección persistente o un cáncer, que implica los pasos siguientes: (a) proporcionar una muestra que contiene células inmunitarias (por ejemplo, linfocitos T o B) de un sujeto, y (b) medir la expresión o actividad de PD-1 en la muestra. Un incremento en la expresión o actividad de PD-1 en comparación con esa expresión o actividad en una muestra de control indica que el sujeto presenta o corre el riesgo de presentar una infección permanente o cáncer. Resulta recomendable que el paso (b) implique la identificación de células inmunitarias de antígeno específico, como un antígeno vírico, un antígeno bacteriano, un antígeno parasitario o un antígeno fúngico.
También se describe un método para seleccionar un tratamiento para un sujeto que presenta o corre el riesgo de presentar una infección persistente o cáncer. Este método implica los pasos siguientes: (a) proporcionar una muestra que contiene células inmunitarias (por ejemplo, linfocitos T o B) de un sujeto; y (b) medir la expresión o actividad de PD-1 en las células inmunitarias, de forma que un incremento de la expresión o actividad de PD-1 en comparación con esa expresión o actividad en una muestra de control indica que el sujeto presenta o corre el riesgo de presentar una infección permanente o cáncer; y (c) seleccionar un tratamiento para el sujeto al que se diagnostica que presenta o corre el riesgo de presentar una infección persistente o cáncer, de forma que el tratamiento incluya un compuesto que reduce la expresión o actividad de PD-1. Es recomendable que el paso (b)
implique la identificación de células inmunitarias de antígeno específico, como un antígeno vírico, un antígeno bacteriano, un antígeno parasitario o un antígeno fúngico.
Las muestras obtenidas de los sujetos incluyen muestras de sangre, biopsias de tejido y biopsias de médula ósea. Por otra parte, las células de control se pueden obtener de un sujeto que no presenta ni corre el riesgo de presentar infección persistente.
Esta divulgación proporciona también una composición que contiene: (a) un compuesto que reduce el nivel o la actividad de PD-1; y (b) un segundo compuesto, como un compuesto antivírico, un compuesto antibacteriano, un compuesto antifúngico, un compuesto antiparasitario, un compuesto antiinflamatorio, un compuesto analgésico, un anticuerpo contra CTLA-4, un anticuerpo contra BTLA, un anticuerpo contra CD28, un anticuerpo contra ICOS, un anticuerpo contra ICOS-L, un anticuerpo contra B7-I, un anticuerpo contra B7-2, un anticuerpo contra B7-H3, o un anticuerpo contra B7-H4.
La divulgación proporciona también un kit que contiene (a) un compuesto que reduce el nivel o la actividad de PD-1; e (b) instrucciones para la administración del compuesto a un sujeto. Alternativamente, el kit contiene (a) un primer compuesto que reduce el nivel o la actividad de PD-1; y (b) un segundo compuesto, como un compuesto antivírico, un compuesto antibacteriano, un compuesto antifúngico, un compuesto antiparasitario, un compuesto antiinflamatorio, un compuesto analgésico, un anticuerpo contra CTLA-4, un anticuerpo contra BTLA, un anticuerpo contra CD28, un anticuerpo contra ICOS, un anticuerpo contra ICOS-L, un anticuerpo contra B7-I, un anticuerpo contra B7-2, un anticuerpo contra B7-H3, o un anticuerpo contra B7-H4; así como (c) instrucciones para la administración del primer compuesto y del segundo compuesto a un sujeto.
La presente invención ofrece significativas ventajas sobre las terapias estándar para el tratamiento y reducción, o alternativamente, el alivio de uno o más síntomas de las infecciones persistentes. La administración del agente terapéutico que reduce el nivel o la actividad de PD-1 incrementa la citotoxicidad de los linfocitos T CD8+, aumentando a su vez la respuesta inmunitaria frente al agente infeccioso que tiene la capacidad de establecer una infección persistente. Por otra parte, los métodos de detección del compuesto candidato permiten la identificación de nuevos agentes terapéuticos que modifican el proceso de lesión, en lugar de limitarse a mitigar los síntomas.
A menos que se defina lo contrario, todos los términos técnicos y científicos empleados en el presente tienen el significado que normalmente entendería una persona cualificada en el campo al que pertenece la presente invención. A pesar de que se pueden emplear métodos y materiales similares o equivalentes a los descritos en el presente para la práctica o prueba de la presente invención, a continuación se describen métodos y materiales apropiados. En caso de conflicto, prevalecerá la presente especificación, incluyendo las definiciones. Por otra parte, los materiales, métodos y ejemplos se ofrecen únicamente a título ilustrativo y no pretenden tener un carácter limitador.
Otras características y ventajas de la invención se pondrán de manifiesto en las siguientes reivindicaciones y descripciones detalladas.
Breve descripción de las ilustraciones
La Figura 1A es un gráfico de barras que muestra los niveles de ARNm de PD-1 en linfocitos T específicos de DbGP33-41 y/o DbGP276-286 de ratón transgénico que no ha recibido tratamiento previo: un ratón infectado inmune a la enfermedad de Armstrong producida por el virus de la coriomeningitis linfocítica (LCMV) (unos 30 días después de la infección), o un ratón infectado por LCMV-C1-13 con bajos niveles de CD4 (aproximadamente 30 días después de la infección), medidos por un análisis de matriz génica.
La Figura 1B es una serie de imágenes de un experimento de citometría de flujo que muestra la expresión de superficie de PD-1 en linfocitos T CD8+ de tetrámero positivo en un ratón infectado inmune a la enfermedad de Armstrong por LCMV y un ratón infectado por LCMV-Cl-13 con bajos niveles de CD4, aproximadamente 60 días después de la infección. Los linfocitos T CD8+ anérgicos expresan elevados niveles del polipéptido PD-1 en la superficie celular unos 60 días después de la infección crónica por el virus LCMV-CI-13 (indicada como «crónica»), pero los linfocitos T CD8+ de virus específico no expresan el polipéptido PD-1 después de la eliminación de una infección aguda de la enfermedad de Armstrong por LCMV (indicada como «inmune»).
La Figura 1C es una serie de imágenes de un experimento de citometría de flujo que demuestra la presencia de PD-L1 o esplenocitos del ratón con infección crónica y del ratón no infectado. Demuestra que la expresión de PD-L1 es máxima en los esplenocitos que están infectados por el virus.
La Figura 2A es una serie de diagramas de dispersión que muestran que cuando el ratón infectado por CI-13 es tratado entre 23 y 37 días después de la infección, se produce un incremento del número de linfocitos T CD8 específicos de DbNP396-404 y específicos DbGP33-41 que prácticamente triplica al de los controles sin tratar. A fin de determinar cualquier cambio en la función, se midió la producción de IFN-y y TNF-a en respuesta a ocho epítopos de LCMV diferentes.
La Figura 2B es un diagrama de dispersión que muestra que cuando se miden todas las especificidades conocidas del linfocito T CD8, el número total de linfocitos T CD8 específicos de LCMV se multiplica por 2,3.
La Figura 2C es una serie de gráficos de citometría de flujo que muestra la producción de IFN-y y TNF-a en respuesta a ocho epítopos de LCMV diferentes.
La Figura 2D es un diagrama de dispersión que muestra que un número mayor de linfocitos T CD8 de virus específico en el ratón tratado tiene la capacidad para producir TNF-a.
La Figura 2E es una serie de gráficos de barras que muestran que el bloqueo de PD-L1 también se tradujo en un mayor control vírico en el bazo, el hígado, el pulmón y el suero.
La Figura 3A es un gráfico que demuestra el incremento de los linfocitos T CD8+ específicos de DbGP33-41 y DbGP276-286 (indicados como «GP33» y «GP276») en el ratón infectado por CI-13 con bajos niveles de Cd4 tratado con anti-PD-LI (indicado como «aPD-L1») entre los días 46 y 60 después de la infección, frente al control (indicado como «untx»), lo que demuestra que el ratón tratado con anti-PD-LI contenía aproximadamente siete veces más linfocitos T CD8+ esplénicos específicos de DbGP276-286 y aproximadamente cuatro veces más linfocitos T CD8+ esplénicos específicos de DbGP33-41 que los ratones sin tratar.
La Figura 3B es una serie de imágenes que demuestran la frecuencia incrementada de linfocitos T CD8+ específicos de DbGP33-41 y DbGP276-286 en el bazo del ratón infectado por CI-13 con bajos niveles de CD4 tratado con anti-PD-LI (indicado como «aPD-L1 Tx») entre los días 46 y 60 después de la infección frente al control (indicado como «untx»).
La Figura 3C es una serie de imágenes que demuestran una proliferación aumentada de linfocitos T CD8+ específicos de DbGP276-286 en el ratón tratado contra PD-L1, medido por la incorporación de BrdU y la expresión Ki67.
La Figura 3D es un gráfico que muestra que el ratón que presenta elevados niveles de expansión de linfocitos T CD8+ demuestra una respuesta apreciable en las células mononucleares de la sangre periférica (PBMC), tal y como se observa al comparar los linfocitos CD8+ específicos de DbGP276-286 en las PBMC con los linfocitos T CD8+ específicos de DbGP276-286 en el bazo.
La Figura 4A es una serie de gráficos que demuestran el incremento de linfocitos T CD8+ específicos de DbGP276-286 y DbGP33-41 que producen IFN-y en el ratón tratado contra PD-L1, en comparación con los controles. También se detectaron mayores frecuencias de linfocitos T CD8+ específicos de DbNP396-404, KbNP205-212, DbNP166-175, y DbGP92-101 en el ratón tratado contra PD-L1.
La Figura 4B es un gráfico que demuestra que en el ratón tratado contra PD-L1, el 50% de los linfocitos T CD8+ específicos de DbGP276-286 produce IFN-y, en comparación con el 20% de linfocitos T CD8+ específicos de DbGP276-286 del ratón de control.
La Figura 4C es una serie de imágenes que demuestran que un ratón crónicamente infectado tratado contra PD-L1 produce unos niveles superiores de TNF-a que el ratón crónicamente infectado sin tratar, aunque unos niveles inferiores de TNF-a que el ratón inmune infectado por el virus de la enfermedad de Armstrong LCMV.
La Figura 4D es un gráfico que demuestra que el tratamiento del ratón infectado por LCMV-C1-13 con anti-PD-LI renueva la actividad lítica ex vivo de los linfocitos T de virus específico, en comparación con el ratón infectado sin tratar, medido utilizando un ensayo de liberación de cromo 51 (51Cr).
La Figura 4E es una serie de gráficos que demuestran la reducción de títulos víricos en diversos órganos tras el tratamiento del ratón infectado por LCMV-CI-13 con a-PD-L1. Las cifras de reducción de los títulos víricos se multiplicaron aproximadamente por tres en el bazo, por cuatro en el hígado, por dos en el pulmón y por dos en el suero, después de dos semanas de tratamiento contra PD-L1, en comparación con el ratón no tratado.
La Figura 5A es una serie de imágenes de un experimento de citometría de flujo que muestra la expresión superficial de PD-1 utilizando 10 tetrámeros del VIH específicos para epítopos dominantes seleccionados en la infección crónica por VIH subtipo C. Los porcentajes indican el porcentaje de células de tetrámero positivo que son PD-1+. La Figura 5B es una serie de gráficos que demuestran que el porcentaje y MFI de PD-1 se ve notablemente regulado al alza en los linfocitos T CD8 específicos del VIH en comparación con la población total de linfocitos T CD8 (p<0,0001) en individuos que no han recibido terapia antirretroviral, y PD-1 se incrementa en la población total de linfocitos T CD8 en los individuos infectados por VIH frente a los controles seronegativos (p=0,0033 y p<0,0001, respectivamente). En el análisis se incluyeron 120 tinciones de tetrámeros del VIH de 65 individuos infectados por el VIH y 11 controles seronegativos.
La Figura 5C es una serie de gráficos que muestran el porcentaje medio y MFI de la expresión de PD-1 en las células de tetrámero positivo por la especificidad del epítopo.
La Figura 5D es un gráfico que ilustra la variación en el porcentaje de células PD-1+ en diferentes poblaciones de epítopo específico dentro de individuos con múltiples respuestas detectables. Las barras horizontales indican el porcentaje medio de células de tetrámero positivo del VIH PD-1+ en cada individuo.
La Figura 6A es una serie de gráficos que demuestran que no existe ninguna correlación entre el número de linfocitos T CD8 específicos del VIH, medida mediante tinción de tetrámeros, y la carga viral plasmática, mientras que sí existe una correlación positiva entre el porcentaje y MFI de PD-1 en las células de tetrámero positivo y la carga viral plasmática (p=0,0013 y p<0,0001, respectivamente).
La Figura 6B es una serie de gráficos que muestran que no existe ninguna correlación entre el número de células de tetrámero positivo del VIH y el recuento de CD4, mientras que existe una correlación inversa entre el porcentaje y MFI de PD-1 en las células de tetrámero positivo del VIH y el recuento de CD4 (p=0,0046 y p=0,0150, respectivamente).
La Figura 6C es una serie de gráficos que demuestran que el porcentaje y MFI de PD-1 sobre la población total de linfocitos T CD8 están correlacionados de forma positiva con la carga viral plasmática (p=0,0021 y p<0,0001, respectivamente).
La Figura 6D es una serie de gráficos que ilustran el porcentaje y MFI de la expresión de PD-1 sobre la población total de linfocitos T CD8 están inversamente correlacionados con el recuento de CD4 (p=0,0049 y p<0,0006, respectivamente).
La Figura 7A es una serie de imágenes de un experimento de citometría de flujo que muestran la tinción fenotípica representativa de linfocitos T CD8 específicos de B*4201 TL9 del sujeto SK222 en el que el 98% de los linfocitos T c D8 específicos de B*4201 TL9 son PD-1+.
La Figura 7B es un gráfico que ilustra un resumen de los datos fenotípicos de las personas en las que >95% de los linfocitos T CD8 específicos del VIH son PD-1+. Se analizaron entre siete y 19 muestras para cada uno de los marcadores fenotípicos indicados. La barra horizontal indica el porcentaje medio de células PD-1 de tetrámero positivo que fueron positivas para el marcador indicado.
La Figura 8A es una serie de imágenes de un experimento de citometría de flujo que muestran los datos representativos del ensayo de proliferación de un sujeto B*4201 positivo. Tras una estimulación de seis días con el péptido, el porcentaje de linfocitos T CD8 específicos de B*4201 TL9 aumentó del 5,7% al 12,4% en presencia del anticuerpo de bloqueo contra PD-L1.
La Figura 8B es un gráfico de líneas que ilustra el resumen de los datos del ensayo de proliferación, que indica un incremento significativo de la proliferación de linfocitos T CD8 específicos del VIH en presencia del anticuerpo de bloqueo contra PD-Ll (n=28, p=0-0006, test t emparejado).
La Figura 8C es un gráfico de barras que muestra los efectos diferenciales del bloqueo de PD-1/PD-L1 sobre la proliferación de linfocitos T CD8 específicos del VIH en cada paciente individual. Las barras blancas indican cuántas veces se han incrementado las células de tetrámero positivo en presencia del péptido solamente, las barras negras indican cuántas veces se han incrementado las células de tetrámero positivo en presencia del péptido más el anticuerpo de bloqueo contra PD-L1. Los individuos en los que se realizaron ensayos de CFSE para más de un epítopo están indicados mediante los símbolos de un asterisco, un cuadrado o un romboide triangular.
Descripción detallada
El uso de antibióticos y vacunas en las últimas décadas ha reducido de forma significativa la tasa de mortalidad a consecuencia de infecciones microbianas. No obstante, el éxito de las modalidades de tratamiento antimicrobiano ha sido limitado por la capacidad de determinados agentes infecciosos para evadir al sistema inmunitario del organismo hospedador y, a su vez, establecer una infección persistente. Por ejemplo, la respuesta inmunitaria que se produce contra virus como el de la hepatitis y el VIH no es suficiente para eliminar el agente infeccioso, que permanece en el sujeto infectado. En estas infecciones, los linfocitos T CD8+ específicos del antígeno se vuelven funcionalmente tolerantes con el agente infeccioso, en un estado conocido como «anergia» o «agotamiento». Los linfocitos T anérgicos pierden su actividad citotóxica, es decir su capacidad para producir citoquinas, proliferar y eliminar al agente infeccioso.
La presente invención se basa en el sorprendente descubrimiento de que la anergia de los linfocitos T es concomitante con una inducción de la expresión de PD-1 y de que la expresión de PD-1 está correlacionada con determinados tipos de trastornos linfoproliferativos. La invención proporciona un compuesto para su uso en un método de tratamiento de una infección por VIH persistente, tal y como se define en las reivindicaciones. La reducción de la actividad o expresión de PD-1, PD-L1 o PD-L2 se traduce en un incremento de la actividad citotóxica de los linfocitos T, incrementando la respuesta inmune específica al agente infeccioso. Los resultados proporcionados en el presente documento demuestran que la administración de anticuerpos de bloqueo contra el ligando 1 de muerte programada (PD-L1) en el ratón con infección persistente incrementaba la actividad citotóxica de los linfocitos T anérgicos. Concretamente, la alteración de las señales de PD-1 inducía la expansión de los
linfocitos T CD8+ anérgicos, una mayor producción de citoquinas y una mayor eliminación vírica. Por otra parte, los linfocitos T CD8+ generados durante infecciones persistentes del ratón con bajos niveles de CD4 proliferaban y recuperaban gran parte de su función tras el tratamiento contra PD-L1.
Para que los linfocitos T respondan a proteínas extrañas, las células presentadoras de antígeno (APC) deben proporcionar dos señales a los linfocitos T inactivos. La primera señal, que confiere especificidad a la respuesta inmunitaria, es transducida a través del receptor de linfocitos T (TCR) tras el reconocimiento de un péptido antigénico extraño presentado en el contexto del complejo principal de histocompatibilidad (MHC). La segunda señal, denominada coestimulación, hace que los linfocitos T proliferen y se vuelvan funcionales. La coestimulación no es de antígeno específico ni está limitada por el MHC y es proporcionada por uno o más polipéptidos de superficie celular distintos expresados por las APC. Si los linfocitos T solamente son estimulados a través del receptor de linfocitos T, sin recibir una señal coestimuladora adicional, dejan de responder, se vuelven anérgicos o mueren, lo que resulta en una modulación a la baja de la respuesta inmunitaria.
Las proteínas CD80 (B7-1) y CD86 (B7-2), expresadas en las APCs, son polipéptidos coestimuladores fundamentales. Mientras que B7-2 desempeña un papel predominante durante las respuestas inmunitarias primarias, B7-1 es regulada al alza posteriormente en el transcurso de una respuesta inmunitaria, con el objeto de prolongar las respuestas primarias o de coestimular las respuestas secundarias de los linfocitos T. Los polipéptidos B7 son capaces de proporcionar señales coestimuladoras o inhibitorias a las células inmunitarias, a fin de promover o inhibir las respuestas de las células inmunitarias. Por ejemplo, cuando se une a un receptor coestimulador, PD-L1 (B7-4) induce la coestimulación de las células inmunitarias o inhibe la coestimulación de las células inmunitarias cuando está presente en una forma soluble. Cuando se unen a un receptor inhibidor, las moléculas B7-4 pueden transmitir una señal inhibidora a una célula inmunitaria. Algunos ejemplos de miembros de la familia de B7 incluyen B7-1, B7-2, B7-3 (reconocidos por el anticuerpo BB-1), B7h (PD-L1), y B7-4, así como fragmentos o derivados solubles de los mismos. Los miembros de la familia de B7 se unen a uno o más receptores de una célula inmunitaria, como CTLA4, CD28, ICOS, PD-1 y/u otros receptores y, dependiendo del receptor, tienen la capacidad de transmitir una señal inhibidora o una señal coestimuladora a una célula inmunitaria.
CD28 es un receptor que se expresa constitutivamente en los linfocitos T inactivos. Tras enviar una señal a través del receptor de linfocitos T, la unión de CD28 y la transducción de una señal coestimuladora provoca que los linfocitos T proliferen y secreten EL-2. CTLA4 (CD152), un receptor homólogo a CD28, está ausente en los linfocitos T inactivos, pero su expresión se induce tras la activación de los linfocitos T. CTLA4 participa en la regulación negativa de las respuestas de los linfocitos T. ICOS, un polipéptido relacionado con CD28 y CTLA4, está implicado en la producción de IL-10. PD-1, el receptor al que están unidos PD-L1 y PD-L2, también se induce rápidamente en la superficie de los linfocitos T. PD-1 también se expresa en la superficie de los linfocitos B (en respuesta a la anti-IgM) y en un subconjunto de timocitos y células mieloides.
La implicación de PD-1 (por ejemplo, mediante enlaces cruzados o agregación) conduce a la transmisión de una señal inhibitoria en una célula inmunitaria, resultando en una reducción de respuestas inmunitarias concomitantes con un incremento de la energía de la célula inmunitaria. Los miembros de la familia de PD-1 se unen a uno o más receptores, como PD-L1 y PD-L2 en las células presentadoras de antígeno.
PD-L1 y PD-L2, siendo ambos polipéptidos del ligando PD-1 humano, son miembros de la familia de polipéptidos B7. Cada ligando PD-1 contiene una secuencia de señal, un dominio IgV, un dominio IgC, un dominio transmembrana y una cola citoplásmica corta. Estos ligandos se expresan en la placenta, el bazo, los nódulos linfáticos, el timo y el corazón. PD-L2 también se expresa en el páncreas, el pulmón y el hígado, mientras que PD-L1 se expresa en el hígado fetal, los linfocitos T activados y las células endoteliales. Ambos ligandos PD-1 se regulan al alza en las células dendríticas y los monocitos activados.
Trabattoni et al., Blood, 1 de abril de 2003, vol. 101, n° 7, páginas 2514-2520 divulga que PD-L1 se regula al alza en la infección por VIH. Latchman et al, Nature Immunology, marzo de 2001, vol. 2, n° 3, páginas 261-268 demuestra que la producción de IL-10 se regula a la baja por la implicación de PD-1 a través de PD-L1 en los linfocitos T CD4+ preactivados.
Definiciones
Para los fines del presente, por «infección persistente» se entiende una infección en la que el agente infeccioso (por ejemplo, virus, bacteria, parásito, micoplasma u hongo) no es erradicado ni eliminado del huésped infectado, ni siquiera tras la inducción de una respuesta inmunitaria. Las infecciones persistentes pueden ser infecciones crónicas, infecciones latentes o infecciones lentas. Mientras que las infecciones agudas son relativamente breves (con una duración de unos días a unas semanas) y se resuelven mediante el sistema inmunitario del organismo, las infecciones persistentes pueden durar meses, años o incluso toda una vida. Estas infecciones también pueden recurrir con frecuencia durante un período de tiempo prolongado, lo que implica etapas de infección silenciosa e infección productiva, sin muerte celular o incluso sin producir daños excesivos a las células hospedadoras. Los agentes infecciosos causantes también se pueden detectar en el huésped (por ejemplo, dentro de células específicas de los individuos infectados) incluso después de que la respuesta inmunitaria se haya resuelto, utilizando
técnicas estándar. A los mamíferos se les diagnostica que padecen una infección persistente conforme a cualquier método estándar conocido en el campo y descrito, por ejemplo, en las Patentes estadounidenses n° 6.368.832, 6.579.854, y 6.808.710 y en las Publicaciones de solicitudes de patentes estadounidenses n° 20040137577, 20030232323,20030166531, 20030064380, 20030044768, 20030039653,20020164600,20020160000, 20020110836, 20020107363, y 20020106730, quedando todas ellas incorporadas al presente como referencia. Por ejemplo, a un sujeto se le puede diagnosticar que padece una infección clamidial persistente tras la detección de una especie clamidial en una muestra biológica de ese individuo utilizando un análisis PCR. Los mamíferos no necesitan que se les diagnostique una infección persistente para ser tratados conforme a esta invención. Los agentes microbianos capaces de establecer una infección persistente incluyen los virus (por ejemplo, virus del papiloma, virus de la hepatitis, virus de la inmunodeficiencia humana y herpesvirus), bacterias (por ejemplo, Eschericchia coli y Chlamydia spp.), parásitos (por ejemplo, Plasmodium, Leishmania spp., Schistosoma spp., Trypanosoma spp., Toxoplasma spp.) y hongos.
Por «aliviar un síntoma de una infección persistente» se entiende mejorar cualquiera de las condiciones o síntomas asociados con la infección persistente, antes o después de que haya ocurrido. Alternativamente, aliviar un síntoma de una infección persistente puede implicar reducir la carga microbiana infecciosa (por ejemplo, vírica, bacteriana, fúngica, micoplásmica o parasitaria) en el sujeto con respecto a esa carga en un control no tratado. En comparación con un control no tratado equivalente, esta reducción es al menos del 5%, 10%, 20%, 40%, 50%, 60%, 80%, 90%, 95%, o 100%, medido mediante cualquier técnica estándar. Es recomendable que la infección persistente sea eliminada por completo cuando sea detectada mediante cualquier método estándar conocido en el campo, en cuyo caso la infección persistente se considera que ha sido tratada. Un paciente que va a ser tratado por una infección persistente es aquel al que un médico le ha diagnosticado esta condición. El diagnóstico se puede realizar a través de cualquier medio adecuado. El diagnóstico y el control pueden implicar, por ejemplo, la detección del nivel de carga microbiana en una muestra biológica (por ejemplo, biopsia de tejido, análisis de sangre o análisis de orina), la detección del nivel de un marcador indirecto de valoración de la infección microbiana en una muestra biológica, la detección de síntomas asociados con las infecciones persistentes, o la detección de células inmunitarias implicadas en la respuesta inmunitaria típica de las infecciones persistentes (por ejemplo, la detección de linfocitos T de antígeno específico que sean anérgicos). Una persona con conocimientos en el campo entenderá que estos pacientes pueden haberse sometido a las mismas pruebas estándar anteriormente descritas o pueden haber sido identificados, sin examen, como pacientes de alto riesgo debido a la presencia de uno o más factores de riesgo (por ejemplo, historial familiar o exposición a agente infeccioso).
Para los fines del presente, por «PD-1» se entiende un polipéptido que forma un complejo con proteínas PD-L1 o PD-L2 y, por tanto, está implicado en las respuestas inmunitarias, como la coestimulación de linfocitos T. Las proteínas PD-1 de la invención son sustancialmente idénticas a la PD-1 naturalmente presente (véase, por ejemplo, Ishida et. al. EMBO J. 11:3887-3895, 1992, Shinohara et al. Genomics 23:704-706,1994; y la Patente estadounidense n° 5.698.520. Las señales de PD-1 pueden reducir, por ejemplo, la citotoxicidad de los linfocitos T CD8+ al reducir la proliferación de linfocitos T, la producción de citoquinas o la eliminación vírica. Según la presente invención, el polipéptido PD-1 reduce la actividad citotóxica de los linfocitos T CD8+ en al menos un 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, o más del 100% por debajo de los niveles de control, medida mediante cualquier método estándar.
Por «gen PD-1» se entiende un ácido nucleico que codifica una proteína PD-1.
Por «gen de fusión de PD-1» se entiende un promotor de PD-1 y/o la totalidad o parte de una región que codifica PD-1 operativamente unida a una segunda secuencia de ácido nucleico heteróloga. En realizaciones preferibles, la segunda secuencia de ácido nucleico heteróloga es un gen informador, es decir, un gen cuya expresión se puede someter a ensayo; los genes informadores incluyen, a título meramente enunciativo, los que codifican glucuronidasa (GUS), luciferasa, cloranfenicol transacetilasa (CAT), proteína fluorescente verde (GFP), fosfatasa alcalina y betagalactosidasa.
Por «reducir la expresión o actividad de PD-1» se entiende reducir el nivel o la actividad biológica de PD-1 con respecto al nivel o la actividad biológica de PD-1 en un control no tratado. Según esta invención, este nivel o actividad se reduce al menos en un 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, o incluso más de un 100%, con respecto a un control sin tratar. Por ejemplo, la actividad biológica de PD-1 se reduce si la unión de PD-1 a PD-L1, PD-L2 o ambos se reduce, resultando así en una reducción de las señales de PD-1 y, por tanto, en un incremento de la citotoxicidad de los linfocitos T CD8+. Para los fines del presente, el término «actividad» con respecto a un polipéptido PD-1 incluye cualquier actividad que es inherente a la proteína PD-1 naturalmente presente, como la capacidad para modular una señal inhibidora en una célula inmunitaria activada, por ejemplo uniendo un ligando natural a una célula presentadora de antígeno. Esta modulación de una señal inhibidora de una célula inmunitaria provoca la modulación de la proliferación y/o la secreción de citoquinas por parte de una célula inmunitaria. PD-1 también puede modular una señal coestimuladora compitiendo con un receptor coestimulador por la unión de una molécula B7. Así, el término «actividad de PD-1» incluye la capacidad de un polipéptido PD-1 para unirse a su ligando o ligandos naturales, la capacidad para modular las señales inhibidoras o coestimuladoras de la célula inmunitaria y la capacidad para modular la respuesta inmunitaria. Por consiguiente, reducir la actividad de PD1 incluye reducir la interacción de PD-1 con PD-L1 o PD-L2. Esto se puede conseguir, por ejemplo, bloqueando PD-L1 o PD-L2.
Por «célula inmunitaria» se entiende una célula de origen hematopoyético y que interviene en la respuesta inmunitaria. Las células inmunitarias incluyen linfocitos (por ejemplo, linfocitos B y linfocitos T), células asesinas naturales y células mieloides (por ejemplo, monocitos, macrófagos, eosinófilos, mastocitos, basófilos y granulocitos). Por «linfocito T» se entiende un linfocito T CD4+ o un linfocito T CD8+. El término linfocito T incluye tanto células TH1 como células TH2.
El término «citotoxicidad de los linfocitos T» incluye cualquier respuesta inmunitaria mediada por la activación de los linfocitos T CD8+. Algunos ejemplos de respuestas inmunitarias incluyen la producción de citoquinas, la proliferación de linfocitos T CD8+, la producción de granzima o perforina y la eliminación del agente infeccioso.
Por «ausencia de reactividad» se incluye la refracción de las células inmunitarias a la estimulación, por ejemplo la estimulación a través de un receptor de activación o una citoquina. La ausencia de reactividad puede ocurrir, por ejemplo, debido a la exposición a inmunosupresores o la exposición a altas dosis de antígeno. Para los fines del presente, el término «anergia» o «tolerancia» incluye la refractividad a la estimulación mediada por un receptor de activación. Por lo general, esta refractividad es de antígeno específico y persiste después de que la exposición al antígeno tolerizante haya cesado. Por ejemplo, la anergia en los linfocitos T (a diferencia de la ausencia de reactividad) se caracteriza por la ausencia de producción de citoquina, por ejemplo IL-2. La anergia de los linfocitos T se produce cuando estos linfocitos están expuestos al antígeno y reciben una primera señal (una señal mediada por CD-3 o un receptor de linfocitos T) en ausencia de una segunda señal (una señal coestimuladora). En estas condiciones, la reexposición de las células al mismo antígeno (incluso cuando la reexposición se produzca en presencia de una molécula coestimuladora) provoca una ausencia de producción de citoquinas y, por tanto, de proliferación. No obstante, los linfocitos T anérgicos presentan respuestas a antígenos no relacionados y pueden proliferar si se cultivan con citoquinas (por ejemplo, EL-2). Por ejemplo, la anergia de los linfocitos T también se puede observar por la ausencia de producción de IL-2 por parte de los linfocitos T, medida por un ensayo de proliferación o ELISA, utilizando una línea celular indicadora. Alternativamente, se puede utilizar la estructura de un gen informador. Por ejemplo, los linfocitos T anérgicos no inician la transcripción del gen de IL-2 inducida por un promotor heterólogo bajo el control del potenciador del extremo 5'-terminal del gen de IL-2 o por un multímero de la secuencia de API que se puede encontrar dentro del potenciador (Kang et al. Science 257:1134, 1992). Los linfocitos T anérgicos de antígeno específico pueden presentar una reducción de al menos el 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, o incluso el 100% de la actividad citotóxica con respecto al correspondiente linfocito T de antígeno específico de control.
Por «anticuerpo purificado» se entiende un anticuerpo que está al menos en un 60%, en peso, libre de proteínas y moléculas orgánicas naturalmente presentes con las que está naturalmente asociado. Preferiblemente, la preparación es al menos un 75%, más preferiblemente un 90% y más preferiblemente al menos un 99%, en peso, anticuerpo, por ejemplo un anticuerpo específico de PD-1, PD-L1 o PD-L2. Se puede obtener un anticuerpo purificado, por ejemplo, mediante cromatografía de afinidad utilizado proteína producida recombinantemente o péptidos de motivos conservados y técnicas estándar.
Por «se une específicamente» se entiende un anticuerpo que reconoce y se une a un antígeno como un polipéptido PD-1, PD-L1 o PD-L2, pero no reconoce ni se une sustancialmente a otras moléculas no-antígeno en una muestra, por ejemplo una muestra biológica que incluye naturalmente proteína. Un anticuerpo preferible se une a los polipéptidos PD-1, PD-L1, o PD-L2 divulgados en la Patente estadounidense n° 6.808.710 y en las Publicaciones de solicitudes de patentes estadounidenses n° 20040137577, 20030232323, 20030166531, 20030064380,20030044768, 20030039653, 20020164600, 20020160000, 20020110836, 20020107363, y 20020106730, quedando todas ellas incorporadas al presente como referencia.
Por «anticuerpos neutralizantes» se entienden anticuerpos que interfieren en cualquiera de las actividades biológicas de un polipéptido PD-1, en particular la capacidad de un polipéptido PD-1 para reducir una respuesta inmunitaria, como la citotoxicidad de los linfocitos T. El anticuerpo neutralizante puede reducir la capacidad de un polipéptido PD-1 para reducir una respuesta inmunitaria preferiblemente en un 50%, más preferiblemente en un 70% y más preferiblemente en un 90% o más. Cualquier ensayo estándar para medir las respuestas inmunitarias, incluyendo las descritas en el presente, puede ser empleado para valorar los anticuerpos potencialmente neutralizantes.
Por «sustancialmente idéntico», cuando se habla de una proteína o de un polipéptido, se entiende una proteína o un polipéptido que presenta una identidad de al menos el 75%, aunque preferiblemente el 95%, más preferiblemente el 90%, más preferiblemente el 95% o incluso el 99% con una secuencia de aminoácidos de referencia. En el caso de las proteínas o los polipéptidos, por lo general la longitud de las secuencias de comparación será de al menos 20 aminoácidos, preferiblemente al menos 30 aminoácidos, más preferiblemente al menos 40 aminoácidos y más preferiblemente 50 aminoácidos, o la proteína o el polipéptido de longitud completa. Los ácidos nucleicos que codifican estas proteínas o polipéptidos «sustancialmente idénticos» constituyen un ejemplo de ácidos nucleicos
«sustancialmente idénticos»; se reconoce que los ácidos nucleicos incluyen cualquier secuencia, debido a la degeneración del código genético, que codifica esas proteínas o polipéptidos. Por otra parte, una secuencia de ácido nucleico «sustancialmente idéntica» incluye también un polinucleótido que se hibrida con una molécula de ácido nucleico de referencia en condiciones de elevada rigurosidad.
Por «condiciones de elevada rigurosidad» se entiende cualquier conjunto de condiciones que se caracterizan por una alta temperatura y una baja fuerza iónica y permiten una hibridación comparable a las resultantes del uso de una sonda de ADN de al menos 40 nucleótidos de longitud, en una solución tampón que contiene 0,5 M NaHP04, pH 7.2, 7% SDS, 1 mM EDTA, y 1% BSA (Fracción V), a una temperatura de 65 °C, o una solución tampón que contiene un 48% de formamida, 4.8XSSC, 0,2 M Tris-Cl, pH 7.6, 1x solución de Denhardt, 10% sulfato de dextrato, y 0,1% SDS, a una temperatura de 42 °C. Otras condiciones para la hibridación de alta rigurosidad, como para la PCR, hibridación Northern, Southern o in situ, secuenciación de ADN, etc., son bien conocidas por las personas cualificadas en el campo de la biología molecular. Véase, por ejemplo, F. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y., 1998.
Por «sustancialmente puro» se entiende un ácido nucleico, polipéptido u otra molécula que ha sido separada de los componentes que naturalmente la acompañan. Típicamente, el polipéptido es sustancialmente puro cuando está al menos un 60%, 70%, 80%, 90%, 95%, o incluso un 99%, en peso, libre de las proteínas y las moléculas orgánicas naturalmente presentes con las que está naturalmente asociado. Por ejemplo, un polipéptido sustancialmente puro se puede obtener mediante extracción de una fuente natural, mediante expresión de un ácido nucleico recombinante en una célula que normalmente no expresa esa proteína o mediante síntesis química.
El término «ADN aislado» significa un ADN que está libre de los genes que rodean al ADN en el genoma naturalmente presente del organismo del que se obtiene el ADN en cuestión. Por tanto, el término «ADN aislado» abarca, por ejemplo, ADNc, ADN genómico clonado y ADN sintético.
Por «una cantidad efectiva» se entiende una cantidad de un compuesto, solo o combinado, necesaria para reducir o evitar la hipertensión o para tratar una infección crónica en un mamífero. La cantidad efectiva de un compuesto o compuestos activos varía dependiendo de la vía de administración, la edad, el peso corporal y la salud general del sujeto. En última instancia, el médico o veterinario responsable decidirá la cantidad apropiada y el régimen de administración.
Por un «compuesto candidato» se entiende un producto químico, sea naturalmente presente u obtenido por medios artificiales. Los compuestos candidatos pueden incluir, por ejemplo, péptidos, polipéptidos, moléculas orgánicas sintéticas, moléculas orgánicas naturalmente presentes, moléculas de ácido nucleico, moléculas de ácido nucleico peptídico, así como componentes y derivados de los mismos. Por ejemplo, un compuesto candidato útil según la presente invención reduce la unión de PD-1 a PD-L1, a PD-L2 o a ambos.
Por el término «composición farmacéutica» se entiende cualquier composición, que contiene al menos un agente terapéutica o biológicamente activo y que es adecuado para su administración al paciente. Cualquiera de estas formulaciones se puede preparar con métodos bien conocidos y aceptados en el campo. Véase, por ejemplo, Remington: The Science and Practice of Pharmacy, 20.sup.th edition, (ed. A R Gennaro), Mack Publishing Co., Easton, Pa., 2000.
Métodos de tratamiento
La citotoxicidad de los linfocitos T se incrementa al poner en contacto un linfocito T con un compuesto que reduce la expresión o actividad de PD-1. El linfocito T es un linfocito T sin tratamiento previo, un linfocito T con memoria o un linfocito T activado. Alternativamente, el linfocito T es un linfocito T de antígeno específico. Los linfocitos T de antígeno específico son anérgicos o tolerantes al agente infeccioso. La citotoxicidad de los linfocitos T se caracteriza por un incremento de la proliferación celular y de la liberación de citoquinas.
Los métodos son útiles para aliviar los síntomas de diversas infecciones y cánceres. Una infección o un cáncer es tratado o sus síntomas son aliviados administrando a un sujeto un inhibidor de PD-1. El sujeto es un mamífero, como un humano, un primate, un ratón, una rata, un perro, un gato, una vaca, un caballo y un cerdo. El sujeto padece o corre el riesgo de desarrollar una infección. Un sujeto que padece o corre el riesgo de desarrollar una infección es idóneo para la infección en cuestión por métodos estándar.
La infección, por ejemplo bacteriana, vírica, fúngica, micoplásmica o parasitaria, es una infección persistente. Las infecciones persistentes, a diferencia de las infecciones agudas, no son eliminadas de forma efectiva al inducir una respuesta inmunitaria en el huésped. El agente infeccioso y la respuesta inmunitaria alcanzan un equilibrio, de forma que el sujeto infectado se mantiene infeccioso durante un periodo de tiempo prolongado, sin que exprese necesariamente síntomas. Las infecciones persistentes incluyen, por ejemplo, infecciones latentes, crónicas y lentas. En una infección crónica, el agente infeccioso se puede detectar en el organismo en todo momento. No obstante, los signos y síntomas de la enfermedad pueden estar presentes o ausentes durante un periodo de tiempo prolongado. Algunos ejemplos de infección crónica incluyen la hepatitis B (causada por el VHB) y la hepatitis C (causada por el
VHC), adenovirus, citomegalovirus, virus de Epstein-Barr, herpesvirus simple 1, herpesvirus simple 2, herpesvirus humano 6, virus varicela-zóster, virus de la hepatitis B, virus de la hepatitis D, virus del papiloma, parvovirus B19, poliomavirus BK, poliomavirus JC, virus del sarampión, virus de la rubeola, virus de la inmunodeficiencia humana (VIH), virus de la leucemia de linfocitos T humana de tipo I y virus de la leucemia de linfocitos T humana de tipo II. Las infecciones persistentes parasitarias pueden producirse como resultado de una infección por Leishmania, Toxoplasma, Trypanosoma, Plasmodium, Schistosoma, y Encephalitozoon.
En una infección latente, el agente infeccioso (por ejemplo, el virus) parece encontrarse inactivo y latente, de forma que el sujeto no siempre presenta signos o síntomas. En una infección vírica latente, el virus se mantiene en equilibrio con el huésped durante periodos de tiempo prolongados antes de que los síntomas aparezcan de nuevo; sin embargo, los virus reales no se pueden detectar hasta que se produce una reactivación de la enfermedad. Algunos ejemplos de infecciones latentes incluyen las causadas por h SV-1 (herpes bucal), HSV-2 (herpes genital), y VZV (varicela, culebrillas).
En una infección lenta, los agentes infecciosos aumentan gradualmente de número durante un periodo de tiempo muy prolongado, en el que no se observan signos ni síntomas significativos. Algunos ejemplos de infecciones lentas incluyen el SIDA (causado por el VIH-1 y VIH-2), lentivirus que causan tumores en los animales y priones.
Por otra parte, las infecciones persistentes suelen surgir como complicaciones tardías de las infecciones agudas. Por ejemplo, la panencefalitis esclerosante subaguda (SSPE) puede ocurrir tras una infección de sarampión aguda o una encefalitis regresiva puede ocurrir como resultado de una infección de rubeola.
Los cánceres incluyen, por ejemplo, el linfoma angioinmunoblástico o el linfoma de Hodgkin nodular de predominio linfocítico.
El linfoma angioinmunoblástico (AIL) es un tipo agresivo (que progresa rápidamente) de linfoma no Hodgkin de células T que se caracteriza por un aumento de tamaño de los nódulos linfáticos e hipergammaglobulinemia Otros síntomas pueden incluir erupción cutánea, fiebre, pérdida de peso, test de Coomb positivo o sudores nocturnos. Esta malignidad se produce habitualmente en adultos. Los pacientes suelen tener entre 40 y 90 años (con una media de unos 65) y más habitualmente son hombres. A medida que el AIL progresa, se puede desarrollar una hepatoesplenomegalia, anemia hemolítica e hipergammaglobulinemia policlonal. La piel se ve afectada en aproximadamente el 40-50% de los pacientes.
El linfoma de Hodgkin nodular de predominio linfocítico es una neoplasia de células B que parece proceder de células B del centro germinal con genes de inmunoglobulina no funcionales mutados. De forma similar al linfoma angioinmunoblástico, las células neoplásicas están asociadas con una malla de células dendríticas foliculares. La expresión de PD-1 se observa en las células T estrechamente asociadas con la célula CD20+ neoplásica en el linfoma de Hodgkin nodular de predominio linfocítico, en un patrón similar al observado para las células T CD57+. La célula CD57 ha sido identificada como otro marcador de las células T asociadas con el centro germinal, junto con CXCR5, y estos resultados respaldan la conclusión de que las células neoplásicas en el linfoma de Hodgkin nodular de predominio linfocítico mantienen una estrecha relación con las células T asociadas con el centro germinal.
Un inhibidor de PD-1 es cualquier agente que tiene la capacidad de reducir la expresión o la actividad de PD-1, PD-L1 o PD-2 en una célula. La actividad o expresión de p D-1 se reduce al menos en un 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, o 100% en comparación con esa actividad o expresión en una célula de control. La célula de control es una célula que no ha sido tratada con el inhibidor de PD-1. La actividad o expresión de PD-1 se determina a través de cualquier método estándar en el campo, incluidos los descritos en el presente. Opcionalmente, el inhibidor de PD-1 inhibe o reduce la unión de PD-1 a PD-L1, a PD-L2 o a ambos. Los inhibidores de PD-1 incluyen polipéptidos, polinucleótidos, moléculas pequeñas antagonistas o siRNA.
Un polipéptido inhibidor de PD-1 incluye, por ejemplo, un anticuerpo o un fragmento del mismo que reduce la señal o expresión de PD-1. Algunos ejemplos de anticuerpos incluyen anticuerpos contra PD-1, anticuerpos contra PD-L1, anticuerpos contra PD-L2, anticuerpos contra CTLA-4, anticuerpos contra BTLA, anticuerpos contra CD28, anticuerpos contra ICOS, anticuerpos contra ICOS-L, anticuerpos contra B7, anticuerpos contra B7-2, anticuerpos contra B7-H3, o anticuerpos contra B7-H4.
Alternativamente, el inhibidor de PD-1 es una proteína negativa dominante o un ácido nucleico que codifica una proteína negativa dominante que interfiere en la actividad biológica de PD-1 (es decir, la unión de PD-1 a PD-L1, PD-L2 o ambos). Una proteína negativa dominante es cualquier molécula de aminoácido que tiene una secuencia con una identidad de secuencia de al menos el 50%, 70%, 80%, 90%, 95%, o incluso el 99% con al menos 10,20, 35, 50,100, o más de 150 aminoácidos de la proteína de tipo salvaje a la que corresponde la proteína negativa dominante. Por ejemplo, un PD-1 negativo dominante presenta una mutación de forma que deja de ser capaz de unirse a PD-L1.
La proteína negativa dominante se puede administrar como un vector de expresión. El vector de expresión puede ser un vector no viral o un vector viral (por ejemplo, retrovirus, virus adenoasociado recombinante o un vector adenoviral recombinante). Alternativamente, la proteína negativa dominante se puede administrar directamente
como una proteína recombinante de forma sistémica o en la zona infectada empleando, por ejemplo, técnicas de microinyección.
Las moléculas pequeñas incluyen, a título meramente enunciativo, péptidos, peptidomiméticos (por ejemplo, peptoides), aminoácidos, análogos de aminoácidos, polinucleóticos, análogos de polinucleótidos, nucleótidos, análogos de nucleótidos, compuestos orgánicos e inorgánicos (incluyendo compuestos heterorgánicos y organometálicos) con un peso molecular inferior a unos 5.000 gramos por mol, compuestos orgánicos o inorgánicos que tienen un peso molecular inferior a unos 2.000 gramos por mol, compuestos orgánicos o inorgánicos que tienen un peso molecular inferior a unos 1.000 gramos por mol, compuestos orgánicos o inorgánicos que tienen un peso molecular inferior a unos 500 gramos por mol y sales, ésteres, así como otras formas farmacéuticamente aceptables de estos compuestos.
El inhibidor de PD-1 es una molécula antisentido, una molécula de ARN pequeño de interferencia (siRNA), o una molécula pequeña antagonista que tiene por objetivo la actividad o expresión de PD-1. Por «siRNA» se entiende una molécula de ARN de cadena doble que impide la traslación de un ARN mensajero diana. Se emplean las técnicas estándar para introducir siRNA en una célula, incluyendo aquellas en las que el ADN es una plantilla se la que se transcribe un ARN de un ARN pequeño de interferencia. El ARN pequeño de interferencia incluye una secuencia sentido de ácido nucleico de PD-1, PD-L1 o PD-L2, una secuencia antisentido de ácido nucleico de PD-1, PD-L1 o PD-L2 o ambas. Opcionalmente, el siRNA se construye de forma que una única transcripción tenga tanto la secuencia sentido como la secuencia antisentido complementaria del gen diana, por ejemplo una horquilla. La unión del siRNA a una transcripción de PD-1, PD-L1 o PD-L2 en la célula diana resulta en una reducción de la producción de PD-1, PD-L1 o PD-L2 por parte de la célula. La longitud del oligonucleótido es de al menos 10 nucleótidos y puede ser tan largo como la transcripción de PD-1, PD-L1 o PD-L2 naturalmente presente. Preferiblemente, el oligonucleótido tiene 19-25 nucleótidos de longitud. Más preferiblemente, el oligonucleótido tiene menos de 75, 50 o 25 nucleótidos de longitud.
Otros inhibidores de PD-1 adecuados se describen, por ejemplo, en la Patente estadounidense n° 6.808.710 y en las Publicaciones de solicitudes de patentes estadounidenses n° 20040137577, 20030232323,20030166531, 20030064380,20030044768,20030039653, 20020164600,20020160000,20020110836, 20020107363, y 20020106730, quedando todas ellas incorporadas al presente como referencia.
La dosis preferible del inhibidor de PD-1 es una dosis biológicamente activa. Una dosis biológicamente activa es una dosis que inducirá un incremento de la actividad citotóxica de los linfocitos T CD8+, el incremento de la respuesta inmunitaria específica en el agente infeccioso. Es recomendable que el inhibidor de PD-1 tenga la capacidad para reducir la actividad o expresión de PD-1 en las células inmunitarias de antígeno específico (por ejemplo, linfocitos T como los linfocitos T CD8+) al menos en un 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, o más del 100% por debajo de los niveles de control sin tratar. Los niveles de actividad de PD-1 en las células inmunitarias se miden a través de cualquier método conocido en el campo, incluyendo, por ejemplo, un ensayo de Western blot, inmunohistoquímica, ELISA y Northern blot. Alternativamente, la actividad biológica de PD-1 se mide valorando la unión de PD-1 a PD-L1, PD-L2 o a ambos. La actividad biológica de PD-1 se determina en función de su capacidad para incrementar la citotoxicidad de los linfocitos T CD8+ incluyendo, por ejemplo, la producción de citoquinas, la eliminación del agente infeccioso y la proliferación de linfocitos T CD8+ de antígeno específico. Preferiblemente, el agente que reduce la expresión o actividad de PD-1 puede incrementar la respuesta inmunitaria específica para el agente infeccioso al menos un 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, o más del 100% por encima de los niveles de control sin tratar. Por lo tanto, el agente de la presente invención es cualquier agente que presenta una o más de estas actividades. A pesar de que el agente de la invención se expresa preferiblemente en los linfocitos T CD8+, se entiende que cualquier célula que pueda influir en la respuesta inmunitaria frente a infecciones persistentes también puede resultar adecuada para los métodos de la invención, incluyendo, por ejemplo, los linfocitos B.
Opcionalmente, al sujeto se le administra uno o más agentes terapéuticos adicionales. Los agentes terapéuticos adicionales incluyen, por ejemplo, compuestos antivíricos (por ejemplo, vidarabina, aciclovir, ganciclovir, valganciclovir, inhibidor de la transcriptasa inversa análogo de nucleótidos (NRTI), como AZT (zidovudina), ddl (didanosina), ddC (zalcitabina), d4T (estavudina) o 3TC (lamivudina), inhibidor de la transcriptasa inverso no análogo de los nucleótidos (NNRTI), como nevirapina o delavirdina, inhibidor de la proteasa (saquinavir, ritonavir, indinavir o nelfinavir, ribavirina o interferón), un compuesto antibacteriano, un compuesto antifúngico, un compuesto antiparasitario, un compuesto antiinflamatorio, compuestos antineoplásicos o un analgésico.
El agente terapéutico adicional se administra con anterioridad, de forma concomitante o con posterioridad a la administración del inhibidor de PD-1. Por ejemplo, el inhibidor de PD-1 y el agente adicional se administran en formulaciones separadas con un intervalo mínimo de 1, 2, 4, 6,10,12, 18, o más de 24 horas. Opcionalmente, el agente adicional está formulado junto con el inhibidor de PD-1. Cuando el agente adicional está presente en una composición diferente, se pueden emplear diferentes vías de administración. El agente se administra a dosis que se sabe que son efectivas para ese agente para el tratamiento o la reducción de una infección.
Las concentraciones del inhibidor de PD-1 y el agente adicional dependen de diferentes factores, incluyendo el medio de administración, el sitio diana, el estado fisiológico del mamífero y otra medicación administrada. Por tanto, las dosis del tratamiento se pueden titular para optimizar la seguridad y eficacia, y esto depende del criterio del especialista. La determinación de la dosis adecuada y el régimen de administración para una determinada situación dependen del criterio del especialista.
Opcionalmente, al sujeto se le administra también una vacuna que desencadena una respuesta inmunitaria protectora frente al agente infeccioso que causa una infección persistente. Por ejemplo, el sujeto recibe una vacuna que desencadena una respuesta inmunitaria contra el virus de la inmunodeficiencia humana (VIH), la tuberculosis, influenza o hepatitis C. Algunos ejemplos de vacunas se describen, por ejemplo, en Berzofsky et al. (J. Clin. Invest.
114:456-462, 2004). Si se desea, la vacuna se administra con una dosis de refuerzo principal o con adyuvantes. Los inhibidores de PD-1 se administran en una cantidad suficiente para aumentar la citotoxicidad de los linfocitos T, por ejemplo linfocitos T CD8+. Un aumento de la citotoxicidad de los linfocitos T provoca una respuesta inmunitaria aumentada y una reducción de la infección persistente. Una respuesta inmunitaria aumentada se mide, por ejemplo, por el incremento de la proliferación de células inmunitarias, por ejemplo linfocitos T o B, un incremento de la producción de citoquina y un incremento en la eliminación de un agente infeccioso. Esta reducción incluye el alivio de uno o más de los síntomas asociados con la infección persistente. La administración del inhibidor de PD-1 reduce la infección persistente o alivia uno o más síntomas asociados con la infección persistente al menos en un 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, o 100%, en comparación con un sujeto no tratado.
El tratamiento es eficaz si aporta un beneficio clínico, como una reducción de la carga del agente infeccioso en el sujeto. Cuando el tratamiento se aplica profilácticamente, el término «eficaz» significa que el tratamiento retarda el desarrollo de una infección. La eficacia se puede determinar empleando cualquier método conocido para el diagnóstico o el tratamiento de la infección en cuestión.
Administración terapéutica
La divulgación incluye la administración a un sujeto de una composición que incluye un compuesto que reduce la actividad o expresión de PD-1 (denominado en el presente «inhibidor de PD-1» o «compuesto terapéutico»).
Una cantidad efectiva de un compuesto terapéutico se encuentra preferiblemente entre unos 0,1 mg/kg a unos 150 mg/kg. Las dosis efectivas varían, como saben las personas cualificadas en el campo, dependiendo de la vía de administración, el uso de excipientes y la administración concomitante de otros tratamientos terapéuticos, incluyendo el uso de otros agentes contra la infección o agentes terapéuticos para tratar o aliviar un síntoma de una determinada infección o cáncer. Un régimen terapéutico se lleva a cabo mediante la identificación de un mamífero, por ejemplo un paciente humano que padece (o corre el riesgo de desarrollar) una infección o cáncer, empleando métodos estándar.
El compuesto farmacéutico se administra a este individuo empleando métodos conocidos en el campo. Preferiblemente, el compuesto se administra por vía oral, rectal, nasal, tópica o parenteral, por ejemplo subcutánea, intraperitoneal, intramuscular e intravenosa. El compuesto se administra profilácticamente o tras la detección de una infección. El compuesto es opcionalmente formulado como un componente de un cóctel de fármacos terapéuticos para tratar la infección. Algunos ejemplos de formulaciones adecuadas para la administración parenteral incluyen soluciones acuosas del agente activo en una solución salina isotónica, una solución de glucosa al 5% u otro excipiente estándar farmacéuticamente aceptable. Los agentes solubilizantes estándar, como las PVP o ciclodextrinas también se utilizan como excipientes farmacéuticos para la administración de los compuestos terapéuticos.
Los compuestos terapéuticos descritos en el presente están formulados en composiciones para otras vías de administración utilizando métodos convencionales. Por ejemplo, el inhibidor de PD-1 está formulado en una cápsula o un comprimido para su administración oral. Las cápsulas pueden contener cualquier material estándar farmacéuticamente aceptable, como gelatina o celulosa. Los comprimidos pueden ser formulados con arreglo a procedimientos convencionales, comprimiendo las mezclas de un compuesto terapéutico con un vehículo sólido y un lubricante. Algunos ejemplos de vehículos sólidos incluyen el almidón y la bentonita de azúcar. El compuesto se administra en forma de un comprimido recubierto rígido o una cápsula que contiene un aglutinante, como lactosa o manitol, un material de relleno convencional y un agente de tableteado. Otras formulaciones incluyen una pomada, un supositorio, una pasta, un espray, un parche, una crema, un gel, una esponja reabsorbible o espuma. Estas formulaciones se producen empleando métodos bien conocidos en el campo.
Cuando el compuesto terapéutico es un ácido nucleico que codifica una proteína, el ácido nucleico terapéutico se administra in vivo para promover la expresión de su proteína codificada, integrándolo como parte de un vector de expresión de ácido nucleico apropiado y administrándolo de forma que penetre en la célula (por ejemplo, mediante el uso de un vector retroviral), por inyección directa, mediante el uso del bombardeo de micropartículas, mediante el revestimiento con lípidos o receptores de superficie celular o agentes transfectantes, o administrándolo conjuntamente con un péptido de tipo caja homeo que se sabe que accede al núcleo (Véase, por ejemplo, Joliot, et al, 1991. Proc Natl Acad Sci USA 88:1864-1868), y similares. Alternativamente, un ácido nucleico terapéutico se
introduce intracelularmente y se incorpora al ADN celular del huésped para la expresión, mediante recombinación homóloga, o se mantiene episomal.
Para la administración local de ADN, se emplean vectores de terapia genética estándar. Estos vectores incluyen vectores virales, incluidos los obtenidos de virus de la hepatitis incapaces de replicarse (por ejemplo, VHB y VHC), retrovirus (véase, por ejemplo, WO 89/07136; Rosenberg et al., 1990, N. Eng. J. Med. 323(9):570-578), adenovirus (véase, por ejemplo, Morsey et al., 1993, J. Cell. Biochem., Supp. 17E,), virus adenoasociados (Kotin et al., 1990, Proc. Natl. Acad. Sci. USA 87:2211-2215,), virus del herpes simple incapaces de replicarse (HSV; Lu et al., 1992, Abstract, página 66, Abstracts de la Reunión sobre Terapia Genética, 22-26 de septiembre, Cold Spring Harbor Laboratory, Cold Spring Harbor, Nueva York), y cualquier versión modificada de estos vectores. La invención puede utilizar cualquier otro sistema de administración que realice la transferencia in vivo de los ácidos nucleicos a las células eucariotas. Por ejemplo, los ácidos nucleicos pueden estar incluidos en liposomas, esto es, liposomas catiónicos (Lipofectin), sistemas de administración mediados por receptores, vectores basados en ácidos nucleicos no víricos, fantasmas de eritrocitos o microesferas (por ejemplo, micropartículas; véase, por ejemplo, la Patente estadounidense n° 4.789.734; la Patente estadounidense n° 4.925.673; la Patente estadounidense n° 3.625.214; Gregoriadis, 1979, Drug Carriers in Biology and Medicine, pp. 287-341 (Academic Press). También se puede administrar ADN desnudo.
El ADN para la terapia genética se puede administrar a los pacientes parenteralmente, por ejemplo por vía intravenosa, subcutánea, intramuscular e intraperitoneal. El ADN o un agente inductor se administra en un vehículo farmacéuticamente aceptable, es decir un vehículo biológicamente compatible que es apropiado para su administración a un animal, como suero salino. Una cantidad terapéuticamente efectiva es una cantidad que es capaz de producir un resultado deseable desde el punto de vista médico, por ejemplo una disminución de un producto del gen PD-1 en un animal tratado. Esta cantidad puede ser determinada por una persona cualificada en el campo. Como se sabe perfectamente en el campo médico, la dosis para un determinado paciente depende de múltiples factores, incluyendo el tamaño del paciente, el área de la superficie del cuerpo, la edad, el compuesto concreto a administrar, el sexo, el tiempo y la vía de administración, el estado de salud general y la administración concomitante de otros fármacos. Las dosis pueden variar, pero una dosis preferible para la administración intravenosa de ADN es aproximadamente de 106 a 1022 copias de la molécula de ADN. Típicamente, los plásmidos se administran a un mamífero en una cantidad de aproximadamente un nanogramo a unos 5.000 microgramos de ADN. Resulta recomendable que las composiciones contengan entre unos 5 nanogramos y unos 1.000 microgramos de ADN, 10 nanogramos a 800 microgramos de ADN, 0,1 microgramos a 500 microgramos de ADN, 1 microgramo a 350 microgramos de ADN, 25 microgramos a 250 microgramos de ADN, o 100 microgramos a 200 microgramos de ADN. Alternativamente, la administración de vectores adenovirales recombinantes que codifican el inhibidor de PD-1 a un mamífero se puede realizar a una concentración de al menos 105, 106,107,108,109,1010, o 1011 unidades formadoras de placa (pfu).
Los productos genéticos de PD-1 se administran al paciente por vía intravenosa en un vehículo farmacéuticamente aceptable como suero fisiológico. Se pueden emplear los métodos estándar para la administración intracelular de péptidos, por ejemplo insertados en liposomas. Estos métodos son bien conocidos por las personas cualificadas en el campo. Se calcula que se administraría una dosis intravenosa de entre 1 y 100 moles aproximadamente del polipéptido de la invención por kg de peso corporal y día. Las composiciones de la invención son útiles para la administración parenteral, por ejemplo intravenosa, subcutánea, intramuscular e intraperitoneal.
Los inhibidores de PD-1 son efectivos tras el contacto directo del compuesto con el tejido afectado. Por consiguiente, el compuesto se puede administrar por vía tópica. Alternativamente, los inhibidores de PD-1 se pueden administrar de forma sistémica. Adicionalmente, los compuestos se pueden administrar implantando (sea directamente en un órgano, como el intestino o el hígado, o de forma subcutánea), una matriz sólida o reabsorbible que libere lentamente el compuesto en los tejidos adyacentes y cercanos del sujeto. Por ejemplo, para el tratamiento de la infección gastrointestinal, el compuesto se puede administrar de forma sistémica (por ejemplo, intravenosa, rectal u oral) o local (por ejemplo, directamente en el tejido gástrico). Alternativamente, se coloca una esponja reabsorbible o una pastilla impregnada en el inhibidor de PD-1 en contacto directo con el tejido gástrico. El inhibidor de PD-1 se libera lentamente in vivo mediante la difusión del fármaco de la pastilla y la erosión de la matriz del polímero. En otro ejemplo, la infección del hígado (por ejemplo, hepatitis) se trata mediante la infusión en la vasculatura hepática de una solución que contiene el inhibidor de PD-1.
Para el tratamiento de infecciones neurológicas, el inhibidor de PD-1 se puede administrar intravenosa o intratecalmente (es decir, mediante infusión directa en el fluido cerebroespinal). Para la administración local, se coloca una esponja reabsorbible o una pastilla impregnada en el compuesto en contacto directo con el tejido del sistema nervioso central. El compuesto o la mezcla de compuestos se liberan lentamente in vivo mediante la difusión del fármaco de la pastilla y la erosión de la matriz del polímero. Alternativamente, se realiza una infusión del compuesto en el cerebro o el fluido cerebroespinal empleando métodos estándar. Por ejemplo, un anillo para agujeros de trépano con un catéter para emplearlo como puerto de inyección se posiciona para llegar al cerebro por un agujero trepanado en el cráneo. A un depósito de líquido conectado al catéter accede una aguja o estilete insertado a través de un septo posicionado sobre la parte superior del anillo para agujeros de trépano. El montaje del
catéter (descrito, por ejemplo, en la Patente estadounidense n° 5.954.687) proporciona una vía para el flujo de fluido adecuada para la transferencia de fluidos hacia o desde un lugar seleccionado en el cerebro, o cerca del mismo, que permite la administración del fármaco durante un período de tiempo.
Para las infecciones cardíacas, el compuesto se puede administrar, por ejemplo, en el tejido cardíaco (es decir, miocardio, pericardio o endocardio) mediante una inyección intracoronaria directa a través de la pared torácica o empleando métodos estándar basados en un catéter percutáneo bajo orientación fluoroscópica. De este modo, el inhibidor se puede inyectar directamente en el tejido o se puede infundir con una cánula o catéter insertado en un lumen corporal. Se puede emplear cualquier variedad de catéter coronario o de perfusión para administrar el compuesto. Alternativamente, el compuesto recubre o está impregnado en una cánula que se coloca en un vaso coronario.
Las infecciones pulmonares se pueden tratar, por ejemplo, administrando el compuesto mediante inhalación. Los compuestos se administran en forma de un espray aerosol desde un dispensador o contenedor presurizado que contiene un propulsor adecuado, por ejemplo un gas como dióxido de carbono, o un nebulizador.
Una persona con conocimientos en el campo entenderá que los pacientes tratados de acuerdo con la invención pueden haberse sometido a las mismas pruebas para el diagnóstico de una infección persistente o pueden haber sido identificados, sin previo examen, como personas de alto riesgo debido a la presencia de uno o más factores de riesgo (por ejemplo, exposición al agente infeccioso, exposición a un sujeto infectado, predisposición genética o padecer una condición patológica que predisponga a infecciones secundarias). La reducción de los daños o síntomas de la infección persistente también puede incluir, a título meramente enunciativo, el alivio de los síntomas, la reducción del alcance de la enfermedad, la estabilización de la enfermedad (es decir, ausencia de empeoramiento), retraso o ralentización del avance de la enfermedad y mejoría o paliación del estado de la enfermedad. El tratamiento se puede administrar en casa, bajo la estrecha supervisión del proveedor de asistencia sanitaria, o en un centro de salud.
Métodos para medir la respuesta inmunitaria
Los métodos para medir la respuesta inmunitaria tras el tratamiento de acuerdo con la presente invención son bien conocidos en el campo. La actividad de los linfocitos T se puede valorar, por ejemplo, a través de ensayos que detectan la producción de citoquinas, ensayos que miden la proliferación de los linfocitos T, ensayos que miden la eliminación del agente microbiano y ensayos que miden la citotoxicidad de los linfocitos T CD8+. Estos ensayos se describen, por ejemplo, en la Patente estadounidense n° 6.808.710 y en las Publicaciones de solicitudes de patentes estadounidenses n° 20040137577, 20030232323.20030166531, 20030064380, 20030044768, 20030039653, 20020164600, 20020160000, 20020110836, 20020107363, y 20020106730, quedando todas ellas incorporadas al presente como referencia.
Opcionalmente, la capacidad de un inhibidor de PD-1 para incrementar la citotoxicidad de los linfocitos T CD8+ es valorada mediante ensayos que miden la proliferación de los linfocitos T CD8+ (por ejemplo, incorporación de timidina, ensayos BrdU y tinción con marcadores del ciclo celular (por ejemplo, Ki67 y CFSE), descritos, por ejemplo, por Dong et al (Nature 5:1365-1369,1999). En un ejemplo, la proliferación de linfocitos T se controla cultivando los linfocitos T purificados que expresan PD-1 con un inhibidor de PD-1, una señal de activación primaria como se describe anteriormente, y 3H-timidina. El nivel de proliferación de los linfocitos T se determina midiendo la incorporación de timidina.
La citotoxicidad de los linfocitos T CD8+ también se valora mediante ensayos de lisis (por ejemplo, ensayos de liberación de 51Cr o ensayos que detectan la liberación de perforina o granzima), ensayos que detectan la activación de caspasa o ensayos que miden la eliminación del agente microbiano del sujeto infectado. Por ejemplo, la carga viral de una muestra biológica del sujeto infectado (por ejemplo, suero, bazo, hígado, pulmón o el tejido del que el virus es trófico) se puede medir antes y después del tratamiento.
También se puede medir la producción de citoquinas, como IFNy, TNF-a, y IL-2. Por ejemplo, los linfocitos T purificados son cultivados en presencia de la proteína del inhibidor de PD-1 y una señal de activación primaria. El nivel de las diversas citoquinas en el supernatante se puede determinar mediante ensayos inmunosorbentes ligados a enzimas u otros ensayos convencionales descritos, por ejemplo, en Dong et al (Nature 5:1365-1369, 1999).
Si se desea, la eficacia del inhibidor de PD-1 se valora por su capacidad para inducir la coestimulación de los linfocitos T. Por ejemplo, un método para la coestimulación de linfocitos T in vitro implica proporcionar linfocitos T purificados que expresan PD-1 con una señal de activación primera o primaria por el anticuerpo monoclonal contra CD3 o éster de forbol, o por un antígeno en asociación con un MHC de clase II. La capacidad de un agente de un compuesto candidato para reducir la actividad o la expresión de PD-1 y, por tanto, proporcionar la señal secundaria o coestimuladora necesaria para modular la función inmunitaria de estos linfocitos T se puede valorar mediante cualquiera de los diversos ensayos convencionales conocidos en el campo.
Una respuesta de los linfocitos B se valora mediante un ELISA de antígeno específico (por ejemplo, LCMV, VIH, tuberculosis o malaria), ELISPOT de células plasmáticas, ensayo de linfocitos B de memoria, fenotipo de linfocitos B y análisis de los centros germinales mediante inmunohistoquímica.
Ensayos de detección
La presente divulgación proporciona métodos de detección para identificar compuestos que pueden inhibir la expresión o actividad de PD-1. Los compuestos útiles incluyen cualquier agente que inhibe la actividad biológica o reduce el nivel celular de PD-1. Por ejemplo, los compuestos candidatos pueden reducir la unión de PD-1 a PD-L1, a PD-L2 o a ambos. Utilizando estos agentes como compuestos principales, por ejemplo, los presentes métodos de detección también permiten la identificación de otros inhibidores nuevos y específicos de PD-1 que funcionan para tratar o reducir infecciones persistentes, o alternativamente para aliviar uno o más síntomas asociados a estas infecciones. El método de detección puede implicar técnicas de alto rendimiento.
Por un «compuesto candidato» se entiende un producto químico, sea naturalmente presente u obtenido por medios artificiales. Los compuestos candidatos pueden incluir, por ejemplo, péptidos, polipéptidos, moléculas orgánicas sintéticas, moléculas orgánicas naturalmente presentes, moléculas de ácido nucleico, moléculas de ácido nucleico peptídico, así como componentes y derivados de los mismos. Por ejemplo, un compuesto candidato útil según la presente invención reduce la unión de PD-1 a PD-L1, a PD-L2 o a ambos.
Existen diversos métodos disponibles para realizar estos ensayos de detección. Según un planteamiento, los compuestos candidatos se añaden a diversas concentraciones al medio de cultivo de las células que expresan PD-1. Por un «gen PD-1» se entiende un ácido nucleico que codifica una proteína PD-1. Por «gen de fusión de PD-1» se entiende un promotor de PD-1 y/o la totalidad o parte de una región que codifica PD-1 operativamente unida a una segunda secuencia de ácido nucleico heteróloga. En realizaciones preferibles, la segunda secuencia de ácido nucleico heteróloga es un gen informador, es decir, un gen cuya expresión se puede someter a ensayo; los genes informadores incluyen, a título meramente enunciativo, los que codifican glucuronidasa (GUS), luciferasa, cloranfenicol transacetilasa (CAT), proteína fluorescente verde (GFP), fosfatasa alcalina y beta-galactosidasa.
La expresión genética de PD-1 se mide entonces, por ejemplo, a través de un análisis estándar de Northern blot (Ausubel et al., supra), utilizando cualquier fragmento preparado a partir de la molécula de ácido nucleico de PD-1 como una sonda de hibridación o a través de una PCR en tiempo real con los cebadores apropiados. El nivel de expresión genética en presencia del compuesto candidato se compara con el nivel medido en un medio de cultivo de control que carece de la molécula candidata. Si se desea, el efecto de los compuestos candidatos puede, alternativamente, medirse por el nivel del polipéptido PD-1 utilizando el mismo planteamiento general y técnicas inmunológicas estándar, como un ensayo de Western blot o inmunoprecipitación con un anticuerpo específico para PD-1, por ejemplo. Los inmunoensayos pueden utilizarse, por ejemplo, para detectar o controlar el nivel de PD-1. Los anticuerpos policlonales o monoclonales que son capaces de unirse a PD-1 pueden ser empleados en cualquier formato de inmunoensayo estándar (por ejemplo, ensayo ELISA o RIA) para medir los niveles de PD-1. El PD-1 también se puede medir empleando la espectroscopia de masa, cromatografía líquida de alto rendimiento, técnicas espectrofotométricas o fluorométricas, o combinaciones de las mismas.
Alternativamente, los métodos de detección pueden utilizarse para identificar compuestos candidatos que disminuyen la actividad biológica de PD-1, reduciendo la unión de PD-1 a PD-L1, a PD-L1 o a ambos, al menos en un 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, o un 100% con respecto al control no tratado. Por ejemplo, un compuesto candidato se puede testar por su capacidad para reducir la actividad de PD-1 en células que naturalmente expresan PD-1, tras la transfección con ADNc para PD-1, o en soluciones libres de células que contienen PD-1, como se describe detalladamente más abajo. El efecto de un compuesto candidato sobre la unión o activación de PD-1 se puede testar mediante ensayos de unión radiactiva y no radiactiva, ensayos de competencia y ensayos de señalización del receptor.
En un ejemplo específico, las células de mamífero (por ejemplo, células de roedor) que expresan un ácido nucleico que codifica PD-1 son cultivadas en presencia de un compuesto candidato (por ejemplo, un péptido, polipéptido, molécula orgánica sintética, molécula orgánica naturalmente presente, molécula de ácido nucleico, o un componente de los mismos). Las células pueden expresar PD-1 de forma endógena o bien, alternativamente, estar genéticamente modificadas mediante cualquier técnica estándar conocida en el campo (por ejemplo, transfección e infección viral) para sobreexpresar PD-1. El nivel de expresión de PD-1 se mide en estas células por medio de un análisis de Western blot, que posteriormente se compara con el nivel de expresión de la misma proteína en células de control que no han entrado en contacto con el compuesto candidato. Un compuesto que promueve un incremento del nivel de actividad de PD-1 como resultado de la reducción de su síntesis o actividad biológica se considera útil en la invención.
En un ejemplo concreto, un compuesto que interfiere en la unión de PD-1 con PD-L1, con PD-L2 o con ambos (reduciendo así la actividad biológica de PD-1), que conduce a un incremento de la respuesta inmunitaria, resulta útil conforme a la presente invención. Dada su capacidad para reducir la actividad biológica de PD-1, esta molécula se
puede utilizar, por ejemplo, como agente terapéutico para tratar o reducir una infección persistente o, alternativamente, para aliviar uno o más síntomas asociados con estas infecciones. En un ejemplo específico, un compuesto candidato se puede poner en contacto con dos proteínas, siendo la primera proteína un polipéptido sustancialmente idéntico a PD-1 y siendo la segunda proteína PD-L1 o PD-L2 (es decir, una proteína que se une al polipéptido PD-1 en condiciones que permiten la unión y que conducen a una respuesta inmunitaria reducida). Según este método de detección concreto, la interacción entre estas dos proteínas se mide tras la adición de un compuesto candidato. Una reducción de la unión de PD-1 al segundo polipéptido tras la adición del compuesto candidato (con respecto a esa unión en ausencia del compuesto) identifica al compuesto candidato como un compuesto que tiene la capacidad de inhibir la interacción entre las dos proteínas. En última instancia, el ensayo de detección de la invención se puede realizar, por ejemplo, en un sistema libre de células o utilizando un sistema de doble híbrido en levaduras. Si se desea, una de las proteínas del compuesto candidato se puede inmovilizar en un soporte como se ha descrito anteriormente o puede tener un grupo detectable.
Alternativa o adicionalmente, los compuestos candidatos se pueden detectar para seleccionar los que presentan una unión específica y, por tanto, inhiben el PD-1. La eficacia de este compuesto candidato dependerá de su capacidad para interactuar con PD-1. Esta interacción se puede testar fácilmente empleando cualquier número de técnicas de unión y ensayos funcionales estándar (por ejemplo, los descritos en Ausubel et al., supra). Por ejemplo, un compuesto candidato se puede testar in vitro para determinar la interacción y la unión con PD-1 y su capacidad para modular respuestas inmunitarias se puede testar mediante ensayos estándar (por ejemplo, los descritos en el presente).
Por ejemplo, un compuesto candidato que se une a PD-1 se puede identificar utilizando una técnica basada en la cromatografía. Por ejemplo, un PD-1 recombinante se puede purificar mediante técnicas estándar a partir de las células modificadas para expresar PD-1 (por ejemplo, las anteriormente descritas) y se pueden inmovilizar en una columna. Alternativamente, el PD-1 naturalmente presente se puede inmovilizar en una columna. A continuación, se pasa una solución de los compuestos candidatos por la columna y se identifica un compuesto específico para PD-1 sobre la base de su capacidad para unirse a PD-1 y para ser inmovilizado en la columna. Para aislar el compuesto, la columna se lava para eliminar las moléculas unidas de forma no específica y el compuesto de interés se libera posteriormente de la columna y se recopila. Los compuestos aislados por este método (o cualquier otro método apropiado) pueden, si se desea, ser posteriormente purificados (por ejemplo, mediante cromatografía líquida de alto rendimiento).
La detección de nuevos inhibidores y la optimización de los principales compuestos se pueden valorar, por ejemplo, evaluando su capacidad para modular la actividad citotóxica de los linfocitos T o la respuesta inmunitaria empleando técnicas estándar. Por otra parte, estos compuestos candidatos se pueden testar para determinar su capacidad para funcionar como agentes antimicrobianos (por ejemplo, como los descritos en el presente). Los compuestos aislados mediante este planteamiento también se pueden utilizar, por ejemplo, como agentes terapéuticos para tratar o reducir infecciones persistentes o, alternativamente, para aliviar uno o más síntomas asociados con estas infecciones. Los compuestos identificados como compuestos que se unen a PD-1 con una constante de afinidad igual o menor que 10 mM se consideran particularmente útiles.
Los agentes terapéuticos potenciales incluyen moléculas orgánicas, péptidos, peptidomiméticos, polipéptidos y anticuerpos que se unen a una secuencia de ácido nucleico o polipéptido que codifica PD-1 y, por tanto, inhibe o extingue su actividad. Los agentes antimicrobianos potenciales también incluyen pequeñas moléculas que se unen al sitio de unión de estos polipéptidos y lo ocupan, evitando así la unión a moléculas de unión celular, de forma que se impide esa actividad biológica normal. Otros agentes antimicrobianos potenciales incluyen moléculas antisentido.
Métodos de diagnóstico y pronóstico
El cáncer, como el linfoma de células T angioinmunoblástico o el linfoma de Hodgking nodular de predominio linfocítico, se detecta examinando la cantidad de un polipéptido PD-1 en una muestra de ensayo (es decir, una muestra obtenida de un paciente). Un cambio en el nivel del polipéptido PD-1 en comparación con una muestra de control es indicativo de cáncer en el sujeto. El cambio puede ser un incremento o una disminución del polipéptido PD-1 con respecto a una muestra de control. La muestra de control se prepara (es decir, se fracciona) de forma similar a la muestra de ensayo.
Una muestra es, por ejemplo, sangre, suero, líquido ascítico, orina u otros fluidos corporales. Preferiblemente, la muestra es un linfocito T o un linfocito B.
La cantidad de PD-1 se determina en la muestra de ensayo y se compara con la expresión del nivel de control normal. Por nivel de control normal se entiende el nivel de expresión de un polipéptido PD-1 que se encuentra típicamente en un sujeto que no padece cáncer. Un incremento del nivel de PD-1 en la muestra obtenida del paciente indica que el sujeto padece o corre el riesgo de desarrollar un cáncer. Por el contrario, cuando los métodos se aplican de forma profiláctica, un nivel similar o un descenso de un polipéptido PD-1 en una muestra obtenida del paciente indica que el sujeto no sufre ni corre el riesgo de desarrollar un cáncer. Un incremento del nivel de un
polipéptido PD-1 en la muestra obtenida del paciente indica que el sujeto padece o corre el riesgo de desarrollar un cáncer.
La alteración de la cantidad de polipéptido PD-1 es estadísticamente significativa. Por estadísticamente significativa se entiende que la alteración es mayor de la que cabría esperar que ocurriese por casualidad solamente. La significación estadística se determina por cualquier método conocido en el campo. Por ejemplo, la significación estadística se determina por el valor p. Los valores p son una medida de la probabilidad de que una diferencia entre grupos durante un experimento se produzca por casualidad.
(P(z > Zobservado)). Por ejemplo, un valor p de 0,01 significa que existe una probabilidad de uno entre 100 de que el resultado se haya producido por casualidad. Cuanto menor sea el valor p, más probable es que la diferencia entre grupos haya sido provocada por el tratamiento. Una alteración es estadísticamente significativa si el valor p es al menos 0,05. Preferiblemente, el valor p es 0,04, 0,03, 0,02, 0,01, 0,005, 0,001 o menos.
La «precisión del diagnóstico» de un test, ensayo o método se refiere a la capacidad de ese test, ensayo o método para distinguir entre los pacientes que tienen cáncer o corren el riesgo de desarrollar un cáncer, basándose en el hecho de si los pacientes tienen una «presencia clínicamente significativa» de un polipéptido PD-1. Por «presencia clínicamente significativa» se entiende que la presencia del polipéptido PD-1 en el paciente (típicamente en una muestra del paciente) es superior o inferior al punto de corte predeterminado (o un valor límite) para ese polipéptido PD-1 y, por tanto, indica que el paciente tiene un cáncer para el que una presencia suficientemente elevada de esa proteína representa un marcador.
Los términos «precisión diagnóstica de alto grado» y «precisión diagnóstica de muy alto grado» se refieren al test o ensayo para ese polipéptido PD-1 con el punto de corte predeterminado correctamente (de forma precisa), lo que indica la presencia o ausencia de cáncer. Un test perfecto tendría una precisión perfecta. Así, en los individuos que padecen diabetes, el test indicaría solamente unos resultados positivos y no indicaría ningún resultado «negativo» para ninguno de estos individuos (no habría «falsos negativos»). Es decir, que la «sensibilidad» del ensayo (el índice de positivos verdaderos) sería del 100%. Por otra parte, en los individuos que no padecen diabetes, el test indicaría solamente resultados negativos y no indicaría ningún resultado «positivo» para ninguno de estos individuos (no habría «falsos positivos»). Es decir, que la «especificidad» (el índice de negativos verdaderos) sería del 100%. Véase, por ejemplo, OTVIarcaigh AS, Jacobson RM, "Estimating The Predictive Value Of A Diagnostic Test, How To Prevent Misleading Or Confusing Results," Clin. Ped. 1993, 32(8): 485-491, que trata sobre la especificidad, la sensibilidad y los valores predictivos positivos y negativos de un test, por ejemplo un test de diagnóstico clínico. Al cambiar el punto de corte o valor límite de un test (o ensayo) normalmente varía la sensibilidad y especificidad, aunque en una relación cualitativamente inversa. Por ejemplo, si el punto de corte se reduce, más individuos de la población testados tendrán típicamente unos resultados del test por encima del punto de corte o valor límite. Dado que los individuos cuyos resultados del test se encuentran por encima del punto de corte son identificados como individuos que padecen la enfermedad, condición o síndrome para el que se está realizando el test, reducir el punto de corte provocará que más individuos sean identificados como individuos con resultados positivos (es decir, que padecen cáncer). Por tanto, una mayor proporción de los que padecen cáncer serán identificados por el test como individuos que lo padecen. Por consiguiente, la sensibilidad (el índice de positivos verdaderos) del ensayo aumentará. No obstante, al mismo tiempo, habrá más falsos positivos porque un mayor número de personas que no padecen la enfermedad, la condición o el síndrome (es decir, personas cuyos resultados son realmente «negativos») serán identificados por el test por presentar unos valores del polipéptido PD-1 por encima del punto de corte y, por tanto, como positivos (es decir, que padecen la enfermedad, la condición o el síndrome) en lugar de ser correctamente identificados por el ensayo como negativos. Por consiguiente, la especificidad (el índice de negativos verdaderos) del test disminuirá. De un modo similar, al aumentar el punto de corte tendrá a disminuir la sensibilidad y aumentar la especificidad. Por tanto, para valorar la eficacia y utilidad de un test, ensayo o método médico propuesto para valorar la condición de un paciente, siempre hay que tener en cuenta la sensibilidad y la especificidad, así como cuál es el punto de corte al que están sujetas la sensibilidad y especificidad, porque la sensibilidad y la especificidad pueden variar de forma significativa a lo largo del rango de puntos de corte.
No obstante, existe un indicador que permite la representación de la sensibilidad y la especificidad de un test, ensayo o método a lo largo de todo el rango de puntos de corte con tan solo un único valor. Ese indicador se obtiene de una curva de características operativas del receptor (ROC) para el test, el ensayo o el método en cuestión. Véase, por ejemplo, Shultz, "Clinical Interpretation Of Laboratory Procedures," el capítulo 14 de Teitz, Fundamentals of Clinical Chemistry, Burtis y Ashwood (eds.), 4a edición 1996, W.B. Saunders Company, páginas 192-199; y Zweig et al., "ROC Curve Analysis: An Example Showing The Relationships Among Serum Lipid And Apolipoprotein Concentrations In Identifying Patients With Coronory Artery Disease," Clin. Chem., 1992, 38(8): 1425-1428.
Una curva ROC es un trazado X-Y de sensibilidad en el eje Y, en una escala de cero a uno (es decir, 100%), frente a un valor igual a uno menos especificidad en el eje X, en una escala de cero a uno (es decir, 100%). En otras palabras, es un trazado del índice de positivos verdaderos frente al índice de positivos falsos para ese test, ensayo o método. Para elaborar la curva ROC para el test, ensayo o método en cuestión, los pacientes son evaluados utilizando un método perfectamente preciso o «patrón oro» que es independiente del test, ensayo o método en
cuestión, para determinar si los pacientes son realmente positivos o negativos para la enfermedad, condición o síndrome (por ejemplo, la angiografía coronaria es un test de patrón oro para la presencia de ateroesclerosis coronaria). Los pacientes también son testados empleando el test, el ensayo o método en cuestión y para diversos puntos de corte los pacientes son identificados como positivos o negativos de acuerdo con el test, ensayo o método. La sensibilidad (el índice de positivos verdaderos) y el valor igual a uno menos la especificidad (un valor equivalente al índice de falsos positivos) se determinan para cada punto de corte y cada par de valores X-Y se traza como un único punto en el diagrama de X-Y. La «curva» que conecta esos puntos es la curva ROC.
El área bajo la curva (AUC) es el indicador que permite la representación de la sensibilidad y la especificidad de un test, ensayo o método a lo largo de todo el rango de puntos de corte con tan solo un único valor. El AUC máximo es uno (un test perfecto) y el área mínima es un medio. Cuanto más se acerca el AUC a uno, mayor es la precisión del test.
Por «precisión diagnóstica de alto grado» se entiende un test o un ensayo (como el test de la invención para determinar la presencia clínicamente significativa del polipéptido PD-1, que indica por ello la presencia de diabetes) en el que el AUC (área bajo la curva ROC para el test o el ensayo) es al menos de 0,70, preferiblemente al menos de 0,75, más preferiblemente al menos de 0,80, preferiblemente al menos de 0,85, más preferiblemente al menos de 0,90 y más preferiblemente al menos de 0,95.
Por «precisión diagnóstica de muy alto grado» se entiende un test o ensayo en el que el AUC (área bajo la curva ROC para el test o el ensayo) es al menos de 0,875, preferiblemente al menos de 0,90, más preferiblemente al menos de 0,925, preferiblemente al menos de 0,95, más preferiblemente al menos de 0,975, y más preferiblemente al menos de 0,98.
Opcionalmente, la expresión de otros biomarcadores conocidos para un determinado cáncer también se determina como otra indicación de si el sujeto padece o no padece cáncer. Por ejemplo, se detecta CD10, bcl-6, CD20, CD57 o CXCR5.
El polipéptido PD-1 y los biomarcadores adicionales se detectan de cualquier manera adecuada, aunque típicamente se detectan poniendo en contacto una muestra del paciente con un anticuerpo que se une a PD-1 o al biomarcador y, por tanto, indican la presencia o ausencia de un producto de la reacción. El anticuerpo puede ser monoclonal, policlonal, quimérico o un fragmento de los anteriores, como se ha tratado detalladamente, y el paso de detectar el producto de la reacción se puede realizar con cualquier inmunoensayo adecuado. La muestra del sujeto es típicamente un fluido biológico como el descrito anteriormente y puede ser la misma muestra de fluido biológico empleada para aplicar el método descrito.
La expresión de un polipéptido PD-1 también permite controlar la evolución del tratamiento para el cáncer. En este método, se proporciona una muestra biológica de un sujeto que se está sometiendo a tratamiento, por ejemplo quirúrgico, quimioterapéutico u hormonal, para el cáncer. Si se desea, las muestras biológicas se obtienen del sujeto en distintos puntos temporales, antes, durante o después del tratamiento. La expresión de un PD-1 se determina y compara después con una referencia, por ejemplo, un control cuyo estado del cáncer es conocido. La muestra de referencia ha sido expuesta al tratamiento. Alternativamente, la muestra de referencia no ha sido expuesta al tratamiento. Opcionalmente, este control se realiza de forma preliminar a unos segundos procedimientos de control quirúrgicos y a unos posteriores procedimientos de control quirúrgicos. Por ejemplo, se pueden recoger muestras de sujetos que han recibido un tratamiento quirúrgico inicial para el cáncer y un posterior tratamiento con agentes antineoplásicos para ese cáncer, para controlar el progreso del tratamiento.
Si la muestra de referencia es de un sujeto que no tiene cáncer, una similitud o una reducción de la cantidad del polipéptido PD-1 en la muestra de ensayo y la muestra de referencia indica que el tratamiento es eficaz. No obstante, un incremento en la cantidad del polipéptido PD-1 en la muestra de ensayo y la muestra de referencia indica un pronóstico o un resultado clínico menos favorable.
Por «eficaz» se entiende que el tratamiento provoca una reducción en la cantidad de un polipéptido PD-1, o una reducción en el tamaño, la prevalencia o el potencial metastásico de un tumor en un sujeto. La valoración del cáncer se realiza utilizando protocolos clínicos estándar. La eficacia se determina en asociación con cualquier método conocido para el diagnóstico o el tratamiento del tumor concreto. La expresión de un polipéptido PD-1 también permite la identificación de pacientes que responderán a la terapia sistémica, por ejemplo quimioterapéutica, hormonal o de radiación. En este método, se proporciona una muestra biológica de un sujeto antes de someterse a un tratamiento quirúrgico para el cáncer. La expresión de un polipéptido PD-1 se determina y compara a continuación con una muestra biológica obtenida del sujeto tras la extracción quirúrgica del cáncer. El paciente probablemente reaccionará al tratamiento sistémico, si la cantidad del polipéptido PD-1 disminuye tras la extracción quirúrgica del cáncer. Por el contrario, el paciente probablemente no reaccionará al tratamiento sistémico, si la cantidad del polipéptido se mantiene constante o aumenta tras la extracción quirúrgica del cáncer.
La expresión del polipéptido PD-1 o de otros biomarcadores del cáncer se determina a nivel de la proteína o del ácido nucleico, empleando cualquier método conocido en el campo. Por ejemplo, se puede utilizar el análisis de hibridación Northern, utilizando sondas que reconocen específicamente una o más de estas secuencias para
determinar la expresión genética. Alternativamente, la expresión se mide utilizando estos ensayos de PCR basados en la transcripción inversa, por ejemplo utilizando cebadores específicos para la secuencia de genes expresada diferencialmente. La expresión también se determina a nivel de la proteína, es decir midiendo los niveles de péptidos codificados por los productos genéticos descritos en el presente o las actividades de los mismos. Estos métodos son bien conocidos en el campo e incluyen, por ejemplo, inmunoensayos basados en anticuerpos para proteínas codificadas por los genes. Se puede emplear cualquier material biológico para la detección/cuantificación de la proteína o su actividad. Alternativamente, se puede seleccionar un método adecuado para determinar la actividad de las proteínas codificadas por los genes marcadores en función de la actividad de cada una de las proteínas analizadas.
El sujeto es preferiblemente un mamífero. El mamífero es, por ejemplo, un ser humano, un primate no humano, un ratón, una rata, un perro, un gato, un caballo o una vaca. Los sujetos son típicamente mujeres u hombres. Al sujeto se le ha diagnosticado previamente que padece un cáncer y posiblemente ya se ha sometido a un tratamiento para el cáncer. Alternativamente, al sujeto no se le ha diagnosticado previamente un cáncer. La presente invención resulta útil para todos los pacientes que corren el riesgo de desarrollar un cáncer. A pesar de que cada tipo de cáncer tiene su propio conjunto de factores de riesgo, el riesgo de desarrollar cáncer aumenta en función de la edad, el sexo, la raza, el historial médico personal y familiar. Otros factores de riesgo están relacionados en gran medida con el estilo de vida, mientras que determinadas infecciones, exposiciones laborales y algunos factores ambientales también pueden estar relacionados con el desarrollo de un cáncer.
El diagnóstico del cáncer se produce típicamente mediante la identificación de una masa durante un examen, aunque también puede ser a través de otro medio, como un diagnóstico radiológico o por ultrasonidos. El tratamiento es típicamente a través de cirugía citorreductora, seguida de un tratamiento con agentes antineoplásicos como docetaxel, vinorelbina, gemcitabina, capecitabina o una combinación de ciclofosfamida, metotrexato y fluorouracilo; ciclofosfamida, doxorubicina y fluorouracilo; doxorubicina y ciclofosfamida; doxorubicina y ciclofosfamida con paclitaxel; doxorubicina seguida de CMF; o ciclofosfamida, epirubicina y fluorouracilo. Por otra parte, muchos pacientes precisarán una terapia de radiación.
Los inmunoensayos realizados de acuerdo con la presente invención pueden ser ensayos homogéneos o heterogéneos. En un ensayo homogéneo, la reacción inmunológica normalmente implica el anticuerpo específico (por ejemplo, el polipéptido PD-1), un analito etiquetado y la muestra de interés. La señal que surge de la etiqueta es modificada, directa o indirectamente, tras la unión del anticuerpo al analito etiquetado. Tanto la reacción inmunológica como la detección del alcance de la misma se realizan en una solución homogénea. Las etiquetas inmunoquímicas que se pueden emplear incluyen radicales libres, radioisótopos, tintes fluorescentes, enzimas, bacteriófagos o coenzimas.
En un planteamiento de ensayo heterogéneo, los reactivos son normalmente la muestra, el anticuerpo y los medios para producir una señal detectable. Se pueden emplear muestras como las descritas anteriormente. Por lo general, el anticuerpo es inmovilizado en un soporte, como un disco, una placa o un portaobjetos, y se pone en contacto con la muestra que se sospecha que contiene el antígeno en una fase líquida. El soporte es entonces separado de la fase líquida y o bien la fase de soporte o bien la fase líquida es examinada para encontrar una señal detectable, empleando medios para producir esa señal. La señal está relacionada con la presencia del analito en la muestra. Los medios para producir una señal detectable incluyen el uso de etiquetas radiactivas, etiquetas fluorescentes o etiquetas enzimáticas. Por ejemplo, si el antígeno a detectar contiene un segundo sitio de unión, un anticuerpo que se une a ese sitio se puede conjugar con un grupo detectable y añadirse a la solución de la reacción de la fase líquida antes del paso de separación. La presencia del grupo detectable sobre el soporte sólido indica la presencia del antígeno en la muestra de ensayo. Algunos ejemplos de inmunoensayos adecuados son radioinmunoensayos, métodos de inmunofluorescencia o inmunoensayos ligados a enzimas.
Las personas con conocimientos en el campo estarán familiarizadas con numerosos formatos de inmunoensayo específicos y variantes de los mismos, que pueden ser útiles para aplicar el método divulgado en el presente. Véase, en general, E. Maggio, Enzyme-Immunoassay, (1980) (CRC Press, Inc., Boca Raton, Fla.); véase también la Patente estadounidense n° 4.727.022 de Skold et al. titulada "Methods for Modulating Ligand-Receptor Interactions and their Application", la Patente estadounidense n° 4.659.678 de Forrest et al. titulada "Immunoassay of Antigens", la Patente estadounidense n° 4.376.110 de David et al., titulada "Immunometric Assays Using Monoclonal Antibodies", la Patente estadounidense n° 4.275.149 de Litman et al., titulada "Macromolecular Environment Control in Specific Receptor Assays", la Patente estadounidense n° 4.233.402 de Maggio et al., titulada "Reagents and Method Employing Channeling" y la Patente estadounidense n° 4.230.767 de Boguslaski et al., titulada "Heterogeneous Specific Binding Assay Employing a Coenzyme as Label". Los anticuerpos se conjugan con un soporte sólido adecuado para un ensayo de diagnóstico (por ejemplo, discos, placas, portaobjetos o pocillos fabricados en materiales como látex o poliestireno) de acuerdo con técnicas conocidas, como la precipitación. Los anticuerpos descritos en el presente pueden igualmente conjugarse con grupos detectables como radioetiquetas (por ejemplo, 35 S, 135 I, 1311), etiquetas enzimáticas (por ejemplo, peroxidasa de rábano, fosfatasa alcalina) y etiquetas fluorescentes (por ejemplo, fluoresceína) de acuerdo con técnicas conocidas.
Los kits de diagnóstico para aplicar los métodos descritos en el presente se producen de distintas maneras. En una realización, el kit de diagnóstico comprende (a) un anticuerpo (por ejemplo, un polipéptido PD-1) conjugado con un soporte sólido; y (b) un anticuerpo secundario de la invención conjugado con un grupo detectable. Los reactivos también pueden incluir agentes auxiliares, tales como agentes amortiguadores y agentes estabilizantes de la proteína, como polisacáridos y similares. El kit de diagnóstico también puede incluir, cuando sea necesario, otros miembros del sistema productor de señal, sistema del que es miembro el grupo detectable (por ejemplo, sustratos enzimáticos), agentes para reducir la interferencia de fondo en un test, reactivos de control, aparatos para realizar una prueba y similares. Alternativamente, un kit de ensayo contiene (a) un anticuerpo y (b) un socio de unión específica para el anticuerpo conjugado con un grupo detectable. Del mismo modo, pueden incluirse agentes auxiliares como los anteriormente descritos. El kit de ensayo puede ser envasado de cualquier manera adecuada, típicamente con todos los elementos en un único envase junto con una hoja de instrucciones impresas para realizar el ensayo.
Esta invención se basa en parte en los experimentos descritos en los siguientes ejemplos. Estos ejemplos se proporcionan para ilustrar la invención y no se deberá interpretar que tienen un carácter limitador.
Ejemplo 1: Inhibición de la ruta de PD-1 en ratones crónicamente infectados utilizando anticuerpos contra PD-L1
Los ratones infectados con diversas cepas del virus de la coriomeningitis linfocítica (LCMV) se emplearon para estudiar el efecto de la infección vírica crónica sobre la función de los linfocitos T CD8+. La cepa de Armstrong LCMV causa una infección aguda que se elimina en el plazo de ocho días, dejando atrás una población de larga vida de linfocitos T CD8+ de memoria, inactivos y altamente funcionales. La cepa LCMV CI-13, por el contrario, establece una infección persistente en el huésped, que se caracteriza por una viremia que se prolonga hasta tres meses. El virus permanece en algunos tejidos por tiempo indefinido y los linfocitos T CD8+ de antígeno específico se vuelven funcionalmente incapacitados. Los linfocitos T CD8+ DbNP396-404 son físicamente sometidos a deleción, mientras que los linfocitos T CD8+ DbGP33-41 y DbGP276-286 CD8+ persisten, aunque pierden la capacidad para proliferar o secretar citoquinas antivirales, como IFN-y y TNF-a.
Los ratones C57BL/6 se adquirieron en el Instituto Nacional contra el Cáncer estadounidense (Frederick, MD). Los ratones fueron infectados por vía intravenosa con 2x 106 pfu de LCMV-C1-13. Las depleciones de CD4 se realizaron inyectando 500 |jg de GK1.5 en PBS el día de la infección y el día siguiente a la infección. Los ratones inmunes al LCMV se generan infectando a los ratones por vía intraperitoneal con 2x105 pfu de LCMV Armstrong.
El análisis de matriz génica se realizó en linfocitos T CD8+ transgénicos P14 específicos de DbGP33-41 desnudo purificado-FACS, linfocitos T CD8+ de memoria específicos de DbGP33-41 obtenidos de ratones inmunes a LCMV Armstrong y linfocitos T CD8+ específicos de DbGP33-41 o específicos de DbGP276-286 obtenidos de ratones infectados con LCMV C1-13 y CD4+ sometidos a depleción. El aislamiento de ARN y el análisis de matriz génica se realizaron tal y como se describe en Kaech et al., (Cell 111:837-51, 2002). El ARNm de PD-1 se expresó a niveles elevados en los linfocitos T CD8+ agotados con respecto a los linfocitos T CD8+ de memoria (Figura 1 A). Por otra parte, PD-1 se expresó en la superficie de los linfocitos T CD8+ en los ratones infectados por LCMV C1-13, aunque no estuvo presente en la superficie de los linfocitos T CD8+ después de la eliminación del LCMV Armstrong (Figura 1B). Los ratones crónicamente infectados también expresaron unos niveles superiores de uno de los ligandos de PD-1, PD-L1, en la mayoría de los linfocitos y APC en comparación con los ratones no infectados. Por tanto, la persistencia del antígeno viral y el agotamiento de los linfocitos T CD8+ son concomitantes con una inducción de la expresión de PD-1.
Para testar la hipótesis de que el bloqueo de la ruta de PD-1/PD-L1 puede restaurar la función de los linfocitos T y mejorar el control viral durante la infección crónica por LCMV, se interrumpió la ruta coinhibidora de PD-1/PD-L1 durante la infección crónica por LCMV utilizando anticuerpos de bloqueo aPD-L1. Se administró un anticuerpo monoclonal contra PD-L1 por vía intraperitoneal cada tres días a los ratones infectados por LCMV C1-13 (200 jg de anticuerpos monoclonales de rata contra ratón PD-L1 IgG2b (clon 10F.5C5 o 10F.9G2)) desde el día 23 hasta el día 37 después de la infección. En el día 37, había aproximadamente 2,5 veces más linfocitos T CD8+ específicos de DbNP396-404 y tres veces más linfocitos T CD8+ específicos de DbGP33-41 en los ratones tratados con respecto a los controles sin tratar (Figura 2A). La inducción de la proliferación fue específica para los linfocitos T CD8+, dado que el número de linfocitos T CD4+ en el bazo era aproximadamente el mismo tanto en los ratones tratados como en los ratones sin tratar (~6x104 IAbGP61-80 de linfocitos T CD4+ por bazo).
Además de un aumento de la proliferación de linfocitos T CD8+, la inhibición de las señales de PD-1 también se tradujo en una producción aumentada de citoquinas antivirales en los linfocitos T CD8+ de virus específico. Se determinó la producción de IFN-y y TNF-cc por parte de los linfocitos T CD8+ hasta ocho epítopos de CTL diferentes. La respuesta combinada fue 2,3 veces mayor en los ratones tratados frente a los ratones no tratados (Figuras 2B y 2C). Tras el tratamiento también se observó una frecuencia de las células productoras de TNF-a dos veces mayor (Figura 2D). La eliminación vírica también se aceleró cuando el virus se eliminó del suero, el bazo y el hígado de los ratones tratados. En los ratones tratados se observaron títulos virales reducidos en el pulmón y el riñón (unas 10 veces menos) para el día 37 después de la infección (14 días después del inicio del tratamiento). Sin
embargo, los ratones sin tratar presentaron unos niveles significativos de virus en todos estos tejidos (Figura 2E). Los títulos virales en suero y homogenados de tejido se determinaron utilizando células Vero, tal y como se describe en Ahmed et al. (J. Virol. 51:34-41, 1984). Los resultados muestran que un inhibidor de PD-1 incrementa la proliferación de linfocitos T CD8+ y la eliminación viral, lo que indica que la inhibición de las señales de PD-1 restablece la función de los linfocitos T CD8+. Por otra parte, la inhibición de las señales de PD-1 también intensificó las respuestas de los linfocitos B, dado que el número de células secretoras de anticuerpo específico para LCMV en el bazo también se incrementó (más de 10 veces) tras el tratamiento.
Los linfocitos T CD4+ desempeñan un papel fundamental en la generación y el mantenimiento de las respuestas de los linfocitos T CD8+. A este respecto, los linfocitos T CD8+ cebados en ausencia de linfocitos T CD4+ (llamados linfocitos T CD8+ «indefensos») son incapaces de desencadenar respuestas inmunitarias normales. Por otra parte, la infección crónica por LCMV es más severa en ausencia de linfocitos T CD4+. Por consiguiente, los linfocitos T indefensos generados durante la infección por LCMV-C1-13 presentan una incapacidad funcional todavía más profunda que los linfocitos T generados en presencia de linfocitos T CD4+. Los linfocitos T CD8+ específicos de DbNP396-404 se someten a deleción hasta niveles indetectables y los linfocitos T CD8+ específicos de DbGP33-41 y DbGP276-286 pierden por completo su capacidad para secretar IFN-y y TNF-a.
Los linfocitos T CD4+ se sometieron a depleción en el momento de la infección por LCMV-C1-13 y los ratones fueron tratados con un tratamiento de anticuerpos contra PD-L1 desde el día 46 hasta el día 60 después de la infección. Los linfocitos T CD4+ específicos de LCMV fueron indetectables mediante tinción intracelular de IFN-y antes o después del tratamiento. Después del tratamiento, los ratones tratados tenían aproximadamente siete veces más linfocitos T CD8+ específicos de DbGP276-286 CD8+ y cuatro veces más linfocitos T CD8+ específicos de DbGP33-41 CD8+ en el bazo que los ratones de control sin tratar (Figura 3A). El número de linfocitos T CD8+ de virus específico en el bazo también aumentó (Figura 3B). Este aumento de los linfocitos T CD8+ de virus específico en los ratones tratados se atribuyó a un aumento de la proliferación, tal y como se detectó mediante la incorporación de BrdU. El 43% de los linfocitos T CD8+ específicos de DbGP276-286 incorporaron niveles intermedios de BrdU y el 2% incorporaron niveles elevados de BrdU en los ratones sin tratar, mientras que el 50% de los linfocitos T c D8+ específicos de DbGP276-286 incorporaron niveles intermedios de BrdU y el 37% incorporaron niveles elevados de BrdU en los ratones tratados. El análisis de BrdU se realizó introduciendo 1mg/ml de BrdU en el agua de beber durante el tratamiento y la tinción se realizó conforme al protocolo del fabricante (BD Biosciences, San Diego, CA). Por otra parte, los ratones tratados contenían un porcentaje más elevado de linfocitos T CD8+ que expresaban la proteína asociada al ciclo celular Ki67 (60% frente al 19% de los ratones sin tratar, Figura 3C). La respuesta al tratamiento en los linfocitos T CD8+ en las PBMC se limitó a los ratones que presentaban unos elevados niveles de expansión de los linfocitos T CD8+.
La inhibición de PD-1 también incrementó la producción de citoquina antiviral en los linfocitos T CD8+ de virus específico agotados e indefensos. Tras el tratamiento, el número de linfocitos T CD8+ específicos de DbGP33-41 y DbGP276-286 que producían IFN-y se incrementó de forma notable (Figura 4A), aunque las cifras más elevadas de linfocitos T CD8+ específicos de DbNP396-404, KbNP205-212, DbNP166-175, y DbGP92-101 CD8+ T también se detectaron en los ratones tratados (Figura 4A). El 50% de los linfocitos T CD8+ específicos de DbGP276-286 de los ratones tratados pueden producir IFN-y frente al 20% de los linfocitos T CD8+ específicos de DbGP276-286 de los ratones de control sin tratar. (Figura 4B). Los niveles de IFN-y y TNF-a producidos por los linfocitos T CD8+ específicos de DbGP276-286 en los ratones tratados, sin embargo, fueron inferiores a los de las células de memoria específicas de DbGP276-286 plenamente funcionales. (Figura 4C).
La inhibición de PD-1 también incrementó la actividad lítica de los linfocitos T CD8+ de virus específico agotados e indefensos. La actividad lítica ex vivo de los linfocitos T CD8+ de virus específico se detectó después del tratamiento, utilizando un ensayo de liberación de 51Cr (Wherry et al., 2003. J. Virol. 77:4911-27). Los títulos virales se redujeron aproximadamente tres veces en el bazo, cuatro en el hígado, dos en el pulmón y dos en el suero, después de dos semanas de tratamiento en comparación con los ratones no tratados. (Figura 4E).
Por tanto, estos resultados demuestran que el bloqueo de la ruta de PD-1 rompe la tolerancia periférica de CTL a una infección vírica crónica y que los linfocitos T CD8+ agotados y privados de la ayuda de los linfocitos T CD4+ no son inactivados de forma irreversible.
Ejemplo 2: administración de una vacuna antivírica y un inhibidor de PD-1
Un planteamiento para potenciar las respuestas de los linfocitos T durante una infección persistente es la vacunación terapéutica. La base lógica para este planteamiento es que los antígenos endógenos pueden no estar presentes de una manera óptima e inmunogénica durante una infección vírica crónica y que proporcionar un antígeno en forma de una vacuna puede ofrecer un estímulo más efectivo para los linfocitos B y T de virus específico. Utilizando el modelo del LCMV crónico, a los ratones se les administró un virus vacuna recombinante que expresaba el epítopo GP33 del LCMV como una vacuna terapéutica (WGP33), lo que provocó una modesta mejora de las respuestas de los linfocitos T CD8+ en algunos ratones crónicamente infectados. Cuatro de los nueve ratones crónicamente infectados que recibieron la vacuna terapéutica demostraron una respuesta positiva, mientras que ninguno de los ratones de control demostró un incremento significativo de la respuesta inmunitaria contra GP33.
Cuando esta vacunación terapéutica se combinó con un inhibidor de PD-L1, las respuestas de los linfocitos T específicos del LCMV se intensificaron en un nivel mayor en comparación con cualquiera de los tratamientos individuales y el efecto del tratamiento combinado fue más que aditivo.
Ejemplo 3: Inhibición de la ruta de PD-1 en ratones crónicamente infectados utilizando ARNi de PD-1
El ARN de interferencia (ARNi) es capaz de silenciar la expresión genética en las células de mamíferos. Los ARN de doble cadena larga (ARNdc) son introducidos en células y, a continuación, son procesados en ARN silenciadores (siRNA) más pequeños dirigidos a moléculas de ARNm específicas o a pequeños grupos de ARNm. Esta tecnología resulta particularmente útil en situaciones en las que los anticuerpos no son funcionales. Por ejemplo, el ARNi se puede emplear en una situación en la que variantes alternativas únicas producen formas solubles de PD-1 y CTLA-4.
Los ARN silenciadores de PD-1 se insertan en un vector de expresión de siRNA disponible en el mercado, como los vectores adenovirales o vectores de expresión pSilencer™ (Ambion, Austin, TX). Estos vectores se ponen después en contacto con linfocitos T agotados diana in vivo o ex vivo (véase el Ejemplo 4).
Ejemplo 4: Regeneración ex vivo de linfocitos T agotados
Los linfocitos T CD8+ agotados de virus específico son aislados de los ratones crónicamente infectados por LCMV-C1-13 utilizando perlas magnéticas o centrifugado de densidad. Los linfocitos T CD8+ transfectados se ponen en contacto con un anticuerpo monoclonal dirigido a PD-L1, PD-L2 o PD-1. Tal y como se describe en el Ejemplo 1, la inhibición de la ruta de PD-1 provoca la regeneración de los linfocitos T CD8+. Por consiguiente, se produce un incremento de la proliferación de linfocitos T CD8+ y de la producción de citoquinas, por ejemplo. Estos linfocitos T CD8+ regenerados son reintroducidos en los ratones infectados y la carga vírica se mide tal y como se describe en el Ejemplo 1.
Ejemplo 5: Detección in vitro de nuevos compuestos regeneradores de los linfocitos T CD8+
Los compuestos que modulan la ruta de PD-1 se pueden identificar en ensayos de detección in vivo y ex vivo basándose en su capacidad para invertir el agotamiento de los linfocitos T CD8+ resultante de la infección vírica crónica.
Los linfocitos T CD8+ agotados se obtienen de ratones crónicamente infectados por LCMV-C'-13 y, a continuación, se ponen en contacto con un compuesto de ensayo. La cantidad de citoquinas antivíricas (por ejemplo, IFN-y o TNF-a) liberadas por los linfocitos T que han estado en contacto con el compuesto se miden, por ejemplo, mediante un ensayo ELISA u otro método cuantitativo y se comparan con la cantidad, si procede, de citoquina antivírica liberada por el linfocito T agotado que no ha estado en contacto con el compuesto del ensayo. Un incremento de la cantidad de citoquina antivírica liberada por las células tratadas con respecto a esa cantidad en las células no tratadas identifica al compuesto como inhibidor de PD-1, útil para modular la actividad de los linfocitos T.
Ejemplo 6: Detección in vivo de nuevos compuestos regeneradores de los linfocitos T CD8+
Los linfocitos T CD8+ agotados se obtienen de ratones crónicamente infectados por LCMV-C1-13. Se administra un compuesto de ensayo por vía intravenosa a los ratones infectados. La cantidad de citoquinas antivíricas (por ejemplo, IFN-y o TNF-a) liberadas en el suero de los ratones tratados y no tratados se mide, por ejemplo, mediante un ensayo ELISA u otro método cuantitativo y se compara. Un incremento de la cantidad de citoquina antivírica encontrada en el suero del ratón tratado con respecto a esa cantidad en los ratones no tratados identifica al compuesto del ensayo como inhibidor de PD-1. Alternativamente, el título vírico (por ejemplo, título vírico en suero) se puede determinar antes y después del tratamiento con el compuesto de prueba.
Ejemplo 7: Chimpancés como modelo para la inmunoterapia de la infección persistente por VHC
Los chimpancés proporcionan un modelo de persistencia del VHC en los seres humanos. Los defectos en la inmunidad de los linfocitos T que conducen a una persistencia del virus durante toda la vida incluyen tanto un déficit de los linfocitos T CD4+ coadyuvantes específicos del VHC como una actividad alterada de los linfocitos T CD8+ efectores. Los chimpancés con una infección persistente son tratados con anticuerpos contra CTLA-4, PD-1 o una combinación de ambos. Se determina la eficacia del bloqueo de las rutas inhibidoras, combinada con la vacunación empleando proteínas del VHC no estructurales y estructurales recombinantes, así como el hecho de si estas estrategias pueden mejorar la frecuencia y longevidad de los linfocitos T de memoria de virus específico. El defecto de la inmunidad de los linfocitos T es exclusivamente específico del VHC en los chimpancés y los seres humanos que sufren una infección persistente. La sangre y el hígado de los chimpancés infectados son examinados para determinar la expresión de CTLA-4, PD-1, BTLA y sus ligandos, así como la presencia de linfocitos Treg. La actividad antivírica se puede entonces restaurar administrando a los chimpancés anticuerpos monoclonales humanizados que bloquean las señales a través de estas moléculas.
Los chimpancés que sufren una infección persistente son tratados con anticuerpos aCTLA-4 humanizados (MDX-010, Medarex) o anticuerpos aPD-1. La dosis inicial de MDX-010 es de 0,3 mg/kg seguida dos semanas más tarde
por 1,0 mg/kg y posteriormente por 3,10, 30 mg/kg a intervalos de tres semanas. Después del tratamiento con anticuerpos para las moléculas coinhibidoras, se determinarán las respuestas inmunitarias humorales y celulares, así como la carga de ARN de VHC. Se tomarán muestras en las semanas 1, 2, 3, 5 y 8, y posteriormente a intervalos mensuales. Las muestras incluyen: 1) suero para el análisis de transaminasas, autoanticuerpos, anticuerpos neutralizantes para el VHC y respuestas de las citoquinas, 2) plasma para la carga vírica y la evolución del genoma, 3) PBMC para las mediciones in vitro de la inmunidad, la función y expresión del receptor inhibidor/coestimulador, 4) hígado natural (sin fijar) para el aislamiento de ARN y linfocitos intrahepáticos, y 5) hígado fijado (introducido en formalina/parafina) para la histología y el análisis inmunohistoquímico. Los nódulos linfáticos regionales también son recogidos en dos o tres puntos temporales, para valorar la expresión de moléculas coinhibidoras y variantes alternativas mediante técnicas moleculares y de inmunohistoquímica. Los ensayos para evaluar la eficacia y la seguridad de estas terapias se realizarán como se describe en el presente.
Para determinar si la vacunación con antígenos del VHC potencia el efecto terapéutico de los anticuerpos para PD-1, los chimpancés reciben el siguiente tratamiento: 1) inmunización intramuscular con glicoproteínas de recubrimiento recombinante El y E2 (en adyuvante MF59) y otras proteínas (núcleo más NS 3,4, y 5 formuladas con ISCOMS) en las semanas 0, 4 y 24; 2) inmunización intramuscular con la vacuna empleada en 1), pero administrada conjuntamente con anticuerpos aCTLA-4 (30 mg de cada/Kg de peso corporal, por vía intravenosa en las semanas 0, 4, y 24 cuando se administra la vacuna); 3) idéntico a 2) salvo porque los anticuerpos aPD-1 (o BTLA) son sustituidos por los anticuerpos para CTLA-4; 4) idéntico a los Grupos 2 y 3, salvo porque se utiliza una combinación de anticuerpos para CTLA-4 y PD-1 (o BTLA) además de la vacuna. Las respuestas de los linfocitos B y T específicos para el VHC se controlan a intervalos mensuales después de la inmunización, durante un período de un año.
Los marcadores examinados en el tetrámero positivo de VHC y los linfocitos T totales de este análisis incluyen marcadores de diferenciación (por ejemplo, CD45RA/RO, CD62L, CCR7, y CD27), activación (por ejemplo, CD25, CD69, CD38, y HLA-DR), supervivencia/proliferación (por ejemplo, bcl-2 y Ki67), potencial citotóxico (por ejemplo, granzimas y perforina), y receptores de citoquina (CD122 y CD127). Existe una correlación interesante entre los niveles previos a la terapia de la quimioquina IP-10 y la respuesta a IFN-y PEG/ribavirina. Los niveles de IP-10 son medidos para investigar una potencial correlación entre las rutas reguladoras negativas o las respuestas de los linfocitos T específicos del v Hc y los niveles de IP-10. La expresión de receptores inhibidores y ligandos en las PBMC se realizan mediante citometría de flujo.
Ejemplo 8: Inmunotinción de PD-1 en tejido linfoide reactivo
Materiales
Los materiales del caso se obtuvieron en el Brigham & Women's Hospital, Boston, MA, de conformidad con las políticas institucionales. Todos los diagnósticos se basaron en las características histológicas e inmunofenotípicas descritas en el sistema de clasificación de linfomas de la Organización Mundial de la Salud (Jaffe ES, et al. 2001) y en todos los casos el material de diagnóstico fue revisado por un hematopatólogo.
Inmunotinciones
La inmunotinción de PD-1 se realizó en secciones de tejido introducidas en parafina fijadas con formalina tras la recuperación de antígenos por microondas en 10 mM de tampón de citrato, pH 6.0 con un anticuerpo monoclonal contra PD-1 humano descrito anteriormente (2H7; 5), utilizando un método estándar indirecto de avidina-biotinaperoxidasa de rábano y desarrollo del color con diaminobencidina, tal y como se ha descrito anteriormente (Jones D, et al. 1999; Dorfman DM, et al. 2003). Los casos se consideraron inmunorreactivos para PD-1, si al menos el 25% de las células neoplásicas presentaba tinción positiva. La tinción de PD-1 se comparó con la del anticuerpo de control de isotipo de IgG de ratón diluido con una concentración de proteína idéntica para todos los casos estudiados, a fin de confirmar la especificidad de la tinción.
El anticuerpo monoclonal 2H7 para PD-1 se utilizó para la tinción de muestras introducidas en parafina y fijadas con formalina de tejido linfoide reactivo, timo y una serie de casos de trastornos linfoproliferativos de linfocitos T y linfocitos B. En las muestras de amígdalas que presentaban cambios reactivos, incluyendo hiperplasia folicular, un subconjunto de linfocitos predominantemente pequeños de los centros germinales presentaba tinción citoplásmica para PD-1, mientras que las células positivas para PD-1 observadas en las zonas de los linfocitos T interfoliculares fueron poco frecuentes. El patrón de tinción de PD-1 en los centros germinales fue prácticamente idéntico al observado con un anticuerpo para CD3, un panmarcador de linfocitos T, mientras que un anticuerpo para CD20, un panmarcador de linfocitos B, tiñó la amplia mayoría de los linfocitos B del centro germinal. Resultados similares se observaron en las secciones histológicas del nódulo linfático reactivo y el bazo. No se observó ninguna tinción de PD-1 en el timo adulto.
Ejemplo 9: Inmunotinción de secciones de tejido introducidas en parafina procedentes de trastornos linfoproliferativos de linfocitos T y linfocitos B
Se estudiaron diversos trastornos linfoproliferativos de los linfocitos B y T, cuyos resultados se resumen en la Tabla 1. Se examinaron 42 casos de trastornos linfoproliferativos de linfocitos B para detectar la expresión de PD-1, incluyendo casos representativos de linfoma linfoblástico/leucemia linfoblástica precursora de células B, así como una serie de trastornos linfoproliferativos de linfocitos B maduros, incluyendo varios linfomas no Hodgkin de células B de origen folicular, incluyendo seis casos de linfoma folicular y siete casos de linfoma de Burkitt. Ninguno de los trastornos linfoproliferativos de células B presentó tinción para p D-1. En algunos casos, había presente tejido linfoide reactivo no neoplásico y presentó un patrón de tinción de PD-1 similar al observado en las amígdalas y otro tejido linfoide reactivo, como se ha señalado anteriormente.
De forma similar, en 25 casos de linfoma de Hodgkin, incluyendo 11 casos de linfoma de Hodgkin clásico y 14 casos de linfoma de Hodgkin de predominio linfocítico, las células neoplásicas no presentaron tinción para PD-1. Es interesante señalar que en los 14 casos de linfoma de Hodgkin de predominio linfocítico, los linfocitos T que rodeaban a las células L&H neoplásicas CD20-positivas fueron inmunorreactivos para PD-1, de forma similar al patrón de tinción observado para los linfocitos T CD57+ en el linfoma de Hodgkin de predominio linfocítico. Estas células positivas para PD-1 eran un subconjunto de la población total de linfocitos T CD3+ presente.
Se estudiaron diversos trastornos linfoproliferativos de linfocitos T para detectar la expresión de PD-1, cuyos resultados se resumen en la Tabla 1. Los casos de linfoma linfoblástico/leucemia linfoblástica precursora de células T, una neoplasia de células T inmaduras, fueron negativos para PD-1, al igual de las neoplasias de los linfocitos T periféricos, postímicos, incluyendo casos de leucemia prolinfocítica de células T, linfoma de células T periféricas, linfoma anaplásico de células grandes sin especificar, y linfoma/leucemia de células T adultas. Por el contrario, los 19 casos de linfoma angioinmunoblástico contenían focos de células positivas para PD-1 que también eran inmunorreactivos para panmarcadores de linfocitos T como CD3. Las células positivas para PD-1 se encontraban constantemente en focos de redes de células dendríticas foliculares (FDC) CD21+ expandidas, una característica del linfoma angioinmunoblástico.
TABLA 1. Inmunotinción de PD-1 en trastornos linfoproliferativos.
Abreviaturas: B-LL/LL - Linfoma linfoblástico/leucemia linfoblástica precursora de células B; CLL - Leucemia linfocítica crónica; MCL - Linfoma de células del manto; FL - Linfoma folicular; MZL - Linfoma de zona marginal; HCL - Linfoma de células peludas; DLBCL - Linfoma difuso de células B grandes; BL - Linfoma de Burkitt; LPL -Linfoma linfoplasmacítico; Mm - Mieloma múltiple; T-LL/L - Linfoma linfoblástico/leucemia linfoblástica precursora de células T; T-PLL- Leucemia prolinfocítica de células T; AIL - Linfoma angioinmunoblástico; PTCL - Linfoma de células T periféricas, sin especificar; ALCL - Linfoma anaplásico de células grandes; ATLL- Linfoma/leucemia de células T adultas.
* número de casos inmunorreactivos/número total de casos
** las células positivas para PD-1 forman rosetas alrededor de las células L&H neoplásicas en 14/14 casos Ejemplo 10: Métodos generales para el estudio de la expresión de PD-1 en linfocitos T CD8 humanos específicos del VIH
Los siguientes métodos se emplearon para realizar los experimentos detallados en los Ejemplos 11 a 14.
Sujetos del estudio
Los participantes del estudio con infección crónica por el VIH de tipo I, subtipo C, fueron reclutados de las clínicas para pacientes externos de los siguientes hospitales: McCord Hospital, Durban, Sudáfrica y St.Mary's Hospital, Mariannhill, Sudáfrica. Se obtuvo sangre periférica de 65 sujetos de esta cohorte. Ninguno de ellos había recibido terapia antirretroviral en el momento del análisis. Los sujetos fueron seleccionados para su inclusión basándose en sus alelos de HLA expresados adecuados para los 10 tetrámeros de clase I construidos (véase más abajo). La carga vírica media de la cohorte era de 42.800 copias de ARN del VIH-1/ml de plasma (rango 163 -750.000), y el recuento absoluto de CD4 medio era de 362 (rango de 129 - 1179). No se disponía de información relativa a la duración de la infección. Todos los sujetos dieron su consentimiento informado por escrito para el estudio, que fue aprobado por las juntas de revisión institucional locales.
Construcción de anticuerpos para PD-1 y PD-L1
Los anticuerpos monoclonales para PD-L1 humano (29E.2A3, IgG2b de ratón) y PD-1 (EH12, IgGl de ratón) se prepararon como se ha descrito anteriormente y se ha demostrado que bloquean la interacción de PD-1 con PD-L1. Tetrámeros de clase I del MHC
Para este estudio se emplearon 10 tetrámeros de clase I del MHC del VIH, sintetizados como se ha descrito anteriormente (Airman JD, et al. 1996): A*0205 GL9 (p24, GAFDLSFFL; SEC. ID. N°: l), A*3002 KIY9 (Integrasa, KIQNFRVYY; SEC. ID. N°: 2), B*0801 DI8 (p24, DIYKRWH; SEC. ID. N°: 3), B*0801 FL8 (Nef, FLKEKGGL; SEC. ID. N°: 4), B*4201 RM9 (Nef, RPQVPLRPM; SEC. ID. N°: 5), B*4201 TL9 (p24, TPQDLNTML; SEC. ID. N°: 6), B*4201 TL10 (Nef, TPGPGVRYPL; SEC. ID. N°: 7), B*4201 YL9 (RT, YPGIKVKQL; SEC. ID. N°: 8), B*8101 TL9 (p24, TPQDLNTML; SEC. ID. N°: 9), y Cw0304 YL9 (p24, YVDRFFKTL; SEC. ID. N°: 10). Las estructuras de plásmidos que expresan A*0205, A*3002, y Cw*0304 fueron proporcionadas amablemente por el Dr. Eugene Ravkov y el Dr. John Airman, NJH Tetramer Core Facility, Atlanta, Georgia.
Tinción del tetrámero de clase I del HLA y análisis fenotípico
Las células mononucleares de la sangre periférica recién aislada (PBMC, 0,5 millones) fueron teñidas con tetrámero durante 20 minutos a 37°C. Las células fueron entonces lavadas una vez con solución tampón de fosfato (PBS), peletizadas y teñidas directamente con isotiocianato de fluoresceína (FITC) contra CD8 (Becton Dickinson), ficoeritrina contra PD-1 (clon EH12), y ViaProbe (Becton Dickinson). Las células fueron incubadas durante 20 minutos a temperatura ambiente, lavadas una vez con PBS y resuspendidas en 200 pl PBS con un 1% de paraformaldehído e introducidas en un clasificador de células activadas por fluorescencia (FACSCalibur, Becton Dickinson). Se introdujeron un mínimo de 100.000 casos en el FACSCalibur.
Ensayos de proliferación de CFSE
Un millón de PBMC recién aisladas fueron lavadas dos veces con PBS, peletizadas y resuspendidas en 1 ml de 0,5 pM carboxifluorescein diacetato, éster de sucinimidilo (CFSE, Molecular Probes) durante 7 minutos a 37°C. Las células fueron lavadas dos veces en PBS, resuspendidas en 1 ml de medio R10 (RPMI1640 suplementado con
glutiationa, penicilina, estreptomicina y un 10% de suero fetal bovino [FCS]), y colocadas en un pocilio de una placa de 24 pocillos. Los estudios iniciales revelaron que una concentración final de 0,2 pg/ml del péptido produjo unas respuestas proliferativas óptimas, por tanto esta fue la concentración final del péptido en el pocillo utilizado para cada ensayo. Los pocillos de control negativo consistían en PBMC en medio solamente, o PBMC en medio con anti-PD-L1 purificado (10 pg/ml), y los pocillos de control positivo fueron estimados con 10 pg/ml de fitohemaglutinina (PHA). Tras seis días de incubación en una incubadora a 37°C, las células se lavaron con 2 ml de PBS y se tiñeron con tetrámeros de clase I de MHC conjugadas con PE, ViaProbe (Becton Dickinson), y anticuerpos contra CD8-APC. Las células se introdujeron en un FACsCalibur y se analizaron con el software CellQuest® (Becton Dickinson). Las células se introdujeron en los linfocitos CD8+ de ViaProbe". La cantidad de veces que se incrementaron las células de tetrámero positivo se calculó dividiendo el porcentaje de células de tetrámero positivo de CD8+ en presencia del péptido por el porcentaje de células de tetrámero positivo de CD8+ en ausencia de estimulación del péptido.
Análisis estadístico
La correlación de Spearman, el test de Mann-Whitney, y análisis de tests t emparejados se realizaron utilizando GraphPad Prism Version 4.0a. Todos los tests tenían dos colas y los valores de p de p<0,05 se consideraron significativos.
Ejemplo 11: Expresión de PD-1 en los linfocitos T CD8 específicos del VIH
Un grupo de 10 tetrámeros de clase I de MHC específicos para los epítopos de linfocitos T CD8 del VIH-1, subtipo C fueron sintetizados, basándose en los alelos de HLA prevalentes y los epítopos diana frecuentes en Gag, Nef, integrasa y RT (Kiepiela P, et al. 2004), permitiendo una visualización directa de la expresión de superficie de PD-1 en estas células. Se realizó una tipificación de HLA de alta resolución en toda la cohorte y se seleccionó un subconjunto de 65 personas que no habían recibido terapia antirretroviral previa para el estudio, basándose en la expresión de alelos de HLA pertinentes. Se examinaron un total de 120 epítopos individuales y la tinción ex vivo de PD-1 de células de tetrámero positivo del VIH se muestra en la Figura 5A. La expresión de PD-1 fue rápidamente evidente en estas células de tetrámero positivo y fue significativamente superior que en la población total de linfocitos T CD8 para los mismos individuos (p<0,0001); a su vez, la expresión de PD-1 tanto en los linfocitos T CD8 de tetrámero positivo como en la población total de linfocitos T CD8 fue significativamente mayor que en los controles seronegativos para el VIH (Figura 5B). Para ocho de los 10 tetrámeros testados, al menos se identificó a una persona en la que el nivel de expresión sobre las células CD8 de antígeno específico fue del 100% (Figura 5C). Las PBMC de 3 a 25 individuos fueron teñidas para cada respuesta del tetrámero del VIH, con unos niveles de expresión de PD-1 medios de entre el 68% y el 94% de las células de tetrámero positivo (Figura 5C). Estas conclusiones fueron también confirmadas mediante un análisis de la intensidad de fluorescencia media (MFI) de PD-1 tanto en las células de tetrámero positivo como en la población total de linfocitos T CD8 (Figura 5B, C).
A continuación se determinó si existían evidencias de diferencias específicas de los isótopos en términos de niveles de expresión de PD-1 en las personas con múltiples respuestas detectables. De las 65 personas examinadas, 16 individuos tenían entre 3 y 5 respuestas positivas al tetrámero cada una. La expresión de PD-1 fue prácticamente idéntica y se aproximó al 100% para cada respuesta analizada para tres de los 16 sujetos; no obstante, los otros 13 individuos presentaban patrones diferentes de expresión de PD-1 dependiendo del epítopo (Figura 5D). Estos datos indican que la expresión de PD-1 se puede expresar diferencialmente en los linfocitos T CD8 contemporáneos específicos del epítopo de una sola persona, lo que quizás concuerda con los datos recientes que indican diferencias específicas del epítopo en la eficacia antivírica (Tsomides TJ, et al. 1994; Yang O, et al. 1996; Loffredo JT, et al. 2005).
Ejemplo 12: La relación entre la expresión de PD-1 y la progresión de la enfermedad del VIH
Se determinó la relación entre la expresión de PD-1 en linfocitos T CD8 específicos del VIH y la carga vírica plasmática y los recuentos de CD4, siendo ambos indicadores de la progresión de la enfermedad del VIH. En línea con estudios anteriores, la relación entre el número de células de tetrámero positivo y la carga vírica o el recuento de CD4 no demostró ninguna correlación significativa (Figura 6A, B). Por el contrario, existían importantes correlaciones positivas con la carga vírica y tanto con el porcentaje como con la MFI de la expresión de PD-1 en las células de tetrámero positivo del VIH (p=0,0013 y p<0,0001, respectivamente; Figura 6A). También existían correlaciones inversas entre el recuento de CD4 y tanto el porcentaje como la MFI de PD-1 en las células de tetrámero positivo del VIH (p=0,0046 y p=0,0150, respectivamente; Figura 6B). Puesto que los tetrámeros testados probablemente representan solamente una fracción de la población de linfocitos T CD8 específicos del VIH en estos sujetos, la relación entre la expresión de PD-1 en todas las células CD8 y estos parámetros también se examinó. Se detectaron correlaciones positivas significativas entre la carga vírica y tanto el porcentaje como la MFI de la expresión de PD-1 sobre la población total de linfocitos T CD8 (p=0,0021 y p<0,0001, respectivamente; Figura 6C), y también se observaron correlaciones inversas entre el recuento de CD4 y tanto el porcentaje como la MFI de la expresión de PD-1 sobre la población total de linfocitos T CD8 (p=0,0049 y p=0,0006, respectivamente; Figura 6D). En este mismo grupo, la expresión de PD-1 sobre los linfocitos T CD8 específicos de CMV se testó en cinco sujetos y el nivel de expresión de PD-1 fue significativamente inferior en estas células en comparación con los linfocitos T CD8 específicos del VIH (media del 23% de PD-1 positivo de tetrámero positivo de CMV, datos no mostrados) y no fue
diferente a la de los linfocitos T CD8 en general en esos mismos individuos, lo que indica que una elevada expresión de PD-1 no es una característica uniforme de todos los linfocitos T CD8 de virus específico. Estos datos sugieren que unas cantidades crecientes de antígeno en la infección crónica por VIH se traducen en una expresión incrementada de PD-1 en los linfocitos T CD8 y son coherentes con los datos murinos sobre la infección crónica por LCMV, donde la expresión de PD-1 está asociada con el agotamiento funcional de los linfocitos T CD8 (Barber DL, et al. 2005). Por otra parte, proporcionan la primera asociación clara, en un gran estudio que incluye el análisis de múltiples epítopos, entre los linfocitos T CD8 específicos del VIH y la carga vírica o el recuento de c D4.
Ejemplo 13: La relación entre la expresión de PD-1 y la función y el estado de memoria de los linfocitos T CD8
La expresión de PD-1 se analizó a continuación en el contexto de una serie de marcadores fenotípicos adicionales asociados con la función y el estado de memoria de los linfocitos T CD8, incluyendo CD27, CD28, CD45RA, CD57, CD62L, CD127, CCR7, perforina, granzima B, y Ki67 (Figura 7). Las tinciones representativas para estos marcadores en las células de tetrámero positivo B*4201 TL9 de un individuo se muestran en la Figura 7A y los datos agregados de los 13 sujetos se muestran en la Figura 7B. Estos estudios se limitaron a aquellas respuestas del tetrámero que eran superiores a un 95% de PD-1 positivo, dado que la citometría de flujo multiparámetro de más de cuatro colores no estaba disponible en KwaZulu Natal. Las células de PD-1 positivo de tetrámero positivo del VIH expresan elevados niveles de CD27 y granzima B, niveles muy reducidos de CD28, CCR7, y Ki67 intracelular, niveles bajos de CD45RA y perforina, así como niveles intermedios de CD57 y CD62L (Figura 7B). Estos datos indican que los linfocitos T de PD-1 positivo específicos para el VIH presentan un fenotipo de memoria efector/efector, y son coherentes con informes previos de maduración sesgada de linfocitos T CD8 específicos del VIH (Champagne P., et al. 2001; Appay V, et al. 2002; Hess C, et al. 2004). Por otra parte, la secuenciación del virus se realizó para determinar si estas células estaban evadiendo al sistema inmunitario (Brown JA, et al. 2003). De 45 de estas respuestas de tetrámero positivo evaluadas, los epítopos víricos de solo cinco eran diferentes de la secuencia de consenso sudafricana de subtipo C (datos no mostrados), lo que indica que estas células ejercen escasa presión de selección in vivo.
Experimentos previos con ratones utilizando el modelo del LCMV demostraron que el bloqueo in vivo de la interacción PD-1/PD-LA mediante la infusión de anticuerpos de bloqueo contra PD-L1 provoca una funcionalidad mejorada de los linfocitos T CD8 específicos de LCMV, medida por la producción de citoquinas, la capacidad citotóxica, la capacidad proliferativa y, más sorprendentemente, la reducción de la carga vírica (Barber DL, et al.
2005).
Ejemplo 14: Efecto del bloqueo de la ruta de PD-1/PD-L1 sobre la proliferación de linfocitos T CD8 específicos del VIH
Dado que los linfocitos T CD8 específicos del VIH también presentan una capacidad proliferativa mermada (Migueles SA, et al. 2002; Lichterfeld M, et al. 2004), se determinó si el bloqueo de PD-1/PD-L1 podría mejorar esta función in vitro. Los datos representativos de un individuo de B*4201 positivo se muestran en la Figura 8A. La incubación de PBMC etiquetadas con CFSE recién aisladas con medio solamente o medio con anticuerpo contra PD-L1 resultó en el mantenimiento de una población de linfocitos T CD8 específicos de B*4201-TL9 (1,2% de linfocitos T CD8) que permanecían en el CFSE10 después de seis días en cultivo. La estimulación de PBMC etiquetadas con CFSE durante seis días con péptido TL9 solamente resultó en un incremento de 4,8 veces las células de tetrámero positivo de CFSE10 B*4201 TL9, mientras que la estimulación de PBMC etiquetadas con CFSE con péptido TL9 en presencia de anticuerpo de bloqueo contra PD-L1 intensificó aún más la proliferación de células específicas de TL9, resultando en un incremento de 10,3 veces las células de tetrámero positivo. Los ensayos de proliferación de CFSE se realizaron en 28 muestras en presencia y ausencia de anticuerpo de bloqueo purificado contra PD-L1 humano. Se observó un aumento significativo de la proliferación de linfocitos T CD8+ específicos del VIH en presencia del péptido más anticuerpo de bloqueo contra PD-L1, en comparación con la cantidad de proliferación tras la estimulación con péptido solamente (Figura 8B; p=0,0006, test t emparejado). Este incremento multiplicado de las células de tetrámero positivo en presencia de anticuerpo de bloqueo contra PD-L1 varió entre individuos y entre epítopos dentro de un individuo dado (Figura 8C), lo que sugiere, una vez más, diferencias específicas del epítopo en el grado de agotamiento funcional de estas respuestas.
OTRAS REALIZACIONES
A pesar de que la invención se ha descrito conjuntamente con las descripciones detalladas de la misma, la anterior descripción tiene por objeto ilustrar y no limitar el alcance de la invención, que se define por el alcance de las reivindicaciones adjuntas.
Claims (11)
1. Un compuesto que reduce la actividad de un polipéptido de muerte programada (PD-1) para su uso en un método de tratamiento de la infección vírica persistente en un sujeto, donde dicho compuesto es un anticuerpo contra PD-L1 y donde la infección vírica persistente es una infección por el virus de la inmunodeficiencia humana (VIH).
2. El uso de un compuesto que reduce la actividad de un polipéptido de muerte programada (PD-1) en la fabricación de un medicamento para aliviar un síntoma de infección vírica persistente en un sujeto, donde dicho compuesto es un anticuerpo contra PD-L1 y donde la infección vírica persistente es una infección por el virus de la inmunodeficiencia humana (VIH).
3. El compuesto para su uso en un método de tratamiento de una infección vírica persistente conforme a la reivindicación 1 o el uso de la reivindicación 2, donde dicho compuesto incrementa la actividad citotóxica de los linfocitos T en dicho sujeto.
4. El compuesto para su uso en un método de tratamiento de una infección vírica persistente, de conformidad con la reivindicación 3, o el uso de la reivindicación 3, donde dicha actividad citotóxica de los linfocitos T es la producción de citoquina, la proliferación de los linfocitos T o la eliminación del agente infeccioso.
5. El compuesto para su uso en un método de tratamiento de una infección vírica persistente de conformidad con la reivindicación 4 o el uso de la reivindicación 4, donde dicha citoquina es IFNy, TNFa, o IL-2.
6. El compuesto para su uso en un método de tratamiento de una infección vírica persistente conforme a la reivindicación 1 o el uso de la reivindicación 2, donde se administra una vacuna o un segundo compuesto a dicho sujeto.
7. El compuesto para el uso de la reivindicación 6, donde dicha vacuna comprende un adyuvante o una dosis de refuerzo principal.
8. El compuesto para su uso en un método de tratamiento o infección vírica persistente de conformidad con la reivindicación 6 o uso de la reivindicación 6, donde dicho segundo compuesto es un compuesto antivírico, un compuesto antiinflamatorio o un analgésico.
9. El compuesto de cualquiera de la anterior reivindicación 6 o uso de la reivindicación 6, donde dicho segundo compuesto reduce la expresión o actividad del antígeno citotóxico de linfocitos T de tipo 4 (CTLA-4) o el atenuador de linfocitos B o T (BTLA).
10. El compuesto de cualquiera de la anterior reivindicación 6 o uso de la reivindicación 6, donde dicho segundo compuesto es un anticuerpo contra CTLA-4, un anticuerpo contra BTLA, un anticuerpo contra CD28, un anticuerpo contra ICOS, un anticuerpo contra ICOS-L, un anticuerpo contra B7-1, un anticuerpo contra B7-2, un anticuerpo contra B7-H3 o un anticuerpo contra B7-H4.
11. El compuesto de cualquiera de las reivindicaciones anteriores o uso de cualquier reivindicación anterior, donde dicho sujeto es un ser humano.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US68887205P | 2005-06-08 | 2005-06-08 | |
| US688872P | 2005-06-08 | ||
| PCT/US2006/022423 WO2006133396A2 (en) | 2005-06-08 | 2006-06-08 | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (pd-1) pathway |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| ES2397355T3 ES2397355T3 (es) | 2013-03-06 |
| ES2397355T5 true ES2397355T5 (es) | 2020-11-10 |
Family
ID=37499143
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES11162681.8T Active ES2608316T3 (es) | 2005-06-08 | 2006-06-08 | Métodos y composiciones para el tratamiento del cáncer e infecciones persistentes mediante la inhibición de la ruta de la muerte celular 1 (PD-1) programada |
| ES06784684T Active ES2397355T5 (es) | 2005-06-08 | 2006-06-08 | Métodos y composiciones para el tratamiento de infecciones persistentes y cáncer por inhibición de la vía de muerte celular programada (PD-1) |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES11162681.8T Active ES2608316T3 (es) | 2005-06-08 | 2006-06-08 | Métodos y composiciones para el tratamiento del cáncer e infecciones persistentes mediante la inhibición de la ruta de la muerte celular 1 (PD-1) programada |
Country Status (23)
| Country | Link |
|---|---|
| US (4) | US8652465B2 (es) |
| EP (5) | EP1907000B2 (es) |
| JP (7) | JP5788632B2 (es) |
| KR (4) | KR101510065B1 (es) |
| CN (3) | CN101355965A (es) |
| AU (1) | AU2006254902B8 (es) |
| BR (1) | BRPI0611766A2 (es) |
| CA (2) | CA2611861C (es) |
| CY (1) | CY1118612T1 (es) |
| DK (2) | DK1907000T4 (es) |
| ES (2) | ES2608316T3 (es) |
| HU (1) | HUE030877T2 (es) |
| IL (5) | IL187999A (es) |
| LT (1) | LT2397156T (es) |
| MX (2) | MX351401B (es) |
| NZ (4) | NZ601439A (es) |
| PL (2) | PL2397156T3 (es) |
| PT (1) | PT2397156T (es) |
| RU (3) | RU2596491C2 (es) |
| SG (1) | SG10201702670VA (es) |
| SI (2) | SI2397156T1 (es) |
| WO (1) | WO2006133396A2 (es) |
| ZA (1) | ZA200710975B (es) |
Families Citing this family (236)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MXPA02001877A (es) * | 1999-08-23 | 2002-08-20 | Dana Farber Cancer Inst Inc | Pd-1, un receptor para b7-4, y usos del mismo. |
| HUP0202882A2 (en) * | 1999-08-23 | 2002-12-28 | Dana Farber Cancer Inst Inc | Novel b7-4 molecules and uses therefor |
| CA3016482A1 (en) | 1999-11-30 | 2001-06-07 | Mayo Foundation For Medical Education And Research | B7-h1, a novel immunoregulatory molecule |
| US7030219B2 (en) * | 2000-04-28 | 2006-04-18 | Johns Hopkins University | B7-DC, Dendritic cell co-stimulatory molecules |
| US7432351B1 (en) | 2002-10-04 | 2008-10-07 | Mayo Foundation For Medical Education And Research | B7-H1 variants |
| AU2005295038B2 (en) | 2004-10-06 | 2012-05-17 | Mayo Foundation For Medical Education And Research | B7-H1 and methods of diagnosis, prognosis, and treatment of cancer |
| WO2006133396A2 (en) | 2005-06-08 | 2006-12-14 | Dana-Farber Cancer Institute | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (pd-1) pathway |
| NZ568015A (en) | 2005-12-08 | 2012-03-30 | Medarex Inc | Human monoclonal antibodies to O8E |
| WO2007082144A2 (en) * | 2006-01-05 | 2007-07-19 | Mayo Foundation For Medical Education And Research | B7-h1 and survivin in cancer |
| US20090215084A1 (en) * | 2006-01-05 | 2009-08-27 | Mayo Foundation For Medical Education And Research | B7-h1 and b7-h4 in cancer |
| WO2007124361A2 (en) * | 2006-04-20 | 2007-11-01 | Mayo Foundation For Medical Education And Research | Soluble b7-h1 |
| PL2056874T3 (pl) * | 2006-08-21 | 2013-02-28 | Hoffmann La Roche | Leczenie nowotworu przeciwciałem przeciw VEGF |
| CA2668800A1 (en) * | 2006-11-08 | 2008-06-05 | Macrogenics West, Inc. | Tes7 and antibodies that bind thereto |
| AU2013200388B2 (en) * | 2006-12-27 | 2014-10-23 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for the treatment of infections and tumors |
| AU2014268176B2 (en) * | 2006-12-27 | 2016-03-31 | Dana-Farber Cancer Institute, Inc | Compositions and methods for the treatment of infections and tumors |
| US20080206235A1 (en) * | 2006-12-27 | 2008-08-28 | Johns Hopkins University | Compositions and methods for stimulating an immune response |
| US7989173B2 (en) | 2006-12-27 | 2011-08-02 | The Johns Hopkins University | Detection and diagnosis of inflammatory disorders |
| NZ626867A (en) * | 2006-12-27 | 2014-09-26 | Harvard College | Compositions and methods for the treatment of infections and tumors |
| MX2009012635A (es) * | 2007-05-23 | 2012-09-13 | Mannkind Corp | Vectores multicistronicos y metodos para su diseño. |
| HRP20131167T1 (hr) | 2007-06-18 | 2014-01-03 | Merck Sharp & Dohme B.V. | Antitijela za humani receptor programirane smrti pd-1 |
| US8153595B2 (en) | 2007-07-13 | 2012-04-10 | The Johns Hopkins University | B7-DC variants immunogenic compositions and methods of use thereof |
| US8062852B2 (en) * | 2007-10-01 | 2011-11-22 | The Children's Hospital And Regional Medical Center | Detection and treatment of autoimmune disorders |
| US20110020325A1 (en) * | 2008-02-29 | 2011-01-27 | Kwon Eugene D | Methods for reducing granulomatous inflammation |
| WO2009114335A2 (en) * | 2008-03-12 | 2009-09-17 | Merck & Co., Inc. | Pd-1 binding proteins |
| EP2317992A2 (en) | 2008-07-24 | 2011-05-11 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Preventing or treating viral infection using an inhibitor of the lsd1 protein, a mao inhibitor or an inhibitor of lsd1 and a mao inhibitor |
| AR072999A1 (es) * | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| EP2328920A2 (en) * | 2008-08-25 | 2011-06-08 | Amplimmune, Inc. | Targeted costimulatory polypeptides and methods of use to treat cancer |
| AU2009288730B2 (en) | 2008-08-25 | 2013-06-20 | Amplimmune, Inc. | Compositions of PD-1 antagonists and methods of use |
| EP2342228B1 (en) | 2008-09-12 | 2017-09-06 | Oxford University Innovation Limited | Pd-1 specific antibodies and uses thereof |
| US8552154B2 (en) | 2008-09-26 | 2013-10-08 | Emory University | Anti-PD-L1 antibodies and uses therefor |
| KR20190064664A (ko) | 2008-10-02 | 2019-06-10 | 압테보 리서치 앤드 디벨롭먼트 엘엘씨 | Cd86 길항제 다중-표적 결합 단백질 |
| CA2743464A1 (en) * | 2008-11-14 | 2010-05-20 | The Brigham And Women's Hospital, Inc. | Therapeutic and diagnostic methods relating to cancer stem cells |
| US11542328B2 (en) | 2008-11-14 | 2023-01-03 | The Brigham And Women's Hospital, Inc. | Therapeutic and diagnostic methods relating to cancer stem cells |
| DK2370593T3 (en) * | 2008-11-28 | 2016-07-04 | Univ Emory | A method for determining the effect of PD-1 Antagonists |
| MY188826A (en) * | 2008-12-09 | 2022-01-06 | Genentech Inc | Anti-pd-l1 antibodies and their use to enhance t-cell function |
| CN107090437A (zh) * | 2009-03-06 | 2017-08-25 | 国立大学法人三重大学 | 用于增强t细胞功能的方法 |
| WO2010106051A1 (en) * | 2009-03-17 | 2010-09-23 | Universite De La Mediterranee | Btla antibodies and uses thereof |
| US8975247B2 (en) | 2009-03-18 | 2015-03-10 | The Board Of Trustees Of The Leland Stanford Junion University | Methods and compositions of treating a flaviviridae family viral infection |
| EP2473521A2 (en) | 2009-08-31 | 2012-07-11 | Amplimmune, Inc. | B7-h4 fusion proteins and methods of use thereof |
| CA2775761C (en) * | 2009-09-30 | 2018-08-28 | Memorial Sloan-Kettering Cancer Center | Combination immunotherapy for the treatment of cancer |
| NZ628923A (en) | 2009-11-24 | 2016-02-26 | Medimmune Ltd | Targeted binding agents against b7-h1 |
| WO2011097345A1 (en) * | 2010-02-04 | 2011-08-11 | Virostatics Srl | Ki-67 assay for patient immune system status |
| US20130202623A1 (en) * | 2010-02-16 | 2013-08-08 | Nicolas Chomont | Pd-1 modulation and uses thereof for modulating hiv replication |
| TW201134488A (en) * | 2010-03-11 | 2011-10-16 | Ucb Pharma Sa | PD-1 antibodies |
| US8993731B2 (en) | 2010-03-11 | 2015-03-31 | Ucb Biopharma Sprl | PD-1 antibody |
| MX374075B (es) | 2010-03-26 | 2025-03-05 | Dartmouth College | Proteina mediadora de celula t regulatoria vista, agentes de enlace de vista y uso de los mismos. |
| US20150231215A1 (en) | 2012-06-22 | 2015-08-20 | Randolph J. Noelle | VISTA Antagonist and Methods of Use |
| US10745467B2 (en) | 2010-03-26 | 2020-08-18 | The Trustees Of Dartmouth College | VISTA-Ig for treatment of autoimmune, allergic and inflammatory disorders |
| CA2802344C (en) | 2010-06-18 | 2023-06-13 | The Brigham And Women's Hospital, Inc. | Bi-specific antibodies against tim-3 and pd-1 for immunotherapy in chronic immune conditions |
| US8907053B2 (en) * | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| EP2595613B1 (en) | 2010-07-22 | 2019-01-09 | The U.S.A. as represented by the Secretary, Department of Health and Human Services | Compounds for use in a method of preventing or treating viral infection |
| SMT201800294T1 (it) | 2011-04-20 | 2018-07-17 | Medimmune Llc | Anticorpi e altre molecole che legano b7-h1 e pd-1 |
| EA201490364A1 (ru) * | 2011-07-29 | 2014-08-29 | Дзе Трастиз Оф Дзе Юниверсити Оф Пенсильвания | Костимулирующие рецепторы-переключатели |
| EP2756094B1 (en) | 2011-08-15 | 2017-12-27 | Medlmmune, LLC | Anti-b7-h4 antibodies and their uses |
| JP2014532053A (ja) | 2011-09-30 | 2014-12-04 | デイナ ファーバー キャンサー インスティチュート,インコーポレイテッド | 治療用ペプチド |
| EP2787999B1 (en) | 2011-12-06 | 2019-01-23 | The Board of Trustees of The Leland Stanford Junior University | Methods and compositions for treating viral diseases |
| WO2013090552A1 (en) * | 2011-12-13 | 2013-06-20 | Yale University | Compositions and methods for reducing ctl exhaustion |
| NZ717682A (en) | 2012-02-16 | 2017-10-27 | Vlp Therapeutics Llc | Virus like particle composition |
| ES2745211T3 (es) | 2012-04-12 | 2020-02-28 | Univ Yale | Vehículos para la administración controlada de diferentes agentes farmacéuticos |
| HK1203971A1 (en) | 2012-05-15 | 2015-11-06 | Bristol-Myers Squibb Company | Cancer immunotherapy by disrupting pd-1/pd-l1 signaling |
| US20150079192A1 (en) * | 2012-05-21 | 2015-03-19 | Marv Enterprises, LLC | Treatment of cancer by manipulating the immune system |
| BR112014032276A2 (pt) | 2012-06-22 | 2017-11-28 | King S College London | construtos de vista-ig e o uso de vista-ig para o tratamento de distúrbios autoimunes, alérgicos e inflamatórios |
| US9890215B2 (en) * | 2012-06-22 | 2018-02-13 | King's College London | Vista modulators for diagnosis and treatment of cancer |
| CN111499755A (zh) * | 2012-08-03 | 2020-08-07 | 丹娜法伯癌症研究院 | 抗-pd-l1和pd-l2双结合抗体单一试剂及其使用方法 |
| CN109793893B (zh) * | 2012-09-07 | 2023-05-26 | 达特茅斯大学理事会 | 用于诊断和治疗癌症的vista调节剂 |
| EP2926142B2 (en) * | 2012-11-30 | 2022-07-06 | F. Hoffmann-La Roche AG | Identification of patients in need of pd-l1 inhibitor cotherapy |
| SG11201504764SA (en) | 2012-12-19 | 2015-07-30 | Amplimmune Inc | Anti-human b7-h4 antibodies and their uses |
| EP2954327A1 (en) | 2013-02-07 | 2015-12-16 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting the survival time of patients suffering from diffuse large b-cell lymphomas |
| DK3292873T3 (da) | 2013-02-22 | 2019-06-03 | Curevac Ag | Kombination af vaccination og hæmning af PD-1-vejen |
| KR102134056B1 (ko) * | 2013-02-22 | 2020-07-15 | 큐어백 아게 | Pd―1 경로의 억제 및 백신접종의 조합물 |
| US9302005B2 (en) | 2013-03-14 | 2016-04-05 | Mayo Foundation For Medical Education And Research | Methods and materials for treating cancer |
| NZ712314A (en) * | 2013-03-15 | 2021-07-30 | Genentech Inc | Biomarkers and methods of treating pd-1 and pd-l1 related conditions |
| EA201591559A1 (ru) | 2013-03-15 | 2016-03-31 | Дана-Фарбер Кэнсер Инститьют, Инк. | Терапевтические пептиды |
| JP6742903B2 (ja) * | 2013-05-02 | 2020-08-19 | アナプティスバイオ インコーポレイティッド | プログラム死−1(pd−1)に対する抗体 |
| WO2014194293A1 (en) | 2013-05-30 | 2014-12-04 | Amplimmune, Inc. | Improved methods for the selection of patients for pd-1 or b7-h4 targeted therapies, and combination therapies thereof |
| WO2014194302A2 (en) | 2013-05-31 | 2014-12-04 | Sorrento Therapeutics, Inc. | Antigen binding proteins that bind pd-1 |
| TWI676636B (zh) | 2013-07-12 | 2019-11-11 | Vlp醫療股份有限公司 | 包含pd-1抗原或pd-1配體抗原的類病毒粒子 |
| WO2015038538A1 (en) * | 2013-09-10 | 2015-03-19 | Medimmune, Llc | Compositions and methods for treating sepsis |
| AR097584A1 (es) | 2013-09-12 | 2016-03-23 | Hoffmann La Roche | Terapia de combinación de anticuerpos contra el csf-1r humano y anticuerpos contra el pd-l1 humano |
| DK3044234T3 (da) * | 2013-09-13 | 2020-05-18 | Beigene Switzerland Gmbh | Anti-PD1-antistoffer og anvendelse deraf som terapeutika og diagnostika |
| WO2015048312A1 (en) | 2013-09-26 | 2015-04-02 | Costim Pharmaceuticals Inc. | Methods for treating hematologic cancers |
| EP3470081A1 (en) | 2013-10-01 | 2019-04-17 | Mayo Foundation for Medical Education and Research | Methods for treating cancer in patients with elevated levels of bim |
| RU2672055C2 (ru) | 2013-11-01 | 2018-11-09 | Йейл Юниверсити | Модульные частицы для иммунотерапии |
| JP6705746B2 (ja) * | 2013-12-06 | 2020-06-03 | デイナ ファーバー キャンサー インスティチュート,インコーポレイテッド | 治療用ペプチド |
| LT3081576T (lt) | 2013-12-12 | 2019-10-25 | Shanghai hengrui pharmaceutical co ltd | Pd-1 antikūnas, antigeną surišantis jo fragmentas ir jų medicininis pritaikomumas |
| ES2920677T3 (es) | 2013-12-24 | 2022-08-08 | Janssen Pharmaceutica Nv | Anticuerpos y fragmentos anti-VISTA |
| US11014987B2 (en) | 2013-12-24 | 2021-05-25 | Janssen Pharmaceutics Nv | Anti-vista antibodies and fragments, uses thereof, and methods of identifying same |
| JOP20200094A1 (ar) | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| JOP20200096A1 (ar) | 2014-01-31 | 2017-06-16 | Children’S Medical Center Corp | جزيئات جسم مضاد لـ tim-3 واستخداماتها |
| GB201403775D0 (en) | 2014-03-04 | 2014-04-16 | Kymab Ltd | Antibodies, uses & methods |
| WO2015135558A1 (en) | 2014-03-12 | 2015-09-17 | Curevac Gmbh | Combination of vaccination and ox40 agonists |
| EP3116903A2 (en) | 2014-03-14 | 2017-01-18 | Dana-Farber Cancer Institute, Inc. | Vaccine compositions and methods for restoring nkg2d pathway function against cancers |
| AU2015229103C9 (en) | 2014-03-14 | 2020-11-26 | Immutep S.A.S | Antibody molecules to LAG-3 and uses thereof |
| US11230719B2 (en) * | 2014-03-26 | 2022-01-25 | Denovo Biopharma Llc | Retroviral vector having immune-stimulating activity |
| WO2015179654A1 (en) | 2014-05-22 | 2015-11-26 | Mayo Foundation For Medical Education And Research | Distinguishing antagonistic and agonistic anti b7-h1 antibodies |
| US11123426B2 (en) | 2014-06-11 | 2021-09-21 | The Trustees Of Dartmouth College | Use of vista agonists and antagonists to suppress or enhance humoral immunity |
| JP6904707B2 (ja) | 2014-06-19 | 2021-07-21 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | ヒト化プログラム細胞死1遺伝子を持つ非ヒト動物 |
| TWI693232B (zh) | 2014-06-26 | 2020-05-11 | 美商宏觀基因股份有限公司 | 與pd-1和lag-3具有免疫反應性的共價結合的雙抗體和其使用方法 |
| KR102130600B1 (ko) | 2014-07-03 | 2020-07-08 | 베이진 엘티디 | Pd-l1 항체와 이를 이용한 치료 및 진단 |
| ES2916923T3 (es) | 2014-07-11 | 2022-07-06 | Ventana Med Syst Inc | Anticuerpos anti-PD-L1 y usos diagnósticos de los mismos |
| CA2955084C (en) | 2014-07-16 | 2023-08-29 | Transgene Sa | Combination of oncolytic virus with immune checkpoint modulators |
| EP3552615B8 (en) | 2014-07-16 | 2022-03-02 | Transgene | Oncolytic virus for expression of immune checkpoint modulators |
| WO2016014148A1 (en) | 2014-07-23 | 2016-01-28 | Mayo Foundation For Medical Education And Research | Targeting dna-pkcs and b7-h1 to treat cancer |
| KR102357893B1 (ko) | 2014-08-05 | 2022-02-04 | 맵퀘스트 에스아 | Pd-1 에 결합하는 면역학적 시약 |
| US9982052B2 (en) | 2014-08-05 | 2018-05-29 | MabQuest, SA | Immunological reagents |
| WO2016020538A1 (en) * | 2014-08-08 | 2016-02-11 | Transgene Sa | Hbv vaccine and antibody combination therapy to treat hbv infections |
| US10385101B2 (en) | 2014-08-08 | 2019-08-20 | Vlp Therapeutics, Llc | Virus like particle comprising modified envelope protein E3 |
| TWI720946B (zh) | 2014-08-08 | 2021-03-11 | 美商Vlp醫療股份有限公司 | 包含改質套膜蛋白質e3之類病毒粒子 |
| CA3133162C (en) | 2014-08-12 | 2024-02-13 | Massachusetts Institute Of Technology | Synergistic tumor treatment with il-2 and integrin-binding-fc-fusion protein |
| JP6942309B2 (ja) | 2014-09-11 | 2021-09-29 | ブイエルピー・セラピューティクス・インコーポレイテッドVLP Therapeutics, Inc. | フラビウイルスウイルス様粒子 |
| WO2016040882A1 (en) | 2014-09-13 | 2016-03-17 | Novartis Ag | Combination therapies of egfr inhibitors |
| IL251669B2 (en) | 2014-10-10 | 2023-02-01 | Idera Pharmaceuticals Inc | Cancer treatment using a tlr9 agonist with checkpoint inhibitors |
| US9988452B2 (en) | 2014-10-14 | 2018-06-05 | Novartis Ag | Antibody molecules to PD-L1 and uses thereof |
| CA2964363A1 (en) * | 2014-10-17 | 2016-04-21 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for identification, assessment, prevention, and treatment of t-cell exhaustion using cd39 biomarkers and modulators |
| AU2015357463B2 (en) | 2014-12-05 | 2021-10-07 | Immunext, Inc. | Identification of VSIG8 as the putative vista receptor and its use thereof to produce vista/VSIG8 modulators |
| GB201500319D0 (en) | 2015-01-09 | 2015-02-25 | Agency Science Tech & Res | Anti-PD-L1 antibodies |
| EP3252469A4 (en) * | 2015-01-29 | 2017-12-06 | Konica Minolta, Inc. | Method for simultaneous detection of blood cells having interacting molecules |
| MA41460A (fr) | 2015-02-03 | 2017-12-12 | Oncomed Pharm Inc | Agents de liaison à la tnfrsf et leurs utilisations |
| US20180028626A1 (en) | 2015-02-13 | 2018-02-01 | Transgene Sa | Immunotherapeutic vaccine and antibody combination therapy |
| SG10201913297TA (en) | 2015-03-13 | 2020-02-27 | Cytomx Therapeutics Inc | Anti-pdl1 antibodies, activatable anti-pdl1 antibodies, and methods of use thereof |
| PH12021552158A1 (en) | 2015-03-23 | 2022-05-02 | Jounce Therapeutics Inc | Antibodies to icos |
| WO2016162867A1 (en) * | 2015-04-08 | 2016-10-13 | Efranat Ltd. | Combination therapy of macrophage activating factor and pd-1 signaling inhibitors |
| PL3292153T3 (pl) * | 2015-05-04 | 2020-02-28 | Affimed Gmbh | Kombinacja przeciwciała cd30xcd16a z przeciwciałem antagonistycznym anty-pd-1 do leczenia |
| EP3090751A1 (en) * | 2015-05-06 | 2016-11-09 | Université de Lausanne | Molecular profiling of cd8 t-cells in autochthonous melanoma identifies maf as driver of exhaustion |
| PL3303619T3 (pl) * | 2015-05-29 | 2020-10-05 | F. Hoffmann-La Roche Ag | Metylacja promotora PD-L1 w chorobach nowotworowych |
| PE20180672A1 (es) | 2015-05-29 | 2018-04-19 | Agenus Inc | Anticuerpos anti-ctla-4 y metodos de uso de los mismos |
| TWI773646B (zh) | 2015-06-08 | 2022-08-11 | 美商宏觀基因股份有限公司 | 結合lag-3的分子和其使用方法 |
| WO2016207717A1 (en) | 2015-06-24 | 2016-12-29 | Janssen Pharmaceutica Nv | Anti-vista antibodies and fragments |
| SMT202100131T1 (it) * | 2015-07-14 | 2021-05-07 | Bristol Myers Squibb Co | Metodo di trattamento di un cancro usando un inibitore di checkpoint immunitari; anticorpo che si lega al recettore della morte programmata-1 (pd-1) o al ligando della morte programmata 1 (pd-l1) |
| PE20181151A1 (es) | 2015-07-30 | 2018-07-17 | Macrogenics Inc | Moleculas de union a pd-1 y metodos de uso de las mismas |
| CA2994631A1 (en) | 2015-08-07 | 2017-02-16 | Pieris Pharmaceuticals Gmbh | Novel fusion polypeptide specific for lag-3 and pd-1 |
| WO2017024465A1 (en) | 2015-08-10 | 2017-02-16 | Innovent Biologics (Suzhou) Co., Ltd. | Pd-1 antibodies |
| PT3334763T (pt) | 2015-08-11 | 2024-10-28 | Wuxi Biologics Ireland Ltd | Novos anticorpos anti-pd-1 |
| WO2017031760A1 (zh) * | 2015-08-27 | 2017-03-02 | 杨光华 | 干涉片段及其应用 |
| WO2017031761A1 (zh) * | 2015-08-27 | 2017-03-02 | 杨光华 | 干涉片段及其应用 |
| CN107949573B (zh) | 2015-09-01 | 2022-05-03 | 艾吉纳斯公司 | 抗-pd-1抗体及其使用方法 |
| HK1251158A1 (zh) | 2015-09-29 | 2019-01-25 | 细胞基因公司 | Pd-1結合蛋白及其使用方法 |
| RU2729371C1 (ru) | 2015-10-02 | 2020-08-06 | Ф. Хоффманн-Ля Рош Аг | Биспецифические антитела, специфические к pd1 и tim3 |
| RS62450B1 (sr) | 2015-10-02 | 2021-11-30 | Hoffmann La Roche | Anti-pd1 antitela i postupci primene |
| UA128469C2 (uk) | 2015-10-08 | 2024-07-24 | Макродженікс, Інк. | Спосіб лікування в7-н3-експресуючого раку |
| JP2018534927A (ja) | 2015-10-22 | 2018-11-29 | ジョンス セラピューティクス, インコーポレイテッド | Icos発現を決定する遺伝子シグネチャー |
| WO2017075045A2 (en) | 2015-10-30 | 2017-05-04 | Mayo Foundation For Medical Education And Research | Antibodies to b7-h1 |
| EA201891093A1 (ru) | 2015-11-03 | 2018-10-31 | Янссен Байотек, Инк. | Антитела, специфически связывающие pd-1, и их применение |
| CA3006462C (en) | 2015-12-14 | 2023-10-31 | Macrogenics, Inc. | Bispecific molecules having immunoreactivity with pd-1 and ctla-4, and methods of use thereof |
| FI3964529T3 (fi) | 2016-01-22 | 2025-06-13 | MabQuest SA | Ei-estäviä PD1-spesifisiä vasta-aineita |
| US11214617B2 (en) | 2016-01-22 | 2022-01-04 | MabQuest SA | Immunological reagents |
| DK3411398T3 (da) * | 2016-02-05 | 2024-06-24 | Orionis Biosciences BV | Målrettede terapeutiske midler og anvendelse heraf |
| TW202216201A (zh) | 2016-02-12 | 2022-05-01 | 比利時商楊森製藥公司 | 抗vista抗體及片段、其用途及鑑定其之方法 |
| WO2017155981A1 (en) | 2016-03-07 | 2017-09-14 | Massachusetts Institute Of Technology | Protein-chaperoned t-cell vaccines |
| SI3430141T1 (sl) * | 2016-03-14 | 2021-04-30 | F. Hoffmann-La Roche Ag | Oligonukleotidi za zmanjšanje izraženosti PD-L1 |
| AU2017234163B2 (en) | 2016-03-15 | 2023-01-19 | Mersana Therapeutics, Inc. | NaPi2b-targeted antibody-drug conjugates and methods of use thereof |
| US11185555B2 (en) | 2016-04-11 | 2021-11-30 | Noah James Harrison | Method to kill pathogenic microbes in a patient |
| PE20190115A1 (es) | 2016-04-15 | 2019-01-16 | Immunext Inc | Anticuerpos vista antihumanos y su uso |
| EP3243832A1 (en) | 2016-05-13 | 2017-11-15 | F. Hoffmann-La Roche AG | Antigen binding molecules comprising a tnf family ligand trimer and pd1 binding moiety |
| JP7261379B2 (ja) | 2016-06-20 | 2023-04-20 | カイマブ・リミテッド | 抗pd-l1抗体 |
| US9567399B1 (en) | 2016-06-20 | 2017-02-14 | Kymab Limited | Antibodies and immunocytokines |
| MX2019000252A (es) | 2016-06-30 | 2019-10-09 | Oncorus Inc | Administracion viral oncolitica pseudotipada de polipeptidos terapeuticos. |
| NZ749997A (en) | 2016-07-05 | 2022-11-25 | Beigene Ltd | Combination of a pd-l antagonist and a raf inhibitor for treating cancer |
| RU2757394C2 (ru) | 2016-08-03 | 2021-10-14 | Нексткьюр, Инк. | Композиции и способы для модуляции передачи сигнала lair |
| CN117736325A (zh) | 2016-08-09 | 2024-03-22 | 科马布有限公司 | 分离抗体及其应用 |
| EP4353747A3 (en) | 2016-08-19 | 2024-06-26 | BeiGene Switzerland GmbH | Combination of zanubrutinib with an anti-cd20 or an anti-pd-1 antibody for use in treating cancer |
| CN109790220A (zh) | 2016-08-25 | 2019-05-21 | 豪夫迈·罗氏有限公司 | 与巨噬细胞激活剂组合的抗csf-1r抗体的间歇给药 |
| JP2019533645A (ja) | 2016-09-16 | 2019-11-21 | ザ・ジョンズ・ホプキンス・ユニバーシティー | 標的組織および細胞内送達のための増大した粘膜浸透のタンパク質ナノケージ |
| US10766958B2 (en) | 2016-09-19 | 2020-09-08 | Celgene Corporation | Methods of treating vitiligo using PD-1 binding antibodies |
| KR102257154B1 (ko) | 2016-09-19 | 2021-05-28 | 셀진 코포레이션 | Pd-1 결합 단백질을 사용하는 면역 질환의 치료 방법 |
| CN106480027A (zh) * | 2016-09-30 | 2017-03-08 | 重庆高圣生物医药有限责任公司 | CRISPR/Cas9 靶向敲除人PD‑1基因及其特异性gRNA |
| AU2017339561B2 (en) * | 2016-10-07 | 2024-02-01 | Secarna Pharmaceuticals Gmbh & Co. Kg | Novel approach for treating cancer |
| WO2018085468A1 (en) | 2016-11-01 | 2018-05-11 | Anaptysbio, Inc. | Antibodies directed against programmed death- 1 (pd-1) |
| WO2018083248A1 (en) | 2016-11-03 | 2018-05-11 | Kymab Limited | Antibodies, combinations comprising antibodies, biomarkers, uses & methods |
| US11135307B2 (en) | 2016-11-23 | 2021-10-05 | Mersana Therapeutics, Inc. | Peptide-containing linkers for antibody-drug conjugates |
| CA3046082A1 (en) | 2016-12-07 | 2018-06-14 | Agenus Inc. | Antibodies and methods of use thereof |
| WO2018106862A1 (en) | 2016-12-07 | 2018-06-14 | Agenus Inc. | Anti-ctla-4 antibodies and methods of use thereof |
| WO2018115051A1 (en) | 2016-12-22 | 2018-06-28 | F. Hoffmann-La Roche Ag | Treatment of tumors with an anti-csf-1r antibody in combination with an anti-pd-l1 antibody after failure of anti-pd-l1/pd1 treatment |
| CA3049440A1 (en) | 2017-01-09 | 2018-07-12 | Tesaro, Inc. | Methods of treating cancer with anti-pd-1 antibodies |
| WO2018132516A1 (en) * | 2017-01-10 | 2018-07-19 | Nodus Therapeutics | Combination tumor treatment with an integrin-binding-fc fusion protein and immune modulator |
| WO2018134279A1 (en) | 2017-01-18 | 2018-07-26 | Pieris Pharmaceuticals Gmbh | Novel fusion polypeptides specific for lag-3 and pd-1 |
| WO2018137681A1 (en) | 2017-01-25 | 2018-08-02 | Beigene, Ltd. | Crystalline forms of (s) -7- (1- (but-2-ynoyl) piperidin-4-yl) -2- (4-phenoxyphenyl) -4, 5, 6, 7-tetrahy dropyrazolo [1, 5-a] pyrimidine-3-carboxamide, preparation, and uses thereof |
| KR102089371B1 (ko) * | 2017-01-26 | 2020-03-16 | 사회복지법인 삼성생명공익재단 | 혈관면역아세포성 t 세포 림프종 진단용 마커 및 이의 용도 |
| US20180271996A1 (en) | 2017-02-28 | 2018-09-27 | Mersana Therapeutics, Inc. | Combination therapies of her2-targeted antibody-drug conjugates |
| EP3606946B1 (en) | 2017-04-03 | 2022-08-24 | F. Hoffmann-La Roche AG | Immunoconjugates of an anti-pd-1 antibody with a mutant il-2 or with il-15 |
| EP4516809A2 (en) | 2017-04-05 | 2025-03-05 | F. Hoffmann-La Roche AG | Bispecific antibodies specifically binding to pd1 and lag3 |
| CN110678200B (zh) | 2017-05-30 | 2024-05-17 | 百时美施贵宝公司 | 包含抗lag-3抗体或抗lag-3抗体和抗pd-1或抗pd-l1抗体的组合物 |
| KR102713203B1 (ko) | 2017-05-30 | 2024-10-10 | 브리스톨-마이어스 스큅 컴퍼니 | Lag-3 양성 종양의 치료 |
| AU2018278327B2 (en) | 2017-06-01 | 2023-03-16 | Cytomx Therapeutics, Inc. | Activatable anti-pdl1 antibodies and methods of use thereof |
| GB201709808D0 (en) | 2017-06-20 | 2017-08-02 | Kymab Ltd | Antibodies |
| CA3066518A1 (en) | 2017-06-26 | 2019-01-03 | Beigene, Ltd. | Immunotherapy for hepatocellular carcinoma |
| CN107253988B (zh) * | 2017-07-19 | 2021-01-29 | 福州大学 | 一种人源程序性死亡因子配体pd-l2蛋白的制备方法 |
| US11306144B2 (en) | 2017-08-25 | 2022-04-19 | Five Prime Therapeutics, Inc. | B7-H4 antibodies and methods of use thereof |
| CN107596374B (zh) * | 2017-09-01 | 2020-06-30 | 广东医科大学 | B12蛋白表达抑制剂及其在结核病免疫和治疗中应用 |
| US11685782B2 (en) | 2017-10-23 | 2023-06-27 | Children's Medical Center Corporation | Methods of treating cancer using LSD1 inhibitors in combination with immunotherapy |
| EP3717021A1 (en) | 2017-11-27 | 2020-10-07 | Mersana Therapeutics, Inc. | Pyrrolobenzodiazepine antibody conjugates |
| US11786529B2 (en) | 2017-11-29 | 2023-10-17 | Beigene Switzerland Gmbh | Treatment of indolent or aggressive B-cell lymphomas using a combination comprising BTK inhibitors |
| US11946094B2 (en) | 2017-12-10 | 2024-04-02 | Augusta University Research Institute, Inc. | Combination therapies and methods of use thereof |
| WO2019122882A1 (en) | 2017-12-19 | 2019-06-27 | Kymab Limited | Bispecific antibody for icos and pd-l1 |
| AU2018388071B2 (en) | 2017-12-20 | 2025-02-06 | Vlp Therapeutics, Inc. | Alphavirus replicon particle |
| EP3727463A1 (en) | 2017-12-21 | 2020-10-28 | Mersana Therapeutics, Inc. | Pyrrolobenzodiazepine antibody conjugates |
| WO2019133847A1 (en) | 2017-12-29 | 2019-07-04 | Oncorus, Inc. | Oncolytic viral delivery of therapeutic polypeptides |
| JP2021512151A (ja) | 2018-01-23 | 2021-05-13 | ネクストキュア インコーポレイテッド | B7−h4抗体およびその使用方法 |
| EP3746480A1 (en) | 2018-01-31 | 2020-12-09 | F. Hoffmann-La Roche AG | Bispecific antibodies comprising an antigen-binding site binding to lag3 |
| KR20200144094A (ko) | 2018-03-02 | 2020-12-28 | 파이브 프라임 테라퓨틱스, 인크. | B7-h4 항체 및 이의 사용 방법 |
| CN108530537B (zh) * | 2018-03-29 | 2019-07-02 | 中国人民解放军军事科学院军事医学研究院 | Pd-1/pd-l1信号通路抑制剂 |
| JP6630026B1 (ja) * | 2018-04-27 | 2020-01-15 | 隆代 大田 | 免疫チェックポイント阻害剤によるがん治療の効果を評価するためのバイオマーカー |
| TW202017569A (zh) | 2018-05-31 | 2020-05-16 | 美商佩樂敦治療公司 | 用於抑制cd73之組合物及方法 |
| WO2020021061A1 (en) | 2018-07-26 | 2020-01-30 | Pieris Pharmaceuticals Gmbh | Humanized anti-pd-1 antibodies and uses thereof |
| EP3843849A1 (en) | 2018-08-27 | 2021-07-07 | Pieris Pharmaceuticals GmbH | Combination therapies comprising cd137/her2 bispecific agents and pd-1 axis inhibitors and uses thereof |
| US20210340279A1 (en) | 2018-08-31 | 2021-11-04 | Yale University | Compositions and methods of using cell-penetrating antibodies in combination with immune checkpoint modulators |
| WO2020063433A1 (zh) * | 2018-09-29 | 2020-04-02 | 四川科伦博泰生物医药股份有限公司 | 抗程序性死亡配体-1(pd-l1)抗体的抗肿瘤用途 |
| JP2022513400A (ja) | 2018-10-29 | 2022-02-07 | メルサナ セラピューティクス インコーポレイテッド | ペプチド含有リンカーを有するシステイン操作抗体-薬物コンジュゲート |
| WO2020092839A1 (en) | 2018-10-31 | 2020-05-07 | Mayo Foundation For Medical Education And Research | Methods and materials for treating cancer |
| EP3873540A4 (en) | 2018-10-31 | 2022-07-27 | Mayo Foundation for Medical Education and Research | Methods and materials for treating cancer |
| SG11202104331YA (en) | 2018-12-11 | 2021-05-28 | Theravance Biopharma R&D Ip Llc | Naphthyridine and quinoline derivatives useful as alk5 inhibitors |
| CN110092826B (zh) * | 2019-02-28 | 2022-04-15 | 天津大学 | CTLA-4类似物CFN13及CFN13-Fc基因和蛋白 |
| CN110452870A (zh) * | 2019-05-20 | 2019-11-15 | 河南省肿瘤医院 | 一种肿瘤特异性t细胞的分离培养方法及由其获得的产品 |
| MA56523A (fr) | 2019-06-18 | 2022-04-27 | Janssen Sciences Ireland Unlimited Co | Combinaison de vaccins contre le virus de l'hépatite b (vhb) et d'anticorps anti-pd-1 ou anti-pd-l1 |
| EP3986460A2 (en) | 2019-06-18 | 2022-04-27 | Janssen Sciences Ireland Unlimited Company | Combination of hepatitis b virus (hbv) vaccines and anti-pd-1 antibody |
| KR20220104208A (ko) | 2019-11-22 | 2022-07-26 | 세라밴스 바이오파마 알앤디 아이피, 엘엘씨 | Alk5 억제제로서 치환된 1,5-나프티리딘 또는 퀴놀린 |
| WO2021108025A1 (en) | 2019-11-26 | 2021-06-03 | Massachusetts Institute Of Technology | Cell-based cancer vaccines and cancer therapies |
| US11673879B2 (en) | 2020-03-31 | 2023-06-13 | Theravance Biopharma R&D Ip, Llc | Substituted pyrimidines and methods of use |
| US12280102B2 (en) | 2020-04-17 | 2025-04-22 | Vlp Therapeutics, Inc. | Alphavirus replicon encoding chimeric SARS-CoV-2 receptor binding domains |
| IL297564A (en) | 2020-04-30 | 2022-12-01 | Vlp Therapeutics Inc | Cytokine immunotherapy |
| IL298019A (en) | 2020-05-13 | 2023-01-01 | Massachusetts Inst Technology | Compositions of polymeric microdevices and their use in cancer immunotherapy |
| US11767353B2 (en) | 2020-06-05 | 2023-09-26 | Theraly Fibrosis, Inc. | Trail compositions with reduced immunogenicity |
| JP2023530275A (ja) | 2020-06-10 | 2023-07-14 | セラヴァンス バイオファーマ アール&ディー アイピー, エルエルシー | Alk5阻害剤として有用なナフチリジン誘導体 |
| US20240423972A1 (en) | 2021-02-01 | 2024-12-26 | Yale University | Chemotherapeutic bioadhesive particles with immunostimulatory molecules for cancer treatment |
| WO2022251359A1 (en) | 2021-05-26 | 2022-12-01 | Theravance Biopharma R&D Ip, Llc | Bicyclic inhibitors of alk5 and methods of use |
| EP4380980A1 (en) | 2021-08-03 | 2024-06-12 | F. Hoffmann-La Roche AG | Bispecific antibodies and methods of use |
| MX2024003887A (es) | 2021-10-14 | 2024-07-09 | Arsenal Biosciences Inc | Células inmunitarias que tienen arnch coespresados y sistemas de compuerta lógica. |
| EP4197525A1 (en) | 2021-12-20 | 2023-06-21 | Scandion Oncology A/S | Combination of drugs for the treatment of cancer |
| CN114181310B (zh) * | 2022-02-14 | 2022-07-05 | 中山康方生物医药有限公司 | 抗tigit抗体、其药物组合物及用途 |
| WO2023194656A1 (en) | 2022-04-08 | 2023-10-12 | Tilt Biotherapeutics Oy | Monoclonal pd-l1 antibodies |
| CN114588258B (zh) * | 2022-05-10 | 2023-04-25 | 中山大学 | Bmp9联合nk细胞和pd-l1抗体在制备肝癌药物方面的应用 |
| WO2023242235A1 (en) | 2022-06-14 | 2023-12-21 | Scandion Oncology A/S | Abcg2 inhibitor and nae inhibitor for the treatment of cancer |
| WO2024040264A1 (en) | 2022-08-19 | 2024-02-22 | Massachusetts Institute Of Technology | Compositions and methods for targeting dendritic cell lectins |
| AU2023361162A1 (en) | 2022-10-11 | 2025-05-29 | Yale University | Compositions and methods of using cell-penetrating antibodies |
| WO2024112867A1 (en) | 2022-11-23 | 2024-05-30 | University Of Georgia Research Foundation, Inc. | Compositions and methods of use thereof for increasing immune responses |
| WO2025029625A1 (en) * | 2023-07-28 | 2025-02-06 | Dicerna Pharmaceuticals, Inc. | Compositions and methods for programmed death ligand receptor (pd-l1) expression |
Family Cites Families (140)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3625214A (en) | 1970-05-18 | 1971-12-07 | Alza Corp | Drug-delivery device |
| CA1178414A (en) | 1978-02-08 | 1984-11-27 | Toyo Boseki Kabushiki Kaisha (Trading Under The Name Of Toyobo Co., Ltd.) | Packaging material having excellent seal packaging property |
| US4233402A (en) | 1978-04-05 | 1980-11-11 | Syva Company | Reagents and method employing channeling |
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4376110A (en) | 1980-08-04 | 1983-03-08 | Hybritech, Incorporated | Immunometric assays using monoclonal antibodies |
| US4659678A (en) | 1982-09-29 | 1987-04-21 | Serono Diagnostics Limited | Immunoassay of antigens |
| US4727022A (en) | 1984-03-14 | 1988-02-23 | Syntex (U.S.A.) Inc. | Methods for modulating ligand-receptor interactions and their application |
| JPS6178686A (ja) | 1984-09-26 | 1986-04-22 | Dainippon Printing Co Ltd | 真空成形用印刷フイルム |
| US4789734A (en) | 1985-08-06 | 1988-12-06 | La Jolla Cancer Research Foundation | Vitronectin specific cell receptor derived from mammalian mesenchymal tissue |
| AU610083B2 (en) | 1986-08-18 | 1991-05-16 | Clinical Technologies Associates, Inc. | Delivery systems for pharmacological agents |
| EP0400047B1 (en) | 1988-02-05 | 1997-04-23 | Whitehead Institute For Biomedical Research | Modified hepatocytes and uses therefor |
| US6235488B1 (en) | 1988-09-29 | 2001-05-22 | Agilent Technologies, Inc. | Surface preparation for chemical-specific binding |
| US5858358A (en) * | 1992-04-07 | 1999-01-12 | The United States Of America As Represented By The Secretary Of The Navy | Methods for selectively stimulating proliferation of T cells |
| EP0711345A1 (en) | 1993-07-26 | 1996-05-15 | Dana Farber Cancer Institute | B7-2: ctl a4/cd 28 counter receptor |
| JPH07291996A (ja) | 1994-03-01 | 1995-11-07 | Yuu Honshiyo | ヒトにおけるプログラムされた細胞死に関連したポリペプチド、それをコードするdna、そのdnaからなるベクター、そのベクターで形質転換された宿主細胞、そのポリペプチドの抗体、およびそのポリペプチドまたはその抗体を含有する薬学的組成物 |
| US5954687A (en) | 1995-04-28 | 1999-09-21 | Medtronic, Inc. | Burr hole ring with catheter for use as an injection port |
| DE19526386C1 (de) | 1995-07-19 | 1997-01-02 | Deutsches Krebsforsch | Papillomviren, Mittel zu deren Nachweis sowie zur Therapie von durch sie verursachten Erkrankungen |
| US6051227A (en) | 1995-07-25 | 2000-04-18 | The Regents Of The University Of California, Office Of Technology Transfer | Blockade of T lymphocyte down-regulation associated with CTLA-4 signaling |
| WO1997046256A1 (en) | 1996-05-23 | 1997-12-11 | The Scripps Research Institute | Mhc class ii antigen-presenting systems and methods for activating cd4+ t cells |
| US6103479A (en) * | 1996-05-30 | 2000-08-15 | Cellomics, Inc. | Miniaturized cell array methods and apparatus for cell-based screening |
| US6579854B1 (en) | 1996-08-14 | 2003-06-17 | Vanderbilt University | Diagnosis and management of infection caused by chlamydia |
| US5939281A (en) * | 1996-09-16 | 1999-08-17 | Case Western Reserve University | Detecting alloreactivity |
| US6232445B1 (en) * | 1997-10-29 | 2001-05-15 | Sunol Molecular Corporation | Soluble MHC complexes and methods of use thereof |
| NL1008929C2 (nl) * | 1998-04-20 | 1999-10-21 | Vhp Ugchelen Bv | Uit papier vervaardigd substraat voorzien van een geïntegreerde schakeling. |
| AU769538B2 (en) * | 1998-04-24 | 2004-01-29 | Hemosol Inc. | Efficient ex vivo expansion of CD4+ and CD8+ T-cells from HIV infected subjects |
| US6406921B1 (en) * | 1998-07-14 | 2002-06-18 | Zyomyx, Incorporated | Protein arrays for high-throughput screening |
| US20030027998A1 (en) | 1998-10-30 | 2003-02-06 | Holtzman Douglas A. | Novel genes encoding proteins having prognostic, diagnostic, preventive, therapeutic, and other uses |
| US20060205034A1 (en) | 1998-10-30 | 2006-09-14 | Millennium Pharmaceuticals, Inc. | Novel genes encoding proteins having prognostic, diagnostic, preventive, therapeutic, and other uses |
| WO2000032231A1 (en) | 1998-12-03 | 2000-06-08 | The Regents Of The University Of California | Stimulation of t cells against self antigens using ctla-4 blocking agents |
| SI1141028T1 (sl) | 1998-12-23 | 2010-05-31 | Pfizer | Človeška monoklonska protitelesa proti CTLA |
| US7041474B2 (en) * | 1998-12-30 | 2006-05-09 | Millennium Pharmaceuticals, Inc. | Nucleic acid encoding human tango 509 |
| US6972125B2 (en) | 1999-02-12 | 2005-12-06 | Genetics Institute, Llc | Humanized immunoglobulin reactive with B7-2 and methods of treatment therewith |
| WO2000055375A1 (en) | 1999-03-17 | 2000-09-21 | Alphagene, Inc. | Secreted proteins and polynucleotides encoding them |
| PL354348A1 (en) | 1999-04-02 | 2004-01-12 | Corixa Corporation | Compounds and methods for therapy and diagnosis of lung cancer |
| EP1074617A3 (en) | 1999-07-29 | 2004-04-21 | Research Association for Biotechnology | Primers for synthesising full-length cDNA and their use |
| RU2182481C2 (ru) * | 1999-08-02 | 2002-05-20 | Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии | Способ лечения злокачественной лимфомы кожи |
| HUP0202882A2 (en) * | 1999-08-23 | 2002-12-28 | Dana Farber Cancer Inst Inc | Novel b7-4 molecules and uses therefor |
| MXPA02001877A (es) | 1999-08-23 | 2002-08-20 | Dana Farber Cancer Inst Inc | Pd-1, un receptor para b7-4, y usos del mismo. |
| DE60033530T2 (de) * | 1999-08-24 | 2007-10-31 | Medarex Inc. | Humane antikörper gegen ctla-4 und deren verwendungen |
| US20040214783A1 (en) | 2002-05-08 | 2004-10-28 | Terman David S. | Compositions and methods for treatment of neoplastic disease |
| EP1218411A4 (en) | 1999-09-20 | 2004-09-01 | Millennium Pharm Inc | SECRETED PROTEINS AND THEIR USES |
| EP1244683A4 (en) | 1999-11-12 | 2005-01-12 | Human Genome Sciences Inc | 21 HUMAN SECRETED PROTEINS |
| US6803192B1 (en) | 1999-11-30 | 2004-10-12 | Mayo Foundation For Medical Education And Research | B7-H1, a novel immunoregulatory molecule |
| CA3016482A1 (en) | 1999-11-30 | 2001-06-07 | Mayo Foundation For Medical Education And Research | B7-h1, a novel immunoregulatory molecule |
| WO2001068134A2 (en) | 2000-03-14 | 2001-09-20 | Genetics Institute, Inc. | Therapies that improve graft survival, using antibodies against a b7 antigen |
| EP2067488A1 (en) | 2000-04-12 | 2009-06-10 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| US7030219B2 (en) | 2000-04-28 | 2006-04-18 | Johns Hopkins University | B7-DC, Dendritic cell co-stimulatory molecules |
| CA2412377A1 (en) * | 2000-06-06 | 2001-12-13 | Bristol-Myers Squibb Company | B7-related nucleic acids and polypeptides and their uses for immunomodulation |
| EP1320599A2 (en) | 2000-06-28 | 2003-06-25 | Genetics Institute, LLC | Pd-l2 molecules: pd-1 ligands and uses therefor |
| US6638915B1 (en) * | 2000-06-30 | 2003-10-28 | Harold Killam | Anti-viral composition |
| US7238360B2 (en) * | 2000-06-30 | 2007-07-03 | Unversity Of Louisville Research Foundation, Inc. | Alteration of cell membrane with B7 |
| US6635750B1 (en) | 2000-07-20 | 2003-10-21 | Millennium Pharmaceuticals, Inc. | B7-H2 nucleic acids, members of the B7 family |
| EP1328624B1 (en) | 2000-09-20 | 2011-11-09 | Amgen Inc. | B7-like molecules and uses thereof |
| US20030180309A1 (en) | 2001-01-08 | 2003-09-25 | Baum Peter R. | Human B7 polypeptides |
| WO2002068647A2 (en) | 2001-01-16 | 2002-09-06 | Curagen Corporation | Proteins, polynucleotides encoding them and methods of using the same |
| US7754208B2 (en) | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| US20030133939A1 (en) | 2001-01-17 | 2003-07-17 | Genecraft, Inc. | Binding domain-immunoglobulin fusion proteins |
| US7829084B2 (en) | 2001-01-17 | 2010-11-09 | Trubion Pharmaceuticals, Inc. | Binding constructs and methods for use thereof |
| US20030064380A1 (en) | 2001-01-29 | 2003-04-03 | The Center For Blood Research, Inc. | Anergy-regulated molecules |
| US20030166531A1 (en) * | 2001-02-16 | 2003-09-04 | Genetics Institute, Inc. | Methods for modulating an immune response by modulating the interaction between CTLA4 and PP2A |
| EP2336167B1 (en) | 2001-03-14 | 2019-05-29 | Dako Denmark A/S | MHC molecule constructs and their uses for diagnosis and therapy |
| WO2002077208A1 (de) | 2001-03-27 | 2002-10-03 | Genethor Gmbh | Antigen-abhängige reduktion von spezifischen immunreaktionen durch beeinflussung der co-stimulation |
| AR036993A1 (es) * | 2001-04-02 | 2004-10-20 | Wyeth Corp | Uso de agentes que modulan la interaccion entre pd-1 y sus ligandos en la submodulacion de respuestas inmunologicas |
| AU2002338272B2 (en) | 2001-04-02 | 2007-10-11 | Dana-Farber Cancer Institute, Inc. | PD-1, a receptor for B7-4, and uses therefor |
| US7794710B2 (en) * | 2001-04-20 | 2010-09-14 | Mayo Foundation For Medical Education And Research | Methods of enhancing T cell responsiveness |
| FR2824567B1 (fr) | 2001-05-11 | 2003-08-08 | Inst Nat Sante Rech Med | Procede d'obtention de lymphocytes tr1 regulateurs specifiques d'antigene |
| WO2002092792A2 (de) | 2001-05-16 | 2002-11-21 | Genethor Gmbh | Antigen-abhängige reduktion von spezifischen immunreaktionen durch beeinflussung der co-stimulation |
| US20060276422A1 (en) | 2001-05-18 | 2006-12-07 | Nassim Usman | RNA interference mediated inhibition of B7-H1 gene expression using short interfering nucleic acid (siNA) |
| IL149701A0 (en) | 2001-05-23 | 2002-11-10 | Pfizer Prod Inc | Use of anti-ctla-4 antibodies |
| GB0116942D0 (en) | 2001-07-11 | 2001-09-05 | Sahajanand Biotech Private Ltd | Herbal formulation |
| AU2002322211A1 (en) | 2001-07-12 | 2003-01-29 | Canvac | Methods and compisitions for activation human t cells in vitro |
| RU2197969C1 (ru) * | 2001-07-18 | 2003-02-10 | Мокеева Марина Викторовна | Способ лечения хронической рецидивирующей герпесвирусной инфекции |
| WO2003042402A2 (en) | 2001-11-13 | 2003-05-22 | Dana-Farber Cancer Institute, Inc. | Agents that modulate immune cell activation and methods of use thereof |
| US7745140B2 (en) | 2002-01-03 | 2010-06-29 | The Trustees Of The University Of Pennsylvania | Activation and expansion of T-cells using an engineered multivalent signaling platform as a research tool |
| US7638325B2 (en) | 2002-01-03 | 2009-12-29 | The Trustees Of The University Of Pennsylvania | Activation and expansion of T-cells using an engineered multivalent signaling platform |
| US7638326B2 (en) | 2002-01-03 | 2009-12-29 | The Trustees Of The University Of Pennsylvania | Activation and expansion of T-cells using an engineered multivalent signaling platform |
| US20030180292A1 (en) * | 2002-03-14 | 2003-09-25 | Idec Pharmaceuticals | Treatment of B cell malignancies using anti-CD40L antibodies in combination with anti-CD20 antibodies and/or chemotherapeutics and radiotherapy |
| ES2384168T3 (es) * | 2002-04-12 | 2012-07-02 | Medarex, Inc. | Procedimientos de tratamiento usando anticuerpos CTLA-4 |
| CA2388441A1 (en) | 2002-06-10 | 2003-12-10 | Wei-Ping Min | Immunomodulation using rna interference |
| WO2004000221A2 (en) | 2002-06-20 | 2003-12-31 | The Regents Of The University Of California | Compositions and methods for modulating lymphocyte activity |
| SI2206517T1 (sl) * | 2002-07-03 | 2023-12-29 | Ono Pharmaceutical Co., Ltd. | Imunopotencirni sestavki,ki obsegajo protitelesa proti PD-L1 |
| JP2004121218A (ja) | 2002-08-06 | 2004-04-22 | Jenokkusu Soyaku Kenkyusho:Kk | 気管支喘息または慢性閉塞性肺疾患の検査方法 |
| AU2003290083A1 (en) * | 2002-08-13 | 2004-03-11 | Cell Center Cologne Gmbh | Use of iap for the diagnosis and of iap-inhibitors for the treatment of hodgkin's lymphomas |
| AU2003301526A1 (en) * | 2002-10-25 | 2004-05-13 | University Of Connecticut Health Center | Immunotherapy of cancer through controlled cell lysis |
| US7449300B2 (en) | 2002-11-21 | 2008-11-11 | Mayo Foundation For Medical Education And Research | Detection of antibodies specific for B7-H1 in subjects with diseases or pathological conditions mediated by activated T cells |
| US7439042B2 (en) | 2002-12-16 | 2008-10-21 | Globeimmune, Inc. | Yeast-based therapeutic for chronic hepatitis C infection |
| WO2004058157A2 (en) | 2002-12-16 | 2004-07-15 | Globeimmune, Inc. | Yeast-based vaccines as immunotherapy |
| EP1576014B1 (en) | 2002-12-23 | 2011-06-29 | Wyeth LLC | Antibodies against pd-1 and uses thereof |
| ITMI20022758A1 (it) | 2002-12-23 | 2004-06-24 | Isagro Ricerca Srl | Nuovi uracili ad attivita' erbicida. |
| TW579556B (en) * | 2003-03-28 | 2004-03-11 | Au Optronics Corp | Method of fabricating a low temperature polysilicon film |
| US20040248205A1 (en) | 2003-04-16 | 2004-12-09 | Stern Lawrence J. | Major histocompatibility complex (MHC)-peptide arrays |
| EP1675596A4 (en) | 2003-10-10 | 2009-01-21 | Powderject Vaccines Inc | METHOD |
| AU2004285923A1 (en) | 2003-10-27 | 2005-05-12 | Genelabs Technologies, Inc. | Nucleoside compounds for treating viral infections |
| WO2005044835A1 (en) | 2003-10-27 | 2005-05-19 | Genelabs Technologies, Inc. | METHODS FOR PREPARING 7-(2'-SUBSTITUTED-ß-D-RIBOFURANOSYL)-4-(NR2R3)-5-(SUBSTITUTED ETHYN-1-YL)-PYRROLO[2,3-D]PYRIMIDINE DERIVATIVES |
| KR20050041296A (ko) | 2003-10-30 | 2005-05-04 | 학교법인 인제학원 | ΗΒx 단백질을 발현하는 간세포의 완전한 사멸을유도시키는 방법 및 이 방법을 이용하여 세포사멸 억제물질 및 유전자를 탐색하는 방법 |
| GB0326168D0 (en) | 2003-11-10 | 2003-12-17 | Arrow Therapeutics Ltd | Chemical compounds |
| US7132504B2 (en) | 2003-11-12 | 2006-11-07 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| US7304146B2 (en) | 2004-01-16 | 2007-12-04 | Applera Corporation | Fluorogenic kinase assays and substrates |
| EP2229945A1 (en) | 2004-05-21 | 2010-09-22 | Japan Tobacco, Inc. | Combinations comprising a 4-isoquinolone derivative and anti-HIV agents |
| ES2653570T3 (es) | 2004-05-27 | 2018-02-07 | The Trustees Of The University Of Pennsylvania | Células presentadoras de antígeno artificiales novedosas y usos de las mismas |
| US20060003452A1 (en) | 2004-07-01 | 2006-01-05 | Virxsys Corporation | Vector packaging cell line |
| WO2006021955A2 (en) | 2004-08-23 | 2006-03-02 | Mor Research Applications Ltd. | Use of bat monoclonal antibody for immunotherapy |
| AU2005295038B2 (en) | 2004-10-06 | 2012-05-17 | Mayo Foundation For Medical Education And Research | B7-H1 and methods of diagnosis, prognosis, and treatment of cancer |
| CA2584562A1 (en) | 2004-10-18 | 2006-04-27 | Globeimmune, Inc. | Yeast-based therapeutic for chronic hepatitis c infection |
| PL1833506T3 (pl) | 2004-12-29 | 2016-01-29 | Mannkind Corp | Zastosowanie kompozycji zawierających różne antygeny związane z nowotworem jako szczepionek przeciwnowotworowych |
| CN103059138B (zh) | 2005-05-09 | 2015-10-28 | 小野药品工业株式会社 | 程序性死亡-1(pd-1)的人单克隆抗体及使用抗pd-1抗体来治疗癌症的方法 |
| US7553661B2 (en) | 2005-05-31 | 2009-06-30 | Mcgill University | Stromal antigen-presenting cells and use thereof |
| WO2006133396A2 (en) * | 2005-06-08 | 2006-12-14 | Dana-Farber Cancer Institute | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (pd-1) pathway |
| JP2006345852A (ja) | 2005-06-16 | 2006-12-28 | Virxsys Corp | 抗体複合体 |
| ME02260B (me) * | 2005-07-01 | 2016-02-29 | Medarex Inc | Humana monoklonska antitela za ligand programirane smrti 1 (pd-l1) |
| WO2007016340A2 (en) | 2005-07-29 | 2007-02-08 | Providence Health System | Defective ribosomal products in blebs (dribbles) and methods of use to stimulate an immune response |
| WO2007030523A2 (en) | 2005-09-06 | 2007-03-15 | Kinemed, Inc. | Kinetic biomarker for quantification of lymphoproliferation, clonal expansion, recruitment and trafficking in lymphoid tissues and of the in vivo actions of antigens and modulating agents thereon |
| JP2007089496A (ja) | 2005-09-29 | 2007-04-12 | Institute Of Physical & Chemical Research | 医薬のスクリーニング方法 |
| MX2008007287A (es) | 2005-12-08 | 2008-10-27 | Univ Louisville Res Found | Metodos y composiciones para expandir celulas reguladoras t. |
| US20070172504A1 (en) | 2005-12-08 | 2007-07-26 | University Of Lousville Research Foundation, Inc. | In vivo cell surface engineering |
| US20090215084A1 (en) | 2006-01-05 | 2009-08-27 | Mayo Foundation For Medical Education And Research | B7-h1 and b7-h4 in cancer |
| WO2007082144A2 (en) | 2006-01-05 | 2007-07-19 | Mayo Foundation For Medical Education And Research | B7-h1 and survivin in cancer |
| EP2468765B1 (en) | 2006-03-03 | 2015-04-22 | ONO Pharmaceutical Co., Ltd. | Tetramer of extracellular domain of PD-L1 |
| CA2648925A1 (en) | 2006-04-13 | 2007-10-25 | Zymogenetics, Inc. | Tetramerizing polypeptides and methods of use |
| WO2007124361A2 (en) | 2006-04-20 | 2007-11-01 | Mayo Foundation For Medical Education And Research | Soluble b7-h1 |
| WO2008034076A2 (en) | 2006-09-15 | 2008-03-20 | The Johns Hopkins University | Cyclophosphamide in combination with immune therapeutics |
| EP2061504A4 (en) | 2006-09-20 | 2010-01-27 | Univ Johns Hopkins | COMBINATION THERAPY FOR CANCER AND INFECTION DISEASES WITH ANTI-B7-H1 ANTIBODIES |
| JP5243269B2 (ja) | 2006-12-26 | 2013-07-24 | 独立行政法人科学技術振興機構 | B細胞におけるcd22機能を抑制することから成る免疫応答の促進方法 |
| NZ626867A (en) * | 2006-12-27 | 2014-09-26 | Harvard College | Compositions and methods for the treatment of infections and tumors |
| WO2008091643A2 (en) | 2007-01-23 | 2008-07-31 | Altarex Medical Corp. | In vitro culture system to evaluate synergy in targeting immune suppressive pathways concurrent to immunotherapy |
| CN101641010A (zh) | 2007-01-26 | 2010-02-03 | 路易斯维尔大学研究基金会公司 | 用作疫苗的外来体组分的修饰 |
| DK2370593T3 (en) | 2008-11-28 | 2016-07-04 | Univ Emory | A method for determining the effect of PD-1 Antagonists |
| JP5140146B2 (ja) * | 2010-12-09 | 2013-02-06 | 住友ゴム工業株式会社 | 空気入りタイヤ |
| AU2014368898B2 (en) * | 2013-12-20 | 2020-06-11 | Dana-Farber Cancer Institute, Inc. | Combination therapy with neoantigen vaccine |
| JOP20200096A1 (ar) * | 2014-01-31 | 2017-06-16 | Children’S Medical Center Corp | جزيئات جسم مضاد لـ tim-3 واستخداماتها |
| CA2964392A1 (en) * | 2014-10-31 | 2016-05-06 | Massachussetts Institute Of Technology | Delivery of biomolecules to immune cells |
| WO2016178779A1 (en) * | 2015-05-01 | 2016-11-10 | Dana-Farber Cancer Institute, Inc. | Methods of mediating cytokine expression with anti ccr4 antibodies |
| EP3316902A1 (en) * | 2015-07-29 | 2018-05-09 | Novartis AG | Combination therapies comprising antibody molecules to tim-3 |
| WO2017019896A1 (en) * | 2015-07-29 | 2017-02-02 | Novartis Ag | Combination therapies comprising antibody molecules to pd-1 |
| MA43037A (fr) * | 2015-10-02 | 2018-08-08 | Dana Farber Cancer Inst Inc | Polythérapie par inhibiteurs de bromodomaine et blocage de point de contrôle |
| KR102497742B1 (ko) * | 2016-08-30 | 2023-02-10 | 다나-파버 캔서 인스티튜트 인크. | 약물 전달 조성물 및 그의 용도 |
| US11285149B2 (en) * | 2017-07-28 | 2022-03-29 | Dana-Farber Cancer Institute, Inc. | Enhanced immunotherapy of cancer using targeted transcriptional modulators |
| US11685782B2 (en) * | 2017-10-23 | 2023-06-27 | Children's Medical Center Corporation | Methods of treating cancer using LSD1 inhibitors in combination with immunotherapy |
| US11674950B2 (en) * | 2017-10-31 | 2023-06-13 | Dana-Farber Cancer Institute, Inc. | Methods determining and treating cellular resistance to ADP-rtbosylating toxin |
| US20190365719A1 (en) * | 2018-06-01 | 2019-12-05 | Massachusetts Institute Of Technology | Combination treatments of hsp90 inhibitors for enhancing tumor immunogenicity and methods of use thereof |
-
2006
- 2006-06-08 WO PCT/US2006/022423 patent/WO2006133396A2/en active Application Filing
- 2006-06-08 BR BRPI0611766-0A patent/BRPI0611766A2/pt not_active Application Discontinuation
- 2006-06-08 PL PL11162681T patent/PL2397156T3/pl unknown
- 2006-06-08 KR KR1020147003918A patent/KR101510065B1/ko active Active
- 2006-06-08 CA CA2611861A patent/CA2611861C/en active Active
- 2006-06-08 MX MX2015000025A patent/MX351401B/es unknown
- 2006-06-08 NZ NZ601439A patent/NZ601439A/xx unknown
- 2006-06-08 CA CA2981431A patent/CA2981431C/en active Active
- 2006-06-08 SI SI200632123A patent/SI2397156T1/sl unknown
- 2006-06-08 CN CNA2006800270076A patent/CN101355965A/zh active Pending
- 2006-06-08 NZ NZ593388A patent/NZ593388A/xx unknown
- 2006-06-08 ES ES11162681.8T patent/ES2608316T3/es active Active
- 2006-06-08 PT PT111626818T patent/PT2397156T/pt unknown
- 2006-06-08 NZ NZ564243A patent/NZ564243A/en unknown
- 2006-06-08 EP EP06784684.0A patent/EP1907000B2/en active Active
- 2006-06-08 KR KR1020147028424A patent/KR101600225B1/ko active Active
- 2006-06-08 SI SI200631501T patent/SI1907000T2/sl unknown
- 2006-06-08 DK DK06784684.0T patent/DK1907000T4/da active
- 2006-06-08 EP EP23163877.6A patent/EP4242655A3/en not_active Withdrawn
- 2006-06-08 ES ES06784684T patent/ES2397355T5/es active Active
- 2006-06-08 EP EP11162667.7A patent/EP2397155B1/en not_active Revoked
- 2006-06-08 PL PL06784684T patent/PL1907000T5/pl unknown
- 2006-06-08 AU AU2006254902A patent/AU2006254902B8/en active Active
- 2006-06-08 US US11/449,919 patent/US8652465B2/en active Active
- 2006-06-08 CN CN201410597059.3A patent/CN104436190A/zh active Pending
- 2006-06-08 MX MX2012004075A patent/MX349137B/es unknown
- 2006-06-08 SG SG10201702670VA patent/SG10201702670VA/en unknown
- 2006-06-08 LT LTEP11162681.8T patent/LT2397156T/lt unknown
- 2006-06-08 RU RU2011133335/15A patent/RU2596491C2/ru active
- 2006-06-08 CN CN201410095192.9A patent/CN103830725A/zh active Pending
- 2006-06-08 NZ NZ590308A patent/NZ590308A/en unknown
- 2006-06-08 KR KR1020167004817A patent/KR101804078B1/ko active Active
- 2006-06-08 DK DK11162681.8T patent/DK2397156T3/en active
- 2006-06-08 HU HUE11162681A patent/HUE030877T2/en unknown
- 2006-06-08 JP JP2008515956A patent/JP5788632B2/ja active Active
- 2006-06-08 EP EP16187881.4A patent/EP3130350A1/en not_active Withdrawn
- 2006-06-08 EP EP11162681.8A patent/EP2397156B1/en not_active Revoked
- 2006-06-08 KR KR1020087000548A patent/KR101514463B1/ko active Active
- 2006-06-08 RU RU2007147642/15A patent/RU2434641C2/ru active
-
2007
- 2007-12-09 IL IL187999A patent/IL187999A/en active IP Right Grant
- 2007-12-18 ZA ZA2007/10975A patent/ZA200710975B/en unknown
-
2012
- 2012-05-29 JP JP2012121491A patent/JP5753819B2/ja active Active
-
2013
- 2013-07-04 JP JP2013140306A patent/JP5882954B2/ja active Active
- 2013-12-30 US US14/144,304 patent/US9457080B2/en active Active
-
2014
- 2014-01-09 IL IL230396A patent/IL230396A/en active IP Right Grant
-
2015
- 2015-01-19 IL IL236806A patent/IL236806A/en active IP Right Grant
- 2015-01-19 IL IL236805A patent/IL236805B/en active IP Right Grant
- 2015-06-04 JP JP2015113648A patent/JP6494434B2/ja active Active
-
2016
- 2016-07-28 RU RU2016131170A patent/RU2746383C2/ru active
- 2016-08-30 US US15/252,133 patent/US10370446B2/en active Active
- 2016-12-14 JP JP2016242046A patent/JP2017075168A/ja active Pending
-
2017
- 2017-01-16 CY CY20171100050T patent/CY1118612T1/el unknown
-
2018
- 2018-02-20 IL IL257622A patent/IL257622B/en active IP Right Grant
- 2018-02-27 JP JP2018032729A patent/JP2018109045A/ja not_active Withdrawn
-
2019
- 2019-06-18 US US16/445,130 patent/US11359013B2/en active Active
- 2019-12-25 JP JP2019233736A patent/JP2020073527A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2397355T5 (es) | Métodos y composiciones para el tratamiento de infecciones persistentes y cáncer por inhibición de la vía de muerte celular programada (PD-1) | |
| AU2012204032B2 (en) | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (PD-1) pathway | |
| HK1233947A1 (en) | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (pd-1) pathway | |
| MX2007015638A (es) | Metodos y composiciones para el tratamiento de infecciones persistentes y cancer por inhibicion de la ruta de muerte celular programada (pd-1) | |
| HK1165265A (en) | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (pd-1)pathway | |
| HK1165265B (en) | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (pd-1)pathway | |
| HK1165266B (en) | Methods and compositions for the treatment of persistent infections by inhibiting the programmed cell death 1 (pd-1)pathway | |
| HK1165266A (en) | Methods and compositions for the treatment of persistent infections by inhibiting the programmed cell death 1 (pd-1)pathway | |
| HK1115326B (en) | Methods and compositions for the treatment of persistent infections and cancer by inhibiting the programmed cell death 1 (pd-1) pathway |