CN1319596A - 3,6-二烷基5,6-二氢-4-羟基-2h-吡喃-2-酮的合成 - Google Patents
3,6-二烷基5,6-二氢-4-羟基-2h-吡喃-2-酮的合成 Download PDFInfo
- Publication number
- CN1319596A CN1319596A CN01111916A CN01111916A CN1319596A CN 1319596 A CN1319596 A CN 1319596A CN 01111916 A CN01111916 A CN 01111916A CN 01111916 A CN01111916 A CN 01111916A CN 1319596 A CN1319596 A CN 1319596A
- Authority
- CN
- China
- Prior art keywords
- formula
- acid
- alkyl
- hydroxy
- ester
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 238000003786 synthesis reaction Methods 0.000 title description 16
- 230000015572 biosynthetic process Effects 0.000 title description 13
- 238000000034 method Methods 0.000 claims abstract description 107
- 239000002253 acid Substances 0.000 claims abstract description 95
- 125000000422 delta-lactone group Chemical group 0.000 claims abstract description 62
- 150000004820 halides Chemical class 0.000 claims abstract description 55
- 230000008569 process Effects 0.000 claims abstract description 39
- 238000004519 manufacturing process Methods 0.000 claims abstract description 21
- 238000006243 chemical reaction Methods 0.000 claims description 59
- 239000003054 catalyst Substances 0.000 claims description 48
- -1 ruthenium diacetate compound Chemical class 0.000 claims description 44
- 238000005984 hydrogenation reaction Methods 0.000 claims description 38
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 37
- 150000001875 compounds Chemical class 0.000 claims description 37
- 238000002360 preparation method Methods 0.000 claims description 37
- 150000002148 esters Chemical class 0.000 claims description 33
- FFUAGWLWBBFQJT-UHFFFAOYSA-N hexamethyldisilazane Chemical compound C[Si](C)(C)N[Si](C)(C)C FFUAGWLWBBFQJT-UHFFFAOYSA-N 0.000 claims description 24
- 125000000217 alkyl group Chemical group 0.000 claims description 20
- 239000002585 base Substances 0.000 claims description 20
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 20
- 125000006239 protecting group Chemical group 0.000 claims description 20
- 239000003795 chemical substances by application Substances 0.000 claims description 17
- ATRNZOYKSNPPBF-UHFFFAOYSA-N D-beta-hydroxymyristic acid Natural products CCCCCCCCCCCC(O)CC(O)=O ATRNZOYKSNPPBF-UHFFFAOYSA-N 0.000 claims description 16
- 150000001277 beta hydroxy acids Chemical class 0.000 claims description 16
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical group ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 claims description 16
- ATRNZOYKSNPPBF-CYBMUJFWSA-N (R)-3-hydroxytetradecanoic acid Chemical compound CCCCCCCCCCC[C@@H](O)CC(O)=O ATRNZOYKSNPPBF-CYBMUJFWSA-N 0.000 claims description 15
- 229910052739 hydrogen Inorganic materials 0.000 claims description 15
- 229910052736 halogen Inorganic materials 0.000 claims description 14
- 125000003118 aryl group Chemical group 0.000 claims description 13
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 12
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 12
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 claims description 12
- 150000002367 halogens Chemical class 0.000 claims description 12
- 239000001257 hydrogen Substances 0.000 claims description 12
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 11
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 11
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 9
- AHLBNYSZXLDEJQ-FWEHEUNISA-N orlistat Chemical compound CCCCCCCCCCC[C@H](OC(=O)[C@H](CC(C)C)NC=O)C[C@@H]1OC(=O)[C@H]1CCCCCC AHLBNYSZXLDEJQ-FWEHEUNISA-N 0.000 claims description 9
- 229960001243 orlistat Drugs 0.000 claims description 9
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 claims description 8
- 150000001768 cations Chemical class 0.000 claims description 8
- 229910052707 ruthenium Inorganic materials 0.000 claims description 8
- 150000007942 carboxylates Chemical class 0.000 claims description 7
- 239000003446 ligand Substances 0.000 claims description 7
- 230000009467 reduction Effects 0.000 claims description 7
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 claims description 7
- 125000002948 undecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 7
- 239000000460 chlorine Substances 0.000 claims description 6
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 claims description 5
- 229910052799 carbon Inorganic materials 0.000 claims description 5
- 239000003153 chemical reaction reagent Substances 0.000 claims description 5
- 229910052801 chlorine Inorganic materials 0.000 claims description 5
- 150000001266 acyl halides Chemical class 0.000 claims description 4
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 claims description 3
- 150000002560 ketene acetals Chemical class 0.000 claims description 3
- 238000007127 saponification reaction Methods 0.000 claims description 3
- UTAHFAJHGGPJEQ-UHFFFAOYSA-N (2-phenylphenyl)phosphane Chemical class PC1=CC=CC=C1C1=CC=CC=C1 UTAHFAJHGGPJEQ-UHFFFAOYSA-N 0.000 claims description 2
- HFBHOAHFRNLZGN-LURJTMIESA-N (2s)-2-formamido-4-methylpentanoic acid Chemical compound CC(C)C[C@@H](C(O)=O)NC=O HFBHOAHFRNLZGN-LURJTMIESA-N 0.000 claims description 2
- WEGKDKPBTCKBQQ-MRXNPFEDSA-N (3r)-3-trimethylsilyloxytetradecanoyl chloride Chemical group CCCCCCCCCCC[C@H](CC(Cl)=O)O[Si](C)(C)C WEGKDKPBTCKBQQ-MRXNPFEDSA-N 0.000 claims description 2
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 2
- 238000010511 deprotection reaction Methods 0.000 claims description 2
- DHCWLIOIJZJFJE-UHFFFAOYSA-L dichlororuthenium Chemical compound Cl[Ru]Cl DHCWLIOIJZJFJE-UHFFFAOYSA-L 0.000 claims description 2
- YHYANIKYZIYYHG-PLYLYKGUSA-N ethyl (2R)-2-hexyl-3,5-bis(trimethylsilyloxy)hexadec-3-enoate Chemical compound C[Si](OC([C@H](C(=O)OCC)CCCCCC)=CC(CCCCCCCCCCC)O[Si](C)(C)C)(C)C YHYANIKYZIYYHG-PLYLYKGUSA-N 0.000 claims description 2
- 238000007142 ring opening reaction Methods 0.000 claims description 2
- DTXSRICYVCKUME-UHFFFAOYSA-L ruthenium(2+);diacetate Chemical compound [Ru+2].CC([O-])=O.CC([O-])=O DTXSRICYVCKUME-UHFFFAOYSA-L 0.000 claims description 2
- 125000005843 halogen group Chemical group 0.000 claims 2
- 125000006737 (C6-C20) arylalkyl group Chemical group 0.000 claims 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 claims 1
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 claims 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 claims 1
- 150000004679 hydroxides Chemical class 0.000 claims 1
- 238000000926 separation method Methods 0.000 claims 1
- 239000000543 intermediate Substances 0.000 abstract description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 141
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 81
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 58
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 57
- 239000000203 mixture Substances 0.000 description 44
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 43
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 39
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 37
- 239000011541 reaction mixture Substances 0.000 description 33
- 239000000243 solution Substances 0.000 description 32
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 28
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 27
- 239000000725 suspension Substances 0.000 description 25
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 24
- 239000000047 product Substances 0.000 description 23
- 239000007787 solid Substances 0.000 description 22
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 19
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 18
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical class C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 18
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 18
- 229910052757 nitrogen Inorganic materials 0.000 description 18
- 238000010992 reflux Methods 0.000 description 18
- 238000003756 stirring Methods 0.000 description 18
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 16
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 16
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 15
- 239000002904 solvent Substances 0.000 description 15
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 14
- 238000004821 distillation Methods 0.000 description 14
- 239000003921 oil Substances 0.000 description 13
- 235000019198 oils Nutrition 0.000 description 13
- MNDIARAMWBIKFW-UHFFFAOYSA-N 1-bromohexane Chemical compound CCCCCCBr MNDIARAMWBIKFW-UHFFFAOYSA-N 0.000 description 11
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 10
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 10
- 239000004912 1,5-cyclooctadiene Substances 0.000 description 9
- HSHMTDVEKPAEGS-UHFFFAOYSA-N diethyl 2-hexylpropanedioate Chemical compound CCCCCCC(C(=O)OCC)C(=O)OCC HSHMTDVEKPAEGS-UHFFFAOYSA-N 0.000 description 9
- 229910052751 metal Inorganic materials 0.000 description 9
- 239000002184 metal Substances 0.000 description 9
- 239000003960 organic solvent Substances 0.000 description 9
- 238000005160 1H NMR spectroscopy Methods 0.000 description 8
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 8
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 8
- 238000009876 asymmetric hydrogenation reaction Methods 0.000 description 8
- VURFVHCLMJOLKN-UHFFFAOYSA-N diphosphane Chemical compound PP VURFVHCLMJOLKN-UHFFFAOYSA-N 0.000 description 8
- 239000010410 layer Substances 0.000 description 8
- 239000006228 supernatant Substances 0.000 description 8
- 150000003512 tertiary amines Chemical class 0.000 description 8
- 229910052786 argon Inorganic materials 0.000 description 7
- 238000005828 desilylation reaction Methods 0.000 description 7
- UCZHVONNLSXXCI-UHFFFAOYSA-N dimethyl 2-hexylpropanedioate Chemical compound CCCCCCC(C(=O)OC)C(=O)OC UCZHVONNLSXXCI-UHFFFAOYSA-N 0.000 description 7
- CSNNHWWHGAXBCP-UHFFFAOYSA-L magnesium sulphate Substances [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 7
- 239000002244 precipitate Substances 0.000 description 7
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 7
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 6
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 6
- 229920006362 Teflon® Polymers 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 239000012298 atmosphere Substances 0.000 description 6
- 239000012043 crude product Substances 0.000 description 6
- 235000019439 ethyl acetate Nutrition 0.000 description 6
- 239000012065 filter cake Substances 0.000 description 6
- 239000012044 organic layer Substances 0.000 description 6
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 238000000967 suction filtration Methods 0.000 description 6
- BLXCWAINNUGTQE-LJQANCHMSA-N (2r)-5-hexyl-4-hydroxy-2-undecyl-2,3-dihydropyran-6-one Chemical compound CCCCCCCCCCC[C@@H]1CC(O)=C(CCCCCC)C(=O)O1 BLXCWAINNUGTQE-LJQANCHMSA-N 0.000 description 5
- LTVRSJBNXLZFGT-UHFFFAOYSA-N 2-silylethenone Chemical compound [SiH3]C=C=O LTVRSJBNXLZFGT-UHFFFAOYSA-N 0.000 description 5
- BLXCWAINNUGTQE-UHFFFAOYSA-N 5-hexyl-4-hydroxy-2-undecyl-2,3-dihydropyran-6-one Chemical compound CCCCCCCCCCCC1CC(O)=C(CCCCCC)C(=O)O1 BLXCWAINNUGTQE-UHFFFAOYSA-N 0.000 description 5
- 238000006418 Brown reaction Methods 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 230000002378 acidificating effect Effects 0.000 description 5
- 239000008139 complexing agent Substances 0.000 description 5
- BEPAFCGSDWSTEL-UHFFFAOYSA-N dimethyl malonate Chemical compound COC(=O)CC(=O)OC BEPAFCGSDWSTEL-UHFFFAOYSA-N 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 239000000706 filtrate Substances 0.000 description 5
- 238000002955 isolation Methods 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 150000004702 methyl esters Chemical class 0.000 description 5
- 238000006884 silylation reaction Methods 0.000 description 5
- WSDKKHKGVVIKSK-LJQANCHMSA-N trimethylsilyl (3R)-3-trimethylsilyloxytetradecanoate Chemical compound CCCCCCCCCCC[C@@H](O[Si](C)(C)C)CC(=O)O[Si](C)(C)C WSDKKHKGVVIKSK-LJQANCHMSA-N 0.000 description 5
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 5
- 229920002554 vinyl polymer Polymers 0.000 description 5
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 4
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 4
- AHLBNYSZXLDEJQ-UHFFFAOYSA-N N-formyl-L-leucylester Natural products CCCCCCCCCCCC(OC(=O)C(CC(C)C)NC=O)CC1OC(=O)C1CCCCCC AHLBNYSZXLDEJQ-UHFFFAOYSA-N 0.000 description 4
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 239000004809 Teflon Substances 0.000 description 4
- 125000005233 alkylalcohol group Chemical group 0.000 description 4
- PWSLBMVNVSADMI-UHFFFAOYSA-N diethyl 2,2-dihexylpropanedioate Chemical compound CCCCCCC(C(=O)OCC)(C(=O)OCC)CCCCCC PWSLBMVNVSADMI-UHFFFAOYSA-N 0.000 description 4
- WUXHROCHHBXGDN-UHFFFAOYSA-N dimethyl 2,2-dihexylpropanedioate Chemical compound CCCCCCC(C(=O)OC)(C(=O)OC)CCCCCC WUXHROCHHBXGDN-UHFFFAOYSA-N 0.000 description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 4
- 238000004817 gas chromatography Methods 0.000 description 4
- 230000002140 halogenating effect Effects 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 4
- 229910052744 lithium Inorganic materials 0.000 description 4
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 4
- 238000001953 recrystallisation Methods 0.000 description 4
- 239000002002 slurry Substances 0.000 description 4
- 239000001632 sodium acetate Substances 0.000 description 4
- 125000005270 trialkylamine group Chemical group 0.000 description 4
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 4
- 239000003039 volatile agent Substances 0.000 description 4
- LTMRRSWNXVJMBA-UHFFFAOYSA-L 2,2-diethylpropanedioate Chemical compound CCC(CC)(C([O-])=O)C([O-])=O LTMRRSWNXVJMBA-UHFFFAOYSA-L 0.000 description 3
- DRSSRPWTPHIRJG-UHFFFAOYSA-N 2-ethoxycarbonyloctanoic acid Chemical compound CCCCCCC(C(O)=O)C(=O)OCC DRSSRPWTPHIRJG-UHFFFAOYSA-N 0.000 description 3
- WEGKDKPBTCKBQQ-UHFFFAOYSA-N 3-trimethylsilyloxytetradecanoyl chloride Chemical compound CCCCCCCCCCCC(CC(Cl)=O)O[Si](C)(C)C WEGKDKPBTCKBQQ-UHFFFAOYSA-N 0.000 description 3
- FQKGSCOHCDSKAC-UHFFFAOYSA-N 4-[3-cyanopropyl(dimethoxy)silyl]butanenitrile Chemical compound N#CCCC[Si](OC)(CCCC#N)OC FQKGSCOHCDSKAC-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- 206010061307 Neck deformity Diseases 0.000 description 3
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 3
- NMLZYEWNUCRSRJ-UHFFFAOYSA-L [1-(2-diphenylphosphanylnaphthalen-1-yl)naphthalen-2-yl]-diphenylphosphane;ruthenium(2+);diacetate Chemical compound [Ru+2].CC([O-])=O.CC([O-])=O.C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 NMLZYEWNUCRSRJ-UHFFFAOYSA-L 0.000 description 3
- PBYRAYONARLAQJ-UHFFFAOYSA-N [2-[2-bis(3,5-ditert-butylphenyl)phosphanyl-6-methoxyphenyl]-3-methoxyphenyl]-bis(3,5-ditert-butylphenyl)phosphane Chemical compound COC=1C=CC=C(P(C=2C=C(C=C(C=2)C(C)(C)C)C(C)(C)C)C=2C=C(C=C(C=2)C(C)(C)C)C(C)(C)C)C=1C=1C(OC)=CC=CC=1P(C=1C=C(C=C(C=1)C(C)(C)C)C(C)(C)C)C1=CC(C(C)(C)C)=CC(C(C)(C)C)=C1 PBYRAYONARLAQJ-UHFFFAOYSA-N 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 239000012300 argon atmosphere Substances 0.000 description 3
- 244000309464 bull Species 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- RXVHBWZRZUBQSM-ZMFCMNQTSA-N ethyl (5r)-2-hexyl-5-hydroxy-3-oxohexadecanoate Chemical compound CCCCCCCCCCC[C@@H](O)CC(=O)C(C(=O)OCC)CCCCCC RXVHBWZRZUBQSM-ZMFCMNQTSA-N 0.000 description 3
- RXVHBWZRZUBQSM-UHFFFAOYSA-N ethyl 2-hexyl-5-hydroxy-3-oxohexadecanoate Chemical compound CCCCCCCCCCCC(O)CC(=O)C(C(=O)OCC)CCCCCC RXVHBWZRZUBQSM-UHFFFAOYSA-N 0.000 description 3
- 238000005658 halogenation reaction Methods 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 229910001629 magnesium chloride Inorganic materials 0.000 description 3
- CQRPUKWAZPZXTO-UHFFFAOYSA-M magnesium;2-methylpropane;chloride Chemical compound [Mg+2].[Cl-].C[C-](C)C CQRPUKWAZPZXTO-UHFFFAOYSA-M 0.000 description 3
- 239000012299 nitrogen atmosphere Substances 0.000 description 3
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 235000011181 potassium carbonates Nutrition 0.000 description 3
- 238000007363 ring formation reaction Methods 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 235000017281 sodium acetate Nutrition 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- OSAHWADQQULDAE-UHFFFAOYSA-N 1-methoxyoct-1-enoxy(trimethyl)silane Chemical compound CCCCCCC=C(OC)O[Si](C)(C)C OSAHWADQQULDAE-UHFFFAOYSA-N 0.000 description 2
- MDLJTYLCQPZADW-UHFFFAOYSA-N 2-methoxycarbonyloctanoic acid Chemical compound CCCCCCC(C(O)=O)C(=O)OC MDLJTYLCQPZADW-UHFFFAOYSA-N 0.000 description 2
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- ZPLNOBKZFHEVGA-SSYAZFEXSA-N C[Si](OC([C@H](C(=O)OC)CCCCCC)=CC(CCCCCCCCCCC)O[Si](C)(C)C)(C)C Chemical compound C[Si](OC([C@H](C(=O)OC)CCCCCC)=CC(CCCCCCCCCCC)O[Si](C)(C)C)(C)C ZPLNOBKZFHEVGA-SSYAZFEXSA-N 0.000 description 2
- 229910004039 HBF4 Inorganic materials 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- WRQNANDWMGAFTP-UHFFFAOYSA-N Methylacetoacetic acid Chemical compound COC(=O)CC(C)=O WRQNANDWMGAFTP-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- WDJHALXBUFZDSR-UHFFFAOYSA-M acetoacetate Chemical compound CC(=O)CC([O-])=O WDJHALXBUFZDSR-UHFFFAOYSA-M 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000003545 alkoxy group Chemical group 0.000 description 2
- 125000000304 alkynyl group Chemical group 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 2
- 239000000920 calcium hydroxide Substances 0.000 description 2
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 2
- OEERIBPGRSLGEK-UHFFFAOYSA-N carbon dioxide;methanol Chemical compound OC.O=C=O OEERIBPGRSLGEK-UHFFFAOYSA-N 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical class OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 150000005690 diesters Chemical class 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- NQGIJDNPUZEBRU-UHFFFAOYSA-N dodecanoyl chloride Chemical compound CCCCCCCCCCCC(Cl)=O NQGIJDNPUZEBRU-UHFFFAOYSA-N 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 125000004494 ethyl ester group Chemical group 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 150000002596 lactones Chemical class 0.000 description 2
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- 229910003002 lithium salt Inorganic materials 0.000 description 2
- 159000000002 lithium salts Chemical class 0.000 description 2
- BNHFWQQYLUPDOG-UHFFFAOYSA-N lithium;1,2,2,3-tetramethylpiperidine Chemical compound [Li].CC1CCCN(C)C1(C)C BNHFWQQYLUPDOG-UHFFFAOYSA-N 0.000 description 2
- 159000000003 magnesium salts Chemical class 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- VEKQMIIFKLSPRZ-VQCQRNETSA-N methyl (3r)-3-(2-bromooctanoyloxy)tetradecanoate Chemical compound CCCCCCCCCCC[C@H](CC(=O)OC)OC(=O)C(Br)CCCCCC VEKQMIIFKLSPRZ-VQCQRNETSA-N 0.000 description 2
- UOZZAMWODZQSOA-UHFFFAOYSA-N methyl 3-hydroxytetradecanoate Chemical compound CCCCCCCCCCCC(O)CC(=O)OC UOZZAMWODZQSOA-UHFFFAOYSA-N 0.000 description 2
- JGHZJRVDZXSNKQ-UHFFFAOYSA-N methyl octanoate Chemical compound CCCCCCCC(=O)OC JGHZJRVDZXSNKQ-UHFFFAOYSA-N 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 239000012452 mother liquor Substances 0.000 description 2
- ULWOJODHECIZAU-UHFFFAOYSA-N n,n-diethylpropan-2-amine Chemical compound CCN(CC)C(C)C ULWOJODHECIZAU-UHFFFAOYSA-N 0.000 description 2
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 2
- 235000015497 potassium bicarbonate Nutrition 0.000 description 2
- 239000011736 potassium bicarbonate Substances 0.000 description 2
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- YBCAZPLXEGKKFM-UHFFFAOYSA-K ruthenium(iii) chloride Chemical compound [Cl-].[Cl-].[Cl-].[Ru+3] YBCAZPLXEGKKFM-UHFFFAOYSA-K 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 2
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 239000005051 trimethylchlorosilane Substances 0.000 description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- RRKODOZNUZCUBN-CCAGOZQPSA-N (1z,3z)-cycloocta-1,3-diene Chemical compound C1CC\C=C/C=C\C1 RRKODOZNUZCUBN-CCAGOZQPSA-N 0.000 description 1
- VYXHVRARDIDEHS-QGTKBVGQSA-N (1z,5z)-cycloocta-1,5-diene Chemical compound C\1C\C=C/CC\C=C/1 VYXHVRARDIDEHS-QGTKBVGQSA-N 0.000 description 1
- AJNZWRKTWQLAJK-KLHDSHLOSA-N (2r,5r)-1-[2-[(2r,5r)-2,5-dimethylphospholan-1-yl]phenyl]-2,5-dimethylphospholane Chemical compound C[C@@H]1CC[C@@H](C)P1C1=CC=CC=C1P1[C@H](C)CC[C@H]1C AJNZWRKTWQLAJK-KLHDSHLOSA-N 0.000 description 1
- FMCAFXHLMUOIGG-JTJHWIPRSA-N (2s)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-formamido-3-sulfanylpropanoyl]amino]-3-methylbutanoyl]amino]-3-(4-hydroxy-2,5-dimethylphenyl)propanoyl]amino]-4-methylsulfanylbutanoic acid Chemical compound O=CN[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(=O)N[C@@H](CCSC)C(O)=O)CC1=CC(C)=C(O)C=C1C FMCAFXHLMUOIGG-JTJHWIPRSA-N 0.000 description 1
- 125000001376 1,2,4-triazolyl group Chemical group N1N=C(N=C1)* 0.000 description 1
- WCLITBPEYKCAGI-UHFFFAOYSA-N 1-[dihexyl-(trihexylsilylamino)silyl]hexane Chemical compound CCCCCC[Si](CCCCCC)(CCCCCC)N[Si](CCCCCC)(CCCCCC)CCCCCC WCLITBPEYKCAGI-UHFFFAOYSA-N 0.000 description 1
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- YCKXBALQXDTQPC-UHFFFAOYSA-N 2-chloro-2-methylbutane;magnesium Chemical compound [Mg].CCC(C)(C)Cl YCKXBALQXDTQPC-UHFFFAOYSA-N 0.000 description 1
- PBVZQAXFSQKDKK-UHFFFAOYSA-N 3-Methoxy-3-oxopropanoic acid Chemical compound COC(=O)CC(O)=O PBVZQAXFSQKDKK-UHFFFAOYSA-N 0.000 description 1
- UZGRZSHGRZYCQV-UHFFFAOYSA-N 4,6-dichloro-1,3-benzothiazol-2-amine Chemical compound C1=C(Cl)C=C2SC(N)=NC2=C1Cl UZGRZSHGRZYCQV-UHFFFAOYSA-N 0.000 description 1
- WDYVUKGVKRZQNM-UHFFFAOYSA-N 6-phosphonohexylphosphonic acid Chemical compound OP(O)(=O)CCCCCCP(O)(O)=O WDYVUKGVKRZQNM-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- WDJHALXBUFZDSR-UHFFFAOYSA-N Acetoacetic acid Natural products CC(=O)CC(O)=O WDJHALXBUFZDSR-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- IYXGSMUGOJNHAZ-UHFFFAOYSA-N Ethyl malonate Chemical compound CCOC(=O)CC(=O)OCC IYXGSMUGOJNHAZ-UHFFFAOYSA-N 0.000 description 1
- 229940127470 Lipase Inhibitors Drugs 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 239000005641 Methyl octanoate Substances 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 150000001216 Samarium Chemical class 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- FWXAUDSWDBGCMN-DNQXCXABSA-N [(2r,3r)-3-diphenylphosphanylbutan-2-yl]-diphenylphosphane Chemical compound C=1C=CC=CC=1P([C@H](C)[C@@H](C)P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 FWXAUDSWDBGCMN-DNQXCXABSA-N 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 238000007605 air drying Methods 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 229910001508 alkali metal halide Inorganic materials 0.000 description 1
- 150000008045 alkali metal halides Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 239000000010 aprotic solvent Substances 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 1
- 238000010533 azeotropic distillation Methods 0.000 description 1
- VEZXCJBBBCKRPI-UHFFFAOYSA-N beta-propiolactone Chemical class O=C1CCO1 VEZXCJBBBCKRPI-UHFFFAOYSA-N 0.000 description 1
- 125000002527 bicyclic carbocyclic group Chemical group 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- BRPQOXSCLDDYGP-UHFFFAOYSA-N calcium oxide Chemical compound [O-2].[Ca+2] BRPQOXSCLDDYGP-UHFFFAOYSA-N 0.000 description 1
- 239000000292 calcium oxide Substances 0.000 description 1
- ODINCKMPIJJUCX-UHFFFAOYSA-N calcium oxide Inorganic materials [Ca]=O ODINCKMPIJJUCX-UHFFFAOYSA-N 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001734 carboxylic acid salts Chemical class 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- UOCJDOLVGGIYIQ-PBFPGSCMSA-N cefatrizine Chemical group S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)[C@H](N)C=2C=CC(O)=CC=2)CC=1CSC=1C=NNN=1 UOCJDOLVGGIYIQ-PBFPGSCMSA-N 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- KOPOQZFJUQMUML-UHFFFAOYSA-N chlorosilane Chemical compound Cl[SiH3] KOPOQZFJUQMUML-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005265 dialkylamine group Chemical group 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- GPAYUJZHTULNBE-UHFFFAOYSA-N diphenylphosphine Chemical compound C=1C=CC=CC=1PC1=CC=CC=C1 GPAYUJZHTULNBE-UHFFFAOYSA-N 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- JWBISEOOIYWJAR-IKOFQBKESA-N ethyl (5r)-2-hexyl-3-oxo-5-trimethylsilyloxyhexadecanoate Chemical compound CCCCCCCCCCC[C@@H](O[Si](C)(C)C)CC(=O)C(C(=O)OCC)CCCCCC JWBISEOOIYWJAR-IKOFQBKESA-N 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012847 fine chemical Substances 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- 238000004508 fractional distillation Methods 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 239000001307 helium Substances 0.000 description 1
- 229910052734 helium Inorganic materials 0.000 description 1
- SWQJXJOGLNCZEY-UHFFFAOYSA-N helium atom Chemical compound [He] SWQJXJOGLNCZEY-UHFFFAOYSA-N 0.000 description 1
- KWHDXJHBFYQOTK-UHFFFAOYSA-N heptane;toluene Chemical compound CCCCCCC.CC1=CC=CC=C1 KWHDXJHBFYQOTK-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- BHEPBYXIRTUNPN-UHFFFAOYSA-N hydridophosphorus(.) (triplet) Chemical compound [PH] BHEPBYXIRTUNPN-UHFFFAOYSA-N 0.000 description 1
- 239000012433 hydrogen halide Substances 0.000 description 1
- 229910000039 hydrogen halide Inorganic materials 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- XGZVUEUWXADBQD-UHFFFAOYSA-L lithium carbonate Chemical compound [Li+].[Li+].[O-]C([O-])=O XGZVUEUWXADBQD-UHFFFAOYSA-L 0.000 description 1
- 229910052808 lithium carbonate Inorganic materials 0.000 description 1
- HQRPHMAXFVUBJX-UHFFFAOYSA-M lithium;hydrogen carbonate Chemical compound [Li+].OC([O-])=O HQRPHMAXFVUBJX-UHFFFAOYSA-M 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 229910001623 magnesium bromide Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- BLQJIBCZHWBKSL-UHFFFAOYSA-L magnesium iodide Chemical compound [Mg+2].[I-].[I-] BLQJIBCZHWBKSL-UHFFFAOYSA-L 0.000 description 1
- 229910001641 magnesium iodide Inorganic materials 0.000 description 1
- FKKWHMOEKFXMPU-UHFFFAOYSA-M magnesium;2-methylbutane;chloride Chemical compound [Mg+2].[Cl-].CC[C-](C)C FKKWHMOEKFXMPU-UHFFFAOYSA-M 0.000 description 1
- 238000003760 magnetic stirring Methods 0.000 description 1
- 150000002696 manganese Chemical class 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- UOGMEBQRZBEZQT-UHFFFAOYSA-L manganese(2+);diacetate Chemical class [Mn+2].CC([O-])=O.CC([O-])=O UOGMEBQRZBEZQT-UHFFFAOYSA-L 0.000 description 1
- 238000010907 mechanical stirring Methods 0.000 description 1
- 238000006140 methanolysis reaction Methods 0.000 description 1
- NBTOZLQBSIZIKS-UHFFFAOYSA-N methoxide Chemical compound [O-]C NBTOZLQBSIZIKS-UHFFFAOYSA-N 0.000 description 1
- LKISJZUZMIQOGM-WUBHUQEYSA-N methyl (3r)-2-hexyl-5-oxo-3-trimethylsilyloxyhexadecanoate Chemical compound CCCCCCCCCCCC(=O)C[C@@H](O[Si](C)(C)C)C(C(=O)OC)CCCCCC LKISJZUZMIQOGM-WUBHUQEYSA-N 0.000 description 1
- UOZZAMWODZQSOA-CQSZACIVSA-N methyl (3r)-3-hydroxytetradecanoate Chemical compound CCCCCCCCCCC[C@@H](O)CC(=O)OC UOZZAMWODZQSOA-CQSZACIVSA-N 0.000 description 1
- BMSVIOWGXQIDOX-MIHMCVIASA-N methyl (5r)-2-hexyl-3-oxo-5-trimethylsilyloxyhexadecanoate Chemical compound CCCCCCCCCCC[C@@H](O[Si](C)(C)C)CC(=O)C(C(=O)OC)CCCCCC BMSVIOWGXQIDOX-MIHMCVIASA-N 0.000 description 1
- OJURWUUOVGOHJZ-UHFFFAOYSA-N methyl 2-[(2-acetyloxyphenyl)methyl-[2-[(2-acetyloxyphenyl)methyl-(2-methoxy-2-oxoethyl)amino]ethyl]amino]acetate Chemical compound C=1C=CC=C(OC(C)=O)C=1CN(CC(=O)OC)CCN(CC(=O)OC)CC1=CC=CC=C1OC(C)=O OJURWUUOVGOHJZ-UHFFFAOYSA-N 0.000 description 1
- DTBSXIIDKUOHEN-UHFFFAOYSA-N methyl 3-oxotetradecanoate Chemical compound CCCCCCCCCCCC(=O)CC(=O)OC DTBSXIIDKUOHEN-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000006060 molten glass Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- HFPZCAJZSCWRBC-UHFFFAOYSA-N p-cymene Natural products CC(C)C1=CC=C(C)C=C1 HFPZCAJZSCWRBC-UHFFFAOYSA-N 0.000 description 1
- 125000000352 p-cymenyl group Chemical group C1(=C(C=C(C=C1)C)*)C(C)C 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- AOJFQRQNPXYVLM-UHFFFAOYSA-N pyridin-1-ium;chloride Chemical compound [Cl-].C1=CC=[NH+]C=C1 AOJFQRQNPXYVLM-UHFFFAOYSA-N 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000002390 rotary evaporation Methods 0.000 description 1
- BIXNGBXQRRXPLM-UHFFFAOYSA-K ruthenium(3+);trichloride;hydrate Chemical compound O.Cl[Ru](Cl)Cl BIXNGBXQRRXPLM-UHFFFAOYSA-K 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- BABPEPRNSRIYFA-UHFFFAOYSA-N silyl trifluoromethanesulfonate Chemical compound FC(F)(F)S(=O)(=O)O[SiH3] BABPEPRNSRIYFA-UHFFFAOYSA-N 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- SJRDNQOIQZOVQD-UHFFFAOYSA-M sodium;2,2-dimethylpropanoate Chemical compound [Na+].CC(C)(C)C([O-])=O SJRDNQOIQZOVQD-UHFFFAOYSA-M 0.000 description 1
- 238000003797 solvolysis reaction Methods 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 125000005207 tetraalkylammonium group Chemical group 0.000 description 1
- DPKBAXPHAYBPRL-UHFFFAOYSA-M tetrabutylazanium;iodide Chemical compound [I-].CCCC[N+](CCCC)(CCCC)CCCC DPKBAXPHAYBPRL-UHFFFAOYSA-M 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 125000005425 toluyl group Chemical group 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 125000005208 trialkylammonium group Chemical group 0.000 description 1
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 229910052720 vanadium Inorganic materials 0.000 description 1
- 239000007966 viscous suspension Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/32—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/18—Compounds having one or more C—Si linkages as well as one or more C—O—Si linkages
- C07F7/1804—Compounds having Si-O-C linkages
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pyrane Compounds (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Catalysts (AREA)
- Epoxy Compounds (AREA)
Abstract
本发明提供用Ⅰ式的酰卤:生产Ⅱ式的δ-内酯的新方法:其中R1、R2、R3和X如本文所述,以及新的中间体。特别地,本发明提供对映体有择地生产δ-内酯的方法。
Description
本发明涉及3,6-二烷基-5,6-二氢-4-羟基-吡喃-2-酮的生产方法。特别地,本发明涉及生产上述化合物的对映体有择方法。
δ-内酯如3,6-二烷基-5,6-二氢-4-羟基-吡喃-2-酮可用作制备各种精细化工和药学活性化合物的中间体。例如,5,6-二氢-3-己基-4-羟基-6-十一烷基-吡喃-2-酮是已知的制备氧杂环丁烷酮化合物如四氢里卜斯他丁(tetrahydrolipstatin)(奥利司他(orlistat))的前体。例如参见,均授予Karpf等的美国专利5,245,056和5,399,720和均授予Ramig等的美国专利5,274,143和5,420,305。
四氢里卜斯他丁的其它制备方法是用β-羟基酯,如3-羟基十四酸甲酯为中间体。例如参见,Pommier等,《合成》(Synthesis),1994,1294-1300,Case-Green等,《合成通信》(Synlett.),1991,781-782,Schmid等,《欧洲’94手性会议论文集》(Proceeding of the Chiral Europe’94Symposium),9月19-20,1994,Nice,France,及上述的美国专利。一些制备氧杂环丁烷酮的方法,例如公开于上述授予Karpf等的美国专利公开的方法,是用β-羟基酯作中间体制备用于氧杂环丁烷酮合成的δ-内酯。
分子的立体化学对于分子的多种特性是非常重要的。例如,已知具有一个或多个手性中心,即立体化学中心的药物的生理特性依赖于药物的手性中心的立体化学。因此,能够控制化学反应的立体化学比较有利。
很多氧杂环丁烷酮,如四氢里卜斯他丁,含有一个或多个手性中心。用于四氢里卜斯他丁合成的中间体δ-内酯和β-羟基酯含有一个或多个手性中心。这些中间体的合成,例如公开于上述授予Karpf等的美国专利中的方法,得到的是外消旋混合物,再通过随后的拆分步骤来分离所需的异构体。其它方法是通过对映体有择地还原相应的β-酮酯来不对称合成β-羟基酯。
而且,为了高收率地得到所需产品,现有的还原3-氧代-十四酸甲酯的不对称氢化法需要极纯的反应条件,如氢气的纯度至少为99.99%,因此进一步提高了β-羟基酯的生产成本。
所以,需要一种生产δ-内酯的方法。并且需要一种在不需要极纯的反应条件或高氢气压力下对映体有择还原β-酮酯的方法。
然后除去保护基R3和R6中的至少一个;再将产物与酸接触得到所δ-内酯,或
然后将所述δ-羟基-保护的-β-烯醇醚酯用酸处理得到所述δ-内酯,
其中在上述结构式中
R1是C1-C20烷基;
R2是H或C1-C10烷基;
R3是羟基保护基
在式(Ⅲ)和(Ⅳ)中的R4和R5独立地是C1-C6烷基、C5-C20芳基、C6-C20芳烷基或-SiR8R9R10,其中R8、R9、R10独立地是C1-C6烷基或苯基;
在式(Ⅴ)和(Ⅵ)中的R5是C1-C6烷基、C5-C20芳基、或C6-C20芳烷基;
R5是C1-C6烷基、C5-C20芳基、或C6-C20芳烷基;
R6是H或R4;
R7是H或R3,以及
X是卤素。
此处所用术语“处理”、“接触”或“反应”是指将两种或多种反应剂在适宜的反应条件下加入或混合以生产所指出和/或所需的产品。应该理解的是生产所指出和/或所需产品的反应不必是由最初加入的两种反应剂的组合直接得到的,即可以存在一个或多个中间体,所述中间体是在混合物中产生的且最终导致所指出和/或所需产品的形成。
术语“烷基”是指直链或支链的脂族烃。烷基任选可以被一个或多个取代基,如卤素,链烯基,炔基,芳基,羟基、氨基,硫代,烷氧基,羧基,氧代或环烷基取代。可以任选在烷基中插入一个或多个氧原子、硫原子或取代或未取代的氮原子。烷基的实例包括甲基,乙基,异丙基,正丁基,叔丁基,氟甲基,二氟甲基,三氟甲基,氯甲基,三氯甲基,戊基,己基,庚基,辛基,癸基和十一烷基。
术语“芳基”是指单环或双环碳环或杂环芳香环部分。芳基可以被一个或多个取代基,例如卤素,链烯基,烷基,炔基,羟基,氨基,硫代、烷氧基或环烷基取代。芳基的实例包括苯基,甲苯基(toluyl),吡咯基,噻吩基,呋喃基,咪唑基,吡唑基,1,2,4-三唑基,吡啶基,吡嗪基,嘧啶基,哒嗪基,噻唑基,异噻唑基,噁唑基和异噁唑基。
因此,任何有关式Ⅰ或Ⅶ的δ-内酯均暗示分别包括式ⅠC或ⅠD的互变异构体。
在本发明的优选方案中,R1是十一烷基,R2是己基,R3是式-SiR11R12R13部分,其中R11,R12和R13独立地为C1-C6烷基或苯基,X是氯,R5是C1-C6烷基,R4和R6各是式-SiR8R9R10部分且R7是H。
然后除去保护基R3和R6中的至少一个,并将所得产品与酸接触得到δ-内酯,
其中在上述结构式中
R1是C1-C20烷基;R2是H或C1-C10烷基;R3是羟基保护基;R4和R5各独立地是C1-C6烷基、C5-C20芳基、C6-C20芳烷基或-SiR8R9R10;R6是H或R4;R8,R9,R10各独立地是C1-C6烷基或苯基;和X是卤素。
然后将δ-羟基-保护的-β-烯醇醚酯用酸处理得到δ-内酯,其中R1、R2、R3、R5和X定义如上,和R7是H或R3。
优选地,本发明方法提供δ-内酯的对映体有择合成。
其中R1,R2,R3和R5定义如上。
本发明进一步的方案是指生产所述酰卤的步骤,其中所述酰卤的生产步骤包括
和
(ⅱ)将所述β-羟基-保护的酯用酰卤化剂处理得到所述酰卤,其中R14是H、R3或羧酸盐抗衡阳离子。在该方法中各R3和R14可以是式-SiR15R16R17部分,其中R15、R16、R17独立地是C1-C6烷基或苯基。该方法可以进一步包括所述β-羟基酸的对映体有择生产步骤,其中所述β-羟基酸生产步骤包括:
(A)对映体有择还原下式的β-酮酯:从而对映体有择地生产下式的β-羟基酯:其中R18是C1-C6烷基、C6-C20芳基或C6-C20芳烷基;和(B)将所述β-羟基酯皂化得到所述β-羟基酸。所得δ-内酯优选具有如下立体化学构型:
其中所述方法生产的所述δ-内酯对映体过量至少约90%。
在本发明的优选方案中,所述对映体有择还原β-酮酯的步骤包括在氢化催化剂存在下氢化所述β-酮酯。适宜的氢化催化剂描述如下或可以选自表2中所示的催化剂。优选地,所述氢化催化剂是式RuCl2((R)-MeOBIPHEP)化合物。氢化催化剂可以是通过将式Ru(OAc)2((R)-MeOBIPHEP)的二乙酸钌化合物与卤化物源接触产生的产品。所述卤化物源与所述二乙酸钌的摩尔比至少约为20∶1。优选的上述定义的对映体有择制备下式的β-羟基酯的方法:包括将下式的β-酮酯:
在约40巴或更低的氢气压力和包括卤化物和手性取代的联苯基膦(phosphorous)配体的钌氢化催化剂存在下氢化,其中R1是C1-C20烷基,和R18是H或C1-C6烷基,C5-C20芳基或C6-C20芳烷基。在该方法中可以使用工业纯的氢气。在上述方法中,R1优选为十一烷基和R18优选为C1-C6烷基。氢化催化剂可以选自上述的催化剂。
本发明进一步优选的方案是式(Ⅶ)的δ-内酯的对映体有择生产方法:
所述方法包括
(b)将所述δ-甲硅烷氧基-β-甲硅烷基烯醇醚酯用碱处理以除去至少一个甲硅烷基;和
(c)将所述步骤(b)的产品与酸,例如盐酸接触得到所述δ-内酯,
其中R1是C11R23,R2是C6H13,R5是C1-C6烷基,C5-C20芳基或C6-C20芳烷基;和R8,R9,R10,R11,R12和R13各独立地为C1-C6烷基或苯基。所述方法生产的δ-内酯对映体过量至少约90%。R5优选为C1-C6烷基。在更优选的方案中,步骤(b)包括将所述δ-甲硅烷氧基-β-甲硅烷基烯醇醚酯用选自氢氧化物和碳酸盐的碱处理以除去两个甲硅烷基。更优选的是所述步骤(b)包括将所述δ-甲硅烷氧基-β-甲硅烷基烯醇醚酯用碳酸氢盐处理得到下式的δ-甲硅烷氧基-β-酮酯:
相应的酰卤可通过下述方法生产:
和
(ⅱ)将所述的β-甲硅烷氧基十四烷酸甲硅烷基酯与酰卤化剂,如亚硫酰氯接触,得到所述酰卤。
优选地,R11、R12和R13是甲基且所述甲硅烷基化试剂选自三甲基甲硅烷基氯和六甲基二硅氮烷。
上述方法可以进一步包括生产所述(R)-3-羟基十四烷酸的步骤,其中所述(R)-3-羟基十四烷酸的生产步骤包括:(A)对映体有择地还原下式的β-酮酯从而得到下式的β-羟基酯其中R18是C1-C6烷基、C5-C20芳基或C6-C20芳烷基;和(B)皂化所述β-羟基酯生产所述(R)-3-羟基十四烷酸。
所述β-酮酯的对映体有择还原步骤包括在上述氢化催化剂存在下氢化所述β-酮酯。
以及(b)将所述的δ-羟基-β-酮酯与酸接触生产所述δ-内酯,其中R1是C11H23,R2是C6H13,R5是C1-C6烷基,C5-C20芳基或C6-C20芳烷基;和R11,R12和R13各独立地为C1-C6烷基或苯基。
该方法生产的所述δ-内酯的对映过量至少为约90%。优选地R5为C1-C6烷基,所述酸是盐酸。酰卤可如上述方法生产。
然后b)在碱性条件下进行开环反应并分离对映体得到式(Ⅸ)化合物
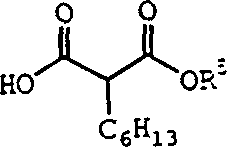
其中R1和R2定义如上。用于制备四氢里卜斯他丁(奥利司他),R1是C11H13和R2是C6H13(如美国专利5,399,720所述)。
本发明的进一步方案提供选自下列的化合物a)下式的β-甲硅烷氧基酰卤:b)下式的δ-甲硅烷氧基-β-甲硅烷基烯醇醚酯:和c)下式的δ-甲硅烷氧基-β-酮酯:其中R1是C1-C20烷基;R2是H或C1-C10烷基;R5是C1-C6烷基、C5-C20芳基或C6-C20芳烷基;各个R8、R9、R10、R11、R12和R13独立地是C1-C6烷基或苯基;而X是卤素。优选的化合物是(R)-3-三甲基甲硅烷氧基十四碳酰氯、(R)-3,5-双-(三甲基甲硅烷基)-2-己基-3-十六烯酸甲酯、(R)-3,5-双-(三甲基甲硅烷氧基)-2-己基-3-十六烯酸乙酯、(5R)-5-(三甲基甲硅烷氧基)-2-己基-3-氧代-十六酸甲酯和(5R)-5-(三甲基甲硅烷氧基)-2-己基-3-氧代-十六烷酸乙酯。
本发明进一步的方案是所述方法在制备四氢里卜斯他丁(奥利司他)上的应用。本发明也包括通过所述任何方法制备的化合物。
其中R1是C1-C20烷基;R2是H或C1-C10烷基;R3是羟基保护基;R4和R5各自独立地是C1-C6烷基、C5-C20芳基、C5-C20芳烷基或-SiR8R9R10;R6是H或R4;R8、R9、R10各自独立地是C1-C6烷基或苯基;和X是卤素。
本发明将参考对映体富含的δ-内酯Ⅶ的合成来详细说明。可以理解的是外消旋体形式的δ-内酯Ⅶ或具有在本文未详细讨论的与式ⅠA相反的立体化学构型的δ-内酯,可以根据本发明方法通过分别使用外消旋混合物或相反立体化学构型的原料而容易地制备。
其中R1和R2分别定义如上;R3是羟基保护基;R4和R5各自独立地是C1-C6烷基、C5-C20芳基(优选C6-C20芳基)、C6-C20芳烷基(优选C7-C20芳烷基)或式-SiR8R9R10部分;R6是H或R4;X是卤素,优选为氯;R8、R9、R10各自独立地是C1-C6烷基或苯基。
各种保护基,包括羟基和羧酸官能团的保护基是现有技术已知的,并且可以使用。多种可能的保护基的实例可以参见《有机合成中的保护基》(ProtectiveGroups in Organi Synthesis),第3版,T.W.Greene和P.G.M.Wuts,JohnWiley&Sons纽约,1999,该文献插入此引作参考。
对于上述化合物(式Ⅰ、Ⅶ、ⅠC、ⅠD、Ⅱa、Ⅲ、Ⅳa):优选地,R1是十一烷基,R2优选是C1-C10烷基,更优选为己基。优选地,R3是式-SiR11R12R13部分,其中R11、R12和R13各自独立地是C1-C6烷基或苯基,更优选各R11、R12和R13独立地为甲基、异丙基、叔丁基或苯基。更优选R3是式-Si(CH3)3部分。优选地,R4是式-SiR8R9R10部分,各R8、R9和R10独立地为甲基、异丙基、叔丁基或苯基。更优选R4是式-Si(CH3)3部分。优选地,R5是C1-C6烷基、C5-C20芳基或C6-C20芳烷基。更优选R5是C1-C6烷基。且更优选R5是甲基或乙基。优选地,式Ⅳa化合物的R6与式Ⅳ化合物的R4相同,特别是当R4是式-SiR8R9R10部分时。
本发明方法也包括在足够的反应条件下处理δ-羟基-保护的-β-烯醇醚酯Ⅳa以除去至少一个保护基(即R3和/或R6,优选至少R6)并将所得脱保护的化合物与酸接触产生δ-内酯Ⅶ。
特别有用的乙烯酮缩二醇Ⅲ是其中R4为式-SiR8R9R10部分和R5是C1-C6烷基、C5-C20芳基或C6-C20芳烷基的甲硅烷基乙烯酮缩二醇。甲硅烷基乙烯酮可以容易地由现有技术已知的任何方法制备。用于制备甲硅烷基乙烯酮的方法公开于Miura等Bull.Chll.Soc.Jpn.,1991,64,1542-1553;Umemoto和Gotoh,Bull.Chem.Soc.Jpn.,1987,60,3823-3825;Sugimoto等Chem.Lett.,1991,1319-1322;Miura等Bull.Chem.Soc.Jpn.,1992,65,1513-1521;和Shono等,J.Org.Chem.,1984,49,1056-1059,这些文献插入此引作参考。
甲硅烷基乙烯酮缩二醇Ⅲ可以从相应的酯制备(即式R2-CH2-C(=O)OR5化合物),通过用强碱(如六甲基二硅氮烷化锂(LiHMDS)、二烷基氨化物,如二异丙基氨化锂和四甲基哌啶锂(LiTMP))在常规非质子性有机溶剂(如四氢呋喃(THE)、己烷、二甲氧基乙烷(DME)、乙醚或其混合物)存在下处理该酯,产生烯醇化物并将烯醇化物用包括三氟甲磺酸甲硅烷基酯和甲硅烷基卤,如甲硅烷基氯,如三甲基甲硅烷基氯的甲硅烷基化试剂捕获(即接触)。二烷基氨化物可以通过将相应的二烷基胺用强碱例如烷基锂(如丁基锂)在上述常规非质子性有机溶剂中处理而制备。甲硅烷基乙烯酮缩二醇Ⅲ的制备通常优选在惰性气氛如氮气,氩气,氦气等中,在优选低于0℃的温度,更优选低于-30℃,和最优选低于-78℃的温度下进行。甲硅烷基乙烯酮缩二醇Ⅲ可以通过如减压蒸馏纯化。当R2是C1-C10烷基而R4和R5不同时,所得的甲硅烷基乙烯酮缩二醇Ⅲ可以有两种不同的几何异构体,即E-或Z-式双键构型。应该理解的是由于含有R2的δ-内酯Ⅶ的碳原子不是手性中心(或因为其可容易地异构化而使得手性不显著),甲硅烷基乙烯酮缩二醇的几何异构体对于本发明的对映有择方法并不重要。
在本发明的一个具体方案中,其中R6是R4的δ-羟基-保护的-β-烯醇醚酯Ⅴ可以通过将上述甲硅烷基乙烯酮缩二醇Ⅲ与其中R3是式-SiR11R12R13的酰卤Ⅲ反应而制备。该反应典型地在常规非质子性有机溶剂,如THF、甲苯庚烷、己烷或其混合物中,在包括三烷基胺,如三乙胺或三丁胺的叔胺存在下,优选在上述惰性气氛中进行。优选地,反应温度为约0℃至约25℃。
可以将粗品δ-羟基-保护的-β-烯醇醚酯Ⅳ纯化,如通过减压蒸馏或通过色谱法,或不需纯化而直接用于下步中。如此处所用“粗品”化合物是指在反应后的常规处理后未进行分离纯化的化合物。
所得δ-羟基-保护的-β-烯醇醚酯Ⅴ,特别是其中R3和R6分别是式-SiR11R12R13和-SiR8R9R10部分的化合物可以在酸性或碱性条件下,优选在碱性条件下进行选择性单脱甲硅烷基化得到下式的δ-甲硅烷氧基-β-酮酯:对于碱性单脱甲硅烷基化条件,典型地可使用叔胺包括三烷基胺,如三乙胺或优选三丁胺;或碳酸氢盐,如碳酸氢钾、碳酸氢锂或优选碳酸氢钠。单脱甲硅烷基化反应可以在质子性溶剂,如烷基醇(如甲醇、乙醇和异丙醇),或非质子性有机溶剂和质子性溶剂(如烷基醇或水)的混合物中进行。可用于单脱甲硅烷基化反应中的非质子性有机溶剂的实例包括二氯甲烷、二甲基甲酰胺(DMF)、二甲亚砜(DMSO)、THF和乙醚。优选地,单脱甲硅烷基化反应在烷基醇溶剂,优选在甲醇中进行。单脱甲硅烷基化反应温度优选为约0℃至约25℃。
δ-甲硅烷氧基-β-酮酯Ⅵa可以进一步在酸性或碱性条件下,优选在酸性条件下脱甲硅烷基,并成环得到δ-内酯Ⅶ。羟基的脱甲硅烷基化是本领域技术人员熟知的并公开于上述的《有机合成中的保护基》(Protective Groupin Organic Synthesis)。对于酸性脱甲硅烷基化条件,典型地可使用酸如盐酸,硫酸,磷酸,乙酸,或三氟乙酸。δ-甲硅烷氧基-β-酮酯Ⅵa在酸性条件下脱甲硅烷基化导致迅速环化得到δ-内酯Ⅶ,从而不需要单独的成环步骤。
或者,δ-内酯Ⅶ可以通过在单个步骤中从δ-羟基-保护的-β-烯醇醚酯Ⅳa除去两个保护基(R3和R6)并将所得脱保护产物与酸在足够生产δ-内酯Ⅶ的条件下接触来制备。如此处所用,术语“单个步骤”是指在相同的反应条件下除去两个保护基R3和R6。在本发明的一个具体方案中,其中δ-羟基-保护的-β-烯醇醚酯Ⅳa的R3和R6分别是式-SiR11R12R13和-SiR8R9R10部分,优选两个甲硅烷基在碱性条件下的单个步骤中除去,典型地可使用氢氧化物或优选使用碳酸盐。可用于本发明的氢氧化物的实例包括氢氧化钠,氢氧化钾,氢氧化锂,氢氧化钙和氢氧化镁。用于本发明的碳酸盐的实例包括碳酸钾,碳酸锂,碳酸钠和碳酸铯。优选的碳酸盐是碳酸钾。除去两个甲硅烷基的单个步骤可以在与上述单脱甲硅烷基化溶剂相同的溶剂中进行。单一步骤的脱甲硅烷基化和随后产生δ-内酯Ⅶ的反应温度范围优选为约0℃至约25℃。
典型地,δ-内酯Ⅶ可以通过将反应混合物的pH值从约pH3调节至约pH5来生产。可以使用任何可以给上述反应混合物提供上述pH范围的酸,例如酸包括但不限于盐酸、硫酸和磷酸。在本发明的一个具体方案中,使用盐酸生产δ-内酯。δ-内酯Ⅶ典型地从反应混合物中沉淀,如当用甲醇作溶剂时。δ-内酯Ⅶ可以进一步纯化,如通过重结晶,得到高纯度和/或更高对映体过量的δ-内酯Ⅶ。
其中R1、R2和R5定义如上,且R7是H或R3。优选R7为H。
本发明方法也包括将δ-羟基-β-酮酯Ⅵa与碱成优选与酸在足够生产上述的δ-内酯Ⅶ的条件下接触。
酰卤Ⅱa和丙二酸半酸酯Ⅴ之间的反应典型地在金属配位剂和叔胺碱存在下进行。例如参见,Rathke和Cowan,J.Org.Chem.,1985,50,2622-2624,和Clay等Synthesis,1993,290-292,它们的全文插入此引作参考。反应可以在非质子性有机溶剂,如正丁基醚,THF,乙腈,二氯甲烷,二甲氧基乙烷(DME),甲基叔丁基醚(MTBE),甲苯,2-甲基四氢呋喃(2-Me-THF)中进行,THF为优选溶剂。
不打算受任何理论束缚,相信用金属配位剂产生丙二酸半酸酯Ⅶ的金属烯醇化物,而该烯醇化物有足够的活性与酰卤Ⅲ反应,但是碱性并不足以使最初形成的含酸性质子的产物脱质子。
一般地,酰卤Ⅱa和丙二酸半酸酯Ⅴ之间的反应通过将酰卤Ⅲ,优选以溶液的形式加入含有丙二酸半酸酯Ⅶ、金属配位剂和叔胺碱的溶液混合物中而进行。可以通过使用相对于丙二酸半酸酯Ⅶ用量至少约2当量相对非亲核碱。如叔胺和至少1当量金属配位剂得到高收率的δ-羟基-β-酮酯Ⅵa。
金属配位剂的实例包括镁盐,包括卤化镁,如MgCl2、MgBr2和MgI2;锰盐,如卤化锰和乙酸锰;锂盐,如卤化锂;钐盐,如卤化钐;钠和锂盐混合物,如卤化钠和卤化锂的混合物。优选地,金属配位剂是镁盐,更优选氯化镁。
可用于本发明中的叔胺碱的实例包括三烷基胺,如三乙胺、二乙基异丙基胺和三丁基胺;和其它叔胺。优选地,叔胺碱是三烷基胺,更优选三乙胺、二乙基异丙基胺或三丁基胺。
典型地,酰卤Ⅱa和丙二酸半酸酯Ⅴ之间的反应在约0℃至约35℃的温度下,优选在上述惰性气氛下进行。优选地,反应在约25℃进行。
所得δ-羟基-β-酮酯Ⅵa可以分离或优选不经分离直接使用并在足够得到δ-内酯Ⅶ的条件下用酸处理。例如,在酰卤Ⅱa与丙二酸半酯Ⅶ反应后,将上述酸加入所得反应混合物中,形成δ-内酯Ⅶ。
优选地,丙二酸半酸烷基酯Ⅴ是丙二酸半酸甲酯Ⅶ,其中R5是甲基,用δ-羟基-β-酮酯Ⅵa甲酯生产δ-内酯Ⅶ比其它丙二酸半酸酯Ⅴ在相同的反应条件和时间内有更高的收率。由于用丙二酸半酸甲酯Ⅴ可以获得高收率,可以将丙二酸半酸酯Ⅴ的非甲基酯转化成丙二酸半酸的甲基酯Ⅶ,然后丙二酸半酸Ⅴ的甲基酯与酰卤Ⅱa反应生产δ-内酯Ⅶ。例如,可以使丙二酸半酸乙酯Ⅶ(其中R5是乙基)与金属甲醇化物,如甲醇钠在甲醇中于足够的反应条件下反应,以从丙二酸半酸乙酯Ⅶ生产丙二酸半酸甲酯Ⅴ,然后将所得丙二酸半酸甲酯Ⅴ与酰卤Ⅱa反应生产δ-内酯Ⅶ。
或者,可以将丙二酸半酸非甲基酯Ⅴ与酰卤Ⅱa之间的反应产物在与酸接触之前或优选在环化步骤中原地转化为其相应的δ-羟基-β-酮甲基酯Ⅵa,从而生产δ-内酯Ⅶ。
其中R2不是H的丙二酸半酸酯Ⅶ可以通过多种方法制备。例如,丙二酸半酸酯可以通过下列方法制备:将丙二酸二酯,如R5OC(=O)CH2C(=O)OR5用碱(如乙醇钠)处理得到相应的烯醇盐,再将烯醇盐与带有离去基、如甲磺酰氧基,甲苯磺酰氧基和卤素(如溴和碘)的烷基化试剂接触得到丙二酸二烷基酯,即R5OC(=O)CH(R2)C(=O)OR5。将丙二酸二烷基酯单皂化,典型地用少于大约1当量,优选约0.9当量氢氧化物在相应的R5醇溶剂中皂化得到丙二酸半酸酯Ⅶ,例如用氢氧化物,如氢氧化钾、氢氧化钠或氢氧化锂,在甲醇(当R5为甲基时)或乙醇(当R5为乙基时)中处理。
并将β-羟基-保护的酯Ⅹa与酰卤化试剂在足够生产其中R1和R3定义如上和R14是H、R3或羧酸盐抗衡阳离子的酰卤Ⅲ的条件下接触。此处所用术语“羧酸盐抗衡阳离子”指式Xa羧酸盐的抗衡阳离子。羧酸盐抗衡阳离子包括金属阳离子,如钠,锂和钾;铵;单-,二-,三-和四-烷基铵;吡啶鎓;和其它本领域技术人员已知的合适的羧酸阴离子的抗衡阳离子。
在本发明一个具体方案中,酰卤Iia如下生产:通过使β-羟基酸Ⅸa与甲硅烷基化试剂接触生产下式的β-甲硅烷氧基甲硅烷酯:
并将β-甲硅烷氧基甲硅烷酯Ⅺa与其中R11、R12和R13定义如上的酰卤化试剂接触。任何现有技术中已知的羟基甲硅烷基化试剂均可用β-甲硅烷氧基甲硅烷酯Ⅺ的生产。甲硅烷基化试剂的实例包括式X1-SiR11R12R13的化合物,其中R11,R12和R13定义如上和X1是卤素或三氟甲磺酸基;和六甲基二硅氮烷(当R11,R12和R13是甲基时)。
例如,其中R11,R12和R13是甲基的化合物Ⅺ的β-三甲基甲硅烷氧基三甲基甲硅烷基酯可以通过将β-羟基酸在吡啶存在下,优选在上述惰性气氛中用三甲基氯硅烷(TMSCl)处理而制备。反应优选在非质子性溶剂如二氯甲烷,MTBE,甲苯和THF,特别优选THF中进行。反应温度范围通常为约0℃至约25℃,优选的反应温度是约25℃。反应也可以包括4-二甲基氨基吡啶(DMAP)或其它本领域技术人员已知的甲硅烷基化催化剂。当使用甲硅烷基化催化剂如DMAP时,典型地其使用量是约1摩尔%。当不存在甲硅烷基化催化剂时,甲硅烷基化典型地在几小时内完成,通常在室温下约2小时内完成。
或者,β-三甲基甲硅烷氧基三甲基甲硅烷基酯Ⅺa可以用六甲基二硅氮烷(HMDS)制备。例如,将β-羟基酸Ⅸa和HMDS在非质子性有机溶剂,如甲苯或优选THF中的混合物加热生产β-三甲基甲硅烷氧基三甲基甲硅烷基酯Ⅺ。当使用HMDS时,反应的副产物是氨。它可以容易地通过在大气压下分部蒸馏反应溶剂而除去。所得的部分浓缩的β-三甲基甲硅烷氧基三甲基甲硅烷基酯Ⅺa溶液可以不经纯化而直接用于酰卤Ⅱa的生产步骤。
各种酰卤化试剂是本领域技术人员已知的。酰卤化试剂的实例和它们的一般使用方法公开于,例如“Comprehensive Organic Synthesis”第6卷,Trost,Fleming和Winterfeldt编辑,Pergamon出版社,1991,301-319页,和“The Chemistry of Acyl Halides”Patai编辑,Interscience出版社,1972,35-64页,将其全文插入此引作参考。本发明者发现,β-羟基保护的酯Ⅹ,特别是β-三甲基甲硅烷氧基三甲基甲硅烷基酯Ⅺ,可以使用草酰氯或亚硫酰氯在非质子性有机溶剂,如甲苯或优选THF中容易地转化为酰卤Ⅱa。
当用草酰氯作酰卤化试剂时,典型地可以使用吡啶和催化量的甲硅烷基化催化剂如DMF。但是,当用亚硫酰氯代替草酰氯作酰卤化试剂时,不需要使用甲硅烷基化催化剂如DMF。在任一情况下,酰卤化反应中吡啶鎓盐的形成会使乙烯酮缩二醇Ⅲ和酰卤Ⅲ之间的反应变复杂,典型地需要将吡啶鎓盐从反应混合物中例如通过过滤除去,以避免乙烯酮缩二醇Ⅲ和酰卤Ⅲ之间的反应的复杂化。将所得反应混合物进一步例如通过蒸馏浓缩,除去至少一部分残余的TMSCl,亚硫酰氯和THF。蒸馏通常在减压下在约0℃进行。
本发明者发现在THF中当用HMDS作为β-羟基酸Ⅸa的甲硅烷基化试剂时,后续的用亚硫酰氯在THF中于约0℃下进行的酰卤化反应缓慢并且在较高温度下收率低但是,吡啶鎓盐,例如盐酸吡啶鎓,吡啶或DMAP的存在可增加反应速率并且提高所需酰卤Ⅲ的收率。因此,当用HMDS作甲硅烷基化试剂时,典型地在随后的酰卤化反应中加入吡啶。吡啶的加入量通常从约1摩尔%至约10摩尔%,并且优选2摩尔%。酰卤化反应的反应温典型地为约0℃。
通过对映体有择地还原β-酮酯Ⅻ的酮羰基并将酯基皂化生产β-羟基酸Ⅸa,其中R1定义如上和R18是C1-C6烷基、C5-C20芳基或C6-C20芳烷基。优选R18是C1-C6基,更优选甲基或乙基。
在本发明的一个具体方案中,对映体有择制备-羟基酯Ⅸa包括在手性氢化催化剂存在下氢化β-酮酯Ⅻ。可以理解非手性氢化催化剂将得到β-羟基酯Ⅸa的外消旋混合物,且具有与下述构型相反构型的手性氢化催化剂将得到具有与图Ⅸa所示相反的构型。特别地,本发明提供用对映体富含的氢化催化剂,即具有大于约97%的对映体过量(%ee)的氢化催化剂对映有择地还原β-酮酯Ⅻ的方法。
其中X2是卤素,如碘,溴或优选氯。和各R19和R20独立地为H,C1-C6烷基或C1-C6烷氧基,条件是R19和R20至少一个不为H。而且,各苯基可以含有多于一个的R19或R20基团。
而且,联苯基部分的一个苯基或两个苯基都可以被其它芳香基团如萘基、吡啶基或其它取代芳基替换。
一种可用于本发明中的氢化催化剂是通过将式Ru(OAc)2((R)-MeOBIPHEP)的二乙酸钌与卤化物源,如碱金属卤化物(如LiX,NaX,KX和CsX,其中X是卤素)或卤化氢(如HX,其中X是卤素),优选盐酸接触所得的产物,其中Ru(OAc)2((R)-MeOBIPHEP)是下式化合物:
不打算被任何理论束缚,可以认为Ru(OAc)2((R)-MeOBIPHEP)用盐酸处理导致两个OAc被氯替换;因此,所得产物可认为是Ru(Cl)2((R)-MeOBIPHEP)。但是,有趣的是,当将Ru(OAc)2((R)-MeOBIPHEP)用少于2当量的HCl处理时,所得氢化催化剂不生产高对映体过量的产物(R)-3-羟基酯Ⅸa。令人惊讶和出乎意料的是,在某些情况下这种氢化催化剂占主导地位的产物是(S)-3-羟基酯。但是,当至少将5当量,优选至少10当量,更优选至少20当量HCl加入Ru(OAc)2((R)-MeOBIPHEP)中时,所得氢化催化剂对映体有择地还原β-酮酯Ⅻ得到相应的(3R)-3-羟基酯。
本发明手性氢化催化剂的前体,即二羧酸二膦合钌化合物或[Ru(OC(=O)R’)2(二膦)],可以根据下述反应流程制备:
以这种方式可以制备多种手性二羧酸二膦合钌化物,包括实施例16中所列的那些。制备二羧酸二膦合钌化合物的方法通常包括将可商购或优选根据Albers等(《无机合成》(Inorg.Synth.),1989,26,68)所述方法制备的[RuCl2(COD)]n,与羧酸盐和相应羧酸的混合物,即MOC(=O)R’和HOC(=O)R’的混合物,如乙酸钠/乙酸混合物和新戊酸钠/新戊酸混合物在非质子性有机溶剂,优选甲苯中接触。将混合物在约80℃至约120℃,优选约100℃下加热。典型的反应时间是从约15小时至约72小时,优选从约20小时至约48小时。羧酸盐的用量是约2当量至约50当量,优选约2当量至约25当量,更优选约2.1当量至约10当量,最优选2.5当量。优选相对于二膦化合物使用稍过量的[RuCl2(COD)]n,以确保二膦化合物转化完全。
当使用商购的[RuCl2(COD)]n配合物时,可以发现由三氯化钌新制备的[RuCl2(COD)]n配合物反应时间更短、重复性更好和/或二羧酸二膦合钌化合物的收率更高。以这种方式,可以从便宜的和容易获得的三氯化钌经一锅法合成二羧酸二膦合钌化合物。
β-羟基化合物(如(3R)-3-羟基化合物)Ⅸa可以进一步纯化,即对映体富集,通过将最初的产物重结晶得到至少99%ee的产品。因此,可以理解,根据具体的手性氢化催化剂的成本,使用可以提供低于约95%ee的β-羟基化合物Ⅸa的氢化催化剂可以更经济,并可以通过重结晶进一步进行对映体富集。
不象目前所用的以钌为基础的用于3-氧代十四烷酸甲酯的不对称还原的氢化催化剂,本发明的氢化催化剂不需要高纯度条件(如氢气的纯度至少99.99%)就能高收率和高对映体过量地生产3-羟基十四烷酸甲酯。事实上,3-氧代十四烷酸甲酯在工业级条件下,如约99.5%的氢气纯度和约99.5%的氮气纯度下的不对称氢化,用本发明的氢化催化剂可以具有与需要高纯度反应条件的现有技术几乎相同的速率。而且,本发明的氢化催化剂允许在更低的氢气压力下进行,因此降低了最初的投资成本并降低了与高氢气压反应条件相关的危险。此外,通过使用上述不对称氢化方法,本发明可以不需要分离任何外消旋中间体而不对称地合成δ-内酯Ⅶ。
典型地,β-酮酯Ⅻ,如3-氧代十四烷酸甲酯的氢化可以在常规氢化溶剂(包括烷基醇,如乙醇或优选在甲醇)中,在约80℃的反应温度下进行。氢化反应中底物(即β-酮酯Ⅻ)的浓度通常为约40wt%,氢化催化剂中HCl和Ru(OAc)2((R)-MeOBIPHEP)的比例为约20∶1.3-氧代十四烷酸甲酯和氢化催化剂的典型比例为约50,000∶1。在该反应混合物中,典型地加入约40巴工业级的氢气,反应进行约4小时。然后所得(R)-3-羟基十四烷酸甲酯通过在甲醇和28%氢氧化钠水溶液中稀释粗品氢化溶液于室温下皂化。然后将皂化产物用酸,例如硫酸酸化以分离(R)-3-羟基十四烷酸。以这种方式,β-羟基酸Ⅲ,例如(R)-3-羟基十四烷酸可以以至少约90%分离收率从相应的β-酮酯Ⅻ生产,更优选约93%分离收率,最优选至少约95%分离收率。产物的对映过量至少约90%ee,优选约95%ee,和更优选99%ee。对映过量可以在一次重结晶后增加到至少约95%ee,优选至少约99%ee,最优选至少约99.5%ee。
β-酮酯Ⅻ可以容易地通过各种已知方法制备。例如参见,Case-Green,《合成通信》(Synlett),1991,781-782和授予Sotoguchi等的美国专利5,945,559,将其全文插入此引作参考。
δ-内酯Ⅶ可以如下制备:将下式的2-烷基乙酰乙酸酯:
用酰卤Ⅱa处理并将所得产物与碱或优选与酸,例如上述的酸在足够生产δ-内酯Ⅶ的条件下接触,其中R2和R5定义如上。
不受任何理论束缚,可以确信2-烷基-乙酰乙酸酯ⅩⅢ和酰卤Ⅱa之间的反应产生下式的β-乙酰基-β-酮酯初产物:其中R1,R3和R5定义如上且R2是C1-C10烷基。将α-乙酰基-β-酮酯ⅩⅣ在碱性或优选在酸性条件下进行溶剂解如甲醇解(即与甲醇接触)除去酰基得到δ-羟基-β-酮酯Ⅷ,其中R7是R3,然后可以将其用于生产上述的δ-内酯Ⅶ。从乙酰乙酸甲酯制备β-酮酯的方法公开于授予Sotokuchi等的日本专利10-53561中,将其全文插入此引作参考。
2-烷基乙酰乙酸酯ⅩⅢ可以通过将乙酰乙酸酯与碱。例如氧化钙或氢氧化钙典型地在回流的甲苯中接触形成乙酰乙酸酯的烯醇化物,然后将烯醇化物与酰卤Ⅲ反应而制备。
或者,δ-羟基-β-酮酯Ⅵa(其中R2是C1-C10烷基,优选己基),和最后的δ-内酯Ⅶ可以通过将乙酰乙酸酯(化合物ⅩⅢ,其中R2是H)与上述的酰氯Ⅱa反应,最初生产δ-羟基-β-酮酯Ⅵa(其中R2是H)。其中R2是H的δ-羟基-β-酮酯Ⅷ可以用碱去质子化生产第二个可以与含有离去基团的烷基(如上所述的那些,例如己基溴)反应的烯醇化物,从而得到δ-羟基-β-酮酯Ⅵa(其中R2是C1-C10烷基,如己基)。在生产第二个烯醇化物时,可以用反向加入法,即将δ-羟基-β-酮酯Ⅵa(其中R2是H)加入含有碱的溶液中,例如可以降低在常规加入步骤(即将碱加入δ-羟基-β-酮酯Ⅷ溶液中)中产生的消除产物的量。
在审阅了下列并不限定本发明的实施例的基础上,本发明的其它目的,优点和新颖性对于本领域普通技术人员来说是显而易见的。
实施例
实施例1
本实施例说明1-甲氧基-1-三甲基甲硅烷氧基-1-辛烯的制备方法。
在1000-mL的3-颈烧瓶上配置具有隔片/热电偶和氮气接头的克莱森接头,桨式搅拌器,和250-mL压力平衡加料漏斗。将烧瓶密封并将气氛换成干燥氮气(10次氮气-真空循环)。通过注射器向其中加入干燥THF(100mL)和69.9mL(50.5g,499mmol,1.05当量)二异丙基胺。将溶液冷却至-10℃并通过注射器在28分钟内在0至-5℃向其中滴加190mL 2.5M丁基锂的己烷溶液(475mmol)。将加料漏斗用10mL干燥己烷洗涤。将所得溶液在0至-5℃搅拌30分钟,然后冷却至-78℃。通过注射器将辛酸甲酯(85.7mL,75.16g,475mmol)加入加料漏斗中,然后在70分钟内在-75℃至-78℃将其滴加至反应混合物中。将所得混合物在-78℃搅拌30分钟。将加料漏斗用10mL干燥己烷洗涤。通过注射器将三甲基氯硅烷(TMSCl)(72mL,61.9g,570mmol,1.2当量)加入加料漏斗中,然后在50分钟内在-75℃至-78℃将其滴加至反应混合物中。将加料漏斗用10mL干燥己烷洗涤。将悬浮液在-75℃至-78℃搅拌30分钟。然后在60分钟内温度升至25℃并搅拌30分钟。
将反应混合物在旋转蒸发仪上在25-30℃和40-100mmHg下浓缩。将残余物用200mL干燥庚烷稀释并在氮气下抽滤(用TeflonTM套管和60-mL半熔玻璃料的无空气漏斗(airlessware funnel with medium frit))。将烧瓶、漏斗和固体用100mL干燥庚烷洗涤。将合并的母液在旋转蒸发仪上在25-30℃和10-90mmHg下浓缩得到119.2g浅黄色油状物。将该油状物用短程仪器在1.0-1.2mmHg(b.p.82-84℃)蒸馏得到99.86g澄清的无色液体。
实施例2
本实施例说明(R)-3-羟基十四烷酸的制备方法。
将33.67g(600mmol)氢氧化钾的600mL H2O溶液在80分钟内和0-5℃滴加入60.00g(232.8mmol)(R)-3-羟基十四烷酸甲酯的1200mL的乙醇溶液中。将所得悬浮液在0℃搅拌3小时。然后在50分钟内在0-5℃滴加盐酸(1N,600mL,600mmol)。将所得悬浮液在0℃搅拌15分钟。将沉淀抽滤,将浆状物用600mL H2O洗涤,然后在25℃空气干燥64小时得到52.76g无色固体。将固体用400mL乙醚重结晶(热过滤并冷却至-28℃ ),空气干燥2小时,并在25℃真空干燥2小时后得到49.87g(87.9%)无色固体。
实施例3
本实施例说明(R)-3-(三甲基甲硅烷氧基)十四烷酸三甲基甲硅烷基酯的制备方法。
在1000-mL的3-颈烧瓶上配置具有隔片/热电偶和氮气接头的克莱森接头、桨式搅拌器、和50-mL具有隔片的压力平衡加料漏斗。在烧瓶中加入45.00g(184.1mmol)(R)-3-羟基十四烷酸和DMAP(113mg,0.921mmol,0.5mol%)。将反应器密封,开始通入氮气,然后通过注射器加入200mL干燥的THF和30.8mL(30.12g,380.8mmol)干燥吡啶。开始搅拌(200rpm)并将烧瓶置于冷水浴中。在加料漏斗中加入49.0mL(41.91g,385.8mmol)TMSCL。然后在在30分钟内并在20-25℃滴加TMSCl。将加料漏斗用5mL干燥THF洗涤。将悬浮液在20-25℃搅拌20小时,然后直接用于下一步骤中。
300MHz 1H NMR(CDCl3)δ0.11(s,9H),0.27(s,9H),0.87(t,3H),1.22-1.37(m,18H),
1.42-1.49(m,2H),2.41-2.44(d,2H),4.08(m,1H)。
另一次重复实验的NMR分析显示在2小时完全转化,且在20小时无变化。
实施例4
本实施例说明(R)-3-(三甲基甲硅烷氧基)十四碳酰氯的制备方法。
将(R)-3-(三甲基甲硅烷氧基)十四烷酸三甲基甲硅烷基酯悬浮液冷却至0℃并通过注射器加入0.14mL(135mg,1.84mmol,1.0mol%)干燥DMF。在加料漏斗中加入亚硫酰氯(17.5mL,28.5g,240mmol,1.3当量),然后在11分钟内在0至-5℃将其滴加入反应液中。将所得悬浮液在-2至-3℃搅拌7小时。
用旋转蒸发仪(干冰-甲醇冷凝器)在0℃和30mmHg浓缩反应混合物回收THF/TMSCl混合物(163mL无色液体)。将残余物在0℃用150mL干燥己烷稀释。将悬浮液在干燥氮气氛下过滤(用TeflonTM套管和200-mL无空气漏斗)。烧瓶和固体用100ml干燥己烷在0℃下洗涤。将合并的母液用旋转蒸发仪(干冰-甲醇冷凝器)在0℃和30mmHg浓缩(254mL含有一些固体的无色液体)。将残余的油状物直接用于下一步骤中。
300MHz 1H NMR(CDCl3)δ0.12(s,9H),0.88(t,3H),1.22-1.37(m,18H),1.42-132(m,
2H),2.95(d,2H),4.18(m,1H)。
实施例5
本实施例说明(R)-3,5-双(三甲基甲硅基)-2-己基-3-十六碳烯酸甲酯的制备方法。
在1000-mL的烧瓶上配置具有隔片/热电偶和氮气接头的克莱森接头、桨式搅拌器、和50-mL压力平衡加料漏斗。将烧瓶密封、通入氮气流并开始搅拌(200rpm)。将实施例4的粗品(R)-3-(三甲基甲硅烷氧基)十四烷酰氯在0至-5℃缓慢地用150mL无水THF稀释。将蒸馏的从实施例1得到的1-甲氧基-1-三甲基甲硅烷氧基-1-辛烯(50.2mL,42.42g,~184mmol)通过注射器加入其中。在加料漏斗中加入25.7mL(18.63g,184.1mmol)三乙胺。然后在20分钟内在-10至0℃滴加该胺。将加料漏斗用5mL干燥THF洗涤。将所得悬浮液在-5℃搅拌16小时。
将悬浮液用旋转蒸发仪在25-30℃和30-80mmHg下浓缩(150mL含有一些固体的无色液体)。将残余物用200mL干燥己烷稀释并将悬浮液在25℃简单搅拌。将悬浮液在干燥氮气下通过10g硅藻土抽滤(用TeflonTM套管和200-mL无空气漏斗)。将烧瓶和滤饼用100mL干燥己烷洗涤。母液用旋转蒸发仪在25-30℃和30-80mmHg浓缩得到94.78g带轻微絮状的橙色油状物,直接用于下一步骤中。
(R)-3,5-双(三甲基甲硅烷氧基)-2-己基-3-十六烯酸甲酯:
300MHz 1H NMR(CDCl3)δ0.08(d,9H),0.19(d,9H),0.87(m,6H),1.28-1.58(m,
30H),2.86-2.91(m,1H),3.75(d,3H),4.33-4.42(m,1H),4.65(t,1H)。
(3R)-2-己基-5-氧代-3-(三甲基甲硅烷氧基)十六烷酸甲酯:
300MHz 1H NMR(CDCl3)δ0.06(d,9H),0.81-0.89(m,6H),1.16-1.46(m,28H),1.74-
1.86(m,2H),2.46-2.76(m,2H),3.38-3.46(m,1H),3.69(m,3H),4.09-4.19(broad m,
1H)。
另一次实验的NMR分析显示在大约2小时完全转化,并在16小时后没有显著变化。
实施例6
本实施例说明(R)-3-己基-4-羟基-6-十一烷基-5,6-二氢吡喃-2-酮的制备方法。
在1000-mL烧瓶上配置隔片/热电偶、桨式搅拌器、和氮气接头。将烧瓶密封、通入氮气流并开始搅拌(200rpm)。将实施例5的(R)-3,5-双(三甲基甲硅烷氧基)-2-己基-3-十六烯酸甲酯粗品冷却至0℃并在0至5℃向其中加入无水碳酸钾粉末(38.16g,276mmol)和350mL冷甲醇。将悬浮液在0℃搅拌17小时。
在43分钟内于0至5℃向其中滴加盐酸(46mL,12N)。将悬浮液用150mL甲醇稀释然后在0℃搅拌4小时。将沉淀抽滤(母液再循环至完成转移),用100mL0℃甲醇洗涤,100mL H2O洗涤三次,然后在25℃空气干燥17小时得到76.90g无色固体。在25℃将固体(72.09g)在700mL H2O中再制成浆状物。搅拌约2小时后,将固体抽滤,用200mL H2O洗涤在25℃空气于燥70小时得到41.30g无色固体。
合并甲醇母液并用旋转蒸发仪在35-40℃和60-90mmHg浓缩。将所得残余物在25℃和<1mmHg真空干燥17小时得到20.56g油黄色固体。
另一次实验的NMR分析显示在0℃下5-6小时内完全转化。
理论收率:基于(R)-3-羟基十四烷酸为64.50g。
实施例7
本实施例说明用HMDS制备(R)-3-(三甲基甲硅烷氧基)-十四烷酸三甲基甲硅烷基酯的方法。
在1000-mL的3-颈烧瓶上配置冷凝器/氮气接头、桨式搅拌器、和250-mL压力平衡加料漏斗/隔片。在反应器中加入45.00g(184.1mmol)实施例2的(R)-3-羟基十四烷酸。将烧瓶密封并开始通入氮气,通过套管加入290mL无水THF,开始搅拌(200rpm)。在加料漏斗中加入38.9mL(29.72g,184.1mmol)六甲基二硅氮烷(HMDS)。然后在15分钟内在20-25℃向其中滴加HMDS。在加完HMDS后将加料漏斗用10mL干燥THF洗涤。将悬浮液在4分钟内加热至回流(在75℃的油浴)然后回流2小时。将悬浮液冷却至25℃然后在干燥氮气下过滤(用TeflonTM套管和60-mL半熔玻璃料的无空气漏斗)。将烧瓶和痕量的固体用50mL干燥THF洗涤。然后通过在大气压下将合并的母液蒸馏浓缩(在85℃的油浴上)(收集约200mLTHF)。蒸馏瓶中溶液(188.1g澄清浅绿色液体)可直接用于下一步骤中。
实施例8
本实施例说明2-己基丙二酸二乙酯的制备方法。
在配置了2-L桨式搅拌器的5-L的3-颈摩顿式烧瓶中加入乙醇钠(在EtOH中,21wt%,1000mL,2.801摩尔)和500mL绝对乙醇。在室温和45分钟内搅拌下(150rpm)经由500-mL压力平衡滴液漏斗向其中滴加丙二酸二乙酯(425mL,2.80摩尔)的50mL乙醇溶液。在加入过程中再加入乙醇(250mL)以再溶解沉淀的盐。将漏斗用150mL乙醇洗涤。将反应混合物加热至回流并在40分钟内滴加1-溴己烷(432mL,3.08摩尔,1.1当量)。将加料漏斗用50mL乙醇洗涤(乙醇的总加入量约为1L)。将反应液保持在回流2小时,之后将反应混合物中和至湿润的石蕊(moist litmus)。除去热源并将反应物缓慢冷却至室温过夜。将反应液再加热至回流并从反应混合物中蒸馏出1200mL乙醇。加入水(1L)和庚烷(500mL),将混合物转入4-L的分液漏斗中,分层。将有机层用500mL饱和盐水洗涤,MgSO4干燥,减压除去溶剂。分析粗品(GC):1-溴己烷(TR=3.4分钟,4.3%);丙二酸二乙酯(TR=4.7分钟,2.9%);2-己基丙二酸二乙酯(TR=10.7min,83.1%);2,2-二己基丙二酸二乙酯(TR=14.9分钟,9.2%)。
将粗品转入1-L圆底烧瓶中并与短颈蒸馏头连接。将粗混合物在0.7至1.0mmHg的压力下逐渐加热,先蒸馏除去的馏分含有绝大多数的1-溴己烷(38-50℃),接着的第二馏分(101g,在0.95mmHg下bp=55-100℃)含有约2%1-溴己烷,10%丙二酸二乙酯,87%2-己基丙二酸二乙酯和0.8%的2,2-二己基丙二酸二乙酯(通过GC确定)。主切口馏分(459g,在0.95托下bp=102-106℃)不含1-溴己烷,含0.4%丙二酸二乙酯,96.7%2-己基丙二酸二乙酯,和2.7%2,2-二己基丙二酸二乙酯。蒸馏瓶底含有52g物质,其中含22%的2-己基丙二酸二乙酯和77%的2,2-二己基丙二酸二乙酯(通过GC确定)。2-己基丙二酸二乙酯在主馏分中的收率:443.6g(1.816摩尔,65%)。
实施例9
本实施例说明2-己基丙二酸二甲酯的制备方法。
在配置了1-L桨式搅拌器的2-L的3-颈摩顿式烧瓶中加入甲醇钠(25wt%的甲醇溶液,460mL,2.01摩尔)和400mL HPLC级甲醇。在45分钟内搅拌下(175rpm)经由500-mL压力平衡滴液漏斗向其中滴加丙二酸二甲酯(216mL,250g,1.89摩尔)的90mL甲醇溶液。反应混合物在加入期间由于沉淀而变得粘稠。再加入110mL甲醇以保持有效的搅拌(搅拌速率增加至350rpm)。然后将反应混合物加热至回流并在60分钟内向其中滴加1-溴己烷(296mL,348g,2.11摩尔)。将漏斗用50mL甲醇洗涤,并将反应混合物回流过夜。
连接短颈蒸馏头,从反应混合物中蒸馏出800mL甲醇。然后将反应液用300mL H2O和700mL庚烷稀释,搅拌15分钟。将混合物转入4-L分液漏斗中并分层。将有机相用300mL饱和盐水洗涤,干燥(MgSO4),并减压浓缩得到399.5g(98%)粗品。分析粗品(GC):丙二酸二甲酯(TR=4.5分钟,0.78%);1-溴己烷(TR=4.7分钟,1.0%);2-己基丙二酸二甲酯(TR=10.0分钟,84.5%);2,2-二己基丙二酸二甲酯(TR=13.2分钟,10.0%)。
将粗品转入连接8”分馏柱和短颈蒸馏头的1-L圆底烧瓶中。将粗混合物在0.6mmHg的压力下缓慢地加热至100℃以蒸馏除去低沸点的含溶剂、1-溴己烷,和丙二酸二甲酯的前馏分。将热浴加热至105℃并在主切口收集到约25mL馏分(0.62mmHg,b.p.85-86℃)。然后收集主切口馏分(0.66mmHg,b.p.86-89℃)。第一馏分不含1-溴己烷或丙二酸二甲酯,含99.6%2-己基丙二酸二甲酯,和0.4%2,2-二己基丙二酸二甲酯。主切口馏分(277.1g)不含1-溴己烷或丙二酸二甲酯,含98.8%2-己基丙二酸二甲酯,和1.2%2,2-二己基丙二酸二甲酯。烧瓶底(59g)含有43%2-己基丙二酸二甲酯和56%2,2-二己基丙二酸二甲酯(GC)。在最先的两个馏分中2-己基丙二酸二甲酯的收率:295.1g,(1.365摩尔,72%)。
实施例10
本实施例说明2-(乙氧基羰基)辛酸,即己基丙二酸单乙酯的制备方法。
向置于2-L,3-颈摩顿式烧瓶中的实施例8的2-己基丙二酸二乙酯(244.36g,1.000摩尔)的25mL绝对乙醇溶液中,在75分钟内用500-mL压力平衡滴液漏斗加入氢氧化钾(59.9g,0.907摩尔)(将商购氢氧化钾调节至85%重量)的450mL绝对乙醇溶液。将漏斗用25mL绝对乙醇洗涤。将反应混合物搅拌2小时,然后减压除去300mL乙醇。加入水(500mL),并将混合物用500mL庚烷萃取以除去未反应的2-己基丙二酸二乙酯。将水溶液用12MHCl酸化至pH2然后用500mL庚烷萃取。将庚烷溶液干燥(MgSO4)并减压除去溶剂得到为无色油状物的2-(乙氧基装基)辛酸。通过往粗品中加入20mL甲苯,然后在1mmHg的压力下搅拌提取溶剂除去痕量的乙醇。得到190.9g(0.8827摩尔,基于2-己基丙二酸二乙酯的收率为88.3%,基于氢氧化钾的收率为97%)。
实施例11
本实施例说明2-(甲氧基羰基)辛酸,即丙二酸单甲酯的制备方法。
在配置磁力搅拌器的2-L圆底烧瓶中将实施例9的2-己基丙二酸二甲酯(220.35g,1.019摩尔)制成500mL甲醇溶液。在60分钟内和20-25℃(水浴)搅拌下向其中滴加氢氧化钾(60.8g,0.921摩尔)的500mL甲醇溶液。将反应液搅拌2小时然后用旋转蒸发仪减压下除去950mL甲醇。加入1L 1∶1的水和庚烷混合物,在2-L分液漏斗中分层。将水层用12M HCl酸化至pH1。然后将悬浮液用500mL庚烷萃取,将庚烷溶液干燥(MgSO4)并浓缩得到浑浊的油状物(悬浮的盐)。加入甲苯(200mL),将混合物静置21小时。将悬浮液过滤并减压蒸发溶剂得到182.53g为澄清油状物的2-(甲氧基羰基)辛酸(0.902摩尔,基于2-己基丙二酸二甲酯的收率为88.5%,基于氢氧化钾为98%)。
实施例12
本实施例说明3-(三甲基甲硅烷氧基)十四烷酰氯的制备方法。
在氮气和磁力搅拌下在500-mL,3-颈摩顿式烧瓶中加入实施例2的(R)-3-羟基十四烷酸(20.06g,82.09毫摩尔)和90mL干燥THF。通过注射器向其中加入六己基-二硅氮烷(HMDS,17.3mL,82.0mmol,1.00当量),将反应混合物加热至回流2小时,然后冷却至20-25C。反应通过1H NMR检测,显示完全转化为(R)-3-(三甲基甲硅烷氧基)十四烷酸三甲基甲硅烷基酯。将反应液冷却至0℃,同时监测内温,然后通过注射器向其中加入吡啶(0.34mL,4.2mmol,5mol%),然后加入亚硫酰氯(6.6mL,90.5mmol,1.1当量),加入在6分钟内完成。将反应液在0℃搅拌140分钟,通过1H NMR检测,显示有约3%的(R)-3-(三甲基甲硅烷氧基)十四烷酸三甲基甲硅烷基酯和少量的分解产物。
加入干燥庚烷(90mL),将反应液搅拌30分钟并在氮气下过滤(用TeflonTM套管和200-mL粗-熔玻璃料的无空气漏斗)入1-L、3-颈圆底烧瓶中。将烧瓶和漏斗用50mL庚烷洗涤。逐渐增加真空度(用VacuubrandTM真空泵由50至8mmHg)在0℃蒸发溶剂2小时得到为黄色油状物的3-(三甲基甲硅烷氧基)-十四烷酰氯。直接用于下一步骤中。
实施例13
本实施例说明5-羟基-2-己基-3-氧代十六烷酸乙酯的制备方法。
在配置机械搅拌器(500ml-桨叶)的1-L、3-颈摩顿式烧瓶中加入实施例10的2-(乙氧基羰基)辛酸(21.34g,98.67mmol)和150mL干燥THF。在室温下向其中加入三乙胺(28.0mL,201mmol,2.04当量)然后加入氯化镁(Aldrich;水含量<1.5%;9.67g,102mmol,1.03当量)。将反应液室温搅拌105分钟(150rpm),然后冷却至0℃。在15分钟内通过50-mL压力平衡加料漏斗向其中滴加于约30mL庚烷中的3-(三甲基甲硅烷氧基)十四烷酰氯外消旋混合物(82.1mmol,0.83当量)。将漏斗用20mL THF(THF总量=170mL)洗涤,然后将反应液温度升至室温搅拌15小时(150rpm)。然后将反应液冷却至0℃,并在9分钟内向其中滴加80mL 3M HCl(3当量)然后立刻加入150mL庚烷。将混合物搅拌15分钟,分层。将有机层用100mL水洗涤一次并用50mL饱和NaHCO3洗涤两次。将有机层干燥(MgSO4)并减压除去溶剂得到32.05g产品。
1H NMR分析显示5-羟基-2-己基-3-氧代十六烷酸乙酯为主要产物。
300MHz 1H NMR(CDCl3)δ0.88(m,6H),1.26(m,29H),1.43(m,2H),1.84(m,2H),
2.57,2.71(m,2H),2.88(m,1H),3.42(m,1H),4.04(m,1H),4.19(q,2H)。
实施例14
本实施例说明反应条件对从(5R)-2-己基-5-羟基-3-氧代十六烷酸乙酯制备3-己基-4-羟基-6-十一烷基-5,6-二氢吡喃-2-酮收率的影响。
用(5R)-2-己基-5-羟基-3-氧代十六烷酸乙酯在各种反应条件下生产3-己基-4-羟基-6-十一烷基-5,6-二氢吡喃-2-酮。所得结果如表1所示。
表1.(5R)-2-己基-5-羟基-3-氧代十六烷酸乙酯环化制备3-己基
-4-羟基-6-十一烷基-5,6-二氢吡喃-2-酮
1()=用丙二酸半酸酯法从(R)-3-羟基十四烷酸所得的收率。
| 记录 | 酸/碱(当量) | 溶剂(mL) | 时间(h) | 温度(℃) | 收率% |
| 12345678910111213 | 12MHCl(0.08)12MHCl(1.03)0.5MHCl(1.0)无NaOMe(1.13)H2SO4(0.08)12MHCl(1.08)12MHCl(1.02)12MHCl(1.04)12MHCl(1.04)H2SO4(1.02)12MHCl(1.03)12MHCl(2.0) | EtOAc(5)EtOAc(8)MTBE(15)9:1THF/H2O(10mL)MeOH(9)MeOH(6)MeOH(6)MeOH(12)MeOH(8)EtOH(8)MeOH(16)MeOH(125)MeOH(100) | 1722.52220441717202020222728 | 25252560252525252525252525 | 173400774072(63)174(65)59386463(63)67(61) |
实施例15
本实施例说明3-己基-4-羟基-6-十一烷基-5,6-二氢吡喃-2-酮的制备方法。
机械搅拌下在1-L、3-颈摩顿式烧瓶中,将实施例13的5-羟基-2-己基-3-氧代十六烷酸乙酯(31.35g,78.64mmol)的外消旋粗品制成于125mL甲醇中的溶液。搅拌(150rpm)下加入盐酸(12M,6.6mL,81mmol,1.0当量)。1.5小时后,3-己基-4-羟基-6-十-烷基-5,6-二氢吡喃-2-酮开始从反应混合物中沉淀。26.5小时后,将悬浮液冷却至0℃并用10mL冷甲醇将其转入150mL粗糙烧结玻璃料漏斗中。将沉淀过滤并用15mL冷甲醇洗涤得到为白色结晶固体的3-己基-4-羟基-6-十一烷基-5,6-二氢吡喃-2-酮(17.39g,49.3mmol,以3-羟基十四烷酸计收率为63%)。
实施例16
本实施例也说明钌氢化催化剂上不同的膦配体对β-酮酯的不对称氢化的收率和%ee的影响。
实施例21的β-酮酯1的氢化反应用Ru(OAc)2(二膦)/20当量HCl(S/C50,000)在60℃,在氢气(70巴)氛下在甲醇中进行,且β-酮酯1的浓度为30%wt.。二膦配体的特性、分离收率%和(%ee)如下表所示:
实施例17本实施例说明添加剂对β-酮酯的不对称氢化的收率和%ee的影响。表3.不对称氢化:添加剂的影响*
*β-酮酯1与催化剂的比例=约50,000∶1。1.所有气体纯度>99.99990%。2.相对于β-酮酯1。
| 纪录1 | 添加剂 | 转化率 | 2%ee | ||||
| 1h | 2h | 4h | 6h | 16h | |||
| 1 | 2eq.HCl | 4 | 8 | 13 | 19 | 50 | 36(S) |
| 2 | 20eq.HCl | 98 | >99.9 | 99 | |||
| 3 | 20eq.LiCl | 87 | 99.7 | 99.9 | >99.9 | 97 | |
| 4 | 20eq.HBr | 31 | 59 | 78 | 82 | 91 | 46 |
| 5 | 20eq.HBF4 | 3 | 6 | 17 | 27 | 77 | 33(S) |
| 6 | 20eq.p-TsOH | 50 | 79 | 96 | 98 | 99.8 | 62 |
| 7 | 2eq.HCl+4%wt.2CH2Cl2 | 32 | 66 | 90 | 97 | >99.9 | 71 |
| 8 | 2eq.HCl+18eq.HBF4 | 12 | 29 | 47 | 63 | 90 | 17(S) |
| 9 | 20eq.Bu4NI | <1 | <1 | <1 | <1 | <1 | |
实施例18本实施例说明钌氢化催化剂上不同的膦配体对β-酮酯的不对称氢化的收率和%ee的影响。表2.不对称氢化:膦的影响*
*β-酮酯1与催化剂的比例=约50,000∶1。**β-酮酯1与催化剂的比例=约5000∶1。1.所有气体纯度>99.99990%。2.没有使用HCl。
| 纪录1 | 催化剂 | 转化率 | 2%ee | ||||
| 1h | 2h | 4h | 6h | 16h | |||
| 1* | [Ru(OAc)2((R)-MeOBIPHEP)] | 26 | 48 | 94 | >99.9 | 99 | |
| 2* | [Ru(OAc)2((R)-3,5-tBu-MeOBIPHEP)] | 66 | 99.5 | >99.9 | 99 | ||
| 3* | [Ru(OAc)2((R)-BIPHEMP)] | 45 | 91 | >99.9 | 99 | ||
| 4* | [Ru(OAc)2((S)-BINAP)] | 31 | 57 | 99.7 | >99.9 | 96(S) | |
| 5** | [Ru(OAc)2((R,R)-NORPHOS)] | 7 | 14 | 27 | 39 | 90 | 64 |
| 6** | [Ru(OAc)2((R,R)-CHIRAPHOS)2] | <1 | <1 | <1 | <1 | 1 | - |
| 7** | [RuCl(p-cym)((R,R)-Me-DUPHOS)]Cl2 | <1 | <1 | <1 | <1 | 1 | - |
| 8** | [RuCl(p-cym)((R)-MeOBIPHEP)]Cl2 | 45 | 99 | >99.9 | 99 | ||
且p-cym=对-伞花烃。
实施例19
本实施例说明用氯化叔丁基镁制备(6R)-3-己基-5,6-二氢-4-羟基-6-十一烷基-吡喃-2-酮的方法。
在约60℃,在配置具有氮气入口的克莱森接头、韦斯特氏冷凝器、热偶-J-KEM控制器和加料漏斗的500-mL 3-颈圆底烧瓶中加入氯化叔丁基镁(341mL 1.0M的溶液,341mmol,3当量)。将(R)-3-(2’-溴-1’-氧代辛氧基)十四烷酸甲酯(52.60g,113.5mmol,1当量)和25mL干燥THF加入加料漏斗中。将起始原料的溴代二酯混合物在大约1小时内回流下缓慢地加入t-BuMgCl/THF混合物中。在约60℃将反应混合物在1小时和2小时取样分析(分别进行气相色谱(AN GC)分析,对应于峰面积归一化后的90和91%)。2小时后将所得反应混合物冷却并用旋转蒸发仪浓缩至为原体积的约1/3至约1/2。将所得混合物浆液置于约250mL甲苯中并将其加入在1L含有250mL甲苯、75mL10%HCl混合物的夹套烧瓶中,保持处理的溶液低于30℃。除去水层。将有机层用50mL 1.0N HCl溶液洗涤一次。除去水层,将有机层用50mL水洗涤一次,硫酸镁干燥,过滤并浓缩。得到凝胶状固体残余物。在40℃将残余物溶解在250mL乙酸乙酯中。用旋转蒸发仪除去乙酸乙酯。将所得灰白色固体粗品(42.4g)用100mL己烷浆化并冷却至0℃。过滤并用50mL冷己烷洗涤,然后再用25mL冷己烷洗涤将分离的白色固体真空下晾干约1至2小时,得到31.4g(6R)-3-己基-5,6-二氢-4-羟基-6-十一烷基-吡喃-2-酮(收率78.4%)。
实施例20
本实施例说明用氯化叔戊基镁制备(6R)-3-己基-5,6-二氢-4-羟基-6-十一烷基-吡喃-2-酮的方法。
在配置具有氮气入口的克莱森接头、韦斯特氏冷凝器、热偶-J-KEM控制器和加料漏斗的500-mL 3-颈圆底烧瓶中加入氯化叔戊基镁溶液(341mL 1.0M乙醚溶液,341mmol,3当量)。将Et2O用THF替换并加热至约60℃。将(R)-3-(2’-溴-1’-氧代辛氧基)十四烷酸甲酯(52.60g,113.5mmol,1当量)和25mL干燥THF加入加料漏斗中。将起始原料的溴代二酯混合物在约1小时内回流下缓慢地加入叔戊基MgCl/THF混合物中。
将在约60℃的反应混合物在1小时和2小时取样分析(分别对应81和80%AN,GC分析)。约2小时后,将所得的反应混合物冷却并浓缩至原体积的约1/3至约1/2。将所得浆液混合物用约250mL甲苯稀释,并在搅拌下将其加入在1L含有约250mL甲苯和约75mL 10%HCl混合物的夹套烧瓶中,同时保持处理的溶液低于30℃。除去水层。将有机层依次用约50mL 1.0NHCl溶液和50mL水洗涤,硫酸镁干燥,过滤并浓缩得到固体残余物。
在约40℃将残余物溶解在约400mL乙酸乙酯中。用旋转蒸发仪除去乙酸乙酯。将所得灰白色固体(42.3g)用约100mL己烷浆化并冷却至约0℃,过滤并先用约50mL冷己烷洗涤,再用约35mL冷己烷洗涤。将分离的白色固体真空干燥约1至约2小时得到27.6g(6R)-3-己基-5,6-二氢-4-羟基-6-十一烷基-吡喃-2-酮(收率69.1%)。
实施例21
本实施例说明实施例17的β-酮酯1的制备方法。
在氮气氛下向配置了机械搅拌器和回流冷凝器的250mL三颈圆底烧瓶加入1.54g镁粉(纯度99.5%,50目)和甲醇(约50mL)。将所得混合物加热回流过夜。将回流冷凝器用蒸馏头替换。加入甲苯(约150mL)并用共沸蒸馏法除去甲醇直至蒸馏头的温度达到104℃。收集到约82mL蒸馏物。
在45℃向所得反应混合物中加入29g乙酰乙酸甲酯。通过蒸馏除去反应中产生的甲醇直至蒸馏头的温度达到104℃。收集到约62mL的蒸馏物。将反应混合物冷却至室温。然后将所得混合物加热至约60℃并在2小时内加入月桂酰氯(20.71g)的20mL甲苯溶液,将反应混合物保持在约60℃。再将反应混合物搅拌60分钟。GC分析表明月桂酰氯的残留率低于1%。
向其中加入甲醇(14.4mL)并将所得混合物加热至约70℃并搅拌4小时。另外再加入9.0mL甲醇并将所得混合物加热至75℃再反应20小时。将所得混合物冷却至室温并加入浓HCl(19.43g)终止反应,将混合物的温度保持在35℃以下。分离下面的水相,将甲苯相用水(2×45mL)、碳酸氢钾水溶液(0.75g在36mL水中的溶液)洗涤,然后再用水(36mL)洗涤。将甲苯用旋转蒸发仪除去(75℃/约25-30mmHg)得到实施例17的β-酮酯1,收率86.6%(21.03g,92%A.N.GC分析)。
实施例22
本实施例说明Ru(OAc)2((R)-MeOBIPHEP)(二(η2-乙酸基)[(R)-6,6’-二甲氧基联苯-2,2’-二基]双(二苯基膦))-钌(Ⅱ)的制备方法
在配置了温度计、克莱森接头、在顶部有氩气进口的回流冷凝器和聚四氟乙烯包覆的磁力搅拌棒的2升2-颈圆底烧瓶中用真空和氩气净化3次后,加入氯化钌(Ⅲ)水合物(Ru含量43.48%,Johnson Matthey&Brandenberger AG,42.0g,0.179摩尔)。然后将烧瓶用氩气真空净化3次。加入乙醇(420mL)和顺,顺-1,5-环辛二烯(44mL,358mmol),然后将深色悬浮液在100℃的外热浴温度下回流搅拌24小时。此后,将所得棕色悬浮液冷却至室温并放置30分钟,用微烛式过滤器(micro-fitler candle)(P4-孔隙度)抽滤除去浅黄色上清液。
将棕色残余物用乙醇(500mL)搅拌10分钟并静置30分钟。用上述抽滤法除去浅黄色上清液。为了除去大部分残留乙醇和环辛二烯,可将由[RuCl2(COD)]n组成的固体残余物置于甲苯(500mL)中并用旋转蒸发仪蒸发至干(在50毫巴55℃)。在氩气氛下在反应器中加入(R)-(6,6’-二甲氧基联苯-2,2’-二基)双(二苯基膦)((R)-MeOBIPHEP)(99.4g,171mmol)和乙酸钠(70g,853mmol)并如上述用氩气净化。加入甲苯/乙酸(1∶1v/v,1.0L)后,将棕色反应混合物在100℃浴上搅拌22小时。用旋转蒸发仪除去挥发物(在30毫巴58℃)后,将残余物在50℃下真空干燥(1毫巴)1小时并室温夜。
将所得棕色残余物置于甲苯(500mL)中,将悬浮液室温搅拌15分钟并在氩气保护下用覆盖2cm加压助滤剂的多孔玻璃烧结过滤器过滤。将滤饼用100mL甲苯洗涤5次(总量500mL),收集滤液并旋转蒸发至于(在30毫巴60℃)。室温真空(1毫巴)干燥过夜后,将棕色残余物在搅拌下用甲醇(500mL)处理。将粘稠的悬浮液在50℃搅拌1小时、室温1小时并最后在冰/甲醇浴中1小时。用微烛式过滤器(P4-孔隙度)除去溶剂,将残余物在冰/甲醇浴上与甲醇(3×120ml)一起搅拌,用上述方法除去溶剂。将黄色残余物室温真空干燥(1毫巴)过夜,然后在搅拌下在50℃溶解在甲苯(150mL)中。
搅拌下在2小时内于40-50℃的温度下向所得棕色溶液中滴加戊烷(600mL)形成黄-棕色悬浮液,室温搅拌45分钟后在冰浴(约2℃)上1.5小时。用微烛式过滤器(P4-孔隙度)抽滤除去上清液,将残余物在戊烷(500mL)中室温搅拌30分钟。用上述方法除去上清液并在室温下真空干燥(1毫巴)过夜得到117.0g内含0.7甲苯的所需产品加合物,为黄色粉末(收率86%,纯度93%)。
实施例23
本实施例说明[Ru(OAc)2((S)-BINAP)]的制备方法
在氮气氛下,在配置了回流冷凝器的25-mL2-颈圆底烧瓶中加入(S)-BINAP(0.50g,0.80mmol),0.25g(0.84mmol)[RuCl2(COD)]n、乙酸钠(0.33g,4.0mmol)和甲苯/乙酸1∶1(5mL)。将棕色反应混合物在100℃的油浴上搅拌25小时。此后,通过旋转蒸发除去挥发物,将残余物用二氯甲烷(5mL)稀释并将所得黄-棕色悬浮液用硅藻土过滤。将滤饼用二氯甲烷(9mL)分三次洗涤,将合并的滤液浓缩并在高真空下室温(r.t)干燥过夜。将棕色油状物用乙醚/己烷1∶1(4mL)稀释并室温搅拌30分钟得到固体沉淀。用微-烛式过滤器抽滤除去上清液并将残余物在室温用己烷(5mL)洗涤,干燥过夜。将粗品用甲醇(5mL)稀释并在50℃搅拌1小时,室温1小时(形成沉淀),最后在0℃1小时。用上述方法除去上清液,将残余物在0℃用甲醇(2mL)洗涤并室温高真空下干燥过夜得到[Ru(OAc)2((S)-BINAP)](0.48g,相对于(R)-BINAP收率72%),为棕色结晶粉末。
实施例24
本实施例说明生产[Ru(OAc)2((R)-BIPHEMP)]的合成方法
在氩气氛下,在配置回流冷凝器的50-mL 2-颈圆底烧瓶中加入(R)-BIPHEMP(2.01g,3.65mmol)、[RuCl2(COD)]n(1.13g,3.83mmol)、乙酸钠(1.5g,18.2mmol)和甲苯/乙酸1∶1(20mL)。将棕色反应混合物在100℃的油浴上搅拌31小时。用旋转蒸发仪除去挥发物,将残余物用二氯甲烷(20mL)稀释,将所得黄-棕悬浮液通过硅藻土过滤。将滤饼用二氯甲烷(12mL)分三次洗涤并将合并的滤液浓缩。用甲醇(10mL)稀释并在50℃搅拌1小时,在室温1小时(形成沉淀),最后在0℃1小时。用微-烛式过滤器抽滤除去上清液,将残余物在0℃用甲醇(6mL)洗涤并在室温高真空干燥过夜得到[Ru(OAc)2((R)-BIPHEMP)](2.48g,相对于(R)-BIPHEMP)收率为88%),为棕色结晶粉末。
实施例25
本实施例说明[Ru(OAc)2((R)-3,5-t-Bu-MeOBIPHEP)]的合成方法在氩气氛下,在配置回流冷凝器的25-mL 2-颈圆底烧瓶中加入(R)-3,5-叔丁基-MeOBIPHEP(0.50g,0.49mmol)[RuCl2(COD)]n(0.14g,0.51mmol)、乙酸钠(0.20g,2.44mmol)和甲苯/乙酸1∶1(5mL)。将棕色反应混合物在100℃的油浴上搅拌26小时。高真空除去挥发物,将残余物用己烷(10mL)稀释,将所得黄-棕悬浮液通过硅藻土过滤。将滤饼用己烷(9mL)分三次洗涤,将合并的滤液浓缩并在室温下高真空干燥得到[Ru(OAc)2((R)-3,5-t-Bu-MeOBIPHEP)](0.62g,相对于(R)-3,5-t-Bu-MeOBIPHEP收率为99%),为棕色结晶粉末。
实施例26
本实施例说明生产[Ru((CH3)3CCO2)2((R)-MeOBIPHEP)]的合成方法
在氩气氛下,在配置回流冷凝器的25-mL2-颈圆底烧瓶中加入(R)-MeOBIPHEP(1.06g,1.82mmol)、[RuCl2(COD)]n(0.56g,2.00mmol)和甲苯(2mL)。在该混合物中加入通过将氢化钠(0.22g,9.1mol)溶解在甲苯(3mL)和戊酸(6.0g,59mmol)混合物中得到的溶液并将所得棕色反应混合物在100℃的油浴上搅拌72小时,冷却,用戊烷(15mL)稀释,通过硅藻土过滤。将滤饼依次用戊烷(15mL)分三次洗涤和二氯甲烷(25mL)分四次洗涤,将合并的二氯甲烷滤液浓缩并将所得残余物在室温高真空干燥过夜。将粗品用甲醇(10mL)处理,在50℃搅拌l小时,室温1小时,最后在0℃30分钟。用微-烛式过滤器抽滤除去上清液,将残余物在0℃用甲醇(5mL)洗涤并在室温高真空干燥过夜得到[Ru((CH3)3CCO2)2((R)-MeOBIPHEP)](0.66g,相对于(R)-MeOBIPHEP收率为41%),为棕色结晶粉末。
本发明前述的讨论已经提供了例证和说明的目的。前述内容并不表示本发明仅限于所公开的这些形式。虽然本发明的说明书包括了一个或多个方案和某些变化和改变的说明,但是其它变化和改变也包括在本发明范围内,在理解了本发明公开后,这些变化和改变包括在本领域技术人员的技术和知识范围内。
Claims (50)
1.式(Ⅰ)的δ-内酯的制备方法:所述方法包括将式(Ⅱ)的酰卤:用a)式(Ⅲ)的乙烯酮缩二醇处理:得到式(Ⅳ)的δ-羟基-保护的-β-烯醇醚酯:然后除去至少一个保护基R3和R6;和将产物与酸接触得到所述δ-内酯,或b)用式(Ⅴ)丙二酸半酸酯处理:得到式(Ⅵ)的δ-羟基-β-酮酯:然后将所述δ-羟基-保护的-β-烯醇醚酯用酸处理得到所述δ-内酯,其中在上述结构式中R1是C1-C20烷基;R2是H或C1-C10烷基;R3是羟基保护基在式(Ⅲ)和(Ⅳ)中的R4和R5独立地是C1-C6烷基、C5-C20芳C6-C20芳烷基或-SiR8R9R10,其中R8、R9、R10独立地是C1-C6烷基或苯基;
在式(Ⅴ)和(Ⅵ)中的R5是C1-C6烷基、C5-C20芳基或C6-C20芳烷基;
R5是C1-C6烷基、C5-C20芳基、或C6-C20芳烷基;
R6是H或R4;
R7是H或R3,以及
X是卤素。
2.权利要求1的方法,其中R1是十一烷基。
3.权利要求1或2的方法,其中R2是己基。
4.根据权利要求1至3任一项的方法,其中R3是式-SiR11R12R13部分,其中R11、R12和R13独立地是C1-C6烷基或苯基。
5.权利要求1至4的方法,其中X是氯。
6.权利要求1至5的方法,其中R5是C1-C6烷基。
7.权利要求1至6的方法,其中R4和R6各为式-SiR8R9R10部分。
8.权利要求1至7的方法,其中R7是H。
9.权利要求1至8的方法,其中步骤a)包括处理所δ-羟基-保护的-β-烯醇醚酯以除去R6保护基得到下式的δ-羟基-保护的-β-酮酯:其中R1、R2、R3和R5如权利要求1至8任一项中所定义。
11.权利要求10的方法,其中R3和R14各是式-SiR15R16R17部分,其中R15、R16、R17各独立地是C1-C6烷基或苯基。
14.权利要求13的方法,其中所述方法生产的所述δ-内酯对映体过量至少约90%。
15.权利要求12的方法,其中所述对映体有择还原所述β-酮酯的步骤包括在氢化催化剂存在下氢化所述β-酮酯。
16.权利要求15的方法,其中所述氢化催化剂选自表2中所示的催化剂。
17.权利要求15或16的方法,其中所述氢化催化剂是式RuCl2((R)-MeOBIPHEP)化合物。
18.权利要求17的方法,其中所述氢化催化剂是通过将式Ru(OAc)2((R)-MeOBIPHEP)的二乙酸钌化合物与卤化物源接触产生的产品。
19.权利要求18的方法,其中所述卤化物源与所述二乙酸钌的摩尔比至少约为20∶1。
21.权利要求20的方法,其中所述氢气是工业级的氢气。
22.权利要求20-21的方法,其中R1为十一烷基
23.权利要求20-22的方法,其中R18为C1-C6烷基。
24.权利要求20-23的方法,其中所述氢化催化剂选自权利要求16至19中所定义的催化剂。
26.权利要求25的方法,其中所述方法生产的δ-内酯对映体过量至少约90%。
27.权利要求25-26的方法,其中R5为C1-C6烷基。
28.权利要求25-27的方法,其中步骤(b)包括将所δ-甲硅烷氧基-β-甲硅烷基烯醇醚酯用选自氢氧化物和碳酸盐的碱处理以脱去两个甲硅烷基。
29.权利要求25-28的方法,其中所述步骤(b)包括将所述δ-甲硅烷氧基-β-甲硅烷基烯醇醚酯用碳酸氢盐处理得到下式的δ-甲硅烷氧基-β-酮酯:
30.权利要求25-29的方法,其中所述酸是盐酸。
31.权利要求25-30的方法,进一步包括生产所述酰卤的步骤,其中所述酰卤生产步骤包括
(ⅰ)将(R)-3-羟基十四烷酸用甲硅烷基化剂处理得到下式的β-甲硅烷氧基十四烷酸甲硅烷基酯:和
(ⅱ)将所述的β-甲硅烷氧基十四烷酸甲硅烷基酯与酰卤化剂接触得到所述酰卤。
32.权利要求31的方法,其中R11、R12和R13是甲基
33.权利要求31-32的方法,其中所述甲硅烷基化试剂选自三甲基甲硅烷基氯和六甲基二硅氮烷。
34.权利要求31-33的方法,其中所述酰卤化试剂是亚硫酰氯。
36.权利要求35的方法,其中所述β-酮酯的对映体有择还原步骤,包括在氢化催化剂存在下氢化所述β-酮酯。
37.权利要求36的方法,其中所述氢化催化剂选自权利要求15至19任一项中所定义的催化剂。
39.权利要求38的方法,其中该方法生产的所述δ-内酯的对映体过量至少为约90%。
40.权利要求38-39的方法,其中R5为C1-C6烷基
41.权利要求38-40的方法,其中所述酸是盐酸
42.权利要求38-41的方法,进一步包括如权利要求31-37中定义的生产所述酰卤的步骤。
44.权利要求43的方法,其中R1是C11H23和R2是C6H13。
46.权利要求45的化合物,其中所述β-甲硅烷氧基酰卤是(R)-3-三甲基甲硅烷氧基十四烷酰氯。
47.权利要求45的化合物,其中所述δ-甲硅烷氧基-β-甲硅烷基烯醇醚酯选自(R)-3,5-双-(三甲基甲硅烷氧基)-2-己基-3-十六烯酸甲酯,和(R)-3,5-双-(三甲基甲硅烷氧基)-2-己基-3-十六烯酸乙酯。
48.权利要求45的化合物,其中所述δ-甲硅烷氧基-β-酮酯选自(5R)-5-(三甲基甲硅烷氧基)-2-己基-3-氧代-十六烷酸甲酯和(5R)-5-(三甲基甲硅烷氧基)-2-己基-3-氧代-十六烷酸乙酯。
49.根据权利要求1-44任一项的方法在制备奥利司他上的用途。
50.通过权利要求1-44中定义的任一方法制备的化合物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US18057800P | 2000-02-04 | 2000-02-04 | |
| US60/180,578 | 2000-02-04 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1319596A true CN1319596A (zh) | 2001-10-31 |
| CN1193992C CN1193992C (zh) | 2005-03-23 |
Family
ID=22660964
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB011119160A Expired - Lifetime CN1193992C (zh) | 2000-02-04 | 2001-02-02 | 3,6-二烷基-5,6-二氢-4-羟基-2h-吡喃-2-酮的合成 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US6552204B1 (zh) |
| EP (1) | EP1127886B1 (zh) |
| JP (3) | JP2001220387A (zh) |
| KR (1) | KR100509081B1 (zh) |
| CN (1) | CN1193992C (zh) |
| AT (1) | ATE239716T1 (zh) |
| CA (1) | CA2333192C (zh) |
| DE (1) | DE60100238T2 (zh) |
| DK (1) | DK1127886T3 (zh) |
| ES (1) | ES2197128T3 (zh) |
| JO (1) | JO2249B1 (zh) |
| MX (1) | MXPA01001187A (zh) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6552204B1 (en) * | 2000-02-04 | 2003-04-22 | Roche Colorado Corporation | Synthesis of 3,6-dialkyl-5,6-dihydro-4-hydroxy-pyran-2-one |
| US8932136B2 (en) | 2000-08-25 | 2015-01-13 | Opentv, Inc. | Method and system for initiating an interactive game |
| WO2004065346A1 (ja) * | 2003-01-21 | 2004-08-05 | Sumitomo Chemical Company, Limited | (-)-テトラヒドロリプスタチンおよびその中間体の製造方法 |
| EP1651627A2 (en) * | 2003-07-15 | 2006-05-03 | Ranbaxy Laboratories Limited | Process for preparation of oxetan-2-ones |
| CA2672687A1 (en) | 2004-07-08 | 2006-02-16 | Merck & Co., Inc. | Formation of tetra-substituted enamides and stereoselective reduction thereof |
| WO2006090377A1 (en) * | 2005-02-22 | 2006-08-31 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | One-pot non-symmetric heterobifunctional coupling of organic molecules through malonic acid derivatives |
| ES2409206T3 (es) * | 2005-04-15 | 2013-06-25 | Dsm Ip Assets B.V. | Fabricación de tiolactonas |
| US20080113325A1 (en) * | 2006-11-09 | 2008-05-15 | Sony Ericsson Mobile Communications Ab | Tv out enhancements to music listening |
| CN101066924B (zh) * | 2007-06-08 | 2011-01-12 | 中国科学院上海有机化学研究所 | 2-己基-3-羟基-5-r1氧基十六羧酸r2酯,制备方法及用于制备减肥药物奥利司他的用途 |
| KR101076680B1 (ko) * | 2007-11-01 | 2011-10-26 | 한미홀딩스 주식회사 | (6r)-3-헥실-4-히드록시-6-운데실-5,6-다이히드로피란-2-온의 제조방법 및 이에 사용되는 중간체 |
| JP2012512221A (ja) | 2008-12-16 | 2012-05-31 | エフ.ホフマン−ラ ロシュ アーゲー | ピロリジン−3−カルボン酸の製造方法 |
| EP3438115B1 (en) * | 2010-05-21 | 2020-01-29 | Firmenich SA | Ruthenium based complexes |
| US8575346B2 (en) * | 2010-06-22 | 2013-11-05 | Firmenich Sa | Ruthenium based complexes |
| US8598925B1 (en) * | 2012-07-16 | 2013-12-03 | Nanowave Technologies Inc. | Frequency determination circuit and method |
| JP7161316B2 (ja) | 2018-06-11 | 2022-10-26 | クノールブレムゼ商用車システムジャパン株式会社 | 不純物分離装置 |
| AU2023303813A1 (en) | 2022-07-04 | 2024-11-14 | F. Hoffmann-La Roche Ag | Process for the preparation of [ru(oac)2(ligand)] catalysts |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3620467A1 (de) * | 1985-06-20 | 1987-01-02 | Ciba Geigy Ag | Verfahren zur herstellung von (beta)-lactamen und (beta)-lactame |
| ES2021058B3 (es) * | 1986-10-24 | 1991-10-16 | Merck & Co Inc | Procedimiento para la sintesis de una azetidinona quiral. |
| EP0333268A1 (en) * | 1988-03-18 | 1989-09-20 | Merck & Co. Inc. | Process for synthesis of a chiral 3-beta hydrogen (3R) 4-aroyloxy azetidinone |
| DE59009670D1 (de) * | 1989-05-18 | 1995-10-26 | Hoffmann La Roche | Phosphorverbindungen. |
| CA2035972C (en) * | 1990-02-23 | 2006-07-11 | Martin Karpf | Process for the preparation of oxetanones |
| JPH04316538A (ja) * | 1991-01-22 | 1992-11-06 | Chisso Corp | 光学活性3,5−アンチ−ジヒドロキシカルボン酸エステル誘導体の製造法 |
| WO1992014692A1 (en) * | 1991-02-11 | 1992-09-03 | Rhone-Poulenc Rorer International (Holdings) Inc. | Enantioselective preparation of acetylenic or olefinic substituted cycloalkenyl dihydroxybutyrates and 4-hydroxy-tetrahydropyran-2-ones |
| DE19636974A1 (de) * | 1996-09-12 | 1998-03-19 | Hoechst Ag | 2-Cyano-3,5-dihydroxy-hex-2-en- carbonsäureamidderivate |
| JP3445074B2 (ja) * | 1996-09-20 | 2003-09-08 | 高砂香料工業株式会社 | ルテニウム−ホスフィン錯体の製造方法 |
| JP2002513424A (ja) * | 1997-07-11 | 2002-05-08 | ファルマシア・アンド・アップジョン・カンパニー | チアジアゾリルおよびオキサジアゾリルフェニルオキサゾリジノン抗菌剤 |
| ES2221199T3 (es) * | 1997-09-11 | 2004-12-16 | PHARMACIA & UPJOHN COMPANY | Procedimiento para preparar derivados de 4-hidroxi-2-oxo-pirano utiles como inhibidores de proteasa. |
| US6552204B1 (en) * | 2000-02-04 | 2003-04-22 | Roche Colorado Corporation | Synthesis of 3,6-dialkyl-5,6-dihydro-4-hydroxy-pyran-2-one |
-
2000
- 2000-09-22 US US09/668,799 patent/US6552204B1/en not_active Expired - Lifetime
-
2001
- 2001-01-04 JO JO20013A patent/JO2249B1/en active
- 2001-01-26 DK DK01101636T patent/DK1127886T3/da active
- 2001-01-26 AT AT01101636T patent/ATE239716T1/de active
- 2001-01-26 EP EP01101636A patent/EP1127886B1/en not_active Expired - Lifetime
- 2001-01-26 DE DE60100238T patent/DE60100238T2/de not_active Expired - Lifetime
- 2001-01-26 ES ES01101636T patent/ES2197128T3/es not_active Expired - Lifetime
- 2001-01-31 CA CA002333192A patent/CA2333192C/en not_active Expired - Lifetime
- 2001-01-31 MX MXPA01001187A patent/MXPA01001187A/es unknown
- 2001-02-02 CN CNB011119160A patent/CN1193992C/zh not_active Expired - Lifetime
- 2001-02-05 JP JP2001027688A patent/JP2001220387A/ja active Pending
- 2001-02-05 KR KR10-2001-0005462A patent/KR100509081B1/ko active IP Right Grant
-
2004
- 2004-06-22 JP JP2004183222A patent/JP4666454B2/ja not_active Expired - Fee Related
-
2008
- 2008-12-11 JP JP2008315718A patent/JP5173775B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| US6552204B1 (en) | 2003-04-22 |
| JO2249B1 (en) | 2004-10-07 |
| ES2197128T3 (es) | 2004-01-01 |
| ATE239716T1 (de) | 2003-05-15 |
| EP1127886A1 (en) | 2001-08-29 |
| JP4666454B2 (ja) | 2011-04-06 |
| JP5173775B2 (ja) | 2013-04-03 |
| KR20010078336A (ko) | 2001-08-20 |
| MXPA01001187A (es) | 2002-06-04 |
| CN1193992C (zh) | 2005-03-23 |
| DK1127886T3 (da) | 2003-09-01 |
| EP1127886B1 (en) | 2003-05-07 |
| JP2001220387A (ja) | 2001-08-14 |
| CA2333192A1 (en) | 2001-08-04 |
| JP2009173635A (ja) | 2009-08-06 |
| DE60100238T2 (de) | 2004-04-01 |
| CA2333192C (en) | 2007-01-23 |
| DE60100238D1 (de) | 2003-06-12 |
| JP2004346078A (ja) | 2004-12-09 |
| KR100509081B1 (ko) | 2005-08-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1319596A (zh) | 3,6-二烷基5,6-二氢-4-羟基-2h-吡喃-2-酮的合成 | |
| CN1291996C (zh) | 作为复分解反应(予)催化剂的钌络合物 | |
| CN1080256C (zh) | 新的β-内酰胺类及制备紫杉烷的方法 | |
| CN1239493C (zh) | 3,6-二烷基-5,6-二氢-4-羟基-吡喃-2-酮的合成方法 | |
| CN1200731A (zh) | 半合成塔三烷用的中间体及其制备方法 | |
| CN1956951A (zh) | 制备二苯基氮杂环丁烷酮衍生物的方法 | |
| CN1183090C (zh) | 制备环丙基丙烯酸衍生物的方法 | |
| CN1092416A (zh) | 具有丁烯基取代的侧链的紫杉烷及含有它们的药物组合物 | |
| CN1095830C (zh) | 制备烷氧基亚氨基乙酰胺衍生物的方法 | |
| JP4139334B2 (ja) | 新規ボロネートエステル | |
| CN1179955C (zh) | 制备紫杉醇及其衍生物的方法 | |
| CN1261428C (zh) | 用于生产海绵内酯和海绵内酯类似物的中间体的制备方法 | |
| CN1918168A (zh) | 制备3-o-保护吗啡酮和3-o-保护吗啡酮二烯醇羧酸酯的方法 | |
| CN1538954A (zh) | 用于合成埃坡霉素及其衍生物并经保护的3,5-二羟基-2,2-二甲基-戊腈及其制备方法和应用 | |
| CN1495189A (zh) | 亚磷酸酯和过渡金属配合物的制备方法 | |
| CN1639172A (zh) | 用于不对称烯丙基化反应、羟醛反应、串联羟醛反应和烯丙基化反应的试剂 | |
| CN1709864A (zh) | 一种紫杉醇及其类似物侧链的合成方法 | |
| CN1102644A (zh) | 缩合吡啶型甲羟戊酸内酯中间体及其制备方法 | |
| KR20200042861A (ko) | 규소 화합물의 제조 방법 및 규소 화합물 | |
| CN1538952A (zh) | 用于合成埃坡霉素及其衍生物并经保护的3,5-二羟基-2,2-二甲基-戊酰胺及其制备方法和应用 | |
| CN1098087A (zh) | 5-甲酰戊酸酯的制备方法 | |
| CN1221505C (zh) | 制备链烷二醇衍生物方法 | |
| CN101056843A (zh) | 大环状酮类的制造方法及其中间体 | |
| CN101080416A (zh) | 噻吩苷衍生物的制备方法 | |
| CN1735589A (zh) | 4-羟基异亮氨酸的非对映异构体和对映异构体及其衍生物的制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| TR01 | Transfer of patent right | ||
| TR01 | Transfer of patent right |
Effective date of registration: 20180629 Address after: Greifswald, Germany Patentee after: Koplar Pharmaceutical Pharmaceutical Company Limited Address before: Basel Patentee before: F. Hoffmann-La Roche AG |
|
| CX01 | Expiry of patent term | ||
| CX01 | Expiry of patent term |
Granted publication date: 20050323 |