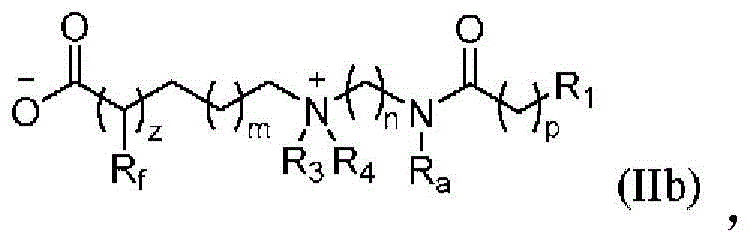CN109414408B - 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 - Google Patents
阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 Download PDFInfo
- Publication number
- CN109414408B CN109414408B CN201780041000.8A CN201780041000A CN109414408B CN 109414408 B CN109414408 B CN 109414408B CN 201780041000 A CN201780041000 A CN 201780041000A CN 109414408 B CN109414408 B CN 109414408B
- Authority
- CN
- China
- Prior art keywords
- substituted
- alkyl
- alkanediyl
- compound
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/06—Phosphorus compounds without P—C bonds
- C07F9/08—Esters of oxyacids of phosphorus
- C07F9/09—Esters of phosphoric acids
- C07F9/091—Esters of phosphoric acids with hydroxyalkyl compounds with further substituents on alkyl
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/543—Lipids, e.g. triglycerides; Polyamines, e.g. spermine or spermidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6905—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion
- A61K47/6911—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion the form being a liposome
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
- A61K48/0033—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid the non-active part being non-polymeric
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/02—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C229/04—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being acyclic and saturated
- C07C229/06—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being acyclic and saturated having only one amino and one carboxyl group bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/02—Sulfonic acids having sulfo groups bound to acyclic carbon atoms
- C07C309/03—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton
- C07C309/13—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing nitrogen atoms, not being part of nitro or nitroso groups, bound to the carbon skeleton
- C07C309/14—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing nitrogen atoms, not being part of nitro or nitroso groups, bound to the carbon skeleton containing amino groups bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/30—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/31—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atoms of the sulfonamide groups bound to acyclic carbon atoms
- C07C311/32—Sulfonamides, the carbon skeleton of the acid part being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups having the sulfur atoms of the sulfonamide groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/06—Phosphorus compounds without P—C bonds
- C07F9/08—Esters of oxyacids of phosphorus
- C07F9/09—Esters of phosphoric acids
- C07F9/10—Phosphatides, e.g. lecithin
- C07F9/106—Adducts, complexes, salts of phosphatides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/88—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation using microencapsulation, e.g. using amphiphile liposome vesicle
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/20—Type of nucleic acid involving clustered regularly interspaced short palindromic repeats [CRISPR]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Nanotechnology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Crystallography & Structural Chemistry (AREA)
- Medical Informatics (AREA)
- Dispersion Chemistry (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Steroid Compounds (AREA)
Abstract
Description
背景
本申请要求2016年5月16日提交的美国临时申请No.62/337,196的优先权,其全部内容通过引用并入本文。
1.技术领域
本公开一般地涉及脂质和纳米粒领域。特别地,其涉及包含核酸的组合物。更特别地,其涉及用于递送核酸的脂质组合物。
2.背景技术
许多遗传病可通过核酸治疗剂来纠正。然而,这些治疗需要递送系统以将核酸药物运输到细胞中。一直在寻找最佳的递送载体。含有阳离子/可离子化脂质、胆固醇、脂质PEG和结构脂质(例如DSPC)的配制脂质纳米粒(lipid nanoparticle,LNP)是目前最有效的siRNA递送系统,并且用于2期和3期临床试验。然而,需要新的脂质、树枝状聚合物和脂质样物质来解决未来的治疗目标并克服当前现有材料的限制。
可递送核酸(siRNA、miRNA、mRNA、CRISPR、tRNA、sgRNA、tracRNA等)的材料具有治疗重要性。鉴于成功递送的众多障碍,对于可递送核酸治疗剂的新材料仍存在巨大的治疗需求。
发明内容
在一些方面,本公开内容提供了下式的化合物或其可药用盐:
其中:
X1是-S(O)2O-、-OP(O)OReO-、-(CHRf)zC(O)O-或-NRgRhRi +,其中:
Re、Rg、Rh和Ri各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);
Rf是氢、氨基、羟基,或烷基(C≤12)、芳基(C≤12)、芳烷基(C≤12)、杂芳基(C≤12)、酰基(C≤12)、烷氧基(C≤12)、酰氧基(C≤12)、酰氨基(C≤12)、烷氧基(C≤12)、烷氧基(C≤12)或后十种基团中任一种的经取代形式;并且
z是1、2、3或4;
Y1是烷二基(C≤12)、烯二基(C≤12)、芳二基(C≤12)、杂芳二基(C≤12)、杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)-烷二基(C≤8)、-烷二基(C≤8)-杂芳二基(C≤12)、-烷二基(C≤8)-杂芳二基(C≤12)-烷二基(C≤8)或这些基团中任一种的经取代形式;
Z1是-N+R3R4-或-OP(O)O-O-
A是-NRa-、-S-或-O-;其中:
Ra是氢、烷基(C≤6)或经取代烷基(C≤6),或者Ra与R3或R4合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)或-Z2A′R7;
其中:
Z2是烷二基(C≤6)、经取代烷二基(C≤6)或下式的基团:
其中:
Z5和Z6各自独立地是烷二基(C≤6)或经取代烷二基(C≤6);
X2和X3各自独立地是-O-、-S-或-NRm-;
其中:
Rm是氢、烷基(C≤6)或经取代烷基(C≤6);并且a是0、1、2、3、4、5或6;
A′是-CHRj-、-S-、-C(O)O-或-C(O)NRb-;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rj是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-Z3A”R8;其中:
Z3是烷二基(C≤6)、经取代烷二基(C≤6)或下式的基团:
其中:
Z7和Z8各自独立地是烷二基(C≤6)或经取代烷二基(C≤6);
X4和X5各自独立地是-O-、-S-或-NRn-;其中:
Rn是氢、烷基(C≤6)或经取代烷基(C≤6);并且b是0、1、2、3、4、5或6;
A”是-CHRk-、-S-、-C(O)O-或-C(O)NR1-;
R1是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
q是1、2或3;并且
r是1、2、3或4;
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)、烷氧二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)或-Z4A”’R12;其中:
Z4是烷二基(C≤6)、经取代烷二基(C≤6)或下式的基团:
其中:
Z9和Z10各自独立地是烷二基(C≤6)或经取代烷二基(C≤6);
X6和X7各自独立地是-O-、-S-或-NRo-;其中:
Ro是氢、烷基(C≤6)或经取代烷基(C≤6);并且
c是0、1、2、3、4、5或6;
A”’是-CHRk-、-S-、-C(O)O-或-C(O)NR1-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是0、1、2、3或4;
R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6),或者R3或R4与Ra合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数;
前提是如果X1带正电荷,则Z1带负电荷,并且如果X1带负电荷,则Z1带正电荷。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
Y1是烷二基(C≤12)、烯二基(C≤12)、芳二基(C≤12)、杂芳二基(C≤12)、杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)-烷二基(C≤8)、-烷二基(C≤8)-杂芳二基(C≤12)、-烷二基(C≤8)-杂芳二基(C≤12)-烷二基(C≤8)或这些基团中任一种的经取代形式;
A是-NRa-、-S-或-O-;其中:
Ra是氢、烷基(C≤6)或经取代烷基(C≤6),或者Ra与R3或R4合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1、2、3或4;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
q是1、2或3;并且
r是1、2、3或4;
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;
R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6),或者R3或R4与Ra合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
Y1是烷二基(C≤12)、杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)-烷二基(C≤8)或这些基团中任一种的经取代形式;
A是-NRa-或-O-;其中:
Ra是氢、烷基(C≤6)或经取代烷基(C≤6),或者Ra与R3或R4合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)或-Z2A′R7;
其中:
Z2是烷二基(C≤4)或经取代烷二基(C≤4);
A′是-CHRj-、-C(O)O-或-C(O)NRb-;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rj是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-Z3A”R8;其中:
Z3是烷二基(C≤4)或经取代烷二基(C≤4);
A”是-CHRk-、-C(O)O-或-C(O)NR1-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
q是1、2或3;并且
r是1、2、3或4;
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)、烷氧二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)或-Z4A”’R12;其中:
Z4是烷二基(C≤4)或经取代烷二基(C≤4);
A”’是-CHRk-、-C(O)O-或-C(O)NR1-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;
R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6),或者R3或R4与Ra合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
Y1是烷二基(C≤12)、杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)、-烷二基(C≤8)-杂环烷二基(C≤12)-烷二基(C≤8)或这些基团中任一种的经取代形式;
A是-NRa-或-O-;其中:
Ra是氢、烷基(C≤6)或经取代烷基(C≤6),或者Ra与R3或R4合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1、2、3或4;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
q是1、2或3;并且
r是1、2、3或4;
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;
R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6),或者R3或R4与Ra合在一起并且是烷二基(C≤8)、烯二基(C≤8)、烷氧二基(C≤8)、烷氨二基(C≤8)或这些基团中任一种的经取代形式;并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)或-Z2A′R7;其中:
Z2是烷二基(C≤4)或经取代烷二基(C≤4);
A′是-CHRj-、-C(O)O-或-C(O)NRb-;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rj是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-Z3A”R8;其中:
Z3是烷二基(C≤4)或经取代烷二基(C≤4);
A”是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
q是1、2或3;并且
r是1、2、3或4;
Ra、R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1、2、3或4;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
q是1、2或3;并且
r是1、2、3或4;
Ra、R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1、2、3或4;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
q是1、2或3;并且
r是1、2、3或4;并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1、2、3或4;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和R2各自独立地是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
q是1、2或3;并且
r是1、2、3或4。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
R5是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;
其中:
t是1或2;并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
R6是烷基(C≤8)或经取代烷基(C≤8);并且
R2是-烷二基(C≤6)-NR’R”或该基团的经取代形式,其中:
R’和R”各自独立地是-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1或2;并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
q是1或2;并且
r是1或2。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
R5是烷基(C≤8)或经取代烷基(C≤8);
R6是-烷二基(C≤6)-NR’R”或该基团的经取代形式,其中:
R’和R”各自独立地是烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1或2;并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
R2是-烷二基(C≤6)-NR’R”或该基团的经取代形式,其中:
R’和R”各自独立地是烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1或2;并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
q是1或2;并且
r是1或2。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
R5是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;其中:
t是1或2;并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
R6是-烷二基(C≤6)-NR’R”或该基团的经取代形式;其中:
R’和R”各自独立地是-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1或2;并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
R2是-烷二基(C≤6)-NR’R”或该基团的经取代形式;其中:
R’和R”各自独立地是-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1或2;并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
q是1或2;并且
r是1或2。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)、烷氧二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)或-Z4A”’R12;其中:
Z4是烷二基(C≤4)或经取代烷二基(C≤4);
A”’是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;
Ra、R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在另一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;
Ra、R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
Y2是杂环烷二基(C≤12)或经取代杂环烷二基(C≤12);
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是下式的基团:
其中:
Y2是杂环烷二基(C≤12)或经取代杂环烷二基(C≤12);
R9、R10和R11各自独立地选自氢、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NH)R12;其中:
u是1或2;并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
Rf是氢、氨基、羟基,或烷基(C≤12)、芳基(C≤12)、芳烷基(C≤12)、杂芳基(C≤12)、酰基(C≤12)、烷氧基(C≤12)、酰氧基(C≤12)、酰氨基(C≤12)、烷氧基(C≤12)、烷氧基(C≤12)或后十种基团中任一种的经取代形式;
z是1、2、3或4;
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)、烷氧二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)或-Z4A”’R12;其中:
Z4是烷二基(C≤4)或经取代烷二基(C≤4);
A”’是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;
Ra、R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
Re是氢、烷基(C≤6)或经取代烷基(C≤6);
R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)、烷氧二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)或-Z4A”’R12;其中:
Z4是烷二基(C≤4)或经取代烷二基(C≤4);
A”’是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4;
Ra、R3和R4各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m、n和p各自独立地是选自0、1、2、3、4、5或6的整数。
在一些实施方案中,Ra是氢。在另一些实施方案中,Ra是烷基(C≤8)或经取代烷基(C≤8)。在一些实施方案中,R3是氢。在另一些实施方案中,R3是烷基(C≤8)或经取代烷基(C≤8)。R3可以是烷基(C≤8),例如甲基。在一些实施方案中,R4是氢。在另一些实施方案中,R4是烷基(C≤8)或经取代烷基(C≤8)。R4可以是烷基(C≤8),例如甲基。
在一些实施方案中m是1或2。在一个实例中,m是1。在另一个实例中,m是2。在一些实施方案中n是2或3。在一个实例中,n是2。在另一个实例中,n是3。在一些实施方案中,p是1、2或3。在一个实例中,p是1。在另一个实例中,p是2。在另一个实例中,p是3。
在一些实施方案中,R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)、-Z2A′R7;
其中:
Z2是烷二基(C≤4)或经取代烷二基(C≤4);
A′是-CHRj-、-C(O)O-或-C(O)NRb-;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rj是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和X1各自独立地是-Z3A”’R8;其中:
Z3是烷二基(C≤4)或经取代烷二基(C≤4);
A”是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);
q是1、2或3;并且
r是1、2、3或4。
在一些实施方案中,R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢或烷基(C≤8)、-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)、-烷二基(C≤6)-NR’R”或这些基团中任一种的经取代形式,其中:
R’和R”各自独立地是氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1、2、3或4;
Rb是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R7是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
R5、R6和X1各自独立地是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8、-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);或
q是1、2或3;并且
r是1、2、3或4。
在一些实施方案中,q是1或2。在一个实例中,q是1。在另一个实例中,q是2。在一些实施方案中,r是1或2。在一个实例中,r是1。在另一个实例中,r是2。在一些实施方案中,R5是氢。在另一些实施方案中,R5是烷基(C≤8)或经取代烷基(C≤8)。R5可以是烷基(C≤8),例如甲基或异内基。
在一些实施方案中,R5进一步限定为-Z3A”R8;其中:
Z3是烷二基(C≤4)或经取代烷二基(C≤4);
A”是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);并且R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,Z3是烷二基(C1-2)。在一个实例中,Z3是-CH2-。在一些实施方案中,Z3是经取代烷二基(C1-2)。在一个实例中,Z3是-CH2CH(OH)。在一些实施方案中,A”是-CHRk-。在一个实例中,Rk是羟基。在一些实施方案中,Rk是酰氧基(C≤24)或经取代酰氧基(C≤24)。在一些实施方案中,Rk是酰氧基(C1-8)或经取代酰氧基(C1-8)。在一些实施方案中,Rk是酰氧基(C≤12-24)或经取代酰氧基(C≤12-24)。在一个实例中,A”是-C(O)O-。在另一个实例中,A”是-C(O)NH-。
在另一些实施方案中,R5是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8或-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,R5是-(CH2)tCH(OH)R8。在另一些实施方案中,R5是-(CH2)tC(O)OR8。在另一些实施方案中,R5是-(CH2)tC(O)(NRc)R8。在一些实施方案中,t是1或2。在一个实例中,t是1。在另一个实例中,t是2。在一些实施方案中,Rc是氢。在另一些实施方案中,Rc是烷基(C≤6)或经取代烷基(C≤6)。在一些实施方案中,R8是烷基(C6-24)或经取代烷基(C6-24)。R8可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R8是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R6是-Z3A”R8;其中:
Z3是烷二基(C≤4)或经取代烷二基(C≤4);
A”是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,Z3是烷二基(C1-2)。在一个实例中,Z3是-CH2-。在一些实施方案中,Z3是经取代烷二基(C1-2)。在一个实例中,Z3是-CH2CH(OH)。在一些实施方案中,A”是-CHRk-。在一个实例中,Rk是羟基。在一些实施方案中,Rk是酰氧基(C≤24)或经取代酰氧基(C≤24)。在一些实施方案中,Rk是酰氧基(C1-8)或经取代酰氧基(C1-8)。在一些实施方案中,Rk是酰氧基(C≤12-24)或经取代酰氧基(C≤12-24)。在一个实例中,A”是-C(O)O-。在另一个实例中,A”是-C(O)NH-。在一些实施方案中,R8是烷基(C6-24)或经取代烷基(C6-24)。R8可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R8是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R6是氢。在另一些实施方案中,R6是烷基(C≤8)或经取代烷基(C≤8)。R6可以是烷基(C≤8),例如甲基或异丙基。在另一些实施方案中,R6是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8或-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,R6是-(CH2)tCH(OH)R8。在另一些实施方案中,R6是-(CH2)tC(O)OR8。在另一些实施方案中,R6是-(CH2)tC(O)(NRc)R8。在一些实施方案中,t是1或2。在一个实例中,t是1。在另一个实例中,t是2。在一些实施方案中,Rc是氢。在一些实施方案中,Rc是烷基(C≤6)或经取代烷基(C≤6)。在一些实施方案中,R8是烷基(C6-24)或经取代烷基(C6-24)。R8可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R8是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R6是-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)或这些基团中任一种的经取代形式。在一些实施方案中,R6是-烷二基(C≤6)-NH2或该基团的经取代形式,例如-CH2CH2NH2。在另一些实施方案中,R6是-烷二基(C≤6)-烷基氨基(C≤8)或该基团的经取代形式,例如-CH2CH2NHMe或-CH2CH2NHiPr。在另一些实施方案中,R6是-烷二基(C≤6)-二烷基氨基(C≤8)或该基团的经取代形式。
在一些实施方案中,R2是氢。在另一些实施方案中,R2是烷基(C≤8)或经取代烷基(C≤8)。R2可以是烷基(C≤8),例如甲基或异丙基。
在一些实施方案中,R2是-Z3A”R8;其中:
Z3是烷二基(C≤4)或经取代烷二基(C≤4);
A”是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,Z3是烷二基(C1-2)。在一个实例中,Z3是-CH2-。在一些实施方案中,Z3是经取代烷二基(C1-2)。在一个实例中,Z3是-CH2CH(OH)。在一些实施方案中,A”是-CHRk-。在一个实例中,Rk是羟基。在一些实施方案中,Rk是酰氧基(C≤24)或经取代酰氧基(C≤24)。在一些实施方案中,Rk是酰氧基(C1-8)或经取代酰氧基(C1-8)。在一些实施方案中,Rk是酰氧基(C≤12-24)或经取代酰氧基(C≤12-24)。在一个实例中,A”是-C(O)O-。在另一个实例中,A”是-C(O)NH-。在一些实施方案中,R8是烷基(C6-24)或经取代烷基(C6-24)。R8可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R8是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R2是-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)或这些基团中任一种的经取代形式。在一些实施方案中,R2是-烷二基(C≤6)-NH2或该基团的经取代形式,例如-CH2CH2NH2。在另一些实施方案中,R2是-烷二基(C≤6)-烷基氨基(C≤8)或该基团的经取代形式,例如-CH2CH2NHMe或-CH2CH2NHiPr。在另一些实施方案中,R2是-烷二基(C≤6)-二烷基氨基(C≤8)或该基团的经取代形式。
在另一些实施方案中,R2是-(CH2)tCH(OH)R8、-(CH2)tC(O)OR8或-(CH2)tC(O)(NRc)R8;其中:
t是1、2、3或4;
Rc是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R8是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,R2是-(CH2)tCH(OH)R8。在另一些实施方案中,R2是-(CH2)tC(O)OR8。在另一些实施方案中,R2是-(CH2)tC(O)(NRc)R8。在一些实施方案中,t是1或2。在一个实例中,t是1。在另一个实例中,t是2。在一些实施方案中,Rc是氢。在一些实施方案中,Rc是烷基(C≤6)或经取代烷基(C≤6)。在一些实施方案中,R8是烷基(C6-24)或经取代烷基(C6-24)。R8可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R8是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R2是-烷二基(C≤6)-NH2、-烷二基(C≤6)-烷基氨基(C≤8)、-烷二基(C≤6)-二烷基氨基(C≤12)或这些基团中任一种的经取代形式。在一些实施方案中,R2是-烷二基(C≤6)-NH2或该基团的经取代形式,例如-CH2CH2NH2。在另一些实施方案中,R2是-烷二基(C≤6)-烷基氨基(C≤8)或该基团的经取代形式,例如-CH2CH2NHMe或-CH2CH2NHiPr。在另一些实施方案中,R2是-烷二基(C≤6)-二烷基氨基(C≤8)或该基团的经取代形式。
在一些实施方案中,R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)、烷氧二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)或-Z4A”’R12;其中:
Z4是烷二基(C≤4)或经取代烷二基(C≤4);
A”’是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);
并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4。
在一些实施方案中,R1是下式的基团:
其中:
Y2是芳二基(C≤12)、杂环烷二基(C≤12)、杂芳二基(C≤12)或这些基团中任一种的经取代形式;
R9、R10和R11各自独立地选自氢、烷基(C≤8)、经取代烷基(C≤8)、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24);并且
x和y是1、2、3或4。
在一些实施方案中,Y2是杂环烷二基(C≤12)或经取代杂环烷二基(C≤12)。Y2可以是杂环烷二基(C≤12),例如哌嗪二基。在另一些实施方案中,Y2是杂芳二基(C≤12)或经取代杂芳二基(C≤12)。在另一些实施方案中,Y2是芳二基(C≤12)或经取代芳二基(C≤12)。在一些实施方案中,Y2是烷氧二基(C≤12)或经取代烷氧二基(C≤12)。在一些实施方案中x是2或3。在一个实例中,x是2。在另一个实例中,x是3。在一些实施方案中y是2或3。在一个实例中,y是2。在另一个实例中,y是3。
在一些实施方案中,R9是-Z4A”’R12;其中:
Z4是烷二基(C≤4)或经取代烷二基(C≤4),
A”’是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);并且
R12是烷基(C6-24、经取代烷基(C6-24、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,Z4是烷二基(C1-2)。在一个实例中,Z4是-CH2-。在一些实施方案中,Z4是经取代烷二基(C1-2)。在一个实例中,Z4是-CH2CH(OH)。在一些实施方案中,A”’是-CHRk-。在一个实例中,Rk是羟基。在一些实施方案中,Rk是酰氧基(C≤24)或经取代酰氧基(C≤24)。在一些实施方案中,Rk是酰氧基(C1-8)或经取代酰氧基(C1-8)。在一些实施方案中,Rk是酰氧基(C≤12-24)或经取代酰氧基(C≤12-24)。在一个实例中,A”’是-C(O)O-。在另一个实例中,A”’是-C(O)NH-。在一些实施方案中,R12是烷基(C6-24)或经取代烷基(C6-24)。R12可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R12是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R9是-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,R9是-(CH2)uCH(OH)R12。在另一些实施方案中,R9是-(CH2)uC(O)OR12。在另一些实施方案中,R9是-(CH2)uC(O)(NRd)R12。在一些实施方案中,u是1、2或3。在一些实施方案中,u是1或2。在一个实例中,u是1。在另一个实例中,u是2。在一些实施方案中,Rd是氢。在另一些实施方案中,Rd是烷基(C≤6)或经取代烷基(C≤6)。在一些实施方案中,R12是烷基(C6-24)或经取代烷基(C6-24)。R12可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在另一些实施方案中,R12是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R10是-Z4A”’R12;其中:
Z4是烷二基(C≤6)或经取代烷二基(C≤6),
A”’是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,Z4是烷二基(C1-2)。在一个实例中,Z4是-CH2-。在一些实施方案中,Z4是经取代烷二基(C1-2)。在一个实例中,Z4是-CH2CH(OH)。在一些实施方案中,A”’是-CHRk-。在一个实例中,Rk是羟基。在一些实施方案中,Rk是酰氧基(C≤24)或经取代酰氧基(C≤24)。在一些实施方案中,Rk是酰氧基(C1-8)或经取代酰氧基(C1-8)。在一些实施方案中,Rk是酰氧基(C≤12-24)或经取代酰氧基(C≤12-24)。在一个实例中,A”’是-C(O)O-。在另一个实例中,A”’是-C(O)NH-。在一些实施方案中,R12是烷基(C6-24)或经取代烷基(C6-24)。R12可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R12是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R10是-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,R10是-(CH2)uCH(OH)R12。在另一些实施方案中,R10是-(CH2)uC(O)OR12。在另一些实施方案中,R10是-(CH2)uC(O)(NRd)R12。在一些实施方案中,u是1、2或3。在一些实施方案中,u是1或2。在一个实例中,u是1。在另一个实例中,u是2。在一些实施方案中,Rd是氢。在另一些实施方案中,Rd是烷基(C≤6)或经取代烷基(C≤6)。在一些实施方案中,R12是烷基(C6-24)或经取代烷基(C6-24)。R12可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在另一些实施方案中,R12是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R11是-Z4A”’R12;其中:
Z4是烷二基(C≤6)或经取代烷二基(C≤6),
A”’是-CHRk-、-C(O)O-或-C(O)NRl-;
Rl是氢、烷基(C≤6)或经取代烷基(C≤6);并且
Rk是氢、卤素、羟基、酰氧基(C≤24)或经取代酰氧基(C≤24);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,Z4是烷二基(C1-2)。在一个实例中,Z4是-CH2-。在一些实施方案中,Z4是经取代烷二基(C1-2)。在一个实例中,Z4是-CH2CH(OH)。在一些实施方案中,A”’是-CHRk-。在一个实例中,Rk是羟基。在一些实施方案中,Rk是酰氧基(C≤24)或经取代酰氧基(C≤24)。在一些实施方案中,Rk是酰氧基(C1-8)或经取代酰氧基(C1-8)。在一些实施方案中,Rk是酰氧基(C≤12-24)或经取代酰氧基(C≤12-24)。在一个实例中,A”’是-C(O)O-。在另一个实例中,A”’是-C(O)NH-。在一些实施方案中,R12是烷基(C6-24)或经取代烷基(C6-24)。R12可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在一些实施方案中,R12是烯基(C6-24)或经取代烯基(C6-24)。
在一些实施方案中,R11是-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);并且
R12是烷基(C6-24)、经取代烷基(C6-24)、烯基(C6-24)、经取代烯基(C6-24)。
在一些实施方案中,R11是-(CH2)uCH(OH)R12。在另一些实施方案中,R11是-(CH2)uC(O)OR12。在另一些实施方案中,R11是-(CH2)uC(O)(NRd)R12。在一些实施方案中,u是1、2或3。在一些实施方案中,u是1或2。在一个实例中,u是1。在另一个实例中,u是2。在一些实施方案中,Rd是氢。在另一些实施方案中,Rd是烷基(C≤6)或经取代烷基(C≤6)。在一些实施方案中,R12是烷基(C6-24)或经取代烷基(C6-24)。R12可以是烷基(C6-24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在另一些实施方案中,R12是烯基(C6-24)或经取代烯基(C6-24)。
在另一方面,本公开内容提供了下式的化合物或其可药用盐:
其中:
R1、R2和R3各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R7和R8各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式;
q是1、2或3;并且
r是0、1、2、3或4;
R4、R5和R6各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6),或者R4与R5或R6合在一起并且是烷二基(C≤12)、烷氧二基(C≤12)、烷氨二基(C≤12)或这些基团中任一种的经取代形式;并且
m和n各自独立地是1、2、3、4或5。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R7和R8各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式;
q是1、2或3;并且
r是0、1、2、3或4;
R4、R5和R6各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6),或者R4与R5或R6合在一起并且是烷二基(C≤12)、烷氧二基(C≤12)、烷氨二基(C≤12)或这些基团中任一种的经取代形式;并且
m和n各自独立地是1、2、3、4或5。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1、R2和R3各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R7和R8各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式;
q是1、2或3;并且
r是0、1、2、3或4;
R5和R6各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m和n各自独立地是1、2、3、4或5。
在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R1、R2和R3各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R7和R8各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式;
q是1、2或3;并且
r是0、1、2、3或4;
R5和R6各自独立地是氢、烷基(C≤6)或经取代烷基(C≤6);并且
m和n各自独立地是1、2、3、4或5。
在一些实施方案中,R2是氢。在另一些实施方案中,R2是烷基(C≤6)或经取代烷基(C≤6)。R2可以是烷基(C≤6),例如甲基或乙基。在另一些实施方案中,R2是下式的基团:
其中:
R7和R8各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式;
q是1、2或3;并且
r是0、1、2、3或4。
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式。
在一些实施方案中,R9是卤素,例如氯或溴。在另一些实施方案中,R9是羟基。在另一些实施方案中,R9是烷氧基(C≤8)或经取代烷氧基(C≤8)。R9可以是烷氧基(C≤8),例如甲氧基。在一些实施方案中,R9是酰氧基(C≤8)或经取代酰氧基(C≤8)。R9可以是酰氧基(C≤8),例如乙酰氧基或新戊酰氧基。在一些实施方案中,R10是烷基(C≤24)或经取代烷基(C≤24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在另一些实施方案中,R10是烯基(C≤24)或经取代烯基(C≤24)。
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式。
在一些实施方案中,R9是卤素,例如氯或溴。在另一些实施方案中,R9是羟基。在另一些实施方案中,R9是烷氧基(C≤8)或经取代烷氧基(C≤8)。R9可以是烷氧基(C≤8),例如甲氧基。在一些实施方案中,R9是酰氧基(C≤8)或经取代酰氧基(C≤8)。R9可以是酰氧基(C≤8),例如乙酰氧基或新戊酰氧基。在一些实施方案中,R10是烷基(C≤24)或经取代烷基(C≤24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在另一些实施方案中,R10是烯基(C≤24)或经取代烯基(C≤24)。
在一些实施方案中,q是1或2。在一个实例中,q是1。在另一个实例中,q是2。在一些实施方案中r是1、2或3。在一个实例中,r是1。在另一个实例中,r是2。在另一个实例中,r是3。
在一些实施方案中,R3是氢。在另一些实施方案中,R3是烷基(C≤6)或经取代烷基(C≤6)。R3可以是烷基(C≤6),例如甲基或乙基。在一些实施方案中,R4是氢。在另一些实施方案中,R4是烷基(C≤6)或经取代烷基(C≤6)。在一些实施方案中,R5是氢。在另一些实施方案中,R5是烷基(C≤6)或经取代烷基(C≤6)。R5可以是烷基(C≤6),例如甲基或乙基。在一些实施方案中,R6是氢。在另一些实施方案中,R6是烷基(C≤6)或经取代烷基(C≤6)。R6可以是烷基(C≤6),例如甲基或乙基。在一些实施方案中,m是2、3或4。在一个实例中,m是2。在另一个实例中,m是3。在另一个实例中,m是4。在一些实施方案中,n是2、3或4。在一个实例中,n是2。在另一个实例中,n是3。在又一个实例中,n是4。
在一些实施方案中,R1是氢。在另一些实施方案中,R1是烷基(C≤6)或经取代烷基(C≤6)。R1可以是烷基(C≤6),例如甲基或乙基。在另一些实施方案中,R1是下式的基团:
其中:
R7和R8各自独立地是氢、烷基(C≤6)、经取代烷基(C≤6)或下式的基团:
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式;
q是1、2或3;并且
r是0、1、2、3或4。
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式。
在一些实施方案中,R9是卤素,例如氯或溴。在另一些实施方案中,R9是羟基。在另一些实施方案中,R9是烷氧基(C≤8)或经取代烷氧基(C≤8)。R9可以是烷氧基(C≤8),例如甲氧基。在一些实施方案中,R9是酰氧基(C≤8)或经取代酰氧基(C≤8)。R9可以是酰氧基(C≤8),例如乙酰氧基或新戊酰氧基。在一些实施方案中,R10是烷基(C≤24)或经取代烷基(C≤24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在另一些实施方案中,R10是烯基(C≤24)或经取代烯基(C≤24)。
其中:
R9是氢、卤素或羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式;并且
R10是烷基(C≤24)、烯基(C≤24)或这两种基团中任一种的经取代形式。
在一些实施方案中,R9是卤素,例如氯或溴。在另一些实施方案中,R9是羟基。在另一些实施方案中,R9是烷氧基(C≤8)或经取代烷氧基(C≤8)。R9可以是烷氧基(C≤8),例如甲氧基。在一些实施方案中,R9是酰氧基(C≤8)或经取代酰氧基(C≤8)。R9可以是酰氧基(C≤8),例如乙酰氧基或新戊酰氧基。在一些实施方案中,R10是烷基(C≤24)或经取代烷基(C≤24),例如辛基、癸基、十二烷基、十四烷基、十六烷基或十八烷基。在另一些实施方案中,R10是烯基(C≤24)或经取代烯基(C≤24)。
在一些实施方案中,q是1或2。在一个实例中,q是1。在另一个方面,q是2。在一些实施方案中r是1、2或3。在一个实例中,r是1。在另一个实例中,r是1。在另一个实例中,r是3。在一些实施方案中,化合物进一步限定为以下或其可药用盐:
其中:
R11是氢、卤素、羟基,或者烷氧基(C≤8)、酰氧基(C≤8)或这两种基团中任一种的经取代形式。
在另一方面,本发明提供包含以下的组合物:
(A)根据权利要求1-274中任一项所述的化合物;以及
(B)核酸。
在一些实施方案中,核酸是治疗性核酸。在一些实施方案中,核酸是短(小)干扰RNA(siRNA)、微RNA(miRNA)、信使RNA(mRNA)、簇规则间隔短回文重复序列(clusterregularly interspaced short palindromic repeat,CRISPR)RNA(crRNA)、反式活化crRNA(tracrRNA)、单指导RNA(single guide RNA,sgRNA)、转移RNA(tRNA)、质粒DNA(pDNA)、双链DNA(dsDNA)、单链DNA(ssDNA)、单链RNA(ssRNA)、双链RNA(dsRNA)、锁核酸(locked nucleic acid,LNA)、肽核酸(peptide nucleic acid,PNA)、miRNA模拟物或抗miRNA。
在一些实施方案中,核酸是siRNA,例如可用于治疗癌症的siRNA。在另一些实施方案中,核酸是tRNA,例如可用于校正无义突变的tRNA。在另一些实施方案中,核酸是mRNA。在另一些实施方案中,核酸是sgRNA。
在一些实施方案中,组合物还包含类固醇或类固醇衍生物。在一些实施方案中,类固醇或类固醇衍生物是固醇,例如胆固醇。在一些实施方案中,组合物还包含磷脂。在一些实施方案中,磷脂是磷脂酰胆碱。在另一些实施方案中,磷脂是二硬脂酰磷脂酰胆碱。在一些实施方案中,组合物还包含PEG脂质。在一些实施方案中,PEG脂质是PEG化的二酰基甘油,例如PEG化的二豆蔻酰基-sn-甘油。在另一些实施方案中,PEG脂质是:
其中:
n1是1至250的整数;并且
n2和n3各自独立地选自5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23。
在一些实施方案中,n1为5至100。在一些实施方案中,n1为45。在一些实施方案中,n2为11、12、13、14、15、16或17。在一些实施方案中,n2为15。在一些实施方案中,n3为11、12、13、14、15、16或17。在一些实施方案中,n3为15。
在一些实施方案中,组合物包含的化合物与核酸的摩尔比为约5∶1至约100∶1。在一些实施方案中,化合物与核酸的摩尔比为约100∶1至约1000∶1。在一些实施方案中,该摩尔比为约166∶1。在另一些实施方案中,该摩尔比为约250∶1至约750∶1,例如约333∶1或约666∶1。在一些实施方案中,组合物包含的化合物与类固醇或类固醇衍生物的比例为约1∶1至约20∶1,例如约1∶1至约6∶1。在一些实施方案中,该比例为约1.3∶1。在一些实施方案中,组合物包含的化合物与磷脂的比例为约1∶1至约9∶1,例如约2.5∶1至约7.5∶1。在一些实施方案中,该比例为约5∶1。在一些实施方案中,组合物包含的化合物与PEG-脂质的比例为约2.5∶1至约100∶1,例如约7.5∶1至约50∶1。在一些实施方案中,该比例为约100∶3。在一些实施方案中,组合物包含的化合物与类固醇或类固醇衍生物与磷脂与PEG脂质的比例为约25∶57∶15∶3至约75∶19∶5∶1,例如约50∶38.5∶10∶1.5。
在一些实施方案中,组合物还包含可药用载体。在一些实施方案中,组合物配制成用于如下施用:经口、脂肪内(intraadiposally)、动脉内、关节内、颅内、皮内、病灶内、肌内、鼻内、眼内、心包内、腹膜内、胸膜内、前列腺内、直肠内、鞘内、气管内、肿瘤内、脐带内、阴道内、静脉内、囊内、玻璃体内、经脂质体、局部、经黏膜、肠胃外、经直肠、结膜下、皮下、舌下、表面、经口含化(transbuccally)、经皮、阴道、作为乳膏(in crème)、作为脂质组合物、通过导管、通过灌洗、通过连续输注、通过输注、通过吸入、通过注射、通过局部递送或通过局部灌注。在一些实施方案中,组合物配制成用于气雾剂、静脉内、腹膜内、皮下、表面或经口施用。在另一些实施方案中,组合物配制成用于注射,例如用于腹膜内注射或静脉内注射。在一些实施方案中,组合物配制成用于吸入。
在又一方面,本公开提供了在有此需要的患者中治疗疾病或病症的方法,其包括向患者施用治疗有效量的本文中所述的化合物或组合物。
在一些实施方案中,所述疾病或病症是遗传病,例如与无义突变相关的疾病。在一些实施方案中,所述疾病或病症是囊性纤维化、NGLY1缺乏、迪谢内肌营养不良(Duchenemuscular dystrophy)、地中海贫血、胡尔勒综合征(Hurler syndrome)或德拉韦综合征(Dravet syndrome)。
在一些实施方案中,所述疾病或病症是囊性纤维化。在一些实施方案中,该方法还包括第二治疗剂。在一些实施方案中,第二治疗剂是另一种囊性纤维化治疗。在一些实施方案中,第二治疗剂是可用于控制囊性纤维化的治疗剂。在一些实施方案中,第二治疗剂是抗生素、可用于使器官功能最大化的药剂、或可用于降低或改变肺的黏膜层的药剂。在一些实施方案中,第二治疗剂是吸入抗生素、经口抗生素、依伐卡托(ivacaftor)、阿法链道酶(domase alfa)、高张盐水、地纽福索(denufosol)或皮质类固醇。在一些实施方案中,该方法还包括第二治疗方式。在一些实施方案中,第二治疗方式是去除或降低痰的机械方法。
在另一些实施方案中,疾病或病症是癌症。在一些实施方案中,癌症是上皮癌、肉瘤、淋巴瘤、白血病、黑素瘤、间皮瘤、多发性骨髓瘤或精原细胞瘤。在一些实施方案中,癌症是膀胱癌、血癌、骨癌、脑癌、乳腺癌、中枢神经系统癌症、宫颈癌、结肠癌、子宫内膜癌、食管癌、胆囊癌、胃肠道癌、外生殖器癌、泌尿生殖道癌、头癌、肾癌、喉癌、肝癌、肺癌、肌肉组织癌症、颈癌、口腔或鼻黏膜癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、脾癌、小肠癌、大肠癌、胃癌、睾丸癌或甲状腺癌。在一些实施方案中,癌症是肝癌、肺癌、卵巢癌、胰腺癌、乳腺癌、白血病癌或骨癌。在一些实施方案中,癌症是肺癌或结直肠癌。在一些实施方案中,癌症在肿瘤抑制基因中具有无义突变,例如p53基因中的突变。在一些实施方案中,无义突变是肺癌中p53基因中的突变。在另一些实施方案中,无义突变位于APC基因中,例如结直肠癌中APC基因中的突变。在另一些实施方案中,无义突变位于LKB1、ERCC3、WRN、BRCA2、IDH1或ARID1A基因中。在一些实施方案中,癌症是乙型肝炎驱动的肝细胞癌。
在一些实施方案中,该方法还包括第二癌症治疗。在一些实施方案中,第二癌症治疗是第二化学治疗剂、免疫治疗、遗传治疗或外科手术。在一些实施方案中,患者是哺乳动物,例如人。在一些实施方案中,该方法包括施用组合物一次。在另一些实施方案中,该方法包括施用组合物两次或更多次。
预期本文中所述的任何方法或组合物可相对于本文中所述的任何其他方法或组合物实施。
术语“包含”(“comprise”、“comprises”和“comprising”)、“具有”(“have”、“has”和“having”)、“含有”(“contain”、“contains”和“containing”)和“包括”(“include”、“includes”和“including”)是开放式连接动词。因此,“包含”、“具有”、“含有”或“包括”一个或更多个记载的步骤或要素的方法、组合物、试剂盒或系统具有那些记载的步骤或要素,但不限于具有仅那些步骤或要素;其可具有(即,覆盖)未记载的要素或步骤。同样地,“包含”、“具有”、“含有”或“包括”一个或更多个记载的特征的方法、组合物、试剂盒或系统具有那些特征,但不限于仅具有那些特征;其可具有未记载的特征。
任何本发明方法、组合物、试剂盒和系统的任何实施方案可由或基本上由(而不是包含/包括/含有/具有)所描述的步骤和/或特征组成。因此,在任何权利要求中,术语“由...组成”或“基本上由......组成”可代替上述任何开放式连接动词,以便将给定权利要求的范围改变为不同于使用开放式连接动词的范围。
权利要求中术语“或/或者”的使用用于表示“和/或”,除非明确指出仅指替代方案或替代方案是相互排斥的,尽管本公开内容支持仅涉及替代方案和“和/或”的定义。
如本申请中所用,术语“平均分子量”是指每种聚合物物质的摩尔数与该物质的摩尔质量之间的关系。特别地,每个聚合物分子可具有不同的聚合水平,并因此具有不同的摩尔质量。平均分子量可用于表示多个聚合物分子的分子量。平均分子量通常与平均摩尔质量同义。特别地,存在三种主要类型的平均分子量:数均摩尔质量、重(质量)均摩尔质量和Z-平均摩尔质量。在本申请的上下文中,除非另有指定,否则平均分子量表示该式的数均摩尔质量或重均摩尔质量。在一些实施方案中,平均分子量是数均摩尔质量。在一些实施方案中,平均分子量可用于描述脂质中存在的PEG组分。
根据以下详细描述,本公开的其他目的、特征和优点将变得明显。然而,应该理解的是,详细描述和具体实例尽管指示本公开的一些具体实施例,但仅以举例说明的方式给出,因为通过详细描述,在本公开的精神和范围内的多种改变和修改对于本领域技术人员将是明显的。
附图说明
专利或申请文件包含至少一幅彩色附图。具有彩色附图的本专利或专利申请公开的副本将在请求和支付必要费用后由主管局提供。
以下附图构成本说明书的一部分,并且被包括在内以进一步示出本公开内容的某些方面。通过参考与本文中给出的描述组合的这些附图中的一个或更多个,可更好地理解本公开内容。
图1显示了本公开内容的阳离子磺酰胺氨基脂质的组分的一些非限制性实例,其为具有使得能够进行核酸治疗递送之性质的新类型脂质。模块化设计使得能够对接头胺区域(红色)、头基胺(蓝色)和官能化侧臂(绿色)进行系统性改变,以确定它们对生物物理性质的相对贡献。评价了季胺周围的空间相互作用、脂质尾的数量和侧臂官能化。
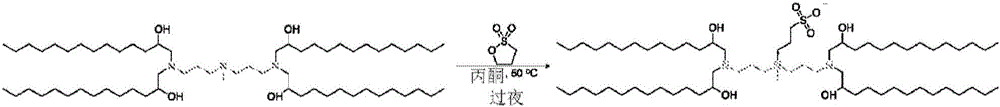
图2显示了由共同的磺基甜菜碱两性离子前体进行基于A1接头胺的CSAL的示例性合成。
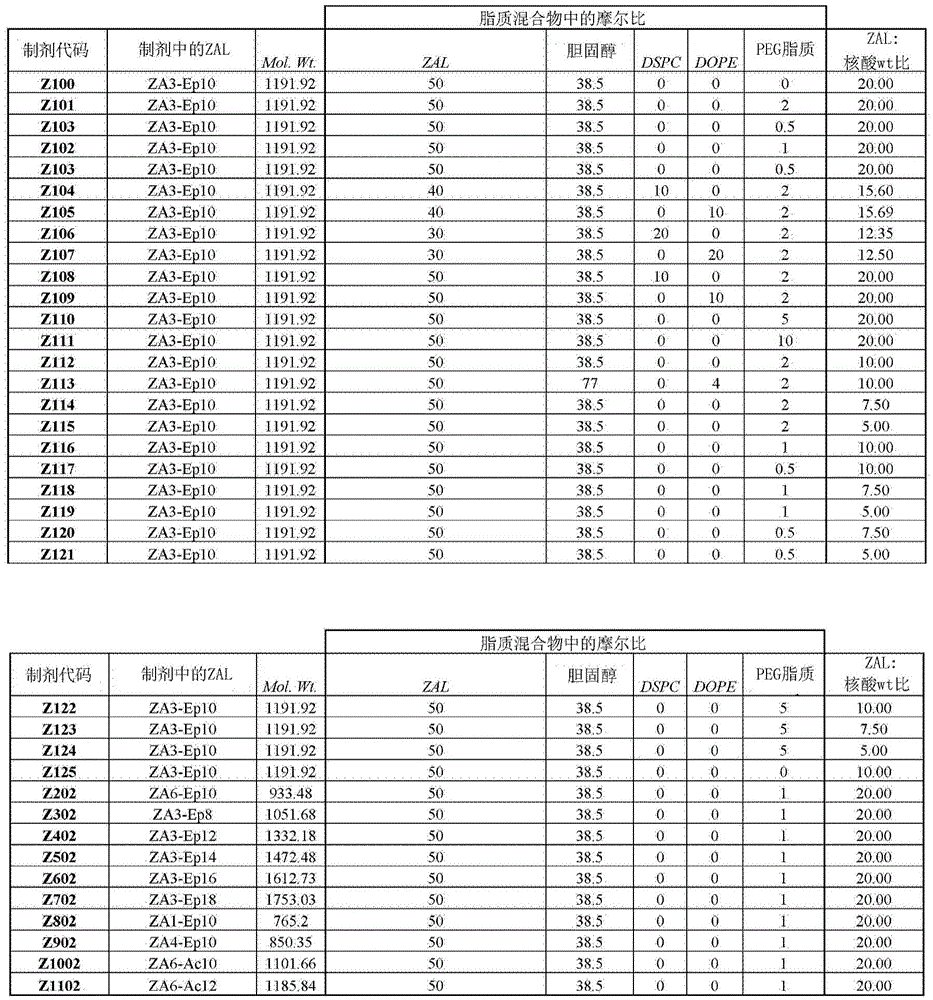
图3显示了通过乙醇稀释法形成CSAL纳米粒,其中将在乙醇中分别含有50∶38.5∶10∶1.5摩尔比的CSAL、胆固醇、DSPC和PEG的脂质混合物与柠檬酸盐磷酸盐缓冲液中的siRNA溶液合并,然后在PBS中稀释。
图4A-4D显示了A1-OAc CSAL的生物物理表征,NP显示结构上独立的尺寸~100nm(图4A),siRNA结合随着头基接头长度的增长而降低(图4B)。在较高摩尔比下电荷的提高表明CSAL存在于纳米粒表面(图4C)。在pH 3下较高的表面电荷表明表面CSAL的质子化状态的变化(图4D)。
图5显示了在HeLa萤光素酶报道细胞中评价基于A1的CSAL的siRNA递送效力。将包封针对萤光素酶报道基因的siRNA的NP以34nM siRNA给药并孵育24小时。在不同的CSAL∶siRNA摩尔比下评价相对萤光素酶活性(柱)和细胞生存力(点)。较高摩尔比的C2Me头基和乙酸酯侧臂显示出更高的效力。
图6显示了新CSAL的设计,其检测了空间对接头胺和头基胺中季铵的影响。C2Me头基显示最多的活动。四尾物质突出了叔胺含量和疏水性在递送效力中的重要性。
图7显示了HeLa细胞中CSAL-NP的摄取研究。用Cy5.5标记的siRNA(红色)以333∶1的CSAL∶siRNA摩尔比配制纳米粒,并在17.1nM siRNA下孵育24小时。用覆盖有siRNA信号的DAPI(蓝色)对细胞进行复染色。
图8显示了CSAL NP在体内的生物分布。将Cy5.5标记的siRNA包封在CSAL NP中并全身注射(1mg/kg siRNA剂量)。IV施用后A1OAcC2Me和A3OAcC2Me定位于肺,在IP施用后A3OAcC2Me定位于肝。检查总脂质∶siRNA重量比对A3OAcC2Me生物分布的影响。所有重量比导致2小时的肺积累,而在较低重量比下24小时后观察到显著的肾清除,表明在较高重量比下更好的稳定性。
图9显示了可制备两性离子氨基脂质的一些模块化组分的一些非限制性实例。绿色分子代表具有适当阳离子胺基团的亲电胺,红色代表核心多胺,且蓝色是疏水性尾部。
图10显示了两性离子亲电体组分的1H NMR波谱和该组分的示例性合成。
图11显示了与多胺偶联的两性离子亲电体组分的1H NMR波谱和该结合组分的示例性合成。
图12显示了具有不同多胺的多种两性离子组分。
图13显示了图12中描述的组分与多种不同疏水性组分的反应。
图14显示了来自图11中所示反应的所得两性离子氨基脂质(zwitterionic aminolipid,ZAL)。
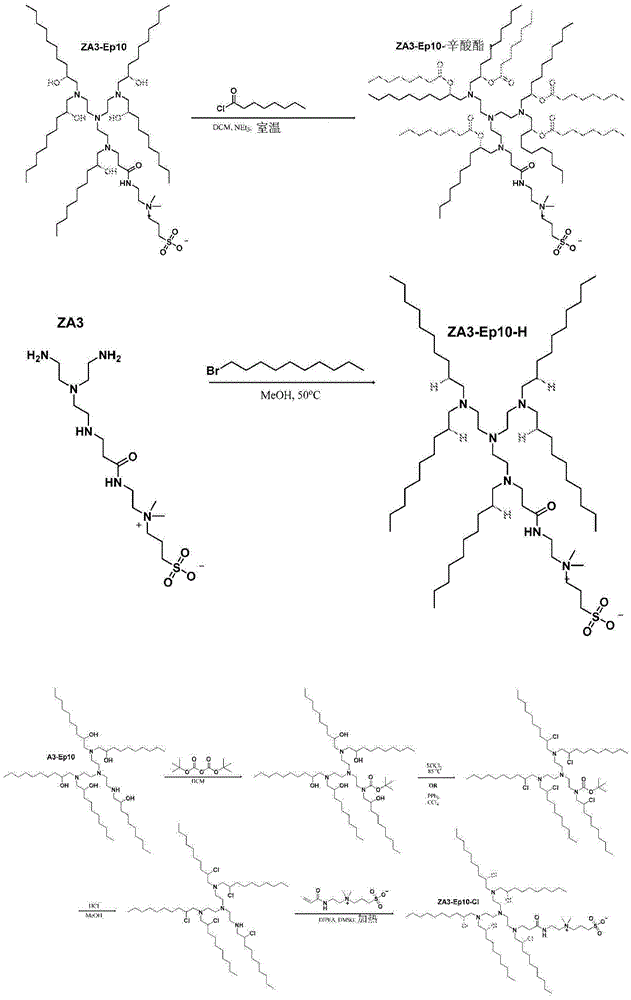
图15A-15C显示了ZA3-Ep10(图15A)、12SBAmO10(图15B)和ZA1-Am10(图15C)的HPLC迹线。
图16显示了在一种或更多种辅助脂质(例如胆固醇)的存在下包含siRNA和ZAL的纳米粒的形成。
图17显示了在胆固醇存在下的ZAL能够包封和结合siRNA。
图18显示了作为HeLa细胞中体外siRNA递送之函数的萤光素酶活性。较暗的颜色代表较低的萤光素酶活性和较高的siRNA递送。
图19显示了作为未处理细胞之百分比的活性(柱)和细胞生存力(点),其中不同的脂质类型由柱的颜色表示。
图20A和20B显示了对于基于环氧化物的脂质(图20A)和基于丙烯酸酯的脂质(图20B),在不同长度和核心胺下,作为未处理细胞的百分比的活性(柱)和细胞生存力(点)。
图21显示了含有tRNA的ZAL纳米粒内化到Calu6细胞中。已经显示这些颗粒被多种不同的细胞系摄取。
图22显示了在使用不同递送组合物递送tRNA后p53合成的恢复。
图23显示了阳离子磺酰胺和两性离子氨基脂质在体内不同器官的分布。
图24显示了使用两性离子氨基脂质将tRNA递送至原代(primary)HBE细胞。
图25显示了在单个纳米粒中组合多种不同核酸分子的效果。在200μL DMEM 5%FBS中以每孔100ng mRNA和每孔50ng sgRNA的RNA剂量测试向HeLa-Luc细胞共递送针对萤光素酶的Cas9 mRNA和sgRNA。“相同颗粒(Same particle)”样品是相同纳米粒制剂中包装有mRNA和sgRNA二者的纳米粒,其通过在配制期间将mRNA和sgRNA在酸性缓冲液中共稀释、然后添加脂质获得。“不同颗粒(Diff particle)”样品是作为分开的纳米粒制备但同时添加至相同孔的mRNA-LNP和sgRNA-LNP。“交错(Staggered)”样品是在sgRNA-ZAL纳米粒之前约16小时配制和添加mRNA-ZAL纳米粒。作为阴性对照“sgLuc仅43h”,在没有Cas9 mRNA的情况下添加具有针对萤光素酶之sgRNA的纳米粒。在单独mRNA或mRNA+sgRNA初始感染之后43小时对样品进行读出。
图26显示了通过针对萤光素酶的ZA3-Ep10纳米粒将Cas9 mRNA和单指导RNA共递送至A549-luc细胞。
图27显示了通过针对萤光素酶的ZA3-Ep10纳米粒将Cas9 mRNA和单指导RNA共递送至HeLa-luc细胞。
图28显示了在特定的sgRNA重量比下ZAL组合物的剂量响应分布。这些剂量响应分布在HeLa-Luc-Cas9细胞中用ZA3-Ep10 NP进行。在纳米粒制剂中20∶1、10∶1、5∶1的ZAL∶sgRNA重量比下,组合物包含50∶38.5∶2的ZAL∶胆固醇∶PEG-脂质。将组合物孵育48小时。使用50ng siLuc作为siRNA阳性对照。
图29显示了已静脉内或腹膜内注射1mg/kg Luc mRNA的BALB-c-Nu小鼠的离体成像。注射之后24小时对小鼠进行成像。这些图像显示了纳米粒的器官定位。
图30显示了在两种不同比例的核酸与纳米粒比例和两种不同CSAL下,当使用CSAL递送时萤光素酶siRNA的剂量依赖性活性。
图31显示了具有34nM siRNA的A549-luc细胞中CSAL的定位。孵育24小时后拍摄图像。图像右下角的比例尺为40μm。
图32显示了在Balb-c裸小鼠中的A549-luc异种移植物中A3OAcC2Me纳米粒(脂质混合物中50 CSAL∶38.5 胆固醇∶10 DSPC∶1.5 PEG摩尔比,30∶1的总脂质∶siRNA重量比)的定位。以1mg/kg siRNA进行纳米粒的肿瘤内注射,IP萤光素注射之后24小时使用IVIS进行生物发光成像。离体分析(48小时)包括处死动物并且收集组织并在干冰上冷冻。然后,将组织用组织匀浆器匀浆,然后在1×裂解缓冲液(Promega)中进行尖端超声处理,并补充蛋白酶抑制剂(Pierce)。样品相对于肿瘤组织总质量进行归一化(N=4+/-S.E.M.)。
图33显示了Calu6细胞中tRNA递送中使用的组合物的结合和颗粒尺寸。
图34显示了凝胶,其显示ZAL和CSAL纳米粒二者均使得能够递送抑制型tRNA,其导致p53表达的恢复。
图35显示了Calu6细胞中具有荧光标记的tRNA纳米粒制剂的多种不同ZAL的摄取。
图36显示了具有氨基ZA的6种不同ZAL的1H NMR波谱。
图37显示了纯化的ZA3-Ep10 ZAL的表征,包括ELDS、质谱和13C NMR。
图38显示了通过质谱和13C NMR表征CSAL A3OAcC2Me。
图39显示了用于制备ZAL的替代合成方法。
图40显示了用于制备CSAL和ZAL的替代合成方法。
图41A-41D显示了CSAL的1H NMR波谱:A1OAcC2Me(图41A)、A1OAcC3Me(图41B)、A1OAcC4Me(图41C)和ZA(图41D)。
图42A-42F显示了ZAL的1H NMR波谱:ZA(图42A)、ZA3-Ep10(图42B)、A1-OH(图42C)、A3-OH(图42D)、A3-OAc(图42E)和A1-OPiv(图42F)。
图43A-43C显示了通过western印迹在HeLa-Luc-Cas9细胞中验证Cas9表达。(图43A)在杀稻瘟素S选择后,在细胞汇集物(pool)中用α-FLAG抗体进行印迹。(图43B)通过One-Glo测定评价的单细胞克隆的萤光素酶表达(5,000个细胞,48小时生长)。(图43C)用α-Cas9印迹的HeLa-Luc-Cas9的单细胞克隆2的Cas9表达。
图44显示了使用商业化试剂(LF3000)评价针对萤光素酶的单指导RNA组,编码sgRNA和Cas9蛋白的质粒DNA的转染显示sgLuc5是用于在未分选的HeLa-Luc细胞中使萤光素酶沉默最强效的sgRNA序列。将值相对于非靶向sgRNA对照归一化并绘制为平均值+/-标准偏差(N=4)。
图45显示了评价从siRNA筛选中鉴定的首要ZAL向HeLa-Luc-Cas9细胞的sgRNA递送。以脂质混合物中50∶38.5∶1(ZAL∶胆固醇∶PEG-脂质摩尔比)和20∶1 ZAL∶sgRNA重量比配制ZNP。以14.7nM和7.4nM二者施用sgRNA 48小时。ZA3-Ep10表现为最高效(>95%萤光素酶沉默)。相对于未处理的细胞确定生存力(点)和相对萤光素酶活性(柱)(N=4+/-标准偏差)。
图46显示了萤光素酶沉默的动力学曲线的早期时间点的放大,比较通过ZA3-Ep10ZNP的sgRNA与siRNA显示siRNA沉默比sgRNA编辑快得多。
图47显示了ZNP编辑的HeLa-Luc-Cas9细胞(sgLuc)相对于未编辑细胞(sgCtrl)的相对生存力,当相对于未处理细胞进行归一化时,通过Cell-Titer Glo测定显示相似的生长速率(N=5+/-S.E.M.)。
图48显示通过调节制剂的PEG含量(2%、1%和0.5%)和ZAL∶sgRNA重量比(20∶1、10∶1、7.5∶1、5∶1)来探索优化ZA3-Ep10 ZNP用于sgRNA递送。所有制剂在7.4nM、48小时孵育下对sgLuc递送有效,而7.5∶1重量比和0.5%PEG显示最佳萤光素酶编辑。
图49显示在IGROV1细胞中进行用于mRNA递送的ZA3-Ep10 ZNP的优化。ZAL∶mRNA的重量比设定为20∶1、10∶1、7.5∶1和5∶1。以相对摩尔比为50∶38.5∶n的ZAL∶胆固醇∶PEG-脂质制备脂质混合物,其中n=5、2、1或0.5。将细胞在96孔板中用100ng mRNA处理并孵育指定时间(18小时浅灰色,26小时灰色,45小时深灰色),然后使用One-Glo+Tox测定评价细胞生存力(点)和萤光素酶表达(柱)。与未处理的细胞相比确定细胞生存力,并将发光相对于生存力归一化以确定相对发光。将值绘制为平均值+/-标准偏差,N=4。
图50显示了配制用于体内测定的ZA3-Ep10 Luc mRNA NP的PEG脂质组合物的效果。ZAL∶胆固醇比例固定在50∶38.5摩尔比,而PEG-脂质以指定的百分比包含在内。如所预期的,提高PEG导致更小的颗粒尺寸,但是更差的mRNA表达。
图51显示比较ZA3-Ep10和已知递送小RNA的阳离子结构类似物(A3-Ep14,文献中也称为C14-110(Love等,2010))的RNA包封、纳米粒尺寸和递送效力。ZNP或LNP制剂固定为7.5∶1重量比的ZAL或阳离子类似物与RNA。NP的脂质混合物为50∶38.5∶0.5的ZAL或阳离子类似物∶胆固醇∶PEG-脂质,而对于A3-Ep14 NP,两性离子磷脂在脂质混合物中从0滴定至50%。使用体外配制方案通过手动混合配制纳米粒。通过Ribogreen测定确定RNA结合(N=3+/-标准偏差),而通过动态光散射确定纳米粒尺寸(N=3+/-标准偏差)。在HeLa-Luc-Cas9细胞中测定siLuc和sgLuc NP的萤光素酶沉默或编辑(7.35nM sgRNA,17.9nM siRNA),而在IGROV1细胞中评价通过Luc mRNA NP的萤光素酶表达(0.77nM mRNA)。通过One-Glo+Tox测定在40小时孵育时间后测定细胞,并将生存力(点)和萤光素酶表达(柱)绘制为平均值+/-标准偏差(N=4)。
图52显示了生物发光成像,显示在通过i.v.注射进行Luc-mRNA施用后体内萤光素酶表达与体外活性相关。向小鼠注射1mg/kg Luc mRNA并在处理之后24小时成像。未处理的小鼠用作阴性对照。右上图显示了图65E中所示动物的离体表达。
图53A和53B显示通过ROI分析对离体图像的定量。(图53A)为图52(顶部)中所示的无胸腺裸小鼠图像的定量,(图53B)为图51(底部,NSG)和图65F(C57BL/6)中图像的定量图像。测量每个器官至少5个ROI并绘制为平均值+/-S.E.M.。
图54显示在A549-Luc和HeLa-Luc二者中在6孔板中以2μg/孔Cas9mRNA和1μgsgLuc进行分阶段递送中,Cas9 mRNA和sgLuc的共递送导致编辑。同时,无指导(unguided)Cas9、Cas9-sgCtrl或单独sgLuc不显示编辑带。预期的基因组DNA扩增子为510bp,而预期的指示编辑的切割带为233bp和277bp(箭头)。
图55显示对照ZNP(Cas9+sgCtrl、无指导Cas9、仅sgLuc和仅sgCtrl)在A549-Luc细胞中未显示出萤光素酶靶标的编辑。利用2∶1 Cas9mRNA∶sgLuc wr在类似条件下进行分阶段共递送显示出sgLuc的编辑。
图56显示了Cas9 mRNA和sgRNA在共递送ZNP中的包封。ZAL∶总RNA固定在7.5∶1,脂质混合物为50∶38.5∶0.5 ZA3-Ep10∶胆固醇∶PEG-脂质。将数据绘制为平均值+/-标准偏差(N=4)。
图57显示了体内施用的包封Cas9 mRNA和sgRNA的ZNP的颗粒特性。对于尺寸和ζ电位测量,N=5;对于RNA包封,N=4。数据绘制为平均值+/-标准偏差。
图58显示在全器官水平和在来自组织切片的细胞中,Cre重组酶AAV阳性对照示出离体肝中tdTomato的表达。
图59显示递送包封Cas9 mRNA和sgCtrl的ZA3-Ep10 ZNP在切片的组织切片中未显示任何tdTomato阳性细胞。
图60显示以5mg/kg总RNA剂量全身施用包封Cas9mRNA和sgRNA的ZA3-Ep10ZNP后动物体重的测量。
图61显示了通过分离的原代肝细胞的流式细胞术测定的,用ZNP处理的动物中tdTomato阳性肝细胞的定量。左图显示来自未处理的LSL-tdTO小鼠和ZNP-Cas9mRNA-sgLoxP处理的小鼠的样品的代表性图。小鼠1和小鼠2在连续天以2mg/kg总RNA处理2次,而小鼠3以5mg/kg总RNA接受单剂量,且所有动物在ZNP施用之后约1周收获。每个样品运行四次,并将值绘制为平均值+/-标准偏差。
图62显示在通过包封Cas9 mRNA和sgLoxP(5mg/kg)的ZA3-Ep10ZNP编辑之后2个月,ZNP处理的tdTomato小鼠在肝和肾中显示显著的荧光信号。
图63A-63D显示ZNP使得能够实现永久性CRISPR/Cas介导的DNA编辑。(图63A)HeLa-Luc-Cas9细胞中通过siRNA(9nM)对萤光素酶的序列特异性沉默,以及通过sgRNA(7nM)的编辑。N=4±stdv,****p<0.0001。(图63B)在动力学上,利用siRNA的沉默是瞬时的,而sgRNA递送导致2天后萤光素酶信号的永久丧失。(图63C)通过Surveyor测定确认萤光素酶的序列特异性编辑。(图63D)ZA3-Ep10的化学结构。
图64显示设计ZAL以通过将两性离子脂质和阳离子脂质的化学和结构作用组合到单一脂质化合物中来提高与较长RNA的分子相互作用。高效反应提供了进入独特电荷不平衡脂质库的途径。
图65A-65F显示ZNP使得能够在体外和体内这两种情况递送长RNA。(图65A)ZA3-Ep10 ZNP(ZAL∶胆固醇∶PEG-脂质=100∶77∶1(mol);ZAL∶RNA=7.5∶1(wt))对于sgRNA和mRNAl二者是均一的。(图65B)ZA3-Ep10 sgRNA ZNP在HeLa-Luc-Cas9细胞中显示剂量响应性Luc编辑。ZA3-Ep10 ZNP还可将(图65C)mCherry mRNA(18小时)和(图65D)萤光素酶mRNA(24小时)递送至IGROV1细胞。(图65E)通过全身性i.v.施用ZA3-Ep10 Luc mRNA ZNP(24小时)实现了体内萤光素酶表达。体内(图65E,无胸腺裸小鼠,1mg/kg)和离体(图65F,C57BL/6小鼠,4rng/kg)二者的生物发光成像显示肝、肺和脾组织中萤光素酶的表达。
图66A-66D显示ZNP使得能够共递送Cas9 mRNA和sgRNA用于CRISPR/Cas编辑。(图66A)在向A549-Luc细胞进行Cas9 mRNA(0.48ng/mL mRNA)的ZNP递送后mRNA和蛋白质表达的动力学。随时间测量Cas9 mRNA水平(浅灰色曲线)和蛋白质表达(黑色曲线,图66B)。(图66C)ZNP使得能够实现Cas9的剂量响应性表达,可检出低至0.05μg/mL的递送的mRNA。(图66D)Surveyor确认在mRNA∶sgRNA比例为3∶1或更高(wt)时萤光素酶靶标的编辑。Cas9 mRNA和sgCtrl的共递送显示无编辑(图55)。
图67A-67C显示ZNP使得能够在体内实现非病毒CRISPR/Cas编辑。(图67A)示意图显示Cas9 mRNA和sgLoxP的共递送使终止盒缺失并活化下游tdTomato蛋白。(图67B)在以5mg/kg总RNA施用包封Cas9mRNA∶sgRNA(4∶1,M)的ZNP后,在全器官离体成像时在肝和肾中检测到tdTomato荧光。(图67C)组织切片的共聚焦荧光显微术显示了肝、肺和肾中的tdTomato阳性细胞。比例尺=50μm)。
图68显示ZA3-Ep10-OAc(上)相对于ZA3-Ep10(下)的1H NMR。上面的光谱显示乙酰基部分(圈)上约2ppm的甲基的存在。
图69显示了油基的缩水甘油酯的1H NMR波谱。
图70A-70O显示了经修饰ZAL化合物的质谱:ZA3-GE8(图70A)、ZA3-GE12(图70B)、ZA3-Ac-油基(图70C)、ZA3-Ep10-OAc(图70D)、ZA3-Ep10-OPiv(图70E)、ZA3-Ep10-烷基(图70F)、ZA3-Ep10-辛酸酯(图70G)、4A2SBAm(图70H)、4A4SBAm(图70I)、SBAm-C3Me(图70J)、SBAm-C2Et(图70K)、SBAm-C3Et(图70L)、CBAm-C2Me(图70M)、C4SBAm-C2Me(图70N)和iPCAm-C2Me(图70O)。
图71A-E显示经修饰ZAL化合物的1H NMR波谱:ZA3-Ac-油基(图71A)、GE12(图71B)、ZA3-GE12(图71C)、ZA3-Ep10-OAc(图71D)和ZA3-Ep10-OPiv(图71E)。
具体实施方式
本公开内容提供了含有一种或更多种磺酸或磺酸衍生物(例如磺酰胺)的氨基脂质组合物。这些化合物可与一种或更多种辅助脂质组合以在水溶液中形成纳米粒,其可用于运输基于核酸的治疗剂。在一些实施方案中,本发明的组合物可用于运输siRNA、sgRNA、mRNA或tRNA治疗剂以治疗疾病或病症,例如癌症、囊性纤维化或其他遗传病。
A.定义
本公开内容提供的化合物(也描述为氨基脂质、化合物或本文中公开内容的化合物)在例如上文的发明内容部分和所附权利要求中示出。其可使用实施例部分中概述的方法制备。可使用本领域技术人员应用的有机化学原理和技术进一步修改和优化这些方法。这样的原理和技术在例如March’s Advanced Organic Chemistry:Reactions,Mechanisms,and Structure(2007)中教导,其通过引用并入本文。
本公开内容的化合物可含有一个或更多个不对称取代的碳或氮原子,并且可以以光学活性或外消旋形式分离。因此,除非特别指出具体的立体化学或异构形式,否则化学式的所有手性、非对映体、外消旋形式、差向异构形式和所有几何异构形式都是预期的。化合物可作为外消旋体和外消旋混合物、单一对映体、非对映体混合物和单独的非对映体形式存在。在一些实施方案中,获得单一的非对映体。本公开内容的化合物的手性中心可具有S或R构型。
用于表示本公开内容化合物的化学式通常将仅显示可能的数种不同的互变异构体中的一种。例如,已知许多类型的酮基与相应的烯醇基团平衡存在。类似地,许多类型的亚胺基团与烯胺基团平衡存在。无论给定化合物描述哪种互变异构体,并且无论哪种最普遍,都给出了给定化学式的所有互变异构体。
本公开内容的化合物还可具有以下优点:无论是用于本文中所述的适应症还是其他方面,与现有技术中已知的化合物相比,它们可更有效,更低毒性,更长效,更强效,产生更少副作用,更容易吸收,和/或具有更好的药代动力学特征(例如,更高的口服生物利用度和/或更低的清除率),和/或具有其他可用的药理学、物理学或化学性质。
另外,构成本公开内容化合物的原子旨在包括这些原子的所有同位素形式。本文中使用的同位素包括具有相同原子序数但质量数不同的那些原子。作为一般实例而非限制,氢的同位素包括氚和氘,且碳的同位素包括13C和14C。
应该认识到,形成本文中提供的化合物的任何盐形式的一部分的特定阴离子或阳离子并不重要,只要该盐作为整体是药理学上可接受的即可。可药用盐及其制备和使用方法的其他实例在Handbook of Pharmaceutical Salts:Properties,and Use(2002)中给出,其通过引用并入本文。
当在化学基团的情况下使用时:“氢”意指-H;“羟基”意指-OH;“氧代”意指=O;“羰基”意指-C(=O)-;“羧基”意指-C(=O)OH(也写作-COOH或-CO2H);“卤代”独立地意指-F、-Cl、-Br或-I;“氨基”意指-NH2;“羟氨基”意指-NHOH;“硝基”意指-NO2;亚氨基意指=NH;“氰基”意指-CN;“异氰酸根”意指-N=C=O;“叠氮基”意指-N3;在一价的情况下,“磷酸根”意指-OP(O)(OH)2或其去质子化形式;在二价的情况下,“磷酸根”意指-OP(O)(OH)O-或其去质子化形式;“巯基”意指-SH;并且“硫代”意指=S;“磺酰基”意指-S(O)2-;并且“亚磺酰基”意指-S(O)-。
在化学式的情况下,符号“-”意指单键,“=”意指双键,且“≡”意指三键。符号“____”表示任选的键,其如果存在的话则为单键或双键。符号表示单键或双键。因此,例如式包括并且应了解,没有一个这样的环原子形成多于一个双键的一部分。此外,注意,当连接一个或两个立体异构源(stereogenic)原子时,共价键符号“-”并不表示任何优选的立体化学。相反,其涵盖所有的立体异构体及其混合物。当与键垂直交叉绘制时(例如,对于甲基的),符号表示该基团的连接点。注意,连接点通常仅对于较大的基团以这种方式指示以有助于读者明确地识别连接点。符号意指单键,其中与楔形物的较厚端连接的基团“离开页面”。符号意指单键,其中与楔形物的较厚端连接的基团“进入页面”。符号意指单键,其中双键周围的几何形状(例如,E或Z)未限定。因此,指示两种选择以及其组合。在本申请中示出的结构的原子上任何未限定的化合价隐含地表示与该原子键合的氢原子。碳原子上的粗点表示连接至该碳上的氢向为从纸平面向外。
当环体系上基团“R”被描述为“浮动基团(floating group)”时,例如,在下式中:
则R可取代与任何环原子连接的任何氢原子,包括所描绘的、隐含的或明确限定的氢,只要形成稳定的结构即可。当在稠环体系上的基团“R”被描述为“浮动基团”时,例如在下式中:
则除非另有指定,否则R可替换与稠环之一的任一环原子连接的任一氢。可替换的氢包括所描绘的氢(例如,上式中与氮连接的氢)、隐含的氢(例如,上式未示出但理解为存在的氢)、明确限定的氢和任选的其存在取决于环原子之特性的氢(例如,当X等于-CH-时,与基团X连接的氢),只要形成稳定的结构即可。在所示的实例中,R可位于稠环体系的5元环或6元环上。在上式中,紧随在括号中的基团“R”之后的下标字母“y”表示数字变量。除非另有规定,否则该变量可以是0、1、2或任何大于2的整数,其仅受环或环体系的可替换氢原子的最大数目限制。
对于化学基团和化合物类别,基团或类别中碳原子数如下所示:“Cn”限定在该基团/类别中碳原子的确切数目(n)。“C≤n”限定可在基团/类别中的碳原子的最大数目(n),其中对于所讨论的基团/类别,最小数目尽可能小,例如,应理解,在基团“烯基(C≤8)”或类别“烯烃(C≤8)”中最小碳原子数目为两个。“烷氧基(C≤10)”表示具有1至10个碳原子的烷氧基。“Cn-n’”限定基团中碳原子的最小数目(n)和最大数目(n’)。因此,“烷基(C2-10)”表示具有2至10个碳原子的那些烷基。这些碳数指示符可在其所修饰的化学基团或类别之前或之后,并且可包括或可不包括在括号中,而不表示含义的任何变化。因此,术语“C5烯烃”、“C5-烯烃”、“烯烃(C5)”和“烯烃C5”都是同义的。当本文中限定的任何化学基团或化合物类别被术语“经取代”修饰时,不计算替换氢原子的部分中的任何碳原子。因此,甲氧基己基是经取代烷基(C1-6)的实例。
当用于修饰化合物或化学基团时,术语“饱和”意指化合物或化学基团不具有碳-碳双键且不具有碳-碳三键,除非如下所述。当该术语用于修饰原子时,其意指该原子不是任何双键或三键的一部分。在饱和基团的经取代形式的情况下,可存在一个或更多个碳氧双键或碳氮双键。且当存在这样的键时,则不排除可作为酮-烯醇互变异构或亚胺/烯胺互变异构的一部分出现的碳-碳双键。当术语“饱和”用于修饰物质的溶液时,其意指更多的该物质不能溶解在该溶液中。
当在没有“经取代”修饰语的情况下使用时,术语“脂肪族”表示如此修饰的化合物或化学基团是无环或环状但非芳香族的烃化合物或基团。在脂肪族化合物/基团中,碳原子可以以直链、支链或非芳香族环(脂环族)连接在一起。脂肪族化合物/基团可以是饱和的(其通过单碳-碳键(烷烃/烷基)连接),或不饱和的(与一个或更多个碳-碳双键(烯烃/烯基)或一个或更多个碳-碳三键(炔烃/炔基)连接)。
当用于修饰化合物或化学基团时,术语“芳香族”是指在完全共轭的环状π体系中具有4n+2个电子的平面不饱和原子环。
当在没有“经取代”修饰语的情况下使用时,术语“烷基”是指这样的一价饱和脂肪族基团,其具有碳原子作为连接点,直链或支链的无环结构,并且不含碳和氢以外的原子。基团-CH3(Me)、-CH2CH3(Et)、-CH2CH2CH3(n-Pr或丙基)、-CH(CH3)2(i-Pr,iPr或异丙基)、-CH2CH2CH2CH3(n-Bu)、-CH(CH3)CH2CH3(仲丁基)、-CH2CH(CH3)2(异丁基)、-C(CH3)3(叔丁基(tert-butyl)、叔丁基(t-butyl)、t-Bu或tBu)和-CH2C(CH3)3(新戊基)是烷基的一些非限制性实例。当不使用“经取代”修饰语时,术语“烷二基”是指这样的二价饱和脂肪族基团,其具有一个或两个饱和碳原子作为连接点,直链或支链的无环结构,不含碳-碳双键或三键,并且不含碳和氢以外的原子。基团-CH2-(亚甲基)、-CH2CH2-、-CH2C(CH3)2CH2-和-CH2CH2CH2-是烷二基的一些非限制性实例。当在没有“经取代”修饰语的情况下使用时,术语“亚烷基”是指二价基团=CRR’,其中R和R’独立地为氢或烷基。亚烷基的非限制性实例包括:=CH2、=CH(CH2CH3)和=C(CH3)2。“烷烃”是指具有式H-R的化合物类别,其中R是如上文所定义的术语烷基。当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。以下基团是经取代烷基的一些非限制性实例:-CH2OH、-CH2Cl、-CF3、-CH2CN、-CH2C(O)OH、-CH2C(O)OCH3、-CH2C(O)NH2、-CH2C(O)CH3、-CH2OCH3、-CH2OC(O)CH3、-CH2NH2、-CH2N(CH3)2和-CH2CH2Cl。术语“卤代烷基”是经取代烷基的子集,其中氢原子替换被限制为卤素(即-F、-Cl、-Br或-I),使得除碳、氢和卤素之外不存在其他原子。基团-CH2Cl是卤代烷基的一个非限制性实例。术语“氟代烷基”是经取代烷基的子集,其中氢原子替换被限制为氟,使得除碳、氢和氟之外不存在其他原子。基团-CH2F、-CF3和-CH2CF3是氟代烷基的一些非限制性实例。
当在没有“经取代”修饰语的情况下使用时,术语“环烷基”是指这样的一价饱和脂肪族基团,其具有碳原子作为连接点(所述碳原子形成一个或更多个非芳香族环结构的一部分),不含碳-碳双键或三键,并且不含碳和氢以外的原子。非限制性实例包括:-CH(CH2)2(环丙基)、环丁基、环戊基或环己基(cyclohexyl,Cy)。当在没有“经取代”修饰语的情况下使用时,术语“环烷二基”是指这样的二价饱和脂肪族基团,其具有两个碳原子作为连接点,不含碳-碳双键或三键,并且不含碳和氢以外的原子。基团是环烷二基的一个非限制性实例。“环烷烃”是指具有式H-R的化合物类别,其中R是上文所定义的术语环烷基。当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。
当在没有“经取代”修饰语的情况下使用时,术语“烯基”是指这样的一价不饱和脂肪族基团,具其有碳原子作为连接点,直链或支链的无环结构,至少一个非芳香族碳-碳双键,不含碳-碳三键,并且不含碳和氢以外的原子。非限制性实例包括:-CH=CH2(乙烯基)、-CH=CHCH3、-CH=CHCH2CH3、-CH2CH=CH2(烯丙基)、-CH2CH=CHCH3、和-CH=CHCH=CH2。当在没有“经取代”修饰语的情况下使用时,术语“烯二基”是指这样的二价不饱和脂肪族基团,其具有两个碳原子作为连接点,直链或支链,直链或支链的无环结构,至少一个非芳香族碳-碳双键键,不含碳-碳三键,并且不含碳和氢以外的原子。基团-CH=CH-、-CH=C(CH3)CH2-、-CH=CHCH2-和-CH2CH=CHCH2-是烯二基的一些非限制性实例。应注意,虽然烯二基是脂肪族的,但一旦在两端连接,则不排除该基团形成芳香族结构的一部分。术语“烯”和“烯烃”是同义的,并且是指具有式H-R的化合物,其中R是如上文所定义的术语烯基。类似地,术语“末端烯烃”和“α-烯烃”是同义的并且是指仅具有一个碳-碳双键的烯烃,其中该键是分子末端的乙烯基的一部分。当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。基团-CH=CHF、-CH=CHCl和-CH=CHBr是经取代烯基的一些非限制性实例。
当在没有“经取代”修饰语的情况下使用时,术语“炔基”是指这样的一价不饱和脂肪族基团,其具有碳原子作为连接点,直链或支链的无环结构,至少一个碳-碳三键,并且不含碳和氢以外的原子。本文中使用的术语炔基不排除存在一个或更多个非芳香族碳-碳双键。基团-C≡CH、-C≡CCH3和-CH2C≡CCH3是炔基的一些非限制性实例。“炔烃”是指具有式H-R的化合物,其中R是炔基。当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。
当在没有“经取代”修饰语的情况下使用时,术语“芳基”是指具有芳香族碳原子作为连接点的一价不饱和芳香族基团,所述碳原子形成一个或更多个六元芳环结构的一部分,其中环原子都是碳,并且其中该基团不含碳和氢以外的原子。如果存在多于一个环,则环可以是稠合的或未稠合的。本文中使用的该术语不排除存在与第一芳环或存在的任何其他芳环连接的一个或更多个烷基或芳烷基(碳数限制允许)。芳基的非限制性实例包括苯基(Ph)、甲基苯基、(二甲基)苯基、-C6H4CH2CH3(乙基苯基)、萘基和来自于联苯的一价基团。当在没有“经取代”修饰语的情况下使用时,术语“芳二基”是指具有两个芳香族碳原子作为连接点的二价芳香族基团,所述碳原子形成一个或更多个六元芳环结构的一部分,其中环原子都是碳,并且其中一价基团不包含碳和氢以外的原子。本文中使用的该术语不排除存在与第一芳环或存在的任何其他芳环连接的一个或更多个烷基、芳基或芳烷基(碳数限制允许)。如果存在多于一个环,则环可以是稠合的或未稠合的。未稠合的环可通过以下一种或更多种连接:共价键、烷二基或烯二基(碳数限制允许)。芳二基的非限制性实例包括:
“芳烃”是指具有式H-R的化合物类,其中R是如上文所定义的术语芳基。苯和甲苯是芳烃的一些非限制性实例。当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。
当在没有“经取代”修饰语的情况下使用时,术语“芳烷基”是指一价基团-烷二基-芳基,其中术语烷二基和芳基各自以与上文提供的定义一致的方式使用。一些非限制性实例是:苯甲基(苄基、Bn)和2-苯基-乙基。当术语芳烷基与“经取代”修饰语一起使用时,来自烷二基和/或芳基的一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。经取代芳烷基的一些非限制性实例是:(3-氯苯基)-甲基和2-氯-2-苯基-乙-1-基。
当在没有“经取代”修饰语的情况下使用时,术语“杂芳基”是指具有芳香族碳原子或氮原子作为连接点的一价芳香族基团,所述碳原子或氮原子形成一个或更多个芳环结构的一部分,其中至少一个环原子是氮、氧或硫,并且其中杂芳基不含碳、氢、芳香族氮、芳香族氧和芳香族硫以外的原子。如果存在多于一个环,则环可以是稠合的或未稠合的。本文中使用的该术语不排除存在与芳环或芳环体系连接的一个或更多个烷基、芳基和/或芳烷基(碳数限制允许)。杂芳基的非限制性实例包括呋喃基、咪唑基、吲哚基、吲唑基(Im)、异唑基、甲基吡啶基、唑基、苯基吡啶基、吡啶基(氮苯基)、吡咯基、嘧啶基、吡嗪基、喹啉基、喹唑啉基、喹喔啉基、三嗪基、四唑基、噻唑基、噻吩基和三唑基。当在没有“经取代”修饰语的情况下使用时,术语“杂芳二基”是指具有两个芳香族碳原子、两个芳香族氮原子或一个芳香族碳原子和一个芳香族氮原子作为两个连接点的二价芳香族基团,所述原子形成一个或更多个芳环结构的一部分,其中至少一个环原子是氮、氧或硫,并且其中二价基团不含碳、氢、芳香族氮、芳香族氧和芳香族硫以外的原子。如果存在多于一个环,则环可以是稠合的或未稠合的。未稠合的环可通过以下一种或更多种连接:共价键、烷二基或烯二基(碳数限制允许)。本文中使用的该术语不排除存在与芳环或芳环体系连接的一个或更多个烷基、芳基和/或芳烷基(碳数限制允许)。杂芳二基的非限制性实例包括:
术语“N-杂芳基”是指具有氮原子作为连接点的杂芳基。“杂芳烃”是指具有式H-R的化合物类,其中R是杂芳基。吡啶和喹啉是杂芳烃的一些非限制性实例。当这些术语与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。
当在没有“经取代”修饰语的情况下使用时,术语“杂环烷基”是指具有碳原子或氮原子作为连接点的一价非芳香族基团,所述碳原子或氮原子形成一个或更多个非芳香族环的一部分结构,其中至少一个环原子是氮、氧或硫,并且其中杂环烷基不包含碳、氢、氮、氧和硫之外的原子。如果存在多于一个环,则环可以是稠合的或未稠合的。本文中使用的该术语不排除存在与环或环体系连接的一个或更多个烷基(碳数限制允许)。此外,该术语不排除在环或环体系中存在一个或更多个双键,前提是所得基团仍为非芳香族。杂环烷基的非限制性实例包括氮杂环丙烷基、氮杂环丁烷基、吡咯烷基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、四氢呋喃基、四氢噻吩基、四氢吡喃基、吡喃基、氧杂环丙烷基和氧杂环丁烷基(oxetanyl)。当在没有“经取代”修饰语的情况下使用时,术语“杂环烷二基”是指具有两个碳原子、两个氮原子或一个碳原子和一个氮原子作为两个连接点二价环状基团,所述原子形成一个或更多个环结构的一部分,其中至少一个环原子是氮、氧或硫,并且其中二价基团不包含碳、氢、氮、氧和硫以外的原子。如果存在多于一个环,则环可以是稠合的或未稠合的。未稠合的环可通过以下一种或更多种连接:共价键、烷二基或烯二基(碳数限制允许)。本文中使用的该术语不排除存在与环或环体系连接的一个或更多个烷基(碳数限制允许)。此外,该术语不排除在环或环体系中存在一个或更多个双键,前提是所得基团仍为非芳香族。杂环烷二基的非限制性实例包括:
术语“N-杂环烷基”是指具有氮原子作为连接点的杂环烷基。N-吡咯烷基是该基团的一个实例。当这些术语与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。
当在没有“经取代”修饰语的情况下使用时,术语“酰基”是指基团-C(O)R,其中R为氢、烷基、环烷基、烯基、芳基、芳烷基或杂芳基,正如上文所定义的那些术语。基团-CHO、-C(O)CH3(乙酰基,Ac)、-C(O)CH2CH3、-C(O)CH2CH3、-C(O)CH2CH2CH3、-C(O)CH(CH3)2、-C(O)CH(CH2)2、-C(O)C6H5、-C(O)C6H4CH3、-C(O)CH2C6H5、-C(O)(咪唑基)是酰基的一些非限制性实例。“硫代酰基”以类似的方式定义,不同之处在于基团-C(O)R的氧原子已被替换为硫原子,即-C(S)R。术语“醛”对应于如上所定义的烷烃,其中至少一个氢原子已被-CHO基团取代。当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子(包括与羰基或硫代羰基的碳原子直接连接的氢原子,如果有的话)已经被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。基团-C(O)CH2CF3、-CO2H(羧基)、-CO2CH3(甲基羧基)、-CO2CH2CH3、-C(O)NH2(氨甲酰基)和-CON(CH3)2是经取代酰基的一些非限制性实例。
当在没有“经取代”修饰语的情况下使用时,术语“烷氧基”是指基团-OR,其中R为烷基,正如上文所定义的该术语。非限制性实例包括:-OCH3(甲氧基)、-OCH2CH3(乙氧基)、-OCH2CH2CH3、-OCH(CH3)2(异丙氧基)、-OC(CH3)3(叔丁氧基)、-OCH(CH2)2、-O-环戊基和-O-环己基。当在没有“经取代”修饰语的情况下使用时,术语“环烷氧基”、“烯氧基”、“炔氧基”、“芳氧基”、“芳烷氧基”、“杂芳氧基”、“杂环烷氧基”和“酰氧基”是指定义为-OR的基团,其中R分别为环烷基、烯基、炔基、芳基、芳烷基、杂芳基、杂环烷基和酰基。当在没有“经取代”修饰语的情况下使用时,术语“烷硫基”和“酰硫基”是指基团-SR,其中R分别是烷基和酰基。术语“醇”对应于如上定义的烷烃,其中至少一个氢原子已替换为羟基。术语“醚”对应于如上定义的烷烃,其中至少一个氢原子已替换为烷氧基。当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。
当在没有“经取代”修饰语的情况下使用时,术语“烷基氨基”是指基团-NHR,其中R为烷基,正如上文所定义的该术语。非限制性实例包括:-NHCH3和-NHCH2CH3。当在没有“经取代”修饰语的情况下使用时,术语“二烷基氨基”是指基团-NRR’,其中R和R’可以是相同或不同的烷基,或者R和R’可一起表示烷二基。二烷基氨基的非限制性实例包括:-N(CH3)2和-N(CH3)(CH2CH3)。当在没有“经取代”修饰语的情况下使用时,术语“环烷基氨基”、“烯基氨基”、“炔基氨基”、“芳基氨基”、“芳烷基氨基”、“杂芳基氨基”、“杂环烷基氨基”、“烷氧基氨基”和“烷基磺酰基氨基”是指定义为-NHR的基团,其中R分别为环烷基、烯基、炔基、芳基、芳烷基、杂芳基、杂环烷基、烷氧基和烷基磺酰基。芳基氨基的一个非限制性实例是-NHC6H5。当在没有“经取代”修饰语的情况下使用时,术语“酰氨基”(酰基氨基)是指基团-NHR,其中R为酰基,正如上文所定义的该术语。酰氨基的一个非限制性实例是-NHC(O)CH3。当在没有“经取代”修饰语的情况下使用时,术语“烷基亚氨基”是指二价基团=NR,其中R为烷基,正如上文所定义的该术语。当这些术语中的任何一个与“经取代”修饰语一起使用时,与碳原子连接的一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。基团-NHC(O)OCH3和-NHC(O)NHCH3是经取代的酰氨基的一些非限制性实例。
当与权利要求书和/或说明书中的术语“包含”一起使用时,没有数量词修饰的名词表示“一个/种或更多个/种”、“至少一个/种”、“一个/种或多于一个/种”的含义。
贯穿本申请中,术语“约”用于表示值包括用于确定值的装置、方法误差的固有变化或研究对象之间存在的变化。
术语“包含”、“具有”和“包括”是开放式连接动词。这些动词中一种或更多种的形式或时态,例如“包含(comprises)”、“包含(comprising)”、“具有(has)”、“具有(having)”、“包括(includes)”和“包括(including)”也是开放式的。例如,“包含”、“具有”或“包括”一个或更多个步骤的任何方法不限于仅具有那些一个或更多个步骤并且还包括其他未列出的步骤。
在说明书和/或权利要求书中使用的术语“有效的”意指足以实现期望的、预期的或想要的结果。当在用化合物治疗患者或对象的情况下使用时,“有效量”、“治疗有效量”或“药学有效量”意指当向对象或患者施用以治疗疾病时化合物的量足以实现疾病的这种治疗。
本文中使用的术语“IC50”是指为所获得的最大响应之50%的抑制剂量。这种定量量度表明抑制给定的生物学、生物化学或化学过程(或过程的组分,即酶、细胞、细胞受体或微生物)的一半需要多少特定药物或其他物质(抑制剂)。
第一化合物的“异构体”是其中每个分子含有与第一化合物相同的组成原子但是三维中这些原子的构型不同的独立化合物。
本文中使用的术语“患者”或“对象”是指活的哺乳动物生物体,例如人、猴、牛、绵羊、山羊、狗、猫、小鼠、大鼠、豚鼠或其转基因物种。在某些实施方案中,患者或对象是灵长类。人对象的一些非限制性实例是成年人、青少年、婴儿和胎儿。
本文中通常使用的“可药用”是指在合理的医学判断范围内适用于与人和动物的组织、器官和/或体液接触而无过度的毒性、刺激性、变态反应的与合理的效益/风险比相称的其他问题或并发症的那些化合物、材料、组合物和/或剂量形式。
“可药用盐”意指本公开内容化合物的盐,其是如上定义的可药用的并且具有期望的药理学活性。这样的盐包括与无机酸形成的酸加成盐,所述无机酸例如盐酸、氢溴酸、硫酸、硝酸、磷酸等;或与有机酸形成的酸加成盐,所述有机酸例如1,2-乙二磺酸、2-羟基乙磺酸、2-萘磺酸、3-苯基丙酸、4,4’-亚甲基双(3-羟基-2-烯-1-羧酸)、4-甲基双环[2.2.2]辛-2-烯-1-羧酸、乙酸、脂肪族单羧酸和二羧酸、脂肪族硫酸、芳香族硫酸、苯磺酸、苯甲酸、樟脑磺酸、碳酸、肉桂酸、柠檬酸、环戊烷丙酸、乙磺酸、富马酸、葡庚糖酸、葡糖酸、谷氨酸、乙醇酸、庚酸、己酸、羟基萘甲酸、乳酸、月桂基硫酸、马来酸、苹果酸、丙二酸、扁桃酸、甲磺酸、黏康酸、o-(4-羟基苯甲酰基)苯甲酸、草酸、对氯苯磺酸、苯基取代的烷酸、丙酸、对甲苯磺酸、丙酮酸、水杨酸、硬脂酸、琥珀酸、酒石酸、叔丁基乙酸、三甲基乙酸等。可药用盐还包括当存在酸性质子时可以能够与无机或有机碱反应形成的碱加成盐。可接受的无机碱包括氢氧化钠、碳酸钠、氢氧化钾、氢氧化铝和氢氧化钙。可接受的有机碱包括乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、N-甲基葡糖胺等。应认识到,构成本公开内容的任何盐的一部分的特定阴离子或阳离子不是关键的,只要该盐作为整体在药理学上是可接受的即可。可药用盐及其制备和使用方法的另外的实例示于Handbook of Pharmaceutical Salts:Properties,and Use(P.H.Stahl和C.G.Wermuth编辑,Verlag Helvetica Chimica Acta,2002)中。
本文中使用的术语“可药用载体”意指涉及携带或运输化学试剂的可药用材料、组合物或载剂,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料。
“预防”或“防止”包括:(1)在可能处于疾病风险和/或易患疾病但尚未经历或显示出疾病的任何或所有病理状况或症状的对象或患者中抑制疾病的发作,和/或(2)在可能处于疾病风险和/或易患疾病但尚未经历或显示出疾病的任何或全部病理状况或症状的对象或患者中减缓疾病之病理状况或症状的发作。
“立体异构体”或“光学异构体”是给定化合物的异构体,其中相同的原子与相同的其他原子键合,但三维中那些原子的构型不同。“对映体”是给定化合物的立体异构体,它们彼此互为镜像,就像左手和右手一样。“非对映体”是给定化合物的不是对映体的立体异构体。手性分子含有手性中心,也称为立构中心或立体异构源中心,是具有基团的分子中是任何这样的点(但未必是原子):使得任何两个基团的交换产生立体异构体。在有机化合物中,手性中心通常是碳、磷或硫原子,但是其他原子也可能是有机和无机化合物中的立构中心。分子可具有多个立构中心,给予其许多立体异构体。在立体异构由四面体立构中心(例如,四面体碳)引起的化合物中,假设可能的立体异构体的总数将不超过2n,其中n是四面体立构中心的数目。具有对称性的分子通常具有少于最大可能数目的立体异构体。对映体的50∶50混合物称为外消旋混合物。或者,对映体的混合物可以是对映体富集的,使得一种对映体的存在量大于50%。通常来说,可使用本领域中已知的技术拆分或分离对映体和/或非对映体。预期对于尚未限定立体化学的任何立构中心或手性轴,该立构中心或手性轴可以以其R形式、S形式或作为R和S形式的混合物(包括外消旋和非外消旋混合物)存在。本文中使用的短语“基本上不含其他立体异构体”是指组合物含有≤15%、更优选≤10%、甚至更优选≤5%、或最优选≤1%的其他立体异构体。
“治疗”包括(1)在经历或显示出疾病之病理状况或症状的对象或患者中抑制疾病(例如,阻止病理状况或症状的进一步发展),(2)在经历或显示出疾病之病理状况或症状的对象或患者中改善疾病(例如,逆转病理状况或症状),和/或(3)在经历或显示出疾病之病理状况或症状的对象或患者中实现疾病的任何可测量的降低。
上述定义代替通过引用并入本文中的任何参考文献中的任何冲突定义。然而,定义某些术语的事实不应被视为指示任何未定义的术语是不明确的。相反,认为所用的所有术语明确地描述本公开内容,使得本领域普通技术人员可理解本公开内容的范围和实践。
B.氨基脂质
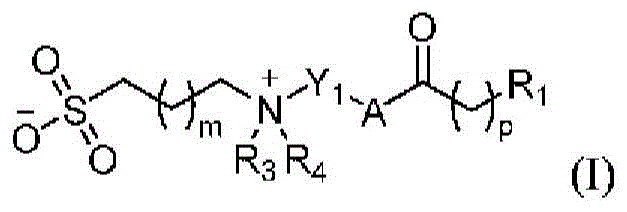
在一些方面,本公开内容提供了一种或更多种氨基脂质化合物,其包含两个或更多个氮原子和磺酸或磺酸衍生物,例如磺酰胺。在一些实施方案中,一类氨基脂质是阳离子磺酰胺氨基脂质,其包含:两个或更多个氮原子,其中至少一个氮原子是在生理pH下质子化的胺;两个或更多个脂质基团;以及磺酰胺基团。这类氨基脂质含有两个或更多个脂质基团,其中脂质基团是C6-C24脂肪族基团,包括烷基、烯基、炔基或这些基团的经取代形式。这些脂质基团通过酯、酰胺或环氧化物连接至氨基脂质基团的其余部分。在一些实施方案中,脂质基团是C6-C24烷基或经取代烷基。
在另一些实施方案中,本文中描述的另一类氨基脂质是两性离子氨基脂质,其包含:两个或更多个氮原子,其中至少一个氮原子是季铵原子;带负电荷的基团;以及两个或更多个脂质基团。带负电荷的基团可以是膦酸基团或磺酸基团。在一些实施方案中,带负电荷的基团是磺酸基团。如上所述,脂质基团是C6-C24脂肪族基团,包括烷基、烯基、炔基或这些基团的经取代形式。这些脂质基团通过酯、酰胺或环氧化物连接至氨基脂质基团的其余部分。在一些实施方案中,脂质基团是C6-C24烷基或经取代烷基。
在一些实施方案中,本发明的组合物包含的化合物或氨基脂质与核酸的比例为约1∶1至约1500∶1或约5∶1至约1000∶1。该比例可以是约100∶1至1000∶1或约250∶1至约750∶1,例如比例为约166∶1、333∶1或666∶1。在一些实施方案中,该比例为约1∶1、5∶1、25∶1、50∶1、75∶1、100∶1、200∶1、300∶1、350∶1、400∶1、500∶1、600∶1、650∶1、700∶1、750∶1、800∶1、900∶1,至约1000∶1,或可从其中来源的任何范围。
C.辅助脂质
在本公开内容的一些方面,将一种或更多种脂质与本公开内容的氨基脂质混合以产生纳米粒组合物。在一些实施方案中,氨基脂质与1、2、3、4或5种不同类型的脂质混合。考虑氨基脂质可与多种不同的单一类型的脂质混合。在一些实施方案中,脂质可以是类固醇或类固醇衍生物。在另一些实施方案中,脂质是PEG脂质。在另一些实施方案中,脂质是磷脂。在另一些实施方案中,纳米粒组合物包含类固醇或类固醇衍生物、PEG脂质、磷脂或其任何组合。
1.类固醇和类固醇衍生物
在本公开内容的一些方面,氨基脂质与一种或更多种类固醇或类固醇衍生物混合以产生纳米粒组合物。在一些实施方案中,类固醇或类固醇衍生物包含任何类固醇或类固醇衍生物。如本文中所用,在一些实施方案中,术语“类固醇”是一类具有四环17碳环状结构的化合物,其可进一步包含一个或更多个取代,包括烷基、烷氧基、羟基、氧代基团、酰基,或两个或更多个碳原子之间的双键。在一个方面,类固醇的环结构包含三个稠合的环己基环和一个稠合的环戊基环,如下式所示:
在一些实施方案中,类固醇衍生物包含具有一个或更多个非烷基取代的上述环结构。在一些实施方案中,类固醇或类固醇衍生物是固醇,其中该式进一步限定为:
在本公开内容的一些实施方案中,类固醇或类固醇衍生物是胆甾烷或胆甾烷衍生物。在胆甾烷中,环结构进一步由下式限定:
如上所述,胆甾烷衍生物包括上述环系的一个或更多个非烷基取代。在一些实施方案中,胆甾烷或胆甾烷衍生物是胆甾烯或胆甾烯衍生物或固醇或固醇衍生物。在另一些实施方案中,胆甾烷或胆甾烷衍生物是胆甾烯和固醇二者或其衍生物。
在一些实施方案中,本发明的组合物包含的化合物或氨基脂质与类固醇或类固醇衍生物的比例为约1∶3至约30∶1或约1∶1至约20∶1。该比例可以是约1∶1至6∶1,例如比例为约1.3∶1。在一些实施方案中,该比例为约1∶3、1∶2、1∶1、1.25∶1、1.5∶1、2∶1、3∶1、5∶1、8∶1、10∶1、12.5∶1、15∶1、17.5∶1、20∶1、25∶1,至约30∶1,或可从其中来源的任何范围。
2.PEG或PEG化脂质
在本公开内容的一些方面,氨基脂质(或化合物)与一种或更多种PEG化脂质(或PEG脂质)混合以产生纳米粒组合物。在一些实施方案中,本公开内容包括使用已连接PEG基团的任何脂质。在一些实施方案中,PEG脂质是甘油二酯,其还包含连接至甘油基团的PEG链。在另一些实施方案中,PEG脂质是包含连接至具有PEG链的接头的一个或更多个C6-C24长链烷基或烯基或C6-C24脂肪酸基团的化合物。PEG脂质的非限制性实例包括PEG修饰的磷脂酰乙醇胺和磷脂酸、PEG神经酰胺缀合的、PEG修饰的二烷基胺和PEG修饰的1,2-二酰氧基丙-3-胺、PEG修饰的二酰基甘油和二烷基甘油。在一些实施方案中,PEG修饰的二硬脂酰磷脂酰乙醇胺或PEG修饰的二豆蔻酰基-sn-甘油。在一些实施方案中,PEG修饰通过脂质的PEG组分的分子量来测量。在一些实施方案中,PEG修饰的分子量为约100至约5,000。在一些实施方案中,分子量为约200至约500或约1,200至约3,000。可在本公开内容中使用的脂质的一些非限制性实例由美国专利5,820,873、WO 2010/141069或美国专利8,450,298教导,其通过引用并入本文。
在另一方面,PEG脂质具有下式:
其中:n1是1至100的整数,n2和n3各自独立地选自1至29的整数。在一些实施方案中,n1为5、10、15、20、25、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95或100,或可从其中来源的任何范围。在一些实施方案中,n1为约30至约50。在一些实施方案中,n2为5至23。在一些实施方案中,n2为11至约17。在一些实施方案中,n3为5至23。在一些实施方案中,n3是11到17。
在一些实施方案中,本发明的组合物包含的化合物或氨基脂质与PEG脂质的比例为约1∶1至约150∶1或约2.5∶1至约100∶1。该比例可以是约7.5∶1至50∶1,例如比例为约33.3∶1。在一些实施方案中,该比例为约5∶1、10∶1、20∶1、25∶1、30∶1、35∶1、40∶1、50∶1、60∶1、70∶1、80∶1、90∶1、100∶1、120∶1、140∶1,至约150∶1,或可从其中来源的任何范围。
3.磷脂
在本公开内容的一些方面,氨基脂质与一种或更多种磷脂混合以产生纳米粒组合物。在一些实施方案中,任何脂质也包含磷酸根基团。在一些实施方案中,磷脂是包含一个或两个长链C6-C24烷基或烯基、甘油或鞘氨醇、一个或两个磷酸根基团和任选的小有机分子的结构。在一些实施方案中,小有机分子是氨基酸、糖或氨基取代的烷氧基,例如胆碱或乙醇胺。在一些实施方案中,磷脂是磷脂酰胆碱。在一些实施方案中,磷脂是二硬脂酰磷脂酰胆碱。
在一些实施方案中,本发明的组合物包含的化合物或氨基脂质与磷脂的比例为约1∶1至约15∶1或约1∶1至约9∶1。该比例可以是约2.5∶1至7.5∶1,例如比例为约5∶1。在一些实施方案中,比例为约1∶1,2∶1,3∶1,4∶1、4.5∶1、5∶1、5.5∶1、6∶1、7∶1、8∶1、9∶1、10∶1、12∶1、14∶1,至约15∶1,或可从其中来源的任何范围。
D.核酸和基于核酸的治疗剂
1.核酸
在本公开内容的一些方面,纳米粒组合物包含一种或更多种核酸。此外,应该清楚的是,本公开内容不限于本文中公开的特定核酸。然而,本公开内容的范围不限于核酸的任何特定来源、序列或类型,因为本领域普通技术人员可容易地鉴定核酸的各种其他来源中的相关同源物,包括来自非人物种(例如,小鼠、大鼠、兔、狗、猴、长臂猿、黑猩猩、猿、狒狒、牛、猪、马、绵羊、猫和其他物种)的核酸。考虑本公开内容中使用的核酸可包含基于天然序列的序列。允许遗传密码的简并性,序列的至少约50%、通常至少约60%、更通常约70%、最通常约80%、优选至少约90%、最优选约95%的核苷酸与天然序列的核苷酸序列相同。在另一个实施方案中,核酸是天然序列的互补序列,或与75%、80%、85%、90%、95%和100%互补。
在一些方面,核酸是沉默、互补或替代体内存在的另一序列的序列。长度为17个碱基的序列在人类基因组中应仅出现一次,因此,足以指定独特的靶序列。尽管较短的寡聚体更容易制备并且提高了体内可及性,但是在确定杂交的特异性中涉及许多其他因素。寡核苷酸与其互补靶标的结合亲和力和序列特异性均随着长度的增大而提高。考虑将使用8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100或更多个碱基对的示例性寡核苷酸,但也考虑其他。还考虑编码250、500、1000、1212、1500、2000、2500、3000或更长的较长多核苷酸。
本文中使用的核酸可源自基因组DNA,即从特定生物的基因组直接克隆。然而,在一些优选的实施方案中,核酸可包含互补DNA(cDNA)。还考虑cDNA加上天然内含子或来自另一基因的内含子;这种工程化分子有时被称为“小基因(mini-gene)”。至少,本公开内容的这些和其他核酸可用作例如凝胶电泳中的分子量标准。
术语“cDNA”意指使用信使RNA(mRNA)作为模板制备的DNA。与基因组DNA或从基因组的未加工或部分加工的RNA模板聚合的DNA相比,使用cDNA的优点是cDNA主要含有相应蛋白质的编码序列。有时优选全部或部分基因组序列,例如当非编码区域是最佳表达所需时,或者当非编码区域(例如内含子)在反义策略中靶向时。
在一些实施方案中,核酸包含一个或更多个抑制基因表达或基因产物的反义片段。反义方法利用核酸倾向于与“互补”序列配对的事实。互补意指多核苷酸是能够根据标准Watson-Crick互补规则进行碱基配对的多核苷酸。也就是说,较大的嘌呤将与较小的嘧啶碱基配对,以形成鸟嘌呤与胞嘧啶配对(G∶C)以及腺嘌呤(在DNA的情况下)与胸腺嘧啶配对(A∶T),或腺嘌呤(在RNA的情况下)与尿嘧啶配对(A∶U)的组合。在杂交序列中引入较不常见的碱基(例如肌苷、5-甲基胞嘧啶、6-甲基腺嘌呤、次黄嘌呤等)不干扰配对。
用多核苷酸靶向双链(ds)DNA导致三螺旋形成;靶向RNA将导致双螺旋形成。当引入到靶细胞中时,反义多核苷酸与其靶多核苷酸特异性结合并干扰转录、RNA加工、转运、翻译和/或稳定性。在体外或体内,例如在宿主动物(包括人对象)内,反义RNA构建体或编码这种反义RNA的DNA可用于抑制宿主细胞内的基因转录或翻译或这二者。
可设计反义构建体以与基因的启动子和其他控制区、外显子、内含子或甚至外显子-内含子边界结合。考虑最有效的反义构建体将包含与内含子/外显子剪接点互补的区域。因此,提出优选的实施方案包括与内含子-外显子剪接点的50-200碱基内的区域互补的反义构建体。已观察到一些外显子序列可包含在构建体中而不会严重影响其靶选择性。包含的外显子材料的量将根据所用的特定外显子和内含子序列而变化。简单地通过在体外测试构建体以确定正常细胞功能是否受影响或具有互补序列的相关基因的表达是否受影响,可容易地测试是否包含过多的外显子DNA。
如上所述,“互补”或“反义”意指在其整个长度上基本上互补并且具有非常少的碱基错配的多核苷酸序列。例如,当长度为十五个碱基的序列在十三个或十四个位置具有互补核苷酸时,可称为互补。当然,完全互补的序列是在其整个长度上完全互补并且没有碱基错配的序列。还考虑具有较低同源性的其他序列。例如,可设计具有有限的高同源性区域但还含有非同源区域的反义构建体(例如,核酶;见下文)。这些分子虽然具有小于50%的同源性,但在适当的条件下会与靶序列结合。
将基因组DNA的部分与cDNA或合成序列组合以形成siRNA或产生特定构建体可能是有利的。例如,在最终构建体中期望内含子的情况下,将需要使用基因组克隆。cDNA、siRNA或合成多核苷酸可为构建体的其余部分提供更方便的限制性位点,因此,将用于序列的其余部分。其他实施方案包括dsRNA或ssRNA,其可用于靶向基因组序列或编码/非编码转录物。
在另一些实施方案中,纳米粒可包含核酸,其包含在基因治疗中使用的一种或更多种表达载体。表达需要在载体中提供合适的信号,并且其包含多种调节元件,例如来自病毒和哺乳动物来源的增强子/启动子,其驱动目的基因在宿主细胞中表达。还定义了设计用于优化宿主细胞中信使RNA稳定性和可翻译性的元件。还提供了使用许多显性药物选择标记来建立表达产物的永久性稳定细胞克隆的条件,以及将药物选择标记的表达与多肽表达联系起来的元件。
在整个申请中,术语“表达构建体”意在包括含有编码基因产物的核酸的任何类型的遗传构建体,其中部分或全部核酸编码序列能够被转录。转录物可翻译成蛋白质,但不一定翻译。在某些实施方案中,表达包括基因的转录和mRNA翻译成基因产物二者。在另一些实施方案中,表达仅包括编码目的基因的核酸的转录。
术语“载体(vector)”用于指载剂核酸分子,其中可插入核酸序列以引入到其可复制的细胞中。核酸序列可以是“外源的”,这意味着它对于引入载体的细胞是外来的,或者该序列与细胞中的序列同源但在宿主细胞核酸内该序列通常不存在的位置中。载体包括质粒、黏粒、病毒(噬菌体、动物病毒和植物病毒)和人工染色体(例如,YAC)。本领域技术人员可通过标准重组技术熟练地构建载体,所述技术在Sambrook等(1989)和Ausubel等(1994)中描述,这二者均通过引用并入本文。
术语“表达载体”是指含有编码能够被转录的基因产物的至少一部分的核酸序列的载体。在一些情况下,然后将RNA分子翻译成蛋白质、多肽或肽。在另一些情况下,这些序列不翻译,例如,在产生反义分子或核酶中。表达载体可含有多种“控制序列”,其指的是在特定宿主生物中转录和可能翻译可操作连接的编码序列所必需的核酸序列。除了控制转录和翻译的控制序列之外,载体和表达载体还可含有用于其他功能的核酸序列,并且在下文中描述。
2.siRNA
如上所述,本公开内容考虑了使用一种或更多种抑制性核酸来降低基因或基因产物的表达和/或活化。抑制性核酸的实例包括但不限于靶向核酸序列的分子,例如siRNA(小干扰RNA)、短发夹RNA(shRNA)、双链RNA、反义寡核苷酸、核酶和靶向基因或基因产物的分子(例如适配体)。
抑制性核酸可在细胞中抑制基因的转录或阻止基因转录物的翻译。抑制性核酸长度可以是16至1000个核苷酸,并且在某些实施方案中,长度为18至100个核苷酸。
抑制性核酸是本领域中公知的。例如,siRNA、shRNA和双链RNA已在美国专利6,506,559和6,573,099以及美国专利公开2003/0051263、2003/0055020、2004/0265839、2002/0168707、2003/0159161、and2004/0064842中描述,所有这些文献都通过引用整体并入本文。
自1998年Fire及其同事发现RNAi以来,生化机制得到了迅速的表征。将双链RNA(dsRNA)通过Dicer切割,所述Dicer是RNA酶III家族核糖核酸酶。该过程产生长度为~21个核苷酸的siRNA。将这些siRNA引入到多蛋白RNA诱导的沉默复合物(RNA-inducedsilencing complex,RISC)中,其被引导至靶mRNA。RISC在互补区域的中间切割靶mRNA。在哺乳动物细胞中,发现相关的微RNA(miRNA)为短RNA片段(~22个核苷酸)。在Dicer介导的具有不完美发夹RNA结构的较长(~70个核苷酸)前体的切割之后,产生miRNA。将miRNA引入到miRNA-蛋白质复合物(miRNP)中,其导致靶mRNA的翻译抑制。
在设计能够产生RNAi效应的核酸时,需要考虑若干因素,例如siRNA的性质、沉默效应的持久性和递送系统的选择。为了产生RNAi效应,引入生物体的siRNA将通常含有外显子序列。此外,RNAi过程是同源依赖性的,因此必须仔细选择序列以使基因特异性最大化,同时使同源但非基因特异性序列之间交叉干扰的可能性最小化。特别地,siRNA在siRNA序列和EphA核苷酸序列的一部分之间表现出大于80%、85%、90%、95%、98%或甚至100%的同一性。与靶基因小于约80%同一性的序列基本上不太有效。因此,siRNA和待抑制基因之间的同一性越大,不相关基因的表达越可不受影响。
另外,siRNA的大小是重要的考虑因素。在一些实施方案中,本公开内容涉及包含至少约19-25个核苷酸并且能够调节基因表达的siRNA分子。在本公开内容的上下文中,siRNA的长度特别小于500、200、100、50、25或20个核苷酸。在一些实施方案中,siRNA的长度为约25个核苷酸至约35个核苷酸或约19个核苷酸至约25个核苷酸。
为了提高siRNA介导的基因沉默的有效性,已经开发了用于选择mRNA上的靶位点的指南以用于siRNA的优化设计(Soutschek等,2004;Wadhwa等,2004)。这些策略可允许选择siRNA序列以实现最大基因敲低(knockdown)的合理方法。为了促进siRNA进入细胞和组织,已使用了多种载体,包括质粒和病毒载体,例如腺病毒、慢病毒和逆转录病毒(Wadhwa等,2004)。
在抑制性核酸内,核酸的组分不需要是全部相同类型或同源的(例如,抑制性核酸可包含核苷酸和核酸或核苷酸类似物)。通常来说,抑制性核酸形成双链结构;双链结构可由两个部分地或完全地互补的独立核酸产生。在本公开内容的某些实施方案中,抑制性核酸可仅包含单个核酸(多核苷酸)或核酸类似物,并通过与其自身互补形成双链结构(例如,形成发夹环)。抑制性核酸的双链结构可包含16-500个或更多个连续核碱基,包括可从其来源的所有范围。抑制性核酸可包含17至35个连续核碱基、更特别是18至30个连续核碱基、更特别是19至25个核碱基、更特别是20至23个连续核碱基、或20至22个连续核碱基、或21个连续核碱基,其与互补核酸(可以是相同核酸的另一部分或单独的互补核酸)杂交以形成双链结构。
siRNA可从商业来源、天然来源获得,或者可使用本领域普通技术人员公知的许多技术中的任一种来合成。例如,预先设计的siRNA的商业来源包括Invitrogen的StealthTMSelect technology(Carlsbad,CA)、(Austin,TX)和(Valencia,CA)。可应用于本公开内容的组合物和方法中的抑制性核酸可以是通过任何来源发现的是基因或基因产物的经验证下调剂的任何核酸序列。
在一些实施方案中,本公开内容的特征在于具有至少19个核苷酸的分离的siRNA分子,其至少一条链与编码基因的核酸的至少十个但不超过三十个连续核苷酸互补,并且降低基因或基因产物的表达。在本公开内容的一个实施方案中,siRNA分子的至少一条链与编码基因或基因产物的mRNA的至少十个但不多于三十个连续核苷酸互补。
在一个实施方案中,siRNA分子与编码靶治疗性蛋白质的任何核酸序列的至少10个连续核苷酸具有至少75%、80%、85%或90%同源性,特别是至少95%、99%或100%相似性或同一性,或前述值之间的任何百分比(例如,本公开内容考虑到75%和更高、80%和更高、85%和更高,等,并且所述范围旨在包括其间的所有整数)。
siRNA还可包含一个或更多个核苷酸的改变。这样的改变可包括添加非核苷酸材料,例如添加至19至25个核苷酸的RNA的末端或内部(在RNA的一个或更多个核苷酸处)。在某些方面,RNA分子含有3′-羟基。本公开内容的RNA分子中的核苷酸还可包含非标准核苷酸,包括非天然的核苷酸或脱氧核糖核苷酸。双链寡核苷酸可包含经修饰骨架,例如硫代磷酸酯、二硫代磷酸酯或本领域中已知的其他经修饰骨架,或者可包含非天然的核苷间键联。siRNA的其他修饰(例如,2′-O-甲基核糖核苷酸、2′-脱氧-2′-氟核糖核苷酸、“通用碱基”核苷酸、5-C-甲基核苷酸、一个或更多个硫代磷酸酯核苷酸间键联和反向脱氧无碱基残基(deoxyabasic residue)引入)可见于美国公开2004/0019001和美国专利6,673,611(其各自通过引用整体并入)。上述所有这些改变的核酸或RNA被统称为经修饰siRNA。
在一个实施方案中,siRNA能够将特定基因产物的表达降低至少10%、至少20%、至少30%、或至少40%、至少50%、至少60%、或至少70%、至少75%、至少80%、至少90%、至少95%或更多或者前述值之间的任何范围。
3.tRNA
在一些方面,本发明的组合物包含转移RNA(称为tRNA)。本文中使用的术语转移RNA或tRNA指传统tRNA分子以及具有一个或更多个修饰的tRNA分子,除非另有特别说明。转移RNA是长度为约70至100个核苷酸的RNA聚合物。在蛋白质合成期间,tRNA向核糖体递送氨基酸以添加至正在增长的肽链。活性tRNA具有3′CCA尾部,其可在其合成期间转录成tRNA,或者可在转录后加工期间稍后添加。氨基酸与3′-末端核糖的2′或3′羟基共价连接,以形成氨酰-tRNA(aa-tRNA);氨基酸可自发地从2′-OH迁移到3′-OH,且反之亦然,但其在核糖体中从3′-OH位置引入到增长的蛋白质链中。折叠的aa-tRNA分子另一端的环含有被称为反密码子的三个碱基的序列。当该反密码子序列与核糖体结合的信使RNA(mRNA)中的三碱基密码子序列碱基配对时,aa-tRNA与核糖体结合并且其氨基酸并入到新生蛋白质链中。由于与特定密码子碱基配对的所有tRNA都被单一特定氨基酸氨酰基化,因此遗传密码的翻译受到tRNA的影响:mRNA中61个非终止密码子中的每一个都指导其同源aa-tRNA的结合,并且向增长的蛋白质聚合物中添加单一特定氨基酸。在一些实施方案中,tRNA可包含tRNA的反密码子区域中的突变,使得aa-tRNA与mRNA上的不同密码子碱基配对。在某些实施方案中,突变的tRNA向增长的蛋白质链中引入与mRNA编码的氨基酸不同的氨基酸。在另一些实施方案中,突变的tRNA与具有终止密码子碱基配对并引入氨基酸而不是终止蛋白质合成,从而允许新生肽继续增长。在一些实施方案中,野生型或突变的tRNA可通过终止密码子读取并引入氨基酸而不终止蛋白质合成。在一些实施方案中,tRNA可包含含有3′-末端-CCA核苷酸的全长tRNA。在另一些实施方案中,缺乏3′-末端-A、-CA或-CCA的tRNA通过CCA添加酶在体内全长制备。
在另一些方面,本发明的组合物可进一步包含一种或更多种经修饰tRNA分子,包括:酰化tRNA;烷基化tRNA;含有腺嘌呤、胞嘧啶、鸟嘌呤或尿嘧啶以外的一个或更多个碱基的tRNA;通过连接荧光性、亲和性、反应性、光谱性或其他探针部分共价修饰的tRNA;含有一个或更多个被甲基化或以其他方式修饰的核糖部分的tRNA;用20种天然氨基酸以外的氨基酸(包括作为试剂载体或作为荧光性、反应性、亲和性、光谱性或其他探针的非天然氨基酸)进行氨酰基化的aa-tRNA;或这些组合物的任何组合。经修饰tRNA分子的一些实例由以下教导:等,1995;El Yacoubi等,2012;Grosjean和Benne等,1998;Hendrickson等,2004;Ibba和2000;Johnson等,1995;Johnson等,1982;Crowley等,1994;Beier和Grimm,2001;Torres等,2014;和等,1987,所有这些文献都通过引用并入本文。
4.mRNA
在一些方面,本发明化合物和组合物可用于将mRNA递送至细胞。信使RNA或mRNA是将遗传密码从DNA转移至核糖体以使其可翻译成功能性蛋白质或肽的短RNA链。本文中描述的mRNA可以是未加工的或已经过加工以添加poly(A)尾、在体内编辑或添加5′帽。考虑本发明的组合物递送多种不同的mRNA,包括那些未经过加工或已经进一步加工的mRNA。另外,这些核酸可用于治疗,用于体内产生抗体,或用于疫苗制剂。
5.CRISPR相关RNA
在一些方面,本发明化合物和组合物可用于递送核酸序列以用于CRISPR基因编辑。可用于本文中的CRISPR/Cas核酸酶或CRISPR/Cas核酸酶系统可包括与DNA序列特异性结合的非编码RNA分子(指导)RNA(sgRNA),以及具有核酸酶功能(例如,两个核酸酶结构域)的Cas蛋白(例如,Cas9)。
在一些方面,将Cas核酸酶和sgRNA(包括对靶序列具有特异性的crRNA与固定的tracrRNA的融合物)引入到细胞中。通常来说,sgRNA的5′末端的靶位点使用互补碱基配对将Cas核酸酶靶向靶位点,例如基因。可基于其紧邻原型间隔区相邻基序(protospaceradjacent motif,PAM)序列(例如通常为NGG或NAG)的5′的位置来选择靶位点。在这方面,通过修饰指导RNA的前20个核苷酸以对应于靶DNA序列,将sgRNA靶向期望序列。通常来说,CRISPR系统的特征在于促进靶序列位点处CRISPR复合物形成的元件。通常来说,“靶序列”通常是指导序列被设计为具有互补性的序列,其中靶序列与指导序列之间的杂交促进CRISPR复合物的形成。如果存在足够的互补性以引起杂交并促进CRISPR复合物的形成,则不一定需要完全互补性。通常来说,指导序列是与靶多核苷酸序列具有足够互补性以与靶序列杂交并且指导CRISPR复合物与靶序列序列特异性结合的任何多核苷酸序列。在一些实施方案中,当使用合适的比对算法最佳比对时,指导序列与其相应的靶序列之间的互补性程度为约或大于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更多。
可使用用于比对序列的任何合适的算法来确定最佳比对,其非限制性示例包括Smith-Waterman算法、Needleman-Wunsch算法、基于Burrows-Wheeler变换的算法(例如Burrows Wheeler Aligner)、Clustal W、Clustal X、BLAT、Novoalign(NovocraftTechnologies、ELAND(Illumina.San Diego,Calif.)、SOAP(可在soap.genomics.org.cn获得)和Maq(可在maq.sourceforge.net获得)。在一些实施方案中,考虑本文中所述的组合物可用于将CRISPR核酸和核酸酶递送至一种或更多种细胞,或可用于指导仅递送核酸。
6.经修饰核碱基
在一些实施方案中,本公开内容的核酸包含一个或更多个包含经修饰糖部分的经修饰核苷。这种包含一个或更多个糖修饰核苷的化合物可具有期望的性质,例如相对于仅包含含有天然糖部分的核苷的寡核苷酸增强的核酸酶稳定性或提高的与靶核酸的结合亲和力。在一些实施方案中,经修饰糖部分是经取代糖部分。在一些实施方案中,经修饰糖部分是糖替代物。这样的糖替代物可包含一个或更多个对应于经取代糖部分的取代。
在一些实施方案中,经修饰糖部分是经取代糖部分,其包含一个或更多个非桥连糖取代基,包括但不限于2′-和/或5′-位的取代基。适用于2′-位的糖取代基的实例包括但不限于:2′-F、2′-OCH3(″OMe″或″O-甲基″)、和2′-O(CH2)2OCH3(“MOE”)。在某些实施方案中,2′-位的糖取代基选自烯丙基、氨基、叠氮基、硫代、O-烯丙基、O--C1-C10烷基、O--C1-C10经取代烷基;OCF3、O(CH2)2SCH3、O(CH2)2--O--N(Rm)(Rn)、以及O--CH2--C(=O)--N(Rm)(Rn),其中每个Rm和Rn独立地为H或者经取代或未经取代的C1-C10烷基。5′-位糖取代基的实例包括但不限于:5′-甲基(R或S);5′-乙烯基和5′-甲氧基。在一些实施方案中,经取代糖包含多于一个非桥连糖取代基,例如,TF-5′-甲基糖部分(对于另外的5′,2′-双取代糖部分和核苷,参见例如PCT国际申请WO 2008/101157)。
包含2′-取代的糖部分的核苷被称为2′-取代的核苷。在一些实施方案中,2′-取代的核苷包含选自以下的2′-取代基:卤素、烯丙基、氨基、叠氮基、SH、CN、OCN、CF3、OCF3、O、S或N(Rm)-烷基;O、S或N(Rm)-烯基;O、S或N(Rm)-炔基;O-亚烷基-O-烷基、炔基、烷芳基、芳烷基、O-烷芳基、O-芳烷基、O(CH2)2SCH3、O(CH2)2--O--N(Rm)(Rn)或O--CH2--C(=O)--N(Rm)(Rn)、其中Rm和Rn各自独立地是H、氨基保护基或者经取代或未经取代的C1-C10烷基。这些2′-取代基可进一步被一个或更多个取代基取代,所述取代基独立地选自羟基、氨基、烷氧基、羧基、苄基、苯基、硝基(NO2)、硫醇、硫代烷氧基(S-烷基)、卤素、烷基、芳基、烯基和炔基。
在一些实施方案中,2′-取代的核苷包含选自以下的2′-取代基:F、NH2、N3、OCF3、O--CH3、O(CH2)3NH2、CH2-CH=CH2、O--CH2-CH=CH2、OCH2CH2OCH3、O(CH2)2SCH3、O--(CH2)2--O--N(Rm)(Rn)、O(CH2)2O(CH2)2N(CH3)2、和N-取代乙酰胺(O--CH2--C(=O)--N(Rm)(Rn),其中Rm和Rn各自独立地是H、氨基保护基或者经取代或未经取代的C1-C10烷基。
在一些实施方案中,2′-取代的核苷包含糖部分,所述糖部分包含选自以下的取代基:F、OCF3、O--CH3、OCH2CH2OCH3、O(CH2)2SCH3、O(CH2)2--O--N(CH3)2、--O(CH2)2O(CH2)2N(CH3)2和O--CH2--C(=O)--N(H)CH3。
在一些实施方案中,2′-取代的核苷包含糖部分,所述糖部分包含选自以下的取代基:F、O--CH3、和OCH2CH2OCH3。
某些经修饰的糖部分包含桥连糖取代基,其形成第二环,产生双环糖部分。在一些这样的实施方案中,双环糖部分包含4′和2′呋喃糖环原子之间的桥。这种4′至2′糖取代基的实例包括但不限于:--[C(Ra)(Rb)]n--、--[C(Ra)(Rb)]n--O--、--C(RaRb)--N(R)--O--或、--C(RaRb)--O--N(R)--;4′-CH2-2′、4′-(CH2)2-2′、4′-(CH2)--O-2′(LNA);4′-(CH2)--S-2′;4′-(CH2)2--O-2′(ENA);4′-CH(CH3)--O-2′(cEt)和4′-CH(CH2OCH3)--O-2′及其类似物(参见例如美国专利7,399,845);4′-C(CH3)(CH3)--O-2′及其类似物(参见例如WO2009/006478);4′-CH2--N(OCH3)-2′及其类似物(参见例如WO2008/150729);4′-CH2--O--N(CH3)-2′(参见例如US2004/0171570,2004年9月2日公开);4′-CH2--O--N(R)-2′和4′-CH2--N(R)--O-2′-,其中每个R独立地是H、保护基或C1-C12烷基;4′-CH2--N(R)--O-2′,,其中R是H、C1-C12烷基或保护基(参见美国专利7,427,672);4′-CH2--C(H)(CH3)-2′(参见例如Chattopadhyaya等,J.Org.Chem.,2009,74,118-134);以及4′-CH2--C(=CH2)-2′及其类似物(参见PCT国际申请WO 2008/154401)。
在一些实施方案中,这样的4′至2′桥独立地包含1至4个连接的基团,所述连接的基团独立地选自--[C(Ra)(Rb)]n--、--C(Ra)=C(Rb)--、--C(Ra)=N--、--C(=NRa)--、--C(=O)--、--C(=S)--、--O--、--Si(Ra)2--、--S(=O)x--、和--N(Ra)--;
其中:
X是0、1或2;
n是1、2、3或4;
Ra和Rb各自独立地是H、保护基、羟基、C1-C12烷基、经取代C1-C12烷基、C2-C12烯基、经取代C2-C12烯基、C2-C12炔基、经取代C2-C12炔基、C5-C20芳基、经取代C5-C20芳基、杂环基、经取代杂环基、杂芳基、经取代杂芳基、C5-C7脂环基、经取代C5-C7脂环基、卤素、OJ1、NJ1J2、SJ1、N3、COOJ1、酰基(C(=O)--H)、经取代酰基、CN、磺酰基(S(=O)2-J1)或亚磺酰基(S(=O)-J1);并且
J1和J2各自独立地是H、C1-C12烷基、经取代C1-C12烷基、C2-C12烯基、经取代C2-C12烯基、C2-C12炔基、经取代C2-C12炔基、C5-C20芳基、经取代C5-C20芳基、酰基(C(=O)--H)、经取代酰基、杂环基、经取代杂环基、C1-C12氨基烷基、经取代C1-C12氨基烷基或保护基。
包含双环糖部分的核苷被称为双环核苷或BNA。双环核苷包括但不限于:(A)α-L-亚甲氧基(4′-CH2--O-2′)BNA、(B)β-D-亚甲氧基(4′-CH2--O-2′)BNA(也称为锁核酸或LNA)、(C)亚乙氧基(4′-(CH2)2--O-2′)BNA、(D)氨氧基(4′-CH2--O--N(R)-2′)BNA、(E)氧代氨基(4′-CH2--N(R)--O-2′)BNA、(F)甲基(亚甲氧基)(4′-CH(CH3)--O-2′)BNA(也称为受约束的乙基(constrained ethyl)或cEt)、(G)亚甲基-硫代(4′-CH2--S-2′)BNA、(H)亚甲基-氨基(4′-CH2-N(R)-2′)BNA、(I)甲基碳环(4′-CH2--CH(CH3)-2′)BNA、(J)亚丙基碳环(4′-(CH2)3-2′)BNA和(K)甲氧基(亚乙氧基)(4′-CH(CH2OMe)-O-2′)BNA(也称为受约束的MOE或cMOE)。
另外的双环糖部分是本领域已知的,例如:Singh等,Chem.Commun.,1998,4,455-456;Koshkin等,Tetrahedron,1998,54,3607-3630;Wahlestedt等,Proc.Natl.Acad.Sci.U.S.A.,2000,97,5633-5638;Kumar等,Bioorg.Med.Chem.Lett.,1998,8,2219-2222;Singh等,J.Org.Chem.,1998,63,10035-10039;Srivastava等,J.Am.Chem.Soc.,129(26)8362-8379(2007年7月4日);Elayadi等,Curr.OpinionInvens.Drugs,2001,2,5561;Braasch等,Chem.Biol.,2001,8,1-7;Orum等,Curr.OpinionMol.Ther.,2001,3,239-243;美国专利7,053,207、6,268,490、6,770,748、6,794,499、7,034,133、6,525,191、6,670,461和7,399,845;WO 2004/106356、WO 1994/14226、WO 2005/021570和WO 2007/134181;美国专利公开号US 2004/0171570、US 2007/0287831和US2008/0039618;美国序列号12/129,154、60/989,574、61/026,995、61/026,998、61/056,564、61/086,231、61/097,787和61/099,844;以及PCT国际申请号PCT/US2008/064591、PCT/US2008/066154和PCT/US2008/068922。
在一些实施方案中,双环糖部分和引入这样的双环糖部分的核苷通过异构构型进一步限定。例如,包含4′-2′亚甲基-氧桥的核苷可以是α-L构型或β-D构型。先前,已将α-L-亚甲氧基(4′-CH2--O-2′)双环核苷引入到显示出反义活性的反义寡核苷酸中(Frieden等,Nucleic Acids Research,2003,21,6365-6372)。
在一些实施方案中,经取代糖部分包含一个或更多个非桥连糖取代基和一个或更多个桥连糖取代基(例如,5′-取代和4′-2′桥连糖;PCT国际申请WO 2007/134181,其中LNA被例如5′-甲基或5′-乙烯基取代)。
在一些实施方案中,经修饰的糖部分是糖替代物。在一些这样的实施方案中,天然糖的氧原子被例如硫、碳或氮原子取代。在一些这样的实施方案中,这种经修饰的糖部分还包含如上所述的桥连和/或非桥连取代基。例如,某些糖替代物包含4′-硫原子和2′-位(参见例如公开的美国专利申请US 2005/0130923)和/或5′位的取代。作为另外的实例,已经描述了具有4′-2′桥的碳环双环核苷(参见例如Freier等,Nucleic Acids Research,1997,25(22),4429-4443和Albaek等,J.Org.Chem.,2006,71,7731-7740)。
在一些实施方案中,糖替代物包含具有5-原子以外的环。例如,在一些实施方案中,糖替代物包含六元四氢吡喃。这种四氢吡喃可被进一步修饰或取代。包含此类经修饰四氢吡喃的核苷包括但不限于己糖醇核酸(HNA)、阿卓糖醇核酸(anitol nucleic acid,ANA)、甘露糖醇核酸(MNA)(参见Leumann,C J.Bioorg.&Med.Chem.(2002)10:841-854)和氟代HNA(F-HNA)。
在一些实施方案中,提供了式VII的经修饰的THP核苷,其中q1、q2、q3、q4、q5、q6和q7各自为H。在某些实施方案中,q1、q2、q3、q4、q5、q6和q7中的至少一个不是H。在一些实施方案中,q1、q2、q3、q4、q5、q6和q7中的至少一个是甲基。在一些实施方案中,提供式VII的THP核苷,其中R1和R2中的一个是F。在某些实施方案中,R1是氟且R2是H,R1是甲氧基且R2是H,并且R1是甲氧基乙氧基且R2是H。
本领域中还已知许多其他双环和三环糖替代物环体系,其可用于修饰核苷以引入到反义化合物中(参见例如综述文章Leumann,J.C,Bioorganic&Medicinal Chemistry,2002,10,841-854)。
还提供了修饰的组合,不限于例如2′-F-5′-甲基取代的核苷(对于其他公开的5′,2′-双取代核苷,参见PCT国际申请WO 2008/101157)以及用S替换核糖基环氧原子以及在2′-位的进一步取代(参见美国专利公开US2005/0130923)或者作为替代地双环核酸的5′-取代(参见PCT国际申请WO 2007/134181,其中4′-CH2--O-2′双环核苷在5′位被5′-甲基或5′-乙烯基进一步取代。已经描述了碳环双环核苷的合成和制备及其寡聚化和生化研究(参见例如,Srivastava等,J.Am.Chem.Soc.2007,129(26),8362-8379)。
在一些实施方案中,本公开内容提供了包含经修饰核苷的寡核苷酸。那些经修饰核苷酸可包括经修饰糖、经修饰核碱基和/或经修饰键联。选择具体修饰使得所得寡核苷酸具有期望特征。在一些实施方案中,寡核苷酸包含一个或更多个RNA样核苷。在一些实施方案中,寡核苷酸包含一个或更多个DNA样核苷酸。
在一些实施方案中,本公开内容的核苷包含一个或更多个未经修饰的核碱基。在某些实施方案中,本公开内容的核苷包含一个或更多个经修饰的核碱基。
在一些实施方案中,经修饰的核碱基选自:如本文定义的通用碱基、疏水碱基、泛主碱基(promiscuous base)、大小扩大的碱基和氟化碱基。5-取代的嘧啶,6-氮杂嘧啶和N-2、N-6和O-6取代的嘌呤,包括2-氨基丙基腺嘌呤,5-丙炔基尿嘧啶;5-丙炔基胞嘧啶;5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物,腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物,2-硫代尿嘧啶,2-硫代胸腺嘧啶和2-硫代胞嘧啶,5-卤代尿嘧啶和胞嘧啶,5-丙炔基CH3)尿嘧啶和胞嘧啶以及嘧啶碱基的其他炔基衍生物,6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶,5-尿嘧啶(假尿嘧啶),4-硫代尿嘧啶,8-卤代、8-氨基、8-硫醇、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤,5-卤素(特别是5-溴)、5-三氟甲基和其他5-取代尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤,2-F-腺嘌呤,2-氨基腺嘌呤,8-氮杂鸟嘌呤和8-氮杂腺嘌呤,7-脱氮鸟嘌呤和7-脱氮腺嘌呤,3-脱氮鸟嘌呤和3-脱氮腺嘌呤,通用碱基、疏水碱基、泛主碱基、大小扩大的碱基和氟化碱基。进一步经修饰的核碱基包括三环嘧啶,例如吩嗪胞苷([5,4-B][1,4]苯并嗪-2(3H)-酮)、吩噻嗪胞苷(1H-嘧啶并[5,4-B][1,4]苯并噻嗪-2(3H)-酮)、G-钳例如经取代吩嗪胞苷(例如,9-(2-氨基乙氧基)-H-嘧啶并[5,4-13][1,4]苯并嗪-2(3H)-酮)、咔唑胞苷(2H-嘧啶并[4,5-b]吲哚-2-酮)、吡啶并吲哚胞苷(H-吡啶并[3′,2′:4,5]吡咯并[2,3-d]嘧啶-2-酮)。经修饰的核碱基还可包括其中嘌呤或嘧啶碱基被其他杂环取代那些,例如7-脱氮-腺嘌呤、7-脱氮鸟苷、2-氨基吡啶和2-吡啶酮。其他核碱基包括美国专利3,687,808中公开的那些,在The Concise Encyclopedia Of Polymer Science And Engineering,Kroschwitz,J.I.,Ed.,John Wiley&Sons,1990,858-859中公开的那些;Englisch et al.,Angewandte Chemie,International Edition,1991,30,613公开的那些;以及Sanghvi,Y.S.,Chapter 15,Antisense Research and Applications,Crooke,S.T.and Lebleu,B.,Eds.,CRC Press,1993,273-288公开的那些。
教导制备某些上述经修饰的核碱基以及其他经修饰的核碱基的代表性美国专利包括但不限于美国专利3,687,808、4,845,205、5,130,302、5,134,066、5,175,273、5,367,066、5,432,272、5,457,187、5,459,255、5,484,908、5,502,177、5,525,711、5,552,540、5,587,469、5,594,121、5,596,091、5,614,617、5,645,985、5,681,941、5,750,692、5,763,588、5,830,653和6,005,096,其各自通过引用整体并入本文。
在一些实施方案中,本公开内容提供了包含连接的核苷的寡核苷酸。在这样的一些实施方案中,核苷可使用任何核苷间键联连接在一起。两种主要类型的核苷间键联基团由磷原子的存在或不存在来限定。代表性的含磷核苷间键联包括但不限于磷酸二酯(P=O)、磷酸三酯、甲基膦酸酯、氨基磷酸酯和硫代磷酸酯(P=S)。代表性的不含磷的核苷间键联基团包括但不限于亚甲基甲基亚氨基(--CH2--N(CH3)--O--CH2--)、硫代二酯(--O--C(O)--S--)、硫代氨基甲酸酯(--O--C(O)(NH)--S--);硅氧烷(--O--Si(H)2--O--);以及N,N′-二甲基肼(--CH2--N(CH3)--N(CH3)--)。与天然磷酸二酯键联相比,经修饰的键联可用于改变(通常是提高)寡核苷酸的核酸酶抗性。在一些实施方案中,具有手性原子的核苷间键联可制备为外消旋混合物,或制备为单独的对映体。代表性的手性键联包括但不限于烷基膦酸酯和硫代磷酸酯。制备含磷和不含磷的核苷间键联的方法是本领域技术人员公知的。
本文中所述的寡核苷酸含有一个或更多个不对称中心,因此产生对映体、非对映体和其他立体异构构型,其可在绝对立体化学方面限定为(R)或(S),α或β(例如对于糖异头物),或者(D)或(L)(例如对于氨基酸)等。本文中提供的反义化合物包括所有此类可能的异构体,以及它们的外消旋和光学纯形式。
中性核苷间键联包括但不限于磷酸三酯、甲基膦酸酯、MMI(3′-CH2--N(CH3)--O-5′)、酰胺-3(3′-CH2--C(=O)--N(H)-5′)、酰胺-4(3′-CH2--N(H)--C(=O)-5′)、甲缩醛(formacetal)(3′-O--CH2--O-5′)和硫代甲缩醛(thioformacetal)(3′-S--CH2--O-5′)。另外的中性核苷间键联包括非离子键联,其包括硅氧烷(二烷基硅氧烷)、羧酸酯、羧酰胺、硫化物、磺酸酯和酰胺(参见例如:Carbohydrate Modifications in Antisense Research;Y.S.Sanghvi和P.D.Cook,编,ACS Symposium Series 580;第3章和第4章,40-65)。另外的中性核苷间键联包括包含混合的N、O、S和CH2组分部分的非离子键联。
还可在寡核苷酸上的其他位置(特别是3′末端核苷酸)上糖的3′位置和5′末端核苷酸的5′位置进行另外的修饰。例如,本公开内容的配体缀合的寡核苷酸的另一种修饰涉及向寡核苷酸化学连接一个或更多个另外的非配体部分或缀合物,其增强寡核苷酸的活性、细胞分布或细胞摄取。这样的部分包括但不限于脂质部分,例如胆固醇部分(Letsinger等,Proc.Natl.Acad.Sci.USA,1989,86,6553),胆酸(Manoharan等,Bioorg.Med.Chem.Lett.,1994,4,1053),硫醚,例如己基-5-三苯甲基硫醇(Manoharan等,Ann.N.Y.Acad.Sci.,1992,660,306;Manoharan等,Bioorg.Med.Chem.Let.,1993,3,2765),硫代胆固醇(Oberhauser等,Nucl.Acids Res.,1992,20,533),脂肪链,例如十二烷二醇或十一烷基残基(Saison-Behmoaras等,EMBO J.,1991,10,111;Kabanov等,FEBS Lett.,1990,259,327;Svinarchuk等,Biochimie,1993,75,49),磷脂,例如二-十六烷基-外消旋-甘油或三乙基铵1,2-二-O-十六烷基-外消旋-甘油-3H-膦酸酯(Manoharan等,TetrahedronLett.,1995,36,3651;Shea等,Nucl.Acids Res.,1990,18,3777),多胺或聚乙二醇链(Manoharan等,Nucleosides&Nucleotides,1995,14,969),或金刚烷乙酸(Manoharan等,Tetrahedron Lett.,1995,36,3651),棕榈基部分(Mishra等,Biochim.Biophys.Acta,1995,1264,229),或十八烷基胺或己基氨基-羰基-氧基胆固醇部分(Crooke等,J.Pharmacol.Exp.Ther.,1996,277,923)。
教导制备这样的寡核苷酸缀合物的代表性美国专利包括但不限于美国专利4,828,979、4,948,882、5,218,105、5,525,465、5,541,313、5,545,730、5,552,538、5,578,717,5,580,731、5,580,731、5,591,584、5,109,124、5,118,802、5,138,045、5,414,077、5,486,603、5,512,439、5,578,718、5,608,046、4,587,044、4,605,735、4,667,025、4,762,779、4,789,737、4,824,941、4,835,263、4,876,335、4,904,582、4,958,013、5,082,830、5,112,963、5,214,136、5,082,830、5,112,963、5,214,136、5,245,022、5,254,469、5,258,506、5,262,536、5,272,250、5,292,873、5,317,098、5,371,241,5,391,723、5,416,203、5,451,463、5,510,475、5,512,667、5,514,785、5,565,552、5,567,810、5,574,142、5,585,481、5,587,371、5,595,726、5,597,696、5,599,923、5,599,928和5,688,941,其各自通过引用并入本文。
E.试剂盒
本公开内容还提供了试剂盒。本文中公开的任何组分可以以试剂盒的形式组合。在一些实施方案中,试剂盒包含上文或所附权利要求书中所述的聚酯聚合物或组合物。
试剂盒通常将包括至少一个小瓶、试管、烧瓶、瓶、注射器或其他容器,其中可放置组分,并且优选适当地等分。在试剂盒中存在多于一种组分的情况下,试剂盒通常还将包含第二、第三或其他另外的容器,其中可单独放置另外的组分。然而,组分的多种组合可包含在容器中。在一些实施方案中,所有核酸递送组分在单个容器中组合。在另一些实施方案中,一些或所有核酸递送组分与本发明化合物或组合物在分开的容器中提供。
本公开内容的试剂盒通常还将包含用于容纳各容器的包装,严格密封以用于商业销售。这样的包装可包括纸板或注射或吹塑塑料包装,其中容纳期望的容器。试剂盒还可包含使用试剂盒组分的说明书。说明书可包含可实施的变化。
F.实施例
包括以下实施例以示出本公开内容的一些优选实施方案。本领域技术人员应该理解,以下实施例中公开的技术代表发明人发现的在本公开内容的实践中很好地发挥作用的技术,并因此其可被认为是构成其实践的一些优选模式。然而,根据本公开内容,本领域技术人员应当理解,在不脱离本公开内容的精神和范围的情况下,可对所公开的具体实施方案进行许多改变并仍然获得相同或相似的结果。
实施例1:材料和仪器
细胞培养:Calu-6和Calu-3细胞获自美国典型培养物保藏中心(American TypeCulture Collection),并在含有L-谷氨酰胺和25mM HEPES且补充有5%FBS(Gemini Bio-Products)的RMP11640(Corning)培养基中培养。IB3-1细胞由Harvey Pollard友情提供,并在无血清LHC-8(Invitrogen)培养基中培养。HEK 293细胞获自美国典型培养物保藏中心,并在补充有10%FBS(Gemini Bio-Products)的DMEM(Invitrogen)中培养。HeLa-Luc细胞和A549-Luc细胞在补充有5%FBS(Sigma-Aldrich)的无酚红的DMEM高葡萄糖培养基(Hyclone)中培养。IGROV1细胞在含有碳酸氢钠和L-谷氨酰胺且补充有5%FBS的RPMI 1640(Sigma-Aldrich)中培养。
抗体和试剂:p53 DO-1(#sc-126)和GFP C2(#sc-390394)抗体购自Santa CruzBiotechnology,Inc。肌动蛋白抗体(MAB1501)购自EMD Millipore。CFTR 596抗体购自UNCAntibody Distribution Program。未酰化的大肠杆菌tRNAPhe-Fl8(P05)购自tRNA Probes,Inc。RNAiMax和Lipofectamine 2000购自Invitrogen并按照供应商推荐的方案使用。G418(sc-29065)购自Santa Cruz。PTC124(S6003)和VX-770(S1144)购自Selleck Chemicals。3-异丁基-1-甲基黄嘌呤(IBMX)(I5879)和佛司可林(Forskolin)(F3917)购自Sigma-Aldrich。CFTR-Inh172获自CFFT(Cystic Fibrosis Foundation Therapeutics,Inc)。
CFTR的质粒和定点诱变:全长野生型CFTR的表达质粒(pBI-CFTR)购自Clontech并使用标准定点诱变方案(Sambrook等,1989)诱变。定点诱变使用PfuUltra High-FidelityDNA Polymerase(Stratagene,Santa Clara,CA)通过PCR技术进行。所有突变通过DNA测序确认。Sup-tRNAArg由Carla Oliveira(Institute of Molecular Pathology andImmunology of the University of Porto(IPATIMUP),Porto,Portugal)惠赠。
成熟CFTR的定量方法:接种HEK293细胞(9×105个细胞)并用CFTR质粒转染。使用4μl Lipofectamine 2000以6孔格式共转染2μgCFTR质粒和500ng Sup-tRNAArg。转染之后24小时将G418(200μg)或PTC124(40μM)添加至培养基并保持48小时。接种IB3-1细胞,并在24小时后添加G418(0-400μG)或PTC124(0-20μM)。48小时后,将细胞在2×样品缓冲液(Tris-HCL 250mM,pH 6.8,20%甘油,2.5%SDS,0.1%溴酚蓝)中直接裂解。使用Tris-甘氨酸缓冲系统在7%/10%分步(wt/vol)聚丙烯酰胺凝胶上通过电泳分离细胞裂解物蛋白质,并转移至聚偏二氟乙烯Immobilon膜(EMD Millipore)。使用第一CFTR抗体(596)(University ofNorth Carolina School of Medicine,Chapel Hill,NC)、肌动蛋白抗体(EMD Millipore)和二抗IRdye-680RD(Li-Cor)进行Western印迹分析,并使用Li-Cor Odyssey CLx(Li-Cor)进行成像/定量。使用Prism 6(Graphpad)对数据进行作图。
HEK293细胞中CFTR依赖性全细胞电流:用用于CFTR成熟实验的质粒转染HEK293细胞。使用4μl Lipofectamine 2000以6孔格式共转染2μg CFTR质粒和500ng Sup-tRNAArg。转染之后24小时,使用膜片钳技术的全细胞构型测量Cl-电流。吸管溶液(pipette solution)含有145mM NMDG+-Cl-、1mM MgCl2、2mM EGTA、5mM ATP和10mM HEPES(pH 7.3,含Tris)。浴溶液是145mM NMDG+-Cl-、1mM MgCl2、1mM CaCl2、10mM HEPES和10mM葡萄糖(pH 7.4,含Tris)。用Axopatch 200B膜片钳放大器记录电流,并以2kHz数字化。通过将膜电位从0mV的保持电位步进至膜电位-40和+40mV步进200ms来探测膜电导。响应于10μM佛司可林加100μMIBMX和10μM CFTRInh-172(Inh-172)测量全细胞电流响应。当用吸管溶液填充时,吸管的电阻为3至5MΩ,并且密封电阻超过8GU。使用pClamp 9.2软件进行电流记录和分析,并用Origin 8软件进行分析。
体外ZAL纳米粒配制:通过乙醇稀释法制备脂质纳米粒。将RNA(无论是siRNA、tRNA、sgRNA或mRNA)在酸性含水缓冲液中稀释(除非另有指明,否则为10mM柠檬酸/柠檬酸钠缓冲液pH 3)。从各组分的乙醇储备溶液,在乙醇中制备具有合适摩尔比的ZAL、胆固醇、PEG-脂质、DSPC和/或DOPE的脂质混合物。通过移液管,将脂质稀释液以1∶3的最终体积比添加至RNA稀释液,用移液管迅速混合,并孵育15-20分钟。在该孵育期后,将颗粒用不含钙和镁的1×Dulbecco改良PBS(Sigma-Aldrich)稀释3倍或进行透析。每个室200μL样品在Pur-A-Lyzer Midi透析室(Sigma-Aldrich)中进行透析1小时。
ZAL siRNA递送库筛选:在HeLa-Luc细胞中筛选用环氧化物和丙烯酸酯疏水性尾部官能化的ZAL库的siRNA递送效力。在白色不透明的96孔板组织培养板中,将HeLa细胞以10×103个细胞/孔的密度接种在100μL生长培养基(不含酚红的DMEM,5%FBS)中,并允许贴壁过夜。在测定当天将培养基更换为200μL新鲜生长培养基。使用50∶38.5的ZAL∶胆固醇制剂脂质混合物和ZAL∶siRNA制备粗制ZAL产品,所述ZAL∶siRNA使得ZAL中疏水性尾部的数目乘以制剂中ZAL∶siRNA的摩尔比为~1000,这导致整个库的重量比对于最大ZAL为16∶1 ZAL∶siRNA和45∶1ZAL∶siRNA,整个库的平均值为29.5+/-6.3重量比。ZAL NP配制通过在96孔板中用多通道移液管以3∶1的水∶EtOH v∶v比例迅速混合ZAL脂质混合物(20μL)和siLuc稀释液(60μL,13.33ng/mL,在10mM柠檬酸-柠檬酸钠缓冲液(pH 5)中)来进行。在15-20分钟孵育期之后,将制剂在12体积(240μL)PBS中稀释。将纳米粒(40μL)以每孔100ng siRNA的剂量添加至HeLa-Luc细胞。将纳米粒与细胞一起孵育24小时,在该时间之后用ONE-Glo+Tox测定细胞生存力和萤光素酶测定(Promega)评价细胞生存力和萤光素酶表达。
向HeLa-Luc-Cas9细胞的sgRNA递送:在向HeLa-Luc-Cas9细胞递送单指导RNA(sgRNA)中评价选择的ZAL。在白色不透明的96孔板组织培养板中,将HeLa-Luc-Cas9细胞以每孔5×103个细胞的密度接种在100μL生长培养基(不含酚红的DMEM,5%FBS)中,并允许贴壁过夜,并随后补充额外的100μL DMEM。使用体外纳米粒配制方案以指定的脂质组成和重量比(保持50∶38.5的ZAL∶胆固醇摩尔比,将PEG-脂质添加物从5%调节至0.5%,并且将重量比从20∶1 ZAL∶sgRNA调节至5∶1 ZAL∶sgRNA)配制ZAL-sgRNA纳米粒。使用CRISPR.mit.edu算法,用针对萤光素酶设计的单指导RNA评价萤光素酶缺失,而非靶向性对照sgRNA(sgScr)用作阴性对照。将纳米粒以每孔50ng sgRNA的剂量添加至细胞,并与细胞一起孵育24小时或48小时。根据制造商的方案用sgLuc或sgScr配制的RNAiMax(Invitrogen)用作阳性对照。在24小时或48小时后,用ONE-Glo+Tox测定细胞生存力和萤光素酶测定(Promega)评价细胞生存力和萤光素酶表达。
向A549和HeLa-Luc细胞共递送Cas9 mRNA和sgRNA:在向表达萤光素酶的癌细胞共递送Cas9 mRNA(Tri-Link biotechnologies)和单指导RNA(sgRNA)中评价ZA3 ZAL。在白色不透明的96孔板组织培养板中,将A549-Luc或HeLa-Luc细胞以每孔5×103个细胞的密度接种在100μL生长培养基(不含酚红的DMEM,5%FBS)中,并允许贴壁过夜,并随后补充额外的100μL DMEM。使用体外纳米粒配制方案以指定的脂质组成和重量比(保持50∶38.5的ZAL∶胆固醇摩尔比,将PEG-脂质添加物从5%调节至0.5%,并且将重量比从20∶1 ZAL∶sgRNA调节至5∶1ZAL∶sgRNA)配制ZAL-Cas9mRNA纳米粒。
评价不同的剂量方案,包括sgRNA和Cas9 mRNA在相同纳米粒中配制(其中将sgRNA和Cas9 mRNA在酸性缓冲液中稀释然后添加脂质混合物),sgRNA和Cas9 mRNA在不同ZAL中配制但同时添加,或者在添加sgRNA之前24小时添加sgRNA。作为阴性对照,对于所有测试的ZAL NP,还包括在不存在Cas9 mRNA的情况下的sgRNA递送。将纳米粒以每孔100ng Cas9mRNA或50ng sgRNA的剂量添加至细胞,并与细胞一起孵育48小时。作为阳性对照,使用Lipofectamine 3000(Invitrogen)递送Cas9 mRNA,而RNAiMax(Invitrogen)根据制造商的方案配制。在sgRNA递送之后48小时,用ONE-Glo+Tox测定细胞生存力和萤光素酶测定(Promega)评价细胞生存力和萤光素酶表达。
CSAL体外siRNA递送效力:在白色不透明的96孔板组织培养板中,将HeLa-Luc或A549-Luc细胞以每孔10×103个细胞的密度接种于100μL生长培养基(不含酚红的DMEM,5%FBS)中,并允许贴壁过夜。在测定当天将培养基更换为200μL新鲜生长培养基。CSAL产品使用50∶38.5∶10∶1.5的ZAL∶胆固醇∶DSPC∶PEG-脂质的制剂脂质混合物,并以666∶1、333∶1和167∶1的CSAL∶siRNA摩尔比筛选。ZAL NP配制通过在96孔板中用多通道移液管以2∶1的水∶EtOH v∶v比迅速混合ZAL脂质混合物(10μL)和siLuc稀释液(20μL,40ng/mL,在10mM柠檬酸-柠檬酸钠缓冲液(pH 3)中)来进行。在15-20分钟孵育期之后,将制剂稀释在12体积(120μL)PBS中。将纳米粒(18.75μL)以每孔100ng siRNA的剂量添加至HeLa-Luc细胞。将纳米粒与细胞一起孵育24小时,在该时间之后用ONE-Glo+Tox测定细胞生存力和萤光素酶测定(Promega)评价细胞生存力和萤光素酶表达,并相对于未处理的细胞进行归一化(N=3或4+/-标准差)。
siRNA摄取研究:在HeLa-Luc细胞和A549-Luc细胞中用与体外递送效力筛选相同制剂的CSAL NP进行细胞摄取研究。将细胞以每孔30,000个细胞的密度接种在8室盖玻片(Nunc)中,并允许贴壁24小时。将纳米粒以34nM的最终siRNA浓度添加至细胞。孵育4小时或24小时后,吸出培养基,用PBS清洗,并使用制造商的方案进行细胞膜染色(Cell MaskGreen,Molecular Probes)。用4%多聚甲醛固定细胞(15分钟RT),用PBS清洗2次,每次5分钟,用DAPI(Sigma-Aldrich)对细胞核进行染色并用PBS清洗。使用Zeiss LSM 700显微镜进行共聚焦显微术成像,并使用ImageJ(NIH)对图像进行分析。
核酸结合实验:使用Ribogreen测定(Molecular Probes)评价核酸结合。简单地说,使用体外或体内配制方案制备纳米粒。将纳米粒制剂(5μL)添加至黑色96孔不透明微孔板(Corning)。在与纳米粒相同的培养基中制备合适核酸的标准曲线。将Ribogreen试剂在1×PBS中1∶1000稀释,并通过多通道移液管向每个孔添加50μL。将混合物在轨道混合器上搅拌10分钟,并使用读板器(λEx485nm,λEm 535nm)读取每个孔的荧光。通过将来自每个纳米粒样品的信号拟合至核酸标准曲线来确定游离核酸的量,并且通过下式确定结合分数:结合的核酸分数=(总核酸输入-游离核酸)/总数核酸输入)(N=3或4+/-标准偏差)。
ZAL mRNA递送体外测定:使用上文概述的体外纳米粒配制方法制备具有萤火虫萤光素酶mRNA(Tri-Link Biotechnologies)的ZAL纳米粒。将IGROV1细胞在白色不透明的96孔组织培养板中以每孔5×103个细胞的密度接种在补充有5%FBS的100μL RPMI 1640培养基中,并允许贴壁过夜。孵育过夜后,向孔添加额外的100μL培养基。以ZAL∶mRNA重量比为20∶1、10∶1、7.5∶1和5∶1制备ZAL∶mRNA纳米粒,且脂质混合物摩尔组成为50∶38.5 ZAL∶胆固醇,在每个重量比下以5%、2%、1%或0.5%的摩尔比补充PEG脂质。将ZAL-mRNA纳米粒以每孔100ng mRNA的剂量添加至细胞并孵育指定的时间(6小时至48小时),在该时间之后用ONE-Glo+Tox测定细胞生存力和萤光素酶测定(Promega)评价细胞生存力和萤光素酶表达,并相对于未处理细胞进行归一化(N=4+/-标准差)。
体内纳米粒配制:使用NanoAssemblr微流控混合系统(Precision Nanosystems)进行体内纳米粒配制。将脂质溶解在乙醇中,并将核酸(mRNA或siRNA)在10mM柠檬酸-柠檬酸钠缓冲液(pH 3)中稀释。以每分钟12mL的总流量将脂质混合物和核酸稀释液以3∶1的核酸∶脂质混合物的体积比混合,并且每次配制开始和结束时废物收集量为0.1mL。将纳米粒在Pur-A-Lyzer midi透析室(Sigma-Aldrich)中以每室200μL体积用1×PBS透析1小时,并在1×PBS中稀释至合适的核酸浓度。
体内siRNA纳米粒生物分布:所有实验均由德克萨斯大学西南医学中心的机构动物护理和使用委员会(IACUC)批准,并且符合适用的地方、州和联邦法规。使用体内纳米粒配制方法制备CSAL纳米粒,脂质混合物摩尔比为50∶38.5∶10∶1.5 CSAL∶胆固醇∶DSPC∶PEG-脂质,且重量比为20∶1至45∶1总脂质∶siRNA重量比。对于siRNA稀释,向siRNA掺杂(spike)50%Cy5.5标记的siRNA,并且正常进行配制。透析后,将纳米粒稀释至浓度为1μg/10μL制剂。将该制剂以1mg/kg siRNA的剂量通过尾静脉注射注射到Black 6小鼠中。在2小时或24小时后,将动物在异氟烷下麻醉,通过颈椎脱位处死,并且切除器官。使用Cy5激发和发射滤光器组在IVIS Lumina系统(PerkinELmer)上进行器官的荧光成像,并使用Living Image分析软件(PerkinElmer)对图像进行处理。
体内萤光素酶mRNA递送:所有实验均由德克萨斯大学西南医学中心的机构动物护理和使用委员会(IACUC)批准,并且符合适用的地方、州和联邦法规。以脂质混合物中50ZAL∶38.5胆固醇∶2或0.5 PEG-脂质摩尔比和7.5∶1 ZAL∶mRNA重量比利用体内配制来配制ZA3-Ep10 ZAL。通过尾静脉注射或腹膜内注射以1mg/kg的剂量向无胸腺Nude-Foxn1nu小鼠(Harlan Laboratories)注射ZAL-mRNA NP。24小时和48小时后,通过活动物生物发光成像评价萤光素酶表达。将动物在异氟烷下麻醉,并且IP注射D-萤光素单钠水合物(GoldBio)底物。孵育10-12分钟后,通过在IVIS Lumina系统(PerkinELmer)上成像获得萤光素酶活性,并使用Living hnage分析软件(PerkinElmer)对图像进行处理。切除后对全身器官进行离体成像,并将组织在干冰上冷冻用于离体萤光素酶表达分析。
A549异种移植物中的体内萤光素酶沉默:所有实验均由德克萨斯大学西南医学中心的机构动物护理和使用委员会(IACUC)批准,并且符合适用的地方、州和联邦法规。无胸腺Nude-Foxn1nu小鼠(Harlan Laboratories)在每个后胁部植入异种移植物,其具有表达萤火虫萤光素酶的A549(5×106个细胞悬浮于100μL的1∶1 v∶v PBS∶基质胶(Coming)中)。在肿瘤达到足够大小后,向同一动物上的每个肿瘤注射CSAL A3OAcC2Me的体内配制的NP(每个肿瘤约50μL),脂质摩尔比为50CSAL∶38.5 胆固醇∶10 DSPC∶1.5 PEG-脂质,且总脂质∶siRNA重量比为30∶1,且最终siRNA剂量为1mg/kg siLuc或siCtrl。在24小时和48小时后,通过活动物生物发光成像评价萤光素酶表达。在异氟烷下麻醉动物,并且IP注射D-萤光素单钠水合物(GoldBio)底物。孵育10-12分钟后,通过在IVIS Lumina系统(PerkinELmer)上成像获得萤光素酶活性,并使用Living Image分析软件(PerkinElmer)对图像进行处理。
A549异种移植物中的离体萤光素酶表达分析:注射A3OAcC2Me siLuc或siCtrl后48小时,通过颈脱位使小鼠安乐死,并切除A549异种移植物并在干冰上冷冻。将肿瘤在天平上称重,用直剃刀切成条并以1∶3肿瘤块∶体积(mg∶μL)的补充有蛋白酶抑制剂小片剂(Pierce)的1×报道裂解缓冲液(Promega)稀释,并保持在冰上。将组织匀浆并通过萤光素酶测定系统评价萤光素酶表达。
纳米粒性质表征:使用具有He-Ne激光(λ=632nm)的Zetasizer Nano ZS(Malvern)测量物理性质。通过173°反向散射,通过动态光散射(DLS)(5次测量,3次运行×10秒,自动衰减器设置)测量颗粒尺寸。在折叠的毛细管小室(folded capillary cell)(Malvem)中测量ζ电位,其中样品在PBS(对于ZAL NP)或柠檬酸盐磷酸盐缓冲液(pH 7.4)(对于CSAL NP)中稀释。
tRNA摄取研究:使用来自筛选的表现最佳的材料进行细胞摄取研究。将Calu6细胞以每孔30,000个细胞的密度接种在8室盖玻片(Nunc)中,并允许贴壁24小时。使用体外纳米粒配制程序制备NP制剂。将纳米粒以0.9μg/孔的最终tRNA浓度添加至细胞。孵育6小时后,吸出培养基,用PBS清洗,并使用制造商的方案进行细胞膜染色(Cell Mask Orange,Molecular Probes)。用4%多聚甲醛(15分钟RT)固定细胞,用PBS清洗2次,每次5分钟,用DAPI(Sigma-Aldrich)对细胞核进行染色并用PBS清洗。使用Zeiss LSM 700显微镜进行共聚焦显微术成像,并使用ImageJ(NIH)对图像进行分析。
Calu6细胞中的纳米粒载剂筛选:以6孔格式以每孔500,000个细胞的密度接种Calu6细胞并允许贴壁过夜。对于质粒DNA,使用制造商推荐的方案使用3μl Lipofectamine2000转染1μg。对于tRNAArg/OP-RNAiMax,使用制造商推荐的方案使用3μl RNAiMax转染4μg。将颗粒在Opti-MEM(Invitrogen)中稀释。将G418(50μg)和PTC124(10μlM)直接添加至培养基。如下配制纳米粒。通过将10μL聚合物储备液(15g/L在DMSO中)添加至tRNA的稀释液(5μgtRNA在490μL10mM柠檬酸盐缓冲液(pH 4.2)中)并孵育20分钟来以30∶1的聚合物∶tRNA重量比制备官能化聚酯-tRNA多聚复合物(polyplex)。使用上文详述的体外纳米粒配制方法制备树枝状聚合物、ZAL和CSAL纳米粒。除非另有指明,否则树枝状聚合物用50∶38∶10∶2树枝状聚合物∶胆固醇∶DSPC∶PEG-脂质的脂质混合物和200∶1的树枝状聚合物∶tRNA摩尔比配制。ZAL-tRNA NP用50∶38.5 ZAL∶胆固醇的脂质混合物和25∶1的总脂质∶tRNA重量比配制。CSAL-tRNANP用20∶1的CSAL∶tRNA重量比配制。对于所有纳米粒,以每孔4μg tRNA的剂量将400μL的每种制剂添加至2mL培养基中的细胞。48小时后,将细胞在2×样品缓冲液((Tris-HCL250mM(pH 6.8)、20%甘油、2.5%SDS、0.1%溴酚蓝)中直接裂解。使用Tris-甘氨酸缓冲系统在10%(wt/vol)聚丙烯酰胺凝胶上通过电泳分离细胞裂解物蛋白质,并转移至聚偏二氟乙烯Immobilon膜(EMD Millipore)。使用第一p53抗体(Santa Cruz Biotechnology,Inc)、肌动蛋白抗体(EMD Millipore)和二抗IRdye-680RD(Li-Cor)进行Western印迹分析,并使用Li-Cor Odyssey CLx(Li-Cor)进行成像/定量。
实施例2:氨基脂质的合成和表征
如图1所示,使用不同的头基、接头酰胺制备阳离子磺酰胺氨基脂质(cationicsulfonamide amino lipid,CSAL),脂质基团具有多种官能化侧臂。用于制备阳离子磺酰胺氨基脂质的示例性合成路线示于图2中。CSAL A3OAcC2Me的一些示例性表征信息示于图40中。替代的合成方法描述于图42中。
A1-OAc-Cn-Me/Et和A2-OAc-Cn-Me/Et CSAL的合成:在配备有搅拌棒的20mL小瓶中,将A1-OAc丙磺酸盐(100mg,0.136mmol)或A2-OAc将丙磺酸盐(在2mL在亚硫酰氯中。将小瓶密封,并将反应混合物加热至85℃保持30分钟。将反应冷却至室温,在5mL新鲜蒸馏的甲苯中稀释并减压浓缩。将粗制磺酰氯中间体在冰上冷却,向其添加溶解在5mL无水乙腈中的合适的N,N-二甲基二胺或N,N-二乙基二胺(5当量)。将反应混合物在冰上搅拌15分钟,并将反应混合物在减压下浓缩。粗制产物在硅胶上纯化(溶剂梯度为DCM中5%MeOH至DCM中20%MeOH、1%饱和NH4OH)以得到作为黏性黄色或棕色固体的产物。
A1OAcC2Me质量计算值m/z 803.6654,实测值(MALDI-TOF ms)m/z 803.3930
A1OAcC3Me质量计算值m/z 817.6810,实测值(MALDI-TOF ms)m/z 817.5598
A1OAcC4Me质量计算值m/z 831.6967,实测值(MALDI-TOF ms)m/z 831.5186
A1OAcC2Et质量计算值m/z 831.6967,实测值(MALDI-TOF ms)m/z 831.80
A1OAcC3Et质量计算值m/z 845.7123,实测值(MALDI-TOF ms)m/z 846.51
A20AcC2Me质量计算值m/z 831.6967,实测值M+1(MALDI-TOF ms)m/z 832.62
A2OAcC2Et质量计算值m/z 859.7280,实测值M+1(MALDI-TOF ms)m/z 860.66
A3-OAc-C2Me的合成:在配备有搅拌棒的20mL小瓶中,将3-OAc丙磺酸盐(200mg,0.155mmol)溶解在2mL亚硫酰氯中。将小瓶密封,并将反应混合物加热至85℃保持30分钟。将反应冷却至室温,在5mL新鲜蒸馏的甲苯中稀释并减压浓缩。将粗制磺酰氯中间体在冰上冷却,向其添加溶解在5mL无水乙腈中的合适的N,N-二甲基乙二胺(0.775mmol,85μL,5当量)。将反应混合物在冰上搅拌15分钟,并将反应混合物减压浓缩。将粗制产物在硅胶上纯化(溶剂梯度为DCM中5%MeOH至DCM中20%MeOH、1%饱和NH4OH)以得到作为黏性棕色固体的产物(79.8mg,38.0%产率)。质量计算值m/z 1355.1567,实测值M+1(MALDI-TOF ms)m/z1355.18。
A1-OPiv-CnMe CSAL的合成:在配备有搅拌棒的20mL小瓶中,将A1-OPiv丙磺酸盐(100mg,0.122mmol)溶解在2mL亚硫酰氯中。将小瓶密封,并将反应混合物加热至85℃保持30分钟。将反应冷却至室温,在5mL新鲜蒸馏的甲苯中稀释并减压浓缩。将粗制磺酰氯中间体在冰上冷却,向其添加溶解在5mL无水乙腈中的合适的的N,N-二甲基二胺(5当量)。将反应混合物在冰上搅拌15分钟,并将反应混合物减压浓缩。将粗制产物在硅胶上纯化(溶剂梯度为DCM中5%甲醇至水中75%DCM、20%甲醇、5%饱和氢氧化铵)以得到作为黏性黄色或棕色固体的产物。
A1OPivC2Me质量计算值m/z 887.7593,实测值M+1(MALDI-TOF ms)m/z 887.7920
A1OPivC3Me质量计算值m/z 901.7749,实测值M+1(MALDI-TOF ms)m/z 901.4854
A1OPivC4Me质量计算值m/z 915.7906,实测值M+1(MALDI-TOF ms)m/z 915.6368
A1-Cl-CnMe CSAL的合成:在配备有搅拌棒的20mL小瓶中,将A1-OH丙磺酸盐(100mg,0.154mmol)溶解在2mL亚硫酰氯中。将小瓶密封,并将反应混合物加热至85℃保持1小时。将反应冷却至室温,在5mL新鲜蒸馏的甲苯中稀释并减压浓缩。将粗制磺酰氯中间体在冰上冷却,向其添加溶解在5mL无水乙腈中的合适的N,N-二甲基二胺(5当量)。将反应混合物在冰上搅拌15分钟,并将反应混合物减压浓缩,并在真空下干燥。
A1ClC2Me质量计算值m/z 755.5765,实测值M+1(MALDI-TOF ms)m/z 755.7258
A1ClC3Me质量计算值m/z 769.5921,实测值M+1(MALDI-TOF ms)m/z 769.6628
A1ClC4Me质量计算值m/z 783.6078,实测值M+1(MALDI-TOF ms)m/z 783.7239
A1OHC2Me的合成:在配备有搅拌棒的20mL小瓶中,将A1-OAc丙磺酸盐(100mg,0.136mmol)溶解在2mL亚硫酰氯中。将小瓶密封,并将反应混合物加热至85℃保持30分钟。将反应冷却至室温,在5mL新鲜蒸馏的甲苯中稀释并减压浓缩。将粗制磺酰氯中间体在冰上冷却,向其添加溶解在5mL无水乙腈中的合适的N,N-二甲基-乙二胺(85.6μL,0.68mmol,5当量)。将反应混合物在冰上搅拌15分钟,并将反应混合物减压浓缩。将反应混合物再溶解在5mL甲醇中,并添加碳酸钾(0.93g,0.68mmol,5当量),并将反应混合物在40℃下搅拌4天。反应后,将混合物冷却,过滤,并减压浓缩。将浓缩物溶解在丙酮中,并通过过滤除去额外的沉淀以得到作为黄色黏性固体的粗制产物。将产物用硅胶纯化(DCM中5%甲醇至二氯甲烷中20%甲醇、2%饱和的氢氧化铵)以得到作为黏性黄色固体的产物(17.5mg,产率17.9%)。质量计算值m/z 719.6443,实测值M+1(MALDI-TOF ms)m/z 719.8963。
类似地,从图9中所示起始组分制备两性离子氨基脂质(ZAL)。如图10中所示,合成了两性离子头基,并显示了原料和两性离子头基的适当1H NMR波谱。使两性离子头基与多胺核心反应以得到图11中所示的化合物,其具有相应的1H NMR波谱。具有不同多胺核心和两性离子头基的多种化合物示于图12中。这些头基和核心的反应如图13中所示,且三种不同的脂质反应基团的合适的反应条件在图14中。三种化合物的LCMS分析显示在图15A-15C中。数种ZAL的一些示例性表征信息包括图36和37。替代的合成方法描述于图39和40中。
3-((2-丙烯酰氨基乙基)二甲基铵基)丙烷-1-磺酸盐(SBAm)的合成:在氮气氛下向配备有搅拌棒和加料漏斗的火焰干燥的500mL圆底烧瓶中加入250mL无水THF中的N,N-二甲基乙二胺(20g,226.9mmol)和三乙胺(1当量,227mmol,31.6mL),并冷却至0℃。将丙烯酰氯(0.9当量,204.2mmol,16.6mL)分别溶解在50mL无水THF中,并通过加料漏斗滴加至搅拌的胺溶液。使反应温热至室温过夜,得到具有白色沉淀物的黄色溶液。滤出沉淀物,并将滤液真空浓缩。将粗制产物通过硅胶柱(DCM中20%MeOH)纯化。产物用无水硫酸钠干燥并减压浓缩以得到作为橙色液体的二甲基氨基丙烯酰胺中间体(9.36g,步骤1产率32.2%)。
在配备有搅拌棒的250mL圆底烧瓶中,将二甲基氨基丙烯酰胺中间体(9.36g,65.8mmol)溶解在100mL丙酮中。在一部分中,添加1,3-丙磺酸内酯(1.1当量,72.4mmol,8.85g)。安装具有针孔的橡胶塞,并将反应混合物加热至50℃过夜,使得形成灰白色固体沉淀物。通过真空过滤收集沉淀物,用大量丙酮洗涤,并在真空下干燥过夜,得到作为浅黄色固体的SBAm产物(14.77g,步骤2的产率为84.9%)。质量计算值m/z264.11,实测值M+1(LCMS)直接进样)m/z 265.1。
用于库制备的氨基SBAm合成:
具有丙磺酸酰胺的两性离子胺(氨基SBAm)的一般合成:在配备有搅拌棒的20mL小瓶中,将3-((2-丙烯酰氨基乙基)二甲基铵基)丙烷-1-磺酸盐(SBAm,1.5g,5.67mmol,1当量)溶解在5.67mL去离子水中至1M浓度。通过移液管一次性添加相应的胺(28.35mmol,5当量),盖上小瓶并在室温下搅拌过夜。在过夜反应后,将氨基SBAm反应混合物转移至数个50mL聚丙烯锥形管中,在>10体积的丙酮中沉淀以除去残留的胺原料,通过离心(4000×g,10分钟)收集。倾析上清液,用丙酮洗涤沉淀物,并在真空下干燥以得到氨基SBAm。
ZA1:浅黄色黏性固体(2.40g,93.6%产率)。质量计算值m/z 452.31,实测值M+1(LCMS直接进样)m/z 453.3。
1H NMR(400MHz,D20)δ3.65(t,J=6.8Hz,2H),3.48(ddd,J=13.7,9.5,5.7Hz,4H),3.14(s,6H),2.95(t,J=7.2Hz,2H),2.68(s,2H),2.65-2.54(m,14H),2.54-2.48(m,2H),2.29(d,J=1.0Hz,9H),2.22-2.16(m,4H).
ZA2:在0.776g SBAm规模上进行的反应。黏性黄色油状物(0.36g,24.8%产率)。质量计算值m/z 536.41,实测值M+1(LCMS直接进样)m/z 537.4。
1H NMR(500MHz,D2O)δ3.50(t,J=7.0Hz,2H),3.33(ddd,J=22.0,11.2,5.7Hz,4H),2.98(s,6H),2.83-2.62(m,4H),2.57(dt,J=21.3,7.3Hz,4H),2.44(p,J=7.1Hz,6H),2.30-2.23(m,1H),2.11-2.01(m,2H),0.92-0.86(m,9H),0.84(d,J=6.5Hz,4H).
ZA3:棕色黏性固体(2.61g,定量产率)。质量计算值m/z 410.58,实测值M+1(LCMS直接进样)m/z 411.3。
1H NMR(500MHz,D2O)δ3.62(t,J=6.7Hz,2H),3.50-3.40(m,4H),3.11(d,J=1.4Hz,6H),2.92(td,J=7.2,1.3Hz,2H),2.82-2.68(m,5H),2.66-2.49(m,8H),2.41(ddd,J=8.2,5.9,1.3Hz,2H),2.23-2.14(m,2H).
ZA4:浅黄色黏性固体(2.01g,92.9%产率)。质量计算值m/z 381.24,实测值M+1(LCMS直接进样)m/z 382.2。
1H NMR(400MHz,D2O)δ3.66(t,J=6.8Hz,2H),3.49(ddd,J=13.7,8.7,5.8Hz,4H),3.14(s,6H),2.96(t,J=7.2Hz,2H),2.86-2.64(m,6H),2.57-2.40(m,5H),2.28-2.14(m,6H).
ZA5:黏性黄色固体(2.32g,84.1%产率)。质量计算值m/z 409.27,实测值M+1(LCMS直接进样)m/z 410.2。
1H NMR(400MHz,D2O)δ3.52(t,J=6.8Hz,3H),3.35(ddd,J=13.8,9.0,5.6Hz,5H),3.00(s,7H),2.82(t,J=7.2Hz,3H),2.65(t,J=7.1Hz,3H),2.49(q,J=6.4,5.5Hz,1H),2.39(t,J=7.4Hz,2H),2.26(dq,J=15.4,5.4,3.7Hz,7H),2.14-1.99(m,7H),1.55-1.41(m,4H).
ZA6:黏性黄色固体(2.71g,定量产率)。质量计算值m/z 464.31,实测值M+1(LCMS直接进样)m/z 465.3。
1H NMR(500MHz,D2O)δ3.64(t,J=6.9Hz,2H),3.52-3.42(m,4H),3.12(s,7H),2.94(t,J=7.2Hz,3H),2.82-2.68(m,5H),2.53(t,J=7.4Hz,2H),2.45-2.30(m,7H),2.26-2.15(m,4H),1.64(tdd,J=15.5,12.1,7.6Hz,4H).
两性离子氨基脂质(ZAL)的氨基SBAm环氧化物和丙烯酸酯库的合成:
通过与1,2-环氧烷烃和疏水性丙烯酸酯反应引入疏水性尾部,制备所有先前描述的官能化氨基SBAm的两性离子氨基脂质(ZAL)库。环氧化物(1,2-环氧辛烷、1,2-环氧癸烷、1,2-环氧十二烷、1,2-环氧十四烷、1,2-环氧十六烷和1,2-环氧十八烷)是市售购买的并编码以包含分子中碳原子的总数(Cn,8-18)疏水性丙烯酸酯(是市售的(O12,O18)或通过适当的伯醇与丙烯酰氯的反应合成(O8,O10,O14,O16),并编码以包含疏水尾部中的碳原子数,但不包含丙烯酸酯部分。为了制备该库,在配备有搅拌棒的4mL小瓶中,通过天平称量两性离子胺(0.1mmol或0.05mmol),并在iPrOH(对于环氧化物ZAL)或DMSO(对于丙烯酸酯ZAL)中溶解至1M的浓度。添加N当量的合适的疏水亲电体,其中N是胺反应性位点的数量,其会使伯胺和仲胺完全转化为叔胺。将小瓶密封,并将反应在75℃(对于环氧化物)或80℃(对于丙烯酸酯)下搅拌数天。反应后,将反应物在丙酮中沉淀以得到两性离子氨基脂质。
ZA3的替代合成:向配备有搅拌棒的20mL小瓶中加入3-((2-丙烯酰氨基乙基)二甲基铵基)丙烷-1-磺酸酯(SBAm,0.8111g,3.068mmol)并溶解在3mL DMSO中。通过注射器,添加三(2-氨基乙基)胺(5当量,15.32mmol,2.24g),得到混浊的黄色/棕色混悬液。将反应混合物密封并在80℃下搅拌过夜,得到橙色混浊混悬液。将反应混合物在DMSO中进一步稀释,转移至数个50mL锥形管中,并在10体积乙酸乙酯中沉淀。通过离心(4,000×g,10分钟)收集沉淀物,并倾析上清液以得到黏性黄色/棕色物。将产物在DMSO/EtOAc中再沉淀数次以除去任何残留的三(2-氨基乙基)胺,并最后溶解在MeOH中,转移至圆底烧瓶中并在减压下浓缩。将产物在真空下干燥过夜以除去残留的溶剂,再溶解在甲醇中并在乙酸乙酯中沉淀,并在真空下干燥以得到作为橙色/棕色油状物的ZA3(1.4058g,100%)。
ZA3-Ep10的合成:向配备有搅拌棒的20mL闪烁瓶中加入ZA3(300mg,0.7307mmol)和iPrOH(730μL,1M SBAm)并在RT下短暂搅拌以得到黄色/棕色混悬液。添加1,2-环氧癸烷(4.384mmol,685mg,6当量),将小瓶密封并在75℃下搅拌过夜持续约24小时,得到澄清的黄色/棕色溶液。减压除去iPrOH以得到黄色/棕色油状物。将粗制产物溶解在DCM中最少5%MeOH中,并使用系统(Teledyne Isco)在硅胶柱(24g)上进行纯化。将产物洗脱并用DCM中5%MeOH至DCM中20%MeOH、2%饱和氢氧化铵的溶剂梯度分级,并通过ELSD跟踪产物洗脱。将含有产物的级分减压浓缩,并在真空下干燥过夜以得到作为黏性黄色固体的产物(192.5mg,22.1%产率)。质量计算值m/z 1191.0246,实测值M+1(LCMS直接进样)m/z 1192.8。
丙磺酸盐A1-OH的合成:在配备有搅拌棒的250mL圆底烧瓶中,将1,1′-((3-(二甲基氨基)丙基)氮烷二基)双(十四烷-2-醇)(6.37g,12.09mmol)溶解在50mL丙酮中,然后1,3-丙磺酸内酯(2.21g,18.13mmol,1.5当量)。盖上烧瓶并在50℃搅拌过夜,这导致形成白色沉淀物。通过过滤收集白色沉淀物,并在真空下干燥以得到作为白色固体的丙磺酸盐产物(7.46g,95.0%)。质量计算值m/z 648.5475,实测值M+1(MALDI-TOF ms)m/z 649.8078。
丙磺酸盐A2-OH的合成:在配备有搅拌棒的20mL小瓶中,将A2-OH(0.5g,0.901mmol)溶解在4mL丙酮中,然后添加1,3-丙磺酸内酯(165mg,1.35mmol,1.5当量)。将小瓶密封并在50℃下搅拌过夜。在过夜反应后,加入额外的1.5当量1,3-丙磺酸内酯并再搅拌一天。将反应混合物浓缩,溶解在最少量的二氯甲烷中,并在硅胶上纯化(DCM中10%MeOH至DCM中10%MeOH、1%饱和NH4OH梯度)以得到作为黏性浅黄色固体的产物(310mg,产率50.8%)。质量计算值m/z 676.5788,实测值M+1(MALDI-TOF ms)m/z 678.22。
丙磺酸盐A3-OH的合成:与丙磺酸盐A2-OH相同的方案,黏性浅黄色固体(2.864g,85.0%产率)质量计算值m/z 1116.0177,实测值M+1(MALDI-TOF ms)m/z 1117.34。
丙磺酸盐A1-OAc的合成:在配备有搅拌棒的20mL小瓶中,将丙磺酸盐A1-OH(1.25g,1.93mmol)溶解在5mL二氯甲烷中,然后添加乙酸酐(10mL,过量)。将反应混合物在室温下搅拌3天,直至通过TLC观察到原料消耗。将反应混合物在丙酮中稀释并减压浓缩以形成透明油状物,其在静置后形成无色沉淀物。通过过滤收集该沉淀物,并在真空下干燥以得到作为无色结晶固体的产物(0.795g,56.3%产率)。质量计算值m/z 732.5686,实测值M+1(MALDI-TOF ms)m/z 733.8095
丙磺酸盐A2-OAc的合成:在配备有搅拌棒和回流冷凝器的100mL圆底烧瓶中,将丙磺酸盐A2-OH(0.28g,.414mmol)溶解在乙酸酐(10mL)中。将反应物加热至100℃持续18小时,得到澄清的橙色溶液,然后将反应真空浓缩,并在硅胶上纯化(DCM中10%MeOH至DCM中10%MeOH、1%饱和NH4OH的梯度)。分离作为橙色黏性固体的产物(211.1mg,67.0%产率)。质量计算值m/z 760.5999,实测值M+1(MALDI-TOF ms)m/z 762.62
丙磺酸盐A3-OAc的合成:向配备有搅拌棒的20mL小瓶添加丙磺酸盐A3-OH(0.752g,0.673mmol)和乙酸酐(10mL)。将小瓶密封,并将反应混合物在100℃下搅拌23小时。反应混合物是丙酮并减压浓缩以得到作为橙色油状物的粗制产物(0.91g,定量产率)。粗制产物无需进一步纯化而使用。质量计算值m/z 1283.0516,实测值M+1(MALDI-TOF ms)m/z 1284.74
丙磺酸盐A1-OPiv的合成:在氮气氛下,在配备有搅拌棒和回流冷凝器的干燥50mL圆底烧瓶中,将Al-OH丙磺酸盐(0.89g,1.37mmol)溶解在二甲基甲酰胺(5mL)中,然后添加三乙胺(0.96mL,6.86mmol,5当量)、4-二甲基氨基吡啶(1.7mg,0.014mmol,0.1当量)和新戊酸酐(1.67mL,8.23mmol,6当量)。在90℃下搅拌反应14小时后,再添加6当量的新戊酸酐、5当量的三乙胺和0.1当量的DMAP,并继续反应另外26小时,此时通过TLC发现起始A1-OH丙磺酸盐消失。将反应混合物在二氯甲烷中稀释,在减压下浓缩,并通过硅胶色谱法(重力柱)用二氯甲烷中的10%甲醇纯化以得到作为黏性棕色固体的产物Al-OPiv丙磺酸盐(0.585g,52.2%)。质量计算值m/z 817.6625,实测值M+1(MALDI-TOF ms)m/z 817.4124。
实施例3:组合物的活性
在一种或更多种辅助脂质(例如胆固醇)的存在下,将CSAL(图3)和ZAL(图16)配制成纳米粒。如图17中所示,胆固醇是允许纳米粒结合siRNA的重要组分。在不含胆固醇的组合物中,结合的siRNA的量显著降低。CSAL纳米粒显示平均尺寸为约100nm(图4A)。另外,组合物随着头基长度的提高,则siRNA结合降低(图4B)。较高摩尔比的CSAL导致电荷提高(图4C),并且溶液pH降低导致更高的表面,特别是在pH3下(图4D)。如图5和6中所示,CSAL显示出递送siRNA的活性,并因此降低萤光素酶活性。另外,还测试了含有CSAL的纳米粒的细胞生存力(图5)。类似地,还测试了含ZAL的纳米粒的萤光素酶活性(参见图18-20B)。进行CSAL和ZAL的细胞成像以确定组合物是否定位于细胞。如图7、21和24中所示,组合物定位于不同的细胞。tRNA递送显示于图22中,随着多种不同组合物递送经修饰的tRNA,导致含有无义突变的基因组中p53产生的恢复(图22)。最后,确定了含有CSAL和ZAL的纳米粒的体内分布(图8和23)。
测试组合物递送mRNA和与CRISPR过程相关的核酸(例如sgRNA)的活性。在这些研究中使用的纳米粒的组成在下表1A和1B中示出。
表1A:两性离子氨基脂质纳米粒摩尔组成
表1B:阳离子磺酰胺氨基脂质纳米粒摩尔组成
使用ZA1Ep10 ZAL,测试多种浓度的PEG脂质将萤光素酶mRNA递送至IGROV1细胞的能力。监测每个群体产生的发光量,在转染之后18小时、26小时和45小时测量发光。测试了在相同颗粒中添加mRNA和sgRNA二者或连续施用这些化合物的效果(图25)。组合物是mRNA,并且相对于使用不同的颗粒,sgRNA通常显示出降低量的未处理细胞。用A549-Luc细胞进行类似的测试(图26)。用针对萤光素酶的HeLa-Luc细胞测试具有单ZAL的纳米粒组合物的效果,并显示在图27中。如所示,ZAL导致萤光素酶活性的剂量依赖性降低(图28)。
当通过静脉内和腹膜内施用时,分析具有不同量的PEG脂质的Z120纳米粒的分布的离体成像。通过尾静脉向BALB-c-Nu小鼠注射1mg/kg Luc mRNA。然后在注射之后24小时对小鼠进行成像。这些图像显示在图29中。与萤光素酶的递送类似,使用具有3mg/kg因子VII的Z112分析因子VII的体内递送。
使用CSAL,在两种不同的重量比和两种不同的CSAL下观察到剂量依赖性活性(图30)。使用荧光标记的核酸,在用34nM siRNA的24小时孵育时间之后,在A549-luc细胞中观察到CSAL纳米粒的内化。这些图像显示在图31中。在BALB-c裸小鼠中进行类似的成像,显示纳米粒在体内的内化和纳米粒在特定器官中的定位,如图32中所示。图33中显示了抑制型tRNA在本文中所述的CSAL组合物中的结合以及颗粒尺寸。凝胶电泳显示,当负载有抑制型tRNA聚合物时,CSAL和ZAL均可恢复p53表达(图34)。当负载有一种或更多种抑制型tRNA分子时,已显示多重不同的ZAL被Calu6细胞摄取(图35)。
实施例4:使用ZAL和CSAL递送CRISPR核苷酸
A.方法和材料
i.用于合成的化学品和试剂。
除非另有指明,否则所有化学品均购自Sigma-Aldrich。1,2-环氧癸烷购自TCIAmerica。1,2-环氧十八烷购自Alfa Aesar。疏水性丙烯酸酯丙烯酸辛酯(Ac8)、丙烯酸癸酯(Ac10)、丙烯酸十四烷基酯(Ac14)和丙烯酸十六烷基酯(Ac16)如下所述合成。有机溶剂购自Fisher Scientific并用溶剂纯化系统(Innovative Technology)纯化。Lipid PEG2000如先前所述(Zhou等,2016)合成。CDCl3、甲醇-d4和DMSO-d6购自Cambridge IsotopeLaboratories。
ii.用于生物测定的核酸和其他试剂。
所有siRNA均购自Sigma-Aldrich。DNA寡核苷酸购自Integrated DNATechnologies。萤光素酶、mCherry和Cas9信使RNA(mRNA)购自Tri-Link Biotechnologies。Lipofectamine 3000和OptiMEM购自Invitrogen。单指导RNA使用MEGAshortscript T7转录试剂盒(Life Technologies)通过体外转录(IVT)制备,然后根据制造商的方案使用MEGAclear Transcription Clean-Up Kit(Life Technologies)纯化。Ribogreen试剂购自Life Technologies。ONE-Glo+Tox和Cell Titer Glow购自Promega。RIPA缓冲液和TRIzol试剂购自Thermo Scientific。QuickExtract DNA Extraction Solution购自Epicenter。实时qPCR使用iTaq Universal SYBR Green 2X Supermix(Bio-Rad)进行。所有抗体均购自Cell Signaling。
iii.细胞培养。
Dulbecco改良的Eagle培养基(DMEM)购自Hyclone,其含有高葡萄糖、L-谷氨酰胺并且不含丙酮酸或酚红。RPMI-1640购自Sigma Aldrich。Dulbecco改良的磷酸缓冲盐水(PBS)、胰蛋白酶-EDTA(0.25%)和胎牛血清(FBS)购自Sigma-Aldrich。HeLa-Luc和A549-Luc细胞在补充有5%FBS的DMEM中培养。IGROV1细胞在补充有5%FBS的RPMI-1640中培养。
iv.动物研究。
所有实验均由德克萨斯大学西南医学中心的机构动物护理和使用委员会(IACUC)批准,并符合适用的当地、州和联邦法规。C57BL/6和无胸腺裸Foxn1nu小鼠购自Envigo。NODscidγ(NSG)小鼠购自UT Southwestern动物繁殖中心。Rosa-CAG-LSL-tdTomato小鼠购自The Jackson Laboratory(库存号:007909)。
v.方法
1H和13C NMR用Varian 400MHz波谱仪或Varian 500MHz波谱仪进行。MS用VoyagerDE-Pro MALDI-TOF进行。LCMS用配备有UV-vis和蒸发光散射检测器(evaporative lightscattering detector,ELSD)的Agilent LCMS系统进行。快速色谱用配备有UV-vis和蒸发光散射检测器(ELSD)的Teledyne Isco CombiFlash Rf-200i色谱系统进行。颗粒尺寸和ζ电位使用Malvern Zetasizer Nano ZS(He-Ne激光,λ=632nm)通过动态光散射(DynamicLight Scattering,DLS)测量。RT qPCR用Bio-Rad C 1000 Touch Thermal Cycler(CFX384Real-time System)运行。每个反应用iTaq Universal SYBR Green 2X Supermix(Bio-Rad)进行。组织切片使用共聚焦激光扫描显微术用Zeiss LSM-700进行成像,并使用ImageJ(NIH)对图像进行处理。流式细胞术使用BD FACSAria Fusion machine(BD Biosciences)进行。
vi.用于体内研究的纳米粒制剂。
使用具有人字形(herringbone)迅速混合特征的双通道微流控混合器(PrecisionNanosystems NanoAssemblr)制备用于体内研究的两性离子氨基脂质(ZAL)纳米粒(ZNP)。将脂质混合物(ZAL、胆固醇和PEG-脂质)的乙醇溶液与核酸的酸性水溶液迅速组合,水溶液∶EtOH体积比为3∶1且流量为12mL/分钟。
vii.核酸序列
a.小干扰RNA(siRNA)
dT是DNA碱基。所有其他都是RNA碱基。
siLuc(针对萤光素酶的siRNA)。
有义:5′-GAUUAUGUCCGGUUAUGUA[dT][dT]-3′(SEQ ID No:1)
反义:5′-UACAUAACCGGACAUAAUC[dT][dT]-3′(SEQ ID No:2)
siCtrl(非靶向siRNA)
单指导RNA(sgRNA)。使用CRISPR.mit.edu平台设计指导RNA,并如先前报道(Ran等,2013)克隆到pSpCas9(BB)-2A-GFP(PX458)中。
表2:sgRNA序列
表3:BbsI sgRNA克隆寡聚物
*指导序列以粗体示出
表4:T7模板PCR引物
表5:Surveyor测定PCR引物
表6:实时qPCR引物
| 引物 | 序列(5′至3′) | SEQ ID NO: |
| Cas9正向 | GGAACCGCTGGAGAGCAACT | 34 |
| Cas9反向 | GTCCCTATCGAAGGACTCTGGCA | 35 |
| hActinB正向 | AGAAGGATTCCTATGTGGGCG | 36 |
| hActinB反向 | CATGTCGTCCCAGTTGGTGAC | 37 |
viii.sgRNA制备。
使用CRISPR.mit.edu平台设计单指导RNA,并用标准BbsI克隆克隆到PX458质粒中。T7转录模板通过PCR扩增并凝胶纯化。使用MEGAshortseript T7转录试剂盒(LifeTechnologies)通过体外转录合成sgRNA,然后根据制造商的方案使用MEGAclearTranscription Clean-Up Kit(Life Technologies)进行纯化。
ix.使用pDNA筛选sgRNA。
使用sgRNA克隆的PX458质粒通过编码sgRNA和Cas9二者的质粒的转染评价sgRNA对萤光素酶的效力。根据制造商的方案,使用Lipofectamine 3000(LF3000,Invitrogen)转染sgRNA-Cas9质粒。将HeLa-Luc细胞以每孔10,000个细胞的密度接种在96孔白色不透明组织培养板中。将LF3000 pDNA颗粒以每孔100ng pDNA的剂量添加至细胞。6小时后,除去培养基并更换为200μL新鲜生长培养基。在24、48和72小时后,使用ONE-Glo+Tox测定(Promega)确定萤光素酶的相对表达,并相对于对照进行归一化。使用非靶向sgRNA(sgScr)和无指导Cas9质粒作为对照。(N=4+/-标准偏差)。
x.HeLa-Luc-Cas9细胞系制备。
通过慢病毒转导制备HeLa-Luc-Cas9稳定细胞。将亲本HeLa-Luc细胞(Zhou等,2016;Hao等,2015)在完全生长培养基中以每孔70,000个细胞的密度接种在24孔板中,并允许培养箱中贴壁过夜。将培养基更换为1mL预热的假颗粒培养基(DMEM、3%FBS、20mMHEPES、4μg/mL聚凝胺)。将Cas9-Blast慢病毒上清液在冰上解冻,并将50-100μL添加至期望的孔。将细胞在室温下以1,000×g旋转孵育(spinoculated)1小时,并返回至培养箱过夜,之后将假颗粒培养基更换为完全生长培养基。在旋转孵之后总共48小时后,施加选择压力(5和10μg/mL杀稻瘟素S)并将细胞维持并扩增。通过流式细胞术通过单细胞分选分离单细胞克隆。通过western印迹证实Cas9蛋白表达,通过在单细胞分选之前对FLAG标签进行印迹和在单细胞分选之后对Cas9进行印迹与亲本HeLa-Luc细胞进行比较。
xi.体外ZAL纳米粒(ZNP)制剂。
通过乙醇稀释法制备ZNP。将RNA(无论是siRNA、sgRNA或mRNA)在酸性含水缓冲液中稀释(除非另有指明,10mM柠檬酸/柠檬酸钠缓冲液(pH 3))。从每种组分的乙醇储备溶液,在乙醇中制备具有适当摩尔比的ZAL、胆固醇和PEG-脂质的脂质混合物。通过移液管,将脂质稀释液以1∶3的最终体积比添加至RNA稀释液,用移液管迅速混合,并孵育15-20分钟。在该孵育期后,将颗粒用不含钙和镁的1×Dulbecco改良的PBS(Sigma-Aldrich)稀释3倍或进行透析。每个室200μL样品在Pur-A-Lyzer Midi透析室(Sigma-Aldrich)中进行透析持续1小时。
xii.ZAL siRNA递送库筛选。
在HeLa-Luc细胞中筛选用环氧化物和丙烯酸酯疏水尾部官能化的ZAL库的siRNA递送效力。在白色不透明的96孔板组织培养板中,将HeLa细胞以10×103个细胞/孔的密度接种在100μL生长培养基(不含酚红的DMEM,5%FBS)中,并允许贴壁过夜。在测定当天将培养基更换为200μL新鲜生长培养基。使用50∶38.5(ZAL∶胆固醇)的制剂脂质混合物和以下ZAL∶siRNA比例制备粗制ZAL产品,所述ZAL∶siRNA使得ZAL中疏水性尾部的数目乘以制剂中ZAL∶siRNA的摩尔比为~1000,这导致整个库的重量比为16∶1至45∶1的ZAL∶siRNA,整个库的平均重量比为29.5+/-6.3。ZAL NP配制通过在96孔板中用多通道移液管以3∶1的水∶EtOHv∶v比迅速混合ZAL脂质混合物(20μL)和siLuc稀释液(60μL,13.33ng/mL,在10mM柠檬酸-柠檬酸钠缓冲液(pH 5)中)进行。在15-20分钟孵育期之后,将制剂在12体积(240μL)PBS中稀释。将纳米粒(40μL)以每孔100ng siRNA的剂量添加至HeLa-Luc细胞。将纳米粒与细胞一起孵育24小时,在该时间之后用ONE-Glo+Tox测定细胞生存力和萤光素酶测定(Promega)评价细胞生存力和萤光素酶表达。
xiii.向HeLa-Luc-Cas9细胞的sgRNA递送。
在向HeLa-Luc-Cas9细胞递送单指导RNA(sgRNA)中评价选择的ZAL。在白色不透明的96孔板组织培养板中,将HeLa-Luc-Cas9细胞以每孔5×103个细胞的密度接种在100μL生长培养基(不含酚红的DMEM,5%FBS)中,并允许贴壁过夜,并随后补充额外的100μL DMEM。使用体外纳米粒配制方案以指定的脂质组成和重量比(保持50∶38.5的(ZAL∶胆固醇摩尔比),将PEG-脂质添加物从5%调节至0.5%,并且将重量比从20∶1 ZAL∶sgRNA调节至5∶1ZAL∶sgRNA)配制包封sgRNA的ZAL。。非靶向对照sgRNA(sgCtrl)用作阴性对照。以适当剂量的sgRNA将纳米粒添加至细胞,并与细胞一起孵育48小时。用ONE-Glo+Tox测定(Promega)评价细胞生存力和萤光素酶表达,相对于未处理的细胞进行归一化(N=4+/-标准偏差)。
xiv.sgRNA和siRNA递送的动力学测定。
在HeLa-Luc-Cas9细胞中测定通过siRNA和sgRNA沉默/编辑后萤光素酶表达的动力学。对于<48小时的时间点,将包封sgRNA或siRNA的ZNP递送至96孔板中每孔5K细胞密度的HeLa-Luc-Cas9细胞。在0.5、1、2、4、11、20、30和44小时的时间点后,通过的One-Glow+Tox测定确定细胞生存力和萤光素酶表达。对于更长的时间点,将细胞在6孔板中处理。从第2天时间点开始,吸出细胞,用1×PBS清洗,用200μL胰蛋白酶进行胰蛋白酶消化,并重悬于1800μL培养基中。将1mL每种细胞混悬液添加至含有1mL DMEM(总共2mL)的新鲜6孔板并返回至培养箱。对于剩余的细胞混悬液,将50μL转移至96孔白色不透明板(每个样品10个孔)。使用Titer Glo测定确定细胞生存力并相对于未处理的细胞进行归一化,而使用One-Glo测定确定相对萤光素酶表达,并相对于对照(siCtrl或sgCtrl)归一化。将数据绘制为5次测量的平均值+/-标准偏差
xv.萤光素酶mRNA递送体外测定。
使用上文概述的体外纳米粒配制方法制备具有mRNA(Tri-LinkBiotechnologies)的ZNP。将IGROV1细胞在白色不透明的96孔组织培养板中以每孔5×103个细胞的密度接种在补充有5%FBS的100μL RPMI1640培养基中,并允许贴壁过夜。孵育过夜后,向孔添加额外的100μL培养基。以ZAL∶mRNA重量比为20∶1、10∶1、7.5∶1和5∶1制备ZAL∶mRNA纳米粒,脂质混合物摩尔组成为50∶38.5∶n的ZAL∶胆固醇∶PEG-脂质,其中在每个重量比下n=5、2、1和0.5。将ZAL-mRNA纳米粒以适当的mRNA剂量添加至细胞并孵育指定的时间(6小时至48小时),在该时间之后用ONE-Glo+Tox测定(Promega)评价细胞生存力和萤光素酶表达,并相对于未处理细胞进行归一化(N=4+/-标准差)。
xvi.Cas9 mRNA和sgRNA的体外共递送。
在向表达萤光素酶的癌细胞共递送Cas9 mRNA(Tri-Link biotechnologies)和单指导RNA(sgRNA)中评价ZNP。将细胞以每孔250,000的密度接种在6孔板和2mL DMEM中。使用体外配制方案配制ZNP。为了在单颗粒中共递送,将Cas9mRNA和sgRNA在pH 3下在酸性缓冲液中组合在一起,然后以适当的ZAL∶总RNA重量比添加ZAL脂质混合物。将细胞与ZNP一起孵育72小时,然后通过Surveyor测定评价编辑。作为阴性对照,添加具有仅Cas9(无指导Cas9)、仅sgLuc、和Cas9加sgCtrl的ZNP。sgRNA剂量固定为每孔0.5μg,而Cas9 mRNA剂量从每孔0.5μg(1∶1)调节至3μg(6∶1)。ZAL∶总RNA比例固定为7.5∶1。通过添加Cas9 mRNA ZNP然后在24小时后以2∶1 Cas9 mRNA与sgRNA的总比例添加sgRNA ZNP进行分阶段共传递。另外48小时孵育时间之后,通过Surveyor测定通过基因编辑评价细胞。
xvii.核酸结合实验。
使用Ribogreen测定(Molecular Probes)评价核酸结合。简单地说,使用体外或体内配制方案制备纳米粒。将纳米粒制剂(5μL)添加至黑色96孔不透明微孔板(Coming)。在与纳米粒相同的培养基中制备合适核酸的标准曲线。将Ribogreen试剂在1×PBS中1∶1000稀释,并通过多通道移液管向每个孔添加50μL。将混合物在轨道混合器上搅拌5分钟,并使用读板器(λEx485nm,λEm 535nm)读取每个孔的荧光。通过将来自每个纳米粒样品的信号拟合至核酸标准曲线来确定游离核酸的量,并且通过下式确定结合分数:结合的核酸分数=(总核酸输入-游离核酸)/总数核酸输入)(N=3或4+/-标准偏差)
xviii.体内纳米粒配制:
使用NanoAssemblr微流控混合系统(Precision Nanosystems)进行体内纳米粒配制。将脂质溶解在乙醇中,并将核酸在10mM柠檬酸-柠檬酸钠缓冲液(pH 3)中稀释。以每分钟12mL的总流量将脂质混合物和核酸稀释液以3∶1的核酸∶脂质混合物的体积比组合,并且每次配制开始和结束时废物收集量为0.1mL。将纳米粒在Pur-A-Lyzer midi透析室(Sigma-Aldrich)中以每室200μL体积用1×PBS透析1小时,并在1×PBS中稀释至合适的核酸浓度。
xix.体内萤光素酶mRNA递送:
所有实验均由德克萨斯大学西南医学中心的机构动物护理和使用委员会(IACUC)批准,并且符合适用的地方、州和联邦法规。以脂质混合物中50 ZAL∶38.5胆固醇∶0.5、1或2PEG-脂质摩尔比和7.5∶1 ZAL∶mRNA重量比利用体内配制来配制ZA3-Ep10。通过尾静脉注射或腹膜内注射以1mg/kg的剂量向小鼠注射ZAL-mRNA NP。在24小时和48小时后,通过活动物生物发光成像评价萤光素酶表达。将动物在异氟烷下麻醉,并在颈背部皮下注射D-萤光素单钠水合物(GoldBio)底物。在麻醉下孵育10-12分钟后,用IVIS Lumina系统(PerkinElmer)对萤光素酶活性进行成像,并使用Living Image分析软件(Perkin Elmer)对图像进行处理。切除后对全身器官进行离体成像,并将组织在干冰上冷冻用于离体萤光素酶表达分析。
xx.纳米粒性质表征
使用具有He-Ne激光(λ=632nm)的Zetasizer Nano ZS(Malvern)测量物理性质。通过173°反向散射,通过动态光散射(DLS)(5次测量,3次运行×10秒,自动衰减器设置)测量颗粒尺寸。在折叠的毛细管小室(Malvem)中测量ζ电位,其中样品在PBS(对于ZAL NP)或柠檬酸盐磷酸盐缓冲液pH 7.4(对于CSAL NP)中稀释。
xxi.Surveyor测定
使用QuickExtract DNA Extraction Solution(Thermo Fisher Scientific)根据制造商的方案分离来自经转染细胞的基因组DNA。然后通过PCR扩增靶区域,并在琼脂糖凝胶(QIAquick Gel Extraction Kit,QIAgen)上凝胶纯化PCR产物。使用SurveyorMutation Detection Kit(IDT)进行Surveyor测定:首先将PCR产物杂交,然后将一半产物用核酸酶S切割;然后将未切割和切割的DNA在4-20%聚丙烯酰胺凝胶(Biorad)上运行。用SYBR Gold Nucleic Acid Gel Stain缓冲液(在TBE缓冲液中1∶10000稀释,Thermo FisherScientific)对凝胶进行染色,并通过UV光成像。
xxii.Western印迹
将细胞在冷RIPA缓冲液(Thermo Scientific)中裂解,通过离心使裂解物澄清,并通过BCA测定(Pierce)对上清液中的总蛋白质进行定量。将50μg总蛋白上样到4-20%预制聚丙烯酰胺凝胶上,并转移至硝酸纤维素膜(BioRad)。将膜在5%脱脂牛奶中在RT下封闭1小时,并随后在4℃下与一抗孵育过夜(Cas9抗体,1∶1000,Cell Signaling,14697S;β-肌动蛋白抗体,1∶2000,Cell Signaling,4970)。在室温下施用二抗1小时(抗兔IgG,HRP连接的抗体,Cell Signaling,7074,抗小鼠IgG,HRP连接的抗体,Cell Signaling,7076),并随后将膜显色并在X射线膜上检测。
xxiii.实时RT-qPCR。
将细胞在6孔板中用Cas9mRNA转染指定时间点和0.5μg/mL mRNA转染指定时间点。使用TRIzol试剂根据制造商的方案提取总RNA。使用iScript Reverse Transcription试剂盒(BioRad)将RNA逆转录,并用Bio-Rad C1000 Touch Thermal Cycler(CFX384 Real-timeSystem)运行实时qPCR。每个反应用iTaq Universal SYBR Green 2×Supermix(Bio-Rad)进行。qPCR程序如下:
1)95℃持续3分钟
2)95℃10秒和55℃30秒持续40个循环
3)95℃10秒
4)65℃5秒
5)95℃5秒
使用人β-肌动蛋白作为对照,并将mRNA水平相对于折叠的肌动蛋白进行归一化,并作为两个独立实验的平均值进行作图。
xxiv.Cas9 mRNA和sgLoxP的体内递送。
根据体内纳米粒配制方案,使用Nanoassemblr微流控混合装置制备包封Cas9mRNA和sgLoxp的ZA3-Ep10 ZNP。脂质混合物含有50ZA3-Ep10∶38.5胆固醇∶0.5 PEG-脂质摩尔比,并且颗粒以7.5∶1 ZAL∶总RNA重量比配制。Cas9 mRNA∶sgLoxP重量比保持在4∶1。通过尾静脉注射以5mg/kg总RNA(4mg/kg mRNA,1mg/kg sgRNA)注射Rosa26-LSL-tdTomato小鼠并监测1周。之后,处死小鼠并使用IVIS Lumina系统对主要器官的荧光表达(dsRed滤光器组)成像,并与未注射的Rosa26-LSL-tdTomato小鼠进行比较。使用通过尾静脉注射(4天)静脉内注射的肝特异性Cre重组酶腺相关病毒(Cre-AAV8)作为阳性对照。
xxv.组织切片
将组织在4%多聚甲醛(PFA)中在RT下固定2小时,然后在30%蔗糖(在PBS中)在4℃下更换过夜。然后将组织包埋在Cryo-gel(Leica Biosystems)中,并在干冰中冷冻。使用低温恒温器(cryostat machine)(Leica Biosystems)以8μm厚度对块进行切片。将切片风干并在PBS中的0.25%Triton X-100(Biorad)5%FBS中在RT下孵育1小时。然后用DAPI(Vector Laboratories)封固载玻片并盖上盖。
xxvi.原代肝细胞分离
通过两步胶原酶灌注分离原代肝细胞。使用肝灌注培养基(Thermo FisherScientific,17701038)、肝消化培养基(Thermo Fisher Scientific,17703034)和肝细胞清洗培养基(Thermo Fisher Scientific,17704024)。
xxvii.流式细胞术
为了检测Tomato阳性群体,分离原代肝细胞(2×106/mL)并用DAPI(Roche,2μg/mL)染色用于死细胞排除。用BD FACSAria Fusion machine(BD Biosciences)分析细胞。在DAPI阴性(活细胞)群体中对Tomato阳性细胞进行计数。
xxviii.统计分析
使用GraphPad Prism中的t-检验(Student′s t-test)进行统计学分析。
B.递送CRISPR核酸序列
合理地合成两性离子氨基脂质(ZAL)以包含两性离子磺基甜菜碱头基、富含胺的接头区域和多样的疏水性尾部(图67)。通过2-(二甲基氨基)乙基丙烯酰胺与1,3-丙磺酸内酯的开环反应制备两性离子亲电子前体(SBAm),其容易通过在丙酮中原位沉淀而分离。向SBAm中缀合添加不同的多胺,得到一系列两性离子胺,其可与疏水性环氧化物和丙烯酸酯反应以附加6至18个碳的烷基尾和醇/酯基团,以增强ZAL-RNA相互作用(参见实施例2)。为了验证ZNP通常可结合并递送RNA,首先筛选72个成员的库向稳定表达萤火虫萤光素酶(HeLa-Luc)的HeLa细胞的siRNA递送(图19)。这允许鉴定关键胺核心(包括ZA1、ZA3和ZA6)的结构。有趣的是,基于环氧化物的ZAL(ZAx-Epn)通常也比基于丙烯酸酯的ZAL(ZAx-Acn)更具活性(图18)。利用手中的主要化合物,注意力集中在了sgRNA和Cas9 mRNA的递送。临时分阶段和同时共递送二者都能实现完全外源的基因编辑。
使用表达Cas9和萤光素酶二者的稳定细胞系(HeLa-Luc-Cas9)评价ZAL递送CRISPR/Cas9组分的能力。在HeLa-Luc细胞的Cas9慢病毒转导后分离单HeLa-Luc-Cas9细胞克隆(图43A-43C)。根据先前报道的靶向基因的前三分之一的方法(表2)(Ran等,2013)设计并产生针对萤光素酶的sgRNA,并通过pDNA转染进行评价(图44)。通过体外转录合成最具活性的针对萤光素酶的sgRNA(sgLuc5,以下称为sgLuc)以及对照sgRNA。接下来,向首要ZNP负载sgLuc并评价其向HeLa-Luc-Cas9细胞的递送。相对于未处理的细胞,在48小时(h)后测量萤光素酶和生存力(Hao等,2015;Zhou等,2016;Yan等,2016)。如将阳离子和两性离子官能团组合的化学设计所预期的,ZNP不需要包含辅助磷脂(图65A)。
在主要ZAL中,发现ZA3-Ep10对于递送sgLuc是有效的(图45)。萤光素酶DNA的编辑导致萤光素酶表达的剂量依赖性降低(图65B)。使用可检测得失位(indel)的Surveyor核酸酶测定(Guschin等人,2010)验证CRISPR/Cas编辑(图63C)。鉴于sgRNA需要负载到细胞中的Cas9核酸酶中并运输至细胞核以进行序列引导的编辑,因此寻求理解该过程的动力学,特别是与RNAi介导的基因沉默相比。siLuc介导的mRNA降解是一个快速过程,其中在前4小时内表达降低40%。萤光素酶在20小时内沉默92%并保持低水平约3天。此后,蛋白质表达稳定地提高并在转染之后6天达到基线水平(图63B和图46(早期时间点))。相比之下,sgLuc介导的DNA编辑在动力学上较慢,可能是由于需要负载到Cas9中并调查DNA用于PAM。萤光素酶表达降低40%花费20小时,最终在2天后降低95%并且无限期地保持在那里。由于永久性基因组改变,低萤光素酶表达(5%)在整个测定期间(9天)持续,即使在多轮细胞分裂后也是如此,表明编辑的细胞以与未编辑细胞相同的速率生长(图63B和47)。
已示出ZA3-Ep10 ZNP可有效地递送sgRNA(~100nt),接下来检查它们递送甚至更长的mRNA(1,000至4,500nt)的能力。将编码mCherry mRNA的mRNA(~1,000nt)或萤光素酶mRNA(~2,000nt)递送至IGROV1人卵巢癌细胞。可见明亮的mCherry表达(图63C),并且观察到萤光素酶表达是剂量依赖性的(图63D)。值得注意的是,高表达需要低mRNA剂量(<600pM)。与sgRNA相反,其不表现出对制剂中PEG脂质摩尔比的依赖性(图28和48),mRNA的递送效力随着PEG脂质比例的提高而降低(图49),而ZNP尺寸仅有适度的变化(图50)。特别是考虑到体外至体内翻译,PEG化的优化是对每种靶疾病、器官和细胞类型进行探索的持续挑战(Whitehead等,2012)。该报告试图通过在多种细胞类型和小鼠品系中检查不同制剂来减轻这些问题中的一些。进一步支持设计假设,随着进入制剂的DOPE的摩尔比例的提高,结构类似的阳离子脂质的滴定显示出改善sgRNA和mRNA的递送,而siRNA不需要额外的两性离子含量(图51)。此外,ZA3-Ep10 ZNP的效力对于所有RNA货物是一致的,并且优于补充有磷脂的阳离子类似物。
接下来通过向对个多个小鼠品系静脉内(i.v.)施用ZA3-Ep10 mRNA ZNP,在体内评价最佳制剂。在无胸腺裸小鼠(图65E,1mg/kg)、C57BL/6小鼠(图65F,4mg/kg)和NODs cidγ(NSG)小鼠(图52,1mg/kg)中进行Luc mRNA递送后的生物发光成像导致注射之后24小时肝、肺和脾组织中萤光素酶的表达,其通过ROI分析进行定量(图53A和53B)。基于高肺信号,探索肺细胞中的共递送(一锅)CRISPR/Cas编辑。
由于Cas9 mRNA的长度非常长(~4,500nt),使用合成载剂的递送特别具有挑战性。值得注意的是,在与ZA3-Ep10 Cas9 mRNA ZNP孵育仅4小时后,发现A549肺癌细胞中Cas9 mRNA的水平非常高(图66A)。在接下来的45小时内,合成引入的mRNA从>4倍肌动蛋白降低至0.7倍肌动蛋白。由于mRNA的翻译需要时间,所以蛋白质表达在4小时低,12小时显著提高,并且在36小时最高(图66A和66B)。其也是剂量依赖性的(图66C)。对于体内效用,合成NP载剂的使用减轻了病毒递送的担忧。此外,Cas9 mRNA的递送允许Cas9的瞬时表达,最小化了可导致脱靶基因组改变的持久性。这可降低向基因组中引入外源核酸酶的显著治疗危险。
如上所示,mRNA和sgRNA的递送在动力学上是不同的。实际上,发现在不同ZNP中的分阶段递送是有效的处理方法。ZNP递送mRNA 24小时,以使Cas9蛋白能够表达,然后在不同的ZNP中递送sgRNA,使得能够在HeLa-Luc和A549-Luc细胞二者中进行有效的体外编辑(图54和55)。然而,当考虑体内效用时,Cas9 mRNA和sgRNA必须存在于同一细胞中。因此推断,由单NP共递送mRNA和sgRNA将提供更高的编辑效率,因为该方法将保证递送至相同一个体细胞。探索了多种条件,并发现通过包封Cas9 mRNA和sgRNA二者的ZNP对靶基因的有效编辑需要mRNA∶sgRNA的比例大于或等于3∶1(wt),如Surveyor测定所证实的(图66D),而对照ZNP未显示任何编辑(图55)。
为了检测体内共递送,使用含有存在于所有细胞中的纯合Rosa26启动子Lox-Stop-Lox tdTomato(tdTO)盒的基因工程小鼠(Tabebordbar等,2016)。Cas9-mRNA和针对LoxP的sgRNA的共递送(Li等人,2015)能够使终止盒缺失并诱导tdTO表达(图67A,表2)。这是合成载剂的具有挑战性的模型,因为需要在待表达的tdTO的同一等位基因上进行两次切割。以5mg/kg RNA剂量静脉内施用以4∶1 mRNA∶sgRNA重量比的包封Cas9 mRNA和sgLoxp的ZNP(图56-58)。施用一周后,在整个器官离体成像时在肝和肾中检测到来自tdTO的荧光信号(图67B)。使用共聚焦荧光显微镜对切片器官的详细检查显示肝、肺和肾组织中的tdTO阳性细胞(图67C)。重要的是,当用sgCtrl ZNP处理动物时未检测到tdTO阳性细胞(图59),并且未观察到经处理动物体重的显著变化(图60)。从灌注的肝分离原代肝细胞,并通过流式细胞术对tdTO细胞进行计数以使编辑量化(图61)。为了进一步确认编辑,在ZNP sgLoxP处理之后2个月收获组织,其仍然在肝和肾中显示出强荧光信号(图62)。该原理验证数据表明,由单ZNP静脉内共递送Cas9 mRNA和靶向的sgRNA可使得能够在体内进行CRISPR/Cas编辑。
实施例5:ZAL和CSAL的进一步修饰
考虑到ZAL和CSAL合成的模块化性质,可在不妨碍获得很多种结构类似物之能力的情况下实现分子的单个部分内的变化。例如,ZAL和CSAL的中心阳离子胺可如下所示进行修饰以获得不同长度的链。
另外,ZAL的阴离子头基可替换成不同的阴离子基团或者当中心胺已被替换成阴离子磷酸酯基团时可转化成阳离子头基,如下所示。
对这些基团的分析将改变分子内的空间、两性离子身份和电荷间隔。这些经修饰的阴离子头基可如下面的方案中所述进行合成。
另外,使用环氧化的起始材料形成疏水性尾部导致存在仲醇位点,其将进一步反应以产生与核酸序列的额外相互作用。可能的修饰的一些非限制性实例包括以下方案中所示的那些。乙酰化ZAL的NMR示于图68中。
另外,胺可用可降解二酯官能化,例如下面所示的二酯。该二酯可用一个或更多个巯基烷基基团进一步修饰以提供必需的疏水性基团。
此外,为了允许引入可降解酯基团以及仲醇二者,制备了缩水甘油酸酯(glycidicester)。
进行用不同的丙烯酸酯形成这些化合物,并通过图69A和69B中的NMR显示。测试这些经修饰的结构ZAL和CSAL结合RNA的能力以及用不同RNA分子形成的纳米粒的物理性质。然后测试这些颗粒将sgRNA递送至HeLa-Luc-Cas9细胞以及将mRNA递送至IGROV1细胞的能力。另一些类似物的质谱和NMR数据分别示于图70和71中。
*********************
根据本公开内容,无需过度实验即可制备和实施本文中公开和要求保护的所有组合物和方法。虽然已经根据某些实施方案描述了本公开内容的组合物和方法,但是对于本领域技术人员明显的是,可在不脱离本公开内容的概念、精神和范围的情况下对本文中所述的组合物和方法以及方法的步骤或步骤顺序进行改变。更具体地,明显的是,化学上和生理学上均相关的某些试剂可代替本文中所述的试剂,而可获得相同或相似的结果。对于本领域技术人员明显的所有此类类似的替代和修改被认为是在由所附权利要求限定的本公开内容的精神、范围和概念内。
参考文献
以下参考文献就其为本文中所述的那些提供示例性程序或其他细节补充的程度上特别地通过引用并入本文。
El Yacoubi,et al.,Annu.Rev.Genel.,46:69-95,2012.
Grosjean and Benne,Modification and Editing of RNA(ASM Press),1998.
Hendrickson,et al.,Annu.Rev.Biochem.,73:147-176,2004.
Johnson et al.,Cold Spring Harbor Symp.Quant.Biol.,60:71-82,1995.
Johnson et al.,J.Mol.Biol.,156:113-140,1982.
Crowley el al.,Cell,78:61-71,1994.
Beier and Grimm,Nucleic Acids Res.,29:4767-4782,2001.
Torres,et al.,Trends Mol.Med.,20:306-314,2014.
Green and Sambrook,Molecular Cloning:A Laboratory Manual(CHSL Press),2012.
Rio el al.,RNA:A Laboratory Manual(CHSL Press),2011.
Flanagan et al.,J.Biol.Chem.,278:18628-18637,2003.
Janiak,et al.,Biochemistry,31:5830-5840,1992.
Zhou et al.,Proc.Natl.Acad.Sci.USA,113:520-525,2016.
Hao et al.,J.Am.Chem.Soc.,137:9206-9209,2015.
Ran et al.,Nat.Protoc.,8:2281-2308,2013.
Love et al.,Proc.Natl.Acad.Soc.,107:1864-1869,2010.
Yan et al.,Proc.Natl.Acad.Soc.,113:E5702-E5710,2016.
Tabebordbar et al.,Science,351:407-411,2016.
Guschin et al.,Methods Mol.Biol.,649:247-256,2010.
Whitehead et al.,ACS Nano,6:6922-6929,2012.
Li et al.,Genome Biol.,16:111,2015.
序列表
<110> 得克萨斯州大学系统董事会
<120> 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质
<130> UTFD.P3035WO
<140> 未知
<141> 2017-05-16
<150> US 62/337,196
<151> 2016-05-16
<160> 37
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 1
gauuaugucc gguuauguat t 21
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 2
uacauaaccg gacauaauct t 21
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 3
gcgcgauagc gcgaauauat t 21
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 4
uauauucgcg cuaucgcgct t 21
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 5
cttcgaaatg tccgttcggt 20
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 6
cccggcgcca ttctatccgc 20
<210> 7
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 7
tccagcggat agaatggcgc 20
<210> 8
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 8
ggattctaaa acggattacc 20
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 9
ataaataacg cgcccaacac 20
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 10
cgtatagcat acattatacg 20
<210> 11
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 11
gcttcgataa tatccgctac 20
<210> 12
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 12
caccgcttcg aaatgtccgt tcggt 25
<210> 13
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 13
aaacaccgaa cggacatttc gaagc 25
<210> 14
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 14
caccgcccgg cgccattcta tccgc 25
<210> 15
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 15
aaacgcggat agaatggcgc cgggc 25
<210> 16
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 16
caccgtccag cggatagaat ggcgc 25
<210> 17
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 17
aaacgcgcca ttctatccgc tggac 25
<210> 18
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 18
caccgggatt ctaaaacgga ttacc 25
<210> 19
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 19
aaacggtaat ccgttttaga atccc 25
<210> 20
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 20
caccgataaa taacgcgccc aacac 25
<210> 21
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 21
aaacgtgttg ggcgcgttat ttatc 25
<210> 22
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 22
caccgcgtat agcatacatt atacg 25
<210> 23
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 23
aaaccgtata atgtatgcta tacgc 25
<210> 24
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 24
caccggcttc gataatatcc gctac 25
<210> 25
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 合成寡聚物
<400> 25
aaacgtagcg gatattatcg aagcc 25
<210> 26
<211> 40
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 26
taatacgact cactataggg ataaataacg cgcccaacac 40
<210> 27
<211> 40
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 27
taatacgact cactataggg cgtatagcat acattatacg 40
<210> 28
<211> 40
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 28
taatacgact cactataggg gcttcgataa tatccgctac 40
<210> 29
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 29
aaaagcaccg actcggtgcc 20
<210> 30
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 30
ggaaccgctg gagagcaact 20
<210> 31
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 31
gtccctatcg aaggactctg gca 23
<210> 32
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 32
gctggagagc aactgcataa 20
<210> 33
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 33
catcgactga aatccctggt aatc 24
<210> 34
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 34
ggaaccgctg gagagcaact 20
<210> 35
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 35
gtccctatcg aaggactctg gca 23
<210> 36
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 36
agaaggattc ctatgtgggc g 21
<210> 37
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成引物
<400> 37
catgtcgtcc cagttggtga c 21
Claims (79)
1.下式的化合物或其可药用盐:
其中:
A是-NRa-、-S-或-O-;其中:
Ra是氢或烷基C≤6,或者
作为替代地,Ra与R3或R4合在一起以形成烷二基C≤8;X1是-S(O)2O-、-OP(O)OReO-或-(CHRf)zC(O)O-,其中:
Re是氢或烷基C≤6;
Rf是氢或烷基C≤12;并且
z是1;
Y1是烷二基C≤12;
Z1是-N+R3R4-;其中
R3和R4各自独立地是氢、烷基C≤6或经取代烷基C≤6,或者
作为替代地,R3或R4与Ra合在一起以形成烷二基C≤8;
R1是下式的基团:
其中:
R5、R6和R2各自独立地是氢、烷基C≤8、-烷二基C≤6-NH2、-烷二基C≤6-烷基氨基C≤8、-烷二基C≤6-二烷基氨基C≤12、-烷二基C≤6-NR’R”或这些基团中任一种的经取代形式,或-Z3A”R8;其中:
R’和R”各自独立地是氢、烷基C≤8或经取代烷基C≤8、-Z3A”R8、-(CH2)sCH(OH)R7、-(CH2)sC(O)OR7或-(CH2)sC(O)(NRb)R7;其中:
s是1、2、3或4;
Rb是氢、烷基C≤6或经取代烷基C≤6;并且
R7是烷基C6-24、经取代烷基C6-24、烯基C6-24、经取代烯基C6-24;
或
Z3是烷二基C≤6或经取代烷二基C≤6,
A”是-CHRk-或-C(O)O-;其中:
Rk是氢、卤素、羟基或酰氧基C≤24;并且
R8是烷基C6-24、经取代烷基C6-24、烯基C6-24或经取代烯基C6-24;
q是1或2;并且
r是1、2或3;或者
R1是下式的基团:
其中:
Y2是杂芳二基C≤12;
R9、R10和R11各自独立地是氢、烷基C≤8、经取代烷基C≤8、-(CH2)uCH(OH)R12、-(CH2)uC(O)OR12、-(CH2)uC(O)(NRd)R12或-Z4A”’R12;其中:
u是1、2、3或4;
Rd是氢、烷基(C≤6)或经取代烷基(C≤6);或者
Z4是烷二基C≤6或经取代烷二基C≤6,
A”’是-CHRk’-或-C(O)O-;其中:
Rk’是氢、卤素、羟基或酰氧基C≤24;并且
R12是烷基C6-24、经取代烷基C6-24、烯基C6-24或经取代烯基C6-24;并且
x和y是1、2或3;并且
m和p各自独立地是选自0、1、2和3的整数;
当这些术语中的任何一个与“经取代”修饰语一起使用时,一个或更多个氢原子已被-OH、-F、-Cl、-Br、-I、-NH2、-NO2、-CO2H、-CO2CH3、-CN、-SH、-OCH3、-OCH2CH3、-C(O)CH3、-NHCH3、-NHCH2CH3、-N(CH3)2、-C(O)NH2、-C(O)NHCH3、-C(O)N(CH3)2、-OC(O)CH3、-NHC(O)CH3、-S(O)2OH或-S(O)2NH2独立地替换。
8.根据权利要求1至7中任一项的化合物,其中A是-NH-。
9.根据权利要求1至7中任一项所述的化合物,其中R3是烷基C≤8。
10.根据权利要求1至7中任一项所述的化合物,其中R4是烷基C≤8。
11.根据权利要求1至7中任一项所述的化合物,其中m是1。
12.根据权利要求4至7中任一项所述的化合物,其中n是2。
13.根据权利要求1至7中任一项所述的化合物,其中p是2。
15.权利要求14所述的化合物,其中r是1或2。
16.根据权利要求1至4中任一项所述的化合物,其中R5是烷基C≤8或经取代烷基C≤8。
17.根据权利要求1至4中任一项所述的化合物,其中R5是-Z3A”R8;
其中:
Z3是烷二基C≤4或经取代烷二基C≤4;
A”是-CHRk-或-C(O)O-;其中:
Rk是氢、卤素、羟基或酰氧基C≤24;并且
R8是烷基C6-24、经取代烷基C6-24、烯基C6-24或经取代烯基C6-24。
18.根据权利要求1至4中任一项所述的化合物,其中R6各自独立地是烷基C≤8、经取代烷基C≤8或-Z3A”R8。
19.根据权利要求18所述的化合物,其中:
R6的Z3是烷二基C≤4或经取代烷二基C≤4;
R6的A”是-CHRk-;其中:
Rk是氢、卤素、羟基或酰氧基C≤24;并且
R6的R8是烷基C6-24、经取代烷基C6-24、烯基C6-24或经取代烯基C6-24。
20.权利要求1至4中任一项所述的化合物,其中R6各自独立地是-烷二基C≤6-NR’R”或-Z3A”R8。
21.权利要求20所述的化合物,其中R’和R”各自独立地是烷基C≤8或经取代烷基C≤8。
22.根据权利要求1至4中任一项所述的化合物,其中R2是烷基C≤8或经取代烷基C≤8。
23.根据权利要求1至4中任一项所述的化合物,其中R2是-Z3A”R8;
其中:
Z3是烷二基C≤4或经取代烷二基C≤4;
A”是-CHRk-或-C(O)O-;其中:
Rk是氢、卤素、羟基或酰氧基C≤24;并且
R8是烷基C6-24、经取代烷基C6-24、烯基C6-24或经取代烯基C6-24。
24.根据权利要求23所述的化合物,其中R2的Z3是烷二基C1-2。
25.根据权利要求23所述的化合物,其中R2的Z3是经取代烷二基C1-2。
26.根据权利要求23所述的化合物,其中R2的A”是-CHRk-。
27.权利要求26所述的化合物,其中Rk是羟基。
28.权利要求26所述的化合物,其中Rk是酰氧基C≤24。
29.根据权利要求23所述的化合物,其中R2的A”是-C(O)O-。
30.根据权利要求23所述的化合物,其中R2的R8是烷基C6-24或经取代烷基C6-24。
31.根据权利要求23所述的化合物,其中R2的R8是烯基C6-24或经取代烯基C6-24。
32.根据权利要求1至4中任一项所述的化合物,其中R2是-烷二基C≤6-NH2、-烷二基C≤6-烷基氨基C≤8、-烷二基C≤6-二烷基氨基C≤12或这些基团中任一种的经取代形式。
34.权利要求33所述的化合物,其中R9是-Z4A”’R12。
35.权利要求33所述的化合物,其中R10是-Z4A”’R12。
36.权利要求33所述的化合物,其中R11是-Z4A”’R12。
37.根据权利要求1至3和5至7中任一项所述的化合物,其中R9是-Z4A”’R12;其中:
Z4是烷二基C≤4或经取代烷二基C≤4;
A”’是-CHRk’-或-C(O)O-;其中:
Rk’是氢、卤素、羟基或酰氧基C≤24;并且
R12是烷基C6-24、经取代烷基C6-24、烯基C6-24或经取代烯基C6-24。
38.根据权利要求1至3和5至7中任一项所述的化合物,其中R10是-Z4A”’R12;其中:
Z4是烷二基C≤4或经取代烷二基C≤4;
A”’是-CHRk’-或-C(O)O-;其中:
R1是氢、烷基C≤6或经取代烷基C≤6;并且
Rk’是氢、卤素、羟基或酰氧基C≤24;并且
R12是烷基C6-24、经取代烷基C6-24、烯基C6-24、经取代烯基C6-24。
39.根据权利要求1至3和5至7中任一项所述的化合物,其中R11是-Z4A”’R12;其中:
Z4是烷二基C≤4或经取代烷二基C≤4;
A”’是-CHRk’-或-C(O)O-;其中:
Rk’是氢、卤素、羟基或酰氧基C≤24;并且
R12是烷基C6-24、经取代烷基C6-24、烯基C6-24或经取代烯基C6-24。
40.根据权利要求1至3和5至7中任一项所述的化合物,其中Z4是烷二基C1-2。
41.根据权利要求1至3和5至7中任一项所述的化合物,其中Z4是经取代烷二基C1-2。
42.根据权利要求1至3和5至7中任一项所述的化合物,其中A”’是-CHRk’-。
43.权利要求42所述的化合物,其中Rk’是羟基。
44.权利要求42所述的化合物,其中Rk’是酰氧基C≤24。
45.根据权利要求1至3和5至7中任一项所述的化合物,其中A”’是-C(O)O-。
46.根据权利要求1至3和5至7中任一项所述的化合物,其中R12是烷基C6-24或经取代烷基C6-24。
47.根据权利要求1至3和5至7中任一项所述的化合物,其中R12是烯基C6-24或经取代烯基C6-24。
51.组合物,其包含:
(A)根据权利要求1至50中任一项所述的化合物;以及
(B)核酸。
52.权利要求51所述的组合物,其中所述核酸是治疗性核酸。
53.权利要求52所述的组合物,其中所述核酸是siRNA。
54.权利要求52所述的组合物,其中所述核酸是tRNA。
55.权利要求52所述的组合物,其中所述核酸是mRNA。
56.权利要求52所述的组合物,其中所述核酸是sgRNA。
57.根据权利要求51至56中任一项所述的组合物,其中所述组合物还包含类固醇或类固醇衍生物。
58.根据权利要求51至56中任一项所述的组合物,其中所述组合物还包含磷脂。
59.根据权利要求51至56中任一项所述的组合物,其中所述组合物还包含PEG脂质。
61.根据权利要求51至56中任一项所述的组合物,其中所述组合物包含的所述化合物与所述核酸的摩尔比为5∶1至1000∶1。
62.根据权利要求57所述的组合物,其中所述组合物包含的所述化合物与所述类固醇或类固醇衍生物的比例为1∶1至20∶1。
63.根据权利要求58所述的组合物,其中所述组合物包含的所述化合物与所述磷脂的比例为1∶1至9∶1。
64.根据权利要求59所述的组合物,其中所述组合物包含的所述化合物与所述PEG-脂质的比例为2.5∶1至100∶1。
65.根据权利要求51至56中任一项所述的组合物,其还包含可药用载体。
66.权利要求65所述的组合物,其中所述组合物配制成用于气雾剂、静脉内、腹膜内、皮下、表面或经口施用。
67.权利要求65所述的组合物,其中所述组合物配制成用于注射。
68.根据权利要求51至67中任一项所述的组合物在制备用于在有需要的患者中治疗疾病或病症的药物中的用途。
69.权利要求68所述的用途,其中所述疾病或病症是遗传病。
70.根据权利要求68或69所述的用途,其还包括第二治疗剂。
71.根据权利要求69所述的用途,其还包括第二治疗方式。
72.权利要求68所述的用途,其中所述疾病或病症是癌症。
73.权利要求72所述的用途,其中所述癌症是上皮癌、肉瘤、淋巴瘤、白血病、黑素瘤、间皮瘤、多发性骨髓瘤或精原细胞瘤。
74.权利要求72所述的用途,其中所述癌症是膀胱癌、血癌、骨癌、脑癌、乳腺癌、中枢神经系统癌症、宫颈癌、结肠癌、子宫内膜癌、食管癌、胆囊癌、胃肠道癌、外生殖器癌、泌尿生殖道癌、头癌、肾癌、喉癌、肝癌、肺癌、肌肉组织癌症、颈癌、口腔或鼻黏膜癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、脾癌、小肠癌、大肠癌、胃癌、睾丸癌或甲状腺癌。
75.根据权利要求72至74中任一项所述的用途,其还包括第二癌症治疗。
76.根据权利要求68或69所述的用途,其中所述患者是哺乳动物。
77.权利要求76所述的用途,其中所述患者是人。
78.根据权利要求68或69所述的用途,其中所述药物用于在方法中使用,所述方法包括施用所述组合物一次。
79.根据权利要求68或69所述的用途,其中所述药物用于在方法中使用,所述方法包括施用所述组合物两次或更多次。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202210228264.7A CN114656378A (zh) | 2016-05-16 | 2017-05-16 | 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662337196P | 2016-05-16 | 2016-05-16 | |
| US62/337,196 | 2016-05-16 | ||
| PCT/US2017/032950 WO2017201076A1 (en) | 2016-05-16 | 2017-05-16 | Cationic sulfonamide amino lipids and amphiphilic zwitterionic amino lipids |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210228264.7A Division CN114656378A (zh) | 2016-05-16 | 2017-05-16 | 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN109414408A CN109414408A (zh) | 2019-03-01 |
| CN109414408B true CN109414408B (zh) | 2022-03-29 |
Family
ID=60326218
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210228264.7A Pending CN114656378A (zh) | 2016-05-16 | 2017-05-16 | 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 |
| CN201780041000.8A Active CN109414408B (zh) | 2016-05-16 | 2017-05-16 | 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210228264.7A Pending CN114656378A (zh) | 2016-05-16 | 2017-05-16 | 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 |
Country Status (7)
| Country | Link |
|---|---|
| US (4) | US10562849B2 (zh) |
| EP (1) | EP3458032A4 (zh) |
| JP (3) | JP7080826B2 (zh) |
| CN (2) | CN114656378A (zh) |
| AU (3) | AU2017267634C1 (zh) |
| CA (1) | CA3024129A1 (zh) |
| WO (1) | WO2017201076A1 (zh) |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10562849B2 (en) * | 2016-05-16 | 2020-02-18 | The Board Of Regents Of The University Of Texas System | Cationic sulfonamide amino lipids and amphiphilic zwitterionic amino lipids |
| EP4393549A3 (en) * | 2016-05-16 | 2024-10-09 | The Board of Regents of the University of Texas System | Compositions for the delivery of trna as nanoparticles and methods of use therewith |
| EP3676244A4 (en) | 2017-08-30 | 2021-05-05 | Ecolab Usa Inc. | MOLECULES PRESENTING ONE HYDROPHOBIC GROUP AND TWO IDENTICAL HYDROPHILIC IONIC GROUPS AND CORRESPONDING COMPOSITIONS |
| US11560575B2 (en) | 2017-12-29 | 2023-01-24 | Texas Tech University System | High efficient delivery of plasmid DNA into human and vertebrate primary cells in vitro and in vivo by nanocomplexes |
| US11084974B2 (en) | 2018-08-29 | 2021-08-10 | Championx Usa Inc. | Use of multiple charged cationic compounds derived from polyamines for clay stabilization in oil and gas operations |
| US11058111B2 (en) | 2018-08-29 | 2021-07-13 | Ecolab Usa Inc. | Use of multiple charged cationic compounds derived from primary amines or polyamines for microbial fouling control in a water system |
| CA3110686A1 (en) * | 2018-08-29 | 2020-03-05 | Ecolab Usa Inc. | Multiple charged ionic compounds derived from polyamines and compositions thereof and methods of preparation thereof |
| EP3843871B1 (en) | 2018-08-29 | 2025-06-25 | Ecolab USA Inc. | Multiple charged ionic compounds derived from polyamines and compositions thereof and use thereof as reverse emulsion breakers in oil and gas operations |
| WO2020047181A1 (en) | 2018-08-29 | 2020-03-05 | Ecolab Usa Inc. | Use of multiple charged ionic compounds derived from polyamines for waste water clarification |
| CN113365498B (zh) | 2019-01-29 | 2022-10-25 | 埃科莱布美国股份有限公司 | 阳离子糖基化合物用于在水系统中进行微生物结垢控制的用途 |
| AU2019441168B2 (en) | 2019-04-16 | 2023-02-02 | Ecolab Usa Inc. | Use of multiple charged cationic compounds derived from polyamines and compositions thereof for corrosion inhibition in a water system |
| AU2020328474A1 (en) * | 2019-08-12 | 2022-03-03 | Integrated Nanotherapeutics Inc. | Lipids for delivery of charged material, formulations thereof and method for making same |
| CA3180101A1 (en) | 2020-05-29 | 2021-12-02 | Flagship Pioneering Innovations Vi, Llc | Trem compositions and methods relating thereto |
| US20230203509A1 (en) | 2020-05-29 | 2023-06-29 | Flagship Pioneering Innovations Vi, Llc | Trem compositions and methods relating thereto |
| BR112023005269A2 (pt) * | 2020-09-23 | 2023-04-25 | Translate Bio Inc | Lipídios catiônicos à base de tes |
| AU2021409740A1 (en) | 2020-12-23 | 2023-07-06 | Flagship Pioneering Innovations Vi, Llc | Compositions of modified trems and uses thereof |
| WO2022204219A1 (en) | 2021-03-22 | 2022-09-29 | Recode Therapeutics, Inc. | Compositions and methods for targeted delivery to cells |
| MX2023011243A (es) | 2021-03-23 | 2023-12-14 | Recode Therapeutics Inc | Composiciones de polinucleotidos, formulaciones relacionadas y metodos de uso de los mismos. |
| US12104181B2 (en) | 2021-03-31 | 2024-10-01 | The Board Of Regents Of The University Of Texas System | Compositions and methods for treating viral infections targeting TRIM7 |
| CN117881789A (zh) * | 2021-06-09 | 2024-04-12 | 瑞科德治疗公司 | 多核苷酸组合物、相关制剂、及其使用方法 |
| EP4377457A1 (en) | 2021-07-26 | 2024-06-05 | Flagship Pioneering Innovations VI, LLC | Trem compositions and uses thereof |
| CN113461577B (zh) * | 2021-09-01 | 2021-12-14 | 中山大学附属第七医院(深圳) | 一种氨基脂质及其应用 |
| CN113816991B (zh) * | 2021-10-17 | 2023-12-15 | 拓新药业集团股份有限公司 | 一种氯化磷酸胆碱钙的制备方法 |
| AU2023269030A1 (en) | 2022-05-09 | 2024-11-14 | Flagship Pioneering Innovations Vi, Llc | Trem compositions and methods of use for treating proliferative disorders |
| JP2025518282A (ja) * | 2022-06-03 | 2025-06-12 | バイオ-トリップ ベーフェー | 核酸送達のための多価分子に基づく脂質ナノ粒子 |
| EP4544043A1 (en) | 2022-06-22 | 2025-04-30 | Flagship Pioneering Innovations VI, LLC | Compositions of modified trems and uses thereof |
| EP4569112A1 (en) | 2022-08-12 | 2025-06-18 | Remix Therapeutics Inc. | Methods and compositions for modulating splicing at alternative splice sites |
| KR20240102846A (ko) | 2022-12-23 | 2024-07-03 | 주식회사 녹십자 | 이온화 지질 및 이의 용도 |
| WO2024216128A1 (en) | 2023-04-12 | 2024-10-17 | Flagship Pioneering Innovations Vi, Llc | Trems for use in correction of missense mutations |
| WO2024216191A1 (en) | 2023-04-12 | 2024-10-17 | Flagship Pioneering Innovations Vi, Llc | Modified trems, compositions, and related methods thereof |
| WO2024216243A2 (en) * | 2023-04-14 | 2024-10-17 | The Johns Hopkins University | Peptide-based vaccines and methods for treatment |
| WO2025059107A1 (en) * | 2023-09-11 | 2025-03-20 | The Trustees Of The University Of Pennsylvania | Degradable, branched lipid compounds, methods of preparation thereof, lipid nanoparticles (lnps) comprising the same, and methods of use thereof |
| WO2025089791A1 (en) | 2023-10-24 | 2025-05-01 | Green Cross Corporation | Ionizable lipids and uses thereof |
| WO2025089790A1 (ko) | 2023-10-24 | 2025-05-01 | 주식회사 녹십자 | 이온화 지질 및 이의 용도 |
| CN117482066B (zh) * | 2023-11-02 | 2024-08-13 | 深圳市易瑞生物技术股份有限公司 | 脂质组合物和用于脂质组合物的化合物 |
| WO2025097659A1 (en) * | 2023-11-08 | 2025-05-15 | Longuide Biopharma Corporation | Lipids and lipid nanoparticle formulations |
| CN118930449A (zh) * | 2024-07-18 | 2024-11-12 | 深圳厚存纳米药业有限公司 | 一种脂质化合物、脂质纳米粒及其制备方法和应用 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1444472A (zh) * | 2000-06-09 | 2003-09-24 | 泰尼·布利卡斯 | 质粒dna(lipogenestm)和含细胞核定位信号/促融合肽缀合物的治疗剂包封到定向脂质体复合体中 |
| EP1547582A1 (en) * | 2003-12-23 | 2005-06-29 | MediGene Oncology GmbH | Method of producing lipid complexed camptothecin-carboxylate |
| CN101674853A (zh) * | 2007-05-04 | 2010-03-17 | Mdrna有限公司 | 氨基酸脂质及其用途 |
| CN102245590A (zh) * | 2008-10-09 | 2011-11-16 | 泰米拉制药公司 | 改善的氨基脂质和递送核酸的方法 |
| CN103153347A (zh) * | 2010-10-21 | 2013-06-12 | 默沙东公司 | 用于寡核苷酸递送的新型低分子量阳离子脂质 |
Family Cites Families (118)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3687808A (en) | 1969-08-14 | 1972-08-29 | Univ Leland Stanford Junior | Synthetic polynucleotides |
| JPS5927900A (ja) | 1982-08-09 | 1984-02-14 | Wakunaga Seiyaku Kk | 固定化オリゴヌクレオチド |
| FR2540122B1 (fr) | 1983-01-27 | 1985-11-29 | Centre Nat Rech Scient | Nouveaux composes comportant une sequence d'oligonucleotide liee a un agent d'intercalation, leur procede de synthese et leur application |
| US4605735A (en) | 1983-02-14 | 1986-08-12 | Wakunaga Seiyaku Kabushiki Kaisha | Oligonucleotide derivatives |
| US4948882A (en) | 1983-02-22 | 1990-08-14 | Syngene, Inc. | Single-stranded labelled oligonucleotides, reactive monomers and methods of synthesis |
| US4824941A (en) | 1983-03-10 | 1989-04-25 | Julian Gordon | Specific antibody to the native form of 2'5'-oligonucleotides, the method of preparation and the use as reagents in immunoassays or for binding 2'5'-oligonucleotides in biological systems |
| US4587044A (en) | 1983-09-01 | 1986-05-06 | The Johns Hopkins University | Linkage of proteins to nucleic acids |
| US5118802A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | DNA-reporter conjugates linked via the 2' or 5'-primary amino group of the 5'-terminal nucleoside |
| US5367066A (en) | 1984-10-16 | 1994-11-22 | Chiron Corporation | Oligonucleotides with selectably cleavable and/or abasic sites |
| US5430136A (en) | 1984-10-16 | 1995-07-04 | Chiron Corporation | Oligonucleotides having selectably cleavable and/or abasic sites |
| US5258506A (en) | 1984-10-16 | 1993-11-02 | Chiron Corporation | Photolabile reagents for incorporation into oligonucleotide chains |
| US4828979A (en) | 1984-11-08 | 1989-05-09 | Life Technologies, Inc. | Nucleotide analogs for nucleic acid labeling and detection |
| FR2575751B1 (fr) | 1985-01-08 | 1987-04-03 | Pasteur Institut | Nouveaux nucleosides de derives de l'adenosine, leur preparation et leurs applications biologiques |
| US4762779A (en) | 1985-06-13 | 1988-08-09 | Amgen Inc. | Compositions and methods for functionalizing nucleic acids |
| US5317098A (en) | 1986-03-17 | 1994-05-31 | Hiroaki Shizuya | Non-radioisotope tagging of fragments |
| JPS638396A (ja) | 1986-06-30 | 1988-01-14 | Wakunaga Pharmaceut Co Ltd | ポリ標識化オリゴヌクレオチド誘導体 |
| US4904582A (en) | 1987-06-11 | 1990-02-27 | Synthetic Genetics | Novel amphiphilic nucleic acid conjugates |
| JP2828642B2 (ja) | 1987-06-24 | 1998-11-25 | ハワード フローレイ インスティテュト オブ イクスペリメンタル フィジオロジー アンド メディシン | ヌクレオシド誘導体 |
| US5585481A (en) | 1987-09-21 | 1996-12-17 | Gen-Probe Incorporated | Linking reagents for nucleotide probes |
| US5525465A (en) | 1987-10-28 | 1996-06-11 | Howard Florey Institute Of Experimental Physiology And Medicine | Oligonucleotide-polyamide conjugates and methods of production and applications of the same |
| DE3738460A1 (de) | 1987-11-12 | 1989-05-24 | Max Planck Gesellschaft | Modifizierte oligonukleotide |
| US5082830A (en) | 1988-02-26 | 1992-01-21 | Enzo Biochem, Inc. | End labeled nucleotide probe |
| US5109124A (en) | 1988-06-01 | 1992-04-28 | Biogen, Inc. | Nucleic acid probe linked to a label having a terminal cysteine |
| US5175273A (en) | 1988-07-01 | 1992-12-29 | Genentech, Inc. | Nucleic acid intercalating agents |
| US5262536A (en) | 1988-09-15 | 1993-11-16 | E. I. Du Pont De Nemours And Company | Reagents for the preparation of 5'-tagged oligonucleotides |
| US5512439A (en) | 1988-11-21 | 1996-04-30 | Dynal As | Oligonucleotide-linked magnetic particles and uses thereof |
| US5457183A (en) | 1989-03-06 | 1995-10-10 | Board Of Regents, The University Of Texas System | Hydroxylated texaphyrins |
| US5599923A (en) | 1989-03-06 | 1997-02-04 | Board Of Regents, University Of Tx | Texaphyrin metal complexes having improved functionalization |
| US5391723A (en) | 1989-05-31 | 1995-02-21 | Neorx Corporation | Oligonucleotide conjugates |
| US4958013A (en) | 1989-06-06 | 1990-09-18 | Northwestern University | Cholesteryl modified oligonucleotides |
| US5451463A (en) | 1989-08-28 | 1995-09-19 | Clontech Laboratories, Inc. | Non-nucleoside 1,3-diol reagents for labeling synthetic oligonucleotides |
| US5134066A (en) | 1989-08-29 | 1992-07-28 | Monsanto Company | Improved probes using nucleosides containing 3-dezauracil analogs |
| US5254469A (en) | 1989-09-12 | 1993-10-19 | Eastman Kodak Company | Oligonucleotide-enzyme conjugate that can be used as a probe in hybridization assays and polymerase chain reaction procedures |
| US5292873A (en) | 1989-11-29 | 1994-03-08 | The Research Foundation Of State University Of New York | Nucleic acids labeled with naphthoquinone probe |
| US5130302A (en) | 1989-12-20 | 1992-07-14 | Boron Bilogicals, Inc. | Boronated nucleoside, nucleotide and oligonucleotide compounds, compositions and methods for using same |
| US5486603A (en) | 1990-01-08 | 1996-01-23 | Gilead Sciences, Inc. | Oligonucleotide having enhanced binding affinity |
| US5459255A (en) | 1990-01-11 | 1995-10-17 | Isis Pharmaceuticals, Inc. | N-2 substituted purines |
| US5681941A (en) | 1990-01-11 | 1997-10-28 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US5587470A (en) | 1990-01-11 | 1996-12-24 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US5578718A (en) | 1990-01-11 | 1996-11-26 | Isis Pharmaceuticals, Inc. | Thiol-derivatized nucleosides |
| US5214136A (en) | 1990-02-20 | 1993-05-25 | Gilead Sciences, Inc. | Anthraquinone-derivatives oligonucleotides |
| AU7579991A (en) | 1990-02-20 | 1991-09-18 | Gilead Sciences, Inc. | Pseudonucleosides and pseudonucleotides and their polymers |
| ATE167523T1 (de) | 1990-05-11 | 1998-07-15 | Microprobe Corp | Teststreifen zum eintauchen für nukleinsäure- hybridisierungsassays und verfahren zur kovalenten immobilisierung von oligonucleotiden |
| US5608046A (en) | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5688941A (en) | 1990-07-27 | 1997-11-18 | Isis Pharmaceuticals, Inc. | Methods of making conjugated 4' desmethyl nucleoside analog compounds |
| US5614617A (en) | 1990-07-27 | 1997-03-25 | Isis Pharmaceuticals, Inc. | Nuclease resistant, pyrimidine modified oligonucleotides that detect and modulate gene expression |
| US5218105A (en) | 1990-07-27 | 1993-06-08 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5138045A (en) | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5245022A (en) | 1990-08-03 | 1993-09-14 | Sterling Drug, Inc. | Exonuclease resistant terminally substituted oligonucleotides |
| US5512667A (en) | 1990-08-28 | 1996-04-30 | Reed; Michael W. | Trifunctional intermediates for preparing 3'-tailed oligonucleotides |
| US5432272A (en) | 1990-10-09 | 1995-07-11 | Benner; Steven A. | Method for incorporating into a DNA or RNA oligonucleotide using nucleotides bearing heterocyclic bases |
| JP3172178B2 (ja) | 1990-11-08 | 2001-06-04 | ハイブライドン インコーポレイテッド | 合成オリゴヌクレオチドに対する多重リポータ基の組込み |
| US5371241A (en) | 1991-07-19 | 1994-12-06 | Pharmacia P-L Biochemicals Inc. | Fluorescein labelled phosphoramidites |
| US5594121A (en) | 1991-11-07 | 1997-01-14 | Gilead Sciences, Inc. | Enhanced triple-helix and double-helix formation with oligomers containing modified purines |
| AU3222793A (en) | 1991-11-26 | 1993-06-28 | Gilead Sciences, Inc. | Enhanced triple-helix and double-helix formation with oligomers containing modified pyrimidines |
| US5484908A (en) | 1991-11-26 | 1996-01-16 | Gilead Sciences, Inc. | Oligonucleotides containing 5-propynyl pyrimidines |
| TW393513B (en) | 1991-11-26 | 2000-06-11 | Isis Pharmaceuticals Inc | Enhanced triple-helix and double-helix formation with oligomers containing modified pyrimidines |
| US5595726A (en) | 1992-01-21 | 1997-01-21 | Pharmacyclics, Inc. | Chromophore probe for detection of nucleic acid |
| US5565552A (en) | 1992-01-21 | 1996-10-15 | Pharmacyclics, Inc. | Method of expanded porphyrin-oligonucleotide conjugate synthesis |
| US6806084B1 (en) | 1992-06-04 | 2004-10-19 | The Regents Of The University Of California | Methods for compositions for in vivo gene delivery |
| US5272250A (en) | 1992-07-10 | 1993-12-21 | Spielvogel Bernard F | Boronated phosphoramidate compounds |
| WO1994014226A1 (en) | 1992-12-14 | 1994-06-23 | Honeywell Inc. | Motor system with individually controlled redundant windings |
| US5574142A (en) | 1992-12-15 | 1996-11-12 | Microprobe Corporation | Peptide linkers for improved oligonucleotide delivery |
| US5502177A (en) | 1993-09-17 | 1996-03-26 | Gilead Sciences, Inc. | Pyrimidine derivatives for labeled binding partners |
| US5457187A (en) | 1993-12-08 | 1995-10-10 | Board Of Regents University Of Nebraska | Oligonucleotides containing 5-fluorouracil |
| US5596091A (en) | 1994-03-18 | 1997-01-21 | The Regents Of The University Of California | Antisense oligonucleotides comprising 5-aminoalkyl pyrimidine nucleotides |
| US5525711A (en) | 1994-05-18 | 1996-06-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Pteridine nucleotide analogs as fluorescent DNA probes |
| US5597696A (en) | 1994-07-18 | 1997-01-28 | Becton Dickinson And Company | Covalent cyanine dye oligonucleotide conjugates |
| US5580731A (en) | 1994-08-25 | 1996-12-03 | Chiron Corporation | N-4 modified pyrimidine deoxynucleotides and oligonucleotide probes synthesized therewith |
| US5820873A (en) | 1994-09-30 | 1998-10-13 | The University Of British Columbia | Polyethylene glycol modified ceramide lipids and liposome uses thereof |
| US20050032068A1 (en) | 2002-11-05 | 2005-02-10 | Prakash Thazha P. | Sugar and backbone-surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| US6770748B2 (en) | 1997-03-07 | 2004-08-03 | Takeshi Imanishi | Bicyclonucleoside and oligonucleotide analogue |
| JP3756313B2 (ja) | 1997-03-07 | 2006-03-15 | 武 今西 | 新規ビシクロヌクレオシド及びオリゴヌクレオチド類縁体 |
| AU733310C (en) * | 1997-05-14 | 2001-11-29 | University Of British Columbia, The | High efficiency encapsulation of charged therapeutic agents in lipid vesicles |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| US6506559B1 (en) | 1997-12-23 | 2003-01-14 | Carnegie Institute Of Washington | Genetic inhibition by double-stranded RNA |
| AU743316C (en) | 1998-03-20 | 2005-09-15 | Commonwealth Scientific And Industrial Research Organisation | Control of gene expression |
| AUPP249298A0 (en) | 1998-03-20 | 1998-04-23 | Ag-Gene Australia Limited | Synthetic genes and genetic constructs comprising same I |
| EP1071753A2 (en) | 1998-04-20 | 2001-01-31 | Ribozyme Pharmaceuticals, Inc. | Nucleic acid molecules with novel chemical compositions capable of modulating gene expression |
| AU1830200A (en) * | 1998-11-25 | 2000-06-13 | Vanderbilt University | Cationic liposomes for gene transfer |
| KR100782896B1 (ko) | 1999-05-04 | 2007-12-06 | 엑시콘 에이/에스 | L-리보-lna 유사체 |
| US6525191B1 (en) | 1999-05-11 | 2003-02-25 | Kanda S. Ramasamy | Conformationally constrained L-nucleosides |
| WO2001006011A2 (en) | 1999-07-14 | 2001-01-25 | Genometrix Genomics, Inc. | Arrays comprising non-covalently associated nucleic acid probes and methods for making and using them |
| EP1235842A4 (en) | 1999-10-15 | 2003-04-23 | Univ Massachusetts | Rna interference pathway genes as tools for targeted genetic interference |
| US20040019001A1 (en) | 2002-02-20 | 2004-01-29 | Mcswiggen James A. | RNA interference mediated inhibition of protein typrosine phosphatase-1B (PTP-1B) gene expression using short interfering RNA |
| EP1562971B1 (en) | 2002-11-05 | 2014-02-12 | Isis Pharmaceuticals, Inc. | Polycyclic sugar surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| EP2957568B1 (en) | 2002-11-05 | 2016-12-21 | Ionis Pharmaceuticals, Inc. | Compositions comprising alternating 2'-modified nucleosides for use in gene modulation |
| WO2004106356A1 (en) | 2003-05-27 | 2004-12-09 | Syddansk Universitet | Functionalized nucleotide derivatives |
| EP1661905B9 (en) | 2003-08-28 | 2012-12-19 | IMANISHI, Takeshi | Novel artificial nucleic acids of n-o bond crosslinkage type |
| JP5379347B2 (ja) | 2003-09-18 | 2013-12-25 | アイシス ファーマシューティカルズ, インコーポレーテッド | 4’−チオヌクレオシドおよびオリゴマー化合物 |
| RU2469727C2 (ru) * | 2005-12-19 | 2012-12-20 | Этерна Центарис ГмбХ | Способ лечения или профилактики заболеваний и/или патофизиологических состояний, вызванных микроорганизмами, посредством производных алкилфосфолипидов |
| US20090175930A1 (en) | 2006-01-11 | 2009-07-09 | Nobuhiro Yagi | Composition Suppressing The Expression of Target Gene in Eyeball and Medicament For Treating of Disease in Eyeball |
| PL2314594T3 (pl) | 2006-01-27 | 2014-12-31 | Isis Pharmaceuticals Inc | Zmodyfikowane w pozycji 6 analogi bicykliczne kwasów nukleinowych |
| WO2007122410A1 (en) * | 2006-04-26 | 2007-11-01 | F.Hoffmann-La Roche Ag | Pyrimidine derivatives as pi3k inhibitors |
| WO2007134181A2 (en) | 2006-05-11 | 2007-11-22 | Isis Pharmaceuticals, Inc. | 5'-modified bicyclic nucleic acid analogs |
| US7411002B2 (en) * | 2006-06-07 | 2008-08-12 | The University Of Kansas | Polycationic sulfonamides and use thereof |
| EP2046266A4 (en) | 2006-07-21 | 2009-11-04 | Massachusetts Inst Technology | ENDMODICIFIED POLY (BETA AMINO ESTER) AND ITS USE |
| EP2125852B1 (en) | 2007-02-15 | 2016-04-06 | Ionis Pharmaceuticals, Inc. | 5'-substituted-2'-f modified nucleosides and oligomeric compounds prepared therefrom |
| CA2688321A1 (en) | 2007-05-30 | 2008-12-11 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| ES2386492T3 (es) | 2007-06-08 | 2012-08-21 | Isis Pharmaceuticals, Inc. | Análogos de ácidos nucleicos bicíclicos carbocíclicos |
| ATE538127T1 (de) | 2007-07-05 | 2012-01-15 | Isis Pharmaceuticals Inc | 6-disubstituierte bicyclische nukleinsäureanaloga |
| KR20090082155A (ko) * | 2008-01-24 | 2009-07-29 | 한국생명공학연구원 | 신규한 디아민 화합물 또는 이의 약학적으로 허용가능한 염, 이의 제조방법 및 이를 포함하는 암 치료용 약학 조성물 |
| EP2274425A2 (en) | 2008-04-11 | 2011-01-19 | Alnylam Pharmaceuticals Inc. | Site-specific delivery of nucleic acids by combining targeting ligands with endosomolytic components |
| ES2540767T3 (es) | 2008-11-06 | 2015-07-13 | University Of Washington | Copolímeros multibloque |
| MX353900B (es) | 2008-11-07 | 2018-02-01 | Massachusetts Inst Technology | Lipidoides de aminoalcohol y usos de los mismos. |
| WO2010071772A2 (en) * | 2008-12-15 | 2010-06-24 | The Penn State Research Foundation | Synthesis of 3b-amino-5-cholestene and related 3b-halides involving i-steroid and retro-i-steroid rearrangements |
| BRPI1010175A2 (pt) | 2009-06-02 | 2016-03-29 | Keller Brian Charles | "composição química que inclui um conjugado de lipídio-peg e lipossoma" |
| WO2011056682A1 (en) | 2009-10-27 | 2011-05-12 | The University Of British Columbia | Reverse head group lipids, lipid particle compositions comprising reverse headgroup lipids, and methods for the delivery of nucleic acids |
| FR2958646B1 (fr) * | 2010-04-07 | 2012-05-18 | Adocia | Polysaccharides comportant des groupes fonctionnels carboxyles substitues par un derive d'acide hydrophobe. |
| WO2012049307A2 (en) * | 2010-10-15 | 2012-04-19 | Novo Nordisk A/S | Novel n-terminally modified insulin derivatives |
| TWI658830B (zh) | 2011-06-08 | 2019-05-11 | 日東電工股份有限公司 | Hsp47表現調控強化用類視色素脂質體 |
| EP2998289B1 (en) | 2011-06-08 | 2019-08-07 | Nitto Denko Corporation | Compounds for targeting drug delivery and enhancing sirna activity |
| WO2013032643A2 (en) * | 2011-08-31 | 2013-03-07 | Dicerna Pharmaceuticals, Inc. | Lipids capable of conformational change and their use in formulations to deliver therapeutic agents to cells |
| CN102698648A (zh) | 2012-06-27 | 2012-10-03 | 东北石油大学 | 一种树枝状磺酸盐型四聚表面活性剂及其制备方法 |
| AU2014276460A1 (en) | 2013-06-04 | 2015-12-24 | Vyome Biosciences Pvt. Ltd. | Coated particles and compositions comprising same |
| US10465030B2 (en) * | 2013-12-04 | 2019-11-05 | Nexdot | Nanoparticles complexed with functionalizable enhanced affinity ligands and use thereof |
| PL3097076T3 (pl) * | 2014-01-22 | 2019-10-31 | Max Delbrueck Centrum Fuer Molekulare Medizin | Nowe pochodne CYP-eikozanoidowe |
| US10562849B2 (en) * | 2016-05-16 | 2020-02-18 | The Board Of Regents Of The University Of Texas System | Cationic sulfonamide amino lipids and amphiphilic zwitterionic amino lipids |
-
2017
- 2017-05-16 US US15/597,049 patent/US10562849B2/en active Active
- 2017-05-16 CN CN202210228264.7A patent/CN114656378A/zh active Pending
- 2017-05-16 CN CN201780041000.8A patent/CN109414408B/zh active Active
- 2017-05-16 AU AU2017267634A patent/AU2017267634C1/en active Active
- 2017-05-16 EP EP17800030.3A patent/EP3458032A4/en active Pending
- 2017-05-16 CA CA3024129A patent/CA3024129A1/en active Pending
- 2017-05-16 JP JP2018560135A patent/JP7080826B2/ja active Active
- 2017-05-16 WO PCT/US2017/032950 patent/WO2017201076A1/en unknown
-
2020
- 2020-01-15 US US16/744,118 patent/US11542229B2/en active Active
-
2021
- 2021-08-11 US US17/399,774 patent/US11685710B2/en active Active
-
2022
- 2022-03-29 AU AU2022202140A patent/AU2022202140B2/en active Active
- 2022-05-25 JP JP2022084888A patent/JP7480220B2/ja active Active
-
2023
- 2023-05-10 US US18/315,446 patent/US12252464B2/en active Active
- 2023-11-06 AU AU2023263423A patent/AU2023263423A1/en active Pending
-
2024
- 2024-04-24 JP JP2024070491A patent/JP2024091896A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1444472A (zh) * | 2000-06-09 | 2003-09-24 | 泰尼·布利卡斯 | 质粒dna(lipogenestm)和含细胞核定位信号/促融合肽缀合物的治疗剂包封到定向脂质体复合体中 |
| EP1547582A1 (en) * | 2003-12-23 | 2005-06-29 | MediGene Oncology GmbH | Method of producing lipid complexed camptothecin-carboxylate |
| CN101674853A (zh) * | 2007-05-04 | 2010-03-17 | Mdrna有限公司 | 氨基酸脂质及其用途 |
| CN102245590A (zh) * | 2008-10-09 | 2011-11-16 | 泰米拉制药公司 | 改善的氨基脂质和递送核酸的方法 |
| CN103153347A (zh) * | 2010-10-21 | 2013-06-12 | 默沙东公司 | 用于寡核苷酸递送的新型低分子量阳离子脂质 |
Non-Patent Citations (4)
| Title |
|---|
| "Acylsulfonamide-Functionalized Zwitterionic Gold Nanoparticles for Enhanced Cellular Uptake at Tumor pH";Tsukasa Mizuhara等;《Angew Chem Int Ed Engl》;20151231;第54卷(第22期);第6567–6570页 * |
| "Rational design of cationic lipids for siRNA delivery";Sean C Semple等;《NATURE BIOTECHNOLOGY》;20101231;第28卷(第2期);第172-178页 * |
| "The systematic design and biophysical evaluation of cationic sulfonamide aminolipids for siRNA delivery";Jason B. Miller1等;《Front. Bioeng. Biotechnol》;20160330;第1-2页 * |
| "聚乙二醇修饰的阳离子脂质体作为siRNA传递系统的处方优化";李颖寰等;《中国药科大学学报》;20111231;第42卷(第5期);第412-417页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2023263423A1 (en) | 2023-11-30 |
| BR112018073699A2 (pt) | 2019-05-07 |
| US10562849B2 (en) | 2020-02-18 |
| JP7480220B2 (ja) | 2024-05-09 |
| US20170349543A1 (en) | 2017-12-07 |
| WO2017201076A1 (en) | 2017-11-23 |
| US11542229B2 (en) | 2023-01-03 |
| JP2022126654A (ja) | 2022-08-30 |
| US20200140378A1 (en) | 2020-05-07 |
| US11685710B2 (en) | 2023-06-27 |
| US12252464B2 (en) | 2025-03-18 |
| JP7080826B2 (ja) | 2022-06-06 |
| CN114656378A (zh) | 2022-06-24 |
| EP3458032A1 (en) | 2019-03-27 |
| CA3024129A1 (en) | 2017-11-23 |
| AU2017267634B2 (en) | 2022-01-27 |
| JP2024091896A (ja) | 2024-07-05 |
| AU2022202140B2 (en) | 2023-08-17 |
| US20240174604A1 (en) | 2024-05-30 |
| CN109414408A (zh) | 2019-03-01 |
| AU2017267634A1 (en) | 2018-11-29 |
| JP2019519503A (ja) | 2019-07-11 |
| AU2022202140A1 (en) | 2022-04-21 |
| EP3458032A4 (en) | 2019-12-25 |
| AU2017267634C1 (en) | 2022-05-26 |
| US20210395192A1 (en) | 2021-12-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN109414408B (zh) | 阳离子磺酰胺氨基脂质和两亲性两性离子氨基脂质 | |
| JP7496808B2 (ja) | リポカチオン性デンドリマーおよびその使用 | |
| AU2021203935B2 (en) | Lipocationic polymers and uses thereof | |
| CN114585370A (zh) | 寡核苷酸组合物及其使用方法 | |
| HK40005337A (zh) | 陽離子磺酰胺氨基脂質和兩親性兩性離子氨基脂質 | |
| HK40005337B (zh) | 陽離子磺酰胺氨基脂質和兩親性兩性離子氨基脂質 | |
| BR112018073699B1 (pt) | Compostos de amino lipídios zwiteriônico anfifílicos, composição compreendendo os mesmos e uso terapêutico dos mesmos | |
| HK40085587A (zh) | 親脂陽離子聚合物及其用途 | |
| HK1257358B (zh) | 親脂陽離子樹枝狀聚合物及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 40005337 Country of ref document: HK |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |