Actina
| Actina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Modelo de fitas da actina G.PDB 1j6z. Represéntanse no centro activo o ADP e o catión divalente, e un ión calcio en complexo (esfera verde).[1] | |||||||||
| Identificadores | |||||||||
| Símbolo | Actin | ||||||||
| Pfam | PF00022 | ||||||||
| InterPro | IPR004000 | ||||||||
| PROSITE | PDOC00340 | ||||||||
| SCOPe | 2btf / SUPFAM | ||||||||
| |||||||||
As actinas[2] son unha familia de proteínas globulares que forman os microfilamentos, un dos tres compoñentes fundamentais do citoesqueleto das células dos organismos eucariotas. A actina pode encontrarse como monómero en forma libre, denominado actina G, ou formando parte de polímeros lineares denominados microfilamentos ou actina F, que son esenciais para funcións celulares tan importantes coma a mobilidade e a contracción da célula durante a división celular. En vertebrados, identificáronse tres grandes grupos de isoformas da actina, chamadas alfa, beta, e gamma. As alfa encóntranse nos tecidos musculares, e son un dos constituíntes principais do aparato contráctil do músculo. As beta e as gamma coexisten na maior parte dos tipos celulares como compoñentes do citoesqueleto, e como mediadores da mobilidade celular interna.
A importancia da actina reflíctese na elevada porcentaxe que esta proteína supón no contido proteico total da célula e en que a súa secuencia está moi conservada, é dicir, que cambiou moi pouco ao longo da evolución, polo que se pode dicir que a súa estrutura foi optimizada. Presenta dúas características peculiares: é un encima que hidroliza ATP, a molécula enerxética biolóxica, e faino de maneira moi lenta, e ademais é a proteína que establece máis interaccións con outras proteínas de todas as coñecidas, o que lle permite realizar as máis variadas funcións, que afectan a case todos os aspectos da vida celular. A miosina é un exemplo de proteína que se une á actina. Outro exemplo é a vilina, que pode entrelazar a actina en feixes ou ben cortar os filamentos de actina, dependendo da concentración do catión calcio no medio.[3]
A actina, ao formar microfilamentos nun proceso dinámico proporciona unha andamiaxe que lle dá á célula a posibilidade de remodelar a súa forma rapidamente en resposta á súa contorna ou a sinais enviados polo organismo, por exemplo, aumentando a superficie celular para a absorción ou dando soporte á adhesión das células para formar tecidos. Sobre esta andamiaxe poden ancorarse outros encimas, orgánulos como os cilios, e dirixirse a deformación da membrana plasmática para permitir a endocitose ou a citocinese. Tamén pode producir movemento, por ela mesma ou axudada por motores moleculares. Dese xeito contribúe a procesos como o transporte intracelular de vesículas e orgánulos e á contracción muscular, ou a migración celular, importante no desenvolvemento embrionario, curación de feridas ou na invasividade do cancro. A orixe evolutiva desta proteína pode rastrearse nas células procariotas, nas cales existen equivalentes. Por último, é importante no control da expresión xénica.
Hai moitas doenzas que teñen a súa base en alteracións xenéticas en alelos dos xenes encargados da produción de actina ou das súas proteínas asociadas, e é tamén esencial no proceso de infección dalgúns microorganismos patóxenos. As mutacións nos distintos xenes de actina presentes en humanos ocasionan miopatías, variacións no tamaño e a función cardíaca e xordeira. Os compoñentes do citoesqueleto tamén teñen relación coa patoxenicidade de bacterias intracelulares e virus, especialmente en procesos relacionados coa evasión da resposta do sistema inmune.[4]
Estrutura
[editar | editar a fonte]A actina é unha das proteínas máis abundantes nos eucariotas e está presente por todo o citoplasma.[3] Nas fibras musculares representa o 20% en peso da proteína celular total e, noutras células animais, oscila entre o 1 e o 5%. Porén, non existe un único tipo de actina, senón que os seus xenes codificantes forman unha familia multixénica (familia que, en plantas, comprende máis de 60 elementos, entre xenes e pseudoxenes e, en humanos, máis de 30).[5] Isto significa que a información xenética de cada individuo posúe instrucións para xerar variantes da actina (denominadas isoformas) que posuirán funcións lixeiramente distintas. Deste modo, os organismos eucariotas expresan distintos xenes que dan lugar a: a actina α, que se encontra en estruturas contráctiles; a actina β, no bordo en expansión das células que empregan a proxección de estruturas celulares como método de mobilidade; e a actina γ, nos filamentos das fibras de estrés.[6] Ademais das similitudes existentes entre as isoformas dun organismo, tamén existe unha conservación evolutiva en canto á estrutura e función entre organismos do dominio eucariota, e mesmo en bacterias, na que se coñece o homólogo MreB, unha proteína que pode polimerizarse en microfilamentos,[7] e en arqueas, nas que existe un representante (Ta0583) aínda máis semellante ás actinas de eucariotas.[8]
A actina preséntase na célula en dúas formas: como monómeros globulares denominados actina G e como polímeros filamentosos denominados actina F (que son filamentos compostos de moitos de monómeros de actina G). A actina F pode denominarse tamén microfilamento. A cada febra de actina únese unha molécula de adenosín trifosfato (ATP) ou de adenosín difosfato (ADP), que á súa vez está asociada a un catión Mg2+. Das distintas combinacións posibles entre as formas de actina e o nucleótido trifosfato, na célula predominan a actina G-ATP e a actina F-ADP.[9][10]
Actina G
[editar | editar a fonte]En canto á súa estrutura molecular, a actina G posúe unha aparencia globular vista co microscopio electrónico de varrido; non obstante, por cristalografía de raios X pode apreciarse que está composta por dous lóbulos separados por unha fenda; a estrutura conforma o pregamento ATPase, un centro de catálise encimática ao que pode unirse o ATP e Mg2+ e pode hidrolizar o ATP a ADP e fosfato. Este pregamento é un motivo estrutural conservado que tamén está presente noutras proteínas que interaccionan con nucleósidos trifosfato como a hexoquinase (un encima do metabolismo enerxético) ou as proteínas Hsp70 (unha familia de proteínas que contribúen a que outras proteínas posúan estruturas funcionais).[11] A actina G só é funcional cando posúe ADP ou ATP na súa fenda; porén, na célula predomina o estado unido a ATP cando a actina está libre.[9]

A actina cristalizada por Kabsch, que é a máis utilizada como modelo en estudos estruturais, porque foi a primeira que se purificou, procede do músculo esquelético de coello. Ten unhas dimensións aproximadas de 67 x 40 x 37 Å, unha masa molecular de 41785 Da e un punto isoeléctrico estimado de 4,8. A súa carga neta a pH 7 é de -7.[13] [14]
- Estrutura primaria
A secuencia de aminoácidos completa deste tipo de actina determinárona Elzinga e colaboradores en 1973, e afinouse en traballos posteriores do mesmo autor. Contén 374 residuos de aminoácidos. O seu extremo N-terminal é moi ácido. Comeza cun aspartato acetilado no seu grupo amino, mentres que o seu C-terminal é básico, formado por unha fenilalanina precedida por unha cisteína de certa importancia funcional. Ambos os extremos sitúanse nunha posición moi próxima dentro do subdominio I. Presenta tamén algúns aminoácidos anómalos, como unha Nτ-metilhistidina en posición 73.[13]
- Estrutura terciaria-dominios
Está formada por dous dominios coñecidos como grande e pequeno, separados por unha fenda que leva no seu centro ao lugar para a unión do ATP-ADP+Pi. Por debaixo deste existe unha greta de menor profundidade chamada "suco". Cando están na súa forma nativa, malia os seus nomes, ambos os dous dominios teñen un tamaño similar.[15]
Nos estudos topolóxicos, por convención, a proteína oriéntase de maneira que o dominio maior queda á esquerda, mentres que o menor se sitúa á dereita. Nesta posición, o dominio pequeno divídese á súa vez no subdominio I (posición inferior, residuos 1-32, 70-144 e 338-374) e subdominio II (posición superior, residuos 33-69). O dominio maior tamén se divide noutros dous, o subdominio III (inferior, residuos 145-180 e 270-337) e o subdominio IV (superior, residuos 181-269). A zona exposta dos subdominios I e III denomínase extremo "barbado", mentres que á dos subdominios II e IV se lle chama extremo "en punta de frecha". Esta denominación fai referencia ao feito de que debido á pequena masa do subdominio 2, a actina adquire polaridade, que se discutirá posteriormente ao falar da dinámica de ensamblaxe. Algúns autores nomean os subdominios como Ia, Ib, IIa e IIb, respectivamente.[16]
- Outras estruturas salientables
- A estrutura supersecundaria máis salientable é unha lámina beta de cinco cadeas que se compoñen dun meandro β e unha unidade β-α β dextroxira. Está presente en ambos os dominios. Isto suxire que a proteína xurdiu por duplicación xénica.[17]
- O lugar de unión para o nucleótido de adenosina está entre dúas estruturas en forma de forquita β pertencentes aos dominios 1 e 3. Os residuos implicados son Asp11-Lys18 e Asp154-His161, respectivamente.
- Xusto debaixo do nucleótido encóntrase o lugar de unión para o catión divalente, que in vivo é con maior probabilidade o Mg2+ ou o Ca2+ mientres que in vitro é o formado por unha estrutura quelante na que contribúen a Lys18 e dous oxíxenos dos fosfatos α e β do nucleótido. Este calcio está coordinado con seis moléculas de auga que se encontran retidas polos aminoácidos Asp11, Asp154, e Gln137. Xunto co nucleótido forma un complexo que restrinxe os movementos dunha rexión chamada bisagra, situada entre os residuos 137 e 144, mantendo desta maneira a forma nativa da proteína, ata o punto de que a súa retirada desnaturaliza o monómero de actina. Esta rexión tamén é importante, porque determina as conformacións "aberta" ou "pechada" da fenda da proteína.[12][16]
- Case con seguridade existen tamén polo menos outros tres centros con menor afinidade (intermedia) e outros de baixa afinidade para catións divalentes. Especulouse sobre o papel destes centros na polimerización da actina na fase de activación.[16]
- No subdominio 2 existe unha estrutura, chamada bucle-D o D-loop debido a que se une á DNase I, situada entre os residuos His40 e Gly48 que aparece como un elemento desordenado na maioría dos cristais e como unha lámina β cando está formando complexo coa DNase I. Segundo Domínguez et al., o episodio clave da polimerización sería a propagación dun cambio conformacional desde o centro de unión para o nucleótido ata este dominio, que pasaría de ser dun bucle a unha hélice. Esta teoría parece ser refutada por outros traballos.[12][18]
Actina F
[editar | editar a fonte]
A descrición clásica da actina F indica que ten unha estrutura filamentosa interpretable como unha hélice levoxira monocatenaria cun xiro de 166º e incremento de 27,5 Å ou ben como unha hélice dextroxira bicatenaria con medio paso de rosca de 350-380 Å, e cada actina está rodeada doutras catro.[20] A simetría do polímero de actina, que é dunhas 2,17 subunidades por volta de hélice é incompatible coa formación de cristais, que só é posible cando estas son exactamente 2, 3, 4 ou 6 subunidades por volta. Por tanto, deben realizarse modelos interpretando datos procedentes de técnicas que salvan estes inconvenientes, como a microscopia electrónica, a criomicroscopia electrónica, cristais de dímeros en distintas posicións ou difracción de raios X.[7] En realidade, falar dunha "estrutura" non é correcto para algo tan dinámico como un filamento de actina, polo que sería mellor falar de distintos estados estruturais, entre os cales o dato máis constante é o incremento de 27,5 Å, mentres que a rotación das subunidades mostra unha considerable variabilidade, sendo normal observar desprazamentos de ata o 10% da súa posición ideal. Algunhas proteínas, como a cofilina, parecen incrementar o ángulo de xiro, pero, novamente, pódese interpretar que, en lugar diso, estabilizan algúns "estados estruturais" normais. Estes poderían ser importantes no proceso de polimerización.[21]
As medidas do raio de xiro ou grosor do filamento son máis controvertidas: mentres que os primeiros modelos lle asignaban unha lonxitude de 25 Å, datos actuais de difracción de raios X e de criomicroscopia electrónica coinciden nunha medida duns 23,7 Å. Estes mesmos estudos determinaron con bastante precisión os puntos de contacto entre monómeros. Uns establécense con unidades da mesma cadea, entre o extremo "barbado" dun monómero e o extremo "en punta de frecha" do seguinte, mentres que os monómeros de cadeas adxacentes fan contacto lateralmente por medio de proxeccións do subdominio 4, e as máis importantes son a formada polo C-terminal e un enlace hidrofóbico formado por tres corpos nos que interveñen os residuos 39-42, 201-203 e 286. Para formaren parte dun filamento, segundo este modelo, os monómeros estarían nunha configuración chamada "plana", na que os subdominios xiran entre si, e que tamén parece encontrarse no homólogo bacteriano da actina MreB.[7]
Dado que todas as subunidades dun microfilamento apuntan cara ao mesmo extremo, dise que o polímero presenta polaridade na súa estrutura. Este feito dá lugar a unha convención consistente en nomear o extremo que posúe unha subunidade de actina que expón o lugar polo que une ATP ao medio como «extremo (-)», mentres que o cabo oposto, no cal a fenda está dirixida a outro monómero adxacente, é o «extremo (+)».[6] A denominación «en punta de frecha» e «barbado» dos extremos dos microfilamentos débese ao seu aspecto vistos con microscopio electrónico de transmisión cando se procesan mediante unha técnica denominada «decoración». Este método consiste na adición de elementos S1 da miosina a tecidos fixados con ácido tánico; esta miosina únese de forma polar aos monómeros de actina, o que dá lugar a unha configuración semellante a frechas con plumas ao longo de todo o seu fuste, onde o fuste correspondería á actina e as plumas á miosina. Deste modo, o extremo do microfilamento que queda sen miosina sobresaíndo interprétase como a punta da frecha, e o extremo oposto denomínase barbado.[22]
No músculo, o filamento helicoidal da actina F contén tamén unha molécula de tropomiosina, unha proteína dunha lonxitude de 40 nanómetros que se enrola arredor da hélice de actina F. Durante o estado de repouso celular, a tropomiosina recobre os sitios activos da actina de modo que non pode producirse a interacción actina-miosina que orixina a contracción muscular. Unidas ao longo da febra de tropomiosina hai outras moléculas proteicas, as troponinas, complexos de tres polímeros: troponina I, troponina T e troponina C.[23]
Pregamento
[editar | editar a fonte]
A actina pode adquirir espontaneamente unha gran parte da súa estrutura terciaria.[25] Porén mostra un comportamento moi especial e case único na forma en que adquire a súa forma plenamente funcional a partir da súa forma nativa recentemente sintetizada. A razón da existencia dunha ruta tan especial podería ser a necesidade de evitar a presenza de monómeros de actina mal pregados, que serían tóxicos, porque poderían actuar de terminadores inadecuados da polimerización. En calquera caso, é clave para a estabilidade do citoesqueleto, e mesmo podería ser un proceso esencial para a coordinación do ciclo celular.[26][27]
Para asegurar o correcto pregamento emprega un tipo de chaperonina (proteína que axuda a outras a pregarse) citosólica do grupo II, chamada CCT, formada por un dobre anel de oito subunidades diferentes (heterooctamérica) que se distingue das demais chaperonas moleculares, e en especial da súa homóloga en arqueas GroEL, en que non precisa dunha co-chaperona que actúe de tapa sobre a cavidade central catalítica. Acepta substratos uníndose a eles por medio de dominios específicos, polo que en principio se pensou que era exclusiva da actina e tubulina, aínda que actualmente se comprobou por inmunoprecipitación que polo menos interacciona cun gran número de polipéptidos, que posiblemente funcionan como substratos. Actúa mediante cambios conformacionais dependentes de ATP, e en ocasións cómpren varias roldas de liberación e catálise para que complete o seu traballo.[28]
Para o seu correcto pregamento, a actina e a tubulina tamén necesitan especificamente da colaboración doutra proteína, a prefoldina, un complexo heterohexamérico (formado por seis subunidades distintas), que interaccionan tan especificamente que se cre que coevolucionaron. No caso da actina, esta proteína únese inmediatamente a ela mentres aínda se está a traducir, aproximadamente cando ten unha lonxitude de 145 aminoácidos, que son os correspondentes ao dominio N-terminal.[29]
Empréganse subunidades de recoñecemento diferentes para a actina e a tubulina, aínda que solapadas. Probablemente no caso da actina trátase das subunidades PFD3 e PFD4 que se unen á actina en dous lugares, o I, entre os residuos 60–79, e o II, entre os residuos 170–198. A actina recoñece, carga e entrega á CCT en conformación aberta pola parte interna do extremo dos "tentáculos" da prefoldina (ver imaxe e nota a rodapé).[30] O contacto cando se entrega a actina é tan breve que non se chega a formar un complexo ternario, liberándose a prefoldina inmediatamente.[24]

Posteriormente, a chaperonina citosólica (CCT) realiza o pregamento da actina de forma secuencial, e formando unións coas subunidades, no canto de simplemente encerrala na súa cavidade.[31] Para iso posúe zonas específicas de recoñecemento no seu dominio β apical. A primeira etapa do pregamento consistiría no recoñecemento dos residuos 245-249. Posteriormente, establecerían contacto outros determinantes.[32] Tanto a actina coma a tubulina únense á CCT en conformacións abertas en ausencia de ATP. No caso da actina, en cada cambio conformacional únese a dúas subunidades, a diferenza da tubulina, que o fai a catro. A actina ten secuencias de unión específicas, interaccionando coas subunidades CCTδ e β ou ben con CCTδ e CCTε. Trala unión de AMP-PNP á CCT, os substratos van movéndose pola cavidade da chaperonina. Parece ser tamén que no caso da actina cómpre a actuación da proteína CAP como un posible cofactor nos estadios finais do pregamento da actina.[27]
Aínda non se coñece con exactitude a regulación deste proceso, pero sábese que a proteína PhLP3 (proteína semellante á fosducina) regula a súa actividade inhibíndoa, por medio da formación dun complexo ternario.[28]
Mecanismo catalítico da ATPase
[editar | editar a fonte]A actina é unha ATPase, é dicir, un encima que hidroliza ATP. Este conxunto de encimas caracterízase por actuar con extrema lentitude. Esta ATPase "actívase", ou o que é o mesmo, a súa velocidade aumenta unhas 40.000 veces cando a actina forma parte dun filamento.[21] Un valor de referencia para esta taxa de hidrólise baixo certas condicións ideais sería 0,3 s-1. Posteriormente, o Pi permanecería moito tempo unido á actina xunto ao ADP, liberándose preto do extremo do filamento.[33]
Polo momento non se coñecen os detalles moleculares do mecanismo catalítico. Pero, aínda que existe moita polémica ao respecto, parece claro que para a hidrólise do ATP cómpre que a proteína teña unha conformación "pechada", e crese que achega á distancia axeitada os residuos implicados.[21] Un dos residuos clave sería o Glu137, situado no subdominio 1. A súa función sería ancorar a molécula de auga que realiza un ataque nucleofílico ao enlace do fosfato γ do ATP, mentres o nucleótido se une fortemente aos subdominios 3 e 4. A lentitude do proceso catalítico deberíase á gran distancia e posición nesgada desta molécula de auga con respecto ao seu reactante. Con moita probabilidade, o cambio conformacional que se produce por rotación de dominios entre as formas G e F da actina aproxima o Glu137, permitindo a súa hidrólise. Segundo este modelo, a polimerización e a función ATPase estarían desacopladas nun primeiro momento.[7]
Xenética
[editar | editar a fonte]A actina é unha das proteínas máis conservadas ao longo da evolución porque interacciona cun gran número de proteínas. Hai un 80,2% de conservación de secuencia a nivel de xene entre a de Homo sapiens e a do lévedo Saccharomyces cerevisiae, e un 95% de conservación da estrutura primaria do produto proteico.
Aínda que a maioría dos lévedos teñen só un xene para a actina, os eucariotas superiores, en xeral, expresan varias isoformas de actina codificadas por unha familia de xenes relacionados. Os mamíferos teñen polo menos seis xenes de isoformas de actina codificadas en xenes separados,[34] que se dividen en tres clases (alfa, beta e gamma) segundo os seus puntos isoeléctricos. En xeral, as actinas alfa atópanse no músculo (α-esquelética, α-liso aórtico, α-cardíaca, e γ2-liso entérico), mentres que as isoformas beta e gamma son abundantes en células non musculares (β- e γ1-citoplásmicas). Aínda que as secuencias de aminoácidos e as propiedades in vitro das isoformas son moi similares, estas isoformas non poden substituírse completamente unhas por outras in vivo.[35]
O xene típico de actina ten aproximadamente un 5'-UTR duns 100 nucleótidos, unha rexión traducida de 1200 nucleótidos, e un 3'-UTR de 200 nucleótidos. A maioría dos xenes de actina están interrompidos por intróns, e teñen ata seis intróns en 19 posibles localizacións ben caracterizadas. A grande conservación da familia fai que a actina sexa o modelo favorito para realizar estudos que comparan modelos de intróns temperáns e tardíos da evolución dos intróns.
Todos os procariotas non esféricos parecen posuír xenes como o MreB, que codifican homólogos da actina; estes xenes son necesarios para o mantemento da forma da célula. O xene ParM derivado dun plásmido codifica unha proteína similar á actina cuxa forma polimerizada é inestable dinamicamente, e parece intervir para repartir o ADN do plásmido entre as células fillas durante a división celular por un mecanismo análogo ao empregado polos microtúbulos durante a mitose eucariótica.[36]
Dinámica de ensamblaxe
[editar | editar a fonte]
A actina F combina as cualidades de ser resistente e dinámica. A diferenza doutros polímeros, como o ADN, que manteñen unidos os seus elementos constitutivos mediante enlaces covalentes, nos filamentos de actina os monómeros ensámblanse por medio de enlaces máis febles de tipo non covalente. Isto, que en principio debilita a estrutura, porque se podería romper por axitación térmica, soluciónase grazas ao establecemento de enlaces laterais cos monómeros veciños. Ao mesmo tempo, os enlaces febles teñen a vantaxe de que os extremos do filamento poden liberar ou incorporar doadamente monómeros, de maneira que se poden remodelar rapidamente e cambiar a estrutura celular da que son responsables en resposta a estímulos ambientais. Isto último xunto co mecanismo bioquímico polo que se efectúa é o que se coñece como "dinámica de ensamblaxe".[4]
- Nucleación e polimerización
A polimerización e despolimerización da actina é necesaria para a quimiotaxe e a citocinese. Cómpren factores nucleantes para estimular a polimerización da actina. Un deses factores nucleantes é o complexo Arp2/3, que imita ao dímero de actina G para estimular a nucleación (ou formación do primeiro trímero) de actina G monomérica. O complexo Arp2/3 únese aos filamentos de actina cun ángulo de 70º para formar novas ramas de actina nos filamentos de actina existentes. Ademais, aos filamentos de actina únese ATP, e a hidrólise deste ATP estimula a desestabilización do polímero.
O crecemento dos filamentos de actina pode ser regulado polas proteínas timosina e profilina. A timosina únese á actina G para amortecer o proceso de polimerización, mentres que a profilina únese á actina G para intercambiar ADP por ATP, promovendo a adición monomérica ao extremo barbado (+) dos filamentos de actina F.
- Estudos in vitro
Os estudos da dinámica de adición e perda de subunidades dos microfilamentos realizáronse in vitro (é dicir, no laboratorio, fóra de sistemas celulares) debido a que o polímero de actina resultante dá lugar á mesma actina F producida in vivo, onde este proceso está controlado por moitas proteínas para responder ás necesidades celulares, de modo que sería moi difícil observar as súas condicións básicas.[37] In vitro, este feito prodúcese de forma secuencial: primeiro, dáse unha «fase de activación», na que a unión e intercambio de catións divalentes en lugares específicos da actina G, unidos a ATP, producen un cambio conformacional, coñecido ás veces como Actina G* ou monómero de actina F, porque é máis parecida ás unidades que se sitúan no filamento.[16] Isto prepáraa para a seguinte «fase de nucleación», na cal a actina G dá lugar a pequenos fragmentos inestables de actina F con capacidade de polimerizar. Inicialmente, fórmanse dímeros e trímeros de maneira inestable. Cando o número destes é grande dabondo, ten lugar a «fase de elongación», na que o filamento se forma e medra rapidamente por adición reversible de novos monómeros a ambos os extremos.[38] Finalmente, no «equilibrio estacionario», os monómeros de actina G intercámbianse nos extremos do microfilamento sen que varíe a lonxitude total do polímero.[3] Nesta última fase defínese a «concentración crítica Cc» como a relación entre as constantes de ensamblaxe e desensamblaxe (trátase, pois, dunha constante de disociación), e representa a concentración de actina G na cal a dinámica de adición e eliminación de monómeros non produce unha modificación na lonxitude do microfilamento. Nas condicións usuais in vitro, Cc é 0,1 μM,[39] o que significa que a valores maiores dáse unha polimerización e a valores menores, unha despolimerización.[40]
- Papel da hidrólise do ATP
Un asunto importante que se introduciu no apartado anterior é o feito de que, aínda que a actina hidroliza ATP, todo parece indicar que isto non intervén na ensamblaxe, porque, por unha parte, a hidrólise prodúcese en grande medida no interior do filamento, e por outra, o ADP tamén pode polimerizar. Isto formula a cuestión de comprender cal é o proceso termodinamicamente desfavorable que require un gasto de enerxía tan enorme. O chamado "ciclo da actina", que liga a hidrólise á polimerización, consiste na adición de monómeros de Actina G-ATP preferentemente no extremo barbado, creando un fluxo de monómeros cara ao extremo en punta de frecha no que se coñece como "cinta de transporte" (treadmilling, en inglés), onde os monómeros estarían en forma de Actina F-ADP e serían liberados, intercambiando posteriormente este ADP por ATP e pechando dese modo o ciclo.
Pouco despois da adición, prodúcese a hidrólise do ATP de forma relativamente rápida. Existen dúas hipóteses sobre como se produce, a estocástica, na que a hidrólise se produciría ao chou influída en certo modo polas moléculas veciñas, e a vectorial, na que só se produciría no límite con outras moléculas que xa hidrolizaron o seu ATP. En calquera caso, non se libera o Pi resultante, senón que permanece un tempo unido non covalentemente á actina-ADP, de maneira que nun filamento existirían tres especies de actina: ATP-Actina, ADP+Pi-Actina e ADP-Actina.[33] O contido dun filamento en cada unha destas especies depende da súa lonxitude e estado: ao comezo da elongación, o filamento ten unha composición aproximadamente equivalente de monómeros con ATP e ADP+Pi e só unha pequena cantidade xunto ao extremo (-) de actina-ADP. A medida que se acada o estado estacionario, a situación invértese, e a maior parte do filamento está con ADP e só a zona preto do extremo (+) contén ADP+Pi, mentres que o ATP está reducido ao extremo.[41]
Se comparamos os filamentos de actina-ADP puros con aqueles que incorporan ATP, nos primeiros as constantes críticas son similares en ambos os extremos, mentres que nos outros dous nucleótidos a Cc é diferente: No extremo (+) Cc+=0,1 μM, mentres que no extremo (-) Cc-=0,8 μM, co cal se dan as seguintes situacións:[6]
- Para concentracións de actina G-ATP menores que Cc+ non se produce a elongación do filamento.
- Para concentracións de actina G-ATP menores que Cc- pero maiores que Cc+ a elongación dáse no extremo (+).
- Para concentracións de actina G-ATP maiores que Cc- o microfilamento crece en ambos os extremos.
Por tanto, pódese deducir que a enerxía da hidrólise utilízase para crear un verdadeiro "estado estacionario", é dicir, crear un fluxo en lugar dun simple equilibrio, o cal dota ao filamento de dinamismo, polaridade e forza de tracción, o que xustifica o gasto pola ganancia de funcións biolóxicas esenciais.[33] Ademais, as proteínas que se unen á actina que controlan este dinamismo detectan a configuración dos distintos tipos de monómeros, como se verá na próxima sección.
Nos estereocilios parece existir unha excepción na forma de acoplamento típica dos microfilamentos mediante cinta de transporte (treadmilling). Neste caso, o control do tamaño da estrutura sería totalmente apical e dalgunha maneira controlada pola expresión xénica, é dicir, pola cantidade total de monómero de proteína sintetizada nun momento dado.[42]
Proteínas asociadas
[editar | editar a fonte]
In vivo, o citoesqueleto de actina non está composto exclusivamente de actina, senón que para a súa xeración, permanencia e función require outras proteínas; estas denomínanse proteínas de unión a la actina ou proteínas que se unen á actina (ABP, actin binding proteins) e interveñen na súa polimerización e despolimerización, estabilidade, organización en feixes ou redes, e na súa fragmentación e destrución.[3] A diversidade destas proteínas é tan grande, que se considera que a actina é a proteína que participa no maior número de interaccións proteína-proteína de todas as coñecidas.[44] Por exemplo, existen elementos que secuestran a actina G, impedindo a súa incorporación aos microfilamentos. De igual maneira, existen proteínas que estimulan a súa polimerización ou que dotan de complexidade ás redes en síntese.[6] Entre elas están:
- A timosina β4 é unha proteína de 5 kDa que se pode unir á actina G-ATP cunha estequiometría de 1:1; isto quere dicir que unha unidade de timosina β4 se une a outra de actina G, nesta proporción. O seu papel é impedir a incorporación dos monómeros ao polímero en crecemento.[45]
- A profilina, unha proteína citosólica de 15 kDa que tamén se une con estequiometría 1:1 aos monómeros de actina G-ATP, mais que ten unha función distinta: facilita o intercambio de nucleótidos de ATP por ADP. Ademais, está envolvida noutras funcións celulares, como a unión de repeticións de Pro noutras proteínas ou de lípidos que actúan como segundos mensaxeiros.[46][47]

Outras proteínas que se unen á actina regulan a lonxitude dos microfilamentos realizando cortes neles, o que dá lugar a novos extremos activos para a polimerización. Por tanto, se un microfilamento, que posúe dous extremos aos que poden unirse ou disociarse monómeros, é cortado dúas veces, orixínanse tres novos microfilamentos con seis extremos; a nova situación favorece a dinámica de ensamblaxe e desensamblaxe. Entre estas proteínas salientan a xelsolina e a cofilina. O corte realízano primeiramente mediante cambios na conformación do monómero de actina ao que se unen no polímero, e despois quedan recubrindo o novo extremo (+) xerado, o que impide o agregado ou o intercambio de novas subunidades de actina G e, como os extremos (-) quedan sen recubrir, favorecen a despolimerización dos filamentos.[49]
Outro tipo de proteínas que se unen á actina recobren os extremos da actina F para estabilizalos, mais sen capacidade de rompelos. Exemplos destas proteínas son CapZ (que une os extremos (+) segundo os niveis de Ca2+/calmodulina da célula, niveis que dependen de sinais externos e internos da célula e que interveñen na regulación das súas funcións biolóxicas)[50] ou a tropomodulina (que se une aos extremos (-)). A tropomodulina é esencial como estabilizador da actina F presente nas miofibrilas dos sarcómeros do músculo, estruturas caracterizadas pola súa grande estabilidade.[51]

O complexo Arp2/3 está amplamente difundido en todos os organismos eucariotas.[53] Está composto por sete subunidades, algunhas das cales posúen unha topoloxía claramente relacionada coa súa función biolóxica: dúas das súas subunidades, denominadas «ARP2» e «ARP3», posúen unha estrutura moi semellante á dos propios monómeros de actina. Dita homoloxía permite a ambas as unidades comportarse como axentes nucleantes da polimerización dos monómeros de actina G a actina F. Ademais, este complexo é necesario para establecer estruturas dendríticas e en anastomose (bifurcadas ou en rede), e, por tanto, máis complexas, de actina F.[54]
Inhibidores químicos
[editar | editar a fonte]
Existen varias toxinas que interfiren coa dinámica das actinas, tanto despolimerizándoas (latrunculina e citocalasina D) coma estabilizándoas (faloidina):
- A latrunculina, unha toxina producida por poríferos, únese á actina G impedindo a súa unión aos microfilamentos.[55]
- A citocalasina D, un alcaloide producido por fungos, únese ao extremo (+) da actina F impedindo a adición de novos monómeros.[56] Describíronse os efectos da citocalasina D, mediados pola alteración da dinámica de actinas, na actividade de p53 (en animais)[57] ou en respostas gravitrópicas (en plantas).[58]
- A faloidina, unha toxina illada do fungo Amanita phalloides, únese ao interface existente entre os monómeros de actina adxacentes do polímero de actina F, o que evita a despolimerización da actina F.[56]
Funcións e localización
[editar | editar a fonte]A proteína actina encóntrase tanto no citoplasma coma no núcleo celular.[59] A súa localización está regulada polas vías de transdución de sinais que integran os estímulos que a célula recibe e que permite a reestruturación das redes de actina en resposta a eles. En Dictyostelium, intervén a ruta dos fosfoinosítidos mediada pola fosfolipase D.[60] Os filamentos de actina son especialmente abondosos e estables nas fibras musculares. Dentro do sarcómero (a unidade morfolóxica e fisiolóxica das fibras musculares) a actina disponse formando as bandas I e A; nestas últimas, preséntase conxuntamente coa miosina.[61]
Citoesqueleto
[editar | editar a fonte]
- Artigo principal: Microfilamento.
Os microfilamentos interveñen no movemento de todas as células móbiles, mesmo nas non musculares, porque se describiu que os fármacos que desorganizan a actina F (como as citocalasinas) afectan á actividade de ditas células. A proteína actina supón o 2% do total de proteínas en hepatocitos, o 10% en fibroblastos, o 15% en amebas e ata o 50-80% en plaquetas activadas.[62] Existen distintos grupos de actina, con estrutura e funcións lixeiramente distintas. A actina α é exclusiva das fibras musculares, e a actina presente noutras células adoita ser dos tipos β e γ. Ademais, a actina de tipos distintos ao α adoita ter unha alta taxa de recambio que provoca que a maior parte dela non forme parte de estruturas permanentes. Así, os microfilamentos nas células non musculares aparecen de dúas formas:[63]
- Redes de microfilamentos. Na célula animal é común que baixo a membrana plasmática se forme un córtex celular ateigado de microfilamentos no que non hai orgánulos. Esta rede está en relación con abundantes receptores celulares que transducen sinais do exterior da célula.
- Feixes de microfilamentos. Estes microfilamentos, dispostos en redes, son de maior lonxitude e interveñen, en asociación con proteínas contráctiles como a miosina non muscular, no desprazamento de substancias a nivel intracelular.
Lévedos
[editar | editar a fonte]En lévedos, o citoesqueleto de actina é clave durante os procesos de endocitose, citocinese, determinación da polaridade celular e durante a morfoxénese. Estes procesos, ademais de depender da actina, implican a 20 ou 30 proteínas asociadas, moi conservadas evolutivamente, xuntro con multitude de moléculas de sinalización; a combinación de todos estes elementos permite unha ensamblaxe modulada espacial e temporalmente que define a bioloxía celular en resposta a estímulos internos e externos.[64]
Os lévedos posúen tres grandes tipos de elementos produto da asociación da actina: parches, cables e aneis que, malia detectarse durante longos períodos de tempo, vense sometidos a un equilibrio dinámico debido á continua polimerización e despolimerización. Como proteínas accesorias, posúen unha cofilina/ADF de 16 kDa (codificiada por un único xene, denominado COF1); o Aip1, un cofactor da cofilina que favorece a desensamblaxe dos microfilamentos; o Srv2/CAP, un regulador da dinámica relacionado con proteínas adenilil ciclases; unha profilina de aproximadamente 14 kDa que se asocia aos monómeros de actina; e a twinfilina, unha proteína de 40 kDa implicada na organización das estruturas tipo parche.[64]
Plantas
[editar | editar a fonte]Os estudos de xenómica de plantas revelaron a existencia de isovariantes proteicas dentro da familia de xenes da actina. En Arabidopsis thaliana, unha dicotiledónea empregada como organismo modelo, existen polo menos dez tipos de actinas, nove de α tubulinas, seis de β tubulinas, seis de profilinas e ducias de miosinas. Tal diversidade explícase pola necesidade evolutiva de posuír variantes lixeiramente diferentes na súa pauta de expresión temporal e espacial; porén, a maioría delas exprésanse conxuntamente nos tecidos analizados. O entramado de redes de actina distribúese por todo o citoplasma das células cultivadas in vitro, cun reforzo arredor do núcleo que se conecta, mediante raios, ao córtex celular; dito entramado é moi dinámico, experimentando unha continua polimerización e despolimerización.[65]

Aínda que as células vexetais posúen xeralmente unha parede celular que define a súa morfoloxía e impide o seu movemento, os seus microfilamentos xeran as forzas necesarias para varias actividades celulares, por exemplo, as correntes citoplasmáticas xeradas polos microfilamentos e as miosinas. Ademais, a actina intervén no movemento de orgánulos e morfoxénese celular, procesos que inclúen a división celular, a elongación e a diferenciación.[67]
En canto ás proteínas asociadas ao citoesqueleto de actina presentes en plantas pódense mencionar as seguintes:[67] a vilina, unha proteína pertencente á familia da xelsolina/severina, que pode cortar microfilamentos e unir monómeros de actina en presenza do catión calcio; a fimbrina, un elemento que pode recoñecer e unir monómeros de actina e que intervén na formación de entramados (mediante unha regulación diferente á que hai en células animais e de lévedos);[68] as forminas, proteínas que poden actuar como axentes nucleantes da polimerización a actina F; a miosina, típico motor molecular propio de eucariotas que, en Arabidopsis thaliana, está codificado por 17 xenes clasificados en dúas clases distintas; a CHUP1, con capacidade de unir actina e implicado na distribución espacial dos cloroplastos na célula; a KAM1/MUR3, unha proteína que define a morfoloxía do complexo de Golgi e a composición en xiloglicanos da parede celular; a NtWLIM1, proteína que facilita a aparición de estruturas con forma de nobelo de actina; e a ERD10, que participa na asociación entre orgánulos delimitados por membranas e os microfilamentos e que parece desempeñar un papel especialmente importante en condicións de estrés.
Actina nuclear
[editar | editar a fonte]A actina é esencial para a transcrición feita polas ARN polimerases Pol I, Pol II e Pol III. Na transcrición feita por Pol I, a actina e a miosina (MYO1C, que se une ao ADN) actúan como motores moleculares. Para a transcrición feita por Pol II, cómpre β-actina para a formación do complexo de preiniciación. A Pol III contén β-actina como unha subunidade. A actina pode tamén ser un compoñente dos complexos de remodelación da cromatina e de partículas de pre-mRNP (formadas polo pre-ARNm envolto en proteínas), e está implicada na exportación nuclear de ARNs e proteínas.[69]
Contracción muscular
[editar | editar a fonte]- Artigo principal: Contracción muscular.

No músculo, o filamento helicoidal da actina F contén tamén unha molécula de tropomiosina, que é unha proteína dunha lonxitude de 40 nanómetros que se enrola arredor da hélice de actina F. Durante o estado de repouso celular, a tropomiosina recobre os sitios activos da actina de modo que non se pode producir a interacción actina-miosina (esta interacción dá lugar a un esvaramento entre ambos os filamentos que, por coordinación de moitas copias destes elementos dispostos nos músculos, produce a súa contracción). Unidas ao longo da febra de tropomiosina hai outras moléculas proteicas, as troponinas, complexos de tres polímeros: troponina I, troponina T e troponina C.[23] A función moduladora da tropomiosina depende da interacción coa troponina en presenza de ións de Ca2+.[70]
A actina, xunto coa miosina, intervén na contracción e relaxación dos músculos, e entre as dúas supoñen o 90% das proteínas musculares.[71] O proceso global dispárase mediante un sinal externo, tipicamente mediante un potencial de acción excitador do músculo que contén as células especializadas ricas en filamentos de actina e miosina. O ciclo de contracción-relaxación comprende os seguintes pasos:[72]
- Despolarización do sarcolema e transmisión do potencial de acción a través dos túbulos T.
- Apertura de canais de Ca2+ do retículo sarcoplásmico.
- Aumento da concentración citosólica de Ca2+ e interacción destes catións coa troponina causando unha modificación na súa conformación, o que á súa vez altera a estrutura da tropomiosina, que recobre o sitio activo da actina, permitindo o establecemento dos enlaces cruzados miosina-actina (esta última presente como filamentos delgados).[23]
- Movemento das cabezas de miosina sobre os filamentos delgados, tanto de forma independente coma dependente de ATP. Este último mecanismo, mediado pola actividade ATPase das cabezas de miosina, provoca o movemento dos filamentos de actina cara ao disco Z.
- Captura do Ca2+ polo retículo sarcoplásmico, que provoca un novo cambio conformacional na tropomiosina, que inhibe a interacción actina-miosina.[71]
Outros procesos biolóxicos
[editar | editar a fonte]O estudo clásico da función da actina circunscribíaa ao mantemento do citoesqueleto e, por tanto, á organización e movemento dos orgánulos e determinación da forma celular.[63] Porén, o papel da actina é bastante máis amplo na fisioloxía celular eucariota; e mesmo existen elementos semellantes en procariotas.
- Citocinese. Nas células animais e de lévedos, a división celular adoita supoñer a separación dunha célula en dúas células fillas mediante a constrición da súa zona ecuatorial. Neste proceso intervén un anel contráctil de actina, miosina e α-actinina.[73] No lévedo de fisión Schizosaccharomyces pombe, a actina ensámblase activamente no anel contráctil coa participación de Arp3, a formina Cdc12, profilina e WASp, pero tamén interveñen microfilamentos preformados. Unha vez constituído o anel, a estrutura mantense nunha continua ensamblaxe/desensamblaxe que, coa axuda do complexo Arp2/3 e das forminas, é un proceso central da citocinese.[74] O conxunto formado polo anel contráctil, os microtúbulos do fuso acromático e o material denso periférico denomínase «corpo de Fleming» ou «corpo intermedio».[63]
- Apoptose. Durante a morte celular programada, a familia de proteases denominadas ICE/ced-3 (da familia das proteases conversoras de interleucina-1β) degradan in vivo a actina en dous fragmentos de 15 kDa e 31 kDa, o que supón un dos mecanismos de destrución da viabilidade celular en que se basea a apoptose.[75] Tamén se observou esta destrución mediante a protease calpaína;[76] e o emprego de inhibidores da calpaína diminúe a proteólise da actina e mesmo a degradación do ADN (outro dos eventos característicos da apoptose).[77] Por outro lado, a indución do proceso de apoptose por un estrés pasa pola reorganización do citoesqueleto de actina (o que implica tamén a súa polimerización), dando lugar ás estruturas denominadas fibras de estrés; isto é activado pola vía das MAP quinases.[78]
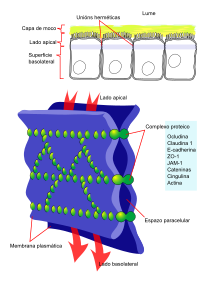
- Adhesión celular e desenvolvemento. A adhesión entre células é un carácter dos organismos pluricelulares da que depende a capacidade de especialización dos tecidos e, por tanto, o aumento da complexidade dos mesmos. As unións celulares dos epitelios empregan o citoesqueleto de actina, dentro de cada célula, e as cadherinas, como elementos extracelulares, cunha conexión entre ambas mediada por cateninas.[79] A interrupción da dinámica das actinas repercute no desenvolvemento dos organismos; de feito, a actina é un elemento tan fundamental que, xeralmente, os organismos dispoñen de sistemas de xenes redundantes. Por exemplo, os exemplares de Dictyostelium que foran privados do xene da α-actinina ou do factor xelificante non mostraban un fenotipo anómalo, posiblemente debido a que unha das proteínas podía realizar a función da outra; pero nos dobres mutantes, carentes de ambas, o desenvolvemento viuse alterado.[80]
- Modulación da expresión xénica. O estado de polimerización da actina inflúe na pauta de expresión xénica. En 1997, en traballos feitos con células de Schwann detectouse que a despolimerización mediada por citocalasina D provocaba unha pauta de expresión peculiar dos xenes implicados na mielinización deste tipo de célula nerviosa.[81] Nos organismos unicelulares, nalgunha das súas fases vitais demostrouse que a actina F tamén modifica o transcriptoma no fungo Candida albicans.[82] Ademais, proteínas semellantes á actina desempeñan un papel regulador durante a espermatoxénese no rato[83] e, en lévedos, propúxose que proteínas semellantes á actina exercen un papel na modulación epixenética.[84] De feito, a actina xunto cun tipo de miosina nuclear pode interaccionar con ARN polimerases e outros encimas da maquinaria transcricional, de actuar como iniciador da transcrición.[59]
- Dinámica de estereocilios. Algúns tipos de células desenvolven na súa superficie unhas finas evaxinaciones filiformes con función mecanosensorial denominadas estereocilios. Por exemplo, estes orgánulos están implicados no funcionamento do órgano de Corti do oído. Como característica principal, estas estruturas posúen unha lonxitude que pode modificarse.[85] En canto á súa arquitectura molecular, os estereocilios presentan un núcleo paracristalino de actina en equilibro dinámico cos monómeros presentes no citosol adxacente. Ao longo deste núcleo dispóñense miosinas dos tipos VI e VIIa, mentres que a miosina XVa está situada nos seus extremos e en cantidades proporcionais á lonxitude do estereocilio.[86]
Patoloxía molecular
[editar | editar a fonte]Na maioría dos mamíferos existen seis xenes diferentes para a actina. Dous deles están relacionados co citoesqueleto (ACTB e ACTG1) mentres que as catro restantes o están co músculo esquelético (ACTA1), músculo liso (ACTA2), músculo liso entérico (ACTG2) e co músculo cardíaco (ACTC1). As mutacións que afectan a estes xenes eran descoñecidas ata 1998, e viuse que producen miopatías, variacións no tamaño e a función cardíaca e xordeira. Ademais, a actina do citoesqueleto está implicada no mecanismo de patoxenicidade de moitos axentes infecciosos, entre eles o VIH. A inmensa maioría das mutacións que afectan á actina son de tipo puntual e teñen un efecto dominante, agás polo menos seis mutacións de miopatía nemalínica. Isto débese a que en moitos casos a variedade mutante do monómero de actina actúa como unha "tapa" que impide a elongación da actina F.[16]
Asociada ao xene ACTA1
[editar | editar a fonte]ACTA1 é o xene que codifica a isoforma α da actina humana, presente principalmente no músculo esquelético, e que tamén se expresa no músculo cardíaco e na glándula tiroide.[87] A súa secuencia consta de sete exóns, que producen cinco transcritos coñecidos.[88] En 2006, o ENMC (European Neuromuscular Centre) publicara 116 mutacións relacionadas con patoloxías coñecidas como actinopatías. A maior parte delas consisten en substitucións puntuais de aminoácidos, que en moitos casos poden ser asociadas co fenotipo que determina a gravidade e o curso da doenza.[16][88]

Maniféstanse alterando a estrutura e a función do músculo esquelético producindo tres formas de miopatía: miopatía nemalínica tipo 3, miopatía conxénita con exceso de microfilamentos (CM) e miopatía conxénita con desproporción de tipos de fibra (CFTDM). Tamén se detectaron mutacións que producen miopatías core (con zonas desprovistas de actividade oxidativa).[90] Aínda que os seus fenotipos son similares, ademais da miopatía nemalínica típica e a de bastóns intranucleares, algúns especialistas distinguen un tipo de miopatía, chamada actínica da miopatía nemalínica. Na primeira acumúlanse agregados de actina en troques dos típicos bastóns. Un paciente pode mostrar máis dun destes fenotipos na biopsia.[91] Os síntomas máis habituais consisten nunha morfoloxía facial típica (facies miopática), debilidade muscular e atraso no desenvolvemento motor e dificultades respiratorias. O curso, a gravidade e a idade de aparición son moi variables, e encóntranse formas de miopatía solapadas. Na miopatía nemalínica aparecen unhas estruturas non patognomónicas en diversas localizacións das fibras musculares tipo 1 coñecidas como "bastóns nemalínicos", cunha composición similar á dos discos Z do sarcómero.[92]
A patoxénese é moi variada. Moitas mutacións danse na zona da fenda da actina, próximas ao lugar de unión para os nucleótidos, mentres que outras se dan no dominio 2, ou nas zonas de interacción coas proteínas asociadas, o que explica a gran variedade de agregados que se forman nestes casos, como corpos nemalínicos, intranucleares ou corpos cebra.[16] Na miopatía nemalínica prodúcense cambios no pregamento e nas propiedades de agregación da actina, e tamén na expresión doutras proteínas asociadas. Nalgunhas variantes nas que se encontran corpos intranucleares, o cambio no pregamento agocha o sinal de exportación nuclear, de tal xeito que a agregación da forma mutante de actina se produce no núcleo celular.[93] Ao contrario, parece que nas mutacións de ACTA1 que dan lugar a CFTDM está máis afectada a función sarcomérica que a propia estrutura.[94] En traballos recentes tratouse de aclarar o aparente paradoxo de que non exista unha correlación clara entre a abundancia de bastóns e a debilidade muscular. Parece ser que algunhas mutacións particulares poden inducir unha maior taxa de apoptose nas fibras musculares de tipo II.[26]

No músculo liso
[editar | editar a fonte]Existen dúas isoformas que codifican actinas do músculo liso:
ACTG2 codifica a isoforma máis longa de actina, que ten nove exóns, un deles, o situado no extremo 5', que non se traduce.[95] Trátase dunha γ actina que se expresa no músculo liso entérico. Non se atoparon mutacións que se correspondan a patoloxías neste xene, aínda que se viu mediante microarrays que esta é a proteína que, con diferenza, máis aumenta a súa expresión nos casos de resistencia á quimioterapia con cisplatino.[96]
ACTA2 codifica unha α actina localizada no músculo liso, e tamén no músculo liso vascular. A mutación MYH11 podería ser responsable de polo menos un 14% dos casos de aneurismas de aorta torácica hereditarios, concretamente o tipo 6, porque a variante mutada produce unha ensamblaxe incorrecta dos filamentos e unha redución da capacidade de contracción do músculo liso vascular. Nestes individuos obsérvase unha dexeneración aórtica medial, con áreas de desorganización e hiperplasia, e estenose dos vasa vasorum da aorta.[97] O número de doenzas nas que se cre que podería estar implicado este xene está en aumento. Foi relacionado coa enfermidade de Moyamoya, e parece ser que algunhas mutacións en heterocigose poderían predispoñer a moitas patoloxías vasculares, como o aneurisma de aorta torácica e a cardiopatía isquémica.[98] A α-actina do músculo liso tamén é un interesante marcador para avaliar a progresión da cirrose hepática.[99]
No músculo cardíaco
[editar | editar a fonte]ACTC1 é o xene que codifica a isoforma da α actina presente no músculo cardíaco. Secuenciárono por primeira vez Hamada e colaboradores en 1982, que comprobaron que estaba interrompido por cinco intróns.[100] Foi o primeiro xene dos seis onde se encontraron alelos implicados en procesos patolóxicos.[101]

Describíronse varios trastornos estruturais que orixinan unha disfunción cardíaca asociados a mutacións puntuais neste xene, como a miocardiopatía dilatada tipo 1R e a miocardiopatía hipertrófica tipo 11. Recentemente viuse que algúns defectos do septo atrial tamén poderían estar relacionados con estas mutacións.[103][104]
No caso da cardiomiopatía dilatada estudáronse dous casos nos que en ambos os dous se produce unha substitución en aminoácidos moi conservados pertencentes aos dominios que se unen aos discos Z e discos intercalados, todo o cal leva á hipótese de que a dilatación se produce por un defecto de trasmisión da forza contráctil nos miocitos.[20][101]
As alteracións de ACTC1 son responsables de menos do 5% das cardiomiopatías hipertróficas.[105] Demostrouse tamén a existencia de varias mutacións puntuais, como son:[106]
- Mutación E101K: cambios de carga neta e formación de enlace electrostático feble na posición de unión da actomiosina.
- P166A: zona de interacción entre monómeros de actina.
- A333P: zona de interacción actina-miosina.
A patoxénese parece obedecer a un mecanismo compensatorio: as proteínas mutantes actuarían como "tóxico" cun efecto dominante, diminuíndo a capacidade de contracción cun rendemento mecánico anormal, de modo que a hipertrofia, que adoita ser tardía, sería consecuencia dunha resposta normal do músculo cardíaco ao estrés.[107]
Recentemente atopáronse mutacións de ACTC1 implicadas noutros dous procesos patolóxicos: a miocardiopatía restritiva idiopática infantil,[108] e o miocardio ventricular esquerdo non compacto.[109]
Nas actinas citoplasmáticas
[editar | editar a fonte]O locus ACTB é moi complexo. Existen moitos pseudoxenes repartidos por todo o xenoma, e a súa secuencia contén seis exóns que poden dar lugar ata 21 transcritos diferentes por splicing alternativo, coñecidos como actinas β. En correspondencia con esta complexidade, tamén os seus produtos teñen localizacións e forman parte de procesos moi distintos (citoesqueleto, complexo NuA4 histona-aciltransferase, núcleo celular) e asociáronse a este mecanismo gran cantidade de procesos patolóxicos (carcinomas, distonía xuvenil, mecanismos de infeccións, malformacións no sistema nervioso e invasividade de neoplasmas, entre outras).[110] Atopouse unha nova forma de actina kappa, que parece substituír a actina β en procesos tumorais.[111]

Ata o momento puidéronse detectar tres procesos patolóxicos que se deben a unha alteración directa da secuencia dun xene:
- O hemanxiopericitoma con translocación t(7;12)(p22;q13) é un trastorno raro, no que se produce unha fusión por translocación do xene ACTB co GLI1 no cromosoma 12.[113]
- A distonía de inicio xuvenil é unha doenza dexenerativa rara, con afectación sistémica do sistema nervioso central, e especialmente de áreas neocorticais e talámicas, onde se poden apreciar un tipo de inclusións eosinofílicas en forma de bastón. Os individuos afectados presentan un fenotipo con malformacións na liña media, perda auditiva sensorial e distonía. Débense a unha mutación puntual que cambia o aminoácido arxinina en posición 183 por un triptófano. Isto altera a interacción da actina co sistema ADF/cofilina, que regula a dinámica de formación do citoesqueleto neuronal.[114]
- Atopouse unha mutación puntual con carácter dominante que produce disfunción dos neutrófilos e infeccións recorrentes. Parece ser que a mutación modifica o dominio de unión coa profilina e outras proteínas reguladoras. A afinidade pola profilina neste alelo está moi reducida.[115]
ACTG1 é o locus que codifica a proteína da γ actina citosólica responsable da formación de microfilamentos do citoesqueleto. Contén 6 exóns, dando lugar a 22 ARN mensaxeiros distintos, o cal produce 4 isoformas completas, posiblemente expresadas dunha forma dependente de tecido. Tamén ten dous promotores alternativos.[116] Atopouse que as secuencias traducidas deste locus e o da β actina son máis semellantes do agardado, o que suxire que puido existir unha secuencia ancestral común que sufriu duplicación e conversión xénica.[117]
Desde o punto de vista patolóxico, asociouse a procesos como a amiloidose, a retinite pigmentosa, mecanismos de infección, enfermidades renais e diversas perdas auditivas conxénitas.[116]
Relacionadas con seis mutacións puntuais autosómicas dominantes na secuencia, encontramos diversas formas de perdas de audición, en especial a sensorineural tipo 20/26. Parece que afectan de forma específica aos estereocilios das células ciliadas do órgano de Corti. A β actina é a proteína máis abundante nos tecidos humanos, pero non así nas células ciliadas, o que explicaría a localización da patoloxía. Por outra parte, parece que a maior parte destas mutacións afectan a zonas de unión con outras proteínas, en especial a actomiosina.[16] Algúns experimentos suxiren que o mecanismo patoxénico deste tipo de xordeira se debe a que a actina F dos mutantes sería máis sensible do habitual á cofilina.[118]
Por outra parte, aínda que non se ten constancia de ningún caso patolóxico, sábese que a γ actina tamén se expresa no músculo esquelético, e aínda que en cantidades moi pequenas, os modelos animais mostraron que a súa ausencia podería dar lugar a miopatías.[119]
Outros mecanismos patolóxicos
[editar | editar a fonte]Algúns axentes infecciosos utilizan a actina, especialmente a citoplasmática, no seu ciclo de vida. En bacterias existen basicamente dúas formas desta utilización:
- Listeria monocytogenes, algunhas especies de Rickettsia, Shigella flexneri e outros xermes intracelulares escapan dos vacúolos fagocíticos mediante o recubrimento cunha cápsula de filamentos de actina. L. monocytogenes e S. flexneri xeran a partir dos filamentos de actina unha estela en forma de "cola de cometa" que permite a súa mobilidade. Existen lixeiras diferenzas no mecanismo molecular de polimerización da «cola de cometa» dependendo da especie de bacteria, e hai distintas velocidades de desprazamento.[120] Este mecanismo foi estudado en moitos experimentos in vitro, que demostraron que non se emprega ningunha proteína motora tipo miosina, e parece que a propulsión se adquire pola presión exercida pola polimerización que ten lugar preto da parede do microorganismo, que previamente se rodeou de proteínas que se unen á actina (ABPs) propias da célula hóspede, que na súa configuración mínima se trataría do complexo Arp2/3, proteínas Ena-VASP, cofilina, unha proteína tampón e promotores da nucleación, como o complexo da vinculina. Mediante estes movementos forman protrusións que chegan ás células veciñas, infectándoas, de modo que o sistema inmunolóxico só pode combater a infección por medio da inmunidade celular. O movemento podería ser debida á modificación da curvatura e desramificación dos filamentos.[121] Outras especies, como Mycobacterium marinum e Burkholderia pseudomallei, tamén teñen a capacidade de polimerizar localmente a actina celular para facilitar o seu desprazamento mediante un mecanismo que se basea no complexo Arp2/3; e ademais, o virus vacinal ou Vaccinia virus tamén emprega elementos do citoesqueleto de actina para a súa diseminación.[122]
- Pseudomonas aeruginosa pode formar un biofilme protector co que escapa das defensas do organismo, en especial dos neutrófilos e dos antibióticos, empregando ADN e filamentos de actina do hóspede.[123]
Ademais do exemplo citado anteriormente, nas etapas iniciais da internalización dalgúns virus, notablemente o VIH, estimúlase a polimerización da actina, por exemplo inactivando a cofilina.[124]
Nos procesos de invasión das células cancerosas, as protrusións baseadas en actina desempeñan un papel aínda non determinado.[125]
Evolución
[editar | editar a fonte]O citoesqueleto eucariota ten algúns compoñentes que presentan unha grande semellanza ao longo da escala filoxenética, especialmente a actina e a tubulina. Por exemplo, a proteína codificada polo xene ACTG2 de humanos posúe unha equivalencia absoluta cos ortólogos presentes en rata e rato, aínda que a nivel de nucleótidos a identidade diminúe ao 92 %.[126] Porén, existen maiores diferenzas cos equivalentes en procariotas (FtsZ e MreB), que, á súa vez, presentan unha identidade de secuencia de entre un 40−50% entre as distintas especies de bacterias e arqueas. Algúns autores suxiren que a proteína ancestral que deu lugar ao modelo básico de actina eucariota aseméllase ás do citoesqueleto bacteriano presentes na actualidade.[127]

Alguúns autores salientan que a actina, a tubulina e as histonas, un tipo de proteínas implicadas na estabilización e regulación do ADN, presentan similitudes na súa capacidade de unir nucleótidos e no seu funcionamento baseado no aproveitamento do movemento browniano, e suxiren que todas elas poderían derivar dun devanceiro común.[128] Por tanto, os mecanismos evolutivos diversificaron a proteína ancestral nas variantes hoxe presentes, conservando, entre outras, as actinas como moléculas eficaces para abordar procesos biolóxicos antigos e esenciais, como a endocitose.[129]
Equivalentes en bacterias
[editar | editar a fonte]As bacterias non teñen un citoesqueleto comparable en complexidade ao dos eucariotas, mais describíronse proteínas que teñen unha grande semellanza cos monómeros e polímeros de actina. A proteína MreB de bacterias polimeriza formando filamentos delgados, non helicoidais e, máis raramente, formando estruturas helicoidais semellantes á actina F.[7] Ademais, a súa estrutura cristalina é moi similar á da actina G (en conformación tridimensional), e mesmo existen equivalencias entre os protofilamentos de MreB e a actina F. O citoesqueleto bacteriano tamén posúe entre os seus compoñentes as proteínas FtsZ, semellantes á tubulina.[130]
Por tanto, as bacterias posúen un citoesqueleto con elementos homólogos á actina (por exemplo, MreB, ParM, e MamK), pero a secuencia aminoacídica destas proteínas diverxe do das presentes en células animais. Non obstante, MreB e ParM posúen unha alta similitude estrutural coa actina eucariota. Os microfilamentos, moi dinámicos, xerados por agregación de MreB e ParM son esenciais para a viabilidade celular e participan na morfoxénese da célula, segregación do xenóforo e polaridade celular. ParM, un homólogo da actina codificado nun plásmido, intervén na regulación do ADN de plásmidos.[131]
Aplicacións
[editar | editar a fonte]O aproveitamento da actina nos laboratorios de ciencia e tecnoloxía deriva da súa participación como pista sobre a que se moven motores moleculares como a miosina (tanto no músculo coma fóra del), e da súa presenza necesaria para o funcionamento celular. Tamén se usa como ferramenta de diagnóstico, xa que algunhas variantes anómalas da actina están relacionadas coa aparición de patoloxías.
- Nanotecnoloxía. Os sistemas actina-miosina actúan como motores moleculares que permiten o transporte de vesículas e orgánulos ao longo do citoplasma. Existen experimentos que aproveitan esta capacidade dinámica mesmo in vitro, é dicir, en sistemas acelulares, aplicando nanotecnoloxía. A idea subxacente é empregar os microfilamentos como pistas sobre as cales escorregan as proteínas motoras, transportando unha determinada carga de forma controlada e dirixida a determinadas localizacións, onde liberarían a súa carga. Isto permitiría a ensamblaxe de nanoestruturas de forma controlada.[132] Estas capacidades poderían aplicarse en chips de investigación como os lab-on-a-chip, en nanocompoñentes mecánicos e en nanotransformadores de enerxía mecánica en eléctrica.[133]
- Control interno en técnicas de bioloxía molecular, como o western blot e a PCR en tempo real. Debido a que a función da actina é necesaria para a supervivencia celular, postulouse que a súa cantidade está tan controlada a nivel de produción celular que pode asumirse que a súa transcrición (é dicir, o grao de expresión dos seus xenes) e tradución, (que é a xeración de proteínas) é practicamente constante, independentemente das condicións experimentais. Por esta razón, nos estudos de cuantificación de proteínas (western blot) e de transcritos (PCR en tempo real) adoita realizarse, ademais da cuantificación do xene de interese, a doutro xene de referencia, como o da mencionada actina. Dividindo a cantidade do xene de interese pola da actina é posible obter unha cantidade relativa comparable entre distintos experimentos,[134] sempre e cando a expresión desta última non varíe; hai que salientar que a actina non sempre presenta a estabilidad desexada na súa expresión.[135]
- Clínica. Algúns alelos da actina son causantes de patoloxías, polo que se desenvolveron técnicas para a súa detección. Ademais, a actina pode empregarse como marcador indirecto en patoloxía cirúrxica: é posible empregar variacións na pauta de localización nos tecidos como marcadores de invasión de neoplasias, vasculite e outros.[136] Tamén, debido á súa relación co aparato contráctil muscular, a atrofia provoca a diminución dos seus niveis no músculo esquelético, polo que pode empregarse como marcador deste fenómeno.[137]
- Tecnoloxía dos alimentos. A determinación da calidade dalgúns alimentos procesados, como os embutidos, pasa pola cuantificación do seu contido na carne. Clasicamente, utilizouse un método baseado na detección da 3-metilhistidina en hidrolizados destes produtos, porque se trata dun composto presente na actina e a cadea pesada da miosina F (os dous compoñentes maioritarios do músculo). A xeración no animal do composto débese á metilación de residuos de histidina presentes en ambas as proteínas.[138][139]
Historia
[editar | editar a fonte]
A actina observouna experimentalmente por primeira vez en 1887 W.D. Halliburton, que extraeu do músculo unha proteína que coagulaba preparacións de miosina, á que denominou "fermento da miosina".[140] Pero Halliburton non foi quen de efectuar a súa caracterización, polo que o descubrimento da actina se atribúe a Brúnó F. Straub, que daquela era un bioquímico mozo que traballaba no laboratorio de Albert Szent-Györgyi no Instituto de Química Médica da Universidade de Szeged, en Hungría.
En 1942, Straub desenvolveu unha nova técnica para a extracción de proteínas musculares que lle permitía illar cantidades substanciais de actina relativamente pura. Este método é o mesmo que esencialmente se utiliza nos laboratorios actualmente. Szent-Györgyi describira previamente unha forma máis viscosa de miosina, producida por extraccións lentas en músculo, como "miosina activada", e, como a proteína de Straub producía o efecto activador, denominouna actina. A viscosidade diminuía se se engadía ATP á mestura de ambas as proteínas, coñecida como actomiosina. O traballo de ambos os investigadores non puido publicarse nos países occidentais debido ao ambiente bélico da segunda guerra mundial, pero saíu á luz en 1945 ao publicarse como suplemento na Acta Physiologica Scandinavica.[141] Straub continuou traballando na actina ata 1950, publicando que podía unirse ao ATP e que, durante a súa polimerización para formar microfilamentos, hidrolizábase a ADP + Pi, que permanecía unido ao microfilamento. Straub suxeriu que esta reacción desempeñaba un papel na contracción muscular, pero isto só é certo no caso do músculo liso e non se verificou experimentalmente ata 2001.[142][143]
A secuencia de aminoácidos completárona Elzinga e colaboradores en 1973,[15] e a estrutura cristalográfica da actina G determinárona en 1990 Kabsch e colaboradores, aínda que se trataba dun cocristal no que formaba un complexo coa desoxirribonuclease I,[17] e nese mesmo ano Holmes e colaboradores propuxeron un modelo para a actina F.[144] Este procedemento de cocristalización con diferentes proteínas foi empregado repetidamente durante os seguintes anos, ata que en 2001 se conseguiu cristalizar a proteína illada xunto con ADP. Foi posible grazas ao emprego dun conxugado de rodamina que impedía a polimerización bloqueando o aminoácido cys-374.[12] Ese mesmo ano produciuse o falecemento de Christine Oriol-Audit, a investigadora que en 1977 conseguiu cristalizar por primeira vez a actina en ausencia de proteínas unidas á actina (ABP). Os cristais eran demasiado pequenos para a tecnoloxía da época.[145]
Aínda que actualmente non existe un modelo de alta resolución da forma filamentosa, o equipo de Sawaya realizou en 2008 unha aproximación máis exacta baseándose en múltiples cristais de dímeros de actina que contactan en diferentes lugares.[146] Este modelo foi refinado polo propio autor e por Lorenz. Outros enfoques, como o uso de criomicroscopia electrónica ou radiación sincrotrón permitiron recentemente aumentar o nivel de resolución e comprender con maior profundidade a natureza das interaccións e os cambios conformacionais implicados na formación do filamento de actina.[7][147]
Notas
[editar | editar a fonte]- ↑ PDB 1J6Z ; Otterbein LR, Graceffa P, Dominguez R (xullo de 2001). "The crystal structure of uncomplexed actin in the ADP state". Science 293 (5530): 708–11. doi:10.1126/science.1059700. PMID 11474115.
- ↑ Definición de Actina no Dicionario de Galego de Ir Indo e a Xunta de Galicia.
- ↑ 3,0 3,1 3,2 3,3 Marc Maillet Biología celular (en castelán). Publicado por Elsevier España, 2002; páx. 132. ISBN 84-458-1105-3
- ↑ 4,0 4,1 Alberts; et al. (2004). Barcelona: Omega, ed. Biología molecular de la célula. ISBN 54-282-1351-8.
- ↑ Ponte, P.; Gunning, P.; Blau, H.; Kedes, L. (1983). "Human actin genes are single copy for alpha-skeletal and alpha-cardiac actin but multicopy for β- and γ-cytoskeletal genes: 3' untranslated regions are isotype specific but are conserved in evolution". Molecular and Cellular Biology 3 (10): 1783–1791. Arquivado dende o orixinal o 05/02/2009. Consultado o 07/11/2014.
- ↑ 6,0 6,1 6,2 6,3 Lodish; et al. (2005). Biología celular y molecular. Buenos Aires: Médica Panamericana. ISBN 950-06-1974-3.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Toshiro Oda, Mitsusada Iwasa, Tomoki Aihara, Yuichiro Maéda e Akihiro Narita (2009): The nature of the globular- to fibrous-actin transition. Nature 457, 441-445 (22 de xaneiro de 2009) | doi:10.1038/nature07685
- ↑ Futoshi Hara, Kan Yamashiro, Naoki Nemoto, Yoshinori Ohta, Shin-ichi Yokobori, Takuo Yasunaga, Shin-ichi Hisanaga, and Akihiko Yamagishi. (2007): An Actin Homolog of the Archaeon Thermoplasma acidophilum That Retains the Ancient Characteristics of Eukaryotic Actin Arquivado 15 de decembro de 2009 en Wayback Machine.. Journal of Bacteriology, p. 2039-2045, Vol. 189, No. 5 doi:10.1128/JB.01454-06
- ↑ 9,0 9,1 Graceffa, Philip; Dominguez, Roberto (2003). "Crystal Structure of Monomeric Actin in the ATP State: STRUCTURAL BASIS OF NUCLEOTIDE-DEPENDENT ACTIN DYNAMICS". Journal of Biological Chemistry 278 (36): 34172–34180. PMID 12813032. doi:10.1074/jbc.M303689200. Arquivado dende o orixinal o 10 de febreiro de 2009. Consultado o 07 de novembro de 2014.
- ↑ Reisler, E. (1993). "Actin molecular structure and function". Curr Opin Cell Biol 5 (1): 41–7. doi:10.1016/S0955-0674(05)80006-7.
- ↑ "NCBI Conserved Domains: ATP binding site" (en inglés). Consultado o 26 de drcembro 2008.
- ↑ 12,0 12,1 12,2 12,3 Domínguez, R; Otterbein LR, Graceffa P (2001). "The crystal structure of uncomplexed actin in the ADP state" (en inglés) 293 (5530): 708–11. PMID 11474115.
- ↑ 13,0 13,1 Elzinga; Collins, JH (1975). "The primary structure of actin from rabbit skeletal muscle. Completion and analysis of the amino acid sequence". J Biol Chem. (en inglés) 250 (15).
- ↑ Elzinga; Collins JH, Kuehl WM,. "Adelsteiskeletal muscle" (PDF). Proc Natl Acad Sci U S A. (en inglés) 70 (9).
- ↑ 15,0 15,1 Elzinga, Marshall; Collins, John H.; Kuehl, W. Michael; Adelstein, Robert S. (1973-09). "Complete Amino-Acid Sequence of Actin of Rabbit Skeletal Muscle". Proceedings of the National Academy of Sciences (en inglés) 70 (9): 2687–2691. PMC 427084. PMID 4517681. doi:10.1073/pnas.70.9.2687.[Ligazón morta]
- ↑ 16,0 16,1 16,2 16,3 16,4 16,5 16,6 16,7 Remedios, Cris dos; Chhabra, Deepak (2008-01-08). Actin-Binding Proteins and Disease (en inglés). Springer Science & Business Media. ISBN 978-0-387-71749-4.
- ↑ 17,0 17,1 Kabsch W, Mannherz HG, Suck D, Pai EF, Holmes KC. (1990). "Atomic structure of the actin:DNase I complex.". Nature 347 (6288). PMID 2395459.
- ↑ Rould; Wan Q, Joel PB, Lowey S, Trybus KM. (2006). "Crystal structures of expressed non-polymerizable monomeric actin in the ADP and ATP states". J Biol chem 281 (42). doi:10.1074/jbc.M601973200. Arquivado dende o orixinal o 25 de setembro de 2019. Consultado o 7 de novembro de 2014.
- ↑ Holmes, K.C.; Popp, D.; Gebhard, W.; Kabsch, W. (1990). "Atomic model of the actin filament" (w). Nature 347 (6288): 44–49. doi:10.1038/347044a0.
- ↑ 20,0 20,1 Devlin, Thomas M (2004). "23". En Reverte. Bioquímica: Libro de texto con aplicaciones clínicas (en inglés) (4 ed.). p. 1021. ISBN 8429172084..
- ↑ 21,0 21,1 21,2 Egelman; Reisler, E (2007). "Actin structure and function: what we still do not understand". J Biol Chem 282 (50). doi:10.1074/jbc.R700030200. Arquivado dende o orixinal o 25 de maio de 2009. Consultado o 07 de novembro de 2014.
- ↑ DA Begg, R Rodewald e LI Rebhun (1978): The visualization of actin filament polarity in thin sections. Evidence for the uniform polarity of membrane-associated filaments. The Journal of Cell Biology, Vol 79, 846-852.
- ↑ 23,0 23,1 23,2 Arthur C. Guyton, John E. Hall Tratado de fisiología médica (en castelán). Publicado por Elsevier España, 2007; pág 76. ISBN 84-8174-926-5
- ↑ 24,0 24,1 Simons, CT; Staes A, Rommelaere H, Ampe C, Lewis SA, Cowan NJ (2004). "Selective contribution of eukaryotic prefoldin subunits to actin and tubulin binding". J Biol Chem. (en inglés) 279 (6): 4196–203. PMID 14634002. doi:10.1074/jbc.M306053200. Arquivado dende o orixinal o 25 de setembro de 2019. Consultado o 07 de novembro de 2014.
- ↑ Martín-Benito; Boskovic J, Gómez-Puertas P, Carrascosa JL, Simons CT, Lewis SA, Bartolini F, Cowan NJ, Valpuesta JM. (2002). "Structure of eukaryotic prefoldin and of its complexes with unfolded actin and the cytosolic chaperonin CCT". EMBO J (en inglés) 21 (23): 6377–86. PMID 12456645. doi:10.1093/emboj/cdf640.
- ↑ 26,0 26,1 Vandamme, D; Lambert E, Waterschoot D, Cognard C, Vandekerckhove J, Ampe C, Constantin B, Rommelaere H. (2009). "alpha-Skeletal muscle actin nemaline myopathy mutants cause cell death in cultured muscle cells". Biochim Biophys Acta. (en inglés) 1793 (7): 1259–71. PMID 19393268.
- ↑ 27,0 27,1 Brackley; Grantham J (2009). "Activities of the chaperonin containing TCP-1 (CCT): implications for cell cycle progression and cytoskeletal organisation". Cell Stress Chaperones (en inglés) 14 (1): 23–31. PMID 18595008. doi:10.1007/s12192-008-0057-x.
- ↑ 28,0 28,1 Stirling, PC; Cuéllar J, Alfaro GA, El Khadali F, Beh CT, Valpuesta JM, Melki R, Leroux MR (2006). "PhLP3 modulates CCT-mediated actin and tubulin folding via ternary complexes with substrates". J Biol Chem (en inglés) 281 (11): 7012–21. PMID 16415341. doi:10.1074/jbc.M513235200. Arquivado dende o orixinal o 25 de setembro de 2019. Consultado o 07 de novembro de 2014.
- ↑ Hansen, WJ; Cowan NJ, Welch WJ. (1999). 265-7, ed. "Prefoldin-nascent chain complexes in the folding of cytoskeletal proteins". J Cell Biol. (en inglés) (145): 2. PMID 10209023.
- ↑ Neste enlace [1] pode verse un modelo da prefoldina coa actina encaixada entre os "tentáculos" das súas subunidades.
- ↑ No seguinte enlace [2] dun traballo de Jaime Martín-Benito e José María Valpuesta, do centro nacional de Biotecnoloxía do CSIC, pode verse a configuración en dobre anel da chaperonina CCT, e as súas subunidades.
- ↑ Neirynck; Waterschoot D, Vandekerckhove J, Ampe C, Rommelaere H (2006). "Actin interacts with CCT via discrete binding sites: a binding transition-release model for CCT-mediated actin folding". J Mol Biol. 355 (1): 124–38. PMID 16300788.
- ↑ 33,0 33,1 33,2 Vavylonis, D; Yang Q, O'Shaughnessy B. (2005). "Actin polymerization kinetics, cap structure, and fluctuations". Proc Natl Acad Sci U S A. (en inglés) 102 (24): 8543–8. PMID 15939882. doi:10.1073/pnas.0501435102.
- ↑ Vandekerckhove J, Weber K (December 1978). "At least six different actins are expressed in a higher mammal: an analysis based on the amino acid sequence of the amino-terminal tryptic peptide". J. Mol. Biol. 126 (4): 783–802. PMID 745245. doi:10.1016/0022-2836(78)90020-7.
- ↑ Khaitlina SY (2001). "Functional specificity of actin isoforms". Int. Rev. Cytol. 202: 35–98. PMID 11061563. doi:10.1016/S0074-7696(01)02003-4.
- ↑ Garner EC, Campbell CS, Weibel DB, Mullins RD (March 2007). "Reconstitution of DNA segregation driven by assembly of a prokaryotic actin homolog". Science 315 (5816): 1270–4. PMC 2851738. PMID 17332412. doi:10.1126/science.1138527.
- ↑ Kawamura, M.; Maruyama, K. (1970). "Electron Microscopic Particle Length of F-Actin Polymerized in Vitro". Journal of Biochemistry 67 (3): 437.
- ↑ Cooper, Geoffrey M.; Robert E. Hausman (2007). "Chapter 12: The Cytoskeleton and Cell Movement". En ASM Press, Washington. The cell: a molecular approach (en inglés). ISBN 0878932194.
- ↑ "Táboa das constantes de asociación e disociación das diferentes especies de monómeros ao filamento de actina, segundo a literatura científica.".
- ↑ Kirschner, M.W. (1980). "Implications of treadmilling for the stability and polarity of actin and tubulin polymers in vivo" (w). The Journal of Cell Biology 86 (1): 330–334. PMID 6893454. doi:10.1083/jcb.86.1.330.
- ↑ Lewin, Benjamin (2006). Jones & Bartlett Publishers, ed. Cells (Google books) (en inglés). ISBN 9780763739058.
- ↑ Zhang, Duan-Sun; Valeria Piazza, Benjamin J. Perrin, Agnieszka K. Rzadzinska, J. Collin Poczatek, Mei Wang, Haydn M. Prosser, James M. Ervasti, David P. Corey, Claude P. Lechene (15-01-2012). "Multi-isotope imaging mass spectrometry reveals slow protein turnover in hair-cell stereocilia". Nature (en inglés) 481 (7382): 520–524. ISSN 0028-0836. doi:10.1038/nature10745. Consultado o 27-01-2012.
- ↑ THE STRUCTURE OF CRYSTALLINE PROFILIN-BETA-ACTIN Protein Data Bank
- ↑ Domínguez, R (2004). "Actin-binding proteins--a unifying hypothesis." 29 (11): 572–8. PMID 15501675.
- ↑ Goldschmidt-clermont, P.J.; Furman, M.I.; Wachsstock, D.; Safer, D.; Nachmias, V.T.; Pollard, T.D. (1992). "The control of actin nucleotide exchange by thymosin β 4 and profilin. A potential regulatory mechanism for actin polymerization in cells". Molecular Biology of the Cell 3 (9): 1015–1024.
- ↑ Witke, W., Podtelejnikov, A., Di Nardo, A., Sutherland, J., Gurniak, C., Dotti, C., and M. Mann (1998) In Mouse Brain Profilin I and Profilin II Associate With Regulators of the Endocytic Pathway and Actin Assembly. The EMBO Journal 17(4): 967-976. Entrez Pubmed 9463375. PMID 9463375.
- ↑ Carlsson L, Nyström LE, Sundkvist I, Markey F, Lindberg U. (1977) Actin polymerizability is influenced by profilin, a low molecular weight protein in non-muscle cells. J. Mol. Biol. 115:465-483 Entrez Pubmed 563468. PMID 563468.
- ↑ Kiselar, J., Janmey, P., Almo, S., Chance, M. (2003). "Visualizing the Ca2+-dependent activation of gelsolin by using synchrotron footprinting". PNAS 100 (7): 3942–3947. PMID 12655044. doi:10.1073/pnas.0736004100. Arquivado dende o orixinal o 01 de outubro de 2007. Consultado o 07 de novembro de 2014.
- ↑ Southwick, Frederick S. (2000). "Gelsolin and ADF/cofilin enhance the actin dynamics of motile cells". Proceedings of the National Academy of Sciences of the United States of America 97 (13): 6936. PMID 10860951. doi:10.1073/pnas.97.13.6936. Arquivado dende o orixinal o 25 de setembro de 2019. Consultado o 07 de novembro de 2014.
- ↑ Caldwell, J.E.; Heiss, S.G.; Mermall, V.; Cooper, J.A. (1989). "Effects of CapZ, an actin-capping protein of muscle, on the polymerization of actin" (w). Biochemistry 28 (21): 8506–8514. doi:10.1021/bi00447a036.
- ↑ Weber, A.; Pennise, C.R.; Babcock, G.G.; Fowler, V.M. (1994). "Tropomodulin caps the pointed ends of actin filaments" (PDF). The Journal of Cell Biology 127 (6): 1627–1635. PMID 7798317. doi:10.1083/jcb.127.6.1627.
- ↑ Robinson RC, Turbedsky K, Kaiser DA, Marchand JB, Higgs HN, Choe S, Pollard TD. (2001) Crystal structure of Arp2/3 complex (en inglés). Science 294(5547):1679-84.
- ↑ Mullins, R. D.; Pollard, T.D. (abril 1999). Elsevier, ed. "Structure and function of the Arp2/3 complex". Current Opinion in Structural Biology 9 (2): 244–249. doi:10.1016/S0959-440X(99)80034-7. Arquivado dende o orixinal o 07 de novembro de 2014. Consultado o 2007-10-03.
- ↑ Laura M Machesky; Kathleen L Gould (febreiro 1999). "The Arp2/3 complex: a multifunctional actin organizer". Current Opinion in Cell Biology 11 (1): 117–121. doi:10.1016/S0955-0674(99)80014-3. Arquivado dende o orixinal o 05 de xullo de 2009. Consultado o 07 de novembro de 2014.
- ↑ Morton, W.M.; Ayscough, K.R.; McLaughlin, P.J. (2000). "Latrunculin alters the actin-monomer subunit interface to prevent polymerization" (PDF). Nature Cell Biology 2 (6): 376–378. doi:10.1038/35014075.
- ↑ 56,0 56,1 Cooper, J.A. (1987). "Effects of cytochalasin and phalloidin on actin" (PDF). The Journal of Cell Biology 105 (4): 1473–1478. doi:10.1083/jcb.105.4.1473.
- ↑ Rubtsova, S.N.; Kondratov, R.V.; Kopnin, P.B.; Chumakov, P.M.; Kopnin, B.P.; Vasiliev, J.M. (1998). "Disruption of actin microfilaments by cytochalasin D leads to activation of p53". FEBS Letters 430 (3): 353–357. doi:10.1016/S0014-5793(98)00692-9.
- ↑ Staves, M.P.; Wayne, R.; Leopold, A.C. (1997). "Cytochalasin D does not inhibit gravitropism in roots". American Journal of Botany 84 (11): 1530–1530. doi:10.2307/2446614. Arquivado dende o orixinal o 25 de setembro de 2019. Consultado o 01 de febreiro de 2019.
- ↑ 59,0 59,1 Grummt, I (2006). "Actin and myosin as transcription factors". Current opinion in genetics & development 16 (2): 191–196. doi:10.1016/j.gde.2006.02.001. Arquivado dende o orixinal (w) o 30 de xuño de 2018. Consultado o 07 de novembro de 2014.
- ↑ M.V. Wakelam, T.R. Insall (2005). "Phospholipase D activity is essential for actin localization and actin-based motility in Dictyostelium" (w). Biochemical Journal 389 (Pt 1): 207. doi:10.1042/BJ20050085.
- ↑ Randall, D.; Burggren, W. et French, K. Eckert Fisiología animal (4ª ed.). ISBN 84-486-0200-5.
- ↑ Pujol-Moix (2001). Elsevier, España, ed. Trombocitopenias (en castelán) (2da ed.). p. 25. ISBN 8481745952.
- ↑ 63,0 63,1 63,2 Paniagua, R.; Nistal, M.; Sesma, P.; Álvarez-Uría, M.; Fraile, B.; Anadón, R. e José Sáez, F. (2002). McGraw-Hill Interamericana de España, S.A.U., ed. Citología e histología vegetal y animal. ISBN 84-486-0436-9.
- ↑ 64,0 64,1 Moseley, James B.; Goode, Bruce L. (2006). "The Yeast Actin Cytoskeleton: from Cellular Function to Biochemical Mechanism". Microbiology and Molecular Biology Reviews 70 (3): 605–645. PMID 16959963. doi:10.1128/MMBR.00013-06.
- ↑ Meagher, R.B.; McKinney, E.C.; Kandasamy, M.K. (1999). "Isovariant Dynamics Expand and Buffer the Responses of Complex Systems: The Diverse Plant Actin Gene Family". The Plant Cell Online 11 (6): 995–1006.
- ↑ Entrada PDBe para 1unc. EBI.
- ↑ 67,0 67,1 Higaki, T.; Sano, T.; Hasezawa, S. (2007). "Actin microfilament dynamics and actin side-binding proteins in plants" (PDF). Current Opinion in Plant Biology 10 (6): 549–556. doi:10.1016/j.pbi.2007.08.012. (require subscrición (?)).
- ↑ Kovar, D.R.; Staiger, C.J.; Weaver, E.A.; McCurdy, D.W. (2000). "AtFim1 is an actin filament crosslinking protein from Arabidopsis thaliana". The Plant Journal 24 (5): 625–636. doi:10.1046/j.1365-313x.2000.00907.x.
- ↑ Zheng B, Han M, Bernier M, Wen JK (maio de 2009). "Nuclear actin and actin-binding proteins in the regulation of transcription and gene expression". FEBS J. 276 (10): 2669–85. PMC 2978034. PMID 19459931. doi:10.1111/j.1742-4658.2009.06986.x.
- ↑ Antoni Bayés de Luna, VV Staff, José López-Sendón, Fause Attie, Eduardo Alegría Ezquerra Cardiología Clínica (en castelán). Publicado por Elsevier España, 2002; páx. 19. ISBN 84-458-1179-7
- ↑ 71,0 71,1 John W. Baynes, Marek H. Dominiczak Bioquímica médica (en castelán). Publicado por Elsevier España, 2007; páx. 268. ISBN 84-8174-866-8
- ↑ Randall, D.; Burggren, W. et French, K. Eckert Fisiología animal (4ª ed.). ISBN 84-486-0200-5.
- ↑ Fujiwara, K.; Porter, M.E.; Pollard, T.D. (1978). "Alpha-actinin localization in the cleavage furrow during cytokinesis" (PDF). The Journal of Cell Biology 79 (1): 268–275. PMID 359574. doi:10.1083/jcb.79.1.268.
- ↑ Pelham, R.J.; Chang, F. (2002). "Actin dynamics in the contractile ring during cytokinesis in fission yeast". Nature 419 (6902): 82–86.
- ↑ Mashima, T.; Naito, M.; Noguchi, K.; Miller, D.K.; Nicholson, D.W.; Tsuruo, T. (1997). "Actin cleavage by CPP-32/apopain during the development of apoptosis" (w). Oncogene 14 (9): 1007–1012. doi:10.1038/sj.onc.1200919.
- ↑ Wang, K.K.W. (2000). "Calpain and caspase: can you tell the difference?" (w). Trends in Neurosciences 23 (1): 20–26. doi:10.1016/S0166-2236(99)01479-4. (require subscrición (?)).
- ↑ Villa, P.G. (1998). "Calpain inhibitors, but not caspase inhibitors, prevent actin proteolysis and DNA fragmentation during apoptosis" (PDF). Journal of Cell Science 111 (6): 713–722.
- ↑ Huot, J.; Houle, F.; Rousseau, S.; Deschesnes, R.G.; Shah, G.M.; Landry, J. (1998). "SAPK2/p38-dependent F-Actin Reorganization Regulates Early Membrane Blebbing during Stress-induced Apoptosis". The Journal of Cell Biology 143 (5): 1361–1373.
- ↑ Adams, C.L.; Nelson, W.J.; Smith, S.J. (1996). "Quantitative analysis of cadherin-catenin-actin reorganization during development of cell-cell adhesion" (w). The Journal of Cell Biology 135 (6): 1899–1911. PMID 8991100. doi:10.1083/jcb.135.6.1899.
- ↑ Witke, W.; Schleicher, M.; Noegel, A.A. (1992). "Redundancy in the microfilament system: abnormal development of Dictyostelium cells lacking two F-actin cross-linking proteins". Cell 68 (1): 53–62.
- ↑ Fernandez-valle, C.; Gorman, D.; Gomez, A.M.; Bunge, M.B. (1997). "Actin Plays a Role in Both Changes in Cell Shape and Gene- Expression Associated with Schwann Cell Myelination". Journal of Neuroscience 17 (1): 241–250.
- ↑ Wolyniak, Michael J.; Sundstrom, Paula (2007). "Role of Actin Cytoskeletal Dynamics in Activation of the Cyclic AMP Pathway and HWP1 Gene Expression in Candida albicans". Eukaryotic Cell 6 (10): 1824–1840. PMID 17715368. doi:10.1128/EC.00188-07.
- ↑ Tanaka, Hiromitsu; Iguchi, Naoko; Egydio De Carvalho, Carlos; Tadokoro, Yuko; Yomogida, Kentaro; Nishimune, Yoshitake (2003). "Novel Actin-Like Proteins T-ACTIN 1 and T-ACTIN 2 Are Differentially Expressed in the Cytoplasm and Nucleus of Mouse Haploid Germ Cells". Biology of Reproduction 69 (2): 475–482. PMID 12672658. doi:10.1095/biolreprod.103.015867.
- ↑ Jiang, Y.W.; Stillman, D.J. (1996). "Epigenetic effects on yeast transcription caused by mutations in an actin-related protein present in the nucleus" (w). Genes & Development 10 (5): 604–619. doi:10.1101/gad.10.5.604.
- ↑ Manor, U.; Kachar, B. (2008). "Dynamic length regulation of sensory stereocilia". Seminars in Cell and Developmental Biology 19 (6): 502–510. Arquivado dende o orixinal o 17 de xuño de 2018. Consultado o 20 de xuño de 2009.
- ↑ Rzadzinska, A.K.; Schneider, M.E.; Davies, C.; Riordan, G.P.; Kachar, B. (2004). "An actin molecular treadmill and myosins maintain stereocilia functional architecture and self-". Journal of Cell Biology 164 (6): 887–897. Consultado o 20 de xuño de 2009.
- ↑ Su AI, Wiltshire T, Batalov S, Lapp H, Ching KA, Block D, Zhang J, Soden R, Hayakawa M, Kreiman G, Cooke MP, Walker JR, Hogenesch JB (2004). "A gene atlas of the mouse and human protein-encoding transcriptomes". Proc Natl Acad Sci U S A. 101 (16). PMID 15075390. Arquivado dende o orixinal o 15 de outubro de 2018. Consultado o 07 de novembro de 2014.
- ↑ 88,0 88,1 "Uniprot ACTA1" (en inglés). Consultado o 26 de decembro de 2008.
- ↑ 89,0 89,1 Friederike S Bathe, Heidi Rommelaere e Laura M Machesky (2007): Phenotypes of Myopathy-related Actin Mutants in differentiated C2C12 Myotubes. BMC Cell Biology, 8:2. doi:10.1186/1471-2121-8-2
- ↑ Kaindl AM, Rüschendorf F, Krause S, Goebel HH, Koehler K, Becker C, Pongratz D, Müller-Höcker J, Nürnberg P, Stoltenburg-Didinger G, Lochmüller H, Huebner A. (2004). "Missense mutations of ACTA1 cause dominant congenital myopathy with cores". J Med Genet. 41 (11). PMID 15520409.
- ↑ Sparrow, JC; Nowak KJ, Durling HJ, Beggs AH, Wallgren-Pettersson C, Romero N, Nonaka I, Laing NG. (2003). "Muscle disease caused by mutations in the skeletal muscle alpha-actin gene (ACTA1)". Neuromuscul Disord. 13 (8): 519–31. PMID 12921789.
- ↑ North, Kathryn (2002). "Nemaline Myopathy". Gene Reviews. PMID.
- ↑ Ilkovski B, Nowak KJ, Domazetovska A, Maxwell AL, Clement S, Davies KE, Laing NG, North KN, Cooper ST. (2004). "Evidence for a dominant-negative effect in ACTA1 nemaline myopathy caused by abnormal folding, aggregation and altered polymerization of mutant actin isoforms". Hum. Mol. Genet. 13 (16). PMID 15198992.
- ↑ Clarke NF, Ilkovski B, Cooper S, Valova VA, Robinson PJ, Nonaka I, Feng JJ, Marston S, North K (2007). "The pathogenesis of ACTA1-related congenital fiber type disproportion". Ann Neurol 61 (6). PMID 17387733.
- ↑ "Structure, chromosome location, and expression of the human smooth muscle (enteric type) γ-actin gene: evolution of six human actin genes". Mol Cell Biol. 11 (6). 1991. PMID 1710027.
- ↑ Watson MB, Lind MJ, Smith L, Drew PJ, Cawkwell L. (2007). "Expression microarray analysis reveals genes associated with in vitro resistance to cisplatin in a cell line model". Acta Oncol. 46 (5). PMID 17562441.
- ↑ Guo DC, Pannu H, Tran-Fadulu V, Papke CL, Yu RK, Avidan N, Bourgeois S, Estrera AL, Safi HJ, Sparks E, Amor D, Ades L, McConnell V, Willoughby CE, Abuelo D, Willing M, Lewis RA, Kim DH, Scherer S, Tung PP, Ahn C, Buja LM, Raman CS, Shete SS, Milewicz DM. (2007). "Mutations in smooth muscle alpha-actin (ACTA2) lead to thoracic aortic aneurysms and dissections". Nature Genet. 39 (12). PMID 17994018.
- ↑ Guo; Papke CL, Tran-Fadulu V, Regalado ES, Avidan N, Johnson RJ, Kim DH, Pannu H, Willing MC, Sparks E, Pyeritz RE, Singh MN, Dalman RL, Grotta JC, Marian AJ, Boerwinkle EA, Frazier LQ, LeMaire SA, Coselli JS, Estrera AL, Safi HJ, Veeraraghavan S, Muzny DM, Wheeler DA, Willerson JT, Yu RK, Shete SS, Scherer SE, Raman CS, Buja LM, Milewicz DM. (2009). "Mutations in smooth muscle alpha-actin (ACTA2) cause coronary artery disease, stroke, and Moyamoya disease, along with thoracic aortic disease". Am J Human Genet (en inglés) 84 (5): 617–27. PMID 19409525.
- ↑ Akpolat N, Yahsi S, Godekmerdan A, Yalniz M, Demirbag K (2005). "The value of alpha-SMA in the evaluation of hepatic fibrosis severity in hepatitis B infection and cirrhosis development: a histopathological and immunohistochemical study". Histopathology 47 (3). PMID 16115228.
- ↑ Hamada H, Petrino MG, Kakunaga T. (1982). "Molecular structure and evolutionary origin of human cardiac muscle actin gene". Proc Natl Acad Sci U S A. 79 (19). PMID 6310553.
- ↑ 101,0 101,1 Olson TM, Michels VV, Thibodeau SN, Tai YS, Keating MT. (1998). "Actin mutations in dilated cardiomyopathy, a heritable form of heart failure.". Science 280 (5364). PMID 9563954.
- ↑ Xia X-G, Zhou H, Samper E, Melov S, Xu Z (2006) Pol II–Expressed shRNA Knocks Down Sod2 Gene Expression and Causes Phenotypes of the Gene Knockout in Mice. PLoS Genet 2(1): e10. doi:10.1371/journal.pgen.0020010
- ↑ "OMIM 102540" (en inglés). Consultado o 01 de febreiro de 2019.
- ↑ Matsson H, Eason J, Bookwalter CS, Klar J, Gustavsson P, Sunnegårdh J, Enell H, Jonzon A, Vikkula M, Gutiérrez I, Granados-Riveron J, Pope M, Bu'Lock F, Cox J, Robinson TE, Song F, Brook DJ, Marston S, Trybus KM, Dahl N. (2008). "Alpha-cardiac actin mutations produce atrial septal defects.". Hum Mol Genet. 17 (2). PMID 17947298.
- ↑ Kabaeva, Kabaeva,Z (2003). "Genetic analysis in hypertrophic cardiomyopathy: missense mutations in the ventricular myosin regulatory light chain gene" (Disertación) (en inglés). Universidade Humboldt de Berlín. Consultado o 27 de decembro de 2008.
- ↑ Olson TM, Doan TP, Kishimoto NY, Whitby FG, Ackerman MJ, Fananapazir L. Inherited and de novo mutations in the cardiac actin gene cause hypertrophic cardiomyopathy (en inglés). J Mol Cell Cardiol 2000; 32:1687-1694.
- ↑ Carlos Darío Ramírez; Raúl Padrón (2004). Invest. clín, mar. 2004, vol.45, no.1, p.69-100, ed. "Cardiomiopatía hipertrófica familiar: Genes, mutaciones y modelos animales. Revisión." (en castelán). Consultado o 15 de xullo de 2009.
- ↑ Kaski JP, Syrris P, Burch M, Tomé-Esteban MT, Fenton M, Christiansen M, Andersen PS, Sebire N, Ashworth M, Deanfield JE, McKenna WJ, Elliott PM. (2008). "Idiopathic restrictive cardiomyopathy in children is caused by mutations in cardiac sarcomere protein genes". Heart 94 (11). PMID 18467357.
- ↑ Klaassen S, Probst S, Oechslin E, Gerull B, Krings G, Schuler P, Greutmann M, Hürlimann D, Yegitbasi M, Pons L, Gramlich M, Drenckhahn JD, Heuser A, Berger F, Jenni R, Thierfelder L. (2008). "Mutations in sarcomere protein genes in left ventricular noncompaction". Circulation 117 (22). PMID 1850600.
- ↑ "ACEVieW:Homo sapiens complex locus ACTB, encoding actin, β." (en inglés). Consultado o 28 de xuño de 2008.
- ↑ Chang KW, Yang PY, Lai HY, Yeh TS, Chen TC, Yeh CT. (2006). "Identification of a novel actin isoform in hepatocellular carcinoma". Hepatol Res. 36 (1). PMID 16824795.
- ↑ Kristy L Williams, Masuma Rahimtula yKaren M Mearow. Hsp27 and axonal growth in adult sensory neurons in vitro BMC Neuroscience 2005, 6:24doi:10.1186/1471-2202-6-24
- ↑ Atlas of Genetics and Cytogenetics in Oncology and Haematology (ed.). "Pericytoma with t(7;12)". Consultado o 28 de decembro de 2008.
- ↑ Procaccio V, Salazar G, Ono S, Styers ML, Gearing M, Dávila A, Jiménez R, Juncos J, Gutekunst CA, Meroni G, Fontanella B, Sontag E, Sontag JM, Faundez V, Wainer BH. (2006). "A mutation of β -actin that alters depolymerization dynamics is associated with autosomal dominant developmental malformations, deafness, and dystonia". Am J Hum Genet 78 (6). PMID 16685646.
- ↑ Nunoi H, Yamazaki T, Tsuchiya H, Kato S, Malech HL, Matsuda I, Kanegasaki S. (1999). "A heterozygous mutation of β-actin associated with neutrophil dysfunction and recurrent infection". Proc Natl Acad Sci U S A. 96 (15). PMID 10411937.
- ↑ 116,0 116,1 "ACEVIEW ACTG1" (en inglés). Consultado o 29 de decembro de 2008.
- ↑ Erba HP, Gunning P, Kedes L. (1986). "Nucleotide sequence of the human γ cytoskeletal actin mRNA: anomalous evolution of vertebrate non-muscle actin genes.". Nucleic Acids Res. 14 (13). PMID 373740.
- ↑ Bryan, KE; Rubenstein, PA (2009). "Allele-specific Effects of Human Deafness {γ}-Actin Mutations (DFNA20/26) on the Actin/Cofilin Interaction". J Biol Chem. (en inglés) 284 (27): 18260–9. PMID 19419963.
- ↑ Sonnemann KJ, Fitzsimons DP, Patel JR, Liu Y, Schneider MF, Moss RL, Ervasti JM. (2006). "Cytoplasmic γ-actin is not required for skeletal muscle development but its absence leads to a progressive myopathy.". Dev Cell 11 (3). PMID 16950128.
- ↑ Gouin, E. (1999). "A comparative study of the actin-based motilities of the pathogenic bacteria Listeria monocytogenes, Shigella flexneri and Rickettsia conorii" (w). Journal of Cell Science 112 (11): 1697–1708.
- ↑ Lambrechts, A; Gevaert K, Cossart P, Vandekerckhove J, Van Troys M. (2008). "Listeria comet tails: the actin-based motility machinery at work". Trends Cell Biol. (en inglés) 18 (5): 220–7. PMID 18396046.
- ↑ Gouin, E.; Welch, M.D.; Cossart, P. (2005). "Actin-based motility of intracellular pathogens". Current Opinion in Microbiology 8 (1): 35–45. Arquivado dende o orixinal o 23 de xuño de 2018. Consultado o 07 de novembro de 2014.
- ↑ Parks, QM; Young RL, Poch KR, Malcolm KC, Vasil ML, Nick JA. (2009). "Neutrophil enhancement of Pseudomonas aeruginosa biofilm development: human F-actin and DNA as targets for therapy". J med microbiol: 492–502 pmid=19273646. doi:10.1099/jmm.0.005728-0.
- ↑ Liu; Belkina NV, Shaw S. (2009). "HIV infection of T cells: actin-in and actin-out". Sci Signal. (en inglés) 2. PMID 19366992.
- ↑ Machesky LM; Tang HR (2009). "Actin-Based Protrusions: Promoters or Inhibitors of Cancer Invasion?". Cancer Cell. 16 (1): 5–7. PMID 19573806.
- ↑ Miwa, T. Manabe (1991). "The nucleotide sequence of a human smooth muscle (enteric type) γ-actin cDNA.". Molecular and Cellular Biology 11 (6): 3296–3306.
- ↑ Erickson, H.P (2007). "Evolution of the cytoskeleton". BioEssays: news and reviews in molecular, cellular and developmental biology 29 (7): 668.
- ↑ Gardiner, J (2008). "Are histones, tubulin, and actin derived from a common ancestral protein?". Protoplasma 233: 1. doi:10.1007/s00709-008-0305-z.
- ↑ J.A (2009). "Actin and endocytosis: mechanisms and phylogeny". Current Opinion in Cell Biology 21: 20. doi:10.1016/j.ceb.2009.01.0. Arquivado dende o orixinal o 14 de xuño de 2018. Consultado o 07 de novembro de 2014.
- ↑ Van Den Ent, F.; Amos, L.A.; Löwe, J. (2001). "Prokaryotic origin of the actin cytoskeleton" (PDF). Nature 413: 39–44. doi:10.1038/35092500. Arquivado dende o orixinal (w) o 18 de abril de 2007. Consultado o 07 de novembro de 2014.
- ↑ Carballido-lopez, Rut (2006). "The Bacterial Actin-Like Cytoskeleton" (w). Microbiology and Molecular Biology Reviews 70 (4): 888–909. PMID 17158703. doi:10.1128/MMBR.00014-06.
- ↑ J (2001). "Light-controlled molecular shuttles made from motor proteins carrying cargo on engineered surfaces". Nano Letters 1 (5): 235–239. doi:10.1021/nl015521e.
- ↑ Mansson, A. Sundberg (2005). "Actin-Based Molecular Motors for Cargo Transportation in Nanotechnology—Potentials and Challenges". IEEE Transactions on Advanced Packaging 28 (4): 547–555.
- ↑ Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F (2002) Accurate normalisation of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes Arquivado 27 de maio de 2020 en Wayback Machine.. Gen. Biol. 3: 1–12.
- ↑ Selvey, S.; Thompson, E.W.; Matthaei, K.; Lea, R.A.; Irving, M.G.; Griffiths, L.R. (2001). "ß-Actin". Molecular and cellular Probes 15 (5): 307–311. Arquivado dende o orixinal o 04 de xuño de 2018. Consultado o 7 de xullo de 2009.
- ↑ Mukai, K.; Schollmeyer, J.V.; Rosai, J. (1981). "Immunohistochemical localization of actin: Applications in surgical pathology". The American Journal of Surgical Pathology 5 (1): 91. Consultado o 2009-04-19.
- ↑ Haddad, F.; Roy, R.R.; Zhong, H.; Edgerton, V.R.; Baldwin, K.M. (2003). "Atrophy responses to muscle inactivity. II. Molecular markers of protein deficits". Journal of Applied Physiology 95 (2): 791–802. Arquivado dende o orixinal o 21 de outubro de 2009. Consultado o 19 de marzo de 2009.
- ↑ Remignon, H.; Molette, C.; Babile, R.; Fernandez, X. (2006). "Current advances in proteomic analysis and its use for the resolution of poultry meat quality" (PDF). World's Poultry Science Journal 62 (01): 123–130. Arquivado dende o orixinal (PDF) o 07 de novembro de 2014. Consultado o 7 de xello de 2009.
- ↑ M.L. (2004). "Methods and Instruments in Applied Food Analysis". Handbook of Food Analysis. Arquivado dende o orixinal o 12 de agosto de 2016. Consultado o 7 de xullo de 2009.
- ↑ Halliburton, W.D. (1887). "On muscle plasma". J. Physio. (8). PMID 16991477.
- ↑ Szent-Gyorgyi, A. (1945) Studies on muscle. Acta Physiol Scandinav 9 (suplemento. 25)
- ↑ Straub, F.B. e Feuer, G. (1950). "Adenosinetriphosphate the functional group of actin.". Biochim.Biophys. Acta. PMID 2673365.
- ↑ Bárány, M., Barron, J.T., Gu, L., e Bárány, K. (2001). "Exchange of the actin-bound nucleotide in intact arterial smooth muscle". J. Biol. Chem. 276 (51). PMID 11602582.
- ↑ Holmes KC, Popp D, Gebhard W, Kabsch W (1990). "Atomic model of the actin filament". Nature 347 (6288). PMID 2395461.
- ↑ Oriol, C; Dubord, C e Landon, F (1977). "Crystallization of native striated-muscle actin". FEBS Lett. (en inglés) 73 (1): 89–91. PMID 320040.
- ↑ Sawaya MR, Kudryashov DS, Pashkov I, Adisetiyo H, Reisler E, Yeates TO. (2008). "Multiple crystal structures of actin dimers and their implications for interactions in the actin filament". Acta Crystallogr D Biol Crystallogr. PMID 18391412.
- ↑ Narita; Takeda S, Yamashita A, Maéda Y. (2006). "Structural basis of actin filament capping at the barbed-end: a cryo-electron microscopy study" (PDF). Embo J (en inglés) 25 (23): 5626–33. doi:10.1038/sj.emboj.7601395. Consultado o 27 de xuño de 2009.
Véxase tamén
[editar | editar a fonte]| Wikimedia Commons ten máis contidos multimedia na categoría: Actina |