Hexoquinase
| Hexoquinase | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Estrutura cristalina da hexoquinase 1 do lévedo Kluyveromyces lactis.[1] | |||||||||
| Identificadores | |||||||||
| Número EC | 2.7.1.1 | ||||||||
| Número CAS | 9001-51-8 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||

| |
| Hexoquinase 1, homodimer, Human | |
| Identificadores | |
| Símbolo | HK1 |
| Entrez | 3098 |
| HUGO | 4922 |
| OMIM | |
| RefSeq | NM_000188 |
| UniProt | P19367 |
| Outros datos | |
| Locus | Cr. 10 q22 |
| Identificadores | |
| Símbolo | HK2 |
| Entrez | 3099 |
| HUGO | 4923 |
| OMIM | |
| RefSeq | NM_000189 |
| UniProt | P52789 |
| Outros datos | |
| Locus | Cr. 2 p13 |
| Identificadores | |
| Símbolo | HK3 |
| Entrez | 3101 |
| HUGO | 4925 |
| OMIM | |
| RefSeq | NM_002115 |
| UniProt | P52790 |
| Outros datos | |
| Locus | Cr. 5 q35.2 |
| Hexoquinase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura cristalina da glicoquinase humana | |||||||||
| Identificadores | |||||||||
| Símbolo | Hexokinase_1 | ||||||||
| Pfam | PF00349 | ||||||||
| Pfam clan | CL0108 | ||||||||
| InterPro | IPR022672 | ||||||||
| PROSITE | PDOC00370 | ||||||||
| SCOPe | 1cza / SUPFAM | ||||||||
| |||||||||
| Hexoquinase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 hexoquinase tipo i do cerebro de rata en complexo coa glicosa e o inhibidor glicosa 6-fosfato | |||||||||
| Identificadores | |||||||||
| Símbolo | Hexokinase_2 | ||||||||
| Pfam | PF03727 | ||||||||
| Pfam clan | CL0108 | ||||||||
| InterPro | IPR022673 | ||||||||
| PROSITE | PDOC00370 | ||||||||
| SCOPe | 1cza / SUPFAM | ||||||||
| |||||||||
A hexoquinase é un encima que fosforila hexosas (azucres de seis carbonos), formando hexosas fosfato. Na maioría dos organismos a glicosa é o substrato máis importante para as hexoquinases, e a glicosa 6-fosfato é o seu produto máis importante.
As hexoquinases normais non deberían confundirse coa glicoquinase, a cal é unha isoforma específica da hexoquinase presente en certos tecidos (principalmente no fígado). As outras hexoquinases poden fosforilar varias hexosas, pero a glicoquinase actúa cunha afinidade de substrato 50 veces menor e nas células só ten como substrato a glicosa.
Variación
[editar | editar a fonte]Descubríronse xenes que codifican a hexoquinase en todos os dominios da vida, en seres vivos tan variados como as bacterias, lévedos, plantas e humanos e outros vertebrados. Clasifícanse como proteínas con pregamento de actina, que comparten un núcleo do sitio de unión para o ATP común que está rodeado de secuencias máis variables que determinan as afinidades de substrato e outras propiedades.
Nunha mesma especie poden aparecer varias isoformas ou isoencimas da hexoquinase que teñen diferentes funcións.
Reacción
[editar | editar a fonte]As reaccións intracelulares mediadas polas hexoquinases poden ser tipificadas como:
- Hexosa-CH2OH + MgATP2−
→ Hexosa-CH2O-PO2−
3 + MgADP−
+ H+
onde hexosa-CH2OH representa calquera hexosa (como a glicosa) que conteña un resto accesible -CH2OH.
Consecuencias da fosforilación da hexosa
[editar | editar a fonte]A fosforilación dunha hexosa como a glicosa xeralmente fai que a hexosa quede limitada a realizar diversos procesos metabólicos intracelulares, como a glicólise ou síntese de glicóxeno. Isto débese a que as hexosas fosforiladas están cargadas (carga negativa do fosfato) e isto fai que sexa moi difícil que as transporten fóra da célula.
Tamaño das distintas isoformas
[editar | editar a fonte]A maioría das hexoquinases bacterianas teñen aproximadamente 50 kD. Os organismos pluricelulares como plantas e animais adoitan ter máis dunha isoforma de hexoquinase. A maioría son de aproximadamente 100 kD de tamaño e constan de dúas metades (N e C terminal), que comparten moita homoloxía de secuencias. Isto suxire que tiveron unha orixe evolutiva por duplicación e fusión dunha hexoquinase ancestral de 50kD similar á das bacterias.
Tipos de hexoquinase de mamíferos
[editar | editar a fonte]Hai catro isoencimas hexoquinases de mamíferos importantes (Número EC 2.7.1.1) que varían en localizacións subcelulares e cinética con respecto a diferentes substratos e condicións, e funcións fisiolóxicas. Desígnanse como hexoquinases I, II, III, e IV ou hexoquinases A, B, C, e D.
Hexoquinases I, II, e III
[editar | editar a fonte]As hexoquinases I, II, e III denomínanse isoencimas de "baixa Km" porque teñen unha alta afinidade pola glicosa mesmo a baixas concentracións (por debaixo de 1 mM). As hexoquinases I e II seguen a cinética de Michaelis-Menten a concentracións fisiolóxicas dos substratos. As tres son fortemente inhibidas polo seu produto, a glicosa 6-fosfato. As súas masas moleculares son de arredor de 100 kD. Cada unha consta de dúas metades similares de 50kD, pero só na hexoquinase II ambas as metades teñen sitios activos funcionais.
- A hexoquinase I/A encóntrase en todos os tecidos de mamífero, e considérase un "encima de mantemento" (housekeeping enzyme) que non se ve afectado pola maioría dos cambios metabólicos, hormonais e fisiolóxicos.
- A hexoquinase II/B constitúe a principal isoforma regulada en moitos tipos celulares e increméntase en moitos cancros.
- A hexoquinase III/C é inhibida polo seu substrato a glicosa a concentracións fisiolóxicas. Sábese pouco sobre as características regulatorias desta isoforma.
Hexoquinase IV ("glicoquinase")
[editar | editar a fonte]A hexoquinase IV de mamífero, tamén chamada glicoquinase, difire doutras hexoquinases en cinética e funcións.
A fosforilación a nivel subcelular ten lugar cando a glicoquinase se traslada do núcleo celular ao citoplasma nas células hepáticas. A glicoquinase só pode fosforilar a glicosa se a concentración deste substrato é alta dabondo; a súa Km pola glicosa é 100 veces máis alta do que a das hexoquinases I, II, e III.
A hexoquinase IV é monomérica e duns 50kD, mostra cooperatividade positiva coa glicosa, e non é inhibida alostericamente polo seu produto, a glicosa 6-fosfato.
A hexoquinase IV está presente no fígado, páncreas, hipotálamo, intestino delgado, e quizais nalgunhas outras células neuroendócrinas, e xoga un importante papel regulatorio no metabolismo de carbohidratos. Nas células beta dos illotes pancreáticos, serve de sensor da glicosa para controlar a liberación de insulina, e de xeito similar controla a liberación de glicagón nas células alfa. Nos hepatocitos do fígado, a glicoquinase responde aos cambios nos niveis de glicosa no ambiente celular incrementando ou reducindo a síntese de glicóxeno.
A hexoquinase na glicólise
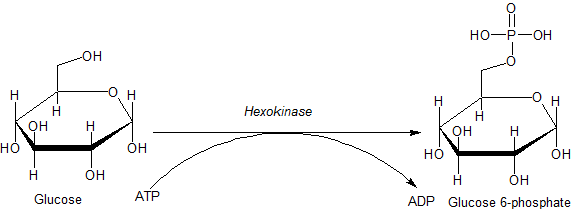
[editar | editar a fonte]A glicosa ten a característica de que pode utilizarse para producir ATP en todas as células, tanto en presenza coma en ausencia de osíxeno (O2). A primeira reacción da glicólise é a fosforilación da glicosa pola hexoquinase.
Ao catalizaren a fosforilación da glicosa para formar glicosa 6-fosfato, as hexoquinases manteñen o gradiente de concentración que favorece o transporte facilitado de glicosa ás células. Esta reacción tamén inicia todas as vías fisioloxicamente relevantes de utilización da glicosa, como a glicólise e a vía da pentosa fosfato.[2] A adición dun grupo fosfato cargado na posición 6 da hexosa asegura que a glicosa e os análogos 2-desoxihexosa da glicosa (por exemplo a 2-desoxiglicosa e a 2-fluoro-2-desoxiglicosa) van quedar "atrapados" dentro das células, xa que a hexosa cargada non pode atravesar facilmente a membrana plasmática e saír da célula.
| D-Glicosa | Hexoquinase | α-D-Glicosa 6-fosfato | |

|

| ||
| ATP | ADP | ||
| |||
Asociación coas mitocondrias
[editar | editar a fonte]As hexoquinases I e II poden asociarse fisicamente á superficie externa da membrana mitocondrial externa ao unirse especificamente a unha porina, ou a unha canle aniónica dependente de voltaxe. Esta asociación dálle á hexoquinase un acceso directo ao ATP xerado pola mitocondria, o cal é un dos dous substratos da hexoquinase (ATP e glicosa). A hexoquinase mitocondrial aumenta moito os seus niveis nas células de tumores malignos de rápido crecemento, chegando a niveis de ata 200 veces maiores dos que hai nos tecidos normais. A hexoquinase unida ás mitocondrias é a forza impulsora[3] das taxas glicolíticas extremadamente altas que se observan en aerobiose nas células tumorais (o chamado efecto Warburg descrito por Otto Heinrich Warburg en 1930).
Notas
[editar | editar a fonte]- ↑ PDB 3O08; Kuettner EB, Kettner K, Keim A, Svergun DI, Volke D (2010). "Crystal structure of dimeric KlHxk1 in crystal form I". doi:10.2210/pdb3o08/pdb.
- ↑ Robey, RB; Hay, N (2006). "Mitochondrial hexokinases, novel mediators of the antiapoptotic effects of growth factors and Akt". Oncogene 25 (34): 4683–96. PMID 16892082. doi:10.1038/sj.onc.1209595.
- ↑ Bustamante E, Pedersen P (1977). "Copia arquivada". Proc Natl Acad Sci USA 74 (9): 3735–9. Bibcode:1977PNAS...74.3735B. PMC 431708. PMID 198801. doi:10.1073/pnas.74.9.3735. Arquivado dende o orixinal o 04 de maio de 2008. Consultado o 06 de decembro de 2013.