Ilt
| Oxygen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Flydende oxygen ved kogepunktet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periodiske system | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtegn | O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | 2, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 16 (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-nummer | E-948 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 15,9994(3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 73 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-radius | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | 1s² 2s² 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner i hver skal | 2, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstrin | −2, −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 3,44 (Paulings skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tilstandsform | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | Kubisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (gas) | 1,429 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | −218,79 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kogepunkt | −182,95 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | −118,56 °C, 5,043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltevarme | (O2) 0,444 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | (O2) 6,82 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmefylde | (O2) 29,378 J·mol–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | 0,02658 W·m–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetiske egenskaber | Paramagnetisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ilt, eller oxygen, er et grundstof med symbolet O og atomnummeret 8.[1] Det er en del af gruppen af chalkogener i det periodiske system, og er et stærkt reaktivt ikkemetal og et oxidationsmiddel, som nemt danner kemiske forbindelser (især oxider) med de fleste andre grundstoffer.[2] Rangeret efter masse er oxygen det tredje-mest forekommende grundstof i universet, efter brint og helium.[3] Ved almindelig temperatur og tryk danner to iltatomer en kemisk binding og danner iltallotropen dioxygen, der er en farveløs og lugtfri diatomisk gas med den kemiske formel O2. Diatomisk oxygen udgør 20,8% af Jordens atmosfære.[4] Iltniveauet i atmosfæren er dog på vej nedad på verdensplan, hvilket muligvis skyldes afbrænding af fossile brændstoffer.[5] Ilt er det mest forekommende grundstof i jordskorpen rangeret efter masse, da oxidforbindelser såsom siliciumdioxid udgør næsten halvdelen af skorpens masse.[6]
Mange større klasser af organiske molekyler i levende organismer indeholder oxygen - heriblandt proteiner, nukleinsyrer (såsom deoxyribonukleinsyre, ofte forkortet "DNA"), kulhydrater og fedtstoffer, og det samme gør de store uorganiske forbindelser i dyrs skjolde, tænder og knogler. Det meste af levende organismers masse er ilt som en komponent i vand, der er den største bestanddel i livsformer. Ilt bruges til aerob respiration og udledes ved fotosyntese, som bruger sollys til at producere ilt fra vand og kuldioxid. Ilt er for kemisk reaktivt til at kunne forblive et frit element i luften, hvis ikke det konstant genopbygges ved levende organismers fotosyntese. En anden iltallotrop, ozon (O3), absorberer ultraviolet B-stråling meget kraftigt, og Jordens højtliggende ozonlag hjælper dermed til at beskytte biosfæren fra ultraviolet stråling. Tættere på jordoverfladen er ozon dog et forurenende stof og et biprodukt af smog. Ved lavt jordkredsløbshøjde eksisterer der nok atomisk ilt til at kunne forårsage korrosion på rumskibe.[7]
Ilt blev opdaget uafhængigt af Carl Wilhelm Scheele i Uppsala i 1773 eller tidligere, og Joseph Priestley i Wiltshire i 1774, men Priestley tilskrives oftest opdagelsen da hans værk blev udgivet først. Ilts kemiske navn, oxygen (egentlig oxygenium), blev dannet i 1777 af Antoine Lavoisier,[8] hvis eksperimenter med ilt var med til at modbevise den ellers meget populære flogiston-teori om forbrænding og korrosion. Navnet stammer fra de græske ordrødder ὀξύς oxys, "syre", bogstaveligt "skarp", som henvisning til syrers sure smag og -γενής -genes, "skaber", fordi man på navngivningens tid fejlagtigt troede at alle syrer krævede ilt i deres sammensætning. Det danske trivialnavn for oxygenmolekylet O2, "ilt", blev dannet af den danske fysiker Hans Christian Ørsted i 1814, og er afledt af ordet "ild", som ilt er en central bestanddel af.[9] Tidligere blev grundstoffet også benævnt surstof, hvilket var en direkte oversættelse af det tyske navn "Sauerstoff" - der selv var en oversættelse af det oprindelige latinske navn.[10]
Blandt den mest udbredte brug af ilt er til åndedræt, respiration, opvarmning af huse, forbrændingsmotorer, produktion af stål, plast og tekstiler, lodning, svejsning og skæring i stål og andre metaller, raketbrændstof, oxygenterapi og livsunderstøttelsessystemer i fly, undervandsbåde, rumskibe og ved dykning.
Historie
[redigér | rediger kildetekst]Tidlige eksperimenter
[redigér | rediger kildetekst]Et af de første kendte eksperimenter med forholdet mellem forbrænding og luft blev udført i det 2. århundrede f.Kr. af den græske ingeniør og mekanikforfatter, Philon af Byzans. I hans værk Pneumatica observerede Philon at det at vende en beholder ned over et brændende lys, og omgive beholderens hals med vand, vil få noget af vandet til at stige op i beholderhalsen.[11] Philon konkluderede dog forkert at dele af luften i beholderen blev konverteret til det klassiske element ild og dermed blev i stand til at undslippe gennem glassets porer. Mange århundreder senere byggede Leonardo da Vinci videre på Philons arbejde ved at observere at en del luft forbruges under forbrænding og respiration.[12]
I det sene 17. århundrede beviste Robert Boyle at luft er nødvendigt for forbrænding. Den engelske kemiker John Mayow (1641–1679) raffinerede dette arbejde ved at vise at ild kun kræver en del af luft som han kaldte spiritus nitroaereus eller blot nitroaereus.[13] I et eksperiment fandt han at ved at placere enten en mus eller et tændt lys i en aflukket beholder over vand kunne han få vandet til at stige og udskifte en fjortendedel af luftens rumfang før testsubjekterne blev udslukket.[14] Fra dette konkluderede han at nitroaereus både forbruges ved respiration og forbrænding.
Mayow observerede at antimon steg i vægt når det blev opvarmet, og udledte heraf at nitroaereus måtte have samlet sig med det.[13] Han mente også at lungerne måtte adskille nitroaereus fra luft, og sende det ind i blodet, og at dyrets varme og muskelbevægelser kommer fra nitroaereus' reaktion med forskellige stoffer i kroppen.[13] Disse og andre eksperimenter og idéer blev udgivet i 1668 i værket Tractatus duo i skriftet "De respiratione".[14]
Flogiston-teorien
[redigér | rediger kildetekst]
Robert Hooke, Ole Borch, Mikhail Lomonosov og Pierre Bayen foretog alle oxygeneksperimenter i det 17. og dele af det 18. århundrede, men ingen af dem anerkendte det som et grundstof.[15] Dette kan delvist skyldes den fremtrædende teori om forbrænding og korrosion, der blev kaldt "flogiston-teorien", som dengang var den foretrukne forklaring på disse processer.
Flogiston-teorien blev etableret i 1667 af den tyske alkymist J. J. Becher, og modificeret af kemikeren Georg Ernst Stahl i 1731.[16] Den anførte at alle brændbare materialer består af to dele: en del, kaldet flogiston, bliver afgivet når substansen, der indeholder den, bliver brændt af, mens den deflogisticerede del mentes at være dens sande form.[12]
Stærkt brændbare materialer, der kun efterlader meget få rester, såsom træ eller kul, mentes hovedsageligt at bestå af flogiston; ikke-brændbare materialer, der korroderer, såsom jern, indeholdt derimod meget lidt. Luft spillede ikke nogen rolle i flogiston-teorien, og der blev heller ikke udført nogle kvantitative eksperimenter til at teste for en sammenhæng; i stedet var den baseret på hvad der kan observeres når noget bliver brændt af: at de fleste almindelige objekter bliver lettere og lader til at 'miste' noget i processen.[12] Det faktum at en substans som træ overordnet set stiger i vægt under afbrænding blev skjult af opdriften af de gasformige forbrændingsprodukter. Et af de første tegn på at flogiston-teorien var forkert var netop at metaller stiger i vægt når de ruster (når de ellers angiveligt skulle miste flogiston).
Opdagelse
[redigér | rediger kildetekst]
Oxygen blev for første gang opdaget af den svenske læge Carl Wilhelm Scheele. Omkring 1772 havde han produceret oxygen i gasform (dvs. ilt) ved at ophede merkurioxid og diverse nitrater.[4][12] Scheele kaldte gassen for "ildluft", da det var den eneste kendte faktor der understøttede forbrænding, og skrev om opdagelsen i et skrift han kaldte Chemische Abhandlung über Luft und Feuer, som han sendte til sin udgiver i 1775. Dokumentet blev først udgivet i 1777.[17] Nogle år senere i 1783, opdager Joseph det også.

I mellemtiden, nærmere bestemt 1. august 1774, udførte den britiske gejstlige Joseph Priestley et eksperiment, hvor han fokuserede sollys på kviksølvoxid (HgO) i et glasrør, hvilket frigav en gas som han navngav "deflogisticeret luft".[4] Han bemærkede at lys brændte lysere i gassen og at en mus var mere aktiv og levede længere når den indåndede den. Efter selv at have indåndet gassen skrev han: "Følelsen af den var for mine lunger ikke sanseligt anderledes end almindelig luft, men jeg syntes at mit bryst føltes særdeles let og nemt i noget tid efter."[15] Priestley udgav sine fund i 1775 i et dokument kaldet "An Account of Further Discoveries in Air", som blev inkluderet i det andet bind af hans bog Experiments and Observations on Different Kinds of Air.[12][18] Priestley tilskrives normalt opdagelsen af oxygen idet han var den første til at udgive sine opdagelser.
Den franske kemiker Antoine Laurent Lavoisier påstod senere at han havde opdaget det nye stof uafhængigt. Priestley besøgte Lavoisier i oktober 1774 og fortalte ham om sit eksperiment og hvordan han frigjorde den nye gas. Scheele skrev også Lavoisier et brev 30. september 1774, hvori han beskrev som opdagelse af det tidligere ukendte stof, men Lavoisier erkendte aldrig at have modtaget det (et kopi af brevet blev fundet blandt Scheeles ejendele efter hans død).[17]
Lavoisiers bidrag
[redigér | rediger kildetekst]Antoine Lavoisier foretog de første passende kvantitative eksperimenter i oxidering, og var den første til korrekt at forklare hvordan forbrænding foregår (skønt dette var bestridt på hans tid).[4] Han brugte disse og lignende eksperimenter, alle påbegyndt i 1774, til at miskreditere flogiston-teorien og bevise at det stof, der blev opdaget af Priestley og Scheele, var et grundstof.

I et eksperiment observerede Lavoisier, at der ikke skete nogen overordnet vægtstigning når tin og luft blev ophedet i en lukket beholder.[4] Han bemærkede, at luft sev ind når han åbnede beholderen, hvilket indikerede, at en del af det indelukkede luft var blevet opbrugt. Han bemærkede også, at tinnet var steget i vægt og, at denne stigning var den samme som vægten på den luft der sev tilbage i beholderen. Dette, samt andre forbrændingseksperimenter, blev dokumenteret i hans bog Sur la combustion en général (Om forbrænding generelt), som blev udgivet i 1777.[4] I den beviste han, at luft er en blanding af to gasser; 'vital luft', som er essentielt for forbrænding og respiration, og azot (græsk ἄζωτον "livløs"), som ikke understøttede nogen af delene. Azot blev senere til "nitrogen", skønt det har beholdt det gamle navn på fransk og flere andre europæiske sprog.[4] Det danske trivialnavn, "kvælstof", er en oversættelse af det tyske "Stickstoff", der henviser til stoffets evne til at "kvæle", eller slukke ild.[19]
Lavoisier omdøbte 'vital luft' til oxygène i 1777 fra den græske rod ὀξύς (oxys) (syre, bogstaveligt "skarp", fra smagen af syre) og -γενής (-genēs) (skaber), da han fejlagtigt troede at oxygen var en nødvendig bestanddel i alle former for syre.[8] Andre kemikere (såsom Sir Humphry Davy i 1812) har senere bevist at Lavoisier tog fejl på dette punkt (grundlaget for syrekemi er hydrogen - ikke oxygen), men på det tidspunkt var navnet allerede udbredt.
Det danske trivialnavn for oxygens normale molekylære form (O2), "ilt", blev første gang brugt af den danske fysiker Hans Christian Ørsted i 1814, og er afledt af ordet "ild", som ilt er nødvendigt for at skabe.[9] I daglig tale bruges oxygen og ilt generelt om det samme, men den korrekte nomenklatur er at anvende "oxygen" om grundstoffet (O), og "ilt" om den almindelige molekyleform (O2), hvis egentlige kemiske betegnelse er '"dioxygen".[a]
Senere historie
[redigér | rediger kildetekst]
John Daltons oprindelige atomiske hypotese gik ud fra, at alle grundstoffer var monatomiske, og at atomerne i forbindelser normalt ville have de simpleste atomforhold overfor hinanden. For eksempel formodede Dalton, at den kemiske formel for vand var HO, og han gav oxygen en atommasse 8 gange større end brints, i stedet for den moderne værdi på 16.[20] I 1805 viste Joseph Louis Gay-Lussac og Alexander von Humboldt at vand dannes af to mængder af hydrogen og en mængde oxygen; og i 1811 var Amedeo Avogadro nået frem til den korrekte fortolkning af vands sammensætning (baseret på det, der nu kaldes Avogadros lov), samt de diatomiske grundstofmolekyler i disse gasser.[21][b]
Ved det sene 19. århundrede indså videnskabsfolk at luft kan gøres flydende, og at dets komponenter kan isoleres ved at komprimere og nedkøle det. Ved brug af en kaskademetode kunne den schweiziske kemiker og fysiker Raoul Pierre Pictet få en svovldioxidvæske til at fordampe, for at kunne væskegøre kuldioxid, som så til gengæld blev fordampet for at køle ilt nok til at væskegøre det. Han sendte 22. december 1877 et telegram til Académie des sciences i Paris, hvor han bekendtgjorde sin opdagelse af flydende oxygen.[22] Blot to dage senere offentliggjorde den franske fysiker Louis Paul Cailletet sin egen metode til at væskegøre oxygen.[22] I begge tilfælde blev der kun produceret nogle få dråber af væsken, og der kunne ikke udføres nogen meningsfuld analyse. Oxygen blev for første gang væskegjort i stabil form 29. marts 1883 af de polske forskere Zygmunt Wróblewski og Karol Olszewski fra Universitet Jagielloński.[23]
I 1891 var den skotske kemiker James Dewar i stand til at producere nok oxygen i væskeform, til at kunne studere det i dybden.[24] Den første kommercielt farbare proces til at producere oxygen i væskeform blev uafhængigt udviklet i 1895 af den tyske ingeniør Carl von Linde, og den britiske ingeniør William Hampson. Begge mænd sænkede luftens temperatur indtil den blev væskeformet, og destillerede de indgående gasser ved at koge dem væk en efter en og indfange dem.[25] Senere, i 1901, blev oxyacetylen-svejsning demonstreret for første gang, da man afbrændte en blanding af acetylen and komprimeret O2. Denne metode til at skære og svejse i metal blev senere meget udbredt.[25]
I 1923 blev den amerikanske forsker Robert H. Goddard den første person til at udvikle en raketmotor, der anvendte flydende brændstof; motoren brugte benzin som brændsel og oxygen i væskeform som oxidationsmiddel. Goddard fløj en lille rakket 56 m ved 97 km/t 16. marts 1926 i Auburn, Massachusetts, USA.[26]
Egenskaber og molekylær struktur
[redigér | rediger kildetekst]Allotroper
[redigér | rediger kildetekst]

Grundstoffet oxygens mest almindelige allotrop på Jorden er ilt, O2, som udgør størstedelen af Jordens atmosfæriske oxygen. O2 har en bindingslængde på 121 pm og en bindingsenergi på 498 kJ·mol−1,[27] som er mindre end energien i andre dobbeltbindinger eller enkeltbindings-par i biosfæren, og ansvarlig for den exotermiske reaktion mellem O2 og ethvert andet organisk molekyle.[28][29] På grund af sit energiindhold bruges O2 af komplekse livsformer, såsom dyr, til cellerespiration.
Trioxygen (O3) kendes normalt som ozon og er et meget reaktivt oxygenallotrop, der er skadeligt for lungevæv.[30] Ozon produceres i den øvre atmosfære når O2 kombineres med atomisk oxygen, der skabes når O2 splittes af UV-stråling.[8] Fordi ozon er stærkt absorberende i UV-regionen af spektrummet, fungerer ozonlaget i den øvre atmosfære som et beskyttende strålingsskjold for planeten.[8] Tættere på Jordens overflade er det et forurenende stof, der dannes som et biprodukt fra bilers udstødning.[30] Det metastabile molekyle tetraoxygen (O4) blev opdaget i 2001,[31][32] og blev formodet at eksistere i en af fast ilts seks faser. I 2006 blev det bevist at denne fase, der blev skabt ved at øge trykket på O2 til 20 GPa, faktisk er en rhombohedral O8 klynge.[33] Denne klynge har potentiale til at kunne blive et meget stærkere oxideringsmiddel end både O2 og O3, og kan derfor bruges til raketbrændstof.[31][32] En metallisk fase blev opdaget i 1990, da fast oxygen blev udsat for tryk på over 96 GPa[34] og i 1998 blev det påvist at ved meget lave temperaturer bliver denne fase superledende.[35]
Fysiske egenskaber
[redigér | rediger kildetekst]
Oxygen opløses nemmere i vand end kvælstof, og i ferskvand nemmere end i saltvand. Vand i ligevægt med luft indeholder omtrent 1 molekyle opløst O2 for hver 2 N2-molekyler (1:2), sammenlignet med et atmosfærisk forhold på omtrent 1:4. Oxygens vandopløselighed er temperaturafhængigt, og der opløses omkring dobbelt så meget (14,6 mg·L−1) ved 0 °C i forhold til ved 20 °C (7,6 mg·L−1).[15][36] Ved 25 °C og 1 standard atmosphere (101,3 kPa) luft indeholder ferskvand omkring 6,04 milliliter (mL) ilt pr. liter, og saltvand indeholder omkring 4,95 mL pr. liter.[37] Ved 5 °C stiger opløseligheden til 9,0 mL (50% mere end ved 25 °C) pr. liter for ferskvand og 7,2 mL (45% mere) pr. liter for saltvand.
| 5 °C | 25 °C | |
|---|---|---|
| Ferskvand | 9,0 mL | 6,04 mL |
| Havvand | 7,2 mL | 4,95 mL |
Oxygen kondenserer ved 90,20 K (−182,95 °C, −297,31 °F), og fryser ved 54,36 K (−218,79 °C, −361,82 °F).[38] Både flydende og fast O2 er klare stoffer med en lys himmelblå farve. Flydende O2 med høj renhed opnås normalt ved fraktioneret destillation af flydende luft.[39] Flydende oxygen kan også kondenseres fra luften ved at bruge flydende kvælstof som en kølevæske.[40]
Oxygen er et stærkt reaktivt stof, og skal adskilles fra brændbare materialer.[40]
Molekylær ilts spektroskopi associeres med de atmosfæriske processer ved polarlys og nathimmellys.[41] Absorberingen i Herzberg-kontinuumet og Schumann–Runge-båndene i det ultraviolette producerer atomisk oxygen, der er en vigtig bestanddel i den midterste atmosfæres kemi.[42] Excited state singlet molecular oxygen is responsible for red chemiluminescence in solution.[43]
Isotoper og stjernemæssig oprindelse
[redigér | rediger kildetekst]
Naturligt forekommende oxygen består af tre stabile isotoper: 16O, 17O og 18O, hvoraf 16O er den mest forekommende (99,762% naturlig forekomst).[44]
De fleste 16O syntetiseres ved enden af deres heliumfusionsproces i massive stjerner, men nogle skabes ved neonforbrændingsprocessen.[45] 17O skabes primært ved afbrænding af brint til helium under CNO-cyklussen, hvilket gør den til en almindeligt forekommende isotop i stjerners brintafbrændingszoner.[45] De fleste 18O produces når 14N (der bliver udbredt fra CNO-afbrænding) fanger en 4He-kerne, hvilket gør 18O mest udbredt i de helium-rige zoner i udviklede, massive stjerner.[45]
14 radioisotoper er blevet beskrevet. De mest stabile er 15O med en halveringstid på 122,24 sekunder og 14O med en halveringstid på 70,606 sekunder.[44] Alle de tilbageværende radioaktive isotoper har halveringstider på mindre end 27 s og størstedelen af disse har halveringstider på mindre end 83 millisekunder.[44] Den mest almindelige henfaldstilstand for isotoper lettere end 16O er β+-henfald[46][47][48] for at afgive kvælstof, og den mest almindelige tilstand for isotoper tungere end 18O er betahenfald for at afgive fluor.[44]
Forekomst
[redigér | rediger kildetekst]| Z | Grundstof | Massefraktion i parter pr. million | ||
|---|---|---|---|---|
| 1 | Hydrogen | 739.000 | 71 × oxygens masse (rød bar) | |
| 2 | Helium | 240.000 | 23 × oxygens masse (rød bar) | |
| 8 | Oxygen | 10400 | ||
| 6 | Kulstof | 4600 | ||
| 10 | Neon | 1340 | ||
| 26 | Jern | 1090 | ||
| 7 | Kvælstof | 960 | ||
| 14 | Silicium | 650 | ||
| 12 | Magnesium | 580 | ||
| 16 | Svovl | 440 | ||
Oxygen er det mest forekommende grundstof, rangeret efter masse, i Jordens biosfære, luft, hav og land. Oxygen er det tredje-mest forekommende grundstof i universet, efter brint og helium.[3] Omkring 0,9% af Solens masse er oxygen.[4] Oxygen udgør 49,2% af Jordens skorpe, rangeret efter masse[6] og er den største bestanddel i verdens have (88,8% rangeret efter masse).[4] Ilt er den næststørste bestanddel i Jordens atmosfære, og står for 20,8% af dens rumfang og 23,1% af dens masse (omkring 1015 ton).[4][50][c] Jorden er usædvanlig blandt Solsystemets planeter idet den har en meget stor koncentration af ilt i atmosfæren: Mars (med 0,1% O2 efter masse) og Venus har væsentligt mindre. Den O2, der omgiver disse planeter produceres udelukkende fra UV-stråling af oxygenindholdige molekyler såsom kuldioxid.
Den usædvanligt høje koncentration af ilt på Jorden er et resultat af oxygencyklusen. Dette stofkredsløb beskriver bevægelsen af oxygen i og mellem dens tre centrale reservoirer på Jorden: atmosfæren, biosfæren og lithosfæren. Den centrale faktor i oxygencyklussen er fotosyntese, som er ansvarlig for den moderne Jords atmosfære. Fotosyntese udleder ilt til atmosfæren, mens respiration, forrådnelse og afbrænding fjerner det fra atmosfæren.

Fri oxygen findes også i opløsning i verdens vandområder. Den øgede opløselighed af O2 ved lavere temperaturer har vigtige implikationer for liv i havene, da havene ved polerne understøtter en meget større mængde af liv på grund af deres højere iltindhold.[51] Vand, der er forurenet med plantenæringsstoffer såsom nitrater eller fosfater kan stimulere algevæksten ved en proces kaldet eutrofiering, og forrådnelsen af disse organismer og andre biomaterialer kan reducere O2-indholdet i eutrofiske vandområder. Videnskabsfolk vurderer normalt dette aspekt af vandkvalitet ved at måle vandets "BOD" (biochemical oxygen demand), eller mængden af O2, der kræves til at genoprette den til sin normale koncentration.[52]
Analyse
[redigér | rediger kildetekst]
Palæoklimatologer måler mængden af oxygen-18 og oxygen-16 i marine organismers skeletter og exoskeletter for at finde frem til hvordan klimaet var for millioner af år siden. Saltvandsmolekyler, der indeholder den lettere isotop oxygen-16 fordamper ved en lidt hurtigere hastighed end vandmolekyler, der indeholder den 12% tungere oxygen-18, og denne ulighed øges yderligere ved lave temperaturer.[53] Under perioder med lave globale temperaturer vil sne og regn fra den fordampede vand derfor have højere indhold af oxygen-16, og det tilbageværende saltvand har ofte højt indhold af oxygen-18. Marine organismer optager derfor mere oxygen-18 i deres skeletter og exoskeletter end de ville i et varmere klima.[53] Palæoklimatologer måler også dette forhold direkte i vandmolekylerne i iskerneprøver, der kan være op til hundreder af tusinde år gamle.
Planetgeologer har målt den relative oxygenisotop-mængde i prøver fra Jorden, Månen, Mars og meteoritter, men har ikke kunnet skaffe referenceværdier for isotopforholdene i Solen, der menes at være det samme som i den oprindelige soltåge. Analyse af siliciumskive, der blev eksponeret til solvinden i rummet og efterfølgende returnerede til Jorden via den nedstyrtede rumsonde Genesis har vist at Solen har en højere proportion af oxygen-16 end Jorden. Målingen tegner et billede af at en ukendt proces fjernede oxygen-16 fra Solens protoplanetariske skive før sammensmeltningen af støvkorn, der dannede Jorden.[54]
Oxygen udgør to spektrofotometriske absorberingsbånd, der topper ved bølgelængderne 687 og 760 nm. Nogle fjernanalyserende forskere har foreslået at bruge målingen af radians fra vegetationskroner i de bånd til at beskrive planters helbredsstatus fra en satellitplatform.[55] Denne tilgang udnytter det faktum at det i de bånd er muligt at adskille vegetationens reflektans fra dens fluorescens, som er langt svagere. Målingen er teknisk besværlig på grund af den lave signal-til-støj-forhold og vegetationens fysiske struktur; men det er blevet foreslået som en mulig metode til at overvåge kulstofkredsløbet fra satellitter på globalt plan.
O2's biologiske rolle
[redigér | rediger kildetekst]Fotosyntese og respiration
[redigér | rediger kildetekst]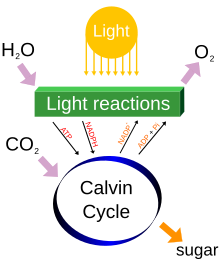
I naturen produceres fri oxygen af lysdrevet opdeling af vand under iltet fotosyntese. Ifølge nogle estimater står grønalger og cyanobakterier i vandområder for omkring 70% af den frie oxygen, der produceres på Jorden, og resten produceres af jordbaserede planter.[56] Visse andre estimater af de oceaniske bidrag til atmosfærisk ilt er højere, mens andre igen er lavere, og foreslår at havene kun producerer ~45% af Jordens ilt hvert år.[57]
En simplificeret overordnet formel for fotosyntese er:[58]
- 6 CO2 + 6 H2O + fotoner → C6H12O6 + 6 O2
eller blot
Der finder fotolytisk oxygenudvikling sted i fotosyntetiske organismers thylakoidmembraner, og denne kræver fire fotoner.[d] Der sker flere skridt, men resultatet er dannelsen af en protongradient henover thylakoidmembranen, som bruges til at syntetisere adenosintrifosfat (ATP) via fotofosforylering.[59] Den tilbageværende O2 (efter produktionen af vandmolekylet) frigives i atmosfæren.[e]
Ilt, O2, er livsvigtigt for cellerespiration i alle aerobe organismer. Ilt bruges i mitokondrierne til at generere ATP ved oxidativ fosforylering. Reaktionen for aerobisk respiration er i essensen den direkte omvendte af fotosyntese, og kan simplificeres som:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2880 kJ·mol−1
I hvirveldyr diffunderer O2 gennem membraner i lungerne og ind i de røde blodlegemer. Hæmoglobin binder O2, og ændrer farve fra en blålig rød til klar rød[30] (CO2 frigives fra en anden del af hæmoglobin gennem Bohreffekten). Andre dyr bruger hæmocyanin (bløddyr og nogle leddyr) eller hæmerythrin (edderkopper og hummere).[50] En liter blod kan opløse 200 cm3 O2.[50]
Frem til opdagelsen af anaerobiske metazoa[60] mentes oxygen at være påkrævet for alt komplekst liv.[61]
Reaktive oxygenforbindelser, såsom superoxid-ion (O2-) og brintoverilte (H2O2), er farlige biprodukter af organismers oxygenforbrug.[50] Dele af højere organismers immunsystemer danner peroxid, superoxide og singleoxygen for at ødelægge invaderende mikrober. Reaktive oxygenforbindelser spiller også en vigtig rolle i planters hypersensitive respons mod patogenangreb.[59] Oxygen er giftigt for obligate anaerobiske organismer, som var den dominerende livsform i det tidlige liv på Jorden indtil O2 begyndte at ophobes i atmosfæren for omkring 2,5 milliarder år siden i det der beskrives som Iltkatastrofen, omkring en milliard år efter disse organismers første fremkomst.[62][63]
Et gennemsnitligt voksent menneske indånder 1,8 til 2,4 gram ilt i minuttet.[64] Dette bliver til mere end 6 milliarder ton ilt, der inhaleres af menneskeheden om året.[f]
Ophobning i atmosfæren
[redigér | rediger kildetekst]
Fri oxygen var næsten ikke-eksisterende i Jordens atmosfære før udviklingen af fotosyntetiske arkæer og bakterier mod omkring 3,5 milliarder år siden. Fri oxygen fremkom for første gang i anseelige mængder i den Palæoproterozoiske æon (for mellem 3,0 og 2,3 milliarder år siden).[65] I den første milliard år herefter blev enhver fri oxygen, der blev produceret af disse organismer, kombineret med opløst jern i havene, og dannede dermed båndede jernformationer. Efter disse "iltdræn" blev mættet begyndte fri oxygen at afgasse fra havene for omkring 3–2,7 milliarder år siden, og nåede 10% af sit nuværende niveau for omkring 1,7 milliarder år siden.[65][66]
Tilstedeværelsen af store mængder opløst og fri oxygen i havene og atmosfæren kan have udryddet de fleste eksisterende anaerobiske organismer under iltkatastrofen for omkring 2,4 milliarder år siden. Cellerespiration via O2 lader aerobiske organismer producere meget mere ATP end anaerobiske organismer.[67] Cellerespiration via O2 finder sted i alle eukaryoter, heriblandt alle komplekse flercellede organismer såsom planter og dyr.
Siden begyndelsen af kambrium-perioden for 540 millioner år siden har det atmosfæriske O2-niveau svunget mellem 15% og 30% efter volumen.[68] Hen mod enden af kultiden (for omkring 300 millioner år siden) nåede det atmosfæriske O2-niveau et maksimum på 35% efter volumen,[68] hvilket kan have bidraget til denne tids insekter og amfibiers enorme størrelse.[69]
Variationer i iltmængde var med til at forme tidligere tiders klima. Når iltmængden faldt, faldt den atmosfæriske densitet også, hvilket medførte en stigning i overfladefordampning, mere nedbør og varmere temperaturer.[70]
Ved den nuværende fotosyntese-hastighed ved det tage omkring 2.000 år at genskabe al den O2, der i øjeblikket findes i atmosfæren.[71]
Industriproduktion
[redigér | rediger kildetekst]
Der udvindes årligt 100 millioner tons O2 fra luften til industribrug gennem to primære metoder.[17] Den mest almindelige metode er fraktioneret destillation af flydende luft, hvor N2 destilleres som en damp, mens O2 bliver tilbage som en væske.[17]
Den anden primærmetode til at producere O2 er ved at sende en strøm af ren, tør luft gennem et leje i et par identiske zeolit-molekylærsigter, som absorberer kvælstoffet og leverer en gasstrøm, der er 90% til 93% O2.[17] Sideløbende hermed frigives kvælstofgas fra det andet kvælstof-mættede zeolit-leje, ved at reducere kammerets drifttryk og aflede dele af oxygenen fra det producerende leje gennem det, ind i den modsatte retning af strømmen. Efter en fastsat cyklusperiode udveksles de to lejers funktion, hvilket lader en uafbrudt mængde ilt blive pumpet gennem en rørledning. Dette kendes som "pressure swing adsorption", ofte forkortet "PSA" . Ilt opnås i stigende grad gennem disse ikke-kryotekniske teknologier.[72]
Oxygen kan også produceres gennem elektrolyse af vand til oxygen og hydrogen. Der skal bruges jævnstrøm: hvis vekselstrøm bruges består gasserne i hvert led af hydrogen og oxygen i det eksplosive forhold 2:1. I modsætning til hvad mange tror så beviser det 2:1-forhold der kan ses i jævnstrømselektrolyse af syrnet vand ikke at vands empiriske formel er H2O medmindre man gøre visse antagelser om hydrogens og oxygens egne molekylære formler. En lignende metode er den elektrokatalytiske O2-udvikling fra oxider og oxosyrer. Kemiske katalysatorer kan også bruges, sådan som det ses i oxygengeneratorer, som bruges som en del af life-support-udstyr på undervandsbåde, og stadig er en del af standardudstyret på kommercielle flyruter i tilfælde af nødsituationer med trykaflastning. En anden metode til luftseparering er ved at tvinge luft til at opløses gennem keramiske membraner baseret på zirkoniumdioxid enten ved højt tryk eller elektrisk strøm, og dermed producere næsten ren O2-gas.[52]
I 2001 lå prisen på store mængder flydende oxygen på omkring $0.21/kg.[73] Siden produktionens primære omkostninger er energiomkostningerne ved at væskegøre luften, ændres produktionsomkostningerne når energiomkostningerne varierer.
Opbevaring
[redigér | rediger kildetekst]Blandt metoder til opbevaring af oxygen er højtryks-iltflasker, kryoteknik og kemiske forbindelser. Af økonomiske årsager transporteres oxygen ofte i store mængder, som væske i specielt isolerede tankskibe, da en liter flydende oxygen svarer til 840 liter ilt ved atmosfærisk tryk og 20 °C (68 °F).[17] Herefter kan man fylde store beholdere til flydende oxygen, der ofte står udenfor hospitaler og andre institutioner, som behøver store mængder ren oxygen. Den flydende oxygen sendes herefter igennem varmevekslere, som konverterer den kryogene væske til gas før den kommer ind i bygningen. Herfra opbevares og leveres ilten i mindre cylindere indeholdende den komprimerede gas; en form der er nyttig ved forskellige lægevidenskabelige procedurer og ved gassvejsning.[17]
Anvendelser
[redigér | rediger kildetekst]Lægevidenskab
[redigér | rediger kildetekst]
Optagelse af O2 fra luften er respirationens centrale formål, så iltsupplementer bruges ofte indenfor lægevidenskaben. Behandlingen øger ikke blot iltniveauet i patientens blod, men har også den bivirkning at det sænker modstanden mod blodgennemstrømning i mange former for syge lunger, hvilket letter hjertets arbejde. Iltterapi bruges til at behandle KOL, lungebetændelse, nogle hjertesygdomme (hjerteinsufficiens), nogle sygdomme, der forårsager øget tryk på lungepulsåren, og enhver sygdom der hæmmer kroppens evne til at optage og bruge ilt.[74]
Behandling er fleksibel nok til at den kan foretages på hospitalet, i patientens bolig eller, i stigende grad, ved hjælp af transportable enheder. Ilttelte var engang udbredt som iltsupplement, men er siden blevet erstattet af brugen af iltmasker eller nasale kanyler.[75]
Hyperbarisk (højtryks-)medicin bruger særlige iltkamre til at øge partialtrykket på O2 omkring patienten og, om nødvendigt, det lægelige personale.[76] Carbonmonoxidforgiftning, gasgangræn og trykfaldssyge kan somme tider afhjælpes med denne type behandling.[77] Øget koncentration af O2 i lungerne hjælper med at fjerne carbonmonoxid fra hæm-gruppen af hæmoglobin.[78][79] Ilt er giftigt for de anaerobiske organismer, der forårsager gasgangræn, så en øgning af dets partialtryk hjælper med at slå dem ihjel.[80][81] Trykfaldssyge sker for dykkere, hvis trykket lettes for hurtigt efter at have dykket, hvilket resulterer i at bobler af inaktiv gas, hovedsageligt kvælstof og helium, dannes i blodet. Det hjælper at øge O2-trykket så hurtigt som muligt for at hjælpe med at gen-opløse boblerne tilbage i blodet så disse overskydende gasser han udåndes naturligt gennem lungerne.[74][82][83]
Ilt bruges også indenfor lægevidenskaben til patienter, som behøver mekanisk ventilering, ofte ved koncentrationer over de 21% der findes i almindelig luft.
Life-support og rekreativt brug
[redigér | rediger kildetekst]
O2 anvendes som lavtryks-indåndingsluft i moderne rumdragter, som omgiver astronautens krop i luft under tryk. Disse dragter bruger næsten ren ilt ved omkring en tredjedel af det normale tryk, hvilket resulterer i et normalt O2-partialtryk i blodet.[84][85] Denne afvejning af højere iltkoncentration for lavere tryk er nødvendig for at opretholde dragtens fleksibilitet.
undervandsdykkere og sømænd på u-både er også afhængige af kunstigt leveret O2, men oftest ved normalt tryk, og/eller blandinger af ilt og luft. Brugen af ren eller næsten ren O2 til dykning ved tryk der er højere end ved havoverfladen, er normalt begrænset til rebreathers, dekompression og nødbehandling ved relativt lavvandet dybde (~6 meter dybt eller mindre).[86][87] Dybere dykning kræver betragtelig fortynding af O2 med andre gasser, såsom kvælstof eller helium, for at forhindre iltforgiftning.[86]
Folk som klatrer i bjerge eller flyver i ikke-trykregulerede fly har somme tider supplerende O2-forsyninger med. Trykregulerede kommercielle fly har en O2-nødforsyning, der automatisk gøres tilgængelig for passagererne ved trykaflastning af kabinen. Pludseligt tab af kabinetryk aktiverer kemiske iltgeneratorer over hvert sæde, hvilket får iltmasker til at falde ned. Ved at trække i maskerne "for at starte ilttilstrømningen", som det instrueres af personalet, tvinges jernspåner ind i natriumklorat i beholderen.[52] Dette påbegynder en exoterm proces, som producerer en konstant strøm af ilt.
Da ilt af nogle opfattes som et mildt euforiserende stof, er det ofte blevet anvendt i oxygenbarer og visse sportsgrene. Oxygenbarer har siden 1990'erne kunnet findes i Japan og visse steder i USA, såsom Californien og Las Vegas, hvor man kan betale for at blive udsat for en større O2-mængde.[88] Professionelle atleter, særligt inden for amerikansk fodbold, går somme tider fra banen i pausen for at tage iltmasker på og øge deres ydeevne. Den farmakologiske effekt er tvivlsom, og en placebo-effekt er en mere sandsynlig forklaring.[88] Available studies support a performance boost from enriched O2 mixtures only if it is breathed during aerobic exercise.[89]
Blandt andre former for rekreativt brug er indenfor pyroteknik, såsom George Gobles femsekunders tænding af barbecuegrills.[90]
Industrielt
[redigér | rediger kildetekst]
Smeltning af jernmalm til stål står for 55% af forbruget af kommercielt produceret oxygen.[52] O2 indsættes gennem en højtrykslanse i smeltet jern, hvilket fjerner svovl-urenheder og overskydende carbon som oxiderne SO2 og CO2. Reaktionerne er exoterme, så temperaturen øges til 1.700 °C.[52]
25% af den kommercielt producerede oxygen bruges i den kemiske industri.[52] Ethen reagerer med O2 for at skabe ethenoxid, som, derefter, konverteres til ethenglykol, som anvendes ved fremstillingen af en lang række produkter, såsom kølevæske og polyester-polymerer (forløberen for mange typer plast og tekstil).[52]
Det meste af de resterende 20% kommercielt produceret oxygen bruges indenfor lægevidenskaben, til skæring og svejsning af metaller, som oxidationsmiddel i raketbrændstof og til vandbehandling.[52] Ilt bruges ved oxyacetylen-svejsning ved at afbrænde acetylen med O2 for at producere en meget varm flamme. Ved denne proces opvarmes metaller, der er op til 60 cm tykke, først med en lille oxy-acetylen-flamme, og skæres derefter hurtigt med en stor strøm af O2.[91]
Forbindelser
[redigér | rediger kildetekst]
Oxygens oxidationstrin er −2 i næsten alle kendte oxygenforbindelser. Oxidationstrinnet −1 findes i nogle få forbindelser såsom peroxider.[92] Forbindelser, der indeholder oxygen i andre oxidationstrin, er meget usædvanlige: −1/2 (superoxider), −1/3 (ozonider), 0 (elementart, hypofluorous acid), +1/2 (dioxygenyl), +1 (dioxygendifluorid) og +2 (oxygendifluorid).
Oxider og andre uorganiske forbindelser
[redigér | rediger kildetekst]Vand (H2O) er en brintoxid, og den mest velkendte oxygenforbindelse. Hydrogenatomer er kovalent bundet til oxygen i et vandmolekyle, men har også en yderligere tiltrækningskraft (omkring 23,3 kJ·mol−1 pr. brintatom) til et nærliggende oxygenatom i et separat molekyle.[93] Disse brintbindinger mellem vandmolekyler holder dem omtrent 15% tættere end hvad der kan forventes af en simpel væske med kun van der Waals-kræfters.[94][g]

På grund af dets elektronegativitet danner oxygen kemiske bindinger med næsten alle andre grundstoffer og giver tilsvarende oxider. Overfladerne på de fleste metaller, såsom aluminium og titanium, iltes ved tilstedeværelsen af luft, og bliver belagt med en tynd oxidfilm som passiverer metallet og sløver yderligere korrosion. Mange overgangsmetallers oxider er ikke-støkiometriske forbindelser, med lidt mindre metal end der ville fremgå af sumformlen. For eksempel angives mineralet FeO (wüstit) som Fe1 − xO, hvor x normalt er omkring 0,05.[95]
Spormængder af ilt er til stede i atmosfæren i form af kuldioxid (CO2). Stenene i Jordens skorpe består af store dele siliciumoxider (silica SiO2, som findes i granit og kvarts), aluminium (aluminiumoxid Al2O3, i bauxit og korund), jern (jern(III)oxid Fe2O3, i hematit og rust), og calciumkarbonat (i kalksten). Resten af Jordens skorpe udgøres også af oxygenforbindelser, særligt i form af diverse komplekse silikater (i silikatmineraler). Jordens kappe, som har en langt større masse end skorpen, består hovedsageligt af magnesium- og jernsilikater.
Vandopløselige silikater i form af Na4SiO4, Na2SiO3 og Na2Si2O5 bruges som detergenter og lim.[96]
Oxygen fungerer også som en ligand for overgangsmetaller, og danner overgangsmetal-dioxygenkomplekser, som indeholder metal–O2. Denne klasse forbindelser omfatter hæmoproteinerne hæmoglobin og myoglobin.[97] En eksotisk og usædvanlig reaktion sker med PtF6, som oxiderer oxygen og giver O2+PtF6−.[98]
Organiske forbindelser og biomolekyler
[redigér | rediger kildetekst]

Blandt de vigtigste klasser af organiske forbindelser, der indeholder oxygen er (hvor "R" er en organisk gruppe): alkoholer (R-OH); ætere (R-O-R); ketoner (R-CO-R); aldehyder (R-CO-H); carboxylsyrer (R-COOH); estere (R-COO-R); syreanhydrider (R-CO-O-CO-R); og amider (R-C(O)-NR2). Der findes mange vigtige organiske opløsningsmidler, som indeholder oxygen, heriblandt: acetone, metanol, ætanol, isopropanol, furan, THF, Diethylether, dioxane, ethylacetat, DMF, DMSO, eddikesyre og myresyre. Acetone ((CH3)2CO) og fenol (C6H5OH) bruges ved syntesen af mange andre stoffer. Blandt andre vigtige organiske forbindelser, der indeholder oxygen er: glycerol, formaldehyd, glutaraldehyd, citronsyre, eddikesyreanhydrid og acetamid. Epoxider er er ætere hvori oxygenatomet er en del af en ring af tre atomer.
Oxygen reagerer spontant med mange organiske forbindelser ved eller under rumtemperatur i en proces kaldet autoxidation.[99] De fleste af de organiske forbindelser, der indeholder oxygen skabes ikke ved direkte handling fra O2. Blandt organiske forbindelser, der er vigtige indenfor industri og handel, og som skabes ved direkte oxidering af en forløber, er ethylenoxid og pereddikesyre.[96]
Grundstoffet oxygen findes i næsten alle biomolekyler, der er vigtige for (eller genereres af) liv. Kun nogle få almindelige komplekse biomolekyler, såsom squalen og karotinerne, indeholder ingen oxygen. Ud af de organiske forbindelser, der har biologisk relevans, indeholder kulhydraterne den største mængde oxygen målt i masseproportion. Alle fedtstoffer, fedtsyrer, aminosyrer og proteiner indeholder oxygen (på grund af tilstedeværelsen af carbonylgrupper i disse syrer og deres esterremanens). Oxygen er også en del af fosfatgrupper (PO3−4) i de biologisk vigtige energibærende molekyler ATP og ADP, i DNA og RNA's rygrad, puriner (bortset fra adenin) og pyrimidiner, og i knoglerne som calciumfosfat og hydroxylapatit.
Sikkerhed og forholdsregler
[redigér | rediger kildetekst]NFPA 704-standarden vurderer komprimeret ilt som ufarligt for helbredet, ikke-brændbart og ikke-reaktivt, men et oxidationsmiddel. Nedkølet flydende oxygen (LOX, for "liquified oxygen") gives en sundhedsfare-værdi på 3 (for øget risiko for hyperoxia fra kondenserede dampe, og for farer, der ofte ses ved kryogene væsker såsom forfrysninger), mens alle de andre værdier er de samme som i komprimeret gasform.
Toksicitet
[redigér | rediger kildetekst]

Ilt (O2) kan være giftigt ved forhøjede partialtryk, hvilket kan føre til krampetrækninger og andre sundhedsmæssige problemer.[86][h][101] Ilttoksicitet begynder normalt at opstå ved partialtryk på mere end 50 kilopascal (kPa), hvilket svarer til omkring 50% iltsammensætning ved standardtryk eller 2,5 gange det normale O2-partialtryk ved havoverfladen (der er omkring 21 kPa). Dette er ikke et problem for andre end patienter med mekanisk ventilering, da gas leveret gennem iltmasker typisk kun består af 30%–50% O2 efter volumen (omkring 30 kPa ved standardtryk).[15]
I tidligere tider blev for tidligt fødte spædbørn placeret i inkubatorer, der indeholdt O2-rig luft, men man gik væk fra denne praksis efter nogle spædbørn blev blinde på grund af det høje iltindhold.[15]
Indånding af ren O2 indenfor rumfart, såsom i nogle moderne rumdrafter, eller i tidlige rumfartøjer såsom Apollo, er ikke skadeligt på grund af det lave samlede tryk der bruges.[84][102] Hvad angår rumdragter så er O2-partialtrykket i indåndingsluften generelt omkring 30 kPa (1,4 gange normalen), og det resulterende O2-partialtryk i astronautens arterieblod er kun marginalt større end ved normalt O2-partialtryk ved havoverfladen.
Iltforgiftning i lungerne og centralnervesystemet kan også ske ved dybvandsdykning.[15][86] Længerevarende indånding af en luftblanding med et O2-partialtryk på mere end 60 kPa kan i sidste ende føre til permanent lungefibrose.[103] At blive udsat for et O2-partialtryk på mere end 160 kPa (omkring 1,6 atm) kan føre til krampetrækninger, der normalt er dødelige for dykkere. Akut iltforgiftning (der giver stærke anfald) kan opstå ved at indånde en luftblanding med 21% O2 ved 66 m eller meres dybde; det samme kan ske ved at indånde 100% O2 ved blot 6 m.[103][104][105][106]
Forbrænding og andre farer
[redigér | rediger kildetekst]
Stærkt koncentrerede oxygenkilder fremmer stærk forbrænding. Der er derfor brand- og eksplosionsfare når koncentrerede oxidanter og brændstoffer bringes fysisk tæt på hinanden; en antændelse, såsom varme eller en gnist, kan i sådanne tilfælde udløse forbrænding.[28][107] Oxygen er oxidanten, ikke brændstoffet, men er alligevel kilden til det meste af den kemiske energi der frigives under forbrændingen.[28][29][i] Brandfare angår også oxygenforbindelser med stærkt oxideringspotentiale, såsom peroxider, klorater, nitrater, perklorater og dikromater, da de kan donere ilt til en ild.
Koncentreret O2 kan få forbrænding til at ske hurtigt og energisk.[107] Stålrør og opbevaringsbeholdere til at opbevare og overføre både gasformig og flydende oxygen vil fungere kan et brændstof; og design og fremstilling af O2-systemer kræver derfor særlig træning i at sikre at potentielle kilder til antændelse minimeres.[107] Branden, der dræbte mandskabet på Apollo 1 i affyrings-testfasen spredte sig ekstremt hurtigt, da rumkapslen var sat under tryk med ren O2, men ved lidt mere end atmosfærisk tryk i stedet for den 1⁄3 af normaltryk, som skulle bruges på en mission.[j][109]
Flydende oxygen kan, hvis det spildes og bliver suget ind i organisk stof såsom træ, petrokemikalier og asfalt, få disse materialer til at detonere uforudsigeligt ved senere mekanisk påvirkning.[107] Ligesom det er tilfældet med andre kryotekniske væsker, kan kontakt med menneskekroppen forårsage forfrysninger på huden eller øjnene.
Noter
[redigér | rediger kildetekst]- ^ O2 er en diatomisk gas, hvilket betyder at to gasformige oxygen-atomer fra naturens side vil binde sig til hinanden og danne O2. Betegnelsen "oxygen" bliver derfor de facto først relevant at anvende hvis man a) taler om grundstoffet, b) taler om kemiske forbindelser mellem oxygen og andre grundstoffer og c) i situationer hvor man manuelt skiller oxygen-atomerne fra hinanden
- ^ Disse resultater blev mere eller mindre ignoreret frem til 1860. En del af denne afvisning skyldtes troen på at et grundstofs element ikke ville have nogen kemisk affinitet overfor atomer fra det samme grundstof, og en anden del skyldtes tilsyneladende undtagelser fra Avogadros lov, der ikke blev forklaret før senere i form af dissocierende molekyler.
- ^ Tallene angivet er for værdier op til 50 miles (80 km) over havoverfladen
- ^ Thylakoidmembraner er en del af kloroplasten i alger og planter mens de blot er en af mange membranstrukturer i cyanobakterier. Faktisk menes kloroplast at have udviklet sig fra cyanobakterier, som engang var symbiotiske partnere med planter og algers progeneratorer.
- ^ Vandoxidering katalyseres af et mangan-indeholdende enzymkompleks kendt som "oxygen evolving complex" (OEC) eller det vandsplittende kompleks, der er forbundet med den lumenale side af thylakoidmembraner. Mangan er en vigtig cofaktor, og calcium og klorid kræves også for at reaktionen kan finde sted. (Raven 2005)
- ^ (1,8 gram/min/person)×(60 min/t)×(24 t/dag)×(365 dage/år)×(6,6 milliarder mennesker)/1.000.000 g/t=6,24 milliarder ton
- ^ Siden oxygen har en højere elektronegativitet end hydrogen gør ladningsforskellen det derudover til et polært molekyle. Interaktionerne mellem de forskellige dipoler på hvert molekyle skaber en netto-tiltrækningskraft.
- ^ Da O2's partialtryk er fraktionen af O2 ganget med det samlede tryk, kan forhøjede partialtryk enten opstå fra en høj O2-fraktion i indåndingsluften, fra højt tryk på indåndingsluften, eller en kombination af begge.
- ^ Dette forklarer også hvorfor det er muligt at "kvæle" en brand ved at afskære den fra ilt.
- ^ Der blev ikke entydigt fundet nogen enkeltstående antændelseskilde, men nogle beviser peger mod at det skyldtes en elektrisk gnist.[108]
Fodnoter
[redigér | rediger kildetekst]- ^ Molekyler med ens atomer - grundstoffer hos Københavns Universitets Fysiklesikon
- ^ "WebElements: the periodic table on the web – Oxygen: electronegativities". WebElements.com. Hentet 7. november 2011.
- ^ a b Emsley 2001, p.297
- ^ a b c d e f g h i j Cook & Lauer 1968, p.500
- ^ Scripps Institute. "Atmospheric Oxygen Research".
- ^ a b "Oxygen". Los Alamos National Laboratory. Arkiveret fra originalen 26. oktober 2007. Hentet 16. december 2007.
- ^ "Atomic oxygen erosion". Arkiveret fra originalen 13. juni 2007. Hentet 8. august 2009.
- ^ a b c d Parks, G. D.; Mellor, J. W. (1939). Mellor's Modern Inorganic Chemistry (6th udgave). London: Longmans, Green and Co.
- ^ a b "Ilt" på Den Danske Ordbog
- ^ "Surstof" på Ordbog over det Danske Sprog
- ^ Jastrow, Joseph (1936). Story of Human Error. Ayer Publishing. s. 171. ISBN 0-8369-0568-7.
- ^ a b c d e Cook & Lauer 1968, p.499.
- ^ a b c Britannica contributors (1911). "John Mayow". Encyclopaedia Britannica (11th udgave). Hentet 16. december 2007.
{{cite book}}:|author=har et generisk navn (hjælp) - ^ a b World of Chemistry contributors (2005). "John Mayow". World of Chemistry. Thomson Gale. ISBN 0-669-32727-1. Hentet 16. december 2007.
{{cite book}}:|author=har et generisk navn (hjælp) - ^ a b c d e f Emsley 2001, p.299
- ^ Morris, Richard (2003). The last sorcerers: The path from alchemy to the periodic table. Washington, D.C.: Joseph Henry Press. ISBN 0-309-08905-0.
- ^ a b c d e f g Emsley 2001, p.300
- ^ Priestley, Joseph (1775). "An Account of Further Discoveries in Air". Philosophical Transactions. 65: 384-94. doi:10.1098/rstl.1775.0039. ISSN 0261-0523.
- ^ "Kvælstof" på Den Danske Ordbog
- ^ DeTurck, Dennis; Gladney, Larry; Pietrovito, Anthony (1997). "Do We Take Atoms for Granted?". The Interactive Textbook of PFP96. University of Pennsylvania. Arkiveret fra originalen 17. januar 2008. Hentet 28. januar 2008.
- ^ Roscoe, Henry Enfield; Schorlemmer, Carl (1883). A Treatise on Chemistry. D. Appleton and Co. s. 38.
- ^ a b Daintith, John (1994). Biographical Encyclopedia of Scientists. CRC Press. s. 707. ISBN 0-7503-0287-9.
- ^ Poland – Culture, Science and Media. Condensation of oxygen and nitrogen Arkiveret 4. oktober 2010 hos Wayback Machine. Retrieved on October 4, 2008.
- ^ Emsley 2001, p.303
- ^ a b How Products are Made contributors (2002). "Oxygen". How Products are Made. The Gale Group, Inc. Hentet 16. december 2007.
{{cite book}}:|author=har et generisk navn (hjælp) - ^ "Dr. Robert H. Goddard, American Rocketry Pioneer". NASA. Hentet 23. august 2016.
- ^ Chieh, Chung. "Bond Lengths and Energies". University of Waterloo. Arkiveret fra originalen 14. december 2007. Hentet 16. december 2007.
- ^ a b c Weiss, H. M. (2008). "Appreciating Oxygen". J. Chem. Educ. 85: 1218-1219. doi:10.1021/ed085p1218.
- ^ a b Schmidt-Rohr, K (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2". J. Chem. Educ. 92: 2094-2099. doi:10.1021/acs.jchemed.5b00333.
- ^ a b c Stwertka, Albert (1998). Guide to the Elements (Revised udgave). Oxford University Press. s. 48–49. ISBN 0-19-508083-1.
- ^ a b Cacace, Fulvio; de Petris, Giulia; Troiani, Anna (2001). "Experimental Detection of Tetraoxygen". Angewandte Chemie International Edition. 40 (21): 4062-65. doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID 12404493.
- ^ a b Ball, Phillip (16. september 2001). "New form of oxygen found". Nature News. Hentet 9. januar 2008.
- ^ Lundegaard, Lars F.; Weck, Gunnar; McMahon, Malcolm I.; Desgreniers, Serge; et al. (2006). "Observation of an O8 molecular lattice in the phase of solid oxygen". Nature. 443 (7108): 201-04. Bibcode:2006Natur.443..201L. doi:10.1038/nature05174. PMID 16971946.
- ^ Desgreniers, S; Vohra, Y. K.; Ruoff, A. L. (1990). "Optical response of very high density solid oxygen to 132 GPa". J. Phys. Chem. 94 (3): 1117-22. doi:10.1021/j100366a020.
- ^ Shimizu, K.; Suhara, K.; Ikumo, M.; Eremets, M. I.; et al. (1998). "Superconductivity in oxygen". Nature. 393 (6687): 767-69. Bibcode:1998Natur.393..767S. doi:10.1038/31656.
- ^ "Air solubility in water". The Engineering Toolbox. Hentet 21. december 2007.
- ^ Evans, David Hudson; Claiborne, James B. (2005). The Physiology of Fishes (3rd udgave). CRC Press. s. 88. ISBN 0-8493-2022-4.
- ^ Lide, David R. (2003). "Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements". CRC Handbook of Chemistry and Physics (84th udgave). Boca Raton, Florida: CRC Press. ISBN 0-8493-0595-0.
- ^ "Overview of Cryogenic Air Separation and Liquefier Systems". Universal Industrial Gases, Inc. Hentet 15. december 2007.
- ^ a b "Liquid Oxygen Material Safety Data Sheet" (PDF). Matheson Tri Gas. Arkiveret fra originalen (PDF) 27. februar 2008. Hentet 15. december 2007.
- ^ Krupenie, Paul H. (1972). "The Spectrum of Molecular Oxygen". Journal of Physical and Chemical Reference Data. 1 (2): 423. doi:10.1063/1.3253101.
- ^ Guy P. Brasseur; Susan Solomon (15. januar 2006). Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Springer Science & Business Media. s. 220–. ISBN 978-1-4020-3824-2.
- ^ Kearns, David R. (1971). "Physical and chemical properties of singlet molecular oxygen". Chemical Reviews. 71 (4): 395-427. doi:10.1021/cr60272a004.
- ^ a b c d "Oxygen Nuclides / Isotopes". EnvironmentalChemistry.com. Hentet 17. december 2007.
- ^ a b c Meyer, B.S. (19.-21. september 2005). Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen (PDF). Workgroup on Oxygen in the Earliest Solar System. Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. Gatlinburg, Tennessee. 9022. Hentet 22. januar 2007.
{{cite conference}}: CS1-vedligeholdelse: Dato-format (link) - ^ "NUDAT 13O". Arkiveret fra originalen 4. oktober 2018. Hentet 6. juli 2009.
- ^ "NUDAT 14O". Arkiveret fra originalen 7. juni 2022. Hentet 6. juli 2009.
- ^ "NUDAT 15O". Arkiveret fra originalen 7. juni 2022. Hentet 6. juli 2009.
- ^ Croswell, Ken (februar 1996). Alchemy of the Heavens. Anchor. ISBN 0-385-47214-5.
- ^ a b c d Emsley 2001, p.298
- ^ Fra The Chemistry and Fertility of Sea Waters af H.W. Harvey, 1955, citerer C.J.J. Fox, "On the coefficients of absorption of atmospheric gases in sea water", Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Harvey bemærker at ifølge senere artikler i Nature lader værdierne til at være omkring 3% for høje.
- ^ a b c d e f g h Emsley 2001, p.301
- ^ a b Emsley 2001, p.304
- ^ Hand, Eric (13. marts 2008). "The Solar System's first breath". Nature. 452 (7185): 259. Bibcode:2008Natur.452..259H. doi:10.1038/452259a. PMID 18354437. Hentet 18. marts 2009.
- ^ Miller, J.R.; Berger, M.; Alonso, L.; Cerovic, Z.; et al. Progress on the development of an integrated canopy fluorescence model. Geoscience and Remote Sensing Symposium, 2003. IGARSS '03. Proceedings. 2003 IEEE International. Hentet 22. januar 2008.
- ^ Fenical, William (september 1983). "Marine Plants: A Unique and Unexplored Resource". Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings). DIANE Publishing. s. 147. ISBN 1-4289-2397-7.
- ^ Walker, J. C. G. (1980). The oxygen cycle in the natural environment and the biogeochemical cycles. Berlin: Springer-Verlag.
- ^ Brown, Theodore L.; LeMay, Burslen (2003). Chemistry: The Central Science. Prentice Hall/Pearson Education. s. 958. ISBN 0-13-048450-4.
- ^ a b Raven 2005, 115–27
- ^ Danovaro R; Dell'anno A; Pusceddu A; Gambi C; et al. (april 2010). "The first metazoa living in permanently anoxic conditions". BMC Biology. 8 (1): 30. doi:10.1186/1741-7007-8-30. PMC 2907586. PMID 20370908.

- ^ Ward, Peter D.; Brownlee, Donald (2000). Rare Earth: Why Complex Life is Uncommon in the Universe. Copernicus Books (Springer Verlag). s. 217. ISBN 0-387-98701-0.
- ^ NASA (27. september 2007). "NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago". Pressemeddelelse. Hentet 20. juni 2016. Arkiveret fra originalen den 13. marts 2008.
- ^ Zimmer, Carl (3. oktober 2013). "Earth's Oxygen: A Mystery Easy to Take for Granted". New York Times. Hentet 3. oktober 2013.
- ^ ""For humans, the normal volume is 6–8 liters per minute."". Arkiveret fra originalen 6. september 2010. Hentet 20. juni 2016.
- ^ a b Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. (2013). "Atmospheric oxygenation three billion years ago". Nature. 501 (7468): 535-538. doi:10.1038/nature12426. PMID 24067713.
- ^ Campbell, Neil A.; Reece, Jane B. (2005). Biology (7th udgave). San Francisco: Pearson – Benjamin Cummings. s. 522-23. ISBN 0-8053-7171-0.
- ^ Freeman, Scott (2005). Biological Science, 2nd. Upper Saddle River, NJ: Pearson – Prentice Hall. s. 214, 586. ISBN 0-13-140941-7.
- ^ a b Berner, Robert A. (1999). "Atmospheric oxygen over Phanerozoic time". Proceedings of the National Academy of Sciences of the USA. 96 (20): 10955-57. Bibcode:1999PNAS...9610955B. doi:10.1073/pnas.96.20.10955. PMC 34224. PMID 10500106.
- ^ Butterfield, N. J. (2009). "Oxygen, animals and oceanic ventilation: An alternative view". Geobiology. 7 (1): 1-7. doi:10.1111/j.1472-4669.2009.00188.x. PMID 19200141.
- ^ Christopher J. Poulsen, Clay Tabor, Joseph D. White. "Long-term climate forcing by atmospheric oxygen concentrations". Science. 348: 1238-1241. doi:10.1126/science.1260670.
{{cite journal}}: CS1-vedligeholdelse: Bruger authors parameter (link) - ^ Dole, Malcolm (1965). "The Natural History of Oxygen" (PDF). The Journal of General Physiology. 49 (1): 5-27. doi:10.1085/jgp.49.1.5. PMC 2195461. PMID 5859927. Hentet 16. december 2007.
- ^ "Non-Cryogenic Air Separation Processes". UIG Inc. 2003. Hentet 16. december 2007.
- ^ Space Shuttle Use of Propellants and Fluids. National Aeronautics and Space Administration. september 2001. Arkiveret fra originalen 17. september 2008. Hentet 16. december 2007.
NASAFacts FS-2001-09-015-KSC
- ^ a b Cook & Lauer 1968, p.510
- ^ Sim MA; Dean P; Kinsella J; Black R; et al. (2008). "Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated". Anaesthesia. 63 (9): 938-40. doi:10.1111/j.1365-2044.2008.05536.x. PMID 18540928.
- ^ Stephenson RN; Mackenzie I; Watt SJ; Ross JA (1996). "Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy". Undersea Hyperb Med. 23 (3): 185-8. PMID 8931286. Arkiveret fra originalen 11. august 2011. Hentet 22. september 2008.
- ^ Undersea and Hyperbaric Medical Society. "Indications for hyperbaric oxygen therapy". Arkiveret fra originalen 25. maj 2011. Hentet 22. september 2008.
- ^ Undersea and Hyperbaric Medical Society. "Carbon Monoxide". Arkiveret fra originalen 25. juli 2008. Hentet 22. september 2008.
- ^ Piantadosi CA (2004). "Carbon monoxide poisoning". Undersea Hyperb Med. 31 (1): 167-77. PMID 15233173. Arkiveret fra originalen 3. februar 2011. Hentet 22. september 2008.
- ^ Hart GB; Strauss MB (1990). "Gas Gangrene – Clostridial Myonecrosis: A Review". J. Hyperbaric Med. 5 (2): 125-144. Arkiveret fra originalen 3. februar 2011. Hentet 22. september 2008.
- ^ Zamboni WA; Riseman JA; Kucan JO (1990). "Management of Fournier's Gangrene and the role of Hyperbaric Oxygen". J. Hyperbaric Med. 5 (3): 177-186. Arkiveret fra originalen 3. februar 2011. Hentet 22. september 2008.
- ^ Undersea and Hyperbaric Medical Society. "Decompression Sickness or Illness and Arterial Gas Embolism". Arkiveret fra originalen 5. juli 2008. Hentet 22. september 2008.
- ^ Acott, C. (1999). "A brief history of diving and decompression illness". South Pacific Underwater Medicine Society Journal. 29 (2). Arkiveret fra originalen 5. september 2011. Hentet 22. september 2008.
- ^ a b Morgenthaler GW; Fester DA; Cooley CG (1994). "As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations". Acta Astronautica. 32 (1): 39-49. Bibcode:1994AcAau..32...39M. doi:10.1016/0094-5765(94)90146-5. PMID 11541018.
- ^ Webb JT; Olson RM; Krutz RW; Dixon G; Barnicott PT (1989). "Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures". Aviat Space Environ Med. 60 (5): 415-21. doi:10.4271/881071. PMID 2730484.
- ^ a b c d Acott, C. (1999). "Oxygen toxicity: A brief history of oxygen in diving". South Pacific Underwater Medicine Society Journal. 29 (3). Arkiveret fra originalen 25. december 2010. Hentet 21. september 2008.
- ^ Longphre, J. M.; Denoble, PJ; Moon, RE; Vann, RD; et al. (2007). "First aid normobaric oxygen for the treatment of recreational diving injuries". Undersea Hyperb Med. 34 (1): 43-49. PMID 17393938. Arkiveret fra originalen 13. juni 2008. Hentet 21. september 2008.
- ^ a b Bren, Linda (november-december 2002). "Oxygen Bars: Is a Breath of Fresh Air Worth It?". FDA Consumer magazine. U.S. Food and Drug Administration. Arkiveret fra originalen 18. oktober 2007. Hentet 23. december 2007.
{{cite web}}: CS1-vedligeholdelse: Dato-format (link) - ^ "Ergogenic Aids". Peak Performance Online. Arkiveret fra originalen 28. september 2007. Hentet 4. januar 2008.
- ^ "George Goble's extended home page (mirror)". Arkiveret fra originalen 11. februar 2009. Hentet 20. juni 2016.
- ^ Cook & Lauer 1968, p.508
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (engelsk) (2nd udgave), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
{{citation}}: CS1-vedligeholdelse: Flere navne: authors list (link),p. 28 - ^ Maksyutenko, P.; Rizzo, T. R.; Boyarkin, O. V. (2006). "A direct measurement of the dissociation energy of water". J. Chem. Phys. 125 (18): 181101. Bibcode:2006JChPh.125r1101M. doi:10.1063/1.2387163. PMID 17115729.
- ^ Chaplin, Martin (4. januar 2008). "Water Hydrogen Bonding". Hentet 6. januar 2008.
- ^ Smart, Lesley E.; Moore, Elaine A. (2005). Solid State Chemistry: An Introduction (3rd udgave). CRC Press. s. 214. ISBN 978-0-7487-7516-3.
- ^ a b Cook & Lauer 1968, p.507
- ^ Crabtree, R. (2001). The Organometallic Chemistry of the Transition Metals (3rd udgave). John Wiley & Sons. s. 152. ISBN 978-0-471-18423-2.
- ^ Cook & Lauer 1968, p.505
- ^ Cook & Lauer 1968, p.506
- ^ Dharmeshkumar N Patel; Ashish Goel; SB Agarwal; Praveenkumar Garg; et al. (2003). "Oxygen Toxicity" (PDF). Indian Academy of Clinical Medicine. 4 (3): 234. Arkiveret fra originalen (PDF) 22. september 2015. Hentet 20. juni 2016.
- ^ Cook & Lauer 1968, p.511
- ^ Wade, Mark (2007). "Space Suits". Encyclopedia Astronautica. Arkiveret fra originalen 13. december 2007. Hentet 16. december 2007.
- ^ a b Wilmshurst P (1998). "Diving and oxygen". BMJ. 317 (7164): 996-9. doi:10.1136/bmj.317.7164.996. PMC 1114047. PMID 9765173.
- ^ Donald, Kenneth (1992). Oxygen and the Diver. England: SPA in conjunction with K. Donald. ISBN 1-85421-176-5.
- ^ Donald K. W. (1947). "Oxygen Poisoning in Man: Part I". Br Med J. 1 (4506): 667-72. doi:10.1136/bmj.1.4506.667. PMC 2053251. PMID 20248086.
- ^ Donald K. W. (1947). "Oxygen Poisoning in Man: Part II". Br Med J. 1 (4507): 712-7. doi:10.1136/bmj.1.4507.712. PMC 2053400. PMID 20248096.
- ^ a b c d Werley, Barry L., red. (1991). ASTM Technical Professional training. Fire Hazards in Oxygen Systems. Philadelphia: ASTM International Subcommittee G-4.05.
- ^ (Report of Apollo 204 Review Board NASA Historical Reference Collection, NASA History Office, NASA HQ, Washington, DC)
- ^ Chiles, James R. (2001). Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen. New York: HarperCollins Publishers Inc. ISBN 0-06-662082-1.
Referencer
[redigér | rediger kildetekst]- Cook, Gerhard A.; Lauer, Carol M. (1968). "Oxygen". I Clifford A. Hampel (red.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. s. 499–512. LCCN 68-29938.
- Emsley, John (2001). "Oxygen". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England: Oxford University Press. s. 297–304. ISBN 0-19-850340-7.
- Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). Biology of Plants (7th udgave). New York: W.H. Freeman and Company Publishers. s. 115–27. ISBN 0-7167-1007-2.
Eksterne henvisninger
[redigér | rediger kildetekst]- Mere ilt i atmosfæren gør klimaet koldere
- Iltning af Furesøen Arkiveret 11. januar 2012 hos Wayback Machine
- Ilt og ilttryk Arkiveret 9. marts 2012 hos Wayback Machine
| Søsterprojekter med yderligere information: |