Oksigen
 Cecair oksigen mendidih | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum oksigen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciri-ciri umum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Alotrop-alotrop | O2, O3 (Ozon) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rupa | gas: tidak berwarna cecair: biru muda | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksigen dalam jadual berkala | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombor atom (Z) | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kumpulan, kala | kumpulan 16 (kumpulan kalkogen), kala 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | Blok p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | bukan logam diatom | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom piawai (Ar) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [He] 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bil. elektron per petala/cengkerang | 2, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciri-ciri fizikal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fasa | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Takat lebur | 54.36 K (−218.79 °C, −361.82 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Takat didih | 90.188 K (−182.962 °C, −297.332 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ketumpatan pada stp (0 °C dan 101.325 kPa) | 1.429 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| apabila cecair, pada t.d. | 1.141 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Takat tigaan | 54.361 K, 0.1463 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik genting | 154.581 K, 5.043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haba pelakuran | (O2) 0.444 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haba pengewapan | (O2) 6.82 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Muatan haba molar | (O2) 29.378 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan wap
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciri-ciri atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Keadaan pengoksidaan | 2, 1, −1, −2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Keelektronegatifan | Skala Pauling: 3.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tenaga pengionan | pertama: 1313.9 kJ/mol ke-2: 3388.3 kJ/mol ke-3: 5300.5 kJ/mol (lagi) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari kovalen | 66±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari van der Waals | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rampaian | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
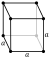
| Struktur hablur | kiub | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelajuan bunyi | 330 m/s (gas, pada 27 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Daya pengaliran terma | 26.58×10−3 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat kemagnetan | paramagnetik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kerentanan magnet (χmol) | +3449.0·10−6 cm3/mol (293 K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombor CAS | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | Carl Wilhelm Scheele (1771) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dinamakan oleh | Antoine Lavoisier (1777) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop utama bagi oksigen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oksigen (Jawi: اوکسيݢن) adalah unsur kimia dengan nombor atom 8 dan simbol kimia O, salah satu daripada kalangan unsur kalkogen dalam jadual berkala unsur dan bertindak balas dengan hampir kesemua unsur kimia, terutamanya menjadi oksida. Gas oksigen memenuhi 20.9% daripada isi padu atmosfera Bumi dan unsur paling banyak wujud dalam kerak Bumi, di mana oksigen memenuhi lebih kurang separuh daripada jisim kerak Bumi.[3][4] Dalam alam semesta, oksigen ialah unsur ketiga paling banyak, selepas hidrogen dan helium.[5]
Semua molekul organik pada makhluk hidup seperti protein, karbohidrat dan lemak, mengandung unsur oksigen, begitu juga dengan sebatian tidak organik pada cangkerang, gigi, dan tulang. Sebahagian besar oksigen dalam tubuh makhluk hidup tersebati dengan hidrogen dalam bentuk air (H2O) yang penting untuk kelangsungan hidup itu sendiri. Oksigen dalam bentuk O dihasilkan dari air secara fotosintesis oleh sianobakteria, alga dan tumbuhan dan digunakan pada respirasi sel oleh hampir semua hidupan. Oksigen beracun kepada organisme hidupan anaerobik yang paling dominan pada masa-masa awal evolusi kehidupan. O kemudian mula berkumpul di atmosfera sekitar 2.5bilion tahun lalu.[6] Terdapat pula alotrop oksigen lainnya seperti ozon (O) yang membentuk lapisan tinggi dari atmosfer melindungi biosfera dari radiasi ultraungu, tetapi pada permukaan bumi ia adalah polutan yang merupakan produk samping dari asbut.
Ciri-ciri khusus
[sunting | sunting sumber]Pada suhu dan tekanan biasa, oksigen didapati sebagai dioksigen, yakni molekul dua atom oksigen dengan formula kimia O2. Oksigen ialah gas yang dibebaskan oleh tumbuhan ketika proses fotosintesis, dan diperlukan oleh spesies manusia dan juga spesies haiwan untuk pernafasan. Oksigen cair dan pepejal mempunyai warna biru lembut dan mempunyai sifat paramagnet (mudah menjadi magnet). Oksigen cair biasanya dihasilkan dengan proses perbezaan suhu dari udara cair (disejukkan sehingga menjadi cecair).
Selain itu, bentuk oksigen yang lain ialah trioksigen atau lebih dikenali sebagai ozon, O3. Bentuk oksigen ini adalah begitu reakitf dan boleh menjejaskan tisu peparu.[7] Bentuk ini terhasil melalui tindak balas sebatian dioksigen dengan atom oksigen yang terhasil daripada pemisahan O2 oleh sinar ultraungu (UV) di mesosfera Bumi. Disebabkan ozon banyak mengalami penyerapan di bahagian sinar UV dalam spektrum elektromagnet, lapisan ozon di atmosfera bertindak sebagai pertahanan radiasi bagi Bumi.[8]
Penggunaan
[sunting | sunting sumber]Oksigen biasanya digunakan sebagai pengoksida, di mana hanya fluorin mempunyai negatif elektron yang lebih tinggi. Oksigen juga digunakan sebagai bahan pengoksida dalam bahan api roket. Oksigen juga penting untuk pernafasan dan digunakan dengan meluas dalam bidang perubatan. Oksigen juga digunakan dengan meluas di kawasan yang kurang oksigen seperti pendaki gunung, juruterbang yang membawa bekalan oksigen tambahan. Oksigen juga digunakan untuk pengimpalan dan dalam proses pembuatan besi dan metanol.
Oksigen mempunyai pengkhayalan sederhana dan digunakan sebagai bahan perangsang semenjak abad ke-19 lagi sehingga sekarang. Pada abad ke-19, oksigen bercampur dengan nitrus oksida dan digunakan sebagai ubat bius.
Oksigen ialah sebuah unsur penting tubuh manusia, bersama-sama dengan hidrogen, karbon dan nitrogen. Namun begitu, oksigen merupakan satu-satunya unsur yang diperlu setiap minit. Kesemua proses penting, seperti pernafasan, peredaran, fungsi otak, penghadaman, penyingkiran bahan buangan, pertumbuhan sel dan tisu, serta pembiakan hanya berlaku apabila terdapat banyak oksigen. Oksigen ialah sumber tenaga yang segera bagi kebanyakan proses metabolisme dalam sel dan tisu.
Sejarah
[sunting | sunting sumber]Michał Sędziwój, seorang ahli alkimia, filsuf, dan tabib Poland dalam karyanya De Lapide Philosophorum Tractatus duodecim e naturae fonte et manuali experientia depromti (tahun 1604) menggambarkan zat terkandung di udara yang disebut sebagai cibus vitae ("makanan kehidupan")[9] yang dikait rapat dengan oksigen.[10] Selama ujikaji dilakukan Michal yang dilakukan antara tahun 1598 dan 1604, mengenali dengan tepat bahwa zat tersebut setara dengan produk sampingan gas yang dilepaskan oleh penguraian bersuhu kalium nitrat. Sejarawan Poland Roman Bugaj berpendapat penulenan oksigen dan bahan berkaitan yang tepat dari zat tersebut ke dalam bahagian udara yang diperlukan untuk kehidupan, adalah bukti mencukupi menyokong penemuan oksigen oleh Sędziwój.[10] Namun, penemuan beliau sering dibantah oleh generasi ilmuwan dan ahli kimia berikutnya.[11]
Penemuan berasingan
[sunting | sunting sumber]Gas oksigen tulen pertama kali diperolehi Karl Wilhelm Scheele, pakar farmasi Sweden, secara menghasilkan gas oksigen dengan memanaskan raksa oksida dan berbagai jenis nitrat sekitar tahun 1772.[3][11] Scheele menyebut gas perolehan ini ini 'angin api' (Feuerluft) kerana kemampuannya menyalakan api dan menuliskan pengamatannya ke dalam Abhandlung von der Luft und dem Feuer (Tatanan Angin dan Api) yang tidak sampai terbit hingga tahun 1777.[12][13]

Pada 1 Ogos 1774, Joseph Priestley memulakan uji kaji sendiri menumpukan cahaya matahari ke arah raksa oksida (HgO) yang diuraikan dalam tabung uji menghasilkan suatu wap gas yang meruap;[3] gas yang didekatkan lilin akan menyala lebih terang dan tikus uji yang didedahkan kepada gas ini akan menjadi lebih aktif dan hidup lebih lama ketika menghirup udara tersebut. Setelah mencuba menghirup gas itu sendiri, beliau mencatatkan rasanya "tidak begitu lain dari udara biasa, tapi saya perasan dada saya lebih ringan dari biasa selepas beberapa ketika."[14] Hasil ujikaji ini dicatatkan tahun berikutnya dalam sebuah laporan yang berjudul "An Account of Further Discoveries in Air"; laporan ini pula dimasukkan ke dalam jilid kedua bukunya yang berjudul Experiments and Observations on Different Kinds of Air.[11][15]
Seorang kimiawan Perancis, Antoine Laurent Lavoisier kemudian mendakwa bahwa ia telah menemukan zat baru secara independen. Namun, Priestley mengunjungi Lavoisier pada Oktober 1774 dan memberitahukan Lavoisier mengenai ujikaji memperoleh gas baru tersebut sendiri. Scheele juga mengirimkan sebuah surat kepada Lavoisier pada 30 September 1774 yang menjelaskan penemuannya mengenai zat yang tak diketahui, tetapi Lavoisier mendakwa tidak ada menerima surat tersebut (sebuah salinan surat ini ditemukan dalam barang-barang peribadi Scheele setelah kematiannya).[12]
Pengamatan lanjut Lavoisier
[sunting | sunting sumber]Antoine Lavoisier menguji kaji terhadap segumpal timah yang dipanaskan dalam suatu bekas dan mengamati bahawa berat keseluruhan timah tidak tertambah meskipun dipanaskan dalam bekas yang tertutup; beliau menyimpulkan udara segera masuk ke dalam wadah sekali dibuka tetapi sebahagiannya telah "dimakan" api tunu tersebut, berat timah juga ditimbang telah meningkat bersamaan dengan berat udara yang masuk ke dalam wadah tersebut.[16]
Hasil kajian ini dicatatkan dalam bukunya Sur la combustion en général ("Perihal Umum Pembakaran") yang terbit pada tahun 1777 yang membincangkan bahawa udara campuran suatu gas "penghidup" (vital) dalam pembakaran dan pernafasan dengan suatu gas lawan "mati" atau azote (Bahasa Yunani Kuno: ἄζωτον, azōton); yang kedua ini kemudiannya dikenal lanjut sebagai nitrogen.[16] Pada tahun sama, beliau memberi nama baru kepada unsur ini:[17][18]
Nous avons donné à la base de la portion respirable de l'air le nom d'oxygène, en le dérivant de deux mots grecs ὀξύς, acide et γείνομαι, j'engendre, parce qu'en effet une des propriétés les plus générales de cette base...est de former des acides en se combinant avec la plupart des substances...
("Kami menamakan bahagian asas udara yang boleh dihirup sebagai oxygène diterbitkan daripada dua kata Yunani ὀξύς, tajam [yakni rasa air berasid] dan γείνομαι, melahirkan, kerana salah satu sifat umum bendasas ini ialah menghasilkan asid secara campuran dengan kebanayakan bahan")— Traité élémentaire de chimie (1789), m/s. 48
Kehadiran oksigen
[sunting | sunting sumber]Oksigen merupakan unsur terbanyak dalam kerak bumi, dianggarkan sebanyak 46.7% daripada mengikut berat. Oksigen merangkumi 87% daripada lautan (sebagai H2O, dan 21% daripada udara Bumi (sebagai O2, molekul oksigen, atau O3, ozon). Sebatian oksigen, terutama dalam logam, silika (SiO44-) and karbonat (CO32-), mudah didapati dalam batu dan tanah. Air beku ialah pepejal biasa di planet lain dan komet. Ais di Marikh terdiri daripada karbon dioksida beku. Sebatian oksigen didapati di merata Alam dan spektrum oksigen diperhatikan dalam cahaya bintang. Malah bintang tidak mampu menghasilkan cahaya tanpa oksigen.
Sebatian
[sunting | sunting sumber]

Oksida
[sunting | sunting sumber]Disebabkan keelektronegatifannya, oksigen membentuk ikatan kimia dengan hampir semua unsur lain, dan dari sinilah datangnya takrifan pengoksidaan. Cuma gas adi sahaja yang kebal dari pengoksidaan.
Air, oksida hidrogen, H2O ialah oksida serta sebatian oksigen yang paling umum.
Permukaan kebanyakan logam seperti aluminium dan besi teroksida untuk membentuk suatu lapisan oksida yang nipis yang boleh memperlahankan proses hakisan.
Rujukan
[sunting | sunting sumber]- ^ Meija, J.; Coplen, T. B. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure Appl. Chem. 88 (3): 265–91. doi:10.1515/pac-2015-0305. Unknown parameter
|displayauthors=ignored (bantuan) - ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. m/s. E110. ISBN 0-8493-0464-4.
- ^ a b c Cook & Lauer 1968, p.500 Ralat petik: Tag
<ref>tidak sah, nama "ECE500" digunakan secara berulang dengan kandungan yang berbeza - ^ "Oxygen". Los Alamos National Laboratory. Dicapai pada 2007-12-16.
- ^ Emsley 2001, p.297
- ^ "NASA Research Indicates Oxygen on Earth 2.5 Billion Years Ago" (Siaran akhbar). NASA. 2007-09-27. Dicapai pada 2008-03-13.[pautan mati kekal]
- ^ Stwertka, Albert (1998). Guide to the Elements (ed. Revised). Oxford University Press. m/s. 48–49. ISBN 978-0-19-508083-4.
- ^ Parks, G. D.; Mellor, J. W. (1939). Mellor's Modern Inorganic Chemistry (ed. 6th). London: Longmans, Green and Co.
- ^ Marples, Frater James A. "Michael Sendivogius, Rosicrucian, and Father Of Studies of Oxygen" (PDF). Societas Rosicruciana in Civitatibus Foederatis, Nebraska College. m/s. 3–4. Diarkibkan daripada yang asal (PDF) pada 2020-05-08. Dicapai pada 2018-05-25. Unknown parameter
|dead-url=ignored (bantuan) - ^ a b Bugaj, Roman (1971). "Michał Sędziwój – Traktat o Kamieniu Filozoficznym". Biblioteka Problemów (dalam bahasa Poland). 164: 83–84. ISSN 0137-5032.
- ^ a b c Cook & Lauer 1968, p.499.
- ^ a b Emsley 2001, p.300
- ^ Priestley, Joseph (Jan 1775). "An Account of Further Discoveries in Air. By the Rev. Joseph Priestley, LL.D. F. R. S. in Letters to Sir John Pringle, Bart. P. R. S. and the Rev. Dr. Price, F. R. S.". Phil. Trans. Band 65.: 384–94. doi:10.1098/rstl.1775.0039.
- ^ Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaNBB299 - ^ Priestley 1775, 384–94
- ^ a b Ralat petik: Tag
<ref>tidak sah; tiada teks disediakan bagi rujukan yang bernamaECE5002 - ^ de Menten de Horne, Pierre (2013). "oxygène". Dictionnaire de chimie: Une approche étymologique et historique (dalam bahasa Perancis). De Boeck. m/s. 227. ISBN 978-2-8041-8175-8.
- ^ Mellor 1939
Pautan luar
[sunting | sunting sumber] Jadual berkala
| |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
- Rencana dengan pautan luar mati dari Juli 2021
- Templat infobox element yang memerlukan perhatian
- Rencana yang mengandungi teks bahasa Yunani Purba (sehingga 1453)
- Oksigen
- Agen pengoksidaan
- Bukan logam
- Kalkogen
- Unsur kimia
- Biologi dan farmokologi dalam unsur kimia
- Gas pernafasan
- Bukan logam diatom
- Bahan kimia untuk ubat kecemasan