OSGEP
Vjerovatna O-sialoglikoproteinska endopeptidaza je enzim koji je kod ljudi kodiran genom OSGEP.[5][6]
Opis
[uredi | uredi izvor]Gen OSGEP kodira O-sialoglikoprotein-endopeptidazu, podjedinicu visoko konzerviranog kompleksa kinaze, endopeptidaze i drugih proteina male veličine (KEOPS), koji regulira drugi biosintetski korak u stvaranju N-6-treonilkarbamoiladoenozina (t6A) u citosolu. T6A je konzervirana modifikacija tRNK koja se javlja na položaju A37 pored petlje antikodonskih drški tRNK koje prepoznaju kodone sa početnim adenozinom (ANN kodoni) i neophodna je za tačnost i efikasnost translacije. Ostali članovi kompleksa KEOPS uključuju LAGE3, TPRKB, TP53RK i GON7. KEOPS kompleks vjerovatno ima dodatne funkcije (sažetak Edvardson et al., 2017. i Braun et al., 2017.).
Aminokiselinska sekvenca
[uredi | uredi izvor]Dužina polipeptidnog lanca je 335 aminokiselina, a molekulska težina 36.427 Da.[7]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MPAVLGFEGS | ANKIGVGVVR | DGKVLANPRR | TYVTPPGTGF | LPGDTARHHR | ||||
| AVILDLLQEA | LTESGLTSQD | IDCIAYTKGP | GMGAPLVSVA | VVARTVAQLW | ||||
| NKPLVGVNHC | IGHIEMGRLI | TGATSPTVLY | VSGGNTQVIA | YSEHRYRIFG | ||||
| ETIDIAVGNC | LDRFARVLKI | SNDPSPGYNI | EQMAKRGKKL | VELPYTVKGM | ||||
| DVSFSGILSF | IEDVAHRMLA | TGECTPEDLC | FSLQETVFAM | LVEITERAMA | ||||
| HCGSQEALIV | GGVGCNVRLQ | EMMATMCQER | GARLFATDER | FCIDNGAMIA | ||||
| QAGWEMFRAG | HRTPLSDSGV | TQRYRTDEVE | VTWRD |
- Simboli
C: Cistein
D: Asparaginska kiselina
E: Glutaminska kiselina
F: Fenilalanin
G: Glicin
H: Histidin
I: Izoleucin
K: Lizin
L: Leucin
M: Metionin
N: Asparagin
P: Prolin
Q: Glutamin
R: Arginin
S: Serin
T: Treonin
V: Valin
W: Triptofan
Y: Tirozin
Kloniranje i ekspresija
[uredi | uredi izvor]Pretragom baze podataka pomoću pacovske sekvence PRSMG1/GCPL1 cDNK kao upita, nakon čega slijedi PCR i skrining biblioteke cDNK skeletnih mišića i genomske biblioteke posteljice, Seki et al. (2002) identificirali su ljudski ortolog, zvani OSGEP, koji kodira O-sialoglikoprotein endopeptidazu (EC 3.4.24.57). Izvedeni OSGEP protein sa 335 aminokiselina ima predviđenu molekulsku masu od 36,4 kD i dijeli 29,7% identiteta sekvence sa glikoproteazom Pasteurella haemolytica A1 gcp, neutralnom glikoproteazom. Obje proteinske sekvence sadrže potencijalna mjesta za vezivanje cinkova prsta, formirana od dva ostatka histidina. OSGEP dijeli 93,4% i 94,9% identiteta sekvence s mišjim osgepom i pacovskim PRSMG1/GCPL1 proteinima. Northern blot analizom otkriven je transkript od 1,3 kb u svim ispitivanim ljudskim tkivima, s najvećom ekspresijom u skeletnim mišićima, bubrezima i jetri.
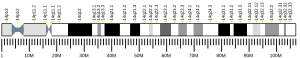
Seki et al. (2002) utvrdili su da gen OSGEP sadrži 11 egzona i da se proteže 7,75 kb. Upotrebom testa ekspresije luciferaze u HeLa ćelijama, identificirali su 23-bp CCAAT-ovo jezgro promotorske regije za transkripciju OSGEP. Ovaj segment je također i in vitro ispoljio promotorsku aktivnost za gen APEX, koji je neposredno uz gen OSGEP u orijentaciji od 5 do 5 primara, i podudara se s prethodnom identifikacijom APEX promotorske regije (Harrison et al. , 1997).[8] Zaključili su da dvosmjerni promotor koji sadrži CCAAT kutiju regulira transkripciju i OSGEP i APEX gena.[9] Seki et al. (2002) locirali su gen OSGEP na hromosomu 14, pozicija q11.2-q12, na osnovu njegove fizičke blizine genu APEX.
Funkcija gena
[uredi | uredi izvor]Braun et al. (2017) otkrili su da su OSGEP i drugi kompleksni proteini LAGE3, TP53RK i TPRKB KEOPS, lokalizovani i u citoplazmi i u jedru u ćelijskim linijama ljudskih podocita. Studije koimunoprecipitacije u ćelijama HEK293 pokazale su da su sva četiri člana kompleksa KEOPS međusobno komunicirala i sa proteinom PARP1 za obnavljanje DNK; OSGEP se kolokalizovao PARP1 u jedarna žarišta u ćelijskoj liniji ljudskih podocita. Studije koimunoprecipitacije također su pokazale da je OSGEP komunicirao s proteinima kompleksa ATP2/3 ( i kolokalizirao se s ARP2 i ARP3 na lamelipodijama u ljudskim podocitima. Nakon rušenja OSGEP-a shRNK, stvaranje sublamelske mreže aktina u ljudskim podocitima bilo je ozbiljno poremećeno i migracija podocita je smanjena.
Molekulska genetika
[uredi | uredi izvor]U dva brata, rođene od srodnih roditelja arapskih muslimana, s Galloway-Mowatovim sindromom-3 (GAMOS3), Edvardson et al. (2017) identificirali su homozigotnu misens mutaciju u genu OSGEP (R325Q). Mutacija, koja je pronađena sekvenciranjem egzoma, razdvajala se od poremećaja u porodici. Ekspresija homologne mutacije kvasca (R376Q) u kvascu osiromašenom kae1 (ortolog OSGEP-a) nije uspjela u potpunosti spasiti defekt sinteze t6A, u usporedbi s ekspresijom alela divljeg tipa. Zaključili su da smanjena sinteza t6A koja je rezultat mutacije R325Q ometa globalnu proizvodnju proteina, što rezultira ozbiljnim nervnim poremećajem.[10]
U pogođenim članovima 24 porodice sa GAMOS3, Braun et al. (2017) identificirali su homozigotne ili složene heterozigotne mutacije u genu OSGEP. Mutacija u prvoj porodici (B57) (I14F) pronađena je kombinacijom mapiranja homozigotnosti i sekvenciranja cijelog egzona. Naknadne mutacije identificirane su sekvenciranjem cijelog egzoma i sekvenciranjem egzona velikog protoka gena OSGEP. Nekoliko OSGEP mutacija se ponavljalo i predstavljalo je alele osnivača u određenim populacijama. Studije komplementacije pokazale su da mutacije GAMOS3 OSGEP nisu uspjele obnoviti nedostatke u rastu ili nivoe t6A u kae1-null kvascu, a mutacije su se desile u dvije funkcionalne klase: ili hipomorfni ili amorfni aleli. Mutacije također nisu mogle spasiti defekt proliferacije u ljudskim podocitima urušavanjem OSGEP-a, posredovanim sa shRNK. Ova otkrića su ukazala na to da su identifikovani aleli ljudskih bolesti oslabile funkcionalnost proteina. Međutim, nijedna od OSGEP mutacija nije poništila intermolekulske interakcije između KEOPS kompleksnih proteina. Nokdaun OSGEP-a, korištenjem shRNK u ljudskim podocitima rezultirao je smanjenjem nivoa t6A, inhibicijom sinteze proteina u nastajanju, smanjenom proliferacijom ćelija, aktivacijom rasprostranjenog proteinskog odgovora s ER stresom i povišenom regulacijom ER-povezanog sistema proteasomske degradacije i povećanom učestalošću apoptoza, povezanom s aktivacijom odgovora na oštećenje DNK (DDR). Nokdaun OSGEP-a također je poremetio stvaranje sublamelske mreže aktina u ljudskim podocitima i smanjio migraciju podocita. Fibroblasti izvedeni od jednog pacijenta (pacijent CP) s mutacijom R325Q, pokazali su povećani fosforilirani H2AX, u skladu s aktivacijom DDR odgovora. Zaključili su da OSGEP mutacije narušavaju i kanonsku i nekanonsku funkciju kompleksa KEOPS, što rezultira nekoliko potencijalnih patogenih mehanizama, uključujući translacijsko slabljenje, aktivaciju DDR signalizacije, povećanu razinu apoptoza i nedostatke u regulaciji aktina, što bi imalo glavne učinke na neurone i podocite. Porodice s GAMOS3 bile su dio kohorte od 91 porodice GAMOS koje su bile podvrgnute genetičkim studijama: identificirane su i mutacije u tri druga gena kompleksa KEOPS (LAGE3, TP53RK i TPRKB); mutacije u ova četiri gena pronađene su u ukupno 32 porodice sa GAMOS-om.
Životinjski model
[uredi | uredi izvor]Braun et al. (2017) otkrili su da je CRISPR/Cas9 posredovano oštećenje gena osgep u larvama zebrica rezultiralo primarnom mikrocefalijom i povećanom apoptozom u mozgu u odnosu na kontrolu. Nokaut riba također je pokazala ranu smrtnost. Embrioni miševa s nokdaunom CRISPR/Cas9 također su pokazali mikrocefalijski fenotip, sa znatno kraćim dužinama moždane kore, srednjim dužinama kore i srednjeg mozga i širinom kore u odnosu na embrione divljeg tipa. Ni mutirane ribe ni mutirani miševi nisu imali fenotip bubrežnih poremećaja, što je možda posljedica rane smrtnosti koja je prikrivala zahvatanje bubrega, koje se moglo dogoditi kod starijih životinja.[11]
Reference
[uredi | uredi izvor]- ^ a b c GRCh38: Ensembl release 89: ENSG00000092094 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000006289 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Seki Y, Ikeda S, Kiyohara H, Ayabe H, Seki T, Matsui H (maj 2002). "Sequencing analysis of a putative human O-sialoglycoprotein endopeptidase gene (OSGEP) and analysis of a bidirectional promoter between the OSGEP and APEX genes". Gene. 285 (1–2): 101–8. doi:10.1016/S0378-1119(02)00429-8. PMID 12039036.
- ^ "Entrez Gene: OSGEP O-sialoglycoprotein endopeptidase".
- ^ "UniProt, Q9NPF4". Pristupljeno 28. 7. 2021.
- ^ Harrison, L., Ascione, A. G., Takiguchi, Y., Wilson, D. M., Chen, D. J., Demple, B. Comparison of the promoters of the mouse (APEX) and human (APE) apurinic endonuclease genes. Mutat. Res. 385: 159-172, 1997. PubMed: 9506886
- ^ Seki, Y., Ikeda, S., Kiyohara, H., Ayabe, H., Seki, T., Matsui, H. Sequencing analysis of a putative human O-sialoglycoprotein endopeptidase gene (OSGEP) and analysis of a bidirectional promoter between the OSGEP and APEX genes. Gene 285: 101-108, 2002. PubMed: 12039036
- ^ Edvardson, S., Prunetti, L., Arraf, A., Haas, D., Bacusmo, J. M., Hu, J. F., Ta-Shma, A., Dedon, P. C., de Crecy-Lagard, V., Elpeleg, O. tRNA N6-adenosine threonylcarbamoyltransferase defect due to KAE1/TCS3 (OSGEP) mutation manifest by neurodegeneration and renal tubulopathy. Europ. J. Hum. Genet. 25: 545-551, 2017. PubMed: 28272532
- ^ Braun, D. A., Rao, J., Mollet, G., Schapiro, D., Daugeron, M.-C., Tan, W., Gribouval, O., Boyer, O., Revy, P., Jobst-Schwan, T., Schmidt, J. M., Lawson, J. A., and 90 others. Mutations in KEOPS-complex genes cause nephrotic syndrome with primary microcephaly. Nature Genet. 49: 1529-1538, 2017. PubMed: 28805828
Dopunska literatura
[uredi | uredi izvor]- Andersson B, Wentland MA, Ricafrente JY, et al. (1996). "A "double adaptor" method for improved shotgun library construction". Anal. Biochem. 236 (1): 107–13. doi:10.1006/abio.1996.0138. PMID 8619474.
- Vickers JD, Packham MA, Kinlough-Rathbone RL (1997). "Differences between platelet phosphoinositide metabolism stimulated by thrombin or SFLLRN are not accounted for by interaction of thrombin with glycoprotein Ib". Am. J. Hematol. 54 (4): 288–95. doi:10.1002/(SICI)1096-8652(199704)54:4<288::AID-AJH5>3.0.CO;2-R. PMID 9092683.
- Yu W, Andersson B, Worley KC, et al. (1997). "Large-Scale Concatenation cDNA Sequencing". Genome Res. 7 (4): 353–8. doi:10.1101/gr.7.4.353. PMC 139146. PMID 9110174.
- Chervenak JL, Illsley NP (2000). "Episialin acts as an antiadhesive factor in an in vitro model of human endometrial-blastocyst attachment". Biol. Reprod. 63 (1): 294–300. doi:10.1095/biolreprod63.1.294. PMID 10859271.
- Kinoshita M, Nakamura T, Ihara M, et al. (2001). "Identification of human endomucin-1 and -2 as membrane-bound O-sialoglycoproteins with anti-adhesive activity". FEBS Lett. 499 (1–2): 121–6. doi:10.1016/S0014-5793(01)02520-0. PMID 11418125.
- Armerding D, Fuhlbrigge RC, Kieffer JD, Kupper TS (2001). "Tonsillar B cells do not express PSGL-1, but a significant fraction displays the cutaneous lymphocyte antigen and exhibits effective E- and P-selectin ligand activity". Int. Arch. Allergy Immunol. 126 (1): 78–90. doi:10.1159/000049497. PMID 11641609.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2003). "Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences". Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899–903. doi:10.1073/pnas.242603899. PMC 139241. PMID 12477932.
- Ota T, Suzuki Y, Nishikawa T, et al. (2004). "Complete sequencing and characterization of 21,243 full-length human cDNAs". Nat. Genet. 36 (1): 40–5. doi:10.1038/ng1285. PMID 14702039.
- Gerhard DS, Wagner L, Feingold EA, et al. (2004). "The Status, Quality, and Expansion of the NIH Full-Length cDNA Project: The Mammalian Gene Collection (MGC)". Genome Res. 14 (10B): 2121–7. doi:10.1101/gr.2596504. PMC 528928. PMID 15489334.
- Rual JF, Venkatesan K, Hao T, et al. (2005). "Towards a proteome-scale map of the human protein-protein interaction network". Nature. 437 (7062): 1173–8. doi:10.1038/nature04209. PMID 16189514.
- Ewing RM, Chu P, Elisma F, et al. (2007). "Large-scale mapping of human protein–protein interactions by mass spectrometry". Mol. Syst. Biol. 3 (1): 89. doi:10.1038/msb4100134. PMC 1847948. PMID 17353931.