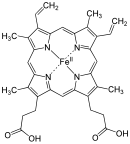
Hem B
| Hem B | |||
|---|---|---|---|
| |||
| Drugi nazivi | Gvožđe protoporfirin IX, protohem IX | ||
| Identifikacija | |||
| CAS registarski broj | 14875-96-8 | ||
| PubChem[1][2] | 444098 | ||
| ChemSpider[3] | 16739950 | ||
| MeSH | |||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C34H32O4N4Fe | ||
| Molarna masa | 616,487 | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Hem B (haem B, protohem IX) je najrasprostanjeniji hem.[4] Hemoglobin i mioglobin su primeri transportnih molekula kiseonika koji sadrže hem B. Familija peroksidaznih enzima takođe sadrži hem B. COX-1[5][6] i COX-2[7] enzimi (ciklooksugenaze) sadrže hem B u jednom od dva aktivna mesta.
Hem B je generalno vezan za okružujući matriks (apoprotein) putem jedne koordinatne veze između gvožđa hema i aminokiselinskog bočnog lanca.
Hemoglobin i mioglobin imaju koordinatnu vezu sa evoluciono konzerviranim histidinom, dok sintaza azot oksida i citohrom P450 imaju koordinacinu vezu sa evoluciono konzerviranim cisteinom.
Gvožđe proteina koji sadrže hem B je vazano za četiri azota porfirina (koji formiraju ravan) i jednim elektron donirajućim atomom proteina. Stoga je gvožđe obično u pentakoordiniranom stanju. Kad se kiseonik ili toksični ugljen monoksid vežu, gvožđe postaje heksakoordinirano.
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Rae, T.; Goff, H. (1998). „The heme prosthetic group of lactoperoxidase. Structural characteristics of heme l and heme l-peptides”. The Journal of Biological Chemistry 273 (43): 27968–27977. DOI:10.1074/jbc.273.43.27968. PMID 9774411.
- ↑ Yokoyama C, Tanabe T (December 1989). „Cloning of human gene encoding prostaglandin endoperoxide synthase and primary structure of the enzyme”. Biochem. Biophys. Res. Commun. 165 (2): 888–94. DOI:10.1016/S0006-291X(89)80049-X. PMID 2512924.
- ↑ Funk CD, Funk LB, Kennedy ME, Pong AS, Fitzgerald GA (June 1991). „Human platelet/erythroleukemia cell prostaglandin G/H synthase: cDNA cloning, expression, and gene chromosomal assignment”. FASEB J. 5 (9): 2304–12. PMID 1907252.
- ↑ Hla, T.; Neilson, K (1992). „Human Cyclooxygenase-2 cDNA”. Proceedings of the National Academy of Sciences 89 (16): 7384–8. DOI:10.1073/pnas.89.16.7384. PMC 49714. PMID 1380156.