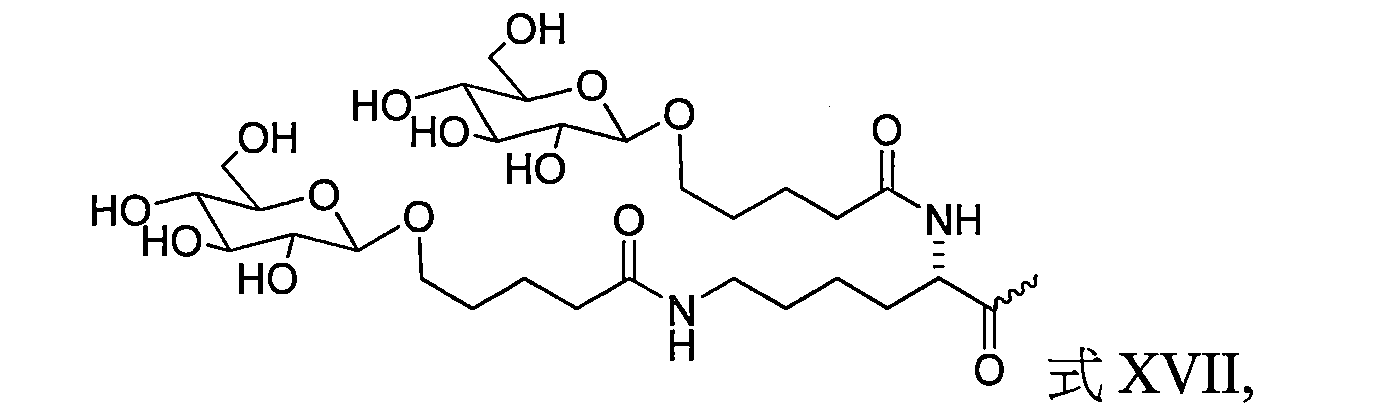
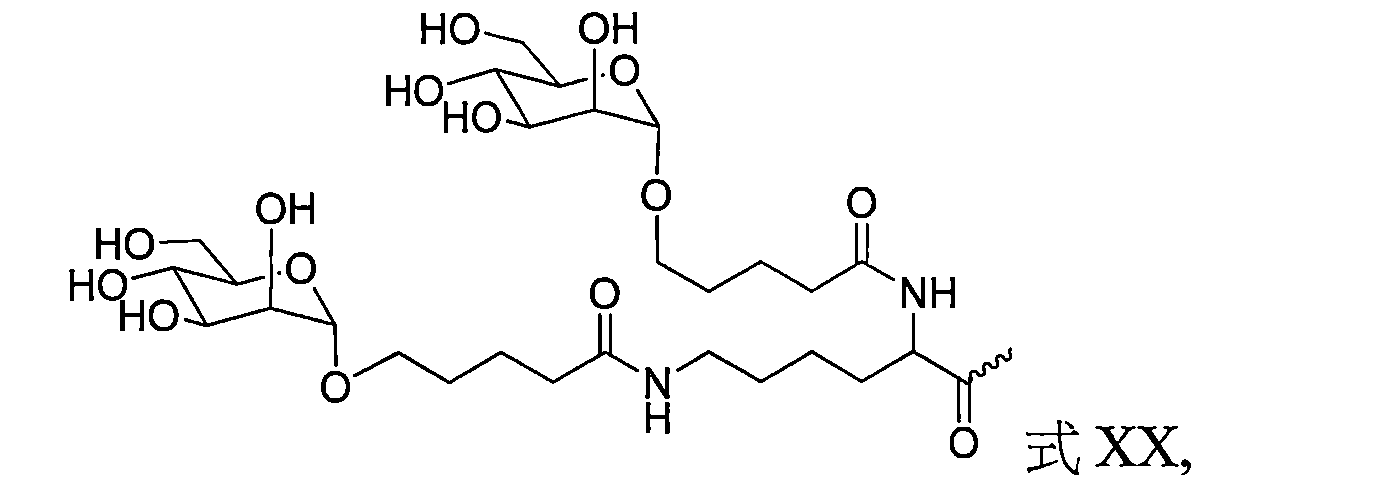
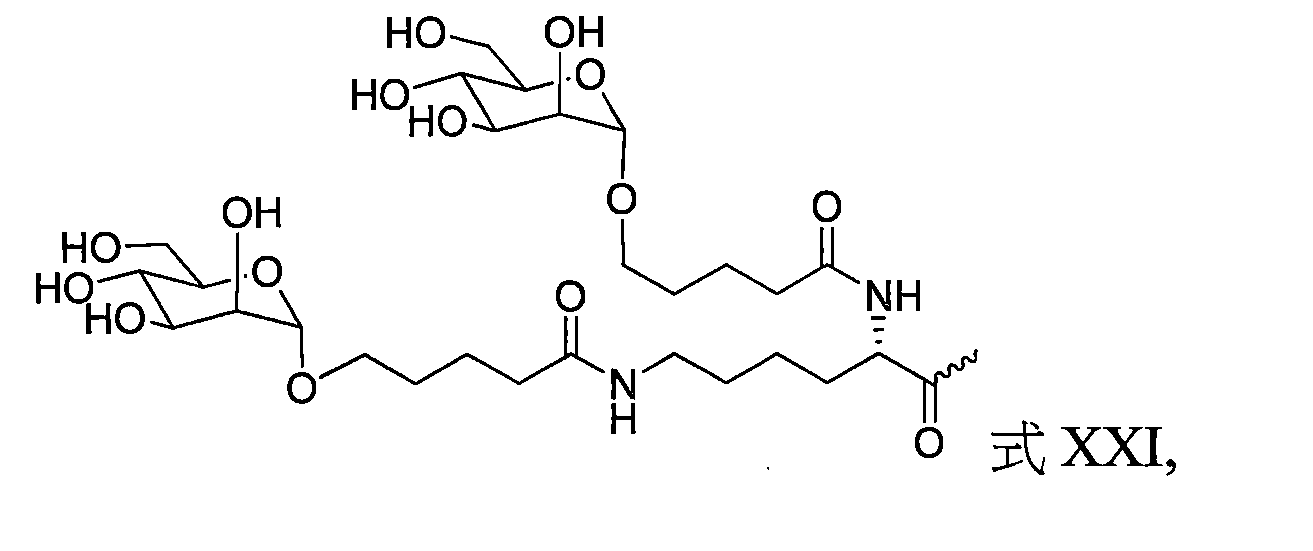
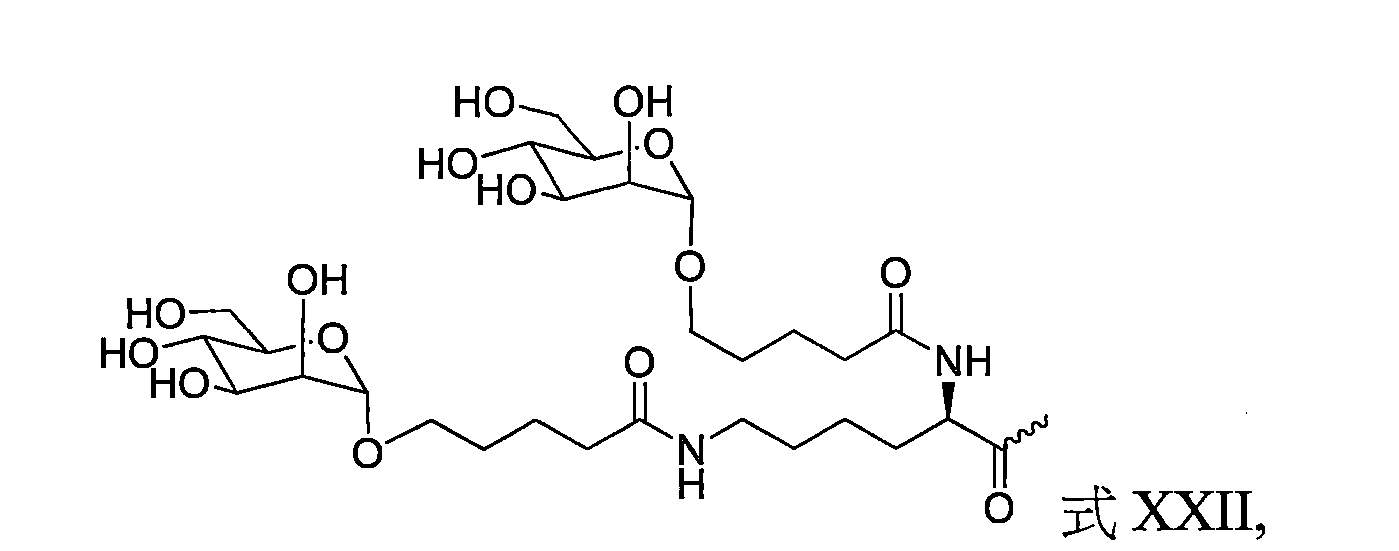
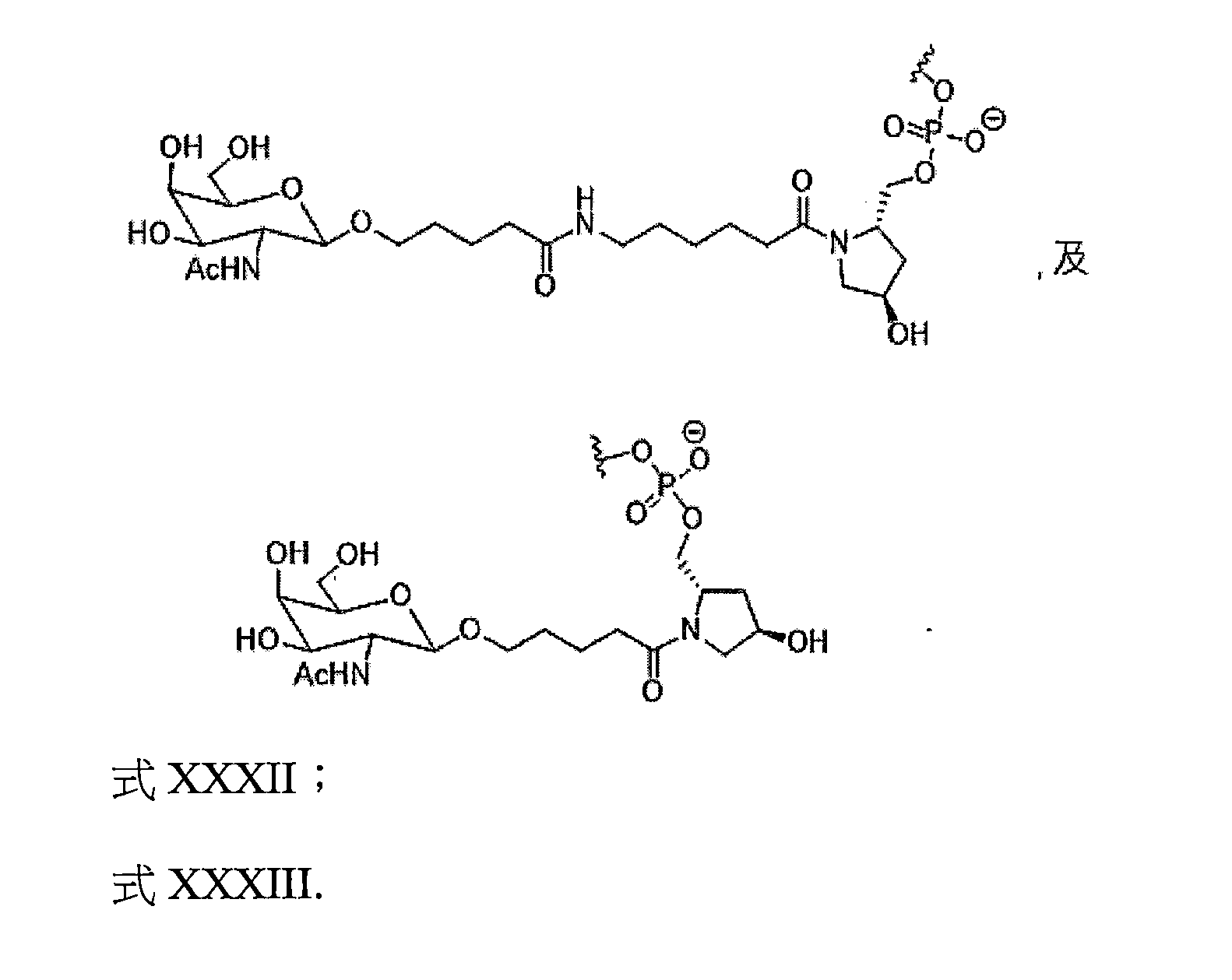
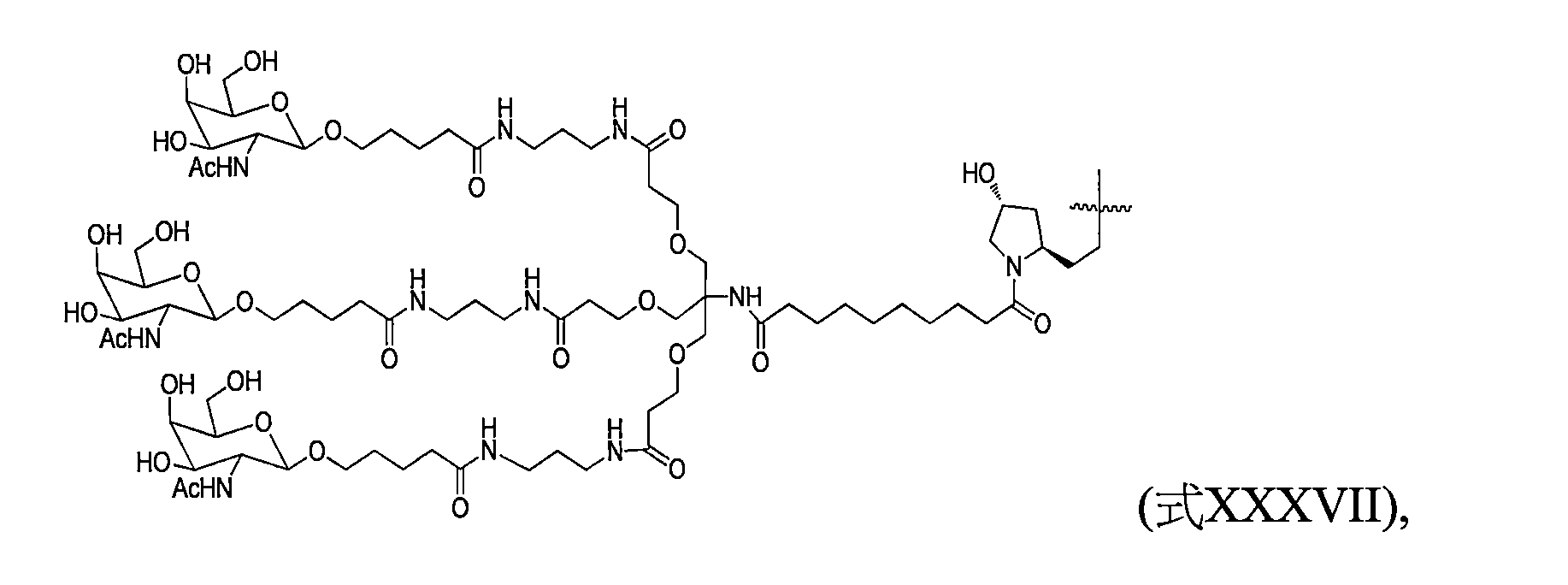
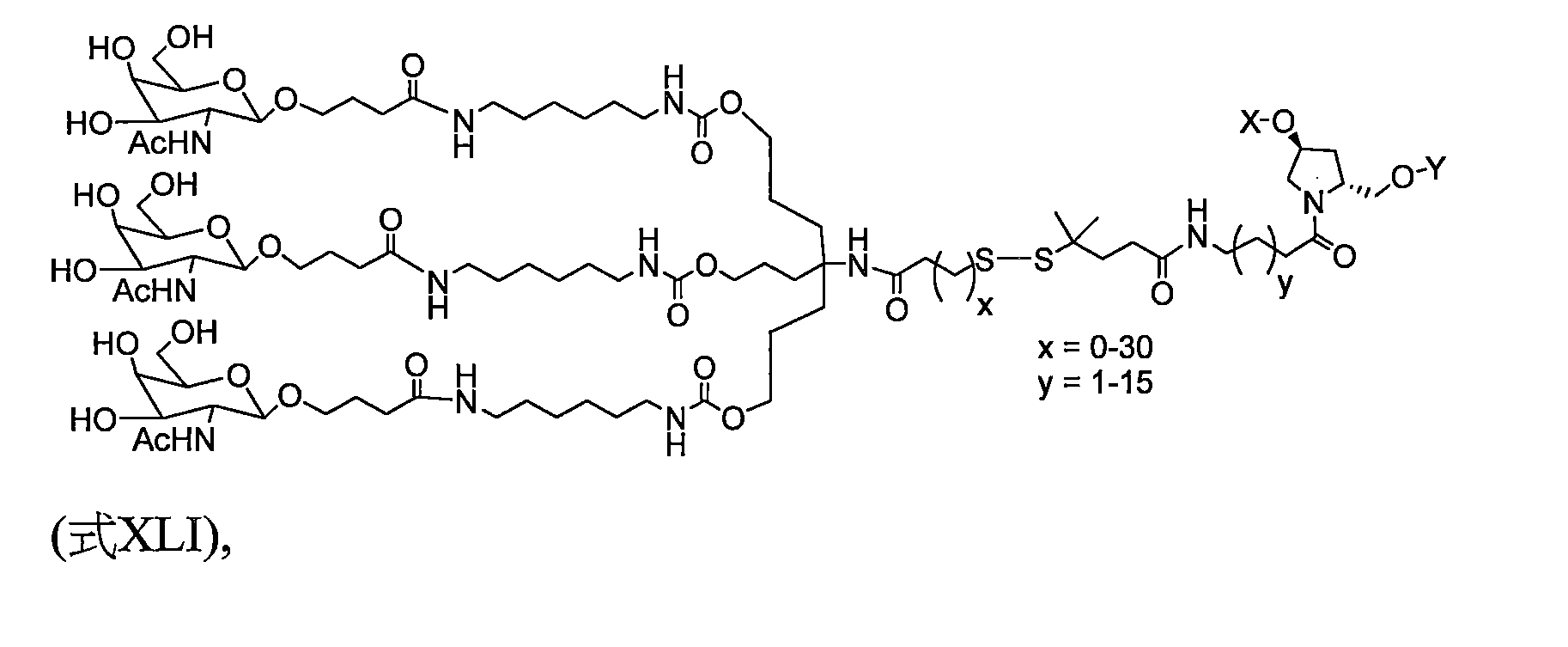
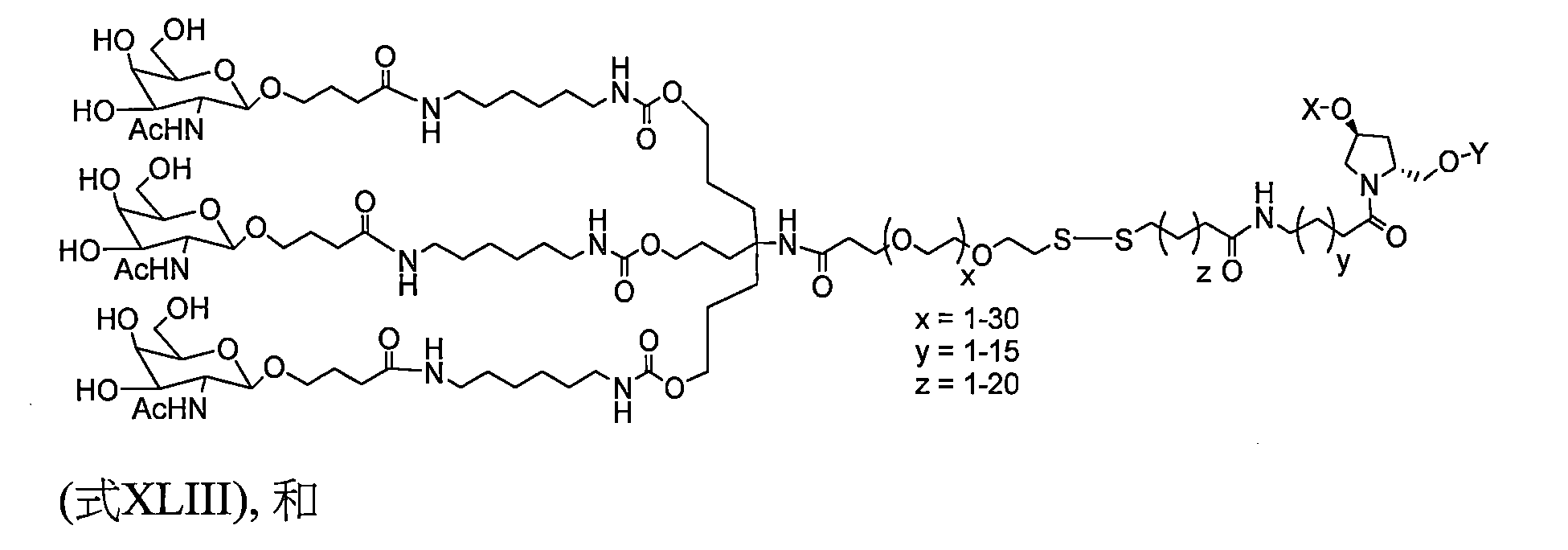
TW202138559A - 含類PATATIN磷脂酶結構域3(PNPLA3)iRNA組成物及其使用方法 - Google Patents
含類PATATIN磷脂酶結構域3(PNPLA3)iRNA組成物及其使用方法 Download PDFInfo
- Publication number
- TW202138559A TW202138559A TW109144095A TW109144095A TW202138559A TW 202138559 A TW202138559 A TW 202138559A TW 109144095 A TW109144095 A TW 109144095A TW 109144095 A TW109144095 A TW 109144095A TW 202138559 A TW202138559 A TW 202138559A
- Authority
- TW
- Taiwan
- Prior art keywords
- nucleotides
- ome
- strand
- nucleotide
- pnpla3
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 93
- 239000000203 mixture Substances 0.000 title claims description 34
- 101001129184 Homo sapiens 1-acylglycerol-3-phosphate O-acyltransferase PNPLA3 Proteins 0.000 title abstract description 19
- 102100031251 1-acylglycerol-3-phosphate O-acyltransferase PNPLA3 Human genes 0.000 title abstract 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 80
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 claims abstract description 78
- 230000014509 gene expression Effects 0.000 claims abstract description 70
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 59
- 101100244213 Homo sapiens PNPLA3 gene Proteins 0.000 claims abstract description 46
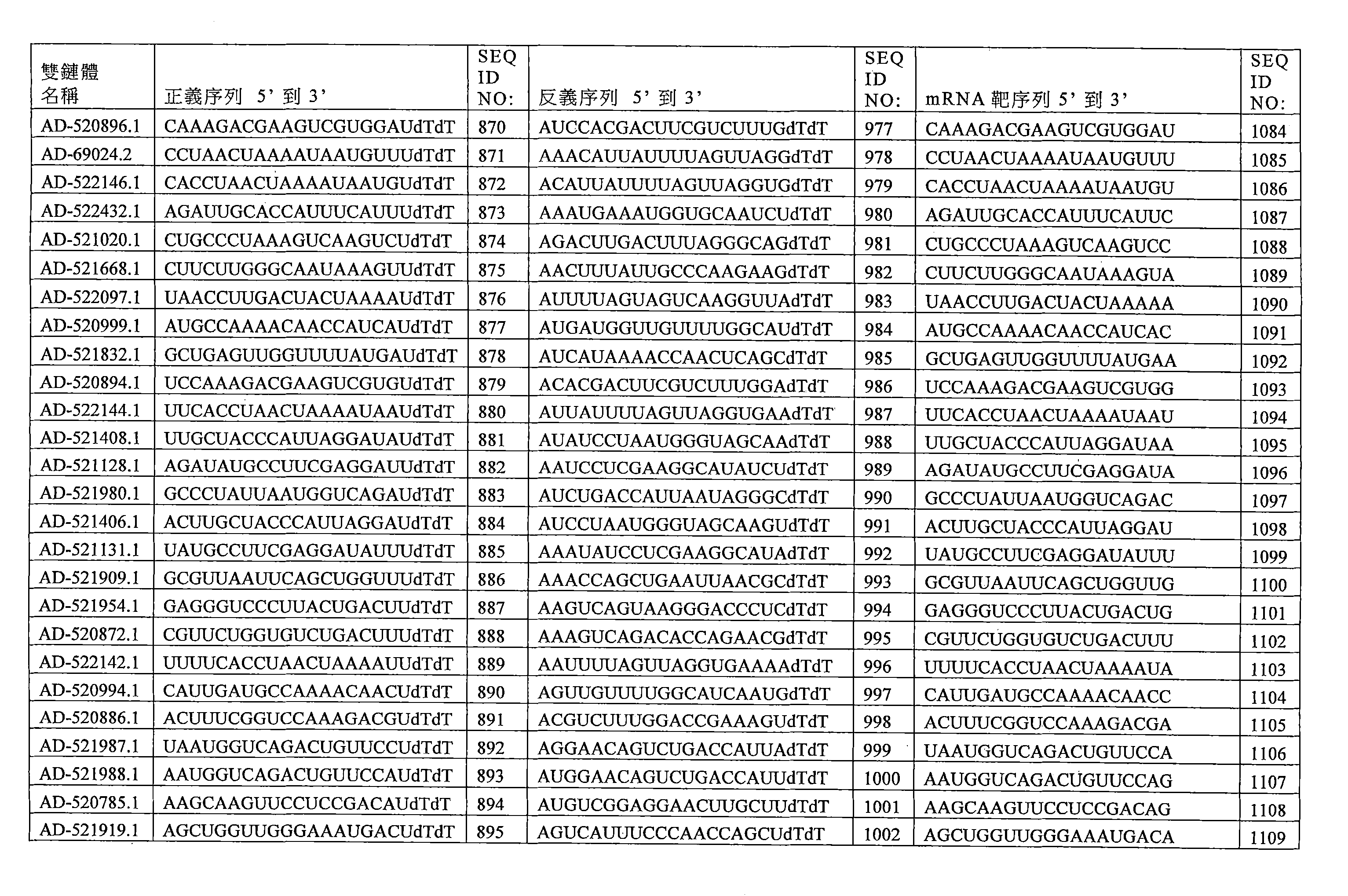
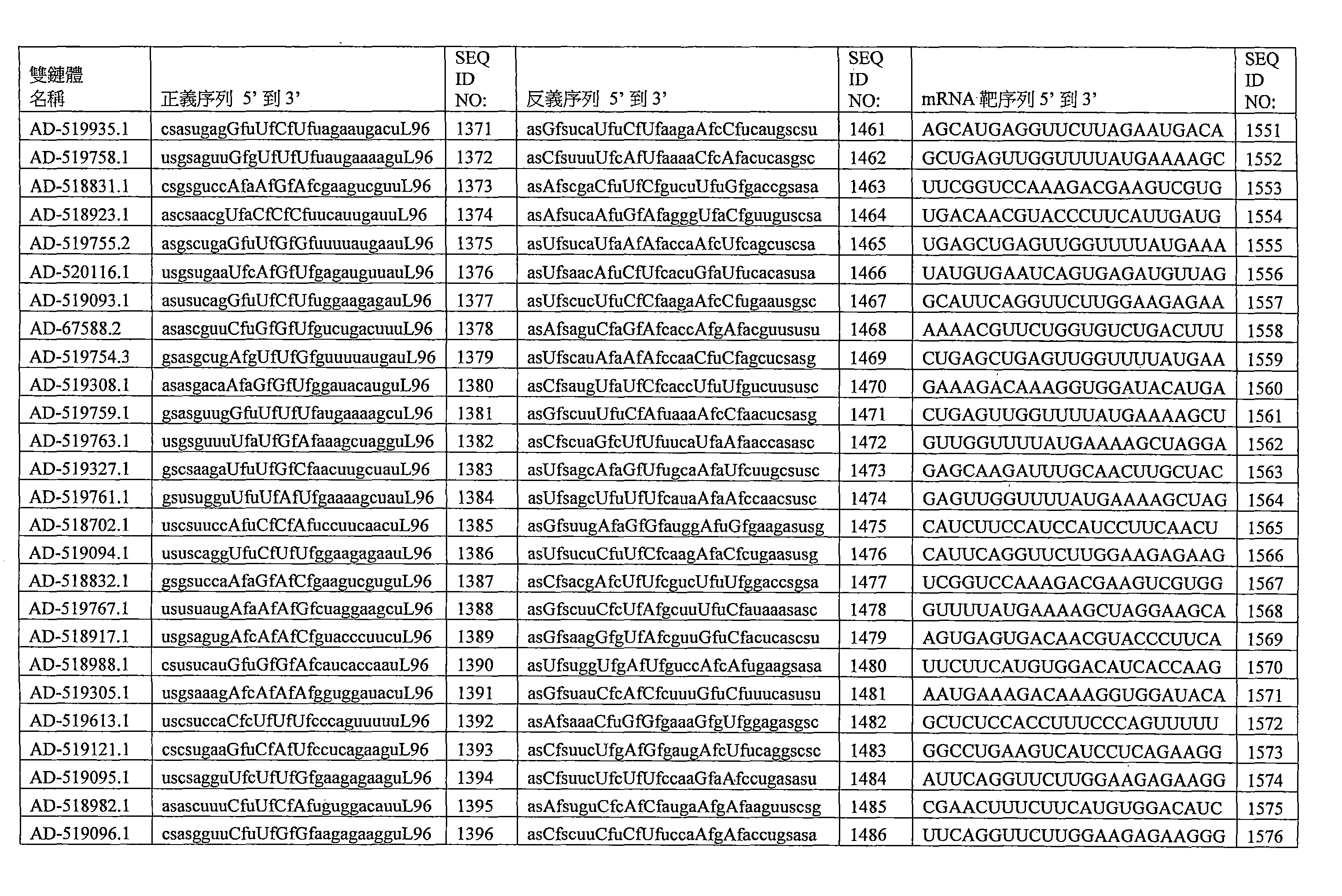
- 125000003729 nucleotide group Chemical group 0.000 claims description 724
- 239000002773 nucleotide Substances 0.000 claims description 668
- 230000000692 anti-sense effect Effects 0.000 claims description 439
- 230000004048 modification Effects 0.000 claims description 410
- 238000012986 modification Methods 0.000 claims description 410
- 239000003795 chemical substances by application Substances 0.000 claims description 362
- 108091081021 Sense strand Proteins 0.000 claims description 273
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 claims description 206
- 239000003446 ligand Substances 0.000 claims description 146
- 210000004027 cell Anatomy 0.000 claims description 119
- 230000000295 complement effect Effects 0.000 claims description 79
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 claims description 74
- -1 Methoxyethyl Chemical group 0.000 claims description 44
- 235000000346 sugar Nutrition 0.000 claims description 44
- 229910052717 sulfur Inorganic materials 0.000 claims description 41
- 102000039446 nucleic acids Human genes 0.000 claims description 39
- 108020004707 nucleic acids Proteins 0.000 claims description 39
- 150000007523 nucleic acids Chemical class 0.000 claims description 33
- 239000008194 pharmaceutical composition Substances 0.000 claims description 33
- 102000002057 Patatin-like phospholipase domains Human genes 0.000 claims description 31
- 108050009491 Patatin-like phospholipase domains Proteins 0.000 claims description 31
- 231100000240 steatosis hepatitis Toxicity 0.000 claims description 31
- 208000035475 disorder Diseases 0.000 claims description 30
- 210000004185 liver Anatomy 0.000 claims description 27
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 claims description 27
- 208000019425 cirrhosis of liver Diseases 0.000 claims description 24
- 230000002401 inhibitory effect Effects 0.000 claims description 24
- 230000008901 benefit Effects 0.000 claims description 20
- 210000005229 liver cell Anatomy 0.000 claims description 20
- 238000009825 accumulation Methods 0.000 claims description 19
- 208000004930 Fatty Liver Diseases 0.000 claims description 18
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 18
- 229910052760 oxygen Inorganic materials 0.000 claims description 18
- 206010019708 Hepatic steatosis Diseases 0.000 claims description 17
- 208000010706 fatty liver disease Diseases 0.000 claims description 17
- 102000004169 proteins and genes Human genes 0.000 claims description 17
- 241000282414 Homo sapiens Species 0.000 claims description 16
- 210000002966 serum Anatomy 0.000 claims description 16
- 208000024891 symptom Diseases 0.000 claims description 16
- 210000004369 blood Anatomy 0.000 claims description 14
- 239000008280 blood Substances 0.000 claims description 14
- 230000007863 steatosis Effects 0.000 claims description 14
- 208000008589 Obesity Diseases 0.000 claims description 13
- 229910019142 PO4 Inorganic materials 0.000 claims description 13
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical group CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 claims description 12
- 235000020824 obesity Nutrition 0.000 claims description 12
- 239000010452 phosphate Substances 0.000 claims description 12
- 230000002829 reductive effect Effects 0.000 claims description 12
- 229920002477 rna polymer Polymers 0.000 claims description 12
- 230000017074 necrotic cell death Effects 0.000 claims description 11
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 claims description 10
- KBDWGFZSICOZSJ-UHFFFAOYSA-N 5-methyl-2,3-dihydro-1H-pyrimidin-4-one Chemical group N1CNC=C(C1=O)C KBDWGFZSICOZSJ-UHFFFAOYSA-N 0.000 claims description 9
- 125000002015 acyclic group Chemical group 0.000 claims description 9
- 208000006454 hepatitis Diseases 0.000 claims description 9
- CAAULPUQFIIOTL-UHFFFAOYSA-N methyl dihydrogen phosphate Chemical compound COP(O)(O)=O CAAULPUQFIIOTL-UHFFFAOYSA-N 0.000 claims description 9
- 235000021317 phosphate Nutrition 0.000 claims description 9
- ZTWTYVWXUKTLCP-UHFFFAOYSA-N vinylphosphonic acid Chemical class OP(O)(=O)C=C ZTWTYVWXUKTLCP-UHFFFAOYSA-N 0.000 claims description 9
- 239000003814 drug Substances 0.000 claims description 8
- 208000018191 liver inflammation Diseases 0.000 claims description 8
- 208000035657 Abasia Diseases 0.000 claims description 7
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 6
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 claims description 6
- 239000007853 buffer solution Substances 0.000 claims description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N ethylene glycol Natural products OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 claims description 5
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 claims description 5
- 239000000243 solution Substances 0.000 claims description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 4
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 claims description 4
- 239000002953 phosphate buffered saline Substances 0.000 claims description 4
- JZTPOMIFAFKKSK-UHFFFAOYSA-N O-phosphonohydroxylamine Chemical class NOP(O)(O)=O JZTPOMIFAFKKSK-UHFFFAOYSA-N 0.000 claims description 3
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical group OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 claims description 3
- 239000011780 sodium chloride Substances 0.000 claims description 3
- 229940124597 therapeutic agent Drugs 0.000 claims description 3
- MPCAJMNYNOGXPB-UHFFFAOYSA-N 1,5-Anhydro-mannit Natural products OCC1OCC(O)C(O)C1O MPCAJMNYNOGXPB-UHFFFAOYSA-N 0.000 claims description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 claims description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 claims description 2
- 125000003158 alcohol group Chemical group 0.000 claims description 2
- 125000001921 locked nucleotide group Chemical group 0.000 claims description 2
- 238000010254 subcutaneous injection Methods 0.000 claims description 2
- 239000007929 subcutaneous injection Substances 0.000 claims description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 claims 2
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical class CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 claims 2
- 108010061711 Gliadin Proteins 0.000 claims 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 claims 1
- 108020004999 messenger RNA Proteins 0.000 claims 1
- 230000009368 gene silencing by RNA Effects 0.000 abstract description 164
- 108091032973 (ribonucleotides)n+m Proteins 0.000 abstract description 107
- 230000008685 targeting Effects 0.000 abstract description 58
- 102000040650 (ribonucleotides)n+m Human genes 0.000 abstract description 24
- 108091030071 RNAI Proteins 0.000 abstract 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 463
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 162
- 229910052731 fluorine Inorganic materials 0.000 description 148
- 125000005647 linker group Chemical group 0.000 description 107
- 108091034117 Oligonucleotide Proteins 0.000 description 66
- 238000003776 cleavage reaction Methods 0.000 description 55
- 108090000765 processed proteins & peptides Proteins 0.000 description 55
- 230000007017 scission Effects 0.000 description 55
- 201000010099 disease Diseases 0.000 description 49
- 239000002777 nucleoside Substances 0.000 description 42
- 239000000562 conjugate Substances 0.000 description 35
- 239000002253 acid Substances 0.000 description 29
- 150000001875 compounds Chemical class 0.000 description 29
- 239000011593 sulfur Substances 0.000 description 28
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 27
- 150000002632 lipids Chemical class 0.000 description 24
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 22
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 22
- 210000001519 tissue Anatomy 0.000 description 22
- 238000011282 treatment Methods 0.000 description 22
- 101150075175 Asgr1 gene Proteins 0.000 description 20
- 150000001720 carbohydrates Chemical group 0.000 description 20
- 239000013598 vector Substances 0.000 description 20
- 241000699670 Mus sp. Species 0.000 description 19
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 19
- 102000000574 RNA-Induced Silencing Complex Human genes 0.000 description 18
- 108010016790 RNA-Induced Silencing Complex Proteins 0.000 description 18
- 235000014633 carbohydrates Nutrition 0.000 description 18
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 18
- 102000040430 polynucleotide Human genes 0.000 description 18
- 108091033319 polynucleotide Proteins 0.000 description 18
- 239000002157 polynucleotide Substances 0.000 description 18
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 17
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 16
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 16
- 102000004196 processed proteins & peptides Human genes 0.000 description 16
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 15
- 229910052799 carbon Inorganic materials 0.000 description 15
- 150000002772 monosaccharides Chemical class 0.000 description 15
- 150000001413 amino acids Chemical group 0.000 description 14
- 125000004122 cyclic group Chemical group 0.000 description 14
- 102000032222 human adiponutrin Human genes 0.000 description 14
- 238000001727 in vivo Methods 0.000 description 14
- 235000018102 proteins Nutrition 0.000 description 14
- 206010016654 Fibrosis Diseases 0.000 description 13
- 102000008100 Human Serum Albumin Human genes 0.000 description 13
- 108091006905 Human Serum Albumin Proteins 0.000 description 13
- 238000000338 in vitro Methods 0.000 description 13
- 238000002360 preparation method Methods 0.000 description 12
- 238000012384 transportation and delivery Methods 0.000 description 12
- 108020004414 DNA Proteins 0.000 description 11
- 102000004190 Enzymes Human genes 0.000 description 11
- 108090000790 Enzymes Proteins 0.000 description 11
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 11
- 108091028664 Ribonucleotide Proteins 0.000 description 11
- 125000000217 alkyl group Chemical group 0.000 description 11
- 239000012634 fragment Substances 0.000 description 11
- 230000009467 reduction Effects 0.000 description 11
- 239000002336 ribonucleotide Substances 0.000 description 11
- 125000002652 ribonucleotide group Chemical group 0.000 description 11
- IYMAXBFPHPZYIK-BQBZGAKWSA-N Arg-Gly-Asp Chemical compound NC(N)=NCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IYMAXBFPHPZYIK-BQBZGAKWSA-N 0.000 description 10
- 229940024606 amino acid Drugs 0.000 description 10
- 235000001014 amino acid Nutrition 0.000 description 10
- 230000015556 catabolic process Effects 0.000 description 10
- 230000007882 cirrhosis Effects 0.000 description 10
- 238000006731 degradation reaction Methods 0.000 description 10
- 150000002148 esters Chemical class 0.000 description 10
- 239000003925 fat Substances 0.000 description 10
- 150000003833 nucleoside derivatives Chemical class 0.000 description 10
- 125000003835 nucleoside group Chemical group 0.000 description 10
- 230000002441 reversible effect Effects 0.000 description 10
- 108091093094 Glycol nucleic acid Proteins 0.000 description 9
- 235000012000 cholesterol Nutrition 0.000 description 9
- 210000000056 organ Anatomy 0.000 description 9
- 239000000816 peptidomimetic Substances 0.000 description 9
- 230000008569 process Effects 0.000 description 9
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 9
- 229930024421 Adenine Natural products 0.000 description 8
- 229960000643 adenine Drugs 0.000 description 8
- 125000004432 carbon atom Chemical group C* 0.000 description 8
- 229940104302 cytosine Drugs 0.000 description 8
- 229920000768 polyamine Polymers 0.000 description 8
- 239000000523 sample Substances 0.000 description 8
- 239000000758 substrate Substances 0.000 description 8
- 150000008163 sugars Chemical class 0.000 description 8
- 150000007513 acids Chemical class 0.000 description 7
- 230000009089 cytolysis Effects 0.000 description 7
- 230000005764 inhibitory process Effects 0.000 description 7
- 229910052757 nitrogen Inorganic materials 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 7
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 7
- 229910052698 phosphorus Inorganic materials 0.000 description 7
- 238000011160 research Methods 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 229940035893 uracil Drugs 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 6
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 6
- 239000002202 Polyethylene glycol Substances 0.000 description 6
- 125000004429 atom Chemical group 0.000 description 6
- 125000002619 bicyclic group Chemical group 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 6
- 210000003494 hepatocyte Anatomy 0.000 description 6
- 239000003112 inhibitor Substances 0.000 description 6
- 239000001301 oxygen Substances 0.000 description 6
- 239000011574 phosphorus Substances 0.000 description 6
- 229920001223 polyethylene glycol Polymers 0.000 description 6
- 239000002243 precursor Substances 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 6
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 6
- 229940088594 vitamin Drugs 0.000 description 6
- 229930003231 vitamin Natural products 0.000 description 6
- 235000013343 vitamin Nutrition 0.000 description 6
- 239000011782 vitamin Substances 0.000 description 6
- 206010022489 Insulin Resistance Diseases 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- 108091093037 Peptide nucleic acid Proteins 0.000 description 5
- 229910005965 SO 2 Inorganic materials 0.000 description 5
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 5
- 239000000074 antisense oligonucleotide Substances 0.000 description 5
- 238000012230 antisense oligonucleotides Methods 0.000 description 5
- 125000003118 aryl group Chemical group 0.000 description 5
- 125000002091 cationic group Chemical group 0.000 description 5
- 229920001577 copolymer Polymers 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 150000004676 glycans Chemical class 0.000 description 5
- 125000005842 heteroatom Chemical group 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 150000004713 phosphodiesters Chemical class 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 4
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 4
- 102000004506 Blood Proteins Human genes 0.000 description 4
- 108010017384 Blood Proteins Proteins 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 4
- 239000004380 Cholic acid Substances 0.000 description 4
- 102100023387 Endoribonuclease Dicer Human genes 0.000 description 4
- 108090000371 Esterases Proteins 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 102000003886 Glycoproteins Human genes 0.000 description 4
- 108090000288 Glycoproteins Proteins 0.000 description 4
- 101000907904 Homo sapiens Endoribonuclease Dicer Proteins 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- 102000007330 LDL Lipoproteins Human genes 0.000 description 4
- 108010007622 LDL Lipoproteins Proteins 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 108091005804 Peptidases Proteins 0.000 description 4
- 102000035195 Peptidases Human genes 0.000 description 4
- 108010039918 Polylysine Proteins 0.000 description 4
- 241000288906 Primates Species 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 125000001931 aliphatic group Chemical group 0.000 description 4
- 150000001408 amides Chemical class 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 230000004700 cellular uptake Effects 0.000 description 4
- 238000007385 chemical modification Methods 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 4
- 235000019416 cholic acid Nutrition 0.000 description 4
- 229960002471 cholic acid Drugs 0.000 description 4
- 230000021615 conjugation Effects 0.000 description 4
- 239000000412 dendrimer Substances 0.000 description 4
- 229920000736 dendritic polymer Polymers 0.000 description 4
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 4
- 150000002016 disaccharides Chemical class 0.000 description 4
- 238000010494 dissociation reaction Methods 0.000 description 4
- 230000005593 dissociations Effects 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 229930182830 galactose Natural products 0.000 description 4
- 230000030279 gene silencing Effects 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 230000002209 hydrophobic effect Effects 0.000 description 4
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 4
- 230000001965 increasing effect Effects 0.000 description 4
- 230000004054 inflammatory process Effects 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 150000002500 ions Chemical class 0.000 description 4
- 210000003734 kidney Anatomy 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 150000003904 phospholipids Chemical class 0.000 description 4
- 125000004437 phosphorous atom Chemical group 0.000 description 4
- 229920000656 polylysine Polymers 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 229920001282 polysaccharide Polymers 0.000 description 4
- 239000005017 polysaccharide Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 125000006413 ring segment Chemical group 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- 150000004043 trisaccharides Chemical class 0.000 description 4
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- 241000702421 Dependoparvovirus Species 0.000 description 3
- 108010042407 Endonucleases Proteins 0.000 description 3
- 229930010555 Inosine Natural products 0.000 description 3
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 3
- 108090001090 Lectins Proteins 0.000 description 3
- 102000004856 Lectins Human genes 0.000 description 3
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- 108010077850 Nuclear Localization Signals Proteins 0.000 description 3
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical group O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 229960001138 acetylsalicylic acid Drugs 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 239000012190 activator Substances 0.000 description 3
- 150000001336 alkenes Chemical class 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 125000002947 alkylene group Chemical group 0.000 description 3
- 125000000304 alkynyl group Chemical group 0.000 description 3
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 description 3
- 125000003710 aryl alkyl group Chemical group 0.000 description 3
- 239000003613 bile acid Substances 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 210000001124 body fluid Anatomy 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 210000000170 cell membrane Anatomy 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 230000000593 degrading effect Effects 0.000 description 3
- 210000001163 endosome Anatomy 0.000 description 3
- 230000004761 fibrosis Effects 0.000 description 3
- 229960000304 folic acid Drugs 0.000 description 3
- 235000019152 folic acid Nutrition 0.000 description 3
- 239000011724 folic acid Substances 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 230000037440 gene silencing effect Effects 0.000 description 3
- OTGHWLKHGCENJV-UHFFFAOYSA-N glycidic acid Chemical compound OC(=O)C1CO1 OTGHWLKHGCENJV-UHFFFAOYSA-N 0.000 description 3
- 125000001475 halogen functional group Chemical group 0.000 description 3
- 125000001072 heteroaryl group Chemical group 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 229960003786 inosine Drugs 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 239000002523 lectin Substances 0.000 description 3
- 239000007791 liquid phase Substances 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 230000009437 off-target effect Effects 0.000 description 3
- 229920001542 oligosaccharide Polymers 0.000 description 3
- 150000002482 oligosaccharides Chemical class 0.000 description 3
- 230000000149 penetrating effect Effects 0.000 description 3
- 150000008300 phosphoramidites Chemical class 0.000 description 3
- 230000001737 promoting effect Effects 0.000 description 3
- 235000019833 protease Nutrition 0.000 description 3
- 102200129022 rs738409 Human genes 0.000 description 3
- 230000037390 scarring Effects 0.000 description 3
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 3
- 159000000000 sodium salts Chemical class 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 125000000547 substituted alkyl group Chemical group 0.000 description 3
- 125000004434 sulfur atom Chemical group 0.000 description 3
- 238000011191 terminal modification Methods 0.000 description 3
- 229940113082 thymine Drugs 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- 230000032258 transport Effects 0.000 description 3
- 150000003626 triacylglycerols Chemical class 0.000 description 3
- 239000013603 viral vector Substances 0.000 description 3
- 235000019165 vitamin E Nutrition 0.000 description 3
- 239000011709 vitamin E Substances 0.000 description 3
- 230000004580 weight loss Effects 0.000 description 3
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 2
- RFSWMBKQFYHKPE-UTLNTRLCSA-N (3S,8S,9S,10R,13S,14S,17R)-10,13-dimethyl-17-[(2R)-6-methylheptan-2-yl]-16-sulfanyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-ol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC(S)[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 RFSWMBKQFYHKPE-UTLNTRLCSA-N 0.000 description 2
- FZWGECJQACGGTI-UHFFFAOYSA-N 2-amino-7-methyl-1,7-dihydro-6H-purin-6-one Chemical compound NC1=NC(O)=C2N(C)C=NC2=N1 FZWGECJQACGGTI-UHFFFAOYSA-N 0.000 description 2
- AGNTUZCMJBTHOG-UHFFFAOYSA-N 3-[3-(2,3-dihydroxypropoxy)-2-hydroxypropoxy]propane-1,2-diol Chemical compound OCC(O)COCC(O)COCC(O)CO AGNTUZCMJBTHOG-UHFFFAOYSA-N 0.000 description 2
- RYVNIFSIEDRLSJ-UHFFFAOYSA-N 5-(hydroxymethyl)cytosine Chemical compound NC=1NC(=O)N=CC=1CO RYVNIFSIEDRLSJ-UHFFFAOYSA-N 0.000 description 2
- LRSASMSXMSNRBT-UHFFFAOYSA-N 5-methylcytosine Chemical compound CC1=CNC(=O)N=C1N LRSASMSXMSNRBT-UHFFFAOYSA-N 0.000 description 2
- UJBCLAXPPIDQEE-UHFFFAOYSA-N 5-prop-1-ynyl-1h-pyrimidine-2,4-dione Chemical compound CC#CC1=CNC(=O)NC1=O UJBCLAXPPIDQEE-UHFFFAOYSA-N 0.000 description 2
- PEHVGBZKEYRQSX-UHFFFAOYSA-N 7-deaza-adenine Chemical compound NC1=NC=NC2=C1C=CN2 PEHVGBZKEYRQSX-UHFFFAOYSA-N 0.000 description 2
- HCGHYQLFMPXSDU-UHFFFAOYSA-N 7-methyladenine Chemical compound C1=NC(N)=C2N(C)C=NC2=N1 HCGHYQLFMPXSDU-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 2
- 241000271566 Aves Species 0.000 description 2
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 2
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 2
- 108010061846 Cholesterol Ester Transfer Proteins Proteins 0.000 description 2
- 102000012336 Cholesterol Ester Transfer Proteins Human genes 0.000 description 2
- 229920000858 Cyclodextrin Polymers 0.000 description 2
- 150000008574 D-amino acids Chemical class 0.000 description 2
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 208000032928 Dyslipidaemia Diseases 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 102100031780 Endonuclease Human genes 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 102100034343 Integrase Human genes 0.000 description 2
- 101710203526 Integrase Proteins 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 208000017170 Lipid metabolism disease Diseases 0.000 description 2
- SMEROWZSTRWXGI-UHFFFAOYSA-N Lithocholsaeure Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 SMEROWZSTRWXGI-UHFFFAOYSA-N 0.000 description 2
- XUMBMVFBXHLACL-UHFFFAOYSA-N Melanin Chemical compound O=C1C(=O)C(C2=CNC3=C(C(C(=O)C4=C32)=O)C)=C2C4=CNC2=C1C XUMBMVFBXHLACL-UHFFFAOYSA-N 0.000 description 2
- 102100031545 Microsomal triglyceride transfer protein large subunit Human genes 0.000 description 2
- 102000014962 Monocyte Chemoattractant Proteins Human genes 0.000 description 2
- 108010064136 Monocyte Chemoattractant Proteins Proteins 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 2
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 2
- BKAYIFDRRZZKNF-VIFPVBQESA-N N-acetylcarnosine Chemical compound CC(=O)NCCC(=O)N[C@H](C(O)=O)CC1=CN=CN1 BKAYIFDRRZZKNF-VIFPVBQESA-N 0.000 description 2
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 2
- OHLUUHNLEMFGTQ-UHFFFAOYSA-N N-methylacetamide Chemical compound CNC(C)=O OHLUUHNLEMFGTQ-UHFFFAOYSA-N 0.000 description 2
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- WSDRAZIPGVLSNP-UHFFFAOYSA-N O.P(=O)(O)(O)O.O.O.P(=O)(O)(O)O Chemical compound O.P(=O)(O)(O)O.O.O.P(=O)(O)(O)O WSDRAZIPGVLSNP-UHFFFAOYSA-N 0.000 description 2
- REYJJPSVUYRZGE-UHFFFAOYSA-N Octadecylamine Chemical compound CCCCCCCCCCCCCCCCCCN REYJJPSVUYRZGE-UHFFFAOYSA-N 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 102000004316 Oxidoreductases Human genes 0.000 description 2
- 108090000854 Oxidoreductases Proteins 0.000 description 2
- KPKZJLCSROULON-QKGLWVMZSA-N Phalloidin Chemical compound N1C(=O)[C@@H]([C@@H](O)C)NC(=O)[C@H](C)NC(=O)[C@H](C[C@@](C)(O)CO)NC(=O)[C@H](C2)NC(=O)[C@H](C)NC(=O)[C@@H]3C[C@H](O)CN3C(=O)[C@@H]1CSC1=C2C2=CC=CC=C2N1 KPKZJLCSROULON-QKGLWVMZSA-N 0.000 description 2
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 2
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 2
- 229920002873 Polyethylenimine Polymers 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- 101710149951 Protein Tat Proteins 0.000 description 2
- RADKZDMFGJYCBB-UHFFFAOYSA-N Pyridoxal Chemical compound CC1=NC=C(CO)C(C=O)=C1O RADKZDMFGJYCBB-UHFFFAOYSA-N 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 229910020008 S(O) Inorganic materials 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 108700019146 Transgenes Proteins 0.000 description 2
- 229910052770 Uranium Inorganic materials 0.000 description 2
- 229930003427 Vitamin E Natural products 0.000 description 2
- XVIYCJDWYLJQBG-UHFFFAOYSA-N acetic acid;adamantane Chemical compound CC(O)=O.C1C(C2)CC3CC1CC2C3 XVIYCJDWYLJQBG-UHFFFAOYSA-N 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 150000001345 alkine derivatives Chemical class 0.000 description 2
- 125000002877 alkyl aryl group Chemical group 0.000 description 2
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 2
- 125000003368 amide group Chemical group 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 125000005122 aminoalkylamino group Chemical group 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 229960005261 aspartic acid Drugs 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 239000013060 biological fluid Substances 0.000 description 2
- 210000004204 blood vessel Anatomy 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- NNBZCPXTIHJBJL-UHFFFAOYSA-N decalin Chemical compound C1CCCC2CCCCC21 NNBZCPXTIHJBJL-UHFFFAOYSA-N 0.000 description 2
- 239000005547 deoxyribonucleotide Substances 0.000 description 2
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 2
- GTZOYNFRVVHLDZ-UHFFFAOYSA-N dodecane-1,1-diol Chemical group CCCCCCCCCCCC(O)O GTZOYNFRVVHLDZ-UHFFFAOYSA-N 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- BNKAXGCRDYRABM-UHFFFAOYSA-N ethenyl dihydrogen phosphate Chemical compound OP(O)(=O)OC=C BNKAXGCRDYRABM-UHFFFAOYSA-N 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 210000001508 eye Anatomy 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 125000003827 glycol group Chemical group 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 208000006575 hypertriglyceridemia Diseases 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000000138 intercalating agent Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 230000002427 irreversible effect Effects 0.000 description 2
- 238000005304 joining Methods 0.000 description 2
- 210000003292 kidney cell Anatomy 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- SMEROWZSTRWXGI-HVATVPOCSA-N lithocholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 SMEROWZSTRWXGI-HVATVPOCSA-N 0.000 description 2
- 208000019423 liver disease Diseases 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 2
- 108091070501 miRNA Proteins 0.000 description 2
- 239000000693 micelle Substances 0.000 description 2
- 239000002679 microRNA Substances 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 108010038232 microsomal triglyceride transfer protein Proteins 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- 229950006780 n-acetylglucosamine Drugs 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 229960002009 naproxen Drugs 0.000 description 2
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 2
- QTNLALDFXILRQO-UHFFFAOYSA-N nonadecane-1,2,3-triol Chemical compound CCCCCCCCCCCCCCCCC(O)C(O)CO QTNLALDFXILRQO-UHFFFAOYSA-N 0.000 description 2
- 125000004430 oxygen atom Chemical group O* 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- ONTNXMBMXUNDBF-UHFFFAOYSA-N pentatriacontane-17,18,19-triol Chemical compound CCCCCCCCCCCCCCCCC(O)C(O)C(O)CCCCCCCCCCCCCCCC ONTNXMBMXUNDBF-UHFFFAOYSA-N 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 2
- 210000002381 plasma Anatomy 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 229920001308 poly(aminoacid) Polymers 0.000 description 2
- 229920002643 polyglutamic acid Polymers 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- ZCCUUQDIBDJBTK-UHFFFAOYSA-N psoralen Chemical compound C1=C2OC(=O)C=CC2=CC2=C1OC=C2 ZCCUUQDIBDJBTK-UHFFFAOYSA-N 0.000 description 2
- 150000003212 purines Chemical class 0.000 description 2
- 108700018163 rat PNPLA3 Proteins 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 229910001415 sodium ion Inorganic materials 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 2
- PFNFFQXMRSDOHW-UHFFFAOYSA-N spermine Chemical compound NCCCNCCCCNCCCN PFNFFQXMRSDOHW-UHFFFAOYSA-N 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- 150000004044 tetrasaccharides Chemical class 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 125000002948 undecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- 235000019155 vitamin A Nutrition 0.000 description 2
- 239000011719 vitamin A Substances 0.000 description 2
- 229940046009 vitamin E Drugs 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical group CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical group C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 description 1
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical group C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 1
- JWZZKOKVBUJMES-UHFFFAOYSA-N (+-)-Isoprenaline Chemical compound CC(C)NCC(O)C1=CC=C(O)C(O)=C1 JWZZKOKVBUJMES-UHFFFAOYSA-N 0.000 description 1
- REPVLJRCJUVQFA-UHFFFAOYSA-N (-)-isopinocampheol Chemical group C1C(O)C(C)C2C(C)(C)C1C2 REPVLJRCJUVQFA-UHFFFAOYSA-N 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- PUDXUJRJLRLJIU-QYVSTXNMSA-N (2r,3r,4r,5r)-5-(6-aminopurin-9-yl)-2-(hydroxymethyl)-4-(2-methoxyethoxy)oxolan-3-ol Chemical compound COCCO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(N)=C2N=C1 PUDXUJRJLRLJIU-QYVSTXNMSA-N 0.000 description 1
- YIMATHOGWXZHFX-WCTZXXKLSA-N (2r,3r,4r,5r)-5-(hydroxymethyl)-3-(2-methoxyethoxy)oxolane-2,4-diol Chemical compound COCCO[C@H]1[C@H](O)O[C@H](CO)[C@H]1O YIMATHOGWXZHFX-WCTZXXKLSA-N 0.000 description 1
- KJTPWUVVLPCPJD-AUWJEWJLSA-N (2z)-7-amino-2-[(4-hydroxy-3,5-dimethylphenyl)methylidene]-5,6-dimethoxy-3h-inden-1-one Chemical compound O=C1C=2C(N)=C(OC)C(OC)=CC=2C\C1=C\C1=CC(C)=C(O)C(C)=C1 KJTPWUVVLPCPJD-AUWJEWJLSA-N 0.000 description 1
- PAHBXVLWUPALMP-KBMWBBLPSA-N (4R)-4-[(8R,9S,10S,13R,14S,17R)-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1H-cyclopenta[a]phenanthren-17-yl]pent-2-enoic acid Chemical compound C1CC2CCCC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@@H](C=CC(O)=O)C)[C@@]1(C)CC2 PAHBXVLWUPALMP-KBMWBBLPSA-N 0.000 description 1
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 description 1
- 125000004400 (C1-C12) alkyl group Chemical group 0.000 description 1
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N 1,1-dimethoxyethane Chemical group COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 1
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical class C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 1
- ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 1,2-dihydrophenazine Chemical compound C1=CC=C2N=C(C=CCC3)C3=NC2=C1 ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 0.000 description 1
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 1
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Chemical group OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 1
- 229940035437 1,3-propanediol Drugs 0.000 description 1
- NEVQCHBUJFYGQO-DNRKLUKYSA-N 1-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-(2-methoxyethoxy)oxolan-2-yl]-5-methylpyrimidine-2,4-dione Chemical compound COCCO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(C)=C1 NEVQCHBUJFYGQO-DNRKLUKYSA-N 0.000 description 1
- MZMNEDXVUJLQAF-UHFFFAOYSA-N 1-o-tert-butyl 2-o-methyl 4-hydroxypyrrolidine-1,2-dicarboxylate Chemical compound COC(=O)C1CC(O)CN1C(=O)OC(C)(C)C MZMNEDXVUJLQAF-UHFFFAOYSA-N 0.000 description 1
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- UHUHBFMZVCOEOV-UHFFFAOYSA-N 1h-imidazo[4,5-c]pyridin-4-amine Chemical compound NC1=NC=CC2=C1N=CN2 UHUHBFMZVCOEOV-UHFFFAOYSA-N 0.000 description 1
- AAILEWXSEQLMNI-UHFFFAOYSA-N 1h-pyridazin-6-one Chemical compound OC1=CC=CN=N1 AAILEWXSEQLMNI-UHFFFAOYSA-N 0.000 description 1
- IHPYMWDTONKSCO-UHFFFAOYSA-N 2,2'-piperazine-1,4-diylbisethanesulfonic acid Chemical compound OS(=O)(=O)CCN1CCN(CCS(O)(=O)=O)CC1 IHPYMWDTONKSCO-UHFFFAOYSA-N 0.000 description 1
- KSXTUUUQYQYKCR-LQDDAWAPSA-M 2,3-bis[[(z)-octadec-9-enoyl]oxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCC(=O)OCC(C[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC KSXTUUUQYQYKCR-LQDDAWAPSA-M 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- AOTQGWFNFTVXNQ-UHFFFAOYSA-N 2-(1-adamantyl)acetic acid Chemical compound C1C(C2)CC3CC2CC1(CC(=O)O)C3 AOTQGWFNFTVXNQ-UHFFFAOYSA-N 0.000 description 1
- QSHACTSJHMKXTE-UHFFFAOYSA-N 2-(2-aminopropyl)-7h-purin-6-amine Chemical compound CC(N)CC1=NC(N)=C2NC=NC2=N1 QSHACTSJHMKXTE-UHFFFAOYSA-N 0.000 description 1
- PIINGYXNCHTJTF-UHFFFAOYSA-N 2-(2-azaniumylethylamino)acetate Chemical compound NCCNCC(O)=O PIINGYXNCHTJTF-UHFFFAOYSA-N 0.000 description 1
- GJHACCZCUOJMPX-UHFFFAOYSA-N 2-aminooxy-2-oxo-1,3,2lambda5-dioxaphosphetane-4-thione Chemical class P1(=O)(OC(=S)O1)ON GJHACCZCUOJMPX-UHFFFAOYSA-N 0.000 description 1
- KJJPLEZQSCZCKE-UHFFFAOYSA-N 2-aminopropane-1,3-diol Chemical group OCC(N)CO KJJPLEZQSCZCKE-UHFFFAOYSA-N 0.000 description 1
- PYSRRFNXTXNWCD-UHFFFAOYSA-N 3-(2-phenylethenyl)furan-2,5-dione Chemical compound O=C1OC(=O)C(C=CC=2C=CC=CC=2)=C1 PYSRRFNXTXNWCD-UHFFFAOYSA-N 0.000 description 1
- VXGRJERITKFWPL-UHFFFAOYSA-N 4',5'-Dihydropsoralen Natural products C1=C2OC(=O)C=CC2=CC2=C1OCC2 VXGRJERITKFWPL-UHFFFAOYSA-N 0.000 description 1
- GUEIFVRYWPOXHJ-DNRKLUKYSA-N 4-amino-1-[(2r,3r,4r,5r)-4-hydroxy-5-(hydroxymethyl)-3-(2-methoxyethoxy)oxolan-2-yl]-5-methylpyrimidin-2-one Chemical compound COCCO[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=C(N)C(C)=C1 GUEIFVRYWPOXHJ-DNRKLUKYSA-N 0.000 description 1
- OVONXEQGWXGFJD-UHFFFAOYSA-N 4-sulfanylidene-1h-pyrimidin-2-one Chemical compound SC=1C=CNC(=O)N=1 OVONXEQGWXGFJD-UHFFFAOYSA-N 0.000 description 1
- ZLAQATDNGLKIEV-UHFFFAOYSA-N 5-methyl-2-sulfanylidene-1h-pyrimidin-4-one Chemical compound CC1=CNC(=S)NC1=O ZLAQATDNGLKIEV-UHFFFAOYSA-N 0.000 description 1
- KXBCLNRMQPRVTP-UHFFFAOYSA-N 6-amino-1,5-dihydroimidazo[4,5-c]pyridin-4-one Chemical compound O=C1NC(N)=CC2=C1N=CN2 KXBCLNRMQPRVTP-UHFFFAOYSA-N 0.000 description 1
- DCPSTSVLRXOYGS-UHFFFAOYSA-N 6-amino-1h-pyrimidine-2-thione Chemical compound NC1=CC=NC(S)=N1 DCPSTSVLRXOYGS-UHFFFAOYSA-N 0.000 description 1
- LOSIULRWFAEMFL-UHFFFAOYSA-N 7-deazaguanine Chemical compound O=C1NC(N)=NC2=C1CC=N2 LOSIULRWFAEMFL-UHFFFAOYSA-N 0.000 description 1
- HRYKDUPGBWLLHO-UHFFFAOYSA-N 8-azaadenine Chemical compound NC1=NC=NC2=NNN=C12 HRYKDUPGBWLLHO-UHFFFAOYSA-N 0.000 description 1
- FJNCXZZQNBKEJT-UHFFFAOYSA-N 8beta-hydroxymarrubiin Natural products O1C(=O)C2(C)CCCC3(C)C2C1CC(C)(O)C3(O)CCC=1C=COC=1 FJNCXZZQNBKEJT-UHFFFAOYSA-N 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- 108010062307 AAVALLPAVLLALLAP Proteins 0.000 description 1
- 239000005541 ACE inhibitor Substances 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 108700023418 Amidases Proteins 0.000 description 1
- 108700031308 Antennapedia Homeodomain Proteins 0.000 description 1
- 101150102415 Apob gene Proteins 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 241000239290 Araneae Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 102000005427 Asialoglycoprotein Receptor Human genes 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- BUGGUMMQXXNZEI-UEWDXFNNSA-N C(C)(=O)NCCCCCCN1[C@@H](CC(C1)O)CO Chemical compound C(C)(=O)NCCCCCCN1[C@@H](CC(C1)O)CO BUGGUMMQXXNZEI-UEWDXFNNSA-N 0.000 description 1
- BPFIHHTZKLGPET-UHFFFAOYSA-N CCCCCCCCCCCCCCCCOCC(CO)OCCCCCCCCCCCCCCCC.CCN(CC)CC Chemical compound CCCCCCCCCCCCCCCCOCC(CO)OCCCCCCCCCCCCCCCC.CCN(CC)CC BPFIHHTZKLGPET-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- 125000000824 D-ribofuranosyl group Chemical group [H]OC([H])([H])[C@@]1([H])OC([H])(*)[C@]([H])(O[H])[C@]1([H])O[H] 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Chemical group CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical class S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000000666 Fowlpox Diseases 0.000 description 1
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- 244000060234 Gmelina philippensis Species 0.000 description 1
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 1
- 108010070875 Human Immunodeficiency Virus tat Gene Products Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- 229940125922 IBAT inhibitor Drugs 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- 229920001202 Inulin Polymers 0.000 description 1
- 206010023126 Jaundice Diseases 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 1
- 101710128836 Large T antigen Proteins 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 241000282553 Macaca Species 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- 108090000301 Membrane transport proteins Proteins 0.000 description 1
- 102000003939 Membrane transport proteins Human genes 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 102000002151 Microfilament Proteins Human genes 0.000 description 1
- 108010040897 Microfilament Proteins Proteins 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 241000713869 Moloney murine leukemia virus Species 0.000 description 1
- 102000015728 Mucins Human genes 0.000 description 1
- 108010063954 Mucins Proteins 0.000 description 1
- 101100244214 Mus musculus Pnpla3 gene Proteins 0.000 description 1
- LNZQMSQNOOANKW-VUWPPUDQSA-N NCCCCCCN1[C@@H](CC(C1)O)CO Chemical compound NCCCCCCN1[C@@H](CC(C1)O)CO LNZQMSQNOOANKW-VUWPPUDQSA-N 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 241000700629 Orthopoxvirus Species 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 239000007990 PIPES buffer Substances 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 241001631646 Papillomaviridae Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108010009711 Phalloidine Proteins 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- 108010069381 Platelet Endothelial Cell Adhesion Molecule-1 Proteins 0.000 description 1
- 102100024616 Platelet endothelial cell adhesion molecule Human genes 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- 241001505332 Polyomavirus sp. Species 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102100034207 Protein argonaute-2 Human genes 0.000 description 1
- 208000003251 Pruritus Diseases 0.000 description 1
- 239000004373 Pullulan Substances 0.000 description 1
- 229920001218 Pullulan Polymers 0.000 description 1
- 102000007615 Pulmonary Surfactant-Associated Protein A Human genes 0.000 description 1
- 108010007100 Pulmonary Surfactant-Associated Protein A Proteins 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 230000007022 RNA scission Effects 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 241000269435 Rana <genus> Species 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 108091007187 Reductases Proteins 0.000 description 1
- 241001068295 Replication defective viruses Species 0.000 description 1
- 108010057163 Ribonuclease III Proteins 0.000 description 1
- 102000003661 Ribonuclease III Human genes 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 108091027568 Single-stranded nucleotide Proteins 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229930182558 Sterol Natural products 0.000 description 1
- 229920000147 Styrene maleic anhydride Polymers 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 102000011923 Thyrotropin Human genes 0.000 description 1
- 108010061174 Thyrotropin Proteins 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 101800001690 Transmembrane protein gp41 Proteins 0.000 description 1
- UYXTWWCETRIEDR-UHFFFAOYSA-N Tributyrin Chemical compound CCCC(=O)OCC(OC(=O)CCC)COC(=O)CCC UYXTWWCETRIEDR-UHFFFAOYSA-N 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003779 Vitamin B12 Natural products 0.000 description 1
- 208000020560 abdominal swelling Diseases 0.000 description 1
- 108020002494 acetyltransferase Proteins 0.000 description 1
- 102000005421 acetyltransferase Human genes 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- PPQRONHOSHZGFQ-LMVFSUKVSA-N aldehydo-D-ribose 5-phosphate Chemical group OP(=O)(O)OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PPQRONHOSHZGFQ-LMVFSUKVSA-N 0.000 description 1
- 125000005024 alkenyl aryl group Chemical group 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 125000005217 alkenylheteroaryl group Chemical group 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000005083 alkoxyalkoxy group Chemical group 0.000 description 1
- 125000004948 alkyl aryl alkyl group Chemical group 0.000 description 1
- 125000005213 alkyl heteroaryl group Chemical group 0.000 description 1
- 125000005600 alkyl phosphonate group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 125000005025 alkynylaryl group Chemical group 0.000 description 1
- 125000004419 alkynylene group Chemical group 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 102000018568 alpha-Defensin Human genes 0.000 description 1
- HMFHBZSHGGEWLO-NEEWWZBLSA-N alpha-L-ribose Chemical compound OC[C@@H]1O[C@@H](O)[C@@H](O)[C@H]1O HMFHBZSHGGEWLO-NEEWWZBLSA-N 0.000 description 1
- 108050007802 alpha-defensin Proteins 0.000 description 1
- 102000005922 amidase Human genes 0.000 description 1
- 150000001409 amidines Chemical class 0.000 description 1
- 125000004103 aminoalkyl group Chemical group 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 229960003473 androstanolone Drugs 0.000 description 1
- 239000002333 angiotensin II receptor antagonist Substances 0.000 description 1
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 229940127218 antiplatelet drug Drugs 0.000 description 1
- 230000004596 appetite loss Effects 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000005018 aryl alkenyl group Chemical group 0.000 description 1
- 125000005015 aryl alkynyl group Chemical group 0.000 description 1
- 108010006523 asialoglycoprotein receptor Proteins 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000037429 base substitution Effects 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- HMFHBZSHGGEWLO-TXICZTDVSA-N beta-D-ribose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-TXICZTDVSA-N 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- 108050002883 beta-defensin Proteins 0.000 description 1
- 102000012265 beta-defensin Human genes 0.000 description 1
- 229920000080 bile acid sequestrant Polymers 0.000 description 1
- 229940096699 bile acid sequestrants Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- CKDOCTFBFTVPSN-UHFFFAOYSA-N borneol Chemical group C1CC2(C)C(C)CC1C2(C)C CKDOCTFBFTVPSN-UHFFFAOYSA-N 0.000 description 1
- 229940116229 borneol Drugs 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 108010046237 cecropin P1-LI Proteins 0.000 description 1
- PRIVBYDFWSFUFP-RJLJEYQFSA-N cecropin p1 Chemical compound O=C([C@H](CCC(N)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](N)CO)[C@@H](C)O)[C@@H](C)CC)[C@@H](C)CC)NCC(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(O)=O PRIVBYDFWSFUFP-RJLJEYQFSA-N 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000005859 cell recognition Effects 0.000 description 1
- 210000004671 cell-free system Anatomy 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- BHONFOAYRQZPKZ-LCLOTLQISA-N chembl269478 Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(O)=O)C1=CC=CC=C1 BHONFOAYRQZPKZ-LCLOTLQISA-N 0.000 description 1
- 150000005829 chemical entities Chemical class 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 230000001906 cholesterol absorption Effects 0.000 description 1
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- JVHIPYJQMFNCEK-UHFFFAOYSA-N cytochalasin Natural products N1C(=O)C2(C(C=CC(C)CC(C)CC=C3)OC(C)=O)C3C(O)C(=C)C(C)C2C1CC1=CC=CC=C1 JVHIPYJQMFNCEK-UHFFFAOYSA-N 0.000 description 1
- ZMAODHOXRBLOQO-UHFFFAOYSA-N cytochalasin-A Natural products N1C(=O)C23OC(=O)C=CC(=O)CCCC(C)CC=CC3C(O)C(=C)C(C)C2C1CC1=CC=CC=C1 ZMAODHOXRBLOQO-UHFFFAOYSA-N 0.000 description 1
- 210000004292 cytoskeleton Anatomy 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 238000002716 delivery method Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000030609 dephosphorylation Effects 0.000 description 1
- 238000006209 dephosphorylation reaction Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 150000005690 diesters Chemical group 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical group OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 1
- ZGSPNIOCEDOHGS-UHFFFAOYSA-L disodium [3-[2,3-di(octadeca-9,12-dienoyloxy)propoxy-oxidophosphoryl]oxy-2-hydroxypropyl] 2,3-di(octadeca-9,12-dienoyloxy)propyl phosphate Chemical compound [Na+].[Na+].CCCCCC=CCC=CCCCCCCCC(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COP([O-])(=O)OCC(O)COP([O-])(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COC(=O)CCCCCCCC=CCC=CCCCCC ZGSPNIOCEDOHGS-UHFFFAOYSA-L 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- DTGKSKDOIYIVQL-UHFFFAOYSA-N dl-isoborneol Chemical group C1CC2(C)C(O)CC1C2(C)C DTGKSKDOIYIVQL-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- CHNUOJQWGUIOLD-NFZZJPOKSA-N epalrestat Chemical compound C=1C=CC=CC=1\C=C(/C)\C=C1/SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-NFZZJPOKSA-N 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 230000003631 expected effect Effects 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 229940125753 fibrate Drugs 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 235000021323 fish oil Nutrition 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 125000003843 furanosyl group Chemical group 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000012226 gene silencing method Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 125000002350 geranyl group Chemical group [H]C([*])([H])/C([H])=C(C([H])([H])[H])/C([H])([H])C([H])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 150000002337 glycosamines Chemical class 0.000 description 1
- 150000002338 glycosides Chemical group 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000004024 hepatic stellate cell Anatomy 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 125000004447 heteroarylalkenyl group Chemical group 0.000 description 1
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 1
- 125000005312 heteroarylalkynyl group Chemical group 0.000 description 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 1
- 125000004449 heterocyclylalkenyl group Chemical group 0.000 description 1
- 125000004415 heterocyclylalkyl group Chemical group 0.000 description 1
- GNOIPBMMFNIUFM-UHFFFAOYSA-N hexamethylphosphoric triamide Chemical compound CN(C)P(=O)(N(C)C)N(C)C GNOIPBMMFNIUFM-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 108091008039 hormone receptors Proteins 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 238000010185 immunofluorescence analysis Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 210000003963 intermediate filament Anatomy 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- JYJIGFIDKWBXDU-MNNPPOADSA-N inulin Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)OC[C@]1(OC[C@]2(OC[C@]3(OC[C@]4(OC[C@]5(OC[C@]6(OC[C@]7(OC[C@]8(OC[C@]9(OC[C@]%10(OC[C@]%11(OC[C@]%12(OC[C@]%13(OC[C@]%14(OC[C@]%15(OC[C@]%16(OC[C@]%17(OC[C@]%18(OC[C@]%19(OC[C@]%20(OC[C@]%21(OC[C@]%22(OC[C@]%23(OC[C@]%24(OC[C@]%25(OC[C@]%26(OC[C@]%27(OC[C@]%28(OC[C@]%29(OC[C@]%30(OC[C@]%31(OC[C@]%32(OC[C@]%33(OC[C@]%34(OC[C@]%35(OC[C@]%36(O[C@@H]%37[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O%37)O)[C@H]([C@H](O)[C@@H](CO)O%36)O)[C@H]([C@H](O)[C@@H](CO)O%35)O)[C@H]([C@H](O)[C@@H](CO)O%34)O)[C@H]([C@H](O)[C@@H](CO)O%33)O)[C@H]([C@H](O)[C@@H](CO)O%32)O)[C@H]([C@H](O)[C@@H](CO)O%31)O)[C@H]([C@H](O)[C@@H](CO)O%30)O)[C@H]([C@H](O)[C@@H](CO)O%29)O)[C@H]([C@H](O)[C@@H](CO)O%28)O)[C@H]([C@H](O)[C@@H](CO)O%27)O)[C@H]([C@H](O)[C@@H](CO)O%26)O)[C@H]([C@H](O)[C@@H](CO)O%25)O)[C@H]([C@H](O)[C@@H](CO)O%24)O)[C@H]([C@H](O)[C@@H](CO)O%23)O)[C@H]([C@H](O)[C@@H](CO)O%22)O)[C@H]([C@H](O)[C@@H](CO)O%21)O)[C@H]([C@H](O)[C@@H](CO)O%20)O)[C@H]([C@H](O)[C@@H](CO)O%19)O)[C@H]([C@H](O)[C@@H](CO)O%18)O)[C@H]([C@H](O)[C@@H](CO)O%17)O)[C@H]([C@H](O)[C@@H](CO)O%16)O)[C@H]([C@H](O)[C@@H](CO)O%15)O)[C@H]([C@H](O)[C@@H](CO)O%14)O)[C@H]([C@H](O)[C@@H](CO)O%13)O)[C@H]([C@H](O)[C@@H](CO)O%12)O)[C@H]([C@H](O)[C@@H](CO)O%11)O)[C@H]([C@H](O)[C@@H](CO)O%10)O)[C@H]([C@H](O)[C@@H](CO)O9)O)[C@H]([C@H](O)[C@@H](CO)O8)O)[C@H]([C@H](O)[C@@H](CO)O7)O)[C@H]([C@H](O)[C@@H](CO)O6)O)[C@H]([C@H](O)[C@@H](CO)O5)O)[C@H]([C@H](O)[C@@H](CO)O4)O)[C@H]([C@H](O)[C@@H](CO)O3)O)[C@H]([C@H](O)[C@@H](CO)O2)O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JYJIGFIDKWBXDU-MNNPPOADSA-N 0.000 description 1
- 229940029339 inulin Drugs 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000004628 isothiazolidinyl group Chemical group S1N(CCC1)* 0.000 description 1
- 230000007803 itching Effects 0.000 description 1
- GQWYWHOHRVVHAP-DHKPLNAMSA-N jaspamide Chemical compound C1([C@@H]2NC(=O)[C@@H](CC=3C4=CC=CC=C4NC=3Br)N(C)C(=O)[C@H](C)NC(=O)[C@@H](C)C/C(C)=C/[C@H](C)C[C@@H](OC(=O)C2)C)=CC=C(O)C=C1 GQWYWHOHRVVHAP-DHKPLNAMSA-N 0.000 description 1
- GQWYWHOHRVVHAP-UHFFFAOYSA-N jasplakinolide Natural products C1C(=O)OC(C)CC(C)C=C(C)CC(C)C(=O)NC(C)C(=O)N(C)C(CC=2C3=CC=CC=C3NC=2Br)C(=O)NC1C1=CC=C(O)C=C1 GQWYWHOHRVVHAP-UHFFFAOYSA-N 0.000 description 1
- 108010052440 jasplakinolide Proteins 0.000 description 1
- 210000001630 jejunum Anatomy 0.000 description 1
- 238000003367 kinetic assay Methods 0.000 description 1
- DDVBPZROPPMBLW-ZJBINBEQSA-N latrunculin a Chemical compound C([C@H]1[C@@]2(O)C[C@H]3C[C@H](O2)CC[C@@H](/C=C\C=C/CC\C(C)=C/C(=O)O3)C)SC(=O)N1 DDVBPZROPPMBLW-ZJBINBEQSA-N 0.000 description 1
- DDVBPZROPPMBLW-UHFFFAOYSA-N latrunculin-A Natural products O1C(=O)C=C(C)CCC=CC=CC(C)CCC(O2)CC1CC2(O)C1CSC(=O)N1 DDVBPZROPPMBLW-UHFFFAOYSA-N 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 150000002634 lipophilic molecules Chemical class 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 235000021266 loss of appetite Nutrition 0.000 description 1
- 208000019017 loss of appetite Diseases 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 230000002934 lysing effect Effects 0.000 description 1
- 125000002960 margaryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000009061 membrane transport Effects 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- WDWDWGRYHDPSDS-UHFFFAOYSA-N methanimine Chemical group N=C WDWDWGRYHDPSDS-UHFFFAOYSA-N 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- IDBOAVAEGRJRIZ-UHFFFAOYSA-N methylidenehydrazine Chemical group NN=C IDBOAVAEGRJRIZ-UHFFFAOYSA-N 0.000 description 1
- 210000003632 microfilament Anatomy 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- QNILTEGFHQSKFF-UHFFFAOYSA-N n-propan-2-ylprop-2-enamide Chemical compound CC(C)NC(=O)C=C QNILTEGFHQSKFF-UHFFFAOYSA-N 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229910052758 niobium Inorganic materials 0.000 description 1
- 229950006344 nocodazole Drugs 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 102000002574 p38 Mitogen-Activated Protein Kinases Human genes 0.000 description 1
- 108010068338 p38 Mitogen-Activated Protein Kinases Proteins 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 210000004738 parenchymal cell Anatomy 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000000863 peptide conjugate Substances 0.000 description 1
- 125000001151 peptidyl group Chemical group 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 210000002824 peroxisome Anatomy 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- DHHVAGZRUROJKS-UHFFFAOYSA-N phentermine Chemical compound CC(C)(N)CC1=CC=CC=C1 DHHVAGZRUROJKS-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 1
- 210000002706 plastid Anatomy 0.000 description 1
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 1
- 229920002627 poly(phosphazenes) Polymers 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 150000004804 polysaccharides Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920000166 polytrimethylene carbonate Chemical group 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 150000004032 porphyrins Chemical class 0.000 description 1
- 230000032361 posttranscriptional gene silencing Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 230000004952 protein activity Effects 0.000 description 1
- 235000019423 pullulan Nutrition 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000002213 purine nucleotide Substances 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 229960003581 pyridoxal Drugs 0.000 description 1
- 235000008164 pyridoxal Nutrition 0.000 description 1
- 239000011674 pyridoxal Substances 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- RONWGALEIBILOG-VMJVVOMYSA-N quinine sulfate Chemical compound [H+].[H+].[O-]S([O-])(=O)=O.C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21.C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 RONWGALEIBILOG-VMJVVOMYSA-N 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 239000002265 redox agent Substances 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 210000005084 renal tissue Anatomy 0.000 description 1
- 125000006853 reporter group Chemical group 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 231100000241 scar Toxicity 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000004055 small Interfering RNA Substances 0.000 description 1
- 230000008410 smoothened signaling pathway Effects 0.000 description 1
- QPILZZVXGUNELN-UHFFFAOYSA-M sodium;4-amino-5-hydroxynaphthalene-2,7-disulfonate;hydron Chemical compound [Na+].OS(=O)(=O)C1=CC(O)=C2C(N)=CC(S([O-])(=O)=O)=CC2=C1 QPILZZVXGUNELN-UHFFFAOYSA-M 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 229940063673 spermidine Drugs 0.000 description 1
- 229940063675 spermine Drugs 0.000 description 1
- 150000003408 sphingolipids Chemical class 0.000 description 1
- 239000004059 squalene synthase inhibitor Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000003335 steric effect Effects 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical group NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 1
- 125000000565 sulfonamide group Chemical group 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical group [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 150000003457 sulfones Chemical group 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- RJVBVECTCMRNFG-ANKJNSLFSA-N swinholide a Chemical compound C1[C@H](OC)C[C@H](C)O[C@H]1CC[C@H](C)[C@H](O)[C@H](C)[C@@H]1[C@@H](C)[C@H](O)C[C@H](O)[C@H](C)[C@@H](OC)C[C@H](CC=C2)O[C@@H]2C[C@@H](O)C/C=C(\C)/C=C/C(=O)O[C@H]([C@@H](C)[C@@H](O)[C@@H](C)CC[C@@H]2O[C@@H](C)C[C@H](C2)OC)[C@@H](C)[C@H](O)C[C@H](O)[C@H](C)[C@@H](OC)C[C@H](CC=C2)O[C@@H]2C[C@@H](O)C/C=C(\C)/C=C/C(=O)O1 RJVBVECTCMRNFG-ANKJNSLFSA-N 0.000 description 1
- GDACDJNQZCXLNU-UHFFFAOYSA-N swinholide-A Natural products C1C(OC)CC(C)OC1CCC(C)C(O)C(C)C1C(C)C(O)CC(O)C(C)C(OC)CC(CC=C2)OC2CC(O)CC=C(C)C=CC(=O)O1 GDACDJNQZCXLNU-UHFFFAOYSA-N 0.000 description 1
- 210000002437 synoviocyte Anatomy 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 238000012385 systemic delivery Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 229960000874 thyrotropin Drugs 0.000 description 1
- 230000001748 thyrotropin Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- ZMANZCXQSJIPKH-UHFFFAOYSA-O triethylammonium ion Chemical compound CC[NH+](CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-O 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 235000019163 vitamin B12 Nutrition 0.000 description 1
- 239000011715 vitamin B12 Substances 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 208000016261 weight loss Diseases 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
- XOOUIPVCVHRTMJ-UHFFFAOYSA-L zinc stearate Chemical compound [Zn+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O XOOUIPVCVHRTMJ-UHFFFAOYSA-L 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/318—Chemical structure of the backbone where the PO2 is completely replaced, e.g. MMI or formacetal
- C12N2310/3183—Diol linkers, e.g. glycols or propanediols
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/321—2'-O-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/322—2'-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Genetics & Genomics (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Virology (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本發明涉及靶向含類PATATIN磷脂酶結構域3(PNPLA3)基因的RNAi劑,例如雙股RNA(dsRNA)劑。本發明亦涉及使用此種RNAi劑以抑制PNPLA3基因表達的方法,以及預防和治療PNPLA3相關病症的方法,例如非酒精性脂肪肝疾病(NAFLD)。
Description
本申請主張享有於2019年12月16日提交的美國臨時申請第62/948,445號和於2020年6月18日提交的美國臨時申請第63/040,602號的優先權。上述每個申請的全部內容藉由引用而併入本文。
[序列表]
本申請含有序列表,該序列表已經以ASCII格式用電子方式提交,並且其全部內容藉由引用併入本文。所述ASCII副本(創建於12月3日)命名為121301-10620_SL.txt,其大小為1,097,169字節。
本發明係關於含類PATATIN磷脂酶結構域3(PNPLA3)的iRNA劑,該劑用於抑制PNPLA3基因表達的方法以及用於預防和治療病症的用途。
肝臟中過剩量的三酸甘油酯的累積被稱為肝的脂肪變性(或脂肪肝),並與不良的代謝後果相關,包含胰島素抗性和血脂異常。脂肪肝經常
可見於過量酒精攝入的患者和患有肥胖症、糖尿病或高脂血症的患者。然而,在沒有過量酒精攝入(>10g/天)的情況下,非酒精性脂肪肝疾病(NAFLD)可能發生。NAFLD係指範圍很廣的一系列肝臟疾病,其可能從單純性脂肪肝(脂肪變性)進展為非酒精性脂肪性肝炎(NASH),進展為肝硬化(不可逆的、晚期的肝臟瘢痕)。NAFLD的所有階段的共同點是脂肪在肝臟細胞(肝細胞)中的積累(脂肪浸潤)。
NAFLD譜系自其最簡單的階段開始及進展,稱為單純性脂肪肝(脂肪變性)。單純性脂肪肝涉及脂肪(三酸甘油酯)在肝臟細胞中的積累,而沒有炎症(肝炎)或瘢痕形成(纖維化)。NAFLD譜系之嚴重度的下一個階段及程度為NASH,其涉及脂肪在肝細胞中的累積以及肝臟的炎症。發炎的細胞破壞肝臟細胞(肝細胞的壞死),而NASH最終導致肝臟瘢痕(纖維化),隨後是不可逆的晚期瘢痕(肝硬化)。由NASH所引起的肝硬化是NAFLD譜系中最後及最嚴重的階段。
在2008年,一項利用對個案的肝臟的質子磁共振波譜分析以評估肝脂肪含量的全基因體關聯研究指出,肝脂肪含量與含類PATATIN磷脂酶結構域3(PNPLA3)基因之間有顯著關聯(參見,例如,Romeo et al.(2008)Nat.Genet.,40(12):1461-1465)。對基因敲入小鼠的研究顯示,PNPLA3中的一個序列多型性(rs738409,I148M)的表達引發NAFLD,並且脂滴表面的無催化活性的PNPLA3的累積與肝臟中三酸甘油酯的累積相關(Smagris et al.(2015)Hepatology,61:108-118)。具體而言,PNPLA3的I148M變體與促進纖維化的發展相關,係藉由激活hedgehog(Hh)訊息傳導路徑,導致肝星狀細胞的活化和
增殖以及細胞外基質的過度生成和沉積(Chen et al.(2015)World J.Gastroenterol.,21(3):794-802)。
目前,對NAFLD的治療係朝向於體重減輕以及治療繼發性病況,比如胰島素抗性或血脂異常。迄今為止,尚未有針對NAFLD的藥物治療獲得批准。因此,有需求於針對苦於NAFLD的患者的療法。
本發明提供iRNA組成物,該組成物影響編碼含類PATATIN磷脂酶結構域3(PNPLA3)之基因的RNA轉錄本的RNA誘導沉默複合體(RISC)所介導的裂解。含類PATATIN磷脂酶結構域3可能是位於細胞內,例如受試者(比如人類受試者)內的細胞。
在一個態樣中,本發明提供了一種雙股核糖核酸(dsRNA)劑,其用於細胞中抑制含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中dsRNA劑包括正義股和反義股,該二股形成雙股區域,其中正義股包括與SEQ ID NO:1的核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸,並且反義股包括與SEQ ID NO:2的核苷酸序列相異不超過1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。在一個具體例中,dsRNA劑包括至少一種熱不穩定的核苷酸修飾,例如無鹼基修飾;雙鏈體(duplex)中與相對核苷酸的錯配;以及不穩定的糖修飾,2’-去氧修飾、無環核苷酸、未鎖核酸(UNA)或二醇核酸(GNA)、例如,反義股包括至少一個熱不穩定的核苷酸修飾。
在另一個態樣中,本發明提供雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中該dsRNA包括正義股和反義股,該二股形成雙股區域,其中反義股包括編碼含類PATATIN磷脂酶結構域3(PNPLA3)的mRNA的互補性區域,並且其中該互補性區域包括與表2-11、21、24、27、30、32、33、36、37、49或50之任一表中的反義核苷酸序列之任一者相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個態樣中,本發明提供雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中該dsRNA包括正義股和反義股,該二股形成雙股區域,其中正義股包括與SEQ ID NO:1核苷酸序列的核苷酸677-721、683-721、773-817、1185-1295、1185-1241、1202-1295、1202-1241、1255-1295、1738-1792、1901-1945、1920-1945、2108-2208、2108-2166、2108-2136,2121-2166、2121-2208、2169-2208、2176-2208、或2239-2265的任何一個核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸,並且反義股包括來自SEQ ID NO:2之對應核苷酸序列的至少19個接連的核苷酸。
在一個態樣中,本發明提供雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中該dsRNA包括正義股和反義股,該二股形成雙股區域,其中正義股包括與SEQ ID NO:1核苷酸序列的核苷酸574-596、677-699、683-705、699-721、773-795、795-817、1185-1207、1192-1214、1202-1224、1208-1230、1209-1231、1210-1232、1211-1233、1212-1234、1213-1233、1214-1234、1214-1236、1215-
1237、1216-1238、1219-1237、1219-1241、1255-1275、1256-1276、1257-1275、1257-1277、1258-1278、1259-1279、1260-1278、1260-1280、1261-1281、1262-1282、1263-1283、1264-1282、1264-1284、1265-1285、1267-1285、1266-1286、1266-1288、1267-1285、1267-1287、1268-1290、1269-1289、1270-1290、1271-1291、1272-1292、1273-1293、1274-1294、1275-1295、1631-1653、1738-1760、1739-1761、1740-1760、1740-1762、1741-1763、1744-1766、1746-1766、1750-1772、1751-1773、1752-1774、1753-1775、1754-1776、1755-1777、1756-1778、1757-1779、1758-1780、1759-1781、1760-1782、1761-1783、1762-1782、1762-1784、1763-1785、1764-1786、1765-1787、1766-1786、1766-1788、1767-1787、1768-1788、1767-1789、1769-1789、1770-1788、1770-1790、1771-1791、1772-1792、1815-1837、1901-1923,1920-1942,1923-1945、2112-2130、2169-2191、2171-2191、2176-2198,2177-2199,2178-2200、2179-2201,2180-2202、2181-2203、2183-2205、2184-2206、2186-2208、2239-2261、2241-2263、2242-2264、或2243-2265的任何一個核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸,並且反義股包括來自SEQ ID NO:2之對應核苷酸序列的至少19個接連的核苷酸。
在一個具體例中,反義股包括與選自下列所組成之群組的雙鏈體的任一反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸:AD-517197.2、AD-517258.2、AD-516748.2、AD-516851.2、AD-519351.2、AD-519754.2、AD-519828.2、AD-520018.2、AD-520035.2、AD-520062.2、AD-520064.2、AD-520065.2、AD-
520067.2、AD-75289.2、AD-520069.2、AD-520099.2、AD-67575.7、AD-520101.2、AD-67605.7、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、和AD-1193481.1。
在一個具體例中,反義股包括該接連的核苷酸與選自下列所組成之群組的雙鏈體的任一反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸:AD-519345.1、AD-519346.1、AD-519347.1、AD-67554.7、AD-519752.3、AD-1010731.1、AD-1010732.1、AD-519343.1、AD-519344.1、AD-519349.1、AD-519350.1、AD-519753.2、AD-519932.1、AD-519935.2、AD-520018.6、AD-517837.2、AD-805635.2、AD-519329.2、AD-520063.2、AD-519757.2、AD-805631.2、AD-516917.2、AD-516828.2、AD-518983.2、AD-805636.2、AD-519754.7、AD-520062.2、AD-67575.9、AD-518923.3、AD-520053.4、AD-519667.2、AD-519773.2、AD-519354.2、AD-520060.4、AD-520061.4、AD-1010733.2、AD-1010735.2、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、和AD-1193481.1。
在一個態樣中,本發明提供雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中dsRNA包括正義股和反義股,該二股形成雙股區域,其中正義股包括與SEQ ID NO:1核苷酸序列中的核苷酸1200-1250、1205-1250、11210-1250、1200-1245、1200-
1240、1200-1235、1200-1237、1205-1237、1210-1232、1212-1237、1212-1234、1250-1300、1255-1300、1260-1300、1250-1295、1250-1390、1250-1285、1250-1282、1255-1282、1260-1282、1262-1300、1262-1295、1262-1390、和1262-1282的任何一個核苷酸序列相異不超過3個核苷酸的至少15個接連的核苷酸,並且反義股包括來自SEQ ID NO:2中對應的核苷酸序列的至少15個接連的核苷酸。
在一個具體例中,反義股包括與選自下列所組成之群組的雙鏈體的反義股核苷酸序列相異不超過0、1、2或3個核苷酸之至少15個,例如15、16、17、18、19或20個接連的核苷酸:AD-519345、AD-1193350、AD-1193365、AD-1193437和AD-519347。
在一個具體例中,反義股包括與雙鏈體AD-519351的反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-1193350的反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-1193365的反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-1193437的反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-519347的反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,dsRNA劑包括至少一個修飾核苷酸。
在一個具體例中,正義股的實質上所有核苷酸包括修飾;反義股的實質上所有核苷酸包括修飾;或者,正義股的實質上所有核苷酸和反義股的實質上所有核苷酸包括修飾。
在一個具體例中,正義股的所有核苷酸包括修飾;反義股的所有核苷酸包括修飾;或者,正義股的所有核苷酸和反義股的所有核苷酸包括修飾。
在一個具體例中,至少一個修飾核苷酸是選自於由下列所組成的群組:去氧-核苷酸、3'-末端去氧-胸腺嘧啶(dT)核苷酸、2'-O-甲基修飾核苷酸、2'-氟基修飾核苷酸、2'-去氧-修飾核苷酸、鎖核苷酸、未鎖核苷酸、構象限制核苷酸、約束乙基核苷酸、無鹼基核苷酸、2'-胺基-修飾核苷酸、2'-O-烯丙基-修飾核苷酸、2'-C-烷基-修飾核苷酸、2'-羥基-修飾核苷酸、2'-甲氧基乙基-修飾核苷酸、2'-O-烷基-修飾核苷酸、N-嗎啉基核苷酸、胺基磷酸酯、包括非自然鹼基的核苷酸、四氫哌喃修飾核苷酸、1,5-脫水己糖醇修飾核苷酸、環己烯基修飾核苷酸、包括硫代磷酸基團的核苷酸、包括甲基膦酸基團的核苷酸、包括5'-磷酸的核苷酸、包括5'-磷酸模擬物的核苷酸、熱不穩定的核苷酸、二醇修飾核苷酸(GNA)和2-O-(N-甲基乙醯胺)修飾核苷酸;及其組合。
在一個具體例中,核苷酸上的修飾是選自於由下列所組成的群組:LNA、HNA、CeNA、2'-甲氧基乙基、2'-O-烷基、2'-O-烯丙基、2'-C-烯丙基、2'-氟基、2'-去氧、2'-羥基、和二醇基;及其組合。
在一個具體例中,至少一個修飾過的核苷酸是選自於由下列所組成的群組:去氧-核苷酸、2'-O-甲基修飾核苷酸、2'-氟基修飾核苷酸、2'-去氧-修飾核苷酸、二醇修飾核苷酸(GNA)、例如Ggn、Cgn、Tgn或Agn、和、乙烯基-膦酸核苷酸;及其組合。
在另一個具體例中,核苷酸的至少一個修飾為熱不穩定的核苷酸修飾。
在一個具體例中,熱不穩定的核苷酸修飾是選自於由下列所組成的群組:無鹼基修飾;雙鏈體中與相對核苷酸的錯配;和不穩定的糖修飾、2’-去氧修飾、無環核苷酸、未鎖核酸(UNA)以及二醇核酸(GNA)。
在一些具體例中,修飾核苷酸包括一段3'-末端去氧-胸腺嘧啶核苷酸(dT)的短序列。
在一些具體例中,核苷酸的修飾是2’-O-甲基,GNA和2’-氟基修飾。
在一些具體例中,dsRNA劑進一步地包括至少一個硫代磷酸酯核苷酸間鍵聯。在一些具體例中,dsRNA劑包括6至8個硫代磷酸酯核苷酸間鍵聯。在一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的3'-末端。可選的,該股是反義股。在另一個具體例中,該股是正義股。在相關的具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的5'-末端。可選的,該股是反義股。在另一個具體例中,該股是正義股。在另一個具體例中,
硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的5'-末端及3'-末端二者。可選的,該股是反義股。在另一個具體例中,該股是正義股。
雙股區域可能是19至30個核苷酸對的長度;19至25個核苷酸對的長度;19至23個核苷酸對的長度;23至27個核苷酸對的長度;或者是21至23個核苷酸對的長度。
在一個具體例中,各股獨立地不超過30個核苷酸的長度。
在一個具體例中,正義股是21個核苷酸的長度,並且反義股是23個核苷酸的長度。
互補性區域可能是至少17個核苷酸的長度;介於19至23個核苷酸的長度;或者,19個核苷酸的長度。
在一個具體例中,至少一股包括至少1個核苷酸的3'突出。在另一個具體例中,至少一股包括至少2個核苷酸的3'突出。
在一個具體例中,dsRNA劑進一步地包括配體。
在一個具體例中,該配體是接合到dsRNA劑之正義股的3'端。
在一個具體例中,配體是N-乙醯半乳糖胺(GalNAc)衍生物。
在一個具體例中,配體是經由一價、二價或三價分枝鏈接子所附接的一個或多個GalNAc衍生物。
在一個具體例中,配體為
在一個具體例中,dsRNA劑如以下方案所示被接合到配體
並且,其中的X是O或S。
在一個具體例中,X是O。
在一個具體例中,dsRNA劑進一步地包括至少一個硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯。
在一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的3'-末端,例如,反義股或正義股。
在另一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的5'-末端,例如,反義股或正義股。
在一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的5'-末端及3'-末端二者。在一個具體例中,該股是反義股。
在一個具體例中,雙鏈體之反義股的5'-端1號位置的鹼基對是AU鹼基對。
本發明還提供了含有本發明之任何dsRNA劑的細胞,以及包括本發明之任何dsRNA劑的醫藥組成物。
本發明的醫藥組成物可以包含在未緩衝溶液中的dsRNA劑,例如鹽水或水,或者本發明的醫藥組成物可以包含在緩衝溶液中的dsRNA劑,例如包括乙酸鹽、檸檬酸鹽、醇溶蛋白、碳酸鹽、或磷酸鹽或其任何組合的緩衝溶液;或者磷酸鹽緩衝鹽水(PBS)。
在一個態樣中,本發明提供了一種抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)基因表達的方法。該方法包含使細胞與本發明的任何dsRNA或本發明的任何醫藥組成物接觸,從而抑制細胞中PNPLA3基因的表達。
在一個具體例中,細胞是於受試者內,例如人類受試者,例如受試者具有含類PATATIN磷脂酶結構域3(PNPLA3)相關病症,諸如選自於由下列所組成的群組的含類PATATIN磷脂酶結構域3(PNPLA3)相關病症:脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
在一個具體例中,細胞與dsRNA劑接觸係抑制PNPLA3表達的程度至少50%、60%、70%、80%、90%、或95%。
在一個具體例中,抑制PNPLA3的表達降低受試者血清中PNPLA3蛋白質量級至少50%、60%、70%、80%、90%、或95%。
在一個態樣中,本發明提供了一種治療受試者的方法,該受試者具有將受益於含類PATATIN磷脂醇結構域3(PNPLA3)表達減低的病症。該方法包含向受試者施用治療有效量的本發明的任何dsRNA或本發明的任何醫藥組成物,從而治療該受試者具有將受益於PNPLA3表達減低的病症。
在另一個態樣中,本發明提供了一種預防受試者至少一項症狀的方法,該受試者具有將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達減低的病症。
該方法包含向受試者施用預防有效量的本發明的任何dsRNA或本發明的任何醫藥組成物,從而預防該受試者具有將受益於含PNPLA3表達減低的病症之至少一項症狀。
在一個具體例中,該病症為一種含類PATATIN磷脂酶結構域3(PNPLA3)相關病症,例如,含類PATATIN磷脂酶結構域蛋白3(PNPLA3)相關病症係選自於由下列所組成的群組:脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
在一個具體例中,PNPLA3相關病症是NAFLD。
在一個具體例中,受試者是人。
在一個具體例中,給受試者施用的dsRNA劑的劑量為約0.01mg/kg至約50mg/kg。
在一個具體例中,dsRNA劑是以皮下注射施用給受試者。
在一個具體例中,本發明的方法包含進一步地測定得自受試者的樣本中PNPLA3的量級。
在一個具體例中,受試者樣本中含類PATATIN磷脂酶結構域3(PNPLA3)的量級,是指血液或血清樣本中的含類PATATIN磷脂酶結構域3(PNPLA3)的蛋白質的量級。
在特定的一些具體例中,本發明的方法進一步地包括給受試者施用額外的治療劑。在一個進一步的具體例中,額外的治療劑選自於由下列所組成的群組:HMG-CoA還原酶抑制劑、纖維酸鹽衍生物、膽汁酸隔離劑、菸鹼酸、抗血小板劑、血管收縮素轉化酶抑制劑、血管收縮素II受體拮抗劑、醯基輔酶A(acylCoA)膽固醇乙醯基轉移酶(ACAT)抑制劑、膽固醇吸收抑制劑、膽固醇酯轉蛋白(CETP)抑制劑、微粒體三酸甘油酯轉移蛋白(MTTP)抑制劑、膽固醇調節劑、膽汁酸調節劑、過氧化物酶體增殖活化受體(PPAR)激動劑、基因療法、複合血管保護劑、醣蛋白Ilb/IIIa抑制劑、阿司匹林或類阿司匹林化合物、IBAT抑制劑、角鯊烯合成酶抑制劑、單核球趨化蛋白(MCP)-I抑制劑、或魚油。
本發明亦提供了試劑盒,該試劑盒包括本發明的任何dsRNA或本發明的任何醫藥組成物,以及可選的,使用說明書。
圖1是顯示被皮下施用3mg/kg或10mg/kg單次劑量的所示dsRNA雙鏈體的小鼠體內(每組n=3),在給藥後第7天或第14天時,人
PNPLA3 mRNA的量級圖。人PNPLA3 mRNA的量級以相對值顯示,而基準是在被施用PBS的小鼠中所檢測到的對照量級。
圖2是顯示如實施例3中所述的,被皮下施用單次劑量的所示dsRNA雙鏈體的小鼠體內(每組n=3),在給藥後第7天時,人PNPLA3 mRNA的量級圖。人PNPLA3 mRNA的量級以相對值顯示,而基準是在被施用PBS的小鼠中所檢測到的對照量級。
圖3是顯示被皮下施用10mg/kg單次劑量的所示dsRNA雙鏈體的小鼠體內(每組n=3),在給藥後第7天時,人PNPLA3 mRNA的量級圖。人PNPLA3 mRNA的量級以相對值顯示,而基準是在被施用PBS的小鼠中所檢測到的對照量級。
圖4是顯示如實施例3中所述的,被皮下施用10mg/kg單次劑量或10mg/kg多次劑量的所示dsRNA雙鏈體的小鼠體內(每組n=3),在給藥後第7天時,人PNPLA3 mRNA的量級圖。人PNPLA3 mRNA的量級以相對值顯示,而基準是在被施用PBS的小鼠中所檢測到的對照量級。
圖5是顯示被皮下施用10mg/kg單次劑量的所示dsRNA雙鏈體的小鼠體內(每組n=3),在給藥後第7天時,人PNPLA3 mRNA的量級圖。人PNPLA3 mRNA的量級以相對值顯示,而基準是在被施用PBS的小鼠中所檢測到的對照量級。
圖6是顯示被皮下施用10mg/kg單次劑量的所示dsRNA雙鏈體的小鼠體內(每組n=3),在給藥後第7天時,人PNPLA3 mRNA的量級圖。人PNPLA3 mRNA的量級以相對值顯示,而基準是在被施用PBS的小鼠中所檢測到的對照量級。
圖7是顯示被皮下施用10mg/kg單次劑量的所示dsRNA雙鏈體的小鼠體內(每組n=3),在給藥後第7天時,人PNPLA3 mRNA的量級圖。人PNPLA3 mRNA的量級以相對值顯示,而基準是在被施用PBS的小鼠中所檢測到的對照量級。
本發明提供iRNA組成物,該組成物影響編碼含類PATATIN磷脂酶結構域3(PNPLA3)之基因的RNA轉錄本的RNA誘導沉默複合體(RISC)-介導的裂解。該基因可能是位於細胞內,例如受試者,比如人類受試者內的細胞內。使用這些iRNA在哺乳動物能使對應的基因(含類PATATIN磷脂酶結構域3(PNPLA3)基因)的mRNA的靶向降解。
本發明的iRNA已被設計成靶向人含類PATATIN磷脂酶結構域3(PNPLA3)基因,包含在其他哺乳動物物種的含類PATATIN磷脂酶結構域3(PNPLA3)異種同源物中所保留的基因部分。不束縛於理論,咸信前述特性和這些iRNA中的特異靶向位點或特異修飾的組合或次組合賦予本發明的iRNA改善的效力、穩定性、效價強度、耐久性、和安全性。
因此,本發明提供了用於治療和預防含類PATATIN磷脂酶結構域3(PNPLA3)相關病症,例如,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)的方法,係使用影響PNPLA3基因的RNA轉錄本的RNA誘導沉默複合體(RISC)-介導的裂解的iRNA組成物。
本發明的iRNA包含RNA股(反義股),該RNA股具有長度最多為約30個核苷酸或更少的區域,例如,19-30、19-29、19-28、19-27、19-26、19-25、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24,20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23、或21-22個核苷酸的長度,該區域實質上互補於PNPLA3基因的mRNA轉錄本的至少一部分。
在某些具體例中,本發明的雙股RNAi劑的一股或雙股的長度最多為66個核苷酸,例如,36-66、26-36、25-36、31-60、22-43、27-53個核苷酸的長度,且具有實質上互補於PNPLA3基因的mRNA轉錄本的至少一部分的至少19個接連的核苷酸的區域。在一些具體例中,具有更長長度的反義股的此類iRNA劑較佳地可以包含長度為20-60個核苷酸的第二RNA股(正義股),其中正義股和反義股形成18-30個接連的核苷酸的雙鏈體。
使用本發明iRNA在哺乳動物中能使對應的基因(PNPLA3基因)的mRNA的靶向降解。使用體外檢測,本發明人已經展示靶向PNPLA3基因的iRNA可以有力地介導RNAi,導致PNPLA3基因表達的顯著抑制。因此,包含這些iRNA的方法和組成物可用於治療罹患PNPLA3相關病症的受試者,例如,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
因此,本發明提供了用於治療具有將受益於抑制或減低PNPLA3基因表達的病症的受試者的方法和聯合療法,例如,含類PATATIN磷脂酶結構域3(PNPLA3)相關疾病,諸如脂肪肝(脂肪變性)、非酒精性脂肪性肝炎
(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD),係係使用影響PNPLA3基因的RNA轉錄本的RNA誘導沉默複合體(RISC)-介導的裂解的iRNA組成物。
本發明亦提供了預防具有將受益於抑制或減低PNPLA3基因的表達的病症的受試者的至少一項症狀的方法,例如,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。例如,在具有NAFLD的受試者中,本發明的方法可以減低受試者的至少一項症狀,例如,疲勞、虛弱、體重減輕、食慾不振、噁心、腹痛、蜘蛛狀血管、泛黃皮膚和眼睛(黃疸)、搔癢、腿部的積液和腫脹(水腫)、腹部腫脹(腹水)和精神錯亂。
以下的詳細描述將揭露如何製備和使用含有抑制PNPLA3基因表達的iRNA的組成物,以及用於治療受試者的組成物、用途和方法,該受試者將受益於抑制和/或減低PNPLA3基因的表達,例如,易受或已診斷為PNPLA3相關病症的受試者。
I.定義
為了可以更迅速地理解本發明,首先定義某些術語。另外,應當注意,每當列舉某參數的值或值的範圍時,用意是介於所列舉值中間的值和範圍也意圖成為本發明的一部分。
冠詞“一(a)”和“一(an)”在本文中用於係指該冠詞的文法對象的一個或多個(即,至少一個)。舉例來說,“一個元素”意指一個元素或一個以上元素,例如,複數個元素。
術語“包含”在本文中用來意指短語“包含但不限於”,並與其可以互換使用。
除非上下文另外明確指出,術語“或”在本文中用於意指術語“和/或”,並與其可以互換使用。例如,“正義股或反義股”應理解為“正義股或反義股,或,正義股和反義股”。
術語“約”在本文中用來意指在本領域的典型公差範圍內。例如,“約”可以理解為平均值左右約2個標準差。在某些具體例中,約意指正負10%。在某些具體例中,約意指正負5%。當“約”出現在一系列數字或一範圍之前時,應理解為“約”可以修飾該系列或範圍中的每個數字。
從上下文清楚可見,在一個數字或數字系列之前的術語“至少”應理解為包含與術語“至少”相鄰的數字,以及可以從邏輯上包含的所有後續數字或整數。例如,核酸分子中核苷酸的數目必須是整數。例如,“21個核苷酸的核酸分子中的至少19個核苷酸”意指19、20或21個核苷酸具有所指的特性。當“至少”出現在一系列數字或一範圍之前時,應理解為“至少”可以修飾該系列或範圍中的每個數字。
如本文所用,“不多於”或“少於”應理解為與短語相鄰的值和邏輯上較低的值或整數,從上下文邏輯看,直到為零。例如,具有“不多於2個核苷酸”的突出的雙鏈體有2、1,或0個核苷酸的突出。當“不多於”出現在一系列數
字或一範圍之前時,應理解為“不多於”可以修飾該系列或範圍中的每個數字。如本文所用,範圍包含上限和下限二者。
如本文所用,偵測方法可以包含測定存在的分析物的量低於該方法的偵測量級。
如果所示靶向位點與正義股或反義股的核苷酸序列間有衝突,則以所示序列為準。
如果序列與其在轉錄本或其他序列的所示位點間發生衝突,則以本說明書中列舉的核苷酸序列為準。
如本文所用,“含類PATATIN磷脂酶結構域3”,其與術語“PNPLA3”可以互換使用,係指眾所周知的編碼介導脂肪細胞中的三醯基甘油水解的三醯基甘油脂肪酶的基因。
PNPLA3的示例性核苷酸和胺基酸序列可以在如下序列中找到,例如,GenBank登錄號NM_025225.2(智人PNPLA3;SEQ ID NO:1;反向互補,SEQ ID NO:2);;GenBank登錄號NM_054088.3(小鼠PNPLA3;SEQ ID NO:3;反向互補,SEQ ID NO:4);;GenBank登錄號NM_001282324.1(褐大鼠PNPLA3;SEQ ID NO:5;反向互補,SEQ ID NO:6);GenBank登錄號XM_005567051.1(馬來猴PNPLA3,SEQ ID NO:7;反向互補,SEQ ID NO:8);GenBank登錄號XM_001109144.2(恒河猴PNPLA3,SEQ ID NO:9;反向互補,SEQ ID NO:10);及GenBank登錄號XM_005567052.1(馬來猴PNPLA3,SEQ ID NO:11;反向互補,SEQ ID NO:12)。
PNPLA3 mRNA序列的其他示例可藉由公共數據庫輕鬆獲得,例如,GenBank、UniProt、OMIM、以及獼猴屬基因組計劃網站。
有關PNPLA3的進一步信息,可參見例如www.ncbi.nlm.nih.gov/gene/?term=pnpla3。
自本申請提交之日起,每個上述GenBank登錄號和基因數據庫號的全部內容在此藉由引用併入本文。
如本文所用,術語PNPLA3,亦指PNPLA3基因之變異,包含SNP數據庫中所提供的變體。已識別出的PNPLA3基因內的許多序列變異可以在例如NCBI dbSNP and UniProt上找到(參見例如www.ncbi.nlm.nih.gov/snp/?term=pnpla3),其全部內容自本申請提交之日起在此藉由引用併入本文。
如本文所用,“靶序列”係指在PNPLA3基因轉錄期間中所形成之mRNA分子的核苷酸序列的接連的部分,包含初級轉錄產物之RNA加工產物的mRNA。序列的靶部分將至少足夠長而可作為位於在PNPLA3基因轉錄期間所形成之mRNA分子的核苷酸序列的前述部分或其附近的iRNA-導向裂解的受質。在一個具體例中,靶序列位於PNPLA3的蛋白質編碼區內。
靶序列可以是約19-36個核苷酸的長度,例如,較佳地是約19-30個核苷酸的長度。例如,靶序列可以是約19-30個核苷酸,19-30、19-29、19-28、19-27、19-26、19-25、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24、20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23、或21-22個核苷酸的長度。在特定的一些具體例中,靶序列為19-23個核苷酸的長度,可選地為21-23個核苷
酸的長度。介於如上列舉的範圍和長度中間的範圍和長度也被預期為是本揭露的一部分。
如本文所用,術語“包括序列的股”係指包括核苷酸鏈的一寡核苷酸,且該寡核苷酸由參照使用標準核苷酸命名法的序列描述。
一般地,“G”、“C”、“A”、“T”及“U”分別代表含有鳥嘌呤、胞嘧啶、腺嘌呤、胸腺嘧啶、及尿嘧啶作為鹼基的核苷酸。然而,應理解術語“核糖核苷酸”或“核苷酸”亦可指修飾過的核苷酸,如下文進一步詳述的,或代理替換部分體(參見,例如,表1)。所屬技術領域者很清楚鳥嘌呤、胞嘧啶,腺嘌呤和尿嘧啶可以被其他部分體取代,而包括帶有此種替換部分體的核苷酸的寡核苷酸的鹼基配對特性實質上不改變。例如,但不限於,包括肌核苷作為其鹼基的核苷酸可以與含有腺嘌呤、胞嘧啶或尿嘧啶的核苷酸進行鹼基配對。故,本發明特別報導的dsRNA的核苷酸序列中的含有尿嘧啶、鳥嘌呤或腺嘌呤之核苷酸可以被含有例如肌核苷的核苷酸所替換。在另一個實施例中,寡核苷酸中任何地方的腺嘌呤和胞嘧啶可以分別被鳥嘌呤和尿嘧啶所替換,分別地形成與靶mRNA的G-U搖擺鹼基配對。含有此種替換部分體的序列適用於本發明特別報導的組成物和方法。
術語“iRNA”,“RNAi劑”,“iRNA劑”,“RNA干擾劑”在本文中可以互換使用,係指含有如本文術語所定義之RNA的劑,且該劑經RNA誘導沉默複合體(RISC)途徑介導RNA轉錄本的靶向裂解。iRNA經由已知為RNA干擾(RNAi)的過程導引mRNA的序列特異性降解。該iRNA調節,例如抑制,PNPLA3基因在細胞中的表達,例如受試者內的細胞,例如哺乳動物受試者。
在一個具體例中,本發明的RNAi劑包含與靶RNA序列,例如PNPLA3靶mRNA序列,相互作用的單股RNA,以導向靶RNA的裂解。不希望被理論束縛,咸信被引入細胞中的長雙股RNA被已知為Dicer的III型核酸內切酶分解成為siRNA(Sharp et al.(2001)Genes Dev.15:485)。Dicer,類核酸酶III酵素,將dsRNA加工成19-23個鹼基對且具有特徵性的二鹼基3'突出的短干擾RNA,(Bernstein,et al.,(2001)Nature 409:363)。然後siRNA被插入RNA誘導沉默複合體(RISC)中,其中一種或多種解旋酶解開siRNA雙鏈體,使互補的反義股能夠引導靶向識別(Nykanen,et al.,(2001)Cell 107:309)。與適當的靶mRNA結合後,RISC內的一種或多種核酸內切酶裂解標靶以誘導沉默過程(Elbashir,et al.,(2001)Genes Dev.15:188)。因此,在一個態樣中本發明涉及在細胞內所產生的單股RNA(siRNA),該siRNA促進RISC複合體的形成以實現靶基因,即PNPLA3基因的沉默。因此,術語“siRNA”在本文中也用於係指如上所述的iRNA。
在一些具體例中,RNAi劑可以是被引入細胞或生物中以抑制靶mRNA的單股siRNA(ssRNAi)。單股RNAi劑結合到RISC核酸內切酶Argonaute 2,後者然後裂解靶mRNA。單股siRNA一般為15-30個核苷酸,且經過化學修飾。單股siRNA的設計和測試描述於美國專利8,101,348和Lima et al.,(2012)Cell 150:883-894中,其每個的全部內容藉由引用併入本文。本文所述的任何反義核苷酸序列都可用作如本文所述的單股siRNA,或如Lima et al.,(2012)Cell 150:883-894中所述方法進行化學修飾後再使用。
在一些具體例中,用於本發明的組成物、用圖和方法的“iRNA”是雙股RNA,並且在本文中被稱作“雙股RNA劑”、“雙股RNA(dsRNA)分
子”、“dsRNA劑”或“dsRNA”。術語“dsRNA”係指具有雙鏈體結構的核糖核酸分子的複合體,該雙鏈體結構包括二條反向平行且實質上互補的核酸股,其被稱為具有相對於靶RNA即PNPLA3基因的“正義”和“反義”的定向。在本發明的某些具體例中,雙股RNA(dsRNA)經由轉錄後基因沉默機制,本文稱為RNA干擾或RNAi,觸發靶RNA,例如mRNA的降解。
通常,dsRNA分子的各股大部分核苷酸是核糖核苷酸,但是如本文詳細描述的,各股或雙股也可以包含一個或多個非核糖核苷酸,例如,去氧核糖核苷酸或經修飾核苷酸。此外,如本說明書中所使用的,“iRNA”可包含具有化學修飾的核糖核苷酸;iRNA可能在多個核苷酸上包含實質的修飾。如本文所用,術語“經修飾核苷酸”係指獨立地具有經修飾糖部分體、經修飾核苷酸間鍵聯、或經修飾核鹼基、或上述其任何組合的核苷酸。因此,術語經修飾核苷酸涵蓋,例如,官能基或原子、對核苷酸間鍵聯、糖部分體、或核苷鹼基的取代、添加或移除。適用於本發明的劑的修飾包含本文揭露或本領域已知的所有類型的修飾。出於本說明書和申請專利範圍的目的,“iRNA”或“RNAi劑”涵蓋用於siRNA類型分子的任何此類修飾。
在此揭露的一些具體例中,如果存在於RNAi劑內則涵蓋去氧核苷酸可以被認為構成經修飾核苷酸。
雙鏈體區域可以是允許所期望的靶RNA經由RISC途徑特異性降解的任何長度,該長度可以在約19至36個鹼基對的長度範圍,例如,約19-30個鹼基對的長度範圍,例如,約9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、或36個鹼基對的長度,諸如約19-30、19-29、19-28、19-27、19-26、19-25、
19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24,20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23、或21-22個鹼基對的長度。在一些具體例中,雙鏈體區域的長度為19-21個鹼基對,例如,21個鹼基對的長度。介於如上列舉的範圍和長度中間的範圍和長度也被預期為是本揭露的一部分。
形成雙鏈體結構的二股可能是一個較大的RNA分子的不同部分,也可能是分離的RNA分子。如果二股是一個較大分子的一部分,並因而藉由不間斷的核苷酸鏈在一股的3'端與相應另一股的5'端之間形成雙鏈體結構相連接,則連接二股的RNA鏈被稱為“髮夾環圈”。髮夾環圈可以包括至少一個不成對的核苷酸。在某些具體例中,髮夾環圈可以包括至少2、3、4、5、6、7、8、9、10、20、23或更多個未配對的核苷酸。在某些具體例中,髮夾環圈可以是10個或更少的核苷酸。在某些具體例中,髮夾環圈可以是8個或更少的未配對核苷酸。在某些具體例中,髮夾環圈可以是4-10個不成對的核苷酸。在某些具體例中,髮夾環圈可以是4-8個核苷酸。
如果dsRNA的二條實質上互補的股是由分離的RNA分子所構成,則這些分子不必是,但可以是共價連接的。如果二股共價連接的方法非利用不間斷的核苷酸鏈在一股的3'端與相應另一股的5'端之間形成雙鏈體結構,則連接結構被稱為“鏈接子”。RNA股可以具有相同或不同數目的核苷酸。鹼基對的最大數目是dsRNA的最短股中的核苷酸數目減去雙鏈體中存在的任何突出數目。除雙鏈體結構外,RNAi可能包括一個或多個核苷酸突出。RNAi劑的一個具體例中,至少一股包括至少1個核苷酸的3'突出。在另一個具體例中,至少一股包括至少2個核苷酸的3'突出,例如,2、3、4、5、6、7、9、10、11、12、
13、14或15個核苷酸。在其他具體例中,RNAi劑的至少一股包括至少1個核苷酸的5'突出。在特定的一些具體例中,至少一股包括至少2個核苷酸的5'突出,例如,2、3、4、5、6、7、9、10、11、12、13、14或15個核苷酸。還是在其他具體例中,RNAi劑的一股的3'端和5'端均包括至少1個核苷酸的突出。
在一些具體例中,本發明的iRNA劑是dsRNA,其各股包括19-23個核苷酸,其與靶RNA序列,例如PNPLA3基因,相互作用,以導引靶RNA的裂解。
在某些具體例中,本發明的iRNA是24-30個核苷酸的dsRNA,其與靶RNA序列,例如PNPLA3靶mRNA序列,相互作用,以導引靶RNA的裂解。
如本文所用,術語“核苷酸突出”係指從雙股iRNA的雙鏈體結構伸出的至少一個未配對的核苷酸。例如,當dsRNA一股的3'端延伸到超出另一條鏈的5'端時,或反之亦然,則存在一個核苷酸突出。dsRNA可以包括至少一個核苷酸的突出;或者突出可以包括至少二個核苷酸、至少三個核苷酸、至少四個核苷酸、至少五個核苷酸或更多。核苷酸突出可以包括或由核苷酸/核苷類似物組成,包含去氧核苷酸/核苷。突出可以位於正義股,反義股或其任何組合上。進一步地,突出的核苷酸可以存在於dsRNA的反義股或正義股的5'端、3'端或二端。
在一個具體例中,dsRNA的反義股具有1-10個核苷酸,例如,1、2、3、4、5、6、7、8、9或10個核苷酸,突出在3'端或5'端。在一個具體例中,dsRNA的正義股具有1-10個核苷酸,例如,1、2、3、4、5、6、7、8、9或
10個核苷酸,突出在3'端或5'端。在另一個具體例中,突出中的一個或多個核苷酸被核苷硫代磷酸所替換。
在一些具體例中,dsRNA的反義股具有1-10個核苷酸,例如,0-3、1-3、2-4、2-5、4-10、5-10,例如,1、2、3,4、5、6、7、8、9或10個核苷酸,突出在3'端或5'端。在一個具體例中,dsRNA的正義股具有1-10個核苷酸,例如,1、2、3、4、5、6、7、8、9或10個核苷酸,突出在3'端或5'端。在另一個具體例中,突出中的一個或多個核苷酸被核苷硫代磷酸所替換。
在一些具體例中,dsRNA的反義股具有1-10個核苷酸,例如,1、2、3、4、5、6、7、8、9、或10個核苷酸,突出在3'端或5'端。在一些具體例中,位於正義股或反義股或二者上的突出,可以包含長度大於10個核苷酸的延伸長度,例如,1-30個核苷酸、2-30個核苷酸、10-30個核苷酸、10-25個核苷酸、10-20個核苷酸、或10-15個核苷酸的長度。在一些具體例中,延伸的突出位於雙鏈體的正義股。在一些具體例中,延伸的突出存在於雙鏈體的正義股的3'端。在一些具體例中,延伸的突出存在於雙鏈體的正義股的5'端。在一些具體例中,延伸的突出延伸的突出位於雙鏈體的反義股。在特定的一些具體例中,延伸的突出存在於雙鏈體的反義股的3'端。在一些具體例中,延伸的突出存在於雙鏈體的反義股的5'端上。在一些具體例中,延伸的突出中的一個或多個核苷酸被核苷硫代磷酸所替換。在一些具體例中,突出包含自我互補的部分,使得突出能夠形成在生理條件下穩定的髮夾結構。
“鈍”或“鈍端”意指在雙股RNA劑的末端沒有未配對的核苷酸,即,沒有核苷酸突出。“鈍端”雙股RNA劑在其整個長度都是雙股,即,在其分子的任一端均無核苷酸突出。本發明的RNAi劑包括在一端沒有核苷酸突出的
RNAi劑(即,有一個突出和一個鈍端的劑)或在任一端均無核苷酸突出的RNAi劑。大多數情況下,此類分子將在其整個長度是雙股的。
術語“反義股”或“引導股”係指iRNA的股,例如,dsRNA,其包含與靶序列,例如,PNPLA3 mRNA,實質上互補的區域。
如本文所用,術語“互補性區域”係指反義股上與序列,例如本文所定義的靶序列(例如PNPLA3核苷酸序列),實質上互補的區域。如果互補性區域與靶序列不完全互補,錯配可以在分子的內部或末端區域。一般地,最耐受的錯配是在末端區域,例如,在iRNA的5’或3’端的5、4、或3個核苷酸內。在某些具體例中,本發明的雙股RNA劑在反義股包含核苷酸錯配。在某些具體例中,本發明的雙股RNA劑的反義股與靶mRNA包含不超過4個錯配,例如,反義股與靶mRNA包含4、3、2、1或0個錯配。在某些具體例中,本發明的雙股RNA劑的反義股與正義股包含不超過4個錯配,例如,反義股與正義股包含4、3、2、1或0個錯配。
在某些具體例中,本發明的雙股RNA劑在正義股包含核苷酸錯配。在某些具體例中,本發明的雙股RNA劑的正義股與反義股包含不超過4個錯配,例如,正義股與反義股包含4、3、2、1或0個錯配。在某些具體例中,核苷酸錯配是,例如,位於距iRNA 3'端5、4、3個核苷酸之內。在另一個具體例中,核苷酸錯配,例如,在iRNA劑的3'末端核苷酸中。在某些具體例中,錯配不在種子區域中。
因此,本文所述的RNAi劑可含有與靶序列的一個或多個錯配。在一個具體例中,本文所述的RNAi劑含有不超過3個錯配(即,3、2、1或0個錯配)。在一個具體例中,本文所述的RNAi劑含有不超過2個錯配。在一個具
體例中,本文所述的RNAi劑含有不超過1個錯配。在一個具體例中,本文所述的RNAi劑含有0個錯配。在一些具體例中,如果RNAi劑的反義股含有與靶序列的錯配,則可以選擇將錯配限制在距互補性區域的5'或3'端的最後5個核苷酸內。例如,在如此的具體例中,對於23個核苷酸的RNAi劑,與PNPLA3基因的區域互補的股,一般在中央的13個核苷酸內不含有任何錯配。本文所述的方法或本領域已知的方法可用於確定含有與靶序列的錯配的RNAi劑是否可有效抑制PNPLA3基因的表達。考量有錯配的RNAi劑抑制PNPLA3基因表達的效力是重要的,尤其是如果PNPLA3基因中的特定互補性區域已知在族群內具有多型性序列變異。
術語“正義股”或“過客股”如本文所用,係指一iRNA的股,其包含與如本文所定義的反義股的區域實質上互補的區域。
如本文所用,“實質上所有的核苷酸都經修飾”為大部分地但並非全部地被修飾,並且可以包含不超過5、4、3、2或1個未經修飾的核苷酸。
如本文所用,術語“裂解區域”係指位於緊鄰裂解位點的區域。裂解位點是在靶發生裂解的位點。在某些具體例中,裂解區域包括在裂解位點的任一端且緊鄰裂解位點的三個鹼基。在某些具體例中,裂解區域包括在裂解位點的任一端且緊鄰裂解位點的二個鹼基。在某些具體例中,裂解位點明確地出現在反義股的核苷酸10和11所結合的位點,而裂解區域包括核苷酸11、12和13。
如本文所用,且除非另有說明,術語“互補的”當用於描述第一核苷酸序列與第二核苷酸序列的關係時,係指構成第一核苷酸序列的寡核苷酸或多核苷酸與構成第二核苷酸序列的寡核苷酸或多核苷酸在特定條件下雜合並形
成雙鏈體結構的能力,正如所屬技術領域者所理解的那樣。此類條件可以,例如,是嚴格的條件,其中嚴格條件可以包含:400mM NaCl,40mM PIPES pH 6.4,1mM EDTA,50℃或70℃持續12-16 hours然後進行沖提(參見,例如,《分子選殖:實驗室手冊》Sambrook,et al.(1989)冷泉港實驗室出版社)。其他條件,諸如生物體內可能遇到的生理相關條件,也可以應用。按照雜合核苷酸的最終應用,所屬技術領域者將能夠確定適合於測試二個序列互補性的條件設置。
iRNA內的互補的序列,例如,本文所述的dsRNA內,包含構成第一核苷酸序列的寡核苷酸或多核苷酸與構成第二核苷酸序列的寡核苷酸或多核苷酸在一個或雙方核苷酸序列的整個長度的鹼基配對。在本文中這樣的二個序列可以被稱為彼此互相“完全互補的”。然而,在本文中如果第一序列相對於第二序列被稱為“實質上互補的”,這二個序列可以是完全互補的,或者在雜合而得到多達30個鹼基對的雙鏈體時它們可以形成一個或多個,但是一般不超過5、4、3、或2個錯配的鹼基對,同時在與最終應用最相關的條件下,例如,經由RISC路徑抑制基因表達,保留了雜合的能力。但是,如果二個寡核苷酸被設計成,在雜合時,形成一個或多個單股突出,就確定互補性而言此類突出不應被視為錯配。例如,包括一個長度為21個核苷酸的寡核苷酸和另一個長度為23個核苷酸的寡核苷酸的dsRNA,其中較長的寡核苷酸包括一個與較短的寡核苷酸完全互補的21個核苷酸的序列,出於本文所述的目的仍可以被稱為“完全互補的”。
“互補的”序列,如本文所用,亦可以包含,或完全由其形成,非Watson-Crick鹼基對或由非天然的和經修飾的核苷酸所形成,只要滿足上述關
於它們雜合能力的要求。這樣的非Watson-Crick鹼基對包含,但不限於,G:U搖擺或Hoogstein鹼基配對。
本文的術語“互補的”,“完全互補的”和“實質上互補的”可用於描述在dsRNA的正義股與反義股之間,或在雙股RNA劑的反義股與靶序列之間的鹼基匹配,從其使用的上下文中將可以理解。
如本文所用,與傳訊RNA(mRNA)“至少部分是實質上互補的”多核苷酸係指與目標mRNA(例如,編碼PNPLA3基因的mRNA)的接連的部分實質上互補的多核苷酸。例如,如果核苷酸的序列與編碼PNPLA3基因的mRNA的不間斷部分是實質上互補的,則該多核苷酸與PNPLA3 mRNA的至少一部分是互補的。
因此,在某些具體例中,本文所揭露的反義多核苷酸與靶PNPLA3序列是完全互補的。在其他具體例中,本文所揭露的反義多核苷酸與靶PNPLA3序列是實質上互補的,並且包括接連的核苷酸序列,該接連的核苷酸序列在其全長上與下列序列的等同區域至少是80%互補的:SEQ ID NOs:1、3、5、7、9、或11中的任何一個,或SEQ ID NOs:1、3、5、7、9、或11中的任何一個的一片段,諸如約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、或約99%互補的。
在某些具體例中,本文所揭露的反義多核苷酸與靶PNPLA3序列的片段是實質上互補的,並且包括接連的核苷酸序列,該接連的核苷酸序列在其全長上與選自如下群組的SEQ ID NO:1的片段至少是80%互補的:核苷酸677-721、683-721、773-817、1185-1295、1185-1241、1202-1295、1202-1241、1255-1295、1738-1792、1901-1945、1920-1945、2108-2208、2108-
2166、2108-2136、2121-2166、2121-2208、2169-2208、2176-2208、或2239-2265,諸如約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、或約99%互補的。
在某些具體例中,本文所揭露的反義多核苷酸與靶PNPLA3序列的片段是實質上互補的,並且包括接連的核苷酸序列,該接連的核苷酸序列在其全長上與選自如下群組的SEQ ID NO:1的片段至少是80%互補的:核苷酸574-596、677-699、683-705、699-721、773-795、795-817、1185-1207、1192-1214、1202-1224、1208-1230、1209-1231、1210-1232、1211-1233、1212-1234、1213-1233、1214-1234、1214-1236、1215-1237、1216-1238、1219-1237、1219-1241、1255-1275、1256-1276、1257-1275、1257-1277、1258-1278、1259-1279、1260-1278、1260-1280、1261-1281、1262-1282、1263-1283、1264-1282、1264-1284、1265-1285、1267-1285、1266-1286、1266-1288、1267-1285、1267-1287、1268-1290、1269-1289、1270-1290、1271-1291、1272-1292、1273-1293、1274-1294、1275-1295、1631-1653、1738-1760、1739-1761、1740-1760、1740-1762、1741-1763、1744-1766、1746-1766、1750-1772、1751-1773、1752-1774、1753-1775、1754-1776、1755-1777、1756-1778、1757-1779、1758-1780、1759-1781、1760-1782、1761-1783、1762-1782、1762-1784、1763-1785、1764-1786、1765-1787、1766-1786、1766-1788、1767-1787、1768-1788、1767-1789、1769-1789、1770-1788、1770-1790、1771-1791、1772-1792、1815-1837、1901-1923、1920-1942、1923-1945、2112-2130、2169-2191、2171-2191、2176-2198,2177-2199,2178-2200、2179-2201,2180-2202、2181-2203、2183-2205、2184-
2206、2186-2208、2239-2261、2241-2263、2242-2264、或2243-2265,諸如約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、或約99%互補的。
在某些具體例中,本文所揭露的反義多核苷酸與靶PNPLA3序列的片段是實質上互補的,並且包括接連的核苷酸序列,該接連的核苷酸序列在其全長上與選自如下群組的SEQ ID NO:1的片段至少是80%互補的:核苷酸1200-1250、1205-1250、11210-1250、1200-1245、1200-1240、1200-1235、1200-1237、1205-1237、1210-1232、1212-1237、1212-1234、1250-1300、1255-1300、1260-1300、1250-1295、1250-1390、1250-1285、1250-1282、1255-1282、1260-1282、1262-1300、1262-1295、1262-1390、和1262-1282,諸如約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、或約99%互補的。
在其他具體例中,本文所揭露的反義多核苷酸與靶PNPLA3序列的片段是實質上互補的,並且包括接連的核苷酸序列,
該接連的核苷酸序列在其全長上與如下序列至少是80%互補的:表2-11、21、24、27、30、32、33、36、37、49或50任一者的任一正義股核苷酸序列,或是表2-11、21、24、27、30、32、33、36、37、49或50的任一者的任一正義股核苷酸序列的片段,諸如約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%互補的、或約100%互補的。
在一個具體例中,本揭露的RNAi劑包含與反義多核苷酸實質上互補的正義股,該反義多核苷酸又反過來與靶PNPLA3序列相同,並且其中正
義股多核苷酸包括接連的核苷酸序列,該接連的核苷酸序列在其全長上與下列序列的等同區域至少是80%互補的:SEQ ID NOs:2、4、6、8、10、或12的核苷酸序列,或是SEQ ID NOs:2、4、6、8、10、或12中任一者的片段,諸如約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%、或約100%互補的。
在某些具體例中,本發明的iRNA包含與反義多核苷酸實質上互補的正義股,該反義多核苷酸又反過來與靶PNPLA3序列互補,並且其中正義股多核苷酸包括接連的核苷酸序列,該接連的核苷酸序列在其全長上與如下序列至少是80%互補的:表2-11、21、24、27、30、32、33、36、37、49或50的任一者的任一反義股核苷酸序列,或是表2-11、21、24、27、30、32、33、36、37、49或50的任一者的任一反義股核苷酸序列的一片段,諸如約85%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%、或約100%互補的。
在一些具體例中,正義股和反義股是選自下列任一雙鏈體:AD-517197.2、AD-517258.2、AD-516748.2、AD-516851.2、AD-519351.2、AD-519754.2、AD-519828.2、AD-520018.2、AD-520035.2、AD-520062.2、AD-520064.2、AD-520065.2、AD-520067.2、AD-75289.2、AD-520069.2、AD-520099.2、AD-67575.7、AD-520101.2、AD-67605.7,AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、以及AD-1193481.1。
在某些具體例中,正義股和反義股是選自下列任一雙鏈體:AD-519345.1、AD-519346.1、AD-519347.1、AD-67554.7、AD-519752.3、AD-1010731.1、AD-1010732.1、AD-519343.1、AD-519344.1、AD-519349.1、AD-519350.1、AD-519753.2、AD-519932.1、AD-519935.2、AD-520018.6、AD-517837.2、AD-805635.2、AD-519329.2、AD-520063.2、AD-519757.2、AD-805631.2、AD-516917.2、AD-516828.2、AD-518983.2、AD-805636.2、AD-519754.7、AD-520062.2、AD-67575.9、AD-518923.3、AD-520053.4、AD-519667.2、AD-519773.2、AD-519354.2、AD-520060.4、AD-520061.4、AD-1010733.2、AD-1010735.2、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、以及AD-1193481.1。
在某些具體例中,正義股和反義股是選自下列任一雙鏈體:AD-519345.1、AD-1193350.1、AD-1193365.1、AD-1193437.1、以及AD-519347.1。
在某些具體例中,正義股和反義股是來自雙鏈體AD-519351。
在一個具體例中,正義股和反義股是來自雙鏈體AD-1193350。
在一個具體例中,正義股和反義股是來自雙鏈體AD-1193365。
在一個具體例中,正義股和反義股是來自雙鏈體AD-1193437。
在一個具體例中,正義股和反義股是來自雙鏈體AD-519347。
一般地,“iRNA”包含具有化學修飾的核糖核苷酸。這樣的修改可以包含本文所揭露的或本領域已知的所有類型的修改。為了本說明書和申請
專利範圍的目的,如在dsRNA分子中所使用的任何此類修飾被“iRNA”所涵蓋。
在本揭露的一些特定具體例中,如果存在於RNAi劑內涵蓋去氧核苷酸則可以認為構成經修飾核苷酸。
在本發明的一個態樣中,用於本發明的方法和組成物中的劑是一單股反義寡核苷酸分子,其經由反義抑制機制而抑制靶mRNA。該單股反義寡核苷酸分子與靶mRNA內的序列是互補的。該單股反義寡核苷酸可以以化學計量的方式抑制轉譯,該抑制是藉由與mRNA鹼基配對進而從物理上阻礙轉譯機器裝置,參見Dias,N.et al.,(2002)Mol Cancer Ther 1:347-355。該單股反義寡核苷酸分子可以為約14至約30個核苷酸的長度,並且具有與靶序列互補的序列。例如,該單股反義寡核苷酸分子可包括至少約14、15、16、17、18、19、20、或更多個接連的核苷酸的序列,而該接連的核苷酸則出自本文所述反義序列中任一序列。
本文所用的短語“使細胞與iRNA接觸”,例如dsRNA,包含藉由任何可能的方式與細胞接觸。使細胞與iRNA接觸包含使細胞與iRNA於體外接觸或使細胞與iRNA於體內接觸。該接觸可以直接地或間接地完成。因此,例如,可以藉由方法執行人使iRNA與細胞發生物理性接觸,或者,可以使iRNA處於允許或導致其隨後與細胞接觸的情境。
體外接觸細胞可以藉由,例如,將細胞與iRNA一起孵育來完成。體內接觸細胞可以藉由,例如,將iRNA注射到細胞所在的組織之中或附近,或者藉由將iRNA注射到另一個區域,例如,血流或皮下空間中來完成,從而使該劑將能夠隨後到達所要接觸的細胞所在的組織。例如,iRNA可以含有或
被耦合至配體,例如,GalNAc,該配體會導引iRNA至目的位點,例如,肝臟。體外和體內接觸方法的組合也是可能的。例如,細胞亦可以在體外與iRNA接觸,其後再被移植到受試者體內。
在一些具體例中,使細胞與iRNA接觸包含藉由促進或達到進入細胞之攝取或吸收,而“將(iRNA)引入”或“將iRNA遞送進入細胞”。iRNA的吸收或攝取的發生,可藉由未受協助的擴散或主動的細胞過程,或藉由輔助劑或輔助設備。將iRNA引入細胞可以是體外或體內的。例如,對於體內引入,可以將iRNA注射進入組織位點或將其全身性施用。
體外引入細胞包含本領域已知的方法,例如電穿孔法和脂轉染法。更多的手段描述於下文中或在本領域中是已知的。
術語“脂質奈米粒子”或“LNP”是囊泡,其包括脂質層,其封裝藥物活性分子,例如核酸分子,例如,iRNA或會轉錄出iRNA的質體。LNP描述於,例如,美國專利6,858,225、6,815,432、8,158,601、和8,058,069,其全部內容藉由引用併入本文。
如本文所用,“受試者”是指內源性地或異源性地表達靶基因的動物,例如哺乳動物,包含靈長類動物(例如人,非人類的靈長動物,例如,猴子和黑猩猩),非靈長類動物(諸如乳牛、豬、馬、山羊、兔子、綿羊、倉鼠、天竺鼠、貓、狗、大鼠或小鼠)或鳥。在一個具體例中,受試者是人,諸如因疾病或病症正接受治療或正被評估的人,而該疾病或病症將受益於PNPLA3表達的降低;有患疾病或病症風險的人,而該疾病或病症將受益於PNPLA3表達的降低;具有疾病或病症的人,而該疾病或病症將受益於PNPLA3表達的降低;因疾病或病症正接受治療的人,而該疾病或病症將受益於
PNPLA3表達的降低,如本文所述。在某些具體例中,受試者是女性。在其他具體例中,受試者是男性。在一個具體例中,受試者是成人受試者。在另一個具體例中,受試者是兒童受試者。
如本文所用,術語“(進行)治療”和“治療(過程)”係指有益的或期望的結果,諸如在受試者降低至少一個PNPLA3相關病症的體徵或症狀。治療亦包含降低一種或多種與多餘PNPLA3表達相關的體徵或症狀;減少多餘PNPLA3的活化或穩定化的程度;改善或減緩多餘PNPLA3的活化或穩定化。與沒有治療的預期存活相比,“治療(過程)”亦可能意味著存活延長。在受試者體內PNPLA3或疾病標記物或疾病症狀的量級的上下文中,術語“較低”係指此量級在統計學上的顯著降低。例如,降低量可以是,例如,至少10%、15%、20%、25%、30%、%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、或更多。在一些具體例中,降低為至少20%。在一些具體例中,疾病標記物,例如蛋白質或基因表達量級,的降低為至少50%。在受試者體內PNPLA3量級的上下文中,“較低”是指較佳地低至無此病症之個體的正常範圍內可接受的量級。在一些具體例中,“較低”是指罹患疾病的受試者的標誌物或症狀的量級與個體的正常範圍內可接受的量級之間的差異之降低,例如,肥胖個體與具有正常範圍內可接受體重的個體之間的體重降低的量級。
如本文所用,“預防(過程)”或“(進行)預防”,當用於形容一疾病,病症或其病況可藉由降低PNPLA3基因的表達來治療或改善時,是指受試者出現與此疾病,病症,或病況相關的症狀的可能性的降低,例如,多餘的或過度的PNPLA3表達的症狀,例如hedgehog訊息傳導路徑中升高量級蛋白質的存在,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝
臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
發展成例如NAFLD的可能性被降低,例如,相對於具有相同風險因子並且未接受本文所述的治療過程的族群,具有一個或多個NAFLD風險因子的個體,不發展成NAFLD,或者發展為嚴重程度較低的NAFLD。未能發展成疾病、病症或病況,或與此疾病、病症或病況相關症狀的發展的降低(例如,在該疾病或病症的臨床可接受量表降低至少約10%)、或展現出延遲的症狀(例如延遲數天、數週、數個月或數年)被認為是有效的預防。
如本文所用,術語“含類PATATIN磷脂酶結構域3相關疾病”或“PNPLA3相關疾病”,是由PNPLA3基因表達或PNPLA3蛋白質生成所引起的或與其相關的疾病或病症。術語“PNPLA3相關疾病”包含將受益於PNPLA3基因表達,複製或蛋白質活性的降低的疾病,病症或病況。PNPLA3相關疾病的非限制性例子包含,例如,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。在另一個具體例中,PNPLA3相關疾病是非酒精性脂肪肝疾病(NAFLD)。在另一個具體例中,PNPLA3相關疾病是非酒精性脂肪性肝炎(NASH)。在另一個具體例中,PNPLA3相關疾病是肝硬化。在另一個具體例中,PNPLA3相關疾病是胰島素抗性。在另一個具體例中,PNPLA3相關疾病不是胰島素抗性。在一個具體例中,PNPLA3相關疾病是肥胖症。
在一個具體例中,PNPLA3相關疾病是非酒精性脂肪肝疾病(NAFLD)。如本文所用,“非酒精性脂肪肝疾病”與術語“NAFLD”互換使
用,係指如下定義的疾病:每天攝入少於20克酒精,仍存在大血管的脂肪變性。NAFLD是美國最常見的肝臟疾病,通常與胰島素抗性/第二型糖尿病和肥胖症相關。NAFLD表徵為脂肪變性、脂肪性肝炎、肝硬化,有時還有肝細胞癌。有關NAFLD的綜述文章,請參見Tolman and Dalpiaz(2007)Ther.Clin.Risk.Manag.,3(6):1153-1163,其全部內容藉由引用併入本文。
“治療有效量”,如本文所用,意欲包含,當施用給具有PNPLA3相關疾病受試者時,足以實現該疾病治療的RNAi劑的量(例如,藉由減輕,改善或維持現有疾病或一種或更多種疾病症狀)。“治療有效量”可能會有所不同,取決於RNAi劑、劑的施用方式、疾病及其嚴重程度以及待治療受試者的病史、年齡、體重、家族史、遺傳構成、既往治療或伴隨治療的類型(如果有)、和其他個體特徵。
“預防有效量”,如本文所用,意欲包含,當施用給具有PNPLA3相關病症受試者時,足以預防或改善該疾病或一種或更多種疾病症狀的RNAi劑的量。改善疾病包含減緩該疾病的進程或降低後發疾病的嚴重程度。
“預防有效量”可能會有所不同,取決於RNAi劑、劑的施用方式、疾病的風險程度、以及待治療受試者的病史、年齡、體重、家族史、遺傳構成、既往治療或伴隨治療的類型(如果有)、其他個體特徵。
“治療有效量”或“預防有效量”亦包含以適用於任何治療的合理的效益/風險比率產生一些預期效果的RNAi劑的量。本發明方法中所使用的iRNA可以足夠的劑量施用以產生適用於這種治療的合理的效益/風險比率。
本文所使用的短語“藥學上可接受的”係指,在合理的醫學判斷範圍內,適合與人類受試者和動物受試者的組織接觸使用的那些化合物、材料、
組成物、或劑型,而沒有過度的毒性、刺激性、過敏反應、或其他問題或併發症,即符合合理的效益/風險比。
本文所用的短語“藥學上可接受的載體”意指藥學上可接受的材料,組成物或媒劑,諸如液體或固體填充劑、稀釋劑、賦形劑、製造助劑(例如,潤滑劑、滑石粉、硬脂酸鈣或硬脂酸鋅、或硬脂酸)或溶劑封裝材料,涉及將受試化合物從一個器官或身體的一部分攜帶或運輸到另一器官或身體的另一部分。在與製劑的其他成分相容並且對被治療的受試者無害的意義上,每種載體必須是“可接受的”。這樣的載體是本領域已知的。藥學上可接受的載體包含用於注射給藥的載體。
如本文所用,術語“樣本”包含從受試者分離出的相似的體液,細胞或組織的一個集合,以及存在於受試者體內的體液,細胞或組織的一個集合。生物學體液的例子包含血液、血清和漿液、血漿、腦脊髓液、眼液、淋巴液、尿液、唾液、及其類似物。組織樣本可包含來自組織、器官或局部區域的樣本。例如,樣本可以源自器官、器官的一部分、或那些器官內的體液或細胞。在一些具體例中,樣本可以來自肝臟(例如,全肝或肝臟的特定區段或肝臟中特定類型的細胞,例如,肝細胞)。在某些具體例中,“源自受試者的樣本”係指從受試者獲得的尿液。“源自受試者的樣本”可指血液或源自血液的血清或來自受試者的血漿。
II.本發明的iRNAs
本發明提供了抑制PNPLA3基因表達的iRNAs。在較佳的具體例中,iRNA包含雙股核糖核酸(dsRNA)分子,用於抑制PNPLA3基因在細胞中
的表達,比如受試者內的細胞,例如哺乳動物,比如易患而好發PNPLA3相關病症的人,例如高三酸甘油酯血症。dsRNAi劑包含具有互補性區域的反義股,該互補性區域與PNPLA3基因表達時所形成之mRNA的至少一部分是互補的。互補性區域約為19-30個核苷酸的長度(例如,約為30、29、28、27、26、25、24、23、22、21、20、或19個核苷酸的長度)。當與表達PNPLA3基因的細胞接觸時,iRNA抑制PNPLA3基因(例如,人、靈長類、非靈長類、或大鼠PNPLA3基因)表達的程度經測定為至少約50%,例如,藉由PCR或基於分枝DNA(bDNA)的方法,或藉由基於蛋白質的方法,諸如藉由免疫螢光分析,使用例如,西方印漬術或流式細胞術。在較佳的具體例中,表達的抑制是藉由本文實施例中所提供的qPCR方法確定的,其siRNA,例如10nM濃度,該抑制是在其中提供的適當生物細胞系中確定的。在較佳的具體例中,體內表達的抑制是藉由在表達人基因的囓齒動物中之人基因的基因減弱來確定,例如,小鼠或表達人靶基因的AAV(腺相關病毒)感染之小鼠,例如,當以單次劑量給藥時,例如,在RNA表達之最低點時以3mg/kg給藥。
dsRNA包含二條RNA股,其二者為互補的,並且在dsRNA將付諸使用的條件下雜合而形成雙鏈體結構。dsRNA的一股(反義股)包含互補性區域,該互補性區域與靶序列是實質上互補的,並且通常是完全互補的。靶序列可以源自在PNPLA3基因表達期間所形成的mRNA序列。另一股(正義股)包含與反義股互補的區域,使得二股在適當條件下結合時雜合並形成雙鏈體結構。如本文他處所述和本領域已知的,dsRNA所含有的二條互補序列也可以作為一單核酸分子的自身互補區,而非位於分離的寡核苷酸。
一般地,雙鏈體結構是15到30個鹼基對的長度,例如,15-29、15-28、15-27、15-26、15-25、15-24、15-23、15-22、15-21、15-20、15-19、15-18、15-17、18-30、18-29、18-28、18-27、18-26、18-25、18-24、18-23、18-22、18-21、18-20、19-30、19-29、19-28、19-27、19-26、19-25、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24,20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21、24、21-23、或21-22個鹼基對的長度。在較佳的一些較佳具體例中,雙鏈體結構是18到25個鹼基對的長度,例如,18-25、18-24、18-23、18-22、18-21、18-20、19-25、19-24、19-23、19-22、19-21、19-20、20-25、20-24,20-23、20-22、20-21、21-25、21-24、21-23、21-22、22-25、22-24、22-23、23-25、23-24或24-25個鹼基對的長度,例如,19-21個鹼基對的長度。介於以上所列舉的範圍和長度中間的範圍和長度也意圖成為本揭露的一部分。
相似地,靶序列的互補性區域是15到30個核苷酸的長度,例如,15-29、15-28、15-27、15-26、15-25、15-24、15-23、15-22、15-21、15-20、15-19、15-18、15-17、18-30、18-29、18-28、18-27、18-26、18-25、18-24、18-23、18-22、18-21、18-20、19-30、19-29、19-28、19-27、19-26、19-25、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24,20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23、或21-22個核苷酸的長度,例如19-23核苷酸的長度或21-23核苷酸的長度。介於以上所列舉的範圍和長度中間的範圍和長度也意圖成為本揭露的一部分。
在某些具體例中,雙鏈體結構是19到30個鹼基對的長度。相似地,靶序列的互補性區域是19到30個核苷酸的長度。
在某些具體例中,dsRNA是約19到約23個核苷酸的長度,或約25到約30個核苷酸的長度。一般地,dsRNA足夠長而可作為Dicer酶的受質。例如,在本領域中眾所周知,長於約21-23個核苷酸長度的dsRNA可作為Dicer的受質。作為所屬技術領域者還將認可,被靶向裂解的RNA區域通常會是一較大RNA分子,通常是mRNA分子的一部分。如果有需要,mRNA靶標的一“部分”是mRNA靶標的一接連的序列,其長度足夠而允許其成為RNAi-導向裂解(即,透過RISC途徑的裂解)的受質。
所屬技術領域者亦將認可,雙鏈體區是dsRNA的主要功能部分,例如,約19至約30個鹼基對的雙鏈體區域,例如,約19-30、19-29、19-28、19-27、19-26、19-25、19-24、19-23、19-22、19-21、19-20、20-30、20-29、20-28、20-27、20-26、20-25、20-24,20-23、20-22、20-21、21-30、21-29、21-28、21-27、21-26、21-25、21-24、21-23、或21-22個鹼基對。因此,在一個具體例中,當到了其被加工成為功能性的雙鏈體的程度時,而該雙鏈體具有例如15-30個鹼基對且靶向所期望的RNA用於裂解,則具有多於30個鹼基對的雙鏈體區域的RNA分子或多RNA分子的複合體是dsRNA。因此,普通所屬技術領域者將認可在一個具體例中,miRNA是dsRNA。在另一個具體例中,dsRNA不是天然存在的miRNA。在另一個具體例中,可用於靶向PNPLA3基因表達的iRNA劑,在靶細胞中藉由裂解較大的dsRNA並未生成。
如本文所述的dsRNA可以進一步地包含一個或多個單股核苷酸突出,例如(包括)1-4、2-4、1-3、2-3、1、2、3、或4個核苷酸(的突出)。
具有至少一個核苷酸突出的dsRNA比起其鈍端的相對物可具有優越的抑制特性。核苷酸突出可以包括或由核苷酸/核苷類似物組成,包含去氧核苷酸/核苷。突出可以位於正義股,反義股或其任何組合上。進一步地,突出的核苷酸可以存在於dsRNA的反義股或正義股的5'端,3'端或二端。
dsRNA可以藉由本領域已知的標準方法合成。本發明的雙股RNAi化合物可以使用二步驟的流程來製備。首先,雙股RNA分子的二條單股被各自製備。然後,將二成分股退火。siRNA化合物的二單股可使用液相或固相有機合成或二者來製備。有機合成的優點是可以容易地製備包括非天然或修飾過的核苷酸的寡核苷酸股。類似地,本發明的單股寡核苷酸可以使用液相或固相有機合成或二者來製備。
在一個態樣中,本發明的dsRNA包含至少二個核苷酸序列,正義序列和反義序列。正義股選自表2-11、21、24、27、30、32、33、36、37、49或50中任何一表所提供的序列的群組,並且正義股對應的反義股選自表2-11、21、24、27、30、32、33、36、37、49或50中任何一表所提供的序列的群組。在此態樣中,二個序列中的一個與該二個序列中的另一個序列是互補的,其中一個序列與在PNPLA3基因表達中生成的mRNA序列是實質上互補的。照此,在此態樣中,dsRNA將包含二個寡核苷酸,其中一個寡核苷酸在表2-11、21、24、27、30、32、33、36、37、49或50的任一表中被描述為正義股,而第二個寡核苷酸在表2-11、21、24、27、30、32、33、36、37、49或50的任一表中被描述為正義股對應的反義股。
在一些具體例中,dsRNA的實質上互補的序列被分離的寡核苷酸所含有。在其他具體例中,dsRNA的實質上互補的序列被單一寡核苷酸所含有。
在一些具體例中,正義股或反義股是選自下列任一雙鏈體的正義股或反義股:AD-517197.2、AD-517258.2、AD-516748.2、AD-516851.2、AD-519351.2、AD-519754.2、AD-519828.2、AD-520018.2、AD-520035.2、AD-520062.2、AD-520064.2、AD-520065.2、AD-520067.2、AD-75289.2、AD-520069.2、AD-520099.2、AD-67575.7、AD-520101.2、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、AD-1193481.1或AD-67605.7。
在某些具體例中,正義股或反義股是選自下列任一雙鏈體的正義股或反義股:AD-519345.1、AD-519346.1、AD-519347.1、AD-67554.7、AD-519752.3、AD-1010731.1、AD-1010732.1、AD-519343.1、AD-519344.1、AD-519349.1、AD-519350.1、AD-519753.2、AD-519932.1、AD-519935.2、AD-520018.6、AD-517837.2、AD-805635.2、AD-519329.2、AD-520063.2、AD-519757.2、AD-805631.2、AD-516917.2、AD-516828.2、AD-518983.2、AD-805636.2、AD-519754.7、AD-520062.2、AD-67575.9、AD-518923.3、AD-520053.4、AD-519667.2、AD-519773.2、AD-519354.2、AD-520060.4、AD-520061.4、AD-1010733.2、AD-1010735.2、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-
1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、或AD-1193481.1。
在某些具體例中,正義股或反義股是選自下列任一雙鏈體的正義股或反義股:AD-519345.1、AD-1193350.1、AD-1193365.1、AD-1193437.1、和AD-519347.1。
在某些具體例中,正義股或反義股是選自雙鏈體AD-519351的正義股或反義股。
在一個具體例中,正義股或反義股是選自雙鏈體AD-1193350的正義股或反義股。
在一個具體例中,正義股或反義股是選自雙鏈體AD-1193365的正義股或反義股。
在一個具體例中,正義股或反義股是選自雙鏈體AD-1193437的正義股或反義股。
在一個具體例中,正義股或反義股是選自雙鏈體AD-519347的正義股或反義股。
應理解,儘管例如表3、5、7、9、11、21、24、27、30、32、36和50中的序列未被描述為經修飾的或已接合的序列,但是本發明之iRNA的RNA,例如本發明的dsRNA,可以包括表2-11、21、24、27、30、32、33、36、37、49或50中任一表所列出的任何一個未修飾的,未接合的,或與其中所描述不同的經修飾的或已接合的序列。換句話說,本發明涵蓋表2-11、21、24、27、30、32、33、36、37、49或50的dsRNA,其是未修飾的、未接合的、經修飾的、或已接合的、如本文所述。
所屬技術領域者很清楚,具有約20至23個鹼基對,例如21個鹼基對,的雙鏈體結構的dsRNA被譽為在誘導RNA干擾方面特別有效(Elbashir et al.,EMBO 2001,20:6877-6888)。然而,其他人已發現較短或較長的RNA雙鏈體結構也可以是有效的(Chu and Rana(2007)RNA 14:1714-1719;Kim et al.(2005)Nat Biotech 23:222-226)。在上述實施方案中,由於表2-11、21、24、27、30、32、33、36、37、49或50中任一表所提供的寡核苷酸序列的自然性質。本文所述的dsRNA可以包含長度至少為21個核苷酸的至少一股。可以合理預期,具有表2-11、21、24、27、30、32、33、36、37、49或50中任一表的任一序列,且該序列只減去一端或二端的幾個核苷酸,的較短的雙鏈體,與上述dsRNA相比可以類似地有效。因此,具有來源於表2-11、21、24、27、30、32、33、36、37、49或50中任一表的任一序列的至少19、20、或更多個接連的核苷酸的序列的dsRNA,並且其在抑制PNPLA3基因表達的能力方面與包括全長序列的dsRNA的差異不超過5、10、15、20、25、or 30%,則該dsRNA預期在本發明的範圍內。
此外,表2-11、21、24、27、30、32、33、36、37、49或50中所提供的RNA識別了PNPLA3轉錄本中容易受RISC-介導裂解的一個或多個位點。因此,本發明進一步地特寫了靶向這些位點之一內的iRNA。如本文所用,可稱iRNA靶向RNA轉錄本的一特定位點內,如果該iRNA促進在該轉錄本的那個特定位點內的任何地方促進轉錄本的裂解。這樣的iRNA通常將包含來自表2-11、21、24、27、30、32、33、36、37、49或50中任一表的任一序列的至少約19個接連的核苷酸,且該至少約19個接連的核苷酸已耦合到額外的核苷酸序
列,而該額外的核苷酸序列是取自PNPLA3基因中與前述所選序列相鄰的區域。
III.本發明的經修飾iRNAs
在一些具體例中,本發明的iRNA的RNA,例如dsRNA,是未修飾的,並且不包括例如本領域已知的和本文所述的化學修飾或接合。在其他具體例中,本發明的iRNA的RNA,例如dsRNA,被化學修飾以增強穩定性或其他有益的特性。在本發明的某些特定具體例中,本發明的iRNA的實質上所有的核苷酸都經修飾。在本發明的其他具體例中,iRNA的所有核苷酸或iRNA的實質上所有的核苷酸都被修飾,即,不超過5、4、3、2或1個未修飾核苷酸存在於iRNA的股中。
本發明中所特寫的核酸可以藉由本領域已完善建立的方法來合成或修飾,例如在“核酸化學實驗操作手冊(Current protocols in nucleic acid chemistry)”,Beaucage,S.L.等(Edrs.),John Wiley & Sons,Inc.,紐約,NY,美國中所描述的那些方法,其藉由引用併入本文。修飾包含,例如端修飾,例如5’端修飾(磷酸化、接合、反向鍵聯)或3’端修飾(接合、DNA核苷酸、反向鍵聯等);鹼基修飾,例如,用如下鹼基進行替換:穩定鹼基,去穩定鹼基,與擴展的配偶體庫進行鹼基配對的鹼基,移除鹼基(無鹼基核苷酸),或已接合的鹼基;糖修飾(例如,在2'-位置或4'-位置)或糖替換;或主鏈修飾,包含磷酸二酯鍵聯的修飾或替換。本文所述的具體例中有用的iRNA化合物的具體例子包含,但不限於含有修飾主鏈的RNA或沒有天然核苷間鍵聯的RNA。具有經修飾主鏈的RNA包含,尤其是,那些在主鏈中沒有磷原子的RNA。為了本說明書
的目的,並且如本領域中有時提及的,在其核苷間主鏈中不具有磷原子的修飾RNA也可以被認為是寡核苷。在某些具體例中,經修飾iRNA在其核苷間主鏈將有磷原子。
經修飾RNA主鏈包含,例如硫代磷酸酯,手性硫代磷酸酯,二硫代磷酸酯,磷酸三酯,胺基烷基磷酸三酯,甲基和其他烷基膦酸酯包含3'-亞烷基膦酸酯和手性膦酸酯,次膦酸酯,胺基磷酸酯包含3'-胺基胺基磷酸酯和胺基烷基胺基磷酸酯,硫羰基胺基磷酸酯,硫羰基烷基膦酸酯,硫羰基烷基磷酸三酯,和具有正常的3'-5'鍵聯、2'-5'-鏈接類似物者的硼代磷酸酯,以及其中相鄰的核苷單元對是以3'-5'至5'-3'或2'-5'至5'-2'鏈接的具有極性反轉者。也包含各種鹽、混合的鹽和游離酸的形式。在本發明的一些具體例中,本發明的dsRNA劑為游離酸的形式。在本發明的其他具體例中,本發明的dsRNA劑為鹽的形式。在一個具體例中,本發明的dsRNA劑為鈉鹽的形式。在一些具體例中,當本發明的dsRNA劑為鈉鹽形式時,鈉離子作為存在於劑中的實質上所有的磷酸二酯和/或硫代磷酸酯基團的相對離子而存在於劑中。其中實質上所有的磷酸二酯和/或硫代磷酸酯鍵聯都具有鈉相對離子的劑,該劑包含不超過5、4、3、2或1個磷酸二酯和/或硫代磷酸酯鍵聯而沒有鈉相對離子。在某些具體例中,當本發明的dsRNA劑為鈉鹽形式時,鈉離子作為劑中存在的所有磷酸二酯和/或硫代磷酸酯基團的相對離子存在於試劑中。
教示上述含磷鍵聯的製備的代表性美國專利包含,但不限於,3,687,808;4,469,863;4,476,301;5,023,243;5,177,195;5,188,897;5,264,423;5,276,019;5,278,302;5,286,717;5,321,131;5,399,676;5,405,939;5,453,496;5,455,233;5,466,677;5,476,925;5,519,126;
5,536,821;5,541,316;5,550,111;5,563,253;5,571,799;5,587,361;5,625,050;6,028,188;6,124,445;6,160,109;6,169,170;6,172,209;6,239,265;6,277,603;6,326,199;6,346,614;6,444,423;6,531,590;6,534,639;6,608,035;6,683,167;6,858,715;6,867,294;6,878,805;7,015,315;7,041,816;7,273,933;7,321,029;以及U.S.Pat RE39464的美國專利,在此藉由引用將其每個專利的全部內容並入本文。
其中不含磷原子的經修飾RNA主鏈具有由如下物質形成的主鏈:短鏈烷基或環烷基核苷間鍵聯,混合的雜原子和烷基或環烷基核苷間鍵聯,或一個或多個短鏈雜原子或雜環核苷間鍵聯。這些包含具有嗎啉基鍵聯(部分由核苷的糖部分形成)的那些;矽氧烷主鏈;硫化物,亞砜和砜主鏈;甲醯基和硫代甲醯基主鏈;亞甲基甲醯基和硫代甲醯基主鏈;含烯烴的主鏈;胺基磺酸主鏈;亞甲基亞胺基和亞甲基肼基主鏈;磺酸鹽和磺醯胺主鏈;醯胺主鏈;以及其他混合了N、O、S、和CH2組分的成分。
教示上述寡核苷酸的製備的代表性美國專利包含,但不限於,5,034,506;5,166,315;5,185,444;5,214,134;5,216,141;5,235,033;5,64,562;5,264,564;5,405,938;5,434,257;5,466,677;5,470,967;5,489,677;5,541,307;5,561,225;5,596,086;5,602,240;5,608,046;5,610,289;5,618,704;5,623,070;5,663,312;5,633,360;5,677,437;和5,677,439的美國專利,在此藉由引用將其每個專利的全部內容並入本文。
合適的RNA模擬物預期可用於本文所提供的iRNA,其中糖和核苷酸單元的核苷間鍵聯即主鏈,均被新基團所替換。鹼基單元維持不變以便與適當的核酸靶化合物雜合。這樣的寡聚化合物被稱為肽核酸(PNA),其中的
RNA模擬物已顯示出具有良好雜合特性。在PNA化合物中,RNA的糖主鏈被含有醯胺的主鏈,特別是胺乙基甘氨酸主鏈,所替換。核鹼基被保留並直接或間接結合到主鏈之醯胺部分的氮雜氮原子。教示PNA化合物的製備的代表性美國專利包含,但不限於,美國專利5,539,082;5,714,331;和5,719,262,在此藉由引用將其每個專利的全部內容並入本文。適用於本發明的iRNA的其他PNA化合物描述於例如Nielsen et al.,Science,1991,254,1497-1500。
本發明特寫的一些具體例包含具有硫代磷酸酯主鏈的RNA和具有雜原子主鏈的寡核苷,特別是--CH2--NH--CH2-,--CH2--N(CH3)--O--CH2--[稱為亞甲基(甲基亞胺基)或MMI主鏈],--CH2--O--N(CH3)--CH2--,--CH2--N(CH3)--N(CH3)--CH2--和--N(CH3)--CH2--CH2--[其中原生的磷酸二酯主鏈表示為--O--P--O--CH2--](以上引用的美國專利5,489,677),和以上引用的美國專利5,602,240的醯胺主鏈。在某些具體例中,本文特寫的RNA具有以上引用的美國專利5,034,506的N-嗎啉主鏈結構。
經修飾RNA亦可以含有一個或多個被置換的糖部分體。本文特寫的iRNA,例如dsRNA可以在2'-位置包含以下之一:OH;F;O--S-、或N-烷基;O-、S-、或N-烯基;O-、S-或N-炔基;或O-烷基-O-烷基,其中該烷基、烯基和炔基可以是經取代的或未經取代的C1至C10烷基或C2至C10烯基和炔基。合適的示例性修飾包含O[(CH2)nO]mCH3、O(CH2).nOCH3、O(CH2)nNH2,O(CH2)nCH3、O(CH2)nONH2、和O(CH2)nON[(CH2)nCH3)]2,其中n和m為從1至約10。在其他具體例中,dsRNA在2'-位置包含以下之一:C1至C10低碳數烷基,經取代的低碳數烷基、烷芳基、芳烷基、O-烷芳基或O-芳烷基,SH,SCH3,OCN,Cl,Br,CN,CF3,OCF3,SOCH3,SO2CH3,ONO2,NO2,
N3,NH2,雜環烷基,雜環烷芳基,胺基烷基胺基,聚烷基胺基,取代的矽烷基,RNA裂解基團,報導基團,嵌入劑,用於改善iRNA藥物代謝動力學特性的基團,或用於改善iRNA藥效動力學特性的基團,以及其他具有類似特性的取代物。在某些具體例中,修飾包含2'-甲氧基乙氧基(2'-O--CH2CH2OCH3,也稱為2'-O-(2-甲氧基乙基)或2'-MOE)(Martin et al.,Helv.Chim.Acta,1995,78:486-504)即,烷氧基-烷氧基基團。另一個示例性的修飾是2'-二甲基胺基氧基乙氧基,即,O(CH2)2ON(CH3)2基團,也稱為2'-DMAOE,如以下本文實施例所述,和2'-二甲基胺基乙氧基乙氧基(本領域中也稱為2'-O-二甲基胺基乙氧基乙基或2'-DMAEOE),即,2'-O--CH2--O--CH2--N(CH2)2。進一步的示例性修飾包含:5’-Me-2’-F核苷酸,5’-Me-2’-OMe核苷酸,5’-Me-2’-去氧核苷酸(這三個家族中的R和S異構物);2’-烷氧基烷基;和2’-NMA(N-甲基乙醯胺)。
其他修飾包含2'-甲氧基(2'-OCH3)、2'-胺基丙氧基(2'-OCH2CH2CH2NH2)和2'-氟基(2'-F)。亦可在iRNA的RNA的其他位置進行類似的修飾,特別是3'末端核苷酸的糖的3'位置或2'-5'鏈接的dsRNA中的糖的3'位置,以及5'末端核苷酸的5'位置。iRNAs亦可具有糖模擬物比如環丁基部分體代替了戊呋喃糖基糖。教示此類修飾糖結構的製備的代表性美國專利包含,但不限於,4,981,957;5,118,800;5,319,080;5,359,044;5,393,878;5,446,137;5,466,786;5,514,785;5,519,134;5,567,811;5,576,427;5,591,722;5,597,909;5,610,300;5,627,053;5,639,873;5,646,265;5,658,873;5,670,633;和5,700,920,其中一些是與本申請所共有的。在此藉由引用將前面每個專利的全部內容並入本文。
iRNA亦可包含核鹼基(在本領域中通常簡稱為“鹼基”)修飾或取代。如本文所用,“未修飾的”或“天然的”核鹼基包含嘌呤鹼基腺嘌呤(A)和鳥嘌呤(G),以及嘧啶鹼基胸腺嘧啶(T)、胞嘧啶(C)、和尿嘧啶(U)。經修飾核鹼基包含其他合成的和天然的核鹼基,例如去氧-胸腺嘧啶(dT)、5-甲基胞嘧啶(5-me-C)、5-羥甲基胞嘧啶、黃嘌呤、次黃嘌呤、2-胺基腺嘌呤、腺嘌呤和鳥嘌呤的6-甲基和其他烷基的衍生物,腺嘌呤和鳥嘌呤的2-丙基和其他烷基衍生物、2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶、5-鹵代尿嘧啶和胞嘧啶,5-丙炔基尿嘧啶和胞嘧啶,6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(偽尿嘧啶)、4-硫尿嘧啶、8-鹵基、8-胺基、8-硫醇基、8-硫代烷基、8-羥基以及其他8-取代的腺嘌呤和鳥嘌呤,5-鹵基、特別是5-溴基、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶,7-甲基鳥嘌呤和7-甲基腺嘌呤,8-氮雜鳥嘌呤和8-氮雜腺嘌呤,7-脫氮鳥嘌呤和7-脫氮腺嘌呤以及3-脫氮鳥嘌呤和3-脫氮腺嘌呤。進一步的核鹼基包含:美國專利編號3,687,808中所揭露的那些,《經修飾核苷:生化、生技和醫學》Herdewijn,P.編.Wiley-VCH,2008中所揭露的那些;《聚合物科學和工程簡明百科全書》第858-859頁,Kroschwitz,J.L,編.John Wiley & Sons,1990中所揭露的那些,Englisch等,Angewandte Chemie,International Edition,1991,30,613中所揭露的這些,以及Sanghvi,Y S.,第15章,《dsRNA研究和應用》,289-302頁,Crooke,S.T.和Lebleu,B.,編.,CRC Press,1993中所揭露的那些。這些核鹼基中的特定一些對於增加本發明特寫的寡聚化合物的結合親和力特別有用。這些包含5-取代的嘧啶,6-氮雜嘧啶和N-2,N-6和0-6取代的嘌呤,包含2-胺基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。已顯示5-甲基胞嘧啶的取代可將核酸雙鏈體的穩定性提高0.6-1.2℃(Sanghvi,Y.S.,Crooke,S.T.和Lebleu,
B.,編.,《dsRNA研究和應用》,CRC Press,Boca Raton,1993,pp.276-278),並且是示例性的鹼基取代,甚至更特別是當與2'-O-甲氧基乙基糖修飾結合時。
教示上述修飾核鹼基以及其他修飾核鹼基之製備的代表性美國專利,包含,但不限於上面提到的3,687,808,4,845,205;5,130,30;5,134,066;5,175,273;5,367,066;5,432,272;5,457,187;5,459,255;5,484,908;5,502,177;5,525,711;5,552,540;5,587,469;5,594,121,5,596,091;5,614,617;5,681,941;5,750,692;6,015,886;6,147,200;6,166,197;6,222,025;6,235,887;6,380,368;6,528,640;6,639,062;6,617,438;7,045,610;7,427,672;和7,495,088,其每個的全部內容在此藉由引用併入本文。
iRNA的RNA也可以被修飾成為包含一個或多個鎖核酸(LNA)。鎖核酸是具有經修飾核糖部分體的核苷酸,其中的核糖部分體包括連接2'和4'碳的一額外橋。此結構有效地將核糖“鎖”在3'-endo結構構象中。已顯示給siRNA添加鎖核酸可增加siRNA在血清中的穩定性,並可降低脫靶效應(Elmen,J.等,(2005)Nucleic Acids Research 33(1):439-447;Mook,OR.等,(2007)Mol Canc Ther 6(3):833-843;Grunweller,A.等,(2003)Nucleic Acids Research 31(12):3185-3193)。
在某些具體例中,iRNA的RNA也可以被修飾成為包含一個或多個雙環糖部分體。“雙環糖”是被二個原子間的橋接所修飾的呋喃糖基圈環。“雙環核苷”(“BNA”)是具有糖部分體的核苷,且該糖部分體包括連接糖圈環之二個碳原子的橋,從而形成雙環的圈環系統。在一些具體例中,橋連接糖圈環的4'-碳和2'-碳。因此,在一些具體例中本發明的劑可以包括一個或多個鎖核酸
(LNA)。鎖核酸是具有經修飾核糖部分體的核苷酸,其中的核糖部分體包括連接2'和4'碳的額外橋。換句話說,LNA是包括雙環糖部分體的核苷酸,且該雙環糖部分體包括4'-CH2-O-2'橋。此結構有效地將核糖“鎖定”在3'-endo結構構象中。已顯示給siRNA添加鎖核酸可增加siRNA在血清中的穩定性,並可降低脫靶效應(Elmen,J.等,(2005)Nucleic Acids Research 33(1):439-447;Mook,OR.等,(2007)Mol Canc Ther 6(3):833-843;Grunweller,A.等,(2003)Nucleic Acids Research 31(12):3185-3193)。用於本發明的多核苷酸的雙環核苷的例子包含但不限於包括在4'和2'核糖基圈環原子之間的橋的核苷。在一些具體例中,本發明的反義多核苷酸劑包含一個或多個雙環核苷,該雙環核苷包括4'至2'的橋。此類4'至2'橋接的雙環核苷的例子包含但不限於4'-(CH2)-O-2'(LNA);4'-(CH2)-S-2';4'-(CH2)2-O-2'(ENA);4'-CH(CH3)-O-2'(也被稱為“受限的乙基”或“cEt”)和4'-CH(CH2OCH3)-O-2'(及其類似物;參見例如美國專利7,399,845);4'-C(CH3)(CH3)-O-2'(及其類似物;參見例如美國專利8,278,283);4'-CH2-N(OCH3)-2'(及其類似物;參見例如美國專利8,278,425);4'-CH2-O-N(CH3)-2'(參見例如美國專利公開號2004/0171570);4'-CH2-N(R)-O-2',其中R是H,C1-C12烷基,或一保護基團(參見例如美國專利7,427,672);4'-CH2-C(H)(CH3)-2'(參見例如Chattopadhyaya等,J.Org.Chem.,2009,74,118-134);以及4'-CH2-C(=CH2)-2'(及其類似物;參見例如美國專利8,278,426)。前述各項的全部內容在此藉由引用併入本文。
教示鎖核酸核苷酸的製備的另外的代表性美國專利和美國專利公開案,包含但不限於以下內容:美國專利6,268,490;6,525,191;6,670,461;6,770,748;6,794,499;6,998,484;7,053,207;7,034,133;7,084,125;7,399,845;
7,427,672;7,569,686;7,741,457;8,022,193;8,030,467;8,278,425;8,278,426;8,278,283;US 2008/0039618;和US 2009/0012281,前述各項的全部內容在此藉由引用併入本文。
可以製備具有一種或多種立體化學糖構型,包含例如α-L-呋喃核糖和β-D-呋喃核糖(參見WO 99/14226)的任何前述雙環核苷。
iRNA的RNA也可以被修飾成為包含一個或多個受限的乙基核苷酸。如本文所用,“受限的乙基核苷酸”或“cEt”是包括雙環糖部分體的鎖核酸,該雙環糖部分體包括4'-CH(CH3)-O-2'橋。在一個具體例中,S構形的受限的乙基核苷酸在本文中稱為“S-cEt”。
本發明的iRNA還可以包含一個或多個“構形受限的核苷酸”(“CRN”)。CRN是核苷酸類似物,其帶有一連接核糖的C2'和C4'碳原子或核糖的C3和-C5'碳原子的鏈接子。CRN將核糖圈環鎖定為穩定的構形並增加了對mRNA的雜合親和力。鏈接子具有足夠的長度以將氧放置在最佳的位置以獲得穩定性和親和力,從而減少核糖圈環的起皺。
教示上述CRN的製備的代表性文獻包含,但不限於,美國專利公開案2013/0190383;以及PCT公開案WO 2013/036868,其各項的全部內容在此藉由引用併入本文。
在某些具體例中,本發明的iRNA包括一種或多種為UNA(未鎖核酸)核苷酸的單體。UNA是未鎖的無環核酸,其中糖的任何鍵均已被去除,形成未鎖定的“糖”殘基。在一個實施例中,UNA亦涵蓋C1'-C4'之間的鍵已被去除的單體(即C1'和C4'碳之間的共價碳-氧-碳鍵)。在另一個實施例中,糖的C2'-C3'鍵(即C2'和C2'碳之間的共價碳-碳鍵)已被去除(參見Nuc.Acids Symp.Series,52,133-134(2008)和Fluiter等,Mol.Biosyst.,2009,10,1039藉由引用特此併入本文)。
教示UNA之製備的代表性美國文獻包含但不限於美國專利8,314,227;和美國專利公開案2013/0096289;2013/0011922;和2011/0313020,其各項的全部內容在此藉由引用併入本文。
潛在的對RNA分子末端的穩定化修飾可能包含N-(乙醯胺基己醯基)-4-羥基脯胺醇(Hyp-C6-NHAc)、N-(己醯基-4-羥基脯胺醇(Hyp-C6)、N-(乙醯-4-羥基脯胺醇(Hyp-NHAc)、胸腺嘧啶-2'-0-去氧胸腺嘧啶(醚)、N-(胺基己醯基)-4-羥基脯胺醇(Hyp-C6-amino)、2-二十二碳醯基-尿苷-3"-磷酸、倒置鹼基dT(idT)及其他。該修飾的揭露可在見PCT公開案WO 2011/005861中找到。
本發明的iRNA的核苷酸的其他修飾包含5’磷酸或5’磷酸模擬物,例如,iRNA的反義股上的5’-末端磷酸或磷酸模擬物。合適的磷酸模擬物在例如美國專利公開案2012/0157511中被揭露,其全部內容藉由引用在此併入本文。
A.經修飾RNAs包括本發明的模體
在本發明的特定態樣中,本發明的雙股RNA劑包含有化學修飾的劑,如例如WO2013/075035中所揭露的,其各項的全部內容在此藉由引用併入本文。WO2013/075035在dsRNAi劑的正義股或反義股中的三個連續核苷酸提供了三個相同的修飾模體,特別是在裂解位點處或其附近。在某些具體例中,dsRNAi劑的正義股和反義股可能另外會被完全修改。這些模體的引入中斷了正
義或反義股的修飾模式,如果存在模式的話。dsRNAi劑可以任選地與GalNAc衍生物配體接合,例如在正義股。
更具體地,當雙股RNA劑的正義股和反義股被完全修飾成為在dsRNAi的至少一股的裂解位點處或其附近具有一個或多個模體時,且該模體為三個連續核苷酸的三個相同的修飾,則觀察到了dsRNAi劑的基因沉默活性。
因此,本發明提供了能夠在體內抑制靶基因(即PNPLA3基因)的表達的雙股RNA劑。RNAi劑包括正義股和反義股。RNAi劑的每股的長度可以是例如,17-30核苷酸的長度、25-30核苷酸的長度、27-30核苷酸的長度、19-25核苷酸的長度、19-23核苷酸的長度、19-21核苷酸的長度、21-25核苷酸的長度、或21-23核苷酸的長度。
正義股和反義股通常形成雙鏈體的雙股RNA(“dsRNA”),本文中也稱為“dsRNAi劑”。dsRNAi劑的雙鏈體區域可以是,例如,雙鏈體區域的長度可以是27-30核苷酸對的長度、19-25核苷酸對的長度、19-23核苷酸對的長度、19-21核苷酸對的長度、21-25核苷酸對的長度或21-23核苷酸對的長度。
在另一個實施例中,雙鏈體區域的長度是選自19、20、21、22、23、24、25、26、和27核苷酸。
在一些具體例中,dsRNAi劑可以在一股或二股的3'端,5'端或二端含有一個或多個突出區域或加帽基團。突出可以獨立地為1-6核苷酸的長度,例如2-6核苷酸的長度、1-5核苷酸的長度、2-5核苷酸的長度、1-4核苷酸的長度、2-4核苷酸的長度、1-3核苷酸的長度、2-3核苷酸的長度、或1-2核苷酸的長度。在一些具體例中,突出區域可以包含如上所述的延伸的突出區域。
突出可以是一股長於另一股的結果,或是相同長度的二股錯開的結果。突出可能與靶mRNA形成錯配,或可能與被靶向的基因序列互補或可能是另一個序列。第一和第二股也可以,例如藉由另外的鹼基,被連接以形成髮夾,或藉由其他非鹼基的鏈接子。
在一些具體例中,dsRNAi劑的突出區域中的核苷酸可以各自獨立地是經修飾或未修飾的核苷酸,其包含但不限於,經修飾2’-糖,例如2’-氟基、2’-O-甲基、胸苷(T)、2`-O-甲氧基乙基-5-甲基尿苷(Teo)、2`-O-甲氧基乙基腺苷(Aeo)、2`-O-甲氧基乙基-5-甲基胞苷(m5Ceo)及其任意組合。
例如,TT可以是任一股之任一端的突出序列。突出可能與靶mRNA形成錯配,或者可能與目標基因序列是互補的或可能是另一個序列。
dsRNAi劑的正義股、反義股、或二股的5’-或3’-突出可以被磷酸化。在某些具體例中,(一個或多個)突出區域含有二個核苷酸,這二個核苷酸之間有硫代磷酸酯,其中二個核苷酸可能相同或不同。在某些具體例中,突出存在於正義股,反義股或二股的3’-端。在某些具體例中,此3’-突出存在於反義股。在某些具體例中,此3’-突出存在於正義股。
dsRNAi劑可以含有僅單一突出,其可強化RNAi的干擾活性,而不影響它的整體穩定性。例如,單股突出也許位於正義股的3'-端,或,要不然,位於反義股的3'-端。RNAi亦可具有鈍端,位於反義股的5'-端(或正義股的3'-端)或相反亦然。一般地,dsRNAi劑的反義股具有在3'-端的核苷酸突出,並且5'-端為鈍端。不希望被理論束縛,反義股的5'-端的不對稱鈍端和反義股的3'-端突出有利於將引導股加載進入RISC過程中。
在一些具體例中,dsRNAi劑為19個核苷酸長度的雙端鈍體,其中正義股含有至少一個模體,該模體為在離5'端的7、8、9位置的三個連續核苷酸的三個2’-氟基修飾。反義股含有至少一個模體,該模體具有在離5'端的11、12、13位置的三個連續核苷酸的三個2’-O-甲基修飾。
在其他的具體例中,dsRNAi劑為20個核苷酸長度的雙端鈍體,其中正義股含有至少一個模體,該模體具有在離5'端的8、9、10位置的三個連續核苷酸的三個2’-氟基修飾。反義股含有至少一個模體,該模體為在離5'端的11、12、13位置的三個連續核苷酸的三個2’-O-甲基修飾。
在又其他的具體例中,dsRNAi劑為21個核苷酸長度的雙端鈍體,其中正義股含有至少一個模體,該模體為在離5'端的9、10、11位置的三個連續核苷酸的三個2’-氟基修飾。反義股含有至少一個模體,該模體具有在離5'端的11、12、13位置的三個連續核苷酸的三個2’-O-甲基修飾。
在一些具體例中,dsRNAi劑包括21個核苷酸的正義股和23個核苷酸的反義股,其中正義股含有至少一個模體,該模體為在離5'端的9、10、11位置的三個連續核苷酸的三個2’-氟基修飾;該反義股還有至少一個模體,該模體具有在離5'端的11、12、13位置的三個連續核苷酸的三個2’-O-甲基修飾,其中RNAi劑的一端是鈍的,而另一端包括2核苷酸長度突出。較佳地,該2核苷酸長度突出是在反義股的3’-端。
當前述2核苷酸長度突出位於反義股的3'-端,則末端三個核苷酸之間可能有二個硫代磷酸酯核苷酸間鍵聯,其中三個核苷酸中的二個是突出核苷酸,而第三個核苷酸是緊鄰突出核苷酸的有配對的核苷酸。在一個具體例中,RNAi劑在正義股的5’-端和反義股的5’-端的末端三個核苷酸之間另外具有
二個硫代磷酸酯核苷酸間鍵聯。在一些具體例中,dsRNAi劑的正義股和反義股中的每個核苷酸,包含作為模體一部分的核苷酸,都是修飾核苷酸。在具體例中,每個殘基均被2’-O-甲基或3’-氟基獨立地修飾,例如以交替的模體。可選地,dsRNAi劑進一步地包括配體(較佳是GalNAc3)。
在一些具體例中,dsRNAi劑包括一正義股和一反義股。其中正義股是25-30個核苷酸殘基的長度,其中從5'末端核苷酸(位置1)開始,第一股的位置1至23包括至少8個核糖核苷酸;反義股是36-66個核苷酸殘基的長度,且從3'末端核苷酸開始,與正義股位置1至23配對而形成雙鏈體的那些位置包括至少8個核糖核苷酸;其中至少反義股的3'末端核苷酸與正義股不配對,並且最多6個連續的3'末端核苷酸與正義股不配對,從而形成1-6核苷酸的3'單股突出;其中反義股的5'末端包括來自與正義股不配對的10-30個連續核苷酸,從而形成10-30個核苷酸的單股5'突出;其中當正義股和反義股對齊以達到最大互補性時,至少正義股的5'末端和3'末端的核苷酸與反義股的核苷酸鹼基配對,從而形成正義股和反義股之間的實質上是雙鏈體的區域;並且反義股沿著至少反義股的19個核糖核苷酸的長度與靶RNA是足夠互補的,以在將雙股核酸引入哺乳動物細胞時降低靶基因的表達;且其中正義股含有至少一個模體,該模體為三個連續核苷酸的三個2’-氟基修飾,其中至少一個模體出現在裂解位點或其附近。反義股在裂解位點或其附近的三個連續核苷酸至少包含三個2'-O-甲基修飾的基序。反義股,在裂解位點或其附近,含有至少一個模體,該模體為三個連續核苷酸的三個2’-O-甲基修飾。
在一些具體例中,dsRNAi劑包括正義股和反義股,其中dsRNAi劑包括第一股,其具有至少25最多29個核苷酸的長度,和第二股,其具有的
長度最多為30個核苷酸,該30個核苷酸具有至少一個模體,該模體具有在離5'端的11、12,、13位置的三個連續核苷酸的三個2’-O-甲基修飾;其中第一股的3'末端和第二股的5'末端形成一鈍端,且第二股在其3'末端比第一股長1-4個核苷酸,其中雙鏈體區域至少為25個核苷酸的長度,第二股沿著至少第二股的19個核糖核苷酸的長度與靶RNA是足夠互補的,以在將RNAi劑引入哺乳動物細胞時降低靶基因的表達,並且其中dsRNAi劑的Dicer裂解優先產生包括第二股的3'-端的siRNA,從而降低了靶基因在哺乳動物中的表達。可選地,dsRNAi劑進一步地包括配體。
在一些具體例中,dsRNAi劑的正義股含有至少一個在三個連續核苷酸有三個相同修飾的模體,其中一個模體出現在正義股的裂解位點或其附近。
在一些具體例中,dsRNAi劑的反義股也含有至少一個在三個連續核苷酸有三個相同修飾的模體,其中一個模體出現在反義股的裂解位點或其附近。
對於具有19-23個核苷酸長度的雙鏈體區域的dsRNAi劑,反義股的裂解位點通常位於5'端的10、11和12位附近。因此,具有三個相同修飾的模體可以出現在9、10、11位置;10、11、12位置;11、12、13位置;12、13、14位置;或反義股的13、14、15位置,計數從反義股的5'端的第一個核苷酸開始,或者,計數從雙鏈體區域內從反義股5'端起算的第一個配對的核苷酸開始。反義股中的裂解位點也可根據dsRNAi劑從5'端開始的雙鏈體區域的長度而變化。
dsRNAi劑的正義股可在該股的裂解位點處含有至少一個在三個連續的核苷酸有三個相同修飾的模體;並且其反義股可在該股的裂解位點處或其附近,具有至少一個在三個連續的核苷酸有三個相同修飾的模體。當正義股和反義股形成dsRNA雙鏈體時,正義股和反義股可以如此對齊,以使正義股有三個核苷酸的一個模體和反義股有三個核苷酸的一個模體具有至少一個核苷酸重疊,即,正義股中模體的三個核苷酸中的至少一個與反義股中模體的三個核苷酸中的至少一個形成鹼基對。或者,至少二個核苷酸可以重疊,或者所有三個核苷酸都可以重疊。
在某些具體例中,dsRNAi劑的正義股可以含有多於一個在三個連續的核苷酸有三個相同修飾的模體。第一模體可以出現在股的裂解位點處或其附近,而其他模體可以是翼修飾。術語“翼修飾”在本文中係指出現在股的另一部分的模體,其與同一股的裂解位點處或附近的模體被分離開。翼修飾與第一模體相鄰,或被至少一個或多個核苷酸分離開。當該模體彼此緊鄰時,則該模體的化學性質彼此不同,且當該模體被一個或多個核苷酸分離開時,則化學性質可以相同或不同。二個或更多翼修飾可能存在。例如,當存在二個翼修飾時,每個翼修飾可以發生在相對於位於裂解位點或其附近的第一模體的一端或在主模體的任一側。
像正義股一樣,dsRNAi劑的反義股可含有多於一個在三個連續的核苷酸有三個相同修飾的模體,至少一個出現在股的裂解位點處或其附近。此反義股亦可含有一個或多個翼修飾,其對齊方式類似於正義股可能存在的翼修飾。
在某些具體例中,dsRNAi劑的正義股或反義股的翼修飾通常不包含該股3'端、5'端或二端的第一個或前二個末端核苷酸。
在其他具體例中,dsRNAi劑的正義股或反義股的翼修飾通常不包含該股3'端、5'端或二端的雙鏈體區域內的第一個或前二個已配對的核苷酸。
當dsRNAi劑的正義股和反義股各自含有至少一個翼修飾時,該翼修飾可落在雙鏈體區域的相同端,並具有1、2或3個核苷酸的重疊。
當dsRNAi劑的正義股和反義股各含有至少二個翼修飾時,正義股和反義股可以如此對齊,以使各自來自一股的二個修飾落在雙鏈體區域的一端,其具有一個、二個或三個核苷酸的重疊;各自來自一股的二個修飾落在雙鏈體區域的另一端,其具有一個、二個或三個核苷酸的重疊;各自來自一股的二個修飾落在主模體的二側,其在雙鏈體區域中具有一個、二個或三個核苷酸的重疊。
在某些具體例中,dsRNAi劑的正義股和反義股的每一個核苷酸,包含作為模體一部分的核苷酸,都可以是被修飾。每個核苷酸可能被相同或不同的修飾所修飾,其可能包含一種或多種改變,該改變為非鏈接的磷酸氧的一種或二種改變,或為鏈接的磷酸氧的一種或多種改變;核糖的成分的改變,例如核糖2'-羥基的改變;用“去磷酸”鏈接子大規模替換磷酸部分體;天然發生的鹼基的修飾或替換;以及核糖磷酸主鏈的替換或修飾。
由於核酸是亞單元的聚合物,許多修飾發生在核酸內重複的位置,例如鹼基、磷酸部分體、或磷酸部分體的非鏈接O的修飾。在某些情況下,修飾將發生在核酸中所有對象位置,但在許多情況下並不會發生,舉個例子,修飾可以僅發生在3’或5’末端位置,可以僅發生在末端區域,例如在末端
核苷酸的位置或一股中的最後2、3、4、5或10個核苷酸的位置。修飾可以發生在雙股區域、單股區域、或二者。修飾可以僅發生在RNA的雙股區域或僅發生在RNA的單股區域。例如,在非鏈接O位置的硫代磷酸修飾可能僅發生在末端或二末端,可能僅發生在末端區域,例如在末端核苷酸的位置或一股的最後2、3、4、5或10個核苷酸的位置,或可以發生在雙股和單股區域,特別是在末端。二5'端可能被磷酸化。
例如為了增強穩定性,可以在突出中包含特定鹼基,或者在單股突出中,例如在5’-或3’-突出中或二者中,包含經修飾核苷酸或核苷酸代用物。例如,可能希望在突出中包含嘌呤核苷酸。在一些具體例中,可以例如利用本文所述的修飾,來修飾3’-或5’-突出中的所有或一些鹼基。修飾可能包括,例如,在核糖的2'位置所使用的修飾為本領域已知的修飾,例如,使用了去氧核糖核苷酸,2’-去氧-2’-氟基(2’-F)或2’-O-甲基被修飾,而非核鹼基的核糖,以及磷酸基團的修飾,例如硫代磷酸修飾。突出不必與靶序列同源。
在某些具體例中,用LNA、CRN、cET、UNA、HNA、CeNA、2’-甲氧基乙基、2’-O-甲基、2’-O-烯丙基、2’-C-烯丙基、2’-去氧、2’-羥基、或2’-氟基獨立地修飾正義股和反義股的每個殘基。這些股可能含有多於一個的修飾。在一個具體例中,正義股和反義股的每個殘基都被2’-O-甲基或2’-氟基獨立地修飾。
至少二種不同的修飾通常存在於正義股和反義股。這二個修飾可以是2’-O-甲基或2’-氟基修飾,或其他修飾。
在一些具體例中,Na或Nb包括交替模式的修飾。如本文所用,術語“交替的模體”係指具有一個或多個修飾的模體,每個修飾發生在一股的交
替的核苷酸。交替的核苷酸可係指每隔一個核苷酸一個,或每三個核苷酸一個,或類似的模式。例如,如果A,B和C分別代表對核苷酸的一種修飾,則交替的模體可能是“ABABABABABAB...”、“AABBAABBAABB...”、“AABAABAABAAB...”、“AAABAAABAAAB...”、“AAABBBAAABBB...”或“ABCABCABCABC...”等。
交替的模體中含有的修飾類型可以相同或不同。例如,如果A、B、C、D分別代表一個在核苷酸的修飾類型,則交替模式,即每隔一個核苷酸的修飾,可以是相同的,但是每個正義股或反義股可以從下列交替的模體內的幾種可能性中選擇,諸如“ABABAB...”、“ACACAC...”、“BDBDBD...”或“CDCDCD...”等。
在某些具體例中,本發明的dsRNAi劑包括正義股的交替的模體之修飾模式,相對於反義股的交替的模體之修飾模式是偏移的。這種偏移可以使得正義股的核苷酸的修飾基團對應於反義股的核苷酸的不同地修飾基團,且反之亦然。例如,當正義股與dsRNA雙鏈體中的反義股配對時,在雙鏈體區域內,正義股的交替的模體可以從該股的5'到3'以“ABABAB”開始,且反向義股的交替的模體可以從該股的5'至3'以“BABABA”開始。作為另一個實施例,在雙鏈體區域內,正義股的交替的模體可以從該股的5'到3'以“AABBAABB”開始,且反義股的交替的模體可以從該股的5'至3'以“BBAABBAA”開始,因此在正義股和反義股之間存在修飾模式的完全或部分的偏移。
在某些具體例中,dsRNAi劑包括正義股的2'-O-甲基修飾和2’-氟基修飾的交替的模體之模式,初始地具有相對於反義股初始的2'-O-甲基修飾和2’-氟基修飾的交替的模體之模式的位移,即正義股的2'-O-甲基修飾核苷酸與反
義股的2'-氟基修飾核苷酸鹼基配對,且反之亦然。正義股的1位置可以從2'-氟基修飾開始,且反義股的1位置可以從2'-O-甲基修飾開始。
將三個連續核苷酸的三個相同修飾的一個或多個模體引入到正義股或反義股,中斷了正義股或反義股中存在的初始修飾模式。藉由將三個連續核苷酸的三個相同修飾的一個或多個模體引入到正義股或反義股來中斷有義或反義股的修飾模式,可以增強針對靶基因的基因沉默活性。
在某些具體例中,在將三個連續核苷酸的三個相同修飾的模體引入任一股時,緊鄰模體的核苷酸修飾是不同於模體之修飾的修飾。例如,含有模體的序列部分是“...NaYYYNb...”,其中“Y”代表三個連續核苷酸的三個相同修飾的模體之修飾,並且“Na”和“Nb”代表緊鄰模體“YYY”的核苷酸的修飾,其不同於Y的修飾,且其中Na和Nb可是相同或不同的修飾。或者,當存在一個翼修飾時,Na或Nb可以存在或不存在。
iRNA可以進一步地包括至少一個硫代磷酸酯或甲基膦酸酯的核苷酸間鍵聯。硫代磷酸酯或甲基膦酸酯核苷酸間鍵聯的修飾可以在股的任一位置出現在正義股,反義股或二股的任一核苷酸。例如,核苷酸間鍵聯修飾可以出現在正義股或反義股的們每一個核苷酸;每個核苷酸間鍵聯修飾可以以交替模式出現在正義股或反義股;或,正義股或反義股可以含有交替模式的二種核苷酸間鍵聯。正義股的核苷酸間鍵聯修飾的交替模式可以與反義股相同或不同,並且正義股的核苷酸間鍵聯修飾的交替模式相對於反義股的核苷酸間鍵聯修飾的交替模式可以具有一偏移。在一個具體例中,一雙股RNAi劑包括6-8個硫代磷酸酯核苷酸間鍵聯。在某些具體例中,反義股包括2個在5’-端的硫代磷
酸酯核苷酸間鍵聯和2個在3’-端的硫代磷酸酯核苷酸間鍵聯,並且正義股包括在5’-端或3’-端的至少2個硫代磷酸酯核苷酸間鍵聯。
在某些具體例中,dsRNAi劑在突出區域包括硫代磷酸酯或甲基膦酸酯核苷酸間鍵聯修飾。例如,突出區域可以含有2個在2個核苷酸之間具有硫代磷酸酯或甲基膦酸酯核苷酸間鍵聯的核苷酸。核苷酸間鍵聯修飾亦可以將突出核苷酸與區域內的末端已配對核苷酸鏈接起來。例如,至少2、3、4個或全部的突出核苷酸可以藉由硫代磷酸酯或甲基膦酸酯核苷酸間鍵聯連接起來,並且可選地,存在鏈接突出核苷酸與緊鄰突出核苷酸之已配對核苷酸的其他硫代磷酸酯或甲基膦酸酯核苷酸間鍵聯。例如,在末端三個核苷酸之間可以存在至少2個硫代磷酸酯核苷酸間鍵聯,其中三個核苷酸的二個是突出核苷酸,並且第三個是緊鄰突出核苷酸的已配對核苷酸。這些末端三個核苷酸可以在反義股的3’-端、正義股的3’-端、反義股的5’-端,或正義股的5’-端。
在某些具體例中,2個核苷酸的突出是在反義股的3’-端,在末端三個核苷酸之間存在2個硫代磷酸酯核苷酸間鍵聯,其中三個核苷酸中的二個是突出核苷酸,並且第三個核苷酸是緊鄰突出核苷酸的已配對核苷酸。可選地,dsRNAi劑可以在正義股的5’-端和反義股的5’-端的末端三個核苷酸之間另外具有二個硫代磷酸酯核苷酸間鍵聯。
在一個具體例中,dsRNAi劑包括與靶標的錯配,在雙鏈體內,或其組合。錯配可以發生在突出區域中或雙鏈體區域中。可以基於其促進解離和熔化的傾向性將鹼基對排名(例如,對於特定配對的締合和解離的自由能,最簡單的手段是基於單個對檢查該對,儘管也可使用相鄰分析或類似分析)。就促進解離而言:A:U優於G:C;G:U優於G:C;和I:C優於G:C(I=肌苷)。錯
配,例如非典型的或典型配對以外的(如本文中別處所描述)優於典型的(A:T、A:U、G:C)配對;並且包含通用鹼基的配對優於典型的配對。
在一些具體例中,dsRNAi劑包括從反義股的5’-端雙鏈體區域內的前1、2、3、4、或5個鹼基對中的至少一個獨立地選自如下群組:A:U、G:U、I:C和錯配的對,例如非典型的或典型配對以外的或包含通用鹼基的配對,以促進反義股在雙鏈體5’-端的解離。
在一些具體例中,反義股的雙鏈體區域內從5’-端的位置1的核苷酸是選自A、dA、dU、U、和dT。或者,反義股的雙鏈體區域內從5’-端的前1、2、或3個鹼基對中至少一個是AU鹼基對。例如,反義股的雙鏈體區域內從5’-端的第一個鹼基對是AU鹼基對。
在其他一些具體例中,正義股3’-端的核苷酸是去氧-胸腺嘧啶(dT)或反義股3’-端的核苷酸是去氧-胸腺嘧啶(dT)。例如,存在短的去氧-胸腺嘧啶核苷酸的序列,例如,在正義股、反義股、或二股的3’-端的2個dT核苷酸。
在一些具體例中,正義股序列可以由式(I)來表示:
5' np-Na-(X X X)i-Nb-Y Y Y-Nb-(Z Z Z)j-Na-nq 3' (I)
其中:
i和j各自獨立地為0或1;
p和q各自獨立地為0-6;
每個Na獨立地表示包括0-25個經修飾核苷酸的寡核苷酸序列,每個序列包括至少二個不同經修飾核苷酸;
每個Nb獨立地表示包括0-10個經修飾核苷酸的寡核苷酸序列;
每個np和nq獨立地表示突出核苷酸;
其中Nb和Y不具有相同修飾;並且
XXX、YYY、和ZZZ各自獨立地表示在三個連續核苷酸的三個相同修飾的一個模體。較佳地YYY全部是經2’-氟基修飾核苷酸。
在某些具體例中,Na或Nb包括交替模式的修飾。
在某些具體例中,YYY模體出現在正義股的裂解位點或其附近。例如,當dsRNAi劑具有長度為17-23個核苷酸的雙鏈體區域時,YYY模體可以出現在正義股的裂解位點或其附近(例如:可發生在位置6、7、8;7、8、9;8、9、10;9、10、11;10、11、12;或11、12、13),計數從第一核苷酸開始,且從5'-端開始;或可選地,計數從雙鏈體區域內的第一對核苷酸開始,且從5'-端開始。
在一個具體例中,i是1且j是0,或i是0且j是1,或i和j都是1。因此,正義股能以如下式所表示:
5' np-Na-YYY-Nb-ZZZ-Na-nq 3' (Ib);
5' np-Na-XXX-Nb-YYY-Na-nq 3' (Ic);或
5' np-Na-XXX-Nb-YYY-Nb-ZZZ-Na-nq 3' (Id).
當正義股是以式(Ib)來表示,Nb表示包括0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。每個Na獨立地可表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
當正義股是以式(Ic)來表示,Nb表示包括包括0-10、0-7、0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。每個Na獨立地可表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
當正義股是以式(Id)來表示,每個Nb獨立地表示包括0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。較佳地,Nb是0、1、2、3、4、5、或6。每個Na獨立地可表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
X,Y和Z中的每一個可以與彼此相同或不同。
在其他具體例中,i是0且j是0,並且正義股可以用此式表示:
5' np-Na-YYY-Na-nq 3' (Ia).
當正義股是以式(Ia)來表示,每個Na獨立地可表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
在一個具體例中,RNAi的反義股序列可以用式(II)來表示:
5' nq’-Na '-(Z’Z'Z')k-Nb '-Y'Y'Y'-Nb '-(X'X'X')l-N' a-np ' 3' (II)
其中:
k和l各自獨立地為0或1;
p’和q’各自獨立地為0-6;
每個Na '獨立地表示包括0-25個經修飾核苷酸的寡核苷酸序列,每個序列包括至少2個不同的經修飾核苷酸;
每個Nb '獨立地表示包括0-10個經修飾核苷酸的寡核苷酸序列;
每個np '和nq '獨立地表示突出核苷酸;
其中Nb’和Y’不具有相同的修飾;並且
X'X'X'、Y'Y'Y',和Z'Z'Z'每個獨立地表示在三個連續核苷酸的三個相同修飾的一個模體。
在某些具體例中,Na’或Nb’包括交替模式的修飾。
Y'Y'Y'模體出現在反義股的裂解位點或其附近。例如,當dsRNAi劑具有長度為17-23個核苷酸的雙鏈體區域時,Y'Y'Y'模體可能出現在反義股的位置9、10、11;10、11、12;11、12、13;12、13、14;或13、14、15、計數從第一核苷酸開始,且從5'-端開始;或可選地,計數從雙鏈體區域內的第一對核苷酸開始,且從5'-端開始。較佳地,Y'Y'Y'模體出現在位置11、12、13。
在一些具體例中,Y'Y'Y'模體全部是經2’-OMe修飾核苷酸。
在一些具體例中,k是1且l是0,或k是0且l是1或k和l都是1。
因此,反義股能以如下式所表示:
5' nq’-Na '-Z'Z'Z'-Nb '-Y'Y'Y'-Na '-np’3' (IIb);
5' nq’-Na '-Y'Y'Y'-Nb '-X'X'X'-np’3' (IIc);或
5' nq’-Na '-Z'Z'Z'-Nb '-Y'Y'Y'-Nb '-X'X'X'-Na '-np’3' (IId).
當反義股是以式(IIb)來表示,Nb’表示包括0-10、0-7、0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。每個Na’獨立地表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
當反義股是以式(IIc)來表示,Nb’表示包括0-10、0-7、0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。每個Na’獨立地表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
當反義股是以式(IId)來表示,每個Nb’獨立地表示包括0-10、0-7、0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。每個Na’
獨立地表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。較佳地,Nb是0、1、2、3、4、5、或6。
在其他具體例中,k是0且l是0並且反義股可以用此式表示:
5' np’-Na’-Y’Y’Y’-Na’-nq’3' (Ia).
當反義股是以式(IIa)來表示,每個Na’獨立地表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
X'、Y'和Z'中的每一個可以與彼此相同或不同。
正義股和反義股中的每個核苷酸可以是獨立地用如下基團來修飾:LNA、CRN、UNA、cEt、HNA、CeNA、2’-甲氧基乙基、2’-O-甲基、2’-O-烯丙基、2’-C-烯丙基、2’-羥基、或2’-氟基。例如,正義股和反義股中的每個核苷酸是獨立地用2’-O-甲基或2’-氟基來修飾。每個X、Y、Z、X'、Y'、和Z',特別地,可以表示2’-O-甲基修飾或2’-氟基修飾。
在某些具體例中,當雙鏈體區域為21 nt(21個核苷酸)時,dsRNAi劑的正義股可以含有在該股位置9、10、和11出現的YYY模體,計數從第一核苷酸開始且從5'-端開始,或可選地,計數從雙鏈體區域內的第一對核苷酸開始,且從5'-端開始;並且Y表示2’-氟基修飾。該正義股可以另外含有XXX模體或ZZZ模體作為在雙鏈體區域相對端的翼修飾;並且XXX和ZZZ各自獨立地表示2’-OMe修飾或2’-F修飾。
在一些具體例中,反義股可以含有在該股位置11、12、13出現的Y'Y'Y'模體,計數從第一核苷酸開始且從5'-端開始,或可選地,計數從雙鏈體區域內的第一對核苷酸開始,且從5'-端開始;並且Y表示2’-O-甲基修飾。該
反義股可以另外含有X'X'X'模體或Z'Z'Z'模體作為在雙鏈體區域相對端的翼修飾;並且X'X'X'和Z'Z'Z'各自獨立地表示2’-OMe修飾或2’-F修飾。
由以上式(Ia)、(Ib)、(Ic)、和(Id)中的任一個所表示的正義股,分別與由式(IIa)、(IIb)、(IIc)、和(IId)中的任一個所表示的反義股,形成一雙鏈體。
因此,用於本發明之方法中的dsRNAi劑可以包括正義股和反義股,每股具有14至30個核苷酸,iRNA雙鏈體由式(III)來表示:
正義:5' np-Na-(X X X)i-Nb-Y Y Y-Nb-(Z Z Z)j-Na-nq 3'
反義:3' np’-Na’-(X’X'X')k-Nb’-Y'Y'Y'-Nb’-(Z'Z'Z')l-Na’-nq’5' (III)
其中:
i、j、k、和l各自獨立地是0或1;
p、p'、q、和q'各自獨立地是0-6;
每個Na和Na’獨立地表示包括0-25個經修飾核苷酸的寡核苷酸序列,每個序列包括至少2個不同的修飾核苷酸;
每個Nb和Nb’獨立地表示包括0-10個經修飾核苷酸的寡核苷酸序列;
其中每個np’、np、nq’、和nq、每個可以存在或不存在,獨立地表示突出核苷酸;並且
XXX、YYY、ZZZ、X'X'X'、Y'Y'Y'、和Z'Z'Z'各自獨立地表示在三個連續核苷酸的三個相同修飾的一個模體。
在一個具體例中,i是0且j是0;或i是1且j是0;或i是0且j是1;或i和j都是0;或i和j都是1。在另一個具體例中,k是0且l是0;或k是1且l是0;k是0且l是1;或k和l都是0;或k和l都是1。
形成iRNA雙鏈體的正義股和反義股的示例性組合包含下面的式:
5' np-Na-Y Y Y-Na-nq 3'
3' np’-Na’-Y'Y'Y'-Na’nq’5' (IIIa)
5' np-Na-Y Y Y-Nb-Z Z Z-Na-nq 3'
3' np’-Na’-Y'Y'Y'-Nb’-Z'Z'Z'-Na’nq’5' (IIIb)
5' np-Na-X X X-Nb-Y Y Y-Na-nq 3'
3' np’-Na’-X'X'X'-Nb’-Y'Y'Y'-Na’-nq’5' (IIIc)
5' np-Na-X X X-Nb-Y Y Y-Nb-Z Z Z-Na-nq 3'
3' np’-Na’-X'X'X'-Nb’-Y'Y'Y'-Nb’-Z'Z'Z'-Na-nq’5' (IIId)
當dsRNAi劑是以式(IIIa)來表示,每個Na獨立地表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
當dsRNAi劑是以式(IIIb)來表示,每個Nb獨立地表示包括1-10、1-7、1-5、或1-4個經修飾核苷酸的寡核苷酸序列。每個Na獨立地表示包括2-20、2-15、或2-10個修飾核苷酸的寡核苷酸序列。
當dsRNAi劑是以式(IIIc)來表示,每個Nb、Nb’獨立地表示包括0-10、0-7、0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。每個Na獨立地表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。
當dsRNAi劑是以式(IIId)來表示,每個Nb、Nb’獨立地表示包括0-10、0-7、0-10、0-7、0-5、0-4、0-2、或0個經修飾核苷酸的寡核苷酸序列。每個Na、Na’獨立地表示包括2-20、2-15、或2-10個經修飾核苷酸的寡核苷酸序列。Na、Na’、Nb、和Nb’中的每個獨立地包括交替模式的修飾。
式(III)、(IIIa)、(IIIb)、(IIIc)、和(IIId)中的X、Y、和Z的每個可以彼此相同或不同。
當dsRNAi劑是以式(III)、(IIIa)、(IIIb)、(IIIc)、和(IIId)來表示,Y核苷酸中的至少一個可以與Y'核苷酸中的一個形成鹼基對。或者,Y核苷酸中的至少二個與相應的Y'核苷酸形成鹼基對;或者全部三個Y核苷酸與相應的Y'核苷酸全部形成鹼基對。
當dsRNAi劑是以式(IIIb)或(IIId)來表示,Z核苷酸中的至少一個可以與Z'核苷酸中的一個形成鹼基對。或者,Z核苷酸中的至少二個與相應的Z'核苷酸形成鹼基對;或者全部三個Z核苷酸與相應的Z'核苷酸全部形成鹼基對。
當dsRNAi劑是以式(IIIc)或(IIId)來表示,X核苷酸中的至少一個可以與X'核苷酸中的一個形成鹼基對。或者,X核苷酸中的至少二個與相應的X'核苷酸形成鹼基對;或者全部三個X核苷酸與相應的X'核苷酸全部形成鹼基對。
在一些具體例中,Y核苷酸的修飾不同於Y’核苷酸的修飾,Z核苷酸的修飾不同於Z’核苷酸的修飾,或者X核苷酸的修飾不同於X’核苷酸的修飾。
在一些具體例中,當dsRNAi劑是以式(IIId)來表示,Na修飾是2'-O-甲基或2'-氟基修飾。在其他具體例中,當RNAi劑是以式(IIId)來表示,Na修飾是2'-O-甲基或2'-氟基修飾,且np '>0,且至少一個np '經由硫代磷酸酯鍵聯與相鄰的核苷酸鏈接。在其他具體例中,當RNAi劑是以式(IIId)來表示,Na修飾是2'-O-甲基或2'-氟基修飾,np '>0且至少一個np '經由硫代磷酸酯鍵聯與相鄰的核苷酸鏈接,並且正義股與藉由二價或三價分枝鏈接子所附接的一個或多個GalNAc衍生物接合(如下所述)。在其他具體例中,當RNAi劑是以式(IIId)來表示,Na修飾是2'-O-甲基或2'-氟基修飾,np '>0並且至少一個np '經由硫代磷酸酯鍵聯與相鄰的核苷酸鏈接,正義股包括至少一個硫代磷酸酯鍵聯,並且正義股與藉由二價或三價分枝鏈接子所附接的一個或多個GalNAc衍生物接合。
在某些具體例中,當dsRNAi劑是以式(IIIa)來表示,Na修飾是2'-O-甲基或2'-氟基修飾,np '>0並且至少一個np '經由硫代磷酸酯鍵聯與相鄰的核苷酸鏈接,正義股包括至少一個硫代磷酸酯鍵聯,並且正義股與藉由二價或三價分枝鏈接子所附接的一個或多個GalNAc衍生物接合。
在某些具體例中,dsRNAi劑是含有至少二個由式(III)、(IIIa)、(IIIb)、(IIIc)、和(IIId)所表示的雙鏈體的多聚體,其中的雙鏈體是由鏈接子所連接。該鏈接子可能是可裂解的或不可裂解的。可選地,該多聚體進一步地包括一配體。每個雙鏈體可能靶向相同的基因或二個不同的基因;或每個雙鏈體可能在二個不同的靶位點靶向同一基因。
在某些具體例中,dsRNAi劑是含有三、四、五、六或更多個由式(III)、(IIIa)、(IIIb)、(IIIc)、和(IIId)所表示的雙鏈體的多聚體,其中的雙鏈體是由鏈接子所連接。該鏈接子可能是可裂解的或不可裂解的。可選地,該多聚體進一步地包括一配體。每個雙鏈體可能靶向相同的基因或二個不同的基因;或每個雙鏈體可能在二個不同的靶位點靶向同一基因。
在一個具體例中,二個由式(III)、(IIIa)、(IIIb)、(IIIc)、和(IIId)中的至少一個所表示的dsRNAi劑在5’端以及在一或二個3’端彼此鏈接起來,並且可選地與配體接合。每個劑可能靶向相同的基因或二個不同的基因;或每個劑可能在二個不同的靶位點靶向同一基因。
在一些具體例中,本發明的RNAi劑可以含有少數含有2’-氟基修飾的核苷酸,例如10個或更少的含有2’-氟基修飾的核苷酸。例如,RNAi劑可以含有10、9、8、7、6、5、4、3、2、1或0個具有2’-氟基修飾的核苷酸。在一具體例中,本發明的RNAi劑含有10個具有2’-氟基修飾的核苷酸,例如4個正義股中的具有2’-氟基修飾的核苷酸和6個反義股中的具有2’-氟基修飾的核苷酸。在另一具體例中,本發明的RNAi劑含有6個具有2’-氟基修飾的核苷酸,例如4個正義股中的具有2’-氟基修飾的核苷酸和2個反義股中的具有2’-氟基修飾的核苷酸。
在其他具體例中,本發明的RNAi劑可以含有極少數含有2’-氟基修飾的核苷酸,例如2個或更少的含有2’-氟基修飾的核苷酸。例如,RNAi劑可以含有2、1或0個具有2’-氟基修飾的核苷酸。在一具體例中,本發明的RNAi劑可以含有2個具有2’-氟基修飾的核苷酸,例如,0個正義股中的具有2’-氟基修飾的核苷酸和2個反義股中的具有2’-氟基修飾的核苷酸。
各種出版物描述了可用於本發明之方法中的多聚體iRNAs。這樣的出版物包含WO2007/091269、美國專利7,858,769、WO2010/141511、WO2007/117686、WO2009/014887,和WO2011/031520,其每個的全部內容藉由引用在此併入本文。
在一些具體例中,本揭露的組成物和方法包含如本文所述的RNAi劑的乙烯基膦酸(VP)修飾。在示例性的具體例中,本揭露的乙烯基膦酸具有如下結構:
本揭露的乙烯基膦酸可以被附接到本揭露的dsRNA的反義股或正義股其一。在較佳具體例中,本揭露的乙烯基膦酸被附接到dsRNA的反義股,可選地在dsRNA的反義股的5’端。
乙烯基磷酸修飾亦預期用於本揭露的組成物和方法。一示例性的乙烯基磷酸結構為:
如以下更詳細描述的,含有接合到自身的一個或多個碳水化合物部分體的iRNA能優化該iRNA的一個或多個特性。在許多情況下,前述碳水化合物部分體將被附接到iRNA的經修飾亞單元。例如,iRNA的一個或多個核
糖核苷酸亞單元的核糖可以被替換為另一個部分體,例如,附接了碳水化合物配體的非碳水化合物(較佳是環狀的)載體。其中亞單元的核糖已被如此替換的核糖核苷酸亞單元在本文中被稱為核糖替換修飾亞單元(RRMS)。環狀載體可以是碳環圈環系統,即所有圈環原子都是碳原子,或雜環圈環系統,即一個或多個圈環原子可以是雜原子,例如氮、氧、硫。環狀載體可以是單環圈環系統,或可以含有二個或更多個圈環,例如併合圈環。環狀載體可以是完全飽和的圈環系統,或者其可以含有一個或多個雙鍵。
配體可以經由載體附接至多核苷酸。載體包含(i)至少一個“主鏈附接點”,較佳為二個“主鏈附接點”和(ii)至少一個“連繫附接點”。如本文所用,“主鏈附接點”係指官能基,例如羥基,或通常是可用於並適用於將載體併入到主鏈中的鍵,例如核糖核酸的,例如磷酸主鏈或經修飾磷酸主鏈,例如含有硫的主鏈。在一些實施方案中,“連繫附接點”(TAP)係指連接選定的部分體的環狀載體之構成圈環原子,例如碳原子或雜原子(與提供主鏈附接點的原子不同)。該部分體可以是,例如碳水化合物,例如,單糖、二醣、三醣、四醣、寡糖或多醣。可選地,選定的部分體藉由一中間連繫而被連接至環狀載體。因此,環狀載體通常將包含一官能基,例如胺基,或者通常提供一鍵,其適合於將另一化學實體例如配體併入或連繫到構成圈環。
iRNA可以經由載體與配體接合,其中的載體可以是環狀基團或無環基團;較佳地,該環狀基團是選自吡咯啶基、吡唑啉基、吡唑啶基、咪唑啉基、咪唑啶基、哌啶基、哌嗪基、[1,3]二氧雜環戊烷、唑啶基、異唑啶基、嗎啉基、噻唑啶基、異噻唑啶基、喹啉基、噠嗪酮基、四氫呋喃基和十氫萘;較佳地,無環基團是絲胺醇主鏈或二乙醇胺主鏈。
i.熱不穩定的修飾
在一些具體例中,可以藉由在反義股的種子區域(即在反義股的5'-端的2-9位置)摻入熱不穩定的修飾來優化dsRNA分子的RNA干擾,以降低或抑制脫靶的基因沉默。已經發現,具有從反義股的5'端起算的前9個核苷酸位置內包括至少一個雙鏈體的熱不穩定的修飾的反義股的dsRNA,這降低了脫靶的基因沉默活性。因此,在某些具體例中,反義股在其5'區域前9個核苷酸位置內包括至少一個(例如,一、二、三、四、五個或更多個)雙鏈體的熱不穩定的修飾。在某些具體例中,雙鏈體的一個或多個熱不穩定的修飾位於從反義股5’-端起的2-9位置,最好是位置4-8。在一些進一步的具體例中,雙鏈體的熱不穩定的修飾位於從反義股5’-端起的位置6、7或8。在一些進一步的具體例中,雙鏈體的熱不穩定的修飾位於從反義股5’-端起的位置7。術語“熱不穩定的修飾”包含會使dsRNA具有較低的總體解鏈溫度(Tm)的修飾(較佳的Tm比沒有此種修飾之dsRNA的Tm低1、2、3或4度)。在某些具體例中,雙鏈體的熱不穩定的修飾位於從反義股的5'端起的位置2、3、4、5或9。
iRNA劑包括正義股和一反義股。每股具有14至40個核苷酸。RNAi劑可以由式(L)來表示:
在式(L)中、B1、B2、B3、B1’、B2’、B3’、和B4’各自獨立地為含有選自於如下基團群組的修飾的核苷酸:2’-O-烷基、2’-取代烷氧基、2’-取代烷基、2’-鹵基、ENA、和BNA/LNA。在一個具體例中、B1、B2、B3、B1’、B2’、B3’、和B4’都含有2’-OMe修飾。在一個具體例中、B1、B2、B3、B1’、B2’、B3’、和B4’都含有2’-OMe或2’-F修飾。在一個具體例中,B1、B2、B3、B1’、B2’、B3’、和B4’中的至少一個含有2'-O-N-甲基乙醯胺基(2'-O-NMA)修飾。
C1為熱不穩定的核苷酸,其位於與反義股種子區域(即在反義股5’-端的位置2-8)對位的位點。例如,C1位於正義股的位置,其與位於反義股5’-端的位置2-8的核苷酸配對。在一個實施例中,C1位於從正義股5'-端起的位置15。C1核苷酸帶有熱不穩定的修飾,其可包含無鹼基修飾;雙鏈體中與對位核苷酸的錯配;以及糖修飾例如2’-去氧修飾(即,下圖中的2’-deoxy)或無環核苷酸例如,例如未鎖核酸(UNA)或二醇核酸(GNA)。在一個具體例中,C1具有選自以下群組的熱不穩定的修飾:i)與反義股中的對位核苷酸的錯配;ii)無鹼基修飾,其選自以下群組:
,,,,,以及
,其中B是經修飾或未修飾的核鹼基,R1和R2獨立地是H、鹵素、OR3或烷基;R3為H、烷基、環烷基、芳基、芳烷基、雜芳基或糖。在一個具體例中,C1中的熱不穩定的修飾是選自如下群組的錯配:G:G、G:A、G:U、G:T、A:A、A:C、C:C、C:U、C:T、U:U、T:T、和U:T;並且可選地,錯配對中的至少一個核鹼基是2’-去氧核鹼基。在一個實施例中,C1中的熱不穩定的修飾是
GNA或。
T1、T1’、T2’、和T3’各自獨立地表示包括修飾的核甘酸,該修飾提供小於或等於2’-OMe修飾之立體體積。立體體積係指修飾的立體效應的總和。確定核苷酸修飾的立體效應的方法是本領域所屬技術領域者已知的。該修飾可以位於核苷酸的核糖的2’位置,或為對如下物質的修飾:非核糖核苷酸、無環核苷酸、或與所述核糖的2’位置類似或等同的核苷酸主鏈,並且該修飾為核苷酸提供了小於或等於2’-OMe修飾之立體體積的立體體積。例如,T1、T1’、T2’、和T3’各自獨立地選自DNA、RNA、LNA、2’-F、和2’-F-5’-甲基。
在一個具體例中,T1是DNA。在一個具體例中,T1’是DNA,RNA或LNA。在一個具體例中,T2’是DNA或RNA。在一個具體例中,T3’是DNA或RNA。
n1、n3、和q1獨立地是4至15個核苷酸的長度。
n5、q3、和q7獨立地是1-6個核苷酸的長度。
n4、q2、和q6獨立地是1-3個核苷酸的長度;或者,n4是0。
q5獨立地是0-10個核苷酸的長度。
n2和q4獨立地是0-3核苷酸的長度。
或者,n4是0-3核苷酸(s)的長度。
在一個具體例中,n4可能是0。在一個實施例中,n4是0,且q2和q6是1。在另一個實施例中,n4是0,且q2和q6是1,具有正義股位置1-5內(從正義股5’-端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,在位置1和2上的二個硫代磷酸酯核苷酸間鍵聯的修飾以及反義股位置18-23內(從反義股5’-端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,n4、q2、和q6都是1。
在一個具體例中,n2、n4、q2、q4、和q6都是1。
在一個具體例中,當正義股是19-22個核苷酸的長度,C1位於正義股5’-端位置14-17,且q4是1。在一個具體例中,C1位於正義股5’-端位置。
在一個具體例中,T3’從反義股5’-端位置2開始。在一個實施例中,T3’位於反義股5’-端位置2且q6等於1。
在一個具體例中,T1’從反義股5’-端位置14開始。在一個實施例中,T1’位於反義股5’-端位置14且q2等於1。
在另一個示例性的具體例中,T3’從反義股5’-端位置2開始並且T1’從反義股5’-端位置14開始。在一個實施例中,T3’從反義股5’-端位置2開始且q6等於1和T1’從反義股5’-端位置14開始且q2等於1。
在一個具體例中,T1’和T3’是由11個核苷酸的長度分離開(即不計入T1’和T3’的核苷酸)。
在一個具體例中,T1’位於反義股5’-端位置14。在一個實施例中,T1’位於反義股5’-端位置14且q2等於1,並且在2’位置的修飾或在非核糖、非環或主鏈的位置的修飾提供了小於2’-OMe核糖的立體體積。
在一個具體例中,T3’位於反義股5’-端位置2。在一個實施例中,T3’位於反義股5’-端位置2且q6等於1,並且在2’位置的修飾或在非核糖、非環或主鏈的位置的修飾提供了小於或等於2’-OMe核糖的立體體積。
在一個具體例中,T1位於正義股的裂解位點。在一個實施例中,當正義股是19-22個核苷酸的長度時,T1位於正義股5’端位置11,且n2是1。在一個示例性的具體例中,當正義股是19-22個核苷酸的長度時,T1位於從正義股5’端起位置11的正義股的裂解位點,且n2是1,
在一個具體例中,T2’從反義股5’端位置6開始。在一個實施例中,T2’位於從反義股5’端起的位置6-10,且q4是1。
在一個示例性的具體例中,當正義股是19-22個核苷酸的長度時,T1位於正義股的裂解位點,例如位於從正義股5’端起位置11,且n2是1;T1’是位於反義股5’-端位置14且q2等於1,並且對T1’的修飾是位於核糖的2’位置或是在非核糖、非環或主鏈的位置的,該修飾提供了小於2’-OMe核糖的立體體積;T2’位於從反義股5’端起的位置6-10,且q4是1;且T3’位於反義股5’-端位
置2且q6等於1,並且對T3’的修飾是在2’位置或在非核糖、非環或主鏈的位置,該修飾提供了小於或等於2’-OMe核糖的立體體積。
在一個具體例中,T2’從反義股5’端位置8開始。在一個實施例中,T2’從反義股5’端位置8開始,且q4是2。
在一個具體例中,T2’從反義股5’端位置9開始。在一個實施例中,T2’從反義股5’端位置9開始,且q4是1。
在一個具體例中,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是1,B3’是2’-OMe或2’-F,q5是6,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是1,B3’是2’-OMe或2’-F,q5是6,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,B1是2’-OMe或2’-F,n1是6,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是7,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。
在一個具體例中,B1是2’-OMe或2’-F,n1是6,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是7,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是1,B3’是2’-OMe或2’-F,q5是6,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是1,B3’是2’-OMe或2’-F,q5是6,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是5,T2’是2’-F,q4是1,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;可選地在反義股3’端具有至少2個額外的TT。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是5,T2’是2’-F,q4是1,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;可選地在反義股3’端具有至少2個額外的TT;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,
q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,
q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1.
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。
RNAi可包括位於正義股或反義股5’端的一含磷基團。該5’端含磷基團可能是5’-端磷酸(5’-P)、5’-端硫代磷酸(5’-PS)、5’-端二硫代磷酸(5’-PS2)、5’-端乙烯基膦酸(5’-VP)、5’-端甲基膦酸(MePhos)、或5’-去氧-5’-C-丙二醯基()。當5’端含磷基團是5’-端乙烯基膦酸(5’-VP)時,the 5’-VP可能是5’-E-VP異構物(即,反式-乙烯基磷酸,),5’-Z-VP異構物(即,順式-乙烯基磷酸,),或其混合物。
在一個具體例中,RNAi劑包括位於正義股5’端的含磷基團。在一個具體例中,RNAi劑包括反義股5’端的含磷基團。
在一個具體例中,RNAi劑包括5’-P。在一個具體例中,RNAi劑在反義股中包括5’-P。
在一個具體例中,RNAi劑包括5’-PS。在一個具體例中,RNAi劑在反義股中包括5’-PS。
在一個具體例中,the RNAi劑包括5’-VP。在一個具體例中,RNAi劑在反義股中包括5’-VP。在一個具體例中,RNAi劑在反義股中包括5’-E-VP。在一個具體例中,RNAi劑在反義股中包括5’-Z-VP。
在一個具體例中,RNAi劑包括5’-PS2。在一個具體例中,RNAi劑在反義股中包括5’-PS2。
在一個具體例中,RNAi劑包括5’-PS2。在一個具體例中,RNAi劑在反義股中包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,,且q7是1。RNAi劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,,且q7是1。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。RNAi劑也包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-
23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有
正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。dsRNA劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q2是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。RNAi劑也包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’
是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,
q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1
和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP。該5’-VP可以是5’-E-VP、5’-Z-VP、或其組合。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS2。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1
和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P和靶向配體。在一個具體例中該5’-P位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS和靶向配體。在一個具體例中該5’-PS位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP(例如5’-E-VP、5’-Z-VP、或其組合),和靶向配體。
在一個具體例中,5’-VP位於反義股5’端,並且靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS2和靶向配體。在一個具體例中,該5’-PS2位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,
B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基和靶向配體。在一個具體例中,該5’-去氧-5’-C-丙二醯基位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P和靶向配體。在一個具體例中該5’-P位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS和靶向配體。在一個具體例中該5’-PS位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2上的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP(例如5’-E-VP、5’-Z-VP、或其組合)和靶向配體。在一個具體例中,該5’-VP位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS2和靶向配體。在一個具體例中,該5’-PS2位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-OMe,且q7是1;具有正義股位置1-
5內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基和靶向配體。在一個具體例中,該5’-去氧-5’-C-丙二醯基位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P和靶向配體。在一個具體例中該5’-P位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑
也包括5’-PS和靶向配體。在一個具體例中該5’-PS位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,q4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2上的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP(例如5’-E-VP、5’-Z-VP、或其組合)和靶向配體。在一個具體例中,該5’-VP位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS2和靶向配體。在一個具體例中,該5’-PS2位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,
q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,T2’是2’-F,q4是2,B3’是2’-OMe或2’-F,q5是5,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基和靶向配體。在一個具體例中,該5’-去氧-5’-C-丙二醯基位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMB,n5是3,e1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-P和靶向配體。在一個具體例中該5’-P位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股
5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS和靶向配體。在一個具體例中該5’-PS位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-VP(例如5’-E-VP、5’-Z-VP、或其組合)和靶向配體。在一個具體例中,該5’-VP位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-PS2和靶向配體。在一個具體例中,該5’-PS2位於反義股5’端,並且該靶向配體位於正義股3’端。
在一個具體例中,B1是2’-OMe或2’-F,n1是8,T1是2’F,n2是3,B2是2’-OMe,n3是7,n4是0,B3是2’-OMe,n5是3,B1’是2’-OMe或2’-F,q1是9,T1’是2’-F,q2是1,B2’是2’-OMe或2’-F,q3是4,q4是0,B3’是2’-OMe或2’-F,q5是7,T3’是2’-F,q6是1,B4’是2’-F,且q7是1;具有正義股位置1-5內(從正義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾,和在位置1和2的二個硫代磷酸酯核苷酸間鍵聯的修飾,以及反義股位置18-23內(從反義股5’端開始計數)的二個硫代磷酸酯核苷酸間鍵聯的修飾。RNAi劑也包括5’-去氧-5’-C-丙二醯基和靶向配體。在一個具體例中,該5’-去氧-5’-C-丙二醯基位於反義股5’端,並且該靶向配體位於正義股3’端。
在一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;以及
(iii)在1、3、5、7、9至11、13、17、19、和21位置的2’-F修飾,和在2、4、6、8、12、14至16、18、和20位置的2’-OMe修飾(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、3、5、9、11至13、15、17、19、21、和23位置的2’-OMe修飾,和在2、4、6至8、10、14、16、18、20、和22位置的2’F修飾(從5’端開始計數);以及
(iii)核苷酸位置21和22之間以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中dsRNA劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1、3、5、7、9至11、13、15、17、19、和21位置的2’-F修飾,和在2、4、6、8、12、14、16、18、和20位置的2’-OMe修飾(從5’端開始計數);以及
(iv)核苷酸位置1和2之間以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、3、5、7、9、11至13、15、17、19、和21至23位置的2’-OMe修飾,和在2、4、6、8、10、14、16、18、和20位置的2’F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1至6、8、10、和12至21位置的2’-OM修飾,在7和9位置的2’-F修飾,以及在11位置的去氧-核苷酸(例如dT)(從5’端開始計數);以及
(iv)核苷酸位置1和2之間以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、3、7、9、11、13、15、17、和19至23位置的2’-OMe修飾,以及在2、4至6、8、10、12、14、16、和18位置的2’-F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1至6、8、10、12、14、和16至21位置的2’-OMe修飾,和在7、9、11、13、和15位置的2’-F修飾;以及
(iv)核苷酸位置1和2之間,以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、5、7、9、11、13、15、17、19、和21至23位置的2’-OMe修飾,和在2至4、6、8、10、12、14、16、18、和20位置的2’-F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1至9、和12至21的2’-OMe修飾,和在10、和11位置的2’-F修飾;以及
(iv)核苷酸位置1和2之間,以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、3、5、7、9、11至13、15、17、19、和21至23位置的2’-OMe修飾,和在2、4、6、8、10、14、16、18、和20位置的2’-F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1、3、5、7、9至11、和13位置的2’-F修飾,和在2、4、6、8、12、和14至21位置的2’-OMe修飾;以及
(iv)核苷酸位置1和2之間以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、3、5至7、9、11至13、15、17至19、和21至23位置的2’-OMe修飾,和在2、4、8、10、14、16、和20位置的2’-F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1、2、4、6、8、12、14、15、17、和19至21位置的2’-OMe修飾,和在3、5、7、9至11、13、16、和18的2’-F修飾;以及
(iv)核苷酸位置1和2之間以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)25個核苷酸的長度;
(ii)在1、4、6、7、9、11至13、15、17、和19至23位置的2’-OMe修飾,在2、3、5、8、10、14、16、和18位置的2’-F修飾,以及在24和25位置的去氧-核苷酸(例如dT)(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有四核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1至6、8、和12至21位置的2’-OMe修飾,和在7、和9至11位置的2’-F
修飾;以及
(iv)核苷酸位置1和2之間以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、3至5、7、8、10至13、15、和17 to 23位置的2’-OMe修飾,和在2、6、9、14、和16位置的2’-F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)21個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1至6、8、和12至21位置的2’-OMe修飾,和7、和9至11位置的2’-F修飾;以及
(iv)核苷酸位置1和2之間以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)23個核苷酸的長度;
(ii)在1、3至5、7、10至13、15、和17至23位置的2’-OMe修飾,和在2、6、8、9、14、和16位置的2’-F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置21和22之間,以及核苷酸位置22和23之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在另一具體例中,本發明的RNAi劑包括:
(a)正義股,其具有:
(i)19個核苷酸的長度;
(ii)附接到3’-端的ASGPR配體,其中該ASGPR配體包括藉由三價分枝鏈接子所附接的三個GalNAc衍生物;
(iii)在1至4、6、和10至19位置的2’-OMe修飾,和在5、和7至9位置的2’-F修飾;以及
(iv)核苷酸位置1和2之間以及核苷酸位置2和3之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
和
(b)反義股,其具有:
(i)21個核苷酸的長度;
(ii)在1、3至5、7、10至13、15、和17至21位置的2’-OMe修飾,和在2、6、8、9、14、和16位置的2’-F修飾(從5’端開始計數);以及
(iii)核苷酸位置1和2之間,核苷酸位置2和3之間,核苷酸位置19和20之間,以及核苷酸位置20和21之間的硫代磷酸酯核苷酸間鍵聯(從5’端開始計數);
其中RNAi劑在反義股3’-端有二核苷酸突出,在反義股5’-端有鈍端。
在一些具體例中,用於本發明之方法中的iRNA是選自表2-11、21、24、27、30、32、33、36、37、49或50中任一表的劑。這些劑可以進一步地包括配體。
III.與配體接合的iRNAs
本發明的iRNA之RNA的另一種修飾涉及將iRNA化學鏈接到可增強iRNA的活性,細胞分佈或細胞攝取(例如進入細胞中)的一個或多個配體、部分體或接合物。這些部分體包含但不限於脂質部分體,例如膽固醇部分體(Letsinger等,Proc.Natl.Acid.Sci.USA,1989,86:6553-6556)。在其他的具體例中,配體是膽酸(Manoharan等,Biorg.Med.Chem.Let.,1994,4:1053-1060),硫醚,例如己基-S-三苯甲硫醇(Manoharan等,Ann.N.Y.Acad.Sci.,1992,660:306-309;Manoharan等,Biorg.Med.Chem.Let.,1993,3:2765-2770),巰基膽固醇(Oberhauser等,Nucl.Acids Res.,1992,20:533-538),脂族鏈,例如,十二烷二醇或十一烷基殘基(Saison-Behmoaras等,EMBO J,1991,10:1111-1118;Kabanov等,FEBS Lett.,1990,259:327-330;Svinarchuk等,Biochimie,1993,75:49-54),磷脂,例如,雙-十六烷基-外消旋-甘油或三乙基-銨,1,2-雙-O-十六烷基-外消旋-甘油-3-膦酸(Manoharan等,Tetrahedron Lett.,1995,36:3651-3654;Shea等,Nucl.Acids Res.,1990,18:3777-3783),多胺或聚乙二醇鏈(Manoharan等,Nucleosides & Nucleotides,1995,14:969-973),或金剛烷乙酸(Manoharan等,Tetrahedron Lett.,1995,36:3651-3654),棕櫚基部分體(Mishra
等,Biochim.Biophys.Acta,1995,1264:229-237),或十八烷胺或己基胺-羰基氧基膽固醇部分體(Crooke等,J.Pharmacol.Exp.Ther.,1996,277:923-937)。
在一些具體例中,配體會改變其併入的iRNA劑的分佈,靶向或壽命。在較佳的具體例中,配體對選定的靶標提供更高的親和力,該靶標例如分子、細胞或細胞類型,區室例如細胞的或器官的區室,身體的組織、器官或區域,好比例如相較於無此配體的物種。較佳的配體不參與雙鏈體核酸中的雙鏈體配對。
配體可包含天然存在的物質,諸如蛋白質(例如,人血清白蛋白(HSA)、低密度脂蛋白(LDL)、或球蛋白);醣類(例如、葡聚醣、普魯蘭多醣、幾丁質、幾丁聚醣、菊糖、環糊精、N-乙醯葡萄糖胺、N-乙醯半乳糖胺、玻尿酸);或脂質。配體也可是重組或合成的分子,諸如合成的聚合物,例如合成的聚胺基酸。聚胺基酸的示例包含聚胺基酸為:聚離胺酸(PLL),聚L-天門冬胺酸;聚L-麩胺酸、苯乙烯-馬來酸酐共聚物、聚(L-乳酸交酯-共-甘醇酸)共聚物、二乙烯醚-馬來酸酐共聚物、N-(2-羥丙基)甲基丙烯醯胺共聚物(HMPA)、聚乙二醇(PEG)、聚乙烯醇(PVA)、聚胺酯、聚(2-乙基丙烯酸)、N-異丙基丙烯醯胺聚合物、或聚磷嗪。聚胺的例子包括:聚乙烯亞胺、聚離胺酸(PLL)、精胺、亞精胺、聚胺、偽肽聚胺、擬肽聚胺、樹枝狀聚胺、精胺酸、脒、魚精蛋白、陽離子脂質、陽離子卟啉、聚胺的四級鹽季鹽或α螺旋肽。
配體還可包含與特定細胞類型(例如腎臟細胞)結合的靶向基團,例如細胞或組織靶向劑,例如凝集素、糖蛋白、脂質或蛋白質,例如抗體。靶向基團可能是:促甲狀腺素、黑促素、凝集素、糖蛋白、表面活性劑蛋白A、黏液素醣類、多價乳糖、多價半乳糖、N-乙醯-半乳糖胺、N-乙醯-葡萄
糖胺、多價甘露糖、多價鹽藻糖、糖基化的聚胺基酸、多價半乳糖、運鐵蛋白、雙膦酸鹽、聚麩胺酸、聚天門東胺酸、脂類、膽固醇、類固醇、膽汁酸、葉酸、維生素B12、維生素A、生物素、或RGD肽或擬RGD肽。在一些具體例中,配體是多價半乳糖,例如,N-乙醯-半乳糖胺。
配體的其他示例包含染料、嵌入劑(例如吖啶)、交聯劑(例如补骨脂素、絲裂黴素C)、卟啉(TPPC4、特沙弗林、噻啉)、多環芳香烴類(例如、吩嗪、二氫吩嗪)、人工的限制性內切酶(例如EDTA)、親脂性分子、例如、膽固醇、膽酸、金剛烷乙酸、1-芘丁酸、二氫睾固酮、1,3-雙-O(十六烷基)甘油、香葉基氧乙基基團、十六烷基甘油、冰片、薄荷醇、1,3-丙二醇、十七烷基基團、棕櫚酸、肉荳蔻酸、O3-(油醯基)石膽酸、O3-(油醯基)膽烯酸、二甲氧基三苯甲基、或吩噁嗪)和肽接合物(例如、觸角足肽、Tat肽)、烷化劑、磷酸、胺、硫醇基、PEG(例如、PEG-40K)、MPEG、[MPEG]2、聚胺基、烷基、取代的烷基、放射性標記的標記物、酶、半抗原(例如生物素)、運輸/吸收促進劑(例如、阿司匹林、維生素E、葉酸)、合成的核糖核酸酶(例如、咪唑、雙咪唑、組織胺、咪唑簇、吖啶-咪唑接合物、四氮雜大環的Eu3+複合體)、二硝基苯基、HRP、或AP。
配體可以是蛋白質,例如糖蛋白,或肽,例如對共配體具有特定親和力的分子,或抗體,例如結合至特定細胞類型(例如肝細胞)的抗體。配體還可以包含激素和激素受體。它們也可以包含非肽類,例如脂質、凝集素、醣類、維生素、輔助因子、多價乳糖、多價半乳糖、N-乙醯基-半乳糖胺、N-乙醯基-葡萄糖胺、多價甘露糖或多價鹽藻糖。配體可以是,例如,脂多醣,其為p38 MAP激酶的活化劑或NF-κB的活化劑。
配體可以是物質,例如藥物,該物質可以,例如藉由破壞細胞的細胞骨架,例如藉由破壞細胞的微管、微絲或中間絲,來增加細胞對iRNA劑的攝取。該藥物可以是例如紫杉醇(taxol)、長春新鹼(vincristine)、長春花鹼(vinblastine)、細胞鬆弛素(cytochalasin)、諾考達唑(nocodazole)、茉莉素(jasplakinolide)、紅海海綿素A(latrunculin A)、蠅虎蕈鹼(phalloidin)、海綿抗菌素(Swinholide A)、茚酮衍生物(indanocine)或邁爾素(myoservin)。
在某些具體例中,如本文所述附接至iRNA的配體充當藥物代謝動力學調節劑(PK調節劑)。PK調節劑包含親脂性的、膽汁酸、類固醇、磷脂類似物、肽、蛋白質結合劑、PEG、維生素等。示例性的PK調節劑包含但不限於膽固醇、脂肪酸、膽酸、石膽酸、二烷基甘油酯、二醯基甘油酯、磷脂、鞘脂、萘普生、布洛芬、維生素E、生物素。包括一些硫代磷酸酯鍵聯的寡核苷酸也已知與血清蛋白質結合,因此,短寡核苷酸,例如約5個鹼基、10個鹼基、15個鹼基或20個鹼基的寡核苷酸,包括主鏈中的多個硫代磷酸酯鍵聯也適合作為本發明的配體(例如作為PK調節劑配體)。另外,結合血清組分(例如血清蛋白)的適體也適合用作本文所述具體例中的PK調節劑配體。
本發明的配體-接合的iRNA可以藉由使用具有側鏈反應官能性的寡核苷酸來合成,例如衍生自鏈接分子與前述寡核苷酸的附接(如下所述)。該反應性寡核苷酸可以與下列配體直接反應:市售的配體,帶有任何一種保護基團的合成配體,或具有附接其上的鏈接部分體的配體。
本發明的接合物中所使用的寡核苷酸可以藉由眾所周知的固相合成技術方便且常規地製備。用於這種合成的設備由包含例如應用生物系統公司/Applied Biosystems®(Foster City,Calif.,美國)在內的一些供應商出售。可以
額外地或替代地採用本領域已知的用於這種合成的任何其他方法。還已知使用類似的技術來製備其他寡核苷酸,諸如硫代磷酸酯和烷基化的衍生物。
在本發明的與配體接合的iRNA和帶有序列特異性鏈接的配體分子的核苷中,寡核苷酸和寡核苷可以在合適的DNA合成儀上使用如下物質組裝:標準的核苷酸或核苷的前體,或已帶有鏈接部分體的核苷酸接合前體或核苷接合前體,或已帶有配體分子或已帶有非核苷配體結構單元的配體-核苷酸前體或核苷接合前體。
當使用已帶有鏈接部分體的核苷酸接合前體時,通常序列特異性鏈接之核苷的合成已經完成,然後使配體分子與該鏈接部分體反應而形成與配體接合的寡核苷酸。在某些具體例中,本發明的寡核苷酸或鏈接的核苷由自動合成儀合成,除了使用市售和常用的標準亞磷醯胺和非標準亞磷醯胺之外,還使用衍生自配體-核苷接合物的亞磷醯胺。
A.脂質接合物
在一些具體例中,配體或接合物是脂質或基於脂質的分子。這樣的脂質或基於脂質的分子較佳地結合血清蛋白質,例如人血清白蛋白(HSA)。HSA與配體的結合允許接合物分佈至靶組織,例如身體的非腎臟靶組織。例如,靶組織可以是肝臟,包含肝臟的實質細胞。能結合HSA的其他分子也可能用作配體。例如,可使用萘普生或阿司匹林。脂質或基於脂質的配體可(a)增加對接合物之降解的抗性,(b)增加到靶細胞中或細胞膜中的靶向或轉運,或(c)可用於調節與血清蛋白質的結合,例如,HSA。
基於脂質的配體可用於抑制,例如控制接合物與靶組織的結合。例如,與HSA更牢固結合的脂質或基於脂質的配體將不太可能被靶向至腎
臟,因此也不太可能從體內被清除。與HSA結合強度較弱的脂質或基於脂質的配體可用於將接合物靶向至腎臟。
在一些具體例中,基於脂質的配體結合HSA。較佳地,其以足夠的親和力結合HSA,使得接合物將較佳地分佈至非腎臟組織。然而,較佳地,親和力不至於強到HSA-配體之結合不能被逆轉的程度。
在其他具體例中,基於脂質的配體微弱地結合或根本不結合HSA,使得接合物將較佳地分佈至腎臟。也可以使用靶向腎臟細胞的其他部分體代替基於脂質的配體,或與其一同使用。
在另一個態樣中,配體是部分體,例如增殖中細胞,所攝取的部分體,例如維生素。這些對於治療特徵在於多餘的細胞增殖的疾病特別有用,例如惡性或非惡性類型的,例如癌細胞。示例性的維生素包含維生素A,E和K。其他示例性的維生素包含B族維生素,例如葉酸、B12、核黃素、生物素、吡哆醛或其他被靶細胞,諸如肝細胞,所吸收的維生素或營養素。HSA和低密度脂蛋白(LDL)也包含在內。
B.細胞滲透劑
在另一個態樣中,配體是細胞滲透劑,較佳地是螺旋細胞滲透劑。較佳地,該試劑是兩親性的。示例性的劑是肽,例如tat或觸角足(antennapedia)。如果試劑是肽,則可以對其修飾,包含肽基模擬物,反轉異構體,非肽或偽肽鍵聯,以及D-胺基酸的使用。螺旋劑較佳地是α-螺旋劑,其較佳地具有親脂相和疏脂相。
配體可以是肽或擬肽。擬肽(在本文中也被稱為擬寡肽)是一種能夠折疊成類似於天然肽的限定的三維結構的分子。肽和擬肽與iRNA試劑的
附接可以影響iRNA的藥物代謝動力學分佈,諸如藉由增強細胞識別和吸收。肽或擬肽部分體可以長約5-50個胺基酸,例如長約5、10、15、20、25、30、35、40、45、或50個胺基酸。
肽或擬肽可以是,例如細胞滲透肽、陽離子肽、兩親性肽或疏水性肽(例如,主要由Tyr,Trp或Phe組成)。肽部分體可以是樹枝狀聚合肽、受限的肽或交聯的肽。在另一個替代方案中,肽部分體可以包含疏水性膜轉運序列(MTS)。示例性的含有疏水性MTS的肽是具有胺基酸序列AAVALLPAVLLALLAP(SEQ ID NO:14)的RFGF。含有疏水性MTS的RFGF類似物(例如,胺基酸序列AALLPVLLAAP(SEQ ID NO:15))也可以是靶向部分體。該肽部分體可以是“遞送”肽,其可以攜帶大的有極分子,包含肽,寡核苷酸,和橫跨細胞膜的蛋白質。例如,已發現HIV Tat蛋白(GRKKRRQRRRPPQ(SEQ ID NO:16))和果蠅觸角足蛋白(RQIKIWFQNRRMKWKK(SEQ ID NO:17))的序列能夠作為傳遞肽。肽或擬肽可由隨機DNA序列編碼,諸如從噬菌體展示文庫或一珠一化合物(OBOC)組合文庫(Lam等,Nature,354:82-84,1991)中所鑑別出來的肽。經由併入的單體單元與dsRNA劑連繫在一起以達到細胞靶向目的的示例性的肽或擬肽為精胺酸-甘胺酸-天門冬胺酸(RGD)-肽,或RGD模擬物。肽部分體的長度可以在約5個胺基酸至約40個胺基酸的範圍內。該肽部分體可以具有結構性的修飾,諸如為了增加穩定性或導引構象特性。可以使用以下描述的任何結構性的修飾。
用於本發明的組成物和方法中的RGD肽可以是線性或環狀的,並且可以被修飾,例如糖基化或甲基化,以促進對特定組織的靶向。含有RGD的肽和擬肽可以包含D-胺基酸,以及合成的RGD模擬物。除RGD外,還可以使
用靶向整合素配體的其他部分體。此配體的較佳接合物靶向PECAM-1或VEGF。
“細胞滲透肽”能夠滲透細胞,例如微生物細胞,諸如細菌或真菌細胞,或哺乳動物細胞,諸如人細胞。微生物細胞的滲透肽可以是,例如,α-螺旋線性肽(例如,LL-37或天蠶素P1)、含有二硫鍵的肽(例如,α-防禦素,β-防禦素或抗菌肽)、或含有僅一個或二個居支配地位胺基酸的肽(例如PR-39或吲哚西丁)。細胞滲透肽也可以包含核定位信號(NLS)。例如,細胞滲透肽可以是二分兩親性肽,諸如MPG,其衍生自HIV-1 gp41和SV40大T抗原的NLS的融合肽結構域(Simeoni et al.,Nucl.Acids Res.31:2717-2724,2003)。
C.醣類接合物
在本發明的組合物和方法的一些具體例中,iRNA進一步地包括醣類。如本文所述,接合有醣類的iRNA有利於核酸的體內遞送,也是適合於體內治療用途的組成物。如本文所用,“醣類”係指化合物,其本身由一個或多個單糖單元組成的碳水化合物,其中單糖單元具有至少6個碳原子(可以是線性,分枝或環狀),而其中每個碳原子都與氧、氮或硫原子鍵結;或係指化合物,其具有多醣部分體作為其一部分,該部分體由一個或多個單糖單元組成,其中每個單醣單元具有至少6個碳原子(可以是線性,分枝或環狀),而其中每個碳原子都與氧、氮或硫原子鍵結。代表性的醣類包含糖(含有約4、5、6、7、8或9個單醣單元的單糖、二醣、三醣和寡醣),和多醣,諸如澱粉、糖原、纖維素和多醣膠。特定的單糖包含C5和以上(例如C5,C6,C7或C8)
糖;二醣和三醣包含具有二個或三個單醣單元(例如C5,C6,C7或C8)的糖。
在一些具體例中,用於本發明的組成物和方法中的醣類接合物是單醣。
在一些具體例中,單醣是N-乙醯半乳糖胺(GalNAc)。包括一種或多種N-乙醯基半乳糖胺(GalNAc)衍生物的GalNAc接合物在例如US 8,106,022中被描述,其全部內容在此藉由引用併入本文。在某些具體例中,GalNAc接合物充當將iRNA靶向到特定細胞的配體。在某些具體例中,GalNAc接合物將iRNA靶向到肝細胞,例如藉由充當肝臟細胞(例如肝細胞)的去唾液酸糖蛋白受體的配體。
在某些具體例中,醣類接合物包括一種或多種GalNAc衍生物。GalNAc衍生物可以經由鏈接子,例如二價或三價分枝鏈接子被附接。在一些具體例中,GalNAc接合物是被接合至正義股的3'端。在某些具體例中,GalNAc接合物是經由鏈接子,例如本文所述的鏈接子,接合到iRNA劑(例如,到正義股的3'端)。在一些具體例中,GalNAc接合物是被接合至正義股的5'端。在某些具體例中,GalNAc接合物是經由鏈接子,例如本文所述的鏈接子,接合到iRNA劑上(例如,到正義股的5'端)。
在本發明的某些特定具體例中,GalNAc或GalNAc衍生物是經由單價鏈接子被附接至本發明的iRNA劑。在某些具體例中,GalNAc或GalNAc衍生物是經由二價鏈接子被附接至本發明的iRNA劑。在本發明的其他具體例中,GalNAc或GalNAc衍生物是經由三價鏈接子被附接至本發明的iRNA劑。在本發
明的其他具體例中,GalNAc或GalNAc衍生物是經由四價鏈接子被附接至本發明的iRNA劑。
在具體例中,本發明的雙股RNAi劑包括一附接到iRNA劑的GalNAc或GalNAc衍生物。在一些具體例中,本發明的雙股RNAi劑包括多個(例如2、3、4、5或6個)GalNAc或GalNAc衍生物,其每個都獨立地,藉由多個單價鏈接子,附接到雙股RNAi劑的多個核苷酸上。
在某些具體例中,例如,當本發明的iRNA劑的二股是一較大分子的一部分,且該較大分子是藉由一股3’-端與另一股5’-端之間的不間斷的核苷酸鏈連接而形成髮夾環圈,而該髮夾環圈包括多個未配對的核苷酸時,髮夾環圈內的每個未配對的核苷酸可以獨立地包括經單價鏈接子附接的GalNAc或GalNAc衍生物。髮夾環圈也可以由雙鏈體的一股的延伸突出形成。
在某些具體例中,例如,當本發明的iRNA劑的二股是一較大分子的一部分,且該較大分子是藉由一股3’-端與另一股5’-端之間的不間斷的核苷酸鏈連接而形成髮夾環圈,而該髮夾環圈包括多個未配對的核苷酸時,髮夾環圈內的每個未配對的核苷酸可以獨立地包括經單價鏈接子附接的GalNAc或GalNAc衍生物。髮夾環圈也可以由雙鏈體的一股的延伸突出形成。
在一個具體例中,用於本發明的組成物和方法中的醣類接合物是選自下列物質所組成的群組:
在另一個具體例中,用於本發明的組成物和方法中的醣類接合物是單醣。在一個具體例中,單醣是N-乙醯半乳糖胺,諸如
在某些具體例中,如下方案所示,RNAi劑藉由鏈接子被附接到醣類接合物,其中X是O或S
在某些具體例中,如下所示,RNAi劑被接合到如表1中所定義的L96:
用於本文所述具體例中的另一代表性醣類接合物包含但不限於,
(式XXXVI),當X或Y中之一為寡核苷酸,另一個為氫。
在某些具體例中,合適的配體是WO 2019/055633中所揭露的配體,其全部內容藉由引用在此併入本文。在一個具體例中,配體包括以下結構:
在本發明的某些特定具體例中,GalNAc或GalNAc衍生物是經由單價鏈接子被附接至本發明的iRNA劑。在某些具體例中,GalNAc或GalNAc衍生物是經由二價鏈接子被附接至本發明的iRNA劑。在本發明的其他具體例中,GalNAc或GalNAc衍生物是經由三價鏈接子被附接至本發明的iRNA劑。
在一個具體例中,本發明的雙股RNAi劑包括一個或多個附接到iRNA劑的GalNAc或GalNAc衍生物。GalNAc可以經由正義股或反義股上的鏈接子附接到任何核苷酸。GalNac可以被附接到正義股的5’端,正義股的3'端,反義股的5'端或反義股的3'端。在一個具體例中,例如,經三價鏈接子將GalNAc附接至正義股的3'端。
在其他具體例中,本發明的雙股RNAi劑包括多個(例如2、3、4、5或6個)GalNAc或GalNAc衍生物,其每個都獨立地,藉由多個鏈接子例如單價鏈接子,被附接至雙股RNAi劑的多個核苷酸。
在某些具體例中,例如,當本發明的iRNA劑的二股是一較大分子的一部分,且該較大分子是藉由一股3’-端與另一股5’-端之間的不間斷的核苷酸鏈連接而形成髮夾環圈,而該髮夾環圈包括多個未配對的核苷酸時,髮夾環圈內的每個未配對的核苷酸可以獨立地包括經由單價鏈接子附接的GalNAc或GalNAc衍生物。
在某些具體例中,醣類接合物進一步地包括如上所述的一種或多種另外的配體,諸如但不限於,PK調節劑或細胞滲透肽。
適用於本發明的其他醣類接合物和鏈接子包含那些在PCT公開案WO 2014/179620和WO 2014/179627中描述的,其各自的全部內容藉由引用在此併入本文。
D.鏈接子
在某些具體例中,本文所述的接合物或配體可以藉由可裂解或不可裂解的各種鏈接子附接至iRNA寡核苷酸。
術語“鏈接子”或“鏈接基團”是指連接化合物的二個部分,例如共價地附接化合物的二個部分,有機部分體。鏈接子通常包括直接鍵結或原子諸如氧或硫,單元例如NR8、C(O)、C(O)NH、SO、SO2、SO2NH或原子鏈,諸如但不限於,取代的或未取代的烷基、取代的或未取代的烯基、取代的或未取代的炔基、芳基烷基、芳基烯基、芳基炔基、雜芳基烷基、雜芳基烯基、雜芳基炔基、雜環基烷基、雜環基烯基、雜環基炔基、芳基、雜芳基、雜環基、環烷基、環烯基、烷基芳基烷基、烷基芳基烯基、烷基芳基炔基、烯基芳基烷基、烯基芳基烯基、烯基芳基炔基、炔基芳基烷基、炔基芳基烯基、炔基芳基
炔基、烷基雜芳基烷基、烷基雜芳基烯基、烷基雜芳基炔基、烯基雜芳基烷基、烯基雜芳基烯基、烯基雜芳基炔基、炔基雜芳基烷基、炔基雜芳基烯基、炔基雜芳基炔基、烷基雜環基烷基、烷基雜環基烯基、烷基雜環基炔基、烯基雜環基烷基、烯基雜環基烯基、烯基雜環基炔基、炔基雜環基烷基、炔基雜環基烯基、炔基雜環基炔基、烷基芳基、烯基芳基、炔基芳基、烷基雜芳基、烯基雜芳基、炔基雜芳基,其中一個或多個亞甲基可以被如下基團所中斷或終止:O、S、S(O)、SO2、N(R8)、C(O)、取代的或未取代的芳基、取代的或未取代的雜芳基,或取代的或未取代的雜環基;其中R8是氫、醯基、脂肪族或取代的脂肪族。在一個具體例中,該鏈接子為約1-24個原子,2-24、3-24、4-24、5-24、6-24、6-18、7-18、8-18、7-17、8-17、6-16、7-17、或8-16原子。
可裂解的鏈接基團是一種在細胞外足夠穩定的基團,但是在進入靶細胞時,該基團被裂解以釋放被鏈接子保持在一起的二個部分。在一個較佳的具體例中,在靶細胞中或在第一參考條件下(例如,其可以被選擇來模擬或代表細胞內之條件),相比在受試者血液中或在第二參考條件下(例如,其可以被選擇來模擬或代表血液或血清中所發現之條件),前述可裂解的鏈接基團被裂解的速度至少快約10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或更高、或至少100倍。
可裂解的鏈接基團易於受裂解劑的影響,例如pH,、氧化還原電位、或降解分子的存在。一般地,與血清或血液相比,在細胞內發現的裂解劑更普遍或其量級或活性更高。這類降解劑的例子包含:為特定受質所選擇的或沒有受質特異性的氧化還原劑,包含,例如存在於細胞中的氧化酶或還原酶或還原劑,例如硫醇,其能藉由還原作用降解一氧化還原可裂解的鏈接基團;
酯酶;能產生酸性環境的胞內體或劑,例如導致pH值等於或低於5的那些胞內體或劑;藉由充當一般的酸,肽酶(可以是受質特異性的)和磷酸酶來水解或降解一酸可裂解的鏈接基團的酶。
可裂解的鏈接基團,諸如二硫鍵可能對pH敏感。人血清的pH值為7.4,而平均的細胞內pH值則略低一些,其範圍約為7.1-7.3。胞內體的酸性高一些,其範圍約為5.5-6.0,而溶體的酸性更高,約為5.0。一些鏈接子將具有可裂解的鏈接基團,其在較佳的pH被裂解,從而將陽離子脂質從細胞內的配體釋放出來,或將其釋放進入所期望的細胞區室內。
鏈接子可包含可被特定酶裂解的可裂解的鏈接基團。結合到鏈接子中的可裂解的鏈接基團之類型可以取決於要靶向的細胞。例如,靶向肝的配體可以藉由包含酯基團的鏈接子與陽離子脂質鏈接。肝臟細胞富含酯醇,因此與不富含酯酶的細胞類型相比,該鏈接子在肝細胞中的被裂解效率更高。其他富含酯酶的細胞類型包含肺、腎皮質和睾丸的細胞。
當靶向富含肽酶的細胞類型時,諸如肝臟細胞和滑膜細胞,可以使用含有肽鍵的鏈接子。
通常,候選可裂解鏈接基團的適用性可藉由測試降解劑(或條件)裂解候選鏈接基團的能力來評估。亦期望也測試候選可裂解鏈接基團在血液中或與其他非靶組織接觸時抵抗裂解的能力。因此,人們可以確定第一條件和第二條件之間的對裂解的相對敏感性,其中選擇第一個條件以指示靶細胞中的裂解,而選擇第二個條件以指示其他組織或生物液中的裂解,例如血液或血清。評估可以在無細胞系統中、在細胞中、在細胞培養中、在器官或組織培養中、或在整個動物中完成。在無細胞或培養條件下進行初步評估,並藉由在整
個動物中的進一步評估進行確認,可能是很有用的。在較佳的具體例中,與血液或血清相比(或在被選用以模擬細胞外條件的體外條件下),有用的候選化合物在細胞中(或在被選用以模擬細胞內條件的體外條件下)的被裂解速度至少快約2、4、10、20、30、40、50、60、70、80、90、或100倍。
i.氧化還原可裂解鏈接基團
在一些具體例中,可裂解的鏈接基團是在還原或氧化時被裂解的氧化還原可裂解的鏈接基團。還原性可裂解的鏈接基團的一個示例是二硫化物鏈接基團(-S-S-)。為了確定候選可裂解的鏈接基團是合適的“還原性可裂解的鏈接基團”,或例如適合與iRNA部分體和靶向劑一起使用,可參見本文所述的方法。例如,可以藉由使用本領域已知的試劑與二硫蘇糖醇(DTT)或其他還原劑一起孵育來評估候選物,所述試劑模仿在細胞中,例如靶細胞,所觀察到的裂解速率。還可以在被用以模擬血液或血清條件的條件下評估候選物。在一種方法中,在血液中候選化合物的被裂解率最高約為10%。在其他具體例中,與血液相比(或在被選用以模擬細胞外條件的體外條件下),有用的候選化合物在細胞中(或在被選用以模擬細胞內條件的體外條件下)降解速度至少快約2、4、10、20、30、40、50、60、70、80、90、或約100倍。可以在選定以模擬細胞內介質的條件下,使用標準酶動力學測定法以確定候選化合物的裂解速率,並與選定以模擬細胞外介質的條件進行比較。
ii.磷酸系可裂解的鏈接基團
在其他具體例中,可裂解的鏈接子包括磷酸系可裂解的鏈接基團。磷酸系可裂解的鏈接基團是被降解或水解磷酸基團的劑所裂解。在細胞中裂解磷酸基團的劑的示例是酶,例如細胞中的磷酸酶。磷酸系可裂解的鏈接基團的示例是:-O-P(O)(ORk)-O-、-O-P(S)(ORk)-O-、-O-P(S)(SRk)-O-、-S-P(O)(ORk)-O-、-O-P(O)(ORk)-S-、-S-P(O)(ORk)-S-、-O-P(S)(ORk)-S-、-S-P(S)(ORk)-O-、-O-P(O)(Rk)-O-、-O-P(S)(Rk)-O-、-S-P(O)(Rk)-O-、-S-P(S)(Rk)-O-、-S-P(O)(Rk)-S-、-O-P(S)(Rk)-S-。較佳的具體例為:-O-P(O)(OH)-O-、-O-P(S)(OH)-O-、-O-P(S)(SH)-O-、-S-P(O)(OH)-O-、-O-P(O)(OH)-S-、-S-P(O)(OH)-S-、-O-P(S)(OH)-S-、-S-P(S)(OH)-O-、-O-P(O)(H)-O-、-O-P(S)(H)-O-、-S-P(O)(H)-O、-S-P(S)(H)-O-、-S-P(O)(H)-S-、以及-O-P(S)(H)-S-。一個較佳的具體例是-O-P(O)(OH)-O-。可以使用類似於上述方法的方法評估這些候選物。
iii.酸可裂解的鏈接基團
在其他具體例中,可裂解的鏈接子包括酸可裂解的鏈接基團。酸可裂解的鏈接基團是在酸性條件下被裂解的鏈接基團。在較佳的具體例中,酸可裂解的鏈接基團在pH約6.5或更低(例如約6.0、5.5、5.0、或更低)的酸性環境中被裂解,或者,被諸如酶的劑所裂解,該酶可以充當一般的酸。在細胞中,低pH細胞器,諸如胞內體和溶體,可以為酸可裂解的鏈接基團提供裂解環境。酸可裂解的鏈接基團的示例包含但不限於:腙、酯,以及胺基酸的酯。酸可裂解的基團可具有一般式-C=NN-、C(O)O、或-OC(O)。一較佳的具體例為:當與酯(烷氧基)的氧所附接的碳是芳基基團時,取代的烷基基團,或叔
烷基基團是諸如二甲基戊基或叔丁基。可以使用類似於上述方法的方法評估這些候選物。
iv.酯系可裂解的鏈接基團
在其他具體例中,可裂解的鏈接子包括酯系可裂解的鏈接基團。酯系可裂解的鏈接基團是被細胞中的酶,諸如酯酶和醯胺酶,所裂解。酯系可裂解的鏈接基團的示例包含但不限於,伸烷基基團、伸烯基基團和伸炔基基團的酯。酯系可裂解的鏈接基團具有一般式-C(O)O-或-OC(O)-。可以使用類似於上述方法的方法評估這些候選物。
v.肽系可裂解的鏈接基團
在其他具體例中,可裂解的鏈接子包括肽系可裂解的鏈接基團。肽系可裂解的鏈接基團是被細胞中的酶,諸如肽酶和蛋白酶,所裂解。肽系可裂解的鏈接基團是在胺基酸之間所形成的肽鍵,其可產出寡肽(例如,二肽、三肽等)和多肽。基於肽的可裂解的基團不包含醯胺基團(-C(O)NH-)。醯胺基團可在任何伸烷、伸烯或伸炔之間形成。肽鍵是胺基酸之間所形成的特殊類型的醯胺鍵,其可產出肽和蛋白質。基於肽的可裂解的基團通常限於產出肽和蛋白質的胺基酸之間所形成的肽鍵(即醯胺鍵),而並不包含整個醯胺官能基。基於肽的可裂解的鏈接基團的一般式為-NHCHRAC(O)NHCHRBC(O)-,其中RA和RB是二個相鄰胺基酸的R基團。可以使用類似於上述方法的方法評估這些候選物。
在某些具體例中,本發明的iRNA藉由鏈接子與醣類接合。本發明的組成物和方法的具有鏈接子的iRNA醣類接合物的非限制性示例包含但不限於,
(式XLIV),當X或Y中之一為寡核苷酸,另一個為氫。
在本發明的組成物和方法的某些特定具體例中,配體是藉由二價或三價分枝鏈接子被附接的一個或多個“GalNAc”(N-乙醯半乳糖胺)衍生物。
在一個具體例中,本發明的dsRNA是被接合到二價或三價分枝鏈接子,其選自含有式(XLV)-(XLVI)中任一所示結構之群組:
其中:
q2A、q2B、q3A、q3B、q4A、q4B、q5A、q5B和q5C對每次出現獨立地代表0-20中的一個,並且其中的重複單元可以相同或不同;
P2A、P2B、P3A、P3B、P4A、P4B、P5A、P5B、P5C、T2A、T2B、T3A、T3B、T4A、T4B、T4A、T5B、T5C對每次出現各自獨立地代表下述之一:不存在、CO、NH、O、S、OC(O)、NHC(O)、CH2、CH2NH或CH2O;
Q2A、Q2B、Q3A、Q3B、Q4A、Q4B、Q5A、Q5B、Q5C對每次出現獨立地代表下述之一:不存在、伸烷基、取代的伸烷基,其中一個或多個亞甲基
可以被如下一個或多個基團所中斷或終止,O、S、S(O)、SO2、N(RN)、C(R’)=C(R”)、C≡C or C(O);
R2A、R2B、R3A、R3B、R4A、R4B、R5A、R5B、R5C對每次出現各自獨立地代表下述之一:不存在、NH、O、S、CH2、C(O)O、C(O)NH、NHCH(Ra)C(O)、-C(O)-CH(Ra)-NH-、CO、CH=N-O、、、、,或雜環基;
L2A、L2B、L3A、L3B、L4A、L4B、L5A、L5B和L5C代表配體;即對每次出現各自獨立地為:單糖(諸如GalNAc)、二醣、三醣、四醣、寡醣、或多醣;並且Ra是H或胺基酸側鏈。三價接合的GalNAc衍生物與RNAi劑一起使用對於抑制靶基因的表達是特別有用的,例如式(XLIX)的那些:
其中L5A、L5B和L5C代表單糖,諸如GalNAc衍生物。
合適的二價或三價分枝鏈接子基團接合的GalNAc衍生物的示例,包含但不限於,上面所列舉的結構如式II、VII、XI、X、和XIII。
教示了RNA接合物的製備的代表性專利包含但不限於,美國專利4,828,979;4,948,882;5,218,105;5,525,465;5,541,313;5,545,730;5,552,538;5,578,717,5,580,731;5,591,584;5,109,124;5,118,802;
5,138,045;5,414,077;5,486,603;5,512,439;5,578,718;5,608,046;4,587,044;4,605,735;4,667,025;4,762,779;4,789,737;4,824,941;4,835,263;4,876,335;4,904,582;4,958,013;5,082,830;5,112,963;5,214,136;5,082,830;5,112,963;5,214,136;5,245,022;5,254,469;5,258,506;5,262,536;5,272,250;5,292,873;5,317,098;5,371,241,5,391,723;5,416,203,5,451,463;5,510,475;5,512,667;5,514,785;5,565,552;5,567,810;5,574,142;5,585,481;5,587,371;5,595,726;5,597,696;5,599,923;5,599,928;5,688,941;6,294,664;6,320,017;6,576,752;6,783,931;6,900,297;7,037,646;和8,106,022,在此藉由引用將其每個的全部內容並入本文。
給定化合物中的所有位置不必統一地被修飾,並且實際上可以將一個以上的上述修飾併入單個化合物中或甚至併入到iRNA的單個核苷。本發明還包含作為嵌合化合物的iRNA化合物。
“嵌合的”iRNA化合物或“嵌合體”,在本發明的上下文中,是iRNA化合物,較佳為dsRNAi劑,其含有二個或更多個化學上不同的區域,且每個區域由至少一個單體單元組成,即在dsRNA化合物的情況下單體單元則為核苷酸。
這些iRNA通常含有至少一個區域,其中RNA被修飾以賦予iRNA對核酸酶降解的抵抗力增加,細胞攝取增加,或對靶核酸的結合親和力增加。iRNA的另一區域可以充當能夠裂解RNA:DNA或RNA:RNA雜合體的酶的受質。舉例來說,RNase H是裂解RNA:DNA雙鏈體之RNA股的細胞的核酸內切酶。因此,RNase H的活化導致RNA靶標的裂解,從而大幅提高了iRNA抑制基
因表達的效率。所以,和與相同靶區域雜合的硫代磷酸酯去氧dsRNA相比,當使用嵌合dsRNA時,通常可以用較短的iRNA獲得可媲美的結果。RNA靶標的裂解可以藉由凝膠電泳和本領域已知的相關核酸雜合技術(如果需要)常規地檢測。
在某些特定情況下,iRNA的RNA可以被非配體基團所修飾。為了增強iRNA的活性、細胞分佈或細胞攝取,已經將一些非配體分子接合到iRNA上,並且執行這種接合的流程在科學文獻中是可得的。此種非配體部分體包含脂質部分體,諸如膽固醇(Kubo,T.等,Biochem.Biophys.Res.Comm.,2007,365(1):54-61;Letsinger等,Proc.Natl.Acad.Sci.USA,1989,86:6553),膽酸(Manoharan等,Bioorg.Med.Chem.Lett.,1994,4:1053),硫醚,例如,己基-S-三苯甲硫醇(Manoharan等,Ann.N.Y.Acad.Sci.,1992,660:306;Manoharan等,Bioorg.Med.Chem.Let.,1993,3:2765),巰基膽固醇(Oberhauser等,Nucl.Acids Res.,1992,20:533),脂肪族鏈,例如,十二烷二醇或十一烷基殘基(Saison-Behmoaras等,EMBO J.,1991,10:111;Kabanov等,FEBS Lett.,1990,259:327;Svinarchuk等,Biochimie,1993,75:49),磷脂,例如,雙-十六烷基-外消旋-甘油或三乙基銨1,2-雙-O-十六烷基-外消旋-甘油-3-H-膦酸(Manoharan等,Tetrahedron Lett.,1995,36:3651;Shea等,Nucl.Acids Res.,1990,18:3777),聚胺或聚乙二醇鏈(Mahoharan等,Nucleosides & Nucleotides,1995,14:969),或金剛烷乙酸(Manoharan等,Tetrahedron Lett.,1995,36:3651),棕櫚基部分體(Mishra等,Biochim.Biophys.Acta,1995,1264:229),或十八烷胺或己基胺-羰基-氧基膽固醇部分體(Crooke等,J.Pharmacol.Exp.Ther.,1996,277:923)。上面列出了教示製備此類RNA接合物的代表性美國專利。典型的接合方案涉及在序列的一個
或多個位置帶有胺基鏈接子之RNA的合成。然後使用適當的耦合劑或活化劑使胺基基團與將被接合的分子反應。接合反應可以用仍與固相支持物結合的RNA來執行,也可以在RNA裂解之後的液相中執行。以HPLC純化RNA接合物通常會給出純的接合物。
IV.本發明的iRNA的遞送
將本發明的iRNA遞送至細胞,例如受試者體內的細胞,諸如人受試者(例如,其中有需要的受試者,例如易受或已診斷為PNPLA3相關病症的受試者,例如NAFLD)可以藉由一些不同方式來實現。例如,在體外或在體內使細胞與本發明的iRNA接觸來執行遞送。體內遞送也可以藉由給受試者施用包括iRNA(例如dsRNA)的組成物來直接執行。或者,體內遞送可以藉由施用一種或多種編碼並導引iRNA表達的載體來間接執行。這些替代方案會在下面進一步討論。
一般而言,任何遞送核酸分子(體外或體內)的方法均可被調試為用於本發明的iRNA(參見例如Akhtar S.和Julian RL.(1992)Trends Cell.Biol.2(5):139-144以及WO94/02595,其全部內容在此藉由引用併入本文)。對於體內遞送,為了遞送iRNA分子而要考慮的因素包含,例如,所遞送的分子的生物穩定性、非特異性效應的防止、以及靶組織中所遞送的分子的積累。也已經顯示了藉由直接注射而將RNA干擾成功局部遞送至CNS(Dorn,G.,et al.(2004)Nucleic Acids 32:e49;Tan,PH.,等(2005)Gene Ther.12:59-66;Makimura,H.,等(2002)BMC Neurosci.3:18;Shishkina,GT.,等(2004)Neuroscience 129:521-528;Thakker,ER.,等(2004)Proc.Natl.Acad.Sci.U.S.A.101:17270-17275;Akaneya,Y.,等(2005)J.Neurophysiol.93:594-602)。RNA或藥物載體的修飾亦
可以允許將iRNA靶向到靶組織並避免不良的脫靶效應。iRNA分子可藉由化學接合至親脂性基團(諸如膽固醇)被修飾,以增強細胞攝取和防止降解。例如,將與親脂性膽固醇部分體接合的導向針對ApoB的iRNA全身性注射到小鼠中,而導致肝臟和空腸中apoB mRNA的基因減弱(Soutschek,J.,等(2004)Nature 432:173-178)。
在一個替代具體例中,iRNA可以使用藥物遞送系統來遞送,諸如奈米粒子、樹枝狀聚合物、共聚物、微脂體或陽離子遞送系統。帶正電荷的陽離子遞送系統可促進iRNA分子(帶負電荷)的結合,並在帶負電荷的細胞膜處增強相互作用從而允許細胞對iRNA的有效攝取。陽離子脂質、樹枝狀聚合物、或共聚物可與iRNA相結合,或被誘導以形成包住iRNA的囊泡或微胞(參見例如,Kim SH,等(2008)Journal of Controlled Release 129(2):107-116)。當其被全身施用時,囊泡或微胞的形成進一步防止了iRNA的降解。製備和施用陽離子-iRNA複合體的方法完全在所屬技術領域者的能力範圍內(參見例如,Sorensen,DR,等(2003)J.Mol.Biol 327:761-766;Verma,UN,等(2003)Clin.Cancer Res.9:1291-1300;Arnold,AS等(2007)J.Hypertens.25:197-205,其全部內容在此藉由引用併入本文)。可用於iRNA的系統遞送的藥物遞送系統的一些非限制性示例包含DOTAP(Sorensen,DR.,等(2003),同上;Verma,UN,等(2003),同上),“固體核酸脂質粒子”(Zimmermann,TS,等(2006)Nature 441:111-114),心磷脂(Chien,PY,等(2005)Cancer Gene Ther.12:321-328;Pal,A,等(2005)Int J.Oncol.26:1087-1091),聚乙烯亞胺(Bonnet ME,等(2008)Pharm.Res.Aug 16電子提前出版;Aigner,A.(2006)J.Biomed.Biotechnol.71659),精胺酸-甘胺酸-天門冬胺酸/Arg-Gly-Asp(RGD)肽(Liu,S.(2006)
Mol.Pharm.3:472-487)和聚醯胺基胺(Tomalia,DA,等(2007)Biochem.Soc.Trans.35:61-67;Yoo,H.,等(1999)Pharm.Res.16:1799-1804)。在某些具體例中,iRNA與環糊精形成用於全身給藥的複合體。iRNA的給藥方法和醫藥組成物和環糊精可見於美國專利7,427,605,其全部內容在此藉由引用併入本文。
A.編碼本發明iRNA的載體
靶向PNPLA3基因的iRNA可以從插入到DNA或RNA載體中的轉錄單元表達(參見例如Couture,A,等,TIG.(1996),12:5-10;Skillern,A,等,國際PCT出版物No.WO 00/22113,Conrad,國際PCT出版物No.WO 00/22114,和Conrad,美國專利No.6,054,299)。表達可以是瞬時的(等級為數小時至數週)或持續的(數週至數月或更長),取決於所用的特定構建體和靶組織或細胞類型。這些轉基因可能以線性構建體、環狀質粒、或病毒載體引入,其可以是整合性或非整合性的載體。還可以構建轉基因以允許其作為染色體外質粒而被遺傳(Gassmann,等.,Proc.Natl.Acad.Sci.USA(1995)92:1292)。
可以用於本文所述的方法和組成物的病毒性載體系統包含但不限於:(a)腺病毒載體;(b)反轉錄病毒載體,包含但不限於慢病毒載體,莫洛尼鼠白血病病毒等;(c)腺-相關病毒載體;(d)單純皰疹病毒載體;(e)SV 40載體;(f)多瘤病毒載體;(g)乳頭狀瘤病毒載體;(h)微小核糖核酸病毒載體;(i)痘病毒載體,諸如正痘病毒,例如牛痘病毒載體或鳥類痘病毒,例如金絲雀痘或雞痘;以及(j)輔助病毒依賴型或空殼(無腸)的腺病毒。複製缺陷型病毒也可能是有利的。不同的載體會或不會併入細胞的基因組中。如果需要,構建體可以包含用於轉染的病毒性序列。或者,可將構建體併入到能夠進行額外型複製的載體中,例如EPV和EBV載體。用於iRNA的重組
表達的構建體將通常需要調節元件,例如啟動子、強化子等,以確保iRNA在靶細胞中的表達。對於載體和構建體需考慮的其他態樣是本領域已知的。
V.本發明的醫藥組成物
本發明也包含醫藥組成物和製劑,其包含本發明的iRNA。在一個具體例中,本文提供的是含有如本文所述的iRNA和藥學上可接受的載體的醫藥組成物。含有iRNA的醫藥組成物可用於預防或治療PNPLA3相關的病症,例如高三酸甘油酯血症。此醫藥組成物是基於遞送方式而配製的。一個示例是配製用於全身給藥的組成物,該施用是經由非消化道遞送,例如藉由皮下(SC)、肌內(IM)或靜脈內(IV)遞送。本發明的醫藥組成物可以用足以抑制PNPLA3基因表達的劑量施用。
在某些具體例中,本發明的醫藥組成物是滅菌的。在另一個具體例中,本發明的醫藥組成物是無熱原的。
可以用足以抑制PNPLA3基因表達的劑量施用本發明的醫藥組成物。通常,適當劑量的本發明的iRNA將是在每天約0.001至約200.0毫克/每千克受體體重的範圍內,通常在每天約1至50毫克/每千克體重的範圍內。通常,本發明的iRNA的合適劑量將在約0.1mg/kg至約5.0mg/kg的範圍內,較佳約0.3mg/kg至約3.0mg/kg。重複劑量的給藥方案可以包含定期施用治療量的iRNA,諸如每月、每3-6個月一次、或每年一次。在一些具體例中,施用iRNA為約每月一次至約每六個月一次。
在初始治療給藥方案之後,可以相對不頻繁地施用治療。治療的持續時間可以根據疾病的嚴重程度來確定。
在其他具體例中,單劑量的醫藥組成物可以是持久的,以使得多劑量以不超過1、2、3或4個月的間隔來施用。在一些本發明的具體例中,單劑量的本發明醫藥組成物約每月施用一次。在其他本發明的具體例中,單劑量的本發明醫藥組成物每季施用一次(即,約每三個月一次)。服用一劑醫藥組成物本發明的藥物。在其他本發明的具體例中,單劑量的本發明醫藥組成物每年施用二次(即,約每六個月一次)。
熟習技術人士將理解,某些因素可以影響有效治療受試者所需的劑量和時間,包含但不限於:受試者體內存在的突變,以前的治療,受試者的一般健康狀況或年齡,以及其他現有疾病。此外,用適當的預防或治療有效量的組成物治療受試者,可以包含單一治療或一系列治療。
可以用靶向特定組織(例如肝細胞)的方式遞送iRNA。
本發明的醫藥組成物包含但不限於,溶液、乳濁液、和含有微脂體的製劑。這些組成物可以由多種組分產生,該組分包含但不限於,預製液體、自乳化固體、和自乳化半固體。製劑包含那些靶向肝臟的製劑。
本發明的藥物製劑,其可以方便地以單位劑型形式存在,可以根據製藥工業中眾所周知的常規技術來製備。這些技術包含將活性成分與藥物載體或賦形劑結合的步驟。通常,藉由將活性成分與液體載體均勻地且緊密地結合在一起來製備製劑。
A.其他的製劑
i.乳劑
本發明的組成物可以被製備並配製成乳劑。乳劑通常是異質系統,其中一種液體以通常超過0.1μm直徑的小滴形式分散在另一種液體中(參見例如,Ansel's藥物劑量形式和藥物遞送系統,Allen,LV.,Popovich NG.,和Ansel HC.,2004,Lippincott Williams & Wilkins(8th ed.),New York,NY;Idson,in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(編),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.199;Rosoff,in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,Volume 1,p.245;Block in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 2,p.335;Higuchi等.,見Remington's藥物科學,Mack Publishing Co.,Easton,Pa.,1985,p.301)。乳劑通常是二相系統,其包括二個不混溶的液相,其彼此緊密混合和分散。通常,乳劑可以是油包水型(w/o)或水包油型(o/w)。當水相被細分並分散為微小的小滴而成為塊狀油相時,所得的組成物稱為油包水(w/o)乳劑。或者,當油相被細分並分散為微小的小滴而成為塊狀水相時,所得的組成物稱為水包油(o/w)乳劑。乳劑除了分散相外,還可以含有其他成分,而活性藥物則可以以溶液形式存在於水相,油相中,或以其本身作為一獨立相而存在。乳劑中還可以根據需要添加藥用賦形劑,如乳化劑、穩定劑、染料、和抗氧化劑。藥物乳劑也可以是包括二個以上相的多種乳劑,諸如在油包水包油(o/w/o)和水包油包水(w/o/w)乳劑的情況下。這種複雜的製劑通常提供簡單的二元乳劑所沒有的特定優點。多種乳劑,其中o/w乳劑的各個油小滴封起水小滴而構成w/o/w乳劑。同樣,一系統的封起油小滴的水小球被油連續相穩定化,則該系統提供了o/w/o乳劑。
乳劑的特徵在於很少或沒有熱力學穩定性。通常,乳劑的分散相或不連續相很好地分散在外相或連續相中,並藉由乳化劑的手段或製劑的粘度保持這種形式。穩定乳劑的其他方法需要使用可摻入乳劑任一相中的乳化劑。乳化劑大致可分為四類:合成表面活性劑、天然乳化劑、吸收基劑和細分散的固體(參見例如,Ansel's藥物劑量形式和藥物遞送系統,Allen,LV.,Popovich NG.,和Ansel HC.,2004,Lippincott Williams & Wilkins(8th ed.),New York,NY;Idson,in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.199)。
合成表面活性劑,也稱為表面活性劑,已在乳劑的製劑中有廣泛的適用性,並已有文獻中對其的綜述(參見例如,Ansel's藥物劑量形式和藥物遞送系統,Allen,LV.,Popovich NG.,和Ansel HC.,2004,Lippincott Williams & Wilkins(8th ed.),New York,NY;Rieger,in Pharmaceutical Dosage Forms,Lieberman,Rieger and Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.285;Idson,in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(編.),Marcel Dekker,Inc.,New York,N.Y.,1988,volume 1,p.199)。表面活性劑通常是兩親性的,且包括親水的和疏水的部分。表面活性劑的親水性與疏水性之比率已被命名為親水/親脂之平衡(HLB),並且是在製劑的製備中分類和選擇表面活性劑的有價值的工具。表面活性劑可以基於親水基團的性質分為不同的類別:非離子、陰離子、陽離子和兩親性的(參見例如,Ansel's藥物劑量形式和藥物遞送系統,Allen,LV.,Popovich NG.,和Ansel HC.,2004,Lippincott Williams & Wilkins(8th ed.),New York,NY Rieger,in Pharmaceutical
Dosage Forms,Lieberman,Rieger and Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.285)。
乳劑製劑中還包含多種非乳化材料,其有助於乳劑的性能。這些包含脂肪、油、蠟、脂肪酸、脂肪醇、脂肪酯、保濕劑、親水膠體、防腐劑和抗氧化劑(Block,in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.335;Idson,in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.199)。
經皮膚、口服和非消化道途徑的乳劑製劑的應用,以及其製造方法,已有文獻的綜述(參見例如,Ansel's藥物劑量形式和藥物遞送系統,Allen,LV.,Popovich NG.,和Ansel HC.,2004,Lippincott Williams & Wilkins(8th ed.),New York,NY;Idson,in Pharmaceutical Dosage Forms,Lieberman,Rieger和Banker(Eds.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.199)。
ii.微乳劑
在本發明的一個具體例中,iRNA和核酸的組成物被配製成微乳劑。微乳劑可以定義為水、油和兩親性分子組成的系統,該系統是單一光學等向性和熱力學穩定的液體溶液(參見例如,Ansel's Pharmaceutical Dosage Forms AND Drug Delivery Systems,Allen,LV.,Popovich NG.,和Ansel HC.,2004,Lippincott Williams & Wilkins(8th ed.),New York,NY;Rosoff,in Pharmaceutical Dosage Forms,Lieberman,Rieger and Banker(編.),1988,Marcel Dekker,Inc.,New York,N.Y.,volume 1,p.245)。典型地,微乳劑是藉由如下製備而得的系統:首
先將油分散在水相的表面活性劑的溶液中,然後添加足夠量的第四組分,通常是中間鏈-長度的醇,以形成一透明的系統。因此,微乳劑也被描述為二種不混溶液體的熱力學穩定的、等向性透明的分散液,而所述二種不混溶液體是藉由表面活性分子的界面膜得以穩定(Leung和Shah,見:可控的藥物釋放:共聚物和聚集系統,Rosoff,M.,Ed.,1989,VCH Publishers,New York,pages 185-215)。
iii.微粒子
本發明的iRNA可以摻入粒子,例如微粒子中。微粒子可以藉由噴霧乾燥來生產,但是也可以藉由其他方法來生產,包括冷凍乾燥法、蒸發法、流體床乾燥、真空乾燥或這些技術的組合。
iv.浸透增強劑
在一個具體例中,本發明使用各種浸透增強劑來實現核酸,特別是iRNA,向動物皮膚的有效遞送。大多數藥物以離子和非離子的形式存在於溶液中。然而,通常僅脂溶性或親脂性藥物容易穿過細胞膜。已經發現,如果用浸透增強劑處理要穿過的膜,即使非親脂性藥物也可以穿過細胞膜。除了幫助非親脂性藥物的跨細胞膜擴散外,浸透增強劑還可以提高親脂性藥物的通透性。
浸透增強劑可被歸類為五大類別,即表面活性劑、脂肪酸、膽鹽、螯合劑和非螯合非表面活性劑(see e.g.,Malmsten,M.藥物遞送中的表面活性劑和共聚物,Informa Health Care,New York,NY,2002;Lee等.,治療性藥物載體系統的重要綜述,1991,p.92)。上述每類浸透增強劑以及它們在醫藥組成物的製造和藥劑遞送中的作用是本領域眾所周知的。
v.賦形劑
與載體化合物相反,“藥物載體”或“賦形劑”是用於將一種或多種核酸遞送給動物的藥學上可接受的溶劑、懸浮劑、或任何其他藥理學上惰性的媒劑。賦形劑可以是液體或固體,並可以根據所計劃的給藥方式進行選擇,以便在將其與核酸和給定醫藥組成物的其他組分結合時提供所期望的容積、稠度等。此種試劑是本領域眾所周知的。
vi.其他組分
本發明的組成物還可以,按其本領域確定的使用量級,另外含有在醫藥組成物中常規找到的其他補佐組分。因此,例如,該組成物可以含有另外的、相容的、藥物活性材料,諸如止癢劑、收斂劑、局部麻醉藥或抗發炎劑,或者可以含有對在物理上配製本發明組成物各種劑量形式有用的其他物質,諸如染料、調味劑、防腐劑、抗氧化劑、遮光劑、增稠劑和穩定劑。然而,添加這些材料時,不應過分地乾擾本發明組成物之組分的生物活性。可以對製劑進行滅菌,如果需要,還可以與輔助劑混合,例如潤滑劑、防腐劑、穩定劑、潤濕劑、乳化劑、影響滲透壓的鹽、緩衝劑、色素、調味劑或芳香族物質等,以及其他類似的不會與製劑的核酸有害地相互作用的物質。
水性懸浮液可含有增加懸浮液黏度的物質,包含例如羧甲基纖維素鈉,山梨糖醇或葡聚醣。懸浮液也可以含有穩定劑。
在某些具體例中,本發明特徵的醫藥組成物包含(a)一種或多種iRNA和(b)一種或多種藉由非-iRNA機制起作用的劑,該劑可用於治療PNPLA3相關病症,例如NAFLD。
這類化合物的毒性和預防效力可藉由在細胞培養或實驗動物中的標準藥學流程來確定,例如用於確定LD50(對群體50%致死的劑量)和ED50(對群體50%有效預防的劑量)。毒性和治療效果之間的劑量比率是治療指數,其可以表示為LD50/ED50的比率。展現出高治療指數的化合物是較佳的。
從細胞培養測定法和動物研究中獲得的數據可用於製定用於人類的劑量範圍。本文中本發明特徵的組成物的劑量通常落在一循環濃度範圍內(該範圍包含ED50,較佳ED80或ED90),很少毒性或沒有毒性。劑量可以在此範圍內變化,取決於所採用的劑量形式和所使用的給藥途徑。對於用於本發明特徵的方法中的任何化合物,可以首先從細胞培養測定中估計預防有效量。可以在動物模型中配製劑量,以取得化合物的循環血漿濃度範圍或,當適當時,取得靶序列的多肽產物(例如實現降低的多肽濃度)的循環血漿濃度範圍,其包含IC50(即,達成半-最大抑制症狀的試驗化合物的濃度)或如在細胞培養中所確定的更高量級的抑制。此類信息可用於更準確地確定對人體有用的劑量。可以測量血漿中的量級,例如藉由高效液相層析。
如上所述,除了其給藥之外,本發明中特色的iRNA可以與用於預防或治療PNPLA3相關病症,例如NAFLD,的其他已知劑組合施用。在任何情況下,給藥醫師可以基於使用本領域已知或本文所述之效力的標準測量方法所觀察到的結果來調節iRNA給藥的數量和時間。
VI.抑制PNPLA3表達的方法
本發明亦提供了抑制PNPLA3基因在細胞中表達的方法。該方法包含使細胞與有效抑制細胞中PNPLA3表達的量的RNAi劑例如雙股RNA劑接觸,從而抑制細胞中PNPLA3的表達。
使細胞與iRNA接觸,例如雙股RNA劑,可以在體外或體內完成。在體內使細胞與iRNA接觸包含使受試者,例如人類受試者,體內的細胞或細胞群組與iRNA接觸。細胞之接觸的體外和體內方法的組合也是可能的。如上所述,細胞之接觸可以是直接或間接的。此外,細胞之接觸可以經由靶向配體來實現,所述靶向配體包含本文所述或本領域已知的任何配體。在較佳的具體例中,靶向配體是醣類部分體,例如GalNAc3配體,或將RNAi劑引導至目標位點的任何其他配體。
本文所用的術語“抑制”與“減少”,“沉默”,“下調”,“壓制”和其他類似術語互換使用,並且包含任何抑制量級。
短語“抑制PNPLA3的表達”是指抑制任何PNPLA3基因(諸如,小鼠PNPLA3基因、大鼠PNPLA3基因、猴PNPLA3基因、或人PNPLA3基因)的表達,以及PNPLA3基因的變體或突變體。因此,在被基因操縱的細胞、細胞群組或生物體的脈絡中,PNPLA3基因可以是野生型PNPLA3基因、突變體PNPLA3基因、或轉基因的PNPLA3基因。
“抑制PNPLA3基因的表達”包含任何量級的對PNPLA3基因的抑制,例如,至少部分壓制PNPLA3基因的表達。可以基於與PNPLA3基因表達相關的任何變量的量級、或其量級的變化來評估PNPLA3基因的表達,例如,
PNPLA3 mRNA量級或PNPLA3蛋白質量級。該量級可以在單個細胞或一組細胞中評估,包含例如,源自受試者的樣本。可以理解,PNPLA3主要在肝臟中表達,但也在腦、膽囊、心臟和腎臟中表達,並存在於循環中。
可以藉由,與對照量級相比,與PNPLA3表達相關的一個或多個變量的絕對或相對量級的降低來評估抑制作用。對照量級可以是本領域中使用的任何類型的對照量級,例如給藥前的基線量級,或從未處理或經對照處理的相似的受試者、細胞、或樣本中所確定的量級(例如,僅緩衝液對照或無活性劑對照)。
在本發明方法的一些具體例中,PNPLA3基因的表達被抑制至少50%、55%、60%、65%、70%、75%、80%、85%、90%、或95%、或低於測定的檢測量級。在較佳的具體例中,PNPLA3基因的表達被抑制至少70%。還應理解,在特定組織例如肝臟中抑制PNPLA3表達,而在其他組織例如大腦中並不顯著抑制表達,可能是理想的。在較佳的具體例中,使用實施例2中提供的測定方法在合適的物種匹配細胞系中以10nM siRNA的濃度確定了表達量級。
在一些具體例中,體內表達的抑制是藉由在表達人基因的囓齒動物中之人基因的基因減弱來確定,例如,表達人靶基因(即PNPLA3)的AAV-感染之小鼠,例如,當以單次劑量給藥時,例如,在RNA表達之最低點時以3mg/kg給藥。還可以,例如在RNA表達最低點時,以例如3mg/kg單劑量給藥後,確定模型動物系統中內源基因表達的基因減弱。當人基因和模型動物基因的核酸序列足夠接近而使得人iRNA提供對模型動物基因的有效基因減弱時,這樣的系統是有用的。使用實施例2中提供的PCR方法確定了肝臟中的RNA表達。
PNPLA3基因表達的抑制可藉由第一細胞或第一組細胞(這種細胞可能存在於例如源自受試者的樣本中)所表達的mRNA量的降低來表徵,在該(組)細胞中PNPLA3基因已被轉錄,並且該(組)細胞已經被處理(例如,藉由使該(組)細胞與本發明的iRNA接觸,或藉由向細胞所在或曾所在的受試者施用本發明的iRNA)以使得,同與第一(組)細胞實質上相同但未經過如此處理的第二(組)細胞(對照細胞:未經iRNA處理,或未經靶向目標基因的iRNA處理)相比,PNPLA3基因的表達受到抑制。在較佳的具體例中,藉由實施例2中提供的方法,使用在物種匹配的細胞系中的10nM siRNA濃度,並且將經處理的細胞中的mRNA量級表達為相對於對照細胞中的mRNA量級的百分比,來評估抑制,使用以下式:
在其他具體例中,可以根據功能上與PNPLA3基因表達相關的參數的降低,例如來自受試者的血液或血清中的PNPLA3蛋白質量級,來評估對PNPLA3基因表達的抑制。PNPLA3基因沉默可以藉由本領域已知的任何測定方法,在任何表達PNPLA3的細胞中確定,無論是內源的PNPLA3或來自表達構建體的異源PNPLA3。
PNPLA3蛋白質表達的抑制可藉由細胞或一組細胞或一個受試者樣本中(例如,源自受試者的血液樣本中的蛋白質量級)所表達的PNPLA3蛋白質量級的降低來表徵。如上所述,為了評估mRNA的壓制,在經處理的(一組)細胞中蛋白質表達量級的抑制可以類似地表達為(一組)對照細胞中蛋白質量級的百分比,或受試者樣本(例如源自其的血液或血清)中蛋白質量級的變化。
可以用於評估對PNPLA3基因表達之抑制的對照細胞、細胞組或受試者樣本,包含尚未接觸過本發明的RNAi劑的細胞、細胞組、或受試者。例如,在用RNAi劑或適當的匹配群體對照對受試者治療之前,對照細胞、細胞組或受試者樣本可源自單個受試者(例如,人或動物受試者)。
可以使用本領域已知的評估mRNA表達的任何方法來確定一個細胞或一組細胞所表達的PNPLA3 mRNA的量級。在一種具體例中,藉由檢測轉錄的多核苷酸,或其部分,例如PNPLA3基因的mRNA來確定樣本中PNPLA3的表達量級。RNA可以從細胞中抽提,使用如下RNA抽提技術,包含例如,酸性苯酚/脈異硫氰酸抽提(RNAzol B;Biogenesis),RNeasyTM RNA製備試劑盒(Qiagen®)或PAXgeneTM(PreAnalytixTM,瑞士)。典型測定形式使用核糖核酸雜合,其包含核轉錄活性測定、RT-PCR、核酸酶(RNase)保護分析、北方墨點法、原位雜合和微陣列分析。
在某些具體例中,使用核酸探針確定PNPLA3的表達量級。如本文所用,術語“探針”係指能夠選擇性地結合至特定PNPLA3的任何分子。探針可以由所屬技術領域者合成,或衍生自適當的生物製品。探針可以被特別設計為被標記的。可用作探針的分子的示例包含但不限於,RNA、DNA、蛋白質、抗體、和有機分子。
經分離的mRNA可用於雜合或擴增測定,包含但不限於,南方或北方分析、聚合酶鏈反應(PCR)分析和探針陣列。確定mRNA量級的一種方法涉及將經分離的mRNA與可以與PNPLA3 mRNA雜合的核酸分子(探針)接觸。在一個具體例中,mRNA被固定在固體表面並與探針接觸,例如藉由在瓊脂糖凝膠把分離的mRNA跑膠並將mRNA從凝膠轉移到膜如硝化纖維。在一個
替代具體例中,將探針固定在固體表面並且使mRNA與探針接觸,例如,在Affymetrix®基因芯片陣列中。熟習技術人士可以容易地調試已知的mRNA檢測方法以用於確定PNPLA3 mRNA的量級。
確定樣本中PNPLA3表達量級的另一種方法涉及樣本中mRNA的核酸擴增或逆轉錄酶(以製備cDNA)的過程,例如,藉由RT-PCR(實驗具體例載於Mullis,1987,美國專利No.4,683,202),連接酶連鎖反應(Barany(1991)Proc.Natl.Acad.Sci.USA 88:189-193),自主序列複製(Guatelli等(1990)Proc.Natl.Acad.Sci.USA 87:1874-1878),轉錄擴增系統(Kwoh等(1989)Proc.Natl.Acad.Sci.USA 86:1173-1177),Q-Beta複製酶(Lizardi等(1988)Bio/Technology 6:1197),滾環式複製(Lizardi等,美國專利No.5,854,033)或任何其他核酸擴增方法,然後使用所屬技術領域者眾所周知的技術檢測擴增的分子。如果此類分子以非常低的數量存在,則這些檢測方案對於核酸分子的檢測特別有用。在本發明的特定態樣中,PNPLA3的表達量級是藉由定量螢光RT-PCR(即TaqManTM系統)確定。在較佳的具體例中,在物種匹配的細胞系中,藉由實施例2中提供的方法使用例如10nM siRNA濃度來確定表達量級。
PNPLA3 mRNA的表達量級可使用如下方法監測:膜印跡法(諸如用於雜合分析,諸如北方墨點、南方墨點、點狀墨點等),或微孔、試樣管、凝膠、珠粒或纖維(或任何包括結合的核酸的固體支持物)。參見美國專利5,770,722、5,874,219、5,744,305、5,677,195和5,445,934,其在此藉由引用併入本文。PNPLA3表達量級的確定還可包括在溶液中使用核酸探針。
在較佳的具體例中,使用分枝DNA(bDNA)測定法或實時PCR(qPCR)評估mRNA表達的量級。在本文提出的實施例中描述和舉例說明了這些
方法的使用。在較佳的具體例中,在物種匹配的細胞系中,藉由實施例2中提供的方法使用10nM siRNA濃度來確定表達量級。
可以使用本領域已知的用於測量蛋白質量級的任何方法來確定PNPLA3蛋白質表達的量級。這些方法包含,例如,電泳、毛細管電泳、高效液相層析(HPLC)、薄層層析(TLC)、超擴散層析、流體或凝膠沉澱素反應、吸收光譜分析、比色測定、分光光度測定、流式細胞儀、免疫擴散(單次或二次)、免疫電泳、西方墨點法、放射免疫測定(RIA)、酵素連結免疫吸附測定(ELISA)、免疫螢光測定、電化學發光測定、以及其他類似的。
在某些具體例中,本發明方法的效力是藉由PNPLA3 mRNA或蛋白質量級的降低(例如,在肝切片檢查中)來評估。
在本發明方法的一些具體例中,將iRNA施用給受試者以使得iRNA被遞送至受試者體內的特定位點。對PNPLA3表達的抑製可藉由測量樣本中PNPLA3 mRNA或PNPLA3蛋白質的量級或量級之變化來評估,該樣本衍生自受試者體內特定位點(例如,肝臟或血液)的體液或組織。
如本文所用,術語“檢測或確定分析物的量級”應理解為是指執行步驟以確定材料是否存在,例如蛋白質、RNA。如本文所用,檢測或確定的方法包含檢測或確定低於所用方法檢測量級的分析物量級。
VII.本發明的預防和治療方法
本發明還提供了使用本發明的iRNA或含有本發明的iRNA的組成物以抑制PNPLA3表達,從而預防或治療與PNPLA3相關病症,例如,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、
肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。在本發明的方法中,細胞可以在體外或在體內與siRNA接觸,即,細胞可以在受試者內。
適用於使用本發明的方法治療的細胞可以是表達PNPLA3基因的任何細胞,例如,肝臟細胞、腦細胞、膽囊細胞、心臟細胞、或腎細胞,但較佳是肝臟細胞。適用於本發明的方法的細胞可以是哺乳動物細胞,例如,靈長類動物細胞(諸如人細胞,包含嵌合非人動物中的人細胞,或非人類靈長類動物細胞,例如猴子細胞或黑猩猩細胞),或非靈長類細胞。在一些具體例中,該細胞是人細胞,例如人肝臟細胞。在本發明的方法中,細胞中PNPLA3的表達被至少50%、55%、60%、65%、70%、75%、80%、85%、90%、或95%抑制,或抑制到低於測定的檢測量級。
本發明的體內方法可以包含給受試者施用含有iRNA的組成物,其中iRNA包含一核苷酸序列,其與接受RNAi劑施用之哺乳動物的PNPLA3基因的至少一部分RNA轉錄本是互補的。該組成物可以藉由本領域已知的任何方式給藥,包含但不限於口服、腹腔內、或非消化道途徑,包含顱內(例如,腦室內、實質內、和鞘內)、靜脈內、肌內、皮下、經皮、氣道(氣溶膠)、鼻腔、直腸和局部(包括頰和舌下)給藥。在一些具體例中,組成物藉由靜脈輸注或注射給藥。在一些具體例中,組成物藉由皮下注射給藥。在一些具體例中,組成物藉由肌內注射給藥。
在一個態樣中,本發明還提供了抑制哺乳動物體內PNPLA3基因表達的方法。該方法包含向哺乳動物施用包括dsRNA的組成物,其靶向哺乳動物細胞中的PNPLA3基因,並將該哺乳動物維持足夠長時間以得到PNPLA3基因
的mRNA轉錄本之降解,從而抑制細胞中PNPLA3基因的表達。基因表達之降低的評估可用本領域已知的任何方法和本文中,例如實施例2,所述方法,例如qRT-PCR。蛋白質生產的降低可以藉由本領域已知的任何方法來評估,例如ELISA。在一些具體例中,肝穿刺切片檢查樣本用作監測PNPLA3基因或蛋白質表達降低的組織材料。在其他具體例中,血液樣本用作監測PNPLA3蛋白質表達降低的受試者樣本。
本發明進一步提供了在有需要的受試者中的治療方法,例如,被診斷為患有PNPLA3相關病症的受試者,諸如,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
本發明進一步提供了在有需要的受試者中的預防方法。本發明的治療方法包含將本發明的iRNA,以預防有效量的靶向PNPLA3基因之iRNA或以預防有效量的包括靶向PNPLA3基因之iRNA的醫藥組成物,施用給受試者,例如將受益於PNPLA3表達減低的受試者。
在一個態樣中,本發明提供了對其所具有病症將受益於PNPLA3表達減低的受試者的治療方法,例如,與PNPLA3相關的疾病,諸如慢性纖維炎性肝病(例如,癌症,例如,肝細胞癌、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟發炎、肝細胞的壞死、肝臟纖維化和非酒精性脂肪肝疾病(NAFLD)。在一個具體例中,前述慢性纖維炎性肝病是NASH。
在一個態樣中,本發明提供了本發明的雙股核糖核酸(dsRNA),該雙股核糖核酸用於治療其所具有病症將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達減低的受試者的方法.
在另一個態樣中,本發明提供了本發明的雙股核糖核酸(dsRNA),該雙股核糖核酸用於預防其所具有病症將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達減低的受試者至少一項症狀的方法。
在一個態樣中,本發明提供了本發明的雙股核糖核酸(dsRNA)在製造用於治療其所具有病症將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達減低的受試者的藥劑中的用途。
在另一個態樣中,本發明提供了本發明的雙股核糖核酸(dsRNA)在製造用於預防其所具有病症將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達減低的受試者至少一項症狀的藥劑中的用途。
在一個具體例中,前述藥劑以約0.01mg/kg至約50mg/kg的劑量給藥。
在一個具體例中,前述病症是PNPLA3相關疾病。
在一個具體例中,PNPLA3相關疾病選自如下所組成之群組:脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
如本文所用,如本文所用,“非酒精性脂肪肝疾病”與術語“NAFLD”互換使用,係指如下定義的疾病:每天攝入少於20克酒精,仍存在大血管的脂肪變性。NAFLD是美國最常見的肝臟疾病,通常與胰島素抗性/第二型糖尿病和肥胖症相關。NAFLD表徵為脂肪變性、脂肪性肝炎、肝硬化,有時還有肝細胞癌。有關NAFLD的綜述文章,請參見Tolman and Dalpiaz(2007)Ther.Clin.Risk.Manag.,3(6):1153-1163,其全部內容藉由引用併入本文。
如本文所用,術語“脂肪變性”,“肝脂肪變性”和“脂肪肝疾病”係指三酸甘油酯和其他脂肪在肝臟細胞中的積累。
如本文所用,術語“非酒精性脂肪性肝炎”或“NASH”係指肝臟發炎和由肝臟中脂肪堆積所引起的損害。NASH是一組被稱為非酒精性脂肪肝疾病(NAFLD)的病況的一部分。NASH類似於酒精性肝病,但發生在很少或不喝酒的人中。NASH的主要特徵是肝臟中的脂肪,以及發炎和損傷。大多數患有NASH的人感覺良好,並且不知道自己有肝臟問題。然而,NASH可能是嚴重的,並可能導致肝硬化,其中肝臟被永久性損傷和瘢痕化,不可逆的、晚期的肝臟瘢痕形成,無法再正常工作。通常首先懷疑NASH是發現某人的血常規檢查所包含的肝臟檢驗有升高,諸如丙胺酸轉胺脢(ALT)或天門冬胺酸轉胺酶(AST)。當進一步評估未發現明顯的肝病原因(諸如藥物、病毒性肝炎或過量飲酒)並且X射線或肝臟影像學檢查顯示脂肪時,則懷疑是NASH。肝切片檢查是證明NASH診斷並將其與單純性脂肪肝分開的唯一方法。
如本文所用,組織學上定義的術語“肝硬化”是以肝纖維化和正常肝結構轉變為結構異常的結節為特徵的瀰漫性肝過程。
本發明的iRNA可以作為“游離iRNA”施用。在無醫藥組成物時施用游離iRNA。裸露的iRNA可以在合適的緩衝溶液中。該緩衝溶液可以包括乙酸鹽、檸檬酸鹽、醇溶蛋白、碳酸鹽、或磷酸鹽,或其任何組合。在一個具體例中,緩衝溶液是磷酸鹽緩衝生理鹽水(PBS)。含有iRNA的緩衝溶液的pH和滲透壓可以被調節,以使其適合於施用給受試者。
或者,本發明的iRNA可以作為醫藥組成物而施用,諸如dsRNA微脂體劑型。
受益於PNPLA3基因表達抑制的受試者是易受或已診斷為PNPLA3相關病症的受試者,諸如脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
在一個具體例中,該方法包含施用本文特色的組成物,以使得靶標PNPLA3基因的表達降低,諸如約每1、2、3、4、5、6、1-6、1-3、或3-6個月施用一劑量。在一些具體例中,該組成物每3-6個月施用一次。
較佳地,可用於本文特色的方法和組成物的iRNA特異性地靶向靶標PNPLA3基因的RNA(原始的或經加工)。使用iRNA抑制這些基因表達的組成物和方法可以如本文所述製備和執行。
根據本發明方法施用iRNA可以導致預防或治療PNPLA3相關病症,例如,脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
可以給受試者施用治療量的iRNA,諸如約0.01mg/kg至約200mg/kg。
iRNA較佳皮下施用,即藉由皮下注射。可以使用一次或多次注射將所期望劑量的iRNA遞送給受試者。可以在一段時間內重複注射。
前述施用可以定期重複。在一些具體例中,在初始治療給藥方案之後,可以相對不頻繁地施用治療。重複劑量的給藥方案可以包含定期施用治療量的iRNA,諸如每月一次至每年一次。在一些具體例中,施用iRNA為約每月一次至約每三個月一次,或約每三個月一次至約每六個月一次。
本發明進一步提供了iRNA劑或其醫藥組成物,與其他藥物和/或其他治療方法組合使用(例如與已知藥物和/或已知治療方法,諸如,例如當前用於治療這些病症的方法),用於治療將受益於降低和/或抑制PNPLA3基因表達的受試者的方法和用途,例如具有PNPLA3相關疾病的受試者。
因此,在本發明的一些態樣中,包含單一的本發明之iRNA劑的方法和用途,進一步包含向受試者施用一種或多種其他治療劑。
iRNA劑和另外的治療劑和/或治療可以同時施用和/或以同一組合施用,例如非消化道施用,或者另外的治療劑可以作為分開的組成物的一部分施用,或在分開的時間施用,和/或藉由本領域已知或本文描述的另一種方法施用。
其他治療劑的示例包含那些已知可治療高三酸甘油酯血症和由其引起,與其相關或為其後果的其他疾病。此類劑的示例包含但不限於,HMG-CoA還原酶抑製劑(例如,他汀類藥物),纖維酸鹽衍生物,膽汁酸隔離劑,菸鹼酸,抗血小板劑,血管收縮素轉化酶抑制劑,血管收縮素II受體的拮抗劑(例如洛沙坦鉀,如默沙東的好悅您®),醯基輔酶A膽固醇乙醯基轉移酶(ACAT)抑製劑,膽固醇吸收抑制劑,膽固醇酯轉蛋白(CETP)抑制劑,微粒體三酸甘油酯轉移蛋白(MTTP)抑制劑,膽固醇調節劑,膽汁酸調節劑,過氧化物酶體增殖活化受體(PPAR)激動劑,基因療法,複合血管保護劑(例如,AGI-1067,來自Atherogenics),醣蛋白Ilb/IIIa抑製劑,阿司匹林或類阿司匹林化合物,IBAT抑制劑(例如,S-8921,來自塩野義),角鯊烯合成酶抑製劑,單核球趨化蛋白(MCP)-I抑制劑,或魚油。示例性的HMG-CoA還原酶抑制劑包含,阿托伐他汀(輝瑞的立普妥®/Tahor/Sortis/Torvast/Cardyl),普伐他汀(必治
妥施貴寶的Pravachol、三共的美百樂鎮/Sanaprav),辛伐他汀(默沙東的素果®/Sinvacor、百靈佳殷格翰的Denan,萬有的Lipovas),洛伐他汀(默沙東的美乏脂/Mevinacor、Bexal的Lovastatina,Cepa;Schwarz Pharma的Liposcler),氟伐他汀(諾華的益脂可®/Locol/Lochol、藤澤的Cranoc、索爾維的Digaril),瑞舒伐他汀(拜耳的Lipobay/葛蘭素史克的Baycol),瑞舒伐他汀(阿斯特捷利康的冠脂妥®),以及匹伐他汀(itavastatin/risivastatin)(日產化學、Kowa Kogyo、三共、以及諾華)。示例性的纖維酸鹽衍生物包含例如,本那非泊(例如,羅氏的Befizal®/Cedur®/倍利脂®、橘生的Bezatol),克氯吩貝(例如,惠氏的安臟美®),非諾貝特(例如,Fournier的Lipidil/Lipantil,亞培的Tricor®、武田的Lipantil-學名藥),健菲布脂(例如,輝瑞的洛脂/Lipur)和環丙貝特(賽諾菲安萬特的Modalim®)。示例性的膽汁酸隔離劑包含例如,銷膽胺(必治妥施貴寶的貴舒醇®和貴舒醇低卡TM),可麗絲特博(例如,法瑪西亞的庫列狄),以及考來維崙(健贊/三共的WelCholTM)。示例性的菸鹼酸療法包含例如,速釋製劑,諸如安萬特的Nicobid,Upsher-Smith的Niacor、安萬特的Nicolar、以及Sanwakagaku的百脂喜妥。菸鹼酸延釋製劑包含例如,Kos製藥的Niaspan和Upsher-Smith的SIo-Niacin。示例性的抗血小板劑包含例如,阿斯匹靈(例如,拜耳的阿斯匹靈),氯吡格雷(賽諾菲安萬特/必治妥施貴寶的保栓通),以及梯可匹定(例如,賽諾菲安萬特的Ticlid和第一的抗血定)。與靶向PNPLA3的dsRNA組合使用的其他阿斯匹靈樣化合物包含例如,Asacard(緩釋阿斯匹靈,來自法瑪西亞)和Pamicogrel(Kanebo/Angelini Ricerche/CEPA)。示例性的血管收縮素轉化酶抑製劑包含例如,雷米普利(例如,安萬特的Altace)和依那普利(例如,默沙東的Vasotec)。示例性的醯基輔酶膽固醇乙醯基轉移酶(ACAT)抑制劑包含例如,
阿伐麥布(輝瑞),依魯麥布(BioMsrieux皮耶法柏/禮來,CS-505(三共和Kyoto),以及SMP-797(Sumito)。示例性的膽固醇吸收抑制劑包含例如,依澤替米貝(默沙東/先靈葆雅製藥Zetia®)和帕馬苷(輝瑞)。示例性的CETP抑製劑包含例如,Torcetrapib(也稱CP-529414,輝瑞),JTT-705(日本煙草),以及CETi-I(Avant Immunotherapeutics)。示例性的微粒體三酸甘油酯轉移蛋白(MTTP)抑制劑包含例如,應普他派(implitapide)(拜耳),R-103757(楊森),和CP-346086(輝瑞)。其他示例性的膽固醇調節劑包含例如,NO-1886(大塚/TAP製藥),CI-1027(輝瑞),和WAY-135433(惠氏-Ayerst)。
示例性的膽汁酸調節劑包含例如,HBS-107(久光/萬有),Btg-511(英國技術集團),BARI-1453(安萬特),S-8921(塩野義),SD-5613(輝瑞),和AZD-7806(阿斯特捷利康)。示例性的過氧化物酶體增殖活化受體(PPAR)激動劑包含例如,替格列札(tesaglitazar)(AZ-242)(阿斯特捷利康),奈格列酮(Netoglitazone)(MCC-555)(田邊三菱/嬌生),GW-409544(Ligand製藥/葛蘭素史克),GW-501516(Ligand製藥/葛蘭素史克),LY-929(Ligand製藥和禮來),LY-465608(Ligand製藥和禮來),LY-518674(Ligand製藥和禮來),和MK-767(默沙東和Kyorin)。示例性的基因療法包含例如,AdGWEGF 121.10(GenVec),ApoAl(UCB Pharma/Groupe Fournier),EG-004(Trinam)(Ark Therapeutics),和ATP結合匣運輸蛋白-Al(ABCA1)(CV Therapeutics/Incyte、安萬特、Xenon)。示例性的醣蛋白Ilb/IIIa抑製劑包含例如,洛昔非班(roxifiban)(也稱DMP754,必治妥施貴寶),更托非班(默沙東德國/山之內),和克洛嗎非班(Cromafiban)(千禧製藥)。示例性的角鯊烯合成酶抑製劑包含例如,BMS-1884941(必治妥施貴寶),CP-210172(輝瑞),CP-295697(輝瑞),CP-294838(輝瑞),和TAK-475(武
田)。An示例性的MCP-I抑製劑為例如,RS-504393(羅氏Bioscience)。抗-動脈粥樣硬化劑BO-653(中外製藥),和菸鹼酸衍生物Nyclin(山之內製藥)也適合與本發明特色的dsRNA組合施用。適用於與靶向PNPLA3的dsRNA一起給藥的示例性的組合療法包含例如,advicor(菸鹼酸/洛伐他汀來自Kos製藥),胺氯地平/阿托伐他汀(輝瑞),和依澤替米貝/辛伐他汀(例如,維妥力® 10/10、10/20、10/40、和10/80片來自默沙東/先靈葆雅製藥)。適用於與靶向PNPLA3的dsRNA組合給藥的治療高三酸甘油酯血症的劑包含例如,洛伐他汀,菸鹼酸-Altoprev®延長錠(Andrx Labs),洛伐他汀-脂脈優®錠劑(輝瑞),胺氯地平,阿托伐他汀鈣-冠脂妥®錠劑(阿斯特捷利康),瑞舒伐他汀鈣-益脂可®膠囊(諾華),氟伐他汀鈉-益脂可®(Reliant,諾華),氟伐他汀鈉-立普妥®錠劑(派德),阿托伐他汀鈣-Lofibra®膠囊(Gate),Niaspan延長錠劑(Kos),菸鹼酸Pravachol錠劑(必治妥施貴寶),普伐他汀鈉-TriCor®錠劑(亞培),非諾貝特-維妥力® 10/10錠劑(默沙東/先靈葆雅製藥),依澤替米貝,辛伐他汀-WelCholTM錠劑(三共),考來維崙鹽酸-Zetia®錠劑(先靈),依澤替米貝-Zetia®錠劑(默沙東/先靈葆雅製藥),和依澤替米貝-素果®錠劑(默沙東)。
在某些具體例中,本發明特徵的iRNA可以與下列藥劑一起施用,例如:吡哆醇,一種ACE抑製劑(血管收縮素轉化酶抑制劑),例如,貝那普利(Lotensin);血管收縮素II受體的拮抗劑(ARB)(例如,洛沙坦鉀,如默沙東的好悅您®),例如,坎地沙坦(Atacand);HMG-CoA還原酶抑制劑(例如,他汀類藥物);鈣結合劑,例如,纖維素磷酸鈉(Calcibind);利尿劑,例如,噻嗪類利尿劑,諸如氫氯苯噻(Microzide);胰島素增敏劑,諸如PPAR激動劑吡格列酮,glp-1r激動劑,諸如利拉魯肽(liraglutatide)、維生素E、SGLT2抑制
劑、DPPIV抑制劑,以及治療腎臟/肝臟移植後衍生的高血糖和高血脂所使用的那些;或上述任何一項的組合。
在一個具體例中,iRNA劑是與依澤替米貝/辛伐他汀組合(例如,維妥力®(默沙東/先靈葆雅製藥))一起組合施用。在一個具體例中,將iRNA劑施用給患者,然後將另外的治療劑使用給患者(反之亦然)。在另一個具體例中,iRNA劑與所述另外的治療劑是在同時施用的。
iRNA劑和其他治療劑和/或治療可以在同時和/或以同一組合施用,例如非消化道給藥,或所述其他治療劑可以作為分開的組成物的一部分或在分開的時間和/或藉由本領域已知或本文描述的另一種方法施用。
在一個具體例中,iRNA劑是與依澤替米貝/辛伐他汀組合(例如,維妥力®(默沙東/先靈葆雅製藥))一起組合施用。在一個具體例中,將iRNA劑施用給患者,然後將另外的治療劑使用給患者(反之亦然)。在另一個具體例中,iRNA劑與所述另外的治療劑是在同時施用的。
iRNA劑和其他治療劑和/或治療可以在同時和/或以同一組合施用,例如非消化道給藥,或所述其他治療劑可以作為分開的組成物的一部分或在分開的時間和/或藉由本領域已知或本文描述的另一種方法施用。
VIII.試劑盒
在特定態樣中,本揭露提供了試劑盒,其包含合適的容器,該容器含有siRNA化合物的藥物製劑,該siRNA化合物為例如雙股siRNA化合物,或siRNA化合物(例如前體,例如較大的siRNA化合物,其可被加工成siRNA化
合物或編碼siRNA化合物的DNA,該被編碼siRNA化合物為例如雙股siRNA化合物,或ssiRNA化合物,或其前體)。
此類試劑盒包含一種或多種dsRNA劑和使用說明,例如預防有效量或治療有效量的dsRNA劑的給藥說明。dsRNA劑可以在小藥瓶或預先填充的注射器中。試劑盒可以可選地進一步包括用於施用dsRNA劑的構件(例如注射裝置,諸如預先填充的注射器),或用於測量對PNPLA3的抑制的構件(例如,用於測量對PNPLA3 mRNA,PNPLA3蛋白質,和/或PNPLA3活性的抑制的構件)。用於測量對PNPLA3的抑制的這種構件可以包括用於從受試者中獲得樣本的構件,諸如例如血漿樣本。本發明的試劑盒可以可選地進一步包括用於確定治療有效量或預防有效量的構件。
在某些具體例中,可以將藥物製劑的各個組分提供在一個容器中,例如小藥瓶或預先填充的注射器。或者,可能需要在二個或更多個容器中分別提供藥物製劑的組分,例如,一個容器用於siRNA化合物製備,和至少另一個用於載劑化合物。試劑盒可以用一些不同的構型包裝,諸如在單一盒子中的一個或多個容器。可以合併不同的組分,例如根據試劑盒所提供的說明。可以根據本文所述的方法將各組分合併,例如以製備和施用醫藥組成物。
本發明藉由以下實施例被進一步演示,這些實施例不應被解釋為限制性的。在本申請中所引用的所有參考文獻,專利和已公開專利申請的全部內容,以及非正式的序列表和圖式,在此藉由引用併入本文。
實施例
實施例1. iRNA合成
試劑的來源
如果本文中沒有具體給出試劑來源,可以從任何分子生物學試劑供應商處以用於分子生物學的質量/純度標準獲得這種試劑。
siRNA設計
使用自定義的R和Python腳本設計了靶向人類含類PATATIN磷脂酶結構域3(PNPLA3)基因(人類:NCBI refseqID NM_025225.2;NCBI GeneID:80339)的siRNA。人類NM_025225.2 REFSEQ mRNA,具有2805個鹼基的長度。
未修飾的PNPLA3正義股和反義股的核苷酸序列的詳細列表如表2、4、6、8、和10所示。經修飾PNPLA3正義股和反義股的核苷酸序列的詳細列表如表3、5、7、9、11、21、24、27、和30所示。
應當理解,在整個申請中,不帶小數的雙鏈體名稱等同於帶小數的雙鏈體名稱,該小數僅為雙鏈體之批次號的參照。例如,AD-959917等同於AD-959917.1。
siRNA合成
使用本領域已知的方法設計,合成和製備siRNA。
簡而言之,使用Mermade 192 synthesizer(BioAutomation)合成儀在固相支持物上以亞磷醯胺化學而合成1μmol的尺度的siRNA序列。固相支持物是可控孔徑玻璃(500-1000Å),其加載有:定制的GalNAc配體(3’-GalNAc接合物),通用固相支持物(AM Chemicals)或感興趣的第一個核苷
酸。輔助合成試劑和標準的2-氰乙基亞磷醯胺單體(2’-去氧-2’-氟基,2’-O-甲基,RNA,DNA)購自賽默飛世爾(Milwaukee,WI,美國),兆维(中國),或Chemgenes(Wilmington,MA,美國)。其他亞磷醯胺單體可從商業供應商那裡採購、內部製備或使用各個CMO提供的定制合成來採購。在乙腈或9:1乙腈:DMF中以100mM的濃度製備亞磷醯胺,並使用5-乙硫基-1H-四唑(ETT,0.25M in乙腈)接合,其反應時間為400秒。硫代磷酸酯鍵聯是在無水乙腈/吡啶(9:1體積/體積)中使用100mM 3-((二甲基胺基-亞甲基)胺基)-3H-1,2,4-二噻唑-3-硫酮(DDTT,從Chemgenes(Wilmington,MA,美國)獲得)生成的。氧化反應的時間為5分鐘。所有序列的合成都有最後的去除DMT基團(“DMT-Off”)的步驟。
固相合成完成後,將固相-支持的寡核糖核苷酸在96孔盤中於室溫用300μL of甲胺(40%水溶液)處理大約2小時,以提供從固相支持物的裂解和隨後的所有其他鹼不穩定之保護基團的去除。對於含有任何被第三丁基二甲基矽烷基(TBDMS)所保護的天然核糖核苷酸鍵聯(2’-OH)的序列,使用TEA.3HF(三乙胺三氟化氫)執行第二次去保護步驟。向每個寡核苷酸的甲胺水溶液中加入200μL二甲基亞堸(DMSO)和300μL TEA.3HF,並將該溶液在60℃溫育約30分鐘。溫育後,使板達到室溫,並藉由添加1mL的9:1乙腈:乙醇或1:1乙醇:異丙醇以沉澱粗糙的寡核苷酸。然後將板在4℃離心45分鐘,並藉助多通道移液器小心地傾析上清液。將寡核苷酸沉澱物重新懸浮於20mM NaOAc中,然後在裝有自動進樣器、UV檢測器、導電率計和分餾收集器的Agilent LC系統上使用HiTrap尺寸的粒徑篩析層析柱(5mL,GE奇異醫療)脫鹽。將脫鹽後的樣本收集在96孔盤中,然後分別藉由LC-MS和UV光譜測定法以確認身份並定量材料。
在Tecan液體處理機器人上進行單股的雙鏈體化。將正義股和反義股的單股以等莫耳比混合,以達到在96孔盤中的1x PBS中為10μM的終濃度,將盤密封,在100℃溫育10分鐘,然後使其在2-3小時內緩慢恢復至室溫。確認每個雙鏈體的濃度和身份,然後將其用於體外的篩選測定。
實施例2. 體外的篩選方法
Hep3B細胞培養和384-孔轉染
使Hep3b cells(ATCC美國標準生物品收藏中心,美國維吉尼亞州馬納薩斯)在37℃和5% CO2氣氛的條件下,在添加了10% FBS(ATCC)的伊格爾最低限度必需培養基(Gibco)中生長到接近匯合,然後藉由胰蛋白酶化使其從盤釋放。轉染的完成如下:在96孔盤的每一單個孔內,加入5μl每個siRNA雙鏈體,再加入14.8μl Opti-MEM加上0.2μl Lipofectamine RNAiMax(Invitrogen,美國加州卡爾斯巴德市cat # 13778-150)。然後將混合物在室溫溫育15分鐘。然後將含有約2 x104個Hep3B細胞的80μl不含抗生素的完全生長培養基加入siRNA混合物中。在RNA純化之前,將細胞溫育24小時。在10nM和0.1nM的最終雙鏈體濃度下執行了單一劑量實驗,並在10nM to 128pM範圍內使用8x 5-倍連續稀釋進行了劑量反應實驗。
總RNA的分離-使用DYNABEADS mRNA分離試劑盒(Invitrogen
TM
,part #:610-12)
將細胞在每孔的含有3μL珠粒之75μL裂解/結合緩衝液中裂解,並在靜電振動器混合10分鐘。清洗步驟在Biotek EL406,使用磁性盤支架自動進行。將珠子在緩衝液A中清洗(以90μL)一次,在緩衝液B中清洗一次,以
及在緩衝液E中清洗二次,並且在每二次清洗之間都有抽吸步驟。最終一次抽吸之後,將完整的10μL RT混合物加到每個孔中,如下所述。
cDNA的合成-使用ABI高容量cDNA反轉錄試劑盒(應用生物系統公司,Foster City,CA,美國Cat #4368813)
每孔中加入一個反應的主混合液:1μl 10X緩衝液,0.4μl 25X dNTPs,1μl隨機引子,0.5μl反轉錄酶,0.5μl RNase抑制劑和6.6μl H2O。將盤密封,在靜電振動器攪動10分鐘,然後在37攝氏度下溫育2小時。然後將盤在80攝氏度攪動8分鐘。
即時PCR(即時聚合酶鏈反應)
將2微升(μl)cDNA加入384孔盤的每孔中的主混合液,其含有:0.5μl人GAPDH TaqMan探針(4326317E),0.5μl人PNPLA3,2μl無核酸酶的水以及5μl Lightcycler 480探針主混合液(羅氏Cat # 04887301001)。即時PCR是在LightCycler 480即時PCR系統(羅氏)中完成。
為了計算相對的倍數變化,使用△△Ct方法分析數據,並將其歸一化到使用被10nM AD-1955轉染的細胞或被模擬轉染的細胞所執行的測定。使用一採用XLFit的4參數擬合模型來計算IC50s,並對其歸一化到被AD-1955轉染的細胞或被模擬轉染的細胞。AD-1955的正義股和反義股的序列為:正義cuuAcGcuGAGuAcuucGAdTsdT(SEQ ID NO:18)以及反義UCGAAGuACUcAGCGuAAGdTsdT(SEQ ID NO:19)。
體外的雙-螢光素酶和內源篩選測定
Cos-7 cells(ATCC美國標準生物品收藏中心,美國維吉尼亞州馬納薩斯)在37℃和5% CO2氣氛的條件下,在添加了10% FBS的DMEM(ATCC)中生長到接近匯合,然後藉由胰蛋白酶化使其從盤釋放。單一劑量實驗是在50nM、10nM、1nM、和0.1nM執行的。用含有3’非轉譯區(UTR)的質體實現了siRNA和psiCHECK2-PNPLA3(GenBank登錄號NM_025225.2)質體的轉染。轉染的實現是藉由每孔加入5μL siRNA雙鏈體和5μL(5ng)psiCHECK2質體,以及每孔4.9μL Opti-MEM加上0.1μL Lipofectamine 2000(Invitrogen,美國加州卡爾斯巴德市cat # 13778-150),然後在室溫溫育15分鐘。然後將混合物添加到細胞中,將其重新懸浮在35μL新鮮的完全培養基中。將被轉染的細胞在37℃和5% CO2氣氛中溫育。
siRNA和psiCHECK2質體被轉染後已過去了48小時;測量了螢火蟲(轉染對照)螢光素酶和海腎(融合到PNPLA3目標序列)螢光素酶。首先,從細胞中去除培養基。然後,藉由向每個孔中加入並混合20μL等於培養基體積的Dual-Glo®螢光素酶試劑來測量螢火蟲螢光素酶的活性。將該混合物在室溫溫育30分鐘,然後在Spectramax(Molecular Devices)測量發光(500nm)以檢測螢火蟲螢光素酶的信號。藉由向每個孔中加入20μL室溫的Dual-Glo®Stop & Glo®試劑來測量海腎螢光素酶的活性,並將盤溫育10-15分鐘,然後再次測量發光以確定海腎螢光素酶的信號。
Dual-Glo®Stop & Glo®試劑淬滅螢火蟲螢光素酶的信號,並保持海腎螢光素酶反應的發光。siRNA活性的確定是藉由將每個孔內的海腎(PNPLA3)信號歸一化為螢火蟲(對照)信號。然後,相對於用相同載體轉
染但未用siRNA處理或用非靶向siRNA處理細胞,評估siRNA活性的大小。所有轉染均以n=4完成。
細胞培養和轉染
轉染細胞的過程如下:在384孔盤的每一孔內,加入5μL siRNA雙鏈體,再加入4.9μL Opti-MEM加上0.1μL RNAiMAX(Invitrogen美國加州卡爾斯巴德市cat # 13778-150),並且每個siRNA雙鏈體有4次重複實驗,然後在室溫溫育15分鐘。然後將40μL含有約5 x103個細胞的培養基加入到前述siRNA混合物中。將細胞溫育24小時後進行RNA純化。實驗在50nM、10nM、1nM、和0.1nM執行。轉染實驗在Cos7細胞中執行。
總RNA的分離-使用DYNABEADS mRNA分離試劑盒
在BioTek-EL406平台使用DYNABEADs(Invitrogen,cat#61012),採用自動化方案以分離RNA。簡而言之,將70μL裂解/結合緩衝液和10μL含有3μL磁珠的裂解緩衝液添加到含有細胞的平盤中。將盤在室溫在電磁振動器溫育10分鐘,然後捕獲磁珠並除去上清液。然後用150μL清洗緩衝液A清洗結合到珠粒的RNA 2次,以及用清洗緩衝液B清洗一次。然後用150μL沖提緩衝液清洗珠粒,重新捕獲並去除上清液。
cDNA的合成-使用ABI高容量cDNA反轉錄試錄盒(應用生物系統公司,Foster City,CA,美國Cat #4368813)
向上述分離的RNA加入10μL主混合液,其每個反應含有:1μL 10X緩衝液,0.4μL 25X dNTPs,1μL 10x隨機引子,0.5μL反轉錄酶,0.5μL RNase抑制劑和6.6μL H2O。將盤密封,混合,並在室溫在電磁振動器溫育10分鐘,然後在37℃溫育2小時。
即時PCR
將2μL cDNA加入384孔盤的每孔中的主混合液,其含有:0.5μL人或小鼠GAPDH TaqMan探針(賽默飛世爾cat 4352934E或4351309),0.5μL適當的PNPLA3探針(市售,例如來自賽默飛世爾)以及5μL Lightcycler 480探針主混合液(羅氏Cat # 04887301001)。即時PCR是在LightCycler 480即時PCR系統(羅氏)完成。每個雙鏈體均測試了N=4次,並將數據歸一化至被非靶向的對照siRNA所轉染的細胞。為了計算相對的倍數變化,使用△△Ct方法分析了實時數據,並將其歸一化到為使用被非靶向的對照siRNA所轉染的細胞所執行的測定。
表12顯示了在Cos7細胞中表2和表3中所列出的dsRNA劑的篩選結果。表13顯示了在Cos7細胞中表4和表5中所列出的dsRNA劑的篩選結果。表14顯示了在Hep3B細胞中表4和表5中所列出的dsRNA劑的篩選結果。表15顯示了在Cos7細胞中表6和表7中所列出的dsRNA劑的篩選結果。表16顯示了在Cos7細胞中表8和表9中所列出的dsRNA劑的篩選結果。表17顯示了在Hep3B細胞中表8和表9中所列出的dsRNA劑的篩選結果。表18顯示了在Cos7細胞中表10和表11中所列出的dsRNA劑的篩選結果。表19顯示了在Hep3B細胞中表10和表11中所列出的dsRNA劑的篩選結果。
實施例3. 在小鼠中的dsRNA雙鏈體的體內篩選
從上述體外研究中鑑別出的感興趣的雙鏈體在體內進行了評估。特別地,在給藥前第14天,藉由靜脈內施用具有編碼人PNPLA3的腺相關病毒8(AAV8)載體的2 x 1011個病毒顆粒,以轉導野生型小鼠(C57BL/6)。特別地,給小鼠施用了編碼人PNPLA3 mRNA的開放閱讀框和3’UTR的AAV8,其編碼為NM_025225.2(AAV8.-TBG-PI-PNPLA3)。
在第0天,一組共三隻小鼠被皮下施用單次3mg/kg劑量或單次10mg/kg劑量的目標劑或PBS對照。表20提供了經處理組,而表21提供了感興趣的雙鏈體的正義股和反義股的修飾核苷酸序列。在給藥後第7天或第14天犧牲動物,收集肝臟樣本並在液態氮中速凍。提取組織mRNA並藉由RT-QPCR方法對其分析。
將人PNPLA3 mRNA量級與持家基因GAPDH進行了比較。然後將數值歸一化到PBS媒劑對照組的平均值。數據表示為基線值的百分比,並呈現為平均值加上標準差。表22中所列出並在圖1中所顯示的結果展示,所測試的示例性雙鏈體劑有效降低體內人PNPLA3信使RNA的量級。
從上述體外研究中鑑別出的其他的感興趣的雙鏈體亦在體內進行了評估。特別地,在給藥前第14天,藉由靜脈內施用具有編碼人PNPLA3的腺相關病毒8(AAV8)載體的2 x 1011個病毒顆粒,以轉導野生型小鼠(C57BL/6)。特別地,給小鼠施用了編碼人PNPLA3 mRNA的開放閱讀框和3’UTR的AAV8,其編碼為NM_025225.2(AAV8.-TBG-PI-PNPLA3)。
在第0天的0時間,一組共三隻小鼠被皮下施用單次3mg/kg劑量的目標劑(AD-517258.2除外),大約1小時後再用7mg/kg的劑量對其施用在0時間所施用的相同劑,或者在第0天的0時間對PBS對照組進行施用。被施用AD-517258.2的小鼠僅在在第0天的0時間以單次3mg/kg劑量對其施用。表20提供了經處理組,而表21提供了感興趣的雙鏈體的正義股和反義股的修飾核苷酸序列。在給藥後第7天犧牲動物,收集肝臟樣本並在液氮中速凍。提取組織mRNA並藉由RT-QPCR方法對其分析。
將人PNPLA3 mRNA量級與持家基因GAPDH進行了比較。然後將數值歸一化到PBS媒劑對照組的平均值。數據表示為基線值的百分比,並呈現為平均值加上標準差。表25中所列出並在圖2中所顯示的結果展示,所測試的示例性雙鏈體劑有效降低體內人PNPLA3信使RNA的量級。
從上述體外研究中鑑別出的其他的感興趣的雙鏈體也在AAV力價研究中進行了體內評估。特別地,在給藥前第14天,藉由靜脈內施用具有編碼人PNPLA3的腺相關病毒8(AAV8)載體的2 x 1011、2 x 1010、2 x 109、或2 x 108個病毒顆粒,以轉導野生型小鼠(C57BL/6)。特別地,給小鼠施用了編碼部
分人PNPLA3 mRNA的AAV8,該部分人PNPLA3 mRNA編碼人PNPLA3 mRNA的開放閱讀框和3’UTR,其編碼為NM_025225.2(AAV8.-TBG-PI-PNPLA3)。
在第0天的0時間,一組共三隻小鼠被皮下施用單次10mg/kg劑量的目標劑或PBS對照。表26提供了經處理組,而表27提供了感興趣的雙鏈體的正義股和反義股的修飾核苷酸序列。在給藥後第7天犧牲動物,收集肝臟樣本並在液態氮中速凍。提取組織mRNA並藉由RT-QPCR方法對其分析。
將人PNPLA3 mRNA量級與持家基因GAPDH進行了比較。然後將數值歸一化到PBS媒劑對照組的平均值。數據表示為基線值的百分比,並呈現為平均值加上標準差。表28中所列出並在圖3中所顯示的結果展示,所測試的示例性雙鏈體劑有效降低體內人PNPLA3信使RNA的量級。
從上述體外研究中鑑別出的其他的感興趣的雙鏈體也在體內進行了評估。特別地,在給藥前第14天(day-14),藉由靜脈內施用具有編碼人PNPLA3的腺相關病毒8(AAV8)載體的2 x 1011個(對應2.4 x 1013個基因體拷貝/毫升)病毒顆粒,以轉導野生型小鼠(C57BL/6)。特別地,給小鼠施用了編碼部
分人PNPLA3 mRNA的AAV8,該部分人PNPLA3 mRNA編碼人PNPLA3 mRNA的開放閱讀框和3’UTR,其編碼為NM_025225.2(AAV8.-TBG-PI-PNPLA3)。
在第0天,對每種目標劑,一組共三隻小鼠被皮下施用單次10mg/kg劑量的目標劑或PBS對照。另一組共三隻小鼠,對每種目標劑,被皮下施用在第0天的單次10mg/kg劑量的目標劑或PBS對照,以及之後的在第1天的10mg/kg劑量的劑。第三組共三隻小鼠,對每種目標劑,被皮下施用在第0天的單次10mg/kg劑量的目標劑或PBS對照,之後的在第1天的10mg/kg劑量的劑,以及進一步的在第2天的10mg/kg劑量的劑。表29提供了處理組,而表30提供了感興趣的雙鏈體的正義股和反義股的修飾核苷酸序列。在施用最後一劑的7天後犧牲動物,收集肝臟樣本並在液態氮中速凍。提取組織mRNA並藉由RT-QPCR方法對其分析。
將人PNPLA3 mRNA量級與持家基因GAPDH進行了比較。然後將數值歸一化到PBS媒劑對照組的平均值。數據表示為基線值的百分比,並呈現為平均值加上標準差。表31中所列出並在圖4中所顯示的結果展示,所測試的示例性雙鏈體劑有效降低體內人PNPLA3信使RNA的量級。
實施例4. 其他的dsRNA雙鏈體的設計,合成和體外篩選
使用本領域已知的和以上在實施例1中所述的方法設計、合成、和製備其他的siRNA。
表32顯示了其他的未修飾的PNPLA3正義股和反義股核苷酸序列的詳細列表。表33顯示了經修飾PNPLA3正義股和反義股核苷酸序列的詳細列表。
為了進行轉染,將細胞(ATCC美國標準生物品收藏中心,美國維吉尼亞州馬納薩斯)在37℃和5% CO2氣氛的條件下,在添加了10% FBS(ATCC)的伊格爾最低限度必需培養基(Gibco)中生長到接近匯合,然後藉由胰蛋白酶化使其從盤釋放。轉染的完成如下:在384孔盤的每一單個孔內,加入2.5μl每個siRNA雙鏈體,再加入7.5μl Opti-MEM加上0.1μl Lipofectamine RNAiMax(Invitrogen美國加州卡爾斯巴德市cat # 13778-150)。然後將混合物在室溫溫育15分鐘。然後將含有約1.5x104個Hep3B細胞的40μl不含抗生素的完全生長培養基加入siRNA混合物中。在RNA純化之前,將細胞溫育24小時。在50nM、10nM、1nM、和0.1nM的最終雙鏈體濃度執行了單一劑量實驗。
使用DYNABEADS執行總RNA的分離。簡而言之,將每孔的細胞在含有3μL珠粒的10μl裂解/結合緩衝液中裂解,並在靜電振動器混合10分鐘。清洗步驟在Biotek EL406,使用磁性盤支架自動進行。將珠粒在緩衝液A中清洗(以3μL)一次,在緩衝液B中清洗一次,以及在緩衝液E中清洗二次,並且在每二次清洗之間都有抽吸步驟。最終一次抽吸之後,將完整的12μL RT混合物加到每個孔中,如下所述。
對於cDNA的合成,每孔中加入一個反應的主混合液:1.5μl 10X緩衝液,0.6μl 25X dNTPs,1.5μl隨機引子,0.75μl反轉錄酶,0.75μl RNase抑制劑和9.9μl H2O。將盤密封,在靜電振動器攪動10分鐘,然後在37攝氏度溫育2小時。然後將盤在80攝氏度攪動8分鐘。
如上所述執行RT-qPCR,並如上所述計算相對的倍數變化。
表34顯示了表32和33中所列出的dsRNA劑在Hep3B細胞中的轉染測定的結果。表35顯示了表32和33中所列出的dsRNA劑在初代食蟹獼猴肝細胞(PCH)中的轉染測定的結果。
實施例5. 結構-活性關係分析
基於實施例4中的體外分析,執行了結構-活性關係(SAR)分析。特別是,設計、合成、和在體外和體內測定了其他的雙鏈體。
使用本領域已知的和如上所述的方法設計、合成和製備siRNA。使用這些siRNA在Hep3B和PCH細胞中的體外篩選測定如上所示被執行。
表36顯示了未修飾的PNPLA3正義股和反義股核苷酸序列的詳細列表。表37顯示了經修飾PNPLA3正義股和反義股核苷酸序列的詳細列表。
表38顯示了表36和37中所列出的dsRNA劑在Hep3B細胞中的轉染測定的結果。表39顯示了表36和37中所列出的dsRNA劑在初代食蟹獼猴肝細胞(PCH)中的轉染測定的結果。
實施例6. 小鼠中dsRNA雙鏈體的體內篩選
從上述體外SAR研究中鑑別出的感興趣的雙鏈體也在體內進行了評估。特別地,在給藥前第14天,藉由靜脈內施用具有編碼人PNPLA3的腺相關病毒8(AAV8)載體的2 x 1010個病毒顆粒,以轉導野生型小鼠(C57BL/6)。特別地,給小鼠施用了編碼部分人PNPLA3 mRNA的AAV8,該部分人PNPLA3 mRNA編碼人PNPLA3 mRNA的開放閱讀框和3’UTR,其被引用為NM_025225.2,被稱為AAV8-TBG-PI-PNPLA3。
在第0天,一組共三隻小鼠被皮下施用單次10mg/kg劑量的目標劑或PBS對照。表40提供了處理組,而表41提供了感興趣的雙鏈體。在給藥後第7天後犧牲動物,收集肝臟樣本並在液氮中速凍。提取肝臟mRNA並藉由RT-QPCR方法對其分析。
將人PNPLA3 mRNA量級與持家基因GAPDH進行了比較。然後將數值歸一化到PBS媒劑對照組的平均值。數據表示為基線值的百分比,並呈現為平均值加上標準差。表42中所列出並在圖5中所顯示的結果展示,所測試的示例性雙鏈體劑有效降低體內人PNPLA3信使RNA的量級。
從上述體外SAR研究中鑑別出的其他的感興趣的雙鏈體也在體內進行了評估。特別地,在給藥前第14天,藉由靜脈內施用具有編碼人PNPLA3的腺相關病毒8(AAV8)載體的2 x 1010個病毒顆粒,以轉導野生型小鼠(C57BL/6)。特別地,給小鼠施用了編碼人PNPLA3 mRNA的NM_025225.2的全長轉錄本的AAV8,其被稱為AAV8-TBG-PI-PNPLA3。
在第0天,一組共三隻小鼠被皮下施用單次10mg/kg劑量的目標劑或PBS對照。表43提供了處理組,而表44提供了感興趣的雙鏈體。在給藥後第7天後犧牲動物,收集肝臟樣本並在液態氮中速凍。提取肝臟mRNA並藉由RT-QPCR方法對其分析。
將人PNPLA3 mRNA量級與持家基因GAPDH進行了比較。然後將數值歸一化到PBS媒劑對照組的平均值。數據表示為基線值的百分比,並呈現為平均值加上標準差。表45中所列出並在圖6中所顯示的結果展示,所測試的示例性雙鏈體劑有效降低體內人PNPLA3信使RNA的量級。
從上述體外SAR研究中鑑別出的其他的感興趣的雙鏈體也在體內進行了評估。特別地,在給藥前第14天,藉由靜脈內施用具有編碼人PNPLA3的腺相關病毒8(AAV8)載體的2 x 1010個病毒顆粒,以轉導野生型小鼠(C57BL/6)。特別地,給小鼠施用了編碼人PNPLA3 mRNA的開放閱讀框和3’UTR的AAV8,其被引用為NM_025225.2,被稱為AAV8-TBG-PI-PNPLA3。
在第0天,一組共三隻小鼠被皮下施用單次10mg/kg劑量的目標劑或PBS對照。表46提供了處理組,而表47提供了感興趣的雙鏈體。在給藥後第7天後犧牲動物,收集肝臟樣本並在液態氮中速凍。提取肝臟mRNA並藉由RT-QPCR方法對其分析。
將人PNPLA3 mRNA量級與持家基因GAPDH進行了比較。然後將數值歸一化到PBS媒劑對照組的平均值。數據表示為基線值的百分比,並呈現為平均值加上標準差。表48中所列出並在圖7中所顯示的結果展示,所測試的示例性雙鏈體劑有效降低體內人PNPLA3信使RNA的量級。
實施例7. 其他的dsRNA雙鏈體的設計、合成和體外篩選
使用本領域已知的和以上在實施例1中所述的方法設計、合成、和製備其他的siRNA。
表49顯示了其他的未修飾的PNPLA3正義股和反義股核苷酸序列的詳細列表。表50顯示了經修飾PNPLA3正義股和反義股核苷酸序列的詳細列表。
藉由自由攝取和轉染執行其他劑的單一劑量篩選。
為了自由攝取,藉由將2.5μl siRNA雙鏈體添加到96孔盤的每一孔內進行實驗。然後,將含有約1.5 x 104個初代食蟹獼猴肝細胞(PCH)的完全生長培養基(47.5μl)加入到siRNA中。在RNA純化和RT-qPCR之前,將細胞溫
育48小時。在500nM、100nM、10nM、和1nM的最終雙鏈體濃度執行了單一劑量實驗。
為了轉染,將Hep3B細胞(ATCC美國標準生物品收藏中心,美國維吉尼亞州馬納薩斯)在37℃和5% CO2氣氛的條件下,在添加了10% FBS(ATCC)的伊格爾最低限度必需培養基(Gibco)中生長到接近匯合,然後藉由胰蛋白酶化使其從盤釋放。轉染的完成如下:在384孔盤的每一單個孔內,加入2.5μl每個siRNA雙鏈體,再加入7.5μl Opti-MEM加上0.1μl Lipofectamine RNAiMax(Invitrogen,美國加州卡爾斯巴德市cat # 13778-150)。然後將混合物在室溫溫育15分鐘。然後將含有約1.5x104個Hep3B細胞的40μl不含抗生素的完全生長培養基加入siRNA混合物中。在RNA純化之前,將細胞溫育24小時。在50nM、10nM、1nM、和0.1nM的最終雙鏈體濃度執行了單一劑量實驗。
使用DYNABEADS執行總RNA的分離。簡而言之,將每孔的細胞在含有3μL珠粒的10μl裂解/結合緩衝液中裂解,並在靜電振動器混合10分鐘。清洗步驟在Biotek EL406,使用磁性盤支架自動進行。將珠粒在緩衝液A中清洗(以3μL)一次,在緩衝液B中清洗一次,以及在緩衝液E中清洗二次,並且在每二次清洗之間都有抽吸步驟。最終一次抽吸之後,將完整的12μL RT混合物加到每個孔中,如下所述。
對於cDNA的合成,每孔中加入一個反應的主混合液:1.5μl 10X緩衝液,0.6μl 25X dNTPs,1.5μl隨機引子,0.75μl反轉錄酶,0.75μl RNase抑制劑和9.9μl H2O。將盤密封,在靜電振動器上攪動10分鐘,然後在37攝氏度溫育2小時。然後將盤在80攝氏度攪動8分鐘。
如上所述執行RT-qPCR,並如上所述計算相對的倍數變化。
表51顯示了表49和50中所列出的dsRNA劑在Hep3B細胞中的轉染測定的結果。表52顯示了表49和50中所列出的dsRNA劑在初代食蟹獼猴肝細胞(PCH)中的自由攝取實驗的結果。
本發明的具體例
在一個態樣中,本發明提供了一種雙股核糖核酸(dsRNA)劑,其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中的dsRNA劑包括正義股和反義股,該二股形成雙股區域,其中的正義股包
括與SEQ ID NO:1的核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸,並且反義股包括與SEQ ID NO:2的核苷酸序列相異不超過1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。在一個具體例中,dsRNA劑包括至少一種熱不穩定的核苷酸修飾,例如無鹼基修飾;雙鏈體中與對位核苷酸的錯配;以及不穩定的糖修飾,2’-去氧修飾,無環核苷酸,未鎖核酸(UNA)或二醇核酸(GNA),例如,反義股包括至少一個熱不穩定的核苷酸修飾。
在另一個態樣中,本發明提供了一種雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中所述dsRNA包括正義股和一反義股,該二股形成雙股區域,其中反義股包括編碼含類PATATIN磷脂酶結構域3(PNPLA3)的mRNA的互補性區域,並且其中的互補性區域包括與表2-11、21、24、27、30、32、33、36、37、49或50中任一者的任何一個反義核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個,接連的核苷酸。
在一個態樣中,本發明提供了一種雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中所述dsRNA包括正義股和反義股,該二股形成雙股區域,其中正義股包括與SEQ ID NO:1核苷酸序列中的核苷酸677-721、683-721、773-817、1185-1295、1185-1241、1202-1295、1202-1241、1255-1295、1738-1792、1901-1945、1920-1945、2108-2208、2108-2166、2108-2136,2121-2166、2121-2208、2169-2208、2176-2208、或2239-2265中的任何一個核苷酸序列相異不超過0、1、2或
3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸,並且反義股包括來自SEQ ID NO:2中相對應的核苷酸序列的至少19個接連的核苷酸。
在一個態樣中,本發明提供了一種雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中所述dsRNA包括一正義股和一反義股,該二股形成雙股區域,其中正義股包括與SEQ ID NO:1核苷酸序列中的核苷酸574-596、677-699、683-705、699-721、773-795、795-817、1185-1207、1192-1214、1202-1224、1208-1230、1209-1231、1210-1232、1211-1233、1212-1234、1213-1233、1214-1234、1214-1236、1215-1237、1216-1238、1219-1237、1219-1241、1255-1275、1256-1276、1257-1275、1257-1277、1258-1278、1259-1279、1260-1278、1260-1280、1261-1281、1262-1282、1263-1283、1264-1282、1264-1284、1265-1285、1267-1285、1266-1286、1266-1288、1267-1285、1267-1287、1268-1290、1269-1289、1270-1290、1271-1291、1272-1292、1273-1293、1274-1294、1275-1295、1631-1653、1738-1760、1739-1761、1740-1760、1740-1762、1741-1763、1744-1766、1746-1766、1750-1772、1751-1773、1752-1774、1753-1775、1754-1776、1755-1777、1756-1778、1757-1779、1758-1780、1759-1781、1760-1782、1761-1783、1762-1782、1762-1784、1763-1785、1764-1786、1765-1787、1766-1786、1766-1788、1767-1787、1768-1788、1767-1789、1769-1789、1770-1788、1770-1790、1771-1791、1772-1792、1815-1837、1901-1923,1920-1942,1923-1945、2112-2130、2169-2191、2171-2191、2176-2198,2177-2199,2178-2200、2179-2201,2180-2202、2181-
2203、2183-2205、2184-2206、2186-2208、2239-2261、2241-2263、2242-2264、或2243-2265中的任何一個核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸,並且反義股包括來自SEQ ID NO:2中相對應的核苷酸序列的至少19個接連的核苷酸。
在一個具體例中,反義股包括與選自下述所成之群組中任何一個雙鏈體的反義股核苷酸序列相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸:AD-517197.2、AD-517258.2、AD-516748.2、AD-516851.2、AD-519351.2、AD-519754.2、AD-519828.2、AD-520018.2、AD-520035.2、AD-520062.2、AD-520064.2、AD-520065.2、AD-520067.2、AD-75289.2、AD-520069.2、AD-520099.2、AD-67575.7、AD-520101.2、AD-67605.7、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、和AD-1193481.1。
在一個具體例中,反義股包括至少15個,例如15、16、17、18、19或20個接連的核苷酸,該接連的核苷酸與選自群組中任何一個雙鏈體的反義股核苷酸序列相異不超過0、1、2或3個核苷酸,該群組由下列序列組成:AD-519345.1、AD-519346.1、AD-519347.1、AD-67554.7、AD-519752.3、AD-1010731.1、AD-1010732.1、AD-519343.1、AD-519344.1、AD-519349.1、AD-519350.1、AD-519753.2、AD-519932.1、AD-519935.2、AD-520018.6、AD-517837.2、AD-805635.2、AD-519329.2、AD-520063.2、AD-519757.2、AD-805631.2、AD-516917.2、AD-516828.2、AD-518983.2、AD-
805636.2、AD-519754.7、AD-520062.2、AD-67575.9、AD-518923.3、AD-520053.4、AD-519667.2、AD-519773.2、AD-519354.2、AD-520060.4、AD-520061.4、AD-1010733.2、AD-1010735.2、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD-1193443.1、AD-1193471.1、和AD-1193481.1。
在一個態樣中,本發明提供了一種雙股核糖核酸(dsRNA),其用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達,其中dsRNA包括一正義股和一反義股,該二股形成雙股區域,其中正義股包括與SEQ ID NO:1核苷酸序列中的核苷酸1200-1250、1205-1250、11210-1250、1200-1245、1200-1240、1200-1235、1200-1237、1205-1237、1210-1232、1212-1237、1212-1234、1250-1300、1255-1300、1260-1300、1250-1295、1250-1390、1250-1285、1250-1282、1255-1282、1260-1282、1262-1300、1262-1295、1262-1390、和1262-1282中的任何一個核苷酸序列相異不超過3個核苷酸的至少15個接連的核苷酸,並且反義股包括來自SEQ ID NO:2中對應的核苷酸序列的至少15個接連的核苷酸。
在一個具體例中,反義股包括與選自下述所成之群組中任何一個雙鏈體的反義股核苷酸序列相異不超過0、1、2或3個核苷酸至少15個,例如15、16、17、18、19或20個接連的核苷酸:AD-519345、AD-1193350、AD-1193365、AD-1193437和AD-519347。
在一個具體例中,反義股包括與雙鏈體AD-519351的反義股核苷酸序列之任何一個相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-1193350的反義股核苷酸序列之任何一個相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-1193365的反義股核苷酸序列之任何一個相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-1193437的反義股核苷酸序列之任何一個相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個,接連的核苷酸。
在一個具體例中,反義股包括與雙鏈體AD-519347的反義股核苷酸序列之任何一個相異不超過0、1、2或3個核苷酸的至少15個,例如15、16、17、18、19或20個接連的核苷酸
在一個具體例中,dsRNA劑包括至少一個經修飾核苷酸。
在一個具體例中,實質上正義股的所有核苷酸包括修飾;實質上反義股的所有核苷酸包括修飾;或者,實質上正義股的所有核苷酸和實質上反義股的所有核苷酸包括修飾。
在一個具體例中,正義股的所有核苷酸包括修飾;反義股的所有核苷酸包括修飾;或者,正義股的所有核苷酸和反義股的所有核苷酸包括修飾。
在一個具體例中,至少一個經修飾核苷酸是選自於由下列所組成的群組:去氧-核苷酸、3'-末端去氧-胸腺嘧啶(dT)核苷酸、2'-O-甲基修飾核苷酸、2'-氟基修飾核苷酸、2'-去氧-修飾核苷酸、鎖核苷酸、未鎖核苷酸、構象限制核苷酸、約束乙基核苷酸、無鹼基核苷酸、2'-胺基-修飾核苷酸、2'-O-烯丙基-修飾核苷酸、2'-C-烷基-修飾核苷酸、2'-羥基-修飾核苷酸、2'-甲氧基乙基-修飾核苷酸、2'-O-烷基-修飾核苷酸、N-嗎啉基核苷酸、胺基磷酸酯、包括非自然鹼基的核苷酸、四氫哌喃修飾核苷酸、1,5-脫水己糖醇修飾核苷酸、環己烯基修飾核苷酸、包括硫代磷酸基團的核苷酸、包括甲基膦酸基團的核苷酸、包括5'-磷酸的核苷酸、包括5'-磷酸模擬物的核苷酸、熱不穩定的核苷酸、二醇修飾核苷酸(GNA)和2-O-(N-甲基乙醯胺)修飾核苷酸;及其組合。
在一個具體例中,核苷酸上的修飾是選自於由下述所組成的群組:LNA、HNA、CeNA、2'-甲氧基乙基、2'-O-烷基、2'-O-烯丙基、2'-C-烯丙基、2'-氟基、2'-去氧、2'-羥基、和二醇基;及其組合。
在一個具體例中,至少一個修飾核苷酸是選自於由下列物質所組成的群組:去氧-核苷酸、2'-O-甲基修飾核苷酸、2'-氟基修飾核苷酸、2'-去氧-修飾核苷酸、二醇修飾核苷酸(GNA),例如Ggn、Cgn、Tgn或Agn,和,乙烯基-膦酸核苷酸;及其組合。
在另一個具體例中,至少一個核苷酸的修飾為熱不穩定的核苷酸修飾。
在一個具體例中,熱不穩定的核苷酸修飾是選自於由下列物質所組成的群組:無鹼基修飾;雙鏈體中與對位核苷酸的錯配;和不穩定的糖修飾,2’-去氧修飾,無環核苷酸,未鎖核酸(UNA)以及二醇核酸(GNA)。
在一些具體例中,經修飾核苷酸包括3'-末端去氧-胸腺嘧啶核苷酸(dT)的短序列。
在一些具體例中,核苷酸的修飾是2’-O-甲基,GNA和2’-氟基修飾。
在一些具體例中,dsRNA劑進一步地包括至少一個硫代磷酸酯核苷酸間鍵聯。在一些具體例中,dsRNA劑包括6-8個硫代磷酸酯核苷酸間鍵聯。在一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的3'-末端。可選的,該股是反義股。在另一個具體例中,該股是正義股。在一個相關的具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的5'-末端。可選的,該股是反義股。在另一個具體例中,該股是正義股。在另一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯既位於一股的5'-末端,又位於該股的3'-末端。可選的,該股是反義股。在另一個具體例中,該股是正義股。
雙股區域可能是19-30個核苷酸對的長度;19-25個核苷酸對的長度;19-23個核苷酸對的長度;23-27個核苷酸對的長度;或者是21-23個核苷酸對的長度。
在一個具體例中,每股的長度是獨立地不超過30個核苷酸。
在一個具體例中,正義股的長度是21個核苷酸,並且反義股的長度是23個核苷酸。
互補性區域的長度可能是至少17個核苷酸;長度是介於19至23個核苷酸之間;或者,長度是19個核苷酸。
在一個具體例中,至少一股包括至少1個核苷酸的3'突出。在另一個具體例中,至少一股包括至少2個核苷酸的3'突出。
在一個具體例中,dsRNA劑進一步地包括配體。
在一個具體例中,該配體是接合到dsRNA劑之正義股的3'端。
在一個具體例中,配體是N-乙醯半乳糖胺(GalNAc)衍生物。
在一個具體例中,配體是藉由一價、二價或三價分枝鏈接子所附接的一個或多個GalNAc衍生物。
在一個具體例中,配體為
在一個具體例中,dsRNA劑如以下示方案所示被接合到配體
並且,其中的X是O或S。
在一個具體例中,X是O。
在一個具體例中,dsRNA劑進一步地包括至少一個硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯。
在一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的3'-末端,例如,反義股或正義股。
在另一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的5'-末端,例如,反義股或正義股。
在一個具體例中,硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯既位於一股的5'-末端,又位於該股的3'-末端。在一個具體例中,該股是反義股。
在一個具體例中,位於雙鏈體之反義股的5'-端1位置的鹼基對是AU鹼基對。
本發明還提供了含有本發明之任何dsRNA劑的細胞,以及包括本發明之任何dsRNA劑的醫藥組成物。
本發明的醫藥組成物可以包含在未緩衝溶液中的dsRNA劑,例如鹽水或水,或者本發明的醫藥組成物可以包含在緩衝溶液中的dsRNA劑,例如包括乙酸鹽、檸檬酸鹽、醇溶蛋白、碳酸鹽、或磷酸鹽或其任何組合的緩衝溶液;或者磷酸鹽緩衝鹽水(PBS)。
在一個態樣中,本發明提供了一種抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)基因表達的方法。該方法包含使細胞與本發明的任何dsRNA或本發明的任何醫藥組成物接觸,從而抑制細胞中PNPLA3基因的表達。
在一個具體例中,細胞是位於受試者內,例如一人類受試者,例如一個受試者,其具有一種含類PATATIN磷脂酶結構域3(PNPLA3)相關病症,諸如選自於由下列病症所組成的群組的一種含類PATATIN磷脂酶結構域3(PNPLA3)相關病症:脂肪肝(脂肪變性)、非酒精性脂肪性肝炎
(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、或非酒精性脂肪肝疾病(NAFLD)。
在一個具體例中,使細胞與dsRNA劑接觸係抑制PNPLA3表達的程度至少50%、60%、70%、80%、90%、或95%。
在一個具體例中,抑制PNPLA3的表達使受試者血清中PNPLA3蛋白質量級降低的程度至少50%、60%、70%、80%、90%、或95%。
在一個態樣中,本發明提供了一種治療受試者的方法,該受試者所罹患病症將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達的減低。該方法包含向受試者施用治療有效量的本發明的任何dsRNA或本發明的任何醫藥組成物,從而治療罹患將受益於PNPLA3表達的減低的病症的受試者。
在另一個態樣中,本發明提供了一種預防受試者至少一項症狀的方法,該受試者所罹患病症將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達的減低。該方法包含向受試者施用預防有效量的本發明的任何dsRNA或本發明的任何醫藥組成物,從而預防罹患將受益於含PNPLA3表達的減低的受試者至少一項症狀。
在一個具體例中,該病症為一種含類PATATIN磷脂酶結構域3(PNPLA3)相關病症,例如,含類PATATIN磷脂酶結構域3(PNPLA3)相關病症選自於由下列病症所組成的群組:脂肪肝(脂肪變性),非酒精性脂肪性肝炎(NASH),肝硬化,肝臟中脂肪累積,肝臟發炎,肝細胞的壞死,肝臟纖維化,肥胖症,或非酒精性脂肪肝疾病(NAFLD)。
在一個具體例中,PNPLA3相關病症是NAFLD。
在一個具體例中,受試者是人。
在一個具體例中,給受試者施用的dsRNA劑的一次劑量為約0.01mg/kg至約50mg/kg。
在一個具體例中,dsRNA劑是以皮下注射施用給受試者。
在一個具體例中,本發明的方法包含進一步地測定取自受試者的一個或多個樣本中PNPLA3的量級。
在一個具體例中,一個(或多個)受試者樣本中含類PATATIN磷脂酶結構域3(PNPLA3)的量級,是指血液或血清樣本中的含類PATATIN磷脂酶結構域3(PNPLA3)的蛋白質的量級。
在一些具體例中,本發明的方法進一步地包括給受試者施用額外的治療劑。在一個進一步的實施方案中,額外的治療劑選自於由下列物質所組成的群組:HMG-CoA還原酶抑制劑,纖維酸鹽衍生物,膽汁酸隔離劑,菸鹼酸,抗血小板劑,血管收縮素轉化酶抑制劑,血管收縮素II受體的拮抗劑,醯基輔酶膽固醇乙醯基轉移酶(ACAT)抑制劑,膽固醇吸收抑制劑,膽固醇酯轉蛋白(CETP)抑制劑,微粒體三酸甘油酯轉移蛋白(MTTP)抑制劑,膽固醇調節劑,膽汁酸調節劑,過氧化物酶體增殖活化受體(PPAR)激動劑,基因療法,複合血管保護劑,醣蛋白Ilb/IIIa抑制劑,阿司匹林或類阿司匹林化合物,IBAT抑制劑,角鯊烯合成酶抑制劑,單核球趨化蛋白(MCP)-I抑制劑,或魚油。
本發明亦提供了試劑盒,該試劑盒包括本發明的任何dsRNA或本發明的任何醫藥組成物,以及可選的,使用說明書。
均等物
僅使用常規的實驗法,所屬技術領域者將辨識出或能夠確認本文所述的具體具體例和方法的許多等同的方式和方法。此種等同的方式和方法意圖被如下請求項之申請專利範圍的範圍所涵蓋。
Claims (73)
- 一種用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達的雙股核糖核酸(dsRNA),其中該dsRNA包括形成雙股區域的正義股和反義股,其中該反義股包括編碼PNPLA3的mRNA的互補性區域,並且其中該互補性區域包括與表2-11、21、24、27、30、32、33、36、37、49或50中任一者的任何一個反義核苷酸序列相異不超過3個核苷酸的至少15個接連的核苷酸。
- 一種用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達的雙股核糖核酸(dsRNA),其中該dsRNA包括形成雙股區域的正義股和反義股,其中該正義股包括與SEQ ID NO:1的核苷酸677-721、683-721、773-817、1185-1295、1185-1241、1202-1295、1202-1241、1255-1295、1738-1792、1901-1945、1920-1945、2108-2208、2108-2166、2108-2136,2121-2166、2121-2208、2169-2208、2176-2208、或2239-2265的核苷酸序列中任何一個相異不超過3個核苷酸的至少15個接連的核苷酸,並且該反義股包括來自SEQ ID NO:2對應的核苷酸序列的至少15個接連的核苷酸。
- 一種用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達的雙股核糖核酸(dsRNA),其中該dsRNA包括形成雙股區域的正義股和反義股,其中該正義股包括與SEQ ID NO:1的核苷酸574-596、677-699、683-705、699-721、773-795、795-817、1185-1207、1192-1214、1202-1224、1208-1230、1209-1231、1210-1232、1211-1233、1212-1234、1213-1233、1214-1234、1214-1236、1215-1237、1216-1238、1219-1237、1219-1241、1255-1275、1256-1276、1257-1275、1257-1277、1258- 1278、1259-1279、1260-1278、1260-1280、1261-1281、1262-1282、1263-1283、1264-1282、1264-1284、1265-1285、1267-1285、1266-1286、1266-1288、1267-1285、1267-1287、1268-1290、1269-1289、1270-1290、1271-1291、1272-1292、1273-1293、1274-1294、1275-1295、1631-1653、1738-1760、1739-1761、1740-1760、1740-1762、1741-1763、1744-1766、1746-1766、1750-1772、1751-1773、1752-1774、1753-1775、1754-1776、1755-1777、1756-1778、1757-1779、1758-1780、1759-1781、1760-1782、1761-1783、1762-1782、1762-1784、1763-1785、1764-1786、1765-1787、1766-1786、1766-1788、1767-1787、1768-1788、1767-1789、1769-1789、1770-1788、1770-1790、1771-1791、1772-1792、1815-1837、1901-1923,1920-1942,1923-1945、2112-2130、2169-2191、2171-2191、2176-2198,2177-2199,2178-2200、2179-2201,2180-2202、2181-2203、2183-2205、2184-2206、2186-2208、2239-2261、2241-2263、2242-2264、或2243-2265的核苷酸序列中任何一個相異不超過3個核苷酸的至少15個接連的核苷酸,並且該反義股包括來自SEQ ID NO:2對應的核苷酸序列的至少15個接連的核苷酸。
- 如請求項1至3中任一項所述之dsRNA劑,其中該反義股包括與選自於由AD-517197.2、AD-517258.2、AD-516748.2、AD-516851.2、AD-519351.2、AD-519754.2、AD-519828.2、AD-520018.2、AD-520035.2、AD-520062.2、AD-520064.2、AD-520065.2、AD-520067.2、AD-75289.2、AD-520069.2、AD-520099.2、AD-67575.7、AD-520101.2、AD-1193323.1、AD-1193344.1、AD-1193350.1、AD-1193365.1、AD-1193379.1、AD-1193407.1、AD-1193421.1、AD-1193422.1、AD-1193429.1、AD-1193437.1、AD- 1193443.1、AD-1193471.1、AD-1193481.1和AD-67605.7所組成的群組中任何一個雙鏈體的反義股核苷酸序列相異不超過3個核苷酸的至少15個接連的核苷酸。
- 如請求項1至3中任一項所述之dsRNA劑,其中該反義股包括與選自於由AD-519345.1、AD-519346.1、AD-519347.1、AD-67554.7、AD-519752.3、AD-1010731.1、AD-1010732.1、AD-519343.1、AD-519344.1、AD-519349.1、AD-519350.1、AD-519753.2、AD-519932.1、AD-519935.2、AD-520018.6、AD-517837.2、AD-805635.2、AD-519329.2、AD-520063.2、AD-519757.2、AD-805631.2、AD-516917.2、AD-516828.2、AD-518983.2、AD-805636.2、AD-519754.7、AD-520062.2、AD-67575.9、AD-518923.3、AD-520053.4、AD-519667.2、AD-519773.2、AD-519354.2、AD-520060.4、AD-520061.4、AD-1010733.2、和AD-1010735.2所組成的群組中任何一個雙鏈體的反義股核苷酸序列相異不超過3個核苷酸的至少15個接連的核苷酸。
- 一種用於抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)的表達的雙股核糖核酸(dsRNA),其中該dsRNA包括形成雙股區域的正義股和反義股,其中該正義股包括與SEQ ID NO:1的核苷酸1200-1250、1205-1250、11210-1250、1200-1245、1200-1240、1200-1235、1200-1237、1205-1237、1210-1232、1212-1237、1212-1234、1250-1300、1255-1300、1260-1300、1250-1295、1250-1390、1250-1285、1250-1282、1255-1282、1260-1282、1262-1300、1262-1295、1262-1390、和1262-1282的核苷酸序列中任何一個相異不超過3個核苷酸的至少15個接連的核苷酸,並且該反義股包括來自SEQ ID NO:2對應的核苷酸序列的至少15個接連的核苷酸。
- 如請求項1至6中任一項所述之dsRNA劑,其中該反義股包括與選自於由AD-519351、AD-519345、AD-1193350、AD-1193365、AD-1193437和AD-519347所組成的群組中任何一個雙鏈體的反義股核苷酸序列相異不超過3個核苷酸的至少15個接連的核苷酸。
- 如請求項1至7中任一項所述之dsRNA劑,其中該dsRNA劑包括至少一個經修飾核苷酸。
- 如請求項1至8中任一項所述之dsRNA劑,其中正義股的實質上所有核苷酸包括修飾;反義股的實質上所有核苷酸包括修飾;或者,正義股的實質上所有核苷酸和反義股的實質上所有核苷酸包括修飾。
- 如請求項1至9中任一項所述之dsRNA劑,其中正義股的所有核苷酸包括修飾;反義股的所有核苷酸包括修飾;或者,正義股的所有核苷酸和反義股的所有核苷酸包括修飾。
- 如請求項8至10中任一項所述之dsRNA劑,其中至少經修飾核苷酸是選自於由下述所組成之群組:去氧-核苷酸、3'-末端去氧-胸腺嘧啶(dT)核苷酸、2'-O-甲基修飾核苷酸、2'-氟基修飾核苷酸、2'-去氧-修飾核苷酸、鎖核苷酸、未鎖核苷酸、構象限制核苷酸、約束乙基核苷酸、無鹼基核苷酸、2'-胺基-修飾核苷酸、2'-O-烯丙基-修飾核苷酸、2'-C-烷基-修飾核苷酸、2'-羥基-修飾核苷酸、2'-甲氧基乙基-修飾核苷酸、2'-O-烷基-修飾核苷酸、N-嗎啉基核苷酸、胺基磷酸酯、包括非自然鹼基的核苷酸、四氫哌喃修飾核苷酸、1,5-脫水己糖醇修飾核苷酸、環己烯基修飾核苷酸、包括硫代磷酸基團的核苷酸、包括甲基膦酸基團的核苷酸、包括5'-磷酸的核苷酸、包括5'-磷酸模擬物 的核苷酸、熱不穩定的核苷酸、二醇修飾核苷酸(GNA)和2-O-(N-甲基乙醯胺)修飾核苷酸;及其組合。
- 如請求項8至10中任一項所述之dsRNA劑,其中核苷酸的修飾是選自於由下述所組成之群組:LNA、HNA、CeNA、2'-甲氧基乙基、2'-O-烷基、2'-O-烯丙基、2'-C-烯丙基、2'-氟基、2'-去氧、2'-羥基、和二醇基;及其組合。
- 如請求項8至10中任一項所述之dsRNA劑,其中至少一個經修飾核苷酸是選自於由下述所組成之群組:去氧-核苷酸、2'-O-甲基修飾核苷酸、2'-氟基修飾核苷酸、2'-去氧-修飾核苷酸、二醇修飾核苷酸(GNA)、和、乙烯基-膦酸核苷酸;及其組合。
- 如請求項8至10中任一項所述之dsRNA劑,其中該核苷酸的至少一個修飾為熱不穩定的核苷酸修飾。
- 如請求項14所述之dsRNA劑,其中熱不穩定的核苷酸修飾是選自於由下述所組成之群組:無鹼基修飾、雙鏈體中與對位核苷酸的錯配;和不穩定的糖修飾、2’-去氧修飾、無環核苷酸、未鎖核酸(UNA)以及二醇核酸(GNA)。
- 如請求項1至15中任一項所述之dsRNA劑,其中該雙股區域為19-30個核苷酸對的長度。
- 如請求項16所述之dsRNA劑,其中該雙股區域為19-25個核苷酸對的長度。
- 如請求項16所述之dsRNA劑,其中該雙股區域為19-23個核苷酸對的長度。
- 如請求項16所述之dsRNA劑,其中該雙股區域為23-27個核苷酸對的長度。
- 如請求項16所述之dsRNA劑,其中該雙股區域為21-23個核苷酸對的長度。
- 如請求項1至20中任一項所述之dsRNA劑,其中每股是獨立地不超過30個核苷酸的長度。
- 如請求項1至21中任一項所述之dsRNA劑,其中正義股是21個核苷酸的長度,並且反義股是23個核苷酸的長度。
- 如請求項1至22中任一項所述之dsRNA劑,其中該互補性區域是至少17核苷酸的長度。
- 如請求項1至23中任一項所述之dsRNA劑,其中該互補性區域是介於19至23個核苷酸之間的長度。
- 如請求項1至24中任一項所述之dsRNA劑,其中該互補性區域是19個核苷酸的長度。
- 如請求項1至25中任一項所述之dsRNA劑,其中至少一股包括至少1個核苷酸的3'突出。
- 如請求項1至25中任一項所述之dsRNA劑,其中至少一股包括至少2個核苷酸的3'突出。
- 如請求項1至27中任一項所述之dsRNA劑,進一步地包括配體。
- 如請求項28所述之dsRNA劑,其中該配體是接合到dsRNA劑之正義股的3'端。
- 如請求項28或29所述之dsRNA劑,其中該配體是N-乙醯半乳糖胺(GalNAc)衍生物。
- 如請求項28至30中任一項所述之dsRNA劑,其中該配體是藉由一價、二價或三價分枝鏈接子所附接的一個或多個GalNAc衍生物。
- 如請求項33所述之dsRNA劑,其中X是O。
- 如請求項1至34中任一項所述之dsRNA劑,其中該dsRNA劑進一步地包括至少一個硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯。
- 如請求項35所述之dsRNA劑,其中該硫代磷酸酯或甲基磷酸酯核苷酸間鍵聯是位於一股的3'-末端。
- 如請求項36所述之dsRNA劑,其中該股是反義股。
- 如請求項36所述之dsRNA劑,其中該股是正義股。
- 如請求項35所述之dsRNA劑,其中該硫代磷酸酯或甲基膦酸酯核苷酸間鍵聯是位於一股的5'-末端。
- 如請求項39所述之dsRNA劑,其中該股是反義股。
- 如請求項39所述之dsRNA劑,其中該股是正義股。
- 如請求項35所述之dsRNA劑,其中該硫代磷酸酯或甲基膦酸酯核苷酸間鍵聯位於一股的5'-末端及該股的3'-末端。
- 如請求項42所述之dsRNA劑,其中該股是反義股。
- 如請求項1至43中任一項所述之dsRNA劑,其中位於雙鏈體之反義股的5'-端1位置的鹼基對是AU鹼基對。
- 一種含有如請求項1至44中任一項所述之dsRNA劑的細胞。
- 一種用於抑制編碼含類PATATIN磷脂酶結構域3(PNPLA3)基因之表達的醫藥組成物,其包括如請求項1至44中任一項所述之dsRNA劑。
- 如請求項46所述之醫藥組成物,其中dsRNA劑是在未緩衝溶液中。
- 如請求項47所述之醫藥組成物,其中該未緩衝溶液是鹽水或水。
- 如請求項46所述之醫藥組成物,其中該dsRNA劑是在緩衝溶液中。
- 如請求項49所述之醫藥組成物,其中該緩衝溶液包括乙酸鹽、檸檬酸鹽、醇溶蛋白、碳酸鹽、或磷酸鹽或其任何組合。
- 如請求項50所述之醫藥組成物,其中該緩衝溶液是磷酸鹽緩衝鹽水(PBS)。
- 一種抑制細胞中含類PATATIN磷脂酶結構域3(PNPLA3)基因表達的方法,該方法包括使細胞與如請求項1至44中任一項所述之dsRNA劑或如請求項48至51中任一項所述之醫藥組成物接觸,從而抑制細胞中PNPLA3基因的表達。
- 如請求項52所述之方法,其中該細胞是位於受試者內。
- 如請求項53所述之方法,其中該受試者是人類。
- 如請求項52所述之方法,其中該受試者患有一種PNPLA3相關病症。
- 如請求項55項所述之方法,其中該PNPLA3相關病症是選自於由下述所組成之群組:脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、以及非酒精性脂肪肝疾病(NAFLD)。
- 如請求項52至56中任一項所述之方法,其中使細胞與dsRNA劑接觸係抑制PNPLA3表達的程度至少50%、60%、70%、80%、90%、或95%。
- 如請求項52至57中任一項所述之方法,其中抑制PNPLA3的表達使受試者血清中PNPLA3蛋白質量級降低的程度至少50%、60%、70%、80%、90%、或95%。
- 一種治療罹患將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達減低的病症的受試者的方法,包括向受試者施用治療有效量的如請求項1至44中任一項所述之dsRNA劑或如請求項46至51中任一項所述之醫藥組成物,從而治療罹患病症將受益於PNPLA3表達減低的病症的受試者。
- 一種預防罹患將受益於含類PATATIN磷脂酶結構域3(PNPLA3)表達之減低低的病症的受試者至少一項症狀的方法,包括向受試者施用預防有效量的如請求項1至44中任一項所述之dsRNA劑或如請求項46至51中任一所述之醫藥組成物,從而預防罹患將受益於PNPLA3表達之減低的病症的受試者至少一項症狀。
- 如請求項59或60所述之方法,其中該病症是PNPLA3相關病症。
- 如請求項61所述之方法,其中該PNPLA3相關病症是選自於由下述所組成之群組:脂肪肝(脂肪變性)、非酒精性脂肪性肝炎(NASH)、肝硬化、肝臟中脂肪累積、肝臟發炎、肝細胞的壞死、肝臟纖維化、肥胖症、以及非酒精性脂肪肝疾病(NAFLD)。
- 如請求項61所述之方法,其中該PNPLA3相關病症是NAFLD。
- 如請求項61所述之方法,其中該受試者是人類。
- 如請求項59或60所述之方法,其中向受試者施用劑係導致PNPLA3蛋白質累積的減少。
- 如請求項59至65中任一項所述之方法,其中該dsRNA劑是以約0.01mg/kg至約50mg/kg的劑量施用給受試者。
- 如請求項59至66中任一項所述之方法,其中該dsRNA劑是以皮下注射施用給受試者。
- 如請求項59至67中任一項所述之方法,進一步包括確定取自受試者的樣本中PNPLA3的量級。
- 如請求項68所述之方法,其中該受試者樣本中PNPLA3的量級,是指血液或血清樣本中的PNPLA3的蛋白質的量級。
- 如請求項59至69中任一項所述之方法,進一步包括給受試者施用額外的用於治療PNPLA3相關病症的治療劑。
- 一種包括如請求項1至44中任一項所述之dsRNA劑或如請求項46至51中任一項所述之醫藥組成物的試劑盒。
- 一種包括如請求項1至44中任一項所述之dsRNA劑或如請求項46至51中任一項所述之醫藥組成物的小瓶。
- 一種包括如請求項1至44中任一項所述之dsRNA劑或如請求項46至51中任一項所述之醫藥組成物的注射器。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962948445P | 2019-12-16 | 2019-12-16 | |
| US62/948,445 | 2019-12-16 | ||
| US202063040602P | 2020-06-18 | 2020-06-18 | |
| US63/040,602 | 2020-06-18 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| TW202138559A true TW202138559A (zh) | 2021-10-16 |
Family
ID=74046218
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW109144095A TW202138559A (zh) | 2019-12-16 | 2020-12-14 | 含類PATATIN磷脂酶結構域3(PNPLA3)iRNA組成物及其使用方法 |
Country Status (4)
| Country | Link |
|---|---|
| CL (2) | CL2022001590A1 (zh) |
| TW (1) | TW202138559A (zh) |
| WO (1) | WO2021126734A1 (zh) |
| ZA (1) | ZA202306590B (zh) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW201904587A (zh) | 2017-06-02 | 2019-02-01 | 新加坡商波濤生命科學有限公司 | 寡核苷酸組合物及其使用方法 |
| EP3630199A4 (en) | 2017-06-02 | 2021-11-10 | Wave Life Sciences Ltd. | COMPOSITIONS OF OLIGONUCLEOTIDES AND THEIR METHODS OF USE |
| TWI869213B (zh) | 2018-09-19 | 2025-01-01 | 美商Ionis製藥公司 | Pnpla3表現之調節劑 |
| TW202313974A (zh) * | 2021-06-08 | 2023-04-01 | 瑞典商阿斯特捷利康公司 | 用於治療肝病之組合療法 |
| TW202346586A (zh) * | 2022-01-28 | 2023-12-01 | 大陸商上海舶望製藥有限公司 | 用於抑制前激肽釋放酶(pkk)蛋白表達的組合物和方法 |
Family Cites Families (215)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3687808A (en) | 1969-08-14 | 1972-08-29 | Univ Leland Stanford Junior | Synthetic polynucleotides |
| US4469863A (en) | 1980-11-12 | 1984-09-04 | Ts O Paul O P | Nonionic nucleic acid alkyl and aryl phosphonates and processes for manufacture and use thereof |
| US5023243A (en) | 1981-10-23 | 1991-06-11 | Molecular Biosystems, Inc. | Oligonucleotide therapeutic agent and method of making same |
| US4476301A (en) | 1982-04-29 | 1984-10-09 | Centre National De La Recherche Scientifique | Oligonucleotides, a process for preparing the same and their application as mediators of the action of interferon |
| JPS5927900A (ja) | 1982-08-09 | 1984-02-14 | Wakunaga Seiyaku Kk | 固定化オリゴヌクレオチド |
| FR2540122B1 (fr) | 1983-01-27 | 1985-11-29 | Centre Nat Rech Scient | Nouveaux composes comportant une sequence d'oligonucleotide liee a un agent d'intercalation, leur procede de synthese et leur application |
| US4605735A (en) | 1983-02-14 | 1986-08-12 | Wakunaga Seiyaku Kabushiki Kaisha | Oligonucleotide derivatives |
| US4948882A (en) | 1983-02-22 | 1990-08-14 | Syngene, Inc. | Single-stranded labelled oligonucleotides, reactive monomers and methods of synthesis |
| US4824941A (en) | 1983-03-10 | 1989-04-25 | Julian Gordon | Specific antibody to the native form of 2'5'-oligonucleotides, the method of preparation and the use as reagents in immunoassays or for binding 2'5'-oligonucleotides in biological systems |
| US4587044A (en) | 1983-09-01 | 1986-05-06 | The Johns Hopkins University | Linkage of proteins to nucleic acids |
| US5118802A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | DNA-reporter conjugates linked via the 2' or 5'-primary amino group of the 5'-terminal nucleoside |
| US5118800A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | Oligonucleotides possessing a primary amino group in the terminal nucleotide |
| US5550111A (en) | 1984-07-11 | 1996-08-27 | Temple University-Of The Commonwealth System Of Higher Education | Dual action 2',5'-oligoadenylate antiviral derivatives and uses thereof |
| FR2567892B1 (fr) | 1984-07-19 | 1989-02-17 | Centre Nat Rech Scient | Nouveaux oligonucleotides, leur procede de preparation et leurs applications comme mediateurs dans le developpement des effets des interferons |
| US5367066A (en) | 1984-10-16 | 1994-11-22 | Chiron Corporation | Oligonucleotides with selectably cleavable and/or abasic sites |
| US5430136A (en) | 1984-10-16 | 1995-07-04 | Chiron Corporation | Oligonucleotides having selectably cleavable and/or abasic sites |
| US5258506A (en) | 1984-10-16 | 1993-11-02 | Chiron Corporation | Photolabile reagents for incorporation into oligonucleotide chains |
| US4828979A (en) | 1984-11-08 | 1989-05-09 | Life Technologies, Inc. | Nucleotide analogs for nucleic acid labeling and detection |
| FR2575751B1 (fr) | 1985-01-08 | 1987-04-03 | Pasteur Institut | Nouveaux nucleosides de derives de l'adenosine, leur preparation et leurs applications biologiques |
| US5185444A (en) | 1985-03-15 | 1993-02-09 | Anti-Gene Deveopment Group | Uncharged morpolino-based polymers having phosphorous containing chiral intersubunit linkages |
| US5235033A (en) | 1985-03-15 | 1993-08-10 | Anti-Gene Development Group | Alpha-morpholino ribonucleoside derivatives and polymers thereof |
| US5034506A (en) | 1985-03-15 | 1991-07-23 | Anti-Gene Development Group | Uncharged morpholino-based polymers having achiral intersubunit linkages |
| US5166315A (en) | 1989-12-20 | 1992-11-24 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| US5405938A (en) | 1989-12-20 | 1995-04-11 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4762779A (en) | 1985-06-13 | 1988-08-09 | Amgen Inc. | Compositions and methods for functionalizing nucleic acids |
| US5317098A (en) | 1986-03-17 | 1994-05-31 | Hiroaki Shizuya | Non-radioisotope tagging of fragments |
| JPS638396A (ja) | 1986-06-30 | 1988-01-14 | Wakunaga Pharmaceut Co Ltd | ポリ標識化オリゴヌクレオチド誘導体 |
| US5276019A (en) | 1987-03-25 | 1994-01-04 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US5264423A (en) | 1987-03-25 | 1993-11-23 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US4904582A (en) | 1987-06-11 | 1990-02-27 | Synthetic Genetics | Novel amphiphilic nucleic acid conjugates |
| JP2828642B2 (ja) | 1987-06-24 | 1998-11-25 | ハワード フローレイ インスティテュト オブ イクスペリメンタル フィジオロジー アンド メディシン | ヌクレオシド誘導体 |
| US5585481A (en) | 1987-09-21 | 1996-12-17 | Gen-Probe Incorporated | Linking reagents for nucleotide probes |
| US4924624A (en) | 1987-10-22 | 1990-05-15 | Temple University-Of The Commonwealth System Of Higher Education | 2,',5'-phosphorothioate oligoadenylates and plant antiviral uses thereof |
| US5188897A (en) | 1987-10-22 | 1993-02-23 | Temple University Of The Commonwealth System Of Higher Education | Encapsulated 2',5'-phosphorothioate oligoadenylates |
| US5525465A (en) | 1987-10-28 | 1996-06-11 | Howard Florey Institute Of Experimental Physiology And Medicine | Oligonucleotide-polyamide conjugates and methods of production and applications of the same |
| DE3738460A1 (de) | 1987-11-12 | 1989-05-24 | Max Planck Gesellschaft | Modifizierte oligonukleotide |
| US5082830A (en) | 1988-02-26 | 1992-01-21 | Enzo Biochem, Inc. | End labeled nucleotide probe |
| EP0406309A4 (en) | 1988-03-25 | 1992-08-19 | The University Of Virginia Alumni Patents Foundation | Oligonucleotide n-alkylphosphoramidates |
| US5278302A (en) | 1988-05-26 | 1994-01-11 | University Patents, Inc. | Polynucleotide phosphorodithioates |
| US5109124A (en) | 1988-06-01 | 1992-04-28 | Biogen, Inc. | Nucleic acid probe linked to a label having a terminal cysteine |
| US5216141A (en) | 1988-06-06 | 1993-06-01 | Benner Steven A | Oligonucleotide analogs containing sulfur linkages |
| US5175273A (en) | 1988-07-01 | 1992-12-29 | Genentech, Inc. | Nucleic acid intercalating agents |
| US5262536A (en) | 1988-09-15 | 1993-11-16 | E. I. Du Pont De Nemours And Company | Reagents for the preparation of 5'-tagged oligonucleotides |
| US5512439A (en) | 1988-11-21 | 1996-04-30 | Dynal As | Oligonucleotide-linked magnetic particles and uses thereof |
| US5457183A (en) | 1989-03-06 | 1995-10-10 | Board Of Regents, The University Of Texas System | Hydroxylated texaphyrins |
| US5599923A (en) | 1989-03-06 | 1997-02-04 | Board Of Regents, University Of Tx | Texaphyrin metal complexes having improved functionalization |
| US5391723A (en) | 1989-05-31 | 1995-02-21 | Neorx Corporation | Oligonucleotide conjugates |
| US4958013A (en) | 1989-06-06 | 1990-09-18 | Northwestern University | Cholesteryl modified oligonucleotides |
| US5744101A (en) | 1989-06-07 | 1998-04-28 | Affymax Technologies N.V. | Photolabile nucleoside protecting groups |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| US5451463A (en) | 1989-08-28 | 1995-09-19 | Clontech Laboratories, Inc. | Non-nucleoside 1,3-diol reagents for labeling synthetic oligonucleotides |
| US5134066A (en) | 1989-08-29 | 1992-07-28 | Monsanto Company | Improved probes using nucleosides containing 3-dezauracil analogs |
| US5254469A (en) | 1989-09-12 | 1993-10-19 | Eastman Kodak Company | Oligonucleotide-enzyme conjugate that can be used as a probe in hybridization assays and polymerase chain reaction procedures |
| US5591722A (en) | 1989-09-15 | 1997-01-07 | Southern Research Institute | 2'-deoxy-4'-thioribonucleosides and their antiviral activity |
| US5399676A (en) | 1989-10-23 | 1995-03-21 | Gilead Sciences | Oligonucleotides with inverted polarity |
| WO1991006556A1 (en) | 1989-10-24 | 1991-05-16 | Gilead Sciences, Inc. | 2' modified oligonucleotides |
| US5264564A (en) | 1989-10-24 | 1993-11-23 | Gilead Sciences | Oligonucleotide analogs with novel linkages |
| US5292873A (en) | 1989-11-29 | 1994-03-08 | The Research Foundation Of State University Of New York | Nucleic acids labeled with naphthoquinone probe |
| US5177198A (en) | 1989-11-30 | 1993-01-05 | University Of N.C. At Chapel Hill | Process for preparing oligoribonucleoside and oligodeoxyribonucleoside boranophosphates |
| CA2029273A1 (en) | 1989-12-04 | 1991-06-05 | Christine L. Brakel | Modified nucleotide compounds |
| US5486603A (en) | 1990-01-08 | 1996-01-23 | Gilead Sciences, Inc. | Oligonucleotide having enhanced binding affinity |
| US5852188A (en) | 1990-01-11 | 1998-12-22 | Isis Pharmaceuticals, Inc. | Oligonucleotides having chiral phosphorus linkages |
| US5459255A (en) | 1990-01-11 | 1995-10-17 | Isis Pharmaceuticals, Inc. | N-2 substituted purines |
| US7037646B1 (en) | 1990-01-11 | 2006-05-02 | Isis Pharmaceuticals, Inc. | Amine-derivatized nucleosides and oligonucleosides |
| US5670633A (en) | 1990-01-11 | 1997-09-23 | Isis Pharmaceuticals, Inc. | Sugar modified oligonucleotides that detect and modulate gene expression |
| US5681941A (en) | 1990-01-11 | 1997-10-28 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US6783931B1 (en) | 1990-01-11 | 2004-08-31 | Isis Pharmaceuticals, Inc. | Amine-derivatized nucleosides and oligonucleosides |
| US5578718A (en) | 1990-01-11 | 1996-11-26 | Isis Pharmaceuticals, Inc. | Thiol-derivatized nucleosides |
| US5587361A (en) | 1991-10-15 | 1996-12-24 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5587470A (en) | 1990-01-11 | 1996-12-24 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US5646265A (en) | 1990-01-11 | 1997-07-08 | Isis Pharmceuticals, Inc. | Process for the preparation of 2'-O-alkyl purine phosphoramidites |
| US5214136A (en) | 1990-02-20 | 1993-05-25 | Gilead Sciences, Inc. | Anthraquinone-derivatives oligonucleotides |
| AU7579991A (en) | 1990-02-20 | 1991-09-18 | Gilead Sciences, Inc. | Pseudonucleosides and pseudonucleotides and their polymers |
| US5321131A (en) | 1990-03-08 | 1994-06-14 | Hybridon, Inc. | Site-specific functionalization of oligodeoxynucleotides for non-radioactive labelling |
| US5470967A (en) | 1990-04-10 | 1995-11-28 | The Dupont Merck Pharmaceutical Company | Oligonucleotide analogs with sulfamate linkages |
| GB9009980D0 (en) | 1990-05-03 | 1990-06-27 | Amersham Int Plc | Phosphoramidite derivatives,their preparation and the use thereof in the incorporation of reporter groups on synthetic oligonucleotides |
| ATE167523T1 (de) | 1990-05-11 | 1998-07-15 | Microprobe Corp | Teststreifen zum eintauchen für nukleinsäure- hybridisierungsassays und verfahren zur kovalenten immobilisierung von oligonucleotiden |
| US5489677A (en) | 1990-07-27 | 1996-02-06 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent oxygen and nitrogen atoms |
| US5541307A (en) | 1990-07-27 | 1996-07-30 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs and solid phase synthesis thereof |
| US5138045A (en) | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5218105A (en) | 1990-07-27 | 1993-06-08 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5610289A (en) | 1990-07-27 | 1997-03-11 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogues |
| US5602240A (en) | 1990-07-27 | 1997-02-11 | Ciba Geigy Ag. | Backbone modified oligonucleotide analogs |
| US5608046A (en) | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5688941A (en) | 1990-07-27 | 1997-11-18 | Isis Pharmaceuticals, Inc. | Methods of making conjugated 4' desmethyl nucleoside analog compounds |
| US5618704A (en) | 1990-07-27 | 1997-04-08 | Isis Pharmacueticals, Inc. | Backbone-modified oligonucleotide analogs and preparation thereof through radical coupling |
| US5623070A (en) | 1990-07-27 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5677437A (en) | 1990-07-27 | 1997-10-14 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5614617A (en) | 1990-07-27 | 1997-03-25 | Isis Pharmaceuticals, Inc. | Nuclease resistant, pyrimidine modified oligonucleotides that detect and modulate gene expression |
| US5245022A (en) | 1990-08-03 | 1993-09-14 | Sterling Drug, Inc. | Exonuclease resistant terminally substituted oligonucleotides |
| ES2083593T3 (es) | 1990-08-03 | 1996-04-16 | Sterling Winthrop Inc | Compuestos y metodos para inhibir la expresion de genes. |
| US5512667A (en) | 1990-08-28 | 1996-04-30 | Reed; Michael W. | Trifunctional intermediates for preparing 3'-tailed oligonucleotides |
| US5214134A (en) | 1990-09-12 | 1993-05-25 | Sterling Winthrop Inc. | Process of linking nucleosides with a siloxane bridge |
| US5561225A (en) | 1990-09-19 | 1996-10-01 | Southern Research Institute | Polynucleotide analogs containing sulfonate and sulfonamide internucleoside linkages |
| WO1992005186A1 (en) | 1990-09-20 | 1992-04-02 | Gilead Sciences | Modified internucleoside linkages |
| US5432272A (en) | 1990-10-09 | 1995-07-11 | Benner; Steven A. | Method for incorporating into a DNA or RNA oligonucleotide using nucleotides bearing heterocyclic bases |
| JP3172178B2 (ja) | 1990-11-08 | 2001-06-04 | ハイブライドン インコーポレイテッド | 合成オリゴヌクレオチドに対する多重リポータ基の組込み |
| GB9100304D0 (en) | 1991-01-08 | 1991-02-20 | Ici Plc | Compound |
| US7015315B1 (en) | 1991-12-24 | 2006-03-21 | Isis Pharmaceuticals, Inc. | Gapped oligonucleotides |
| US5719262A (en) | 1993-11-22 | 1998-02-17 | Buchardt, Deceased; Ole | Peptide nucleic acids having amino acid side chains |
| US5539082A (en) | 1993-04-26 | 1996-07-23 | Nielsen; Peter E. | Peptide nucleic acids |
| US5714331A (en) | 1991-05-24 | 1998-02-03 | Buchardt, Deceased; Ole | Peptide nucleic acids having enhanced binding affinity, sequence specificity and solubility |
| US5371241A (en) | 1991-07-19 | 1994-12-06 | Pharmacia P-L Biochemicals Inc. | Fluorescein labelled phosphoramidites |
| US5571799A (en) | 1991-08-12 | 1996-11-05 | Basco, Ltd. | (2'-5') oligoadenylate analogues useful as inhibitors of host-v5.-graft response |
| DE59208572D1 (de) | 1991-10-17 | 1997-07-10 | Ciba Geigy Ag | Bicyclische Nukleoside, Oligonukleotide, Verfahren zu deren Herstellung und Zwischenprodukte |
| US5594121A (en) | 1991-11-07 | 1997-01-14 | Gilead Sciences, Inc. | Enhanced triple-helix and double-helix formation with oligomers containing modified purines |
| EP0916396B1 (en) | 1991-11-22 | 2005-04-13 | Affymetrix, Inc. (a Delaware Corporation) | Combinatorial strategies for polymer synthesis |
| US6235887B1 (en) | 1991-11-26 | 2001-05-22 | Isis Pharmaceuticals, Inc. | Enhanced triple-helix and double-helix formation directed by oligonucleotides containing modified pyrimidines |
| US5484908A (en) | 1991-11-26 | 1996-01-16 | Gilead Sciences, Inc. | Oligonucleotides containing 5-propynyl pyrimidines |
| US5359044A (en) | 1991-12-13 | 1994-10-25 | Isis Pharmaceuticals | Cyclobutyl oligonucleotide surrogates |
| US6277603B1 (en) | 1991-12-24 | 2001-08-21 | Isis Pharmaceuticals, Inc. | PNA-DNA-PNA chimeric macromolecules |
| ATE317848T1 (de) | 1991-12-24 | 2006-03-15 | Isis Pharmaceuticals Inc | Unterbrochene 2'-modifizierte oligonukleotide |
| US5565552A (en) | 1992-01-21 | 1996-10-15 | Pharmacyclics, Inc. | Method of expanded porphyrin-oligonucleotide conjugate synthesis |
| US5595726A (en) | 1992-01-21 | 1997-01-21 | Pharmacyclics, Inc. | Chromophore probe for detection of nucleic acid |
| FR2687679B1 (fr) | 1992-02-05 | 1994-10-28 | Centre Nat Rech Scient | Oligothionucleotides. |
| DE4203923A1 (de) | 1992-02-11 | 1993-08-12 | Henkel Kgaa | Verfahren zur herstellung von polycarboxylaten auf polysaccharid-basis |
| US5633360A (en) | 1992-04-14 | 1997-05-27 | Gilead Sciences, Inc. | Oligonucleotide analogs capable of passive cell membrane permeation |
| US5434257A (en) | 1992-06-01 | 1995-07-18 | Gilead Sciences, Inc. | Binding compentent oligomers containing unsaturated 3',5' and 2',5' linkages |
| EP0577558A2 (de) | 1992-07-01 | 1994-01-05 | Ciba-Geigy Ag | Carbocyclische Nukleoside mit bicyclischen Ringen, Oligonukleotide daraus, Verfahren zu deren Herstellung, deren Verwendung und Zwischenproduckte |
| US5272250A (en) | 1992-07-10 | 1993-12-21 | Spielvogel Bernard F | Boronated phosphoramidate compounds |
| CA2140343A1 (en) | 1992-07-17 | 1994-02-03 | Sean M. Sullivan | Method and reagent for treatment of animal diseases |
| US6346614B1 (en) | 1992-07-23 | 2002-02-12 | Hybridon, Inc. | Hybrid oligonucleotide phosphorothioates |
| US5574142A (en) | 1992-12-15 | 1996-11-12 | Microprobe Corporation | Peptide linkers for improved oligonucleotide delivery |
| US5476925A (en) | 1993-02-01 | 1995-12-19 | Northwestern University | Oligodeoxyribonucleotides including 3'-aminonucleoside-phosphoramidate linkages and terminal 3'-amino groups |
| GB9304618D0 (en) | 1993-03-06 | 1993-04-21 | Ciba Geigy Ag | Chemical compounds |
| EP0691968B1 (en) | 1993-03-30 | 1997-07-16 | Sanofi | Acyclic nucleoside analogs and oligonucleotide sequences containing them |
| AU6412794A (en) | 1993-03-31 | 1994-10-24 | Sterling Winthrop Inc. | Oligonucleotides with amide linkages replacing phosphodiester linkages |
| DE4311944A1 (de) | 1993-04-10 | 1994-10-13 | Degussa | Umhüllte Natriumpercarbonatpartikel, Verfahren zu deren Herstellung und sie enthaltende Wasch-, Reinigungs- und Bleichmittelzusammensetzungen |
| US5955591A (en) | 1993-05-12 | 1999-09-21 | Imbach; Jean-Louis | Phosphotriester oligonucleotides, amidites and method of preparation |
| US6015886A (en) | 1993-05-24 | 2000-01-18 | Chemgenes Corporation | Oligonucleotide phosphate esters |
| US6294664B1 (en) | 1993-07-29 | 2001-09-25 | Isis Pharmaceuticals, Inc. | Synthesis of oligonucleotides |
| US5502177A (en) | 1993-09-17 | 1996-03-26 | Gilead Sciences, Inc. | Pyrimidine derivatives for labeled binding partners |
| NZ276956A (en) | 1993-11-16 | 1998-04-27 | Genta Inc | Synthetic oligomers having chirally pure phosphonate internucleosidyl linkages mixed with non-phosphonate linkages and their preparation |
| US5457187A (en) | 1993-12-08 | 1995-10-10 | Board Of Regents University Of Nebraska | Oligonucleotides containing 5-fluorouracil |
| US5446137B1 (en) | 1993-12-09 | 1998-10-06 | Behringwerke Ag | Oligonucleotides containing 4'-substituted nucleotides |
| US5519134A (en) | 1994-01-11 | 1996-05-21 | Isis Pharmaceuticals, Inc. | Pyrrolidine-containing monomers and oligomers |
| US5599922A (en) | 1994-03-18 | 1997-02-04 | Lynx Therapeutics, Inc. | Oligonucleotide N3'-P5' phosphoramidates: hybridization and nuclease resistance properties |
| US5596091A (en) | 1994-03-18 | 1997-01-21 | The Regents Of The University Of California | Antisense oligonucleotides comprising 5-aminoalkyl pyrimidine nucleotides |
| US5627053A (en) | 1994-03-29 | 1997-05-06 | Ribozyme Pharmaceuticals, Inc. | 2'deoxy-2'-alkylnucleotide containing nucleic acid |
| US5625050A (en) | 1994-03-31 | 1997-04-29 | Amgen Inc. | Modified oligonucleotides and intermediates useful in nucleic acid therapeutics |
| US6054299A (en) | 1994-04-29 | 2000-04-25 | Conrad; Charles A. | Stem-loop cloning vector and method |
| US5525711A (en) | 1994-05-18 | 1996-06-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Pteridine nucleotide analogs as fluorescent DNA probes |
| US5597696A (en) | 1994-07-18 | 1997-01-28 | Becton Dickinson And Company | Covalent cyanine dye oligonucleotide conjugates |
| US5597909A (en) | 1994-08-25 | 1997-01-28 | Chiron Corporation | Polynucleotide reagents containing modified deoxyribose moieties, and associated methods of synthesis and use |
| US5580731A (en) | 1994-08-25 | 1996-12-03 | Chiron Corporation | N-4 modified pyrimidine deoxynucleotides and oligonucleotide probes synthesized therewith |
| US5556752A (en) | 1994-10-24 | 1996-09-17 | Affymetrix, Inc. | Surface-bound, unimolecular, double-stranded DNA |
| US6608035B1 (en) | 1994-10-25 | 2003-08-19 | Hybridon, Inc. | Method of down-regulating gene expression |
| US6166197A (en) | 1995-03-06 | 2000-12-26 | Isis Pharmaceuticals, Inc. | Oligomeric compounds having pyrimidine nucleotide (S) with 2'and 5 substitutions |
| WO1996027606A1 (en) | 1995-03-06 | 1996-09-12 | Isis Pharmaceuticals, Inc. | Improved process for the synthesis of 2'-o-substituted pyrimidines and oligomeric compounds therefrom |
| US5981501A (en) | 1995-06-07 | 1999-11-09 | Inex Pharmaceuticals Corp. | Methods for encapsulating plasmids in lipid bilayers |
| US5545531A (en) | 1995-06-07 | 1996-08-13 | Affymax Technologies N.V. | Methods for making a device for concurrently processing multiple biological chip assays |
| US6160109A (en) | 1995-10-20 | 2000-12-12 | Isis Pharmaceuticals, Inc. | Preparation of phosphorothioate and boranophosphate oligomers |
| US5854033A (en) | 1995-11-21 | 1998-12-29 | Yale University | Rolling circle replication reporter systems |
| US6444423B1 (en) | 1996-06-07 | 2002-09-03 | Molecular Dynamics, Inc. | Nucleosides comprising polydentate ligands |
| US6576752B1 (en) | 1997-02-14 | 2003-06-10 | Isis Pharmaceuticals, Inc. | Aminooxy functionalized oligomers |
| US6172209B1 (en) | 1997-02-14 | 2001-01-09 | Isis Pharmaceuticals Inc. | Aminooxy-modified oligonucleotides and methods for making same |
| US6639062B2 (en) | 1997-02-14 | 2003-10-28 | Isis Pharmaceuticals, Inc. | Aminooxy-modified nucleosidic compounds and oligomeric compounds prepared therefrom |
| US6770748B2 (en) | 1997-03-07 | 2004-08-03 | Takeshi Imanishi | Bicyclonucleoside and oligonucleotide analogue |
| JP3756313B2 (ja) | 1997-03-07 | 2006-03-15 | 武 今西 | 新規ビシクロヌクレオシド及びオリゴヌクレオチド類縁体 |
| AU733310C (en) | 1997-05-14 | 2001-11-29 | University Of British Columbia, The | High efficiency encapsulation of charged therapeutic agents in lipid vesicles |
| CA2303299C (en) | 1997-09-12 | 2016-02-23 | Exiqon A/S | Oligonucleotide analogues |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| US6528640B1 (en) | 1997-11-05 | 2003-03-04 | Ribozyme Pharmaceuticals, Incorporated | Synthetic ribonucleic acids with RNAse activity |
| US6617438B1 (en) | 1997-11-05 | 2003-09-09 | Sirna Therapeutics, Inc. | Oligoribonucleotides with enzymatic activity |
| US6320017B1 (en) | 1997-12-23 | 2001-11-20 | Inex Pharmaceuticals Corp. | Polyamide oligomers |
| US7273933B1 (en) | 1998-02-26 | 2007-09-25 | Isis Pharmaceuticals, Inc. | Methods for synthesis of oligonucleotides |
| US7045610B2 (en) | 1998-04-03 | 2006-05-16 | Epoch Biosciences, Inc. | Modified oligonucleotides for mismatch discrimination |
| US6531590B1 (en) | 1998-04-24 | 2003-03-11 | Isis Pharmaceuticals, Inc. | Processes for the synthesis of oligonucleotide compounds |
| US6867294B1 (en) | 1998-07-14 | 2005-03-15 | Isis Pharmaceuticals, Inc. | Gapped oligomers having site specific chiral phosphorothioate internucleoside linkages |
| BR9914773A (pt) | 1998-10-09 | 2002-02-05 | Ingene Inc | Conjunto de elementos genéricos, método para a produção de dna de cordão único, transcrição de mrna, construção de ácido nucléico, transcrição de ssdna, vetor, sistema vetor, célula hospedeira, conjunto para a produção de uma sequência de ácido nucléico de cordão único, método para a produção in vivo ou in vitro de uma sequência de ácido nucléico de cordão único, transcrição de cdna de cordão único, ácido nucléico inibidor, molécula heteroduplex, e composição farmacêutica |
| KR20010099682A (ko) | 1998-10-09 | 2001-11-09 | 추후보충 | 단일가닥 dna의 효소 합성 |
| US6465628B1 (en) | 1999-02-04 | 2002-10-15 | Isis Pharmaceuticals, Inc. | Process for the synthesis of oligomeric compounds |
| US7084125B2 (en) | 1999-03-18 | 2006-08-01 | Exiqon A/S | Xylo-LNA analogues |
| KR100782896B1 (ko) | 1999-05-04 | 2007-12-06 | 엑시콘 에이/에스 | L-리보-lna 유사체 |
| US6525191B1 (en) | 1999-05-11 | 2003-02-25 | Kanda S. Ramasamy | Conformationally constrained L-nucleosides |
| US6593466B1 (en) | 1999-07-07 | 2003-07-15 | Isis Pharmaceuticals, Inc. | Guanidinium functionalized nucleotides and precursors thereof |
| US6147200A (en) | 1999-08-19 | 2000-11-14 | Isis Pharmaceuticals, Inc. | 2'-O-acetamido modified monomers and oligomers |
| AU2001227965A1 (en) | 2000-01-21 | 2001-07-31 | Geron Corporation | 2'-arabino-fluorooligonucleotide n3'-p5'phosphoramidates: their synthesis and use |
| EP1334109B1 (en) | 2000-10-04 | 2006-05-10 | Santaris Pharma A/S | Improved synthesis of purine locked nucleic acid analogues |
| CA2489174C (en) | 2002-07-10 | 2013-02-05 | Thomas Tuschl | Rna-interference by single-stranded rna molecules |
| US6878805B2 (en) | 2002-08-16 | 2005-04-12 | Isis Pharmaceuticals, Inc. | Peptide-conjugated oligomeric compounds |
| EP2957568B1 (en) | 2002-11-05 | 2016-12-21 | Ionis Pharmaceuticals, Inc. | Compositions comprising alternating 2'-modified nucleosides for use in gene modulation |
| EP1562971B1 (en) | 2002-11-05 | 2014-02-12 | Isis Pharmaceuticals, Inc. | Polycyclic sugar surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| EP1661905B9 (en) | 2003-08-28 | 2012-12-19 | IMANISHI, Takeshi | Novel artificial nucleic acids of n-o bond crosslinkage type |
| CA2554212A1 (en) | 2004-02-10 | 2005-08-25 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of gene expression using multifunctional short interfering nucleic acid (multifunctional sina) |
| ATE541928T1 (de) | 2005-03-31 | 2012-02-15 | Calando Pharmaceuticals Inc | Inhibitoren der untereinheit 2 der ribonukleotidreduktase und ihre verwendungen |
| PL2314594T3 (pl) | 2006-01-27 | 2014-12-31 | Isis Pharmaceuticals Inc | Zmodyfikowane w pozycji 6 analogi bicykliczne kwasów nukleinowych |
| US7569686B1 (en) | 2006-01-27 | 2009-08-04 | Isis Pharmaceuticals, Inc. | Compounds and methods for synthesis of bicyclic nucleic acid analogs |
| WO2007091269A2 (en) | 2006-02-08 | 2007-08-16 | Quark Pharmaceuticals, Inc. | NOVEL TANDEM siRNAS |
| JP5761911B2 (ja) | 2006-04-07 | 2015-08-12 | イデラ ファーマシューティカルズ インコーポレイテッドIdera Pharmaceuticals, Inc. | Tlr7およびtlr8に対する安定化免疫調節rna(simra)化合物 |
| WO2007134181A2 (en) | 2006-05-11 | 2007-11-22 | Isis Pharmaceuticals, Inc. | 5'-modified bicyclic nucleic acid analogs |
| US20100105134A1 (en) | 2007-03-02 | 2010-04-29 | Mdrna, Inc. | Nucleic acid compounds for inhibiting gene expression and uses thereof |
| DK2162538T3 (en) | 2007-05-22 | 2016-06-06 | Arcturus Therapeutics Inc | Oligomers for THERAPY |
| CA2688321A1 (en) | 2007-05-30 | 2008-12-11 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| ES2386492T3 (es) | 2007-06-08 | 2012-08-21 | Isis Pharmaceuticals, Inc. | Análogos de ácidos nucleicos bicíclicos carbocíclicos |
| ATE538127T1 (de) | 2007-07-05 | 2012-01-15 | Isis Pharmaceuticals Inc | 6-disubstituierte bicyclische nukleinsäureanaloga |
| CN102921003B (zh) | 2007-07-09 | 2014-11-26 | 艾德拉药物股份有限公司 | 稳定化免疫调控性rna(simra)化合物 |
| CN102006890A (zh) | 2007-12-04 | 2011-04-06 | 阿尔尼拉姆医药品有限公司 | 靶向脂质 |
| CA2721333C (en) | 2008-04-15 | 2020-12-01 | Protiva Biotherapeutics, Inc. | Novel lipid formulations for nucleic acid delivery |
| CN102239259A (zh) | 2008-12-03 | 2011-11-09 | 玛瑞纳生物技术有限公司 | UsiRNA复合物 |
| ES2804764T3 (es) | 2009-06-01 | 2021-02-09 | Halo Bio Rnai Therapeutics Inc | Polinucleótidos para la interferencia de ARN multivalente, composiciones y métodos de uso de los mismos |
| EP3431076B1 (en) | 2009-06-10 | 2021-10-06 | Arbutus Biopharma Corporation | Improved lipid formulation |
| WO2011005861A1 (en) | 2009-07-07 | 2011-01-13 | Alnylam Pharmaceuticals, Inc. | Oligonucleotide end caps |
| US8927513B2 (en) | 2009-07-07 | 2015-01-06 | Alnylam Pharmaceuticals, Inc. | 5′ phosphate mimics |
| CN104673795A (zh) | 2009-08-27 | 2015-06-03 | 艾德拉药物股份有限公司 | 用于抑制基因表达的组合物及其用途 |
| EP2563922A1 (en) | 2010-04-26 | 2013-03-06 | Marina Biotech, Inc. | Nucleic acid compounds with conformationally restricted monomers and uses thereof |
| HK1198766A1 (zh) | 2011-09-07 | 2015-06-05 | 玛瑞纳生物技术有限公司 | 具有構象限制的單體的核酸化合物的合成和用途 |
| HK1200171A1 (zh) | 2011-11-18 | 2015-07-31 | Alnylam Pharmaceuticals, Inc. | Rnai試劑、組合物及其用於治療甲狀腺素運載蛋白(ttr)相關疾病的使用方法 |
| ES2730015T3 (es) | 2013-05-01 | 2019-11-07 | Ionis Pharmaceuticals Inc | Composiciones y métodos para modular expresión de HBV y de TTR |
| JP2018510621A (ja) * | 2015-02-13 | 2018-04-19 | アルナイラム ファーマシューティカルズ, インコーポレイテッドAlnylam Pharmaceuticals, Inc. | パタチン様ホスホリパーゼドメイン含有3(PNPLA3)iRNA組成物およびその使用方法 |
| EP3350328A1 (en) * | 2015-09-14 | 2018-07-25 | Alnylam Pharmaceuticals, Inc. | Polynucleotide agents targeting patatin-like phospholipase domain containing 3 (pnpla3) and methods of use thereof |
| US10036024B2 (en) * | 2016-06-03 | 2018-07-31 | Purdue Research Foundation | siRNA compositions that specifically downregulate expression of a variant of the PNPLA3 gene and methods of use thereof for treating a chronic liver disease or alcoholic liver disease (ALD) |
| US10995335B2 (en) | 2017-09-14 | 2021-05-04 | Arrowhead Pharmaceuticals, Inc. | RNAi agents and compositions for inhibiting expression of angiopoietin-like 3 (ANGPTL3), and methods of use |
| AR113490A1 (es) * | 2017-12-12 | 2020-05-06 | Amgen Inc | CONSTRUCCIONES DE ARNi PARA INHIBIR LA EXPRESIÓN DE PNPLA3 Y MÉTODOS DE USO DE LAS MISMAS |
-
2020
- 2020-12-14 TW TW109144095A patent/TW202138559A/zh unknown
- 2020-12-14 WO PCT/US2020/064776 patent/WO2021126734A1/en active Application Filing
-
2022
- 2022-06-14 CL CL2022001590A patent/CL2022001590A1/es unknown
-
2023
- 2023-06-27 ZA ZA2023/06590A patent/ZA202306590B/en unknown
-
2024
- 2024-04-10 CL CL2024001059A patent/CL2024001059A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CL2022001590A1 (es) | 2023-03-17 |
| WO2021126734A1 (en) | 2021-06-24 |
| CL2024001059A1 (es) | 2024-10-11 |
| ZA202306590B (en) | 2025-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TW202016304A (zh) | 血管收縮素原(AGT)iRNA組成物及其使用方法 | |
| KR20230150844A (ko) | 케토헥소키나아제(KHK) iRNA 조성물 및 이의 사용 방법 | |
| TW202214856A (zh) | 黃嘌呤脫氫酶(XDH)iRNA組成物及其使用之方法 | |
| TW202138559A (zh) | 含類PATATIN磷脂酶結構域3(PNPLA3)iRNA組成物及其使用方法 | |
| WO2021178736A1 (en) | KETOHEXOKINASE (KHK) iRNA COMPOSITIONS AND METHODS OF USE THEREOF | |
| US11866710B2 (en) | Transmembrane protease, serine 6 (TMPRSS6) iRNA compositions and methods of use thereof | |
| TW202337474A (zh) | 用於緘默血管收縮素原(AGT)的iRNA組成物及方法 | |
| CN115397989A (zh) | 载脂蛋白C3(APOC3)iRNA组合物及其使用方法 | |
| TW202328445A (zh) | 甲狀腺素運載蛋白(TTR)iRNA組成物及其使用方法 | |
| KR20230150843A (ko) | 안지오포이에틴-유사 3(ANGPTL3) iRNA 조성물 및 이의 사용 방법 | |
| TW202333749A (zh) | 補體因子b(cfb)irna組成物及其使用方法 | |
| US11149276B2 (en) | Patatin-like phospholipase domain containing 3 (PNPLA3) iRNA compositions and methods of use thereof | |
| TW202334413A (zh) | 第十二因子(F12)iRNA組成物及其使用方法 | |
| TW202325312A (zh) | β-鏈蛋白(CTNNB1)iRNA組成物及其使用方法 | |
| US20240318184A1 (en) | PATATIN-LIKE PHOSPHOLIPASE DOMAIN CONTAINING 3 (PNPLA3) iRNA COMPOSITIONS AND METHODS OF USE THEREOF | |
| TW202237841A (zh) | 凝血因子V(F5)iRNA組成物及其使用方法 | |
| WO2022212153A1 (en) | Proline dehydrogenase 2 (prodh2) irna compositions and methods of use thereof | |
| CN117751187A (zh) | 己酮糖激酶(KHK)iRNA组合物及其使用方法 | |
| CN117203338A (zh) | 跨膜蛋白酶丝氨酸6(tmprss6)irna组合物和其使用方法 |