KR20220069992A - 네이세리아 메닌기티디스 조성물 및 그의 방법 - Google Patents
네이세리아 메닌기티디스 조성물 및 그의 방법 Download PDFInfo
- Publication number
- KR20220069992A KR20220069992A KR1020227013540A KR20227013540A KR20220069992A KR 20220069992 A KR20220069992 A KR 20220069992A KR 1020227013540 A KR1020227013540 A KR 1020227013540A KR 20227013540 A KR20227013540 A KR 20227013540A KR 20220069992 A KR20220069992 A KR 20220069992A
- Authority
- KR
- South Korea
- Prior art keywords
- composition
- meningitidis
- dose
- serogroup
- human
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
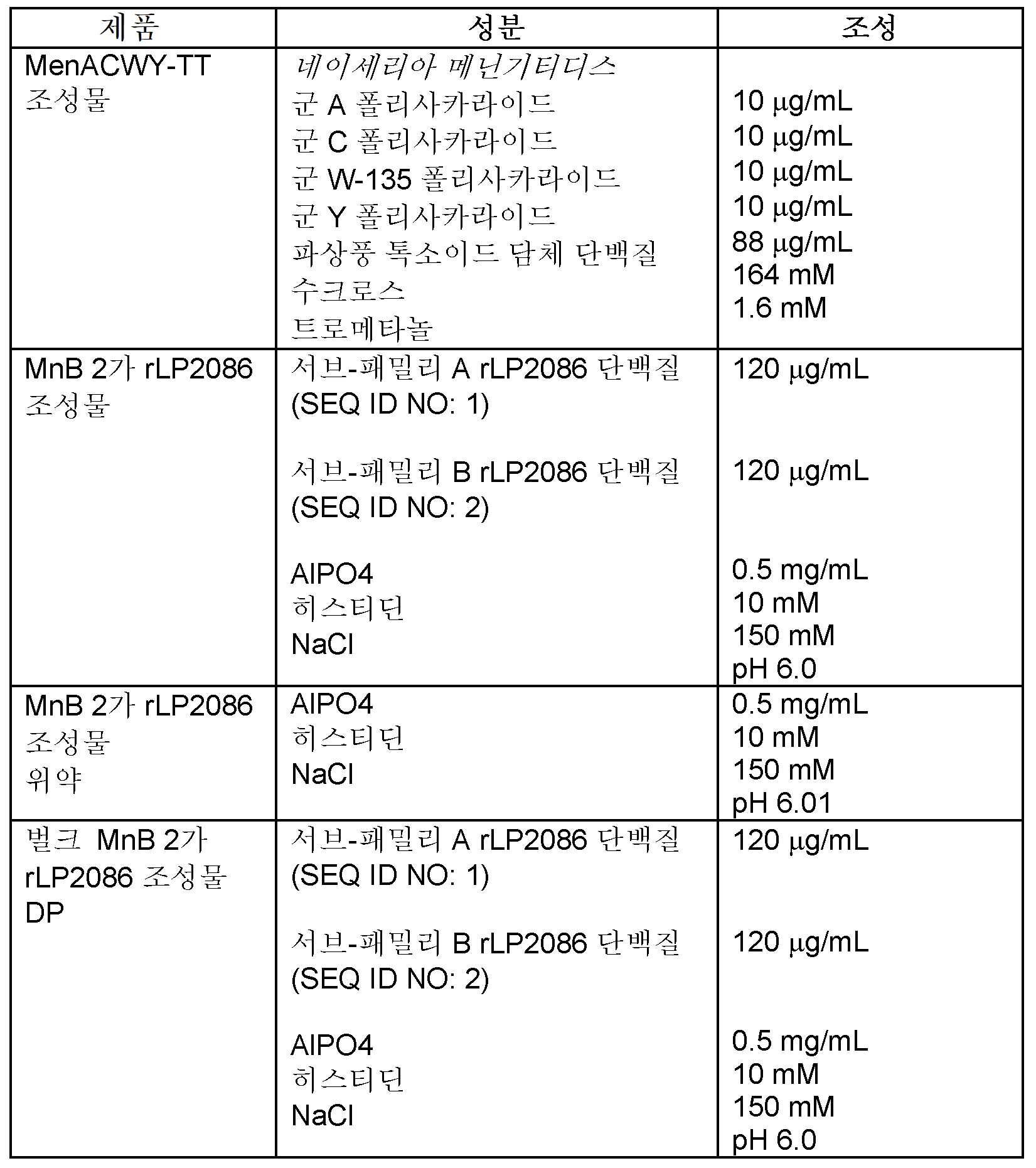
- 239000000203 mixture Substances 0.000 title claims abstract description 684
- 238000000034 method Methods 0.000 title claims abstract description 200
- 241000588650 Neisseria meningitidis Species 0.000 title claims abstract description 70
- 230000028993 immune response Effects 0.000 claims abstract description 229
- 150000004676 glycans Chemical class 0.000 claims abstract description 128
- 229920001282 polysaccharide Polymers 0.000 claims abstract description 128
- 239000005017 polysaccharide Substances 0.000 claims abstract description 128
- 150000001720 carbohydrates Chemical class 0.000 claims description 252
- 229960005486 vaccine Drugs 0.000 claims description 238
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 223
- 229920001184 polypeptide Polymers 0.000 claims description 222
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 222
- 230000000844 anti-bacterial effect Effects 0.000 claims description 150
- 229960000814 tetanus toxoid Drugs 0.000 claims description 149
- 229910052799 carbon Inorganic materials 0.000 claims description 148
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 89
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 87
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 86
- 229940068968 polysorbate 80 Drugs 0.000 claims description 86
- 229920000053 polysorbate 80 Polymers 0.000 claims description 86
- 210000002966 serum Anatomy 0.000 claims description 79
- 229910052782 aluminium Inorganic materials 0.000 claims description 69
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims description 68
- -1 1-cyano-4-dimethylamino pyridinium tetrafluoroborate Chemical compound 0.000 claims description 59
- 239000011780 sodium chloride Substances 0.000 claims description 47
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 claims description 43
- 229960002885 histidine Drugs 0.000 claims description 37
- 150000001718 carbodiimides Chemical class 0.000 claims description 34
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 claims description 33
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims description 31
- 241000921898 Neisseria meningitidis serogroup A Species 0.000 claims description 29
- 230000001939 inductive effect Effects 0.000 claims description 29
- 239000007788 liquid Substances 0.000 claims description 27
- 241000947238 Neisseria meningitidis serogroup C Species 0.000 claims description 26
- 241001573069 Neisseria meningitidis serogroup Y Species 0.000 claims description 25
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 18
- 229930006000 Sucrose Natural products 0.000 claims description 18
- 239000005720 sucrose Substances 0.000 claims description 18
- IBVAQQYNSHJXBV-UHFFFAOYSA-N adipic acid dihydrazide Chemical compound NNC(=O)CCCCC(=O)NN IBVAQQYNSHJXBV-UHFFFAOYSA-N 0.000 claims description 17
- 239000002671 adjuvant Substances 0.000 claims description 17
- 150000001413 amino acids Chemical group 0.000 claims description 12
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 claims description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 9
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 claims description 5
- 101710186862 Factor H binding protein Proteins 0.000 abstract description 200
- 125000003275 alpha amino acid group Chemical group 0.000 description 166
- 108090000623 proteins and genes Proteins 0.000 description 120
- 235000018102 proteins Nutrition 0.000 description 119
- 102000004169 proteins and genes Human genes 0.000 description 119
- 238000002255 vaccination Methods 0.000 description 96
- 102000014914 Carrier Proteins Human genes 0.000 description 87
- 108010078791 Carrier Proteins Proteins 0.000 description 87
- 238000012360 testing method Methods 0.000 description 70
- 239000000725 suspension Substances 0.000 description 65
- 241000588677 Neisseria meningitidis serogroup B Species 0.000 description 61
- 230000002163 immunogen Effects 0.000 description 54
- 230000004044 response Effects 0.000 description 52
- 238000003556 assay Methods 0.000 description 47
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 46
- 229940126534 drug product Drugs 0.000 description 41
- 239000000825 pharmaceutical preparation Substances 0.000 description 41
- 108091007433 antigens Proteins 0.000 description 39
- 102000036639 antigens Human genes 0.000 description 39
- 208000037909 invasive meningococcal disease Diseases 0.000 description 38
- 239000000427 antigen Substances 0.000 description 37
- 239000002245 particle Substances 0.000 description 34
- 229940035144 trumenba Drugs 0.000 description 32
- 201000010099 disease Diseases 0.000 description 31
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 31
- 230000000295 complement effect Effects 0.000 description 29
- 230000005875 antibody response Effects 0.000 description 24
- 241000282412 Homo Species 0.000 description 23
- 125000003277 amino group Chemical group 0.000 description 22
- 230000000694 effects Effects 0.000 description 22
- 230000003053 immunization Effects 0.000 description 22
- 239000012071 phase Substances 0.000 description 22
- 238000002649 immunization Methods 0.000 description 21
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 20
- 230000005847 immunogenicity Effects 0.000 description 20
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 19
- 229940031937 polysaccharide vaccine Drugs 0.000 description 19
- 238000011156 evaluation Methods 0.000 description 18
- 238000004062 sedimentation Methods 0.000 description 18
- 125000003636 chemical group Chemical group 0.000 description 17
- 230000021615 conjugation Effects 0.000 description 17
- 230000027455 binding Effects 0.000 description 16
- 108010001064 glycyl-glycyl-glycyl-glycine Proteins 0.000 description 16
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 15
- ZJZNLRVCZWUONM-JXUBOQSCSA-N Leu-Thr-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O ZJZNLRVCZWUONM-JXUBOQSCSA-N 0.000 description 15
- 235000001014 amino acid Nutrition 0.000 description 15
- DKJPOZOEBONHFS-ZLUOBGJFSA-N Ala-Ala-Asp Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC(O)=O DKJPOZOEBONHFS-ZLUOBGJFSA-N 0.000 description 14
- 241000588653 Neisseria Species 0.000 description 14
- 229960003983 diphtheria toxoid Drugs 0.000 description 14
- 230000001681 protective effect Effects 0.000 description 14
- 108010060123 Conjugate Vaccines Proteins 0.000 description 13
- YNJBLTDKTMKEET-ZLUOBGJFSA-N Cys-Ser-Ser Chemical compound SC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O YNJBLTDKTMKEET-ZLUOBGJFSA-N 0.000 description 13
- 108700026633 Neisseria meningitidis factor H-binding Proteins 0.000 description 13
- 239000000872 buffer Substances 0.000 description 13
- 210000002418 meninge Anatomy 0.000 description 13
- 208000037941 meningococcal disease Diseases 0.000 description 13
- 241000894006 Bacteria Species 0.000 description 12
- 108010071134 CRM197 (non-toxic variant of diphtheria toxin) Proteins 0.000 description 12
- 108010024078 alanyl-glycyl-serine Proteins 0.000 description 12
- 125000000539 amino acid group Chemical group 0.000 description 12
- 238000004458 analytical method Methods 0.000 description 12
- 230000008859 change Effects 0.000 description 12
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 12
- MHXKHKWHPNETGG-QWRGUYRKSA-N Gly-Lys-Leu Chemical compound [H]NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O MHXKHKWHPNETGG-QWRGUYRKSA-N 0.000 description 11
- 108010076324 alanyl-glycyl-glycine Proteins 0.000 description 11
- 108010050848 glycylleucine Proteins 0.000 description 11
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 11
- QMOQBVOBWVNSNO-UHFFFAOYSA-N 2-[[2-[[2-[(2-azaniumylacetyl)amino]acetyl]amino]acetyl]amino]acetate Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(O)=O QMOQBVOBWVNSNO-UHFFFAOYSA-N 0.000 description 10
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 10
- NZOCIWKZUVUNDW-ZKWXMUAHSA-N Ile-Gly-Ala Chemical compound CC[C@H](C)[C@H](N)C(=O)NCC(=O)N[C@@H](C)C(O)=O NZOCIWKZUVUNDW-ZKWXMUAHSA-N 0.000 description 10
- 108060003951 Immunoglobulin Proteins 0.000 description 10
- RBEATVHTWHTHTJ-KKUMJFAQSA-N Lys-Leu-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(O)=O RBEATVHTWHTHTJ-KKUMJFAQSA-N 0.000 description 10
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 10
- YBAFDPFAUTYYRW-UHFFFAOYSA-N N-L-alpha-glutamyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CCC(O)=O YBAFDPFAUTYYRW-UHFFFAOYSA-N 0.000 description 10
- 229940024606 amino acid Drugs 0.000 description 10
- 238000010168 coupling process Methods 0.000 description 10
- 238000009472 formulation Methods 0.000 description 10
- 102000018358 immunoglobulin Human genes 0.000 description 10
- 230000003993 interaction Effects 0.000 description 10
- 238000000569 multi-angle light scattering Methods 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- FJVAQLJNTSUQPY-CIUDSAMLSA-N Ala-Ala-Lys Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCCN FJVAQLJNTSUQPY-CIUDSAMLSA-N 0.000 description 9
- NHCPCLJZRSIDHS-ZLUOBGJFSA-N Ala-Asp-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(O)=O NHCPCLJZRSIDHS-ZLUOBGJFSA-N 0.000 description 9
- PIXQDIGKDNNOOV-GUBZILKMSA-N Ala-Lys-Gln Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O PIXQDIGKDNNOOV-GUBZILKMSA-N 0.000 description 9
- MYLZFUMPZCPJCJ-NHCYSSNCSA-N Asp-Lys-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O MYLZFUMPZCPJCJ-NHCYSSNCSA-N 0.000 description 9
- QSFHZPQUAAQHAQ-CIUDSAMLSA-N Asp-Ser-Leu Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O QSFHZPQUAAQHAQ-CIUDSAMLSA-N 0.000 description 9
- HXOLDXKNWKLDMM-YVNDNENWSA-N Gln-Ile-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](CCC(=O)N)N HXOLDXKNWKLDMM-YVNDNENWSA-N 0.000 description 9
- GGEJHJIXRBTJPD-BYPYZUCNSA-N Gly-Asn-Gly Chemical compound NCC(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O GGEJHJIXRBTJPD-BYPYZUCNSA-N 0.000 description 9
- KAXZXLSXFWSNNZ-XVYDVKMFSA-N His-Ser-Ala Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O KAXZXLSXFWSNNZ-XVYDVKMFSA-N 0.000 description 9
- WXUOJXIGOPMDJM-SRVKXCTJSA-N Leu-Lys-Asn Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(O)=O WXUOJXIGOPMDJM-SRVKXCTJSA-N 0.000 description 9
- CLJLVCYFABNTHP-DCAQKATOSA-N Pro-Leu-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O CLJLVCYFABNTHP-DCAQKATOSA-N 0.000 description 9
- QGMLKFGTGXWAHF-IHRRRGAJSA-N Ser-Arg-Phe Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O QGMLKFGTGXWAHF-IHRRRGAJSA-N 0.000 description 9
- MUJQWSAWLLRJCE-KATARQTJSA-N Ser-Leu-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MUJQWSAWLLRJCE-KATARQTJSA-N 0.000 description 9
- MPUMPERGHHJGRP-WEDXCCLWSA-N Thr-Gly-Lys Chemical compound C[C@H]([C@@H](C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)O)N)O MPUMPERGHHJGRP-WEDXCCLWSA-N 0.000 description 9
- QHDXUYOYTPWCSK-RCOVLWMOSA-N Val-Asp-Gly Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)NCC(=O)O)N QHDXUYOYTPWCSK-RCOVLWMOSA-N 0.000 description 9
- 108010044940 alanylglutamine Proteins 0.000 description 9
- 108010087924 alanylproline Proteins 0.000 description 9
- 229940031670 conjugate vaccine Drugs 0.000 description 9
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 9
- 108010019832 glycyl-asparaginyl-glycine Proteins 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 230000004048 modification Effects 0.000 description 9
- 238000012986 modification Methods 0.000 description 9
- BUANFPRKJKJSRR-ACZMJKKPSA-N Ala-Ala-Gln Chemical compound C[C@H]([NH3+])C(=O)N[C@@H](C)C(=O)N[C@H](C([O-])=O)CCC(N)=O BUANFPRKJKJSRR-ACZMJKKPSA-N 0.000 description 8
- PCJOFZYFFMBZKC-PCBIJLKTSA-N Asp-Phe-Ile Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O PCJOFZYFFMBZKC-PCBIJLKTSA-N 0.000 description 8
- MFVQGXGQRIXBPK-WDSKDSINSA-N Gly-Ala-Glu Chemical compound NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O MFVQGXGQRIXBPK-WDSKDSINSA-N 0.000 description 8
- LHRXAHLCRMQBGJ-RYUDHWBXSA-N Gly-Glu-Phe Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)CN LHRXAHLCRMQBGJ-RYUDHWBXSA-N 0.000 description 8
- PAWIVEIWWYGBAM-YUMQZZPRSA-N Gly-Leu-Ala Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O PAWIVEIWWYGBAM-YUMQZZPRSA-N 0.000 description 8
- RNMNYMDTESKEAJ-KKUMJFAQSA-N His-Leu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC1=CN=CN1 RNMNYMDTESKEAJ-KKUMJFAQSA-N 0.000 description 8
- QEYUCKCWTMIERU-SRVKXCTJSA-N His-Lys-Asp Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(=O)O)C(=O)O)N QEYUCKCWTMIERU-SRVKXCTJSA-N 0.000 description 8
- GLYJPWIRLBAIJH-UHFFFAOYSA-N Ile-Lys-Pro Natural products CCC(C)C(N)C(=O)NC(CCCCN)C(=O)N1CCCC1C(O)=O GLYJPWIRLBAIJH-UHFFFAOYSA-N 0.000 description 8
- PJYSOYLLTJKZHC-GUBZILKMSA-N Leu-Asp-Gln Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCC(N)=O PJYSOYLLTJKZHC-GUBZILKMSA-N 0.000 description 8
- WUHBLPVELFTPQK-KKUMJFAQSA-N Leu-Tyr-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(O)=O WUHBLPVELFTPQK-KKUMJFAQSA-N 0.000 description 8
- QYOXSYXPHUHOJR-GUBZILKMSA-N Lys-Asn-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O QYOXSYXPHUHOJR-GUBZILKMSA-N 0.000 description 8
- QBEPTBMRQALPEV-MNXVOIDGSA-N Lys-Ile-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CCCCN QBEPTBMRQALPEV-MNXVOIDGSA-N 0.000 description 8
- YFQSSOAGMZGXFT-MEYUZBJRSA-N Lys-Thr-Tyr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O YFQSSOAGMZGXFT-MEYUZBJRSA-N 0.000 description 8
- 229940124951 Menveo Drugs 0.000 description 8
- 241000283973 Oryctolagus cuniculus Species 0.000 description 8
- IAOHCSQDQDWRQU-GUBZILKMSA-N Ser-Val-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O IAOHCSQDQDWRQU-GUBZILKMSA-N 0.000 description 8
- LVRFMARKDGGZMX-IZPVPAKOSA-N Thr-Tyr-Thr Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)O)C(O)=O)CC1=CC=C(O)C=C1 LVRFMARKDGGZMX-IZPVPAKOSA-N 0.000 description 8
- 108010062796 arginyllysine Proteins 0.000 description 8
- 238000010790 dilution Methods 0.000 description 8
- 239000012895 dilution Substances 0.000 description 8
- 108010015792 glycyllysine Proteins 0.000 description 8
- 239000011159 matrix material Substances 0.000 description 8
- 108010048818 seryl-histidine Proteins 0.000 description 8
- BEMGNWZECGIJOI-WDSKDSINSA-N Ala-Gly-Glu Chemical compound [H]N[C@@H](C)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(O)=O BEMGNWZECGIJOI-WDSKDSINSA-N 0.000 description 7
- HPNDBHLITCHRSO-WHFBIAKZSA-N Asp-Ala-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)NCC(O)=O HPNDBHLITCHRSO-WHFBIAKZSA-N 0.000 description 7
- 102000016550 Complement Factor H Human genes 0.000 description 7
- 108010053085 Complement Factor H Proteins 0.000 description 7
- CSMHMEATMDCQNY-DZKIICNBSA-N Gln-Val-Tyr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O CSMHMEATMDCQNY-DZKIICNBSA-N 0.000 description 7
- XBWMTPAIUQIWKA-BYULHYEWSA-N Gly-Asp-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CN XBWMTPAIUQIWKA-BYULHYEWSA-N 0.000 description 7
- ADZGCWWDPFDHCY-ZETCQYMHSA-N Gly-His-Gly Chemical compound OC(=O)CNC(=O)[C@@H](NC(=O)CN)CC1=CN=CN1 ADZGCWWDPFDHCY-ZETCQYMHSA-N 0.000 description 7
- WQWSMEOYXJTFRU-GUBZILKMSA-N Leu-Glu-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O WQWSMEOYXJTFRU-GUBZILKMSA-N 0.000 description 7
- NNCDAORZCMPZPX-GUBZILKMSA-N Lys-Gln-Ser Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CO)C(=O)O)N NNCDAORZCMPZPX-GUBZILKMSA-N 0.000 description 7
- IOQWIOPSKJOEKI-SRVKXCTJSA-N Lys-Ser-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O IOQWIOPSKJOEKI-SRVKXCTJSA-N 0.000 description 7
- BEZTUFWTPVOROW-KJEVXHAQSA-N Thr-Tyr-Arg Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N)O BEZTUFWTPVOROW-KJEVXHAQSA-N 0.000 description 7
- 238000002835 absorbance Methods 0.000 description 7
- 238000013459 approach Methods 0.000 description 7
- 108010092854 aspartyllysine Proteins 0.000 description 7
- 230000001580 bacterial effect Effects 0.000 description 7
- 230000008878 coupling Effects 0.000 description 7
- 238000005859 coupling reaction Methods 0.000 description 7
- 239000004643 cyanate ester Substances 0.000 description 7
- 238000011161 development Methods 0.000 description 7
- 238000000338 in vitro Methods 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 230000014759 maintenance of location Effects 0.000 description 7
- 229940124731 meningococcal vaccine Drugs 0.000 description 7
- 108010070409 phenylalanyl-glycyl-glycine Proteins 0.000 description 7
- 229940071643 prefilled syringe Drugs 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 238000006722 reduction reaction Methods 0.000 description 7
- 239000006228 supernatant Substances 0.000 description 7
- 108010051110 tyrosyl-lysine Proteins 0.000 description 7
- SUMYEVXWCAYLLJ-GUBZILKMSA-N Ala-Leu-Gln Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O SUMYEVXWCAYLLJ-GUBZILKMSA-N 0.000 description 6
- LDLSENBXQNDTPB-DCAQKATOSA-N Ala-Lys-Arg Chemical compound NCCCC[C@H](NC(=O)[C@@H](N)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N LDLSENBXQNDTPB-DCAQKATOSA-N 0.000 description 6
- PBSQFBAJKPLRJY-BYULHYEWSA-N Asn-Gly-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CC(=O)N)N PBSQFBAJKPLRJY-BYULHYEWSA-N 0.000 description 6
- 102100037840 Dehydrogenase/reductase SDR family member 2, mitochondrial Human genes 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 6
- FCKPEGOCSVZPNC-WHOFXGATSA-N Gly-Ile-Phe Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 FCKPEGOCSVZPNC-WHOFXGATSA-N 0.000 description 6
- FFJQHWKSGAWSTJ-BFHQHQDPSA-N Gly-Thr-Ala Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O FFJQHWKSGAWSTJ-BFHQHQDPSA-N 0.000 description 6
- UWSMZKRTOZEGDD-CUJWVEQBSA-N His-Thr-Ser Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O UWSMZKRTOZEGDD-CUJWVEQBSA-N 0.000 description 6
- HGNUKGZQASSBKQ-PCBIJLKTSA-N Ile-Asp-Phe Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N HGNUKGZQASSBKQ-PCBIJLKTSA-N 0.000 description 6
- PMGDADKJMCOXHX-UHFFFAOYSA-N L-Arginyl-L-glutamin-acetat Natural products NC(=N)NCCCC(N)C(=O)NC(CCC(N)=O)C(O)=O PMGDADKJMCOXHX-UHFFFAOYSA-N 0.000 description 6
- LIINDKYIGYTDLG-PPCPHDFISA-N Leu-Ile-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O LIINDKYIGYTDLG-PPCPHDFISA-N 0.000 description 6
- KFSALEZVQJYHCE-AVGNSLFASA-N Lys-Met-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCCCN)N KFSALEZVQJYHCE-AVGNSLFASA-N 0.000 description 6
- LGBVMDMZZFYSFW-HJWJTTGWSA-N Phe-Arg-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC1=CC=CC=C1)N LGBVMDMZZFYSFW-HJWJTTGWSA-N 0.000 description 6
- WIVCOAKLPICYGY-KKUMJFAQSA-N Phe-Asp-Lys Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O)N WIVCOAKLPICYGY-KKUMJFAQSA-N 0.000 description 6
- 101710188053 Protein D Proteins 0.000 description 6
- 101710132893 Resolvase Proteins 0.000 description 6
- 238000006640 acetylation reaction Methods 0.000 description 6
- 108010005233 alanylglutamic acid Proteins 0.000 description 6
- 108010008355 arginyl-glutamine Proteins 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- 125000002843 carboxylic acid group Chemical group 0.000 description 6
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 6
- 235000014113 dietary fatty acids Nutrition 0.000 description 6
- 229930195729 fatty acid Natural products 0.000 description 6
- 239000000194 fatty acid Substances 0.000 description 6
- 150000004665 fatty acids Chemical class 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 238000007710 freezing Methods 0.000 description 6
- 230000008014 freezing Effects 0.000 description 6
- 210000004201 immune sera Anatomy 0.000 description 6
- 229940042743 immune sera Drugs 0.000 description 6
- 230000036039 immunity Effects 0.000 description 6
- 230000002147 killing effect Effects 0.000 description 6
- 108010034529 leucyl-lysine Proteins 0.000 description 6
- 238000002156 mixing Methods 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- ZODMADSIQZZBSQ-FXQIFTODSA-N Ala-Gln-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O ZODMADSIQZZBSQ-FXQIFTODSA-N 0.000 description 5
- NBTGEURICRTMGL-WHFBIAKZSA-N Ala-Gly-Ser Chemical compound C[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O NBTGEURICRTMGL-WHFBIAKZSA-N 0.000 description 5
- OERMIMJQPQUIPK-FXQIFTODSA-N Asp-Arg-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O OERMIMJQPQUIPK-FXQIFTODSA-N 0.000 description 5
- BRRPVTUFESPTCP-ACZMJKKPSA-N Asp-Ser-Glu Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCC(O)=O BRRPVTUFESPTCP-ACZMJKKPSA-N 0.000 description 5
- KDXKFBSNIJYNNR-YVNDNENWSA-N Gln-Glu-Ile Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O KDXKFBSNIJYNNR-YVNDNENWSA-N 0.000 description 5
- OLPPXYMMIARYAL-QMMMGPOBSA-N Gly-Gly-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)CNC(=O)CN OLPPXYMMIARYAL-QMMMGPOBSA-N 0.000 description 5
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 5
- GLYJPWIRLBAIJH-FQUUOJAGSA-N Ile-Lys-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N1CCC[C@@H]1C(=O)O)N GLYJPWIRLBAIJH-FQUUOJAGSA-N 0.000 description 5
- 241000880493 Leptailurus serval Species 0.000 description 5
- TWQIYNGNYNJUFM-NHCYSSNCSA-N Leu-Asn-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O TWQIYNGNYNJUFM-NHCYSSNCSA-N 0.000 description 5
- INCJJHQRZGQLFC-KBPBESRZSA-N Leu-Phe-Gly Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)NCC(O)=O INCJJHQRZGQLFC-KBPBESRZSA-N 0.000 description 5
- FHIAJWBDZVHLAH-YUMQZZPRSA-N Lys-Gly-Ser Chemical compound NCCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O FHIAJWBDZVHLAH-YUMQZZPRSA-N 0.000 description 5
- BIYWZVCPZIFGPY-QWRGUYRKSA-N Phe-Gly-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)NCC(=O)N[C@@H](CO)C(O)=O BIYWZVCPZIFGPY-QWRGUYRKSA-N 0.000 description 5
- SRTCFKGBYBZRHA-ACZMJKKPSA-N Ser-Ala-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O SRTCFKGBYBZRHA-ACZMJKKPSA-N 0.000 description 5
- YMTLKLXDFCSCNX-BYPYZUCNSA-N Ser-Gly-Gly Chemical compound OC[C@H](N)C(=O)NCC(=O)NCC(O)=O YMTLKLXDFCSCNX-BYPYZUCNSA-N 0.000 description 5
- UIGMAMGZOJVTDN-WHFBIAKZSA-N Ser-Gly-Ser Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O UIGMAMGZOJVTDN-WHFBIAKZSA-N 0.000 description 5
- BSXKBOUZDAZXHE-CIUDSAMLSA-N Ser-Pro-Glu Chemical compound [H]N[C@@H](CO)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O BSXKBOUZDAZXHE-CIUDSAMLSA-N 0.000 description 5
- MQGGXGKQSVEQHR-KKUMJFAQSA-N Tyr-Ser-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 MQGGXGKQSVEQHR-KKUMJFAQSA-N 0.000 description 5
- ASQFIHTXXMFENG-XPUUQOCRSA-N Val-Ala-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O ASQFIHTXXMFENG-XPUUQOCRSA-N 0.000 description 5
- 239000008186 active pharmaceutical agent Substances 0.000 description 5
- 230000000890 antigenic effect Effects 0.000 description 5
- 108010040443 aspartyl-aspartic acid Proteins 0.000 description 5
- 108010038633 aspartylglutamate Proteins 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 210000004027 cell Anatomy 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 230000000875 corresponding effect Effects 0.000 description 5
- 235000018417 cysteine Nutrition 0.000 description 5
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 5
- 229940088679 drug related substance Drugs 0.000 description 5
- 108010078144 glutaminyl-glycine Proteins 0.000 description 5
- 108010054666 glycyl-leucyl-glycyl-glycine Proteins 0.000 description 5
- 108010025306 histidylleucine Proteins 0.000 description 5
- 238000004255 ion exchange chromatography Methods 0.000 description 5
- 108010064235 lysylglycine Proteins 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 229920001542 oligosaccharide Polymers 0.000 description 5
- 150000002482 oligosaccharides Chemical class 0.000 description 5
- 108010064486 phenylalanyl-leucyl-valine Proteins 0.000 description 5
- 230000035939 shock Effects 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 238000003860 storage Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 5
- HMRWQTHUDVXMGH-GUBZILKMSA-N Ala-Glu-Lys Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN HMRWQTHUDVXMGH-GUBZILKMSA-N 0.000 description 4
- MEFILNJXAVSUTO-JXUBOQSCSA-N Ala-Leu-Thr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MEFILNJXAVSUTO-JXUBOQSCSA-N 0.000 description 4
- IETUUAHKCHOQHP-KZVJFYERSA-N Ala-Thr-Val Chemical compound CC(C)[C@H](NC(=O)[C@@H](NC(=O)[C@H](C)N)[C@@H](C)O)C(O)=O IETUUAHKCHOQHP-KZVJFYERSA-N 0.000 description 4
- LYILPUNCKACNGF-NAKRPEOUSA-N Ala-Val-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C)N LYILPUNCKACNGF-NAKRPEOUSA-N 0.000 description 4
- XWFPGQVLOVGSLU-CIUDSAMLSA-N Asn-Gln-Arg Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N XWFPGQVLOVGSLU-CIUDSAMLSA-N 0.000 description 4
- MYRLSKYSMXNLLA-LAEOZQHASA-N Asn-Val-Glu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O MYRLSKYSMXNLLA-LAEOZQHASA-N 0.000 description 4
- KHBLRHKVXICFMY-GUBZILKMSA-N Asp-Glu-Lys Chemical compound N[C@@H](CC(=O)O)C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O KHBLRHKVXICFMY-GUBZILKMSA-N 0.000 description 4
- 102100021277 Beta-secretase 2 Human genes 0.000 description 4
- 101710150190 Beta-secretase 2 Proteins 0.000 description 4
- 238000011752 CBA/J (JAX™ mouse strain) Methods 0.000 description 4
- XTHUKRLJRUVVBF-WHFBIAKZSA-N Cys-Gly-Ser Chemical compound SC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O XTHUKRLJRUVVBF-WHFBIAKZSA-N 0.000 description 4
- ZFBBMCKQSNJZSN-AUTRQRHGSA-N Gln-Val-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZFBBMCKQSNJZSN-AUTRQRHGSA-N 0.000 description 4
- HZISRJBYZAODRV-XQXXSGGOSA-N Glu-Thr-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O HZISRJBYZAODRV-XQXXSGGOSA-N 0.000 description 4
- MHHUEAIBJZWDBH-YUMQZZPRSA-N Gly-Asp-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)CN MHHUEAIBJZWDBH-YUMQZZPRSA-N 0.000 description 4
- GDOZQTNZPCUARW-YFKPBYRVSA-N Gly-Gly-Glu Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CCC(O)=O GDOZQTNZPCUARW-YFKPBYRVSA-N 0.000 description 4
- SWQALSGKVLYKDT-UHFFFAOYSA-N Gly-Ile-Ala Natural products NCC(=O)NC(C(C)CC)C(=O)NC(C)C(O)=O SWQALSGKVLYKDT-UHFFFAOYSA-N 0.000 description 4
- IRJWAYCXIYUHQE-WHFBIAKZSA-N Gly-Ser-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)CN IRJWAYCXIYUHQE-WHFBIAKZSA-N 0.000 description 4
- NQKRILCJYCASDV-QWRGUYRKSA-N His-Gly-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC1=CN=CN1 NQKRILCJYCASDV-QWRGUYRKSA-N 0.000 description 4
- ZHHLTWUOWXHVQJ-YUMQZZPRSA-N His-Ser-Gly Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CO)C(=O)NCC(=O)O)N ZHHLTWUOWXHVQJ-YUMQZZPRSA-N 0.000 description 4
- BRQKGRLDDDQWQJ-MBLNEYKQSA-N His-Thr-Ala Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O BRQKGRLDDDQWQJ-MBLNEYKQSA-N 0.000 description 4
- 241000701806 Human papillomavirus Species 0.000 description 4
- IXEFKXAGHRQFAF-HVTMNAMFSA-N Ile-Glu-His Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N IXEFKXAGHRQFAF-HVTMNAMFSA-N 0.000 description 4
- CIVKXGPFXDIQBV-WDCWCFNPSA-N Leu-Gln-Thr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O CIVKXGPFXDIQBV-WDCWCFNPSA-N 0.000 description 4
- QWWPYKKLXWOITQ-VOAKCMCISA-N Leu-Thr-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC(C)C QWWPYKKLXWOITQ-VOAKCMCISA-N 0.000 description 4
- GQFDWEDHOQRNLC-QWRGUYRKSA-N Lys-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN GQFDWEDHOQRNLC-QWRGUYRKSA-N 0.000 description 4
- MRNRMSDVVSKPGM-AVGNSLFASA-N Phe-Asn-Gln Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O MRNRMSDVVSKPGM-AVGNSLFASA-N 0.000 description 4
- PPCZVWHJWJFTFN-ZLUOBGJFSA-N Ser-Ser-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPCZVWHJWJFTFN-ZLUOBGJFSA-N 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- FBHBVXUBTYVCRU-BZSNNMDCSA-N Tyr-His-Leu Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CN=CN1 FBHBVXUBTYVCRU-BZSNNMDCSA-N 0.000 description 4
- 108010086434 alanyl-seryl-glycine Proteins 0.000 description 4
- 108010069205 aspartyl-phenylalanine Proteins 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 230000005540 biological transmission Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000002131 composite material Substances 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 108010063718 gamma-glutamylaspartic acid Proteins 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 4
- 108010033719 glycyl-histidyl-glycine Proteins 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 229940072221 immunoglobulins Drugs 0.000 description 4
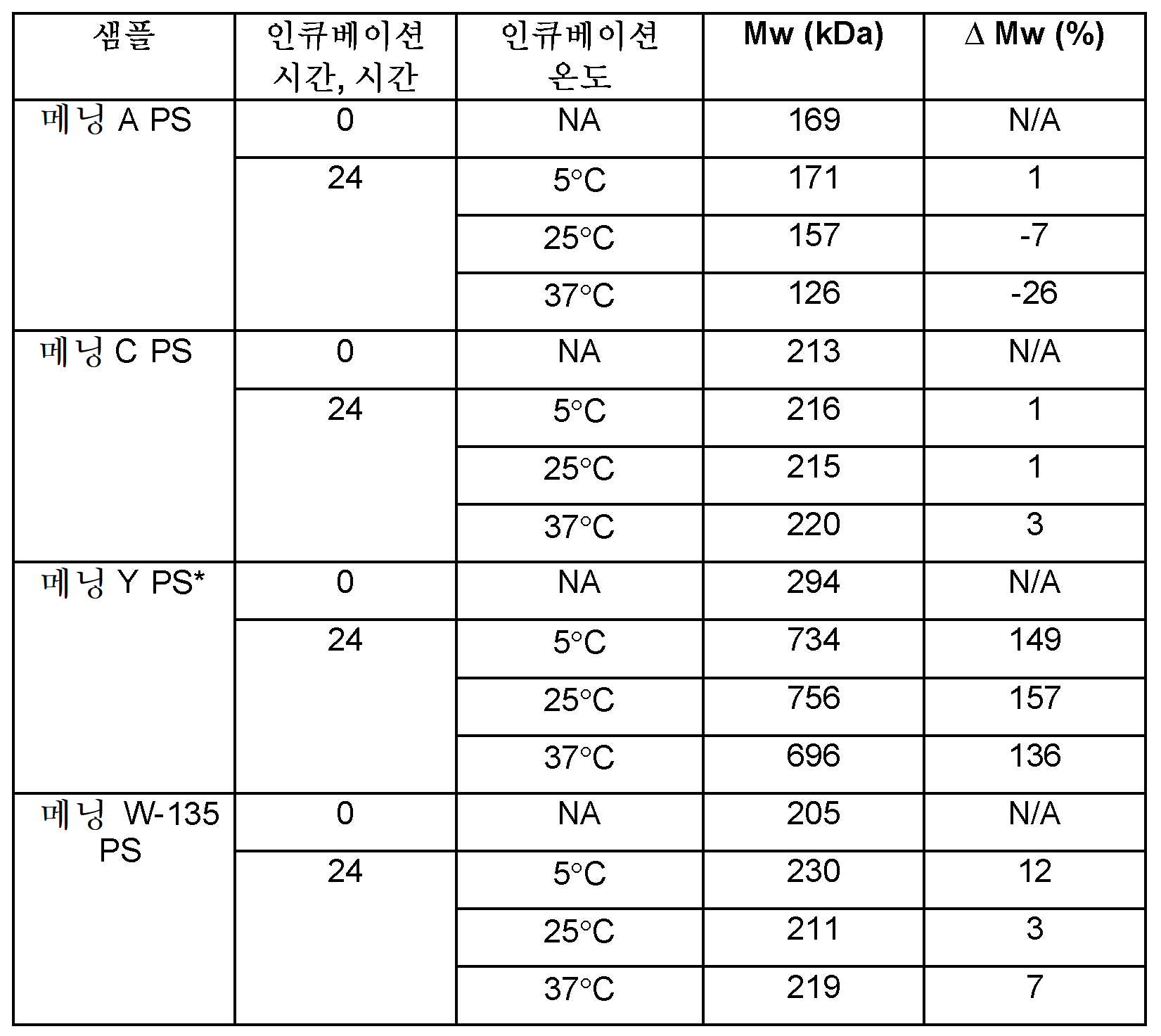
- 238000011534 incubation Methods 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 229960005037 meningococcal vaccines Drugs 0.000 description 4
- XNLICIUVMPYHGG-UHFFFAOYSA-N pentan-2-one Chemical compound CCCC(C)=O XNLICIUVMPYHGG-UHFFFAOYSA-N 0.000 description 4
- 239000003755 preservative agent Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 230000005180 public health Effects 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 238000005057 refrigeration Methods 0.000 description 4
- 125000006850 spacer group Chemical group 0.000 description 4
- 125000003396 thiol group Chemical group [H]S* 0.000 description 4
- 108010073969 valyllysine Proteins 0.000 description 4
- 229910017119 AlPO Inorganic materials 0.000 description 3
- IFTVANMRTIHKML-WDSKDSINSA-N Ala-Gln-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O IFTVANMRTIHKML-WDSKDSINSA-N 0.000 description 3
- VGPWRRFOPXVGOH-BYPYZUCNSA-N Ala-Gly-Gly Chemical compound C[C@H](N)C(=O)NCC(=O)NCC(O)=O VGPWRRFOPXVGOH-BYPYZUCNSA-N 0.000 description 3
- ZJEDSBGPBXVBMP-PYJNHQTQSA-N Arg-His-Ile Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O ZJEDSBGPBXVBMP-PYJNHQTQSA-N 0.000 description 3
- PBVLJOIPOGUQQP-CIUDSAMLSA-N Asp-Ala-Leu Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O PBVLJOIPOGUQQP-CIUDSAMLSA-N 0.000 description 3
- KNMRXHIAVXHCLW-ZLUOBGJFSA-N Asp-Asn-Ser Chemical compound C([C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CO)C(=O)O)N)C(=O)O KNMRXHIAVXHCLW-ZLUOBGJFSA-N 0.000 description 3
- HAFCJCDJGIOYPW-WDSKDSINSA-N Asp-Gly-Gln Chemical compound OC(=O)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCC(N)=O HAFCJCDJGIOYPW-WDSKDSINSA-N 0.000 description 3
- LBOVBQONZJRWPV-YUMQZZPRSA-N Asp-Lys-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(O)=O LBOVBQONZJRWPV-YUMQZZPRSA-N 0.000 description 3
- GYWQGGUCMDCUJE-DLOVCJGASA-N Asp-Phe-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C)C(O)=O GYWQGGUCMDCUJE-DLOVCJGASA-N 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- IKDOHQHEFPPGJG-FXQIFTODSA-N Gln-Asp-Glu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O IKDOHQHEFPPGJG-FXQIFTODSA-N 0.000 description 3
- JRCUFCXYZLPSDZ-ACZMJKKPSA-N Glu-Asp-Ser Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O JRCUFCXYZLPSDZ-ACZMJKKPSA-N 0.000 description 3
- WDTAKCUOIKHCTB-NKIYYHGXSA-N Glu-His-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CCC(=O)O)N)O WDTAKCUOIKHCTB-NKIYYHGXSA-N 0.000 description 3
- FQFWFZWOHOEVMZ-IHRRRGAJSA-N Glu-Phe-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O FQFWFZWOHOEVMZ-IHRRRGAJSA-N 0.000 description 3
- JXYMPBCYRKWJEE-BQBZGAKWSA-N Gly-Arg-Ala Chemical compound [H]NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O JXYMPBCYRKWJEE-BQBZGAKWSA-N 0.000 description 3
- QPTNELDXWKRIFX-YFKPBYRVSA-N Gly-Gly-Gln Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CCC(N)=O QPTNELDXWKRIFX-YFKPBYRVSA-N 0.000 description 3
- QITBQGJOXQYMOA-ZETCQYMHSA-N Gly-Gly-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)CNC(=O)CN QITBQGJOXQYMOA-ZETCQYMHSA-N 0.000 description 3
- VBOBNHSVQKKTOT-YUMQZZPRSA-N Gly-Lys-Ala Chemical compound [H]NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O VBOBNHSVQKKTOT-YUMQZZPRSA-N 0.000 description 3
- SOEGEPHNZOISMT-BYPYZUCNSA-N Gly-Ser-Gly Chemical compound NCC(=O)N[C@@H](CO)C(=O)NCC(O)=O SOEGEPHNZOISMT-BYPYZUCNSA-N 0.000 description 3
- ZLCLYFGMKFCDCN-XPUUQOCRSA-N Gly-Ser-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CO)NC(=O)CN)C(O)=O ZLCLYFGMKFCDCN-XPUUQOCRSA-N 0.000 description 3
- ZZWUYQXMIFTIIY-WEDXCCLWSA-N Gly-Thr-Leu Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O ZZWUYQXMIFTIIY-WEDXCCLWSA-N 0.000 description 3
- HXKZJLWGSWQKEA-LSJOCFKGSA-N His-Ala-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CN=CN1 HXKZJLWGSWQKEA-LSJOCFKGSA-N 0.000 description 3
- KWBISLAEQZUYIC-UWJYBYFXSA-N His-His-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CC2=CN=CN2)N KWBISLAEQZUYIC-UWJYBYFXSA-N 0.000 description 3
- SYIPVNMWBZXKMU-HJPIBITLSA-N His-His-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CC2=CN=CN2)N SYIPVNMWBZXKMU-HJPIBITLSA-N 0.000 description 3
- AQCUAZTZSPQJFF-ZKWXMUAHSA-N Ile-Ala-Gly Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O AQCUAZTZSPQJFF-ZKWXMUAHSA-N 0.000 description 3
- WUKLZPHVWAMZQV-UKJIMTQDSA-N Ile-Glu-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](C(C)C)C(=O)O)N WUKLZPHVWAMZQV-UKJIMTQDSA-N 0.000 description 3
- JHNJNTMTZHEDLJ-NAKRPEOUSA-N Ile-Ser-Arg Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O JHNJNTMTZHEDLJ-NAKRPEOUSA-N 0.000 description 3
- KBDIBHQICWDGDL-PPCPHDFISA-N Ile-Thr-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)O)N KBDIBHQICWDGDL-PPCPHDFISA-N 0.000 description 3
- BQSLGJHIAGOZCD-CIUDSAMLSA-N Leu-Ala-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O BQSLGJHIAGOZCD-CIUDSAMLSA-N 0.000 description 3
- FIJMQLGQLBLBOL-HJGDQZAQSA-N Leu-Asn-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O FIJMQLGQLBLBOL-HJGDQZAQSA-N 0.000 description 3
- ZDSNOSQHMJBRQN-SRVKXCTJSA-N Leu-Asp-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N ZDSNOSQHMJBRQN-SRVKXCTJSA-N 0.000 description 3
- VCHVSKNMTXWIIP-SRVKXCTJSA-N Leu-Lys-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O VCHVSKNMTXWIIP-SRVKXCTJSA-N 0.000 description 3
- YIBOAHAOAWACDK-QEJZJMRPSA-N Lys-Ala-Phe Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 YIBOAHAOAWACDK-QEJZJMRPSA-N 0.000 description 3
- BYPMOIFBQPEWOH-CIUDSAMLSA-N Lys-Asn-Asp Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N BYPMOIFBQPEWOH-CIUDSAMLSA-N 0.000 description 3
- CANPXOLVTMKURR-WEDXCCLWSA-N Lys-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN CANPXOLVTMKURR-WEDXCCLWSA-N 0.000 description 3
- OIQSIMFSVLLWBX-VOAKCMCISA-N Lys-Leu-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OIQSIMFSVLLWBX-VOAKCMCISA-N 0.000 description 3
- LKDXINHHSWFFJC-SRVKXCTJSA-N Lys-Ser-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)N LKDXINHHSWFFJC-SRVKXCTJSA-N 0.000 description 3
- 201000009906 Meningitis Diseases 0.000 description 3
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 3
- 108010079364 N-glycylalanine Proteins 0.000 description 3
- DJPXNKUDJKGQEE-BZSNNMDCSA-N Phe-Asp-Phe Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O DJPXNKUDJKGQEE-BZSNNMDCSA-N 0.000 description 3
- XKHCJJPNXFBADI-DCAQKATOSA-N Pro-Asp-Lys Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O XKHCJJPNXFBADI-DCAQKATOSA-N 0.000 description 3
- VDGTVWFMRXVQCT-GUBZILKMSA-N Pro-Glu-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CCCN1 VDGTVWFMRXVQCT-GUBZILKMSA-N 0.000 description 3
- NMELOOXSGDRBRU-YUMQZZPRSA-N Pro-Glu-Gly Chemical compound OC(=O)CNC(=O)[C@H](CCC(=O)O)NC(=O)[C@@H]1CCCN1 NMELOOXSGDRBRU-YUMQZZPRSA-N 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- MIJWOJAXARLEHA-WDSKDSINSA-N Ser-Gly-Glu Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCC(O)=O MIJWOJAXARLEHA-WDSKDSINSA-N 0.000 description 3
- HEUVHBXOVZONPU-BJDJZHNGSA-N Ser-Leu-Ile Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HEUVHBXOVZONPU-BJDJZHNGSA-N 0.000 description 3
- 229940124858 Streptococcus pneumoniae vaccine Drugs 0.000 description 3
- LVHHEVGYAZGXDE-KDXUFGMBSA-N Thr-Ala-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C)C(=O)N1CCC[C@@H]1C(=O)O)N)O LVHHEVGYAZGXDE-KDXUFGMBSA-N 0.000 description 3
- CRZNCABIJLRFKZ-IUKAMOBKSA-N Thr-Ile-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H]([C@@H](C)O)N CRZNCABIJLRFKZ-IUKAMOBKSA-N 0.000 description 3
- VTVVYQOXJCZVEB-WDCWCFNPSA-N Thr-Leu-Glu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O VTVVYQOXJCZVEB-WDCWCFNPSA-N 0.000 description 3
- YOOAQCZYZHGUAZ-KATARQTJSA-N Thr-Leu-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YOOAQCZYZHGUAZ-KATARQTJSA-N 0.000 description 3
- VGYVVSQFSSKZRJ-OEAJRASXSA-N Thr-Phe-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)[C@H](O)C)CC1=CC=CC=C1 VGYVVSQFSSKZRJ-OEAJRASXSA-N 0.000 description 3
- OVBMCNDKCWAXMZ-NAKRPEOUSA-N Val-Ile-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](C(C)C)N OVBMCNDKCWAXMZ-NAKRPEOUSA-N 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- XUGUHTGSMPZQIW-UHFFFAOYSA-N [[4-(4-diazonioiminocyclohexa-2,5-dien-1-ylidene)cyclohexa-2,5-dien-1-ylidene]hydrazinylidene]azanide Chemical compound C1=CC(N=[N+]=[N-])=CC=C1C1=CC=C(N=[N+]=[N-])C=C1 XUGUHTGSMPZQIW-UHFFFAOYSA-N 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 238000013019 agitation Methods 0.000 description 3
- 108010041407 alanylaspartic acid Proteins 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- CETPSERCERDGAM-UHFFFAOYSA-N ceric oxide Chemical compound O=[Ce]=O CETPSERCERDGAM-UHFFFAOYSA-N 0.000 description 3
- 229910000422 cerium(IV) oxide Inorganic materials 0.000 description 3
- 229940001442 combination vaccine Drugs 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 229960005097 diphtheria vaccines Drugs 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 108020001507 fusion proteins Proteins 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 108010062266 glycyl-glycyl-argininal Proteins 0.000 description 3
- 230000005484 gravity Effects 0.000 description 3
- 229960004443 hemophilus influenzae b vaccines Drugs 0.000 description 3
- 208000006454 hepatitis Diseases 0.000 description 3
- 231100000283 hepatitis Toxicity 0.000 description 3
- 108010036413 histidylglycine Proteins 0.000 description 3
- 108010018006 histidylserine Proteins 0.000 description 3
- 229940029583 inactivated polio vaccine Drugs 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 230000000366 juvenile effect Effects 0.000 description 3
- 239000006194 liquid suspension Substances 0.000 description 3
- 239000008176 lyophilized powder Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 229940031346 monovalent vaccine Drugs 0.000 description 3
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 3
- 238000012856 packing Methods 0.000 description 3
- 230000002688 persistence Effects 0.000 description 3
- 229940066827 pertussis vaccine Drugs 0.000 description 3
- 108010051242 phenylalanylserine Proteins 0.000 description 3
- 230000000704 physical effect Effects 0.000 description 3
- 239000000902 placebo Substances 0.000 description 3
- 229940068196 placebo Drugs 0.000 description 3
- 229960001539 poliomyelitis vaccine Drugs 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 239000013049 sediment Substances 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 229960002766 tetanus vaccines Drugs 0.000 description 3
- 108010061238 threonyl-glycine Proteins 0.000 description 3
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 2
- CGMWMYHEKGCISN-UHFFFAOYSA-N (2-chloro-6-fluorophenyl)hydrazine Chemical compound NNC1=C(F)C=CC=C1Cl CGMWMYHEKGCISN-UHFFFAOYSA-N 0.000 description 2
- GJLXVWOMRRWCIB-MERZOTPQSA-N (2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-acetamido-5-(diaminomethylideneamino)pentanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanamide Chemical compound C([C@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=C(O)C=C1 GJLXVWOMRRWCIB-MERZOTPQSA-N 0.000 description 2
- HKZAAJSTFUZYTO-LURJTMIESA-N (2s)-2-[[2-[[2-[[2-[(2-aminoacetyl)amino]acetyl]amino]acetyl]amino]acetyl]amino]-3-hydroxypropanoic acid Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(O)=O HKZAAJSTFUZYTO-LURJTMIESA-N 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- WDIYWDJLXOCGRW-ACZMJKKPSA-N Ala-Asp-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O WDIYWDJLXOCGRW-ACZMJKKPSA-N 0.000 description 2
- NWVVKQZOVSTDBQ-CIUDSAMLSA-N Ala-Glu-Arg Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O NWVVKQZOVSTDBQ-CIUDSAMLSA-N 0.000 description 2
- HXNNRBHASOSVPG-GUBZILKMSA-N Ala-Glu-Leu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O HXNNRBHASOSVPG-GUBZILKMSA-N 0.000 description 2
- DHBKYZYFEXXUAK-ONGXEEELSA-N Ala-Phe-Gly Chemical compound OC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=CC=C1 DHBKYZYFEXXUAK-ONGXEEELSA-N 0.000 description 2
- ADSGHMXEAZJJNF-DCAQKATOSA-N Ala-Pro-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](C)N ADSGHMXEAZJJNF-DCAQKATOSA-N 0.000 description 2
- DCVYRWFAMZFSDA-ZLUOBGJFSA-N Ala-Ser-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O DCVYRWFAMZFSDA-ZLUOBGJFSA-N 0.000 description 2
- GCTANJIJJROSLH-GVARAGBVSA-N Ala-Tyr-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](C)N GCTANJIJJROSLH-GVARAGBVSA-N 0.000 description 2
- LLZXKVAAEWBUPB-KKUMJFAQSA-N Arg-Gln-Phe Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O LLZXKVAAEWBUPB-KKUMJFAQSA-N 0.000 description 2
- KRQSPVKUISQQFS-FJXKBIBVSA-N Arg-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCN=C(N)N KRQSPVKUISQQFS-FJXKBIBVSA-N 0.000 description 2
- UAOSDDXCTBIPCA-QXEWZRGKSA-N Arg-Ile-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CCCN=C(N)N)N UAOSDDXCTBIPCA-QXEWZRGKSA-N 0.000 description 2
- VLIJAPRTSXSGFY-STQMWFEESA-N Arg-Tyr-Gly Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=C(O)C=C1 VLIJAPRTSXSGFY-STQMWFEESA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- QISZHYWZHJRDAO-CIUDSAMLSA-N Asn-Asp-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CC(=O)N)N QISZHYWZHJRDAO-CIUDSAMLSA-N 0.000 description 2
- RAQMSGVCGSJKCL-FOHZUACHSA-N Asn-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC(N)=O RAQMSGVCGSJKCL-FOHZUACHSA-N 0.000 description 2
- YRTOMUMWSTUQAX-FXQIFTODSA-N Asn-Pro-Asp Chemical compound NC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(O)=O YRTOMUMWSTUQAX-FXQIFTODSA-N 0.000 description 2
- MKJBPDLENBUHQU-CIUDSAMLSA-N Asn-Ser-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O MKJBPDLENBUHQU-CIUDSAMLSA-N 0.000 description 2
- FMNBYVSGRCXWEK-FOHZUACHSA-N Asn-Thr-Gly Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O FMNBYVSGRCXWEK-FOHZUACHSA-N 0.000 description 2
- ODNWIBOCFGMRTP-SRVKXCTJSA-N Asp-His-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)CC1=CN=CN1 ODNWIBOCFGMRTP-SRVKXCTJSA-N 0.000 description 2
- ICZWAZVKLACMKR-CIUDSAMLSA-N Asp-His-Ser Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CO)C(O)=O)CC1=CN=CN1 ICZWAZVKLACMKR-CIUDSAMLSA-N 0.000 description 2
- KYQNAIMCTRZLNP-QSFUFRPTSA-N Asp-Ile-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(O)=O KYQNAIMCTRZLNP-QSFUFRPTSA-N 0.000 description 2
- GPPIDDWYKJPRES-YDHLFZDLSA-N Asp-Phe-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](C(C)C)C(O)=O GPPIDDWYKJPRES-YDHLFZDLSA-N 0.000 description 2
- AHWRSSLYSGLBGD-CIUDSAMLSA-N Asp-Pro-Glu Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O AHWRSSLYSGLBGD-CIUDSAMLSA-N 0.000 description 2
- KGHLGJAXYSVNJP-WHFBIAKZSA-N Asp-Ser-Gly Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O KGHLGJAXYSVNJP-WHFBIAKZSA-N 0.000 description 2
- DRCOAZZDQRCGGP-GHCJXIJMSA-N Asp-Ser-Ile Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O DRCOAZZDQRCGGP-GHCJXIJMSA-N 0.000 description 2
- 108010034055 CRM45 fragment of diphtheria toxin Proteins 0.000 description 2
- 208000034628 Celiac artery compression syndrome Diseases 0.000 description 2
- 102000016917 Complement C1 Human genes 0.000 description 2
- 108010028774 Complement C1 Proteins 0.000 description 2
- RZSLYUUFFVHFRQ-FXQIFTODSA-N Gln-Ala-Glu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O RZSLYUUFFVHFRQ-FXQIFTODSA-N 0.000 description 2
- ZQPOVSJFBBETHQ-CIUDSAMLSA-N Gln-Glu-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZQPOVSJFBBETHQ-CIUDSAMLSA-N 0.000 description 2
- VSXBYIJUAXPAAL-WDSKDSINSA-N Gln-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CCC(N)=O VSXBYIJUAXPAAL-WDSKDSINSA-N 0.000 description 2
- JKGHMESJHRTHIC-SIUGBPQLSA-N Gln-Ile-Tyr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)NC(=O)[C@H](CCC(=O)N)N JKGHMESJHRTHIC-SIUGBPQLSA-N 0.000 description 2
- LURQDGKYBFWWJA-MNXVOIDGSA-N Gln-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(=O)N)N LURQDGKYBFWWJA-MNXVOIDGSA-N 0.000 description 2
- KVQOVQVGVKDZNW-GUBZILKMSA-N Gln-Ser-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)N)N KVQOVQVGVKDZNW-GUBZILKMSA-N 0.000 description 2
- ITBHUUMCJJQUSC-LAEOZQHASA-N Glu-Ile-Gly Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(O)=O ITBHUUMCJJQUSC-LAEOZQHASA-N 0.000 description 2
- VMKCPNBBPGGQBJ-GUBZILKMSA-N Glu-Leu-Asn Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CCC(=O)O)N VMKCPNBBPGGQBJ-GUBZILKMSA-N 0.000 description 2
- IVGJYOOGJLFKQE-AVGNSLFASA-N Glu-Leu-Lys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N IVGJYOOGJLFKQE-AVGNSLFASA-N 0.000 description 2
- OCJRHJZKGGSPRW-IUCAKERBSA-N Glu-Lys-Gly Chemical compound NCCCC[C@@H](C(=O)NCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O OCJRHJZKGGSPRW-IUCAKERBSA-N 0.000 description 2
- QDMVXRNLOPTPIE-WDCWCFNPSA-N Glu-Lys-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QDMVXRNLOPTPIE-WDCWCFNPSA-N 0.000 description 2
- SUIAHERNFYRBDZ-GVXVVHGQSA-N Glu-Lys-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O SUIAHERNFYRBDZ-GVXVVHGQSA-N 0.000 description 2
- RFTVTKBHDXCEEX-WDSKDSINSA-N Glu-Ser-Gly Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)NCC(O)=O RFTVTKBHDXCEEX-WDSKDSINSA-N 0.000 description 2
- XOEKMEAOMXMURD-JYJNAYRXSA-N Glu-Tyr-His Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)NC(=O)[C@H](CCC(=O)O)N)O XOEKMEAOMXMURD-JYJNAYRXSA-N 0.000 description 2
- KIEICAOUSNYOLM-NRPADANISA-N Glu-Val-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O KIEICAOUSNYOLM-NRPADANISA-N 0.000 description 2
- YPHPEHMXOYTEQG-LAEOZQHASA-N Glu-Val-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CCC(O)=O YPHPEHMXOYTEQG-LAEOZQHASA-N 0.000 description 2
- LZEUDRYSAZAJIO-AUTRQRHGSA-N Glu-Val-Glu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O LZEUDRYSAZAJIO-AUTRQRHGSA-N 0.000 description 2
- PMNHJLASAAWELO-FOHZUACHSA-N Gly-Asp-Thr Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PMNHJLASAAWELO-FOHZUACHSA-N 0.000 description 2
- CQZDZKRHFWJXDF-WDSKDSINSA-N Gly-Gln-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CN CQZDZKRHFWJXDF-WDSKDSINSA-N 0.000 description 2
- NPSWCZIRBAYNSB-JHEQGTHGSA-N Gly-Gln-Thr Chemical compound [H]NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O NPSWCZIRBAYNSB-JHEQGTHGSA-N 0.000 description 2
- SOEATRRYCIPEHA-BQBZGAKWSA-N Gly-Glu-Glu Chemical compound [H]NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O SOEATRRYCIPEHA-BQBZGAKWSA-N 0.000 description 2
- ZQIMMEYPEXIYBB-IUCAKERBSA-N Gly-Glu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CN ZQIMMEYPEXIYBB-IUCAKERBSA-N 0.000 description 2
- SXJHOPPTOJACOA-QXEWZRGKSA-N Gly-Ile-Arg Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CCCN=C(N)N SXJHOPPTOJACOA-QXEWZRGKSA-N 0.000 description 2
- PCPOYRCAHPJXII-UWVGGRQHSA-N Gly-Lys-Met Chemical compound [H]NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCSC)C(O)=O PCPOYRCAHPJXII-UWVGGRQHSA-N 0.000 description 2
- FGPLUIQCSKGLTI-WDSKDSINSA-N Gly-Ser-Glu Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCC(O)=O FGPLUIQCSKGLTI-WDSKDSINSA-N 0.000 description 2
- FKYQEVBRZSFAMJ-QWRGUYRKSA-N Gly-Ser-Tyr Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 FKYQEVBRZSFAMJ-QWRGUYRKSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- HQKADFMLECZIQJ-HVTMNAMFSA-N His-Glu-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CC1=CN=CN1)N HQKADFMLECZIQJ-HVTMNAMFSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- ASCFJMSGKUIRDU-ZPFDUUQYSA-N Ile-Arg-Gln Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(O)=O ASCFJMSGKUIRDU-ZPFDUUQYSA-N 0.000 description 2
- FVEWRQXNISSYFO-ZPFDUUQYSA-N Ile-Arg-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N FVEWRQXNISSYFO-ZPFDUUQYSA-N 0.000 description 2
- QYZYJFXHXYUZMZ-UGYAYLCHSA-N Ile-Asn-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC(=O)N)C(=O)O)N QYZYJFXHXYUZMZ-UGYAYLCHSA-N 0.000 description 2
- DFJJAVZIHDFOGQ-MNXVOIDGSA-N Ile-Glu-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCCCN)C(=O)O)N DFJJAVZIHDFOGQ-MNXVOIDGSA-N 0.000 description 2
- NYEYYMLUABXDMC-NHCYSSNCSA-N Ile-Gly-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)O)N NYEYYMLUABXDMC-NHCYSSNCSA-N 0.000 description 2
- DFFTXLCCDFYRKD-MBLNEYKQSA-N Ile-Gly-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)O)N DFFTXLCCDFYRKD-MBLNEYKQSA-N 0.000 description 2
- UAELWXJFLZBKQS-WHOFXGATSA-N Ile-Phe-Gly Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](Cc1ccccc1)C(=O)NCC(O)=O UAELWXJFLZBKQS-WHOFXGATSA-N 0.000 description 2
- XMYURPUVJSKTMC-KBIXCLLPSA-N Ile-Ser-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N XMYURPUVJSKTMC-KBIXCLLPSA-N 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- ZRLUISBDKUWAIZ-CIUDSAMLSA-N Leu-Ala-Asp Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC(O)=O ZRLUISBDKUWAIZ-CIUDSAMLSA-N 0.000 description 2
- XBBKIIGCUMBKCO-JXUBOQSCSA-N Leu-Ala-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XBBKIIGCUMBKCO-JXUBOQSCSA-N 0.000 description 2
- LAPSXOAUPNOINL-YUMQZZPRSA-N Leu-Gly-Asp Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC(O)=O LAPSXOAUPNOINL-YUMQZZPRSA-N 0.000 description 2
- OVZLLFONXILPDZ-VOAKCMCISA-N Leu-Lys-Thr Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OVZLLFONXILPDZ-VOAKCMCISA-N 0.000 description 2
- CHJKEDSZNSONPS-DCAQKATOSA-N Leu-Pro-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O CHJKEDSZNSONPS-DCAQKATOSA-N 0.000 description 2
- IRMLZWSRWSGTOP-CIUDSAMLSA-N Leu-Ser-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O IRMLZWSRWSGTOP-CIUDSAMLSA-N 0.000 description 2
- 206010024769 Local reaction Diseases 0.000 description 2
- 238000003231 Lowry assay Methods 0.000 description 2
- 238000009013 Lowry's assay Methods 0.000 description 2
- MPGHETGWWWUHPY-CIUDSAMLSA-N Lys-Ala-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCCN MPGHETGWWWUHPY-CIUDSAMLSA-N 0.000 description 2
- PNPYKQFJGRFYJE-GUBZILKMSA-N Lys-Ala-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(O)=O PNPYKQFJGRFYJE-GUBZILKMSA-N 0.000 description 2
- LMVOVCYVZBBWQB-SRVKXCTJSA-N Lys-Asp-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN LMVOVCYVZBBWQB-SRVKXCTJSA-N 0.000 description 2
- GKFNXYMAMKJSKD-NHCYSSNCSA-N Lys-Asp-Val Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O GKFNXYMAMKJSKD-NHCYSSNCSA-N 0.000 description 2
- VSRXPEHZMHSFKU-IUCAKERBSA-N Lys-Gln-Gly Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O VSRXPEHZMHSFKU-IUCAKERBSA-N 0.000 description 2
- MXMDJEJWERYPMO-XUXIUFHCSA-N Lys-Ile-Arg Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O MXMDJEJWERYPMO-XUXIUFHCSA-N 0.000 description 2
- KYNNSEJZFVCDIV-ZPFDUUQYSA-N Lys-Ile-Asn Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(O)=O KYNNSEJZFVCDIV-ZPFDUUQYSA-N 0.000 description 2
- IUWMQCZOTYRXPL-ZPFDUUQYSA-N Lys-Ile-Asp Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(O)=O IUWMQCZOTYRXPL-ZPFDUUQYSA-N 0.000 description 2
- YPLVCBKEPJPBDQ-MELADBBJSA-N Lys-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCCN)N YPLVCBKEPJPBDQ-MELADBBJSA-N 0.000 description 2
- WGILOYIKJVQUPT-DCAQKATOSA-N Lys-Pro-Asp Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(O)=O WGILOYIKJVQUPT-DCAQKATOSA-N 0.000 description 2
- WZVSHTFTCYOFPL-GARJFASQSA-N Lys-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)[C@H](CCCCN)N)C(=O)O WZVSHTFTCYOFPL-GARJFASQSA-N 0.000 description 2
- VHTOGMKQXXJOHG-RHYQMDGZSA-N Lys-Thr-Val Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O VHTOGMKQXXJOHG-RHYQMDGZSA-N 0.000 description 2
- BWECSLVQIWEMSC-IHRRRGAJSA-N Lys-Val-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCCCN)N BWECSLVQIWEMSC-IHRRRGAJSA-N 0.000 description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 2
- 229940124843 Measles-Mumps vaccine Drugs 0.000 description 2
- HUKLXYYPZWPXCC-KZVJFYERSA-N Met-Ala-Thr Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O HUKLXYYPZWPXCC-KZVJFYERSA-N 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 108010002311 N-glycylglutamic acid Proteins 0.000 description 2
- 235000021314 Palmitic acid Nutrition 0.000 description 2
- BJEYSVHMGIJORT-NHCYSSNCSA-N Phe-Ala-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=CC=C1 BJEYSVHMGIJORT-NHCYSSNCSA-N 0.000 description 2
- RJYBHZVWJPUSLB-QEWYBTABSA-N Phe-Gln-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC1=CC=CC=C1)N RJYBHZVWJPUSLB-QEWYBTABSA-N 0.000 description 2
- INHMISZWLJZQGH-ULQDDVLXSA-N Phe-Leu-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC1=CC=CC=C1 INHMISZWLJZQGH-ULQDDVLXSA-N 0.000 description 2
- GPSMLZQVIIYLDK-ULQDDVLXSA-N Phe-Lys-Val Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O GPSMLZQVIIYLDK-ULQDDVLXSA-N 0.000 description 2
- 108010013381 Porins Proteins 0.000 description 2
- ZLXKLMHAMDENIO-DCAQKATOSA-N Pro-Lys-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O ZLXKLMHAMDENIO-DCAQKATOSA-N 0.000 description 2
- ABSSTGUCBCDKMU-UWVGGRQHSA-N Pro-Lys-Gly Chemical compound NCCCC[C@@H](C(=O)NCC(O)=O)NC(=O)[C@@H]1CCCN1 ABSSTGUCBCDKMU-UWVGGRQHSA-N 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 206010040047 Sepsis Diseases 0.000 description 2
- MESDJCNHLZBMEP-ZLUOBGJFSA-N Ser-Asp-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O MESDJCNHLZBMEP-ZLUOBGJFSA-N 0.000 description 2
- CDVFZMOFNJPUDD-ACZMJKKPSA-N Ser-Gln-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O CDVFZMOFNJPUDD-ACZMJKKPSA-N 0.000 description 2
- UICKAKRRRBTILH-GUBZILKMSA-N Ser-Glu-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CO)N UICKAKRRRBTILH-GUBZILKMSA-N 0.000 description 2
- GZFAWAQTEYDKII-YUMQZZPRSA-N Ser-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO GZFAWAQTEYDKII-YUMQZZPRSA-N 0.000 description 2
- XNCUYZKGQOCOQH-YUMQZZPRSA-N Ser-Leu-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O XNCUYZKGQOCOQH-YUMQZZPRSA-N 0.000 description 2
- UPLYXVPQLJVWMM-KKUMJFAQSA-N Ser-Phe-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(O)=O UPLYXVPQLJVWMM-KKUMJFAQSA-N 0.000 description 2
- DFTCYYILCSQGIZ-GCJQMDKQSA-N Thr-Ala-Asn Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(O)=O DFTCYYILCSQGIZ-GCJQMDKQSA-N 0.000 description 2
- UNURFMVMXLENAZ-KJEVXHAQSA-N Thr-Arg-Tyr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O UNURFMVMXLENAZ-KJEVXHAQSA-N 0.000 description 2
- GKWNLDNXMMLRMC-GLLZPBPUSA-N Thr-Glu-Gln Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N)O GKWNLDNXMMLRMC-GLLZPBPUSA-N 0.000 description 2
- GXUWHVZYDAHFSV-FLBSBUHZSA-N Thr-Ile-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GXUWHVZYDAHFSV-FLBSBUHZSA-N 0.000 description 2
- MVYRJYISVJWKSX-KBPBESRZSA-N Tyr-His-Gly Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)NCC(=O)O)N)O MVYRJYISVJWKSX-KBPBESRZSA-N 0.000 description 2
- BYAKMYBZADCNMN-JYJNAYRXSA-N Tyr-Lys-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O BYAKMYBZADCNMN-JYJNAYRXSA-N 0.000 description 2
- RUCNAYOMFXRIKJ-DCAQKATOSA-N Val-Ala-Lys Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCCN RUCNAYOMFXRIKJ-DCAQKATOSA-N 0.000 description 2
- TZVUSFMQWPWHON-NHCYSSNCSA-N Val-Asp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](C(C)C)N TZVUSFMQWPWHON-NHCYSSNCSA-N 0.000 description 2
- YCMXFKWYJFZFKS-LAEOZQHASA-N Val-Gln-Asp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N YCMXFKWYJFZFKS-LAEOZQHASA-N 0.000 description 2
- MBGFDZDWMDLXHQ-GUBZILKMSA-N Val-Met-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CCSC)NC(=O)[C@H](C(C)C)N MBGFDZDWMDLXHQ-GUBZILKMSA-N 0.000 description 2
- UGFMVXRXULGLNO-XPUUQOCRSA-N Val-Ser-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O UGFMVXRXULGLNO-XPUUQOCRSA-N 0.000 description 2
- RLVTVHSDKHBFQP-ULQDDVLXSA-N Val-Tyr-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)CC1=CC=C(O)C=C1 RLVTVHSDKHBFQP-ULQDDVLXSA-N 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 108010047495 alanylglycine Proteins 0.000 description 2
- 125000003172 aldehyde group Chemical group 0.000 description 2
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 108010013835 arginine glutamate Proteins 0.000 description 2
- 108010059459 arginyl-threonyl-phenylalanine Proteins 0.000 description 2
- 238000000149 argon plasma sintering Methods 0.000 description 2
- 108010077245 asparaginyl-proline Proteins 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 108010047857 aspartylglycine Proteins 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 230000001588 bifunctional effect Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 239000013065 commercial product Substances 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 230000006806 disease prevention Effects 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000013020 final formulation Substances 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N glycerol group Chemical group OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 125000003976 glyceryl group Chemical group [H]C([*])([H])C(O[H])([H])C(O[H])([H])[H] 0.000 description 2
- 108010082286 glycyl-seryl-alanine Proteins 0.000 description 2
- HVODZEXFHPAFHB-UHFFFAOYSA-N hexadec-15-enoic acid Chemical compound OC(=O)CCCCCCCCCCCCCC=C HVODZEXFHPAFHB-UHFFFAOYSA-N 0.000 description 2
- SYECJBOWSGTPLU-UHFFFAOYSA-N hexane-1,1-diamine Chemical compound CCCCCC(N)N SYECJBOWSGTPLU-UHFFFAOYSA-N 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 238000002354 inductively-coupled plasma atomic emission spectroscopy Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 229960003971 influenza vaccine Drugs 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000010255 intramuscular injection Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 2
- 108010003700 lysyl aspartic acid Proteins 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 229940041323 measles vaccine Drugs 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 230000000116 mitigating effect Effects 0.000 description 2
- 210000004897 n-terminal region Anatomy 0.000 description 2
- 239000002736 nonionic surfactant Substances 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 108010018625 phenylalanylarginine Proteins 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 102000007739 porin activity proteins Human genes 0.000 description 2
- 230000002335 preservative effect Effects 0.000 description 2
- 229940023143 protein vaccine Drugs 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 239000012925 reference material Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 2
- 229960003131 rubella vaccine Drugs 0.000 description 2
- 230000000405 serological effect Effects 0.000 description 2
- 238000004513 sizing Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000000527 sonication Methods 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000013517 stratification Methods 0.000 description 2
- 239000008362 succinate buffer Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 238000011282 treatment Methods 0.000 description 2
- 108010017949 tyrosyl-glycyl-glycine Proteins 0.000 description 2
- 229940021648 varicella vaccine Drugs 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- NKUZQMZWTZAPSN-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 2-bromoacetate Chemical compound BrCC(=O)ON1C(=O)CCC1=O NKUZQMZWTZAPSN-UHFFFAOYSA-N 0.000 description 1
- PVGATNRYUYNBHO-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(2,5-dioxopyrrol-1-yl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O PVGATNRYUYNBHO-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- AWAFMFHOLVZLFG-UHFFFAOYSA-N 1-iodoaziridine-2,3-dione Chemical compound IN1C(=O)C1=O AWAFMFHOLVZLFG-UHFFFAOYSA-N 0.000 description 1
- OTEWWRBKGONZBW-UHFFFAOYSA-N 2-[[2-[[2-[(2-azaniumylacetyl)amino]-4-methylpentanoyl]amino]acetyl]amino]acetate Chemical compound NCC(=O)NC(CC(C)C)C(=O)NCC(=O)NCC(O)=O OTEWWRBKGONZBW-UHFFFAOYSA-N 0.000 description 1
- XJFPXLWGZWAWRQ-UHFFFAOYSA-N 2-[[2-[[2-[[2-[[2-[(2-azaniumylacetyl)amino]acetyl]amino]acetyl]amino]acetyl]amino]acetyl]amino]acetate Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(=O)NCC(=O)NCC(O)=O XJFPXLWGZWAWRQ-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- OTLNPYWUJOZPPA-UHFFFAOYSA-N 4-nitrobenzoic acid Chemical compound OC(=O)C1=CC=C([N+]([O-])=O)C=C1 OTLNPYWUJOZPPA-UHFFFAOYSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- ALEBYBVYXQTORU-UHFFFAOYSA-N 6-hydrazinyl-6-oxohexanoic acid Chemical compound NNC(=O)CCCCC(O)=O ALEBYBVYXQTORU-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- 229910018626 Al(OH) Inorganic materials 0.000 description 1
- YLTKNGYYPIWKHZ-ACZMJKKPSA-N Ala-Ala-Glu Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O YLTKNGYYPIWKHZ-ACZMJKKPSA-N 0.000 description 1
- YYSWCHMLFJLLBJ-ZLUOBGJFSA-N Ala-Ala-Ser Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O YYSWCHMLFJLLBJ-ZLUOBGJFSA-N 0.000 description 1
- UGLPMYSCWHTZQU-AUTRQRHGSA-N Ala-Ala-Tyr Chemical compound C[C@H]([NH3+])C(=O)N[C@@H](C)C(=O)N[C@H](C([O-])=O)CC1=CC=C(O)C=C1 UGLPMYSCWHTZQU-AUTRQRHGSA-N 0.000 description 1
- WKOBSJOZRJJVRZ-FXQIFTODSA-N Ala-Glu-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O WKOBSJOZRJJVRZ-FXQIFTODSA-N 0.000 description 1
- ROLXPVQSRCPVGK-XDTLVQLUSA-N Ala-Glu-Tyr Chemical compound N[C@@H](C)C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O ROLXPVQSRCPVGK-XDTLVQLUSA-N 0.000 description 1
- OMMDTNGURYRDAC-NRPADANISA-N Ala-Glu-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O OMMDTNGURYRDAC-NRPADANISA-N 0.000 description 1
- MPLOSMWGDNJSEV-WHFBIAKZSA-N Ala-Gly-Asp Chemical compound [H]N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O MPLOSMWGDNJSEV-WHFBIAKZSA-N 0.000 description 1
- CJQAEJMHBAOQHA-DLOVCJGASA-N Ala-Phe-Asn Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(=O)N)C(=O)O)N CJQAEJMHBAOQHA-DLOVCJGASA-N 0.000 description 1
- RTZCUEHYUQZIDE-WHFBIAKZSA-N Ala-Ser-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O RTZCUEHYUQZIDE-WHFBIAKZSA-N 0.000 description 1
- SLNCSSWAIDUUGF-LSJOCFKGSA-N Arg-His-Ala Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](C)C(O)=O SLNCSSWAIDUUGF-LSJOCFKGSA-N 0.000 description 1
- WMEVEPXNCMKNGH-IHRRRGAJSA-N Arg-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N WMEVEPXNCMKNGH-IHRRRGAJSA-N 0.000 description 1
- FKQITMVNILRUCQ-IHRRRGAJSA-N Arg-Phe-Asp Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O FKQITMVNILRUCQ-IHRRRGAJSA-N 0.000 description 1
- JPAWCMXVNZPJLO-IHRRRGAJSA-N Arg-Ser-Phe Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O JPAWCMXVNZPJLO-IHRRRGAJSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 206010053555 Arthritis bacterial Diseases 0.000 description 1
- NLCDVZJDEXIDDL-BIIVOSGPSA-N Asn-Asn-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC(=O)N)N)C(=O)O NLCDVZJDEXIDDL-BIIVOSGPSA-N 0.000 description 1
- IICZCLFBILYRCU-WHFBIAKZSA-N Asn-Gly-Asp Chemical compound [H]N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IICZCLFBILYRCU-WHFBIAKZSA-N 0.000 description 1
- JZLFYAAGGYMRIK-BYULHYEWSA-N Asn-Val-Asp Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O JZLFYAAGGYMRIK-BYULHYEWSA-N 0.000 description 1
- NJIKKGUVGUBICV-ZLUOBGJFSA-N Asp-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O NJIKKGUVGUBICV-ZLUOBGJFSA-N 0.000 description 1
- NAPNAGZWHQHZLG-ZLUOBGJFSA-N Asp-Asp-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CC(=O)O)N NAPNAGZWHQHZLG-ZLUOBGJFSA-N 0.000 description 1
- PZXPWHFYZXTFBI-YUMQZZPRSA-N Asp-Gly-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC(O)=O PZXPWHFYZXTFBI-YUMQZZPRSA-N 0.000 description 1
- SEMWSADZTMJELF-BYULHYEWSA-N Asp-Ile-Gly Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(O)=O SEMWSADZTMJELF-BYULHYEWSA-N 0.000 description 1
- YFSLJHLQOALGSY-ZPFDUUQYSA-N Asp-Ile-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(=O)O)N YFSLJHLQOALGSY-ZPFDUUQYSA-N 0.000 description 1
- CTWCFPWFIGRAEP-CIUDSAMLSA-N Asp-Lys-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O CTWCFPWFIGRAEP-CIUDSAMLSA-N 0.000 description 1
- HJCGDIGVVWETRO-ZPFDUUQYSA-N Asp-Lys-Ile Chemical compound CC[C@H](C)[C@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC(O)=O)C(O)=O HJCGDIGVVWETRO-ZPFDUUQYSA-N 0.000 description 1
- GKWFMNNNYZHJHV-SRVKXCTJSA-N Asp-Lys-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC(O)=O GKWFMNNNYZHJHV-SRVKXCTJSA-N 0.000 description 1
- USNJAPJZSGTTPX-XVSYOHENSA-N Asp-Phe-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O USNJAPJZSGTTPX-XVSYOHENSA-N 0.000 description 1
- MJJIHRWNWSQTOI-VEVYYDQMSA-N Asp-Thr-Arg Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O MJJIHRWNWSQTOI-VEVYYDQMSA-N 0.000 description 1
- CKLJMWTZIZZHCS-UHFFFAOYSA-N Aspartic acid Chemical compound OC(=O)C(N)CC(O)=O CKLJMWTZIZZHCS-UHFFFAOYSA-N 0.000 description 1
- 208000031504 Asymptomatic Infections Diseases 0.000 description 1
- 208000031729 Bacteremia Diseases 0.000 description 1
- 230000005653 Brownian motion process Effects 0.000 description 1
- 108010053406 CRM 107 Proteins 0.000 description 1
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 1
- BQENDLAVTKRQMS-SBBGFIFASA-L Carbenoxolone sodium Chemical compound [Na+].[Na+].C([C@H]1C2=CC(=O)[C@H]34)[C@@](C)(C([O-])=O)CC[C@]1(C)CC[C@@]2(C)[C@]4(C)CC[C@@H]1[C@]3(C)CC[C@H](OC(=O)CCC([O-])=O)C1(C)C BQENDLAVTKRQMS-SBBGFIFASA-L 0.000 description 1
- 241000193163 Clostridioides difficile Species 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 229940032024 DPT vaccine Drugs 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108010084884 GDP-mannose transporter Proteins 0.000 description 1
- LMPBBFWHCRURJD-LAEOZQHASA-N Gln-Asn-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCC(=O)N)N LMPBBFWHCRURJD-LAEOZQHASA-N 0.000 description 1
- SXIJQMBEVYWAQT-GUBZILKMSA-N Gln-Asp-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)N)N SXIJQMBEVYWAQT-GUBZILKMSA-N 0.000 description 1
- LVSYIKGMLRHKME-IUCAKERBSA-N Gln-Gly-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CCC(=O)N)N LVSYIKGMLRHKME-IUCAKERBSA-N 0.000 description 1
- GQZDDFRXSDGUNG-YVNDNENWSA-N Gln-Ile-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(O)=O GQZDDFRXSDGUNG-YVNDNENWSA-N 0.000 description 1
- PSERKXGRRADTKA-MNXVOIDGSA-N Gln-Leu-Ile Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O PSERKXGRRADTKA-MNXVOIDGSA-N 0.000 description 1
- ZBKUIQNCRIYVGH-SDDRHHMPSA-N Gln-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)N)N ZBKUIQNCRIYVGH-SDDRHHMPSA-N 0.000 description 1
- DUGYCMAIAKAQPB-GLLZPBPUSA-N Gln-Thr-Glu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(O)=O DUGYCMAIAKAQPB-GLLZPBPUSA-N 0.000 description 1
- LGYZYFFDELZWRS-DCAQKATOSA-N Glu-Glu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O LGYZYFFDELZWRS-DCAQKATOSA-N 0.000 description 1
- DVLZZEPUNFEUBW-AVGNSLFASA-N Glu-His-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CCC(=O)O)N DVLZZEPUNFEUBW-AVGNSLFASA-N 0.000 description 1
- HVYWQYLBVXMXSV-GUBZILKMSA-N Glu-Leu-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O HVYWQYLBVXMXSV-GUBZILKMSA-N 0.000 description 1
- SJJHXJDSNQJMMW-SRVKXCTJSA-N Glu-Lys-Arg Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O SJJHXJDSNQJMMW-SRVKXCTJSA-N 0.000 description 1
- YGLCLCMAYUYZSG-AVGNSLFASA-N Glu-Lys-His Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 YGLCLCMAYUYZSG-AVGNSLFASA-N 0.000 description 1
- YKBUCXNNBYZYAY-MNXVOIDGSA-N Glu-Lys-Ile Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O YKBUCXNNBYZYAY-MNXVOIDGSA-N 0.000 description 1
- RBXSZQRSEGYDFG-GUBZILKMSA-N Glu-Lys-Ser Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O RBXSZQRSEGYDFG-GUBZILKMSA-N 0.000 description 1
- 101000597577 Gluconacetobacter diazotrophicus (strain ATCC 49037 / DSM 5601 / CCUG 37298 / CIP 103539 / LMG 7603 / PAl5) Outer membrane protein Proteins 0.000 description 1
- SWQALSGKVLYKDT-ZKWXMUAHSA-N Gly-Ile-Ala Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O SWQALSGKVLYKDT-ZKWXMUAHSA-N 0.000 description 1
- LLZXNUUIBOALNY-QWRGUYRKSA-N Gly-Leu-Lys Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCCN LLZXNUUIBOALNY-QWRGUYRKSA-N 0.000 description 1
- FHQRLHFYVZAQHU-IUCAKERBSA-N Gly-Lys-Gln Chemical compound [H]NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(O)=O FHQRLHFYVZAQHU-IUCAKERBSA-N 0.000 description 1
- PTIIBFKSLCYQBO-NHCYSSNCSA-N Gly-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)CN PTIIBFKSLCYQBO-NHCYSSNCSA-N 0.000 description 1
- OHUKZZYSJBKFRR-WHFBIAKZSA-N Gly-Ser-Asp Chemical compound [H]NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O OHUKZZYSJBKFRR-WHFBIAKZSA-N 0.000 description 1
- JQFILXICXLDTRR-FBCQKBJTSA-N Gly-Thr-Gly Chemical compound NCC(=O)N[C@@H]([C@H](O)C)C(=O)NCC(O)=O JQFILXICXLDTRR-FBCQKBJTSA-N 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- JMSONHOUHFDOJH-GUBZILKMSA-N His-Ser-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CN=CN1 JMSONHOUHFDOJH-GUBZILKMSA-N 0.000 description 1
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 1
- 101000619708 Homo sapiens Peroxiredoxin-6 Proteins 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- PJLLMGWWINYQPB-PEFMBERDSA-N Ile-Asn-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N PJLLMGWWINYQPB-PEFMBERDSA-N 0.000 description 1
- DCQMJRSOGCYKTR-GHCJXIJMSA-N Ile-Asp-Ser Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O DCQMJRSOGCYKTR-GHCJXIJMSA-N 0.000 description 1
- MQFGXJNSUJTXDT-QSFUFRPTSA-N Ile-Gly-Ile Chemical compound N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)O MQFGXJNSUJTXDT-QSFUFRPTSA-N 0.000 description 1
- FZWVCYCYWCLQDH-NHCYSSNCSA-N Ile-Leu-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)O)N FZWVCYCYWCLQDH-NHCYSSNCSA-N 0.000 description 1
- BATWGBRIZANGPN-ZPFDUUQYSA-N Ile-Pro-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(=O)N)C(=O)O)N BATWGBRIZANGPN-ZPFDUUQYSA-N 0.000 description 1
- ZUWSVOYKBCHLRR-MGHWNKPDSA-N Ile-Tyr-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCCCN)C(=O)O)N ZUWSVOYKBCHLRR-MGHWNKPDSA-N 0.000 description 1
- 208000004575 Infectious Arthritis Diseases 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- RSFGIMMPWAXNML-MNXVOIDGSA-N Leu-Gln-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O RSFGIMMPWAXNML-MNXVOIDGSA-N 0.000 description 1
- HFBCHNRFRYLZNV-GUBZILKMSA-N Leu-Glu-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O HFBCHNRFRYLZNV-GUBZILKMSA-N 0.000 description 1
- ZRHDPZAAWLXXIR-SRVKXCTJSA-N Leu-Lys-Ala Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O ZRHDPZAAWLXXIR-SRVKXCTJSA-N 0.000 description 1
- HGLKOTPFWOMPOB-MEYUZBJRSA-N Leu-Thr-Tyr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 HGLKOTPFWOMPOB-MEYUZBJRSA-N 0.000 description 1
- VKVDRTGWLVZJOM-DCAQKATOSA-N Leu-Val-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O VKVDRTGWLVZJOM-DCAQKATOSA-N 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- CLBGMWIYPYAZPR-AVGNSLFASA-N Lys-Arg-Arg Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O CLBGMWIYPYAZPR-AVGNSLFASA-N 0.000 description 1
- BRSGXFITDXFMFF-IHRRRGAJSA-N Lys-Arg-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCCCN)N BRSGXFITDXFMFF-IHRRRGAJSA-N 0.000 description 1
- OAPNERBWQWUPTI-YUMQZZPRSA-N Lys-Gln Chemical compound NCCCC[C@H](N)C(=O)N[C@H](C(O)=O)CCC(N)=O OAPNERBWQWUPTI-YUMQZZPRSA-N 0.000 description 1
- YFGWNAROEYWGNL-GUBZILKMSA-N Lys-Gln-Asn Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O YFGWNAROEYWGNL-GUBZILKMSA-N 0.000 description 1
- GGNOBVSOZPHLCE-GUBZILKMSA-N Lys-Gln-Asp Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O GGNOBVSOZPHLCE-GUBZILKMSA-N 0.000 description 1
- PRCHKVGXZVTALR-KKUMJFAQSA-N Lys-His-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)NC(=O)[C@H](CCCCN)N PRCHKVGXZVTALR-KKUMJFAQSA-N 0.000 description 1
- PRSBSVAVOQOAMI-BJDJZHNGSA-N Lys-Ile-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CCCCN PRSBSVAVOQOAMI-BJDJZHNGSA-N 0.000 description 1
- WVJNGSFKBKOKRV-AJNGGQMLSA-N Lys-Leu-Ile Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O WVJNGSFKBKOKRV-AJNGGQMLSA-N 0.000 description 1
- PYFNONMJYNJENN-AVGNSLFASA-N Lys-Lys-Gln Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N PYFNONMJYNJENN-AVGNSLFASA-N 0.000 description 1
- BDFHWFUAQLIMJO-KXNHARMFSA-N Lys-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCCN)N)O BDFHWFUAQLIMJO-KXNHARMFSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 229940124904 Menactra Drugs 0.000 description 1
- 206010027249 Meningitis meningococcal Diseases 0.000 description 1
- 208000034762 Meningococcal Infections Diseases 0.000 description 1
- 201000010924 Meningococcal meningitis Diseases 0.000 description 1
- YGNUDKAPJARTEM-GUBZILKMSA-N Met-Val-Ala Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O YGNUDKAPJARTEM-GUBZILKMSA-N 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- 108010047562 NGR peptide Proteins 0.000 description 1
- 241001174901 Neisseria meningitidis alpha275 Species 0.000 description 1
- 101900047473 Neisseria meningitidis serogroup B Factor H binding protein Proteins 0.000 description 1
- 101100342977 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) leu-1 gene Proteins 0.000 description 1
- 101710141454 Nucleoprotein Proteins 0.000 description 1
- 241000040340 Oat mosaic virus Species 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 206010033078 Otitis media Diseases 0.000 description 1
- 101710116435 Outer membrane protein Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241001103145 Pentas Species 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 102100022239 Peroxiredoxin-6 Human genes 0.000 description 1
- 201000005702 Pertussis Diseases 0.000 description 1
- NKLDZIPTGKBDBB-HTUGSXCWSA-N Phe-Gln-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC1=CC=CC=C1)N)O NKLDZIPTGKBDBB-HTUGSXCWSA-N 0.000 description 1
- FXPZZKBHNOMLGA-HJWJTTGWSA-N Phe-Ile-Arg Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)N FXPZZKBHNOMLGA-HJWJTTGWSA-N 0.000 description 1
- ZUQACJLOHYRVPJ-DKIMLUQUSA-N Phe-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC1=CC=CC=C1 ZUQACJLOHYRVPJ-DKIMLUQUSA-N 0.000 description 1
- MCIXMYKSPQUMJG-SRVKXCTJSA-N Phe-Ser-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O MCIXMYKSPQUMJG-SRVKXCTJSA-N 0.000 description 1
- 101710183389 Pneumolysin Proteins 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 241000702619 Porcine parvovirus Species 0.000 description 1
- XROLYVMNVIKVEM-BQBZGAKWSA-N Pro-Asn-Gly Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O XROLYVMNVIKVEM-BQBZGAKWSA-N 0.000 description 1
- SGCZFWSQERRKBD-BQBZGAKWSA-N Pro-Asp-Gly Chemical compound OC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@@H]1CCCN1 SGCZFWSQERRKBD-BQBZGAKWSA-N 0.000 description 1
- NXEYSLRNNPWCRN-SRVKXCTJSA-N Pro-Glu-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O NXEYSLRNNPWCRN-SRVKXCTJSA-N 0.000 description 1
- BGWKULMLUIUPKY-BQBZGAKWSA-N Pro-Ser-Gly Chemical compound OC(=O)CNC(=O)[C@H](CO)NC(=O)[C@@H]1CCCN1 BGWKULMLUIUPKY-BQBZGAKWSA-N 0.000 description 1
- 238000012356 Product development Methods 0.000 description 1
- 239000002262 Schiff base Substances 0.000 description 1
- 150000004753 Schiff bases Chemical class 0.000 description 1
- BTKUIVBNGBFTTP-WHFBIAKZSA-N Ser-Ala-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)NCC(O)=O BTKUIVBNGBFTTP-WHFBIAKZSA-N 0.000 description 1
- JPIDMRXXNMIVKY-VZFHVOOUSA-N Ser-Ala-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O JPIDMRXXNMIVKY-VZFHVOOUSA-N 0.000 description 1
- HBZBPFLJNDXRAY-FXQIFTODSA-N Ser-Ala-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O HBZBPFLJNDXRAY-FXQIFTODSA-N 0.000 description 1
- UIPXCLNLUUAMJU-JBDRJPRFSA-N Ser-Ile-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O UIPXCLNLUUAMJU-JBDRJPRFSA-N 0.000 description 1
- KCNSGAMPBPYUAI-CIUDSAMLSA-N Ser-Leu-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O KCNSGAMPBPYUAI-CIUDSAMLSA-N 0.000 description 1
- UGTZYIPOBYXWRW-SRVKXCTJSA-N Ser-Phe-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O UGTZYIPOBYXWRW-SRVKXCTJSA-N 0.000 description 1
- XKFJENWJGHMDLI-QWRGUYRKSA-N Ser-Phe-Gly Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)NCC(O)=O XKFJENWJGHMDLI-QWRGUYRKSA-N 0.000 description 1
- VVKVHAOOUGNDPJ-SRVKXCTJSA-N Ser-Tyr-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(O)=O VVKVHAOOUGNDPJ-SRVKXCTJSA-N 0.000 description 1
- 101710084578 Short neurotoxin 1 Proteins 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108010055044 Tetanus Toxin Proteins 0.000 description 1
- BSNZTJXVDOINSR-JXUBOQSCSA-N Thr-Ala-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O BSNZTJXVDOINSR-JXUBOQSCSA-N 0.000 description 1
- KEGBFULVYKYJRD-LFSVMHDDSA-N Thr-Ala-Phe Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 KEGBFULVYKYJRD-LFSVMHDDSA-N 0.000 description 1
- BECPPKYKPSRKCP-ZDLURKLDSA-N Thr-Glu Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(O)=O)CCC(O)=O BECPPKYKPSRKCP-ZDLURKLDSA-N 0.000 description 1
- QQWNRERCGGZOKG-WEDXCCLWSA-N Thr-Gly-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O QQWNRERCGGZOKG-WEDXCCLWSA-N 0.000 description 1
- BVOVIGCHYNFJBZ-JXUBOQSCSA-N Thr-Leu-Ala Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O BVOVIGCHYNFJBZ-JXUBOQSCSA-N 0.000 description 1
- VRUFCJZQDACGLH-UVOCVTCTSA-N Thr-Leu-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O VRUFCJZQDACGLH-UVOCVTCTSA-N 0.000 description 1
- XKWABWFMQXMUMT-HJGDQZAQSA-N Thr-Pro-Glu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O XKWABWFMQXMUMT-HJGDQZAQSA-N 0.000 description 1
- WKGAAMOJPMBBMC-IXOXFDKPSA-N Thr-Ser-Phe Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O WKGAAMOJPMBBMC-IXOXFDKPSA-N 0.000 description 1
- PELIQFPESHBTMA-WLTAIBSBSA-N Thr-Tyr-Gly Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=C(O)C=C1 PELIQFPESHBTMA-WLTAIBSBSA-N 0.000 description 1
- ABCLYRRGTZNIFU-BWAGICSOSA-N Thr-Tyr-His Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)N)O ABCLYRRGTZNIFU-BWAGICSOSA-N 0.000 description 1
- 101710182223 Toxin B Proteins 0.000 description 1
- 101710182532 Toxin a Proteins 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- PMDWYLVWHRTJIW-STQMWFEESA-N Tyr-Gly-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC1=CC=C(O)C=C1 PMDWYLVWHRTJIW-STQMWFEESA-N 0.000 description 1
- AZGZDDNKFFUDEH-QWRGUYRKSA-N Tyr-Gly-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC1=CC=C(O)C=C1 AZGZDDNKFFUDEH-QWRGUYRKSA-N 0.000 description 1
- QPOUERMDWKKZEG-HJPIBITLSA-N Tyr-Ser-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 QPOUERMDWKKZEG-HJPIBITLSA-N 0.000 description 1
- NZBSVMQZQMEUHI-WZLNRYEVSA-N Tyr-Thr-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N NZBSVMQZQMEUHI-WZLNRYEVSA-N 0.000 description 1
- LABUITCFCAABSV-BPNCWPANSA-N Val-Ala-Tyr Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 LABUITCFCAABSV-BPNCWPANSA-N 0.000 description 1
- LABUITCFCAABSV-UHFFFAOYSA-N Val-Ala-Tyr Natural products CC(C)C(N)C(=O)NC(C)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 LABUITCFCAABSV-UHFFFAOYSA-N 0.000 description 1
- ZEVNVXYRZRIRCH-GVXVVHGQSA-N Val-Gln-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCCCN)C(=O)O)N ZEVNVXYRZRIRCH-GVXVVHGQSA-N 0.000 description 1
- RHYOAUJXSRWVJT-GVXVVHGQSA-N Val-His-Glu Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N RHYOAUJXSRWVJT-GVXVVHGQSA-N 0.000 description 1
- QRVPEKJBBRYISE-XUXIUFHCSA-N Val-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C(C)C)N QRVPEKJBBRYISE-XUXIUFHCSA-N 0.000 description 1
- DHZPCJWLUQMUPF-RTRLPJTCSA-N [(2R,3S,4R,5R)-5-acetamido-4,6-dihydroxy-2-(hydroxymethyl)oxan-3-yl] dihydrogen phosphate Chemical group CC(=O)N[C@H]1C(O)O[C@H](CO)[C@@H](OP(O)(O)=O)[C@@H]1O DHZPCJWLUQMUPF-RTRLPJTCSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 229940102614 adacel Drugs 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 238000005054 agglomeration Methods 0.000 description 1
- 238000005904 alkaline hydrolysis reaction Methods 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- LSQZJLSUYDQPKJ-NJBDSQKTSA-N amoxicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=C(O)C=C1 LSQZJLSUYDQPKJ-NJBDSQKTSA-N 0.000 description 1
- 229960003022 amoxicillin Drugs 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 108010068380 arginylarginine Proteins 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 229940090821 bexsero Drugs 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 238000010170 biological method Methods 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- KDPAWGWELVVRCH-UHFFFAOYSA-M bromoacetate Chemical compound [O-]C(=O)CBr KDPAWGWELVVRCH-UHFFFAOYSA-M 0.000 description 1
- 229920005557 bromobutyl Polymers 0.000 description 1
- 238000005537 brownian motion Methods 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000002144 chemical decomposition reaction Methods 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 238000011217 control strategy Methods 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 238000007333 cyanation reaction Methods 0.000 description 1
- OOTFVKOQINZBBF-UHFFFAOYSA-N cystamine Chemical compound CCSSCCN OOTFVKOQINZBBF-UHFFFAOYSA-N 0.000 description 1
- 229940099500 cystamine Drugs 0.000 description 1
- UFULAYFCSOUIOV-UHFFFAOYSA-N cysteamine Chemical compound NCCS UFULAYFCSOUIOV-UHFFFAOYSA-N 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 238000007822 cytometric assay Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000022811 deglycosylation Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- KZNICNPSHKQLFF-UHFFFAOYSA-N dihydromaleimide Natural products O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 208000001606 epiglottitis Diseases 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 125000005313 fatty acid group Chemical group 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000008394 flocculating agent Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 108010027668 glycyl-alanyl-valine Proteins 0.000 description 1
- 108010078326 glycyl-glycyl-valine Proteins 0.000 description 1
- 108010089804 glycyl-threonine Proteins 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 230000010370 hearing loss Effects 0.000 description 1
- 231100000888 hearing loss Toxicity 0.000 description 1
- 208000016354 hearing loss disease Diseases 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 108010040030 histidinoalanine Proteins 0.000 description 1
- 108010028295 histidylhistidine Proteins 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 1
- 125000000717 hydrazino group Chemical group [H]N([*])N([H])[H] 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 230000006054 immunological memory Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000001095 inductively coupled plasma mass spectrometry Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000008384 inner phase Substances 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 108010057821 leucylproline Proteins 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 108010017391 lysylvaline Proteins 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000005541 medical transmission Effects 0.000 description 1
- 229940035102 meningococcal group b vaccine Drugs 0.000 description 1
- 229960003151 mercaptamine Drugs 0.000 description 1
- 238000007392 microtiter assay Methods 0.000 description 1
- 238000012821 model calculation Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- RYRIMPODRHVEIW-UHFFFAOYSA-N n-(2-phenylethyl)nitramide Chemical compound [O-][N+](=O)NCCC1=CC=CC=C1 RYRIMPODRHVEIW-UHFFFAOYSA-N 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 229960005030 other vaccine in atc Drugs 0.000 description 1
- 239000008385 outer phase Substances 0.000 description 1
- LSQZJLSUYDQPKJ-UHFFFAOYSA-N p-Hydroxyampicillin Natural products O=C1N2C(C(O)=O)C(C)(C)SC2C1NC(=O)C(N)C1=CC=C(O)C=C1 LSQZJLSUYDQPKJ-UHFFFAOYSA-N 0.000 description 1
- 229960002566 papillomavirus vaccine Drugs 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 238000004803 parallel plate viscometry Methods 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical compound OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 229920000553 poly(phenylenevinylene) Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 108010070643 prolylglutamic acid Proteins 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000006268 reductive amination reaction Methods 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 201000001223 septic arthritis Diseases 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000013097 stability assessment Methods 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 229960002317 succinimide Drugs 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 230000003319 supportive effect Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 229940118376 tetanus toxin Drugs 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 239000011800 void material Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/095—Neisseria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/646—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the entire peptide or protein drug conjugate elicits an immune response, e.g. conjugate vaccines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/22—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Neisseriaceae (F)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/575—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 humoral response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/62—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier
- A61K2039/627—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier characterised by the linker
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/70—Multivalent vaccine
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Mycology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Communicable Diseases (AREA)
- Microbiology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Inorganic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
Abstract
한 측면에서, 본 개시내용은 인자 H 결합 단백질 (fHBP) 및 네이세리아 메닌기티디스 비-혈청군 B 피막 폴리사카라이드를 포함하는 조성물, 및 그의 사용 방법에 관한 것이다. 본 개시내용은 추가로, fHBP를 포함하는 조성물의 용도, 예컨대 예를 들어, 엔. 메닌기티디스 혈청군 B 균주 및 비-혈청군 B 균주에 대한 면역 반응을 도출하기 위한 용도에 관한 것이다. 본원에 기재된 조성물 및 방법은 성인, 청소년, 유아, 및 영아를 포함한 인간에서의 투여에 관한 것이다.
Description
관련 출원에 대한 상호 참조
본 출원은 2019년 9월 27일에 출원된 미국 특허 가출원 62/907,097 및 2020년 6월 17일에 출원된 미국 특허 가출원 63/040,498의 이익을 주장한다. 상기 출원은 모두 그 전문이 본원에 참조로 포함된다.
개시내용의 분야
본 개시내용은 네이세리아 메닌기티디스(Neisseria meningitidis) 조성물 및 그의 방법에 관한 것이다.
네이세리아 메닌기티디스는 패혈증, 수막염 및 사망을 유발할 수 있는 그람-음성 피막화된 박테리아이다. 엔. 메닌기티디스는 화학적으로 및 항원적으로 구별되는 폴리사카라이드 피막에 기초하여 적어도 12종의 혈청군 (혈청군 A, B, C, 29E, H, I, K, L, W-135 (대부분 현재 W로 지칭됨), X, Y 및 Z 포함)으로 분류될 수 있다. 혈청군 중 5종 (A, B, C, Y 및 W135)의 균주가 대다수의 질환의 원인이 된다.
수막구균 수막염은 항생제의 이용가능성에도 불구하고 소아 및 청년을 수시간 내에 사망하게 할 수 있는 파괴적인 질환이다. 수막구균 혈청군 A, B, C, Y 및 W135 및/또는 X에 대한 개선된 면역원성 조성물에 대한 필요가 존재한다.
현재, 광범위한 MnB 및 수막구균 혈청군 A, C, Y, 및 W 및/또는 X 분리주에 대한 효과적인 교차-보호 백신 또는 조성물이 아직 상업적으로 입수가능하지 않다. 따라서, 다양한 MnB 및 수막구균 혈청군 A, C, Y, 및 W 및/또는 X 분리주에 대해 효과적인 교차-보호 백신 또는 조성물이 필요하다.
본 개시내용의 추가의 목적은 수막구균 백신을 투여하는 것에 대한 개선된 스케줄을 제공하는 것이다. 현행 권장 스킴 하에, 상이한 연령에게 제공되는 수막구균 혈청군 A, C, W, Y 및 B에 대한 4 내지 5회의 백신접종이 제공된다. 면역화 스케줄을 단순화하고 백신접종 커버리지를 개선시켜 침습성 수막구균 질환 (IMD)의 추가의 감소를 달성할 수 있는 효율적인 백신접종에 대한 미충족 필요가 존재한다.
이들 및 다른 필요를 충족시키기 위해, 본 개시내용은 네이세리아 메닌기티디스 조성물 및 그의 방법에 관한 것이다.
본 발명자들은 인간에게 a) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 폴리펩티드; (b) 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드 접합체; (c) 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드 접합체; (d) 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드 접합체; 및 (e) 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드 접합체를 포함하는 조성물을 투여하는 것을 포함하는, 인간에서 면역 반응을 유도하는 방법을 발견하였으며, 여기서 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 중 적어도 1종 및 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고, 여기서 면역 반응은 혈청군에 대한 각각의 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 혈청 살박테리아 항체의 역가를 포함한다.
본 발명자들은 놀랍게도 인간에게 a) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제1 폴리펩티드; (b) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제2 폴리펩티드; (c) 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드 접합체; (d) 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드 접합체; (e) 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드 접합체; 및 (f) 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드 접합체를 포함하는 조성물을 투여하는 것을 포함하는, 인간에서 면역 반응을 유도하는 방법을 발견하였으며, 여기서 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 중 적어도 1종 및 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고, 여기서 면역 반응은 혈청군에 대한 각각의 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 혈청 살박테리아 항체의 역가를 포함한다.
일부 실시양태에서, 폴리펩티드는 서열식별번호(SEQ ID NO): 1 내지 서열식별번호: 62로부터 선택된 어느 하나의 아미노산 서열에 대해 적어도 70% 동일성을 갖는 아미노산 서열을 포함한다.
바람직한 실시양태에서, 조성물은 (a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함한다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 어느 하나에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 A에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 C에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 W에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 Y에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 각각에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 수막구균 혈청군 B 인자 H 결합 백신에 의해 도출된 것보다 더 높다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 각각에 대한 면역 반응을 도출하며, 여기서 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 각각에 대한 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높고; 조성물은 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 수막구균 혈청군 B 인자 H 결합 백신에 의해 도출된 것보다 더 높고; 여기서 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신 및 허가된 수막구균 혈청군 B 인자 H 결합 백신은 순차적으로 투여되고 조합 용량은 아니다.
일부 실시양태에서, 조성물은 아주반트를 포함한다. 일부 실시양태에서, 조성물은 알루미늄 아주반트를 포함한다. 일부 실시양태에서, 조성물은 수산화알루미늄을 포함한다. 일부 실시양태에서, 조성물은 인산알루미늄을 포함한다. 일부 실시양태에서, 조성물은 알루미늄을 포함한다.
일부 실시양태에서, 제1 폴리펩티드의 적어도 90%는 조성물 중의 알루미늄에 결합된다. 일부 실시양태에서, 제2 폴리펩티드의 적어도 90%는 조성물 중의 알루미늄에 결합된다.
일부 실시양태에서, 조성물은 멸균 액체로서 제제화된다. 일부 실시양태에서, 조성물은 제약상 허용되는 보존제를 포함한다. 일부 실시양태에서, 조성물은 폴리소르베이트-80을 포함한다. 일부 실시양태에서, 조성물은 트리스-HCl; 염화나트륨; 수크로스; 히스티딘; 폴리소르베이트 80; 및 인산알루미늄을 포함한다.
일부 실시양태에서, 조성물은 약 120 μg/ml의 제1 폴리펩티드; 약 120 μg/ml의 제2 폴리펩티드; 인산알루미늄으로서 약 0.5 mg/ml 알루미늄; 약 0.02 mg 폴리소르베이트-80; 약 10 mM 히스티딘; 및 약 150 mM 염화나트륨을 포함한다.
일부 실시양태에서, 조성물은 용량당 약 60 μg의 제1 폴리펩티드; 약 60 μg의 제2 폴리펩티드; 약 7.5 μg TT에 접합된 약 5 μg의 MenA 피막 사카라이드; 약 7.5 μg TT에 접합된 약 5 μg의 MenC 피막 사카라이드; 약 3.75 μg TT에 접합된 약 5 μg의 MenW 피막 사카라이드; 약 3.25 μg TT에 접합된 약 5 μg의 MenY 피막 사카라이드; 약 97 μg 트리스-HCl, pH 6.8 ± 0.3; 4.69-4.71 mg의 염화나트륨; 약 28 mg의 수크로스; 약 0.78 mg의 L-히스티딘; 약 0.02 mg 폴리소르베이트-80; 약 0.25 mg 알루미늄을 포함하고; 0.5 mL 물을 추가로 포함한다.
일부 실시양태에서, 면역 반응은 혈청 살박테리아 항체를 포함한다. 일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 1종에 대한 부스터 면역 반응을 도출할 수 있다. 일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 B에 대한 부스터 면역 반응을 도출할 수 있다.
일부 실시양태에서, 면역 반응은 최대 25세의 인간에서 도출된다. 일부 실시양태에서, 면역 반응은 적어도 2개월 내지 25세의 인간에서 도출된다. 일부 실시양태에서, 면역 반응은 10세 내지 25세의 인간에서 도출된다. 일부 실시양태에서, 면역 반응은 10세 내지 26세의 인간에서 도출된다. 일부 실시양태에서, 면역 반응은 12개월 내지 <18개월 또는 18개월 내지 <24개월령의 인간에서 도출된다. 일부 실시양태에서, 면역 반응은 18개월 내지 <24개월령의 인간에서 도출된다. 일부 실시양태에서, 면역 반응은 ≥24개월 내지 <10세의 인간에서 도출된다.
일부 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y에 대해 혈청음성인 인간에서 도출된다. 일부 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y에 대해 혈청양성인 인간에서 도출된다.
일부 실시양태에서, 조성물은 적어도 2회의 용량으로 인간에게 투여되며, 여기서 제2 용량은 제1 용량의 약 6개월 후이다. 일부 실시양태에서, 인간은 적어도 10세 및 최대 17세이다. 일부 실시양태에서, 조성물의 제3 용량이 인간에게 투여되며, 여기서 인간은 적어도 16세이다.
일부 실시양태에서, 조성물은 최대 2회의 용량으로 인간에게 투여되며, 여기서 제2 용량은 제1 용량의 약 6개월 후이다.
일부 실시양태에서, 조성물은 A22에 대한 면역 반응을 도출한다. 일부 실시양태에서, 조성물은 A56에 대한 면역 반응을 도출한다. 일부 실시양태에서, 조성물은 B24에 대한 면역 반응을 도출한다. 일부 실시양태에서, 조성물은 B44에 대한 면역 반응을 도출한다.
일부 실시양태에서, 조성물은 용량당 약 60 μg의 제1 폴리펩티드; 약 60 μg의 제2 폴리펩티드; 약 7.5 μg TT에 접합된 약 5 μg의 MenA 피막 사카라이드; 약 7.5 μg TT에 접합된 약 5 μg의 MenC 피막 사카라이드; 약 3.75 μg TT에 접합된 약 5 μg의 MenW 피막 사카라이드; 약 3.25 μg TT에 접합된 약 5 μg의 MenY 피막 사카라이드; 약 97 μg 트리스-HCl, pH 6.8 ± 0.3; 4.69-4.71 mg의 염화나트륨; 약 28 mg의 수크로스; 약 0.78 mg의 L-히스티딘; 약 0.02 mg 폴리소르베이트-80; 약 0.25 mg 알루미늄을 포함하고; 0.5 mL 물을 추가로 포함한다.
(a) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제1 폴리펩티드; (b) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제2 폴리펩티드; (c) 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드 접합체; (d) 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드 접합체; (e) 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드 접합체; 및 (f) 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드 접합체를 포함하며; 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 1종에 대한 면역 반응을 도출하고, 상기 혈청 살박테리아 항체 반응이 엔. 메닌기티디스 혈청군에 대한 허가된 백신에 의해 도출된 것보다 더 높은 것인 조성물.
일부 실시양태에서, 폴리펩티드는 서열식별번호: 1 내지 서열식별번호: 62로부터 선택된 어느 하나의 아미노산 서열에 대해 적어도 70% 동일성을 갖는 아미노산 서열을 포함한다.
(a) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제1 폴리펩티드; (b) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함하며; 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 1종에 대한 면역 반응을 도출하고, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 조성물.
유효량의 조성물을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 B 서브패밀리 A 균주 및 네이세리아 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대한 면역 반응을 유도하는 방법.
유효량의 조성물을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 A, 네이세리아 메닌기티디스 혈청군 C, 네이세리아 메닌기티디스 혈청군 W, 및/또는 네이세리아 메닌기티디스 혈청군 Y 균주에 대한 면역 반응을 유도하는 방법.
유효량의 조성물을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 A, 네이세리아 메닌기티디스 혈청군 B, 네이세리아 메닌기티디스 혈청군 C, 네이세리아 메닌기티디스 혈청군 W, 및/또는 네이세리아 메닌기티디스 혈청군 Y 균주에 대한 면역 반응을 유도하는 방법.
유효량의 조성물을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 A, 네이세리아 메닌기티디스 혈청군 B, 네이세리아 메닌기티디스 혈청군 C, 네이세리아 메닌기티디스 혈청군 W, 네이세리아 메닌기티디스 혈청군 Y 균주, 및/또는 네이세리아 메닌기티디스 혈청군 X 균주에 대한 면역 반응을 유도하는 방법.
일부 실시양태에서, 환자는 조성물의 제1 투여 전에 다가 수막구균 피막 사카라이드-담체 단백질 접합체 백신을 이전에 제공받지 않았다.
일부 실시양태에서, 환자는 조성물의 제1 투여 전에 다가 수막구균 피막 사카라이드-담체 단백질 접합체 백신을 이전에 제공받았다.
도 1a-b - (도 1a) 용량 2의 1개월 후 MenB 시험 균주 및 (도 1b) 용량 1 및 2의 1개월 후 MenA, MenC, MenW, 및 MenY 시험 균주에 대해 hSBA에서 측정된 바와 같은 면역 반응. 오차 막대는 95% 시스를 나타낸다. MenB 균주는 괄호 안에 FHbp 변이체를 나타낸다. *MenABCWY, n=418-4432; MenB-FHbp, n=814-850. †복합 반응=모든 4종의 MenB 시험 균주에 대해 hSBA 역가 ≥LLOQ. ‡MenABCWY, n=227-262; MenACWY-CRM, n=446-506. §MenABCWY, n=187-257; MenACWY-CRM, n=370-495. hSBA=인간 보체를 사용한 혈청 살박테리아 활성; MenA=수막구균 혈청군 A; LLOQ=정량 하한치; m-개월; MenABCWY=5가 혈청군 A, B, C, W, Y 백신; MenACWY-CRM=멘베오(MENVEO)®, 수막구균 (군 A, C, Y, 및 W-135) 올리고사카라이드 CRM197 접합체 백신 (4가 수막구균 CRM 백신); MenB= 수막구균 혈청군 B; MenB-FHbp=트루멘바(TRUMENBA)®, 수막구균 군 B 2가 재조합 지단백질 2086 (2가 rLP2086).
백신; MenC= 수막구균 혈청군 C; MenW= 수막구균 혈청군 W; MenY= 수막구균 혈청군 Y; PD=투여후.
도 2a-b. 임의의 용량 후 7일 내에 보고된 (도 2a) 국부 반응 및 (도 2b) 전신 사건. MenABCWY, n=542; MenB-FHbp+MenACWY-CRM, n=1050. *MenABCWY/MenB-FHbp 주사 부위에서의 것. MenABCWY=5가 혈청군 A, B, C, W, Y 백신; MenACWY-CRM=멘베오®, 수막구균 (군 A, C, Y, 및 W-135) 올리고사카라이드 CRM197 접합체 백신 (4가 수막구균 CRM 백신); MenB-FHbp=트루멘바®, 수막구균 군 B 2가 재조합 지단백질 2086 (2가 rLP2086).
도 3. 가설상 백신접종이 없는 시나리오와 비교하여 다양한 백신 투여 전략 하에 10년에 걸쳐 회피된 추정 사례.
서열 식별자
서열식별번호: 1은 재조합 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05 폴리펩티드 항원에 대한 아미노산 서열을 제시한다.
서열식별번호: 2는 재조합 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B01 폴리펩티드 항원에 대한 아미노산 서열을 제시한다.
서열식별번호: 3은 서열식별번호: 1 및 서열식별번호: 2의 위치 1-4의 아미노산 잔기를 제시한다.
서열식별번호: 4는 재조합 네이세리아 서브패밀리 A LP2086 폴리펩티드 (rLP2086) (A05) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 5는 네이세리아 서브패밀리 A LP2086 M98250771 폴리펩티드 (A05) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 6은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B153에 대한 아미노산 서열을 제시한다.
서열식별번호: 7은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A04에 대한 아미노산 서열을 제시한다.
서열식별번호: 8은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 9는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A12에 대한 아미노산 서열을 제시한다.
서열식별번호: 10은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A22에 대한 아미노산 서열을 제시한다.
서열식별번호: 11은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B02에 대한 아미노산 서열을 제시한다.
서열식별번호: 12는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B03에 대한 아미노산 서열을 제시한다.
서열식별번호: 13은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B09에 대한 아미노산 서열을 제시한다.
서열식별번호: 14는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B22에 대한 아미노산 서열을 제시한다.
서열식별번호: 15는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B24에 대한 아미노산 서열을 제시한다.
서열식별번호: 16은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B44에 대한 아미노산 서열을 제시한다.
서열식별번호: 17은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B16에 대한 아미노산 서열을 제시한다.
서열식별번호: 18은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A07에 대한 아미노산 서열을 제시한다.
서열식별번호: 19는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A19에 대한 아미노산 서열을 제시한다.
서열식별번호: 20은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A06에 대한 아미노산 서열을 제시한다.
서열식별번호: 21은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A15에 대한 아미노산 서열을 제시한다.
서열식별번호: 22는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A29에 대한 아미노산 서열을 제시한다.
서열식별번호: 23은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B15에 대한 아미노산 서열을 제시한다.
서열식별번호: 24는 재조합 네이세리아 서브패밀리 B LP2086 폴리펩티드 (rLP2086) (B01) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 25는 네이세리아 서브패밀리 B LP2086 CDC-1573 폴리펩티드 (B01) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 26은 인자 H 결합 단백질 (fHBP) B16을 발현하는 엔. 메닌기티디스 혈청군 A 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 27은 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 C 균주에 대한 아미노산 서열을 제시한다. 서열식별번호: 27은 또한 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 28은 fHBP A19를 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 29는 fHBP B47을 발현하는 엔. 메닌기티디스 혈청군 Y 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 30은 fHBP B49를 발현하는 엔. 메닌기티디스 혈청군 X 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 31은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B16에 대한 아미노산 서열을 제시한다.
서열식별번호: 32는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A07에 대한 아미노산 서열을 제시한다.
서열식별번호: 33은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A19에 대한 아미노산 서열을 제시한다.
서열식별번호: 34는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A06에 대한 아미노산 서열을 제시한다.
서열식별번호: 35는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A15에 대한 아미노산 서열을 제시한다.
서열식별번호: 36은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A29에 대한 아미노산 서열을 제시한다.
서열식별번호: 37은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B15에 대한 아미노산 서열을 제시한다.
서열식별번호: 38은 인자 H 결합 단백질 (fHBP) B16을 발현하는 엔. 메닌기티디스 혈청군 A 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 39는 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 C 균주에 대한 아미노산 서열을 제시한다. 서열식별번호: 39는 또한 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 40은 fHBP A19를 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 41은 fHBP B47을 발현하는 엔. 메닌기티디스 혈청군 Y 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 42는 fHBP B49를 발현하는 엔. 메닌기티디스 혈청군 X 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 43은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B44에 대한 아미노산 서열을 제시한다.
서열식별번호: 44는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B09에 대한 아미노산 서열을 제시한다.
서열식별번호: 45는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B09에 대한 아미노산 서열을 제시한다.
서열식별번호: 46은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 47은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B01에 대한 아미노산 서열을 제시한다.
서열식별번호: 48은 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B01에 대한 아미노산 서열을 제시한다.
서열식별번호: 49는 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B15에 대한 아미노산 서열을 제시한다.
서열식별번호: 50은 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B16에 대한 아미노산 서열을 제시한다.
서열식별번호: 51은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B22에 대한 아미노산 서열을 제시한다.
서열식별번호: 52는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A22에 대한 아미노산 서열을 제시한다.
서열식별번호: 53은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A12에 대한 아미노산 서열을 제시한다.
서열식별번호: 54는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A22에 대한 아미노산 서열을 제시한다.
서열식별번호: 55는 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스 혈청군 B, 2086 변이체 A62에 대한 아미노산 서열을 제시한다.
서열식별번호: 56은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A62에 대한 아미노산 서열을 제시한다.
서열식별번호: 57은 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A29에 대한 아미노산 서열을 제시한다.
서열식별번호: 58은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B22에 대한 아미노산 서열을 제시한다.
서열식별번호: 59는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 60은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 61은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B24에 대한 아미노산 서열을 제시한다.
서열식별번호: 62는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B24에 대한 아미노산 서열을 제시한다.
서열식별번호: 63은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A02에 대한 아미노산 서열을 제시한다.
서열식별번호: 64는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A28에 대한 아미노산 서열을 제시한다.
서열식별번호: 65는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A42에 대한 아미노산 서열을 제시한다.
서열식별번호: 66은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A63에 대한 아미노산 서열을 제시한다.
서열식별번호: 67은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A76에 대한 아미노산 서열을 제시한다.
서열식별번호: 68은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B05에 대한 아미노산 서열을 제시한다.
서열식별번호: 69는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B07에 대한 아미노산 서열을 제시한다.
서열식별번호: 70은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B08에 대한 아미노산 서열을 제시한다.
서열식별번호: 71은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B13에 대한 아미노산 서열을 제시한다.
서열식별번호: 72는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B52에 대한 아미노산 서열을 제시한다.
서열식별번호: 73은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B107에 대한 아미노산 서열을 제시한다.
서열식별번호: 74는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A56에 대한 아미노산 서열을 제시한다.
백신; MenC= 수막구균 혈청군 C; MenW= 수막구균 혈청군 W; MenY= 수막구균 혈청군 Y; PD=투여후.
도 2a-b. 임의의 용량 후 7일 내에 보고된 (도 2a) 국부 반응 및 (도 2b) 전신 사건. MenABCWY, n=542; MenB-FHbp+MenACWY-CRM, n=1050. *MenABCWY/MenB-FHbp 주사 부위에서의 것. MenABCWY=5가 혈청군 A, B, C, W, Y 백신; MenACWY-CRM=멘베오®, 수막구균 (군 A, C, Y, 및 W-135) 올리고사카라이드 CRM197 접합체 백신 (4가 수막구균 CRM 백신); MenB-FHbp=트루멘바®, 수막구균 군 B 2가 재조합 지단백질 2086 (2가 rLP2086).
도 3. 가설상 백신접종이 없는 시나리오와 비교하여 다양한 백신 투여 전략 하에 10년에 걸쳐 회피된 추정 사례.
서열 식별자
서열식별번호: 1은 재조합 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05 폴리펩티드 항원에 대한 아미노산 서열을 제시한다.
서열식별번호: 2는 재조합 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B01 폴리펩티드 항원에 대한 아미노산 서열을 제시한다.
서열식별번호: 3은 서열식별번호: 1 및 서열식별번호: 2의 위치 1-4의 아미노산 잔기를 제시한다.
서열식별번호: 4는 재조합 네이세리아 서브패밀리 A LP2086 폴리펩티드 (rLP2086) (A05) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 5는 네이세리아 서브패밀리 A LP2086 M98250771 폴리펩티드 (A05) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 6은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B153에 대한 아미노산 서열을 제시한다.
서열식별번호: 7은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A04에 대한 아미노산 서열을 제시한다.
서열식별번호: 8은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 9는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A12에 대한 아미노산 서열을 제시한다.
서열식별번호: 10은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A22에 대한 아미노산 서열을 제시한다.
서열식별번호: 11은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B02에 대한 아미노산 서열을 제시한다.
서열식별번호: 12는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B03에 대한 아미노산 서열을 제시한다.
서열식별번호: 13은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B09에 대한 아미노산 서열을 제시한다.
서열식별번호: 14는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B22에 대한 아미노산 서열을 제시한다.
서열식별번호: 15는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B24에 대한 아미노산 서열을 제시한다.
서열식별번호: 16은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B44에 대한 아미노산 서열을 제시한다.
서열식별번호: 17은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B16에 대한 아미노산 서열을 제시한다.
서열식별번호: 18은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A07에 대한 아미노산 서열을 제시한다.
서열식별번호: 19는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A19에 대한 아미노산 서열을 제시한다.
서열식별번호: 20은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A06에 대한 아미노산 서열을 제시한다.
서열식별번호: 21은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A15에 대한 아미노산 서열을 제시한다.
서열식별번호: 22는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A29에 대한 아미노산 서열을 제시한다.
서열식별번호: 23은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B15에 대한 아미노산 서열을 제시한다.
서열식별번호: 24는 재조합 네이세리아 서브패밀리 B LP2086 폴리펩티드 (rLP2086) (B01) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 25는 네이세리아 서브패밀리 B LP2086 CDC-1573 폴리펩티드 (B01) 폴리펩티드의 N-말단의 아미노산 서열을 제시한다.
서열식별번호: 26은 인자 H 결합 단백질 (fHBP) B16을 발현하는 엔. 메닌기티디스 혈청군 A 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 27은 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 C 균주에 대한 아미노산 서열을 제시한다. 서열식별번호: 27은 또한 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 28은 fHBP A19를 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 29는 fHBP B47을 발현하는 엔. 메닌기티디스 혈청군 Y 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 30은 fHBP B49를 발현하는 엔. 메닌기티디스 혈청군 X 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 31은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B16에 대한 아미노산 서열을 제시한다.
서열식별번호: 32는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A07에 대한 아미노산 서열을 제시한다.
서열식별번호: 33은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A19에 대한 아미노산 서열을 제시한다.
서열식별번호: 34는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A06에 대한 아미노산 서열을 제시한다.
서열식별번호: 35는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A15에 대한 아미노산 서열을 제시한다.
서열식별번호: 36은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A29에 대한 아미노산 서열을 제시한다.
서열식별번호: 37은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B15에 대한 아미노산 서열을 제시한다.
서열식별번호: 38은 인자 H 결합 단백질 (fHBP) B16을 발현하는 엔. 메닌기티디스 혈청군 A 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 39는 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 C 균주에 대한 아미노산 서열을 제시한다. 서열식별번호: 39는 또한 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 40은 fHBP A19를 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 41은 fHBP B47을 발현하는 엔. 메닌기티디스 혈청군 Y 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 42는 fHBP B49를 발현하는 엔. 메닌기티디스 혈청군 X 균주에 대한 아미노산 서열을 제시한다.
서열식별번호: 43은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B44에 대한 아미노산 서열을 제시한다.
서열식별번호: 44는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B09에 대한 아미노산 서열을 제시한다.
서열식별번호: 45는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B09에 대한 아미노산 서열을 제시한다.
서열식별번호: 46은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 47은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B01에 대한 아미노산 서열을 제시한다.
서열식별번호: 48은 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B01에 대한 아미노산 서열을 제시한다.
서열식별번호: 49는 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B15에 대한 아미노산 서열을 제시한다.
서열식별번호: 50은 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B16에 대한 아미노산 서열을 제시한다.
서열식별번호: 51은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B22에 대한 아미노산 서열을 제시한다.
서열식별번호: 52는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A22에 대한 아미노산 서열을 제시한다.
서열식별번호: 53은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A12에 대한 아미노산 서열을 제시한다.
서열식별번호: 54는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A22에 대한 아미노산 서열을 제시한다.
서열식별번호: 55는 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스 혈청군 B, 2086 변이체 A62에 대한 아미노산 서열을 제시한다.
서열식별번호: 56은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A62에 대한 아미노산 서열을 제시한다.
서열식별번호: 57은 아미노산 위치 1에 N-말단 Cys를 포함하는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A29에 대한 아미노산 서열을 제시한다.
서열식별번호: 58은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B22에 대한 아미노산 서열을 제시한다.
서열식별번호: 59는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 60은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A05에 대한 아미노산 서열을 제시한다.
서열식별번호: 61은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B24에 대한 아미노산 서열을 제시한다.
서열식별번호: 62는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B24에 대한 아미노산 서열을 제시한다.
서열식별번호: 63은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A02에 대한 아미노산 서열을 제시한다.
서열식별번호: 64는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A28에 대한 아미노산 서열을 제시한다.
서열식별번호: 65는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A42에 대한 아미노산 서열을 제시한다.
서열식별번호: 66은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A63에 대한 아미노산 서열을 제시한다.
서열식별번호: 67은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A76에 대한 아미노산 서열을 제시한다.
서열식별번호: 68은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B05에 대한 아미노산 서열을 제시한다.
서열식별번호: 69는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B07에 대한 아미노산 서열을 제시한다.
서열식별번호: 70은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B08에 대한 아미노산 서열을 제시한다.
서열식별번호: 71은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B13에 대한 아미노산 서열을 제시한다.
서열식별번호: 72는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B52에 대한 아미노산 서열을 제시한다.
서열식별번호: 73은 엔. 메닌기티디스, 혈청군 B, 2086 변이체 B107에 대한 아미노산 서열을 제시한다.
서열식별번호: 74는 엔. 메닌기티디스, 혈청군 B, 2086 변이체 A56에 대한 아미노산 서열을 제시한다.
본 발명자들은 적어도 1종의 인자 H 결합 단백질 (fHBP) 및 엔. 메닌기티디스 혈청군 A, C, W 및 Y 피막 사카라이드 접합체를 포함하는 조성물이 안정하고 면역원성이라는 것을 발견하였다. 본 발명자들은 추가로, 조성물이 인간에서 엔. 메닌기티디스 혈청군 A, C, W, Y 및 B 중 적어도 2, 3, 4, 또는 5종에 대한 면역 반응을 유도한다는 것을 발견하였다. 놀랍게도, 도출된 면역 반응은 엔. 메닌기티디스에 대한 허가된 백신에 의해 도출된 면역 반응보다 더 높다.
한 측면에서, 조성물은 엔. 메닌기티디스 인자 H 결합 단백질로부터 유래된 적어도 1종의 폴리펩티드 및 담체 단백질에 접합된 적어도 1종의 수막구균 피막 사카라이드를 포함한다.
인자 H 결합 단백질 (FHBP)로부터 유래된 단백질.
한 실시양태에서, 조성물은 임의의 fHBP, 예컨대 예를 들어, 하기 폴리펩티드: B24, B16, B44, A22, B03, B09, A12, A19, A05, A07, A06, A15, A29, B01, A62, B15, 및 그의 임의의 조합 중 어느 하나를 포함한다. 바람직하게는, 조성물은 A05 및 B01 폴리펩티드의 조합을 포함한다. 또 다른 바람직한 실시양태에서, 조성물은 B24 및 A05 폴리펩티드의 조합을 포함한다. 또 다른 실시양태에서, 조성물은 A05, A12, B09, 및 B44 폴리펩티드의 조합을 포함한다. 한 실시양태에서, 조성물은 지질화된 fHBP를 포함한다. 한 실시양태에서, 조성물은 비-지질화된 fHBP를 포함하지 않는다.
또 다른 실시양태에서, 조성물은 비-지질화된 fHBP, 예컨대 국제 특허 공개 번호 WO2012/032489, 미국 특허 공개 번호 US20120093852, 국제 특허 공개 번호 WO2013/132452, 및 미국 특허 공개 번호US20160030543에 기재된 비-지질화된 fHBP 중 어느 하나를 포함하며, 이들은 각각 그 전문이 본원에 참조로 포함된다. 한 실시양태에서, 조성물은 적어도 1종의 비-지질화된 fHBP 및 적어도 1종의 지질화된 fHBP를 포함한다.
일부 실시양태에서, 조성물은 서열식별번호: 1, 서열식별번호: 2, 서열식별번호: 6, 서열식별번호: 7, 서열식별번호: 8, 서열식별번호: 9, 서열식별번호: 10, 서열식별번호: 11, 서열식별번호: 12, 서열식별번호: 13, 서열식별번호: 14, 서열식별번호: 15, 서열식별번호: 16, 서열식별번호: 17, 서열식별번호: 18, 서열식별번호: 19, 서열식별번호: 20, 서열식별번호: 21, 서열식별번호: 22, 서열식별번호: 23, 서열식별번호: 26, 서열식별번호: 27, 서열식별번호: 28, 서열식별번호: 29, 서열식별번호: 30, 서열식별번호: 31, 서열식별번호: 32, 서열식별번호: 33, 서열식별번호: 34, 서열식별번호: 35, 서열식별번호: 36, 서열식별번호: 37, 서열식별번호: 38, 서열식별번호: 39, 서열식별번호: 40, 서열식별번호: 41, 서열식별번호: 42, 서열식별번호: 43, 서열식별번호: 44, 서열식별번호: 45, 서열식별번호: 46, 서열식별번호: 47, 서열식별번호: 48, 서열식별번호: 49, 서열식별번호: 50, 서열식별번호: 51, 서열식별번호: 52, 서열식별번호: 53, 서열식별번호: 54, 서열식별번호: 55, 서열식별번호: 56, 서열식별번호: 57, 서열식별번호: 58, 서열식별번호: 59, 서열식별번호: 60, 서열식별번호: 61, 및 서열식별번호: 62 중 어느 하나에 제시된 아미노산 서열에 대해 적어도 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 99.9% 동일성을 갖는 폴리펩티드를 포함한다.
바람직한 실시양태에서, 조성물은 (a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 엔. 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 엔. 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 엔. 메닌기티디스 혈청군 Y 피막 사카라이드를 포함한다.
제1 폴리펩티드; MNB RLP2086 서브패밀리 A (A05) 단백질
한 실시양태에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열을 갖는 제1 폴리펩티드를 포함한다. 폴리펩티드는 엔. 메닌기티디스 균주 M98250771로부터의 변형된 인자 H 결합 단백질 (fHBP)이다. fHBP의 설명은 WO2012032489 및 미국 특허 공개 US 2012/0093852에 개시되어 있으며, 이들은 각각 그 전문이 본원에 참조로 포함된다. 폴리펩티드는 폴리펩티드의 3개의 위치에서 공유 연결된 3개의 우세한 지방산 C16:0, C16:1, 및 C18:1에 의해 N-말단 지질화된다. 제1 폴리펩티드는 총 258개의 아미노산을 포함한다.
MnB rLP2086 A05 단백질의 대표적인 1차 구조는 미국 특허 10,183,070의 도 4에 제시되어 있다. 단백질의 1차 구조는 N-말단 시스테인 및 글리세릴 모이어티를 제외하고 (이는 완전 화학식을 사용하여 예시됨) 모든 아미노산에 대해 단일 문자 표기법을 사용하여 미국 특허 10,183,070의 도 4에 예시된다. 이러한 구조는 N-말단 시스테인 잔기가 지질화된 단백질 서열의 1차 구조를 포함한다. 단백질 N-말단의 N-말단 시스테인 잔기의 아미노 기는 지방산 (R1)에 부착되어 아미드 연결을 형성하고, 시스테이닐 술프히드릴 기는 2개의 에스테르-결합된 지방산 (R2)을 함유하는 글리세롤 모이어티에 부착된다. R1의 구조는 헥사데칸산 (C16:0)인 것으로 추정되고, R2의 구조는 MnB rLP2086 이소형에 따라 달라진다.
제1 폴리펩티드는 엔. 메닌기티디스 균주 M98250771로부터의 상응하는 야생형 서열과 비교하여 폴리펩티드의 N-말단 영역에 도입된 2개의 변형을 포함한다. 제2 위치의 글리신은 클로닝 부위 도입의 결과로서 부가된다. 제2 변형은 4개의 아미노산의 결실을 포함한다. 따라서, 한 실시양태에서, 제1 폴리펩티드는 N-말단에 C-G-S-S 서열 (서열식별번호: 3)을 포함한다. 서열식별번호: 1, 처음 4개의 아미노산 잔기를 참조한다.
제1 폴리펩티드 서열과 야생형 네이세리아 서열 사이의 N-말단 차이를 하기 제시한다. 따라서, 한 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1에 제시된 아미노산 서열의 적어도 처음 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13개, 또는 그 초과의 아미노산 잔기를 포함한다. 바람직하게는 제1 폴리펩티드는 서열식별번호: 1의 적어도 처음 4개, 보다 바람직하게는 적어도 처음 6개, 및 가장 바람직하게는 적어도 처음 8개의 아미노산 잔기를 포함한다.
재조합 및 네이세리아 서브패밀리 A LP2086 폴리펩티드의 예측된 N-말단 서열의 비교
한 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1에 제시된 아미노산 서열을 포함한다. 한 실시양태에서, 제1 폴리펩티드는 총 258개의 아미노산을 갖는다. 한 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1에 대해 100% 미만의 서열 동일성을 갖는 아미노산 서열은 포함하지 않는다. 또 다른 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1에 제시된 아미노산 서열로 이루어진다. 또 다른 실시양태에서, 제1 폴리펩티드는 아미노산 서열 KDN을 포함한다. 예를 들어, 서열식별번호: 1의 아미노산 잔기 73-75를 참조한다. 또 다른 실시양태에서, 제1 폴리펩티드는 폴리펩티드의 N-말단에 서열식별번호: 3에 제시된 아미노산 서열을 포함한다. 또 다른 실시양태에서, 제1 폴리펩티드는 폴리펩티드의 N-말단에 서열식별번호: 4에 제시된 아미노산 서열을 포함한다.
바람직한 실시양태에서, 제1 폴리펩티드는 관련 기술분야에 공지된 표준 기술을 사용하여 재조합 숙주 세포에서 용이하게 발현된다. 또 다른 바람직한 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1의 N- 및/또는 C-도메인 상에 살박테리아 에피토프를 포함한다. 한 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1에 제시된 아미노산 서열의 적어도 처음 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 또는 100개의 아미노산 잔기를 포함한다. 바람직하게는, 제1 폴리펩티드는 서열식별번호: 1의 적어도 처음 2개, 보다 바람직하게는 적어도 처음 4개, 및 가장 바람직하게는, 적어도 처음 8개의 아미노산 잔기를 포함한다.
또 다른 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1에 제시된 아미노산 서열의 적어도 마지막 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 또는 100개의 아미노산 잔기를 포함한다.
한 실시양태에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드 약 30 μg/ml를 포함한다. 하나의 바람직한 실시양태에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드 약 60 μg을 포함한다. 하나의 바람직한 실시양태에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드 약 60 μg을 포함하며, 여기서 조성물은 바람직하게는 0.5 ml의 총 부피를 갖는다. 또 다른 실시양태에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드 약 120 μg/ml를 포함한다.
제2 폴리펩티드; MnB rLP2086 서브패밀리 B (B01) 단백질
한 실시양태에서, 조성물은 서열식별번호: 2에 제시된 아미노산 서열을 갖는 제2 폴리펩티드를 포함한다. 폴리펩티드는 엔. 메닌기티디스 균주 CDC1573으로부터의 인자 H 결합 단백질 (fHBP)이다. fHBP의 설명은 WO2012032489 및 미국 특허 공개 US 2012/0093852에 개시되어 있으며, 이들은 각각 그 전문이 본원에 참조로 포함된다. 폴리펩티드는 폴리펩티드의 3개의 위치에서 공유 연결된 3개의 우세한 지방산 C16:0, C16:1, 및 C18:1에 의해 N-말단 지질화된다. 제2 폴리펩티드는 총 261개의 아미노산을 포함한다.
MnB rLP2086 B01 단백질의 대표적인 1차 구조는 미국 특허 10,183,070의 도 5에 제시되어 있다. 단백질의 1차 구조는 N-말단 시스테인 및 글리세릴 모이어티를 제외하고 (이는 완전 화학식을 사용하여 예시됨) 모든 아미노산에 대해 단일 문자 표기법을 사용하여 미국 특허 10,183,070의 도 5에 예시된다. 이러한 구조는 N-말단 시스테인 잔기가 지질화된 단백질 서열의 1차 구조를 포함한다. 단백질 N-말단의 N-말단 시스테인 잔기의 아미노 기는 지방산 (R1)에 부착되어 아미드 연결을 형성하고, 시스테이닐 술프히드릴 기는 2개의-에스테르 결합된 지방산 (R2)을 함유하는 글리세롤 모이어티에 부착된다. R1의 구조는 헥사데칸산 (C16:0)인 것으로 추정되고, R2의 구조는 rLP2086 이소형에 따라 달라진다.
제2 폴리펩티드는 엔. 메닌기티디스 균주 CDC-1573으로부터의 상응하는 야생형 서열과 비교하여 rLP2086 서브패밀리 B 단백질에 대한 N-말단 영역에 도입된 1개의 변형을 포함한다. 제2 위치의 글리신은 클로닝 부위 도입의 결과이다.
원래의 네이세리아 서열과의 N-말단 차이를 하기 제시한다.
재조합 및 네이세리아 서브패밀리 B LP2086 단백질의 예측된 N-말단 서열의 비교
한 실시양태에서, 제2 폴리펩티드는 N-말단에 C-G-S-S 서열 (서열식별번호: 3)을 포함한다. 서열식별번호: 2의 처음 4개의 아미노산 잔기를 참조한다.
한 실시양태에서, 제2 폴리펩티드는 서열식별번호: 2에 제시된 아미노산 서열을 포함한다. 한 실시양태에서, 제2 폴리펩티드는 총 261개의 아미노산을 갖는다. 한 실시양태에서, 제2 폴리펩티드는 서열식별번호: 2에 제시된 아미노산 서열로 이루어진다. 또 다른 실시양태에서, 제2 폴리펩티드는 서열식별번호: 2에 대해 100% 미만의 서열 동일성을 갖는 폴리펩티드는 추가로 포함하지 않는다. 바람직한 실시양태에서, 제1 폴리펩티드 및 제2 폴리펩티드는 각각의 폴리펩티드의 N-말단에서 C-G-S-S (서열식별번호: 3) 서열을 포함한다.
바람직한 실시양태에서, 제2 폴리펩티드는 관련 기술분야에 공지된 표준 기술을 사용하여 재조합 숙주 세포에서 용이하게 발현된다. 또 다른 바람직한 실시양태에서, 제2 폴리펩티드는 서열식별번호: 2의 N- 및/또는 C-도메인 상에 살박테리아 에피토프를 포함한다. 한 실시양태에서, 제2 폴리펩티드는 서열식별번호: 2에 제시된 아미노산 서열의 적어도 처음 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 또는 100개의 아미노산 잔기를 포함한다. 바람직하게는, 제2 폴리펩티드는 서열식별번호: 2의 적어도 처음 2개, 보다 바람직하게는 적어도 처음 4개, 및 가장 바람직하게는, 적어도 처음 8개의 아미노산 잔기를 포함한다.
또 다른 실시양태에서, 제2 폴리펩티드는 서열식별번호: 2에 제시된 아미노산 서열의 적어도 마지막 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 또는 100개의 아미노산 잔기를 포함한다.
한 실시양태에서, 조성물은 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드 약 30 μg/ml를 포함한다. 하나의 바람직한 실시양태에서, 조성물은 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드 약 60 μg을 포함한다. 하나의 바람직한 실시양태에서, 조성물은 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드 약 60 μg을 포함하며, 여기서 조성물은 바람직하게는 0.5 ml의 총 부피를 갖는다. 또 다른 실시양태에서, 조성물은 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드 120 μg/ml를 포함한다.
수막구균 혈청군 A, C, W, 및 Y (MENACWY) 피막 사카라이드
본 명세서 전반에 걸쳐 용어 "사카라이드"는 폴리사카라이드 또는 올리고사카라이드를 나타낼 수 있고, 둘 다를 포함한다. 폴리사카라이드는 박테리아로부터 단리되거나, 또는 박테리아로부터 단리되고 공지된 방법에 의해 및 임의로 마이크로유동화에 의해 어느 정도 크기 조절된다. 폴리사카라이드는 폴리사카라이드 샘플의 점도를 감소시키기 위해 및/또는 접합된 생성물에 대한 여과성을 개선시키기 위해 크기 조절될 수 있다. 올리고사카라이드는 적은 수의 반복 단위 (전형적으로 5-30개의 반복 단위)를 갖고, 전형적으로 가수분해된 폴리사카라이드이다.
엔. 메닌기티디스 피막 사카라이드 각각은 TT, DT, CRM197, TT의 단편 C 및 단백질 D로 이루어진 군으로부터 독립적으로 선택된 담체 단백질에 접합될 수 있다. 하나 이상의 엔. 메닌기티디스 피막 사카라이드가 다른 것으로부터의 상이한 담체 단백질에 접합될 수 있지만, 한 실시양태에서 이들은 모두 동일한 담체 단백질에 접합된다. 예를 들어, 이들은 모두 TT, DT, CRM197, TT의 단편 C 및 단백질 D로 이루어진 군으로부터 선택된 동일한 담체 단백질에 접합될 수 있다. 이와 관련하여, CRM197 및 DT는 이들이 단지 1개의 아미노산만큼 상이하기 때문에 동일한 담체 단백질인 것으로 간주될 수 있다. 바람직한 실시양태에서, 존재하는 모든 엔. 메닌기티디스 피막 사카라이드는 TT에 접합된다.
단백질 담체가 조성물 중의 2개 이상의 사카라이드에 대해 동일한 경우, 사카라이드는 단백질 담체의 동일한 분자에 접합될 수 있다 (담체 분자가 그에 접합된 2개 초과의 상이한 사카라이드를 가짐) [예를 들어 WO 04/083251 참조; 예를 들어 단일 담체 단백질은 MenA 및 MenC; MenA 및 MenW; MenA 및 MenY; MenC 및 MenW; MenC 및 MenY; Men W 및 MenY; MenA, MenC 및 MenW; MenA, MenC 및 MenY; MenA, MenW 및 MenY; MenC, MenW 및 MenY; MenA, MenC, MenW 및 MenY에 접합될 수 있음]. 대안적으로, 사카라이드는 각각 단백질 담체의 상이한 분자에 개별적으로 접합될 수 있다 (각각의 단백질 담체 분자가 그에 접합된 단지 하나의 유형의 사카라이드를 가짐).
한 실시양태에서, 적어도 2개의 상이한 사카라이드 접합체가 동일한 유형의 담체 단백질에 개별적으로 접합되고, 여기서 1개 이상의 사카라이드(들)는 단백질 담체 상의 제1 유형의 화학적 기를 통해 담체 단백질에 접합되고, 1개 이상의 사카라이드(들)는 단백질 담체 상의 제2 (상이한) 유형의 화학적 기를 통해 담체 단백질에 접합된다.
한 실시양태에서, 2개의 접합체는 동일한 담체에 연결되었지만 상이한 접합 화학에 의한 동일한 사카라이드를 수반한다. 대안적 실시양태에서, 2개의 상이한 사카라이드는 단백질 담체 상의 상이한 기에 접합된다.
"동일한 유형의 담체 단백질에 개별적으로 접합된"은 사카라이드가 동일한 담체에 별개로 접합된 것을 의미한다 (예를 들어, MenA는 파상풍 톡소이드 상의 아민 기를 통해 파상풍 톡소이드에 접합되고, MenC는 상이한 분자의 파상풍 톡소이드 상의 카르복실산 기를 통해 파상풍 톡소이드에 접합됨).
피막 사카라이드(들)는 TT, DT, CRM197, TT의 단편 C 및 단백질 D로 이루어진 군으로부터 독립적으로 선택된 동일한 담체 단백질에 접합될 수 있다. 본 개시내용의 접합체에 사용될 수 있는 단백질 담체의 보다 완전한 목록이 하기 제시된다. 이와 관련하여, CRM197 및 DT는 이들이 단지 1개의 아미노산만큼 상이하기 때문에 동일한 담체 단백질인 것으로 간주될 수 있다. 한 실시양태에서, 존재하는 모든 피막 사카라이드는 TT에 접합된다.
사카라이드는 하기: 엔. 메닌기티디스 혈청군 A 피막 사카라이드 (MenA), 엔. 메닌기티디스 혈청군 C 피막 사카라이드 (MenC), 엔. 메닌기티디스 혈청군 Y 피막 사카라이드 (MenY), 및 엔. 메닌기티디스 혈청군 W 피막 사카라이드 (MenW), 또는 그의 임의의 조합 중 어느 하나를 포함할 수 있다.
단백질 담체 상에 존재하는 제1 및 제2 화학적 기는 서로 상이하고, 이상적으로는 접합 목적을 위해 용이하게 사용될 수 있는 천연 화학적 기이다. 이들은 독립적으로 카르복실 기, 아미노 기, 술프히드릴 기, 히드록실 기, 이미다졸릴 기, 구아니딜 기 및 인돌릴 기로 이루어진 군으로부터 선택될 수 있다. 한 실시양태에서, 제1 화학적 기는 카르복실이고, 제2는 아미노이거나, 또는 그 반대이다. 이들 기는 하기에서 보다 상세하게 설명된다.
구체적 실시양태에서, 면역원성 조성물은 적어도 2개의 상이한 엔. 메닌기티디스 피막 사카라이드를 포함하고, 여기서 1개 이상은 단백질 담체 상의 제1 유형의 화학적 기 (예를 들어, 카르복실)를 통해 담체 단백질에 접합된 MenA 및 MenC로 이루어진 제1 군으로부터 선택되고, 1개 이상의 상이한 사카라이드는 단백질 담체 상의 제2 유형의 화학적 기 (예를 들어 아미노)를 통해 담체 단백질에 접합된 MenC, MenY 및 MenW로 이루어진 제2 군으로부터 선택된다.
추가 실시양태에서, 본 개시내용의 면역원성 조성물은 제1 유형의 화학적 기 (예를 들어 카르복실)를 통해 접합된 MenA, 및 제2 유형의 화학적 기 (예를 들어 아미노)를 통해 접합된 MenC를 포함한다.
또 다른 실시양태에서, 면역원성 조성물은 제1 유형의 화학적 기 (예를 들어 카르복실)를 통해 접합된 MenC, 및 제2 유형의 화학적 기 (예를 들어 아미노)를 통해 접합된 MenY를 포함한다.
또 다른 실시양태에서, 면역원성 조성물은 제1 유형의 화학적 기 (예를 들어 카르복실)를 통해 접합된 MenA, 및 제2 유형의 화학적 기 (예를 들어 아미노)를 통해 접합된 MenC, MenY 및 MenW를 포함한다.
또 다른 실시양태에서, 면역원성 조성물은 제1 유형의 화학적 기 (예를 들어 카르복실)를 통해 접합된 MenA 및 MenC, 및 제2 유형의 화학적 기 (예를 들어 아미노)를 통해 접합된 MenY 및 MenW를 포함한다.
본 개시내용의 제약 (면역원성) 조성물에 포함된 본 개시내용의 사카라이드는 담체 단백질 예컨대 파상풍 톡소이드 (TT), 파상풍 톡소이드 단편 C, 파상풍 독소의 비-독성 돌연변이체 [주: TT의 모든 이러한 변이체는 본 개시내용의 목적상 동일한 유형의 담체 단백질인 것으로 간주됨], 디프테리아 톡소이드 (DT), CRM197, 디프테리아 독소의 다른 비-독성 돌연변이체 [예컨대 CRM176, CRM 197, CRM228, CRM 45 (Uchida et al., J. Biol. Chem. 218; 3838-3844, 1973); CRM 9, CRM 45, CRM102, CRM 103 및 CRM107 및 문헌 [Nicholls and Youle in Genetically Engineered Toxins, Ed: Frankel, Maecel Dekker Inc, 1992]에 기재된 다른 돌연변이; Glu-148의 결실 또는 Asp, Gln 또는 Ser으로의 돌연변이 및/또는 Ala 158의 결실 또는 Gly로의 돌연변이 및 US 4709017 또는 US 4950740에 개시된 다른 돌연변이; 적어도 1개 이상의 잔기 Lys 516, Lys 526, Phe 530 및/또는 Lys 534의 돌연변이 및 US 5917017 또는 US 6455673에 개시된 다른 돌연변이; 또는 US 5843711에 개시된 단편] (주: 모든 이러한 DT의 변이체는 본 개시내용의 목적상 동일한 유형의 담체 단백질인 것으로 간주됨), 폐렴구균 뉴모리신 (Kuo et al., (1995) Infect Immun 63; 2706-13), OMPC (수막구균 외막 단백질 - 통상적으로 엔. 메닌기티디스 혈청군 B로부터 추출됨 - EP0372501), 합성 펩티드 (EP0378881, EP0427347), 열 쇼크 단백질 (WO 93/17712, WO 94/03208), 백일해 단백질 (WO 98/58668, EP0471177), 시토카인, 림포카인, 성장 인자 또는 호르몬 (WO 91/01146), 다양한 병원체 유래 항원으로부터의 다중 인간 CD4+ T 세포 에피토프를 포함하는 인공 단백질 (Falugi et al., (2001) Eur J Immunol 31; 3816-3824) 예컨대 N19 단백질 (Baraldoi et al., (2004) Infect Immun 72; 4884-7) 폐렴구균 표면 단백질 PspA (WO 02/091998), 철 흡수 단백질 (WO 01/72337), 씨. 디피실레(C. difficile)의 독소 A 또는 B (WO 00/61761) 또는 단백질 D (EP594610 및 WO 00/56360)에 접합된다.
한 실시양태에서, 본 개시내용의 면역원성 조성물은 그 안에 함유된 적어도 2, 3, 4개 또는 각각의 사카라이드에서 (독립적으로) 동일한 유형의 담체 단백질을 사용한다.
한 실시양태에서, 본 개시내용의 면역원성 조성물은 TT, DT, CRM197, TT의 단편 C 및 단백질 D로 이루어진 군으로부터 선택된 담체 단백질에 접합된 엔. 메닌기티디스 사카라이드를 포함한다.
본 개시내용의 면역원성 조성물은 임의로 Men 사카라이드 대 담체 단백질의 1:5 내지 5:1, 1:2 내지 5:1, 1:0.5 내지 1:2.5 또는 1:1.25 내지 1:2.5(w/w)의 비를 갖는 적어도 하나의 수막구균 사카라이드 (예를 들어 MenA; MenC; MenW; MenY; MenA 및 MenC; MenA 및 MenW; MenA 및 MenY; MenC 및 Men W; Men C 및 MenY; Men W 및 MenY; MenA, MenC 및 MenW; MenA, MenC 및 MenY; MenA, MenW 및 MenY; MenC, MenW 및 MenY 또는 MenA, MenC, MenW 및 MenY) 접합체를 포함한다. 하나의 바람직한 실시양태에서, 조성물은 각각 약 3, 약 3, 약 1.5 및 약 1.3의 비 (톡소이드 대 폴리사카라이드)로 각각 파상풍 톡소이드에 접합된 MenA, MenC, MenW 및 MenY를 포함한다.
접합체의 사카라이드 대 담체 단백질의 비 (w/w)는 멸균된 접합체를 사용하여 결정될 수 있다. 단백질의 양은 로우리 검정 (예를 들어 [Lowry et al., (1951) J. Biol. Chem. 193, 265-275 또는 Peterson et al., Analytical Biochemistry 100, 201-220 (1979)])을 사용하여 결정되고, 사카라이드의 양은 MenA의 경우 ICP-OES (유도 커플링된 플라즈마-광학 방출 분광분석법), MenC의 경우 DMAP 검정 및 MenW 및 MenY의 경우 레조르시놀 검정을 사용하여 결정된다 (Monsigny et al., (1988) Anal. Biochem. 175, 525-530).
한 실시양태에서, 본 개시내용의 면역원성 조성물은 엔. 메닌기티디스 사카라이드 접합체(들)를 포함하며, 여기서 엔. 메닌기티디스 사카라이드(들)는 링커, 예를 들어 이관능성 링커를 통해 담체 단백질에 접합된다. 링커는 임의로, 예를 들어 반응성 아미노 기 및 반응성 카르복실산 기, 2개의 반응성 아미노 기 또는 2개의 반응성 카르복실산 기를 갖는, 이종이관능성 또는 동종이관능성이다. 링커는 예를 들어 4 내지 20, 4 내지 12, 5 내지 10개의 탄소 원자를 갖는다. 가능한 링커는 ADH이다. 다른 링커는 B-프로피온아미도 (WO 00/10599), 니트로페닐-에틸아민 (Gever et al., (1979) Med. Microbiol. Immunol. 165; 171-288), 할로알킬 할라이드 (US4057685), 글리코시드 연결 (US4673574, US4808700), 헥산 디아민 및 6-아미노카프로산 (US4459286)을 포함한다.
본 개시내용의 면역원성 조성물에 존재하는 사카라이드 접합체는 임의의 공지된 커플링 기술에 의해 제조될 수 있다. 접합 방법은 시아네이트 에스테르를 형성하기 위한 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 (CDAP)를 사용한 사카라이드의 활성화에 의존할 수 있다. 따라서, 활성화된 사카라이드는 담체 단백질 상의 아미노기에 직접 또는 스페이서 (링커) 기를 통해 커플링될 수 있다. 예를 들어, 스페이서는 시스타민 또는 시스테아민일 수 있고 이는 티올화된 폴리사카라이드를 제공하며, 이는 말레이미드-활성화된 담체 단백질 (예를 들어 GMBS를 사용함) 또는 할로아세틸화된 담체 단백질 (예를 들어 아이오도아세트이미드 또는 N-숙신이미딜 브로모아세테이트브로모아세테이트를 사용함)과의 반응 후에 수득되는 티오에테르 연결을 통해 담체에 커플링될 수 있다. 임의로, 시아네이트 에스테르 (임의로 CDAP 화학에 의해 제조됨)는 헥산 디아민 또는 ADH와 커플링되고, 아미노-유도체화된 사카라이드는 단백질 담체 상의 카르복실기를 통해 카르보디이미드 (예를 들어 EDAC 또는 EDC) 화학을 사용하여 담체 단백질에 접합된다. 이러한 접합체는 PCT 공개 WO 93/15760 유니폼드 서비시즈 유니버시티(Uniformed Services University) 및 WO 95/08348 및 WO 96/29094에 기재되어 있다.
다른 적합한 기술은 카르비이니드, 히드라지드, 활성 에스테르, 노르보란, p-니트로벤조산, N-히드록시숙신이미드, S-NHS, EDC, TSTU를 사용한다. 많은 것이 WO 98/42721에 기재되어 있다. 접합은 카르보닐 링커를 수반할 수 있고, 이는 사카라이드의 유리 히드록실 기와 CDI와의 반응 (Bethell et al., J. Biol. Chem. 1979, 254; 2572-4, Hearn et al., J. Chromatogr. 1981. 218; 509-18)에 이어서, 카르바메이트 연결을 형성하기 위한 단백질과의 반응에 의해 형성될 수 있다. 이는 아노머 말단의 1급 히드록실 기로의 환원, CDI 카르바메이트 중간체를 형성하기 위한 CDI와 1급 히드록실 기의 1급 히드록실기 반응의 임의적인 보호/탈보호 및 CDI 카르바메이트 중간체와 단백질 상의 아미노 기의 커플링을 수반할 수 있다.
접합체는 또한 US 4365170 (제닝스(Jennings)) 및 US 4673574 (안데르손(Anderson))에 기재된 바와 같은 직접 환원성 아미노화 방법에 의해 제조될 수 있다. 다른 방법은 EP-0-161-188, EP-208375 및 EP-0-477508에 기재되어 있다.
추가의 방법은, 예를 들어 EDAC를 사용한 카르보디이미드 축합에 의한, 아디프산 히드라지드 (ADH)에 의해 유도체화된 브로민화시아노겐 (또는 CDAP) 활성화된 사카라이드의 단백질 담체에의 커플링을 수반한다 (Chu C. et al., Infect. Immunity, 1983 245 256).
한 실시양태에서, 사카라이드 상의 히드록실 기 (임의로 활성화된 히드록실 기, 예를 들어 시아네이트 에스테르에 의해 활성화된 히드록실 기)는 단백질 상의 아미노 또는 카르복실 기에 직접적으로 또는 간접적으로 (링커를 통해) 연결된다. 링커가 존재하는 경우, 사카라이드 상의 히드록실 기는, 예를 들어 CDAP 접합을 사용하는 것에 의해, 링커 상의 아미노 기에 임의로 연결된다. 링커 (예를 들어, ADH) 내의 추가의 아미노 기는 단백질 상의 카르복실산 기에, 예를 들어 카르보디이미드 화학을 사용하는 것에 의해, 예를 들어 EDAC를 사용하는 것에 의해 접합될 수 있다. 한 실시양태에서, 링커가 담체 단백질에 접합되기 전에, 먼저 엔. 메닌기티디스 피막 사카라이드(들) (또는 일반적으로 사카라이드)가 링커에 접합된다. 대안적으로, 링커는 사카라이드에의 접합 전에 담체에 접합될 수 있다.
일반적으로 단백질 담체 상의 하기 유형의 화학적 기가 커플링/접합을 위해 사용될 수 있다:
A) 카르복실 (예를 들어, 아스파르트산 또는 글루탐산을 통함). 한 실시양태에서, 이러한 기는 사카라이드 상의 아미노 기에 직접, 또는 카르보디이미드 화학에 의해, 예를 들어 EDAC에 의해 링커 상의 아미노 기에 연결된다.
B) 아미노 기 (예를 들어 리신을 통함). 한 실시양태에서, 이러한 기는 사카라이드 상의 카르복실기에 직접, 또는 카르보디이미드 화학에 의해, 예를 들어 EDAC에 의해 링커 상의 카르복실 기에 연결된다. 또 다른 실시양태에서, 이러한 기는 사카라이드 상의 CDAP 또는 CNBr에 의해 활성화된 히드록실 기에 직접, 또는 링커 상의 이러한 기에; 알데히드 기를 갖는 사카라이드 또는 링커에; 숙신이미드 에스테르 기를 갖는 사카라이드 또는 링커에 연결된다.
C) 술프히드릴 (예를 들어 시스테인을 통함). 한 실시양태에서, 이러한 기는 말레이미드 화학에 의해 브로모 또는 클로로 아세틸화된 사카라이드 또는 링커에 연결된다. 한 실시양태에서, 이러한 기는 비스 디아조벤지딘에 의해 활성화/변형된다.
D) 히드록실 기 (예를 들어, 티로신을 통함). 한 실시양태에서, 이러한 기는 비스 디아조벤지딘에 의해 활성화/변형된다.
E) 이미다졸릴 기 (예를 들어, 히스티딘을 통함). 한 실시양태에서, 이러한 기는 비스 디아조벤지딘에 의해 활성화/변형된다.
F) 구아니딜 기 (예를 들어, 아르기닌을 통함).
G) 인돌릴 기 (예를 들어, 트립토판을 통함).
사카라이드 상에서, 일반적으로 하기 기: OH, COOH 또는 NH2가 커플링에 사용될 수 있다. 알데히드 기는 관련 기술분야에 공지된 상이한 처리, 예컨대: 퍼아이오데이트, 산 가수분해, 과산화수소 등의 후에 생성될 수 있다.
직접 커플링 접근법:
사카라이드-OH + CNBr 또는 CDAP -----> 시아네이트 에스테르 + NH2-Prot ----> 접합체
사카라이드-알데히드 + NH2-Prot ----> 쉬프 염기 + NaCNBH3 ----> 접합체
사카라이드-COOH + NH2-Prot + EDAC ----> 접합체
사카라이드-NH2 + COOH-Prot + EDAC ----> 접합체
스페이서 (링커) 접근법을 통한 간접 커플링:
사카라이드-OH + CNBr 또는 CDAP ---> 시아네이트 에스테르 + NH2----NH2 ----> 사카라이드----NH2 + COOH-Prot + EDAC -----> 접합체
사카라이드-OH + CNBr 또는 CDAP ----> 시아네이트 에스테르 + NH2-----SH -----> 사카라이드----SH + SH-Prot (노출된 시스테인을 갖거나 또는 예를 들어 SPDP에 의한 단백질의 아미노 기의 변형 후에 수득된 천연 단백질) -----> 사카라이드-S-S-Prot
사카라이드-OH + CNBr 또는 CDAP ---> 시아네이트 에스테르 + NH2----SH -------> 사카라이드----SH + 말레이미드-Prot (아미노 기의 변형) ----> 접합체
사카라이드-COOH + EDAC + NH2-----NH2 ---> 사카라이드------NH2 + EDAC + COOH-Prot ----> 접합체
사카라이드-COOH + EDAC+ NH2----SH -----> 사카라이드----SH + SH-Prot (노출된 시스테인을 갖거나 또는 예를 들어 SPDP에 의한 단백질의 아미노 기의 변형 후에 수득된 천연 단백질) -----> 사카라이드-S-S-Prot
사카라이드-COOH + EDAC+ NH2----SH -----> 사카라이드----SH + 말레이미드-Prot (아미노 기의 변형) ----> 접합체
사카라이드-알데히드 + NH2-----NH2 ----> 사카라이드---NH2 + EDAC + COOH-Prot ----> 접합체
주: 상기 EDAC 대신, 임의의 적합한 카르보디이미드가 사용될 수 있다.
요약하면, 사카라이드와의 커플링에 일반적으로 사용될 수 있는 단백질 담체 화학적 기의 유형은 아미노 기 (예를 들어 리신 잔기 상), COOH 기 (예를 들어 아스파르트산 및 글루탐산 잔기 상) 및 SH 기 (접근가능한 경우) (예를 들어 시스테인 잔기 상)이다.
한 실시양태에서, 엔. 메닌기티디스 피막 사카라이드 (또는 일반적으로 사카라이드) 중 적어도 1개는 담체 단백질에 직접 접합되고; 임의로 Men W 및/또는 MenY 및/또는 MenC 사카라이드(들)는 담체 단백질에 직접 접합된다. 예를 들어 MenW; MenY; MenC; MenW 및 MenY; MenW 및 MenC; MenY 및 MenC; 또는 MenW, MenY 및 MenC는 담체 단백질에 직접 연결된다. 임의로, 엔. 메닌기티디스 피막 사카라이드 중 적어도 1개는 CDAP에 의해 직접 접합된다. 예를 들어, MenW; MenY; MenC; MenW 및 MenY; MenW 및 MenC; MenY 및 MenC; 또는 MenW, MenY 및 MenC는 CDAP에 의해 담체 단백질에 직접 연결된다 (WO 95/08348 및 WO 96/29094 참조). 한 실시양태에서, 모든 엔. 메닌기티디스 피막 사카라이드는 파상풍 톡소이드에 접합된다.
한 실시양태에서, Men W 및/또는 Y 사카라이드 대 담체 단백질의 비는 1:0.5 내지 1:2 (w/w)이고/거나, MenC 사카라이드 대 담체 단백질의 비는 1:0.5 내지 1:4 또는 1:0.5 내지 1:1.5 (w/w)이고, 특히 여기서 이들 사카라이드는 임의로 CDAP를 사용하여 단백질에 직접 연결된다.
한 실시양태에서, 엔. 메닌기티디스 피막 사카라이드(들) (또는 일반적으로 사카라이드) 중 적어도 1개는 링커, 예를 들어 이관능성 링커를 통해 담체 단백질에 접합된다. 링커는 임의로, 예를 들어 반응성 아민 기 및 반응성 카르복실산 기, 2개의 반응성 아민 기 또는 2개의 반응성 카르복실산 기를 갖는, 이종이관능성 또는 동종이관능성이다. 링커는 예를 들어 4 내지 20, 4 내지 12, 5 내지 10개의 탄소 원자를 갖는다. 가능한 링커는 ADH이다.
한 실시양태에서, MenA; MenC; 또는 MenA 및 MenC는 링커를 통해 담체 단백질 (예를 들어 파상풍 톡소이드)에 접합된다.
한 실시양태에서, 적어도 1개의 엔. 메닌기티디스 사카라이드는 CDAP 및 EDAC를 사용하여 링커를 통해 담체 단백질에 접합된다. 예를 들어, MenA; MenC; 또는 MenA 및 MenC는 상기 기재된 바와 같이 CDAP 및 EDAC를 사용하여 링커 (예를 들어, 그의 말단에 2개의 히드라지노 기를 갖는 것, 예컨대 ADH)를 통해 단백질에 접합된다. 예를 들어, CDAP는 사카라이드를 링커에 접합시키는데 사용되고, EDAC는 링커를 단백질에 접합시키는데 사용된다. 임의로 링커를 통한 접합은, MenA; MenC; 또는 MenA 및 MenC의 경우 1:0.5 내지 1:6; 1:1 내지 1:5 또는 1:2 및 1:4의 사카라이드 대 담체 단백질의 비를 생성한다.
한 실시양태에서, MenA 피막 사카라이드는 존재하는 경우 반복 단위의 적어도 50%, 60%, 70%, 80%, 90%, 95% 또는 98%가 적어도 1개의 위치에서 O-아세틸화되도록 적어도 부분적으로 O-아세틸화된다. O-아세틸화는 예를 들어 반복 단위의 적어도 50%, 60%, 70%, 80%, 90%, 95% 또는 98%의 적어도 O-3 위치에 존재한다.
한 실시양태에서, MenC 피막 사카라이드는 존재하는 경우 (α2→9)-연결된 NeuNAc 반복 단위의 적어도 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 98%가 적어도 1개 또는 2개의 위치에서 O-아세틸화되도록 적어도 부분적으로 O-아세틸화된다. O-아세틸화는 예를 들어 반복 단위의 적어도 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 98%의 O-7 및/또는 O-8 위치에 존재한다.
한 실시양태에서, MenW 피막 사카라이드는 존재하는 경우 반복 단위의 적어도 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 98%가 적어도 1개 또는 2개의 위치에서 O-아세틸화되도록 적어도 부분적으로 O-아세틸화된다. O-아세틸화는 예를 들어 반복 단위의 적어도 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 98%의 O-7 및/또는 O-9 위치에 존재한다.
한 실시양태에서, MenY 피막 사카라이드는 존재하는 경우 반복 단위의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 98%가 적어도 1개 또는 2개의 위치에서 O-아세틸화되도록 적어도 부분적으로 O-아세틸화된다. O-아세틸화는 반복 단위의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 98%의 7 및/또는 9 위치에 존재한다.
O-아세틸화의 백분율은 O-아세틸화를 함유하는 반복 단위의 백분율을 지칭한다. 이는 접합 전 및/또는 접합 후에 사카라이드에서 측정될 수 있다.
본 개시내용의 한 실시양태에서, 면역원성 조성물, 존재하는 사카라이드, 또는 존재하는 엔. 메닌기티디스 피막 사카라이드 각각은 TT에 접합된다. 추가 실시양태에서, 엔. 메닌기티디스 피막 사카라이드 각각은 별개의 담체 단백질에 개별적으로 접합된다. 추가 실시양태에서, 엔. 메닌기티디스 피막 사카라이드 접합체 각각은 1:5-5:1 또는 1:1-1:4(w/w)의 사카라이드:담체 비를 갖는다. 추가 실시양태에서, 적어도 1, 2 또는 3개의 엔. 메닌기티디스 피막 사카라이드 접합체(들)가 담체 단백질에 직접 접합된다. 추가 실시양태에서, MenW 및/또는 MenY, MenW 및/또는 MenC, MenY 및/또는 MenC, 또는 MenW 및 MenC 및 MenY는 담체 단백질에 직접 접합된다. 추가 실시양태에서, 적어도 1, 2 또는 3개의 엔. 메닌기티디스 사카라이드 접합체(들)는 CDAP 화학에 의해 직접 접합된다. 추가 실시양태에서, MenW 및/또는 Y 사카라이드 대 담체 단백질의 비는 1:0.5 내지 1:2 (w/w)이다. 추가 실시양태에서, MenC 사카라이드 대 담체 단백질의 비는 1:0.5 내지 1:2 (w/w)이다. 추가 실시양태에서, 적어도 1, 2 또는 3개의 엔. 메닌기티디스 피막 사카라이드(들)는 링커 (이는 예컨대 2개의 반응성 아미노 기 (예컨대, ADH) 또는 2개의 반응성 카르복실 기, 또는 한쪽 말단에 반응성 아미노 기 및 다른쪽 말단에 반응성 카르복실 기를 갖는 이관능성일 수 있음)를 통해 담체 단백질에 접합된다. 링커는 4 내지 12개의 탄소 원자를 가질 수 있다. 추가 실시양태에서, 링커를 통해 접합된 엔. 메닌기티디스 피막 사카라이드(들) 각각은 CDAP 화학에 의해 링커에 접합된다. 추가 실시양태에서, 담체 단백질은 카르보디이미드 화학을 사용하여, 예를 들어 EDAC를 사용하여 링커에 접합된다. 추가 실시양태에서, 엔. 메닌기티디스 피막 사카라이드 각각은 담체 단백질이 링커에 접합되기 전에 링커에 접합된다. 추가 실시양태에서, MenA는 링커를 통해 담체 단백질에 접합된다 (MenA 사카라이드 대 담체 단백질의 비는 1:2 내지 1:5 (w/w)일 수 있음). 추가 실시양태에서, MenC는 링커를 통해 담체 단백질에 접합된다 (MenC 사카라이드 대 담체 단백질의 비는 1:2 내지 1:5 (w/w)일 수 있음).
천연 또는 약간 크기 조절된 폴리사카라이드 접합체를 사용함으로써, 하기 이점 중 하나 이상이 실현될 수 있다: 1) 높은 면역원성을 갖는 접합체가 0.2 마이크로미터 필터를 통해 여과될 수 있음; 2) 면역 기억이 증진될 수 있음 (실시예 3에서와 같음); 3) 접합체 내의 폴리사카라이드 대 단백질의 비 (w/w)가 증가될 수 있도록 접합체 내의 폴리사카라이드 대 단백질의 비의 변경 (이는 담체 억제 효과의 감소를 발생시킬 수 있음); 4) 가수분해 경향이 있는 면역원성 접합체 (예컨대, MenA 접합체)가 접합을 위한 보다 큰 폴리사카라이드의 사용에 의해 안정화될 수 있음. 보다 큰 폴리사카라이드의 사용은 접합체 담체와 보다 많은 가교를 생성할 수 있고, 접합체로부터의 유리 사카라이드의 유리를 경감시킬 수 있다. 선행 기술에 기재된 접합체 백신은 접합을 개선시키기 위해 접합 전에 폴리사카라이드를 탈중합시키는 경향이 있다. 보다 큰 크기의 사카라이드를 보유하는 수막구균 (또는 사카라이드) 접합체 백신은 수막구균 질환에 대해 우수한 면역 반응을 제공할 수 있다.
따라서, 본 개시내용의 면역원성 조성물은 1개 이상의 사카라이드 접합체를 포함할 수 있고, 여기서 접합 전의 각각의 사카라이드의 평균 크기는 50kDa, 75kDa, 100kDa, 110kDa, 120kDa 또는 130kDa 초과이다. 한 실시양태에서 접합 후 접합체는 여과 전 샘플과 비교하여 여과 후 50, 60, 70, 80, 90 또는 95% 초과의 수율이 수득되도록 0.2 마이크로미터 필터를 통해 용이하게 여과될 수 있어야 한다.
특히, 본 개시내용의 면역원성 조성물은 담체 단백질에 접합된 혈청군 A, C, W 및 Y 중 적어도 1, 2, 3 또는 4종으로부터의 엔. 메닌기티디스 피막 사카라이드를 포함하고, 여기서 적어도 1, 2, 3 또는 4종, 또는 각각의 엔. 메닌기티디스 사카라이드의 평균 크기 (중량-평균 분자량; Mw)는 50kDa, 60kDa, 75kDa, 100kDa, 110kDa, 120kDa 또는 130kDa 초과이다.
바람직한 실시양태에서, MenAAH-TT 접합체의 평균 Mw는 적어도 250 kDa, 260 kDa, 270 kDa, 280 kDa, 또는 290 kDa이고, 가장 바람직하게는 약 300 kDa, 및 최대 350 kDa 또는 330 kDa이다. 바람직한 실시양태에서, MenCAH-TT 접합체의 평균 Mw는 적어도 150 kDa, 160 kDa, 170 kDa, 180 kDa, 또는 190 kDa이고, 가장 바람직하게는 약 200 kDa이고, 최대 250 kDa 또는 230 kDa이다. 바람직한 실시양태에서, MenW-TT 접합체의 평균 Mw는 적어도 240, 250 kDa, 260 kDa, 또는 270 kDa이고, 가장 바람직하게는 약 280 kDa이고, 최대 330 kDa 또는 310 kDa이다. 바람직한 실시양태에서, MenY-TT 접합체의 평균 Mw는 적어도 220 kDa, 230 kDa, 240 kDa, 또는 250 kDa이고, 가장 바람직하게는 약 270 kDa이고, 최대 320 kDa 또는 300 kDa이다.
면역원성 조성물은 담체 단백질에 접합된 혈청군 A, C, W 및 Y 중 적어도 1, 2, 3 또는 4종으로부터의 엔. 메닌기티디스 피막 사카라이드를 포함할 수 있고, 여기서 적어도 1, 2, 3 또는 4종, 또는 각각의 엔. 메닌기티디스 사카라이드는 천연 사카라이드이거나, 또는 천연 폴리사카라이드의 중량 평균 분자량에 비해 최대 x2, x3, x4, x5, x6, x7, x8, x9 또는 x10 비율로 크기 조절된다.
본 개시내용의 목적상, "천연 폴리사카라이드"는, 그 목적이 사카라이드의 크기를 감소시키는 것인 공정에 적용되지 않은 사카라이드를 지칭한다. 폴리사카라이드는 정상 정제 절차 동안 크기가 약간 감소될 수 있다. 이러한 사카라이드는 여전히 천연이다. 폴리사카라이드가 크기 조절 기술에 적용된 경우에만, 폴리사카라이드는 천연으로 간주되지 않을 것이다.
본 개시내용의 목적상, "최대 x2 비율로 크기 조절"은 사카라이드의 크기를 감소시키되 천연 폴리사카라이드의 크기의 절반을 초과하는 크기는 보유하도록 의도되는 공정에 사카라이드가 적용되는 것을 의미한다. x3, x4 등은 동일한 방식으로 해석되어야 하며, 즉 폴리사카라이드의 크기를 감소시키되 천연 폴리사카라이드의 크기의 3분의 1, 4분의 1 등을 초과하는 크기는 보유하도록 의도되는 공정에 사카라이드가 적용된다.
본 개시내용의 한 측면에서, 면역원성 조성물은 담체 단백질에 접합된 혈청군 A, C, W 및 Y 중 적어도 1, 2, 3 또는 4종으로부터의 엔. 메닌기티디스 피막 사카라이드를 포함하고, 여기서 적어도 1, 2, 3 또는 4종, 또는 각각의 엔. 메닌기티디스 사카라이드는 천연 폴리사카라이드이다.
본 개시내용의 한 측면에서, 면역원성 조성물은 담체 단백질에 접합된 혈청군 A, C, W 및 Y 중 적어도 1, 2, 3 또는 4종으로부터의 엔. 메닌기티디스 피막 사카라이드를 포함하고, 여기서 적어도 1, 2, 3 또는 4종, 또는 각각의 엔. 메닌기티디스 사카라이드는 최대 x1.5, x2, x3, x4, x5, x6, x7, x8, x9 또는 x10 비율로 크기 조절된다.
본 개시내용의 면역원성 조성물은 임의로: 엔. 메닌기티디스 혈청군 C 피막 사카라이드 (MenC), 혈청군 A 피막 사카라이드 (MenA), 혈청군 W135 피막 사카라이드 (MenW), 혈청군 Y 피막 사카라이드 (MenY), 혈청군 C 및 Y 피막 사카라이드 (MenCY), 혈청군 C 및 A 피막 사카라이드 (MenAC), 혈청군 C 및 W 피막 사카라이드 (MenCW), 혈청군 A 및 Y 피막 사카라이드 (MenAY), 혈청군 A 및 W 피막 사카라이드 (MenAW), 혈청군 W 및 Y 피막 사카라이드 (MenWY), 혈청군 A, C 및 W 피막 사카라이드 (MenACW), 혈청군 A, C 및 Y 피막 사카라이드 (MenACY); 혈청군 A, W135 및 Y 피막 사카라이드 (MenAWY), 혈청군 C, W135 및 Y 피막 사카라이드 (MenCWY); 또는 혈청군 A, C, W135 및 Y 피막 사카라이드 (MenACWY)의 접합체를 포함한다. 이는 본원에 언급된 혈청군 A, C, W 및 Y, 또는 각각의 엔. 메닌기티디스 사카라이드 중 "1, 2, 3 또는 4종", 또는 "중 적어도 1종"의 정의이다.
한 실시양태에서, 적어도 1, 2, 3, 4종 또는 각각의 엔. 메닌기티디스 사카라이드의 평균 크기는 MALLS에 의해 결정 시 50KDa 내지 1500kDa, 50kDa 내지 500kDa, 50 kDa 내지 300 KDa, 101kDa 내지 1500kDa, 101kDa 내지 500kDa, 101kDa 내지 300kDa이다.
한 실시양태에서, MenA 사카라이드는, 존재하는 경우, 50-500kDa, 50-100kDa, 100-500kDa, 55-90KDa, 60-70kDa 또는 70-80kDa 또는 60-80kDa의 분자량을 갖는다.
한 실시양태에서, MenC 사카라이드는, 존재하는 경우, 100-200kDa, 50-100kDa, 100-150kDa, 101-130kDa, 150-210kDa 또는 180-210kDa의 분자량을 갖는다.
한 실시양태에서, MenY 사카라이드는, 존재하는 경우, 60-190kDa, 70-180kDa, 80-170kDa, 90-160kDa, 100-150kDa 또는 110-140kDa, 50-100kDa, 100-140kDa, 140-170kDa 또는 150-160kDa의 분자량을 갖는다.
한 실시양태에서, MenW 사카라이드는, 존재하는 경우, 60-190kDa, 70-180kDa, 80-170kDa, 90-160kDa, 100-150kDa, 110-140kDa, 50-100kDa 또는 120-140kDa의 분자량을 갖는다.
본원에서 사카라이드의 분자량 또는 평균 분자량은 접합 전에 측정된 사카라이드의 중량-평균 분자량 (Mw)을 지칭하고, 이는 MALLS에 의해 측정된다.
MALLS 기술은 관련 기술분야에 널리 공지되어 있고, 이는 전형적으로 실시예 2에 기재된 바와 같이 수행된다. 수막구균 사카라이드의 MALLS 분석을 위해, 2개의 칼럼 (TSKG6000 및 5000PWxl)이 조합되어 사용될 수 있고, 사카라이드는 물에서 용리된다. 사카라이드는 광 산란 검출기 (예를 들어 10mW 아르곤 레이저가 장착된 와이어트 다운(Wyatt Dawn) DSP, 488nm) 및 간섭측정 굴절계 (예를 들어, P100 셀 및 적색 필터가 장착된 와이어트 오티랩(Wyatt Otilab) DSP, 498nm)를 사용하여 검출된다.
한 실시양태에서, 엔. 메닌기티디스 사카라이드는 천연 폴리사카라이드 또는 정상 추출 공정 동안 크기가 감소된 천연 폴리사카라이드이다.
한 실시양태에서, 엔. 메닌기티디스 사카라이드는 기계적 절단에 의해, 예를 들어 마이크로유동화 또는 초음파처리에 의해 크기 조절된다. 마이크로유동화 및 초음파처리는 보다 큰 천연 폴리사카라이드의 크기를 충분히 감소시켜 (예를 들어 0.2 마이크로미터 필터를 통과하는) 여과가능한 접합체를 제공하는 이점을 갖는다. 크기 조절은 x20, x10, x8, x6, x5, x4, x3, x2 또는 x1.5 이하의 비율이다.
한 실시양태에서, 면역원성 조성물은 천연 폴리사카라이드 및 x20 이하의 비율로 크기 조절된 사카라이드의 혼합물로 제조된 엔. 메닌기티디스 접합체를 포함한다. 예를 들어, MenC 및/또는 MenA로부터의 사카라이드는 천연이다. 예를 들어, MenY 및/또는 MenW로부터의 사카라이드는 x20, x10, x8, x6, x5, x4, x3 또는 x2 이하의 비율로 크기 조절된다. 예를 들어, 면역원성 조성물은 x10 이하의 비율로 크기 조절되고/거나 마이크로유동화된 MenY 및/또는 MenW 및/또는 MenC 및/또는 MenA로 제조된 접합체를 함유한다. 예를 들어, 면역원성 조성물은 천연 MenA 및/또는 MenC 및/또는 MenW 및/또는 MenY로 제조된 접합체를 함유한다. 예를 들어, 면역원성 조성물은 천연 MenC로 제조된 접합체를 포함한다. 예를 들어, 면역원성 조성물은 x10 이하의 비율로 크기 조절되고/거나 마이크로유동화된 천연 MenC 및 MenA로 제조된 접합체를 포함한다. 예를 들어, 면역원성 조성물은 x10 이하의 비율로 크기 조절되고/거나 마이크로유동화된 천연 MenC 및 MenY로 제조된 접합체를 포함한다.
한 실시양태에서, 사카라이드의 다분산도는 1-1.5, 1-1.3, 1-1.2, 1-1.1 또는 1-1.05이고, 담체 단백질에의 접합 후, 접합체의 다분산도는 1.0-2.5, 1.0-2.0, 1.0-1.5, 1.0-1.2, 1.5-2.5, 1.7-2.2 또는 1.5-2.0이다. 모든 다분산도 측정은 MALLS에 의한다.
사카라이드는 박테리아로부터 단리된 폴리사카라이드의 크기로부터 임의로 최대 1.5, 2, 4, 6, 8, 10, 12, 14, 16, 18 또는 20배로 크기 조절된다.
한 실시양태에서, 각각의 엔. 메닌기티디스 사카라이드는 천연 폴리사카라이드이거나, 또는 x10 이하의 비율로 크기 조절된다. 추가 실시양태에서 엔. 메닌기티디스 피막 사카라이드 각각은 천연 폴리사카라이드이다. 추가 실시양태에서, 적어도 1, 2, 3 또는 4종의 엔. 메닌기티디스 피막 사카라이드(들)가 마이크로유동화에 의해 크기 조절된다. 추가 실시양태에서, 엔. 메닌기티디스 피막 사카라이드 각각은 x10 이하의 비율로 크기 조절된다. 추가 실시양태에서, 엔. 메닌기티디스 접합체는 천연 폴리사카라이드 및 x10 이하의 비율로 크기 조절된 사카라이드의 혼합물로 제조된다. 추가 실시양태에서, 혈청군 Y로부터의 피막 사카라이드는 x10 이하의 비율로 크기 조절된다. 추가 실시양태에서, 혈청군 A 및 C로부터의 피막 사카라이드는 천연 폴리사카라이드이고, 혈청군 W135 및 Y로부터의 사카라이드는 x10 이하의 비율로 크기 조절된다. 추가 실시양태에서, 각각의 엔. 메닌기티디스 피막 사카라이드의 평균 크기는 50 kDa 내지 300 KDa 또는 50kDa 내지 200kDa이다. 추가 실시양태에서, 면역원성 조성물은 50kDa, 75kDa, 100kDa 초과의 평균 크기 또는 50-100kDa 또는 55-90KDa 또는 60-80kDa의 평균 크기를 갖는 MenA 피막 사카라이드를 포함한다. 추가 실시양태에서, 면역원성 조성물은 50kDa, 75kDa, 100kDa 초과 또는 100-200kDa, 100-150kDa, 80-120kDa, 90-110kDa, 150-200kDa, 120-240kDa, 140-220kDa, 160-200kDa 또는 190-200kDa의 평균 크기를 갖는 MenC 피막 사카라이드를 포함한다. 추가 실시양태에서, 면역원성 조성물은 50kDa, 75kDa, 100kDa 초과 또는 60-190kDa 또는 70-180kDa 또는 80-170kDa 또는 90-160kDa 또는 100-150kDa, 110-145kDa 또는 120-140kDa의 평균 크기를 갖는 MenY 피막 사카라이드를 포함한다. 추가 실시양태에서, 면역원성 조성물은 50kDa, 75kDa, 100kDa 초과 또는 60-190kDa 또는 70-180kDa 또는 80-170kDa 또는 90-160kDa 또는 100-150kDa, 140-180kDa, 150-170kDa 또는 110-140kDa의 평균 크기를 갖는 MenW 피막 사카라이드를 포함한다.
본 개시내용의 한 실시양태에서, 각각의 적어도 2, 3, 4종의 또는 각각의 엔. 메닌기티디스 사카라이드 접합체의 사카라이드 용량은 임의로 동일하거나, 또는 대략 동일하다.
한 실시양태에서, 본 개시내용의 면역원성 조성물은 pH 7.0 내지 8.0, pH 7.2 내지 7.6 또는 대략 또는 정확히 pH 7.4로 조정되거나, 완충되거나, 또는 조정된다.
본 개시내용의 면역원성 조성물 또는 백신은 안정화제, 예를 들어 폴리올, 예컨대 수크로스 또는 트레할로스의 존재 하에 임의로 동결건조된다.
상기 논의된 엔. 메닌기티디스 사카라이드 조합물의 경우, 임의의 알루미늄 염 아주반트 또는 임의의 아주반트를 전혀 사용하지 않는 것이 유리할 수 있다.
활성제는 본 개시내용의 제약 조성물 또는 백신에서 다양한 농도로 존재할 수 있다. 전형적으로, 물질의 최소 농도는 그의 의도된 용도를 달성하는데 필요한 양인 한편, 최대 농도는 용액으로 유지되거나 또는 초기 혼합물 내에 균질하게 현탁될 최대량이다. 예를 들어, 치료제의 최소량은 임의로, 단일 치료 유효 투여량을 제공할 양이다. 생물활성 물질의 경우, 최소 농도는 재구성시 생물활성에 필요한 양이고, 최대 농도는 균질 현탁액이 유지될 수 없는 지점이다.
또 다른 실시양태에서, 조성물은 네이세리아 메닌기티디스 혈청군 X 피막 폴리사카라이드 및 담체 분자의 접합체를 포함한다. 군 X 피막 폴리사카라이드의 구조는 O-아세틸 기 없이 al-4 포스포디에스테르 결합에 의해 함께 유지되는 N-아세틸글루코사민-4-포스페이트 잔기로 이루어진다. 담체 분자는 디프테리아 또는 파상풍 톡소이드, CRM 197 또는 단백질 D일 수 있다. 바람직한 실시양태에서, 실시예에 예시된 바와 같이, 조성물은 엔. 메닌기티디스 혈청군 X 피막 폴리사카라이드의 접합체를 포함하지 않는다.
예시적인 조성물의 추가 설명이 하기 기재된다.
조성물 및 백신
일부 실시양태에서, 조성물은 액체 MnB 2가 rLP2086 조성물로 재구성된 동결건조된 MenACWY-TT 조성물을 포함한다. 동결건조된 MenACWY-TT 조성물 및 액체 MnB 2가 rLP2086 조성물은 바람직하게는 상용성이고, 실온에서 적어도 24시간 동안 재구성 후에 안정하다.
바람직한 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 B 및 B 이외의 엔. 메닌기티디스 혈청군에 대한 살박테리아 항체를 도출한다. 예를 들어, 일부 실시양태에서, MnB 2가 rLP2086 조성물은 적어도 엔. 메닌기티디스 혈청군 A, C, W, Y, 및 X에 대한 살박테리아 항체를 도출한다.
추가로, 본 발명자들은 조성물이 엔. 메닌기티디스 혈청군 A, C, W, 및 Y에 대한 허가된 백신에 대해 관찰된 기하 평균 역가와 일치하는 엔. 메닌기티디스 혈청군 A, C, W, 및 Y에 대한 기하 평균 역가를 도출하였음을 발견하였다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 A, C, W, 및 Y에 대한 허가된 백신에 대해 관찰된 기하 평균 역가보다 더 높은 엔. 메닌기티디스 혈청군 A, C, W, 및 Y에 대한 기하 평균 역가를 도출한다.
또한, 본 발명자들은 조성물이 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신에 대해 관찰된 기하 평균 역가와 일치하는 엔. 메닌기티디스 혈청군 B에 대한 기하 평균 역가를 도출하였음을 발견하였다.
일부 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신에 대해 관찰된 기하 평균 역가보다 더 높은 엔. 메닌기티디스 혈청군 B에 대한 기하 평균 역가를 도출한다.
일부 실시양태에서, fHBP를 포함하는 조성물은 적어도 12개월령의 인간에서 효과적인 면역 반응을 도출한다. 조성물은 또한 엔. 메닌기티디스 혈청군 X 균주에 대한 면역 반응을 도출한다. 일부 실시양태에서, 조성물은 적어도 1개의 인자 H 결합 폴리펩티드 (fHBP) 및 적어도 1개의 엔. 메닌기티디스 피막 사카라이드 접합체를 포함한다. 바람직한 실시양태에서, 조성물은 안정하고, 다중-성분 조성물에서 fHBP 변이체에 동종인 fHBP 변이체를 발현하는 균주에 대한 면역 반응 및 다중-성분 조성물에서 fHBP 변이체에 이종인 fHBP 변이체를 발현하는 균주에 대한 면역 반응을 도출한다.
일부 실시양태에서, 액체 MnB 2가 rLP2086 조성물은 동결건조된 MenACWY-TT 조성물을 용이하게 재구성할 수 있고, 조합된 조성물은 상용성이고 안정하다.
한 측면에서, 본 개시내용은 네이세리아 메닌기티디스에 대한 조성물에 관한 것이다. 조성물은 (a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합된 것인 네이세리아 메닌기티디스 혈청군 A (MenA) 피막 사카라이드 (MenAAH-TT 접합체); (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합된 것인 네이세리아 메닌기티디스 혈청군 C (MenC) 피막 사카라이드 (MenCAH-TT 접합체); (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합된 네이세리아 메닌기티디스 혈청군 W135 (MenW) 피막 사카라이드 (MenW-TT 접합체); (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y (MenY) 피막 사카라이드 (MenY-TT 접합체)를 포함한다.
또 다른 측면에서, 본 개시내용은 MnB 2가 rLP2086 조성물 및 MenACWY-TT 조성물의 조합물을 포함하는 조성물에 관한 것이다. MnB 2가 rLP2086 조성물은 엔. 메닌기티디스 혈청군 B의 다중 균주에 대해 효과적인 광범위한 보호 면역 반응을 유도하는 단일 엔. 메닌기티디스 폴리펩티드 성분을 포함하는 조성물을 지칭한다. 구체적으로, 한 실시양태에서, MnB 2가 rLP2086 조성물은 MnB rLP2086 서브패밀리 A 단백질 (서열식별번호: 1) 및 MnB rLP2086 서브패밀리 B 단백질 (서열식별번호: 2)을 포함한다. 한 실시양태에서, 조성물은 융합 단백질을 포함하지 않는다. 한 실시양태에서, 조성물은 키메라 단백질을 포함하지 않는다. 한 실시양태에서, 조성물은 하이브리드 단백질을 포함하지 않는다. 한 실시양태에서, 조성물은 펩티드 단편을 추가로 포함하지 않는다. 또 다른 실시양태에서, 조성물은 fHBP가 아닌 네이세리아 폴리펩티드를 추가로 포함하지 않는다. 예를 들어, 한 실시양태에서, 조성물은 PorA 단백질을 포함하지 않는다. 또 다른 실시양태에서, 조성물은 NadA 단백질을 포함하지 않는다. 또 다른 실시양태에서, 조성물은 네이세리아 헤파린 결합 항원 (NHBA)을 추가로 포함하지 않는다. 또 다른 실시양태에서, 조성물은 네이세리아 외부 막 소포 (OMV)를 추가로 포함하지 않는다. 바람직한 실시양태에서, 조성물은 제1 폴리펩티드 및 제2 폴리펩티드 이외의 항원을 추가로 포함하지 않는다. 바람직한 실시양태에서, MnB 2가 rLP2086 조성물은 폴리소르베이트-80을 추가로 포함한다. 한 실시양태에서, MnB 2가 rLP2086 조성물은 히스티딘 완충제를 추가로 포함한다. 한 실시양태에서, MnB 2가 rLP2086 조성물은 염화나트륨을 추가로 포함한다. 한 실시양태에서, MnB 2가 rLP2086 조성물은 인산알루미늄을 추가로 포함한다. 한 실시양태에서, MnB 2가 rLP2086 조성물은 폴리소르베이트-80, 히스티딘 완충제, 염화나트륨, 및 인산알루미늄을 추가로 포함한다. 바람직하게는, MnB 2가 rLP2086 조성물은 액체 제제이고, 여기서 폴리펩티드는 0.5 mg/mL 인산알루미늄 (AlPO4)의 존재 하의 10 mM 히스티딘 완충제, pH 6.0, 150 mM 염화나트륨 (NaCl) 중의 120 mcg/mL/서브패밀리로서 제제화되며, 이는 추가로 0.5 mL 용량 중에 0.018 mg 폴리소르베이트-80을 포함한다.
MenACWY-TT 조성물은, 각각 독립적으로 TT에 각각 ~3, ~3, ~1.5 및 ~1.3의 비 (TT 대 폴리사카라이드)로 접합된, 네이세리아 메닌기티디스 혈청군 A, C, W-135 및 Y의 정제된 피막 폴리사카라이드를 포함하는 조성물을 지칭한다. 구체적으로, 조성물은 (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합된 것인 네이세리아 메닌기티디스 혈청군 A (MenA) 피막 사카라이드 (MenAAH-TT 접합체); (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합된 것인 네이세리아 메닌기티디스 혈청군 C (MenC) 피막 사카라이드 (MenCAH-TT 접합체); (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합된 네이세리아 메닌기티디스 혈청군 W135 (MenW) 피막 사카라이드 (MenW-TT 접합체); (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y (MenY) 피막 사카라이드 (MenY-TT 접합체)를 포함한다. 바람직하게는, MenACWY-TT 조성물은 동결건조된 분말로서 제공된다.
MenAAH-TT, MenCAH-TT, MenW-TT, 및 MenY-TT 접합체는 하기 단계를 통해 제조된다: 폴리사카라이드 약물 물질 중간체의 제조, TT 약물 물질 중간체의 제조, 폴리사카라이드의 마이크로유동화, 폴리사카라이드의 유도체화 (MenAAH-TT 및 MenCAH-TT 공정의 경우에만), TT의 추가의 정제, 및 개별 폴리사카라이드의 TT에의 접합.
MenAAH-TT 접합체와 관련하여, MenA 폴리사카라이드는 먼저 분자 크기 및 점도를 감소시키기 위해 마이크로유동화된 다음, 1-시아노-4-디메틸아미노-피리디늄 테트라플루오로보레이트 (CDAP)에 의한 시아닐화를 통해 활성화된다. 활성화된 MenA는 아디프산 디히드라지드 (ADH)로 유도체화되어 MenAAH를 형성한다. MenAAH 및 파상풍 톡소이드 (TT)는 카르보디이미드-매개 축합 (1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 (EDAC) 커플링 기술)을 통해 커플링되어, MenAAH-파상풍 톡소이드 접합체 (MenAAH-TT)를 형성한다.
MenCAH-TT 접합체와 관련하여, MenC 폴리사카라이드는 먼저 분자 크기 및 점도를 감소시키기 위해 마이크로유동화된 다음, CDAP에 의한 시아닐화를 통해 활성화된다. 활성화된 MenC는 아디프산 디히드라지드 (ADH)로 유도체화되어 MenCAH를 형성한다. MenCAH 및 TT는 카르보디이미드-매개 축합 EDAC 커플링 기술을 통해 커플링되어, MenCAH-파상풍 톡소이드 (MenCAH-TT)를 형성한다.
MenW-TT 접합체와 관련하여, MenW 폴리사카라이드는 먼저 분자 크기 및 점도를 감소시키기 위해 마이크로유동화된 다음, CDAP에 의한 시아닐화를 통해 활성화된다. 활성화된 MenW는 TT에 직접 커플링되어 MenW-파상풍 톡소이드 (MenW-TT)를 형성한다.
MenY-TT 접합체와 관련하여, MenY 폴리사카라이드는 먼저 분자 크기 및 점도를 감소시키기 위해 마이크로유동화된 다음, CDAP에 의한 시안화를 통해 활성화된다. 활성화된 MenY는 TT에 직접 커플링되어 MenY-파상풍 톡소이드 (MenY-TT)를 형성한다.
또 다른 측면에서, 최대 2종의 엔. 메닌기티디스 혈청군 B 균주로부터 유래된 폴리펩티드 항원은 엔. 메닌기티디스 혈청군 B의 다중 균주에 대해 효과적인 광범위한 보호 면역 반응을 유도한다. 따라서, 한 실시양태에서, 조성물은 엔. 메닌기티디스 혈청군 B fHBP 서브패밀리 A M98250771 균주 및/또는 엔. 메닌기티디스 혈청군 B fHBP 서브패밀리 B CDC1573 균주로부터 유래되지 않은 폴리펩티드는 추가로 포함하지 않는다.
한 실시양태에서, 조성물은 서열식별번호: 1에 대해 100% 미만의 서열 동일성을 갖는 폴리펩티드는 추가로 포함하지 않는다. 또 다른 실시양태에서, 조성물은 서열식별번호: 2에 대해 100% 미만의 서열 동일성을 갖는 폴리펩티드는 추가로 포함하지 않는다. 예를 들어 조성물은 서열식별번호: 1 및/또는 서열식별번호: 2의 전장에 대해 100% 미만의 서열 동일성을 갖는 폴리펩티드를 추가로 포함하지 않는다.
한 실시양태에서, 조성물은 폴리소르베이트-80, 알루미늄, 히스티딘 및 염화나트륨을 추가로 포함한다. 한 실시양태에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드 약 60 μg, 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드 약 60 μg, 각각의 폴리펩티드에 대해 2.8 몰비의 폴리소르베이트-80, 인산알루미늄으로서 0.5 mg 알루미늄/ml, 10 mM 히스티딘, 및 150 mM 염화나트륨을 포함하며, 여기서 조성물은 바람직하게는 약 0.5 ml의 총 부피를 갖는다.
또 다른 측면에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드 약 120 μg/ml, 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드 약 120 μg/ml, 각각의 폴리펩티드에 대해 2.8 몰비의 폴리소르베이트-80, 인산알루미늄으로서 0.5 mg 알루미늄/ml, 10 mM 히스티딘, 및 150 mM 염화나트륨을 포함한다.
추가의 측면에서, 조성물은 a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드 60 μg; b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드 60 μg; c) 18 μg 폴리소르베이트-80; d) 250 μg 알루미늄; e) 780 μg 히스티딘, 및; f) 4380 μg 염화나트륨을 포함한다.
예시적 실시양태에서, 조성물은 서열식별번호: 1에 제시된 아미노산 서열로 이루어진 제1 지질화된 폴리펩티드 약 60 μg, 서열식별번호: 2에 제시된 아미노산 서열로 이루어진 제2 지질화된 폴리펩티드 약 60 μg, 제1 지질화된 폴리펩티드에 대해, 및 제2 지질화된 폴리펩티드에 대해 2.8 몰비의 폴리소르베이트-80, 0.5 mg/ml 인산알루미늄, 10 mM 히스티딘, 및 150 mM 염화나트륨을 포함하며, 여기서 조성물은 약 0.5 ml의 총 부피를 갖는다. 예시적 실시양태에서, 조성물은 멸균 등장성 완충된 액체 현탁액이다. 예시적 실시양태에서, 조성물은 pH 6.0을 갖는다. 예시적 실시양태에서, 제1 폴리펩티드 및 제2 폴리펩티드는 알루미늄에 흡착된다.
한 실시양태에서, 조성물은 평균 TT/폴리사카라이드 비 3을 갖는 MenAAH-TT 접합체; 평균 TT/폴리사카라이드 비 3을 갖는 MenCAH-TT 접합체; 평균 TT/폴리사카라이드 비 1.5를 갖는 MenW-TT 접합체; 및 평균 TT/폴리사카라이드 비 1.3을 갖는 MenY-TT 접합체를 포함한다. 바람직한 실시양태에서, 조성물은 5 mcg MenA 폴리사카라이드 및 ~ 15 mcg TT를 갖는 MenAAH-TT 접합체; 5 mcg MenC 폴리사카라이드 및 ~ 15 mcg TT를 갖는 MenCAH-TT 접합체; 5 mcg MenW 폴리사카라이드 및 ~ 7.5 mcg TT를 갖는 MenW-TT 접합체; 및 5 mcg MenY 폴리사카라이드 및 ~ 6.5 mcg TT를 갖는 MenY-TT 접합체를 포함한다. 조성물은 트리스-HCl, 수크로스, 및 염화나트륨을 추가로 포함할 수 있다.
또 다른 실시양태에서, 조성물은 MenA 폴리사카라이드; MenC 폴리사카라이드; MenW 폴리사카라이드; 및 MenY 폴리사카라이드 및 TT 담체 단백질을 포함하는 MenAAH-TT 접합체; MenCAH-TT 접합체; MenW-TT 접합체; 및 MenY-TT 접합체를 포함한다. 조성물은 수크로스 및 트로메타놀을 추가로 포함할 수 있다. 예를 들어, 한 실시양태에서, 조성물은 10 μg/mL MenA 폴리사카라이드; 10 μg/mL MenC 폴리사카라이드; 10 μg/mL MenW 폴리사카라이드; 및 10 μg/mL MenY 폴리사카라이드; 88 μg/mL TT 담체 단백질; 164 mM 수크로스; 및 1.6 mM 트로메타놀을 포함한다.
한 실시양태에서, 조성물은 약 0.5 ml의 총 부피를 갖는다. 한 실시양태에서, 조성물의 제1 용량은 약 0.5 ml의 총 부피를 갖는다. "제1 용량"은 제0일에 투여되는 조성물의 용량을 지칭한다. "제2 용량" 또는 "제3 용량"은 제1 용량에 후속적으로 투여되는 조성물의 용량을 지칭하며, 이는 제1 용량과 동일한 양일 수 있거나 그렇지 않을 수 있다.
한 측면에서, 본 개시내용은 액체 MnB 2가 rLP2086 조성물로 재구성된, 동결건조된 MenACWY-TT 조성물로부터 생성된 액체 면역원성 조성물에 관한 것이다. 재구성은 액체 희석제를 첨가함으로써 건조 동결건조 조성물을 액체 형태로 복원시키는 것을 지칭한다. 하나의 바람직한 실시양태에서, 액체 MnB 2가 rLP2086 조성물은 동결건조된 MenACWY-TT 조성물과 병용으로 투여되지 않고, 공투여되지 않고, 동시에 투여되지 않으며, 여기서 동결건조된 MenACWY-TT 조성물은 액체 MnB 2가 rLP2086 조성물이 아닌 액체 조성물에 의해 재구성된다. 예를 들어, 하나의 바람직한 실시양태에서, 동결건조된 MenACWY-TT 조성물은 염화나트륨 및 물로 이루어진 수성 희석제에 의해 재구성되지 않고, 후속적으로 액체 MnB 2가 rLP2086 조성물과 병용으로 투여되지 않고, 공투여되지 않고, 동시에 투여되지 않는다.
오히려, 바람직한 실시양태에서, 동결건조된 MenACWY-TT 조성물은 인간에게 MnB 2가 rLP2086 조성물과 함께 1회, 즉 단일 투여로 투여된다. 생성된 단일 투여 (예를 들어, MenABCWY 조성물)는 제1 용기로부터의 MnB 2가 rLP2086 조성물을 제2 용기로부터의 동결건조된 MenACWY-TT 조성물과 혼합하는 것으로부터 이루어질 수 있다. 대안적으로, MenABCWY 조성물의 단일 투여는 MnB 2가 rLP2086 조성물 및 동결건조된 MenACWY-TT 조성물을 포함하는 하나의 (단일) 용기로부터 이루어질 수 있다. 백신 또는 면역원성 조성물을 위한 전달 장치는 관련 기술분야에 공지되어 있다. 한 실시양태에서, MenABCWY 조성물은 이부프로펜, 파라세타몰 및 아목시실린 중 어느 하나와 병용으로 투여된다.
조성물은 인간에게 제1 용량을 투여한 후에 면역원성이다. 한 실시양태에서, 제1 용량은 총 부피로 약 0.5 ml이다.
조성물은 인간 보체를 사용한 혈청 살박테리아 검정 (hSBA)에서 동일한 조건 하에 측정 시, 제1 용량을 제공하기 전 인간에서의 혈청 이뮤노글로불린의 살박테리아 역가보다 제1 용량을 제공한 후 인간에서 적어도 1-배를 초과하여 더 높은, 바람직하게는 적어도 2-배 더 높은 혈청 이뮤노글로불린의 살박테리아 역가를 유도한다.
살박테리아 역가 또는 살박테리아 면역 반응은 엔. 메닌기티디스 혈청군 B에 대한 것이다. 바람직한 실시양태에서, 살박테리아 역가 또는 살박테리아 면역 반응은 엔. 메닌기티디스 혈청군 B fHBP 서브패밀리 A 균주 및 엔. 메닌기티디스 혈청군 B fHBP 서브패밀리 B 균주에 대한 것이다. 가장 바람직하게는, 살박테리아 역가 또는 살박테리아 면역 반응은 적어도 엔. 메닌기티디스 혈청군 B, fHBP 서브패밀리 B, B01 균주에 대한 것이다.
한 실시양태에서, 조성물은 인간 보체를 사용한 혈청 살박테리아 검정에서 동일한 조건 하에 측정 시, 조성물의 용량을 제공하기 전 인간에서의 혈청 이뮤노글로불린의 살박테리아 역가보다 상기 용량을 제공한 후 인간에서 적어도 1-배를 초과하여 더 높은, 예컨대 예를 들어, 적어도 1.01-배, 1.1-배, 1.5-배, 2-배, 3-배, 4-배, 5-배, 6-배, 7-배, 8-배, 9-배, 10-배, 11-배, 12-배, 13-배, 14-배, 15-배, 또는 16-배 더 높은 혈청 이뮤노글로불린의 살박테리아 역가를 유도한다.
한 실시양태에서, 조성물은 면역원성 조성물이다. 한 실시양태에서, 조성물은 인간을 위한 면역원성 조성물이다. 또 다른 실시양태에서, 조성물은 백신이다. "백신"은 항원에 특이적인 면역 반응을 유도하는 적어도 1종의 에피토프를 함유하는, 항원을 포함하는 조성물을 지칭한다. 백신은 피하, 경구, 구비강내, 또는 비강내 투여 경로에 의해 대상체에게 직접 투여될 수 있다. 바람직하게는, 백신은 근육내로 투여된다. 한 실시양태에서, 조성물은 인간 백신이다. 한 실시양태에서, 조성물은 엔. 메닌기티디스에 대한 면역원성 조성물이다.
한 실시양태에서, 조성물은 액체 조성물이다. 바람직한 실시양태에서, 조성물은 액체 현탁액 조성물이다. 또 다른 바람직한 실시양태에서, 조성물은 동결건조되지 않는다.
안정성
용어 "안정한" 및 "안정성"은 소정의 기간에 걸쳐 면역원성을 유지하는 항원의 능력을 지칭한다. 안정성은 시간의 경과에 따라 효력면에서 측정될 수 있다. 용어 "안정한" 및 "안정성"은 면역원성 조성물의 물리적, 화학적, 및 입체형태적 안정성을 추가로 지칭한다. 단백질 조성물의 불안정성은 보다 고차의 중합체를 형성하기 위한 단백질 분자의 화학적 분해 또는 응집에 의해, 이종이량체의 단량체로의 해리, 탈글리코실화, 글리코실화의 변형, 또는 본 개시내용에 포함된 단백질 조성물의 적어도 1종의 생물학적 활성을 감소시키는 임의의 다른 구조적 변형에 의해 유발될 수 있다. 안정성은 샘플의 광 산란, 겉보기 광 감쇠 (흡광도 또는 광학 밀도), 크기 (예를 들어, 크기 배제 크로마토그래피에 의함), 시험관내 또는 생체내 생물학적 활성 및/또는 시차 주사 열량측정 (DSC)에 의한 특성의 측정을 포함한, 관련 기술분야에 널리 공지된 방법에 의하여 평가될 수 있다. 다른 안정성 평가 방법은 관련 기술분야에 공지되어 있고, 이는 또한 본 개시내용에 따라 사용될 수 있다.
일부 실시양태에서, 본 개시내용의 안정한 제제 내의 항원은 참조 표준물과 비교하여 적어도 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 9개월, 12개월, 18개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 또는 60개월 동안 적어도 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 효력을 유지할 수 있다. 일부 실시양태에서, 본 개시내용의 안정한 제제 내의 항원은 참조 표준물과 비교하여 적어도 1년, 2년, 3년, 4년 또는 5년 동안 적어도 50% 효력을 유지할 수 있다. 용어 "안정한" 및 "안정성"은 또한 소정의 기간에 걸쳐 에피토프 또는 면역반응성을 유지하는 항원의 능력을 지칭한다. 예를 들어, 본 개시내용의 안정한 제제 내의 항원은 참조 표준물과 비교하여 적어도 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 9개월, 12개월, 18개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 또는 60개월 동안 그의 에피토프 또는 면역반응성의 적어도 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100%를 유지할 수 있다. 일부 실시양태에서, 안정성은 환경 조건과 관련하여 측정된다. 환경 조건의 비제한적 예는 광, 온도, 냉동/해동 주기, 교반 및 pH를 포함한다. 관련 기술분야의 통상의 기술자는 본원에 개시된 방법 또는 관련 기술분야에 공지된 다른 방법을 사용하여 항원 에피토프 또는 면역반응성의 존재를 결정할 수 있을 것이다. 일부 실시양태에서, 항원의 안정성은 그의 제제화일로부터 측정된다. 일부 실시양태에서, 항원의 안정성은 그의 저장 조건의 변화일로부터 측정된다. 저장 조건의 변화의 비제한적 예는 동결 온도에서 냉장 온도로의 변화, 동결 온도에서 실온으로의 변화, 냉장 온도에서 실온으로의 변화, 냉장 온도에서 동결 온도로의 변화, 실온에서 동결 온도로의 변화, 실온에서 냉장 온도로의 변화, 명에서 암으로의 변화, 또는 교반의 도입을 포함한다.
한 실시양태에서, 용어 "안정한" 및 "안정성"은 알루미늄에 결합되는 항원의 능력을 포함한다. 예를 들어, 본 개시내용의 안정한 제제는 참조 표준물과 비교하여 적어도 1시간, 6시간, 12시간, 18시간, 24시간, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 9개월, 12개월, 18개월, 24개월, 30개월, 36개월, 42개월, 48개월, 54개월, 또는 60개월 동안 제제 중의 알루미늄 (예를 들어, 인산알루미늄)에 결합된 단백질의 적어도 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100%를 포함한다. 예를 들어 실시예 13을 참조한다. 바람직한 실시양태에서, 총 서브패밀리 A rLP2086 폴리펩티드 (예를 들어, 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 폴리펩티드)의 적어도 90%, 보다 바람직하게는 적어도 95%, 및 가장 바람직하게는 적어도 99%가 조성물 중의 알루미늄에 결합된다. 바람직한 실시양태에서, 총 서브패밀리 B rLP2086 폴리펩티드 (예를 들어 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 폴리펩티드)의 적어도 90%, 보다 바람직하게는 적어도 95%, 및 가장 바람직하게는 적어도 99%가 조성물 중의 알루미늄에 결합된다.
알루미늄 결합의 결정. 알루미늄 및 적어도 1종의 단백질 항원을 포함하는 조성물을 알루미늄이 펠릿화되도록 원심분리하였다. 알루미늄 흡수된 단백질의 원심분리는 관련 기술분야에 공지되어 있다. 예를 들어, 문헌 [Egan et al., Vaccine, Vol. 27(24): 3175-3180 (2009)]을 참조한다. 알루미늄-결합된 단백질이 또한 펠릿화되었고, 한편 비-알루미늄-결합된 단백질은 상청액에 잔류하였다. 상청액 및 펠릿 내의 총 단백질을 로우리 검정에 의해 결정하였다. 상청액 중 총 단백질을 조성물에 첨가된 총 단백질로 나누고, 이에 100%를 곱하여 결합된 단백질의 백분율을 계산하였다. 유사하게, 상청액 중 총 단백질을 조성물에 첨가된 총 단백질로 나누고, 이에 100%를 곱하여 미결합된 단백질의 백분율을 계산하였다. 서브패밀리 A 및 서브패밀리 B 항원 둘 다를 포함하는 조성물의 경우, 상청액 중 개별 서브패밀리 A 및 B 단백질 농도를 이온-교환 크로마토그래피에 의해 결정하였다. 강음이온 칼럼 및 높은 염 농도 용리액을 사용하여 서브패밀리 A 및 B 단백질의 분리 및 용리를 수행하였다. 여기 = 280 실행 및 방출 = 310 실행으로 설정된 형광 검출기를 사용하여 서브패밀리 A 및 B 단백질 둘 다를 검출하고 정량화하였다. 서브패밀리 A 및 서브패밀리 B 단백질은 별개의 체류 시간에 용리되고, rLP2086 단백질 참조 물질에 대해 생성된 표준 곡선을 사용하여 이를 정량화하였다. 상청액 중 총 단백질을 조성물에 첨가된 총 단백질로 나누고, 이에 100%를 곱하여 미결합된 단백질의 백분율을 계산하였다. 미결합된 단백질의 백분율을 100%에서 차감하여 결합된 단백질 백분율을 계산하였다.
폴리소르베이트-80
폴리소르베이트 80 (PS-80)은 비-이온성 계면활성제이다. 시험관내 모노클로날 항체 기반 효력 검정을 사용한 가속 안정성 연구는 최종 제제 중의 PS-80 대 MnB rLP2086 단백질의 보다 높은 몰비에서의 서브패밀리 B 단백질의 불안정성을 입증하였다. PS-80의 다양한 비를 사용한 추가의 실험은, 효력을 보유하기 위한 PS-80 대 MnB rLP2086 단백질의 최적의 몰비가 대략 2.8 ± 1.4임을 입증하였다.
조성물 중 PS-80의 농도는 PS-80 대 폴리펩티드의 몰비에 의존한다. 한 실시양태에서, 조성물은 2.8±1.4 몰비의 PS-80 대 제1 폴리펩티드 및 제2 폴리펩티드를 포함한다. 한 실시양태에서, 조성물은 2.8±1.1 몰비의 PS-80 대 제1 폴리펩티드 및 제2 폴리펩티드를 포함한다. 한 실시양태에서, 조성물은 적어도 1.9, 2.0, 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 3.0, 3.1, 3.2, 또는 3.3 몰비의 PS-80 대 폴리펩티드를 포함한다. 한 실시양태에서, 조성물은 최대 4.0, 3.9, 3.8, 3.7, 3.6, 3.5, 3.4, 3.3, 3.2, 3.1, 3.0, 또는 2.9 몰비의 PS-80 대 폴리펩티드를 포함한다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다. 바람직하게는, 조성물은 2.8 몰비의 PS-80 대 폴리펩티드를 포함한다.
PS-80 대 폴리펩티드 몰비는 PS-80의 측정된 농도 및 측정된 총 폴리펩티드 농도로부터의 계산에 의해 결정되고, 여기서 둘 다의 값은 몰로 표현된다. 예를 들어, PS-80 대 단백질 몰비는 최종 약물 물질 중의 PS-80의 측정된 농도 (예를 들어, 역상 고압 액체 크로마토그래피 (RP-HPLC)에 의함) 대 측정된 총 단백질 농도 (예를 들어, 이온 교환-고압 액체 크로마토그래피 (IEX-HPLC)에 의함)의 계산에 의해 결정되고, 여기서 둘 다의 값은 몰로 표현된다.
RP-HPLC를 사용하여 백신 제제 중 폴리소르베이트 80의 농도를 정량화한다. 세제의 농도는 지방산 모이어티의 비누화에 의해 결정되고; 폴리소르베이트 80은 40℃에서의 알칼리 가수분해에 의해 유리 올레산으로 전환된다. 샘플은 C18 칼럼을 사용하여 RP-HPLC에 의해 분리되고, 200 nm 파장에서 UV 검출기를 사용하여 정량화된다.
제1 및 제2 폴리펩티드는 음이온-교환 HPLC에 의해 분해된다. rLP2086(fHBP) 서브패밀리 A 및 B 단백질은 별개의 체류 시간에 용리되고, 각각의 rLP2086 단백질 참조 물질에 대해 생성된 표준 곡선을 사용하여 정량화된다.
용어 "몰비" 및 fHBP 및 PS-80을 포함하는 면역원성 조성물의 기재는 WO2012025873 및 미국 특허 공개 US 2013/0171194에 추가로 개시되어 있으며, 이들은 각각 그 전문이 참조로 포함된다.
본원에 사용된 용어 "몰비"는 조성물 중의 2종의 상이한 요소의 몰수의 비를 지칭한다. 일부 실시양태에서, 몰비는 세제의 몰 대 폴리펩티드 몰의 비이다. 일부 실시양태에서, 몰비는 PS-80의 몰 대 단백질의 몰의 비이다. 한 실시양태에서, 단백질 및 폴리소르베이트 80 농도에 기초하여, 몰비는 하기 방정식을 사용하여 계산될 수 있다:
한 실시양태에서, 조성물은 효력을 유지하기 위해 1.4 내지 4.2의 PS-80 대 MnB rLP2086 단백질의 몰비를 포함한다. 한 실시양태에서, 조성물은 적어도 1.2, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8, 1.9, 2.0, 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 또는 2.8을 포함한다. 한 실시양태에서, 조성물은 최대 4.2, 4.1, 4.0, 3.9, 3.8, 3.7, 3.7, 3.6, 3.5, 3.4, 3.3, 3.2, 3.1, 3.0, 2.9, 또는 2.8을 포함한다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다.
한 실시양태에서, 조성물은 약 0.0015, 0.0017, 0.0019, 0.0021, 0.0023, 0.0025, 0.0027, 0.0029, 0.0031, 0.0033, 0.0035, 0.0037, 0.0039, 0.0041, 0.0043, 0.0045, 0.0047, 0.0049, 0.0051 mg/mL의 PS-80을 포함한다. 바람직하게는, 조성물은 약 0.0035 mg/mL의 PS-80을 포함한다.
또 다른 실시양태에서, 조성물은 적어도 10 μg, 11 μg, 12 μg, 13 μg, 14 μg, 15 μg, 16 μg, 17 μg, 18 μg, 19 μg, 20 μg, 21 μg, 22 μg, 23 μg, 24 μg, 또는 25 μg의 PS-80을 포함한다. 또 다른 실시양태에서, 조성물은 최대 30 μg, 29 μg, 28 μg, 27 μg, 26 μg, 25 μg, 24 μg, 23 μg, 22 μg, 21 μg, 20 μg, 19 μg, 또는 18 μg의 PS-80을 포함한다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다. 바람직한 실시양태에서, 조성물은 적어도 10 μg 및 최대 20 μg의 PS-80을 포함한다. 가장 바람직한 실시양태에서, 조성물은 약 18 μg의 PS-80을 포함한다.
또 다른 실시양태에서, 조성물은 0.0005% 내지 1% 범위의 PS-80 농도를 포함한다. 예를 들어, 조성물 중 PS-80 농도는 적어도 0.0005%, 0.005%, 0.01%, 0.02%, 0.03%, 0.04%, 0.05%, 0.06%, 0.07%, 0.08%, 0.09%, 0.10%, 0.2%, 0.3%, 0.4%, 0.5%, 0.6%, 0.7%, 0.8%, 0.9%, 1%, 또는 1.1% PS-80일 수 있다. 한 실시양태에서, 조성물 중 PS-80 농도는 최대 2.0%, 1.9%, 1.8%, 1.7%, 1.6%, 1.5%, 1.4%, 1.3%, 1.2%, 1.1%, 1.0%, 0.9%, 0.8%, 또는 0.7% PS-80일 수 있다. 바람직한 실시양태에서, 조성물은 약 0.07% PS-80을 포함한다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다.
일부 실시양태에서, 제1 조성물 및 제2 조성물의 조합물을 포함하는 조성물은, 제1 조성물 중의 MnB rLP2086 폴리펩티드에 대한 폴리소르베이트-80의 몰비와 비교하여, MnB rLP2086 폴리펩티드에 대한 폴리소르베이트-80의 상이한 몰비를 가질 수 있다. 일부 실시양태에서, 조합된 조성물에 대한 추가의 계면활성제는 조합된 조성물 중의 MnB rLP2086 폴리펩티드의 용해도 및 안정성을 유지시키는데 필요하지 않다. 따라서, 한 실시양태에서, 키트는 0.02 mg 초과의 폴리소르베이트-80을 포함하지 않는다.
알루미늄
조성물은 알루미늄을 인산알루미늄으로서 포함한다. AlPO4는 안정화제로서 첨가되어 증진된 제조성 및 안정성을 제공한다. 인산알루미늄의 제조 방법은 미국 특허 공개 US 2009/0016946에 기재되어 있고, 이는 그 전문이 참조로 포함된다. 한 실시양태에서, 조성물은 알루미늄 외에 다가 양이온을 추가로 포함하지 않는다. 한 실시양태에서, 조성물은 Al(OH)3 또는 Al(SO4)3을 추가로 포함하지 않는다.
한 실시양태에서, 조성물은 적어도 50 μg, 60 μg, 70 μg, 80 μg, 90 μg, 100 μg, 110 μg, 120 μg, 130 μg, 140 μg, 150 μg, 160 μg, 170 μg, 180 μg, 190 μg, 200 μg, 210 μg, 220 μg, 230 μg, 240 μg, 또는 250 μg의 알루미늄을 포함한다. 한 실시양태에서, 조성물은 최대 500 μg, 490 μg, 480 μg, 470 μg, 460 μg, 450 μg, 440 μg, 430 μg, 420 μg, 410 μg, 400 μg, 390 μg, 380 μg, 370 μg, 360 μg, 350 μg, 340 μg, 330 μg, 320 μg, 310 μg, 300 μg, 290 μg, 280 μg, 270 μg, 260 μg, 또는 250 μg의 알루미늄을 포함한다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다. 가장 바람직한 실시양태에서, 조성물은 250 μg의 알루미늄을 포함한다.
한 실시양태에서, 조성물은 적어도 0.005 mg/ml, 0.01 mg/ml, 0.02 mg/ml, 0.03 mg/ml, 0.04 mg/ml, 0.05 mg/ml, 0.06 mg/ml, 0.07 mg/ml, 0.08 mg/ml, 0.09 mg/ml, 0.10 mg/ml, 0.2 mg/ml, 0.3 mg/ml, 0.4 mg/ml, 또는 0.5 mg/ml의 인산알루미늄을 포함한다. 한 실시양태에서, 조성물은 최대 2.0 mg/ml, 1.9 mg/ml, 1.8 mg/ml, 1.7 mg/ml, 1.6 mg/ml, 1.5 mg/ml, 1.4 mg/ml, 1.3 mg/ml, 1.2 mg/ml, 1.1 mg/ml, 1.0 mg/ml, 0.9 mg/ml, 0.8 mg/ml, 또는 0.7 mg/ml의 PS-80을 포함한다. 바람직한 실시양태에서, 조성물은 약 0.07 mg/ml PS-80을 포함한다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다. 바람직한 실시양태에서, 조성물은 0.5 mg/ml의 인산알루미늄을 포함한다. 가장 바람직한 실시양태에서, 조성물은 인산알루미늄 (AlPO4)으로서 0.5 mg 알루미늄/ml를 포함한다. 이 농도는 서브패밀리 A 및 B 단백질의 알루미늄에 대한 결합 (적어도 90% 결합 이상)을 유지시킨다.
일부 실시양태에서, 제1 조성물 및 제2 조성물의 조합물은 제1 조성물 중의 알루미늄에 결합된 MnB rLP2086 폴리펩티드의 백분율과 비교하였을 때 알루미늄에 결합된 MnB rLP2086 폴리펩티드의 백분율을 변화시킨다. 일부 실시양태에서, 제1 및 제2 조성물의 조합물은 알루미늄에 대한 총 MnB rLP2086 폴리펩티드의 적어도 90%의 결합을 유지시킨다. 따라서, 한 실시양태에서, 조합된 조성물 중의 알루미늄에 대한 총 MnB rLP2086 폴리펩티드의 백분율은 적어도 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100%이다. 바람직하게는, 조합된 조성물 중의 알루미늄에 대한 총 MnB rLP2086 폴리펩티드의 백분율은 적어도 90%, 보다 바람직하게는 적어도 95%, 및 가장 바람직하게는 적어도 100%이다.
또 다른 실시양태에서, 면역원성 조성물 중의 알루미늄에 결합된 폴리펩티드의 농도는 동결건조된 조성물의 재구성 전 액체 조성물 중의 알루미늄에 결합된 폴리펩티드의 농도와 비교하여 24시간 후에 감소되지 않는다. 또 다른 실시양태에서, 면역원성 조성물 중의 MenAAH-TT 접합체의 농도는 동결건조된 조성물 중의 MenAAH-TT 접합체의 농도와 비교하여 24시간 후에 감소되지 않는다. 한 실시양태에서, 농도는 재구성 전의 액체 조성물 중의 각각의 농도와 비교하여 24시간 후 최대 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 또는 20%만큼 감소된다.
또 다른 실시양태에서, 면역원성 조성물 중의 MenCAH-TT 접합체의 농도는 동결건조된 조성물 중의 MenCAH-TT 접합체의 농도와 비교하여 24시간 후에 감소되지 않는다. 또 다른 실시양태에서, 면역원성 조성물 중의 MenW-TT 접합체의 농도는 동결건조된 조성물 중의 MenW-TT 접합체의 농도와 비교하여 24시간 후에 감소되지 않는다. 또 다른 실시양태에서, 면역원성 조성물 중의 MenY-TT 접합체의 농도는 동결건조된 조성물 중의 MenY-TT 접합체의 농도와 비교하여 24시간 후에 감소되지 않는다. 한 실시양태에서, 농도는 재구성 전 동결건조된 조성물 중의 각각의 농도와 비교하여 24시간 후 최대 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 또는 20%만큼 감소된다.
부형제
한 실시양태에서, 조성물은 히스티딘을 포함한다. 한 실시양태에서, 조성물은 적어도 650 μg, 660 μg, 670 μg, 680 μg, 690 μg, 700 μg, 710 μg, 720 μg, 730 μg, 740 μg, 750 μg, 760 μg, 770 μg, 780 μg, 790 μg, 800 μg, 810 μg, 820 μg, 830 μg, 840 μg, 또는 850 μg의 히스티딘을 포함한다. 한 실시양태에서, 조성물은 최대 1560 μg, 1500 μg, 1400 μg, 1300 μg, 1200 μg, 1100 μg, 1000 μg, 950 μg, 900 μg, 890 μg, 880 μg, 870 μg, 860 μg, 850 μg, 840 μg, 830 μg, 820 μg, 810 μg, 800 μg, 790 μg, 또는 780 μg의 히스티딘을 포함한다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다. 바람직하게는, 조성물은 780 μg의 히스티딘을 포함한다.
한 실시양태에서, 조성물은 트리스, 포스페이트 또는 숙시네이트 완충제를 포함한다. 바람직한 실시양태에서, 조성물은 트리스 완충제를 포함하지 않는다. 바람직한 경우에, 조성물은 포스페이트 완충제를 포함하지 않는다. 하나의 바람직한 실시양태에서, 조성물은 숙시네이트 완충제를 포함하지 않는다. 또 다른 바람직한 실시양태에서, 조성물은 히스티딘 완충제를 포함한다.
한 실시양태에서, 조성물은 염화나트륨을 포함한다. MenABCWY 조성물 중의 염화나트륨 농도는 160.5-161.1 mM 사이에서 달라질 수 있다.
한 실시양태에서, 조성물의 pH는 5.5 내지 7.5이다. 바람직한 실시양태에서, 조성물의 pH는 5.8 내지 7.0, 가장 바람직하게는 pH 5.8 내지 pH 6.0이다. 한 실시양태에서, 조성물의 pH는 최대 6.1이다. 한 실시양태에서, 조성물의 pH는 5.8이다.
키트
본 개시내용의 추가 측면은 포유동물에서 네이세리아 메닌기티디스에 대한 살박테리아 항체를 도출하기 위한 조성물의 용량을 투여하기 위한 키트이다.
한 측면에서, 키트는 상기 기재된 바와 같은 제1 폴리펩티드 및 상기 기재된 바와 같은 제2 폴리펩티드를 포함하는 제1 조성물을 포함한다. 바람직한 실시양태에서, 제1 폴리펩티드는 서열식별번호: 1에 제시된 아미노산 서열을 포함한다. 또 다른 바람직한 실시양태에서, 제2 폴리펩티드는 서열식별번호: 2에 제시된 아미노산 서열을 포함한다. 키트는 추가로 MenAAH-TT 접합체, MenCAH-TT 접합체, MenW-TT 접합체, 및 MenY-TT 접합체를 포함하는 제2 조성물을 포함한다. 한 실시양태에서, 키트는 적어도 2개의 용기를 포함하며, 여기서 제1 용기는 제1 조성물을 포함하고, 제2 용기는 제2 조성물을 포함한다.
한 실시양태에서, 키트는 액체 제1 조성물 및 동결건조된 제2 조성물을 포함한다. 바람직하게는, 키트는 액체 MnB 2가 rLP2086 조성물 및 동결건조된 MenACWY-TT 조성물을 포함한다.
일부 실시양태에서, 조성물은 제1 조성물 및 제2 조성물의 조합물을 포함하며, 이는 제1 조성물 중의 MnB rLP2086 폴리펩티드에 대한 폴리소르베이트-80의 몰비를 변화시킨다. 일부 실시양태에서, 조합된 조성물에 대한 추가의 계면활성제는 조합된 조성물 중의 MnB rLP2086 폴리펩티드의 용해도 및 안정성을 유지시키는데 필요하지 않다. 따라서, 한 실시양태에서, 키트는 0.02 mg 초과의 폴리소르베이트-80을 포함하지 않는다.
본 개시내용의 한 실시양태에서, 키트는 하기 상업적 면역원성 조성물: 메낙트라(R), 멘베오(R), 아다셀(R), 하브릭스(R), 가르다실(R), 레페박스, 또는 그의 임의의 조합 중 어느 하나를 추가로 포함하지 않는다. 예를 들어, 키트는 바람직하게는 담체 단백질이 디프테리아 톡소이드인 수막구균 A, C, Y 및 W-135 폴리사카라이드 접합체 (MCV4) 조성물을 추가로 포함하지 않는다. 한 실시양태에서, 키트는 담체 단백질이 CRM197인 수막구균 A, C, Y 및 W-135 폴리사카라이드 접합체 (MCV4) 조성물을 추가로 포함하지 않는다. 한 실시양태에서, 키트는 염화나트륨 및 물로 이루어진 희석제를 포함하는 니멘릭스 백신을 추가로 포함하지 않는다.
살박테리아 활성
MnB의 질환 발생률은 대략 1/100,000이고, 이는 효능의 통계적으로 유의한 평가를 지지하기 위해서는 극히 많은 수의 대상체 (400,000 내지 6백만명 초과)가 요구될 것임을 의미한다. 따라서, 보호 및 백신 효능의 대용물인 인간 보체를 사용한 혈청 살박테리아 검정 (hSBA)이 임상 시험에서 면역원성을 평가하는데 사용된다.
화이자(Pfizer)는 2000년부터 2006년까지 IMD-유발 분리주를 포함한 광범위한 MnB 균주 수집물 (N=적어도 1263)을 구축하였다. MnB 분리주는 미국 질병 관리 예방센터 (CDC) 및 유럽 국가로부터의 건강 및 표준 실험실로부터 체계적으로 수집되었다.
한 실시양태에서, 인간에게 조성물을 투여함으로써 유도되는 면역 반응은 4종의 엔. 메닌기티디스 혈청군 B (MnB) 균주에 대한 인간 보체를 사용한 혈청 살박테리아 검정 (hSBA)을 사용하여 결정된다. hSBA에 사용되는 MnB 균주는 균주 풀로부터 선택되었다. 균주 풀은 체계적으로 수집된 임상적으로 관련된 엔. 메닌기티디스 균주의 수집물을 나타낸다.
모든 시험 균주, 특히 제1 폴리펩티드 및 제2 폴리펩티드 둘 다에 대해 이종인 서열을 갖는 지단백질 2086 변이체를 발현하는 균주에 대한 hSBA 반응의 높은 비율은, 조성물이 추가의 혈청군, 예컨대 혈청군 X를 포함한 적어도 혈청군 B로부터의 rLP2086 (FHBP)을 발현하는 엔. 메닌기티디스 균주에 대한 높은 혈청보호를 부여하는데 충분한 광범위한 보호 백신이라는 것을 시사한다.
서브패밀리 A 균주
한 실시양태에서, hSBA 균주는 LP2086 (fHBP) 서브패밀리 A 단백질을 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 A05를 발현하는 엔. 메닌기티디스 균주에 대해 이종인 지단백질 2086 변이체를 발현하는 LP2086 (fHBP) 서브패밀리 A 균주이다. 예를 들어, 한 실시양태에서, hSBA 균주는 균주 M98250771에 대해 이종인 지단백질 2086 변이체를 발현하는 LP2086 (fHBP) 서브패밀리 A 균주이다.
한 실시양태에서, hSBA 균주는 fHBP A10을 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 (fHBP) A22를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 (fHBP) A56을 발현하는 엔. 메닌기티디스 균주이다. 추가 실시양태에서, hSBA 균주는 LP2086 (fHBP) A22 및 LP2086 (fHBP) A56 균주이다. 또 다른 실시양태에서, hSBA 균주는 LP2086 A04를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 A05를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 A12를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 A22를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 A12를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 A04를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 A19를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 A07을 발현하는 엔. 메닌기티디스 균주이다. 추가 실시양태에서, hSBA 균주는 A22-, A12-, A19-, A05-, 및 A07-발현 균주 중 어느 하나를 포함한다. 한 실시양태에서, hSBA 균주는 A06-, A15-, 및 A29-발현 균주 중 어느 하나를 포함한다.
한 실시양태에서, 면역 반응은 A05를 발현하는 엔. 메닌기티디스 균주에 대해 이종인 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 A 균주에 대해 살박테리아성이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B A22 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B A56 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B A06 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B A15 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B A29 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B A62 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 M98250771에 대해 이종인 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해 살박테리아성이다.
한 실시양태에서, 면역 반응은 제1 폴리펩티드에 대해 적어도 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해 살박테리아성이다. 또 다른 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 M98250771에 의해 발현된 인자 H 결합 단백질에 대해 적어도 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해 살박테리아성이다. 바람직한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 M98250771에 의해 발현된 인자 H 결합 단백질에 대해 적어도 80%, 보다 바람직하게는 적어도 84% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해 살박테리아성이다.
또 다른 실시양태에서, 면역 반응은 제1 폴리펩티드에 대해 최대 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해 살박테리아성이다. 또 다른 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 M98250771에 의해 발현된 인자 H 결합 단백질에 대해 최대 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해 살박테리아성이다. 바람직한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 M98250771에 의해 발현된 인자 H 결합 단백질에 대해 최대 85%, 보다 바람직하게는 최대 99% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해 살박테리아성이다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다.
한 실시양태에서, 조성물에 의해 도출된 면역 반응은 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 A 균주 뿐만 아니라 혈청군이 혈청군 B가 아닌 fHBP 서브패밀리 A 폴리펩티드를 발현하는 엔. 메닌기티디스 균주에 대해서도 살박테리아성이다. 예를 들어, 하나의 바람직한 실시양태에서, 조성물에 의해 도출된 면역 반응은 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주 및 fHBP A05에 대해 이종인 fHBP 서브패밀리 A 폴리펩티드를 발현하는 엔. 메닌기티디스 혈청군 C 균주에 대해 살박테리아성이다. 예를 들어, 한 실시양태에서, 면역 반응은 fHBP A10을 발현하는 엔. 메닌기티디스 혈청군 C 균주에 대한 것이다. 또 다른 실시양태에서, 면역 반응은 fHBP A19를 발현하는 엔. 메닌기티디스 혈청군 W 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 M98250771에 대해 이종인, fHBP 서브패밀리 A 폴리펩티드를 발현하는 엔. 메닌기티디스 균주에 대해 살박테리아성이다.
서브패밀리 B 균주
한 실시양태에서, hSBA 균주는 LP2086 (fHBP) 서브패밀리 B 균주이다. 한 실시양태에서, hSBA 균주는 B01을 발현하는 엔. 메닌기티디스 균주에 대해 이종인 지단백질 2086 변이체를 발현하는 LP2086 (fHBP) 서브패밀리 B 균주이다. 예를 들어, 한 실시양태에서, hSBA 균주는 균주 CDC1127에 대해 이종인 지단백질 2086 변이체를 발현하는 LP2086 (fHBP) 서브패밀리 B 균주이다. 바람직한 실시양태에서, hSBA 균주는 균주 CDC1573에 대해 이종인 지단백질 2086 변이체를 발현하는 LP2086 (fHBP) 서브패밀리 B 균주이다.
한 실시양태에서, 면역 반응은 B01을 발현하는 엔. 메닌기티디스 균주에 대해 이종인 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 B 균주에 대해 살박테리아성이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B24 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B44 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B16 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B03 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B09 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B15 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B153 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 CDC1573에 대해 이종인 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다.
한 실시양태에서, 면역 반응은 제2 폴리펩티드에 대해 적어도 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 또 다른 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 CDC1573에 의해 발현된 인자 H 결합 단백질에 대해 적어도 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 바람직한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 CDC1573에 의해 발현된 인자 H 결합 단백질에 대해 적어도 80% 동일성, 보다 바람직하게는 적어도 87% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 또 다른 바람직한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 CDC1573에 의해 발현된 인자 H 결합 단백질에 대해 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다.
또 다른 실시양태에서, 면역 반응은 제2 폴리펩티드에 대해 최대 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 또 다른 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 CDC1573에 의해 발현된 인자 H 결합 단백질에 대해 최대 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 바람직한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 CDC1573에 의해 발현된 인자 H 결합 단백질에 대해 최대 88% 동일성, 보다 바람직하게는 적어도 99% 동일성을 갖는 아미노산 서열을 포함하는 인자 H 결합 단백질을 발현하는 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다.
한 실시양태에서, hSBA 균주는 LP2086 (fHBP) B24 균주이다. 또 다른 실시양태에서, hSBA 균주는 LP2086 (fHBP) B44 균주이다. 추가 실시양태에서, hSBA 균주는 LP2086 (fHBP) B24 및 LP2086 (fHBP) B44 균주를 포함한다. 한 실시양태에서, hSBA 균주는 LP2086 (fHBP) A22, LP2086 (fHBP) A56, LP2086 (fHBP) B24, 및 LP2086 (fHBP) B44 균주를 포함한다. 한 실시양태에서, hSBA 균주는 B15를 포함한다. 한 실시양태에서, hSBA 균주는 B153을 포함한다. 또 다른 실시양태에서, hSBA 균주는 LP2086 B16 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 B03 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 B09 균주이다. 추가 실시양태에서, hSBA 균주는 B24, B16, B44, B03, 및 B09, 또는 그의 임의의 조합을 포함한다. 또 다른 실시양태에서, hSBA 균주는 B24, B16, B44, A22, B03, B09, A12, A19, A05, 및 A07, 또는 그의 임의의 조합을 포함한다. 또 다른 실시양태에서, hSBA 균주는 A06, A07, A12, A15, A19, A29, B03, B09, B15, 및 B16, 또는 그의 임의의 조합을 포함한다.
한 실시양태에서, 방법은 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 A 균주에 대한 면역 반응 및 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 B 균주에 대한 면역 반응을 유도한다. 바람직하게는, 면역 반응은 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 A 균주에 대해, 및 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 B 균주에 대해 살박테리아성이다.
한 실시양태에서, 조성물에 의해 도출된 면역 반응은 엔. 메닌기티디스 혈청군 B fHPB 서브패밀리 B 균주 뿐만 아니라 혈청군이 혈청군 B가 아닌 fHBP 서브패밀리 B 폴리펩티드를 발현하는 엔. 메닌기티디스 균주에 대해서도 살박테리아성이다. 예를 들어, 하나의 바람직한 실시양태에서, 조성물에 의해 도출된 면역 반응은 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주 및 fHBP B01에 대해 이종인 fHBP 서브패밀리 B 폴리펩티드를 발현하는 엔. 메닌기티디스 혈청군 Y 균주에 대해 살박테리아성이다. 예를 들어, 한 실시양태에서, 면역 반응은 fHBP B16을 발현하는 엔. 메닌기티디스 혈청군 A 균주에 대한 것이다. 또 다른 실시양태에서, 면역 반응은 fHBP B47을 발현하는 엔. 메닌기티디스 혈청군 Y 균주에 대한 것이다. 또 다른 실시양태에서, 면역 반응은 fHBP B49를 발현하는 엔. 메닌기티디스 혈청군 X 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B 균주 CDC1573에 대해 이종인, fHBP 서브패밀리 B 폴리펩티드를 발현하는 엔. 메닌기티디스 균주에 대해 살박테리아성이다.
한 측면에서, 본 발명은 네이세리아 메닌기티디스 혈청군 B 인자 H 결합 단백질 (fHBP)의 제1 지질화된 폴리펩티드 변이체 및 네이세리아 메닌기티디스 혈청군 B fHBP의 제2 지질화된 폴리펩티드 변이체를 포함하는 조성물의 용도에 관한 것이다. 한 실시양태에서, 조성물은 B A02, A28, A42, A63, A76, B05, B07, B08, B13, B52 및 B107로 이루어진 군으로부터 선택된 폴리펩티드를 발현하는 적어도 1종의 엔. 메닌기티디스 혈청군 B 균주에 대한 살박테리아 면역 반응을 유도한다. 예를 들어, 한 측면에서, 본 발명은 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드 및 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드를 포함하는 조성물의 용도에 관한 것이다.
한 실시양태에서, hSBA 균주는 fHBP B05를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 (fHBP) B07을 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 (fHBP) B08을 발현하는 엔. 메닌기티디스 균주이다. 또 다른 실시양태에서, hSBA 균주는 LP2086 B13을 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 B52를 발현하는 엔. 메닌기티디스 균주이다. 한 실시양태에서, hSBA 균주는 LP2086 B107을 발현하는 엔. 메닌기티디스 균주이다. 추가 실시양태에서, hSBA 균주는 B05, B07, B08, B13, B52 및 B107로 이루어진 군으로부터 선택된 어느 하나의 균주를 포함한다. 추가 실시양태에서, hSBA 균주는 B05, B07, B08, B13, B52, B107, B01, B24, B44, B16, B03, B09, B15, 및 B153으로 이루어진 군으로부터 선택된 어느 하나의 균주를 포함한다.
한 실시양태에서, 면역 반응은 B01을 발현하는 엔. 메닌기티디스 균주에 대해 이종인 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B05 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B07 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B08 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B13 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B52 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B107 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B24 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B44 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B16 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B03 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B09 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B15 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 혈청군 B B153 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 엔. 메닌기티디스 균주 CDC1573에 대해 이종인 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다.
한 실시양태에서, 면역 반응은 A02, A28, A42, A63, 및 A76으로 이루어진 군으로부터 선택된 엔. 메닌기티디스 혈청군 B 균주에 대한 것이다. 한 실시양태에서, 면역 반응은 B05, B07, B08, B13, B52, B107, B01, B24, B44, B16, B03, B09, B15, 및 B153, 및 그의 임의의 조합으로 이루어진 군으로부터 선택된 엔. 메닌기티디스 혈청군 B 균주에 대한 것이다.
한 실시양태에서, hSBA 균주는 B05, B07, B08, B13, B52 및 B107, 및 그의 임의의 조합을 포함한다. 추가 실시양태에서, hSBA 균주는 B05, B07, B08, B13, B52 및 B107, B24, B16, B44, B03, 및 B09, 및 그의 임의의 조합을 포함한다. 한 실시양태에서, hSBA 균주는 A02, A28, A42, A63, A76, B05, B07, B08, B13, B52 및 B107, 및 그의 임의의 조합을 포함한다. 또 다른 실시양태에서, hSBA 균주는 추가로 A06, A07, A12, A15, A19, A29, B03, B09, B15, 및 B16, 또는 그의 임의의 조합을 포함한다. 또 다른 실시양태에서, hSBA 균주는 A02, A28, A42, A63, A76, B05, B07, B08, B13, B52 및 B107, A06, A07, A12, A15, A19, A29, B03, B09, B15, 및 B16, 및 그의 임의의 조합을 포함한다.
한 실시양태에서, 방법은 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대한 면역 반응 및 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대한 면역 반응을 유도한다. 바람직하게는, 면역 반응은 엔. 메닌기티디스 혈청군 B 서브패밀리 A 균주에 대해, 및 엔. 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대해 살박테리아성이다. 한 실시양태에서, 방법은 A02, A28, A42, A63, A76, B05, B07, B08, B13, B52 및 B107, 및 그의 임의의 조합으로 이루어진 군으로부터 선택된 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 유도한다. 한 실시양태에서, 방법은 A02, A28, A42, A63, A76, B05, B07, B08, B13, B52 및 B107, A06, A07, A12, A15, A19, A29, B03, B09, B15, 및 B16, 및 그의 임의의 조합으로 이루어진 군으로부터 선택된 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 유도한다.
역가
한 실시양태에서, 조성물은 hSBA에서 동일한 조건 하에 측정 시, 조성물의 용량의 투여 전의 인간에서의 살박테리아 역가와 비교하여, 인간에서 살박테리아 역가의 증가를 유도한다. 한 실시양태에서, 살박테리아 역가의 증가는 hSBA에서 동일한 조건 하에 측정 시, 조성물의 제1 용량의 투여 전의 인간에서의 살박테리아 역가와 비교하여, 조성물의 제1 용량의 투여 후의 인간에서의 살박테리아 역가와 비교된다. 한 실시양태에서, 역가의 증가는 hSBA에서 동일한 조건 하에 측정 시, 조성물의 제2 용량의 투여 전의 인간에서의 살박테리아 역가와 비교하여, 조성물의 제2 용량 후에 관찰된다. 또 다른 실시양태에서, 살박테리아 역가의 증가는 hSBA에서 동일한 조건 하에 측정 시, 조성물의 제3 용량의 투여 전의 인간에서의 살박테리아 역가와 비교하여, 조성물의 제3 용량 후에 관찰된다.
한 실시양태에서, 조성물은 용량의 투여 후 인간에서 살박테리아 역가를 유도하며, 여기서 살박테리아 역가는 hSBA에서 동일한 조건 하에 측정 시, 용량의 투여 전의 인간에서의 살박테리아 역가보다 적어도 1-배를 초과하여 더 높다. 예를 들어, 살박테리아 역가는 hSBA에서 동일한 조건 하에 측정 시, 용량의 투여 전의 인간에서의 살박테리아 역가와 비교하여, 조성물의 용량을 제공한 후 인간에서 적어도 1.01-배, 1.1-배, 1.5-배, 2-배, 3-배, 4-배, 5-배, 6-배, 7-배, 8-배, 9-배, 10-배, 11-배, 12-배, 13-배, 14-배, 15-배, 또는 16-배 더 높을 수 있다.
한 실시양태에서, "반응자"는 조성물이 용량의 투여 후 인간에서 살박테리아 역가를 유도하는 인간을 지칭하고, 여기서 살박테리아 역가는 용량의 투여 전의 인간에서의 살박테리아 역가보다 적어도 1-배를 초과하여 더 높다. 바람직한 실시양태에서, 반응자는 용량의 투여 전의 인간에서의 살박테리아 역가와 비교하여 hSBA 역가에서 적어도 ≥ 4-배 상승을 달성한다. 이러한 반응자는 보호 역가를 갖는 것으로 언급될 수 있다. 일부 실시양태에서, 보호 역가는 1:4를 초과하는 역가이다.
한 실시양태에서, hSBA 역가는 측정가능한 효과를 생성하는 혈청 샘플의 최고 희석의 역수이다. 예를 들어, 한 실시양태에서, hSBA 역가는 T30 CFU 값 (즉 시험 혈청을 제외한 모든 검정 성분을 함유하는 검정 웰에서 인큐베이션한 후 생존한 박테리아의 수; 100% 박테리아 생존)과 비교하여 MnB 박테리아의 적어도 50% 감소 (50% 박테리아 생존)를 발생시키는 시험 혈청의 최고 2-배 희석의 역수이다.
한 실시양태에서, 조성물은 hSBA에서 동일한 조건 하에 측정 시, 제1 용량의 제공 전의 인간에서의 살박테리아 역가보다 적어도 2-배 더 높은 (예를 들어, 제1 용량의 부재 하의 인간에서의 살박테리아 역가보다 더 높은) 제1 용량의 제공 후의 인간에서의 살박테리아 역가를 유도한다. 한 실시양태에서, 조성물은 인간 보체를 사용한 인간 혈청 살박테리아 검정 (hSBA)에서 동일한 조건 하에 측정 시, 제1 용량의 제공 전의 인간에서의 살박테리아 역가보다 적어도 4-배 더 높은 인간에서의 살박테리아 역가를 유도한다. 한 실시양태에서, 조성물은 인간 보체를 사용한 인간 혈청 살박테리아 검정 (hSBA)에서 동일한 조건 하에 측정 시, 제1 용량의 제공 전의 인간에서의 살박테리아 역가보다 적어도 8-배 더 높은 인간에서의 살박테리아 역가를 유도한다.
바람직한 실시양태에서, 인간 혈청 보체는 주어진 hSBA 시험 균주에 대해 낮은 내인성 살박테리아 활성을 갖는 인간으로부터 유래된다. 낮은 내인성 살박테리아 활성은, 예를 들어, 주어진 hSBA 시험 균주에 대해 적어도 1:4 희석 미만의 살박테리아 역가를 지칭한다. 한 실시양태에서, 인간 보체는 주어진 hSBA 시험 균주에 대해 적어도 1:4 희석 미만, 예컨대 1:2 희석의 hSBA 역가를 갖는 인간으로부터 유래되고, 여기서 조성물은 인간에게 투여되지 않는다.
인간은 조성물, 예컨대 2가 rLP2086 조성물의 투여 전에 1:4 미만의 hSBA 역가를 나타낼 수 있거나, 또는 인간은 조성물의 투여 전에 ≥ 1:4의 hSBA 역가를 나타낼 수 있다. 따라서, 바람직한 실시양태 및 실시예에서, 인간에게의 조성물의 적어도 1회 용량의 투여는 투여 전의 인간에서의 역가보다 적어도 4-배 더 큰 hSBA 역가를 발생시킨다. 일부 실시양태에서, 인간에게의 조성물의 적어도 1회 용량의 투여는 적어도 1:4를 초과하는 hSBA 역가, 예컨대 예를 들어, ≥ 1:8의 hSBA 역가, ≥ 1:16의 hSBA 역가, 및 ≥ 1:32의 hSBA 역가를 발생시킨다. 본원에 기재된 각각의 실시예는 ≥ 1:8 및/또는 ≥ 1:16의 hSBA 역가를 갖는 인간 대상체의 비율의 평가를 포함하고, 여기서는 2가 rLP2086 조성물이 인간에게 투여되었다. 일부 실시양태에서, 조성물의 투여 전과 비교하여 조성물의 투여 후의 인간에서의 역가의 4-배 상승은 보호가 조성물과 연관된다는 것을 나타낸다. 일부 실시양태에서, 1:4를 초과하는 hSBA 역가의 이러한 바람직한 평가는 보호, 즉 인간에서 유도된 살박테리아 면역 반응이 조성물과 연관된다는 것을 나타낸다.
한 실시양태에서, 인간은 조성물의 제1 용량의 투여 후 hSBA의 정량 하한치 (LLOQ) 이상의 hSBA 역가를 갖는다. 또 다른 실시양태에서, 인간은 조성물의 제2 용량의 투여 후 hSBA의 LLOQ 이상의 hSBA 역가를 갖는다. 또 다른 실시양태에서, 인간은 조성물의 제3 용량의 투여 후 hSBA의 LLOQ 이상의 hSBA 역가를 갖는다.
방법 및 투여
한 측면에서, 본 개시내용은 인간에서 엔. 메닌기티디스에 대한 면역 반응을 유도하는 방법에 관한 것이다. 또 다른 측면에서, 본 개시내용은 인간에게 백신접종하는 방법에 관한 것이다.
일부 실시양태에서, 방법은 인간에게 조성물을 투여하는 것을 포함하며, 여기서 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 각각에 대한 면역 반응을 유도하고, 여기서 면역 반응은 혈청 살박테리아 항체의 역가를 포함하고, 여기서 역가는 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신에 의해 유도된 것보다 더 높다. 일부 실시양태에서, 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신은 멘베오이다.
일부 실시양태에서, 방법은 인간에게 조성물을 투여하는 것을 포함하며, 여기서 조성물은 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고, 여기서 면역 반응은 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 혈청 살박테리아 항체의 역가를 포함한다. 일부 실시양태에서, 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신 백신은 트루멘바이다.
일부 실시양태에서, 방법은 인간에게 조성물을 투여하는 것을 포함하며, 여기서 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 각각 및 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고, 여기서 면역 반응은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대한 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 각각에 대한 혈청 살박테리아 항체의 역가를 포함하고, 여기서 면역 반응은 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 엔. 메닌기티디스 혈청군 B에 대한 혈청 살박테리아 항체의 역가를 포함한다. 일부 실시양태에서, 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신은 멘베오이다. 일부 실시양태에서, 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신 백신은 트루멘바이다.
본 개시내용은 임의의 연령의 인간에서 면역 반응을 도출하는 방법에 관한 것이다. 일부 실시양태에서, 인간은 적어도 4주, 5주, 6주, 7주, 8주, 9주, 10주, 11주 또는 12주령이다. 예를 들어, 바람직한 실시양태에서, 인간은 적어도 6주령이다. 관련 기술분야에 공지된 바와 같이, 수막구균 군 A, C, W-135, 및 Y 접합체 백신, 예컨대 니멘릭스®는 6주령만큼 어린 영아에 적합하고, 6주령 이상의 임의의 인간에게 투여될 수 있다. 일부 실시양태에서, 인간은 적어도 6개월, 7개월, 8개월, 9개월, 10개월, 11개월, 또는 12개월령이다. 예를 들어, 바람직한 실시양태에서, 인간은 적어도 12개월령이다. 한 실시양태에서, 인간은 12개월 내지 18개월령이다. 또 다른 측면에서, 본 개시내용은 적어도 18개월령의 환자에서 면역 반응을 도출하는 방법에 관한 것이다. 한 실시양태에서, 인간은 18개월 내지 24개월령이다. 또 다른 측면에서, 본 개시내용은 적어도 24개월령의 환자에서 면역 반응을 도출하는 방법에 관한 것이다. 한 실시양태에서, 인간은 24개월 내지 10세이다. 또 다른 측면에서, 본 개시내용은 10세 이상의 환자에서 면역 반응을 도출하는 방법에 관한 것이다.
일부 실시양태에서, 인간은 10세 내지 25세이다. 일부 실시양태에서, 인간은 10세 내지 26세이다. 일부 실시양태에서, 인간은 12개월 내지 <18개월령이다. 일부 실시양태에서, 인간은 18개월 내지 <24개월령이다. 일부 실시양태에서, 인간은 18개월 내지 <24개월령이다. 일부 실시양태에서, 인간은 ≥24개월 내지 <10세이다.
일부 실시양태에서, 인간은 적어도 16세이다. 이러한 실시양태에서, 방법은 인간에게 1회 용량, 바람직하게는 적어도 16세의 인간에게 최대 1회 용량을 투여하는 것을 포함한다. 일부 실시양태에서, 인간은 최대 17세이다.
일부 실시양태에서, 인간은 10세 내지 12세이다. 이러한 실시양태에서, 방법은 인간에게 적어도 1회의 용량을 투여하는 것을 포함한다. 바람직한 실시양태에서, 제2 용량은 제1 용량의 약 6개월 후에 인간에게 투여된다. 바람직한 실시양태에서, 방법은 10세 내지 12세의 인간에게 조성물의 제1 용량 및 제2 용량을 투여하는 것을 포함하고, 조성물의 제3 용량은 제1 용량의 적어도 4년 후에 인간에게 투여된다.
일부 실시양태에서, 방법은 인간에게 적어도 2회 용량을 투여하는 것을 포함한다. 바람직한 실시양태에서, 2회 용량은 적어도 약 6개월 간격이다. 바람직한 실시양태에서, 방법은 10세 내지 12세의 인간에게 조성물의 제1 용량 및 제2 용량을 투여하는 것을 포함하고, 조성물의 제3 용량은 제1 용량의 적어도 4년 후에 인간에게 투여된다.
일부 실시양태에서, 방법은 약 11세의 인간에게 조성물의 제1 용량을 투여하고, 제1 용량의 적어도 4년 후에 인간에게 조성물의 적어도 2회 용량을 투여하는 것을 포함한다. 일부 실시양태에서, 방법은 제1 용량의 약 5년 후에 조성물의 제2 및 후속 용량을 투여하는 것을 포함한다.
일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 A에 대해 혈청음성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 C에 대해 혈청음성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 W에 대해 혈청음성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 Y에 대해 혈청음성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대해 혈청음성이다.
일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 A에 대해 혈청양성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 C에 대해 혈청양성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 W에 대해 혈청양성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 Y에 대해 혈청양성이다. 일부 실시양태에서, 인간은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대해 혈청양성이다.
한 실시양태에서, 방법은 인간에게 상기 기재된 조성물의 적어도 1회의 용량을 투여하는 것을 포함한다. 바람직한 실시양태에서, 방법은 인간에게 상기 기재된 조성물의 최대 1회의 용량을 투여하는 것을 포함한다. 또 다른 실시양태에서, 방법은 인간에게 상기 기재된 조성물의 적어도 제1 용량 및 제2 용량을 투여하는 것을 포함한다.
한 실시양태에서, 제2 용량은 제1 용량의 적어도 20, 30, 50, 60, 100, 120, 160, 170, 또는 180일 후, 및 제1 용량의 최대 250, 210, 200, 또는 190일 후에 투여된다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다.
또 다른 실시양태에서, 제2 용량은 제1 용량의 약 30일 후에 투여된다. 또 다른 실시양태에서, 제2 용량은 제1 용량의 약 60일 후에, 예컨대 예를 들어 0, 2개월 면역화 스케줄로 투여된다. 또 다른 실시양태에서, 제2 용량은 제1 용량의 약 180일 후에, 예컨대 예를 들어, 0, 6개월 면역화 스케줄로 투여된다. 또 다른 실시양태에서, 제2 용량은 제1 용량의 약 120일 후에, 예컨대 예를 들어, 2, 6개월 면역화 스케줄로 투여된다.
한 실시양태에서, 방법은 인간에게 2회 용량의 조성물 및 최대 2회 용량을 투여하는 것을 포함한다. 한 실시양태에서, 2회 용량은 제1 용량 후 약 6개월의 기간 내에 투여된다. 한 실시양태에서, 방법은 인간에게의 추가의 부스터 투여를 포함하지 않는다. 본원에 사용된 "부스터"는 인간에게의 조성물의 추가 투여를 지칭한다. 인간에게 최대 2회 용량의 조성물을 투여하는 것이 유리할 수 있다. 이러한 이점은, 예를 들어, 인간이 완전한 투여 스케줄을 준수하는 것을 용이하게 하는 것 및 스케줄의 비용-유효성을 용이하게 하는 것을 포함한다.
한 실시양태에서, 제1 용량 및 제2 용량은 인간에게 약 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 또는 200일의 기간에 걸쳐, 및 제1 용량의 최대 400, 390, 380, 370, 365, 350, 340, 330, 320, 310, 300, 290, 280, 270, 260, 250, 240, 230, 220, 210, 또는 200일 후에 투여된다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다. 바람직하게는, 제1 및 제2 용량은 적어도 4주 간격, 예를 들어 ≥ 8주 간격, ≥ 2개월 간격, ≥ 3개월 간격, ≥ 6개월 간격 등으로 투여될 것이다.
한 실시양태에서, 제1 용량 및 제2 용량은 약 30일의 기간에 걸쳐 인간에게 투여된다. 또 다른 실시양태에서, 제1 용량 및 제2 용량은 약 60일의 기간에 걸쳐 인간에게 투여된다. 또 다른 실시양태에서, 제1 용량 및 제2 용량은 약 180일의 기간에 걸쳐 인간에게 투여된다.
편리하게는, 제1 용량은 또 다른 백신과 실질적으로 동일한 시간에 (예를 들어 건강관리 전문가에게의 동일한 의학 상담 또는 방문 동안 또는 수막구균 백신의 제1 용량의 24시간 내에), 예를 들어 B형 간염 바이러스 백신, 디프테리아 백신, 파상풍 백신, 백일해 백신 (세포성 또는 바람직하게는 무세포성), 헤모필루스 인플루엔자에(Haemophilus influenzae) 유형 b 백신, 스트렙토코쿠스 뉴모니아에(Streptococcus pneumoniae) 백신, 및/또는 소아마비 백신 (바람직하게는 불활성화된 폴리오바이러스 백신으로)과 실질적으로 동일한 시간에 투여될 수 있다. 이들 임의로 공투여되는 백신은 각각 1가 백신일 수 있거나 또는 (예를 들어 DTP 백신의 일부로서) 조합 백신의 일부일 수 있다.
편리하게는, 제2 용량은 또 다른 백신과 실질적으로 동일한 시간에 (예를 들어 건강관리 전문가에게의 동일한 의학 상담 또는 방문 동안 또는 수막구균 백신의 제2 용량의 24시간 내에), 예를 들어 B형 간염 바이러스 백신, 디프테리아 백신, 파상풍 백신, 백일해 백신 (세포성 또는 무세포성), 헤모필루스 인플루엔자에 유형 b 백신, 스트렙토코쿠스 뉴모니아에 백신, 소아마비 백신 (바람직하게는 불활성화된 폴리오바이러스 백신으로), 인플루엔자 백신, 수두 백신, 홍역 백신, 볼거리 백신, 및/또는 풍진 백신과 실질적으로 동일한 시간에 투여될 수 있다. 이들 임의로 공투여되는 백신은 각각 1가 백신일 수 있거나 또는 (예를 들어 MMR 백신의 일부로서) 조합 백신의 일부일 수 있다.
편리하게는, 제3 용량은 또 다른 백신과 실질적으로 동일한 시간에 (예를 들어 건강관리 전문가에게의 동일한 의학 상담 또는 방문 동안 또는 수막구균 백신의 제3 용량의 24시간 내에), 예를 들어 B형 간염 바이러스 백신, 디프테리아 백신, 파상풍 백신, 백일해 백신 (세포성 또는 무세포성), 헤모필루스 인플루엔자에 유형 b 백신, 스트렙토코쿠스 뉴모니아에 백신, 소아마비 백신 (바람직하게는 불활성화된 폴리오바이러스 백신으로), 인플루엔자 백신, 수두 백신, 홍역 백신, 볼거리 백신, 및/또는 풍진 백신과 실질적으로 동일한 시간에 투여될 수 있다. 이들 임의로 공투여되는 백신은 각각 1가 백신일 수 있거나 또는 (예를 들어 MMR 백신의 일부로서) 조합 백신의 일부일 수 있다.
한 실시양태에서, 조성물의 3회-용량 스케줄은 2회-용량 스케줄보다 더 큰 백분율의 인간에서 제1 및/또는 제2 폴리펩티드에 대해 이종인 LP2086 (fHBP)을 발현하는 다수의 균주에 대해 살박테리아 역가를 유도한다.
한 실시양태에서, 방법은 인간에게 조성물의 3회 용량을 투여하는 것을 포함한다. 또 다른 실시양태에서, 방법은 인간에게 조성물의 최대 3회 용량을 투여하는 것을 포함한다. 한 실시양태에서, 3회 용량은 제1 용량 후 약 6개월의 기간 내에 투여된다. 한 실시양태에서, 방법은 제3 용량 후 인간에게 부스터 용량을 투여하는 것을 포함한다. 또 다른 실시양태에서, 방법은 제3 용량 후 인간에게 부스터 용량을 투여하는 것을 포함하지 않는다. 또 다른 실시양태에서, 방법은 인간에게 조성물의 제4 또는 부스터 용량을 투여하는 것을 추가로 포함하지 않는다. 추가 실시양태에서, 약 6개월의 기간 내에 최대 3회 용량이 인간에게 투여된다.
예시적 실시양태에서, 제2 용량은 제1 용량의 약 30일 후에 투여되고, 제3 용량은 제2 용량의 약 150일 후, 예컨대 예를 들어, 0, 1, 6개월 면역화 스케줄로 투여된다. 또 다른 예시적인 실시양태에서, 제2 용량은 제1 용량의 약 60일 후에 투여되고, 제3 용량은 제2 용량의 약 120일 후, 예컨대 예를 들어, 0, 2, 6개월 면역화 스케줄로 투여된다.
한 실시양태에서, 제1 용량, 제2 용량, 및 제3 용량은 약 150, 160, 170, 또는 180일, 및 최대 240, 210, 200, 또는 190일의 기간에 걸쳐 인간에게 투여된다. 범위를 규정하기 위해 임의의 최소 값은 본원에 기재된 임의의 최대 값과 조합될 수 있다. 바람직하게는, 제1 용량, 제2 용량, 및 제3 용량은 약 180일 또는 6개월의 기간에 걸쳐 인간에게 투여된다. 예를 들어, 제2 용량은 제1 용량의 약 60일 후 인간에게 투여될 수 있고, 제3 용량은 제2 용량의 약 120일 후 인간에게 투여될 수 있다. 따라서, 예시적인 투여 스케줄은 약 제0개월, 제2개월, 및 제6개월에 인간에게 용량을 투여하는 것을 포함한다.
상기 기재된 바와 같이, 면역원성 조성물의 다중 용량이 인간에게 투여될 수 있고, 각각의 용량 사이의 일수는 달라질 수 있다. 방법의 이점은, 예를 들어, 인간이 투여 스케줄을 준수하는 것에 대한 유연성을 포함한다.
한 실시양태에서, 방법은 동일한 면역원성 조성물의 최대 3회 용량을 인간에게 투여하는 것을 포함한다. 예를 들어, 바람직한 실시양태에서, 방법은 제1 조성물의 제1 용량을 인간에게 투여하는 것, 제2 조성물의 제2 용량을 인간에게 투여하는 것, 및 제3 조성물의 제3 용량을 인간에게 투여하는 것을 포함하지 않으며, 여기서 제1, 제2 및 제3 조성물은 동일하지 않다. 또 다른 실시양태에서, 방법은 동일한 면역원성 조성물의 최대 4회 용량을 인간에게 투여하는 것을 포함한다.
실시예
하기 실시예는 본 개시내용의 실시양태를 예시한다. 본원에서 달리 나타내지 않는 한, 하기 실시예에서 120-μg 2가 rLP2086 용량 수준으로의 MnB 2가 rLP2086 조성물이 언급되며, 이는 하기를 포함하는 조성물의 바람직한 예시적인 실시양태이다: 0.5 mL 용량당 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드 60 μg, 0.5 mL 용량당 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드 60 μg, 제1 폴리펩티드에 대해 2.8 몰비의 폴리소르베이트-80, 제2 폴리펩티드에 대해 2.8 몰비의 폴리소르베이트-80, 0.5 mg Al3+/조성물 ml, 10 mM 히스티딘, 및 150 mM 염화나트륨.
보다 구체적으로, 120-μg 2가 rLP2086 용량 수준으로의 임상시험용 2가 재조합 rLP2086 백신은 (a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드 60 μg; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드 60 μg; (c) 18 μg 폴리소르베이트-80; (d) 250 μg 알루미늄; (e) 780 μg 히스티딘; 및 (f) 4380 μg 염화나트륨을 포함한다. 각각의 용량은 0.5 mL이다.
본원에서 달리 나타내지 않는 한, 하기 실시예에서 MenACWY-TT 조성물이 언급되며, 이는 각각이 담체 단백질로서 파상풍 톡소이드에 커플링된 네이세리아 메닌기티디스 피막 폴리사카라이드 A, C, W-135 및 Y를 포함하는 4가 수막구균 폴리사카라이드 접합된 조성물의 바람직한 예시적인 실시양태이다. 네이세리아 메닌기티디스 혈청군 A 및 C 폴리사카라이드는 아디프산 디히드라지드 (AH) 스페이서와 접합되고, 파상풍 톡소이드에 간접적으로 접합되는 반면에, W-135 및 Y 폴리사카라이드는 파상풍 톡소이드에 직접 접합된다. 조성물은 어떠한 보존제 또는 아주반트도 함유하지 않는다.
보다 구체적으로, 하기 실시예에 기재된 동결건조된 MenACWY-TT 조성물은 용량 (0.5 mL)당 파상풍 톡소이드 담체 단백질에 접합된 네이세리아 메닌기티디스 혈청군 A 폴리사카라이드 5 마이크로그램; 파상풍 톡소이드 담체 단백질에 접합된 네이세리아 메닌기티디스 혈청군 C 폴리사카라이드 5 마이크로그램; 파상풍 톡소이드 담체 단백질에 접합된 네이세리아 메닌기티디스 혈청군 W-135 폴리사카라이드 5 마이크로그램; 파상풍 톡소이드 담체 단백질에 접합된 네이세리아 메닌기티디스 혈청군 Y 폴리사카라이드 5 마이크로그램; 28 mg 수크로스; 97 μg 트로메타몰을 포함한다.
실시예 1: MenABCWY 조성물
동결건조된 MenACWY-TT 약물 제품 (하기 실시예 2에 기재됨) 바이알을 0.67 mL의 MnB 2가 rLP2086 약물 제품 (하기 실시예 3에 기재됨)으로 재구성함으로써 최종 MenABCWY 조성물을 제조하여, 근육내 주사를 위한 0.5 mL 용량의 MenABCWY 백신을 취출하였다. MenABCWY 백신의 제조에 사용된 모든 성분 및 그의 기능을 하기 표 1에 제공한다.
표 1
MenABCWY 백신의 조성
aMenABCWY 백신 중의 염화나트륨 농도는 임상용 및 상업용 니멘릭스 약물 제품 (DP) 로트의 조성에 기초하여 160.5-161.1 mM 사이에서 달라질 수 있다.
MenABCWY는 2 mL 유형 1 유리 바이알 내의 동결건조된 MenACWY-TT의 단일-용량, 재구성을 위한 MnB 2가 rLP2086 현탁액을 함유하는 비-눈금이 매겨진 1 mL 유형 I 유리 표준 사전-충전된 시린지 (PFS), 및 13 mm 바이알 어댑터를 포함하는 조합 제품이다.
동결건조된 MenACWY-TT 약물 제품은 공급된 바이알 어댑터를 동결건조된 바이알에 고정시키고, MnB 2가 rLP2086 PFS를 바이알 어댑터에 부착시킴으로써 재구성될 것이다. 이 과정은 PFS로부터 바이알로의 MnB 현탁액의 무균 전달 및 투여를 위한 바이알로부터 PFS로의 재구성된 백신의 후속 전달을 용이하게 하도록 의도된다. 재구성 후에, 바이알의 내용물은 바이알 어댑터를 통해 동일한 시린지 내로 취출될 것이다. 바이알 어댑터는 시린지로부터 탈착될 것이고, 근육내 (IM) 주사를 위해 PFS에 바늘이 고정될 것이다. MnB 2가 rLP2086 PFS는 최종 백신 (MenABCWY)의 표적 용량 부피 (0.5 mL)가 전달될 수 있도록 보장하기 위해 트루멘바보다 더 높은 충전 부피 (현행 0.57 mL과 대조적으로 ~0.67 mL)를 갖도록 설계될 것이다.
최종 백신 조성물은 10 mM 히스티딘, 1.2 mM 트리스 완충제, 160.5 - 161.1 mM 염화나트륨, 인산알루미늄 (AlPO4)으로서 0.5 mg/mL 알루미늄, 1.35 mg/mL 폴리소르베이트 80 및 56 mg/mL 수크로스 중의 120 μg/mL/서브패밀리로 제제화된 rLP2086 서브패밀리 A 및 B 단백질, 각각 ~ 1:3, ~ 1:3, ~ 1:1.5, ~ 1:1.3의 비로 파상풍 톡소이드에 접합된 10 μg/mL/유형의 농도의 네이세리아 메닌기티디스 혈청군 A, C, W 및 Y의 정제된 피막 폴리사카라이드를 포함한다.
실시예 2: MnB 2가 rLP2086 약물 제품의 설명 및 조성
MnB 2가 rLP2086 약물 제품은 인산알루미늄 (AlPO4)으로서 0.5 mg/mL 알루미늄의 존재 하의 10 mM 히스티딘 완충제, 150 mM 염화나트륨 (NaCl), pH 6.0 중에 120 μg/mL/서브패밀리로 제제화된 rLP2086 서브패밀리 A 및 B 단백질로 구성된 멸균 액체 제제이다. 폴리소르베이트 80 (PS-80)을 약물 물질에 첨가하여 목표 PS-80 대 단백질 몰비를 수득한다. 따라서, PS-80은 약물 제품 제제화 동안 첨가되지 않지만, 최종 약물 제품에 동일한 비로 존재한다. 약물 제품을 1 mL 주사기에 충전한다. 단일 용량의 백신은 보존제 없이 0.5 mL이다.
표 2 MnB 2가 rLP2086 약물 제품의 조성
a 폴리소르베이트 80 (PS-80)은 약물 물질의 일부이다. PS-80은 약물 제품에서 계면활성제로서 기능한다.
b 용량당 0.25 mg 알루미늄과 등가
폴리소르베이트 80 농도의 효과
폴리소르베이트 80 (PS-80)은 비-이온성 계면활성제이다. 이는 온도, 필터, 튜빙, 용기/마개 접촉 및 공정 혼합에 의해 유발될 수 있는 응집 및 흡착을 방지함으로써 제제 내의 MnB rLP2086 서브패밀리 A 및 B 단백질을 안정화시키고 가용화시키는데 사용된다. 시험관내 모노클로날 항체 기반 효력 검정을 사용한 안정성 연구는 최종 제제 중의 PS-80 대 MnB rLP2086 단백질의 보다 높은 몰비에서 서브패밀리 B 단백질의 불안정성을 입증하였다. 다양한 몰비의 PS-80 대 단백질을 사용한 실험은 효력을 유지하기 위한 PS-80 대 MnB rLP2086 단백질의 최적 몰비가 대략 1.4 내지 4.2라는 것을 입증하였다.
실시예 3: MenACWY-TT 조성물의 설명 및 조성
MenACWY-TT 약물 제품은 폴리사카라이드에 대해 각각 ~3, ~3, ~1.5 및 ~1.3의 비로 각각 파상풍 톡소이드 (TT)에 접합된, 네이세리아 메닌기티디스 혈청군 A, C, W 및 Y의 정제된 폴리사카라이드로 구성된다.
MenACWY-TT 약물 제품은 동결건조 및 알루미늄 플립-오프 캡에 적합한 브로모부틸 고무 마개를 갖는 3 mL 유리 바이알에 공급된 동결건조 분말로서 제공된다. MenACWY-TT 약물 제품의 제조에 사용된 모든 성분 및 그의 기능을 표 3에 제공한다.
표 3 MenACWY-TT 약물 제품의 조성
a동결건조된 케이크는 또한 각각의 벌크 정제된 TT 접합체에 존재하는 염으로부터 생성된 염화나트륨을 함유한다. 염화나트륨 농도는 임상용 및 상업용 로트의 조성에 기초하여 10.5-11.1 mM 사이에서 달라진다.
실시예 4: MenABCWY 조성물의 제조
동결건조된 MenACWY-TT 약물 제품 바이알을 0.67 mL의 MnB 2가 rLP2086으로 재구성함으로써 최종 MenABCWY 조성물을 임상에서 제조한다. 생성된 MenABCWY 조성물 (백신 액체 약물 제품)은 근육내 주사를 위해 pH 6.05의 160.5-161.1 mM 염화나트륨, 인산알루미늄 (AlPO4)으로서 0.5 mg/mL 알루미늄, 0.035 mg/mL 폴리소르베이트 80 및 56 mg/mL 수크로스를 함유하는 1.6 mM 트리스 완충제 및 10 mM 히스티딘 중의 120 mcg/mL/서브패밀리의 rLP2086 서브패밀리 A 및 B 단백질, 각각 ~ 3, ~ 3, ~ 1.5, 및 ~ 3의 비로 파상풍 톡소이드에 접합된 10 mcg/mL/유형의 농도의 네이세리아 메닌기티디스 유형 A, C, W 및 Y의 정제된 폴리사카라이드를 함유한다.
2종의 약물 제품, MenACWY-TT 및 MnB 2가 rLP2086을 혼합하여 MenABCWY 백신을 제조한다. 완충 성분 및 부형제를 각각의 성분의 개별 개발에 기초하여 선택하였고, 이는 연장된 보관 수명을 위해 필요한 안정성 프로파일을 제공하는 것으로 제시된다.
투여량 검증 연구를 수행하여 MenACWY-TT 약물 제품 및 MnB 2가 rLP2086 약물 제품이 MenABCWY 백신의 투여를 위해 함께 혼합할 경우 상용성이고, 모든 약물 제품 및 투여 용액이 투여 성분과 상용성이고, 투여 용액이 용량 제조 및 투여 작업을 수행하기에 충분한 시간 동안 투여 성분 중에서 안정하다는 것을 입증하였다. 주위 온도 및 광 조건에서 유지 시간에 걸쳐 MenACWY-TT 약물 제품을 0.67 mL의 MnB 2가 rLP2086 약물 제품으로 재구성하는 것에 의해 제조된 MenABCWY 백신의 안정성을 재구성된 바이알 및 투여 시린지에서 확인하였다.
MenABCWY 백신의 투여 용액을 대표하는 샘플을 안정성 표시 방법, 예컨대 항원 결합 및 순도에 대한 RP-HPLC, 바이오플렉스 활성 검정, ELISA, 및 ICP-MS를 사용하여 미리 규정된 수용 기준 하에 시험하였다. 본 연구의 결과는 실온 및 광 조건에서 24시간 동안의 MenABCWY 백신의 허용되는 안정성을 보여준다.
실시예 5: MenABCWY 백신의 평가
동결건조된 MenACWY-TT 조성물을 MnB 2가 rLP2086 조성물로 재구성할 경우 허용되는 물리적 상용성 및 단기 안정성이 존재하는지 여부를 평가하기 위해 연구를 수행하였다. 동결건조된 MenACWY-TT 조성물 및 액체 MnB 2가 rLP2086 조성물을 조합하고, 실제 생활 조건을 근사화하기 위해 비제어 실온 환경에서 최대 24시간 동안 저장하였다. 동결건조된 MenACWY-TT 조성물은 액체 MnB 2가 rLP2086 조성물에 의해 온화한 수동 혼합 하에 재구성될 수 있고, 조합된 pH 및 오스몰랄농도는 주사가능한 전형적인 범위 내에 있는 것으로 입증되었다. 접합체 및 단백질에 대한 모든 주요 속성은 대조군의 것과, 비제어 실온 환경에서 최대 24시간 동안 유사하였다.
조합된 약물 제품의 pH, 외관, 재구성의 용이성, 및 오스몰랄농도를 검토함으로써 물리적 상용성을 평가하였다. 항원의 안정성은 rLP2086 서브패밀리 A 및 서브패밀리 B 단백질의 농도, 순도 및 시험관내 상대 항원성 (IVRA) 뿐만 아니라 접합된 수막구균 A, C, Y, 및 W-135 폴리사카라이드의 농도를 ELISA에 의해 검토함으로써 평가하였다.
실시예 5 내지 실시예 15는 동결건조된 MenACWY-TT 조성물 및 액체 MnB 2가 rLP2086 조성물의 조합물, 즉 MenABCWY 조성물이 상용성이고 실온에서 적어도 24시간 동안 안정한 것으로 확인되었다는 것을 입증한다.
MenABCWY 조성물 중의 메닝 A, C, Y, 및 W-135 폴리사카라이드 농도를 결정하기 위한 ELISA- 메닝 A, C, Y 및 W-135 ELISA의 개발 & 검출을 위한 pAb의 스크리닝
ELISA 검정에 사용하기 위한 스크리닝을 위해 6종의 항체를 선택하였다. 10마리의 토끼의 4개의 군 각각을 Men A, C, Y 또는 W-135 폴리사카라이드 TT 접합체로 면역화하고, 후속해서 항체 발생 후 토끼에서 방혈시켰다. 각각의 토끼를 담체 단백질 CRM197에 접합된 Men A, C, Y 또는 W-135 폴리사카라이드를 사용하여 결합 및 특이성에 대해 개별적으로 스크리닝하였다. 배경 흡광도를 3-배 넘게 초과하는 흡광도 판독과 등가인 양성 결합 신호에 대해 토끼 혈청을 스크리닝하였다. 추가적으로, 블랭크에 대한 흡광도 판독을 초과하는 2차 또는 검출인 항원이 없는 혈청 조합물에 대한 임의의 흡광도 판독인 낮은 비-특이적 결합, 뿐만 아니라 배경 흡광도를 초과하는 이종 혈청형에 대한 임의의 흡광도 판독인 낮은 교차-반응성에 대해 토끼 혈청을 스크리닝하였다. 스크리닝 기준을 충족시키는 토끼를 풀링하였다. CRM 접합체를 사용하여 표준 곡선 범위를 확립하였고, 재구성된 동결건조된 MenACWY-TT 조성물을 사용하여 확인하였다. CRM 접합체를 사용하여 표준 곡선 범위를 확립하였고, 재구성된 동결건조된 MenACWY-TT 조성물을 사용하여 확인하였다.
조합된 약물 제품 (MenABCWY 조성물) 중의 A, C, Y 및 W 접합체의 정량화의 실행가능성을 확립하였다. MnB 2가 rLP2086 조성물 단독은 검정에서 검출되지 않았음이 결정되었다. 추가적으로, MenABCWY 조성물 샘플 중의 인산알루미늄이 가용화되었을 때, 접합체의 완전한 회복이 수득되었다. 따라서, MnB 2가 rLP2086 조성물은 ELISA에 의한 MenACWY-TT 접합체의 정량화를 방해하지 않는 것으로 결정되었다.
실시예 6: MenACWY-TT 조성물의 존재 하에 MnB 2가 rLP2086 조성물을 검토하기 위한 방법의 적합성 평가
IEX-HPLC를 MenACWY-TT 조성물의 존재 하에서 MnB 2가 rLP2086 조성물 서브패밀리 A 및 B 단백질의 농도를 결정하는 것에 대한 그의 적합성에 대해 평가하였다. MenACWY-TT 조성물의 존재 하에서 및 MenACWY-TT 조성물의 부재 하에서, MnB 2가 rLP2086 조성물에 대한 총 단백질 및 결합된 단백질 결과를 검토하였다.
표 4
실시예 7: MenACWY-TT 조성물의 존재 하에서의 MnB 2가 rLP2086 조성물 순도 및 피크 비의 평가
RP-HPLC를 MenACWY-TT 조성물의 존재 하에서 MnB 2가 rLP2086 조성물의 순도를 결정하는 것에 대한 그의 적합성에 대해 평가하였다. MenACWY-TT 조성물의 존재 하에서의 및 MenACWY-TT 조성물의 부재 하에서의 MnB 2가 rLP2086 조성물의 순도 결과를 비교하였다. 오버레이된 크로마토그램은 미국 특허 10,183,070의 도 2에 제시되어 있다. 불순물 피크의 적분의 예는 미국 특허 10,183,070의 도 2에 삽입물로서 제시되어 있다. 평가 결과는 MenACWY-TT 조성물의 존재가 RP-HPLC 방법을 사용한 MnB 2가 rLP2086 조성물 순도의 평가를 방해하지 않음을 제시한다.
실시예 8: MenACWY-TT 조성물의 존재 하에서의 MnB 2가 rLP2086 조성물 IVRA의 평가
IVRA 방법을 MenACWY-TT 조성물의 존재 하에서 MnB 2가 rLP2086 조성물 서브패밀리 A (서열식별번호: 1) 및 서브패밀리 B (서열식별번호: 2) 단백질의 시험관내 상대 항원성을 결정하는 것에 대한 그의 적합성에 대해 평가하였다.
MenACWY-TT 조성물의 존재 및 부재 하에서의 MnB 2가 rLP2086 조성물 서브패밀리 A 및 서브패밀리 B 단백질에 대한 IVRA 결과를 비교하였다. 실현가능성 평가 결과는 결과가 검정 가변성 내에서 대등하고, MenACWY-TT 조성물의 존재가 시험관내 상대 항원성의 결정을 방해하지 않는다는 것을 보여준다.
실시예 9: MenACWY-TT 조성물 바이알의 MnB 2가 rLP2086 조성물에 의한 재구성
MnB 2가 rLP2086 조성물 약물 제품으로 재구성된 MenACWY-TT 조성물 바이알을 사용하여 MenACWY-TT 조성물 및 MnB 2가 rLP2086 조성물 약물 제품을 수행하였다. 방법에 따라, 염수 또는 MenACWY-TT 조성물 매트릭스 위약으로 재구성된 MenACWY-TT 조성물 바이알을 대조군으로서 사용하였다.
표 5
MenACWY-TT 조성물에 대한 염수 재구성 부피의 결정
니멘릭스® 상업용 제품 패키지는 동결건조된 MenACWY-TT 조성물을 함유하는 바이알 및 재구성에 사용되는 0.9% 염수를 함유하는 주사기 둘 다를 함유한다. MnB 2가 rLP2086 조성물에 의한 재구성 시 상업용 백신 중 최종 니멘릭스® 농도를 재현하기 위해, 시판 제품으로부터의 시린지를 사용하여 분배되는 염수의 양을 결정해야 했다. 이어서, 이러한 동일한 부피의 MnB 2가 rLP2086 조성물을 모든 재구성 연구에 사용할 것이다.
MnB 2가 rLP2086 조성물에 의한 MenACWY-TT 조성물 바이알의 재구성
MnB 2가 rLP2086 조성물을 10 mL 유리 바이알에 풀링하였다. 대략 800 μL의 용액을 1 mL 주사기 내로 취출하였다. 시린지의 조정된 내용물을 MenACWY-TT 조성물을 함유하는 바이알 내로 주입하였다. 바이알을 와류시켜 내용물을 용해시켰다.
MenABCWY 조성물에 대한 pH 및 외관을 이중 샘플에 대해 결정하였다. 염수로 재구성된 MenACWY-TT 조성물 및 MnB 2가 rLP2086 조성물로 재구성된 MenACWY-TT 조성물에 대해 오스몰랄농도를 삼중으로 측정하였다.
실시예 10: DP 매트릭스에서 메닝 A, C, Y, 및 W-135 폴리사카라이드 안정성을 평가하기 위한 SEC-MALLS.
조합된 약물 제품 (MenABCWY 조성물) 중 접합된 수막구균 A, C, Y, 및 W-135 폴리사카라이드의 임의의 불안정성이 예상될 수 있는지 평가하기 위한 대용물로서 메닝 A, C, Y 및 W-135 폴리사카라이드를 사용하였다.
메닝 A, C, Y 및 W-135 폴리사카라이드의 처리
시약 제조 ("완전 MenABCWY 조성물 완충제 매트릭스")
2.24 g의 수크로스 및 7.8 mg의 트리스 (트로메타민)를 MnB rLP2086 단백질 (각각 히스티딘 20mM pH 6.0, NaCl 300mM, PS 80 0.07mg/ml, AlPO4 1mg/ml (8mM), rLP2086 서브패밀리 A (서열식별번호: 1) 및 서브패밀리 B (서열식별번호: 2) 단백질 240 μg/mL)이 존재하는 20 ml의 2X MnB 2가 rLP2086 조성물 완충제 매트릭스에 첨가하였다.
샘플 제조
각각의 메닝 폴리사카라이드를 완전 MenABCWY 조성물 완충제 매트릭스로 1:1 희석하고, 5℃, 25℃ 및 37℃에서 0, 6 및 24시간 동안 인큐베이션하였다. 인큐베이션 후, 샘플 현탁액을 14,000 r.p.m.에서 1분 동안 회전시켰다. 상청액을 SEC-MALLS에 의해 분석하였다.
실시예 11: MenABCWY 조성물의 안정성 - 조합된 MnB 2가 rLP2086 및 MenACWY-TT 조성물의 pH, 외관 및 오스몰랄농도의 평가
조합된 MnB 2가 rLP2086 조성물 및 MenACWY-TT 조성물, 즉 MenABCWY 조성물의 pH 및 외관을 재구성 직후 및 24시간 후에 다시 평가하였다.
모든 결과는 예상된 바와 같았다 (표 6).
표 6
MnB 2가 rLP2086 조성물로 재구성된 MenACWY-TT 조성물의 평균 오스몰랄농도는 염수로 재구성된 MenACWY-TT 조성물의 평균 오스몰랄농도의 3% 이내였다.
표 7
실시예 12: 조합된 약물 제품 중의 메닝 A, C, Y 및 W-135 폴리사카라이드 접합체 농도
MenABCWY 조성물 중의 메닝 A, C, Y 및 W-135-TT 접합체의 농도를 초기에 및 24시간 후에 다시 평가하였다. 4종의 접합체의 농도는 24시간의 기간에 걸쳐 안정하였다 (표 8).
표 8
실시예 13: MenABCWY 조성물 중의 MnB 2가 rLP2086 단백질의 안정성의 평가
조합된 약물 제품 중의 총 및 결합된 rLP2086 서브패밀리 A (서열식별번호: 1) 및 서브패밀리 B (서열식별번호: 2) 단백질 농도
MenABCWY 조성물 샘플을 IEX-HPLC에 의해 분석하여 단백질 농도를 결정하였다. 표 9에 제시된 바와 같이, 총 단백질, (알루미늄에) 결합된 단백질, 및 MnB 2가 rLP2086 서브패밀리 A (서열식별번호: 1) 및 서브패밀리 B (서열식별번호: 2) 단백질 둘 다의 결합 % (알루미늄에 결합됨)는 24시간 내에 변화하지 않았고, 이는 rLP2086 서브패밀리 A 및 서브패밀리 B 단백질이 24시간의 기간에 걸쳐 안정하였음을 나타낸다.
표 9
실시예 14: 조합된 MenABCWY 조성물 중의 rLP2086 단백질 순도 및 피크 비
MenABCWY 조성물 샘플을 RP-HPLC에 의해 분석하여 rLP2086 단백질에 대한 순도 및 피크 비를 결정하였다. 미국 특허 10,183,070의 도 3을 참조한다. 11.9분의 피크는 순도 계산에서 제외된다.
조합된 약물 제품 중의 rLP2086 서브패밀리 A 및 서브패밀리 B 단백질 IVRA
MenABCWY 조성물 샘플의 IVRA를 혼합 후 최대 24시간 동안 평가하였다. MenABCWY 조성물 중의 rLP2086 서브패밀리 A (서열식별번호: 1) 및 서브패밀리 B (서열식별번호: 2) 단백질의 상대 항원성은 24시간의 기간에 걸쳐 안정한 것으로 결정되었다.
실시예 15: SEC-MALS에 의한 완전 MenABCWY 조성물 완충제 매트릭스 중의 메닝 A, C, Y 및 W-135 폴리사카라이드 안정성
다양한 온도에서의 6 및 24시간 인큐베이션 후 SEC-MALLS에 의한 완전 MenABCWY 조성물 완충제 매트릭스 중의 메닝 A PS의 안정성
메닝 A, C, W 및 Y 폴리사카라이드를 완전 MenABCWY 조성물 완충제 매트릭스와 혼합하고, 5℃, 25℃ 및 37℃에서 최대 24시간 동안 인큐베이션한 후 SEC-MALS에 의해 안정성을 평가하였다. 모든 4종의 폴리사카라이드는 5℃ 및 25℃에서 최대 24시간 동안 안정한 것으로 보인다. 메닝 A 및 Y에 대해서는 37℃에서 일부 분해가 관찰되었다. 분해 정도는 초기를 제외한 모든 시험된 조건 하에 높은 Mw 응집체의 형성으로 인해 메닝 Y 폴리사카라이드에 대해 결정될 수 없었다.
표 10
실시예 16: CBA/J 마우스에서의 Mn 5가 및 트루멘바® 백신의 네이세리아 메닌기티디스 혈청군 B 면역원성의 평가
CBA/J 마우스에서 2가 Mn B fHBP 백신, 트루멘바, 또는 4가 ACWY 폴리사카라이드 접합체 백신과 함께 제제화된 2가 Mn B fHBP 백신 (Mn 5가 ABCWY)을 사용한 백신접종 후의 네이세리아 메닌기티디스 혈청군 B fHBP에 대한 면역 반응을 평가하였다. CBA/J 마우스의 군을 3종의 상이한 백신: 5가 (ABCYW), 트루멘바® (MnB) 및 니멘릭스® (ACYW)로 면역화시켰다 (표 11).
표 11
각각의 부문에 대해, 각각의 백신의 2-배 희석 용량 수준을 사용하여 CBA/J 마우스 (25마리/군)를 목의 뒷덜미에서 피하로 면역화하였다 (표 11). 마우스를 시간 0에 백신으로 프라이밍하고, 제2주에 부스팅하였다. 인간 보체를 사용한 2종의 상이한 혈청 살박테리아 검정 (hSBA)을 사용하여 시험하기 위해 제3주에 혈청을 PD2 수집하였다. 하나의 hSBA는 fHBP 서브패밀리 A 발현 균주 (M98250771)를 사용하였고, 다른 하나는 fHBP 서브패밀리 B 발현 균주 (CDC1127)를 사용하였다.
hSBA는 엔 메닌기티디스 혈청군 B 균주에 대한 항체-의존성 보체 매개된 살박테리아 활성을 측정한다. 간략하게, 적절히 희석된 시험 혈청을 96-웰 마이크로타이터 검정 플레이트에서 엔 메닌기티디스 B 균주 (서브패밀리 A 또는 B)의 새로이 제조된 박테리아 배양물 및 인간 보체와 함께 혼합하였다. 검정 플레이트를 오비탈 진탕기 상에 놓고, 가습 인큐베이터 37oC/5% CO2) 내에서 30분 동안 혼합하였다. 후속해서, 각각의 웰로부터의 검정 반응의 분취물을 96-웰 필터 플레이트로 옮겨 생존 박테리아를 열거하였다.
백신접종에 대한 반응률을 hSBA에서 반응한 각각의 투여군 (n=25)의 마우스의 백분율로서 계산하였다. 미리 결정된 희석 수준에서 시험한 경우, T30 대조군 수막구균 박테리아의 ≥ 50%를 사멸시킨 마우스 혈청 샘플을 반응자로 간주하였다. T30 대조군 웰은 박테리아 및 보체를 함유하지만 시험 혈청은 함유하지 않았고, 30분 검정 인큐베이션의 종료 시에 계수하였다.
표 12 및 표 11
표 13은 엔 메닌기티디스 혈청형 B 균주의 서브패밀리 A 및 서브패밀리 B 둘 다에 대한 트루멘바® 또는 Mn 5가에 의해 유도된 대등한 용량-의존성 반응률을 보여준다. 예상된 바와 같이, 니멘릭스™는 Mn B 균주에 대해 기능적 면역 반응을 유도하지 않았다.
표 12
서브패밀리 A hSBA 반응 (% 반응자)
a표 11에서 상응하는 용량 수준 참조
표 13
서브패밀리 B hSBA 반응 (% 반응자)
a표 11에서 상응하는 용량 수준 참조
실시예 16: ≥ 10세 내지 < 26세의 건강한 대상체에서의 2가 rLP2086-함유 5가 백신 (MenABCWY)의 면역원성, 안전성, 및 내약성을 설명하기 위한 연구 (B1971057)
B1971057은 ≥ 10세 내지 < 26세의 건강한 대상체에서의 펜타의 안전성 및 면역원성을 평가하기 위한 2상 개념 증명 (POC) 연구이다. 연구는 2017년 4월에 개시되었고, 대략 530명의 대상체가 펜타를 제공받았다.
수막구균 백신은 백신에 포함된 혈청군을 나타내는 수막구균 균주를 사멸시키는 면역 혈청의 능력을 입증하는 인간 보체를 사용한 혈청 살박테리아 검정 (hSBA)인 면역학적 대용물에 의해 허가된다. MenACWY 반응에 대해, 각각의 혈청군으로부터의 1종의 균주를 hSBA에서 평가하고, 펜타 반응을 허가된 ACWY 백신 멘베오와 비교하였다. MenB 평가를 위해; 트루멘바 허가 연구 동안 또한 사용되었던 4종의 혈청군 B 균주를 시험하였다.
연구 데이터는 ACWY 평가를 위한 1회의 백신접종 후에 펜타가 멘베오에 비해 비-열등하고, B 평가를 위한 2회의 백신접종 후에 펜타가 트루멘바에 비해 비-열등하다는 것을 보여주었다.
임상시험용 펜타 백신
본 연구의 경우, 임상시험용 제품은 2가 rLP2086 (트루멘바), (펜타; 상기 실시예 1 및 실시예 4에 기재됨), MenACWY-CRM (멘베오), 및 위약이다.
연구 설계
B1971057은 대략 1590명의 대상체가 펜타 및 위약 (염수), 또는 트루멘바 (화이자), 및 멘베오 (GSK)를 제공받도록 무작위로 배정된 3상, 무작위, 활성-대조, 관찰자-맹검 다기관 시험이다. 모든 대상체는 등록 전에 임의의 수막구균 군 B 백신에 대해 나이브였다. 무작위화는 사전 백신접종 이력별로 계층화되었다; ~ 50% ACWY-나이브 대상체 및 ~ 50% ACWY-경험함 (무작위화 날짜 ≥4년 전에 1종 이상의 ACWY 군을 함유하는 백신의 1회 선행 용량을 제공받음). 이러한 ACWY 경험군은 미국에서 10대 중 86%가 대략 11세에 ACWY 백신의 용량을 제공받았고, 16세에 부스터 용량을 제공받아야 하기 때문에 포함되었다. 무작위화는 또한 지리적 영역별로 계층화되었다. 미국 조사 지역으로부터의 대략 80% 대상체 및 유럽으로부터의 대략 20% 대상체. 영역 계층화는 충분한 집단 대표성을 보장하였다. 연구는 2 스테이지로 수행하였다. 현재 완료된 스테이지 1은 1차 시리즈의 백신접종 단계를 포함하였다. 스테이지 1의 경우 방문 스케줄이 하기 표 14에 표시된다. 스테이지 2는 면역의 지속성 및 펜타의 1차 시리즈가 완료되고 대략 4년 후에 투여된 부스터 용량을 평가할 것이다.
표 14
B1971057 스테이지 1 연구 설계
면역 반응의 평가를 위해, 수막구균 군 A, B, C, W, 및 Y 균주를 사용하여 hSBA에서 기능성 항체를 분석하였다. hSBA는 표적 수막구균 균주의 보체-의존성 사멸을 발생시키는 인간 혈청 내의 항체를 측정한다. 트루멘바 및 펜타의 B 성분에 대한 면역 반응의 평가를 위해, 4종의 1차 MnB 시험 균주, PMB80 (A22), PMB2001 (A56), PMB2948 (B24), 및 PMB2707 (B44)을 본 연구에서 면역원성 종점의 결정을 위해 hSBA에 사용하였다. 멘베오 및 펜타의 ACWY 성분에 대한 면역 반응의 평가를 위해, 각각의 ACWY 군에 특이적인 시험 균주를 확인하고, 시험 시작 전에 hSBA에서 검증하였다. MenB를 평가하는데 사용된 승인된 검정은 트루멘바를 허가하는데 사용된 것과 동일하였다.
목적
본 연구는 펜타의 안전성, 내약성, 및 면역원성을 설명하고, 펜타, 또는 미국 허가된 수막구균 군 A, C, W-135, 및 Y 접합체 백신인 트루멘바 및 멘베오의 투여 후의 군 A, B, C, W, 및 Y에 대한 면역 반응을 설명하기 위해 설계되었다. 니멘릭스는 ACWY 비교자로서 사용되지 않았고; 이는 미국에서 허가되지 않았다.
펜타의 MenACWY 성분의 면역원성은 1회 용량 후 트루멘바 + 멘베오에 대해 관찰된 hSBA 기하 평균 역가 (GMT)와 비교하였을 때 단일 용량 후 펜타의 hSBA GMT에 기초하였다.
본 발명자들은 이전에 MenACWY 백신의 용량을 제공받지 않은 개체 (ACWY 나이브 개체) 뿐만 아니라 그의 제2 MenACYW 부스터 용량을 제공받을 개체 (ACWY 경험 개체)에 대해 본 평가를 수행하였다. 펜타의 MenACWY 성분에 대한 POC 기준은 ACWY 나이브 개체에 대해 충족될 필요가 있었다.
펜타의 MenB 성분의 면역원성에 대한 기준은 0,6-개월 스케줄에 대해 확립된 3상 LCI 기준을 충족할 것으로 예측되는 0-,6-개월 스케줄로 투여된 펜타의 2회 용량 후 4-배 상승 및 복합 hSBA 반응의 점 추정치를 달성하는 것에 기초하였다.
연구에 대한 2차 종점은 펜타의 B 성분에 대해 2.0-배 마진 및 퍼센트 반응자를 갖는 2개의 GMT의 비의 표준 비열등성 평가를 포함하였다. 퍼센트 반응자 분석은, 반응자를 1차 MenB 균주에 대한 백신접종 2의 1개월 후 hSBA 역가의 ≥4-배 상승 및 복합 반응을 달성한 것으로서 정의한 다음, 펜타와 트루멘바 사이의 차이를 계산함으로써 수행하였다. 성공을 달성하기 위해 10% 이하의 차이가 요구되었다.
펜타에 대한 면역 반응 및 POC 면역원성 결과
연구 B1971057은 펜타와 멘베오 사이의 MenACWY에 대한 살박테리아 반응과 관련하여 하기를 제시한다: ACWY 성분에 대한 유사한 hSBA GMT가 단일 용량 후 멘베오와 비교하여 펜타를 제공받은 대상체에 대해 관찰되었다. 1.5-배 GMT 비 비-열등성 (NI) 마진이 ACWY 나이브 대상체에서 달성되었고 (표 15), 2.0-배 GMT 비 NI 마진이 ACWY 경험 대상체에서 달성되었다 (표 16).
표 15
멘베오와 비교하여 펜타 ACWY hSBA GMT는 ACWY 나이브 대상체에서 단일 용량 후 1.5-배 GMR NI 마진 내였다
펜타 vs 멘베오에 대한 POC GMR 점 추정치는 MenA의 경우 ≥0.612; MenC의 경우 ≥0.67; MenW의 경우 ≥0.635 및 MenY의 경우 ≥0.626. 모두 달성되었다.
모든 혈청군에 대한 GMR LCI가 > 0.67이므로, 1.5-배 GMR 마진에서 ACWY 나이브 대상체에서 멘베오에 대한 펜타 비-열등성이 확립된다.
혈청군 C, W 및 Y에 대해 멘베오에 대해 통계적으로 더 큰 펜타
표 16
멘베오와 비교하여 펜타 ACWY hSBA GMT는 ACWY 경험 대상체에서 단일 용량 후 1.5-배 GMR NI 마진 내였다
모든 혈청군에 대한 GMR LCI가 ACWY 배경을 갖는 대상체에서 > 0.5이므로, 본 연구에서 2.0배 GMR 마진에서 멘베오에 대한 펜타 비-열등성이 확립된다.
트루멘바는 사전명시된 하한 95% 신뢰 구간 (LCI) 역치를 충족시키는 항체 역가에서 4-배 상승 (및 복합 반응)을 달성한 대상체의 비율에 기초하여 허가되었다. 4-배 항체 반응을 평가할 때, 이는 백신에 대해 4-배 반응을 갖는 대상체의 비율에 독립적으로 영향을 미칠 수 있는 집단 내의 배경 역가에 의해 영향을 받을 수 있다. 또한, 사용된 hSBA 검정은 엄격하게 제어되더라도 연구마다 절대 반응 기준에 영향을 미칠 수 있는 생물학적 성분으로 구성된다. 허가 LCI 역치가 상이한 집단에서 달성된 점 추정치에 기초하여, 상이한 보체 공급원을 사용하여 계산되었음을 고려하여, 본 발명자들은 또한 펜타 혈청군 B 반응을 트루멘바 + 멘베오 부문으로부터의 반응과 비교하였다. 결과를 표 17에 제공한다.
표 17
용량 2의 1개월 후 모든 연령 (10세 내지 <26세)의 4-배 상승 및 복합 반응.
B24 데이터 계류 중
4종의 혈청군 B 시험 균주 중 3종에 대해 SBA는 4-배 상승하였고, 복합 반응은 사전명시된 점 추정치를 상당히 초과하였다. 1종의 균주 PMB80(A22)의 경우, 78.1%의 POC 기준 PE와 비교하여 대상체의 75.8%가 역가의 4-배 상승을 달성하였지만 (트루멘바 군의 경우, 점 추정치 (PE)는 73.8이었음); 그러나, 상기 언급된 바와 같이, 95% LCI 기준은 상이한 집단에서 및 시간 경과에 따라 제어하기가 보다 어렵다. 본 POC 연구를 위한 LCI를 생성하는데 사용된 2상 연구에는 A22에 대한 기준선 hSBA 비율이 22.1%인 유럽 집단이 등록되었다. 펜타의 PE가 트루멘바의 PE보다 더 높았기 때문에, 이는 펜타의 MenB 성분의 면역 간섭이 없었음을 시사하였다. 이 점을 확인하기 위해, 2차 종점 분석은 트루멘바 + 멘베오가 2가지 비열등성 분석에서 펜타보다 비열등하였음을 보여주었다. 실제로, 이들은 엄격한 1.5 GMR 비-열등성 마진 (표 18) 및 5% 마진에서의 퍼센트 반응자 분석 (표 19)을 충족하였다.
표 18
용량 2의 1개월 후 트루멘바와 비교한 펜타의 GMT 및 GMT 비.
GMR LCI가 > 0.67이므로, 본 연구에서 A22, A56 및 B44에 대해 1.5-배 GMR 마진에서 트루멘바에 대한 펜타 비-열등성이 확립된다. 간섭 없음
표 19
4-배 반응을 달성한 % 반응자에서의 차이
본 연구에서 A22, A56 및 B44에 대해 5% 마진에서 트루멘바에 대한 펜타 비-열등성이 확립된다
트루멘바와 펜타 사이에 간섭 없음
실시예 17: 네이세리아 메닌기티디스 혈청군 A, B, C, W 및 Y를 표적화하는 5가 백신의 미국에서의 잠재적 공중 보건 영향
목적: 5가 백신을 사용한 백신접종 스케줄 및 순응률의 다양한 가정 하에 미국 집단 중에서 IMD 사례의 추가의 감소에 대한 잠재력을 평가하기 위함.
백신접종 시나리오
4가지 1차 백신접종 시나리오를 분석하고, 현행 권장사항에 의해 회피되는 추정 사례 및 순응도 수준과 비교하였다 (도 1)
1. 16세의 MenACWY/MenB 백신을 펜타로 대체하고, 11세는 MenACWY를 유지시킴
2. 11세 및 16세의 MenACWY/MenB 백신을 펜타로 대체함
3. 16세의 MenACWY/MenB를 펜타로 대체하고, 11세에는 MenACWY 백신접종을 하지 않음
4. 11세의 MenACWY를 2회 용량의 펜타로 대체하고, 16세의 MenACWY/MenB를 1회 용량의 펜타로 대체함
각각의 스케줄로 백신 커버리지를 변화시켜 전체 IMD 감소 수준에 대한 상이한 권장사항의 영향을 추정하였다.
질환 감소 추정치는 미국에서의 청소년 면역화 커버리지의 공개된 2018년 추정치에 기초하였다.
-- 86.6%는 MenACWY의 ≥1회 용량을 제공받음
-- 모든 청소년의 68.1%는 HPV의 ≥1회 용량을 제공받음
-- 50.8%는 MenACWY의 ≥2회 용량을 제공받음
-- 17.2%는 MenB의 ≥1회 용량을 제공받음
-- 16세에 2-용량 시리즈에서 제2 용량의 커버리지는 제1 용량3의 것의 50% 및 11세의 70%인 것으로 가정됨
결과
현행 커버리지 수준 및 총 4회의 주사를 필요로 하는 백신접종 스케줄을 고려하면, MenACWY 및 MenB 백신은 백신접종이 전혀 없는 가설과 비교하여 10년에 걸쳐 178건의 IMD 사례를 회피할 것으로 추정된다.
MenACWY 또는/및 MenB 백신접종을 펜타로 대체하는 것은 적어도 1회의 주사를 제거하며; 16세때 면역화 커버리지가 현행 MenACWY 백신 커버리지와 유사하게 유지된다고 가정하면, 펜타 백신은 유사하거나 더 많은 수의 IMD 사례를 회피할 것으로 추정되었다 (도 3).
11세때 펜타의 2회 용량 및 16세때 펜타의 1회 용량 (시나리오 10-12)은 대등한 커버리지율을 갖는 다른 백신접종 스케줄과 비교하여 대부분의 사례 (최대 282건)를 예방할 수 있었다.
11세때 펜타의 1회 용량 및 16세때 펜타의 2회 용량 (시나리오 4-6)은 최대 251건의 사례를 예방할 수 있었다.
16세때 현행 MenB 커버리지율보다 펜타의 제2 용량의 약간 더 높은 커버리지를 고려하면, 11세때 MenACWY 백신의 1회 용량 및 16세때 펜타의 2회 용량 (시나리오 3) 또는 16세때 펜타의 2회 용량 (시나리오 8, 도 1 참조)에 의해 유사한 수의 IMD 사례가 예방될 수 있었다.
결론
백신접종 전략의 질환 영향은 수득된 커버리지의 수준과 직접적으로 관련된다.
1회 이상의 MenACWY 또는 MenB 백신 용량을 펜타로 대체하는 것은 모든 5종의 수막구균 혈청군에 의해 유발된 IMD를 추가로 감소시킬 수 있고;
청소년에 대한 백신 투여 횟수를 감소시키고;
잠재적으로 ACIP 권장사항에 대한 순응도를 개선시키고, 개별 IMD 사례에 대한 의료 방문 및 공중 보건 대응 비용을 감소시킨다.
네이세리아 메닌기티디스에 의해 유발된 침습성 수막구균 질환 (IMD)은 비통상적이고, 급속하게 진행되고, 잠재적으로 치명적인 감염으로, 영아 및 청소년 연령군에서 가장 높은 발생률이 관찰된다. 혈청군 A, B, C, W 및 Y는 전세계적으로 질환의 94%를 차지하며; 미국에서, 대부분의 질환은 혈청군 B, C, 및 Y에 의해 유발된다. 미국에서의 2018년 감시 데이터에 따르면, IMD의 발생률은 100,000명 집단당 0.10건이었다. 혈청군 B는 미국 청소년 및 청년에서 우세하였고 (16세 내지 23세 중 사례의 62%), 또한 모든 연령군에 걸쳐 우세하였다 (사례의 36%).
미국 면역화 자문 위원회 (ACIP)는 현재, 건강한 청소년을 IMD로부터 보호하는 것을 돕기 위해 2가지 유형의 수막구균 백신을 권장한다. 4가 수막구균 혈청군 A, C, W, 및 Y (MenACWY) 백신은 상용적으로 11세 내지 12세에 1차 용량 및 16세에 부스터 용량으로 권장된다. 수막구균 혈청군 B (MenB) 백신접종은 공유된 임상 의사 결정에 기초하여 16세 내지 23세 (16-18세가 바람직함)의 청소년 및 청년에게 권장된다. 2018년에, 13세 내지 17세의 청소년에 대한 추정된 MenACWY 백신접종 커버리지는 ≥1 용량의 경우 86.6%이고, ≥2 용량의 경우 50.8%였다. 대조적으로, 17세의 17.2%만이 ≥1 용량의 MenB 백신을 제공받았고, 이들 개체 중 50% 미만이 다중용량 백신접종 시리즈를 완료하였다. 이들 데이터는 미국에서 많은 청소년이 수막구균 질환에 대해 완전히 보호되지 않음을 시사한다.
상이한 백신접종 스케줄에 의한 2종의 개별 MenB 및 MenACWY 백신 대신에 모든 5종의 혈청군에 의해 유발되는 수막구균 질환을 보호하는 것을 도울 수 있는 단일 백신 (즉, MenABCWY 5가 백신)은 면역화를 단순화하고, 요구되는 주사의 횟수를 감소시키고, 잠재적으로 백신접종 커버리지를 개선시킬 수 있다. 본 발명자들은 5가 MenABCWY 백신을 사용하여 분류된 수막구균 면역화 프로그램의 공중 보건 영향을 평가하기 위한 모델을 개발하였다.
2.0 방법
2.1 모델 설명
미국에서 10-년의 기간에 걸쳐 회피되는 IMD 사례의 예상되는 수를 추정하기 위해 집단-기반 동적 모델을 개발하였다. 모델 구조는 이전에 다른 곳에서 전체적으로 기재된 것과 유사하다. 집단을 101개의 1-년 연령 밴드로 계층화하고, 각각의 연령 밴드의 개체를 다음 해에 다음 연령 밴드로 이행시켰다. 수막구균 보유는 감염성 질환 전파의 주요 공급원이었고, 모델 계산에서 1차 고려사항이었다. 수막구균 보유 및 전파는 집단을 10개의 상호 배타적 연령군 (0-5개월, 6-12개월, 1세, 2-4세, 5-9세, 10-14세, 15-19세, 20-24세, 25-59세, 및 ≥60세)으로 계층화함으로써 모델링하였다. 각각의 연령군은 수막구균 혈청군 A, B, C, W, 및 Y의 보균자인 개체의 비율에 의해 특징화되었고, IMD가 발생하고 그의 연령군 내에서 또는 다른 연령군으로 박테리아를 전파할 연령-특이적 확률을 가졌다. 매년 10개의 연령군 각각에서의 수막구균 보균자의 비율을 (1) 이전 연도에서의 보유 유병률; (2) 연령군 내 및 연령군 중에서의 박테리아 전파 및 혼합 패턴; (3) 백신접종된 개체의 수 (백신접종 커버리지); 및 (4) 보유 획득에 대한 백신 효능에 기초하여 계산하였다. 모델 내에서 10-년 시간 범위의 매년 동안, 표적화된 연령군의 개체의 비율은 4가지의 상이한 스케줄링 시나리오 하에 MenACWY, MenB, 및/또는 MenABCWY 백신을 제공받는 것으로 추정되었다. 모든 백신접종 시나리오에 대해, 모델은 IMD가 발생한 개체가 합병증의 존재 또는 부재 하에 회복되었거나 사망한 것으로 추정하였다.
2.2 모델 입력
각각의 혈청군에 대한 평균 연령-군-기반 IMD 발생률은 2015-2017년의 질병 관리 예방 센터 (CDC) 증진 수막구균 질환 감시 보고로부터 유래되었다. MenABCWY 백신은 혈청군 A, B, C, W, 및 Y에 대한 직접 보호를 제공하는 것으로 가정되었다.
MenABCWY 백신의 1 또는 2회 용량을 제공받는 청소년에서 혈청군 B에 대한 백신 효능 가정은 MenB-FHbp 백신 (트루멘바®, 2가 rLP2086; 화이자 인크(Pfizer Inc), 펜실베니아주 필라델피아)에 대한 공개된 임상 연구에 기초하였다. 이 연구에서, 백신접종 1개월 후 인간 보체를 사용한 검정에서 혈청 살박테리아 활성 (hSBA) 역가 ≥1:8 (보호의 표준 상관관계는 ≥1:4임)을 갖는 대상체의 백분율은 각각 MenB-FHbp의 1 또는 2회 용량 후에 23.8% 내지 67.6% 및 69.1% 내지 100% 범위였다. 이들 데이터에 기초하여, 각각 MenABCWY 백신의 1 또는 2회 용량을 제공받는 청소년에 대해 혈청군 B에 대한 30% 및 85% 백신 효능의 추정치를 가정하였다.
혈청군 A, C, W, 및 Y에 대한 백신 효능 가정은 MenACWY-TT 백신 (니멘릭스®, 화이자 리미티드(Pfizer Ltd), 영국 샌드위치)의 임상 연구로부터의 공개된 면역원성 및 효능 데이터의 검토에 기초하였으며, 여기서 백신접종 1개월 후 토끼 보체를 사용한 검정에서 혈청 살박테리아 활성 (rSBA) 또는 hSBA 역가 ≥1:8을 갖는 대상체의 백분율은 MenACWY-TT의 1회 용량 후에 81.9% 내지 97.4% 범위였다. 이들 데이터에 기초하여, 혈청군 A, C, W, 및 Y에 대해 95% 백신 효능의 추정치를 가정하였다.
보유 유병률 및 전파의 감소로 인한 비백신접종된 개체의 간접 보호는 혈청군 B의 경우 0% 및 혈청군 A, C, W, 및 Y의 경우 36.2%인 것으로 가정되었고, 둘 다는 MenB 및 MenACWY 백신에 대한 공개된 문헌으로부터 유래되었다.
제시된 혈청군 B에 대한 MenABCWY 백신의 경우의 5-년 보호 지속기간 및 고정된 10% 연간 감쇠율은 (1) 이전에 공개된 건강 경제 모델 및 (2) MenB-FHbp 백신에 의해 도출된 면역 반응의 지속성을 평가한 청소년에서의 3상 연장 연구로부터의 임상 데이터의 고려사항에 기초하여 가정하였다. 임상 연구로부터의 결과는 1차 백신접종 후에 반응률이 최고치였고, 후속 12개월에 걸쳐 감소하였고, 이어서 48개월까지 기준선 초과에서 안정하게 유지되었음을 나타내었다. 1차 백신접종 48개월 후에, 대상체의 18.0% 내지 61.3%는 보호의 폭을 평가하는데 사용된 4종의 다양한 혈청군 B 시험 염색에 걸쳐 정량 하한치 이상의 hSBA 역가 (즉, 균주에 따라 1:16 또는 1:8)를 가졌다.
혈청군 A, C, W 및 Y에 대한 MenABCWY 백신의 보호의 평가의 경우 (표 2), 5-년 직접 보호 지속기간 및 10% 연간 감쇠율은 1차 백신접종 후 10년간 11세 내지 55세의 청소년 및 성인에서 MenACWY-TT에 의해 도출된 면역 반응의 지속성을 평가한 연구로부터의 임상 데이터에 기초한 보수적인 가정이었다. 제10년에 백신접종된 대상체의 70.2% 내지 90.7%는, 백신접종 1개월 후 99.7% 내지 100%와 비교하여, 혈청군 A, C, W 및 Y에 걸쳐 rSBA 역가 ≥1:8을 가졌다. 현재, 허가된 MenACWY 백신에 대한 간접 보호의 지속기간 및 감쇠율에 관한 데이터는 이용가능하지 않고; 따라서 모델은 MenACWY에 대한 감쇠율이 MenABCWY와 동일하다고 가정하였다.
2.3 백신접종 시나리오 및 감수성 분석
백신접종 시나리오는 미국에서의 기존 청소년 수막구균 백신접종 플랫폼 (즉, 11세 및 16세)에 기초하여 구축하였다. 4종의 1차 백신접종 스케줄을 검사하고, 현행 스케줄과 비교하였다: (1) 11세에 1회 용량의 MenACWY 백신 및 16세에 2회 용량의 MenABCWY 백신; (2) 11세에 1회 용량의 MenABCWY 백신 및 16세에 2회 용량의 MenABCWY 백신; (3) 16세에만 2회 용량의 MenABCWY 백신; 및 (4) 11세에 2회 용량의 MenABCWY 백신 및 16세에 1회 용량.
각각의 1차 스케줄에 대한 백신접종 커버리지의 가정은 2018년 국립 면역화 조사-10대 (NIS-Teen)에 보고된 바와 같은 관찰된 청소년 백신접종 커버리지, 백신접종 연령, 및 요구되는 용량의 횟수로부터 취하였다. NIS-Teen 조사에서 관찰된 경향과 일치하게, 11세의 청소년 사이의 백신접종 커버리지는 16세에서보다 더 높은 것으로 가정되었고, 11세에서의 2-용량 시리즈의 순응도 (즉, 권장 투여 시리즈의 완료)는 16세에서의 2-용량 시리즈의 순응도보다 더 높은 것으로 가정되었다.
기본 사례 분석을 위해, 11세의 제1 용량에 대한 백신접종 커버리지는 2018년에 보고된 MenACWY 백신의 1차 용량의 전체 커버리지와 동일한 것으로 가정되었고 (86.6%), 16세의 제1 용량에 대한 백신접종 커버리지는 MenACWY 부스터 용량의 커버리지와 동일한 것으로 가정되었다 (50.8%). 이들 데이터에 기초하여, MenABCWY의 제1 용량을 제공받는 11세 청소년의 80%가 2-용량 시리즈를 완료할 것으로 가정된 반면, 16세에서의 2-용량 시리즈의 순응도는 MenB 백신 시리즈 완료에 대한 이용가능한 정보에 기초하여 50%인 것으로 가정되었다. 2018년에 보고된 16세의 청소년 백신 커버리지의 수준을 사용하여 4가지 수막구균 백신 투여 스케줄 각각에 대해 감수성 분석을 수행하였다. 가정된 최고 커버리지는 11-12세의 인간 유두종바이러스 (HPV) 백신의 ≥1 용량에 대한 것과 동일하였고 (68.1%), 가정된 최저 커버리지는 16세의 MenB 백신의 ≥1 용량에 대한 것과 동일하였다 (17.2%). 1차 투여 스케줄 및 백신접종 커버리지 추정치를 고려한 후, 총 13가지의 상이한 시나리오를 평가하였다.
3.0 결과
현행 백신접종 스케줄 및 2018년에 보고된 백신접종 커버리지 (MenACWY, 11세에서 86.6% 및 16세에서 50.8%; MenB, 16세에서 17.2%)를 고려하면, 11세 내지 16세 사이의 총 4회 주사에 대해 2회 용량의 각각의 MenACWY 및 MenB 백신을 사용한 백신접종은 잠재적으로 수막구균 백신접종이 없는 것과 비교하여 다음 10년에 걸쳐 165건의 IMD 사례를 회피할 수 있었다 (현행 시나리오). 이러한 시나리오 하에, 19건의 혈청군 B 사례 (총 예방가능한 IMD 사례의 11.5%)가 다음 10년에 걸쳐 예방될 것으로 추정된다. MenACWY 및/또는 MenB 백신을 5가 MenABCWY 백신으로 대체하는 것은 백신접종 스케줄에 따라 1 또는 2회의 주사를 제거할 것이고, 잠재적으로 보다 많은 수의 IMD 사례를 회피할 것이다 (시나리오 1, 2, 4, 5, 7, 8, 10, 및 11). 이는 16세의 MenABCWY 백신접종 커버리지가 2018 MenACWY 백신접종 커버리지와 유사하게 유지되거나 (50.8%; 시나리오 1, 4, 7, 및 10), 또는 아마도 11세 내지 12세에서 관찰되는 약간 더 높은 HPV 백신접종 커버리지로 상승할 것으로 가정한다 (68.1%; 시나리오 2, 5, 8, 및 11).
그러나, 16세에서의 MenABCWY 백신접종 커버리지가 16세에서의 현행 2-용량 MenB 백신접종 스케줄과 동일하다고 가정하면 (17.2%), 11세에서의 1회 용량 및 16세에서의 2회 용량의 MenABCWY 요법 (즉, 현행 스케줄과 유사함)은 현행 백신접종 스케줄과 비교하여 더 적은 IMD 사례 (n=137)를 예방할 것이다 (도 2, 시나리오 6). 이들 결과는 현재 16세에서 보고된 것보다 더 낮은 MenACWY 백신접종 커버리지의 가정에 의해 주로 유도된 것으로, 이는 현행 스케줄과 비교하여 더 낮은, 혈청군 A, C, W, 및 Y 사례 회피의 추정되는 수 (n=89; 65.0%)로 이어진다.
3.1 기본 사례 백신접종 커버리지 가정
모든 기본 사례 백신접종 시나리오 (시나리오 1, 4, 7, 및 10)에서, MenABCWY 백신접종 커버리지가 11세 (86.6%) 또는 16세 (50.8%)에서의 MenACWY 백신에 대한 현행 커버리지와 동일하다고 가정하면, MenACWY 및/또는 MenB 백신을 5가 MenABCWY 백신으로 대체하는 것은 현행 스케줄보다 더 많은 수의 IMD 사례를 회피할 것이다 (스케줄에 따라 범위, 189-256건의 IMD 사례를 회피함). 현행 백신접종 스케줄과 비교하여 회피된 더 높은 총 IMD 사례의 수는 주로, 예방된 혈청군 B 사례의 더 큰 수 (범위, 55-111건의 혈청군 B 사례)에 의해 구동된다. 평가된 모든 기본 사례 백신접종 시나리오 중에서, 질환 예방은 11세에 MenABCWY 백신의 2회 용량 및 16세에 1회 용량을 투여하는 것에 의해 최대화될 것이다 (시나리오 10; 256건이 회피됨 [111건 혈청군 B; 146건 혈청군 A, C, W 및 Y]).
3.2 대안적 백신접종 커버리지에 기초한 감수성 분석
16세의 MenABCWY 백신접종 커버리지가 11세 내지 12세의 HPV 백신에 대해 관찰된 수준 (68.1%)으로 상승하면, 수막구균 질환 예방에 대한 가장 큰 영향은 11세에 MenABCWY 백신의 2회 용량 및 16세에 1회 용량에 의해 제공될 것이다 (시나리오 11; 299건의 총 사례가 회피됨). 이 스케줄은 또한 10-년 기간에 걸쳐 총 예방가능한 사례 중 혈청군 B 사례의 최대 수 및 백분율을 예방할 것이다 (140건의 혈청군 B 사례가 회피됨 [46.8%]). 다음의 최상의 요법은 11세에 MenABCWY 백신의 1회 용량 및 16세에 MenABCWY 백신의 2회 용량이었다 (시나리오 5; 263건의 사례가 회피됨; 103건 혈청군 B; 159건 혈청군 A, C, W, 및 Y). 추가적으로, 11세에 현재 권장되는 MenACWY 용량을 포함하거나 또는 포함하지 않고 유사한 수의 사례가 회피될 것이다 (시나리오 2 [234건의 사례가 회피됨; 74건 혈청군 B; 159건 혈청군 A, C, W 및 Y] 및 8 [220건의 사례가 회피됨; 74건 혈청군 B; 146건 혈청군 A, C, W 및 Y]). 대조적으로, MenABCWY 백신접종 커버리지가 16세의 현행 2-용량 MenB 백신접종 스케줄에 대한 것과 동일한 것으로 가정되는 요법 (≥1 용량에 대해 17.2%)은, 주로 회피되는 보다 적은 혈청군 B 사례 (시나리오 3, 6, 9, 및 12)로 인해, 예방되는 추정 IMD 사례를 훨씬 더 적게 만들었다. 이러한 백신접종 커버리지 가정 하에, 예방되는 가장 적은 수의 총 IMD 사례는 16세의 2회 MenABCWY 백신 요법을 통하는 것일 것이다 (시나리오 9, 93건의 총 사례가 회피됨 [19건 혈청군 B; 74건 혈청군 A, C, W, 및 Y]).
4.0 논의
이는 미국 청소년 수막구균 면역화 플랫폼과 관련하여 5종의 가장 보편적인 질환-유발 혈청군 (즉, 혈청군 A, B, C, W, 및 Y)에 의해 유발되는 수막구균 질환을 보호하기 위한 5가 MenABCWY 백신의 영향을 모델링한, 본 발명자들의 지식에 대한 최초 연구이다. 전세계적으로, 이들 5종의 혈청군의 상이한 조합을 표적화하는 다양한 1가, 2가, 또는 4가 수막구균 백신 제제가 수막구균 질환을 보호하는 것을 돕는데 사용된다. 여러 국가에서, 진행되고 있는 감시 노력은 퍼지고 있는 질환-유발 수막구균 혈청군에서의 변화를 검출하였고; 이들 역학적 이동은 IMD에 대한 포괄적 보호를 위한 MenACWY 백신을 포함하는 일부 국가 백신접종 전략에 대한 변화를 촉발하였다. MenABCWY 백신을 활용하는 것은 이들 5종의 혈청군에 의해 유발되는 것으로 전세계적으로 추정되는 IMD 사례 중 94%를 잠재적으로 보호할 것이다.
미국에서, 청소년에 대한 MenACWY 백신접종은 2005년 이래로 권장되었고, MenB 백신접종 권장사항은 2015년에 시행되었다. 단일 5가 MenABCWY 백신은 상이한 연령에서의 2종의 상이한 백신을 사용한 다중 주사에 대한 필요를 제거함으로써 면역화 스케줄을 단순화할 수 있으며, 이는 잠재적으로 백신접종 커버리지를 개선시키고, 대부분의 보편적인 질환-유발 혈청군에 대한 보호를 증진시킨다. 미국에서의 MenACWY 및 MenB 백신에 대한 현행 스케줄 및 백신접종 커버리지에 기초하여, 본 발명자들의 모델은 MenACWY 및 MenB 백신 둘 다를 사용한 백신접종이 백신접종하지 않은 경우와 비교하여 10년에 걸쳐 165건의 IMD 사례를 잠재적으로 회피할 수 있을 것으로 추정한다. MenABCWY 백신접종 커버리지가 2018년부터 CDC NIS-Teen 조사에 의해 주목된 현행 MenACWY 백신접종 커버리지와 유사하다고 가정하면, 본 발명자들의 모델은 1종 이상의 MenACWY 또는 MenB 백신 용량을 MenABCWY 백신으로 대체하는 것이 미국 청소년들 사이에서 256건만큼 많은 IMD 사례가 회피되도록 하면서 동시에 권장 백신 주사 횟수를 감소시킬 것으로 추정한다. 실제로, 본 연구에서 조사된 대부분의 시나리오는 현행 스케줄과 비교하여 회피된 보다 많은 수의 사례의 관점에서 단일 MenABCWY 백신의 추가의 이익을 입증한다.
청소년 면역화 전달은, 부분적으로 면역화가 전형적으로 이루어지는 예방 방문 비율이 16세 이후에 꾸준히 감소하기 때문에 도전과제이며, 소아과의사에서 전형적으로 청소년 면역화에 덜 관여하는 의료 제공자로의 전환과 조합될 경우 이는 이러한 연령-군에서 질환에 대한 준최적 보호의 원인이 될 수 있다. MenABCWY 백신접종에 대한 연령-기반 플랫폼은 청소년이 다중용량 요법을 제공받고 준수할 가능성이 큰 연령에서 백신 투여를 가능하게 함으로써 청소년 면역화를 지지하고 촉매할 것이며, 주사 및 방문 횟수를 감소시킬 것이다. 중요하게는, MenACWY 접합체 백신 및 재조합 단백질 MenB 백신을 사용한 청소년의 면역화는 둘 다 1차 백신접종 후에 보호성 면역 반응을 도출하고, 부스터 용량 후에 강건한 반응을 도출한다. 종합하면, 이들 데이터는 기존의 미국 청소년 MenACWY 및 MenB 면역화 플랫폼을 지지할 뿐만 아니라, 청소년이 11세 내지 16세 사이의 어느때이든 백신접종 시리즈를 시작하고 가장 높은 위험 기간 전반에 걸쳐 보호를 유지할 수 있는 유연한 MenABCWY 백신접종 스케줄에 대한 지지를 제공한다.
연구는 사회경제적 지위, 교육, 및 인종이 또한 백신접종 인식, 접근, 및 이용, 및 연속-완료율에서 소정의 역할을 하는 것으로 제시하였다. 따라서, MenABCWY 백신은 수막구균 백신접종 권장사항을 단순화함으로써 이들 차이를 감소시키는 것을 도울 수 있으며, 그에 의해 백신 접근 문제를 감소시키고, 기존의 MenB 및 MenACWY 백신 권장사항을 둘러싼 혼란을 제거할 수 있다. 또한, 조합 백신은 일반적으로 다양한 연령군들 사이에서 백신접종 커버리지를 개선시키는 것으로 나타났다.
실시예 18: 트루멘바에 대한 인간 면역 반응의 폭: hSBA에서 감수성인 MenB 균주에 의해 발현된 fHBP 변이체의 요약
도입 & 목적: 네이세리아 수막염 혈청군 B (MenB) 질환의 예방을 위한 백신인 트루멘바 (2가 rLP2086)는 2종의 단백질 항원, 수막구균 인자 H 결합 단백질 (fHBP)의 변이체를 포함한다. fHBP는 2개의 서브패밀리, A 및 B로서 존재한다. 각각의 서브패밀리 내에서, 수백개의 고유한 fHBP 변이체가 확인되었다. 이러한 서열 다양성에도 불구하고, 각각의 서브패밀리로부터의 1종의 단백질을 함유하는 백신은 fHBP 변이체의 다양성을 나타내는 MenB 균주에 걸쳐 광범위한 커버리지를 유도하는 것으로 입증되었다. 허가는 인간 보체를 사용하는 혈청 살박테리아 검정 (hSBA)에서 침습성 MenB 균주의 보체-매개된 사멸을 개시하는 항체를 도출하는 백신의 능력에 기초하였다. 수막구균 질환의 풍토병성 성질로 인해, fHBP 변이체 개체가 노출될 수 있는지를 예측하는 것은 가능하지 않다. 이러한 이유로, 본 발명자들은 트루멘바에 의해 부여되는 커버리지를 계속 연구하였고, 여기서 면역 커버리지의 폭을 예시하기 위한 추가의 증거를 제시하였다.
물질 & 방법: MenB 침습성 균주 (n=109)를 선택하여 트루멘바 커버리지의 폭을 확인하였다. 균주는 각각 22 및 16종의 고유한 서브패밀리 A 및 서브패밀리 B fHBP 변이체를 코딩하였다. 박테리아 표면에서의 fHBP의 발현을 유동 세포측정 수막구균 항원 표면 발현 (MEASURE) 검정을 사용하여 결정하였다. 탐색적 hSBA는 청년으로부터의 백신접종 전 및 후의 혈청 (대상체-매칭됨)을 사용하여 수행하였다. 백신접종 전 및 후의 혈청 샘플 사이에서 hSBA 역가의 4-배 상승이 달성된다면, 균주는 트루멘바 면역 혈청에 감수성인 것으로 간주되었다.
결과: 109종의 균주 중에서, 87종 (거의 80%)이 hSBA에서 트루멘바 면역 혈청에 감수성이었다. 이는 이전에 보고된 변이체에 더하여, fHBP 변이체 A02, A28, A42, A63, A76, B05, B07, B08, B13, B52 및 B107을 발현하는 균주를 포함하였다. 사멸될 수 없는 대부분의 균주는 hSBA에서 살박테리아 사멸을 개시하기에 충분한 것으로 간주되는 수준 미만인 fHBP 발현 수준을 가졌다. 도 3, 표 1, 표 2, 및 표 3을 참조한다.
표 20
표 21
hSBA에서 트루멘바 면역 혈청에 의해 사멸된 MenB 균주에 의해 발현된 fHBP 변이체
(A05 (서열식별번호: 1) 및 B01 (서열식별번호: 2)과의 % 아미노산 서열 동일성)
표 22
<1000 MFI로 균주에 의해 발현되고 hSBA에서 트루멘바 면역 혈청에 의해 사멸되지 않은 fHBP 변이체* (백신 항원 A05 (서열식별번호: 1) 및 B01 (서열식별번호: 2)과의 %아미노산 서열 동일성)
결론: hSBA는 수막구균 백신에 대한 효능의 대용물로서 인식된다. 검정 복잡성은 수백개의 고유한 fHBP 서열 변이체 각각을 발현하는 MenB 균주에 대한 트루멘바 면역 혈청의 살박테리아 활성의 입증을 막는다. 트루멘바에 의해 부여되는 면역 커버리지의 폭을 예시하기 위해, 본 발명자들은 추가의 다양한 fHBP 변이체를 발현하는 MenB 균주가 백신 항원에 대해 이종임에도 불구하고 hSBA에서 사멸될 수 있음을 보여준다.
실시예 19: 2가 FHbp 수막구균 B 백신의 광범위한 커버리지를 평가하기 위한 다양한 균주의 선택
네이세리아 메닌기티디스의 전파는 통상적으로 상부 호흡기도의 무증상 콜로니화를 유발하지만, 일부 개체에서, 박테리아혈증 및 침습성 수막구균 질환 (IMD)이 발생한다. IMD는 통상적으로 수막염 및/또는 패혈증으로서 나타나고; 폐렴, 패혈성 관절염, 후두개염, 및 중이염은 보다 덜 빈번하게 관찰된다. 높은 사례의 치명률이 IMD와 연관되고 (10%-15%), 생존자의 대략 20%는 심각한 평생 후유증, 예컨대 사지 절단, 청각 상실, 및 신경계 손상을 갖는다.
전세계적으로 거의 모든 수막구균 질환은 12종의 특징화된 수막구균 혈청군 중에서 6종 (즉, A, B, C, W, X, 및 Y)에 의해 유발된다. 피막 폴리사카라이드에 기초한 효과적인 백신이 혈청군 A, C, W, 및 Y에 대해 개발되었다. 그러나, MenB 폴리사카라이드의 면역원성은 인간 뉴런 세포 상에 존재하는 폴리시알산 구조와의 유사성 때문에 불량하다. 최근 수년 동안, 특히 수막구균 혈청군 B (MenB)는 유럽, 미국, 캐나다, 호주, 및 뉴질랜드에서의 IMD의 큰 비율과 연관되었다. 외막 소포 (OMV)를 기초로 하는 백신이 단일 MenB 발생 균주에 의해 유발된 유행병을 제어하는데 성공적으로 사용되어 왔지만, 생성되는 면역 반응은 주로 고도로 가변적인 포린 A 단백질 (PorA)에 대한 것이다. 따라서, 유효성은 일반적으로 표적 균주로 제한된다. 결과적으로, 광범위하게 효과적인 MenB 백신의 개발을 위해 다양한 MenB 균주에 걸쳐 보호적 살박테리아 항체를 유도할 수 있는 표면-노출 단백질이 추구되었다.
MenB의 거의 모든 균주 상에서 발현되는 보존된 표면-노출 지단백질인 인자 H 결합 단백질 (FHbp; 또한 LP2086 및 GNA1870으로도 공지됨)이 이러한 표적으로서 확인되었다. 아미노산 서열을 기초로, FHbp 변이체는 2가지의 면역학적으로 별개의 서브패밀리 (서브패밀리 A 및 서브패밀리 B로 명명됨)로 분리되고; 각각의 MenB 균주는 단일 서브패밀리 변이체를 발현한다 (도 1a 참조).
MenB-FHbp (트루멘바®, 2가 rLP2086; 화이자 인크, 미국 펜실베니아주 필라델피아)는, 하나는 서브패밀리 A로부터의 것 (변이체 A05)이고 다른 것은 서브패밀리 B로부터의 것 (변이체 B01)인 2종의 재조합 지질화된 FHbp 항원의 동등량으로 구성된 2가의 재조합 단백질 MenB 백신이다. 중요하게는, 이러한 FHbp 변이체의 조합이 다양한 MenB 균주에 대한 보호를 제공할 수 있는 것으로 예측된다. MenB-FHbp는 미국, 캐나다, 유럽, 및 호주를 비롯한 여러 국가 및 지역에서 IMD의 예방을 위해 승인되었다. 또 다른 MenB 백신, MenB-4C (벡스세로(Bexsero)®, 4CMenB; 글락소스미스클라인 백신즈(GlaxoSmithKline Vaccines), 이탈리아 시에나 Srl)는 또한 재조합 FHbp 성분 (서브패밀리 B로부터의 비지질화된 변이체 1.1) 뿐만 아니라 2종의 다른 재조합 단백질 항원 및 OMV를 갖는다. 따라서, MenB-4C는 MenB-FHbp와 상이하며, 이는 넓은 커버리지를 제공하기 위한 단일 항원의 2종의 변이체를 함유한다.
인간 보체를 사용한 혈청 살박테리아 검정 (hSBA)은 수막구균 박테리아의 보체-의존성, 항체-매개 용해를 측정한다. hSBA 역가는 검정 박테리아의 ≥50%를 사멸시키는 최고 혈청 희석으로서 정의되며; hSBA 역가 ≥1:4는 수막구균 질환에 대한 보호의 허용된 상관관계이고, 이 상관관계에 기초한 hSBA 반응률은 수막구균 백신 효능에 대한 대용물로서 사용되었다. SBA 반응률은 혈청군 C 및 A 폴리사카라이드 백신에 대한 자연 보호와 특이적으로 상관관계가 있었다. 혈청군-특이적 폴리사카라이드는 가변적이지 않기 때문에, 각각의 혈청군으로부터의 단일 균주가 광범위한 백신 커버리지를 추론하는데 충분하였다. MenB OMV 백신이 또한 효과적이며, 백신-도출된 hSBA 역가는 유행성을 유발하는 표적 균주에 대한 보호와 상관관계가 있다. 단백질-기반 백신의 균주 커버리지를 정확하게 예측하는 것은, 단백질 서열 다양성 및 발현 수준에서의 가변성이 상이한 수막구균 질환 균주 사이에서 상이하다는 것을 고려하면, 피막 폴리사카라이드를 표적화하는 백신보다 hSBA를 사용하여 더 복잡하다. 예를 들어, (PorA는 OMV 백신 면역화 후에 보호를 부여하는 혈청 살박테리아 항체에 대한 우세한 표적이다. PorA는 그의 작은 세포 표면 노출된 영역이 고도의 서열 다양성을 갖는 세포 표면 포린이다. 미국에서 산발성 MenB 질환-유발 균주의 대략 80%에 대한 보호를 위해 20종의 상이한 PorA 혈청하위유형을 발현하는 균주로 보호 면역이 입증될 필요가 있을 것으로 추정되었다. 역사적으로, OMV 백신은 1종의 PorA를 함유하였고, 백신 항원과 비교하여 아미노산 서열이 이종인 PorA 서열을 갖는 균주에 대한 보호는 입증하지 않았다. 따라서, 백신-도출된 항체가 수막구균 질환 균주에 대해 효과적일 수 있음을 입증하기 위한 대표적인 시험 균주의 선택은 단백질-기반 백신에 대해 가장 중요하다.
전임상 및 초기 임상 연구에서 MenB-FHbp에 의해 도출된 면역 혈청은 백신 FHbp 변이체 A05 및 B01에 대해 이종인 FHbp 서브패밀리 A 및 B 변이체를 함유하는 다양한 MenB 균주를 사멸시킬 수 있는 광범위한 살박테리아 항체를 입증하였다. MenB-FHbp 커버리지의 잠재적 폭의 초기 평가에서, 다양한 FHbp 변이체, 지리적 기원, 및 유전적 배경을 갖는 100종의 MenB 분리주를 MenB-FHbp 면역 토끼 혈청을 사용하여 hSBA에서 시험하였다. 시험된 100종의 균주 중에서, 87종이 이들 hSBA에서 사멸되었다. 사멸되지 않은 13종의 균주의 분석은 주어진 MenB 균주 상에서의 역치 FHbp 표면 발현 수준이 hSBA 반응에 영향을 미쳤음을 시사하였다. 역치 FHbp 표면 발현 수준을 후속적으로 결정하였으며, 그 초과에서 분리주는 hSBA에서 예측가능하게 사멸되었다. 균주 감수성을 결정하는 잠재적 인자에 관한 추가의 조사로, 사멸은 FHbp 서열 변이체, 다중유전자좌 서열 유형, 또는 PorA 하위유형과 거의 무관함을 발견하였다.
임상 시험을 위한 광범위한 항원적 및 역학적 다양성을 갖는 균주를 선택하기 위해, 1200종 초과의 침습성 MenB 질환 분리주를 미국 및 유럽의 실험실 및 보건 기관으로부터 수집하여 수집 시점과 동시기의 MenB 분리주의 유병률을 나타내었고; 모든 균주는 FHbp 유전자를 함유하였다. MenB-FHbp 면역원성 연구에 사용하기 위한 4종의 항원적으로 및 역학적으로 다양한 대표적인 시험 균주를 선택하기 위해 비편향 접근법을 사용하였다. 선택 기준은 백신 항원에 대해 이종인 FHbp 변이체의 발현 및 MenB 질환 분리주에서의 FHbp의 다양성을 적절하게 반영하는 것, 낮은 내지 중간 FHbp 표면 발현 수준, 및 낮은 기준선 hSBA 혈청양성 비율을 포함하였다. 이들 4종의 1차 MenB 시험 균주는 둘 다의 FHbp 서브패밀리로부터의 FHbp 변이체를 발현한다 (균주 [변이체]: PMB2001 [A22], PMB80 [A56], PMB2707 [B24], 및 PMB2948 [B44]; 도 1a 참조).
4종의 1차 MenB 시험 균주를 사용하여 생성된 면역원성 데이터를 보충하고, 4종의 1차 MenB 시험 균주에 대한 면역 반응이 MenB 질환-유발 분리주에 의해 발현된 FHbp 변이체의 다양성에 대한 면역 반응을 예측한다는 것을 입증하기 위해, 10종의 추가의 시험 균주를 사용하는 hSBA를 개발하였다. 미국 및 유럽에서 MenB 질환-유발 균주에서 발견되는 보편적인 FHbp 변이체를 포함하도록 10종의 추가의 시험 균주를 선택하였다. 여기서, 본 발명자들은 (i) 10종의 추가의 시험 균주를 선택하는데 사용된 전략 및 기준을 기재하고, (ii) 4종의 1차 MenB 균주를 사용하여 hSBA에 의해 측정된 면역 반응이 10종의 추가의 시험 균주를 사용하여 수득된 반응을 예측한다는 것을 입증하는 데이터를 제시하며, 이는 MenB-FHbp에 의해 도출된 면역 반응의 광범위한 커버리지를 추가로 입증하고 지지한다.
결과
추가의 MenB 시험 균주에 대한 공급원 및 선택 기준
10종의 추가의 MenB 시험 균주 중 9종을 1263종의 침습성 질환-유발 MenB 균주의 수집물 (MenB 분리주 수집물)로부터 수득하였다. MenB 분리주 수집물의 경우, 미국 균주는 활성 박테리아 집중 감시 지역 (2000-2005)으로부터의 것이었고, 이는 집단의 대략 13%를 포괄하였다. 유럽 분리주 (2001-2006)는 노르웨이, 프랑스, 체코 공화국의 공중 보건 실험실 및 맨체스터의 보건보호청 (영국, 웨일즈, 및 북아일랜드를 커버함)으로부터의 것이며, 체계적으로 수집하였고 (7번째 또는 8번째 분리주마다 국가 표준 실험실에서 받는 주문에 의해 포함됨), 기간 동안 침습성 MenB 분리주의 대략 13%를 나타내었다. FHbp 변이체 A07을 발현하는 균주는 스페인 및 독일로부터의 추가의 551종의 질환-유발 MenB 균주를 포함하는 MenB 분리주 수집물의 확장물로부터 수득하였다 (n=1814). MenB 분리주 수집물에서의 A07-발현 균주는 이들 균주 상에서의 FHbp의 낮은 표면 발현, 높은 기준선 혈청양성, 및 용이하게 이용 가능한 보체 공급원의 부족으로 인해 적합하지 않았기 때문에 확장된 MenB 분리주 수집물이 사용되었다.
추가의 MenB 시험 균주를 선택하는데 사용된 기준은 (i) 미국 및/또는 유럽에서의 MenB 질환-유발 균주 중에서의 FHbp 변이체 유병률, (ii) MenB 1차 시험 균주에 의해 발현된 것과 상이할 필요가 있는 FHbp 변이체, (iii) 균주가 그가 속한 변이체 군을 대표하는 것을 보장하기 위한 각각의 FHbp 변이체 군에 대한 중앙 수준 이하의 시험관내 FHbp 발현 수준, (iv) hSBA에서의 기술적 상용성, 및 (v) 변이체 군에 대한 우세한 클론 복합체로 간주되는 것 (우세한 복합체가 존재하는 경우)이었다. 이들 기준을 충족시키는 균주는 또한 적합한 인간 보체 로트의 충분한 이용가능성을 비롯하여 hSBA에서 기술적으로 상용성일 필요가 있었다 (도 2). 컷오프 수준 미만 (즉, 각각의 FHbp 변이체 군에 대한 중앙 수준 이하)의 발현 수준을 갖는 각각의 FHbp 변이체 군 내의 균주를 무작위로 선택하였고, FHbp 변이체 군 내의 제1 균주는 요구되는 유전적, 표현형적, 및 hSBA 개발 기준을 충족시켜 추가의 MenB 시험 균주가 되었다. 이러한 방법론에 대한 예외가 FHbp 변이체 B03을 발현하는 균주에 대해 이루어졌으며, 이는 2상 연구에서 그의 이전 사용에 기초하여 US FDA에 의해 제공된 지침과 협력하여 이를 사용하여 선택되었다.
추가의 MenB 시험 균주의 특징
10종의 추가의 선택된 MenB 시험 균주는 4종의 1차 시험 균주 (A22, A56, B24, B44)에서의 것과 상이하고 백신 항원과 비교하여 상이한 서열을 갖는 FHbp 변이체 A06, A07, A12, A15, A19, A29, B03, B09, B15, 및 B16을 발현한다 (표 23). 4종의 1차 시험 균주에 의해 발현된 특이적 변이체는 MenB 분리주 수집물에서 질환-유발 분리주의 42.0% (530/1263)에 존재하고, 10종의 추가의 시험 균주에 의해 발현된 특이적 변이체는 MenB 분리주 수집물에서 질환-유발 분리주의 추가의 비-중첩 38.8% (490/1263)에 존재한다 (도 1b).
표 23
4종의 1차 및 10종의 추가의 MenB 시험 균주의 특징
면역원성 분석: 10종의 추가의 균주에 대해 hSBA 역가 ≥LLOQ를 갖는 대상체
청소년 및 청년에서 2가지 중추적 3상 연구에 참여한 대상체에서 2 또는 3회 용량의 MenB-FHbp 후 혈청학적 반응을 평가하기 위해 4종의 1차 균주를 사용하였다. 10종의 추가의 hSBA 균주에 대한 혈청학적 반응을 연구 대상체의 하위군에서 평가하였다. 대다수의 대상체는 1차 (각각 64.0%-99.1% 및 87.1%-99.5%) 및 10종의 추가의 MenB 시험 균주 (각각 51.6%-100.0% 및 71.3%-99.3%) 각각에 대해 용량 2의 1개월 후 및 용량 3의 1개월 후에 hSBA ≥ 정량 하한치 (LLOQ; 즉, hSBA 역가가 균주에 따라 1:8 또는 1:16과 동등함)를 가졌다 (표 24). 1차 및 추가의 MenB 시험 균주에 대해, hSBA 역가 ≥LLOQ를 달성한 대상체의 비율에서 기준선으로부터의 실질적 증가는 제2 MenB-FHbp 용량 후에 MenB-FHbp 수용자 중에서 관찰되었고 (0, 2, 6개월 스케줄), 제3 용량 후 추가 증가가 존재하였다.
표 24
1차 및 추가의 MenB 시험 균주에 대해 hSBA 역가 ≥ LLOQ (1:8 또는 1:16)를 갖는 대상체
FHbp=인자 H 결합 단백질; hSBA=인간 보체를 사용한 혈청 살박테리아 검정; LLOQ=정량 하한치; MenB=네이세리아 메닌기티디스 혈청군 B.
클로퍼-피어슨 방법을 사용하여 대상체의 관찰된 비율을 정확한 양측 95% CI로 요약하였다.
LLOQ = A06, A12, A19, 및 A22의 경우 1:16; LLOQ = A07, A15, A29, A56, B03, B09, B15, B16, B24, 및 B44의 경우 1:8.
a평가가능한 면역원성 집단
1차 및 추가의 균주에 대한 양성 예측치
1차 MenB 시험 균주 및 10종의 추가의 MenB 시험 균주에 대한 백신-유도된 hSBA 반응 사이의 관계를 평가하였다 (표 25). FHbp 서브패밀리 내에서, 양성 예측치 (PPV)는 용량 3의 1개월 후에 대부분의 1차/추가의 균주 쌍에 대해 80% 초과였다. 따라서, 1차 시험 균주를 사용하여 hSBA에서 측정된 면역 반응은 동일한 서브패밀리 내의 추가의 균주에 대한 면역 반응을 고도로 예측하였다. 용량 2의 1개월 후의 PPV는 통상적으로 용량 3의 1개월 후에 관찰된 것보다 약간 더 낮았고, 연구에 걸쳐 서브패밀리 A 및 B 균주 쌍에 대해 각각 61.6% 내지 100% 및 70.0% 내지 100% 범위였다. 요약하면, 모든 PPV는 1차 및 추가의 균주 hSBA 반응을 비교할 때 보호 반응에 대한 높은 예측가능성을 나타내었다.
표 25
MenB-FHbp 백신접종 후 추가의 균주에 대한 면역 반응에 대한 1차 균주에 대한 면역 반응의 양성 예측치
hSBA=인간 보체를 사용한 혈청 살박테리아 검정; LLOQ=정량 하한치; MenB=네이세리아 메닌기티디스 혈청군 B.
LLOQ = 변이체 A07, A15, A29, A56, B03, B09, B15, B16, B24, 및 B44를 발현하는 균주의 경우 1:8; LLOQ = 변이체 A06, A12, A19, 및 A22를 발현하는 균주의 경우 1:16.
a클로퍼-피어슨 방법을 사용한 대상체의 관찰된 비율에 기초한 정확한 양측 CI.
bN = 백신접종 2의 1개월 후 및 백신접종 3의 1개월 후에 1차 균주에 대해 관찰된 hSBA 역가 ≥LLOQ를 갖는, 1차 및 추가의 균주 둘 다에 대해 유효하고 결정적인 검정 결과를 갖는 대상체의 수; n = 백신접종 2의 1개월 후 및 백신접종 3의 1개월 후에 주어진 추가의 균주에 대해 관찰된 hSBA 역가 ≥LLOQ를 갖는 대상체의 수.
논의
보호의 폭을 결정하기 위한 MenB-FHbp 백신의 임상 평가의 중요한 성분은, 서열 및 발현 가변성이 수집 시점과 동시기의 MenB 질환-유발 균주의 다양성을 대표하는 표면 단백질 항원을 갖는 시험 균주를 사용한 hSBA의 개발이었다. 청소년 및 청년에서의 3상 연구에 기재된 바와 같이, 모두 백신 항원에 대해 이종인 FHbp 변이체를 발현하는 4종의 1차 MenB 시험 균주에 대한 hSBA 반응 데이터는 2가 MenB-FHbp 백신이 다양한 질환-유발 수막구균 균주에 걸쳐 광범위한 커버리지를 제공한다는 것을 강하게 시사한다. 본원에 기재된 10종의 추가의 MenB 시험 균주는 MenB-FHbp에 대한 지지적 면역학적 데이터를 제공하고, MenB-FHbp에 대한 면역 반응을 측정하기 위한 4종의 1차 시험 균주의 사용의 타당성을 추가로 확인시켜 준다. 4종의 1차 시험 균주에 대해 수득된 반응이 추가의 10종의 시험 균주에 대해 수득된 반응을 예측하기 때문에, hSBA에서 1차 균주를 평가함으로써 수득된 면역학적 반응은 침습성 MenB 질환을 유발하는 균주의 다양성을 대표한다.
MenB-FHbp에 대한 허가 연구에서의 가설 시험-구동 면역원성 평가를 위해, 비편향 접근법을 사용하여 미국 및 유럽에서 수집된 질환-유발 MenB의 패널로부터 4종의 1차 MenB 시험 균주를 선택하였다. 유사한 방법을 사용하여, 시험 균주가 MenB 분리주의 항원 다양성을 대표하는 것을 보장하기 위한 구체적 선택 기준을 고려하여, 10종의 추가의 MenB hSBA 시험 균주를 선택하였다.
집합적으로, 14종의 MenB 시험 균주는 대다수의 보편적인 수막구균 FHbp를 나타내며, FHbp 변이체는 미국 및 유럽에서 퍼지고 있는 침습성 질환-유발 분리주의 대략 80%에 상응한다.
양성 예측치 분석을 사용하여 동일한 서브패밀리 내의 FHbp를 발현하는 1차 및 추가의 시험 균주 중에서 hSBA에 의해 측정된 면역 반응의 연관성을 결정하였다. 모든 PPV 분석은 추가의 균주에 대해 관찰된 보호 반응에 대한 1차 균주에 대한 보호 반응의 높은 예측가능성을 보여주었다. 이들 PPV 분석은 4종의 1차 MenB 시험 균주에 대해 관찰된 반응이 백신 항원 변이체와 상이한 추가의 서열-다양성 FHbp 변이체를 발현하는 다른 질환-유발 MenB 균주에 대한 반응을 대표한다는 것을 나타낸다.
4종의 1차 및 10종의 추가의 MenB 시험 균주에 대해 hSBA에 의해 측정된 MenB-FHbp-도출된 반응을 개별 백신 수용자로부터의 혈청을 사용하여 평가하였다. 기능적 살박테리아 항체를 갖는 백신접종된 대상체의 비율을 결정함으로써, 개별 수준에서 MenB-FHbp 커버리지의 폭의 평가를 결정하였으며, 이는 풀링된 혈청을 사용하여서는 가능하지 않았다. MenB 질환-유발 IMD의 다양성을 나타내기 위해 4종의 1차 MenB 시험 균주를 선택하였고, 따라서 hSBA를 사용한 MenB-FHbp에 대한 잠재적인 커버리지 폭을 지지하였다. hSBA 역가 ≥1:4를 갖는 개체의 반응은 보호의 허용되는 상관관계이고, 수막구균 백신 효능의 대용물이다. 따라서, 반응은 백신 커버리지의 폭의 포괄적이고 생물학적으로 예측적인 평가를 제공한다. 백신 커버리지의 폭을 설명하기 위한 4종의 1차 MenB 시험 균주에 대한 hSBA 반응의 관련성은 또한 유럽 및 미국으로부터의 다양한 동시기의 MenB 발생 균주 및 비-MenB 질환-유발 균주 (즉, 수막구균 혈청군 C, Y, W 및 X)에 대해 관찰된 MenB-FHbp에 의한 보호적 살박테리아 반응의 입증에 의해 지지된다.
또 다른 방법론, 효소-연결된 면역흡착 검정-기반 수막구균 항원 유형결정 시스템 (MATS)이 MenB-4C의 백신 커버리지를 예측하는데 사용되어 왔다. 그러나, MATS는 MenB-4C에 특이적인 항원의 커버리지만을 예측하고, 상이한 항원 조성을 갖는 다른 백신의 커버리지를 평가하는데 유용하지 않다. 구체적으로, MATS는 살박테리아 활성보다는 항원 발현을 측정하고, 각각의 항원에 대해 참조 균주와 비교한 상대 효력으로서 보고된다. 성분 항원 중 어느 하나에 대한 상대 효력이 MenB-4C 면역 혈청에 대한 살박테리아 활성과 대등한 경우 (즉, 양성 살박테리아 역치를 달성하는 경우), 균주는 사멸에 대해 감수성인 것으로 간주된다. 그러나, 백신접종된 개체로부터의 혈청이 MATS에서 사용되지 않기 때문에, 검정은 면역화에 반응하여 hSBA 역가 ≥1:4 (즉, 보호의 상관관계)를 달성한 집단의 비율을 예측할 수 없다.
주목할 만하게, hSBA를 수행하는데 있어서 한계가 존재한다. 예를 들어, hSBA는 노동 집약적이고, 특히 보다 많은 수의 균주 및/또는 혈청을 평가하고자 하는 경우에 대량의 혈청 및 검정-상용성 보체를 필요로 할 수 있다. 또한, hSBA에 사용된 검정 시약 및 균주의 성능에서의 실험실간 차이는 반응의 비교 및 백신 사이의 커버리지의 폭의 평가를 제한한다. PPV 분석의 공지된 한계는 유병률 (즉, 이러한 설정에서, 추가의 균주에 대해 hSBA ≥LLOQ를 달성한 대상체의 비율)에 대한 반응의 크기 의존성이다. 그러나, 이러한 분석에서, 추가의 균주에 대한 소정의 범위의 백신접종후 반응이 존재하지만 (투여 2 후 및 투여 3 후 1개월), PPV가 균일하게 높다는 것은 주목할 만하다.
종합하면, 10종의 추가의 MenB hSBA 시험 균주로부터 수득된 면역원성 데이터는 4종의 1차 MenB hSBA 시험 균주로부터 수득된 반응 데이터를 지지하고, MenB-FHbp에 의해 부여된 MenB 분리주의 광범위한 커버리지를 확인시켜 준다. 이는 인식된 보호 대용물 (hSBA)과 함께, 백신 항원 서열 및 발현과 관련하여 MenB 균주의 역학을 사용하여 MenB 백신의 도출된 면역 반응의 엄격한 평가를 적용한 최초의 연구이고, 이러한 지식을 사용하여 백신 허가를 유도하였다.
방법
FHbp 표면 발현의 정량화
모든 균주에 대해, 둘 다의 FHbp 서브패밀리에 대해 공통인 보존된 FHbp 에피토프의 모노클로날 항체 (MN86-994-11) 인식을 사용하는 유동 세포측정 검정인 MEASURE 검정에 의해 FHbp 표면 발현을 정량화하였다. MEASURE 검정의 세부사항은 이전에 기재되었다. 각각의 FHbp 변이체 군에 대해 채택된 컷오프 수준은 25.2% 상대 표준 편차의 정밀도 추정을 사용한, 관찰된 중앙 평균 형광 강도 플러스 1 표준 편차였다.
면역원성 분석
각각의 10종의 추가의 MenB 시험 균주를 hSBA에 사용하여 MenB-FHbp의 2가지 중추적 3상 연구에 참여한 대상체로부터의 혈청을 시험하였다. 각각의 연구로부터의 총 900명의 대상체를 3개의 하위세트 (각각 n=300)로 나누고; 10종의 추가의 시험 균주를 이들 하위세트에 걸쳐 할당하여 2개의 하위세트가 각각 3종의 시험 균주를 포함하고, 1개의 하위세트가 4종의 시험 균주를 포함하도록 하였다. 하위세트는 각각의 연구로부터 ≥150개의 평가가능한 hSBA 결과가 수득될 것을 보장하기 위해 300명의 대상체로부터의 샘플을 포함하였다. 3상 임상 연구 혈청을 사용하여 hSBA에 의해 측정된 면역 반응은 검정 LLOQ에 기초하였으며, 이는 균주에 따라 1:8 또는 1:16과 동등한 hSBA 역가였다.
양성 예측치 분석
FHbp 서브패밀리 내의 각각의 1차/추가의 균주 쌍에 대한 PPV는 1차 균주 반응자의 총수 (1차 균주에 대해 hSBA 역가 ≥LLOQ) 중에서 추가의 균주에 반응하는 대상체의 비율 (추가의 균주에 대해 hSBA 역가 ≥LLOQ)로서 정의되었다. PPV 분석은 4종의 1차 균주에 대해 관찰된 hSBA 반응이 동일한 서브패밀리로부터의 FHbp를 발현하는 추가의 균주에 대한 면역 반응을 예측하는지 평가하였다.
실시예 20: 5가 수막구균 (MenABCWY) 백신은 건강한 청소년 및 청년의 2상 연구에서 공투여된 MenB-FHbp 및 MenACWY-CRM보다 비열등한 면역원성으로 안전하고 잘 허용된다
배경: 수막구균 혈청군 A, B, C, W 및 Y는 전세계적으로 거의 모든 수막구균 질환을 유발한다. 백신접종은 혈청군 B (MenB) 및 4가 (MenACWY) 백신에 대한 상이한 투여 권장사항에 의해 복잡해지고, 이는 단일 5가 백신으로 해결될 수 있다. 청소년 및 청년에서의 본 연구는 2종의 허가된 백신, MenB-FHbp (트루멘바®; 2가 rLP2086) 및 MenACWY-TT (니멘릭스®)를 단일 백신으로 조합한 새로운 5가 MenABCWY 백신을 평가하였다.
방법: 이러한 진행 중인, 무작위화, 제어된, 관찰자-맹검, 다기관 연구 (NCT03135834)에서, MenB 백신-나이브 및 MenACWY-나이브 또는 -경험한 건강한 10-25-세를 MenABCWY (제0개월, 제6개월) 또는 MenB-FHbp (제0개월, 제6개월) 및 MenACWY-CRM (제0개월)으로 1:2 무작위화하였다. 면역 반응을 혈청군 A, C, W 및 Y 균주 및 4종의 다양한 백신-이종 MenB 균주에 대해 인간 보체를 사용한 혈청 살박테리아 활성 검정 (hSBA)에 의해 측정하였다. 종점은 기준선으로부터 역가의 ≥ 4-배 상승을 달성한 대상체의 백분율을 포함하였다. 면역 반응의 비열등성을 10% 마진 (95% CI 하한치 > -10%)에서 선험적으로 평가하였다. 안전성을 평가하였다.
결과: 용량 2 후, 높은 백분율의 MenABCWY (n=543) 및 MenB-FHbp (n=1057) 수용자가 각각의 4종의 MenB 균주에 대해 ≥ 4-배 상승을 달성하였고 (75.8-94.7% vs 67.4-95.0%), 역가는 합한 모든 4종의 균주에 대해 적어도 정량 하한치였다 (79.9% vs 74.3%; 도 1a). MenABCWY는 모든 5개의 종점에 대해 MenB-FHbp보다 비열등하였다. MenABCWY는 또한 단일 MenACWY-CRM 용량보다 비열등하였고, 용량 1 또는 2 후에 MenABCWY 수용자의 각각 75.5-96.9% 및 93.0-97.4%가 선행 MenACWY 경험에 따라 혈청군 A, C, W 및 Y에 대해 ≥ 4-배 상승을 달성하였다 (도 1b). MenABCWY 또는 MenB-FHbp 후의 국부 반응 및 전신 사건은 유사하게 빈번하였고, 중증도가 대부분 경도/중등도였으며 (도 2), 이는 MenACWY 경험에 의해 영향을 받지 않았다.
6.2.2.3 MenABCWY 임상 개발 프로그램으로부터의 면역원성 결과
(연구 B1971057) 연구의 이 부분은 전체 연구의 2상 구성요소였다. MenABCWY의 MenB 성분의 경우, 백신접종 2의 1개월 후에 hSBA 역가에서 기준선으로부터 4-배 상승을 달성한 MenABCWY 및 2가 rLP2086 + MenACWY-CRM 수용자의 비율은 PMB80 (A22)의 경우에 각각 75.8% 및 73.8%였고; PMB2001 (A56)의 경우에 각각 94.7% 및 95.0%였고; PMB2948 (B24)의 경우에 각각 76.1% 및 67.4%였고; PMB2707 (B44)의 경우에 각각 91.7% 및 86.4%였다. 백신접종 2의 1개월 후에 복합 반응 (모든 4종의 MenB 시험 균주에 대해 hSBA 역가 ≥ LLOQ)을 달성한 MenABCWY 및 2가 rLP2086 + MenACWY-CRM 수용자의 비율은 각각 79.9% 및 74.3%였다.
결론: 이들 결과는 MenABCWY가, 단일 용량으로서 제공되든지 또는 6개월 분리된 2-용량 시리즈로서 제공되든지, 선행 ACWY 경험과 상관없이, 2가 rLP2086 (0, 6-개월) 및 MenACWY-CRM (0-개월)을 개별적으로 투여하였을 때 달성된 것과 유사한, 2회 용량 후 MenB 및 1 또는 2회 용량 후 MenACWY에 대해 고도의 보호 면역을 제공한다는 것을 나타낸다. 기준선으로부터의 MenABCWY 4-배 면역 반응은 개별적으로 투여된 MenB-FHbp 및 MenACWY-CRM보다 강건하고 비열등하였다. 0-, 6-개월 스케줄의 백신접종은 안전하고 잘 허용되었다. 유리한 이익-위험 프로파일은 현행 수막구균 백신접종 실시에 대한 단순화된 대안으로서 추가의 MenABCWY 개발을 지지한다.
연구 B1971057 (MenABCWY[FIH])로부터 생성된 데이터는, 10세 내지 25세의 건강한 개체에게 투여한 경우에 (섹션 5.2 참조), MenABCWY에 대한 반응이 트루멘바 (수막구균 군 B 2가 재조합 지단백질 2086 백신) (MenB 평가) 및 멘베오 (수막구균 (군 A, C, Y, 및 W-135) 올리고사카라이드 CRM197 접합체 백신) (MenACWYCRM 평가)에 비해 비열등함을 입증하였다.
본 FIH 연구에서 관찰된 MenABCWY의 구성요소 부분 사이에 면역 간섭은 없었다.
실시예 21: 현탁액 백신에 대한 운송 스트레스의 영향
본 실시예는 현탁액 백신에 대한 운송 스트레스 (충격/강하, 진동, 저압/고도, 및 온도)의 영향을 예시한다. 백신 현탁액의 재분산은 중요한 고려사항이다. 최종 사용자에 대한 재분산 시간을 최소화하기 위해 재분산 시간에 영향을 미칠 수 있는 인자를 이해하는 것은 주요 제품 개발 목표이다. 본 발명자들은 현탁액 백신에 대한 재분산 시간에 영향을 미치는 파라미터를 평가하는 체계적인 방식 및 연관된 제어 전략을 제시한다.
현탁액 백신은 액체 또는 동결건조된 분말과 비교하여 저장 및 운송 동안 물리적 특성을 유지하는데 있어서 유의한 도전과제를 구성하는 열역학적으로 불안정한 시스템이다. 운송 스트레스가 백신 제품의 제품 품질 뿐만 아니라 물리적 특성에 영향을 미칠 수 있지만, 본 실시예는 현탁액 백신의 물리적 특성에 대한 운송 스트레스의 영향에 초점을 맞춘다. 제품 품질에 대한 영향은, 제품 품질이 분자 의존적이고 제품-특이적 분석 및 생물학적 방법에 의해 평가될 수 있기 때문에, 범주를 벗어난다.
알루미늄-함유 아주반트는 70년 넘게 항원에 대한 면역 반응을 증진 또는 변형시키기 위해 백신에 포함되었다. 알루미늄-함유 백신은 내부 상이 불용성 알루미늄-함유 염 (인산알루미늄 또는 수산화알루미늄)으로 이루어지고 외부 상이 액체 비히클인 현탁액이다. 백신 약물 제품에의 불용성 아주반트의 첨가는 분산된 상이 시간에 따라 침강하는 경향이 있는 현탁액을 초래한다. 이상적으로, 현탁액은 균일해야 하고, 저장 동안 발생하는 임의의 침강은 교반시 용이하게 재분산될 수 있다. 재분산 전 및 후의 백신 현탁액을 함유하는 사전-충전된 시린지를 비교한다. 종종, 현탁액이 사전-충전된 시린지 내로 충전되고 장기간 저장을 위해 유지된 후에 재분산 문제가 대두된다. 무수한 연구는 대형의 느슨하고 용이하게 분산될 수 있는 침강물을 형성하도록 제어된 응집제 또는 중합체 첨가제를 첨가하는 것에 초점을 맞추었다4. 여러 상업용 알루미늄-기반 백신은 그의 패키지 삽입물에서 "사용 직전에 격렬하게 흔들 것"을 분명하게 지시한다. 2010년 4월 26일에, WHO는 재현탁시키기 어렵거나 불가능했던 SHAN 5 백신 바이알에 백색 침강물이 점착된 사건에 따른 예방 조치로서 SHAN 5 백신의 모든 로트의 회수 및 폐기를 권장하였다5. 따라서, 백신 현탁액의 재분산은 재분산 시간에 영향을 미치는 인자를 이해하기 위해 철저히 평가되어야 하고, 필요한 경우, 완화 대책을 세울 수 있다.
입자 크기, 전하 및 침강 속도 사이의 상호작용. 본 발명자들이 증가된 재분산 시간의 원인을 이해하고자 하는 바와 같이 현탁액 안정성에 영향을 미치는 인자를 이해하는 것은 필수적이다. 본 섹션에서는, 현탁액 안정성에 대한 고려사항의 배경이 현탁액의 입자 크기, 전하, 및 침강 사이의 상호작용을 이해하기 위한 2종의 현탁액의 사례 연구와 함께 제시된다.
이상적인 현탁액 시스템에서, 분산된 상은 장시간 동안 현탁되고, 희박 시스템의 침강이 발생하면, 분산된 시스템은 용이하게 재현탁 또는 분산될 수 있다. 현탁액 안정성은 열역학적 또는 동역학적 수단을 통해 달성될 수 있다. 열역학적 안정성 접근법은 현탁액 입자 표면 상에 전하를 부여함으로써, 현탁액 안정화로 이어지는 입자-입자 반발로 인한 입체 장애를 유도하는 것을 포함한다. 다른 한편으로는, 동역학적 접근법은 현탁액의 점도를 증가시켜 현탁액의 침강을 감소시키고, 따라서 안정성을 제공하는 것을 포함한다. 입자 크기는 열역학적 및 동역학적 안정성의 이러한 상호작용에서 필수적인 역할을 한다. 서브마이크론 초과의 입자 크기를 갖는 현탁액 시스템의 경우, 투명 상과 분산 상 사이의 밀도 차이는 유의한 인자이며, 중력으로 인해 분산 상의 침강으로 이어질 수 있다. 입자 크기는 현탁액 시스템의 응집 또는 응고에 영향을 미칠 수 있는 것으로 보고되어 있다. 예를 들어, PEG는 고체 활성 성분 입자가 보다 큰 응집된 침강물을 형성하게 하여, 침강물이 보다 용이하게 재현탁되도록 하기 위해 많은 주사가능한 고체/액체 현탁액에 첨가된다. 초-마이크로미터 입자는 용해 동역학을 늦추는데 이상적으로 적합하지만, 이는 중력 효과에 의해 훨씬 더 영향을 받으며, 상당히 치밀하고 거의 재현탁될 수 없는 침강물을 야기할 수 있다.
침전 또는 침강은 농축 현탁액에서의 집합적 상호작용의 결과이다. 집합적 상호작용은 유체역학적 및 입자-입자 상호작용 (전하-전하 상호작용을 통해 결정됨)을 포함한다. 유체역학적 효과는 침강 입자의 운동을 보상하기 위한 유체의 반대 흐름인 역류의 지연을 설명한다. 입자-입자 상호작용은 농축 분산액에서의 인력 자기-고갈 및 척력 구조적 힘에 기인한다.
전하, 침강 속도, 및 입자 크기 사이의 상호작용을 설명하기 위해 2종의 현탁액 시스템이 예시된다. 본 연구에서 백신 현탁액 약물 제품은 이러한 예시를 위해 현탁액 1 및 2로서 지정된다. 현탁액 1 및 현탁액 2는 대등한 입자 크기 (대략 15 μm)로 도시된다. 이들 현탁액은 침강 속도를 비교할 때 매우 상이하게 거동한다. 현탁액 1은 대략 0.04 abs/분의 침강 속도로 유의하게 더 빠르게 침강하는 반면, 현탁액 2는 심지어 침강을 시작하는데 수주가 걸린다. 이러한 차이는 대등한 입자 크기 분포를 가짐에도 불구하고 극명하다. 앞서 논의된 바와 같이, 입자 표면 상의 전하를 이해하는 것은 필수적이게 된다. 현탁액 1에 대한 제타 전위는 대략 -5 mV인 한편, 현탁액 2는 -45 mV의 제타 전위를 갖는다. 현탁액 1은 입자 표면 상에 약간의 전하를 갖기 때문에, 열역학적 현탁액 불안정성은 입자-입자 인력을 촉진하고, 결국 분산된 상의 침강을 촉진한다.
다른 한편으로는, 현탁액 2 시스템에 대한 높은 전하는 시스템을 열역학적으로 안정하게 만들고, 입자-입자 척력은 분산된 상의 유의하게 느린 침강으로 이어진다. 이에 기초하여, 현탁액 2는 최대의 열역학적 안정성을 부여하고 바람직하다. 가장 큰 의문은 열역학적으로 안정한 현탁액이 분산된 시스템이 침강된 후에 분산되기가 더 용이한지 또는 그 반대인지 이지만, 이것이 어떻게 백신 현탁액용 시린지에서의 현탁의 용이성으로 해석되는지?이다. 이들 2종의 현탁액을 사용한 본 발명자들의 데이터는 현탁액 1이 전하의 결여로 인해 열역학적으로 불안정하지만, 입자-입자 상호작용 및 가능하게는 보다 큰 응집된 침강물의 형성을 유발하여 보다 빠른 침강을 유발하고, 따라서 분산된 상 시스템을 용이하게 재현탁가능하게 한다는 것을 시사한다. 다른 한편으로는, 현탁액 2는 전하-전하 극성으로 인해 유의하게 더 긴 침강 시간이 걸리지만, 일단 침강되면, 보다 미세한 입자가 함께 패킹되어 유의하게 더 재현탁되기 어려운 침강된 분산 상을 형성한다.
이들 관찰 및 배경에 기초하여, 현탁액 1 백신에 대한 재분산 시간의 증가를 이해하기 위해 본 발명자들의 연구에서 2가지의 주요 질문을 시험하였다: 운송 스트레스가 열역학적 현탁액 안정성을 변경시켜 재분산 시간의 증가를 야기할 수 있는가? 운송 동안 개별 운송 스트레스 성분의 영향이 무엇이고, 증가된 재분산 시간에 상관관계가 있는가?
열역학적 현탁액 안정성에 대한 운송 스트레스의 영향
또 다른 연구에서, 백신 약물 제품 현탁액을 운송 온도, 충격/강하 및 진동을 포함하는 모의 운송 스트레스에 적용하였다. 열역학적 현탁액 안정성을 운송 전 및 후의 전하 (제타 전위), 입자 크기 분포, 및 침강 속도의 측정을 통해 결정하였다.
약물 제품 현탁액은 약 -5 mV의 제타 전위 값을 나타내었으며, 이는 현탁액 입자 상에 약간의 전하가 존재함을 시사한다. 현탁액의 이러한 열역학적 불안정성은 입자-입자 인력을 촉진하고, 결국 분산된 상의 침강을 촉진한다. 본 발명자들의 데이터는 시린지의 모의 운송 전 및 후에 제타 전위 값, 입자 크기 분포, 및 측정된 침강 속도에서 명백한 변화가 없었음을 시사한다. 이들 결과는 운송 스트레스가 약물 제품 현탁액에 대한 열역학적 현탁액 안정성을 변경시키지 않는다는 것을 시사한다. 이들 특성은 운송 후 변화되지 않기 때문에, 열역학적 안정성은 관찰된 증가된 재분산 시간에 대한 구동 인자가 아니고, 운송 스트레스의 영향을 평가하고 임의의 특정 물리적 메카니즘이 관찰된 재분산 시간에 기여하는지 이해하는 것에 대한 필요를 필요로 한다고 결론지을 수 있다.
재분산 시간에 대한 개별 운송 스트레스의 영향
패키지가 운송될 때, 제품은 다양한 운송 스트레스를 분명히 경험할 것이다. 이는 패키지가 다양한 높이로부터 강하될 때의 충격/강하 스트레스, 진동 주파수의 진폭이 항공기와 트럭 사이에서 상이하기는 하지만, 트럭 또는 항공기 수송 동안의 진동을 포함한다. 약물 제품 시린지를 모의 운송에 적용한 경우에 재분산 시간에 대한 개별 운송 스트레스의 영향을 평가하였다 11. 연구 설계는 또한 시린지 배향의 함수로서 운송 스트레스의 영향의 평가를 포함하였다. 시린지를 3가지의 별개의 배향으로 유지시켰다: 팁 캡 하향, 팁 캡 상향, 및 팁 캡 수평. 연구는 개별 스트레스를 판독하고 영향을 이해하는 것을 목표로 한다.
충격/강하 스트레스는 팁 캡 하향 배향의 경우에 재분산 시간을 감소시켰고, 팁 캡 수평 및 팁 캡 상향 배향에서는 재분산에 대한 충격/강하의 영향이 거의 없는 것으로 관찰되었다.
다른 한편으로는, 항공기 진동은 팁 캡 하향 배향의 경우에 재분산 시간을 증가시켰다. 이는 흥미로운 발견이었고, 항공기 수송 동안 직면하는 진동 주파수와 관련될 수 있다. 시린지가 팁 캡 하향 배향으로 있을 때의 진동 주파수는 현탁액의 입자가 시린지 구멍 아래로 내려가는 것을 추가로 용이하게 할 수 있다. 팁 캡이 상향으로 및 수평으로 배열된 시린지에 대한 항공기 진동의 영향은 거의 없었다. 항공기 진동과 유사하게, 트럭 진동은 팁 캡 하향 배향에서 재분산 시간을 증가시켰다. 재분산 시간의 증가 정도가 항공기 진동과 비교하여 더 컸지만, 이들 발견은 항공기 진동과 유사하다. 추가적으로, 항공기 진동과 일치하게 팁 캡이 상향으로 및 수평으로 배열된 시린지에 대한 트럭 진동의 영향은 거의 없었다.
또한, 시린지를 조합 스트레스 (충격/강하, 항공기 진동, 트럭 진동 충격/강하)에 대한 재분산 시간에 대해 평가하였을 때, 데이터는 혼동되었고, 이는 실제 운송에서, 가장 가능하게는 1종 이상의 운송 스트레스 모드가 결과를 지배하여-엄청나게 상이한 결과를 초래할 수 있다는 것을 시사한다.
진동 주파수 강도는 항공기 및 트럭 진동에서 관찰되는 차이에 기초하여 중요한 인자로 주목됨이 흥미롭다. 시린지를 팁 캡 하향 배향으로 둘 경우 재분산 시간의 증가는, 중력으로부터 유래되고 진동에 의해 가중되는 현탁액 입자의 하향 운동이 보다 작은 입자는 공극 공간을 채우면서 보다 큰 입자의 긴밀한 패킹을 용이하게 하기 때문일 수 있다. 바닥, 특히 시린지의 구멍에서 입자는 상부의 입자의 중량에 의해 함께 점차적으로 가압된다.
약물 제품이 팁 캡 상향 배향으로 운송되는 경우, 중력 효과는 여전히 존재하지만, 좁은 구멍 대신에 더 넓은 플런저 표면에서 침강이 일어난다. 덩어리의 패킹은 명백하지 않다. 약물 제품이 팁 캡 수평 배향으로 운송되는 경우, 브라운 운동으로 인한 측면 움직임 및 진동으로부터의 대류 흐름이 중력을 극복한다. 침강이 일어나더라도, 이는 입자를 패킹할 가능성이 거의 없이 시린지 벽의 큰 표면 상에서 발생할 것이다. 따라서, 재현탁은 팁 캡 상향 및 팁 캡 수평 배향 둘 다에서는 문제가 되지 않고, 팁 캡 수평 배향은 아마도 더 큰 표면적으로 인해 약간 더 양호한 결과를 가져온다. 운송 시, 운송 진동은 침강이 패킹되는 최종 상태를 초래하는 우세한 힘이다. 시린지의 배향 및 이용가능한 상이한 표면적에 따라, 재분산 시간은 이들 개방 표면적에 상응한다.
높은 재분산 시간을 감소시키기 위한 완화 전략
모의 운송 연구 데이터에 기초하여, 팁 캡 수평 또는 팁 캡 상향 배향이 백신 현탁액의 보다 높은 재분산 시간을 완화시킬 수 있다는 것은 분명하다.
현탁액 백신에 대한 수송 온도의 영향
재분산에 더하여, 백신 현탁액의 제품 품질은 또한 수송 동안의 온도에 의해 영향을 받을 수 있다. 동결 후에, 아주반트와 항원 사이의 결합은 파괴될 수 있다. 분리된 아주반트는, 입자 크기 및 중량이 점점 더 커져서 점차적으로 용기의 바닥에 침강하는 응집체를 형성하는 경향이 있다. 응집체의 크기는 반복된 동결 및 해동 주기 후에 증가할 수 있다. 응집체의 형성은 제품의 재분산, 물리적 및 화학적 특성 둘 다에 영향을 미친다. 백신의 국제 포장 및 운송에 대한 WHO 가이드라인은 흡착된 백신이 동결에 의해 영향을 받는지 결정하기 위해 진탕 시험 프로토콜을 부착하였다. 가이드라인은 또한 수송 동안 온도가 0 미만으로 떨어졌다는 표시가 있는 경우에 백신의 무작위 샘플에 대한 진탕 시험을 명시한다. 다른 한편으로는, 보다 높은 온도는 또한 백신 현탁액의 제품 품질에 영향을 미쳐, 입자 형성 및 화학적 특성 변화 또는 둘 다를 초래할 수 있다. 따라서, WHO는 적어도 48시간 동안의 국제 수송 동안 단열된 부류 A 포장 내부에 허용되는 최대 온도로서 +8℃를 명시한다. 부류 B 및 C 포장에 대해 허용되는 최대 온도는 +30℃이다.
하기 항목은 본 발명의 추가의 실시양태를 기재한다:
C1. (a) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제1 폴리펩티드; (b) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제2 폴리펩티드; (c) 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드 접합체; (d) 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드 접합체; (e) 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드 접합체; 및 (f) 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드 접합체를 포함하며; 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 중 어느 하나에 대한 면역 반응을 도출하고, 상기 혈청 살박테리아 항체 반응이 엔. 메닌기티디스 혈청군에 대한 허가된 백신에 의해 도출된 것보다 더 높은 것인 조성물.
C2. 항목 C1에 있어서, 폴리펩티드가 서열식별번호: 1 내지 서열식별번호: 62로부터 선택된 어느 하나의 아미노산 서열에 대해 적어도 70% 동일성을 갖는 아미노산 서열을 포함하는 것인 방법.
C3. 항목 C1에 있어서, 조성물이 (a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함하는 것인 방법.
C4. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 어느 하나에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 방법.
C5. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 방법.
C6. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 C에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 방법.
C7. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 W에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 방법.
C8. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 Y에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 방법.
C9. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 각각에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 방법.
C10. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 수막구균 혈청군 B 인자 H 결합 백신에 의해 도출된 것보다 더 높은 것인 방법.
C11. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 각각에 대한 면역 반응을 도출하며, 여기서 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 각각에 대한 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높고; 조성물이 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 도출하며, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 수막구균 혈청군 B 인자 H 결합 백신에 의해 도출된 것보다 더 높고; 여기서 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신 및 허가된 수막구균 혈청군 B 인자 H 결합 백신은 순차적으로 투여되고 조합 용량이 아닌 것인 방법.
C12. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 아주반트를 포함하는 것인 방법.
C13. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 알루미늄 아주반트를 포함하는 것인 방법.
C14. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 수산화알루미늄을 포함하는 것인 방법.
C15. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 인산알루미늄을 포함하는 것인 방법.
C16. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 알루미늄을 포함하는 것인 방법.
C17. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 제1 폴리펩티드의 적어도 90%가 조성물 중의 알루미늄에 결합된 것인 방법.
C18. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 제2 폴리펩티드의 적어도 90%가 조성물 중의 알루미늄에 결합된 것인 방법.
C19. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 멸균 액체로서 제제화된 것인 방법.
C20. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 제약상 허용되는 보존제를 포함하는 것인 방법.
C21. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 폴리소르베이트-80을 포함하는 것인 방법.
C22. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 트리스-HCl; 염화나트륨; 수크로스; 히스티딘; 폴리소르베이트 80; 및 인산알루미늄을 포함하는 것인 방법.
C23. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 약 120 μg/ml의 제1 폴리펩티드; 약 120 μg/ml의 제2 폴리펩티드; 인산알루미늄으로서 약 0.5 mg/ml 알루미늄; 약 0.02 mg 폴리소르베이트-80; 약 10 mM 히스티딘; 및 약 150 mM 염화나트륨을 포함하는 것인 방법.
C24. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 약 60 μg의 제1 폴리펩티드; 약 60 μg의 제2 폴리펩티드; 약 7.5 μg TT에 접합된 약 5 μg의 MenA 피막 사카라이드; 약 7.5 μg TT에 접합된 약 5 μg의 MenC 피막 사카라이드; 약 3.75 μg TT에 접합된 약 5 μg의 MenW 피막 사카라이드; 약 3.25 μg TT에 접합된 약 5 μg의 MenY 피막 사카라이드; 약 97 μg 트리스-HCl, pH 6.8 ± 0.3; 4.69-4.71 mg의 염화나트륨; 약 28 mg의 수크로스; 약 0.78 mg의 L-히스티딘; 약 0.02 mg 폴리소르베이트-80; 약 0.25 mg 알루미늄을 포함하고; 추가로 용량당 0.5 mL 물을 포함하는 것인 방법.
C25. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 면역 반응이 혈청 살박테리아 항체를 포함하는 것인 방법.
C26. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 하나에 대한 부스터 면역 반응을 도출할 수 있는 것인 방법.
C27. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B에 대한 부스터 면역 반응을 도출할 수 있는 것인 방법.
C28. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 면역 반응이 10세 내지 26세의 인간에서 도출되는 것인 방법.
C29. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 면역 반응이 12개월 내지 <18개월 또는 18개월 내지 <24개월령의 인간에서 도출되는 것인 방법.
C30. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 면역 반응이 18개월 내지 <24개월령의 인간에서 도출되는 것인 방법.
C31. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 면역 반응이 ≥24개월 내지 <10세의 인간에서 도출되는 것인 방법.
C32. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 면역 반응이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y에 대해 혈청음성인 인간에서 도출되는 것인 방법.
C33. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 면역 반응이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y에 대해 혈청양성인 인간에서 도출되는 것인 방법.
C34. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 적어도 2회의 용량으로 인간에게 투여되며, 여기서 제2 용량은 제1 용량의 약 6개월 후인 방법.
C35. 항목 C34에 있어서, 인간이 적어도 10세 및 최대 17세인 방법.
C36. 항목 C35에 있어서, 조성물의 제3 용량이 인간에게 투여되며, 여기서 인간은 적어도 16세인 방법.
C37. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 최대 2회의 용량으로 인간에게 투여되며, 여기서 제2 용량은 제1 용량의 약 6개월 후인 방법.
C38. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 A22에 대한 면역 반응을 도출하는 것인 방법.
C39. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 A56에 대한 면역 반응을 도출하는 것인 방법.
C40. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 B24에 대한 면역 반응을 도출하는 것인 방법.
C41. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 B44에 대한 면역 반응을 도출하는 것인 방법.
C42. 항목 C1 내지 항목 C3 중 어느 하나에 있어서, 조성물이 약 60 μg의 제1 폴리펩티드; 약 60 μg의 제2 폴리펩티드; 약 7.5 μg TT에 접합된 약 5 μg의 MenA 피막 사카라이드; 약 7.5 μg TT에 접합된 약 5 μg의 MenC 피막 사카라이드; 약 3.75 μg TT에 접합된 약 5 μg의 MenW 피막 사카라이드; 약 3.25 μg TT에 접합된 약 5 μg의 MenY 피막 사카라이드; 약 97 μg 트리스-HCl, pH 6.8 ± 0.3; 4.69-4.71 mg의 염화나트륨; 약 28 mg의 수크로스; 약 0.78 mg의 L-히스티딘; 약 0.02 mg 폴리소르베이트-80; 약 0.25 mg 알루미늄을 포함하고; 추가로 용량당 0.5 mL 물을 포함하는 것인 방법.
C43. (a) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제1 폴리펩티드; (b) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제2 폴리펩티드; (c) 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드 접합체; (d) 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드 접합체; (e) 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드 접합체; 및 (f) 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드 접합체를 포함하며; 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 1종에 대한 면역 반응을 도출하고, 상기 혈청 살박테리아 항체 반응이 엔. 메닌기티디스 혈청군에 대한 허가된 백신에 의해 도출된 것보다 더 높은 것인 조성물.
C44. 항목 C43에 있어서, 폴리펩티드가 서열식별번호: 1 내지 서열식별번호: 62로부터 선택된 어느 하나의 아미노산 서열에 대해 적어도 70% 동일성을 갖는 아미노산 서열을 포함하는 것인 조성물.
C45. (a) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제1 폴리펩티드; (b) 네이세리아 메닌기티디스 인자 H 결합 단백질 (fHBP)로부터 유래된 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함하며; 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드 각각에 대한 면역 반응을 도출하고, 여기서 상기 혈청 살박테리아 항체 반응은 허가된 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 백신에 의해 도출된 것보다 더 높은 것인 조성물.
C46. 항목 C43 내지 항목 C45 중 어느 하나에 따른 조성물의 유효량을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 B 서브패밀리 A 균주 및 네이세리아 메닌기티디스 혈청군 B 서브패밀리 B 균주에 대한 면역 반응을 유도하는 방법.
C47. 항목 C43 내지 항목 C45 중 어느 하나에 따른 조성물의 유효량을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 A, 네이세리아 메닌기티디스 혈청군 C, 네이세리아 메닌기티디스 혈청군 W, 및/또는 네이세리아 메닌기티디스 혈청군 Y 균주에 대한 면역 반응을 유도하는 방법.
C48. 항목 C43 내지 항목 C45 중 어느 하나에 따른 조성물의 유효량을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 A, 네이세리아 메닌기티디스 혈청군 B, 네이세리아 메닌기티디스 혈청군 C, 네이세리아 메닌기티디스 혈청군 W, 및/또는 네이세리아 메닌기티디스 혈청군 Y 균주에 대한 면역 반응을 유도하는 방법.
C49. 항목 C43 내지 항목 C45 중 어느 하나에 따른 조성물의 유효량을 인간에게 투여하는 것을 포함하는, 인간에서 네이세리아 메닌기티디스 혈청군 A, 네이세리아 메닌기티디스 혈청군 B, 네이세리아 메닌기티디스 혈청군 C, 네이세리아 메닌기티디스 혈청군 W, 네이세리아 메닌기티디스 혈청군 Y 균주, 및/또는 네이세리아 메닌기티디스 혈청군 X 균주에 대한 면역 반응을 유도하는 방법.
C50. 항목 C46 내지 C49 중 어느 하나에 있어서, 환자가 항목 C43 내지 항목 C45 중 어느 하나에 따른 조성물의 제1 투여 전에 다가 수막구균 피막 사카라이드-담체 단백질 접합체 백신을 이전에 제공받지 않은 것인 방법.
C51. 항목 C46 내지 C49 중 어느 하나에 있어서, 환자가 항목 C1 내지 항목 C10 중 어느 하나에 따른 조성물의 제1 투여 전에 다가 수막구균 피막 사카라이드-담체 단백질 접합체 백신을 이전에 제공받은 것인 방법.
C52. 인간에서 네이세리아 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하기 위한 조성물의 유효량의 용도이며, 여기서 상기 조성물은 a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 지질화된 폴리펩티드, 및 b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 지질화된 폴리펩티드를 포함하고, 여기서 조성물은 A02, A28, A42, A63, A76, B05, B07, B08, B13, B52 및 B107로 이루어진 군으로부터 선택된 폴리펩티드를 발현하는 적어도 1종의 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 유도하는 것인 용도.
C53. 항목 C52에 있어서, 유도된 면역 반응이 살박테리아성인 용도.
C54. 항목 C52에 있어서, 조성물이 폴리소르베이트-80을 추가로 포함하는 것인 용도.
C55. 항목 C52 내지 C54 중 어느 하나에 있어서, 조성물이 알루미늄을 추가로 포함하는 것인 용도.
C56. 항목 C52 내지 C55 중 어느 하나에 있어서, 조성물이 히스티딘 완충제를 추가로 포함하는 것인 용도.
C57. 항목 C52 내지 C56 중 어느 하나에 있어서, 조성물이 염화나트륨을 추가로 포함하는 것인 용도.
C58. 항목 C52 내지 C57 중 어느 하나에 있어서, 조성물이 약 120 μg/ml의 제1 폴리펩티드; 약 120 μg/ml의 제2 폴리펩티드; 약 2.8 몰비의 폴리소르베이트-80; 약 0.5 mg/ml 알루미늄; 약 10 mM 히스티딘; 및 약 150 mM 염화나트륨을 포함하는 것인 용도.
C59. 항목 C52 내지 C58 중 어느 하나에 있어서, 조성물이 약 60 μg의 제1 폴리펩티드; 약 60 μg의 제2 폴리펩티드; 약 18 μg 폴리소르베이트-80; 약 250 μg 알루미늄; 약 780 μg 히스티딘; 및 약 4380 μg 염화나트륨을 포함하는 것인 용도.
C60. 항목 C52 내지 C59 중 어느 하나에 있어서, 조성물이 4종의 별개이고 개별적으로 제조된 단백질-피막 폴리사카라이드 접합체의 혼합물을 포함하는 적어도 1종의 추가의 면역원성 조성물을 추가로 포함하며, 여기서 제1 접합체는 담체 단백질에 접합된 혈청군 W의 엔. 메닌기티디스 피막 폴리사카라이드를 포함하고, 제2 접합체는 담체 단백질에 접합된 혈청군 Y의 엔. 메닌기티디스 피막 폴리사카라이드를 포함하고, 제3 접합체는 담체 단백질에 접합된 혈청군 A의 엔. 메닌기티디스 피막 폴리사카라이드를 포함하고, 제4 접합체는 담체 단백질에 접합된 혈청군 C의 엔. 메닌기티디스 피막 폴리사카라이드를 포함하고, 여기서 담체 단백질은 디프테리아 톡소이드, CRM197, 및 파상풍 톡소이드로 이루어진 군으로부터 선택된 것인 용도.
C61. 항목 C60에 있어서, 담체 단백질이 디프테리아 톡소이드인 용도.
C62. 항목 C60에 있어서, 담체 단백질이 파상풍 톡소이드인 용도.
C63. 항목 C60에 있어서, 적어도 1종의 추가의 면역원성 조성물이 액체 조성물인 용도.
C64. 항목 C60에 있어서, 적어도 1종의 추가의 면역원성 조성물이 동결건조되지 않은 것인 용도.
C65. 항목 C60 내지 C64 중 어느 하나에 있어서, 조성물이 적어도 1종의 네이세리아 메닌기티디스 혈청군 A 균주에 대한 면역 반응을 유도하는 것인 용도.
C66. 항목 C60 내지 C64 중 어느 하나에 있어서, 조성물이 적어도 1종의 네이세리아 메닌기티디스 혈청군 C 균주에 대한 면역 반응을 유도하는 것인 용도.
C67. 항목 C60 내지 C64 중 어느 하나에 있어서, 조성물이 적어도 1종의 네이세리아 메닌기티디스 혈청군 W 균주에 대한 면역 반응을 유도하는 것인 용도.
C68. 항목 C60 내지 C64 중 어느 하나에 있어서, 조성물이 적어도 1종의 네이세리아 메닌기티디스 혈청군 Y 균주에 대한 면역 반응을 유도하는 것인 용도.
C69. 항목 C60 내지 C64 중 어느 하나에 있어서, 조성물이 네이세리아 메닌기티디스 혈청군 A 균주, 네이세리아 메닌기티디스 혈청군 C 균주, 네이세리아 메닌기티디스 혈청군 Y 균주, 네이세리아 메닌기티디스 혈청군 W 균주, 및 그의 임의의 조합 중 적어도 1종에 대한 면역 반응을 유도하는 것인 용도.
C70. 항목 C52 내지 C69 중 어느 하나에 있어서, 조성물의 유효량이 1회 용량을 포함하는 것인 용도.
C71. 항목 C52 내지 C70 중 어느 하나에 있어서, 조성물의 유효량이 2회 용량을 포함하는 것인 용도.
C72. 항목 C52 내지 C70 중 어느 하나에 있어서, 조성물의 유효량이 추가로 부스터 용량을 포함하는 것인 용도.
C73. 항목 C52 내지 C70 중 어느 하나에 있어서, 조성물의 유효량이 최대 2회 용량을 포함하는 것인 용도.
C74. 항목 C52 내지 C70 중 어느 하나에 있어서, 조성물의 유효량이 최대 3회 용량을 포함하는 것인 용도.
C75. 항목 C52에 있어서, 조성물이 하이브리드 단백질을 포함하지 않는 것인 용도.
C76. 항목 C52에 있어서, 조성물이 융합 단백질을 포함하지 않는 것인 용도.
C77. 항목 C52에 있어서, 조성물이 동결건조되지 않은 것인 용도.
C78. 항목 C52에 있어서, 조성물이 포름알데히드를 포함하지 않는 것인 용도.
C79. 항목 C60에 있어서, 조성물이 디프테리아 톡소이드 또는 CRM을 포함하지 않는 것인 용도.
C80. 항목 C60에 있어서, 네이세리아 메닌기티디스 혈청군 A (MenA) 피막 사카라이드가 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합된 것 (MenAAH-TT 접합체)인 용도.
C81. 항목 C60에 있어서, 네이세리아 메닌기티디스 혈청군 C (MenC) 피막 사카라이드가 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합된 것 (MenCAH-TT 접합체)인 용도.
C82. 항목 C60에 있어서, 네이세리아 메닌기티디스 혈청군 W (MenW) 피막 사카라이드가 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합된 것 (MenW-TT 접합체)인 용도.
C83. 항목 C60에 있어서, 네이세리아 메닌기티디스 혈청군 Y (MenY) 피막 사카라이드가 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합된 것 (MenY-TT 접합체)인 용도.
C84. 항목 C60에 있어서, 네이세리아 메닌기티디스 혈청군 A (MenA) 피막 사카라이드가 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합되고 (MenAAH-TT 접합체); 네이세리아 메닌기티디스 혈청군 C (MenC) 피막 사카라이드가 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 접합되고 (MenCAH-TT 접합체); 네이세리아 메닌기티디스 혈청군 W (MenW) 피막 사카라이드가 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합되고 (MenW-TT 접합체); 네이세리아 메닌기티디스 혈청군 Y (MenY) 피막 사카라이드가 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트 화학에 의해 파상풍 톡소이드 담체 단백질 (TT)에 직접 접합된 것 (MenY-TT 접합체)인 용도.
C85. 항목 C60에 있어서, 조성물이 아디프산 디히드라지드 (ADH) 링커의 부재 하에 MenA 피막 사카라이드를 포함하지 않는 것인 용도.
C86. 항목 C52 내지 C85 중 어느 하나에 있어서, 환자가 12개월 내지 <18개월 또는 18개월 내지 <24개월령인 용도.
C87. 항목 C52 내지 C85 중 어느 하나에 있어서, 환자가 18개월 내지 <24개월령인 용도.
C88. 항목 C52 내지 C85 중 어느 하나에 있어서, 환자가 ≥24개월 내지 <10세인 용도.
C89. 항목 C52 내지 C88 중 어느 하나에 있어서, 조성물이 인간 보체를 사용한 혈청 살박테리아 검정에서 동일한 조건 하에 측정 시, 제1 용량을 제공하기 전 인간에서의 혈청 이뮤노글로불린의 살박테리아 역가보다 제1 용량을 제공한 후 인간에서 적어도 2-배 더 높은 혈청 이뮤노글로불린의 살박테리아 역가를 유도하는 것인 용도.
C90. 항목 C52 내지 C89 중 어느 하나에 있어서, 조성물이 인간 보체를 사용한 혈청 살박테리아 검정에서 동일한 조건 하에 측정 시, 제1 용량을 제공하기 전 인간에서의 혈청 이뮤노글로불린의 살박테리아 역가보다 제1 용량을 제공한 후 인간에서 적어도 4-배 더 높은 혈청 이뮤노글로불린의 살박테리아 역가를 유도하는 것인 용도.
C91. 항목 C52 내지 C90 중 어느 하나에 있어서, 조성물이 인간 보체를 사용한 혈청 살박테리아 검정에서 동일한 조건 하에 측정 시, 제1 용량을 제공하기 전 인간에서의 혈청 이뮤노글로불린의 살박테리아 역가보다 제1 용량을 제공한 후 인간에서 적어도 8-배 더 높은 혈청 이뮤노글로불린의 살박테리아 역가를 유도하는 것인 용도.
C92. 인간에게
(a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함하는 조성물을 투여하는 것을 포함하며,
여기서 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 1종에 대한 면역 반응을 유도하고, 여기서 면역 반응은 혈청 살박테리아 항체의 역가를 포함하고, 여기서 역가는 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신에 의해 유도된 것보다 더 높은 것인
인간에서 면역 반응을 유도하는 방법.
C93. 제1항에 있어서, 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신이 멘베오인 방법.
C94. 인간에게 a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함하는 조성물을 투여하는 것을 포함하며, 여기서 조성물은 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고, 여기서 면역 반응은 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 혈청 살박테리아 항체의 역가를 포함하는 것인, 인간에서 면역 반응을 유도하는 방법.
C95. 항목 C94에 있어서, 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신이 트루멘바인 방법.
C96. 인간에게 a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함하는 조성물을 투여하는 것을 포함하며, 여기서 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 1종 및 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고, 여기서 면역 반응은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대한 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 각각에 대한 혈청 살박테리아 항체의 역가를 포함하고, 여기서 면역 반응은 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은 엔. 메닌기티디스 혈청군 B에 대한 혈청 살박테리아 항체의 역가를 포함하는 것인, 인간에서 면역 반응을 유도하는 방법.
C97. 항목 C96에 있어서, 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신이 멘베오인 방법.
C98. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 아주반트를 추가로 포함하는 것인 방법.
C99. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 알루미늄을 추가로 포함하는 것인 방법.
C100. 항목 C99에 있어서, 아주반트가 수산화알루미늄을 포함하는 것인 방법.
C101. 항목 C99에 있어서, 아주반트가 인산알루미늄을 포함하는 것인 방법.
C102. 항목 C94에 있어서, 제1 폴리펩티드의 적어도 90%가 조성물 중의 알루미늄에 결합된 것인 방법.
C103. 항목 C94에 있어서, 제2 폴리펩티드의 적어도 90%가 조성물 중의 알루미늄에 결합된 것인 방법.
C104. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 멸균 액체로서 제제화된 것인 방법.
C105. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 폴리소르베이트-80을 추가로 포함하는 것인 방법.
C106. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 트리스-HCl; 염화나트륨; 수크로스; 히스티딘; 폴리소르베이트 80; 및 인산알루미늄을 추가로 포함하는 것인 방법.
C107. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 약 120 μg/ml의 제1 폴리펩티드; 약 120 μg/ml의 제2 폴리펩티드; 인산알루미늄으로서 약 0.5 mg/ml 알루미늄; 약 0.02 mg 폴리소르베이트-80; 약 10 mM 히스티딘; 및 약 150 mM 염화나트륨을 포함하는 것인 방법.
C108. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 약 60 μg의 제1 폴리펩티드; 약 60 μg의 제2 폴리펩티드; 약 7.5 μg TT에 접합된 약 5 μg의 MenA 피막 사카라이드; 약 7.5 μg TT에 접합된 약 5 μg의 MenC 피막 사카라이드; 약 3.75 μg TT에 접합된 약 5 μg의 MenW 피막 사카라이드; 약 3.25 μg TT에 접합된 약 5 μg의 MenY 피막 사카라이드; 약 97 μg 트리스-HCl, pH 6.8 ± 0.3; 4.69-4.71 mg의 염화나트륨; 약 28 mg의 수크로스; 약 0.78 mg의 L-히스티딘; 약 0.02 mg 폴리소르베이트-80; 약 0.25 mg 알루미늄을 포함하고; 추가로 용량당 0.5 mL 물을 포함하는 것인 방법.
C109. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 각각에 대한 부스터 면역 반응을 도출할 수 있는 것인 방법.
C110. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B에 대한 부스터 면역 반응을 도출할 수 있는 것인 방법.
C111. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 10세 내지 26세인 방법.
C112. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 12개월 내지 <18개월 또는 18개월 내지 <24개월령인 방법.
C113. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 18개월 내지 <24개월령인 방법.
C114. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 ≥24개월 내지 <10세인 방법.
C115. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 적어도 16세인 방법.
C116. 항목 C115에 있어서, 인간에게 1회 용량을 투여하는 것을 포함하는 방법.
C117. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 10세 내지 12세인 방법.
C118. 항목 C113에 있어서, 인간에게 적어도 2회의 용량을 투여하는 것을 포함하는 방법.
C119. 항목 C113에 있어서, 인간이 최대 16세인 방법.
C120. 항목 C94 내지 C97 중 어느 하나에 있어서, 약 11세의 인간에게 조성물의 적어도 1회 용량을 투여하고, 제1 용량의 적어도 4년 후에 인간에게 조성물의 추가 용량을 투여하는 것을 포함하는 방법.
C121. 항목 C94 내지 C97 중 어느 하나에 있어서, 약 11세의 인간에게 조성물의 적어도 1회 용량을 투여하고, 마지막 용량의 적어도 4년 후에 인간에게 조성물의 추가 용량을 투여하는 것을 포함하는 방법.
C122. 항목 C116에 있어서, 조성물의 추가 용량이 마지막 용량의 약 5년 후에 투여되는 것인 방법.
C123. 항목 C94 내지 C97 중 어느 하나에 있어서, 약 11세의 인간에게 조성물의 1회 용량을 투여하고, 제1 용량의 약 5년 후에 인간에게 조성물의 적어도 2회 용량을 투여하는 것을 포함하는 방법.
C124. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대해 혈청음성인 방법.
C125. 항목 C94 내지 C97 중 어느 하나에 있어서, 인간이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대해 혈청양성인 방법.
C126. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물의 제1 용량 및 제2 용량을 투여하는 것을 포함하며, 여기서 제2 용량은 제1 용량의 약 6개월 후인 방법.
C127. 항목 C122에 있어서, 인간이 최대 17세인 방법.
C128. 항목 C122에 있어서, 16세의 인간에게 조성물의 제3 용량을 투여하는 것을 포함하는 방법.
C129. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물의 최대 2회의 용량을 투여하는 것을 포함하며, 여기서 제2 용량은 제1 용량의 약 6개월 후인 방법.
C130. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 A22를 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
C131. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 A56을 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
C132. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 B24를 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
C133. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 B44를 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
C134. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B A22, A56, B24, B44 균주 중 어느 하나, 또는 그의 임의의 조합에 대한 살박테리아 면역 반응을 유도하는 것인 방법.
C135. 항목 C94 내지 C97 중 어느 하나에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B B24, B16, B44, A22, B03, B09, A12, A19, A05, A07, B153 균주 중 어느 하나, 또는 그의 임의의 조합에 대한 살박테리아 면역 반응을 유도하는 것인 방법.
SEQUENCE LISTING
<110> Pfizer Inc.
<120> NEISSERIA MENINGITIDIS COMPOSITIONS AND METHODS THEREOF
<130> PC072522
<150> 63/040498
<151> 2020-06-17
<150> 62/907097
<151> 2019-09-27
<160> 74
<170> PatentIn version 3.5
<210> 1
<211> 258
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 1
Cys Gly Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Thr Gly
1 5 10 15
Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu
20 25 30
Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr
35 40 45
Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp
50 55 60
Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe
65 70 75 80
Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala
85 90 95
Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala
100 105 110
Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile
115 120 125
Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala
130 135 140
Phe Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe
145 150 155 160
Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala
165 170 175
Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln
180 185 190
Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His
195 200 205
Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr
210 215 220
Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser
225 230 235 240
Ala Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly
245 250 255
Lys Gln
<210> 2
<211> 261
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 2
Cys Gly Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala
1 5 10 15
Asp Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His
20 25 30
Lys Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln
35 40 45
Asn Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly
50 55 60
Asn Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser
65 70 75 80
Arg Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr
85 90 95
Leu Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu
100 105 110
Thr Ala Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys
115 120 125
Met Val Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His
130 135 140
Thr Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly
145 150 155 160
Thr Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile
165 170 175
Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser
180 185 190
Pro Glu Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu
195 200 205
Lys His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu
210 215 220
Lys Gly Ser Tyr Ser Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val
225 230 235 240
Ala Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly
245 250 255
Leu Ala Ala Lys Gln
260
<210> 3
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 3
Cys Gly Ser Ser
1
<210> 4
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 4
Cys Gly Ser Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10
<210> 5
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 5
Cys Ser Ser Gly Ser Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
<210> 6
<211> 255
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 6
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Tyr Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Glu Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 7
<211> 259
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 7
Cys Ser Ser Gly Gly Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Thr
1 5 10 15
Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly
20 25 30
Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn Gly Thr Leu
35 40 45
Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala Gly Asp Lys
50 55 60
Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg
65 70 75 80
Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu
85 90 95
Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val
100 105 110
Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu
115 120 125
Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr
130 135 140
Ala Phe Asn Gln Leu Pro Gly Asp Lys Ala Glu Tyr His Gly Lys Ala
145 150 155 160
Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe
165 170 175
Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu
180 185 190
Gln Asn Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser
195 200 205
His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly
210 215 220
Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly
225 230 235 240
Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile Gly Ile Ala
245 250 255
Gly Lys Gln
<210> 8
<211> 261
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 8
Cys Ser Ser Gly Ser Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile
1 5 10 15
Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly
35 40 45
Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly
50 55 60
Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile
65 70 75 80
Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile
85 90 95
Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala
100 105 110
Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp
115 120 125
Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu
130 135 140
His Thr Ala Phe Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly
145 150 155 160
Lys Ala Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile
165 170 175
Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr
180 185 190
Pro Glu Gln Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu
195 200 205
Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu
210 215 220
Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile
225 230 235 240
Ala Gly Ser Ala Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly
245 250 255
Ile Ala Gly Lys Gln
260
<210> 9
<211> 254
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 9
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 10
<211> 254
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 10
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 11
<211> 263
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 11
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Arg Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu
85 90 95
Ile Thr Leu Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser
100 105 110
Ala Leu Thr Ala Leu Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser
115 120 125
Gly Lys Met Val Ala Lys Arg Gln Phe Arg Ile Gly Asp Ile Val Gly
130 135 140
Glu His Thr Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr
145 150 155 160
Arg Gly Thr Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr
165 170 175
Thr Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu
180 185 190
Lys Ser Pro Glu Leu Asn Val Asp Leu Ala Ala Ala Asp Ile Lys Pro
195 200 205
Asp Glu Lys His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln
210 215 220
Ala Glu Lys Gly Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln
225 230 235 240
Glu Val Ala Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile Arg His
245 250 255
Ile Gly Leu Ala Ala Lys Gln
260
<210> 12
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 12
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Glu Gln Asp Pro Glu His Ser Gly Lys Met Val Ala Lys Arg Arg
115 120 125
Phe Lys Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu
180 185 190
Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 13
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 13
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu
180 185 190
Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 14
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 14
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Val Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 15
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 15
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 16
<211> 263
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 16
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Arg Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu
85 90 95
Ile Thr Leu Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser
100 105 110
Ala Leu Thr Ala Leu Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser
115 120 125
Gly Lys Met Val Ala Lys Arg Gln Phe Arg Ile Gly Asp Ile Val Gly
130 135 140
Glu His Thr Ser Phe Gly Lys Leu Pro Lys Asp Val Met Ala Thr Tyr
145 150 155 160
Arg Gly Thr Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr
165 170 175
Thr Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu
180 185 190
Lys Ser Pro Glu Leu Asn Val Asp Leu Ala Ala Ala Asp Ile Lys Pro
195 200 205
Asp Glu Lys His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln
210 215 220
Ala Glu Lys Gly Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln
225 230 235 240
Glu Val Ala Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile Arg His
245 250 255
Ile Gly Leu Ala Ala Lys Gln
260
<210> 17
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 17
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 18
<211> 254
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 18
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Gly Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 19
<400> 19
000
<210> 20
<211> 257
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 20
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Lys
20 25 30
Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr Leu
35 40 45
Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp Asn
50 55 60
Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe Asp
65 70 75 80
Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser
85 90 95
Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu
100 105 110
Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn
115 120 125
Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe
130 135 140
Asn Gln Leu Pro Gly Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser
145 150 155 160
Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala
165 170 175
Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn
180 185 190
Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala
195 200 205
Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr
210 215 220
His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala
225 230 235 240
Thr Val Lys Ile Gly Glu Lys Val His Glu Ile Ser Ile Ala Gly Lys
245 250 255
Gln
<210> 21
<211> 254
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 21
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Thr Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 22
<211> 262
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 22
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr
85 90 95
Ile Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser
100 105 110
Ala Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile
115 120 125
Asp Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly
130 135 140
Glu His Thr Ala Phe Asn Gln Leu Pro Gly Asp Lys Ala Glu Tyr His
145 150 155 160
Gly Lys Ala Phe Ser Ser Asp Asp Pro Asn Gly Arg Leu His Tyr Thr
165 170 175
Ile Asp Phe Thr Asn Lys Gln Gly Tyr Gly Arg Ile Glu His Leu Lys
180 185 190
Thr Pro Glu Leu Asn Val Asp Leu Ala Ser Ala Glu Leu Lys Ala Asp
195 200 205
Glu Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu
210 215 220
Glu Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu
225 230 235 240
Ile Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile
245 250 255
Gly Ile Ala Gly Lys Gln
260
<210> 23
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 23
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Ile Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Ser Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Ile Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 24
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 24
Cys Gly Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala
1 5 10 15
Asp
<210> 25
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic amino acid sequence
<400> 25
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala Asp
1 5 10 15
<210> 26
<211> 255
<212> PRT
<213> Neisseria meningitidis
<400> 26
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 27
<211> 254
<212> PRT
<213> Neisseria meningitidis
<400> 27
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 28
<211> 254
<212> PRT
<213> Neisseria meningitidis
<400> 28
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Gly Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 29
<211> 260
<212> PRT
<213> Neisseria meningitidis
<400> 29
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Gln Ser Leu Met Leu Asp Gln Ser Val Arg Lys Asn
35 40 45
Glu Lys Leu Lys Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn
50 55 60
Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg
65 70 75 80
Phe Asp Phe Ile His Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu
85 90 95
Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr
100 105 110
Ala Leu Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser Glu Lys Met
115 120 125
Val Ala Lys Arg Arg Phe Lys Ile Gly Asp Ile Ala Gly Glu His Thr
130 135 140
Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr
145 150 155 160
Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp
165 170 175
Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro
180 185 190
Glu Leu Asn Val Glu Leu Ala Ala Ala Tyr Ile Lys Pro Asp Glu Lys
195 200 205
Arg His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys
210 215 220
Gly Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala
225 230 235 240
Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu
245 250 255
Ala Ala Lys Gln
260
<210> 30
<211> 255
<212> PRT
<213> Neisseria meningitidis
<400> 30
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Glu Gln Asp Pro Glu His Ser Gly Lys Met Val Ala Lys Arg Arg
115 120 125
Phe Lys Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 31
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 31
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu Gln
100 105 110
Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln Phe
115 120 125
Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp
145 150 155 160
Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp Leu
180 185 190
Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile Ser
195 200 205
Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu Gly
210 215 220
Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val Glu
225 230 235 240
Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 32
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 32
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu Lys
100 105 110
Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser Phe
115 120 125
Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu Pro
130 135 140
Gly Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp Pro
145 150 155 160
Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly Tyr
165 170 175
Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu Ala
180 185 190
Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu Gly
195 200 205
Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His Leu Ala Leu
210 215 220
Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys Ile
225 230 235 240
Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 33
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 33
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu Lys
100 105 110
Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser Phe
115 120 125
Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu Pro
130 135 140
Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp Ala
145 150 155 160
Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly His
165 170 175
Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu Ala
180 185 190
Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu Gly
195 200 205
Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His Leu Ala Leu
210 215 220
Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys Ile
225 230 235 240
Gly Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 34
<211> 256
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 34
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Lys Ser
20 25 30
Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr Leu Ser
35 40 45
Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp Asn Ser
50 55 60
Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe Asp Phe
65 70 75 80
Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser Gly
85 90 95
Glu Phe Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu Gln
100 105 110
Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln
115 120 125
Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn
130 135 140
Gln Leu Pro Gly Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser
145 150 155 160
Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys
165 170 175
Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val
180 185 190
Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val
195 200 205
Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His
210 215 220
Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr
225 230 235 240
Val Lys Ile Gly Glu Lys Val His Glu Ile Ser Ile Ala Gly Lys Gln
245 250 255
<210> 35
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 35
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Thr Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser Gly Glu Phe Gln
85 90 95
Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu Gln Ile Glu Lys
100 105 110
Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser Phe
115 120 125
Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu Pro
130 135 140
Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp Pro
145 150 155 160
Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly Tyr
165 170 175
Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu Ala
180 185 190
Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu Gly
195 200 205
Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala Leu
210 215 220
Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys Ile
225 230 235 240
Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 36
<211> 261
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 36
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile
1 5 10 15
Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn Gly
35 40 45
Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala Gly
50 55 60
Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile
65 70 75 80
Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile
85 90 95
Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser Ala
100 105 110
Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp
115 120 125
Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu
130 135 140
His Thr Ala Phe Asn Gln Leu Pro Gly Asp Lys Ala Glu Tyr His Gly
145 150 155 160
Lys Ala Phe Ser Ser Asp Asp Pro Asn Gly Arg Leu His Tyr Thr Ile
165 170 175
Asp Phe Thr Asn Lys Gln Gly Tyr Gly Arg Ile Glu His Leu Lys Thr
180 185 190
Pro Glu Leu Asn Val Asp Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu
195 200 205
Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu
210 215 220
Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile
225 230 235 240
Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile Gly
245 250 255
Ile Ala Gly Lys Gln
260
<210> 37
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 37
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln Ser
20 25 30
Leu Ile Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu Gln
100 105 110
Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln Phe
115 120 125
Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Ser Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Ile Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp Leu
180 185 190
Ala Ala Ala Asp Ile Lys Pro Asp Glu Lys His His Ala Val Ile Ser
195 200 205
Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu Gly
210 215 220
Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val Lys
225 230 235 240
Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 38
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 38
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu Gln
100 105 110
Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln Phe
115 120 125
Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp
145 150 155 160
Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp Leu
180 185 190
Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile Ser
195 200 205
Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu Gly
210 215 220
Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val Glu
225 230 235 240
Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 39
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 39
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu Lys
100 105 110
Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser Phe
115 120 125
Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu Pro
130 135 140
Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp Pro
145 150 155 160
Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly Tyr
165 170 175
Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu Ala
180 185 190
Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu Gly
195 200 205
Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala Leu
210 215 220
Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys Ile
225 230 235 240
Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 40
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 40
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu Lys
100 105 110
Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser Phe
115 120 125
Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu Pro
130 135 140
Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp Ala
145 150 155 160
Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly His
165 170 175
Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu Ala
180 185 190
Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu Gly
195 200 205
Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His Leu Ala Leu
210 215 220
Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys Ile
225 230 235 240
Gly Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 41
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 41
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile
1 5 10 15
Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Gly Leu Gln Ser Leu Met Leu Asp Gln Ser Val Arg Lys Asn Glu
35 40 45
Lys Leu Lys Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly
50 55 60
Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe
65 70 75 80
Asp Phe Ile His Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu
85 90 95
Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala
100 105 110
Leu Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser Glu Lys Met Val
115 120 125
Ala Lys Arg Arg Phe Lys Ile Gly Asp Ile Ala Gly Glu His Thr Ser
130 135 140
Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala
145 150 155 160
Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe
165 170 175
Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu
180 185 190
Leu Asn Val Glu Leu Ala Ala Ala Tyr Ile Lys Pro Asp Glu Lys Arg
195 200 205
His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly
210 215 220
Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly
225 230 235 240
Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala
245 250 255
Ala Lys Gln
<210> 42
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 42
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu Gln
100 105 110
Glu Gln Asp Pro Glu His Ser Gly Lys Met Val Ala Lys Arg Arg Phe
115 120 125
Lys Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp Leu
180 185 190
Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys His His Ala Val Ile Ser
195 200 205
Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu Gly
210 215 220
Ile Phe Gly Glu Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val Lys
225 230 235 240
Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 43
<211> 262
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 43
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile
1 5 10 15
Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly
35 40 45
Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Arg Thr Phe Lys Ala Gly
50 55 60
Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile
65 70 75 80
Ser Arg Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile
85 90 95
Thr Leu Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala
100 105 110
Leu Thr Ala Leu Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser Gly
115 120 125
Lys Met Val Ala Lys Arg Gln Phe Arg Ile Gly Asp Ile Val Gly Glu
130 135 140
His Thr Ser Phe Gly Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg
145 150 155 160
Gly Thr Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr
165 170 175
Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys
180 185 190
Ser Pro Glu Leu Asn Val Asp Leu Ala Ala Ala Asp Ile Lys Pro Asp
195 200 205
Glu Lys His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Ala
210 215 220
Glu Lys Gly Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln Glu
225 230 235 240
Val Ala Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile Arg His Ile
245 250 255
Gly Leu Ala Ala Lys Gln
260
<210> 44
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 44
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu Gln
100 105 110
Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln Phe
115 120 125
Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu Leu
180 185 190
Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys Arg His Ala Val Ile Ser
195 200 205
Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu Gly
210 215 220
Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val Glu
225 230 235 240
Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 45
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 45
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile
1 5 10 15
Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Gly Leu Gln Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu
35 40 45
Lys Leu Lys Leu Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly
50 55 60
Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe
65 70 75 80
Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu
85 90 95
Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala
100 105 110
Leu Gln Thr Glu Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val
115 120 125
Ala Lys Arg Gln Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser
130 135 140
Phe Asp Lys Leu Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala
145 150 155 160
Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe
165 170 175
Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu
180 185 190
Leu Asn Val Glu Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys Arg
195 200 205
His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly
210 215 220
Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly
225 230 235 240
Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala
245 250 255
Ala Lys Gln
<210> 46
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 46
Ser Ser Gly Ser Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly
1 5 10 15
Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys
20 25 30
Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr
35 40 45
Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp
50 55 60
Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser
65 70 75 80
Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr
85 90 95
Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val
100 105 110
Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser
115 120 125
Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His
130 135 140
Thr Ala Phe Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly Lys
145 150 155 160
Ala Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp
165 170 175
Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro
180 185 190
Glu Gln Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys
195 200 205
Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys
210 215 220
Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala
225 230 235 240
Gly Ser Ala Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile
245 250 255
Ala Gly Lys Gln
260
<210> 47
<211> 259
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 47
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala Asp Ile
1 5 10 15
Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly
35 40 45
Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly
50 55 60
Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe
65 70 75 80
Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu
85 90 95
Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala
100 105 110
Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys Met Val
115 120 125
Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser
130 135 140
Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala
145 150 155 160
Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe
165 170 175
Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu
180 185 190
Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys His
195 200 205
His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly
210 215 220
Ser Tyr Ser Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala Gly
225 230 235 240
Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala
245 250 255
Ala Lys Gln
<210> 48
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 48
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn
50 55 60
Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg
65 70 75 80
Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu
85 90 95
Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr
100 105 110
Ala Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys Met
115 120 125
Val Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr
130 135 140
Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr
145 150 155 160
Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp
165 170 175
Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro
180 185 190
Glu Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys
195 200 205
His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys
210 215 220
Gly Ser Tyr Ser Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala
225 230 235 240
Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu
245 250 255
Ala Ala Lys Gln
260
<210> 49
<211> 255
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 49
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Ile Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Ser Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Ile Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 50
<211> 255
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 50
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 51
<211> 255
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 51
Gly Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Val Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 52
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 52
Gly Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 53
<211> 258
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 53
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile
1 5 10 15
Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Ser Leu Gln Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu
35 40 45
Lys Leu Lys Leu Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly
50 55 60
Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe
65 70 75 80
Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala
85 90 95
Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala
100 105 110
Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile
115 120 125
Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala
130 135 140
Phe Asn Gln Leu Pro Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe
145 150 155 160
Ser Ser Asp Asp Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr
165 170 175
Lys Lys Gln Gly Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln
180 185 190
Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His
195 200 205
Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr
210 215 220
Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser
225 230 235 240
Ala Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly
245 250 255
Lys Gln
<210> 54
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 54
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu Lys
100 105 110
Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser Phe
115 120 125
Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu Pro
130 135 140
Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp Ala
145 150 155 160
Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly His
165 170 175
Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu Ala
180 185 190
Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu Gly
195 200 205
Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala Leu
210 215 220
Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys Ile
225 230 235 240
Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 55
<211> 255
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 55
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu
180 185 190
Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile
195 200 205
Leu Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu
210 215 220
Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val
225 230 235 240
Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250 255
<210> 56
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 56
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu Gln
100 105 110
Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln Phe
115 120 125
Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 57
<211> 262
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 57
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr
85 90 95
Ile Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser
100 105 110
Ala Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile
115 120 125
Asp Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly
130 135 140
Glu His Thr Ala Phe Asn Gln Leu Pro Gly Asp Lys Ala Glu Tyr His
145 150 155 160
Gly Lys Ala Phe Ser Ser Asp Asp Pro Asn Gly Arg Leu His Tyr Thr
165 170 175
Ile Asp Phe Thr Asn Lys Gln Gly Tyr Gly Arg Ile Glu His Leu Lys
180 185 190
Thr Pro Glu Leu Asn Val Asp Leu Ala Ser Ala Glu Leu Lys Ala Asp
195 200 205
Glu Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu
210 215 220
Glu Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu
225 230 235 240
Ile Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile
245 250 255
Gly Ile Ala Gly Lys Gln
260
<210> 58
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 58
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Val Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu Gln
100 105 110
Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln Phe
115 120 125
Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp
145 150 155 160
Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp Leu
180 185 190
Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile Ser
195 200 205
Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu Gly
210 215 220
Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val Glu
225 230 235 240
Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 59
<211> 258
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 59
Cys Gly Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Thr Gly
1 5 10 15
Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu
20 25 30
Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr
35 40 45
Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp
50 55 60
Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe
65 70 75 80
Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala
85 90 95
Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala
100 105 110
Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile
115 120 125
Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala
130 135 140
Phe Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe
145 150 155 160
Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala
165 170 175
Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln
180 185 190
Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His
195 200 205
Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr
210 215 220
Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser
225 230 235 240
Ala Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly
245 250 255
Lys Gln
<210> 60
<211> 257
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 60
Gly Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Thr Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Lys
20 25 30
Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr Leu
35 40 45
Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp Asn
50 55 60
Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe Asp
65 70 75 80
Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser
85 90 95
Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu
100 105 110
Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn
115 120 125
Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe
130 135 140
Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser
145 150 155 160
Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala
165 170 175
Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn
180 185 190
Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala
195 200 205
Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr
210 215 220
His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala
225 230 235 240
Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys
245 250 255
Gln
<210> 61
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 61
Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala
1 5 10 15
Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln Ser
20 25 30
Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala
35 40 45
Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr
50 55 60
Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln
65 70 75 80
Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln
85 90 95
Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu Gln
100 105 110
Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln Phe
115 120 125
Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro
130 135 140
Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp Leu
180 185 190
Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile Ser
195 200 205
Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu Gly
210 215 220
Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val Lys
225 230 235 240
Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 62
<211> 252
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic amino acid sequence
<400> 62
Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu Ala Asp Ala
1 5 10 15
Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln Ser Leu Thr
20 25 30
Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu Ala Ala Gln
35 40 45
Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn Thr Gly Lys
50 55 60
Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg Gln Ile Glu
65 70 75 80
Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe Gln Val Tyr
85 90 95
Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu Gln Ile Gln
100 105 110
Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln Phe Arg Ile
115 120 125
Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu Pro Glu Gly
130 135 140
Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp Asp Ala Gly
145 150 155 160
Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly Asn Gly
165 170 175
Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp Leu Ala Ala
180 185 190
Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile Ser Gly Ser
195 200 205
Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu Gly Ile Phe
210 215 220
Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val Lys Thr Val
225 230 235 240
Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250
<210> 63
<211> 262
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 63
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr
85 90 95
Ile Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser
100 105 110
Ala Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile
115 120 125
Asp Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly
130 135 140
Glu His Thr Ala Phe Asn Gln Leu Pro Gly Gly Lys Ala Glu Tyr His
145 150 155 160
Gly Lys Ala Phe Ser Ser Asp Asp Pro Asn Gly Arg Leu His Tyr Ser
165 170 175
Ile Asp Phe Thr Lys Lys Gln Gly Tyr Gly Gly Ile Glu His Leu Lys
180 185 190
Thr Pro Glu Gln Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp
195 200 205
Glu Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu
210 215 220
Glu Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu
225 230 235 240
Ile Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile
245 250 255
Gly Ile Ala Gly Lys Gln
260
<210> 64
<211> 262
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 64
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr
85 90 95
Ile Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser
100 105 110
Ala Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile
115 120 125
Asp Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly
130 135 140
Glu His Thr Ala Phe Asn Gln Leu Pro Gly Gly Lys Ala Glu Tyr His
145 150 155 160
Gly Lys Ala Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr
165 170 175
Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys
180 185 190
Thr Pro Glu Gln Asn Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp
195 200 205
Glu Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu
210 215 220
Glu Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu
225 230 235 240
Ile Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile
245 250 255
Ser Ile Ala Gly Lys Gln
260
<210> 65
<211> 257
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 65
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Lys
20 25 30
Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr Leu
35 40 45
Ser Ala Gln Gly Ala Glu Arg Thr Phe Lys Ala Gly Asn Lys Asp Asn
50 55 60
Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe Asp
65 70 75 80
Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser
85 90 95
Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu
100 105 110
Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn
115 120 125
Gln Arg Ser Phe Leu Val Ser Ser Leu Gly Gly Glu His Thr Ala Phe
130 135 140
Asn Gln Leu Pro Gly Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser
145 150 155 160
Ser Asp Asp Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys
165 170 175
Lys Gln Gly Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn
180 185 190
Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala
195 200 205
Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr
210 215 220
His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala
225 230 235 240
Thr Val Lys Ile Gly Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys
245 250 255
Gln
<210> 66
<211> 262
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 66
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr
85 90 95
Ile Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser
100 105 110
Ala Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile
115 120 125
Asp Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly
130 135 140
Glu His Thr Ala Phe Asn Gln Leu Pro Gly Gly Lys Ala Glu Tyr His
145 150 155 160
Gly Lys Ala Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr
165 170 175
Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys
180 185 190
Thr Pro Glu Gln Asn Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp
195 200 205
Glu Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Asp Ser Glu
210 215 220
Glu Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu
225 230 235 240
Ile Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile
245 250 255
Ser Ile Ala Gly Lys Gln
260
<210> 67
<211> 262
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 67
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr
85 90 95
Ile Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser
100 105 110
Ala Val Val Ala Leu Gln Thr Glu Lys Val Asn Asn Pro Asp Lys Thr
115 120 125
Asp Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly
130 135 140
Glu His Thr Ala Phe Asn Gln Leu Pro Val Gly Lys Ser Glu Tyr His
145 150 155 160
Gly Lys Ala Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr
165 170 175
Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys
180 185 190
Thr Pro Glu Gln Asn Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp
195 200 205
Glu Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu
210 215 220
Glu Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu
225 230 235 240
Ile Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile
245 250 255
Ser Ile Ala Gly Lys Gln
260
<210> 68
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 68
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Ser Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu
180 185 190
Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Gln His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 69
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 69
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Leu Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu
180 185 190
Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Val Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 70
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 70
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu
180 185 190
Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 71
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 71
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Arg Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Ile Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 72
<211> 255
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 72
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Glu Gln Asp Leu Glu His Ser Gly Lys Met Val Ala Lys Arg Arg
115 120 125
Phe Lys Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 73
<211> 258
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 73
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Lys
20 25 30
Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr Leu
35 40 45
Ser Ala Gln Gly Ala Glu Arg Thr Phe Lys Ala Gly Asp Lys Asp Asn
50 55 60
Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe Asp
65 70 75 80
Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser
85 90 95
Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu
100 105 110
Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala
115 120 125
Lys Arg Gln Phe Arg Ile Gly Asp Ile Val Gly Glu His Thr Ser Phe
130 135 140
Gly Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala Phe
145 150 155 160
Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala
165 170 175
Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu
180 185 190
Asn Val Asp Leu Ala Ala Ala Asp Ile Lys Pro Asp Glu Lys His His
195 200 205
Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser
210 215 220
Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser
225 230 235 240
Ala Glu Val Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala
245 250 255
Lys Gln
<210> 74
<211> 257
<212> PRT
<213> Neisseria meningitidis (group B)
<400> 74
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Lys
20 25 30
Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr Leu
35 40 45
Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp Asn
50 55 60
Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe Asp
65 70 75 80
Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser
85 90 95
Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu
100 105 110
Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn
115 120 125
Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe
130 135 140
Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser
145 150 155 160
Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala
165 170 175
Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn
180 185 190
Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala
195 200 205
Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr
210 215 220
His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala
225 230 235 240
Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys
245 250 255
Gln
Claims (39)
- 인간에게 a) 서열식별번호: 1에 제시된 아미노산 서열을 포함하는 제1 폴리펩티드; (b) 서열식별번호: 2에 제시된 아미노산 서열을 포함하는 제2 폴리펩티드; (c) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 아디프산 디히드라지드 (ADH) 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스(Neisseria meningitidis) 혈청군 A 피막 사카라이드; (d) 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 ADH 링커에 접합된 것으로, 여기서 링커는 카르보디이미드 화학에 의해 파상풍 톡소이드에 접합된 것인 네이세리아 메닌기티디스 혈청군 C 피막 사카라이드; (e) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 W 피막 사카라이드; 및 (f) 링커의 부재 하에 1-시아노-4-디메틸아미노 피리디늄 테트라플루오로보레이트에 의해 파상풍 톡소이드에 직접 접합된 네이세리아 메닌기티디스 혈청군 Y 피막 사카라이드를 포함하는 조성물을 투여하는 것을 포함하며, 여기서 조성물은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 적어도 1종에 대한 면역 반응을 유도하고; 여기서 면역 반응은 혈청 살박테리아 항체의 역가를 포함하고, 여기서 역가는 (a) 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 접합체를 포함하는 조성물이며, 여기서 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 접합체를 포함하는 조성물이 추가로 엔. 메닌기티디스 폴리펩티드는 포함하지 않는 것인 조성물; 및 (b) 엔. 메닌기티디스 혈청군 B 폴리펩티드를 포함하는 조성물이며, 여기서 엔. 메닌기티디스 혈청군 B 폴리펩티드를 포함하는 조성물이 추가로 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 접합체는 포함하지 않는 것인 조성물 중 어느 하나로부터 선택된 조성물에 의해 유도된 것보다 더 높은 것인, 인간에서 면역 반응을 유도하는 방법.
- 제1항에 있어서, 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드 접합체를 포함하는 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신인 방법.
- 제1항 또는 제2항에 있어서, 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 수막구균 피막 폴리사카라이드에 대한 허가된 백신이 멘베오인 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 엔. 메닌기티디스 혈청군 B 폴리펩티드를 포함하는 조성물이 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신인 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 엔. 메닌기티디스 혈청군 B에 대한 허가된 백신이 트루멘바인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 어느 하나로부터 선택된 엔. 메닌기티디스 혈청군 및 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고; 여기서 면역 반응은 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대한 조성물에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은, 선택된 엔. 메닌기티디스 혈청군에 대한 혈청 살박테리아 항체의 역가를 포함하는 것인 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 중 어느 하나로부터 선택된 엔. 메닌기티디스 혈청군 및 엔. 메닌기티디스 혈청군 B에 대한 면역 반응을 유도하고; 여기서 면역 반응은 엔. 메닌기티디스 혈청군 B에 대한 조성물에 의해 유도된 혈청 살박테리아 항체의 역가보다 더 높은, 선택된 엔. 메닌기티디스 혈청군에 대한 혈청 살박테리아 항체의 역가를 포함하는 것인 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 조성물이 아주반트를 추가로 포함하는 것인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 조성물이 알루미늄을 추가로 포함하는 것인 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 아주반트가 수산화알루미늄을 포함하는 것인 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 아주반트가 인산알루미늄을 포함하는 것인 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 제1 폴리펩티드의 적어도 90%가 조성물 중의 알루미늄에 결합된 것인 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 제2 폴리펩티드의 적어도 90%가 조성물 중의 알루미늄에 결합된 것인 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 조성물이 멸균 액체로서 제제화된 것인 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 조성물이 폴리소르베이트-80을 추가로 포함하는 것인 방법.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 조성물이 트리스-HCl; 염화나트륨; 수크로스; 히스티딘; 폴리소르베이트 80; 및 인산알루미늄을 추가로 포함하는 것인 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 조성물이 약 120 μg/ml의 제1 폴리펩티드; 약 120 μg/ml의 제2 폴리펩티드; 인산알루미늄으로서 약 0.5 mg/ml 알루미늄; 약 0.02 mg 폴리소르베이트-80; 약 10 mM 히스티딘; 및 약 150 mM 염화나트륨을 포함하는 것인 방법.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 조성물이 약 60 μg의 제1 폴리펩티드; 약 60 μg의 제2 폴리펩티드; 약 7.5 μg TT에 접합된 약 5 μg의 MenA 피막 사카라이드; 약 7.5 μg TT에 접합된 약 5 μg의 MenC 피막 사카라이드; 약 3.75 μg TT에 접합된 약 5 μg의 MenW 피막 사카라이드; 약 3.25 μg TT에 접합된 약 5 μg의 MenY 피막 사카라이드; 약 97 μg 트리스-HCl, pH 6.8 ± 0.3; 4.69-4.71 mg의 염화나트륨; 약 28 mg의 수크로스; 약 0.78 mg의 L-히스티딘; 약 0.02 mg 폴리소르베이트-80; 약 0.25 mg 알루미늄을 포함하고; 추가로 용량당 0.5 mL 물을 포함하는 것인 방법.
- 제1항 내지 제18항 중 어느 한 항에 있어서, 조성물이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 각각에 대한 부스터 면역 반응을 도출할 수 있는 것인 방법.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B에 대한 부스터 면역 반응을 도출할 수 있는 것인 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 인간이 10세 내지 26세인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 인간이 10세 내지 12세인 방법.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 인간에게 적어도 2회의 용량을 투여하는 것을 포함하는 방법.
- 제1항 내지 제23항 중 어느 한 항에 있어서, 인간이 최대 16세인 방법.
- 제1항 내지 제24항 중 어느 한 항에 있어서, 약 11세의 인간에게 조성물의 적어도 1회 용량을 투여하고, 제1 용량의 적어도 4년 후에 인간에게 조성물의 추가 용량을 투여하는 것을 포함하는 방법.
- 제1항 내지 제25항 중 어느 한 항에 있어서, 약 11세의 인간에게 조성물의 적어도 1회 용량을 투여하고, 마지막 용량의 적어도 4년 후에 인간에게 조성물의 추가 용량을 투여하는 것을 포함하는 방법.
- 제1항 내지 제26항 중 어느 한 항에 있어서, 조성물의 추가 용량이 마지막 용량의 약 5년 후에 투여되는 것인 방법.
- 제1항 내지 제27항 중 어느 한 항에 있어서, 약 11세의 인간에게 조성물의 1회 용량을 투여하고, 제1 용량의 약 5년 후에 인간에게 조성물의 적어도 2회 용량을 투여하는 것을 포함하는 방법.
- 제1항 내지 제28항 중 어느 한 항에 있어서, 인간이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대해 혈청음성인 방법.
- 제1항 내지 제29항 중 어느 한 항에 있어서, 인간이 엔. 메닌기티디스 혈청군 A, C, W-135 및 Y 피막 폴리사카라이드에 대해 혈청양성인 방법.
- 제1항 내지 제30항 중 어느 한 항에 있어서, 조성물의 제1 용량 및 제2 용량을 투여하는 것을 포함하며, 여기서 제2 용량은 제1 용량의 약 6개월 후인 방법.
- 제1항 내지 제31항 중 어느 한 항에 있어서, 16세의 인간에게 조성물의 제3 용량을 투여하는 것을 포함하는 방법.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 조성물의 최대 2회의 용량을 투여하는 것을 포함하며, 여기서 제2 용량은 제1 용량의 약 6개월 후인 방법.
- 제1항 내지 제33항 중 어느 한 항에 있어서, 조성물이 A22를 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 조성물이 A56을 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
- 제1항 내지 제35항 중 어느 한 항에 있어서, 조성물이 B24를 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
- 제1항 내지 제36항 중 어느 한 항에 있어서, 조성물이 B44를 발현하는 엔. 메닌기티디스 혈청군 B 균주에 대한 면역 반응을 도출하는 것인 방법.
- 제1항 내지 제37항 중 어느 한 항에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B A22, A56, B24, B44 균주 중 어느 하나, 또는 그의 임의의 조합에 대한 살박테리아 면역 반응을 유도하는 것인 방법.
- 제1항 내지 제38항 중 어느 한 항에 있어서, 조성물이 엔. 메닌기티디스 혈청군 B B24, B16, B44, A22, B03, B09, A12, A19, A05, A07, B153 균주 중 어느 하나, 또는 그의 임의의 조합에 대한 살박테리아 면역 반응을 유도하는 것인 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962907097P | 2019-09-27 | 2019-09-27 | |
| US62/907,097 | 2019-09-27 | ||
| US202063040498P | 2020-06-17 | 2020-06-17 | |
| US63/040,498 | 2020-06-17 | ||
| PCT/IB2020/058928 WO2021059181A1 (en) | 2019-09-27 | 2020-09-24 | Neisseria meningitidis compositions and methods thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20220069992A true KR20220069992A (ko) | 2022-05-27 |
Family
ID=72744819
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227013540A Pending KR20220069992A (ko) | 2019-09-27 | 2020-09-24 | 네이세리아 메닌기티디스 조성물 및 그의 방법 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20220401544A1 (ko) |
| EP (1) | EP4034157A1 (ko) |
| JP (1) | JP2021066727A (ko) |
| KR (1) | KR20220069992A (ko) |
| CN (1) | CN115605222A (ko) |
| AU (1) | AU2020355401B2 (ko) |
| BR (1) | BR112022004921A2 (ko) |
| CA (1) | CA3155669A1 (ko) |
| IL (1) | IL291239A (ko) |
| MX (1) | MX2022003682A (ko) |
| WO (1) | WO2021059181A1 (ko) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB202208089D0 (en) * | 2022-06-01 | 2022-07-13 | Glaxosmithkline Biologicals Sa | Immunogenic composition |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3071552D1 (en) | 1979-09-21 | 1986-05-22 | Hitachi Ltd | Semiconductor switch |
| US4673574A (en) | 1981-08-31 | 1987-06-16 | Anderson Porter W | Immunogenic conjugates |
| US4459286A (en) | 1983-01-31 | 1984-07-10 | Merck & Co., Inc. | Coupled H. influenzae type B vaccine |
| US4695624A (en) | 1984-05-10 | 1987-09-22 | Merck & Co., Inc. | Covalently-modified polyanionic bacterial polysaccharides, stable covalent conjugates of such polysaccharides and immunogenic proteins with bigeneric spacers, and methods of preparing such polysaccharides and conjugates and of confirming covalency |
| US4808700A (en) | 1984-07-09 | 1989-02-28 | Praxis Biologics, Inc. | Immunogenic conjugates of non-toxic E. coli LT-B enterotoxin subunit and capsular polymers |
| US4709017A (en) | 1985-06-07 | 1987-11-24 | President And Fellows Of Harvard College | Modified toxic vaccines |
| IT1187753B (it) | 1985-07-05 | 1987-12-23 | Sclavo Spa | Coniugati glicoproteici ad attivita' immunogenica trivalente |
| US4950740A (en) | 1987-03-17 | 1990-08-21 | Cetus Corporation | Recombinant diphtheria vaccines |
| DE3841091A1 (de) | 1988-12-07 | 1990-06-13 | Behringwerke Ag | Synthetische antigene, verfahren zu ihrer herstellung und ihre verwendung |
| CA2006700A1 (en) | 1989-01-17 | 1990-07-17 | Antonello Pessi | Synthetic peptides and their use as universal carriers for the preparation of immunogenic conjugates suitable for the development of synthetic vaccines |
| JPH04506662A (ja) | 1989-07-14 | 1992-11-19 | アメリカン・サイアナミド・カンパニー | 接合体ワクチンのためのサイトカイニンおよびホルモンのキヤリヤー |
| IT1237764B (it) | 1989-11-10 | 1993-06-17 | Eniricerche Spa | Peptidi sintetici utili come carriers universali per la preparazione di coniugati immunogenici e loro impiego per lo sviluppo di vaccini sintetici. |
| SE466259B (sv) | 1990-05-31 | 1992-01-20 | Arne Forsgren | Protein d - ett igd-bindande protein fraan haemophilus influenzae, samt anvaendning av detta foer analys, vacciner och uppreningsaendamaal |
| DE69113564T2 (de) | 1990-08-13 | 1996-05-30 | American Cyanamid Co | Faser-Hemagglutinin von Bordetella pertussis als Träger für konjugierten Impfstoff. |
| US5153312A (en) | 1990-09-28 | 1992-10-06 | American Cyanamid Company | Oligosaccharide conjugate vaccines |
| EP1958646A1 (en) | 1992-02-11 | 2008-08-20 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | Dual carrier immunogenic construct |
| IT1262896B (it) | 1992-03-06 | 1996-07-22 | Composti coniugati formati da proteine heat shock (hsp) e oligo-poli- saccaridi, loro uso per la produzione di vaccini. | |
| ES2130265T3 (es) | 1992-05-06 | 1999-07-01 | Harvard College | Region de union al receptor de la toxina difterica. |
| IL102687A (en) | 1992-07-30 | 1997-06-10 | Yeda Res & Dev | Conjugates of poorly immunogenic antigens and synthetic pepide carriers and vaccines comprising them |
| AU678613B2 (en) | 1993-09-22 | 1997-06-05 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | Method of activating soluble carbohydrate using novel cyanylating reagents for the production of immunogenic constructs |
| US6455673B1 (en) | 1994-06-08 | 2002-09-24 | President And Fellows Of Harvard College | Multi-mutant diphtheria toxin vaccines |
| US5917017A (en) | 1994-06-08 | 1999-06-29 | President And Fellows Of Harvard College | Diphtheria toxin vaccines bearing a mutated R domain |
| ATE241384T1 (de) | 1995-03-22 | 2003-06-15 | Jackson H M Found Military Med | Herstellung von immunogenen konstrukten unter verwendung von löslichen kohlehydraten, die durch organische cyanylierungs-reagenzien aktiviert wurden |
| US6299881B1 (en) | 1997-03-24 | 2001-10-09 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | Uronium salts for activating hydroxyls, carboxyls, and polysaccharides, and conjugate vaccines, immunogens, and other useful immunological reagents produced using uronium salts |
| GB9713156D0 (en) | 1997-06-20 | 1997-08-27 | Microbiological Res Authority | Vaccines |
| NZ509986A (en) | 1998-08-19 | 2003-10-31 | Baxter Healthcare S | Immunogenic beta-propionamido-linked polysaccharide and oligosaccharide protein conjugates as vaccines |
| DE60038166T2 (de) | 1999-03-19 | 2009-03-12 | Glaxosmithkline Biologicals S.A., Rixensart | Impfstoff gegen bakterielle antigene |
| EP1165796A2 (en) | 1999-04-09 | 2002-01-02 | Techlab, Inc. | Recombinant clostridium toxin a protein carrier for polysaccharide conjugate vaccines |
| GB0007432D0 (en) | 2000-03-27 | 2000-05-17 | Microbiological Res Authority | Proteins for use as carriers in conjugate vaccines |
| AU2002309706A1 (en) | 2001-05-11 | 2002-11-25 | Aventis Pasteur, Inc. | Novel meningitis conjugate vaccine |
| CN102302776B (zh) * | 2003-01-30 | 2014-06-18 | 诺华疫苗和诊断有限公司 | 抗多种脑膜炎球菌血清组的可注射性疫苗 |
| US20060251675A1 (en) | 2003-03-17 | 2006-11-09 | Michael Hagen | Mutant cholera holotoxin as an adjuvant and an antigen carrier protein |
| US20050002948A1 (en) * | 2003-05-07 | 2005-01-06 | Ryall Robert P. | Method of enhanced immunogenicity to meningococcal vaccination |
| JP2006528936A (ja) * | 2003-05-07 | 2006-12-28 | アヴェンティス パストゥール インコーポレイテッド | 多価髄膜炎菌誘導体化多糖−タンパク質複合体およびワクチン |
| US8540955B2 (en) | 2007-07-10 | 2013-09-24 | Wyeth Llc | Process for producing aluminum phosphate |
| PL3831406T3 (pl) | 2010-08-23 | 2024-09-09 | Wyeth Llc | Stabilne preparaty antygenów rLP2086 Neisseria meningitidis |
| JP5976652B2 (ja) | 2010-09-10 | 2016-08-24 | ワイス・エルエルシー | 髄膜炎菌orf2086抗原の非脂質化変異体 |
| KR101763625B1 (ko) | 2012-03-09 | 2017-08-01 | 화이자 인코포레이티드 | 수막염균 조성물 및 이의 사용 방법 |
| SA115360586B1 (ar) * | 2012-03-09 | 2017-04-12 | فايزر انك | تركيبات لعلاج الالتهاب السحائي البكتيري وطرق لتحضيرها |
| EP2964665B1 (en) * | 2013-03-08 | 2018-08-01 | Pfizer Inc | Immunogenic fusion polypeptides |
| KR101905278B1 (ko) * | 2013-09-08 | 2018-10-08 | 화이자 인코포레이티드 | 나이세리아 메닌지티디스 조성물 및 그의 방법 |
| KR20190049940A (ko) * | 2015-02-19 | 2019-05-09 | 화이자 인코포레이티드 | 나이세리아 메닌지티디스 조성물 및 그의 방법 |
| AU2018215585B2 (en) | 2017-01-31 | 2022-03-17 | Pfizer Inc. | Neisseria meningitidis compositions and methods thereof |
-
2020
- 2020-09-24 EP EP20786082.6A patent/EP4034157A1/en active Pending
- 2020-09-24 AU AU2020355401A patent/AU2020355401B2/en active Active
- 2020-09-24 US US17/764,153 patent/US20220401544A1/en active Pending
- 2020-09-24 BR BR112022004921A patent/BR112022004921A2/pt unknown
- 2020-09-24 WO PCT/IB2020/058928 patent/WO2021059181A1/en active IP Right Grant
- 2020-09-24 KR KR1020227013540A patent/KR20220069992A/ko active Pending
- 2020-09-24 CN CN202080082380.1A patent/CN115605222A/zh active Pending
- 2020-09-24 MX MX2022003682A patent/MX2022003682A/es unknown
- 2020-09-24 CA CA3155669A patent/CA3155669A1/en active Pending
- 2020-09-25 JP JP2020160424A patent/JP2021066727A/ja active Pending
-
2022
- 2022-03-09 IL IL291239A patent/IL291239A/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2020355401A1 (en) | 2022-04-14 |
| EP4034157A1 (en) | 2022-08-03 |
| AU2020355401B2 (en) | 2025-03-27 |
| US20220401544A1 (en) | 2022-12-22 |
| WO2021059181A1 (en) | 2021-04-01 |
| CN115605222A (zh) | 2023-01-13 |
| MX2022003682A (es) | 2022-04-25 |
| JP2021066727A (ja) | 2021-04-30 |
| CA3155669A1 (en) | 2021-04-01 |
| IL291239A (en) | 2022-05-01 |
| BR112022004921A2 (pt) | 2022-07-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7119245B2 (ja) | 髄膜炎菌組成物およびその方法 | |
| US20220118072A1 (en) | Neisseria meningitidis compositions and methods thereof | |
| AU2020355401B2 (en) | Neisseria meningitidis compositions and methods thereof | |
| RU2839906C9 (ru) | Композиции с Neisseria meningitidis и способы их применения | |
| RU2839906C1 (ru) | Композиции с Neisseria meningitidis и способы их применения | |
| HK40081069A (en) | Neisseria meningitidis compositions and methods thereof | |
| RU2780425C2 (ru) | Композиции neisseria meningitidis и способы |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20220422 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PA0201 | Request for examination | ||
| PG1501 | Laying open of application | ||
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20250115 Patent event code: PE09021S01D |