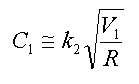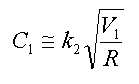KR101410019B1 - Process for producing chlorohydrin compound by reaction between polyhydric alcohol and hydrogen chloride - Google Patents
Process for producing chlorohydrin compound by reaction between polyhydric alcohol and hydrogen chloride Download PDFInfo
- Publication number
- KR101410019B1 KR101410019B1 KR1020070097675A KR20070097675A KR101410019B1 KR 101410019 B1 KR101410019 B1 KR 101410019B1 KR 1020070097675 A KR1020070097675 A KR 1020070097675A KR 20070097675 A KR20070097675 A KR 20070097675A KR 101410019 B1 KR101410019 B1 KR 101410019B1
- Authority
- KR
- South Korea
- Prior art keywords
- reactor
- reaction
- chlorohydrin
- feed
- distillation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 title claims abstract description 172
- 150000005846 sugar alcohols Polymers 0.000 title claims abstract description 34
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 title claims abstract description 31
- 229910000041 hydrogen chloride Inorganic materials 0.000 title claims abstract description 31
- 238000006243 chemical reaction Methods 0.000 title claims description 130
- 238000000034 method Methods 0.000 title claims description 71
- 230000008569 process Effects 0.000 title description 28
- -1 chlorohydrin compound Chemical class 0.000 title description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims abstract description 225
- 235000011187 glycerol Nutrition 0.000 claims abstract description 109
- 238000004821 distillation Methods 0.000 claims abstract description 94
- 238000004519 manufacturing process Methods 0.000 claims abstract description 64
- XENVCRGQTABGKY-ZHACJKMWSA-N chlorohydrin Chemical compound CC#CC#CC#CC#C\C=C\C(Cl)CO XENVCRGQTABGKY-ZHACJKMWSA-N 0.000 claims abstract description 45
- 239000003054 catalyst Substances 0.000 claims abstract description 33
- 239000000203 mixture Substances 0.000 claims abstract description 32
- 239000011541 reaction mixture Substances 0.000 claims abstract description 29
- 238000005660 chlorination reaction Methods 0.000 claims abstract description 14
- 150000007524 organic acids Chemical class 0.000 claims abstract description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 117
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 50
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 claims description 26
- SSZWWUDQMAHNAQ-UHFFFAOYSA-N 3-chloropropane-1,2-diol Chemical compound OCC(O)CCl SSZWWUDQMAHNAQ-UHFFFAOYSA-N 0.000 claims description 17
- 238000000926 separation method Methods 0.000 claims description 14
- 239000003377 acid catalyst Substances 0.000 claims description 13
- 150000002148 esters Chemical class 0.000 claims description 12
- 238000005457 optimization Methods 0.000 claims description 10
- 238000005292 vacuum distillation Methods 0.000 claims description 8
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 claims description 5
- 150000003839 salts Chemical class 0.000 claims description 5
- 238000004090 dissolution Methods 0.000 claims description 4
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical compound C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 claims description 2
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 claims description 2
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Substances OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 claims description 2
- DYPJJAAKPQKWTM-UHFFFAOYSA-N 2-chloropropane-1,3-diol Chemical compound OCC(Cl)CO DYPJJAAKPQKWTM-UHFFFAOYSA-N 0.000 claims description 2
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims description 2
- 229920000166 polytrimethylene carbonate Polymers 0.000 claims description 2
- 235000013772 propylene glycol Nutrition 0.000 claims description 2
- 150000001875 compounds Chemical class 0.000 claims 6
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 claims 1
- 150000008064 anhydrides Chemical class 0.000 claims 1
- 150000002763 monocarboxylic acids Chemical class 0.000 claims 1
- DEWLEGDTCGBNGU-UHFFFAOYSA-N 1,3-dichloropropan-2-ol Chemical compound ClCC(O)CCl DEWLEGDTCGBNGU-UHFFFAOYSA-N 0.000 abstract description 86
- 235000005985 organic acids Nutrition 0.000 abstract 1
- 235000011054 acetic acid Nutrition 0.000 description 38
- 239000000047 product Substances 0.000 description 31
- 239000007788 liquid Substances 0.000 description 27
- 239000002994 raw material Substances 0.000 description 16
- 239000000243 solution Substances 0.000 description 15
- 239000007791 liquid phase Substances 0.000 description 14
- 238000009835 boiling Methods 0.000 description 13
- 150000001735 carboxylic acids Chemical class 0.000 description 13
- 238000000066 reactive distillation Methods 0.000 description 13
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- 230000014509 gene expression Effects 0.000 description 11
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 11
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 11
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 10
- 239000006227 byproduct Substances 0.000 description 10
- 239000000460 chlorine Substances 0.000 description 10
- 229910052801 chlorine Inorganic materials 0.000 description 10
- 238000010924 continuous production Methods 0.000 description 8
- 239000003960 organic solvent Substances 0.000 description 8
- OSDWBNJEKMUWAV-UHFFFAOYSA-N Allyl chloride Chemical compound ClCC=C OSDWBNJEKMUWAV-UHFFFAOYSA-N 0.000 description 7
- 239000003225 biodiesel Substances 0.000 description 7
- 239000003513 alkali Substances 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 238000011033 desalting Methods 0.000 description 5
- 230000003647 oxidation Effects 0.000 description 5
- 238000007254 oxidation reaction Methods 0.000 description 5
- 238000007086 side reaction Methods 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 239000012808 vapor phase Substances 0.000 description 5
- ZXCYIJGIGSDJQQ-UHFFFAOYSA-N 2,3-dichloropropan-1-ol Chemical compound OCC(Cl)CCl ZXCYIJGIGSDJQQ-UHFFFAOYSA-N 0.000 description 4
- 230000002378 acidificating effect Effects 0.000 description 4
- XXROGKLTLUQVRX-UHFFFAOYSA-N allyl alcohol Chemical compound OCC=C XXROGKLTLUQVRX-UHFFFAOYSA-N 0.000 description 4
- 239000012295 chemical reaction liquid Substances 0.000 description 4
- 239000001279 citrus aurantifolia swingle expressed oil Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 4
- 239000011259 mixed solution Substances 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 239000000376 reactant Substances 0.000 description 4
- 235000011121 sodium hydroxide Nutrition 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 238000007259 addition reaction Methods 0.000 description 3
- 230000000052 comparative effect Effects 0.000 description 3
- 230000001276 controlling effect Effects 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 150000004665 fatty acids Chemical class 0.000 description 3
- 238000004508 fractional distillation Methods 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- QWPPOHNGKGFGJK-UHFFFAOYSA-N hypochlorous acid Chemical compound ClO QWPPOHNGKGFGJK-UHFFFAOYSA-N 0.000 description 3
- 238000006386 neutralization reaction Methods 0.000 description 3
- 230000035484 reaction time Effects 0.000 description 3
- 239000002699 waste material Substances 0.000 description 3
- 239000002351 wastewater Substances 0.000 description 3
- XEPXTKKIWBPAEG-UHFFFAOYSA-N 1,1-dichloropropan-1-ol Chemical compound CCC(O)(Cl)Cl XEPXTKKIWBPAEG-UHFFFAOYSA-N 0.000 description 2
- KNKRKFALVUDBJE-UHFFFAOYSA-N 1,2-dichloropropane Chemical compound CC(Cl)CCl KNKRKFALVUDBJE-UHFFFAOYSA-N 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- HGINCPLSRVDWNT-UHFFFAOYSA-N Acrolein Chemical compound C=CC=O HGINCPLSRVDWNT-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical compound ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- XYAUIVRRMJYYHR-UHFFFAOYSA-N acetic acid;propane-1,2,3-triol Chemical compound CC(O)=O.OCC(O)CO XYAUIVRRMJYYHR-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 238000005886 esterification reaction Methods 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 238000005984 hydrogenation reaction Methods 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 239000013067 intermediate product Substances 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- BDJRBEYXGGNYIS-UHFFFAOYSA-N nonanedioic acid Chemical compound OC(=O)CCCCCCCC(O)=O BDJRBEYXGGNYIS-UHFFFAOYSA-N 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- 230000001590 oxidative effect Effects 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- HVAMZGADVCBITI-UHFFFAOYSA-M pent-4-enoate Chemical compound [O-]C(=O)CCC=C HVAMZGADVCBITI-UHFFFAOYSA-M 0.000 description 2
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 2
- 238000010926 purge Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 239000000344 soap Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 238000009834 vaporization Methods 0.000 description 2
- 230000008016 vaporization Effects 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 235000019871 vegetable fat Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 235000013311 vegetables Nutrition 0.000 description 2
- OWXJKYNZGFSVRC-NSCUHMNNSA-N (e)-1-chloroprop-1-ene Chemical compound C\C=C\Cl OWXJKYNZGFSVRC-NSCUHMNNSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- AVGQTJUPLKNPQP-UHFFFAOYSA-N 1,1,1-trichloropropane Chemical compound CCC(Cl)(Cl)Cl AVGQTJUPLKNPQP-UHFFFAOYSA-N 0.000 description 1
- ZAIDIVBQUMFXEC-UHFFFAOYSA-N 1,1-dichloroprop-1-ene Chemical compound CC=C(Cl)Cl ZAIDIVBQUMFXEC-UHFFFAOYSA-N 0.000 description 1
- CSVFWMMPUJDVKH-UHFFFAOYSA-N 1,1-dichloropropan-2-one Chemical compound CC(=O)C(Cl)Cl CSVFWMMPUJDVKH-UHFFFAOYSA-N 0.000 description 1
- IFDLXKQSUOWIBO-UHFFFAOYSA-N 1,3-dichloropropan-1-ol Chemical compound OC(Cl)CCCl IFDLXKQSUOWIBO-UHFFFAOYSA-N 0.000 description 1
- 229940035437 1,3-propanediol Drugs 0.000 description 1
- PSYQXTDKRKLJQC-UHFFFAOYSA-N 1-chloropropane-1,3-diol Chemical compound OCCC(O)Cl PSYQXTDKRKLJQC-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- PPQNQXQZIWHJRB-UHFFFAOYSA-N Methylcholanthrene Chemical compound C1=CC=C2C3=CC4=CC=C(C)C(CC5)=C4C5=C3C=CC2=C1 PPQNQXQZIWHJRB-UHFFFAOYSA-N 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 238000006137 acetoxylation reaction Methods 0.000 description 1
- 238000000184 acid digestion Methods 0.000 description 1
- 150000007933 aliphatic carboxylic acids Chemical class 0.000 description 1
- 239000012670 alkaline solution Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 238000010533 azeotropic distillation Methods 0.000 description 1
- 238000010923 batch production Methods 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 238000010961 commercial manufacture process Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000006837 decompression Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 238000006735 epoxidation reaction Methods 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- ULYZAYCEDJDHCC-UHFFFAOYSA-N isopropyl chloride Chemical compound CC(C)Cl ULYZAYCEDJDHCC-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 229960003424 phenylacetic acid Drugs 0.000 description 1
- 239000003279 phenylacetic acid Substances 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- CSIGAEASXSGNKS-UHFFFAOYSA-N propane-1,1,3-triol Chemical compound OCCC(O)O CSIGAEASXSGNKS-UHFFFAOYSA-N 0.000 description 1
- ULWHHBHJGPPBCO-UHFFFAOYSA-N propane-1,1-diol Chemical compound CCC(O)O ULWHHBHJGPPBCO-UHFFFAOYSA-N 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 238000000197 pyrolysis Methods 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 150000004072 triols Chemical class 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C31/00—Saturated compounds having hydroxy or O-metal groups bound to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/62—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by introduction of halogen; by substitution of halogen atoms by other halogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/74—Separation; Purification; Use of additives, e.g. for stabilisation
- C07C29/76—Separation; Purification; Use of additives, e.g. for stabilisation by physical treatment
- C07C29/80—Separation; Purification; Use of additives, e.g. for stabilisation by physical treatment by distillation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C31/00—Saturated compounds having hydroxy or O-metal groups bound to acyclic carbon atoms
- C07C31/34—Halogenated alcohols
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
본 발명은 글리세린 등의 다가알코올로부터 염화수소를 이용한 염소화 반응에 의하여 클로로히드린을 제조하는 방법에 관한 것으로서, 다가알코올, 염화수소 및 염소화 촉매인 유기산으로 이루어진 반응혼합물 피드가 제1반응기에 공급되어 상기 제1반응기로부터 염소화 반응에 의하여 클로로히드린이 제조되며; 상기 제1반응기로부터 배출되는 클로로히드린 및 미반응된 반응혼합물을 포함하는 제1생성혼합물 피드와 추가의 다가알콜 피드가 상기 제2반응기로 공급되어 추가의 염소화반응에 의하여 클로로히드린이 제조되고; 제2반응기로부터 배출되는 클로로히드린을 포함하는 제2생성혼합물 피드가 증류컬럼에 공급되어 클로로히드린을 포함하는 증류생산물이 증류컬럼 상부로 분리되며, 상기 증류컬럼 하부로 배출되는 클로로히드린을 포함하는 증류잔류액으로부터 순환되는 재순환 피드가 상기 제1반응기로 순환되는 것을 특징으로 한다.The present invention relates to a method for producing chlorohydrin by a chlorination reaction using a hydrogen chloride from a polyhydric alcohol such as glycerol, wherein a reaction mixture feed comprising a polyhydric alcohol, hydrogen chloride and an organic acid as a chlorination catalyst is supplied to a first reactor, Chlorohydrin is prepared from the 1 reactor by chlorination reaction; A first product mixture feed comprising chlorohydrin exiting the first reactor and an unreacted reaction mixture and an additional polyhydric alcohol feed are fed to the second reactor to produce chlorohydrin by an additional chlorination reaction ; A second product mixture feed comprising chlorohydrin discharged from the second reactor is fed to the distillation column to separate the distillation product containing the chlorohydrin into the upper portion of the distillation column and the chlorohydrin discharged to the lower portion of the distillation column And a recycle feed circulating from the distillation residue containing is circulated to the first reactor.
다가알코올, 염소화, 염화수소, 글리세린, 클로로히드린, 유기산, 디클로로히드린 Polyhydric alcohols, chlorinated, hydrogen chloride, glycerin, chlorohydrin, organic acids, dichlorohydrin
Description
본 발명은 글리세린 등의 다가알코올로부터 염화수소를 이용한 염소화 반응에 의하여 에폭시 수지의 원료 물질인 에피클로로히드린의 제조에 사용되는 클로로히드린을 제조하는 방법에 관한 것이다. The present invention relates to a method for producing chlorohydrin used for the production of epichlorohydrin, which is a raw material of an epoxy resin, by chlorination reaction using hydrogen chloride from polyhydric alcohols such as glycerol.
공지된 에피클로로히드린(ECH)의 상용화된 생산 기술 중 가장 보편적인 방법은 프로필렌의 고온 (450~550도) 염소화에 의해 알릴 클로라이드(ALC)를 제조한 후, 제조된 알릴 클로라이드와 하이포아염소산 용액을 반응시켜 디클로로히드린(디클로로프로판올) 용액을 제조하고, 이어서 석회유 또는 가성소다 등의 알칼리 수용액을 사용한 디클로로히드린의 탈염산화에 의하여 에피클로로히드린을 제조하는 것이다.The most common method of commercialized production of known epichlorohydrin (ECH) is to produce allyl chloride (ALC) by high temperature (450-550 degrees) chlorination of propylene and then reacting the produced allyl chloride with hypochlorous acid To prepare a dichlorohydrin (dichloropropanol) solution, followed by the desalting and oxidation of dichlorohydrin using an aqueous alkaline solution such as lime oil or caustic soda.
상기의 방법의 경우 원료 사용 효율 측면에서 살펴볼 때, 에피클로로히드린 1몰 당 2몰의 염소가 사용되며, 2당량의 알칼리가 필요하기 때문에, 결국 이론상 25%의 염소만이 에피클로로히드린의 합성에 사용되고, 나머지는 염화수소 및 중화에 의한 염 폐기물로 전환되는 단점이 있다. 또한 반응 효율 측면에서도 상기의 방법은 다양한 부반응을 수반하여, 알릴 클로라이드 제조 시에 디클로로프로펜, 트리클로로프로판, 클로로프로펜, 디클로로프로판, 이소프로필 클로라이드 등이 생성되기 때문에 목적하는 알릴 클로라이드의 수율이 감소되고, 제조 비용이 증가하게 된다. 또한 상기의 방법에 의한 중간 생성물로서 2,3-디클로로히드린이 1,3-디클로로히드린의 약 2배 정도로 발생하지만, 에피클로로히드린으로의 전환은 1,3-디클로로히드린이 훨씬 빠르기 때문에 반응효율에 제한이 있다. 그리고 하이포아염소산의 생성을 위해 사용된 다량의 공정수로 인해 약 1~10% 정도의 저농도 디클로로히드린 용액이 생성되고, 최종적으로 에피클로로히드린을 제조한 뒤에는 염을 포함한 다량의 폐수가 발생되는 단점이 있다.In view of the efficiency of raw material use in the above method, since 2 moles of chlorine is used per mole of epichlorohydrin, and 2 equivalents of alkali is required, only 25% of chlorine in theory results in the use of epichlorohydrin And the remainder is converted to hydrochloric acid and salt waste by neutralization. Also, from the viewpoint of the reaction efficiency, since the above method involves various side reactions, dichloropropene, trichloropropane, chloropropene, dichloropropane, isopropyl chloride and the like are produced in the production of allyl chloride, And the manufacturing cost is increased. In addition, 2,3-dichlorohydrin as an intermediate product by the above-mentioned method occurs to about twice as much as 1,3-dichlorohydrin, but the conversion to epichlorohydrin is much faster than 1,3-dichlorohydrin Therefore, the reaction efficiency is limited. A large amount of process water used for the production of hypochlorous acid produces about 1 to 10% of a low concentration of dichlorohydrin solution. After the final production of epichlorohydrin, a large amount of waste water including salt is generated .
또 다른 상용화된 생산 기술로서 팔라듐 촉매 하에서 프로필렌과 아세트산의 산화 아세톡시화에 의해 알릴 아세테이트를 제조하는 단계, 제조된 알릴 아세테이트를 가수분해하여 알릴 알코올을 제조하는 단계, 이어서 액상 염산 촉매 하에서 알릴 알코올과 염소의 부가반응을 통해 2,3-디클로로히드린을 제조하는 단계, 마지막으로 알칼리 수용액을 사용한 디클로로히드린의 탈염산화 단계를 거쳐 에피클로로히드린을 제조하는 방법이 상용화되어 있다.Another commercialized production technique is to produce allyl acetate by acetoxylation of propylene and acetic acid under palladium catalyst, to produce allyl alcohol by hydrolysis of the allyl acetate produced, followed by reaction with allyl alcohol A step of producing 2,3-dichlorohydrin through the addition reaction of chlorine, and finally a method of producing epichlorohydrin through the step of desalting and oxidation of dichlorohydrin using an aqueous alkali solution.
상기의 방법은 이론상 에피클로로히드린 1몰 당 1몰의 염소가 사용되고, 알릴 클로라이드를 거치지 않으므로 부생 염화수소도 없으며, 또한 하이포아염소산 용액을 사용하지 않으므로 이론상 에피클로로히드린 1몰 당 1당량의 알칼리가 요구되며, 폐수 발생량도 적은 것이 특징이다.The above method is theoretically based on the assumption that 1 mole of chlorine per mole of epichlorohydrin is used, there is no by-product hydrogen chloride because no allyl chloride is used, and hypochlorous acid solution is not used. Therefore, in theory, 1 equivalent of alkali per 1 mole of epichlorohydrin And the amount of waste water generated is small.
이상의 기술 외에 상용화되지 않은 방법으로서 에피클로로히드린을 제조하는 방법으로는 프로필렌의 고온 염소화로 제조된 알릴 클로라이드를, 티타늄 실리칼라이트 촉매하에서 과산화수소와의 직접 에폭시화를 통해, 에피클로로히드린을 제조하는 방법, 프로필렌을 산화시켜 아크롤레인을 제조하고, 이를 염소 부가반응하여 2,3-디클로로프로판알을 얻은 후, 수소화 하여 2,3-디클로로히드린을 제조하는 방법 및 프로필렌을 산화시켜 아세톤을 제조하고, 이를 염소 부가반응하여 디클로로아세톤을 얻은 후, 수소화 하여 1,3-디클로로히드린을 제조하는 방법 등이 공지되어 있다.As a method for producing epichlorohydrin, which is not commercially available, there is a method in which allyl chloride produced by high temperature chlorination of propylene is directly produced by epoxidation with hydrogen peroxide under a titanium silicalite catalyst to produce epichlorohydrin A method of producing acrolein by oxidizing propylene to obtain 2,3-dichloropropane by chlorine addition reaction followed by hydrogenation to produce 2,3-dichlorohydrin, and a method of oxidizing propylene to produce acetone , A method in which dichloroacetone is obtained by chlorine addition reaction followed by hydrogenation to produce 1,3-dichlorohydrin, and the like.
앞서 언급한 대부분의 방법들은 모두 프로필렌과 염소를 원료로 하는 것들로서, 세계적으로 프로필렌 등의 원료 가격이 계속적으로 상승하고 있어 제조 비용의 부담이 가중되고 있다.Most of the above-mentioned methods are based on propylene and chlorine as raw materials, and the prices of raw materials such as propylene are continuously rising worldwide, which increases the manufacturing cost.
한편 환경 문제에 대한 전세계적인 관심과 제한된 석유자원에 대한 대체 노력의 결과로, 기존의 수송용 연료를 대신할 수 있는 바이오디젤 산업이 급성장하고 있으며, 이러한 바이오디젤은 유채꽃과 같은 식물성 원료를 사용하여 친환경적이고 재생 가능한 에너지원으로 주목받고 있으며, 바이오디젤 제조를 위한 가메탄올 분해반응 시에 함께 글리세린이 생성되므로 프로필렌을 대신하는 새로운 C-3 자원으로서의 글리세린 활용에 대한 관심이 높아지고 있다.On the other hand, as a result of global interest in environmental issues and efforts to substitute limited oil resources, the biodiesel industry, which can replace existing transportation fuels, is growing rapidly. Such biodiesel uses vegetable raw materials such as rape blossoms As a result, glycerin is produced in the methanol decomposition reaction for biodiesel production. Therefore, there is a growing interest in using glycerin as a new C-3 resource instead of propylene.
글리세린은 바이오디젤 부산물 외에도 기존에는 유지나 지질 등 동식물성 기 름이나 지방을 원료로 하여, 지방산을 제조하기 위한 가수분해반응, 비누를 제조하기 위한 비누화반응의 부산물로도 얻어진다.In addition to biodiesel by-products, glycerin can also be obtained as a by-product of hydrolysis to produce fatty acids and saponification reaction to produce soaps, using the same vegetable oil or fat as raw material, such as fat or oil.
최근 바이오디젤 부산물로 나오는 글리세린의 공급이 늘어나면서 전체 글리세린 공급량이 급증하여 C-3 원료로서 프로필렌을 대체할 수 있는 수준까지 가격이 하락한 상황이며, 따라서 기존 합성글리세린의 제조 방법을 뒤집어 오히려 글리세린으로부터 에피클로로히드린을 제조하는 것이 에피클로로히드린의 제조 비용이나 글리세린의 활용 측면에서 경제적으로 많은 효과를 가져올 것으로 예상된다. 이에 더하여 글리세린으로부터 에피클로로히드린을 제조하는 것은 염소 대신 여러 산업에서 부생되는 무수 염화수소 또는 액상 염산을 원료로 사용하기 때문에 큰 장점이 있다.As the supply of glycerin from biodiesel byproducts has increased recently, the supply of glycerin has increased sharply and the price has fallen to a level that can replace propylene as a raw material for C-3. Therefore, the conventional method of producing glycerin is reversed, It is expected that the production of chlorohydrin will have a great economic effect in terms of the production cost of epichlorohydrin and the utilization of glycerin. In addition, the production of epichlorohydrin from glycerin has a great advantage because it uses anhydrous hydrogen chloride or liquid hydrochloric acid as a by-product instead of chlorine as a raw material.
한편 글리세린으로부터 촉매적 염화수소화 반응에 의하여 클로로히드린으로 전환하는 방법에 대하여 독일특허공보 제197308호(1908)에 글리세린과 무수 염화수소를 카르복실산 촉매의 존재 하에서 반응시켜 모노클로로히드린(모노클로로프로판디올, MCH)과 디클로로히드린(디클로로프로판올, DCH)을 얻고 물이 부생되는 평형반응으로 구성되는 것이 공지되었다.On the other hand, a method for converting from glycerin to chlorohydrin by a catalytic hydrogenation reaction is described in German Patent Publication No. 197308 (1908) by reacting glycerin and anhydrous hydrogen chloride in the presence of a carboxylic acid catalyst to obtain monochlorohydrin Propanediol, MCH) and dichlorohydrin (dichloropropanol, DCH), and an equilibrium reaction in which water is produced as a by-product.
상기의 공지된 제조방법은 100년 전에 공지된 방법임에도 불구하고 그동안 글리세린의 가격 문제로 인하여 상업적인 활용은 이루어지지 않았으며, 최근에 글리세린의 공급 증가와 그에 따른 가격 하락이 진행됨에 따라 21세기 이후 상업화하기 위한 노력들이 시도되고 있는 상황이다. Although the above-mentioned known production method is a method known 100 years ago, commercial use has not been made due to the problem of the price of glycerin, and since the supply of glycerin has been recently increased and the price thereof has decreased, Efforts are being tried to do.
프로필렌과 염소의 반응에 의한 제조방법에 비하여 글리세린과 염화수소를 사용하여 클로로히드린을 제조하는 방법은 제조시 알릴 클로라이드 반응을 거치지 않아 부반응에 의한 유기 염화물의 발생이 현저히 감소하며, 하이포아염소산 용액을 사용하지 않으면서 직접 디클로로히드린을 제조할 수 있어 폐수량도 급감하는 장점이 있다. 이렇게 제조된 디클로로히드린은 기존의 상용화된 방법대로 석회유나 가성소다 등의 알칼리 수용액을 사용한 탈염산화를 통해 에피클로로히드린으로 전환 가능하다.Compared with the production process by the reaction of propylene and chlorine, the method of producing chlorohydrin by using glycerin and hydrogen chloride is not carried out by allyl chloride reaction during production, and the generation of organic chloride by side reaction is remarkably reduced, It is possible to directly produce dichlorohydrin without using it, and the amount of wastewater is also reduced. The dichlorohydrin thus prepared can be converted into epichlorohydrin through desalting oxidation using an aqueous alkali solution such as lime oil or caustic soda according to a conventional commercial method.
앞서 언급된 독일특허공보 제197308호(1908)에는 약 100도 (95~120도) 의 온도에서 진행되는 회분식 평형 반응에 대해 기술하고 있으며, 이 반응은 공급된 무수 염화수소가 용해된 후 진행되는 액상 반응으로서, 클로로히드린이 생성되는 방향으로 평형을 이동시키기 위한 반응수의 연속 제거는 이루어지지 않았다. 상기 공보에는 반응압력에 대하여 대기압일 수도 있고, 무수 염화수소의 용해도를 높여 반응을 촉진하기 위해 가압을 할 수도 있으며, 사용가능한 카르복실산 촉매로는 아세트산, 프로피온산, 포름산, 신남산, 아젤라산, 숙신산, 페닐아세트산 등에 대하여 기재하고 있으며, 촉매 사용량을 늘이면 부반응이 증가되어 수율이 감소하므로 촉매 사용량은 공급된 글리세린 무게 대비 약 1~2 중량%를 추천하고 있다.The above-mentioned German Patent Publication No. 197308 (1908) describes a batchwise equilibrium reaction at a temperature of about 100 degrees (95-120 degrees), which is a liquid phase reaction after the supplied anhydrous hydrogen chloride has dissolved As a reaction, there was no continuous removal of the reaction water to shift the equilibrium in the direction in which chlorohydrin was generated. In the above publication, atmospheric pressure relative to the reaction pressure may be used, or pressure may be applied to promote the reaction by increasing the solubility of anhydrous hydrogen chloride. Examples of usable carboxylic acid catalysts include acetic acid, propionic acid, formic acid, cinnamic acid, azelaic acid, , Phenylacetic acid and the like. When the amount of the catalyst used is increased, the side reaction is increased and the yield is decreased. Therefore, the amount of the catalyst is preferably about 1 to 2% by weight based on the weight of the supplied glycerin.
독일특허공보 제197309호(1908)에는 무수 염화수소 대신 액상염산 (예, 37 중량% 염산용액)을 사용하였고, 아세트산 촉매는 무수 염화수소의 경우보다 많은 양인 공급된 글리세린 무게 대비 2~30 중량%를 사용하는 것이 기재되어 있다. In German Patent Publication No. 197309 (1908), liquid hydrochloric acid (for example, 37% by weight hydrochloric acid solution) was used instead of anhydrous hydrogen chloride and acetic acid catalyst was used in an amount of 2 to 30% by weight based on the weight of glycerin supplied, which is greater than that of anhydrous hydrogen chloride. .
또한 독일특허공보 제238341호(1911)에도 무수 염화수소와 글리세린의 반응에 의한 모노클로로히드린과 디클로로히드린의 제조에 대해 공지되어 있다.German Patent Publication No. 238341 (1911) also discloses the preparation of monochlorohydrin and dichlorohydrin by reaction of anhydrous hydrogen chloride with glycerin.
이상의 공지발명들은 대기압 또는 가압 하에서 진행되는 회분식 반응으로서, 반응수의 축적으로 평형조건이 형성되어 완전 전환을 위해서는 긴 반응시간 (24~48시간)이 요구되며, 10~20시간 정도의 반응시간으로는 전환율이 높지 않고, 특히 유용한 물질인 디클로로히드린의 수율이 상당히 낮다는 문제가 있으며, 따라서 과량의 무수 염화수소를 계속적으로 공급하는 반회분식 반응을 적용하여, 디클로로히드린이 생성되는 방향으로 평형을 이동시켜 그 수율을 높이기 위한 노력들이 진행되어 왔다.The above-mentioned known inventions are batch reactions proceeding at atmospheric pressure or under pressure. The equilibrium conditions are formed by the accumulation of the reaction water, so that a long reaction time (24 to 48 hours) is required for complete conversion and a reaction time of about 10 to 20 hours There is a problem that the conversion rate is not high and the yield of dichlorohydrin which is a particularly useful substance is considerably low. Therefore, a semi-batch reaction in which an excess amount of anhydrous hydrogen chloride is continuously supplied is used to produce an equilibrium in the direction in which dichlorohydrin is produced Efforts have been made to increase the yield by moving.
Conant 등에 의하여 개시된 Organic Syntheses, Coll. Vol.1, p.292(1941)와 Organic Syntheses, Coll. Vol.2, p.29(1942)에는, 90% 글리세린과 무수 염화수소, 아세트산 촉매를 사용하는 반회분식 반응으로서 아세트산 촉매는 공급된 90% 글리세린 무게 대비 2 중량%가 사용되고, 반응은 100~110도, 대기압 하에서 진행되는 것이 기재되어 있다. 상기 Conant의 방법으로부터 계속적으로 공급되는 무수 염화수소의 용해 속도는 반응 초기에는 매우 빠르지만 반응시간의 경과에 따라 감소하므로, 반응 용기의 전체 무게 변화도 초기에는 증가하다가 일정 무게에 수렴하게 되며, 이때 반응이 종료된 것임을 알 수 있다. 상기의 Conant의 제조방법에 대하여 상세히 설명하면, 계속적으로 공급되는 무수 염화수소 중 용해되지 않은 부분은 기상으로 포집하여 흡수하게 되며, 이러한 손실량을 최소화하기 위해 반응 용기 전체 무게 변화에 따라 무수 염화수소 공급량을 조절하는 방법으로서, 반응 종료 시까지 용해된 무수 염화수소의 양(손실량 제외)이 이론적으로 요구되는 양의 125%가 용해되어 반응에 25% 과량으로 공급되며, 반응 종료 후에는 반응액을 냉각하고, 반응액 중 미반응 상태로 용해되어 있는 염산 및 아세트산을 중화하기 위해 소다회로 처리하고, 이 때 중화를 촉진하고, 생성된 염의 석출을 막기 위해 주기적으로 물을 첨가하는 것이 기재되어 있다. 또한 Conant의 제보방법에는 최종 목적물의 수득단계로서 중화 처리된 반응액은 층분리를 통해 액상층을 분리 제거하고, 남은 유기층 (미정제 디클로로히드린 용액)은 물 농도를 낮추기 위해 14 mmHg로 감압 분별 증류함으로서 상당량의 물을 68℃도 이하에서 수득하고, 68~75℃ 범위에서는 고농도의 디클로로히드린 용액을 수득하며, 이때 68℃ 이하에서 얻어진 증류액을 다시 증류하여 물을 제거함으로서 추가적으로 고농도 디클로로히드린 용액을 수득한 후, 앞서 68~75℃ 범위에서 얻어진 증류액과 합하여 이론량의 70% 정도의 고농도 디클로로히드린 용액을 제조할 수 있으며, 농도를 더 높이기 위해 이를 다시 14 mmHg로 감압 분별 증류하면 70~73℃ 범위에서 이론량의 55~57% 정도의 디클로로히드린 용액을 제조할 수 있음을 기재하고 있다.Organic Syntheses, < RTI ID = 0.0 > Coll. Vol. 1, p. 292 (1941) and Organic Syntheses, Coll. Vol.2, p.29 (1942), a semi-batch reaction using 90% glycerin, anhydrous hydrogen chloride, and an acetic acid catalyst, an acetic acid catalyst is used in an amount of 2% by weight based on the weight of 90% glycerin supplied, , And it proceeds under atmospheric pressure. Since the dissolution rate of anhydrous hydrogen chloride continuously supplied from the Conant method is very fast at the beginning of the reaction but decreases with the lapse of the reaction time, the overall weight change of the reaction vessel also increases at first and then converges to a certain weight, Is completed. The method of producing Conant is described in detail. The unreacted portion of the anhydrous hydrogen chloride continuously supplied is collected and absorbed in the vapor phase. In order to minimize the amount of loss, the supply amount of anhydrous hydrogen chloride , 125% of the theoretically required amount of the anhydrous hydrogen chloride (exclusive of the loss) dissolved until the end of the reaction is dissolved and supplied to the reaction in an excess amount of 25%. After completion of the reaction, the reaction solution is cooled, It has been described that water is periodically added in order to neutralize hydrochloric acid and acetic acid dissolved in an unreacted state in the liquid and to neutralize the resulting salt and prevent precipitation of the resulting salt. In Conant's report, the liquid phase was separated and removed from the neutralized reaction solution by layer separation, and the remaining organic layer (microcrystalline dichlorohydrin solution) was reduced to 14 mmHg in order to lower the water concentration By distillation, a considerable amount of water is obtained at 68 ° C or less, and a high concentration of dichlorohydrin solution is obtained at 68 to 75 ° C. At this time, the distillate obtained at 68 ° C or less is distilled again to remove water, After adding the distilled solution obtained in the range of 68 to 75 ° C, it is possible to prepare a high concentration dichlorohydrin solution of about 70% of the theoretical amount. To further increase the concentration, it is further subjected to reduced pressure fractionation distillation It is possible to produce a dichlorohydrin solution of about 55 to 57% of the theoretical amount in the range of 70 to 73 ° C.
상기한 Conant 등의 방법은 무수 염화수소의 손실량이 많고, 반응수도 계속 축적되며, 미반응 염산과 아세트산의 중화 처리 및 물과 디클로로히드린의 분리 과정에서 디클로로히드린의 손실이 많이 발생하며, 또한 복잡한 분리 과정을 거쳐서도 디클로로히드린만을 회수하기는 매우 어렵다는 단점을 갖고 있다.The above-mentioned method of Conant et al. Has a large amount of loss of anhydrous hydrogen chloride and continues accumulation of the reaction, and there is a lot of loss of dichlorohydrin in the neutralization treatment of unreacted hydrochloric acid and acetic acid and in the separation of water and dichlorohydrin, It has a disadvantage that it is very difficult to recover dichlorohydrin even after the separation process.
한편 약 120℃ 이상의 온도에서 반응을 진행하여 생성되는 반응수의 일정량을 계속적으로 증류 제거하는 반회분식 반응증류를 적용하여, 디클로로히드린이 생성되는 방향으로 더욱 평형을 이동시켜 그 수율을 높이기 위한 제조방법들도 오래전부터 공지되어 있다. 이러한 제조방법들은 승온된 온도에서 반응이 진행되므로 재활용이 불가능한 상당량의 클로로히드린 글리세라이드, 수지성 고분자, 이와 유사한 고비점의 부반응 잔류물이 생성된다. 또한 승온된 온도에서 증류도 동시에 진행되므로, 반응물로부터 제거된 반응 증류액은 상당량의 디클로로히드린 (비점이 높지만 물과 공비를 형성하므로 상당량 물과 같이 제거됨)과 염산, 아세트산이 함유된 부식성의 액상 산성 혼합물로서, 이로부터 디클로로히드린을 회수하기는 매우 어렵게 된다. 이와 관련하여 미국등록특허 제2,198,600호(1940)에는 반응 종료 후 잔류액을 감압분별증류에 의하여 상당량의 물이 제거된 디클로로히드린을 얻고, 반응 중 제거된 반응 증류액은 적절한 유기 용매를 사용하여 디클로로히드린을 추출해 낸 후, 추출액을 분별증류하여 추가의 무수 디클로로히드린을 얻는 방법이 기술되어 있다.On the other hand, a semi-batch reactive distillation method in which the reaction is continued at a temperature of about 120 ° C or higher to continuously distill off a certain amount of the produced reaction water is further applied so as to move the equilibrium further in the direction of dichlorohydrin, Methods have also been known for a long time. These processes produce a significant amount of chlorohydrin glycerides, resinous polymers, and similar high-boiling side reaction residues that can not be recycled because the reaction proceeds at elevated temperatures. In addition, the distillation proceeds at the elevated temperature. Therefore, the reactive distillation liquid removed from the reactant contains a considerable amount of dichlorohydrin (which has a high boiling point but forms an azeotropic ratio with water and thus is removed as much as water) and a corrosive liquid containing hydrochloric acid and acetic acid As an acidic mixture, it becomes very difficult to recover dichlorohydrin. In this connection, U.S. Patent No. 2,198,600 (1940) discloses that after the completion of the reaction, the residue is subjected to reduced pressure fractional distillation to obtain dichlorohydrin in which a considerable amount of water has been removed, and the reactive distillate removed during the reaction is purified using an appropriate organic solvent After extracting dichlorohydrin, the extraction solution is fractionally distilled to obtain additional anhydrous dichlorohydrin.
미국등록특허 제2,144,612호(1939)에는 대기압, 감압 또는 가압 조건에서 무수 염화수소 또는 액상 염산과 아세트산 또는 포름산과 같은 지방족 카르복실산 촉매를 사용하는 반회분식 반응증류를 적용하면서도, 재활용이 불가능한 고비점 부반응 잔류물의 생성을 억제하기 위해 저온에서 반응이 진행되도록 하고, 디클로로히드린의 물과의 공비증류를 억제하여 물만을 충분히 증류 제거하기 위한 두 가지 목적을 동시에 달성하기 위해 적절한 유기 용매의 사용을 기재하고 있다. 이때 사용되는 유기 용매는 반응성이 없어야 하고, 디클로로히드린을 쉽게 용해하며, 물과는 혼합되지 않아야 하며, 또한 반응 온도는 사용하는 유기 용매에 따라 달라지며, 일반적으로 반응혼합물(용매 포함)의 스팀증류 온도 정도 (100℃ 이하 또는 이를 크게 넘지 않는 온도로서, 반응 구역을 떠나는 증기상 혼합물의 온도 정도)에서 진 행된다. 이렇게 반응 중에 제거된 산성 증류액은 물과 염산 및 소량의 아세트산, 용매, 디클로로히드린으로 구성되어 있으며, 반응증류가 종료된 후 폐기하거나 또는 염산의 활용도를 높이기 위해 80~95℃의 온도에서 추가의 글리세린으로 염산을 소화하는 반응을 진행한 후 다음 반응 배치에 활용하게 되며, 필요에 따라서는 염산 소화반응 시에 글리세린과 함께 용매도 투입하여 물을 제거하기도 한다. 한편 상기한 방법에 의해서도 반응증류에 의해 더 이상 산성 증류액이 발생하지 않는 반응 종료 시간은 35시간 이상이며, 반응 종료 후에는 남은 반응 혼합물을 냉각하고, 분별증류를 통해 물, 디클로로히드린, 유기 용매 및 모노클로로히드린 및 미반응 글리세린으로 구성되는 고비점 잔류물을 각각 분리한다. 분리된 물은 폐기하고, 회수된 유기 용매는 재활용하며, 고비점 잔류물은 다음 반응 배치에 활용한다.U.S. Patent No. 2,144,612 (1939) discloses a process for the preparation of a high boiling point non-recyclable intermediate product which is capable of being subjected to semi-batch reaction distillation using anhydrous hydrogen chloride or liquid hydrochloric acid and an aliphatic carboxylic acid catalyst such as acetic acid or formic acid under atmospheric pressure, Described is the use of a suitable organic solvent in order to allow the reaction to proceed at low temperature to inhibit the formation of residues and to simultaneously achieve the two objectives of distilling off only the water by suppressing the azeotropic distillation of dichlorohydrin with water have. The organic solvent used should be non-reactive, easily soluble in dichlorohydrin, not mixed with water, and the reaction temperature will vary depending on the organic solvent used. Generally, steam of the reaction mixture (including solvent) (At a temperature not exceeding 100 DEG C or significantly lower than the distillation temperature, about the temperature of the vapor phase mixture leaving the reaction zone). The acid distillate removed during the reaction is composed of water, hydrochloric acid, and a small amount of acetic acid, a solvent, and dichlorohydrin. After the reactive distillation is completed, the acid distillate is added at a temperature of 80 to 95 ° C Of glycerin, and then used in the next reaction arrangement. If necessary, the solvent may be removed by adding a solvent together with glycerin during the hydrochloric acid digestion reaction. On the other hand, according to the above-mentioned method, the reaction termination time at which the acid distillate is no longer generated by reactive distillation is 35 hours or more. After the completion of the reaction, the remaining reaction mixture is cooled and water, dichlorohydrin, Solvent and a high boiling point residue composed of monochlorohydrin and unreacted glycerin, respectively. The separated water is discarded, the recovered organic solvent is recycled, and the high boiling point residue is used in the next reaction arrangement.
또한 미국등록특허 제2,144,612호(1939)에는 무수 염화수소와 글리세린 및 아세트산 촉매를 반응기에 연속적으로 공급하면서, 실질적으로 반응이 진행된 반응 혼합액 중 일정량을 연속적으로 빼내어 분별증류에 의해 물을 제거하고, 원하는 디클로로히드린 생산물만을 분리하며, 회수된 용매와 미반응 글리세린, 모노클로로히드린, 아세트산 촉매는 반응기로 다시 순환시키며, 반응증류에 의해 증기상으로 제거된 산성 증류액 중 유기 용매층은 다시 반응기로 되돌려지고, 액상층은 폐기되고, 글리세린은 디클로로히드린 생산량에 상당하는 양으로 연속 공급되며, 아세트산 촉매는 산성 증류액 중 폐기되는 액상층에 함유되어 손실되는 양 만큼 연속 공급하는 것을 특징으로 하는 연속 반응증류 공정에 대하여 기재하고 있다.US Patent No. 2,144,612 (1939) discloses a method in which anhydrous hydrogen chloride, glycerin and an acetic acid catalyst are continuously supplied to a reactor while continuously removing a predetermined amount of a reaction mixture from which reaction has substantially progressed, removing water by fractional distillation, The organic solvent layer in the acidic distillate removed by vaporization by reactive distillation is returned to the reactor again. The organic solvent is removed from the distillation column, Characterized in that the liquid phase is discarded and the liquid phase is discarded and the glycerin is continuously supplied in an amount corresponding to the amount of dichlorohydrin production and the acetic acid catalyst is continuously fed by the amount contained in the liquid phase discarded in the acidic distillate, The distillation process is described.
이상의 20세기에 소개된 기술들을 정리해보면 크게 회분식 반응, 반회분식 반응 (HCl 연속 공급), 반회분식 반응증류 (HCl 연속 공급 및 기상으로 물 연속 제거), 연속 반응증류 (HCl, 글리세린, 산 촉매 연속 공급, 기상(반응증류) 및 액상으로 물 연속 제거)로 구분되며, 이들 모두 카르복실산, 특히 아세트산을 촉매로 사용하고 있는 공통점이 있다. 이들 선행발명들에 기재된 내용으로부터 알 수 있는 기술적 특징들을 요약하면 다음과 같다.The technologies introduced in the 20th century are summarized as follows: batch reaction, semi-batch reaction (continuous supply of HCl), semi-batch reaction distillation (continuous supply of HCl and continuous water removal by gas phase), continuous reaction distillation (HCl, glycerin, (Reactive distillation), and continuous removal of water in liquid phase), all of which have carboxylic acid, especially acetic acid, as catalysts. Technical characteristics that can be known from the contents described in these prior inventions are summarized as follows.
- 글리세린은 순수 글리세린에만 국한되어 있지는 않고, 사용되는 HCl도 무수 염화수소와 액상 염산이 모두 가능하다.- Glycerin is not limited to pure glycerin, and both HCl used and anhydrous hydrogen chloride and liquid hydrochloric acid are available.
- 무수 염화수소를 사용하는 경우에 촉매 사용량은 투입된 글리세린 무게 대비 1~5 중량%이며, 액상 염산을 사용하는 경우에는 다량의 물을 포함하여 반응이 느리므로 투입된 글리세린 무게 대비 2~30 중량% 정도로 촉매를 사용한다.- When anhydrous hydrogen chloride is used, the amount of the catalyst used is 1 to 5 wt% based on the weight of the glycerin supplied, and when using liquid hydrochloric acid, the reaction is slow due to a large amount of water. Lt; / RTI >
- 회분식 반응 또는 반회분식 반응의 경우에는 120℃ 이하의 온도에서 반응이 진행되고, 반회분식 반응증류 또는 연속 반응증류의 경우에는 주로 120℃ 이상의 온도에서 반응증류가 진행되며, 용매 사용 또는 감압조건의 채용으로 반응증류 온도를 낮출 수 있다.In the case of the batch reaction or the semi-batch reaction, the reaction proceeds at a temperature of 120 ° C. or less. In the case of semi-batch reaction or continuous reaction distillation, the reaction distillation proceeds mainly at a temperature of 120 ° C. or higher. The adoption of this method can lower the reactive distillation temperature.
- 회분식 반응 또는 반회분식 반응의 경우에는 대기압 또는 가압 (무수 염화수소 사용시 용해도 증가 목적) 조건에서 반응이 진행되고, 반회분식 반응증류 또는 연속 반응증류의 경우에는 대기압, 감압 또는 가압 조건에서 반응증류가 진행된다.In the case of batch reaction or semi-batch reaction, the reaction proceeds under atmospheric pressure or pressurization (for the purpose of increasing the solubility when using anhydrous hydrogen chloride). In case of semi-batch reaction or continuous reaction distillation, reactive distillation proceeds under atmospheric pressure, do.
- 상기 공정들은 모두 완전 반응에 걸리는 시간은 24~48시간 정도로 길며, 반응 잔류액으로부터 물을 제거하고, 디클로로히드린만을 분리해내기 위해 감압하 에 분별증류한다.- All of the above processes take about 24 to 48 hours to complete reaction. Water is removed from the reaction residue, and fractional distillation under reduced pressure is performed to separate only dichlorohydrin.
상기의 공지기술들은 글리세린의 높은 가격, 긴 반응 종료 시간 및 분리 공정의 어려움 등으로 상업적인 활용이 이루어지지 않았으나, 21세기 이후 글리세린의 가격 하락, 프로필렌 및 염소의 가격 상승, 에폭시 수지의 수요 증가 등의 상황이 도래하여, 에피클로로히드린 제조의 중간 생성물로서의 디클로로히드린에 대한 관심이 증가하고 있으며, 이에 글리세린을 원료로 한 디클로로히드린 및 에피클로로히드린의 제조방법에 대한 특허들이 출원되었다.These prior arts have not been used commercially due to the high price of glycerin, long reaction termination time and difficulty in separation process. However, since the 21st century, there has been a decrease in the price of glycerin, an increase in the prices of propylene and chlorine, With the advent of epichlorohydrin, interest in dichlorohydrin as an intermediate in the production of epichlorohydrin has increased, and patents have been filed on methods for producing dichlorohydrin and epichlorohydrin from glycerin.
Spolek이 최근 출원한 국제공개특허 WO05/021476에는 무수 염화수소, 글리세린, 아세트산 촉매를 연속적으로 공급하는 연속 생산 기술이 공지되었다. Spolek의 제조방법은 20세기 초에 공지된 기존의 회분식/반회분식 반응과 유사하게 대기압 또는 무수 염화수소의 용해도 향상을 위한 가압 조건에서 운전되며, 온도는 100~110℃ 범위를 추천한다. 또한 상기 제조방법에서의 연속 공정 구성은 미국등록특허 제2,144,612호(1939)에서 공지된 연속 반응증류와 유사한 것으로, 단지 액상으로만 물을 제거하는 식으로 변형을 준 것이며, 그 상세한 공정 구성은 아래와 같다.In WO 05/021476, which is recently filed by Spolek, a continuous production technique for continuously feeding anhydrous hydrogen chloride, glycerin, and acetic acid catalyst is known. The preparation method of Spolek is operated under pressurized conditions for improving the solubility of atmospheric or anhydrous hydrogen chloride similar to the conventional batch / semi-batch reaction known at the beginning of the 20th century, and the temperature is preferably in the range of 100 to 110 ° C. Also, the continuous process configuration in the above production method is similar to the continuous reaction distillation known from U.S. Patent No. 2,144,612 (1939), and is a modification in which water is removed only in a liquid phase. same.
- 제 1 실시태양은 반응액을 반응기와 증류 컬럼을 통해 연속적으로 순환시키는 방법을 채용하는 것으로서, 반응기 액상으로부터 연속적으로 반응액을 뽑아 내어, 반응생성물(반응수 및 디클로로히드린) 제거를 위하여 감압 증류 컬럼에서 디클로로히드린과 반응수를 생산물로서 얻고 증류 잔류물은 다시 반응기로 순환된 다. 이 때 이 증류 잔류물 중 일부는 반응기가 아닌 2차 감압 증류 컬럼으로 보내지며, 이 컬럼 상부에서 디클로로히드린과 모노클로로히드린을 회수하여 다시 반응기로 되돌리고, 하부의 증류 잔류물은 원하지 않는 고비점 폐기물로서 별도 처리된다. The first embodiment employs a method in which the reaction liquid is continuously circulated through the reactor and the distillation column. The reaction liquid is continuously withdrawn from the reactor liquid phase, and the reaction product (reaction water and dichlorohydrin) In the distillation column, dichlorohydrin and the reaction water are obtained as a product, and the distillation residue is circulated back to the reactor. At this time, a part of the distillation residue is sent to a secondary, non-reactive distillation column, from which dichlorohydrin and monochlorohydrin are recovered and returned to the reactor, while the lower distillation residue has an undesirable high And treated separately as point waste.
- 제 2 실시태양은 1~3기의 반응기들을 케스케이드로 연결한 후 흐름을 순차적으로 거치게 하는 것으로서, 이 경우 1차 반응기에는 무수 염화수소, 글리세린, 아세트산 촉매가 연속적으로 투입되고, 2차 이후의 반응기들에는 무수 염화수소와 손실 촉매 보충분이 연속적으로 투입된다. 1차 반응기의 액상으로부터 연속적으로 반응액을 뽑아내어 1차 증류 컬럼에서 디클로로히드린과 반응수를 생산물로서 얻고 증류 잔류물은 2차 반응기로 보내진다. 다시 2차 반응기의 액상으로부터 연속적으로 반응액을 뽑아 내어 2차 증류 컬럼에서 디클로로히드린과 반응수를 생산물로서 얻고 증류 잔류물은 3차 반응기로 보내진다. 이러한 과정을 순차적으로 거친 후 마지막 반응기에 연결된 증류 컬럼에서 또 다시 디클로로히드린과 반응수를 생산물로서 얻고 증류 잔류물은 회수용 감압 증류 컬럼으로 보내진다. 이 컬럼 상부에서 얻어진 디클로로히드린과 모노클로로히드린은 1차 반응기로 되돌려지며, 하부의 최종 증류 잔류물은 원하지 않는 고비점 폐기물로서 별도 처리된다.In the second embodiment, the first to third reactors are cascade-connected, and then the flow is sequentially passed. In this case, anhydrous hydrogen chloride, glycerin, and acetic acid catalyst are continuously fed into the first reactor, The anhydrous hydrogen chloride and the lost catalyst supplement are continuously introduced. The reaction liquid is continuously withdrawn from the liquid phase of the first reactor to obtain dichlorohydrin and reactive water as a product in the primary distillation column and the distillation residue is sent to the secondary reactor. The reaction liquid is continuously withdrawn from the liquid phase of the secondary reactor to obtain dichlorohydrin and the reaction water as a product in the secondary distillation column and the distillation residue is sent to the tertiary reactor. After this process, the dichlorohydrin and the reaction water are again obtained as the product from the distillation column connected to the last reactor, and the distillation residue is sent to the distillation column for recovery. The dichlorohydrin and monochlorohydrin obtained at the top of this column are returned to the primary reactor and the bottom distillation residue is treated separately as undesired high boiling point waste.
Dow사에 의하여 출원된 국제공개특허 WO06/020234에도 상기 Spolek의 국제공개특허에 공지된 공정과 유사한 연속 공정이 공지되어 있다. Dow사의 공개특허에서는 상기 Spolek의 국제공개특허와 달리 "상당량의 물을 제거하지 않음"을 강조하고 있으나, 가장 유용한 생성물인 디클로로히드린을 연속 생산하면서, 반응에 의해 함께 생성되는 물을 거의 제거하지 않으면, 반응계 내에 물이 계속적으로 축적되어 반응기 크기를 초과하게 될 것이기 때문에 연속 공정에서는 구현이 어려우며, 따라서 Dow 특허의 "상당량의 물을 제거하지 않음"은 연속 공정이 아닌 회분식 또는 반회분식 반응에서 당연히 형성되는 조건이라 할 수 있으며, 실시예도 모두 반회분식 반응의 경우만이 개시되어 있다. 한편 Dow 특허에서는 이미 20세기의 선행 기술들에서 공지된 무수 염화수소의 용해도 향상을 위한 가압조건과 유사하게 가압 조건으로 공급되는 무수 염화수소의 부분압을 구체적으로 제시하고 있으며, 이는 기존에 알려진 가압 반회분식 반응 공정에 통상 채용가능한 범위에서의 가압 압력을 채용한 것이라 할 수 있다.International patent application WO06 / 020234, filed by Dow, also discloses a continuous process similar to that known in the above Spolek international patent application. Unlike the international patent of Spolek, Dow's patent discloses that "do not remove a significant amount of water" but emphasizes that the most useful product, dichlorohydrin, is continuously produced, It is difficult to implement in a continuous process because the water will continue to accumulate in the reaction system beyond the reactor size and thus the "do not remove a significant amount of water" of the Dow patent is of course not in the continuous process but in the batch or semi-batch reaction And all of the examples are disclosed only in the case of a semi-batch reaction. On the other hand, the Dow patent specifically discloses the partial pressure of anhydrous hydrogen chloride supplied under the pressurization conditions similar to the pressurization conditions for improving the solubility of anhydrous hydrogen chloride already known in the prior art of the 20th century, It can be said that the pressurizing pressure in the range generally applicable to the process is adopted.
Solvay 사가 출원한 국제공개특허 WO05/054167에는 액상 염산과 글리세린을 연속적으로 공급하는 클로로히드린의 제조방법이 공지되어 있다. 상기 Solvay 사의 연속 공정 구성은 미국등록특허 제2,144,612호(1939)에서 공지된 연속 반응증류와 유사한 것으로서, 반응증류에 의해 기상으로 물을 제거할 때 함께 손실되는 디클로로히드린을 줄이기 위해 별도의 증류 컬럼을 추가로 두고 있으나, 디클로로히드린의 손실을 조금이라도 더 줄이기 위해 추가로 증류 컬럼을 두는 것은 관용적 수단의 채용이라 할 수 있으므로 본질적으로는 미국등록특허 제2,144,612호(1939)에서 공지된 공정구성과 동일한 것이라 할 수 있으며, 상세한 공정 구성은 아래와 같다.WO05 / 054167, filed by Solvay, discloses a process for the production of chlorohydrin which continuously feeds liquid hydrochloric acid and glycerin. The continuous process configuration of the Solvay company is similar to the continuous reaction distillation known from U.S. Patent No. 2,144,612 (1939), which is a separate distillation column to reduce the amount of dichlorohydrin that is lost together with water when the gas is removed by reactive distillation However, since addition of a distillation column in order to further reduce the loss of dichlorohydrin can be regarded as adoption of conventional means, essentially the process configuration disclosed in U.S. Patent No. 2,144,612 (1939) And the detailed process configuration is as follows.
- 반응증류 조건에서 가동되는 반응기, 반응기 증기상과 연결된 증류 컬럼, 반응기 액상과 연결된 증류 컬럼으로 구성되어 있으며, 증기상과 연결된 컬럼의 상부로 물이 제거되고, 액상과 연결된 컬럼의 상부로 디클로로히드린 생산물을 수득하며, 두 컬럼의 하부 액상은 공히 반응기로 재순환된다.- a reactor which is operated under reactive distillation conditions, a distillation column connected to the reactor vapor phase, and a distillation column connected to the reactor liquid phase, where water is removed to the top of the column connected to the vapor phase, The bottom product of the two columns is recycled back to the reactor.
- 임의로 반응기 액상과 연결된 증류 컬럼 없이 증기상과 연결된 증류 컬럼만 가동할 수도 있으며, 이 경우에는 증류 컬럼 상부에서 발생하는 증류액을 층분리한 후 유기층에서 디클로로히드린을 얻는다.- Only the distillation column connected to the vapor phase may be operated without a distillation column optionally connected to the liquid phase of the reactor. In this case, the distillation liquid generated in the upper part of the distillation column is separated and dichlorohydrin is obtained in the organic layer.
상기한 최근의 제조방법들이 20세기에 공지된 제조방법에 비하여 단순한 공정인 것처럼 보이는 것은 순수한 디클로로히드린을 얻기 위한 복잡한 분리 공정을 채용하지 않는 것에 기인하며, 이는 에피클로로히드린을 제조하기 위한 출발물질로서 채용되는 디클로로히드린은 순수한 무수 디클로로히드린일 필요가 없고 물을 포함하고 있어도 이후 공정상 문제가 없기 때문에 디클로로히드린과 물을 완벽히 분리할 필요가 없다는 점때문이라 할 수 있으며, 따라서 최근에 공지된 제조방법들의 구성적 특징은 20세기에 공지된 글리세린으로부터 클로로히드린을 제조하는 방법의 그것과 크게 다르지 않은 것이라 할 수 있다.The above-mentioned recent manufacturing methods appear to be a simple process as compared to the production methods known in the 20th century due to the fact that they do not employ a complicated separation process for obtaining pure dichlorohydrin, which leads to the start of production of epichlorohydrin Dichlorohydrin employed as a material does not need to be pure anhydrous dichlorohydrin and it does not need to completely separate dichlorohydrin and water because it does not have any problems in the subsequent process even if it contains water, Can be said to be no different from that of the method of producing chlorohydrin from glycerin known in the 20th century.
본 발명자들은 제1반응기와 제2반응기에 투입되는 다가알코올과 제1반응기로 순환되는 재순환 피드의 유량, 제2반응기로 공급되는 피드 중 남아있는 미반응 염산의 농도 및 제2반응기로 투입되는 추가의 다가알코올 피드의 양 등을 제어함으로서 상업생산 시 경제적이고 고효율로 클로로로히드린을 제조할 수 있다는 점으로부터 본 발명을 완성하였으며, 본 발명의 목적은 글리세린 등의 다가알코올로부터 염화수소를 이용한 염소화 반응에 의하여 클로로히드린을 상업적 규모로 효과적으로 제조하는 방법을 제공하는 것이다.The present inventors have found that the flow rate of the recycle feed circulated in the first reactor and the first reactor and the amount of the unreacted hydrochloric acid remaining in the feed supplied to the second reactor, The present invention has been accomplished on the basis of the fact that chlorohydrin can be produced economically and efficiently with high efficiency in commercial production by controlling the amount of polyhydric alcohol feed of the polyhydric alcohol such as glycerin. To provide a method for effectively producing chlorohydrin on a commercial scale.
상기와 같은 목적을 달성하기 위하여 안출된 본 발명에 따른 클로로히드린의 제조방법은 다가알코올, 염화수소 및 염소화 촉매인 유기산으로 이루어진 반응혼합물 피드가 제1반응기에 공급되어 상기 제1반응기로부터 염소화 반응에 의하여 클로로히드린이 제조되며; 상기 제1반응기로부터 배출되는 클로로히드린 및 미반응된 반응혼합물을 포함하는 제1생성혼합물 피드와 추가의 다가알콜 피드가 상기 제2반응기로 공급되어 추가의 염소화반응에 의하여 클로로히드린이 제조되고; 제2반응기로부터 배출되는 클로로히드린을 포함하는 제2생성혼합물 피드가 증류컬럼에 공급되어 클로로히드린을 포함하는 증류생산물이 증류컬럼 상부로 분리되며; 상기 증류컬럼 하부로 배출되며 클로로히드린을 포함하는 증류잔류액 일부의 재순환 피드가 상기 제1반응기로 순환되는 것을 특징으로 한다.In order to achieve the above object, the present invention provides a method for producing chlorohydrin, which comprises feeding a reaction mixture feed comprising a polyhydric alcohol, hydrogen chloride and an organic acid as a chlorination catalyst to a first reactor, Chlorohydrin is prepared; A first product mixture feed comprising chlorohydrin exiting the first reactor and an unreacted reaction mixture and an additional polyhydric alcohol feed are fed to the second reactor to produce chlorohydrin by an additional chlorination reaction ; A second product mixture feed comprising chlorohydrin exiting the second reactor is fed to the distillation column to separate the distillation product comprising the chlorohydrin into the upper portion of the distillation column; And a recycle feed of a part of the distillation residue discharged to the lower portion of the distillation column and containing chlorohydrin is circulated to the first reactor.
본 발명의 제조방법에 있어서 제1반응기로부터 배출되는 제1생성혼합물 피드 중 미반응된 반응혼합물은 다가알코올, 염화수소, 유기산 촉매 및 물을 포함하며, 제1반응기로 순환되는 재순환 피드는 클로로히드린 및 미반응 다가알코올을 포함하며, 증류컬럼 상부로부터 분리되는 증류생산물은 클로로히드린, 유기산 촉매 및 물을 포함하고, 상기 증류생산물 중 클로로히드린의 함량은 50 내지 90중량%로 유지하는 것이 공정의 경제성 및 효율성을 높일 수 있으며, 상기 증류생산물은 감압증류에 의하여 분리되는 것이 바람직하다.In the production process of the present invention, the unreacted reaction mixture in the first product mixture feed discharged from the first reactor comprises a polyhydric alcohol, a hydrogen chloride, an organic acid catalyst and water, and the recycle feed circulated to the first reactor is chlorohydrin And an unreacted polyhydric alcohol, wherein the distillation product separated from the upper portion of the distillation column comprises chlorohydrin, an organic acid catalyst and water, and the content of chlorohydrin in the distillation product is maintained at 50 to 90 wt% And it is preferable that the distillation product is separated by distillation under reduced pressure.
상기 제1반응기의 반응온도는 70 내지 140℃가 바람직하며, 상기 제1반응기의 반응온도는 재순환 피드의 온도와 무수 염화수소의 용해열을 열원으로 하여 상기의 반응온도를 유지하는 것이 가능하다.The reaction temperature of the first reactor is preferably 70 to 140 ° C. The reaction temperature of the first reactor can be maintained at the reaction temperature by using the temperature of the recycle feed and the heat of dissociation of anhydrous hydrogen chloride as a heat source.
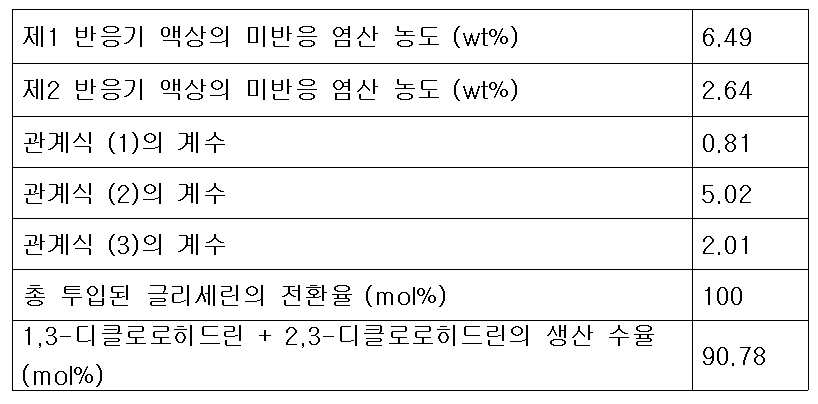
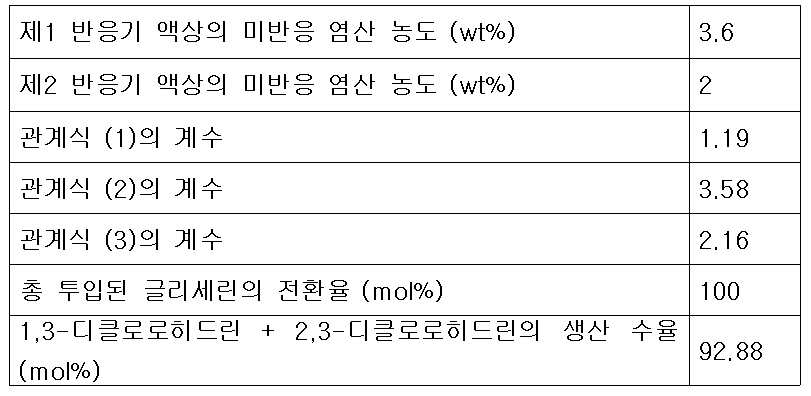
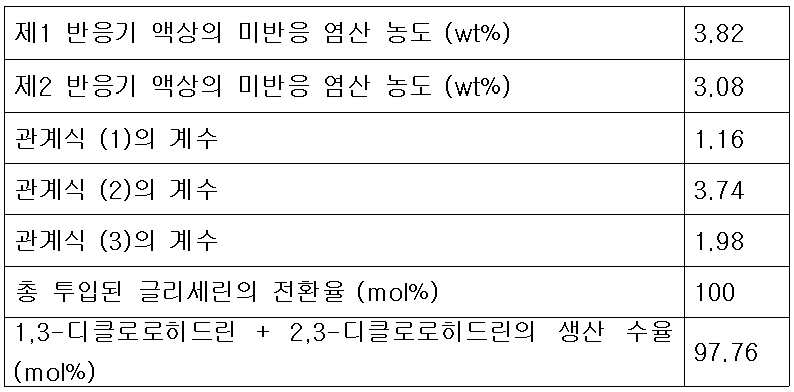
또한 본 발명은 상기 제1반응기 및 제2반응기에 투입되는 다가알코올 유량과 재순환 피드 유량의 비가 하기의 식 (1)을 만족하는 것을 특징으로 한다.Further, the present invention is characterized in that the ratio of the flow rate of the polyhydric alcohol fed into the first reactor and the flow rate of the recycle feed into the first reactor and the second reactor satisfies the following formula (1).
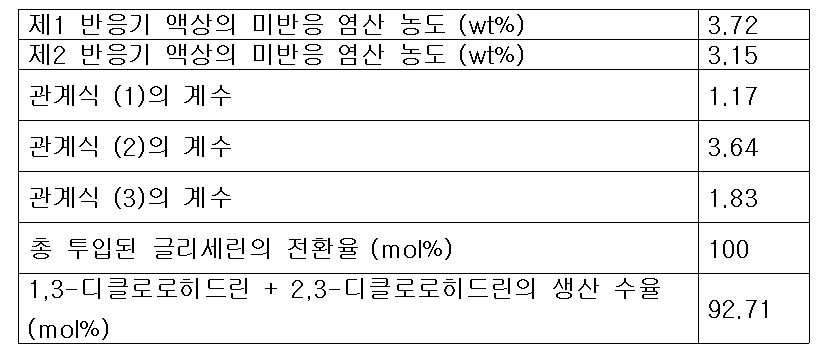
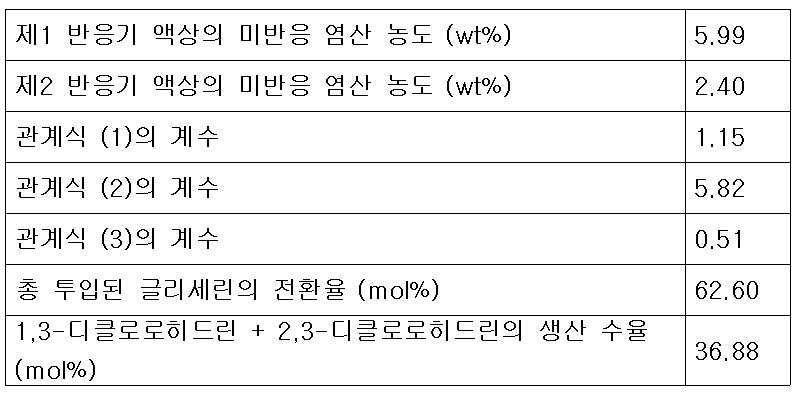
(1) (One)
상기 식 (1)에서 V1은 제1반응기의 유효 부피(ℓ)이고, G는 제1반응기 및 제2반응기에 투입되는 다가알코올의 총 투입 유량(kg/hr)이며, R은 증류컬럼에서 제1반응기로 순환되는 재순환 피드의 유량(kg/hr)이며, k1은 유량 최적화 상수로서 0.3 내지 5 kg/(ℓ-hr)의 값이 바람직하며, 상기 유량 최적화 상수 k1은 0.5 내지 1.5 kg/(ℓ-hr)인 것이 더욱 바람직하다.In the formula (1) V 1 is the effective volume (ℓ) of the first reactor, G is a polyvalent total input flow rate (kg / hr) of the alcohol that is added to the first reactor and the second reactor, R is the distillation column (Kg / hr) of the recycle feed circulated to the first reactor, k 1 is preferably a value of 0.3 to 5 kg / (ℓ-hr) as the flow rate optimization constant, and the flow rate optimization constant k 1 is 0.5 to 1.5 kg / (ℓ-hr).
또한 본 발명에 따른 클로로히드린의 제조방법은 제2반응기로 공급되는 피드 중 존재하는 미반응 염산의 농도와의 관계를 하기 식(2)의 관계를 만족하도록 하는 것을 특징으로 한다.The method for producing chlorohydrin according to the present invention is characterized in that the relationship between the concentration of unreacted hydrochloric acid present in the feed supplied to the second reactor and the concentration of the unreacted hydrochloric acid present in the feed is satisfied by the following formula (2).
(2) (2)
상기 식 (2)에서 C1은 제1생성혼합물 피드 중에 존재하는 미반응 염산의 농도(wt%)이고, V1은 제1반응기의 유효 부피(ℓ)이고, R은 증류컬럼에서 제1반응기로 순환되는 재순환 피드의 유량(kg/hr)이며, k2는 유량최적화 상수로서 3 내지 5의 값이 바람직하다.Wherein C 1 is the concentration (wt%) of unreacted hydrochloric acid present in the first product mixture feed, V 1 is the effective volume (l) of the first reactor, R is the concentration (Kg / hr) of the recirculated feed circulated to the feed line, and k 2 is a flow rate optimization constant of 3 to 5.
본 발명에 따른 클로로히드린의 제조방법으로서 또 다른 기술적 특징은 제2반응기로 투입되는 추가의 다가알코올 피드 유량, 재순환 피드 유량 및 제1생성혼합물 중 미반응 염산의 농도가 하기 식 (3)을 만족하는 것이다. Another technical feature of the method for producing chlorohydrin according to the present invention is that the additional polyhydric alcohol feed flow rate, the recycle feed flow rate and the concentration of unreacted hydrochloric acid in the first product mixture introduced into the second reactor satisfy the following formula (3) It is satisfied.
(3) (3)
상기 식 (3)에서 G2는 제2반응기에 투입되는 다가알코올의 유량(kg/hr)이고, G1은 제1반응기의 반응혼합물 피드에 포함되는 다가알코올의 유량(kg/hr)이며, G는 제1반응기 및 제2반응기에 투입되는 다가알코올의 총 투입 유량(kg/hr)이고, R은 증류컬럼에서 제1반응기로 순환되는 재순환 피드의 유량(kg/hr)이며, C1은 제1생성혼합물 피드 중에 남아있는 미반응 염산의 농도(wt%)이고, k3는 유량 최적화 상수로서 0.7 내지 2.5의 값을 갖는 것이 바람직하다.Wherein G 2 is a flow rate (kg / hr) of the polyhydric alcohol to be fed into the second reactor, G 1 is a flow rate (kg / hr) of the polyhydric alcohol contained in the reaction mixture feed in the first reactor, G is a first total input flow rate (kg / hr) of a polyhydric alcohol is added to the reactor and the second reactor, R is the flow rate (kg / hr) of recycle feed, which is circulated to the first reactor from the distillation column, C 1 is It is preferable that the concentration (wt%) of unreacted hydrochloric acid remaining in the first product mixture feed and k 3 has a value of 0.7 to 2.5 as a flow optimization constant.
본 발명에 따른 글리세린 등의 다가알코올로부터 염화수소를 이용한 염소화 반응에 의하여 클로로히드린을 상업적 규모로 제조하는데 있어서 경제적이고 고효율의 방법을 제공하는 효과가 있다. The present invention provides an economical and highly efficient method for producing chlorohydrin on a commercial scale by chlorination reaction using hydrogen chloride from polyhydric alcohols such as glycerol.
이하, 상기한 바와 같은 구성을 가지는 본 발명에 따른 클로로히드린의 제조방법에 대하여 상세하게 설명한다.Hereinafter, a method for producing chlorohydrin according to the present invention having the above-described structure will be described in detail.
본 발명에서 원료물질로 유용한 다가알코올로는 여러 종류의 디올, 트리올 등이 가능하며, 1,2-에탄디올(에틸렌글리콜) 및 그 에스테르, 1,2-프로판디올 및 그 에스테르, 1,3-프로판디올 및 그 에스테르, 3-클로로-1,2-프로판디올(3-모노클로로히드린) 및 그 에스테르, 2-클로로-1,3-프로판디올(2-모노클로로히드린) 및 그 에스테르, 1,2,3-프로판트리올(글리세린, 글리세롤) 및 그 에스테르와 이들의 혼합물이 포함된다. 바람직하게는 3-클로로-1,2-프로판디올(3-모노클로로히드린) 및 그 에스테르, 2-클로로-1,3-프로판디올(2-모노클로로히드린) 및 그 에스테르, 1,2,3-프로판트리올(글리세린, 글리세롤) 및 그 에스테르와 이들의 혼합물을 포함한다.Examples of polyhydric alcohols useful as raw materials in the present invention include various diols and triols, and include 1,2-ethanediol (ethylene glycol) and esters thereof, 1,2-propanediol and esters thereof, 1,3 Propanediol and its esters, 3-chloro-1,2-propanediol (3-monochlorohydrin) and esters thereof, 2-chloro-1,3-propanediol (2-monochlorohydrin) , 1,2,3-propanetriol (glycerin, glycerol) and esters thereof, and mixtures thereof. Chloro-1,3-propanediol (2-monochlorohydrin) and esters thereof, 1,2-dichloro-1,2-propanediol , 3-propanetriol (glycerin, glycerol) and esters thereof, and mixtures thereof.
가장 바람직한 다가알코올은 1,2,3-프로판트리올(글리세린, 글리세롤)이며, 본 발명에 따른 제조공정 중에서 카르복실산 촉매, 염화수소와의 반응에 의해 3-클로로-1,2-프로판디올(3-모노클로로히드린) 및 그 에스테르, 2-클로로-1,3-프로판디올(2-모노클로로히드린) 및 그 에스테르, 1,2,3-프로판트리올(글리세린, 글리세롤)의 에스테르가 생성되어 다양한 조성의 반응 혼합액을 형성하고, 이 반응 혼합액이 최종 생성물을 얻기 위한 중간 원료로 사용된다.The most preferred polyhydric alcohol is 1,2,3-propanetriol (glycerin, glycerol), which is reacted with a carboxylic acid catalyst and hydrogen chloride in the preparation process according to the invention to give 3-chloro-1,2-propanediol Chloro-1,3-propanediol (2-monochlorohydrin) and esters thereof, esters of 1,2,3-propanetriol (glycerin, glycerol) To form reaction mixture liquids of various compositions, and this reaction mixture liquid is used as an intermediate raw material for obtaining the final product.
본 발명에서 채용되는 글리세린은 식물성 원료로부터 바이오디젤을 제조할 때 부생되는 글리세린, 유지나 지질 등 동식물성 기름이나 지방을 원료로 하여 지방산이나 비누를 제조할 때 부생되는 글리세린 등을 포함하며, 바람직하게는 바이오디젤이나 지방산 제조 산업에서 발생하는 글리세린이다. 또한 본 발명에 사용 가능한 글리세린의 순도는 50 중량% 이상이어야 한다. 바람직하게는 70~100 중량%의 정제 글리세린이어야 한다. 가장 바람직하게는 80~100 중량%의 정제 글리세린이 추천되며, 이들 글리세린의 조건은 이미 당 분야에서는 오래전에 공지된 것들이다.The glycerin employed in the present invention includes glycerin as a by-product when producing biodiesel from a vegetable raw material, glycerin as a by-product in producing a fatty acid or a soap from the same vegetable oil or fat as a raw material, and preferably glycerin as a by- It is the glycerin produced in the biodiesel and fatty acid manufacturing industries. The purity of the glycerin usable in the present invention should be 50 wt% or more. Preferably 70 to 100% by weight of purified glycerin. Most preferably, 80 to 100% by weight of purified glycerin is recommended, and the conditions of these glycerin are already well known in the art for a long time.
본 발명에서 요구되는 염화수소 공급원은 무수 염화수소나 액상 염산의 형태이며, 바람직하게는 비닐 클로라이드(VCM), 이소시아네이트(MDI, TDI) 또는 알릴 클로라이드 등을 제조하는 산업에서 발생하는 염화수소 부산물 등과 같은 다양한 공정에서 발생되는 부산물 염화수소를 채용하는 것이며, 상기 공정으로부터 부산되는 염화수소는 무수물형태로 사용하는 것이 바람직하며, 상기 무수 염화수소는 연 속적으로 공급되어 가압 하에 반응이 진행되게 된다.The source of the hydrogen chloride required in the present invention is in the form of anhydrous hydrogen chloride or liquid hydrochloric acid and is preferably used in various processes such as vinyl chloride (VCM), isocyanate (MDI, TDI) or hydrogen chloride by- The by-product hydrogen chloride is preferably employed. The hydrogen chloride introduced from the above process is preferably used in the form of an anhydrous form, and the anhydrous hydrogen chloride is continuously supplied, and the reaction proceeds under pressure.
본 발명에서 사용되는 촉매는 일반적으로 알려진 카르복실산 계열의 물질이 가능하며, 특히 저비점의 카르복실산을 사용할 때에는 투입된 촉매의 상당량이 디클로로히드린 생산물과 함께 손실되므로 촉매 손실 비용을 고려한 제조 비용을 산출해야 한다. 바람직하게는 아세트산 촉매를 추천된다. 아세트산은 여러 카르복실산 중 가장 저렴한 물질 중 하나로서 본 발명에 활용하기에 경제적으로 가장 적합하며, 촉매 손실 비용을 고려할 때 투입되는 글리세린 무게 대비 1~5 중량%의 사용이 바람직하다. 촉매 선정 시에는 경제성, 수율 및 끓는점, 용해도, 혼합도, 점도 등에 대한 다양한 고려가 필요하며, 고비점의 카르복실산을 사용할 때에는 중부산물(HEAVY BY-PRODUCT)과 함께 제거되는 촉매 손실을 고려하여 촉매 회수에 대한 고려도 필요하다. The catalyst used in the present invention is a generally known carboxylic acid-based material. In particular, when a low-boiling carboxylic acid is used, a considerable amount of the added catalyst is lost together with the dichlorohydrin product. Should be calculated. Preferably, an acetic acid catalyst is recommended. Acetic acid is one of the most inexpensive materials among various carboxylic acids, and is most economically suitable for use in the present invention. It is preferable to use 1 to 5% by weight based on the weight of glycerin added in consideration of the cost of catalyst loss. Consideration should be given to economical efficiency, yield, boiling point, solubility, mixing degree, viscosity, etc. when selecting the catalyst, and considering the catalyst loss to be removed together with the HEAVY BY-PRODUCT when using a high boiling carboxylic acid Consideration of catalyst recovery is also necessary.
본 발명의 제조방법에서 글리세린을 출발물질로 사용하는 경우 수득되는 클로로히드린 화합물은 3-모노클로로히드린 (3-클로로-1,2-프로판디올, 이하 3-MCH), 2-모노클로로히드린 (2-클로로-1,3-프로판디올, 이하 2-MCH), 1,3-디클로로히드린 (1,3-디클로로프로판올, 이하 1,3-DCH), 2,3-디클로로히드린 (2,3-디클로로프로판올, 이하 2,3-DCH)이며, 기존의 상용화된 공정과 달리 에피클로로히드린 (이하 ECH)의 생산에 더 유리한 1,3-DCH가 2,3-DCH에 비해 선택적으로 더 많이 얻어진다. 본 발명에서 얻어지는 1,3-DCH의 2,3-DCH에 대한 선택도는 90~99%이다. 또한 분리 과정을 통해 얻어진 디클로로히드린 혼합액의 농도는 기존의 상용화된 공정보다 매 우 고농도로서, 50~90 중량% 수준이며, 바람직하게는 60~80 중량%이다. 얻어진 고농도의 디클로로히드린 혼합액은 기존의 상용화된 방법대로 석회유나 가성소다 등의 알칼리 수용액을 사용한 탈염산화를 통해 에피클로로히드린 (이하 ECH)으로 전환된다.When the glycerin is used as the starting material in the production process of the present invention, the obtained chlorohydrin compound is preferably selected from the group consisting of 3-monochlorohydrin (3-chloro-1,2-propanediol, hereinafter referred to as 3-MCH) (1,3-dichloropropanol, hereinafter referred to as 1,3-DCH), 2,3-dichlorohydrin (hereinafter referred to as " 2-chloro-1,3-propanediol 2,3-dichloropropanol, hereinafter referred to as 2,3-DCH), 1,3-DCH, which is more advantageous for the production of epichlorohydrin (hereinafter referred to as ECH) . The selectivity of 1,3-DCH to 2,3-DCH obtained in the present invention is 90 to 99%. Also, the concentration of the dichlorohydrin mixed solution obtained through the separation process is 50 to 90% by weight, preferably 60 to 80% by weight, much higher than the conventional commercialized process. The obtained high concentration of dichlorohydrin mixture is converted into epichlorohydrin (hereinafter referred to as ECH) through desalting oxidation using an alkali aqueous solution such as lime oil or caustic soda according to a conventional commercial method.
본 발명에 따른 제조방법은 20세기에 공지된 클로로히드린의 제조방법과 본질적으로 동일한 경로를 거치게 되며, 주된 반응 경로는 글리세린과 염화수소의 치환반응에 의해 모노클로로히드린과 물이 생성되고, 제조된 모노클로로히드린과 염화수소의 치환반응에 의해 다시 디클로로히드린과 물이 생성되는 것이다. 더 상세하게는 카르복실산 촉매의 반응 참여 경로를 통해 설명할 수 있다. 예를 들어 아세트산을 촉매로 사용하는 경우에, 우선 글리세린과 아세트산의 에스테르화 반응에 의해 글리세린 아세테이트와 물이 형성되고, 이 글리세린 아세테이트와 염화수소의 치환반응에 의해 모노클로로히드린이 생성되고 아세트산이 회복된다. 마찬가지로 모노클로로히드린과 아세트산의 에스테르화 반응에 의해 모노클로로히드린 아세테이트와 물이 형성되고, 이 모노클로로히드린 아세테이트와 염화수소의 치환반응에 의해 디클로로히드린이 생성되고 아세트산이 회복된다. 모노클로로히드린의 경우에는 촉매의 참여 없이 글리세린과 염화수소의 직접 치환반응에 의해서도 반응이 상당한 속도로 진행이 될 수 있으나, 디클로로히드린의 제조를 위해서는 촉매가 없는 직접 치환반응의 속도는 매우 느리므로, 효과적인 반응 진행을 위해서는 반드시 촉매가 필요하다.The production process according to the present invention is essentially the same as the production process of chlorohydrin known in the 20th century, and the main reaction pathway is the production of monochlorohydrin and water by the substitution reaction of glycerin and hydrogen chloride, The dichlorochlorohydrin and water are produced again by the substitution reaction of hydrogen chloride and monochlorohydrin. More specifically, it can be explained through the reaction participating pathway of the carboxylic acid catalyst. For example, when acetic acid is used as a catalyst, glycerin acetate and water are formed by the esterification reaction of glycerin and acetic acid, monochlorohydrin is produced by the substitution reaction of glycerin acetate and hydrogen chloride, and acetic acid is recovered do. Likewise, monochlorohydrin acetate and water are formed by the esterification reaction of monochlorohydrin and acetic acid. By the substitution reaction of monochlorohydrin acetate and hydrogen chloride, dichlorohydrin is produced and acetic acid is recovered. In the case of monochlorohydrin, the reaction can proceed at a considerable rate by the direct substitution reaction of glycerin and hydrogen chloride without the participation of the catalyst, but the rate of the direct substitution reaction without catalyst is very slow for the production of dichlorohydrin , Catalysts are indispensable for effective reaction progress.
본 발명에 따른 클로로히드린의 제조방법은 상업생산에 요구되는 수준의 반 응 속도 및 수율의 확보와 분리 과정에서의 원료, 촉매 및 생산물의 손실을 최소화하기에 가장 효율적이고 경제적인 반응 및 분리 공정으로 구성되어 있다. 예를 들어 원료로 사용되는 물질이 무수 염화수소나 아세트산 촉매일 경우에는 글리세린이나 클로로히드린 화합물에 비해 비점이 낮아 반응 및 분리 과정에서 많은 손실이 예상된다. 따라서 반응과 증류가 함께 진행되는 반응증류 공정을 적용할 때에는 이런 저비점 원료의 손실이 매우 크므로, 반응과 증류가 구분된 구역에서 진행되는 공정의 구성이 필요하다.The process for preparing chlorohydrin according to the present invention is a most effective and economical reaction and separation process for minimizing the reaction rate and yield required for commercial production and minimizing the loss of raw materials, . For example, when the material used as the raw material is anhydrous hydrogen chloride or acetic acid catalyst, the boiling point is lower than that of glycerin or chlorohydrin, and thus a large loss is expected in the reaction and separation processes. Therefore, when the reactive distillation process in which the reaction and the distillation are carried out together is applied, the loss of such low-boiling raw materials is very large.
본 발명의 제조방법은, 반응기에서 반응과 증류가 함께 진행되는 반응증류공정을 채택한 것이 아닌, 반응과 증류가 구분된 구역에서 진행되는 공정으로서 바람직하게는 반응기 기상으로의 저비점 원료 손실을 막아 반응에 참여하게 하기 위해 기상이 밀폐된 압력반응용기를 사용한다. 즉 반응 온도 등의 조건에 의해 기화되거나 반응혼합액에 과량으로 공급되어 용해되지 못한 원료의 손실을 막고, 이들의 반응혼합액으로의 재용해 및 반응 참여를 촉진하기 위한 압력의 확보를 위해 기상이 밀폐된 압력반응용기를 사용하는 것이다. 또한 반응물의 혼합 및 균일 온도 분포의 확보를 위해 교반 장치 또는 외부 순환장치가 부착된 압력반응용기가 바람직하다. The production process of the present invention is a process which proceeds in a zone where the reaction and the distillation are distinguished rather than adopting the reactive distillation process in which the reaction and the distillation are progressed together in the reactor. Preferably, the process lowers the loss of the low- Use a pressure-tight vessel with an enclosed vapor to engage. That is, vaporization under the conditions such as reaction temperature, or excessive supply to the reaction mixture to prevent the loss of the undissolved raw material, and to ensure the pressure for promoting redissolution and reaction participation in the reaction mixture, Pressure reaction vessel. It is also preferable to use a pressure reaction vessel equipped with an agitator or an external circulation device for mixing the reactants and ensuring a uniform temperature distribution.
본 발명의 제조방법에서의 분리 공정은 유기 용매의 사용 등 불편하고 복잡한 설비 및 절차가 요구되지 않으며, 가장 기본적인 분리 설비인 증류 컬럼을 활용한 것으로서, 반응혼합액으로부터 디클로로히드린 혼합액을 효과적으로 분리해 낼 수 있다. 반응혼합액은 미반응 글리세린 및 그 에스테르, 모노클로로히드린 및 그 에스테르, 디클로로히드린, 촉매, 물, 미반응 염산 등으로 구성되며, 이로부터 디 클로로히드린을 분리하기 위해 감압 하에 증류한다. 대기압하의 증류에 의해 디클로로히드린을 분리할 경우에는 컬럼 하부 고온 조건에서 열분해 및 중합 등의 부반응에 의해 원하지 않는 고비점 잔류물이 급속히 생성되므로, 감압에 의해 컬럼 하부 온도 조건을 낮추어 부반응 생성을 억제하면서 디클로로히드린을 얻을 수 있다.The separation process in the production method of the present invention does not require inconvenient and complicated equipment and procedures such as the use of an organic solvent and utilizes a distillation column which is the most basic separation facility and effectively separates the dichlorohydrin mixture from the reaction mixture . The reaction mixture consists of unreacted glycerin and its esters, monochlorohydrin and esters thereof, dichlorohydrin, catalyst, water, unreacted hydrochloric acid and the like, from which distillation under reduced pressure is carried out to separate dichlorohydrin. When dichlorohydrin is separated by distillation under atmospheric pressure, undesired high-boiling point residues are rapidly formed due to side reactions such as pyrolysis and polymerization at a high temperature under the column, so that the lower temperature condition of the column is lowered by decompression, Dichlorohydrin can be obtained.
또한 에피클로로히드린 제조에 사용 가능한 디클로로히드린 혼합액은 석회유나 가성소다 등의 알칼리 수용액을 사용하여 탈염산화 및 중화처리를 거치게 되므로, 물이나 염산, 카르복실산 촉매 등의 산성 성분을 함유하고 있어도 가능하므로 상기 디크로로로히드린 혼합액은 순도를 높이기 위한 추가의 분리단계 없이 직접 에피클로로히드린 제조공정에 적용될 수 있다. 따라서 순수한 디클로로히드린 만을 분리하기 위한 복잡하고 어려운 분리 설비가 요구되지 않으며, 분리 과정에서 손실되는 염산 및 카르복실산 촉매의 양을 최소화하기 위한 공정 설계가 요구된다.Further, the dichlorohydrin mixed solution usable for the production of epichlorohydrin is subjected to desalting oxidation and neutralization treatment using an aqueous alkali solution such as lime oil or caustic soda. Therefore, even if it contains acidic components such as water, hydrochloric acid and carboxylic acid catalyst , The dichlororhydrin mixture can be directly applied to the epichlorohydrin production process without further separation steps for increasing the purity. Therefore, complex and difficult separation equipment for separating pure dichlorohydrin is not required, and a process design is required to minimize the amount of hydrochloric acid and carboxylic acid catalyst lost in the separation process.
본 발명의 바람직한 공정 구성은 기상 밀폐 압력 반응 장치로 글리세린과 아세트산 및 무수 염화수소가 연속으로 공급되어 가압 하에 반응이 진행되고, 반응 장치와 연결된 감압 증류 컬럼으로 일정량의 반응혼합액이 연속 공급되어 디클로로히드린 혼합액이 얻어지며, 증류잔류액은 다시 반응 장치로 연속 순환된다. 증류잔류액은 모노클로로히드린, 디클로로히드린, 미반응 글리세린, 아세테이트 등으로 구성된다. 연속적으로 가동되는 본 발명에 따른 제조방법의 정상 상태 조건에서는 반응 장치로 연속 순환되는 증류잔류액 흐름 중 디클로로히드린의 조성은 일정하게 유지되며, 연속적으로 투입되는 피드들의 추가적인 반응에 의해 생성된 디클로로히드린은 생산물로서 감압 증류 컬럼의 상부로부터 얻어 진다. The preferred process configuration of the present invention is that the glycerin, acetic acid and anhydrous hydrogen chloride are continuously supplied to the gaseous pressure reaction apparatus and the reaction proceeds under pressure, and a certain amount of the reaction mixture is continuously supplied to the reduced pressure distillation column connected to the reaction apparatus, A mixed solution is obtained, and the distillation residue is continuously circulated back to the reaction apparatus. The distillation residue consists of monochlorohydrin, dichlorohydrin, unreacted glycerin, acetate and the like. In steady-state conditions of the continuously operating production process according to the present invention, the composition of the dichlorohydrin in the distillation residue liquid stream continuously circulated to the reactor remains constant and the dichloro Hydrin is obtained as the product from the top of the reduced pressure distillation column.
본 발명의 가장 바람직한 공정 구성은 도 1에 나타낸 것과 같은 2기의 기상 밀폐 가압 반응기와 감압 증류 컬럼으로 구성된다. 제 1 반응기 (23)에 라인 (11)을 통해 글리세린이 공급되고, 라인 (12)를 통해 카르복실산 촉매가 공급되며, 라인 (13)을 통해 염화수소가 공급된다. 제 1 반응기 (23)의 액상 반응혼합액은 라인 (14)를 통해 제 2 반응기 (24)로 공급되고, 라인 (15)를 통해 추가 공급되는 글리세린과 반응한다. 제 2 반응기 (24)의 액상 반응혼합액은 라인(16)을 통해 감압 증류 컬럼 (25)로 공급되고, 감압 증류 컬럼 (25)의 증류생산물 증기는 라인 (17)을 통해 응축기 (26)으로 공급되며, 증류잔류액은 라인 (22)를 통해 제 1 반응기 (23)으로 순환된다. 이 과정에서 라인 (21)을 통해 일정량 퍼지하여 고비점, 고점도 잔류물의 농도를 조절할 수도 있다. 응축기 (26)으로부터 라인 (18)을 통해 얻어진 디클로로히드린 혼합액은 일정량 라인 (19)를 통해 환류로 감압 증류 컬럼 (25)에 공급되며, 라인 (20)을 통해 생산물로서의 디클로로히드린 혼합액을 얻는다.The most preferable process constitution of the present invention is composed of two gaseous pressure-tight reactors and a vacuum distillation column as shown in Fig. Glycerine is fed to the
도 1과 같은 공정 구성에서, 제 1 반응기는 주된 반응이 진행되는 반응기로서 원하는 디클로로히드린 화합물은 대부분 제 1 반응기에서 생성된다. 따라서 평형의 계속적인 이동에 의한 디틀로로히드린 생성 반응을 촉진하기 위해 일정량의 액상 반응혼합액이 연속적으로 제거되어 제 2 반응기로 공급되는 것이다. 이는 반응에 의해 생성된 디클로로히드린과 물을 연속적으로 반응기에서 제거하는 효과를 얻기 위한 것이며, 보다 효과적인 평형의 이동을 위해서는 공급되는 무수 염화수소를 과량으로 유지하면서도 무수 염화수소의 손실을 방지하기 위해 기상이 밀폐된 압력 반응기를 사용하여 계속적인 무수 염화수소의 용해를 촉진해야 한다. In the process configuration as shown in FIG. 1, the first reactor is a reactor in which the main reaction proceeds, and most of the desired dichlorohydrin compounds are produced in the first reactor. Therefore, a certain amount of the liquid reaction mixture is continuously removed and fed to the second reactor to promote the formation of the dimerization by the continuous movement of the equilibrium. This is to obtain the effect of continuously removing the dichlorohydrin and water produced by the reaction in the reactor. In order to prevent the loss of anhydrous hydrogen chloride while maintaining an excess amount of anhydrous hydrogen chloride for more effective equilibrium transfer, Closed pressure reactors should be used to promote continuous dissolution of anhydrous hydrogen chloride.
본 발명에서는 제 1 반응기의 압력 조건에 따라 과량 용해된 무수 염화수소 중 미반응 염산의 처리를 위해 제 2 반응기를 가동하는 것을 특징으로 한다. 제 1 반응기로부터 제 2 반응기로 공급되는 액상 반응혼합물에는 제 1 반응기에서 아직 반응에 참여하지 못한 염산이 상당량 존재하며, 이는 감압 증류 컬럼에서 디클로로히드린 혼합액 생산 시 함께 손실된다. 따라서 제 2 반응기는 용해된 염산의 반응 효율화 및 손실 최소화를 위한 반응기로서, 미반응 염산은 추가로 제 2 반응기에 공급되는 글리세린과의 반응을 통해 클로로히드린 화합물로 전환된다.The present invention is characterized in that the second reactor is operated for the treatment of unreacted hydrochloric acid in anhydrous hydrogen chloride which is excessively dissolved in accordance with the pressure condition of the first reactor. The liquid reaction mixture fed from the first reactor to the second reactor contains a significant amount of hydrochloric acid which has not yet participated in the reaction in the first reactor, which is lost together with the production of the dichlorohydrin mixture in the reduced pressure distillation column. Therefore, the second reactor is a reactor for efficient reaction of dissolved hydrochloric acid and minimized loss, and unreacted hydrochloric acid is further converted into chlorohydrin compound through reaction with glycerin supplied to the second reactor.
제 1 반응기의 가압 수준은 무수 염화수소의 용해도 및 글리세린과의 반응 속도를 최적화할 수 있는 범위로 조절하며, 반응물인 무수 염화수소의 공급 압력을 조절하여 반응기 전체 압력을 유지한다. 제 1 반응기의 운전 온도는 70~140℃ 범위이며, 바람직하게는 90~120℃ 범위이다. 본 발명은 제 1 반응기의 운전 온도 확보를 위한 추가의 가열을 필요로 하지 않는 것을 특징으로 한다. 제 1 반응기의 온도를 유지하기 위한 열량은 감압 증류 컬럼으로부터 순환 공급되는 증류잔류액의 온도와 무수 염화수소의 공급에 따른 용해열로부터 얻어진다.The pressurization level of the first reactor is adjusted to a range in which the solubility of anhydrous hydrogen chloride and the reaction rate with glycerin can be optimized, and the pressure of the anhydrous hydrogen chloride is regulated to maintain the pressure of the reactor as a whole. The operating temperature of the first reactor is in the range of 70 to 140 캜, preferably in the range of 90 to 120 캜. The present invention is characterized in that it does not require additional heating for securing the operating temperature of the first reactor. The amount of heat for maintaining the temperature of the first reactor is obtained from the temperature of the distillation residue liquid circulating through the reduced pressure distillation column and the heat of dissolution according to the supply of anhydrous hydrogen chloride.
제 2 반응기의 운전 온도는 제 1 반응기에서 공급되는 액상 반응 혼합액의 온도에 따라 결정되며, 제 2 반응기의 운전 압력은 제 1 반응기의 가압 조건과 제 2 반응기로 공급되는 글리세린 유량에 의해 결정된다. 제 2 반응기에서 형성되는 압력은 제 1 반응기에서 미 반응된 무수 염화수소에 의해 형성되므로 글리세린 투입에 따라 그 압력이 떨어지는 것이다.The operating temperature of the second reactor is determined by the temperature of the liquid reaction mixture supplied from the first reactor and the operating pressure of the second reactor is determined by the pressurizing condition of the first reactor and the glycerin flow rate supplied to the second reactor. The pressure formed in the second reactor is formed by the unreacted anhydrous hydrogen in the first reactor, so that the pressure is lowered as glycerin is added.
본 발명에 최적화된 유량 조건은 반응기의 가압 및 온도 조건과 함께 반응 속도 및 수율에 결정적인 영향을 미친다. 특히 상업화를 고려한 연속 제조 설비의 개발에 있어서, 투입물과 생산물의 양적 균형이 맞지 않는다면 제조 설비 내에 반응물이 계속적으로 축적되어 라인 (21)을 통한 퍼지량이 증가할 수 밖에 없으며, 이는 결국 추가적인 회수 설비의 효율적인 가동이 뒤따르지 않는다면 반응물 손실로 이어지며, 결국 전체 수율의 감소로 상업적 제조를 어렵게 하는 요인이 된다. 이처럼 투입물과 생산물의 균형이 맞지 않는 경우는 크게 두 가지로 그 원인을 파악할 수 있는데, 첫 번째는 연속 상업 설비에 적용하기에는 반응 속도 자체가 느려 투입물의 생산물로의 전환 자체가 원활히 이루어지지 않는 경우로서, 근원적인 반응성 향상을 위해 새로운 촉매를 개발하거나, 반응기의 특별한 구조를 설계하거나, 회분식 공정을 활용하는 등의 노력이 필요하다. 두 번째는 연속 상업 설비에 적용하기에 충분한 반응 속도를 확보했지만, 투입량의 충분한 전환을 위해 필요한 반응기의 크기 또는 체류 시간이 확보되지 못한 경우로서, 투입물과 순환유량 및 반응기 크기 간의 최적 조건의 개발을 통해 해결해야 한다. The flow conditions optimized for the present invention have a crucial effect on the reaction rate and yield, as well as the pressure and temperature conditions of the reactor. Particularly in the development of continuous production plants, which are particularly commercialized, if the quantitative balance of inputs and products is not met, the reactants will accumulate continuously in the production facility and the amount of purge through the
본 발명에 따른 제조방법에 있어서 유도되는 최적 유량은 크게 앞서 언급한 바와 같이 3가지 기술적 특징으로 언급된다.The optimum flow rate induced in the manufacturing method according to the present invention is largely referred to as three technical characteristics as mentioned above.
첫 번째는 정해진 반응기의 크기 내에서 투입되는 글리세린, 아세트산 촉매, 무수 염화수소의 유량의 합 (라인 (11), (12), (13), (15))과 생산되는 디클로로히드린 유량 (라인 (20)) 간에 균형을 맞추기 위해서는, 투입되는 글리세린, 아세트산 촉매, 무수 염화수소의 유량의 합과 감압 증류 컬럼(25)로부터 라인 (22)를 통해 제 1 반응기 (23)으로 재순환되는 유량 간에 특별한 상관관계를 갖는다는 것이 며, 더욱 바람직하게는 투입되는 글리세린의 유량과 재순환되는 유량 간의 상관관계가 존재한다는 것이다. 본 발명에서 개발된 상업화를 고려한 연속 제조 설비에 있어서 최적의 상관 관계는, 제 1 반응기의 유효 부피를 V1(ℓ), 글리세린의 총 투입 유량 (라인 (11)과 (15)의 합)을 G(kg/hr), 재순환되는 유량을 R(kg/hr)이라 할 경우 아래와 같이 주어진다.The first is the sum of the flow rates of glycerin, acetic acid catalyst and anhydrous hydrogen chloride (lines (11), (12), (13), (15)) and the dichlorohydrin flow rate 20), there is a special correlation between the sum of the flow rates of the input glycerin, acetic acid catalyst and anhydrous hydrogen chloride and the flow rate recirculated from the reduced
(1) (One)
상기의 관계식 (1)에서 k1은 유량 최적화 계수이며, 본 발명에서 개발된 공정 구성에서는 0.3~5 kg/(ℓ-hr)의 값을 나타내며, 더욱 바람직하게는 0.5~1.5 kg/(ℓ-hr)의 값을 가질 때 가장 최적의 글리세린 전환율 (95~100%) 및 디클로로히드린 생산 수율 (90~95%) 을 얻을 수 있다.In the above relational expression (1), k 1 is a flow-rate optimization coefficient, and in the process composition developed in the present invention, the value is 0.3 to 5 kg / (ℓ-hr), more preferably 0.5 to 1.5 kg / (95 to 100%) and the yield of dichlorohydrin production (90 to 95%) can be obtained.
본 발명에서 개발된 최적 유량 조건 중 두 번째는 라인 (22)를 통해 제 1 반응기 (23)으로 재순환되는 유량 R(kg/hr)과, 제 1 반응기 (23)으로부터 라인 (14)를 통해 제 2 반응기 (24)로 공급되는 액상 반응혼합물 중에 남아있는 미반응 염산의 농도 C1(wt%) 간에 아래와 같은 특정한 관계를 나타낸다는 것이다.The second of the optimum flow conditions developed in the present invention is a flow rate R (kg / hr) recirculated to the
(2) (2)
상기의 관계식 (2)는 미반응 염산의 농도를 줄이기 위한 효과적인 방안을 제시하는 것으로서, 재순환 유량 R(kg/hr)을 증대시키면 미반응 염산의 농도를 줄일 수 있음을 나타낸다. 그러나, 미반응 염산의 농도를 줄이기 위해 재순환 유량 R(kg/hr)을 늘이면 관계식 (1)에 의해 공급되는 글리세린의 유량이 줄게 되므로, 상업 설비의 생산량 및 수용할 수 있는 수준의 미반응 염산 농도를 고려하여 재순환 유량 R(kg/hr)을 결정해야 하며, 상기의 관계식 (2)에서 계수 k2는 본 발명의 공정 구성에서 바람직하게는 3~5 의 값을 가질 때 최적의 글리세린 전환율과 및 디클로로히드린 생산 수율을 나타낸다.The above relational formula (2) suggests an effective method for reducing the concentration of unreacted hydrochloric acid, and it is shown that increasing the recycle flow rate R (kg / hr) can reduce the concentration of unreacted hydrochloric acid. However, if the recirculation flow rate R (kg / hr) is increased to reduce the concentration of unreacted hydrochloric acid, the flow rate of the glycerin supplied by the relational expression (1) is reduced, so that the commercial production amount and the acceptable level of unreacted hydrochloric acid The recycle flow rate R (kg / hr) should be determined in consideration of the concentration, and the coefficient k 2 in the above relational expression (2) is preferably 3 to 5 in the process composition of the present invention, And the production yield of dichlorohydrin.
한편 제 1 반응기(23)으로부터 라인 (14)를 통해 제 2 반응기 (24)로 공급되는 액상 반응혼합물 중의 물 농도 W(wt%)도 관계식 (2)와 같은 형태를 나타내며, 이는 물 농도와 염산 용해도 간의 비례 관계를 의미하는 것이다. 결국 본 발명에서 상기의 관계식 (2)는 재순환 유량 R의 조절로 반응기내에 존재하는 염산 및 물 농도를 제어할 수 있으며, 이로부터 반응 평형의 이동을 조절하여 반응속도를 제어할 수 있다는 특징을 보여주는 것이다.On the other hand, the water concentration W (wt%) in the liquid phase reaction mixture supplied from the
본 발명에 따른 제조방법에서 유도되는 최적 유량 조건 중 세 번째는 제 1 반응기 (23)으로부터 라인(14)를 통해 제 2 반응기 (24)로 공급되는 액상 반응혼합물 중에 남아있는 미반응 염산을, 라인 (15)를 통해 추가 공급되는 글리세린과 제 2 반응기 (24)에서 반응시킴으로써 미반응 염산의 양을 줄여 후단의 감압 증류 컬럼에서의 염산 손실을 낮추기 위해 필요한 효과적인 방안이다. 이 때 요구되는 글리세린의 투입 유량 (라인 (15))을 G2(kg/hr)라 할 때, 아래와 같은 관계가 성립한다.The third of the optimum flow conditions derived from the production process according to the invention is the unreacted hydrochloric acid remaining in the liquid reaction mixture fed from the
(3) (3)
상기의 관계식 (3)에서 계수 k3은 본 발명의 공정 구성에서 바람직하게는 0.7~2.5 의 값을 가질 때 최적의 글리세린 전환율과 및 디클로로히드린 생산 수율을 나타낸다.The coefficient k 3 in the above relational expression (3) represents the optimum glycerin conversion and the yield of dichlorohydrin production when the process composition of the present invention preferably has a value of 0.7 to 2.5.
이하 본 발명을 비교예 및 실시예를 들어 설명하나, 하기의 설명은 본 발명에 따른 제조방법을 설명하기 위한 예시일 뿐 본 발명을 한정하는 것은 아니다.Hereinafter, the present invention will be described by way of Comparative Examples and Examples, but the following description is only illustrative of the method of manufacturing according to the present invention and is not intended to limit the present invention.
[실시예][Example]
[실시예 1][Example 1]
첨부된 도 1에 제시된 것과 같이 2개의 반응기와 1개의 감압 증류 컬럼으로 구성된 실험 장치에서 글리세린, 아세트산, 무수 염화수소의 연속 공급에 의해 반응을 진행하여 디클로로히드린 생산물을 얻었다. 두 반응기의 유효 반응 부피는 각각 1ℓ이며, 제 1 반응기는 110℃, 5 Kgf/㎠G의 조건에서 가동된다. 제 1 반응기에는 75.42g/hr의 글리세린, 3.55g/hr의 아세트산을 연속 공급하였으며, 제 2 반응기에는 29.83g/hr의 글리세린을 연속 공급하고, 두 반응기의 액위는 항상 일정하게 유지되도록 운전하였다. 감압 증류 컬럼에서 제 1 반응기로 재순환되는 유량은 633.28g/hr로 유지하였다. 이상의 조건하에 연속 운전을 진행한 결과, 각 반응기에서 미반응된 염산의 농도 및 관계식 (1)~(3)에 제시된 계수들과 총 투입된 글리세린의 전환율 및 디클로로히드린 생산 수율을 다음의 표 1에 나타내었다.1, the reaction was carried out by continuous feeding of glycerin, acetic acid and anhydrous hydrogen chloride in an experimental apparatus composed of two reactors and one vacuum distillation column to obtain a dichlorohydrin product. The effective reaction volume of the two reactors is 1 L each, and the first reactor is operated at 110 DEG C and 5 Kgf / cm2G. The first reactor was fed continuously with 75.42 g / hr of glycerin, 3.55 g / hr of acetic acid, the second reactor was continuously fed with 29.83 g / hr of glycerin, and the liquid level of both reactors was kept constant. The flow rate recycled to the first reactor in the reduced pressure distillation column was maintained at 633.28 g / hr. As a result of continuous operation under the above conditions, the concentration of unreacted hydrochloric acid in each reactor and the coefficients shown in the relational expressions (1) to (3), the conversion rate of the total charged glycerin and the yield of dichlorohydrin production are shown in the following Table 1 Respectively.
[표 1][Table 1]
[실시예 2][Example 2]
도 1에 제시된 것과 같이 2개의 반응기와 1개의 감압 증류 컬럼으로 구성된 실험 장치에서 글리세린, 아세트산, 무수 염화수소의 연속 공급에 의해 반응을 진행하여 디클로로히드린 생산물을 얻었다. 두 반응기의 유효 반응 부피는 각각 1ℓ이며, 제 1 반응기는 110℃, 5 Kgf/㎠G의 조건에서 가동된다. 제 1 반응기에는 192.35/hr의 글리세린, 9.06g/hr의 아세트산을 연속 공급하였으며, 제 2 반응기에는 19.33g/hr의 글리세린을 연속 공급하고, 두 반응기의 액위는 항상 일정하게 유지되도록 운전하였다. 감압 증류 컬럼에서 제 1 반응기로 재순환되는 유량은 597.83g/hr로 유지하였다. 이상의 조건하에 연속 운전을 진행한 결과, 각 반응기에서 미반응된 염산의 농도 및 관계식(1)~(3)에 제시된 계수들과 총 투입된 글리세린의 전환율 및 디클로로히드린 생산 수율을 다음의 표 2에 나타내었다.1, the reaction was carried out by continuous feeding of glycerin, acetic acid and anhydrous hydrogen chloride in an experimental apparatus composed of two reactors and one vacuum distillation column to obtain a dichlorohydrin product. The effective reaction volume of the two reactors is 1 L each, and the first reactor is operated at 110 DEG C and 5 Kgf / cm2G. In the first reactor, glycerin at a rate of 192.35 / hr and acetic acid at a rate of 9.06 g / hr were continuously supplied. In the second reactor, glycerin was continuously supplied at a rate of 19.33 g / hr. The flow rate recycled to the first reactor in the reduced pressure distillation column was maintained at 597.83 g / hr. As a result of continuous operation under the above conditions, the concentration of unreacted hydrochloric acid in each reactor and the coefficients shown in the relational expressions (1) to (3), the conversion rate of the total charged glycerin and the yield of dichlorohydrin production are shown in the following Table 2 Respectively.
[표 2][Table 2]
[실시예 3][Example 3]
도 1에 도시된 바와 같이 2개의 반응기와 1개의 감압 증류 컬럼으로 구성된 실험 장치에서 글리세린, 아세트산, 무수 염화수소의 연속 공급에 의해 반응을 진행하여 디클로로히드린 생산물을 얻었다. 두 반응기의 유효 반응 부피는 각각 1ℓ이며, 제 1 반응기는 110℃, 5 Kgf/㎠G의 조건에서 가동된다. 제 1 반응기에는 180.95/hr의 글리세린, 8.53g/hr의 아세트산을 연속 공급하였으며, 제 2 반응기에는 16.51g/hr의 글리세린을 연속 공급하고, 두 반응기의 액위는 항상 일정하게 유지되도록 운전하였다. 감압 증류 컬럼에서 제 1 반응기로 재순환되는 유량은 990.2g/hr로 유지하였다. 이상의 조건하에 연속 운전을 진행한 결과, 각 반응기에서 미반응된 염산의 농도 및 관계식(1)~(3)에 제시된 계수들과 총 투입된 글리세린의 전환율 및 디클로로히드린 생산 수율을 다음의 표 3에 나타내었다.As shown in FIG. 1, the reaction was carried out by continuous feeding of glycerin, acetic acid and anhydrous hydrogen chloride in an experimental apparatus composed of two reactors and one vacuum distillation column to obtain a dichlorohydrin product. The effective reaction volume of the two reactors is 1 L each, and the first reactor is operated at 110 DEG C and 5 Kgf / cm2G. In the first reactor, glycerin and 8.53 g / hr of acetic acid were continuously supplied at 180.95 / hr, and 16.51 g / hr of glycerin was continuously supplied to the second reactor, and the liquid levels of the two reactors were kept constant. The flow rate recycled to the first reactor in the reduced pressure distillation column was maintained at 990.2 g / hr. As a result of continuous operation under the above conditions, the concentration of unreacted hydrochloric acid in each reactor and the coefficients shown in the relational expressions (1) to (3), the conversion rate of the total charged glycerin and the yield of dichlorohydrin production are shown in the following Table 3 Respectively.
[표 3][Table 3]
[실시예 4][Example 4]
도 1에 도시된 것과 같이 2개의 반응기와 1개의 감압 증류 컬럼으로 구성된 실험 장치에서 글리세린, 아세트산, 무수 염화수소의 연속 공급에 의해 반응을 진행하여 디클로로히드린 생산물을 얻었다. 두 반응기의 유효 반응 부피는 각각 1ℓ이며, 제 1 반응기는 120℃, 5 Kgf/㎠G의 조건에서 가동된다. 제 1 반응기에는 181.4/hr의 글리세린, 8.55g/hr의 아세트산을 연속 공급하였으며, 제 2 반응기에는 18.5g/hr의 글리세린을 연속 공급하고, 두 반응기의 액위는 항상 일정하게 유지되도록 운전하였다. 감압 증류 컬럼에서 제 1 반응기로 재순환되는 유량은 961.4g/hr로 유지하였다. 이상의 조건하에 연속 운전을 진행한 결과, 각 반응기에서 미반응된 염산의 농도 및 관계식 (1)~(3)에 제시된 계수들과 총 투입된 글리세린의 전환율 및 디클로로히드린 생산 수율을 다음의 표 4에 나타내었다.1, the reaction was carried out by continuous feeding of glycerin, acetic acid and anhydrous hydrogen chloride in an experimental apparatus composed of two reactors and one vacuum distillation column to obtain a dichlorohydrin product. The effective reaction volumes of the two reactors are respectively 1 liter, and the first reactor is operated at 120 DEG C and 5 Kgf / cm2G. In the first reactor 181.4 / hr of glycerin and 8.55 g / hr of acetic acid were continuously supplied, and in the second reactor 18.5 g / hr of glycerin was continuously supplied and the liquid levels of the two reactors were kept constant. The flow rate recycled to the first reactor in the reduced pressure distillation column was maintained at 961.4 g / hr. As a result of continuous operation under the above conditions, the concentration of unreacted hydrochloric acid in each reactor and the coefficients shown in the relational expressions (1) to (3), the conversion rate of the total charged glycerin and the yield of dichlorohydrin production are shown in Table 4 Respectively.
[표 4][Table 4]
[실시예 5][Example 5]
도 1에 도시된 것과 같이 2개의 반응기와 1개의 감압 증류 컬럼으로 구성된 실험 장치에서 글리세린, 아세트산, 무수 염화수소의 연속 공급에 의해 반응을 진행하여 디클로로히드린 생산물을 얻었다. 두 반응기의 유효 반응 부피는 각각 1ℓ이며, 제 1 반응기는 120℃, 5 Kgf/㎠G의 조건에서 가동된다. 제 1 반응기에는 189.96/hr의 글리세린, 3.88g/hr의 아세트산을 연속 공급하였으며, 제 2 반응기에는 19.5g/hr의 글리세린을 연속 공급하고, 두 반응기의 액위는 항상 일정하게 유지되도록 운전하였다. 감압 증류 컬럼에서 제 1 반응기로 재순환되는 유량은 956.74g/hr로 유지하였다. 이상의 조건하에 연속 운전을 진행한 결과, 각 반응기에서 미반응된 염산의 농도 및 관계식 (1)~(3)에 제시된 계수들과 총 투입된 글리세린의 전환율 및 디클로로히드린 생산 수율을 다음의 표 5에 나타내었다.1, the reaction was carried out by continuous feeding of glycerin, acetic acid and anhydrous hydrogen chloride in an experimental apparatus composed of two reactors and one vacuum distillation column to obtain a dichlorohydrin product. The effective reaction volumes of the two reactors are respectively 1 liter, and the first reactor is operated at 120 DEG C and 5 Kgf / cm2G. In the first reactor, 189.96 / hr of glycerin and 3.88 g / hr of acetic acid were continuously supplied. In the second reactor, 19.5 g / hr of glycerin was continuously supplied and the liquid levels of the two reactors were kept constant. The flow rate recycled to the first reactor in the reduced pressure distillation column was maintained at 956.74 g / hr. As a result of continuous operation under the above conditions, the concentration of unreacted hydrochloric acid in each reactor and the coefficients shown in the relational expressions (1) to (3), the conversion rate of the total charged glycerin and the yield of dichlorohydrin production are shown in the following Table 5 Respectively.
[표 5][Table 5]
[비교예][Comparative Example]
첨부된 도 1에 제시된 것과 같이 2개의 반응기와 1개의 감압 증류 컬럼으로 구성된 실험 장치에서 글리세린, 아세트산, 무수 염화수소의 연속 공급에 의해 반응을 진행하여 디클로로히드린 생산물을 얻었다. 두 반응기의 유효 반응 부피는 각각 1ℓ이며, 제 1 반응기는 110℃, 5 Kgf/㎠G의 조건에서 가동된다. 제 1 반응기에는 90g/hr의 글리세린, 5.25g/hr의 아세트산을 연속 공급하였으며, 제 2 반응기에는 110.25g/hr의 글리세린을 연속 공급하고, 두 반응기의 액위는 항상 일정하게 유지되도록 운전하였다. 감압 증류 컬럼에서 제 1 반응기로 재순환되는 유량은 946.8g/hr로 유지하였다. 이상의 조건하에 연속 운전을 진행한 결과, 각 반응기에서 미반응된 염산의 농도 및 관계식 (1)~(3)에 제시된 계수들과 총 투입된 글리세린의 전환율 및 디클로로히드린 생산 수율을 다음의 표 6에 나타내었다.1, the reaction was carried out by continuous feeding of glycerin, acetic acid and anhydrous hydrogen chloride in an experimental apparatus composed of two reactors and one vacuum distillation column to obtain a dichlorohydrin product. The effective reaction volume of the two reactors is 1 L each, and the first reactor is operated at 110 DEG C and 5 Kgf / cm2G. The first reactor was continuously supplied with 90 g / hr of glycerin, 5.25 g / hr of acetic acid, the second reactor was continuously fed with 110.25 g / hr of glycerin, and the liquid level of the two reactors was kept constant. The flow rate recycled to the first reactor in the reduced pressure distillation column was maintained at 946.8 g / hr. As a result of continuous operation under the above conditions, the concentration of unreacted hydrochloric acid in each reactor and the coefficients shown in the relational expressions (1) to (3), the conversion rate of the total charged glycerin and the yield of dichlorohydrin production are shown in the following Table 6 Respectively.
[표 6][Table 6]
상기 실시예 1 내지 실시예 5와 비교예의 결과로부터 다가알코올 유량과 재순환 피드 유량의 비를 결정하는 유량 최적화 상수 k1이 0.3 내지 5 kg/(ℓ-hr)의 범위일때, 제1생성혼합물 피드 중에 존재하는 미반응 염산의 농도(wt%)와 제1반응기의 유효 부피(ℓ) 및/또는 증류컬럼에서 제1반응기로 순환되는 재순환 피드의 유량(kg/hr) 관계를 결정하는 유량 최적화 상수 k2가 3 내지 5 kg/(ℓ-hr)의 범위일때 그리고 제2반응기로 투입되는 추가의 다가알코올 피드 유량, 재순환 피드 유량 및 제1생성혼합물 중 미반응 염산의 농도에 대한 유량 최적화 상수 k3이 0.7 내지 2.5의 범위의 조건일때 다가알코올로부터 염화수소를 이용한 염소화 반응에 의하여 클로로히드린을 상업적 규모로 제조에 효과적임을 알 수 있다.From the results of Examples 1 to 5 and Comparative Example, the flow rate optimization constant k 1 for determining the ratio of the polyhydric alcohol flow rate to the recycle feed flow rate (Wt%) of the unreacted hydrochloric acid present in the first product mixture feed and the effective volume (l) of the first reactor and / or in the distillation column in the range of 0.3 to 5 kg / (ℓ-hr) (Kg / hr) < / RTI > of the recirculated feed circulated to < RTI ID = 0.0 > The flow optimization constant k 3 for the additional polyhydric feed feed rate, the recycle feed flow rate and the concentration of the unreacted hydrochloric acid in the first product mixture, which are in the range of 3 to 5 kg / (ℓ-hr), is 0.7 To 2.5, chlorohydrin is effective for commercial scale production by chlorination reaction using hydrogen chloride from polyhydric alcohol.
도 1은 본 발명에 따른 제조방법을 도시한 공정도이다.1 is a process drawing showing a manufacturing method according to the present invention.
<도면의 주요 부분에 대한 부호의 설명>Description of the Related Art
11 : 글리세린 공급 라인 11: Glycerine supply line
12 : 카르복실산 촉매 공급라인12: Carboxylic acid catalyst feed line
13 : 염화수소 공급라인13: Hydrogen chloride supply line
14 : 액상 반응혼합액 피드라인14: Liquid phase reaction mixture feed line
15 : 추가 글리세린 공급라인15: Additional glycerin feed line
17 : 증류생산물 증기 라인17: Distillation product vapor line
22 : 증류잔류액 순환라인22: distillation residue circulation line
23 : 제 1 반응기23: First reactor
24 : 제 2 반응기24: Second reactor
25 : 감압 증류 컬럼25: reduced pressure distillation column
26 : 응축기26: Condenser
Claims (20)
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020070097675A KR101410019B1 (en) | 2007-09-28 | 2007-09-28 | Process for producing chlorohydrin compound by reaction between polyhydric alcohol and hydrogen chloride |
| PCT/KR2008/005474 WO2009041766A1 (en) | 2007-09-28 | 2008-09-17 | Process for preparing chlorohydrin by reaction of polyol with hydrochloric acid |
| CN2008801143217A CN101842339B (en) | 2007-09-28 | 2008-09-17 | Process for the preparation of chlorohydrins by reaction of polyalcohols with hydrochloric acid |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020070097675A KR101410019B1 (en) | 2007-09-28 | 2007-09-28 | Process for producing chlorohydrin compound by reaction between polyhydric alcohol and hydrogen chloride |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20090032429A KR20090032429A (en) | 2009-04-01 |
| KR101410019B1 true KR101410019B1 (en) | 2014-06-26 |
Family
ID=40511628
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020070097675A Active KR101410019B1 (en) | 2007-09-28 | 2007-09-28 | Process for producing chlorohydrin compound by reaction between polyhydric alcohol and hydrogen chloride |
Country Status (3)
| Country | Link |
|---|---|
| KR (1) | KR101410019B1 (en) |
| CN (1) | CN101842339B (en) |
| WO (1) | WO2009041766A1 (en) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101705209B1 (en) * | 2010-06-30 | 2017-02-09 | 롯데정밀화학 주식회사 | Method of preparing composition of chlorohydrins and method of preparing epichlorohydrin using composition of chlorohydrins prepared by the same |
| KR101705208B1 (en) * | 2010-06-30 | 2017-02-09 | 롯데정밀화학 주식회사 | Method of preparing composition of chlorohydrins and method of preparing epichlorohydrin using composition of chlorohydrins prepared by the same |
| KR101705207B1 (en) * | 2010-06-30 | 2017-02-09 | 롯데정밀화학 주식회사 | Method of preparing chlorohydrins and method of preparing epichlorohydrin using chlorohydrins prepared by the same |
| KR101705205B1 (en) * | 2010-06-30 | 2017-02-09 | 롯데정밀화학 주식회사 | Method of preparing chlorohydrins and method of preparing epichlorohydrin using chlorohydrins prepared by the same |
| KR101705206B1 (en) * | 2010-06-30 | 2017-02-09 | 롯데정밀화학 주식회사 | Method of preparing chlorohydrins and method of preparing epichlorohydrin using chlorohydrins prepared by the same |
| KR101705210B1 (en) * | 2010-06-30 | 2017-02-09 | 롯데정밀화학 주식회사 | Method of preparing composition of chlorohydrins and method of preparing epichlorohydrin using composition of chlorohydrins prepared by the same |
| CN110922299A (en) * | 2019-11-07 | 2020-03-27 | 无锡市银杏塑业科技有限公司 | Continuous preparation method of high-content 2-chloroethanol |
| CN113234041B (en) * | 2021-04-07 | 2023-03-10 | 江苏瑞恒新材料科技有限公司 | Preparation method of epichlorohydrin |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4665240A (en) | 1986-05-27 | 1987-05-12 | Shell Oil Company | Process for the production of dichlorohydrin |
| WO2006020234A1 (en) | 2004-07-21 | 2006-02-23 | Dow Global Technologies Inc. | Conversion of a multihydroxylated-aliphatic hydrocarbon or ester thereof to a chlorohydrin |
| WO2006106154A1 (en) | 2005-05-20 | 2006-10-12 | Solvay (Société Anonyme) | Continuous method for making chlorhydrines |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS60258171A (en) * | 1984-06-04 | 1985-12-20 | Showa Denko Kk | Preparation of epichlorohydrin |
-
2007
- 2007-09-28 KR KR1020070097675A patent/KR101410019B1/en active Active
-
2008
- 2008-09-17 CN CN2008801143217A patent/CN101842339B/en not_active Expired - Fee Related
- 2008-09-17 WO PCT/KR2008/005474 patent/WO2009041766A1/en not_active Ceased
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4665240A (en) | 1986-05-27 | 1987-05-12 | Shell Oil Company | Process for the production of dichlorohydrin |
| WO2006020234A1 (en) | 2004-07-21 | 2006-02-23 | Dow Global Technologies Inc. | Conversion of a multihydroxylated-aliphatic hydrocarbon or ester thereof to a chlorohydrin |
| WO2006106154A1 (en) | 2005-05-20 | 2006-10-12 | Solvay (Société Anonyme) | Continuous method for making chlorhydrines |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2009041766A1 (en) | 2009-04-02 |
| CN101842339B (en) | 2013-08-28 |
| KR20090032429A (en) | 2009-04-01 |
| CN101842339A (en) | 2010-09-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101410019B1 (en) | Process for producing chlorohydrin compound by reaction between polyhydric alcohol and hydrogen chloride | |
| TWI325417B (en) | Method of preparing dichloropropanols from glycerine | |
| TWI320036B (en) | Process for preparing a chlorohydrin starting from a polyhydroxylated aliphatic hydrocarbon | |
| JP6373554B2 (en) | Epoxide production method | |
| US7906690B2 (en) | Batch, semi-continuous or continuous hydrochlorination of glycerin with reduced volatile chlorinated hydrocarbon by-products and chloracetone levels | |
| CN101208323A (en) | Process for the preparation of epoxides from polyhydroxyaliphatic hydrocarbons and chlorinating agents | |
| US9963436B2 (en) | Process for the manufacture of epoxy-monomers and epoxides | |
| EP2589585B1 (en) | Method for preparing chlorohydrins and method for preparing epichlorohydrin using chlorohydrins prepared thereby | |
| CN102040479B (en) | System for preparing dichloropropanol through autocatalytic reaction of glycerol and hydrogen chloride | |
| TWI523834B (en) | Process for hydrochlorination of multihydroxylated aliphatic hydrocarbons | |
| EP3844140B1 (en) | Method and apparatus to produce fatty acids from methyl esters throughout non-catalytic process | |
| JP3903513B2 (en) | Method for producing diacetoxybutene | |
| HK1096081B (en) | Method of preparing dichloropropanols from glycerine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application |
Patent event code: PA01091R01D Comment text: Patent Application Patent event date: 20070928 |
|
| PG1501 | Laying open of application | ||
| A201 | Request for examination | ||
| PA0201 | Request for examination |
Patent event code: PA02012R01D Patent event date: 20120809 Comment text: Request for Examination of Application Patent event code: PA02011R01I Patent event date: 20070928 Comment text: Patent Application |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20140221 Patent event code: PE09021S01D |
|
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration |
Patent event code: PE07011S01D Comment text: Decision to Grant Registration Patent event date: 20140520 |
|
| PR0701 | Registration of establishment |
Comment text: Registration of Establishment Patent event date: 20140613 Patent event code: PR07011E01D |
|
| PR1002 | Payment of registration fee |
Payment date: 20140616 End annual number: 3 Start annual number: 1 |
|
| PG1601 | Publication of registration | ||
| FPAY | Annual fee payment |
Payment date: 20170526 Year of fee payment: 4 |
|
| PR1001 | Payment of annual fee |
Payment date: 20170526 Start annual number: 4 End annual number: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20180403 Year of fee payment: 5 |
|
| PR1001 | Payment of annual fee |
Payment date: 20180403 Start annual number: 5 End annual number: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20190307 Year of fee payment: 6 |
|
| PR1001 | Payment of annual fee |
Payment date: 20190307 Start annual number: 6 End annual number: 6 |
|
| PR1001 | Payment of annual fee |
Payment date: 20200330 Start annual number: 7 End annual number: 7 |
|
| PR1001 | Payment of annual fee |
Payment date: 20210326 Start annual number: 8 End annual number: 8 |
|
| PR1001 | Payment of annual fee |
Payment date: 20220323 Start annual number: 9 End annual number: 9 |
|
| PR1001 | Payment of annual fee |
Payment date: 20230329 Start annual number: 10 End annual number: 10 |
|
| PR1001 | Payment of annual fee |
Payment date: 20240325 Start annual number: 11 End annual number: 11 |
|
| PR1001 | Payment of annual fee |
Payment date: 20250325 Start annual number: 12 End annual number: 12 |