JP6979797B2 - 固液分離方法、固液分離装置およびそれに用いるピペットチップ、粒子およびキット - Google Patents
固液分離方法、固液分離装置およびそれに用いるピペットチップ、粒子およびキット Download PDFInfo
- Publication number
- JP6979797B2 JP6979797B2 JP2017108765A JP2017108765A JP6979797B2 JP 6979797 B2 JP6979797 B2 JP 6979797B2 JP 2017108765 A JP2017108765 A JP 2017108765A JP 2017108765 A JP2017108765 A JP 2017108765A JP 6979797 B2 JP6979797 B2 JP 6979797B2
- Authority
- JP
- Japan
- Prior art keywords
- particles
- solid
- suction nozzle
- liquid
- liquid separation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000007788 liquid Substances 0.000 title claims description 350
- 239000002245 particle Substances 0.000 title claims description 222
- 238000000926 separation method Methods 0.000 title claims description 214
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 89
- 239000000725 suspension Substances 0.000 claims description 79
- 239000000523 sample Substances 0.000 claims description 52
- 238000011033 desalting Methods 0.000 claims description 50
- 210000004369 blood Anatomy 0.000 claims description 40
- 239000008280 blood Substances 0.000 claims description 40
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 39
- 238000000034 method Methods 0.000 claims description 35
- 239000013076 target substance Substances 0.000 claims description 29
- 102000039446 nucleic acids Human genes 0.000 claims description 15
- 108020004707 nucleic acids Proteins 0.000 claims description 15
- 150000007523 nucleic acids Chemical class 0.000 claims description 15
- 238000010438 heat treatment Methods 0.000 claims description 14
- 230000007246 mechanism Effects 0.000 claims description 13
- 238000004062 sedimentation Methods 0.000 claims description 13
- 150000003839 salts Chemical class 0.000 claims description 12
- 230000003028 elevating effect Effects 0.000 claims description 10
- 239000000377 silicon dioxide Substances 0.000 claims description 10
- 238000007599 discharging Methods 0.000 claims description 9
- 230000008569 process Effects 0.000 claims description 9
- 239000006228 supernatant Substances 0.000 claims description 9
- 238000009826 distribution Methods 0.000 claims description 8
- MCMNRKCIXSYSNV-UHFFFAOYSA-N Zirconium dioxide Chemical compound O=[Zr]=O MCMNRKCIXSYSNV-UHFFFAOYSA-N 0.000 claims description 6
- 210000002381 plasma Anatomy 0.000 claims description 6
- 210000002966 serum Anatomy 0.000 claims description 6
- 239000011148 porous material Substances 0.000 claims description 5
- 239000012488 sample solution Substances 0.000 claims description 4
- 239000004793 Polystyrene Substances 0.000 claims description 3
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 claims description 3
- 229920002223 polystyrene Polymers 0.000 claims description 3
- 239000007787 solid Substances 0.000 claims description 3
- 238000012546 transfer Methods 0.000 claims description 2
- 239000013049 sediment Substances 0.000 claims 1
- 239000002904 solvent Substances 0.000 description 51
- 239000003997 corticotropin derivative Substances 0.000 description 33
- 229960000258 corticotropin Drugs 0.000 description 31
- 238000013019 agitation Methods 0.000 description 27
- 239000000275 Adrenocorticotropic Hormone Substances 0.000 description 25
- 101800000414 Corticotropin Proteins 0.000 description 25
- 102400000739 Corticotropin Human genes 0.000 description 25
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 25
- 239000000969 carrier Substances 0.000 description 24
- 230000005484 gravity Effects 0.000 description 22
- 238000005259 measurement Methods 0.000 description 22
- 238000011084 recovery Methods 0.000 description 22
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 21
- 238000002474 experimental method Methods 0.000 description 18
- 239000002953 phosphate buffered saline Substances 0.000 description 18
- 229910021642 ultra pure water Inorganic materials 0.000 description 16
- 239000012498 ultrapure water Substances 0.000 description 16
- 239000011259 mixed solution Substances 0.000 description 15
- 239000000203 mixture Substances 0.000 description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 15
- 239000000243 solution Substances 0.000 description 14
- 101800000407 Brain natriuretic peptide 32 Proteins 0.000 description 13
- 101800002247 Brain natriuretic peptide 45 Proteins 0.000 description 13
- 238000010612 desalination reaction Methods 0.000 description 13
- -1 aminosilyl group modified silica Chemical class 0.000 description 12
- 230000000694 effects Effects 0.000 description 12
- 239000000499 gel Substances 0.000 description 11
- 238000003756 stirring Methods 0.000 description 11
- 102000012406 Carcinoembryonic Antigen Human genes 0.000 description 9
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 description 9
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 9
- 239000012223 aqueous fraction Substances 0.000 description 9
- 238000001514 detection method Methods 0.000 description 9
- 239000006185 dispersion Substances 0.000 description 9
- 230000036961 partial effect Effects 0.000 description 9
- 238000013207 serial dilution Methods 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 102400000667 Brain natriuretic peptide 32 Human genes 0.000 description 8
- 238000000746 purification Methods 0.000 description 8
- 238000005054 agglomeration Methods 0.000 description 7
- 230000002776 aggregation Effects 0.000 description 7
- 230000008859 change Effects 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- HPNRHPKXQZSDFX-OAQDCNSJSA-N nesiritide Chemical compound C([C@H]1C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)CNC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](CCSC)NC(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CO)C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1N=CNC=1)C(O)=O)=O)[C@@H](C)CC)C1=CC=CC=C1 HPNRHPKXQZSDFX-OAQDCNSJSA-N 0.000 description 7
- 238000005406 washing Methods 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 6
- 238000010586 diagram Methods 0.000 description 6
- 230000005284 excitation Effects 0.000 description 6
- 238000000799 fluorescence microscopy Methods 0.000 description 6
- 238000002189 fluorescence spectrum Methods 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 230000002441 reversible effect Effects 0.000 description 6
- 239000004094 surface-active agent Substances 0.000 description 6
- 208000002109 Argyria Diseases 0.000 description 5
- 238000001962 electrophoresis Methods 0.000 description 5
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 4
- 239000003480 eluent Substances 0.000 description 4
- 230000014759 maintenance of location Effects 0.000 description 4
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 4
- 241000209094 Oryza Species 0.000 description 3
- 235000007164 Oryza sativa Nutrition 0.000 description 3
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 150000001413 amino acids Chemical group 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 230000001186 cumulative effect Effects 0.000 description 3
- 238000000326 densiometry Methods 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000007561 laser diffraction method Methods 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 235000009566 rice Nutrition 0.000 description 3
- 238000000790 scattering method Methods 0.000 description 3
- 229910052709 silver Inorganic materials 0.000 description 3
- 239000004332 silver Substances 0.000 description 3
- 235000014347 soups Nutrition 0.000 description 3
- 230000000007 visual effect Effects 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 239000008049 TAE buffer Substances 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- HGEVZDLYZYVYHD-UHFFFAOYSA-N acetic acid;2-amino-2-(hydroxymethyl)propane-1,3-diol;2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetic acid Chemical compound CC(O)=O.OCC(N)(CO)CO.OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O HGEVZDLYZYVYHD-UHFFFAOYSA-N 0.000 description 2
- 239000003463 adsorbent Substances 0.000 description 2
- 239000011543 agarose gel Substances 0.000 description 2
- 238000000246 agarose gel electrophoresis Methods 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 238000003795 desorption Methods 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 239000012160 loading buffer Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 230000001376 precipitating effect Effects 0.000 description 2
- 238000007873 sieving Methods 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 238000001179 sorption measurement Methods 0.000 description 2
- 239000012134 supernatant fraction Substances 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 238000005303 weighing Methods 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 101800000112 Acidic peptide Proteins 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 230000005653 Brownian motion process Effects 0.000 description 1
- 241000701959 Escherichia virus Lambda Species 0.000 description 1
- 241000282414 Homo sapiens Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 239000011542 SDS running buffer Substances 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- OWMVSZAMULFTJU-UHFFFAOYSA-N bis-tris Chemical compound OCCN(CCO)C(CO)(CO)CO OWMVSZAMULFTJU-UHFFFAOYSA-N 0.000 description 1
- 238000007664 blowing Methods 0.000 description 1
- 238000005537 brownian motion Methods 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 239000000696 magnetic material Substances 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 1
- 235000019796 monopotassium phosphate Nutrition 0.000 description 1
- 229920002113 octoxynol Polymers 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 108010091748 peptide A Proteins 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000000284 resting effect Effects 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 125000005372 silanol group Chemical group 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- AIDBEARHLBRLMO-UHFFFAOYSA-M sodium;dodecyl sulfate;2-morpholin-4-ylethanesulfonic acid Chemical compound [Na+].OS(=O)(=O)CCN1CCOCC1.CCCCCCCCCCCCOS([O-])(=O)=O AIDBEARHLBRLMO-UHFFFAOYSA-M 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000008399 tap water Substances 0.000 description 1
- 235000020679 tap water Nutrition 0.000 description 1
- 239000013077 target material Substances 0.000 description 1
- WGTODYJZXSJIAG-UHFFFAOYSA-N tetramethylrhodamine chloride Chemical compound [Cl-].C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=CC=C1C(O)=O WGTODYJZXSJIAG-UHFFFAOYSA-N 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000007723 transport mechanism Effects 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/02—Burettes; Pipettes
- B01L3/0275—Interchangeable or disposable dispensing tips
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D21/00—Separation of suspended solid particles from liquids by sedimentation
- B01D21/02—Settling tanks with single outlets for the separated liquid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D21/00—Separation of suspended solid particles from liquids by sedimentation
- B01D21/24—Feed or discharge mechanisms for settling tanks
- B01D21/2444—Discharge mechanisms for the classified liquid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/02—Burettes; Pipettes
- B01L3/021—Pipettes, i.e. with only one conduit for withdrawing and redistributing liquids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/02—Burettes; Pipettes
- B01L3/0289—Apparatus for withdrawing or distributing predetermined quantities of fluid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/02—Burettes; Pipettes
- B01L3/0289—Apparatus for withdrawing or distributing predetermined quantities of fluid
- B01L3/0293—Apparatus for withdrawing or distributing predetermined quantities of fluid for liquids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6806—Preparing nucleic acids for analysis, e.g. for polymerase chain reaction [PCR] assay
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/40—Concentrating samples
- G01N1/405—Concentrating samples by adsorption or absorption
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/06—Investigating concentration of particle suspensions
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/10—Devices for transferring samples or any liquids to, in, or from, the analysis apparatus, e.g. suction devices, injection devices
- G01N35/1009—Characterised by arrangements for controlling the aspiration or dispense of liquids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0631—Purification arrangements, e.g. solid phase extraction [SPE]
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
- B01L2200/0668—Trapping microscopic beads
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0681—Filter
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/06—Investigating concentration of particle suspensions
- G01N15/075—Investigating concentration of particle suspensions by optical means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/06—Investigating concentration of particle suspensions
- G01N2015/0687—Investigating concentration of particle suspensions in solutions, e.g. non volatile residue
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/10—Devices for transferring samples or any liquids to, in, or from, the analysis apparatus, e.g. suction devices, injection devices
- G01N2035/1027—General features of the devices
- G01N2035/1048—General features of the devices using the transfer device for another function
- G01N2035/1053—General features of the devices using the transfer device for another function for separating part of the liquid, e.g. filters, extraction phase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/10—Devices for transferring samples or any liquids to, in, or from, the analysis apparatus, e.g. suction devices, injection devices
- G01N2035/1027—General features of the devices
- G01N2035/1048—General features of the devices using the transfer device for another function
- G01N2035/1055—General features of the devices using the transfer device for another function for immobilising reagents, e.g. dried reagents
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Analytical Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Clinical Laboratory Science (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Organic Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Sampling And Sample Adjustment (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
Description
しかし、それらの方法を分析装置内で行う場合、複雑な機構と制御が必要であった。
そこで、分注ノズル(ピペットチップ)に吸着剤としての個体やフィルターを取り付け、吸引・排出動作時に特定の成分を抽出するものが提案されている(例えば、特許文献1、2参照)。
この発明は、以上のような事情を考慮してなされたものであって、フィルター等の複雑な構造を有するノズルが不要な固液分離方法、固液分離装置およびそれに用いるキットを提供するものである。
また、この発明は、上述の固液分離方法に用いられ先端開口近傍にフィルターを有しない吸引ノズルとしてのピペットチップを提供する。
さらに、この発明は、上述の固液分離方法に用いられる粒子を提供する。
さらにまた、この発明は、上述の固液分離方法に用いられ先端開口近傍にフィルターを有しない吸引ノズルとしてのピペットチップと、前記固液分離方法に用いられる粒子とを含む固液分離用キットであって、前記ピペットチップの最小の開口径が前記粒子の最大径より大きくかつ前記粒子の最大径の6倍よりも小さい固液分離用キットを提供する。
この発明による固液分離装置についても同様の作用効果を奏する。
本実施形態の固液分離方法は、先端に開口が形成された吸引ノズルの内部へ前記開口から粒子を含む懸濁液を吸引する工程を含む。
吸引ノズルは、先端に開口が形成され、先端へ向かうにつれて内径が先細りになっていることが好ましい。吸引ノズルは、略管状であり得る。前記吸引ノズルの先端に形成された開口を先端開口とも呼ぶ。前記先端開口の径を開口径と呼ぶ。開口径は、内径が先細りになっている前記吸引ノズルの先端の内径に対応する。先端へ向かうにつれて内径が先細りになっていることにより、粒子を詰まらせる(閉塞させる)ことが可能になる。その結果、詰まった粒子が吸引ノズルの先端の開口から排出されなくなる一方で、懸濁液の溶媒である液体は開口から排出されることにより、固液分離が達成される。ここで、「詰まる」とは、先端開口の手前側の箇所に粒子が集中し管壁や他の粒子に制約されて自由に移動できない状態になり、他の粒子がその箇所を通過できないこという。ただし、詰まった粒子よりも十分小さな分子は、粒子と粒子の隙間あるいは粒子と管壁の隙間を通過できるため、排出された液体に粒子が混入することは妨げない。また、本明細書でいう粒子が「詰まる」とは、液体が通過できる程度の状態を意味する。本発明者らは、吸引ノズル、特にピペットチップの先端へのフィルターの取付けを要することなく、粒子の詰まりを利用して、高い再現性をもって、粒子と液体とを分離することに成功した。
吸引ノズルの最大容量は、好ましくは500〜2000μL、より好ましくは1000〜1500μLである。
粒子の形状は、固液分離を妨げない限り、特に限定されない。例えば球状、略球状、正多面体、正多角形状の開口形状を有するハニカム構造などが挙げられる。
粒子は、例えばアミノシリル基やオクタデシルシリル基(ODS)などにより、表面修飾されていてもよい。
なお、本実施形態の固液分離はBF分離に応用できるため、粒子は、所望のペプチド又は核酸を精製するのに適した粒子であることが好ましい。
粒子の最大径とは、粒径の最大値を意味する。粒子の最大径は、固液分離を妨げない限り特に限定されず、好ましくは150μm以上、より好ましくは250μm以上である。
粒子のD10は、固液分離を妨げない限り、特に限定されない。D10とは、粒子径に係る数値であって粒子径の累積分布が10%となる点、即ち、粉体をある粒子径を基準に大小二つに分けた場合に大きな側と小さな側とが9:1となる粒子径を示す。D90は、好ましくは150μm以上、より好ましくは170μm以上である。
粒子のD90−D10は、D90とD10との差である。D90−D10は、固液分離を妨げない限り特に限定されず、好ましくは90μm以上、より好ましくは120μm以上である。
懸濁液の溶媒となる液体の種類は、固液分離を妨げない限り特に限定されない。液体の比重は、固液分離を妨げない限り特に限定されず、粒子の比重などを考慮して当業者が適宜設定することができる。液体の比重は、粒子の比重よりも小さいことが好ましい。また、液体の粘度は、固液分離を妨げない限り特に限定されない。
液体の排出(イジェクション)は、好ましくは、吸引ノズルの内部へ吸引された粒子が略均一に分散した懸濁液の先端開口近傍と先端開口から最遠部とに沈降による粒子濃度の差が生じた後に行われる。本実施形態の固液分離では、沈降によって、あるいは、液体の排出に伴って、粒子は吸引ノズル内に詰まって留まる一方で、液体は吸引ノズル内に詰まった粒子を通過して排出される。これにより、本実施形態の固液分離が可能となる。液体の排出は、好ましくは、標的物質が吸着した粒子を開口手前側に残すようにして行われる。開口手前側とは、先端開口の最遠部から先端開口へと向かう方向のことをいう。
より具体的には、前記液体を排出した後に、標的物質が吸着された粒子から標的物質を溶出させる溶出液を吸引ノズル内に吸引し、吸引された溶出液により混ぜられる粒子の少なくとも一部を開口手前側に沈降させ、溶出液と溶出した標的物質とを先端開口を介して排出し、得られた液体を必要に応じて更に精製することにより、本実施形態の固液分離方法をBF分離方法として用いることができる。
また、制御部は懸濁液の吸引後、吸引された懸濁液に含まれる粒子の少なくとも一部を吸引ノズルの内部に沈降させて詰まらせるが、ここで少なくとも一部の沈降とは、液体を排出する際に吸引ノズルが詰まる程度の沈降をいう。
ここで、少なくとも排出は、吸引ノズルの先端に形成された開口(先端開口)を介して行われる。吸引部は、装着された吸引ノズルの外部から内部へ、また、吸引ノズルの内部から外部へ液体を送るポンプとして作用する。吸引部の典型的な構造はプランジャを往復させて吸引と排出を行うプランジャ型のポンプであるが、それに限定されるものでない。例えば、ダイヤフラム型やギヤ型等、種々のタイプのポンプが適用可能である。
前記制御部は、以下のように前記吸引部を制御してもよい。即ち、前記懸濁液の吸引後、吸引ノズル内で粒子が略均一に分散した懸濁液の先端開口近傍と先端開口から最遠部とに沈降による粒子濃度の差が生じるまでの期間に基づいて予め定められた静止期間において、前記懸濁液の吸引を停止して前記粒子の少なくとも一部を沈降させる。さらに、前記静止期間の経過後、前記粒子を内部に詰まらせた吸引ノズルの開口を介して内部の液体を排出する。
上述のように、懸濁液を吸引ノズル内に吸引し、吸引ノズルの先端開口近傍と先端開口から最遠部とに沈降による粒子濃度の差が生じるまでの期間を予め測定して静止期間を定めておけば、その後の固液分離は、吸引を終了してから前記静止期間が経過した後に排出を開始することによって実現できる。即ち、静止期間中に粒子が沈降するので、吸引ノズルの内部に粒子が詰まった状態で内部の液体を排出することができ、固液分離が可能になる。
このようにすれば、プランジャの移動および静止を制御することによって、懸濁液を吸引し、吸引ノズル内に粒子を沈降させ、内部の液体を排出して吸引ノズル内に粒子を残すことができる。
このようにすれば、吸引時は攪拌された粒子が懸濁液中に分散する程度の速さでプランジャを移動させ、排出時は沈降した粒子が攪拌されない程度の速さでプランジャを移動させることができる。ここでの速さは方向を含まず、単位時間当たりの位置の変化の大きさをいう。
さらにまた、吸引ノズルを、前記吸引部に装着される位置へ搬送するノズル搬送機構と、前記吸引部に装着された吸引ノズルの先端を前記容器支持体に支持された容器内の懸濁液に向けて下降させる昇降機構とをさらに備えていてもよい。
これらの好ましい態様は適宜組み合わせることができる。
以下、図面を用いてこの発明をさらに詳述する。なお、以下の説明は、すべての点で例示であって、この発明を限定するものと解されるべきではない。
図1は、この実施形態における固液分離装置の概略構成を示す説明図である。図1に示すように、固液分離装置11は、吸引部13、制御部15および容器支持体17を備え、それらは固液分離装置11に必須の構成である。図1で、固液分離装置11の固液分離に必要な構成を鎖線の枠で示している。
この実施形態において吸引部13は、プランジャ13aを含み、下端に吸引ノズル21(ピペットチップ)が装着されるシリンジ13bを含む。
プランジャ駆動モータ13cは、プランジャ13aをシリンジ13b内で移動させる駆動源である。
容器支持体17は、粒子を含む液体を収容する容器23を支持する。そして、容器23の位置を決める。容器23は、容器支持体17によって交換可能に支持される。容器23に収容された粒子と液体を攪拌すると懸濁液になる。ただし、粒子と液体とは比重が異なり、静置すると徐々に粒子が沈降するものとする。
吸引ノズル21をシリンジ13bに装着する際、制御部15は、他端を上方に向けてノズルスタンド25aに保持された吸引ノズル21がシリンジ13bのコネクタの直下に位置するようにテーブル駆動モータ25bを制御する。そして、制御部15は、シャフト駆動モータ29dを制御してシリンジ13b下端のコネクタが吸引ノズル21の他端に挿入される位置までシリンジ13bを降下させる。これらの動作によって、シリンジ13bに吸引ノズル21が装着される。
制御部15は、プランジャの13aの移動を制御することにより、容器23に収容された粒子を含む液体の吸引および吐出を制御する。
好ましい構成によれば、制御部15は、圧力センサ31が検出するシリンジ13bの内圧Pに基づいて、プランジャ13aの移動、停止、動作期間等を制御してもよい。あるいは、時間の経過に伴うシリンジ内圧Pの変化(Pt曲線)を、例えば、図1に図示しない表示装置に表示してもよい。
続いて、制御部15によるプランジャ13aの制御について説明する。
図2は、固液分離のために制御部15がプランジャ13aを移動させる様子を示す説明図である。図2の(a)はシリンジ13b内のプランジャ13aの動きを示し、(b)はシリンジ内圧Pの変化の例を示し、(c)は吸引ノズル21内の粒子と液体の様子の例を示している。(b)の波形は、固液分離装置11が圧力センサ31を備える場合のPt曲線に対応するものである。
制御部15は、まず、プランジャ13aをシリンジ13bの上死点と下死点の中間の位置で停止させる。ただし、一例であってこれ以外の位置で停止させても構わない。
その状態で、吸引ノズル21の先端が容器23に収容された粒子を含む液体に浸漬される。好ましい構成によれば、昇降機構29が制御部15の制御に基づいて吸引ノズル21の先端を液体に浸漬させるが、固液分離装置11が昇降機構29を備えない場合はユーザが手動で吸引ノズル21または容器23の位置を移動させる。なお、昇降機構29は、吸引ノズル21を降下させることで浸漬させてもよいが、それに代えてあるいはそれに加えて、容器23を上昇させることで浸漬させてもよい。
その後、制御部15は、シリンジ内圧Pが負圧になる方向、即ち、プランジャ13aを上死点へ向けて移動させる。移動に伴って、吸引ノズル21の内部に容器23に収容された粒子と液体が吸引される。
さらに、制御部15は、プランジャ13aを上死点と下死点との間で往復させる。以下、プランジャ13aが上死点から下死点へ向かう移動を前進、下死点から上死点へ向かう移動を後進ともいう。図2の例ではプランジャ13aを5回往復させた後に上死点で停止させている。
プランジャ13aの往復動によって、粒子を含む液体が吸引ノズル21と容器23との間を往復して攪拌される。攪拌(アジテーション)前は粒子が容器23内で沈殿していたとしても、プランジャ13aの往復による攪拌動作によって粒子と液体とが混ざり合い懸濁液になる。図2(b)において攪拌動作の期間をΔtaで示している。攪拌動作における内圧の極大値Pbdcの平均をPaで示している。攪拌動作の終了時、制御部15はプランジャ13aを上死点に位置させており、懸濁液が吸引ノズル21に吸引されている(図2(c)参照)。
この実施形態において、制御部15は予め定められた周期、予め定められた速さでプランジャ13aを往復動させて攪拌動作を行う。往復動のうち上死点へ向かう際のプランジャ13aの移動速さ、即ち、吸引時の速さをRsuctionとする。プランジャ13aの移動速さは、シリンジの容積の変化の速さに対応する。吸引部としてプランジャ型以外のポンプを用いる態様においても、吸引ノズル21の内部と連通する室の容積の変化として捉えて同様の動作を行うことが可能である。なお、この実施例において、アジテーションにおけるプランジャ13aの前進と後進(吸引)は、移動の方向が逆であるが速さが等しい。その速さをRagitとする。プランジャ13aは、アジテーション工程の最後の段階において上死点で停止し、吸引が行われる。よって、Rsuction=Ragitである。
攪拌動作の後、制御部15は、上死点にあるプランジャ13aを静止させる(図2(a)の期間Δtsにおける図参照)。静止は、所定の期間(図2(b)に示すΔts)行う。なお、攪拌終了後に、吸引ノズル21の先端を上昇させて、あるいは容器23を降下させて、容器23に収容された懸濁液の液面の上方へ移動させてもよい。ただし、ここで吸引ノズル21を液面の上方に上昇させなくても固液分離は可能である。好ましい構成によれば、昇降機構29が制御部15の制御に基づいて吸引ノズル21の先端を容器23の液面の上に上昇させることができる。固液分離装置11が昇降機構29を備えない構成ではユーザが手動で吸引ノズル21または容器23の位置を移動させてもよい。
一方、容器23の液面より下に吸引ノズル21の先端が位置する場合でも、シリンジ内圧Pが大気圧に比べて負圧になっており、吸引ノズル21内の懸濁液は容器23へ流出することがない。
図2(b)にΔtsで示す静止期間中、吸引ノズル21内に懸濁液が留まり、懸濁液中の粒子が下端部へ沈降を始める。そして、次第に懸濁液の下端部と上端部とで粒子濃度の差、即ち濁度の差が生じる。
後述するように、この実施形態による固液分離は現象の再現性が良好である。よって、吸引ノズル21と粒子および液体を決め、予め実験によって好適な静止期間Δtsを定めれば、安定した固液分離が実現できる。
異なる態様として、固液分離装置11がカメラやフォトセンサ等のセンサを備え、制御部15がそれらのセンサの検出に基づいて適応的に静止期間Δtsを定めてもよい。即ち、吸引ノズル21内の下端部と上端部とで粒子濃度の差が検出されるまで、プランジャ13aを上死点で静止させるように制御してもよい。
静止期間Δtsの経過後、制御部15は、プランジャ13aを予め定められたΔt1の期間で下死点へ移動させる(図2(a)の「I」参照)。その際、プランジャ13aの移動の速さをRejectとする。制御部15は、好ましくは吸引時よりもゆっくりとした速さでプランジャ13aを移動させる。即ち、Reject<Rsuctionの関係が成り立つようにプランジャ13aの移動を制御する。
期間Δt1、速度Reject、期間Δt2は、例えば、実験に基づき予め定められる。実験は、固液分離に用いるものと同型の吸引ノズル21に固液分離に用いるものと同じ粒子と溶液を吸引し、プランジャ13aを上述の期間Δt1だけ静止させて粒子を沈降させ、開口先端の手間で粒子のプラグが形成されて粒子が詰まる好適な条件を目視観察あるいはカメラを用いた画像解析等センサを用いた検出により見出す。このようにして期間Δt1、速度Rejectを決定すればよい。期間Δt2については、決定された期間Δt1、速度Rejectでプランジャ13aを下死点に移動させた後、吸引ノズル21から液体が十分に排出されるまでの期間を目視観察あるいは圧力センサ31等のセンサを用いた検出により決定すればよい。
以上、固液分離方法、固液分離装置および固液分離用キットについて、好ましい態様を含めて実施の形態を述べた。好ましい態様は、適宜組み合わせることが可能である。
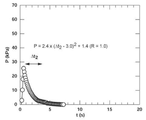
Pt曲線は、吸引ノズル21に粒子が詰まって固液分離が成功したか否かの状態を明確に示す。
図4A〜図4Cは、図1に示す構成の固液分離装置11を用いて測定したPt曲線の実測例を示すグラフである。固液分離装置11は、圧力センサ31を備えており、圧力センサ31が検出するシリンジ内圧P値を一定時間間隔でプロットした。
吸引ノズル21(以下、単に管ともいう)は、後述する図5Cに記載の、管の名称が「B」のもの(以下、管Bあるいは管B型)を用いた。
この実施例で用いた粒子は、全血、血清または血漿を加熱して得られる上清を脱塩処理した液体から標的物質として所望のペプチドまたは核酸を吸着させる吸着剤(担体)を想定し、多孔質シリカを用いた。
(a)後述する図5A記載の担体の名称が「1」のもの(以下、担体1番あるいは担体1型)の日本化成社製メソ多孔質シリカ担体(商品名メソピュア:なお、図5Aに示す担体2番〜10番は担体1番の分級品) を100 mg、
(b)図5Aに記載の担体10番を100 mg、
(c)図5Aに記載の担体5番を10 mg、
を秤量して容器23(epppendorf社製Safe-Lock Tubes 2.0 mL)(図1)へ移した。
なお、担体1番は、目開きサイズ75 μmの篩と900 μmの篩とを重ねて、原末としての上記メソ多孔質シリカ担体を篩って、篩間に残った粒子を回収することによって得た。担体2〜10番は、図5A所定の目開きサイズの篩を重ねて、原末としての担体1番を篩って、篩間に残った粒子を回収することによって得た。マイクロトラックFRA 9220装置(Leeds & Northrup社製)を用いてレーザー回折・散乱法により測定した担体1番〜10番の粒度分布を図5Bに示す。
プランジャ13aが上死点から下死点へまたは下死点から上死点へ移動するとシリンジの容積は1000 μL変化する、攪拌動作におけるプランジャ13aの移動速さRsuctionは、2800 μL/sである。
なお、固液分離成功は、アジテーション工程とイジェクション工程のあとで、上記担体1番と上記PBS溶媒とを分けることができたと判断したことを示している。
固液分離不成功と判断した管と担体の組み合わせにおいては、固液分離成功時と比べてPt曲線に関して以下の特徴が挙げられる。
(1)アジテーション工程において計測されたPagitの値と比して、イジェクション工程の時間の前半部分のΔt1期間中に計測されたPejectの値は、有意な差を示さなかった、
(2)イジェクション工程の後半部分のΔt2期間中に、プランジャ13aの前進移動が終了した以降に続く溶媒の管外への排出(以下「緩和」)が認められなかった。
Pe =a×(t+b)2+c
ただし、係数a≠0である。
を用いたカーブフィットで得られる曲線、即ち放物線にフィットする曲線が含まれていた。
なお、カーブフィットには、Synergy Software社製のKaleida Graphを用いた。
以上、Pt曲線が固液分離の成功と不成功を判断するツールの役割を果たすことが確かめられた。
図4A〜図4Cを用いて説明した固液分離成否の判定手法を用いて、より多種類の管と担体について、固液分離を行って可否を判断した。
この実施形態で、担体の種類は固有のサイズ(粒度分布)および、混合液または懸濁液中での体積分率(担体濃度)で規定される。
図5Bは、図5A所定の目開きサイズを有する篩を用いて作製した担体1番〜10番についてレーザー回折・散乱法より粒径を測定することによって得られた担体1番〜10番の粒度分布を示す表である。
図5Cは、実験に用いた管の種類を示す説明図である。管の種類は、特に固有の先端開口のサイズ(液体通過断面積)で規定される。図5Cの右上にイラストで示しているが、管の先端の開口径をS0としている。
図5Dは、図5Aに示す担体と、図5Cに示す管の組合せで固液分離の実験を行った結果を示す表である。表および以下の記載で「◎」は固液分離良好と判断したことを示し、「〇」は固液分離可能と判断したことを示す。
つぎに、図2に示すようにアジテーション工程とイジェクション工程を実施してPt曲線を得た。目視観察および得られたPt曲線およびに基づいて固液分離の成否を判定し、図5Dの表を得た。
(1)固液分離を可能とする組み合わせは、ひとつまたは限定された複数ではなく、多数に及ぶ、
(2)前記のとおり、管の形状(写真等)や担体の形状(担体1番〜担体9番は二次凝集体のため形状は不定形)よりも、管の先端開口と担体の粒径との相対的なサイズの方が固液分離の成否に大きく影響している。
管N型;Precision Science社製、F4100、
管A型;epppendorf社製、ep T.I.PS Standard 50−1000μL、
管B型;Corning社製、100−1000μL Universal Fit Pipet Tips、
管O型;GILSON社製、CP−1000のキャピラリー部、
管B1型;管B型の先端を、精密アートナイフ157B型(オルファ社製)を用いて、開口面と平行に輪切り加工したもの。先端の開口径S0は、加工後にノギスCD−15PSX(ミツトヨ社製)で計測し、0.8 mm〜1.6 mmの範囲であることを確認した。
管B2型;管B型の先端を、精密アートナイフ157B型(オルファ社製)を用いて、開口面と平行に輪切り加工したもの。先端の開口径S0は、加工後にノギスCD−15PSX(ミツトヨ社製)で計測し、1.6 mm〜2.4 mmの範囲であることを確認した。
前述のとおり、溶液中の担体の濃度も担体の種類を決める因子であるが、この因子に基づいた組み合わせの実施例は、実施例6にて後述する。
実施例2で得られた成功率について、その実際の値が非常に高いことを次に示す。図5Aおよび図5Cに記載の管を図1に記載の装置に接続して、アジテーション工程とイジェクション工程を100回連続して繰り返した。
その結果、いずれの回数においても、合格と判定されるPt曲線を示した。つまり、成功率が100%であった。図6A〜Cは、そのことを示すPt曲線の例示である。すなわち、図6Aは11〜15回目のPt曲線を、図6Bは13回目のPt曲線を、図6Cは14回目のPt曲線を示す。これらの結果は、本実施形態の固液分離が再現性良く実施できることを表している。
以上のような合格と判定されるケースが、特定のプランジャの移動速さRejectによって限定されるか否かを検証した。方法は、実施例1に記載の方法と同一である。詳しい検証条件は、次のとおりである。
なお、Rejectの値がより大きい(より速くプランジャが前進する)とき、より高い管内圧力が生ずること、あるいは、Rejectの値がより小さい(より遅くプランジャが前進する)とき、より長い時間(Δt2)を費やす圧力降下(緩和)が生ずること、が確認された。
本実施形態の固液分離の成否が撹拌方法(アジテーション工程)の多様性に影響されるか否かを調査するために、以下の実験を行った。
内径18mmの円筒状の容器に担体としてイオン交換樹脂バイオレックスMSZ501D(バイオラッド社)4.9gを秤量し、溶媒としてミリポア社製水精製装置MilliQ型が供給する超純水3.2mLを添加した。第1の管として図5C記載の管B2型(口径2.34mm)、第2の管として図5C記載の管B2型(口径1.8mm)を用いて、それを図1の装置に接続した。第2の管による容器内の溶媒の吸引と吐出、あるいは、第1の管と第2の管の両者による容器内の溶媒の吸引と吐出によって、懸濁液を作製した。懸濁液を第1の管で吸引してから、プラグが形成されるのを観察した。その後、所定の命令によりプランジャを前進させて、第1の管の中の懸濁液から溶媒だけを管外へ排出した。目視観察により、また、Pt曲線を用いた合否判定により、固液分離が実施されたことを証明した。
以上の結果から、溶媒または混合液または懸濁液に接する管の本数とは関係なく、本実施形態の固液分離を達成できることが示された。
担体の濃度の影響を調査するために、以下の実験を行った。使用した担体、溶媒、管の口径を表1に示す。
表1に記載の管を図1に記載の装置のコネクタ部に接続し、実施例1と同様のアジテーション工程とイジェクション工程を適用した。イジェクション工程の前進は、25℃(室温)、大気圧下において行った。
その結果、いずれの濃度においても、期待された担体の分散や担体の塊化が観察され、固液分離が果たされることが確認された(図8A〜図8C)。
担体の比重の影響を調査するために、以下の実験を行った。使用した担体と溶媒、イジェクション時のΔVplngr とRejectを表2に示す。
まず、実施例1で使用したものと同じ容器に表2に記載の各種担体(9A〜9D)を秤量し、比重1のリン酸緩衝液(PBS)を1.5mL添加して混合液とした。各種混合液について、図5Cに記載の管Bを接続した装置(図1)を用いて、実施例1と同様のアジテーション工程とイジェクション工程を行った。
図1記載の装置によって記録されたPt曲線を図9A〜Dに示す。それらの結果から、いずれの比重の担体を用いても、期待された担体の分散や担体の塊化が観察され、固液分離を達成できることが確認された。
担体14番;粒径0.5mmのSUS304球 九州ベアリング株式会社
担体15番;粒径0.5 mmのアルミナ球 アズワン株式会社 型番AL9-0.5
担体16番;粒径0.5 mmのポリスチレン球
PBS;10×PBS(バイオラッド社製、1610780)を超純水で10倍に希釈
溶媒の比重の影響を調査するために、以下の実験を行った。使用した担体と溶媒、イジェクション時のΔVplngr とRejectを表3に示す。
図1記載の装置によって記録されたPt曲線を図10A〜Cに示す。それらの結果から、いずれの比重の溶媒を用いても、期待された担体の分散や担体の塊化が観察され、固液分離を達成できることが確認された。
PBS;10×PBS(バイオラッド社製、1610780)を超純水で10倍に希釈
60%CsCl;CsCl(和光純薬社製、034−08161)を超純水で溶解
Hexan;n-Hexan(和光純薬社、082−00421)
溶媒の粘度の影響を調査するために、以下の実験を行った。使用した担体と溶媒、イジェクション時のΔVplngr とRejectを表4に示す。
まず、実施例1で使用したものと同じ容器に表4に記載の各種担体(11A〜11D)を秤量し、表4に記載の各種溶媒を1.5mL添加して混合液とした。各種混合液について、図5Cに記載の管Bを接続した装置(図1)を用いて、実施例1と同様のアジテーション工程とイジェクション工程を行った。
Tween;tween−20(ナカライテスク社製、23926−35)
80%Glycerol;Glycerol(ナカライテスク社製、17018−25)を超純水で希釈
超純水 95℃;超純水をホットバス(東京理化器械社製、SB−450型)中に30分間静置することで調製
実施例1で使用したものと同じ容器に図5Cに記載の担体6を100mg秤量して、超純水を1.5mL添加して得られた混合液を(a)アイスバス(容器に水道水と、Scotsman社製AFE400型の製氷砕氷器にて作製した氷で満たしたもの)に30分間静置することで0.5℃に調製した混合液、(b)室温下に静置した25℃の混合液、(c)ホットバス(東京理化器械社製SB−450型)中に30分間静置することで98℃に調製した各種混合液について、図5Cに記載の管Bを接続した装置(図1)を用いて、実施例1と同様のアジテーション工程とイジェクション工程を行った。
図1記載の装置によって記録されたPt曲線を図12A〜Cに示す。その結果、いずれの温度下においても、期待された担体の分散や担体の塊化が観察され、固液分離を達成できることが確認された。
溶媒に界面活性剤が含まれる場合の影響を調査するために、以下の実験を行った。
図5Cに記載の担体1を100mgを実施例1で使用したものと同じ容器に秤量し、溶媒としてTritonX(ナカライテスク社製、商品コード:35501−15)を超純水で所定の濃度((a)20%、(b)8%、(c)0%)に達するまで希釈したものを1mL添加して得られた混合液を作製した。これらの混合液について、図5Cに記載の管B1(S0=1.32)を接続した装置(図1)を用いて、実施例1と同様のアジテーション工程とイジェクション工程を適用した。
図1に記載の装置によって記録されたPt曲線を図13A〜Cに示す。その結果、いずれの溶媒を用いても、期待された担体の分散や担体の塊化が観察され、固液分離を達成できることが確認された。
ある管との組み合わせにおいて固液分離が不成功、即ち、不合格と判別された担体が、支持体と併用されることによって、固液分離が可能になるか否かを調査するために、以下の実験を行った。
不合格と判定された担体であっても、合格となった担体を支持体として添加することによって、固液分離を達成可能になることが実証された。つまり、支持体を添加するという簡単な操作のみで、本発明の固液分離において取り扱える担体の範囲を、大きく広げられることが明らかとなった。
本実施形態の固液分離を利用することで、ACTHペプチドを含む液体試料から塩を除去し、ACTHペプチドを精製画分として回収することが可能であるか調査した。
(1)TMR-ACTHペプチドを含む液体試料の調製
標的分子として、副腎皮質刺激ホルモン(ACTH)の1位〜24位のアミノ酸からなるACTH部分ペプチドをテトラメチルローダミン(TMR)で標識したTMR-ACTHペプチド(株式会社スクラム製)を用いた。なお、ACTHは塩基性ペプチド(等電点pI=10.64)であり、配列番号1で表される。TMR-ACTHペプチドの最終濃度が50 nMとなるように、PBS(バイオラッド社製、1610780)に溶解し、TMR-ACTHペプチドを含む液体試料を調製した。
TMR-ACTHペプチドを含む液体試料を、本実施形態の固液分離を用いる図15に記載の工程(以下、シリアルダイリューション式のBF分離操作という)により脱塩処理した。一連の工程は、図1に記載の装置を用いて行った。担体として、細孔径4 nmの日本化成社製のメソ多孔質シリカ担体の表面にアミノシリル基修飾を有するもの(以下、アミノシリル基修飾シリカ担体という)を用いた。図5C記載の管B型の管と、実施例1で使用したものと同じ容器を用いた。
(i) 吸着工程
TMR-ACTHペプチドを含む液体試料(F0)1.5 mLを、担体100 mgを収容した容器に添加した。アジテーション工程によりTMR-ACTHペプチドを担体に吸着させて、担体を含む液体試料を管内に吸引した。管を容器から引き上げ、管の口部へと担体を沈降させ、プラグが形成されるのを観察した。その後、イジェクション工程により液体のみを吐出した。吐出した液体をフロースルー画分(F1)として回収した。
吐出後の管をイオン交換水1 mLが入った実施例1と同様の容器に浸し、吸排操作を繰り返すことによって攪拌し、塩類を洗い流した。担体とイオン交換水との懸濁液を管内に吸引し、管を容器から引き上げ、管の口部へと担体を沈降させ、プラグが形成されるのを観察した。その後、イジェクション工程により液体のみを吐出した。吐出した液体をすすぎ水画分(F2-1)として回収した。同様の水洗工程をさらに2回繰り返し行った。図15では、2回目及び3回目の水洗工程で得られたすすぎ水画分を、それぞれF2-2およびF2-3と表記している。
吐出後の管を、ペプチド溶出用の脱着液(溶出液){50%アセトニトリル(和光純薬社製、019−21691)と0.1%トリフルオロ酢酸(和光純薬社製、206−10731)とを含む水溶液}1 mLの入った実施例1と同様の容器に浸し、アジテーションにより攪拌し、担体に吸着したペプチドを溶出させた。担体と脱着液との懸濁液を管内に吸引し、管を容器から引き上げ、管の口部へと担体を沈降させ、プラグが形成されるのを観察した。その後、イジェクション工程により液体のみを吐出した。吐出した液体を精製画分(F3)として回収した。
脱塩処理前の液体試料(F0)及び脱塩処理後の精製画分(F3)について、導電率を測定した。導電率計はTwin Cond B-173(株式会社堀場製作所)を用いた。ここで、脱塩処理前の溶媒が水であるのに対して、脱塩処理後の溶媒は50%アセトニトリル/0.1%TFA溶液である。よって、脱塩処理後の導電率値は、測定値から50%アセトニトリル/0.1%TFA溶液の導電率値(2.0 mS/cm)を差し引いた値を示した。
脱塩効率(%)=(脱塩処理前の導電率−脱塩処理後の導電率)/(脱塩処理前の導電率)×100 ・・・ 式1
導電率と脱塩効率を下記の表5に示す。なお、F3の導電率は、アセトニトリル自体の導電率(2.0 mS/cm)を差し引いたためにマイナスの値になった。引き算前の値は1.72 mS/cmであった。
脱塩処理前の液体試料(F0)及び脱塩処理後の精製画分(F3)について、蛍光強度を測定した。分光蛍光光度計はF-7000(株式会社日立ハイテクノロジーズ)を用いて、励起波長480 nmおよび蛍光波長580 nmでの蛍光強度を測定した。
得られた蛍光強度から、下記の式2に従って、本脱塩処理によるペプチド回収率を算出した。
ペプチド回収率(%)=(脱塩処理後における蛍光強度)/(脱塩処理前における蛍光強度)×100 ・・・ 式2
蛍光スペクトルを図16に、蛍光強度とペプチド回収率を下記の表6に示す。
本実施形態の固液分離を利用することで、CEAペプチドを含む液体試料から塩を除去し、CEAペプチドを精製画分として回収することが可能であるか調査した。
(1)TMR-CEAペプチドを含む液体試料の調製
標的分子として、癌胎児性抗原(CEA)の132位〜171位のアミノ酸からなるCEA部分ペプチドをTMRで標識したTMR-CEAペプチド(株式会社スクラム製)を用いた。なお、CEAは酸性ペプチド(等電点pI=4.38)であり、配列番号2で表される。TMR-CEAペプチドの最終濃度が2.5μMとなるように、PBSに溶解し、TMR-CEAペプチドを含む液体試料を調製した。
TMR-ACTHペプチドを含む液体試料に代えて上記(1)で調製したTMR-CEAペプチドを含む液体試料を用いたこと、担体として、細孔径4 nmの日本化成社製メソ多孔質シリカ担体(商品名メソピュア:図5A記載の担体の名称が「1」のもの)の表面にオクタデシルシリル基(ODS)修飾を有するもの(ODS修飾シリカ担体)を用いたことを除いては、実施例13と同様に、図15に記載のシリアルダイリューション式のBF分離操作で脱塩処理を実施した。
脱塩処理前の液体試料F0及び脱塩処理後の精製画分F3について、実施例13と同様の方法で導電率を測定した。得られた導電率から、実施例13に記載の式1に従って、本脱塩処理による脱塩効率を算出した。導電率と脱塩効率を下記の表7に示す。なお、F3の導電率は、アセトニトリル自体の導電率(2.0 mS/cm)を差し引いたためにゼロになった。引き算前の値は2 mS/cmであった。
脱塩処理前の液体試料F0及び脱塩処理後の精製画分F3について、実施例13と同様の方法で励起波長480 nmおよび蛍光波長580 nmでの蛍光強度を測定した。得られた蛍光強度から、実施例13に記載の式2に従って、本脱塩処理によるペプチド回収率を算出した。
蛍光スペクトルを図17に、蛍光強度とペプチド回収率を下記の表8に示す。
BNPと比較してACTHに対して高い親和性をもつ担体を使用して、ACTHとBNPペプチドを含む液体試料から、本実施形態の固液分離を利用したBF分離操作による精製画分におけるBNPとACTHの回収率の差を調査した。
(1)ペプチド混合物を含む液体試料の調製
標的分子として、TMR-ACTHペプチドと脳性ナトリウム利尿ペプチド(BNP)(株式会社スクラム製)を用いた。なお、BNPは塩基性ペプチド(等電点pI=10.95)であり、配列番号3で表される。TMR-ACTHペプチドの最終濃度が5μM、BNPペプチドの最終濃度が100μMとなるようにPBSに溶解し、ペプチド混合物を含む液体試料を調製した。
ペプチド混合物を含む液体試料を、実施例13と同様の方法でBF分離処理した。用いた担体はODS修飾シリカ担体である。
BF分離処理前後の各画分[BF分離処理前(F0)、BF分離処理工程中のフロースルー画分(F1)とすすぎ水画分{F2; 3つのすすぎ水画分(F2-1、F2-2およびF2-3)を等量ずつ混合した}、および、BF分離処理後の精製画分(F3)]について、SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)を行った。具体的には、10xローディングバッファー(タカラバイオ株式会社)および60%(w/w)グリセロール溶液の1:1混合物であるサンプルバッファー(還元剤非添加)と上記の各画分とを混合し、ニューページ4-12%ビス-トリスゲルおよびニューページMES SDSランニングバッファー(共にライフテクノロジーズジャパン株式会社)を用いて200 V(定電圧)で30分間、電気泳動を行った。泳動槽はエクセルシュアロックミニセル(ライフテクノロジーズジャパン株式会社)、電源装置はパワーステーション1000XP(アトー株式会社)を用いた。電気泳動後のゲルについて、TMR-ACTHペプチドを蛍光イメージャーPharos FX システム(バイオラッドラボラトリーズ株式会社)を用いて検出した。
回収率(%)=(各画分でのデンシトメトリー値)/(BF分離処理前のデンシトメトリー値)×100 ・・・ 式3
ゲルの蛍光イメージング像と銀染色像を図18および図19に、TMR-ACTHペプチドあるいはBNPペプチドの回収率を下記の表9に示す。
ACTHに対して高い親和性をもち、λDNAに対して低い親和性を持つ担体を使用して、本発明の固液分離を利用したBF分離操作により、ACTHとλDNAを含む液体試料からACTHを選択的に精製画分として回収可能であるかを調査した。
(1)ペプチドと核酸とを含む液体試料の調製
標的分子として、TMR-ACTHペプチドを用いた。夾雑物として、バクテリオファージλ由来の直鎖状核酸で、48,502塩基長からなるλDNA(タカラバイオ株式会社製、型番:3010)を用いた。TMR-ACTHペプチドの最終濃度が5μM、λDNAの最終濃度が50μg/mLとなるようにPBSに溶解し、ペプチドと核酸とを含む液体試料を調製した。
ペプチドと核酸とを含む液体試料を、実施例13と同様の方法でBF分離処理した。担体として、細孔径4 nmの、化学修飾を有さないメソ多孔質シリカ担体、すなわち部材表面にシラノール基を有する無修飾シリカ担体(日本化成社製)を用いた。
BF分離処理前後の各画分[BF分離処理前(F0)、BF分離処理工程中のフロースルー画分(F1)とすすぎ水画分{F2; 3つのすすぎ水画分(F2-1、F2-2およびF2-3)を等量ずつ混合した}、および、BF分離処理後の精製画分(F3)]について、SDS-PAGEあるいはアガロースゲル電気泳動を行った。SDS-PAGEは実施例15と同様の方法で行った。アガロースゲル電気泳動は、具体的には、アガロース(タカラバイオ株式会社)とトリス酢酸EDTA(TAE)バッファー(和光純薬工業株式会社)を混合し、加熱溶解後にゲルトレイ(株式会社ミューピッド)中で固めて1%アガロースゲルを作成した。6xローディングバッファー(タカラバイオ株式会社)と上記の各画分とを混合し、作製した1%アガロースゲルとTAEバッファーを用いて100 V(定電圧)で40分間、電気泳動を行った。電源装置付泳動槽はMupid-2plus(株式会社ミューピッド)を用いた。電気泳動後のゲルについて、核酸蛍光染色剤SYBR Green II(ロンザジャパン株式会社)でλDNAを染色し、蛍光イメージャーImage Quant LAS4000(GEヘルスケア・ジャパン株式会社)を用いて検出した。λDNAの染色は、1xSYBR Green II/TAEバッファー中でゲルを60分間振とうして行った。振とう機はインビトロシェーカーWave-SIを用いた。
ゲルの蛍光イメージング像を図20および図21に、TMR-ACTHペプチドあるいはλDNAの回収率を下記の表10に示す。
特開2015−140320号に記載の方法に従って、全血を処理することにより得られたペプチドの液(以下、ペプチドスープともいう)中の塩を取り除き、精製画分としてペプチドを取り出すことが可能であるかを調査した。
(1)ペプチドと全血とを含む液体試料の調製
標的分子として、ACTHの1位〜24位のアミノ酸からなるACTH部分ペプチドを、赤色蛍光色素であるテトラメチルローダミン(TMR)で標識したTMR−ACTH部分ペプチド(株式会社バイオロジカ)を用いた。夾雑物として、抗凝固剤EDTA塩が添加された健常ボランティア血液(全血)をPROMEDDX社から購入して用いた。特開2015−140320号に記載の方法に従って、TMR-ACTHペプチドの最終濃度が5μM、全血が3倍希釈となるように、TMR-ACTH部分ペプチドおよび全血を、塩化亜鉛を含有するトリス−リン酸混合系緩衝液(Tris・HCl[pH=7.0](最終濃度100 mM)、リン酸ナトリウム(最終濃度0.4 mM)、NaCl (最終濃度6 mM)、そしてZnCl2(最終濃度100 mM))に溶解し、ペプチドと全血とを含む液体試料を調製した。
ペプチドと全血とを含む液体試料1.4 mLを10 mL容のガラス試験管に移し、次にテフロン(登録商標)製の試験管用耐圧密封ホルダー(マイルストーンゼネラル株式会社)にて封じてから、マイクロ波照射装置MultiSYNTH(マイルストーンゼネラル株式会社)を用いて、室温(25℃)から100℃まで30秒間で昇温し、その後100℃から160℃まで1分間で昇温することにより加熱処理を行った。加熱処理後の冷却は、前記のマイクロ波照射装置に接続されたエアコンプレッサーYC-3R(株式会社八重崎空圧)から圧縮空気を前記の耐圧密封ホルダーに吹き付けることで行った。冷却速度は、毎分20℃とした。加熱処理後の上清画分であるペプチドスープを回収した。
ペプチドと全血とを含む液体試料の加熱処理上清(ペプチドスープ)を、実施例13と同様のBF分離操作で脱塩処理した。用いた担体はODS修飾シリカ担体である。
脱塩処理前後の各画分{脱塩処理前(F0)、脱塩処理工程中のフロースルー画分(F1)とすすぎ水画分(F2-1,F2-2,F2-3)、および、脱塩処理後の精製画分(F3)}について、実施例13と同様の方法で導電率を測定し、本脱塩処理による脱塩効率を算出した。
導電率と脱塩効率を下記の表11に示す。
脱塩処理前後の各画分{脱塩処理前(F0)、脱塩処理工程中のフロースルー画分(F1)とすすぎ水画分(F2-1,F2-2,F2-3)、および、脱塩処理後の精製画分(F3)}について、実施例13と同様の方法で蛍光強度を測定し、本脱塩処理によるペプチド回収率を算出した。蛍光強度測定において、TMR-ACTHペプチドの検出では励起波長540 nmおよび蛍光波長580 nm、また、全血由来ペプチドの検出では励起波長287 nmおよび蛍光波長350 nmとした。
蛍光スペクトルを図22および図23に、蛍光強度とペプチド回収率を下記の表12に示す。
ACTHに対して高い親和性をもつことが確認されている3種類の担体を使用して、特開2015−137978号に記載の試薬中で加熱処理を行って得られた液中の塩を、本発明の固液分離を利用したBF分離操作によって除去することが可能であるかを調査した。さらに、3種類の担体による回収率の差を調査した。
標的分子として、TMR-ACTHペプチドを用いた。夾雑物として、実施例17と同様の全血を用いた。両者を共に、グリシンを含有する0.5×リン酸緩衝性生理食塩水(0.5×PBS[pH=7.4]、塩化ナトリウム(最終濃度68.5 mM)、リン酸水素二ナトリウム(最終濃度4 mM)、塩化カリウム(最終濃度1.3 mM)、リン酸二水素カリウム(最終濃度0.7 mM、そしてグリシン(最終濃度500 mM))に溶解し、ペプチドと全血とを含む液体試料を調製した。
(2)ペプチドと全血とを含む液体試料の加熱処理
ペプチドと全血とを含む液体試料を実施例17と同様の方法で加熱処理を行いさらにそのまま160℃で60秒間保持することで、加熱処理後の上清画分を回収した。
ペプチドと全血とを含む液体試料の加熱処理上清を、本実施形態の固液分離を用いた図24に記載の工程(以下、リテンションバック式のBF分離操作)により脱塩処理した。一連の工程は、図1記載の装置を用いて行った。担体として、無修飾シリカ担体、ODS修飾シリカ担体、あるいは、アミノシリル基修飾シリカ担体を用いた。管として図5C記載の管B1型(口径1.34mm)を、容器として実施例1と同様の容器を使用した。一連の工程の概略図と工程中に生じる各画分の名称を図24に示した。
(i) 吸着工程
TMR-ACTHペプチドと全血とを含む液体試料(F0)1.5 mLを、担体100 mgを秤量した実施例1と同様の容器に添加した。混合液を攪拌し、TMR-ACTHペプチドを担体に吸着させて、担体を含む液体試料を管内に吸引した。担体を含む液体試料を吸引した後の容器内に僅かに残る担体を含む液体試料を残渣(R0)とした。管を容器から引き上げ、静置し、管の口部へと担体を沈降させ、プラグが形成されるのを観察した。その後、溶媒を吐出した。吐出した溶媒をフロースルー画分(F1)として回収した。
水洗用のイオン交換水1 mLを前述の残渣(R0)に添加した後、管内でプラグ形成した担体をイオン交換水中で攪拌し、塩類を洗い流した。撹拌された液を管内に吸引し、管を容器から引き上げ、静置し、管の口部へと担体を沈降させ、プラグが形成されるのを観察した。その後、溶媒を吐出した。吐出した溶媒をすすぎ水画分(F2)として回収した。担体を含むイオン交換水を吸引した後の1.5 mL容器内に僅かに残る担体を含むイオン交換水を残渣(R0)とした。同様の水洗工程をさらに2回繰り返した。
ペプチド溶出用の脱着液1 mLを、上記の水洗工程によって最終的に得られた残渣(R0)に添加した後、担体を脱着液中で攪拌し、担体に吸着したペプチドを溶出させた。担体と脱着液との混液を管内に吸引し、管を容器から引き上げ、静置し、管の口部へと担体を沈降させ、プラグが形成されるのを観察した。その後、溶媒を吐出した。吐出した液体を精製画分(F3)として回収した。
無修飾シリカ担体、ODS修飾シリカ担体、あるいは、アミノシリル基修飾シリカ担体を用いた脱塩処理前後の各画分{脱塩処理前(F0)および脱塩処理後の精製画分(F3)}について、実施例13と同様の方法で導電率を測定した。導電率を下記の表13に示す。なお、F3の導電率は、アセトニトリル自体の導電率(2.0 mS/cm)を差し引いたためにマイナスの値になった。引き算前の値は1.18 mS/cm。
無修飾シリカ担体、ODS修飾シリカ担体、あるいは、アミノシリル基修飾シリカ担体を用いた脱塩処理前後の各画分{脱塩処理前(F0)および脱塩処理後の精製画分(F3)}について、実施例13と同様の方法で蛍光強度を測定し、ペプチド回収率を算出した。
蛍光強度測定において、TMR-ACTHペプチドの検出では励起波長540 nmおよび蛍光波長580 nm、また、全血由来ペプチドの検出では励起波長287 nmおよび蛍光波長350 nmとした。
また、算出したペプチド回収率から、下記の式4に従って、本脱塩処理後のTMR-ACTHペプチドと全血由来ペプチドとの比率の違いを算出した。
TMR-ACTHペプチド/全血由来ペプチド回収率比=(TMR-ACTHペプチドの回収率)/(全血由来ペプチドの回収率)・・・ 式4
前述した実施の形態の他にも、この発明について種々の変形例があり得る。それらの変形例は、この発明の範囲に属さないと解されるべきものではない。この発明には、請求の範囲と均等の意味および前記範囲内でのすべての変形とが含まれるべきである。
21:吸引ノズル、 23:容器、 25a:ノズルスタンド、 25b:テーブル駆動モータ、 27:容器支持体、 29:昇降機構、 29a:スクリューシャフト、 29b:スクリューナット、 29c:シャフト軸受、 29d:シャフト駆動モータ、 31:圧力センサ、 40:試薬キット、 41:第1容器、 42:第2容器、 43:添付文書、 44:梱包箱
Claims (26)
- 先端に開口が形成された吸引ノズルの内部へ前記開口から粒子を含む懸濁液を吸引し、
吸引された懸濁液に含まれる粒子の少なくとも一部を沈降させて前記吸引ノズル内で詰まらせ、
前記粒子を詰まらせた吸引ノズルの開口を介して内部の液体を排出する固液分離方法。 - 前記液体の排出は、吸引された粒子が略均一に分散した懸濁液の先端開口近傍と先端開口から最遠部とに沈降による粒子濃度の差が生じた後に行われ、排出に伴って粒子を詰まらせた吸引ノズルを通過し得る液体を排出する工程である請求項1に記載の固液分離方法。
- 前記懸濁液は、標的物質を含む試料液と、標的物質を吸着させる粒子とが混合されたものである請求項2に記載の固液分離方法。
- 前記標的物質が、所望のペプチドまたは核酸であり、
前記液体が、前記所望のペプチドまたは核酸以外のペプチドおよび/または核酸、塩を含む請求項3に記載の固液分離方法。 - 前記試料液が、全血、血清または血漿である請求項3に記載の固液分離方法。
- 前記試料液が、全血、血清または血漿を電子レンジで加熱することにより得られる上清である請求項3に記載の固液分離方法。
- 前記試料液が、全血、血清または血漿を電子レンジで加熱することにより得られる上清の脱塩処理液である請求項3に記載の固液分離方法。
- 前記粒子が、前記標的物質を吸着させる多孔性材料の粒子である請求項3〜7の何れか一つに記載の固液分離方法。
- 前記粒子が、シリカ、アルミナ、ジルコニアまたはポリスチレンを材料とする請求項3〜8の何れか一つに記載の固液分離方法。
- 前記粒子が、粒子径および粒子径分布について120μm以上のD90−D10を有し、かつD50が、170μm以上である請求項1〜9の何れか一つに記載の固液分離方法。
- 前記吸引ノズルの最小の開口径が、前記粒子の最大径より大きく、かつ、前記粒子の最大径の6倍よりも小さい請求項1〜10の何れか一つに記載の固液分離方法。
- 前記液体を排出した後に、標的物質が吸着された粒子から標的物質を溶出させる溶出液を吸引ノズル内に吸引し、
吸引された溶出液により混ぜられる粒子の少なくとも一部を開口手前側に沈降させ、
溶出液と溶出した標的物質とを先端開口を介して排出させる請求項3に記載の固液分離方法。 - 前記懸濁液の吸引は、吸引ノズルの先端を懸濁液に浸し、吸引ノズル内の気圧を外部の気圧に対して負圧にする工程であり、
前記粒子の沈降は、吸引ノズル内の気圧を一定に保つ工程であり、
前記液体の排出は、吸引ノズル内の気圧を外部の気圧に対して正圧にする工程である請求項1〜12の何れか一つに記載の固液分離方法。 - 吸引ノズル内の気圧の制御は、吸引ノズルの後端にプランジャを含むシリンジが接続された状態でプランジャの位置を制御する工程であり、
前記懸濁液の吸引は、プランジャを移動させて吸引ノズルを含むシリンジ内部の容積を増大させる工程であり、
前記粒子の沈降は、プランジャを静止させて同じ位置を保つ工程であり、
前記液体の排出は、プランジャを移動させて吸引ノズルを含むシリンジ内部の容積を減少させた後、プランジャを静止させて同じ位置を保つ工程である請求項13に記載の固液分離方法。 - BF分離のために用いられる請求項1〜14の何れか一つに記載の固液分離方法。
- 前記懸濁液中の前記粒子の濃度が、10〜100mg/mLである請求項1〜15の何れか一つに記載の固液分離方法。
- 前記吸引部の先端の内径が先細りになっている、請求項1〜16の何れか一つに記載の固液分離方法。
- 先端に開口が形成された吸引部の内部へ前記開口から標的物質を含む試料液と標的物質を吸着させる粒子を含む懸濁液を吸引し、
吸引された懸濁液に含まれる粒子の少なくとも一部を沈降させて前記吸引ノズル内で詰まらせ、
前記粒子を詰まらせた吸引部の開口を介して内部の液体を排出し、
標的物質が吸着した粒子から標的物質を溶出させる溶出液を吸引部内に吸引し、
吸引された溶出液により混ぜられる粒子の少なくとも一部を沈降させて詰まらせ、
前記粒子を詰まらせた吸引部の開口を介して標的物質が溶出した溶出液を排出し、
前記溶出液に含まれる標的物質を測定する、標的物質の測定方法。 - 先端に開口が形成された吸引ノズルが装着される吸引部と、
前記吸引部の動作を制御する制御部と、
粒子を含む液体が収容された容器を支持する容器支持体と備え、
前記制御部は、前記懸濁液の少なくとも一部を前記開口から吸引ノズルの内部へ吸引し、吸引された懸濁液に含まれる粒子の少なくとも一部を沈降させて前記吸引ノズル内で詰まらせ、前記粒子を内部に詰まらせた吸引ノズルの開口を介して内部の液体を排出するように前記吸引部を制御する固液分離装置。 - 前記制御部は、前記懸濁液の吸引後、吸引ノズル内で粒子が略均一に分散した懸濁液の先端開口近傍と先端開口から最遠部とに沈降による粒子濃度の差が生じるまでの期間に基づいて予め定められた静止期間において、前記懸濁液の吸引を停止して前記粒子の少なくとも一部を沈降させ、前記静止期間の経過後、前記粒子を内部に詰まらせた吸引ノズルの開口を介して内部の液体を排出するように前記吸引部を制御する請求項19に記載の固液分離装置。
- 前記容器は、標的物質を含む試料液とその標的物質を吸着させる粒子とを収容するものである請求項19または20に記載の固液分離装置。
- 前記吸引部は、プランジャを含むシリンジと、そのプランジャを移動させるアクチュエータとを含み、
前記制御部は、アクチュエータを制御して吸引ノズルを含むシリンジ内部の容積を増大させるようにプランジャを移動させて前記懸濁液の吸引を行った後、前記静止期間においては同じ位置を保つようにプランジャを静止させ、前記静止期間の経過後、吸引ノズルを含むシリンジ内部の容積を減少させるようにプランジャを移動させた後にプランジャを静止させる請求項19〜21の何れか一つに記載の固液分離装置。 - 前記制御部は、前記懸濁液を吸引するプランジャの移動速さよりもゆっくりと前記プランジャを移動させて、内部の液体を排出する請求項21に記載の固液分離装置。
- 前記吸引ノズルは、吸引部に着脱可能である請求項19〜22の何れか一つに記載の固液分離装置。
- 吸引ノズルを、前記吸引部に装着される位置へ搬送するノズル搬送機構と、
前記吸引部に装着された吸引ノズルの先端を前記容器支持体に支持された容器内の懸濁液に向けて下降させる昇降機構とをさらに備える請求項19に記載の固液分離装置。 - 請求項1〜17の何れか一つに記載の方法に用いられ先端開口近傍にフィルターを有しない吸引ノズルとしてのピペットチップと、
前記方法に用いられる粒子と
を含む固液分離用キットであって、
前記ピペットチップの最小の開口径が前記粒子の最大径より大きくかつ前記粒子の最大径の6倍よりも小さい固液分離用キット。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017108765A JP6979797B2 (ja) | 2017-05-31 | 2017-05-31 | 固液分離方法、固液分離装置およびそれに用いるピペットチップ、粒子およびキット |
| EP18174792.4A EP3409365B1 (en) | 2017-05-31 | 2018-05-29 | Solid-liquid separation method, solid-liquid separation apparatus, and kit to be used therefor |
| US15/993,013 US10702864B2 (en) | 2017-05-31 | 2018-05-30 | Solid-liquid separation method, solid-liquid separation apparatus, and kit to be used therefor |
| CN201810547116.5A CN108970659A (zh) | 2017-05-31 | 2018-05-31 | 固液分离方法和装置及在其中使用的移液器吸头、粒子及试剂盒 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017108765A JP6979797B2 (ja) | 2017-05-31 | 2017-05-31 | 固液分離方法、固液分離装置およびそれに用いるピペットチップ、粒子およびキット |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018205043A JP2018205043A (ja) | 2018-12-27 |
| JP6979797B2 true JP6979797B2 (ja) | 2021-12-15 |
Family
ID=62486441
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017108765A Active JP6979797B2 (ja) | 2017-05-31 | 2017-05-31 | 固液分離方法、固液分離装置およびそれに用いるピペットチップ、粒子およびキット |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US10702864B2 (ja) |
| EP (1) | EP3409365B1 (ja) |
| JP (1) | JP6979797B2 (ja) |
| CN (1) | CN108970659A (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11698333B2 (en) * | 2017-06-21 | 2023-07-11 | Sony Corporation | Sample liquid-sending apparatus, flow cytometer, and sample liquid-sending method |
| US12226776B2 (en) | 2021-11-04 | 2025-02-18 | Instrumentation Laboratory Company | Preparing substances in a medical diagnostic system |
| CN116399648B (zh) * | 2023-03-29 | 2023-09-29 | 石家庄地震监测中心站 | 一种管中管地下流体分层取样装置 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL8900725A (nl) * | 1989-03-23 | 1990-10-16 | Az Univ Amsterdam | Werkwijze en combinatie van middelen voor het isoleren van nucleinezuur. |
| JPH07306204A (ja) * | 1994-05-11 | 1995-11-21 | Sanyo Chem Ind Ltd | 免疫測定法 |
| US6048457A (en) * | 1997-02-26 | 2000-04-11 | Millipore Corporation | Cast membrane structures for sample preparation |
| JPH11266864A (ja) * | 1998-03-19 | 1999-10-05 | Hitachi Ltd | 核酸の精製方法および精製用装置 |
| JP2003254877A (ja) | 2002-03-04 | 2003-09-10 | Aloka Co Ltd | 検体の処理方法およびフィルター付部材 |
| NO20023599D0 (no) * | 2002-07-29 | 2002-07-29 | Andrew T Campbell | Fremgangsmåte og anordning for manipulering av magnetiske partikler, spesielt for blanding, separasjon, oppsamling ogvasking |
| CN100538362C (zh) * | 2002-11-07 | 2009-09-09 | 株式会社三菱化学药得论 | 用于收集磁性颗粒的磁性材料及其应用 |
| JP5122091B2 (ja) * | 2006-06-13 | 2013-01-16 | ユニバーサル・バイオ・リサーチ株式会社 | 担体封入変形容器、担体封入変形容器処理装置、および担体封入変形容器処理方法 |
| JP5202339B2 (ja) * | 2007-02-07 | 2013-06-05 | ユニバーサル・バイオ・リサーチ株式会社 | 容器反復利用磁性粒子並行処理装置および容器反復利用磁性粒子並行処理方法 |
| WO2008103828A1 (en) | 2007-02-21 | 2008-08-28 | William Brewer | Pipette tips for extraction, sample collection and sample cleanup and methods for their use |
| US20090095057A1 (en) * | 2007-10-16 | 2009-04-16 | Phoenix S&T, Inc. | Integrated microfluidic nozzle device for chromatographic sample preparation for mass spectrometry applications |
| JP6088651B2 (ja) * | 2013-07-03 | 2017-03-01 | 株式会社島津製作所 | 粒子操作方法および粒子操作デバイス |
| JP6161548B2 (ja) | 2014-01-23 | 2017-07-12 | シスメックス株式会社 | ペプチドの回収方法 |
| JP6182465B2 (ja) * | 2014-01-29 | 2017-08-16 | シスメックス株式会社 | ペプチドの回収方法 |
| CN204337888U (zh) * | 2014-11-19 | 2015-05-20 | 北京汇赢创业投资有限公司 | 过滤膜支架及过滤装置 |
| CN105879486B (zh) * | 2016-06-24 | 2018-12-04 | 象山东方输煤设备有限公司 | 一种含煤污水过滤回收装置及过滤回收方法 |
-
2017
- 2017-05-31 JP JP2017108765A patent/JP6979797B2/ja active Active
-
2018
- 2018-05-29 EP EP18174792.4A patent/EP3409365B1/en active Active
- 2018-05-30 US US15/993,013 patent/US10702864B2/en active Active
- 2018-05-31 CN CN201810547116.5A patent/CN108970659A/zh active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2018205043A (ja) | 2018-12-27 |
| EP3409365B1 (en) | 2019-12-04 |
| EP3409365A1 (en) | 2018-12-05 |
| US10702864B2 (en) | 2020-07-07 |
| CN108970659A (zh) | 2018-12-11 |
| US20180345272A1 (en) | 2018-12-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6979797B2 (ja) | 固液分離方法、固液分離装置およびそれに用いるピペットチップ、粒子およびキット | |
| JP5097204B2 (ja) | カラムチップ処理装置およびカラムチップ処理方法 | |
| EP3563154B1 (en) | Magnetic immunoglobulin-binding particles | |
| JP5319672B2 (ja) | 磁性粒子を用いる分析装置 | |
| US20130296538A1 (en) | Downstream bioprocessing device | |
| JPWO2006123688A1 (ja) | フィルタ処理方法、フィルタ封入チップ、およびフィルタ処理装置 | |
| EP2584337A1 (en) | Biological sample pretreatment method and apparatus | |
| CN1582191A (zh) | 提取装置与化学分析装置及化学分析方法 | |
| KR101817671B1 (ko) | 추출물 분리 및 정제장치 | |
| JP2017205760A (ja) | マイクロフロー濾過システム及びフロー濾過方法 | |
| JP2016507729A (ja) | 充填ベッドクロマトグラフィーカラムの洗浄方法 | |
| CN111226116B (zh) | 组合式分离 | |
| US11761863B2 (en) | Systems and methods for extracting analytes from a sample | |
| Rezvani et al. | Characterization and evaluation of the novel agarose–nickel composite matrix for possible use in expanded bed adsorption of bio-products | |
| EP2251409B1 (en) | Material for capturing microbes or the like, device for capturing microbes or the like, method of capturing microbes or the like and method of producing material for capturing microbes or the like | |
| CN218823515U (zh) | 一种用于临床质谱的多功能样品前处理装置 | |
| CN112011533B (zh) | 一种核酸提取、检测的集成系统以及检测方法 | |
| JP2003254877A (ja) | 検体の処理方法およびフィルター付部材 | |
| WO2007099937A1 (ja) | タンパク質等溶液ろ過処理方法およびその装置 | |
| JP2012251937A (ja) | 前処理装置及びそれを用いた自動分析装置 | |
| CN111638114A (zh) | 基于磁分离的全自动QuEChERS前处理一体机及其前处理方法 | |
| CN211660243U (zh) | 活性物质自动筛选装置 | |
| CN110882838A (zh) | 活性物质自动筛选方法 | |
| WO2023242964A1 (ja) | 核酸溶離液及び当該核酸溶離液を用いた核酸の溶離方法 | |
| CN110208063A (zh) | 一种在线自动化磁性纳米材料震荡-解吸装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20180425 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180529 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200528 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210420 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210601 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210730 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210927 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211019 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211116 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6979797 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313117 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |