JP5752419B2 - 新規ヒト転移性腫瘍関連分子、活性化遺伝子およびタンパク質を検出する方法ならびに遺伝子発現を妨害する方法 - Google Patents
新規ヒト転移性腫瘍関連分子、活性化遺伝子およびタンパク質を検出する方法ならびに遺伝子発現を妨害する方法 Download PDFInfo
- Publication number
- JP5752419B2 JP5752419B2 JP2010543378A JP2010543378A JP5752419B2 JP 5752419 B2 JP5752419 B2 JP 5752419B2 JP 2010543378 A JP2010543378 A JP 2010543378A JP 2010543378 A JP2010543378 A JP 2010543378A JP 5752419 B2 JP5752419 B2 JP 5752419B2
- Authority
- JP
- Japan
- Prior art keywords
- tucap
- cells
- protein
- seq
- melanoma
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000623 proteins and genes Proteins 0.000 title claims description 76
- 102000004169 proteins and genes Human genes 0.000 title claims description 61
- 238000000034 method Methods 0.000 title claims description 22
- 230000014509 gene expression Effects 0.000 title claims description 18
- 206010061289 metastatic neoplasm Diseases 0.000 title claims description 12
- 230000002452 interceptive effect Effects 0.000 title 1
- 210000004027 cell Anatomy 0.000 claims description 146
- 201000001441 melanoma Diseases 0.000 claims description 43
- 206010028980 Neoplasm Diseases 0.000 claims description 37
- 239000003550 marker Substances 0.000 claims description 14
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 13
- 230000000242 pagocytic effect Effects 0.000 claims description 11
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 10
- 210000004881 tumor cell Anatomy 0.000 claims description 10
- 150000001413 amino acids Chemical class 0.000 claims description 9
- 230000001394 metastastic effect Effects 0.000 claims description 8
- 230000000295 complement effect Effects 0.000 claims description 7
- 108010033276 Peptide Fragments Proteins 0.000 claims description 6
- 102000007079 Peptide Fragments Human genes 0.000 claims description 6
- 108020004999 messenger RNA Proteins 0.000 claims description 5
- 238000000338 in vitro Methods 0.000 claims description 4
- 239000003112 inhibitor Substances 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 3
- 206010027476 Metastases Diseases 0.000 claims description 3
- 230000009401 metastasis Effects 0.000 claims description 3
- 239000003814 drug Substances 0.000 claims description 2
- 150000007523 nucleic acids Chemical group 0.000 claims 3
- 108091028043 Nucleic acid sequence Proteins 0.000 claims 2
- 108020004707 nucleic acids Proteins 0.000 claims 1
- 102000039446 nucleic acids Human genes 0.000 claims 1
- 201000011510 cancer Diseases 0.000 description 30
- 102100032466 Transmembrane 9 superfamily member 4 Human genes 0.000 description 18
- 101000798726 Homo sapiens Transmembrane 9 superfamily member 4 Proteins 0.000 description 17
- 241000699666 Mus <mouse, genus> Species 0.000 description 17
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 15
- 108020004459 Small interfering RNA Proteins 0.000 description 15
- 208000021039 metastatic melanoma Diseases 0.000 description 15
- 238000004458 analytical method Methods 0.000 description 14
- 239000012634 fragment Substances 0.000 description 13
- 210000002966 serum Anatomy 0.000 description 13
- 206010057249 Phagocytosis Diseases 0.000 description 12
- 238000001514 detection method Methods 0.000 description 12
- 210000004698 lymphocyte Anatomy 0.000 description 12
- 230000008782 phagocytosis Effects 0.000 description 12
- 238000001262 western blot Methods 0.000 description 11
- 108091033319 polynucleotide Proteins 0.000 description 10
- 102000040430 polynucleotide Human genes 0.000 description 10
- 239000002157 polynucleotide Substances 0.000 description 10
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 9
- 241000699670 Mus sp. Species 0.000 description 9
- 230000003902 lesion Effects 0.000 description 8
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 8
- 210000001519 tissue Anatomy 0.000 description 8
- 239000013598 vector Substances 0.000 description 8
- 241000283973 Oryctolagus cuniculus Species 0.000 description 7
- 238000010166 immunofluorescence Methods 0.000 description 7
- 230000008569 process Effects 0.000 description 7
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 6
- 101100297438 Dictyostelium discoideum phg1a gene Proteins 0.000 description 6
- 230000001580 bacterial effect Effects 0.000 description 6
- 210000004408 hybridoma Anatomy 0.000 description 6
- 238000001114 immunoprecipitation Methods 0.000 description 6
- 210000002540 macrophage Anatomy 0.000 description 6
- 210000001539 phagocyte Anatomy 0.000 description 6
- 102000004196 processed proteins & peptides Human genes 0.000 description 6
- 238000010186 staining Methods 0.000 description 6
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 5
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 5
- 238000012137 double-staining Methods 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 239000013604 expression vector Substances 0.000 description 5
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 5
- 230000036074 healthy skin Effects 0.000 description 5
- 230000003834 intracellular effect Effects 0.000 description 5
- 239000006166 lysate Substances 0.000 description 5
- 230000036210 malignancy Effects 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- FNEZBBILNYNQGC-UHFFFAOYSA-N methyl 2-(3,6-diamino-9h-xanthen-9-yl)benzoate Chemical compound COC(=O)C1=CC=CC=C1C1C2=CC=C(N)C=C2OC2=CC(N)=CC=C21 FNEZBBILNYNQGC-UHFFFAOYSA-N 0.000 description 5
- 239000013642 negative control Substances 0.000 description 5
- 229920001184 polypeptide Polymers 0.000 description 5
- 102000007469 Actins Human genes 0.000 description 4
- 108010085238 Actins Proteins 0.000 description 4
- 101150048357 Lamp1 gene Proteins 0.000 description 4
- 108091034117 Oligonucleotide Proteins 0.000 description 4
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 4
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 4
- 210000000170 cell membrane Anatomy 0.000 description 4
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 4
- 229960004316 cisplatin Drugs 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 230000003211 malignant effect Effects 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 230000001629 suppression Effects 0.000 description 4
- 239000012103 Alexa Fluor 488 Substances 0.000 description 3
- 241000224489 Amoeba Species 0.000 description 3
- 206010059866 Drug resistance Diseases 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 239000011324 bead Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000004709 cell invasion Effects 0.000 description 3
- 230000030570 cellular localization Effects 0.000 description 3
- 230000008045 co-localization Effects 0.000 description 3
- 210000004292 cytoskeleton Anatomy 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 210000001163 endosome Anatomy 0.000 description 3
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 3
- 108020001507 fusion proteins Proteins 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 238000003365 immunocytochemistry Methods 0.000 description 3
- 238000002991 immunohistochemical analysis Methods 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 210000004379 membrane Anatomy 0.000 description 3
- 210000003470 mitochondria Anatomy 0.000 description 3
- 230000037311 normal skin Effects 0.000 description 3
- 210000000680 phagosome Anatomy 0.000 description 3
- INAAIJLSXJJHOZ-UHFFFAOYSA-N pibenzimol Chemical compound C1CN(C)CCN1C1=CC=C(N=C(N2)C=3C=C4NC(=NC4=CC=3)C=3C=CC(O)=CC=3)C2=C1 INAAIJLSXJJHOZ-UHFFFAOYSA-N 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 210000001626 skin fibroblast Anatomy 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- 239000012110 Alexa Fluor 594 Substances 0.000 description 2
- 108090000672 Annexin A5 Proteins 0.000 description 2
- 102000004121 Annexin A5 Human genes 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 206010005003 Bladder cancer Diseases 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 2
- 241000283074 Equus asinus Species 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 2
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 2
- 208000000172 Medulloblastoma Diseases 0.000 description 2
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 2
- 108091030071 RNAI Proteins 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 230000035605 chemotaxis Effects 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 238000010230 functional analysis Methods 0.000 description 2
- 230000009368 gene silencing by RNA Effects 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- 238000002169 hydrotherapy Methods 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 210000005061 intracellular organelle Anatomy 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 108010082117 matrigel Proteins 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 239000003068 molecular probe Substances 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 230000020477 pH reduction Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 210000004976 peripheral blood cell Anatomy 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 230000029219 regulation of pH Effects 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 210000004927 skin cell Anatomy 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 230000004960 subcellular localization Effects 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 201000005112 urinary bladder cancer Diseases 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 210000005253 yeast cell Anatomy 0.000 description 2
- 101710191936 70 kDa protein Proteins 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 244000075850 Avena orientalis Species 0.000 description 1
- 235000007319 Avena orientalis Nutrition 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 102000004225 Cathepsin B Human genes 0.000 description 1
- 108090000712 Cathepsin B Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 208000037845 Cutaneous squamous cell carcinoma Diseases 0.000 description 1
- 102100021238 Dynamin-2 Human genes 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102100023078 Early endosome antigen 1 Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102100020903 Ezrin Human genes 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 101000817607 Homo sapiens Dynamin-2 Proteins 0.000 description 1
- 101001050162 Homo sapiens Early endosome antigen 1 Proteins 0.000 description 1
- 101100260827 Homo sapiens TM9SF4 gene Proteins 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 239000012097 Lipofectamine 2000 Substances 0.000 description 1
- 239000012098 Lipofectamine RNAiMAX Substances 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 238000010222 PCR analysis Methods 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 241000312117 Phago Species 0.000 description 1
- 238000010240 RT-PCR analysis Methods 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108091078243 Rho family Proteins 0.000 description 1
- 102000042463 Rho family Human genes 0.000 description 1
- 241000700141 Rotifera Species 0.000 description 1
- 239000012722 SDS sample buffer Substances 0.000 description 1
- 241000235343 Saccharomycetales Species 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 206010064390 Tumour invasion Diseases 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 230000009400 cancer invasion Effects 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000002975 chemoattractant Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 208000030381 cutaneous melanoma Diseases 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 108010055671 ezrin Proteins 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 238000012921 fluorescence analysis Methods 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 201000006585 gastric adenocarcinoma Diseases 0.000 description 1
- 210000001156 gastric mucosa Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000010185 immunofluorescence analysis Methods 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000013388 immunohistochemistry analysis Methods 0.000 description 1
- 238000007901 in situ hybridization Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000011325 microbead Substances 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000009919 sequestration Effects 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 201000003708 skin melanoma Diseases 0.000 description 1
- 201000010106 skin squamous cell carcinoma Diseases 0.000 description 1
- 239000004055 small Interfering RNA Substances 0.000 description 1
- NRHMKIHPTBHXPF-TUJRSCDTSA-M sodium cholate Chemical compound [Na+].C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC([O-])=O)C)[C@@]2(C)[C@@H](O)C1 NRHMKIHPTBHXPF-TUJRSCDTSA-M 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000009747 swallowing Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 239000012130 whole-cell lysate Substances 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Urology & Nephrology (AREA)
- Cell Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Food Science & Technology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Description
本発明は、一般に、癌研究の分野に関するものであり、とりわけ、新規腫瘍発生および転移関連タンパク質および遺伝子の同定に関する。本発明は、悪性度の新規マーカーに関する。本発明はさらに、遺伝子治療の分野に関する。
2005年には、世界中で年間5800万人の死亡者のうち、760万人が癌により死亡した。癌による死亡者は増え続け、2015年には900万人、2030年には1140万人にのぼると予測されている(WHOデータ)。癌の処置は、外科手術、放射線治療、化学療法、ホルモン療法、またはこれらのうちのいくつかの組み合わせを含み得るが、現在における多くの癌患者の生存率は、極めて低いものである。世界保健機関によると、癌病状(cancer burden)の3分の1は、早期に発見され、十分に処置された場合、治癒し得る。病理学的研究は、多くの固形腫瘍の診断を確立するための手段を提供する。多くの症例は、現在の病理学的基準を用いて正確に分類され得るが、病理学者の間においてさえコンセンサスが得られていない重要な症例が存在する。診断の曖昧さは、患者に対するかなり不利な結果をもたらす。悪性腫瘍を良性と誤って分類することは、致命的であり得て、良性腫瘍を悪性と診断することは、かなりの罹患率(significant morbidity)を生じ得る。現在、これらの不明瞭性を決定的に解決する方法は存在しない。したがって、これらの不明瞭性を減少させ得る診断テストの必要性が明らかに存在する。
癌細胞は、単細胞真核生物としての摂食および挙動のために他の細胞を使用することから、アメーバと同じ制御エレメントを用いた同じフレームワークをおそらく共有しているであろうという我々の理論に基づき、我々は、PHG1A遺伝子をヒトゲノムで比較した。ヒトにおけるphg1の3つのホモログ(TM9SF4、U81006およびU94831)を完全に塩基配列決定し、我々は、キイロタマホコリカビのphg1と最も近いヒトホモログが、第20染色体q11.21に位置するtm9sf4 (別名: KIAA0255, dJ836N17.2)であることを見出した。この遺伝子が完全に塩基配列決定されたとしても、その機能またはこの発現産物は全く特徴づけられていなかった。
TUCAP-1/TM9SF4 (HUGO命名委員会(nomenclature official committee)による正式名称: 9回膜貫通型スーパーファミリータンパク質メンバー4)は、9回膜貫通型スーパーファミリー(TM9SF)に属し、それは、巨大な細胞外可変N末端ドメインおよび9〜10個の推定上の膜貫通ドメインの存在により特徴づけられる高度に保存されたタンパク質のファミリーである。しかしながら、TM9SF4の機能および局在は、ヒト細胞において現在まで記載されていない。本願において、我々は、当該タンパク質の発現を特定し、当該タンパク質の新規かつ有用な用途を提供する。本願は、当該タンパク質を新規癌タンパク質として同定し、当該タンパク質が悪性腫瘍細胞において発現するが、さまざまな健常細胞および組織において検出されないことを示す。本願はまた、当該タンパク質の構造を示し、他のタンパク質との類似性により、当該タンパク質が細胞内小胞のpH制御に関与し得ることを示す。本願を通して、我々は、適宜、TUCAP-1タンパク質および当該タンパク質をコードする遺伝子をtucap-1と呼ぶ。
Tucap-1転写産物およびTUCAP-1タンパク質は、原発性黒色腫細胞、末梢血単核細胞または健常な皮膚細胞においては検出されないが、ヒト悪性黒色腫細胞において検出される。
細胞培養
ヒト原発性および転移性黒色腫細胞株の各々は、Istituto Nazionale dei Tumori, Milan, Italyで外科的に切除された患者の原発性もしくは転移性腫瘍病変部位に由来するものであった。現在の研究で使用したすべての細胞をPM (原発性黒色腫)またはMM (転移性黒色腫)と名付けて、その後ろに、進行度に応じて数字(progressive number)を付けた。ヒト末梢血単核細胞(PBMC)を、健常なドナーから、バフィーコートのFicoll-Hypaque (Pharmacia)濃度勾配により精製した。単球を、製造者の指示にしたがって、CD14標識化Miltenyiマイクロビーズを用いてPBMCから分離し、RPMI 1640+15% FCS中、37℃で2週間、分離させておいた。残りの末梢血リンパ球(PBL)を、CD14ビーズ仲介単球除去後に得た。すべての細胞を、5% CO2環境中、37℃で、100 IU/mL ペニシリン、100 Ag/mL ストレプトマイシン、10% FCSを補充したRPMI 1640に播種した(すべての試薬は、Cambrexから購入された)。
Tucap-1転写産物の発現を、末梢血リンパ球(PBL)と比較して、Instituto Nazionale Tumori, Milanで外科的に切除された患者の黒色腫から得られたいくつかの原発性および転移性黒色腫細胞株について、rt-PCRにより評価した。細胞からの全RNAをRNAzol (Invitrogen)法により回収し、RNA鋳型をRT-PCR増幅のために使用した。TUCAP-1検出のためのプライマーは、下記のとおりであった:
tgtgtgaaacaagcgccttc (配列番号3)および
atgaggtggacgtagtagt (配列番号4)。
gaattcatgtgtgaaacaagcgcctt (配列番号5)および
gtcgacagaaaaccagtggatctg (配列番号6)。
ccatggagaaggctgggg (配列番号7)および
caaagttgtcatggatgacc (配列番号8)。
PCR産物をpTopoベクター(Invitrogen)にクローン化し、次いで、適当な制限酵素(EcoRI、SalI)で切断することにより単一断片を獲得し、その後、pTrcHis2ベクター(Invitrogen)に連結した。製造者の指示にしたがって、Ni NTAアガロース樹脂(Qiagen)を用いて発現した組み換えタンパク質を精製し、マウスを免疫するためにこれを使用した。
gaattcatgtgtgaaacaagcg (配列番号9)および
gtcgatgtctatcttcacagcata (配列番号10)。
細菌溶解物、全黒色腫細胞溶解物およびCCD-1064SKの健常な皮膚線維芽細胞(SantaCruz)をSDSサンプル緩衝液に再懸濁し、煮沸で変性させ、SDS-PAGEで分離し、ウエスタンブロットで解析した。6xHisタグ化タンパク質、GFP、TUCAP-1およびGAPDHの各々を、抗6His mAb (Sigma)、抗GFP (クローン1E4 MBL)、抗TUCAP-1マウス血清および抗GAPDH (SantaCruz)で検出した。TUCAP-1タンパク質を、ウサギ抗TUCAP-1 pAb抗体を用いて、前もって除去された細胞溶解物から、プロテインA+G-Sepharoseビーズ(Pierce)の存在下、4℃で一晩、免疫沈降した。ウサギ免疫前血清をネガティブコントロールとして使用した。アクチンを抗アクチンmAb (Sigma)で検出した。
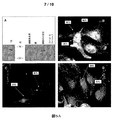
免疫化学は、黒色腫細胞におけるTUCAP-1の占有を示す
免疫細胞化学および免疫組織化学
免疫細胞化学について、ガラスチャンバースライド(Falcon)上で培養した黒色腫細胞およびマクロファージ、ならびにガラススライド上でサイトスピンした(cytospun)PBLを、4℃で10分間、80% メタノールで固定し、TUCAP-1、TUCAP-1マウス血清または免疫前コントロール血清で染色した。Biomaxアレイスライド(Biomax)からの悪性黒色腫および対応する正常皮膚組織を、抗TUCAP-1マウス抗血清について免疫前血清で免疫染色した。黒色腫をまた抗gp100 (Immunotech)で染色し、正常な皮膚をまた抗エズリン(Sigma)で染色した。タンパク質を、単一染色でのペルオキシダーゼ・抗ペルオキシダーゼ法(Dako)を用いて視覚化し、マイヤー・ヘマトキシリンで対比染色した。
TUCAP-1の細胞内局在
さらなる実験をTUCAP 1の細胞内局在を解析するために行った。
細胞を回収し、Qproteome細胞膜キットプロトコール(Quiagen)に基づいて加工し、精製した細胞膜および細胞質基質に相当する細胞内コンパートメントの非変性画分を得た。次いで、後者の画分をアセトンで沈殿させ、免疫沈降緩衝液B (0.1% SDS, 1% NP40, 0.5% コール酸ナトリウム)に再懸濁し、ウサギ抗TUCAP-1を用いた免疫沈降にかけた。インタクト細胞および細胞内小器官を含む細胞内コンパートメント由来の残ったペレットから、遠心分離により前者を除去し、Triton X-100抽出にかけ、可溶性および不可溶性画分を得て、それをウサギ抗TUCAP-1で免疫沈降させた。サンプルの電気泳動後、ニトロセルロース膜をマウス抗TUCAP-1でブロットした。
MM2細胞を、60-mmペトリ皿に入れたカバーガラス上に播種した。細胞を2% パラホルムアルデヒドで固定し、透過処理した(Triton X-100 (0.1%)または24時間)。TUCAP 1およびRab5の二重染色のために、細胞をマウス抗TUCAP-1血清およびウサギ抗Rab5 (SantaCruz)で標識し、各々をAlexa Fluor 488共役抗マウスIgGおよび抗ウサギAlexa Fluor 594共役IgG (Molecular Probes)で曝露した。TUCAP 1およびLamp-1の検出のために、細胞をそれぞれウサギ抗TUCAP-1 pAbおよびマウス抗Lamp-1 Mab (BD Pharmingen)で標識し、Alexa Fluor 594共役抗ウサギIgGおよびAlexa Fluor 488共役抗マウスIgGで染色した。TUCAP-1およびミトコンドリアに関しては、TUCAP-1を抗TUCAP-1マウスpAbで標識して、Alexa Fluor 488共役抗マウスIgGで染色し、ミトコンドリアをMithotracker Red (Invitrogen)で標識した。洗浄後、すべてのサンプルにグリセロール:PBS (2:1)を載せ、Leica DM 2500蛍光顕微鏡で観察した。画像を画像解析のIAS 8.2システム(Delta Sistemi)を備えたSpot Insightデジタルカメラ(Delta Sistemi)で記録した。
TUCAP-1の機能解析
Tucap-1の抑制は、食細胞挙動を阻害する
ヒト転移性黒色腫細胞におけるTUCAP-1タンパク質の役割を、Tucap-1の抑制を介してその発現を阻害することにより評価した。
gagugacguccagauccacugguuu (配列番号13)、および
aaaccaguggaucuggacgucacuc (配列番号14)。ネガティブコントロールとして、Stealth RNAiネガティブコントロール培地GC二本鎖(Invitrogen)を使用した。製造者の指示にしたがい、黒色腫細胞にLipofectamine RNAiMAX試薬(Invitrogen)を用いて導入した。簡潔に述べると、導入の前日に、黒色腫細胞を6ウェルプレート(1X105/ウェル)に播種し、24時間後、ウェルあたり30pmolのsiRNAを細胞に導入した。導入の48時間後、細胞をFACS解析によりTUCAP-1発現について解析した。
FITC染色酵母およびDHR123で染色した生きたリンパ球に対するスクランブルsiRNA導入(SC-siRNA)およびTucap-1抑制(Tucap-1 siRNA) MM2およびMM3転移性黒色腫細胞の食作用/共食い活性。食作用活性を食細胞の%として示した。数字は、5つの異なる実験の平均±s.d.である。
TUCAP-1は、エンドソーム小胞の酸性化の制御において役割を果たす
スクランブルsiRNA導入およびTUCAP-1抑制MM2およびMM3細胞を、37℃で30分間、1 μM LysoTrackerプローブ(Molecular Probes)で染色し、即座にサイトメーターで解析した。異なる黒色腫細胞株間の比較を、蛍光強度ヒストグラムの平均値を用いてCellQuestソフトウェアにより行った。TUCAP-1がRab5保有エンドソームに局在する(実施例3を参照のこと)という結果に基づき、我々は、TUCAP-1タンパク質が悪性腫瘍細胞内のphago/エンドソーム区画のpH制御において役割を果たすという仮説を試験した。この仮説を証明するために、コントロールSC-RNAiおよびTUCAP-1-siRNA導入細胞を酸性プローブLysoTracker greenで染色し、フローサイトメトリーで解析した。Tucap-1遺伝子の抑制は、SC-RNA導入コントロール細胞(FIG 9C)と比較して、黒色腫細胞内の酸性度の低い小胞の出現を誘導した。これらの実験は、TUCAP-1が内部小胞、例えば、初期エンドソームの酸性化の制御において役割を果たすという仮説を支持する。
転移過程の早期段階におけるTUCAP-1の関与
TUCAP-1過剰発現細胞を用いた進行中の実験は、このタンパク質が転移過程の初期段階における腫瘍細胞浸潤に関与することを示す。これらの細胞の細胞浸潤能力をMatrigel浸潤チャンバー(Becton-Dickenson, Bedford, MA, USA)を用いてアッセイする。簡潔に述べると、非導入WM743またはGFPタグ化全長TUCAP-1 WM743黒色腫細胞(TWM)を無血清培地に再懸濁し、上部チャンバーに載せ、一方、下部チャンバーには、化学誘因物質として10 % FCSを加えた培地を入れた。細胞を、湿潤雰囲気下、37℃でインキュベートし、48時間、走化性チャンバーを介して移動させた。インキュベーション後、上部表面に残った細胞をコットンキャリア(cotton carrier)を用いて完全に除去した。走化性チャンバーの底に移動した細胞をクリスタルバイオレットで染色した。浸潤細胞を、フィルターあたり4つの異なる視野で顕微鏡を用いて(40×)計測した。図10は、トランスウェル膜の下側の部分を示しており、それは、明確に、浸潤した細胞の数がTWMについてかなり多いことを示す(非導入細胞について平均25細胞、TUCAP 1導入TWMについて平均132細胞)。
黒色腫細胞のシスプラチン耐性におけるTUCAP-1の関与
いくつかの文献は、イオントラフィッキングに関与するタンパク質の役割および薬剤耐性のメカニズムとして、薬剤封鎖、不活性化および排出におけるエンドリソソームコンパートメントの役割を示している。初期エンドソームにおけるTUCAP 1発現およびエンドソーム小胞のpH制御におけるTUCAP 1の関与(上記の実施例で示されたとおりである)により、我々は、癌細胞の薬剤耐性におけるこのタンパク質の役割について仮説を立てた。これを証明するために、TUCAP-1を高度に発現するMM2黒色腫細胞を、48時間、スクランブル(SC-siRNA)またはTucap-1 si-RNAで前処理し(上記の実施例で示されたとおりである)、導入後、細胞を2μM シスプラチンで処理した。48時間後、シスプラチン誘導細胞毒性を、初期(アネキシンV単一陽性)および後期(PI/アネキシンV二重陽性)アポトーシスのFACS解析により評価した。Tucap-1の抑制は、非導入コントロール細胞のような挙動を示すスクランブルsi-RNAで処理したWM743細胞と比較して、シスプラチンの細胞毒性効果を著しく増加させた。コントロール非導入細胞では、平均63 %の細胞が生存していたのに対して、TUCAP-1抑制細胞では、平均37 %の細胞が生存していた。
TUCAP-1に対するポリクローナル抗体およびモノクローナル抗体
上記の実施例に基づいて、TUCAP-1に特異的なポリクローナル抗体(pAb)およびモノクローナル抗体(mAb)は、例えば、腫瘍の悪性度を決定するための診断および癌の処置を含むさまざまな目的のために有用であり得る。
Bukrinskaya A, Brichacek B, Mann A, Stevenson M. Establishment of a functional human immunodeficiency virus type 1 (HIV-1) reverse transcription complex involves the cytoskeleton. J Exp Med. 1998;188:2113-2125.
Caruso RA, Muda AO, Bersiga A, Rigoli L, Inferrera C. Morphological evidence of neutrophil-tumor cell phagocytosis (cannibalism) in human gastric adenocarcinomas. Ultrastruct Pathol 2002;26:315-21.
Chou, K.C. (2005). "Using amphiphilic pseudo amino acid composition to predict enzyme subfamily classes". Bioinformatics, 21, 10-19.
DeSimone PA, East R, Powell RD. Phagocytic tumor cell activity in oat cell carcinoma of the 6y7y- j - -- ol 1980;11:535-9.
Fujii M, Ishii Y, Wakabayashi T, et al. Cytologic diagnosis of male breast cancer with nipple discharge.A case report. Acta Cytol 1986;30:2
Gasteiger E., Gattiker A., Hoogland C., Ivanyi I., Appel R.D., Bairoch A. ExPASy: the proteomics server for in-depth protein knowledge and analysis Nucleic Acids Res. 31:3784-3788(2003).
Kojima S, Sekine H, Fukui I, Ohshima H. Clinical significance of "cannibalism" in urinary cytology of bladder cancer. Acta Cytol 1998;42:1365-9.
Kumar PV, Hosseinzadeh M, Bedayat GR. Cytologic findings of medulloblastoma in crush smears. Acta Cytol 2001;45:542-6.
Lugini L, Lozupone F, Matarrese P, Funaro C, Luciani F, Malorni W, Rivoltini L, Castelli C, Tinari A, Piris A, Parmiani G, Fais S.Potent phagocytic activity discriminates metastatic and primary human malignant melanomas: a key role of ezrin. Lab Invest. 2003 Nov;83(11):1555-67.
Lugini L, Matarrese P, Tinari A, Lozupone F, Federici C, Iessi E, Gentile M, Luciani F, Parmiani G, Rivoltini L, Malorni W, Fais S.Cannibalism of live lymphocytes by human metastatic but not primary melanoma cells. Cancer Res. 2006 Apr 1;66(7):3629-38.
B Rost, G Yachdav and J Liu (2004) Server. Nucleic Acids Research 32(Web Server issue):W321-W326
B Rost (1996) Methods in Enzymology, 266:525-539
Shen, H. B. and Chou, K. C (2007) "Hum-mPLoc: an ensemble classifier for large-scale human protein subcellular location prediction by incorporating samples with multiple sites", Biochemical and Biophysical Research Communications. 355(4):1006-11.
Sloane BF, Dunn JR, Honn KV. Lysosomal cathepsin B: correlation with metastatic potential. Science 1981; 212:1151-3.
Steinhaus J. Ueber carcinoma-einschlusse. Virchows Arch 1891;126:533-5.
Stroebe H. Zur Kenntniss verschiedener cellularer Vorgange und Erscheinungen in Geschwulsten. Beitrage Pathol 1892;11:1.
Shen, H. B. and Chou, K. C. (2006). "Ensemble classifier for protein folding pattern recognition". Bioinformatics, Jul 15;22(14):1717-22.
Claims (7)
- 配列番号1で示されるアミノ酸配列を含むペプチドを含む、転移性腫瘍を検出するためのマーカー。
- 配列番号11、12または15で示されるアミノ酸配列からなるペプチドからなる、転移性腫瘍を検出するためのマーカー。
- 腫瘍が黒色腫である、請求項1または2に記載のマーカー。
- 患者から得られた腫瘍細胞において配列番号1で示されるアミノ酸配列を含むペプチドの発現の存在または非存在を決定する工程を含み、発現の存在が該細胞の転移性を示す、インビトロで腫瘍細胞の転移性を決定する方法。
- 腫瘍が黒色腫である、請求項4に記載の方法。
- 配列番号1のアミノ酸18-282、221-235および303-352からなる群から選択されるアミノ酸配列からなるペプチド断片に結合することによりヒトTUCAP-1タンパク質を認識することができる抗体を使用することをさらに特徴とする、請求項4に記載の方法。
- 食作用特性を有する腫瘍に対する医薬の製造における配列番号1で示されるアミノ酸配列を含むペプチドの発現阻害剤の使用であって、該発現が配列番号2で示される核酸配列と相補的な、またはTUCAP-1 mRNAと相補的な核酸配列を含む単離核酸により阻害される、使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US6245308P | 2008-01-25 | 2008-01-25 | |
| US61/062,453 | 2008-01-25 | ||
| PCT/EE2009/000001 WO2009092385A1 (en) | 2008-01-25 | 2009-01-26 | A new metastatic human tumor associated molecule, methods to detect both activated gene and protein and to interfere with gene expression |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011511625A JP2011511625A (ja) | 2011-04-14 |
| JP2011511625A5 JP2011511625A5 (ja) | 2012-02-16 |
| JP5752419B2 true JP5752419B2 (ja) | 2015-07-22 |
Family
ID=40527972
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010543378A Active JP5752419B2 (ja) | 2008-01-25 | 2009-01-26 | 新規ヒト転移性腫瘍関連分子、活性化遺伝子およびタンパク質を検出する方法ならびに遺伝子発現を妨害する方法 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US8097407B2 (ja) |
| EP (1) | EP2245465B1 (ja) |
| JP (1) | JP5752419B2 (ja) |
| CN (1) | CN102016587B (ja) |
| AU (1) | AU2009207926B2 (ja) |
| BR (1) | BRPI0906681A2 (ja) |
| CA (1) | CA2713193C (ja) |
| ES (1) | ES2587055T3 (ja) |
| MX (1) | MX2010008163A (ja) |
| PL (1) | PL2245465T3 (ja) |
| RU (1) | RU2546000C2 (ja) |
| WO (1) | WO2009092385A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120122118A1 (en) * | 2008-01-25 | 2012-05-17 | Primm Srl | Monclonal antibodies, hybridomas and methods for use |
| JP2013502217A (ja) * | 2009-08-17 | 2013-01-24 | ノックス テクノロジーズ インコーポレイテッド | arNOXタンパク質9回膜貫通型スーパーファミリー(TM9SF)のクローニング及び発現、方法並びに利用 |
| WO2013133220A1 (ja) * | 2012-03-08 | 2013-09-12 | 学校法人産業医科大学 | がんの悪性度の試験方法、ならびに多能性を有する造腫瘍細胞およびその調製方法 |
| CA2950977C (en) * | 2014-06-06 | 2023-10-10 | Exosomics Siena S.P.A. | Use of tm9sf4 as a biomarker for tumor associated exosomes |
| CN105675378A (zh) * | 2014-11-18 | 2016-06-15 | 上海张江转化医学研发中心有限公司 | 一种简单的分离单个循环肿瘤细胞的方法和装置 |
| US12105085B2 (en) | 2017-05-29 | 2024-10-01 | National University Corporation Kobe University | Base material for manufacturing sensor for analyzing detection target, sensor for analyzing detection target, method for analyzing detection target |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030175787A1 (en) * | 1997-10-28 | 2003-09-18 | Incyte Corporation | Vesicle membrane proteins |
| WO2000008056A1 (fr) * | 1998-08-07 | 2000-02-17 | Ono Pharmaceutical Co., Ltd. | NOUVEAU POLYPEPTIDE, ADNc LE CODANT ET SON UTILISATION |
| US20030008356A1 (en) * | 1998-08-07 | 2003-01-09 | Ono Pharmaceutical Co., Ltd. | Novel polypeptide, a cDNA encoding the same, and use of it |
| US20070224201A1 (en) * | 2002-10-02 | 2007-09-27 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| US20080299042A1 (en) * | 2004-04-30 | 2008-12-04 | Biogen Idec Ma Inc. | Membrane Associated Molecules |
| WO2006110593A2 (en) * | 2005-04-07 | 2006-10-19 | Macrogenics, Inc. | Biological targets for the diagnosis, treatment and prevention of cancer |
-
2009
- 2009-01-26 US US12/321,821 patent/US8097407B2/en active Active
- 2009-01-26 AU AU2009207926A patent/AU2009207926B2/en active Active
- 2009-01-26 BR BRPI0906681 patent/BRPI0906681A2/pt not_active Application Discontinuation
- 2009-01-26 PL PL09703627.1T patent/PL2245465T3/pl unknown
- 2009-01-26 CN CN200980111385.6A patent/CN102016587B/zh active Active
- 2009-01-26 WO PCT/EE2009/000001 patent/WO2009092385A1/en active Application Filing
- 2009-01-26 CA CA2713193A patent/CA2713193C/en active Active
- 2009-01-26 EP EP09703627.1A patent/EP2245465B1/en active Active
- 2009-01-26 MX MX2010008163A patent/MX2010008163A/es active IP Right Grant
- 2009-01-26 RU RU2010135525/15A patent/RU2546000C2/ru active
- 2009-01-26 ES ES09703627.1T patent/ES2587055T3/es active Active
- 2009-01-26 JP JP2010543378A patent/JP5752419B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US20090191222A1 (en) | 2009-07-30 |
| WO2009092385A1 (en) | 2009-07-30 |
| MX2010008163A (es) | 2011-04-26 |
| AU2009207926B2 (en) | 2014-06-19 |
| EP2245465B1 (en) | 2016-05-18 |
| CA2713193C (en) | 2018-01-02 |
| CA2713193A1 (en) | 2009-07-30 |
| BRPI0906681A2 (pt) | 2019-11-26 |
| ES2587055T3 (es) | 2016-10-20 |
| JP2011511625A (ja) | 2011-04-14 |
| AU2009207926A1 (en) | 2009-07-30 |
| CN102016587A (zh) | 2011-04-13 |
| PL2245465T3 (pl) | 2016-11-30 |
| US8097407B2 (en) | 2012-01-17 |
| CN102016587B (zh) | 2015-05-13 |
| RU2546000C2 (ru) | 2015-04-10 |
| RU2010135525A (ru) | 2012-02-27 |
| EP2245465A1 (en) | 2010-11-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2270509B1 (en) | Method for detection of liver cancer cell using anti-glypican-3 antibody | |
| US9316654B2 (en) | TAZ/WWTR1 for diagnosis and treatment of cancer | |
| JP5752419B2 (ja) | 新規ヒト転移性腫瘍関連分子、活性化遺伝子およびタンパク質を検出する方法ならびに遺伝子発現を妨害する方法 | |
| JP2021006039A (ja) | ヒト非小細胞肺癌における転座及び変異体rosキナーゼ | |
| US20070031419A1 (en) | Methods and compositions for treating diseases targeting CDCP1 | |
| JP5893037B2 (ja) | Brafv600eに特異的に結合する抗体を使用する癌の診断のための手段及び方法 | |
| US20180313841A1 (en) | Ovary Tumor Markers And Methods Of Use Thereof | |
| KR100972618B1 (ko) | 허셉틴을 이용한 유방암 진단 키트, 조성물 및 이들을이용하여 허셉틴 민감성 her2 과발현 세포를 검출하는방법 | |
| US20120122118A1 (en) | Monclonal antibodies, hybridomas and methods for use | |
| JPWO2006082851A1 (ja) | エピグリカニン関連ムチン | |
| US20250067744A1 (en) | Use of bmmf1 rep protein as diagnostic marker for pancreatic cancer and diabetes mellitus type 2 | |
| KR101927577B1 (ko) | 간암 바이오 마커로서 h2a.z.1의 용도 | |
| EP4522991A1 (en) | Use of bmmf1 rep protein as diagnostic marker for lung cancer | |
| WO2006022682A2 (en) | Method and compositions for treating diseases targeting cd49b | |
| US8507213B1 (en) | Methods and compositions for treating diseases targeting maba | |
| US20060039907A1 (en) | Method and compositions for treating diseases targeting CD71 | |
| WO2004013634A2 (en) | Dna damage repair polypeptide and uses thereof | |
| WO2006038904A2 (en) | Method and compositions for treating diseases targeting e-cadherin |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111219 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111219 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130903 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20131203 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20131210 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20131219 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140106 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140114 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20140120 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140203 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140210 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140228 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140902 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20141201 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150421 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150520 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5752419 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |