JP5594121B2 - Novel metallosilicate and nitrogen oxide purification catalyst - Google Patents
Novel metallosilicate and nitrogen oxide purification catalyst Download PDFInfo
- Publication number
- JP5594121B2 JP5594121B2 JP2010283167A JP2010283167A JP5594121B2 JP 5594121 B2 JP5594121 B2 JP 5594121B2 JP 2010283167 A JP2010283167 A JP 2010283167A JP 2010283167 A JP2010283167 A JP 2010283167A JP 5594121 B2 JP5594121 B2 JP 5594121B2
- Authority
- JP
- Japan
- Prior art keywords
- nitrogen oxide
- sio
- purification catalyst
- less
- oxide purification
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Exhaust Gas Treatment By Means Of Catalyst (AREA)
- Solid-Sorbent Or Filter-Aiding Compositions (AREA)
- Silicates, Zeolites, And Molecular Sieves (AREA)
- Catalysts (AREA)
- Exhaust Gas After Treatment (AREA)
Description
本発明は、触媒、吸着剤及び分離剤等として有用な新規メタロシリケートに関するものであり、更に詳しくは、工業的使用が困難なフッ素を用いることなく合成され、固体酸点としてのAl及び触媒活性点あるいは吸着点等として働きうるFeを共に高分散状態にて結晶中に含有し、なおかつ耐熱性の高い高結晶性のβ型鉄シリケートに関するものである。 The present invention relates to a novel metallosilicate useful as a catalyst, an adsorbent, a separating agent, and the like. More specifically, the present invention is synthesized without using fluorine, which is difficult to industrially use, and has Al as a solid acid site and catalytic activity. The present invention relates to a highly crystalline β-type iron silicate that contains both Fe, which can serve as spots or adsorption points, in a crystal in a highly dispersed state and has high heat resistance.
また本発明は、内燃機関から排出される窒素酸化物の浄化に関するものであり、β構造を有する結晶性シリケートからなる窒素酸化物浄化触媒、並びにそれを用いてアンモニア、尿素、有機アミン類の少なくとも一つと反応させる窒素酸化物浄化方法を提供するものである。 The present invention also relates to purification of nitrogen oxides exhausted from an internal combustion engine, a nitrogen oxide purification catalyst comprising a crystalline silicate having a β structure, and at least ammonia, urea, and organic amines using the catalyst. The present invention provides a method for purifying nitrogen oxides that reacts with one.
β型ゼオライトは特許文献1によって初めて開示されたハイシリカゼオライトであり、触媒及び吸着剤等として広く利用されている。 β-type zeolite is a high-silica zeolite first disclosed by Patent Document 1, and is widely used as a catalyst, an adsorbent and the like.
ゼオライトの利用にあたっては、触媒活性や吸着選択性等の特定の機能を付与することを目的に、しばしば金属によるゼオライトの化学修飾が行われる。一般的に用いられる方法には、ゼオライトのイオン交換能を利用して金属カチオンを液相でのイオン交換により担持する方法や、金属の塩を含む溶液をゼオライトに含浸させることで金属を担持する方法がある。 When using zeolite, chemical modification of the zeolite with metal is often performed for the purpose of imparting specific functions such as catalytic activity and adsorption selectivity. Commonly used methods include a method of supporting metal cations by ion exchange in the liquid phase utilizing the ion exchange ability of zeolite, and a method of supporting metals by impregnating zeolite with a solution containing a metal salt. There is a way.
ゼオライトの化学修飾においては、目的とする機能を最大限に発揮するため、担持する金属は一般にゼオライト基材中に高分散に存在し、できる限り凝集していないことが望ましい。 In the chemical modification of zeolite, in order to maximize the intended function, it is desirable that the supported metal is generally present in a highly dispersed state in the zeolite base material and is not aggregated as much as possible.
しかし、例えば上述のイオン交換による担持では、交換可能な金属量はゼオライトのイオン交換能に依存し、それ以上に担持しようとすると金属の凝集が起こりやすい。また、含浸による担持では金属の担持量を制御しやすい代わりに、担持する金属量を増やすに従い金属の凝集が起こりやすくなるという問題がある。 However, in the above-described loading by ion exchange, for example, the amount of metal that can be exchanged depends on the ion exchange ability of the zeolite, and if it is attempted to carry more than that, metal aggregation tends to occur. Further, in the case of supporting by impregnation, there is a problem that the metal agglomeration is likely to occur as the amount of metal to be supported is increased, instead of easily controlling the amount of metal supported.
一部の金属は、ゼオライトの水熱合成の原料として添加することにより、SiやAlと同様にゼオライト骨格中に導入することができる。このような方法によって導入した金属は、原子ごとに酸素原子を介したSiのネットワークに取り込まれるため、非常に高分散な状態となる。導入可能な金属としては、B、Cr、V、Ge、Ga、Fe、Sn、Zn等が知られている。これらの金属の中で、Feの導入に関しては比較的多くの試みがこれまでに行われている。 Some metals can be introduced into the zeolite framework in the same manner as Si and Al by adding them as raw materials for the hydrothermal synthesis of zeolite. Since the metal introduced by such a method is taken into the Si network via oxygen atoms for each atom, the metal is in a very highly dispersed state. Known metals that can be introduced include B, Cr, V, Ge, Ga, Fe, Sn, and Zn. Among these metals, relatively many attempts have been made to introduce Fe.
β型ゼオライトの骨格にFeを導入したβ型鉄シリケートについては以下のような先行技術が開示されている。 The following prior art has been disclosed for β-type iron silicate in which Fe is introduced into the framework of β-type zeolite.
例えば、特許文献2においてAlとFeの両方を骨格に有するβ型鉄シリケートを含む吸着材が開示されている。また特許文献3において、X線回折ピークの半値幅等により規定されたβ型鉄シリケートを含む自動車排ガス浄化用吸着材が開示されている。その他特許文献4において骨格鉄とイオン交換サイトの鉄カチオンを含むアルミノシリケートゼオライトが開示されている。 For example, Patent Document 2 discloses an adsorbent containing β-type iron silicate having both Al and Fe as a skeleton. Patent Document 3 discloses an adsorbent for purifying automobile exhaust gas containing β-type iron silicate defined by the half width of the X-ray diffraction peak. In addition, Patent Document 4 discloses an aluminosilicate zeolite containing skeletal iron and an iron cation at an ion exchange site.
また例えば、非特許文献1および非特許文献2にもβ型鉄シリケートが開示されている。さらに非特許文献3において、原料中にフッ素を添加することで合成されたβ型鉄シリケートが開示されている。一般に、ゼオライト合成において原料中にフッ素を添加することで、フッ素を添加しない場合と比べて格子欠陥の少ない結晶性の良好なゼオライトが得られることが知られている。例えば、β型ゼオライトでは非特許文献4に開示されている。 Further, for example, non-patent document 1 and non-patent document 2 also disclose β-type iron silicate. Further, Non-Patent Document 3 discloses β-type iron silicate synthesized by adding fluorine to the raw material. In general, it is known that by adding fluorine to a raw material in zeolite synthesis, a zeolite having good crystallinity with few lattice defects can be obtained as compared with the case where fluorine is not added. For example, non-patent document 4 discloses β-type zeolite.
しかしながら、これらに開示されているβ型鉄シリケートはFeの導入量が非常に少ないために触媒等の活性点として利用するのに必ずしも十分ではないか、Al及びFeの導入量は十分であっても結晶性が十分でないものであった。これは、一般にAlを含有する鉄シリケートの水熱合成においては、原料中のFeが少ないほど生成物の物性は通常のアルミノシリケートに近づき、結晶化が容易となると同時に得られる結晶の結晶性が良くなる傾向があるのに対し、原料中のFeを増加させると急速に結晶の生成領域が縮小し、得られる結晶の結晶性が低下するためである。こうした傾向は、アルカリ性の原料混合物中におけるAlに対するFeの不安定性や、Alよりもイオン半径の大きいFeがゼオライト骨格に存在することによる結晶の歪みの増大に起因すると考えられる。 However, since the β-type iron silicates disclosed in these publications have a very small amount of Fe introduced, it is not always sufficient for use as an active point of a catalyst or the like, or the amounts of Al and Fe introduced are sufficient. Also, the crystallinity was not sufficient. In general, in hydrothermal synthesis of iron silicates containing Al, the smaller the Fe in the raw material, the closer the physical properties of the product are to those of ordinary aluminosilicate, which facilitates crystallization and at the same time the crystallinity of the crystals obtained. In contrast to the tendency to improve, when the amount of Fe in the raw material is increased, the crystal generation region is rapidly reduced, and the crystallinity of the obtained crystal is lowered. Such a tendency is considered to be caused by the instability of Fe with respect to Al in the alkaline raw material mixture and the increase in crystal distortion due to the presence of Fe having an ionic radius larger than that of Al in the zeolite framework.
また、ゼオライト合成におけるフッ素の使用は設備腐食等の観点から工業的に難しく、また生成したゼオライトに残存するフッ素が性能に悪影響を及ぼすという問題もあった。 In addition, the use of fluorine in zeolite synthesis is industrially difficult from the viewpoint of equipment corrosion and the like, and there is also a problem that fluorine remaining in the produced zeolite adversely affects performance.
また、SiO2/Fe2O3比が20〜300、含有鉄中の孤立鉄イオンが80%以上のβ型構造中に鉄を有する結晶性シリケートから成る窒素酸化物浄化触媒(特許文献5)が報告されている。しかし、それらはフッ素原料を用いて結晶粒径を増大し、結晶性を高めたものであった。 Also, SiO 2 / Fe 2 O 3 ratio of 20 to 300, the nitrogen oxide purification catalyst comprising a crystalline silicate having an iron isolated iron ion is more than 80% beta-type structure in containing iron (Patent Document 5) Has been reported. However, they have increased crystal grain size and improved crystallinity using fluorine raw materials.
また、SiO2/Fe2O3モル比が20〜300、log(SiO2/Al2O3)が2以上(モル比)のβ骨格構造中に鉄を有する結晶性シリケートが優れた低温での窒素酸化物の分解性能並びに水熱耐久性を有することが報告されている(特許文献6)。しかしながら、これらの粒子径も5μm以上と大きいものであった。 In addition, a crystalline silicate having iron in a β skeleton structure having a SiO 2 / Fe 2 O 3 molar ratio of 20 to 300 and a log (SiO 2 / Al 2 O 3 ) of 2 or more (molar ratio) is excellent at a low temperature. It has been reported that it has decomposition performance and hydrothermal durability of nitrogen oxide (Patent Document 6). However, these particle sizes were as large as 5 μm or more.
これまで工業使用が困難なフッ素を用いることなく合成され、固体酸点としてのAl及び触媒活性点あるいは吸着点等として働きうるFeを共に高分散状態にて結晶中に含有し、触媒として高い動的性能が期待できる粒径範囲で、耐熱性の高い高結晶性のβ型鉄シリケートは知られていなかった。 It has been synthesized without using fluorine, which has been difficult to use industrially, and contains both Al as a solid acid site and Fe that can act as a catalyst active site or adsorption site in a highly dispersed state in the crystal, and has high activity as a catalyst. No highly crystalline β-type iron silicate with high heat resistance in a particle size range in which mechanical performance can be expected has been known.
骨格構造中に異種元素を置換した結晶性シリケートは、通常のアルミノシリケートゼオライトとは異なる特性が期待され、触媒反応への利用が検討されている。例えば白金を担持した鉄シリケートを用いたキシレン異性化触媒(特許文献7)、また鉄シリケートを用いたナフタレン性化合物の選択メチル化触媒(特許文献8)、また環状エーテルの開環重合触媒として鉄シリケートを用いたポリアルキレングリコールの製造方法(特許文献9)等が開示されている。 A crystalline silicate having a skeletal structure substituted with a different element is expected to have characteristics different from those of ordinary aluminosilicate zeolites, and its use for catalytic reactions is being studied. For example, iron as a xylene isomerization catalyst using an iron silicate carrying platinum (Patent Document 7), a selective methylation catalyst of a naphthalene compound using an iron silicate (Patent Document 8), and a ring-opening polymerization catalyst of a cyclic ether A method for producing polyalkylene glycol using silicate (Patent Document 9) and the like are disclosed.
一方、鉄シリケートを用いた窒素酸化物の浄化技術も検討されている。例えば、ZSM−5型鉄シリケートに銅とガリウムとの共沈複合酸化物が分散担持された窒素酸化物を含む排ガスの浄化用触媒(特許文献10)、過剰の酸素が存在する雰囲気中で、炭化水素類または含酸素化合物の存在下、ZSM−5型鉄シリケートのアルカリ金属交換体を窒素酸化物を含む排ガスと接触させる窒素酸化物浄化方法(特許文献11)、窒素酸化物、酸素ガスおよび必要に応じて亜硫酸ガスを含有する燃焼排ガスを、鉄シリケート触媒および炭化水素還元剤の存在下で接触反応させる窒素酸化物の除去方法(特許文献12)、鉄シリケートに白金、パラジウム、ロジウム及びコバルトのうち少なくとも一種を担持した窒素酸化物を主として除去する排気ガス浄化触媒(特許文献13)等が報告されている。なお、特許文献12、13に記載される鉄シリケートは合成の際にテトラプロピルアンモニウム塩を使用していることから、得られた鉄シリケートの骨格構造はZSM−5構造である。 On the other hand, nitrogen oxide purification technology using iron silicate is also being studied. For example, a catalyst for purifying exhaust gas containing nitrogen oxide in which a coprecipitation complex oxide of copper and gallium is dispersed and supported on ZSM-5 type iron silicate (Patent Document 10), in an atmosphere where excess oxygen exists, Nitrogen oxide purification method (patent document 11) in which an alkali metal exchanger of ZSM-5 type iron silicate is contacted with exhaust gas containing nitrogen oxide in the presence of hydrocarbons or oxygen-containing compounds, nitrogen oxide, oxygen gas, and Nitrogen oxide removal method (PTL 12) in which combustion exhaust gas containing sulfurous acid gas is contact-reacted in the presence of an iron silicate catalyst and a hydrocarbon reducing agent, if necessary, platinum, palladium, rhodium and cobalt on iron silicate Among them, an exhaust gas purification catalyst that mainly removes nitrogen oxide supporting at least one of them (Patent Document 13) has been reported. In addition, since the iron silicate described in patent documents 12 and 13 uses tetrapropylammonium salt at the time of synthesis, the skeleton structure of the obtained iron silicate is a ZSM-5 structure.
亜酸化窒素の浄化触媒については、亜酸化窒素の直接分解に用いられる、銅やコバルト等を担持したβ型鉄シリケートを含む触媒の製造方法(特許文献14)、β構造を有する鉄シリケートを用いて、亜酸化窒素を直接分解する方法、及び一酸化炭素を還元剤として亜酸化窒素を非選択的接触還元する方法(非特許文献3)等が開示されている。 As for the purification catalyst for nitrous oxide, a method for producing a catalyst containing β-type iron silicate supporting copper, cobalt, etc., used for direct decomposition of nitrous oxide (Patent Document 14), an iron silicate having a β structure is used. In addition, a method of directly decomposing nitrous oxide, a method of non-selective catalytic reduction of nitrous oxide using carbon monoxide as a reducing agent (Non-patent Document 3), and the like are disclosed.
一方、排ガス中の窒素酸化物の浄化触媒については、リーンバーン燃焼排ガスやディーゼル燃焼排ガスに代表される酸素過剰排ガスの窒素酸化物の浄化に関し、鉄又は銅を担持したアルミノシリケートゼオライト触媒を用い、アンモニアにより選択的接触還元(通常SCRという)する方法(特許文献15)が知られている。 On the other hand, for the purification catalyst of nitrogen oxides in exhaust gas, with respect to the purification of nitrogen oxides of oxygen excess exhaust gas represented by lean burn combustion exhaust gas and diesel combustion exhaust gas, an aluminosilicate zeolite catalyst supporting iron or copper is used, A method of selective catalytic reduction (usually called SCR) with ammonia (Patent Document 15) is known.
また、SiO2/Fe2O3比が20〜300、含有鉄中の孤立鉄イオンが80%以上のβ型構造中に鉄を有する結晶性シリケートから成る窒素酸化物浄化触媒(特許文献5)が報告されている。しかし、アンモニアを還元剤として用いた窒素酸化物(NOx)の還元方法において、低温での窒素酸化物の分解性能並びに水熱耐久性は不十分であった。 Also, SiO 2 / Fe 2 O 3 ratio of 20 to 300, the nitrogen oxide purification catalyst comprising a crystalline silicate having an iron isolated iron ion is more than 80% beta-type structure in containing iron (Patent Document 5) Has been reported. However, in the nitrogen oxide (NOx) reduction method using ammonia as a reducing agent, the nitrogen oxide decomposition performance and hydrothermal durability at low temperatures were insufficient.
また、SiO2/Fe2O3モル比が20〜300、log(SiO2/Al2O3)が2以上(モル比)のβ骨格構造中に鉄を有する結晶性シリケートが優れた低温での窒素酸化物の分解性能並びに水熱耐久性を有することが報告されている(特許文献6)。しかしながら、これらの結晶粒子径は5μm以上と大きく、コーティングや成型等、ハンドリングに問題が残るものであった。 In addition, a crystalline silicate having iron in a β skeleton structure having a SiO 2 / Fe 2 O 3 molar ratio of 20 to 300 and a log (SiO 2 / Al 2 O 3 ) of 2 or more (molar ratio) is excellent at a low temperature. It has been reported that it has decomposition performance and hydrothermal durability of nitrogen oxide (Patent Document 6). However, these crystal particle diameters are as large as 5 μm or more, and problems remain in handling such as coating and molding.
本発明の目的は、工業的使用が困難なフッ素を使用することなく合成され、フッ素の含有率が400ppm以下であり、Al及びFeの両方を含有する高結晶性のβ型鉄シリケート、及び、その製造方法を提供することにある。 The object of the present invention is to synthesize without using fluorine, which is difficult to use industrially, the fluorine content is 400 ppm or less, a highly crystalline β-type iron silicate containing both Al and Fe, and It is in providing the manufacturing method.
また、排出ガス中の窒素酸化物の効率的な浄化が望まれている中で、従来、200℃以下の低温における窒素酸化物浄化活性及び水熱耐久性能が高く、尚且つハンドリングに優れた窒素酸化物浄化触媒は得られていなかった。 In addition, while nitrogen oxides in exhaust gas are desired to be efficiently purified, conventionally, nitrogen oxides have high nitrogen oxide purifying activity and hydrothermal durability performance at a low temperature of 200 ° C. or lower, and excellent handling. An oxide purification catalyst was not obtained.
本発明の目的は、幅広い温度域、特に200℃以下の比較的低温の領域で効率的に窒素酸化物を浄化する触媒性能及び水熱耐久性を有し、尚且つハンドリングに優れた結晶性シリケート触媒を提供することにある。さらに他の目的は、上記触媒を用いた窒素酸化物の浄化方法を提供することにある。 An object of the present invention is a crystalline silicate having catalytic performance and hydrothermal durability for efficiently purifying nitrogen oxides in a wide temperature range, particularly in a relatively low temperature range of 200 ° C. or less, and excellent in handling. It is to provide a catalyst. Still another object is to provide a method for purifying nitrogen oxides using the above catalyst.
本発明者らは以上のような状況を鑑み、β型鉄シリケートの製造方法、製造条件に対して鋭意検討を重ねた結果、本発明のβ型鉄シリケートを見出すに至った。 In view of the situation as described above, the present inventors have intensively studied the production method and production conditions of β-type iron silicate, and as a result, have come to find the β-type iron silicate of the present invention.
以下、本発明のβ型鉄シリケートについて説明する。 Hereinafter, the β-type iron silicate of the present invention will be described.
なお、最初に特許請求の範囲の請求項1から請求項5までに記載された発明のβ型鉄シリケートについて説明する。 First, the β-type iron silicate according to claims 1 to 5 of the claims will be described.
本発明のβ型鉄シリケートの組成は、
(x+y)M(2/n)O・xFe2O3・yAl2O3・zSiO2・wH2O
(但し、nは陽イオンMの原子価、x、y、z、はそれぞれFe2O3、Al2O3、SiO2のモル分率を表し、x+y+z=1である。wは0以上の数である)で表される。
The composition of the β-type iron silicate of the present invention is:
(X + y) M (2 / n) O.xFe 2 O 3 .yAl 2 O 3 .zSiO 2 .wH 2 O
(Where n is the valence of the cation M, x, y, and z are mole fractions of Fe 2 O 3 , Al 2 O 3 , and SiO 2 , respectively, and x + y + z = 1. W is 0 or more. Number).
本発明のβ型鉄シリケートの結晶構造は、X線回折で確認される結晶構造がβ型である。β型鉄シリケートは、酸素12員環からなる0.76×0.64nmおよび0.55×0.55nmの細孔が交差した3次元細孔を有するメタロシリケートである。β型鉄シリケートのX線回折パターンは以下の表1に示す格子面間隔d(オングストローム)とその回折強度で特徴付けられる。 The crystal structure of the β-type iron silicate of the present invention is β-type as confirmed by X-ray diffraction. β-type iron silicate is a metallosilicate having three-dimensional pores in which 0.76 × 0.64 nm and 0.55 × 0.55 nm pores composed of oxygen 12-membered rings intersect. The X-ray diffraction pattern of β-type iron silicate is characterized by the lattice spacing d (angstrom) shown in Table 1 below and its diffraction intensity.
本発明のβ型鉄シリケートは、その含有するFeの全部又は一部が4配位構造の骨格原子として酸素原子と連結した構造であり、アルミノシリケートゼオライトと同様にシリケート骨格の電荷不足に由来する固体酸性質を有するものである。本発明のβ型鉄シリケートが含有するFeは、必ずしもその全てが骨格に存在する必要はない。骨格に存在するFeは構造指向剤(これ以降、“SDA”と称する)除去のための焼成操作等の熱処理によって、その一部が脱離しうるからである。 The β-type iron silicate of the present invention has a structure in which all or a part of Fe contained therein is connected to an oxygen atom as a skeleton atom of a tetracoordinate structure, and is derived from insufficient charge of the silicate skeleton as in the case of an aluminosilicate zeolite. It has solid acid properties. All of the Fe contained in the β-type iron silicate of the present invention is not necessarily present in the skeleton. This is because a part of Fe existing in the skeleton can be detached by a heat treatment such as a baking operation for removing the structure directing agent (hereinafter referred to as “SDA”).
本発明のβ型鉄シリケート組成のSiO2/Fe2O3は50以上150以下である。SiO2/Fe2O3が50を下回るとβ型構造の結晶化が次第に困難になるため結晶性が低下する。SiO2/Fe2O3が150を上回るとFeの絶対量が少なくなり触媒活性の低下等に繋がる。結晶性の観点から、好ましくはSiO2/Fe2O3が100以上150以下、更に好ましくは130以上150以下である。 SiO 2 / Fe 2 O 3 of the β-type iron silicate composition of the present invention is 50 or more and 150 or less. When SiO 2 / Fe 2 O 3 is less than 50, crystallization of the β-type structure becomes increasingly difficult, so that the crystallinity is lowered. When SiO 2 / Fe 2 O 3 exceeds 150, the absolute amount of Fe decreases, leading to a decrease in catalytic activity and the like. From the viewpoint of crystallinity, the SiO 2 / Fe 2 O 3 is preferably 100 or more and 150 or less, more preferably 130 or more and 150 or less.
AlとFeはいずれもゼオライト骨格に4配位構造で導入されるため、AlとFeの個々の組成だけでなく、これらの合計の導入量によっても結晶化は制御される。即ち本発明のβ型鉄シリケートのSiO2/(Al2O3+Fe2O3)は20以上70以下であり、結晶性の観点から好ましくは25以上70以下、更に好ましくは30以上70以下である。 Since both Al and Fe are introduced into the zeolite framework in a four-coordinate structure, crystallization is controlled not only by the individual composition of Al and Fe, but also by the total amount of these introduced. That is, the SiO 2 / (Al 2 O 3 + Fe 2 O 3 ) of the β-type iron silicate of the present invention is 20 or more and 70 or less, preferably 25 or more and 70 or less, more preferably 30 or more and 70 or less from the viewpoint of crystallinity. is there.
本発明のβ型鉄シリケートは原料にフッ素を使用することなく合成され、結晶の乾燥重量に対するフッ素の含有率が400ppm以下である。フッ素を使用して合成されたβ型鉄シリケートはSDAの除去焼成後においてもフッ素が残存する。本発明のβ型鉄シリケート結晶の乾燥重量に対するフッ素の含有率は200ppm以下であることが好ましく、100ppm以下であることがより好ましく、検出限界以下であることが更に好ましい。 The β-type iron silicate of the present invention is synthesized without using fluorine as a raw material, and the fluorine content relative to the dry weight of the crystal is 400 ppm or less. In the β-type iron silicate synthesized using fluorine, fluorine remains even after SDA removal and baking. The fluorine content relative to the dry weight of the β-type iron silicate crystal of the present invention is preferably 200 ppm or less, more preferably 100 ppm or less, and even more preferably the detection limit or less.
β型鉄シリケート中のフッ素の定量は、例えばランタンアリザリンコンプレキソン吸光光度法にて行うことができる。ランタンアリザリンコンプレキソンとして、市販のアルフッソン((株)同仁化学研究所)を用いることができる。分析は前処理として試料をアルカリ溶解、濃縮及び蒸留後、アルフッソンを添加し、pH調整後に波長620nmの吸光度を測定する。 Quantification of fluorine in β-type iron silicate can be performed, for example, by lanthanum alizarin complexone spectrophotometry. Commercially available Alfusson (Dojindo Laboratories) can be used as the lanthanum alizarin complexone. In the analysis, as a pretreatment, the sample is alkali-dissolved, concentrated and distilled, Alfusson is added, and the absorbance at a wavelength of 620 nm is measured after pH adjustment.
本発明のβ型鉄シリケートは、X線結晶回折(302)面の半値幅(FWHM)が0.16〜0.24°である。 In the β-type iron silicate of the present invention, the full width at half maximum (FWHM) of the X-ray crystal diffraction (302) plane is 0.16 to 0.24 °.
尚、X線結晶回折は合成後のSDA含有状態にて測定される。 X-ray crystal diffraction is measured in the SDA-containing state after synthesis.
半値幅(FWHM)は結晶の状態を表す指標であり、結晶の規則性、格子の歪みの度合いを表す。この値が低いほど結晶は長周期構造を維持しており結晶性が高いといえる。半値幅が0.24°を超えるものは結晶性が十分ではなく、高温での耐熱水処理等によって結晶構造が崩壊しやすい。 The full width at half maximum (FWHM) is an index representing the state of the crystal, and represents the regularity of the crystal and the degree of distortion of the lattice. It can be said that the lower this value is, the higher the crystallinity is because the crystal maintains a long-period structure. When the half width exceeds 0.24 °, the crystallinity is not sufficient, and the crystal structure tends to collapse due to a high temperature hot water treatment or the like.
本発明のβ型鉄シリケートは、β骨格構造中に鉄の全部又は一部を含有する。β型鉄シリケートの骨格にFeが存在することは電子スピン共鳴測定(測定温度77K)によって確認することができる。 The β-type iron silicate of the present invention contains all or part of iron in the β skeleton structure. The presence of Fe in the skeleton of β-type iron silicate can be confirmed by electron spin resonance measurement (measurement temperature 77K).
常磁性のFeイオン(Fe3+)は電子スピン共鳴測定において共鳴吸収を示し、吸収ピークとしてはg≒2.0、g≒4.3及びg>4.3の少なくとも3つの吸収ピークをもつものに帰属されることが知られている(Journal of Catalysis,249(2007)67他参照)。g≒2.0の吸収ピークをもつものは対称四面体構造(又は高対称な多配位構造)を有する孤立Feイオン、g≒4.3及びg>4.3の吸収をもつFeイオンは歪んだ四面体構造及び歪んだ多配位構造を有する孤立Feイオンに帰属される。 Paramagnetic Fe ions (Fe 3+ ) exhibit resonance absorption in electron spin resonance measurement, and have absorption peaks having at least three absorption peaks of g≈2.0, g≈4.3, and g> 4.3. (See Journal of Catalysis, 249 (2007) 67 et al.). Those having an absorption peak of g≈2.0 are isolated Fe ions having a symmetric tetrahedral structure (or highly symmetric multi-coordination structure), and Fe ions having absorption of g≈4.3 and g> 4.3 are It is attributed to isolated Fe ions having a distorted tetrahedral structure and a distorted multi-coordination structure.
シリケート骨格中に存在するFeは孤立状態かつ高対称な四面体構造をとり、骨格外のFeは八面体構造をとると考えられることから、本発明のβ型鉄シリケートの骨格にFeが存在することは、電子スピン共鳴測定におけるg≒2.0の共鳴吸収によって確認することができる。 Fe existing in the silicate skeleton has an isolated and highly symmetric tetrahedral structure, and Fe outside the skeleton is considered to have an octahedral structure. Therefore, Fe exists in the skeleton of the β-type iron silicate of the present invention. This can be confirmed by the resonance absorption of g≈2.0 in the electron spin resonance measurement.
電子スピン共鳴測定は、一般的な方法で行うことができる。 Electron spin resonance measurement can be performed by a general method.
例えば、電子スピン共鳴装置((株)日本電子製JES−TE200)を用い、測定条件としては測定温度77K、マイクロ波出力は1.0mW、観測範囲は0〜1000mT、変調幅は0.32mT、時定数は0.3secとすることができる。試料は約10mgを石英製試料管に秤取し、液体窒素温度測定用デュアに挿入後、測定を行う。 For example, using an electron spin resonance apparatus (JES-TE200 manufactured by JEOL Ltd.), the measurement conditions are a measurement temperature of 77K, a microwave output of 1.0 mW, an observation range of 0 to 1000 mT, a modulation width of 0.32 mT, The time constant can be 0.3 sec. About 10 mg of the sample is weighed into a quartz sample tube, inserted into a liquid nitrogen temperature measurement dewar, and then measured.
またβ型鉄シリケートの骨格にFeが存在することは、X線吸収スペクトル(XAFS)を解析することによっても確認することができる。この場合、FeのK吸収端の前に現れるプリエッジピーク(7110eV)が四面体構造の孤立Feイオンに帰属される。 The presence of Fe in the skeleton of β-type iron silicate can also be confirmed by analyzing an X-ray absorption spectrum (XAFS). In this case, the pre-edge peak (7110 eV) appearing before the K absorption edge of Fe is attributed to the isolated Fe ions having a tetrahedral structure.
本発明のβ型鉄シリケートはAlを含有する、所謂アルミノシリケートである。ゼオライトのAlは固体酸点であり、触媒反応における吸着点等として機能することから、吸着対象の化学種や、適用しようとする触媒反応によっては必須の要素となる。Alの含有量を減らしていけばゼオライトの水熱耐久性は一般に向上するが、一方でその代償としてAlに由来する固体酸点の機能は徐々に失われる。 The β-type iron silicate of the present invention is a so-called aluminosilicate containing Al. Since Al in the zeolite is a solid acid point and functions as an adsorption point in the catalytic reaction, it becomes an essential element depending on the chemical species to be adsorbed and the catalytic reaction to be applied. If the Al content is reduced, the hydrothermal durability of the zeolite is generally improved. On the other hand, the function of solid acid sites derived from Al is gradually lost.
尚、ゼオライトの水熱耐久性とは、ゼオライト骨格自体の水熱耐久性を意味する。 Incidentally, the hydrothermal durability of the zeolite means the hydrothermal durability of the zeolite skeleton itself.
本発明のβ型鉄シリケートは、固体酸点として働くAlを十分に含有しながら、高結晶性であり高い水熱耐久性を有するものである。 The β-type iron silicate of the present invention has high crystallinity and high hydrothermal durability while sufficiently containing Al acting as a solid acid point.
本発明のβ型鉄シリケート組成のSiO2/Al2O3は25以上70以下であることが好ましい。SiO2/Al2O3が25を下回るとβ型構造の結晶化が次第に困難になるため結晶性が低下する。またSiO2/Al2O3が70を上回ると固体酸量が不十分となる。結晶性の観点から、好ましくはSiO2/Al2O3は35以上70以下、更に好ましくは45以上70以下である。 The SiO 2 / Al 2 O 3 of the β-type iron silicate composition of the present invention is preferably 25 or more and 70 or less. When SiO 2 / Al 2 O 3 is less than 25, crystallization of the β-type structure becomes increasingly difficult, so that the crystallinity is lowered. On the other hand, if SiO 2 / Al 2 O 3 exceeds 70, the amount of solid acid becomes insufficient. From the viewpoint of crystallinity, SiO 2 / Al 2 O 3 is preferably 35 or more and 70 or less, more preferably 45 or more and 70 or less.
本発明のβ型鉄シリケートのSEM観察における結晶粒径は0.2μm以上2.0μm以下であることが好ましい。 The crystal grain size in SEM observation of the β-type iron silicate of the present invention is preferably 0.2 μm or more and 2.0 μm or less.
尚、本発明での結晶粒径とは平均結晶粒径を意味し、その測定方法は15000倍のSEM観察倍率において50個の一次粒子の直径を計測して得られた算術平均値である。一次粒子の形状には不規則なものも存在するため、全ての粒子について一律に水平方向の最大径を計測して直径とした。観察倍率は直径の計測に適当であれば任意に選択できる。 In the present invention, the crystal grain size means an average crystal grain size, and the measurement method is an arithmetic average value obtained by measuring the diameters of 50 primary particles at an SEM observation magnification of 15000 times. Since there are irregular shapes in the primary particles, the maximum horizontal diameter was uniformly measured for all the particles to obtain the diameter. The observation magnification can be arbitrarily selected as long as it is suitable for measuring the diameter.
0.2μm未満では水熱耐久性が低く、2.0μmを超えると触媒として用いる場合、特に流速が大きい場合の動的性能が低下する。さらにコーティング、成型等のハンドリング性においても本発明の範囲の粒径が好ましい。 If it is less than 0.2 μm, the hydrothermal durability is low, and if it exceeds 2.0 μm, when used as a catalyst, the dynamic performance particularly when the flow rate is large is lowered. Furthermore, the particle size within the range of the present invention is preferable in handling properties such as coating and molding.
次に本発明のβ型鉄シリケートの製造方法について説明する。 Next, the manufacturing method of (beta) type iron silicate of this invention is demonstrated.
本発明のβ型鉄シリケートの原料混合物の仕込み組成は下記のように例示される。但し、これらの組成範囲は限定的なものではなく、最終的な生成物組成が本発明のβ型鉄シリケートの組成の範囲内となるように任意に設定することができる。また、種晶などの結晶化促進作用を有する成分を添加してもよい。 The feed composition of the raw material mixture of β-type iron silicate of the present invention is exemplified as follows. However, these composition ranges are not limited, and can be arbitrarily set so that the final product composition falls within the composition range of the β-type iron silicate of the present invention. Moreover, you may add the component which has crystallization promotion effects, such as a seed crystal.
aM2O・SiO2・bFe2O3・cAl2O3・dSDA・eH2O
ここで、
M = K+又はRb+又はCs+
a = 0.005〜0.10であり、好ましくは0.01〜0.05
b = 0.006〜0.02であり、好ましくは0.006〜0.01
c = 0.014〜0.04であり、好ましくは0.014〜0.028
d = 0.10〜0.35であり、好ましくは0.10〜0.30
e = 7〜15であり、好ましくは9〜13
aM 2 O · SiO 2 · bFe 2 O 3 · cAl 2 O 3 · dSDA · eH 2 O
here,
M = K + or Rb + or Cs +
a = 0.005 to 0.10, preferably 0.01 to 0.05
b = 0.006 to 0.02, preferably 0.006 to 0.01
c = 0.014-0.04, preferably 0.014-0.028
d = 0.10 to 0.35, preferably 0.10 to 0.30
e = 7-15, preferably 9-13
上述のM2Oについて、一般的に用いられるNa+は含まない。Na+の存在は反応溶液中の負電荷を帯びたアルミノシリケート種を安定化し、結晶化を促進するが、一方で結晶核発生の増大から個々の結晶粒子の微細化を招くことが多く、結果的に十分な結晶性が得られにくいためである。 The above-mentioned M 2 O does not contain commonly used Na + . The presence of Na + stabilizes the negatively charged aluminosilicate species in the reaction solution and promotes crystallization. On the other hand, the increase in crystal nucleation often leads to the refinement of individual crystal grains. This is because sufficient crystallinity is difficult to obtain.
合成用原料はシリカ源、アルミニウム源、鉄源、SDA、アルカリ金属源及び水から構成される。 The raw material for synthesis is composed of a silica source, an aluminum source, an iron source, SDA, an alkali metal source and water.
シリカ源としてはコロイダルシリカ、無定型シリカ、珪酸ナトリウム、テトラエチルオルトシリケート、鉄アルミノシリケートゲルなどを用いることができ、アルミニウム源としては硫酸アルミニウム、アルミン酸ナトリウム、水酸化アルミニウム、硝酸アルミニウム、アルミノシリケートゲル、金属アルミニウムなどを用いることができる。また鉄源としては硝酸鉄、塩化鉄、硫酸鉄、金属鉄などを用いることができ、これら原料は、他の成分と十分均一に混合できるものが好ましい。 Colloidal silica, amorphous silica, sodium silicate, tetraethylorthosilicate, iron aluminosilicate gel, etc. can be used as the silica source, and aluminum sulfate, sodium aluminate, aluminum hydroxide, aluminum nitrate, aluminosilicate gel can be used as the aluminum source. Metal aluminum or the like can be used. Further, as the iron source, iron nitrate, iron chloride, iron sulfate, metallic iron and the like can be used, and these raw materials are preferably those which can be sufficiently mixed with other components.
SDA原料としてはテトラエチルアンモニウムカチオンを有するテトラエチルアンモニウムヒドロキシド(これ以降“TEAOH”と称する。)、テトラエチルアンモニウムブロマイド、更にはオクタメチレンビスキヌクリジウム、α,α’−ジキヌクリジウム−p−キシレン、α,α’−ジキヌクリジウム−m−キシレン、α,α’−ジキヌクリジウム−o−キシレン、1,4−ジアザビシクロ[2,2,2]オクタン、1,3,3,N,N−ペンタメチル−6−アゾニウムビシクロ[3,2,1]オクタン又はN,N−ジエチル−1,3,3−トリメチル−6−アゾニウムビシクロ[3,2,1]オクタンカチオンを含む化合物の群の少なくとも一種以上を使用することができる。 As SDA raw materials, tetraethylammonium hydroxide having a tetraethylammonium cation (hereinafter referred to as “TEAOH”), tetraethylammonium bromide, octamethylenebiskinucridium, α, α′-diquinuclidium-p-xylene, α, α′-diquinuclidium-m-xylene, α, α′-diquinuclidium-o-xylene, 1,4-diazabicyclo [2,2,2] octane, 1,3,3, N, N-pentamethyl-6-azonium At least one or more of the group of compounds containing bicyclo [3,2,1] octane or N, N-diethyl-1,3,3-trimethyl-6-azonium bicyclo [3,2,1] octane cation are used. be able to.
アルカリ金属源としては水酸化カリウム、硫酸カリウム、塩化カリウム、酢酸カリウム、水酸化ルビジウム、硫酸ルビジウム、塩化ルビジウム、酢酸ルビジウム、水酸化セシウム、硫酸セシウム、塩化セシウム、酢酸セシウムなどを用いることができ、これら原料は、他の成分と十分均一に混合できるものが好ましい。 As the alkali metal source, potassium hydroxide, potassium sulfate, potassium chloride, potassium acetate, rubidium hydroxide, rubidium sulfate, rubidium chloride, rubidium acetate, cesium hydroxide, cesium sulfate, cesium chloride, cesium acetate, etc. can be used. These raw materials are preferably those that can be sufficiently uniformly mixed with other components.
水、シリカ源、アルミニウム源、鉄源、SDA及びアルカリ金属源の原料混合物を密閉式圧力容器中で、100〜180℃の温度で結晶化させることにより本発明のβ型鉄シリケートを得ることができる。 The β-type iron silicate of the present invention can be obtained by crystallizing a raw material mixture of water, silica source, aluminum source, iron source, SDA and alkali metal source in a sealed pressure vessel at a temperature of 100 to 180 ° C. it can.
結晶化の際、原料混合物は混合攪拌された状態でも静置した状態でもよい。結晶化終了後、十分放冷し、固液分離し、十分量の純水で洗浄し、110〜150℃の温度で乾燥して本発明のβ型鉄シリケートが得られる。 At the time of crystallization, the raw material mixture may be mixed and stirred or left standing. After completion of crystallization, the mixture is allowed to cool sufficiently, separated into solid and liquid, washed with a sufficient amount of pure water, and dried at a temperature of 110 to 150 ° C. to obtain the β-type iron silicate of the present invention.
SDAの除去処理は、酸性溶液やSDA分解成分を含んだ薬液を用いた液相処理、レジンなどを用いた交換処理、熱分解処理を用いることができ、これらの処理を組み合わせても良い。更には、β型鉄シリケートのイオン交換能を利用してH型やNH4型に変換して用いることもできる。 For the SDA removal treatment, a liquid phase treatment using a chemical solution containing an acidic solution or an SDA decomposition component, an exchange treatment using a resin or the like, or a thermal decomposition treatment may be used, and these treatments may be combined. Furthermore, it can be used by converting into β-type or NH 4 type by utilizing the ion exchange ability of β-type iron silicate.
本発明のβ型鉄シリケート中には高分散状態の鉄が含まれているため、そのまま触媒、あるいは吸着材等として用いることができ、用途は特に限定されない。 Since the β-type iron silicate of the present invention contains highly dispersed iron, it can be used as it is as a catalyst or an adsorbent, and its application is not particularly limited.
本発明のβ型鉄シリケートにはさらに活性な金属種を担持させてもよい。担持させる金属種は特に限定されない。 The β-type iron silicate of the present invention may further support an active metal species. The metal species to be supported is not particularly limited.
担持方法として、イオン交換法、含浸担持法、蒸発乾固法、沈殿担持法、物理混合法等の方法を用いることができる。金属担持に用いる原料は硝酸塩、硫酸塩、酢酸塩、塩化物、錯塩、酸化物、複合酸化物などを使用することができる。 As the loading method, methods such as an ion exchange method, an impregnation loading method, an evaporation to dryness method, a precipitation loading method, and a physical mixing method can be used. As the raw material used for supporting the metal, nitrates, sulfates, acetates, chlorides, complex salts, oxides, complex oxides and the like can be used.
金属の担持量は限定されないが、特に0.1〜10重量%の範囲が好ましい。 The amount of metal supported is not limited, but a range of 0.1 to 10% by weight is particularly preferable.
本発明のβ型鉄シリケートは、シリカ、アルミナ及び粘土鉱物等のバインダーと混合し成形して使用することもできる。成形する際に用いられる粘土鉱物として、カオリン、アタパルガイト、モンモリロナイト、ベントナイト、アロフェン、セピオライトが例示される。また、コージェライト製あるいは金属製のハニカム基材にウォッシュコートして使用することもできる。 The β-type iron silicate of the present invention can be used after being mixed with a binder such as silica, alumina and clay mineral. Examples of the clay mineral used for molding include kaolin, attapulgite, montmorillonite, bentonite, allophane, and sepiolite. Moreover, it can also be used by wash-coating on a cordierite or metal honeycomb substrate.
次に、特許請求の範囲の請求項6から請求項13までに記載された発明のβ型鉄シリケートから成る窒素酸化物浄化触媒、及び、その窒素酸化物浄化触媒の製造方法、並びに、その窒素酸化物浄化触媒を用いた窒素酸化物の還元方法について説明する。 Next, a nitrogen oxide purification catalyst comprising the β-type iron silicate according to claims 6 to 13 of the claims, a method for producing the nitrogen oxide purification catalyst, and the nitrogen A method for reducing nitrogen oxides using an oxide purification catalyst will be described.
本発明者らは、アンモニア等を用いた窒素酸化物の選択還元触媒について鋭意検討を重ねた結果、SiO2/Al2O3モル比が20〜70、好ましくは20〜60、SiO2/Fe2O3モル比が50〜200であり、結晶回折(302)面の半値幅(FWHM)が0.30〜0.40°であるβ骨格構造中に鉄とアルミを含有する結晶性シリケートでは、アンモニア等を還元剤とする窒素酸化物の選択還元において、優れた窒素酸化物の浄化性能、700℃、20時間、10容量%水蒸気雰囲気下の水熱耐久処理後におけるNOx還元率が反応温度200℃で45%以上60%以下となる優れた窒素酸化物の浄化性能を有していることを見出し、本発明を完成させるに至ったものである。 As a result of intensive studies on selective reduction catalysts for nitrogen oxides using ammonia or the like, the inventors of the present invention have a SiO 2 / Al 2 O 3 molar ratio of 20 to 70, preferably 20 to 60, SiO 2 / Fe. In a crystalline silicate containing iron and aluminum in a β skeleton structure in which the 2 O 3 molar ratio is 50 to 200 and the half width (FWHM) of the crystal diffraction (302) plane is 0.30 to 0.40 ° In the selective reduction of nitrogen oxides using ammonia or the like as the reducing agent, the NOx reduction rate after hydrothermal endurance treatment in a 10% by volume water vapor atmosphere at 700 ° C. for 20 hours is excellent in the reaction temperature. The present inventors have found that it has excellent nitrogen oxide purification performance that is 45% or more and 60% or less at 200 ° C., and has completed the present invention.
以下、本発明の請求項6〜13の窒素酸化物浄化触媒、その製造方法、及び、その触媒を用いた窒素酸化物浄化方法について説明する。 Hereinafter, the nitrogen oxide purification catalyst according to claims 6 to 13 of the present invention, the production method thereof, and the nitrogen oxide purification method using the catalyst will be described.
本発明の窒素酸化物浄化触媒は、SiO2/Al2O3モル比が20以上70以下、SiO2/Fe2O3モル比が50以上200以下であり、結晶回折(302)面の半値幅(FWHM)が0.30〜0.40°であるβ骨格構造中に鉄とアルミを含有するβ型結晶性鉄シリケート(以下、「β型鉄シリケート」と呼称する)である。 The nitrogen oxide purification catalyst of the present invention has a SiO 2 / Al 2 O 3 molar ratio of 20 or more and 70 or less, a SiO 2 / Fe 2 O 3 molar ratio of 50 or more and 200 or less, and a half of the crystal diffraction (302) plane. It is a β-type crystalline iron silicate (hereinafter referred to as “β-type iron silicate”) containing iron and aluminum in a β-skeleton structure having a value range (FWHM) of 0.30 to 0.40 °.
β骨格構造中に鉄とアルミを含有するとは、全ての鉄がβ骨格構造中に含有するのではなく、鉄の一部がβ骨格構造中に含有され、残りの鉄は、β骨格構造の構成元素とて存在せず、β骨格構造を構成しないイオン交換サイトや表面のシラノール基付近に存在している状態をさすものである。 The inclusion of iron and aluminum in the β skeleton structure means that not all iron is contained in the β skeleton structure, but part of iron is contained in the β skeleton structure, and the remaining iron is It refers to a state that does not exist as a constituent element and exists near an ion exchange site or surface silanol group that does not constitute a β skeleton structure.
β型鉄シリケートの組成は、
(x+y)M(2/n)O・xFe2O3・yAl2O3・zSiO2・wH2O
(但し、nは陽イオンMの原子価、x、y、z、はそれぞれFe2O3、Al2O3、SiO2のモル分率を表し、x+y+z=1である。wは0以上の数である)で表される。
The composition of β-type iron silicate is
(X + y) M (2 / n) O.xFe 2 O 3 .yAl 2 O 3 .zSiO 2 .wH 2 O
(Where n is the valence of the cation M, x, y, and z are mole fractions of Fe 2 O 3 , Al 2 O 3 , and SiO 2 , respectively, and x + y + z = 1. W is 0 or more. Number).
本発明の窒素酸化物浄化触媒のβ型鉄シリケートの結晶構造は、X線回折で確認される結晶構造がβ型である。β型鉄シリケートは、酸素12員環からなる0.76×0.64nmおよび0.55×0.55nmの細孔が交差した3次元細孔を有するメタロシリケートである。β型鉄シリケートのX線回折パターンは以下の表2に示す格子面間隔d(オングストローム)とその回折強度で特徴付けられる。 The crystal structure of the β-type iron silicate of the nitrogen oxide purification catalyst of the present invention is β-type as confirmed by X-ray diffraction. β-type iron silicate is a metallosilicate having three-dimensional pores in which 0.76 × 0.64 nm and 0.55 × 0.55 nm pores composed of oxygen 12-membered rings intersect. The X-ray diffraction pattern of β-type iron silicate is characterized by the lattice spacing d (angstrom) shown in Table 2 below and its diffraction intensity.
本発明の窒素酸化物浄化触媒のβ型鉄シリケートは、四配位構造の鉄が骨格原子として酸素原子と連結した構造を有し、アルミノシリケートゼオライトと同様にシリケート骨格の電荷不足に由来する固体酸性質を有するものである。本発明の鉄シリケートは、触媒の活性金属としての鉄が高度に分散した孤立鉄イオン(Fe3+)として存在しており、アンモニア等を用いた選択還元反応において、鉄の凝集が抑制され、高活性を示す。 The β-type iron silicate of the nitrogen oxide purification catalyst of the present invention has a structure in which tetracoordinate iron is linked to an oxygen atom as a skeleton atom, and is a solid derived from insufficient charge of the silicate skeleton similarly to an aluminosilicate zeolite. It has acid properties. The iron silicate of the present invention exists as isolated iron ions (Fe 3+ ) in which iron as a catalyst active metal is highly dispersed, and in a selective reduction reaction using ammonia or the like, iron aggregation is suppressed, Shows activity.
本発明の窒素酸化物浄化触媒のβ型鉄シリケートはβ骨格構造中に鉄を有する結晶性シリケートであって、SiO2/Al2O3モル比は20〜70、好ましくは20〜60の範囲である。SiO2/Al2O3モル比が20未満ではアルミの含有量は多くなるが、骨格内アルミが多すぎると耐熱水処理によって脱アルミ、脱鉄等の骨格からの金属の脱離、凝集が著しく進みやすくなり、活性に寄与する孤立Fe3+を十分に保持することが難しい。そのため、SiO2/Al2O3モル比20以上が好ましい。また、SiO2/Al2O3モル比が70より大きくなると骨格内のアルミ量が少なくなり、十分な水熱耐久性を得ることができない。また、固体酸量が減少することから、十分な触媒活性を得ることができない。特にSiO2/Al2O3モル比を60以下とすることが好ましく、50以下とすることがより好ましい。 The β-type iron silicate of the nitrogen oxide purification catalyst of the present invention is a crystalline silicate having iron in the β skeleton structure, and the SiO 2 / Al 2 O 3 molar ratio is in the range of 20 to 70, preferably 20 to 60. It is. If the SiO 2 / Al 2 O 3 molar ratio is less than 20, the aluminum content increases, but if the amount of aluminum in the skeleton is too large, desorption and agglomeration of the metal from the skeleton such as dealumination and iron removal by hot water treatment. It becomes extremely easy to proceed, and it is difficult to sufficiently retain isolated Fe 3+ that contributes to activity. Therefore, a SiO 2 / Al 2 O 3 molar ratio of 20 or more is preferable. On the other hand, when the SiO 2 / Al 2 O 3 molar ratio is larger than 70, the amount of aluminum in the skeleton is reduced, and sufficient hydrothermal durability cannot be obtained. Further, since the amount of solid acid is reduced, sufficient catalytic activity cannot be obtained. In particular, the SiO 2 / Al 2 O 3 molar ratio is preferably 60 or less, and more preferably 50 or less.
SiO2/Fe2O3モル比が50未満では鉄の含有量は多くなるが、骨格内の鉄が多すぎると耐熱水処理によって脱アルミ、脱鉄等の骨格からの金属の脱離、凝集が著しく進みやすくなり、活性に寄与する孤立Fe3+を十分に保持することが難しい。そのため、SiO2/Fe2O3モル比は50以上が好ましい。また、SiO2/Fe2O3モル比が200を超えるものでは、絶対的な鉄イオン量が少なく、十分な触媒活性が得られない。SiO2/Fe2O3モル比は50〜200、さらに100〜200の範囲であることが好ましい。 When the SiO 2 / Fe 2 O 3 molar ratio is less than 50, the iron content increases. However, if the amount of iron in the skeleton is too large, metal removal from the skeleton such as dealumination and iron removal by a hot water treatment and aggregation It becomes difficult to keep the isolated Fe 3+ that contributes to the activity sufficiently. Therefore, the SiO 2 / Fe 2 O 3 molar ratio is preferably 50 or more. In addition, when the SiO 2 / Fe 2 O 3 molar ratio exceeds 200, the absolute iron ion amount is small and sufficient catalytic activity cannot be obtained. The SiO 2 / Fe 2 O 3 molar ratio is preferably in the range of 50 to 200, more preferably 100 to 200.
なお、本発明の窒素酸化物浄化触媒のβ型鉄シリケート中で窒素酸化物の還元に最も寄与する鉄は、後述するシリケート骨格中に孤立鉄イオン(Fe3+)として分散して存在するものであり、Fe2O3として凝集しているものではない。なお本発明のβ型鉄シリケートの組成の定義で用いているSiO2/Fe2O3モル比は、孤立鉄イオンを含む全ての鉄含有量を定義するために便宜上に用いられる表記である。 The iron that contributes most to the reduction of nitrogen oxides in the β-type iron silicate of the nitrogen oxide purification catalyst of the present invention is present as dispersed iron ions (Fe 3+ ) in the silicate skeleton described later. Yes, it is not agglomerated as Fe 2 O 3 . Note that the SiO 2 / Fe 2 O 3 molar ratio used in the definition of the composition of the β-type iron silicate of the present invention is a notation used for convenience in order to define the total iron content including isolated iron ions.
本発明の窒素酸化物浄化触媒のβ型鉄シリケートは、X線結晶回折(302)面の半値幅(FWHM)が0.30〜0.40°である。半値幅(FWHM)は結晶の状態を表す指標であり、結晶の規則性、格子のひずみの度合いを表す。この値が大きいほど結晶の規則性は低く、強く歪んでいることを示しており、シリカ骨格と鉄とアルミの相互作用が強く発現されており、水熱処理後の触媒活性が向上するものと考えられる。 The β-type iron silicate of the nitrogen oxide purification catalyst of the present invention has an X-ray crystal diffraction (302) plane half width (FWHM) of 0.30 to 0.40 °. The full width at half maximum (FWHM) is an index representing the state of the crystal, and represents the regularity of the crystal and the degree of strain of the lattice. The larger the value, the lower the regularity of the crystal and the stronger the distortion, and the stronger the interaction between the silica skeleton, iron and aluminum, and the higher the catalytic activity after hydrothermal treatment. It is done.
尚、X線結晶回折はSDA除去のための熱処理後において測定される。 X-ray crystal diffraction is measured after heat treatment for SDA removal.
一方、半値幅(FWHM)が著しく大きい場合はゼオライト構造自体の崩壊が進みすぎており、触媒活性は著しく低下すると考えられる。従って、半値幅(FWHM)が0.30°未満であるものは歪が小さく、シリカ骨格と鉄とアルミの相互作用が十分でないため、熱水処理後の触媒活性が低くなり、0.40°を超えるとゼオライト構造自体の崩壊が著しく進みすぎ、触媒活性が低くなる。 On the other hand, when the full width at half maximum (FWHM) is remarkably large, the zeolite structure itself is excessively collapsed, and the catalytic activity is considered to be significantly reduced. Therefore, when the full width at half maximum (FWHM) is less than 0.30 °, the strain is small, and the interaction between the silica skeleton, iron and aluminum is not sufficient, so that the catalytic activity after the hydrothermal treatment becomes low, and 0.40 ° Exceeding this causes the zeolite structure itself to collapse so much that the catalytic activity becomes low.
本発明の窒素酸化物浄化触媒のβ型鉄シリケートの平均結晶粒子径は0.2〜2.0μmの範囲であることが好ましい。その理由は、0.2μm未満では水熱耐久性が低く、触媒活性を維持することができないからであり、また、2.0μmを超えるとコーティング、成型等のハンドリング性が低下するからであり、0.2〜1.0μmであることが更に好ましい。 The average crystal particle diameter of β-type iron silicate of the nitrogen oxide purification catalyst of the present invention is preferably in the range of 0.2 to 2.0 μm. The reason is that if it is less than 0.2 μm, the hydrothermal durability is low and the catalytic activity cannot be maintained, and if it exceeds 2.0 μm, the handling properties such as coating and molding are reduced, More preferably, it is 0.2-1.0 micrometer.
本発明の窒素酸化物浄化触媒は、700℃、20時間、10容量%水蒸気雰囲気下、ガス流量/ゼオライト容量比100倍/分での水熱耐久処理後に、窒素酸化物浄化触媒で重要とされる低温活性、水熱耐久性を判断する指標である反応温度200℃でのNOx還元率が45%以上60%以下と優れた水熱耐久性を示す。 The nitrogen oxide purification catalyst of the present invention is important as a nitrogen oxide purification catalyst after hydrothermal durability treatment at 700 ° C. for 20 hours in a 10 vol% steam atmosphere at a gas flow rate / zeolite volume ratio of 100 times / min. The NOx reduction rate at a reaction temperature of 200 ° C., which is an index for judging low temperature activity and hydrothermal durability, is 45% to 60% and exhibits excellent hydrothermal durability.
従って、本発明の窒素酸化物浄化触媒は、安定して長時間にわたりNOxを処理することができる。熱耐久後のNOx還元率は高いほど好ましいが、60%程度が限界である。 Therefore, the nitrogen oxide purification catalyst of the present invention can stably treat NOx for a long time. The higher the NOx reduction rate after heat endurance, the better, but about 60% is the limit.
従来から窒素酸化物浄化触媒は水熱耐久処理後の性能で評価されることが一般的であるが、その水熱耐久処理としては、特に規格化されたものはない。上記の水熱耐久試験条件は窒素酸化物浄化触媒の水熱耐久処理条件として一般的に用いられる条件の範疇であり、特殊な条件ではない。 Conventionally, nitrogen oxide purifying catalysts are generally evaluated by the performance after hydrothermal durability treatment, but there is no standardized hydrothermal durability treatment. The above hydrothermal durability test conditions are a category of conditions generally used as hydrothermal durability treatment conditions for the nitrogen oxide purification catalyst, and are not special conditions.
なお、β型ゼオライトに限らず、ゼオライトは600℃以上における熱的なダメージは指数関数的に増大するため、700℃で20時間の水熱耐久処理は、650℃であれば100〜200時間以上、800℃であれば数時間の処理に相当するものである。 In addition, not only β-type zeolite, but the thermal damage at 600 ° C. or higher exponentially increases in zeolite, so the hydrothermal durability treatment at 700 ° C. for 20 hours is 100 to 200 hours or longer at 650 ° C. If it is 800 degreeC, it is equivalent to the process for several hours.
本発明の窒素酸化物浄化触媒は、シリカ、アルミナ及び粘土鉱物等のバインダーと混合し成形して使用することもできる。成形する際に用いられる粘土鉱物として、カオリン、アタパルジャイト、モンモリロナイト、ベントナイト、アロフェン、セピオライトが例示できる。 The nitrogen oxide purification catalyst of the present invention can be used after being mixed with a binder such as silica, alumina and clay mineral. Examples of clay minerals used for molding include kaolin, attapulgite, montmorillonite, bentonite, allophane, and sepiolite.
本発明の窒素酸化物浄化触媒は排ガス浄化用触媒として高い性能を有する。 The nitrogen oxide purification catalyst of the present invention has high performance as an exhaust gas purification catalyst.
本発明の窒素酸化物浄化触媒はシリカ骨格と一部骨格に含まれる鉄とアルミの相互作用を熱処理により高めることで、水熱処理後の特に低温で高いNOx分解性を発揮するものであり、窒素酸化物を含む排ガスと接触させることにより、高度に排ガス浄化することができる。 The nitrogen oxide purification catalyst of the present invention exhibits high NOx decomposability particularly at low temperatures after hydrothermal treatment by enhancing the interaction between iron and aluminum contained in the silica skeleton and part of the skeleton by heat treatment. The exhaust gas can be highly purified by contacting with exhaust gas containing oxide.
本発明で浄化される窒素酸化物は、例えば一酸化窒素、二酸化窒素、三酸化二窒素、四酸化二窒素、一酸化二窒素、及びそれらの混合物が例示される。好ましくは一酸化窒素、二酸化窒素、一酸化二窒素である。ここで本発明が処理可能な排ガスの窒素酸化物濃度は限定されるものではない。 Examples of nitrogen oxides purified by the present invention include nitric oxide, nitrogen dioxide, dinitrogen trioxide, dinitrogen tetroxide, dinitrogen monoxide, and mixtures thereof. Nitric oxide, nitrogen dioxide, and dinitrogen monoxide are preferred. Here, the nitrogen oxide concentration of the exhaust gas that can be treated by the present invention is not limited.
また排ガスには窒素酸化物以外の成分が含まれていてもよく、例えば炭化水素、一酸化炭素、二酸化炭素、水素、窒素、酸素、硫黄酸化物、水が含まれていても良い。具体的には、本発明の方法ではディーゼル自動車、ガソリン自動車、ボイラー、ガスタービン等の多種多様の排ガスから窒素酸化物を浄化することができる。 The exhaust gas may contain components other than nitrogen oxides, and may contain, for example, hydrocarbons, carbon monoxide, carbon dioxide, hydrogen, nitrogen, oxygen, sulfur oxides, and water. Specifically, the method of the present invention can purify nitrogen oxides from a wide variety of exhaust gases such as diesel vehicles, gasoline vehicles, boilers, gas turbines and the like.
本発明の窒素酸化物浄化触媒は、特に還元剤の存在下で窒素酸化物を浄化するSCR触媒として用いることにより窒素酸化物を浄化することができる。 The nitrogen oxide purification catalyst of the present invention can purify nitrogen oxide, particularly by using it as an SCR catalyst that purifies nitrogen oxide in the presence of a reducing agent.
還元剤としては排ガス中に含まれる炭化水素、一酸化炭素、水素等を還元剤として利用することができ、更には必要に応じて適当な還元剤を排ガスに添加して共存させても良い。排ガスに添加される還元剤は特に限定されないが、アンモニア、尿素、有機アミン類、炭化水素、アルコール類、ケトン類、一酸化炭素、水素等が挙げられ、特に窒素酸化物の浄化効率をより高めるためには、特にアンモニア、尿素、有機アミン類を用いることが好ましい。これらの還元剤により、窒素酸化物は無害な窒素に転化され、排ガスを処理することが可能となる。 As the reducing agent, hydrocarbons, carbon monoxide, hydrogen, and the like contained in the exhaust gas can be used as the reducing agent. Further, if necessary, an appropriate reducing agent may be added to the exhaust gas to coexist. The reducing agent added to the exhaust gas is not particularly limited, and examples thereof include ammonia, urea, organic amines, hydrocarbons, alcohols, ketones, carbon monoxide, hydrogen, and the like, particularly improving the purification efficiency of nitrogen oxides. For this purpose, it is particularly preferable to use ammonia, urea or organic amines. By these reducing agents, nitrogen oxides are converted into harmless nitrogen, and the exhaust gas can be treated.
これらの還元剤の添加方法は特に限定されず、還元成分をガス状で直接添加する方法、水溶液などの液状を噴霧し気化させる方法、噴霧熱分解させる方法等を採用することができる。またこれらの還元剤の添加量は、十分に窒素酸化物が浄化できるように任意に設定することができる。 The method of adding these reducing agents is not particularly limited, and a method of directly adding the reducing component in a gaseous state, a method of spraying and vaporizing a liquid such as an aqueous solution, a method of spraying pyrolysis, and the like can be employed. Moreover, the addition amount of these reducing agents can be arbitrarily set so that nitrogen oxides can be sufficiently purified.
本発明の窒素酸化物浄化触媒を用いた窒素酸化物の浄化方法は、本発明の窒素酸化物浄化触媒を用いれば特に限定はないが、例えば、本発明の窒素酸化物浄化触媒からなるSCR触媒と排ガスを接触させる際の空間速度を、体積基準で500〜50万hr−1、更に2000〜30万hr−1とすることが好ましい。 The nitrogen oxide purification method using the nitrogen oxide purification catalyst of the present invention is not particularly limited as long as the nitrogen oxide purification catalyst of the present invention is used. For example, an SCR catalyst comprising the nitrogen oxide purification catalyst of the present invention It is preferable that the space velocity at the time of contacting the exhaust gas with the exhaust gas is 500 to 500,000 hr −1 , more preferably 2000 to 300,000 hr −1 on a volume basis.
次に、本発明の窒素酸化物浄化触媒の製造方法について説明する。 Next, the manufacturing method of the nitrogen oxide purification catalyst of this invention is demonstrated.
本発明の窒素酸化物浄化触媒は、シリカ、アルミ、鉄、有機構造指向剤(SDA)を含む反応液から結晶化した合成物を水蒸気濃度5容量%以下の雰囲気、700〜850℃で焼成を行い、有機構造指向剤を除去することで製造することができる。 The nitrogen oxide purifying catalyst of the present invention is obtained by calcining a compound obtained by crystallization from a reaction solution containing silica, aluminum, iron, and an organic structure directing agent (SDA) at 700 to 850 ° C. in an atmosphere having a water vapor concentration of 5 vol% or less. And can be produced by removing the organic structure directing agent.
本発明の窒素酸化物浄化触媒は、得られるβ型鉄シリケートの組成がSiO2/Al2O3モル比で20〜70、かつSiO2/Fe2O3モル比で50〜200となる様な仕込み組成によって結晶化することによって製造することができる。この様な条件下での結晶化では、β型鉄シリケートの骨格構造中に、孤立鉄イオンとして高度に分散しており、なおかつ高対称四面体構造を有する孤立鉄イオンを導入することができる。鉄の量が多すぎると、フレッシュ焼成や耐久処理によって凝集が進み易く、孤立した対称四面体構造の孤立鉄イオンの導入が十分でなく、またβ型鉄シリケートの結晶性も低下し易い。 Nitrogen oxide purification catalyst of the present invention, like the composition of the obtained β-type ferrosilicate is SiO 2 / Al 2 O 3 20~70 molar ratio and 50 to 200 at a SiO 2 / Fe 2 O 3 molar ratio, It can be produced by crystallization with a suitable charge composition. In crystallization under such conditions, it is possible to introduce isolated iron ions that are highly dispersed as isolated iron ions in the skeleton structure of β-type iron silicate and that have a highly symmetric tetrahedral structure. If the amount of iron is too large, aggregation is likely to proceed due to fresh baking or durability treatment, and isolated iron ions having an isolated symmetric tetrahedral structure are not sufficiently introduced, and the crystallinity of β-type iron silicate is likely to deteriorate.
合成用原料はシリカ源、鉄源、アルミニウム源、SDA、アルカリ及び水から構成され、必要に応じてフッ素源が使用される。シリカ源としてはコロイダルシリカ、無定型シリカ、珪酸ナトリウム、テトラエチルオルトシリケート、アルミノシリケートゲルなどを用いることができる。鉄源としては硝酸鉄、塩化鉄、硫酸鉄、金属鉄などを用いることができる。これらの原料は、他の成分と十分均一に混合できるものが好ましい。 The raw material for synthesis is composed of a silica source, an iron source, an aluminum source, SDA, alkali and water, and a fluorine source is used as necessary. As the silica source, colloidal silica, amorphous silica, sodium silicate, tetraethylorthosilicate, aluminosilicate gel and the like can be used. As the iron source, iron nitrate, iron chloride, iron sulfate, metallic iron and the like can be used. These raw materials are preferably those that can be sufficiently uniformly mixed with other components.
SDAとしてはテトラエチルアンモニウムカチオンを有するテトラエチルアンモニウムヒドロキシド、テトラエチルアンモニウムブロマイド、テトラエチルアンモニウムフルオリド、更にはオクタメチレンビスキヌクリジウム、α,α’−ジキヌクリジウム−p−キシレン、α,α’−ジキヌクリジウム−m−キシレン、α,α’−ジキヌクリジウム−o−キシレン、1,4−ジアザビシクロ[2,2,2]オクタン、1,3,3,N,N−ペンタメチル−6−アゾニウムビシクロ[3,2,1]オクタン又はN,N−ジエチル−1,3,3−トリメチル−6−アゾニウムビシクロ[3,2,1]オクタンカチオンを含む化合物の群の少なくとも一種以上を使用することができる。 As SDA, tetraethylammonium hydroxide having tetraethylammonium cation, tetraethylammonium bromide, tetraethylammonium fluoride, octamethylenebiskinucridium, α, α′-diquinuclidium-p-xylene, α, α′-diquinuclidium-m -Xylene, α, α'-diquinuclidium-o-xylene, 1,4-diazabicyclo [2,2,2] octane, 1,3,3, N, N-pentamethyl-6-azonium bicyclo [3,2, 1] At least one of a group of compounds containing octane or N, N-diethyl-1,3,3-trimethyl-6-azonium bicyclo [3,2,1] octane cation can be used.
アルカリ源としては水酸化ナトリウム、硫酸ナトリウム、塩化ナトリウム、酢酸ナトリウム、水酸化カリウム、硫酸カリウム、塩化カリウム、酢酸カリウム、水酸化ルビジウム、硫酸ルビジウム、塩化ルビジウム、酢酸ルビジウム、水酸化セシウム、硫酸セシウム、塩化セシウム、酢酸セシウムなどを用いることができる。 Examples of alkali sources include sodium hydroxide, sodium sulfate, sodium chloride, sodium acetate, potassium hydroxide, potassium sulfate, potassium chloride, potassium acetate, rubidium hydroxide, rubidium sulfate, rubidium chloride, rubidium acetate, cesium hydroxide, cesium sulfate, Cesium chloride, cesium acetate, and the like can be used.
アルミニウム源としては硫酸アルミニウム、アルミン酸ナトリウム、水酸化アルミニウム、硝酸アルミニウム、アルミノシリケートゲル、金属アルミニウムなどを用いることができる。 As the aluminum source, aluminum sulfate, sodium aluminate, aluminum hydroxide, aluminum nitrate, aluminosilicate gel, metallic aluminum, or the like can be used.
フッ素源としてはフッ酸、フッ化ナトリウム、フッ化カリウム、フッ化アンモニウム、テトラエチルアンモニウムフルオリドなどを用いることができる。 As the fluorine source, hydrofluoric acid, sodium fluoride, potassium fluoride, ammonium fluoride, tetraethylammonium fluoride, or the like can be used.
これらの原料は他の成分と均一に混合し易いものが望ましい。 These raw materials are preferably easy to mix uniformly with other components.
原料混合物の仕込み組成は下記の組成範囲が例示される。但しこれらの組成範囲は限定的なものではなく、最終的な生成物組成が本発明の窒素酸化物浄化触媒のβ型鉄シリケートの組成の範囲内となるように任意に設定することができる。また、種晶などの結晶化促進作用を有する成分を添加してもよく、大きな結晶粒子径が得られる条件が好ましい。 The following composition range is illustrated as a preparation composition of a raw material mixture. However, these composition ranges are not limited, and can be arbitrarily set so that the final product composition falls within the composition range of the β-type iron silicate of the nitrogen oxide purification catalyst of the present invention. In addition, a component having a crystallization promoting action such as a seed crystal may be added, and conditions under which a large crystal particle diameter can be obtained are preferable.
SiO2/Al2O3モル比 20〜70、好ましくは30〜60、更に好ましくは30〜50
SiO2/Fe2O3モル比 50〜200、好ましくは100〜200
H2O/SiO2モル比 5〜50、好ましくは5〜10
SDA/SiO2モル比 0.1〜5、好ましくは0.1〜1
アルカリ/SiO2モル比0〜0.1
F/SiO2モル比 0〜5、好ましくは0〜1
SiO 2 / Al 2 O 3 molar ratio from 20 to 70, preferably 30 to 60, more preferably 30 to 50
SiO 2 / Fe 2 O 3 molar ratio 50-200, preferably 100-200
H 2 O / SiO 2 molar ratio 5-50, preferably 5-10
SDA / SiO 2 molar ratio of 0.1 to 5, preferably 0.1 to 1
Alkali / SiO 2 molar ratio of 0 to 0.1
F / SiO 2 molar ratio 0-5, preferably 0-1
水、シリカ源、鉄源、アルミニウム源、SDA、アルカリ源、必要に応じてフッ素源の原料混合物を密閉式圧力容器中で、100〜180℃の温度で、結晶化させる。結晶化の際、原料混合物は混合攪拌された状態でも静置した状態でもよい。結晶化終了後、十分放冷し、固液分離、十分量の純水で洗浄し、110〜150℃の温度で乾燥した後に、細孔内のSDAを焼却除去することによって本発明のβ型鉄シリケートを得ることができる。 A raw material mixture of water, silica source, iron source, aluminum source, SDA, alkali source and, if necessary, a fluorine source is crystallized in a sealed pressure vessel at a temperature of 100 to 180 ° C. At the time of crystallization, the raw material mixture may be mixed and stirred or left standing. After completion of crystallization, the product is allowed to cool sufficiently, separated into solid and liquid, washed with a sufficient amount of pure water, dried at a temperature of 110 to 150 ° C., and then the SDA in the pores is removed by incineration. Iron silicate can be obtained.
通常、β型鉄シリケート細孔内のSDAの熱処理除去は、シリケート結晶の熱劣化抑制の観点からできるだけ低温で行なうほうが良いと考えられており、大気雰囲気中での550〜650℃での焼成処理、酸性溶液又はSDAを分解する成分を含んだ薬液を用いた液相処理、レジンなどを用いた交換処理が行なわれていた。 In general, it is considered that the heat treatment and removal of SDA in the pores of β-type iron silicate should be performed at a temperature as low as possible from the viewpoint of suppressing thermal deterioration of the silicate crystal, and a baking process at 550 to 650 ° C. in an air atmosphere. In addition, a liquid phase treatment using a chemical solution containing an acidic solution or a component that decomposes SDA, and an exchange treatment using a resin or the like have been performed.
本発明の窒素酸化物浄化触媒は、従来には行なわれない700〜850℃の高温域でSDAの除去のための熱処理を行なうことにより、シリカ骨格と骨格中の一部の鉄とアルミの相互作用が強くなり、水熱耐久処理後の低温触媒活性が向上するものである。 The nitrogen oxide purification catalyst of the present invention performs a heat treatment for removing SDA at a high temperature range of 700 to 850 ° C., which is not conventionally performed, so that the silica skeleton and a part of iron and aluminum in the skeleton are mutually bonded. The action becomes stronger and the low-temperature catalytic activity after hydrothermal durability treatment is improved.
本発明の窒素酸化物浄化触媒の製造におけるSDA除去目的の熱処理時の水蒸気濃度は、5容量%以下で行なうことを必須とする。特に1容量%以下で行なうことが、水蒸気による骨格からの脱アルミと脱鉄、および鉄の凝集、不活性化を抑制するために好ましい。5容量%を超える水蒸気濃度では、骨格シリカと骨格中の一部の鉄とアルミの相互作用による性能向上は生じず、逆に鉄の凝集が促進され、水熱処理後の耐久活性は低下する。 It is essential that the water vapor concentration during the heat treatment for the purpose of removing SDA in the production of the nitrogen oxide purification catalyst of the present invention is 5% by volume or less. In particular, it is preferable to perform the treatment at 1% by volume or less in order to suppress dealumination and iron removal from the skeleton by water vapor, and aggregation and inactivation of iron. When the water vapor concentration exceeds 5% by volume, the performance is not improved by the interaction between the skeleton silica and a part of the iron in the skeleton and the aluminum, and conversely, iron aggregation is promoted and the durability activity after the hydrothermal treatment is lowered.
本発明の窒素酸化物浄化触媒の製造における熱処理温度は700〜850℃で行なうことを必須とする。特に800〜850℃で行なうことが好ましい。700℃未満では骨格シリカと骨格中の一部の鉄とアルミとの相互作用の促進が十分に進まず、本発明の触媒活性を得ることができず、一方で850℃を超えるとβ型結晶性鉄シリケートの結晶崩壊が著しく進行し、触媒活性が低下する。 It is essential that the heat treatment temperature in the production of the nitrogen oxide purification catalyst of the present invention is 700 to 850 ° C. It is particularly preferable to carry out at 800 to 850 ° C. If the temperature is lower than 700 ° C., the interaction between the skeleton silica and a part of iron in the skeleton and aluminum is not sufficiently promoted, and the catalytic activity of the present invention cannot be obtained. The crystal disintegration of the ferrous iron silicate proceeds remarkably and the catalytic activity decreases.
熱処理時間は特に限定されるものではないが、熱処理時間が短すぎると鉄とβ型ゼオライトのシリカ骨格との相互作用が十分に進行しないため、1時間以上保持することが好ましい。 The heat treatment time is not particularly limited, but if the heat treatment time is too short, the interaction between iron and the silica skeleton of the β-type zeolite does not proceed sufficiently, and it is preferable to hold for 1 hour or longer.
本発明の窒素酸化物浄化触媒のβ型鉄シリケートの電子顕微鏡(SEM)で観測される結晶粒子径(平均結晶粒子)は耐熱水性、コーティング、成型等におけるハンドリングの容易さから0.2〜2.0μmであり、0.2〜1.0μmであることが好ましい。 The crystal particle diameter (average crystal particle) observed with an electron microscope (SEM) of β-type iron silicate of the nitrogen oxide purifying catalyst of the present invention is 0.2 to 2 due to hot water resistance, ease of handling in coating, molding and the like. 0.0 μm, preferably 0.2 to 1.0 μm.
本発明の窒素酸化物浄化触媒のβ型鉄シリケート中には活性な孤立鉄イオンが含まれているため、そのまま窒素酸化物の浄化触媒として用いることができるが、さらに触媒活性な金属種を担持させて用いてもよい。 Since the β-type iron silicate of the nitrogen oxide purification catalyst of the present invention contains active isolated iron ions, it can be used as it is as a nitrogen oxide purification catalyst, but further supports a catalytically active metal species. May be used.
担持させる金属種は特に限定されないが、例えば8、9、10族、11族の元素、特に鉄、コバルト、パラジウム、イリジウム、白金、銅、銀、金の群から選ばれる一種以上である。特に、鉄、パラジウム、白金、銅、銀の一種以上であることが好ましい。また希土類金属、チタン、ジルコニアなどの助触媒成分を付加的に加えることもできる。
The metal species to be supported is not particularly limited, but is, for example, at least one selected from the group consisting of elements of
触媒活性な金属種を担持させる場合の担持方法は特に限定されない。担持方法として、イオン交換法、含浸担持法、蒸発乾固法、沈殿担持法、物理混合法等の方法が採用することができる。金属担持に用いる原料としては硝酸塩、硫酸塩、酢酸塩、塩化物、錯塩、酸化物、複合酸化物などがいずれも使用できる。金属の担持量は限定されないが、特に0.1〜10重量%の範囲が好ましい。 There are no particular limitations on the loading method when loading a catalytically active metal species. As the loading method, methods such as an ion exchange method, an impregnation loading method, an evaporation to dryness method, a precipitation loading method, and a physical mixing method can be employed. Nitrate, sulfate, acetate, chloride, complex salt, oxide, composite oxide and the like can be used as raw materials for metal loading. The amount of metal supported is not limited, but a range of 0.1 to 10% by weight is particularly preferable.
本発明の窒素酸化物浄化触媒のβ型鉄シリケートは、シリカ、アルミナ及び粘土鉱物等のバインダーと混合し成形して使用することもできる。成形する際に用いられる粘土鉱物として、カオリン、アタパルガイト、モンモリロナイト、ベントナイト、アロフェン、セピオライトが例示できる。また、コージェライト製或いは金属製のハニカム基材にウォッシュコートして使用することもできる。 The β-type iron silicate of the nitrogen oxide purification catalyst of the present invention can be used by mixing with a binder such as silica, alumina and clay mineral. Examples of clay minerals used for molding include kaolin, attapulgite, montmorillonite, bentonite, allophane, and sepiolite. Moreover, it can also be used by wash-coating on a cordierite or metal honeycomb substrate.
本発明のβ型鉄シリケートは、工業的使用が困難なフッ素を使用することなく合成され、高い結晶性を有しなおかつ結晶格子中にFeを含有し、2.0μm以下の微細な結晶粒径において高い耐熱性を有する。 The β-type iron silicate of the present invention is synthesized without using fluorine, which is difficult to use industrially, has high crystallinity, contains Fe in the crystal lattice, and has a fine crystal grain size of 2.0 μm or less. Has high heat resistance.
また、本発明の窒素酸化物浄化触媒は窒素酸化物の浄化性能が高く、幅広い温度域、特に200℃以下の低温において効率的に窒素酸化物を浄化することができる。また耐久性に優れ、耐久処理後も高い触媒活性を有する。 The nitrogen oxide purification catalyst of the present invention has high nitrogen oxide purification performance, and can efficiently purify nitrogen oxide in a wide temperature range, particularly at a low temperature of 200 ° C. or lower. Moreover, it is excellent in durability and has high catalytic activity even after durability treatment.
以下、本発明を実施例で説明するが、本発明はこれらの実施例に限定されるものではない。 EXAMPLES Hereinafter, although an Example demonstrates this invention, this invention is not limited to these Examples.
以下の実施例1〜11及び比較例1〜3は本発明の請求項1〜5のβ型鉄シリケートに関するものである。 Examples 1 to 11 and Comparative Examples 1 to 3 below relate to β-type iron silicates according to claims 1 to 5 of the present invention.
実施例1
3号珪酸ソーダ(SiO2;30%、Na2O;9.1%、Al2O3;0.01%)、98%硫酸、水、硫酸アルミニウム水溶液及び硝酸鉄九水和物の所定量を混合し、生成したゲルを固液分離し、純水により洗浄した。洗浄後のゲルに所定量の水、35%TEAOH、水酸化セシウム一水和物及び種晶を加えて十分に撹拌混合した。反応混合物の組成比はSiO2:0.015Fe2O3:0.026Al2O3:0.049Cs2O:0.15TEAOH:10H2Oであった。この反応混合物をステンレス製オートクレーブに密閉し、回転条件下150℃で48時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は分析の定量限界100ppmを下回り検出限界以下であった。
Example 1
No. 3 sodium silicate (SiO 2 ; 30%, Na 2 O; 9.1%, Al 2 O 3 ; 0.01%), 98% sulfuric acid, water, aluminum sulfate aqueous solution and iron nitrate nonahydrate And the produced gel was separated into solid and liquid and washed with pure water. A predetermined amount of water, 35% TEAOH, cesium hydroxide monohydrate and seed crystals were added to the washed gel, and the mixture was sufficiently stirred and mixed. The composition ratio of the reaction mixture SiO 2: 0.015Fe 2 O 3: 0.026Al 2 O 3: 0.049Cs 2 O: 0.15TEAOH: was 10H 2 O. The reaction mixture was sealed in a stainless steel autoclave and heated at 150 ° C. for 48 hours under a rotating condition to crystallize β-type iron silicate. The slurry-like mixture after crystallization was white, and the F content of the crystals was below the quantitative limit of analysis of 100 ppm and below the detection limit.
実施例2
実施例1と同様の方法により反応混合物を調製した。反応混合物の組成比はSiO2:0.012Fe2O3:0.025Al2O3:0.015Cs2O:0.15TEAOH:10H2Oであった。この反応混合物をステンレス製オートクレーブに密閉し、回転条件下150℃で48時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は検出限界以下であった。
Example 2
A reaction mixture was prepared in the same manner as in Example 1. The composition ratio of the reaction mixture was SiO 2 : 0.012Fe 2 O 3 : 0.025Al 2 O 3 : 0.015Cs 2 O: 0.15TEAOH: 10H 2 O. The reaction mixture was sealed in a stainless steel autoclave and heated at 150 ° C. for 48 hours under a rotating condition to crystallize β-type iron silicate. The slurry mixture after crystallization was white, and the F content of the crystals was below the detection limit.
実施例3
水酸化セシウム一水和物の代わりに48%水酸化カリウム水溶液を用いた以外は実施例1と同様の方法により反応混合物を調製した。反応混合物の組成比はSiO2:0.010Fe2O3:0.012Al2O3:0.030K2O:0.14TEAOH:10H2Oであった。この反応混合物をステンレス製オートクレーブに密閉し、回転条件下150℃で48時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は検出限界以下であった。
Example 3
A reaction mixture was prepared in the same manner as in Example 1 except that 48% potassium hydroxide aqueous solution was used instead of cesium hydroxide monohydrate. The composition ratio of the reaction mixture was SiO 2 : 0.010Fe 2 O 3 : 0.012Al 2 O 3 : 0.030K 2 O: 0.14TEAOH: 10H 2 O. The reaction mixture was sealed in a stainless steel autoclave and heated at 150 ° C. for 48 hours under a rotating condition to crystallize β-type iron silicate. The slurry mixture after crystallization was white, and the F content of the crystals was below the detection limit.
実施例4
実施例3と同様の方法により反応混合物を調製した。反応混合物の組成比はSiO2:0.0062Fe2O3:0.019Al2O3:0.021K2O:0.15TEAOH:10H2Oであった。この反応混合物をステンレス製オートクレーブに密閉し、回転条件下150℃で90時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は検出限界以下であった。
Example 4
A reaction mixture was prepared in the same manner as in Example 3. The composition ratio of the reaction mixture was SiO 2 : 0.0062Fe 2 O 3 : 0.019Al 2 O 3 : 0.021K 2 O: 0.15TEAOH: 10H 2 O. The reaction mixture was sealed in a stainless steel autoclave and heated at 150 ° C. for 90 hours under a rotating condition to crystallize β-type iron silicate. The slurry mixture after crystallization was white, and the F content of the crystals was below the detection limit.
実施例5
実施例3と同様の方法により反応混合物を調製した。反応混合物の組成比はSiO2:0.0067Fe2O3:0.028Al2O3:0.031K2O:0.15TEAOH:10H2Oであった。この反応混合物をステンレス製オートクレーブに密閉し、回転条件下150℃で48時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は検出限界以下であった。
Example 5
A reaction mixture was prepared in the same manner as in Example 3. The composition ratio of the reaction mixture was SiO 2 : 0.0067Fe 2 O 3 : 0.028Al 2 O 3 : 0.031K 2 O: 0.15TEAOH: 10H 2 O. The reaction mixture was sealed in a stainless steel autoclave and heated at 150 ° C. for 48 hours under a rotating condition to crystallize β-type iron silicate. The slurry mixture after crystallization was white, and the F content of the crystals was below the detection limit.
実施例6
水酸化セシウム一水和物の代わりに水酸化ルビジウムn水和物を用いた以外は実施例1と同様の方法により反応混合物を調製した。反応混合物の組成比はSiO2:0.0069Fe2O3:0.034Al2O3:0.030Rb2O:0.15TEAOH:10H2Oであった。この反応混合物をステンレス製オートクレーブに密閉し、回転条件下150℃で48時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は検出限界以下であった。
Example 6
A reaction mixture was prepared in the same manner as in Example 1 except that rubidium hydroxide n-hydrate was used instead of cesium hydroxide monohydrate. The composition ratio of the reaction mixture was SiO 2 : 0.0069Fe 2 O 3 : 0.034Al 2 O 3 : 0.030Rb 2 O: 0.15TEAOH: 10H 2 O. The reaction mixture was sealed in a stainless steel autoclave and heated at 150 ° C. for 48 hours under a rotating condition to crystallize β-type iron silicate. The slurry mixture after crystallization was white, and the F content of the crystals was below the detection limit.
比較例1
水酸化セシウム一水和物の代わりに48%水酸化ナトリウム水溶液を用いた以外は実施例1と同様の方法により反応混合物を調製した。反応混合物の組成比はSiO2:0.015Fe2O3:0.026Al2O3:0.049Na2O:0.15TEAOH:10H2Oであった。この反応混合物をステンレス製オートクレーブに密閉し、回転条件下150℃で48時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は検出限界以下であった。
Comparative Example 1
A reaction mixture was prepared in the same manner as in Example 1 except that 48% aqueous sodium hydroxide solution was used instead of cesium hydroxide monohydrate. The composition ratio of the reaction mixture was SiO 2 : 0.015Fe 2 O 3 : 0.026Al 2 O 3 : 0.049Na 2 O: 0.15TEAOH: 10H 2 O. The reaction mixture was sealed in a stainless steel autoclave and heated at 150 ° C. for 48 hours under a rotating condition to crystallize β-type iron silicate. The slurry mixture after crystallization was white, and the F content of the crystals was below the detection limit.
比較例2
TEAOHに硝酸鉄九水和物を溶解させた後、これにアルミン酸ナトリウム及び純水を加え、強撹拌下においてシリカゾル(SiO2;40%、Na2O;0.5%、Al2O3;0.00%)及び種晶を添加した。反応混合物の組成比はSiO2:0.0058Fe2O3:0.038Al2O3:0.077Na2O:0.12TEAOH:7.7H2Oであった。生成したゲルを30分間継続して撹拌した後、この反応混合物をステンレス製オートクレーブに密閉し、回転条件下160℃で48時間加熱してβ型鉄シリケートを結晶化した。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は検出限界以下であった。
Comparative Example 2
After iron nitrate nonahydrate is dissolved in TEAOH, sodium aluminate and pure water are added thereto, and silica sol (SiO 2 ; 40%, Na 2 O; 0.5%, Al 2 O 3 is added under strong stirring. 0.00%) and seed crystals were added. The composition ratio of the reaction mixture was SiO 2 : 0.0058Fe 2 O 3 : 0.038Al 2 O 3 : 0.077Na 2 O: 0.12TEAOH: 7.7H 2 O. The resulting gel was continuously stirred for 30 minutes, and then the reaction mixture was sealed in a stainless steel autoclave and heated at 160 ° C. for 48 hours under a rotating condition to crystallize β-type iron silicate. The slurry mixture after crystallization was white, and the F content of the crystals was below the detection limit.
比較例3
TEAOHに硝酸鉄九水和物を溶解し、テトラエチルオルトシリケートを加え、十分に撹拌混合し室温にて加水分解を行い、生成したエタノールを蒸発させた。続いて必要量の水を蒸発させた。これに48%フッ酸を加え、乳鉢にて混合した後、この反応混合物をステンレス製オートクレーブに充填し、150℃で240時間加熱して結晶化した。反応混合物の組成はSiO2:0.016Fe2O3:0.50HF:0.61TEAOH:7.5H2Oであった。結晶化後のスラリー状混合物は白色であり、結晶のF含有率は14000ppmであった。これを空気流通下、600℃で2時間焼成し、SDAを除去した後の結晶のF含有率は430ppmであった。
Comparative Example 3
Iron nitrate nonahydrate was dissolved in TEAOH, tetraethylorthosilicate was added, and the mixture was thoroughly stirred and mixed to perform hydrolysis at room temperature to evaporate the produced ethanol. Subsequently, the required amount of water was evaporated. 48% hydrofluoric acid was added thereto and mixed in a mortar, and then the reaction mixture was filled in a stainless steel autoclave and heated at 150 ° C. for 240 hours for crystallization. The composition of the reaction mixture was SiO 2 : 0.016Fe 2 O 3 : 0.50HF: 0.61TEAOH: 7.5H 2 O. The slurry mixture after crystallization was white, and the F content of the crystals was 14000 ppm. This was calcined at 600 ° C. for 2 hours under air flow, and the F content of the crystals after removing SDA was 430 ppm.
実施例7
実施例1〜6及び比較例1〜2で合成したβ型鉄シリケートの結晶組成を誘導結合プラズマ発光分析法により分析した。以下の表3に結果を示す。
Example 7
The crystal compositions of β-type iron silicates synthesized in Examples 1 to 6 and Comparative Examples 1 and 2 were analyzed by inductively coupled plasma emission spectrometry. The results are shown in Table 3 below.
実施例8
実施例1〜6及び比較例1〜2で合成したβ型鉄シリケートのX線回折測定を行った。
Example 8
X-ray diffraction measurement of the β-type iron silicate synthesized in Examples 1 to 6 and Comparative Examples 1 and 2 was performed.
X線回折測定の条件を以下に示す。 The conditions for the X-ray diffraction measurement are shown below.
ターゲット:Cu
加速電圧:40KV
電流:30mA
ステップ幅:0.02°
サンプリング時間:1秒
発散スリット:1°
散乱防止スリット:1°
受光スリット:0.3mm
結果を表4に示す。実施例の半値幅は0.16〜0.24°の範囲であった。
Target: Cu
Accelerating voltage: 40KV
Current: 30mA
Step width: 0.02 °
Sampling time: 1 second Divergence slit: 1 °
Anti-scattering slit: 1 °
Receiving slit: 0.3mm
The results are shown in Table 4. The full width at half maximum of the example was in the range of 0.16 to 0.24 °.
実施例9
実施例1及び比較例1で合成したβ型鉄シリケートの耐熱水性評価を実施した。評価ではSDAを焼成除去した試料(フレッシュ)を用い、ペレット成型後、破砕して評価に供した。固定床流通式反応管に試料を充填し、10容量%のH2Oの流通下において、所定の温度で5時間の耐久処理を行った。フレッシュの試料及び耐久処理を行った試料について、通常用いられるCu−Kα線源を用いる粉末X線結晶回折により、2θ=22.3°の回折ピーク高さから試料の結晶化度を測定した。
Example 9
The hot water resistance of the β-type iron silicate synthesized in Example 1 and Comparative Example 1 was evaluated. In the evaluation, a sample (fresh) from which SDA was burned and removed was used, and after pellet molding, the sample was crushed and subjected to evaluation. A sample was filled into a fixed bed flow type reaction tube, and a durability treatment was performed at a predetermined temperature for 5 hours under a flow of 10% by volume of H 2 O. With respect to a fresh sample and a sample subjected to endurance treatment, the crystallinity of the sample was measured from the diffraction peak height of 2θ = 22.3 ° by powder X-ray crystal diffraction using a commonly used Cu—Kα ray source.
その結果を以下の表5に示す。 The results are shown in Table 5 below.
以上のように、本発明のβ型鉄シリケートはいずれの処理条件においても比較例に対して高い耐熱水性を示した。 As described above, the β-type iron silicate of the present invention showed high hot water resistance compared to the comparative example under any treatment conditions.
実施例10
実施例1〜6及び比較例1〜3で合成したβ型鉄シリケートをSEMにより、倍率15000倍で観察して得られたβ型鉄シリケートの平均結晶粒径を以下の表6に示す。
Example 10
Table 6 below shows the average crystal grain sizes of β-type iron silicates obtained by observing the β-type iron silicates synthesized in Examples 1 to 6 and Comparative Examples 1 to 3 with a SEM at a magnification of 15000 times.
実施例11
実施例1で合成したβ型鉄シリケートについて電子スピン共鳴測定を実施し、骨格に存在するFeの確認を行った。
Example 11
Electron spin resonance measurement was performed on the β-type iron silicate synthesized in Example 1, and Fe present in the skeleton was confirmed.
電子スピン共鳴測定の条件を以下に示す。 The conditions for electron spin resonance measurement are shown below.
測定温度:77K
マイクロ波出力:1.0mW
観測範囲:0〜1000mT
変調幅:0.32mT
時定数:0.3sec
試料量:約10mg
Measurement temperature: 77K
Microwave output: 1.0 mW
Observation range: 0 to 1000 mT
Modulation width: 0.32 mT
Time constant: 0.3 sec
Sample amount: about 10mg
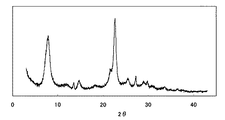
測定により得られたスペクトルを図1に示す。 The spectrum obtained by the measurement is shown in FIG.
g≒2.0の大きな共鳴吸収が観測されており、シリケート骨格に存在する高対称な四面体構造を有するFeの存在が確認された。 A large resonance absorption of g≈2.0 was observed, confirming the presence of Fe having a highly symmetric tetrahedral structure present in the silicate skeleton.
以下の実施例12〜14及び比較例4〜6は本発明の請求項6〜9の別のβ型鉄シリケートから成る窒素酸化物浄化触媒に関するものである。 The following Examples 12 to 14 and Comparative Examples 4 to 6 relate to a nitrogen oxide purification catalyst comprising another β-type iron silicate according to claims 6 to 9 of the present invention.
(X線による半値幅(FWHM)の測定)
通常用いられるCu−Kα線源を用いる粉末X線結晶回折により、2θ=22.6°付近に現れるメインピークを使用して半値幅(FWHM)を求めた。X線回折測定条件は実施例8に記載の条件と同様である。
(Measurement of full width at half maximum (FWHM) by X-ray)
The full width at half maximum (FWHM) was determined using the main peak appearing in the vicinity of 2θ = 22.6 ° by powder X-ray crystal diffraction using a commonly used Cu—Kα radiation source. The X-ray diffraction measurement conditions are the same as those described in Example 8.
(水熱耐久処理条件)
窒素酸化物浄化触媒を以下の条件で処理した。
(Hydrothermal durability treatment conditions)
The nitrogen oxide purification catalyst was treated under the following conditions.
温度 :700℃
時間 :20時間
ガス中水分濃度 :10容量%
ガス流量/ゼオライト容量比 :100倍/分
Temperature: 700 ° C
Time: 20 hours Gas concentration in gas: 10% by volume
Gas flow rate / zeolite volume ratio: 100 times / min
(NOx還元率の測定)
NOx還元率は、以下の条件のガスを所定の温度で接触させた場合の窒素酸化物の還元率とした。窒素酸化物浄化触媒は、還元分解するNOガスと還元剤のアンモニアを1:1で含有するガスを用いて評価することが一般的である。本発明で用いたNOx還元条件は、通常の窒素酸化物浄化触媒のNOx還元性を評価する一般的な条件の範疇に入るものであり、特殊な条件ではない。
(Measurement of NOx reduction rate)
The NOx reduction rate was defined as the nitrogen oxide reduction rate when a gas having the following conditions was brought into contact at a predetermined temperature. The nitrogen oxide purification catalyst is generally evaluated by using a gas containing NO gas for reductive decomposition and ammonia as a reducing agent in a ratio of 1: 1. The NOx reduction conditions used in the present invention fall within the category of general conditions for evaluating the NOx reduction properties of ordinary nitrogen oxide purification catalysts, and are not special conditions.
本発明の評価で採用した窒素還元条件:
処理ガス組成 NO 200ppm
NH3 200ppm
O2 10容量%
H2O 3容量%
残り N2バランス
処理ガス流量 1.5リットル/分
処理ガス/触媒容量比 1000/分
Nitrogen reduction conditions employed in the evaluation of the present invention:
Process gas composition NO 200ppm
NH 3 200ppm
H 2 O 3% by volume
Remaining N 2 balance Process gas flow rate 1.5 l / min Process gas /
実施例12
珪酸ソーダ水溶液、硫酸アルミニウム水溶液、硝酸第二鉄水溶液、硫酸を用い、スラリー状生成物の組成が、SiO2:0.027Al2O3:0.007Fe2O3となるように攪拌下で反応させ、スラリー状生成物とし、脱水した後、洗浄して粒状無定形珪酸塩とした。
Example 12
Using a sodium silicate aqueous solution, an aluminum sulfate aqueous solution, a ferric nitrate aqueous solution, and sulfuric acid, the reaction is performed with stirring so that the composition of the slurry product is SiO 2 : 0.027Al 2 O 3 : 0.007Fe 2 O 3 The slurry was made into a slurry product, dehydrated, and washed to give a granular amorphous silicate.
次に反応混合物の組成が、SiO2:0.027Al2O3:0.007Fe2O3:0.060KOH:0.15TEAOH:10H2Oとなるように混合し、さらに当該組成物100部に対して1部の種晶(東ソー製HSZ940NHA)を加え、オートクレーブ中、150℃で60時間水熱合成により結晶化した(TEAOH:水酸化テトラエチルアンモニウム35%水溶液)。 Next, the reaction mixture was mixed so that the composition of SiO 2 : 0.027Al 2 O 3 : 0.007Fe 2 O 3 : 0.060KOH: 0.15TEAOH: 10H 2 O was further added to 100 parts of the composition. On the other hand, 1 part of seed crystals (Tosoh HSZ940NHA) was added and crystallized by hydrothermal synthesis at 150 ° C. for 60 hours in an autoclave (TEAOH: 35% aqueous solution of tetraethylammonium hydroxide).
結晶化後のスラリーは固液分離し、十分量の純水で洗浄し、110℃で乾燥した。その乾燥粉末を水蒸気濃度0.05容量%の乾燥空気流通下、800℃で2時間焼成して触媒1を得た。 The slurry after crystallization was solid-liquid separated, washed with a sufficient amount of pure water, and dried at 110 ° C. The dried powder was calcined at 800 ° C. for 2 hours under a flow of dry air having a water vapor concentration of 0.05 vol% to obtain Catalyst 1.
触媒1の組成はICP発光分析の結果SiO2/Al2O3モル比は35、SiO2/Fe2O3モル比は144であり、平均結晶粒子径は0.28μmであった。X線結晶回折(302)面の半値幅(FWHM)は0.36°であり、700℃、20時間、10容量%水蒸気雰囲気下の水熱耐久処理後におけるNOx還元率は反応温度200℃で50%であった。また、耐久処理前のNOx還元率は反応温度200℃で50%であった。 As a result of ICP emission analysis, the composition of catalyst 1 was a SiO 2 / Al 2 O 3 molar ratio of 35, a SiO 2 / Fe 2 O 3 molar ratio of 144, and an average crystal particle diameter of 0.28 μm. The full width at half maximum (FWHM) of the X-ray crystal diffraction (302) plane is 0.36 °, and the NOx reduction rate after hydrothermal endurance treatment in a 10 vol% steam atmosphere at 700 ° C. for 20 hours is a reaction temperature of 200 ° C. 50%. Further, the NOx reduction rate before the durability treatment was 50% at a reaction temperature of 200 ° C.
図2に触媒1のX線回折チャート図を示す。そのピークパターンはβ型ゼオライトのパターンと一致し、触媒1はβ型結晶構造を有する事が明らかである。 FIG. 2 shows an X-ray diffraction chart of the catalyst 1. The peak pattern coincides with the pattern of β-type zeolite, and it is clear that catalyst 1 has a β-type crystal structure.
実施例13
珪酸ソーダ水溶液、硫酸アルミニウム水溶液、硝酸第二鉄水溶液、硫酸を用い、スラリー状生成物の組成をSiO2:0.035Al2O3:0.007Fe2O3とし、反応混合物の組成をSiO2:0.035Al2O3:0.007Fe2O3:0.060KOH:0.15TEAOH:10H2Oとなるように混合し、該組成物100部に対して0.5部の種晶(東ソー製HSZ940NHA)を加えた以外は実施例12と同様にして触媒2を得た。
Example 13
Using a sodium silicate aqueous solution, an aluminum sulfate aqueous solution, a ferric nitrate aqueous solution, and sulfuric acid, the composition of the slurry product is SiO 2 : 0.035Al 2 O 3 : 0.007Fe 2 O 3 and the composition of the reaction mixture is SiO 2. : 0.035Al 2 O 3 : 0.007Fe 2 O 3 : 0.060KOH: 0.15TEAOH: 10H 2 O and mixed to 100 parts of the composition, 0.5 parts of seed crystals (Tosoh Corporation) Catalyst 2 was obtained in the same manner as in Example 12 except that HSZ940NHA) was added.
触媒2の組成はICP発光分析の結果SiO2/Al2O3モル比は26、SiO2/Fe2O3モル比は138であり、平均結晶粒子径は0.26μmであった。X線結晶回折(302)面の半値幅(FWHM)は0.34°であり、700℃、20時間、10容量%水蒸気雰囲気下の水熱耐久処理後におけるNOx還元率は反応温度200℃で47%であった。また、耐久処理前のNOx還元率は反応温度200℃で47%であった。 As a result of ICP emission analysis, the composition of the catalyst 2 was a SiO 2 / Al 2 O 3 molar ratio of 26, a SiO 2 / Fe 2 O 3 molar ratio of 138, and an average crystal particle diameter of 0.26 μm. The full width at half maximum (FWHM) of the X-ray crystal diffraction (302) plane is 0.34 °, and the NOx reduction rate after hydrothermal endurance treatment in a 10 vol% steam atmosphere at 700 ° C. for 20 hours is a reaction temperature of 200 ° C. It was 47%. Further, the NOx reduction rate before the durability treatment was 47% at a reaction temperature of 200 ° C.
実施例14
珪酸ソーダ水溶液、硫酸アルミニウム水溶液、硝酸第二鉄水溶液、硫酸を用い、スラリー状生成物の組成をSiO2:0.026Al2O3:0.015Fe2O3とし、反応混合物の組成をSiO2:0.026Al2O3:0.015Fe2O3:0.100KOH:0.15TEAOH:10H2Oとなるように混合し、該組成物100部に対して0.5部の種晶(東ソー製HSZ940NHA)を加えた以外は実施例12と同様にして触媒3を得た。
Example 14
Using a sodium silicate aqueous solution, an aluminum sulfate aqueous solution, a ferric nitrate aqueous solution, and sulfuric acid, the composition of the slurry product is SiO 2 : 0.026Al 2 O 3 : 0.015Fe 2 O 3 and the composition of the reaction mixture is SiO 2. : 0.026 Al 2 O 3 : 0.015 Fe 2 O 3 : 0.100 KOH: 0.15 TEAOH: 10 H 2 O The mixture was mixed so that 0.5 part of seed crystals (Tosoh) was added to 100 parts of the composition. Catalyst 3 was obtained in the same manner as in Example 12 except that HSZ940NHA) was added.
触媒3の組成はICP発光分析の結果SiO2/Al2O3モル比は34、SiO2/Fe2O3モル比は56であり、平均結晶粒子径は0.24μmであった。X線結晶回折(302)面の半値幅(FWHM)は0.36°であり、700℃、20時間、10容量%水蒸気雰囲気下の水熱耐久処理後におけるNOx還元率は反応温度200℃で46%であった。また、耐久処理前のNOx還元率は反応温度200℃で55%であった。 As a result of ICP emission analysis, the composition of catalyst 3 was a SiO 2 / Al 2 O 3 molar ratio of 34, a SiO 2 / Fe 2 O 3 molar ratio of 56, and an average crystal particle diameter of 0.24 μm. The full width at half maximum (FWHM) of the X-ray crystal diffraction (302) plane is 0.36 °, and the NOx reduction rate after hydrothermal endurance treatment in a 10 vol% steam atmosphere at 700 ° C. for 20 hours is a reaction temperature of 200 ° C. It was 46%. Moreover, the NOx reduction rate before the durability treatment was 55% at a reaction temperature of 200 ° C.
比較例4
珪酸ソーダ水溶液、硫酸アルミニウム水溶液、硝酸第二鉄水溶液、硫酸を用い、スラリー状生成物の組成をSiO2:0.009Al2O3:0.017Fe2O3とし、反応混合物の組成をSiO2:0.009Al2O3:0.017Fe2O3:0.050KOH:0.15TEAOH:10H2Oとなるようにした以外は実施例12と同様にして比較触媒1を得た。
Comparative Example 4
Using a sodium silicate aqueous solution, an aluminum sulfate aqueous solution, a ferric nitrate aqueous solution, and sulfuric acid, the composition of the slurry product is SiO 2 : 0.009Al 2 O 3 : 0.017Fe 2 O 3 and the composition of the reaction mixture is SiO 2. Comparative catalyst 1 was obtained in the same manner as in Example 12 except that 0.009Al 2 O 3 : 0.017Fe 2 O 3 : 0.050 KOH: 0.15 TEAOH: 10H 2 O.
比較触媒1の組成はICP発光分析の結果SiO2/Al2O3モル比は102、SiO2/Fe2O3モル比は49であり、平均結晶粒子径は0.24μmであった。X線結晶回折(302)面の半値幅(FWHM)は0.34°であり、700℃、20時間、10容量%水蒸気雰囲気下の水熱耐久処理後におけるNOx還元率は反応温度200℃で36%であった。また、耐久処理前のNOx還元率は反応温度200℃で54%であった。 As a result of ICP emission analysis, the composition of Comparative Catalyst 1 was SiO 2 / Al 2 O 3 molar ratio was 102, SiO 2 / Fe 2 O 3 molar ratio was 49, and the average crystal particle diameter was 0.24 μm. The full width at half maximum (FWHM) of the X-ray crystal diffraction (302) plane is 0.34 °, and the NOx reduction rate after hydrothermal endurance treatment in a 10 vol% steam atmosphere at 700 ° C. for 20 hours is a reaction temperature of 200 ° C. It was 36%. Moreover, the NOx reduction rate before the durability treatment was 54% at a reaction temperature of 200 ° C.
比較例5
珪酸ソーダ水溶液、硫酸アルミニウム水溶液、硝酸第二鉄水溶液、硫酸を用い、スラリー状生成物の組成をSiO2:0.009Al2O3:0.027Fe2O3とし、反応混合物の組成をSiO2:0.009Al2O3:0.027Fe2O3:0.140KOH:0.15TEAOH:10H2Oとなるように混合し、該組成物100部に対して0.5部の種晶(東ソー製HSZ940NHA)を加えた以外は実施例12と同様にして比較触媒2を得た。
Comparative Example 5
Using a sodium silicate aqueous solution, an aluminum sulfate aqueous solution, a ferric nitrate aqueous solution, and sulfuric acid, the composition of the slurry product is SiO 2 : 0.009Al 2 O 3 : 0.027Fe 2 O 3 and the composition of the reaction mixture is SiO 2. : 0.009Al 2 O 3 : 0.027Fe 2 O 3 : 0.140KOH: 0.15TEAOH: 10H 2 O The mixture was mixed so that 0.5 parts of seed crystals (Tosoh) was added to 100 parts of the composition. Comparative catalyst 2 was obtained in the same manner as in Example 12 except that HSZ940NHA) was added.
比較触媒2の組成はICP発光分析の結果SiO2/Al2O3モル比は88、SiO2/Fe2O3モル比は30であり、平均結晶粒子径は0.19μmであった。X線結晶回折(302)面の半値幅(FWHM)は0.38°であり、700℃、20時間、10容量%水蒸気雰囲気下の水熱耐久処理後におけるNOx還元率は反応温度200℃で43%であった。また、耐久処理前のNOx還元率は反応温度200℃で59%であった。 As a result of ICP emission analysis, the composition of Comparative Catalyst 2 was 88 / SiO 2 / Al 2 O 3 molar ratio, 30 / SiO 2 / Fe 2 O 3 molar ratio, and the average crystal particle diameter was 0.19 μm. The full width at half maximum (FWHM) of the X-ray crystal diffraction (302) plane is 0.38 °, and the NOx reduction rate after hydrothermal endurance treatment in a 10% by volume steam atmosphere at 700 ° C. for 20 hours is 200 ° C. 43%. Further, the NOx reduction rate before the durability treatment was 59% at a reaction temperature of 200 ° C.
比較例6
乾燥粉末を水蒸気濃度0.05容量%の乾燥空気流通下、600℃で2時間焼成した以外は実施例12と同様にして比較触媒3を得た。
Comparative Example 6
Comparative catalyst 3 was obtained in the same manner as in Example 12 except that the dried powder was calcined at 600 ° C. for 2 hours under a flow of dry air having a water vapor concentration of 0.05 vol%.
比較触媒3の組成はICP発光分析の結果SiO2/Al2O3モル比は35、SiO2/Fe2O3モル比は144であり、平均結晶粒子径は0.28μmであった。X線結晶回折(302)面の半値幅(FWHM)は0.28°であり、700℃、20時間、10容量%水蒸気雰囲気下の水熱耐久処理後におけるNOx還元率は反応温度200℃で38%であった。また、耐久処理前のNOx還元率は反応温度200℃で77%であった。 As a result of ICP emission analysis, the composition of the comparative catalyst 3 was a SiO 2 / Al 2 O 3 molar ratio of 35, a SiO 2 / Fe 2 O 3 molar ratio of 144, and an average crystal particle diameter of 0.28 μm. The full width at half maximum (FWHM) of the X-ray crystal diffraction (302) plane is 0.28 °, and the NOx reduction rate after hydrothermal endurance treatment in a 10 vol% steam atmosphere at 700 ° C. for 20 hours is a reaction temperature of 200 ° C. 38%. Further, the NOx reduction rate before the durability treatment was 77% at a reaction temperature of 200 ° C.
実施例12〜14及び比較例4〜6で得られた窒素酸化物浄化触媒の物性と200℃でのNOx還元率との関係を以下の表7に示す。 Table 7 below shows the relationship between the physical properties of the nitrogen oxide purifying catalysts obtained in Examples 12 to 14 and Comparative Examples 4 to 6 and the NOx reduction rate at 200 ° C.
表から明らかな様に、実施例12〜14の触媒は耐久処理後における200℃でのNOx還元率が比較例4〜6の触媒と比較して高い。 As is clear from the table, the catalysts of Examples 12-14 have a higher NOx reduction rate at 200 ° C. after the endurance treatment than the catalysts of Comparative Examples 4-6.
本発明の高結晶性β型鉄シリケートは、例えば窒素酸化物の浄化触媒として使用可能であり、自動車の排ガスの窒素酸化物除去に適用される。 The highly crystalline β-type iron silicate of the present invention can be used, for example, as a nitrogen oxide purification catalyst, and is applied to the removal of nitrogen oxides from automobile exhaust gas.
また本発明の窒素酸化物浄化触媒は、還元剤の存在下で自動車排ガス中の窒素酸化物を浄化するのに利用できる。 Further, the nitrogen oxide purification catalyst of the present invention can be used to purify nitrogen oxide in automobile exhaust gas in the presence of a reducing agent.
Claims (13)
aM2O・SiO2・bFe2O3・cAl2O3・dSDA・eH2O
ここで、
M = K+又はRb+又はCs+
a = 0.005〜0.10
b = 0.006〜0.02
c = 0.014〜0.04
d = 0.10〜0.35
e = 7〜15
、を水熱処理することにより結晶化させる請求項1乃至4のいずれかに記載のβ型鉄シリケートの製造方法。 The following fluorine containing no starting composition aM 2 O · SiO 2 · bFe 2 O 3 · cAl 2 O 3 · dSDA · eH 2 O
here,
M = K + or Rb + or Cs +
a = 0.005-0.10
b = 0.006-0.02
c = 0.014-0.04
d = 0.10-0.35
e = 7-15
The method for producing β-type iron silicate according to any one of claims 1 to 4, wherein crystallization is performed by hydrothermal treatment.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010283167A JP5594121B2 (en) | 2009-12-22 | 2010-12-20 | Novel metallosilicate and nitrogen oxide purification catalyst |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009290442 | 2009-12-22 | ||
| JP2009290442 | 2009-12-22 | ||
| JP2009293724 | 2009-12-25 | ||
| JP2009293724 | 2009-12-25 | ||
| JP2010283167A JP5594121B2 (en) | 2009-12-22 | 2010-12-20 | Novel metallosilicate and nitrogen oxide purification catalyst |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011148678A JP2011148678A (en) | 2011-08-04 |
| JP5594121B2 true JP5594121B2 (en) | 2014-09-24 |
Family
ID=44536057
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010283167A Active JP5594121B2 (en) | 2009-12-22 | 2010-12-20 | Novel metallosilicate and nitrogen oxide purification catalyst |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5594121B2 (en) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5609620B2 (en) * | 2009-12-25 | 2014-10-22 | 東ソー株式会社 | New metallosilicate |
| JP5760435B2 (en) * | 2010-12-27 | 2015-08-12 | 東ソー株式会社 | Microcrystalline and highly crystalline β-type zeolite and method for producing the same |
| JP5970927B2 (en) * | 2012-04-05 | 2016-08-17 | いすゞ自動車株式会社 | Method for producing urea SCR catalyst |
| JP6127232B2 (en) * | 2012-07-19 | 2017-05-17 | 株式会社 Acr | Anti-sintering catalyst |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3986186B2 (en) * | 1997-11-07 | 2007-10-03 | 日本碍子株式会社 | High heat-resistant β-zeolite and adsorbent for automobile exhaust gas purification using the same |
| JP4867065B2 (en) * | 2000-11-20 | 2012-02-01 | 東ソー株式会社 | Method for producing novel BEA type metalloaluminosilicate |
| JP5082361B2 (en) * | 2006-09-27 | 2012-11-28 | 東ソー株式会社 | Β-type zeolite for SCR catalyst and method for purifying nitrogen oxides using the same |
| JP6176891B2 (en) * | 2007-08-13 | 2017-08-09 | ピーキュー コーポレイション | Novel iron-containing aluminosilicate zeolite and methods for making and using the same |
| CN101462054A (en) * | 2007-12-18 | 2009-06-24 | 东曹株式会社 | Nitrogen oxide purification catalyst and nitrogen oxide purification method |
| JP5309936B2 (en) * | 2007-12-18 | 2013-10-09 | 東ソー株式会社 | Nitrogen oxide purification catalyst and nitrogen oxide purification method |
| US9138685B2 (en) * | 2009-08-27 | 2015-09-22 | Tosoh Corporation | Highly hydrothermal-resistant SCR catalyst and manufacturing method therefor |
| US9675935B2 (en) * | 2009-12-22 | 2017-06-13 | Tosoh Corporation | Metallosilicates, processes for producing the same, nitrogen oxide removal catalyst, process for producing the same, and method for removing nitrogen oxide with the same |
| JP5609620B2 (en) * | 2009-12-25 | 2014-10-22 | 東ソー株式会社 | New metallosilicate |
-
2010
- 2010-12-20 JP JP2010283167A patent/JP5594121B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2011148678A (en) | 2011-08-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5082361B2 (en) | Β-type zeolite for SCR catalyst and method for purifying nitrogen oxides using the same | |
| JP5958070B2 (en) | β-type iron silicate composition and nitrogen oxide reduction method | |
| JP5169779B2 (en) | Nitrogen oxide purification catalyst and nitrogen oxide purification method | |
| CN102666387B (en) | Novel metal silicate and method for producing the same, nitrogen oxide removing catalyst and method for producing the same, and nitrogen oxide removing method using the catalyst | |
| JP6169069B2 (en) | Large crystals of organic chabazite and methods for making and using the same | |
| JP5895510B2 (en) | Chabazite-type zeolite and method for producing the same, low-silica zeolite supporting copper, nitrogen oxide reduction and removal catalyst containing the zeolite, and nitrogen oxide reduction and removal method using the catalyst | |
| JP7557663B2 (en) | Denitrification catalyst and denitrification method using said catalyst | |
| JP4957176B2 (en) | Nitrogen oxide purification catalyst and nitrogen oxide purification method | |
| US7794680B2 (en) | Nitrogen oxide-reducing catalyst and method for reducing nitrogen oxide | |
| KR102319424B1 (en) | Low-silica chabazite zeolite with high acidity | |
| WO2020252447A9 (en) | Chabazite zeolite synthesis with organic templates | |
| JP5594121B2 (en) | Novel metallosilicate and nitrogen oxide purification catalyst | |
| JP5309936B2 (en) | Nitrogen oxide purification catalyst and nitrogen oxide purification method | |
| JP2023551654A (en) | Synthesis of chabazite zeolite using a combination of organic templates | |
| RU2807541C2 (en) | Chabazite-type zeolites with low silicon dioxide content and high acidity | |
| RU2807541C9 (en) | Low-silica chabazite zeolites with high acidity |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20131121 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20140325 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140415 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140416 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140708 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140721 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 5594121 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |