JP4762514B2 - 3,6−ジフェニルカルバゾール誘導体 - Google Patents
3,6−ジフェニルカルバゾール誘導体 Download PDFInfo
- Publication number
- JP4762514B2 JP4762514B2 JP2004245423A JP2004245423A JP4762514B2 JP 4762514 B2 JP4762514 B2 JP 4762514B2 JP 2004245423 A JP2004245423 A JP 2004245423A JP 2004245423 A JP2004245423 A JP 2004245423A JP 4762514 B2 JP4762514 B2 JP 4762514B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- derivative
- diphenylcarbazole
- carbazole
- toluene
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- PCMKGEAHIZDRFL-UHFFFAOYSA-N 3,6-diphenyl-9h-carbazole Chemical class C1=CC=CC=C1C1=CC=C(NC=2C3=CC(=CC=2)C=2C=CC=CC=2)C3=C1 PCMKGEAHIZDRFL-UHFFFAOYSA-N 0.000 title claims description 29
- 238000006243 chemical reaction Methods 0.000 claims description 11
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 8
- 239000003795 chemical substances by application Substances 0.000 claims description 7
- 125000005843 halogen group Chemical group 0.000 claims description 6
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 5
- 230000029936 alkylation Effects 0.000 claims description 3
- 238000005804 alkylation reaction Methods 0.000 claims description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 84
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 37
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 21
- 238000002844 melting Methods 0.000 description 17
- 230000008018 melting Effects 0.000 description 17
- 238000000921 elemental analysis Methods 0.000 description 16
- 239000002904 solvent Substances 0.000 description 13
- FIHILUSWISKVSR-UHFFFAOYSA-N 3,6-dibromo-9h-carbazole Chemical compound C1=C(Br)C=C2C3=CC(Br)=CC=C3NC2=C1 FIHILUSWISKVSR-UHFFFAOYSA-N 0.000 description 12
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 12
- -1 carbazole compound Chemical class 0.000 description 12
- 238000000034 method Methods 0.000 description 12
- 239000012299 nitrogen atmosphere Substances 0.000 description 12
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 12
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 12
- 238000010992 reflux Methods 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- 238000000862 absorption spectrum Methods 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- YCOXTKKNXUZSKD-UHFFFAOYSA-N as-o-xylenol Natural products CC1=CC=C(O)C=C1C YCOXTKKNXUZSKD-UHFFFAOYSA-N 0.000 description 8
- SNHMUERNLJLMHN-UHFFFAOYSA-N iodobenzene Chemical compound IC1=CC=CC=C1 SNHMUERNLJLMHN-UHFFFAOYSA-N 0.000 description 8
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 7
- 239000003480 eluent Substances 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 239000012046 mixed solvent Substances 0.000 description 7
- 239000012044 organic layer Substances 0.000 description 7
- QPTWWBLGJZWRAV-UHFFFAOYSA-N 2,7-dibromo-9-H-carbazole Natural products BrC1=CC=C2C3=CC=C(Br)C=C3NC2=C1 QPTWWBLGJZWRAV-UHFFFAOYSA-N 0.000 description 6
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 229910000027 potassium carbonate Inorganic materials 0.000 description 6
- 235000011181 potassium carbonates Nutrition 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 238000010898 silica gel chromatography Methods 0.000 description 6
- 229910000029 sodium carbonate Inorganic materials 0.000 description 6
- 238000005406 washing Methods 0.000 description 6
- 125000000217 alkyl group Chemical group 0.000 description 5
- 238000001816 cooling Methods 0.000 description 5
- 239000013078 crystal Substances 0.000 description 5
- 238000001035 drying Methods 0.000 description 5
- 239000010410 layer Substances 0.000 description 5
- RKSPTRGAOMSBQN-UHFFFAOYSA-N 3,6-bis(4-methoxyphenyl)-9h-carbazole Chemical compound C1=CC(OC)=CC=C1C1=CC=C(NC=2C3=CC(=CC=2)C=2C=CC(OC)=CC=2)C3=C1 RKSPTRGAOMSBQN-UHFFFAOYSA-N 0.000 description 4
- 125000003118 aryl group Chemical group 0.000 description 4
- 150000001716 carbazoles Chemical class 0.000 description 4
- 239000010408 film Substances 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 229910052757 nitrogen Inorganic materials 0.000 description 4
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 4
- 125000001424 substituent group Chemical group 0.000 description 4
- 239000010409 thin film Substances 0.000 description 4
- RINOYHWVBUKAQE-UHFFFAOYSA-N 1-iodo-2-methylbenzene Chemical compound CC1=CC=CC=C1I RINOYHWVBUKAQE-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical class CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 125000003545 alkoxy group Chemical group 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 125000001153 fluoro group Chemical group F* 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- IKXASSREATZHGT-UHFFFAOYSA-N 3,6-bis(2-methylphenyl)-9h-carbazole Chemical compound CC1=CC=CC=C1C1=CC=C(NC=2C3=CC(=CC=2)C=2C(=CC=CC=2)C)C3=C1 IKXASSREATZHGT-UHFFFAOYSA-N 0.000 description 2
- ULJIGXLVZCZSQD-UHFFFAOYSA-N 3,6-bis(2-phenylphenyl)-9h-carbazole Chemical compound C1=CC=CC=C1C1=CC=CC=C1C1=CC=C(NC=2C3=CC(=CC=2)C=2C(=CC=CC=2)C=2C=CC=CC=2)C3=C1 ULJIGXLVZCZSQD-UHFFFAOYSA-N 0.000 description 2
- HTDAWWHUKPVYHM-UHFFFAOYSA-N 3,6-bis(3-fluorophenyl)-9h-carbazole Chemical compound FC1=CC=CC(C=2C=C3C4=CC(=CC=C4NC3=CC=2)C=2C=C(F)C=CC=2)=C1 HTDAWWHUKPVYHM-UHFFFAOYSA-N 0.000 description 2
- RDSQPGMBOYKIHV-UHFFFAOYSA-N 3,6-bis(3-phenylphenyl)-9h-carbazole Chemical compound C1=CC=CC=C1C1=CC=CC(C=2C=C3C4=CC(=CC=C4NC3=CC=2)C=2C=C(C=CC=2)C=2C=CC=CC=2)=C1 RDSQPGMBOYKIHV-UHFFFAOYSA-N 0.000 description 2
- UTKIOZXIDDHRAR-UHFFFAOYSA-N 3,6-bis(4-methoxyphenyl)-9-phenylcarbazole Chemical compound C1=CC(OC)=CC=C1C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC(=CC=2)C=2C=CC(OC)=CC=2)C3=C1 UTKIOZXIDDHRAR-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N Carbazole Natural products C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- MUHKRFZKLQNOCK-UHFFFAOYSA-N [In].c1ccc(cc1)-c1ccccn1.c1ccc(cc1)-c1ccccn1.c1ccc(cc1)-c1ccccn1 Chemical compound [In].c1ccc(cc1)-c1ccccn1.c1ccc(cc1)-c1ccccn1.c1ccc(cc1)-c1ccccn1 MUHKRFZKLQNOCK-UHFFFAOYSA-N 0.000 description 2
- 150000001543 aryl boronic acids Chemical class 0.000 description 2
- 150000001502 aryl halides Chemical class 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- DENRZWYUOJLTMF-UHFFFAOYSA-N diethyl sulfate Chemical compound CCOS(=O)(=O)OCC DENRZWYUOJLTMF-UHFFFAOYSA-N 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 108091008695 photoreceptors Proteins 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000002861 polymer material Substances 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 235000011121 sodium hydroxide Nutrition 0.000 description 2
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 2
- NSJVYHOPHZMZPN-UHFFFAOYSA-N (2-methylphenyl)boronic acid Chemical compound CC1=CC=CC=C1B(O)O NSJVYHOPHZMZPN-UHFFFAOYSA-N 0.000 description 1
- HYCYKHYFIWHGEX-UHFFFAOYSA-N (2-phenylphenyl)boronic acid Chemical compound OB(O)C1=CC=CC=C1C1=CC=CC=C1 HYCYKHYFIWHGEX-UHFFFAOYSA-N 0.000 description 1
- KNXQDJCZSVHEIW-UHFFFAOYSA-N (3-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC=CC(F)=C1 KNXQDJCZSVHEIW-UHFFFAOYSA-N 0.000 description 1
- VOAAEKKFGLPLLU-UHFFFAOYSA-N (4-methoxyphenyl)boronic acid Chemical compound COC1=CC=C(B(O)O)C=C1 VOAAEKKFGLPLLU-UHFFFAOYSA-N 0.000 description 1
- CYSGHNMQYZDMIA-UHFFFAOYSA-N 1,3-Dimethyl-2-imidazolidinon Chemical compound CN1CCN(C)C1=O CYSGHNMQYZDMIA-UHFFFAOYSA-N 0.000 description 1
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- NXYICUMSYKIABQ-UHFFFAOYSA-N 1-iodo-4-phenylbenzene Chemical group C1=CC(I)=CC=C1C1=CC=CC=C1 NXYICUMSYKIABQ-UHFFFAOYSA-N 0.000 description 1
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 1
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 1
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 1
- VQGHOUODWALEFC-UHFFFAOYSA-N 2-phenylpyridine Chemical compound C1=CC=CC=C1C1=CC=CC=N1 VQGHOUODWALEFC-UHFFFAOYSA-N 0.000 description 1
- CPYDOSKTHDXJKH-UHFFFAOYSA-N 3,6,9-tris(2-methylphenyl)carbazole Chemical compound CC1=CC=CC=C1C1=CC=C(N(C=2C(=CC=CC=2)C)C=2C3=CC(=CC=2)C=2C(=CC=CC=2)C)C3=C1 CPYDOSKTHDXJKH-UHFFFAOYSA-N 0.000 description 1
- WDARESURZMNDSO-UHFFFAOYSA-N 3,6,9-tris(4-phenylphenyl)carbazole Chemical compound C1=CC=CC=C1C1=CC=C(C=2C=C3C4=CC(=CC=C4N(C=4C=CC(=CC=4)C=4C=CC=CC=4)C3=CC=2)C=2C=CC(=CC=2)C=2C=CC=CC=2)C=C1 WDARESURZMNDSO-UHFFFAOYSA-N 0.000 description 1
- YZHRORGAQPSVKD-UHFFFAOYSA-N 3,6-bis(2-methylphenyl)-9-phenylcarbazole Chemical compound CC1=CC=CC=C1C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC(=CC=2)C=2C(=CC=CC=2)C)C3=C1 YZHRORGAQPSVKD-UHFFFAOYSA-N 0.000 description 1
- RHPOSOWIKIUAQO-UHFFFAOYSA-N 3,6-bis(3-fluorophenyl)-9-phenylcarbazole Chemical compound FC1=CC=CC(C=2C=C3C4=CC(=CC=C4N(C=4C=CC=CC=4)C3=CC=2)C=2C=C(F)C=CC=2)=C1 RHPOSOWIKIUAQO-UHFFFAOYSA-N 0.000 description 1
- MOMYUUMWCXCNBX-UHFFFAOYSA-N 3,6-bis(4-methoxyphenyl)-9-(2-methylphenyl)carbazole Chemical compound C1=CC(OC)=CC=C1C1=CC=C(N(C=2C(=CC=CC=2)C)C=2C3=CC(=CC=2)C=2C=CC(OC)=CC=2)C3=C1 MOMYUUMWCXCNBX-UHFFFAOYSA-N 0.000 description 1
- DDUYWGWKRVMENO-UHFFFAOYSA-N 3,6-bis(4-phenylphenyl)-9h-carbazole Chemical compound C1=CC=CC=C1C1=CC=C(C=2C=C3C4=CC(=CC=C4NC3=CC=2)C=2C=CC(=CC=2)C=2C=CC=CC=2)C=C1 DDUYWGWKRVMENO-UHFFFAOYSA-N 0.000 description 1
- UUMDSELMDKINPL-UHFFFAOYSA-N 4,4,5,5-tetramethyl-2-(3-phenylphenyl)-1,3,2-dioxaborolane Chemical group O1C(C)(C)C(C)(C)OB1C1=CC=CC(C=2C=CC=CC=2)=C1 UUMDSELMDKINPL-UHFFFAOYSA-N 0.000 description 1
- 125000006283 4-chlorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Cl)C([H])([H])* 0.000 description 1
- 125000006181 4-methyl benzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])C([H])([H])* 0.000 description 1
- DCPSTSVLRXOYGS-UHFFFAOYSA-N 6-amino-1h-pyrimidine-2-thione Chemical compound NC1=CC=NC(S)=N1 DCPSTSVLRXOYGS-UHFFFAOYSA-N 0.000 description 1
- UMUPRPZJEWRQAI-UHFFFAOYSA-N 9-ethyl-3,6-bis(4-methoxyphenyl)carbazole Chemical compound C=1C=C2N(CC)C3=CC=C(C=4C=CC(OC)=CC=4)C=C3C2=CC=1C1=CC=C(OC)C=C1 UMUPRPZJEWRQAI-UHFFFAOYSA-N 0.000 description 1
- HALXIZNOSGQWQX-UHFFFAOYSA-N 9-ethyl-3,6-diphenylcarbazole Chemical compound C=1C=C2N(CC)C3=CC=C(C=4C=CC=CC=4)C=C3C2=CC=1C1=CC=CC=C1 HALXIZNOSGQWQX-UHFFFAOYSA-N 0.000 description 1
- PMLRKCJPRODCOF-UHFFFAOYSA-N 9-phenyl-3,6-bis(2-phenylphenyl)carbazole Chemical compound C1=CC=CC=C1C1=CC=CC=C1C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC(=CC=2)C=2C(=CC=CC=2)C=2C=CC=CC=2)C3=C1 PMLRKCJPRODCOF-UHFFFAOYSA-N 0.000 description 1
- DEYKAKJCJUJHNO-UHFFFAOYSA-N 9-phenyl-3,6-bis(3-phenylphenyl)carbazole Chemical compound C1=CC=CC=C1C1=CC=CC(C=2C=C3C4=CC(=CC=C4N(C=4C=CC=CC=4)C3=CC=2)C=2C=C(C=CC=2)C=2C=CC=CC=2)=C1 DEYKAKJCJUJHNO-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 238000006161 Suzuki-Miyaura coupling reaction Methods 0.000 description 1
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 1
- 238000006887 Ullmann reaction Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 125000003828 azulenyl group Chemical group 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000006267 biphenyl group Chemical group 0.000 description 1
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000002676 chrysenyl group Chemical group C1(=CC=CC=2C3=CC=C4C=CC=CC4=C3C=CC12)* 0.000 description 1
- 238000010549 co-Evaporation Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000006880 cross-coupling reaction Methods 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000006165 cyclic alkyl group Chemical group 0.000 description 1
- 150000004292 cyclic ethers Chemical class 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 229940008406 diethyl sulfate Drugs 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000005525 hole transport Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- LZWQNOHZMQIFBX-UHFFFAOYSA-N lithium;2-methylpropan-2-olate Chemical compound [Li+].CC(C)(C)[O-] LZWQNOHZMQIFBX-UHFFFAOYSA-N 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 229920000553 poly(phenylenevinylene) Polymers 0.000 description 1
- RPDAUEIUDPHABB-UHFFFAOYSA-N potassium ethoxide Chemical compound [K+].CC[O-] RPDAUEIUDPHABB-UHFFFAOYSA-N 0.000 description 1
- 235000011118 potassium hydroxide Nutrition 0.000 description 1
- BDAWXSQJJCIFIK-UHFFFAOYSA-N potassium methoxide Chemical compound [K+].[O-]C BDAWXSQJJCIFIK-UHFFFAOYSA-N 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- CGRKYEALWSRNJS-UHFFFAOYSA-N sodium;2-methylbutan-2-olate Chemical compound [Na+].CCC(C)(C)[O-] CGRKYEALWSRNJS-UHFFFAOYSA-N 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 125000003960 triphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C3=CC=CC=C3C12)* 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Landscapes
- Indole Compounds (AREA)
Description
請求項1に記載の発明は、下記一般式(I)で表される3,6−ジフェニルカルバゾール誘導体とアルキル化剤との反応により得られ、下記一般式(II)で表される3,6−ジフェニルカルバゾール誘導体を特徴とする。
また、請求項2に記載の発明は、下記一般式(I)で表される3,6−ジフェニルカルバゾール誘導体とアリール化剤との反応により得られ、下記一般式(III)で表される3,6−ジフェニルカルバゾール誘導体を特徴とする。
また、請求項3に記載の発明は、下記一般式(I)で表される3,6−ジフェニルカルバゾール誘導体とアリール化剤との反応により得られ、下記一般式(III)で表される3,6−ジフェニルカルバゾール誘導体を特徴とする。
また、本発明の新規3,6−ジフェニルカルバゾール誘導体は、光電変換素子としての有機感光体電荷輸送材料として有用である。
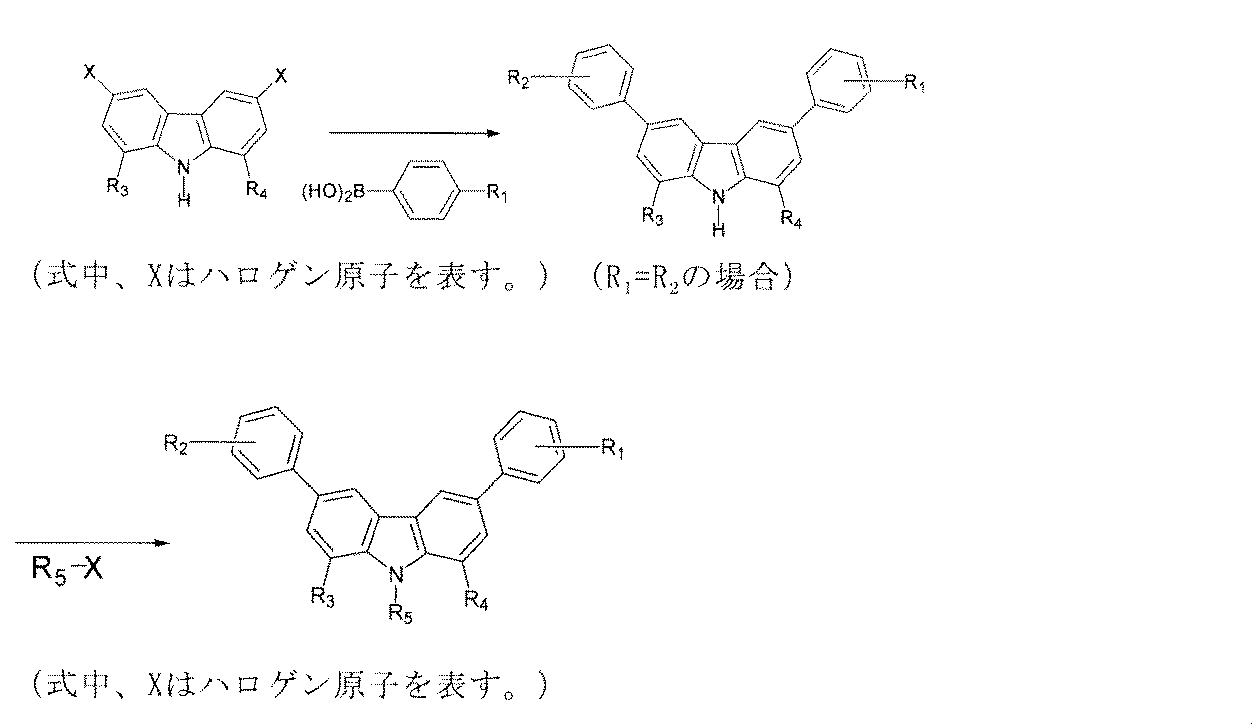
本発明の一般式(I)で示される3,6−ジフェニル−9H−カルバゾール誘導体および一般式(II)で示される3,6−ジフェニルカルバゾール誘導体は下記経路(反応工程)で製造できる。
また第2段階の反応において、アルキル化を行なう場合のアルキル化剤としては、ジエチル硫酸等を挙げることができる。
3,6−ジブロモカルバゾール20.0g、4−メトキシフェニルボロン酸20.6g、テトラキス(トリフェニルホスフィン)パラジウム2.23gをエタノール60mlおよびトルエン250mlに採り、これに炭酸ナトリウムの22%水溶液120mlを加え、窒素雰囲気下5.5時間加熱還流した。熱時、ろ過助剤を用いて不溶物を除去した後、有機層を分離し減圧下溶媒を留去した。水洗後乾燥して淡褐色の粉末20.2gを得た。これをトルエン/エタノールの混合溶媒から再結晶して無色針状晶の3,6−ビス(4−メトキシフェニル)カルバゾール13.5gを得た。
融点 213.0〜214.0℃
元素分析値(%)実測値/計算値
C:82.69/82.30 H:5.61/5.58 N:3.70/3.69
赤外吸収スペクトル(KBr錠剤法)を図1に示した。
NH伸縮振動 3426cm−1 COC伸縮振動 1235cm−1、1035cm−1
3,6−ビス(4−メトキシフェニル)カルバゾール13.4g、ヨードベンゼン40ml、炭酸カリウム19.3gおよび銅紛1.0gを窒素雰囲気下3時間加熱還流した。100℃まで冷却したのちトルエンを加え、ろ過助剤を用いて不溶物を除去した。溶媒を減圧下留去した後メタノールで洗浄し、無色針状晶の3,6−ビス(4−メトキシフェニル)−9−フェニルカルバゾール14.8gを得た。融点169.5〜170.5℃。これをトルエン/エタノールの混合溶媒から再結晶して無色針状結晶を得た。
融点 170.0〜171.0℃
元素分析値(%)実測値/計算値
C:84.31/84.37 H:5.44/5.53 N:3.06/3.07
赤外吸収スペクトル(KBr錠剤法)を図2に示した。
実施例1におけるヨードベンゼンの代わりに、表1に示す対応するヨード化合物を用いる他は実施例1と同様の操作で表1に示す本発明の3,6−ジフェニルカルバゾール誘導体を得た。分析結果と合わせて表1に示す。
3,6−ジブロモカルバゾール12.7g、フェニルボロン酸10.0g、テトラキス(トリフェニルホスフィン)パラジウム2.61gをエタノール40mlおよびトルエン170mlに採り、これに炭酸ナトリウムの22%水溶液90mlを加え、窒素雰囲気下5時間加熱還流した。熱時、ろ過助剤を用いて不溶物を除去した後、有機層を分離し減圧下溶媒を留去した。水洗後乾燥して淡褐色の粉末を得た。これをカラムクロマト処理(溶離液:トルエン)したのちヘキサンで洗浄し、無色針状晶の3,6−ジフェニルカルバゾール6.0gを得た。
融点 180.5〜181.5℃
元素分析値(%)実測値/計算値
C:90.44/90.24 H:5.25/5.38 N:4.31/4.39
赤外吸収スペクトル(KBr錠剤法)
NH伸縮振動 3423cm−1、3378cm−1
参考例2において用いたフェニルボロン酸の代わりに表2に示す対応するアリールボロン酸を用いる他は参考例2と同様に操作して表2に示す3,6−ジフェニル−9H−カルバゾール誘導体を得た。
参考例2〜7で得られた3,6−ジフェニル−9H−カルバゾール誘導体とヨードベンゼンを用いて、実施例1と同様に操作して表3に示す本発明の3,6−ジフェニルカルバゾール誘導体を得た。
参考例7で得られた3,6−ビス(4−ビフェニリル)カルバゾール1.62g、4−ヨードビフェニル1.43g、炭酸カリウム1.90gおよび銅紛0.20gをニトロベンゼン20ml中で窒素雰囲気下3時間加熱還流した。100℃まで冷却したのち、ろ過助剤を用いて不溶物を除去した。溶媒を減圧下留去した後メタノールで洗浄し、トルエン/エタノールの混合溶媒から再結晶して無色針状晶の3、6、9−トリス(4−ビフェニリル)カルバゾール0.90gを得た。
融点 273.5〜275.0℃
元素分析値(%)実測値/計算値
C:92.72/92.42 H:5.10/5.33 N:2.22/2.25
参考例2で得られた3,6−ジフェニルカルバゾール2.0g、水酸化ナトリウム0.26gを脱水アセトン200mlに採り、これにジエチル硫酸0.89mlを室温にて30分を要して滴下した。その後室温で1日攪拌した後、内容物を水にあけ、酢酸エチルで抽出した。有機層を炭酸水素ナトリウム水溶液で洗浄したのち、水洗、乾燥し溶媒を留去し無色粉末を得た。トルエン/エタノールの混合溶媒から再結晶して、無色板状晶の3、6−ジフェニル−9−エチルカルバゾール1.70gを得た。
融点 184.5〜185.0℃
元素分析値(%)実測値/計算値
C:89.86/89.86 H:6.03/6.10 N:3.97/4.03
参考例10において用いた3,6−ジフェニルカルバゾールの代わりに、参考例1で得られた3,6−ビス(4−メトキシフェニル)カルバゾールを用いる他は実施例10と同様に操作して、無色板状晶の3,6−ビス(4−メトキシフェニル)−9−エチルカルバゾールを得た。
融点 226.5〜227.5℃
元素分析値(%)実測値/計算値
C:82.95/82.53 H:6.22/6.18 N:3.48/3.44
3,6−ジブロモカルバゾール11.30g、2−メチルフェニルボロン酸10.40g、テトラキス(トリフェニルホスフィン)パラジウム1.27gをエタノール30mlおよびトルエン125mlに採り、これに炭酸ナトリウムの22%水溶液75gを加え、窒素雰囲気下4時間加熱還流した。熱時、ろ過助剤を用いて不溶物を除去した後、有機層を分離し減圧下溶媒を留去した。水洗後乾燥して淡褐色の粉末を得た。これをシリカゲルカラムクロマト処理(溶離液:トルエン/ヘキサン=1/1体積比)して、無色針状晶の3,6−ビス(2−メチルフェニル)カルバゾール7.44gを得た。
融点 ガラス質
元素分析値(%)実測値/計算値
C:89.62/89.88 H:6.00/6.09 N:4.00/4.03
赤外吸収スペクトル(KBr錠剤法)
NH伸縮振動 3411cm−1
3,6−ビス(2−メチルフェニル)カルバゾール3.41g、2−ヨードトルエン15ml、炭酸カリウム5.51gおよび銅紛0.5gを窒素雰囲気下3時間加熱還流した。室温まで冷却したのちトルエンを加え、ろ過助剤を用いて不溶物を除去した。溶媒を減圧下留去した後シリカゲルカラムクロマト処理(溶離液:トルエン/ヘキサン=1/8体積比)し、無色針状晶の3,6,9−トリス(2−メチルフェニル)カルバゾール3.60gを得た。
融点 80.0〜82.0℃
元素分析値(%)実測値/計算値
C:90.84/90.58 H:6.26/6.22 N:3.12/3.20
実施例13において、2−ヨードトルエンの代わりにヨードベンゼンを用いる他は実施例13と同様に操作して、3,6−ビス(2−メチルフェニル)−9−フェニルカルバゾールを得た。
融点 121.0〜122.0℃
元素分析値(%)実測値/計算値
C:90.84/90.74 H:6.03/5.95 N:3.19/3.31
3,6−ジブロモカルバゾール10.00g、3−フルオロフェニルボロン酸9.86g、テトラキス(トリフェニルホスフィン)パラジウム1.08gをエタノール30mlおよびトルエン125mlに採り、これに炭酸ナトリウムの21.2%水溶液60gを加え、窒素雰囲気下5時間加熱還流した。室温まで放冷後、ろ過助剤を用いて不溶物を除去した後、有機層を分離し減圧下溶媒を留去した。水洗後乾燥して淡褐色の粉末を得た。これをシリカゲルを用いて吸着処理したのちエーテル/ヘキサンの混合溶媒から再結晶して、無色針状晶の3,6−ビス(3−フルオロフェニル)カルバゾール4.07gを得た。
融点 151.5〜152.5℃
元素分析値(%)実測値/計算値
C:81.00/81.11 H:4.26/4.25 N:4.00/3.94
赤外吸収スペクトル(KBr錠剤法)
NH伸縮振動 3392cm−1
3,6−ビス(3−フルオロフェニル)カルバゾール3.50g、ヨードベンゼン30ml、炭酸カリウム5.00gおよび銅紛0.25gを窒素雰囲気下1.5時間加熱還流した。100℃まで冷却したのちトルエンを加え、ろ過助剤を用いて不溶物を除去した。溶媒を減圧下留去した後、シリカゲルカラムクロマト処理(溶離液:トルエン)した後、エタノールから再結晶して、無色針状晶の3,6−ビス(3−フルオロフェニル)−9−フェニルカルバゾールを得た。
融点 124.5〜125.5℃
元素分析値(%)実測値/計算値
C:83.26/83.51 H:4.22/4.44 N:3.12/3.25
実施例1においてヨードベンゼンの代わりに2−ヨードトルエンを用いる他は実施例1と同様に操作して淡褐色粗製物を得た。これをシリカゲルカラムクロマト処理(溶離液:トルエン)した後、トルエン/エタノールから再結晶して、無色針状晶の3,6−ビス(4−メトキシフェニル)−9−(2−メチルフェニル)カルバゾールを得た。
融点 175.5〜176.5℃
元素分析値(%)実測値/計算値
C:84.22/84.41 H:5.84/5.80 N:3.00/2.98
3,6−ジブロモカルバゾール6.50g、ビフェニル2−ボロン酸10.00g、テトラキス(トリフェニルホスフィン)パラジウム0.72gをエタノール20mlおよびトルエン100mlに採り、これに炭酸ナトリウムの22%水溶液40gを加え、窒素雰囲気下7.5時間加熱還流した。放冷後、トルエンおよび水を加え、ろ過助剤を用いて不溶物を除去した後、有機層を分離し減圧下溶媒を留去した。水洗後乾燥して淡褐色の粉末を得た。これをシリカゲルカラムクロマト処理して(溶離液:トルエン/ヘキサン=2/1体積比)ついでエタノールで洗浄し無色針状晶の3,6−ビス(2−ビフェニリル)カルバゾール5.22gを得た。
融点 186.0〜189.0℃
元素分析値(%)実測値/計算値
C:91.46/91.69 H:5.13/5.34 N:3.05/2.97
赤外吸収スペクトル(KBr錠剤法)
NH伸縮振動 3425cm−1
3,6−ビス(2−ビフェニリル)カルバゾール3.00g、ヨードベンゼン30ml、炭酸カリウム3.70gおよび銅紛0.5gを窒素雰囲気下4時間加熱還流した。室温まで冷却したのちトルエンを加え、ろ過助剤を用いて不溶物を除去した。溶媒を減圧下留去した後析出した結晶をエタノールで洗浄しついでトルエン/エタノールの混合溶媒から再結晶して無色針状晶の3,6−ビス(2−ビフェニリル)−9−フェニルカルバゾール2.60gを得た。
融点 233℃
元素分析値(%)実測値/計算値
C:92.57/92.11 H:5.26/5.34 N:2.57/2.56
3,6−ジブロモカルバゾール5.27g、3−(4、4、5、5−テトラメチル−1、3、2−ジオキサボロラン−2−イル)ビフェニル11.3g、テトラキス(トリフェニルホスフィン)パラジウム0.58gをエタノール16mlおよびトルエン80mlに採り、これに炭酸ナトリウムの21.2%水溶液33gを加え、窒素雰囲気下8時間加熱還流した。室温まで放冷後、トルエンを加えた後ろ過助剤を用いて不溶物を除去した。有機層を分離し水洗後乾燥して減圧下溶媒を留去した。これをシリカゲルカラムクロマト処理(溶離液:トルエン/ヘキサン=2/1体積比)した後エタノールで洗浄し無色針状晶の3,6−ビス(3−ビフェニリル)カルバゾール4.70gを得た。
融点 262℃
元素分析値(%)実測値/計算値
C:91.94/91.69 H:5.15/5.34 N:3.01/2.97
赤外吸収スペクトル(KBr錠剤法)
NH伸縮振動 3394cm−1
3,6−ビス(3−ビフェニリル)カルバゾール4.20g、ヨードベンゼン40ml、炭酸カリウム5.20gおよび銅紛0.70gを窒素雰囲気下3時間加熱還流した。放冷後トルエンを加え、ろ過助剤を用いて不溶物を除去した。溶媒を減圧下留去した後、析出した結晶をエタノールで洗浄した。ついでトルエン/ヘキサンの混合溶媒から再結晶して無色板状晶の3,6−ビス(3−ビフェニリル)−9−フェニルカルバゾール3.65gを得た。
融点 188.0〜189.0℃
元素分析値(%)実測値/計算値
C:92.55/92.11 H:5.21/5.34 N:2.59/2.56
110nmの膜厚のITO基板を中性洗剤、アセトン、イソプロパノールで十分に洗浄を行い、イソプロパノールで煮沸洗浄した後に、UV−オゾンチャンバーで12分間処理をして、真空蒸着装置に入れた。1×10−4Paの真空下にてホール輸送層としてN,N′−ジ−m−トリル−N,N′−ジフェニル−4,4′−ジフェニルジアミン(TPD)を50nm形成した。次に、発光層として実施例1で得られたカルバゾール誘導体(CBZ)とトリス(2−フェニルピリジン)インジウム[Ir(ppy)3]を共蒸着法により20nm形成した。この際、トリス(2−フェニルピリジン)インジウムの濃度を6wt%に保持した。さらに、電子輸送層として2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン(BCP)を10nmと8−ヒドロキシキノリノールアルミニウム錯体(Alq3)を30nm蒸着した。最後に、陰極として、MgAg/Agを100/10nmの膜厚でシャドーマスクを介して蒸着を行い、デバイスを完成させた。
素子は、図3に示すような電流−量子効率の関係を示し、最大量子効率6.6%を示した。
また、図4に示すように、良好な電流−電圧特性を示し、印加電圧14.4Vにおいて、最大電流密度4.065A/cm2と最大発光輝度122264cd/m2(図5)が観測された。また、発光スペクトルは510nmを中心とするトリス(2−フェニルピリジン)インジウムからの発光が観測された。
Claims (4)
- 前記請求項1乃至3のいずれかに記載の3,6−ジフェニルカルバゾール誘導体を含むことを特徴とする有機EL素子。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004245423A JP4762514B2 (ja) | 2003-09-05 | 2004-08-25 | 3,6−ジフェニルカルバゾール誘導体 |
| US10/933,230 US7745988B2 (en) | 2003-09-05 | 2004-09-03 | 3, 6-diphenylcarbazole compound and organic electroluminescent device |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003314495 | 2003-09-05 | ||
| JP2003314495 | 2003-09-05 | ||
| JP2003373735 | 2003-10-31 | ||
| JP2003373735 | 2003-10-31 | ||
| JP2004245423A JP4762514B2 (ja) | 2003-09-05 | 2004-08-25 | 3,6−ジフェニルカルバゾール誘導体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005154412A JP2005154412A (ja) | 2005-06-16 |
| JP4762514B2 true JP4762514B2 (ja) | 2011-08-31 |
Family
ID=34743434
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004245423A Expired - Fee Related JP4762514B2 (ja) | 2003-09-05 | 2004-08-25 | 3,6−ジフェニルカルバゾール誘導体 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4762514B2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9206202B2 (en) | 2011-07-29 | 2015-12-08 | Ricoh Company, Ltd. | Carbazole derivative and semiconductor nanocrystal |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8188315B2 (en) | 2004-04-02 | 2012-05-29 | Samsung Mobile Display Co., Ltd. | Organic light emitting device and flat panel display device comprising the same |
| US7858207B2 (en) | 2005-12-21 | 2010-12-28 | Lg Display Co., Ltd. | Host material for organic electroluminescence devices |
| JP2008120769A (ja) * | 2006-11-15 | 2008-05-29 | Bando Chem Ind Ltd | 新規な芳香族第3級アミン類とその利用 |
| JP5595085B2 (ja) | 2010-03-31 | 2014-09-24 | キヤノン株式会社 | 新規有機化合物およびそれを有する有機発光素子 |
| JP5760779B2 (ja) | 2010-08-06 | 2015-08-12 | 株式会社リコー | 発光素子及び表示装置 |
| EP2433929B1 (en) * | 2010-09-27 | 2013-10-23 | Semiconductor Energy Laboratory Co, Ltd. | Organic Compound, Light-Emitting Element, Light-Emitting Device, Electronic Device, and Lighting Device |
| JP5798754B2 (ja) * | 2011-02-14 | 2015-10-21 | ケミプロ化成株式会社 | 新規な置換ジフェニルカルバゾール誘導体、該誘導体よりなるホスト材料及び該誘導体を含む有機エレクトロルミネッセンス素子 |
| JP5505450B2 (ja) * | 2012-04-10 | 2014-05-28 | コニカミノルタ株式会社 | 含窒素多環複素環化合物の製造方法 |
| US10396294B2 (en) | 2013-12-27 | 2019-08-27 | Samsung Electronics Co., Ltd. | Carbazole compound and organic light-emitting device including the same |
| JP5761388B2 (ja) * | 2014-01-14 | 2015-08-12 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子 |
| KR101584626B1 (ko) * | 2014-07-03 | 2016-01-12 | 주식회사 엘엠에스 | 신규한 화합물 및 이를 포함하는 발광소자 |
| FR3024144B1 (fr) * | 2014-07-28 | 2017-05-19 | Univ De Tours Francois-Rabelais | Nouveaux synthons pour l'elaboration de semi-conducteurs organiques |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW532048B (en) * | 2000-03-27 | 2003-05-11 | Idemitsu Kosan Co | Organic electroluminescence element |
| EP2770036B1 (en) * | 2002-03-15 | 2017-12-20 | Idemitsu Kosan Co., Ltd | Material for organic electroluminescent devices and organic electroluminescent devices made by using the same |
| CN100530746C (zh) * | 2002-03-18 | 2009-08-19 | 埃西斯创新有限公司 | 用于发光器件的磷光质枝晶体 |
| EP2169028B1 (en) * | 2002-03-22 | 2018-11-21 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescent devices and organic electroluminescent devices made by using the same |
| US20050158578A1 (en) * | 2002-03-25 | 2005-07-21 | Toshihiro Iwakuma | Material for organic electroluminescent element and organic electroluminescent element employing the same |
| US6562982B1 (en) * | 2002-07-25 | 2003-05-13 | Xerox Corporation | Carbazole compounds |
| JP4411851B2 (ja) * | 2003-03-19 | 2010-02-10 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子 |
-
2004
- 2004-08-25 JP JP2004245423A patent/JP4762514B2/ja not_active Expired - Fee Related
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9206202B2 (en) | 2011-07-29 | 2015-12-08 | Ricoh Company, Ltd. | Carbazole derivative and semiconductor nanocrystal |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2005154412A (ja) | 2005-06-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4328801B2 (ja) | フルオレン化合物及び有機エレクトロルミネッセンス素子 | |
| KR101806464B1 (ko) | 피리딜기가 결합된 피리미딘 유도체 및 이를 이용한 유기 전계 발광 소자 | |
| US7745988B2 (en) | 3, 6-diphenylcarbazole compound and organic electroluminescent device | |
| KR101011857B1 (ko) | 벤조플루오란센 유도체 및 이를 이용한 유기 발광 소자 | |
| CN103262283B (zh) | 有机电致发光元件 | |
| KR100812178B1 (ko) | 플루오렌기를 함유하는 전기발광화합물 및 이를 발광재료로채용하고 있는 표시소자 | |
| CN102746293B (zh) | 用作有机发光二极管的主体材料的双极化合物 | |
| KR101529878B1 (ko) | 유기 전기 발광 조성물 및 이를 포함하는 유기 전기 발광 소자 | |
| CN103958485A (zh) | 用于发光器件的螺二芴化合物 | |
| KR20140143397A (ko) | 유기 전계 발광 소자 | |
| JP4762514B2 (ja) | 3,6−ジフェニルカルバゾール誘導体 | |
| KR20110113470A (ko) | 이형고리 화합물 및 이를 포함하는 유기전계발광소자 | |
| KR101780699B1 (ko) | 스피로 화합물 및 이를 포함하는 유기전계발광소자 | |
| KR102259757B1 (ko) | 화합물 및 이를 이용하는 유기 전자 소자 | |
| JP2009051764A (ja) | 置換されたフェナントレン環構造を有する化合物および有機エレクトロルミネッセンス素子 | |
| JP5870346B2 (ja) | 置換されたオルトターフェニル構造を有する化合物および有機エレクトロルミネッセンス素子 | |
| JP4886975B2 (ja) | 電界発光素子 | |
| CN112062765B (zh) | 一种有机光电致发光化合物及其制备方法 | |
| CN111763223B (zh) | 一种有机化合物、热活化延迟荧光材料及其应用 | |
| JP6475795B2 (ja) | 化合物およびこれを用いた有機電子デバイス | |
| CN113666832B (zh) | 一种有机化合物以及使用其的电子元件和电子装置 | |
| CN114853778B (zh) | 一种有机电致发光材料及其应用 | |
| CN114805379B (zh) | 一种含杂环的有机材料及其应用 | |
| KR101766464B1 (ko) | 피리딜기가 결합된 피리미딘 유도체 및 이를 이용한 유기 전계 발광 소자 | |
| JP2006249229A (ja) | 化学構造が変化した後に発光する発光単位を有するポリマー、及びこれを用いた有機エレクトロルミネセンス素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070619 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100707 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100715 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100913 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101224 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110222 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110527 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110608 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140617 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |