JP2023538630A - B型肝炎ウイルス感染症を処置するためのa1cf阻害剤の使用 - Google Patents
B型肝炎ウイルス感染症を処置するためのa1cf阻害剤の使用 Download PDFInfo
- Publication number
- JP2023538630A JP2023538630A JP2023512305A JP2023512305A JP2023538630A JP 2023538630 A JP2023538630 A JP 2023538630A JP 2023512305 A JP2023512305 A JP 2023512305A JP 2023512305 A JP2023512305 A JP 2023512305A JP 2023538630 A JP2023538630 A JP 2023538630A
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- a1cf
- acid molecule
- nucleosides
- hbv
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/549—Sugars, nucleosides, nucleotides or nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
- A61K48/0033—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid the non-active part being non-polymeric
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Virology (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本発明は、HBV感染症、特に慢性HBV感染症の処置に使用するためのA1CF阻害剤に関する。本発明は、特に、HBV cccDNAなどのcccDNAを不安定化するためのA1CF阻害剤の使用に関する。本発明はまた、A1CFに対して相補的であり、A1CF mRNAのレベルを低下させることができる核酸分子に関する。本発明はまた、HBV感染症の処置における医薬組成物、及びその使用も含む。
【選択図】なし
【選択図】なし
Description
発明の分野
本発明は、B型肝炎ウイルス(HBV)感染症、特に慢性HBV感染症の処置に使用するためのA1CF阻害剤に関する。本発明は、特に、HBV cccDNAなどのcccDNAを不安定化するためのA1CF阻害剤の使用に関する。本発明はまた、A1CFに対して相補的であり、A1CFの発現を減少させることができる、siRNA、shRNA及びアンチセンスオリゴヌクレオチドを含むオリゴヌクレオチドなどの核酸分子に関する。本発明はまた、HBV感染症の処置における医薬組成物、及びその使用も含む。
本発明は、B型肝炎ウイルス(HBV)感染症、特に慢性HBV感染症の処置に使用するためのA1CF阻害剤に関する。本発明は、特に、HBV cccDNAなどのcccDNAを不安定化するためのA1CF阻害剤の使用に関する。本発明はまた、A1CFに対して相補的であり、A1CFの発現を減少させることができる、siRNA、shRNA及びアンチセンスオリゴヌクレオチドを含むオリゴヌクレオチドなどの核酸分子に関する。本発明はまた、HBV感染症の処置における医薬組成物、及びその使用も含む。
背景
B型肝炎は、逆転写を介して複製する小型肝臓指向性ウイルスであるB型肝炎ウイルス(HBV)に起因する感染性疾患である。慢性HBV感染症は、肝硬変及び肝細胞癌腫のような重篤な肝疾患に対する重要な因子である。慢性HBV感染症に対する現在の処置は、多機能逆転写酵素であるウイルスポリメラーゼを標的とする、ラミブジン、アデホビル、エンテカビル、テノホビル・ジソプロキシル、及びテノホビル・アラフェナミドなどのペグ化1型インターフェロン又はヌクレオシ(チ)ド類似体の投与に基づいている。処置の成功は、通常、B型肝炎表面抗原(HBsAg)の消失として測定される。しかしながら、B型肝炎ウイルスDNAは感染後も体内に残存するため、完全なHBsAgクリアランスが達成されることは稀である。HBVの持続は、核内で安定に維持されているHBVゲノムのエピソーム型によって媒介される。このエピソーム型は「共有結合閉環状(covalently closed circular)DNA」(cccDNA)と呼ばれる。cccDNAは、ウイルス複製中間体であるプレゲノム(pregenomic)RNA(pgRNA)を含む、全てのHBV転写物の鋳型として役立つ。cccDNAのいくつかのコピーの存在は、末期のHBV感染症を再開するのに充分であろう。HBVに対する現在の処置はcccDNAを標的としない。しかしながら、慢性HBV感染症の治癒には、cccDNAの排除が必要であろう(Nassal,Gut.2015 Dec;64(12):1972-84.doi:10.1136/gutjnl-2015-309809による概説)。
B型肝炎は、逆転写を介して複製する小型肝臓指向性ウイルスであるB型肝炎ウイルス(HBV)に起因する感染性疾患である。慢性HBV感染症は、肝硬変及び肝細胞癌腫のような重篤な肝疾患に対する重要な因子である。慢性HBV感染症に対する現在の処置は、多機能逆転写酵素であるウイルスポリメラーゼを標的とする、ラミブジン、アデホビル、エンテカビル、テノホビル・ジソプロキシル、及びテノホビル・アラフェナミドなどのペグ化1型インターフェロン又はヌクレオシ(チ)ド類似体の投与に基づいている。処置の成功は、通常、B型肝炎表面抗原(HBsAg)の消失として測定される。しかしながら、B型肝炎ウイルスDNAは感染後も体内に残存するため、完全なHBsAgクリアランスが達成されることは稀である。HBVの持続は、核内で安定に維持されているHBVゲノムのエピソーム型によって媒介される。このエピソーム型は「共有結合閉環状(covalently closed circular)DNA」(cccDNA)と呼ばれる。cccDNAは、ウイルス複製中間体であるプレゲノム(pregenomic)RNA(pgRNA)を含む、全てのHBV転写物の鋳型として役立つ。cccDNAのいくつかのコピーの存在は、末期のHBV感染症を再開するのに充分であろう。HBVに対する現在の処置はcccDNAを標的としない。しかしながら、慢性HBV感染症の治癒には、cccDNAの排除が必要であろう(Nassal,Gut.2015 Dec;64(12):1972-84.doi:10.1136/gutjnl-2015-309809による概説)。
A1CF(APOBEC1相補因子(complementation factor))は、アポリポタンパク質B mRNAの停止のために、Glnに対するCAAコドンからUAAコドンへの転写後編集を担うアポリポタンパク質B mRNA編集酵素複合体の成分である。アポリポタンパク質B mRNAへの終止コドンの導入は、消化管における脂質代謝を変化させる。編集酵素複合体は、シチジンデアミナーゼAPOBEC-1(アポリポタンパク質B mRNA編集酵素1)及びA1CF遺伝子によってコードされる相補因子で構成される最小コアを含む。A1CFタンパク質は、3つの同一でないRNA認識モチーフを有し、RNA結合タンパク質のhnRNP Rファミリーに属する。これはアポリポタンパク質BのmRNAに結合し、おそらく触媒サブユニットAPOBEC1をmRNAにドッキングして、その標的シトシンを脱アミノ化することを可能にする役割を果たす(Chester et al.,EMBO J.2003 Aug 1;22(15):3971-82)。
アポリポプロテインB mRNA編集酵素複合体に関する多くの報告は、APOBEC1相補因子ではなく、シチジンデアミナーゼAPOBEC1に焦点を当てている。APOBEC1はアポリポタンパク質B mRNAを編集するだけでなく、HBVを含むウイルスゲノムも編集することが示されている。
HBV複製のマウスモデルでは、Renardらは、マウスAPOBEC1がインビボでHBVを編集することを示した(Renard et al.,J Mol Biol.2010 Jul 16;400(3):323-34.doi:10.1016/j.jmb.2010.05.029)。対照的に、ラットAPOBEC1はHBV DNA産生を阻害しなかった(Rosler et al.,Hepatology.2005 Aug;42(2):301-9)。
Gonzalezらは、ヒトAPOBEC1がHBV DNAを編集することを示した。HBV及びヒトAPOBEC1を同時トランスフェクトした細胞では、HBVゲノムにいくつかのGからAへの超変異が同定された。さらに、ヒトAPOBEC1の存在は、HBV DNAの複製に影響を与えた。具体的には、APOBEC1の発現が増加すると、HBV DNA量が減少することが示された(Gonzalez et al.,Retrovirology.2009 Oct 21;6:96.doi:10.1186/1742-4690-6-96)。
我々の知る限りでは、A1CFは、cccDNAの安定性及び維持に関してcccDNA依存性因子として同定されたことはなく、A1CFを阻害する分子がHBV感染症の処置のためのcccDNA不安定化剤として示唆されたこともない。
さらに、我々の知る限りでは、A1CF発現の調節に潜在的に関連するオリゴヌクレオチドの唯一の開示は、国際公開第2016/142948号に示唆されている。しかしながら、国際公開第2016/142948号は、選択的スプライスバリアントを作製するための、A1CFを含む列挙された多数の標的のスプライシングの変更に関する。しかしながら、オリゴヌクレオチドは、スプライシング因子結合部位をコードするデコイオリゴヌクレオチドであり、したがって標的自体には結合しない。国際公開第2016/142948号はまた、癌、炎症、免疫学的障害、神経変性、アルツハイマー病、パーキンソン病、ウイルス感染症(HIV、HSV、HBV)を含む処置のリストに言及している。しかしながら、A1CFを標的とするオリゴヌクレオチドの具体的な例もHBVにおけるそれらの使用もない。
本発明の目的
本発明は、A1CFの阻害とHBV感染細胞中のcccDNAの量の減少との間に関連があり、これがHBV感染個体の処置に関連することを示す。本発明の目的は、HBV感染細胞中のcccDNAの量を減少させるA1CF阻害剤を同定することである。このようなA1CF阻害剤はHBV感染症の処置に用いることができる。
本発明は、A1CFの阻害とHBV感染細胞中のcccDNAの量の減少との間に関連があり、これがHBV感染個体の処置に関連することを示す。本発明の目的は、HBV感染細胞中のcccDNAの量を減少させるA1CF阻害剤を同定することである。このようなA1CF阻害剤はHBV感染症の処置に用いることができる。
本発明は、インビトロ及びインビボでA1CFの発現を阻害することができる、新規の核酸分子を更に同定する。
本発明は、A1CFの発現を調節し、A1CFの機能に関連する疾患を処置又は予防することができる核酸を標的とするオリゴヌクレオチドに関する。
したがって、第1の態様では、本発明は、B型肝炎ウイルス(HBV)感染症の処置及び/又は予防用のA1CF阻害剤を提供する。特に、HBV cccDNA及び/又はHBVプレゲノムRNA(pgRNA)の量を減少させることができる A1CF阻害剤が有用である。そのような阻害剤は、有利には、A1CF mRNAを減少させることができる、12~60ヌクレオチド長の核酸分子である。
さらなる態様では、本発明は、哺乳動物A1CF、例えば、ヒトA1CF、マウスA1CF又はカニクイザルA1CFに対して少なくとも90%相補的な、例えば、完全に相補的な、少なくとも10ヌクレオチド、特に16~20ヌクレオチドの連続ヌクレオチド配列を含む12~60ヌクレオチド、例えば12~30ヌクレオチドの核酸分子に関する。そのような核酸分子は、A1CFを発現する細胞におけるA1CFの発現を阻害することができる。A1CFの阻害は、細胞中に存在するcccDNAの量の減少を可能にする。核酸分子は、一本鎖アンチセンスオリゴヌクレオチド、二本鎖siRNA分子又はshRNA核酸分子(特に化学的に生成されたshRNA分子)から選択することができる。
本発明のさらなる態様は、A1CFの発現及び/又は活性を阻害する一本鎖アンチセンスオリゴヌクレオチド又はsiRNAに関する。特に、A1CF mRNAを減少させる1つ又は複数の2’糖修飾ヌクレオシド及び1つ又は複数のホスホロチオエート結合を含む修飾アンチセンスオリゴヌクレオチド又は修飾siRNAが有利である。
さらなる態様では、本発明は、本発明のアンチセンスオリゴヌクレオチド又はsiRNAなどの本発明のA1CF阻害剤と、薬学的に許容され得る添加物とを含む医薬組成物を提供する。
更なる態様では、本発明は、本発明のA1CF阻害剤、例えば、本発明のアンチセンスオリゴヌクレオチド又は組成物を有効量で細胞に投与することによって、A1CFを発現している標的細胞におけるA1CF発現のインビボ又はインビトロ調節を提供する。いくつかの実施形態では、A1CF発現は、標的細胞において、一切無処理又は対照で処理されたレベルと比較して少なくとも50%、又は少なくとも60%、又は少なくとも70%、又は少なくとも80%減少する。いくつかの実施形態では、標的細胞はHBVに感染し、HBV感染細胞のcccDNAは、HBV感染標的細胞において、一切無処理又は対照で処理されたレベルと比較して少なくとも50%、又は少なくとも60%、又は少なくとも70%減少する。いくつかの実施形態では、標的細胞はHBVに感染し、HBV感染細胞のpgRNAは、HBV感染標的細胞において、一切無処理又は対照で処理されたレベルと比較して少なくとも50%、又は少なくとも60%減少する。
更なる態様では、本発明は、A1CFのインビボ活性に関連する疾患、障害、又は機能障害を処置又は予防するための方法であって、該疾患、障害、又は機能障害に罹患する又は罹り易い対象に、治療的又は予防的に有効量の、本発明のA1CF阻害剤、例えば本発明のアンチセンスオリゴヌクレオチド又はsiRNAを投与することを含む、方法を提供する。
本発明の更なる態様は、本発明の核酸分子のコンジュゲート及び本発明の分子を含む医薬組成物である。特に、GalNAcクラスターのように、肝臓を標的とするコンジュゲートである。
図1A-Dのそれぞれに示される2つの異なるジアステレオ異性体は、コンジュゲート反応の結果である。したがって、特定のアンチセンスオリゴヌクレオチドコンジュゲートのプールは、2つの異なるジアステレオ異性体のうちの1つのみを含有することができ、又は特定のアンチセンスオリゴヌクレオチドコンジュゲートのプールは、2つの異なるジアステレオ異性体の混合物を含有することができる。
定義
HBV感染症
用語「B型肝炎ウイルス感染症」又は「HBV感染症」とは、当該技術分野では一般的に知られており、B型肝炎ウイルス(HBV)によって引き起こされ、かつ肝臓に影響を及ぼす感染性疾患を指す。HBV感染症は急性感染症又は慢性感染症であり得る。慢性B型肝炎ウイルス(chronic hepatitis B virus:CHB)感染症は、世界中で2億4800万人に影響する世界的な疾病負荷である。年間およそ686,000人の死亡は、HBV関連末期肝疾患及び肝細胞癌腫(HCC)に起因する(GBD 2013;Schweitzer et al.,Lancet.2015 Oct 17;386(10003):1546-55)。WHOは、更なる介入がなければ、CHB感染者の数は今後40~50年間にわたり現在の高い水準を維持し、累積2000万人が2015~2030年の間に死亡すると予測した(WHO、2016年)。CHB感染症は特異な臨床症状を呈する同種疾患ではない。感染した個体は、生涯でCHB関連肝疾患のいくつかの段階を経て進行している。これらの病期もまた標準治療(standard of care:SOC)による処置の基礎となる。現在のガイドラインでは、血清ALTレベル、HBV DNAレベル、及び肝疾患の重症度の3つの基準に基づいて、CHBに感染した特定の個人のみを処置することを推奨している(EASL、2017年)。この推奨は、SOC、すなわちヌクレオシ(チ)ド類似体(NA)及びペグ化インターフェロン-α(PEG-IFN)が治癒的ではなく、かつ長期間投与しなければならず、それによって安全性リスクが増加するという事実による。NAはHBV DNA複製を効果的に抑制する。しかしながら、他のウイルスマーカには非常に限られた影響しか及ぼさない/一切影響を及ぼさない。HBV感染症の2つの特徴である、B型肝炎表面抗原(HBsAg)及び共有結合閉環状DNA(cccDNA)は、HBV治癒を目的とする新薬の主な標的である。CHB患者の血漿中において、HBsAgサブウイルス(中空)粒子は、HBVビリオンを数で103~105倍上回る(Ganem&Prince,N Engl J Med.2004 Mar 11;350(11):1118-29)。その過剰は、急性HBV感染症の消散後に観察された血清学的マーカーである中和抗HBs抗体を発現できない個体を含む、該疾患の免疫病理発生に寄与すると考えられている。
HBV感染症
用語「B型肝炎ウイルス感染症」又は「HBV感染症」とは、当該技術分野では一般的に知られており、B型肝炎ウイルス(HBV)によって引き起こされ、かつ肝臓に影響を及ぼす感染性疾患を指す。HBV感染症は急性感染症又は慢性感染症であり得る。慢性B型肝炎ウイルス(chronic hepatitis B virus:CHB)感染症は、世界中で2億4800万人に影響する世界的な疾病負荷である。年間およそ686,000人の死亡は、HBV関連末期肝疾患及び肝細胞癌腫(HCC)に起因する(GBD 2013;Schweitzer et al.,Lancet.2015 Oct 17;386(10003):1546-55)。WHOは、更なる介入がなければ、CHB感染者の数は今後40~50年間にわたり現在の高い水準を維持し、累積2000万人が2015~2030年の間に死亡すると予測した(WHO、2016年)。CHB感染症は特異な臨床症状を呈する同種疾患ではない。感染した個体は、生涯でCHB関連肝疾患のいくつかの段階を経て進行している。これらの病期もまた標準治療(standard of care:SOC)による処置の基礎となる。現在のガイドラインでは、血清ALTレベル、HBV DNAレベル、及び肝疾患の重症度の3つの基準に基づいて、CHBに感染した特定の個人のみを処置することを推奨している(EASL、2017年)。この推奨は、SOC、すなわちヌクレオシ(チ)ド類似体(NA)及びペグ化インターフェロン-α(PEG-IFN)が治癒的ではなく、かつ長期間投与しなければならず、それによって安全性リスクが増加するという事実による。NAはHBV DNA複製を効果的に抑制する。しかしながら、他のウイルスマーカには非常に限られた影響しか及ぼさない/一切影響を及ぼさない。HBV感染症の2つの特徴である、B型肝炎表面抗原(HBsAg)及び共有結合閉環状DNA(cccDNA)は、HBV治癒を目的とする新薬の主な標的である。CHB患者の血漿中において、HBsAgサブウイルス(中空)粒子は、HBVビリオンを数で103~105倍上回る(Ganem&Prince,N Engl J Med.2004 Mar 11;350(11):1118-29)。その過剰は、急性HBV感染症の消散後に観察された血清学的マーカーである中和抗HBs抗体を発現できない個体を含む、該疾患の免疫病理発生に寄与すると考えられている。
いくつかの実施形態では、「HBV感染症」という用語は、「慢性HBV感染症」を指す。
さらに、この用語は、任意のHBV遺伝子型による感染症を包含する。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Aに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Bに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Cに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Dに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Eに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Fに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Gに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Hに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Iに感染している。
いくつかの実施形態では、処置される患者は、HBV遺伝子型Jに感染している。
cccDNA(共有結合的に閉じた環状DNA)
cccDNAは感染した肝細胞の核に存在するHBVのウイルス遺伝的鋳型であり、増殖性感染に必要な全てのHBV RNA転写物を生じ、慢性HBV感染症の自然経過中のウイルス持続に関与する(Locarnini&Zoulim,Antivir Ther.2010;15 Suppl 3:3-14.doi:10.3851/IMP1619)。cccDNAはウイルスのリザーバとして作用し、処置中止後のウイルスリバウンド源であって、長期の、時として、生涯の処置を必要とする。PEG-IFNは、その種々の副作用に起因して、CHBの小サブセットにしか投与できない。
cccDNAは感染した肝細胞の核に存在するHBVのウイルス遺伝的鋳型であり、増殖性感染に必要な全てのHBV RNA転写物を生じ、慢性HBV感染症の自然経過中のウイルス持続に関与する(Locarnini&Zoulim,Antivir Ther.2010;15 Suppl 3:3-14.doi:10.3851/IMP1619)。cccDNAはウイルスのリザーバとして作用し、処置中止後のウイルスリバウンド源であって、長期の、時として、生涯の処置を必要とする。PEG-IFNは、その種々の副作用に起因して、CHBの小サブセットにしか投与できない。
したがって、HBV cccDNAの分解又は除去により定義される完全治癒をCHB患者の大部分にもたらすことができる新規の治療法が、強く必要とされている。
化合物
本明細書では、用語「化合物」とは、A1CFの発現又は活性を阻害することができる任意の分子を意味する。本発明の特定の化合物は、本発明に係るRNAi分子若しくはアンチセンスオリゴヌクレオチドなどの核酸分子、又はそのような核酸分子を含む任意のコンジュゲートである。例えば、本明細書において、化合物は、A1CFを標的とする核酸分子、特にアンチセンスオリゴヌクレオチド又はsiRNAであり得る。
本明細書では、用語「化合物」とは、A1CFの発現又は活性を阻害することができる任意の分子を意味する。本発明の特定の化合物は、本発明に係るRNAi分子若しくはアンチセンスオリゴヌクレオチドなどの核酸分子、又はそのような核酸分子を含む任意のコンジュゲートである。例えば、本明細書において、化合物は、A1CFを標的とする核酸分子、特にアンチセンスオリゴヌクレオチド又はsiRNAであり得る。
オリゴヌクレオチド
本明細書で用いられる「オリゴヌクレオチド」という用語は、2つ以上の共有結合したヌクレオシドを含む分子として当業者に一般に理解されるように定義される。このような共有結合したヌクレオシドはまた、核酸分子又はオリゴマーとも称され得る。
本明細書で用いられる「オリゴヌクレオチド」という用語は、2つ以上の共有結合したヌクレオシドを含む分子として当業者に一般に理解されるように定義される。このような共有結合したヌクレオシドはまた、核酸分子又はオリゴマーとも称され得る。
明細書及び特許請求の範囲に記載されているオリゴヌクレオチドは、概して、70ヌクレオチド長未満の治療用オリゴヌクレオチドである。オリゴヌクレオチドは、一本鎖アンチセンスオリゴヌクレオチドであり、若しくはそれを含み得、又は例えばCRISPR RNA、siRNA、shRNA、アプタマー若しくはリボザイムなどの他の核酸分子であり得る。治療的オリゴヌクレオチド分子は、通常、固相化学合成と、その後の精製及び単離によって、研究室内で作製される。しかしながら、shRNAは、多くの場合、レンチウイルスベクタを用いて細胞に送達され、次いで転写されて一本鎖RNAを生成し、これにより、RNA干渉機構(RNA誘導サイレンシング複合体(RISC)を含む)と相互作用することができるステムループ(ヘアピン)RNA構造を形成するであろう。本発明の一実施形態では、shRNAは、化学的に生成されたshRNA分子である(プラスミド又はウイルスからの細胞ベースの発現に依存しない)。オリゴヌクレオチドの配列に言及する場合には、共有結合したヌクレオチド又はヌクレオシドの核酸塩基部分の配列又は順序、若しくはその修飾が言及される。概して、本発明のオリゴヌクレオチドは、人工であり、化学的に合成され、典型的には精製又は単離される。しかしながら、いくつかの実施形態では、本発明のオリゴヌクレオチドは標的細胞への侵入時にベクタから転写されるshRNAである。本発明のオリゴヌクレオチドは、1つ以上の修飾ヌクレオシド又はヌクレオチドを含み得る。
いくつかの実施形態では、本発明のオリゴヌクレオチドは、10~70ヌクレオチド長、例えば12~60、例えば13~50、例えば14~40、例えば15~30、例えば16~25、例えば16~22、例えば16~20連続ヌクレオチド長を含むか、又はそれらからなる。したがって、本発明のオリゴヌクレオチドは、いくつかの実施形態では、12~25ヌクレオチドの長さを有し得る。あるいは、本発明のオリゴヌクレオチドは、いくつかの実施形態では、15~22ヌクレオチドの長さを有し得る。
いくつかの実施形態では、オリゴヌクレオチド又はその連続ヌクレオチド配列は、24以下のヌクレオチド、例えば22、例えば20以下のヌクレオチド、例えば18以下のヌクレオチド、例えば14、15、16、又は17ヌクレオチドを含むか、又はそれらからなる。本明細書で提供されるいずれの範囲も、範囲の終点を含むことを理解するべきである。したがって、核酸分子が12~25ヌクレオチドを含むと記される場合、12ヌクレオチド及び25ヌクレオチドの両方が含まれる。
いくつかの実施形態では、連続ヌクレオチド配列は、12、13、14、15、16、17、18、19、20、21、又は22連続ヌクレオチド長を含むか、又はそれらからなる。
オリゴヌクレオチド(olignucleotide)(複数可)は、哺乳動物における標的核酸の発現の調節用である。いくつかの実施形態では、siRNA、shRNA、及びアンチセンスオリゴヌクレオチド等の核酸分子は、典型的には、標的核酸(複数可)の発現を阻害するためのものである。
本発明の一実施形態では、オリゴヌクレオチドは、RNAi剤、例えばsiRNA又はshRNAから選択される。別の実施形態では、オリゴヌクレオチドは、RNase Hと相互作用する高親和性修飾アンチセンスオリゴヌクレオチドなどの、一本鎖アンチセンスオリゴヌクレオチドである。
いくつかの実施形態では、本発明のオリゴヌクレオチドは、例えば2’糖修飾ヌクレオシドなどの1つ以上の修飾ヌクレオシド又はヌクレオチドを含んでもよい。
いくつかの実施形態では、オリゴヌクレオチドは、ホスホロチオエートヌクレオシド間結合を含む。
いくつかの実施形態では、オリゴヌクレオチドは、非ヌクレオシド部分(コンジュゲート部分)に結合され得る。
オリゴヌクレオチドのライブラリは、バリアントオリゴヌクレオチドのコレクションとして理解されるべきである。オリゴヌクレオチドのライブラリの目的は様々であり得る。いくつかの実施形態では、オリゴヌクレオチドのライブラリは、オリゴヌクレオチドのライブラリ内で最も強力な配列を同定する目的で、1つ又は複数の哺乳動物A1CF標的核酸を標的とする重複する核酸塩基配列を有するオリゴヌクレオチドから構成される。いくつかの実施形態では、オリゴヌクレオチドのライブラリは、親又は先祖オリゴヌクレオチドのオリゴヌクレオチド設計バリアント(子核酸分子)のライブラリであって、オリゴヌクレオチド設計バリアントは、親核酸分子のコア核酸塩基配列を保持する。
アンチセンスオリゴヌクレオチド
本明細書で用いられる「アンチセンスオリゴヌクレオチド」又は「ASO」という用語は、標的核酸、特に標的核酸上の連続配列にハイブリダイズすることによって標的遺伝子の発現を調節することができるオリゴヌクレオチドとして定義される。アンチセンスオリゴヌクレオチドは、本質的に二本鎖ではなく、したがってsiRNA又はshRNAではない。好ましくは、本発明のアンチセンスオリゴヌクレオチドは一本鎖である。本発明の単鎖オリゴヌクレオチドは、自己内又は自己間の相補性の程度がオリゴヌクレオチドの全長にわたって50%未満である限り、ヘアピン又は分子間二重構造(同じオリゴヌクレオチドの2つの分子間の二重鎖)を形成することができるものと理解される。
本明細書で用いられる「アンチセンスオリゴヌクレオチド」又は「ASO」という用語は、標的核酸、特に標的核酸上の連続配列にハイブリダイズすることによって標的遺伝子の発現を調節することができるオリゴヌクレオチドとして定義される。アンチセンスオリゴヌクレオチドは、本質的に二本鎖ではなく、したがってsiRNA又はshRNAではない。好ましくは、本発明のアンチセンスオリゴヌクレオチドは一本鎖である。本発明の単鎖オリゴヌクレオチドは、自己内又は自己間の相補性の程度がオリゴヌクレオチドの全長にわたって50%未満である限り、ヘアピン又は分子間二重構造(同じオリゴヌクレオチドの2つの分子間の二重鎖)を形成することができるものと理解される。
有利には、本発明の一本鎖アンチセンスオリゴヌクレオチドは、ヌクレアーゼ耐性を低下させるためRNAヌクレオシドを含まない。
有利には、本発明のオリゴヌクレオチドは、例えば2’糖修飾ヌクレオシドなどの1つ又は複数の修飾ヌクレオシド又はヌクレオチドを含む。さらに、修飾されていないヌクレオシドがDNAヌクレオシドであることは有利である。
RNAi分子
本明細書では、「RNA干渉(RNAi)分子」という用語は、RNAヌクレオシドを含有し、RNA誘導サイレンシング複合体(RISC)を介してRNA転写物の標的化された切断を媒介する短い二本鎖オリゴヌクレオチドを指し、触媒的RISC成分のアルゴナウトと相互作用する。RNAi分子は、細胞、例えば哺乳動物対象などの対象内の細胞における標的核酸の発現を調節、例えば阻害する。RNAi分子には、一本鎖RNAi分子(Lima at al 2012 Cell 150:883)及び二本鎖siRNA、並びに短ヘアピンRNA(shRNA)が含まれる。本発明のいくつかの実施形態では、本発明のオリゴヌクレオチド、又はその連続ヌクレオチド配列は、siRNAなどのRNAi剤である。
本明細書では、「RNA干渉(RNAi)分子」という用語は、RNAヌクレオシドを含有し、RNA誘導サイレンシング複合体(RISC)を介してRNA転写物の標的化された切断を媒介する短い二本鎖オリゴヌクレオチドを指し、触媒的RISC成分のアルゴナウトと相互作用する。RNAi分子は、細胞、例えば哺乳動物対象などの対象内の細胞における標的核酸の発現を調節、例えば阻害する。RNAi分子には、一本鎖RNAi分子(Lima at al 2012 Cell 150:883)及び二本鎖siRNA、並びに短ヘアピンRNA(shRNA)が含まれる。本発明のいくつかの実施形態では、本発明のオリゴヌクレオチド、又はその連続ヌクレオチド配列は、siRNAなどのRNAi剤である。
siRNA
「低分子干渉リボ核酸」又は「siRNA」という用語は、低分子干渉リボ核酸RNAi分子を指す。それは、二本鎖RNA分子の一種であり、当該技術分野においては、短鎖干渉RNA又はサイレンシングRNAとしても知られている。siRNAは典型的には、(パッセンジャー鎖とも呼ばれる)センス鎖、及び(ガイド鎖とも呼ばれる)アンチセンス鎖を含み、各鎖は17~30ヌクレオチド長、典型的には19~25ヌクレオシド長であり、アンチセンス鎖は、標的核酸(好適には成熟mRNA配列)に対して相補的、例えば少なくとも95%相補的であり、例えば完全に相補的であり、センス鎖はアンチセンス鎖に相補的であるために、センス鎖とアンチセンス鎖はデュプレックス又はデュプレックス領域を形成する。siRNA鎖は、平滑末端二重鎖を形成し得るか、又は有利には、センス鎖及びアンチセンス鎖3’末端は、例えば、1、2、又は3ヌクレオシドの3’オーバーハングを形成することがあり、これは、インビボでRISC基質を形成するDicerによって生成される生成物に類似する。Dicer基質の有効な拡張形態は、参照により本明細書に組み込まれる米国特許第8,349,809号及び米国特許第8,513,207号に記載されている。いくつかの実施形態では、センス鎖及びアンチセンス鎖の両方は、2nt 3’オーバーハングを有する。したがって、二重鎖領域は、例えば17~25ヌクレオチド長、例えば21~23ヌクレオチド長であり得る。
「低分子干渉リボ核酸」又は「siRNA」という用語は、低分子干渉リボ核酸RNAi分子を指す。それは、二本鎖RNA分子の一種であり、当該技術分野においては、短鎖干渉RNA又はサイレンシングRNAとしても知られている。siRNAは典型的には、(パッセンジャー鎖とも呼ばれる)センス鎖、及び(ガイド鎖とも呼ばれる)アンチセンス鎖を含み、各鎖は17~30ヌクレオチド長、典型的には19~25ヌクレオシド長であり、アンチセンス鎖は、標的核酸(好適には成熟mRNA配列)に対して相補的、例えば少なくとも95%相補的であり、例えば完全に相補的であり、センス鎖はアンチセンス鎖に相補的であるために、センス鎖とアンチセンス鎖はデュプレックス又はデュプレックス領域を形成する。siRNA鎖は、平滑末端二重鎖を形成し得るか、又は有利には、センス鎖及びアンチセンス鎖3’末端は、例えば、1、2、又は3ヌクレオシドの3’オーバーハングを形成することがあり、これは、インビボでRISC基質を形成するDicerによって生成される生成物に類似する。Dicer基質の有効な拡張形態は、参照により本明細書に組み込まれる米国特許第8,349,809号及び米国特許第8,513,207号に記載されている。いくつかの実施形態では、センス鎖及びアンチセンス鎖の両方は、2nt 3’オーバーハングを有する。したがって、二重鎖領域は、例えば17~25ヌクレオチド長、例えば21~23ヌクレオチド長であり得る。
一旦細胞内に入ると、アンチセンス鎖は、標的核酸の標的分解又は標的阻害を媒介するRISC複合体に組み込まれる。siRNAは、典型的には、RNAヌクレオシドに加えて修飾ヌクレオシドを含む。一実施形態では、siRNA分子はまた、修飾ヌクレオチド間結合及び2’糖修飾ヌクレオシド、例えば2’-4’二環式リボース修飾ヌクレオシド(LNA及びcET又は2’-O-アルキル-RNA、2’-O-メチル-RNA、2’-アルコキシ-RNA、2’-O-メトキシエチル-RNA(MOE)、2’-アミノ-DNA、2’-フルオロ-DNA、アラビノ核酸(ANA)、2’-フルオロ-ANAのような2’置換修飾を含む)を用いて化学的に修飾されてもよい。特に、2’フルオロ、2’-O-メチル、又は2’-O-メトキシエチルをsiRNAに組み込むことができる。
いくつかの実施形態では、siRNAセンス(パッセンジャー)鎖のヌクレオチドの全ては、LNAなどの2’糖修飾ヌクレオシドで修飾され得る(例えば、国際公開第2004/083430号、同第2007/085485号を参照されたい)。いくつかの実施形態では、siRNAのパッセンジャー鎖は不連続であり得る(例えば、国際公開第2007/107162号を参照されたい)。siRNAのアンチセンス鎖のシード領域で生じる熱不安定化ヌクレオチドの取込みは、siRNAのオフターゲット活性の減少に有用であることが報告されている(例えば、国際公開第2018/098328号を参照されたい)。好適には、siRNAは、アンチセンス鎖の5’末端に5’リン酸基又は5’リン酸模倣物を含む。いくつかの実施形態では、アンチセンス鎖の5’末端は、RNAヌクレオシドである。
一実施形態では、siRNA分子は、少なくとも1つのホスホロチオエート又はメチルホスホネートのヌクレオシド間結合を更に含む。ホスホロチオエート(phosphorothioaie)若しくはメチルホスホネートのヌクレオシド間結合は一方若しくは両方の鎖の3’末端にあり得る(例えば、アンチセンス鎖又はセンス鎖)か、又はホスホロチオエート若しくはメチルホスホネートのヌクレオシド間結合は一方若しくは両方の鎖の5’末端にあり得る(例えば、アンチセンス鎖又はセンス鎖)か、又はホスホロチオエート若しくはメチルホスホネートのヌクレオシド間結合は一方又は両方の鎖の5’末端及び3’末端の両方にあり得る(例えば、アンチセンス鎖又はセンス鎖)。いくつかの実施形態では、残りのヌクレオシド間結合は、ホスホジエステル結合である。いくつかの実施形態では、siRNA分子は、1つ又は複数のホスホロチオエートヌクレオシド間結合を含む。siRNA分子において、ホスホロチオエートヌクレオシド間結合はRICSにおけるヌクレアーゼ切断を減少し得るため、したがって、アンチセンス鎖における全てのヌクレオシド間結合が修飾されはしないことが有利である。
siRNA分子は、リガンドを更に含むことができる。いくつかの実施形態では、リガンドは、センス鎖の3’末端にコンジュゲートされる。
生物学的分布については、siRNAを標的リガンドにコンジュゲートされ得るか、及び/又は脂質ナノ粒子に製剤化され得る。
本発明の他の態様は、治療的使用に適したsiRNA分子といったこれらのdsRNAを含む医薬組成物と、例えば本明細書に開示されている種々の疾患症状の処置のために、本発明のsiRNAといったdsRNA分子を投与することによって標的遺伝子の発現を阻害する方法と、に関する。
shRNA
「短ヘアピンRNA」又は「shRNA」という用語は、一般に40個~70個の間のヌクレオチド長、例えば45個~65個の間のヌクレオチド長、例えば50~60ヌクレオチド長であり、ステムループ(ヘアピン)RNA構造を形成する分子を指し、これは、特徴的な2塩基3’オーバーハングを有する19~23塩基対の短干渉RNAにdsRNAをプロセシングすると考えられるDicerとして既知のエンドヌクレアーゼと相互作用し、次いでRNA誘導サイレンシング複合体(RISC)に組み込まれる。適切な標的mRNAに結合すると、RISC内の1つ又は複数のエンドヌクレアーゼが標的を切断してサイレンシングを誘導する。shRNAオリゴヌクレオチドは、修飾ヌクレオチド間結合及び2’糖修飾ヌクレオシド、例えば2’-4’二環式リボース修飾ヌクレオシド(LNA及びcET又は2’-O-アルキル-RNA、2’-O-メチル-RNA、2’-アルコキシ-RNA、2’-O-メトキシエチル-RNA(MOE)、2’-アミノ-DNA、2’-フルオロ-DNA、アラビノ核酸(ANA)、2’-フルオロ-ANAのような2’置換修飾を含む)を用いて化学的に修飾されてもよい。
「短ヘアピンRNA」又は「shRNA」という用語は、一般に40個~70個の間のヌクレオチド長、例えば45個~65個の間のヌクレオチド長、例えば50~60ヌクレオチド長であり、ステムループ(ヘアピン)RNA構造を形成する分子を指し、これは、特徴的な2塩基3’オーバーハングを有する19~23塩基対の短干渉RNAにdsRNAをプロセシングすると考えられるDicerとして既知のエンドヌクレアーゼと相互作用し、次いでRNA誘導サイレンシング複合体(RISC)に組み込まれる。適切な標的mRNAに結合すると、RISC内の1つ又は複数のエンドヌクレアーゼが標的を切断してサイレンシングを誘導する。shRNAオリゴヌクレオチドは、修飾ヌクレオチド間結合及び2’糖修飾ヌクレオシド、例えば2’-4’二環式リボース修飾ヌクレオシド(LNA及びcET又は2’-O-アルキル-RNA、2’-O-メチル-RNA、2’-アルコキシ-RNA、2’-O-メトキシエチル-RNA(MOE)、2’-アミノ-DNA、2’-フルオロ-DNA、アラビノ核酸(ANA)、2’-フルオロ-ANAのような2’置換修飾を含む)を用いて化学的に修飾されてもよい。
いくつかの実施形態では、shRNA分子は、1つ又は複数のホスホロチオエートヌクレオシド間結合を含む。RNAi分子において、ホスホロチオエートヌクレオシド間結合は、RICSにおけるヌクレアーゼ切断を減少し得るため、したがってshRNA分子のステムループにおける全てのヌクレオシド間結合が修飾されはしないことが有利である。ホスホロチオエートヌクレオシド間結合は、shRNA分子のステムループの3’及び/又は5’末端、特に標的核酸に対して相補的ではない分子の部分に配置されることが有利であり得る。標的核酸に対して相補的なshRNA分子の領域は、しかしながら、Dicerによる切断後に3’末端及び/又は5’末端になると予測される部分における最初の2~3個のヌクレオシド間結合でもまた修飾され得る。
連続ヌクレオチド配列
「連続ヌクレオチド配列」という用語は、標的核酸に対して相補的な核酸分子の領域を指す。この用語は、本明細書で「連続核酸塩基配列」という用語及び「オリゴヌクレオチドモチーフ配列」という用語と互換的に用いられる。いくつかの実施形態では、オリゴヌクレオチドの全てのヌクレオチドが連続ヌクレオチド配列を構成する。いくつかの実施形態では、連続ヌクレオチド配列は、siRNA分子のガイド鎖に含まれる。いくつかの実施形態では、連続ヌクレオチド配列は、標的核酸に対して100%相補的であるshRNA分子の一部である。いくつかの実施形態では、オリゴヌクレオチドは、F-G-F’ギャップマー領域のような連続ヌクレオチド配列を含み、任意に、更なるヌクレオチド(複数可)、例えば、官能基(例えば、標的化のためのコンジュゲート基)を連続ヌクレオチド配列に結合するために使用され得るヌクレオチドリンカー領域を含み得る。ヌクレオチドリンカー領域は、標的核酸に対して相補的であっても相補的でなくてもよい。いくつかの実施形態では、アンチセンスオリゴヌクレオチドの核酸塩基配列は、連続ヌクレオチド配列を構成である。いくつかの実施形態では、連続ヌクレオチド配列は、標的核酸に対して100%相補的である。
「連続ヌクレオチド配列」という用語は、標的核酸に対して相補的な核酸分子の領域を指す。この用語は、本明細書で「連続核酸塩基配列」という用語及び「オリゴヌクレオチドモチーフ配列」という用語と互換的に用いられる。いくつかの実施形態では、オリゴヌクレオチドの全てのヌクレオチドが連続ヌクレオチド配列を構成する。いくつかの実施形態では、連続ヌクレオチド配列は、siRNA分子のガイド鎖に含まれる。いくつかの実施形態では、連続ヌクレオチド配列は、標的核酸に対して100%相補的であるshRNA分子の一部である。いくつかの実施形態では、オリゴヌクレオチドは、F-G-F’ギャップマー領域のような連続ヌクレオチド配列を含み、任意に、更なるヌクレオチド(複数可)、例えば、官能基(例えば、標的化のためのコンジュゲート基)を連続ヌクレオチド配列に結合するために使用され得るヌクレオチドリンカー領域を含み得る。ヌクレオチドリンカー領域は、標的核酸に対して相補的であっても相補的でなくてもよい。いくつかの実施形態では、アンチセンスオリゴヌクレオチドの核酸塩基配列は、連続ヌクレオチド配列を構成である。いくつかの実施形態では、連続ヌクレオチド配列は、標的核酸に対して100%相補的である。
ヌクレオチド及びヌクレオシド
ヌクレオチド及びヌクレオシドは、オリゴヌクレオチド及びポリヌクレオチドの構成単位であり、本発明の目的のために、天然に存在するヌクレオチド及びヌクレオシドと、天然に存在しないヌクレオチド及びヌクレオシドとの両方を含む。本来、DNAヌクレオチド及びRNAヌクレオチドなどのヌクレオチドは、リボース糖部分、核酸塩基部分、及び1つ又は複数のリン酸基(ヌクレオシドには存在しない)を含む。ヌクレオシド及びヌクレオチドはまた、互換的に「単位」又は「モノマー」と呼ぶことができる。
ヌクレオチド及びヌクレオシドは、オリゴヌクレオチド及びポリヌクレオチドの構成単位であり、本発明の目的のために、天然に存在するヌクレオチド及びヌクレオシドと、天然に存在しないヌクレオチド及びヌクレオシドとの両方を含む。本来、DNAヌクレオチド及びRNAヌクレオチドなどのヌクレオチドは、リボース糖部分、核酸塩基部分、及び1つ又は複数のリン酸基(ヌクレオシドには存在しない)を含む。ヌクレオシド及びヌクレオチドはまた、互換的に「単位」又は「モノマー」と呼ぶことができる。
修飾ヌクレオシド
本明細書で用いられる「修飾ヌクレオシド」又は「ヌクレオシド修飾」という用語は、糖部分又は(核酸)塩基部分の1つ又は複数の修飾の導入によって、同等のDNA又はRNAヌクレオシドと比較して修飾されたヌクレオシドを指す。有利には、修飾ヌクレオシドの1つ又は複数は修飾糖部分を含む。修飾ヌクレオシドという用語はまた、「ヌクレオシド類似体」又は修飾「ユニット」又は修飾「モノマー」という用語と互換的に使用されてもよい。非修飾DNA又はRNA糖部分を有するヌクレオシドは、本明細書ではDNA又はRNAヌクレオシドと称される。DNA又はRNAヌクレオシドの塩基領域に修飾を有するヌクレオシドは、それらがワトソン・クリック塩基対合可能な場合には、依然として一般的にDNA又はRNAと称される。
本明細書で用いられる「修飾ヌクレオシド」又は「ヌクレオシド修飾」という用語は、糖部分又は(核酸)塩基部分の1つ又は複数の修飾の導入によって、同等のDNA又はRNAヌクレオシドと比較して修飾されたヌクレオシドを指す。有利には、修飾ヌクレオシドの1つ又は複数は修飾糖部分を含む。修飾ヌクレオシドという用語はまた、「ヌクレオシド類似体」又は修飾「ユニット」又は修飾「モノマー」という用語と互換的に使用されてもよい。非修飾DNA又はRNA糖部分を有するヌクレオシドは、本明細書ではDNA又はRNAヌクレオシドと称される。DNA又はRNAヌクレオシドの塩基領域に修飾を有するヌクレオシドは、それらがワトソン・クリック塩基対合可能な場合には、依然として一般的にDNA又はRNAと称される。
修飾ヌクレオシド間結合
「修飾ヌクレオシド間結合」という用語は、2つのヌクレオシドを共に共有結合する、ホスホジエステル(PO)結合以外の結合として当業者に一般的に理解されるように定義される。したがって、本発明のオリゴヌクレオチドは、1又は複数のホスホロチオエートのヌクレオシド間結合又は1又は複数のホスホロジチオエートのヌクレオシド間結合のような、1又は複数の修飾ヌクレオシド間結合を含むことができる。
「修飾ヌクレオシド間結合」という用語は、2つのヌクレオシドを共に共有結合する、ホスホジエステル(PO)結合以外の結合として当業者に一般的に理解されるように定義される。したがって、本発明のオリゴヌクレオチドは、1又は複数のホスホロチオエートのヌクレオシド間結合又は1又は複数のホスホロジチオエートのヌクレオシド間結合のような、1又は複数の修飾ヌクレオシド間結合を含むことができる。
本発明のオリゴヌクレオチドでは、ホスホロチオエートヌクレオシド間結合を用いることが有利である。
ホスホロチオエートヌクレオシド間結合は、ヌクレアーゼ耐性、有益な薬物動態、及び製造の容易さに起因して、特に有用である。いくつかの実施形態では、オリゴヌクレオチド又はその連続ヌクレオチド配列の少なくとも50%のヌクレオシド間結合がホスホロチオエートであり、オリゴヌクレオチド又はその連続ヌクレオチド配列の少なくとも60%、例えば少なくとも70%、例えば少なくとも75%、例えば少なくとも80%又は例えば少なくとも90%のヌクレオシド間結合が、ホスホロチオエートである。いくつかの実施形態では、オリゴヌクレオチド又はその連続ヌクレオチド配列のヌクレオシド間結合の全てが、ホスホロチオアートである。
いくつかの有利な実施形態では、オリゴヌクレオチドの連続ヌクレオチド配列の全てのヌクレオシド間結合がホスホロチオエートであるか、又はオリゴヌクレオチドの全てのヌクレオシド間結合がホスホロチオエート結合である。
EP 2 742 135に開示されているように、アンチセンスオリゴヌクレオチドは、他のヌクレオシド間結合(ホスホジエステル及びホスホロチオエート以外の)、例えばアルキルホスホネート/メチルホスホネートヌクレオシド間結合を含んでもよいことが認識され、これはEP 2 742 135によれば、例えば別のDNAホスホロチオエートのギャップ領域内で耐性であり得る。
核酸塩基
「核酸塩基」という用語は、ヌクレオシド及びヌクレオチドに存在するプリン(例えばアデニン及びグアニン)及びピリミジン(例えばウラシル、チミン及びシトシン)部分を含み、これらは核酸ハイブリダイゼーションにおいて水素結合を形成する。本発明の文脈において、核酸塩基という用語はまた、天然に存在する核酸塩基とは異なっていてもよいが、核酸ハイブリダイゼーション中に機能する修飾核酸塩基も包含する。この文脈において、「核酸塩基」とは、アデニン、グアニン、シトシン、チミジン、ウラシル、キサンチン、及びヒポキサンチンなどの天然に存在する核酸塩基と、天然に存在しないバリアントとの両方を指す。このようなバリアントは、例えば、Hirao et al(2012)Accounts of Chemical Research vol 45 page 2055及びBergstrom(2009)Current Protocols in Nucleic Acid Chemistry Suppl.37 1.4.1に記載されている。
「核酸塩基」という用語は、ヌクレオシド及びヌクレオチドに存在するプリン(例えばアデニン及びグアニン)及びピリミジン(例えばウラシル、チミン及びシトシン)部分を含み、これらは核酸ハイブリダイゼーションにおいて水素結合を形成する。本発明の文脈において、核酸塩基という用語はまた、天然に存在する核酸塩基とは異なっていてもよいが、核酸ハイブリダイゼーション中に機能する修飾核酸塩基も包含する。この文脈において、「核酸塩基」とは、アデニン、グアニン、シトシン、チミジン、ウラシル、キサンチン、及びヒポキサンチンなどの天然に存在する核酸塩基と、天然に存在しないバリアントとの両方を指す。このようなバリアントは、例えば、Hirao et al(2012)Accounts of Chemical Research vol 45 page 2055及びBergstrom(2009)Current Protocols in Nucleic Acid Chemistry Suppl.37 1.4.1に記載されている。
いくつかの実施形態では、核酸塩基部分は、プリン又はピリミジンを修飾プリン又はピリミジン、例えば置換プリン又は置換ピリミジン、例えばイソシトシン、シュードイソシトシン、5-メチルシトシン、5-チアゾロ-シトシン、5-プロピニル-シトシン、5-プロピニル-ウラシル、5-ブロモウラシル5-チアゾロ-ウラシル、2-チオ-ウラシル、2’チオ-チミン、イノシン、ジアミノプリン、6-アミノプリン、2-アミノプリン、2,6-ジアミノプリン及び2-クロロ-6-アミノプリンから選択される核酸塩基(nucleobased)に変えることにより修飾される。
核酸塩基部分は、対応する各核酸塩基についての文字コード、例えば、A、T、G、C又はUにより示されてもよく、各文字は、任意に等価機能の改変された核酸塩基を含んでもよい。例えば、例示したオリゴヌクレオチドにおいて、核酸塩基部分は、A、T、G、C、及び5-メチルシトシンから選択される。任意に、LNAギャップマーについて、5-メチルシトシンLNAヌクレオシドが使用され得る。
修飾オリゴヌクレオチド
「修飾オリゴヌクレオチド」という用語は、1つ若しくは複数の糖修飾ヌクレオシド及び/又は修飾ヌクレオシド間結合を含むオリゴヌクレオチドを表す。「キメラオリゴヌクレオチド」という用語は、修飾ヌクレオシド及びDNAヌクレオシドを含むオリゴヌクレオチドを記述するために文献で使用されている用語である。本発明のアンチセンスオリゴヌクレオチドは、有利にはキメラオリゴヌクレオチドである。
「修飾オリゴヌクレオチド」という用語は、1つ若しくは複数の糖修飾ヌクレオシド及び/又は修飾ヌクレオシド間結合を含むオリゴヌクレオチドを表す。「キメラオリゴヌクレオチド」という用語は、修飾ヌクレオシド及びDNAヌクレオシドを含むオリゴヌクレオチドを記述するために文献で使用されている用語である。本発明のアンチセンスオリゴヌクレオチドは、有利にはキメラオリゴヌクレオチドである。
相補性
「相補性」又は「相補的」という用語は、ヌクレオシド/ヌクレオチドのWatson-Crick塩基対形成の能力を表す。ワトソン・クリック塩基対は、グアニン(G)-シトシン(C)及びアデニン(A)-チミン(T)/ウラシル(U)である。オリゴヌクレオチドは修飾核酸塩基を有するヌクレオシドを含んでいてもよく、例えば5-メチルシトシンは、しばしばシトシンの代わりに用いられ、したがって、相補性という用語は、非修飾核酸塩基と修飾核酸塩基との間のワトソン・クリック塩基対合を包含することが理解されよう(例えば、Hirao et al(2012)Accounts of Chemical Research vol 45 page 2055 and Bergstrom(2009)Current Protocols in Nucleic Acid Chemistry Suppl.37 1.4.1を参照されたい)。
「相補性」又は「相補的」という用語は、ヌクレオシド/ヌクレオチドのWatson-Crick塩基対形成の能力を表す。ワトソン・クリック塩基対は、グアニン(G)-シトシン(C)及びアデニン(A)-チミン(T)/ウラシル(U)である。オリゴヌクレオチドは修飾核酸塩基を有するヌクレオシドを含んでいてもよく、例えば5-メチルシトシンは、しばしばシトシンの代わりに用いられ、したがって、相補性という用語は、非修飾核酸塩基と修飾核酸塩基との間のワトソン・クリック塩基対合を包含することが理解されよう(例えば、Hirao et al(2012)Accounts of Chemical Research vol 45 page 2055 and Bergstrom(2009)Current Protocols in Nucleic Acid Chemistry Suppl.37 1.4.1を参照されたい)。
用語「%相補的」とは、本明細書で使用される場合、連続ヌクレオチド配列にわたって参照配列(例えば、標的配列又は配列モチーフ)に対して相補的である、核酸分子(例えば、オリゴヌクレオチド)の連続ヌクレオチド配列のヌクレオチドの割合(パーセント)を指す。したがって、相補性のパーセンテージは、2つの配列間(標的配列5’-3’と3’-5’からのオリゴヌクレオチド配列とを整列させた場合)で相補的である(ワトソン・クリック塩基対から)整列した核酸塩基の数を数え、その数をオリゴヌクレオチド中のヌクレオチドの総数で割り、100を掛けることによって計算される。このような比較において、整列(塩基対を形成)しない核酸塩基/ヌクレオチドは、ミスマッチと称される。挿入及び欠失は、連続ヌクレオチド配列の%相補性の計算において許容されない。相補性の決定において、核酸塩基の化学的修飾は、核酸塩基がワトソン・クリック塩基対合を形成する機能的能力が保持される限り、無視されることが理解されるであろう(例えば、5’-メチルシトシンは、%同一性の計算の目的のために、シトシンと同一であると見なされる)。
「完全に相補的な」という用語は、100%の相補性を指す。
同一性
本明細書で使用される「同一性」という用語は、連続ヌクレオチド配列にわたって参照配列(例えば、配列モチーフ)と同一である、核酸分子(例えば、オリゴヌクレオチド)内の連続ヌクレオチド配列のヌクレオチドの割合(パーセントで表される)を指す。したがって、同一性のパーセンテージは、2つの配列(本発明の化合物の連続ヌクレオチド配列及び参照配列における)の間で同一の(一致する)整列された核酸塩基の数を数え、その数をオリゴヌクレオチドのヌクレオチドの総数で割り、100を掛けることにより計算される。したがって、同一性の百分率=(一致数×100)/整列領域(例えば、連続ヌクレオチド配列)の長さ。挿入及び欠失は、連続ヌクレオチド配列の同一性の百分率の計算において許容されない。同一性の決定において、核酸塩基の化学的修飾は、核酸塩基がWatson Crick塩基対を形成する機能的能力が保持される限り、無視されることが理解されよう(例えば、5-メチルシトシンは、同一性%の計算の目的のために、シトシンと同一であると見なされる)。
本明細書で使用される「同一性」という用語は、連続ヌクレオチド配列にわたって参照配列(例えば、配列モチーフ)と同一である、核酸分子(例えば、オリゴヌクレオチド)内の連続ヌクレオチド配列のヌクレオチドの割合(パーセントで表される)を指す。したがって、同一性のパーセンテージは、2つの配列(本発明の化合物の連続ヌクレオチド配列及び参照配列における)の間で同一の(一致する)整列された核酸塩基の数を数え、その数をオリゴヌクレオチドのヌクレオチドの総数で割り、100を掛けることにより計算される。したがって、同一性の百分率=(一致数×100)/整列領域(例えば、連続ヌクレオチド配列)の長さ。挿入及び欠失は、連続ヌクレオチド配列の同一性の百分率の計算において許容されない。同一性の決定において、核酸塩基の化学的修飾は、核酸塩基がWatson Crick塩基対を形成する機能的能力が保持される限り、無視されることが理解されよう(例えば、5-メチルシトシンは、同一性%の計算の目的のために、シトシンと同一であると見なされる)。
ハイブリダイゼーション
本明細書で用いられる「ハイブリダイズ」又は「ハイブリダイズする」という用語は、2つの核酸鎖(例えば、オリゴヌクレオチド及び標的核酸)が対向する鎖上の塩基対間に水素結合を形成することにより二重鎖を形成することと理解されるべきである。2つの核酸鎖の間の結合の親和性は、ハイブリダイゼーションの強度である。これは、オリゴヌクレオチドの半分が標的核酸と二重鎖を形成する温度として定義される、融解温度(Tm)によって説明されることが多い。生理学的条件では、Tmは親和性に厳密に比例しない(Mergny及びLacroix(2003年)「Oligonucleotides」第13巻、第515~537頁)。標準状態ギブス自由エネルギーΔG°は、結合親和性をより正確に表し、ΔG°=-RTln(Kd)によって反応の解離定数(Kd)に関連付けられ、式中、Rは気体定数であり、Tは絶対温度である。したがって、オリゴヌクレオチドと標的核酸との間の反応の非常に低いΔG°は、オリゴヌクレオチドと標的核酸との間の強いハイブリダイゼーションを反映している。ΔG°は、水性濃度が1M、pHが7、温度が37℃の反応に関連したエネルギーである。標的核酸へのオリゴヌクレオチドのハイブリダイゼーションは、自発反応であり、自発反応の場合、ΔG°はゼロ未満である。ΔG°は、Hansen et al.,1965,Chem.Comm.36-38及びHoldgate et al.,2005,Drug Discov Todayに記載されているように、例えば等温滴定熱量測定(ITC)により、実験的に測定し得る。当業者は、ΔG°測定のために市販の装置が入手可能であることを知るであろう。ΔG°は、SantaLucia,1998,Proc Natl Acad Sci USA.95:1460-1465 に記載の最近接モデル(nearest neighbor model)を用いて、Sugimoto et al.,1995,Biochemistry 34:11211-11216 and McTigue et al.,2004,Biochemistry 43:5388-5405に記載される適切に得られる熱力学的パラメータを使用し、数値的に推定し得る。その意図した核酸標的をハイブリダイゼーションによって調節する可能性を確保するために、本発明のオリゴヌクレオチドは、10~30ヌクレオチド長のオリゴヌクレオチドに対して-10kcal未満の推定ΔG°値で標的核酸にハイブリダイズする。いくつかの実施形態では、ハイブリダイゼーションの程度又は強度は、標準状態ギブス自由エネルギーΔG°により測定される。オリゴヌクレオチドは、8~30ヌクレオチド長のオリゴヌクレオチドについて、-10kcal未満、例えば-15kcal未満、例えば-20kcal未満、及び例えば-25kcal未満の推定ΔG°値で標的核酸にハイブリダイズし得る。いくつかの実施形態では、オリゴヌクレオチドは、-10から-60kcal、例えば-12から-40、例えば-15から-30kcal、又は-16から-27kcal、例えば-18から-25kcalの範囲内の推定ΔG°値で、標的核酸にハイブリダイズする。
本明細書で用いられる「ハイブリダイズ」又は「ハイブリダイズする」という用語は、2つの核酸鎖(例えば、オリゴヌクレオチド及び標的核酸)が対向する鎖上の塩基対間に水素結合を形成することにより二重鎖を形成することと理解されるべきである。2つの核酸鎖の間の結合の親和性は、ハイブリダイゼーションの強度である。これは、オリゴヌクレオチドの半分が標的核酸と二重鎖を形成する温度として定義される、融解温度(Tm)によって説明されることが多い。生理学的条件では、Tmは親和性に厳密に比例しない(Mergny及びLacroix(2003年)「Oligonucleotides」第13巻、第515~537頁)。標準状態ギブス自由エネルギーΔG°は、結合親和性をより正確に表し、ΔG°=-RTln(Kd)によって反応の解離定数(Kd)に関連付けられ、式中、Rは気体定数であり、Tは絶対温度である。したがって、オリゴヌクレオチドと標的核酸との間の反応の非常に低いΔG°は、オリゴヌクレオチドと標的核酸との間の強いハイブリダイゼーションを反映している。ΔG°は、水性濃度が1M、pHが7、温度が37℃の反応に関連したエネルギーである。標的核酸へのオリゴヌクレオチドのハイブリダイゼーションは、自発反応であり、自発反応の場合、ΔG°はゼロ未満である。ΔG°は、Hansen et al.,1965,Chem.Comm.36-38及びHoldgate et al.,2005,Drug Discov Todayに記載されているように、例えば等温滴定熱量測定(ITC)により、実験的に測定し得る。当業者は、ΔG°測定のために市販の装置が入手可能であることを知るであろう。ΔG°は、SantaLucia,1998,Proc Natl Acad Sci USA.95:1460-1465 に記載の最近接モデル(nearest neighbor model)を用いて、Sugimoto et al.,1995,Biochemistry 34:11211-11216 and McTigue et al.,2004,Biochemistry 43:5388-5405に記載される適切に得られる熱力学的パラメータを使用し、数値的に推定し得る。その意図した核酸標的をハイブリダイゼーションによって調節する可能性を確保するために、本発明のオリゴヌクレオチドは、10~30ヌクレオチド長のオリゴヌクレオチドに対して-10kcal未満の推定ΔG°値で標的核酸にハイブリダイズする。いくつかの実施形態では、ハイブリダイゼーションの程度又は強度は、標準状態ギブス自由エネルギーΔG°により測定される。オリゴヌクレオチドは、8~30ヌクレオチド長のオリゴヌクレオチドについて、-10kcal未満、例えば-15kcal未満、例えば-20kcal未満、及び例えば-25kcal未満の推定ΔG°値で標的核酸にハイブリダイズし得る。いくつかの実施形態では、オリゴヌクレオチドは、-10から-60kcal、例えば-12から-40、例えば-15から-30kcal、又は-16から-27kcal、例えば-18から-25kcalの範囲内の推定ΔG°値で、標的核酸にハイブリダイズする。
標的核酸
本発明によれば、標的核酸は、哺乳動物A1CFをコードする核酸であり、例えば遺伝子、RNA、mRNA、及びプレmRNA、成熟mRNA又はcDNA配列であり得る。したがって、標的は、A1CF標的核酸と称することができる。
本発明によれば、標的核酸は、哺乳動物A1CFをコードする核酸であり、例えば遺伝子、RNA、mRNA、及びプレmRNA、成熟mRNA又はcDNA配列であり得る。したがって、標的は、A1CF標的核酸と称することができる。
適切には、標的核酸は、A1CFタンパク質、特に、本明細書で配列番号1、4、5、6、7、8、9、10、又は11として提供されるpre-mRNA又はmRNA配列をコードするヒトA1CF遺伝子などの哺乳動物A1CFをコードする。
本発明の治療用オリゴヌクレオチドは、例えば、哺乳動物A1CFのエクソン領域(特に、siRNA及びshRNAであるが、アンチセンスオリゴヌクレオチドでもある)を標的とすることができるか、又は例えば、A1CFプレmRNA(特に、アンチセンスオリゴヌクレオチド)の任意のイントロン領域を標的とすることができる。ヒトA1CF遺伝子は10個の転写物をコードし、そのうちの8個はタンパク質コードであり、したがって潜在的な核酸標的である。
適切には、標的核酸は、ヒト、カニクイザル及びマウスA1CF(表2)のゲノム配列並びにヒト、サル及びマウスA1CFのプレmRNA配列並びにヒトA1CFの成熟mRNA(表3)の概要を提供するヒトA1CF(例えば表2及び表3を参照)などのA1CFタンパク質、特に哺乳動物A1CFをコードする。
本発明の核酸分子を研究又は診断に使用する場合、標的核酸は、cDNA、又はDNA若しくはRNAに由来する合成核酸であり得る。
インビボ又はインビトロ用途に関して、本発明の治療用核酸分子は、典型的には、A1CF標的核酸を発現する細胞内で、A1CF標的核酸の発現を阻害することが可能である。いくつかの実施形態では、上記細胞は、HBV cccDNAを含む。本発明の核酸分子の核酸塩基の連続配列は、典型的には、核酸分子の長さにわたって測定して、任意に1つ又は2つのミスマッチを除いて、また任意にオリゴヌクレオチドをコンジュゲートなどの任意の官能基に結合し得るヌクレオチドベースのリンカー領域、又は他の非相補的末端ヌクレオチドを除いて、A1CF標的核酸の保存された領域に対して相補的である。標的核酸は、哺乳動物A1CFタンパク質、例えばヒトA1CF、例えば配列番号1として開示されるものなどのヒトA1CFプレmRNA配列、配列番号2として開示されるものなどのサルA1CFプレmRNA配列、又は配列番号3として開示されるものなどのマウスA1CFプレmRNA配列をコードするプレmRNA、又は配列番号4、6、7、8、10、若しくは11として開示されるヒト成熟mRNAなどの成熟A1CFmRNAなどのメッセンジャーRNAである。配列番号1~13はDNA配列である。標的RNA配列は、チミジン塩基(T)の代わりに、ウラシル(U)塩基を有することが理解されよう。
いくつかの実施形態では、標的核酸は、配列番号1である。
いくつかの実施形態では、標的核酸は、配列番号2である。
いくつかの実施形態では、標的核酸は、配列番号3である。
いくつかの実施形態では、標的核酸は、配列番号4である。
いくつかの実施形態では、標的核酸は、配列番号5である。
いくつかの実施形態では、標的核酸は、配列番号6である。
いくつかの実施形態では、標的核酸は、配列番号7である。
いくつかの実施形態では、標的核酸は、配列番号8である。
いくつかの実施形態では、標的核酸は、配列番号9である。
いくつかの実施形態では、標的核酸は、配列番号10である。
いくつかの実施形態では、標的核酸は、配列番号11である。
標的配列
本明細書で使用される用語「標的配列」は、本発明のオリゴヌクレオチド又は核酸分子に対して相補的な核酸塩基配列を含む、標的核酸中に存在するヌクレオチドの配列を指す。いくつかの実施形態では、標的配列は、本発明のオリゴヌクレオチドの連続ヌクレオチド配列に対して相補的な核酸塩基配列を有する標的核酸上の領域からなる。標的核酸のこの領域は、互換的に標的ヌクレオチド配列、標的配列、又は標的領域と称され得る。いくつかの実施形態では、標的配列は、本発明の核酸分子の相補的配列よりも長く、例えば、本発明のいくつかの核酸分子により標的とされ得る標的核酸の好ましい領域を表し得る。
本明細書で使用される用語「標的配列」は、本発明のオリゴヌクレオチド又は核酸分子に対して相補的な核酸塩基配列を含む、標的核酸中に存在するヌクレオチドの配列を指す。いくつかの実施形態では、標的配列は、本発明のオリゴヌクレオチドの連続ヌクレオチド配列に対して相補的な核酸塩基配列を有する標的核酸上の領域からなる。標的核酸のこの領域は、互換的に標的ヌクレオチド配列、標的配列、又は標的領域と称され得る。いくつかの実施形態では、標的配列は、本発明の核酸分子の相補的配列よりも長く、例えば、本発明のいくつかの核酸分子により標的とされ得る標的核酸の好ましい領域を表し得る。
いくつかの実施形態では、標的配列は、ヒトA1CF mRNAエクソン、例えばe1、e2、e3、e4、e5、e6、e7、e8、e9、e10、e11、e12、13、e14、及びe15からなる群から選択されるA1CFヒトmRNAエクソンからなる群から選択される配列である(例えば上記の表1参照)。
したがって、本発明は、e1~e15(表1参照)からなる群から選択される配列番号1のエクソン領域に対して少なくとも90%相補的、例えば完全に相補的な連続配列を含むオリゴヌクレオチドを提供する。
いくつかの実施形態では、標的配列は、ヒトA1CF mRNAイントロン、例えば、i1、i2、i3、i4、i5、i6、i7、i8、i9、i10、i11、i12、i13、及びi14からなる群から選択されるA1CFヒトmRNAイントロンからなる群から選択される配列である(例えば上記の表1参照)。
したがって、本発明は、i1~i14(表1参照)からなる群から選択される配列番号1のイントロン領域に対して少なくとも90%相補的、例えば完全に相補的な連続配列を含むオリゴヌクレオチドを提供する。
いくつかの実施形態では、標的配列は、配列番号12、13、14及び15からなる群から選択される。いくつかの実施形態では、本明細書で言及される連続ヌクレオチド配列は、配列番号12、13、14及び15からなる群から選択される標的配列に対して少なくとも90%相補的、例えば少なくとも95%相補的である。いくつかの実施形態では、連続ヌクレオチド配列は、配列番号12、13、14及び15からなる群から選択される標的配列に対して完全に相補的である。
本発明のオリゴヌクレオチドは、標的核酸上の領域、例えば本明細書に記載される標的配列に対して相補的又はハイブリダイズする連続ヌクレオチド配列を含む。
治療用オリゴヌクレオチドが相補的であるか又はハイブリダイズする標的核酸配列は、一般に、少なくとも10ヌクレオチドの一続きの連続する核酸塩基を含む。連続ヌクレオチド配列は、12個~70個の間のヌクレオチド、例えば12~50、例えば13~30、例えば14~25、例えば15~20、例えば16~18連続ヌクレオチドである。
いくつかの実施形態において、標的配列は、上記の表5に示されるような標的領域1C~178Cからなる群から選択される。
標的細胞
本明細書で使用される用語「標的細胞」は、標的核酸を発現している細胞を指す。本発明の治療的使用のためには、標的細胞がHBVに感染している場合が有利である。いくつかの実施形態では、標的細胞は、インビボ又はインビトロであり得る。いくつかの実施形態では、標的細胞は、哺乳動物細胞、例えばげっ歯類細胞、例えばマウス細胞若しくはラット細胞、若しくはウッドチャック細胞、又は霊長類細胞、例えばサル細胞(例えば、カニクイザル細胞)若しくはヒト細胞である。
本明細書で使用される用語「標的細胞」は、標的核酸を発現している細胞を指す。本発明の治療的使用のためには、標的細胞がHBVに感染している場合が有利である。いくつかの実施形態では、標的細胞は、インビボ又はインビトロであり得る。いくつかの実施形態では、標的細胞は、哺乳動物細胞、例えばげっ歯類細胞、例えばマウス細胞若しくはラット細胞、若しくはウッドチャック細胞、又は霊長類細胞、例えばサル細胞(例えば、カニクイザル細胞)若しくはヒト細胞である。
好ましい実施形態では、標的細胞は、A1CFプレmRNA又はA1CF成熟mRNAなどのA1CF mRNAを発現する。A1CF mRNAのポリAテールは、典型的には、アンチセンスオリゴヌクレオチド標的化では無視される。
更に、標的細胞は肝細胞であってもよい。一実施形態では、標的細胞は、HBVに感染した初代ヒト肝細胞であり、HBV感染個体に由来するか、又はヒト化肝臓を有するHBVに感染したマウス(PhoenixBio、PXBマウス)に由来するかのいずれかである。
本発明によれば、標的細胞は、HBVに感染していてもよい。更に、標的細胞は、HBV cccDNAを含み得る。したがって、標的細胞は、A1CFプレmRNA又はA1CF成熟mRNAなどのA1CF mRNA及びHBV cccDNAを含むことが好ましい。一実施形態では、標的細胞はヒト細胞である。一実施形態では、ヒト細胞は肝細胞である。
天然に存在するバリアント
用語「天然に存在するバリアント」とは、標的核酸と同じ遺伝子座に由来するが、例えば、同じアミノ酸をコードする多数のコドンを引き起こす遺伝コードの縮重のために、又はプレmRNAの選択的スプライシング、又は多型、例えば単一ヌクレオチド多型(SNP)の存在に起因して異なり得るA1CF遺伝子又は転写産物のバリアント、及び対立遺伝子バリアントを指す。オリゴヌクレオチドに対する十分な相補的な配列の存在に基づいて、本発明のオリゴヌクレオチドは、したがって、標的核酸及びその天然に存在するバリアントを標的とし得る。
用語「天然に存在するバリアント」とは、標的核酸と同じ遺伝子座に由来するが、例えば、同じアミノ酸をコードする多数のコドンを引き起こす遺伝コードの縮重のために、又はプレmRNAの選択的スプライシング、又は多型、例えば単一ヌクレオチド多型(SNP)の存在に起因して異なり得るA1CF遺伝子又は転写産物のバリアント、及び対立遺伝子バリアントを指す。オリゴヌクレオチドに対する十分な相補的な配列の存在に基づいて、本発明のオリゴヌクレオチドは、したがって、標的核酸及びその天然に存在するバリアントを標的とし得る。
いくつかの実施形態では、天然に存在するバリアントは、哺乳動物A1CF標的核酸、例えば配列番号1及び/又は配列番号2に対して少なくとも95%、例えば少なくとも98%又は少なくとも99%相同性を有する。いくつかの実施形態では、天然に存在するバリアントは、配列番号1のヒトA1CF標的核酸に対して少なくとも99%相同性を有する。いくつかの実施形態では、天然に存在するバリアントは、既知の多型である。
発現の阻害
本明細書で使用される「発現の阻害」という用語は、標的細胞においてA1CF(APOBEC1相補因子)の量又は活性を阻害するA1CF阻害剤の能力の全体的な用語として理解されるべきである。発現又は活性の阻害は、A1CFプレmRNA若しくはA1CF mRNAのレベルを測定することによって、又は細胞中のA1CFタンパク質若しくは活性のレベルを測定することによって決定され得る。発現の阻害は、インビトロ又はインビボで決定され得る。阻害は、対照を参照することによって決定される。対照は、生理食塩水組成物で処理された個々の細胞又は標的細胞であることが一般に理解される。
本明細書で使用される「発現の阻害」という用語は、標的細胞においてA1CF(APOBEC1相補因子)の量又は活性を阻害するA1CF阻害剤の能力の全体的な用語として理解されるべきである。発現又は活性の阻害は、A1CFプレmRNA若しくはA1CF mRNAのレベルを測定することによって、又は細胞中のA1CFタンパク質若しくは活性のレベルを測定することによって決定され得る。発現の阻害は、インビトロ又はインビボで決定され得る。阻害は、対照を参照することによって決定される。対照は、生理食塩水組成物で処理された個々の細胞又は標的細胞であることが一般に理解される。
「阻害」又は「阻害する」という用語は、A1CFの発現又は活性を下方調節する、減少させる、抑制する、減らす、低下させる、低減させるとも呼ばれ得る。
A1CFの発現の阻害は、例えばプレmRNA又はmRNAの分解によって、例えばRNA干渉経路を介して機能するギャップマー又は核酸分子、例えばsiRNA又はshRNAなどのオリゴヌクレオチドを動員するRNase Hを使用して起こり得る。あるいは、本発明の阻害剤は、A1CFポリペプチドに結合し、A1CFの活性を阻害するか、又は他の分子へのその結合を妨げ得る。
いくつかの実施形態では、A1CF標的核酸の発現又はA1CFタンパク質の活性の阻害は、標的細胞中のHBV cccDNAの量の減少をもたらす。好ましくは、HBV cccDNAの量は、対照と比較して低減する。いくつかの実施形態では、HBV cccDNAの量の減少は、対照と比較して少なくとも20%、少なくとも30%である。いくつかの実施形態では、HBV感染細胞中のcccDNAの量は、対照と比較した場合、少なくとも50%、例えば60%、例えば70%減少する。
いくつかの実施形態では、A1CF標的核酸の発現又はA1CFタンパク質の活性の阻害は、標的細胞中のHBV pgRNAの量の低減をもたらす。好ましくは、HBV pgRNAの量は、対照と比較して低減する。いくつかの実施形態では、HBV pgRNAの量の低減は、対照と比較して、少なくとも20%、少なくとも30%である。いくつかの実施形態では、HBV感染細胞中のpgRNAの量は、対照と比較した場合、少なくとも50%、例えば60%減少する。
糖修飾
本発明のオリゴヌクレオチドは、修飾された糖部分、すなわち、DNA及びRNAに見られるリボース糖部分と比較した場合の糖部分の修飾を有する1つ又は複数のヌクレオシドを含み得る。
本発明のオリゴヌクレオチドは、修飾された糖部分、すなわち、DNA及びRNAに見られるリボース糖部分と比較した場合の糖部分の修飾を有する1つ又は複数のヌクレオシドを含み得る。
リボース糖部分の修飾を有する数多くのヌクレオシドは、親和性及び/又はヌクレアーゼ耐性などのオリゴヌクレオチドのある特定の性質を改善することを主な目的として作製されてきた。
このような修飾には、例えば、ヘキソース環(HNA)、又は典型的にはリボース環(LNA)上のC2炭素とC4炭素との間にビラジカル架橋を有する二環式環、又は典型的にはC2炭素とC3炭素との間の結合を欠く非結合リボース環(例えば、UNA)で置き換えることにより、リボース環構造が修飾されているものが含まれる。他の糖修飾ヌクレオシドには、例えばビシクロヘキソース核酸(国際公開第2011/017521号)又は三環式核酸(国際公開第2013/154798号)が含まれる。修飾ヌクレオシドにはまた、糖部分が例えばペプチド核酸(PNA)又はモルホリノ核酸の場合には非糖部分で置き換えられているヌクレオシドが含まれる。
糖修飾にはまた、リボース環上の置換基を、水素以外の基、又はDNA及びRNAヌクレオシド中に天然に存在する2’-OH基に変更することによってなされる修飾も含まれる。置換基は、例えば2’、3’、4’、又は5’位で導入され得る。
高親和性修飾ヌクレオシド
高親和性修飾ヌクレオシドは、修飾されたヌクレオチドであり、これは、オリゴヌクレオチドに組み込まれる場合、例えば融解温度(Tm)によって測定されるように、その相補的標的に対するオリゴヌクレオチドの親和性を高める。本発明の高親和性修飾ヌクレオシドは、好ましくは、修飾ヌクレオシドあたり+0.5~+12oCの範囲内、より好ましくは+1.5~+10oCの範囲内、最も好ましくは+3~+8oCの範囲内の融解温度の上昇をもたらす。数多くの高親和性修飾ヌクレオシドが当該技術分野において知られており、例えば、多くの2’置換ヌクレオシド及びロックド核酸(LNA)が挙げられる(例えば、Freier&Altmann;Nucl.Acid Res.,1997,25,4429-4443及びUhlmann;Curr.Opinion in Drug Development,2000,3(2),293-213を参照されたい)。
高親和性修飾ヌクレオシドは、修飾されたヌクレオチドであり、これは、オリゴヌクレオチドに組み込まれる場合、例えば融解温度(Tm)によって測定されるように、その相補的標的に対するオリゴヌクレオチドの親和性を高める。本発明の高親和性修飾ヌクレオシドは、好ましくは、修飾ヌクレオシドあたり+0.5~+12oCの範囲内、より好ましくは+1.5~+10oCの範囲内、最も好ましくは+3~+8oCの範囲内の融解温度の上昇をもたらす。数多くの高親和性修飾ヌクレオシドが当該技術分野において知られており、例えば、多くの2’置換ヌクレオシド及びロックド核酸(LNA)が挙げられる(例えば、Freier&Altmann;Nucl.Acid Res.,1997,25,4429-4443及びUhlmann;Curr.Opinion in Drug Development,2000,3(2),293-213を参照されたい)。
2’糖修飾ヌクレオシド
2’糖修飾ヌクレオシドは、2’位にH又は-OH以外の置換基を有するか(2’置換ヌクレオシド)、又は2’炭素とリボース環上の第2の炭素との間に架橋を形成することができる2’結合ビラジカルを含むヌクレオシド、例えばLNA(2’-4’ビラジカル架橋)ヌクレオシドである。
2’糖修飾ヌクレオシドは、2’位にH又は-OH以外の置換基を有するか(2’置換ヌクレオシド)、又は2’炭素とリボース環上の第2の炭素との間に架橋を形成することができる2’結合ビラジカルを含むヌクレオシド、例えばLNA(2’-4’ビラジカル架橋)ヌクレオシドである。
実際、2’糖置換ヌクレオシドの開発には多くの注目が集まっており、数多くの2’置換ヌクレオシドが、オリゴヌクレオチドに組み込まれた際に有益な特性を有することが見出されている。例えば、2’修飾糖は、高められた結合親和性及び/又は増大されたヌクレアーゼ耐性をオリゴヌクレオチドにもたらすことができる。2’置換修飾ヌクレオシドの例は、2’-O-アルキル-RNAヌクレオシド、2’-O-メチル-RNAヌクレオシド、2’-アルコキシ-RNAヌクレオシド、2’-O-メトキシエチル-RNA(MOE)ヌクレオシド、2’-アミノ-DNAヌクレオシド、2’-フルオロ-RNAヌクレオシド及び2’-F-ANAヌクレオシドである。更なる例については、例えばFreier&Altmann;Nucl.Acid Res.,1997,25,4429-4443及びUhlmann;Curr.Opinion in Drug Development,2000,3(2),293-213、及びDeleavey and Damha,Chemistry and Biology 2012,19,937を参照されたい。以下は、いくつかの2’置換修飾ヌクレオシドの例示である。
本発明に関して、2’置換糖修飾ヌクレオシドは、LNAのような2’架橋ヌクレオシドを含まない。
ロックド核酸ヌクレオシド(LNAヌクレオシド)
「LNAヌクレオシド」は、該ヌクレオシドのリボース糖環のC2’とC4’とを結合するバイラジカル(「2’-4’架橋」とも称される)を含む2’糖修飾ヌクレオシドであり、これはリボース環の立体配座を制限又は固定する。これらのヌクレオシドはまた、文献において、架橋核酸又は二環式核酸(BNA)とも称されている。リボースの立体配座の固定は、LNAが相補的RNA又はDNA分子のオリゴヌクレオチドに組み込まれる場合、ハイブリダイゼーションの親和性の向上(二重鎖の安定化)に関連している。これは、オリゴヌクレオチド/相補二重鎖の融解温度を測定することによって、日常的に決定され得る。
「LNAヌクレオシド」は、該ヌクレオシドのリボース糖環のC2’とC4’とを結合するバイラジカル(「2’-4’架橋」とも称される)を含む2’糖修飾ヌクレオシドであり、これはリボース環の立体配座を制限又は固定する。これらのヌクレオシドはまた、文献において、架橋核酸又は二環式核酸(BNA)とも称されている。リボースの立体配座の固定は、LNAが相補的RNA又はDNA分子のオリゴヌクレオチドに組み込まれる場合、ハイブリダイゼーションの親和性の向上(二重鎖の安定化)に関連している。これは、オリゴヌクレオチド/相補二重鎖の融解温度を測定することによって、日常的に決定され得る。
非限定的で例示的なLNAヌクレオシドは、国際公開第99/014226、国際公開第00/66604、国際公開第98/039352、国際公開第2004/046160、国際公開第00/047599、国際公開第2007/134181、国際公開第2010/077578、国際公開第2010/036698、国際公開第2007/090071、国際公開第2009/006478、国際公開第2011/156202、国際公開第2008/154401、国際公開第2009/067647、国際公開第2008/150729、Morita et al.,Bioorganic&Med.Chem.Lett.12,73-76、Seth et al.J.Org.Chem.2010,Vol 75(5)pp.1569-81、Mitsuoka et al.,Nucleic Acids Research 2009,37(4),1225-1238、及びWan and Seth,J.Medical Chemistry 2016,59,9645-9667に開示されている。
特定のLNAヌクレオシドは、ベータ-D-オキシ-LNA、6’-メチル-ベータ-D-オキシLNA、例えば(S)-6’-メチル-ベータ-D-オキシ-LNA(ScET)及びENAである。
RNase Hの活性及び動員
アンチセンスオリゴヌクレオチドのRNase H活性とは、相補的RNA分子との二重鎖にあるときにRNase Hを動員する能力を指す。国際公開第01/23613号は、RNase Hを動員する能力を決定するために使用され得る、RNase H活性を決定するためのインビトロ方法を提供する。典型的には、オリゴヌクレオチドが、相補的標的核酸配列が提供された場合に、試験されている修飾オリゴヌクレオチドと同じ塩基配列を有するが、オリゴヌクレオチド中の全てのモノマー間にホスホロチオアート結合を有するDNAモノマーのみを含有するオリゴヌクレオチドを使用し、国際公開第01/23613号(参照により本明細書に組み込まれる)の実施例91~95により提供される方法論を使用したときに決定された初期速度の少なくとも5%、例えば、少なくとも10%又は20%超のpmol/l/分で測定された初期速度を有する場合に、このオリゴヌクレオチドはRNase Hを動員することができると見なされる。RNase H活性の決定での使用について、組換えヒトRNase H1は、Creative Biomart(登録商標)(大腸菌で発現したHisタグと融合した組換えヒトRNase H1)から入手できる。
アンチセンスオリゴヌクレオチドのRNase H活性とは、相補的RNA分子との二重鎖にあるときにRNase Hを動員する能力を指す。国際公開第01/23613号は、RNase Hを動員する能力を決定するために使用され得る、RNase H活性を決定するためのインビトロ方法を提供する。典型的には、オリゴヌクレオチドが、相補的標的核酸配列が提供された場合に、試験されている修飾オリゴヌクレオチドと同じ塩基配列を有するが、オリゴヌクレオチド中の全てのモノマー間にホスホロチオアート結合を有するDNAモノマーのみを含有するオリゴヌクレオチドを使用し、国際公開第01/23613号(参照により本明細書に組み込まれる)の実施例91~95により提供される方法論を使用したときに決定された初期速度の少なくとも5%、例えば、少なくとも10%又は20%超のpmol/l/分で測定された初期速度を有する場合に、このオリゴヌクレオチドはRNase Hを動員することができると見なされる。RNase H活性の決定での使用について、組換えヒトRNase H1は、Creative Biomart(登録商標)(大腸菌で発現したHisタグと融合した組換えヒトRNase H1)から入手できる。
ギャップマー
本発明のアンチセンスオリゴヌクレオチド又はその連続ヌクレオチド配列はギャップマーであってもよく、また、ギャップマーオリゴヌクレオチド又はギャップマー設計とも称され得る。アンチセンスギャップマーは、通常、RNase H媒介分解を介した標的核酸の阻害に用いられる。ギャップマー型オリゴヌクレオチドは、少なくとも3つの別個の構造領域、5’-フランク、ギャップ及び3’-フランク、F-G-F’を5’→3’方向で含む。「ギャップ」領域(G)は、オリゴヌクレオチドがRNase Hを動員することを可能にする連続DNAヌクレオチドのストレッチを含む。ギャップ領域は、1つ又は複数の糖修飾ヌクレオシド、有利には高親和性糖修飾ヌクレオシドを含む5’フランキング領域(F)と、1つ又は複数の糖修飾ヌクレオシド、有利には高親和性糖修飾ヌクレオシドを含む3’フランキング領域(F’)が隣接する。領域F及びF’の1つ又は複数の糖修飾ヌクレオシドは、標的核酸に対するオリゴヌクレオチドの親和性を向上させる(すなわち、親和性向上糖修飾ヌクレオシドである)。いくつかの実施形態では、領域F及びF’の1つ又は複数の糖修飾ヌクレオシドは、例えばLNA及び2’-MOEから独立して選択される、高親和性2’糖修飾などの2’糖修飾ヌクレオシドである。
本発明のアンチセンスオリゴヌクレオチド又はその連続ヌクレオチド配列はギャップマーであってもよく、また、ギャップマーオリゴヌクレオチド又はギャップマー設計とも称され得る。アンチセンスギャップマーは、通常、RNase H媒介分解を介した標的核酸の阻害に用いられる。ギャップマー型オリゴヌクレオチドは、少なくとも3つの別個の構造領域、5’-フランク、ギャップ及び3’-フランク、F-G-F’を5’→3’方向で含む。「ギャップ」領域(G)は、オリゴヌクレオチドがRNase Hを動員することを可能にする連続DNAヌクレオチドのストレッチを含む。ギャップ領域は、1つ又は複数の糖修飾ヌクレオシド、有利には高親和性糖修飾ヌクレオシドを含む5’フランキング領域(F)と、1つ又は複数の糖修飾ヌクレオシド、有利には高親和性糖修飾ヌクレオシドを含む3’フランキング領域(F’)が隣接する。領域F及びF’の1つ又は複数の糖修飾ヌクレオシドは、標的核酸に対するオリゴヌクレオチドの親和性を向上させる(すなわち、親和性向上糖修飾ヌクレオシドである)。いくつかの実施形態では、領域F及びF’の1つ又は複数の糖修飾ヌクレオシドは、例えばLNA及び2’-MOEから独立して選択される、高親和性2’糖修飾などの2’糖修飾ヌクレオシドである。
ギャップマー設計において、ギャップ領域の最も5’及び3’のヌクレオシドはDNAヌクレオシドであり、それぞれ、5’(F)又は3’(F’)領域の糖修飾ヌクレオシドに隣接して配置されている。フランクはさらに、ギャップ領域から最も遠い端、即ち5’フランクの5’末端及び3’フランクの3’末端に少なくとも1つの糖修飾ヌクレオシドを有することによって定義されてもよい。
領域F-G-F’は、連続ヌクレオチド配列を形成する。本発明のアンチセンスオリゴヌクレオチド又はその連続ヌクレオチド配列は、式F-G-F’のギャップマー領域を含み得る。
ギャップマー設計F-G-F’の全長は、例えば12から32ヌクレオシド、例えば13から24、例えば14から22ヌクレオシド、例えば15から20、例えば16から18ヌクレオシドであり得る。
例として、本発明のギャップマーオリゴヌクレオチドは、以下の式によって表すことができる:
F1-8-G5-18-F’1-8、例えば
F1-8-G7-18-F’2-8
ただし、ギャップマー領域F-G-F’の全長は、少なくとも12、例えば少なくとも14ヌクレオチド長であることを条件とする。
F1-8-G5-18-F’1-8、例えば
F1-8-G7-18-F’2-8
ただし、ギャップマー領域F-G-F’の全長は、少なくとも12、例えば少なくとも14ヌクレオチド長であることを条件とする。
本発明の一態様では、アンチセンスオリゴヌクレオチド又はその連続ヌクレオチド配列は、式5’-F-G-F’-3’のギャップマーからなるか又はそれを含み、式中、領域F及びF’が独立して1~8個のヌクレオシドを含むか又はそれらからなり、そのうち1~4個が2’糖修飾され、F及びF’領域の5’及び3’末端を規定し、GがRNase Hを動員することができる6個~18個の間のヌクレオシドの領域である。いくつかの実施形態では、G領域はDNAヌクレオシドからなる。
いくつかの実施形態では、領域F及びF’は、独立して、糖修飾ヌクレオシドの連続する配列からなるか、又はそれを含む。いくつかの実施形態では、領域Fの糖修飾ヌクレオシドは、独立して、2’-O-アルキル-RNA単位、2’-O-メチル-RNA、2’-アミノ-DNA単位、2’-フルオロ-DNA単位、2’-アルコキシ-RNA、MOE単位、LNA単位、アラビノ核酸(ANA)単位及び2’-フルオロ-ANA単位から選択されてもよい。
幾つかの実施形態では、領域F及びF’は、独立して、LNAと2’置換糖修飾ヌクレオチドの両方を含む(混合ウィング設計)。いくつかの実施形態では、2’置換糖修飾ヌクレオチドは、2’-O-アルキル-RNA単位、2’-O-メチル-RNA、2’-アミノ-DNA単位、2’-フルオロ-DNA単位、2’-アルコキシ-RNA、MOE単位、アラビノ核酸(ANA)単位及び2’-フルオロ-ANA単位からなる群から独立して選択されてもよい。
幾つかの実施形態では、領域F及びF’の全修飾ヌクレオシドが、例えばβ-D-オキシLNA、ENA、又はScETヌクレオシドから独立して選択されるLNAヌクレオシドであり、領域F又はF’、若しくはF及びF’は、任意に、DNAヌクレオシドを含んでいてもよい。幾つかの実施形態では、領域F及びF’の全修飾ヌクレオシドがβ-D-オキシLNAヌクレオシドであり、領域F又はF’、若しくはF及びF’は、任意に、DNAヌクレオシドを含んでいてもよい。このような実施形態では、フランキング領域F又はF’、若しくはF及びF’の両方が少なくとも3つのヌクレオシドを含み、F及び/又はF’領域の最も5’及び3’のヌクレオシドは、LNAヌクレオシドである。
LNAギャップマー
LNAギャップマーは、領域F及びF’の一方又は両方に、LNAヌクレオシドを含むか、若しくはそれからなるギャップマーである。β-D-オキシギャップマーは、領域F及びF’の一方又は両方に、β-D-オキシLNAヌクレオシドを含むか、若しくはそれからなるギャップマーである。
LNAギャップマーは、領域F及びF’の一方又は両方に、LNAヌクレオシドを含むか、若しくはそれからなるギャップマーである。β-D-オキシギャップマーは、領域F及びF’の一方又は両方に、β-D-オキシLNAヌクレオシドを含むか、若しくはそれからなるギャップマーである。
いくつかの実施形態では、LNAギャップマーは、式:[LNA]1-5-[領域G]6-18-[LNA]1-5であり、領域Gはギャップマー領域Gの定義で定義したとおりである。
MOEギャップマー
MOEギャップマーは、領域F及びF’がMOEヌクレオシドからなるギャップマーである。いくつかの実施形態では、MOEギャップマーは、設計[MOE]1-8-[領域G]5-16-[MOE]1-8、例えば[MOE]2-7-[領域G]6-14-[MOE]2-7、例えば[MOE]3-6-[領域G]8-12-[MOE]3-6、例えば[MOE]5-[領域G]10-[MOE] 5 のものであり、領域Gはギャップマーの定義に規定したとおりである。5-10-5設計(MOE-DNA-MOE)を有するMOEギャップマーは、当技術分野で広く使用されている。
MOEギャップマーは、領域F及びF’がMOEヌクレオシドからなるギャップマーである。いくつかの実施形態では、MOEギャップマーは、設計[MOE]1-8-[領域G]5-16-[MOE]1-8、例えば[MOE]2-7-[領域G]6-14-[MOE]2-7、例えば[MOE]3-6-[領域G]8-12-[MOE]3-6、例えば[MOE]5-[領域G]10-[MOE] 5 のものであり、領域Gはギャップマーの定義に規定したとおりである。5-10-5設計(MOE-DNA-MOE)を有するMOEギャップマーは、当技術分野で広く使用されている。
オリゴヌクレオチド内の領域D’又はD’’
本発明のオリゴヌクレオチドは、いくつかの実施形態では、標的核酸に対して相補的なオリゴヌクレオチドの連続ヌクレオチド配列、例えばギャップマー領域F-G-F’、並びにさらに5’及び/又は3’ヌクレオシドを含むか、又はそれからなり得る。さらなる5’及び/又は3’ヌクレオシドは、標的核酸に対して完全に相補的であっても、完全に相補的でなくてもよい。このようなさらなる5’及び/又は3’ヌクレオシドは、本明細書では領域D’及びD’’と称され得る。
本発明のオリゴヌクレオチドは、いくつかの実施形態では、標的核酸に対して相補的なオリゴヌクレオチドの連続ヌクレオチド配列、例えばギャップマー領域F-G-F’、並びにさらに5’及び/又は3’ヌクレオシドを含むか、又はそれからなり得る。さらなる5’及び/又は3’ヌクレオシドは、標的核酸に対して完全に相補的であっても、完全に相補的でなくてもよい。このようなさらなる5’及び/又は3’ヌクレオシドは、本明細書では領域D’及びD’’と称され得る。
領域D’又はD’’の付加は、連続ヌクレオチド配列、例えばギャップマーをコンジュゲート部分又は別の官能基に連結する目的のために使用され得る。連結に用いられる場合、コンジュゲート部分を有する連続ヌクレオチド配列は、生体切断可能なリンカーとしての役割を果たし得る。あるいは、それはエキソヌクレアーゼ保護を提供するために、若しくは合成又は製造を容易にするために使用されてもよい。
領域D’及びD’’は、それぞれ、領域Fの5’末端又は領域F’の3’末端に結合して、以下の式D’-F-G-F’、F-G-F’-D’’又はD’-F-G-F’-D’’の設計を生成することができる。この場合、F-G-F’はオリゴヌクレオチドのギャップマー部分であり、領域D’又はD’’は、オリゴヌクレオチドの別個の部分を構成する。
領域D’又はD’’は、独立して、1、2、3、4又は5個の追加のヌクレオチドを含むか、又はそれからなり、標的核酸に対して相補的であっても、相補的でなくてもよい。F又はF’領域に隣接するヌクレオチドは、DNA又はRNAなどの糖修飾ヌクレオチドではなく、若しくはこれらの塩基修飾バージョンでもない。D’又はD’’領域は、ヌクレアーゼ感受性の生体切断可能なリンカーとしての役割を果たし得る(リンカーの定義を参照されたい)。いくつかの実施形態では、追加の5’及び/又は3’末端ヌクレオチドは、ホスホジエステル結合で結合されており、DNA又はRNAである。領域D’又はD’’としての使用に好適なヌクレオチドベースの生体切断可能なリンカーは、国際公開第2014/076195号に開示されており、これには例としてホスホジエステル結合DNAジヌクレオチドが含まれる。ポリオリゴヌクレオチド構築物における生体切断可能なリンカーの使用は国際公開第WO2015/113922号に開示されており、それらは複数のアンチセンス構築物(例えば、ギャップマー領域)を単一のオリゴヌクレオチド内で結合するのに使用されている。
一実施形態では、本発明のオリゴヌクレオチドは、ギャップマーを構成する連続ヌクレオチド配列に加えて、領域D’及び/又はD’’を含む。
幾つかの実施形態では、本発明のオリゴヌクレオチドは、以下の式によって表すことができる:
F-G-F’、特に、F1-8-G5-18-F’2-8
D’-F-G-F’、特に、D’1-3-F1-8-G5-18-F’2-8
F-G-F’-D’’、特に、F1-8-G5-18-F’2-8-D’’1-3
D’-F-G-F’-D’’、特に、D’1-3-F1-8-G5-18-F’2-8-D’’1-3
F-G-F’、特に、F1-8-G5-18-F’2-8
D’-F-G-F’、特に、D’1-3-F1-8-G5-18-F’2-8
F-G-F’-D’’、特に、F1-8-G5-18-F’2-8-D’’1-3
D’-F-G-F’-D’’、特に、D’1-3-F1-8-G5-18-F’2-8-D’’1-3
いくつかの実施形態では、領域D’と領域Fとの間に位置するヌクレオシド間結合は、ホスホジエステル結合である。いくつかの実施形態では、領域F’と領域D’’との間に位置するヌクレオシド間結合は、ホスホジエステル結合である。
コンジュゲート
本明細書で用いられる「コンジュゲート」という用語は、非ヌクレオチド部分(コンジュゲート部分又は領域C又は第3の領域)に共有結合したオリゴヌクレオチドを指す。コンジュゲート部分は、任意に領域D’又はD’’などのリンカー基を介して、アンチセンスオリゴヌクレオチドに共有結合していてもよい。
本明細書で用いられる「コンジュゲート」という用語は、非ヌクレオチド部分(コンジュゲート部分又は領域C又は第3の領域)に共有結合したオリゴヌクレオチドを指す。コンジュゲート部分は、任意に領域D’又はD’’などのリンカー基を介して、アンチセンスオリゴヌクレオチドに共有結合していてもよい。
オリゴヌクレオチドコンジュゲート及びそれらの合成は、ManoharanによるAntisense Drug Technology,Principles,Strategies,and Applications,S.T.Crooke,ed.,Ch.16,Marcel Dekker,Inc.,2001 and Manoharan,Antisense and Nucleic Acid Drug Development,2002,12,103の包括的レビューに報告されており、これらの各々は参照によりその全体が本明細書に組み込まれる。
いくつかの実施形態では、非ヌクレオチド部分(コンジュゲート部分)は、炭水化物(例えば、ガラクトース又はN-アセチルガラクトサミン(GalNAc))、細胞表面受容体リガンド、原薬、ホルモン、親油性物質、ポリマー、タンパク質(例えば抗体)、ペプチド、毒素(例えば、細菌毒素)、ビタミン、ウイルスタンパク質(例えば、キャプシド)又はそれらの組合せからなる群から選択される。
例示的なコンジュゲート部分は、アシアロ糖タンパク質受容体(ASGPR)に結合することができるものである。特に、三価N-アセチルガラクトサミンのコンジュゲート部分は、ASGPRへの結合に適しており、例えば、国際公開第2014/076196号、国際公開第2014/207232号、及び国際公開第2014/179620号(参照することによって本明細書に組み込まれる)を参照されたい。そのようなコンジュゲートは、肝臓へのオリゴヌクレオチドの取り込みを増強するのに役立つ。
リンカー
結合又はリンカーは、1つ以上の共有結合を介して目的の1つの化学基又はセグメントを目的の別の化学基又はセグメントに連結する、2つの原子間の接続である。コンジュゲート部分は、直接又は連結部分(例えば、リンカー又はテザー)を介してオリゴヌクレオチドに結合させることができる。リンカーは、第3の領域、例えばコンジュゲート部分(領域C)を、第1の領域、例えば、標的核酸に対して相補的なオリゴヌクレオチド又は連続ヌクレオチド配列(領域A)に共有結合する役割を果たす。
結合又はリンカーは、1つ以上の共有結合を介して目的の1つの化学基又はセグメントを目的の別の化学基又はセグメントに連結する、2つの原子間の接続である。コンジュゲート部分は、直接又は連結部分(例えば、リンカー又はテザー)を介してオリゴヌクレオチドに結合させることができる。リンカーは、第3の領域、例えばコンジュゲート部分(領域C)を、第1の領域、例えば、標的核酸に対して相補的なオリゴヌクレオチド又は連続ヌクレオチド配列(領域A)に共有結合する役割を果たす。
本発明の幾つかの実施形態では、本発明のコンジュゲート又はオリゴヌクレオチドコンジュゲートは、任意に、標的核酸に対して相補的なオリゴヌクレオチド又は連続ヌクレオチド配列(領域A又は第1の領域)と、コンジュゲート部分(領域C又は第3の領域)との間に位置するリンカー領域(第2の領域又は領域B及び/又は領域Y)を含み得る。
領域Bは、哺乳動物の体内で通常遭遇する又は遭遇するものに類似した条件下で切断可能である生理学的に不安定な結合を含むか、又はそれからなる生体切断可能なリンカーを指す。生理学的に不安定なリンカーが化学的変換(例えば、切断)を受ける条件には、pH、温度、酸化又は還元条件、若しくは薬剤などの化学条件、並びに哺乳動物の細胞で見られる又は遭遇するものに類似した塩濃度が含まれる。哺乳動物の細胞内条件には、タンパク質分解酵素又は加水分解酵素又はヌクレアーゼなどの哺乳動物細胞に通常存在する酵素活性の存在も含まれる。一実施形態では、生体切断可能なリンカーは、S1ヌクレアーゼ切断の影響を受けやすい。好ましい実施形態では、ヌクレアーゼ感受性リンカーは、少なくとも2つの連続したホスホジエステル結合、例えば、少なくとも3つ又は4つ又は5つの連続したホスホジエステル結合を含む、1個~5個の間のヌクレオシド、例えば、1、2、3、4又は5個のヌクレオシド、より好ましくは2個~4個の間のヌクレオシド、最も好ましくは2又は3個の結合したヌクレオシドを含む。好ましくは、ヌクレオシドは、DNA又はRNAである。ホスホジエステルを含む生体切断可能なリンカーは、WO2014/076195(参照により本明細書に組み込まれる)においてより詳細に記載されている。
領域Yは、必ずしも生体切断可能ではないが、主にコンジュゲート部分(領域C又は第3の領域)をオリゴヌクレオチド(領域A又は第1の領域)に共有結合させるのに役立つリンカーを指す。領域Yリンカーは、エチレングリコール、アミノ酸単位又はアミノアルキル基などの反復単位の鎖構造又はオリゴマーを含み得る。本発明のオリゴヌクレオチドコンジュゲートは、以下の領域要素A-C、A-B-C、A-B-Y-C、A-Y-B-C又はA-Y-Cから構築することができる。いくつかの実施形態では、リンカー(領域Y)は、例えばC6~C12アミノアルキル基を含むC2~C36アミノアルキル基などのアミノアルキルである。いくつかの実施形態では、リンカー(領域Y)はC6アミノアルキル基である。
処置
本明細書で使用される「処置」という用語は、既存の疾患(例えば、本明細書で言及される疾患又は障害)の処置、又は疾患の予防(prevention)、すなわち予防(prophylaxis)の両方を指す。したがって、本明細書で言及される処置は、いくつかの実施形態において、予防的であり得ることが認識されよう。予防とは、HBV感染症が慢性HBV感染症に転化するのを防ぐこと、又は慢性HBV感染症による肝硬変及び肝細胞癌腫などの重篤な肝疾患を予防することと理解することができる。
本明細書で使用される「処置」という用語は、既存の疾患(例えば、本明細書で言及される疾患又は障害)の処置、又は疾患の予防(prevention)、すなわち予防(prophylaxis)の両方を指す。したがって、本明細書で言及される処置は、いくつかの実施形態において、予防的であり得ることが認識されよう。予防とは、HBV感染症が慢性HBV感染症に転化するのを防ぐこと、又は慢性HBV感染症による肝硬変及び肝細胞癌腫などの重篤な肝疾患を予防することと理解することができる。
患者
本発明の目的について、「対象」(又は「患者」)は、脊椎動物であり得る。本発明に関連して、用語「対象」は、ヒト及び他の動物、特に哺乳動物と、他の生物との両方を含む。したがって、本明細書に提供される手段及び方法は、ヒト治療及び獣医学的用途の両方に適用可能である。好ましくは、対象は、哺乳動物である。より好ましくは、対象は、ヒトである。
本発明の目的について、「対象」(又は「患者」)は、脊椎動物であり得る。本発明に関連して、用語「対象」は、ヒト及び他の動物、特に哺乳動物と、他の生物との両方を含む。したがって、本明細書に提供される手段及び方法は、ヒト治療及び獣医学的用途の両方に適用可能である。好ましくは、対象は、哺乳動物である。より好ましくは、対象は、ヒトである。
本明細書の他の箇所に記載されるように、処置される患者は、慢性HBV感染症などのHBV感染症に罹患している可能性がある。いくつかの実施形態では、HBV感染症に罹患している患者は、肝細胞癌腫(HCC)に罹患している可能性がある。いくつかの実施形態では、HBV感染症に罹患している患者は、肝細胞癌腫に罹患していない。
発明の詳細な説明
感染肝細胞におけるHBV cccDNAは持続的な慢性感染症及び再活性化に関与し、全てのウイルスサブゲノム転写物及びプレゲノムRNA(pgRNA)の鋳型であって、新たに合成されたウイルス子孫と細胞内ヌクレオカプシド再循環を介したcccDNAプール補充との両方を確実にする。本発明の文脈において、A1CFがcccDNA安定性と関連することが初めて示された。この知識により、HBV感染対象におけるcccDNAを不安定化する機会が生まれ、慢性感染HBV患者の完全治癒の機会が開ける。
感染肝細胞におけるHBV cccDNAは持続的な慢性感染症及び再活性化に関与し、全てのウイルスサブゲノム転写物及びプレゲノムRNA(pgRNA)の鋳型であって、新たに合成されたウイルス子孫と細胞内ヌクレオカプシド再循環を介したcccDNAプール補充との両方を確実にする。本発明の文脈において、A1CFがcccDNA安定性と関連することが初めて示された。この知識により、HBV感染対象におけるcccDNAを不安定化する機会が生まれ、慢性感染HBV患者の完全治癒の機会が開ける。
本発明の一態様は、B型肝炎ウイルス(HBV)感染症、特に慢性HBV感染症の処置及び/又は予防用のA1CF阻害剤である。
A1CF阻害剤は、例えばA1CFタンパク質に特異的に結合する小分子であることができ、該阻害剤は、cccDNAへのA1CFタンパク質の結合を防止又は減少させる。
本発明の実施形態は、HBV感染細胞などの感染細胞中のcccDNA及び/又はpgRNAの量を減少させることができる、A1CF阻害剤である。
更なる実施形態では、A1CF阻害剤は、HBV感染個体においてインビボでHBsAg及び/又はHBeAgを減少させることができる。
HBVの処置における使用のためのA1CF阻害剤
理論に拘束されるものではないが、A1CFは、cccDNAへの直接的又は間接的な結合を介して、細胞核におけるcccDNAの安定化に関与し、A1CFとcccDNAとの結合/会合を妨げることによって、cccDNAは不安定化され、分解しやすくなると考えられる。したがって、本発明の一実施形態は、A1CFタンパク質と相互作用し、cccDNAへのその結合/会合を防止又は減少させるA1CF阻害剤である。
理論に拘束されるものではないが、A1CFは、cccDNAへの直接的又は間接的な結合を介して、細胞核におけるcccDNAの安定化に関与し、A1CFとcccDNAとの結合/会合を妨げることによって、cccDNAは不安定化され、分解しやすくなると考えられる。したがって、本発明の一実施形態は、A1CFタンパク質と相互作用し、cccDNAへのその結合/会合を防止又は減少させるA1CF阻害剤である。
本発明のいくつかの実施形態では、阻害剤は、抗体、抗体フラグメント又は小分子化合物である。いくつかの実施形態では、阻害剤は、A1CFタンパク質、例えば配列番号1、4、5、6、7、8、9、10又は11によってコードされるA1CFタンパク質に特異的に結合する、抗体、抗体断片又は小分子であり得る。
本発明の核酸分子
治療用核酸分子は、A1CF転写物を標的とし、RNA干渉経路又はRNase H切断のいずれかを介してその分解を促進することができるので、潜在的に優れたA1CF阻害剤である。あるいは、アプタマーのようなオリゴヌクレオチドもまた、A1CFタンパク質相互作用の阻害剤として作用し得る。
治療用核酸分子は、A1CF転写物を標的とし、RNA干渉経路又はRNase H切断のいずれかを介してその分解を促進することができるので、潜在的に優れたA1CF阻害剤である。あるいは、アプタマーのようなオリゴヌクレオチドもまた、A1CFタンパク質相互作用の阻害剤として作用し得る。
本発明の一態様は、B型肝炎ウイルス(HBV)感染症の処置及び/又は予防用のA1CF標的化核酸分子である。このような核酸分子は、一本鎖アンチセンスオリゴヌクレオチド、siRNA、及びshRNAからなる群から選択され得る。
本発明のセクションは、B型肝炎ウイルス(HBV)感染症の処置及び/又は予防に好適な新規の核酸分子を解説する。
本発明の核酸分子は、インビトロ及びインビボでA1CFのmRNA及び/又はタンパク質の発現を阻害することができる。阻害は、A1CFをコードする標的核酸にオリゴヌクレオチドをハイブリダイズさせることによって達成される。標的核酸は、哺乳動物A1CF配列であり得る。いくつかの実施形態では、標的核酸は、配列番号1の配列などのヒトA1CFプレ-mRNA配列、又は配列番号4~11から選択されるヒト成熟A1CF mRNA配列であり得る。いくつかの実施形態では、標的核酸は、配列番号2の配列などのカニクイザルA1CF配列であり得る。
いくつかの実施形態では、本発明の核酸分子は、標的の発現を阻害又は下方調節することにより、それを調節することができる。好ましくは、このような調節は、標的の正常な発現レベルと比較して少なくとも20%の発現の阻害、より好ましくは、標的の正常な発現レベルと比較して少なくとも30%、少なくとも40%、又は少なくとも50%の阻害をもたらす。いくつかの実施形態では、本発明の核酸分子は、25nMの核酸分子をPXB-PHH細胞にトランスフェクトすることによって、インビトロで少なくとも50%又は60%、A1CF mRNAの発現レベルを阻害することができ、この標的減少の範囲は、cccDNA減少との良好な相関を有する核酸分子を選択する点で有利である。適切には、実施例は、A1CF mRNA阻害を測定するために使用され得るアッセイを提供する(例えば、実施例1及び「材料及び方法」セクション)。A1CF阻害は、siRNAのガイド鎖又はアンチセンスオリゴヌクレオチドのギャップマー領域などのオリゴヌクレオチドの連続ヌクレオチド配列と標的核酸との間のハイブリダイゼーションによって引き起こされる。いくつかの実施形態では、本発明の核酸分子は、オリゴヌクレオチドと標的核酸との間のミスマッチを含む。ミスマッチにもかかわらず、標的核酸へのハイブリダイゼーションは、A1CF発現の所望の阻害を示すのに尚充分であり得る。ミスマッチから生じる結合親和性の低下は、標的核酸に対して相補的なオリゴヌクレオチド内のヌクレオチド数の増加、及び/又は、標的への結合親和性を増加させることができる修飾ヌクレオシドの数、例えばオリゴヌクレオチド配列内に存在する、LNAを含む2’糖修飾ヌクレオシドの数の増加により有利に補償され得る。
本発明の一態様は、12~60ヌクレオチド長の核酸分子であって、少なくとも12ヌクレオチド長、例えば少なくとも12~30ヌクレオチド長の連続ヌクレオチド配列を含み、哺乳動物A1CF標的核酸、特にヒトA1CF核酸に対して少なくとも95%相補的、例えば完全に相補的である、オリゴヌクレオチドに関する。これらの核酸分子はA1CFのmRA及び/又はタンパク質の発現を阻害することができる。
本発明の一態様は、哺乳動物A1CF標的配列に対して少なくとも90%相補的、例えば完全に相補的である、少なくとも12ヌクレオチド、例えば12~30ヌクレオチド長の連続ヌクレオチド配列を含む、12~30ヌクレオチド長の核酸分子に関する。
本発明のさらなる態様は、配列番号1の標的配列に対して少なくとも90%相補的、例えば完全に相補的な、14~22ヌクレオチド長の連続ヌクレオチド配列を含む本発明による核酸分子に関する。
いくつかの実施形態では、核酸分子は、12~30ヌクレオチド長の連続配列を含み、これは、標的核酸又は標的配列の領域と、少なくとも90%相補的、例えば少なくとも91%、例えば少なくとも92%、例えば少なくとも93%、例えば少なくとも94%、例えば少なくとも95%、例えば少なくとも96%、例えば少なくとも97%、例えば少なくとも98%、又は100%相補的である。
オリゴヌクレオチド、若しくはその連続ヌクレオチド配列が、標的配列の領域に対して完全に相補性(100%相補性)である、又は、いくつかの実施形態では、オリゴヌクレオチドと標的配列との間に、1つ又は2つのミスマッチを含み得る場合、有利である。
いくつかの実施形態では、オリゴヌクレオチド配列は、配列番号1及び/又は配列番号4、5、6、7、8、9、10及び/又は11の標的配列の領域に対して100%相補的である。
いくつかの実施形態では、本発明の核酸分子又は連続ヌクレオチド配列は、配列番号1及び/又は2の標的核酸に対して少なくとも90%又は95%相補性、例えば完全に(又は100%)相補的である。
いくつかの実施形態では、本発明の核酸分子又は連続ヌクレオチド配列は、配列番号2及び/又は配列番号4、5、6、7、8、9 10及び/又は11の標的核酸に対して少なくとも90%又は95%相補性、例えば完全に(又は100%)相補的である。
いくつかの実施形態では、本発明のオリゴヌクレオチド又は連続ヌクレオチド配列は、配列番号1、及び/又は配列番号2、及び/又は配列番号3の標的核酸に対して少なくとも90%又は95%相補性、例えば完全に(又は100%)相補的である。
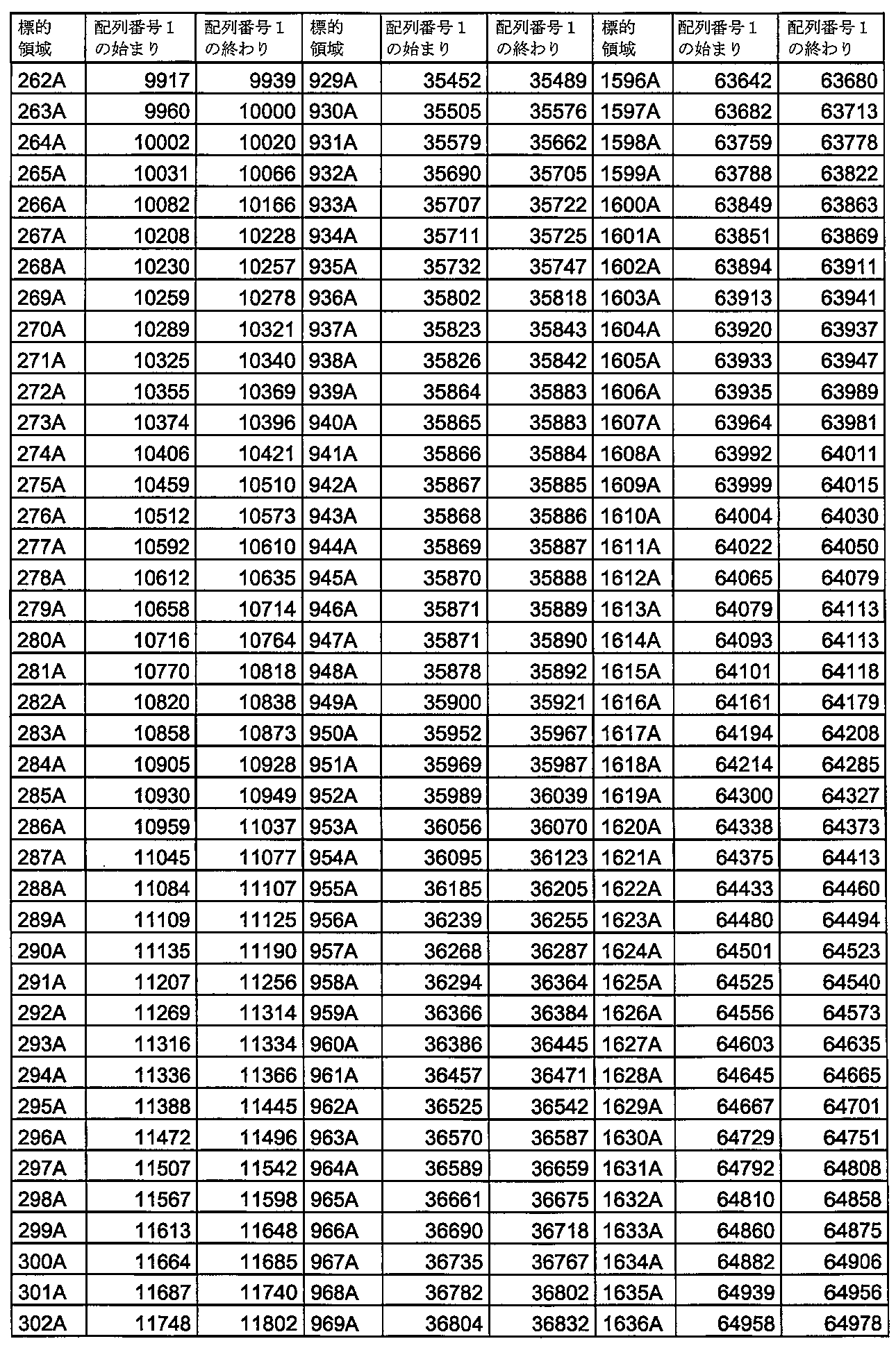
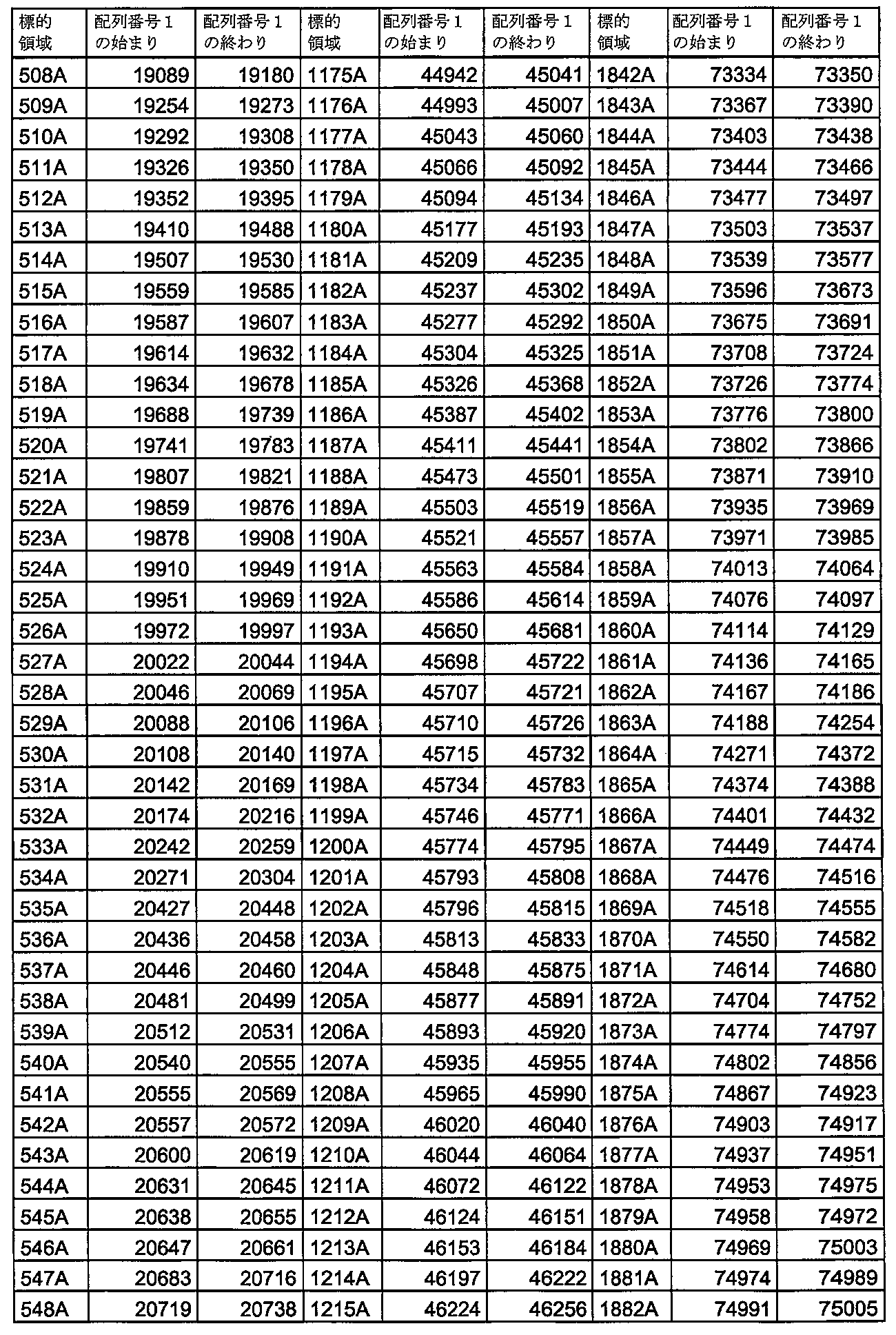
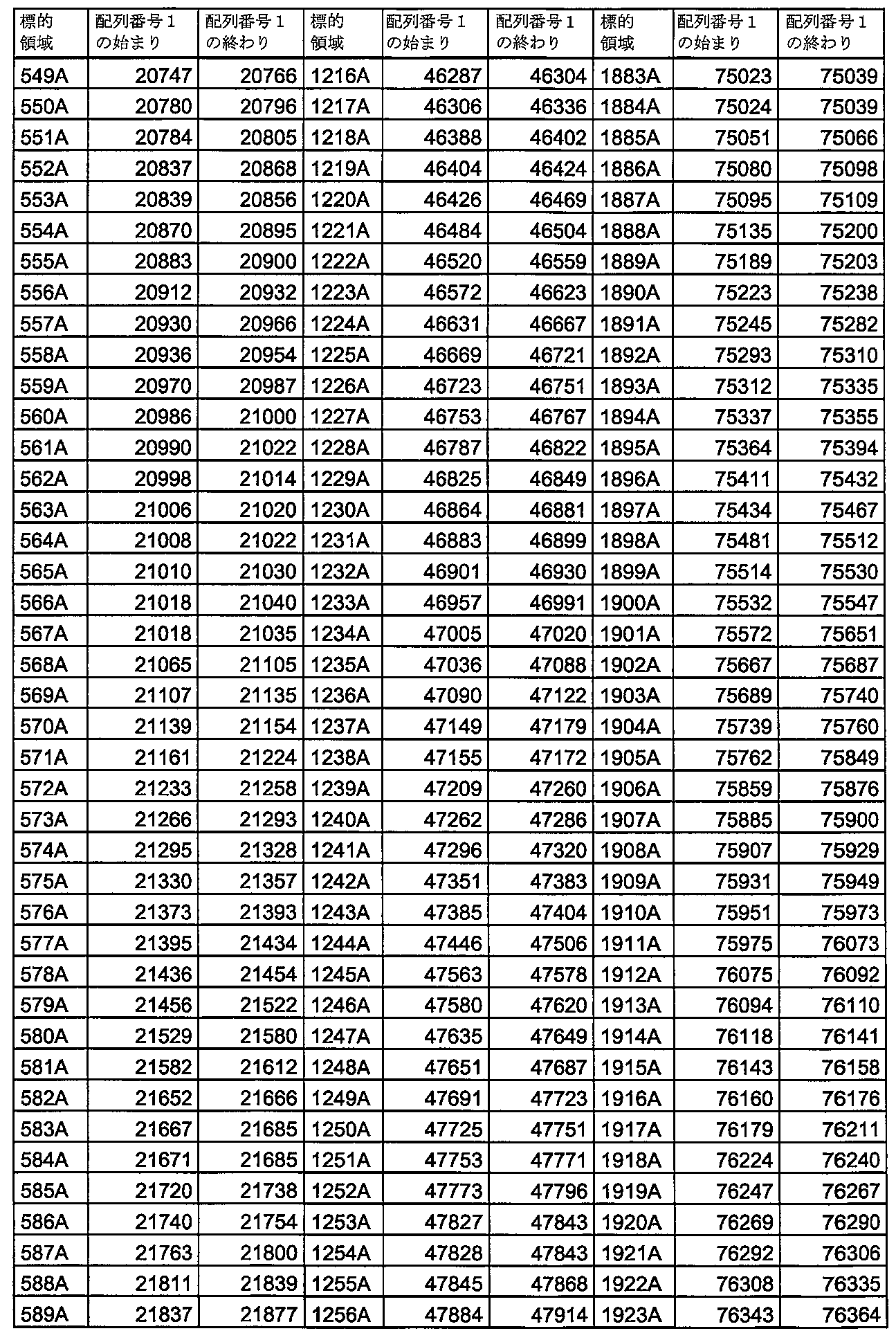
いくつかの実施形態では、本発明の核酸分子の連続配列は、表4に示す標的領域1A~2001Aからなる群から選択される配列番号1の領域に対して少なくとも90%相補的、例えば完全に相補的である。
いくつかの実施形態では、本発明の核酸分子の連続配列は、表5に示す標的領域1C~178Cからなる群から選択される配列番号1の領域に対して少なくとも90%相補的、例えば完全に相補的である。
いくつかの実施形態では、本発明の核酸分子は、12~60ヌクレオチド長、例えば13~50、例えば14~35、例えば15~30、例えば16~22連続ヌクレオチド長を含むか、又はそれらからなる。好ましい実施形態では、核酸分子は、15、16、17、18、19、20、21又は22ヌクレオチド長を含むか又はそれからなる。
いくつかの実施形態では、標的核酸に対して相補的である核酸分子の連続ヌクレオチド配列は、12~30、例えば13~25、例えば15~23、例えば16~22連続ヌクレオチド長を含むか、又はそれらからなる。
いくつかの実施形態では、オリゴヌクレオチドは、アンチセンスオリゴヌクレオチド、siRNA及びshRNAからなる群から選択される。
いくつかの実施形態では、標的配列に対して相補的であるsiRNA又はshRNAの連続ヌクレオチド配列は、18~28、例えば19~26、例えば20~24、例えば21~23連続ヌクレオチド長を含むか、又はそれらからなる。
いくつかの実施形態では、標的核酸に対して相補的なアンチセンスオリゴヌクレオチドの連続ヌクレオチド配列は、12~22、例えば14~20、例えば16~20、例えば15~18、例えば16~18、例えば16、17、18、19又は20の連続ヌクレオチド長を含むか、又はそれらからなる。
いくつかの実施形態では、オリゴヌクレオチド又は連続ヌクレオチド配列は、表6に列挙された配列からなる群から選択される配列を含むか又はそれからなる(材料及び方法セクション)。
連続オリゴヌクレオチド配列(モチーフ配列)は、例えばヌクレアーゼ耐性及び/又は標的核酸に対する結合親和性を増大させるために修飾され得ることが理解される。
修飾ヌクレオシド(高親和性修飾ヌクレオシドなど)がオリゴヌクレオチド配列に組み込まれるパターンは、一般にオリゴヌクレオチド設計と称される。
本発明の核酸分子は、修飾ヌクレオシド及びRNAヌクレオシド(特に、siRNA及びshRNA分子)又はDNAヌクレオシド(特に、一本鎖アンチセンスオリゴヌクレオチド)を用いて設計することができる。
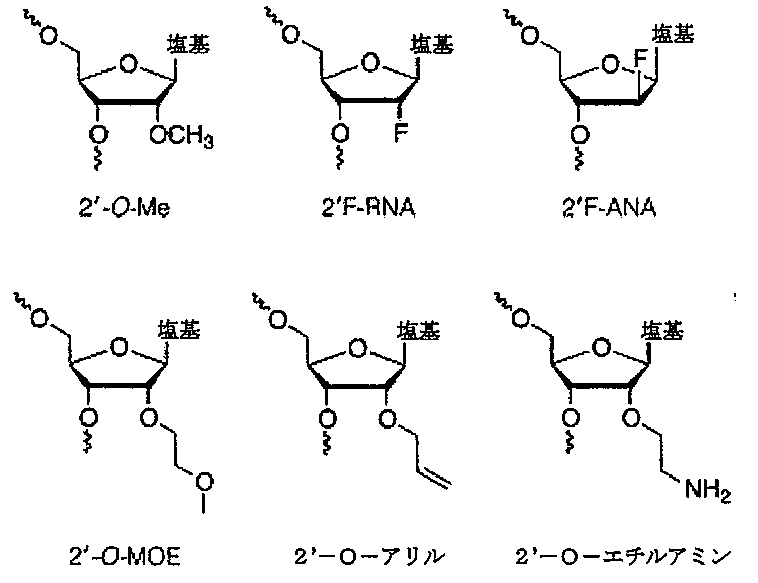
有利な実施形態では、核酸分子又は連続ヌクレオチド配列は、1つ又は複数の糖修飾ヌクレオシド、例えば2’糖修飾ヌクレオシドを含み、例えば、2’-O-アルキル-RNAヌクレオシド、2’-O-メチル-RNAヌクレオシド、2’-アルコキシ-RNAヌクレオシド、2’-O-メトキシエチル-RNAヌクレオシド、2’-アミノ-DNAヌクレオシド、2’-フルオロ-DNAヌクレオシド、アラビノ核酸(ANA)ヌクレオシド、2’-フルオロ-ANAヌクレオシド及びLNAヌクレオシドからなる群から独立して選択される1つ又は複数の2’糖修飾ヌクレオシドを含む。修飾ヌクレオシド(複数可)の1つ又は複数がロックド核酸(LNA)である場合、有利である。
いくつかの実施形態では、連続ヌクレオチド配列は、LNAヌクレオシドを含む。
いくつかの実施形態では、連続ヌクレオチド配列は、LNAヌクレオシド及びDNAヌクレオシドを含む。
いくつかの実施形態では、連続ヌクレオチド配列は、2’-O-メトキシエチル(2’MOE)ヌクレオシドを含む。
いくつかの実施形態では、連続ヌクレオチド配列は、2’-O-メトキシエチル(2’MOE)ヌクレオシド及びDNAヌクレオシドを含む。
有利には、アンチセンスオリゴヌクレオチド、又はその連続ヌクレオチド配列の最も3’側のヌクレオシドは、2’糖修飾ヌクレオシドである。
更なる実施形態では、核酸分子は、少なくとも1つの修飾ヌクレオシド間結合を含む。好適なヌクレオシド間修飾は、「修飾ヌクレオシド間結合」の「定義」セクションに記載されている。
有利には、オリゴヌクレオチドは、ホスホロチオエート又はホスホロジチオエートなどの少なくとも1つの修飾されたヌクレオシド間結合を含む。
いくつかの実施形態では、連続ヌクレオチド配列中の少なくとも1つのヌクレオシド間結合は、ホスホジエステル・ヌクレオシド間結合である。
オリゴヌクレオチドの5’末端又は3’末端における少なくとも2~3個のヌクレオシド間結合がホスホロチオエートヌクレオシド間結合である場合、有利である。
一本鎖アンチセンスオリゴヌクレオチドについて、連続ヌクレオチド配列内の少なくとも75%、例えば全てのヌクレオシド間結合がホスホロチオエート結合であれば有利である。いくつかの実施形態では、一本鎖アンチセンスオリゴヌクレオチドの連続配列中の全ヌクレオチド間結合は、ホスホロチオエート結合である。
本発明の有利な実施形態では、本発明のアンチセンスオリゴヌクレオチドは、RNase H、例えばRNase H1を動員することができる。有利な構造設計は、例えば、「ギャップマー」、「LNAギャップマー」、及び「MOEギャップマー」の「定義」セクションに記載されているギャップマー設計である。本発明では、本発明のアンチセンスオリゴヌクレオチドがF-G-F’設計のギャップマーである場合が有利である。
全ての場合において、F-G-F’設計は、「オリゴヌクレオチド中の領域D’又はD’’」の「定義」セクションに記載されるように、領域D’及び/又はD’’を更に含み得る。
本発明のさらなる態様では、本発明のアンチセンスオリゴヌクレオチド、siRNA又はshRNAなどの核酸分子を、アシアロ糖タンパク質受容体(ASGPr)に結合することができるコンジュゲート部分、例えば二価又は三価のGalNAcクラスターに共有結合することによって、肝臓に直接標的化することができる。
コンジュゲート
HBV感染症は主に肝臓の肝細胞に影響を及ぼすので、A1CF阻害剤をコンジュゲート部分に結合させ、未結合阻害剤と比較して阻害剤の肝臓への送達を増加させることが、有利である。一実施形態では、肝臓標的化部分は、コレステロール若しくは他の脂質を含む部分、又はアシアロ糖タンパク質受容体(ASGPR)に結合することができるコンジュゲート部分から選択される。
HBV感染症は主に肝臓の肝細胞に影響を及ぼすので、A1CF阻害剤をコンジュゲート部分に結合させ、未結合阻害剤と比較して阻害剤の肝臓への送達を増加させることが、有利である。一実施形態では、肝臓標的化部分は、コレステロール若しくは他の脂質を含む部分、又はアシアロ糖タンパク質受容体(ASGPR)に結合することができるコンジュゲート部分から選択される。
いくつかの実施形態では、本発明は、コンジュゲート部分に共有結合した本発明の核酸分子を含む、コンジュゲートを提供する。
アシアロ糖タンパク質受容体(ASGPR)コンジュゲート部分は、ガラクトースと同等以上の親和性でアシアロ糖タンパク質受容体(ASPGR標的化部分)に結合することができる、1つ以上の炭水化物部分を含む。アシアロ糖タンパク質受容体に対する多数のガラクトース誘導体の親和性が研究されており(例えば、Jobst,S.T.and Drickamer,K.JB.C.1996,271,6686を参照)、又は当技術分野で典型的な方法を用いて容易に決定される。
一実施形態では、コンジュゲート部分は、ガラクトース、ガラクトサミン、N-ホルミル-ガラクトサミン、N-アセチルガラクトサミン、N-プロピオニル-ガラクトサミン、N-n-ブタノイル-ガラクトサミン、及びN-イソブタノイルガラクサミンからなる群より選択される、少なくとも1つのアシアロ糖タンパク質受容体標的化部分を含む。有利には、アシアロ糖タンパク質受容体標的化部分は、N-アセチルガラクトサミン(GalNAc)である。
ASGPRコンジュゲート部分を生成するために、ASPGR標的化部分(好ましくは、GalNAc)をコンジュゲート足場に付着させることができる。一般に、ASPGR標的化部分は、足場の同じ末端にあり得る。一実施形態では、コンジュゲート部分は、アンチセンスオリゴヌクレオチドに結合され得るブランチャー分子に各GalNAc部分を結合するスペーサーに結合された、2~4個の末端GalNAc部分からなる。
更なる実施形態では、コンジュゲート部分は、アシアロ糖タンパク質受容体標的化部分に関して、一価、二価、三価、又は四価である。有利には、アシアロ糖タンパク質受容体標的化部分は、N-アセチルガラクトサミン(GalNAc)部分を含む。
GalNAcコンジュゲート部分としては、例えば、国際公開第2014/179620号及び同第2016/055601号及び国際出願第PCT/EP2017/059080号(参照により本明細書に組み込まれる)に記載されているもの、並びに、Tyr-Glu-Glu-(アミノヘキシルGalNAc)3(YEE(ahGalNAc)3などのGalNAc部分が結合した小さなペプチド;肝細胞上のアシアロ糖タンパク質受容体に結合するグリコトリペプチド、例えば、Duff,et al.,Methods Enzymol,2000,313,297;リシン系ガラクトースクラスター(例えば、L3G4;Biessen,et al.,Cardovasc.Med.,1999,214);及びコラン系ガラクトースクラスター(例えば、アシアロ糖タンパク質受容体に対する炭水化物認識モチーフ)を挙げることができる。
ASGPRコンジュゲート部分、特に三価GalNAcコンジュゲート部分は、当該技術分野で公知の方法を用いてオリゴヌクレオチドの3’末端又は5’末端に結合することができる。一実施形態では、ASGPRコンジュゲート部分は、オリゴヌクレオチドの5’末端に結合する。
一実施形態では、コンジュゲート部分は、図1に示すような三価のN-アセチルガラクトサミン(GalNAc)である。一実施形態では、コンジュゲート部分は、図1A-1若しくは図1A-2の三価N-アセチルガラクトサミン(GalNAc)、又はその両方の混合物である。一実施形態では、コンジュゲート部分は、図1B-1若しくは図1B-2の三価N-アセチルガラクトサミン(GalNAc)、又はその両方の混合物である。一実施形態では、コンジュゲート部分は、図1C-1若しくは図1C-2の三価N-アセチルガラクトサミン(GalNAc)、又はその両方の混合物である。一実施形態では、コンジュゲート部分は、図1D-1若しくは図1D-2の三価N-アセチルガラクトサミン(GalNAc)、又はその両方の混合物である。
製造方法
更なる態様では、本発明は、ヌクレオチド単位を反応させ、それによってオリゴヌクレオチドからなる共有結合された連続ヌクレオチド単位を形成することを含む、本発明のオリゴヌクレオチドを製造するための方法を提供する。好ましくは、この方法は、ホスホロアミダイト化学を使用する(例えば、Caruthersら(1987年)「Methods in Enzymology」第154巻第287~313頁を参照のこと)。さらなる実施形態において、この方法は、連続ヌクレオチド配列をコンジュゲーティング部分(リガンド)と反応させて、コンジュゲート部分をオリゴヌクレオチドに共有結合させることをさらに含む。更なる態様では、本発明のオリゴヌクレオチド又はコンジュゲートしたオリゴヌクレオチドを薬学的に許容され得る希釈剤、溶媒、担体、塩、及び/又はアジュバントと混合することを含む、本発明の組成物を製造する方法が提供される。
更なる態様では、本発明は、ヌクレオチド単位を反応させ、それによってオリゴヌクレオチドからなる共有結合された連続ヌクレオチド単位を形成することを含む、本発明のオリゴヌクレオチドを製造するための方法を提供する。好ましくは、この方法は、ホスホロアミダイト化学を使用する(例えば、Caruthersら(1987年)「Methods in Enzymology」第154巻第287~313頁を参照のこと)。さらなる実施形態において、この方法は、連続ヌクレオチド配列をコンジュゲーティング部分(リガンド)と反応させて、コンジュゲート部分をオリゴヌクレオチドに共有結合させることをさらに含む。更なる態様では、本発明のオリゴヌクレオチド又はコンジュゲートしたオリゴヌクレオチドを薬学的に許容され得る希釈剤、溶媒、担体、塩、及び/又はアジュバントと混合することを含む、本発明の組成物を製造する方法が提供される。
薬学的な塩
本発明による化合物は、その薬学的に許容され得る塩の形態で存在し得る。「薬学的に許容され得る塩」という用語は、本発明の化合物の生物学的有効性及び特性を保持する従来の酸付加塩又は塩基付加塩を指す。
本発明による化合物は、その薬学的に許容され得る塩の形態で存在し得る。「薬学的に許容され得る塩」という用語は、本発明の化合物の生物学的有効性及び特性を保持する従来の酸付加塩又は塩基付加塩を指す。
さらなる態様では、本発明は、核酸分子の薬学的に許容され得る塩又はそのコンジュゲート、例えば薬学的に許容され得るナトリウム塩、アンモニウム塩又はカリウム塩を提供する。
医薬組成物
さらなる態様では、本発明は、本発明の化合物のいずれか、特に前述の核酸分子及び/又は核酸分子コンジュゲート又はその塩と、薬学的に許容され得る希釈剤、担体、塩及び/又はアジュバントとを含む医薬組成物を提供する。薬学的に許容され得る希釈剤には、リン酸緩衝生理食塩水(PBS)が含まれ、薬学的に許容され得る塩には、限定するものではないが、ナトリウム塩及びカリウム塩が含まれる。いくつかの実施形態では、薬学的に許容され得る希釈剤は、無菌リン酸緩衝生理食塩水である。いくつかの実施形態では、核酸分子は、50~300μMの溶液の濃度で薬学的に許容され得る希釈剤中で使用される。
さらなる態様では、本発明は、本発明の化合物のいずれか、特に前述の核酸分子及び/又は核酸分子コンジュゲート又はその塩と、薬学的に許容され得る希釈剤、担体、塩及び/又はアジュバントとを含む医薬組成物を提供する。薬学的に許容され得る希釈剤には、リン酸緩衝生理食塩水(PBS)が含まれ、薬学的に許容され得る塩には、限定するものではないが、ナトリウム塩及びカリウム塩が含まれる。いくつかの実施形態では、薬学的に許容され得る希釈剤は、無菌リン酸緩衝生理食塩水である。いくつかの実施形態では、核酸分子は、50~300μMの溶液の濃度で薬学的に許容され得る希釈剤中で使用される。
本発明での使用に適した製剤は、Remington’s Pharmaceutical Sciences,Mack Publishing Company,Philadelphia,Pa.,17th ed.,1985に見られる。薬物送達の方法の簡単な総説については、例えば、Langer(Science 249:1527-1533,1990)を参照されたい。国際公開第2007/031091号は、薬学的に許容され得る希釈剤、担体及びアジュバントの適切で好ましいさらなる例を提供している(参照により本明細書に組み込まれる)。適切な用量、製剤、投与経路、組成物、剤形、他の治療剤との組合せ、プロドラッグ製剤もまた、国際公開第2007/031091号に提供されている。
いくつかの実施形態では、本発明の核酸分子若しくは核酸分子コンジュゲート、又はその薬学的に許容され得る塩は、粉末、例えば凍結乾燥粉末などの固体形態である。
本発明の化合物、核酸分子若しくは核酸分子コンジュゲートは、医薬組成物又は製剤の調製のために、薬学的に許容され得る活性又は不活性物質と混合されてもよい。医薬組成物の調製のための組成物及び方法は、限定されるものではないが、投与経路、疾患の程度、又は投与される用量を含む多くの基準に依存する。
これらの組成物は、従来の滅菌技術によって滅菌されても、又は滅菌フィルタにかけられてもよい。得られた水溶液は、そのまま使用するために包装するか、又は凍結乾燥することができ、凍結乾燥された調製物は、投与前に滅菌水性担体と組み合わされる。調製物のpHは、典型的には3~11、より好ましくは5~9又は6~8、最も好ましくは7~8、例えば7~7.5であろう。得られた固体形態の組成物は、錠剤又はカプセルの密封パッケージなどのように、各々が上記の薬剤又は薬剤群の固定量を含む複数の単回用量単位で包装することができる。固体形態の組成物はまた、局所適用可能なクリーム又は軟膏用に設計された絞り出し可能なチューブなどの柔軟な量の容器に包装することもできる。
いくつかの実施形態では、本発明の核酸分子又は核酸分子コンジュゲートはプロドラッグである。特に核酸分子コンジュゲートに関して、プロドラッグが作用部位、例えば標的細胞に送達されると、コンジュゲート部分は核酸分子から切断される。
投与
本発明の化合物、核酸分子又は核酸分子コンジュゲート又は医薬組成物は、局所的に、又は経腸的に、又は非経口的に(例えば、静脈内、皮下、又は筋肉内)投与され得る。
本発明の化合物、核酸分子又は核酸分子コンジュゲート又は医薬組成物は、局所的に、又は経腸的に、又は非経口的に(例えば、静脈内、皮下、又は筋肉内)投与され得る。
好ましい実施形態では、本発明のオリゴヌクレオチド又は医薬組成物は、静脈内、動脈内、皮下、腹腔内又は筋肉内注射若しくは注入を含む非経口経路によって投与される。一実施形態では、活性核酸分子又は核酸分子コンジュゲートは静脈内投与される。別の実施形態では、活性核酸分子又は核酸分子コンジュゲートは皮下投与される。
いくつかの実施形態では、本発明の核酸分子、核酸分子コンジュゲート又は医薬組成物は、0.1~15mg/kg、例えば0.2~10mg/kg、例えば0.25~5mg/kgの用量で投与される。投与は、週に1回、2週に1回、3週に1回、又は月に1回であり得る。
本発明はまた、医薬の製造のために記載された本発明の核酸分子又は核酸分子コンジュゲートの使用も提供し、該医薬は皮下投与のための剤形である。
併用療法
いくつかの実施形態では、本発明の核酸分子、核酸分子コンジュゲート又は医薬組成物などの本発明の阻害剤は、別の治療剤との併用処置で使用するためのものである。治療剤は、例えば、上記の疾患又は障害の標準ケアであり得る。
いくつかの実施形態では、本発明の核酸分子、核酸分子コンジュゲート又は医薬組成物などの本発明の阻害剤は、別の治療剤との併用処置で使用するためのものである。治療剤は、例えば、上記の疾患又は障害の標準ケアであり得る。
例として、本発明の核酸分子又は核酸分子コンジュゲートは、アンチセンス(他のLNAオリゴマーを含む)、siRNA(ARC520など)、アプタマー、モルホリノ、又は任意の他の抗ウイルス、ヌクレオチド配列依存性作用様式のいずれかを介して作用する、オリゴヌクレオチド系抗ウイルス剤、例えば配列特異的オリゴヌクレオチド系抗ウイルス剤などの他の活性剤と組み合わせて使用することができる。
さらなる例として、本発明の核酸分子又は核酸分子コンジュゲートは、インターフェロン(例えば、ペグ化インターフェロンα)、TLR7アゴニスト(例えば、GS-9620)、又は治療ワクチンなどの免疫刺激抗ウイルス化合物といった他の活性物質と組み合わせて使用することができる。
さらなる例として、本発明の核酸分子又は核酸分子コンジュゲート剤は、抗ウイルス活性を有する他の活性物質、例えば小分子と組み合わせて使用することができる。これらの他の活性物質は、例えば、ヌクレオシド/ヌクレオチド阻害剤(例えば、エンテカビル又はテノホビル・ジソプロキシルフマル酸塩)、封入阻害剤、侵入阻害剤(例えば、Myrcludex B)であり得る。
特定の実施形態では、追加の治療剤は、HBV薬、C型肝炎ウイルス(HCV)薬、化学療法薬、抗生物質、鎮痛薬、非ステロイド性抗炎症薬(NSAID)、抗真菌薬、抗寄生虫薬、制吐薬、下痢止め薬、又は免疫抑制薬であり得る。
特に、関連する実施形態では、追加のHBV剤は、インターフェロンα-2b、インターフェロンα-2a、及びインターフェロンアルファコン-1(ペグ化及び非ペグ化)、リバビリン;HBV RNA複製阻害薬;第2のアンチセンスオリゴマー;HBV治療ワクチン;HBV予防ワクチン;ラミブジン(3TC);エンテカビル(ETV);フマル酸テノホビル・ジソプロキシル(TDF);テルビブジン(LdT);アデホビル;又はHBV抗体療法(単クローン性又は多クローン性)であり得る。
他の特定の関連する実施形態では、更なるHCV剤は、インターフェロンα-2b、インターフェロンα-2a、及びインターフェロンアルファコン(interferon alphacon)-1(ペグ化及び非ペグ化);リバビリン;ペガシス;HCV RNA複製阻害剤(例えば、ViroPharma社製VP50406シリーズ);HCVアンチセンス剤;HCV治療ワクチン;HCVプロテアーゼ阻害剤;HCVヘリカーゼ阻害剤;又はHCVモノクローナル抗体療法若しくはHCVポリクローナル抗体療法であり得る。
用途
本発明の核酸分子は、例えば、診断、治療及び予防のための研究試薬として利用し得る。
本発明の核酸分子は、例えば、診断、治療及び予防のための研究試薬として利用し得る。
研究では、そのような核酸分子を使用して、細胞(例えば、インビトロ細胞培養物)及び実験動物におけるA1CFタンパク質の合成を特異的に調節し、それによって標的の機能分析又は治療的介入の標的としてのその有用性の評価を促進し得る。典型的には、標的調節は、タンパク質を生成するmRNAを分解又は阻害し、それによりタンパク質形成を防止することによって、又はタンパク質を生成する遺伝子若しくはmRNAのモジュレータを分解若しくは阻害することによって達成される。
本発明の核酸分子を研究又は診断に使用する場合、標的核酸は、cDNA、又はDNA若しくはRNAに由来する合成核酸であり得る。
本発明はまた、A1CFを発現している標的細胞においてA1CF発現を調節するためのインビボ又はインビトロの方法であって、有効量の本発明の核酸分子、コンジュゲート化合物、又は医薬組成物を該細胞に投与することを含む、方法も、包含する。
いくつかの実施形態では、標的細胞は、哺乳動物細胞、特にヒト細胞である。標的細胞は、哺乳動物の組織の一部を形成するインビトロ細胞培養物又はインビボ細胞であってよい。好ましい実施形態では、標的細胞は、肝臓中に存在する。標的細胞は肝細胞であってもよい。
本発明の一態様は、医薬として使用するための本発明の核酸分子、コンジュゲート化合物又は医薬組成物に関する。
本発明の一態様では、本発明の核酸分子、コンジュゲート化合物又は医薬組成物などのA1CF阻害剤は、HBV感染細胞中のcccDNAレベルを減少させ、それによりHBV感染症を阻害することができる。特に、アンチセンスオリゴヌクレオチドは、感染細胞中における以下のパラメータ(i)cccDNAの減少、及び/又は(ii)pgRNAの減少、及び/又は(iii)HBV DNAの減少、及び/又は(iv)HBVウイルス抗原の減少のうちの1つ以上に影響を及ぼすことができる。
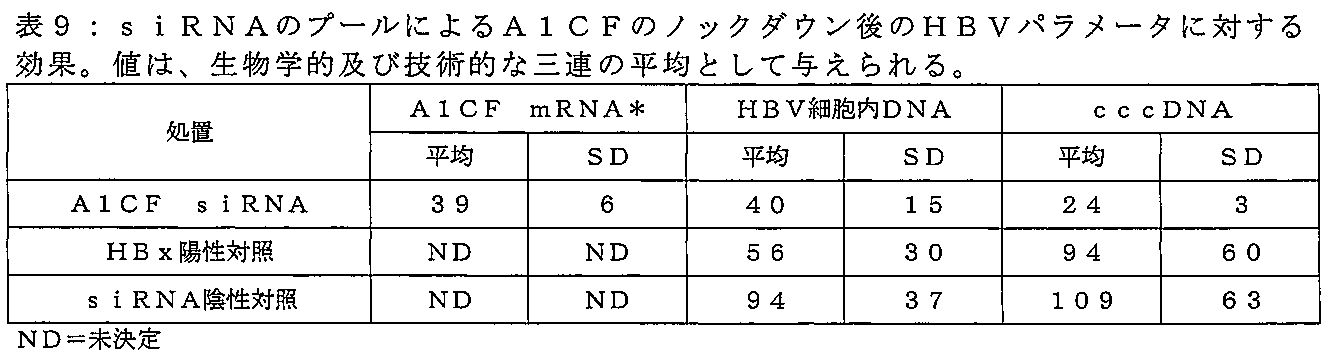
例えば、HBV感染症を阻害する核酸分子は、(i)感染細胞中のcccDNAレベルを、対照と比較して、少なくとも40%、例えば50%、60%又は70%減少、又は(ii)pgRNAレベルを、少なくとも40%、対照と比較して、例えば50%、60%又は70%減少させることができる。対照は、未処理の細胞若しくは動物、又は適切な対照で処理された細胞若しくは動物であり得る。
HBV感染症の阻害は、HBVに感染した初代ヒト肝細胞を用いてインビトロで、又はヒト化肝細胞PXBマウスモデル(PhoenixBioから入手可能、また、Kakuniら(2014年)「Int.J.Mol.Sci.」第15巻、第58~74も参照されたい)を用いてインビボで測定することができる。HBsAg及び/又はHBeAgの分泌阻害は、製造業者の指示に従って、例えばCLIA ELISAキット(Autobio Diagnostic)を用いてELISAにより測定することができる。細胞内cccDNA又はHBV mRNA及びpgRNAの減少は、例えば、材料及び方法セクションに記載されるように、qPCRによって測定することができる。試験化合物がHBV感染を阻害するかどうかを評価するための更なる方法は、例えば国際公開第2015/173208号に記載されているとおりqPCRにより、又はノーザンブロット、インサイチュハイブリダイゼーション、又は免疫蛍光を用いて、HBV DNAの分泌を測定することである。
A1CFレベルの減少により、本発明の核酸分子、コンジュゲート化合物又は医薬組成物は、HBV感染症の発症を阻害するために、又はその処置において使用することができる。特に、cccDNAの不安定化及び減少により、本発明の核酸分子、コンジュゲート化合物又は医薬組成物は、HBsAgの分泌のみを減少させる化合物と比較して、慢性HBV感染症の発症をより効率的に阻害又は処置する。
したがって、本発明の一態様は、HBV感染個体におけるcccDNA及び/又はpgRNAを減少させるための本発明の核酸分子、コンジュゲート化合物、又は医薬組成物などのA1CF阻害剤の使用に関する。
本発明の更なる態様は、慢性HBV感染症の発症を阻害又は処置するための本発明の核酸分子、コンジュゲート化合物、又は医薬組成物などのA1CF阻害剤の使用に関する。
本発明の更なる態様は、HBV感染者の感染性を低下させるための、本発明の核酸分子、コンジュゲート化合物、又は医薬組成物などのA1CF阻害剤の使用に関する。本発明の特定の態様では、本発明の核酸分子、コンジュゲート化合物、又は医薬組成物などのA1CF阻害剤は、慢性HBV感染症の発症を阻害する。
本発明の核酸分子、コンジュゲート化合物、又は医薬組成物などのA1CF阻害剤(又は本発明の核酸分子、コンジュゲート化合物、若しくは医薬組成物を予防的に受容するもの)で処置される対象は、好ましくはヒトであり、より好ましくはHBsAg陽性及び/又はHBeAg陽性のヒト患者であり、より好ましくはHBsAg陽性及びHBeAg陽性のヒト患者である。
したがって、本発明は、有効量の、本発明の核酸分子、コンジュゲート化合物、又は医薬組成物などのA1CF阻害剤を投与することを含む、HBV感染症を処置する方法に関する。本発明は更に、慢性HBV感染症に起因する肝硬変及び肝細胞癌腫を予防する方法に関する。一実施形態では、本発明のA1CF阻害剤は、肝細胞癌腫の処置を意図するものではなく、その予防のみを意図する。
本発明はまた、医薬、特にHBV感染症若しくは慢性HBV感染症の処置、又はHBV感染者の感染性の減少に使用する医薬の製造のための、本発明の核酸分子、コンジュゲート化合物、又は医薬組成物などのA1CF阻害剤の使用を提供する。好ましい実施形態では、医薬は、皮下投与のための剤形で製造される。
本発明はまた、医薬を製造するための本発明の核酸分子、コンジュゲート化合物、又は医薬組成物の使用を提供し、該薬物は静脈内投与のための剤形である。
本発明の核酸分子、コンジュゲート又は医薬組成物などのA1CF阻害剤は、併用療法で使用され得る。例えば、本発明の核酸分子、コンジュゲート、又は医薬組成物は、HBVの処置及び/又は予防のために、インターフェロンα-2b、インターフェロンα-2a、及びインターフェロンアルファコン-1(ペグ化及び非ペグ化)、リバビリン、ラミブジン(3TC)、エンテカビル、テノホビル、テルビブジン(LdT)、アデホビルなどの他の抗HBV剤、又はHBV RNA複製阻害剤、HBsAg分泌阻害剤、HBVカプシド阻害剤、アンチセンスオリゴマー(例えば、国際公開第2012/145697号、同第2014/179629号、及び同第2017/216390号に記載)、siRNA(例えば、国際公開第2005/014806号、同第2012/024170号、同第2012/2055362号、同第2013/003520号、同第2013/159109号、同第2017/027350号、及び同第2017/015175号に記載)、HBV治療ワクチン、HBV予防ワクチン、HBV抗体療法(単クローン性又は多クローン性)、又はTLR2、3、7、8、若しくは9アゴニストなどの他の抗HBV剤と組み合わせてもよい。
本発明の実施形態
本発明の以下の実施形態は、本明細書に記載される任意の他の実施形態と組み合わせて使用することができる。上記の、特に「発明の概要」、「定義」及び「発明の詳細な説明」の項で提供される定義及び説明は、以下に準用される。
本発明の以下の実施形態は、本明細書に記載される任意の他の実施形態と組み合わせて使用することができる。上記の、特に「発明の概要」、「定義」及び「発明の詳細な説明」の項で提供される定義及び説明は、以下に準用される。
1. B型肝炎ウイルス(HBV)感染症の処置及び/又は予防用のA1CF阻害剤。
2. A1CF阻害剤が有効量で投与される、実施形態1に記載の使用のためのA1CF阻害剤。
3. HBV感染症が慢性感染症である、実施形態1又は2に記載の使用のためのA1CF阻害剤。
4. 感染細胞中のcccDNA及び/又はpgRNAの量を減少させることができる、実施形態1~3に記載の使用のためのA1CF阻害剤。
5. A1CFタンパク質のcccDNAへの会合を防止又は減少させる、実施形態1~4のいずれか一つに記載の使用のためのA1CF阻害剤。
6. A1CFタンパク質に特異的に結合する小分子であり、cccDNAへのA1CFタンパク質の会合を防止又は低減する、実施形態5に記載の使用のためのA1CF阻害剤。
7. A1CFタンパク質が配列番号4、5、6、7、8、9、10又は11によってコードされる、実施形態6に記載の使用のためのA1CF阻害剤。
8. 哺乳動物のA1CF標的核酸に対して少なくとも90%相補的な少なくとも12ヌクレオチド長の連続ヌクレオチド配列を含むか又はそれからなる12~60ヌクレオチド長の核酸分子である、実施形態1~7のいずれか一つに記載の使用のためのA1CF阻害剤。
9. 哺乳動物のA1CF標的核酸のレベルを減少させることができる、実施形態8に記載の使用のためのA1CF阻害剤。
10. 哺乳動物のA1CF標的核酸がRNAである、実施形態8又は9に記載の使用のためのA1CF阻害剤。
11. RNAがプレmRNAである、実施形態10に記載の使用のためのA1CF阻害剤。
12. 核酸分子が、アンチセンスオリゴヌクレオチド、siRNA及びshRNAからなる群より選択される、実施形態8~11のいずれか一つに記載の使用のためのA1CF阻害剤。
13. 核酸分子が一本鎖アンチセンスオリゴヌクレオチド又は二本鎖siRNAである、実施形態12に記載の使用のためのA1CF阻害剤。
14. 哺乳動物A1CF標的核酸が、配列番号1、4、5、6、7、8、9、10及び11からなる群から選択される、実施形態8から13のいずれか一つに記載の使用のためのA1CF阻害剤。
15. 核酸分子の連続ヌクレオチド配列が、配列番号1及び配列番号2の標的核酸に対して少なくとも98%相補的、例えば完全に相補的である、実施形態8~13のいずれか一つに記載の使用のためのA1CF阻害剤。
16. 核酸分子の連続ヌクレオチド配列が、配列番号1及び配列番号2及び配列番号3の標的核酸に対して少なくとも98%相補的、例えば完全に相補的である、実施形態8~13のいずれか一つに記載の使用のためのA1CF阻害剤。
17. HBV感染細胞中のcccDNAの量が、対照と比較した場合、少なくとも50%、例えば60%減少する、実施形態1~16のいずれか一つに記載の使用のためのA1CF阻害剤。
18. HBV感染細胞中のpgRNAの量が、対照と比較した場合、少なくとも50%、例えば60%減少する、実施形態1~16のいずれか一つに記載の使用のためのA1CF阻害剤。
19. 哺乳動物のA1CF標的核酸の量が、対照と比較した場合、少なくとも50%、例えば60%減少する、実施形態8~18のいずれか一つに記載の使用のためのA1CF阻害剤。
20. 12~30ヌクレオチド長の連続ヌクレオチド配列を含むか又はそれからなる12~60ヌクレオチド長のオリゴヌクレオチドであって、連続ヌクレオチド配列が、哺乳動物A1CF標的核酸に対して少なくとも90%相補的、例えば95%、例えば98%の完全な相補的である、核酸分子。
21. 核酸分子が化学的に作製される、実施形態20に記載の核酸分子。
22. 哺乳動物A1CF標的核酸が配列番号1、4、5、6、7、8、9、10及び11からなる群より選択される、実施形態20又は21に記載の核酸分子。
23. 連続ヌクレオチド配列が、配列番号1及び配列番号2の標的核酸に対して少なくとも98%相補的、例えば完全に相補的である、実施形態20又は21に記載の核酸分子。
24. 連続ヌクレオチド配列が、配列番号1及び配列番号2及び配列番号3の標的核酸に対して完全に相補的である、実施形態20又は21に記載の核酸分子。
25. 12~30ヌクレオチド長である、実施形態20~23のいずれか一つに記載の核酸分子。
26. 核酸分子が二本鎖siRNA又はshRNAなどのRNAi分子である、実施形態20~25のいずれか一つに記載の核酸分子。
27. 核酸分子が一本鎖アンチセンスオリゴヌクレオチドである、実施形態20~25のいずれか一つに記載の核酸分子。
28. 連続ヌクレオチド配列が、表4又は表5から選択される標的核酸配列に対して完全に相補的である、実施形態20~27のいずれか一つの核酸分子。
29. -15 kcal未満のΔG°で配列番号1及び配列番号2の標的核酸にハイブリダイズすることができる、実施形態20~28のいずれか一つに記載の核酸分子。
30. 連続ヌクレオチド配列が、少なくとも14連続ヌクレオチド、特に15、16、17、18、19、20、21、又は22連続ヌクレオチドを含むか、又はそれらからなる、実施形態20~29のいずれか一つに記載の核酸分子。
31. 連続ヌクレオチド配列が、14~22個のヌクレオチドを含むか、又はそれらからなる、実施形態20~29のいずれか一つに記載の核酸分子。
32. 連続ヌクレオチド配列が、16~20個のヌクレオチドを含むか、又はそれらからなる、実施形態31に記載の核酸分子。
33. 14~25ヌクレオチド長を含むか、又はそれらからなる、実施形態20~32のいずれか一つに記載の核酸分子。
34. 16~22ヌクレオチド長の少なくとも1つのオリゴヌクレオチド鎖を含むか、又はそれらからなる、実施形態33に記載の核酸分子。
35. 連続ヌクレオチド配列が、配列番号12、13、14、及び15からなる群から選択される標的配列に対して完全に相補的である、実施形態20~34のいずれか一つの核酸分子。
36. 連続ヌクレオチド配列が、それが相補的である哺乳動物のA1CF標的核酸と比較して0~3個のミスマッチを有する、実施形態20~35のいずれか一つの核酸分子。
37. 連続ヌクレオチド配列が、哺乳動物のA1CF標的核酸と比較して1つのミスマッチを有する、実施形態36に記載の核酸分子。
38. 連続ヌクレオチド配列が、哺乳動物のA1CF標的核酸と比較して2つのミスマッチを有する、実施形態36に記載の核酸分子。
39. 連続ヌクレオチド配列が、哺乳動物のA1CF標的核酸に対して完全に相補的である、実施形態36に記載の核酸分子。
40. 1つ又は複数の修飾ヌクレオシドを含む、実施形態20~39のいずれか一つに記載の核酸分子。
41. 1つ又は複数の修飾ヌクレオシドが高親和性修飾ヌクレオシドである、実施形態40に記載の核酸分子。
42. 1つ又は複数の修飾ヌクレオシドが2’糖修飾ヌクレオシドである、実施形態40又は41に記載の核酸分子。
43. 1つ又は複数の2’糖修飾ヌクレオシドが、2’-O-アルキル-RNAヌクレオシド、2’-O-メチル-RNAヌクレオシド、2’-アルコキシ-RNAヌクレオシド、2’-O-メトキシエチル-RNAヌクレオシド、2’-アミノ-DNAヌクレオシド、2’-フルオロ-DNAヌクレオシド、2’-フルオロ-ANAヌクレオシド及びLNAヌクレオシドからなる群から独立して選択される、実施形態42に記載の核酸分子。
44. 1つ又は複数の修飾ヌクレオシドがLNAヌクレオシドである、実施形態40~43のいずれか一つに記載の核酸分子。
45. 修飾LNAヌクレオシドが、オキシLNA、アミノLNA、チオLNA、cET及びENAからなる群から選択される、実施形態44に記載の核酸分子。
46. 修飾LNAヌクレオシドが、それに続く2’-4’架橋-O-CH2-を有するオキシLNAである、実施形態44又は45に記載の核酸分子。
47. オキシLNAがベータ-D-オキシLNAである、実施形態46に記載の核酸分子。
48. 修飾LNAヌクレオシドが、以下の2’-4’架橋-O-CH(CH3)-を有するcETである、実施形態44又は45に記載の核酸分子。
49. cETが(S)cET、すなわち6’(S)メチル-ベータ-D-オキシLNAである、実施形態48に記載の核酸分子。
50. LNAがENAであり、それに続く2’-4’架橋-O-CH2-CH2-を有する、実施形態44又は45に記載の核酸分子。
51. 少なくとも1つの修飾されたヌクレオシド間結合を含む、実施形態20~50のいずれか一つの核酸分子。
52. 上記少なくとも1つの修飾されたヌクレオシド間結合がホスホロチオエートヌクレオシド間結合である、実施形態51に記載の核酸分子。
53. RNase Hを動員することができるアンチセンスオリゴヌクレオチドである、実施形態20~52のいずれか一つに記載の核酸分子。
54. アンチセンスオリゴヌクレオチド又は連続ヌクレオチド配列が、ギャップマーである、実施形態53に記載の核酸分子。
55. アンチセンスオリゴヌクレオチド又はその連続ヌクレオチド配列が、式5’-F-G-F’-3’のギャップマーからなるか、又はそれを含み、式中、領域F及びF’が独立して1~4個の2’糖修飾ヌクレオシドを含むか又はそれらからなり、GがRNase Hを動員することができる6個~18個の間のヌクレオシドの領域である、実施形態54に記載の核酸分子。
56. 1~4個の2’糖修飾ヌクレオシドが、2’-O-アルキル-RNAヌクレオシド、2’-O-メチル-RNAヌクレオシド、2’-アルコキシ-RNAヌクレオシド、2’-O-メトキシエチル-RNAヌクレオシド、2’-アミノ-DNAヌクレオシド、2’-フルオロ-DNAヌクレオシド、アラビノ核酸(ANA)ヌクレオシド、2’-フルオロ-ANAヌクレオシド及びLNAヌクレオシドからなる群から独立して選択される、実施形態55に記載の核酸分子。
57. 領域F及びF’における1~4個の2’糖修飾ヌクレオシドの1つ又は複数がLNAヌクレオシドである、実施形態55又は56に記載の核酸分子。
58. 領域F及びF’における2’糖修飾ヌクレオシドの全てがLNAヌクレオシドである、実施形態57に記載の核酸分子。
59. LNAヌクレオシドが、β-D-オキシ-LNA、α-L-オキシ-LNA、β-D-アミノ-LNA、α-L-アミノ-LNA、β-D-チオ-LNA、α-L-チオ-LNA、(S)cET、(R)cET β-D-ENA及びα-L-ENAから選択される、実施形態56~58のいずれか一つに記載の核酸分子。
60. 領域F及びF’が同一のLNAヌクレオシドからなる、実施形態56~59のいずれか一つに記載の核酸分子。
61. 領域F及びF’における全ての2’糖修飾ヌクレオシドがオキシ-LNAヌクレオシドである、実施形態56~60のいずれか一つに記載の核酸分子。
62. 領域GにおけるヌクレオシドがDNAヌクレオシドである、実施形態55~61のいずれか一つに記載の核酸分子。
63. 領域Gが、少なくとも75%のDNAヌクレオシドからなる、実施形態62に記載の核酸分子。
64. 領域Gにおける全てのヌクレオシドがDNAヌクレオシドである、実施形態63に記載の核酸分子。
65. 実施形態20~64のいずれか一項に記載の核酸分子と、核酸分子に共有結合した少なくとも1つのコンジュゲート部分とを含む、コンジュゲート化合物。
66. 核酸分子が二本鎖siRNAであり、コンジュゲート部分がsiRNAのセンス鎖に共有結合している、実施形態65に記載のコンジュゲート化合物。
67. コンジュゲート部分が、炭水化物、細胞表面受容体リガンド、原薬、ホルモン、親油性物質、ポリマー、タンパク質、ペプチド、毒素、ビタミン、ウイルスタンパク質、又はそれらの組合せから選択される、実施形態65又は66に記載のコンジュゲート化合物。
68. コンジュゲート部分が、アシアロ糖タンパク質受容体に結合することができる、実施形態65~67のいずれか一つに記載のコンジュゲート化合物。
69. コンジュゲート部分が、ガラクトース、ガラクトサミン、N-ホルミル-ガラクトサミン、N-アセチルガラクトサミン、N-プロピオニル-ガラクトサミン、N-n-ブタノイル-ガラクトサミン、及びN-イソブタノイルガラクサミンからなる群から選択される、少なくとも1つのアシアロ糖タンパク質受容体標的化部分を含む、実施形態68に記載のコンジュゲート化合物。
70. アシアロ糖タンパク質受容体標的化部分が、N-アセチルガラクトサミン(GalNAc)である、実施形態69に記載のコンジュゲート化合物。
71. コンジュゲート部分が、アシアロ糖タンパク質受容体標的化部分に関して、一価、二価、三価、又は四価である、実施形態69又は70コンジュゲート化合物。
72. コンジュゲート部分が、2~4つの末端GalNAc部分と、アンチセンス化合物にコンジュゲートされ得るブランチャー分子に各GalNAc部分を結合するスペーサーと、からなる、実施形態71に記載のコンジュゲート化合物。
73. スペーサーが、PEGスペーサーである、実施形態72に記載のコンジュゲート化合物。
74. コンジュゲート部分が、GalNAc部分、例えば三価のN-アセチルガラクトサミン(GalNAc)部分である、実施形態68~73のいずれか一つに記載のコンジュゲート化合物。
75. コンジュゲート部分が、図1の三価GalNAc部分のうち1つから選択される、実施形態68~74のいずれか一つに記載のコンジュゲート化合物。
76. コンジュゲート部分が、図1B-1若しくは図1B-2の三価GalNAc部分、又はその両方の混合物である、実施形態75に記載のコンジュゲート化合物。
77. コンジュゲート部分が、図1D-1若しくは図1D-2の三価GalNAc部分、又はその両方の混合物である、実施形態75に記載のコンジュゲート化合物。
78. 核酸分子とコンジュゲート部分との間に配置されたリンカーを含む、実施形態65~77のいずれか一つに記載のコンジュゲート化合物。
79. リンカーが生理学的に不安定なリンカーである、実施形態78に記載のコンジュゲート化合物。
80. 生理学的に不安定なリンカーが、ヌクレアーゼ感受性リンカーである、実施形態79に記載のコンジュゲート化合物。
81. 生理学的に不安定なリンカーが、2~5個の連続ホスホジエステル結合からなる、実施形態79又は80のいずれか一つに記載のコンジュゲート化合物。
82. 非コンジュゲート核酸と比較して、肝臓対腎臓の間の改善した細胞分布、又は該コンジュゲート化合物の該肝臓への改善した細胞取込みを示す、実施形態65~81のいずれか一つに記載のコンジュゲート化合物。
83. 実施形態20~64のいずれか一つに記載の核酸分子、実施形態65~82のいずれか一つに記載のコンジュゲート化合物又はその許容され得る塩、並びに薬学的に許容され得る希釈剤、担体、塩及び/又はアジュバントを含む、医薬組成物。
84. B型肝炎ウイルス(HBV)感染症を予防、改善、及び/又は阻害する化合物を同定するための方法であって、
a. 試験化合物を
i. A1CFポリペプチド;又は
ii. A1CFを発現する細胞と接触させることと、
b. 上記試験化合物の存在下又は非存在下において、A1CFの発現及び/又は活性を測定することと、
c. A1CFの発現及び/又は活性を減少させ、cccDNAを減少させる化合物を同定することと
を含む、方法。
a. 試験化合物を
i. A1CFポリペプチド;又は
ii. A1CFを発現する細胞と接触させることと、
b. 上記試験化合物の存在下又は非存在下において、A1CFの発現及び/又は活性を測定することと、
c. A1CFの発現及び/又は活性を減少させ、cccDNAを減少させる化合物を同定することと
を含む、方法。
85. A1CFを発現している標的細胞におけるA1CF発現を調節するためのインビボ又はインビトロ方法であって、実施形態20~64のいずれか一つに記載の核酸分子、実施形態65~82のいずれか一つに記載のコンジュゲート化合物、又は実施形態83に記載の医薬組成物を有効量で上記細胞に投与することを含む、方法。
86. A1CF発現が、標的細胞において、一切無処理又は対照で処理されたレベルと比較して少なくとも50%、又は少なくとも60%減少する、実施形態85に記載の方法。
87. 標的細胞がHBVに感染し、HBV感染細胞のcccDNAが、HBV感染標的細胞において、一切無処理又は対照で処理されたレベルと比較して少なくとも50%、又は少なくとも60%減少する、実施形態85に記載の方法。
88. HBV感染症などの疾患を処置又は予防するための方法であって、治療有効量又は予防有効量の、実施形態20~64のいずれか一つに記載の核酸分子、実施形態65~82のいずれか一つに記載のコンジュゲート化合物、又は実施形態83に記載の医薬組成物を、疾患に罹患しているか又は疾患に罹患しやすい対象に投与することを含む、方法。
89. 対象におけるHBV感染症などの疾患を処置又は予防するための医薬として使用するための、実施形態20~64のいずれか一項に記載の核酸分子、又は実施形態65~82のいずれか一項に記載のコンジュゲート化合物、又は実施形態83に記載の医薬組成物。
90. 対象におけるHBV感染症などの疾患を処置又は予防するための医薬を調製するための実施形態20~64のいずれか一つに記載の核酸分子又は実施形態65~82のいずれか一つに記載のコンジュゲート化合物の使用。
91. 対象が哺乳動物である、実施形態88~90のいずれか一つの方法、核酸分子、コンジュゲート化合物又は使用。
92. 哺乳動物がヒトである、実施形態91に記載の方法、核酸分子、コンジュゲート化合物又は使用。
これより、本発明を、限定的な特徴を有しない以下の実施例によって説明する。
siRNAのプール(ON-TARGETplus SMART pool siRNA Cat.No.LU-013576-02-0005,Dharmacon)は、上記の表に列挙された配列を標的とする4つの個々のsiRNA分子を含む。
オリゴヌクレオチド合成
オリゴヌクレオチド合成は、当技術分野で一般に知られている。以下は、適用できるプロトコルである。本発明のオリゴヌクレオチドは、使用される装置、支持体、及び濃度に関してわずかに異なる方法によって、生成されている場合がある。
オリゴヌクレオチド合成は、当技術分野で一般に知られている。以下は、適用できるプロトコルである。本発明のオリゴヌクレオチドは、使用される装置、支持体、及び濃度に関してわずかに異なる方法によって、生成されている場合がある。
オリゴヌクレオチドは、Oligomaker 48のホスホロアミダイトアプローチを1μmolスケールで用いて、ウリジンユニバーサル支持体上で合成される。合成の最後に、水性アンモニアを60℃で5~16時間使用してオリゴヌクレオチドを固相支持体から切断する。オリゴヌクレオチドを逆相HPLC(RP-HPLC)又は固相抽出によって精製し、UPLCによって特徴付け、分子量をさらにESI-MSによって確認する。
オリゴヌクレオチドの伸長:
β-シアノエチル-ホスホロアミダイトのカップリング(DNA-A(Bz)、DNA-G(ibu)、DNA-C(Bz)、DNA-T、LNA-5-メチル-C(Bz)、LNA-A(Bz)、LNA-G(dmf)、又はLNA-T)は、アセトニトリル中の0.1Mの5’-O-DMT保護アミダイト及びアセトニトリル(0.25M)中のDCI(4,5-ジシアノイミダゾール)の溶液を活性剤として用いて行われる。最終サイクルでは、所望の修飾を有するホスホロアミダイト、例えばコンジュゲート基を結合するためのC6リンカー、又はそのようなコンジュゲート基を使用できる。ホスホルチオエート結合を導入するためのチオール化は、水素化キサンタン(アセトニトリル/ピリジン9:1中0.01M)を用いることにより行われる。ホスホジエステル結合は、THF/ピリジン/水7:2:1中の0.02Mヨウ素を用いて導入できる。残りの試薬は、オリゴヌクレオチド合成に通常使用される試薬である。
β-シアノエチル-ホスホロアミダイトのカップリング(DNA-A(Bz)、DNA-G(ibu)、DNA-C(Bz)、DNA-T、LNA-5-メチル-C(Bz)、LNA-A(Bz)、LNA-G(dmf)、又はLNA-T)は、アセトニトリル中の0.1Mの5’-O-DMT保護アミダイト及びアセトニトリル(0.25M)中のDCI(4,5-ジシアノイミダゾール)の溶液を活性剤として用いて行われる。最終サイクルでは、所望の修飾を有するホスホロアミダイト、例えばコンジュゲート基を結合するためのC6リンカー、又はそのようなコンジュゲート基を使用できる。ホスホルチオエート結合を導入するためのチオール化は、水素化キサンタン(アセトニトリル/ピリジン9:1中0.01M)を用いることにより行われる。ホスホジエステル結合は、THF/ピリジン/水7:2:1中の0.02Mヨウ素を用いて導入できる。残りの試薬は、オリゴヌクレオチド合成に通常使用される試薬である。
固相合成後のコンジュゲートでは、固相合成の最後のサイクルで市販のC6アミノリンカーホルフォラミダイトを使用でき、脱保護及び固相支持体からの切断後、アミノ結合脱保護オリゴヌクレオチドが単離される。コンジュゲートは、標準的な合成方法を使用した官能基の活性化によって導入される。
RP-HPLCによる精製:
粗化合物は、Phenomenex Jupiter(登録商標)C18 10μm 150×10mmカラムでの分取RP-HPLCにより精製される。0.1M酢酸アンモニウムpH8及びアセトニトリルを5mL/分の流速で緩衝液として使用する。収集された画分を凍結乾燥して、精製された化合物を典型的には白色固体として得る。
粗化合物は、Phenomenex Jupiter(登録商標)C18 10μm 150×10mmカラムでの分取RP-HPLCにより精製される。0.1M酢酸アンモニウムpH8及びアセトニトリルを5mL/分の流速で緩衝液として使用する。収集された画分を凍結乾燥して、精製された化合物を典型的には白色固体として得る。
略語:
DCI:4,5-ジシアノイミダゾール
DCM:ジクロロメタン
DMF:ジメチルホルムアミド
DMT:4,4’-ジメトキシトリチル
THF:テトラヒドロフラン
Bz:ベンゾイル
Ibu:イソブチリル
RP-HPLC:逆相高速液体クロマトグラフィ
DCI:4,5-ジシアノイミダゾール
DCM:ジクロロメタン
DMF:ジメチルホルムアミド
DMT:4,4’-ジメトキシトリチル
THF:テトラヒドロフラン
Bz:ベンゾイル
Ibu:イソブチリル
RP-HPLC:逆相高速液体クロマトグラフィ
Tmアッセイ:
オリゴヌクレオチドとRNA標的(リン酸結合、PO)二重鎖を、500mlのRNaseフリー水で3mMに希釈し、500mlの2倍Tm緩衝液(200mMのNaCl、0.2mMのEDTA、20mMのNa-リン酸、pH7.0)と混合する。この溶液を95℃で3分間加熱し、次いで、室温で30分間アニールする。二重鎖の融解温度(Tm)は、PE Templabソフトウェア(Perkin Elmer)を用いて、ペルチェ温度プログラマーPTP6を備えたLambda 40 UV/VIS分光光度計で測定する。温度を20℃から95℃に上昇させ、次いで25℃に低下させ、260nmで吸収を記録する。一次導関数と、融解及びアニーリングの両方の極大値とを使用して、二重鎖Tmを評価する。
オリゴヌクレオチドとRNA標的(リン酸結合、PO)二重鎖を、500mlのRNaseフリー水で3mMに希釈し、500mlの2倍Tm緩衝液(200mMのNaCl、0.2mMのEDTA、20mMのNa-リン酸、pH7.0)と混合する。この溶液を95℃で3分間加熱し、次いで、室温で30分間アニールする。二重鎖の融解温度(Tm)は、PE Templabソフトウェア(Perkin Elmer)を用いて、ペルチェ温度プログラマーPTP6を備えたLambda 40 UV/VIS分光光度計で測定する。温度を20℃から95℃に上昇させ、次いで25℃に低下させ、260nmで吸収を記録する。一次導関数と、融解及びアニーリングの両方の極大値とを使用して、二重鎖Tmを評価する。
クローン増殖培地(dHCGM).dHCGMは、100U/mlペニシリン、100μg/mLストレプトマイシン、20mMヘペス、44mM NaHCO3、15μg/mL L-プロリン、0.25μg/mLインスリン、50nMデキサメタゾン、5ng/mL EGF、0.1mM Asc-2P、2%DMSO、及び10%FBS(石田ら、2015年)を含有するDMEM培地である。細胞を、5%CO2を含む加湿雰囲気下において37℃のインキュベーターで培養した。培養培地を、播種後24時間、採取まで2日毎に交換した。
HBV感染PHH細胞
新鮮な初代ヒト肝細胞(PHH)を、PhoenixBio,Higashi-Hiroshima City,Japan(PXB-細胞はIshida et al 2015 Am J Pathol.185(5):1275-85にも記載されている)によって96ウェルプレート形式で70,000細胞/ウェルで提供した。
新鮮な初代ヒト肝細胞(PHH)を、PhoenixBio,Higashi-Hiroshima City,Japan(PXB-細胞はIshida et al 2015 Am J Pathol.185(5):1275-85にも記載されている)によって96ウェルプレート形式で70,000細胞/ウェルで提供した。
到着したら、PHH培地中の4%(v/v)PEG中でPHH細胞をHBVと共に16時間インキュベートすることによって、HepG2 2.2.15由来HBV(バッチZ12)を使用してPHHに2GEのMOIを感染させた。次いで、細胞をPBSで3回洗浄し、10%(v/v)熱不活性化ウシ胎児血清(GIBCO、カタログ番号10082)、2%(v/v)DMSO、1%(v/v)ペニシリン/ストレプトマイシン(GIBCO、カタログ番号15140-148)、20mM HEPES(GIBCO、カタログ番号15630-080)、44mM NaHCO3(Wako、カタログ番号195-14515)、15μg/ml L-プロリン(MP-Biomedicals、カタログ番号0219472825)、0.25μg/mlインスリン(Sigma、カタログ番号I 1882)、50nMデキサメタゾン(Sigma、カタログ番号D8893)、5ng/ml EGF(Sigma、カタログ番号E9644)及び0.1mMのL-アスコルビン酸2-リン酸(Wako、カタログ番号013-12061)を補充したDMEM(GIBCO、カタログ番号21885)からなる新鮮PHH培地中、5% CO2で加湿雰囲気を培養した。細胞を、5%CO2を含む加湿雰囲気下において37℃のインキュベーターで培養した。培養培地を、播種後24時間、採取まで週に3回交換した。
siRNAトランスフェクション
感染の4日後、細胞を3連でA1CF siRNAプール(表6を参照)でトランスフェクトした。薬物なし対照(NDC)、陰性対照siRNA及びHBx siRNAを対照として含めた(表7を参照)。
感染の4日後、細胞を3連でA1CF siRNAプール(表6を参照)でトランスフェクトした。薬物なし対照(NDC)、陰性対照siRNA及びHBx siRNAを対照として含めた(表7を参照)。
ウェル毎に、18.2μlのOptiMEM(登録商標)(Thermo Fisher Scientific Reduced Serum media)及び0.6μlのLipofectamine(登録商標)RNAiMAX Transfection Reagent(Thermofisher ScientificカタログNo.13778)を含む2μlの陰性対照siRNA(ストック濃度1μM)、A1CF siRNAプール(ストック濃度1μM)、HBx対照siRNA(ストック濃度0.12μM)又はH2O(NDC)のいずれかでトランスフェクション混合物を調製した。トランスフェクション混合物を混合し、トランスフェクションの5分前に室温でインキュベートした。トランスフェクションの前に、培地をPHH細胞から除去し、P/Sを含まないHepaRG補充物(Biopredic International、#ADD711C)を補充した100μl/ウェルのWilliam’s E Medium+GlutaMAX(商標)(Gibco、番号32551)と交換した。20μlのトランスフェクション混合物を各ウェルに添加して、陰性対照siRNA若しくはA1CF siRNAプールについては16nM、又はHBx対照siRNAについては1.92nMの最終濃度を得て、プレートを穏やかに揺動させた後、インキュベーターに入れた。培地を6時間後にPHH培地と交換した。siRNA処理を上記のように感染後6日目に繰り返した。感染後8日目に上清を回収し、-20oCで保存した。所望であれば、上清からHBsAg及びHBeAgを決定することができる。
HBV抗原発現の測定 HBV抗原の発現及び分泌は、必要に応じて、収集した上清中で測定することができる。HBV増殖パラメータであるHBsAg及びHBeAgレベルは、製造業者のプロトコルに従って、CLIA ELISAキット(Autobio Diagnostic、CL0310-2号、CL0312-2号)を用いて測定される。簡単に述べると、25μL/ウェルの上清をそれぞれの抗体被覆マイクロタイタプレートに移し、25μLの酵素コンジュゲート試薬を加える。プレートを振盪機上で室温にて60分間インキュベートした後、自動洗浄機を用いて洗浄緩衝液によりウェルを5回洗浄する。25μLの基質A及びBを各ウェルに加えた。プレートを振盪機上で室温にて10分間インキュベートした後、EnVision(登録商標)発光リーダ(Perkin Elmer)を用いて発光を測定する。
細胞生存率測定
細胞生存率は、Cell Counting Kit-8(Sigma Aldrich製CCK8、#96992)によって上清を含まない細胞で測定した。測定のために、CCK8試薬を通常の培養培地で1:10に希釈し、100μl/ウェルを細胞に添加した。インキュベーター内で1時間インキュベートした後、80μlの上清を透明な平底96ウェルプレートに移し、450nmでの吸光度を読み取った。吸光度値をNDCに対して正規化し、これを100%に設定して相対細胞生存率を計算した。
細胞生存率は、Cell Counting Kit-8(Sigma Aldrich製CCK8、#96992)によって上清を含まない細胞で測定した。測定のために、CCK8試薬を通常の培養培地で1:10に希釈し、100μl/ウェルを細胞に添加した。インキュベーター内で1時間インキュベートした後、80μlの上清を透明な平底96ウェルプレートに移し、450nmでの吸光度を読み取った。吸光度値をNDCに対して正規化し、これを100%に設定して相対細胞生存率を計算した。
ウイルスパラメータの減少が細胞死の原因ではないことを確認するために細胞生存率測定値が使用され、値が100%に近いほど毒性が低い。
cccDNA及びHBV DNA定量化のためのqRT-PCR
細胞生存率決定後、細胞をPBSで1回洗浄し、次いで、TaqMan(登録商標)Gene Expression Cells-to-CT(商標)キット(Thermo Fisher Scientific、#AM1729)からの50μl/ウェルの溶解溶液で溶解し、-80 oCで保存した。
細胞生存率決定後、細胞をPBSで1回洗浄し、次いで、TaqMan(登録商標)Gene Expression Cells-to-CT(商標)キット(Thermo Fisher Scientific、#AM1729)からの50μl/ウェルの溶解溶液で溶解し、-80 oCで保存した。
cccDNA qPCR分析の前に、細胞溶解物の画分をT5酵素(15U/4μL細胞溶解物;New England Biolabs、#M0363L)で消化した。消化を37oCで30分間行った。
各反応に関するcccDNAの定量のために、2μlのT5消化細胞溶解物、0.5μlの20×cccDNA_DANDRI Taqmanプライマー/プローブ(以下の表に列挙されるLife Technologies、カスタム#AI1RW7N、FAM色素)、5μlのTaqMan(登録商標)Fast Advanced Master Mix(Applied Biosystems、#4444557)及び2.5μlのDEPC処理水を用いた。技術的な三連を各サンプルに関して実行した。
細胞内HBV DNA及び正常化対照、ヒトヘモグロビンベータ(HBB)の定量化のために、各反応について、2μlの未消化細胞溶解物、0.5μlの20×HBV Taqmanプライマー/プローブ(Life Technologies、#Pa03453406_s1、FAM色素)、0.5μlの20×HBB Taqman(登録商標)プライマー/プローブ(Life Technologies、#Hs00758889_s1、VIC色素)、5μlのTaqMan(登録商標)Fast Advanced Master Mix(Applied Biosystems、#4444557)及び2μlのDEPC処理水を使用した。技術的な三連を各サンプルに関して実行した。
qRT-PCRを、急速加熱ブロック(95℃で20秒間、次いで95℃で1秒間及び60℃で20秒間を40サイクル)の標準設定を用いてQuantStudio(商標)K12 Flexで実行した。
各試料についての9つ全ての生物学的及び技術的反復実験の中央値Ctに対して0.9を超える差を有する値を除外することによって、データセットから外れ値を除去した。cccDNA及び総HBV DNAの倍数変化を、2-ddCT法を介してCt値から決定し、ハウスキーピング遺伝子としてのHBBに対して正規化した。発現レベルを平均薬物なし対照試料の%として示す(すなわち、値が低いほど阻害/減少は大きくなる)。
A1CF mRNA発現を測定するためのリアルタイムPCR
A1CF RNAレベル及び正常化対照の定量のために、GUS B、TaqMan(登録商標)RNA-to-Ct(商標)1-Stepキット(Life Technologies、#4392656)を使用した。各反応について、2μlの未消化細胞溶解物、0.5μlの20×A1CF Taqmanプライマー/プローブ(Life Technologies、#Hs00205840_m1、FAM染料)、0.5μlの20×GUS B Taqmanプライマー/プローブ(Life Technologies、#Hs00939627_m1、VIC染料)、5μlの2×TaqMan(登録商標)RT-PCR Mix、0.25μlの40×TaqMan(登録商標)RT Enzyme Mix及び1.75μlのDEPC処理水を使用した。技術的三連実験を各試料について行い、存在するDNAによる潜在的増幅を評価するために、マイナスRT対照を含めた。
A1CF RNAレベル及び正常化対照の定量のために、GUS B、TaqMan(登録商標)RNA-to-Ct(商標)1-Stepキット(Life Technologies、#4392656)を使用した。各反応について、2μlの未消化細胞溶解物、0.5μlの20×A1CF Taqmanプライマー/プローブ(Life Technologies、#Hs00205840_m1、FAM染料)、0.5μlの20×GUS B Taqmanプライマー/プローブ(Life Technologies、#Hs00939627_m1、VIC染料)、5μlの2×TaqMan(登録商標)RT-PCR Mix、0.25μlの40×TaqMan(登録商標)RT Enzyme Mix及び1.75μlのDEPC処理水を使用した。技術的三連実験を各試料について行い、存在するDNAによる潜在的増幅を評価するために、マイナスRT対照を含めた。
qRT-PCRを、QuantStudio(商標)K12 Flexで、48Cで15分間、95°Cで10分間、次いで、95°Cで15秒間及び60°Cで60秒間を40サイクル実行した。
参照遺伝子GUS B及び非トランスフェクト細胞に対して正規化された比較サイクル閾値2-ΔΔCt法を使用して、A1CF mRNA発現レベルを分析した。GUS B RNA及び標的mRNAの定量に使用したプライマーを表8に列挙する。発現レベルを平均薬物なし対照試料の%として示す(すなわち、値が低いほど阻害/減少は大きくなる)。
実施例1:siRNA処置から生じるHBV感染PHH細胞におけるA1CF mRNA、HBV細胞内DNA及びcccDNAの減少の測定
以下の実験では、HBVパラメータ、HBV DNA及びcccDNAに対するA1CFノックダウンの効果を試験した。
以下の実験では、HBVパラメータ、HBV DNA及びcccDNAに対するA1CFノックダウンの効果を試験した。
HBV感染PHH細胞を、材料及び方法のセクション「siRNAトランスフェクション」に記載されているように、DharmaconからのsiRNAのプール(LU-013576-02-0005、表6参照)で処理した。
4日間の処理の後、A1CF mRNA、cccDNA及び細胞内HBV DNAを、材料及び方法のセクション「A1CF mRNA発現を測定するためのリアルタイムPCR」、「cccDNA及びHBV DNA定量化のためのqRT-PCR」に記載されるようにqPCRによって測定した。結果を、平均薬物なし対照試料の%として表9に示す(すなわち、値が低いほど、阻害/減少は大きくなる)。
このことから、A1CF siRNAプールは、A1CF mRNA、cccDNA並びにHBV DNAを非常に効率的に減少させることができることが分かる。陽性対照は、予想通り細胞内HBV DNAを減少させたが、cccDNAに影響を及ぼさなかった。
Claims (32)
- B型肝炎ウイルス(HBV)感染症の処置に使用するためのA1CF(APOBEC1相補因子)阻害剤。
- 前記HBV感染症が慢性感染症である、請求項1に記載の使用のためのA1CF阻害剤。
- HBV感染細胞中のcccDNA(共有結合閉環状DNA)の量を減少させることができる、請求項1又は2に記載の使用のためのA1CF阻害剤。
- 前記阻害剤が、哺乳動物A1CF標的配列、特にヒトA1CF標的配列に対して少なくとも95%相補的、例えば完全に相補的である、少なくとも12ヌクレオチド長の連続ヌクレオチド配列を含む12~60ヌクレオチド長の核酸分子であり、A1CF mRNAを発現する細胞において、前記A1CF mRNAの発現を減少させることができる、請求項1~3のいずれか一項に記載の使用のためのA1CF阻害剤。
- 前記阻害剤が、一本鎖アンチセンスオリゴヌクレオチド、siRNA及びshRNAからなる群から選択される、請求項1~4のいずれか一項に記載の使用のためのA1CF阻害剤。
- 前記哺乳動物A1CF標的配列が、配列番号1、4、5、6、7、8、9、10及び11からなる群から選択される、請求項1~5のいずれか一項に記載の使用のためのA1CF阻害剤。
- 前記連続ヌクレオチド配列が、配列番号1及び配列番号2の標的配列に対して少なくとも98%相補的、例えば完全に相補的である、請求項4~6のいずれか一項に記載の使用のためのA1CF阻害剤。
- 前記HBV感染細胞中の前記cccDNAの量が、少なくとも60%減少する、請求項3~7のいずれか一項に記載の使用のためのA1CF阻害剤。
- 前記A1CF mRNAが、少なくとも60%減少する、請求項4~7のいずれか一項に記載の使用のためのA1CF阻害剤。
- 哺乳動物のA1CF標的配列、特にヒトA1CF標的配列に対して90%相補的、例えば完全に相補的である、少なくとも12ヌクレオチドの連続ヌクレオチド配列を含む12~30ヌクレオチド長の核酸分子であって、A1CF mRNAの発現を阻害することができる、核酸分子。
- 前記連続ヌクレオチド配列が、配列番号1、4、5、6、7、8、9、10及び11からなる群より選択される配列に対して完全に相補的である、請求項10に記載の核酸分子。
- 前記核酸分子が、12~25ヌクレオチド長、例えば16~20ヌクレオチド長の連続ヌクレオチド配列を含む、請求項10又は11に記載の核酸分子。
- 前記核酸分子が、二本鎖siRNA又はshRNAなどのRNAi分子である、請求項10~12のいずれか一項に記載の核酸分子。
- 前記核酸分子が、一本鎖アンチセンスオリゴヌクレオチドである、請求項10~12のいずれか一項に記載の核酸分子。
- 前記一本鎖アンチセンスオリゴヌクレオチドが、RNase Hを動員することができる、請求項14に記載の核酸分子。
- 前記核酸分子が、1つ又は複数の2’糖修飾ヌクレオシドを含む、請求項10~15のいずれか一項に記載の核酸分子。
- 前記1つ又は複数の2’糖修飾ヌクレオシドが、2’-O-アルキル-RNAヌクレオシド、2’-O-メチル-RNAヌクレオシド、2’-アルコキシ-RNAヌクレオシド、2’-O-メトキシエチル-RNAヌクレオシド、2’-アミノ-DNAヌクレオシド、2’-フルオロ-DNAヌクレオシド、アラビノ核酸(ANA)ヌクレオシド、2’-フルオロ-ANAヌクレオシド及びLNAヌクレオシドからなる群から独立して選択される、請求項16に記載の核酸分子。
- 前記1つ又は複数の2’糖修飾ヌクレオシドが、LNAヌクレオシドである、請求項16又は17に記載の核酸分子。
- 前記連続ヌクレオチド配列が、少なくとも1つのホスホロチオエートヌクレオシド間結合を含む、請求項10~18のいずれか一項に記載の核酸分子。
- 前記連続ヌクレオチド配列内のヌクレオシド間結合の全てが、ホスホロチオエートヌクレオシド間結合である、請求項19に記載の核酸分子。
- 前記核酸分子又はその連続ヌクレオチド配列が、式5’-F-G-F’-3’のギャップマーを含み、式中、領域F及びF’が、独立して、1~4個の2’糖修飾ヌクレオシドを含み、Gが、RNase Hを動員することができる6個~18個の間のヌクレオシドの領域、例えば6個~18個の間のDNAヌクレオシドを含む領域である、請求項10~20のいずれか一項に記載の核酸分子。
- 請求項10~21のいずれか一項に記載の核酸分子と、前記核酸分子に共有結合した少なくとも1つのコンジュゲート部分とを含む、コンジュゲート化合物。
- 前記コンジュゲート部分が、三価GalNAc部分などのGalNAc部分、例えば図1の三価GalNAc部分の1つ若しくは複数から選択されるGalNAc部分であるか、又はそれを含む、請求項22に記載のコンジュゲート化合物。
- 前記コンジュゲート化合物が、少なくとも2つの連続するホスホジエステル結合を含む2~5個の連結されたヌクレオシドからなる生理学的に不安定なリンカーを含み、前記生理学的に不安定なリンカーが、前記核酸分子の5’又は3’末端に共有結合している、請求項22又は23に記載のコンジュゲート化合物。
- 請求項10~21のいずれか一項に記載の核酸分子又は請求項22~24のいずれか一項に記載のコンジュゲート化合物の薬学的に許容され得る塩。
- 請求項10~21のいずれか一項に記載の核酸分子、請求項22~24のいずれか一項に記載のコンジュゲート化合物、又は請求項25に記載の薬学的に許容され得る塩と、薬学的に許容され得る添加物とを含む、医薬組成物。
- A1CFを発現している標的細胞におけるA1CF発現を阻害するためのインビボ又はインビトロ方法であって、請求項10~21のいずれか一項に記載の核酸分子、請求項22~24のいずれか一項に記載のコンジュゲート化合物、請求項25に記載の薬学的に許容され得る塩、又は請求項26に記載の医薬組成物を有効量で前記細胞に投与することを含む、方法。
- 疾患を処置するための方法であって、治療有効量又は予防有効量の、請求項10~21のいずれか一項に記載の核酸分子、請求項22~24のいずれか一項に記載のコンジュゲート化合物、請求項25に記載の薬学的に許容され得る塩、又は請求項26に記載の医薬組成物を、疾患に罹患しているか又は罹患しやすい対象に投与することを含む、方法。
- 前記疾患がB型肝炎ウイルス(HBV)感染症、例えば慢性HBV感染症である、請求項28に記載の方法。
- 薬に使用するための、請求項10~21のいずれか一項に記載の核酸分子、請求項22~24のいずれか一項に記載のコンジュゲート化合物、請求項25に記載の薬学的に許容され得る塩、又は請求項26に記載の医薬組成物。
- B型肝炎ウイルス(HBV)感染症、例えば慢性HBV感染症の処置に使用するための、請求項10~21のいずれか一項に記載の核酸分子、請求項22~24のいずれか一項に記載のコンジュゲート化合物、請求項25に記載の薬学的に許容され得る塩、又は請求項26に記載の医薬組成物。
- B型肝炎ウイルス(HBV)感染症、例えば慢性HBV感染症の処置のための医薬の調製のための、請求項10~21のいずれか一項に記載の核酸分子、請求項22~24のいずれか一項に記載のコンジュゲート化合物、請求項25に記載の薬学的に許容され得る塩、又は請求項26に記載の医薬組成物の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP20192212 | 2020-08-21 | ||
| EP20192212.7 | 2020-08-21 | ||
| PCT/EP2021/072985 WO2022038211A2 (en) | 2020-08-21 | 2021-08-19 | Use of a1cf inhibitors for treating hepatitis b virus infection |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2023538630A true JP2023538630A (ja) | 2023-09-08 |
Family
ID=72193368
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023512305A Pending JP2023538630A (ja) | 2020-08-21 | 2021-08-19 | B型肝炎ウイルス感染症を処置するためのa1cf阻害剤の使用 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20230257748A1 (ja) |
| EP (1) | EP4200419A2 (ja) |
| JP (1) | JP2023538630A (ja) |
| CN (1) | CN116157522A (ja) |
| WO (1) | WO2022038211A2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20240167040A1 (en) * | 2022-02-21 | 2024-05-23 | Hoffmann-La Roche Inc. | Antisense oligonucleotide |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3756313B2 (ja) | 1997-03-07 | 2006-03-15 | 武 今西 | 新規ビシクロヌクレオシド及びオリゴヌクレオチド類縁体 |
| CA2303299C (en) | 1997-09-12 | 2016-02-23 | Exiqon A/S | Oligonucleotide analogues |
| CA2361318C (en) | 1999-02-12 | 2008-11-25 | Sankyo Company, Limited | Novel nucleosides and oligonucleotide analogues |
| KR100782896B1 (ko) | 1999-05-04 | 2007-12-06 | 엑시콘 에이/에스 | L-리보-lna 유사체 |
| US6617442B1 (en) | 1999-09-30 | 2003-09-09 | Isis Pharmaceuticals, Inc. | Human Rnase H1 and oligonucleotide compositions thereof |
| DK2284269T3 (en) | 2002-11-18 | 2017-10-23 | Roche Innovation Ct Copenhagen As | Antisense design |
| EP1606406B2 (en) | 2003-03-21 | 2013-11-27 | Santaris Pharma A/S | SHORT INTERFERING RNA (siRNA) ANALOGUES |
| CA2528510C (en) | 2003-06-12 | 2019-06-04 | Nucleonics, Inc. | Conserved hbv and hcv sequences useful for gene silencing |
| WO2007031091A2 (en) | 2005-09-15 | 2007-03-22 | Santaris Pharma A/S | Rna antagonist compounds for the modulation of p21 ras expression |
| AU2007209481B2 (en) | 2006-01-27 | 2012-01-12 | Roche Innovation Center Copenhagen A/S | LNA modified phosphorothiolated oligonucleotides |
| PL2314594T3 (pl) | 2006-01-27 | 2014-12-31 | Isis Pharmaceuticals Inc | Zmodyfikowane w pozycji 6 analogi bicykliczne kwasów nukleinowych |
| JP5244087B2 (ja) | 2006-03-23 | 2013-07-24 | サンタリス ファーマ アー/エス | 低分子内部セグメント化干渉rna |
| WO2007134181A2 (en) | 2006-05-11 | 2007-11-22 | Isis Pharmaceuticals, Inc. | 5'-modified bicyclic nucleic acid analogs |
| US7666854B2 (en) | 2006-05-11 | 2010-02-23 | Isis Pharmaceuticals, Inc. | Bis-modified bicyclic nucleic acid analogs |
| US20090075925A1 (en) * | 2006-11-16 | 2009-03-19 | Smith Harold C | Methods and Compositions Related to APOBEC-1 Expression |
| CA2688321A1 (en) | 2007-05-30 | 2008-12-11 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| ES2386492T3 (es) | 2007-06-08 | 2012-08-21 | Isis Pharmaceuticals, Inc. | Análogos de ácidos nucleicos bicíclicos carbocíclicos |
| ATE538127T1 (de) | 2007-07-05 | 2012-01-15 | Isis Pharmaceuticals Inc | 6-disubstituierte bicyclische nukleinsäureanaloga |
| US8546556B2 (en) | 2007-11-21 | 2013-10-01 | Isis Pharmaceuticals, Inc | Carbocyclic alpha-L-bicyclic nucleic acid analogs |
| WO2010036698A1 (en) | 2008-09-24 | 2010-04-01 | Isis Pharmaceuticals, Inc. | Substituted alpha-l-bicyclic nucleosides |
| US20100184841A1 (en) | 2008-12-18 | 2010-07-22 | Dicerna Pharmaceuticals, Inc. | Extended dicer substrate agents and methods for the specific inhibition of gene expression |
| WO2010093788A2 (en) | 2009-02-11 | 2010-08-19 | Dicerna Pharmaceuticals, Inc. | Multiplex dicer substrate rna interference molecules having joining sequences |
| WO2011017521A2 (en) | 2009-08-06 | 2011-02-10 | Isis Pharmaceuticals, Inc. | Bicyclic cyclohexose nucleic acid analogs |
| WO2011156202A1 (en) | 2010-06-08 | 2011-12-15 | Isis Pharmaceuticals, Inc. | Substituted 2 '-amino and 2 '-thio-bicyclic nucleosides and oligomeric compounds prepared therefrom |
| EP3587574B1 (en) | 2010-08-17 | 2022-03-16 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of hepatitis b virus (hbv) gene expression using short interfering nucleic acid (sina) |
| EP2633051B1 (en) | 2010-10-28 | 2016-09-14 | Benitec Biopharma Limited | Hbv treatment |
| SI3505528T1 (sl) | 2011-04-21 | 2021-04-30 | Glaxo Group Limited | Modulacija izražanja virusa hepatitisa B (HBV) |
| KR102025295B1 (ko) | 2011-06-30 | 2019-09-26 | 애로우헤드 파마슈티컬스 인코포레이티드 | B형 간염 바이러스의 유전자 발현 저해용 조성물 및 방법 |
| DK2742135T4 (da) | 2011-08-11 | 2020-07-13 | Ionis Pharmaceuticals Inc | Bindingsmodificerede gapped oligomeriske forbindelser og anvendelser deraf |
| US9221864B2 (en) | 2012-04-09 | 2015-12-29 | Isis Pharmaceuticals, Inc. | Tricyclic nucleic acid analogs |
| WO2013159109A1 (en) | 2012-04-20 | 2013-10-24 | Isis Pharmaceuticals, Inc. | Modulation of hepatitis b virus (hbv) expression |
| EP2854832A4 (en) * | 2012-06-01 | 2016-06-08 | Univ Drexel | MODULATION OF HEPATITIS B-VIRUS CCCDNS TRANSCRIPTION |
| NZ708171A (en) | 2012-11-15 | 2019-11-29 | Roche Innovation Ct Copenhagen As | Oligonucleotide conjugates |
| ES2730015T3 (es) | 2013-05-01 | 2019-11-07 | Ionis Pharmaceuticals Inc | Composiciones y métodos para modular expresión de HBV y de TTR |
| US9879265B2 (en) | 2013-06-27 | 2018-01-30 | Roche Innovation Center Copenhagen A/S | Oligonucleotide conjugates |
| US10519446B2 (en) * | 2013-10-04 | 2019-12-31 | Novartis Ag | Organic compounds to treat hepatitis B virus |
| JP2017505623A (ja) | 2014-01-30 | 2017-02-23 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 生物切断性コンジュゲートを有するポリオリゴマー化合物 |
| GB201408623D0 (en) | 2014-05-15 | 2014-07-02 | Santaris Pharma As | Oligomers and oligomer conjugates |
| JP6626101B2 (ja) | 2014-10-10 | 2019-12-25 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | GalNAcホスホラミダイト、その核酸結合体およびそれらの使用 |
| US10781445B2 (en) | 2015-03-11 | 2020-09-22 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd. | Decoy oligonucleotides for the treatment of diseases |
| JP6924744B2 (ja) | 2015-07-17 | 2021-08-25 | アークトゥラス・セラピューティクス・インコーポレイテッドArcturus Therapeutics,Inc. | B型肝炎ウイルスに対する組成物および薬剤ならびにその使用 |
| KR101771309B1 (ko) * | 2015-07-24 | 2017-08-24 | 재단법인 목암생명과학연구소 | B형 간염 바이러스의 cccDNA 형성 억제용 약학 조성물 |
| AU2016306275A1 (en) | 2015-08-07 | 2018-02-08 | Arrowhead Pharmaceuticals, Inc. | RNAi therapy for Hepatitis B virus infection |
| US11248019B2 (en) | 2016-04-14 | 2022-02-15 | Hoffmann-La Roche Inc. | Trityl-mono-GalNAc compounds and their use |
| MA45496A (fr) | 2016-06-17 | 2019-04-24 | Hoffmann La Roche | Molécules d'acide nucléique pour la réduction de l'arnm de padd5 ou pad7 pour le traitement d'une infection par l'hépatite b |
| US20180179542A1 (en) * | 2016-11-11 | 2018-06-28 | Alios Biopharma, Inc. | OLIGONUCLEOTIDE TARGETING STRATEGY FOR cccDNA |
| WO2018098328A1 (en) | 2016-11-23 | 2018-05-31 | Alnylam Pharmaceuticals, Inc. | Modified rna agents with reduced off-target effect |
| WO2019193165A1 (en) * | 2018-04-05 | 2019-10-10 | F. Hoffmann-La Roche Ag | Use of fubp1 inhibitors for treating hepatitis b virus infection |
-
2021
- 2021-08-19 JP JP2023512305A patent/JP2023538630A/ja active Pending
- 2021-08-19 WO PCT/EP2021/072985 patent/WO2022038211A2/en unknown
- 2021-08-19 CN CN202180051604.7A patent/CN116157522A/zh active Pending
- 2021-08-19 EP EP21765633.9A patent/EP4200419A2/en active Pending
-
2023
- 2023-02-17 US US18/171,130 patent/US20230257748A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP4200419A2 (en) | 2023-06-28 |
| WO2022038211A2 (en) | 2022-02-24 |
| WO2022038211A3 (en) | 2022-04-28 |
| CN116157522A (zh) | 2023-05-23 |
| US20230257748A1 (en) | 2023-08-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12303525B2 (en) | Nucleic acid molecule for reduction of PAPD5 and PAPD7 mRNA for treating hepatitis B infection | |
| JP7515400B2 (ja) | B型肝炎ウイルス感染を治療するためのfubp1阻害剤の使用 | |
| JP2025072578A (ja) | B型肝炎ウイルス感染症を処置するためのsept9阻害剤の使用 | |
| JP2025039668A (ja) | Rtel1発現の調節用のオリゴヌクレオチド | |
| JP2023509870A (ja) | Hbvの処置のためのhbvを標的とする治療用オリゴヌクレオチドとtlr7アゴニストとの医薬組合せ | |
| US20230118138A1 (en) | Use of scamp3 inhibitors for treating hepatitis b virus infection | |
| JP2023538630A (ja) | B型肝炎ウイルス感染症を処置するためのa1cf阻害剤の使用 | |
| JP2023506954A (ja) | B型肝炎ウイルス感染を処置するためのsaraf阻害剤の使用 | |
| JP7653997B2 (ja) | B型肝炎ウイルス感染を処置するためのcops3阻害剤の使用 | |
| US20230193263A1 (en) | Use of sbds inhibitors for treating hepatitis b virus infection | |
| HK40071185A (en) | Use of sept9 inhibitors for treating hepatitis b virus infection | |
| HK40078456A (en) | Use of sbds inhibitors for treating hepatitis b virus infection | |
| HK40078459A (en) | Use of scamp3 inhibitors for treating hepatitis b virus infection | |
| JP2024546993A (ja) | Rtel1及びfubp1を調節するためのオリゴヌクレオチドの組み合わせ | |
| HK40077333A (en) | Use of saraf inhibitors for treating hepatitis b virus infection |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20240708 |