JP2017507983A - 新規な3−インドール置換誘導体、医薬組成物、および使用方法 - Google Patents
新規な3−インドール置換誘導体、医薬組成物、および使用方法 Download PDFInfo
- Publication number
- JP2017507983A JP2017507983A JP2016557605A JP2016557605A JP2017507983A JP 2017507983 A JP2017507983 A JP 2017507983A JP 2016557605 A JP2016557605 A JP 2016557605A JP 2016557605 A JP2016557605 A JP 2016557605A JP 2017507983 A JP2017507983 A JP 2017507983A
- Authority
- JP
- Japan
- Prior art keywords
- fluoro
- indol
- benzo
- alkyl
- mmol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
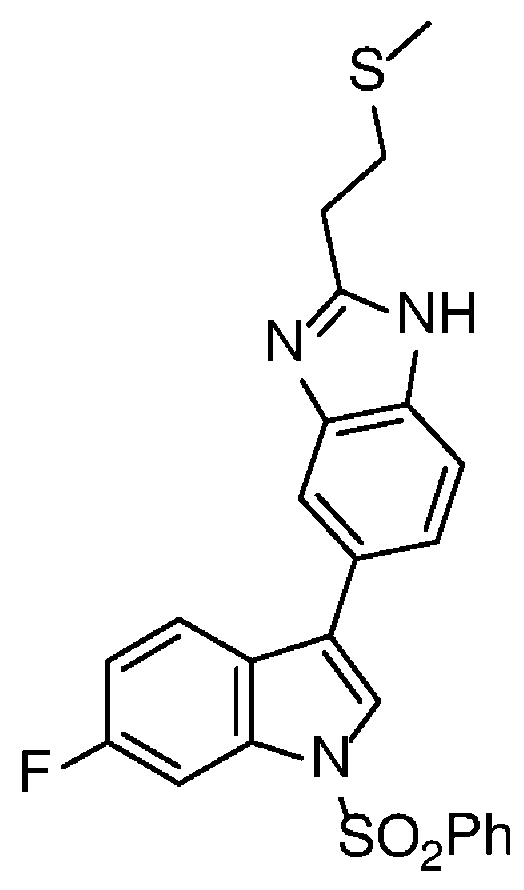
- 0 Cc1c(*)c(*)cc2c1[n]cc2-c1c(*)c(*)c2[n](*)nc(*)c2c1* Chemical compound Cc1c(*)c(*)cc2c1[n]cc2-c1c(*)c(*)c2[n](*)nc(*)c2c1* 0.000 description 25
- XDTMQSROBMDMFD-UHFFFAOYSA-N C1CCCCC1 Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- IIBBUJGNMXNYOC-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)CCC1c([o]c1c2)nc1ccc2-c1c[nH]c2cc(F)ccc12)=O Chemical compound CC(C)(C)OC(N(CC1)CCC1c([o]c1c2)nc1ccc2-c1c[nH]c2cc(F)ccc12)=O IIBBUJGNMXNYOC-UHFFFAOYSA-N 0.000 description 1
- XXCLWKMFWBKYEV-UHFFFAOYSA-N CC(C1=C2)C(c3c[nH]c4cc(F)ccc34)=CC=C1NC2=O Chemical compound CC(C1=C2)C(c3c[nH]c4cc(F)ccc34)=CC=C1NC2=O XXCLWKMFWBKYEV-UHFFFAOYSA-N 0.000 description 1
- CFPXRNWZMUSUDB-UHFFFAOYSA-N CC(NCCc1nc(ccc(-c2c[nH]c3cc(F)ccc23)c2)c2[nH]1)=O Chemical compound CC(NCCc1nc(ccc(-c2c[nH]c3cc(F)ccc23)c2)c2[nH]1)=O CFPXRNWZMUSUDB-UHFFFAOYSA-N 0.000 description 1
- ASSAPUPXNGWQKH-UHFFFAOYSA-N CC1(C)OB(c2ccc3nc(N)[o]c3c2)OC1(C)C Chemical compound CC1(C)OB(c2ccc3nc(N)[o]c3c2)OC1(C)C ASSAPUPXNGWQKH-UHFFFAOYSA-N 0.000 description 1
- MGNIUMZKZJEFRX-UHFFFAOYSA-N CC1(C)OS(c(cc2)cc3c2[o]c(C)n3)OC1(C)C Chemical compound CC1(C)OS(c(cc2)cc3c2[o]c(C)n3)OC1(C)C MGNIUMZKZJEFRX-UHFFFAOYSA-N 0.000 description 1
- VTVSXSRJIHEZCX-IOMHPIHLSA-N CCC/C=C(/c1ccc2nc(CNS(CCN3C[IH]NCC3)(O)=O)[o]c2c1)\c(c(C)c1)ccc1F Chemical compound CCC/C=C(/c1ccc2nc(CNS(CCN3C[IH]NCC3)(O)=O)[o]c2c1)\c(c(C)c1)ccc1F VTVSXSRJIHEZCX-IOMHPIHLSA-N 0.000 description 1
- DSPXTPHKIYHTMI-UHFFFAOYSA-N CN1CCN(CC(Cc2c3)=Nc2ccc3-c2c[nH]c3c2ccc(F)c3)CC1 Chemical compound CN1CCN(CC(Cc2c3)=Nc2ccc3-c2c[nH]c3c2ccc(F)c3)CC1 DSPXTPHKIYHTMI-UHFFFAOYSA-N 0.000 description 1
- WXOBRKPRAOVVEQ-UHFFFAOYSA-N CN1CCN(CCS(NCc([o]c2c3)nc2ccc3-c2c[nH]c3cc(F)ccc23)(=O)=O)CC1 Chemical compound CN1CCN(CCS(NCc([o]c2c3)nc2ccc3-c2c[nH]c3cc(F)ccc23)(=O)=O)CC1 WXOBRKPRAOVVEQ-UHFFFAOYSA-N 0.000 description 1
- MIQQJFMNQUYWCY-UHFFFAOYSA-N CS(N1CCN(CCc([o]c2c3)nc2ccc3-c2c[nH]c3cc(F)ccc23)CC1)(=O)=O Chemical compound CS(N1CCN(CCc([o]c2c3)nc2ccc3-c2c[nH]c3cc(F)ccc23)CC1)(=O)=O MIQQJFMNQUYWCY-UHFFFAOYSA-N 0.000 description 1
- XPOMXONTSPWHHY-UHFFFAOYSA-N CS(NCc([o]c1c2)nc1ccc2-c1c[nH]c2c1cccc2)(=O)=O Chemical compound CS(NCc([o]c1c2)nc1ccc2-c1c[nH]c2c1cccc2)(=O)=O XPOMXONTSPWHHY-UHFFFAOYSA-N 0.000 description 1
- GANDMFWBFQLZHN-UHFFFAOYSA-N Cc(cc1Br)ccc1NC(CC(C(N1)=O)NC1=O)=O Chemical compound Cc(cc1Br)ccc1NC(CC(C(N1)=O)NC1=O)=O GANDMFWBFQLZHN-UHFFFAOYSA-N 0.000 description 1
- KRFIPUUKIGJSFK-UHFFFAOYSA-N Fc1ccc(c(-c2ccc(CNC3)c3c2)c[nH]2)c2c1 Chemical compound Fc1ccc(c(-c2ccc(CNC3)c3c2)c[nH]2)c2c1 KRFIPUUKIGJSFK-UHFFFAOYSA-N 0.000 description 1
- UOCYIXXSBUSRAQ-UHFFFAOYSA-N O=C1Oc2cc(-c3c[nH]c4cc(F)ccc34)ccc2N1 Chemical compound O=C1Oc2cc(-c3c[nH]c4cc(F)ccc34)ccc2N1 UOCYIXXSBUSRAQ-UHFFFAOYSA-N 0.000 description 1
- BSLHXHZMGJSZKG-UHFFFAOYSA-N OC(CC[n]1ncc2c1ccc(-c1c[nH]c3cc(F)ccc13)c2)=O Chemical compound OC(CC[n]1ncc2c1ccc(-c1c[nH]c3cc(F)ccc13)c2)=O BSLHXHZMGJSZKG-UHFFFAOYSA-N 0.000 description 1
- PZAZCHVOSSBLID-UHFFFAOYSA-N OCCNC(CC[n]1ncc2c1ccc(-c1c[nH]c3cc(F)ccc13)c2)=O Chemical compound OCCNC(CC[n]1ncc2c1ccc(-c1c[nH]c3cc(F)ccc13)c2)=O PZAZCHVOSSBLID-UHFFFAOYSA-N 0.000 description 1
- BPPYSPDYOGPWNH-UHFFFAOYSA-N c([nH]c1c2cccc1)c2-c1ccc2[nH]ncc2c1 Chemical compound c([nH]c1c2cccc1)c2-c1ccc2[nH]ncc2c1 BPPYSPDYOGPWNH-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Virology (AREA)
- Oncology (AREA)
- Psychology (AREA)
- Communicable Diseases (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Physical Education & Sports Medicine (AREA)
- Molecular Biology (AREA)
- Psychiatry (AREA)
- Child & Adolescent Psychology (AREA)
- Reproductive Health (AREA)
- AIDS & HIV (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Hospice & Palliative Care (AREA)
- Gastroenterology & Hepatology (AREA)
- Dermatology (AREA)
- Endocrinology (AREA)
- Pain & Pain Management (AREA)
- Tropical Medicine & Parasitology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pulmonology (AREA)
Abstract
本発明は、式(I)の化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物に関する。本発明はさらに、式Iの化合物のTDO2阻害薬としての使用に関する。本発明はまた、HIV、うつ病、および肥満の治療および/または予防のための、式Iの化合物の使用に関する。本発明はまた、式(I)の化合物の製造方法に関する。【化1】
Description
本発明は、薬学的に許容できるその鏡像異性体、塩、および溶媒和物を含めた新奇な3−(インドール−3−イル)−ピリジン誘導体に関する。本発明の化合物は、TDO2(トリプトファン2,3−ジオキシゲナーゼ)の阻害薬であり、特にがんの治療および/または予防において治療用化合物として有用である。
胎盤の免疫特権の維持にとってのトリプトファン異化の重要性が発見されてから20年が経過した後(Munn、D.H.ら、Science、1998、281、1191〜1193)、積み重なる証拠から、その生物学的関連性は、非自己に対する免疫寛容の範囲を超えて拡大している。一般に受け入れられている概念によれば、必須アミノ酸であるトリプトファンは、腫瘍、免疫特権部位、または炎症部位の局所微小環境において異化される(Mellor ALおよびMunn DH、Nat Rev Immunol、2008、8、74〜80)。こうした組織では、がん細胞、免疫細胞、または特殊化した上皮細胞(たとえば、胎盤の合胞体栄養細胞)によって腫瘍における免疫抑制環境が作り出されるが、免疫抑制環境では、トリプトファンの枯渇および免疫抑制性トリプトファン異化産物の蓄積を通してT細胞アネルギーおよびアポプトーシスが誘発されることにより、腫瘍および腫瘍排出リンパ節における抗腫瘍免疫応答が遮断される(Munn DHら、J Exp Med.、1999、189、1363〜1372;Fallarino Fら、Cell Death Differ.、2002、9、1069〜1077)。
最近になって、肝臓において全身のトリプトファンレベルの調節を担うと考えられている、トリプトファン異化の鍵酵素であるトリプトファン2,3−ジオキシゲナーゼ(TDO2)が、たとえば、膀胱癌、肝臓癌、黒色腫、中皮腫、神経芽細胞腫、肉腫、乳癌、白血病、腎細胞癌、結腸直腸癌、頭頸部癌、肺癌、脳腫瘍、神経膠芽腫、星状細胞腫、骨髄腫、膵臓癌などの多種多様ながんにおいて構成的に発現することが発見されている(Pilotte Lら、Proc Natl Acad Sci USA、2012、109(7)、2497〜502)。腫瘍細胞においてTDO2が発現すると、局所的にトリプトファンを分解することで、免疫系による腫瘍の監視が妨げられ、したがって、腫瘍拒絶が妨げられる(Opitz CAら、Nature、2011、478(7368)、197〜203)。これについての最初の証拠は、予防的なワクチン接種手法によってP815肥満細胞腫腫瘍モデルにおける腫瘍成長を抑制した低分子が、TDO2を阻害したことから得られた(Pilotte Lら、Proc Natl Acad Sci USA、2012、109(7)、2497〜502)。P815mTDO2を発現する腫瘍は、空のベクターが形質移入されたP815腫瘍に比べて拒絶されず、TDO2発現腫瘍では成長が有利なことがはっきりと示された。TDO2阻害薬による阻害によって、P815mTDO2が移植された腫瘍において腫瘍成長が強力に低下した。TDO2阻害薬による抗腫瘍活性は、TDO2陰性の、P815対照が移植された腫瘍でも等しく観察され、したがって、動物の免疫系において発現したTDO2の影響であることの証拠が得られた。こうした実験により初めて、がん細胞ならびに免疫区画における発現を通した腫瘍成長の調節におけるTDO2の役割について、明白な証拠が得られた。
肝臓におけるその発現プロファイルと整合することには、TDO2は、大部分が肝細胞癌(HCC)において見出されている(Pilotte Lら、Proc Natl Acad Sci USA、2012、109(7)、2497〜502)。トリプトファン異化を阻害することで、トリプトファン濃度を回復させ、下流代謝産物の産生を減少させることが、肝臓癌の段階へと進行している肝疾患の状況において有益であることが立証される可能性がある。より詳細には、(i)いくつかの報告が、補給によるトリプトファンの利用可能性の増大は、タンパク質合成へのトリプトファンの直接の使用を可能にし、たとえば硬変肝に有益であるという証拠を示している(Ohtaら、Amino Acids、1996、10(4)、369〜78)、(ii)キノリン酸などの下流血清トリプトファン代謝産物の増加と、肝硬変患者における肝機能不全とには相関がある(Lahdouら、Hum Immunol、2013、74(1)、60〜6)、(iii)別のトリプトファン代謝産物であるインドール−3−乳酸の分泌の増加が、マウスにおけるアルコール誘発性肝疾患と関連付けられた(Mannaら、J Proteome Res、2011、10(9)、4120〜33)。肝臓癌それ自体に関して言えば、非常に高いRNA発現は、TDO2阻害薬の治療評価の好適な指標である(Pilotte Lら、Proc Natl Acad Sci USA、2012、109(7)、2497〜502)。したがって、上記事項から、肝臓腫瘍進展のコントロールにおいてTDO2活性を調節することの論理的根拠が明白となる。
肝臓における発現に加えて、TDO2は、ニューロン、小神経膠細胞、および星状細胞でも発現し、神経膠腫の状況でのTDO2阻害の潜在的な恩恵は、別の動物モデルで示されている。Plattenおよび共同研究者らは、腫瘍細胞において発現したTDOが産生するトリプトファン異化産物のキヌレニンが、オートクリン/パラクリンの形でAHRを介して、抗腫瘍免疫応答を抑制し、腫瘍細胞の生存および運動性を促進することを実証している(Opitz CAら、Nature、2011、478(7368)、197〜203)。TDO−AHR経路は、ヒト脳腫瘍において活発であり、悪性進行および思わしくない生存期間と関連付けられる。さらなる証拠となったのは、ヒト神経膠腫に蓄積し、悪性表現型と関連付けられている、下流代謝産物のキノリン酸の蓄積である(Sahmら、Cancer Res、2013、73(11)、3225〜34)。ここで、トリプトファン異化が、小神経膠細胞でも起こることが示された。したがって、上記データは、神経膠腫において脳浸透低分子でTDO2ターゲティングを行う根拠となる。
TDO2 mRNAが見出された他の腫瘍タイプは、乳癌、膀胱、腎細胞、膵臓、結腸直腸、頭頸部癌、肺癌、および黒色腫であり、したがって、TDO2ターゲティングの範囲は、HCCおよび神経膠腫以外に広がっている(Pilotte Lら、Proc Natl Acad Sci USA、2012、109(7)、2497〜502)。
婦人科がん(卵巣癌、子宮頚がん、子宮内膜がん)の患者で観察されるトリプトファン分解の亢進は、これらのがんにおいてTDO2ターゲティングを行うことのさらなる論理的根拠となる(Sperner−Unterweger Bら、Immunology、2011、216(3);296〜301)。
一部のがんにおけるトリプトファン異化は、腫瘍細胞によるインドールアミン2,3−ジオキシゲナーゼ(IDO1)の発現によっても増大する可能性がある(Uyttenhove,C.ら、Nat.Med.、2003、9、1269〜1274)。
トリプトファン異化は、炎症メディエーター、特にIFN−γによって誘発されるので、過剰な免疫応答を制限し、それによって免疫病理を予防する、内因性の機序であると考えられる。しかし、がんに関しては、前がん病変および確立したがんにおけるトリプトファン異化による抗腫瘍免疫応答の抑制が、腫瘍成長を促進することについては強固な証拠があり、そのため、このような異化は、治療介入の魅力的なターゲットとなる(Dolusic EおよびFrederick R、Expert Opin Ther Pat.、2013、23(10)、1367〜81)。したがって、従来の化学療法、免疫チェックポイント薬(Holmgaard RBら、J Exp Med.、2013、210(7)、1389〜402)、または治療ワクチンの有効性を高める、トリプトファン異化の選択的で有効な阻害薬を特定するために、相当な努力が払われている。
神経学的脳障害に関しては、ニューロン、脳脈管構造において、加えて統合失調症の場合では星状膠細胞において、TDO2発現が明らかにされている(Miller Cら、2004、Neurobiology Dis、15(3):618〜29)。キヌレニン経路は、現在、双極性障害やトゥーレット症状群のような認知疾患、アルツハイマーのような神経変性障害、筋萎縮性側索硬化症、多発性硬化症、ハンチントン病、またはパーキンソン病のような運動ニューロン疾患における治療ターゲットであると考えられている(Stone TW、2013、Br J of Pharmacol、169(6):1211〜27;Wuら、2013、Plos One、8(4):e59749;Fuvesiら、2012、J Neural Transm、119(2):225〜34;Widnerら、2002、J Neural Transm、109(2):181〜9;Comingsら、1996、Pharmacogenetics、6(4):307〜18;Forrest、2010、J Neurochem、112(1):112〜22)。
トリプトファン異化に関連した認知的変化も、HIV関連神経認知障害(HAND)と呼ばれる、1型ヒト免疫不全ウイルス(HIV)に感染した患者において示されている(Daviesら、2010、Int J of Tryptophan Res、3:121〜40)。加えて、最近では、T細胞の低応答性が、HIV感染患者においてトリプトファン異化経路と関連付けられており、たとえばC型肝炎のような他の慢性感染性疾患にも広げられる可能性がある。
いくつかのTDO2阻害剤が、WO2010/008427およびDolusic,E.ら(Dolusicら、J.Med.Chem.、2011、54、5320〜5334)において提案されてはいるが、しかし、ターゲットに対するその親和性は限定され、またはその薬動学的性質が、ヒトに使用する薬物としての開発に適したものでない。
したがって、がん治療および/または予防のための、有効性が改善されている新たなTDO2阻害薬が求められている。
本発明は、限定はしないが、がんと診断された患者またはがんになるリスクのあるいずれかの対象を含めて、TDO2のレベルを調節する、特に低下させることが望ましい状態または疾患を抱えている哺乳動物対象に投与することができる、新たなTDO2阻害薬を提供する。こうした化合物を含有する組成物およびその使用も提供される。
一態様では、A1、A2、A3、Y1、Y2、Y4、R1、R2、R3、X1、およびX3が本明細書で規定するとおりである、式Iの化合物、または薬学的に許容できるその塩、溶媒、もしくは溶媒和物が提供される。
一実施形態では、A1、A2、およびA3のうちの最初の1つは、Nであり、A1、A2、およびA3のうちの二つ目のものは、Cであり、A1、A2、およびA3のうちの三つ目のものは、NまたはOである。別の実施形態では、A2は、Nであり、A1およびA3の一方は、NまたはSであり、他方は、Cである。さらに別の実施形態では、A1またはA3は、Sであり、A1−Y1またはA3−Y3は、SO2である。さらに別の実施形態では、A2は、Cであり、A1およびA3の一方は、Nであり、他方は、NまたはOである。さらに別の実施形態では、A1またはA3は、Oであり、Cは、本明細書で規定するとおりのCR6R7R8で置換されており、R6、R7、R8のうちの1つは、a1であり、A1またはA3は、Oであり、Cは、CR6R7R8で置換されており、R6、R7、またはR8は、ヘテロシクリルまたはC1−ヘテロシクリルであり、ヘテロシクリルは、ピペリジン、ピロリジン、ピペラジン、モルホリン、または2,6−ジアザスピロ[3.3]ヘプタンであり、これらはいずれも、C1〜C3アルキル、アミノ、ヒドロキシル、ハロゲン、COCH3、COOH、またはSO2CH3のうちの1つまたは複数で置換されていてもよい。さらに別の実施形態では、A1、A2、もしくはA3のうちの1つは、Sであり、またはA1−Y1、A2−Y2、もしくはA3−Y3は、SO2であり、A1、A2、またはA3のうちの1つは、NまたはCであり、A1、A2、およびA3のうちの1つは、Cである。別の実施形態では、X1およびX2は、独立に、HまたはFである。さらに別の実施形態では、R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、もしくはメチルを表し、またはそれぞれHであってもよい。
別の態様では、式Iによる化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物と、薬学的に許容できる少なくとも1種の担体、希釈剤、医薬添加剤、および/またはアジュバントとを含む医薬組成物が提供される。
さらに別の態様では、式Iによる化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物を含む医薬が提供される。
さらに別の態様では、がん、パーキンソン病、アルツハイマー病、ハンチントン病などの神経変性障害、HCVおよびHIVなどの慢性ウイルス感染症、うつ病、ならびに肥満の治療および/または予防において使用するため、またはTDO2阻害薬として使用するための、式Iの化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物が提供される。
さらに別の態様では、がん、パーキンソン病、アルツハイマー病、ハンチントン病などの神経変性障害、HCVおよびHIVなどの慢性ウイルス感染症、うつ病、ならびに肥満を治療および/もしくは予防する、またはTD02を阻害する方法が提供される。本方法は、式Iの化合物または薬学的に許容できるその塩を投与することを含む。
別の態様では、式Iの化合物または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物の製造方法が提供される。本方法は、
(a1)式(i)の化合物
(a1)式(i)の化合物
X1およびX2は、それぞれ独立に、H、ハロゲン、アルキル、ハロアルキルを表し、
Z1は、Hまたはアミノ保護基を表し、
Yは、ハロゲン、1〜6個の炭素原子を有するアルキルスルホニルオキシ、または6〜10個の炭素原子を有するアリールスルホニルオキシを表す]を、
式(ii)の化合物
R1、R2、R3、A1、A2、A3、Y1、Y2、およびY3は、本明細書で規定するとおりであり、
Z2およびZ3は、Hまたはアルキル基を表すか、Z2およびZ3は、環を形成していてもよい]と反応させて、
式(iii)の化合物
(b1)Z1がHでない場合、式(iii)の化合物のインドールアミンを脱保護して、式Iの化合物を得るステップと
を含む。
本発明のさらに他の態様および利点は、以下の本発明の詳細な説明から明らかとなる。
化合物
本発明は、式Iの化合物
本発明は、式Iの化合物
X1およびX2は、それぞれ独立に、H、ハロゲン、アルキル、またはハロアルキルを表し、
R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、C1〜C6アルキル、アルコキシ、またはハロアルキルを表し、これらは、ハロゲン、ヒドロキシル、OR4、COOR4、CONR4R5、NR4COR5、NR4R5、SO2R4、SO2NR4R5、NR4SO2R5、SO2R4、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルから選択される1つまたは複数の置換基で置換されていてもよく、R4およびR5は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、
A1、A2、およびA3は、それぞれ独立に、C、N、S、またはOを表し、A1、A2、またはA3がSである場合、A1−Y1、A2−Y2、またはA3−Y3は、SO2であってもよく、
Y1、Y2、およびY3のそれぞれは、不在であるか、または独立に、
a)水素原子、
b)オキソ、
c)SH、
d)CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
i)水素原子、
ii)ハロゲン、
iii)ヒドロキシル、
iv)OR9もしくはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、もしくはSO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、ヒドロキシル、もしくはアミノから選択される置換されていてもよい基を表す]、
v)直鎖もしくは分岐C1〜C10アルキル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、またはCO−アルキルから選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]、
vi)ヘテロシクリルまたはC1〜C2アルキル−ヘテロシクリル[ヘテロシクリルは、3つまでの置換基ハロゲン、ヒドロキシル、オキソ、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、またはアルキルで置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]、
vii)−CO−R11もしくは−SO2R11[R11は、ヒドロキシ、アミン、アルキル、ヘテロシクリルから選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]
を表し、
viii)Y1、Y2、もしくはY3がCR6R7R8である場合、R6、R7、およびこれらが結合している炭素原子は、一緒になって、
シクロアルキル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルから選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]もしくは
ヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]
から選択される環を形成していてもよく、または
ix)Y1、Y2、もしくはY3がNR6R7である場合、R6、R7、およびこれらが結合している窒素原子は、一緒になって、環を形成していてもよく、環は、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R11、SO2R9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つもしくは複数の基で置換されていてもよいC1〜C6アルキルから選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、もしくはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、R11は、水素原子、もしくはアリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、もしくはR11は、ハロゲン、ヒドロキシル、OR12、COOR12、CONR12R13、NR12COR13、NR12R13、SO2R12、SO2NR12R13、NR12SO2R13、SO2R12、もしくはアリールから選択される3つまでの置換基で置換されていてもよいアルキル基を表し、R12およびR13は、それぞれ独立に、水素原子、もしくはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、
点線は、単結合または二重結合を表し、
但し、A1、A2、およびA3は、すべてがCになることはなく、
但し、A1またはA3のうちの1つがNである場合、他の2つは、両方ともがCになることはなく、但し、A1、A2、およびA3のうちの1つがSである場合、1つだけSが存在し、他の2つの少なくとも一方はCであり、他方はCまたはNであり、
但し、式Iの化合物は、3−(ベンゾフラン−5−イル)−6−クロロ−1H−インドールまたは3−(ベンゾ[d][1,3]ジオキソール−5−イル)−1H−インドールではない。
別の実施形態では、式Iにおいて、
X1およびX2は、それぞれ独立に、H、ハロゲン、アルキル、ハロアルキル、好ましくはHまたはFを表し、
R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、C1〜C6アルキル、アルコキシ、ハロアルキルを表し、これらは、ハロゲン、ヒドロキシル、OR4、COOR4、CONR4R5、NR4COR5、NR4R5、SO2R4、SO2NR4R5、NR4SO2R5、SO2R4、アリール、CO−アルキル、アルキルを含む群から選択される1つまたは複数の置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R4およびR5は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、
好ましくは、R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、またはアルキルを表し、
好ましくは、R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、またはメチルを表し、
好ましくは、R1、R2、およびR3は、それぞれHを表し、
A1、A2、およびA3は、それぞれ独立に、C、N、またはOを表し、
Y1、Y2、およびY3のそれぞれは、不在であるか、または独立に、
− 水素原子、
− オキソ、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・ハロゲン、好ましくはF、Cl、またはI、より好ましくはF、
・ヒドロキシル、
・OR9またはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、SO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・直鎖または分岐C1〜C10アルキル、好ましくはメチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・CR6R7R8において、R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、
シクロアルキル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
から選択されることが好ましく、
・NR6R7において、R6、R7、およびこれらが結合している窒素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R11、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、R11は、水素原子、もしくはアリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、またはR11は、ハロゲン、ヒドロキシル、OR12、COOR12、CONR12R13、NR12COR13、NR12R13、SO2R12、SO2NR12R13、NR12SO2R13、SO2R12、アリールを含む群から選択される3つまでの置換基で置換されていてもよいアルキル基を表し、R12およびR13は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、
点線は、単結合または二重結合を表し、
但し、A1、A2、およびA3は、すべてがCになることはなく、
但し、A1、A2、およびA3のうちの1つがNである場合、他の2つは、両方ともがCになることはなく、
但し、式Iの化合物は、3−(ベンゾフラン−5−イル)−6−クロロ−1H−インドールまたは3−(ベンゾ[d][1,3]ジオキソール−5−イル)−1H−インドールではない。
X1およびX2は、それぞれ独立に、H、ハロゲン、アルキル、ハロアルキル、好ましくはHまたはFを表し、
R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、C1〜C6アルキル、アルコキシ、ハロアルキルを表し、これらは、ハロゲン、ヒドロキシル、OR4、COOR4、CONR4R5、NR4COR5、NR4R5、SO2R4、SO2NR4R5、NR4SO2R5、SO2R4、アリール、CO−アルキル、アルキルを含む群から選択される1つまたは複数の置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R4およびR5は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、
好ましくは、R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、またはアルキルを表し、
好ましくは、R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、またはメチルを表し、
好ましくは、R1、R2、およびR3は、それぞれHを表し、
A1、A2、およびA3は、それぞれ独立に、C、N、またはOを表し、
Y1、Y2、およびY3のそれぞれは、不在であるか、または独立に、
− 水素原子、
− オキソ、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・ハロゲン、好ましくはF、Cl、またはI、より好ましくはF、
・ヒドロキシル、
・OR9またはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、SO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・直鎖または分岐C1〜C10アルキル、好ましくはメチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・CR6R7R8において、R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、
シクロアルキル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
から選択されることが好ましく、
・NR6R7において、R6、R7、およびこれらが結合している窒素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R11、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、R11は、水素原子、もしくはアリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、またはR11は、ハロゲン、ヒドロキシル、OR12、COOR12、CONR12R13、NR12COR13、NR12R13、SO2R12、SO2NR12R13、NR12SO2R13、SO2R12、アリールを含む群から選択される3つまでの置換基で置換されていてもよいアルキル基を表し、R12およびR13は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表し、
点線は、単結合または二重結合を表し、
但し、A1、A2、およびA3は、すべてがCになることはなく、
但し、A1、A2、およびA3のうちの1つがNである場合、他の2つは、両方ともがCになることはなく、
但し、式Iの化合物は、3−(ベンゾフラン−5−イル)−6−クロロ−1H−インドールまたは3−(ベンゾ[d][1,3]ジオキソール−5−イル)−1H−インドールではない。
一実施形態によれば、式Iにおけるインドール環を置換する、縮合したヘテロ環は、芳香族である。別の実施形態では、式Iにおけるインドール環を置換している縮合したヘテロ環は、部分的に芳香族である。別の実施形態では、式Iにおけるインドール環を置換しているヘテロ環は、芳香族でない。
好ましい実施形態によれば、式Iにおいて、X1およびX2は、それぞれ独立に、Hまたはハロゲン、好ましくはHまたはFを表す。特定の実施形態によれば、X1は、Hを表し、X2は、Fを表す。好ましい実施形態によれば、式Iにおいて、R1、R2、およびR3は、それぞれHを表す。特定の実施形態によれば、式Iにおいて、X1およびX2は、それぞれ独立に、Hまたはハロゲンを表し、R1、R2、およびR3は、それぞれHを表し、好ましくは、X1は、Hを表し、X2は、Fを表し、R1、R2、およびR3は、それぞれHを表す。
一実施形態によれば、式Iにおいて、A1、A2、およびA3のうちの最初の1つは、Nであり、A1、A2、およびA3のうちの二つ目のものは、Cであり、A1、A2、およびA3のうちの三つ目のものは、NまたはOである。
一実施形態によれば、式Iにおいて、A2は、Nであり、A1およびA3の一方は、NまたはSrであり、他方は、Cである。
一実施形態によれば、式Iにおいて、A2は、Cであり、A1およびA3の一方は、Nであり、他方は、NまたはOである。A1またはA3がOであり、CがCR6R7R8で置換されており、R6、R7、またはR8がヘテロシクリルまたはC1−ヘテロシクリルである一実施形態において、ヘテロシクリルは、ピペリジン、ピロリジン、ピペラジン、モルホリン、または2,6−ジアザスピロ[3.3]ヘプタンであり、これらはいずれも、C1〜C3アルキル、アミノ、ヒドロキシル、ハロゲン、COCH3、COOH、またはSO2CH3のうちの1つまたは複数で置換されていてもよい。
別の実施形態によれば、式Iにおいて、A1またはA3は、Sであり、A1−Y1またはA3−Y3は、SO2である。場合により、A1、A2、もしくはA3のうちの1つがSであるか、またはA1−Y1、A2−Y2、もしくはA3−Y3がSO2である場合において、A1、A2、またはA3のうちの1つは、NまたはCであり、A1、A2、およびA3のうちの1つは、Cである。
一実施形態では、好ましい式Iの化合物は、式II−1の化合物
一実施形態によれば、式II−1において、A1およびA3は、両方ともがCになることはない。別の実施形態によれば、A1およびA1の一方は、Sであり、他方は、Cであり、A1−Y1またはA3−Y3は、SO2であってもよく、Cは、オキソで置換されていてもよい。
一実施形態では、好ましい式Iの化合物は、式II−2の化合物
一実施形態によれば、式II−1において、{A1、A3}は、{C、N}、{N、C}、または{C、C}でない。
一実施形態では、好ましい式Iの化合物は、式II−1aの化合物
一実施形態では、好ましい式Iの化合物は、式II−1bの化合物
一実施形態では、好ましい式Iの化合物は、式II−2aの化合物
一実施形態によれば、式II−2aにおいて、A1は、Cでない。
一実施形態では、好ましい式Iの化合物は、式II−2bの化合物
一実施形態によれば、式II−2bにおいて、A3は、Cでない。
一実施形態では、好ましい式Iの化合物は、式II−1a1の化合物
好ましい実施形態によれば、式II−1a1において、Y1は、Hを表し、Y3は、式Iで規定したとおりであり、好ましくは、Y3は、
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
一実施形態では、好ましい式Iの化合物は、式II−1a2の化合物
好ましい実施形態によれば、式II−1a2において、Y1は、Hを表し、Y2は、式Iで規定したとおりであり、好ましくは、Y2は、
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
一実施形態では、好ましい式Iの化合物は、式II−1b1の化合物
好ましい実施形態によれば、式II−1b1において、Y3は、Hを表し、Y1は、式Iで規定したとおりであり、好ましくは、Y1は、
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
一実施形態では、好ましい式Iの化合物は、式II−1b2の化合物
好ましい実施形態によれば、式II−1b2において、Y3は、Hを表し、Y2は、式Iで規定したとおりであり、好ましくは、Y2は、
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
一実施形態では、好ましい式Iの化合物は、式II−2a1の化合物
好ましい実施形態によれば、式II−2a1において、Y1は、Hを表し、Y2は、式Iで規定したとおりであり、好ましくは、Y2は、
− 水素原子、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・OR9またはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、SO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
− 水素原子、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・OR9またはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、SO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表し、
・R6、R7、およびこれらが結合している炭素原子は、一緒になって、環を形成しており、前記環は、モルホリン、ピペラジン、またはピペリジンから選択されることが好ましいヘテロシクリルであることが好ましく、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
一実施形態では、好ましい式Iの化合物は、式II−2a2の化合物
好ましい実施形態によれば、式II−2a2において、Y2は、
− 水素原子、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
− 水素原子、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す。
一実施形態では、好ましい式Iの化合物は、式II−2b1の化合物
好ましい実施形態によれば、式II−2b1において、Y3は、Hを表し、Y2は、式Iで規定したとおりであり、好ましくは、Y2は、
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・OR9またはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、SO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表す。
− 水素原子、
− CR6R7R8
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・OR9またはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、SO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・直鎖または分岐C1〜C10アルキル、好ましくは、メチル、エチル、またはプロピル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・ピペリジン、ピロリジン、ピペラジン、モルホリンから選択されることが好ましいヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表す。
一実施形態では、好ましい式Iの化合物は、式II−2b2の化合物
好ましい実施形態によれば、式II−2b2において、点線が不在であり、NとCの間に単結合がある場合、Y2は、オキソであり、点線が存在し、NとCの間に二重結合がある場合、Y2は、
− 水素原子、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・ピペリジン、ピロリジン、ピペラジン、モルホリン、または2,6−ジアザスピロ[3.3]ヘプタンから選択されることが好ましいヘテロシクリルまたはC1−ヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表す。
− 水素原子、
− CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
・水素原子、
・ピペリジン、ピロリジン、ピペラジン、モルホリン、または2,6−ジアザスピロ[3.3]ヘプタンから選択されることが好ましいヘテロシクリルまたはC1−ヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]、
・−CO−R11または−SO2R11[R11は、アミン、アルキル、ヘテロシクリル(好ましくは、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシド)から選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノから選択される置換されていてもよい基を表す]
を表す。
一実施形態では、ヘテロ環の1つまたは複数は、H、またはSO2CH3、C1〜C3低級アルキル、好ましくはCH3、もしくはCOOHから選択される基の少なくとも1つで置換されている。
一実施形態では、好ましい式Iの化合物は、式II−2b3の化合物
式II−2b3の一実施形態では、R1、R2、またはR3は、それぞれ独立に、H、ハロゲン、またはC1〜C6アルキル、好ましくはC1アルキルである。式II−2b3の別の実施形態では、X1およびX2は、独立に、Hまたはハロゲンである。
特に好ましい本発明の式Iの化合物は、以下で表1に掲載する化合物である。
表1において、用語「Cpd」は、化合物を意味する。
表1の化合物は、ChemBioDraw(登録商標)Ultraバージョン12.0(PerkinElmer)を使用して命名した。
式Iおよびその下位式の化合物は、不斉中心を含んでいる場合もあり、したがって、異なる立体異性体型として存在することもある。それに応じて、本発明は、可能なすべての立体異性体を包含し、ラセミ化合物だけでなく、個々の鏡像異性体およびその非ラセミ混合物もなお包含する。化合物は、単一の鏡像異性体として所望される場合、それぞれ当技術分野で知られているような、立体特異的合成、最終生成物もしくは好都合ないずれかの中間体の分割、またはキラルクロマトグラフィー法によって得ることができる。最終生成物、中間体、または出発材料の分割は、当技術分野で知られている適切ないずれかの方法によって行うことができる。
本発明の化合物は、「薬学的に許容できる塩」の形であってもよい。式Iの化合物の薬学的に許容できる塩には、その酸付加塩および塩基塩が含まれる。適切な酸付加塩は、非毒性の塩を形成する酸から生成される。例としては、酢酸塩、ラクトビオン酸塩、ベンゼンスルホン酸塩、ラウリン酸塩、アジピン酸塩、アスパラギン酸塩、安息香酸塩、ベシル酸塩、炭酸水素塩/炭酸塩、硫酸水素塩/硫酸塩、ホウ酸塩、カムシル酸塩、クエン酸塩、シクラミン酸塩、エジシル酸塩、エシル酸塩、ギ酸塩、フマル酸塩、グルセプト酸塩、グルコン酸塩、グルクロン酸塩、ヘキサフルオロリン酸塩、ヒベンズ酸塩、塩酸塩/塩化物、臭化水素酸塩/臭化物、ヨウ化水素酸塩/ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、マンデル酸塩、酒石酸水素塩、メチル臭化物、臭化物、メチル硝酸塩、エデト酸カルシウム、粘液酸塩、ナプシル酸塩、塩化物、クラブラン酸塩、Nオレイン酸塩、エデト酸塩、エストル酸塩(estolate)、パントテン酸塩、ポリガラクツロン酸塩(polygalacuronate)、サリチル酸塩、グルタミン酸塩、グリコリルアルサニル酸塩、硫酸塩、ヘキシルレソルシン酸(hexylrosorcinate)、次酢酸塩、ヒドラバミン、ヒドロキシナフトエ酸塩(hydroxynaphthaloate)、エトレート(etolate)、トリエトヨウ化物、吉草酸塩、メシル酸塩、メチル硫酸塩、ナフチル酸塩、2−ナプシル酸塩、ニコチン酸塩、硝酸塩、オロト酸塩、シュウ酸塩、パルミチン酸塩、パモ酸塩、リン酸塩/リン酸水素塩/リン酸二水素塩、ピログルタミン酸塩、糖酸塩、ステアリン酸塩、コハク酸塩、タンニン酸塩、酒石酸塩、トシル酸塩、トリフルオロ酢酸塩、およびキシノホ酸塩(xinofoate)が挙げられる。適切な塩基塩は、非毒性の塩を形成する塩基から生成される。例としては、アルミニウム、アルギニン、ベンザチン、カルシウム、コリン、ジエチルアミン、ジオールアミン、グリシン、リシン、マグネシウム、メグルミン、オールアミン、オルニチン、N,N−ジベンジルエチレンジアミン(N,N−dibenzyethelenediamine)、ピペラジン、トリ(ヒドロキシメチルアミノメタン、水酸化テトラメチルアンモニウム、メチルグカミン(methylgucamine)、アンモニウム塩、カリウム、ナトリウム、トロメタミン、2−(ジエチルアミノ)エタノール、エタノールアミン、モルホリン、4−(2−ヒドロキシエチル)モルホリン、および亜鉛塩が挙げられる。酸および塩基の半塩、たとえば、半硫酸塩および半カルシウム塩を生成してもよい。薬学的に許容できる好ましい塩としては、塩酸塩/塩化物、臭化水素酸塩/臭化物、硫酸水素塩/硫酸塩、硝酸塩、クエン酸塩、および酢酸塩が挙げられる。
本発明の化合物が酸性の基に加えて塩基性の基を含んでいる場合、本発明の化合物は、分子内塩を形成することもあり、このような化合物は、本発明の範囲内である。本発明の化合物が水素供与ヘテロ原子(たとえば、NH)を含んでいる場合、本発明は、前記水素原子が分子内の塩基性基または原子に移動してできた塩および/または異性体もカバーする。
式Iの化合物の薬学的に許容できる塩は、これらの方法の1つまたは複数
(i)式Iの化合物を所望の酸と反応させる、
(ii)式Iの化合物を所望の塩基と反応させる、
(iii)式Iの化合物の適切な前駆体から酸もしくは塩基に不安定な保護基を除去する、もしくは適切な環式前駆体、たとえば、ラクトンもしくはラクタムを、所望の酸を使用して開環する、もしくは
(iv)式Iの化合物のある塩を、適切な酸と反応させて、もしくは適切なイオン交換カラムによって、別の塩に変換する、
ことによって調製することができる。
こうした反応はすべて、通常は溶液中で実施される。塩は、溶液から沈殿することもあり、濾過によって収集してもよいし、または溶媒を蒸発させて回収してもよい。塩のイオン化の程度は、完全なイオン化から、ほとんどイオン化していない程度まで、様々となりうる。
(i)式Iの化合物を所望の酸と反応させる、
(ii)式Iの化合物を所望の塩基と反応させる、
(iii)式Iの化合物の適切な前駆体から酸もしくは塩基に不安定な保護基を除去する、もしくは適切な環式前駆体、たとえば、ラクトンもしくはラクタムを、所望の酸を使用して開環する、もしくは
(iv)式Iの化合物のある塩を、適切な酸と反応させて、もしくは適切なイオン交換カラムによって、別の塩に変換する、
ことによって調製することができる。
こうした反応はすべて、通常は溶液中で実施される。塩は、溶液から沈殿することもあり、濾過によって収集してもよいし、または溶媒を蒸発させて回収してもよい。塩のイオン化の程度は、完全なイオン化から、ほとんどイオン化していない程度まで、様々となりうる。
本発明の化合物は、上で定義したとおりである、薬学的に許容できる塩の形で投与することができる。そうした塩は、たとえば、遊離酸を適切な有機または無機塩基と反応させることによる、標準の手順によって調製することができる。アミノなどの塩基性基が存在する場合には、酸性塩、すなわち、塩酸塩、臭化水素酸塩、酢酸塩、パモ酸塩などを剤形として使用することができる。
また、アルコール基が存在する場合には、薬学的に許容できるエステル、たとえば、酢酸エステル、マレイン酸エステル、ピバロイルオキシメチルなど、および溶解性または加水分解特性を変化させることが当技術分野で知られているエステルを用いて、持効性製剤またはプロドラッグ製剤として使用してもよい。
本明細書全体における式Iの化合物への言及はすべて、その鏡像異性体、塩、溶媒和物、多形体、多成分錯体、および液晶への言及を含めて、その下位式、式II(II−1、II−1a、II−1a1、II−1a2、II−1b、II−1b1、II−1b2、II−2、II−2a、II−2a1、II−2a2、II−2b、II−2b1、II−2b2、II−2b3を含める)を包含する。
本発明の化合物には、そのすべての多形体および晶癖、そのプロドラッグおよび異性体(光学、幾何、および互変異性体を含める)を含めた、上で規定したとおりの式Iの化合物、ならびに同位体標識された式Iの化合物を包含する。
加えて、一般に、本発明の化合物の塩に関して、薬学的に許容できる塩が好ましいとしても、広い意味で、本発明は、たとえば、本発明の化合物の単離および/または精製に使用してもよい、薬学的に許容されない塩も包含することを留意すべきである。たとえば、光学活性のある酸または塩基に対して形成された塩を使用して、上記の式Iの化合物の光学活性異性体の分離を促進しうる、ジアステレオ異性体塩を生成することができる。
本発明は一般に、式Iの化合物の薬学的に許容できるすべてのプレドラッグおよびプロドラッグもカバーする。
製造方法
式Iの化合物は、当業者に知られている反応を用いた異なる方法によって調製することができる。
式Iの化合物は、当業者に知られている反応を用いた異なる方法によって調製することができる。
本発明はさらに、式Iの化合物
(a1)式(i)の化合物
X1およびX2は、式Iで規定したとおりであり、
Z1は、H、または、たとえばアリールスルホニル、tert−ブトキシカルボニル、メトキシメチル、パラメトキシベンジル、ベンジル、もしくは当業者に知られている適切な他のいずれかの保護基などのアミノ保護基を表し、
Yは、ハロゲン(好ましくは、ヨウ素、臭素、または塩素)、1〜6個の炭素原子を有するアルキルスルホニルオキシ(好ましくは、メチルスルホニルオキシまたはトリフルオロメチルスルホニルオキシ)、または6〜10個の炭素原子を有するアリールスルホニルオキシ(好ましくは、フェニルまたはp−トリルスルホニルオキシ)、または当業者に知られているいずれかの脱離基を表す]を、
式(ii)の化合物
R1、R2、R3、A1、A2、A3、Y1、Y2、およびY3は、式Iで規定したとおりであり、
Z2およびZ3は、Hまたはアルキル基を表すか、Z2およびZ3は、環を形成していてもよい]と反応させて、式(iii)の化合物
(b1)Z1がHでない場合、式(iii)の化合物のインドールアミンを脱保護して、式Iの化合物を得るステップと
を含む製造方法に関する。
一実施形態によれば、本発明の方法のステップ(a1)は、限定はしないが、Pd2(dba)3、Pd(PPh3)4、ジクロロビス(トリフェニルホスフィン)パラジウム(II)または1,1’−ビス(ジフェニルホスフィノ)フェロセンジクロロパラジウム(II)、Pd(OAc)2、Pd/Cなどの触媒を用い、または用いずに、限定はしないが、X−Phos、S−Phos、P(oTol)3、PPh3、BINAP、P(tBu)3、または当業者に知られている適切な他のいずれかのホスフィン配位子などの、追加の配位子の存在下、または非存在下で実施することができる。
一実施形態によれば、本発明の方法のステップ(a1)は、限定はしないが、K3PO4、K2CO3、Na2CO3などの塩基の存在下で実施することができる。
一実施形態によれば、本発明の方法のステップ(a1)は、限定はしないが、ジオキサン、THF、DMF、水、またはこれらの混合物などの適切な溶媒の存在下で、好ましくは、ジオキサンまたはTHFと水の混合物中で実施することができる。
一実施形態によれば、本発明の方法のステップ(a1)は、マイクロ波照射を用い、または用いずに、20℃〜約180℃の範囲の温度で、10分〜数時間、たとえば、10分〜24時間の範囲の期間にかけて実施することができる。
一実施形態によれば、脱保護(b1)は、基Z1の性質に応じて、限定はしないが、水酸化ナトリウム、水酸化カリウム、炭酸カリウムなどの、塩基での処理によって行うことができる。一実施形態によれば、脱保護は、限定はしないが、メタノール、エタノール、イソプロパノール、tert−ブタノール、THF、DMF、ジオキサン、水、またはこれらの混合物などの適切な溶媒の存在下または非存在下で行うことができる。一実施形態によれば、脱保護は、20℃〜100℃の範囲の温度、好ましくは約85℃で、数時間、たとえば、1時間〜24時間行うことができる。
代替実施形態によれば、脱保護(b1)は、基Z1の性質に応じて、限定はしないが、HCl、TFA、HF、HBrなどの強酸の存在下で行うことができる。一実施形態によれば、脱保護は、メタノール、エタノール、イソプロパノール、tert−ブタノール、THF、DMF、ジオキサン、水、またはこれらの混合物などの適切な溶媒の存在下または非存在下で行うことができる。一実施形態によれば、脱保護は、約20℃〜約100℃の間の温度で、10分〜数時間の間からなる期間にかけて、たとえば、10分〜24時間行うことができる。
本発明はさらに、式Iの化合物
但し、Y1、Y2、およびY3のうちの少なくとも1つは、Hまたは不在でない]の第二の製造方法であって、
(a2)式(iv)の化合物
Y1’、Y2’、およびY3’は、それぞれ、式Iで規定したとおりのY1、Y2、およびY3を表し、但し、Y1’、Y2’、およびY3’のうちの少なくとも1つは、Hであり、
Z1は、H、または、たとえばアリールスルホニル、tert−ブトキシカルボニル、メトキシメチル、パラメトキシベンジル、ベンジル、もしくは当業者に知られている適切な他のいずれかの保護基などのアミノ保護基を表す]をアルキル化して、式(v)の化合物
(b2)Z1がHでない場合、式(v)の化合物のインドール窒素を脱保護して、式Iの化合物を得るステップと
を含む製造方法に関する。
一実施形態によれば、アルキル化ステップ(a2)は、式(vi)の化合物
Y4−X
の存在下で実施され、式中、Y4は、式Iで規定したとおりのY1、Y2、またはY3を表し、但し、Y4は、Hまたは不在でなく、
Xは、ハロゲン(好ましくは、ヨウ素、臭素、または塩素)、1〜6個の炭素原子を有するアルキルスルホニルオキシ(好ましくは、メチルスルホニルオキシまたはトリフルオロメチルスルホニルオキシ)、6〜10個の炭素原子を有するアリールスルホニルオキシ(好ましくは、フェニルまたはp−トリルスルホニルオキシ)、または当業者に知られている他のいずれかの脱離基を表す。
Y4−X
の存在下で実施され、式中、Y4は、式Iで規定したとおりのY1、Y2、またはY3を表し、但し、Y4は、Hまたは不在でなく、
Xは、ハロゲン(好ましくは、ヨウ素、臭素、または塩素)、1〜6個の炭素原子を有するアルキルスルホニルオキシ(好ましくは、メチルスルホニルオキシまたはトリフルオロメチルスルホニルオキシ)、6〜10個の炭素原子を有するアリールスルホニルオキシ(好ましくは、フェニルまたはp−トリルスルホニルオキシ)、または当業者に知られている他のいずれかの脱離基を表す。
一実施形態によれば、本発明の方法のステップ(a2)は、限定はしないが、炭酸カリウム、炭酸ナトリウム、炭酸セシウム、水酸化カリウム、水酸化ナトリウム、ナトリウムtert−ブトキシド、カリウムtert−ブトキシド、水素化ナトリウム、リチウムジイソプロピルアミド、ブチルリチウムなどの、塩基の存在下で実施することができる。
一実施形態によれば、本発明の方法のステップ(a2)は、限定はしないが、DMF、メタノール、エタノール、イソプロパノール、tert−ブタノール、THF、ジオキサン、ジクロロメタン、水などの、適切な溶媒の存在下で実施することができる。
一実施形態によれば、本発明の方法のステップ(a2)は、限定はしないが、ヨウ化テトラブチルアンモニウムなどの、触媒量の適切なヨウ化物塩の存在下または非存在下で実施することができる。
一実施形態によれば、本発明の方法のステップ(a2)は、マイクロ波照射を用いまたは用いずに、20℃〜約180℃の範囲の温度で実施することができる。
一実施形態によれば、本発明の方法のステップ(a2)は、10分〜数時間の範囲の期間、たとえば、10分〜24時間実施することができる。
一実施形態によれば、脱保護ステップ(b2)は、脱保護(b1)について上述した条件で実施することができる。
本発明はさらに、Y1がHである式II−2a1の化合物
Z1は、H、または、たとえばアリールスルホニル、tert−ブトキシカルボニル、メトキシメチル、パラメトキシベンジル、ベンジル、もしくは当業者に知られている適切な他のいずれかの保護基などのアミノ保護基を表す]を、
式(viii)の化合物
Yは、ヒドロキシル、ハロゲン(好ましくは、ヨウ素、臭素、または塩素)、1〜6個の炭素原子を有するアルキルスルホニルオキシ(好ましくは、メチルスルホニルオキシまたはトリフルオロメチルスルホニルオキシ)、6〜10個の炭素原子を有するアリールスルホニルオキシ(好ましくは、フェニルまたはp−トリルスルホニルオキシ)、または当業者に知られている他のいずれかの脱離基を表す]と反応させて、
式(ix)の化合物
(b3)Z1がHでない場合、式(ix)の化合物のインドールアミンを脱保護して、Y1がHであるII−2a1の化合物を得るステップと
を含む製造方法に関する。
一実施形態によれば、Yがヒドロキシルを表す場合、本発明の方法のステップ(a3)は、限定はしないが、HATU、DCC、DIC、BOP、PyBOPなどの、適切なアミドカップリング試薬の存在下、限定はしないがHOBtなどの追加の添加剤を用い、または用いずに実施することができる。
一実施形態によれば、本発明の方法のステップ(a3)は、限定はしないが、トリエチルアミン、ジイソプロピルエチルアミン、DBU、炭酸セシウム、炭酸ナトリウム、炭酸カリウム、水酸化ナトリウム、水酸化カリウムなどの、塩基の存在下で実施することができる。
一実施形態によれば、本発明の方法のステップ(a3)は、限定はしないが、ジクロロメタン、DMF、THF、ジオキサンなどの、適切な溶媒の存在下で実施することができる。
一実施形態によれば、ステップ(a3)は、環化の完了に必要な場合には必ず、限定はしないが酢酸などの、適切な酸を加えるステップをさらに含む。
一実施形態によれば、本発明の方法のステップ(a3)は、マイクロ波照射を用い、または用いずに、20℃〜約180℃の範囲の温度で実施することができる。
一実施形態によれば、本発明の方法のステップ(a3)は、10分〜数時間の範囲の期間、たとえば、10分〜24時間実施することができる。
一実施形態によれば、脱保護ステップ(b3)は、脱保護(b1)について上述した条件で実施することができる。
本発明はさらに、式Iの化合物
(a4)式(x)の化合物
X1およびX2は、式Iで規定したとおりであり、
Z1は、H、または、たとえばアリールスルホニル、tert−ブトキシカルボニル、メトキシメチル、パラメトキシベンジル、ベンジル、もしくは当業者に知られている適切な他のいずれかの保護基などのアミノ保護基を表し、
Z2およびZ3は、Hまたはアルキル基を表すか、Z2およびZ3は、環を形成していてもよい]を、
式(xi)の化合物
R1、R2、R3、A1、A2、A3、Y1、Y2、およびY3は、式Iで規定したとおりであり、
Yは、ハロゲン(好ましくは、ヨウ素、臭素、または塩素)、1〜6個の炭素原子を有するアルキルスルホニルオキシ(好ましくは、メチルスルホニルオキシまたはトリフルオロメチルスルホニルオキシ)、6〜10個の炭素原子を有するアリールスルホニルオキシ(好ましくは、フェニルまたはp−トリルスルホニルオキシ)、または当業者に知られているいずれかの脱離基を表す]と反応させて、
式(xii)の化合物
(b4)Z1がHでない場合、式(xii)の化合物のインドールアミンを脱保護して、式Iの化合物を得るステップと
を含む製造方法に関する。
一実施形態によれば、本発明の方法のステップ(a4)は、限定はしないが、Pd2(dba)3、Pd(PPh3)4、ジクロロビス(トリフェニルホスフィン)パラジウム(II)または1,1’−ビス(ジフェニルホスフィノ)フェロセンジクロロパラジウム(II)、Pd(OAc)2、Pd/Cなどの触媒を、限定はしないが、X−Phos、S−Phos、P(oTol)3、PPh3、BINAP、P(tBu)3、または当業者に知られている適切な他のいずれかのホスフィン配位子などの追加配位子の存在下または非存在下で用い、または用いずに、実施することができる。
一実施形態によれば、本発明の方法のステップ(a4)は、限定はしないが、K3PO4、K2CO3、Na2CO3などの、塩基の存在下で実施することができる。
一実施形態によれば、本発明の方法のステップ(a4)は、限定はしないが、ジオキサン、THF、DMF、水、またはこれらの混合物などの、適切な溶媒の存在下で、好ましくは、ジオキサンまたはTHFと水の混合物中で実施することができる。
一実施形態によれば、本発明の方法のステップ(a4)は、マイクロ波照射を用い、または用いずに、20℃〜約180℃の範囲の温度で、10分〜数時間の範囲の期間、たとえば、10分〜24時間実施することができる。
一実施形態によれば、脱保護ステップ(b4)は、脱保護(b1)について上述した条件で実施することができる。
一般に、個々のいずれかの式(I)の化合物の合成経路は、各分子の特定の置換基および必要な中間体の入手しやすさに応じて決まり、こうした要素も、当業者に正しく認識されている。
別の一般法によれば、当業者によく知られている適切な相互交換技術を用いて、式Iの化合物を、式Iの代替化合物に変換することができる。
式Iおよび関連式の化合物は、さらに、その官能性誘導体の1つから、加溶媒分解剤または水素化分解剤での処理によって、式Iの化合物を遊離させて取得することもできる。
加溶媒分解または水素化分解のための好ましい出発材料は、1つまたは複数の遊離アミノおよび/もしくはヒドロキシル基の代わりに、対応する保護されたアミノ/もしくはヒドロキシル基を含んでいる以外は式Iおよび関連式に一致するもの、好ましくは、N原子に結合したH原子の代わりにアミノ保護基を有するもの、特に、HN基の代わりにR*−N基[R*は、アミノ保護基を意味する]を有するもの、および/またはヒドロキシル基のH原子の代わりにヒドロキシル保護基を有するもの、たとえば、−COOH基の代わりに−COOR**基[R**は、ヒドロキシル保護基を意味する]を有する以外は式Iに一致するものである。
出発材料の分子中に、同一または異なる複数の保護されたアミノおよび/またはヒドロキシル基が存在することもありうる。存在する保護基が互いに異なっている場合、それらの保護基は、多くの場合、選択的に切り離すことができる。
用語「アミノ保護基」は、一般用語で知られており、化学反応に対してアミノ基を保護する(封鎖する)のに適しているが、分子中の他の場所で所望の化学反応が実施された後に容易に除去される基に関係する。このような基の典型は、特に、非置換または置換アシル、アリール、アラルコキシメチル、またはアラルキル基である。アミノ保護基は、所望の反応(または連続する反応)の後に除去されるので、そのタイプおよび大きさは、なおそれほど重要ではないが、しかし、1〜20個、特に1〜8個の炭素原子を有するものが好ましい。用語「アシル基」は、本方法に関連して、広い意味で理解される。この用語は、脂肪族、芳香脂肪族(araliphatic)、芳香族、またはヘテロ環式のカルボン酸またはスルホン酸から導かれるアシル基、詳細には、アルコキシカルボニル、アリールオキシカルボニル、特にアラルコキシカルボニル基を包含する。このようなアシル基の例は、アセチル、プロピオニル、ブチリルなどのアルカノイル;フェニルアセチルなどのアラルカノイル;ベンゾイルやトリルなどのアロイル;POAなどのアリールオキシアルカノイル;メトキシカルボニル、エトキシカルボニル、2,2,2−トリクロロエトキシカルボニル、BOC(tert−ブトキシカルボニル)、2−ヨードエトキシカルボニルなどのアルコキシカルボニル;CBZ(「カルボベンゾキシ」)、4−メトキシベンジルオキシカルボニル、FMOCなどのアラルコキシカルボニル;およびMtrなどのアリールスルホニルである。好ましいアミノ保護基は、BOCおよびMtr、さらに、CBZ、Fmoc、ベンジル、およびアセチルである。
用語「ヒドロキシル保護基」は、同様に一般用語で知られており、化学反応に対してヒドロキシル基を保護するのに適しているが、分子中の他の場所で所望の化学反応が実施された後に容易に除去される基に関係する。このような基の典型は、上で言及した非置換または置換アリール、アラルキル、またはアシル基、さらにまたアルキル基である。ヒドロキシル保護基の性質および大きさは、こうした保護基が、所望の化学反応または連続する反応の後にまた除去されるので、それほど重要ではなく、1〜20個、特に1〜10個の炭素原子を有する基が好ましい。ヒドロキシル保護基の例は、特に、ベンジル、4−メトキシベンジル、p−ニトロベンゾイル、p−トルエンスルホニル、tert−ブチル、およびアセチルであり、ベンジルおよびtert−ブチルが特に好ましい。
式Iおよび関連式の化合物は、使用された保護基に応じて、たとえば、塩酸、過塩素酸、硫酸などの強無機酸、トリクロロ酢酸、TFAなどの強有機カルボン酸、またはベンゼンもしくはp−トルエンスルホン酸などのスルホン酸、その官能性誘導体から遊離させる。追加の不活性溶媒の存在も考えうるが、必ずしも必要ではない。適切な不活性溶媒は、有機、たとえば、酢酸などのカルボン酸、テトラヒドロフランやジオキサンなどのエーテル、DMFなどのアミド、ジクロロメタンなどのハロゲン化炭化水素、さらにまたメタノール、エタノール、イソプロパノールなどのアルコール、および水であることが好ましい。上で言及した溶媒の混合物は、さらに適する。TFAは、別の溶媒を加えずに過剰に使用することが好ましく、過塩素酸は、酢酸と70%過塩素酸の9:1の比の混合物の形で使用することが好ましい。開裂のための反応温度は、約0℃〜約50℃の間、好ましくは15℃〜30℃の間(室温)であることが有利である。
BOC、OtBu、およびMtr基は、たとえば、ジクロロメタン中でTFAを使用し、または15〜30℃でおよそ3〜5NのHClジオキサン溶液を使用して、好ましく切り離すことができ、FMOC基は、15〜30℃でジメチルアミン、ジエチルアミン、またはピペリジンのおよそ5〜50%のDMF溶液を使用して切り離すことができる。
水素化分解で除去することができる保護基(たとえば、CBZ、ベンジル、またはそのオキサジアゾール誘導体からのアミジノ基の遊離)は、たとえば、触媒(たとえばパラジウムなどの貴金属触媒、有利には炭素などの支持体上)の存在下で水素処理することにより、切り離すことができる。ここでの適切な溶媒は、上で示したもの、特に、たとえば、メタノールやエタノールなどのアルコール、またはDMFなどのアミドである。水素化分解は、一般に、約0℃〜100℃の間の温度、約1バール〜200バールの間の圧力、好ましくは、20〜30℃、1〜10バールで実施される。CBZ基の水素化分解は、たとえば、メタノール中にて5〜10%Pd/Cを用いる、またはメタノール/DMF中にて20〜30℃でPd/Cを用い(水素の代わりに)ギ酸アンモニウムを使用すると好結果になる。
適切な不活性溶媒の例は、ヘキサン、石油エーテル、ベンゼン、トルエン、キシレンなどの炭化水素;トリクロロエチレン、1,2−ジクロロエタン、テトラクロロメタン、トリフルオロメチルベンゼン、クロロホルム、ジクロロメタンなどの塩素化炭化水素;メタノール、エタノール、イソプロパノール、n−プロパノール、n−ブタノール、tert−ブタノールなどのアルコール;ジエチルエーテル、ジイソプロピルエーテル、テトラヒドロフラン(THF)、ジオキサンなどのエーテル;エチレングリコールモノメチルもしくはモノエチルエーテル、エチレングリコールジメチルエーテル(ジグリム)などのグリコールエーテル;アセトンやブタノンなどのケトン;アセトアミド、ジメチルアセトアミド、N−メチルピロリドン(NMP)、ジメチルホルムアミド(DMF)などのアミド;アセトニトリルなどのニトリル;ジメチルスルホキシド(DMSO)などのスルホキシド;二硫化炭素;ギ酸や酢酸などのカルボン酸;ニトロメタンやニトロベンゼンなどのニトロ化合物;酢酸エチルなどのエステル、または前記溶媒の混合物である。
エステルは、たとえば、HCl、H2SO4を使用し、または水、水/THF、水/THF/エタノール、もしくは水/ジオキサン中にて0℃〜100℃の間の温度でLiOH、NaOH、もしくはKOHを使用して加水分解することができる。
さらに、遊離アミノ基は、塩化アシルもしくは無水アシルを使用して従来のようにしてアシル化する、または、有利に、ジクロロメタンやTHFなどの不活性溶媒中にて、かつ/もしくはトリエチルアミンやピリジンなどの塩基の存在下、−60℃〜+30℃の間の温度で、非置換もしくは置換ハロゲン化アルキルを使用してアルキル化することができる。
保護および脱保護方法についてはどれも、Philip J.Kocienski、「Protecting Groups」、Georg Thieme Verlag、シュトゥットガルト、ニューヨーク、1994、およびTheodora W.Greene and Peter G.M.Wuts、「Protective Groups in Organic Synthesis」、Wiley Interscience、第3版、1999を参照されたい。
実施例の部に記載する反応スキームは、実例にすぎず、一切本発明を限定すると解釈すべきでない。
適用分野
本発明はさらに、本発明の化合物または薬学的に許容できるその鏡像異性体、塩、および溶媒和物のTDO2阻害薬としての使用を対象とする。
本発明はさらに、本発明の化合物または薬学的に許容できるその鏡像異性体、塩、および溶媒和物のTDO2阻害薬としての使用を対象とする。
それに応じて、特に好ましい実施形態において、本発明は、式I、および下位式の化合物、特に上記表1のもの、または薬学的に許容できるその鏡像異性体、塩、および溶媒和物の、TDO2阻害薬としての使用に関する。
したがって、別の態様において、本発明は、TDO2阻害薬などの活性医薬成分を合成するための、こうした化合物、またはその鏡像異性体、塩、および溶媒和物の使用に関する。
一実施形態では、本発明は、式I、および下位式の化合物、特に上記表1のもの、または薬学的に許容できるその鏡像異性体、塩、および溶媒和物の、がん細胞の免疫認識および破壊を増進するための使用に関する。
したがって、本発明の化合物は、特にがんの予防および/または治療において、医薬として有用である。
一態様では、本発明の化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物は、がん、パーキンソン病、アルツハイマー病、ハンチントン病などの神経変性障害、HCVおよびHIVなどの慢性ウイルス感染症、うつ病、ならびに肥満の治療および/または予防において使用するためのものである。
本発明はさらに、がん、パーキンソン病、アルツハイマー病、ハンチントン病などの神経変性障害、HCVおよびHIVなどの慢性ウイルス感染症、うつ病、ならびに肥満を治療または予防する方法であって、それを必要とする哺乳動物種に、治療有効量の本発明による化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物を投与することを含む方法に関する。
種々のがんが当技術分野で知られている。がんは、転移性でも、または非転移性でもよい。がんは、家族性でも、または散在性でもよい。一部の実施形態では、がんは、白血病および多発性骨髄腫からなる群から選択される。本発明の方法を使用して治療することができる追加のがんとしては、たとえば、良性および悪性の固形腫瘍ならびに良性および悪性の非固形腫瘍が挙げられる。
固形腫瘍の例としては、限定はしないが、胆道がん、脳腫瘍(神経膠芽腫および髄芽細胞腫を含める)、乳がん、子宮頚がん、絨毛癌、結腸がん、子宮内膜がん、食道がん、胃がん、上皮内新生物(ボーエン病およびページェット病を含める)、肝臓がん、肺がん、神経芽細胞腫、口腔がん(扁平上皮癌を含める)、卵巣がん(上皮細胞、間質細胞、胚細胞、および間葉細胞から生じるものを含める)、膵臓がん、前立腺がん、直腸がん、腎がん(腺癌およびウィルムス腫瘍を含める)、肉腫(平滑筋肉腫、横紋筋肉腫、脂肪肉腫、線維肉腫、および骨肉腫を含める)、皮膚がん(黒色腫、カポジ肉腫、基底細胞がん、および扁平上皮がんを含める)、胚腫瘍(germinal tumours)を含めた精巣がん(精上皮腫、および奇形腫や絨毛癌などの非精上皮腫)、間質腫瘍、胚細胞腫瘍、および甲状腺がん(甲状腺腺癌および髄様癌を含める)が挙げられる。
非固形腫瘍の例としては、限定はしないが、造血器新生物が挙げられる。本明細書で使用する場合、造血器新生物とは、リンパ系障害、骨髄系障害、およびAIDS関連白血病を包含する専門用語である。
リンパ系障害には、限定はしないが、急性リンパ性白血病および慢性リンパ球増殖性障害(たとえば、リンパ腫、骨髄腫、および慢性リンパ性白血病)が含まれる。リンパ腫には、たとえば、ホジキン病、非ホジキンリンパ腫、およびリンパ球性リンパ腫が含まれる。慢性リンパ性白血病には、たとえば、T細胞慢性リンパ性白血病およびB細胞慢性リンパ性白血病が含まれる。
本発明はまた、式Iの化合物、または薬学的に許容できるその鏡像異性体、塩、および溶媒和物の薬学的に有効な量を、それを必要とする患者に投与することを含む、患者においてがんの発症を遅らせる方法を提供する。
患者は、温血動物、より好ましくはヒトであることが好ましい。
本発明の化合物は、がんの治療および/または予防において特に有用である。
特定の実施形態では、本発明の化合物は、がんの治療および/または予防において特に有用である。
本発明はさらに、がんを治療および/または予防する医薬を製造するための、式Iの化合物、または薬学的に許容できるその鏡像異性体、塩、および溶媒和物の使用を提供する。
本発明の別の特色によれば、そのような治療を必要とする患者、好ましくは温血動物、より一層好ましくはヒトにおいてTDO2活性を調節する方法であって、前記患者に、有効量の本発明の化合物、または薬学的に許容できるその鏡像異性体、塩、および溶媒和物を投与することを含む方法が提供される。
製剤
本発明はまた、式Iの化合物または薬学的に許容できるその鏡像異性体、塩、および溶媒和物と、薬学的に許容できる少なくとも1種の担体、希釈剤、医薬添加剤、および/またはアジュバントとを含む医薬組成物を提供する。上で指摘したとおり、本発明は、活性成分としての本発明の化合物、薬学的に許容できるその鏡像異性体、塩、および溶媒和物に加えて、追加の治療薬および/または活性成分を含有する医薬組成物もカバーする。
本発明はまた、式Iの化合物または薬学的に許容できるその鏡像異性体、塩、および溶媒和物と、薬学的に許容できる少なくとも1種の担体、希釈剤、医薬添加剤、および/またはアジュバントとを含む医薬組成物を提供する。上で指摘したとおり、本発明は、活性成分としての本発明の化合物、薬学的に許容できるその鏡像異性体、塩、および溶媒和物に加えて、追加の治療薬および/または活性成分を含有する医薬組成物もカバーする。
本発明の別の目的は、少なくとも1種の本発明の化合物、または薬学的に許容できるその鏡像異性体、塩、および溶媒和物を活性成分として含む医薬である。
本発明の別の特色によれば、そのような治療を必要とする患者においてTDO2活性を調節する医薬を製造するための、式Iの化合物または薬学的に許容できるその鏡像異性体、塩、および溶媒和物の使用であって、そのような治療が、前記患者に、有効量の本発明の化合物、または薬学的に許容できるその鏡像異性体、塩、および溶媒和物を投与することを含む使用が提供される。
一般に、本発明の化合物は、医薬として使用するために、少なくとも1種の本発明の化合物と、薬学的に許容できる少なくとも1種の担体、希釈剤、医薬添加剤、および/またはアジュバントと、場合により、薬学的に活性のある別の1種または複数の化合物とを含む医薬調製物として製剤することができる。
非限定的な例によって、このような製剤は、経口投与、非経口投与(静脈内、筋肉内、もしくは皮下注射、または静脈内注入などによる)、局所投与(眼内を含める)、吸入、皮膚パッチ、植込錠、坐剤などによる投与に適する形態にすることができる。投与方式に応じて固体、半固体、または液体となりうる、このような適切な投与形態、ならびに方法、およびその調製において使用する担体、希釈剤、および医薬添加剤は、当業者には明白となり、Remington’s Pharmaceutical Sciencesの最新版が参考になる。
そのような調製物の、好ましいが非限定的な一部の例としては、錠剤、丸剤、粉末、口中錠、サシェ剤、カシェ剤、エリキシル、懸濁液、乳濁液、溶液、シロップ、エアロゾル、軟膏、クリーム、ローション、軟および硬ゼラチンカプセル剤、坐剤、滴剤、滅菌注射用溶液、およびボーラスとしての投与および/または継続投与のための(通常は使用前に復元される)滅菌包装粉末が挙げられ、これらは、このような製剤にそれ自体が適する担体、医薬添加剤、および希釈剤、たとえば、ラクトース、デキストロース、スクロース、ソルビトール、マンニトール、デンプン、アカシアゴム、リン酸カルシウム、アルギン酸塩、トラガカント、ゼラチン、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、ポリエチレングリコール、セルロース、(滅菌)水、メチルセルロース、ヒドロキシ安息香酸メチルおよびプロピル、タルク、ステアリン酸マグネシウム、食用油、植物油、および鉱油、またはこれらの適切な混合物を用いて製剤することができる。製剤は、滑沢剤、湿潤剤、乳化および懸濁化剤、分散剤、崩壊剤、増量剤、賦形剤、保存剤、甘味剤、着香剤、流動性調節剤、放出剤などの、医薬製剤中に一般に使用される他の物質を場合により含有してもよい。組成物は、それが含有する活性化合物の即時、持続、遅延放出が実現されるように製剤することもできる。
本発明の医薬調製物は、単位剤形にすることが好ましく、たとえば、箱、ブリスター、バイアル、ボトル、サシェ、アンプル、または適切な他のいずれかの単用量もしくは多用量保持器もしくは容器(適正にラベルが貼られることもある)に、場合により、製品情報および/または使用手順を収載する1つまたは複数の折込み印刷物と共に、適切に包装することができる。
本発明の活性化合物は、予防または治療する状態、および投与経路に応じて、単一の一日量として、一日量を1回または複数に分けて、またはたとえば点液注入を使用して実質的に継続して、投与することができる。
定義
本発明では、以下の用語は、次の意味を有する。
基が置換されていることもある場合において、そのような基は、1つまたは複数の置換基、好ましくは、1つ、2つ、または3つの置換基で置換されていることがある。置換基は、限定はしないが、たとえば、ハロゲン、ヒドロキシル、オキソ、ニトロ、アミド、カルボキシ、アミノ、シアノ、ハロアルコキシ、およびハロアルキルを含む群から選択されるものでよい。
本発明では、以下の用語は、次の意味を有する。
基が置換されていることもある場合において、そのような基は、1つまたは複数の置換基、好ましくは、1つ、2つ、または3つの置換基で置換されていることがある。置換基は、限定はしないが、たとえば、ハロゲン、ヒドロキシル、オキソ、ニトロ、アミド、カルボキシ、アミノ、シアノ、ハロアルコキシ、およびハロアルキルを含む群から選択されるものでよい。
用語「ハロゲン」とは、フルオロ(F)、クロロ(Cl)、ブロモ(Br)、またはヨード(I)を意味する。
以下の定義は、本明細書に記載の化合物に関連して使用する。一般に、所与の基に存在する炭素原子の数は、「Cx〜Cy」で示され、xおよびyは、それぞれ、下限および上限である。本明細書における定義で使用する炭素数は、炭素主鎖および炭素分岐を指すが、アルコキシ置換基などの置換基の炭素原子は含まない。別段指摘しない限り、本明細書で明確に定義しない置換基の命名は、官能基の末端部分、続いて結合点に隣接する官能基を、左から右に命名することにより決定される。本明細書で使用する場合、「置換されていてもよい」とは、置換されていてもよい基の少なくとも1つの水素原子が置き換えられていることを意味する。
用語「アルキル」とは、それだけで、または別の置換基の一部として、式CnH2n+1[式中、nは、1以上の数である]のヒドロカルビルラジカルを指す。アルキル基は、1〜10個(1と10を含める)の炭素、すなわち、C1、C2、C3、C4、C5、C6、C7、C8、C9、またはC10を含有する、すなわち、C1〜C10アルキルでよい。ある特定の実施形態では、本発明のアルキル基は、1〜6個の炭素原子、好ましくは1〜4個の炭素原子、より好ましくは1〜3個の炭素原子を含む。アルキル基は、直鎖でも分岐でもよく、本明細書で示すとおりに置換されていることもある。適切なアルキル基としては、メチル、エチル、n−プロピル、i−プロピル、n−ブチル、i−ブチル、s−ブチル、およびt−ブチル、ペンチルおよびその異性体(たとえば、n−ペンチル、iso−ペンチル)、ならびにヘキシルおよびその異性体(たとえば、n−ヘキシル、iso−ヘキシル)が挙げられる。
用語「ハロアルキル」は、単独または複合語で、1つまたは複数の水素が上で定義したとおりのハロゲンで置き換えられている、上で定義したとおりの意味を有するアルキルラジカルを指す。このようなハロアルキルラジカルの非限定的な例としては、フルオロメチル、ジフルオロメチル、トリフルオロメチルなどが挙げられる。一例では、ハロアルキルは、少なくとも1つのハロゲンで置換されているC1〜C6アルキル基である。別の例では、ハロアルキルは、少なくとも1つのハロゲンで置換されているC1〜C4アルキル基である。各ハロゲン置換は、独立に選択されるものでよい。
本明細書で使用する用語「シクロアルキル」は、環状アルキル基、換言すれば、1つまたは2つの環状構造を有する一価飽和または不飽和ヒドロカルビル基である。シクロアルキルには、単環式または二環式ヒドロカルビル基が含まれる。シクロアルキル基は、環中に3つ以上の炭素原子を含むことがあり、一般に、本発明によれば、3〜10個、より好ましくは3〜8個の炭素原子、より一層好ましくは3〜6個の炭素原子を含む。シクロアルキル基の例としては、限定はしないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルが挙げられ、シクロプロピルが特に好ましい。
用語「ヘテロ原子」とは、硫黄、窒素、または酸素原子を指す。
シクロアルキル基中の少なくとも1個の炭素原子がヘテロ原子で置き換えられる場合において、結果として生じた環を、本明細書では「ヘテロシクリル」と呼ぶ。
本明細書で使用する用語「ヘテロシクリル」または「ヘテロ環」は、それだけで、または別の基の一部として、少なくとも1つの含炭素原子環中に少なくとも1つのヘテロ原子を有する、(たとえば、3〜7員単環式、7〜11員二環式、または合計3〜10個の環原子を含んでいる)非芳香族完全飽和または部分不飽和環式基を指す。ヘテロ原子を含んでいるヘテロ環式基の各環は、窒素、酸素、および/または硫黄原子から選択される1、2、3、または4個のヘテロ原子を有することがあり、窒素および硫黄ヘテロ原子は、場合により酸化されていてもよく、窒素ヘテロ原子は、場合により四級化されていてもよい。ヘテロ環は、3〜7個(3と7を含める)またはその間の整数の炭素原子を収容しうる。ヘテロ環式基の炭素原子のいずれかは、オキソ(たとえば、ピペリドン、ピロリジノン)で置換されていることもある。ヘテロ環式基は、原子価の点で許容される、環または環系のいずれかのヘテロ原子または炭素原子の箇所で結合していてよい。多環ヘテロ環の環は、縮合し、架橋し、かつ/または1つまたは複数のスピロ原子を介して連結していてよい。非限定的な典型的なヘテロ環式基としては、ピペリジニル、アゼチジニル、テトラヒドロピラニル、ピペラジニル、イミダゾリニル、モルホリニル、オキセタニル、ピラゾリジニル イミダゾリジニル、イソオキサゾリニル、オキサゾリジニル、イソオキサゾリジニル、チアゾリジニル、イソチアゾリジニル、インドリル、インドリニル、イソインドリニル、テトラヒドロフラニル、テトラヒドロキノリニル、チオモルホリニル、チオモルホリニルスルホキシド、チオモルホリニルスルホン、ピロリジニルが挙げられる。
本明細書で使用する用語「アリール」とは、通常は5〜12個、好ましくは6〜10個の原子を含んでいる、単環(すなわち、フェニル)または縮合もしくは共有結合した複数の芳香族環(たとえば、ナフチル)を有しており、少なくとも1つの環が芳香族である、多価不飽和芳香族ヒドロカルビル基を指す。芳香族環は、それに縮合した1つ〜2つの追加の環(シクロアルキル、ヘテロシクリル、またはヘテロアリール)を場合により含んでもよい。アリールは、本明細書で列挙する炭素環(含炭素環)系の、部分的に水素化された誘導体も包含するものとする。アリールの非限定的な例は、フェニル、ビフェニリル、ビフェニレニルナフタレニル、インデニルを含む。
本明細書で使用する用語「ヘテロアリール」とは、それだけで、または別の基の一部として、限定はしないが、通常は5〜6個の原子を含んでいる、縮合または共有結合した1〜2つの環を含んでおり、その少なくとも1つが芳香族であり、こうした環の1つまたは複数にある1個または複数の炭素原子が、酸素、窒素、および/または硫黄原子で置き換えられている、5〜12個の炭素原子の芳香族環または環系を指し、窒素および硫黄ヘテロ原子は、場合により酸化されていてもよく、窒素ヘテロ原子は、場合により四級化されていてもよい。このような環は、アリール、シクロアルキル、ヘテロアリール、またはヘテロシクリル環に縮合することがある。このようなヘテロアリールの非限定的な例としては、ピリダジニル、ピリジニル、フラニル、チオフェニル、ピラゾリル、イミダゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、イソチアゾリル、トリアゾリル、オキサジアゾリル、チアジアゾリル、テトラゾリル、オキサトリアゾリル、チアトリアゾリル、ピリミジル、ピラジニル、オキサジニル、ジオキシニル、チアジニル、トリアジニル、インドリル、インドリジニル、イソインドリル、ベンゾフラニル、イソベンゾフラニル、ベンゾチオフェニル、イソベンゾチオフェニル、インダゾリル、ベンゾイミダゾリル、キノリニル、イソキノリニル、シンノリニル、キナゾリニル、キノキサリニルが挙げられる。
用語「アリールアルキル」とは、いずれかの−アルキル−アリール基を指す。用語「アルキルアリール」とは、いずれかの−アリール−アルキル基を指す。
用語「ヘテロアリールアルキル」とは、いずれかの−アルキル−ヘテロアリール基を指す。用語「アルキルヘテロアリール」とは、いずれかの−ヘテロアリール−アルキル基を指す。
用語「アルコキシ」とは、いずれかのO−アルキル基を指す。用語「ハロアルコキシ」とは、いずれかのO−ハロアルキル基を指す。
用語「オキソ」とは、=O部分を指す。
用語「アミノ」とは、−NH2基、または1個もしくは2個の水素原子が有機脂肪族もしくは芳香族基で置換されることでこれから導かれるいずれかの基を指す。−NH2から導かれる基は、モノアルキルアミノおよびジアルキルアミノを包含する「アルキルアミノ」基、すなわち、N−アルキル基であることが好ましい。用語「アミノ」の非限定的な例としては、NH2、NHMe、またはNMe2が挙げられる。
用語「アミノ保護基」とは、アミン官能性に対する保護基を指す。好ましい実施形態によれば、アミノ保護基は、アリールスルホニル、tert−ブトキシカルボニル、メトキシメチル、パラメトキシベンジル、またはベンジルを含む群において選択される。
用語「脱離基」とは、不均一結合開裂において一対の電子と共に離れた分子断片を指す。好ましい実施形態によれば、脱離基は、ハロゲン、好ましくはヨウ素、臭素、もしくは塩素、1〜6個の炭素原子を有するアルキルスルホニルオキシ、好ましくはメチルスルホニルオキシもしくはトリフルオロメチルスルホニルオキシ、または6〜10個の炭素原子を有するアリールスルホニルオキシ、好ましくはフェニル−もしくはp−トリルスルホニルオキシを含む群において選択される。
用語「溶媒和物」は、本明細書では、化学量論または化学量論量未満の1種または複数の薬学的に許容できる溶媒分子、たとえば、エタノールを含んでいる、本発明における化合物を述べるのに使用する。通常、溶媒和物は、化合物の生理活性または毒性を実質的に変化させず、そのため、本明細書で規定するとおりの式Iおよびその下位式の非溶媒和物化合物の薬理学的同等物として機能しうる。本明細書で使用する用語「溶媒和物」とは、本発明の化合物の溶媒分子との複合化、物理的会合、および/または溶媒和である。この物理的会合は、水素結合を含めた、様々な度合いのイオン結合および共有結合を含む。ある特定の例では、1種または複数の溶媒分子が結晶質固体の結晶格子に組み込まれている場合などに、溶媒和物を単離することができる。したがって、「溶媒和物」は、溶液相と単離可能な溶媒和物両方を包含する。「溶媒和物」は、式Iの化合物の塩の溶媒和物を包含しうる。
用語「水和物」とは、溶媒分子が水である場合を指し、nH2Oを含んでいる無機塩でよく、nは、塩の式単位あたりの水分子の数である。Nは、1/2、1と1/2、または1〜10の整数となりうる。水を失った水和物。
本発明の化合物には、そのすべての多形体および晶癖、そのプロドラッグおよびプロドラッグを含めた、上で規定したとおりの式Iの化合物、ならびに同位体標識された式Iの化合物が含まれる。
本発明は、一般に、式Iの化合物の薬学的に許容できるすべてのプレドラッグおよびプロドラッグも包含する。
本明細書で使用する用語「プロドラッグ」とは、たとえば、そのin vivo生体内変換生成物が生物学的に活性のある薬物を生じるエステルなどの、式Iの化合物の薬理学的に許容できる誘導体を意味する。プロドラッグは、一般に、生物学的利用能が増していることを特徴とし、in vivoで容易に代謝されて生物学的に活性のある化合物になる。
本明細書で使用する用語「プレドラッグ」とは、薬物種を生成するように修飾されるいずれかの化合物を意味し、修飾が行われるのは、身体の内部または外部のいずれでもよく、また薬物の投与が適応となる身体領域にプレドラッグが到達する前または後のいずれでもよい。
用語「患者」とは、診療を受けるのを待っている、診療を受けている、または医療処置の対象である/となる、温血動物、より好ましくはヒトを指す。
用語「ヒト」とは、両方の性の、いずれかの発育段階(すなわち、新生児、小児、若年、青年、成人)にある対象を指す。
本明細書で使用する用語「治療する」、「治療すること」、および「治療」とは、状態もしくは疾患および/またはそれに伴う症状を軽減する、緩和する、または解消することを包含するものとする。
本明細書で使用する用語「予防する」、「予防すること」、および「予防」とは、状態もしくは疾患および/またはそれに伴う症状の発症を遅らせるもしくは未然に防ぐ、患者が状態もしくは疾患に見舞われるのを防ぐ、または患者が状態もしくは疾患に見舞われるリスクを軽減する方法を指す。
本明細書で使用する用語「治療有効量」(またはより簡潔に「有効量」)とは、それが投与される患者において所望の治療または予防効果を得るのに十分である、活性薬剤または活性成分の量を意味する。
用語「投与」またはその変形語(たとえば「投与すること」)は、状態、症状、または疾患の治療または予防がなされる患者に、活性薬剤または活性成分を、単独、または薬学的に許容できる組成物の一部として提供することを意味する。
「薬学的に許容できる」とは、医薬組成物の成分が、互いに相性がよく、その患者に有害でないことを意味する。
本明細書で使用する用語「薬学的ビヒクル」とは、薬学的に活性のある薬剤がそこに含まれて製剤および/または投与される溶媒または希釈剤として使用される担体または不活性媒質を意味する。薬学的ビヒクルの非限定的な例としては、クリーム、ゲル、ローション、溶液、およびリポソームが挙げられる。
語「含む(comprise)」、「含む(comprises)」、および「含む(comprising)」は、排他的でなく包含的に解釈される。語「からなる(consist)」、「からなる(consisting)」、およびその変形語は、包含的でなく排他的に解釈される。
本明細書で使用する場合、用語「約」は、別段指定しない限り、所与の基準からの10%の変動性を意味する。
本発明は、以下の実施例を参照することでよりよく理解される。こうした実施例は、本発明の特定の実施形態を表すものであり、本発明の範囲を限定するものではない。
I.化学実施例
以下に記載する実施例において提供する質量分析(MS)データは、次のように取得した。質量スペクトル:LC/MS Agilent 6110(電子スプレーイオン化法、ESI)またはWaters Acquity SQD(ESI)。
以下に記載する実施例において提供する質量分析(MS)データは、次のように取得した。質量スペクトル:LC/MS Agilent 6110(電子スプレーイオン化法、ESI)またはWaters Acquity SQD(ESI)。
以下に記載する実施例において提供するNMRデータは、次のように取得した。Bruker Ultrashield(商標)400PLUSおよびBruker Fourier 300MHz。TMSを内部標準として使用した。
マイクロ波化学反応は、Biotageの単モードマイクロ波反応器であるInitiator Microwave System EUで行った。
分取高速液体クロマトグラフィー(HPLC)精製は、別段報告しない限り、Xbridge(商標)Prep C18 OBDカラム19×150mm 5μmを備え付けた、Watersの質量式自動精製Fractionlynxで行った。HPLC精製はすべて、CH3CN/H2O/NH4HCO3(5mM)、CH3CN/H2O/TFA(0.1%)、またはCH3CN/H2O/NH3H2O(0.1%)の勾配で行った。
以下の略語が本明細書において使用され、示される定義を有する。
ACNは、アセトニトリルであり、DMSOは、ジメチルスルホキシドであり、DCMは、ジクロロメタンであり、DIPEAは、ジイソプロピルエチルアミンであり、DMFは、N,N−ジメチルホルムアミドであり、dppfは、1,1’−ビス(ジフェニルホスフィノ)フェロセンであり、EtOHは、エタノールであり、HATUは、2−(1H−7−アザベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスフェートメタンアミニウムであり、Hzは、ヘルツであり、KOAcは、酢酸カリウムであり、MeOHは、メタノールであり、MHzは、メガヘルツであり、mMは、ミリモル濃度であり、mLは、ミリリットルであり、minは、分であり、molは、モルであり、M+は、分子イオンであり、[M+H]+は、プロトン化された分子イオンであり、Nは、規定度であり、NMRは、核磁気共鳴であり、PPh3は、トリフェニルホスフィンであり、psiは、平方インチ毎ポンドであり、PPMは、百万分率であり、qd poは、経口で毎日を意味し、rtは、室温であり、RTは、保持時間であり、TLCは、薄層クロマトグラフィーであり、TFAは、トリフルオロ酢酸であり、TEAは、トリエチルアミンである。
ACNは、アセトニトリルであり、DMSOは、ジメチルスルホキシドであり、DCMは、ジクロロメタンであり、DIPEAは、ジイソプロピルエチルアミンであり、DMFは、N,N−ジメチルホルムアミドであり、dppfは、1,1’−ビス(ジフェニルホスフィノ)フェロセンであり、EtOHは、エタノールであり、HATUは、2−(1H−7−アザベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスフェートメタンアミニウムであり、Hzは、ヘルツであり、KOAcは、酢酸カリウムであり、MeOHは、メタノールであり、MHzは、メガヘルツであり、mMは、ミリモル濃度であり、mLは、ミリリットルであり、minは、分であり、molは、モルであり、M+は、分子イオンであり、[M+H]+は、プロトン化された分子イオンであり、Nは、規定度であり、NMRは、核磁気共鳴であり、PPh3は、トリフェニルホスフィンであり、psiは、平方インチ毎ポンドであり、PPMは、百万分率であり、qd poは、経口で毎日を意味し、rtは、室温であり、RTは、保持時間であり、TLCは、薄層クロマトグラフィーであり、TFAは、トリフルオロ酢酸であり、TEAは、トリエチルアミンである。
I.1.中間体の合成
中間体1:6−フルオロ−3−ヨード−1−(フェニルスルホニル)−1H−インドール
中間体1:6−フルオロ−3−ヨード−1−(フェニルスルホニル)−1H−インドール
中間体2:
tert−ブチル6−フルオロ−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−インドール−1−カルボキシレート
tert−ブチル6−フルオロ−3−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−インドール−1−カルボキシレート
中間体3:6−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−インダゾール
[M+H]+のLC-MS: 計算値
245.1; 実測値: 245.0.
中間体4:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール
[M+H]+のLC-MS: 計算値392.1;
実測値: 391.8. 1H NMR (300 MHz, DMSO-d6)
δ [ppm]: 13.13 (s, 1H), 8.20 - 8.11 (m, 4H), 7.93 -
7.78 (m, 4H), 7.77 - 7.70 (m, 1H), 7.65 - 7.60 (m, 2H), 7.44 (dd, J = 9.3, 2.1
Hz, 1H), 7.26 (ddd, J = 9.3, 9.0, 2.1 Hz, 1H).
中間体5:tert−ブチル4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−カルボキシレートおよびtert−ブチル4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
589.2; 実測値: 588.9.
中間体6:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール塩酸塩および6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール塩酸塩
[M+H]+のLC-MS: 計算値
489.2; 実測値: 488.9.
中間体7:1−(4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−イル)エタノン
[M+H]+のLC-MS: 計算値
531.2; 実測値: 530.9.
中間体8:3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド
[M+H]+のLC-MS: 計算値
463.1; 実測値: 462.8.
中間体9:tert−ブチル4−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−カルボキシレートおよびtert−ブチル4−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
575.2; 実測値: 574.8.
中間体10:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール塩酸塩および6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール塩酸塩
[M+H]+のLC-MS: 計算値
475.2; 実測値: 474.8.
中間体11:5−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−インダゾール
[M+H]+のLC-MS: 計算値
245.1; 実測値: 245.2.
中間体12:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール
[M+H]+のLC-MS: 計算値
392.1; 実測値: 392.0.
中間体13:2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)アセトアミドおよび2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)アセトアミド
[M+H]+のLC-MS: 計算値
449.1; 実測値: 448.8.
中間体14:tert−ブチル4−((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−カルボキシレートおよびtert−ブチル4−((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
589.2; 実測値: 588.8.
中間体15:tert−ブチル4−((5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
449.2; 実測値: 448.9
中間体16:3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミドおよび3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド
[M+H]+のLC-MS: 計算値
463.2; 実測値: 462.8.
中間体17:tert−ブチル4−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
575.2; 実測値: 574.9.
中間体18:tert−ブチル4−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−カルボキシレート
[M+H-(CH3)2C=CH2]+のLC-MS: 計算値 379.2; 実測値: 378.9.
中間体19:1−(4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−イル)エタノン
[M+H]+のLC-MS: 計算値
531.2; 実測値: 530.9.
中間体20:3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド
中間体21:tert−ブチル4−((5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
449.2; 実測値: 448.9
中間体22:5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール
中間体23:tert−ブチル4−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
575.2; 実測値: 574.9.
中間体24:tert−ブチル4−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
435.5; 実測値: 434.9.
中間体25:tert−ブチル5−ブロモ−1H−ベンゾ[d]イミダゾール−1−カルボキシレートおよびtert−ブチル6−ブロモ−1H−ベンゾ[d]イミダゾール−1−カルボキシレート
[M+H-(CH3)2C=CH2]+のLC-MS: 計算値241.0; 実測値:
240.9. 1H NMR (300 MHz, CDCl3) δ [ppm]: 8.42 (s, 0.5H), 8.40 (s, 0.5H), 8.20 (s, 0.5H), 7.95 (s,
0.5H), 7.88 (d, J = 8.7 Hz, 0.5H), 7.66 (d, J = 8.7 Hz, 0.5H), 7.55 - 7.44 (m,
1H), 1.71 (s, 9H), 互変異性体の混合物.
中間体26:tert−ブチル5−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ベンゾ[d]イミダゾール−1−カルボキシレートおよびtert−ブチル6−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ベンゾ[d]イミダゾール−1−カルボキシレート
[M+H]+のLC-MS: 計算値
345.2; 実測値: 345.0.
中間体27:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール
[M+H]+のLC-MS: 計算値
392.1; 実測値: 391.9.
中間体28:tert−ブチル5−ブロモ−2−メチル−1H−ベンゾ[d]イミダゾール−1−カルボキシレート
[M+H-(CH3)2C=CH2]+のLC-MS: 計算値256.0; 実測値:
256.8. 1H NMR (300 MHz, CDCl3) δ [ppm]: 7.79 (d, J = 8.7 Hz, 1H), 7.79 (d, J = 2.0 Hz, 1H), 7.76 (m,
2H), 7.41 (dd, J = 8.7, 2.0 Hz, 1H), 2.82 (s, 3H), 1.72 (s, 9H).
中間体29:tert−ブチル2−メチル−5−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ベンゾ[d]イミダゾール−1−カルボキシレート
[M+H]+のLC-MS: 計算値359.2;
実測値: 359.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 7.91 (d, J = 8.2 Hz, 1H), 7.84 (s, 1H), 7.64
(d, J = 8.2 Hz, 1H), 2.72 (s, 3H), 1.66 (s, 9H), 1.32 (s, 12H).
中間体30:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−メチル−1H−ベンゾ[d]イミダゾール
[M+H]+のLC-MS: 計算値
406.1; 実測値: 405.8.
中間体31:4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)ベンゼン−1,2−ジアミン
[M+H]+のLC-MS: 計算値235.2;
実測値: 235.0. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 7.22 (d, J = 7.7 Hz, 1H), 7.16 (s, 1H), d, J =
7.7 Hz, 1H, 1.32 (s, 12H).
中間体32:4−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゼン−1,2−ジアミン
[M+H]+のLC-MS: 計算値382.1;
実測値: 381.8. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 7.90 (d, J = 7.6 Hz, 1H), 7.77 (dd, J = 9.7,
2.0 Hz, 1H), 7.68 (dd, J = 8.7, 5.3 Hz, 1H), 7.58 - 7.53 (m, 2H), 7.49 - 7.43
(m, 2H), 7.01 (ddd, J = 9.3, 8.7, 2.3 Hz, 1H), 6.94 - 6.89 (m, 2H), 6.78 (d, J =
7.6 Hz, 1H).
中間体33:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(2−(メチルチオ)エチル)−1H−ベンゾ[d]イミダゾール
[M+H]+のLC-MS: 計算値
466.1; 実測値: 465.8.
中間体34:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)−1H−ベンゾ[d]イミダゾール
[M-H]-のLC-MS: 計算値496.1; 実測値: 495.9. 1H NMR
(300 MHz, CDCl3) δ [ppm]: 7.97 - 7.89 (m,
2H), 7.83 - 7.75 (m, 1H), 7.75 - 7.66 (m, 3H), 7.65 - 7.52 (m, 2H), 7.51 - 7.41
(m, 3H), 7.09 - 6.98 (m, 1H), 3.70 - 3.61 (m, 2H), 3.59 - 3.48 (m, 2H), 2.97
(s, 3H).
中間体35:
tert−ブチル2−(2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニルアミノ)−2−オキソエチル(メチル)カルバメートおよびtert−ブチル2−(2−アミノ−4−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニルアミノ)−2−オキソエチル(メチル)カルバメート
tert−ブチル2−(2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニルアミノ)−2−オキソエチル(メチル)カルバメートおよびtert−ブチル2−(2−アミノ−4−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニルアミノ)−2−オキソエチル(メチル)カルバメート
[M+H-(CH3)2C=CH2]+のLC-MS: 計算値 497.1; 実測値: 496.8.
中間体36:tert−ブチル(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル(メチル)カルバメート
[M+H]+のLC-MS: 計算値
535.2; 実測値: 534.8.
中間体37:tert−ブチル(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル(メチル)カルバメート
中間体38:N−(2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニル)−2−クロロアセトアミドおよびN−(2−アミノ−4−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニル)−2−クロロアセトアミド
C22H17ClFN3O3S+H+
[M+H]+のLC-MS: 計算値
458.1; 実測値: 457.7.
中間体39:2−(クロロメチル)−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール
[M+H]+のLC-MS: 計算値
440.1; 実測値: 439.8.
中間体40:3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)プロパン酸
[M+H]+のLC-MS: 計算値464.1;
実測値: 464.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 12.30 (s, 1H), 8.15 (d, J = 7.7 Hz, 2H), 8.06
(s, 1H), 7.87 - 7.80 (m, 2H), 7.77 - 7.70 (m, 2H), 7.66 - 7.60 (m, 2H), 7.57
(d, J = 8.3 Hz, 1H), 7.44 (d, J = 8.3 Hz, 1H), 7.24 (ddd, J = 9.3, 8.7, 2.2 Hz,
1H), 3.57 (s, 1H), 3.07 (t, J = 7.1 Hz, 2H), 2.82 (t, J = 7.1 Hz, 2H).
中間体41:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2,3−ジヒドロ−1H−ベンゾ[d]ピロロ[1,2−a]イミダゾール−1−オン
[M+H]+のLC-MS: 計算値
446.1; 実測値: 446.0.
中間体42:5−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)ベンゾ[d]オキサゾール
246.0. 1H NMR (400 MHz, CDCl3) δ [ppm]: 8.26 (s, 1H), 8.10 (s, 1H), 7.86 (d, J = 8.0 Hz, 1H), 7.58
(d, J = 8.0 Hz, 1H), 1.37 (s, 12H).
中間体43:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール
392.8. 1H NMR (400 MHz, CDCl3) δ [ppm]: 8.16 (s, 1H), 7.99 - 7.93 (m, 3H), 7.81 (dd, J = 9.5, 2.1
Hz, 1H), 7.73 -7.65 (m, 3H), 7.62 - 7.57 (m, 2H), 7.53 - 7.47 (m, 2H), 7.07
(ddd, J = 9.2, 8.7, 2.2 Hz, 1H).
中間体44:2−メチル−5−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)ベンゾ[d]オキサゾール
中間体45:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値407.1;
実測値: 406.8. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 8.20 - 8.14 (m, 3H), 7.97 (d, J = 0.8 Hz, 1H),
7.88 - 7.81 (m, 2H), 7.79 - 7.70 (m, 2H) , 7.69 - 7.60 (m, 3H), 7.23 (ddd, J =
9.2, 8.8, 2.4 Hz, 1H), 2.65 (s, 3H) .
中間体46:tert−ブチル(2−((2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニル)アミノ)−2−オキソエチル)カルバメート
[M+H]+のLC-MS: 計算値
539.2; 実測値: 538.8
中間体47:tert−ブチル((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)カルバメート
[M+H]+のLC-MS: 計算値521.2;
実測値: 520.8. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]:12.29 (d, J = 20.0 Hz, 1H), 8.16 (d, J = 7.8
Hz, 2H), 8.08 (d, J = 11.5 Hz, 1H), 7.87 - 7.80 (m, 2H), 7.74 (ddd, J = 11.4,
3.6, 1.2 Hz, 1H), 7.69 - 7.60 (m, 2H), 7.57 - 7.44 (m, 3H), 7.29 - 7.21 (m,
1H), 4.38 (d, J = 5.7 Hz, 2H), 2.70 (d, J = 8.2 Hz, 1H), 1.42 (s, 9H).
中間体48:tert−ブチル((6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)カルバメート
[M+H]+のLC-MS: 計算値
381.2; 実測値: 380.9.
中間体49:N−(2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニル)−2−(ジメチルアミノ)アセトアミド
[M+H]+のLC-MS: 計算値
467.2 実測値: 466.8.
中間体50:1−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)−N,N−ジメチルメタンアミン
[M+H]+のLC-MS: 計算値
449.1; 実測値: 449.0.
中間体51:tert−ブチル(2−(((6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アミノ)−2−オキソエチル)カルバメート
[M+H]+のLC-MS: 計算値
438.2; 実測値: 437.9
中間体52:2−アセトアミド−N−(2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニル)アセトアミド
[M+H]+のLC-MS: 計算値
481.1; 実測値: 480.8.
中間体53:N−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アセトアミド
[M+H]+のLC-MS: 計算値
463.1; 実測値: 462.8.
中間体54:tert−ブチル4−((2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェニル)カルバモイル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
593.2; 実測値: 592.9.
中間体55:tert−ブチル4−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
575.2; 実測値: 574.9.
中間体56:tert−ブチル4−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
435.2; 実測値: 434.9.
中間体57:2−アミノ−5−(6−フルオロ−1H−インドール−3−イル)フェノール
中間体58:N−[2−アミノ−5−(1−ベンゼンスルホニル−6−フルオロ−1H−インドール−3−イル)−フェニル]−2−クロロ−アセトアミドおよびN−[2−アミノ−4−(1−ベンゼンスルホニル−6−フルオロ−1H−インドール−3−イル)−フェニル]−2−クロロ−アセトアミド
[M+H]+のLC-MS: 計算値
458.1; 実測値: 457.7.
中間体59:6−(1−ベンゼンスルホニル−6−フルオロ−1H−インドール−3−イル)−2−クロロメチル−1H−ベンゾイミダゾール
[M+H]+のLC-MS: 計算値
440.1; 実測値: 439.8.
中間体60:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)−1H−ベンゾ[d]イミダゾール
[M+H]+のLC-MS: 計算値
504.2; 実測値: 503.8.
中間体61:2−(((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アミノ)エタノール
[M+H]+のLC-MS: 計算値
465.1; 実測値: 464.9.
中間体62:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)−1H−ベンゾ[d]イミダゾール
C26H24FN5O2S+H+
[M+H]+のLC-MS: 計算値
490.2; 実測値: 490.5.
中間体63:tert−ブチル(2−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エチル)カルバメート
粗生成物をAcOH(10mL)に溶解し、50℃で6時間撹拌した後、これをNaHCO3水溶液でクエンチした。pHを7に調整した。混合物をEtOAc(100mL×3)で抽出し、無水Na2SO4で乾燥させ、濃縮して、粗生成物(4.17g)を得、これをさらに精製することなく次のステップに使用する。
中間体64:2−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エタンアミン
7.74 - 7.67 (m, 1H), 7.65 (s, 1H), 7.59 - 7.55 (m, 2H), 7.49 - 7.39 (m, 4H),
7.04 (td, J = 8.8, 1.6 Hz, 1H), 3.24 (t, J = 5.6 Hz, 2H), 3.06 (t, J = 5.2 Hz,
2H).
中間体65:N−{2−[6−(1−ベンゼンスルホニル−6−フルオロ−1H−インドール−3−イル)−1H−ベンゾイミダゾール−2−イル]−エチル}−メタンスルホンアミド
中間体66:N−(2−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エチル)アセトアミド
中間体67:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−((4−(メチルスルホニル)ピペラジン−1−イル)メチル)−1H−ベンゾ[d]イミダゾール
中間体68:2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)アセトニトリル
中間体69:2−アミノ−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェノール
381.3. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 9.20 (s, 1H), 8.10 (d, J = 7.5 Hz, 2H), 7.89 - 7.66 (m, 4H),
7.61 (t, J = 7.5 Hz, 2H), 7.22 (t, J = 8.1 Hz, 1H), 6.95 (s, 1H), 6.89 (d, J =
7.9 Hz, 1H), 6.67 (d, J = 8.1 Hz, 1H), 4.77(s, 2H).
中間体70:2−アミノ−4−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)フェノール
7.66 (dd, J = 8.8, 4.8 Hz, 1H), 7.59 - 7.53 (m, 2H), 7.51 - 7.44 (m, 2H), 7.02
(td, J = 8.8, 2.0 Hz, 1H), 6.94 (s, 1H), 6.89 - 6.85 (m, 1H), 6.83 - 6.79 (m,
1H), 4.99 (brs, 1H), 3.80 - 3.69 (m, 2H).
中間体71:2−(クロロメチル)−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
441.0; 実測値: 441.4.
中間体72:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
491.2; 実測値: 491.6.
中間体73:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
505.2; 実測値: 505.5.
中間体74:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(モルホリノメチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
492.1; 実測値: 492.5.
中間体75:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2(3H)−オン
[M-H]-のLC-MS: 計算値
407.1; 実測値: 406.8. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]:11.94 (s, 1H), 8.14 (d, J = 8.5 Hz, 1H), 7.87 -
7.78 (m, 1H), 7.76 - 7.70 (m, 0H), 7.68 - 7.60 (m, 2H), 7.49 (d, J = 7.9 Hz,
0H), 7.23 (td, J = 9.1, 2.2 Hz, 0H), 7.18 (d, J = 7.8 Hz, 1H), 7.02 (s, 2H).
中間体76:2−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド
[M+H]+のLC-MS: 計算値
466.1; 実測値: 465.8.
中間体77:5−(1−ベンゼンスルホニル−6−フルオロ−1H−インドール−3−イル)−1,3−ジヒドロ−ベンゾイミダゾール−2−オン
[M+H]+のLC-MS: 計算値
408.1; 実測値: 408.4.
中間体78:2−クロロ−N−(4−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−ヒドロキシフェニル)アセトアミド
中間体79:2−(クロロメチル)−6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
441.0; 実測値: 441.0.
中間体80:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(モルホリノメチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
492.1; 実測値: 492.1.
中間体81:3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)プロパンアミド
[M-H]-のLC-MS: 計算値
478.1; 実測値: 477.7.
中間体82:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
505.2; 実測値: 504.9.
中間体83:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2(3H)−オン
[M+H]+のLC-MS: 計算値
409.1; 実測値: 408.8.
中間体84:2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド
[M+H]+のLC-MS: 計算値
466.1; 実測値: 465.8.
中間体85:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−アミン
[M+H]+のLC-MS: 計算値
407.1; 実測値: 407.4.
中間体86:tert−ブチル((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)(メチルスルホニル)カルバメート
[M+H]+のLC-MS: 計算値
600.1; 実測値: 600.5.
中間体87:N−((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド
[M+H]+のLC-MS: 計算値
500.1; 実測値: 499.9.
中間体88:3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)プロパンアミド
[M-H]-のLC-MS: 計算値
408.1; 実測値: 477.8.
中間体89:2−ベンゾ[b]チオフェン−5−イル−4,4,5,5−テトラメチル−[1,3,2]ジオキサボロラン
1H NMR
(400 MHz, CDCl3) δ 8.31 (s, 1H), 7.89 (d, J
= 8.0 Hz, 1H), 7.75 (d, J = 8.0 Hz, 1H), 7.41 (d, J = 5.4 Hz, 1H), 7.35 (d, J =
5.2 Hz, 1H), 1.37 (s, 12H).
中間体90:3−(ベンゾ[b]チオフェン−5−イル)−6−フルオロ−1−(フェニルスルホニル)−1H−インドール
中間体91:tert−ブチル((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)(メチルスルホニル)カルバメート
[M+H]+のLC-MS: 計算値
600.1; 実測値: 599.8.
中間体92:tert−ブチル((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)(メチルスルホニル)カルバメート
[M-Boc+H]+のLC-MS: 計算値 360.1; 実測値: 360.0.
中間体93:tert−ブチルN−({6−[1−(ベンゼンスルホニル)−6−フルオロ−1H−インドール−3−イル]−1,3−ベンゾオキサゾール−2−イル}メチル)−N−[(tert−ブトキシ)カルボニル]カルバメート
[M-Boc+H]+のLC-MS: 計算値 522.2 ; 実測値: 522.9.
中間体94:tert−ブチルN−[(tert−ブトキシ)カルボニル]−N−{[6−(6−フルオロ−1H−インドール−3−イル)−1,3−ベンゾオキサゾール−2−イル]メチル}カルバメート
[M-Boc+H]+のLC-MS: 計算値 382.2; 実測値: 381.9.
中間体95:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
491.2; 実測値: 490.8.
中間体96:2−(ベンゾ[b]チオフェン−6−イル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン
中間体97:3−(ベンゾ[b]チオフェン−6−イル)−6−フルオロ−1−(フェニルスルホニル)−1H−インドール
中間体98:5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(2−(メチルチオ)エチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値467.1;
実測値: 467.5. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 7.97 - 7.92 (m, 2H), 8.85 (d, J = 1.6 Hz, 1H),
7.80 (dd, J = 9.6, 2.4 Hz, 1H), 7.71 - 7.66 (m, 2H), 7.62 - 7.55 (m, 2H), 7.53
- 7.46 (m, 3H), 7.06 (td, J = 8.8, 2.4 Hz, 1H), 3.28 (t, J = 7.2 Hz, 2H), 3.06
(t, J = 7.2 Hz, 2H), 2.19 (s, 3H).
中間体99:5−(6−フルオロ−1H−インドール−3−イル)−2−(2−(メチルチオ)エチル)ベンゾ[d]オキサゾール
327.4. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 8.28 (brs, 1H), 7.91 (s, 1H), 7.82 (dd, J = 8.8, 5.2 Hz,
1H), 7.59 - 7.53 (m, 2H), 7.34 (d, J = 2.4 Hz, 1H), 7.13 (dd, J = 9.6, 2.4 Hz,
1H), 6.96 (td, J = 9.2, 2.0 Hz, 1H), 3.93 (t, J = 6.4 Hz, 2H), 3.42 (s, 3H),
3.25 (t, J = 6.4 Hz, 2H).
中間体100:tert−ブチル6−フルオロ−3−(2−(2−(メチルチオ)エチル)ベンゾ[d]オキサゾール−5−イル)−1H−インドール−1−カルボキシレート
[M+H]+のLC-MS: 計算値
427.1; 実測値: 427.6.
中間体101:tert−ブチル6−フルオロ−3−(2−(2−(メチルスルホニル)エチル)ベンゾ[d]オキサゾール−5−イル)−1H−インドール−1−カルボキシレート
[M+H]+のLC-MS: 計算値459.1;
実測値: 459.6. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 8.18-8.00 (m, 1H), 7.99 - 7.90 (m, 1H), 7.88
(s, 1H), 7.72 - 7.66 (m, 1H), 7.58 - 7.50 (m, 1H), 7.40 - 7.30 (m, 1H), 7.04
(td, J = 8.8, 2.0 Hz, 1H), 3.69 (t, J = 7.2 Hz, 2H), 3.54 (t, J = 7.2 Hz, 2H),
3.03 (s, 3H), 1.68 (s, 9H).
中間体102:tert−ブチルN−({5−[1−(ベンゼンスルホニル)−6−フルオロ−1H−インドール−3−イル]−1,3−ベンゾオキサゾール−2−イル}メチル)−N−[(tert−ブトキシ)カルボニル]カルバメート
[M+H]+のLC-MS: 計算値
622.2; 実測値: 622.7.
中間体103:tert−ブチル((5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)カルバメート
1H), 7.63 - 7.54 (m, 2H), 7.35 (d, J = 2.4 Hz, 1H), 7.13 (dd, J = 9.3, 2.4 Hz,
1H), 6.97 (td, J = 9.3, 2.4 Hz, 1H), 4.66 (d, J = 5.7 Hz, 2H), 1.49 (s, 9H).
中間体104:3−(ベンゾフラン−5−イル)−6−フルオロ−1−(フェニルスルホニル)−1H−インドール
391.8. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 8.17 - 8.13 (m, 2H), 8.12 (s, 1H), 8.06 (d, J = 2.2 Hz, 1H),
7.99 (d, J = 1.8 Hz, 1H), 7.87 (dd, J = 8.8, 5.3 Hz, 1H), 7.82 (dd, J = 9.9,
2.4 Hz, 1H), 7.76 - 7.69 (m, 2H), 7.67 - 7.60 (m, 3H), 7.24 (ddd, J = 9.5, 8.8,
2.4 Hz, 1H), 7.02 (d, J = 2.0 Hz, 1H).
中間体105:tert−ブチル4−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値576.2;
実測値: 576.7. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 8.21 (s, 1H), 8.15 (d, J = 7.6 Hz, 2H), 8.04
(s, 1H), 7.89 (dd, J = 4.8, 8.8 Hz, 1H), 7.84 - 7.78 (m, 2H), 7.75 - 7.68 (m,
2H), 7.63 (t, J = 7.6 Hz, 2H), 7.24 (td, J = 1.6, 8.8 Hz, 1H), 3.97 (d, J =
12.8 Hz, 2H), 3.32 - 3.25 (m, 1H), 3.01 (brs, 2H), 2.11 (d, J = 10.8 Hz, 2H),
1.75 - 1.65 (m, 2H), 1.42 (s, 9H).
中間体106:tert−ブチル4−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
436.2; 実測値: 436.6.
中間体107:メチル3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)プロパノエート
[M+H]+のLC-MS: 計算値479.1;
実測値: 479.6. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 8.21 (s, 1H), 8.16 (d, J = 8.1 Hz, 2H), 8.04
(s, 1H), 7.93-7.59 (m, 7H), 7.23 (td, J = 9.0, 1.8 Hz, 1H), 3.62 (s, 3H), 3.24
(t, J = 9.2 Hz, 2H), 2.94 (t, J = 9.2 Hz, 2H).
中間体108:3−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)プロパン酸
[M+H]+のLC-MS: 計算値
325.1; 実測値: 325.3.
中間体109:2−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)アセトアミドおよび2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)アセトアミド
[M+H]+のLC-MS: 計算値
449.1; 実測値: 448.8.
中間体110:エチル3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパノエート
[M+H]+のLC-MS: 計算値492.1;
実測値: 491.8. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 8.16-8.13 (m, 4H), 8.08 (s, 1H), 7.91 - 7.87
(m, 1H), 7.85 - 7.79 (m, 2H), 7.75 - 7.70 (m, 2H), 7.66 - 7.61 (m, 2H), 7.25
(td, J = 9.2, 2.4 Hz, 1H), 4.68 (t, J = 6.4 Hz, 2H), 4.00 (q, J = 7.2 Hz, 2H),
2.95 (t, J = 6.4 Hz, 2H), 1.10 (t, J = 7.2 Hz, 3H).
中間体111:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパン酸
[M+H]+のLC-MS: 計算値 324.1;
実測値: 323.9.
中間体112:tert−ブチル4−(3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパノイル)ピペラジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
492.2; 実測値: 491.9.
中間体113:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)インドリン−2−オン
7.63 (m, 3H), 7.61 - 7.56 (m, 1H), 7.54 - 7.45 (m, 2H), 7.31 (d, J = 7.7 Hz,
1H), 7.22 (dd, J = 7.7, 1.5 Hz, 1H), 7.10 - 7.01 (m, 2H), 3.59 (s, 2H).
中間体114:3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)プロパンアミドおよび3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)プロパンアミド
[M+H]+のLC-MS: 計算値
463.1; 実測値: 462.8.
中間体115:5−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)インドリン−2−オン
中間体116:1−ベンゼンスルホニル−6−フルオロ−1’,3’−ジヒドロ−1H−[3,5’]ビインドリル−2’−オン
405.4. 1H NMR (400 MHz, DMSO) δ 10.49
(s, 1H), 8.12 (d, J = 7.6 Hz, 2H), 8.01 (s, 1H), 7.86 - 7.76 (m, 2H), 7.72 (t,
J = 7.5 Hz, 1H), 7.62 (t, J = 7.7 Hz, 2H), 7.55 (s, 1H), 7.51 (d, J = 7.9 Hz,
1H), 7.22 (td, J = 9.1, 2.3 Hz, 1H), 6.91 (d, J = 8.0 Hz, 1H), 3.54 (s, 2H).
中間体117:6−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)ベンゾ[d]オキサゾール−2−アミン
[M+H]+のLC-MS: 計算値261.1;
実測値: 261.4. 1H NMR (300 MHz, DMSO-d6)
δ [ppm]: 7.58 (s, 2H), 7.48 (s, 1H), 7.46 - 7.43 (m,
1H), 7.18 (d, J = 7.8 Hz, 1H), 1.29 (s, 12H).
中間体118:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−アミン
[M+H]+のLC-MS: 計算値
408.1; 実測値: 408.5.
中間体119:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)エテンスルホンアミド
[M+H]+のLC-MS: 計算値
372.1; 実測値: 372.5.
中間体120:6−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−2−ビニルベンゾ[d]オキサゾール
1H NMR
(400 MHz, CDCl3) δ [ppm]: 7.95 (s, 1H), 7.78
(d, J = 8.0 Hz, 1H), 7.69 (d, J = 8.0 Hz, 1H), 6.76 (dd, J = 17.6, 11.2 Hz,
1H), 6.50 (dd, J = 17.6, 0.8 Hz, 1H), 5.88 (dd, J = 11.6, 0.8 Hz, 1H), 1.37 (s,
12 H).
中間体121:tert−ブチル6−フルオロ−3−(2−ビニルベンゾ[d]オキサゾール−6−イル)−1H−インドール−1−カルボキシレート
7.76 - 7.70 (m, 3H), 7.59 (dd, J = 8.0, 1.6 Hz, 1H), 7.07 (td, J = 8.8, 2.4 Hz,
1H), 6.79 (dd, J = 17.6, 11.2 Hz, 1H), 6.50 (dd, J = 17.6, 0.8 Hz, 1H), 5.89
(dd, J = 11.2, 0.8 Hz, 1H), 1.70 (s, 9H).
中間体122:tert−ブチル6−フルオロ−3−(2−(2−(メチルチオ)エチル)ベンゾ[d]オキサゾール−6−イル)−1H−インドール−1−カルボキシレート
8.0, 1.2 Hz, 1H), 7.06 (td, J = 8.8, 2.4 Hz, 1H), 3.29 (t, J = 7.6 Hz, 2H),
3.06 (t, J = 7.6 Hz, 2H), 2.20 (s, 3H), 1.70 (s, 9H).
中間体123:tert−ブチル6−フルオロ−3−(2−(2−(メチルスルホニル)エチル)ベンゾ[d]オキサゾール−6−イル)−1H−インドール−1−カルボキシレート
[M+H]+のLC-MS: 計算値459.1;
実測値: 459.6. 1H NMR (300 MHz, CDCl3)
δ [ppm]: 7.96 (d, J = 8.7 Hz, 1H), 7.78-7.68 (m, 4H),
7.59 (dd, J = 8.4, 1.5 Hz, 1H), 7.07 (td, J = 9.0, 2.4 Hz, 1H), 3.70 (t, J =
7.8 Hz, 2H), 3.54 (t, J = 7.8 Hz, 2H), 3.03 (s, 3H), 1.70 (s, 9H).
中間体124:N−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンスルホンアミド
[M-H]-のLC-MS: 計算値
484.1; 実測値: 484.4.
中間体125:2−(2−クロロエチル)−6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール
[M +H]+のLC-MS: 計算値454.1;
実測値: 455.5. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 7.95 (d, J = 7.9 Hz, 2H), 7.81 (dd, J = 9.2,
1.6 Hz, 1H), 7.77 (d, J = 8.0 Hz, 1H), 7.73 -7.66 (m, 3H), 7.59 (t, J = 7.3 Hz,
1H), 7.54-7.48 (m, 3H), 7.07 (td, J = 9.2, 2.4 Hz, 1H), 4.04 (t, J = 6.8Hz,
2H), 3.45 (t, J = 6.8 Hz, 2H).
中間体126:6−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)ベンゾ[d]オキサゾール
246.4. 1H NMR (300 MHz, CDCl3) δ 8.15 (s, 1H), 8.05 (s, 1H), 7.84 (dd, J = 8.0, 0.8 Hz, 1H), 7.80
(dd, J = 8.0, 0.5 Hz, 1H), 1.39 (s, 12H).
中間体127:6−(1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
375.1; 実測値: 375.5.
中間体128:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−ビニルベンゾ[d]オキサゾール
419.6. 1H NMR (400 MHz, CDCl3) δ [ppm]: 7.95 (d, J = 7.4 Hz, 2H), 7.85 - 7.74 (m, 2H), 7.72 (q, J =
5.1 Hz, 3H), 7.60 (t, J = 7.5 Hz, 1H), 7.57 - 7.45 (m, 3H), 7.08 (td, J = 8.9,
2.4 Hz, 1H), 6.78 (dd, J = 17.6, 11.1 Hz, 1H), 6.51 (d, J = 17.6 Hz, 1H), 5.90
(d, J = 11.2 Hz, 1H).
中間体129:5−(6−クロロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール
C21H13ClN2O3S+H+
[M+H]+のLC-MS: 計算値409.0;
実測値: 409.5. 1H NMR (300 MHz, DMSO-d6)
δ [ppm]: 8.82 (s, 1H), 8.26 (s, 1H), 8.16 (s, 1H), 8.13
(d, J = 1.5 Hz, 2H), 8.03 (d, J = 1.8 Hz, 1H), 7.88 (m, 2H), 7.85 (dd, J = 8.4,
1.7 Hz, 1H), 7.73 (d, J = 7.5 Hz, 1H), 7.64 (t, J = 7.6 Hz, 2H), 7.41 (dd, J =
8.6, 1.9 Hz, 1H).
中間体130:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−チオール
[M-H]-のLC-MS: 計算値
423.1; 実測値: 423.3.
中間体131:tert−ブチル4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)ピペリジン−1−カルボキシレート
[M+H]+のLC-MS: 計算値
590.2; 実測値: 590.2.
中間体132:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
490.2; 実測値: 490.2.
中間体133:tert−ブチルメチルスルホニル((6−(1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)カルバメート
[M+H]+のLC-MS: 計算値582.1; 実測値: 582.7. 1H NMR
(400 MHz, DMSO-d6) δ [ppm]:8.22 (s, 1H),
8.13 (d, J = 1.1 Hz, 1H), 8.11 (s, 1H), 8.09 (d, J = 1.3 Hz, 1H), 8.05 (d, J =
8.3 Hz, 1H), 7.89 (d, J = 7.9 Hz, 1H), 7.85 (d, J = 8.3 Hz, 1H), 7.76 (dd, J =
8.3, 1.5 Hz, 1H), 7.73 - 7.68 (m, 1H), 7.61 (t, J = 7.7 Hz, 2H), 7.47 - 7.42
(m, 1H), 7.39 - 7.34 (m, 1H), 5.17 (s, 2H), 3.57 (s, 3H), 1.43 (s, 9H).
中間体134:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−メトキシベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値423.1;
実測値: 423.6. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 7.95 (s, 1H), 7.92 (d, J = 1.6 Hz, 1H), 7.80
(dd, J = 9.6, 2.4 Hz, 1H), 7.72 - 7.67 (m, 1H), 7.66 (s, 1H), 7.60 - 7.54 (m,
3H), 7.52 - 7.48 (m,2H), 7.45 (dd, J = 8.0, 1.6 Hz, 1H), 7.06(td, J = 9.2, 2.4
Hz, 1H), 4.26 (s, 3H).
中間体135:tert−ブトキシカルボニルアミノ{[6−(6−フルオロインドール−3−イル)ベンゾオキサゾール−2−イル]メチル}スルホンアミド
[M+H]+のLC-MS: 計算値461.1;
実測値: 461.6. 1H NMR (400 MHz, DMSO) δ 11.48 (s, 1H), 11.02 (s, 1H), 8.55 (t, J = 6.0 Hz, 1H), 7.92 (d, J
= 1.0 Hz, 1H), 7.87 (dd, J = 8.8, 5.4 Hz, 1H), 7.80 - 7.70 (m, 2H), 7.69 (dd, J
= 8.3, 1.5 Hz, 1H), 7.24 (dd, J = 9.9, 2.4 Hz, 1H), 6.97 (td, J = 9.6, 2.4 Hz,
1H), 4.49 (d, J = 6.0 Hz, 2H), 1.34 (s, 9H).
中間体136:5−(1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール
C21H14N2O3S+H+
[M+H]+のLC-MS: 計算値375.1;
実測値: 375.4
1H NMR
(300 MHz, DMSO-d6) δ [ppm]: 8.81 (s, 1H),
8.17 (s, 1H), 8.15 - 8.07 (m, 3H), 8.04 (d, J = 8.2 Hz, 1H), 7.90 - 7.81 (m,
2H), 7.79 (dd, J = 8.4, 1.8 Hz, 1H), 7.70 - 7.58 (m, 3H), 7.43 - 7.38 (m, 1H),
7.37-7.35 (m, 1H).
中間体137:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−((1−(メチルスルホニル)ピペリジン−4−イル)メチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値
568.1; 実測値: 568.1.
中間体138:6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−((1−メチルピペリジン−4−イル)メチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値504.2;
実測値: 504.2.
中間体139:N−(2,4−ジブロモフェニル)−2−(2,5−ジオキソイミダゾリジン−4−イル)アセトアミド
[M+H]+のLC-MS: 計算値389.9;
実測値: 389.6. 1H NMR (300 MHz, DMSO-d6)
δ [ppm]: 10.62 (br s, 1H), 9.64 (br s, 1H), 7.90 ( s,
2H), 7.64 - 7.56 (m, 2 H), 4.31 (td, J = 6.6, 4.2 Hz, 1H), 2.89 - 2.83 (m, 1H),
2.75 -2.50 (m, 1H).
中間体140:5−((6−ブロモベンゾ[d]オキサゾール−2−イル)メチル)イミダゾリジン−2,4−ジオン
[M-H]-のLC-MS: 計算値
308.0; 実測値: 307.8.
中間体141:tert−ブチル3−(2−((2,5−ジオキソイミダゾリジン−4−イル)メチル)ベンゾ[d]オキサゾール−6−イル)−6−フルオロ−1H−インドール−1−カルボキシレート
C24H21FN4O5+H+
[M+H]+のLC-MS: 計算値465.2;
実測値: 464.8. 1H NMR (400 MHz, MeOH-d4)
δ [ppm]: 7.94 (dd, J = 10.1, 2.3 Hz, 1H), 7.86 (d, J =
1.6 Hz, 1H), 7.81 (s, 1H). 7.80 (dd, J = 8.7, 5.4 Hz, 1H), 7.76 (d, J = 8.4 Hz,
1H), 7.66 (dd, J = 8.4, 1.6 Hz, 1H), 7.11 (ddd, J = 9.6, 8.7, 2.3 Hz, 1H), 4.70
(dd, J = 7.2, 4.6 Hz, 1H), 3.54 (dd, J = 16.3, 4.6 Hz, 1H), 3.40 (dd, J = 16.3,
7.2 Hz, 1H), 1.71 (s, 9H).
中間体142:6−(5−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2(3H)−オン
[M-H]-のLC-MS: 計算値407.1;
実測値: 407.5. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.79 (s, 1H), 8.19 (s, 1H), 8.08 (d, J = 7.6
Hz, 2H), 8.03 (dd, J = 9.1, 4.5 Hz, 1H), 7.75 - 7.67 (m, 2H), 7.65 - 7.57 (m,
3H), 7.50 (dd, J = 8.0, 1.2 Hz, 1H), 7.28 (td, J = 9.1, 2.5 Hz, 1H), 7.18 (d, J
= 8.1 Hz, 1H).
中間体143:2−(6−(5−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド
[M-H]-のLC-MS: 計算値464.1;
実測値:464.4. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 8.22 (s, 1H), 8.13 - 8.07 (m, 2H), 8.04 (dd, J
= 9.2, 4.4 Hz, 1H), 7.82 - 7.75 (m, 2H), 7.72 (t, J = 7.2 Hz, 1H), 7.66 - 7.55
(m, 4H), 7.40 (s, 1H), 7.33 - 7.26 (m, 2H), 4.50 (s, 2H).
中間体144:ジメチル4−(1−(tert−ブトキシカルボニル)−6−フルオロ−1H−インドール−3−イル)フタレート
428.6. 1H NMR (400 MHz, CDCl3) δ [ppm] : 7.97 (d, J = 10.0 Hz, 1H), 7.91 (d, J = 2.0 Hz, 1H), 7.88
(d, J = 8.4 Hz, 1H), 7.78 (dd, J = 8.0, 2.0 Hz, 1H),7.77(s, 1H), 7.70 (dd, J =
8.8, 5.2 Hz, 1H), 7.07 (td, J = 8.8, 2.4 Hz, 1H), 3.95 (s, 3H), 3.94 (s, 3H),
1.70 (s, 9H).
中間体145:4−(6−フルオロ−1H−インドール−3−イル)フタル酸
298.4. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 12.99 (brs, 2H), 11.64 (s, 1H), 7.92 (d, J = 2.4 Hz, 1H),
7.88 (dt, J = 6.6, 3.0 Hz, 3H), 7.79 (d, J = 8.0 Hz, 1H), 7.25 (dd, J = 10.0,
2.4 Hz, 1H), 7.01 (td, J = 9.4, 2.4 Hz, 1H).
中間体146:tert−ブチル3−(2−(tert−ブトキシカルボニル)イソインドリン−5−イル)−6−フルオロ−1H−インドール−1−カルボキシレート
[M+H-56]+のLC-MS: 計算値397.2;
実測値: 397.6. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 7.97 - 7.93 (m, 1H), 7.74 - 7.59 (m, 2H),
7.53-7.45(m, 2H), 7.37-7.28 (m, 1H), 7.07 - 7.02 (m, 1H), 4.76 - 4.71 (m, 4H),
1.69 (s, 9H), 1.54 (s, 9H).
中間体147:tert−ブチル3−(1,1−ジオキシド−2,3−ジヒドロベンゾ[d]イソチアゾール−6−イル)−6−フルオロ−1H−インドール−1−カルボキシレート
7.92 - 7.83 (m, 3H), 7.67 (d, J = 8.1 Hz, 1H), 7.24 (td, J = 9.0, 1.5 Hz, 1H),
4.46 (s, 2H), 1.66 (s, 9H).
中間体148:4−(1−(tert−ブトキシカルボニル)−6−フルオロ−1H−インドール−3−イル)−2−(N−メチルスルファモイル)安息香酸
Hz, 1H), 2.39 (s, 3H), 1.66 (s, 9H).
中間体149:tert−ブチル6−フルオロ−3−(2−オキソ−2,3−ジヒドロベンゾ[d]オキサゾール−6−イル)−1H−インドール−1−カルボキシレート
7.46 (s, 1H), 7.42 (dd, J = 8.0, 1.6 Hz, 1H), 7.16 (d, J = 8.0 Hz, 1H), 7.06
(td, J = 8.8, 2.4 Hz, 1H), 3.71 (s, 1H), 1.70 (s, 9H).
中間体150:tert−ブチル3−(3−(1−(tert−ブトキシカルボニル)ピペリジン−4−イル)−2−オキソ−2,3−ジヒドロベンゾ[d]オキサゾール−6−イル)−6−フルオロ−1H−インドール−1−カルボキシレート
[M+H]+のLC-MS: 計算値552.2;
実測値: 552.8. 1H NMR (400 MHz, CDCl3)
δ [ppm]: 7.94 (d, J = 10.0 Hz, 1H), 7.69 - 7.61 (m,
2H), 7.46 (s, 1H), 7.40 (dd, J = 8.0, 2.0 Hz, 1H), 7.18 (d, J = 8.0 Hz, 1H),
7.06 (td, J = 8.8, 2.4 Hz, 1H), 4.43 - 4.30 (m, 3H), 2.95 - 2.83 (m, 2H), 2.36
- 2.24 (m, 2H), 1.95 - 1.88 (m, 2H), 1.70 (s, 9H), 1.51 (s, 9H).
中間体151:tert−ブチル6−フルオロ−3−(2−メチル−1,1−ジオキシド−3−オキソ−2,3−ジヒドロベンゾ[d]イソチアゾール−5−イル)−1H−インドール−1−カルボキシレート
(m, 2H), 7.28 (td, J = 9.2, 2.4 Hz, 1H), 3.21 (s, 3H), 1.67 (s, 9H).
中間体152:tert−ブチル6−(2−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)エチル)−2,6−ジアザスピロ[3.3]ヘプタン−2−カルボキシレート
中間体153:tert−ブチル3−(ベンゾフラン−6−イル)−6−フルオロ−1H−インドール−1−カルボキシレート
3H),7.50 (dd, J = 8.0 Hz,1.6Hz, 1H),7.06 (dd, J = 8.8, 2.4 Hz, 1H), 6.82
(d, J = 1.0 Hz, 1H), 1.70 (s, 9H).
I.2.最終化合物の合成
化合物1:6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール
MeOH(15mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体4;390mg;1.00mmol)の溶液に、水(2mL)中のNaOH(200mg;5.00mmol)の溶液を添加した。反応混合物を80℃で2時間撹拌し、濃縮し、シリカゲルクロマトグラフィー(石油エーテル/EtOAc=5/1〜2/1)により精製して、50mg(20%)の表題化合物を白色固体として得た。C15H10FN3+H+ [M+H]+のLC-MS: 計算値252.1; 実測値:
252.1. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 12.94 (s, 1H), 11.45 (s, 1H), 8.05 (s, 1H), 7.88 (dd, J =
8.8, 5.4 Hz, 1H), 7.79 (d, J = 8.4 Hz, 1H), 7.77 - 7.73 (m, 2H), 7.44 (d, J =
8.4 Hz, 1H), 7.24 (dd, J = 10.0, 2.2 Hz, 1H), 6.99 (ddd, J = 9.3, 8.8, 2.2 Hz,
1H).
化合物1:6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール
MeOH(15mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体4;390mg;1.00mmol)の溶液に、水(2mL)中のNaOH(200mg;5.00mmol)の溶液を添加した。反応混合物を80℃で2時間撹拌し、濃縮し、シリカゲルクロマトグラフィー(石油エーテル/EtOAc=5/1〜2/1)により精製して、50mg(20%)の表題化合物を白色固体として得た。C15H10FN3+H+ [M+H]+のLC-MS: 計算値252.1; 実測値:
252.1. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 12.94 (s, 1H), 11.45 (s, 1H), 8.05 (s, 1H), 7.88 (dd, J =
8.8, 5.4 Hz, 1H), 7.79 (d, J = 8.4 Hz, 1H), 7.77 - 7.73 (m, 2H), 7.44 (d, J =
8.4 Hz, 1H), 7.24 (dd, J = 10.0, 2.2 Hz, 1H), 6.99 (ddd, J = 9.3, 8.8, 2.2 Hz,
1H).
化合物2:2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)アセトアミド
DMF(16.5mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体4;300mg;0.77mmol)、2−ブロモアセトアミド(1.05g;7.61mmol)、KI(290mg;1.75mmol)、K2CO3(986mg;7.13mmol)の混合物を、窒素下60℃で48時間撹拌した。混合物を室温に冷却し、EtOAc(100mL)で希釈し、濾過し、濃縮し、分取HPLCにより精製して、25mg(11%)の表題化合物を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.46 (s, 1H), 8.03 (s, 1H), 7.96 (dd, J = 8.7, 5.4 Hz, 1H),
7.80 - 7.77 (m, 2H), 7.76 - 7.73 (m, 2H), 7.55 (br s, 1H), 7.46 (dd, J = 8.3,
1.3 Hz, 1H), 7.26 (br s, 1H), 7.22 (dd, J = 9.9, 2.4 Hz, 1H), 6.96 (ddd, J =
9.6, 8.8, 2.4, 1H), 5.11 (s, 2H).
DMF(16.5mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体4;300mg;0.77mmol)、2−ブロモアセトアミド(1.05g;7.61mmol)、KI(290mg;1.75mmol)、K2CO3(986mg;7.13mmol)の混合物を、窒素下60℃で48時間撹拌した。混合物を室温に冷却し、EtOAc(100mL)で希釈し、濾過し、濃縮し、分取HPLCにより精製して、25mg(11%)の表題化合物を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.46 (s, 1H), 8.03 (s, 1H), 7.96 (dd, J = 8.7, 5.4 Hz, 1H),
7.80 - 7.77 (m, 2H), 7.76 - 7.73 (m, 2H), 7.55 (br s, 1H), 7.46 (dd, J = 8.3,
1.3 Hz, 1H), 7.26 (br s, 1H), 7.22 (dd, J = 9.9, 2.4 Hz, 1H), 6.96 (ddd, J =
9.6, 8.8, 2.4, 1H), 5.11 (s, 2H).
化合物3:6−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール塩酸塩
6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール塩酸塩および6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール塩酸塩(中間体6;136mg;0.26mmol)から出発し、化合物1で概説した一般的方法に従って、緩衝剤として0.1%HClを用いる分取HPLCによる精製後に、3mg(3%)の表題化合物を黄色固体として得た。C21H21FN4+H+ [M+H]+のLC-MS: 計算値349.2; 実測値:
349.0. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.52 (s, 1H), 9.26 (br s, 1H), 8.90 (br s, 1H), 8.39 (s,
1H), 7.87 (dd, J = 8.8, 5.4 Hz, 1H), 7.80 (s, 1H), 7.77 - 771 (m, 2H), 7.41 (d,
J = 8.6 Hz, 1H), 7.24 (d, J = 9.9, 2.3 Hz, 1H), 6.97 (ddd, J = 9.4, 8.8, 2.3
Hz, 1H), 4.38 (d, J = 6.9 Hz, 2H), 3.18 - 3.18 (m, 2H), 2.91 - 2.72 (m, 2H),
2.38 - 2.22 (m, 1H), 1.73 - 1.59 (m, 2H), 1.58 - 1.40 (m, 2H).
6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール塩酸塩および6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール塩酸塩(中間体6;136mg;0.26mmol)から出発し、化合物1で概説した一般的方法に従って、緩衝剤として0.1%HClを用いる分取HPLCによる精製後に、3mg(3%)の表題化合物を黄色固体として得た。C21H21FN4+H+ [M+H]+のLC-MS: 計算値349.2; 実測値:
349.0. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.52 (s, 1H), 9.26 (br s, 1H), 8.90 (br s, 1H), 8.39 (s,
1H), 7.87 (dd, J = 8.8, 5.4 Hz, 1H), 7.80 (s, 1H), 7.77 - 771 (m, 2H), 7.41 (d,
J = 8.6 Hz, 1H), 7.24 (d, J = 9.9, 2.3 Hz, 1H), 6.97 (ddd, J = 9.4, 8.8, 2.3
Hz, 1H), 4.38 (d, J = 6.9 Hz, 2H), 3.18 - 3.18 (m, 2H), 2.91 - 2.72 (m, 2H),
2.38 - 2.22 (m, 1H), 1.73 - 1.59 (m, 2H), 1.58 - 1.40 (m, 2H).
化合物4:1−(4−((6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−イル)エタノン
1−(4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−イル)エタノン(中間体7;267mg;0.50mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、12mg(6%)の表題化合物を白色固体として得た。C23H23FN4O-H- [M-H]-のLC-MS: 計算値389.2; 実測値:
389.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.51 (s, 1H), 8.05 (s, 1H), 7.95 (dd, J = 8.8, 5.4 Hz, 1H),
7.87 (s, 1H), 7.80 - 7.76 (m, 2H), 7.47 (d, J = 8.4 Hz, 1H), 7.25 (dd, J = 9.9,
2.0 Hz, 1H), 6.99 (ddd, J = 9.4, 8.8, 2.0 Hz, 1H), 4.40 - 4.30 (m, 3H), 3.82 -
3.73 (m, 1H), 2.99 - 2.89 (m, 1H), 2.50 - 2.40 (m, 1H), 2.26 - 2.14 (m, 1H),
1.95 (s, 3H), 1.56 - 1.44 (m, 2H), 1.30 - 1.16 (m, 2H).
1−(4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−イル)エタノン(中間体7;267mg;0.50mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、12mg(6%)の表題化合物を白色固体として得た。C23H23FN4O-H- [M-H]-のLC-MS: 計算値389.2; 実測値:
389.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.51 (s, 1H), 8.05 (s, 1H), 7.95 (dd, J = 8.8, 5.4 Hz, 1H),
7.87 (s, 1H), 7.80 - 7.76 (m, 2H), 7.47 (d, J = 8.4 Hz, 1H), 7.25 (dd, J = 9.9,
2.0 Hz, 1H), 6.99 (ddd, J = 9.4, 8.8, 2.0 Hz, 1H), 4.40 - 4.30 (m, 3H), 3.82 -
3.73 (m, 1H), 2.99 - 2.89 (m, 1H), 2.50 - 2.40 (m, 1H), 2.26 - 2.14 (m, 1H),
1.95 (s, 3H), 1.56 - 1.44 (m, 2H), 1.30 - 1.16 (m, 2H).
化合物5:3−(6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド
3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド(中間体8;95mg;0.21mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(EtOAc)による精製後に、35mg(53%)の表題化合物を白色固体として得た。
C18H15FN4O+H+
[M+H]+のLC-MS: 計算値323.1;
実測値: 323.1. 1H NMR (300 MHz, DMSO-d6)
δ [ppm]: 11.48 (s, 1H), 8.05 (dd, J = 8.8, 5.6 Hz, 1H),
8.03 (s, 1H), 7.89 (s, 1H), 7.79 - 7.73 (m, 2H), 7.45 (d, J = 8.4 Hz, 1H), 7.40
(br s, 1H), 7.24 (dd, J = 9.9, 2.2 Hz, 1H), 6.99 (ddd, J = 9.4, 8.8, 2.2 Hz,
1H), 6.87 (br s, 1H), 4.64 (t, J = 6.6 Hz, 2H), 2.70 (t, J = 6.6 Hz, 2H).
3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド(中間体8;95mg;0.21mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(EtOAc)による精製後に、35mg(53%)の表題化合物を白色固体として得た。
C18H15FN4O+H+
[M+H]+のLC-MS: 計算値323.1;
実測値: 323.1. 1H NMR (300 MHz, DMSO-d6)
δ [ppm]: 11.48 (s, 1H), 8.05 (dd, J = 8.8, 5.6 Hz, 1H),
8.03 (s, 1H), 7.89 (s, 1H), 7.79 - 7.73 (m, 2H), 7.45 (d, J = 8.4 Hz, 1H), 7.40
(br s, 1H), 7.24 (dd, J = 9.9, 2.2 Hz, 1H), 6.99 (ddd, J = 9.4, 8.8, 2.2 Hz,
1H), 6.87 (br s, 1H), 4.64 (t, J = 6.6 Hz, 2H), 2.70 (t, J = 6.6 Hz, 2H).
化合物6:6−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール
6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール塩酸塩および6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール塩酸塩(中間体10;700mgの粗製物;1.37mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、12.3mg(3%)の表題化合物を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.2; 実測値:
334.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.49 (s, 1H), 8.04 (s, 1H), 7.94 (dd, J = 9.0, 5.4 Hz, 1H),
7.88 (s, 1H), 7.80 - 7.75 (m, 2H), 7.46 (dd, J = 8.4, 1.3 Hz, 1H), 7.25 (dd, J
= 9.8, 2.4 Hz, 1H), 6.99 (ddd, J = 9.7, 8.9, 2.4 Hz, 1H), 4.87 - 4.75 (m, 1H),
3.20 - 3.10 (m, 2H), 2.86 - 2.75 (m, 2H), 2.10 - 2.00 (m, 2H), 2.00 - 1.92 (m,
2H).
6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール塩酸塩および6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール塩酸塩(中間体10;700mgの粗製物;1.37mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、12.3mg(3%)の表題化合物を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.2; 実測値:
334.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.49 (s, 1H), 8.04 (s, 1H), 7.94 (dd, J = 9.0, 5.4 Hz, 1H),
7.88 (s, 1H), 7.80 - 7.75 (m, 2H), 7.46 (dd, J = 8.4, 1.3 Hz, 1H), 7.25 (dd, J
= 9.8, 2.4 Hz, 1H), 6.99 (ddd, J = 9.7, 8.9, 2.4 Hz, 1H), 4.87 - 4.75 (m, 1H),
3.20 - 3.10 (m, 2H), 2.86 - 2.75 (m, 2H), 2.10 - 2.00 (m, 2H), 2.00 - 1.92 (m,
2H).
化合物7:1−(4−(6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−イル)エタノン
DCM(30mL)中の6−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール(化合物6;300mg;0.90mmol)およびEt3N(5.0mL;36mmol)の溶液に、AcCl(84.6mg;1.08mmol)を窒素下で添加した。混合物を1時間撹拌し、飽和NaHCO3水溶液(30mL)でクエンチした。水層をDCM(60mL×2)で抽出した。合わせた有機層をブライン(20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、濃縮し、分取HPLCにより精製して、15mg(4%)の表題化合物を黄色固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.2; 実測値:
376.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.49 (s, 1H), 8.05 (s, 1H), 7.96 (dd, J = 8.8, 5.4 Hz, 1H),
7.91 (s, 1H), 7.81 - 7.76 (m, 2H), 7.47 (dd, J = 8.4, 1.2 Hz, 1H), 7.25 (dd, J
= 9.9, 2.4 Hz, 1H), 6.99 (ddd, J = 9.6, 8.8, 2.4 Hz, 1H), 5.08 - 4.95 (m, 1H),
4.58 - 4.48 (m, 1H), 4.03 - 3.93 (m, 1H), 3.33 - 3.27 (m, 1H), 2.90 - 2.78 (m,
1H), 2.07 (s, 3H), 2.10 - 1.88 (m, 4H).
DCM(30mL)中の6−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール(化合物6;300mg;0.90mmol)およびEt3N(5.0mL;36mmol)の溶液に、AcCl(84.6mg;1.08mmol)を窒素下で添加した。混合物を1時間撹拌し、飽和NaHCO3水溶液(30mL)でクエンチした。水層をDCM(60mL×2)で抽出した。合わせた有機層をブライン(20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、濃縮し、分取HPLCにより精製して、15mg(4%)の表題化合物を黄色固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.2; 実測値:
376.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.49 (s, 1H), 8.05 (s, 1H), 7.96 (dd, J = 8.8, 5.4 Hz, 1H),
7.91 (s, 1H), 7.81 - 7.76 (m, 2H), 7.47 (dd, J = 8.4, 1.2 Hz, 1H), 7.25 (dd, J
= 9.9, 2.4 Hz, 1H), 6.99 (ddd, J = 9.6, 8.8, 2.4 Hz, 1H), 5.08 - 4.95 (m, 1H),
4.58 - 4.48 (m, 1H), 4.03 - 3.93 (m, 1H), 3.33 - 3.27 (m, 1H), 2.90 - 2.78 (m,
1H), 2.07 (s, 3H), 2.10 - 1.88 (m, 4H).
化合物8:5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体12;270mgの粗製物;0.45mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、40mg(32%)の表題化合物を黄色固体として得た。C15H10FN3+H+ [M+H]+のLC-MS: 計算値252.1; 実測値:
252.1. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 13.02 (s, 1H), 11.34 (s, 1H), 8.08 (s, 1H), 7.99 (s, 1H),
7.86 (dd, J = 8.8, 5.4 Hz, 1H), 7.66 (dd, J = 9.0, 1.5 Hz, 1H), 7.64 (d, J =
1.5 Hz, 1H), 7.59 (d, J = 9.0 Hz, 1H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.95
(ddd, J = 9.7, 8.8, 2.4 Hz, 1H).
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体12;270mgの粗製物;0.45mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、40mg(32%)の表題化合物を黄色固体として得た。C15H10FN3+H+ [M+H]+のLC-MS: 計算値252.1; 実測値:
252.1. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 13.02 (s, 1H), 11.34 (s, 1H), 8.08 (s, 1H), 7.99 (s, 1H),
7.86 (dd, J = 8.8, 5.4 Hz, 1H), 7.66 (dd, J = 9.0, 1.5 Hz, 1H), 7.64 (d, J =
1.5 Hz, 1H), 7.59 (d, J = 9.0 Hz, 1H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.95
(ddd, J = 9.7, 8.8, 2.4 Hz, 1H).
化合物9:2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)アセトアミド
2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)アセトアミドおよび2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)アセトアミド(中間体13;353mg;0.79mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCおよびキラル分取HPLCによる精製後に、34.1mg(14%)の表題化合物を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.39 (s, 1H), 8.08 (s, 1H), 7.99 (s, 1H), 7.87 (dd, J =
8.8, 5.3 Hz, 1H), 7.72 - 7.61 (m, 3H), 7.58 (br s, 1H), 7.30 (br s, 1H), 7.23
(dd, J = 10.0, 2.3 Hz, 2H), 6.99 (dd, J = 9.5, 8.8, 2.3 Hz, 1H), 5.08 (s, 2H).
2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)アセトアミドおよび2−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)アセトアミド(中間体13;353mg;0.79mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCおよびキラル分取HPLCによる精製後に、34.1mg(14%)の表題化合物を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.39 (s, 1H), 8.08 (s, 1H), 7.99 (s, 1H), 7.87 (dd, J =
8.8, 5.3 Hz, 1H), 7.72 - 7.61 (m, 3H), 7.58 (br s, 1H), 7.30 (br s, 1H), 7.23
(dd, J = 10.0, 2.3 Hz, 2H), 6.99 (dd, J = 9.5, 8.8, 2.3 Hz, 1H), 5.08 (s, 2H).
化合物10:5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール
1,4−ジオキサン中飽和HCl(20mL)中のtert−ブチル4−((5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−カルボキシレート(中間体15;1.18g;2.63mmol)の溶液を、室温で1時間撹拌した。反応混合物を真空中で濃縮し、水(100mL)で希釈し、EtOAc(50mL×3)で抽出した。水層をNaOH水溶液でpH=13に塩基性化し、EtOAc(100mL×3)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過し、濃縮し、分取TLC(DCM/MeOH=8/1)により精製して、31mg(33%)の表題化合物を黄色固体として得た。C21H21FN4+H+ [M+H]+のLC-MS: 計算値349.2; 実測値:
349.0. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.42 (s, 1H), 8.60 (br s, 1H), 8.09 (s, 1H), 8.00 (s, 1H),
7.86 (dd, J = 8.8, 5.3 Hz, 1H), 7.79 - 7.65 (m, 3H), 7.30 (dd, J = 10.0, 2.4
Hz, 1H), 6.96 (ddd, J = 9.6, 8.8, 2.4 Hz, 1H), 4.38 (d, J = 6.7 Hz, 2H), 3.26 -
3.15 (m, 2H), 2.86 - 2.71 (m, 2H), 2.30 - 2.13 (m, 1H), 1.72 - 1.60 (m, 2H),
1.55 - 1.36 (m, 2H).
1,4−ジオキサン中飽和HCl(20mL)中のtert−ブチル4−((5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−カルボキシレート(中間体15;1.18g;2.63mmol)の溶液を、室温で1時間撹拌した。反応混合物を真空中で濃縮し、水(100mL)で希釈し、EtOAc(50mL×3)で抽出した。水層をNaOH水溶液でpH=13に塩基性化し、EtOAc(100mL×3)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過し、濃縮し、分取TLC(DCM/MeOH=8/1)により精製して、31mg(33%)の表題化合物を黄色固体として得た。C21H21FN4+H+ [M+H]+のLC-MS: 計算値349.2; 実測値:
349.0. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.42 (s, 1H), 8.60 (br s, 1H), 8.09 (s, 1H), 8.00 (s, 1H),
7.86 (dd, J = 8.8, 5.3 Hz, 1H), 7.79 - 7.65 (m, 3H), 7.30 (dd, J = 10.0, 2.4
Hz, 1H), 6.96 (ddd, J = 9.6, 8.8, 2.4 Hz, 1H), 4.38 (d, J = 6.7 Hz, 2H), 3.26 -
3.15 (m, 2H), 2.86 - 2.71 (m, 2H), 2.30 - 2.13 (m, 1H), 1.72 - 1.60 (m, 2H),
1.55 - 1.36 (m, 2H).
化合物11:1−(4−((5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−イル)エタノン
5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール(化合物10;204mg;0.59mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、65mg(28%)の表題化合物を白色固体として得た。C23H23FN4O+H+ [M+H]+のLC-MS: 計算値391.2; 実測値:
390.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.38 (s, 1H), 8.08 (s, 1H), 7.99 (s, 1H), 7.87 (dd, J =
8.9, 5.5 Hz, 1H), 7.76 (d, J = 8.8 Hz, 1H), 7.71 - 7.66 (m, 2H), 7.22 (dd, J =
10.0, 2.4 Hz, 1H), 6.96 (ddd, J = 9.6, 8.9, 2.3 Hz, 1H), 4.39 - 4.30 (m, 3H),
3.83 - 3.73 (m, 1H), 3.00 - 2.87 (m, 1H), 2.50 - 2.40 (m, 1H), 2.26 - 2.10 (m,
1H), 1.96 (s, 3H), 1.54 - 1.43 (m, 2H), 1.30 - 1.00 (m, 2H).
5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール(化合物10;204mg;0.59mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、65mg(28%)の表題化合物を白色固体として得た。C23H23FN4O+H+ [M+H]+のLC-MS: 計算値391.2; 実測値:
390.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.38 (s, 1H), 8.08 (s, 1H), 7.99 (s, 1H), 7.87 (dd, J =
8.9, 5.5 Hz, 1H), 7.76 (d, J = 8.8 Hz, 1H), 7.71 - 7.66 (m, 2H), 7.22 (dd, J =
10.0, 2.4 Hz, 1H), 6.96 (ddd, J = 9.6, 8.9, 2.3 Hz, 1H), 4.39 - 4.30 (m, 3H),
3.83 - 3.73 (m, 1H), 3.00 - 2.87 (m, 1H), 2.50 - 2.40 (m, 1H), 2.26 - 2.10 (m,
1H), 1.96 (s, 3H), 1.54 - 1.43 (m, 2H), 1.30 - 1.00 (m, 2H).
化合物12:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド
3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミドおよび3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド(中間体16;492mg;1.06mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCおよびキラル分取HPLCによる精製後に、33.9mg(10%)の表題化合物を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
322.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.34 (s, 1H), 8.27 (d, J = 0.8 Hz, 1H), 7.93 - 7.91 (m,
1H), 7.88 (dd, J = 8.8, 5.4 Hz, 1H), 7.67 - 7.61 (m, 2H), 7.56 (dd, J = 9.0,
1.6 Hz, 1H), 7.43 (br s, 1H), 7.21 (dd, J = 10.0, 2.3 Hz, 1H), 6.95 (ddd, J =
9.6, 8.8, 2.3 Hz, 1H), 6.92 (br s, 1H), 4.62 (t, J = 6.8 Hz, 2H), 2.79 (t, J =
6.9 Hz, 2H).
3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミドおよび3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド(中間体16;492mg;1.06mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCおよびキラル分取HPLCによる精製後に、33.9mg(10%)の表題化合物を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
322.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.34 (s, 1H), 8.27 (d, J = 0.8 Hz, 1H), 7.93 - 7.91 (m,
1H), 7.88 (dd, J = 8.8, 5.4 Hz, 1H), 7.67 - 7.61 (m, 2H), 7.56 (dd, J = 9.0,
1.6 Hz, 1H), 7.43 (br s, 1H), 7.21 (dd, J = 10.0, 2.3 Hz, 1H), 6.95 (ddd, J =
9.6, 8.8, 2.3 Hz, 1H), 6.92 (br s, 1H), 4.62 (t, J = 6.8 Hz, 2H), 2.79 (t, J =
6.9 Hz, 2H).
化合物13:5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール
1,4−ジオキサン(20mL)中のtert−ブチル4−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−カルボキシレート(中間体18;180mg;0.41mmol)の溶液に、1,4−ジオキサン中飽和HCl(10mL)を添加した。反応混合物を終夜撹拌した。得られた沈殿物を濾過により収集し、分取HPLCにより精製して、56mg(40%)の表題化合物を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.2; 実測値:
334.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.36 (s, 1H), 8.07 (s, 1H), 7.98 (s, 1H), 7.86 (dd, J =
8.8, 5.4 Hz, 1H), 7.77 (d, J = 8.8 Hz, 1H), 7.67 (dd, J = 8.8, 1.6 Hz, 1H),
7.66 (d, J = 1.6 Hz, 1H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.95 (ddd, J = 9.6,
8.8, 2.4 Hz, 1H), 4.73 - 4.60 (m, 1H), 3.14 - 3.04 (m, 2H), 2.76 - 2.64 (m,
2H), 2.20 (br s, 1H), 2.05 - 1.93 (m, 2H), 1.91 - 1.82 (m, 2H).
1,4−ジオキサン(20mL)中のtert−ブチル4−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−カルボキシレート(中間体18;180mg;0.41mmol)の溶液に、1,4−ジオキサン中飽和HCl(10mL)を添加した。反応混合物を終夜撹拌した。得られた沈殿物を濾過により収集し、分取HPLCにより精製して、56mg(40%)の表題化合物を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.2; 実測値:
334.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.36 (s, 1H), 8.07 (s, 1H), 7.98 (s, 1H), 7.86 (dd, J =
8.8, 5.4 Hz, 1H), 7.77 (d, J = 8.8 Hz, 1H), 7.67 (dd, J = 8.8, 1.6 Hz, 1H),
7.66 (d, J = 1.6 Hz, 1H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.95 (ddd, J = 9.6,
8.8, 2.4 Hz, 1H), 4.73 - 4.60 (m, 1H), 3.14 - 3.04 (m, 2H), 2.76 - 2.64 (m,
2H), 2.20 (br s, 1H), 2.05 - 1.93 (m, 2H), 1.91 - 1.82 (m, 2H).
化合物14:1−(4−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−イル)エタノン
5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール(化合物13;53mg;0.16mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、16mg(27%)の表題化合物を黄色固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.2; 実測値:
376.9. 1H NMR (300 MHz, MeOH-d4) δ [ppm]: 8.25 (s, 1H), 7.92 - 7.89 (m, 1H), 7.83 (dd, J = 8.8, 5.3 Hz,
1H), 7.66 - 7.63 (m, 2H), 7.46 (s, 1H), 7.12 (dd, J = 10.0, 2.3 Hz, 1H), 6.88
(ddd, J = 9.6, 8.8, 2.3 Hz, 1H), 4.86 - 4.66 (m, 2H), 4.16 - 4.06 (m, 1H), 3.42
- 3.32 (m, 1H), 2.93 - 2.81 (m, 1H), 2.32 - 2.00 (m, 4H), 2.18 (s, 3H).
5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール(化合物13;53mg;0.16mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、16mg(27%)の表題化合物を黄色固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.2; 実測値:
376.9. 1H NMR (300 MHz, MeOH-d4) δ [ppm]: 8.25 (s, 1H), 7.92 - 7.89 (m, 1H), 7.83 (dd, J = 8.8, 5.3 Hz,
1H), 7.66 - 7.63 (m, 2H), 7.46 (s, 1H), 7.12 (dd, J = 10.0, 2.3 Hz, 1H), 6.88
(ddd, J = 9.6, 8.8, 2.3 Hz, 1H), 4.86 - 4.66 (m, 2H), 4.16 - 4.06 (m, 1H), 3.42
- 3.32 (m, 1H), 2.93 - 2.81 (m, 1H), 2.32 - 2.00 (m, 4H), 2.18 (s, 3H).
化合物15:2−(6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)アセトアミド
DMF(16.5mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体4;300mg;0.77mmol)、2−ブロモアセトアミド(1.05g;7.61mmol)、KI(290mg;1.75mmol)およびK2CO3(986mg;7.13mmol)の混合物を、窒素下60℃で48時間撹拌した。混合物を室温に冷却し、EtOAc(100mL)で希釈し、濾過し、濃縮し、分取HPLCにより精製して、50mg(21%)の表題化合物を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.42 (s, 1H), 8.32 (s, 1H), 7.90 (dd, J = 8.8, 5.4 Hz, 1H),
7.80 (s, 1H), 7.81 - 7.72 (m, 2H), 7.66 (br s, 1H), 7.39 (dd, J = 8.7, 1.4 Hz,
1H), 7.35 (br s, 1H), 7.24 (dd, J = 10.0, 2.4 Hz, 1H), 6.97 (ddd, J = 9.6, 8.8,
2.4 Hz, 1H), 5.09 (s, 2H).
DMF(16.5mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−インダゾール(中間体4;300mg;0.77mmol)、2−ブロモアセトアミド(1.05g;7.61mmol)、KI(290mg;1.75mmol)およびK2CO3(986mg;7.13mmol)の混合物を、窒素下60℃で48時間撹拌した。混合物を室温に冷却し、EtOAc(100mL)で希釈し、濾過し、濃縮し、分取HPLCにより精製して、50mg(21%)の表題化合物を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.42 (s, 1H), 8.32 (s, 1H), 7.90 (dd, J = 8.8, 5.4 Hz, 1H),
7.80 (s, 1H), 7.81 - 7.72 (m, 2H), 7.66 (br s, 1H), 7.39 (dd, J = 8.7, 1.4 Hz,
1H), 7.35 (br s, 1H), 7.24 (dd, J = 10.0, 2.4 Hz, 1H), 6.97 (ddd, J = 9.6, 8.8,
2.4 Hz, 1H), 5.09 (s, 2H).
化合物16:1−(4−((6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−イル)エタノン
1−(4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−イル)エタノン(中間体19;358mg;0.67mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、10mg(4%)の表題化合物を白色固体として得た。
C23H23FN4O+H+
[M+H]+のLC-MS: 計算値389.9;
実測値: 389.9. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.43 (s, 1H), 8.32 (s, 1H), 7.90 (dd, J =
8.8, 5.4 Hz, 1H), 7.80 (s, 1H), 7.77 - 7.71 (m, 2H), 7.39 (d, J = 8.6 Hz, 1H),
7.23 (dd, J = 10.0, 2.3 Hz, 1H), 6.97 (dd, J =9.6, 8.8, 2.3 Hz, 1H), 4.40 -
4.30 (m, 3H), 3.85 - 3.75 (m, 1H), 3.05 - 2.90 (m, 1H), 2.50 - 2.42 (m, 1H),
2.31 - 2.22 (m, 1H), 1.97 (s, 3H), 1.60 - 1.40 (m, 2H), 1.30 - 1.00 (m, 2H).
1−(4−((6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−イル)エタノン(中間体19;358mg;0.67mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、10mg(4%)の表題化合物を白色固体として得た。
C23H23FN4O+H+
[M+H]+のLC-MS: 計算値389.9;
実測値: 389.9. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.43 (s, 1H), 8.32 (s, 1H), 7.90 (dd, J =
8.8, 5.4 Hz, 1H), 7.80 (s, 1H), 7.77 - 7.71 (m, 2H), 7.39 (d, J = 8.6 Hz, 1H),
7.23 (dd, J = 10.0, 2.3 Hz, 1H), 6.97 (dd, J =9.6, 8.8, 2.3 Hz, 1H), 4.40 -
4.30 (m, 3H), 3.85 - 3.75 (m, 1H), 3.05 - 2.90 (m, 1H), 2.50 - 2.42 (m, 1H),
2.31 - 2.22 (m, 1H), 1.97 (s, 3H), 1.60 - 1.40 (m, 2H), 1.30 - 1.00 (m, 2H).
化合物17:3−(6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド
3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド(中間体20;75mg;0.16mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(EtOAc)による精製後に、20mg(38%)の表題化合物を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
323.1. 1H NMR (300 MHz, MeOH-d4) δ [ppm]: 8.16 (s, 1H), 7.87 (dd, J = 8.8, 5.3 Hz, 1H), 7.81 (s, 1H),
7.70 (d, J = 8.7 Hz, 1H), 7.52 (s, 1H), 7.41 (d, J = 8.7 Hz, 1H), 7.13 (dd, J =
9.8, 2.3 Hz, 1H), 6.90 (ddd, J = 9.6, 8.8, 2.3 Hz, 1H), 4.73 (t, J = 6.7 Hz,
2H), 2.94 (t, J = 6.7 Hz, 2H).
3−(6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド(中間体20;75mg;0.16mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(EtOAc)による精製後に、20mg(38%)の表題化合物を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
323.1. 1H NMR (300 MHz, MeOH-d4) δ [ppm]: 8.16 (s, 1H), 7.87 (dd, J = 8.8, 5.3 Hz, 1H), 7.81 (s, 1H),
7.70 (d, J = 8.7 Hz, 1H), 7.52 (s, 1H), 7.41 (d, J = 8.7 Hz, 1H), 7.13 (dd, J =
9.8, 2.3 Hz, 1H), 6.90 (ddd, J = 9.6, 8.8, 2.3 Hz, 1H), 4.73 (t, J = 6.7 Hz,
2H), 2.94 (t, J = 6.7 Hz, 2H).
化合物18:6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール
化合物6の調製中、分取HPLCによる精製後に、表題化合物(26mg、5%)を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.2; 実測値:
334.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.41 (s, 1H), 8.36 (s, 1H), 7.91 (dd, J = 8.6, 5.4 Hz, 1H),
7.83 (s, 1H), 7.75 - 7.70 (m, 2H), 7.39 (d, J = 8.6, 1.4 Hz, 1H), 7.24 (dd, J =
10.0, 2.4 Hz, 1H), 6.97 (ddd, J = 9.6, 8.8, 2.4 Hz, 1H), 4.62 - 4.50 (m, 1H),
3.22 - 3.13 (m, 2H), 2.82 - 2.70 (m, 2H), 2.16 - 1.93 (m, 4H).
化合物6の調製中、分取HPLCによる精製後に、表題化合物(26mg、5%)を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.2; 実測値:
334.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.41 (s, 1H), 8.36 (s, 1H), 7.91 (dd, J = 8.6, 5.4 Hz, 1H),
7.83 (s, 1H), 7.75 - 7.70 (m, 2H), 7.39 (d, J = 8.6, 1.4 Hz, 1H), 7.24 (dd, J =
10.0, 2.4 Hz, 1H), 6.97 (ddd, J = 9.6, 8.8, 2.4 Hz, 1H), 4.62 - 4.50 (m, 1H),
3.22 - 3.13 (m, 2H), 2.82 - 2.70 (m, 2H), 2.16 - 1.93 (m, 4H).
化合物19:1−(4−(6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−イル)エタノン
6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール(化合物18;300mg;0.90mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、20mg(6%)の表題化合物を黄色固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.2; 実測値:
376.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.42 (s, 1H), 8.40 (s, 1H), 7.89 (dd, J = 8.7, 5.4 Hz, 1H),
7.80 (s, 1H), 7.75 - 7.71 (m, 2H), 7.39 (d, J = 8.5 Hz, 1H), 7.23 (dd, J =
10.0, 2.3 Hz, 1H), 6.96 (dd, J = 9.4, 8.7, 2.3 Hz, 1H), 4.81 - 4.71 (m, 1H),
4.56 - 4.43 (m, 1H), 4.02 - 3.94 (m, 1H), 3.32 - 3.22 (m, 1H), 2.82 - 2.73 (m,
1H), 2.21 - 1.86 (m, 4H), 2.07 (s, 3H).
6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール(化合物18;300mg;0.90mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、20mg(6%)の表題化合物を黄色固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.2; 実測値:
376.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.42 (s, 1H), 8.40 (s, 1H), 7.89 (dd, J = 8.7, 5.4 Hz, 1H),
7.80 (s, 1H), 7.75 - 7.71 (m, 2H), 7.39 (d, J = 8.5 Hz, 1H), 7.23 (dd, J =
10.0, 2.3 Hz, 1H), 6.96 (dd, J = 9.4, 8.7, 2.3 Hz, 1H), 4.81 - 4.71 (m, 1H),
4.56 - 4.43 (m, 1H), 4.02 - 3.94 (m, 1H), 3.32 - 3.22 (m, 1H), 2.82 - 2.73 (m,
1H), 2.21 - 1.86 (m, 4H), 2.07 (s, 3H).
化合物20:2−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)アセトアミド
分取HPLCおよびキラル分取HPLCにより化合物9の位置異性体として精製した後、表題化合物(71mg、29%)を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.38 (s, 1H), 8.31 (s, 1H), 7.97 (s, 1H), 7.90 (dd, J =
8.7, 5.5 Hz, 1H), 7.70 - 7.55 (m, 4H), 7.37 (s, 1H), 7.22 (dd, J = 9.9, 2.3 Hz,
1H), 6.96 (ddd, J = 9.6, 8.7 2.3 Hz, 1H), 5.08 (s, 2H).
分取HPLCおよびキラル分取HPLCにより化合物9の位置異性体として精製した後、表題化合物(71mg、29%)を黄色固体として得た。C17H13FN4O+H+ [M+H]+のLC-MS: 計算値309.1; 実測値:
308.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.38 (s, 1H), 8.31 (s, 1H), 7.97 (s, 1H), 7.90 (dd, J =
8.7, 5.5 Hz, 1H), 7.70 - 7.55 (m, 4H), 7.37 (s, 1H), 7.22 (dd, J = 9.9, 2.3 Hz,
1H), 6.96 (ddd, J = 9.6, 8.7 2.3 Hz, 1H), 5.08 (s, 2H).
化合物21:1−(4−((5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−イル)エタノン
5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール(中間体22;100mg;0.29mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、5mg(4%)の表題化合物をオフホワイトの固体として得た。C23H23FN4O+H+ [M+H]+のLC-MS: 計算値391.2; 実測値:
390.9. 1H NMR (400 MHz, MeOH-d4) δ [ppm]: 8.14 (s, 1H), 7.90 (s, 1H), 7.84 (dd, J = 8.8, 5.4 Hz, 1H),
7.68 - 7.61 (m, 2H), 7.46 (s, 1H), 7.12 (dd, J = 9.8, 2.3 Hz, 1H), 6.89 (dd, J
= 9.7, 8.8, 2.3 Hz, 1H), 4.54 - 4.47 (m, 1H), 4.11 (d, J = 7.0 Hz, 2H), 3.92 -
3.85 (m, 1H), 3.09 - 3.00 (m, 1H), 2.62 - 2.53 (m, 1H), 2.37 - 2.24 (m, 1H),
2.06 (s, 3H), 1.63 - 1.54 (m, 2H), 1.34 - 1.13 (m, 2H).
5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール(中間体22;100mg;0.29mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、5mg(4%)の表題化合物をオフホワイトの固体として得た。C23H23FN4O+H+ [M+H]+のLC-MS: 計算値391.2; 実測値:
390.9. 1H NMR (400 MHz, MeOH-d4) δ [ppm]: 8.14 (s, 1H), 7.90 (s, 1H), 7.84 (dd, J = 8.8, 5.4 Hz, 1H),
7.68 - 7.61 (m, 2H), 7.46 (s, 1H), 7.12 (dd, J = 9.8, 2.3 Hz, 1H), 6.89 (dd, J
= 9.7, 8.8, 2.3 Hz, 1H), 4.54 - 4.47 (m, 1H), 4.11 (d, J = 7.0 Hz, 2H), 3.92 -
3.85 (m, 1H), 3.09 - 3.00 (m, 1H), 2.62 - 2.53 (m, 1H), 2.37 - 2.24 (m, 1H),
2.06 (s, 3H), 1.63 - 1.54 (m, 2H), 1.34 - 1.13 (m, 2H).
化合物22:3−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド
化合物12の調製中、分取HPLCおよびキラル分取HPLCによる精製後に、表題化合物(48mg、14%)を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
322.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.39 (s, 1H), 8.07 (s, 1H), 7.98 (s, 1H), 7.87 (dd, J =
8.7, 5.4 Hz, 1H), 7.74 - 7.66 (m, 3H), 7.43 (s, 1H), 7.23 (dd, J = 10.0, 2.0
Hz, 1H), 6.96 (ddd, J =9.3, 8.7 2.0 Hz, 1H), 6.89 (s, 1H), 4.61 (t, J = 6.8 Hz,
2H), 2.70 (t, J = 6.8 Hz, 2H).
化合物12の調製中、分取HPLCおよびキラル分取HPLCによる精製後に、表題化合物(48mg、14%)を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
322.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.39 (s, 1H), 8.07 (s, 1H), 7.98 (s, 1H), 7.87 (dd, J =
8.7, 5.4 Hz, 1H), 7.74 - 7.66 (m, 3H), 7.43 (s, 1H), 7.23 (dd, J = 10.0, 2.0
Hz, 1H), 6.96 (ddd, J =9.3, 8.7 2.0 Hz, 1H), 6.89 (s, 1H), 4.61 (t, J = 6.8 Hz,
2H), 2.70 (t, J = 6.8 Hz, 2H).
化合物23:5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール
1,4−ジオキサン(20mL)中のtert−ブチル4−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−カルボキシレート(中間体24;180mg;0.41mmol)の溶液に、1,4−ジオキサン中飽和HCl(10mL)を添加した。反応混合物を室温で終夜撹拌し、濾過し、分取HPLCにより精製して、59mg(43%)の表題化合物を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.4; 実測値:
334.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.37 (s, 1H), 8.36 (s, 1H), 7.92 (s, 1H), 7.87 (dd, J =
8.8, 5.4 Hz, 1H), 7.68 - 7.63 (m, 2H), 7.55 (dd, J = 9.0, 1.6 Hz, 1H), 7.22
(dd, J = 10.0, 2.4 Hz, 1H), 6.96 (ddd, J = 9.7, 8.8, 2.4 Hz, 1H), 4.59 - 4.43
(m, 1H), 3.11 - 3.02 (m, 2H), 2.70 - 2.59 (m, 2H), 2.26 (br s, 1H), 2.10 - 1.89
(m, 4H).
1,4−ジオキサン(20mL)中のtert−ブチル4−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−カルボキシレート(中間体24;180mg;0.41mmol)の溶液に、1,4−ジオキサン中飽和HCl(10mL)を添加した。反応混合物を室温で終夜撹拌し、濾過し、分取HPLCにより精製して、59mg(43%)の表題化合物を黄色固体として得た。C20H19FN4+H+ [M+H]+のLC-MS: 計算値335.4; 実測値:
334.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.37 (s, 1H), 8.36 (s, 1H), 7.92 (s, 1H), 7.87 (dd, J =
8.8, 5.4 Hz, 1H), 7.68 - 7.63 (m, 2H), 7.55 (dd, J = 9.0, 1.6 Hz, 1H), 7.22
(dd, J = 10.0, 2.4 Hz, 1H), 6.96 (ddd, J = 9.7, 8.8, 2.4 Hz, 1H), 4.59 - 4.43
(m, 1H), 3.11 - 3.02 (m, 2H), 2.70 - 2.59 (m, 2H), 2.26 (br s, 1H), 2.10 - 1.89
(m, 4H).
化合物24:1−(4−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−イル)エタノン
5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール(化合物23;53mg;0.16mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、16mg(27%)の表題化合物をオフホワイトの固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.4; 実測値:
376.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 8.25 (s, 1H), 7.90 (s, 1H), 7.83 (dd, J = 8.8, 5.3 Hz, 1H),
7.65 - 7.61 (m, 2H), 7.45 (s, 1H), 7.11 (dd, J = 9.8, 2.4 Hz, 1H), 6.88 (ddd, J
= 9.6, 8.8, 2.4 Hz, 1H), 4.78 - 4.67 (m, 2H), 4.15 - 4.06 (m, 1H), 3.40 - 3.34
(m, 1H), 2.91 - 2.80 (m, 1H), 2.30 - 2.00 (m, 4H), 2.17 (s, 3H).
5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール(化合物23;53mg;0.16mmol)から出発し、化合物7で概説した一般的方法に従って、分取HPLCによる精製後に、16mg(27%)の表題化合物をオフホワイトの固体として得た。C22H21FN4O+H+ [M+H]+のLC-MS: 計算値377.4; 実測値:
376.9. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 8.25 (s, 1H), 7.90 (s, 1H), 7.83 (dd, J = 8.8, 5.3 Hz, 1H),
7.65 - 7.61 (m, 2H), 7.45 (s, 1H), 7.11 (dd, J = 9.8, 2.4 Hz, 1H), 6.88 (ddd, J
= 9.6, 8.8, 2.4 Hz, 1H), 4.78 - 4.67 (m, 2H), 4.15 - 4.06 (m, 1H), 3.40 - 3.34
(m, 1H), 2.91 - 2.80 (m, 1H), 2.30 - 2.00 (m, 4H), 2.17 (s, 3H).
化合物25:5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール(中間体27;550mgの粗製物;0.46mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、5mg(3%)の表題化合物を黄色固体として得た。C15H10FN3+H+ [M+H]+のLC-MS: 計算値252.1; 実測値:
252.0. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 12.44 - 12.33 (m, 1H), 11.38 - 11.30 (m, 1H), 8.22 - 8.17
(m, 1H), 7.88 - 7.72 (m, 2H), 7.71 - 7.44 (m, 3H), 7.25 - 7.18 (m, 1H), 7.01 -
6.90 (m, 1H).
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール(中間体27;550mgの粗製物;0.46mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、5mg(3%)の表題化合物を黄色固体として得た。C15H10FN3+H+ [M+H]+のLC-MS: 計算値252.1; 実測値:
252.0. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 12.44 - 12.33 (m, 1H), 11.38 - 11.30 (m, 1H), 8.22 - 8.17
(m, 1H), 7.88 - 7.72 (m, 2H), 7.71 - 7.44 (m, 3H), 7.25 - 7.18 (m, 1H), 7.01 -
6.90 (m, 1H).
化合物26:5−(6−フルオロ−1H−インドール−3−イル)−2−メチル−1H−ベンゾ[d]イミダゾール
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−メチル−1H−ベンゾ[d]イミダゾール(中間体30;870mgの粗製物;1.99mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、240mg(45%)の表題化合物をオフホワイトの固体として得た。C16H12FN3+H+ [M+H]+のLC-MS: 計算値266.1; 実測値:
265.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 12.16 (s, 1H), 11.34 (s, 1H), 7.82 (dd, J = 8.7, 5.5 Hz,
1H), 7.67 (s, 1H), 7.62 (s, 1H), 7.51 (d, J = 8.2 Hz, 1H), 7.41 (d, J = 8.2 Hz,
1H), 7.22 (dd, J = 10.0, 1.9 Hz, 1H), 6.95 (ddd, J = 9.6, 8.7, 1.9 Hz, 1H),
2.50 (s, 3H).
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−メチル−1H−ベンゾ[d]イミダゾール(中間体30;870mgの粗製物;1.99mmol)から出発し、化合物1で概説した一般的方法に従って、分取HPLCによる精製後に、240mg(45%)の表題化合物をオフホワイトの固体として得た。C16H12FN3+H+ [M+H]+のLC-MS: 計算値266.1; 実測値:
265.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 12.16 (s, 1H), 11.34 (s, 1H), 7.82 (dd, J = 8.7, 5.5 Hz,
1H), 7.67 (s, 1H), 7.62 (s, 1H), 7.51 (d, J = 8.2 Hz, 1H), 7.41 (d, J = 8.2 Hz,
1H), 7.22 (dd, J = 10.0, 1.9 Hz, 1H), 6.95 (ddd, J = 9.6, 8.7, 1.9 Hz, 1H),
2.50 (s, 3H).
化合物27:(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メタンアミン
280.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]:11.34 (s, 1H), 7.82 (dd, J = 8.8, 5.5 Hz, 1H), 7.70 (s, 1H),
7.61 (s, 1H), 7.54 (d, J = 8.2 Hz, 1H), 7.42 (d, J = 8.3 Hz, 1H), 7.22 (dd, J =
9.9, 2.3 Hz, 1H), 6.95 (td, J = 9.4, 2.1 Hz, 1H), 3.94 (s, 2H).
化合物28:1−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)−N,N−ジメチルメタンアミン
309.1. 1H NMR (400 MHz, CDCl3) δ [ppm]: 10.06- 9.46 (m, 1H), 8.31 (s, 1H), 7.86 (dd, J = 8.6, 5.3
Hz, 1H), 7.80 - 7.62 (m, 1H), 7.52 (d, J = 6.8 Hz, 1H), 7.35 (d, J = 2.3 Hz,
1H), 7.12 (dd, J = 9.5, 2.2 Hz, 1H), 6.96 (td, J = 9.3, 2.3 Hz, 1H), 3.80 (s,
2H), 2.38 (s, 6H).
化合物30:N−((6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アセトアミド
322.1. 1H NMR (400 MHz, MeOH-d4) δ [ppm]: 7.76 (dd, J = 8.8, 5.2 Hz, 1H), 7.71 (s, 1H), 7.53 (d, J =
8.4 Hz, 1H), 7.48 (d, J = 8.4 Hz, 1H), 7.38 (s, 1H), 7.07 (d, J = 9.6 Hz, 1H),
6.83 (td, J = 9.2, 2.4 Hz, 1H), 4.59 (s, 2H), 2.03 (s, 3H).
化合物31:2−アミノ−N−((6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アセトアミド
337.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.36 (s, 1H), 8.55 (s, 1H), 7.83 (dd, J = 8.7, 5.4 Hz, 1H),
7.73 (s, 1H), 7.63 (d, J = 1.7 Hz, 1H), 7.56 (d, J = 8.3 Hz, 1H), 7.45 (d, J =
8.3 Hz, 1H), 7.22 (dd, J = 10.0, 2.2 Hz, 1H), 6.95 (td, J = 9.5, 2.2 Hz, 1H),
4.55 (s, 2H), 3.22 (s, 2H).
化合物32:N−((6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)メタンスルホンアミド
[M-H]-のLC-MS: 計算値357.1;
実測値: 356.9. 1H NMR (400 MHz, MeOD) δ [ppm]:7.74 (dd, J = 8.8, 5.3 Hz, 1H), 7.70 (s, 1H), 7.52 (d, J =
8.4 Hz, 1H), 7.46 (dd, J = 8.4, 1.2 Hz, 1H), 7.35 (s, 1H), 7.04 (dd, J = 9.8,
2.3 Hz, 1H), 6.80 (td, J = 9.3, 2.3 Hz, 1H), 4.46 (s, 2H), 2.92 (s, 3H).
化合物33:6−(6−フルオロ−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)−1H−ベンゾ[d]イミダゾール
364.2. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.69 (br s, 1H), 11.10 (br s, 1H), 7.99 (s, 1H), 7.86 -
7.84 (m, 4H), 7.28 (dd, J = 9.8, 2.0 Hz, 1H), 7.02 (td, J = 9.6, 2.0 Hz, 1H),
4.26 (s, 2H), 3.43 - 3.40 (m, 2H), 3.18 - 3.10 (m, 4H), 2.84 - 2.76 (m, 5H).
化合物34:5−(6−フルオロ−1H−インドール−3−イル)−2−((4−(メチルスルホニル)ピペラジン−1−イル)メチル)−1H−ベンゾ[d]イミダゾール
[M+H]+のLC-MS: 計算値428.2;
実測値: 428.2. 1H NMR (400 MHz, CD3OD)
δ [ppm]: 7.72 (dd, J = 8.8, 5.2 Hz, 1H), 7.67 (s, 1H),
7.49 (d, J = 8.8 Hz, 1H), 7.43 (dd, J = 8.4, 0.9 Hz, 1H), 7.33 (s, 1H), 7.02
(dd, J = 9.6, 2.0 Hz, 1H), 7.78 (d, J = 8.8, 2.0 Hz, 1H), 3.77 (s, 2H),
3.28-3.20 (m, 4H), 2.75 (s, 3H), 2.62 - 2.52 (m, 4H).
化合物35:2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エタンアミン
295.1. 1H NMR (400 MHz, CD4O-d4) δ [ppm]: 7.86 - 7.82 (m, 2H), 7.61 - 7.53 (m, 2H), 7.46 (s, 1H), 7.14
(dd, J = 10.0, 2.4 Hz, 1H), 6.91 (td, J = 9.2, 2.4 Hz, 1H), 3.28 - 3.22 (m,
2H), 3.16 - 3.08 (m, 2H).
化合物36:N−(2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エチル)アセトアミド
337.1. 1H NMR (400 MHz, CD4O-d4) δ [ppm]: 7.70 (dd, J = 8.8, 5.6 Hz, 2H), 7.64 (s, 1H), 7.47 - 7.40
(m, 2H), 7.32 (s, 1H), 7.02 (dd, J = 9.6, 2.2 Hz, 1H), 6.77 (td, J = 9.2,
2.4Hz, 1H), 3.54 (t, J = 6.8 Hz, 2H), 2.99 (t, J = 6.8 Hz, 2H).
化合物37:N−(2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エチル)メタンスルホンアミド
[M+H]+のLC-MS: 計算値373.1;
実測値: 373.1. 1H NMR (400 MHz, CD4O-d4)
δ [ppm]: 7.73 - 7.66 (m, 2H), 7.51-7.44 (m, 2H), 7.34
(s, 1H), 7.02 (dd, J = 10.0, 2.0 Hz, 1H), 6.78 (td, J = 8.8, 2.0 Hz, 1H), 3.48
(t, J = 7.0 Hz, 2H), 3.11 (m, J = 7.0 Hz, 2H), 2.81 (s, 3H).
化合物38:5−(6−フルオロ−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)−1H−ベンゾ[d]イミダゾール
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)−1H−ベンゾ[d]イミダゾール(中間体34;170mg;0.34mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(DCM/MeOH=10/1)および分取HPLCによる精製後に、20mg(16%)の表題化合物を白色固体として得た。C18H16FN3O2S+H+
[M+H]+のLC-MS: 計算値358.1;
実測値: 358.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 12.35 (s, 0.45H), 12.35 (s, 0.55H), 11.37 (s,
0.55H), 11.33 (s, 0.45H), 7.85 - 7.79 (m, 1H), 7.77 (s, 0.45H), 7.66 - 7.63 (m,
1H), 7.62 - 7.57 (m, 1H), 7.52 - 7.41 (m, 1.55H), 7.24 - 7.19 (m, 1H), 6.99 -
6.91 (m, 1H), 3.71 - 3.65 (m, 2H), 3.32 - 3.27 (m, 2H), 2.32 (s, 3H), 互変異性体の混合物.
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)−1H−ベンゾ[d]イミダゾール(中間体34;170mg;0.34mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(DCM/MeOH=10/1)および分取HPLCによる精製後に、20mg(16%)の表題化合物を白色固体として得た。C18H16FN3O2S+H+
[M+H]+のLC-MS: 計算値358.1;
実測値: 358.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 12.35 (s, 0.45H), 12.35 (s, 0.55H), 11.37 (s,
0.55H), 11.33 (s, 0.45H), 7.85 - 7.79 (m, 1H), 7.77 (s, 0.45H), 7.66 - 7.63 (m,
1H), 7.62 - 7.57 (m, 1H), 7.52 - 7.41 (m, 1.55H), 7.24 - 7.19 (m, 1H), 6.99 -
6.91 (m, 1H), 3.71 - 3.65 (m, 2H), 3.32 - 3.27 (m, 2H), 2.32 (s, 3H), 互変異性体の混合物.
化合物39:6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−1H−ベンゾ[d]イミダゾール
335.1. 1H NMR (400 MHz, MeOH-d4) δ [ppm]: 7.84 (dd, J = 8.8, 5.2 Hz, 1H), 7.79 (s, 1H), 7.62 (d, J =
8.4 Hz, 1H), 7.56 (d, J = 8.4 Hz, 1H), 7.46 (s, 1H), 7.15 (dd, J = 9.8, 2.2 Hz,
1H), 6.91 (td, J = 9.2, 2.0 Hz, 1H), 3.54 - 3.51 (m, 2H), 3.31-3.28 (m, 1H),
3.21 - 3.15 (m, 2H), 2.38 - 2.35 (m, 2H), 2.20 - 2.13 (m, 2H).
化合物40:6−(6−フルオロ−1H−インドール−3−イル)−2−(1−(メチルスルホニル)ピペリジン−4−イル)−1H−ベンゾ[d]イミダゾール
[M+H]+のLC-MS: 計算値413.1;
実測値: 413.1. 1H NMR (400 MHz, MeOH-d4)
δ [ppm]: 7.72 (dd, J = 8.4, 5.2 Hz, 1H), 7.65 (s, 1H),
7.47 (d, J = 8.4 Hz, 1H), 7.41 (d, J = 8.4, 1H), 7.33 (s, 1H), 7.02 (dd, J =
9.8, 2.4 Hz, 1H), 6.78 (td, J = 9.2, 2.0 Hz, 1H), 3.75 (d, J = 12.0 Hz, 2H),
3.02 (tt, J = 11.7, 3.6 Hz, 1H), 2.86 - 2.77 (m, 2H), 2.73 (s, 3H), 2.13 - 2.09
(m, 2H), 1.96 - 1.86 (m, 2H).
化合物41:6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−アミン
267.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.21 (br s, 1H), 10.61 (br s, 1H), 7.78 (dd, J = 8.8, 5.5
Hz, 1H), 7.49 (d, J = 2.0 Hz, 1H), 7.34 (s, 1H), 7.18 (dd, J = 10.1, 2.2 Hz,
1H), 7.16 - 7.11 (m, 2H), 6.92 (ddd, J = 9.6, 8.6, 2.2 Hz, 1H), 6.11 (br s,
2H).
化合物44:1−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)−N−メチルメタンアミン
THF(30mL)中のtert−ブチル(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル(メチル)カルバメート(中間体37;470mgの粗製物;0.87mmol)の溶液に、濃HCl水溶液(3mL;37%)を添加した。反応混合物を51℃で3時間撹拌し、真空中で濃縮し、水(80mL)で希釈し、EtOAc(50mL×3)で抽出した。水層をNaOH水溶液でpH=13に塩基性化し、EtOAc(80mL×3)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過し、濃縮し、分取TLC(DCM/MeOH=10/1)および分取HPLCにより精製して、40mg(16%)の表題化合物を白色固体として得た。C17H15FN4+H+ [M+H]+のLC-MS: 計算値295.1; 実測値:
294.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.34 (s, 1H), 7.82 (dd, J = 8.7, 5.4 Hz, 1H), 7.70 (s, 1H),
7.61 (s, 1H), 7.53 (d, J = 8.7 Hz, 1H), 7.42 (d, J = 8.7 Hz, 1H), 7.22 (dd, J =
10.0, 2.3 Hz, 1H), 6.95 (ddd, J =9.4, 8.7, 2.3 Hz, 1H), 3.87 (s, 2H), 2.34 (s,
3H).
THF(30mL)中のtert−ブチル(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル(メチル)カルバメート(中間体37;470mgの粗製物;0.87mmol)の溶液に、濃HCl水溶液(3mL;37%)を添加した。反応混合物を51℃で3時間撹拌し、真空中で濃縮し、水(80mL)で希釈し、EtOAc(50mL×3)で抽出した。水層をNaOH水溶液でpH=13に塩基性化し、EtOAc(80mL×3)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過し、濃縮し、分取TLC(DCM/MeOH=10/1)および分取HPLCにより精製して、40mg(16%)の表題化合物を白色固体として得た。C17H15FN4+H+ [M+H]+のLC-MS: 計算値295.1; 実測値:
294.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.34 (s, 1H), 7.82 (dd, J = 8.7, 5.4 Hz, 1H), 7.70 (s, 1H),
7.61 (s, 1H), 7.53 (d, J = 8.7 Hz, 1H), 7.42 (d, J = 8.7 Hz, 1H), 7.22 (dd, J =
10.0, 2.3 Hz, 1H), 6.95 (ddd, J =9.4, 8.7, 2.3 Hz, 1H), 3.87 (s, 2H), 2.34 (s,
3H).
化合物45:4−((5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)モルホリン
ステップ1:4−((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)モルホリン
DMF(2mL)中の2−(クロロメチル)−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール(中間体39;100mg;0.23mmol)およびモルホリン(59mg;0.68mmol)の溶液を、80℃で2時間撹拌した。混合物をEtOAc(50mL)で希釈し、H2O(20mL)、ブライン(30mL×2)で洗浄し、無水Na2SO4で乾燥させ、濾過し、濃縮し、分取TLC(DCM/MeOH=20/1)により精製して、56mg(50%)の表題化合物を褐色固体として得た。C26H23FN4O3S+H+
[M+H]+のLC-MS: 計算値
491.2; 実測値: 490.9.
ステップ2:
4−((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)モルホリン(ステップ1;56mg;0.11mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(DCM/MeOH=20/1)による精製後に、13mg(32%)の表題化合物を白色固体として得た。C20H19FN4O+H+ [M+H]+のLC-MS: 計算値351.2; 実測値:
351.2. 1H NMR (400 MHz, MeOH-d4) δ [ppm]: 7.71 (dd, J = 8.4, 5.2 Hz, 1H), 7.67 (s, 1H), 7.49 (d, J =
8.4 Hz, 1H), 7.41 (d, J = 8.4 Hz, 1H), 7.33 (s, 1H), 7.01 (dd, J = 10.0, 2.4
Hz, 1H), 6.78 (ddd, J = 9.2, 8.4, 2.4 Hz, 1H), 3.72 (s, 1H), 3.66 - 3.61 (m,
4H), 2.50 - 2.44 (m, 4H).
ステップ1:4−((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)モルホリン
DMF(2mL)中の2−(クロロメチル)−5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール(中間体39;100mg;0.23mmol)およびモルホリン(59mg;0.68mmol)の溶液を、80℃で2時間撹拌した。混合物をEtOAc(50mL)で希釈し、H2O(20mL)、ブライン(30mL×2)で洗浄し、無水Na2SO4で乾燥させ、濾過し、濃縮し、分取TLC(DCM/MeOH=20/1)により精製して、56mg(50%)の表題化合物を褐色固体として得た。C26H23FN4O3S+H+
[M+H]+のLC-MS: 計算値
491.2; 実測値: 490.9.
ステップ2:
4−((5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)モルホリン(ステップ1;56mg;0.11mmol)から出発し、化合物1で概説した一般的方法に従って、分取TLC(DCM/MeOH=20/1)による精製後に、13mg(32%)の表題化合物を白色固体として得た。C20H19FN4O+H+ [M+H]+のLC-MS: 計算値351.2; 実測値:
351.2. 1H NMR (400 MHz, MeOH-d4) δ [ppm]: 7.71 (dd, J = 8.4, 5.2 Hz, 1H), 7.67 (s, 1H), 7.49 (d, J =
8.4 Hz, 1H), 7.41 (d, J = 8.4 Hz, 1H), 7.33 (s, 1H), 7.01 (dd, J = 10.0, 2.4
Hz, 1H), 6.78 (ddd, J = 9.2, 8.4, 2.4 Hz, 1H), 3.72 (s, 1H), 3.66 - 3.61 (m,
4H), 2.50 - 2.44 (m, 4H).
化合物46:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)プロパンアミド
ステップ1:3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)プロパンアミド
THF中飽和NH3(100mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2,3−ジヒドロ−1H−ベンゾ[d]ピロロ[1,2−a]イミダゾール−1−オン(中間体41;456mgの粗製物;0.92mmol)の溶液を、オートクレーブ内137℃で24時間撹拌した。反応混合物を室温に冷却し、濃縮して、480mg(100%)の表題化合物を黄色固体として得、これをさらに精製することなく直接使用した。C24H19FN4O3S+H+
[M+H]+のLC-MS: 計算値
463.1; 実測値: 462.8.
ステップ2:
EtOH(10mL)中の3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)プロパンアミド(ステップ1;480mgの粗製物;0.92mmol)の溶液に、KOH(116mg;2.07mmol)を添加した。反応混合物を50℃で4時間撹拌した。混合物を2M HCl水溶液で中和し、濃縮し、分取HPLCにより精製して、50mg(17%)の表題化合物を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
322.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 12.15 (s, 1H), 11.33 (s, 1H), 7.82 (dd, J = 8.7, 5.5 Hz,
1H), 7.67 (s, 1H), 7.61 (d, J = 1.9 Hz, 1H), 7.51 (d, J = 8.1 Hz, 1H), 7.48 -
7.38 (m, 2H), 7.22 (dd, J = 10.0, 2.0 Hz, 1H), 6.95 (ddd, J = 9.6, 8.7, 2.0 Hz,
1H), 6.86 (s, 1H), 3.03 (t, J = 7.6 Hz, 2H), 2.64 (t, J = 7.6 Hz, 2H).
ステップ1:3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)プロパンアミド
THF中飽和NH3(100mL)中の6−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2,3−ジヒドロ−1H−ベンゾ[d]ピロロ[1,2−a]イミダゾール−1−オン(中間体41;456mgの粗製物;0.92mmol)の溶液を、オートクレーブ内137℃で24時間撹拌した。反応混合物を室温に冷却し、濃縮して、480mg(100%)の表題化合物を黄色固体として得、これをさらに精製することなく直接使用した。C24H19FN4O3S+H+
[M+H]+のLC-MS: 計算値
463.1; 実測値: 462.8.
ステップ2:
EtOH(10mL)中の3−(5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)プロパンアミド(ステップ1;480mgの粗製物;0.92mmol)の溶液に、KOH(116mg;2.07mmol)を添加した。反応混合物を50℃で4時間撹拌した。混合物を2M HCl水溶液で中和し、濃縮し、分取HPLCにより精製して、50mg(17%)の表題化合物を白色固体として得た。C18H15FN4O+H+ [M+H]+のLC-MS: 計算値323.1; 実測値:
322.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 12.15 (s, 1H), 11.33 (s, 1H), 7.82 (dd, J = 8.7, 5.5 Hz,
1H), 7.67 (s, 1H), 7.61 (d, J = 1.9 Hz, 1H), 7.51 (d, J = 8.1 Hz, 1H), 7.48 -
7.38 (m, 2H), 7.22 (dd, J = 10.0, 2.0 Hz, 1H), 6.95 (ddd, J = 9.6, 8.7, 2.0 Hz,
1H), 6.86 (s, 1H), 3.03 (t, J = 7.6 Hz, 2H), 2.64 (t, J = 7.6 Hz, 2H).
化合物47:5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール(中間体43;423mg;1.08mmol)から出発し、化合物1で概説した一般的方法に従って、シリカゲルクロマトグラフィー(石油エーテル/EtOAc=100/1〜6/1)による精製後に、60mg(22%)の表題化合物を白色固体として得た。C15H9FN2O+H+ [M+H]+のLC-MS: 計算値253.1; 実測値:
253.0. 1H NMR (400 MHz, CDCl3) δ [ppm]: 8.30 (br s, 1H), 8.14 (s, 1H), 8.03 (s, 1H), 7.84 (dd, J =
8.8, 5.2 Hz, 1H), 7.69 - 7.63 (m, 2H), 7.37 (d, J = 2.4 Hz, 1H), 7.14 (dd, J =
9.4, 2.2 Hz, 1H), 6.98 (ddd, J = 9.4, 8.8, 2.2 Hz, 1H).
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)ベンゾ[d]オキサゾール(中間体43;423mg;1.08mmol)から出発し、化合物1で概説した一般的方法に従って、シリカゲルクロマトグラフィー(石油エーテル/EtOAc=100/1〜6/1)による精製後に、60mg(22%)の表題化合物を白色固体として得た。C15H9FN2O+H+ [M+H]+のLC-MS: 計算値253.1; 実測値:
253.0. 1H NMR (400 MHz, CDCl3) δ [ppm]: 8.30 (br s, 1H), 8.14 (s, 1H), 8.03 (s, 1H), 7.84 (dd, J =
8.8, 5.2 Hz, 1H), 7.69 - 7.63 (m, 2H), 7.37 (d, J = 2.4 Hz, 1H), 7.14 (dd, J =
9.4, 2.2 Hz, 1H), 6.98 (ddd, J = 9.4, 8.8, 2.2 Hz, 1H).
化合物48:5−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール(中間体45;718mg;1.77mmol)から出発し、化合物1で概説した一般的方法に従って、石油エーテル/EtOAc=4/1中での再結晶による精製後に、184mg(39%)の表題化合物を褐色固体として得た。C16H11FN2O+H+ [M+H]+のLC-MS: 計算値267.1; 実測値:
267.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.45 (s, 1H), 7.87 (s, 1H), 7.83 (dd, J = 8.8, 5.2 Hz, 1H),
7.73 - 7.68 (m, 2H), 7.63 (d, J = 8.0 Hz, 1H), 7.50 (dd, J = 10.0, 2.4 Hz, 1H),
7.23 (ddd, J = 9.2, 8.8, 2.4 Hz, 1H), 2.63 (s, 3H).
5−(6−フルオロ−1−(フェニルスルホニル)−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール(中間体45;718mg;1.77mmol)から出発し、化合物1で概説した一般的方法に従って、石油エーテル/EtOAc=4/1中での再結晶による精製後に、184mg(39%)の表題化合物を褐色固体として得た。C16H11FN2O+H+ [M+H]+のLC-MS: 計算値267.1; 実測値:
267.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.45 (s, 1H), 7.87 (s, 1H), 7.83 (dd, J = 8.8, 5.2 Hz, 1H),
7.73 - 7.68 (m, 2H), 7.63 (d, J = 8.0 Hz, 1H), 7.50 (dd, J = 10.0, 2.4 Hz, 1H),
7.23 (ddd, J = 9.2, 8.8, 2.4 Hz, 1H), 2.63 (s, 3H).
化合物53:6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
253.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 8.43 (s, 1H), 7.89 (s, 1H), 7.84 - 7.82 (m, 1H), 7.75 (d, J
= 8.0Hz, 1H), 7.70 (dd, J = 8.4, 1.6 Hz, 1H), 7.52 (s, 1H), 7.12 (dd, J = 10,
2.4 Hz, 1H), 6.90 (m, 1H).
化合物54:6−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール
267.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 7.85 (dd, J = 8.8, 5.6 Hz, 1H), 7.82 (s, 1H), 7.66 (s, 2H),
7.53 (s, 1H), 7.16 (dd, J = 9.6, 2.4 Hz, 1H), 6.93 (td, J = 9.2, 2.0 Hz, 1H),
2.67 (s, 3H).
化合物55:6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)ベンゾ[d]オキサゾール
336.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.49 (br s, 1H), 7.91 (s, 1H), 7.89 (dd, J = 8.8, 3.2 Hz,
1H), 7.75 (d, J = 1.6 Hz, 1H), 7.73 (d, J = 8.4 Hz, 1H), 7.66 (dd, J = 8.6, 1.4
Hz, 1H), 7.25 (dd, J = 9.8, 2.6 Hz, 1H), 6.97 (td, J =10.6, 2.5 Hz, 1H), 3.13 -
3.02 (m, 3H), 2.64 (t, J = 11.2 Hz, 2H), 2.03 (d, J = 10.8 Hz, 2H), 1.72 (td, J
= 12.2, 3.0 Hz, 2H).
化合物56:1−(4−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)ピペリジン−1−イル)エタノン
7.75 (d, J = 2.8 Hz, 1H), 7.73 (d, J = 7.2 Hz, 1H), 7.66 (dd, J = 1.6, 8.0 Hz,
1H), 7.23 (dd, J = 2.4, 10.0 Hz, 1H), 6.97 (td, J = 2.4, 9.6 Hz, 1H), 4.32 (d,
J = 13.6 Hz, 1H), 3.87 (d, J = 13.6 Hz, 1H), 3.35 - 3.27 (m, 2H), 2.88 (t, J =
11.2 Hz, 1H), 2.13 (t, J = 14.0 Hz, 2H), 2.04 (s, 3H), 1.88-1.77 (m, 1H), 1.72
- 1.62 (m, 1H).
化合物58:N−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンスルホンアミド
[M+H]+のLC-MS: 計算値346.1;
実測値: 346.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 12.51(s, 1H), 11.44 (s, 1H), 7.86 (dd, J =
9.2, 5.6 Hz, 1H), 7.76 (s, 1H), 7.72 (d, J = 2.0 Hz, 1H), 7.59 (d, J = 8.0 Hz,
1H), 7.36 (d, J = 8.4 Hz, 1H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.98 - 6.94 (m,
1H), 3.08 (s, 3H).
化合物59:6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)−1H−ベンゾ[d]イミダゾール
350.1. 1H NMR (400 MHz, CD3OD) δ [ppm]: 7.73 (dd, J = 8.8, 5.2 Hz, 1H), 7.70 (s, 1H), 7.50 (d, J =
8.8 Hz, 1H), 7.44 (d, J = 8.4 Hz, 1H), 7.34 (s, 1H), 7.03 (dd, J = 9.6, 2.0 Hz,
1H), 7.79 (d, J = 8.8, 2.0 Hz, 1H), 3.74 (s, 2H), 2.89 (t, J = 4.8 Hz, 4H),
2.52 (t, J = 4.8 Hz, 4H).
化合物60:2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)アセトアミド
309.3. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 12.19 (d, J = 24.0 Hz, 1H), 11.33 (d, J = 12.8 Hz, 1H), 7.82
(dd, J = 8.4, 5.2 Hz, 1H), 7.76 - 7.66 (m, 2H), 7.61 (dd, J = 9.6, 2.4 Hz, 1H),
7.59 - 7.47 (m, 1H), 7.43 (td, J = 9.6, 2.4 Hz, 1H), 7.25 - 7.16 (m, 2H), 6.99
- 6.91 (m, 1H), 3.73 (s, 2H).
化合物61:5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)ベンゾ[d]オキサゾール
351.1. 1H NMR (400 MHz, CD3OD) δ [ppm]: 7.77 (s, 1H), 7.67 (dd, J = 8.8, 5.2 Hz, 1H), 7.54 (dd, J =
8.8, 1.2 Hz, 1H), 7.49 (d, J = 8.4 Hz, 1H), 7.36 (s, 1H), 7.03 (dd, J = 9.6,
2.0 Hz, 1H), 6.78 (td, J = 9.6, 2.0 Hz, 1H), 3.77 (s, 2H), 2.83 (t, J = 4.8 Hz,
4H), 2.56 (t, J = 4.8 Hz, 4H).
化合物62:5−(6−フルオロ−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)ベンゾ[d]オキサゾール
365.1. 1H NMR (400 MHz, CD3OD) δ [ppm]: 7.89 (d, J = 0.8 Hz, 1H), 7.80 (dd, J = 8.8, 5.2 Hz, 1H),
7.67 (dd, J = 8.8, 1.6 Hz, 1H), 7.62 (d, J = 8.4 Hz, 1H), 7.47 (s, 1H), 7.13
(dd, J = 9.6, 2.0 Hz, 1H), 6.89 (td, J = 9.6, 2.0 Hz, 1H), 3.90 (s, 2H), 2.78 -
2.68 (m, 4H), 2.68 - 2.39 (m, 4H), 2.28 (s, 3H).
化合物63:5−(6−フルオロ−1H−インドール−3−イル)−2−(モルホリノメチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値352.1;
実測値: 352.1. 1H NMR (400 MHz, CD3OD)
δ [ppm]: 7.86 (s, 1H), 7.75 (dd, J = 8.8, 5.6 Hz, 1H),
7.62 (d, J = 8.4 Hz, 1H), 7.56 (d, J = 8.4 Hz, 1H), 7.44 (s, 1H), 7.12 (dd, J =
9.6, 1.6 Hz, 1H), 6.87 (td, J = 9.6, 2.0 Hz, 1H), 3.82 (s, 2H), 3.69 (t, J =
4.4 Hz, 4H), 2.59 (t, J = 4.4 Hz, 4H).
化合物64:2−(6−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド
[M+H]+のLC-MS: 計算値326.1;
実測値: 325.8. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.43 (br s, 1H), 10.97 (br s, 1H), 9.81 (br
s, 1H), 7.81 (dd, J = 8.4, 5.2 Hz, 1H), 7.65 (d, J = 2.4 Hz, 1H), 7.31 (d, J =
8.0 Hz, 1H), 7.24 - 7.21 (m, 2H), 7.12 (dd, J = 8.0, 1.2 Hz, 1H), 6.97 (td, J =
9.2, 2.0 Hz, 1H), 4.28 (s, 2H).
化合物65:5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2(3H)−オン
265.9. 1H NMR (400 MHz, MeOD-d4) δ [ppm]: 11.30 (s, 1H), 10.59 (s, 2H), 7.76 (dd, J1 = 8.4
Hz, J2 = 5.6 Hz, 1H), 7.56 (d, J = 2.0 Hz, 1H), 7.23 -
7.19 (m, 2H), 7.15 (s, 1H), 6.98 (d, J = 7.6 Hz, 1H), 6.94 (td, J1
= 9.2 Hz, J2 = 2.0 Hz, 1H).
化合物66:6−(6−フルオロ−1H−インドール−3−イル)−2−(モルホリノメチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値352.1;
実測値: 352.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.51 (s, 1H), 7.96 (s, 1H), 7.91 - 7.88 (m,
1H), 7.77 - 7.74 (m, 2H),7.69 - 7.67 (m, 1H), 7.24 (dd, J = 2.0, 9.6 Hz, 1H),
6.97 (td, J = 2.4, 9.6 Hz, 1H), 3.87 (s, 2H), 3.61 - 3.59 (m, 4H), 2.56 - 2.54
(m, 4H).
化合物67:3−(6−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)プロパンアミド
[M-H]-のLC-MS: 計算値338.1;
実測値: 337.9. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.40 (br s, 1H), 10.27 (br s, 1H), 9.60 (br
s, 1H), 7.81 (dd, J = 8.8, 5.4 Hz, 1H), 7.63 (d, J = 2.8 Hz, 1H), 7.24-7.19 (m,
3H), 7.11 (dd, J = 8.0, 1.6 Hz, 1H), 6.97 (td, J = 9.6, 2.0 Hz, 1H), 3.63 (t, J
= 6.6 Hz, 2H), 2.70 (t, J = 6.8 Hz, 2H).
化合物68:6−(6−フルオロ−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)ベンゾ[d]オキサゾール
7.24 (dd, J = 9.6, 1.6 Hz, 1H), 6.99 - 6.95 (m, 1H), 3.84 (s, 2H), 2.55 (s,
4H), 2.34 (s, 4H), 2.15 (s,3H)
化合物69:2−(5−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド
[M-H]-のLC-MS: 計算値324.1;
実測値: 323.9. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.31 (br s, 1H), 10.95 (br s, 1H), 9.74 (br
s, 1H), 7.80 (dd, J = 8.7, 5.4 Hz, 1H), 7.59 (d, J = 2.0 Hz, 1H), 7.54 (d, J =
2.0 Hz, 1H), 7.46 -7.43 (m, 1H), 7.19 (dd, J = 10.0, 2.0 Hz, 1H), 6.99 - 6.90
(m, 2H), 4.32 (s, 2H).
化合物70:N−((5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド
[M+H]+のLC-MS: 計算値360.1;
実測値: 360.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.45 (br s, 1H), 8.01 (br s, 1H), 7.95 (s,
1H), 7.89-7.81 (m, 1H), 7.78 (d, J = 8.0 Hz, 1H), 7.73 (d, J = 2.8 Hz, 1H),
7.70 (d, J = 8.8 Hz, 1H), 7.23 (dd, J = 10.0, 2.0 Hz, 1H), 6.96 (td, J = 8.8,
2.0 Hz, 1H), 4.54 (s, 2H), 3.04 (s, 3H).
化合物71:3−(5−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)プロパンアミド)
[M-H]-のLC-MS: 計算値338.1;
実測値: 338.0. 1H NMR (400 MHz, DMSO) δ 11.30 (s, 1H), 10.31 (s, 1H), 9.56 (s, 1H), 7.78 (dd, J = 8.8, 5.6
Hz, 1H), 7.54 (d, J = 2.0 Hz, 1H), 7.47 (d, J = 2.0 Hz, 1H), 7.43 (dd, J = 8.4,
2.2 Hz, 1H), 7.19 (dd, J = 9.9, 1.9 Hz, 1H), 6.98 (d, J = 8.4 Hz, 1H), 6.99 -
6.90 (m, 2H), 3.67 (t, J = 6.6 Hz, 2H), 2.72 (t, J = 6.6 Hz, 2H).
化合物72:3−(ベンゾ[b]チオフェン−5−イル)−6−フルオロ−1H−インドール
265.9. 1H NMR (400 MHz, DMSO) δ 11.44
(s, 1H), 8.18 (s, 1H), 8.03 (d, J = 8.0 Hz, 1H), 7.92 (dd, J = 8.8, 5.2 Hz,
1H), 7.77 (d, J = 5.2 Hz, 1H), 7.74 (s, 1H), 7.68 (d, J = 8.8 Hz, 1H), 7.51 (d,
J = 5.6 Hz, 1H), 7.23 (dd, J = 9.8, 2.0 Hz, 1H), 6.97 (td, J = 9.2, 2.4 Hz,
1H).
化合物73:N−((5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)アセトアミド
[M+H]+のLC-MS: 計算値324.1;
実測値: 324.1. 1H NMR (400 MHz, CD3OD)
δ [ppm]: 7.90 (s, 1H), 7.82 (dd, J = 8.8, 1.6 Hz, 1H),
7.70 (dd, J = 8.4, 1.6 Hz, 1H), 7.66 (d, J = 8.4 Hz, 1H), 7.50 (s, 1H), 7.16
(dd, J = 9.6, 2.0 Hz, 1H), 6.92 (td, J = 9.6, 2.4 Hz, 1H), 4.70 (s, 2H), 2.10
(s, 3H).
化合物74:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド
[M + H]+のLC-MS: 計算値360.1;
実測値: 360.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.51 (s, 1H), 8.03 - 7.99 (m, 1H), 7.97 (s,
1H), 7.90 (dd, J = 8.8, 5.4 Hz, 1H), 7.80 - 7.75 (m, 2H), 7.70 (dd, J = 8.3,
1.3 Hz, 1H), 7.24 (dd, J = 10.2, 2.2 Hz, 1H), 6.97 (td, J = 9.2, 2.1 Hz, 1H),
4.54 (d, J = 4.4 Hz, 2H), 3.04 (s, 3H).
化合物75:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)アセトアミド
[M+H]+のLC-MS: 計算値324.1;
実測値: 324.5. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.50 (s, 1H), 8.69 (t, J = 5.6 Hz, 1H), 7.94
(s, 1H), 7.89 (dd, J = 9.0, 5.4 Hz, 1H), 7.77 (d, J = 2.5 Hz, 1H), 7.74 (d, J =
8.2 Hz, 1H), 7.69 - 7.67 (m, 1H), 7.24 (dd, J = 9.9, 2.3 Hz, 1H), 6.97 (td, J =
9.2, 2.0 Hz, 1H), 4.57 (d, J = 5.6 Hz, 2H), 1.93 (s, 3H).
化合物76:(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンアミン
281.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.51 (br s, 1H), 7.92 (s, 1H), 7.90 - 7.87 (m, 1H), 7.77
(s, 1H), 7.74 (d, J = 8.0 Hz, 1H), 7.67 (d, J = 8.2 Hz, 1H), 7.25 (d, J = 9.6
Hz, 1H), 6.98 (t, J = 9.0 Hz, 1H), 3.99 (s, 2H).
化合物77:5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール
348.9
1H NMR
(400 MHz, MeOD-d4) δ [ppm]: 11.35 (s, 1H),
8.31 (s, 1H), 7.92-7.86 (m, 2H), 7.66-7.63 (m, 2H), 7.55 (dd, J = 9.2, 1.6 Hz,
1H), 7.21 (dd, J = 9.6, 2.4 Hz, 1H), 6.95 (td, J = 9.6, 2.4 Hz, 1H), 4.28 (d, J
= 7.2 Hz, 2H), 2.91-2. 89 (m, 2H), 2.41-2.36 (m, 2H), 1.39 (d, J = 10.8 Hz,
2H), 1.12 (td, J = 12.2, 3.4 Hz, 2H).
化合物78:6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)ベンゾ[d]オキサゾール
351.1. 1H NMR (400 MHz, MeOD) δ [ppm]:
7.89 - 7.84 (m, 2H), 7.74 - 7.73 (m, 2H), 7.56 (s, 1H), 7.16 (dd, J = 10, 2.4
Hz, 1H), 6.94 (td, J = 9.2, 2.4 Hz, 1H), 3.96 - 3.95 (m, 2H), 2.97 (br s, 4H),
2.71 (br s, 4H)
化合物79:3−(ベンゾ[b]チオフェン−6−イル)−6−フルオロ−1H−インドール
266.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.47 (s, 1H), 8.29 (s, 1H), 7.97 - 7.91 (m, 2H), 7.78 (d, J
= 2.4 Hz, 1H), 7.73 - 7.68 (m, 2H), 7.45 (d, J = 5.2 Hz, 1H), 7.24 (dd, J =
10.0, 2.0 Hz, 1H), 6.98 (td, J = 9.2, 2.4 Hz, 1H).
化合物80:5−(6−フルオロ−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)ベンゾ[d]オキサゾール
359.0. 1H NMR (400 MHz, CDCl3) δ [ppm]: 8.26 (brs, 1H), 7.91 (s, 1H), 7.82 (dd, J = 8.8, 5.2 Hz,
1H), 7.61 (d, J = 8.0 Hz, 1H), 7.57 (d, J = 8.0 Hz, 1H), 7.35 (d, J = 2.0 Hz,
1H), 7.14 (d, J = 9.6, 2.0 Hz, 1H), 6.97 (td, J = 8.8, 2.0 Hz, 1H), 3.70 (t, J
= 7.6 Hz, 2H), 3.54 (t, J = 7.6 Hz, 2H), 3.02 (s, 3H).
化合物81:(5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンアミン
282.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.53 (br s, 1H), 8.83 (br s, 3H), 8.00 (s, 1H), 7.86 - 7.82
(m, 2H), 7.77 - 7.75 (m, 2H), 7.25 (dd, J = 10.0, 2.4 Hz, 1H), 6.98 (td, J =
8.8, 2.0 Hz, 1H), 4.54 - 4.52 (m, 2H).
化合物82:3−(ベンゾフラン−5−イル)−6−フルオロ−1H−インドール
250.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.39 (br s, 1H), 8.00 (d, J = 2.0 Hz, 1H), 7.91 (d, J = 1.8
Hz, 1H), 7.85 (dd, J = 8.8, 5.5 Hz, 1H), 7.66 (s, 1H), 7.60 (dd, J = 8.4, 2.0
Hz, 2H), 7.23 (dd, J = 9.6, 2.4 Hz, 1H), 6.70 - 6.93 (m, 2H).
化合物83:3−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)プロパンアミド
[M+H]+のLC-MS: 計算値324.1;
実測値: 324.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.48 (brs, 1H), 7.92-7.86 (m, 2H), 7.75(d, J
= 2.4 Hz, 1H), 7.69 (d, J = 8.0 Hz, 1H), 7.64 (dd, J = 8.0, 1.6 Hz, 1H), 7.47
(brs, 1H), 7.24 (dd, J = 9.6, 2.0 Hz, 1H), 6.96 (td, J = 8.4, 2.0 Hz, 1H),
6.91(brs, 1H), 3.14 (t J = 7.2 Hz, 2H), 2.68 (t J = 7.2 Hz, 2H).
化合物84:2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)アセトアミド
309.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.48 (br s, 1H), 8.14 (s, 1H), 7.88 (dd, J = 8.8, 5.5 Hz,
1H), 7.87 (br s, 1H), 7.70 (d, J = 1.6 Hz, 1H), 7.68 (d, J = 8.4 Hz, 1H), 7.65
(d, J = 2.4 Hz, 1H), 7.50 (dd, J = 8.4, 1.6 Hz, 1H), 7.37 (br s, 1H), 7.23 (dd,
J = 9.9, 2.4 Hz, 1H), 6.95 (m, 1H), 4.98 (s, 2H).
化合物85:2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)アセトアミド
309.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.35 (br s, 1H), 8.16 (s, 1H), 7.87 (d, J = 1.6 Hz, 1H),
7.84 (dd, J = 8.8, 5.5 Hz, 1H), 7.76 (br s, 1H), 7.64 (d, J = 2.2 Hz, 1H), 7.56
(dd, J = 8.4, 1.6 Hz, 1H), 7.50 (d, J = 8.4 Hz, 1H), 7.37 (br s, 1H), 7.22 (dd,
J = 10.0, 2.4 Hz, 1H), 6.95 (m, 1H), 4.93 (s, 2H).
化合物86:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−1−モルホリノプロパン−1−オン
[M+H]+のLC-MS: 計算値393.1;
実測値: 393.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.37 (br s, 1H), 8.08 (br s, 1H), 7.98 (br s,
1H), 7.86 (dd, J = 8.8, 5.6 Hz, 1H), 7.74 - 7.67 (m, 3H), 7.22 (dd, J = 9.6,
2.4 Hz, 1H), 6.96 (td, J = 9.4, 2.4 Hz, 1H), 4.65 (t, J = 6.8 Hz, 2H), 3.47 -
3.38 (m, 6H), 3.34 - 3.30 (m, 2H), 2.96 (t, J = 6.8 Hz, 2H).
化合物87:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−1−(4−メチルピペラジン−1−イル)プロパン−1−オン
406.2. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.36 (s, 1H), 8.08 (s, 1H), 7.98 (s, 1H), 7.88 - 7.84 (m,
1H), 7.73 - 7.66 (m, 3H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.96 (td, J = 8.8,
2.4 Hz, 1H), 4.64 (t, J = 6.8 Hz, 2H), 3.40-3.38 (m, 2H), 3.32 - 3.29 (m, 2H),
2.94 (t, J = 6.8 Hz, 2H), 2.14 - 2.09 (m, 7H).
化合物88:N−(2−(ジメチルアミノ)エチル)−3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド
394.2. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.37 (br s, 1H), 8.07 (s, 1H), 7.97 (s, 1H), 7.88 - 7.84
(m, 2H), 7.72 - 7.66 (m, 3H), 7.22 (dd, J = 10.0, 1.6 Hz, 1H), 6.96 (t, J = 5.2
Hz, 1H), 4.62 (t, J = 6.4 Hz, 2H), 3.06 (q, J = 6.4 Hz, 2H), 2.69 (t, J = 6.4
Hz, 2H), 2.11 (t, J = 6.4 Hz, 2H), 2.04 (s, 6H).
化合物89:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−N−(2−ヒドロキシエチル)プロパンアミド
[M+H]+のLC-MS: 計算値367.2;
実測値: 367.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.37 (br s, 1H), 8.07 (br s, 1H), 7.98 - 7.94
(m, 2H), 7.88 - 7.85 (m, 1H), 7.70 - 7.67 (m, 3H), 7.22 (d, J = 10.0 Hz, 1H),
6.96 (t, J = 9.2 Hz, 1H), 4.63 - 4.61 (m, 3H), 3.36 - 3.30 (m, 2H), 3.08 - 3.07
(m, 2H), 2.71 (t, J = 6.0 Hz, 2H).
化合物90:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−N−(2−(メチルスルホニル)エチル)プロパンアミド
[M+H]+のLC-MS: 計算値429.1;
実測値: 429.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.37 (br s, 1H), 8.25 (t, J = 5.6 Hz, 1H),
8.07 (s, 1H), 7.98 (s, 1H), 7.89 - 7.85 (m, 1H), 7.70 (s, 2H), 7.67 (s, 1H),
7.22 (dd, J = 10.0, 2.0 Hz, 1H), 6.96 (td, J = 9.2, 2.0 Hz, 1H), 4.63 (t, J =
6.8 Hz, 2H), 3.40 (q, J = 6.4 Hz, 2H), 3.12 (t, J = 6.8 Hz, 2H), 2.89 (s, 3H),
2.72 (t, J = 6.8 Hz, 2H).
化合物91:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−1−(ピペラジン−1−イル)プロパン−1−オン
392.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.37 (br s, 1H), 8.07 (s, 1H), 7.97 (s, 1H), 7.88 - 7.85
(m, 1H), 7.74 - 7.66 (m, 3H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.96 (td, J =
9.2, 2.4 Hz, 1H), 4.63 (t, J = 6.8 Hz, 2H), 3.32 - 3.30 (m, 2H), 3.25 - 3.23
(m, 2H), 2.93 (t, J = 6.8 Hz, 2H), 2.55 - 2.47 (m, 4H).
化合物92:6−(6−フルオロ−1H−インドール−3−イル)インドリン−2−オン
265.1. 1H NMR (400 MHz, MeOH-d4) δ [ppm]: 7.68 (dd, J = 8.8, 5.2 Hz, 1H), 7.33 (s, 1H), 7.18 (s, 1H),
7.07 (s, 2H), 7.01 (dd, J = 9.8, 2.2 Hz, 1H), 6.77 (td, J = 9.1, 2.4 Hz, 1H),
3.45 (s, 2H).
化合物93:3−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)プロパンアミド
323.2. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.51 (br s, 1H), 8.13 (s, 1H), 7.96 (dd, J = 8.8, 5.6 Hz,
1H), 7.85 (s, 1H), 7.69 -7.67(m, 2H). 7.51 (d, J = 8.0 Hz, 1H), 7.47 (br s,
1H), 7.24 (dd, J = 9.8, 2.2 Hz, 1H), 6.97 (td, J = 9.2, 2.0 Hz, 2H), 4.52 (t, J
= 6.4 Hz, 2H), 2.68 (t, J = 6.6 Hz, 2H).
化合物94:3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)プロパンアミド
323.2. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.37 (br s, 1H), 8.16 (s, 1H), 7.87 (s, 1H), 7.84 (dd, J =
8.4, 5.6 Hz, 1H), 7.68 (d, J = 8.0 Hz, 1H), 7.64 (d, J = 2.4 Hz, 1H), 7.57 (d,
J = 8.4 Hz, 1H), 7.42 (s, 1H), 7.22 (dd, J = 10.0, 2.4 Hz, 1H), 6.95 (m, 2H),
4.48 (t, J = 6.4 Hz, 2H), 2.66 (t, J = 6.6 Hz, 2H).
化合物95:1−(4−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)ピペリジン−1−イル)エタノン
[M+H]+のLC-MS: 計算値378.2;実測値: 378.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.48 (s, 1H), 7.92 (s, 1H), 7.89 (dd, J = 5.6, 8.8 Hz, 1H),
7.75 (d, J = 2.8 Hz, 1H), 7.73 (d, J = 7.2 Hz, 1H), 7.66 (dd, J = 1.6, 8.0 Hz,
1H), 7.23 (dd, J = 2.4, 10.0 Hz, 1H), 6.97 (td, J = 2.4, 9.6 Hz, 1H), 4.32 (d,
J = 13.6 Hz, 1H), 3.87 (d, J = 13.6 Hz, 1H), 3.35 - 3.27 (m, 2H), 2.88 (t, J =
11.2 Hz, 1H), 2.13 (t, J = 14.0 Hz, 2H), 2.04 (s, 3H), 1.88-1.77 (m, 1H), 1.72
- 1.62 (m, 1H).
化合物96:6−(6−フルオロ−1H−インドール−3−イル)−2−(1−(メチルスルホニル)ピペリジン−4−イル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値414.12;
実測値: 414.10. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.48 (s, 1H), 7.93 (s, 1H), 7.88 (dd, J =
5.6, 8.8 Hz, 1H), 7.75 (s, 1H), 7.74 (d, J = 11.2 Hz, 2H), 7.66 (dd, J = 1.6,
8.0 Hz, 1H), 7.24 (dd, J = 2.4, 10.0 Hz, 1H), 6.97 (td, J = 2.4, 10.0 Hz, 1H),
3.62 - 3.58 (m, 2H), 3.26-3.19 (m, 1H), 3.00 (td, J = 2.4, 12.0 Hz, 2H), 2.91 (s,
3H), 2.24 (dd, J = 13.6, 3.6 Hz, 2H), 1.93 - 1.89 (m, 2H).
化合物97:5−(6−フルオロ−1H−インドール−3−イル)インドリン−2−オン
265.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.31 (s, 1H), 10.38 (s, 1H), 7.78 (dd, J = 8.8, 5.6 Hz,
1H), 7.56 (d, J = 2.4 Hz, 1H), 7.50 (s, 1H), 7.46 (d, J = 8.0 Hz, 1H), 7.19
(dd, J = 10.0, 2.3 Hz, 1H), 6.93 (td, J = 9.5, 2.4 Hz, 1H), 6.88 (d, J = 8.0
Hz, 1H), 3.53 (s, 2H).
化合物98:6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−アミン
268.0. 1H NMR (400 MHz, DMSO) δ 11.33
(s, 1H), 7.82 (dd, J = 8.8, 5.4 Hz, 1H), 7.61 (d, J = 2.4 Hz, 1H), 7.56 (d, J =
1.2 Hz, 1H), 7.40 (dd, J = 8.0, 1.2 Hz, 1H), 7.36 (s, 2H), 7.24 (d, J = 8.1 Hz,
1H), 7.20 (dd, J = 10.0, 2.4 Hz, 1H), 6.93 (td, J = 9.6, 2.4 Hz, 1H).
化合物99:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−メトキシエタンスルホンアミド
[M+H]+のLC-MS: 計算値404.1;
実測値: 403.8. 1H NMR (400 MHz, MeOD ) δ [ppm]: 7.77 - 7.71 (m, 2H), 7.63 - 7.58 (m, 2H), 7.43 (s, 1H), 7.04
(dd, J = 10.0, 2.4 Hz, 1H), 6.82 (td, J = 9.2, 2.4 Hz, 1H), 4.49 (s, 2H), 3.68
(t, J = 6.0 Hz, 2H), 3.34 (t, J = 6.0 Hz, 2H), 3.22 (s, 3H).
化合物100:2−(ジメチルアミノ)−N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)エタンスルホンアミド
[M+H]+のLC-MS: 計算値417.1;
実測値: 417.5. 1H NMR (400 MHz, CDCl3
) δ [ppm]: 8.33 (s, 1H), 7.82 (dd, J = 8.8, 5.2 Hz,
1H), 7.76 (d, J = 0.9 Hz, 1H), 7.74 (d, J = 8.3 Hz, 1H), 7.62 (dd, J = 8.2, 1.4
Hz, 1H), 7.38 (d, J = 2.3 Hz, 1H), 7.14 (dd, J = 9.4, 2.2 Hz, 1H), 6.99 (td, J
= 9.2, 2.3 Hz, 1H), 4.67 (s, 2H), 3.34 (t, J = 6.3 Hz, 2H), 2.86 (t, J = 6.3
Hz, 2H), 2.27 (s, 6H).
化合物101:6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値359.1;
実測値: 359.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.49 (br s, 1H), 7.93 (d, J = 1.2 Hz, 1H),
7.88 (dd, J = 8.8, 1.6 Hz, 1H), 7.76 (d, J = 2.4 Hz, 1H), 7.73 (d, J = 8.0 Hz,
1H), 7.68 (dd, J = 8.4, 1.6 Hz, 1H), 7.24 (dd, J = 9.6, 2.4 Hz, 1H), 6.97 (td,
J = 9.6, 2.4 Hz, 1H), 3.73 (t, J = 7.6 Hz, 2H), 3.44 (t, J = 7.8 Hz, 2H), 3.11
(s, 3H).
化合物102:1−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)尿素
[M+H]+のLC-MS: 計算値325.1;
実測値: 325.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.48 (br s, 1H), 7.92 (s, 1H), 7.89 (dd, J =
8.8, 5.5 Hz, 1H), 7.76 (d, J = 1.8 Hz, 1H), 7.72 (d, J = 8.4 Hz, 1H), 7.67 (dd,
J = 8.4, 1.8 Hz, 1H), 7.24 (dd, J = 9.9, 2.2 Hz, 1H), 6.97 (t, J = 2.0 Hz, 1H),
6.69 (t, J = 6.0 Hz, 1H), 5.77 (br s, 2H), 4.50 (d, J = 6.0 Hz, 2H).
化合物103:1−カルバモイル−1−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)尿素
[M+H]+のLC-MS: 計算値368.1;
実測値: 368.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.49 (br s, 1H), 8.92 (s, 1H), 8.30 (br t,
1H), 7.95 (s, 1H), 7.90 (dd, J = 8.8, 5.5 Hz, 1H), 7.76 (d, J = 2.2 Hz, 1H),
7.74 (d, J = 8.4 Hz, 1H), 7.68 (d, J = 8.4 Hz, 1H), 7.24 (dd, J = 10.0, 2.2 Hz,
1H), 6.96 (m, 1H), 6.7d (br s, 2H), 4.66 (d, J = 5.7 Hz, 2H).
化合物104:5−(1H−インドール−3−イル)−1H−インダゾール
234.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 13.01 (br s, 1H), 11.27 (br s, 1H), 8.09 (s, 1H), 8.01 (s,
1H), 7.90 (d, J = 7.8 Hz, 1H), 7.69 (d, J = 8.6 Hz, 1H), 7.65 (d, J = 2.3 Hz,
1H), 7.59 (d, J = 8.6 Hz, 1H), 7.45 (d, J = 8.0 Hz, 1H), 7.18-7.08 (m, 2H).
化合物105:6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(4−メチルピペラジン−1−イル)エチル)ベンゾ[d]オキサゾール
379.2. 1H NMR (400 MHz, CDCl3) δ [ppm]: 8.28 (s, 1H), 7.86 - 7.82 (m 1H), 7.76 - 7.67 (m, 2H), 7.58
(d, J = 8.1 Hz, 1H), 7.37 (d, J = 1.9 Hz, 1H), 7.13 (dd, J = 9.5, 2.1 Hz, 1H),
7.01 - 6.96 (m, 1H), 3.19 - 3.15 (m, 2H), 3.01 - 2.97 (m, 2H), 2.66 - 2.47 (m,
8H), 2.32 (s, 3H).
化合物106:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−ヒドロキシエタンスルホンアミド
[M+H]+のLC-MS: 計算値390.1;
実測値: 390.5. 1H NMR (400 MHz, CD3OH
) δ [ppm]: 7.77 (s, 1H), 7.74 (dd, J = 8.8, 5.3 Hz,
1H), 7.640 - 7.58 (m, 2H), 7.43 (s, 1H), 7.04 (dd, J = 9.7, 2.3 Hz, 1H), 6.81
(td, J = 9.2, 2.3 Hz, 1H), 4.52 (s, 2H), 3.88 (t, J = 6.2 Hz, 2H), 3.29 (t, J =
6.2 Hz, 2H).
化合物107:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−モルホリノエタンスルホンアミド
[M+H]+のLC-MS: 計算値459.1;
実測値: 458. 8. 1H NMR (400 MHz, CD3OH
) δ [ppm]: 7.90 (s, 1H), 7.86 (dd, J = 8.7, 5.4 Hz,
1H), 7.78 - 7.71 (m, 2H), 7.56 (s, 1H), 7.17 (dd, J = 9.7, 2.3 Hz, 1H), 6.94
(td, J = 9.1, 2.2 Hz, 1H), 4.66 (s, 2H), 3.65 (t, J = 4.6 Hz, 4H), 3.39 (t, J =
7.2 Hz, 2H), 2.84 (t, J = 7.6 Hz, 2H), 2.48 - 2.47 (m, 4H).
化合物108:6−(1H−インドール−3−イル)−1H−インダゾール
234.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 12.93 (s, 1H), 11.40 (s, 1H), 8.04 (s, 1H), 7.91 (d, J = 7.6
Hz, 1H), 7.80 - 7.76 (m, 3H), 7.47 (d, J = 8.4 Hz, 2H), 7.20 - 7.10 (m, 2H).
化合物109:6−(1H−インドール−3−イル)ベンゾ[d]オキサゾール
235.5. 1H NMR (300 MHz, DMSO-d6) δ [ppm]: 11.45 (s, 1H), 8.71 (s, 1H), 8.01 (d, J = 1.1 Hz, 1H), 7.93
(d, J = 7.6 Hz, 1H), 7.83 (d, J = 8.2 Hz, 1H), 7.79 (d, J = 2.6 Hz, 1H), 7.75
(dd, J = 8.3, 1.5 Hz, 1H), 7.48-7.45 (m, 1H), 7.20 - 7.09 (m, 2H).
化合物110:6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(ピペラジン−1−イル)エチル)ベンゾ[d]オキサゾール
365.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.46 (br s, 1H), 7.90-7.86 (m, 2H), 7.74 (d, J = 2.4 Hz,
1H), 7.70 (d, J = 8.2 Hz, 1H), 7.64 (dd, J = 8.3, 1.5 Hz, 1H), 7.23 (dd, J =
9.9, 2.4 Hz, 1H), 6.96 (td, J = 9.5, 2.4 Hz, 1H), 3.11 (t, J = 7.2 Hz, 2H),
2.80 (t, J = 7.4 Hz, 2H), 2.70 - 2.62 (m, 4H), 2.38 (m, 4H).
化合物111:5−(6−クロロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
269.3. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.52 (s, 1H), 8.75 (s, 1H), 8.02 (d, J = 1.3 Hz, 1H), 7.88
(d, J = 8.6 Hz, 1H), 7.83 (d, J = 8.4 Hz, 1H), 7.79 (d, J = 2.6 Hz, 1H), 7.74
(dd, J = 8.6, 1.7 Hz, 1H), 7.50 (d, J = 1.8 Hz, 1H), 7.12 (dd, J = 8.6, 2.0 Hz,
1H).
化合物112:6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−チオール
283.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 13.85 (s, 1H), 11.48 (s, 1H), 7.86 (dd, J = 9.2, 5.2 Hz,
1H), 7.77 (d, J = 1.1 Hz, 1H), 7.74 (d, J = 2.4 Hz, 1H), 7.62 (dd, J = 8.4, 1.6
Hz, 1H), 7.29 (d, J = 8.4 Hz, 1H), 7.24 (dd, J = 9.6, 2.4 Hz, 1H), 6.97 (td, J
= 9.6, 2.4 Hz, 1H).
化合物113:6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)ベンゾ[d]オキサゾール
350.1. 1H NMR (400 MHz, MeOD) δ [ppm]:
7.73 -7.69 (m, 2H), 7.54 (d, J = 0.8 Hz, 2H), 7.40 (s, 1H), 7.03 (dd, J = 10.0,
2.0 Hz, 1H), 6.80 (td, J = 9.2, 2.0 Hz, 1H), 2.99 (d, J = 12.4Hz, 2H), 2.80 (d,
J = 7.2 Hz ,2H), 2.57 (td, J = 12.4, 2.4 Hz, 2H), 2.06 - 2.00 (m, 1H), 1.70 (d,
J = 12.8 Hz, 2H), 1.31 - 1.20 (m,2H).
化合物114:N−((6−(1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド
[M+H]+のLC-MS: 計算値342.1;
実測値: 341.9. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.44 (s, 1H), 8.00 (s, 1H), 7.98 (d, J = 0.9
Hz, 1H), 7.92 (d, J = 7.8 Hz, 1H), 7.78 (dd, J = 7.0, 5.5 Hz, 2H), 7.72 (dd, J
= 8.3, 1.5 Hz, 1H), 7.47 (d, J = 8.0 Hz, 1H), 7.20 - 7.15 (m, 1H), 7.14 - 7.09
(m, 1H), 4.54 (s, 2H), 3.04 (s, 3H).
化合物115:(S)−N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−1−メチルピロリジン−2−カルボキサミド
[M+H]+のLC-MS: 計算値393.2;
実測値: 393.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.48 (br s, 1H), 8.49 (t, J = 5.6 Hz, 1H),
7.91-7.87 (m, 2H), 7.76 (d, J = 2.8 Hz, 1H), 7.72 (d, J = 8.4 Hz, 1H)),7.66
(dd,J = 8.0, 1.2 Hz, 1H), 7.24 (dd, J = 10, 2.4 Hz, 1H), 6.98 (m, 1H), 4.62 -
4.57 (m, 2H), 3.08 - 3.07 (m, 1H), 2.83 - 2.80 (m, 1H), 2.36 (s, 3H), 2.30 -
2.28 (m, 1H), 2.11 - 2.07 (m, 1H), 1.78 - 1.74 (m, 3H).
化合物116:6−(6−フルオロ−1H−インドール−3−イル)−2−メトキシベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値283.1;
実測値: 283.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.43 (brs, 1H), 7.86 (dd, J = 8.8, 5.6 Hz,
1H), 7.79 (s, 1H), 7.69 (s, 1H), 7.59 (dd, J = 8.0, 1.6 Hz, 1H), 7.54 (d, J =
8.0 Hz, 1H), 7.22 (dd, J = 9.6, 2.0 Hz, 1H), 6.98 - 6.93 (m, 1H), 4.19 (s, 3H).
化合物117:アミノ{[6−(6−フルオロインドール−3−イル)ベンゾオキサゾール−2−イル]メチル}スルホンアミド
[M+H]+のLC-MS: 計算値361.1;
実測値: 361.0. 1H NMR (400 MHz, DMSO) δ 11.49 (br s, 1H), 7.94 (s, 1H), 7.89 (dd, J = 8.8, 5.2 Hz, 1H),
7.77 (d, J = 2.4 Hz, 1H), 7.74 (d, J = 8.0 Hz, 1H), 7.68 (dd, J = 8.0, 1.2 Hz,
1H), 7.46 (t, J = 6.0 Hz, 1H), 7.24 (dd, J = 10.0, 2.4 Hz, 1H), 6.97 (td, J =
9.6, 2.4 Hz, 1H), 6.77 (s, 2H), 4.40 (d, J = 6.4 Hz, 2H).
化合物118:5−(1H−インドール−3−イル)ベンゾ[d]オキサゾール
235.1. 1H NMR (400 MHz, CDCl3) δ [ppm]: 8.30 (br s, 1H), 8.13 (s, 1H), 8.06 (d, J = 1.1 Hz, 1H),
7.95 (d, J = 7.9 Hz, 1H), 7.71 (dd, J = 8.5, 1.6 Hz, 1H), 7.65 (dd, J = 8.5,
0.5 Hz, 1H), 7.47 - 7.45 (m, 1H), 7.41 (d, J = 2.8 Hz, 1H), 7.30-7.20 (m, 2H).
化合物119:6−(6−フルオロ−1H−インドール−3−イル)−2−((1−(メチルスルホニル)ピペリジン−4−イル)メチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値428.1;
実測値: 428.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.47(s, 1H), 7.90 - 7.86 (m, 2H),7.75 - 7.70 (m, 2H), 7.66
- 7.64 (m, 1H), 7.23 (dd, J = 10, 2.4 Hz, 1H), 6.96 (td, J = 9.6, 2.4 Hz, 1H),
3.56 (d, J= 12.0 Hz, 2H), 2.95 (d, J= 6.8 Hz, 2H), 2.85 (s, 3H), 2.74 (td, J=
12.4, 2.4 Hz, 2H), 2.07 - 2.01(m, 1H), 1.84 (dd, J= 12.4, 2.0 Hz, 2H) 1.37(qd,
J= 12.4, 4.0 Hz, 2H).
化合物120:6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(4−(メチルスルホニル)ピペラジン−1−イル)エチル)ベンゾ[d]オキサゾール
[M+H]+のLC-MS: 計算値443.2;
実測値: 443.2. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.47 (s, 1H), 7.90-7.86 (m, 2H), 7.75 (d, J =
2.5 Hz, 1H), 7.70 (d, J = 8.3 Hz, 1H), 7.65 (dd, J = 8.2, 1.5 Hz, 1H), 7.23
(dd, J = 10.1, 2.4 Hz, 1H), 6.97 (td, J = 9.6, 2.6 Hz, 1H), 3.15 (t, J = 7.2
Hz, 2H), 3.11 - 3.03 (m, 4H), 2.91 (t, J = 7.2 Hz, 2H), 2.85 (s, 3H), 2.63 -
2.55 (m, 4H).
化合物121:5−(5−クロロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
268.9. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.60 (br s, 1H), 8.76 (s, 1H), 8.01 (d, J = 1.8 Hz, 1H),
7.85 - 7.81 (m, 3H), 7.73 (dd, J = 8.4, 1.8 Hz, 1H), 7.49 (d, J = 8.6 Hz, 1H),
7.18 (dd, J = 8.6, 2.0 Hz, 1H).
化合物122:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(4−メチルピペラジン−1−イル)エタンスルホンアミド
[M+H]+のLC-MS: 計算値472.2;
実測値: 472.8. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.50 (s, 1H), 8.02 (t, J = 6.0 Hz, 1H), 7.96
(d, J = 1.0 Hz, 1H), 7.89 (dd, J = 8.8, 5.4 Hz, 1H), 7.78 - 7.75 (m, 2H), 7.70
(dd, J = 8.3, 1.5 Hz, 1H), 7.24 (dd, J = 9.9, 2.3 Hz, 1H), 6.97 (td, J = 9.6,
2.4 Hz, 1H), 4.55 (d, J = 5.8 Hz, 2H), 3.29 (d, J = 7.8 Hz, 2H), 2.70 - 2.64
(m, 2H), 2.44 - 2.23 (m, 7H), 2.13 (s, 3H).
化合物123:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(ピペラジン−1−イル)エタンスルホンアミド
[M+H]+のLC-MS: 計算値458.2;
実測値: 457.8. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.50 (s, 1H), 7.96 (d, J = 1.0 Hz, 1H), 7.89
(dd, J = 8.8, 5.4 Hz, 1H), 7.80 - 7.74 (m, 2H), 7.70 (dd, J = 8.3, 1.5 Hz, 1H),
7.24 (dd, J = 9.9, 2.3 Hz, 1H), 6.97 (td, J = 9.5, 2.4 Hz, 1H), 4.55 (s, 2H),
3.29 (t, J = 7.6 Hz, 2H), 2.66 - 2.61 (m, 6H), 2.33 - 2.24 (m, 4H).
化合物124:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(ピロリジン−1−イル)エタンスルホンアミド
[M+H]+のLC-MS: 計算値443.2;
実測値: 443.6. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.50 (s, 1H), 8.03 (s, 1H), 7.95 (d, J = 1.0
Hz, 1H), 7.89 (dd, J = 8.8, 5.4 Hz, 1H), 7.79 - 7.74 (m, 2H), 7.70 (dd, J =
8.3, 1.4 Hz, 1H), 7.24 (dd, J = 9.9, 2.4 Hz, 1H), 6.97 (td, J = 9.4, 2.4 Hz,
1H), 4.54 (s, 2H), 3.31 - 3.28 (m, 2H), 2.79 - 2.75 (m, 2H), 2.41 (s, 4H), 1.64
(dt, J = 6.3, 3.0 Hz, 4H).
化合物125:6−(6−フルオロ−1H−インドール−3−イル)−2−((1−メチルピペリジン−4−イル)メチル)ベンゾ[d]オキサゾール
364.1. 1H NMR (400 MHz, DMSO-d6) δ [ppm]:
11.47(s, 1H), 7.89 - 7.86(m, 2H), 7.74(d, J=2.4Hz,1H), 7.70 (d, J=8.4Hz, 1H),
7.64 (dd, J=1.6Hz, J=8.8Hz, 1H), 7.23(dd, J = 2.4Hz, J=9.6Hz, 1H), 6.96 (td, J
= 2.4Hz, J=9.6Hz, 1H), 2.87 (d, J=8.8Hz, 2H), 2.73 (d, J=11.6Hz, 2H), 2.13(s,
3H), 1.88 - 1.81 (m, 3H), 1.68 (d, J=12.8Hz, 2H) 1.36 - 1.28 (m, 2H),
化合物126:N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(4−(メチルスルホンアミド)ピペリジン−1−イル)エタンスルホンアミド
[M+H]+のLC-MS: 計算値550.2;
実測値: 550.7. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.51 (br s, 1H), 8.06 - 8.01 (m, 1H), 7.96
(d, J = 1.0 Hz, 1H), 7.89 (dd, J = 8.8, 5.4 Hz, 1H), 7.80 - 7.75 (m, 2H), 7.70
(dd, J = 8.3, 1.5 Hz, 1H), 7.24 (dd, J = 9.9, 2.4 Hz, 1H), 7.03 - 6.95 (m, 2H),
4.54 (d, J = 5.6 Hz, 2H), 3.30 (s, 2H), 3.08 (br s, 1H), 2.86 (s, 3H), 2.76 -
2.74 (m, 2H), 2.69 - 2.67 (m, 2H), 2.03 - 1.98 (m, 2H), 1.77 - 1.75 (m, 2H),
1.45 -1.40 (m, 2H).
化合物127:N−((6−(6−クロロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド
[M+H]+のLC-MS: 計算値376.0;
実測値: 376.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.58 (br s, 1H), 7.98 - 7.95 (m, 2H), 7.92
(d, J = 8.6 Hz, 1H), 7.83 (d, J = 2.5 Hz, 1H), 7.77 (d, J = 8.4 Hz, 1H), 7.70
(dd, J = 8.3, 1.6 Hz, 1H), 7.51 (d, J = 1.9 Hz, 1H), 7.12 (dd, J = 8.6, 2.0 Hz,
1H), 4.54 (s, 2H), 3.03 (s, 3H).
化合物128:N−((6−(5−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド
[M+H]+のLC-MS: 計算値360.1;
実測値: 360.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.59 (br s, 1H), 8.02 (br t, J = 6.1 Hz, 1H),
7.98 (d, J = 1.6 Hz, 1H), 7.87 (d, J = 2.2 Hz, 1H), 7.76 (d, J = 8.4 Hz, 1H),
7.70 (dd, J = 8.4, 1.6 Hz, 1H), 7.64 (dd, J = 10.6, 2.4 Hz, 1H), 7.47 (dd, J =
8.8, 4.8 Hz, 1H), 7.03 (ddd, J = 9.5, 8.8, 2.4 Hz, 1H), 4.54 (d, J = 6.0 Hz,
2H), 3.04 (s, 3H).
化合物129:5−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)イミダゾリジン−2,4−ジオン
[M-H]-のLC-MS: 計算値363.1;
実測値: 363.1. 1H NMR (400 MHz, MeOH-d4)
δ [ppm]: 7.74-7.71 (m, 2H), 7.60-7.58 (m, 2H), 7.42 (s,
1H), 7.09 (dd, J = 9.6, 2.0 Hz, 1H), 6.81 (td, J = 8.8, 2.4 Hz, 1H), 4.59 (dd,
J = 7.2, 4.8 Hz, 1H), 3.43 (dd, J = 16.4, 4.8 Hz, 1H), 3.27-3.25 (m, 1H).
化合物130:5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]イソチアゾール−3(2H)−オン1,1−ジオキシド
ステップ2:
HCl/EtOAc(10mL、2M)中のtert−ブチル3−(1,1−ジオキシド−3−オキソ−2,3−ジヒドロベンゾ[d]イソチアゾール−5−イル)−6−フルオロ−1H−インドール−1−カルボキシレート(ステップ1、300mg、0.72mmol)の溶液を、60℃で2時間撹拌した。反応混合物をアンモニアでクエンチし、濃縮し、シリカゲルクロマトグラフィー(DCM)により精製して、31mg(14%)の表題化合物を黄色固体として得た。C15H9FN2O3S-H-
[M-H]-のLC-MS: 計算値315.0;
実測値: 315.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.80 (br s, 1H), 8.26 (dd, J = 8.4, 1.6 Hz,
1H), 8.17 (d, J = 1.6 Hz, 1H), 8.12 (d, J = 8.4 Hz, 1H), 8.10 (d, J = 2.4 Hz,
1H), 7.93 (dd, J = 8.8, 5.3 Hz, 1H), 7.28 (dd, J = 9.8, 2.4 Hz, 1H), 7.05 (m,
1H).
化合物131:2−(6−(5−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド
[M-H]-のLC-MS: 計算値324.1;
実測値: 324.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.48 (s, 1H), 11.00 (s, 1H), 9.78 (s, 1H),
7.74 (d, J = 2.6 Hz, 1H), 7.54 (dd, J = 10.4, 2.4 Hz, 1H), 7.45 (dd, J = 8.9,
4.7 Hz, 1H), 7.30 (d, J = 8.1 Hz, 1H), 7.24 (d, J = 1.9 Hz, 1H), 7.12 (dd, J =
8.1, 1.9 Hz, 1H), 7.01 (td, J = 9.1, 2.4 Hz, 1H), 4.28 (s, 2H).
化合物132:5−(6−フルオロ−1H−インドール−3−イル)イソインドリン−1,3−ジオン
[M-H]-のLC-MS: 計算値279.1;
実測値: 279.0. 1H NMR (400 MHz, DMSO-d6)
δ[ppm]: 11.75 (br s, 1H), 11.25 (br s, 1H), 8.14 (d, J
= 8.0 Hz, 1H), 8.06 (s, 1H), 8.05 (s, 1H),7.92 (dd, J = 8.8, 5.2 Hz, 1H), 7.85
(d, J = 7.6 Hz, 1H), 7.27 (dd, J = 9.8, 2.8 Hz, 1H), 7.03 (td, J = 9.3, 2.4 Hz,
1H).
化合物133:6−フルオロ−3−(イソインドリン−5−イル)−1H−インドール
253.1. 1H NMR (400 MHz, MeOD) δ [ppm]:
7.81 - 7.78 (m, 1H), 7.58 (s, 1H), 7.54 (d, J = 7.6 Hz, 1H), 7.45 (s, 1H), 7.35
(d, J = 7.8 Hz, 1H), 7.13 (dd, J = 9.9, 2.4 Hz, 1H), 6.89 (td, J =9.6, 2.4 Hz,
1H), 4.27 (d, J = 10.0 Hz, 4H).
化合物134:6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]イソチアゾール−3(2H)−オン1,1−ジオキシド
[M-H]-のLC-MS: 計算値301.1;
実測値: 301.0. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.60 (s, 1H), 8.03-8.00 (m, 2H), 7.92 (d, J =
2.4 Hz, 1H), 7.88 - 7.86 (m, 2H), 7.86 (s, 1H), 7.62 (d, J = 8.0 Hz, 1H), 7.26
(dd, J = 9.6, 2.0 Hz, 1H), 7.03 - 6.99 (m, 1H), 4.44 (s, 2H).
化合物135:5−(6−フルオロ−1H−インドール−3−イル)−2,3−ジヒドロベンゾ[d]イソチアゾール1,1−ジオキシド
ステップ2:
tert−ブチル3−(1,1−ジオキシド−2,3−ジヒドロベンゾ[d]イソチアゾール−5−イル)−6−フルオロ−1H−インドール−1−カルボキシレート(240mg、0.59mmol)の溶液を、10mLのEA/HClに溶解した。溶液を60℃未満で2時間撹拌した。混合物を濾過し、濾液を真空中で蒸発させた。残留物を分取TLC(EtOAc/石油エーテル=1/3)により精製して、32mg(17%)の最終生成物を黄色固体として得た。C15H11FN2O2S-H- [M-H]-のLC-MS: 計算値301.0; 実測値:
301.0. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.64 (br s, 1H), 7.95 (dd, J = 8.4, 5.6 Hz, 1H), 7.90 -
7.80 (m, 4H), 7.74 (s, 1H), 7.27-7.25 (m, 1H), 7.03 - 6.98 (m, 1H), 4.45 (d, J
= 4.3 Hz, 2H).
化合物136:6−(6−フルオロ−1H−インドール−3−イル)−3−(ピペリジン−4−イル)ベンゾ[d]オキサゾール−2(3H)−オン
[M+H]+のLC-MS: 計算値352.1;
実測値: 352.1. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.42 (br s, 1H), 7.81 (dd, J = 8.8, 5.6 Hz,
1H), 7.68 (d, J = 2.4 Hz, 1H), 7.60 (s, 1H), 7.53 - 7.45 (m, 2H), 7.22 (dd, J =
10.0, 2.4 Hz, 1H), 6.95 (td, J = 9.2, 2.4 Hz, 1H), 4.21 - 4.15 (m, 1H), 3.08
(d, J = 12.0 Hz, 2H), 2.59 (t, J = 12.0 Hz, 2H), 2.19 - 2.07 (m, 3H), 1.76 -
1.72 (m, 2H).
化合物137:(6−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール−5−イル)メタノール
[M+H]+のLC-MS: 計算値297.1;
実測値: 297.1. 1H NMR (400 MHz, DMSO) δ 11.40 (s, 1H), 7.81 (s, 1H), 7.59 (s, 1H), 7.55 (d, J = 2.0 Hz,
1H), 7.41 (dd, J = 8.4, 5.4 Hz, 1H), 7.24 (dd, J = 10.0, 2.4 Hz, 1H), 6.89 (td,
J = 9.6, 2.4 Hz, 1H), 5.19 (t, J = 5.6 Hz, 1H), 4.50 (d, J = 5.6 Hz, 2H), 2.63
(s, 3H).
化合物138:5−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]イソチアゾール−3(2H)−オン1,1−ジオキシド
[M-H]-のLC-MS: 計算値329.0;
実測値: 329.0.
1H NMR
(400 MHz, DMSO-d6) δ [ppm]: 11.86 (br s,
1H), 8.35-8.29 (m, 3H), 8.16 (d, J = 2.4 Hz, 1H), 7.95 (dd, J = 8.6, 5.0 Hz,
1H), 7.29 (dd, J = 9.6, 2.0 Hz, 1H), 7.06-7.05 (m, 1H), 3.19 (s, 3H).
化合物139:2−(2−(cis−3,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
393.2. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.46 (br s, 1H), 7.89 - 7.86 (m, 2H), 7.74 (s, 1H), 7.70
(d, J = 8.3 Hz, 1H), 7.64 (dd, J = 8.2, 1.5 Hz, 1H), 7.23 (dd, J = 9.9, 2.2 Hz,
1H), 6.96 (td, J = 9.3, 2.4 Hz, 1H), 3.11 (t, J = 7.3 Hz, 2H), 2.85 - 2.73 (m,
4H), 2.67 (s, 2H), 1.82 (s, 1H), 1.54 (t, J = 10.3 Hz, 2H), 0.91 (d, J = 6.3
Hz, 6H).
化合物140:1−(2−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)エチル)ピペリジン−4−オール
[M + H]+のLC-MS: 計算値380.2;
実測値: 380.2. 1H NMR (400 MHz, DMSO-d6)
δ [ppm]: 11.46 (br s 1H), 7.90-7.86 (m, 2H), 7.74 (d, J
= 2.5 Hz, 1H), 7.70 (d, J = 8.4 Hz, 1H), 7.64 (dd, J = 8.2, 1.5 Hz, 1H), 7.23
(dd, J = 10.0, 2.4 Hz, 1H), 6.96-6.93 (m, 1H), 4.51 (s,1H), 3.34 - 3.29 (m,
1H), 3.12 - 3.08 (m, 2H), 2.83 - 2.75 (m, 4H), 2.14 - 2.11 (m, 2H), 1.71
- 1.62 (m, 2H), 1.39 - 1.30 (m, 2H).
化合物141:2−(2−(trans−2,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
10.0, 2.4 Hz, 1H), 6.77 (td, J = 9.2, 2.4 Hz, 1H), 3.25-3.19 (m, 1H), 3.05-3.00
(m, 2H), 2.85-2.79 (m, 2H), 2.78-2.67 (m, 2H), 2.36-2.21 (m, 1H), 2.20 (s, 1H),
2.04 (t, J = 10.9 Hz, 1H), 1.10 (m, 6H).
化合物142:(+)−2−(2−((3R,5R)−3,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
C23H25FN4O
+H+ [M+H]+のLC-MS: 計算値: 393.2; 実測値: 393.2
1H NMR
(300 MHz, DMSO-d6) δ [ppm]: 11.46 (br s,
1H), 7.90-7.85 (m, 2H), 7.74 (d, J = 1.8 Hz, 1H), 7.69 (d, J = 8.1 Hz, 1H),
7.64 (dd, J = 8.1, 1.8 Hz, 1H), 7.23 (dd, J = 9.6, 2.4 Hz, 1H), 6.96 (td, J =
9.6, 2.4 Hz, 1H), 3.12-3.00 (m, 2H), 2.99-2.95 (m, 2H), 2.81-2.68 (m, 2H),
2.43-2.38 (m, 2H), 2.11-2.08 (m, 2H), 1.68 (brs, 1H), 0.95 (d, J = 6.6 Hz, 6H).
[α]20 D
+10.9° (c=0.2,MeOH).
化合物143:2−(2−(2,6−ジアザスピロ[3.3]ヘプタン−2−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
376.8. 1H NMR (400 MHz, DMSO-d6) δ [ppm]: 11.50 (br s, 1H), 7.90-7.86 (m, 2H), 7.75 (s, 1H), 7.71-7.63
(m, 2H), 7.23 (dd, J = 10.0, 2.4 Hz, 1H), 6.96 (td, J = 18.8, 2.0 Hz, 1H), 3.82
(s, 2H), 3.48 (s, 2H), 3.20 (s, 4H), 2.94-2.90 (m, 2H), 2.83-2.81 (m, 2H).
化合物144:(−)−2−(2−((3S,5S)−3,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール
C23H25FN4O+H+
[M+H]+のLC-MS: 計算値: 393.2; 実測値: 393.2
1H NMR
(400 MHz, DMSO-d6) δ [ppm]: 11.48 (br s,
1H), 7.89-7.86 (m, 2H), 7.75 (d, J = 2.4 Hz, 1H), 7.67 (d, J = 13.6 Hz, 2H),
7.24 (dd, J = 10.0, 2.0 Hz, 1H), 6.96 (td, J = 9.6, 2.4 Hz, 1H), 3.12-3.00 (m,
2H), 3.00-2.98 (m, 2H), 2.80-2.77 (m, 2H), 2.43-2.40 (m, 2H), 2.12-2.10 (m,
2H), 1.68 (brs, 1H), 0.97 (d, J = 6.4 Hz, 6H).
化合物145:4−(2−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)エチル)ピペラジン−2−カルボン酸
[M + H]+のLC-MS: 計算値:
409.2; 実測値: 408.8. 1H NMR (400 MHz,
DMSO-d6) δ [ppm]: 11.51 (br s, 1H), 7.90 -
7.87 (m, 2H), 7.75 (s, 1H), 7.71 (d, J = 8.4 Hz, 1H), 7.65 (d, J = 8.0 Hz, 1H),
7.24 (d, J = 10.4 Hz, 1H), 6.96 (t, J = 9.6 Hz, 1H), 3.34-3.09 (m, 5H), 3.05
(d, J = 11.6 Hz, 1H), 2.92-2.87 (m, 3H), 2.78 (t, J = 11.6 Hz, 1H), 2.27 -2.18
(m, 2H).
化合物146:3−(ベンゾフラン−6−イル)−6−フルオロ−1H−インドール
=8.8, 5.2 Hz, 1H), 7.84 (s, 1H), 7.55 (d, J = 2.4 Hz, 1H), 7.70 (d, J = 8.0 Hz,
1H), 7.59 (d, J = 8.0 Hz, 1H), 7.24 (dd, J = 9.8, 2.4 Hz, 1H), 6.97 (td,
J = 9.2, 2.4 Hz, 2H).
II.生物学実施例
II.1.TDO2酵素活性を求めるアッセイ
式Iの化合物は、ヒトTDO2の酵素活性を阻害する。
II.1.TDO2酵素活性を求めるアッセイ
式Iの化合物は、ヒトTDO2の酵素活性を阻害する。
TDO2活性を測定するために、Dolusicら、J.Med.Chem.、2011、54、5320〜533に記載の手順を適合させた。反応混合物は、リン酸カリウム緩衝液(50mM、pH7.5)、アスコルビン酸(0.25M)、メチレンブルー(0.125μM)、カタラーゼ(40単位/mL、ウシ肝臓由来、Sigma)、およびヒト組換えTDO2酵素(Dolusicら、J.Med.Chem.、2011、54、5320〜5334に記載のとおりに調製したもの、0.9μg)を、本発明の化合物なしでまたは示した濃度の本発明の化合物と共に含有していた(最終濃度)(総体積112.5μL)。室温で37.5μLのL−Trp(最終濃度1mM)を加えることにより、反応を開始した。反応は、室温で1時間実施し、30μLの30%(w/v)トリクロロ酢酸を加えて停止させた。
N−ホルミルキヌレニンをキヌレニンに変換するために、反応混合物を65℃で30分間インキュベートした。次いで、150μLの反応混合物を酢酸中2.5%(w/v)の4−(ジメチルアミノ)−ベンズアルデヒド120μLと混合し、室温で5分間インキュベートした。480nmで吸光度を測定することによりキヌレニン濃度を求めた。純粋なキヌレニンで検量線を作成した。10段階の濃度の本発明の化合物を使用して、上述のとおりにTDO活性を測定した。Prism(商標)ソフトウェア(GraphPad Software,Inc.)を使用し、標準のパラメーターを用いてデータを当てはめた。
代表的な化合物の生物学的活性を以下の表に要約する。
一実施形態では、IC50が2000nm未満である化合物、好ましくは、IC50が1000nm未満である化合物が選択される。
II.2.TDO2活性を求める細胞アッセイ
II.2.a hTDO2を過剰発現するP815細胞
式Iの化合物は、細胞においてヒトTDO2の活性を阻害する。
II.2.a hTDO2を過剰発現するP815細胞
式Iの化合物は、細胞においてヒトTDO2の活性を阻害する。
hTDO2を過剰発現するネズミ肥満細胞腫P815細胞(Pilotteら、PNAS、2012、109(7)、2497〜2502に記載のとおりに調製したもの)を、最終体積200μL中に5×104細胞/ウェルの濃度で播いた96ウェル平底プレートにおいて、アッセイ(Pilotte Lら、Proc Natl Acad Sci USA、2012、109(7)、2497〜502を適合させたもの)を行った。TDOまたはIDO活性を求めるために、2%のFBSおよび2%のペニシリン/ストレプトマイシンを補充したIMDM(Invitrogen)中で、異なる濃度の本発明の化合物の存在下、細胞を37℃、5%CO2で終夜インキュベートした。細胞は、アメリカ培養細胞系統保存機関から[ATCC(登録商標)TIB−64(商標)、または市販品として、たとえば、Sigma−AldrichもしくはLife Technologies]から入手することができる。
次いで、プレートを1000rpmで5分間遠心分離し、上清100μLをコニカルプレートに集め、30uLのTCA30%を加え、3000×gで10分間さらに遠心分離した。上清100μLを、酢酸中2%(w/v)の4−(ジメチルアミノ)−ベンズアルデヒド100μLを含む平底プレートに集め、室温で5分間インキュベートした。480nmで吸光度を測定することによりキヌレニン濃度を求めた。純粋なキヌレニンで検量線を作成した。10段階の濃度の本発明の化合物を使用して、上述のとおりにTDO活性を測定した。Prism(商標)ソフトウェア(GraphPad Software,Inc.)を使用し、標準のパラメーターを用いてデータを当てはめた。
代表的な化合物の生物学的活性を以下の表に要約する。
一実施形態では、IC50が2000nm未満である化合物が選択される。別の実施形態では、IC50が1000nm未満である化合物が選択される。
II.2.b A172細胞
式Iの化合物は、A172細胞などの、TDO2を構成的に発現する細胞において、ヒトTDO2の活性を阻害する。A172は、ヒト脳神経膠芽腫細胞由来の細胞株である。この細胞は、アメリカ培養細胞系統保存機関(ATCC(登録商標))からCRL−1620(商標)として入手可能である。
式Iの化合物は、A172細胞などの、TDO2を構成的に発現する細胞において、ヒトTDO2の活性を阻害する。A172は、ヒト脳神経膠芽腫細胞由来の細胞株である。この細胞は、アメリカ培養細胞系統保存機関(ATCC(登録商標))からCRL−1620(商標)として入手可能である。
hTDO2を自然発現するヒト神経膠芽腫A172細胞(Tilmanら、Mol Cancer、2007、17(6)、80に記載のとおりに調製したもの)を、最終体積200μL中に1.25×104細胞/ウェルの濃度で播いた、96ウェル平底プレートにおいて、アッセイ(Pilotte Lら、Proc Natl Acad Sci USA、2012、109(7)、2497〜502を適合させたもの)を行った。TDOを求めるために、2%のFBSおよび2%のペニシリン/ストレプトマイシンを補充したIMDM(Invitrogen)中で、異なる濃度の本発明の化合物の存在下、細胞を37℃、5%CO2で終夜インキュベートした。
次いで、プレートを1000rpmで5分間遠心分離し、上清100μLをコニカルプレートに集め、30uLのTCA30%を加え、3000×gで10分間さらに遠心分離した。上清100μLを平底プレートおよび酢酸中2%(w/v)の4−(ジメチルアミノ)−ベンズアルデヒド100μLに集め、室温で5分間インキュベートした。480nmで吸光度を測定することによりキヌレニン濃度を求めた。純粋なキヌレニンで検量線を作成した。10段階の濃度の本発明の化合物を使用して、上述のとおりにTDO活性を測定した。Prism(商標)ソフトウェア(GraphPad Software,Inc.)を使用し、標準のパラメーターを用いてデータを当てはめた。
代表的な化合物の生物学的活性を以下の表に要約する。
一実施形態では、IC50が2000nm未満である化合物が選択される。別の実施形態では、IC50が1000nm未満である化合物が選択される。
II.3. TDO2のin vivo活性を求める薬力学アッセイ:マウスにおける血中トリプトファンレベルの増大
本発明の化合物は、マウス血液中のトリプトファンの量を増加させる。簡潔に述べると、雌のBALB/cマウス(7〜8週齢)を、異なる用量(30、60、および100mg/kg)の、本発明の化合物の1種を0.5%ヒドロキシプロピルメチルセルロース(HPMC)K4M(4000mPa・s(cPs)、Methocell(商標)、Dow chemical)/0.25%Tween(登録商標)20(Signma Aldrich)に懸濁させた懸濁液、またはビヒクル対照(0.5%HPMC K4M/0.25%Tween 20)のいずれかで、経管栄養による経口経路によって処置した(投与体積5mL/kg、1群あたり10匹のマウス)。2時間後、血液を採取し、血漿を準備し、存在するトリプトファンの量を、LC−MS−MS(HPLCカラムUnison UK−Phenyl、75×4.6、3μm、流量0.8mL/分、95%の水+0.1%ギ酸/5%のアセトニトリル+0.1%ギ酸から5%の水+0.1%ギ酸/95%のアセトニトリル+0.1%ギ酸への8分での勾配、保持時間2.4分;AB SciexのAPI4000 MS−MSシステム、ESI+モード、親イオン205.1、娘イオン146.1)によって求めた。
本発明の化合物は、マウス血液中のトリプトファンの量を増加させる。簡潔に述べると、雌のBALB/cマウス(7〜8週齢)を、異なる用量(30、60、および100mg/kg)の、本発明の化合物の1種を0.5%ヒドロキシプロピルメチルセルロース(HPMC)K4M(4000mPa・s(cPs)、Methocell(商標)、Dow chemical)/0.25%Tween(登録商標)20(Signma Aldrich)に懸濁させた懸濁液、またはビヒクル対照(0.5%HPMC K4M/0.25%Tween 20)のいずれかで、経管栄養による経口経路によって処置した(投与体積5mL/kg、1群あたり10匹のマウス)。2時間後、血液を採取し、血漿を準備し、存在するトリプトファンの量を、LC−MS−MS(HPLCカラムUnison UK−Phenyl、75×4.6、3μm、流量0.8mL/分、95%の水+0.1%ギ酸/5%のアセトニトリル+0.1%ギ酸から5%の水+0.1%ギ酸/95%のアセトニトリル+0.1%ギ酸への8分での勾配、保持時間2.4分;AB SciexのAPI4000 MS−MSシステム、ESI+モード、親イオン205.1、娘イオン146.1)によって求めた。
以下の表に明示されるとおり、化合物110では、ビヒクルで処置した対照に比べて、循環トリプトファンが30mg/kgで46%(p<0.0001)、60mg/kgで52%(p<0.0001)、100mg/kgで78%(p<0.0001)増加した。
血漿中のトリプトファン濃度(平均±平均値の標準誤差、nM):
本明細書で引用したすべての刊行物、ならびに2014年3月18日出願の米国仮特許出願第61/996,975号を含めた優先権出願は、参照により本明細書に援用される。本発明について特定の実施形態に関連して述べてきたが、本発明の真意から逸脱することなく、変更がなされてもよいことは理解されよう。そのような変更は、添付の特許請求の範囲内にあるものとする。
Claims (30)
- 式Iの化合物
X1およびX2は、それぞれ独立に、H、ハロゲン、アルキル、またはハロアルキルを表し、
R1、R2、およびR3は、それぞれ独立に、H、ハロゲン、C1〜C6アルキル、アルコキシ、またはハロアルキルを表し、これらは、ハロゲン、ヒドロキシル、OR4、COOR4、CONR4R5、NR4COR5、NR4R5、SO2R4、SO2NR4R5、NR4SO2R5、SO2R4、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルから選択される1つまたは複数の置換基で置換されていてもよく、R4およびR5は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、
A1、A2、およびA3は、それぞれ独立に、C、N、S、またはOを表し、A1、A2、またはA3がSである場合、A1−Y1、A2−Y2、またはA3−Y3は、SO2であってもよく、
Y1、Y2、およびY3のそれぞれは、不在であるか、または独立に、
e)水素原子、
f)オキソ、
g)SH、
h)CR6R7R8、NR6R7、およびOR6
を表し、R6、R7、およびR8は、それぞれ独立に、
i)水素原子、
ii)ハロゲン、
iii)ヒドロキシル、
iv)OR9もしくはNR9R10[R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、アミノ、CO−アルキル、もしくはSO2R11から選択される置換されていてもよい基を表し、R11は、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、ヒドロキシル、もしくはアミノから選択される置換されていてもよい基を表す]、
v)直鎖もしくは分岐C1〜C10アルキル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、またはCO−アルキルから選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、ヘテロシクリル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]、
vi)ヘテロシクリルまたはC1〜C2アルキル−ヘテロシクリル[ヘテロシクリルは、3つまでの置換基ハロゲン、ヒドロキシル、オキソ、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、またはアルキルで置換されていてもよく、アルキル基は、ハロゲン、ヒドロキシル、アミノ、またはCOOHから選択される1つまたは複数の基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]、
vii)−CO−R11もしくは−SO2R11[R11は、ヒドロキシ、アミン、アルキル、ヘテロシクリルから選択される基を表し、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SOR9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]
を表し、
viii)Y1、Y2、もしくはY3がCR6R7R8である場合、R6、R7、およびこれらが結合している炭素原子は、一緒になって、
シクロアルキル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルから選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]もしくは
ヘテロシクリル[ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R10、SO2R9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つまたは複数の基で置換されていてもよいC1〜C6アルキルを含む群から選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、またはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表す]
から選択される環を形成していてもよく、または
ix)Y1、Y2、もしくはY3がNR6R7である場合、R6、R7、およびこれらが結合している窒素原子は、一緒になって、環を形成していてもよく、環は、ハロゲン、ヒドロキシル、OR9、COOR9、CONR9R10、NR9COR10、NR9R10、SO2R9、SO2NR9R10、NR9SO2R11、SO2R9、アリール、CO−アルキル、または、ハロゲン、ヒドロキシル、アミノもしくはCOOHから選択される1つもしくは複数の基で置換されていてもよいC1〜C6アルキルから選択される3つまでの置換基で置換されていてもよく、R9およびR10は、それぞれ独立に、水素原子、もしくはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、R11は、水素原子、もしくはアリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、もしくはR11は、ハロゲン、ヒドロキシル、OR12、COOR12、CONR12R13、NR12COR13、NR12R13、SO2R12、SO2NR12R13、NR12SO2R13、SO2R12、もしくはアリールから選択される3つまでの置換基で置換されていてもよいアルキル基を表し、R12およびR13は、それぞれ独立に、水素原子、もしくはC1〜C6アルキル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、もしくはアミノから選択される置換されていてもよい基を表し、
点線は、単結合または二重結合を表し、
但し、A1、A2、およびA3は、すべてがCになることはなく、
但し、A1およびA3のうちの1つがNである場合、他の2つは、両方ともがCになることはなく、但し、A1、A2、およびA3のうちの1つがSである場合、1つだけSが存在し、少なくとも1つのCが存在し、他はCまたはNであり、
但し、式Iの化合物は、3−(ベンゾフラン−5−イル)−6−クロロ−1H−インドールまたは3−(ベンゾ[d][1,3]ジオキソール−5−イル)−1H−インドールではない]。 - X1およびX2が、独立に、HまたはFである、請求項1に記載の化合物。
- R1、R2、およびR3が、それぞれ独立に、H、ハロゲン、またはメチルを表す、請求項2に記載の化合物。
- R1、R2、およびR3が、それぞれHである、請求項1または請求項2に記載の化合物。
- R6、R7、またはR8がハロゲンを表す場合、ハロゲンがFである、請求項1から4のいずれか一項に記載の化合物。
- R6、R7、またはR8がヘテロシクリルまたはC1−ヘテロシクリルである場合、ヘテロシクリルが、ピペリジン、ピロリジン、ピペラジン、モルホリン、または2,6−ジアザスピロ[3.3]ヘプタンであり、これらのいずれもが、C1〜C3アルキル、アミノ、ヒドロキシル、ハロゲン、COCH3、COOH、またはSO2CH3のうちの1つまたは複数で置換されていてもよい、請求項1から4のいずれか一項に記載の化合物。
- R6、R7、またはR8がC1〜C10アルキルである場合、アルキルが、メチル、エチル、またはプロピルである、請求項1から4のいずれか一項に記載の化合物。
- R11がヘテロ環である場合、ヘテロ環が、ピペリジン、ピロリジン、ピペラジン、またはテトラヒドロチオピランジオキシドである、請求項1に記載の化合物。
- R6、R7、およびこれらが結合している炭素原子が、ヘテロ環である環を形成している場合、ヘテロ環が、モルホリン、ピペラジン、またはピペリジンであり、これらのいずれもが置換されていてもよい、請求項1に記載の化合物。
- R6、R7、およびこれらが結合している窒素原子が、ヘテロシクリル環を形成している、請求項1に記載の化合物。
- ヘテロ環が、モルホリン、ピペラジン、またはピペリジンであり、これらのいずれもが置換されていてもよい、請求項10に記載の化合物。
- A1、A2、およびA3のうちの最初の1つがNであり、A1、A2、およびA3のうちの二つ目のものがCであり、A1、A2、およびA3のうちの三つ目のものがNまたはOである、請求項1から11のいずれか一項に記載の化合物。
- A2がNであり、A1およびA3の一方がNまたはSであり、他方がCである、請求項1から12のいずれか一項に記載の化合物。
- A1またはA3がSである場合、A1−Y1またはA3−Y3がSO2である、請求項13に記載の化合物。
- A2がCであり、A1およびA3の一方がNであり、他方がNまたはOである、請求項1から11のいずれか一項に記載の化合物。
- A1またはA3がOであり、A1、A2、またはA3のうちの別のものが、CR6R7R8で置換されているCであり、R6、R7、またはR8が、ヘテロシクリルまたはC1〜C2アルキル−ヘテロシクリルであり、ヘテロシクリルが、ピペリジン、ピロリジン、ピペラジン、モルホリン、またはアゼチジンで置換されているアゼチジンであり、これらのいずれもが、C1〜C3アルキル、アミノ、ヒドロキシル、ハロゲン、COCH3、COOH、またはSO2CH3のうちの1つまたは複数で置換されていてもよい、請求項15に記載の化合物。
- A1、A2、またはA3のうちの1つがSであり、またはA1−Y1、A2−Y2、もしくはA3−Y3がSO2であり、A1、A2、またはA3のうちの1つがNまたはCであり、A1、A2、およびA3のうちの1つがCである、請求項1から11のいずれか一項に記載の化合物。
- − 6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール;
− 2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)アセトアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール;
− 1−(4−((6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−イル)エタノン;
− 3−(6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール;
− 1−(4−(6−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−イル)エタノン;
− 5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール;
− 2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)アセトアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イルメチル)−1H−インダゾール;
− 1−(4−((5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)メチル)ピペリジン−1−イル)エタノン;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)−1−(ピペリジン−4−イル)−1H−インダゾール;
− 1−(4−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)ピペリジン−1−イル)エタノン;
− 2−(6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)アセトアミド;
− 1−(4−((6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−イル)エタノン;
− 3−(6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール;
− 1−(4−(6−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−イル)エタノン;
− 2−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)アセトアミド;
− 1−(4−((5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)メチル)ピペリジン−1−イル)エタノン;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)プロパンアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−2H−インダゾール;
− 1−(4−(5−(6−フルオロ−1H−インドール−3−イル)−2H−インダゾール−2−イル)ピペリジン−1−イル)エタノン;
− 5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−メチル−1H−ベンゾ[d]イミダゾール;
− (5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メタンアミン;
− 1−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)−N,N−ジメチルメタンアミン;
− 2−(((5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アミノ)エタノール;
− N−((5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アセトアミド;
− 2−アミノ−N−((5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)アセトアミド;
− N−((5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)メタンスルホンアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)−1H−ベンゾ[d]イミダゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−((4−(メチルスルホニル)ピペラジン−1−イル)メチル)−1H−ベンゾ[d]イミダゾール;
− 2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エタンアミン;
− N−(2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エチル)アセトアミド;
− N−(2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)エチル)メタンスルホンアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)−1H−ベンゾ[d]イミダゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)−1H−ベンゾ[d]イミダゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(1−(メチルスルホニル)ピペリジン−4−イル)−1H−ベンゾ[d]イミダゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−アミン;
− N−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)アセトアミド;
− N−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メタンスルホンアミド;
− 1−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)−N−メチルメタンアミン;
− 4−((5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)メチル)モルホリン;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)プロパンアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)ベンゾ[d]オキサゾール;
− 1−(4−(5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)ピペリジン−1−イル)エタノン;
− N−(5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)アセトアミド;
− N−(5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンスルホンアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イル)ベンゾ[d]オキサゾール;
− 1−(4−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)ピペリジン−1−イル)エタノン;
− N−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)アセトアミド;
− N−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンスルホンアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)−1H−ベンゾ[d]イミダゾール;
− 2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2−イル)アセトアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)ベンゾ[d]オキサゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)ベンゾ[d]オキサゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(モルホリノメチル)ベンゾ[d]オキサゾール;
− 2−(6−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−2(3H)−オン;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(モルホリノメチル)ベンゾ[d]オキサゾール;
− 3−(6−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)プロパンアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−((4−メチルピペラジン−1−イル)メチル)ベンゾ[d]オキサゾール;
− 2−(5−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド;
− N−((5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)プロパンアミド;
− 3−(ベンゾ[b]チオフェン−5−イル)−6−フルオロ−1H−インドール;
− N−((5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)アセトアミド;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)アセトアミド;
− (6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンアミン;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)−2H−インダゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペラジン−1−イルメチル)ベンゾ[d]オキサゾール;
− 3−(ベンゾ[b]チオフェン−6−イル)−6−フルオロ−1H−インドール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)ベンゾ[d]オキサゾール;
− (5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メタンアミン;
− 3−(ベンゾフラン−5−イル)−6−フルオロ−1H−インドール;
− 3−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)プロパンアミド;
− 2−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)アセトアミド;
− 2−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)アセトアミド;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−1−モルホリノプロパン−1−オン;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−1−(4−メチルピペラジン−1−イル)プロパン−1−オン;
− N−(2−(ジメチルアミノ)エチル)−3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)プロパンアミド;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−N−(2−ヒドロキシエチル)プロパンアミド;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−N−(2−(メチルスルホニル)エチル)プロパンアミド;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−インダゾール−1−イル)−1−(ピペラジン−1−イル)プロパン−1−オン;
− 6−(6−フルオロ−1H−インドール−3−イル)インドリン−2−オン;
− 3−(6−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)プロパンアミド;
− 3−(5−(6−フルオロ−1H−インドール−3−イル)−1H−ベンゾ[d]イミダゾール−1−イル)プロパンアミド;
− 1−(4−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)ピペリジン−1−イル)エタノン;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(1−(メチルスルホニル)ピペリジン−4−イル)ベンゾ[d]オキサゾール;
− 5−(6−フルオロ−1H−インドール−3−イル)インドリン−2−オン;
− 6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−アミン;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−メトキシエタンスルホンアミド;
− 2−(ジメチルアミノ)−N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)エタンスルホンアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(メチルスルホニル)エチル)ベンゾ[d]オキサゾール;
− 1−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)尿素;
− 1−カルバモイル−1−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)尿素;
− 5−(1H−インドール−3−イル)−1H−インダゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(4−メチルピペラジン−1−イル)エチル)ベンゾ[d]オキサゾール;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−ヒドロキシエタンスルホンアミド;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−モルホリノエタンスルホンアミド;
− 6−(1H−インドール−3−イル)−1H−インダゾール;
− 6−(1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(ピペラジン−1−イル)エチル)ベンゾ[d]オキサゾール;
− 5−(6−クロロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−チオール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(ピペリジン−4−イルメチル)ベンゾ[d]オキサゾール;
− N−((6−(1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド;
− (S)−N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−1−メチルピロリジン−2−カルボキサミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−メトキシベンゾ[d]オキサゾール;
− アミノ{[6−(6−フルオロインドール−3−イル)ベンゾオキサゾール−2−イル]メチル}スルホンアミド;
− 5−(1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−((1−(メチルスルホニル)ピペリジン−4−イル)メチル)ベンゾ[d]オキサゾール;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−(2−(4−(メチルスルホニル)ピペラジン−1−イル)エチル)ベンゾ[d]オキサゾール;
− 5−(5−クロロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(4−メチルピペラジン−1−イル)エタンスルホンアミド;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(ピペラジン−1−イル)エタンスルホンアミド;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(ピロリジン−1−イル)エタンスルホンアミド;
− 6−(6−フルオロ−1H−インドール−3−イル)−2−((1−メチルピペリジン−4−イル)メチル)ベンゾ[d]オキサゾール;
− N−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)−2−(4−(メチルスルホンアミド)ピペリジン−1−イル)エタンスルホンアミド;
− N−((6−(6−クロロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド;
− N−((6−(5−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)メタンスルホンアミド
− 5−((6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)メチル)イミダゾリジン−2,4−ジオン;
− 5−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]イソチアゾール−3(2H)−オン1,1−ジオキシド;
− 2−(6−(5−フルオロ−1H−インドール−3−イル)−2−オキソベンゾ[d]オキサゾール−3(2H)−イル)アセトアミド;
− 5−(6−フルオロ−1H−インドール−3−イル)イソインドリン−1,3−ジオン;
− 6−フルオロ−3−(イソインドリン−5−イル)−1H−インドール;
− 6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]イソチアゾール−3(2H)−オン1,1−ジオキシド;
− 5−(6−フルオロ−1H−インドール−3−イル)−2,3−ジヒドロベンゾ[d]イソチアゾール1,1−ジオキシド;
− 6−(6−フルオロ−1H−インドール−3−イル)−3−(ピペリジン−4−イル)ベンゾ[d]オキサゾール−2(3H)−オン;
− (6−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]オキサゾール−5−イル)メタノール;
− 5−(6−フルオロ−1H−インドール−3−イル)−2−メチルベンゾ[d]イソチアゾール−3(2H)−オン1,1−ジオキシド;
− 2−(2−(cis−3,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 1−(2−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)エチル)ピペリジン−4−オール;
− 2−(2−(trans−2,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− (+)−2−(2−((3R,5R)−3,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 2−(2−(2,6−ジアザスピロ[3.3]ヘプタン−2−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− (−)−2−(2−((3S,5S)−3,5−ジメチルピペラジン−1−イル)エチル)−6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール;
− 4−(2−(6−(6−フルオロ−1H−インドール−3−イル)ベンゾ[d]オキサゾール−2−イル)エチル)ピペラジン−2−カルボン酸;または
− 3−(ベンゾフラン−6−イル)−6−フルオロ−1H−インドール
からなる群から選択される、請求項1に記載の化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物。 - 請求項1から18のいずれか一項に記載の化合物または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物と、薬学的に許容できる少なくとも1種の担体、希釈剤、医薬添加剤、および/またはアジュバントとを含む医薬組成物。
- 請求項1から18のいずれか一項に記載の化合物または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物を含む医薬。
- がん、パーキンソン病、アルツハイマー病、ハンチントン病などの神経変性障害、HCVおよびHIVなどの慢性ウイルス感染症、うつ病、ならびに肥満の治療および/または予防において使用するための、請求項1から18のいずれか一項に記載の化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物。
- 前記がんが、膀胱癌、肝臓癌、黒色腫、中皮腫、神経芽細胞腫、肉腫、乳癌、白血病、腎細胞癌、結腸直腸癌、頭頸部癌、肺癌、脳腫瘍、神経膠芽腫、星状細胞腫、骨髄腫、膵臓癌からなる群から選択される、請求項21に記載の化合物。
- TDO2阻害薬として使用するための、請求項1から18のいずれか一項に記載の化合物、または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物。
- がん、パーキンソン病、アルツハイマー病、ハンチントン病などの神経変性障害、HCVおよびHIVなどの慢性ウイルス感染症、うつ病、ならびに肥満を治療および/もしくは予防する、またはTD02を阻害する方法であって、請求項1から18のいずれかに記載の化合物を、それを必要とする対象に投与することを含む方法。
- 前記がんが、膀胱癌、肝臓癌、黒色腫、中皮腫、神経芽細胞腫、肉腫、乳癌、白血病、腎細胞癌、結腸直腸癌、頭頸部癌、肺癌、脳腫瘍、神経膠芽腫、星状細胞腫、骨髄腫、および膵臓癌からなる群から選択される、請求項24に記載の方法。
- 請求項1から18に記載の式Iの化合物または薬学的に許容できるその鏡像異性体、塩、もしくは溶媒和物の製造方法であって、
(a1)式(i)の化合物
X1およびX2は、それぞれ独立に、H、ハロゲン、アルキル、ハロアルキルを表し、
Z1は、Hまたはアミノ保護基を表し、
Yは、ハロゲン、1〜6個の炭素原子を有するアルキルスルホニルオキシ、または6〜10個の炭素原子を有するアリールスルホニルオキシを表す]を、
式(ii)の化合物
R1、R2、R3、A1、A2、A3、Y1、Y2、およびY3は、請求項1で規定されており、
Z2およびZ3は、Hまたはアルキル基を表すか、Z2およびZ3は、環を形成していてもよい]と反応させて、
式(iii)の化合物
(b1)Z1がHでない場合、式(iii)の化合物のインドールアミンを脱保護して、式Iの化合物を得るステップと
を含むことを特徴とする製造方法。 - Z1のアミノ保護基が、アリールスルホニル、tert−ブトキシカルボニル、メトキシメチル、パラメトキシベンジル、またはベンジルである、請求項26に記載の方法。
- Yがハロゲンである場合、Yが、ヨウ素、臭素、または塩素である、請求項26または請求項27に記載の方法。
- Yがアルキルスルホニルである場合、Yが、メチルスルホニルオキシまたはトリフルオロメチルスルホニルオキシである、請求項26または請求項27に記載の方法。
- Yがアリールスルホニルである場合、Yが、フェニル−またはp−トリルスルホニルオキシである、請求項26または請求項27に記載の方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461996975P | 2014-03-18 | 2014-03-18 | |
| EP14160578.2 | 2014-03-18 | ||
| US61/996,975 | 2014-03-18 | ||
| EP14160578 | 2014-03-18 | ||
| BEBE2014/0776 | 2014-11-06 | ||
| BE2014/0776A BE1021253B1 (fr) | 2014-03-18 | 2014-11-06 | Nouveaux derives substitues de 3-indol, compositions pharmaceutiques et methode d'utilisation |
| PCT/IB2015/051957 WO2015140717A1 (en) | 2014-03-18 | 2015-03-17 | Novel 3-indol substituted derivatives, pharmaceutical compositions and methods for use |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2017507983A true JP2017507983A (ja) | 2017-03-23 |
Family
ID=54143823
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016557605A Pending JP2017507983A (ja) | 2014-03-18 | 2015-03-17 | 新規な3−インドール置換誘導体、医薬組成物、および使用方法 |
Country Status (4)
| Country | Link |
|---|---|
| EP (1) | EP3119763A1 (ja) |
| JP (1) | JP2017507983A (ja) |
| CA (1) | CA2942761A1 (ja) |
| WO (1) | WO2015140717A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018511587A (ja) * | 2015-03-17 | 2018-04-26 | ファイザー・インク | 新奇な3−インドール置換誘導体、医薬組成物、および使用方法 |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2948842C (en) | 2014-05-15 | 2019-09-24 | Iteos Therapeutics | Pyrrolidine-2,5-dione derivatives, pharmaceutical compositions and methods for use as ido1 inhibitors |
| ME03334B (me) | 2014-06-19 | 2019-10-20 | Ariad Pharma Inc | Heteroarilna jedinjenja za inhibiciju kinaza |
| JP2018052817A (ja) * | 2015-01-21 | 2018-04-05 | 大日本住友製薬株式会社 | 新規ベンズイミダゾール誘導体およびその医薬用途 |
| IL293719B2 (en) | 2015-05-21 | 2023-07-01 | Harpoon Therapeutics Inc | Trispecific binding proteins and methods of use |
| CA2994917A1 (en) | 2015-08-10 | 2017-02-16 | Pfizer Inc. | 3-indol substituted derivatives, pharmaceutical compositions and methods for use |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| EP3269714A1 (en) | 2016-07-13 | 2018-01-17 | Netherlands Translational Research Center B.V. | Inhibitors of tryptophan 2,3-dioxygenase |
| CN109952300B (zh) | 2016-09-24 | 2022-01-18 | 百济神州有限公司 | 5或8-取代的咪唑并[1,5-a]吡啶 |
| AU2018265856B2 (en) | 2017-05-12 | 2023-04-27 | Harpoon Therapeutics, Inc. | Mesothelin binding proteins |
| BR112019018759A2 (pt) | 2017-05-30 | 2020-05-05 | Bristol-Myers Squibb Company | composições compreendendo uma combinação de um anticorpo anti-lag-3, um inibidor da via pd-1, e um agente imunoterápico |
| IL315737A (en) | 2017-10-13 | 2024-11-01 | Harpoon Therapeutics Inc | B-cell maturation antigen-binding proteins |
| PL3752501T3 (pl) | 2018-02-13 | 2023-08-21 | Gilead Sciences, Inc. | Inhibitory pd-1/pd-l1 |
| TWI712412B (zh) | 2018-04-19 | 2020-12-11 | 美商基利科學股份有限公司 | Pd‐1/pd‐l1抑制劑 |
| JP2021523208A (ja) | 2018-05-14 | 2021-09-02 | アリアド ファーマシューティカルズ, インコーポレイテッド | ピリミジン誘導体の医薬塩及び障害の処置方法 |
| CN108586432B (zh) * | 2018-05-31 | 2020-08-25 | 温州医科大学 | 一种3-(吲哚-5-基)-吲唑衍生物及其应用 |
| US10774071B2 (en) | 2018-07-13 | 2020-09-15 | Gilead Sciences, Inc. | PD-1/PD-L1 inhibitors |
| WO2020061482A1 (en) | 2018-09-21 | 2020-03-26 | Harpoon Therapeutics, Inc. | Egfr binding proteins and methods of use |
| IL281683B2 (en) | 2018-09-25 | 2023-04-01 | Harpoon Therapeutics Inc | dll3 binding proteins and methods of use |
| CN112955435B (zh) | 2018-10-24 | 2024-09-06 | 吉利德科学公司 | Pd-1/pd-l1抑制剂 |
| WO2021024020A1 (en) | 2019-08-06 | 2021-02-11 | Astellas Pharma Inc. | Combination therapy involving antibodies against claudin 18.2 and immune checkpoint inhibitors for treatment of cancer |
| CN115443274B (zh) | 2020-04-30 | 2025-04-25 | 勤浩医药(苏州)有限公司 | 含苯基并内磺酰胺的化合物 |
| EP4178611A1 (en) | 2020-07-07 | 2023-05-17 | BioNTech SE | Therapeutic rna for hpv-positive cancer |
| AR123730A1 (es) * | 2020-10-15 | 2023-01-04 | Ac Immune Sa | Compuestos novedosos |
| TW202245808A (zh) | 2020-12-21 | 2022-12-01 | 德商拜恩迪克公司 | 用於治療癌症之治療性rna |
| WO2022135666A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Treatment schedule for cytokine proteins |
| WO2022135667A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Therapeutic rna for treating cancer |
| KR20240046323A (ko) | 2021-07-13 | 2024-04-08 | 비온테크 에스이 | 암에 대한 병용 요법에 있어서 cd40 및 cd137에 대한 다중특이 결합제 |
| TW202333802A (zh) | 2021-10-11 | 2023-09-01 | 德商拜恩迪克公司 | 用於肺癌之治療性rna(二) |
| US20250082633A1 (en) * | 2021-11-24 | 2025-03-13 | Remix Therapeutics Inc. | Compounds and methods for modulating splicing |
| WO2023170606A1 (en) | 2022-03-08 | 2023-09-14 | Alentis Therapeutics Ag | Use of anti-claudin-1 antibodies to increase t cell availability |
| CN119866329A (zh) * | 2022-05-20 | 2025-04-22 | 渤健马萨诸塞州股份有限公司 | 用于治疗亨廷顿氏病的杂环化合物 |
| WO2024126457A1 (en) | 2022-12-14 | 2024-06-20 | Astellas Pharma Europe Bv | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and immune checkpoint inhibitors |
| WO2025120866A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and agents stabilizing or increasing expression of cldn18.2 |
| WO2025121445A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and agents stabilizing or increasing expression of cldn18.2 |
| WO2025120867A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and anti-vegfr2 antibodies |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101265254A (zh) * | 2003-03-27 | 2008-09-17 | 兰肯瑙医学研究所 | 新型ido抑制剂及其使用方法 |
| US20070117818A1 (en) | 2004-02-04 | 2007-05-24 | Masaichi Hasegawa | Pyrimidinone compounds useful as kinase inhibitors |
| EP1940787A4 (en) * | 2005-10-27 | 2009-07-01 | Lankenau Inst Medical Res | NEW IDO HEMMER AND APPLICATION METHOD THEREFOR |
| US8389568B2 (en) * | 2007-03-16 | 2013-03-05 | Lankenau Institute For Medical Research | IDO inhibitors and methods of use thereof |
| US20110159017A1 (en) | 2008-04-11 | 2011-06-30 | Ludwig Institute For Cancer Research Ltd. | Trytophan catabolism in cancer treatment and diagnosis |
| WO2010136491A1 (en) | 2009-05-27 | 2010-12-02 | F. Hoffmann-La Roche Ag | Bicyclic indole-pyrimidine pi3k inhibitor compounds selective for p110 delta, and methods of use |
| WO2014164596A1 (en) | 2013-03-11 | 2014-10-09 | The Regents Of The University Of Michigan | Bet bromodomain inhibitors and therapeutic methods using the same |
| AP2015008601A0 (en) | 2013-03-14 | 2015-07-31 | Boehringer Ingelheim Int | Substituted 2-aza-bicyclo[2.2.1] heptane-3-carboxylic acid (benzyl-cyano-methyl)-amides inhibitors of cathepsin C |
-
2015
- 2015-03-17 EP EP15714653.1A patent/EP3119763A1/en not_active Withdrawn
- 2015-03-17 CA CA2942761A patent/CA2942761A1/en not_active Abandoned
- 2015-03-17 WO PCT/IB2015/051957 patent/WO2015140717A1/en active Application Filing
- 2015-03-17 JP JP2016557605A patent/JP2017507983A/ja active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018511587A (ja) * | 2015-03-17 | 2018-04-26 | ファイザー・インク | 新奇な3−インドール置換誘導体、医薬組成物、および使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2942761A1 (en) | 2015-09-24 |
| WO2015140717A1 (en) | 2015-09-24 |
| EP3119763A1 (en) | 2017-01-25 |
| WO2015140717A9 (en) | 2016-03-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2017507983A (ja) | 新規な3−インドール置換誘導体、医薬組成物、および使用方法 | |
| AU2016231832B2 (en) | Novel 3-indol substituted derivatives, pharmaceutical compositions and methods for use | |
| JP2017505346A (ja) | 新規な3−(インドール−3−イル)−ピリジン誘導体、医薬組成物、および使用方法 | |
| US9126984B2 (en) | 4-(indol-3-yl)-pyrazole derivatives, pharmaceutical compositions and methods for use | |
| WO2017025868A1 (en) | 3-indol substituted derivatives, pharmaceutical compositions and methods for use | |
| TWI457125B (zh) | 睡眠障礙之治療劑 | |
| US20150266857A1 (en) | Novel 3-indol substituted derivatives, pharmaceutical compositions and methods for use | |
| WO2018178338A1 (en) | 2-oxo-thiazole derivatives as a2a inhibitors and compounds for use in the treatment of cancers | |
| AU2018246355B2 (en) | 2-oxo-thiazole derivatives as A2A inhibitors and compounds for use in the treatment of cancers | |
| BRPI0418082B1 (pt) | Derivados de tiazol úteis como antagonistas de receptor de adenosina A2A | |
| JP2020503268A (ja) | 選択的hdac1、2阻害剤としてのピペラジン誘導体 | |
| KR20110100624A (ko) | 다발성 경화증의 치료에 유용한 옥사디아졸 융합된 헤테로사이클릭 유도체 | |
| CN111315734A (zh) | 作为食欲素受体拮抗剂的经取代的2-氮杂双环[3.1.1]庚烷和2-氮杂双环[3.2.1]辛烷衍生物 | |
| EP3066090A1 (en) | 4-(indol-3-yl)-pyrazole derivatives, pharmaceutical compositions and methods for use | |
| JP5011097B2 (ja) | カンナビノイドcb1受容体のアゴニストとしての、(インドール−3−イル)−複素環誘導体 | |
| BE1021253B1 (fr) | Nouveaux derives substitues de 3-indol, compositions pharmaceutiques et methode d'utilisation | |
| HK40019115A (en) | 2-oxo-thiazole derivatives as a2a inhibitors and compounds for use in the treatment of cancers | |
| HK40019115B (en) | 2-oxo-thiazole derivatives as a2a inhibitors and compounds for use in the treatment of cancers |