CN1384816A - 多晶型形式的盐酸舍曲林 - Google Patents
多晶型形式的盐酸舍曲林 Download PDFInfo
- Publication number
- CN1384816A CN1384816A CN00815052A CN00815052A CN1384816A CN 1384816 A CN1384816 A CN 1384816A CN 00815052 A CN00815052 A CN 00815052A CN 00815052 A CN00815052 A CN 00815052A CN 1384816 A CN1384816 A CN 1384816A
- Authority
- CN
- China
- Prior art keywords
- sertraline hydrochloride
- sertraline
- hydrochloride
- polymorphic form
- polymorphic
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/33—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings
- C07C211/39—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of an unsaturated carbon skeleton
- C07C211/41—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of an unsaturated carbon skeleton containing condensed ring systems
- C07C211/42—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of an unsaturated carbon skeleton containing condensed ring systems with six-membered aromatic rings being part of the condensed ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2602/00—Systems containing two condensed rings
- C07C2602/02—Systems containing two condensed rings the rings having only two atoms in common
- C07C2602/04—One of the condensed rings being a six-membered aromatic ring
- C07C2602/10—One of the condensed rings being a six-membered aromatic ring the other ring being six-membered, e.g. tetraline
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Emergency Medicine (AREA)
- Psychiatry (AREA)
- Pain & Pain Management (AREA)
- Addiction (AREA)
- Child & Adolescent Psychology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Gynecology & Obstetrics (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
发现一种结晶形式的盐酸舍曲林,下文中将称之为多晶型物CSC2,具有高溶解率,从而将令人惊奇地提高药物的吸收率。还公开盐酸舍曲林醇溶剂合物的不同晶形、不同结晶形式的盐酸舍曲林水合物,以下称作多晶型物CSC1,制备无定形形式的盐酸舍曲林的方法以及制备多晶型物I、II、V和T1的不同方法。
Description
技术领域
本发明涉及(1S-顺式)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸化物即盐酸舍曲林(sertraline hydrochloride)的结晶多晶型物(crystalline polymorphic forms)的和无定形形式的(1S-顺式)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸化物即盐酸舍曲林(sertraline hydrochloride),它们的制备方法以及盐酸舍曲林的已知多晶型物的制备方法。
盐酸舍曲林可用作抗抑郁剂和厌食剂,还可用于治疗化学药物依赖性、与焦虑有关的病症以及早泄,并在US-A-4,536,518(Pfizer公司)中做了描述。
盐酸舍曲林可以不同的晶形、多晶型物存在,它们在稳定性、物理性质、光谱数据和制备方法上均有所不同。
舍曲林具有下列化学结构式:
US-A-4,536,518(Pfizer公司)公开了盐酸舍曲林的合成。该胺被溶解在二乙醚与乙酸乙酯的混合物中,然后与氯化氢气体进行反应。该参考文献提到,本发明化合物可以不同多晶型形式,即,不同晶形存在。该参考文献并未提及盐酸舍曲林的各种具体多晶型物。
US-A-5,248,699(Pfizer公司)公开了5种盐酸舍曲林的多晶型物(I、II、III、IV和V)及其制备方法。该文献还披露:“US-A-4,536,518中描述并例举的合成程序可生产这里指定为形式II的盐酸舍曲林多晶型”。
US-A-5,734,083(Torcan化学公司)公开盐酸舍曲林的另一种多晶型物(=T1),连同其制备方法。
虽然US-A-5,248,699(Pfizer公司)披露,多晶型物I表现出在盐酸舍曲林诸结晶形式当中稳定性最大,但此种形式的溶解度却不足以使其成功地付诸应用。例如,药物吸收(速)率依赖溶解(速)率。溶解率和吸收率的提高或降低与所存在的多晶型物有关。最稳定的多晶型物将具有最低溶解度并且在许多情况下最慢的溶解率。其他稳定性较小的多晶型物通常具有较高溶解率。[Stephen R.Byrn,《药物固态化学》,学术出版社,纽约,1982]。
发现一种晶形的盐酸舍曲林,下文中将称之为多晶型物CSC2,兼具有高溶解度与优良热稳定性。
再者,本发明还涉及不同晶形的盐酸舍曲林醇溶剂合物、不同晶形的盐酸舍曲林水合物,即以下称作多晶型物CSC1,制备无定形形式的盐酸舍曲林的方法以及制备多晶型物I、II、V和T1的不同方法。
总规定:
盐酸舍曲林醇溶剂合物
由化合物盐酸舍曲林与通式为R-OH的醇组合而生成的物质,其中R是有机基团。
此类物质具有通式(C17H17Cl2N·HCl)(ROH)X,其中X为0.5~2。
盐酸舍曲林水合物
由化合物盐酸舍曲林与水组合而生成的物质。
此类物质具有通式(C17H17Cl2N·HCl)(H2O)X,其中X为0~4(其中X=0代表脱溶剂水合物)。
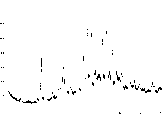
结晶多晶型物CSC2显示特征X-射线粉末衍射图形,其特征峰以衍射角2θ度数表示:12.2、15.7、17.2、18.3、22.8、23.0、24.4和30.7,如图19所示。这里以及下文中,该谱是由采用铜辐射的衍射仪测定的。
有关X-射线粉末衍射图形理论的讨论可见诸于《X-射线衍射规程》(“X-ray diffraction procedures”),H.P.Klug和L.E.Alexander,J.Wiley,纽约(1974)。
结晶多晶型物CSC2在加热时在约大于120℃时转变为形式V,然后在约大于160℃的温度发生第二次转变,变为形式III(在DSC设备中进行实验,加热速率20℃/min)。
结晶多晶型物CSC2还由拉曼吸收光谱来表征,具有下列特征吸收带,以波数(cm-1)表示:
3052(s),2976(s),2963(s),2943(s),2885(m),2862(m),1590(s),1049(m),744(m),676(s),490(m),477(m),364(m),349(m),237(m),203(m),181(s);[(m)=中等强度;(s)=强强度],如图20所示。
本发明还涉及盐酸舍曲林水合物的晶形,以下称之为晶形CSC1。盐酸舍曲林水合物的晶形随着水合物晶体中存在的水量而变化。采用一种测定期间其中的环境湿度(RH)可控的X-射线衍射仪,可分辨出至少5种明显不同的X-射线粉末衍射图形,其特征峰,以2θ表示,如下(图13):CSC1 90%RH(湿):4.0;12.0;19.7;20.0;22.7;24.0;26.6;30.7;34.7CSC1 90%RH: 4.0;4.2;16.2;17.2;19.9;20.7;21.2;22.7;24.1;25.2;27.3;29.9;
30.7;31.3;31.8CSC1 50%RH: 4.7;9.3;13.9;15.1;16.0;16.4;16.8;17.5;17.9;19.3;20.5;21.1;
21.5;22.2;23.0;23.7;24.1;24.8;25.8;31.2;32.2;33.5CSC1 20%RH: 4.9;9.7;12.1;14.1;15.4;16.5;17.0;18.1;19.4;21.9;22.3;24.8;
25.9;31.7CSC1 0%RH: 5.0;14.0;15.6;16.5;18.1;19.5;22.1;22.9;25.1;25.9;30.3;33.5.
本发明还涉及不同晶形的盐酸舍曲林醇溶剂合物,盐酸舍曲林醇溶剂合物例如,盐酸舍曲林乙醇溶剂合物、盐酸舍曲林异丙醇溶剂合物和盐酸舍曲林甲醇溶剂合物。
盐酸舍曲林乙醇溶剂合物的晶形所显示的X-射线粉末衍射图形具有用下列2θ值表示的特征峰:
12.7,15.1,15.8,16.0,17.0,17.7,17.9,20.1,20.5,20.7,21.0,21.3,21.9,22.8,23.1,23.9,24.4,25.0,25.4,26.0,26.4,27.0,28.6,29.1,31.3,31.7,32.0和32.9正如图22所示。
盐酸舍曲林乙醇溶剂合物的晶形还用拉曼吸收光谱表征,具有下列特征吸收带,以波数(cm-1)表示:
3060(s),2974(s),2945(s),2878(s),1590(s),1046(s),740(s),672(s),504(m),475(m),462(m),377(m),361(m),232(s),211(s),197(s),182(s),144(s),104(s)[(m)=中等强度;(s)=强强度],如图23所示。
盐酸舍曲林异丙醇溶剂合物的晶形所显示的X-射线粉末衍射图形具有用下列2θ值表示的特征峰:
6.4,10.7,12.9,14.2,15.0,15.2,16.3,17.9,19.1,19.9,20.4,22.4,22.9,23.9,24.5,25.3,25.5,25.9,27.8,28.8,29.6,30.2,33.0和34.2正如图24所示。
盐酸舍曲林异丙醇溶剂合物的晶形还用拉曼吸收光谱表征,具有下列特征吸收带,以波数(cm-1)表示:
3057(s),2975(s),2939(s),2883(m),2865(m),1591(s),1043(s),744(m),676(s),505(m),491(m),477(m),461(m),355(m),229(m),196(s),182(s),148(s),125(s)[(m)=中等强度;(s)=强强度],如图25所示。
盐酸舍曲林甲醇溶剂合物的晶形所显示的X-射线粉末衍射图形具有用下列2θ表示的特征峰:
7.4,9.7,12.0,12.4,12.8,14.3,16.0,16.2,17.9,20.3,20.7,21.0,22.1,23.1,23.6,24.2,24.4,24.9,25.7,26.6,27.1,29.5,30.6,31.4,31.9,32.5,33.2,34.1,35.1,36.5,38.0正如图28所示。
盐酸舍曲林甲醇溶剂合物的晶形还用拉曼吸收光谱表征,具有下列特征吸收带,以波数(cm-1)表示:
3061(s),2975(s),2959(s),2941(s),2876(s),1591(s),1046(s),740(s),673(s),505(m),477(m),462(m),378(m),361(m),234(m),213(s),197(s),179(s),129(s),[(m)=中等强度;(s)=强强度],如图21所示。
本发明还涉及无定形形式盐酸舍曲林。该无定形形式的盐酸舍曲林给出的X-射线粉末衍射图形具有宽突起(bump),宽突起的最高峰值在25~30之间的2θ处,并在16和23处有宽带峰,如图26所示。
无定形形式的盐酸舍曲林还用拉曼吸收光谱表征,具有下列特征吸收带,以波数(cm-1)表示:
3054(s),2970(s),2933(s),2872(s),1590(s),1043(s),745(m),676(s),491(m),478(m),359(m),236(m),206(s),181(s),130(s),[(m)=中等强度;(s)=强强度],如图27所示。
盐酸舍曲林多晶型物CSC2可通过将舍曲林游离胺(sertralinefree amine)在溶剂,优选在乙醇中的溶液加入到盐酸水溶液中,或者通过将过量盐酸水溶液加入到舍曲林游离胺的溶液中而生成。优选的是,反应在约5~35℃的温度,最优选在室温进行。
制备盐酸舍曲林多晶型物CSC2的方法是本发明另一个目的。
该盐酸化物醇溶剂合物可通过将盐酸舍曲林从对应醇中结晶或再结晶而生成,所述醇优选地选自乙醇、异丙醇和甲醇,或者通过将盐酸舍曲林在对应醇中的悬浮体在约-20~40℃的温度,最优选在室温下长时间搅拌而生成。
盐酸化物醇溶剂合物的制备方法是本发明另一个目的。
盐酸舍曲林多晶型物CSC1可这样生成:舍曲林游离胺与氯化氢在水存在下在约5~40℃温度,最优选在室温下进行反应,或者将盐酸舍曲林从约5~40℃温度的水中结晶或再结晶。
盐酸舍曲林多晶型物CSC1也可通过盐酸舍曲林的任何多晶型物从水中再结晶而生成。
盐酸舍曲林多晶型物CSC1还可通过将盐酸舍曲林除多晶型形式I以外的任何多晶型物在盐酸水溶液中的悬浮体,在pH为0~2,最优选pH等于约1,温度5~40℃的条件下进行搅拌来生成。
制备盐酸舍曲林多晶型物CSC1的方法是本发明另一个目的。
本发明再一个目的是制备无定形盐酸舍曲林的方法。无定形盐酸舍曲林可在将氯化氢气体加入到在溶剂中的舍曲林游离胺中之后生成,其中溶剂例如是二乙醚,温度为约0~30℃,最优选在0~10℃的温度。
本发明又一个目的是制备多晶型物T1的方法。盐酸舍曲林多晶型物T1可通过舍曲林游离胺与氯化氢在二乙醚与乙酸乙酯的混合物中,或者在二丁基醚中,在约0~30℃的温度下进行反应来生成。
本发明又一个目的是制备多晶型物I的方法。
盐酸舍曲林多晶型物I可由无定形盐酸舍曲林、或多晶型物CSC1,或者多晶型物CSC2,或者盐酸舍曲林醇溶剂合物的非醇悬浮体,在经过长时间搅拌之后生成,或者在放入盐酸舍曲林多晶型物1的一些晶种之后以更快的反应时间生成。
本发明又一个目的是制备多晶型物II的方法。
盐酸舍曲林多晶型物II可由舍曲林游离胺的溶液在加入盐酸溶液之前放入一些多晶型物II的晶体种而生成;或者由向盐酸舍曲林多晶型物V的被搅拌的悬浮体中搅拌入一些盐酸舍曲林多晶型物II的种子晶体而生成;或者通过盐酸舍曲林醇溶剂合物在约0~30℃的温度、高真空(<1mbar)下进行干燥而生成;或者由在搅拌下向盐酸舍曲林多晶型物CSC1、CSC2或T1的悬浮体中放入一些盐酸舍曲林多晶型物II的种子晶体而生成。
再有,盐酸舍曲林多晶型物II可按照这样一种方法生成,其中在舍曲林游离胺的溶液中播种一些多晶型物II的晶体,并加入盐酸溶液。
优选使用舍曲林游离胺在酮中的溶液。优选通式为R1-CO-R2的酮,其中R1和R2是C1~C4烷基。R1和R2的例子是甲基、乙基、正-或异-丙基以及正-、仲-、异-或叔-丁基。R1优选是甲基。R2优选是甲基、乙基或异丁基。酮的例子是丙酮、丁酮或甲基异丁基甲酮。
使用的盐酸溶液例如可以是在有机溶剂如上面举出的酮中的溶液,或者优选地是水溶液。
优选在加入盐酸溶液之前先加入多晶型物II的种子晶体。种子晶体的典型加入量为0.1~10mol%,以舍曲林的摩尔量为基准。
本发明又一个目的是制备多晶型物V的方法。
盐酸舍曲林多晶型物V可通过盐酸舍曲林醇溶剂合物在约50℃~约100℃的温度在中等真空(medium vacuum)(>10mbar)条件下的干燥而生成,或者通过将盐酸舍曲林多晶型物CSC2在约80℃~约150℃的温度加热而生成。
本发明还涉及一种药物组合物,它包含:在治疗人类抑郁、焦虑引起的病症、肥胖、化学药物依赖性或成瘾或早泄等方面有效用量的具有上述特征的盐酸舍曲林的多晶型物CSC2、CSC1、无定形形式的盐酸舍曲林或醇溶剂合物,以及药用可接受的载体。
这些多晶型物、水合物、无定形形式的盐酸舍曲林和醇溶剂合物可作为单一成分使用或者以混合物形式使用。
下面的实施例用于说明,而不是限制本发明的范围。
实例1:多晶型物CSC2的制备
将21g舍曲林游离胺在75g乙醇中的溶液在30min内滴加到搅拌下的盐酸水溶液(8g 37%HCl/H2O在200mL水中)中。在反应终点,反应混合物的pH=3。停止搅拌,让结晶从溶液中分离过夜。晶体滤出后用水洗涤(3×50mL),然后在真空(100mbar)中、25℃干燥24h。
以92%的收率获得白色结晶固体产物(见图19和20)。
实例2:盐酸舍曲林乙醇溶剂合物的制备
将0.5g盐酸舍曲林溶解在85℃的5mL乙醇中。形成的澄清溶液放在冰/水浴中,随后生成白色结晶产物。这些晶体被滤出后用少量冷乙醇洗涤。形成的产物在环境温度在空气中进行干燥。
以92%的已分离的纯产物收率获得盐酸舍曲林乙醇溶剂合物(参见图22和23)。
该乙醇溶剂合物的生成与原料多晶型形式无关。
实例3:盐酸舍曲林异丙醇溶剂合物的制备
将0.5g盐酸舍曲林溶解在90℃的10mL异丙醇中。形成的澄清溶液在搅拌下冷却至0℃,随后生成白色结晶产物。这些晶体被过滤后用一些冷异丙醇洗涤。产物在环境温度下在空气中进行干燥。
以90%的收率获得盐酸舍曲林异丙醇溶剂合物(参见图24和25)。
该异丙醇溶剂合物的生成与原料的多晶型形式无关。
实例4:盐酸舍曲林甲醇溶剂合物的制备
将0.4g盐酸舍曲林在3mL甲醇中的悬浮体在室温搅拌30min。过滤白色沉淀,并在室温下在空气中进行干燥。
以89%的收率获得盐酸舍曲林甲醇溶剂合物(参见图21和28)。
该甲醇溶剂合物的生成与原料的多晶型形式无关。
实例5:多晶型物CSC1的制备
将0.5mL的4摩尔的盐酸水溶液滴加到610mg舍曲林游离胺在7mL水中的悬浮体中。形成的白色悬浮体在室温搅拌3h,随后,pH值从约1变到约6。过滤产物后,以水洗涤(2×3mL),随后在真空中进行干燥。
产物以86%的纯产物收率获得。取得的X-射线和拉曼光谱与化合物的干燥度有关,也依赖于用传统仪器记录的空气相对湿度(RH)(典型例子表示在图9~12,和14~18中)。当湿样品放在X-射线衍射仪中,其中环境相对湿度可控时,可记录到X-射线图谱的变化(参见图13)。
实例6:无定形盐酸舍曲林的制备
将2.85g舍曲林游离胺(将扁桃酸舍曲林盐在乙酸乙酯中的溶液以氢氧化钠在中水的2摩尔溶液处理,再按标准有机后处理程序处理之后获得的)在300mL二乙醚中的溶液冷却至0℃。在此温度,向反应混合物中引入气体氯化氢,持续30min。反应混合物,此时为白色悬浮体,暖至室温,在氩气氛中搅拌过夜。将白色悬浮体进行过滤,以二乙醚洗涤白色产物(3×50mL)。获得的白色固体在室温通过在产物上方缓缓地吹拂空气流进行干燥。
X-射线粉末衍射图形未显示明显信号,这表明产物为无定形形式。
令人惊奇的是,即使12个月后抽取的样品,也仅显示在2θ=16和23°的一些宽信号,表明盐酸舍曲林的无定形形式具有热稳定性(参见图26和27)。
实例7:多晶型物T1的制备
将5.4g在丙酮中的氯化氢溶液(通过将9.47g盐酸水溶液(37wt%)与138g丙酮混合而制成)滴加到1g舍曲林游离胺在16mL丙酮中的溶液中。搅拌3h后,过滤白色沉淀,在室温、真空(100mbar)中进行干燥。
产物以82%的收率获得。
拉曼和X-射线粉末衍射研究显示产物是多晶型形式T1(参见图7和8)。
实例8:由盐酸舍曲林异丙醇合物制备多晶型物I
将盐酸舍曲林异丙醇溶剂合物在70℃、高真空(0.1mbar)下加热20h,结果,定量地生成盐酸舍曲林多晶型物I。
拉曼和X-射线粉末衍射研究显示产物是多晶型形式I(参见图24和25)。
实例9:多晶型物II的制备
将24g舍曲林游离胺溶解在280mL丙酮中。向该溶液中加入1.2g盐酸舍曲林多晶型物II作为种子晶体。在室温下向该混合物中滴加53.7g氯化氢在丙酮中的溶液(5.33wt%)。形成的白色悬浮体再搅拌2h,过滤,以丙酮洗涤形成的白色产物(2×20 mL)。产物在真空(0.1mbar)中干燥16h。
产物以91%的纯产物收率取得。
拉曼和X-射线粉末衍射研究显示产物是多晶型形式II(参见图3和4)。
实例10:多晶型物II的制备
将50g舍曲林游离胺溶解在500mL丙酮中。该溶液通过过滤而变清,将澄清溶液充分地搅拌并加热至回流温度。在此温度,加入2.5g(5mol%)盐酸舍曲林形式II,然后开始直接加入盐酸水溶液(32%)直至pH<5。形成的白色悬浮体冷却至-5℃,经过滤离析出盐酸舍曲林,然后在真空中干燥。获得的舍曲林为形式II。
实例11:多晶型物II的制备
将10g舍曲林游离胺溶解在85mL丁酮中。该溶液通过过滤而变清,将澄清溶液充分地搅拌并加热至60℃。在此温度,加入0.5g(5mol%)盐酸舍曲林形式II,然后开始直接加入盐酸水溶液(37%)直至pH<5。形成的白色悬浮体冷却至-5℃,经过滤离析出盐酸舍曲林,然后在真空中干燥。获得的舍曲林为形式II。
实例12:多晶型物II的制备
将40g舍曲林游离胺溶解在360mL甲基异丁基甲酮中。该溶液通过过滤而变清,将澄清溶液充分地搅拌并加热至60℃。在此温度,加入2g(5mol%)盐酸舍曲林形式II,然后开始直接加入盐酸水溶液(37%)直至pH<5。形成的白色悬浮体冷却至20℃,经过滤离析出盐酸舍曲林,然后在真空中干燥。获得的舍曲林为形式II。
实例13:多晶型物V的制备
将1g盐酸舍曲林乙醇溶剂合物在真空(约100mbar)、70℃干燥12h。
拉曼和X-射线粉末衍射研究显示产物是多晶型物V(参见图5和6)。
附图简述
图1是多晶型物I的特征X-射线粉末衍射图形
图2是多晶型物I的特征拉曼光谱
图3是多晶型物II的特征X-射线粉末衍射图形
图4是多晶型物II的特征拉曼光谱
图5是多晶型物V的特征X-射线粉末衍射图形
图6是多晶型物V的特征拉曼光谱
图7是多晶型物T1的特征X-射线粉末衍射图形
图8是多晶型物T1的特征拉曼光谱
图9、10、11和12是晶格中结合的水的量不同的不同水合物,统称多晶型物CSC1的特征X-射线粉末衍射图形
图13是一组不同相对湿度下水合物的X-射线粉末衍射图形
图14、15、16、17和18是晶格中结合的水的量不同的不同水合物,统称多晶型物CSC1的特征拉曼光谱
图19是多晶型物CSC2的特征X-射线粉末衍射图形
图20是多晶型物CSC2的特征拉曼光谱
图21是甲醇溶剂合物的特征拉曼光谱
图22是乙醇溶剂合物的特征X-射线粉末衍射图形
图23是乙醇溶剂合物的特征拉曼光谱
图24是异丙醇溶剂合物的特征X-射线粉末衍射图形
图25是异丙醇溶剂合物的特征拉曼光谱
图26展示12个月后无定形形式样品的X-射线粉末衍射图形
图27展示该无定形形式的拉曼光谱
图28是甲醇溶剂合物的特征X-射线粉末衍射图形
Claims (27)
1.一种(1S-顺式)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸化物的结晶多晶型物(CSC2),它显示的特征X-射线粉末衍射图形具有以2θ表示的以下位置的特征峰:12.2、15.7、17.2、18.3、22.8、23.0、24.4和30.7。
2.一种(1S-顺式)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸化物的结晶多晶型物(CSC2),它显示的拉曼吸收光谱具有以波数(cm-1)表示的以下特征吸收带:
3052(s),2976(s),2963(s),2943(s),2885(m),2862(m),1590(s),1049(m),744(m),676(s),490(m),477(m),364(m),349(m),237(m),203(m),181(s),其中(m)=中等强度;和(s)=强强度。
3.结晶形式的盐酸舍曲林水合物(CSC1),它在不同空气湿度(RH)值显示的特征X-射线粉末衍射图形具有以2θ表示的以下位置的特征峰:CSC1 90%RH(湿):4.0;12.0;19.7;20.0;22.7;24.0;26.6;30.7;34.7CSC1 90%RH:4.0;4.2;16.2;17.2;19.9;20.7;21.2;22.7;24.1;25.2;27.3;29.9;30.7;31.3;31.8CSC1 50%RH:4.7;9.3;13.9;15.1;16.0;16.4;16.8;17.5;17.9;19.3;20.5;21.1;21.5;22.2;23.0;23.7;24.1;24.8;25.8;31.2;32.2;33.5CSC1 20%RH:4.9;9.7;12.1;14.1;15.4;16.5;17.0;18.1;19.4;21.9;22.3;24.8;25.9;31.7CSC 10%RH:5.0;14.0;15.6;16.5;18.1;19.5;22.1;22.9;25.1;25.9;30.3;33.5。
4.结晶形式的盐酸舍曲林乙醇溶剂合物,它显示的特征X-射线粉末衍射图形具有以2θ表示的以下位置的特征峰:
12.7,15.1,15.8,16.0,17.0,17.7,17.9,20.1,20.5,20.7,21.0,21.3,21.9,22.8,23.1,23.9,24.4,25.0,25.4,26.0,26.4,27.0,28.6,29.1,31.3,31.7,32.0和32.9。
5.结晶形式的盐酸舍曲林乙醇溶剂合物,它显示的拉曼吸收光谱具有以波数(cm-1)表示的以下特征吸收带:
3060(s),2974(s),2945(s),2878(s),1590(s),1046(s),740(s),672(s),
504(m),475(m),462(m),377(m),361(m),232(s),211(s),197(s),182(s),144(s),
104(s),其中(m)=中等强度;和(s)=强强度。
6.结晶形式的盐酸舍曲林异丙醇溶剂合物,它显示的特征X-射线粉末衍射图形具有以2θ表示的以下位置的特征峰:
6.4,10.7,12.9,14.2,15.0,15.2,16.3,17.9,19.1,19.9,20.4,22.4,22.9,23.9,24.5,25.3,
25.5,25.9,27.8,28.8,29.6,30.2,33.0和34.2。
7.结晶形式的盐酸舍曲林异丙醇溶剂合物,它显示的拉曼吸收光谱具有以波数(cm-1)表示的下述特征吸收带:
3057(s),2975(s),2939(s),2883(m),2865(m),1591(s),1043(s),744(m),676(s),505(m),491(m),477(m),461(m),355(m),229(m),196(s),182(s),148(s),125(s),其中(m)=中等强度;和(s)=强强度。
8.结晶形式的盐酸舍曲林甲醇溶剂合物,它显示的特征X-射线粉末衍射图形具有以2θ表示的以下位置的特征峰:
7.4,9.7,12.0,12.4,12.8,14.3,16.0,16.2,17.9,20.3,20.7,21.0,22.1,23.1,23.6,24.2,24.4,24.9,25.7,26.6,27.1,29.5,30.6,31.4,31.9,32.5,33.2,34.1,35.1,36.5,38.0。
9.结晶形式的盐酸舍曲林甲醇溶剂合物,它显示如图2 1所示的特征X-射线粉末衍射图形,以及拉曼吸收光谱具有以波数(cm-1)表示的以下特征吸收带:3061(s),2975(s),2959(s),2941(s),2876(s),1591(s),1046(s),740(s),673(s),505(m),477(m),462(m),378(m),361(m),234(m),213(s),197(s),179(s),129(s)其中(m)=中等强度;和(s)=强强度。
10.无定形形式的盐酸舍曲林,其X-射线粉末衍射谱包含最大值在2θ为25~30之间的宽突起,以及位于16和23处的一些宽峰。
11.无定形形式的盐酸舍曲林,它显示的拉曼吸收光谱具有以波数(cm-1)表示的下述特征吸收带:
3054(s),2970(s),2933(s),2872(s),1590(s),1043(s),745(m),676(s),491(m),478(m),359(m),236(m),206(s),181(s),130(s)其中(m)=中等强度;和(s)=强强度。
12.一种制备权利要求1或2的(1S-顺式)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸化物的结晶多晶型物(CSC2)的方法,其中将舍曲林游离胺在乙醇中的溶液加入到盐酸水溶液中,或者其中将过量盐酸水溶液加入到舍曲林游离胺溶液中。
13.一种制备盐酸化物醇溶剂合物的方法,其中将盐酸舍曲林在-20~40℃温度从相应醇中结晶或再结晶,或者其中在该醇中搅拌盐酸舍曲林的悬浮体。
14.权利要求13的方法,其中醇选自乙醇、异丙醇和甲醇。
15.一种制备权利要求3的(1 S-顺式)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸化物的结晶多晶型物(CSC1)的方法,其中,舍曲林游离胺与氯化氢在水存在下在5~40℃的温度进行反应,或者将任何多晶型形式的盐酸舍曲林从水中结晶或再结晶出来。
16.一种制备(1S-顺式)-4-(3,4-二氯苯基)-1,2,3,4-四氢-N-甲基-1-萘胺盐酸化物的结晶多晶型物(CSC1)的方法,其中,在盐酸水溶液中于pH为0~2、温度为5~40℃条件下搅拌除多晶型形式I以外的任何多晶型形式的盐酸舍曲林的悬浮体。
17.制备无定形盐酸舍曲林的方法,其中无定形盐酸舍曲林在将氯化氢气体加入到在二乙醚中的舍曲林游离胺中之后生成。
18.制备多晶型物T1的方法,其中舍曲林游离胺与氯化氢在二乙醚与乙酸乙酯的混合物中进行反应,或者在二丁基醚中进行反应。
19.制备多晶型物I的方法,其中在选自无定形盐酸舍曲林、多晶型物CSC1、多晶型物CSC2和盐酸舍曲林醇溶剂合物的非醇悬浮体中,播种一些盐酸舍曲林多晶型物I的晶体。
20.制备多晶型物II的方法,其中在加入盐酸溶液之前在舍曲林游离胺的溶液中放入一些多晶型物II的晶体种,或者其中向盐酸舍曲林多晶型物V的被搅拌的悬浮体中搅拌入一些盐酸舍曲林多晶型物II的种子晶体,或者其中将盐酸舍曲林醇溶剂合物在0~30℃的温度、高真空中进行干燥,或者其中在搅拌下向盐酸舍曲林多晶型物CSC1、CSC2或T1的悬浮体中加入一些盐酸舍曲林多晶型物II的种子晶体。
21.制备多晶型物II的方法,其中在舍曲林游离胺溶液中放入一些多晶型物II的晶体种,然后加入盐酸溶液。
22.权利要求21的方法,其中使用舍曲林游离胺在酮中的溶液。
23.权利要求21的方法,其中使用舍曲林游离胺在丙酮、丁酮或甲基异丁基甲酮中的溶液。
24.权利要求2 1的方法,其中使用盐酸水溶液。
25.权利要求21的方法,其中在加入盐酸溶液之前加入多晶型物II的种子晶体。
26.制备多晶型物V的方法,其中盐酸舍曲林醇溶剂合物在50℃~100℃的温度、中等真空中进行干燥,或者其中盐酸舍曲林多晶型物CSC2在80℃~约150℃的温度进行加热。
27.一种药物组合物,它包含:在治疗人类抑郁、焦虑引起的病症、肥胖、化学药物依赖性或成瘾或早泄等方面有效的用量的盐酸舍曲林的多晶型物CSC2、水合物CSC1、无定形形式的盐酸舍曲林和醇溶剂合物,以及一种药用可接受的载体。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP99810981 | 1999-10-29 | ||
| EP99810981.3 | 1999-10-29 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1384816A true CN1384816A (zh) | 2002-12-11 |
Family
ID=8243113
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN00815052A Pending CN1384816A (zh) | 1999-10-29 | 2000-10-23 | 多晶型形式的盐酸舍曲林 |
Country Status (17)
| Country | Link |
|---|---|
| US (2) | US6872853B1 (zh) |
| EP (1) | EP1224160B1 (zh) |
| JP (1) | JP2003513062A (zh) |
| CN (1) | CN1384816A (zh) |
| AR (1) | AR026293A1 (zh) |
| AT (1) | ATE409684T1 (zh) |
| AU (1) | AU1386301A (zh) |
| CA (1) | CA2387135A1 (zh) |
| DE (1) | DE60040406D1 (zh) |
| HU (1) | HUP0203559A3 (zh) |
| IL (2) | IL149050A0 (zh) |
| MX (1) | MXPA02004255A (zh) |
| MY (1) | MY141509A (zh) |
| TR (1) | TR200201146T2 (zh) |
| TW (1) | TWI260315B (zh) |
| WO (1) | WO2001032601A1 (zh) |
| ZA (1) | ZA200203254B (zh) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105061217A (zh) * | 2015-06-30 | 2015-11-18 | 徐静 | 枸橼酸舍曲林的2种晶型及其制备方法 |
| CN112552188A (zh) * | 2020-12-17 | 2021-03-26 | 山西仟源医药集团股份有限公司 | 盐酸舍曲林晶型i的制备方法 |
| CN113588626A (zh) * | 2021-08-24 | 2021-11-02 | 上海师范大学 | 一种苯丙氨酸对映体的拉曼光谱检测方法 |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6500987B1 (en) * | 1998-11-27 | 2002-12-31 | Teva Pharmaceutical Industries Ltd. | Sertraline hydrochloride polymorphs |
| IL143311A0 (en) * | 1998-11-27 | 2002-04-21 | Teva Pharma | Sertraline hydrochloride polymorphs |
| EP1632473A1 (en) * | 1998-11-27 | 2006-03-08 | Teva Pharmaceutical Industries Ltd | Sertraline hydrochloride polymorphs |
| US6495721B1 (en) | 1999-08-09 | 2002-12-17 | Teva Pharmaceutical Industries Ltd. | Sertraline hydrochloride Form II and methods for the preparation thereof |
| US20050119351A1 (en) * | 1999-10-29 | 2005-06-02 | Van Der Schaaf Paul A. | Polymorphic forms of sertraline hydrochloride |
| US7442838B2 (en) * | 1999-10-29 | 2008-10-28 | Ciba Specialty Chemicals Corp. | Polymorphic forms of sertraline hydrochloride |
| ES2281374T3 (es) * | 1999-12-21 | 2007-10-01 | Teva Pharmaceutical Industries Ltd. | Nuevos polimorfos de hidrocloruro de sertralina, procedimientos para su preparacion, composiciones que los contienen y metodos para su utilizacion. |
| EP1774965A3 (en) * | 1999-12-21 | 2007-10-10 | Teva Pharmaceutical Industries Ltd | Novel sertraline hydrochloride polymorph, processes for preparing them, compositions containing them and methods of using them |
| IN192343B (zh) * | 2000-05-26 | 2004-04-10 | Ranbaxy Lab Ltd | |
| US7067700B2 (en) | 2001-05-31 | 2006-06-27 | Fermion Oy | Process for preparing sertraline hydrochloride polymorphic form II |
| WO2003093217A1 (en) * | 2002-04-29 | 2003-11-13 | Teva Pharmaceutical Industries Ltd. | Process for preparation of polymorphic form ii of sertraline hydrochloride, pharmaceutical formulations and methods of administration thereof |
| AU2003245666B2 (en) * | 2002-06-27 | 2007-10-04 | Interdigital Technology Corporation | Radio network controller exchange of equipment information |
| EP1626950A4 (en) * | 2003-05-23 | 2007-05-23 | Transform Pharmaceuticals Inc | SERTRALINZUSAMMENSETZUNGEN |
| NZ546902A (en) * | 2003-11-04 | 2010-02-26 | Cipla Ltd | Process for the preparation of polymorphs of selective serotonin reuptake inhibitor |
| EP1711493A2 (en) * | 2004-02-06 | 2006-10-18 | CIBA SPECIALTY CHEMICALS HOLDING INC. Patent Departement | Crystalline forms of zolmitriptan |
| WO2007008317A2 (en) * | 2005-06-09 | 2007-01-18 | Teva Pharmaceutical Industries Ltd. | Process for preparation of sertraline hydrochloride form i |
| US7518019B2 (en) | 2006-06-01 | 2009-04-14 | Hetero Drugs Limited | Processes for preparing sertraline hydrochloride crystalline forms |
| CA2594198A1 (en) * | 2007-07-20 | 2009-01-20 | Apotex Pharmachem Inc. | A novel process for the preparation of sertraline hydrochloride form ii |
| US9186642B2 (en) | 2010-04-28 | 2015-11-17 | The Procter & Gamble Company | Delivery particle |
| US9993793B2 (en) | 2010-04-28 | 2018-06-12 | The Procter & Gamble Company | Delivery particles |
| WO2012138710A2 (en) | 2011-04-07 | 2012-10-11 | The Procter & Gamble Company | Personal cleansing compositions with increased deposition of polyacrylate microcapsules |
| US8927026B2 (en) | 2011-04-07 | 2015-01-06 | The Procter & Gamble Company | Shampoo compositions with increased deposition of polyacrylate microcapsules |
| MX2013010981A (es) | 2011-04-07 | 2013-10-30 | Procter & Gamble | Composiciones acondicionadoras con deposito mejorado de microcapsulas de poliacrilato. |
| EP4229164A1 (en) | 2020-10-16 | 2023-08-23 | The Procter & Gamble Company | Consumer product compositions with at least two encapsulate populations |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4536518A (en) | 1979-11-01 | 1985-08-20 | Pfizer Inc. | Antidepressant derivatives of cis-4-phenyl-1,2,3,4-tetrahydro-1-naphthalenamine |
| US5082970A (en) | 1991-03-06 | 1992-01-21 | Pfizer Inc. | Process for recycling amine isomer |
| GB9114947D0 (en) | 1991-07-11 | 1991-08-28 | Pfizer Ltd | Process for preparing sertraline |
| US5248699A (en) | 1992-08-13 | 1993-09-28 | Pfizer Inc. | Sertraline polymorph |
| US5734083A (en) | 1996-05-17 | 1998-03-31 | Torcan Chemical Ltd. | Sertraline polymorph |
| HU222341B1 (hu) | 1996-12-18 | 2003-06-28 | Richter Gedeon Vegyészeti Gyár Rt. | Eljárás sertralin előállítására és az eljárásban alkalmazott intermedier |
| EP0928784B1 (en) | 1997-12-11 | 2002-06-12 | TORCAN CHEMICAL Ltd | Sertraline polymorph having improved water solubility |
| CA2323629A1 (en) | 1998-03-18 | 1999-09-23 | Ciba Specialty Chemicals Holding Inc. | Process for the cis-selective catalytic hydrogenation of cyclohexylidenamines |
| JP2000026378A (ja) | 1998-07-03 | 2000-01-25 | Sumika Fine Chemicals Co Ltd | 塩酸セルトラリンの製法 |
| US6500987B1 (en) | 1998-11-27 | 2002-12-31 | Teva Pharmaceutical Industries Ltd. | Sertraline hydrochloride polymorphs |
| IL143311A0 (en) * | 1998-11-27 | 2002-04-21 | Teva Pharma | Sertraline hydrochloride polymorphs |
| US6495721B1 (en) | 1999-08-09 | 2002-12-17 | Teva Pharmaceutical Industries Ltd. | Sertraline hydrochloride Form II and methods for the preparation thereof |
| ES2281374T3 (es) | 1999-12-21 | 2007-10-01 | Teva Pharmaceutical Industries Ltd. | Nuevos polimorfos de hidrocloruro de sertralina, procedimientos para su preparacion, composiciones que los contienen y metodos para su utilizacion. |
-
2000
- 2000-10-07 TW TW089120975A patent/TWI260315B/zh not_active IP Right Cessation
- 2000-10-20 MY MYPI20004969A patent/MY141509A/en unknown
- 2000-10-23 TR TR2002/01146T patent/TR200201146T2/xx unknown
- 2000-10-23 IL IL14905000A patent/IL149050A0/xx active IP Right Grant
- 2000-10-23 HU HU0203559A patent/HUP0203559A3/hu unknown
- 2000-10-23 JP JP2001534755A patent/JP2003513062A/ja not_active Withdrawn
- 2000-10-23 CA CA002387135A patent/CA2387135A1/en not_active Abandoned
- 2000-10-23 MX MXPA02004255A patent/MXPA02004255A/es active IP Right Grant
- 2000-10-23 US US10/111,947 patent/US6872853B1/en not_active Expired - Fee Related
- 2000-10-23 WO PCT/EP2000/010416 patent/WO2001032601A1/en active IP Right Grant
- 2000-10-23 CN CN00815052A patent/CN1384816A/zh active Pending
- 2000-10-23 EP EP00975896A patent/EP1224160B1/en not_active Expired - Lifetime
- 2000-10-23 AT AT00975896T patent/ATE409684T1/de not_active IP Right Cessation
- 2000-10-23 AU AU13863/01A patent/AU1386301A/en not_active Abandoned
- 2000-10-23 DE DE60040406T patent/DE60040406D1/de not_active Expired - Fee Related
- 2000-10-27 AR ARP000105711A patent/AR026293A1/es not_active Application Discontinuation
-
2002
- 2002-04-09 IL IL149050A patent/IL149050A/en not_active IP Right Cessation
- 2002-04-24 ZA ZA200203254A patent/ZA200203254B/xx unknown
-
2003
- 2003-12-15 US US10/736,195 patent/US6939992B2/en not_active Expired - Fee Related
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105061217A (zh) * | 2015-06-30 | 2015-11-18 | 徐静 | 枸橼酸舍曲林的2种晶型及其制备方法 |
| CN112552188A (zh) * | 2020-12-17 | 2021-03-26 | 山西仟源医药集团股份有限公司 | 盐酸舍曲林晶型i的制备方法 |
| CN112552188B (zh) * | 2020-12-17 | 2023-07-28 | 山西仟源医药集团股份有限公司 | 盐酸舍曲林晶型i的制备方法 |
| CN113588626A (zh) * | 2021-08-24 | 2021-11-02 | 上海师范大学 | 一种苯丙氨酸对映体的拉曼光谱检测方法 |
| CN113588626B (zh) * | 2021-08-24 | 2024-05-24 | 上海师范大学 | 一种苯丙氨酸对映体的拉曼光谱检测方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| AR026293A1 (es) | 2003-02-05 |
| CA2387135A1 (en) | 2001-05-10 |
| JP2003513062A (ja) | 2003-04-08 |
| ATE409684T1 (de) | 2008-10-15 |
| HUP0203559A2 (hu) | 2003-03-28 |
| IL149050A (en) | 2007-03-08 |
| TWI260315B (en) | 2006-08-21 |
| MY141509A (en) | 2010-05-14 |
| ZA200203254B (en) | 2003-07-22 |
| MXPA02004255A (es) | 2002-10-17 |
| US6939992B2 (en) | 2005-09-06 |
| US6872853B1 (en) | 2005-03-29 |
| HUP0203559A3 (en) | 2008-01-28 |
| EP1224160B1 (en) | 2008-10-01 |
| AU1386301A (en) | 2001-05-14 |
| DE60040406D1 (de) | 2008-11-13 |
| TR200201146T2 (tr) | 2004-12-21 |
| WO2001032601A1 (en) | 2001-05-10 |
| IL149050A0 (en) | 2002-11-10 |
| EP1224160A1 (en) | 2002-07-24 |
| US20040132828A1 (en) | 2004-07-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1384816A (zh) | 多晶型形式的盐酸舍曲林 | |
| CN1623985A (zh) | 抗组胺哌啶衍生物,其多晶形物和假同晶物的无水和水合物形式的制备方法 | |
| CN1203895C (zh) | 含前列腺素e1的局部组合物 | |
| CN1845917A (zh) | 3-[(2-{[4-(已氧基羰基氨基-亚氨基-甲基)-苯氨基]-甲基}-1-甲基-1 h-苯并咪唑-5-羰基)-吡啶-2-基-氨基]-丙酸乙酯-甲磺酸酯及其作为药物的用途 | |
| CN1275126A (zh) | 2-(3-氰基-4-异丁氧基苯基)-4-甲基-5-噻唑甲酸的多晶型体及其制备方法 | |
| CN1085659C (zh) | 2-(4-取代)-苄基氨基-2-甲基-丙酰胺衍生物 | |
| CN1336366A (zh) | N-苄基二氧代噻唑烷基苯甲酰胺衍生物的制造中间体及其制造方法 | |
| CN1680284A (zh) | 阿戈美拉汀的新合成方法、新晶型及其药物组合物 | |
| CN1308603A (zh) | 苯氧基乙酸衍生物和含有该衍生物的医药组合物 | |
| CN1034807C (zh) | 含有基本不含亚硝胺的用金属硝酸盐稳定化的3-异噻唑酮的组合物 | |
| CN1061035C (zh) | 苯基链烷醇胺衍生物及其制备方法和用途 | |
| CN1132829C (zh) | N-乙酰基神经氨酸衍生物结晶及其制备方法 | |
| CN1874998A (zh) | 1-苄基-4-[(5,6-二甲氧基-1-二氢茚酮)-2-基]甲基哌啶草酸盐(多奈哌齐草酸盐)及其多晶型物 | |
| CN1053605A (zh) | 具有局部麻醉和止痛作用的新取代4-苯基-4-哌啶甲酰胺的制备方法 | |
| CN1224609C (zh) | 制备具有抗肥胖和抗糖尿病性质的芳基乙醇胺衍生物的方法 | |
| CN88101541A (zh) | 新的苯并嗪衍生物及其制备方法 | |
| CN1498216A (zh) | 新的奥丹西隆盐酸盐晶体和溶剂化物及其制备方法 | |
| CN1019010B (zh) | 取代的β-二酮的制备方法 | |
| CN1225625A (zh) | α-氨基酸酰胺,其制备方法及其治疗用途 | |
| CN1114592C (zh) | 奥沙奈丹的晶型 | |
| CN1023223C (zh) | 1,5-二苯基-1h-1,2,4-三唑-3-甲酰胺衍生物的制备方法 | |
| CN1551871A (zh) | 制备噻唑ppar-配体及其多晶型物的方法 | |
| CN1137085C (zh) | 制备5,6-二羟基-2-氨基-1,2,3,4-四氢化萘的方法 | |
| CN1030077A (zh) | 法莫丁啶多晶型物及其制备方法 | |
| CN1852894A (zh) | [R-(R*, R*)]-2-(4-氟苯基) -β,δ-二羟基-5-(1-甲基乙基) -3-苯基-4-[(苯基氨基)羰基] -1 H-吡咯-1-庚酸的结晶形式 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C12 | Rejection of a patent application after its publication | ||
| RJ01 | Rejection of invention patent application after publication |