CN115197245A - 一种Kras抑制剂及其制备方法 - Google Patents
一种Kras抑制剂及其制备方法 Download PDFInfo
- Publication number
- CN115197245A CN115197245A CN202210373726.4A CN202210373726A CN115197245A CN 115197245 A CN115197245 A CN 115197245A CN 202210373726 A CN202210373726 A CN 202210373726A CN 115197245 A CN115197245 A CN 115197245A
- Authority
- CN
- China
- Prior art keywords
- compound
- pharmaceutically acceptable
- acceptable salt
- deuterium
- hydroxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229940124785 KRAS inhibitor Drugs 0.000 title abstract description 4
- 238000002360 preparation method Methods 0.000 title description 61
- 150000001875 compounds Chemical class 0.000 claims abstract description 154
- 150000003839 salts Chemical class 0.000 claims abstract description 65
- -1 cyano, hydroxy Chemical group 0.000 claims description 213
- 229910052805 deuterium Inorganic materials 0.000 claims description 63
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 claims description 62
- 125000000623 heterocyclic group Chemical group 0.000 claims description 53
- 125000000217 alkyl group Chemical group 0.000 claims description 50
- 229910052736 halogen Inorganic materials 0.000 claims description 49
- 150000002367 halogens Chemical class 0.000 claims description 49
- 229910052739 hydrogen Inorganic materials 0.000 claims description 45
- 239000001257 hydrogen Substances 0.000 claims description 41
- 125000003118 aryl group Chemical group 0.000 claims description 38
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 28
- 239000008194 pharmaceutical composition Substances 0.000 claims description 24
- 238000006467 substitution reaction Methods 0.000 claims description 20
- 239000000460 chlorine Substances 0.000 claims description 18
- 125000000449 nitro group Chemical class [O-][N+](*)=O 0.000 claims description 18
- 125000004429 atom Chemical group 0.000 claims description 17
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims description 15
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 12
- 102200006539 rs121913529 Human genes 0.000 claims description 12
- 206010028980 Neoplasm Diseases 0.000 claims description 11
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 10
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 10
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 10
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 9
- 229910052801 chlorine Inorganic materials 0.000 claims description 9
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 9
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 8
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 8
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 8
- 229910052794 bromium Inorganic materials 0.000 claims description 8
- 229910052731 fluorine Inorganic materials 0.000 claims description 8
- 239000011737 fluorine Substances 0.000 claims description 8
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 8
- 201000011510 cancer Diseases 0.000 claims description 7
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 7
- 201000010099 disease Diseases 0.000 claims description 6
- 208000035475 disorder Diseases 0.000 claims description 6
- 239000003814 drug Substances 0.000 claims description 6
- 125000000304 alkynyl group Chemical group 0.000 claims description 5
- 125000004431 deuterium atom Chemical group 0.000 claims description 5
- 230000000155 isotopic effect Effects 0.000 claims description 5
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 4
- 206010009944 Colon cancer Diseases 0.000 claims description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 4
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 claims description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 2
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 2
- 125000001246 bromo group Chemical group Br* 0.000 claims description 2
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 2
- 125000001153 fluoro group Chemical group F* 0.000 claims description 2
- AQYSYJUIMQTRMV-UHFFFAOYSA-N hypofluorous acid Chemical compound FO AQYSYJUIMQTRMV-UHFFFAOYSA-N 0.000 claims description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 2
- 201000002528 pancreatic cancer Diseases 0.000 claims description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 2
- 206010038038 rectal cancer Diseases 0.000 claims description 2
- 201000001275 rectum cancer Diseases 0.000 claims description 2
- 238000004519 manufacturing process Methods 0.000 claims 2
- 230000002265 prevention Effects 0.000 claims 2
- 150000005840 aryl radicals Chemical class 0.000 claims 1
- 150000002431 hydrogen Chemical class 0.000 claims 1
- 125000001424 substituent group Chemical group 0.000 abstract description 31
- 239000000203 mixture Substances 0.000 abstract description 29
- 238000000034 method Methods 0.000 abstract description 13
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 78
- 238000006243 chemical reaction Methods 0.000 description 64
- 239000000243 solution Substances 0.000 description 55
- 239000012043 crude product Substances 0.000 description 43
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 42
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 38
- 125000000753 cycloalkyl group Chemical group 0.000 description 37
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 37
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 description 32
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 31
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 29
- 235000019439 ethyl acetate Nutrition 0.000 description 27
- 230000002829 reductive effect Effects 0.000 description 26
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 description 22
- 238000005481 NMR spectroscopy Methods 0.000 description 22
- 125000004432 carbon atom Chemical group C* 0.000 description 20
- 239000003480 eluent Substances 0.000 description 20
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 19
- 238000001914 filtration Methods 0.000 description 19
- 238000003818 flash chromatography Methods 0.000 description 19
- 229910052757 nitrogen Inorganic materials 0.000 description 19
- 239000003208 petroleum Substances 0.000 description 19
- 238000010898 silica gel chromatography Methods 0.000 description 19
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 18
- 238000001035 drying Methods 0.000 description 18
- 239000012074 organic phase Substances 0.000 description 18
- 229910052799 carbon Inorganic materials 0.000 description 17
- 125000004043 oxo group Chemical group O=* 0.000 description 16
- 230000015572 biosynthetic process Effects 0.000 description 15
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 15
- 239000007858 starting material Substances 0.000 description 15
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 14
- 238000003786 synthesis reaction Methods 0.000 description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 14
- 125000001072 heteroaryl group Chemical group 0.000 description 13
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 11
- 125000004093 cyano group Chemical group *C#N 0.000 description 11
- JWAZRIHNYRIHIV-UHFFFAOYSA-N 2-naphthol Chemical compound C1=CC=CC2=CC(O)=CC=C21 JWAZRIHNYRIHIV-UHFFFAOYSA-N 0.000 description 10
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 150000001721 carbon Chemical group 0.000 description 10
- 125000004433 nitrogen atom Chemical group N* 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 9
- 239000011541 reaction mixture Substances 0.000 description 9
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 8
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 8
- 125000003545 alkoxy group Chemical group 0.000 description 8
- 125000002947 alkylene group Chemical group 0.000 description 8
- 229910052717 sulfur Inorganic materials 0.000 description 8
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 7
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 7
- 239000012295 chemical reaction liquid Substances 0.000 description 7
- 239000007789 gas Substances 0.000 description 7
- GVOISEJVFFIGQE-YCZSINBZSA-N n-[(1r,2s,5r)-5-[methyl(propan-2-yl)amino]-2-[(3s)-2-oxo-3-[[6-(trifluoromethyl)quinazolin-4-yl]amino]pyrrolidin-1-yl]cyclohexyl]acetamide Chemical compound CC(=O)N[C@@H]1C[C@H](N(C)C(C)C)CC[C@@H]1N1C(=O)[C@@H](NC=2C3=CC(=CC=C3N=CN=2)C(F)(F)F)CC1 GVOISEJVFFIGQE-YCZSINBZSA-N 0.000 description 7
- 229910052760 oxygen Inorganic materials 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 238000004809 thin layer chromatography Methods 0.000 description 7
- 125000005330 8 membered heterocyclic group Chemical group 0.000 description 6
- 102100030708 GTPase KRas Human genes 0.000 description 6
- 101000584612 Homo sapiens GTPase KRas Proteins 0.000 description 6
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 6
- 229940125773 compound 10 Drugs 0.000 description 6
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 6
- 125000005842 heteroatom Chemical group 0.000 description 6
- 239000000543 intermediate Substances 0.000 description 6
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 229920006395 saturated elastomer Polymers 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 125000003342 alkenyl group Chemical group 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- ZSFLPNDWUWXOGM-UHFFFAOYSA-N naphthalen-2-yl formate Chemical compound C1=CC=CC2=CC(OC=O)=CC=C21 ZSFLPNDWUWXOGM-UHFFFAOYSA-N 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- 238000002953 preparative HPLC Methods 0.000 description 5
- 125000006413 ring segment Chemical group 0.000 description 5
- 239000000741 silica gel Substances 0.000 description 5
- 229910002027 silica gel Inorganic materials 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 4
- HIHOEGPXVVKJPP-JTQLQIEISA-N 5-fluoro-2-[[(1s)-1-(5-fluoropyridin-2-yl)ethyl]amino]-6-[(5-methyl-1h-pyrazol-3-yl)amino]pyridine-3-carbonitrile Chemical compound N([C@@H](C)C=1N=CC(F)=CC=1)C(C(=CC=1F)C#N)=NC=1NC=1C=C(C)NN=1 HIHOEGPXVVKJPP-JTQLQIEISA-N 0.000 description 4
- 125000002853 C1-C4 hydroxyalkyl group Chemical group 0.000 description 4
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- 125000001931 aliphatic group Chemical group 0.000 description 4
- 150000001413 amino acids Chemical group 0.000 description 4
- 239000012298 atmosphere Substances 0.000 description 4
- 238000004296 chiral HPLC Methods 0.000 description 4
- 125000000000 cycloalkoxy group Chemical group 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- 125000004474 heteroalkylene group Chemical group 0.000 description 4
- 125000005844 heterocyclyloxy group Chemical group 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 125000002950 monocyclic group Chemical group 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 238000007789 sealing Methods 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- RBWMYPKAPIYTJQ-VMBFOHBNSA-N (1R,2S,5S)-6,6-dimethyl-N-[(2S)-1-oxo-3-[(3S)-2-oxopyrrolidin-3-yl]propan-2-yl]-3-[2-[4-(trifluoromethoxy)phenoxy]acetyl]-3-azabicyclo[3.1.0]hexane-2-carboxamide Chemical compound CC1([C@@H]2[C@H]1[C@H](N(C2)C(=O)COC3=CC=C(C=C3)OC(F)(F)F)C(=O)N[C@@H](C[C@@H]4CCNC4=O)C=O)C RBWMYPKAPIYTJQ-VMBFOHBNSA-N 0.000 description 3
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 3
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 3
- PHDIJLFSKNMCMI-ITGJKDDRSA-N (3R,4S,5R,6R)-6-(hydroxymethyl)-4-(8-quinolin-6-yloxyoctoxy)oxane-2,3,5-triol Chemical compound OC[C@@H]1[C@H]([C@@H]([C@H](C(O1)O)O)OCCCCCCCCOC=1C=C2C=CC=NC2=CC=1)O PHDIJLFSKNMCMI-ITGJKDDRSA-N 0.000 description 3
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 3
- DMQYDVBIPXAAJA-VHXPQNKSSA-N (3z)-5-[(1-ethylpiperidin-4-yl)amino]-3-[(3-fluorophenyl)-(5-methyl-1h-imidazol-2-yl)methylidene]-1h-indol-2-one Chemical compound C1CN(CC)CCC1NC1=CC=C(NC(=O)\C2=C(/C=3NC=C(C)N=3)C=3C=C(F)C=CC=3)C2=C1 DMQYDVBIPXAAJA-VHXPQNKSSA-N 0.000 description 3
- FRJJJAKBRKABFA-TYFAACHXSA-N (4r,6s)-6-[(e)-2-[6-chloro-4-(4-fluorophenyl)-2-propan-2-ylquinolin-3-yl]ethenyl]-4-hydroxyoxan-2-one Chemical compound C(\[C@H]1OC(=O)C[C@H](O)C1)=C/C=1C(C(C)C)=NC2=CC=C(Cl)C=C2C=1C1=CC=C(F)C=C1 FRJJJAKBRKABFA-TYFAACHXSA-N 0.000 description 3
- UVNPEUJXKZFWSJ-LMTQTHQJSA-N (R)-N-[(4S)-8-[6-amino-5-[(3,3-difluoro-2-oxo-1H-pyrrolo[2,3-b]pyridin-4-yl)sulfanyl]pyrazin-2-yl]-2-oxa-8-azaspiro[4.5]decan-4-yl]-2-methylpropane-2-sulfinamide Chemical compound CC(C)(C)[S@@](=O)N[C@@H]1COCC11CCN(CC1)c1cnc(Sc2ccnc3NC(=O)C(F)(F)c23)c(N)n1 UVNPEUJXKZFWSJ-LMTQTHQJSA-N 0.000 description 3
- LVHOHZHTZXRVRJ-CMDGGOBGSA-N (e)-3-(3-methoxyphenyl)-n-(3,4,5-trimethoxyphenyl)prop-2-enamide Chemical compound COC1=CC=CC(\C=C\C(=O)NC=2C=C(OC)C(OC)=C(OC)C=2)=C1 LVHOHZHTZXRVRJ-CMDGGOBGSA-N 0.000 description 3
- JNPGUXGVLNJQSQ-BGGMYYEUSA-M (e,3r,5s)-7-[4-(4-fluorophenyl)-1,2-di(propan-2-yl)pyrrol-3-yl]-3,5-dihydroxyhept-6-enoate Chemical compound CC(C)N1C(C(C)C)=C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)C(C=2C=CC(F)=CC=2)=C1 JNPGUXGVLNJQSQ-BGGMYYEUSA-M 0.000 description 3
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 3
- RZFJBSIAXYEPBX-UHFFFAOYSA-N 1-[4-[4-[2-[4-chloro-3-(diethylsulfamoyl)anilino]pyrimidin-4-yl]pyridin-2-yl]phenyl]-3-methylurea Chemical compound C1=C(Cl)C(S(=O)(=O)N(CC)CC)=CC(NC=2N=C(C=CN=2)C=2C=C(N=CC=2)C=2C=CC(NC(=O)NC)=CC=2)=C1 RZFJBSIAXYEPBX-UHFFFAOYSA-N 0.000 description 3
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 3
- QBXVXKRWOVBUDB-GRKNLSHJSA-N ClC=1C(=CC(=C(CN2[C@H](C[C@H](C2)O)C(=O)O)C1)OCC1=CC(=CC=C1)C#N)OCC1=C(C(=CC=C1)C1=CC2=C(OCCO2)C=C1)C Chemical compound ClC=1C(=CC(=C(CN2[C@H](C[C@H](C2)O)C(=O)O)C1)OCC1=CC(=CC=C1)C#N)OCC1=C(C(=CC=C1)C1=CC2=C(OCCO2)C=C1)C QBXVXKRWOVBUDB-GRKNLSHJSA-N 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 229940126657 Compound 17 Drugs 0.000 description 3
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 3
- NELWQUQCCZMRPB-UBPLGANQSA-N [(2r,3r,4r,5r)-4-acetyloxy-5-(4-amino-5-ethenyl-2-oxopyrimidin-1-yl)-2-methyloxolan-3-yl] acetate Chemical compound CC(=O)O[C@@H]1[C@H](OC(C)=O)[C@@H](C)O[C@H]1N1C(=O)N=C(N)C(C=C)=C1 NELWQUQCCZMRPB-UBPLGANQSA-N 0.000 description 3
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 3
- 150000001336 alkenes Chemical class 0.000 description 3
- 125000003282 alkyl amino group Chemical group 0.000 description 3
- SRVFFFJZQVENJC-IHRRRGAJSA-N aloxistatin Chemical compound CCOC(=O)[C@H]1O[C@@H]1C(=O)N[C@@H](CC(C)C)C(=O)NCCC(C)C SRVFFFJZQVENJC-IHRRRGAJSA-N 0.000 description 3
- 239000011324 bead Substances 0.000 description 3
- UNXISIRQWPTTSN-UHFFFAOYSA-N boron;2,3-dimethylbutane-2,3-diol Chemical compound [B].[B].CC(C)(O)C(C)(C)O UNXISIRQWPTTSN-UHFFFAOYSA-N 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 229940125904 compound 1 Drugs 0.000 description 3
- 229940125797 compound 12 Drugs 0.000 description 3
- 229940126142 compound 16 Drugs 0.000 description 3
- 229940125782 compound 2 Drugs 0.000 description 3
- 229940126214 compound 3 Drugs 0.000 description 3
- 229940125898 compound 5 Drugs 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 125000004438 haloalkoxy group Chemical group 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- KQNYTTDHCMFOME-UHFFFAOYSA-N methyl n-[[3-[(4-tert-butylpiperazin-1-yl)methyl]-8-fluoro-2-phenylquinoline-4-carbonyl]amino]-n-phenylcarbamate Chemical compound C=1C=CC=CC=1N(C(=O)OC)NC(=O)C(C1=CC=CC(F)=C1N=C1C=2C=CC=CC=2)=C1CN1CCN(C(C)(C)C)CC1 KQNYTTDHCMFOME-UHFFFAOYSA-N 0.000 description 3
- MUJNAWXXOJRNGK-UHFFFAOYSA-N n-[3-(6-methyl-1,2,3,4-tetrahydrocarbazol-9-yl)propyl]cyclohexanamine Chemical compound C1=2CCCCC=2C2=CC(C)=CC=C2N1CCCNC1CCCCC1 MUJNAWXXOJRNGK-UHFFFAOYSA-N 0.000 description 3
- PFGVNLZDWRZPJW-OPAMFIHVSA-N otamixaban Chemical compound C([C@@H](C(=O)OC)[C@@H](C)NC(=O)C=1C=CC(=CC=1)C=1C=C[N+]([O-])=CC=1)C1=CC=CC(C(N)=N)=C1 PFGVNLZDWRZPJW-OPAMFIHVSA-N 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 125000003367 polycyclic group Chemical group 0.000 description 3
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 3
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 3
- TZSZZENYCISATO-WIOPSUGQSA-N rodatristat Chemical compound CCOC(=O)[C@@H]1CC2(CN1)CCN(CC2)c1cc(O[C@H](c2ccc(Cl)cc2-c2ccccc2)C(F)(F)F)nc(N)n1 TZSZZENYCISATO-WIOPSUGQSA-N 0.000 description 3
- DVWOYOSIEJRHKW-UIRZNSHLSA-M sodium (2S)-2-[[(2S)-2-[[(4,4-difluorocyclohexyl)-phenylmethoxy]carbonylamino]-4-methylpentanoyl]amino]-1-hydroxy-3-[(3S)-2-oxopyrrolidin-3-yl]propane-1-sulfonate Chemical compound FC1(CCC(CC1)C(OC(=O)N[C@H](C(=O)N[C@H](C(S(=O)(=O)[O-])O)C[C@H]1C(NCC1)=O)CC(C)C)C1=CC=CC=C1)F.[Na+] DVWOYOSIEJRHKW-UIRZNSHLSA-M 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- GLGNXYJARSMNGJ-VKTIVEEGSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[(1-ethyl-6-methoxy-2-oxo-4,5-dihydro-3h-1-benzazepin-7-yl)amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound CCN1C(=O)CCCC2=C(OC)C(NC=3N=C(C(=CN=3)Cl)N[C@H]3[C@H]([C@@]4([H])C[C@@]3(C=C4)[H])C(N)=O)=CC=C21 GLGNXYJARSMNGJ-VKTIVEEGSA-N 0.000 description 2
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 2
- DIXMBHMNEHPFCX-MCMMXHMISA-N (2r)-2-[5-[6-amino-5-[(1r)-1-[5-fluoro-2-(triazol-2-yl)phenyl]ethoxy]pyridin-3-yl]-4-methyl-1,3-thiazol-2-yl]propane-1,2-diol Chemical compound O([C@H](C)C=1C(=CC=C(F)C=1)N1N=CC=N1)C(C(=NC=1)N)=CC=1C=1SC([C@](C)(O)CO)=NC=1C DIXMBHMNEHPFCX-MCMMXHMISA-N 0.000 description 2
- HPJGEESDHAUUQR-SKGSPYGFSA-N (2s)-2-[[(2s)-5-(diaminomethylideneamino)-2-[[(2s)-1-[(2s)-5-(diaminomethylideneamino)-2-[[(2s)-2-[[(2s)-3-naphthalen-2-yl-2-(3-pyridin-3-ylpropanoylamino)propanoyl]amino]-3-phenylpropanoyl]amino]pentanoyl]pyrrolidine-2-carbonyl]amino]pentanoyl]amino]buta Chemical compound NC(=O)C[C@@H](C(N)=O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=C2C=CC=CC2=CC=1)NC(=O)CCC=1C=NC=CC=1)CC1=CC=CC=C1 HPJGEESDHAUUQR-SKGSPYGFSA-N 0.000 description 2
- VUDZSIYXZUYWSC-DBRKOABJSA-N (4r)-1-[(2r,4r,5r)-3,3-difluoro-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-4-hydroxy-1,3-diazinan-2-one Chemical compound FC1(F)[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N[C@H](O)CC1 VUDZSIYXZUYWSC-DBRKOABJSA-N 0.000 description 2
- AXQACEQYCPKDMV-RZAWKFBISA-N (4r,4as,7ar,12bs)-3-(cyclopropylmethyl)-4a,7,9-trihydroxy-n-[2-(3-phenyl-1,2,4-oxadiazol-5-yl)propan-2-yl]-1,2,4,5,7a,13-hexahydro-4,12-methanobenzofuro[3,2-e]isoquinoline-6-carboxamide Chemical compound N1([C@@H]2CC=3C4=C(C(=CC=3)O)O[C@H]3C(O)=C(C[C@]2(O)[C@]34CC1)C(=O)NC(C)(C)C=1ON=C(N=1)C=1C=CC=CC=1)CC1CC1 AXQACEQYCPKDMV-RZAWKFBISA-N 0.000 description 2
- VAVHMEQFYYBAPR-ITWZMISCSA-N (e,3r,5s)-7-[4-(4-fluorophenyl)-1-phenyl-2-propan-2-ylpyrrol-3-yl]-3,5-dihydroxyhept-6-enoic acid Chemical compound CC(C)C1=C(\C=C\[C@@H](O)C[C@@H](O)CC(O)=O)C(C=2C=CC(F)=CC=2)=CN1C1=CC=CC=C1 VAVHMEQFYYBAPR-ITWZMISCSA-N 0.000 description 2
- YKYWUHHZZRBGMG-JWTNVVGKSA-N 1-methyl-2-[[(1r,5s)-6-[[5-(trifluoromethyl)pyridin-2-yl]methoxymethyl]-3-azabicyclo[3.1.0]hexan-3-yl]methyl]benzimidazole Chemical compound C1([C@@H]2CN(C[C@@H]21)CC=1N(C2=CC=CC=C2N=1)C)COCC1=CC=C(C(F)(F)F)C=N1 YKYWUHHZZRBGMG-JWTNVVGKSA-N 0.000 description 2
- WGABOZPQOOZAOI-UHFFFAOYSA-N 2-[4-[[(3,5-dimethoxy-4-methylbenzoyl)-(3-phenylpropyl)amino]methyl]phenyl]acetic acid Chemical compound COC1=C(C)C(OC)=CC(C(=O)N(CCCC=2C=CC=CC=2)CC=2C=CC(CC(O)=O)=CC=2)=C1 WGABOZPQOOZAOI-UHFFFAOYSA-N 0.000 description 2
- TXEBWPPWSVMYOA-UHFFFAOYSA-N 4-[3-[(1-amino-2-chloroethyl)amino]propyl]-1-[[3-(2-chlorophenyl)phenyl]methyl]-5-hydroxyimidazolidin-2-one Chemical compound NC(CCl)NCCCC1NC(=O)N(Cc2cccc(c2)-c2ccccc2Cl)C1O TXEBWPPWSVMYOA-UHFFFAOYSA-N 0.000 description 2
- KUZSBKJSGSKPJH-VXGBXAGGSA-N 5-[(9R)-6-[(3R)-3-methylmorpholin-4-yl]-11-oxa-1,3,5-triazatricyclo[7.4.0.02,7]trideca-2,4,6-trien-4-yl]pyrazin-2-amine Chemical compound C[C@@H]1COCCN1c1nc(nc2N3CCOC[C@H]3Cc12)-c1cnc(N)cn1 KUZSBKJSGSKPJH-VXGBXAGGSA-N 0.000 description 2
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- NZSQBRZWARZNQH-ZWOACCQCSA-N C1(CC1)NC(=O)O[C@H]1C(C2CC[C@]3([C@@]4(CC[C@@]5(C(C4CCC3[C@]2(CC1)C)[C@@H](CC5)[C@H](C)O)C(=O)O)C)C)(C)C Chemical compound C1(CC1)NC(=O)O[C@H]1C(C2CC[C@]3([C@@]4(CC[C@@]5(C(C4CCC3[C@]2(CC1)C)[C@@H](CC5)[C@H](C)O)C(=O)O)C)C)(C)C NZSQBRZWARZNQH-ZWOACCQCSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 229940126204 KRAS G12D inhibitor Drugs 0.000 description 2
- ZNSPHKJFQDEABI-NZQKXSOJSA-N Nc1nc(O[C@H](c2ccc(Cl)cc2-c2ccccc2)C(F)(F)F)cc(n1)N1CCC2(CN[C@@H](C2)C(O)=O)CC1 Chemical compound Nc1nc(O[C@H](c2ccc(Cl)cc2-c2ccccc2)C(F)(F)F)cc(n1)N1CCC2(CN[C@@H](C2)C(O)=O)CC1 ZNSPHKJFQDEABI-NZQKXSOJSA-N 0.000 description 2
- QQONPFPTGQHPMA-UHFFFAOYSA-N Propene Chemical group CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- 102100032929 Son of sevenless homolog 1 Human genes 0.000 description 2
- 101710146001 Son of sevenless homolog 1 Proteins 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000012300 argon atmosphere Substances 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- AEULIVPVIDOLIN-UHFFFAOYSA-N cep-11981 Chemical compound C1=C2C3=C4CNC(=O)C4=C4C5=CN(C)N=C5CCC4=C3N(CC(C)C)C2=CC=C1NC1=NC=CC=N1 AEULIVPVIDOLIN-UHFFFAOYSA-N 0.000 description 2
- 239000012069 chiral reagent Substances 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 229940126543 compound 14 Drugs 0.000 description 2
- 229940125758 compound 15 Drugs 0.000 description 2
- 229940125876 compound 15a Drugs 0.000 description 2
- 229940126212 compound 17a Drugs 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 230000006837 decompression Effects 0.000 description 2
- 238000001212 derivatisation Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 125000001188 haloalkyl group Chemical group 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 2
- 125000004404 heteroalkyl group Chemical group 0.000 description 2
- 238000005984 hydrogenation reaction Methods 0.000 description 2
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 2
- 239000005457 ice water Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- 239000012452 mother liquor Substances 0.000 description 2
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 2
- DOWVMJFBDGWVML-UHFFFAOYSA-N n-cyclohexyl-n-methyl-4-(1-oxidopyridin-1-ium-3-yl)imidazole-1-carboxamide Chemical compound C1=NC(C=2C=[N+]([O-])C=CC=2)=CN1C(=O)N(C)C1CCCCC1 DOWVMJFBDGWVML-UHFFFAOYSA-N 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 2
- 125000003386 piperidinyl group Chemical group 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 125000003003 spiro group Chemical group 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- WJKHJLXJJJATHN-UHFFFAOYSA-N triflic anhydride Chemical compound FC(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)F WJKHJLXJJJATHN-UHFFFAOYSA-N 0.000 description 2
- 238000007039 two-step reaction Methods 0.000 description 2
- HBENZIXOGRCSQN-VQWWACLZSA-N (1S,2S,6R,14R,15R,16R)-5-(cyclopropylmethyl)-16-[(2S)-2-hydroxy-3,3-dimethylpentan-2-yl]-15-methoxy-13-oxa-5-azahexacyclo[13.2.2.12,8.01,6.02,14.012,20]icosa-8(20),9,11-trien-11-ol Chemical compound N1([C@@H]2CC=3C4=C(C(=CC=3)O)O[C@H]3[C@@]5(OC)CC[C@@]2([C@@]43CC1)C[C@@H]5[C@](C)(O)C(C)(C)CC)CC1CC1 HBENZIXOGRCSQN-VQWWACLZSA-N 0.000 description 1
- LJIOTBMDLVHTBO-CUYJMHBOSA-N (2s)-2-amino-n-[(1r,2r)-1-cyano-2-[4-[4-(4-methylpiperazin-1-yl)sulfonylphenyl]phenyl]cyclopropyl]butanamide Chemical compound CC[C@H](N)C(=O)N[C@]1(C#N)C[C@@H]1C1=CC=C(C=2C=CC(=CC=2)S(=O)(=O)N2CCN(C)CC2)C=C1 LJIOTBMDLVHTBO-CUYJMHBOSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000006023 1-pentenyl group Chemical group 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- AVRPFRMDMNDIDH-UHFFFAOYSA-N 1h-quinazolin-2-one Chemical compound C1=CC=CC2=NC(O)=NC=C21 AVRPFRMDMNDIDH-UHFFFAOYSA-N 0.000 description 1
- JENUMEXEVAAAJX-SNVBAGLBSA-N 2-(3,5-dimethyl-1,2,4-triazol-1-yl)-1-[(2r)-2-methyl-4-[2-(trifluoromethyl)-4-[2-(trifluoromethyl)pyrimidin-5-yl]-1,3-thiazol-5-yl]piperazin-1-yl]ethanone Chemical compound C([C@H]1C)N(C2=C(N=C(S2)C(F)(F)F)C=2C=NC(=NC=2)C(F)(F)F)CCN1C(=O)CN1N=C(C)N=C1C JENUMEXEVAAAJX-SNVBAGLBSA-N 0.000 description 1
- IOOWNWLVCOUUEX-WPRPVWTQSA-N 2-[(3r,6s)-2-hydroxy-3-[(2-thiophen-2-ylacetyl)amino]oxaborinan-6-yl]acetic acid Chemical compound OB1O[C@H](CC(O)=O)CC[C@@H]1NC(=O)CC1=CC=CS1 IOOWNWLVCOUUEX-WPRPVWTQSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- HRADVHZVMOMEPU-UHFFFAOYSA-N 3-iodopyrrolidine-2,5-dione Chemical compound IC1CC(=O)NC1=O HRADVHZVMOMEPU-UHFFFAOYSA-N 0.000 description 1
- 125000003542 3-methylbutan-2-yl group Chemical group [H]C([H])([H])C([H])(*)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000006042 4-hexenyl group Chemical group 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- OSJRWZLWCLWVJF-UHFFFAOYSA-N 7H-pyrido[4,3-d]pyrimidin-8-one Chemical class O=C1CN=Cc2cncnc12 OSJRWZLWCLWVJF-UHFFFAOYSA-N 0.000 description 1
- MITGKKFYIJJQGL-UHFFFAOYSA-N 9-(4-chlorobenzoyl)-6-methylsulfonyl-2,3-dihydro-1H-carbazol-4-one Chemical compound ClC1=CC=C(C(=O)N2C3=CC=C(C=C3C=3C(CCCC2=3)=O)S(=O)(=O)C)C=C1 MITGKKFYIJJQGL-UHFFFAOYSA-N 0.000 description 1
- QUMCIHKVKQYNPA-RUZDIDTESA-N C1(CCCCC1)CN1[C@@H](C=2N(C=3C=NC(=NC1=3)NC1=C(C=C(C(=O)NC3CCN(CC3)C)C=C1)OC)C(=NN=2)C)CC Chemical compound C1(CCCCC1)CN1[C@@H](C=2N(C=3C=NC(=NC1=3)NC1=C(C=C(C(=O)NC3CCN(CC3)C)C=C1)OC)C(=NN=2)C)CC QUMCIHKVKQYNPA-RUZDIDTESA-N 0.000 description 1
- 125000000041 C6-C10 aryl group Chemical group 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Natural products NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 101000801643 Homo sapiens Retinal-specific phospholipid-transporting ATPase ABCA4 Proteins 0.000 description 1
- 101000652482 Homo sapiens TBC1 domain family member 8 Proteins 0.000 description 1
- 101150105104 Kras gene Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- HPKJGHVHQWJOOT-ZJOUEHCJSA-N N-[(2S)-3-cyclohexyl-1-oxo-1-({(2S)-1-oxo-3-[(3S)-2-oxopyrrolidin-3-yl]propan-2-yl}amino)propan-2-yl]-1H-indole-2-carboxamide Chemical compound C1C(CCCC1)C[C@H](NC(=O)C=1NC2=CC=CC=C2C=1)C(=O)N[C@@H](C[C@H]1C(=O)NCC1)C=O HPKJGHVHQWJOOT-ZJOUEHCJSA-N 0.000 description 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N Nitrogen dioxide Chemical compound O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 101150003085 Pdcl gene Proteins 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 102000001788 Proto-Oncogene Proteins c-raf Human genes 0.000 description 1
- 108010029869 Proto-Oncogene Proteins c-raf Proteins 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102100033617 Retinal-specific phospholipid-transporting ATPase ABCA4 Human genes 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical class [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 1
- 102100030302 TBC1 domain family member 8 Human genes 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- YLEIFZAVNWDOBM-ZTNXSLBXSA-N ac1l9hc7 Chemical compound C([C@H]12)C[C@@H](C([C@@H](O)CC3)(C)C)[C@@]43C[C@@]14CC[C@@]1(C)[C@@]2(C)C[C@@H]2O[C@]3(O)[C@H](O)C(C)(C)O[C@@H]3[C@@H](C)[C@H]12 YLEIFZAVNWDOBM-ZTNXSLBXSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000012445 acidic reagent Substances 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 238000003016 alphascreen Methods 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000011914 asymmetric synthesis Methods 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical class B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 235000019504 cigarettes Nutrition 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000006552 constitutive activation Effects 0.000 description 1
- DOBRDRYODQBAMW-UHFFFAOYSA-N copper(i) cyanide Chemical compound [Cu+].N#[C-] DOBRDRYODQBAMW-UHFFFAOYSA-N 0.000 description 1
- 125000005366 cycloalkylthio group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000002188 cycloheptatrienyl group Chemical group C1(=CC=CC=CC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 150000001975 deuterium Chemical group 0.000 description 1
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 description 1
- 125000005047 dihydroimidazolyl group Chemical group N1(CNC=C1)* 0.000 description 1
- 125000005052 dihydropyrazolyl group Chemical group N1(NCC=C1)* 0.000 description 1
- 125000005054 dihydropyrrolyl group Chemical group [H]C1=C([H])C([H])([H])C([H])([H])N1* 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 150000002332 glycine derivatives Chemical class 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 1
- 125000004468 heterocyclylthio group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical class CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical class IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 239000002608 ionic liquid Substances 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000003384 isochromanyl group Chemical group C1(OCCC2=CC=CC=C12)* 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- JFOZKMSJYSPYLN-QHCPKHFHSA-N lifitegrast Chemical compound CS(=O)(=O)C1=CC=CC(C[C@H](NC(=O)C=2C(=C3CCN(CC3=CC=2Cl)C(=O)C=2C=C3OC=CC3=CC=2)Cl)C(O)=O)=C1 JFOZKMSJYSPYLN-QHCPKHFHSA-N 0.000 description 1
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- LVWZTYCIRDMTEY-UHFFFAOYSA-N metamizole Chemical compound O=C1C(N(CS(O)(=O)=O)C)=C(C)N(C)N1C1=CC=CC=C1 LVWZTYCIRDMTEY-UHFFFAOYSA-N 0.000 description 1
- BGXZIBSLBRKDTP-UHFFFAOYSA-N methyl 9-(4-chloroanilino)-[1,3]thiazolo[5,4-f]quinazoline-2-carboximidate Chemical compound C12=C3SC(C(=N)OC)=NC3=CC=C2N=CN=C1NC1=CC=C(Cl)C=C1 BGXZIBSLBRKDTP-UHFFFAOYSA-N 0.000 description 1
- KTMKRRPZPWUYKK-UHFFFAOYSA-N methylboronic acid Chemical compound CB(O)O KTMKRRPZPWUYKK-UHFFFAOYSA-N 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- FMASTMURQSHELY-UHFFFAOYSA-N n-(4-fluoro-2-methylphenyl)-3-methyl-n-[(2-methyl-1h-indol-4-yl)methyl]pyridine-4-carboxamide Chemical compound C1=CC=C2NC(C)=CC2=C1CN(C=1C(=CC(F)=CC=1)C)C(=O)C1=CC=NC=C1C FMASTMURQSHELY-UHFFFAOYSA-N 0.000 description 1
- PHHRKRGXWSEXFZ-UHFFFAOYSA-N n-(pyridin-3-ylmethyl)-3-[[2-[(2,3,4-trifluorophenoxy)methyl]-1,3-benzoxazol-4-yl]oxy]propan-1-amine Chemical compound FC1=C(F)C(F)=CC=C1OCC(OC1=CC=C2)=NC1=C2OCCCNCC1=CC=CN=C1 PHHRKRGXWSEXFZ-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- WOOWBQQQJXZGIE-UHFFFAOYSA-N n-ethyl-n-propan-2-ylpropan-2-amine Chemical compound CCN(C(C)C)C(C)C.CCN(C(C)C)C(C)C WOOWBQQQJXZGIE-UHFFFAOYSA-N 0.000 description 1
- HBEDNENASUYMPO-LJQANCHMSA-N n-hydroxy-4-[[(2r)-3-oxo-2-(thiophen-2-ylmethyl)-2,4-dihydroquinoxalin-1-yl]methyl]benzamide Chemical compound C1=CC(C(=O)NO)=CC=C1CN1C2=CC=CC=C2NC(=O)[C@H]1CC1=CC=CS1 HBEDNENASUYMPO-LJQANCHMSA-N 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- JWAZRIHNYRIHIV-UHFFFAOYSA-M naphthalen-2-olate Chemical compound C1=CC=CC2=CC([O-])=CC=C21 JWAZRIHNYRIHIV-UHFFFAOYSA-M 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 231100000590 oncogenic Toxicity 0.000 description 1
- 230000002246 oncogenic effect Effects 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 201000008129 pancreatic ductal adenocarcinoma Diseases 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- PLZDHJUUEGCXJH-UHFFFAOYSA-N pyrido[4,3-d]pyrimidine Chemical compound C1=NC=C2C=NC=CC2=N1 PLZDHJUUEGCXJH-UHFFFAOYSA-N 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 102000016914 ras Proteins Human genes 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- JQSHBVHOMNKWFT-DTORHVGOSA-N varenicline Chemical compound C12=CC3=NC=CN=C3C=C2[C@H]2C[C@@H]1CNC2 JQSHBVHOMNKWFT-DTORHVGOSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic Table
- C07F5/02—Boron compounds
- C07F5/025—Boronic and borinic acid compounds
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本公开涉及一种Kras抑制剂及其制备方法。具体而言,本公开涉及一种式I所示的化合物或其药学上可接受的盐,本公开还涉及组合物及其医药用途,具体取代基的定义如说明书中所述。
Description
技术领域
本公开属于医药领域,涉及一种Kras抑制剂及其制备方法、组合物和医药用途。
背景技术
Kirsten Rat Sarcoma 2病毒癌基因同源物(“kras”)是一个小的GTP酶和RAS系列的癌症组织。KRAS用作循环的分子开关循环在无活性(GDP键)和活性(GTP结合)状态之间,以将从多个酪氨酸激酶接收到下游效应器的上游细胞信号,以调节各种过程,包括细胞增殖。KRA的异常表达占所有癌症和致癌的癌症的20%,稳定GTP结合,并导致克拉斯和下游信号的组成型激活,在25-30%的肺腺癌中报告。在KRAS伯氨基酸序列的密码子12和13处导致密码突变的单核苷酸取代包含肺腺癌中的约40%的KRAS驱动突变。KRAS G12D突变中的25.0%占胰腺导管腺癌患者的25.0%,占所有结直肠癌患者的13.3%,占全直肠癌患者的10.1%,占所有非小细胞肺癌患者的4.1%,占所有小细胞肺的1.7%癌患者。KRAS在恶性肿瘤中的众所周知的作用以及各种肿瘤类型中KRAS频繁突,使KRAS成为癌症治疗的制药行业的高度吸引力的目标,现有技术WO2021041671公开了一类KRA G12D抑制剂。
发明内容
本公开提供一种式I所示的化合物或其药学上可接受的盐,
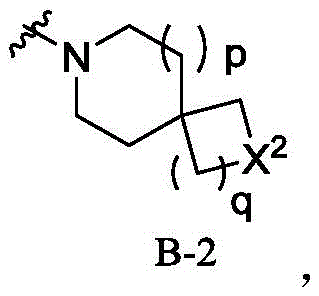
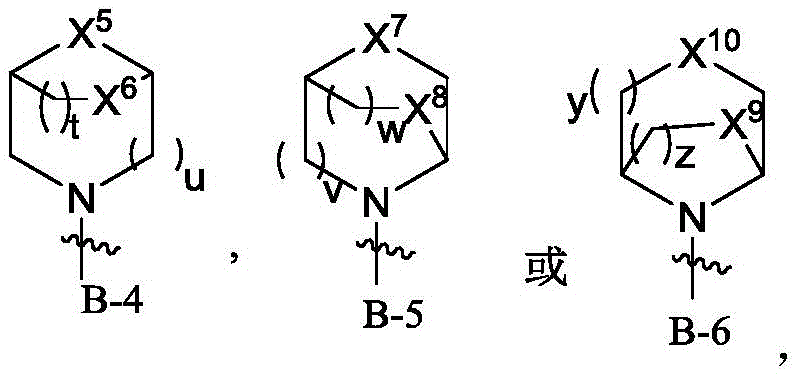
其中,R1为至少含1个N原子的杂环基,所述的至少含1个N原子的杂环基选自B-1、B-2、B-3、B-4、B-5或B-6,
所述X1、X2、X3、X4、X5、X6、X7、X8、X9、X10各自独立地选自-CRaRb-、-O-、-S-、-NRc-;
n,p,q,r,s,t,u,v,w,y,z各自独立的选自0,1,2,3或4;
所述至少含1个N原子的杂环基任选被选自0,1,2,3,4,5或6个Rd取代;
X选自N或者CRe;
L1选自-CH2Rf-,-ORf-,-SRf-,-RfNRgRh-,-CORf-,-CONRgRh,-SO2NRgRh,所述Rf选自-CRf1Rf2-、-CRf1Rf2-CRf3Rf4-或-CRf1Rf2-CRf3Rf4-CRf5Rf6-;
R2没有,或为选自至少含1个氮原子的3-12元的杂环基、至少含1个氮原子的5-10元杂芳基;所述3-12元的杂环基或5-10元杂芳基任选独立地被0,1,2,3,4,5或6个Ri取代;
Cy与其连接的原子形成5-7元环烷基、5-7元杂环基、5-7元芳香基、5-7元含氮杂芳基;
m选自0,1,2,3,4,5或6;
R3选自氢、氘、卤素、氰基、羟基、叠氮基、硝基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基、氧代、C3-8环烷基、3-8元的杂环基;或者两个R3与其连接的碳原子形成3-6元的环烷基;
L2选自键、-S-、-C(O)-、-CRf1Rf2-;
Ar选自C6-10芳基、5-10元杂芳基,所述Ar任选被1-6个Rj取代;
Ra、Rb、Rc、Ri、Rj各自独立的选自氢、氘、卤素、氰基、羟基、叠氮基、-B(OH)2、硝基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基、C2-6烯基、C2-6炔基、氧代、=NRa1,-SRa1、-ORa1、-NRa1Ra2、-CORa2、-CONRa1Ra2、-C(O)ORa2、-N(Ra2)-C(O)Ra2、-N(Ra2)-C(O)NRa1Ra2、-N(Ra2)-C(O)ORa2、-N(Ra2)-SO2Ra2、-SO2Ra2、-SO2ORa2、-SO2NRa1Ra2、-O-SO2NRa1Ra2、-O(CO)NRa1Ra2、C3-8环烷基、3-8元的杂环基、C6-10芳基、5-10元杂芳基、C3-8环烷基取代-C1-4烷基、3-8元的杂环基取代-C1-4烷基、C6-10芳基取代-C1-4烷基、5-10元杂芳基取代-C1-4烷基;
所述C3-8环烷基、3-8元的杂环基、C6-10芳基、5-10元杂芳基、C3-8环烷基取代-C1-4烷基、3-8元的杂环基取代-C1-4烷基、C6-10芳基取代-C1-4烷基、5-10元杂芳基取代-C1-4烷基任选被1-3个选自卤素、氰基、羟基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基,所述的5-10元杂芳基含有1-5个杂原子,各自独立的选自S,N和O;
其中R4或R5各自独立的选自氢、C1-6烷基、C1-6卤代烷基,C1-6烷氧基、C1-4羟基烷基;
X11选自-O-或-NRa1-;
R6选自-ORa1或-NRa1Ra2;
其中,L3选自含有1-6个碳的亚烷基或亚杂烷基;
X12选自-O-或-NRa1-;
X13选自氧或硫;
R7选自-ORa1或-NRa1Ra2;
Rd选自氢、氘、卤素、氰基、羟基、叠氮基、硝基、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基、-NRa1Ra2、-SRa1、-ORa1、-CORa2;
Re选自氢、氘、羟基、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基、-NRa1Ra2、C(O)NH2;
Rg选自H、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C(O)NH2;
Rh选自H、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基,所述C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基任选被1-3个选自卤素、氰基、羟基、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C1-4烷氧基-C1-4烷基的取代基取代;
Ra1选自氢、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C(O)NH2;
Ra2选自氢、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基,其中C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基任选被1-3个选自卤素、氰基、羟基、C1-4烷基、C1-4卤代烷基、C1-4烷氨基、羟基-C1-4烷基、C1-4烷氧基-C1-4烷基取代;或
Ra1与Ra2与其连接的氮原子组成3-8元的杂环基;
所述Rf1、Rf2、Rf3、Rf4、Rf5、Rf6各自独立的选自氢、氘、卤素、羟基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基,或者任选Rf1与Rf2、Rf3与Rf4、Rf5与Rf6与其连接的碳原子组成3-6元的环烷基或3-6元的杂环基,所述3-6元的环烷基或3-6元的杂环基任选被1-3个选自氘、卤素、羟基、C1-6烷基的取代基取代。
可选的实施方案中,本公开提供的式I所示的化合物或其药学上可接受的盐,
其中,R1为至少含1个N原子的杂环基,所述的至少含1个N原子的杂环基选自B-1、B-2、B-3、B-4、B-5或B-6,
所述X1、X2、X3、X4、X5、X6、X7、X8、X9、X10各自独立地选自-CRaRb-、-O-、-S-、-NRc-;
n,p,q,r,s,t,u,v,w,y,z各自独立的选自0,1,2,3或4;
所述至少含1个N原子的杂环基任选被选自0,1,2,3,4,5或6个Rd取代;
X选自N或者CRe;
L1选自-CH2Rf-,-ORf-,-SRf-,-RfNRgRh-,-CORf-,-CONRgRh,-SO2NRgRh,所述Rf选自-CRf1Rf2-、-CRf1Rf2-CRf3Rf4-或-CRf1Rf2-CRf3Rf4-CRf5Rf6-;
R2没有,或为选自至少含1个氮原子的3-12元的杂环基、至少含1个氮原子的5-10元杂芳基;所述3-12元的杂环基或5-10元杂芳基任选独立地被0,1,2,3,4,5或6个Ri取代;
Cy与其连接的原子形成5-7元环烷基、5-7元杂环基、5-7元芳香基、5-7元含氮杂芳基;
m选自0,1,2,3,4,5或6;
R3选自氢、氘、卤素、氰基、羟基、叠氮基、硝基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基、氧代、C3-8环烷基、3-8元的杂环基;或者两个R3与其连接的碳原子形成3-6元的环烷基;
L2选自键、-S-、-C(O)-、-CRf1Rf2-;
Ar选自C6-10芳基、5-10元杂芳基,所述Ar任选被1-6个Rj取代;
Ra、Rb、Rc、Ri、Rj各自独立的选自氢、氘、卤素、氰基、羟基、叠氮基、硝基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基、C2-6烯基、C2-6炔基、氧代、=NRa1,-SRa1、-ORa1、-NRa1Ra2、-CORa2、-CONRa1Ra2、-C(O)ORa2、-N(Ra2)-C(O)Ra2、-N(Ra2)-C(O)NRa1Ra2、-N(Ra2)-C(O)ORa2、-N(Ra2)-SO2Ra2、-SO2Ra2、-SO2ORa2、-SO2NRa1Ra2、-O-SO2NRa1Ra2、-O(CO)NRa1Ra2、C3-8环烷基、3-8元的杂环基、C6-10芳基、5-10元杂芳基、C3-8环烷基取代-C1-4烷基、3-8元的杂环基取代-C1-4烷基、C6-10芳基取代-C1-4烷基、5-10元杂芳基取代-C1-4烷基;
所述C3-8环烷基、3-8元的杂环基、C6-10芳基、5-10元杂芳基、C3-8环烷基取代-C1-4烷基、3-8元的杂环基取代-C1-4烷基、C6-10芳基取代-C1-4烷基、5-10元杂芳基取代-C1-4烷基任选被1-3个选自卤素、氰基、羟基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基,所述的5-10元杂芳基含有1-5个杂原子,各自独立的选自S,N和O;
Rd选自氢、氘、卤素、氰基、羟基、叠氮基、硝基、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基、-NRa1Ra2、-SRa1、-ORa1、-CORa2;
Re选自氢、氘、羟基、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基、-NRa1Ra2、C(O)NH2;
Rg选自H、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C(O)NH2;
Rh选自H、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基,所述C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基任选被1-3个选自卤素、氰基、羟基、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C1-4烷氧基-C1-4烷基的取代基取代;
Ra1选自氢、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C(O)NH2;
Ra2选自氢、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基,其中C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,C6-10芳香基、5-10元杂芳基任选被1-3个选自卤素、氰基、羟基、C1-4烷基、C1-4卤代烷基、C1-4烷氨基、羟基-C1-4烷基、C1-4烷氧基-C1-4烷基取代;
所述Rf1、Rf2、Rf3、Rf4、Rf5、Rf6各自独立的选自氢、氘、卤素、羟基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基,或者任选Rf1与Rf2、Rf3与Rf4、Rf5与Rf6与其连接的碳原子组成3-6元的环烷基或3-6元的杂环基,所述3-6元的环烷基或3-6元的杂环基任选被1-3个选自氘、卤素、羟基、C1-6烷基的取代基取代。
一些实施方案中,所述的化合物或其药学上可接受的盐,结构为式II-1或II-2,
一些实施方案中,所述的化合物或其药学上可接受的盐,结构为式III-1到III-58,
所述Rk同式I所示化合物或其药学上可接受的盐的Rc。
一些实施方案中,式I所示的化合物或其药学上可接受的盐,结构为
一些实施方案中,所述式I所示化合物或其药学上可接受的盐、式II-1或II-2所示化合物或其药学上可接受的盐、式III-1到III-54所示化合物或其药学上可接受的盐,其中L1选自-CH2Rf-,-ORf-,-SRf-,-CORf-,-CONRgRh,可选-CH2Rf-,-ORf-,-SRf-,-CONRgRh。
可选的实施方案中,所述Rf选自-CRf1Rf2-、-CRf1Rf2-CRf3Rf4-,可选-CRf1Rf2-。
可选的实施方案中,所述Rf1、Rf2、Rf3、Rf4、Rf5、Rf6各自独立的选自氢、氘、卤素、C1-6烷基,或者任选Rf1与Rf2、Rf3与Rf4、Rf5与Rf6与其连接的碳原子组成3-6元的环烷基或3-6元的杂环基,所述3-6元的环烷基或3-6元的杂环基任选被1-3个选自氘、卤素、羟基、C1-6烷基的取代基取代。
可选的实施方案中,所述Rf1、Rf2、Rf3、Rf4、Rf5、Rf6各自独立的选自氢、氘、氟、氯、溴、碘、甲基、乙基、正丙基、异丙基、叔丁基,可选氢、氘、氟、甲基或乙基。
可选的实施方案中,所述Rf1、Rf2、Rf3、Rf4、Rf5、Rf6与其连接的碳原子组成3-6元的环烷基,所述3-6元的环烷基任选被1-3个选自氘、卤素、羟基、C1-6烷基的取代基取代,可选所述Rf1、Rf2、Rf3、Rf4、Rf5、Rf6与其连接的碳原子组成3元、4元、五元的环烷基。
一些实施方案中,所述式I所示化合物或其药学上可接受的盐、式II-1或II-2所示化合物或其药学上可接受的盐、式III-1到III-54所示化合物或其药学上可接受的盐,所述R2选自至少含1个氮原子的3-12元的杂环基、至少含1个氮原子的5-10元杂芳基,所述至少含1个氮原子的3-12元的杂环基、至少含1个氮原子的5-10元杂芳基选自六氢-1H-吡咯嗪基、六氢-1H-吡咯嗪-3-酮基、六氢-1H-吡咯并[2,1-c][1,4]噁嗪基、八氢吲哚嗪基、六氢吡咯嗪-4-1H-氧化物、氮杂环丁烷、吡咯烷基、吡咯烷-2-酮、氧杂环丁烷基、哌啶基、l-氮杂双环[2.2.1]庚基、吗啉基、氧杂-5-氮杂双环[2.2.1]庚基-5-基、硫吡喃基或2',3'-二氢螺[环丙烷-1,1'-茚基],可选六氢-1H-吡咯嗪基,可选六氢-1H-吡咯嗪基或吡咯烷基。
可选的实施方案中,所述Ri选自氢、卤素、氘、羟基、氨基、氧代、C1-6烷基、C1-6卤代烷基
其中,L3选自含有1-6个碳的亚烷基或亚杂烷基;
X12选自-O-或-NRa1-;
X13选自氧或硫;
R7选自-ORa1或-NRa1Ra2;
Ra1和Ra2各自独立地选自氢、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,或Ra1与Ra2与其连接的氮原子组成3-8元的杂环基;
可选的实施方案中,所述Ri选自氢、卤素、氘、羟基、氨基、氧代、C1-6烷基、C1-6卤代烷基,可选氘、卤素、甲基、乙基、正丙基、异丙基、叔丁基。
可选的实施方案中,所述-L1-R2选自
可选的实施方案中,所述-L1-R2选自
一些实施方案中,所述式I所示化合物或其药学上可接受的盐、式II-1或II-2所示化合物或其药学上可接受的盐、式III-1到III-54所示化合物或其药学上可接受的盐,所述Ar选自选自C6-10芳基、5-10元杂芳基,所述C6-10芳基或5-10元杂芳基选自苯基、萘基、1,2,3,4-四氢萘基、2,3-二氢-1H-茚基、吡啶基、哒嗪基、吡嗪基、嘧啶基、喹啉基、吲唑基、吲哚基、异喹啉基、异恶唑基、噻吩基、三唑基、吡唑基、苯并噻唑基、吡啶酮基团、喹啉酮基,异喹啉酮基、喹唑啉二酮基、吡嗪酮基、嘧啶酮基、嘧啶二酮基、哒嗪酮基、喹唑啉酮基、苯并呋喃基、苯并二恶唑基、萘啶酮基、苯并吡喃基、异苯并二氢吡喃基,所述Ar任选被1-6个Rj取代。
可选的实施方案中,所述Ar选自C6-10芳基、5-10元杂芳基,所述C6-10芳基或5-10元杂芳基选自
其中R4或R5各自独立的选自氢、C1-6烷基、C1-6卤代烷基,C1-6烷氧基、C1-4羟基烷基;
X11选自-O-或-NRa1-;
R6选自-ORa1或-NRa1Ra2;
Ra1和Ra2各自独立地选自氢、C1-4烷基、C1-4卤代烷基、羟基-C1-4烷基、C3-8环烷基、C1-4烷氧基-C1-4烷基,或Ra1与Ra2与其连接的氮原子组成3-8元的杂环基;
可选的实施方案中,所述Rj选自卤素、氘、羟基、C2-6烯基、C2-6炔基,优选氘、羟基、氟、氯、溴、C2-6烯基、C2-6炔基。
一些实施方案中,式I所示的化合物或其药学上可接受的盐,其为IV-1,
各个取代基如式I所示化合物或其药学上可接受的盐、式II-1或II-2所示化合物或其药学上可接受的盐、式III-1到III-54所示化合物或其药学上可接受的盐中定义。
可选的实施方案中,所述Ar选自
可选的实施方案中,所述Ar选自
可选的实施方案中,所述Ar选自
可选的实施方案中,所述Ar选自
可选的实施方案中,所述Ar选自
可选的实施方案中,所述Ar选自
可选的实施方案中,所述R1选自
所述B-4、B-5、B-6各自独立地任选被选自0,1,2,3,4,5或6个Rd取代,所述X5、X6、X7、X8、X9、X10各自独立的选自-NRc-、-CRaRb-。
可选的实施方案中,所述Rd选自氢、卤素、氘、羟基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基、C2-6烯基、C2-6炔基、氧代、-SRa1、-ORa1、-NRa1Ra2、-CORa2、C3-8环烷基、3-8元的杂环基、C3-8环烷基取代-C1-4烷基、3-8元的杂环基取代-C1-4烷基;
所述C3-8环烷基、3-8元的杂环基、C3-8环烷基取代-C1-4烷基、3-8元的杂环基取代-C1-4烷基任选被1-3个选自卤素、氰基、羟基、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、C1-4羟基烷基;
可选的实施方案中,所述Rd选自氢、卤素、氘、C1-6烷基、C3-8环烷基;
可选的实施方案中,所述Rd选自氢、氟、氯、溴、碘、甲基、乙基、正丙基、异丙基、叔丁基、环丙烷、环丁烷、环戊烷、环己烷。
可选的实施方案中,所述Rc选自氢、氘、C1-6烷基、C3-8环烷基、3-8元的杂环基,可选氢、氘甲基、乙基、正丙基、异丙基、叔丁基、环丙烷、环丁烷、环戊烷、环己烷。
可选的实施方案中,所述Ra、Rb各自独立的选自氢、氘、羟基、氨基、卤素、C1-6烷基、C3-8环烷基、3-8元的杂环基。
可选的实施方案中,所述Ra、Rb各自独立的选自氢。
一些实施方案中,所述B-2选自
一些实施方案中,所述B-3选自自
一些实施方案中,所述B-4、B-5、B-6选自
一些实施方案中,所述R1选自
一些实施方案中,所述R3选自选自氢、氘、卤素、氰基、羟基、C1-6烷基,优选氢、氘、氟、氯、溴、碘、甲基、乙基、正丙基、异丙基、叔丁基。
可选的实施方案中,所述L2选自键。
可选的实施方案中,所述L2选自-S-。
可选的实施方案中,所述L2选自-C(O)-。
可选的实施方案中,所述L2选自-CRf1Rf2-;所述Rf1、Rf2各自独立的选自氢、氘、卤素、C1-6烷基,或者任选Rf1与Rf2与其连接的碳原子组成3-6元的环烷基或3-6元的杂环基,所述3-6元的环烷基或3-6元的杂环基任选被1-3个选自氘、卤素、羟基、C1-6烷基的取代基取代,可选地,所述Rf1、Rf2各自独立的选自氢、氘、氟、氯、溴、碘、甲基、乙基、正丙基、异丙基、叔丁基;或者所述Rf1、Rf2与其连接的碳原子组成3-6元的环烷基,所述3-6元的环烷基任选被1-3个选自氘、卤素、羟基、C1-6烷基的取代基取代,可选所述Rf1、Rf2与其连接的碳原子组成3元、4元、五元的环烷基。
一些实施方案中,所述的化合物或其药学上可接受的盐,其为
各个取代基如式I所示化合物或其药学上可接受的盐、式II-1或II-2所示化合物或其药学上可接受的盐、式III-1到III-54所示化合物或其药学上可接受的盐中定义、IV-1所示化合物或其药学上可接受的盐中定义。
一些实施方案中,所述的化合物或其药学上可接受的盐,其为
各个取代基如式I所示化合物或其药学上可接受的盐、式II-1或II-2所示化合物或其药学上可接受的盐、式III-1到III-54所示化合物或其药学上可接受的盐中定义、IV-1所示化合物或其药学上可接受的盐中定义。
可选的实施方案中,所述的式I所示的化合物或其药学上可接受的盐,其为
可选的实施方案中,所述的式I所示的化合物或其药学上可接受的盐,其为
或其药学上可接受的盐。
另一方面,本公开提供一种所述的化合物或其药学上可接受的盐的同位素取代物,同位素原子为氘。
可选的实施方案中,所述氘原子的丰度大于20%,可选所述氘原子的丰度大于50%,可选所述氘原子的丰度大于90%,可选所述氘原子的丰度大于95%。
另一方面,本公开提供一种药物组合物,包括至少一种治疗有效量的上述化合物或其药学上可接受的盐以及药学上可接受的赋形剂。
在一些实施方案中,所述的药物组合物的单位剂量为0.001mg-1000mg。
在某些实施方案中,基于组合物的总重量,所述的药物组合物含有0.01-99.99%的前述式I所示化合物或其药学上可接受的盐。
在某些实施方案中,所述的药物组合物含有0.1-99.9%的前述化合物或其药学上可接受的盐。
在某些实施方案中,所述的药物组合物含有0.5%-99.5%的前述化合物或其药学上可接受的盐。
在某些实施方案中,所述的药物组合物含有1%-99%的前述前述化合物或其药学上可接受的盐。
在某些实施方案中,所述的药物组合物含有2%-98%的前述式前述化合物或其药学上可接受的盐。
在某些实施方案中,基于组合物的总重量,所述的药物组合物含有0.01%-99.99%的药学上可接受的赋形剂。
在某些实施方案中,所述的药物组合物含有0.1%-99.9%的药学上可接受的赋形剂。
在某些实施方案中,所述的药物组合物含有0.5%-99.5%的药学上可接受的赋形剂。
在某些实施方案中,所述的药物组合物含有1%-99%的药学上可接受的赋形剂。
在某些实施方案中,所述的药物组合物含有2%-98%的药学上可接受的赋形剂。
另一方面,本公开提供一种预防和/或治疗患有与KRAS G12D相关疾病或病症的患者的方法,其包括向所述患者施用治疗有效量的上述化合物或其药学上可接受的盐或上述的药物组合物。
另一方面,本公开提供一种预防和/或治疗患有癌症患者的方法,其包括向所述患者施用治疗有效量的上述化合物或其药学上可接受的盐或上述的药物组合物。
另一方面,本公开提供一种上述化合物或其药学上可接受的盐或上述的药物组合物制备用于预防和/或治疗与KRAS G12D相关疾病或病症的药物中的用途。
另一方面,本公开提供一种上述化合物或其药学上可接受的盐或上述的药物组合物制备用于预防和/或治疗癌症的药物中的用途。
另一方面,本公开提供一种使用上述化合物或其药学上可接受的盐或上述的药物组合物抑制细胞中KRA G12D活性的方法。
另一方面,本公开提供一种上述化合物或其药学上可接受的盐或上述的药物组合物用于医药治疗的用途。
另一方面,本公开提供一种上述化合物或其药学上可接受的盐或上述的药物组合物作为KRAS G12D抑制剂的用途。
本公开中所述的癌症选自非小细胞肺癌、小细胞肺癌、结直肠癌、直肠癌或胰腺癌。
另一方面,本公开中所述化合物可药用盐选自无机盐或有机盐。
“KRAS G12D”是指哺乳动物KRA蛋白的突变体形式,其含有在氨基酸位置12的甘氨酸的氨基酸取代。氨基酸密码子和人类KRA的残留位置的分配是基于Uniprotkb/Swiss-prot P01116:Variantp.gly12ax鉴定的氨基酸序列。
“KRAS G12D抑制剂”是指通过如本文所述的式(I)表示的本发明化合物。这些化合物能够负调节或抑制KRAS G12D的全部或一部分酶活性。
“KRAS G12D相关疾病或病症”与患有或具有KRAS G12D突变相关或介导的疾病或病症。KRAS G12D相关疾病或病症的非限制性典范是KRAS G12D相关癌症。
本公开化合物可以存在特定的几何或立体异构体形式。本公开设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对对映体、(R)-和(S)-对映体、非对映异构体、(D)-异构体、(L)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本公开的范围之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本公开的范围之内。本公开的含有不对称碳原子的化合物可以以光学活性纯的形式或外消旋形式被分离出来。光学活性纯的形式可以从外消旋混合物拆分,或通过使用手性原料或手性试剂合成。
可以通过的手性合成或手性试剂或者其他常规技术制备光学活性的(R)-和(S)-异构体以及D和L异构体。如果想得到本公开某化合物的一种对映体,可以通过不对称合成或者具有手性助剂的衍生作用来制备,其中将所得非对映体混合物分离,并且辅助基团裂开以提供纯的所需对映异构体。或者,当分子中含有碱性官能团(如氨基)或酸性官能团(如羧基)时,与适当的光学活性的酸或碱形成非对映异构体的盐,然后通过本领域所公知的常规方法进行非对映异构体拆分,然后回收得到纯的对映体。此外,对映异构体和非对映异构体的分离通常是通过使用色谱法完成的,所述色谱法采用手性固定相,并任选地与化学衍生法相结合(例如由胺生成氨基甲酸盐)。
本公开的化合物和中间体还可以以不同的互变异构体形式存在,并且所有这样的形式包含于本公开的范围内。术语“互变异构体”或“互变异构体形式”是指可经由低能垒互变的不同能量的结构异构体。例如,质子互变异构体(也称为质子转移互变异构体)包括经由质子迁移的互变,如酮-烯醇及亚胺-烯胺、内酰胺-内酰亚胺异构化。内酰胺-内酰亚胺平衡实例是在如下所示的A和B之间。
本公开中的所有化合物可以被画成A型或B型。所有的互变异构形式在本公开的范围内。化合物的命名不排除任何互变异构体。
本公开还包括一些与本文中记载的那些相同的,但一个或多个原子被原子量或质量数不同于自然中通常发现的原子量或质量数的原子置换的同位素标记的本公开化合物。可结合到本公开化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、碘和氯的同位素,诸如分别为2H、3H、11C、13C、14C、13N、15N、15O、17O、18O、31P、32P、35S、18F、123I、125I和36Cl等。
除另有说明,当一个位置被特别地指定为氘(D)时,该位置应理解为具有大于氘的天然丰度(其为0.015%)至少1000倍的丰度的氘(即,至少10%的氘掺入)。示例中化合物的具有大于氘的天然丰度可以是至少1000倍的丰度的氘、至少2000倍的丰度的氘、至少3000倍的丰度的氘、至少4000倍的丰度的氘、至少5000倍的丰度的氘、至少6000倍的丰度的氘或更高丰度的氘。本公开还包括各种氘化形式的式(I)化合物。与碳原子连接的各个可用的氢原子可独立地被氘原子替换。本领域技术人员能够参考相关文献合成氘化形式的式(I)化合物。在制备氘代形式的式(I)化合物时可使用市售的氘代起始物质,或它们可使用常规技术采用氘代试剂合成,氘代试剂包括但不限于氘代硼烷、三氘代硼烷四氢呋喃溶液、氘代氢化锂铝、氘代碘乙烷和氘代碘甲烷等。
术语解释:
“药学上可接受的赋形剂”包括但不限于任何已经被美国食品和药物管理局批准对于人类或家畜动物使用可接受的任何助剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增香剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂。
“烷基”指饱和的脂族烃基团,包括1至20个碳原子的直链和支链基团。优选含有1至12个碳原子的烷基,更优选含有1至6个碳原子的烷基。非限制性实施例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1-二甲基丙基、1,2-二甲基丙基、2,2-二甲基丙基、1-乙基丙基、2-甲基丁基、3-甲基丁基,及其各种支链异构体等。烷基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选一个或多个以下基团,独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等。
“杂烷基”指烷基中的一个或多个-CH2-被选自N、O和S的杂原子所取代;其中所述的烷基如上所定义;杂烷基可以是取代的或非取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,所述取代基优选独立地任选选自H原子、D原子、卤素、烷基、烷氧基、卤代烷基、卤代烷氧基、环烷基氧基、杂环基氧基、羟基、羟烷基、氰基、氨基、硝基、环烷基、杂环基、芳基、杂芳基中的一个或多个取代基。
术语“亚烷基”指饱和的直链或支链脂肪族烃基,其具有2个从母体烷的相同碳原子或两个不同的碳原子上除去两个氢原子所衍生的残基,其为包含1至20个碳原子的直链或支链基团,优选含有1至12个(例如1、2、3、4、5、6、7、8、9、10、11和12个)碳原子,更优选含有1至6个碳原子的亚烷基。亚烷基的非限制性实例包括但不限于亚甲基(-CH2-)、1,1-亚乙基(-CH(CH3)-)、1,2-亚乙基(-CH2CH2)-、1,1-亚丙基(-CH(CH2CH3)-)、1,2-亚丙基(-CH2CH(CH3)-)、1,3-亚丙基(-CH2CH2CH2-)、1,4-亚丁基(-CH2CH2CH2CH2-)等。亚烷基可以是取代的或非取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,所述取代基优选独立地任选选自烷基、烯基、炔基、烷氧基、卤代烷氧基、环烷基氧基、杂环基氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基和氧代基中的一个或多个取代基。
“亚杂烷基”指亚烷基中的一个或多个-CH2-被选自N、O和S的杂原子所替代;其中所述的亚烷基如上所定义;亚杂烷基可以是取代的或非取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,所述取代基优选独立地任选选自H原子、D原子、卤素、烷基、烷氧基、卤代烷基、卤代烷氧基、环烷基氧基、杂环基氧基、羟基、羟烷基、氰基、氨基、硝基、环烷基、杂环基、芳基、杂芳基中的一个或多个取代基。
“烯基”包括具有2至12个碳原子的支链和直链烯烃或含有脂族烃基团的烯烃。例如“C2-6烯基”表示具有2、3、4、5或6个碳原子的烯基。烯基的实例包括但不限于,乙烯基、烯丙基、1-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、2-甲基丁-2-烯基、3-甲基丁-1-烯基、1-戊烯基、3-戊烯基及4-己烯基。烯基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选一个或多个以下基团,独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等。
“炔基”包括具有2至12个碳原子的支链和直链炔基或含有脂族烃基的烯烃,或若规定指定碳原子数,则意指该特定数目。例如乙炔基、丙炔基(例如1-丙炔基、2-丙炔基)、3-丁炔基、戊炔基、己炔基及1-甲基戊-2-炔基。炔基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选一个或多个以下基团,独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等。
术语“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,环烷基环包含3至20个碳原子,优选包含3至12个碳原子,更优选包含3至6个碳原子。单环环烷基的非限制性实例包括环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基、环庚基、环庚三烯基、环辛基等;多环环烷基包括螺环、稠环和桥环的环烷基。
所述环烷基环可以稠合于芳基、杂芳基或杂环烷基环上,其中与母体结构连接在一起的环为环烷基,非限制性实例包括茚满基、四氢萘基、苯并环庚烷基等。环烷基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等。
术语“杂环基”指饱和或部分不饱和单环或多环环状烃取代基,其包含3至20个环原子,其中一个或多个环原子为选自氮、氧或S(O)m(其中m是整数0至2)的杂原子,但不包括-O-O-、-O-S-或-S-S-的环部分,其余环原子为碳。优选包含3至12个环原子,其中1~4个是杂原子;更优选包含3至8个环原子。单环杂环基的非限制性实例包括吡咯烷基、咪唑烷基、四氢呋喃基、四氢噻吩基、二氢咪唑基、二氢呋喃基、二氢吡唑基、二氢吡咯基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基等。多环杂环基包括螺环、稠环和桥环的杂环基。“杂环基”非限制性实例包括:
所述杂环基环可以稠合于芳基、杂芳基或环烷基环上,其中与母体结构连接在一起的环为杂环基,其非限制性实例包括:
杂环基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等。
术语“芳基”指具有共轭的π电子体系的6至14元全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选为6至12元,例如苯基和萘基。所述芳基环可以稠合于杂芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为芳基环,其非限制性实例包括:
芳基可以是取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等,优选苯基。
术语“杂芳基”指包含1至4个杂原子、5至14个环原子的杂芳族体系,其中杂原子选自氧、硫和氮。杂芳基优选为6至12元,更优选为5元或6元。例如。其非限制性实例包括:咪唑基、呋喃基、噻吩基、噻唑基、吡唑基、噁唑基、吡咯基、四唑基、吡啶基、嘧啶基、噻二唑、吡嗪,等等。
所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环,其非限制性实例包括:
杂芳基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等。
术语“烷氧基”指-O-(烷基)和-O-(非取代的环烷基),其中烷基的定义如上所述。烷氧基的非限制性实例包括:甲氧基、乙氧基、丙氧基、丁氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基。烷氧基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、C1-6烷基、C1-6烷氧基、C3-7环烷基、3-12元杂环基等。
术语“羟基”指-OH基团。
术语“卤素”指氟、氯、溴或碘。
术语“氨基”指-NH2。
术语“氰基”指-CN。
术语“硝基”指-NO2。
术语“氧代”指=O取代基。
“任选”或“任选地”意味着随后所描述地事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生地场合。例如,“任选被烷基取代的杂环基团”意味着烷基可以但不必须存在,该说明包括杂环基团被烷基取代的情形和杂环基团不被烷基取代的情形。
“取代的”指基团中的一个或多个氢原子,优选为最多5个,更优选为1~3个氢原子彼此独立地被相应数目的取代基取代。不言而喻,取代基仅处在它们的可能的化学位置,本领域技术人员能够在不付出过多努力的情况下确定(通过实验或理论)可能或不可能的取代。例如,具有游离氢的氨基或羟基与具有不饱和(如烯属)键的碳原子结合时可能是不稳定的。
“药物组合物”表示含有一种或多种本文所述化合物或其生理学上药学上可接受的盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
具体实施方式
以下结合实施例进一步描述本公开,但这些实施例并非限制着本公开的范围。
本公开实施例中未注明具体条件的实验方法,通常按照常规条件,或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
NMR位移(δ)以10-6(ppm)的单位给出。NMR的测定是用Bruker AVANCE-400核磁仪,测定溶剂为氘代二甲基亚砜(DMSO-d6),氘代氯仿(CDCl3),氘代甲醇(CD3OD),内标为四甲基硅烷(TMS)。
MS的测定用Shimadzu 2010Mass Spectrometer或Agilent 6110A MSD质谱仪。
HPLC的测定使用Shimadzu LC-20A systems、Shimadzu LC-2010HT series或安捷伦Agilent 1200LC高压液相色谱仪(Ultimate XB-C18 3.0*150mm色谱柱或Xtimate C182.1*30mm色谱柱)。
手性HPLC分析测定使用Chiralpak IC-3 100×4.6mm I.D.,3um、Chiralpak AD-3150×4.6mm I.D.,3um、Chiralpak AD-3 50×4.6mm I.D.,3um、Chiralpak AS-3 150×4.6mm I.D.,3um、Chiralpak AS-3 100×4.6mm I.D.,3μm、ChiralCel OD-3 150×4.6mmI.D.,3um、Chiralcel OD-3 100×4.6mm I.D.,3μm、ChiralCel OJ-H 150×4.6mm I.D.,5um、Chiralcel OJ-3 150×4.6mm I.D.,3um色谱柱;薄层层析硅胶板使用烟台黄海HSGF254或青岛GF254硅胶板,薄层色谱法(TLC)使用的硅胶板采用的规格是0.15mm~0.2mm,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm。
柱层析一般使用烟台黄海硅胶100~200目、200~300目或300~400目硅胶为载体。
手性制备柱使用DAICEL CHIRALPAK IC(250mm*30mm,10um)或Phenomenex-Amylose-1(250mm*30mm,5um)。
CombiFlash快速制备仪使用Combiflash Rf150(TELEDYNE ISCO)。
激酶平均抑制率及IC50值的测定用NovoStar酶标仪(德国BMG公司)。
本公开的已知的起始原料可以采用或按照本领域已知的方法来合成,或可购买自ABCR GmbH&Co.KG,Acros Organics,Aldrich Chemical Company,韶远化学科技(AccelaChemBio Inc)、达瑞化学品等公司。
实施例中无特殊说明,反应能够均在氩气氛或氮气氛下进行。
氩气氛或氮气氛是指反应瓶连接一个约1L容积的氩气或氮气气球。
氢气氛是指反应瓶连接一个约1L容积的氢气气球。
加压氢化反应使用Parr 3916EKX型氢化仪和清蓝QL-500型氢气发生器或HC2-SS型氢化仪。
氢化反应通常抽真空,充入氢气,反复操作3次。
微波反应使用CEM Discover-S 908860型微波反应器。
实施例中无特殊说明,溶液是指水溶液。
实施例中无特殊说明,反应的温度为室温,为20℃~30℃。
实施例中的反应进程的监测采用薄层色谱法(TLC),反应所使用的展开剂,纯化化合物采用的柱层析的洗脱剂的体系和薄层色谱法的展开剂体系包括:A:二氯甲烷/甲醇体系,B:正己烷/乙酸乙酯体系,C:石油醚/乙酸乙酯体系,D:石油醚/乙酸乙酯/甲醇,E:四氢呋喃/石油醚,溶剂的体积比根据化合物的极性不同而进行调节,也可以加入少量的三乙胺和醋酸等碱性或酸性试剂进行调节。
下述实验中所用缩写代表的含义如下:
DCM:二氯甲烷;DIEA:N,N-二异丙基乙胺Boc:叔丁氧羰基;Pd(dppf)Cl2:[1,1'-双(二苯基膦基)二茂铁]二氯化钯;1,4-dioxane:1,4-二氧六环;Cs2CO3:碳酸铯;NIS:氮碘代丁二酰亚胺;DAST:二乙胺基三氟化硫;Tf2O:三氟甲磺酸酐
实施例1
4-(4-(2,5-二氮双环[2.2.2]辛烷-2-基)-8-氟代-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)萘-2-醇(化合物1)
第一步:化合物1c的制备
化合物1a的制备方法参考(WO 2021/041671 A1)。在-40℃下,向溶有化合物1a(300.0mg,1.19mmol)和DIEA(921.5mg,7.13mmol)的DCM(5mL)溶液中加入化合物1b(252.3mg,1.19mmol),在此温度下搅拌0.5小时。向反应液中加入水(20mL),用DCM(15mL×3)萃取,合并的有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品1c(450.0mg,粗品)。粗品直接用于下一步反应。
MS(ESI):m/z=428.0[M+H]+
第二步:化合物1e的制备
向溶有化合物1c(450.0mg,粗品)的1,4-二氧六环(10mL)溶液中加入化合物1d(334.5mg,2.10mmol)和DIEA(921.5mg,7.13mmol)。加热反应液至80℃并搅拌16小时,反应液真空减压浓缩得到粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:10-100%乙酸乙酯的石油醚,得到化合物1e(400.0mg)。
MS(ESI):m/z=551.1[M+H]+
第三步:化合物1g的制备
在Ar气保护下,向溶有化合物1e(150.0mg,0.27mmol)的1,4-二氧六环(8mL)溶液加入化合物1f(95.6mg,0.35mmol),Pd(dppf)Cl2(20.2mg,0.03mmol),Cs2CO3(266.1,0.82mmol)及H2O(2mL)。加热至100℃搅2小时。反应液减压真空浓缩给出粗品,粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:5%甲醇的二氯甲烷,得到化合物1g(80.0mg,收率44.6%)。
MS(ESI):m/z=659.3[M+H]+
第四步:化合物1的制备
向溶有化合物1g(80.0mg,0.12mmol)的CH3CN(1.0mL)溶液中加入HCl/1,4-dioxane(4M,8mL)。在室温下搅拌0.5小时。反应液通过真空减压浓缩得到粗产品,粗产品经过制备级HPLC(碱性流动相)得到化合物1(17.10mg,收率25.2%)。
MS(ESI):m/z=559.2[M+H]+
1H NMR:(400MHz,DMSO)δ10.02(s,1H),9.27(s,1H),7.81(d,J=8.2Hz,1H),7.51(d,J=8.5Hz,1H),7.48-7.42(m,1H),7.30(d,J=2.5Hz,1H),7.28-7.21(m,2H),5.40-5.17(m,1H),4.98(s,1H),4.34-4.22(m,2H),4.21-4.14(m,1H),4.10-4.03(m,1H),3.27-3.25(m,1H),3.26-3.25(m,2H),3.11-3.09(m,2H),3.02(s,1H),2.88-2.77(m,1H),2.21-2.10(m,2H),2.09-1.95(m,4H),1.89-1.74(m,4H)
实施例2
4-(8-氟代-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)-4-((1R,5S)-8-甲基-3,8-二氮双环[3.2.1]辛烷-3-基)吡啶骈[4,3-d]嘧啶-7-基)萘-2-醇甲酸盐(化合物2)
第一步:化合物2b的制备
在-40℃下,向溶有化合物1a(200.0mg,0.79mmol)和DIEA(614.2mg,4.75mmol)的DCM(5mL)溶液中加入化合物2a(100.0mg,0.79mmol),在此温度下搅拌0.5小时。向反应中加入水(10mL),用DCM(10mL×3)萃取,合并的有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品2b(278.0mg,粗品)。粗品直接用于下一步反应。
MS(ESI):m/z=341.9[M+H]+
第二步:化合物2c的制备
向溶有化合物2b(278.0mg,粗品)的1,4-二氧六环(5mL)溶液中加入化合物1d(258.7mg,1.63mmol)和DIEA(226.6mg,1.75mmol)。加热反应液至95℃并搅拌12小时,反应液减压真空浓缩得到粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:1-30%四氢呋喃的石油醚,得到化合物2c(280.0mg)。
MS(ESI):m/z=465.1[M+H]+
第三步:化合物2的制备
在Ar气保护下,向溶有化合物2c(280.0mg,0.60mmol)的1,4-二氧六环(7.5mL)溶液加入化合物1f(211.5mg,0.78mmol),Pd(dppf)Cl2(44.7mg,0.06mmol),Cs2CO3(588.6mg,1.81mmol)及H2O(2mL)。加热至110℃搅拌1.5小时。反应液真空减压浓缩得到粗品,粗产品经过制备级HPLC(酸性流动相)得到化合物2(28.2mg,收率8.18%)。
MS(ESI):m/z=573.1[M+H]+
1H NMR:(400MHz,CD3OD)δ9.19(s,1H),8.43(s,1H),7.79(d,J=8.2Hz,1H),7.55(d,J=8.2Hz,1H),7.48-7.42(m,1H),7.32(d,J=2.3Hz,1H),7.29-7.23(m,2H),5.62-5.42(m,1H),4.74(dd,J=5.9,11.6Hz,2H),4.60(q,J=11.8Hz,2H),3.93-3.85(m,2H),3.83-3.66(m,3H),3.62(s,2H),3.41-3.34(m,1H),2.69-2.46(m,5H),2.42-2.34(m,1H),2.31-2.23(m,2H),2.19-2.12(m,3H),1.86-1.81(m,2H)
实施例3
4-(4-(3,6-二氮杂双环[3.1.1]庚烷-3-基)-8-氟-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)萘-2-醇甲酸盐(化合物3)
化合物3的制备参考化合物1的合成方法。由起始原料化合物1a(200.0mg,0.79mmol)和3a(157.1mg,0.79mmol)经四步反应得到化合物3(11.3mg)。
m/z=545.1[M+H]+
1H NMR:(400MHz,CD3OD)δ9.43(s,1H),8.34(s,1H),7.67(d,J=8.3Hz,1H),7.42(d,J=8.3Hz,1H),7.34(t,J=7.4Hz,1H),7.21(d,J=2.1Hz,1H),7.17-7.10(m,2H),5.52-5.17(m,1H),4.60-4.37(m,5H),4.24(d,J=5.4Hz,2H),3.64-3.43(m,3H),2.97-2.80(m,1H),2.54-2.33(m,2H),2.28-2.07(m,3H),2.0-1.92(m,1H),1.88-1.77(m,1H),1.31–1.19(m,2H)
实施例4
4-(8-氟-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)-4-(2,7-偶氮螺[3.5]壬烷-7-基)吡啶骈[4,3-d]嘧啶-7-基)萘-2-醇(化合物4)
化合物4的制备参考化合物1的合成方法。由起始原料化合物1a(200.0mg,0.79mmol)和4a(179.3mg,0.792mmol)经四步反应得到化合物4(29.34mg)。
m/z=573.3[M+H]+
1H NMR:(400MHz,DMSO-d6)δ9.13(s,1H),8.36(br,1H),7.80(d,J=8.3Hz,1H),7.53(d,J=8.5Hz,1H),7.43(t,J=7.5Hz,1H),7.29(d,J=2.3Hz,1H),7.26-7.21(m,2H),5.38-5.18(m,1H),4.15(d,J=10.4Hz,1H),4.05(d,J=10.4Hz,1H),3.89(s,4H),3.76(s,4H),3.15-2.99(m,4H),2.87-2.79(m,1H),2.15-1.92(m,7H),1.90-1.72(m,3H)
实施例5
4-(4-(3,5-二甲基哌嗪-1-基)-1-基)-8-氟-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)萘-2-醇(化合物5)
化合物5的制备参考化合物1的合成方法。由起始原料化合物1a(200.0mg,0.79mmol)和5a(169.8mg,0.79mmol)经四步反应得到化合物5(13.0mg)。
m/z=561.3[M+H]+
1H NMR(400MHz,DMSO-d6)δ9.17(s,1H),8.21(s,1H),7.81(d,J=8.3Hz,1H),7.56(d,J=8.5Hz,1H),7.45(t,J=7.4Hz,1H),7.32-7.20(m,3H),5.42-5.16(m,1H),4.47(d,J=11.6Hz,2H),4.47(d,J=12Hz,1H),4.16(d,J=12Hz,1H),3.15-2.77(m,9H),2.19-1.99(m,3H),1.92-1.73(m,3H),1.11-1.09(m,6H)
实施例6
4-(4-((1R,5S)-3,9-偶氮双环[3.3.1]壬烷-3-基)-8-氟代-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)萘-2-醇(化合物6)
化合物6的制备参考化合物1的合成方法。由起始原料化合物1a(200.0mg,0.79mmol)和6a(169.8mg,0.79mmol)经四步反应得到化合物6(13.0mg)。
MS(ESI):m/z=573.2[M+H]+
1H NMR:(400MHz,DMSO-d6)δ9.23(s,1H),8.23(s,1H),7.81(d,J=8.3Hz,1H),7.56(d,J=8.3Hz,1H),7.45(t,J=7.4Hz,1H),7.32-7.21(m,3H),5.38-5.20(m,1H),4.70–4.67(m,2H),4.18(d,J=10.4Hz,1H),4.10(d,J=10.4Hz,1H),3.81(d,J=12.6Hz,2H),3.34(s,2H),3.16-3.00(m,3H),2.87-2.79(m,1H),2.20-2.11(m,1H),2.11-1.91(m,3H),1.89-1.71(m,8H),1.52(s,1H)
实施例7
4-(4-((1R,5S)-3,8-偶氮双环[3.2.1]辛烷-3-基)-8-氟代-2-(1-((S)-1-甲基吡咯-2-基)环丙基氧基吡啶骈[4,3-d]嘧啶-7-基)萘-2-醇甲酸盐(化合物7)
化合物7的制备参考化合物1的合成方法。由起始原料化合物7a(200.0mg,0.79mmol,采用专利申请“WO2021041671A1中说明书第82页的中间体5”公开的方法制备而得)和7b(179.3mg,0.79mmol)经四步反应得到化合物7(4.7mg)。
MS(ESI):m/z=565.4[M+H]+
1H NMR:(400MHz,CD3OD)δ8.74(s,1H),8.48(s,1H),7.81(d,J=7.7Hz,1H),7.51(d,J=6.2Hz,1H),7.42-7.36(m,1H),7.32(d,J=2.4Hz,1H),7.14(d,J=2.4Hz,1H),4.60–4.56(m,3H),4.16(s,2H),3.76(d,J=12.0Hz,4H),3.43(s,1H),3.26(s,3H),3.06(s,2H),2.87–2.85(m,1H),2.26-2.08(m,5H),1.83-1.61(m,4H)
实施例8
4-(4-((1R,5S)-3,8-偶氮双环[3.2.1]辛烷-3-基)-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)-7-(3-甲氧基萘基-1-基)嘧啶[4,5-d]哒嗪-8(7H)-酮(化合物8)
第一步:化合物8b的制备
在15℃下,向溶有化合物8a(10.0g,44.8mmol)的DMF(100mL)溶液中加入K2CO3(18.6g,134.5mmol)。在此温度下搅拌3小时。向反应中加入水(10mL),用AcOEt(100mL×3)萃取,合并的有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品8b(278.0mg,粗品)。粗品直接用于下一步反应。
第二步:化合物8d的制备
在Ar气保护下,向溶有化合物8b(6.00g)的H2O(7.5mL)溶液加入t-BuONa(4.86g,50.6mmol),t-BuBrettPhos Pd G3(2164.7mg,2.5mmol),及化合物8c(2mL)。加热至45℃搅拌16小时。反应液过滤,滤液真空减压浓缩得到粗品8d(6.51g,粗品)。
MS(ESI):m/z=288.9[M+H]+
第三步:化合物8e的制备
将化合物8d(6.00g,20.8mmol)溶于HCl/1,4-dioxane(4M,10mL)。在室温下搅拌0.5小时。反应液通过真空减压浓缩得到粗产品8e(3.91g),粗产品直接用于下一步反应。
MS(ESI):m/z=188.9[M+H]+
第四步/第五步:化合物8i的制备
在20℃下,向溶有化合物8e(3.00g)的DMF(30mL)溶液中加入化合物8f(3.56g,15.9mmol)。在此温度下搅拌4小时。然后想反应液中加入化合物8h(2.70g,12.7mmol)andDIEA(4.11g,31.8mmol),继续搅拌3小时。向反应中加入水(100mL),用AcOEt(100mL×3)萃取,合并的有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:10%的石油醚的乙酸乙酯,得到化合物8i(5.81g)。
MS(ESI):m/z=569.3[M+H]+
第六步:化合物8j的制备
室温下,向溶有化合物8i(5.00g,8.80mmol)的MeOH溶液中加入TEA(2.4mL,17.6mmol)和Pd(dppf)Cl2(651.7mg,0.88mmol)。在CO(2M Pa)氛围下,加热至100℃,搅拌12个小时。反应液经真空减压浓缩得到粗品,粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:10%的石油醚的乙酸乙酯,得到化合物8j(1.31g)。MS(ESI):m/z=593.2[M+H]+
第七步:化合物8k的制备
盛有化合物8j(500.0mg,0.84mmol)的AcOH(20mL)溶液,在110℃下搅拌15min。向反应液中加入饱和Na2CO3水溶液(20mL),用AcOEt(20mL×3)萃取,合并的有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品8k(461.3mg)。粗品直接用于下一步反应。
MS(ESI):m/z=561.2[M+H]+
第八步:化合物8l的制备
向溶有化合物8k(500.0mg,0.89mmol)的DCM(20mL)溶液中加入m-CPBA(384.7mg,2.23mmol),在0℃下搅拌40min。向反应液中加入饱和NaHCO3(30mL),用AcOEt(30mL×3)萃取,合并的有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品8l(431.1mg)。粗品直接用于下一步反应。
MS(ESI):m/z=577.1[M+H]+
第九步:化合物8m的制备
向溶有化合物8l(400mg)的THF(20mL)溶液中加入化合物1d(220.9mg,1.39mmol)。在0℃,Ar气保护下,向反应液中加入LiHMDS(0.14mL,0.76mmol)。反应液在0℃下搅拌30min,升温至室温,继续搅拌1个小时。向反应液中加入饱和NH4Cl(30mL),用AcOEt(30mL×3)萃取,合并的有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品8m(219.5mg)。
MS(ESI):m/z=672.3[M+H]+
第十步:化合物8的制备
将化合物8m(100.0mg,)溶解在HCl/1,4-二氧六环(4M,8.0mL)中。在室温下搅拌0.5小时。反应液通过真空减压浓缩得到粗产品,粗产品经过制备级HPLC得到化合物8(4.29mg)。
MS(ESI):m/z=572.2[M+H]+
1H NMR:(400MHz,CD3CN)δ8.28(s,1H),7.92(d,J=8.3Hz,1H),7.57-7.43(m,3H),7.39-7.31(m,1H),7.26(d,J=2.3Hz,1H),5.38-5.16(m,1H),4.34(s,2H),4.21(d,J=10.8Hz,1H),4.13(d,J=10.8Hz,1H),3.96(s,3H),3.61-3.50(m,4H),3.24-3.11(m,3H),3.96-2.85(m,1H),2.15-2.03(m,4H),1.92-1.81(m,2H),1.76-1.63(m,4H)
实施例9
4-((1R,5S)-3,8-偶氮双环[3.2.1]壬烷-3-基)-N-((R)-1-(二甲基氨基)丙烷-2-基)-7-(3-羟基萘-1-基)-5,6,7,8-四氢-1,7-萘啶-2-甲酰胺甲酸盐(化合物9)
第一步:化合物9c的制备
在室温下,向反应瓶中加入化合物9a(10.0g,72.4mmol)和化合物9b((20.2g,17.38mmol),搅拌10min。向反应液中缓慢加入POCl3(150mL),加热至100℃,搅拌1h。向反应液中加入水(25mL),用DCM(20mL×3)萃取,合并有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:25%的石油醚的乙酸乙酯,得到化合物9c(3.00g,17.5%收率)。
MS(ESI):m/z=236.9[M+H]+
第二步:化合物9d的制备
向溶有化合物9c(3.30g)的1,4-dioxane(60mL)溶液中加入化合物8h(3.55g,16.7mmol),Ruphos-Pd-G3(1.17g,1.39mmol)和Cs2CO3(11.3g,34.9mmol)。在80℃,Ar气保护下,搅拌16个小时。反应液经过滤后,滤液真空减压浓缩的到粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:25-40%的石油醚的乙酸乙酯,得到化合物9d(2.8g)。
MS(ESI):m/z=399.1[M+H]+
第三步:化合物9e的制备
向溶有化合物9d(1.60g,4.02mmol)的AcOH(10mL)溶液中加入化合物NaBH3CN(720.6mg,12.0mmol)。在20℃,Ar气保护下,搅拌10min。向反应液中加入水(10mL),用DCM(15mL×3)萃取,合并有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品9e(1.20g)。粗品直接用于下一步反应。
MS(ESI):m/z=403.2[M+H]+
第四步:化合物9h的制备
向溶有化合物9e(400mg)的1,4-dioxane(60mL)溶液中加入化合物9f(318.6mg,1.19mmol),Ruphos-Pd-G3(3.1mg,0.10mmol)和Cs2CO3(971.4mg,2.98mmol)。在80℃,Ar气保护下,搅拌10个小时。反应液经过滤后,滤液真空减压浓缩的到粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:8-15%的石油醚的乙酸乙酯,得到化合物9h(200mg,0.34mmol)。
MS(ESI):m/z=589.5[M+H]+
第五步:化合物9i的制备
向溶有化合物9h(200.0mg,0.34mmol)的THF/H2O(1:1,4mL)溶液中加入LiOH-H2O(28.2mg,0.67mmol)。在20℃下,搅拌0.5小时。反应液真空减压浓缩,加入H2O(15mL),并用1N HCl调节pH到3-4。溶液用DCM(10mL×3)萃取,合并有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品9i(180mg)。粗品直接用于下一步反应。
MS(ESI):m/z=575.4[M+H]+
第六步:化合物9k的制备
向溶有化合物9i(180.0mg)的DMF(3mL)溶液中加入化合物9j(82.2mg,0.47mmol),DIEA(0.26mL,1.57mmol)和HATU(178.6mg,0.47mmol)。在20℃下,搅拌1个小时。反应液真空减压浓缩,加入饱和Na2CO3(15mL),用DCM(15mL×3)萃取,合并有机相用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品9k(190mg)。粗品直接用于下一步反应。
MS(ESI):m/z=659.6[M+H]+
第七步:化合物9的制备
向溶有化合物9k(100.0mg)的CH3CN(1mL)加入HCl/1,4-二氧六环(4M,6.0mL)中。在室温下搅拌15min。反应液通过真空减压浓缩得到粗产品,粗产品经过制备级HPLC得到化合物9(41.96mg)。
MS(ESI):m/z=515.1[M+H]+
1H NMR:(400MHz,CD3OD)δ8.50(s,1H),8.08(d,J=8.4Hz,1H),7.72-7.59(m,2H),7.38(t,J=7.3Hz,1H),7.30-7.22(m,1H),6.89(d,J=1.7Hz,1H),6.83(d,J=2.0Hz,1H),4.54-4.48(m,1H),4.40(s,2H),4.11(s,2H),3.44–3.40(m,4H),3.29-3.20(m,2H),3.16(s,2H),3.11-3.01(m,1H),2.85–2.82(m,1H),2.63(s,6H),2.31(d,J=7.5Hz,2H),2.14(s,2H),1.30(d,J=6.6Hz,3H)
实施例10
4-(4-(2,5-二氮双环[2.2.2]辛烷-2-基)-8-氟代-2-(((2R)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)-5-乙炔基-6-氟萘-2-酚(化合物10)
化合物10c的制备参考化合物1的合成方法。由起始原料1e(300mg,0.54mmol)和10a(334.8mg,0.65mmol,采用专利申请“采用专利申请“WO2021041671A1中说明书第96页中间体15”公开的方法制备而得)经两步反应得到化合物10c(320.0mg)。
化合物10的制备:
在室温下,向溶有化合物10c(310.0mg,0.410mmol)的DMF(6.0mL)溶液中加入CsF(311.0mg,2.05mmol)。反应液升温至85℃,搅拌1.5h。反应液过滤后,真空减压浓缩得到粗品经制备级HPLC分离纯化得到化合物10(36.7mg,收率15.1%)
化合物10通过手性HPLC拆分得到化合物10-1和化合物10-2
单一构型化合物10-1:
MS(ESI)m/z=601.4[M+H]+
手性HPLC分析:保留时间1.975分钟,手性纯度:100%(色谱柱:ChiralCel IC-3100*4.6mm,3um带保护柱;流动相:A:CO2;B:Methanol(0.05%DEA)
1H NMR:(400MHz,DMSO-d6)
δ9.13(br s,1H),8.23(br s,1H),7.98(dd,J=6.0,9.2Hz,1H),7.47(t,J=8.9Hz,1H),7.40(d,J=2.3Hz,1H),7.18(br s,1H),5.37-5.18(m,1H),4.91(s,1H),4.14-4.01(m,4H),3.44-3.43(m,1H),3.26-3.19(m,2H),3.09(br d,J=7.6Hz,2H),3.02(br s,1H),2.86-2.82(m,1H),2.25-1.72(m,10H)
单一构型化合物10-2:
MS(ESI):m/z=601.4[M+H]+
手性HPLC分析:保留时间4.088分钟,手性纯度:94.5%(色谱柱:ChiralCel IC-3100*4.6mm,3um带保护柱;流动相:A:CO2;B:Methanol(0.05%DEA)
1H NMR:(400MHz,DMSO-d6)δ9.13(s,1H),8.23(s,1H),7.98(dd,1H),7.47(t,1H),7.40(d,1H),7.18(s,1H),5.37-5.18(m,1H),4.91(s,1H),4.14-4.01(m,4H),3.44-3.19(m,3H),3.09(m,2H),3.02(s,1H),2.86-2.82(m,1H),2.25-1.72(m,10H)
实施例11
4-(1R,5S)-3,8-二氮杂双环[3.2.1]辛烷-3-基)-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)-7-(萘-1-基)吡啶骈[4,3-d]嘧啶-8-腈(化合物11)
第一步:化合物11b的制备
在室温下,向溶有化合物11a(12.0g,57.8mmol)的DMSO(100mL)中加入CuCN(15.5g,173.5mmol)。反应液加热至130℃并搅拌10-12h。反应液降温至15℃,向反应液中加入NH4OH(250mL),搅拌10min,用EtOAc(200mL×2)萃取。合并的有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品11b(2.2g,粗品)。粗品直接用于下一步反应。
MS(ESI):m/z=154.3[M+H]+
第二步:化合物11c的制备
在室温下,向溶有化合物11b(2.00g,粗品)的CH3CN(20mL)中加入NIS(4.40g,19.5mmol)和TsOH(123.9mg,0.65mmol)。反应液升温至70℃,搅拌10-12h。反应液真空减压浓缩后,加入水(50mL),EtOAc(50mL×2)萃取。合并的有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品11c(2.20g,粗品)。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:10%乙酸乙酯的石油醚,得到化合物11c(2.10g)。
MS(ESI):m/z=279.8[M+H]+
第三步:化合物11d的制备
在室温下,向乙醇(10mL)中加入化合11c(1.00g,3.58mmol),TEA(1.09g,10.7mmol)和PdCl2(PPh3)2(251.1mg,0.36mmol),在CO(50psi)氛围下加热至80℃搅拌16h。反应液经过滤后,减压浓缩得到粗产品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:20%乙酸乙酯的石油醚,得到化合物11d(440.0mg,收率54.5%)。
第四步:化合物11f的制备
在室温下,向1,4-dioxane/H2O(4mL,3:1)中加入化合物11d(300mg,1.33mmol),化合物11e(439.3mg,1.73mmol),Cs2CO3(1.30g,3.99mmol)和Pd(dppf)Cl2。在Ar气氛围下升温至100℃,搅拌2h。向反应液中加入水(10mL),EtOAc(15mL×2)萃取。合并的有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:30%乙酸乙酯的石油醚,得到化合物11f(300.0mg,收率71.1%)。
MS(ESI):m/z=318.2[M+H]+
第五步:化合物11g的制备
在室温下,向溶有化合物11f(250.0mg,0.79mmol)的THF(3mL)加入三氯乙酰羰基异氰酸酯(0.19mL,1.58mmol)。反应液在室温下搅拌12h。反应液真空减压浓缩得到粗产品。向粗产品磨细并加入MTBE(10.0mL),搅拌10min,过滤,给出化合物11g(346.0mg,收率86.8%)。
MS(ESI):m/z=505.1[M+H]+
第六步:化合物11h的制备
在25℃,将化合物11g(340.0mg,0.67mmol)加入4M NH3/MeOH(5mL)搅拌1h。反应液真空减压浓缩得到粗产品。加入MTBE(10.0mL)搅拌10min,过滤,得到化合物11h(170.0mg,收率80.5%)
MS(ESI):m/z=314.9[M+H]+
第七步:化合物11i的制备
将化合物11h(160.0mg,0.51mmol)溶到POCl3(2mL),向其中滴加DIEA(0.25mL,1.53mmol)。升温至110℃,搅拌2h。向反应液中加入水(20mL),EtOAc(15mL×2)萃取。合并的有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品11i(130.0mg,粗品)。
MS(ESI):m/z=351.1[M+H]+
第八步:化合物11j的制备
在-40℃下,向溶有化合物11i(120.0mg,粗品)的DCM(0.5mL)中加入DIEA(294.9mg,2.282mmol)和化合物8h(72.5mg,0.34mmol),在此温度下搅拌30min。向反应液中加入水(20mL),EtOAc(15mL×2)萃取。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:乙酸乙酯,得到化合物11j(170.0mg)。
MS(ESI):m/z=527.3[M+H]+
第九步:化合物11k的制备
在室温下,向溶有化合物11j(120.0mg,0.23mmol)的1,4-二氧六环(2.0mL)中加入DIEA(88.3mg,0.683mmol)和化合物1d(72.5mg,0.34mmol)。升温至80℃,搅拌12h。向反应液中加入水(10mL),EtOAc(15mL×3)萃取。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:10%甲醇的二氯甲烷,得到化合物11k(60.0mg,收率40.5%)。
MS(ESI):m/z=650.2[M+H]+
第十步:化合物11的制备
在0℃下,向溶有化合物11k(45.0mg,0.07mmol)的CH3CN(2.5mL)加入4M HCl/dioxane(2mL),搅拌1h。反应液减压浓缩得到粗产品,粗产品经制备级HPLC得到化合物11(10.8mg,收率28.4%)。
MS(ESI):m/z=550.1[M+H]+
1H NMR(400MHz,DMSO-d6)δ9.43(s,1H),8.13(d,1H),8.06(d,1H),7.75-7.65(m,3H),7.63-7.57(m,1H),7.54-7.48(m,1H),5.45-5.07(m,1H),4.56(m,2H),4.27-4.06(m,2H),4.02-3.52(m,3H),3.16-2.98(m,3H),2.89-2.74(m,1H),2.21-1.95(m,3H),1.90-1.65(m,7H)
实施例12
4-(1R,5S)-3,8-二氮杂双环[3.2.1]辛烷-3-基)-7-(3-(二氟甲基)萘-1-基)-8-氟-2-((四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶(化合物12)
第一步:化合物12b-2的制备
在室温下,向溶有化合物12b-1(500.00mg,2.13mmol)的DCM(5.0mL)溶液中缓慢加入DAST(3.43g,21.3mmol),在此温度N2保护下,搅拌12h。将反应液倒进0℃的冰水中(30mL),DCM(20mL×3)萃取。合并的有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:10%乙酸乙酯的石油醚,得到化合物12b-2(430.0mg,收率78.6%)。
第二步:化合物12b的制备
在室温下,向溶有化合物12b-2(380.0mg,1.48mmol)的1,4-二氧六环(5.0mL)中加入联硼酸频那醇酯(563.0mg,2.22mmol),KOAc(290.1mg,2.95mmol)和Pd(dppf)Cl2(109.6mg,0.148mmol)。反应液升温至110℃,搅拌12h。向反应液中加入水(10mL),EtOAc(15mL×2)萃取。合并有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:20%乙酸乙酯的石油醚,得到化合物12b(340.0mg,收率75.6%)。
1H NMR:(400MHz,CD3OD)δ8.78(d,J=8.3Hz,1H),8.13(s,2H),7.98-7.92(m,1H),7.63-7.51(m,2H),7.08-6.74(m,1H),1.44(s,12H)
化合物12的制备参考化合物1的合成方法。由起始原料12a(200.0mg,0.38mmol,采用专利申请“WO2021041671A1中说明书第83页中间体6”公开的方法制备而得)和12b(148.3mg,0.49mmol)经两步反应得到化合物12(26.5mg)。
MS(ESI):m/z=575.2[M+H]+
1H NMR:(400MHz,DMSO-d6)δ9.21(s,1H),8.21-8.17(m,2H),7.82-7.77(m,2H),7.73-7.60(m,2H),7.45-7.14(m,1H),4.53–4.50(m,2H),4.21(d,2H),3.70(s,4H),3.09(s,2H),2.77-2.67(m,2H),1.99-1.94(m,2H),1.93-1.77(m,4H),1.71(s,6H)
实施例13
4-(4-(1R,5S)-3,8-二氮杂双环[3.2.1]辛烷-3-基)-8-氟-2-((四氢-1H-双稠吡咯啶-7a(5H)-基)氘代甲氧基-d2)吡啶骈[4,3-d]嘧啶-7-基)-5-乙炔基萘-2-酚(化合物13)
化合物13a的制备:
在0℃下,向溶有化合物7a(1g,5.91mmol)的THF(10mL)中加入LiAlD4(744.2mg,17.7mmol),升温至20℃,搅拌16h。降温至0℃,向反应液中缓慢加入D2O(1.0mL)淬灭反应。减压浓缩得到粗品,粗品直接用于下一步反应。
1H NMR:(400MHz,CDCl3)δ3.05-2.93(m,2H),2.69-2.57(m,2H),1.88-1.64(m,6H),1.61-1.50(m,2H)
化合物13的制备参考化合物10的合成方法。由起始原料7a(500.0mg,1.17mmol,采用专利申请“WO2021041671A1中说明书第82页中间体5”公开的方法制备而得)和13a(334.4mg,2.34mmol)经四步反应得到化合物13(4.7mg)。(化合物7d采用专利申请“WO2021041671A1中说明书第102页中间体17”公开的方法制备而得)
MS(ESI):m/z=567.3[M+H]+
1H NMR:(400MHz,DMSO-d6)δ9.04(s,1H),8.27(s,1H),7.88(dd,1H),7.49-7.38(m,2H),7.34(d,1H),7.12(d,1H),4.52(d,1H),4.35(d,2H),3.71-3.57(m,6H),3.11-2.99(m,2H),2.71-2.67(m,2H),1.99-1.63(m,12H)
实施例14
4-(1R,5S)-3,8-二氮杂双环[3.2.1]辛烷-3-基)-7-(8-氯萘-1-基)-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-8(7H)-酮化合物14)
第一步:化合物14b的合成
在室温及CO2氛围下,将化合物加入到离子液体[HDBU+][TFE-](6mL)中搅拌8h。向反应液中加入水(5mL),过滤,滤饼用MTBE(10mL)洗涤处理得到化合物14b。
MS(ESI):m/z=339.9[M+H]+
第二步:化合物14c的合成
在室温下,将化合物10(600.0mg,339.7mmol)溶入POCl3(4mL)中,缓慢加入DIEA(1.46mL,8.83mmol)。反应液升温至100℃,搅拌12h。将反应液缓慢倒入冰水中(10mL),过滤,真空减压干燥化合物14c(600.0mg,收率90.2%)
MS(ESI):m/z=377.8[M+H]+
化合物14的制备参考化合物10的合成方法。由起始原料14c(600.0mg,1.59mmol)和8h(507.3mg,2.39mmol)经三步反应得到化合物14(400.0mg)。
MS(ESI):m/z=575.1[M+H]+
1H NMR:(400MHz,DMSO-d6)δ8.21(d,1H),8.11(d,1H),7.74(t,1H),7.68-7.63(m,1H),7.61-7.53(m,2H),7.29(d,1H),6.57(d,1H),5.41-5.11(m,1H),4.21-3.94(m,4H),3.65(s,1H),3.47-3.36(m,4H),3.15-3.03(m,2H),3.01(s,1H),2.86-2.77(m,1H),2.18-1.93(m,3H),1.88-1.67(m,7H)
实施例15
4-(4-(1R,5S)-3,8-二氮杂双环[3.2.1]辛烷-3-基)-8-氟-2-(((2R,7aS)-2-氟代四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)-5-乙炔基-6氟萘-2-基)硼酸(化合物15)
化合物15a的合成参考“WO2021041671A1中说明书第456页实施例252”公开的方法制备而得。
第一步:化合物15b的制备
在-40℃,向溶有化合物15a(540.0mg,0.63mmol)的DCM(2mL)中加入DIEA(244.3mg,1.89mmol)和Tf2O(244.2mg,0.95mmol),搅拌2h。反应液真空减压浓缩得到粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:25-50%乙酸乙酯的石油醚,得到化合物15b(400.0mg,收率64.2%)。
MS(ESI):m/z=989.3[M+H]+
第二步:化合物15c的制备
在室温N2氛围下,向溶有化合物15b(400.0mg,0.40mmol)的1,4-二氧六环(2.0mL)中加入联硼酸频那醇酯(205.4mg,0.81mmol),Pd(dppf)Cl2(30.0mg,0.04mmol)和KOAc(138.9mg,1.42mmol)。反应液加热至120℃,搅拌12h。反应液真空减压浓缩得到粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:25-50%乙酸乙酯的石油醚,得到化合物15c(260.0mg,收率66.5%)。
MS(ESI):m/z=967.9[M+H]+
第三步:化合物15d的制备
在室温下,向溶有化合物15c(400.0mg,0.40mmol)的DCM(7.0mL)中加入甲基硼酸(80.5mg,1.34mmol)和TFA(0.33mL)。在N2氛围下,该温度下搅拌2h。反应液真空减压浓缩得到粗品15d。
MS(ESI):m/z=885.6[M+H]+
化合物15(12.26mg)的合成参考化合物10的方法由化合物15d制备而来。
MS(ESI):m/z=629.1[M+H]+δ10.90(s,1H),9.41(s,1H),9.22-9.08(m,2H),8.46(s,1H),8.23(dd,1H),7.60(t,1H),5.68-5.47(m,1H),4.70(d,1H),4.66-4.52(m,3H),4.26-4.19(m,2H),3.96(d,1H),3.93-3.82(m,4H),3.76(m,4H),2.29-2.09(m,3H),2.06-1.89(m,5H)
实施例16
9-(4-(1R,5S)-3,8-二氮杂双环[3.2.1]辛烷-3-基)-8-氟-2-((四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)-9H-咔唑(化合物16)
化合物16的制备参考化合物1的合成方法。由起始原料12a(200.0mg,0.38mmol)和16a(75.3mg,0.45mmol)经两步反应得到化合物16(83.5mg)。
MS(ESI):m/z=564.2[M+H]+
1H NMR:(400MHz,CD3OD)δ9.16(s,1H),8.17(d,2H),7.51-7.44(m,4H),7.37-7.32(m,2H),4.76(d,2H),4.67(s,2H),3.93(s,2H),3.86(d,2H),3.70(m,2H),3.30-3.24(m,2H),2.38-2.30(m,2H),2.28-2.15(m,4H),2.15-2.06(m,2H),2.04-1.87(m,4H)
实施例17
(4-(4-(1R,5S)-3,8-二氮杂双环[3.2.1]辛烷-3-基)-8-氟-2-((四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)萘-2-基)甲醇(化合物17)
第一步:化合物17a-1的制备
在室温N2氛围下,向溶有化合物12a(400.0mg,1.70mmol)的1,4-二氧六环(1.0mL)中加入联硼酸频那醇酯(648.1mg,2.55mmol),Pd(dppf)Cl2(126.2mg,0.17mmol)和KOAc(333.9mg,3.40mmol)。反应液加热至110℃,搅拌12h。反应液真空减压浓缩得到粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:20%乙酸乙酯的石油醚,得到化合物17a-1(160.0mg,收率33.3%)。
MS(ESI):m/z=282.9[M+H]+
第二步:化合物17a的制备
在0℃下,向溶有化合物17a-1(400.0mg,1.42mmol)的MeOH(5mL)中加入NaBH4(95.8mg,2.84mmol),搅拌1h。向反应液中加入水(10mL),EtOAc(15mL×3)萃取。合并有机相并用无水Na2SO4干燥,过滤,真空减压浓缩得到化合物粗品。粗品通过硅胶色谱法快速柱层析纯化,淋洗剂为:20%乙酸乙酯的石油醚,得到化合物17a(120.0mg,收率29.8%)。
化合物17的制备参考化合物1的合成方法。由起始原料12a(200.0mg,0.38和17a(138.6mg,0.488mmol)经两步反应得到化合物17(21.8mg)。
MS(ESI):m/z=555.5[M+H]+
1H NMR:(400MHz,DMSO-d6)δ9.19(s,1H),8.04-7.97(m,2H),7.70-7.69(m,1H),7.63(s,1H),7.58-7.52(m,1H),7.49-7.43(m,1H),4.74(s,2H),4.50(d,2H),4.17(d,2H),3.67(s,4H),3.06(s,2H),2.68(s,2H),2.02-1.62(m,12H)
实施例18
(4-(4-(1R,5S)-8-氧杂-3-氮杂双环[3.2.1]辛烷-3-基)-8-氟-2-((四氢-1H-双稠吡咯啶-7a(5H)-基)甲氧基)吡啶骈[4,3-d]嘧啶-7-基)-5-乙炔基萘-2-酚(化合物18)
化合物18的制备参考化合物10的合成方法。由起始原料1a(300.0mg,1.19mmol)和18a(142.2mg,0.95mmol)经五步反应得到化合物18(15.2mg)。
MS(ESI):m/z=566.3[M+H]+
1H NMR:(400MHz,CD3OD)δ9.04(s,1H),7.83(d,1H),7.51(d,1H),7.44-7.37(m,1H),7.34(d,1H),7.16(d,1H),4.71-4.43(m,5H),3.83-3.82(m,2H),3.40-3.33(m,2H),3.01(s,1H),3.00-2.92(m,2H),2.22-2.13(m,2H),2.12-1.96(m,6H),1.96-1.82(m,5H)
试验例1、活性测试
实验方案
1.化合物准备
根据化合物孔板分布图,使用ECHO进行加样,最高浓度10000nM,3倍稀释,10个剂量,使用0.5%DMSO作为溶剂,复孔。
2.实验操作
1)使用缓冲溶液配制160nM的His-K-RasG12D母液;
2)在Plate 1中加入5uL His-K-RasG12D蛋白母液到相应板孔中;封板,1000rpm快速离心1分钟;室温孵育120min;
3)冰上利用缓冲溶液制备SOS-1和GTP的混合液;
4)加5Ul SOS-1和GTP的混合液到相应板孔中;封板,1000rpm离心一分钟;室温孵育60min;
5)加5uL GST c-Raf和受体珠子的混合液到相应板孔中;封板,1000rpm离心一分钟;室温孵育60min;
6)加5uL供体珠子混合液到相应的板孔(供体珠子需避光);封板,1000rpm离心一分钟;室温孵育60min。
3.使用Envision 3读板
| 滤光片 | AlphaScreen emission 570-Em Slot 8 |
| 镜像 | AlphaScreen-Slot 4 |
| 总测试时间(ms) | 600 |
| 激发时间(ms) | 150 |
| 测试模式 | By rows,bi-directional |
| 测试模式 | Optiplate-384 |
表1.
Claims (15)
4.根据权利要求1-3任一项所述的化合物或其药学上可接受的盐,所述Rj选自氘、羟基、氟、氯、溴、C2-6烯基、C2-6炔基、-B(OH)2、二氟甲基。
5.根据权利要求1-4任一项所述的化合物或其药学上可接受的盐,所述Rj选自卤素、氘、羟基、C2-6烯基或C2-6炔基,优选氘、羟基、氟、氯、溴、C2-6烯基或C2-6炔基。
7.根据权利要求1-32任一项所述的化合物或其药学上可接受的盐,所述R3选自选自氘、卤素、氰基、羟基、C1-6烷基,优选氢、氘、氟、氯、溴、碘、甲基、乙基、正丙基、异丙基或叔丁基。
10.根据权利要求1-9任一项所述的化合物或其药学上可接受的盐的同位素取代物,同位素原子为氘。
11.根据权利要求10所述的化合物或其药学上可接受的盐的同位素取代物,其中所述氘原子的丰度大于20%,优选所述氘原子的丰度大于50%,更优选所述氘原子的丰度大于90%,最优选所述氘原子的丰度大于95%。
12.一种药物组合物,包括至少一种治疗有效量的权利要求1-11任一项所述化合物或其药学上可接受的盐以及药学上可接受的赋形剂。
13.权利要求1-11任一项所述的化合物或其药学上可接受的盐或权利要求12所述的药物组合物在制备用于预防和/或治疗与KRAS G12D相关疾病或病症的药物中的用途。
14.权利要求1-11任一项所述的化合物或其药学上可接受的盐或权利要求12所述的药物组合物在制备用于预防和/或治疗癌症的药物中的用途。
15.根据权利要求14所述的用途,所述癌症选自非小细胞肺癌、小细胞肺癌、结直肠癌、直肠癌或胰腺癌。
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2021103835370 | 2021-04-09 | ||
| CN202110383537 | 2021-04-09 | ||
| CN2021104858810 | 2021-04-30 | ||
| CN202110485881 | 2021-04-30 | ||
| CN2021107301315 | 2021-06-29 | ||
| CN202110730131 | 2021-06-29 | ||
| CN202110790442 | 2021-07-13 | ||
| CN2021107904420 | 2021-07-13 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN115197245A true CN115197245A (zh) | 2022-10-18 |
Family
ID=83574334
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210373726.4A Pending CN115197245A (zh) | 2021-04-09 | 2022-04-07 | 一种Kras抑制剂及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN115197245A (zh) |
Cited By (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115785124A (zh) * | 2021-09-10 | 2023-03-14 | 润佳(苏州)医药科技有限公司 | Kras g12d抑制剂及其用途 |
| CN116157401A (zh) * | 2021-04-28 | 2023-05-23 | 浙江海正药业股份有限公司 | 杂环类衍生物及其制备方法和用途 |
| WO2023098426A1 (zh) * | 2021-12-02 | 2023-06-08 | 上海和誉生物医药科技有限公司 | 一种7-(萘-1-基)吡啶并[4,3-d]嘧啶衍生物及其制备和应用 |
| CN116284055A (zh) * | 2021-09-10 | 2023-06-23 | 润佳(苏州)医药科技有限公司 | 一种kras抑制剂及其用途 |
| WO2023134465A1 (zh) * | 2022-01-11 | 2023-07-20 | 上海艾力斯医药科技股份有限公司 | 一种含氮杂环化合物、其制备方法、中间体及应用 |
| WO2023138583A1 (zh) * | 2022-01-21 | 2023-07-27 | 上海湃隆生物科技有限公司 | 杂环类化合物、药物组合物及其应用 |
| WO2024119277A1 (en) * | 2022-12-08 | 2024-06-13 | Risen (Suzhou) Pharma Tech Co., Ltd. | Kras inhibitors and pharmaceutical uses thereof |
| US12059425B2 (en) | 2022-08-05 | 2024-08-13 | Kumquat Biosciences Inc. | Heterocyclic compounds and uses thereof |
| WO2024206858A1 (en) | 2023-03-30 | 2024-10-03 | Revolution Medicines, Inc. | Compositions for inducing ras gtp hydrolysis and uses thereof |
| WO2024227091A1 (en) * | 2023-04-26 | 2024-10-31 | Ranok Therapeutics (Hangzhou) Co. Ltd. | Diazabicyclooctane inhibitors of kras (g12d) and uses |
| WO2024229406A1 (en) | 2023-05-04 | 2024-11-07 | Revolution Medicines, Inc. | Combination therapy for a ras related disease or disorder |
| WO2025034702A1 (en) | 2023-08-07 | 2025-02-13 | Revolution Medicines, Inc. | Rmc-6291 for use in the treatment of ras protein-related disease or disorder |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020146613A1 (en) * | 2019-01-10 | 2020-07-16 | Mirati Therapeutics, Inc. | Kras g12c inhibitors |
| WO2021041671A1 (en) * | 2019-08-29 | 2021-03-04 | Mirati Therapeutics, Inc. | Kras g12d inhibitors |
| WO2022042630A1 (en) * | 2020-08-26 | 2022-03-03 | InventisBio Co., Ltd. | Heteroaryl compounds, preparation methods and uses thereof |
| WO2022060583A1 (en) * | 2020-09-03 | 2022-03-24 | Revolution Medicines, Inc. | Use of sos1 inhibitors to treat malignancies with shp2 mutations |
| WO2022061251A1 (en) * | 2020-09-18 | 2022-03-24 | Plexxikon Inc. | Compounds and methods for kras modulation and indications therefor |
-
2022
- 2022-04-07 CN CN202210373726.4A patent/CN115197245A/zh active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020146613A1 (en) * | 2019-01-10 | 2020-07-16 | Mirati Therapeutics, Inc. | Kras g12c inhibitors |
| WO2021041671A1 (en) * | 2019-08-29 | 2021-03-04 | Mirati Therapeutics, Inc. | Kras g12d inhibitors |
| WO2022042630A1 (en) * | 2020-08-26 | 2022-03-03 | InventisBio Co., Ltd. | Heteroaryl compounds, preparation methods and uses thereof |
| WO2022060583A1 (en) * | 2020-09-03 | 2022-03-24 | Revolution Medicines, Inc. | Use of sos1 inhibitors to treat malignancies with shp2 mutations |
| WO2022061251A1 (en) * | 2020-09-18 | 2022-03-24 | Plexxikon Inc. | Compounds and methods for kras modulation and indications therefor |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116157401A (zh) * | 2021-04-28 | 2023-05-23 | 浙江海正药业股份有限公司 | 杂环类衍生物及其制备方法和用途 |
| CN115785124B (zh) * | 2021-09-10 | 2024-11-08 | 润佳(苏州)医药科技有限公司 | Kras g12d抑制剂及其用途 |
| CN116284055A (zh) * | 2021-09-10 | 2023-06-23 | 润佳(苏州)医药科技有限公司 | 一种kras抑制剂及其用途 |
| CN115785124A (zh) * | 2021-09-10 | 2023-03-14 | 润佳(苏州)医药科技有限公司 | Kras g12d抑制剂及其用途 |
| WO2023098426A1 (zh) * | 2021-12-02 | 2023-06-08 | 上海和誉生物医药科技有限公司 | 一种7-(萘-1-基)吡啶并[4,3-d]嘧啶衍生物及其制备和应用 |
| WO2023134465A1 (zh) * | 2022-01-11 | 2023-07-20 | 上海艾力斯医药科技股份有限公司 | 一种含氮杂环化合物、其制备方法、中间体及应用 |
| WO2023138583A1 (zh) * | 2022-01-21 | 2023-07-27 | 上海湃隆生物科技有限公司 | 杂环类化合物、药物组合物及其应用 |
| US12059425B2 (en) | 2022-08-05 | 2024-08-13 | Kumquat Biosciences Inc. | Heterocyclic compounds and uses thereof |
| WO2024119277A1 (en) * | 2022-12-08 | 2024-06-13 | Risen (Suzhou) Pharma Tech Co., Ltd. | Kras inhibitors and pharmaceutical uses thereof |
| WO2024206858A1 (en) | 2023-03-30 | 2024-10-03 | Revolution Medicines, Inc. | Compositions for inducing ras gtp hydrolysis and uses thereof |
| WO2024227091A1 (en) * | 2023-04-26 | 2024-10-31 | Ranok Therapeutics (Hangzhou) Co. Ltd. | Diazabicyclooctane inhibitors of kras (g12d) and uses |
| WO2024229406A1 (en) | 2023-05-04 | 2024-11-07 | Revolution Medicines, Inc. | Combination therapy for a ras related disease or disorder |
| WO2025034702A1 (en) | 2023-08-07 | 2025-02-13 | Revolution Medicines, Inc. | Rmc-6291 for use in the treatment of ras protein-related disease or disorder |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN115197245A (zh) | 一种Kras抑制剂及其制备方法 | |
| CN111704611B (zh) | 一类芳基螺环类shp2抑制剂化合物、制备方法和用途 | |
| CN111153901B (zh) | 一类含氮稠杂环类shp2抑制剂化合物、制备方法和用途 | |
| CN114615981B (zh) | Kras g12d抑制剂 | |
| CN112300194B (zh) | 一类稠环吡啶酮类化合物、制备方法和用途 | |
| CN109311889B (zh) | 激活素受体样激酶抑制剂 | |
| CN104837829B (zh) | 抑制剂化合物 | |
| JP6726677B2 (ja) | 抗がん剤としての置換2−h−ピラゾール誘導体 | |
| EP3556758B1 (en) | 1,2-dihydro-1,6-naphthyridin-2-one derivatives as cdk4/6 inhibitors | |
| AU2015252654A1 (en) | Polyfluorinated compounds acting as Bruton's tyrosine kinase inhibitors | |
| TW202102509A (zh) | 靶向prmt5之化合物 | |
| CN112094269B (zh) | 一类饱和六元环并杂环类化合物、制备方法和用途 | |
| CN114656482A (zh) | 作为egfr抑制剂的大环杂环类化合物及其应用 | |
| CN115315427A (zh) | Hpk1抑制剂及其制备方法和用途 | |
| CN112300196A (zh) | 一类哌啶稠环类化合物、制备方法和用途 | |
| EP4206197A1 (en) | Preparation method for novel rho-related protein kinase inhibitor and intermediate in preparation method | |
| JP2021501738A (ja) | アミノピラゾロピリミジン含有大環状化合物とその医薬組成物、ならびにそれらの使用 | |
| WO2023151621A1 (zh) | 具有抗kras突变肿瘤活性的化合物 | |
| WO2024002373A1 (zh) | 取代嘧啶并环类抑制剂及其制备方法和应用 | |
| TW202417455A (zh) | 新穎三雜環化合物及藥學組成物 | |
| WO2019074809A1 (en) | INDAZOLYL-SPIRO [2.2] PENTANE-CARBONITRILE DERIVATIVES AS LRRK2 INHIBITORS, PHARMACEUTICAL COMPOSITIONS AND USES THEREOF | |
| CN110655520A (zh) | 嘧啶并环化合物及其制备方法和应用 | |
| AU2021351093A1 (en) | Compound as akt kinase inhibitor | |
| CN118955502A (zh) | 一类具有激酶抑制活性的化合物 | |
| WO2023224894A9 (en) | Macrocycles as lrrk2 inhibitors, pharmaceutical compositions, and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20221018 |