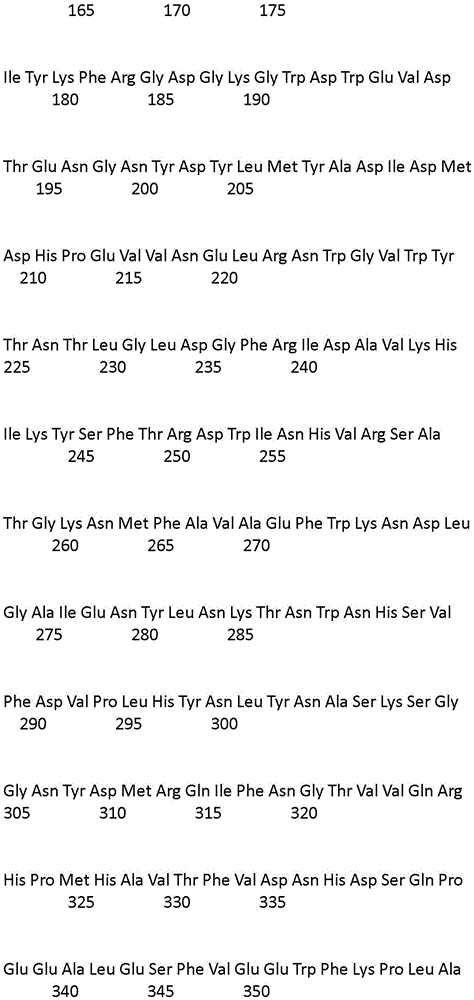CN112204138A - 自动盘碟洗涤剂组合物 - Google Patents
自动盘碟洗涤剂组合物 Download PDFInfo
- Publication number
- CN112204138A CN112204138A CN201980035161.5A CN201980035161A CN112204138A CN 112204138 A CN112204138 A CN 112204138A CN 201980035161 A CN201980035161 A CN 201980035161A CN 112204138 A CN112204138 A CN 112204138A
- Authority
- CN
- China
- Prior art keywords
- composition
- amino acid
- acid
- seq
- protease
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 143
- 238000004851 dishwashing Methods 0.000 title claims abstract description 30
- 239000003599 detergent Substances 0.000 title description 16
- 108091005804 Peptidases Proteins 0.000 claims abstract description 83
- 239000004365 Protease Substances 0.000 claims abstract description 81
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 claims abstract description 59
- 238000004140 cleaning Methods 0.000 claims abstract description 30
- 229920000642 polymer Polymers 0.000 claims description 43
- 239000007844 bleaching agent Substances 0.000 claims description 38
- 150000001413 amino acids Chemical group 0.000 claims description 25
- 239000008139 complexing agent Substances 0.000 claims description 23
- 239000002270 dispersing agent Substances 0.000 claims description 22
- 239000002736 nonionic surfactant Substances 0.000 claims description 20
- MIDXCONKKJTLDX-UHFFFAOYSA-N 3,5-dimethylcyclopentane-1,2-dione Chemical compound CC1CC(C)C(=O)C1=O MIDXCONKKJTLDX-UHFFFAOYSA-N 0.000 claims description 18
- 235000013736 caramel Nutrition 0.000 claims description 18
- -1 carboxymethyl inulin Chemical compound 0.000 claims description 18
- 239000003054 catalyst Substances 0.000 claims description 18
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 claims description 18
- 235000011962 puddings Nutrition 0.000 claims description 18
- 238000006467 substitution reaction Methods 0.000 claims description 17
- 108010065511 Amylases Proteins 0.000 claims description 15
- 102000013142 Amylases Human genes 0.000 claims description 15
- 235000019418 amylase Nutrition 0.000 claims description 15
- 239000004382 Amylase Substances 0.000 claims description 13
- CIEZZGWIJBXOTE-UHFFFAOYSA-N 2-[bis(carboxymethyl)amino]propanoic acid Chemical compound OC(=O)C(C)N(CC(O)=O)CC(O)=O CIEZZGWIJBXOTE-UHFFFAOYSA-N 0.000 claims description 12
- 239000003795 chemical substances by application Substances 0.000 claims description 12
- 230000035772 mutation Effects 0.000 claims description 11
- 238000000034 method Methods 0.000 claims description 10
- 150000003839 salts Chemical class 0.000 claims description 10
- 239000011521 glass Substances 0.000 claims description 9
- 239000012190 activator Substances 0.000 claims description 8
- 238000004061 bleaching Methods 0.000 claims description 6
- MWNQXXOSWHCCOZ-UHFFFAOYSA-L sodium;oxido carbonate Chemical group [Na+].[O-]OC([O-])=O MWNQXXOSWHCCOZ-UHFFFAOYSA-L 0.000 claims description 6
- 108090000637 alpha-Amylases Proteins 0.000 claims description 5
- 102000004139 alpha-Amylases Human genes 0.000 claims description 5
- 229910052748 manganese Inorganic materials 0.000 claims description 5
- 239000011572 manganese Substances 0.000 claims description 5
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 claims description 4
- PQHYOGIRXOKOEJ-UHFFFAOYSA-N 2-(1,2-dicarboxyethylamino)butanedioic acid Chemical compound OC(=O)CC(C(O)=O)NC(C(O)=O)CC(O)=O PQHYOGIRXOKOEJ-UHFFFAOYSA-N 0.000 claims description 3
- 229920001202 Inulin Polymers 0.000 claims description 3
- 229940029339 inulin Drugs 0.000 claims description 3
- 229940024171 alpha-amylase Drugs 0.000 claims description 2
- 238000006243 chemical reaction Methods 0.000 claims description 2
- 238000005406 washing Methods 0.000 claims description 2
- VCVKIIDXVWEWSZ-YFKPBYRVSA-N (2s)-2-[bis(carboxymethyl)amino]pentanedioic acid Chemical compound OC(=O)CC[C@@H](C(O)=O)N(CC(O)=O)CC(O)=O VCVKIIDXVWEWSZ-YFKPBYRVSA-N 0.000 claims 1
- 125000003275 alpha amino acid group Chemical group 0.000 description 28
- 235000001014 amino acid Nutrition 0.000 description 26
- 102000035195 Peptidases Human genes 0.000 description 24
- 239000002253 acid Substances 0.000 description 23
- 102000004190 Enzymes Human genes 0.000 description 20
- 108090000790 Enzymes Proteins 0.000 description 20
- 229940088598 enzyme Drugs 0.000 description 20
- 241000193830 Bacillus <bacterium> Species 0.000 description 18
- 239000000178 monomer Substances 0.000 description 18
- 229940024606 amino acid Drugs 0.000 description 17
- 239000011575 calcium Substances 0.000 description 16
- 125000004432 carbon atom Chemical group C* 0.000 description 14
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 13
- 238000003556 assay Methods 0.000 description 13
- 239000000243 solution Substances 0.000 description 13
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 13
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 10
- 239000013078 crystal Substances 0.000 description 10
- 229910052751 metal Inorganic materials 0.000 description 10
- 239000002184 metal Substances 0.000 description 10
- 239000012071 phase Substances 0.000 description 10
- 239000004094 surface-active agent Substances 0.000 description 10
- 101000740449 Bacillus subtilis (strain 168) Biotin/lipoyl attachment protein Proteins 0.000 description 9
- 230000001747 exhibiting effect Effects 0.000 description 9
- 239000003966 growth inhibitor Substances 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 239000012224 working solution Substances 0.000 description 9
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 8
- 229910052791 calcium Inorganic materials 0.000 description 8
- 229920001577 copolymer Polymers 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 7
- 229920002125 Sokalan® Polymers 0.000 description 7
- 239000007983 Tris buffer Substances 0.000 description 7
- 238000012217 deletion Methods 0.000 description 7
- 230000037430 deletion Effects 0.000 description 7
- 239000008234 soft water Substances 0.000 description 7
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 7
- 102220590260 Lysophospholipase-like protein 1_N76D_mutation Human genes 0.000 description 6
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 6
- 108090000787 Subtilisin Proteins 0.000 description 6
- 125000001931 aliphatic group Chemical group 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- FRPJTGXMTIIFIT-UHFFFAOYSA-N tetraacetylethylenediamine Chemical group CC(=O)C(N)(C(C)=O)C(N)(C(C)=O)C(C)=O FRPJTGXMTIIFIT-UHFFFAOYSA-N 0.000 description 6
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 5
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 5
- 241000193744 Bacillus amyloliquefaciens Species 0.000 description 5
- 235000014469 Bacillus subtilis Nutrition 0.000 description 5
- DBVJJBKOTRCVKF-UHFFFAOYSA-N Etidronic acid Chemical compound OP(=O)(O)C(O)(C)P(O)(O)=O DBVJJBKOTRCVKF-UHFFFAOYSA-N 0.000 description 5
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 5
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Natural products NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 5
- 229920000877 Melamine resin Polymers 0.000 description 5
- 102220528606 Ribonuclease P/MRP protein subunit POP5_S99D_mutation Human genes 0.000 description 5
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 5
- 150000007513 acids Chemical class 0.000 description 5
- 150000007942 carboxylates Chemical class 0.000 description 5
- 229920001519 homopolymer Polymers 0.000 description 5
- 150000002500 ions Chemical class 0.000 description 5
- JDSHMPZPIAZGSV-UHFFFAOYSA-N melamine Chemical compound NC1=NC(N)=NC(N)=N1 JDSHMPZPIAZGSV-UHFFFAOYSA-N 0.000 description 5
- 229910000029 sodium carbonate Inorganic materials 0.000 description 5
- 239000002689 soil Substances 0.000 description 5
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 5
- LKDMKWNDBAVNQZ-WJNSRDFLSA-N 4-[[(2s)-1-[[(2s)-1-[(2s)-2-[[(2s)-1-(4-nitroanilino)-1-oxo-3-phenylpropan-2-yl]carbamoyl]pyrrolidin-1-yl]-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-4-oxobutanoic acid Chemical compound OC(=O)CCC(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(=O)NC=1C=CC(=CC=1)[N+]([O-])=O)CC1=CC=CC=C1 LKDMKWNDBAVNQZ-WJNSRDFLSA-N 0.000 description 4
- 244000063299 Bacillus subtilis Species 0.000 description 4
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 4
- 102000005701 Calcium-Binding Proteins Human genes 0.000 description 4
- 108010045403 Calcium-Binding Proteins Proteins 0.000 description 4
- 102000002322 Egg Proteins Human genes 0.000 description 4
- 108010000912 Egg Proteins Proteins 0.000 description 4
- 241000193385 Geobacillus stearothermophilus Species 0.000 description 4
- 239000007984 Tris EDTA buffer Substances 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- STZIXLPVKZUAMV-UHFFFAOYSA-N cyclopentane-1,1,2,2-tetracarboxylic acid Chemical group OC(=O)C1(C(O)=O)CCCC1(C(O)=O)C(O)=O STZIXLPVKZUAMV-UHFFFAOYSA-N 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 235000013345 egg yolk Nutrition 0.000 description 4
- 210000002969 egg yolk Anatomy 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 230000000813 microbial effect Effects 0.000 description 4
- 229920001184 polypeptide Polymers 0.000 description 4
- 102000004196 processed proteins & peptides Human genes 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 108010082371 succinyl-alanyl-alanyl-prolyl-phenylalanine-4-nitroanilide Proteins 0.000 description 4
- UZJGVXSQDRSSHU-UHFFFAOYSA-N 6-(1,3-dioxoisoindol-2-yl)hexaneperoxoic acid Chemical compound C1=CC=C2C(=O)N(CCCCCC(=O)OO)C(=O)C2=C1 UZJGVXSQDRSSHU-UHFFFAOYSA-N 0.000 description 3
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 3
- 241000193422 Bacillus lentus Species 0.000 description 3
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 3
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 3
- 241000179039 Paenibacillus Species 0.000 description 3
- 229920002873 Polyethylenimine Polymers 0.000 description 3
- 108010022999 Serine Proteases Proteins 0.000 description 3
- 102000012479 Serine Proteases Human genes 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 3
- 229910052783 alkali metal Inorganic materials 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 229910000019 calcium carbonate Inorganic materials 0.000 description 3
- 229910001424 calcium ion Inorganic materials 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- 239000008367 deionised water Substances 0.000 description 3
- 229910021641 deionized water Inorganic materials 0.000 description 3
- VTIIJXUACCWYHX-UHFFFAOYSA-L disodium;carboxylatooxy carbonate Chemical compound [Na+].[Na+].[O-]C(=O)OOC([O-])=O VTIIJXUACCWYHX-UHFFFAOYSA-L 0.000 description 3
- 239000012153 distilled water Substances 0.000 description 3
- 235000013601 eggs Nutrition 0.000 description 3
- 239000008233 hard water Substances 0.000 description 3
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 3
- 229930182817 methionine Natural products 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- RGSFGYAAUTVSQA-UHFFFAOYSA-N pentamethylene Natural products C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 3
- 229940045872 sodium percarbonate Drugs 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000011550 stock solution Substances 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 238000004448 titration Methods 0.000 description 3
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 2
- CRSBERNSMYQZNG-UHFFFAOYSA-N 1-dodecene Chemical compound CCCCCCCCCCC=C CRSBERNSMYQZNG-UHFFFAOYSA-N 0.000 description 2
- CTMHWPIWNRWQEG-UHFFFAOYSA-N 1-methylcyclohexene Chemical compound CC1=CCCCC1 CTMHWPIWNRWQEG-UHFFFAOYSA-N 0.000 description 2
- ZGZHWIAQICBGKN-UHFFFAOYSA-N 1-nonanoylpyrrolidine-2,5-dione Chemical compound CCCCCCCCC(=O)N1C(=O)CCC1=O ZGZHWIAQICBGKN-UHFFFAOYSA-N 0.000 description 2
- JAHNSTQSQJOJLO-UHFFFAOYSA-N 2-(3-fluorophenyl)-1h-imidazole Chemical compound FC1=CC=CC(C=2NC=CN=2)=C1 JAHNSTQSQJOJLO-UHFFFAOYSA-N 0.000 description 2
- AIIITCMZOKMJIM-UHFFFAOYSA-N 2-(prop-2-enoylamino)propane-2-sulfonic acid Chemical group OS(=O)(=O)C(C)(C)NC(=O)C=C AIIITCMZOKMJIM-UHFFFAOYSA-N 0.000 description 2
- WWUVJRULCWHUSA-UHFFFAOYSA-N 2-methyl-1-pentene Chemical compound CCCC(C)=C WWUVJRULCWHUSA-UHFFFAOYSA-N 0.000 description 2
- XEEYSDHEOQHCDA-UHFFFAOYSA-N 2-methylprop-2-ene-1-sulfonic acid Chemical compound CC(=C)CS(O)(=O)=O XEEYSDHEOQHCDA-UHFFFAOYSA-N 0.000 description 2
- 241000194108 Bacillus licheniformis Species 0.000 description 2
- 241000194103 Bacillus pumilus Species 0.000 description 2
- 241000555281 Brevibacillus Species 0.000 description 2
- 239000008001 CAPS buffer Substances 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- VQTUBCCKSQIDNK-UHFFFAOYSA-N Isobutene Chemical compound CC(C)=C VQTUBCCKSQIDNK-UHFFFAOYSA-N 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical group CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Chemical group CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 241000863031 Lysobacter Species 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- 108010006035 Metalloproteases Proteins 0.000 description 2
- 102000005741 Metalloproteases Human genes 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 241000187747 Streptomyces Species 0.000 description 2
- 101710135785 Subtilisin-like protease Proteins 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 241000203775 Thermoactinomyces Species 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 150000001340 alkali metals Chemical class 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 229940025131 amylases Drugs 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 239000012964 benzotriazole Substances 0.000 description 2
- IAQRGUVFOMOMEM-UHFFFAOYSA-N butene Natural products CC=CC IAQRGUVFOMOMEM-UHFFFAOYSA-N 0.000 description 2
- 125000002843 carboxylic acid group Chemical group 0.000 description 2
- 239000000919 ceramic Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 239000004120 green S Substances 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- LVHBHZANLOWSRM-UHFFFAOYSA-N methylenebutanedioic acid Natural products OC(=O)CC(=C)C(O)=O LVHBHZANLOWSRM-UHFFFAOYSA-N 0.000 description 2
- 239000000693 micelle Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- CCCMONHAUSKTEQ-UHFFFAOYSA-N octadec-1-ene Chemical compound CCCCCCCCCCCCCCCCC=C CCCMONHAUSKTEQ-UHFFFAOYSA-N 0.000 description 2
- 150000004967 organic peroxy acids Chemical class 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 238000005192 partition Methods 0.000 description 2
- 235000021317 phosphate Nutrition 0.000 description 2
- 125000002467 phosphate group Chemical class [H]OP(=O)(O[H])O[*] 0.000 description 2
- 229920005646 polycarboxylate Polymers 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 125000000542 sulfonic acid group Chemical group 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- URAYPUMNDPQOKB-UHFFFAOYSA-N triacetin Chemical compound CC(=O)OCC(OC(C)=O)COC(C)=O URAYPUMNDPQOKB-UHFFFAOYSA-N 0.000 description 2
- 150000003628 tricarboxylic acids Chemical class 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- HFVMEOPYDLEHBR-UHFFFAOYSA-N (2-fluorophenyl)-phenylmethanol Chemical compound C=1C=CC=C(F)C=1C(O)C1=CC=CC=C1 HFVMEOPYDLEHBR-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical group OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- FFLHFURRPPIZTQ-UHFFFAOYSA-N (5-acetyloxy-2,5-dihydrofuran-2-yl) acetate Chemical compound CC(=O)OC1OC(OC(C)=O)C=C1 FFLHFURRPPIZTQ-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- UYXFOIMFLBVYDL-UHFFFAOYSA-N 1,2,4,7-tetramethyl-1,4,7-triazonane Chemical compound CC1CN(C)CCN(C)CCN1C UYXFOIMFLBVYDL-UHFFFAOYSA-N 0.000 description 1
- WLDGDTPNAKWAIR-UHFFFAOYSA-N 1,4,7-trimethyl-1,4,7-triazonane Chemical compound CN1CCN(C)CCN(C)CC1 WLDGDTPNAKWAIR-UHFFFAOYSA-N 0.000 description 1
- LYPVKWMHGFMDPD-UHFFFAOYSA-N 1,5-diacetyl-1,3,5-triazinane-2,4-dione Chemical compound CC(=O)N1CN(C(C)=O)C(=O)NC1=O LYPVKWMHGFMDPD-UHFFFAOYSA-N 0.000 description 1
- RIICRLQIUAAOOE-UHFFFAOYSA-N 1,5-dimethylcyclopentene Chemical compound CC1CCC=C1C RIICRLQIUAAOOE-UHFFFAOYSA-N 0.000 description 1
- IAUGBVWVWDTCJV-UHFFFAOYSA-N 1-(prop-2-enoylamino)propane-1-sulfonic acid Chemical compound CCC(S(O)(=O)=O)NC(=O)C=C IAUGBVWVWDTCJV-UHFFFAOYSA-N 0.000 description 1
- VDNSZPNSUQRUMS-UHFFFAOYSA-N 1-cyclohexyl-4-ethenylbenzene Chemical compound C1=CC(C=C)=CC=C1C1CCCCC1 VDNSZPNSUQRUMS-UHFFFAOYSA-N 0.000 description 1
- AFFLGGQVNFXPEV-UHFFFAOYSA-N 1-decene Chemical compound CCCCCCCCC=C AFFLGGQVNFXPEV-UHFFFAOYSA-N 0.000 description 1
- WJNKJKGZKFOLOJ-UHFFFAOYSA-N 1-dodecyl-4-ethenylbenzene Chemical compound CCCCCCCCCCCCC1=CC=C(C=C)C=C1 WJNKJKGZKFOLOJ-UHFFFAOYSA-N 0.000 description 1
- JZHGRUMIRATHIU-UHFFFAOYSA-N 1-ethenyl-3-methylbenzene Chemical compound CC1=CC=CC(C=C)=C1 JZHGRUMIRATHIU-UHFFFAOYSA-N 0.000 description 1
- VVTGQMLRTKFKAM-UHFFFAOYSA-N 1-ethenyl-4-propylbenzene Chemical compound CCCC1=CC=C(C=C)C=C1 VVTGQMLRTKFKAM-UHFFFAOYSA-N 0.000 description 1
- GQEZCXVZFLOKMC-UHFFFAOYSA-N 1-hexadecene Chemical compound CCCCCCCCCCCCCCC=C GQEZCXVZFLOKMC-UHFFFAOYSA-N 0.000 description 1
- LIKMAJRDDDTEIG-UHFFFAOYSA-N 1-hexene Chemical compound CCCCC=C LIKMAJRDDDTEIG-UHFFFAOYSA-N 0.000 description 1
- ATQUFXWBVZUTKO-UHFFFAOYSA-N 1-methylcyclopentene Chemical compound CC1=CCCC1 ATQUFXWBVZUTKO-UHFFFAOYSA-N 0.000 description 1
- IGGDKDTUCAWDAN-UHFFFAOYSA-N 1-vinylnaphthalene Chemical compound C1=CC=C2C(C=C)=CC=CC2=C1 IGGDKDTUCAWDAN-UHFFFAOYSA-N 0.000 description 1
- LVLXQRZPKUFJJQ-UHFFFAOYSA-N 2,3-dimethylhex-1-ene Chemical compound CCCC(C)C(C)=C LVLXQRZPKUFJJQ-UHFFFAOYSA-N 0.000 description 1
- LAAVYEUJEMRIGF-UHFFFAOYSA-N 2,4,4-trimethylpent-2-ene Chemical compound CC(C)=CC(C)(C)C LAAVYEUJEMRIGF-UHFFFAOYSA-N 0.000 description 1
- PKVDGQHNRICJLA-UHFFFAOYSA-N 2,4-dimethylhex-1-ene Chemical compound CCC(C)CC(C)=C PKVDGQHNRICJLA-UHFFFAOYSA-N 0.000 description 1
- ISZWTVCVSJVEOL-UHFFFAOYSA-N 2,5-dimethylhex-1-ene Chemical compound CC(C)CCC(C)=C ISZWTVCVSJVEOL-UHFFFAOYSA-N 0.000 description 1
- TWDUKWCXYKWSKZ-UHFFFAOYSA-N 2-(7-methyloctanoyloxy)benzenesulfonic acid Chemical class CC(C)CCCCCC(=O)OC1=CC=CC=C1S(O)(=O)=O TWDUKWCXYKWSKZ-UHFFFAOYSA-N 0.000 description 1
- XHZPRMZZQOIPDS-UHFFFAOYSA-N 2-Methyl-2-[(1-oxo-2-propenyl)amino]-1-propanesulfonic acid Chemical compound OS(=O)(=O)CC(C)(C)NC(=O)C=C XHZPRMZZQOIPDS-UHFFFAOYSA-N 0.000 description 1
- JTXMVXSTHSMVQF-UHFFFAOYSA-N 2-acetyloxyethyl acetate Chemical compound CC(=O)OCCOC(C)=O JTXMVXSTHSMVQF-UHFFFAOYSA-N 0.000 description 1
- VLEIUWBSEKKKFX-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetic acid Chemical compound OCC(N)(CO)CO.OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O VLEIUWBSEKKKFX-UHFFFAOYSA-N 0.000 description 1
- GZFRVDZZXXKIGR-UHFFFAOYSA-N 2-decanoyloxybenzoic acid Chemical compound CCCCCCCCCC(=O)OC1=CC=CC=C1C(O)=O GZFRVDZZXXKIGR-UHFFFAOYSA-N 0.000 description 1
- WROUWQQRXUBECT-UHFFFAOYSA-N 2-ethylacrylic acid Chemical compound CCC(=C)C(O)=O WROUWQQRXUBECT-UHFFFAOYSA-N 0.000 description 1
- XMWLVXXYIYBETQ-UHFFFAOYSA-N 2-hydroxy-3-(2-methylprop-2-enoylamino)propane-1-sulfonic acid Chemical compound CC(=C)C(=O)NCC(O)CS(O)(=O)=O XMWLVXXYIYBETQ-UHFFFAOYSA-N 0.000 description 1
- KOQQKLZTINXBAS-UHFFFAOYSA-N 2-hydroxy-3-prop-2-enoxypropane-1-sulfonic acid Chemical compound OS(=O)(=O)CC(O)COCC=C KOQQKLZTINXBAS-UHFFFAOYSA-N 0.000 description 1
- VSSGDAWBDKMCMI-UHFFFAOYSA-N 2-methyl-2-(2-methylprop-2-enoylamino)propane-1-sulfonic acid Chemical compound CC(=C)C(=O)NC(C)(C)CS(O)(=O)=O VSSGDAWBDKMCMI-UHFFFAOYSA-N 0.000 description 1
- PSZAEHPBBUYICS-UHFFFAOYSA-N 2-methylidenepropanedioic acid Chemical compound OC(=O)C(=C)C(O)=O PSZAEHPBBUYICS-UHFFFAOYSA-N 0.000 description 1
- AGBXYHCHUYARJY-UHFFFAOYSA-N 2-phenylethenesulfonic acid Chemical compound OS(=O)(=O)C=CC1=CC=CC=C1 AGBXYHCHUYARJY-UHFFFAOYSA-N 0.000 description 1
- ONPJWQSDZCGSQM-UHFFFAOYSA-N 2-phenylprop-2-enoic acid Chemical compound OC(=O)C(=C)C1=CC=CC=C1 ONPJWQSDZCGSQM-UHFFFAOYSA-N 0.000 description 1
- KXYAVSFOJVUIHT-UHFFFAOYSA-N 2-vinylnaphthalene Chemical compound C1=CC=CC2=CC(C=C)=CC=C21 KXYAVSFOJVUIHT-UHFFFAOYSA-N 0.000 description 1
- FEZKAPRRVNNJTK-UHFFFAOYSA-N 3,5-dimethylhex-1-ene Chemical compound CC(C)CC(C)C=C FEZKAPRRVNNJTK-UHFFFAOYSA-N 0.000 description 1
- KFNGWPXYNSJXOP-UHFFFAOYSA-N 3-(2-methylprop-2-enoyloxy)propane-1-sulfonic acid Chemical compound CC(=C)C(=O)OCCCS(O)(=O)=O KFNGWPXYNSJXOP-UHFFFAOYSA-N 0.000 description 1
- YNJSNEKCXVFDKW-UHFFFAOYSA-N 3-(5-amino-1h-indol-3-yl)-2-azaniumylpropanoate Chemical class C1=C(N)C=C2C(CC(N)C(O)=O)=CNC2=C1 YNJSNEKCXVFDKW-UHFFFAOYSA-N 0.000 description 1
- ZRKSKKQONQUFMR-UHFFFAOYSA-N 3-amino-2-methyl-3-oxoprop-1-ene-1-sulfonic acid Chemical compound NC(=O)C(C)=CS(O)(=O)=O ZRKSKKQONQUFMR-UHFFFAOYSA-N 0.000 description 1
- LDTAOIUHUHHCMU-UHFFFAOYSA-N 3-methylpent-1-ene Chemical compound CCC(C)C=C LDTAOIUHUHHCMU-UHFFFAOYSA-N 0.000 description 1
- SUJVAMIXNUAJEY-UHFFFAOYSA-N 4,4-dimethylhex-1-ene Chemical compound CCC(C)(C)CC=C SUJVAMIXNUAJEY-UHFFFAOYSA-N 0.000 description 1
- DXFURPHVJQITAC-UHFFFAOYSA-N 4-benzyl-1-ethenyl-2-ethylbenzene Chemical compound C1=C(C=C)C(CC)=CC(CC=2C=CC=CC=2)=C1 DXFURPHVJQITAC-UHFFFAOYSA-N 0.000 description 1
- UHPMCKVQTMMPCG-UHFFFAOYSA-N 5,8-dihydroxy-2-methoxy-6-methyl-7-(2-oxopropyl)naphthalene-1,4-dione Chemical compound CC1=C(CC(C)=O)C(O)=C2C(=O)C(OC)=CC(=O)C2=C1O UHPMCKVQTMMPCG-UHFFFAOYSA-N 0.000 description 1
- ITCICEGAURIGTM-UHFFFAOYSA-N 6-aminohexaneperoxoic acid Chemical compound NCCCCCC(=O)OO ITCICEGAURIGTM-UHFFFAOYSA-N 0.000 description 1
- 241001147780 Alicyclobacillus Species 0.000 description 1
- 241000862484 Alicyclobacillus sp. Species 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000193375 Bacillus alcalophilus Species 0.000 description 1
- 241001328119 Bacillus gibsonii Species 0.000 description 1
- 241000194110 Bacillus sp. (in: Bacteria) Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108091005658 Basic proteases Proteins 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 229910021532 Calcite Inorganic materials 0.000 description 1
- 241000186321 Cellulomonas Species 0.000 description 1
- 108090000317 Chymotrypsin Proteins 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- 241000605056 Cytophaga Species 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical group C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 241000223218 Fusarium Species 0.000 description 1
- 241000626621 Geobacillus Species 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical class [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- SHBUUTHKGIVMJT-UHFFFAOYSA-N Hydroxystearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OO SHBUUTHKGIVMJT-UHFFFAOYSA-N 0.000 description 1
- 241001063996 Kribbella Species 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- YIVJZNGAASQVEM-UHFFFAOYSA-N Lauroyl peroxide Chemical compound CCCCCCCCCCCC(=O)OOC(=O)CCCCCCCCCCC YIVJZNGAASQVEM-UHFFFAOYSA-N 0.000 description 1
- 241000568397 Lysinibacillus Species 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- UDPYEFRYPGXIAL-UHFFFAOYSA-N NC(=O)C(C)=CCS(O)(=O)=O Chemical compound NC(=O)C(C)=CCS(O)(=O)=O UDPYEFRYPGXIAL-UHFFFAOYSA-N 0.000 description 1
- 108091005507 Neutral proteases Proteins 0.000 description 1
- 102220519747 Neutrophil cytosol factor 1_S99G_mutation Human genes 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- LGRFSURHDFAFJT-UHFFFAOYSA-N Phthalic anhydride Natural products C1=CC=C2C(=O)OC(=O)C2=C1 LGRFSURHDFAFJT-UHFFFAOYSA-N 0.000 description 1
- 108090000316 Pitrilysin Proteins 0.000 description 1
- 239000004237 Ponceau 6R Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 102220528571 Ribonuclease P/MRP protein subunit POP5_S99A_mutation Human genes 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 239000004115 Sodium Silicate Substances 0.000 description 1
- 108010056079 Subtilisins Proteins 0.000 description 1
- 102000005158 Subtilisins Human genes 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical group CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N aldehydo-N-acetyl-D-glucosamine Chemical compound CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- 229910001413 alkali metal ion Inorganic materials 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000005263 alkylenediamine group Polymers 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- XYLMUPLGERFSHI-UHFFFAOYSA-N alpha-Methylstyrene Chemical compound CC(=C)C1=CC=CC=C1 XYLMUPLGERFSHI-UHFFFAOYSA-N 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960005261 aspartic acid Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 125000002511 behenyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- DRZOELSSQWENBA-UHFFFAOYSA-N benzene-1,2-dicarboperoxoic acid Chemical compound OOC(=O)C1=CC=CC=C1C(=O)OO DRZOELSSQWENBA-UHFFFAOYSA-N 0.000 description 1
- BJFLSHMHTPAZHO-UHFFFAOYSA-N benzotriazole Chemical compound [CH]1C=CC=C2N=NN=C21 BJFLSHMHTPAZHO-UHFFFAOYSA-N 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 235000019400 benzoyl peroxide Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 108010064866 biozym Proteins 0.000 description 1
- 238000009529 body temperature measurement Methods 0.000 description 1
- JHIWVOJDXOSYLW-UHFFFAOYSA-N butyl 2,2-difluorocyclopropane-1-carboxylate Chemical compound CCCCOC(=O)C1CC1(F)F JHIWVOJDXOSYLW-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 229910052793 cadmium Inorganic materials 0.000 description 1
- BDOSMKKIYDKNTQ-UHFFFAOYSA-N cadmium atom Chemical compound [Cd] BDOSMKKIYDKNTQ-UHFFFAOYSA-N 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001244 carboxylic acid anhydrides Chemical class 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229960002376 chymotrypsin Drugs 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- HNEGQIOMVPPMNR-IHWYPQMZSA-N citraconic acid Chemical compound OC(=O)C(/C)=C\C(O)=O HNEGQIOMVPPMNR-IHWYPQMZSA-N 0.000 description 1
- 229940018557 citraconic acid Drugs 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- JAWGVVJVYSANRY-UHFFFAOYSA-N cobalt(3+) Chemical compound [Co+3] JAWGVVJVYSANRY-UHFFFAOYSA-N 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 239000007891 compressed tablet Substances 0.000 description 1
- 230000003750 conditioning effect Effects 0.000 description 1
- 230000007797 corrosion Effects 0.000 description 1
- 238000005260 corrosion Methods 0.000 description 1
- LDHQCZJRKDOVOX-NSCUHMNNSA-N crotonic acid Chemical compound C\C=C\C(O)=O LDHQCZJRKDOVOX-NSCUHMNNSA-N 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- ZXIJMRYMVAMXQP-UHFFFAOYSA-N cycloheptene Chemical compound C1CCC=CCC1 ZXIJMRYMVAMXQP-UHFFFAOYSA-N 0.000 description 1
- ARUKYTASOALXFG-UHFFFAOYSA-N cycloheptylcycloheptane Chemical compound C1CCCCCC1C1CCCCCC1 ARUKYTASOALXFG-UHFFFAOYSA-N 0.000 description 1
- NLUNLVTVUDIHFE-UHFFFAOYSA-N cyclooctylcyclooctane Chemical compound C1CCCCCCC1C1CCCCCCC1 NLUNLVTVUDIHFE-UHFFFAOYSA-N 0.000 description 1
- UNWDCFHEVIWFCW-UHFFFAOYSA-N decanediperoxoic acid Chemical compound OOC(=O)CCCCCCCCC(=O)OO UNWDCFHEVIWFCW-UHFFFAOYSA-N 0.000 description 1
- 238000006114 decarboxylation reaction Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 239000013024 dilution buffer Substances 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- BRDYCNFHFWUBCZ-UHFFFAOYSA-N dodecaneperoxoic acid Chemical compound CCCCCCCCCCCC(=O)OO BRDYCNFHFWUBCZ-UHFFFAOYSA-N 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 239000001087 glyceryl triacetate Substances 0.000 description 1
- 235000013773 glyceryl triacetate Nutrition 0.000 description 1
- 150000002332 glycine derivatives Chemical group 0.000 description 1
- 125000001046 glycoluril group Chemical group [H]C12N(*)C(=O)N(*)C1([H])N(*)C(=O)N2* 0.000 description 1
- 229920000578 graft copolymer Polymers 0.000 description 1
- XLYOFNOQVPJJNP-ZSJDYOACSA-N heavy water Substances [2H]O[2H] XLYOFNOQVPJJNP-ZSJDYOACSA-N 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- JYJIGFIDKWBXDU-MNNPPOADSA-N inulin Chemical class O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)OC[C@]1(OC[C@]2(OC[C@]3(OC[C@]4(OC[C@]5(OC[C@]6(OC[C@]7(OC[C@]8(OC[C@]9(OC[C@]%10(OC[C@]%11(OC[C@]%12(OC[C@]%13(OC[C@]%14(OC[C@]%15(OC[C@]%16(OC[C@]%17(OC[C@]%18(OC[C@]%19(OC[C@]%20(OC[C@]%21(OC[C@]%22(OC[C@]%23(OC[C@]%24(OC[C@]%25(OC[C@]%26(OC[C@]%27(OC[C@]%28(OC[C@]%29(OC[C@]%30(OC[C@]%31(OC[C@]%32(OC[C@]%33(OC[C@]%34(OC[C@]%35(OC[C@]%36(O[C@@H]%37[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O%37)O)[C@H]([C@H](O)[C@@H](CO)O%36)O)[C@H]([C@H](O)[C@@H](CO)O%35)O)[C@H]([C@H](O)[C@@H](CO)O%34)O)[C@H]([C@H](O)[C@@H](CO)O%33)O)[C@H]([C@H](O)[C@@H](CO)O%32)O)[C@H]([C@H](O)[C@@H](CO)O%31)O)[C@H]([C@H](O)[C@@H](CO)O%30)O)[C@H]([C@H](O)[C@@H](CO)O%29)O)[C@H]([C@H](O)[C@@H](CO)O%28)O)[C@H]([C@H](O)[C@@H](CO)O%27)O)[C@H]([C@H](O)[C@@H](CO)O%26)O)[C@H]([C@H](O)[C@@H](CO)O%25)O)[C@H]([C@H](O)[C@@H](CO)O%24)O)[C@H]([C@H](O)[C@@H](CO)O%23)O)[C@H]([C@H](O)[C@@H](CO)O%22)O)[C@H]([C@H](O)[C@@H](CO)O%21)O)[C@H]([C@H](O)[C@@H](CO)O%20)O)[C@H]([C@H](O)[C@@H](CO)O%19)O)[C@H]([C@H](O)[C@@H](CO)O%18)O)[C@H]([C@H](O)[C@@H](CO)O%17)O)[C@H]([C@H](O)[C@@H](CO)O%16)O)[C@H]([C@H](O)[C@@H](CO)O%15)O)[C@H]([C@H](O)[C@@H](CO)O%14)O)[C@H]([C@H](O)[C@@H](CO)O%13)O)[C@H]([C@H](O)[C@@H](CO)O%12)O)[C@H]([C@H](O)[C@@H](CO)O%11)O)[C@H]([C@H](O)[C@@H](CO)O%10)O)[C@H]([C@H](O)[C@@H](CO)O9)O)[C@H]([C@H](O)[C@@H](CO)O8)O)[C@H]([C@H](O)[C@@H](CO)O7)O)[C@H]([C@H](O)[C@@H](CO)O6)O)[C@H]([C@H](O)[C@@H](CO)O5)O)[C@H]([C@H](O)[C@@H](CO)O4)O)[C@H]([C@H](O)[C@@H](CO)O3)O)[C@H]([C@H](O)[C@@H](CO)O2)O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JYJIGFIDKWBXDU-MNNPPOADSA-N 0.000 description 1
- 239000011133 lead Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- BQKYBHBRPYDELH-UHFFFAOYSA-N manganese;triazonane Chemical compound [Mn].C1CCCNNNCC1 BQKYBHBRPYDELH-UHFFFAOYSA-N 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 108010020132 microbial serine proteinases Proteins 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- JLCNIMCQBVMUIN-UHFFFAOYSA-N n-docosylprop-2-enamide Chemical compound CCCCCCCCCCCCCCCCCCCCCCNC(=O)C=C JLCNIMCQBVMUIN-UHFFFAOYSA-N 0.000 description 1
- XQPVIMDDIXCFFS-UHFFFAOYSA-N n-dodecylprop-2-enamide Chemical compound CCCCCCCCCCCCNC(=O)C=C XQPVIMDDIXCFFS-UHFFFAOYSA-N 0.000 description 1
- JKZQBSUPPNQHTK-UHFFFAOYSA-N n-ethyl-2-methylideneoctanamide Chemical compound CCCCCCC(=C)C(=O)NCC JKZQBSUPPNQHTK-UHFFFAOYSA-N 0.000 description 1
- SWPMNMYLORDLJE-UHFFFAOYSA-N n-ethylprop-2-enamide Chemical compound CCNC(=O)C=C SWPMNMYLORDLJE-UHFFFAOYSA-N 0.000 description 1
- YPHQUSNPXDGUHL-UHFFFAOYSA-N n-methylprop-2-enamide Chemical compound CNC(=O)C=C YPHQUSNPXDGUHL-UHFFFAOYSA-N 0.000 description 1
- CNWVYEGPPMQTKA-UHFFFAOYSA-N n-octadecylprop-2-enamide Chemical compound CCCCCCCCCCCCCCCCCCNC(=O)C=C CNWVYEGPPMQTKA-UHFFFAOYSA-N 0.000 description 1
- AWGZKFQMWZYCHF-UHFFFAOYSA-N n-octylprop-2-enamide Chemical compound CCCCCCCCNC(=O)C=C AWGZKFQMWZYCHF-UHFFFAOYSA-N 0.000 description 1
- XFHJDMUEHUHAJW-UHFFFAOYSA-N n-tert-butylprop-2-enamide Chemical compound CC(C)(C)NC(=O)C=C XFHJDMUEHUHAJW-UHFFFAOYSA-N 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000001451 organic peroxides Chemical class 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 150000002924 oxiranes Chemical group 0.000 description 1
- UFOIOXZLTXNHQH-UHFFFAOYSA-N oxolane-2,3,4,5-tetracarboxylic acid Chemical compound OC(=O)C1OC(C(O)=O)C(C(O)=O)C1C(O)=O UFOIOXZLTXNHQH-UHFFFAOYSA-N 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- YWAKXRMUMFPDSH-UHFFFAOYSA-N pentene Chemical compound CCCC=C YWAKXRMUMFPDSH-UHFFFAOYSA-N 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 150000004965 peroxy acids Chemical class 0.000 description 1
- XCRBXWCUXJNEFX-UHFFFAOYSA-N peroxybenzoic acid Chemical class OOC(=O)C1=CC=CC=C1 XCRBXWCUXJNEFX-UHFFFAOYSA-N 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 125000005342 perphosphate group Chemical group 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- UIIIBRHUICCMAI-UHFFFAOYSA-N prop-2-ene-1-sulfonic acid Chemical compound OS(=O)(=O)CC=C UIIIBRHUICCMAI-UHFFFAOYSA-N 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Chemical group CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 239000004180 red 2G Substances 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 229910001415 sodium ion Inorganic materials 0.000 description 1
- NTHWMYGWWRZVTN-UHFFFAOYSA-N sodium silicate Chemical compound [Na+].[Na+].[O-][Si]([O-])=O NTHWMYGWWRZVTN-UHFFFAOYSA-N 0.000 description 1
- 229910052911 sodium silicate Inorganic materials 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000008399 tap water Substances 0.000 description 1
- 235000020679 tap water Nutrition 0.000 description 1
- 238000005494 tarnishing Methods 0.000 description 1
- 108010075550 termamyl Proteins 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- YMBCJWGVCUEGHA-UHFFFAOYSA-M tetraethylammonium chloride Chemical compound [Cl-].CC[N+](CC)(CC)CC YMBCJWGVCUEGHA-UHFFFAOYSA-M 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- VWNRYDSLHLCGLG-NDNWHDOQSA-J tetrasodium;(2s)-2-[bis(carboxylatomethyl)amino]butanedioate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]C(=O)C[C@@H](C([O-])=O)N(CC([O-])=O)CC([O-])=O VWNRYDSLHLCGLG-NDNWHDOQSA-J 0.000 description 1
- 238000005382 thermal cycling Methods 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- LDHQCZJRKDOVOX-UHFFFAOYSA-N trans-crotonic acid Natural products CC=CC(O)=O LDHQCZJRKDOVOX-UHFFFAOYSA-N 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical group 0.000 description 1
- 229960002622 triacetin Drugs 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- WEAPVABOECTMGR-UHFFFAOYSA-N triethyl 2-acetyloxypropane-1,2,3-tricarboxylate Chemical compound CCOC(=O)CC(C(=O)OCC)(OC(C)=O)CC(=O)OCC WEAPVABOECTMGR-UHFFFAOYSA-N 0.000 description 1
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 1
- 125000004417 unsaturated alkyl group Chemical group 0.000 description 1
- 239000004474 valine Chemical group 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- NLVXSWCKKBEXTG-UHFFFAOYSA-N vinylsulfonic acid Chemical compound OS(=O)(=O)C=C NLVXSWCKKBEXTG-UHFFFAOYSA-N 0.000 description 1
- 239000004711 α-olefin Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/16—Organic compounds
- C11D3/38—Products with no well-defined composition, e.g. natural products
- C11D3/386—Preparations containing enzymes, e.g. protease or amylase
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/16—Organic compounds
- C11D3/38—Products with no well-defined composition, e.g. natural products
- C11D3/386—Preparations containing enzymes, e.g. protease or amylase
- C11D3/38618—Protease or amylase in liquid compositions only
-
- A—HUMAN NECESSITIES
- A47—FURNITURE; DOMESTIC ARTICLES OR APPLIANCES; COFFEE MILLS; SPICE MILLS; SUCTION CLEANERS IN GENERAL
- A47L—DOMESTIC WASHING OR CLEANING; SUCTION CLEANERS IN GENERAL
- A47L15/00—Washing or rinsing machines for crockery or tableware
- A47L15/42—Details
- A47L15/44—Devices for adding cleaning agents; Devices for dispensing cleaning agents, rinsing aids or deodorants
- A47L15/4418—Devices for adding cleaning agents; Devices for dispensing cleaning agents, rinsing aids or deodorants in the form of liquids
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D1/00—Detergent compositions based essentially on surface-active compounds; Use of these compounds as a detergent
- C11D1/008—Polymeric surface-active agents
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/02—Inorganic compounds ; Elemental compounds
- C11D3/04—Water-soluble compounds
- C11D3/10—Carbonates ; Bicarbonates
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/16—Organic compounds
- C11D3/20—Organic compounds containing oxygen
- C11D3/2075—Carboxylic acids-salts thereof
- C11D3/2086—Hydroxy carboxylic acids-salts thereof
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/16—Organic compounds
- C11D3/20—Organic compounds containing oxygen
- C11D3/22—Carbohydrates or derivatives thereof
- C11D3/222—Natural or synthetic polysaccharides, e.g. cellulose, starch, gum, alginic acid or cyclodextrin
- C11D3/225—Natural or synthetic polysaccharides, e.g. cellulose, starch, gum, alginic acid or cyclodextrin etherified, e.g. CMC
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/16—Organic compounds
- C11D3/26—Organic compounds containing nitrogen
- C11D3/33—Amino carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/39—Organic or inorganic per-compounds
- C11D3/3902—Organic or inorganic per-compounds combined with specific additives
- C11D3/3905—Bleach activators or bleach catalysts
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/39—Organic or inorganic per-compounds
- C11D3/3945—Organic per-compounds
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/395—Bleaching agents
- C11D3/3951—Bleaching agents combined with specific additives
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/52—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from bacteria or Archaea
- C12N9/54—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from bacteria or Archaea bacteria being Bacillus
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21062—Subtilisin (3.4.21.62)
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D2111/00—Cleaning compositions characterised by the objects to be cleaned; Cleaning compositions characterised by non-standard cleaning or washing processes
- C11D2111/10—Objects to be cleaned
- C11D2111/14—Hard surfaces
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Health & Medical Sciences (AREA)
- Inorganic Chemistry (AREA)
- Emergency Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Detergent Compositions (AREA)
Abstract
本发明提供了一种具有新型蛋白酶的自动盘碟洗涤清洁组合物。
Description
技术领域
本发明涉及洗涤剂领域。具体地,本发明涉及包含特定蛋白酶的自动盘碟洗涤剂。与包含常规蛋白酶的组合物相比,所述组合物提供改善的蛋白质性污垢去除。
背景技术
人们一直期望改善自动盘碟洗涤组合物的性能及其环境特征。
由于环境问题,磷酸盐逐渐被可生物降解的络合剂替代。这些络合剂可具有对金属的强结合能力并且/或者以高含量使用,并且可不利地影响酶的稳定性,具体地,络合剂可通过提取蛋白酶的结构性钙金属离子而不利地影响蛋白酶。蛋白酶可在产品和/或使用中受到影响。虽然具有高含量漂白剂的组合物可提供良好的清洁效果,但是漂白剂也可以损害酶、具体地蛋白酶的性能。高含量的络合剂、高温和长时间循环会加剧这种效果。
自动盘碟洗涤组合物可被设计成在某些应用条件下具有最佳性能,例如组合物可被设计成在软水循环中具有最佳性能,然而在软水循环中具有最佳性能的组合物在硬水循环中可能不具有最佳性能,反之亦然。
本发明的目的是提供一种盘碟洗涤组合物,该组合物可更好地去除蛋白质性污垢。优选地,当该组合物用于软水中时,并且优选地在不同的水硬度条件下,所述去除应当是良好的。还期望即使在胁迫条件下,诸如在热的长时间循环中洗涤的重垢负荷下,该组合物也具有改善的稳定性并且提供改善的性能。
发明内容
根据本发明的第一方面,提供了包含特定蛋白酶的自动盘碟洗涤剂组合物。该组合物优选地为不含磷酸盐的自动盘碟洗涤清洁组合物。更优选地,该组合物包含络合剂体系,并且更优选地该组合物包含络合剂体系和高含量的漂白体系。该组合物在鸡蛋和/或焦糖布丁去除方面表现出改善的稳定性和/或性能。本发明的组合物可适于在自动盘碟洗涤中使用的软水和/或高温和/或长时间循环。
根据本发明的第二方面,提供了使用本发明的组合物进行自动盘碟洗涤的方法。根据本发明的组合物用于在自动盘碟洗涤中提供焦糖布丁去除的用途。
结合本发明的第一方面描述的本发明的组合物的元素作必要修改之后适用于本发明的其他方面。
具体实施方式
本发明涵盖包含特定蛋白酶的自动盘碟洗涤清洁组合物。该组合物优选地不含磷酸盐,并且优选地包含络合剂体系。与包含常规蛋白酶的清洁组合物相比,所述组合物在多种条件下实现改善的清洁效果。所述组合物提供良好的蛋白质清洁效果,尤其是对于鸡蛋和焦糖布丁污垢而言。本发明还涵盖自动盘碟洗涤的方法。本发明的组合物在热、长时间循环和使用软水时提供良好的清洁效果。
所谓“软”水在本文中是指硬度小于约2gpg(34.3ppm)的水。格令/加仑(gpg)是定义为1格令(64.8毫克)碳酸钙溶解于1US加仑水(3.785412L)中的水硬度单位。它可转换为17.1份每百万份(ppm)。
所谓“热”循环在本文中被理解为其中主循环在高于50℃、优选地高于55℃的温度下执行的盘碟洗涤程序。
所谓“长时间”循环在本文中被理解为其中主循环具有至少25分钟、优选地至少30分钟并且更优选地至少35分钟的持续时间的盘碟洗涤程序。
本发明的组合物包含变体蛋白酶,该变体蛋白酶相对于参考蛋白酶(SEQ ID NO:1的蛋白酶)具有限定的同一性百分比。
本发明的组合物的蛋白酶在本文中有时称为“本发明的蛋白酶”。具有SEQ ID NO:1的蛋白酶在本文中有时称为“参考蛋白酶”。
两个氨基酸序列之间或两个核苷酸序列之间的相关性由参数“序列同一性”描述。
术语“变体”是指相对于参考蛋白酶在一个或多个(例如,若干个)位置处包含突变(即,取代、插入和/或缺失)的蛋白酶。取代是指占据某一位置的氨基酸被另一不同的氨基酸替换;缺失是指占据某一位置的氨基酸的移除;并且插入是指邻近占据某一位置的氨基酸并紧接在该氨基酸之后添加氨基酸。本发明的变体与参考蛋白酶具有至少90%、优选地至少92%、更优选地至少95%并且特别是99%的同一性。
术语“野生型”蛋白酶是指由天然存在的微生物诸如存在于自然界中的细菌、酵母或丝状真菌表达的蛋白酶。
在一些实施方案中,参考多肽包括吉氏芽孢杆菌-进化枝枯草杆菌蛋白酶。在一些实施方案中,如本文所提供的参考多肽所包括的吉氏芽孢杆菌-进化枝枯草杆菌蛋白酶具有SEQ ID NO:1中所示氨基酸序列。
酶相关术语
氨基酸修饰的命名
在描述本文的酶变体时,使用以下命名法以便于参考:原始氨基酸:位置:取代的氨基酸。
根据该命名法,例如在第195位用谷氨酸取代甘氨酸被显示为G195E。同一位置处甘氨酸的缺失被示出为G195*,并且另外的氨基酸残基诸如赖氨酸的插入被示出为G195GK。在特定酶与其他酶相比包含“缺失”并在该位置进行插入的情况下,这表示为*36D以在第36位插入天冬氨酸。多个突变由加号分开,即:S99G+V102N,分别表示在第99位和第102位用丝氨酸和缬氨酸取代甘氨酸和天冬酰胺的突变。在某一位置(例如,102)的氨基酸可被选自一组氨基酸(例如由N和I组成的组)的另一氨基酸取代的情况下,这将由V102N,I表示。
在所有情况下,采用公认的IUPAC单字母或三字母氨基酸缩写。
蛋白酶氨基酸编号
本专利中所用的编号是相对于SEQ ID NO:1的编号。
氨基酸同一性
两个氨基酸序列之间的相关性由参数“同一性”描述。就本发明目的而言,两个氨基酸序列的比对通过使用来自EMBOSS软件包(http://emboss.org),版本2.8.0的Needle程序进行确定。Needle程序执行Needleman,S.B.和Wunsch,C.D.在(1970)J.Mol.Biol.48:443-453中描述的全局比对算法。使用的取代矩阵为BLOSUM62,空位开放罚分为10,并且空位延伸罚分为0.5。
本文所用的酶的氨基酸序列(“本发明序列”)与不同氨基酸序列(“外来序列”)之间的同一性程度被计算为两个序列的比对中的精确匹配数除以“本发明序列”的长度或“外来序列”的长度,取最短者。结果以同一性百分比表示。当“本发明序列”和“外来序列”在重叠的相同位置具有相同的氨基酸残基时,发生精确匹配。序列的长度是序列中氨基酸残基的数目。
术语“基于琥珀酸盐的化合物”和“基于琥珀酸的化合物”在本文中可互换使用。
如本文所用,当用于权利要求中时,冠词诸如“一种”和“一个”被理解为是指一个或多个受权利要求保护或描述的物质。
除非另外指明,否则所有组分或组合物水平均是就该组分或组合物的活性部分而言,且不包括可能存在于此类组分或组合物的可商购获得的来源中的杂质,例如残余溶剂或副产物。
除非另外指明,否则所有百分比和比率均按重量计算。除非另外指明,否则所有百分比和比率均基于总组合物计算。
本发明的蛋白酶
本发明的变体与SEQ ID NO:1的蛋白酶具有至少90%、更优选地至少92%、更优选地至少95%并且特别是至少99%的同一性,并且所述变体在一个或多个位置处包含一个或多个氨基酸取代,所述一个或多个氨基酸取代选自:
(i)1C/D/E/M/N、21L、37A、54A、73V、76D/H/N/T、83G、84D/E/F、85I/M、86I/S/T/V、87T、88M/V、89F/W、91I、95A/N/S、96M/Q、97E、98M、99A/F/H/I/K/L/Q/T/W/Y、102L、104E、105L、106I/V、108A、109I、112C、114M/N、115A/E/H/Q、116A/E/G/H/Q、118A/D/N、122C、124E/Q、126I/Q/V、128H/I/L/M/N/Q/S/T/V/Y、129D/H、130N、131D/E/N/P/Q、135A/D/H/K/L/M/N/Q/T/V/W/Y、138D/E、139E/L、141A/E/F/H/Y、142A/D/E、143E/H/K/M/S/V、156E和157C/D/E
其中所述变体的氨基酸位置通过与SEQ ID NO:1的氨基酸序列的对应关系进行编号。
优选地,该变体包含至少两个、更优选地至少三个、更优选地至少四个氨基酸取代(使用SEQ ID NO:1编号)
所述组合物非常有利于去除鸡蛋、焦糖布丁并且/或者呈现出良好的稳定性。所述组合物特别有利于去除焦糖布丁。
在焦糖布丁去除方面,优选的组合物包含如下变体,该变体与SEQ ID NO:1的蛋白酶具有至少90%、更优选地至少92%、更优选地至少95%并且特别是至少99%的同一性,并且在一个或多个位置处包含一个或多个氨基酸取代,所述一个或多个氨基酸取代选自:1D、21L、37A、73V、76D、84D/E、85M、86I/V、87T、96M、97E、99A/F/H/I/L/Q/T/W/Y、104E、106I/V、115A/E、116E、122C、126I/Q/V、128S/T/V、129D、130N、131D/E、135A/D/H/L/M/N/Q/T/V/W/Y、138D、139E/L、141E/Y、142D/E、143E/H/M/V、156E和157C/D/E。
该变体与SEQ ID NO:1的氨基酸序列具有至少90%的同一性,并且优选地包含至少三个取代。
用于本发明的组合物中的特别优选的变体选自由与氨基酸序列SEQ ID:1具有至少90%、更优选地至少92%、更优选地至少95%并且特别是至少99%的同一性的变体组成的组。
在一个实施方案中,所述组合物包含蛋白酶,其中所述蛋白酶是与SEQ ID NO:1的氨基酸序列具有至少90%同一性的变体,并且所述变体在与SEQ ID NO:1位置对应的一个或多个位置处包含一个或多个氨基酸取代,所述一个或多个氨基酸取代选自:1C/D/E/M/N、21L、37A、54A、73V、76D/H/N/T、83G、84D/E/F、85I/M、86I/S/T/V、87T、88M/V、89F/W、91I、95A/N/S、96M/Q、97E、98M、99A/F/H/I/K/L/Q/T/W/Y、102L、104E、105L、106I/V、108A、109I、112C、114M/N、115A/E/H/Q、116A/E/G/H/Q、118A/D/N、122C、124E/Q、126I/Q/V、128H/I/L/M/N/Q/S/T/V/Y、129D/H、130N、131D/E/N/P/Q、135A/D/H/K/L/M/N/Q/T/V/W/Y、138D/E、139E/L、141A/E/F/H/Y、142A/D/E、143E/H/K/M/S/V、156E和157C/D/E;其中所述变体的氨基酸位置通过与SEQ ID NO:1的氨基酸序列的对应关系进行编号。
在一些实施方案中,所述变体蛋白酶还包含选自以下的至少一个、两个、三个或更多个另外的取代:Q012E、Q037E、N060D、N097D、Q107E、N115D、N154D、N167D、Q176E、Q185E、Q200E、N205D、Q230E、N236D、N242D、N250D、N253D、Q256E、N253D-Q256E、G025R-M117I-H118N、A149S、R044P-D175N-Y208N-Q230H、L041F-G078D-P084A、S101G-T174A、I021V-N177I、I021V-S142G-T188A、I021V-M122L-A222S、Q012L-I021V-M122L-A222S、I021V-M122L-N253D、I021V-N177V-V228I、I021V-S039T-M122L-N177E、I021V-V079L-D087E-A209N-A222S、I021V-M122L-A222S-T247N、I021V-M122L、S039E-N074D-D087E、N253P、S039E-N074D-D087E-N253D、I021V-S039E-N074D-D087E-N253D、S039E-N074D-D087E-M122L-N253D、I021V-S039E-N074D-D087E-M122L-N253D、I021V、M122L、M211S、P212N、Q012L、N177V、A222S、V228I、T274N、R099E、N097D-R099E、S097D、S099E、I043V、M122L-N145S-T156A、M211N-P212D、M211L-P212D、G160S、D127P-M211L-P212D、P212H、Q012L-M122L-A222S、D127P、N145S、T156A、M211N和P212D。
另一个的实施方案涉及一种自动盘碟洗涤的方法,具体地讲,涉及清洁焦糖布丁污渍的方法,该方法包括使需要清洁的表面或物品与包含蛋白酶的组合物接触,其中所述蛋白酶是与SEQ ID NO:1的氨基酸序列具有至少90%同一性的变体,并且所述变体在与SEQID NO:1位置对应的一个或多个位置处包含一个或多个取代,所述一个或多个取代选自:1C/D/E/N、21L、37A、73V、76D/H/N、84D/E、85M、95A、96M/Q、97E、99A/H/Q/T、104E、115E、116E/G、129D、131D/E、135H/K/L/M/Q/T/V/W/Y、138D、139E/L、141E/H/Y、142D/E、143E/H/K/M/S/V、156E和157D/E以及组合;其中所述变体的氨基酸位置通过与SEQ ID NO:1的氨基酸序列的对应关系进行编号。
即使当组合物用于软水中时,本发明的蛋白酶在不含磷酸盐的组合物中也表现非常好。
本发明的组合物中蛋白酶的优选含量包括每克组合物约0.04mg至约5mg、更优选地约0.05mg至约2mg活性蛋白酶。
自动盘碟洗涤清洁组合物
自动盘碟洗涤清洁组合物可为任何物理形式。它可以是散粉、凝胶或以单位剂型存在。优选地,它是单位剂型,单位剂型包括压片和水溶性包装。本发明的自动盘碟洗涤清洁组合物优选地以单位剂型存在,并且它可以是任何物理形式,包括固体、液体和凝胶形式。本发明的组合物非常适于以多隔室包装的形式存在,更具体地以包含具有不同物理形式的组合物的隔室的多隔室包装的形式存在,例如一个隔室包含固体形式的组合物并且另一个隔室包含液体形式的组合物。所述组合物优选地被水溶性薄膜如聚乙烯醇包封。特别优选的是被封装在聚乙烯醇膜中的单位剂型的组合物,所述聚乙烯醇膜具有小于100μm、优选地为20μm至90μm的厚度。本发明的洗涤剂组合物的重量为约8克至约25克,优选地为约10克至约20克。该重量范围与盘碟洗涤机的分配器十分契合。虽然该范围相当于少量洗涤剂,但洗涤剂也以提供上文提及的全部有益效果的方式配制。
所述组合物优选地不含磷酸盐。所谓“不含磷酸盐”在本文中被理解为所述组合物包含按所述组合物的重量计少于1%、优选地少于0.1%的磷酸盐。
本发明的组合物优选地不含磷酸盐,并且包含络合剂体系。
络合剂体系
出于本发明的目的,“络合剂”是能够结合多价离子诸如钙、镁、铅、铜、锌、镉、汞、锰、铁、铝和其他阳离子多价离子以形成水溶性络合物的化合物。所述络合剂对于Ca2+具有至少3的对数稳定常数([log K])。该稳定常数log K在25℃的温度下、在离子强度为0.1的溶液中测定。
本发明的组合物包含按所述组合物的重量计10%至50%的络合剂体系。优选地,该组合物包含络合剂,该络合剂选自由柠檬酸、甲基甘氨酸二乙酸(MGDA)、谷氨酸-N,N-二乙酸(GLDA)、亚氨基二琥珀酸(IDS)、羧甲基菊粉、L-天冬氨酸N,N-二乙酸四钠盐(ASDA)以及它们的混合物组成的组。出于本发明的目的,当提及络合剂时,术语“酸”包括酸及其盐。
在一个优选的实施方案中,所述组合物包含按本发明组合物的重量计15%至40%的MGDA,更优选MGDA的三钠盐。包含这种高含量MGDA的组合物在硬水的存在下以及在长时间和/或热循环中表现良好。
在一个优选的实施方案中,所述组合物包含按本发明组合物的重量计15%至28%的柠檬酸,更优选柠檬酸钠。包含柠檬酸的组合物在软水的存在下表现良好。
在一个优选的实施方案中,络合剂体系包含重量比优选地为约0.5:1至约2:1、更优选地为约0.5:1至约2.5:1的柠檬酸和MGDA。
分散剂聚合物
分散剂聚合物可以按所述组合物的重量计约0.1%至约20%、优选地0.2%至约15%、更优选地0.3至%的任意合适的量使用。
分散剂聚合物能够在自动盘碟洗涤过程中混悬钙或碳酸钙。
在25℃下,分散剂聚合物具有介于30至250mg Ca/g分散剂聚合物、优选地介于35至200mg Ca/g分散剂聚合物、更优选地40至150mg Ca/g分散剂聚合物范围内的钙结合能力。为了确定聚合物是否为本发明意义上的分散剂聚合物,根据以下说明进行以下钙结合能力测定:
钙结合能力测试方法
本文提及的钙结合能力经由滴定、使用pH/离子计如Meettler ToledoSevenMultiTM台式计和PerfectIONTM复合钙离子电极来测定。为了测量结合能力,将适用于烧杯或洗涤仪罐的加热搅拌装置设定为25℃,并且根据制造商说明书校准具有仪表的离子电极。电极校准的标准浓度应包括测试浓度,并且应在25℃下测量。通过将3.67g CaCl2-2H2O添加到1L去离子水中来制备1000mg/g Ca的原液,然后进行稀释以制备三种各100mL的工作溶液,分别包含100mg/g、10mg/g和1mg/g浓度的钙。将100mg Ca/g工作溶液用作在25℃下进行的滴定期间的初始浓度。通过向每种工作溶液中添加2.5g/L NaCl来调节每种工作溶液的离子强度。将100mL的100mg Ca/g工作溶液加热并搅拌,直至其达到25℃。在溶液达到25℃时,使用离子电极进行钙离子浓度的初始读数。然后将测试聚合物逐渐地添加到钙工作溶液中(以0.01g/L的间隔),并且在每次增量添加后搅拌5分钟后再测量。当溶液达到1mg/g钙时,停止滴定。使用剩余的两种钙浓度工作溶液重复滴定过程。测试聚合物的结合能力被计算为相对于所添加的测试聚合物的克/L所测量的钙浓度的线性斜率。
当溶解于pH大于6的水性溶液中时,分散剂聚合物优选地具有净负电荷。
分散剂聚合物还可具有磺化羧酸酯或酰胺,以在较低pH下增加负电荷,并且改善它们在硬水中的分散特性。优选的分散剂聚合物为磺化/羧化聚合物,即包含磺化单体和羧化单体的聚合物。
优选地,所述分散剂聚合物为多元羧酸的磺化衍生物,并且可包含两种、三种、四种或更多种不同的单体单元。优选的共聚物包含:
至少一个衍生自具有通式(III)的羧酸单体的结构单元:
其中R1至R3独立地选自氢、甲基、具有2至12个碳原子的直链或支链的饱和烷基基团、具有2至12个碳原子的直链或支链的单不饱和或多不饱和的烯基基团、如前述被-NH2或-OH、或-COOH、或COOR4取代的烷基或烯基基团,其中R4选自氢、碱金属或具有2至12个碳的直链或支链的、饱和或不饱和的烷基或烯基基团;
优选的羧酸单体包括下列中的一种或多种:丙烯酸、马来酸、马来酸酐、衣康酸、柠康酸、2-苯基丙烯酸、肉桂酸、巴豆酸、富马酸、甲基丙烯酸、2-乙基丙烯酸、亚甲基丙二酸或山梨酸。丙烯酸和甲基丙烯酸是更优选的。
任选地,一个或多个衍生自至少一种具有通式(IV)的非离子单体的结构单元:
其中R5至R7独立地选自氢、甲基、苯基或含有1至6个碳原子的羟烷基基团,并且可以是环状结构的一部分,X为选自-CH2-、-COO-、-CONH-或-CONR8-的任选地存在的间隔基团,并且R8选自具有1至22个碳原子的直链或支链的饱和烷基基团或具有6至22个碳原子的不饱和、优选芳族的基团。
优选的非离子单体包括下列中的一种或多种:丁烯、异丁烯、戊烯、2-甲基戊-1-烯、3-甲基戊-1-烯、2,4,4-三甲基戊-1-烯、2,4,4-三甲基戊-2-烯、环戊烯、甲基环戊烯、2-甲基-3-甲基-环戊烯、己烯、2,3-二甲基己-1-烯、2,4-二甲基己-1-烯、2,5-二甲基己-1-烯、3,5-二甲基己-1-烯、4,4-二甲基己-1-烯、环己烯、甲基环己烯、环庚烯、具有10个或更多个碳原子的α-烯烃诸如癸-1-烯、十二碳-1-烯、十六碳-1-烯、十八碳-1-烯和二十二碳-1-烯,优选的芳族单体为苯乙烯、α-甲基苯乙烯、3-甲基苯乙烯、4-十二烷基苯乙烯、2-乙基-4-苄基苯乙烯、4-环己基苯乙烯、4-丙基苯乙烯、1-乙烯基萘、2-乙烯基萘;优选的羧酸酯单体为(甲基)丙烯酸甲酯、(甲基)丙烯酸乙酯、(甲基)丙烯酸丙酯、(甲基)丙烯酸叔丁酯、(甲基)丙烯酸戊酯、(甲基)丙烯酸己酯、(甲基)丙烯酸2-乙基己酯、(甲基)丙烯酸辛酯、(甲基)丙烯酸月桂酯、(甲基)丙烯酸硬脂酯和(甲基)丙烯酸二十二烷基酯;优选的酰胺为N-甲基丙烯酰胺、N-乙基丙烯酰胺、N-叔丁基丙烯酰胺、N-2-乙基己基丙烯酰胺、N-辛基丙烯酰胺、N-月桂基丙烯酰胺、N-硬脂基丙烯酰胺、N-二十二烷基丙烯酰胺。
以及至少一个衍生自至少一种具有通式(V)和(VI)的磺酸单体的结构单元:
其中R7为包含至少一个sp2键的基团,A为O、N、P、S、酰胺基或酯键,B为单环或多环芳族基团或脂族基团,每个t独立地为0或1,并且M+为阳离子。在一个方面,R7为C2至C6烯烃。在另一方面,R7为乙烯、丁烯或丙烯。
优选的磺化单体包括下列中的一种或多种:1-丙烯酰胺-1-丙磺酸、2-丙烯酰胺-2-丙磺酸、2-丙烯酰胺-2-甲基-1-丙磺酸、2-甲基丙烯酰胺-2-甲基-1-丙磺酸、3-甲基丙烯酰胺-2-羟基-丙磺酸、烯丙基磺酸、甲基烯丙基磺酸、烯丙氧基苯磺酸、甲基烯丙氧基苯磺酸、2-羟基-3-(2-丙烯氧基)丙磺酸、2-甲基-2-丙烯-1-磺酸、苯乙烯磺酸、乙烯基磺酸、3-磺基丙基、甲基丙烯酸3-磺基丙酯、磺基甲基丙烯酰胺、磺基甲基甲基丙烯酰胺以及所述酸的混合物或它们的水溶性盐。
优选地,所述聚合物包含以下含量的单体:按所述聚合物的重量计约40%至约90%、优选地约60%至约90%的一种或多种羧酸单体;按所述聚合物的重量计约5%至约50%、优选地约10%至约40%的一种或多种磺酸单体;以及任选地按所述聚合物的重量计约1%至约30%、优选地约2%至约20%的一种或多种非离子单体。特别优选的聚合物包含按所述聚合物的重量计约70%至约80%的至少一种羧酸单体,以及按所述聚合物的重量计约20%至约30%的至少一种磺酸单体。
在所述聚合物中,羧酸基团或磺酸基团中的全部或一些可以中和形式存在,即,一些或全部酸基团中的羧酸基团和/或磺酸基团的酸性氢原子可用金属离子、优选地碱金属离子并且具体地用钠离子替代。
羧酸优选地为(甲基)丙烯酸。磺酸单体优选地为2-丙烯酰胺-2-丙磺酸(AMPS)。
优选的可商购获得的聚合物包括:由Alco Chemical提供的Alcosperse 240、Aquatreat AR 540和Aquatreat MPS;由Rohm&Haas提供的Acumer 3100、Acumer 2000、Acusol 587G和Acusol 588G;由BF Goodrich提供的Goodrich K-798、K-775和K-797;以及由ISP technologies Inc提供的ACP 1042。特别优选的聚合物是由Rohm&Haas提供的Acusol 587G和Acusol 588G。
合适的分散剂聚合物包括低分子量的阴离子羧酸聚合物。它们可以是重均分子量小于或等于约200000g/mol、或小于或等于约75000g/mol、或小于或等于约50000g/mol、或约3000g/mol至约50000g/mol、优选地约5000g/mol至约45000g/mol的均聚物或共聚物。分散剂聚合物可以是聚丙烯酸酯的低分子量均聚物,其平均分子量为1000至20000,具体地2000至10000,并且具体地优选3000至5000。
分散剂聚合物可以是分子量小于70000的丙烯酸与甲基丙烯酸的共聚物、丙烯酸和/或甲基丙烯酸与马来酸的共聚物以及丙烯酸和/或甲基丙烯酸与富马酸的共聚物。其分子量在2000g/mol至80000g/mol并且更优选地20000g/mol至50000g/mol并且具体地30000g/mol至40000g/mol的范围内,并且(甲基)丙烯酸酯与马来酸酯或延胡索酸酯链段的比率为30:1至1:2。
分散剂聚合物可以是分子量为3000至100000或者4000至20000的丙烯酰胺和丙烯酸酯的共聚物,并且也可使用按分散剂聚合物的重量计小于50%或者小于20%的丙烯酰胺含量。另选地,此类分散剂聚合物可具有按所述聚合物的重量计4000至20000的分子量和0%至15%的丙烯酰胺含量。
适用于本文的分散剂聚合物还包括衣康酸均聚物和共聚物。
另选地,分散剂聚合物可选自由烷氧基化聚亚烷基亚胺、烷氧基化聚羧酸酯、聚乙二醇、苯乙烯共聚物、硫酸纤维素酯、羧化多糖、两亲性接枝共聚物以及它们的混合物组成的组。
漂白体系
本发明的组合物包含漂白体系,该漂白体系包含高含量的漂白剂,优选过碳酸盐与漂白活化剂或漂白催化剂或两者的组合。优选地,所述漂白活化剂为TAED,并且所述漂白催化剂为锰漂白催化剂。
漂白剂
本发明的组合物优选地包含按所述组合物的重量计约10%至约20%、更优选地约12%至约18%的漂白剂,优选过碳酸盐。
无机漂白剂和有机漂白剂适用于本文。无机漂白剂包括过氧化氢合物盐,诸如过硼酸盐、过碳酸盐、过磷酸盐、过硫酸盐和过硅酸盐。无机过氧化氢合物盐通常为碱金属盐。无机过氧化氢合物盐可作为结晶固体包含在内,而无需另外的保护。另选地,盐可为经涂覆的。合适的涂料包含硫酸钠、碳酸钠、硅酸钠以及它们的混合物。所述涂料可作为混合物施加到表面或依次施加成层。
碱金属过碳酸盐、具体地过碳酸钠是优选用于本文的漂白剂。过碳酸盐最优选地以涂覆形式掺入到产品中,这提供了产品内的稳定性。
过氧单过硫酸钾是可用于本文的另一种无机过氧化氢合物盐。
典型的有机漂白剂是有机过氧酸,尤其是十二烷二过氧酸、十四烷二过氧酸和十六烷二过氧酸。单过壬二酸和二过壬二酸、单过十三烷二酸和二过十三烷二酸也适用于本文。二酰基和四酰基过氧化物例如过氧化二苯甲酰和过氧化二月桂酰是可用于本发明上下文的其他有机过氧化物。
其他典型的有机漂白剂包括过氧酸,具体示例是烷基过氧酸和芳基过氧酸。优选的代表是(a)过氧苯甲酸及其环取代的衍生物,诸如烷基过氧苯甲酸,以及过氧-α-萘甲酸和单过邻苯二甲酸镁,(b)脂族或取代的脂族过氧酸,诸如过氧月桂酸、过氧硬脂酸、ε-邻苯二甲酰亚胺过氧己酸[邻苯二甲酰亚氨基过氧己酸(PAP)]、邻羧基苯甲酰胺基过氧己酸、N-壬烯酰胺基过己二酸和N-壬烯酰胺基过琥珀酸盐,以及(c)脂族和芳脂族过氧二羧酸,诸如1,12-二过氧羧酸、1,9-二过氧壬二酸、二过氧癸二酸、二过氧十三烷二酸、二过氧邻苯二甲酸、2-癸基二过氧丁烷-1,4-二酸、N,N-对苯二甲酰二(6-氨基过己酸)。
漂白活化剂
漂白活化剂通常是能在60℃和更低的温度下在清洁过程中增强漂白作用的有机过酸前体。适用于本文的漂白活化剂包括在过水解条件下提供优选具有1至12个碳原子、具体地2至10个碳原子的脂族过氧羧酸和/或任选取代的过苯甲酸的化合物。合适的物质具有指定碳原子数的O-酰基和/或N-酰基基团和/或任选取代的苯甲酰基基团。优选的是聚酰化亚烷基二胺、具体地四乙酰基乙二胺(TAED),酰化三嗪衍生物、具体地1,5-二乙酰基-2,4-二氧代六氢-1,3,5-三嗪(DADHT),酰化甘脲、具体地四乙酰基甘脲(TAGU),N-酰基酰亚胺、具体地N-壬酰基琥珀酰亚胺(NOSI),酰化酚磺酸盐、具体地正壬酰基或异壬酰基氧基苯磺酸盐(正-或异-NOBS)、癸酰氧基苯甲酸(DOBA),羧酸酐具体地邻苯二甲酸酐,酰化多元醇、具体地甘油三乙酸酯、乙二醇二乙酸酯和2,5-二乙酰氧基-2,5-二氢呋喃,以及乙酰柠檬酸三乙酯(TEAC)。如果存在的话,本发明的组合物包含按所述组合物的重量计0.01%至5%、优选地0.2%至2%的漂白活化剂,优选TAED。
漂白催化剂
本文的组合物优选地包含漂白催化剂,优选含金属的漂白催化剂。更优选地,所述含金属的漂白催化剂是含过渡金属的漂白催化剂,尤其是含锰或钴的漂白催化剂。
优选用于本文的漂白催化剂包括锰三氮杂环壬烷及相关络合物;Co、Cu、Mn和Fe联吡啶胺及相关络合物;以及五胺乙酸钴(III)及相关络合物。可用于本文的特别优选的漂白催化剂是1,4,7-三甲基-1,4,7-三氮杂环壬烷(Me-TACN)和1,2,4,7-四甲基-1,4,7-三氮杂环壬烷(Me/Me-TACN)。
优选地,本发明的组合物包含按所述组合物的重量计0.001%至0.5%、更优选地0.002%至0.05%、更优选地0.005%至0.075%的漂白催化剂。优选地,所述漂白催化剂为锰漂白催化剂。
无机助洗剂
本发明的组合物优选地包含无机助洗剂。合适的无机助洗剂选自由碳酸盐、硅酸盐以及它们的混合物组成的组。特别优选用于本文的是碳酸钠。优选地,本发明的组合物包含按所述组合物的重量计5%至60%、更优选地10%至50%并且特别是15%至45%的碳酸钠。
表面活性剂
适用于本文的表面活性剂包括非离子表面活性剂,优选地,所述组合物不含任何其他表面活性剂。传统上,非离子表面活性剂已在自动盘碟洗涤中被用于表面改性目的,具体地用于片材,以避免成膜和斑染并改善光泽度。据发现,非离子表面活性剂还可有助于防止污垢再沉积。
优选地,本发明的组合物包含非离子表面活性剂或非离子表面活性剂体系,更优选地,所述非离子表面活性剂或非离子表面活性剂体系具有介于40℃和70℃之间、优选地介于45℃和65℃之间的相转化温度,如在蒸馏水中以1%的浓度测得。所谓“非离子表面活性剂体系”在本文中是指两种或更多种非离子表面活性剂的混合物。优选用于本文的是非离子表面活性剂体系。与单一非离子表面活性剂相比,非离子表面活性剂体系似乎具有改善的清洁和修整特性以及在产品中更好的稳定性。
相转化温度是这样的温度,在低于该温度时,表面活性剂或其混合物作为油溶胀的胶束优先分配到水相中,并且在高于该温度时,则作为水溶胀的反相胶束优先分配到油相中。相转化温度可通过识别在哪个温度下发生浑浊而目视确定。
非离子表面活性剂或体系的相转化温度可如下测定:制备在蒸馏水中包含按所述溶液的重量计1%的对应表面活性剂或混合物的溶液。在相转化温度分析之前轻轻搅拌溶液,以确保该过程在化学平衡下发生。通过在75mm密封玻璃试管中浸入溶液,在热稳定浴中获取相转化温度。为了确保不存在渗漏,在相转化温度测量之前和之后称量试管的重量。温度以小于1℃/分钟的速率逐渐升高,直到温度达到低于预估的相转化温度几度。相转化温度在第一浊度标志下目视确定。
合适的非离子表面活性剂包括:i)乙氧基化非离子表面活性剂,其通过具有6至20个碳原子的一羟基链烷醇或烷基酚与优选每摩尔醇或烷基酚至少12摩尔、尤其优选至少16摩尔并且还更优选至少20摩尔的环氧乙烷的反应制备;ii)具有6至20个碳原子和至少一个乙氧基和丙氧基基团的醇烷氧基化表面活性剂。优选可用于本文的是表面活性剂i)和ii)的混合物。
另一种合适的非离子表面活性剂是由下式表示的环氧封端的聚(烷氧基化)醇:
R1O[CH2CH(CH3)O]x[CH2CH2O]y[CH2CH(OH)R2] (I)
其中R1为具有4至18个碳原子的直链或支链的脂族烃基;R2为具有2至26个碳原子的直链或支链的脂族烃基;x为平均值为0.5至1.5、更优选地约1的整数;并且y为值为至少15、更优选地至少20的整数。
优选地,式I的表面活性剂在末端环氧化物单元[CH2CH(OH)R2]中具有至少约10个碳原子。根据本发明,式I的合适表面活性剂是Olin Corporation的SLF-18B非离子表面活性剂,如1994年10月13日由Olin Corporation公布的WO 94/22800中所述。
酶
其他蛋白酶
除本发明的蛋白酶之外,本发明的组合物还可包含蛋白酶。两种或更多种蛋白酶的混合物可有助于在较宽的温度、循环持续时间和/或底物范围内增强清洁,并且提供优异的光泽有益效果,尤其是当与抗再沉积剂和/或磺化聚合物结合使用时。
与本发明的变体蛋白酶组合使用的合适蛋白酶包括金属蛋白酶和丝氨酸蛋白酶,所述丝氨酸蛋白酶包括中性或碱性微生物丝氨酸蛋白酶,诸如枯草杆菌蛋白酶(EC3.4.21.62)。合适的蛋白酶包括动物源、植物源或微生物源的那些。在一个方面,此类合适的蛋白酶可为微生物源。合适的蛋白酶包括前述合适蛋白酶的经化学修饰或基因修饰的突变体。在一个方面,合适的蛋白酶可为丝氨酸蛋白酶,诸如碱性微生物蛋白酶或/和胰蛋白酶型蛋白酶。合适的中性或碱性蛋白酶的示例包括:
(a)枯草杆菌蛋白酶(EC 3.4.21.62),特别是WO2004067737、WO2015091989、WO2015091990、WO2015024739、WO2015143360、US 6,312,936B1、US 5,679,630、US 4,760,025、DE102006022216A1、DE102006022224A1、WO2015089447、WO2015089441、WO2016066756、WO2016066757、WO2016069557、WO2016069563、WO2016069569中描述的来源于芽孢杆菌(诸如芽孢杆菌属、迟缓芽孢杆菌(B.lentus)、嗜碱芽孢杆菌(B.alkalophilus)、枯草芽孢杆菌(B.subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、短小芽孢杆菌(B.pumilus)、吉氏芽孢杆菌(B.gibsonii)和秋叶氏芽孢杆菌(B.akibaii))的那些。
(b)胰蛋白酶型或胰凝乳蛋白酶型蛋白酶,诸如胰蛋白酶(例如源自猪或牛的胰蛋白酶),包括WO 89/06270中所述的镰孢菌蛋白酶和WO 05/052161和WO 05/052146中所述的来源于纤维单胞菌属(Cellumonas)的胰凝乳蛋白酶。
(c)金属蛋白酶,特别是WO 07/044993A2中所述的来源于解淀粉芽孢杆菌的那些;WO2014194032、WO2014194054和WO2014194117中所述的来源于芽孢杆菌属、短芽胞杆菌属(Brevibacillus)、热放线菌属(Thermoactinomyces)、杆菌属(Geobacillus)、类芽孢杆菌属(Paenibacillus)、赖氨酸芽胞杆菌属(Lysinibacillus)或链霉菌属菌种的那些;WO2015193488中所述的来源于Kribella alluminosa的那些;以及WO2016075078中所述的来源于链霉菌属和溶杆菌属(Lysobacter)的那些。
(d)与在WO92/17577(Novozymes A/S)中所述的来自芽孢杆菌属TY145,NCIMB40339的枯草杆菌酶具有至少90%的同一性的蛋白酶,包括WO2015024739和WO2016066757中所述的该芽孢杆菌TY145枯草杆菌酶的变体。
用于本发明的洗涤剂的特别优选的蛋白酶是与来自迟缓芽孢杆菌的野生型酶具有至少90%、优选至少95%、更优选至少98%、甚至更优选至少99%、特别是100%的同一性的多肽,使用如WO00/37627(其以引用方式并入本文)中所示的BPN′编号系统和氨基酸缩写,所述多肽在下列一个或多个、优选两个或更多个、更优选三个或更多个位置包含突变:V68A、N76D、N87S、S99D、S99SD、S99A、S101G、S101M、S103A、V104N/I、G118V、G118R、S128L、P129Q、S130A、Y167A、R170S、A194P、V205I、Q206L/D/E、Y209W和/或M222S。
最优选地,蛋白酶选自相对于PB92野生型(WO 08/010925中的SEQ ID NO:2)或枯草杆菌蛋白酶309野生型(按照PB92主链的序列,不同的是包含自然变异N87S)包含下列突变(BPN′编号系统)的组。
(i)G118V+S128L+P129Q+S130A
(ii)S101M+G118V+S128L+P129Q+S130A
(iii)N76D+N87R+G118R+S128L+P129Q+S130A+S188D+N248R
(iv)N76D+N87R+G118R+S128L+P129Q+S130A+S188D+V244R
(v)N76D+N87R+G118R+S128L+P129Q+S130A
(vi)V68A+N87S+S101G+V104N
(vii)S99AD
合适的可商购获得的另外的蛋白酶包括以商品名 LiquanaseSavinase Blaze和由Novozymes A/S(Denmark)出售的那些;以商品名 PurafectPurafect 和Purafect由Dupont出售的那些;以商品名和由SolvayEnzymes出售的那些;以及可从Henkel/Kemira获得的那些,即BLAP(序列示于US US 5,352,604的图29中,具有下列突变S99D+S101 R+S103A+V104I+G159S,下文称为BLAP)、BLAP R(具有S3T+V4I+V199M+V205I+L217D的BLAP)、BLAP X(具有S3T+V4I+V205I的BLAP)和BLAP F49(具有S3T+V4I+A194P+V199M+V205I+L217D的BLAP);以及来自Kao的KAP(具有突变A230V+S256G+S259N的嗜碱芽孢杆菌枯草杆菌蛋白酶)。
本发明产品中蛋白酶的优选含量包括约0.05mg至约10mg、更优选地约0.5mg至约7mg并且特别是约1mg至约6mg活性蛋白酶/g组合物。
淀粉酶
优选地,本发明的组合物可包含淀粉酶。合适的α-淀粉酶包括源自细菌或真菌的那些。包括经化学修饰或基因修饰的突变体(变体)。优选的碱性α-淀粉酶来源于芽孢杆菌(Bacillus)的菌株,诸如地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、嗜热脂肪芽胞杆菌(Bacillus stearothermophilus)、枯草芽孢杆菌(Bacillus subtilis)或其他芽孢杆菌属(Bacillus sp.),诸如芽孢杆菌属NCBI 12289、NCBI 12512、NCBI 12513、DSM 9375(USP 7,153,818)DSM 12368、DSMZ号12649、KSM AP1378(WO 97/00324)、KSM K36或KSM K38(EP 1,022,334)。优选的淀粉酶包括:
(a)在WO 96/23873、WO00/60060、WO06/002643和WO2017/192657中描述的变体,特别是相对于SEQ ID NO.11在下列位置具有一个或多个取代的变体:
26、30、33、82、37、106、118、128、133、149、150、160、178、182、186、193、202、214、231、246、256、257、258、269、270、272、283、295、296、298、299、303、304、305、311、314、315、318、319、339、345、361、378、383、419、421、437、441、444、445、446、447、450、461、471、482、484,这些变体优选地还包含D183*和G184*缺失。
(b)表现出与WO06/002643中的SEQ ID No.4表现出至少90%同一性的变体,来自芽孢杆菌属SP722的野生型酶,特别是在第183和184位具有缺失的变体,以及WO 00/60060、WO2011/100410和WO2013/003659中描述的变体,所述文献以引用方式并入本文。
(c)表现出与来自芽孢杆菌属707的野生型酶(US 6,093,562中的SEQ ID NO:7)具有至少95%同一性的变体,特别是包含以下突变中的一个或多个突变的那些:M202、M208、S255、R172和/或M261。优选地,所述淀粉酶包含M202L、M202V、M202S、M202T、M202I、M202Q、M202W、S255N和/或R172Q中的一个或多个。尤其优选的是包含M202L或M202T突变的那些。
(d)在WO 09/149130中描述的变体,优选表现出与WO 09/149130中的SEQ ID NO:1或SEQ ID NO:2(来自嗜热脂肪芽孢杆菌(Geobacillus Stearophermophilus)的野生型酶或其截短型式)至少90%的同一性的那些。
(e)表现出与WO2016091688中的SEQ ID NO:1具有至少89%同一性的变体,特别是在位置H183+G184处包含缺失并且还在第405位、第421位、第422位和/或第428位处包含一个或多个突变的那些。
(f)表现出与来自解凝乳类芽孢杆菌YK9的“PcuAmyl α-淀粉酶”(WO2014099523中的SEQ ID NO:3)具有至少60%的氨基酸序列同一性的变体。
(g)表现出与来自噬细胞菌属(Cytophaga sp.)的“CspAmy2淀粉酶”(WO2014164777中的SEQ ID NO:1)具有至少60%的氨基酸序列同一性的变体。
(h)表现出与来自枯草芽孢杆菌的AmyE(WO2009149271中的SEQ ID NO:1)具有至少85%同一性的变体。
(i)表现出与来自芽孢杆菌属KSM-K38的野生型淀粉酶(登录号AB051102)具有至少90%同一性的变体。
(j)表现出与来自芽孢杆菌属的AAI10(WO2016180748中的SEQ ID NO:7)的成熟氨基酸序列具有至少80%同一性的变体。
(k)表现出与脂环酸芽孢杆菌属(Alicyclobacillus sp.)淀粉酶(WO2016180748中的SEQ ID NO:8)的成熟氨基酸序列具有至少80%同一性的变体。
优选地,淀粉酶为工程化酶,其中易于漂白氧化的氨基酸中的一个或多个已被不太易于氧化的氨基酸取代。具体地,优选的是甲硫氨酸残基被任何其他氨基酸取代。具体地,优选的是最易于氧化的甲硫氨酸被取代。优选地,SEQ ID NO:11中等同于202的位置处的甲硫氨酸被取代。优选地,该位置处的甲硫氨酸被苏氨酸或亮氨酸、优选亮氨酸取代。
合适的可商购获得的α-淀粉酶包括 TERMAMYL STAINZYME 和(Novozymes A/S,Bagsvaerd,Denmark)、AT 9000 Biozym BiotechTrading GmbH Wehlistrasse 27b A-1200 Wien Austria、OPTISIZE PREFERENZ 系列(包括PREFERENZ 和PREFERENZ )、PURASTAR (DuPont.,Palo Alto,California)和(Kao,14-10 NihonbashiKayabacho,1-chome,Chuo-ku Tokyo 103-8210,Japan)。在一个方面,合适的淀粉酶包括 和STAINZYME以及它们的混合物。
优选地,本发明的产品包含至少0.01mg、优选地约0.05mg至约10mg、更优选地约0.1mg至约6mg、特别是约0.2mg至约5mg活性淀粉酶/g组合物。
优选地,本发明组合物的蛋白酶和/或淀粉酶为颗粒形式,所述颗粒包含按所述颗粒的重量计大于29%的硫酸钠,并且/或者硫酸钠和活性酶(蛋白酶和/或淀粉酶)的重量比介于3:1和100:1之间,或优选地介于4:1和30:1之间,或更优选地介于5:1和20:1之间。
晶体生长抑制剂
晶体生长抑制剂是可与碳酸钙晶体结合并防止物质(诸如霰石和方解石)进一步生长的材料。
有效的晶体生长抑制剂的示例包括膦酸盐、聚膦酸盐、菊粉衍生物、聚衣康酸均聚物和环状聚羧酸盐。
合适的晶体生长抑制剂可选自HEDP(1-羟基亚乙基1,1-二膦酸)、羧甲基菊粉(CMI)、三羧酸和环状羧酸盐。出于本发明的目的,术语羧酸盐涵盖阴离子形式和质子化羧酸形式两者。
环状羧酸盐包含至少两个,优选三个或优选至少四个羧酸根基团,并且环状结构基于单环或双环烷烃或杂环。合适的环状结构包括环丙烷、环丁烷、环己烷或环戊烷或环庚烷、双环庚烷或双环辛烷和/或四氢呋喃。一种优选的晶体生长抑制剂是环戊烷四羧酸盐。
在环的3D结构的同一侧或“顺式”位置上具有至少75%,优选100%羧酸根基团的环状羧酸盐优选地用于本文中。
优选的是,位于环的同一侧的两个羧酸根基团在直接相邻或“邻位”的位置。
优选的晶体生长抑制剂包括HEDP、三羧酸、四氢呋喃四羧酸(THFTCA)和环戊烷四羧酸(CPTCA)。THFTCA优选地为2c,3t,4t,5c-构型,并且CPTCA为顺式,顺式,顺式,顺式-构型。可用于本文的尤其优选的晶体生长抑制剂是HEDP。
晶体生长抑制剂的量按组合物的重量计优选为约0.01%至约10%,具体地为约0.02%至约5%,并且具体地为0.05%至3%。
金属护理剂
金属护理剂可防止或减少金属(包括铝、不锈钢和有色金属,诸如银和铜)的失泽、腐蚀或氧化。优选地,本发明的组合物包含按产品的重量计0.1%至5%、更优选0.2%至4%并且尤其是0.3%至3%的金属护理剂,优选地,该金属护理剂为苯并三唑(BTA)。
玻璃护理剂
玻璃护理剂可在盘碟洗涤过程中保护玻璃物品的外观。优选地,本发明的组合物包含按组合物的重量计0.1%至5%、更优选0.2%至4%并且尤其是0.3%至3%的金属护理剂,优选地,该玻璃护理剂为含锌材料,尤其是水锌矿。其他合适的玻璃护理剂为聚乙烯亚胺(PEI)。尤其优选的PEI为由BASF提供的FG。
本发明的自动盘碟洗涤组合物优选具有在20℃下以1%重量/体积水溶液在蒸馏水中测得的约9至约12、更优选约10至小于约11.5并且尤其是约10.5至约11.5的pH。
本发明的自动盘碟洗涤组合物在pH为9.5下优选具有约10至约20、更优选约12至约18的储备碱度,如在20℃下以100克产品在NaOH中测得的。
本发明的优选的自动盘碟洗涤组合物包含:
i)按组合物的重量计10%至20%的过碳酸钠;
ii)按组合物的重量计10%至50%的有机络合剂体系,优选地所述络合剂体系包含MGDA;
iii)TAED;
iv)淀粉酶;
v)任选但优选按组合物的重量计5%至50%的无机助洗剂,优选碳酸钠;
vi)任选但优选按组合物的重量计2%至10%的非离子表面活性剂;
vii)其他任选成分,包括:晶体生长抑制剂(优选HEDP)和玻璃护理剂。
本发明的优选的自动盘碟洗涤组合物包含:
i)按组合物的重量计10%至20%的漂白剂,优选过碳酸钠;
ii)按组合物的重量计10%至50%的有机络合剂体系。
iii)锰漂白催化剂和任选的TAED;
iv)淀粉酶;
v)任选但优选按组合物的重量计5%至50%的无机助洗剂,优选碳酸钠;
vi)任选但优选按组合物的重量计2%至10%的非离子表面活性剂;
vii)任选但优选的玻璃护理剂。
实施例1
制备表1中所示的组合物。将3g的每种组合物溶解于一升去离子水中以产生具有11的pH的清洁溶液。将本发明的蛋白酶以0.25ppm至0.75ppm之间的水平添加到清洁溶液中。
表1:自动盘碟洗涤组合物
表1:自动盘碟洗涤(ADW)组合物
所述组合物提供良好的焦糖布丁去除效果。
实施例2
在洗涤剂中的清洁性能
蛋黄污渍
相对于参考蛋白酶(具有氨基酸序列SEQ ID NO:1),使用蛋黄(PAS-38,Centerfor TesTMaterials BV,Vlaardingen,Netherlands)微样本和GSM-B洗涤剂(参见下表1)在pH 10.5下在微量滴定板(MTP)中测试本文所述的蛋白酶变体的自动盘碟洗涤(ADW)清洁性能。在该测定中,使用预穿孔的PAS-38(以贴合在MTP中)冲洗和未冲洗的样本。通过将180μL10mM CAPS缓冲液(pH 11)添加至含有PAS-38微样本的MTP并在60℃和1100rpm下振荡30分钟来制备冲洗的样本。温育后,移除缓冲液,用去离子水冲洗样本以移除任何残余的缓冲液,并在用于测定之前将MTP风干。在添加酶之前,用调节至374ppm水硬度的3g/l的GSM-B洗涤剂填充所有微样本板。
另选地,通过使用如本文所述由CFT(Vlaardingen,the Netherlands)制备的DM21的三聚氰胺瓷砖,测试变体对蛋黄污渍的清洁性能。使用2.5g材料/瓷砖,由CFT制备三聚氰胺瓷砖上的蛋黄。
将三聚氰胺瓷砖用作封盖,并紧紧压在微量滴定板(MTP)上。使用300μL 10mMCAPS pH 11(含有0.005%Tween-80),在40℃下将DM21瓷砖预冲洗,同时以250rpm振荡40分钟。将瓷砖用自来水冲洗并干燥过夜。对于清洁,将3g/L的GSMB(参见表1)调节至374ppm的水硬度,并将每个酶样品添加至MTP,然后将三聚氰胺瓷砖封盖附接到MTP。MTP的体积容量以及因此添加到其中的溶液的体积可以变化,其中应将最小体积的溶液添加到MTP中,该最小体积的溶液使得溶液和污渍表面之间能够接触。在该实施例中,将300μL体积的含洗涤剂的酶添加到铝96孔MTP的每个孔中。将MTP在Infors热振荡器中在40℃下以250rpm温育45分钟。温育后,将瓷砖从MTP取走并风干。
通过拍摄板的照片并使用定制软件测量每个污渍区域的RGB值来定量污渍去除。通过将RGB值用于下式来计算经洗涤的瓷砖的污垢去除百分比(%SRI)值:
%SRI=(ΔE/ΔE初始)*100
其中ΔE=SQR((R后-R前)2+(G后-G前)2+(B后-前)2)
其中ΔE初始=SQR((R白-R前)2+(G白-G前)2+(B白-前)2)
通过从每个样品值减去空白对照(无酶)的值获得清洁性能(下文称为“减去了空白的清洁”)。对于每种条件和变体,通过将减去了空白的清洁除以相同浓度下的参考蛋白酶(具有氨基酸序列SEQ ID NO:1)的减去了空白的清洁来计算性能指数(PI)。参考蛋白酶PI的值由参考蛋白酶的标准曲线确定,该标准曲线包括在测试中并且拟合到朗缪尔拟合(Langmuir fit)。
焦糖布丁污渍
焦糖布丁污渍:通过使用如本文所述由CFT,Vlaardingen,Netherlands制造并标记为DM10c的定制三聚氰胺盘碟洗涤机监测器(瓷砖),测试变体对焦糖布丁污渍的清洁性能。该研究中使用的DM10c瓷砖使用2.7g与用于制备可商购获得的DM10监测器(焦糖布丁Debic.com产品)的材料相同的材料制备,但是在140℃而不是150℃下烘焙2小时。
AAPF活性测定
通过测量N-suc-AAPF-pNA的水解来测试参考蛋白酶及其变体的蛋白酶活性。用于AAPF水解测定的试剂溶液是:100mM Tris/HCl pH 8.6,其含有0.005%(Tris稀释缓冲液);100mM Tris缓冲液pH 8.6,其包含10mM CaCl2和0.005%(Tris/Ca缓冲液);以及溶于DMSO中的160mM suc-AAPF-pNA(suc-AAPF-pNA储备溶液)(Sigma:S-7388)。通过将1mL suc-AAPF-pNA储备溶液添加至100mL Tris/Ca缓冲液并充分混合来制备底物工作溶液。将酶样品添加至含有1mg/suc-AAPF-pNA工作溶液的MTP(Greiner 781101),用SpectraMax读板机在室温(RT)下以动力学模式在405nm处测定3分钟内的活性。从每个样品读数减去不含蛋白酶的空白的吸光度。蛋白酶活性以mOD·min-1表示。
稳定性测定
通过在应力缓冲液中稀释变体并且在热温育步骤之前和之后使用上述AAPF测定测量变体的蛋白水解活性来测量本文所述变体的稳定性。选择热温育步骤的温度和持续时间,使得参考蛋白酶显示出约50%的残余活性。在Tris-EDTA(50mM Tris pH9;5mM EDTA;0.005%吐温80)缓冲条件下测量稳定性。通过将变体的残余活性除以参考蛋白酶的残余活性来获得稳定性PI。
实施例3
变体的性能
在实施例2中所述的以下测定中评估根据实施例2制备的参考蛋白酶及其变体的清洁有益效果:GSM-B洗涤剂中的PAS-38或DM21清洁、GSM-B(表1)或MGDA(表2)洗涤剂中的焦糖布丁(DM10c)清洁以及在Tris/EDTA中的稳定性。这些对参考蛋白酶及其变体的评估的结果被报告为相对于如实施例2中所述参考蛋白酶计算的性能指数(PI)值,并且示于表3中。ND意指所述值未测定或者所述值在测定的置信区间之外。
*表示从使用DM21瓷砖进行的测定中获得的PI值
在以下测定(PAS-38(经冲洗或未经冲洗)或焦糖布丁(GSMB或MGDA洗涤剂)ADW清洁,或在Tris-EDTA缓冲液中的稳定性)之一上,以下变体与参考蛋白酶相比显示出改善的性能指数(PI值≥1.1):Q001C/D/E/M/N、I021L、T037A、T054A、L073V、S076D/H/N/T、A083G、P084D/E/F、S085I/M、A086I/S/T/V、D087T、L088M/V、Y089F/W、V091I、G095A/N/S、A096M/Q、N097E、G098M、R099A/F/H/I/K/L/Q/T/W/Y、V102L、G104E、I105L、A106I/V、Q107E、G108A、L109I、A112C、Q114A/M/N、N115A/E/H/Q、N116A/E/G/H/Q、M117I、H118A/D/N、M122C、L124E/Q、A126I/Q/T/V、G128H/I/L/M/N/Q/S/T/V/Y、P129D/H、S130N、S131D/E/N/P/Q/T、R135A/D/H/K/L/M/N/Q/T/V/W/Y、N138D/E、Y139E/L、T141A/E/F/H/Y、S142A/D/E、R143A/E/H/K/M/Q/S/V、N154D、S156E、G157C/D/E、M211D/E/N/Q、M216Q
在至少一个PAS-38测定中,以下变体与参考蛋白酶相比显示出改善的ADW清洁性能指数(PI值≥1.1):P084F、S085I、A086I/S/T/V、Y089F、V091I、G108A、L109I、A112C、Q114A/M/N、N115A、N116Q、M117I、H118N、M122C、A126I/Q/T/V、G128T/V、S130N、S131N、Y139E/L、T141A/E/Y、S142A、N154D、M211D/E/N/Q
在至少一个焦糖布丁测定中,以下变体与参考蛋白酶相比显示出改善的ADW清洁性能指数(PI值≥1.1):Q001C/D/E/N、I021L、T037A、L073V、S076D/H/N、P084D/E、S085M、G095A、A096M/Q、N097E、R099A/H/Q/T、G104E、Q107E、N115E、N116E/G、P129D、S131D/E、R135H/K/L/M/Q/T/V/W/Y、N138D、Y139E/L、T141E/H/Y、S142D/E、R143A/E/H/K/M/Q/S/V、N154D、S156E、G157D/E、M211E/N/Q
以下变体与参考蛋白酶相比在Tris-EDTA缓冲液中显示出改善的稳定性(PI值≥1.1):T054A、A083G、P084F、A086V、D087T、L088M、Y089W、G095A/N/S、N097E、G098M、R099A/F/H/I/K/L/Q/T/W/Y、V102L、I105L、A106I/V、Q107E、G108A、Q114M/N、N115A/E、N116E、H118A/D、M122C、L124E/Q、A126I/Q/T/V、G128H/I/L/M/N/Q/S/T/V/Y、P129D/H、S131D/E/N/P/Q/T、R135A/D/H/K/L/M/N/Q/T/V/W/Y、N138D/E、Y139E、T141A/E/F、S142D/E、R143A/E/H/K/M/Q/S/V、N154D、S156E、G157C/D/E、M211D、M216Q
在至少一个PAS-38测定中或在至少一个焦糖布丁测定中,以下变体与参考蛋白酶相比显示出改善的性能指数(PI值≥1.1),并且这些变体在Tris-EDTA缓冲液中显示出改善的稳定性:P084F、A086V、G095A、N097E、R099A/H/Q/T、Q107E、G108A、Q114M/N、N115A/E、N116E、M122C、A126I/Q/T/V、G128T/V、P129D、S131D/E/N、R135H/K/L/M/Q/T/V/W/Y、N138D、Y139E、T141A/E、S142D/E、R143A/E/H/K/M/Q/S/V、N154D、S156E、G157D/E、M211D
在至少一个PAS-38或焦糖布丁测定中,以下变体与参考蛋白酶相比显示出改善的性能指数(PI值≥1.1)和减少的净电荷:Q001C/D/E、S076D、P084D/E、N097E、R099A/H/Q/T、G104E、Q107E、N115E、N116E、P129D、S131D/E、R135H/K/L/M/Q/T/V/W/Y、N138D、Y139E、T141E/Y、S142D/E、R143A/E/H/K/M/Q/S/V、N154D、S156E、G157D/E、M211E
以下变体与参考蛋白酶相比在Tris-EDTA缓冲液中显示出改善的稳定性(PI值≥1.1)和减少的净电荷:N097E、R099A/F/H/I/K/L/Q/T/W/Y、Q107E、N115E、N116E、H118D、M122C、L124E、G128Y、P129D、S131D/E、R135A/D/H/K/L/M/N/Q/T/V/W/Y、N138D/E、Y139E、T141E、S142D/E、R143A/E/H/K/M/Q/S/V、N154D、S156E、G157C/D/E、M211D
本文所公开的量纲和值不应理解为严格限于所引用的精确数值。相反,除非另外指明,否则每个此类量纲旨在表示所述值以及围绕该值功能上等同的范围。例如,公开为“40mm”的量纲旨在表示“约40mm”。
Claims (15)
1.一种包含蛋白酶的自动盘碟洗涤清洁组合物,其中所述蛋白酶是与SEQ ID NO:1的氨基酸序列具有至少90%同一性的变体,并且所述变体在与SEQ ID NO:1位置对应的一个或多个位置处包含一个或多个氨基酸取代,所述一个或多个氨基酸取代选自:
(i)1C/D/E/M/N、21L、37A、54A、73V、76D/H/N/T、83G、84D/E/F、85I/M、86I/S/T/V、87T、88M/V、89F/W、91I、95A/N/S、96M/Q、97E、98M、99A/F/H/I/K/L/Q/T/W/Y、102L、104E、105L、106I/V、108A、109I、112C、114M/N、115A/E/H/Q、116A/E/G/H/Q、118A/D/N、122C、124E/Q、126I/Q/V、128H/I/L/M/N/Q/S/T/V/Y、129D/H、130N、131D/E/N/P/Q、135A/D/H/K/L/M/N/Q/T/V/W/Y、138D/E、139E/L、141A/E/F/H/Y、142A/D/E、143E/H/K/M/S/V、156E和157C/D/E
其中所述变体的氨基酸位置通过与SEQ ID NO:1的氨基酸序列的对应关系进行编号。
2.根据权利要求1所述的组合物,其中所述变体在与SEQ ID NO:1位置对应的一个或多个位置处包含一个或多个氨基酸取代,所述一个或多个氨基酸取代选自:1D;21L;37A;73V;76D;84D/E;85M;86I/V;87T;96M;97E;99A/F/H/I/L/Q/T/W/Y;104E;106I/V;115A/E;116E;122C;126I/Q/V;128S/T/V;129D;130N;131D/E;135A/D/H/L/M/N/Q/T/V/W/Y;138D;139E/L;141E/Y;142D/E;143E/H/M/V;156E;和157C/D/E。
3.根据权利要求1或2中任一项所述的组合物,其中所述蛋白酶是与SEQ ID NO:1的氨基酸序列具有至少95%同一性的变体。
4.根据前述权利要求中任一项所述的组合物,其中所述组合物不含磷酸盐。
5.根据前述权利要求中任一项所述的组合物,其中所述组合物包含按所述组合物的重量计10%至50%的有机络合剂体系。
6.根据前述权利要求中任一项所述的组合物,所述组合物包含按所述组合物的重量计超过10%的漂白剂。
7.根据前述权利要求所述的组合物,所述组合物包含漂白活化剂和/或漂白催化剂,优选锰催化剂。
8.根据权利要求5至7中任一项所述的组合物,其中所述络合剂体系包含选自由柠檬酸、甲基甘氨酸二乙酸、谷氨酸-N,N-二乙酸、亚氨基二琥珀酸、羧甲基菊粉、它们的盐以及它们的混合物组成的组的络合剂,优选甲基甘氨酸二乙酸的盐。
9.根据权利要求5至8中任一项所述的组合物,其中所述络合剂体系包含优选地重量比为约0.5:1至约2:1的柠檬酸和甲基甘氨酸二乙酸。
10.根据权利要求5至9中任一项所述的组合物,其中所述漂白剂为过碳酸盐。
11.根据前述权利要求中任一项所述的组合物,其中所述组合物还包含α淀粉酶,所述α淀粉酶优选地在等同于SEQ ID No.2中的202的位置处具有突变。
12.根据前述权利要求中任一项所述的组合物,其中所述组合物包含分散剂聚合物,优选羧化/磺化聚合物。
13.根据前述权利要求中任一项所述的组合物,所述组合物包含:
i)按所述组合物的重量计10%至50%的有机络合剂体系;
ii)漂白体系,所述漂白体系包含按所述组合物的重量计至少10%的过碳酸盐和任选地漂白活化剂和/或漂白催化剂;
iii)非离子表面活性剂;
iv)分散剂聚合物;
v)淀粉酶;以及
vi)任选但优选地玻璃护理剂。
14.一种在盘碟洗涤机中洗涤脏污盘碟的方法,所述方法包括以下步骤:
i)提供所述脏污盘碟;
ii)用根据前述权利要求中任一项所述的清洁组合物处理所述盘碟;以及
iii)任选地冲洗所述盘碟。
15.根据权利要求1至12中任一项所述的组合物用于在自动盘碟洗涤中去除焦糖布丁的用途。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862686833P | 2018-06-19 | 2018-06-19 | |
| US62/686,833 | 2018-06-19 | ||
| US201962852321P | 2019-05-24 | 2019-05-24 | |
| US62/852,321 | 2019-05-24 | ||
| PCT/US2019/036889 WO2019245839A1 (en) | 2018-06-19 | 2019-06-13 | Automatic dishwashing detergent composition |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN112204138A true CN112204138A (zh) | 2021-01-08 |
Family
ID=67108196
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201980035161.5A Pending CN112204138A (zh) | 2018-06-19 | 2019-06-13 | 自动盘碟洗涤剂组合物 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US11220656B2 (zh) |
| EP (1) | EP3810769A1 (zh) |
| CN (1) | CN112204138A (zh) |
| WO (1) | WO2019245839A1 (zh) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20220396595A1 (en) * | 2019-10-17 | 2022-12-15 | Rhodia Operations | A metal complex and use thereof |
| JP7417753B2 (ja) * | 2020-01-31 | 2024-01-18 | エコラボ ユーエスエー インコーポレイティド | ウェア洗浄用途における酸素漂白剤とのアミラーゼ相乗効果 |
| JP7594088B2 (ja) | 2020-08-04 | 2024-12-03 | ザ プロクター アンド ギャンブル カンパニー | 自動食器洗浄方法 |
| JP2023535061A (ja) | 2020-08-04 | 2023-08-15 | ザ プロクター アンド ギャンブル カンパニー | 自動食器洗浄方法 |
| CA3187735A1 (en) | 2020-08-04 | 2022-02-10 | Nina Elizabeth GRAY | Automatic dishwashing method and pack |
| WO2022031309A1 (en) | 2020-08-04 | 2022-02-10 | The Procter & Gamble Company | Automatic dishwashing method |
| US20220169952A1 (en) | 2020-11-17 | 2022-06-02 | The Procter & Gamble Company | Automatic dishwashing composition comprising amphiphilic graft polymer |
| EP4001388A1 (en) | 2020-11-17 | 2022-05-25 | The Procter & Gamble Company | Automatic dishwashing method with amphiphilic graft polymer in the rinse |
| WO2022108611A1 (en) | 2020-11-17 | 2022-05-27 | The Procter & Gamble Company | Automatic dishwashing method with alkaline rinse |
| AU2023272468A1 (en) | 2022-05-14 | 2024-11-14 | Novonesis Plant Biosolutions A/S | Compositions and methods for preventing, treating, supressing and/or eliminating phytopathogenic infestations and infections |
| EP4388967A1 (en) | 2022-12-19 | 2024-06-26 | The Procter & Gamble Company | Dishwashing method |
| DE102023204055A1 (de) * | 2023-05-03 | 2024-11-07 | Henkel Ag & Co. Kgaa | Leistungsverbesserte protease-varianten |
| DE102023212361A1 (de) * | 2023-12-07 | 2025-06-12 | Henkel Ag & Co. Kgaa | Protease-varianten mit verbesserter bleichestabilität |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001060963A1 (de) * | 2000-02-18 | 2001-08-23 | Henkel Kommanditgesellschaft Auf Aktien | Protease und percarbonat enthaltende wasch- und reinigungsmittel |
| WO2016069563A1 (en) * | 2014-10-27 | 2016-05-06 | Danisco Us Inc. | Serine proteases |
| CN106029881A (zh) * | 2013-12-13 | 2016-10-12 | 丹尼斯科美国公司 | 吉氏芽孢杆菌-进化枝的丝氨酸蛋白酶 |
| CA3209924A1 (en) * | 2015-10-28 | 2016-12-22 | Novozymes A/S | Detergent composition comprising amylase and protease variants |
| WO2017192692A1 (en) * | 2016-05-03 | 2017-11-09 | Danisco Us Inc | Protease variants and uses thereof |
| WO2017210295A1 (en) * | 2016-05-31 | 2017-12-07 | Danisco Us Inc. | Protease variants and uses thereof |
| CN107849549A (zh) * | 2015-06-17 | 2018-03-27 | 丹尼斯科美国公司 | 吉氏芽孢杆菌进化枝丝氨酸蛋白酶 |
Family Cites Families (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4760025A (en) | 1984-05-29 | 1988-07-26 | Genencor, Inc. | Modified enzymes and methods for making same |
| DE68924654T2 (de) | 1988-01-07 | 1996-04-04 | Novonordisk As | Spezifische Protease. |
| JP3220137B2 (ja) | 1989-08-25 | 2001-10-22 | ヘンケル・リサーチ・コーポレイション | アルカリ性タンパク質分解酵素およびその製造方法 |
| DK58491D0 (da) | 1991-04-03 | 1991-04-03 | Novo Nordisk As | Hidtil ukendte proteaser |
| US5576281A (en) | 1993-04-05 | 1996-11-19 | Olin Corporation | Biogradable low foaming surfactants as a rinse aid for autodish applications |
| CA2173105C (en) | 1993-10-14 | 2003-05-27 | Andre Baeck | Protease-containing cleaning compositions |
| AR000862A1 (es) | 1995-02-03 | 1997-08-06 | Novozymes As | Variantes de una ó-amilasa madre, un metodo para producir la misma, una estructura de adn y un vector de expresion, una celula transformada por dichaestructura de adn y vector, un aditivo para detergente, composicion detergente, una composicion para lavado de ropa y una composicion para la eliminacion del |
| US6093562A (en) | 1996-02-05 | 2000-07-25 | Novo Nordisk A/S | Amylase variants |
| JP3025627B2 (ja) | 1995-06-14 | 2000-03-27 | 花王株式会社 | 液化型アルカリα−アミラーゼ遺伝子 |
| MA25044A1 (fr) | 1997-10-23 | 2000-10-01 | Procter & Gamble | Compositions de lavage contenant des variants de proteases multisubstituees. |
| US6403355B1 (en) | 1998-12-21 | 2002-06-11 | Kao Corporation | Amylases |
| JP4745503B2 (ja) | 1999-03-31 | 2011-08-10 | ノボザイムス アクティーゼルスカブ | アルカリα−アミラーゼ活性を有するポリペプチド及びそれらをコードする核酸 |
| ES2252287T3 (es) | 2000-07-28 | 2006-05-16 | Henkel Kommanditgesellschaft Auf Aktien | Enzima amilolitico de bacillus sp. a7-7 (dsm 12368) asi com0 agentes de lavado y de limpieza con este nuevo enzima amilolitico. |
| DE10162727A1 (de) | 2001-12-20 | 2003-07-10 | Henkel Kgaa | Neue Alkalische Protease aus Bacillus gibsonii (DSM 14391) und Wasch-und Reinigungsmittel enthaltend diese neue Alkalische Protease |
| WO2004067737A2 (en) | 2003-01-30 | 2004-08-12 | Novozymes A/S | Subtilases |
| WO2005052161A2 (en) | 2003-11-19 | 2005-06-09 | Genencor International, Inc. | Serine proteases, nucleic acids encoding serine enzymes and vectors and host cells incorporating same |
| CN101010429B (zh) | 2004-07-05 | 2013-05-08 | 诺维信公司 | 具有改变特性的α-淀粉酶变异体 |
| CN101341248B (zh) | 2005-10-12 | 2015-05-13 | 金克克国际有限公司 | 储存稳定的中性金属蛋白酶的用途和制备 |
| DE102006022216A1 (de) | 2006-05-11 | 2007-11-15 | Henkel Kgaa | Neue Alkalische Protease aus Bacillus gibsonii und Wasch- und Reinigungsmittel enthaltend diese neue Alkalische Protease |
| DE102006022224A1 (de) | 2006-05-11 | 2007-11-15 | Henkel Kgaa | Subtilisin aus Bacillus pumilus und Wasch- und Reinigungsmittel enthaltend dieses neue Subtilisin |
| NZ573467A (en) | 2006-07-18 | 2012-02-24 | Danisco Us Inc Genencor Div | Subtilisin variants active over a broad temperature range |
| DE102007003143A1 (de) | 2007-01-16 | 2008-07-17 | Henkel Kgaa | Neue Alkalische Protease aus Bacillus gibsonii und Wasch- und Reinigungsmittel enthaltend diese neue Alkalische Protease |
| DE102007044415A1 (de) | 2007-09-17 | 2009-03-19 | Henkel Ag & Co. Kgaa | Leistungsverbesserte Proteasen und Wasch- und Reinigungsmittel enthaltend diese Proteasen |
| EP2447361B1 (en) | 2008-06-06 | 2014-10-08 | Danisco US Inc. | Geobacillus stearothermophilus alpha-amylase (AMYS) variants with improved properties |
| WO2009149271A2 (en) | 2008-06-06 | 2009-12-10 | Danisco Us Inc. | Production of glucose from starch using alpha-amylases from bacillus subtilis |
| EP2357220A1 (en) | 2010-02-10 | 2011-08-17 | The Procter & Gamble Company | Cleaning composition comprising amylase variants with high stability in the presence of a chelating agent |
| EP2540824A1 (en) | 2011-06-30 | 2013-01-02 | The Procter & Gamble Company | Cleaning compositions comprising amylase variants reference to a sequence listing |
| WO2014099523A1 (en) | 2012-12-21 | 2014-06-26 | Danisco Us Inc. | Alpha-amylase variants |
| WO2014164777A1 (en) | 2013-03-11 | 2014-10-09 | Danisco Us Inc. | Alpha-amylase combinatorial variants |
| WO2014194117A2 (en) | 2013-05-29 | 2014-12-04 | Danisco Us Inc. | Novel metalloproteases |
| EP3004341B1 (en) | 2013-05-29 | 2017-08-30 | Danisco US Inc. | Novel metalloproteases |
| US20160160202A1 (en) | 2013-05-29 | 2016-06-09 | Danisco Us Inc. | Novel metalloproteases |
| EP3339436B1 (en) | 2013-07-29 | 2021-03-31 | Henkel AG & Co. KGaA | Detergent composition comprising protease variants |
| DE102013219467A1 (de) | 2013-09-26 | 2015-03-26 | Henkel Ag & Co. Kgaa | Stabilisierte Inhibitor-Proteasevarianten |
| ES2723948T3 (es) | 2013-12-13 | 2019-09-04 | Danisco Us Inc | Serina proteasas procedentes de especies de Bacillus |
| WO2015091990A1 (en) | 2013-12-20 | 2015-06-25 | Novozymes A/S | Polypeptides having protease activity and polynucleotides encoding same |
| WO2015091989A1 (en) | 2013-12-20 | 2015-06-25 | Novozymes A/S | Polypeptides having protease activity and polynucleotides encoding same |
| EP4155398A1 (en) | 2014-03-21 | 2023-03-29 | Danisco US Inc. | Serine proteases of bacillus species |
| CN106414732A (zh) | 2014-06-20 | 2017-02-15 | 诺维信公司 | 来自明矾韩国生工菌的金属蛋白酶和包括金属蛋白酶的洗涤剂组合物 |
| EP3957729A1 (en) | 2014-10-27 | 2022-02-23 | Danisco US Inc. | Serine proteases |
| EP3224357A1 (en) | 2014-10-27 | 2017-10-04 | Danisco US Inc. | Serine proteases of bacillus species |
| WO2016066756A2 (en) | 2014-10-30 | 2016-05-06 | Novozymes A/S | Protease variants and polynucleotides encoding same |
| US11407989B2 (en) | 2014-10-30 | 2022-08-09 | Novozymes A/S | Protease variants and polynucleotides encoding same |
| WO2016075078A2 (en) | 2014-11-10 | 2016-05-19 | Novozymes A/S | Metalloproteases and uses thereof |
| DE102014224825A1 (de) | 2014-12-04 | 2016-06-09 | Henkel Ag & Co. Kgaa | Proteasevarianten mit verbesserter Waschleistung |
| DE102014225472A1 (de) | 2014-12-10 | 2016-06-16 | Henkel Ag & Co. Kgaa | Handgeschirrspülmittel mit verbesserter Wirkung gegen Stärke |
| AU2016259703B2 (en) | 2015-05-08 | 2021-12-23 | Novozymes A/S | Alpha-amylase variants and polynucleotides encoding same |
| EP3241890B1 (en) | 2016-05-03 | 2019-06-26 | The Procter and Gamble Company | Automatic dishwashing detergent composition |
| DE102016210628A1 (de) | 2016-06-15 | 2017-12-21 | Henkel Ag & Co. Kgaa | Bacillus gibsonii Protease und Varianten davon |
| CN110312795B (zh) * | 2016-12-21 | 2024-07-23 | 丹尼斯科美国公司 | 蛋白酶变体及其用途 |
| EP3559226B1 (en) | 2016-12-21 | 2023-01-04 | Danisco US Inc. | Bacillus gibsonii-clade serine proteases |
| CN111373039A (zh) | 2017-11-29 | 2020-07-03 | 丹尼斯科美国公司 | 具有改善的稳定性的枯草杆菌蛋白酶变体 |
| CN112189052A (zh) | 2018-06-19 | 2021-01-05 | 宝洁公司 | 自动盘碟洗涤剂组合物 |
-
2019
- 2019-06-13 EP EP19734614.1A patent/EP3810769A1/en active Pending
- 2019-06-13 CN CN201980035161.5A patent/CN112204138A/zh active Pending
- 2019-06-13 US US16/439,731 patent/US11220656B2/en active Active
- 2019-06-13 WO PCT/US2019/036889 patent/WO2019245839A1/en unknown
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001060963A1 (de) * | 2000-02-18 | 2001-08-23 | Henkel Kommanditgesellschaft Auf Aktien | Protease und percarbonat enthaltende wasch- und reinigungsmittel |
| CN106029881A (zh) * | 2013-12-13 | 2016-10-12 | 丹尼斯科美国公司 | 吉氏芽孢杆菌-进化枝的丝氨酸蛋白酶 |
| WO2016069563A1 (en) * | 2014-10-27 | 2016-05-06 | Danisco Us Inc. | Serine proteases |
| CN107849549A (zh) * | 2015-06-17 | 2018-03-27 | 丹尼斯科美国公司 | 吉氏芽孢杆菌进化枝丝氨酸蛋白酶 |
| CA3209924A1 (en) * | 2015-10-28 | 2016-12-22 | Novozymes A/S | Detergent composition comprising amylase and protease variants |
| WO2017192692A1 (en) * | 2016-05-03 | 2017-11-09 | Danisco Us Inc | Protease variants and uses thereof |
| WO2017210295A1 (en) * | 2016-05-31 | 2017-12-07 | Danisco Us Inc. | Protease variants and uses thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3810769A1 (en) | 2021-04-28 |
| WO2019245839A1 (en) | 2019-12-26 |
| US20200010782A1 (en) | 2020-01-09 |
| US11220656B2 (en) | 2022-01-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11220656B2 (en) | Automatic dishwashing detergent composition | |
| JP7351005B2 (ja) | プロテアーゼを含む自動食器洗浄組成物 | |
| JP7572416B2 (ja) | 自動食器洗浄洗剤組成物 | |
| US11834634B2 (en) | Phosphate-free automatic dishwashing detergent compositions having a protease and a complexing agent | |
| US20220098524A1 (en) | Automatic dishwashing detergent composition | |
| US20230203406A1 (en) | Automatic dishwashing detergent composition | |
| CA3085345C (en) | Automatic dishwashing detergent composition | |
| EP3502227B1 (en) | Automatic dishwashing detergent composition | |
| JP7196178B2 (ja) | 自動食器洗浄洗剤組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20210108 |