Isosorbiid
| Isosorbiid | |
|---|---|
 1,4:3,6-dianhüdro-D-glütsitool (IUPAC) | |
| Üldised omadused | |
| Keemiline valem | C6H10O4 |
| Välimus | Värvusetu[1] |
| Füüsikalised omadused | |
| Molekuli mass | 146,14[2] amü |
| Sulamistemperatuur | 334,15...337,15 K (61...64 °C) |
| Keemistemperatuur | 430,15 K (157 °C) |
| Tihedus | 1,3777[3] kg/m³ |
| Lahustuvus |
Lahustub täielikult vees, alkoholis, kloroformis, dioksaanis, äädikhappes. Vähelahustuv etüülatsetaadis, benseenis, eetris ja atsetoonis.[1] |
| Ohutus | |
| Suukaudne manustamine | Mittetoksiline (terav, mõru maitse) [1][4][5] |
| Nahk | Mittetoksiline[4] |
| Kasutatakse SI-süsteemi ühikuid. Kui pole teisiti öeldud, eeldatakse normaaltingimusi. | |
Isosorbiid on heterotsükliline keemiline ühend, mille nimetus süstemaatilise nomenklatuuri (IUPAC) järgi on 1,4:3,6-dianhüdro-D-glütsitool (ka 1,4:3,6-dianhüdrosorbitool), CAS 652-67-5.[6] Isosorbiid ja tema kaks isomeeri (isomanniid ja isoidiid) on kiraalsed sekundaarsed dioolid üldnimega isoheksiidid. Neid sünteesitakse kuuesüsinikulistest suhkuralkoholidest, mida saadakse tselluloosist.[7] Isosorbiid on kolmest isomeerist ainuke, mida toodetakse suuremas mahus ka tööstuses. Põhjuseks on, et isosorbiidi valmistatakse sorbitoolist, mida on biomassist lihtsam kätte saada kui teise kahe isomeeri vahetuid lähteaineid.[7]
Ajalugu
[muuda | muuda lähteteksti]Esimestena on isosorbiidi maininud 1927. aastal saksa teadlased Johannes Müller ja Ulrich Hoffmann. Nad uurisid sorbitooli reageerimist erinevate veevabade ainetega, mille tulemusel said amorfse aine keemistemperatuuriga 157 °C (3 mmHg rõhu juures).[8]
Mõni aasta hiljem sünteesis isosorbiidi kristallilisel kujul W. C. Harden, võttes eeskujuks Fauconnier' meetodi (mannitoolist isomanniidi valmistamine).[9]
Aine füüsikalisi-keemilisi omadusi kajastasid teaduskirjanduses esimestena hoopis F. K. Bell, C. J. Carr ja J. C. Krantz 1940. aastal. Nad tiitrisid isosorbiidi-boorhappe kompleksi naatriumhüdroksiidi lahusega. Selgus, et tulemus on sarnane isomanniidi-boorhappe kompleksi tiitrimisel saadud tiitrimiskõveraga, mis oli juba varem publitseeritud. Kuid lahuse elektrijuhtivuse määramisel selgus, et isosorbiidi-boorhappe lahuse juhtivus on suurem, seega täpselt sama ühendiga tegemist siiski ei olnud. Oletati, et üks uuritava ühendi hüdroksüülrühm asub ekso-asendis.[9]
Isoheksiidi täpse struktuuri kirjelduse avaldasid aastal 1946 R. C. Hockett, H. G. Fletcher Jr., Elizabeth L. Sheffield ja R. Max Goepp Jr. Nad andsid ülevaate isosorbiidi saamise ja tema füüsikaliste omaduste kohta, samuti raporteeriti mõned läbiviidud reaktsioonid.[1]
Struktuur
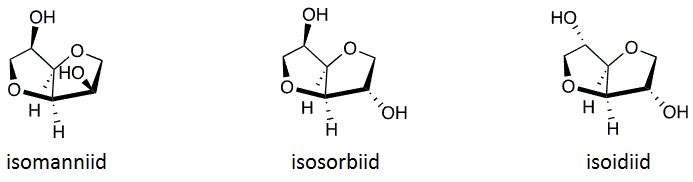
[muuda | muuda lähteteksti]Isosorbiid koosneb kahest tetrahüdrofuraani ringist, mis asetsevad teineteise suhtes 120º nurga all, moodustades nii V-kujulise molekuli. Kummagi tetrahüdrofuraani tsükli küljes on üks hüdroksüülrühm.[6] Positsioonis 5 olev hüdroksüülrühm on endo-konfiguratsiooniga ja positsioonis 2 on ekso-konfiguratsiooniga.[7]
Endo-konfiguratsiooniga hüdroksüülrühm moodustab molekulisisese vesiniksideme hapnikuga, mis asub teises tetrahüdrofuraani tsüklis. See nukelofiilne tsenter on reaktsioonivõimelisem kui molekulis olev teine hüdroksüülrühm. Asendusreaktsioon toimub aga eelistatult ekso-asendis oleva hüdroksüülrühmaga, kuna see on steeriliselt vähem takistatud. See tähendab, et ruumiliselt pääsevad teised molekulid funktsionaalrühmale paremini ligi.[6]
Oma isomeeridest erineb isosorbiid kahe hüdroksüülrühma asendi poolest. Isomanniidis on mõlemad hüdroksüülrühmad endo-konfiguratsiooniga ja isoidiidis ekso-konfiguratsiooniga.[7]
Isosorbiidi valmistamine
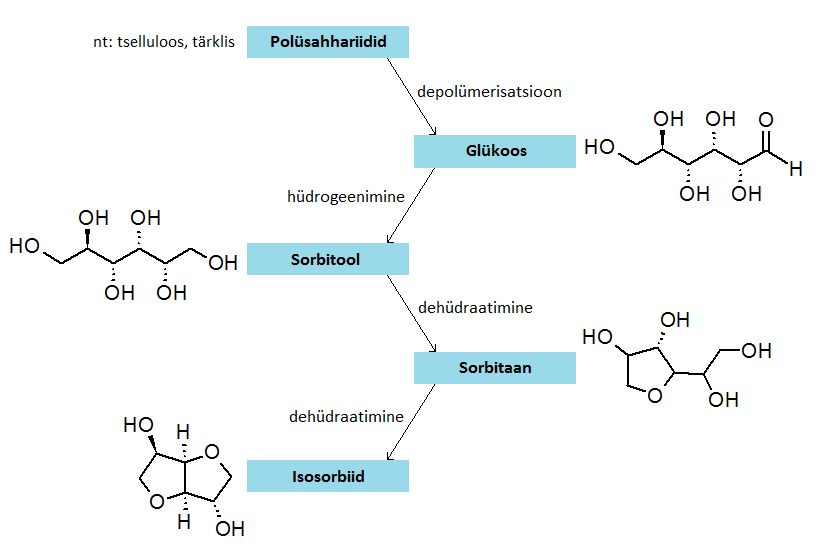
[muuda | muuda lähteteksti]Isosorbiidi saab toota biomassist. Isosorbiidi saamiseks on välja töötatud mitmeid erinevaid sünteesiradasid, neist üks lihtsamaid üldistatud reaktsiooniahelaid on järgmine:
- esmalt saadakse mitme biotehnolooglise ja katalüütilise depolümerisatsioonireaktsiooni kaudu tselluloosist või tärklisest glükoos;
- seejärel glükoos hüdrogeenitakse, mille tulemusena tekib sorbitool;
- kahekordse dehüdraatimise abil saab sorbitoolist isosorbiidi;
- vaheproduktina tekib veel sorbitaan, milles on moodustunud vaid üks tetrahüdrofuraani tsükkel.[6]
Täpsem reaktsioonikirjeldus sorbitoolist isosorbiidi saamiseks aastast 1946:
„Kuumutada sorbitooli-väävelhappe segu 140–150 ºC juures vaakumi all ligikaudu tund aega. Saadud must segu tuleb jahutada ning lahjendada veega, seejärel lisada baariumkarbonaati (BaCO3) ning filtreerida. Vesi tuleb pealt ära aurustada ning siis järelejäänud segu destilleerida, tulemuseks kollane viskoosne destillaat. Etüüleetriga rekristalliseerimisel saabki kätte isosorbiidi, mis on küllaltki hügroskoopne ühend.“
– [1]
Isosorbiidi derivaatide kasutusalad
[muuda | muuda lähteteksti]Isosorbiid on väga oluline komponent mitmesugustes keemilistes ühendites ja materjalides, mistõttu leiavad isosorbiidi derivaadid laialdast kasutust.
Enamasti moodustuvad isosorbiidi derivaadid hüdroksüülrühmades olevate vesinike asendamisel mõne muu funktsionaalrühmaga. See tähendab, et isosorbiidi molekul on estersidemega ühendatud suuremasse ühendisse. Seda võimaldab hüdroksüülrühmade nukleofiilsus, mille tõttu on nendega kergem läbi viia mitmeid asendusreaktsioone.[4][6][10]
Plastifikaator
[muuda | muuda lähteteksti]Ettevõte Roquette on loonud isosorbiidist plastifikaatori POLYSORBID 37, mis on kahte alkoksürühma sisaldav isosorbiidi diester. See ühend on heaks asenduseks väga laialdaselt kasutusel olevale polüvinüülkloriidile (PVC), mis ftalaadisisalduse tõttu on ohtlik polümeermaterjal.[11]
Lisand polümeerides
[muuda | muuda lähteteksti]Tänapäeval uuritakse isosorbiidi juures peamiselt seda, kuidas seda kasutada polümeersetes materjalides. Eesmärgiks on vähendada naftasaaduste kasutamist ja suurendada biomassist sünteesitavate ühendite kui taastuvate ressursside osakaalu tarbeesemetes.[10]
Isosorbiidi lisatakse polüetüleentereftalaadile, saadud materjalist (polüetüleen-isosorbiid-tereftalaat) valmistatavad plastpudelid on vastupidavamad kõrgematele temperatuuridele. Tänu sellele saab nendes plastpudelites hoida kuumemaid jooke.[12]
Ka mitmetesse biopolümeeridesse viiakse sisse isosorbiidi. Näiteks püütakse polükarbonaatides ja epoksüvaikudes bisfenool A asendada isosorbiidiga, vältimaks ohtlike bisfenool A jäätmete sattumist loodusesse.[6]
Ravimid
[muuda | muuda lähteteksti]

Veresoonkonnahaiguste raviks kasutatakse nii isosorbiidmononitraati kui ka isosorbiiddinitraati, milles on vastavalt üks või kaks hüdroksüülrühma asendatud nitrorühmadega.[13]
Isosorbiiddinitraat on valge lõhnatu kristalliline aine. See ühend on peamiselt kasutusel stenokardia ja hüpertoonia ravimina.[14]
Viimastel aastatel on aktuaalne olnud ka isosorbiid-5-mononitraadi negatiivne mõju inimorganismile, nimelt tekitab ühend endoteliaalset väärtalitlust ja oksüdatiivset stressi.[15]
Lisaks võib isosorbiidi leida diureetikumide komponendina. Selle diureetiline omadus avastati juba 1964. aastal, märkimisväärne oli võimalus manustada isosorbiidi suu kaudu. Seega kirjutati ravimit välja nii tablettidena kui ka vedelikus lahustamiseks. Sama päritoluga diureetikume oli selleks ajaks avastatud ka teisi (näiteks mannitool ja sorbitool), kuid nende puudus seisnes selles, et neid sai manustada vaid süstimise kaudu.[5]
Päikesekreemide komponent
[muuda | muuda lähteteksti]Kuna isosorbiid on mittetoksiline ühend, sobib see hästi päikesekreemides kasutamiseks. Sellel baseeruvaid päikesekreeme on valmistatud nii UVA- kui ka UVB-kiirguse blokeerimiseks. UVA-kaitsekreemides on olulised isosorbiidi derivaadid etüültsüanoatsetaadi ja vanilliiniga, kuid UVB-kaitsekreemide puhul kasutatakse isosorbiidi derivaati 4-metoksükaneelhappega. Isosorbiid on neis ühendites stabiliseerivaks aineks teistele molekulidele, tagades nii järjepideva UV-kiirguse neelavuse.[10]
Solvent farmaatsiatööstuses
[muuda | muuda lähteteksti]Isosorbiidi derivaat dimetüülisosorbiid, kus mõlema hüdroksüülrühma vesinikud on asendatud metüülrühmadega, sobib solvendiks mitmete ravimite valmistamisel, seda kasutatakse näiteks salvide, kreemide, ihupiimade, silma-, nina- ja kõrvatilkade tootmisel. Dimetüülisosorbiid on vähetoksiline, õrna magusa lõhna ja mõru maitsega keemiline ühend.[16]

Kütuse komponent
[muuda | muuda lähteteksti]Diiselmootorite kütustes võib samuti leida nii isosorbiidi kui ka selle derivaate (näiteks dimetüülisosorbiid ja isosorbiiddinitraat).[17]
Muud kasutusotstarbed tööstuses
[muuda | muuda lähteteksti]Isosorbiidi fosfaate, kus eksoasendis olev hüdroksüülrühm on asendatud fosfaatrühmaga, kasutatakse nii detergentidena kui ka kosmeetikatoodete komponentidena.[18]
Isosorbiidi monoestreid võib leida olmepuhastusvahenditest ja detergentidest, näiteks nõudepesuvahendist. Monoestrites on ühe hüdroksüülrühma asemel estersideme kaudu isosorbiidi molekuli külge seotud lineaarne või hargnenud, küllastunud või küllastumata alküül- või alkenüülrühm, mis sisaldab 6–22 süsinikuaatomit.[19]
Viited
[muuda | muuda lähteteksti]- ↑ 1,0 1,1 1,2 1,3 1,4 Hockett, R. C.; Fletcher Jr., H. G.; Sheffield, E. L.; Goepp Jr., R. M. Hexitol Anhydrides. The Structure of Isosorbide, a Crystalline Dianhydrosorbitol. J. Am. Chem. Soc. 1946, 68, 927–930.
- ↑ The Merck Index, 14th Edit, 05224; https://web.archive.org/web/20141001041925/https://themerckindex.cambridgesoft.com/
- ↑ Hayashi, I.; Hamada,S.; Hachihama, Y. Preparation of sorbide esters and their properties as plasticizers. Nippon Kagaku Kaishi (1921–47) 1953, Volume Ind. Chem. Sect. 56, 623–625.
- ↑ 4,0 4,1 4,2 Fenouillot, F.; Rousseau, A.; Colomines, G.; Saint-Loup, R.; Pascault, J.-P. Polymers from renewable 1,4:3,6-dianhydrohexitols (isosorbide, isomannide and isoidide) – A review. Progress in Polymer Science 2010, 35, 578–622.
- ↑ 5,0 5,1 Diuretic composition. GB1067298 A, 1967.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 Rose, M.; Palkovits, R. Isosorbide as a Renewable Platform chemical for Versatile Applications – Quo Vadis? ChemSusChem 2012, 5, 167–176.
- ↑ 7,0 7,1 7,2 7,3 Kabascki, S. Bio-Based Plastics: Materials and Applications. John Wiley & Sons Ldt: West Sussex, United Kingdom, 2014, 242–244.
- ↑ Müller, J.; Hoffmann, U. Dehydration product of sorbitol and the process of making it. US 1757468 A, 1930.
- ↑ 9,0 9,1 Bell, F. K.; Carr, C. J.; Kratz Jr., J. C. A Study of the Effect of the Anhydrides of Sorbitol on the Dissociation Constant of Boric Acid. J. Phys. Chem 1940, 44, 862–865.
- ↑ 10,0 10,1 10,2 Feng, X.; East, A. J.; Hammond, W.; Jaffe, M. Sugar-Based Chemicals for Environmentally Sustainable Applications. Contemporary Science of Polymeric Materials; Korugic-Karasz, L.; ACS Symposium Series; American Chemical Society, Washington, DC, 2010, 3–5, 15–23.
- ↑ The Roquette; http://www.roquette.com
- ↑ Crocker, M. Thermochemical Conversion of Biomass to Liquid Fuels and Chemicals. Royal Society of Chemistry, United Kingdom, 2010, 359–360.
- ↑ Loscalzo, J.; Vita, J. A.; Loberg, M. D.; Morce, M. Methods of treating vascular diseases characterized by nitric oxide insufficieny. US 20040005306 A1, 2004.
- ↑ The toxicology data network; http://toxnet.nlm.nih.gov
- ↑ Thomas, G. R.; DiFabio, J. M.; Gori, T.; Parker, J. D. Once Daily Therapy With Isosorbide-5-Mononitrate Causes Endothelial Dysfunction in Humans. J. Am. Coll. Cardiol. 2007, 49, 12, 1289–1295.
- ↑ Dederen, J. C. Dimethyl isosorbide, a novel pharmaceutical solvent. Expo. – Congr. Int. Technol. Pharm., 3rd 1983, 5, 335–336.
- ↑ Menegassi de Almeida, R.; Rabello, K. Diesel cycle fuel compositions containing deanhydrohexitols and related products. US 20100064574 A1, 2010.
- ↑ Behler, A.; Breffa, C.; Raths, H.-C. Use of anionic isosorbide derivatives. EP 2336281 A1, 2011.
- ↑ Weuthen, M.; Nieendick, C.; Both, S.; Breffa, C.; Beckedahl, B.; Dieker, M.; Behler, A.; Alexandre, T.; Loehl, T. Isosorbide monoesters and their use in household applications. EP 2239315 A1, 2010.