Bariumoxid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
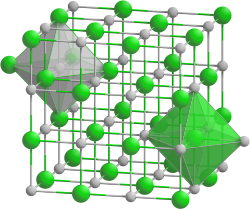
| |||||||||||||||||||
| _ Ba2+ _ O2− | |||||||||||||||||||
| Kristallsystem |
kubisch | ||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||||||||||||||
| Koordinationszahlen |
Ba[6], O[6] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumoxid | ||||||||||||||||||
| Verhältnisformel | BaO | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 153,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
5,72 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
2000 °C[2] | ||||||||||||||||||
| Löslichkeit |
In Wasser Zersetzung zu Bariumhydroxid[2] | ||||||||||||||||||
| Brechungsindex |
1,9841[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,5 mg·m−3 (Ba)[2] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−554 kJ·mol−1[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Bariumoxid ist das Oxid des Erdalkalimetalls Barium. Es besitzt die Formel BaO.
Bariumoxid (Baryterde) wurde zuerst von Johan Gottlieb Gahn 1774 dargestellt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bariumoxid ist ein farbloser Feststoff, der bei 1918 °C schmilzt. Mit Wasser reagiert es unter lebhafter Wärmeentwicklung zu Bariumhydroxid.
Er besitzt eine Kristallstruktur vom Natriumchlorid-Typ und reagiert mit feuchter Luft zum Hydroxid, mit CO2-haltiger Luft bildet sich Bariumcarbonat.[7]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Technisch wird es durch das Erhitzen eines Kohle-Bariumcarbonat-Gemisches auf etwa 1030 °C hergestellt, im Laboratorium auch durch Glühen von Bariumnitrat.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bariumoxid wird als Absorptionsmittel für Kohlenstoffdioxid und als Trocknungsmittel sowie zur Herstellung von Bariumperoxid, Bariumhydroxid, organischen Bariumsalzen, Spezialgläsern und Oxidkathoden verwendet.
Bariumoxid unterliegt an Sauerstoffatmosphäre einer Gleichgewichtsreaktion zu Bariumperoxid BaO2.
Zwischen 500 und 600 °C reagiert BaO zum Bariumperoxid. Oberhalb von 600 °C wird der im Peroxid gebundene Sauerstoff wieder abgegeben. BaO darf also nicht zu sehr erhitzt werden. Da die Gleichgewichtsreaktion zum Bariumperoxid mit Wärmeabgabe (exotherme Reaktion) und Volumenänderung verbunden ist, verschiebt sich das Gleichgewicht mit steigender Temperatur nach links. Man kann daher Sauerstoff bei niedriger Temperatur binden und bei höherer Temperatur wieder freisetzen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Bariumoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ a b c d e Datenblatt Bariumoxid bei Alfa Aesar, abgerufen am 29. Januar 2010 (Seite nicht mehr abrufbar).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-245.
- ↑ a b Eintrag zu Bariumoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ PAETEC Formelsammlung Ausgabe 2003, S. 116.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 926.

