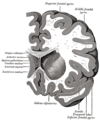
Insulární kortex

V každé hemisféře mozku savce je insula n. insulární kortex n. insulární lalůček jako část mozkové kůry mozku složená hluboko v laterálním sulku (trhlině oddělující temporální lalok od parietálních a frontálních laloků).
Předpokládá se, že se insula podílí na vědomí a má různé funkce související obvykle s emocemi nebo regulací homeostázy těla. Mezi tyto funkce patří soucit a empatie, vnímání, motorická kontrola, sebeuvědomění, kognitivní funkce a interpersonální zkušenosti. Ve vztahu k nim se podílí na psychopatologii.
Struktura
[editovat | editovat zdroj]Insula je rozdělena do dvou částí: větší přední a menší zadní oblast, ve které bylo identifikováno více než dvanáct oblastí. Kortikální oblast překrývající insulu směrem k bočnímu povrchu mozku je operculum (překl. víko ). Operculum je tvořeno z částí obklopujících frontálních, temporálních a parietálních laloků.
Připojení
[editovat | editovat zdroj]Přední část insuly je rozdělena mělkými sulci do tří nebo čtyř krátkých gyri.
Přední insula přijímá přímou projekci z bazální části ventrálního středního jádra thalamu a zvláště velký vstup z centrálního jádra amygdaly. Kromě toho přední insula sama projektuje na amygdalu.
Jedna studie na opicích odhalila rozšířené vzájemné vazby mezi insulárním kortexem a téměř všemi subnuklei amygdaloidního komplexu. Zadní insula směřuje převážně k dorzálnímu aspektu laterálního a centrálního amygdaloidního jádra. Naproti tomu přední insulární projece směřuje k přední amygdaloidní oblasti, stejně jako k mediálnímu, kortikálnímu, pomocnému bazálnímu magnocelulárnímu, mediálnímu bazálnímu a laterálnímu amygdaloidnímu jádru.[1]
Zadní část insuly je tvořena tzv. dlouhým gyrem.
Zadní insula se vzájemně spojuje se sekundárním somatosenzorickým kortexem a přijímá vstup ze spinothalamicky aktivovaných ventrálních zadních horních thalamických jader. Bylo také prokázáno, že tato oblast přijímá vstupy z ventromediálního jádra (zadní část) thalamu, které jsou vysoce specializované na zprostředkování homeostatických informací, jako je bolest, teplota, svědění, místní stav kyslíku a smyslný dotek.[2]
Studie zaměřená na zobrazování neuroimagingu pomocí difuzního tenzoru ukázala, že přední insula je propojena s oblastmi v temporálním a okcipitálním laloku, operálním a orbitofrontálním kortexu, trojúhelníkových a operačních částech horního frontálního gyrusu. Stejná studie odhalila rozdíly v anatomickém spojení mezi levou a pravou hemisférou.[3]
Kruhový sulcus insuly (nebo Reilův sulcus[4] ) je půlkruhový sulcus[4] oddělující insulu od sousedních gyrů opercula[5] vpředu nahoře a vzadu.[4]
Cytoarchitektura
[editovat | editovat zdroj]Insulární kortex má oblasti variabilní buněčné struktury nebo cytoarchitektury, které se mění z granulované v zadní části na agranulární v přední části.insula také přijímá diferenciální kortikální a thalamický vstup podél své délky. John Allman a jeho kolegové ukázali, že přední insulární kortex obsahuje populaci neuronů, nazývanou vřetenové neurony. Tito jsou také nazvaní von Economovy neurony, identifikované jako charakteristika výrazného subregionu, agranulární frontální insuly.[6]
Vývoj
[editovat | editovat zdroj]Inzulární kortex je považován některými za samostatný lalok telencephalonu.[7] Jiné zdroje vidí insula jako součást temporálního laloku.[8] Někdy je také přiřazován k limbickým strukturám hluboko v mozku do limbického laloku. Jakožto paralimbická kůra se insulární kůra považuje za strukturu evolučněrelativně starou .
Funkce
[editovat | editovat zdroj]Multimodální smyslové zpracování, smyslová vazba
[editovat | editovat zdroj]Funkčně zobrazovací studie ukazují. že se insula aktivuje při úlohách audio-vizuální integrace.[9][10]
Sebevnímání
[editovat | editovat zdroj]Existují důkazy o tom, že kromě svých základních funkcí může insula hrát roli v určitých funkcích vyšší úrovně, které fungují pouze u lidí a ostatních hominidů. Vřetenové neurony , jež se nalézají ve vyšší hustotě v pravém frontálním insulárním kortexu, vyskytují se také v přední cingulární kůře, což je další oblast, která dosáhla vysoké úrovně specializace u velkých lidoopů. Někteří spekulovali, že tyto neurony jsou zapojeny do kognitivně–emocionálních procesů, jež jsou specifické pro primáty, včetně velkých lidoopů, jako je empatie a metakognitivní emocionální pocity. To je podpořeno funkčními zobrazovacími výsledky, které ukazují, že struktura a funkce pravé čelní inzuly koreluje se schopností cítit vlastní srdeční tep, nebo se vcítit do bolesti ostatních. Zdá se, že tyto funkce nejsou odlišné od funkcí insuly na nižší úrovni, ale vyvstávají v důsledku role insuly v předávání homeostatické informace do vědomí.[11][12] Pravá přední izolace napomáhá vzájemnému vnímání stavů těla, jako je schopnost měřit vlastní tep. Větší pravý přední ostrovní objem šedé hmoty navíc koreluje se zvýšenou přesností v tomto subjektivním smyslu vnitřního těla as negativním emocionálním prožitkem.[13] To je také zapojené do kontroly krevního tlaku,[14] zvláště během a po cvičení,[14] a jeho aktivita se mění s množstvím úsilí osoby věří, že on / ona je vyvíjející se.[15][16]
Význam
[editovat | editovat zdroj]Funkční neuroimagingový výzkum naznačuje, že insula je zapojena do dvou typů salience. Interoceptivní zpracování informací, které spojuje interoception s emocionálním výkyvem pro generování subjektivní reprezentace těla. To zahrnuje, nejprve, přední insulární kortex s pregenual předním cingulate kortexem ( Brodmann oblast 33 ) a přední a zadní střední cingulate cortices, a, za druhé, obecná síť salience zaujatá environmentálním sledováním, výběrem odezvy a orientací skeletomotorového těla. to zahrnuje všechny ostrovní kůry a střední cingulate kortex.[17]
Alternativní nebo možná doplňující návrh je ten, že pravý přední insulární reguluje interakci mezi významem selektivní pozornosti vytvořené k dosažení úkolu (dorzální systém pozornosti) a významem vzrušení vytvořeného tak, aby se zaměřil na relevantní část životního prostředí ( systém ventrální pozornosti).[18] Tato regulace vynalézavosti může být zvláště důležitá při náročných úkolech, kde může být únava únavná a způsobit tak neopatrné chyby, ale pokud je příliš mnoho vzrušení, riskuje to, že se stane špatným výkonem změnou v úzkost.[18]
Klinický význam
[editovat | editovat zdroj]Progresivní expresivní afázie
[editovat | editovat zdroj]Progresivní expresivní afázie je zhoršení funkce normálního jazyka, která způsobuje, že jednotlivci ztrácejí schopnost plynule komunikovat a zároveň jsou schopni porozumět jednotlivým slovům a neporušenému jinému ne-lingvistickému poznání. To je nalezené v paletě degenerativních neurologických stavů včetně Pickovy nemoci, nemoci motorického neuronu, kortikobasal degenerace, frontotemporal demence a Alzheimerovy nemoci. To je spojováno s hypometabolism[19] a atrofií levé přední insulární kůry.[20]
Závislost
[editovat | editovat zdroj]Řada funkčních studií zobrazujících mozek ukázala, že insulární kortex je aktivován, když jsou osoby užívající drogy vystaveny environmentálním pokynům, které vyvolávají chuť k jídlu. To bylo prokázáno u řady léčiv, včetně kokainu, alkoholu, opiátů a nikotinu. Navzdory těmto nálezům byla v literatuře o drogových závislostech ignorována izolace, možná proto, že není známo, že by byla přímým cílem mezokortikálního dopaminového systému, který je ústředním bodem současných teorií závislosti na závislosti na dopaminu. Výzkum publikovaný v roce 2007[21] ukázal, že kuřáci cigaret trpící poškozením ostrovní kůry, například mrtvicí, mají svou závislost na cigaretách prakticky vyloučeni. Bylo zjištěno, že tito jedinci jsou až 136krát více vystaveni narušení závislosti na kouření než kuřáci s poškozením v jiných oblastech. Narušení závislosti bylo doloženo vlastními změnami chování, jako je odvykání kouření méně než jeden den po poranění mozku, odvykání kouření s velkou lehkostí, opětovné kouření po odvykání od kouření a žádné nutkání pokračovat v kouření od ukončení kouření. Studie byla prováděna v průměru osm let po mrtvicích, což otevírá možnost, že vzpomínky by mohly ovlivnit výsledky.[22] Nedávnější prospektivní studie, které překonají toto omezení, potvrdily tato zjištění[23][24] Toto naznačuje významnou roli pro ostrovní kůru v neurologických mechanismech, které jsou základem závislosti na nikotinu a jiných drogách, a učinil by tuto oblast mozku možným cílem pro nové léky proti závislosti. Toto zjištění navíc naznačuje, že funkce zprostředkované izolací, zejména vědomé pocity, mohou být zvláště důležité pro udržení drogové závislosti, ačkoliv tento pohled není zastoupen v žádném moderním výzkumu ani v recenzích tohoto tématu.[25]
Nedávná studie na potkanech Contreras et al.[26] potvrzuje tato zjištění tím, že ukazuje, že reverzibilní inaktivace izolace narušuje amfetaminem podmíněné místo preferencí, zvířecí model touhy vyvolané cue. V této studii inaktivace izolací také narušila "malátnost" reakce na injekci chloridu lithného, což naznačuje, že reprezentace negativních interceptivních stavů izolací hraje roli v závislosti. V této studii se však upřednostňovala podmínka podmíněného místa bezprostředně po injekci amfetaminu, což naznačuje, že je to bezprostřední, příjemné interoceptivní působení podávání amfetaminu, spíše než opožděné, averzivní účinky abstinenčního amfetaminu, které jsou zastoupeny v izolaci..
Model navrhl Naqvi et al. (viz výše) je, že izolace uchovává reprezentaci příjemných interoceptivních účinků užívání drog (např. smyslové účinky nikotinu na dýchací cesty, kardiovaskulární účinky amfetaminu) a že tato reprezentace je aktivována expozicí narážkami, které byly dříve spojené s užíváním drog. Řada funkčních zobrazovacích studií ukázala, že během podávání léků zneužívajících léčiva se má aktivovat izolace. Několik funkčních zobrazovacích studií také prokázalo, že izolace je aktivována, když jsou uživatelé drog vystaveni návykům na léky, a že tato aktivita koreluje se subjektivními nutkáním. Ve studiích cue-exposure je aktivita isola vyvolána, když nedochází ke skutečné změně hladiny léčiva v těle. Namísto pouhého reprezentování interoceptivních účinků užívání léků, jak se vyskytuje, může hrát izolace roli v paměti pro příjemné interoceptivní účinky užívání drog v minulosti, očekávání těchto účinků v budoucnu nebo obojí. Taková reprezentace může vést k vědomým nutkáním, která mají pocit, jako by vycházely z těla. To může vést k tomu, že se závislí budou cítit, jako by jejich těla potřebovali užívat lék, a mohou mít za následek, že osoby s lézemi v hlášeních o insuficienci uvedou, že jejich těla zapomněla na nutkání používat podle této studie.
Subjektivní jistota při extatických záchvatech
[editovat | editovat zdroj]Společná kvalita v mystických zkušenostech je silný pocit jistoty, který nelze vyjádřit slovy. Fabienne Picard navrhuje neurologické vysvětlení této subjektivní jistoty, založené na klinickém výzkumu epilepsie. Podle Picarda, tento pocit jistoty může být způsoben dysfunkcí přední izolace, částí mozku, která je zapojena do interoception, sebereflexe a vyhýbání se nejistotě ohledně vnitřních reprezentací světa „předvídáním rozlišení“. nejistoty nebo rizika “. Toto vyhýbání se nejistotě funguje prostřednictvím srovnání předpokládaných stavů a skutečných stavů, tj. "Signalizace, že nerozumíme, tj. Že existuje nejednoznačnost."[27] Picard poznamenává, že "pojem vhledu je velmi blízký pojmu jistoty" a odkazuje na Archimédovu "Eureku!"[28][29] Picard předpokládá, že během extatických záchvatů srovnání mezi předpokládanými stavy a skutečnými stavy již nefunguje a že nesoulad mezi předpokládaným stavem a skutečným stavem již není zpracováván, blokuje „negativní emoce a negativní vzrušení vyplývající z prediktivní nejistoty“, která bude prožívána jako emocionální důvěru.[30] Picard dospěl k závěru, že "jeho vedení může vést k duchovní interpretaci v některých jedincích."[30]
Jiné klinické stavy
[editovat | editovat zdroj]Předpokládá se, že insulární kortex má úlohu v úzkostných poruchách,[31] poruchách regulace emoce[32] a mentální anorexii.[33]
Historie
[editovat | editovat zdroj]Insula byla poprvé popsána Johannem Christianem Reilem při popisu kraniálních a spinálních nervů a plexi.[34] Henry Gray v Grayově anatomii je zodpovědný za to, že je znám jako ostrov Reil.[34]
Další obrázky
[editovat | editovat zdroj]-
Insula levé strany, odkrytá odstraněním operkuly.
-
Koronální řez přes přední kornu laterálních komor.
-
Horizontální řez levou mozkovou hemisférou.
Příbuzná témata
[editovat | editovat zdroj]- Seznam oblastí v lidském mozku
Reference
[editovat | editovat zdroj]- ↑ MUFSON, E; MESULAM, M; PANDYA, D. Insular interconnections with the amygdala in the rhesus monkey. Neuroscience. 1 July 1981, s. 1231–1248. Dostupné online. DOI 10.1016/0306-4522(81)90184-6. PMID 6167896.
- ↑ Craig AD, Chen K, Bandy D, Reiman EM. Thermosensory activation of insular cortex. Nat. Neurosci.. 2000, s. 184–90. DOI 10.1038/72131. PMID 10649575.
- ↑ JAKAB, A; MOLNAR, P; BOGNER, P; BERES, M; BERENYI, E. Connectivity-based parcellation reveals interhemispheric differences in the insula. Brain Topography. 1 Oct 2011, s. 264–271. Dostupné online. DOI 10.1007/s10548-011-0205-y. PMID 22002490.[nedostupný zdroj]
- ↑ a b c Atlas and textbook of human anatomy / by Johannes ... v. 3. Sobotta, Johannes, 1869-1945. [online]. Dostupné online.
- ↑ medilexicon.com - circular sulcus of insula [online]. [cit. 2019-08-30]. Dostupné v archivu pořízeném dne 2013-06-04.
- ↑ BAUERNFEIND A. A volumetric comparison of the insular cortex and its subregions in primates. Human Evolution. April 2013, s. 263–279. DOI 10.1016/j.jhevol.2012.12.003. PMID 23466178.<
- ↑ Brain Archivováno 28. 10. 2009 na Wayback Machine., MSN Encarta. 2009-10-31.
- ↑ [s.l.]: [s.n.] ISBN 978-0-7167-5300-1.
- ↑ BUSHARA, KO; GRAFMAN, J; HALLETT, M. Neural correlates of auditory-visual stimulus onset asynchrony detection.. The Journal of Neuroscience. 1 January 2001, s. 300–4. DOI 10.1523/JNEUROSCI.21-01-00300.2001. PMID 11150347.
- ↑ BUSHARA, KO; HANAKAWA, T; IMMISCH, I; TOMA, K; KANSAKU, K; HALLETT, M. Neural correlates of cross-modal binding.. Nature Neuroscience. February 2003, s. 190–5. DOI 10.1038/nn993. PMID 12496761.
- ↑ Benedetto De Martino; DHARSHAN KUMARAN; BEN SEYMOUR; RAYMOND J. DOLAN. Frames, Biases, and Rational Decision-Making in the Human Brain. Science. August 2006, s. 684–687. DOI 10.1126/science.1128356. PMID 16888142. Bibcode 2006Sci...313..684D.
- ↑ Gui Xue; ZHONGLIN LU; IRWIN P. LEVIN D; ANTOINE BECHARA. The impact of prior risk experiences on subsequent risky decision-making: The role of the insula. NeuroImage. 2010, s. 709–716. DOI 10.1016/j.neuroimage.2009.12.097. PMID 20045470.
- ↑ Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Neural systems supporting interoceptive awareness. Nat. Neurosci.. February 2004, s. 189–95. DOI 10.1038/nn1176. PMID 14730305.
- ↑ a b Lamb K, Gallagher K, McColl R, Mathews D, Querry R, Williamson JW. Exercise-induced decrease in insular cortex rCBF during postexercise hypotension. Med Sci Sports Exerc. April 2007, s. 672–9. Dostupné online. DOI 10.1249/mss.0b013e31802f04e0. PMID 17414805.
- ↑ Williamson JW, McColl R, Mathews D, Mitchell JH, Raven PB, Morgan WP. Hypnotic manipulation of effort sense during dynamic exercise: cardiovascular responses and brain activation. J. Appl. Physiol.. April 2001, s. 1392–9. Dostupné online. DOI 10.1152/jappl.2001.90.4.1392. PMID 11247939.
- ↑ Williamson JW, McColl R, Mathews D, Ginsburg M, Mitchell JH. Activation of the insular cortex is affected by the intensity of exercise. J. Appl. Physiol.. September 1999, s. 1213–9. Dostupné online. DOI 10.1152/jappl.1999.87.3.1213. PMID 10484598.
- ↑ Taylor KS, Seminowicz DA, Davis KD. Two systems of resting state connectivity between the insula and cingulate cortex. Hum Brain Mapp. September 2009, s. 2731–45. DOI 10.1002/hbm.20705. PMID 19072897.
- ↑ a b Eckert MA, Menon V, Walczak A, Ahlstrom J, Denslow S, Horwitz A, Dubno JR. At the heart of the ventral attention system: the right anterior insula. Hum. Brain Mapp.. 2009, s. 2530–41. DOI 10.1002/hbm.20688. PMID 19072895.
- ↑ Nestor PJ, Graham NL, Fryer TD, Williams GB, Patterson K, Hodges JR. Progressive non-fluent aphasia is associated with hypometabolism centred on the left anterior insula. Brain. November 2003, s. 2406–18. Dostupné online. DOI 10.1093/brain/awg240. PMID 12902311.
- ↑ Gorno-Tempini ML, Dronkers NF, Rankin KP, etal. Cognition and anatomy in three variants of primary progressive aphasia. Annals of Neurology. March 2004, s. 335–46. DOI 10.1002/ana.10825. PMID 14991811.
- ↑ Nasir H. Naqvi; DAVID RUDRAUF; HANNA DAMASIO; ANTOINE BECHARA. Damage to the Insula Disrupts Addiction to Cigarette Smoking. Science. January 2007, s. 531–4. Dostupné online. DOI 10.1126/science.1135926. PMID 17255515. Bibcode 2007Sci...315..531N.
- ↑ Vorel SR, Bisaga A, McKhann G, Kleber HD. Insula damage and quitting smoking. Science. July 2007, s. 318–9; author reply 318–9. Dostupné online. DOI 10.1126/science.317.5836.318c. PMID 17641181.
- ↑ SUNER-SOLER, R. Smoking Cessation 1 Year Poststroke and Damage to the Insular Cortex. Stroke. 2011, s. 131–136. DOI 10.1161/STROKEAHA.111.630004. PMID 22052507.
- ↑ GAZNICK, N. Basal Ganglia Plus Insula Damage Yields Stronger Disruption of Smoking Addiction Than Basal Ganglia Damage Alone. Nicotine. 2013, s. 445–453. DOI 10.1093/ntr/ntt172. PMID 24169814.
- ↑ HYMAN, Steven E. Addiction: A Disease of Learning and Memory. Am J Psychiatry. 2005-08-01, s. 1414–22. Dostupné online. DOI 10.1176/appi.ajp.162.8.1414. PMID 16055762.
- ↑ Marco Contreras; FRANCISCO CERIC; FERNANDO TORREALBA. Inactivation of the Interoceptive Insula Disrupts Drug Craving and Malaise Induced by Lithium. Science. January 2007, s. 655–8. Dostupné online. DOI 10.1126/science.1145590. PMID 17962567. Bibcode 2007Sci...318..655C.
- ↑ Picard 2013, p.2496-2498
- ↑ Picard 2013, p.2497-2498
- ↑ See also satori in Japanese Zen
- ↑ a b Picard 2013, p.2498
- ↑ Paulus MP, Stein MB. An insular view of anxiety. Biol. Psychiatry. August 2006, s. 383–7. Dostupné online. DOI 10.1016/j.biopsych.2006.03.042. PMID 16780813.
- ↑ Thayer JF, Lane RD. A model of neurovisceral integration in emotion regulation and dysregulation. J Affect Disord. December 2000, s. 201–16. Dostupné online. DOI 10.1016/S0165-0327(00)00338-4. PMID 11163422.
- ↑ Gaudio S, Wiemerslage L, Brooks SJ, Schiöth HB. A systematic review of resting-state functional-MRI studies in anorexia nervosa: Evidence for functional connectivity impairment in cognitive control and visuospatial and body-signal integration.. Neurosci Biobehav Rev. 2016, s. 578–589. DOI 10.1016/j.neubiorev.2016.09.032. PMID 27725172.
- ↑ a b Binder DK, Schaller K, Clusmann H. The seminal contributions of Johann-Christian Reil to anatomy, physiology, and psychiatry. Neurosurgery. November 2007, s. 1091–6; discussion 1096. Dostupné online. DOI 10.1227/01.neu.0000303205.15489.23. PMID 18091285.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Insulární kortex na Wikimedia Commons
Obrázky, zvuky či videa k tématu Insulární kortex na Wikimedia Commons