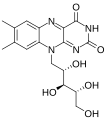
Flavin adenin-dinukleotid
| Flavin adenin-dinukleotid | |
|---|---|
   | |
| Općenito | |
| Hemijski spoj | Flavin adenin-dinukleotid |
| Druga imena | FAD |
| Molekularna formula | C27H33P2N9O15 |
| CAS registarski broj | 146-14-5 |
| SMILES | c12cc(C)c(C)cc1N=C3C(=O)NC(=O)N=C3N2C[C@H](O)[C@H](O)[C@H](O)COP(=O)(O)OP(=O)(O)OC[C@@H]4[C@@H](O)[C@@H](O)[C@@H](O4)n5cnc6c5ncnc6N |
| InChI | 1S/C27H33N9O15P2/c1-10-3-12-13(4-11(10)2)35(24-18(32-12)25(42)34-27(43)33-24)5-14(37)19(39)15(38)6-48-52(44,45)51-53(46,47)49-7-16-20(40)21(41)26(50-16)36-9-31-17-22(28)29-8-30-23(17)36/h3-4,8-9,14-16,19-21,26,37-41H,5-7H2,1-2H3,(H,44,45)(H,46,47)(H2,28,29,30)(H,34,42,43)/t14-,15+,16+,19-,20+,21+,26+/m0/s1 |
| Kratki opis | Bijeli prozirni kristali |
| Osobine1 | |
| Molarna masa | 785,157 g/mol |
| Agregatno stanje | Čvrsto |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
U biohemiji, flavin adenin dinukleotid (FAD) je redoks-aktivni koenzim povezan s raznim proteinima, koji je uključen u nekoliko enzimskih reakcija u metabolizmu. Flavoprotein je protein koji sadrži flavinsku grupu, koja može biti u obliku FAD ili flavin-mononukleotida (FMN). Poznati su mnogi flavoproteini: komponente kompleksa sukcinat dehidrogenaze, α-ketoglutarat dehidrogenaze i komponenta kompleksa piruvat dehidrogenaze.
FAD može postojati u četiri redoks stanja, a to su flavin-N(5)-oksid, kinon, semikinon i hidrokinon.[1] FAD se pretvara između ovih stanja prihvatanjem ili doniranjem elektrona. FAD, u svom potpuno oksidiranom obliku, ili kinonskom obliku, prihvata dva elektrona i dva protona da postane FADH2 (hidrokinonski oblik). Semikinon (FADH2) može nastati ili redukcijom FAD-a ili oksidacijom FADH2 prihvatanjem ili doniranjem jednog elektrona, odnosno jednog protona. Neki proteini, međutim, stvaraju i održavaju superoksidirani oblik flavin-kofaktora, flavin-N(5)-oksida.[2][3]
Historija
[uredi | uredi izvor]Flavoproteini su prvi put otkriveni 1879., odvajanjem komponenti kravljeg mlijeka. U početku su ih zvali laktohrom zbog svog mliječnog porijekla i žutog pigmenta.[4] Znanstvenoj zajednici trebalo je 50 godina da postigne značajan napredak u identificiranju molekula odgovornih za žuti pigment. 1930-ih godina pokrenuto je polje istraživanja koenzima, objavljivanjem mnogih flavina i nikotinamidnih derivatnih struktura i njihovih obaveznih uloga u redoks katalizi. Njemački znanstvenici Otto Warburg i Walter Christian otkrili su 1932. žuti protein iz kvasca koji je potreban za ćelijsko disanje. Njihov kolega Hugo Theorell odvojio je ovaj žuti enzim kod apoenzima i žutog pigmenta, te je pokazalo da ni enzim ni pigment nisu sposobni sami oksidirati NADH, ali bi njihovo zajedničko miješanje obnovilo aktivnost. Theorell je potvrdio da je pigment riboflavin fosfatni ester, flavin-mononukleotid (FMN) 1937., što je bio prvi izravni dokaz za enzimske kofaktore.[5] Warburg i Christian su zatim otkrili da je FAD kofaktor D-aminokiselinske oksidaze u sličnim eksperimentima, 1938.[6] Warburgov rad na povezivanju nikotinamida sa hidridnim transferima i otkrićem flavina otvorio je put mnogim naučnicima 40-ih i 50-ih godina da otkriju obilne količine redoksne biohemije i povežu ih zajedno na puteve kao što su ciklus limunske kiseline i sinteza ATP.
Svojstva
[uredi | uredi izvor]Flavin adenin-dinukleotid sastoji se od dva dijela: adenin-nukleotid (adenozin-monofosfat) i flavin-mononukleotid (FMN) premoštenih zajedno preko fosfatne grupe. Adenin je vezan za cikličku ribozu na 1' ugljiku, dok je fosfat vezan za ribozu na 5' ugljiku da bi formirao adenin-nukledotid . Riboflavin nastaje vezom ugljik-dušik (C-N) između izoaloksazina i ribitola. Fosfatna grupa se zatim vezuje za terminalni ugljik riboze, formirajući FMN. Budući da se veza između izoaloksazina i ribitola ne smatra glikozidnom vezom, flavin-mononukleotid nije istinski nukleotid.[7] Ovo čini naziv dinukleotida pogrešnim; međutim, flavin-mononukleotidna grupa je još uvijek vrlo bliska nukleotidu po svojoj strukturi i hemijskim svojstvima.


FAD se može reducirati na FADH2 dodavanjem 2 H+ i 2 e–. FADH2 također može biti oksidiran, gubitkom 1 H+ i 1 e– da bi se formirao FADH. FAD obrazac može se ponovo kreirati kroz dalji gubitak 1 H+ i 1 e–. Do stvaranja FAD-a može doći i redukcijom i dehidracijom flavin-N(5)-oksida.[8] Na osnovu oksidacijskog stanja, flavini poprimaju određene boje kada su u vodenom rastvoru. Flavin-N(5)-oksid (superoksidiran) je žuto-narandžast, FAD (potpuno oksidiran) je žut, FADH (polureduciran) je ili plav ili crven na osnovu pH, a potpuno redukovana forma je bezbojna.[9][10] Promjena oblika može imati veliki uticaj na ostala hemijska svojstva. Naprimjer, FAD, potpuno oksidirani oblik je podložan nukleofilnom napadu, potpuno redukovani oblik, FADH2 ima visoku polarizabilnost, dok je poluredukovani oblik nestabilan u vodenom rastvoru.[11] FAD je sistem aromatskih prstenova, dok FADH2 nije.[12] To znači da FADH2 ima znatno više energije, bez stabilizacije kroz rezonanciju koju aromatska struktura pruža. FADH2 je molekula koji nosi energiju, jer nakon oksidacije ponovo dobija aromatičnost i oslobađa energiju koju predstavlja ova stabilizacija.
Spektroskopska svojstva FAD-a i njegovih varijanti omogućavaju praćenje reakcije upotrebom UV-VIS apsorpcija i fluorescencentna spektroskopija. Svaki oblik FAD-a ima različite spektre apsorpcije, što olakšava posmatranje promjena u oksidacijskom stanju.[11] Glavni lokalni maksimum apsorpcije za FAD je uočen na 450 nm, sa koeficijentom ekstinkcije od 11.300 M−1cm−1.[13] Flavini općenito imaju fluorescentnu aktivnost kada su nevezani (proteini vezani za derivate nukleinske kiseline flavina nazivaju se flavoproteini). Ovo svojstvo može se koristiti kada se ispituje vezivanje proteina, posmatrajući gubitak fluorescentne aktivnosti kada se stavi u vezano stanje.[9]
Hemijska stanja
[uredi | uredi izvor]U biološkim sistemima, FAD djeluje kao akceptor H+ i e– u svom potpuno oksidiranom obliku, akceptor ili donor u FADH obliku i donor u reduciranom obliku. FADH2 obrazac. Dijagram u nastavku sumira potencijalne promjene koje može proći.
Zajedno sa gore navedenim, mogu se formirati i konzumirati i drugi reaktivni oblici FAD-a. Ove reakcije uključuju prijenos elektrona i stvaranje/razbijanje hemijskih veza. Kroz reakcione mehanizme, FAD je u stanju da doprinese hemijskim aktivnostima unutar bioloških sistema. Sljedeće slike prikazuju opće oblike nekih radnji u koje FAD može biti uključen.
Mehanizmi 1 i 2 predstavljaju hidridnu dobit, u kojoj molekula dobija ono što iznosi jedan hidridni ion. Mehanizmi 3 i 4 formiranje radikala i hibridni gubitak. Radikalne vrste sadrže nesparene atome elektrona i veoma su hemijski aktivne. Gubitak hidrida je inverzni proces povećanja hidrida koji smo ranije vidjeli. Poslednja dva mehanizma pokazuju nukleofilnu adiciju i reakciju koja koristi ugljični radikal.






Biosinteza
[uredi | uredi izvor]FAD ima glavnu ulogu kao enzimski kofaktor zajedno sa flavin-mononukleotidom, još jednom molekulom koja potiče od riboflavina.[8] Bakterije, gljive i biljke mogu proizvoditi riboflavin, ali drugi eukarioti, kao što su ljudi, izgubili su sposobnost da ga naprave.[9] Stoga, ljudi moraju dobiti riboflavin, također poznat kao vitamin B2, iz izvora ishrane.[14] Riboflavin se generalno unosi u tanko crijevo, a zatim se transportuje do ćelija putem proteina nosača.[9] Riboflavin-kinaza (EC 2.7.1.26) dodaje fosfatnu grupu riboflavinu da bi proizveo flavin-mononukleotid, a zatim FAD-sintetaza vezuje adenin nukleotid; oba koraka zahtijevaju ATP.[9] Bakterije općenito imaju jedan bifunkcionalni enzim, ali Archaea i eukarioti obično koriste dva različita enzima.[9] Dosadašnja istraživanja pokazuju da različite izoforme postoje u citosolu i mitohondrijama.[9] Čini se da je FAD sintetizirano na obje lokacije i potencijalno transportirano gdje je potrebno.[11]
Funkcija
[uredi | uredi izvor]Flavoproteini koriste jedinstvenu i raznovrsnu strukturu flavinskih dijelova da kataliziraju teške redoks reakcije. Budući da flavini imaju više redoks stanja, mogu učestvovati u procesima koji uključuju prijenos jednog ili dva elektrona, atoma vodika ili hidronijevog iona. N5 i C4a potpuno oksidovanog flavinskog prstena su takođe podložni nukleofilnom napadu.[15] Ova široka raznolikost ionizacije i modifikacije flavinskog dijela može se pripisati sistemu izoaloksazinskih prstenova i sposobnosti flavoproteina da drastično remete kinetičke parametre flavina nakon vezivanja, uključujući flavin adenin-dinukleotid (FAD).
Broj gena za kodiranje sinteze flavina zavisnih od proteina u genomu (flavoproteom) zavisi od vrste i može se kretati od 0,1% – 3,5%, pri čemu ljudi imaju 90 gena kodiranja flavoproteina.[16] FAD je složeniji i bogatiji oblik flavina i navodi se da se vezuje za 75% ukupnog flavoproteoma[16] i 84% flavoproteina kodiranih kod ljudi.[17] Prijavljene su ćelijske koncentracije slobodnih ili nekovalentno vezanih flavina u različitim kultiviranim ćelijskim linijama sisara za FAD (2,2-17,0 amol/ćeliju) i FMN (0,46-3,4 amol/ćeliju).).[18]
FAD ima pozitivniji redukcioni potencijal od NAD+ i veoma je jak oksidans. Ćelija to koristi u mnogim energetski teškim reakcijama oksidacije kao što je dehidrogenacija C-C veze na alkenu. FAD-ovisni proteini funkcionišu u velikom broju metaboličkih puteva uključujući transport elektrona, popravku DNK, biosintezu nukleotida, beta-oksidaciju masnih kiselina, katabolizam aminokiselina, kao i sintezu drugih kofaktora kao što su CoA, CoQ i hem grupe. Jedna dobro poznata reakcija je dio ciklusa limunske kiseline (također poznat kao TCA ili Krebsov ciklus); sukcinat-dehidrogenaza (kompleks II u lancu transporta elektrona) zahtijeva kovalentno vezan FAD da katalizira oksidaciju sukcinata u fumarat, spajanjem sa redukcijom ubikinona do ubikinola.[11] Visokoenergetski elektroni iz ove oksidacije se trenutno pohranjuju, redukcijom FAD u FADH2. FADH2 se zatim vraća u FAD, šaljući svoja dva elektrona visoke energije kroz lanac transporta elektrona; energija u FADH2 je dovoljna da proizvede 1,5 ekvivalenata ATP[19] oksidativnom fosforilacijom. Neki redoks flavoproteini se nekovalentno vezuju za FAD poput acetil-CoA-dehidrogenaze koji su uključeni u beta-oksidaciju masnih kiselina i katabolizam aminokiselina poput leucina (izovaleril-CoA dehidrogenaza), izoleucin, (acil-CoA dehidrogenaza kratkog/razgranatog lanca), valin (izobutiril-CoA dehidrogenaza) i lizin (glutaril- CoA dehidrogenaza).[20] Dodatni primjeri enzima zavisnih od FAD-a koji reguliraju metabolizam su glicerol-3-fosfat dehidrogenaza (sinteza triglicerida) i ksantin-oksidaza uključeni u katabolizam purinskih nukleotida[21] Nekatalitske funkcije koje FAD može imati u flavoproteinima uključuju strukturne uloge ili uključene u svjetlo osjetljivo na plavo fotoreceptore koji reguliraju biološke satove i razvoj, stvaranje svjetlosti u bioluminiscentnim bakterijama.[20]
Flavoproteini
[uredi | uredi izvor]Flavoproteini imaju ili FMN ili FAD molekulu kao prostetsku grupu, koja može biti čvrsto vezana ili kovalentno povezana. Samo oko 5–10% flavoproteina ima kovalentno povezan FAD, ali ovi enzimi imaju jaču redoksnu moć.[11] U nekim slučajevima, FAD može pružiti strukturnu podršku za aktivna mjesta ili osigurati stabilizaciju intermedijara tokom kataliza.[20] Na osnovu dostupnih strukturnih podataka, poznata mjesta vezana za FAD mogu se podijeliti u više od 200 tipova.[22]
U ljudskom genomu, kodirano je 90 flavoproteina; oko 84% zahtijeva FAD, a oko 16% zahtijeva FMN, dok 5 proteina zahtijeva da oba budu prisutna.[17] Flavoproteini se uglavnom nalaze u mitohondrijama zbog njihove redoks moći.[17] Od svih flavoproteina, 90% vrši redoksne reakcije, a ostalih 10% su transferaze, lijaze, izomeraze, ligaze.[16]
Oksidacija ugljenik-heteroatom veza
[uredi | uredi izvor]Ugljik–dušik
[uredi | uredi izvor]Monoamin-oksidaza (MAO) je opširno proučavani flavoenzim zbog njegove biološke važnosti za katabolizam noradrenalina, serotonina i dopamina. MAO oksidira primarne, sekundarne i tercijarne amine, koji neenzimski hidroliziraju iz imina u aldehid ili keton. Iako je ova klasa enzima opširno proučavana, njen mehanizam djelovanja se još uvijek raspravlja. Predložena su dva mehanizma: radikalni mehanizam i nukleofilni mehanizam. Radikalni mehanizam je manje općenito prihvaćen jer ne postoje spektarski ili elektronskoparamagnetno rezonancijski dokazi za prisustvo radikalnog intermedijera. Nukleofilni mehanizam je više favorizovan jer je podržan od strane studija mutageneze usmjerene na mjesto koje su mutirale dva ostatka tirozina za koje se očekivalo da će povećati nukleofilnost supstrata.[23]
Ugljik–kisik
[uredi | uredi izvor]Glukoza-oksidaza (GOX) katalizuje oksidaciju β-D-glukoze u D-glukono-δ-lakton, uz istovremenu redukciju flavina vezanog za enzim. GOX postoji kao homodimer, pri čemu svaka podjedinica vezuje jednu moledkulu FAD-a. Kristalne strukture pokazuju da se FAD vezuje u dubokom džepu enzima blizu sučelja dimera. Studije su pokazale da je nakon zamjene FAD-a sa 8-hidroksi-5-karba-5-deaza FAD-a, stereohemija reakcije određena reakcijom sa re face flavina. U toku obrta primećuju se neutralni i anionski semikinoni što ukazuje na radikalan mehanizam.[23]
Ugljik–sumpor
[uredi | uredi izvor]Prenilcistein-lijaza (PCLaza) katalizira cijepanje prenilcisteina (modifikacija proteina) kako bi se formirao izoprenoidni aldehid i oslobođeni cisteinski ostatak na proteinskoj meti. FAD je nekovalentno vezan za PCLase. Nije rađeno mnogo mehaničkih studija koje su proučavale reakcije flavina, ali predloženi mehanizam je prikazan u nastavku. Predlaže se hibridni transfer sa C1 prenil grupe na FAD, što rezultira redukcijom flavina u FADH2. COFORMED je karbokation koji je stabiliziran susjednim atomom sumpora. FADH2 zatim reaguje sa molekulskim kisikom, kako bi obnovio oksidovani enzim.[23]
Ugljik–ugljik
[uredi | uredi izvor]UDP-N-acetilenolpiruvilglukozamin reduktaza (MurB) je enzim koji katalizuje nikotinamid adenin-dinukleotid fosfat-zavisnu redukciju enolpiruvil-UDP-N-acetilglukozamina (odgovarajućeg jedinjenja UDP-Nlac-) u acetilmuramsku kiselinu (proizvod). MurB je monomer i sadrži jednu FAD molekulu. Prije nego što se supstrat može pretvoriti u proizvod, NADPH prvo mora smanjiti FAD. Jednom kada se NADP+ disocira, supstrat se može vezati, a smanjeni flavin može smanjiti proizvod.[23]
Hemija tiola/disulfida
[uredi | uredi izvor]Glutation-reduktaza (GR) katalizuje redukciju glutation-disulfida (GSSG) u glutation (GSH). GR zahtijeva FAD i NADPH da olakša ovu reakciju; prvo hibrid mora biti prebačen sa NADPH na FAD. Redukovani flavin tada može djelovati kao nukleofil za napad na disulfid, što stvara C4a-cisteinski adukt. Eliminacija ovog adukta rezultira kompleksom flavin-tiolatnog prijenosa naboja.[23]
Reakcije transporta elektrona
[uredi | uredi izvor]Enzimi tipa citohroma P450 koji katalizuju reakcije monooksigenaze (hidroksilacije) ovise o prijenosu dva elektrona sa FAD-a na P450. Dva tipa sistema P450 nalaze se kod eukariota. P450 sistemi koji se nalaze u endoplazmatskom retikulumu zavise od citohrom P-450 reduktaze (CPR) koji sadrži i FAD i FMN. Dva elektrona na smanjenom FAD-u (FADH2) prenose se jedan po jedan na FMN, a zatim se jedan elektron prenosi od FMN do hemskog P450.[24]
Sistemi P450 koji se nalaze u mitohondrijama zavise od dva proteina za prenos elektrona: FAD koji sadrži adrenodoksin-reduktazu (AR) i malu grupu gvožđa i sumpora koja sadrži protein pod nazivom adrenodoksin. FAD je ugrađen u domen AR-a koji vezuje FAD.[25][26] FAD AR-a reducira se na FADH2 prijenosom dva elektrona iz NADPH koji se vezuje za NADP-vezujući domen AR. Struktura ovog enzima je visoko konzervirana, kako bi se precizno održio poravnanje donora elektrona NADPH i akceptora FAD za efikasan prijenos elektrona.[26] Dva elektrona u smanjenom FAD-u prenose se jedanput na adrenodoksin koji zauzvrat donira jedan elektron hem grupi mitohondrija P450.[27] Strukture mikrosomske reduktaze naspram reduktaze mitohondrijskog P450 sistema su potpuno različite i ne pokazuju nikakvu homologiju.[24]
ORP
[uredi | uredi izvor]p-Hidroksibenzoat-hidroksilaza (PHBH) katalizuje oksigenaciju p-hidroksibenzoata (pOHB) u 3,4-dihidroksibenzoat (3,4-diOHB); Za ovu reakciju su potrebni FAD, NADPH i molekulski kisik. NADPH prvo prenosi hidridni ekvivalent FAD-u, stvarajući FADH–, a zatim se NADP+ odvaja od enzima. Redukovani PHBH zatim reaguje sa molekulskim kisikom da bi se formirao flavin-C(4a)-hidroperoksid. Flavin hidroperoksid brzo hidroksilira pOHB, a zatim eliminira vodu da bi regenerirao oksidirani flavin.[23] Alternativni mehanizam oksigenacije posredovan flavinom uključuje korištenje flavina -N(5)-oksida, umjesto flavin-C(4a)-(hidro)peroksida.[2][3]
Neredoks
[uredi | uredi izvor]Chorismatova sintaza (CS) katalizira posljednji korak u shikimate putu—formiranje chorismate. Poznate su dve klase CS, od kojih obe zahtevaju FMN, ali su podijeljene po potrebi za NADPH kao redukcionim agensom. Predloženi mehanizam za CS uključuje radikalne vrste. Radikalna vrsta flavina nije otkrivena spektroskopski bez upotrebe analoga supstrata, što sugerira da je kratkotrajna. Međutim, kada se koristi fluorirani supstrat, otkriven je neutralni flavin-semikinon.[23]
Klinički značaj
[uredi | uredi izvor]Bolesti vezane za flavoproteine
[uredi | uredi izvor]Zbog važnosti flavoproteina, nije iznenađujuće da otprilike 60% ljudskih flavoproteina uzrokuje ljudske bolesti kada mutira.[17] U nekim slučajevima, to je zbog smanjenog afiniteta za FAD ili FMN i tako višak unosa riboflavina može smanjiti simptome bolesti, kao što je višestruki nedostatak acil-CoA dehidrogenaze.[9] Osim toga, sam nedostatak riboflavina (i rezultirajući nedostatak FAD-a i FMN-a) može uzrokovati zdravstvene probleme.[9] Naprimjer, u ALS pacijenata, postoji smanjen nivo sinteze FAD-a.[9] Oba ova puta mogu rezultirati raznim simptomima, uključujući razvojne ili gastrointestinalne abnormalnosti, neispravnu razgradnju masti, anemiju, neurološke probleme, rak ili srčanu bolest, migrenu, pogoršanje vida i d lezije kože.[9] Farmaceutska industrija stoga proizvodi riboflavin kao dodatak ishrani u određenim slučajevima. U 2008. godini, globalna potreba za riboflavinom iznosila je 6.000 tona godišnje, sa proizvodnim kapacitetom od 10.000 tona.[4] Ovo tržište vrijedno 150 do 500 miliona dolara nije samo za medicinske primjene, već se koristi i kao dodatak hrani za životinje u poljoprivrednoj industriji i kao prehrambene boje.[4]
Dizajn lijekova
[uredi | uredi izvor]Novi dizajn antibakterijskih lijekova je od kontinuiranog značaja u naučnim istraživanjima jer raste otpornost bakterija na na uobičajene antibiotike. Specifičan metabolički protein koji koristi FAD (kompleks II) je od vitalnog značaja za virulenciju bakterija, pa bi ciljanje sinteze FAD-a ili stvaranje analoga FAD-a moglo biti korisno područje istraživanja.[28] Već su utvrđene dvije strukture koje FAD obično pretpostavlja kada se veže: ili produžena ili leptirska konformacija, u kojoj se molekula u suštini savija na pola, što rezultira slaganjem adenina i izoaloksazinskih prstenova.[14] Imitatori FAD-a koji su u stanju da se vežu na sličan način, ali ne dozvoljavaju funkciju proteina, mogli bi biti korisni mehanizmi inhibicije bakterijske infekcije.[14] Alternativno, lijekovi koji blokiraju sintezu FAD-a mogu postići isti cilj; ovo je posebno intrigantno jer se ljudska i bakterijska sinteza FAD-a oslanjaju na vrlo različite enzime, što znači da lijek napravljen za ciljanje bakterijske FAD sintaze vjerojatno neće ometati enzime sintaze FAD-a čovjeka.[29]
Optogenetika
[uredi | uredi izvor]Optogenetika omogućava kontrolu bioloških događaja na neinvazivan način.[30] Polje je napredovalo posljednjih godina s brojnim novim alatima, uključujući one za aktiviranje osjetljivosti na svjetlost, kao što su FAD domeni koji koriste plavo svjetlo (BLUF). BLUF kodiraju sekvencu od 100 do 140 aminokiselina koja je izvedena iz fotoreceptora u biljkama i bakterijama.[30] Slično drugim fotoreceptori, svjetlost uzrokuje strukturne promjene u BLUF domena koja rezultira prekidom nizvodnih interakcija.[30] Trenutna istraživanja istražuju proteine sa dodanim BLUF domenom i kako različiti vanjski faktori mogu utjecati na proteine.[30]
Praćenje tretmana
[uredi | uredi izvor]Postoji veliki broj molekula u tijelu koji imaju nativnu fluorescenciju uključujući triptofan, kolagen, FAD, NADH i porfirine.[31] Naučnici su to iskoristili za praćenje progresije bolesti ili efikasnosti liječenja ili za pomoć u dijagnozi. Naprimjer, nativna fluorescencija FAD-a i NADH varira u normalnom tkivu i oralna submukozna fibroza oralnoj submukoznoj fibrozi, što je rani znak invazivnog oralnog karcinoma.[31] Ljekari stoga koriste fluorescenciju za pomoć u dijagnostici i praćenje liječenja za razliku od standardnih biopsija.[31]
Dodatne slike
[uredi | uredi izvor]-
FADH2
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Teufel, Robin; Agarwal, Vinayak; Moore, Bradley S. (1. 4. 2016). "Unusual flavoenzyme catalysis in marine bacteria". Current Opinion in Chemical Biology. 31: 31–39. doi:10.1016/j.cbpa.2016.01.001. ISSN 1879-0402. PMC 4870101. PMID 26803009.
- ^ a b Teufel, R; Miyanaga, A; Michaudel, Q; Stull, F; Louie, G; Noel, JP; Baran, PS; Palfey, B; Moore, BS (28. 11. 2013). "Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement". Nature. 503 (7477): 552–6. Bibcode:2013Natur.503..552T. doi:10.1038/nature12643. PMC 3844076. PMID 24162851.
- ^ a b Teufel, Robin; Stull, Frederick; Meehan, Michael J.; Michaudel, Quentin; Dorrestein, Pieter C.; Palfey, Bruce; Moore, Bradley S. (1. 7. 2015). "Biochemical Establishment and Characterization of EncM's Flavin-N5-oxide Cofactor". Journal of the American Chemical Society. 137 (25): 8078–8085. doi:10.1021/jacs.5b03983. ISSN 1520-5126. PMC 4720136. PMID 26067765.
- ^ a b c Abbas CA, Sibirny AA (Jun 2011). "Genetic control of biosynthesis and transport of riboflavin and flavin nucleotides and construction of robust biotechnological producers". Microbiology and Molecular Biology Reviews. 75 (2): 321–60. doi:10.1128/mmbr.00030-10. PMC 3122625. PMID 21646432.
- ^ Hayashi H (2013). B Vitamins and Folate: Chemistry, Analysis, Function and Effects. Cambridge, UK: The Royal Society of Chemistry. str. 7. ISBN 978-1-84973-369-4.
- ^ Warburg O, Christian W (1938). "Isolation of the prosthetic group of the amino acid oxidase". Biochemische Zeitschrift. 298: 150–168.
- ^ Metzler DE, Metzler CM, Sauke DJ (2003). Biochemistry (2nd izd.). San Diego: Harcourt, Academic Press. ISBN 978-0-12-492541-0.
- ^ a b Devlin TM (2011). Textbook of Biochemistry: with Clinical Correlations (7th izd.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0-470-28173-4.
- ^ a b c d e f g h i j k Barile M, Giancaspero TA, Brizio C, Panebianco C, Indiveri C, Galluccio M, Vergani L, Eberini I, Gianazza E (2013). "Biosynthesis of flavin cofactors in man: implications in health and disease". Current Pharmaceutical Design. 19 (14): 2649–75. doi:10.2174/1381612811319140014. PMID 23116402.
- ^ Teufel, Robin; Miyanaga, Akimasa; Michaudel, Quentin; Stull, Frederick; Louie, Gordon; Noel, Joseph P.; Baran, Phil S.; Palfey, Bruce; Moore, Bradley S. (28. 11. 2013). "Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement". Nature. 503 (7477): 552–556. Bibcode:2013Natur.503..552T. doi:10.1038/nature12643. ISSN 1476-4687. PMC 3844076. PMID 24162851.
- ^ a b c d e Kim HJ, Winge DR (maj 2013). "Emerging concepts in the flavinylation of succinate dehydrogenase". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1827 (5): 627–36. doi:10.1016/j.bbabio.2013.01.012. PMC 3626088. PMID 23380393.
- ^ Liu S (2012). Bioprocess Engineering: Kinetics, Sustainability, and Reactor Design. Newnes. ISBN 978-0-444-63783-3.
- ^ Lewis JA, Escalante-Semerena JC (Aug 2006). "The FAD-dependent tricarballylate dehydrogenase (TcuA) enzyme of Salmonella enterica converts tricarballylate into cis-aconitate". Journal of Bacteriology. 188 (15): 5479–86. doi:10.1128/jb.00514-06. PMC 1540016. PMID 16855237.
- ^ a b c Kuppuraj G, Kruise D, Yura K (Nov 2014). "Conformational behavior of flavin adenine dinucleotide: conserved stereochemistry in bound and free states". The Journal of Physical Chemistry B. 118 (47): 13486–97. doi:10.1021/jp507629n. PMID 25389798.
- ^ Monteira M (2013). B Vitamins and Folate: Chemistry, Analysis, Function and Effects. Cambridge, UK: The Royal Society of Chemistry. str. 94. ISBN 978-1-84973-369-4.
- ^ a b c Macheroux P, Kappes B, Ealick SE (Aug 2011). "Flavogenomics--a genomic and structural view of flavin-dependent proteins". The FEBS Journal. 278 (15): 2625–34. doi:10.1111/j.1742-4658.2011.08202.x. PMID 21635694. S2CID 22220250.
- ^ a b c d Lienhart WD, Gudipati V, Macheroux P (Jul 2013). "The human flavoproteome". Archives of Biochemistry and Biophysics. 535 (2): 150–62. doi:10.1016/j.abb.2013.02.015. PMC 3684772. PMID 23500531.
- ^ Hühner J, Ingles-Prieto Á, Neusüß C, Lämmerhofer M, Janovjak H (Feb 2015). "Quantification of riboflavin, flavin mononucleotide, and flavin adenine dinucleotide in mammalian model cells by CE with LED-induced fluorescence detection". Electrophoresis. 36 (4): 518–25. doi:10.1002/elps.201400451. PMID 25488801. S2CID 27285540.
- ^ Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (6th izd.). New York: Freeman. ISBN 978-0-7167-8724-2.
- ^ a b c Mansoorabadi SO, Thibodeaux CJ, Liu HW (Aug 2007). "The diverse roles of flavin coenzymes--nature's most versatile thespians". The Journal of Organic Chemistry. 72 (17): 6329–42. doi:10.1021/jo0703092. PMC 2519020. PMID 17580897.
- ^ King MW (18. 5. 2020). "Vitamins, Minerals, Supplements". The Medical Biochemistry Page.
- ^ Garma, Leonardo D.; Medina, Milagros; Juffer, André H. (1. 11. 2016). "Structure-based classification of FAD binding sites: A comparative study of structural alignment tools". Proteins: Structure, Function, and Bioinformatics (jezik: engleski). 84 (11): 1728–1747. doi:10.1002/prot.25158. ISSN 1097-0134. PMID 27580869. S2CID 26066208.
- ^ a b c d e f g Fagan RL, Palfey BA (2010). "Flavin-Dependent Enzymes". Comprehensive Natural Products II Chemistry and Biology. 7: 37–113.
- ^ a b Hanukoglu I (1996). "Electron transfer proteins of cytochrome P450 systems" (PDF). Adv. Mol. Cell Biol. Advances in Molecular and Cell Biology. 14: 29–55. doi:10.1016/S1569-2558(08)60339-2. ISBN 9780762301133.
- ^ Ziegler GA, Vonrhein C, Hanukoglu I, Schulz GE (Jun 1999). "The structure of adrenodoxin reductase of mitochondrial P450 systems: electron transfer for steroid biosynthesis". Journal of Molecular Biology. 289 (4): 981–90. doi:10.1006/jmbi.1999.2807. PMID 10369776.
- ^ a b Hanukoglu I (2017). "Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme". Journal of Molecular Evolution. 85 (5): 205–218. Bibcode:2017JMolE..85..205H. doi:10.1007/s00239-017-9821-9. PMID 29177972. S2CID 7120148.
- ^ Hanukoglu I, Jefcoate CR (Apr 1980). "Mitochondrial cytochrome P-450scc. Mechanism of electron transport by adrenodoxin" (PDF). The Journal of Biological Chemistry. 255 (7): 3057–61. doi:10.1016/S0021-9258(19)85851-9. PMID 6766943.
- ^ McNeil MB, Fineran PC (maj 2013). "Prokaryotic assembly factors for the attachment of flavin to complex II". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1827 (5): 637–47. doi:10.1016/j.bbabio.2012.09.003. PMID 22985599.
- ^ Serrano A, Ferreira P, Martínez-Júlvez M, Medina M (2013). "The prokaryotic FAD synthetase family: a potential drug target". Current Pharmaceutical Design. 19 (14): 2637–48. doi:10.2174/1381612811319140013. PMID 23116401.
- ^ a b c d Christie JM, Gawthorne J, Young G, Fraser NJ, Roe AJ (maj 2012). "LOV to BLUF: flavoprotein contributions to the optogenetic toolkit". Molecular Plant. 5 (3): 533–44. doi:10.1093/mp/sss020. PMID 22431563.
- ^ a b c Sivabalan S, Vedeswari CP, Jayachandran S, Koteeswaran D, Pravda C, Aruna PR, Ganesan S (2010). "In vivo native fluorescence spectroscopy and nicotinamide adinine dinucleotide/flavin adenine dinucleotide reduction and oxidation states of oral submucous fibrosis for chemopreventive drug monitoring". Journal of Biomedical Optics. 15 (1): 017010–017010–11. Bibcode:2010JBO....15a7010S. doi:10.1117/1.3324771. PMID 20210484. S2CID 40028193.
Vanjski linkovi
[uredi | uredi izvor]- FAD bound to proteins in the PDB
- FAD entry in the NIH Chemical Database