HTT
Huntingtin (Htt) jest protein koji je kod ljudi kodiran genom HTT sa hromosoma 4. Gn je poznat i kao IT15 ("'interesni transkript 15'").[5] Mutirani HTT je uzrok Huntingtonove bolesti (HD), a eksprimirana je zbog ove uloge i uključenosti u dugotrajno skladištenje memorije.[6]
Aminokiselinska sekvenca
[uredi | uredi izvor]Dužina polipeptidnog lanca je 3.142 aminokiseline, а molekulska težina 347.603 Da.[7]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MATLEKLMKA | FESLKSFQQQ | QQQQQQQQQQ | QQQQQQQQPP | PPPPPPPPPQ | ||||
| LPQPPPQAQP | LLPQPQPPPP | PPPPPPGPAV | AEEPLHRPKK | ELSATKKDRV | ||||
| NHCLTICENI | VAQSVRNSPE | FQKLLGIAME | LFLLCSDDAE | SDVRMVADEC | ||||
| LNKVIKALMD | SNLPRLQLEL | YKEIKKNGAP | RSLRAALWRF | AELAHLVRPQ | ||||
| KCRPYLVNLL | PCLTRTSKRP | EESVQETLAA | AVPKIMASFG | NFANDNEIKV | ||||
| LLKAFIANLK | SSSPTIRRTA | AGSAVSICQH | SRRTQYFYSW | LLNVLLGLLV | ||||
| PVEDEHSTLL | ILGVLLTLRY | LVPLLQQQVK | DTSLKGSFGV | TRKEMEVSPS | ||||
| AEQLVQVYEL | TLHHTQHQDH | NVVTGALELL | QQLFRTPPPE | LLQTLTAVGG | ||||
| IGQLTAAKEE | SGGRSRSGSI | VELIAGGGSS | CSPVLSRKQK | GKVLLGEEEA | ||||
| LEDDSESRSD | VSSSALTASV | KDEISGELAA | SSGVSTPGSA | GHDIITEQPR | ||||
| SQHTLQADSV | DLASCDLTSS | ATDGDEEDIL | SHSSSQVSAV | PSDPAMDLND | ||||
| GTQASSPISD | SSQTTTEGPD | SAVTPSDSSE | IVLDGTDNQY | LGLQIGQPQD | ||||
| EDEEATGILP | DEASEAFRNS | SMALQQAHLL | KNMSHCRQPS | DSSVDKFVLR | ||||
| DEATEPGDQE | NKPCRIKGDI | GQSTDDDSAP | LVHCVRLLSA | SFLLTGGKNV | ||||
| LVPDRDVRVS | VKALALSCVG | AAVALHPESF | FSKLYKVPLD | TTEYPEEQYV | ||||
| SDILNYIDHG | DPQVRGATAI | LCGTLICSIL | SRSRFHVGDW | MGTIRTLTGN | ||||
| TFSLADCIPL | LRKTLKDESS | VTCKLACTAV | RNCVMSLCSS | SYSELGLQLI | ||||
| IDVLTLRNSS | YWLVRTELLE | TLAEIDFRLV | SFLEAKAENL | HRGAHHYTGL | ||||
| LKLQERVLNN | VVIHLLGDED | PRVRHVAAAS | LIRLVPKLFY | KCDQGQADPV | ||||
| VAVARDQSSV | YLKLLMHETQ | PPSHFSVSTI | TRIYRGYNLL | PSITDVTMEN | ||||
| NLSRVIAAVS | HELITSTTRA | LTFGCCEALC | LLSTAFPVCI | WSLGWHCGVP | ||||
| PLSASDESRK | SCTVGMATMI | LTLLSSAWFP | LDLSAHQDAL | ILAGNLLAAS | ||||
| APKSLRSSWA | SEEEANPAAT | KQEEVWPALG | DRALVPMVEQ | LFSHLLKVIN | ||||
| ICAHVLDDVA | PGPAIKAALP | SLTNPPSLSP | IRRKGKEKEP | GEQASVPLSP | ||||
| KKGSEASAAS | RQSDTSGPVT | TSKSSSLGSF | YHLPSYLKLH | DVLKATHANY | ||||
| KVTLDLQNST | EKFGGFLRSA | LDVLSQILEL | ATLQDIGKCV | EEILGYLKSC | ||||
| FSREPMMATV | CVQQLLKTLF | GTNLASQFDG | LSSNPSKSQG | RAQRLGSSSV | ||||
| RPGLYHYCFM | APYTHFTQAL | ADASLRNMVQ | AEQENDTSGW | FDVLQKVSTQ | ||||
| LKTNLTSVTK | NRADKNAIHN | HIRLFEPLVI | KALKQYTTTT | CVQLQKQVLD | ||||
| LLAQLVQLRV | NYCLLDSDQV | FIGFVLKQFE | YIEVGQFRES | EAIIPNIFFF | ||||
| LVLLSYERYH | SKQIIGIPKI | IQLCDGIMAS | GRKAVTHAIP | ALQPIVHDLF | ||||
| VLRGTNKADA | GKELETQKEV | VVSMLLRLIQ | YHQVLEMFIL | VLQQCHKENE | ||||
| DKWKRLSRQI | ADIILPMLAK | QQMHIDSHEA | LGVLNTLFEI | LAPSSLRPVD | ||||
| MLLRSMFVTP | NTMASVSTVQ | LWISGILAIL | RVLISQSTED | IVLSRIQELS | ||||
| FSPYLISCTV | INRLRDGDST | STLEEHSEGK | QIKNLPEETF | SRFLLQLVGI | ||||
| LLEDIVTKQL | KVEMSEQQHT | FYCQELGTLL | MCLIHIFKSG | MFRRITAAAT | ||||
| RLFRSDGCGG | SFYTLDSLNL | RARSMITTHP | ALVLLWCQIL | LLVNHTDYRW | ||||
| WAEVQQTPKR | HSLSSTKLLS | PQMSGEEEDS | DLAAKLGMCN | REIVRRGALI | ||||
| LFCDYVCQNL | HDSEHLTWLI | VNHIQDLISL | SHEPPVQDFI | SAVHRNSAAS | ||||
| GLFIQAIQSR | CENLSTPTML | KKTLQCLEGI | HLSQSGAVLT | LYVDRLLCTP | ||||
| FRVLARMVDI | LACRRVEMLL | AANLQSSMAQ | LPMEELNRIQ | EYLQSSGLAQ | ||||
| RHQRLYSLLD | RFRLSTMQDS | LSPSPPVSSH | PLDGDGHVSL | ETVSPDKDWY | ||||
| VHLVKSQCWT | RSDSALLEGA | ELVNRIPAED | MNAFMMNSEF | NLSLLAPCLS | ||||
| LGMSEISGGQ | KSALFEAARE | VTLARVSGTV | QQLPAVHHVF | QPELPAEPAA | ||||
| YWSKLNDLFG | DAALYQSLPT | LARALAQYLV | VVSKLPSHLH | LPPEKEKDIV | ||||
| KFVVATLEAL | SWHLIHEQIP | LSLDLQAGLD | CCCLALQLPG | LWSVVSSTEF | ||||
| VTHACSLIYC | VHFILEAVAV | QPGEQLLSPE | RRTNTPKAIS | EEEEEVDPNT | ||||
| QNPKYITAAC | EMVAEMVESL | QSVLALGHKR | NSGVPAFLTP | LLRNIIISLA | ||||
| RLPLVNSYTR | VPPLVWKLGW | SPKPGGDFGT | AFPEIPVEFL | QEKEVFKEFI | ||||
| YRINTLGWTS | RTQFEETWAT | LLGVLVTQPL | VMEQEESPPE | EDTERTQINV | ||||
| LAVQAITSLV | LSAMTVPVAG | NPAVSCLEQQ | PRNKPLKALD | TRFGRKLSII | ||||
| RGIVEQEIQA | MVSKRENIAT | HHLYQAWDPV | PSLSPATTGA | LISHEKLLLQ | ||||
| INPERELGSM | SYKLGQVSIH | SVWLGNSITP | LREEEWDEEE | EEEADAPAPS | ||||
| SPPTSPVNSR | KHRAGVDIHS | CSQFLLELYS | RWILPSSSAR | RTPAILISEV | ||||
| VRSLLVVSDL | FTERNQFELM | YVTLTELRRV | HPSEDEILAQ | YLVPATCKAA | ||||
| AVLGMDKAVA | EPVSRLLEST | LRSSHLPSRV | GALHGVLYVL | ECDLLDDTAK | ||||
| QLIPVISDYL | LSNLKGIAHC | VNIHSQQHVL | VMCATAFYLI | ENYPLDVGPE | ||||
| FSASIIQMCG | VMLSGSEEST | PSIIYHCALR | GLERLLLSEQ | LSRLDAESLV | ||||
| KLSVDRVNVH | SPHRAMAALG | LMLTCMYTGK | EKVSPGRTSD | PNPAAPDSES | ||||
| VIVAMERVSV | LFDRIRKGFP | CEARVVARIL | PQFLDDFFPP | QDIMNKVIGE | ||||
| FLSNQQPYPQ | FMATVVYKVF | QTLHSTGQSS | MVRDWVMLSL | SNFTQRAPVA | ||||
| MATWSLSCFF | VSASTSPWVA | AILPHVISRM | GKLEQVDVNL | FCLVATDFYR | ||||
| HQIEEELDRR | AFQSVLEVVA | APGSPYHRLL | TCLRNVHKVT | TC |
Pregled
[uredi | uredi izvor]Promjenjiv je u svojoj strukturi, jer mnogi polimorfizmi gena mogu dovesti do promjenjivog broja glutaminskih ostataka u proteinu. U svom divljem tipu (normalnom obliku), sadrži 6-35 ostataka glutamina. Međutim, kod osoba pogođenih Huntingtonovom bolešću (autosomno dominantni genetički poremećaj), sadrži više od 36 glutaminskih ostataka (najveća prijavljena dužina ponavljanja je oko 250).[8] Njegovo uobičajeno ime je izvedeno od ove bolesti; ranije se običnono koristila oznaka IT15.
Masa huntingtinskog proteina u velikoj meri zavisi od broja glutaminskih ostataka koje ima; predviđena masa je oko 350 kDa. Općenito je prihvaćeno da normalni huntingtin ima 3144 aminokiseline. Tačna funkcija ovog proteina nije poznata, ali on igra važnu ulogu u nervnim ćelijama. Unutar ćelija, huntingtin može, ali i ne mora biti uključen u signalizaciju, transport materijala, vezivanje proteina i drugih struktura, i zaštitu od apoptoza oblika programirane ćelijske smrti. Huntingtinski protein je potreban za normalan razvoj prije rođenja.[9] Izražava se u mnogim tkivima u tijelu, s najvišim nivoima ekspresije u mozgu.
Gen
[uredi | uredi izvor]Usmjernost 5′-kraj (pet primarnih krajeva) "HTT" gena ima sekvencu od tri DNK baze, citozin-adenin-]]guanin (CAG), za kodiranje aminokiseline glutamin, što se ponavlja više puta. Ova regija se naziva trinukleotidno ponavljanje. Uobičajeni broj ponavljanja CAG je između sedam i 35 puta.
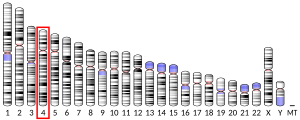
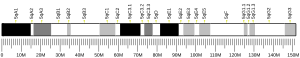
HTT gen nalazi se na kratkom kraku (p) hromosoma 4, na poziciji 16.3, od baznog para 3,074.510 do baznog para 3,243.960.[10]
Protein
[uredi | uredi izvor]Funkcija
[uredi | uredi izvor]Funkcija huntingtina (Htt) nije dobro shvaćena, ali je uključena u aksonski transport.[11] Huntingtin je neophodan za razvoj, a njegovo odsustvo je smrtonosno za miševe.[9] Protein nema homologiju sekvence sa drugim proteinima i visoko je eksprimiran u neuronima i testisima kod ljudi i glodara.[12] Huntingtin pojačava regulaciju ekspresije moždanog neutrotrofnog faktora (BDNF) na nivou transkripcije, ali mehanizam kojim huntingtin reguliše ekspresiju gena nije određen.[13] Iz imunohistohemijske, elektronske mikroskopije i subćelijske frakcionacije studija molekula, otkriveno je da je huntingtin prvenstveno povezan sa [ vezikulama i mikrotubulama.[14][15] Ukazuju na funkcionalnu ulogu u citoskeletnom sidrenju ili transportu mitohondrija. Htt protein je uključen u promet vezikula jer je u interakciji sa HIP1, proteinom koji vezuje klatrin, da posreduje endocitozu, promet materijala u ćeliju.[16][17] Takođe se pokazalo da huntingtin ima ulogu u uspostavljanju polarnosti epitela preko interakcije sa RAB11A.[18]
Interakcije
[uredi | uredi izvor]Utvrđeno je da huntingtin direktno stupa u interakciju s najmanje 19 drugih protein a, od kojih se šest koristi za transkripciju, četiri za transport, tri za ćelijdku signalizaciju i šest ostalih je nepoznate funkcije (HIP5, HIP11, HIP13, HIP15, HIP16 i CGI-125).[19] Pronađeno je preko 100 interakcijskih proteina, kao što su huntington-vezani protein 1 (HAP1) i huntingtin interaktivni protein 1 (HIP1), obično pronađeni korištenjem dvohibridnog skrininga i potvrđeni imunoprecipitacijom.[20][21]
| Interaktivni protein | Ovisnost o dužini PolyQ | Funkcija |
|---|---|---|
| α-Adaptin C/HYPJ | Da | Endocitoza |
| Akt/PKB | Ne | Kinaza |
| CBP | Da | Transkripcijski koaktivator sa acetultransferaznom aktivnošću |
| CA150 | Ne | Transkripcijski aktivator |
| CIP4 | Da | cdc42-ovisna transdukcija signala |
| CtBP | Da | Transkripcijski faktor |
| FIP2 | Nepoznato | Ćelijska morfogeneza |
| Grb2[22] | Nepoznato | Vezujući protein receptora faktora rasta |
| HAP1 | Da | Membranski promet |
| HAP40 (F8A1, F8A2, F8A3) | Nepoznato | Nepoznata |
| HIP1 | Da | Proapotozna endocitoza |
| HIP14/HYP-H | Da | Promet, endocitoza |
| N-CoR | Da | Korepresor jedarnog receptora |
| NF-κB | Nepoznato | Transkripcijski faktor |
| p53[23] | Ne | Transkripcijski faktor |
| PACSIN1[24] | Da | Endocitoza, citoskeletni aktin |
| DLG4 (PSD-95) | Da | Postsinapsna gustoća 95 |
| RASA1 (RasGAP)[22] | Nepoznato | Protein aktivacije Ras GTPaze |
| SH3GL3[25] | Da | Endocitoza |
| SIN3A | Da | Transkripcijski represor |
| Sp1[26] | DA | Transkripcijski faktor |
Također je pokazano da je huntingtin u interakciji sa:
Mitohondrijska disfunkcija
[uredi | uredi izvor]Mutant huntingtin (mHtt) ima ključnu ulogu u mitohondrijalnoj disfunkciji, uključujući inhibiciju mitohondrijski transport elektrona, viši nivo reaktivnih vrsta kisika i povećan oksidativni stres.[33] Mutantni protein huntingtin također podstiče oksidativno oštećenje DNK koje može doprinijeti patološkim promjenama u Huntingtonovoj bolesti.[34]
Klinički značaj
[uredi | uredi izvor]| Broj ponavljanja | Klasifikacija | Status bolesti |
|---|---|---|
| <26 | Normalan | Nepogođeni |
| 27–35 | Umjerana | Nepogođeni |
| 36–40 | Smanjena penetracija | +/– Pogođeni |
| >40 | Potpuna penetracija | Pogođeni |
Huntingtonova bolest (HD) je uzrokovana mutiranim oblikom gena huntingtin, gdje prekomjerno (više od 36) CAG ponavljanja rezultira stvaranjem nestabilnog proteina.[35] Ova proširena ponavljanja dovode do proizvodnje proteina huntingtin koji sadrži abnormalno dug poliglutaminski trakt na N-terminalu. To ga čini dijelom klase neurodegenerativnih poremećaja poznatih kao poremećaji trinukleotidnih ponavljanja ili poliglutaminski poremećaji. Ključna sekvenca koja se nalazi kod Huntingtonove bolesti je ponovljena ekspanzija trinukleotida ostataka glutamina koji počinju od 18. aminokiseline. Kod nepogođenih osoba, sadrži između devet i 35 glutaminskih ostataka bez štetnih efekata.[5] Međutim, 36 ili više ostataka stvaraju pogrešan mutantni oblik Htt, (mHtt). Smanjena penetrsbilnodt nalazi se u tačkama 36–39.[36]
Enzimi u ćeliji često sjeku ovaj izduženi protein na fragmente. Fragmenti proteina formiraju abnormalne nakupine, poznate kao neuronske unutarjedarne inkluzije (NII), unutar nervnih ćelija, i mogu privući druge, normalne proteine u nakupine. Smatralo se da karakteristično prisustvo ovih nakupina kod pacijenata doprinosi razvoju Huntingtonove bolesti.[37] Međutim, kasnija istraživanja postavila su pitanja o ulozi inkluzija (grudica), pokazujući da je prisustvo vidljivih NII produžilo život neurona i djelovalo na smanjenje unutarćelijskog mutantnog huntingtina u susjednim neuronima.[38] Jedan od zbunjujućih faktora je to što se sada prepoznaje da različiti tipovi agregata formiraju mutantni protein, uključujući proteinske naslage koje su premale da bi se prepoznale kao vidljive u gore navedenim studijama.[39] I dalje je teško predvidjeti vjerovatnoću neuronske smrti. Vjerovatno je važno više faktora, uključujući: (1) dužinu CAG ponavljanja u huntingtinskom genu i (2) izloženost neurona difuznom unutarćelijskom mutantnom proteinu huntingtin. NII (skupljanje proteina) mogu biti od pomoći kao mehanizam za suočavanje – a ne samo kao patogeni mehanizam – za zaustavljanje smrti neurona, smanjenjem količine difuznog huntingtina.[40] Za ovaj proces je posebno vjerovatno da će se dogoditi prvenstveno u strijatumu (dio mozga koji koordinira kretanje) i čeonom korteksu (dio mozga koji kontrolira razmišljanje i emocije).
Ljudi sa 36 do 40 CAG ponavljanja mogu, ali i ne moraju razviti znakove i simptome Huntingtonove bolesti, dok će oni s više od 40 ponavljanja razviti poremećaj tokom normalnog života. Kada ima više od 60 CAG ponavljanja, osoba razvija teški oblik HD poznat kao juvenilna HD. Stoga broj ponavljanja CAG (sekvencije koja kodira aminokiselinu glutamin) utiče na dob početka bolesti. Nijedan slučaj HD nije dijagnosticiran s brojem manjim od 36.[36]
Kako se izmijenjeni gen prenosi s jedne generacije na drugu, veličina CAG ponovljene ekspanzije može se promijeniti; često se povećava u veličini, posebno kada je naslijeđen od oca. Nije prijavljeno da ljudi sa 28 do 35 CAG ponavljanja razviju poremećaj, ali njihova djeca su u riziku da obole od bolesti ako se ekspanzija ponavljanja poveća.
Reference
[uredi | uredi izvor]- ^ a b c GRCh38: Ensembl release 89: ENSG00000197386 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000029104 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b The Huntington's Disease Collaborative Research Group (Mar 1993). "A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. The Huntington's Disease Collaborative Research Group" (PDF). Cell. 72 (6): 971–83. doi:10.1016/0092-8674(93)90585-E. hdl:2027.42/30901. PMID 8458085. S2CID 802885.
- ^ Choi YB, Kadakkuzha BM, Liu XA, Akhmedov K, Kandel ER, Puthanveettil SV (23. 7. 2014). "Huntingtin is critical both pre- and postsynaptically for long-term learning-related synaptic plasticity in Aplysia". PLOS ONE. 9 (7): e103004. Bibcode:2014PLoSO...9j3004C. doi:10.1371/journal.pone.0103004. PMC 4108396. PMID 25054562.
- ^ "UniProt, P42858" (jezik: engleski). Pristupljeno 28. 10. 2021.
- ^ Nance MA, Mathias-Hagen V, Breningstall G, Wick MJ, McGlennen RC (Jan 1999). "Analysis of a very large trinucleotide repeat in a patient with juvenile Huntington's disease". Neurology. 52 (2): 392–4. doi:10.1212/wnl.52.2.392. PMID 9932964. S2CID 33091017.
- ^ a b Nasir J, Floresco SB, O'Kusky JR, Diewert VM, Richman JM, Zeisler J, Borowski A, Marth JD, Phillips AG, Hayden MR (Jun 1995). "Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes". Cell. 81 (5): 811–23. doi:10.1016/0092-8674(95)90542-1. PMID 7774020. S2CID 16835259.
- ^ { "HTT gen".
- ^ Vitet H, Brandt V, Saudou F (august 2020). "Traffic signaling: new functions of huntingtin and axonal transport in neurological disease". Current Opinion in Neurobiology. 63: 122–130. doi:10.1016/j.conb.2020.04.001. PMID 32408142. S2CID 218596089.
- ^ Cattaneo E, Zuccato C, Tartari M (decembar 2005). "Normal huntingtin function: an alternative approach to Huntington's disease". Nature Reviews. Neuroscience. 6 (12): 919–30. doi:10.1038/nrn1806. PMID 16288298. S2CID 10119487.
- ^ Zuccato C, Ciammola A, Rigamonti D, Leavitt BR, Goffredo D, Conti L, et al. (juli 2001). "Loss of huntingtin-mediated BDNF gene transcription in Huntington's disease". Science. 293 (5529): 493–8. doi:10.1126/science.1059581. PMID 11408619. S2CID 20703272.
- ^ Hoffner G, Kahlem P, Djian P (mart 2002). "Perinuclear localization of huntingtin as a consequence of its binding to microtubules through an interaction with beta-tubulin: relevance to Huntington's disease". Journal of Cell Science. 115 (Pt 5): 941–8. doi:10.1242/jcs.115.5.941. PMID 11870213.
- ^ DiFiglia M, Sapp E, Chase K, Schwarz C, Meloni A, Young C, et al. (maj 1995). "Huntingtin is a cytoplasmic protein associated with vesicles in human and rat brain neurons". Neuron. 14 (5): 1075–81. doi:10.1016/0896-6273(95)90346-1. PMID 7748555. S2CID 18071283.
- ^ Velier J, Kim M, Schwarz C, Kim TW, Sapp E, Chase K, et al. (juli 1998). "Wild-type and mutant huntingtins function in vesicle trafficking in the secretory and endocytic pathways". Experimental Neurology. 152 (1): 34–40. doi:10.1006/exnr.1998.6832. PMID 9682010. S2CID 36726422.
- ^ Waelter S, Scherzinger E, Hasenbank R, Nordhoff E, Lurz R, Goehler H, et al. (august 2001). "The huntingtin interacting protein HIP1 is a clathrin and alpha-adaptin-binding protein involved in receptor-mediated endocytosis". Human Molecular Genetics. 10 (17): 1807–17. doi:10.1093/hmg/10.17.1807. PMID 11532990.
- ^ Elias S, McGuire JR, Yu H, Humbert S (maj 2015). "Huntingtin Is Required for Epithelial Polarity through RAB11A-Mediated Apical Trafficking of PAR3-aPKC". PLoS Biology. 13 (5): e1002142. doi:10.1371/journal.pbio.1002142. PMC 4420272. PMID 25942483.
- ^ Harjes P, Wanker EE (Aug 2003). "The hunt for huntingtin function: interaction partners tell many different stories". Trends in Biochemical Sciences. 28 (8): 425–33. doi:10.1016/S0968-0004(03)00168-3. PMID 12932731.
- ^ Goehler H, Lalowski M, Stelzl U, Waelter S, Stroedicke M, Worm U, Droege A, Lindenberg KS, Knoblich M, Haenig C, Herbst M, Suopanki J, Scherzinger E, Abraham C, Bauer B, Hasenbank R, Fritzsche A, Ludewig AH, Büssow K, Buessow K, Coleman SH, Gutekunst CA, Landwehrmeyer BG, Lehrach H, Wanker EE (Sep 2004). "A protein interaction network links GIT1, an enhancer of huntingtin aggregation, to Huntington's disease". Molecular Cell. 15 (6): 853–65. doi:10.1016/j.molcel.2004.09.016. PMID 15383276.
- ^ Wanker EE, Rovira C, Scherzinger E, Hasenbank R, Wälter S, Tait D, Colicelli J, Lehrach H (Mar 1997). "HIP-I: a huntingtin interacting protein isolated by the yeast two-hybrid system". Human Molecular Genetics. 6 (3): 487–95. doi:10.1093/hmg/6.3.487. PMID 9147654.
- ^ a b Liu YF, Deth RC, Devys D (Mar 1997). "SH3 domain-dependent association of huntingtin with epidermal growth factor receptor signaling complexes". The Journal of Biological Chemistry. 272 (13): 8121–4. doi:10.1074/jbc.272.13.8121. PMID 9079622.
- ^ Steffan JS, Kazantsev A, Spasic-Boskovic O, Greenwald M, Zhu YZ, Gohler H, Wanker EE, Bates GP, Housman DE, Thompson LM (Jun 2000). "The Huntington's disease protein interacts with p53 and CREB-binding protein and represses transcription". Proceedings of the National Academy of Sciences of the United States of America. 97 (12): 6763–8. Bibcode:2000PNAS...97.6763S. doi:10.1073/pnas.100110097. PMC 18731. PMID 10823891.
- ^ Modregger J, DiProspero NA, Charles V, Tagle DA, Plomann M (Oct 2002). "PACSIN 1 interacts with huntingtin and is absent from synaptic varicosities in presymptomatic Huntington's disease brains". Human Molecular Genetics. 11 (21): 2547–58. doi:10.1093/hmg/11.21.2547. PMID 12354780.
- ^ Sittler A, Wälter S, Wedemeyer N, Hasenbank R, Scherzinger E, Eickhoff H, Bates GP, Lehrach H, Wanker EE (Oct 1998). "SH3GL3 associates with the Huntingtin exon 1 protein and promotes the formation of polygln-containing protein aggregates". Molecular Cell. 2 (4): 427–36. doi:10.1016/S1097-2765(00)80142-2. PMID 9809064.
- ^ Li SH, Cheng AL, Zhou H, Lam S, Rao M, Li H, Li XJ (Mar 2002). "Interaction of Huntington disease protein with transcriptional activator Sp1". Molecular and Cellular Biology. 22 (5): 1277–87. doi:10.1128/MCB.22.5.1277-1287.2002. PMC 134707. PMID 11839795.
- ^ Kalchman MA, Graham RK, Xia G, Koide HB, Hodgson JG, Graham KC, Goldberg YP, Gietz RD, Pickart CM, Hayden MR (Aug 1996). "Huntingtin is ubiquitinated and interacts with a specific ubiquitin-conjugating enzyme". The Journal of Biological Chemistry. 271 (32): 19385–94. doi:10.1074/jbc.271.32.19385. PMID 8702625.
- ^ Liu YF, Dorow D, Marshall J (Jun 2000). "Activation of MLK2-mediated signaling cascades by polyglutamine-expanded huntingtin". The Journal of Biological Chemistry. 275 (25): 19035–40. doi:10.1074/jbc.C000180200. PMID 10801775.
- ^ Hattula K, Peränen J (2000). "FIP-2, a coiled-coil protein, links Huntingtin to Rab8 and modulates cellular morphogenesis". Current Biology. 10 (24): 1603–6. doi:10.1016/S0960-9822(00)00864-2. PMID 11137014. S2CID 12836037.
- ^ a b c Faber PW, Barnes GT, Srinidhi J, Chen J, Gusella JF, MacDonald ME (Sep 1998). "Huntingtin interacts with a family of WW domain proteins". Human Molecular Genetics. 7 (9): 1463–74. doi:10.1093/hmg/7.9.1463. PMID 9700202.
- ^ Holbert S, Dedeoglu A, Humbert S, Saudou F, Ferrante RJ, Néri C (Mar 2003). "Cdc42-interacting protein 4 binds to huntingtin: neuropathologic and biological evidence for a role in Huntington's disease". Proceedings of the National Academy of Sciences of the United States of America. 100 (5): 2712–7. Bibcode:2003PNAS..100.2712H. doi:10.1073/pnas.0437967100. PMC 151406. PMID 12604778.
- ^ Singaraja RR, Hadano S, Metzler M, Givan S, Wellington CL, Warby S, Yanai A, Gutekunst CA, Leavitt BR, Yi H, Fichter K, Gan L, McCutcheon K, Chopra V, Michel J, Hersch SM, Ikeda JE, Hayden MR (Nov 2002). "HIP14, a novel ankyrin domain-containing protein, links huntingtin to intracellular trafficking and endocytosis". Human Molecular Genetics. 11 (23): 2815–28. doi:10.1093/hmg/11.23.2815. PMID 12393793.
- ^ Liu Z, Zhou T, Ziegler AC, Dimitrion P, Zuo L (2017). "Oxidative Stress in Neurodegenerative Diseases: From Molecular Mechanisms to Clinical Applications". Oxid Med Cell Longev. 2017: 2525967. doi:10.1155/2017/2525967. PMC 5529664. PMID 28785371.
- ^ Ayala-Peña S (septembar 2013). "Role of oxidative DNA damage in mitochondrial dysfunction and Huntington's disease pathogenesis". Free Radic. Biol. Med. 62: 102–10. doi:10.1016/j.freeradbiomed.2013.04.017. PMC 3722255. PMID 23602907.
- ^ a b Walker FO (Jan 2007). "Huntington's disease". Lancet. 369 (9557): 218–28. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289. S2CID 46151626.
- ^ a b Chong SS, Almqvist E, Telenius H, LaTray L, Nichol K, Bourdelat-Parks B, Goldberg YP, Haddad BR, Richards F, Sillence D, Greenberg CR, Ives E, Van den Engh G, Hughes MR, Hayden MR (Feb 1997). "Contribution of DNA sequence and CAG size to mutation frequencies of intermediate alleles for Huntington disease: evidence from single sperm analyses". Human Molecular Genetics. 6 (2): 301–9. doi:10.1093/hmg/6.2.301. PMID 9063751.
- ^ Davies SW, Turmaine M, Cozens BA, DiFiglia M, Sharp AH, Ross CA, Scherzinger E, Wanker EE, Mangiarini L, Bates GP (Aug 1997). "Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation". Cell. 90 (3): 537–48. doi:10.1016/S0092-8674(00)80513-9. PMID 9267033. S2CID 549691.
- ^ Arrasate M, Mitra S, Schweitzer ES, Segal MR, Finkbeiner S (Oct 2004). "Inclusion body formation reduces levels of mutant huntingtin and the risk of neuronal death". Nature. 431 (7010): 805–10. Bibcode:2004Natur.431..805A. doi:10.1038/nature02998. PMID 15483602.
- ^ Sahl SJ, Lau L, Vonk WI, Weiss LE, Frydman J, Moerner WE (2016). "Delayed Emergence of Subdiffraction-Sized Mutant Huntingtin Fibrils Following Inclusion Body Formation". Q Rev Biophys. 49: e2. doi:10.1017/S0033583515000219. PMC 4785097. PMID 26350150.
- ^ Orr HT (Oct 2004). "Neurodegenerative disease: neuron protection agency". Nature. 431 (7010): 747–8. Bibcode:2004Natur.431..747O. doi:10.1038/431747a. PMID 15483586. S2CID 285829.
Dopunska literatura
[uredi | uredi izvor]- Kosinski CM, Schlangen C, Gellerich FN, Gizatullina Z, Deschauer M, Schiefer J, et al. (august 2007). "Myopathy as a first symptom of Huntington's disease in a Marathon runner". Movement Disorders. 22 (11): 1637–40. doi:10.1002/mds.21550. PMID 17534945. S2CID 30904037.
- Bates G (maj 2003). "Huntingtin aggregation and toxicity in Huntington's disease". Lancet. 361 (9369): 1642–4. doi:10.1016/S0140-6736(03)13304-1. PMID 12747895. S2CID 7587406.
- Cattaneo E (Feb 2003). "Dysfunction of wild-type huntingtin in Huntington disease". News in Physiological Sciences. 18: 34–7. doi:10.1152/nips.01410.2002. PMID 12531930.
- Gárdián G, Vécsei L (Oct 2004). "Huntington's disease: pathomechanism and therapeutic perspectives". Journal of Neural Transmission. 111 (10–11): 1485–94. doi:10.1007/s00702-004-0201-4. PMID 15480847. S2CID 2961376.
- Landles C, Bates GP (Oct 2004). "Huntingtin and the molecular pathogenesis of Huntington's disease. Fourth in molecular medicine review series". EMBO Reports. 5 (10): 958–63. doi:10.1038/sj.embor.7400250. PMC 1299150. PMID 15459747.
- Jones AL (Jun 1999). "The localization and interactions of huntingtin". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 354 (1386): 1021–7. doi:10.1098/rstb.1999.0454. PMC 1692601. PMID 10434301.
- Li SH, Li XJ (Oct 2004). "Huntingtin and its role in neuronal degeneration". The Neuroscientist. 10 (5): 467–75. doi:10.1177/1073858404266777. PMID 15359012. S2CID 19491573.
- MacDonald ME, Novelletto A, Lin C, Tagle D, Barnes G, Bates G, Taylor S, Allitto B, Altherr M, Myers R (maj 1992). "The Huntington's disease candidate region exhibits many different haplotypes". Nature Genetics. 1 (2): 99–103. doi:10.1038/ng0592-99. PMID 1302016. S2CID 25472459.
- MacDonald ME (Nov 2003). "Huntingtin: alive and well and working in middle management". Science's STKE. 2003 (207): pe48. doi:10.1126/stke.2003.207.pe48. PMID 14600292. S2CID 35318234.
- Myers RH (Apr 2004). "Huntington's disease genetics". NeuroRx. 1 (2): 255–62. doi:10.1602/neurorx.1.2.255. PMC 534940. PMID 15717026.
- Rangone H, Humbert S, Saudou F (Jul 2004). "Huntington's disease: how does huntingtin, an anti-apoptotic protein, become toxic?". Pathologie-Biologie. 52 (6): 338–42. doi:10.1016/j.patbio.2003.06.004. PMID 15261377.
- Young AB (Feb 2003). "Huntingtin in health and disease". The Journal of Clinical Investigation. 111 (3): 299–302. doi:10.1172/JCI17742. PMC 151871. PMID 12569151.
Vanjski linkovi
[uredi | uredi izvor]- Huntingtin protein, human na US National Library of Medicine Medical Subject Headings (MeSH)
- The Huntingtin Protein and Protein Aggregation at HOPES Arhivirano 27. 8. 2020. na Wayback Machine : Huntington's Outreach Project for Education at Stanford
- The HDA Huntington's Disease Association UK
- OMIM: 143100
- EntrezGene 3064
- GeneCard
- iHOP