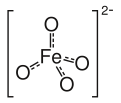
Anion ferrat(VI)
| |
 Dung dịch ferrat (trái)
và permanganat (phải) | |
| Names | |
|---|---|
| Tên IUPAC Ferrate(VI)
| |
| Systematic IUPAC name
Tetraoxoironbis(olate) | |
| Tên khác Ferrate(2−)
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider |
|
PubChem CID
|
|
SMILES
| |
| Tính chất | |
| FeO2− 4 | |
| Khối lượng mol | 119.843 g mol−1 |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
Ferrat(VI) là anion vô cơ với công thức hóa học FeO42−. Ferrat(VI) có tính nhạy sáng, tạo nên màu tím nhạt trong các hợp chất và dung dịch chứa nó. Đồng thời nó cũng là một trong những chất oxi hoá tồn tại được trong nước mạnh và ổn định nhất. Mặc dù được coi là một base yếu, dung dịch có nồng độ ferrat(VI) lớn là chất ăn mòn (kể cả da) và chỉ ổn định ở độ pH cao.
Danh pháp
[sửa | sửa mã nguồn]Từ "ferrat" thường được dùng để gọi ferrat(VI) nhưng cũng có thể chỉ các ion âm chứa sắt khác, trong đó có các anion thường gặp hơn FeO42−. Chúng bao gồm natri tetracacbonylferat Na2Fe(CO)4, K2Fe(CO)4 và muối ion phức tetracloroferrat(III) FeCl4−. Mặc dù hiếm khi được nghiên cứu, ferrat(V) FeO43− (hay hypoferrat) và ferrat(IV) FeO44− có tồn tại. Chúng cũng được gọi là ferrat.[1]
Trước đây, ion ferrat(VI) được gọi là peferrat[2]. Ngày nay, ion peferrat có công thức là FeO4-.[3]
Điều chế
[sửa | sửa mã nguồn]Sắt thường tồn tại dưới trạng thái oxi hoá +2 hoặc +3; tuy nhiên khi có sự xuất hiện của các chất oxi hoá mạnh, sắt có thể tạo thành các trạng thái oxi hoá cao hơn (+4, +5 và +6).
Muối ferrat được tạo thành khi oxi hoá sắt trong môi trường kiềm bằng các chất oxi hoá mạnh, hoặc đốt hỗn hợp bột sắt và bột kali nitrat.[4]
Ví dụ, ferrat được tạo thành khi đun nóng sắt(III) hydroxide với natri hypoclorit trong dung dịch kiềm:
- 2Fe(OH)3 + 3OCl− + 4 OH− → 2FeO42− + 5 H2O + 3Cl−
Anion dễ dàng tách ra khỏi dung dịch khi có mặt bari, hình thành bari ferrat.
Tính chất
[sửa | sửa mã nguồn]Anion ferrat(VI) không bền ở môi trường trung tính[4] hoặc pH thấp, tạo thành sắt(III)[5]:
- [FeO4]2− + 3e− + 8 H+ ⇌ Fe3+ + 4 H2O
Quá trình khử tạo ra một số hợp chất trung gian chứa sắt ở số oxi hoá +5 và +4. Những anion này còn phản ứng mạnh mẽ hơn cả ferrat(VI). Ferrat bền hơn trong môi trường kiềm, tồn tại trong khoảng 8 đến 9 tiếng ở pH 8 hoặc 9.[6]
Dung dịch ferrat có màu hồng khi pha loãng, nhưng sẽ có màu đỏ hoặc tím ở nồng độ cao hơn.[7][8] Ion ferrat là chất oxi hoá mạnh hơn pemanganat,[9] nó sẽ oxi hoá crom(III) thành đicromat,[10] amonia thành phân tử nitơ.[11]
Ferrat có khả năng khử trùng mạnh, dễ dàng loại bỏ và phá huỷ virus.[12]
Anion ferrat(VI) có hai electron độc thân, nên nó có tính thuận từ. Nó có cấu trúc phân tử tứ diện. Fe(VI) là chất oxi hoá mạnh ở bất kì độ pH nào. Thế điện cực chuẩn của Fe(VI)/Fe(III) dao động từ +2.2 V đến +0.7 V lần lượt trong môi trường axit đến base. Natri ferrat (Na2FeO4) là loại thuốc thử hữu ích với khả năng chọn lọc tốt, ổn định trong dung dịch có pH cao, vẫn giữ được tính tan trong dung dịch bị bão hoà bởi natri hydroxide. Ferrat là một trong những chất tẩy uế nước tốt nhất, mà lại thân thiện với môi trường. Sản phẩm sau phản ứng khử ferrat thường không gây hại, ví dụ như muối sắt(III), hoặc sắt(III) oxit. Fe(III) được hấp thụ một cách tự nhiên vào cơ thể con người, động vật và cây cối. Anion ferrat mang cấu trúc tứ diện, tương tự với anion cromat và pemanganat.
Xem thêm
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ Graham Hill; John Holman (2000). Chemistry in context (ấn bản thứ 5). Nelson Thornes. tr. 202. ISBN 0-17-448276-0.
- ^ Potassium perferrate, K2FeO4 - atomistry.com
- ^ Annual Report of the Board of Regents of the Smithsonian Institution, trang 443 - https://books.google.com.vn/books?id=4_EyAQAAMAAJ&pg=PA443&dq=&hl=vi&sa=X&ved=0ahUKEwiI6cmFp7joAhUEM94KHYffDmYQuwUIQzAC#v=onepage&q&f=false. Truy cập 26 tháng 3 năm 2020.
- ^ a b . ISBN 81-8356-223-X.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ . ISBN 0-935702-66-0.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ . ISBN 0-8493-8679-9.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ . ISBN 0-12-352651-5.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ . ISBN 0-19-860918-3.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ . ISBN 0-7487-6420-8.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ . ISBN 81-8356-013-X.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp) - ^ Karlis Svanks (tháng 6 năm 1976). “Oxidation of Ammonia in Water by Ferrates(VI) and (IV)” (PDF). Water Resources Center, Ohio State University. tr. 3. Truy cập ngày 4 tháng 5 năm 2010. Đã định rõ hơn một tham số trong
|tác giả=và|họ=(trợ giúp)Đã định rõ hơn một tham số trong|tác giả=và|họ=(trợ giúp); Đã định rõ hơn một tham số trong|tác giả=và|họ=(trợ giúp) - ^ . ISBN 1-56670-633-5.
|title=trống hay bị thiếu (trợ giúp)|tựa đề=trống hay bị thiếu (trợ giúp)