Kloroform
| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Triklorometan | |||
Diğer adlar Chloroformium / Chloroformum (Latince); formil triklorür; Freon 20; metan triklorür; metenil triklorür; metenil klorür; metil triklorür; trikloroform;[b] refrigerant-20 | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| Kısaltmalar | R-20 (soğutucu kodu); TCM | ||
| 4-01-00-00042 | |||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.603 | ||
| EC Numarası |
| ||
| 1837 | |||
| KEGG | |||
| MeSH | D002725 | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| UN numarası | 1888 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Kimyasal formül | CHCl3 | ||
| Molekül kütlesi | 119,38 g mol−1 | ||
| Görünüm | Renksiz sıvı | ||
| Koku | nane yağı benzeri güçlü koku | ||
| Yoğunluk | 1,564 g/cm³ (–20 °C) 1,524 g/cm³ (0 °C) 1,489 g/cm³ (20 °C) 1,452 g/cm³ (40 °C) 1,394 g/cm³ (60 °C) Buhar: 4 g/L (25 °C)[2] | ||
| Erime noktası | −63,5 °C (−82,3 °F; 209,7 K) | ||
| Kaynama noktası | 61,15 °C (142,07 °F; 334,30 K) 450 °C'de bileşenlerine ayrışır. | ||
| Çözünürlük (su içinde) | 1,062 g/100 mL (0 °C) 0,809 g/100 mL (20 °C) 0,732 g/100 mL (60 °C) | ||
| Çözünürlük | Benzende çözünür. Dietil eter, aseton, yağlar, ligroin, alkol, CCl4 ve CS2 ile karışabilir.[3] | ||
| Buhar basıncı | 0,62 kPa (–40 °C) 7,89 kPa (0 °C) 25,9 kPa (25 °C) 313 kPa (100 °C) 2,26 MPa (200 °C) | ||
Henry yasası
sabiti (kH) |
3,67 L·atm/mol (24 °C) | ||
| Asitlik (pKa) | 15,7 (20 °C) | ||
| Isı iletkenliği | 0,13 W/(m·K) (20 °C) | ||
| Kırınım dizimi (nD) | 1,4459 (20 °C) | ||
| Dipol momenti | 1,15 D | ||
| Yapı | |||
| Tetrahedral | |||
| Termokimya | |||
Isı sığası (C)
|
114,25 J/(mol·K) | ||
Standart molar entropi (S⦵298)
|
202,9 J/(mol·K) | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
−134,3 kJ/mol | ||
Standart yanma entalpisi (ΔcH⦵298)
|
473,21 kJ/mol | ||
| Farmakoloji | |||
| İnhalasyon | |||
| Farmakokinetik: | |||
| Karaciğer | |||
| ortalama 8 saat[4] | |||
| Akciğerlerden kloroform ve karbondioksit olarak | |||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Akut olarak bilinç kaybı; kronik olarak, geçici karaciğer ve böbrek hasarı.[3] Işık mevcudiyetinde son derece toksik fosgen ve hidrojen klorüre ayrışır – Şüpheli Kanserojen – Üreme toksisitesi – Spesifik hedef organ toksisitesi (STOT)[5][6][7] | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar |  
| ||
| İşaret sözcüğü | Tehlike | ||
| R-ibareleri | R22, R38, R40, R48/20/22 | ||
| G-ibareleri | S2, S36/37 | ||
| Tehlike ifadeleri | H302, H315, H319, H331, H336, H351, H361d, H372 | ||
| Önlem ifadeleri | P201, P202, P235, P260, P264, P270, P271, P280, P281, P301+P330+P331, P302+P352, P304+P340, P305+P351+P338, P308+P313, P310, P311, P314, P332+P313, P337+P313, P362, P403+P233, P405, P501 | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | yanıcı değil | ||
| Patlama sınırları | hava ile patlayıcı karışım oluşturmaz | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
704 mg/kg (fare, dermal)[8] | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | 50 ppm (240 mg/m³)[6] | ||
| Güvenlik bilgi formu (SDS) | Merck Millipore | ||
| Benzeyen bileşikler | |||
Benzeyen
|
Klorometan Diklorometan Karbon tetraklorür | ||
Benzeyen bileşikler
|
İyodoform Bromoform Floroform | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Kloroform[c] veya triklorometan, CHCl
3 formülüne sahip bir organik bileşiktir. Oda sıcaklığında kolay buharlaşan, hoş kokulu, renksiz, yanıcı olmayan ağır bir sıvıdır. Çözücü olarak sıkça kullanılır. PTFE (Teflon) ve bazı soğutucuların üretiminde kullanılmak için bol miktarlarda üretilir.
Solunduğunda ya da yutulduğunda güçlü bir anestezik ve yatıştırıcıdır. Bu özelliğinden dolayı kloroform, 1847 yılından itibaren 20. yüzyılın ilk yarısına kadar anestezik amaçlarla sıklıkla kullanıldı. Kloroformun cerrahide anestezik olarak kullanımı, hastalarda sebep olduğu sağlık sorunları nedeniyle tahminen 1970'lerde bırakılmış ve yerini daha güvenli anestezikler almıştır. Kloroform günümüzde farklı endüstrilerde ve laboratuvarlarda çözücü ve hammadde olarak kullanılmaktadır. Endüstriyel ve tarihî öneminden çok, halk arasında kurguda suçluların kurbanları etkisiz hâle getirmek için kullanılma klişesi ile tanınır.
Kloroform birçok farklı yöntemle elde edilebilir; aseton, izopropil alkol ve etanol gibi bileşiklerin, çamaşır suyunda bulunan sodyum hipoklorit ile yaptığı haloform tepkimesi ile,klorale sodyum hidroksit ile müdahaleden, karbon tetraklorürün hidrojen ile indirgenmesi ve metanın veya klorometanın klorlandırılması ile. Metanın yüksek sıcaklık veya güneş ışığında klorla tepkimesi, endüstride en çok kullanılan yöntemdir.
Yüksek miktarlarda kloroform solunması rehavete, bilinç kaybına ve hatta kalp ritmini bozarak ölüme sebep olabilir. Kloroforma uzun süre maruz kalmak karaciğeri ve böbrekleri olumsuz etkiler. Kloroform, ısı ve ışık altında oksijen varlığında çok zehirli ve korozif olan hidrojen klorür ve fosgen bileşiklerine bozunmasını önleyen stabilizatörler eklenir.
Özellikleri
[değiştir | kaynağı değiştir]Fiziksel özellikleri
[değiştir | kaynağı değiştir]Kloroform (Triklorometan), nane yağını andıran hoş bir kokuya ve buharları solunduğunda alınabilen aşırı tatlı ve yakıcı bir tada sahip, oda sıcaklığında renksiz sıvı hâlde bir maddedir.[10] Kloroform oldukça uçucudur, yanıcı değildir ve buharları hava ile patlayıcı karışımlar oluşturmaz. Kendisi yanıcı olmamasına rağmen buharları bir alevden geçirildiğinde aleve yeşilimsi bir renk verir.[10] Normal basınç altında erime noktası –63,5 °C, kaynama noktası 61,2 °C'dir, buharları renksizdir. Yoğunluğu 20 °C'de 1,48 g/cm3 olan kloroform, sudan daha ağırdır. Buharlarının yoğunluğu (hava 1 olarak alındığında) 4,12 ve kloroform-hava karışımlarının yoğunluğu 1,7'dir.[11] 20 °C'de kırılma indisi 1,4459'dur.
Su ile karışabilirliği sınırlıdır ve su içinde çok az çözünür, su içinde çözündüğünde ise suya tatlı tadını verir.[10] Artan sıcaklıkla kloroformun sudaki çözünürlüğü azalır ve suyun kloroformdaki çözünürlüğü artar.[12]
Kloroformun ve suyun birbiri içindeki çözünürlüğü[12] Sıcaklık (°C cinsinde) 0 9,5 19,6 29,5 39,3 49,2 59,2 Su içinde kloroform (Kütle %) 1,02 0,93 0,82 0,79 0,74 0,77 0,79 Kloroform içinde su (kütle %) 0,0365 0,0527 0,0661 0,0841 0,1108 0,1353 0,1672
CHCl
3.17 H
2O bileşimine sahip bir hidrat tarif edilmiştir; 1,6 °C'de bozunan altıgen kristaller oluşturur.[13][14]
Kloroform düşük polarlığı sayesinde, katı ve sıvı yağlar, reçineler, mumlar, vb. gibi birçok organik madde için mükemmel bir çözücüdür. Birçok organik çözücü ile tamamen karışabilir ve iyot ve kükürdü çözer.
Bileşik, çeşitli çözücülerle azeotropik karışımlar oluşturur. Azeotropik bileşimler, yüzdeleri ve kaynama noktaları aşağıdaki tabloda verilmiştir.
| Farklı çözücüler ile kloroformun azeotropları[15] | ||||||||||||
| Çözücü | Su | Metanol | Etanol | 2-Propanol | Aseton | Bütanon | ||||||
| Kloroform miktarı | w% | 97 | 87 | 93 | 96 | 78 | 17 | |||||
| Kaynama noktası | °C | 56 | 53 | 59 | 61 | 64 | 80 | |||||
| Çözücü | Diizopropil eter | Tetrahidrofuran | Metil asetat | Etil asetat | n-Hekzan | |||||||
| Kloroform miktarı | w% | 36 | 66 | 77 | 28 | 83 | ||||||
| Kaynama noktası | °C | 71 | 73 | 65 | 78 | 60 | ||||||
Kloroform; n-pentan, n-heptan, siklohekzan, benzen, toluen, n-propanol, i-bütanol, karbon tetraklorür, dietil eter, 1,4-dioksan, n-bütil asetat, asetik asit, asetonitril, nitrobenzen, piridin ve karbondisülfür ile azeotrop oluşturmaz.[15]
Kimyasal özellikleri ve reaksiyonları
[değiştir | kaynağı değiştir]Molekül kütlesi 119,38 g/mol'dür (C: %10,06, H: %0,84, Cl: %89,09). Yapısı (CHX3) olan floroform, bromoform ve iyodoform ile "haloformlar" adı verilen homolog bir dizi oluşturur.
Kloroform, benzer bileşikler olan metilen klorür ve karbon tetraklorürden daha az stabildir ve her ikisinden daha kolay bozunur; UV ışık ve ısı etkisi altında oksijen tarafından fotokimyasal olarak ayrıştığında fosgen, klor ve hidrojen klorür ortaya çıkar. Ticarî olarak temin edilebilen kloroform, oluşan fosgeni nötralize etmek için stabilizatör olarak %0,5-1,0 etanol ya da amilen içerir. Bozunma riskinden ötürü koyu kahverengi cam şişelerde, günışığı almayan soğuk ve karanlık ortamda saklanmalıdır.
Kloroform bir Lewis asidi olarak kabul edilir. Karbon tetraklorür ve alkanlar gibi çözücülerde, kloroform çeşitli Lewis bazları ile hidrojen bağı yapar.
Güçlü bazlar, güçlü oksidanlar ve alüminyum, lityum, potasyum, sodyum, magnezyum ve çinko gibi metallerle şiddetli tepkimeye girer.[16]
Kloroform buharlarının kızgın bir tüpten geçirilmesi sonucunda tetrakloroetilen, hekzakloroetan ve hekzaklorobenzen gibi yalnızca klor ve karbondan oluşan bileşikler elde edilir.[17] Kloroformun 535-800 °C arasında pirolizi sonucu diklorokarben ve hidrojen klorüre ayrıldığı gözlemlenmiştir. Pirolizi sonucu oluşan bileşikler arasında diklorometan, karbon tetraklorür, trikloroetilen, tetrakloroetilen ve pentakloroetan bulunur. Örneğin, serbest kalan diklorokarben kendisine eklenerek tetrakloroetilen oluşturur:[18]
- :CCl
2 + :CCl
2 → Cl
2CCCl
2
Kloroformun oksijensiz ortamda fotokimyasal ayrışması sonucu 1,1,2,2-tetrakloroetan, pentakloroetan ve hekzakloroetan ortaya çıktığı bildirilmiştir.[19] Kloroformun karboksilasyonu dikloroasetil klorür verir.[20]
Yapı
[değiştir | kaynağı değiştir]Molekül, C3v simetrili bir dörtyüzlü moleküler geometriye sahiptir.[21] Kloroform molekülü, tek bir hidrojen atomu bırakılarak üç hidrojeni klor atomları ile değiştirilen bir metan molekülü olarak görülebilir ("Triklorometan"). Moleküldeki merkezî karbon atomunun yükseltgenme basamağı +2'dir.
Kloroformun tespiti
[değiştir | kaynağı değiştir]Bir test tüpüne 1-2 mL test çözeltisi ve 1 mL %10'luk alkol–potasyum hidroksit çözeltisi eklenir. Tüp, bir gaz ocağının alevinde 3-5 dakika dikkatlice ısıtılır. Çözelti soğutulduktan sonra, %10'luk bir nitrik asit solüsyonu ve turnusol ile tepkimesiyle asitleştirilir ve 0,5 mL %1'lik bir gümüş nitrat solüsyonu eklenir.[22] Amonyakta çözünen beyaz bir çökeltinin görünümü, test çözeltisinde kloroformun varlığını gösterir, ancak bu tepkime yalnızca kloroforma özel değildir. Ayrıca diğer organoklorür bileşikleri (kloral hidrat, karbon tetraklorür, dikloroetan, vb. gibi) için de pozitif verebilir.[22]
- CHCl
3 + 4 KOH → 3NaCl + HCOONa + H
2O
- KCl + AgNO
3 → AgCl + KNO
3
Alkollü potas ve amonyak ile ısıtıldığında potasyum siyanür verir.[23] Amonyak yerine birincil aminler kullanılırsa izonitriller elde edilir. August Wilhelm von Hofmann tarafından keşfedilen bu tepkime ile, birincil aminler de niteliksel olarak tanımlanabilir, çünkü izonitriller güçlü ve kötü kokuları sayesinde kolaylıkla tanınabilir. Örneğin, kloroformun anilin ve potasyum hidroksit ile tepkimesi sonucu fenil izosiyanür (izobenzonitril), potasyum klorür ve su elde edilir:[24]
- CHCl
3 + C
6H
5NH
2 + 3KOH → C
6H
5NC + 3KCl + H
2O
Hayvan dokularında, yüzde 0,0001 kadar düşük konsantrasyonlarda kloroform, kolorimetrik test ile tespit edilebilir. Piridindeki çözelti sodyum hidroksit ile ısıtıldığında pembe rengin oluşumu kloroformun varlığına işaret eder.[25]
Üretim
[değiştir | kaynağı değiştir]Endüstriyel üretimi
[değiştir | kaynağı değiştir]Endüstriyel olarak kloroform, klor ve klorometan (CH3Cl) veya metan (CH4) karışımının ısıtılmasıyla üretilir. 400–500 °C'de, bu öncülleri giderek daha fazla klorlu bileşiklere dönüştüren bir serbest radikal halojenasyonu meydana gelir:[26][27]
- Cl2 + hν → 2 Cl·;
- Cl· + CH4 → ·CH3 + HCl.
- ·CH3 + Cl2 → CH3Cl + Cl·.
- CH3Cl + Cl· → ·CH2Cl + HCl,
- ·CH2Cl + Cl2 → CH2Cl2 + Cl·,
- CH2Cl2 + Cl· → ·CHCl2 + HCl,
- ·CHCl2 + Cl2 → CHCl3 + Cl·,
- Kloroform, karbon tetraklorür (CCl4) vermek üzere daha fazla klorlama işlemine tâbi tutulur:
- CHCl3 + Cl· → ·CCl3 + HCl,
- ·CCl3 + Cl2 → CCl4 + Cl·
- Bu işlemin çıktısı, dört klorometanın bir karışımıdır: monoklorometan (metil klorür), diklorometan (metilen klorür), triklorometan (kloroform) ve tetraklorometan (karbon tetraklorür). Bu ürünler daha sonra damıtma ile ayrıştırılabilir.[26] Başka bir yöntemde reaktan olarak metan yerine metanol kullanılır.[3]
2017 yılında klorometanların dünya çapındaki toplam üretimi yaklaşık 6,7 milyon tondu ve bunun yaklaşık 1,5 milyon tonu kloroformdu. Ana üretim tesisleri, Kuzeydoğu Asya (%50), Batı Avrupa (%23) ve Kuzey Amerika'da (%16) bulunmaktadır.[28]
Laboratuvar metodları
[değiştir | kaynağı değiştir]Britanya'da yalnızca 1895 yılında haftalık yaklaşık 750.000 doz kloroform, 1960'lara kadar önemini koruyan, kloral ve sodyum hidroksit kullanan Liebig prosesiyle ticarî olarak üretilmişti:[29][30]
- CCl
3CHO + NaOH → CHCl
3 + NaHCO
2 - Bu tepkime çıktı olarak kloroform ve sodyum bikarbonat verir.
Endüstriyel kloroform, karbon tetraklorürün demir katalizörlüğünde bir asit ya da hidrojen (H2) ile indirgenmesi ile elde edilebilir.[31] Kloroform aseton ve sodyum hipoklorit arasındaki haloform tepkimesi yoluyla küçük miktarlarda üretilebilir.[32]
- 3 NaClO + (CH
3)
2CO → CHCl
3 + 2 NaOH + CH
3COONa - Haloform tepkimesinde asetona alternatif olarak etanol, metil etil keton ya da izopropil alkol de kullanılabilir.
Haloform tepkimesine benzer bir şekilde, trikloroasetik asidin sulu bazlarla kaynatılması ile de kloroform üretilebilir.[10]
Asetonu bir baz varlığında diklor (Cl2) ile işleyerek daha basit bir şekilde kloroform elde etmek de mümkündür. Kolayca bir baz tarafından kloroform ve bir asetat tuzuna ayrılabilen bir madde olan 1,1,1-trikloroaseton aracılığıyla oluşturulur:[33]
- (CH
3)
2CO + 3Cl
2 + 3KOH → CH
3(CO)CCl
3 + 3KCl + 2H
2O - CH
3(CO)CCl
3 + KOH → CH
3COOK + CHCl
3 - Yine de, bu son sentez oldukça tehlikeli olabilir çünkü yan ürün olarak, Birinci Dünya Savaşı sırasında kimyasal silah olarak kullanılmış aşırı zehirli ve ölümcül bir gaz olan fosgen oluşturma riski vardır.
Trifenilfosfin ve karbon tetraklorür kullanarak alkollerden alkil monoklorür üretmeyi amaçlayan Appel tepkimesinin yan ürünlerden biri kloroformdur.[34] Tepkimeye giren karbon tetraklorür (CCl4), trifenilfosfinle (P(C6H5)3) bir klor atomunu iyonik olarak paylaşıp trifenilfosfonyum klorür tuzunu oluştururken geride kalan triklorometil radikali (.CCl3), alkolün (R-OH) hidroksilindeki hidrojeni alarak kloroforma dönüşür.[35]

İzotopologları
[değiştir | kaynağı değiştir]Döteryumlanmış kloroform (ağır kloroform), kloroformun, hidrojen yerine hidrojenin biz izotopu olan döteryum atomuna sahip analoğudur (izotopolog). CDCl3, NMR spektroskopisinde kullanılan yaygın bir çözücüdür. Döterokloroform, döteryumlanmış aseton ya da döteryumlanmış etanol ve sodyum hipokloritin arasındaki haloform tepkimesi ile üretilir. Normal kloroformun üretimi için haloform işlemi artık endüstriyel önemini yitirmiştir. Döterokloroform, sodyum döteroksitin (NaOD) kloral hidrat ile tepkimesi ile hazırlanabilir.[36][37] Döterokloroform, ayrıca hekzakloroasetonun döteryum oksit (ağır su) ile tepkimesi sonucu elde edilebilir.[38]
Trityumlu kloroform (CTCl
3), döteryumlu kloroformun bir baz katalizörü eşliğinde trityumlu ağır şu (DOT) ile izotop değişimi ile küçük miktarlarda elde edilebilir.[39]
Kasıtsız kloroform oluşumu
[değiştir | kaynağı değiştir]Haloform tepkimesi, kasıtsız bir şekilde ev ortamında da meydana gelebilir. Hipokloritler kullanılarak ağartma, yan tepkimelerle çeşitli halojenli bileşikler üretir ve bunlar arasında, kloroform ana üründür. Aseton, etanol veya izopropil alkol gibi yaygın evsel sıvılarla karıştırılan sodyum hipoklorit solüsyonu (klorlu ağartıcı), kloroaseton veya dikloroaseton gibi diğer bileşiklere ek olarak bir miktar kloroform üretebilir. Bu miktarlar herhangi bir tehlike arz etmeyecek kadar düşüktür.[40]
Yüzme havuzlarında eser miktarda kloroform oluşur.[41][42][43][44]
Kullanım alanları
[değiştir | kaynağı değiştir]Ölçek açısından, kloroformun en önemli kullanımı, yaygın olarak "Teflon" markası ile tanınan politetrafloroetilen (PTFE) ve diğer floropolimerlerin üretiminde bir öncül olan klorodiflorometan (R-22) üretmek üzere hidrojen florür (HF) ile tepkimesidir.[45]
- CHCl
3 + 2 HF → CHClF
2 + 2 HCl
Tepkime, katalitik miktarda karışık antimon halojenürlerin varlığında gerçekleştirilir. Klorodiflorometan, daha sonra Teflon'un monomeri olan tetrafloroetilene dönüştürülür:[46]
- 2 CHClF2 → C2F4 + 2 HCl
Tetrafloroetilenin üretiminde yaygın bir alternatif yöntemde başlangıç maddesi olarak kullanılabilen floroform[47] da kloroform ve hidrojen klorürden elde edilmektedir:[48]
- CHCl
3 + 3 HF → CHF
3 + 3 HCl
Çözücü olarak
[değiştir | kaynağı değiştir]Kloroformdaki karbona bağlı hidrojen, bileşiğin hidrojen bağlarına katılmasını sağlar.[49][50] Dünya çapında, kloroform aynı zamanda pestisit formülasyonlarında, katı ve sıvı yağlar, kauçuk, alkaloidler, mumlar, güta-perka ve reçineler için bir çözücü olarak, bir temizleme maddesi, tahıl fumigantı olarak, yangın söndürücülerde ve kauçuk endüstrisinde kullanılmaktadır.[51][52] Ağır hidrojen izotopundan yapılan analoğu Döterokloroform (CDCl3), NMR spektroskopisinde sıklıkla kullanılan bir çözücüdür.
Kloroform ve diklorometan, birçok sentetik polimeri çözebilme kabiliyetlerinden dolayı bazı plastikler için yapıştırıcı olarak kullanılırlar. Kloroform, DNA izolasyon sürecinde lipitler gibi suda çözünmeyen bileşenleri çıkarmak için kullanılabilir. DNA izolasyon işlemi; fenol, kloroform ve izoamil alkol karışımı içeren bir çözelti içerir. Bu karışım DNA süspansiyonunu üst katmana taşır ve kalan safsızlıklar tüpün dibine çöker. Tüpün tepesindeki sıvı, DNA analizi için daha fazla işlenerek safsızlık giderilir.[53]
Kloroform, içeceklerdeki kafeini çıkarmak için kullanılır. Kafeini elde etmek ve ayrıştırılmasındaki safsızlıkları gidermek için ayrıca diklorometan da daha sonra kullanılabilir.[54]
Soğutucular
[değiştir | kaynağı değiştir]Kloroform, R-22'yi (klorodiflorometan) üretmek için bir öncül olarak kullanılır. Bu, CHCl3 molekülünü florlayacak ve bir yan ürün olarak hidroklorik asiti serbest bırakacak olan bir hidroflorik asit çözeltisi (HF.H2O) ile tepkimeye sokularak yapılır.[55]
Kloroformun düşük kaynama noktası (61 °C), yanıcı olmaması ve küresel ısınmaya katkı potansiyelinin 31 kadar düşük olması (R-22'nin 1.760'ına kıyasla) gibi özelliklerinden dolayı iyi bir soğutucu olma potansiyeli vardır, ancak herhangi bir tüketici ürününde soğutucu olarak kullanımını destekleyen çok az bilgi vardır.[56]
Reaktan olarak
[değiştir | kaynağı değiştir]Bir reaktan olarak kloroform, diklorokarben (:CCl2) grubunun kaynağı olarak kullanılır.[57] Diklorokarben, ilk kez 1862'de kloroformu CCl2.HCl olarak gören Anton Geuther tarafından önerildi.[58] Üretimi 1950'de Jack Hine tarafından yeniden araştırıldı.[59] Kloroform, diklorokarben üretmek için genellikle bir faz transfer katalizörünün varlığında sulu sodyum hidroksit ile tepkimeye girer.[60][61] Bu reaktif, Reimer-Tiemann tepkimesi olarak bilinen bir tepkimede aril aldehitler üreten fenoller gibi aktif aromatik halkaların orto-formilasyonunu etkiler.[62]

Alternatif olarak bu karben, [1+2]siklo-ekleme ile siklopropan türevleri oluşturmak üzere bir alken tarafından tutulabilir. Bu klorlu siklopropan türevleri, siklopropanlara indirgenebilir ya da siklopropanonlar elde etmek için hidrolize uğrayabilir.[18]
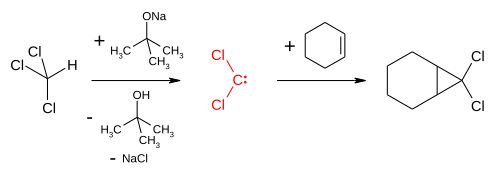
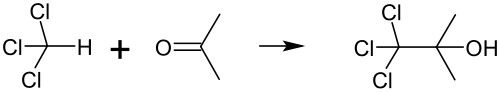
Diklorokarben dışında kloroform, triklorometil radikali vererek de tepkimeye girebilir. Buna en iyi örnek 1,1,1-trikloro-2-metil-2-propanol (trikloro-tert-bütanol, yanlış adlandırma olmasına rağmen yaygın olarak "klorobütanol" olarak bilinir) sentezidir. Bu basit bir tepkimedir ve yüksek miktarlarda atık kloroform ve asetonun birlikte saklanmasında kasıtsız olarak oluşabilir. Kloroform ve asetonun, eser miktarda dâhi olsa potasyum veya sodyum hidroksit gibi bazlar varlığında tepkimesi ile elde edilir:[63]
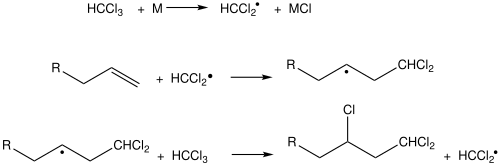
Kharasch eklemesinde, bir metal katalizörlüğünde, bir terminal alkene (alfa-olefin, çifte bağın sonda bulunduğu alken) kloroformdan elde edilen diklorometil radikali eklenir ve yan ürün olarak metal klorürler çıkar.[64] Diklorometil radikali, alkenin ilk karbonuna bağlanır ve çift bağın açılması nedeniyle ikinci karbon açıkta kalır. Açıkta kalan ikinci karbon, başka bir kloroform molekülünden klor alır. Bu tepkimenin en iyi örneği 1-oktenden kloroform ile 1,1,3-trikloro-n-nonan sentezidir.[65]
Geçmişte yangın söndürmek için kullanılmış olan bromoklorodiflorometan, kloroformdan elde edilir. İlk adımda kloroform, hidroflorik asitle florlanır. Daha sonra, oluşan klorodiflorometan 400-600 °C'de elemental brom ile 3 saniye tutulur.[66]
- CHCl
3 + 2 HF → CHClF
2 + 2 HCl - CHClF
2 + Br
2 → CClF
2Br + HBr
Kloroformun, azot oksitler açısından zengin nitrik asit ile tepkimesi sonucunda kloropikrin elde edilir:[67]
- Cl
3CH + HONO
2 → Cl
3CNO
2 + H
2O
Benzen ile alüminyum klorür katalizörlüğünde Friedel–Crafts tepkimesi yaparak trifenilmetan verir:[28]
- 3 C6H6 + CHCl3 → Ph3CH + 3 HCl
Başka kullanımları
[değiştir | kaynağı değiştir]Su buharı yerine çalışma akışkanı olarak kloroform kullanılarak en az bir deneysel ısı motoru inşa edilmiştir; düşük kaynama noktasına sahip çalışma sıvısı olarak eter kullanılarak benzer deneyler yapılmıştı, ancak aşırı yanıcı olması zorluklara neden olduğundan, yanıcı olmayan bir alternatif olarak kloroform denendi. Bu tür deneyler, kaynama noktası sudan daha düşük olan ve buharlaşması daha kolay olan bir sıvının daha verimli bir motorun yapımına olanak sağlayacağı şeklindeki yanlış kanıdan ilham almıştı, ancak aslında durum tam tersidir. 19. yüzyılda Fransa'da kloroform ve eter ile çalışan buhar makineleri denenmiştir. Bu motorların verimliliğine ilişkin abartılı iddialar, 1848'de Scientific American dergisinde, bunlar hakkında ciddi şüpheler uyandıran bir editör yorumuyla birlikte bildirildi; buluşun gelişiminin daha fazla ilerlemediği görülmektedir.[68] 1849 yılında Galilee adlı kloroform buharlarıyla çalışan bir buharlı gemi, liman çevresinde deneme sürüşü yaptı, 9 knot hıza ulaşması bir başarı olarak kabul edilmiş olsa da, kloroformla çalışan buharlı motorlar hiçbir zaman ün kazanamamıştır.[69]
Tarihçe
[değiştir | kaynağı değiştir]Keşfi
[değiştir | kaynağı değiştir]Kloroform, 1830 dolaylarında üç farklı ülkeden dört araştırmacı tarafından bağımsız olarak sentezlendi. 1830 yılında, Almanya'nın Frankfurt an der Oder şehrinden bir eczacı olan Moldenhawer, etanole kireç kaymağı (kalsiyum hipoklorit) katarak kloroform üretmişti. Ancak Moldenhawer, ürettiği ürünü başka bir kimyasal olan Chloräther (Klorik eter, 1,2-dikloroetan) sandı.[70][71] 1831'de New York, Sackets Harbor'dan ABD'li bir doktor olan Samuel Guthrie'nin, ucuz ve daha güvenli (1,2-dikloroetanın üretimi için gaz hâlde etilen ve klor gerekmekteydi) bir "klorik eter" üretme yöntemi ararken kireç kaymağını etanolle tepkimeye sokarak kloroform ürettiği ve yatıştırıcı özelliklerinden bahsettiği görülüyor; ancak o da Moldenhawer gibi ürettiği ürünün klorik eter olduğuna inanmıştı. Samuel Guthrie bulduğu bu sıvıyı "lezzetli" olarak tanımladı. Laboratuvarına gelen kişilere, "tatlı viski" dediği alkol ve kloroform karışımından ikram etti.[69][72][73] Aynı yıl Justus von Liebig, kloroformu, kendisinin keşfettiği kloralden alkali çıkarımı ile elde etti:[29]
- CCl
3CHO + NaOH → CHCl
3 + NaHCO
2
Liebig, bileşiği "Chlorkohlenstoff" ("karbon klorür") olarak adlandırdı ve yanlış bir şekilde kloroformun ampirik formülünün C2Cl5 olduğunu belirtti.[29][74] Yine aynı yıl, Fransız kimyager ve eczacı Eugène Soubeiran, bileşiği klorlu ağartıcının (sodyum hipoklorit) hem etanol hem de aseton üzerindeki etkisiyle elde etti.[75]
1834 yılında Fransız kimyacı Jean-Baptiste Dumas kloroformun ampirik formülünü belirleyip adlandırdı. 1835'te Dumas, maddeyi trikloroasetik asidin alkali bölünmesiyle hazırladı. Dumas formülü ve verdiği adı şöyle açıkladı: "Böylece, tarafımca analiz edilen maddenin C2H2Cl6[d] formülüne sahip olduğunu gösteriyor."
Dumas daha sonra kloroformun basit formülünün (CHCl3) formik asitinkine (CHOOH) benzediğini not etti. Ayrıca, kloroform potasyum hidroksit ile kaynatılırsa ortaya çıkan ürünlerden biri de potasyum formattır.
- CHCl
3 + 4KOH → KHCO
2 + 3KCl + 2H
2O
Dumas kloroformu adlandırır: "Bu, bu maddeye 'kloroform' [yani formil klorür veya formik asit klorür] adını vermeme neden oldu."[76]
Anestezik olarak kullanımı
[değiştir | kaynağı değiştir]
1842'de Londra'dan İngiliz doktor Robert Mortimer Glover, kloroformu bir köpeğin boynuna enjekte ederek kloroformun hayvanlar üzerindeki anestezik özelliklerini ve kalp üzerindeki yan etkilerini not etti. Tezinde, kloroformun ameliyatlarda kullanılma potansiyelinden bahsetmedi. Glover, teorilerini daha da geliştirdi ve 1847 yazında Edinburgh Üniversitesi'ndeki doktora tezinde sundu.[77] Glover, daha sonraki yıllarda (1859) içtiği aşırı doz kloroform nedeniyle öldü.[77]
1847 yılının Mart ayında Fransız fizyolog Jean Pierre Flourens kloroformun hayvanlar üzerindeki anestezik etkilerini araştırdı.[78][79]
Aynı yılın Kasım ayında İskoç kadın doğum uzmanı James Young Simpson, kloroformun insanlar üzerindeki anestezik özelliklerini ilk kez keşfetti. 4 Kasım 1847'de Simpson ve iki meslektaşı, yerel eczacı William Flockhart'tan temin ettikleri çeşitli maddelerin etkilerini kendi üzerlerinde deneyerek eğlenirken kloroformun anestezik potansiyelini keşfettiler.[80] Simpson başta sıvının ağırlığı nedeniyle anestezik potansiyelinin düşük olacağını ve denemeye değer olmadığını düşündü.[69] Kloroformun insanlar üzerindeki anestezik özelliklerini gösteren ilk kişiydi ve ilacın tıpta kullanılması için popüler hâle gelmesine yardımcı oldu.[81]

İlk kez 8 Kasım 1847'de doğum esnasında James Young Simpson, bir kadına kloroform verdi. Koni şekline getirdiği bir mendili bir çay kaşığı kadar kloroform ile ıslatıp kadının burnunun ve ağzının üstünde tuttu. Yirmi beş dakika sonra bebek güvenli bir şekilde dünyaya geldi. Simpson, kadını çocuğu onun doğurduğuna ikna etmek zorunda kaldı.[69] Birkaç gün sonra, Edinburgh'daki bir dişçilik prosedürü sırasında Francis Brodie Imlach, klinik bağlamda bir hasta üzerinde kloroform kullanan ilk kişi oldu.[82] Mayıs 1848'de Robert Halliday Gunning, Glover'ın bulgularını doğrulayan ve ayrıca Simpson'ın özgünlük iddialarını çürüten, tavşanlar üzerinde bir dizi laboratuvar deneyinin ardından Edinburgh Medico-Chirurgical Society'ye bir sunum yaptı. Kloroformun tehlikelerini kanıtlayan laboratuvar deneyleri büyük ölçüde göz ardı edildi.[83] Simpson kloroformu o kadar sevmişti ki, The Lancet gibi saygıdeğer tıp dergilerinde, kimyasalın özelliklerini olduğundan farklı gösteren abartılı ve övgü dolu yazılar yazdı. Ona göre kloroform, meyve kokusuna sahip ve çok tatlı bir tada sahipti.[69]
Ocak 1848'de, kloroformun anesteziye tanıtılmasından neredeyse üç ay sonra, enfekte ayak tırnağı aldırılmak istenen 15 yaşındaki bir kız çocuğu, Hannah Greener, kloroform verildikten sonra öldü.[84] Ölüm nedenini belirleyen otopsisi, Robert Mortimer Glover'ın yardım ettiği John Fife tarafından yapıldı. Fiziksel olarak sağlıklı bir dizi hasta kloroform teneffüs ettikten sonra öldü. Kloroformdan ölenlerin çoğunun anesteziye direndikleri ve nefeslerini tuttukları tahmin ediliyordu. Bazı araştırmalara göre, nadir de olsa en çok ölümler Greener'ın vakasındaki gibi hafif kloroform anestezisi altında gerçekleşmekte ve derin kloroform anestezisinin "koruyucu" etkileri olduğunu düşünülmektedir.[85] Ancak, 1848'de John Snow, dozu düzenleyen ve böylece ölüm sayısını başarılı bir şekilde azaltan bir inhaler (soluma aparatı) geliştirdi.[86]
Kloroforma karşıt bazı doktorlar ise kloroformun "şeytanî" olduğunu düşündü.[69] Doğumda kloroform anestezisi en çok Anglikan Kilisesi tarafından eleştirildi. Pek çok Hristiyan din adamı, doğum sancısının Havva'nın günahı için adil bir ceza, yani Tanrı'nın isteği olduğuna inanıyordu ve İncil'in Yaratılış 3:16 âyetini gösteriyordu:[85] Tanrı kadına, Çocuk doğururken sana çok acı çektireceğim. Ağrı çekerek doğum yapacaksın, dedi. Simpson ise Tanrı'nın da anestezi kullandığını söyleyip Yaratılış 2:21 âyetini sunarak cevap verdi:[85] Tanrı Âdem'e derin bir uyku verdi. Âdem uyurken, Tanrı onun kaburga kemiklerinden birini alıp yerini etle kapadı. 1850'lerde, Kraliçe Victoria'nın (yani Anglikan Kilisesi'nin başı) son iki çocuğunun doğumunda doktor John Snow tarafından kloroform kullanılması büyük bir gelişmeydi.[87]
İskoç doktor George Harley, kloroformun eter ve alkolle bir karışım olarak kullanılması fikrini öne sürdü ve "ACE mixture" adını verdiği bu karışım ilk olarak 1860 civarlarında İngiltere'de kullanıldı.[88] 1864 yılında, ACE karışımının kullanımı Kloroform Komitesi tarafından, cerrahi operasyonlarda kullanımı tavsiye edildi. Bu karışım 19. yüzyıldan sonra nadiren kullanılmıştır, sadece karışımın daha yaygın olduğu Almanya'daki kullanımı biraz daha uzun sürmüştü.[89] Çoğunlukla 1 kısım alkol, 2 kısım kloroform ve 3 kısım eterden oluşan[89] bu karışımın kaynama noktası 48 °C olarak verilmiştir.[90] Alkol ve eterin uyarıcı etkilerinin, kloroformun kalpteki etkilerini önleyeceğine inanılıyordu.[89]
Kloroform karşıtları ve savunucuları, komplikasyonların yalnızca solunum bozukluğundan mı kaynaklandığı yoksa kloroformun kalp üzerinde belirli bir etkisinin olup olmadığı sorusuyla büyük bir anlaşmazlığa düştüler. 1864 ve 1910 yılları arasında Britanya'da çok sayıda komisyon kloroform üzerinde çalıştı ancak net bir sonuca varamadı. Levy, kloroformun kardiyak fibrilasyona neden olabileceğini hayvanlar üzerinde yaptığı deneylerde ancak 1911'de kanıtladı.[85][91] Kloroformun güvenliği hakkındaki çekinceler, kimyasalın dünya tıp çevrelerindeki artan ününü durduramadı. Kırım Savaşı ve Amerikan İç Savaşı gibi savaşlarda, özellikle amputasyonlar olmak üzere, cerrahi operasyonlarda genel anestezi (narkoz) amaçlı büyük ölçekte kloroform kullanıldı. Kloroform anestezisi sayesinde uyluk amputasyonları gibi ağır ameliyatlardaki ölüm oranı ciddi bir şekilde düştü.[92] Ancak bütün bunlara rağmen, bazı araştırmacılar kloroformun kullanıldığı ilk 100 yıl içinde 100.000 kişinin ölümüne sebep olduğunu iddia etmekte ve sadece İngiltere ve Galler'de 1933 yılında kloroform nedeniyle 278 kişinin öldüğü bildirilmiştir.[69]

Kloroform anestezisi, Türkiye'ye Cemil Topuzlu tarafından Paris'teki tıp eğitiminin ardından 1890 yılında tanıtılmıştır.[93][94]
Amerika Birleşik Devletleri'nde 19. yüzyılın sonlarında, kloroform bir anestezik olarak, aşırı yanıcı olduğu ve patlayıcı peroksit oluşturma riski bulunduğu bilinen eterin yerini almaya başladı; ölümcül kardiyak aritmiye neden olma eğilimi ve toksisitesinin keşfedilmesi üzerine hızla sağlık açısından daha güvenli olan eter lehine terk edildi. ABD'de kloroformun ilk yasaklandığı yer, dietil eterin tanıtıldığı hastane olan Massachusetts General Hospital olmuştur.[92] 1860'larda anestezide kloroforma alternatif olarak karbon tetraklorür ve diklorometan gibi benzer maddeler sunulmuş olsa da, yüksek toksisiteleri ve yetersiz anestezik etkileri nedeniyle kullanımları yaygınlaşmamıştır.[95] Kloroformu ilk kez anestezik olarak kullanan J. Y. Simpson da daha sonraları karbon tetraklorür ile anestezik deneyler yapmıştır.[96]
Würzburglu cerrah Ludwig Burkhardt'ın 1909'da denediği damara enjeksiyon yoluyla anestezik kloroform uygulama deneyleri, ortaya çıkan ciddi komplikasyonlar nedeniyle başarılı olmadı.[97][98]
1930'lara doğru kloroform ve eterin anestezideki yerini, karaciğer için kloroformdan daha güvenli olduğu öne sürülen ve yanıcı olmayan bir alifatik klorlu hidrokarbon olan trikloroetilen (C
2HCl
3) almıştır. Trikloroetilen, fiziksel olarak (görünüm, koku, yoğunluk bakımından) kloroforma çok benzemekteydi ve bu yüzden anestezik kullanım için üretilen trikloroetilen, kloroformdan kolayca ayırt edilebilmesi için maviye boyanıyordu.[99] Kloroformun dünya çapındaki ününü kaybetmesi, ilk kullanımından neredeyse 130 yıl sonrasını buldu.[100] 1968 yılında, 100 kişi üzerinde aynı koşullarda kloroform ile o dönemde çok daha yaygın olarak kullanılan bir anestezik olan halotan karşılaştırması yapılmıştır; sonuçlar, ikisinin de eşit koşullarda aynı derecede güvenli olduğunu göstermiştir.[101]
Kloroform komiteleri
[değiştir | kaynağı değiştir]Kloroformun güvenliğinin araştırması amacıyla 1864 yılından itibaren birçok komite kurulmuştur:
- Kloroform Komitesi (Chloroform Committee), 1864 yılında Kraliyet Tıp ve Cerrahi Derneği (şu anda Kraliyet Tıp Derneği olarak biliniyor) tarafından kloroform kullanımını araştırmak üzere görevlendirildi.[102] Komite, eterin daha güvenli olduğunun farkında olarak, kurulduğu yıldan itibaren kloroform kullanımını savundu.[89][103] Bu tür komitelerin ilkiydi ve Kloroformun kalbin hareketini baskıladığı ve sıklıkla insanları öldürdüğü sonucuna vardı. Üyelerden biri olan ve buluşmalara sıklıkla katılan doktor Joseph Clover, komitede bulunduğu süre boyunca "Clover çantası" adı verilen kloroformun daha güvenli kullanılmasını sağlayan aparat geliştirdi.[102]

- Glasgow Anestezikler Komitesi (The Glasgow Committee on Anæsthetics), 1875 yılında Edinburgh'daki İngiliz Tabipler Birliği'nin yıllık toplantısında kuruldu. Kloroformun yerine 1,1-dikloroetanın kullanımını önerdi.[102]
- İngiliz Tabipler Birliği Özel Kloroform Komitesi (The Special Chloroform Committee of the British Medical Association, bazen "Üçüncü Kloroform Komitesi" olarak da anılır[104]) İngiliz Tabipler Birliği'nin yıllık toplantısının ardından 1901 yılında kurulmuş ve son nihai raporunu 1910'da yayınlamıştır. Komite, o dönemde mesleğin ve kamuoyunun büyük ilgisini çeken kloroformun araştırılması için kuruldu.[105] Nihai raporunda komite, vagus sinirinin inhibisyonu sonucu kalp durması meydana geldiğinden %2'nin üzerindeki kloroform dozlarının güvenli olmadığını belirtti.[104][106]
- Amerikan Tabipler Birliği Anestezi Komitesi (American Medical Association Committee on Anæsthesia), 1910'da kloroformun ABD'deki anestezik kullanımının yasaklanmasını önerdi.[102]
Tıbbî olmayan amaçlar ile kullanımı
[değiştir | kaynağı değiştir]Kloroform, bazı kişiler tarafından keyif verici bir madde olarak veyâ intihar için kullanıldı.[107] Eter ve nitröz oksit anestezisinin öncülerinden biri olan kloroform bağımlısı diş hekimi Horace Wells, Ocak 1848'de hapishanede uyluk damarını keserek intihar etmeden önce kendini kloroformla uyuşturdu.[108] Kasıtlı olarak soluma veya içme yoluyla vücuda kloroform alınması alışkanlığına "kloroformizm" adı verilir.[109] 19. yüzyıl İngilteresinde birçok sağlık çalışanının bu alışkanlığa sahip olduğu tahmin ediliyordu.[109] Bu alışkanlığın, kişilerin ağrı veya uykusuzluk ile başa çıkmak için kloroform almaya başlamalarından doğduğu düşünülüyordu.[110]
Kloroformun suçlular tarafından kurbanları etkisiz hâle getirmek ve hatta öldürmek için kullanıldığı biliniyor. 1894 yılında Joseph Harris, insanları soymak için kloroform kullanmıştı.[111] Seri katil H. H. Holmes, kadın kurbanlarını öldürmek için aşırı doz kloroform kullandı ve H. H. Holmes'un otelinde kloroformlu gizli gaz odası inşa ettiği iddia edildi. Eylül 1900'da, şimdi Rice Üniversitesi olarak bilinen kurumun adaşı olan ABD'li işadamı William Marsh Rice'ın cinayetinde kloroform kullanıldı. Kloroform, 1991 yılında uyurken boğulan bir kadının ölümünde bir faktör olarak kabul edildi.[112] 2002 yılında, 13 yaşındaki Kacie Woody, David Fuller tarafından kaçırıldığında ve elinde tutulduğu sırada, vurulup öldürülmeden önce kloroform ile sakinleştirlmişti.[113]
II. Dünya Savaşı sırasında Nazi doktor Josef Mengele, bir gecede on dört Çingene ikiz çocuğu önce kollarından hekzobarbital enjeksiyonu verdikten sonra kalplerine kloroform enjekte ederek öldürmüştür.[114]
Kullanımına dair yaygın yanlış inançlar
[değiştir | kaynağı değiştir]Kloroformun bayıltıcı olarak kullanılması klişesi –suçluların, kurbanlarını bilinçsiz hâle getirmek için kloroforma batırılmış bez kullanmasını yazan suç kurgu yazarlarının popülerliği nedeniyle– geniş çapta kabul gördü. Bununla birlikte, kloroform kullanarak birini bu kadar hızlı şekilde etkisiz hâle getirmek neredeyse imkansızdır.[115] Bir kişiyi bilinçsiz hâle getirmek için, kloroforma batırılmış bir nesnenin en az 5 dakika teneffüs edilmesi gerekir. Bir kişi kloroform solunumu nedeniyle bilincini kaybettikten sonra, sürekli bir doz uygulanmalı ve dilin hava yolunu tıkamasını önlemek için çene desteklenmelidir; bu, bir anestezi uzmanının becerilerini gerektiren zor bir işlemdir.[115] Kloroformun kazandığı suçta kullanılma klişesinin eleştirilmesi adına, tıp dergisi The Lancet 1865 yılında kloroforma maruz kalarak anında bilincini kaybedebilen herkese "kalıcı bilimsel itibar" teklif etti.[116]
Anestezi harici tıbbî kullanımları
[değiştir | kaynağı değiştir]
Kloroform, geçmişte öksürük şurupları gibi birçok ilaç formülasyonunda rahatlatıcı bileşen, tatlandırıcı veya çözücü olarak kullanılmıştır.[117] Kloroform, geçmiş yıllarda birçok ilacın bileşiminde bulunuyordu. Bunlardan en ünlülerinden birisi, 19. yüzyılda İngiliz kolonilerinde bolca kullanılmış olan Chlorodyne ilacıdır. Asıl amacı kolera tedavisi olan bu ilacın içeriğinde laudanum (alkollü afyon çözeltisi), kenevir ve kloroform bulunmaktaydı. Chlorodyne, kolera, ishal, uykusuzluk ve migren gibi sorunların tedavisi için kullanılmış, yüksek opiat içeriği nedeniyle bazı kullanıcılarda bağımlılığa sebep olmuştur ve aşırı doz alımlarından ölümler bildirilmiştir.[118] Kloroformun anestezik olarak ilk kullanımdan önce yıllarca alkollü çözeltisinin antispazmodik olarak kullanıldığı bilinmektedir.[92] Astım ve kolerayı tedavi etmek için de kullanıldığı bilinmektedir.[117] Kloroform ilk olarak 1833'te "klorik eter" adı altında, astımın tedavisi için önerilmiştir.[119]
Aqua Chloroformii (Latince, "kloroform suyu") ya da Eau chloroformée (Fransızca, "kloroformlu su"), 5 kısım kloroform ve 1000 kısım suyun (%0,5'lik çözelti) çalkalanması ile hazırlanan bir ilaçtı.[120] Genel olarak şiddetli mide bulantısı ve karın ağrısı için kullanılıyordu.[121]
Güvenlik
[değiştir | kaynağı değiştir]Kloroform havada ısı ve ışık varlığında yavaşça son derece zehirli fosgene (COCl2) dönüşür ve bu esnada hidrojen klorür açığa çıkar.[122]
- 2 CHCl
3 + O
2 → 2 COCl
2 + 2 HCl
Bu tür kazaları önlemek için ticarî kloroform, etanol veya amilen ile stabilize edilir, ancak geri kazanılmış veya kurutulmuş numuneler artık herhangi bir stabilizatör içermez. Amilenin etkisiz olduğu bulunmuştur ve fosgen, numunelerdeki analitleri, lipitleri ve kloroformda çözünmüş veya kloroformla ekstrakte edilmiş nükleik asitleri etkileyebilir.[123] Fosgen ve hidrojen klorür, sodyum bikarbonat gibi doymuş sulu karbonat çözeltileri ile yıkanarak kloroformdan çıkarılabilir. Bu işlem basittir ve zararsız ürünlerle sonuçlanır. Fosgen, su ile hidrolize uğrayarak karbondioksit ve HCl verir[124] ve karbonat tuzu, oluşan asiti nötralize eder.[125] Stabilizatör olarak etanol kullanıldığı zaman, kloroform içinde oluşan ve çözünmüş olan fosgen, etanolle tepkimeye girer ve nispeten zararsız olan dietil karbonat verir:
Şüpheli kloroform numuneleri, fosgen buharıyla sarıya dönen filtre kâğıdı (%5 difenilamin, etanol içinde %5 dimetilaminobenzaldehit ile işlenir ve sonra kurutulur) kullanılarak fosgen için test edilebilir. Fosgen için çeşitli kolorimetrik ve florometrik reaktifler vardır ve ayrıca kütle spektrometresi ile ölçülebilir.[126]
Temizlenmesi
[değiştir | kaynağı değiştir]Temizleme işlemi birkaç aşamaya ayrılmıştır. İlk olarak, kloroform konsantre sülfürik asit ile çalkalanır, su ile yıkanır, kalsiyum klorür veya magnezyum sülfat üzerinde kurutulur ve damıtılır. Kloroformun saflığı filtre kâğıdından buharlaştırarak kontrol edilebilir: kloroformdan başka koku olmamalıdır. Küflü, keskin, tahriş edici bir koku, klor, hidrojen klorür veya fosgen gibi safsızlıkların varlığını gösterir.[127]
Maruziyeti ve toksikoloji
[değiştir | kaynağı değiştir]
Kloroformun, bir dizi başka yan ürünle birlikte, suyun dezenfeksiyon amacıyla klorlanmasının bir yan ürünü olarak oluştuğu bilinmektedir ve bu nedenle musluk suyunda ve yüzme havuzlarında yaygın olarak bulunur.[128] Bildirilen aralıklar önemli ölçüde değişiklik gösterse de, genellikle 100 μg/L'lik miktar, tam trihalometanlar (TTHM'ler) için mevcut sağlık standardının altındadır.[129] Bununla birlikte, içme suyunda sıklıkla bulunan diğer trihalometanlarla (diklorobromometan, dibromoklorometan ve bromoform[128]) kombinasyon hâlinde ele alındığında, THM'lerin seviyesi genellikle önerilen maruziyet sınırlarını aşmaktadır.[130]
Tarihî olarak kloroform maruziyeti; anestezik olarak, öksürük şuruplarında rahatlatıcı ve tatlandırıcı bir bileşen olarak ve DDT'nin daha önce fumigant olarak kullanıldığı tütün dumanının bir bileşeni olarak yaygın kullanımı nedeniyle pekâlâ daha yüksek olabilir.[131]
Farmakoloji
[değiştir | kaynağı değiştir]
Oral, solunum veya dermal maruziyetten sonra memeliler tarafından iyi emilir, metabolize edilir ve hızla vücuttan atılır.[4] Gözle teması tahrişe neden olur.[51] Uzun süreli dermal maruz kalma, ciltteki yağ kaybının bir sonucu olarak ciltte yaraların ve kimyasal yanıkların gelişmesine neden olabilir. Atılım öncelikle kloroform ve karbondioksit formunda akciğerler yoluyla gerçekleşir.[52]
Kloroform karaciğerde sitokrom P450 enzimleri tarafından, oksidasyon yoluyla triklorometanole ve diklorometil serbest radikaline indirgenerek metabolize edilir. Kloroformun diğer metabolitleri arasında hidroklorik asit ve digluatiyonil ditiyokarbonat bulunur ve metabolizmanın baskın son ürünü karbondioksittir.[132]
Solunan havada %0,5 ila 0,7 arası (5000-7000 ppm) konsantrasyonlarda kloroform bulunması, kişide sarhoşluk durumuna sebep olabilir. İnsanlarda derin anestezi için havadaki kloroform konsantrasyonunun %1,4 (14.000 ppm) olması yeterlidir. %1,6 (16.000 ppm) ve üstü konsantrasyonlar boğucu olabilir.[133] Diğer birçok genel anestezik ve yatıştırıcı-hipnotik ilaç gibi, kloroform da GABAA reseptörü için pozitif bir allosterik modülatördür.[134] Kloroform, merkezî sinir sistemini (MSS) baskılar ve sonuçta derin koma ve solunum merkezinin yavaşlamasına neden olur. Kloroformun olası bir etki mekanizması, potasyum iyonlarının sinir hücrelerindeki belirli potasyum kanalları yoluyla hareketini arttırmasıdır. Bu, zarların hiperpolarizasyonuna yol açabilir. Sinir hücresi zarının hiperpolarizasyonu, onu daha az uyarılabilir hâle getirir. Bu presinaptik olarak meydana geldiğinde nörotransmitterlerin salınımını azaltacaktır. Bu etki postsinaptik olarak ortaya çıktığında, bir nörotransmittere verilen yanıtı azaltır.[135] Yutulduğunda, solunumdan sonra görülenlere benzer semptomlara neden olduğu gözlemlenmiştir. 7,5 gram (5 mL) kloroform alımını ciddi rahatsızlıklar takip etmiştir. Bir yetişkin için ortalama öldürücü oral dozun 45 gram (30 mL) olduğu tahmin edilmektedir.[51] İnsanlarda solunumundan sonra kloroformun yarı ömrü 7,9 saattir.[4]
Kloroformun anestezik kullanımı, solunum yetmezliği ve kalpte ritim bozukluklarına bağlı ölümlere yol açtığı için bırakıldı. Kloroformla yapılan anesteziyi takiben, bazı hastalarda karaciğer fonksiyon bozukluğu nedeniyle bulantı, kusma, hipertermiya, sarılık ve koma görüldü. Otopside karaciğer nekrozu ve dejenerasyonu gözlemlendi.[51] Kloroform için terapötik aralık (etkili ve öldürücü doz arasındaki fark) çok küçüktür, buna karşılık olarak aynı dönemlerde anestezide kullanılan bir başka uçucu anestezik olan dietil eterin terapötik aralığı çok daha geniştir.[100]
Uluslararası Kanser Araştırma Ajansı (IARC) Monograflarına göre kloroformun kansere neden olduğundan şüphelenilmektedir ancak yeterli kanıt bulunmamaktadır (IARC Grup 2B; yani olası kanserojen).[136][137]
Yan etkileri
[değiştir | kaynağı değiştir]Toksisite mekanizması
[değiştir | kaynağı değiştir]Kloroform iki biyokimyasal mekanizma ile hücre ölümüne neden olabilir:
- Kalsiyum homeostazisinin bozulması: Kloroform, plazma zarında ve endoplazmik retikulum zarında bulunan Ca2+ ATPaz pompası ile kovalent bağlar oluşturur. Bu pompa, kalsiyumu endoplazmik retikulum içinde depolama ve kalsiyumu sitozolden dışarı atma işlevine sahiptir. Bu nedenle kloroform bu işlevleri inhibe eder ve sonuç olarak hücre içi kalsiyum seviyeleri artar.[138]
- Oksidatif stres: Kloroform, reaktif oksijen türlerinin ve reaktif azot türlerinin aşırı üretiminde yer alır. Bu türler, canlılarda kloroformun biyotransformasyon sürecinde üretilir.[138]
Akut etkileri
[değiştir | kaynağı değiştir]Düşük miktarda maruz kalınan kloroform; rehavet, baş ağrısı ve baş dönmesine sebep olabilir. Daha yüksek dozlardaki yan etkileri düzensiz solunum, mide bulantısı, kusma, böbrekte ve karaciğerde çeşitli geçici etkilerdir. Yüksek konsantrasyonlarda kloroforma maruz kalmak, bilinç kaybına sebep olur ve artan dozlarda kalp durmasına kadar gidebilir.[139]
Kloroformun hepatotoksisitesinin ve nefrotoksisitesinin büyük ölçüde fosgene bağlı olduğu düşünülmektedir.[132] Karbonhidrat bakımından zengin diyet, kloroform alımı öncesinde glukoz tüketimi veya sık oksijen bulunması, kloroformun karaciğer üstündeki etkilerinden korur.[85]
Kronik etkileri
[değiştir | kaynağı değiştir]Kloroform hafif ilâ orta derece toksisite sergiler. Kronik (uzun süreli) maruz kalmanın karaciğer (hepatit ve sarılık gibi), merkezî sinir sistemi (depresyon ve sinirlilik gibi) ve böbrekler üzerinde etkileri vardır.[140][141] Kloroform, B12 vitaminine kovalent bağlanarak metiyonin sentezini yavaşlatır.[142]
Kloroform, farelerde ve sıçanlarda solunum yoluyla uygulama yoluyla gelişimsel toksisite açısından test edilmiştir. Fetal toksisite, büyüme geriliği, maternal toksisite kanıtıyla birlikte birkaç çalışmada gözlemlenmiştir. Başka bir çalışmada üreme üzerine etkileri gözlenmiştir.[143][144]
Köpeklerde yapılan bir çalışmada tümör gelişiminde artış gözlenmedi.[145] Mevcut in vitro ve in vivo çalışmalar, kloroformun kanserojen etkisinin genotoksik olmayan mekanizmalardan kaynaklandığı ve kronik doku hasarına bağlı olduğu sonucuna varmıştır.[146]
Üreme üzerinde etkileri
[değiştir | kaynağı değiştir]Hayvanlar üzerinde yapılan çeşitli araştırmalar, kloroformun malformasyon ve cenin miktarında azalmayı sağlayan güçlü bir etkisi olduğunu göstermiştir. Erkeklerde kloroforma maruz kalmak normal ve sağlıklı olmayan şekilde sperm artışına sebep olmaktadır.[147]
Doğadaki varlığı
[değiştir | kaynağı değiştir]Kloroform, klorometandan sonraki doğal olarak oluşan ve atmosferde en çok bulunan ikinci uçucu organik klor bileşiğidir.[148] Çevreye kloroform salınımı yılda ortalama 660000 tondur ve bunun %90 kadarı doğal kaynaklıdır.[149] Birçok deniz yosunu (kahverengi yosunlar: Laminaria digitata, Laminaria saccharina, Fucus serratus, Pelvetia canaliculata, Ascophyllum nodosum, kırmızı yosunlar: Gigartina stellata, Corallina officinalis, Polysiphonia lanosa; yeşil yosunlar: Ulva lactuca, Enteromorpha türleri, Cladophora albida)[150] kloroform üretmektedir ve bazı mantar türlerinin de toprakta kloroform ürettiği düşünülmektedir.[151][152] Kloroform ayrıca kahverengi alg Fucus vesiculosus, yeşil algler Cladophora glomerata, Enteromorpha ahlneriana, Enteromorpha flexuosa ve Pleurosira laevis tarafından da üretilir.[153] Benzer şekilde, karagenan üretimi için büyük ölçekte yetiştirilen ve hasat edilen yosun Eucheuma denticulatum da kloroform üretir.[154] Bu çalışmalar, muhtemelen fotosentez en yüksek olduğunda, artan ışık yoğunluğuyla birlikte kloroform üretiminin arttığını göstermektedir. Abiyotik prosesin de topraktaki kloroform üretimine katkıda bulunduğu düşünülse de mekanizması hâlâ bilinmemektedir.[155]

Toprakla temas hâlindeki hava genellikle normalden daha yüksek konsantrasyonlarda kloroform içerir. Basidiomycetes türleri Mycena metata ve Peniophora pseudopini ve Deuteromycetes türleri Cardariomyces fumago gibi bazı mantarların kloroform üretebildiğini gösteren araştırmalar mevcuttur.[156]
Kloroform; toprak ve sudan hızlıca buharlaşıp havada fosgen, metilen klorür, formil klorür, hidrojen klorür, karbon dioksit ve karbon monoksite bozunur. Kloroformun havadaki yarı ömrü 55 ila 620 gün arasında değişmektedir. Sucul organizmalarda biyo-akümüle olmaz.[51]
Biyoremediasyon
[değiştir | kaynağı değiştir]Bazı anaerobik bakteriler, organohalojenür solunumu olarak adlandırılan solunumları için kloroform kullanır ve diklorometana dönüştürür.[157][158]
Popüler kültür
[değiştir | kaynağı değiştir]
Kloroform genellikle anestezik etkisi ile tanınır ve sıklıkla polisiye TV dizilerinde, romanlarda ve çizgi romanlarda suçlular tarafından kurbanlarını bayıltmak ya da etkisiz hâle getirmek için kullanılır. Bu tür sahnelerde habersiz bir karakterin arkasından sessizce yaklaşan (ve çoğu zaman öykünün suçlusu olan) başka bir karakter, üzerine kloroform döktüğü bezle onun ağzını ve burnunu kapatır, kurban başarısız direnişinden sonra birkaç saniye içinde saatler sürecek derin bir uykuya dalar. Kloroform aslında biraz solumadan sonra kişiyi bayıltmaz, ancak en iyi ihtimalle rehavete veyâ yetersiz oksijen alımı sonucu baş ağrısına neden olur. Kloroformun kurguda anlatıldığı gibi güçlü anestezik özelliklere sahip olduğu doğru olsa da, anesteziyi başlatmak için önemli miktarlarda bir süre boyunca devamlı olarak solunması gerekir. Anlatıldığı gibi kullanmak gerçek hayatta mümkün değildir. İlk olarak, kloroformun etkisini göstermesi saniyeler değil birkaç dakika sürdüğü için, bu da teorik olarak kurbana direnmesi ya da yardım çağırması için zaman verir.[159][160] Ayrıca etkisi gösterildiği gibi uzun süreli değildir. Bunu kullanmış anestezistler, hastalarını bilinçsiz tutmak için verilen kloroform dozunu düzenli olarak yenilemek zorundaydılar.[160]
Suçluların, kurbanlarının üzerine sıktıkları bir parfüm şişesinin içine sakladıkları kloroformla uyuttuklarına dair sahneler de gerçekçi değildir. Kloroform, havada anestezik konsantrasyonlarda bulunamayacak kadar uçucudur.[161]
Öte yandan, aşırı doz kloroformun ölüme yol açması muhtemeldir ve anestezik olarak kullanım için solunum miktarı ve genel durum kontrol edilmelidir. Yani kloroformun anestezik olarak kullanılabilmesi için alıcının uyuşturulma iradesine sahip olması gerekmektedir.[160] Ayrıca kloroform cilt ile temas ettiğinde duruma göre tahrişe ve hatta hafif kimyasal yanıklara neden olabilmektedir.
Veriler
[değiştir | kaynağı değiştir]Fiziksel verileri
[değiştir | kaynağı değiştir]| Yapı ve özellikler | |
|---|---|
| Kırılma indisi, nD | 1,4459 (19 °C) |
| Abbe sayısı | Bilinmiyor |
| Dielektrik sabiti, εr | 4,8069 ε0 (20 °C) |
| Bağ gücü | Bilinmiyor |
| Bağ uzunluğu[162] | C-Cl 1,75 Å |
| Bağ açısı[162] | Cl-C-Cl 110.3° |
| Dipol momenti | 1,08 D (gaz) 1,04 D[163] |
| Manyetik alınganlık | Bilinmiyor, Teflon'unkine yakın |
| Yüzey gerilimi | 28,5 dyn/cm (10 °C) 27,1 dyn/cm (20 °C) 26,67 dyn/cm (25 °C) 23,44 dyn/cm (50 °C) 21,7 dyn/cm (60 °C) 20,20 dyn/cm (75 °C) |
| Viskozite[164] | 0,786 mPa·s (–10 °C) 0,699 mPa·s (0 °C) 0,563 mPa·s (20 °C) 0,542 mPa·s (25 °C) 0,464 mPa·s (40 °C) 0,389 mPa·s (60 °C) |
Termodinamik özellikleri
[değiştir | kaynağı değiştir]| Faz davranışı | |
|---|---|
| Üçlü nokta | 209,61 K (-63,54 °C), ? Pa |
| Kritik nokta | 537 K (264 °C), 5328,68 kPa |
| Standart füzyon entalpi değişimi, ΔfusH |
8,8 kJ/mol |
| Standart füzyon entalpi değişimi, ΔfusS |
42 J/(mol·K) |
| Standart buharlaşma entalpi değişimi, ΔvapH |
31,4 kJ/mol |
| Standart buharlaşma entropi değişimi, ΔvapS |
105,3 J/(mol·K) |
| Katı özellikleri | |
| Standart oluşum entalpi değişimi, ΔfH |
Bilinmiyor |
| Standart molar entropi, S |
Bilinmiyor |
| Isı kapasitesi, cp | Bilinmiyor |
| Sıvı özellikleri | |
| Standart oluşum entalpi değişimi, ΔfH |
–134,3 kJ/mol |
| Standart molar entropi, S |
Bilinmiyor |
| Yanma entalpisi | –473,2 kJ/mol ΔcH |
| Isı kapasitesi, cp | 114,25 J/(mol K) |
| Gaz özellikleri | |
| Standart oluşum entalpi değişimi, ΔfH |
–103,18 kJ/mol |
| Standart molar entropi, S |
295,6 J/(mol K), 25 °C |
| Isı kapasitesi, cp | 65,33 J/(mol K), 25 °C |
| van der Waals sabitleri[165] | a = 1537 L2 kPa/mol2 b = mol başına 0,1022 litre |
Buhar basıncı[166]
[değiştir | kaynağı değiştir]| Basınç (mm Hg) | 1 | 10 | 40 | 100 | 400 | 760 | 1520 | 3800 | 7600 | 15200 | 30400 | 45600 | |
| Sıcaklık (°C) | –58,0 | –29,7 | –7,1 | 10,4 | 42,7 | 61,3 | 83,9 | 120,0 | 152,3 | 191,8 | 237,5 | — | |
Galeri
[değiştir | kaynağı değiştir]-
Bir kloroform molekülünün 3B modeli
-
Kloroform içeren cam ampul (Paris, Fransa)
-
Bir kloroform reklamı (1916)
-
Londra'dan Kloroform için damlalık şişe. Kloroform bir beze yavaşça damlatılarak kullanılırdı.
-
Joseph Clover'ın kloroform aparatı (19. Yüzyıl)
-
Doğum anestezisi için kloroform kapsülleri
-
I. Dünya Savaşı sırasında Almanya'da kullanılan taşınabilir kloroform kiti
-
Anestezik kloroform uygulaması
-
II. Dünya Savaşı'nda kullanılması için üretilmiş kloroform uygulama aparatı
Ayrıca bakınız
[değiştir | kaynağı değiştir]İlgili olaylar
[değiştir | kaynağı değiştir]Benzer bileşikler
[değiştir | kaynağı değiştir]- Metilen klorür
- Karbon tetraklorür
- Nitrokloroform (kloropikrin)
- Trikloroetilen
- 1,1,1-Trikloroetan
- Triklorosilan
Notlar
[değiştir | kaynağı değiştir]- ^ Tutulan adlar, HCBr3 için 'bromoform', HCCl3 için 'kloroform' ve HCI3 için 'iyodoform' genel terminolojide kabul edilebilir. Tercih edilen IUPAC adları ikâme adlardır.[1]
- ^ Başka bir kimyasalın adının yanlış yazılmasından türetilmiştir.
- ^ Adı, "terklorür" (tersiyer klorür, triklorür) ya da "perklorür" ve bir formik asit radikali olan "formil" (CH, günümüzde metiliden olarak bilinir) kelimelerinin birleşimidir.
Kloroformun Türkçedeki en eski adı 1873 yılında yazılan Lügat-ı Tıbbiye'de geçen ve kabaca "karınca kloru" olarak çevirilen klor-i nemldir.[9] - ^ formülünün katsayıları yarıya indirilmelidir.
Kaynakça
[değiştir | kaynağı değiştir]- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: Royal Society of Chemistry. 2014. s. 661. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Occupational Exposure to Chloroform, NIOSH, 1974
- ^ a b c Chloroform (PIM 121) https://inchem.org/documents/pims/chemical/pim121.htm 21 Mayıs 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ a b c Chloroform, Eugenio Vilanova, Carmen Estevan, Miguel A. Sogorb, Jorge Estévez, Encyclopedia of Toxicology (Fourth Edition), Sayfa 921-928, doi
- ^ "Part 3 Health Hazards" (PDF). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Second revised edition. United Nations. 4 Mart 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 30 Eylül 2017.
- ^ a b NIOSH Pocket Guide to Chemical Hazards. "#0127". National Institute for Occupational Safety and Health (NIOSH).
- ^ Toxicity on PubChem 2018-08-17 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Lewis, Richard J. (2012). Sax's Dangerous Properties of Industrial Materials (12. bas.). ISBN 978-0-470-62325-1.
- ^ Nişanyan Sözlük "Kloroform" maddesi"Arşivlenmiş kopya". 26 Mayıs 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Mayıs 2023.
- ^ a b c d CHLOROFORM, Watts, H. (1863). A Dictionary of Chemistry and Allied Branches of Other Sciences. Birleşik Krallık:
- ^ Inchem - Chloroform "Arşivlenmiş kopya". 1 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Mayıs 2023.
- ^ a b R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols, J. Chem. Eng. Data 37 (1992), S. 80–95, doi:10.1021/je00005a024.
- ^ G. Chancel, Fresenius Zeitschrift f. anal. Chemie, 1886, 25, s. 118
- ^ Chloroform (EHC 163, 1994) https://inchem.org/documents/ehc/ehc/ehc163.htm 1 Nisan 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ a b I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 142–143.
- ^ "Arşivlenmiş kopya". 9 Mayıs 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Mayıs 2023.
- ^ W. Ramsay ve S. Young, Jahresberichte, 1886, s. 628
- ^ a b Chloroform Pyrolysis: Experiment and Detailed Reaction Model Yang Soo Won ve Joseph W. Bozzelli (1992), Combustion Science and Technology, 85:1-6, 345-373, DOI: 10.1080/00102209208947177 21 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Photochemical Reaction of Chloroform, Korean Society of Photoscience, Journal of Photoscience, Cilt 4.1, Sayfa 17-21 21 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi., 1997
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_537.
- ^ "Illustrated Glossary of Organic Chemistry - Chloroform". www.chem.ucla.edu. 27 Nisan 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Aralık 2022.
- ^ a b Journal Of The Association Of Official Agricultural Chemists Vol-xii': (1929) s. 50
- ^ Eintrag „Chloroform“ 14 Mart 2023 tarihinde Wayback Machine sitesinde arşivlendi. im Lexikon der gesamten Technik (1905)
- ^ Kathryn Bardsley, Michael Hagigeorgiou, István Lengyel & Victor Cesare (2013) New One-Step Synthesis of Isonitriles, Synthetic Communications, 43:12, 1727-1733, DOI: 10.1080/00397911.2012.666693
- ^ CHLOROFORMUM, The Extra Pharmacopoeia (1943), s. 132-133
- ^ a b Süss, Hans Ulrich. "Bleaching". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- ^ Rossberg, M.; et al. "Chlorinated Hydrocarbons". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_233.pub2.
- ^ a b Büyük Rus Ansiklopedisiʼnde Kloroform girdisi
- ^ a b c von Liebig, Justus (1831). "Ueber die Zersetzung des Alkohols durch Chlor". Annalen der Physik und Chemie. 99 (11): 444. Bibcode:1831AnP....99..444L. doi:10.1002/andp.18310991111. 10 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2016.
- ^ Worling, P.M. (1998). "Duncan and Flockhart: the Story of Two Men and a Pharmacy". Pharmaceutical Historian. 28 (2): 28–33. PMID 11620310.
- ^ Timothy L. Johnson, William Fish, Yuri A. Gorby, Paul G. Tratnyek, Degradation of carbon tetrachloride by iron metal: Complexation effects on the oxide surface, Journal of Contaminant Hydrology, Volume 29, Issue 4, 1998, Pages 379-398, ISSN 0169-7722, https://doi.org/10.1016/S0169-7722(97)00063-6. (https://www.sciencedirect.com/science/article/pii/S0169772297000636)
- ^ Reynold C. Fuson ve Benton A. Bull (1934). "The Haloform Reaction". Chemical Reviews. 15 (3): 275-309. doi:10.1021/cr60052a001.
- ^ Trichloromethane Formation through the Chlorination of Acetone [1] MASANORI INOKO, NORIKO OOE (1985)
- ^ Rolf Appel (1975). "Tertiary Phosphane/Tetrachloromethane, a Versatile Reagent for Chlorination, Dehydration, and P-N Linkage". Angewandte Chemie International Edition in English. 14 (12): 801-811. doi:10.1002/anie.197508011.
- ^ Wang, Zerong (2009). "22: Appel Reaction". Comprehensive organic name reactions and reagents. Hoboken, N.J.: John Wiley. ss. 95-99. doi:10.1002/9780470638859.conrr022. ISBN 9780470638859.
- ^ Breuer, F. W. (1935). "Chloroform-d (Deuteriochloroform)1". Journal of the American Chemical Society. 57 (11): 2236-2237. doi:10.1021/ja01314a058.
- ^ Kluger, Ronald (1964). "A Convenient Preparation of Chloroform-d1". The Journal of Organic Chemistry. 29 (7): 2045-2046. doi:10.1021/jo01030a526.
- ^ Paulsen, P. J.; Cooke, W. D. (1 Eylül 1963). "Preparation of Deuterated Solvents for Nuclear Magnetic Resonance Spectrometry". Analytical Chemistry. 35 (10): 1560. doi:10.1021/ac60203a072.
- ^ AK Nayak, SK Sarkar, DJ Biswas, KVS RamaRao, JP Mittal, Separation of tritium from deuterium by pulsed NH3 laser-selective multiple photon dissociation of CTCl3, Ekim 1991, Applied Physics B 53(4):246-249, DOI:10.1007/BF00357144
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- ^ Lindstrom, A B; Pleil, J.D.; Berkoff, D.C. (1997). "Alveolar breath sampling and analysis to assess trihalomethane exposures during competitive swimming training". Environmental Health Perspectives. 105 (6): 636-642. doi:10.1289/ehp.97105636. ISSN 0091-6765. PMC 1470079 $2. PMID 9288498.
- ^ Drobnic, Franchek; Freixa, Assumpci??; Casan, Pere; Sanchis, Joaqu??N; Guardino, Xavier (1996). "Assessment of chlorine exposure in swimmers during training". Medicine & Science in Sports & Exercise. 28 (2): 271-274. doi:10.1097/00005768-199602000-00018. ISSN 0195-9131. PMID 8775165.
- ^ Aiking, Harry; van Ackert, Manila B.; Schölten, Rob J.P.M.; Feenstra, Jan F.; Valkenburg, Hans A. (1994). "Swimming pool chlorination: a health hazard?". Toxicology Letters. 72 (1–3): 375-380. doi:10.1016/0378-4274(94)90051-5. ISSN 0378-4274. PMID 7911264.
- ^ Nickmilder, M.; Bernard, A. (2011). "Associations between testicular hormones at adolescence and attendance at chlorinated swimming pools during childhood". International Journal of Andrology. 34 (5pt2): e446-e458. doi:10.1111/j.1365-2605.2011.01174.x. ISSN 0105-6263. PMC 3229674 $2. PMID 21631527.
- ^ Rossberg, M.; et al. "Chlorinated Hydrocarbons". Ullmann's Encyclopedia of Industrial Chemistry
- ^ "Chlorodifluoromethane | chemical compound". Encyclopedia Britannica (İngilizce). 17 Temmuz 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Eylül 2021.
- ^ ShivaKumar Kyasa (2015). "Fluoroform (CHF3)". Synlett. 26 (13): 1911-1912. doi:10.1055/s-0034-1380924.
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_349.
- ^ Wiley, G. R.; Miller, S. I. (1972). "Thermodynamic parameters for hydrogen bonding of chloroform with Lewis bases in cyclohexane. Proton magnetic resonance study". Journal of the American Chemical Society. 94 (10): 3287-3293. doi:10.1021/ja00765a001.
- ^ Kwak, K.; Rosenfeld, D. E.; Chung, J. K.; Fayer, M. D. (2008). "Solute-solvent complex switching dynamics of chloroform between acetone and dimethylsulfoxide-two-dimensional IR chemical exchange spectroscopy". The Journal of Physical Chemistry B. 112 (44): 13906-13915. doi:10.1021/jp806035w. PMC 2646412 $2. PMID 18855462.
- ^ a b c d e Chloroform (PDF), CICAD, 58, World Health Organization, 2004, 17 Aralık 2014 tarihinde kaynağından arşivlendi (PDF)
- ^ a b Leikin, Jerrold B.; Paloucek, Frank P., (Ed.) (2008). "Chloroform". Poisoning and Toxicology Handbook (4. bas.). Informa. s. 774.
- ^ (Endonezce)Suwanto A, Soka S, Candra Krishna Purnawan. 2008. Teknik Percobaan dalam Genetika Molekuler. Jakarta: Penerbit Atma Jaya.
- ^ Bibby Scientific. The quantitative determination of caffeine in beverages and soft drinks using UV wavelength spectroscopy. http://www.jenway.com/adminimages/A09_010A_Determination_of_Caffeine_in_Beverages_using_UV_Wavelength_Spectroscopy(1).pdf 6 Mayıs 2021 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ "Chloroform (CHEBI:35255)". 10 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Şubat 2023.
- ^ "Arşivlenmiş kopya". 3 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Şubat 2023.
- ^ Srebnik, M.; Laloë, E. (2001). "Chloroform". Encyclopedia of Reagents for Organic Synthesis. Wiley. doi:10.1002/047084289X.rc105. ISBN 978-0471936237.
- ^ Ueber die Zersetzung des Chloroforms durch alkoholische Kalilösung (1862), Annalen der Chemie und Pharmacie, Sayı 123, Cilt 1, Sayfa: 121-122 A. Geuther DOI:10.1002/jlac.18621230109
- ^ Carbon Dichloride as an Intermediate in the Basic Hydrolysis of Chloroform. A Mechanism for Substitution Reactions at a Saturated Carbon Atom (1950) Jack Hine, J. Am. Chem. Soc., 72 (6), sayfa 2438–2445 DOI:10.1021/ja01162a024
- ^ "1,6-Methano[10]annulene". Organic Syntheses.; Collective Volume, 6, s. 731
- ^ "Phase-Transfer Hofmann Carbylamine Reaction: tert-Butyl Isocyanide". Organic Syntheses.; Collective Volume, 6, s. 232
- ^ Wynberg, Hans (1960). "The Reimer-Tiemann Reaction". Chemical Reviews. 60 (2): 169-184. doi:10.1021/cr60204a003.
- ^ Lutz Roth, Ursula Weller Gefährliche Chemische Reaktionen ISBN 3-609-73090-0 ecomed Sicherheit; 2005
- ^ Name reactions: a collection of detailed reaction mechanisms, Jie Jack Li Springer; (17 Eylül 2003) 3540402039
- ^ D. Vofsi, M. Asscher (1965). "1,1,3-Trichlorononane". Organic Syntheses. 45: 104. doi:10.15227/orgsyn.045.0104.
- ^ Rozen, Shlomo; Hagooly, Aviv (2005). Bromochlorodifluoromethane. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rn00562. ISBN 0471936235.
- ^ Chloropicrin Kirby E. Jackson, Chemical Reviews 1934 14 (2), 251-286 DOI: 10.1021/cr60048a003
- ^ "Ether and Chloroform Engines". 14 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Aralık 2023.
- ^ a b c d e f g Stratmann, Linda (2003). Chloroform: The Quest for Oblivion. Stroud: Sutton Publishing. ISBN 9780752499314. 29 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2016.
- ^ Moldenhawer (1830). "Verfahren den Spiritus von dem Fuselöl auf leichte Weise zu befreien" ["Alkolü fuzel yağından kolayca çıkarma işlemi"]. Magazin für Pharmacie. 8 (31): 222-227. 29 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2016.
- ^ Defalque, Ray J.; Wright, A. J. (2000). "Was chloroform produced before 1831?". Anesthesiology. 92 (1): 290-291. doi:10.1097/00000542-200001000-00060. PMID 10638939.
- ^ Guthrie, Samuel (1832). "New mode of preparing a spirituous solution of chloric ether". The American Journal of Science and Arts. 21: 64-65 and 405-408. 29 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2016.
- ^ Guthrie, Ossian (1887). Memoirs of Dr. Samuel Guthrie, and the History of the Discovery of Chloroform. Chicago: George K. Hazlitt & Co. s. 1.
- ^ Liebig, Justus von (1832). "Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildendes Gas und Essiggeist entstehen". Annalen der Physik und Chemie. 100 (2): 243-295. Bibcode:1832AnP...100..243L. doi:10.1002/andp.18321000206.
Sayfa 259–265 - ^ Soubeiran, Eugène (1831). "Recherches sur quelques combinaisons du chlore" [Bazı klor bileşikleri üzerine araştırmalar]. Annales de Chimie et de Physique. Série 2. 48: 113-157. 10 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2016.
- Tekrar basım: Soubeiran, Eugène (1831). "Recherches sur quelques combinaisons du chlore" [Bazı klor bileşikleri üzerine araştırmalar]. Journal de Pharmacie et des Sciences Accessoires. 17: 657-672. 29 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2016.
- Tekrar basım: Soubeiran, Eugène (1832). "Suite des recherches sur quelques combinaisons du chlore" [Bazı klor bileşikleri üzerine araştırmaların devamı]. Journal de Pharmacie et des Sciences Accessoires. 18: 1-24. 29 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2016.
- ^ Dumas, J.-B. (1834). "Récherches rélative à l'action du chlore sur l'alcool" [Experiments regarding the action of chlorine on alcohol]. L'Institut, Journal Général des Sociétés et Travaux Scientifiques de la France et de l'Étranger. 2: 106–108 and 112–115.
- ^ a b Defalque, R. J.; Wright, A. J. (2004). "The short, tragic life of Robert M. Glover" (PDF). Anaesthesia. 59 (4): 394-400. doi:10.1111/j.1365-2044.2004.03671.x. PMID 15023112. 9 Mart 2016 tarihinde kaynağından arşivlendi (PDF).
- ^ 1911 Encyclopædia Britannica' da Flourens, Marie Jean Pierre 1 Mart 2024 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Fatoş Belgin Yıldırım, Levent Sarıkçıoğlu Marie Jean Pierre Flourens (1794–1867): an extraordinary scientist of his time (2007), J Neurol. Neurosurg. Psychiatry. Ağustos 2007, 78(8): 852. doi: 10.1136/jnnp.2007.118380
- ^ Gordon, H. Laing (November 2002). Sir James Young Simpson and Chloroform (1811–1870). Minerva Group. ss. 106-109. ISBN 978-1-4102-0291-8. 6 Mayıs 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Ocak 2016.
- ^ "Sir James Young Simpson". Encyclopædia Britannica. 27 Temmuz 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ağustos 2013.
- ^ Dingwall (April 2004). "A pioneering history: dentistry and the Royal College of Surgeons of Edinburgh" (PDF). historyofdentistry.co.uk. 1 Şubat 2013 tarihinde kaynağından (PDF) arşivlendi.
- ^ Baillie, T. W. (2003). "Robert Halliday Gunning and the Victoria Jubilee Prizes" (PDF). Scottish Medical Journal. 48 (2): 54-57. doi:10.1177/003693300304800209. PMID 12774598. 22 Ağustos 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 18 Ağustos 2016.
- ^ Knight, Paul R., III; Bacon, Douglas R. (2002). "An Unexplained Death: Hannah Greener and Chloroform". Anesthesiology. 96 (5): 1250–1253.
- ^ a b c d e Chloroform in Clinical Anaesthesia, JP Payne, Br. J. Anaesth. (1981), 53, lIS
- ^ Snow, John (1858). On Chloroform and Other Anaesthetics and Their Action and Administration
- ^ "Anesthesia and Queen Victoria". ph.ucla.edu. 16 Temmuz 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Ağustos 2012.
- ^ Wilmot Buxton, Dudley (9 Aralık 2009). Anaesthetics - Their Uses and Administration (Reprint of the first edition - 1888). Read Books. ss. 332-340. ISBN 978-1-4446-9013-2.
- ^ a b c d Wawersik, Juergen (1991). "History of anesthesia in Germany". Journal of Clinical Anesthesia. 3 (3): 235-244. doi:10.1016/0952-8180(91)90167-L. PMID 1878238.
- ^ Mccardie, WJ (17 Aralık 1898). "On the administration of a certain mixture of chloroform and ether in gynecological operations by means of a Clover's inhaler without the bag". The Lancet. 152 (3929): 1621-1624. doi:10.1016/S0140-6736(01)84517-7. 4 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Kasım 2023.
- ^ J. Wawersik, History of chloroform anesthesia, Anaesthesiologie und Reanimation 22 (6), 144-152, 1997
- ^ a b c The early use of chloroform 16 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi., K. B. Thomas, Anaesthesia vol26 no 3, Temmuz 1971
- ^ "Arşivlenmiş kopya". 16 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Nisan 2023.
- ^ Koç, Alparslan. (2022). MODERN TIP UYGULAMALARINDA ANESTEZİYOLOGLAR.
- ^ "A New Anaesthetic", British Journal of Dental Science and Prosthetics (1867). UK: J. P. Segg & Company, sayfa: 239
- ^ Sayfa 170-173, "Anaesthetic and Sedative Properties of Bichloride of Carbon, or Chlorocarbon" (Aralık 1865), Simpson, J. Y. (1871). Anaesthesia, Hospitalism, Hermaphroditism, and a Proposal to Stamp Out Small-pox and Other Contagious Diseases. Birleşik Krallık: Adam and Charles Black.
- ^ Ludwig Burkhardt: Die intravenöse Narkose mit Äther und Chloroform., Münchner medizinische Wochenschrift. cilt 2, 1909, sayfa 2365
- ^ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Münih 1973, ISBN 3-87185-021-7
- ^ James Parkhouse, Trichloroethylene, Brit. J. Anaesth. (1965), 37, 681
- ^ a b Wawersik J. Die Geschichte der Chloroformnarkose [Kloroform anestezisinin tarihi]. Anaesthesiol Reanim. 1997;22(6):144-52. PMID 9487785.
- ^ Chloroform anaesthesia: A clinical comparison of chloroform and halothane administered from precision vaporisers 17 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi., S. A. Oduntan, Anaesthesia ~0123 110, 4 Ekim1968
- ^ a b c d Thomas, K Bryn (August 1974). "Chloroform: Commissions and Omissions" (PDF). Proceedings of the Royal Society of Medicine. 67 (8): 723-730. PMC 1645794 $2. PMID 4609043.
- ^ Pearce, David (2008). "Chloroform". Utopian Surgery: Early arguments against anaesthesia in surgery, dentistry and childbirth. BLTC Research. 1 Mayıs 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Aralık 2010.
In 1864, the Report of Chloroform Committee of Royal Medical and Chirurgical Society endorsed chloroform as Britain's favourite anaesthetic. But ether was safer for patients.
- ^ a b Shearer, WM. M. (1960). "The Evolution of Premedication". British Journal of Anaesthesia. 32 (11): 554-562. doi:10.1093/bja/32.11.554.
- ^ Enquirer (29 Kasım 1862). "The Chloroform Committee". The British Medical Journal. 2 (100): 573. doi:10.1136/bmj.2.100.573. JSTOR 25199328.
- ^ "Final Report Of Special Chloroform Committee". The British Medical Journal. 2 (2584): 47-72. 9 Temmuz 1910. JSTOR 25291374.
- ^ Martin, William (3 Temmuz 1886). "A Case of Chloroform Poisoning; Recovery". British Medical Journal. 2 (1331): 16-17. doi:10.1136/bmj.2.1331.16-a. PMC 2257365 $2. PMID 20751619.
- ^ "Suicide of Dr. Horace Wells, of Hartford, Connecticut, U.S". Providence Medical and Surgical Journal. 12 (11): 305-06. 31 Mayıs 1848. PMC 2487383 $2. PMID 20794459.
- ^ a b Chloroformism - Twentieth century practice v. 3, (1895). Birleşik Krallık: Sampson Low, Marston. Sayfa 92–95 19 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Chrystie, W. (1891). Morbid Habits - A System of Practical Therapeutics.' Amerika Birleşik Devletleri Sayfa 503–506 19 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ "Knock-out and Chloroform". The Philadelphia Record. 9 Şubat 1894. 20 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Mart 2011.
- ^ "Chloroform case retrial underway". Record-Journal. 7 Temmuz 1993. 6 Kasım 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Mart 2011.
- ^ Cathy Frye - Arkansas Democrat-Gazette (17 Aralık 2003). "But not forgotten". www.arkansasonline.com. 7 Aralık 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Aralık 2021.
- ^ The Nazi Doctors and the Nuremberg Code: Human Rights in Human Experimentation. (1992).s. 15-16 9 Aralık 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ a b Payne, J. P. (July 1998). "The criminal use of chloroform". Anaesthesia. 53 (7): 685-690. doi:10.1046/j.1365-2044.1998.528-az0572.x. PMID 9771177.
- ^ "Medical Annotation: Chloroform amongst Thieves". The Lancet. 2 (2200): 490-491. 1865. doi:10.1016/s0140-6736(02)58434-8.
- ^ a b Chloroform: 170 years of controversy 17 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi., Linda Stratmann
- ^ Parker, R. R.; Cobb, J. P.; Connell, P. H. (March 1974). "Chlorodyne dependence". Br Med J. 1 (5905): 427-9. doi:10.1136/bmj.1.5905.427. PMC 1633222 $2. PMID 4816855.
- ^ J. Black, Chloric Ether – New Remedy in Spasmodic Asthma, &c. (Eylül 1833), 856-866,The London Medical Gazette vol. 21 (1833)
- ^ Pharmacopoea Helvetica (1907) sayfa 48
- ^ Übersicht der gebräuchlichen und neueren Arzneimittel : für Ärzte, Apotheker und Zahnärzte (1946) sayfa 158
- ^ "Chloroform and Phosgene, Chemical Hygiene and Safety". Earlham College. 19 Ağustos 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Ağustos 2017.
- ^ Turk, Eric (2 Mart 1998). "Phosgene from Chloroform". Chemical & Engineering News. 76 (9): 6. doi:10.1021/cen-v076n009.p006. 24 Temmuz 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Ağustos 2012.
- ^ "phosgene (chemical compound)". Encyclopædia Britannica. 5 Haziran 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Ağustos 2013.
- ^ Manogue, W. H.; Pigford, R. L. (September 1960). "The kinetics of the absorption of phosgene into water and aqueous solutions". AIChE Journal (İngilizce). 6 (3): 494-500. doi:10.1002/aic.690060329. ISSN 0001-1541.
- ^ Cheng, Xueheng; Gao, Quanyin; Smith, Richard D.; Simanek, Eric E.; Mammen, Mathai; Whitesides, George M. (1996). "Characterization of Hydrogen-Bonded Aggregates in Chloroform by Electrospray Ionization Mass Spectrometry". The Journal of Organic Chemistry. 61 (6): 2204-2206. doi:10.1021/jo951345g. ISSN 0022-3263. 31 Temmuz 2022 tarihinde kaynağından arşivlendi.
- ^ WILLIAM GREGORY Morphine, chloroform, and hippuric acid 16 Kasım 2023 tarihinde Wayback Machine sitesinde arşivlendi. Jaime Wisniak, CENIC Ciencias Biológicas, vol. 51, no. 2, pp. 159-173, 2020
- ^ a b "Public Health Goals for Trihalomethanes in Drinking Water" (PDF). oehha.ca.gov. s. 93. 10 Ağustos 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 8 Ağustos 2023.
- ^ Nieuwenhuijsen, MJ; Toledano, MB; Elliott, P (8 Ağustos 2000). "Uptake of chlorination disinfection by-products; a review and a discussion of its implications for exposure assessment in epidemiological studies". Journal of Exposure Analysis and Environmental Epidemiology. 10 (6 Pt 1): 586-99. doi:10.1038/sj.jea.7500139. PMID 11140442.
- ^ Group, Environmental Working. "EWG's Tap Water Database: Contaminants in Your Water". www.ewg.org (İngilizce). 11 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2023.
- ^ Yin-Tak Woo, David Y. Lai, Joseph C. Arcos Aliphatic and Polyhalogenated Carcinogens: Structural Bases and Biological 5 Haziran 2018 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ a b Fan, Anna M. (2005). "Chloroform". Encyclopedia of Toxicology. Vol. 1 (2nd ed.). Elsevier. pp. 561–565.
- ^ "Chloroform [MAK Value Documentation, 2000]". The MAK-Collection for Occupational Health and Safety. 2012. ss. 20-58. doi:10.1002/3527600418.mb6766e0014.
- ^ Jenkins, Andrew; Greenblatt, Eric P.; Faulkner, Howard J.; Bertaccini, Edward; Light, Adam; Lin, Audrey; Andreasen, Alyson; Viner, Anna; Trudell, James R.; Harrison, Neil L.
- ^ Patel, Amanda J; Honoré, Eric; Lesage, Florian; Fink, Micheal; Romey, Georges; Lazdunski, Michel (1999). "Inhalational anesthetics activate two-pore-domain background K+ channels". Nature Neuroscience. Valbonne, France. 2 (5): 422-426. doi:10.1038/8084. ISSN 1097-6256. PMID 10321245. 28 Ocak 2010 tarihinde kaynağından arşivlendi.
- ^ Chloroform (IARC Summary & Evaluation, Supplement, 1987) https://inchem.org/documents/iarc/suppl7/chloroform.html 1 Nisan 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Chloroform (IARC Summary & Evaluation, Volume 73, 1999) https://inchem.org/documents/iarc/vol73/73-05.html 1 Nisan 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ a b Klaasen CD. Casarett & Doull’s Toxicology: The Basic Science of Poisons, 6 ed., Mc Graw-Hill, New York. 2001.
- ^ "Chloroform". 19 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Temmuz 2021.
- ^ Torkelson, T.R., Oyen, F. y Rowe, V.K. (1976). The toxicity of chloroform as determined by single and repeated exposure of laboratory animals. J. Am. Ind. Hyg. Assoc., 37, 697-705.
- ^ Eschenbrenner, A.B. Induction of hepatomas in mice by repeat oral administration of chloroform, with observations on sex differences. J. Nat'l. Cancer Inst., 5:251-55, 1945.
- ^ Inhibition of vitamin B12-dependent methionine biosynthesis by chloroform and carbon tetrachloride Biochemical Pharmacology, Cilt 42:12, 1991, Sayfa R25-R28 [2]
- ^ "National Toxicology Program: Report on the carcinogenesis bioassay of chloroform" (PDF). 30 Ekim 2004 tarihinde kaynağından (PDF) arşivlendi.
- ^ Schwetz, B.A., Leong B.K.J. y Gehring, P.J. (1974). Embryo- and fetotoxicity of inhaled chloroform in rats. Toxicol. Appl. Pharmacol., 28, 442-451.
- ^ U.S. Department of Health and Human Services. Hazardous Substances Data Bank (HSDB, online database). National Toxicology Information Program, National Library of Medicine, Bethesda, MD. 1993.
- ^ Fujie, K., Aoki, T. y Wada, M. (1990). Acute and subacute cytogenetic effects of the trihalomethanes on rat bone marrow cells in vivo. Mutat. Res., 242, 111-119.
- ^ "KLOROFORM ve KLOROFORM MARUZİYETİ". 5 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Temmuz 2021.
- ^ Naturally Occurring Organohalogen Compounds. (2023). Springer Nature Switzerland.
- ^ McCulloch A. Chloroform in the environment: occurrence, sources, sinks and effects. Chemosphere. 2003 Mar;50(10):1291-308. doi: 10.1016/s0045-6535(02)00697-5. PMID 12586161.
- ^ Nightingale PB, Malin G, Liss PS (1995). "Production of Chloroform and Other Low- Molecular-Weight Halocarbons by Some Species of Macroalgae". Limnology and Oceanography. American Society of Limnology and Oceanography. 40 (4): 680.
- ^ Gribble, Gordon W. (2004). "Natural Organohalogens: A New Frontier for Medicinal Agents?". Journal of Chemical Education. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021/ed081p1441.
- ^ Cappelletti, M. (2012). "Microbial degradation of chloroform". Applied Microbiology and Biotechnology. 96 (6): 1395-409. doi:10.1007/s00253-012-4494-1. PMID 23093177.
- ^ Abrahamsson, K; Choo, KS; Pedersén, M; Johansson, G; Snoeijs, P (2003). "Effects of temperature on the production of hydrogen peroxide and volatile halocarbons by brackish-water algae". Phytochemistry. 64 (3): 725-34. doi:10.1016/S0031-9422(03)00419-9. PMID 13679095.
- ^ Mtolera, Matern; Collén, Jonas; Pedersén, Marianne; Ekdahl, Anja; Abrahamsson, Katarina; Semesi, Adelaida (1996). "Stress-induced production of volatile halogenated organic compounds in Eucheuma denticulatum (Rhodophyta) caused by elevated pH and high light intensities". European Journal of Phycology. 31 (1): 89. doi:10.1080/09670269600651241.
- ^ Jiao, Yi (2018). "Halocarbon Emissions from a Degraded Forested Wetland in Coastal South Carolina Impacted by Sea Level Rise". ACS Earth and Space Chemistry. 2 (10): 955-967. Bibcode:2018ECS.....2..955J. doi:10.1021/acsearthspacechem.8b00044.
- ^ "Natural Production Of Chloroform By Fungi, Eddo J. Hoekstra, Frank J.M. Verhagen, Jim A Field,Ed W.B.De Leer, Udo A.Th Brinkman Phytochemistry, 49(1), 3 September 1998, bls 91-97". 3 Mayıs 2020 tarihinde kaynağından arşivlendi.
- ^ Shuiquan Tang; Elizabeth A. Edwards (2013). "Identification of Dehalobacter reductive dehalogenases that catalyse dechlorination of chloroform, 1,1,1-trichloroethane and 1,1-dichloroethane". Philos Trans R Soc Lond B Biol Sci. 368 (1616): 20120318. doi:10.1098/rstb.2012.0318. PMC 3638459 $2. PMID 23479748.
- ^ Jugder, Bat-Erdene; Ertan, Haluk; Wong, Yie Kuan; Braidy, Nady; Manefield, Michael; Marquis, Christopher P.; Lee, Matthew (10 Ağustos 2016). "Genomic, transcriptomic and proteomic analyses of Dehalobacter UNSWDHB in response to chloroform". Environmental Microbiology Reports (İngilizce). 8 (5): 814-824. doi:10.1111/1758-2229.12444. ISSN 1758-2229. PMID 27452500.
- ^ "7 faits violents qui n'ont rien à voir avec les films : mines, drogues, chloroforme..." 23 Eylül 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Mayıs 2019.
- ^ a b c "How chloroform went from a beloved sedative to a crime-fiction trope Jake Rossen, Linda Stratmann,". 27 Ekim 2016 tarihinde kaynağından arşivlendi.
- ^ "Désintox. Agression au chloroforme par de faux vendeurs de parfums : une intox très ancienne". 2 Nisan 2019. 2 Nisan 2019 tarihinde kaynağından arşivlendi..
- ^ a b R. Fourme, M. Renaud, C. R. Acad. Sci, Ser. C(Chim),1966, p 69
- ^ CRC Handbook of Chemistry and Physics. 89th ed./David R. Lide ed.-in-chief. CRC Press: Boca Raton, 2008. - p. 9–58
- ^ Lange's Handbook of Chemistry, 10th ed. pp 1669-1674
- ^ Lange's Handbook of Chemistry 10th ed, pp 1522–1524
- ^ CRC Handbook of Chemistry and Physics 44th ed.
Dış bağlantılar
[değiştir | kaynağı değiştir]- IARC Değerlendirmeleri: Vol. 1 (1972), Vol. 20 (1979), Suppl. 7 (1987), Vol. 73 (1999)












