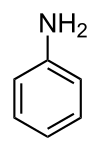
Anilin
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Phenylamine
| |||
| Drugi nazivi
Aminobenzen
Benzenamin | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.491 | ||
| KEGG[1] | |||
| UNII | |||
| |||
| Svojstva | |||
| C6H5NH2 | |||
| Molarna masa | 93,13 g/mol | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 1,0217 g/mL, tečnost | ||
| Tačka topljenja | −63 °C (−81 °F; 210 K) | ||
| Tačka ključanja | 18.413 °C (33.175 °F; 18.686 K) | ||
| 3.6 g/100 mL na 20°C | |||
| Baznost (pKb) | 9.3 | ||
| Viskoznost | 3.71 cP (3.71 mPa·s na 25 °C | ||
| Termohemija | |||
| Std entalpija sagorevanja ΔcH |
-3394 kJ/mol | ||
| Opasnosti | |||
EU klasifikacija (DSD)
|
Toksičan (T) Karc. kat. 3 Mutag. kat. 3 Opasan za okruženje (N) | ||
| R-oznake | R23/24/25 R40 R41 R43 R48/23/24/25 R68 R50 | ||
| S-oznake | (S1/2) S26 S27 S36/37/39 S45 S46 S61 S63 | ||
| NFPA 704 | |||
| Srodna jedinjenja | |||
Srodne materije: aromatični amini
|
1-Naftilamin 2-Naftilamin | ||
Srodna jedinjenja
|
Fenilhidrazin Nitrosobenzen Nitrobenzen | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Anilin (fenilamin, aminobenzen) je organsko jedinjenje[2] sa formulom C6H5NH2. On se sastoji od fenil grupe vezane za amino grupu, anilin je prototipski aromatični amin. On je prekurzor mnogih industrijskih hemikalija. Njegova glavna upotreba je u proizvodnji prekurzora poliuretana. Poput mnogih isparljivih amina, on poseduje neprijatan zadah trule ribe. On se lako pali, i sagoreva sa dimljivim plamenom karakterističnim za aromatična jedinjenja. Anilin je bezbojan, ali se sporo oksiduje i pretvara u smolu na vazduhu, što daje crveno-smeđu nijansu starijim uzorcima.[3]
Proizvodnja
[уреди | уреди извор]Anilin se industrijski uglavnom proizvodi u dva stepena iz benzena. Prvo se benzen nitrira koristeći koncentrovanu mešavinu azotne i sumporne kiseline ja 50 do 60 °C, što daje nitrobenzen. U drugom stepenu, nitrobenzen se hidrogeniše, tipični na 200-300 °C i u prisustvu raznih metalnih katalizatora:
- C6H5NO2 + 3 H2 → C6H5NH2 + 2 H2O
Alternativno, anilin se takođe može pripremiti iz fenola i amonijaka.[4]
Reakcije
[уреди | уреди извор]Hemija anilina je izuzetno bogata.
Oksidacija
[уреди | уреди извор]Oksidacija anilina se može odviti na azotu ili može doći do formiranja C-N veza. U alkalnom rastvoru, nastaje azobenzen, dok arsenatna kiselina proizvodi ljubičasto-obojenu materiju violanilin. Hromna kiselina ga konvertuje u hinon, dok hlorati, u prisustvu pojedinih metalnih soli (posebno vanadijuma), daju „anilinsko crno“. Hlorovodonična kiselina i kalijum hlorat daju hloranil. Kalijum permanganat u neutralnom rastvoru ga oksiduje do nitrobenzena, u baznom rastvoru do azobenzena, amonijak i oksalna kiselina, u kiselom rastvoru do anilinskog crnog. Hipohlorasta kiselina daje 4-aminofenol i para-amino difenilamin. Oksidacija sa persulfatom proizvodi više polianilinskih jedinjenja. Ti polimeri manifestuju bogate redoks i kiselo-bazne osobine.
Elektrofilne reakcije na ugljeniku
[уреди | уреди извор]Poput fenola, derivati anilina su visoko podložni reakcijama elekrofilne supstitucije. Njegova visoka reaktivnost je posledica toga da je on enamin, što povećava elektron-donirajuću sposobnost prstena. Na primer, reakcija anilina sa sumpornom kiselinom na 180 °C proizvodi sulfanilnu kiselinu, H2NC6H4SO3H, koja se može konvertovati u sulfanilamid. Sulfanilamid je jedan od lekova, koji je imao široku primenu kao antibiotik tokom ranog XX veka.
Anilinska industrijska reakcija najvećih razmera je alkilacija formaldehidom:
- 2°Csub>6H5NH2 + CH2O → CH2(C6H4NH2)2 + H2O
Rezultujući diamin je prekurzor 4,4'-MDI i srodnih diizocianata.
Literatura
[уреди | уреди извор]- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Мишић, Милан, ур. (2005). Енциклопедија Британика. А-Б. Београд: Народна књига : Политика. стр. 53. ISBN 86-331-2075-5.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Thomas Kahl, Kai-Wilfrid Schröder, F. R. Lawrence, W. J. Marshall, Hartmut Höke, Rudolf Jäckh "Aniline" in Ullmann's Encyclopedia of Industrial Chemistry 2007; John Wiley & Sons: New York.. doi:10.1002/14356007.a02_303. Недостаје или је празан параметар
|title=(помоћ)