Бензил
| |

| |

| |
| Називи | |
|---|---|
| IUPAC назив
1,2-diphenylethane-1,2-dione
| |
| Други називи
дибензоил
бибензоил дифенилглиоксал дифенилетандион 1,2-дифенилетан-1,2-дион 1,2-дифенил-етандион дифенил-α,β-дикетон | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.004.689 |
| |
| |
| Својства | |
| C14H10O2 | |
| Моларна маса | 210,23 g·mol−1 |
| Агрегатно стање | жути кристали или прах |
| Густина | 1,23 g/cm3, чврсти материјал (1.255 g/cm3) |
| Тачка топљења | 94.43-95.08 °C, 201.97-203.14 °F, 367-368 K |
| Тачка кључања | 346- 348 °C, 654.8-658.4 °F, 619-621 K |
| нерастворан | |
| Растворљивост у бензен | растворан |
| Структура | |
| Кристална решетка/структура | P31,221[3] |
| Диполни момент | 3.8 D[4] |
| Опасности | |
| Главне опасности | Иритант |
| NFPA 704 | |
| Сродна једињења | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
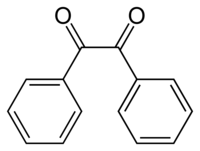
Бензил је аромачни 1,2-дикетон, са хемијском формулом (С6Н5СО)2 или краће (PhCO)2. Његово системско име по IUPAC-у је 1,2-дифенил-1,2-етандион. Познат је и под другим именима као дибензоил, бибензоил, дифенилглиоксал, дифенилетандион, 1,2-дифенилетан-1,2-дион, 1,2-дифенил-етандион, дифенил-α,β-дикетон. Налази се у чврстом стању. Кристали су му жуте боје.
Овај дикетон се користи као интермедијер у органској синтези. Бензил се такође користи као фотоиницијатор слободних радикала за лечење полимерних мрежа. Ултраљубичасто зрачење раставља бензил, стварајући слободне радикале који се крећу кроз полимерни материјал, стварајући унакрсне везе између индиведуалних полимерних ланаца. Недавно бензил је идентификован као селективни инхибитор ензима карбоксилестераза, протеина укључених у металолизам естерификованих лекова и ксенобиотика.
Добијање бензила
[уреди | уреди извор]Бензил се лако може добити оксидацијом бензоина азотном киселином, хлоридом и јодидом. Чак и блага оксидациона средства, као Фелингов раствор или бакар-сулфат у пиридину могу довести до реакције. У пракси се за оксидацију бензоина у бензил најчешће користи бакар-сулфат у пиридину и азотна киселина. Код оксидације бензоина са бакар-сулфатом користи се његов раствор у пиридину, јер пиридин спречавава таложење бакар оксида, није испарљив као амонијак, и понаша се као делимични растварач за бензоин. При оксидацији бензоина са азотном киселином издвајају се отровни оксиди азота, па је синтезу неопходно изводити у дигестору.[5]
Извори
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Acta Cryst. B43 398 (1987)
- ^ Spectrochim. Acta A60 (8-9) 1805 (2004)
- ^ „Benzil”. Organic Syntheses, Coll. 1: 87. 1941.
