WO2013062028A1 - Hiv複製阻害剤 - Google Patents
Hiv複製阻害剤 Download PDFInfo
- Publication number
- WO2013062028A1 WO2013062028A1 PCT/JP2012/077544 JP2012077544W WO2013062028A1 WO 2013062028 A1 WO2013062028 A1 WO 2013062028A1 JP 2012077544 W JP2012077544 W JP 2012077544W WO 2013062028 A1 WO2013062028 A1 WO 2013062028A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- substituted
- unsubstituted
- group
- aromatic
- aromatic carbocyclic
- Prior art date
Links
- 230000010076 replication Effects 0.000 title abstract description 9
- 239000003112 inhibitor Substances 0.000 title description 4
- 150000001875 compounds Chemical class 0.000 claims abstract description 831
- 125000003118 aryl group Chemical group 0.000 claims abstract description 575
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 568
- 125000002837 carbocyclic group Chemical group 0.000 claims abstract description 517
- 230000036436 anti-hiv Effects 0.000 claims abstract description 6
- 125000000547 substituted alkyl group Chemical group 0.000 claims abstract 4
- 125000000217 alkyl group Chemical group 0.000 claims description 657
- -1 hydroxy, formyl Chemical group 0.000 claims description 371
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims description 361
- 125000003545 alkoxy group Chemical group 0.000 claims description 281
- 229910052736 halogen Inorganic materials 0.000 claims description 121
- 150000002367 halogens Chemical class 0.000 claims description 121
- 125000003342 alkenyl group Chemical group 0.000 claims description 98
- 150000003839 salts Chemical class 0.000 claims description 87
- 125000000304 alkynyl group Chemical group 0.000 claims description 83
- 125000004429 atom Chemical group 0.000 claims description 72
- 229910052757 nitrogen Inorganic materials 0.000 claims description 54
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 49
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 42
- 125000003302 alkenyloxy group Chemical group 0.000 claims description 27
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 26
- 125000005133 alkynyloxy group Chemical group 0.000 claims description 24
- 125000004414 alkyl thio group Chemical group 0.000 claims description 23
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 20
- 125000004122 cyclic group Chemical group 0.000 claims description 20
- 125000005090 alkenylcarbonyl group Chemical group 0.000 claims description 19
- 125000005087 alkynylcarbonyl group Chemical group 0.000 claims description 18
- 125000004043 oxo group Chemical group O=* 0.000 claims description 18
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 18
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 17
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 16
- 125000005092 alkenyloxycarbonyl group Chemical group 0.000 claims description 15
- 125000002947 alkylene group Chemical group 0.000 claims description 13
- 125000005225 alkynyloxycarbonyl group Chemical group 0.000 claims description 13
- 125000000623 heterocyclic group Chemical group 0.000 claims description 13
- 125000000392 cycloalkenyl group Chemical group 0.000 claims description 10
- 125000004450 alkenylene group Chemical group 0.000 claims description 9
- 125000005115 alkyl carbamoyl group Chemical group 0.000 claims description 9
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 claims description 9
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 9
- 125000003016 chromanyl group Chemical group O1C(CCC2=CC=CC=C12)* 0.000 claims description 9
- 125000005117 dialkylcarbamoyl group Chemical group 0.000 claims description 9
- 125000004598 dihydrobenzofuryl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 claims description 9
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 9
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 claims description 8
- 125000004419 alkynylene group Chemical group 0.000 claims description 7
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 7
- 239000008194 pharmaceutical composition Substances 0.000 claims description 4
- 230000009471 action Effects 0.000 claims description 3
- APVPOHHVBBYQAV-UHFFFAOYSA-N n-(4-aminophenyl)sulfonyloctadecanamide Chemical compound CCCCCCCCCCCCCCCCCC(=O)NS(=O)(=O)C1=CC=C(N)C=C1 APVPOHHVBBYQAV-UHFFFAOYSA-N 0.000 claims description 2
- 239000003814 drug Substances 0.000 abstract description 13
- 229940079593 drug Drugs 0.000 abstract description 9
- 230000002401 inhibitory effect Effects 0.000 abstract description 5
- 230000000840 anti-viral effect Effects 0.000 abstract description 3
- 125000005415 substituted alkoxy group Chemical group 0.000 abstract 1
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 141
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 118
- 230000015572 biosynthetic process Effects 0.000 description 114
- 238000003786 synthesis reaction Methods 0.000 description 114
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 109
- 239000002904 solvent Substances 0.000 description 85
- 238000000034 method Methods 0.000 description 81
- 229910052739 hydrogen Inorganic materials 0.000 description 72
- 239000001257 hydrogen Substances 0.000 description 72
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 69
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 69
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 66
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 61
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 57
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 49
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 42
- 239000002585 base Substances 0.000 description 42
- 125000004432 carbon atom Chemical group C* 0.000 description 37
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 36
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 36
- 239000012046 mixed solvent Substances 0.000 description 36
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 32
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 30
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 26
- 125000001424 substituent group Chemical group 0.000 description 26
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 24
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 22
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 22
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 22
- 239000003153 chemical reaction reagent Substances 0.000 description 22
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 22
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 21
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 21
- 125000003277 amino group Chemical group 0.000 description 20
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 19
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 18
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 16
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 16
- 239000003054 catalyst Substances 0.000 description 16
- 238000006243 chemical reaction Methods 0.000 description 16
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 16
- ACIMRXKJKQGBGL-UHFFFAOYSA-N N-(2-aminoethyl)-5-chloro-1-naphthalenesulfonamide Chemical compound C1=CC=C2C(S(=O)(=O)NCCN)=CC=CC2=C1Cl ACIMRXKJKQGBGL-UHFFFAOYSA-N 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- 235000011054 acetic acid Nutrition 0.000 description 14
- 229910052799 carbon Inorganic materials 0.000 description 14
- 125000001309 chloro group Chemical group Cl* 0.000 description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 14
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 13
- 239000000203 mixture Substances 0.000 description 13
- 125000004430 oxygen atom Chemical group O* 0.000 description 13
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 description 12
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 12
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 12
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 12
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 11
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 11
- 150000001408 amides Chemical class 0.000 description 11
- 125000001188 haloalkyl group Chemical group 0.000 description 11
- 229910052763 palladium Inorganic materials 0.000 description 11
- 229910000027 potassium carbonate Inorganic materials 0.000 description 11
- 235000011181 potassium carbonates Nutrition 0.000 description 11
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 11
- 229910000029 sodium carbonate Inorganic materials 0.000 description 11
- 235000017550 sodium carbonate Nutrition 0.000 description 11
- 125000003396 thiol group Chemical group [H]S* 0.000 description 11
- 239000002253 acid Substances 0.000 description 10
- 125000001246 bromo group Chemical group Br* 0.000 description 10
- 239000000460 chlorine Substances 0.000 description 10
- 125000004663 dialkyl amino group Chemical group 0.000 description 10
- 125000004438 haloalkoxy group Chemical group 0.000 description 10
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 10
- 229910052717 sulfur Inorganic materials 0.000 description 10
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 10
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 10
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 9
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 9
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 9
- 239000012298 atmosphere Substances 0.000 description 9
- 125000001841 imino group Chemical group [H]N=* 0.000 description 9
- 125000002950 monocyclic group Chemical group 0.000 description 9
- 230000003287 optical effect Effects 0.000 description 9
- 239000012312 sodium hydride Substances 0.000 description 9
- 229910000104 sodium hydride Inorganic materials 0.000 description 9
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 8
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 8
- 229910000024 caesium carbonate Inorganic materials 0.000 description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 8
- 125000001153 fluoro group Chemical group F* 0.000 description 8
- 150000002430 hydrocarbons Chemical group 0.000 description 8
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 8
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 8
- 229940002612 prodrug Drugs 0.000 description 8
- 239000000651 prodrug Substances 0.000 description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 7
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 7
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 7
- 241000700605 Viruses Species 0.000 description 7
- 125000003003 spiro group Chemical group 0.000 description 7
- 125000004434 sulfur atom Chemical group 0.000 description 7
- 239000011701 zinc Substances 0.000 description 7
- 229910052725 zinc Inorganic materials 0.000 description 7
- KOFLVDBWRHFSAB-UHFFFAOYSA-N 1,2,4,5-tetrahydro-1-(phenylmethyl)-5,9b(1',2')-benzeno-9bh-benz(g)indol-3(3ah)-one Chemical compound C1C(C=2C3=CC=CC=2)C2=CC=CC=C2C23C1C(=O)CN2CC1=CC=CC=C1 KOFLVDBWRHFSAB-UHFFFAOYSA-N 0.000 description 6
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 6
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 6
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 6
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical class NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000006880 cross-coupling reaction Methods 0.000 description 6
- 125000000753 cycloalkyl group Chemical group 0.000 description 6
- HPYNZHMRTTWQTB-UHFFFAOYSA-N dimethylpyridine Natural products CC1=CC=CN=C1C HPYNZHMRTTWQTB-UHFFFAOYSA-N 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- OWFXIOWLTKNBAP-UHFFFAOYSA-N isoamyl nitrite Chemical compound CC(C)CCON=O OWFXIOWLTKNBAP-UHFFFAOYSA-N 0.000 description 6
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 6
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 6
- 229910017604 nitric acid Inorganic materials 0.000 description 6
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 6
- IOGXOCVLYRDXLW-UHFFFAOYSA-N tert-butyl nitrite Chemical compound CC(C)(C)ON=O IOGXOCVLYRDXLW-UHFFFAOYSA-N 0.000 description 6
- 239000012414 tert-butyl nitrite Substances 0.000 description 6
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 6
- UAYWVJHJZHQCIE-UHFFFAOYSA-L zinc iodide Chemical compound I[Zn]I UAYWVJHJZHQCIE-UHFFFAOYSA-L 0.000 description 6
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 5
- 208000030507 AIDS Diseases 0.000 description 5
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 5
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 5
- 150000008065 acid anhydrides Chemical class 0.000 description 5
- YKIOKAURTKXMSB-UHFFFAOYSA-N adams's catalyst Chemical compound O=[Pt]=O YKIOKAURTKXMSB-UHFFFAOYSA-N 0.000 description 5
- 125000005193 alkenylcarbonyloxy group Chemical group 0.000 description 5
- 125000005136 alkenylsulfinyl group Chemical group 0.000 description 5
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 5
- 125000005277 alkyl imino group Chemical group 0.000 description 5
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 5
- 125000005198 alkynylcarbonyloxy group Chemical group 0.000 description 5
- 125000005134 alkynylsulfinyl group Chemical group 0.000 description 5
- 125000005139 alkynylsulfonyl group Chemical group 0.000 description 5
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 5
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 5
- 229910052751 metal Inorganic materials 0.000 description 5
- 239000002184 metal Substances 0.000 description 5
- GRVDJDISBSALJP-UHFFFAOYSA-N methyloxidanyl Chemical group [O]C GRVDJDISBSALJP-UHFFFAOYSA-N 0.000 description 5
- NXJCBFBQEVOTOW-UHFFFAOYSA-L palladium(2+);dihydroxide Chemical compound O[Pd]O NXJCBFBQEVOTOW-UHFFFAOYSA-L 0.000 description 5
- 229910000160 potassium phosphate Inorganic materials 0.000 description 5
- 235000011009 potassium phosphates Nutrition 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 5
- 229910052722 tritium Inorganic materials 0.000 description 5
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 description 4
- FEJUGLKDZJDVFY-UHFFFAOYSA-N 9-borabicyclo(3.3.1)nonane Chemical compound C1CCC2CCCC1B2 FEJUGLKDZJDVFY-UHFFFAOYSA-N 0.000 description 4
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 4
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical class OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 4
- 208000036142 Viral infection Diseases 0.000 description 4
- 125000005137 alkenylsulfonyl group Chemical group 0.000 description 4
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 4
- 239000002259 anti human immunodeficiency virus agent Substances 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 4
- 239000003638 chemical reducing agent Substances 0.000 description 4
- 238000001816 cooling Methods 0.000 description 4
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 4
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 4
- 229940045803 cuprous chloride Drugs 0.000 description 4
- 230000032050 esterification Effects 0.000 description 4
- 238000005886 esterification reaction Methods 0.000 description 4
- 239000003205 fragrance Substances 0.000 description 4
- 150000004820 halides Chemical class 0.000 description 4
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 4
- 239000007800 oxidant agent Substances 0.000 description 4
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 4
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 4
- 238000001308 synthesis method Methods 0.000 description 4
- 125000004665 trialkylsilyl group Chemical group 0.000 description 4
- WJKHJLXJJJATHN-UHFFFAOYSA-N triflic anhydride Chemical compound FC(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)F WJKHJLXJJJATHN-UHFFFAOYSA-N 0.000 description 4
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 4
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 4
- 230000009385 viral infection Effects 0.000 description 4
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 3
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 3
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 3
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 3
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 3
- 208000031886 HIV Infections Diseases 0.000 description 3
- 208000037357 HIV infectious disease Diseases 0.000 description 3
- 241000725303 Human immunodeficiency virus Species 0.000 description 3
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 3
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 101150003085 Pdcl gene Proteins 0.000 description 3
- 238000006619 Stille reaction Methods 0.000 description 3
- 238000006069 Suzuki reaction reaction Methods 0.000 description 3
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 3
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 3
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 3
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- 235000019270 ammonium chloride Nutrition 0.000 description 3
- 239000004202 carbamide Substances 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- JCWIWBWXCVGEAN-UHFFFAOYSA-L cyclopentyl(diphenyl)phosphane;dichloropalladium;iron Chemical compound [Fe].Cl[Pd]Cl.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1 JCWIWBWXCVGEAN-UHFFFAOYSA-L 0.000 description 3
- 125000003493 decenyl group Chemical group [H]C([*])=C([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 3
- BGRWYRAHAFMIBJ-UHFFFAOYSA-N diisopropylcarbodiimide Natural products CC(C)NC(=O)NC(C)C BGRWYRAHAFMIBJ-UHFFFAOYSA-N 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 3
- 150000002431 hydrogen Chemical class 0.000 description 3
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
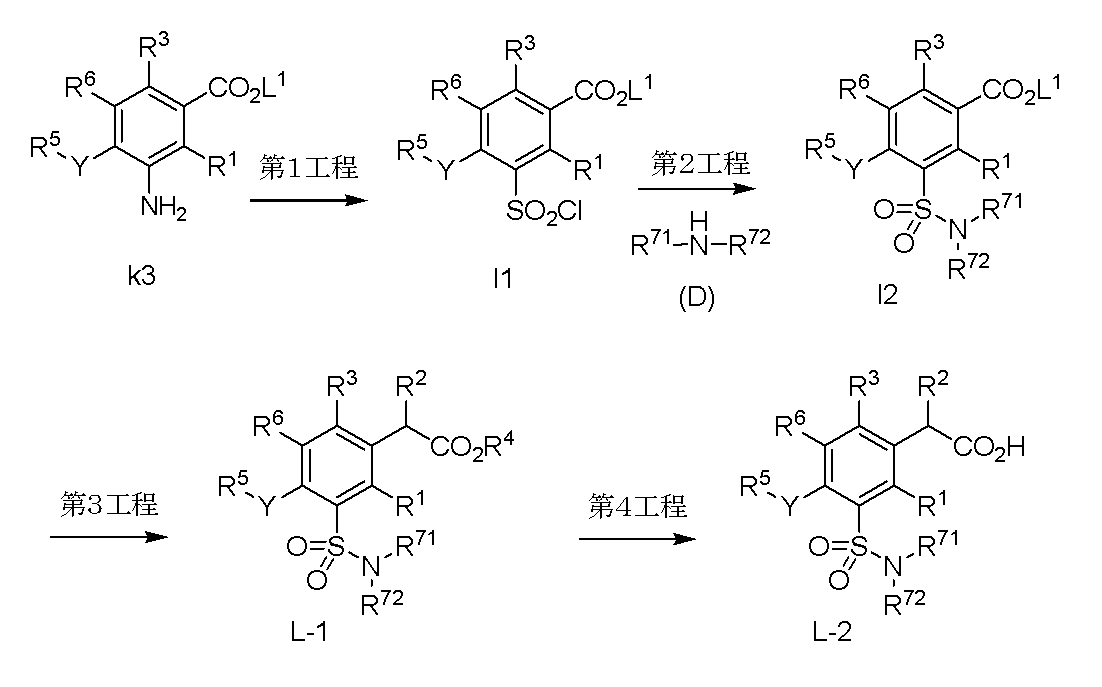
- 238000004519 manufacturing process Methods 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 239000012299 nitrogen atmosphere Substances 0.000 description 3
- LHKVDVFVJMYULK-UHFFFAOYSA-N nitrosylazide Chemical compound [N-]=[N+]=NN=O LHKVDVFVJMYULK-UHFFFAOYSA-N 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 150000004986 phenylenediamines Chemical class 0.000 description 3
- NNFCIKHAZHQZJG-UHFFFAOYSA-N potassium cyanide Chemical compound [K+].N#[C-] NNFCIKHAZHQZJG-UHFFFAOYSA-N 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 239000003419 rna directed dna polymerase inhibitor Substances 0.000 description 3
- 235000010288 sodium nitrite Nutrition 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 3
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 125000005300 thiocarboxy group Chemical group C(=S)(O)* 0.000 description 3
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 3
- 229920002554 vinyl polymer Polymers 0.000 description 3
- DKYBVKMIZODYKL-UHFFFAOYSA-N 1,3-diazinane Chemical compound C1CNCNC1 DKYBVKMIZODYKL-UHFFFAOYSA-N 0.000 description 2
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 2
- WTAPZWXVSZMMDG-UHFFFAOYSA-N 1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1C=CC(=O)C=CC1=CC=CC=C1 WTAPZWXVSZMMDG-UHFFFAOYSA-N 0.000 description 2
- FEWLNYSYJNLUOO-UHFFFAOYSA-N 1-Piperidinecarboxaldehyde Chemical compound O=CN1CCCCC1 FEWLNYSYJNLUOO-UHFFFAOYSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- HFFXLYHRNRKAPM-UHFFFAOYSA-N 2,4,5-trichloro-n-(5-methyl-1,2-oxazol-3-yl)benzenesulfonamide Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C(=CC(Cl)=C(Cl)C=2)Cl)=N1 HFFXLYHRNRKAPM-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- IZXIZTKNFFYFOF-UHFFFAOYSA-N 2-Oxazolidone Chemical compound O=C1NCCO1 IZXIZTKNFFYFOF-UHFFFAOYSA-N 0.000 description 2
- IMSODMZESSGVBE-UHFFFAOYSA-N 2-Oxazoline Chemical compound C1CN=CO1 IMSODMZESSGVBE-UHFFFAOYSA-N 0.000 description 2
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 2
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- BPSNETAIJADFTO-UHFFFAOYSA-N 2-pyridinylacetic acid Chemical class OC(=O)CC1=CC=CC=N1 BPSNETAIJADFTO-UHFFFAOYSA-N 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- XVMSFILGAMDHEY-UHFFFAOYSA-N 6-(4-aminophenyl)sulfonylpyridin-3-amine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)C1=CC=C(N)C=N1 XVMSFILGAMDHEY-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 241000282324 Felis Species 0.000 description 2
- XPDWGBQVDMORPB-UHFFFAOYSA-N Fluoroform Chemical compound FC(F)F XPDWGBQVDMORPB-UHFFFAOYSA-N 0.000 description 2
- 238000005863 Friedel-Crafts acylation reaction Methods 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 241000714260 Human T-lymphotropic virus 1 Species 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 239000002841 Lewis acid Substances 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- LWLSVNFEVKJDBZ-UHFFFAOYSA-N N-[4-(trifluoromethoxy)phenyl]-4-[[3-[5-(trifluoromethyl)pyridin-2-yl]oxyphenyl]methyl]piperidine-1-carboxamide Chemical compound FC(OC1=CC=C(C=C1)NC(=O)N1CCC(CC1)CC1=CC(=CC=C1)OC1=NC=C(C=C1)C(F)(F)F)(F)F LWLSVNFEVKJDBZ-UHFFFAOYSA-N 0.000 description 2
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Substances IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 239000012346 acetyl chloride Substances 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- XXROGKLTLUQVRX-UHFFFAOYSA-N allyl alcohol Chemical compound OCC=C XXROGKLTLUQVRX-UHFFFAOYSA-N 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 150000001555 benzenes Chemical class 0.000 description 2
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 235000019445 benzyl alcohol Nutrition 0.000 description 2
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 2
- KCXMKQUNVWSEMD-UHFFFAOYSA-N benzyl chloride Chemical compound ClCC1=CC=CC=C1 KCXMKQUNVWSEMD-UHFFFAOYSA-N 0.000 description 2
- 229940073608 benzyl chloride Drugs 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 2
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 2
- ZDQWVKDDJDIVAL-UHFFFAOYSA-N catecholborane Chemical compound C1=CC=C2O[B]OC2=C1 ZDQWVKDDJDIVAL-UHFFFAOYSA-N 0.000 description 2
- KXZJHVJKXJLBKO-UHFFFAOYSA-N chembl1408157 Chemical compound N=1C2=CC=CC=C2C(C(=O)O)=CC=1C1=CC=C(O)C=C1 KXZJHVJKXJLBKO-UHFFFAOYSA-N 0.000 description 2
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 2
- DOBRDRYODQBAMW-UHFFFAOYSA-N copper(i) cyanide Chemical compound [Cu+].N#[C-] DOBRDRYODQBAMW-UHFFFAOYSA-N 0.000 description 2
- QTMDXZNDVAMKGV-UHFFFAOYSA-L copper(ii) bromide Chemical compound [Cu+2].[Br-].[Br-] QTMDXZNDVAMKGV-UHFFFAOYSA-L 0.000 description 2
- GBRBMTNGQBKBQE-UHFFFAOYSA-L copper;diiodide Chemical compound I[Cu]I GBRBMTNGQBKBQE-UHFFFAOYSA-L 0.000 description 2
- 229960003280 cupric chloride Drugs 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical group C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 2
- JMQGGPRJQOQKRT-UHFFFAOYSA-N diphenyl hydrogen phosphate;azide Chemical compound [N-]=[N+]=[N-].C=1C=CC=CC=1OP(=O)(O)OC1=CC=CC=C1 JMQGGPRJQOQKRT-UHFFFAOYSA-N 0.000 description 2
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 2
- 125000004672 ethylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C(*)=O 0.000 description 2
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- MTNDZQHUAFNZQY-UHFFFAOYSA-N imidazoline Chemical compound C1CN=CN1 MTNDZQHUAFNZQY-UHFFFAOYSA-N 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 229940124524 integrase inhibitor Drugs 0.000 description 2
- 239000002850 integrase inhibitor Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 125000002346 iodo group Chemical group I* 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 239000012948 isocyanate Substances 0.000 description 2
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 150000007517 lewis acids Chemical class 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- 125000004674 methylcarbonyl group Chemical group CC(=O)* 0.000 description 2
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 2
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000002560 nitrile group Chemical group 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- BSCHIACBONPEOB-UHFFFAOYSA-N oxolane;hydrate Chemical compound O.C1CCOC1 BSCHIACBONPEOB-UHFFFAOYSA-N 0.000 description 2
- 125000005981 pentynyl group Chemical group 0.000 description 2
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 2
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical group OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 2
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 2
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 2
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 2
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 2
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- LEHBURLTIWGHEM-UHFFFAOYSA-N pyridinium chlorochromate Chemical compound [O-][Cr](Cl)(=O)=O.C1=CC=[NH+]C=C1 LEHBURLTIWGHEM-UHFFFAOYSA-N 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000006722 reduction reaction Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- VWDWKYIASSYTQR-UHFFFAOYSA-N sodium nitrate Chemical compound [Na+].[O-][N+]([O-])=O VWDWKYIASSYTQR-UHFFFAOYSA-N 0.000 description 2
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 125000004426 substituted alkynyl group Chemical group 0.000 description 2
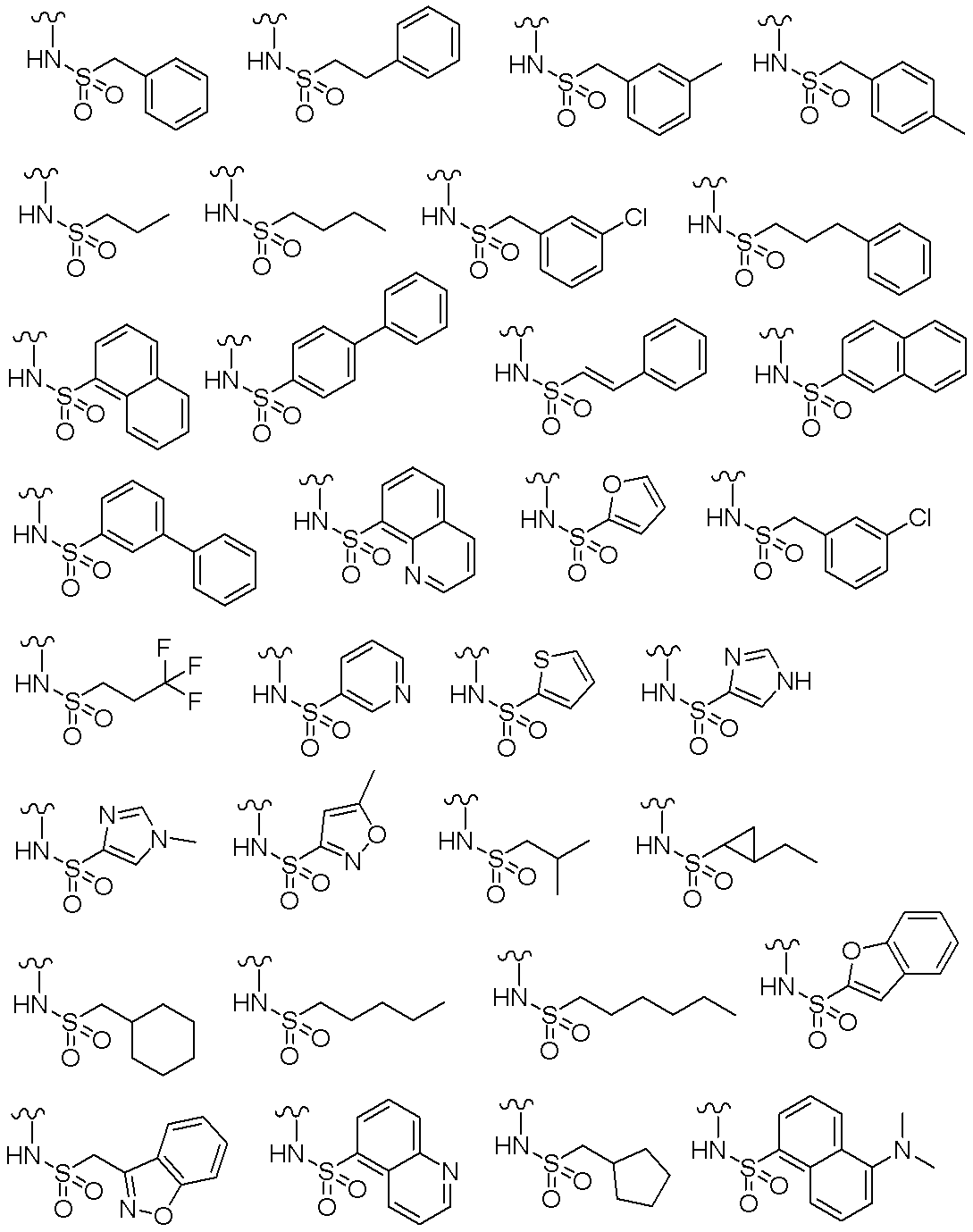
- 229940124530 sulfonamide Drugs 0.000 description 2
- 150000003456 sulfonamides Chemical class 0.000 description 2
- WMOVHXAZOJBABW-UHFFFAOYSA-N tert-butyl acetate Chemical compound CC(=O)OC(C)(C)C WMOVHXAZOJBABW-UHFFFAOYSA-N 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000005302 thiazolylmethyl group Chemical group [H]C1=C([H])N=C(S1)C([H])([H])* 0.000 description 2
- BRNULMACUQOKMR-UHFFFAOYSA-N thiomorpholine Chemical compound C1CSCCN1 BRNULMACUQOKMR-UHFFFAOYSA-N 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 125000004306 triazinyl group Chemical group 0.000 description 2
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 2
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 2
- 125000005040 tridecenyl group Chemical group C(=CCCCCCCCCCCC)* 0.000 description 2
- QAEDZJGFFMLHHQ-UHFFFAOYSA-N trifluoroacetic anhydride Chemical compound FC(F)(F)C(=O)OC(=O)C(F)(F)F QAEDZJGFFMLHHQ-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- LEIMLDGFXIOXMT-UHFFFAOYSA-N trimethylsilyl cyanide Chemical compound C[Si](C)(C)C#N LEIMLDGFXIOXMT-UHFFFAOYSA-N 0.000 description 2
- CSRZQMIRAZTJOY-UHFFFAOYSA-N trimethylsilyl iodide Chemical compound C[Si](C)(C)I CSRZQMIRAZTJOY-UHFFFAOYSA-N 0.000 description 2
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- BHHYHSUAOQUXJK-UHFFFAOYSA-L zinc fluoride Chemical compound F[Zn]F BHHYHSUAOQUXJK-UHFFFAOYSA-L 0.000 description 2
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- OJOFMLDBXPDXLQ-SECBINFHSA-N (4r)-4-benzyl-1,3-oxazolidin-2-one Chemical compound C1OC(=O)N[C@@H]1CC1=CC=CC=C1 OJOFMLDBXPDXLQ-SECBINFHSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- IRFCLLARAUQTNK-UHFFFAOYSA-N 1,1,2,2,3,3,4,4,4-nonafluorobutane-1-sulfonyl chloride Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)S(Cl)(=O)=O IRFCLLARAUQTNK-UHFFFAOYSA-N 0.000 description 1
- QKIHLPFZYGFMDK-UHFFFAOYSA-N 1,1,2,2,3,3,4,4,4-nonafluorobutylsulfonyl 1,1,2,2,3,3,4,4,4-nonafluorobutane-1-sulfonate Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F QKIHLPFZYGFMDK-UHFFFAOYSA-N 0.000 description 1
- ILFIRBGRMCGNOO-UHFFFAOYSA-N 1,1-bis($l^{1}-oxidanyl)ethene Chemical group [O]C([O])=C ILFIRBGRMCGNOO-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- CZSRXHJVZUBEGW-UHFFFAOYSA-N 1,2-thiazolidine Chemical compound C1CNSC1 CZSRXHJVZUBEGW-UHFFFAOYSA-N 0.000 description 1
- LVEYOSJUKRVCCF-UHFFFAOYSA-N 1,3-Bis(diphenylphosphino)propane Substances C=1C=CC=CC=1P(C=1C=CC=CC=1)CCCP(C=1C=CC=CC=1)C1=CC=CC=C1 LVEYOSJUKRVCCF-UHFFFAOYSA-N 0.000 description 1
- OGYGFUAIIOPWQD-UHFFFAOYSA-N 1,3-thiazolidine Chemical compound C1CSCN1 OGYGFUAIIOPWQD-UHFFFAOYSA-N 0.000 description 1
- 125000004066 1-hydroxyethyl group Chemical group [H]OC([H])([*])C([H])([H])[H] 0.000 description 1
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- JVSFQJZRHXAUGT-UHFFFAOYSA-N 2,2-dimethylpropanoyl chloride Chemical compound CC(C)(C)C(Cl)=O JVSFQJZRHXAUGT-UHFFFAOYSA-N 0.000 description 1
- FVVDPJOHERATAO-UHFFFAOYSA-N 2,3-dihydroxybutanedioic acid;2-hydroxypropanoic acid Chemical compound CC(O)C(O)=O.OC(=O)C(O)C(O)C(O)=O FVVDPJOHERATAO-UHFFFAOYSA-N 0.000 description 1
- JECYNCQXXKQDJN-UHFFFAOYSA-N 2-(2-methylhexan-2-yloxymethyl)oxirane Chemical compound CCCCC(C)(C)OCC1CO1 JECYNCQXXKQDJN-UHFFFAOYSA-N 0.000 description 1
- FYASBBZWSBMUNJ-UHFFFAOYSA-N 2-(2-oxo-1h-pyridin-3-yl)acetic acid Chemical class OC(=O)CC1=CC=CNC1=O FYASBBZWSBMUNJ-UHFFFAOYSA-N 0.000 description 1
- NRRCYZPJUABYHL-UHFFFAOYSA-N 2-Pyrimidine Acetic Acid Chemical class OC(=O)CC1=NC=CC=N1 NRRCYZPJUABYHL-UHFFFAOYSA-N 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 229940124321 AIDS medicine Drugs 0.000 description 1
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical group CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 238000006066 Comins reaction Methods 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229910021590 Copper(II) bromide Inorganic materials 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- YXHKONLOYHBTNS-UHFFFAOYSA-N Diazomethane Chemical compound C=[N+]=[N-] YXHKONLOYHBTNS-UHFFFAOYSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 239000007818 Grignard reagent Substances 0.000 description 1
- 108010078851 HIV Reverse Transcriptase Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- YZCKVEUIGOORGS-UHFFFAOYSA-N Hydrogen atom Chemical compound [H] YZCKVEUIGOORGS-UHFFFAOYSA-N 0.000 description 1
- 238000006809 Jones oxidation reaction Methods 0.000 description 1
- 239000012448 Lithium borohydride Substances 0.000 description 1
- 241001024304 Mino Species 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- PHSPJQZRQAJPPF-UHFFFAOYSA-N N-alpha-Methylhistamine Chemical compound CNCCC1=CN=CN1 PHSPJQZRQAJPPF-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- LFTLOKWAGJYHHR-UHFFFAOYSA-N N-methylmorpholine N-oxide Chemical compound CN1(=O)CCOCC1 LFTLOKWAGJYHHR-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 206010034133 Pathogen resistance Diseases 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 238000006859 Swern oxidation reaction Methods 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- YPWFISCTZQNZAU-UHFFFAOYSA-N Thiane Chemical compound C1CCSCC1 YPWFISCTZQNZAU-UHFFFAOYSA-N 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- SAHIZENKTPRYSN-UHFFFAOYSA-N [2-[3-(phenoxymethyl)phenoxy]-6-(trifluoromethyl)pyridin-4-yl]methanamine Chemical compound O(C1=CC=CC=C1)CC=1C=C(OC2=NC(=CC(=C2)CN)C(F)(F)F)C=CC=1 SAHIZENKTPRYSN-UHFFFAOYSA-N 0.000 description 1
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N acetaldehyde dimethyl acetal Natural products COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 150000001266 acyl halides Chemical class 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 230000002730 additional effect Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 150000001347 alkyl bromides Chemical class 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 150000001351 alkyl iodides Chemical class 0.000 description 1
- 125000005233 alkylalcohol group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- IYABWNGZIDDRAK-UHFFFAOYSA-N allene Chemical group C=C=C IYABWNGZIDDRAK-UHFFFAOYSA-N 0.000 description 1
- 125000005336 allyloxy group Chemical group 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000798 anti-retroviral effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000004069 aziridinyl group Chemical group 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004604 benzisothiazolyl group Chemical group S1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 1
- 150000001649 bromium compounds Chemical group 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- 150000001925 cycloalkenes Chemical class 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000004850 cyclobutylmethyl group Chemical group C1(CCC1)C* 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000006639 cyclohexyl carbonyl group Chemical group 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 description 1
- 125000000298 cyclopropenyl group Chemical group [H]C1=C([H])C1([H])* 0.000 description 1
- 125000006255 cyclopropyl carbonyl group Chemical group [H]C1([H])C([H])([H])C1([H])C(*)=O 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000005070 decynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 238000005695 dehalogenation reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 125000004987 dibenzofuryl group Chemical group C1(=CC=CC=2OC3=C(C21)C=CC=C3)* 0.000 description 1
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004639 dihydroindenyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000005056 dihydrothiazolyl group Chemical group S1C(NC=C1)* 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 125000005066 dodecenyl group Chemical group C(=CCCCCCCCCCC)* 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- YFXCNIVBAVFOBX-UHFFFAOYSA-N ethenylboronic acid Chemical class OB(O)C=C YFXCNIVBAVFOBX-UHFFFAOYSA-N 0.000 description 1
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 description 1
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 1
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 1
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 description 1
- 125000004705 ethylthio group Chemical group C(C)S* 0.000 description 1
- QKBHVMBPNSNIHV-UHFFFAOYSA-N ethynylboronic acid Chemical compound OB(O)C#C QKBHVMBPNSNIHV-UHFFFAOYSA-N 0.000 description 1
- 125000005290 ethynyloxy group Chemical group C(#C)O* 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 210000004211 gastric acid Anatomy 0.000 description 1
- 150000004795 grignard reagents Chemical class 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 125000005343 heterocyclic alkyl group Chemical group 0.000 description 1
- 125000004634 hexahydroazepinyl group Chemical group N1(CCCCCC1)* 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004871 hexylcarbonyl group Chemical group C(CCCCC)C(=O)* 0.000 description 1
- 125000005935 hexyloxycarbonyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- RCBVKBFIWMOMHF-UHFFFAOYSA-L hydroxy-(hydroxy(dioxo)chromio)oxy-dioxochromium;pyridine Chemical compound C1=CC=NC=C1.C1=CC=NC=C1.O[Cr](=O)(=O)O[Cr](O)(=O)=O RCBVKBFIWMOMHF-UHFFFAOYSA-L 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000005945 imidazopyridyl group Chemical group 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 229960001936 indinavir Drugs 0.000 description 1
- CBVCZFGXHXORBI-PXQQMZJSSA-N indinavir Chemical compound C([C@H](N(CC1)C[C@@H](O)C[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H]2C3=CC=CC=C3C[C@H]2O)C(=O)NC(C)(C)C)N1CC1=CC=CN=C1 CBVCZFGXHXORBI-PXQQMZJSSA-N 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 125000006301 indolyl methyl group Chemical group 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000006328 iso-butylcarbonyl group Chemical group [H]C([H])([H])C([H])(C(*)=O)C([H])([H])[H] 0.000 description 1
- 125000005929 isobutyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])OC(*)=O 0.000 description 1
- 125000003384 isochromanyl group Chemical group C1(OCCC2=CC=CC=C12)* 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005932 isopentyloxycarbonyl group Chemical group 0.000 description 1
- 125000005928 isopropyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 1
- 150000002642 lithium compounds Chemical class 0.000 description 1
- 229910000103 lithium hydride Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229960003194 meglumine Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- SJFNDMHZXCUXSA-UHFFFAOYSA-M methoxymethyl(triphenyl)phosphanium;chloride Chemical compound [Cl-].C=1C=CC=CC=1[P+](C=1C=CC=CC=1)(COC)C1=CC=CC=C1 SJFNDMHZXCUXSA-UHFFFAOYSA-M 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 1
- 125000006216 methylsulfinyl group Chemical group [H]C([H])([H])S(*)=O 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000006093 n-propyl sulfinyl group Chemical group 0.000 description 1
- 125000006252 n-propylcarbonyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000005185 naphthylcarbonyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 1
- 125000005146 naphthylsulfonyl group Chemical group C1(=CC=CC2=CC=CC=C12)S(=O)(=O)* 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 150000002828 nitro derivatives Chemical class 0.000 description 1
- 125000005187 nonenyl group Chemical group C(=CCCCCCCC)* 0.000 description 1
- 125000005071 nonynyl group Chemical group C(#CCCCCCCC)* 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000012285 osmium tetroxide Substances 0.000 description 1
- 229910000489 osmium tetroxide Inorganic materials 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000003431 oxalo group Chemical group 0.000 description 1
- 125000005880 oxathiolanyl group Chemical group 0.000 description 1
- 125000003551 oxepanyl group Chemical group 0.000 description 1
- AHHWIHXENZJRFG-UHFFFAOYSA-N oxetane Chemical compound C1COC1 AHHWIHXENZJRFG-UHFFFAOYSA-N 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 125000004675 pentylcarbonyl group Chemical group C(CCCC)C(=O)* 0.000 description 1
- 125000001148 pentyloxycarbonyl group Chemical group 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000004932 phenoxathinyl group Chemical group 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 125000003356 phenylsulfanyl group Chemical group [*]SC1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 239000004323 potassium nitrate Substances 0.000 description 1
- 235000010333 potassium nitrate Nutrition 0.000 description 1
- 239000012286 potassium permanganate Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 125000001844 prenyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004673 propylcarbonyl group Chemical group 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000005400 pyridylcarbonyl group Chemical group N1=C(C=CC=C1)C(=O)* 0.000 description 1
- 125000005344 pyridylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 1
- 125000005554 pyridyloxy group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000000163 radioactive labelling Methods 0.000 description 1
- 229960004742 raltegravir Drugs 0.000 description 1
- CZFFBEXEKNGXKS-UHFFFAOYSA-N raltegravir Chemical compound O1C(C)=NN=C1C(=O)NC(C)(C)C1=NC(C(=O)NCC=2C=CC(F)=CC=2)=C(O)C(=O)N1C CZFFBEXEKNGXKS-UHFFFAOYSA-N 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 125000005930 sec-butyloxycarbonyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 239000004317 sodium nitrate Substances 0.000 description 1
- 235000010344 sodium nitrate Nutrition 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000003797 solvolysis reaction Methods 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- UDYFLDICVHJSOY-UHFFFAOYSA-N sulfur trioxide pyridine complex Chemical compound O=S(=O)=O.C1=CC=NC=C1 UDYFLDICVHJSOY-UHFFFAOYSA-N 0.000 description 1
- 125000006253 t-butylcarbonyl group Chemical group [H]C([H])([H])C(C(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000006173 tetrahydropyranylmethyl group Chemical group 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- RLTPJVKHGBFGQA-UHFFFAOYSA-N thiadiazolidine Chemical compound C1CSNN1 RLTPJVKHGBFGQA-UHFFFAOYSA-N 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000005458 thianyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- VOVUARRWDCVURC-UHFFFAOYSA-N thiirane Chemical compound C1CS1 VOVUARRWDCVURC-UHFFFAOYSA-N 0.000 description 1
- 125000001166 thiolanyl group Chemical group 0.000 description 1
- HFRXJVQOXRXOPP-UHFFFAOYSA-N thionyl bromide Chemical compound BrS(Br)=O HFRXJVQOXRXOPP-UHFFFAOYSA-N 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 1
- 125000004784 trichloromethoxy group Chemical group ClC(O*)(Cl)Cl 0.000 description 1
- PNQBEPDZQUOCNY-UHFFFAOYSA-N trifluoroacetyl chloride Chemical compound FC(F)(F)C(Cl)=O PNQBEPDZQUOCNY-UHFFFAOYSA-N 0.000 description 1
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 1
- GRGCWBWNLSTIEN-UHFFFAOYSA-N trifluoromethanesulfonyl chloride Chemical compound FC(F)(F)S(Cl)(=O)=O GRGCWBWNLSTIEN-UHFFFAOYSA-N 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- CYTQBVOFDCPGCX-UHFFFAOYSA-N trimethyl phosphite Chemical compound COP(OC)OC CYTQBVOFDCPGCX-UHFFFAOYSA-N 0.000 description 1
- FTVLMFQEYACZNP-UHFFFAOYSA-N trimethylsilyl trifluoromethanesulfonate Chemical compound C[Si](C)(C)OS(=O)(=O)C(F)(F)F FTVLMFQEYACZNP-UHFFFAOYSA-N 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000005065 undecenyl group Chemical group C(=CCCCCCCCCC)* 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- MBMQEIFVQACCCH-QBODLPLBSA-N zearalenone Chemical compound O=C1O[C@@H](C)CCCC(=O)CCC\C=C\C2=CC(O)=CC(O)=C21 MBMQEIFVQACCCH-QBODLPLBSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/04—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring
- C07D311/58—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring other than with oxygen or sulphur atoms in position 2 or 4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C205/00—Compounds containing nitro groups bound to a carbon skeleton
- C07C205/49—Compounds containing nitro groups bound to a carbon skeleton the carbon skeleton being further substituted by carboxyl groups
- C07C205/56—Compounds containing nitro groups bound to a carbon skeleton the carbon skeleton being further substituted by carboxyl groups having nitro groups bound to carbon atoms of six-membered aromatic rings and carboxyl groups bound to acyclic carbon atoms of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/40—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino groups bound to carbon atoms of at least one six-membered aromatic ring and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C229/42—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino groups bound to carbon atoms of at least one six-membered aromatic ring and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton with carboxyl groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by saturated carbon chains
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/45—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups
- C07C233/53—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by a carbon atom of a six-membered aromatic ring
- C07C233/54—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by a carbon atom of a six-membered aromatic ring having the carbon atom of the carboxamide group bound to a hydrogen atom or to a carbon atom of a saturated carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/57—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of rings other than six-membered aromatic rings
- C07C233/63—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of rings other than six-membered aromatic rings having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/64—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings
- C07C233/81—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C255/00—Carboxylic acid nitriles
- C07C255/49—Carboxylic acid nitriles having cyano groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C255/58—Carboxylic acid nitriles having cyano groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing cyano groups and singly-bound nitrogen atoms, not being further bound to other hetero atoms, bound to the carbon skeleton
- C07C255/59—Carboxylic acid nitriles having cyano groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing cyano groups and singly-bound nitrogen atoms, not being further bound to other hetero atoms, bound to the carbon skeleton the carbon skeleton being further substituted by singly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/08—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms
- C07C271/26—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atom of at least one of the carbamate groups bound to a carbon atom of a six-membered aromatic ring
- C07C271/28—Esters of carbamic acids having oxygen atoms of carbamate groups bound to acyclic carbon atoms with the nitrogen atom of at least one of the carbamate groups bound to a carbon atom of a six-membered aromatic ring to a carbon atom of a non-condensed six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C275/00—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups
- C07C275/28—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of urea groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C275/42—Derivatives of urea, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of urea groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton being further substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/01—Sulfonamides having sulfur atoms of sulfonamide groups bound to acyclic carbon atoms
- C07C311/10—Sulfonamides having sulfur atoms of sulfonamide groups bound to acyclic carbon atoms of a saturated carbon skeleton containing rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/14—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of rings other than six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C311/00—Amides of sulfonic acids, i.e. compounds having singly-bound oxygen atoms of sulfo groups replaced by nitrogen atoms, not being part of nitro or nitroso groups
- C07C311/15—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of six-membered aromatic rings
- C07C311/21—Sulfonamides having sulfur atoms of sulfonamide groups bound to carbon atoms of six-membered aromatic rings having the nitrogen atom of at least one of the sulfonamide groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C317/00—Sulfones; Sulfoxides
- C07C317/44—Sulfones; Sulfoxides having sulfone or sulfoxide groups and carboxyl groups bound to the same carbon skeleton
- C07C317/48—Sulfones; Sulfoxides having sulfone or sulfoxide groups and carboxyl groups bound to the same carbon skeleton the carbon skeleton being further substituted by singly-bound nitrogen atoms, not being part of nitro or nitroso groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/12—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D215/14—Radicals substituted by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/20—Oxygen atoms
- C07D215/22—Oxygen atoms attached in position 2 or 4
- C07D215/227—Oxygen atoms attached in position 2 or 4 only one oxygen atom which is attached in position 2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/24—Benzimidazoles; Hydrogenated benzimidazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D235/26—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D265/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one oxygen atom as the only ring hetero atoms
- C07D265/28—1,4-Oxazines; Hydrogenated 1,4-oxazines
- C07D265/34—1,4-Oxazines; Hydrogenated 1,4-oxazines condensed with carbocyclic rings
- C07D265/36—1,4-Oxazines; Hydrogenated 1,4-oxazines condensed with carbocyclic rings condensed with one six-membered ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/68—Benzothiazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D277/82—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/78—Benzo [b] furans; Hydrogenated benzo [b] furans
- C07D307/79—Benzo [b] furans; Hydrogenated benzo [b] furans with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/78—Benzo [b] furans; Hydrogenated benzo [b] furans
- C07D307/82—Benzo [b] furans; Hydrogenated benzo [b] furans with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the hetero ring
- C07D307/83—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/87—Benzo [c] furans; Hydrogenated benzo [c] furans
- C07D307/88—Benzo [c] furans; Hydrogenated benzo [c] furans with one oxygen atom directly attached in position 1 or 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/87—Benzo [c] furans; Hydrogenated benzo [c] furans
- C07D307/89—Benzo [c] furans; Hydrogenated benzo [c] furans with two oxygen atoms directly attached in positions 1 and 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/74—Benzo[b]pyrans, hydrogenated in the carbocyclic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D317/00—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D317/08—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3
- C07D317/44—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D317/46—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D317/48—Methylenedioxybenzenes or hydrogenated methylenedioxybenzenes, unsubstituted on the hetero ring
- C07D317/50—Methylenedioxybenzenes or hydrogenated methylenedioxybenzenes, unsubstituted on the hetero ring with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to atoms of the carbocyclic ring
- C07D317/60—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/12—1,4-Dioxanes; Hydrogenated 1,4-dioxanes not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/14—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems
- C07D319/16—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems condensed with one six-membered ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/14—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems
- C07D319/16—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D319/18—Ethylenedioxybenzenes, not substituted on the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/14—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems
- C07D319/16—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D319/20—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems condensed with one six-membered ring with substituents attached to the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/04—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/10—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/06—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/02—Systems containing only non-condensed rings with a three-membered ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/06—Systems containing only non-condensed rings with a five-membered ring
- C07C2601/08—Systems containing only non-condensed rings with a five-membered ring the ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/16—Systems containing only non-condensed rings with a six-membered ring the ring being unsaturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/18—Systems containing only non-condensed rings with a ring being at least seven-membered
Definitions
- the compounds of the present invention and medicaments containing them are antiviral drugs (eg, antiretroviral drugs, anti-HIV drugs, anti-HTLV-1 (Human T cell leukemia virus type 1: human T cell leukemia virus type 1) , Anti-FIV (Feline immunodefectivity virus: feline AIDS virus) drug, anti-SIV (Simian immunodefectivity virus: salid AIDS virus) drug, particularly anti-HIV drug, anti-AIDS drug, or related diseases
- antiviral drugs eg, antiretroviral drugs, anti-HIV drugs, anti-HTLV-1 (Human T cell leukemia virus type 1: human T cell leukemia virus type 1) , Anti-FIV (Feline immunodefectivity virus: feline AIDS virus) drug, anti-SIV (Simian immunodefectivity virus: salid AIDS virus) drug, particularly anti-HIV drug, anti-AIDS drug, or related diseases
- antiviral drugs eg, antiretroviral drugs, anti-HIV
- Halogen includes fluorine atom, chlorine atom, bromine atom, and iodine atom. In particular, a fluorine atom and a chlorine atom are preferable.
- Examples include pyrrolyl, imidazolyl, pyrazolyl, pyridyl, pyridazinyl, pyrimidinyl, pyrazinyl, triazolyl, triazinyl, tetrazolyl, furyl, thienyl, isoxazolyl, oxazolyl, oxadiazolyl, isothiazolyl, thiazolyl, thiadiazolyl, and the like.
- bicyclic aromatic heterocyclic group examples include indolyl, isoindolyl, indazolyl, indolizinyl, quinolinyl, isoquinolinyl, cinnolinyl, phthalazinyl, quinazolinyl, naphthyridinyl, quinoxalinyl, purinyl, pteridinyl, benzimidazolyl, benzisoxazolyl, benzisoxazolyl, Oxazolyl, benzoxiazolyl, benzisothiazolyl, benzothiazolyl, benzothiadiazolyl, benzofuryl, isobenzofuryl, benzothienyl, benzotriazolyl, imidazopyridyl, triazolopyridyl, imidazothiazolyl, pyrazinopyr Dazinyl, oxazolopyridyl, thiazolopyridyl and the like can be mentioned.
- the monocyclic non-aromatic heterocyclic group is preferably 3 to 8 members, more preferably 5 or 6 members.
- Alkenyloxy means a group in which the above “alkenyl” is bonded to an oxygen atom.
- vinyloxy, allyloxy, 1-propenyloxy, 2-butenyloxy, 2-pentenyloxy, 2-hexenyloxy, 2-heptenyloxy, 2-octenyloxy and the like can be mentioned.
- Alkynyloxy means a group in which the above “alkynyl” is bonded to an oxygen atom. Examples include ethynyloxy, 1-propynyloxy, 2-propynyloxy, 2-butynyloxy, 2-pentynyloxy, 2-hexynyloxy, 2-heptynyloxy, 2-octynyloxy and the like.
- Haloalkyl means a group in which one or more of the above “halogens” are bonded to the above “alkyl”. For example, monofluoromethyl, monofluoroethyl, monofluoropropyl, 2,2,3,3,3-pentafluoropropyl, monochloromethyl, trifluoromethyl, trichloromethyl, 2,2,2-trifluoroethyl, 2, Examples include 2,2-trichloroethyl, 1,2-dibromoethyl, 1,1,1-trifluoropropan-2-yl and the like. Preferable embodiments of “haloalkyl” include trifluoromethyl and trichloromethyl.
- Alkyloxyalkyl means a group in which the above “alkyloxy” is bonded to the above “alkyl”. For example, methoxymethyl, methoxyethyl, ethoxymethyl and the like can be mentioned.
- “Monoalkylamino” means a group in which the above “alkyl” is replaced with one hydrogen atom bonded to the nitrogen atom of the amino group. For example, methylamino, ethylamino, isopropylamino and the like can be mentioned. Preferable embodiments of “monoalkylamino” include methylamino and ethylamino.
- Dialkylamino means a group in which the above “alkyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the amino group. Two alkyl groups may be the same or different. Examples include dimethylamino, diethylamino, N, N-diisopropylamino, N-methyl-N-ethylamino, N-isopropyl-N-ethylamino and the like. Preferred embodiments of “dialkylamino” include dimethylamino and diethylamino.
- Alkylsulfonyl means a group in which the above “alkyl” is bonded to a sulfonyl group.
- methylsulfonyl, ethylsulfonyl, propylsulfonyl, isopropylsulfonyl, tert-butylsulfonyl, isobutylsulfonyl, sec-butylsulfonyl and the like can be mentioned.
- Preferable embodiments of “alkylsulfonyl” include methylsulfonyl and ethylsulfonyl.
- “Monoalkylcarbonylamino” means a group in which the above “alkylcarbonyl” is replaced with one hydrogen atom bonded to the nitrogen atom of the amino group.
- methylcarbonylamino, ethylcarbonylamino, propylcarbonylamino, isopropylcarbonylamino, tert-butylcarbonylamino, isobutylcarbonylamino, sec-butylcarbonylamino and the like can be mentioned.
- Preferable embodiments of “monoalkylcarbonylamino” include methylcarbonylamino and ethylcarbonylamino.
- Dialkylcarbonylamino means a group in which the above “alkylcarbonyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the amino group. Two alkylcarbonyl groups may be the same or different. For example, dimethylcarbonylamino, diethylcarbonylamino, N, N-diisopropylcarbonylamino and the like can be mentioned. Preferred embodiments of “dialkylcarbonylamino” include dimethylcarbonylamino and diethylcarbonylamino.
- Dialkylsulfonylamino means a group in which the above “alkylsulfonyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the amino group. Two alkylsulfonyl groups may be the same or different. For example, dimethylsulfonylamino, diethylsulfonylamino, N, N-diisopropylsulfonylamino and the like can be mentioned. Preferred embodiments of “dialkylcarbonylamino” include dimethylsulfonylamino and diethylsulfonylamino.
- Alkynylimino means a group in which the above “alkynyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- alkynylimino ethynylimino, propynylimino and the like can be mentioned.
- Alkenylcarbonylimino means a group in which the above “alkenylcarbonyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- alkenylcarbonylimino ethylenylcarbonylimino, propenylcarbonylimino and the like can be mentioned.
- Alkyloxyimino means a group in which the above “alkyloxy” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group. Examples thereof include methyloxyimino, ethyloxyimino, n-propyloxyimino, isopropyloxyimino and the like.
- Alkenylcarbonyloxy means a group in which the above “alkenylcarbonyl” is bonded to an oxygen atom.
- alkenylcarbonyl ethylenylcarbonyloxy, propenylcarbonyloxy and the like can be mentioned.
- Alkenyloxycarbonyl means a group in which the above “alkenyloxy” is bonded to a carbonyl group. For example, ethylenyloxycarbonyl, propenyloxycarbonyl and the like can be mentioned.
- Non-aromatic carbocyclic alkyl means alkyl substituted with one or more of the above “non-aromatic carbocyclic groups”.
- the “non-aromatic carbocyclic alkyl” also includes “non-aromatic carbocyclic alkyl” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group”. For example, cyclopropylmethyl, cyclobutylmethyl, cyclopentylmethyl, cyclohexylmethyl, groups shown below Etc.
- “Aromatic carbocyclic alkylsulfanyl” means alkylsulfanyl substituted with one or more of the above “aromatic carbocyclic groups”. Examples include benzylsulfanyl, phenethylsulfanyl, phenylpropynylsulfanyl, benzhydrylsulfanyl, tritylsulfanyl, naphthylmethylsulfanyl and the like.
- “Aromatic heterocyclic alkyloxycarbonyl” means alkyloxycarbonyl substituted with one or more of the above “aromatic heterocyclic groups”.
- the “aromatic heterocyclic alkyloxycarbonyl” is an “aromatic heterocyclic alkyloxycarbonyl” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group” and / or “non-aromatic carbocyclic group”. Is also included.
- “Aromatic carbocyclic alkylamino” means a group in which the above “aromatic carbocyclic alkyl” is replaced with one or two hydrogen atoms bonded to the nitrogen atom of the amino group. Examples include benzylamino, phenethylamino, phenylpropynylamino, benzohydrylamino, tritylamino, naphthylmethylamino, dibenzylamino and the like.
- Non-aromatic heterocyclic alkylamino means a group in which the above “non-aromatic heterocyclic alkyl” is replaced with one or two hydrogen atoms bonded to the nitrogen atom of the amino group.
- tetrahydropyranylmethylamino, morpholinylethylamino, piperidinylmethylamino, piperazinylmethylamino and the like can be mentioned.
- R 3 preferably has any of the following structures.
- R 31 , R 32 , R 33 , R 34 and R 35 are preferably each independently a hydrogen atom, halogen, hydroxy, amino, alkyl, alkenyl, alkynyl, haloalkyl, alkyloxy, alkenyloxy, Alkynyloxy or haloalkyloxy, more preferably hydrogen atom, halogen, hydroxy, amino, alkyl or alkyloxy, still more preferably fluoro, chloro, bromo, hydroxy, amino, methyl, ethyl, or methyloxy And particularly preferred is fluoro, chloro, hydroxy, amino, methyl or methyloxy.
- R 5 is more preferably a group shown below.
- R 5 is particularly preferably a group shown below.
- R 7 is more preferably —Z—R 71 (Z is a single bond, —O—, —NR 72 —, —SO 2 —, —NR 72 —CO—, —CO—NR 72 —, —NR 72 —CO—O—, —NR 72 —CO—NR 73 —, —NR 72 —SO 2 —, or —SO 2 —NR 72 —, wherein R 71 represents a hydrogen atom, substituted or unsubstituted alkyl, A substituted or unsubstituted aromatic carbocyclic group, or a substituted or unsubstituted non-aromatic carbocyclic group, wherein R 72 and R 73 are each independently a hydrogen atom, substituted or unsubstituted alkyl, Substituted or unsubstituted alkenyl, or substituted or unsubstituted alkynyl), particularly preferably —ZR 71 (Z represents a single bond, —NR
- R 1 and R 7 may form a ring A together with adjacent atoms.
- Ring A may be substituted with one or more, preferably 1 to 7 R A.
- the compound represented by the formula (I) may be a compound represented by the following formula (II).
- Ring A is preferably an aromatic carbocyclic ring, a non-aromatic carbocyclic ring, an aromatic heterocyclic ring, or a non-aromatic heterocyclic ring, and more preferably an aromatic heterocyclic ring or a non-aromatic heterocyclic ring. Moreover, it is preferable that it is a 5-membered ring or a 6-membered ring.
- R A1 is preferably a hydrogen atom, substituted or unsubstituted alkyl, substituted or unsubstituted alkenyl, substituted or unsubstituted alkynyl, substituted or unsubstituted aromatic carbocyclic group, substituted or unsubstituted non-aromatic Group carbocyclic group, substituted or unsubstituted aromatic heterocyclic group, or substituted or unsubstituted non-aromatic heterocyclic group, more preferably a hydrogen atom, substituted or unsubstituted alkyl, substituted or Unsubstituted alkenyl, substituted or unsubstituted aromatic carbocyclic group, substituted or unsubstituted non-aromatic carbocyclic group, substituted or unsubstituted aromatic heterocyclic group, or substituted or unsubstituted non-aromatic A heterocyclic group, more preferably a hydrogen atom, substituted or unsubstituted alky
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic carbocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z A compound of —R 71 (Z is —NR 72 —, R 71 is a hydrogen atom, and R 72 is a hydrogen atom).
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic carbocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 (Z Is —NR 72 —, R 71 is substituted or unsubstituted alkyl, and R 72 is a hydrogen atom).
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is substituted or unsubstituted alkyl
- R 7 is —Z—R 71 (Z is , —NR 72 —, R 71 is substituted or unsubstituted alkyl
- R 72 is a hydrogen atom.
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 (Z Is —NR 72 —CO—, R 71 is a hydrogen atom, and R 72 is a hydrogen atom).
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z A compound in which —R 71 (Z is —NR 72 —CO—, R 71 is a hydrogen atom, and R 72 is a hydrogen atom).
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic carbocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is substituted or unsubstituted alkyl
- R 7 is —Z—R 71 (Z is , —NR 72 —CO—, wherein R 71 is substituted or unsubstituted alkyl, and R 72 is a hydrogen atom.
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 (Z Is —NR 72 —CO—, wherein R 71 is substituted or unsubstituted alkyl, and R 72 is substituted or unsubstituted alkyl).
- R 1 is a hydrogen atom
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 (Z Is —NR 72 —CO—O—, wherein R 71 is a hydrogen atom, and R 72 is a hydrogen atom.
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 (Z Is —NR 72 —CO—O—, wherein R 71 is a hydrogen atom, and R 72 is a hydrogen atom.
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic carbocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is substituted or unsubstituted alkyl
- R 7 is —Z—R 71 (Z is , —NR 72 —CO—O—, wherein R 71 is substituted or unsubstituted alkyl, and R 72 is a hydrogen atom.
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic carbocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 (Z Is —NR 72 —CO—O—, wherein R 71 is substituted or unsubstituted alkyl, and R 72 is a hydrogen atom).
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z—.
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is substituted or unsubstituted alkyl
- R 7 is —Z—R 71 (Z is , —NR 72 —CO—NH—, wherein R 71 is a hydrogen atom, and R 72 is a hydrogen atom.
- R 1 is a hydrogen atom
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 (Z Is —NR 72 —CO—NH—, wherein R 71 is substituted or unsubstituted alkyl, and R 72 is substituted or unsubstituted alkyl).
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z A compound wherein -R 71 (Z is -NR 72 -CO-NH-, R 71 is substituted or unsubstituted alkyl, and R 72 is substituted or unsubstituted alkyl).
- R 1 is a hydrogen atom
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is A hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 ( Z is —NR 72 —SO 2 —, R 71 is a hydrogen atom, and R 72 is a hydrogen atom).
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is substituted or unsubstituted alkyl
- R 7 is —Z—R 71 (Z is , —NR 72 —SO 2 —, wherein R 71 is substituted or unsubstituted alkyl, and R 72 is a hydrogen atom.
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z—.
- a compound of R 71 (Z is —NR 72 —SO 2 —, R 71 is substituted or unsubstituted alkyl, and R 72 is a hydrogen atom).
- R 1 is a hydrogen atom
- R 2 is a substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is A hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —ZR 71 ( Z is —NR 72 —SO 2 —, R 71 is substituted or unsubstituted alkyl, and R 72 is a hydrogen atom).
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic carbocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z—.
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z—.
- R 1 is halogen
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is a substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is hydrogen
- An atom R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z—R 71 (Z Is —NR 72 —SO 2 —, wherein R 71 is substituted or unsubstituted alkyl, and R 72 is substituted or unsubstituted alkyl).
- R 1 is substituted or unsubstituted alkyl
- R 2 is substituted or unsubstituted alkyloxy
- n is 1
- R 3 is substituted or unsubstituted non-aromatic heterocyclic group
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is a substituted or unsubstituted alkyl
- R 7 is —Z A compound in which —R 71 (Z is —NR 72 —SO 2 —, R 71 is substituted or unsubstituted alkyl, and R 72 is substituted or unsubstituted alkyl).
- Ring A is an aromatic heterocycle, m is 3, R 2 is substituted or unsubstituted alkyloxy, n is 1, and R 3 is substituted or unsubstituted aromatic carbocyclic A compound in which R 4 is a hydrogen atom, R 5 is a substituted or unsubstituted aromatic carbocyclic group, Y is a single bond, and R 6 is substituted or unsubstituted alkyl.
- Ring A is an aromatic heterocycle
- m 4
- R 2 is substituted or unsubstituted alkyloxy
- n 1
- R 3 is substituted or unsubstituted non-aromatic carbocycle
- R 4 is a hydrogen atom
- R 5 is a substituted or unsubstituted aromatic carbocyclic group
- Y is a single bond
- R 6 is substituted or unsubstituted alkyl.
- R 5 is a hydrogen atom, a substituted or unsubstituted alkyl, a substituted or unsubstituted non-aromatic carbocyclic group, Substituted or unsubstituted aromatic heterocyclic group, substituted or unsubstituted non-aromatic heterocyclic group, substituted or unsubstituted aromatic carbocyclic carbamoyl, substituted or unsubstituted non-aromatic carbocyclic carbamoyl, or- NR 51 R 52 (wherein R 51 is a substituted or unsubstituted aromatic carbocyclic carbonyl or substituted or unsubstituted non-aromatic carbocyclic carbonyl, R 52 is a hydrogen atom), and the like.
- the compound represented by formula (I) or a pharmaceutically acceptable salt thereof has a hydroxyl group
- prodrugs such as acyloxy derivatives and sulfonyloxy derivatives produced by reacting sulfonyl anhydride and mixed anhydride or by reacting with a condensing agent.
- the compound a11 By reacting for a period of time, deprotection of the TMS group, hydrolysis of the nitrile group to a carboxylic acid, and subsequent esterification, the compound a11 can be obtained.
- Step 11 In a solvent such as THF, DMF, toluene, etc., compound a11 is mixed with a base such as sodium hydride, potassium tert-butoxide, sodium methoxide and the like and R 2 ′ -I, R 2 ′ -Br, R 2 ′ -Cl.
- the compound a12 can be obtained by reacting at ⁇ 20 ° C. to 100 ° C., preferably 0 ° C. to 60 ° C. for 1 hour to 24 hours, preferably 3 hours to 12 hours.
- Compound a13 can be obtained by reacting in a hydrogen atmosphere at -25 ° C. for 0.1 hour to 48 hours, preferably 1 hour to 24 hours. Under these conditions, the reaction may be accelerated by adding acetic acid or hydrochloric acid. In a mixed solvent of water and an organic solvent such as methanol, ethanol, and THF, the compound a12 is added with iron, zinc, or the like under hydrochloric acid or acetic acid acidity, potassium hydroxide or sodium hydroxide alkalinity, or ammonium chloride neutrality. Compound a13 can also be obtained by adding a metal such as tin and reacting at 0 ° C. to 120 ° C., preferably 25 ° C.
- compound A-1 can also be synthesized from compound a20 by the following method. (Wherein R 1 , R 2 ′ , R 3 , R 4 , R 5 , R 6 , Y, and L 1 are as defined above.
- L 6 is an amino group such as tert-butyloxycarbonyl, trifluoroacetyl, etc.
- Step 42 In a solvent such as THF, diethyl ether, dioxane, or a mixed solvent thereof, compound a28-3 is mixed with a base such as potassium hexamethyldisilazide, lithium hexamethyldisilazide, lithium diisopropylamide and the like, TMSCl, TMSOTf. And by reacting at ⁇ 130 ° C. to ⁇ 20 ° C., preferably ⁇ 110 ° C. to ⁇ 50 ° C., for 0.1 hour to 5 hours, preferably 0.5 hour to 1 hour, Compound a28 can be obtained.
- a base such as potassium hexamethyldisilazide, lithium hexamethyldisilazide, lithium diisopropylamide and the like
- TMSCl lithium hexamethyldisilazide
- TMSOTf lithium diisopropylamide and the like
- Step 43 In a solvent such as dichloromethane, toluene, dichloroethane, or a mixture thereof, a reagent such as oxalyl chloride, thionyl chloride and oxazolidinone (a28-4) are added to compound a28-2, and -50 ° C to 50 ° C is added.
- Compound a28-5 can be obtained by reacting preferably at ⁇ 30 ° C. to 30 ° C. for 0.1 hour to 4 hours, preferably 0.5 hour to 1 hour.
- Step 44 Compound a28 ′ can be obtained from compound a28-5 in the same manner as in Step 42.
- optical isomers of compounds A-1 and A-2 can also be synthesized from compound a16 by the method shown below. (In the formula, each definition is as defined above.) 47th Step From compound a16, compound a38 can be obtained in the same manner as in the 7th step. 48th Step From compound a38, compound a39 can be obtained in the same manner as in the 8th step. Step 49 Compound a40 can be obtained from compound a39 by the same method as in Step 9. Fifth Step From compound a40, compound a41 can be obtained in the same manner as in the tenth step.
- Step 54 From compound a44, compound a45 can be obtained in the same manner as in Step 17. Fifty-fifth Step From compound a45, compound a46 can be obtained in the same manner as in the eighteenth step. 56th Step From compound a46, compounds a47 and a49 can be obtained in the same manner as in the 19th step. Step 57 Compound a48 can be obtained from compound a47 by the same method as in Step 20. Step 58 Compound a24 can be obtained from compound a48 by the same method as in Step 21. Step 59 Compound a13 can be obtained from compound a49 by the same method as in Step 20.
- a metal salt such as zinc iodide, TMSCl, sodium cyanide, potassium cyanide or the like is ⁇ 20 ° C. to 50 ° C., preferably 0 ° C. to 30 ° C., for 0.1 hour to 10 ° C. It can also be obtained by reacting for a time, preferably 0.5 to 2 hours.
- Step 68 In R 4 OH of compound a29-3, an acid such as concentrated sulfuric acid or concentrated hydrochloric acid is added, and the temperature is 0 ° C. to 150 ° C., preferably 80 ° C. to 110 ° C., for 1 hour to 24 hours, preferably 6 hours.
- diethyl azodicarboxylate or diisopropyl azodicarboxylate and benzyl alcohol are added in a solvent such as tetrahydrofuran, toluene or dichloromethane, and the temperature is 0 to 100 ° C., preferably 20 to 50 ° C., for 0.5 to 24 hours. Preferably, it can also be obtained by reacting for 1 to 5 hours.
- a29-5 such as dichloromethane, dichloroethane, chloroform, etc.
- an oxidizing agent such as Dess-Martin reagent, manganese dioxide, pyridinium chlorochromate is added, and 0 ° C-80 ° C, preferably 20 ° C-45 ° C.
- the compound a29-6 can be obtained by reacting for 0.5 to 5 hours, preferably 1 to 3 hours. It can also be obtained by general Swern oxidation.
- Step 71 In a solvent of compound a29-6 such as benzene, toluene, xylene, dichloromethane, dichloroethane, (R) -CBS reagent is added as an asymmetric source, and catecholborane or 9-borabicyclo [3.3.1] nonane is added.
- a reducing agent such as -100 ° C. to 0 ° C., preferably ⁇ 78 ° C. to ⁇ 50 ° C.
- the reaction is carried out for 0.5 hour to 6 hours, preferably 1 hour to 3 hours. Can be obtained.
- Compound a57 can be obtained by reacting for a time, preferably 1 to 12 hours.
- Second Step Compound a57 and an amine derivative (D) prepared commercially or by a known method are converted into 1-hydroxy-7-azabenzotriazole or 1-hydroxybenzotriazole in DMF, DMA, THF, acetonitrile or a mixed solvent thereof.
- R 1 , R 2 ′ , R 3 , R 4 , and R 6 are as defined above.
- R 5b is alkyl.
- Q is halogen, hydroxy, carboxy, amino, imino, hydroxyamino, hydroxyimino, formyl , Formyloxy, carbamoyl, sulfamoyl, sulfanyl, sulfino, sulfo, thioformyl, thiocarboxy, dithiocarboxy, thiocarbamoyl, cyano, nitro, nitroso, azide, hydrazino, ureido, amidino, guanidino, trialkylsilyl, alkyl, alkenyl, alkynyl , Haloalkyl, hydroxyalkyl, alkyloxy, alkenyloxy, alkynyloxy, haloalkyloxy, alkyloxy
- R 1 , R 2 ′ , R 3 , R 4 , and R 6 are as defined above.
- R 5e and R 5e ′ are each independently a hydrogen atom, formyl, carbamoyl, carboxy, substituted or unsubstituted.
- Compound a64 can be obtained by reacting preferably in 0.5 to 2 hours. Kill.
- R 5g ′ is substituted or unsubstituted alkyl, substituted or unsubstituted alkenyl, substituted or unsubstituted alkynyl, substituted or unsubstituted aromatic carbocyclic group, substituted Or an unsubstituted non-aromatic carbocyclic group, a substituted or unsubstituted aromatic heterocyclic group, or a substituted or unsubstituted non-aromatic heterocyclic group.
- a reaction at 0 ° C. to 100 ° C., preferably 20 ° C. to 50 ° C., for 1 hour to 24 hours, preferably 2 hours to 6 hours, to give compound a68.
- Compound a70 can be obtained by adding 51- Cl or the like and reacting at 0 ° C. to 80 ° C., preferably 25 ° C. to 50 ° C. for 1 hour to 12 hours, preferably 3 hours to 6 hours.
- Fourth Step From compound A-19, compound A-20 can be obtained in the same manner as in the fifteenth step in "1) Synthesis of Compounds A-1 and A-2" described above.
- Alkyl substituted or unsubstituted alkenyl, substituted or unsubstituted alkynyl, substituted or unsubstituted alkylcarbonyl, substituted or unsubstituted alkenylcarbonyl, substituted or unsubstituted alkynylcarbonyl, substituted or unsubstituted alkylcarbamoyl, substituted Or unsubstituted alkenylcarbamoyl, substituted or unsubstituted alkynylcarbamoyl, substituted or unsubstituted alkyloxycarbonyl, substituted or unsubstituted alkenyloxycarbonyl, substituted or unsubstituted alkynyloxycarbonyl, substituted or unsubstituted aromatic carbon Prime cyclic group, substituted or unsubstituted non-aromatic carbocyclic group, substituted or unsubstituted aromatic heterocyclic group, substituted or unsub
- Compound a71 can be obtained by reacting at -100 ° C, preferably 25 ° C-60 ° C, for 0.5-24 hours, preferably 3-12 hours.
- Second Step From compound a71 compound A-21 can be obtained in the same manner as in the thirty second to thirty fourth steps in "1) Synthesis of compounds A-1 and A-2" described above.
- Third Step From compound A-21, compound A-22 can be obtained in the same manner as in the fifteenth step in "1) Synthesis of Compounds A-1 and A-2" described above.
- compound A-25 can be obtained in the same manner as in the thirty second to thirty fourth steps in "1) Synthesis of compounds A-1 and A-2" described above.
- compound A-26 can be obtained in the same manner as in the fifteenth step in "1) Synthesis of Compounds A-1 and A-2" described above.
- Second Step Compound a75 is added with a base such as triethylamine, N-methylmorpholine or pyridine in a solvent such as dichloromethane, toluene or tetrahydrofuran, and an amine synthesized by a commercially available or known method is added in order, and 0 ° C-100 ° C, Compound a76 can be obtained by reacting at 25 to 60 ° C. for 0.5 to 24 hours, preferably 2 to 12 hours.
- Third Step From compound a76 compound A-29 can be obtained in the same manner as in the thirty second to thirty fourth steps in "1) Synthesis of compounds A-1 and A-2" described above.
- Fourth Step From compound A-29 compound A-30 can be obtained in the same manner as in the fifteenth step in "1) Synthesis of Compounds A-1 and A-2" described above.
- Compound B-3 can be obtained.
- compound B-4 can be obtained in the same manner as in the fifteenth step in "1) Synthesis of Compounds A-1 and A-2" described above.
- Compounds B-1 to B-4 can also be synthesized by the method shown below. (Wherein R 1 , R 2 ′ , R 3 , R 4 , R 5 , R 6 , R 71 , R 72 , L 2 and L 3 are as defined above.
- L 16 is a substituted or unsubstituted alkylsulfonyl.
- a catalyst such as 5% or 10% palladium carbon, palladium hydroxide, platinum dioxide or the like is added to compound b2, and 1-10 atm, preferably under hydrogen atmosphere
- the compound b3 can be obtained by reacting at 0 to 60 ° C., preferably 20 to 40 ° C. for 0.1 to 24 hours, preferably 1 to 12 hours at 2 to 5 atm. .
- the compound b2 is converted to iron, under acidic conditions of hydrochloric acid or acetic acid, alkaline of potassium hydroxide or sodium hydroxide, or neutral of ammonium chloride.
- Compound b3 can also be obtained by adding a metal such as zinc or tin and reacting at 0 ° C. to 120 ° C., preferably 25 ° C. to 80 ° C., for 0.1 to 24 hours, preferably for 1 to 12 hours. Can do.
- Second Step In a solvent such as methanol, ethanol or tetrahydrofuran, a catalyst such as 5% or 10% palladium carbon, palladium hydroxide or platinum dioxide is added to compound i1 wherein L 15 is benzyl, and a hydrogen atmosphere is applied at 0 ° C. to 60 ° C.
- Compound I-1 can be obtained by reacting at 0.1 ° C., preferably 20 ° C. to 40 ° C., for 0.1 to 24 hours, preferably 1 to 12 hours.
- Third Step From compound i1, compound I-2 can be obtained in the same manner as in the fifteenth step in “1) Synthesis of Compounds A-1 and A-2” described above.
- Second Step In a mixed solvent of THF, acetonitrile, acetone, tert-butyl alcohol and the like and water or a phosphate buffer, compound o1 is added with an oxidizing agent such as N-methylmorpholine oxide, K 3 Fe (CN) 6 and a catalyst. By adding an amount of osmium tetroxide or dipotassium osmate dihydrate and reacting at 0 ° C. to 100 ° C., preferably 20 ° C. to 50 ° C.
- Step 16 In a solvent such as DMF, DMA, THF, acetonitrile or the like, or a mixed solvent thereof, a base such as sodium hydride or cesium carbonate and a haloalkane prepared by a commercially available or known method are added to Compound a′16, and 20 Compound A′-1 can be obtained by reacting at a temperature of from ⁇ 40 ° C. to 140 ° C., preferably from 40 ° C. to 80 ° C. for 1 to 48 hours, preferably from 2 to 24 hours.
- a base such as sodium hydride or cesium carbonate and a haloalkane prepared by a commercially available or known method
- Step 17 In a solvent such as methanol, ethanol, THF, DMSO, etc., potassium hydroxide, sodium hydroxide, lithium hydroxide or the like is added to compound A′-1, and 0 ° C. to 100 ° C., preferably 20 ° C. to 50 ° C.
- the compound A′-2 can be obtained by reacting for 0.1 to 24 hours, preferably 1 to 6 hours.
- hydrochloric acid, TFA or the like is added to compound A′-1 in a solvent such as methanol, ethanol, THF, DMSO and the like, and 0 ° C. to 100 ° C., preferably 20 ° C. to 50 ° C., for 0.1 hour to 24 hours.
- the compound A′-2 can also be obtained by reacting preferably for 1 to 6 hours.
- compound A′-4 can be obtained from compound A′-3 (a′16).
- compound a′12 ′ which is an optical isomer of compound a′12
- compounds A′-1 ′ and A′-2 ′ which are the respective optical isomers of compounds A′-1 and A′-2
- compound a′12 ′ by the method described above.
- each definition is as defined above.
- Eighteenth Step From compound a'4 compound a'17 can be obtained in the same manner as in the seventh step.
- compound a'18 can be obtained in the same manner as in the eighth step.
- 20th step From compound a'18, compound a'19 can be obtained in the same manner as in 9th step.
- Step 21 Compound a′20 can be obtained from compound a′19 by the same method as in Step 10.
- Step 22 In a solvent such as dichloromethane, dichloroethane, chloroform, etc., an oxidizing agent such as Dess-Martin reagent or manganese dioxide is added to compound a′20, and the temperature is 0 ° C. to 80 ° C., preferably 20 ° C. to 45 ° C. for 0.5 hours.
- Compound a′21 can be obtained by reacting for ⁇ 5 hours, preferably 1 hour to 3 hours.
- the acid chloride solution prepared above is mixed at ⁇ 60 ° C. to ⁇ 10 ° C., preferably ⁇ 40 ° C. to ⁇ 20 ° C., and the temperature is raised to ⁇ 10 ° C. to 60 ° C., preferably 10 ° C. to 30 ° C.
- compound a′28 is obtained by reacting in an L 1 OH solvent at 20 ° C. to 120 ° C., preferably 50 ° C. to 80 ° C., for 0.5 hour to 6 hours, preferably 1 hour to 3 hours. be able to.
- Step 41 From compound a′37, compounds a′38 and a′39 can be obtained in the same manner as in Step 33.
- Step 42 When Y is a single bond and R 5 is a hydrogen atom, Compound A′-1 which is an optical isomer of Compound A′-1 is obtained from Compound a′38 in the same manner as in Steps 14-16. 'You can get.
- Step 43 Compound a′13 ′, which is an optical isomer of compound a′13, can be obtained from compound a′39 by the same method as in Step 36.
- Compound a′34-3 can be obtained by reacting for 1 to 48 hours, preferably 2 to 24 hours.
- the 46th step compound a′34-2 and a phenylenediamine derivative (E) commercially available or prepared by a known method are converted into 1-hydroxy-7-azabenzotriazole in DMF, DMA, THF, acetonitrile or the like or a mixed solvent thereof.
- 1-hydroxybenzotriazole, and / or a condensing agent such as dicyclohexylcarbodiimide or diisopropylcarbodiimide, and a base such as triethylamine, diisopropylethylamine, N-methylmorpholine are added, and 0 ° C to 100 ° C, preferably 20 ° C to 50 ° C.
- Compound a′34-4 can be obtained by reacting for 1 hour to 48 hours, preferably 2 hours to 24 hours. Step 47 Compound a'34-4 is added DMF, DMA, THF, acetonitrile or the like, or a mixed solvent thereof such as a base such as sodium hydride or cesium carbonate, and an alkyl halide prepared by a commercially available method.
- Compound a′34-5 can be obtained by reacting at 20 ° C. to 140 ° C., preferably 40 ° C. to 80 ° C. for 1 hour to 48 hours, preferably 2 hours to 24 hours.
- Step 48 Add a base such as triethylamine, diisopropylethylamine, N-methylmorpholine, isobutyl chloroformate, pivaloyl chloride, etc. to compound a'34-2 in THF, DMF, dichloromethane, water or the like or a mixed solvent thereof.
- a base such as triethylamine, diisopropylethylamine, N-methylmorpholine, isobutyl chloroformate, pivaloyl chloride, etc.
- a condensing agent such as hydroxybenzotriazole, cyclohexylcarbodiimide and diisopropylcarbodiimide and a base such as triethylamine, diisopropylethylamine and N-methylmorpholine are added, and the temperature is 0 to 100 ° C., preferably 20 to 50 ° C. for 1 to 48 hours.
- Compound a′34-11 can also be obtained by reacting preferably for 2 to 24 hours.
- a catalyst such as palladium or dichlorobistriphenylphosphine palladium and a base such as N-methylmorpholine are added, and 30 ° C. to 180 ° C., preferably 50 ° C. to 150 ° C., for 1 hour to 48 hours, preferably 4 hours to 24 hours.
- Compound a′34-12 can be obtained by reacting with ethylene gas. Step 55 In a mixed solvent of THF, acetonitrile, acetone, tert-butyl alcohol, and the like, and water or a phosphate buffer, compound a′34-12 is mixed with N-methylmorpholine oxide, K 3 Fe (CN) 6 or the like.
- a condensing agent such as —N, N, N ′, N′-tetramethyluronium hexafluorophosphate, and if necessary, 1-hydroxy-7-azabenzotriazole, 1-hydroxybenzotriazole, N-hydroxy
- An additive such as succinimide is further added, and a substituted amine (D) synthesized commercially or by a known method is sequentially added, and the temperature is 0 to 100 ° C., preferably 25 to 60 ° C., 0.5 to 24 hours, preferably By reacting for 2 to 12 hours, compound a′34-16 can be obtained.
- R 5e and R 5e ′ are each independently a hydrogen atom, formyl, carbamoyl, carboxy, substituted or non-substituted.
- Step 61 In a solvent such as dichloromethane, dichloroethane, THF, etc., pyridine, triethylamine, N-methylmorpholine, etc. are added as a base to compound a′34-18, and acid chlorides, acid anhydrides, etc. synthesized by a commercially available or known method are used.
- a solvent such as dichloromethane, dichloroethane, THF, etc., pyridine, triethylamine, N-methylmorpholine, etc.
- Compound a′34-21 can be obtained by reacting for 0.5 to 4 hours, preferably 1 to 2 hours.
- An isocyanate compound is synthesized in the system by adding a base such as triethylamine or N-methylmorpholine to compound a'34-18 in a solvent such as dichloromethane, THF or toluene, and reacting with triphosgene without taking it out of the reaction mixture.
- R 5g NH 2 which is commercially available or synthesized by a known method is added and reacted at 0 ° C. to 50 ° C., preferably 20 ° C. to 35 ° C., for 0.1 hour to 6 hours, preferably 0.5 hour to 2 hours.
- the compound a′34-21 can also be obtained.
- R 5h is substituted or unsubstituted alkyl, substituted or unsubstituted alkenyl, substituted or unsubstituted alkynyl.
- Step 64 In a solvent such as pyridine or lutidine, a commercially available or substituted sulfonyl chloride synthesized by a known method is added to compound a′34-18, and 20 ° C. to 100 ° C., preferably 50 ° C. to 70 ° C. for 1 hour to Compound a′34-22 can be obtained by reacting for 24 hours, preferably 5 to 10 hours.
- a solvent such as pyridine or lutidine
- R 5k is substituted or unsubstituted alkyl, substituted or unsubstituted alkenyl, substituted or unsubstituted alkynyl.
- compound a′41 is mixed with a base such as lithium diisopropylamide, potassium hexamethyldisilazide, lithium hexamethyldisilazide, sodium hexamethyldisilazide, and R Add an alkyl halide such as 2- I, R 2 -Br, R 2 -Cl, and the like at -70 ° to 50 °, preferably -20 ° C to 20 ° C, for 1 hour to 24 hours, preferably 3 hours to 10 hours.
- compound a′42 can be obtained.
- Compound B′-1 can be obtained by reacting at 80 ° C. to 170 ° C. for 0.5 to 8 hours, preferably 2 to 4 hours.
- Fourth Step In a solvent such as methanol, ethanol, propanol, butanol, water, or a mixed solvent thereof, lithium hydroxide, sodium hydroxide, potassium hydroxide, etc. are added to compound B′-1, and 20 ° C.-100 ° C.
- Compound B′-2 can be obtained by reacting preferably at 40 ° C. to 80 ° C. for 0.5 to 8 hours, preferably 1 to 4 hours.
- compound D′ 3 can be obtained by reacting for 1 to 8 hours, preferably 0.5 to 2 hours.
- compound D′-3 can be obtained in the same manner as in the fourth step in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- compound D'-4 can be obtained in the same manner as in the seventeenth step in "33) Synthesis of compounds A'-1 to A'-4" described above.
- Compound E′-1 can be obtained by reacting preferably at 20 ° C. to 50 ° C. for 0.1 hour to 24 hours, preferably 1 hour to 6 hours.
- Step 4 In a solvent such as methanol, ethanol, THF, DMSO or a mixed solvent thereof, a base such as potassium hydroxide, sodium hydroxide, lithium hydroxide or the like is added to compound E′-1, and 25 ° C. to 120 ° C.
- Compound E′-2 can be obtained by reacting at 70 ° C. to 100 ° C. for 1 hour to 48 hours, preferably 2 hours to 12 hours.
- Compound E′-3 can be obtained by reacting for a period of time, preferably 0.5 to 3 hours.
- Sixth Step In a solvent such as tetrahydrofuran and ethyl acetate, a substituted isothiocyanate commercially available or synthesized by a known method is added to Compound E′-2, and 0 ° C. to 80 ° C., preferably 25 ° C. to 50 ° C.
- Compound E′-4 can be obtained by reacting for 1 to 6 hours, preferably 0.5 to 3 hours.
- Second Step In a solvent such as dichloromethane, 1,2-dichloroethane, THF, or a mixed solvent thereof, compound i′2 and a base such as pyridine, lutidine, triethylamine, and trifluoromethanesulfonic anhydride, comin's reagent And a reaction at ⁇ 50 ° C. to 50 ° C., preferably ⁇ 30 ° C.
- a solvent such as dichloromethane, 1,2-dichloroethane, THF, or a mixed solvent thereof
- compound i′2 and a base such as pyridine, lutidine, triethylamine, and trifluoromethanesulfonic anhydride
- Compound i′3 can be obtained.
- Third Step From compound i′3, compound i′4 can be obtained in the same manner as in the second step in “34) Synthesis of Compounds A′-5 and A′-6” described above.
- Fourth Step From compound i′4, compound i′5 can be obtained in the same manner as in the seventh to tenth steps in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- Fifth Step From compound i′5, compound i′6 can be obtained in the same manner as in the thirteenth step in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- Second Step Compound k′1 is dissolved in a solvent such as DMF, DMA, THF, dioxane or the like, or a mixed solvent thereof, and is 20 to 150 ° C., preferably 50 to 120 ° C., for 0.5 to 8 hours.
- the compound K′-1 can be obtained by stirring preferably for 1 to 4 hours.
- compound M′-1 can be obtained in the same manner as in the seventh to eleventh steps in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- compound M′-2 can be obtained in the same manner as in the seventeenth step in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- Compound o′1 can be obtained by a carbon insertion reaction.
- Second Step In a solvent such as dichloromethane or tetrahydrofuran, compound o′1 is mixed with methanesulfonyl chloride in the presence of a base such as pyridine or triethylamine at ⁇ 20 ° C. to 100 ° C., preferably 0 ° C. to 50 ° C., 0.5%
- Compound o′2 can be obtained by reacting for a period of time to 24 hours, preferably 6 hours to 12 hours.
- Step 6 Compound O′-1 in a solvent such as methanol, ethanol, tetrahydrofuran, etc., in the presence of a palladium catalyst such as 5% or 10% palladium on carbon, palladium hydroxide, etc., in a hydrogen atmosphere, 0 ° C. to 60 ° C.
- a solvent such as methanol, ethanol, tetrahydrofuran, etc.
- a palladium catalyst such as 5% or 10% palladium on carbon, palladium hydroxide, etc.
- a compound p′1 can be obtained by a coupling reaction at 120 ° C. for 0.5 to 24 hours, preferably 1 to 12 hours.
- Second Step In a solvent such as tetrahydrofuran, acetonitrile, DMF, etc., a diazotization reagent such as cuprous bromide, cupric bromide, etc. and tert-butyl nitrite isoamyl nitrate is added to compound p′1 at ⁇ 20 ° C.
- Compound p′2 can be obtained by reacting at ⁇ 80 ° C., preferably 0 ° C. to 25 ° C., for 1 hour to 12 hours, preferably 3 hours to 6 hours.
- a solvent such as dichloromethane, toluene, tetrahydrofuran, etc.
- a base such as pyridine, triethylamine, N-methylmorpholine, and methanesulfonyl chloride or methanesulfonic anhydride is added to compound p′3, and ⁇ 20 ° C. to 60 ° C.
- the compound p′4 can be obtained by reacting at 0 ° C. to 25 ° C., preferably 0.5 to 12 hours, preferably 1 to 6 hours.
- Step 6 In a solvent such as acetone, tetrahydrofuran, or DMF, an azide reagent such as sodium azide or trimethylsilyl azide is added to compound p′4, and 0 ° C. to 100 ° C., preferably 20 ° C. to 50 ° C.
- Compound p′5 can be obtained by reacting for 5 to 12 hours, preferably 1 to 6 hours.
- Step 6 In a solvent such as methanol, ethanol, tetrahydrofuran, etc., 0 ° C. to 60 ° C.
- compound q′2 is converted to benzyl N- (2-hydroxyethyl) carbamate, phosphines such as triphenylphosphine, tri-n-butylphosphine, tritert-butylphosphine, N-methylmorpholine, triethylamine.
- phosphines such as triphenylphosphine, tri-n-butylphosphine, tritert-butylphosphine, N-methylmorpholine, triethylamine.
- an azodicarboxylic acid ester such as diethyl azodicarboxylate and diisopropyl azodicarboxylate, and added at 0 ° C. to 60 ° C., preferably 20 ° C. to 40 ° C., for 1 hour to 24 hours, preferably 6 hours to 12 hours.
- compound Q′-1 can be obtained in the same manner as in the seventeenth step in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- compound Q′-3 can be obtained in the same manner as in the third step in “49) Synthesis of Compounds O′-1 to O′-4” described above.
- compound Q'-4 can be obtained in the same manner as in the seventeenth step in "33) Synthesis of Compounds A'-1 to A'-4" described above.
- compound r′1 is converted to a phase transfer catalyst such as benzyltriethylammonium chloride or benzyltriethylammonium bromide, an inorganic base such as sodium bicarbonate or potassium bicarbonate, and By adding chloroacetyl chloride, bromoacetyl bromide or the like and reacting at ⁇ 20 ° C. to 100 ° C., preferably 0 ° C. to 50 ° C. for 1 hour to 24 hours, preferably 3 hours to 12 hours, compound r′2 Can be obtained.
- a phase transfer catalyst such as benzyltriethylammonium chloride or benzyltriethylammonium bromide
- an inorganic base such as sodium bicarbonate or potassium bicarbonate
- compound R′-1 can be obtained in the same manner as in the sixth step in “49) Synthesis of Compounds O′-1 to O′-4” described above.
- compound R′-2 can be obtained in the same manner as in the seventeenth step in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- Fifth Step In a solvent such as tetrahydrofuran or diethyl ether, a reducing agent such as borane-tetrahydrofuran or borane-dimethyl sulfide complex is added to compound R′-1, and the reaction is performed at 20 ° C. to 150 ° C., preferably 50 ° C. to 100 ° C.
- Compound R′-3 can be obtained by reacting for 1 to 24 hours, preferably 3 to 12 hours.
- Sixth Step From compound R'-3, compound R'-4 can be obtained in the same manner as in the seventeenth step in "33) Synthesis of compounds A'-1 to A'-4" described above.
- compound s′2 is added to an inorganic base such as potassium carbonate, sodium carbonate, cesium carbonate, and a halogenating reagent such as 1,2-dibromoethane, 1,2-diiodoethane. And reacting at 20 ° C. to 150 ° C., preferably 60 ° C. to 100 ° C. for 1 hour to 24 hours, preferably 3 hours to 12 hours, to obtain compound S′-1.
- compound S′-2 can be obtained in the same manner as in the seventeenth step in “33) Synthesis of Compounds A′-1 to A′-4” described above.
- Step 6 In a solvent such as dioxane, DMF, DME, THF, acetone, acetonitrile, etc., a base such as potassium carbonate and sodium carbonate and benzyl bromide or benzyl chloride are added to compound s′4, and 0 ° C. to 100 ° C., preferably 20 ° C.
- Compound s′5 can be obtained by reacting at from 50 to 50 ° C. for 0.5 to 24 hours, preferably 1 to 5 hours.
- Seventh Step From compound s′5, compound s′6 can be obtained in the same manner as in the seventh step in “33) Synthesis of Compounds A′-1 to A-4” described above.
- Step A catalyst such as 5% or 10% palladium carbon, palladium hydroxide or platinum dioxide is added to the compound s′6 in a solvent such as methanol, ethanol or tetrahydrofuran, and 0 ° C. to 60 ° C. in a hydrogen atmosphere, preferably Compound s′7 can be obtained by reacting at 20 ° C. to 40 ° C. for 0.1 to 24 hours, preferably 1 to 12 hours.
- Step 9 Compound s′7 is mixed with a base such as pyridine, lutidine, triethylamine and trifluoromethanesulfonic anhydride, comin's reagent, etc.
- compound s′10 can be obtained in the same manner as in the seventh step in “33) Synthesis of Compounds A′-1 to A-4” described above.
- compound s′11 can be obtained in the same manner as in the thirteenth step in “33) Synthesis of Compounds A′-1 to A-4” described above.
- compound S′-1 can be obtained in the same manner as in the eighth to eleventh steps in “33) Synthesis of Compounds A′-1 to A-4” described above.
- Step 14 From compound S′-1 compound S′-2 can be obtained in the same manner as in the 17th step in “33) Synthesis of Compounds A′-1 to A-4” described above.
- compound T′-1 can be obtained in the same manner as in the third step in “49) Synthesis of Compounds O′-1 to O′-4” described above.
- compound T′-2 can be obtained in the same manner as in the seventeenth step in “33) Synthesis of Compounds A′-1 to A-4” described above.
- compound T'-3 can be obtained in the same manner as in the fifth step in "52) Synthesis of compounds R'-1 to R'-4" described above.
- Sixth Step From compound T'-3, compound T'-4 can be obtained in the same manner as in the seventeenth step in "33) Synthesis of Compounds A'-1 to A-4" described above.
- Second Step In a solvent such as dichloromethane, tetrahydrofuran or DMF, sodium hydride and 1-1′-carbonyldiimidazole are added to compound u′1 as an inorganic base, and 0 ° C. to 100 ° C., preferably 20 ° C. to 50 ° C. By reacting at 0 ° C. for 1 hour to 48 hours, preferably 6 hours to 24 hours, compound u′2 can be obtained.
- a solvent such as dichloromethane, tetrahydrofuran or DMF
- sodium hydride and 1-1′-carbonyldiimidazole are added to compound u′1 as an inorganic base, and 0 ° C. to 100 ° C., preferably 20 ° C. to 50 ° C.
- the compound of the present invention Since the compound of the present invention has an HIV replication inhibitory action, it is useful as a therapeutic and / or prophylactic agent for viral infections such as AIDS.
- the compound of the present invention has not only an HIV replication inhibitory action but also a usefulness as a medicine, and preferably has any or all of the following excellent features. a) The inhibitory effect on CYP enzymes (eg, CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4, etc.) is weak. b) Good pharmacokinetics such as high bioavailability and moderate clearance. c) High metabolic stability.
- CYP enzymes eg, CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4, etc.
- Oral administration may be carried out by preparing a commonly used dosage form such as tablets, granules, powders, capsules and the like according to conventional methods.
- a commonly used dosage form such as tablets, granules, powders, capsules and the like according to conventional methods.
- parenteral administration any commonly used dosage form such as an injection can be suitably administered. Since the compound of the present invention preferably has high oral absorbability, it can be suitably used as an oral preparation.
- the compounds of the present invention are reverse transcriptase inhibitors, protease inhibitors, integrase inhibitors, other anti-HIV drugs, etc. (hereinafter referred to as concomitant drugs) for the purpose of enhancing the action of the compounds or reducing the dose of the compounds.
- concomitant drugs for the purpose of enhancing the action of the compounds or reducing the dose of the compounds.
- the administration time of the compound of the present invention and the concomitant drug is not limited, and these may be administered to the administration subject at the same time or may be administered with a time difference.
- the compound of the present invention and the concomitant drug may be administered as two types of preparations containing each active ingredient, or may be administered as a single preparation containing both active ingredients. *
- Step 4 Synthesis of Compound (5)
- Compound (4) (18.5 g, 70.1 mmol) and 3,4-dimethylphenylboronic acid (22.07 g, 147 mmol) were dissolved in dioxane (315 mL) to give 2 mol / L potassium carbonate aqueous solution (105 mL, 210 mmol) was added, and the operation of deaeration and nitrogen substitution was repeated three times.
- Pd (PPh 3 ) 4 (810 mg, 0.701 mmol) was added, and the operations of deaeration and nitrogen replacement were repeated three times, followed by stirring at 100 ° C. for 22 hours.
- the reaction mixture was poured into ice water (450 mL) and a 2 mol / L aqueous hydrochloric acid solution (150 mL), and extracted with ethyl acetate.
- the organic layer was washed successively with a saturated aqueous solution of sodium bicarbonate and a saturated aqueous solution of sodium chloride, dried over anhydrous sodium sulfate, and the solvent was distilled off under reduced pressure using an evaporator.
- the obtained residue was purified by silica gel chromatography (hexane-ethyl acetate) to give compound (5) as a yellow foam (20.06 g, yield 71.0%).
- Step 7 Synthesis of Compound (8)
- Compound (7) 13.95 g, 37.4 mmol
- dichloromethane 140 mL
- Zinc iodide 12.55 g, 37.4 mmol
- trimethylsilyl cyanide 15.65 mL, 112 mmol
- the reaction solution was poured into ice water and saturated aqueous sodium hydrogen carbonate solution, and extracted with chloroform.
- Step 8 Synthesis of Compound (9)
- Compound (8) (18.80 g) was dissolved in methanol (83.1 mL), and the internal temperature was cooled to 0 ° C. with an ice bath. Concentrated sulfuric acid (20.8 mL, 374 mmol) was added and the ice bath was removed and stirred at 90 ° C. for 21 hours.
- the reaction mixture was poured into ice water and extracted with ethyl acetate.
- the organic layer was washed successively with a saturated aqueous solution of sodium bicarbonate and a saturated aqueous solution of sodium chloride, dried over anhydrous sodium sulfate, and the solvent was distilled off under reduced pressure using an evaporator.
- Step 14 Synthesis of Compound I-6
- Compound (14) (79 mg, 0.153 mmol) was dissolved in a mixed solvent of tetrahydrofuran (0.8 mL) and methanol (1.6 mL), and a 2 mol / L sodium hydroxide aqueous solution (0 .383 mL) was added, and the mixture was stirred at 60 ° C. for 4 hours.
- the reaction solution was poured into ice water, the aqueous layer was washed with diethyl ether, adjusted to pH ⁇ 3 with a 2 mol / L hydrochloric acid aqueous solution, and extracted with ethyl acetate.
- Step 2 Synthesis of Compound I-11
- compound I-11 was converted from compound (16) (82 mg, 0.149 mmol) to white powder (48 mg, yield 60.1%).
- 1 H NMR (DMSO-d 6 ) ⁇ : 0.88-0.91 (m, 9H), 1.17 (t, J 7.2 Hz, 3H), 1.54-1.57 (m, 3H), 2.18-2.29 (m, 15H), 2.85-3.00 (m, 2H), 4.91 (m, 1H), 5.71 (br s, 1H), 6.75 (s, 1H), 6.80-7.25 (m, 6H).
- FABMS m / z [M + H] + 531.
- the reaction solution was poured into ice water, the pH was adjusted to about 3 with 2 mol / L hydrochloric acid aqueous solution, and extracted with ethyl acetate.
- the organic layer was washed with a saturated aqueous sodium chloride solution and dried over anhydrous sodium sulfate, and then the solvent was distilled off under reduced pressure using an evaporator.
- the obtained residue was purified by silica gel chromatography (chloroform-methanol) to obtain Compound I-14 as a pale white powder (22 mg, yield 88.2%).
- Step 2 Synthesis of Compound I-15 In the same manner as in Step 14 of Example 1, from Compound (19) (6.0 mg, 0.012 mmol) to Compound I-15 (5.6 mg, yield 96%) Got. 1 H-NMR (CDCl 3 ) ⁇ : 7.23-7.20 (m, 3H), 7.04-6.96 (m, 3H), 5.16 (s, 1H), 2.62 (s, 3H), 2.30 (s, 12H), 1.75 (s, 3H), 1.24 (s, 3H), 1.03 (s, 9H)
- Step 5 Synthesis of Compound (25)
- Compound (24) (36.9 g, 98 mmol), trimethylboroxine (50%, 36.9 g, 148 mmol), Cs 2 CO 3 (96 g, 295 mmol) in dioxane (400 mL)- was dissolved in water (80 mL), under nitrogen atmosphere, Pd (dppf) Cl 2 ( 4g, 4.9mmol) and the mixture was stirred with heating for 14 hours at 90 ° C..
- Step 12 Synthesis of Compound (32)
- Compound (31) 200 mg, 0.5 mmol
- p-chlorobenzoic acid 94 mg, 0.6 mmol
- 1-ethyl-3- (3-dimethylaminopropyl) carbodiimide 144 mg
- 1-hydroxybenzotriazole 100 mg, 0.7 mmol
- dichloromethane 10 mL
- triethylamine 80 mg, 0.7 mmol
- Example 13 Synthesis of Compounds I-300 and I-301 First Step Synthesis of Compound (42)
- compound (41) (25.0 g, 166 mmol) in sulfuric acid (350 mL) was added potassium nitrate (18.5 g, 183 mmol) under ice cooling.
- the mixture was stirred at 0 ° C. for 1.5 hours, and the reaction solution was poured into ice water.
- the precipitated solid was filtered to obtain a yellow solid compound (42) (31.8 g, 98%).
- boronic acid ester (30.1 mg, 0.11 mmol) and PdCl 2 (dtbpf) (4.8 mg, 0.007 mmol) were added, and the mixture was stirred at 80 ° C. for 40 minutes in a nitrogen atmosphere.
- 2 mol / L hydrochloric acid (1 mL) was added, and the mixture was extracted with ethyl acetate (1 mL ⁇ 3). The organic layer was washed with water and saturated brine. After drying over sodium sulfate, concentration, and purification by column chromatography, compound (55) (17.9 mg, 80%) of a white foamy diastereomer mixture was obtained.
- Step 3 Synthesis of Compound (59)
- Compound (58) 500 mg, 1.45 mmol was dissolved in pyridine (5 ml), and cyclohexylmethylsulfonyl chloride (371 mg, 1.89 mmol) was added at room temperature. Stir for 48 hours. Further, cyclohexylmethylsulfonyl chloride (143 mg, 0.726 mmol) was added and stirred at room temperature for 5 hours. The reaction mixture was poured into water and extracted with ethyl acetate. The organic layer was washed with 1N hydrochloric acid and dried over anhydrous sodium sulfate.
- the reaction solution was cooled to room temperature, poured into ice water and 2 mol / L hydrochloric acid aqueous solution, and extracted with ethyl acetate.
- the organic layer was washed successively with a saturated aqueous solution of sodium bicarbonate and a saturated aqueous solution of sodium chloride, dried over anhydrous sodium sulfate, and the solvent was distilled off under reduced pressure using an evaporator.
- the obtained residue was purified by silica gel chromatography (hexane-ethyl acetate) to obtain Compound (65) as a yellow foam (3.22 g, 80.9%).
- the reaction solution was cooled to room temperature, poured into ice water and 2 mol / L hydrochloric acid aqueous solution, and extracted with ethyl acetate.
- the organic layer was washed successively with a saturated aqueous solution of sodium bicarbonate and a saturated aqueous solution of sodium chloride, dried over anhydrous sodium sulfate, and the solvent was distilled off under reduced pressure using an evaporator.
- the obtained residue was purified by silica gel chromatography (hexane-ethyl acetate) to obtain Compound (72) as a brown foam (20.0 mg, 16.6%).
- Example 17 Synthesis of Compound II-1 and Compound II-2 Step 1 Synthesis of Compound (102)
- Compound (101) (220 mg, 0.409 mmol) was dissolved in acetone (4 mL), and benzoyl isothiocyanate (98%, 82 mg, 0.490 mmol) in acetone (0.5 mL) was dissolved. The solution was added dropwise and stirred at room temperature for 0.5 hour. The concentrated residue was purified by silica gel chromatography (hexane-ethyl acetate) to obtain Compound (102) (232 mg, 81% yield).
- Step 3 Synthesis of Compound II-6
- Compound (109) (30 mg, 0.058 mmol) was dissolved in methanol (1 mL), 2 mol / L aqueous sodium hydroxide solution (0.146 mL, 0.291 mmol) was added, and 70 Stir at 4 ° C. for 4 hours.
- Aqueous hydrochloric acid solution was added, and the mixture was extracted with ethyl acetate.
- the organic layer was washed with saturated brine and then dried over anhydrous sodium sulfate.
- the solvent was distilled off under reduced pressure, and the obtained residue was purified by silica gel chromatography (ethyl acetate-methanol) to obtain Compound II-6 (21 mg, yield 72%).
- Example 22 Synthesis of Compound II-8 Step 1 Synthesis of Compound (111) To a solution of compound (110) in 1,4-dioxane / water (100 mL / 10 mL) was added cesium carbonate (48.5 g, 149 mmol), Pd (dppf) Cl 2 and after nitrogen substitution. , Compound (110 ′) (15.7 g, 69.4 mmol) was added and stirred at 85 ° C. for 14 hours. After cooling to room temperature, ethyl acetate and water were added, the organic layer was dried over sodium sulfate, and the concentrated residue was purified by silica gel column chromatography to obtain compound (111) (15.0 g).
- Step 8 Synthesis of Compound (118) Compound (117) (132 mg, 0.3 mmol) was dissolved in DMF (10 mL), 2-chloromethylpyridine (100 mg, 0.45 mmol), cesium carbonate (300 mg, 0.9 mmol) ) And stirred at 40 ° C. for 14 hours. After cooling to room temperature, water was added and the mixture was extracted with diethyl ether (20 mL ⁇ 2 times), dried over sodium sulfate, and concentrated to dryness to give compound (118). Used in the next reaction without purification.
- trifluoromethanesulfonic anhydride (3.20 mL, 19.0 mmol) was added dropwise over 5 minutes, and the mixture was stirred for 2.5 hours while raising the temperature from ⁇ 78 ° C. to ⁇ 25 ° C.
- Water 100 mL was added at ⁇ 20 ° C., and the mixture was extracted with ethyl acetate (150 mL). The organic layer was washed with saturated brine (100 mL) and then dried over anhydrous magnesium sulfate.
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Virology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Oncology (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Tropical Medicine & Parasitology (AREA)
- AIDS & HIV (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Thiazole And Isothizaole Compounds (AREA)
- Furan Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Pyrane Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Heterocyclic Compounds That Contain Two Or More Ring Oxygen Atoms (AREA)
- Quinoline Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
(式中、
R1は、ハロゲン、シアノ、ニトロ、または-X-R11であり、
ここで、Xは、単結合、-O-、-S-、-NR12-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR12-CO-、-CO-NR12-、-NR12-CO-O-、-NR12-CO-NR13-、-NR12-SO2-または-SO2-NR12-であり、
R11は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R12およびR13は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルであり、
Xが-NR12-、-CO-NR12-または-SO2-NR12-の場合は、R11とR12が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良く、
R2は、それぞれ独立して、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルオキシ、置換若しくは非置換のアルケニルオキシ、置換若しくは非置換のアルキニルオキシ、置換若しくは非置換のアルキルスルファニル、置換若しくは非置換のアルケニルスルファニルまたは置換若しくは非置換のアルキニルスルファニルであり、
nは、1または2であり、
R3は、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R4は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R5は、水素原子、ヒドロキシ、ホルミル、カルボキシ、カルバモイル、カルバモイルオキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルオキシ、置換若しくは非置換のアルケニルオキシ、置換若しくは非置換のアルキニルオキシ、置換若しくは非置換のアルキルスルファニル、置換若しくは非置換のアルケニルスルファニル、置換若しくは非置換のアルキニルスルファニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換のモノアルキルカルバモイル、置換若しくは非置換のジアルキルカルバモイル、置換若しくは非置換のモノアルキルカルバモイルオキシ、置換若しくは非置換のジアルキルカルバモイルオキシ、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環オキシ、置換若しくは非置換の非芳香族炭素環オキシ、置換若しくは非置換の芳香族複素環オキシ、置換若しくは非置換の非芳香族複素環オキシ、置換若しくは非置換の芳香族炭素環スルファニル、置換若しくは非置換の非芳香族炭素環スルファニル、置換若しくは非置換の芳香族複素環スルファニル、置換若しくは非置換の非芳香族複素環スルファニル、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニル、置換若しくは非置換の非芳香族複素環オキシカルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイルまたは-NR51R52(R51、R52は、それぞれ独立して、水素原子、ホルミル、カルバモイル、カルボキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキニルカルバモイル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニルまたは置換若しくは非置換の非芳香族複素環オキシカルボニル)であり、
Yは、単結合、アルキレン、アルケニレンまたはアルキニレンであり
但し、R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルの場合は、Yは単結合であり、
R6は、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の非芳香族炭素環式基または置換若しくは非置換のアルキルオキシであり、ならびに
R7は、ハロゲン、シアノ、ニトロ、または-Z-R71であり、
ここで、Zは、単結合、-O-、-S-、-NR72-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-であり、
R71は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R72およびR73は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルであり、
Zが-NR72-、-CO-NR72-、または-SO2-NR72-の場合は、R71とR72が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良く、
ここで、R1とR7は、隣接する原子と一緒になって環Aを形成しても良く、
環Aは、芳香族炭素環、非芳香族炭素環、芳香族複素環または非芳香族複素環であり、1~7個のRAで置換されていてもよく、
RAは、それぞれ独立して、ハロゲン、シアノ、ニトロ、オキソまたは-XA-RA1であり、
ここで、XAは、単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、-O-CO-、-CO-O-、-NRA2-CO-、-CO-NRA2-、-NRA2-CO-O-、-CO-O-NRA2-、-O-CO-NRA2-、-NRA2-O-CO-、-CO-NRA2-O-、-O-NRA2-CO-、-NRA2-CO-NRA3-、-NRA2-SO2-または-SO2-NRA2-であり、
RA1は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
RA2およびRA3は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルであり、
XAが-NRA2-、-CO-NRA2-、-CO-O-NRA2-、-O-CO-NRA2-、または-SO2-NRA2-の場合は、RA1とRA2が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。
但し、以下の化合物:
を除く。)
で示される化合物またはその製薬上許容される塩、
(2)R4が水素原子である、上記(1)記載の化合物またはその製薬上許容される塩、
(3)nが1である、上記(1)または(2)記載の化合物またはその製薬上許容される塩、
(4)R2が置換若しくは非置換のアルキルオキシである、上記(3)記載の化合物またはその製薬上許容される塩、
(5)R1がハロゲン、シアノ、ニトロまたは-X-R11であり(Xは単結合、-O-、-S-、-NR12-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR12-CO-、-CO-NR12-、-NR12-CO-O-、-NR12-CO-NR13-、-NR12-SO2-または-SO2-NR12-;R11は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基;R12およびR13は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニル。ここで、Xが-NR12-、-CO-NR12-、または-SO2-NR12-の場合は、R11とR12が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)、
R7がハロゲン、シアノ、ニトロまたは-Z-R71である(Zは単結合、-O-、-S-、-NR72-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-;R71は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基;R72およびR73は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニル。ここで、Zが-NR72-、-CO-NR72-、または-SO2-NR72-の場合は、R71とR72が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)、
上記(1)記載の化合物またはその製薬上許容される塩、
(6)R4が水素原子である、上記(5)記載の化合物またはその製薬上許容される塩、
(7)nが1である、上記(5)または(6)記載の化合物またはその製薬上許容される塩、
(8)R2が置換若しくは非置換のアルキルオキシである、上記(7)記載の化合物またはその製薬上許容される塩、
(9)R1が水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換の芳香族炭素環式基である、上記(5)~(8)のいずれかに記載の化合物またはその製薬上許容される塩、
(10)R7が-Z-R71であり、Zが単結合、-O-、-NR72-、-SO2-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-である、上記(5)~(9)のいずれかに記載の化合物またはその製薬上許容される塩、
(11)R71が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基または置換若しくは非置換の非芳香族炭素環式基である、上記(10)記載の化合物またはその製薬上許容される塩、
(12)R71が置換若しくは非置換のアルケニル、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基である、上記(10)記載の化合物またはその製薬上許容される塩、
(13)Zが単結合、-NR72-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NH-、-NR72-SO2-または-SO2-NR72-である、上記(10)~(12)のいずれかに記載の化合物またはその製薬上許容される塩、
(14)Zが単結合、-NR72-、-NR72-CO-、-NR72-CO-O-、-NR72-CO-NH-または-NR72-SO2-である、上記(13)記載の化合物またはその製薬上許容される塩、
(15)R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、およびR1が水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換の芳香族炭素環式基である、上記(5)記載の化合物またはその製薬上許容される塩、
(16)R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、R1が水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換の芳香族炭素環式基、R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイルまたは-NR51R52(R51は置換若しくは非置換の芳香族炭素環カルボニルまたは置換若しくは非置換の非芳香族炭素環カルボニル、R52は水素原子)、Yが単結合、R7が-Z-R71、Zが単結合、-O-、-NR72-、-SO2-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-、ならびにR3が置換若しくは非置換のフェニル、置換若しくは非置換のシクロアルケニル、置換若しくは非置換のベンゾフリル、置換若しくは非置換のベンゾジオキソリル、置換若しくは非置換のベンゾジオキサニル、置換若しくは非置換のジヒドロベンゾフリル、置換若しくは非置換のクロマニルまたは置換若しくは非置換のベンゾモルホリニルである、上記(5)記載の化合物またはその製薬上許容される塩、
(17)式(II):
(式中、mは0~7のいずれかの整数であり、その他の記号は請求項1と同意義)
で示される、上記(1)記載の化合物またはその製薬上許容される塩、
(18)R4が水素原子である、上記(17)記載の化合物またはその製薬上許容される塩、
(19)nが1である、上記(17)または(18)記載の化合物またはその製薬上許容される塩、
(20)R2が置換若しくは非置換のアルキルオキシである、上記(17)~(19)のいずれかに記載の化合物またはその製薬上許容される塩、
(21)環Aが5員環または6員環である、上記(17)~(20)のいずれかに記載の化合物またはその製薬上許容される塩、
(22)環Aが芳香族複素環または非芳香族複素環である、上記(17)~(21)のいずれかに記載の化合物またはその製薬上許容される塩、
(23)mが0~4のいずれかの整数である、上記(17)~(22)のいずれかに記載の化合物またはその製薬上許容される塩、
(24)RAがハロゲン、シアノ、オキソまたは-XA-RA1(XAは単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、NRA2-CO-、-CO-NRA2-、-NRA2-CO-NRA3-、-NRA2-SO2-または-SO2-NRA2-、RA1は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基、RA2およびRA3は、それぞれ独立して、水素原子または置換若しくは非置換のアルキル)である、上記(17)~(23)のいずれかに記載の化合物またはその製薬上許容される塩、
(25)R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、環Aが5員環または6員環の芳香族複素環または非芳香族複素環、およびmが0~4のいずれかの整数である、上記(17)記載の化合物またはその製薬上許容される塩、
(26)R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、環Aが5員環または6員環の芳香族複素環または非芳香族複素環、mが0~4のいずれかの整数、R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイルまたは-NR51R52(R51は置換若しくは非置換の芳香族炭素環カルボニルまたは置換若しくは非置換の非芳香族炭素環カルボニル、R52は水素原子)、Yが単結合、RAが、それぞれ独立して、ハロゲン、シアノ、オキソまたは-XA-RA1(XAは単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、NRA2-CO-、-CO-NRA2-、-NRA2-CO-NRA3-、-NRA2-SO2-または-SO2-NRA2-、RA1は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基、RA2およびRA3は、それぞれ独立して、水素原子または置換若しくは非置換のアルキル)、ならびにR3が置換若しくは非置換のフェニル、置換若しくは非置換のシクロアルケニル、置換若しくは非置換のベンゾフリル、置換若しくは非置換のベンゾジオキソリル、置換若しくは非置換のベンゾジオキサニル、置換若しくは非置換のジヒドロベンゾフリル、置換若しくは非置換のクロマニルまたは置換若しくは非置換のベンゾモルホリニルである、上記(17)記載の化合物またはその製薬上許容される塩、
(27)R6が置換若しくは非置換のアルキルである、上記(1)~(26)のいずれかに記載の化合物、またはその製薬上許容される塩、
(28)R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルバモイルまたは-NR51H(R51は置換若しくは非置換の芳香族炭素環カルボニル)である、上記(1)~(27)のいずれかに記載の化合物またはその製薬上許容される塩、
(29)R5が置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基である、上記(28)記載の化合物またはその製薬上許容される塩、
(30)R5が水素原子である、上記(28)記載の化合物またはその製薬上許容される塩、
(31)R5が置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキルオキシ、置換若しくは非置換のアルケニルオキシ、置換若しくは非置換の芳香族炭素環式基カルボニル、置換若しくは非置換の非芳香族炭素環式基カルボニル、置換若しくは非置換の芳香族複素環式基カルボニル、置換若しくは非置換の非芳香族複素環式基カルボニルまたは置換若しくは非置換の非芳香族炭素環カルバモイルである、上記(1)~(27)のいずれかに記載の化合物またはその製薬上許容される塩、
(32)Yが単結合である、上記(1)~(31)のいずれかに記載の化合物またはその製薬上許容される塩、
(33)Yがアルキレンである、上記(1)~(31)のいずれかに記載の化合物またはその製薬上許容される塩、
(34)R3が置換若しくは非置換のフェニル、置換若しくは非置換のシクロアルケニル、置換若しくは非置換のベンゾフリル、置換若しくは非置換のベンゾジオキソリル、置換若しくは非置換のベンゾジオキサニル、置換若しくは非置換のジヒドロベンゾフリル、置換若しくは非置換のクロマニルまたは置換若しくは非置換のベンゾモルホリニルである、上記(1)~(33)のいずれかに記載の化合物またはその製薬上許容される塩、
(35)上記(1)~(34)のいずれかに記載の化合物またはその製薬上許容される塩を含有する医薬組成物、
(36)抗HIV作用を有する、上記(35)記載の医薬組成物、
(37)抗ウイルス的に有効量の上記(1)~(34)のいずれかに記載の化合物をヒトに投与することを特徴とする、ウイルス感染症の治療方法、
(38)HIV感染症に対する、上記(37)記載の治療方法、
(39)ウイルス感染症の治療のための、上記(1)~(34)のいずれかに記載の化合物またはその製薬上許容される塩、
(40)HIV感染症の治療のための、上記(39)記載の化合物またはその製薬上許容される塩。
(41)ウイルス感染症治療剤の製造のための、上記(1)~(34)のいずれかに記載の化合物またはその製薬上許容される塩の使用、
(42)HIV感染症治療剤の製造のための、上記(41)記載の使用。
「アルキル」の好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、tert-ブチル、n-ペンチルが挙げられる。さらに好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、tert-ブチルが挙げられる。
「アルケニル」の好ましい態様として、ビニル、アリル、プロペニル、イソプロペニル、ブテニルが挙げられる。
「アルキニル」の好ましい態様として、エチニル、プロピニル、ブチニル、ペンチニルが挙げられる。
「芳香族炭素環式基」の好ましい態様として、フェニルが挙げられる。
さらに、「非芳香族炭素環式基」は、以下のように架橋している基、またはスピロ環を形成する基も包含する。
単環の非芳香族炭素環式基としては、炭素数3~16が好ましく、より好ましくは炭素数3~12、さらに好ましくは炭素数4~8である。例えば、シクロアルキル、シクロアルケニル等が挙げられる。
「シクロアルキル」としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、シクロノニル、シクロデシル等が挙げられる。
「シクロアルケニル」としては、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロヘキサジエニル等が挙げられる。
2環以上の非芳香族炭素環式基としては、例えば、インダニル、インデニル、アセナフチル、テトラヒドロナフチル、フルオレニル、ジヒドロインデニル等が挙げられる。
2環以上の芳香族複素環式基は、単環または2環以上の芳香族複素環式基に、上記「芳香族炭素環式基」における環が縮合したものも包含する。
単環の芳香族複素環式基としては、5~8員が好ましく、より好ましくは5員または6員である。例えば、ピロリル、イミダゾリル、ピラゾリル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、トリアゾリル、トリアジニル、テトラゾリル、フリル、チエニル、イソオキサゾリル、オキサゾリル、オキサジアゾリル、イソチアゾリル、チアゾリル、チアジアゾリル等が挙げられる。
2環の芳香族複素環式基としては、例えば、インドリル、イソインドリル、インダゾリル、インドリジニル、キノリニル、イソキノリニル、シンノリニル、フタラジニル、キナゾリニル、ナフチリジニル、キノキサリニル、プリニル、プテリジニル、ベンズイミダゾリル、ベンズイソオキサゾリル、ベンズオキサゾリル、ベンズオキサジアゾリル、ベンズイソチアゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾフリル、イソベンゾフリル、ベンゾチエニル、ベンゾトリアゾリル、イミダゾピリジル、トリアゾロピリジル、イミダゾチアゾリル、ピラジノピリダジニル、オキサゾロピリジル、チアゾロピリジル等が挙げられる。
3環以上の芳香族複素環式基としては、例えば、カルバゾリル、アクリジニル、キサンテニル、フェノチアジニル、フェノキサチイニル、フェノキサジニル、ジベンゾフリル等が挙げられる。
2環以上の非芳香族複素環式基は、単環または2環以上の非芳香族複素環式基に、上記「芳香族炭素環式基」、「非芳香族炭素環式基」、および/または「芳香族複素環式基」におけるそれぞれの環が縮合したものも包含する。
さらに、「非芳香族複素環式基」は、以下のように架橋している基、またはスピロ環を形成する基も包含する。
単環の非芳香族複素環式基としては、3~8員が好ましく、より好ましくは5員または6員である。例えば、ジオキサニル、チイラニル、オキシラニル、オキセタニル、オキサチオラニル、アゼチジニル、チアニル、チアゾリジニル、ピロリジニル、ピロリニル、イミダゾリジニル、イミダゾリニル、ピラゾリジニル、ピラゾリニル、ピペリジル、ピペラジニル、モルホリニル、モルホリノ、チオモルホリニル、チオモルホリノ、ジヒドロピリジル、テトラヒドロピリジル、テトラヒドロフリル、テトラヒドロピラニル、ジヒドロチアゾリル、テトラヒドロチアゾリル、テトラヒドロイソチアゾリル、ジヒドロオキサジニル、ヘキサヒドロアゼピニル、テトラヒドロジアゼピニル、テトラヒドロピリダジニル、ヘキサヒドロピリミジニル、ジオキソラニル、ジオキサジニル、アジリジニル、ジオキソリニル、オキセパニル、チオラニル、チイニル、チアジニル等が挙げられる。
2環以上の非芳香族複素環式基としては、例えば、インドリニル、イソインドリニル、クロマニル、イソクロマニル、ジヒドロベンゾフリル、ベンゾジオキソリル、ベンゾジオキサニル、ベンゾモルホリニル等が挙げられる。
「ヒドロキシアルキル」の好ましい態様として、ヒドロキシメチルが挙げられる。
「アルキルオキシ」の好ましい態様として、メトキシ、エトキシ、n-プロピルオキシ、イソプロピルオキシ、tert-ブチルオキシが挙げられる。
例えば、ビニルオキシ、アリルオキシ、1-プロペニルオキシ、2-ブテニルオキシ、2-ペンテニルオキシ、2-ヘキセニルオキシ、2-ヘプテニルオキシ、2-オクテニルオキシ等が挙げられる。
例えば、エチニルオキシ、1-プロピニルオキシ、2-プロピニルオキシ、2-ブチニルオキシ、2-ペンチニルオキシ、2-ヘキシニルオキシ、2-ヘプチニルオキシ、2-オクチニルオキシ等が挙げられる。
「ハロアルキル」の好ましい態様として、トリフルオロメチル、トリクロロメチルが挙げられる。
「ハロアルキルオキシ」の好ましい態様として、トリフルオロメトキシ、トリクロロメトキシが挙げられる。
「アルキルカルボニル」の好ましい態様として、メチルカルボニル、エチルカルボニル、n-プロピルカルボニルが挙げられる。
「モノアルキルアミノ」の好ましい態様として、メチルアミノ、エチルアミノが挙げられる。
「ジアルキルアミノ」の好ましい態様として、ジメチルアミノ、ジエチルアミノが挙げられる。
「アルキルスルホニル」の好ましい態様として、メチルスルホニル、エチルスルホニルが挙げられる。
「モノアルキルカルボニルアミノ」の好ましい態様としては、メチルカルボニルアミノ、エチルカルボニルアミノが挙げられる。
「ジアルキルカルボニルアミノ」の好ましい態様として、ジメチルカルボニルアミノ、ジエチルカルボニルアミノが挙げられる。
「モノアルキルスルホニルアミノ」の好ましい態様としては、メチルスルホニルアミノ、エチルスルホニルアミノが挙げられる。
「ジアルキルカルボニルアミノ」の好ましい態様として、ジメチルスルホニルアミノ、ジエチルスルホニルアミノが挙げられる。
「アルキルカルボニルオキシ」の好ましい態様としては、メチルカルボニルオキシ、エチルカルボニルオキシが挙げられる。
「アルキルオキシカルボニル」の好ましい態様としては、メチルオキシカルボニル、エチルオキシカルボニル、プロピルオキシカルボニルが挙げられる。
「芳香族炭素環アルキルスルファニル」、「非芳香族炭素環アルキルスルファニル」、「芳香族複素環アルキルスルファニル」、および「非芳香族複素環アルキルスルファニル」、
「芳香族炭素環アルキルオキシカルボニル」、「非芳香族炭素環アルキルオキシカルボニル」、「芳香族複素環アルキルオキシカルボニル」、および「非芳香族複素環アルキルオキシカルボニル」、「芳香族炭素環アルキルオキシアルキル」、「非芳香族炭素環アルキルオキシアルキル」、「芳香族複素環アルキルオキシアルキル」、および「非芳香族複素環アルキルオキシアルキル」、ならびに「芳香族炭素環アルキルアミノ」、「非芳香族炭素環アルキルアミノ」、「芳香族複素環アルキルアミノ」、および「非芳香族複素環アルキルアミノ」のアルキル部分も、上記「アルキル」と同様である。
等が挙げられる。
「芳香族炭素環アルキル」の好ましい態様としては、ベンジル、フェネチル、ベンズヒドリルが挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
等が挙げられる。
「芳香族炭素環オキシ」とは、「芳香族炭素環」が酸素原子に結合した基を意味する。例えば、フェニルオキシ、ナフチルオキシ等が挙げられる。
「芳香族炭素環アミノ」とは、「芳香族炭素環」がアミノ基の窒素原子と結合している水素原子1個または2個と置き換わった基を意味する。例えば、フェニルアミノ、ナフチルアミノ等が挙げられる。
「芳香族炭素環カルボニル」とは、「芳香族炭素環」がカルボニル基に結合した基を意味する。例えば、フェニルカルボニル、ナフチルカルボニル等が挙げられる。
「芳香族炭素環オキシカルボニル」とは、上記「芳香族炭素環オキシ」がカルボニル基に結合した基を意味する。例えば、フェニルオキシカルボニル、ナフチルオキシカルボニル等が挙げられる。
「芳香族炭素環カルボニルアミノ」とは、上記「芳香族炭素環カルボニル」がアミノ基の窒素原子と結合している水素原子1個または2個と置き換わった基を意味する。例えば、フェニルカルボニルアミノ、ナフチルカルボニルアミノ等が挙げられる。
「芳香族炭素環スルファニル」とは、「芳香族炭素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、フェニルスルファニル、ナフチルスルファニル等が挙げられる。
「芳香族炭素環スルホニル」とは、「芳香族炭素環」がスルホニル基に結合した基を意味する。例えば、フェニルスルホニル、ナフチルスルホニル等が挙げられる。
「非芳香族炭素環オキシ」とは、「非芳香族炭素環」が酸素原子に結合した基を意味する。例えば、シクロプロピルオキシ、シクロヘキシルオキシ、シクロへキセニルオキシ等が挙げられる。
「非芳香族炭素環アミノ」とは、「非芳香族炭素環」がアミノ基の窒素原子と結合している水素原子1個または2個と置き換わった基を意味する。例えば、シクロプロピルアミノ、シクロヘキシルアミノ、シクロへキセニルアミノ等が挙げられる。
「非芳香族炭素環カルボニル」とは、「非芳香族炭素環」がカルボニル基に結合した基を意味する。例えば、シクロプロピルカルボニル、シクロヘキシルカルボニル、シクロへキセニルカルボニル等が挙げられる。
「非芳香族炭素環オキシカルボニル」とは、上記「非芳香族炭素環オキシ」がカルボニル基に結合した基を意味する。例えば、シクロプロピルオキシカルボニル、シクロヘキシルオキシカルボニル、シクロへキセニルオキシカルボニル等が挙げられる。
「非芳香族炭素環カルボニルアミノ」とは、上記「非芳香族炭素環カルボニル」がアミノ基の窒素原子と結合している水素原子1個または2個と置き換わった基を意味する。例えば、シクロプロピルカルボニルアミノ、シクロヘキシルカルボニルアミノ、シクロへキセニルカルボニルアミノ等が挙げられる。
「非芳香族炭素環スルファニル」とは、「非芳香族炭素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、シクロプロピルスルファニル、シクロヘキシルスルファニル、シクロヘキセニルスルファニル等が挙げられる。
「非芳香族炭素環スルホニル」とは、「非芳香族炭素環」がスルホニル基に結合した基を意味する。例えば、シクロプロピルスルホニル、シクロヘキシルスルホニル、シクロヘキセニルスルホニル等が挙げられる。
「芳香族複素環オキシ」とは、「芳香族複素環」が酸素原子に結合した基を意味する。例えば、ピリジルオキシ、オキサゾリルオキシ等が挙げられる。
「芳香族複素環アミノ」とは、「芳香族複素環」がアミノ基の窒素原子と結合している水素原子1個または2個と置き換わった基を意味する。例えば、ピリジルアミノ、オキサゾリルアミノ等が挙げられる。
「芳香族複素環カルボニル」とは、「芳香族複素環」がカルボニル基に結合した基を意味する。例えば、ピリジルカルボニル、オキサゾリルカルボニル等が挙げられる。
「芳香族複素環オキシカルボニル」とは、上記「芳香族複素環オキシ」がカルボニル基に結合した基を意味する。例えば、ピリジルオキシカルボニル、オキサゾリルオキシカルボニル等が挙げられる。
「芳香族複素環カルボニルアミノ」とは、上記「芳香族複素環カルボニル」がアミノ基の窒素原子と結合している水素原子1個または2個と置き換わった基を意味する。例えば、ピリジルカルボニルアミノ、オキサゾリルカルボニルアミノ等が挙げられる。
「芳香族複素環スルファニル」とは、「芳香族複素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、ピリジルスルファニル、オキサゾリルスルファニル等が挙げられる。
「芳香族複素環スルホニル」とは、「芳香族複素環」がスルホニル基に結合した基を意味する。例えば、ピリジルスルホニル、オキサゾリルスルホニル等が挙げられる。
「非芳香族複素環オキシ」とは、「非芳香族複素環」が酸素原子に結合した基を意味する。例えば、ピペリジニルオキシ、テトラヒドロフリルオキシ等が挙げられる。
「非芳香族複素環アミノ」とは、「非芳香族複素環」がアミノ基の窒素原子と結合している水素原子1個と置き換わった基を意味する。例えば、ピペリジニルアミノ、テトラヒドロフリルアミノ等が挙げられる。
「非芳香族複素環カルボニル」とは、「非芳香族複素環」がカルボニル基に結合した基を意味する。例えば、ピペリジニルカルボニル、テトラヒドロフリルカルボニル等が挙げられる。
「非芳香族複素環オキシカルボニル」とは、上記「非芳香族複素環オキシ」がカルボニル基に結合した基を意味する。例えば、ピペリジニルオキシカルボニル、テトラヒドロフリルオキシカルボニル等が挙げられる。
「非芳香族複素環カルボニルアミノ」とは、上記「非芳香族複素環カルボニル」がアミノ基の窒素原子と結合している水素原子1個または2個と置き換わった基を意味する。例えば、ピペリジニルカルボニルアミノ、テトラヒドロフリルカルボニルアミノ等が挙げられる。
「非芳香族複素環スルファニル」とは、「非芳香族複素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、ピペリジニルスルファニル、テトラヒドロフリルスルファニル等が挙げられる。
「非芳香族複素環スルホニル」とは、「非芳香族複素環」がスルホニル基に結合した基を意味する。例えば、ピペリジニルスルホニル、テトラヒドロフリルスルホニル等が挙げられる。
置換基:ハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環オキシ、置換若しくは非置換の非芳香族炭素環オキシ、置換若しくは非置換の芳香族複素環オキシ、置換若しくは非置換の非芳香族複素環オキシ、置換若しくは非置換の芳香族炭素環アミノ、置換若しくは非置換の非芳香族炭素環アミノ、置換若しくは非置換の芳香族複素環アミノ、置換若しくは非置換の非芳香族複素環アミノ、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニル、置換若しくは非置換の非芳香族複素環オキシカルボニル、芳香族炭素環カルボニルアミノ、非芳香族炭素環カルボニルアミノ、芳香族複素環カルボニルアミノ、非芳香族複素環カルボニルアミノ、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルスルファニル、非芳香族炭素環アルキルスルファニル、芳香族複素環アルキルスルファニル、非芳香族複素環アルキルスルファニル、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、置換若しくは非置換の芳香族炭素環スルファニル、置換若しくは非置換の非芳香族炭素環スルファニル、置換若しくは非置換の芳香族複素環スルファニル、置換若しくは非置換の非芳香族複素環スルファニル、置換若しくは非置換の非芳香族炭素環スルホニル、置換若しくは非置換の芳香族炭素環スルホニル、置換若しくは非置換の芳香族複素環スルホニル、および置換若しくは非置換の非芳香族複素環スルホニル。
「置換若しくは非置換の芳香族炭素環オキシ」、「置換若しくは非置換の非芳香族炭素環オキシ」、「置換若しくは非置換の芳香族複素環オキシ」、および「置換若しくは非置換の非芳香族複素環オキシ」、
「置換若しくは非置換の芳香族炭素環アミノ」、「置換若しくは非置換の非芳香族炭素環アミノ」、「置換若しくは非置換の芳香族複素環アミノ」、および「置換若しくは非置換の非芳香族複素環アミノ」、
「置換若しくは非置換の芳香族炭素環カルボニル」、「置換若しくは非置換の非芳香族炭素環カルボニル」、「置換若しくは非置換の芳香族複素環カルボニル」、および「置換若しくは非置換の非芳香族複素環カルボニル」、
「置換若しくは非置換の芳香族炭素環オキシカルボニル」、「置換若しくは非置換の非芳香族炭素環オキシカルボニル」、「置換若しくは非置換の芳香族複素環オキシカルボニル」、および「置換若しくは非置換の非芳香族複素環オキシカルボニル」、
「置換若しくは非置換の芳香族炭素環スルファニル」、「置換若しくは非置換の非芳香族炭素環スルファニル」、「置換若しくは非置換の芳香族複素環スルファニル」、および「置換若しくは非置換の非芳香族複素環スルファニル」、ならびに
「置換若しくは非置換の芳香族炭素環スルホニル」、「置換若しくは非置換の非芳香族炭素環スルホニル」、「置換若しくは非置換の芳香族複素環スルホニル」、および「置換若しくは非置換の非芳香族複素環スルホニル」の「芳香族炭素環」、「非芳香族炭素環」、「芳香族複素環」、および「非芳香族複素環」の環上の置換基としては、次の置換基が挙げられる。環上の任意の位置の原子が次の置換基から選択される1以上の基と結合していてもよい。
置換基:ハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキル、アルケニル、アルキニル、ハロアルキル、ヒドロキシアルキル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルオキシアルキル、アルキルオキシアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環オキシ、非芳香族炭素環オキシ、芳香族複素環オキシ、非芳香族複素環オキシ、芳香族炭素環アミノ、非芳香族炭素環アミノ、芳香族複素環アミノ、非芳香族複素環アミノ、芳香族炭素環カルボニル、非芳香族炭素環カルボニル、芳香族複素環カルボニル、非芳香族複素環カルボニル、芳香族炭素環オキシカルボニル、非芳香族炭素環オキシカルボニル、芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、芳香族炭素環カルボニルアミノ、非芳香族炭素環カルボニルアミノ、芳香族複素環カルボニルアミノ、非芳香族複素環カルボニルアミノ、芳香族炭素環アルキル、非芳香族炭素環アルキル、芳香族複素環アルキル、非芳香族複素環アルキル、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルスルファニル、非芳香族炭素環アルキルスルファニル、芳香族複素環アルキルスルファニル、非芳香族複素環アルキルスルファニル、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルオキシアルキル、非芳香族炭素環アルキルオキシアルキル、芳香族複素環アルキルオキシアルキル、非芳香族複素環アルキルオキシアルキル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、芳香族炭素環スルファニル、非芳香族炭素環スルファニル、芳香族複素環スルファニル、非芳香族複素環スルファニル、非芳香族炭素環スルホニル、芳香族炭素環スルホニル、芳香族複素環スルホニル、および非芳香族複素環スルホニル。
さらに、「置換若しくは非置換の非芳香族炭素環式基」および「置換若しくは非置換の非芳香族複素環式基」は、以下のようにアルキレン、アルケニレン、若しくはアルキニレンにより架橋、または他の環、例えばシクロアルカン、シクロアルケン、シクロアルキン、オキシラン、オキセタン、チイラン等と共にスピロ環が形成されていても良い。
R1は、好ましくは、ハロゲン、シアノ、ニトロ、または-X-R11(Xは、単結合、-O-、-S-、-NR12-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR12-CO-、-CO-NR12-、-NR12-CO-O-、-NR12-CO-NR13-、-NR12-SO2-、または-SO2-NR12-であり、R11は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基であり、R12およびR13は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニル)である。
Xが-NR12-、-CO-NR12-、または-SO2-NR12-の場合は、R11とR12が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。
ここで、Xは、好ましくは、単結合、-O-、-NR12-、-SO2-、-NR12-CO-、-CO-NR12-、-NR12-CO-O-、-NR12-CO-NR13-、-NR12-SO2-、または-SO2-NR12-であり、より好ましくは、単結合である。
R1は、より好ましくは、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、または置換若しくは非置換の非芳香族炭素環式基であり、さらに好ましくは、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換の芳香族炭素環式基であり、さらに好ましくは、水素原子、ハロゲン、シアノ、または置換若しくは非置換のアルキルであり、特に好ましくは、ハロゲン、シアノ、または炭素数1~4のアルキルであり、最も好ましくは、ブロモ、シアノ、またはメチルである。
ここで、R31、R32、R33、R34およびR35は、それぞれ独立して、好ましくは、水素原子、ハロゲン、ヒドロキシ、アミノ、アルキル、アルケニル、アルキニル、ハロアルキル、アルキルオキシ、アルケニルオキシ、アルキニルオキシまたはハロアルキルオキシであり、より好ましくは、水素原子、ハロゲン、ヒドロキシ、アミノ、アルキルまたはアルキルオキシであり、さらに好ましくは、フルオロ、クロロ、ブロモ、ヒドロキシ、アミノ、メチル、エチル、またはメチルオキシであり、特に好ましくは、フルオロ、クロロ、ヒドロキシ、アミノ、メチルまたはメチルオキシである。R31とR32、R32とR33、R33とR34ならびにR34とR35は、それぞれ独立して、隣接する原子と一緒になって芳香族炭素環、非芳香族炭素環、芳香族複素環または非芳香族複素環を形成していても良い。該環はハロゲン、アルキルまたはオキソで置換されていてもよく、また、5員環または6員環が好ましい。
R36は、それぞれ独立して、好ましくは、アルキル、アルケニル、アルキニル、ハロアルキルであり、より好ましくはアルキルであり、特に好ましくはメチルである。pは好ましくは0~6のいずれかの整数であり、より好ましくは0~2のいずれかの整数である。X3は、好ましくは、アルキレン、アルケニレンまたはアルキニレンであり、より好ましくはアルキレンであり、特に好ましくは、メチレン、エチレンまたはプロピレンである。
R5は、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキルオキシ、置換若しくは非置換のアルケニルオキシ、置換若しくは非置換の芳香族炭素環式基カルボニル、置換若しくは非置換の非芳香族炭素環式基カルボニル、置換若しくは非置換の芳香族複素環式基カルボニル、置換若しくは非置換の非芳香族複素環式基カルボニルまたは置換若しくは非置換の非芳香族炭素環カルバモイルもさらに好ましい。
R5は、R1とR7が隣接する原子と一緒になって環Aを形成しない場合、特に好ましくは以下に示される基である。
Yは、アルキレンもより好ましい。
Zが-NR72-、-CO-NR72-、または-SO2-NR72-の場合は、R71とR72が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い
ここで、Zは、好ましくは、単結合、-O-、-NR72-、-SO2-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-、または-SO2-NR72-であり、より好ましくは、単結合、-NR72-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NH-、-NR72-SO2-、または-SO2-NR72-であり、さらに好ましくは、単結合、-NR72-、-NR72-CO-、-NR72-CO-O-、-NR72-CO-NH-、または-NR72-SO2-である。R71は、好ましくは、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、または置換若しくは非置換の非芳香族炭素環式基であり、特に好ましくは、水素原子、メチル、エチル、プロピル、イソプロピル、ブチル、ペンチル、ヘキシル、1~3個のハロゲンで置換されたアルキル(例えば、トリフルオロメチル)、シクロアルキル、またはフェニルである。R72は、好ましくは、水素原子または置換若しくは非置換のアルキルであり、より好ましくは、水素原子またはメチルである。R73は、好ましくは、水素原子である。
R7は、さらに好ましくは、-Z-R71(Zは、単結合、-O-、-NR72-、-SO2-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-、または-SO2-NR72-であり、R71は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、または置換若しくは非置換の非芳香族炭素環式基であり、R72およびR73は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニル)であり、特に好ましくは、-Z-R71(Zは、単結合、-NR72-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NH-、-NR72-SO2-、または-SO2-NR72-であり、R71は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、または置換若しくは非置換の非芳香族炭素環式基であり、R72が水素原子または置換若しくは非置換のアルキル)であり、最も好ましくは、-Z-R71(Zは、単結合、-NR72-、-NR72-CO-、-NR72-CO-O-、-NR72-CO-NH-、または-NR72-SO2-であり、R71は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、または置換若しくは非置換の非芳香族炭素環式基であり、R72が水素原子または置換若しくは非置換のアルキル)である。
また、Zは、好ましくは、-O-、-SO2-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-、または-SO2-NR72-であり、より好ましくは、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NH-、-NR72-SO2-、または-SO2-NR72-であり、さらに好ましくは、-NR72-CO-、-NR72-CO-O-、-NR72-CO-NH-、または-NR72-SO2-である。
ここで、R71は、好ましくは、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基または置換若しくは非置換の非芳香族炭素環式基である。置換若しくは非置換のアルケニル、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基も好ましい。
環Aは、好ましくは、芳香族炭素環、非芳香族炭素環、芳香族複素環、または非芳香族複素環であり、より好ましくは、芳香族複素環または非芳香族複素環である。また、5員環または6員環であるのが好ましい。さらに好ましくは、5員環または6員環の芳香族複素環または非芳香族複素環であり、特に好ましくは、チアゾール、オキサゾール、イミダゾール、チアジアゾール、オキサジアゾール、トリアゾール、フラン、チオフェン、ピロール、イソチアゾール、イソキサゾール、ピラゾール、ピリジン、ピリダジン、ピリミジン、ピラジン、テトラヒドロピラン、チアン、ピペリジン、モルホリン、チオモルホリン、ピペラジン、ジオキサン、ヘキサヒドロピリミジン、テトラヒドロフラン、テトラヒドロチオフェン、ピロリジン、ジオキソラン、オキサゾリン、チアゾリジン、イミダゾリン、イソチアゾリジン、またはチアジアゾリジンであり、最も好ましくは、チアゾール、イミダゾール、ピロール、ピリジン、ピロリジン、ジオキソラン、オキサゾリン、イミダゾリン、テトラヒドロピラン、ピペリジン、モルホリン、チオモルホリン、ジオキサン、ピペラジン、またはヘキサヒドロピリミジンである。
環Aが母核のベンゼン環と縮合している部分の2つの原子は炭素原子である。
ここで、XAは、好ましくは、単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、-O-CO-、-CO-O-、-NRA2-CO-、-CO-NRA2-、-NRA2-CO-O-、-CO-O-NRA2-、-O-CO-NRA2-、-NRA2-O-CO-、-CO-NRA2-O-、-O-NRA2-CO-、-NRA2-CO-NRA3-、-NRA2-SO2-、または-SO2-NRA2-であり、より好ましくは、単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、-NRA2-CO-、-CO-NRA2-、-NRA2-CO-NRA3-、-NRA2-SO2-、または-SO2-NRA2-、であり、さらに好ましくは、単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、-NRA2-CO-、-CO-NRA2-、または-NRA2-CO-NRA3-である。
RA1は、好ましくは、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基であり、より好ましくは、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基であり、さらに好ましくは、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換の芳香族炭素環式基または置換若しくは非置換の非芳香族炭素環式基である。 RA2およびRA3は、それぞれ独立して、好ましくは、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニルであり、XAが-NRA2-、-CO-NRA2-、-CO-O-NRA2-、-O-CO-NRA2-、または-SO2-NRA2-の場合は、RA1とRA2が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良く、より好ましくは、水素原子または置換若しくは非置換のアルキルである。
RAは、特に好ましくは、置換若しくは非置換の炭素数1~4のアルキル(例:メチル、ベンジル)、置換若しくは非置換の炭素数1~4のアルケニル、置換若しくは非置換の炭素数1~4のアルキルスルホニル、置換若しくは非置換の炭素数1~4のアルキルカルボニル、置換若しくは非置換の炭素数1~4のモノアルキルカルバモイル、置換若しくは非置換の炭素数1~4のモノアルキルカルボニルアミノ、置換若しくは非置換の炭素数1~4のアルキルカルバモイルアミノ、ヒドロキシ、アミノ、オキソ、置換若しくは非置換の芳香族炭素環スルホニル、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイルまたは置換若しくは非置換の芳香族炭素環カルボニルアミノである。該芳香族炭素環は、ベンゼンまたはナフタレンが好ましい。該非芳香族炭素環はシクロアルキルが好ましい。
但し、R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニルの場合は、Yは単結合である。
1)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
2)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
3)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
4)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
5)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
6)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
7)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
8)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
9)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
10)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
11)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
12)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、水素原子であり、R72が水素原子)である化合物。
13)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
14)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
15)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
16)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
17)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
18)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
19)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
20)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
21)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
22)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
23)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
24)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
25)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
26)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
27)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
28)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
29)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
30)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
31)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
32)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
33)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
34)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
35)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
36)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
38)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
39)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
40)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
41)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
42)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
43)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
44)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
45)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
46)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
47)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
48)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、水素原子であり、R72が水素原子)である化合物。
49)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
50)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
51)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
52)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
53)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
54)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
55)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
56)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
57)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
58)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
59)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
60)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
61)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
62)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
63)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
64)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
65)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
66)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
67)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
68)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
69)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
70)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
71)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
72)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
74)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
75)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
76)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
77)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
78)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
79)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
80)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
81)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
82)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
83)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
84)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、水素原子であり、R72が水素原子)である化合物。
85)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
86)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
87)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
88)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
89)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
90)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
91)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
92)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
93)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
94)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
95)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
96)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
97)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
98)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
99)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
100)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
101)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
102)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
103)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
104)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
105)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
106)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
107)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
108)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-O-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
110)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
111)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
112)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
113)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
114)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
115)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
116)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
117)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
118)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
119)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
120)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、水素原子であり、R72が水素原子)である化合物。
121)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
122)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
123)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
124)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
125)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
126)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
127)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
128)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
129)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
130)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
131)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
132)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
133)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
134)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
135)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
136)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
137)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
138)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
139)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
140)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
141)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
142)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
143)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
144)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-CO-NH-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
146)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
147)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
148)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
149)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
150)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
151)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
152)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
153)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
154)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
155)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
156)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、水素原子であり、R72が水素原子)である化合物。
157)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
158)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
159)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
160)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
161)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
162)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
163)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
164)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
165)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
166)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
167)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
168)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が水素原子)である化合物。
169)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
170)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
171)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
172)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
173)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
174)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
175)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
176)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
177)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
178)R1が水素原子であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
179)R1がハロゲンであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
180)R1が置換若しくは非置換のアルキルであり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルであり、R7が-Z-R71(Zは、-NR72-SO2-であり、R71は、置換若しくは非置換のアルキルであり、R72が置換若しくは非置換のアルキル)である化合物。
201)環Aが芳香族複素環であり、mが0であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
202)環Aが芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
203)環Aが芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
204)環Aが芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
205)環Aが芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
206)環Aが非芳香族複素環であり、mが0であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
207)環Aが非芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
208)環Aが非芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
209)環Aが非芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
210)環Aが非芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
212)環Aが芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
213)環Aが芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
214)環Aが芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
215)環Aが芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
216)環Aが非芳香族複素環であり、mが0であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
217)環Aが非芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
218)環Aが非芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
219)環Aが非芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
220)環Aが非芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族炭素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
222)環Aが芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
223)環Aが芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
224)環Aが芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
225)環Aが芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
226)環Aが非芳香族複素環であり、mが0であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
227)環Aが非芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
228)環Aが非芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
229)環Aが非芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
230)環Aが非芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
232)環Aが芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
233)環Aが芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
234)環Aが芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
235)環Aが芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
236)環Aが非芳香族複素環であり、mが0であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
237)環Aが非芳香族複素環であり、mが1であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
238)環Aが非芳香族複素環であり、mが2であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
239)環Aが非芳香族複素環であり、mが3であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
240)環Aが非芳香族複素環であり、mが4であり、R2が置換若しくは非置換のアルキルオキシであり、nが1であり、R3が置換若しくは非置換の非芳香族複素環式基であり、R4が水素原子であり、R5が置換若しくは非置換の芳香族炭素環式基であり、Yが単結合であり、R6が置換若しくは非置換のアルキルである化合物。
(1)主骨格であるベンゼン環上に、少なくとも一つの環式基(R3)が置換しており、
(2)同ベンゼン環上に、-C(R2)nCOOR4で(n=1、2)示される側鎖を有する、
HIV複製阻害作用を有する点である。
本発明に係る式(I)で示される化合物は、例えば、下記に示す一般的合成法によって製造することができる。また、抽出、精製等は、通常の有機化学の実験で行う処理を行えばよい。
本発明の化合物の合成は、当該分野において公知の手法を参酌しながら実施することができる。
(式中、R6は前記と同意義。L1は置換若しくは非置換のアルキル)
第1工程
市販もしくは公知の方法によって合成した化合物a1を、塩化メチレン、ジクロロエタン等の溶媒中、塩化アルミニウムなどのルイス酸存在下、アセチルクロライドや無水酢酸などの酸ハライドもしくは酸無水物と、0℃~150℃、好ましくは60℃~120℃で、1時間~48時間、好ましくは12時間~24時間、フリーデル・クラフツ・アシル化反応させることにより、化合物a2を得ることができる。
第2工程
硫酸と硝酸の混酸中において、化合物a2を-30℃~100℃、好ましくは0℃~50℃で、0.5時間~48時間、好ましくは6時間~24時間反応させることにより、化合物a3を得ることができる。
第3工程
L1OH中において、化合物a3に濃硫酸や濃塩酸等の酸を加え、0℃~150℃、好ましくは80℃~110℃で、1時間~24時間、好ましくは6時間~12時間反応させることにより、化合物a4を得ることができる。
(式中、R3、R5、R6、Y、およびL1は前記と同意義。RAは置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。L2はボロン酸、ボロン酸エステル、アルキルスズ、ハロゲン化亜鉛など。)
第4工程
化合物a4とRA-L2とのカップリング反応により、化合物a5、a6、a7を得ることができる。該反応としては、鈴木クロスカップリング、Ullmannクロスカップリング、根岸クロスカップリング、Stilleカップリング等が例示される。
ジオキサン、DMF、DME、THF、水等の溶媒あるいは混合溶媒中において、化合物a4にPd(PPh3)4、Pd(OAc)2、Pd(PPh3)2Cl2、Pd(dppf)2Cl2等のパラジウム触媒と、炭酸カリウム、炭酸ナトリウム、リン酸カリウム等の塩基と、市販もしくは公知の方法によって合成したボロン酸、ボロン酸エステル、アルキルスズ、ハロゲン化亜鉛を加え、窒素雰囲気下にて、0℃~150℃、好ましくは60℃~120℃で、0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物a5、a6、a7(R3=R5=RA、Yは単結合)を得ることができる。
第5工程
化合物a5より、第4工程と同様の方法で、化合物a7(R3=RA)を得ることができる。
第6工程
化合物a6より、第4工程と同様の方法で、化合物a7(R5=RA、Yは単結合)を得ることができる。
(式中、R1、R3、R4、R5、R6、Y、およびL1は前記と同意義。R2’は置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニル。L3はハロゲン。)
第7工程
塩化メチレン、ジクロロエタン、テトラヒドロフラン等の溶媒中において、化合物a7に水素化ジイソブチルアルミニウムのトルエン溶液または水素化アルミニウムリチウムのテトラヒドロフラン溶液を加え、-100℃~50℃、好ましくは-60℃~0℃で、0.5時間~10時間、好ましくは1時間~3時間反応させ還元することにより、化合物a8を得ることができる。
第8工程
塩化メチレン、アセトン、DMSO等の溶媒中において、化合物a8にDess-Martin試薬、二酸化マンガン、三酸化硫黄ピリジン等の酸化剤を加え、-20℃~50℃、好ましくは0℃~30℃で、0.5時間~10時間、好ましくは1時間~3時間反応させ、酸化することにより、化合物a9を得ることができる。
第9工程
塩化メチレン,ジクロロエタン,トルエン等の溶媒中において、化合物a9にヨウ化亜鉛及びTMSCNを加え、-20℃~50℃、好ましくは0℃~30℃で、0.1時間~10時間、好ましくは0.5時間~2時間反応させることにより、化合物a10を得ることができる。
第10工程
R4OH中において、化合物a10に濃硫酸や濃塩酸等の酸を加え、0℃~150℃、好ましくは80℃~110℃で、1時間~24時間、好ましくは6時間~12時間反応させ、TMS基の脱保護、ニトリル基のカルボン酸への加水分解、引き続きエステル化することにより、化合物a11を得ることができる。
第11工程
THF、DMF、トルエン等の溶媒中において、化合物a11に水素化ナトリウム、カリウムtert-ブトキシド、ナトリウムメトキシド等の塩基とR2’-I、R2’-Br、R2’-Clなどを加え、-20℃~100℃、好ましくは0℃~60℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物a12を得ることができる。
また、tert-ブチルエステル等は、酢酸tert-ブチル中において、70%過塩素酸水溶液を1~3当量加え、0℃~60℃、好ましくは15℃~30℃で、0.1時間~10時間、好ましくは0.5時間~2時間反応させることによっても得ることができる。
第12工程
メタノール、エタノール、THFや酢酸エチル等の溶媒中において、化合物a12に5%または10%パラジウム炭素、水酸化パラジウムや二酸化白金等の触媒を加え,0℃~50℃、好ましくは15℃~25℃、0.1時間~48時間、好ましくは1時間~24時間、水素雰囲気下にて反応させることよって化合物a13を得ることができる。
本条件において、酢酸あるいは塩酸等を添加することにより、反応が促進される場合がある。メタノール、エタノール、THF等の有機溶媒と水との混合溶媒中において、塩酸または酢酸酸性下、水酸化カリウムまたは水酸化ナトリウムアルカリ性下、または塩化アンモニウム中性下にて、化合物a12に鉄、亜鉛やスズ等の金属を加え、0℃~120℃、好ましくは、25℃~80℃、0.1時間~24時間、好ましくは1時間~12時間反応させることによっても、化合物a13を得ることができる。
第13工程
ジクロロメタン、THF、トルエン、アセトニトリルやDMF等の溶媒中において、化合物a13に臭素やNBS、NCS、NISなどのハロゲン化試薬を加え、L3がブロモの場合、-30℃~50℃、好ましくは-10℃~20℃、0.1時間~10時間、好ましくは0.5時間~2時間反応することによって、化合物a14を得ることができる。
L3がクロロまたはヨードの場合、10℃~150℃、好ましくは60℃~120℃、0.5時間~24時間、好ましくは1時間~6時間反応することによって、化合物a14を得ることができる。
第14工程
化合物a14より、第4工程と同様の方法で、化合物A-1を得ることができる。
第15工程
メタノール、エタノール、THF、DMSO等の溶媒中において、化合物A-1に水酸化カリウム、水酸化ナトリウム、水酸化リチウム等を加え,0℃~100℃、好ましくは20℃~50℃で、0.1時間~24時間、好ましくは1時間~6時間反応させることにより、化合物A-2を得ることができる。
メタノール、エタノール、THF、DMSO等の溶媒中において、化合物A-1に塩酸やTFA等を加え、0℃~100℃、好ましくは20℃~50℃で、0.1時間~24時間、好ましくは1時間~6時間反応させることにより、化合物A-2を得ることもできる。
(式中、R1、R2’、R3、R4、R5、R6、Y、およびL1は前記と同意義。L4はハロゲン。L5はハロゲン。)
第16工程
市販もしくは公知の方法によって合成した化合物a15を、濃硫酸または酢酸等の溶媒中において、硝酸または発煙硝酸等を氷冷下にて加え、-20℃~60℃、好ましくは0℃~25℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、ニトロ化合物を得ることができる。この化合物を塩化チオニル及びオキシ塩化りん等の溶媒中において、20℃~120℃、好ましくは80℃~100℃で、0.5時間~6時間、好ましくは1時間~3時間反応させ、溶媒を減圧濃縮することにより、粗酸塩化物を得ることができる。引き続き、L1OH溶媒中において、20℃~120℃、好ましくは50℃~80℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a16を得ることができる。
第17工程
化合物a16より、第4工程と同様の方法で、化合物a17を得ることができる。
第18工程
化合物a17より、第12工程と同様の方法で、化合物a18を得ることができる。
第19工程
化合物a18より、第13工程と同様の方法で、化合物a19を得ることができる。
第20工程
化合物a19より、第4工程と同様の方法で、化合物a20を得ることができる。
第21工程
化合物a20より、第13工程と同様の方法で、化合物a21を得ることができる。
第22工程
化合物a21より、第4工程と同様の方法で、化合物a22を得ることができる。
第23工程
化合物a22より、第7~11工程と同様の方法で、化合物A-1を得ることができる。
第24工程
THF、DMSO等の溶媒中において、化合物a20にtert-ブチルオキシカルボニル化試薬またはトリフルオロアセチルクロリド、トリフルオロ酢酸無水物等のトリフルオロアセチル化試薬などのアミノ基保護試薬、およびトリエチルアミン、N-メチルモルホリン等の塩基を加え,0℃~100℃、好ましくは20℃~50℃で、0.1時間~24時間、好ましくは1時間~6時間反応させることにより、アミノ基保護体である化合物a23を得ることができる。
第25工程
化合物a23より、第7工程~第11工程と同様の方法で反応させた後、第13工程と同様の方法で、化合物a24を得ることができる。
第26工程
化合物a24より、第4工程と同様の方法で、化合物A-1を得ることができる。
(式中、R1、R2’、R3、R4、R5、R6、およびYは前記と同意義。L8はハロゲン。L9はハロゲン。)
第27工程
市販もしくは公知の方法によって合成した化合物a25より、第13工程と同様の方法で、化合物a26を得ることができる。
第28工程
濃硫酸または酢酸等の溶媒中において、化合物a26に硝酸または発煙硝酸等を氷冷下にて加え、-20℃~60℃、好ましくは0℃~25℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a27を得ることができる。
第29工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物a27にトリtert-ブチルホスフィン、トリシクロヘキシルホスフィン、トリフェニルホスフィンなどのホスフィンとジベンジリデンアセトンパラジウム、酢酸パラジウム、ジクロロビストリフェニルホスフィンパラジウムなどの触媒とフッ化亜鉛と別途調製したシリルエノールエーテル(a28)を加え、30℃~130℃、好ましくは50℃~150℃で、0.1時間~6時間、好ましくは0.5時間~1時間で反応させることにより、化合物a29を得ることができる。
第30工程
ジクロロメタン、1,2-ジクロロエタン、テトラヒドロフランなどの溶媒中、またはそれらの混合溶媒中、化合物a29にピリジン、ルチジン、トリエチルアミンなどの塩基とトリフルオロメタンスルホン酸無水物、comin’s試薬などのトリフルオロメタンスルホニル化剤を加え、-50℃~50℃、好ましくは-30℃~30℃で、0.1時間~4時間、好ましくは0.5時間~1時間で反応させることにより、化合物a30を得ることができる。
第31工程
化合物a30より、第4工程と同様の方法で、化合物a31を得ることができる。
第32工程
化合物a31より、第12工程と同様の方法で、化合物a32を得ることができる。
第33工程
化合物a32より、第13工程と同様の方法で、化合物a33を得ることができる。
第34工程
化合物a33より、第4工程と同様の方法で、化合物A-1を得ることができる。
(式中、各定義は前記と同意義。)
第35工程
ジオキサン、DMF、DME、THF、アセトン、アセトニトリル等の溶媒中、化合物a26に炭酸カリウム、炭酸ナトリウムなどの塩基とベンジルブロマイドまたはベンジルクロライドを加え、0℃~100℃、好ましくは20℃~50℃で、0.5時間~24時間、好ましくは1時間~5時間反応させることにより、化合物a34を得ることができる。
第36工程
ジエチルエーテルまたはTHF等の溶媒中、化合物a34を公知の方法でL8を金属マグネシウムやn-ブチルリチウムによってグリニャール試薬やリチウム化合物に変換し、ジメチルホルムアミド、N-ホルミルピペリジンやN-ホルミルモルホリン等の試薬を加え、-20℃~50℃、好ましくは0℃~20℃で0.5時間~6時間、好ましくは1時間~3時間反応させることによって、化合物a35を得ることができる。
第37工程
化合物a35より、第9工程と同様の方法で、化合物a36を得ることができる。
第38工程
化合物a36より、第10工程と同様の方法で、化合物a37を得ることができる。
第39工程
化合物a37より、第11工程と同様の方法で、化合物a29を得ることができる。
(式中、各定義は前記と同意義。)
第40工程
市販もしくは公知の方法によって合成した化合物a28-1を、THF、ジエチルエーテル、ジオキサン等の溶媒中、またはそれらの混合溶媒中、R2’OHと、水素化ナトリウム、水素化リチウム、水素化カリウムなどの金属試薬を加え、20℃~120℃、好ましくは40℃から100℃で、0.1時間~12時間、好ましくは0.5時間~6時間反応させることにより、化合物a28-2を得ることができる。
第41工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物a28-2に炭酸カリウム、炭酸ナトリウム、リン酸カリウムなどの塩基、およびヨウ化アルキル、臭化アルキル、硫酸アルキルなどのアルキル化剤を加え、-30℃~70℃、好ましくは-10℃~50℃で、0.1時間~5時間、好ましくは、0.5時間~1時間反応させることにより、化合物a28-3を得ることができる。
第42工程
THF、ジエチルエーテル、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物a28-3にカリウムヘキサメチルジシラジド、リチウムヘキサメチルジシラジド、リチウムジイソプロピルアミドなどの塩基とTMSCl、TMSOTfなどのシリル化剤を加え、-130℃~-20℃、好ましくは-110℃から-50℃で、0.1時間~5時間、好ましくは、0.5時間~1時間反応させることにより、化合物a28を得ることができる。
(式中、各定義は前記と同意義。)
第43工程
ジクロロメタン、トルエン、ジクロロエタン等の溶媒中、またはそれらの混合溶媒中、化合物a28-2にオキサリルクロライド、チオニルクロライドなどの試薬とオキサゾリジノン(a28-4)を加え、-50℃~50℃、好ましくは-30℃~30℃で、0.1時間~4時間、好ましくは0.5時間~1時間で反応させることにより、化合物a28-5を得ることができる。
第44工程
化合物a28-5より、第42工程と同様の方法で、化合物a28’を得ることができる。
(式中、各定義は前記と同意義。)
第45工程
化合物a28’より、第29工程と同様の方法で、化合物a28-6を得ることができる。
第46工程
テトラヒドロフラン-水混合溶媒中、化合物a28-6に過酸化水素水と水酸化リチウム水溶液の混合液を加え、-20℃~10℃、好ましくは-10℃~10℃で、0.1時間~5時間、好ましくは0.1時間~1時間反応させてカルボン酸体を得た後に、精製せずそのまま、R4N2/ジエチルエーテル溶液等を添加してエステル化することにより、化合物a29を得ることができる。
(式中、各定義は前記と同意義。)
第47工程
化合物a16より、第7工程と同様の方法で、化合物a38を得ることができる。
第48工程
化合物a38より、第8工程と同様の方法で、化合物a39を得ることができる。
第49工程
化合物a39より、第9工程と同様の方法で、化合物a40を得ることができる。
第50工程
化合物a40より、第10工程と同様の方法で、化合物a41を得ることができる。
第51工程
ジクロロメタン、ジクロロエタン、クロロホルム等の溶媒中、化合物a41にデスマーチン試薬や二酸化マンガン等の酸化剤を加え、0℃~80℃、好ましくは20℃~45℃で、0.5時間~5時間、好ましくは1時間~3時間反応させることにより、化合物a42を得ることができる。
第52工程
ベンゼン、トルエン、キシレン等の溶媒中、化合物a42に不斉源として(R)-CBS試薬を加え、カテコールボランや9-ボラビシクロ[3.3.1]ノナン等の還元剤を順次加え、-50℃~0℃、好ましくは-35℃~-10℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a43を得ることができる。
第53工程
化合物a43より、第11工程と同様の方法で、化合物a44を得ることができる。
(式中、R1、R2’、R3、R4、R5、R6、Y、L3、およびL7は前記と同意義。L10はハロゲン。L11はハロゲン。)
第54工程
化合物a44より、第17工程と同様の方法で、化合物a45を得ることができる。
第55工程
化合物a45より、第18工程と同様の方法で、化合物a46を得ることができる。
第56工程
化合物a46より、第19工程と同様の方法で、化合物a47およびa49を得ることができる。
第57工程
化合物a47より、第20工程と同様の方法で、化合物a48を得ることができる。
第58工程
化合物a48より、第21工程と同様の方法で、化合物a24を得ることができる。
第59工程
化合物a49より、第20工程と同様の方法で、化合物a13を得ることができる。
(式中、各定義は前記と同意義。)
第60工程
化合物a4より、第47工程~第53工程と同様の方法で、化合物a50を得ることができる。
第61程
化合物a50より、第4工程~第6工程と同様の方法で、化合物a11を得ることができる。
(式中、各定義は前記と同意義。)
第62工程
化合物a41より、第11工程と同様の方法で、化合物a51を得ることができる。
第63工程
化合物a51より、第15工程と同様の方法で、化合物a52を得ることができる。
第64工程
化合物a53は、化合物a52をR-(+)-4-ベンジル-2-オキサゾリジノン(化合物(A))のようなエナンチオピュアなキラル補助化合物と縮合してジアステレオマー混合物を生成し、シリカゲルカラムクロマトグラフィーで分離することにより合成することができる。
即ち、化合物a52を無水ジクロロメタン、無水クロロホルム、無水THFなどの溶媒に溶解後、少量の無水DMFを添加し、-30℃~50℃、好ましくは-10℃~20℃で、塩化チオニル、オキザリルクロリドなどのクロロ化試薬を滴下する。その後、-30℃~50℃、好ましくは-10℃~20℃で、0.1時間~10時間、好ましくは0.5時間~2時間攪拌したのち濃縮して得られる泡沫状固体を、無水テトラヒドロフランや無水ジクロロメタン等に溶解する。化合物(A)の無水テトラヒドロフランや無水ジクロロメタン等の溶液を、-100℃~-30℃、好ましくは-80℃~-60℃で攪拌し、n-BuLi/ヘキサン溶液を加え、-100℃~-30℃、好ましくは-80℃~-60℃で0.1時間~1時間、好ましくは0.1時間~0.5時間攪拌し、さらに-20℃~60℃、好ましくは0℃~30℃で、0.1時間~5時間、好ましくは0.1時間~2時間攪拌する。その後、上記調製した酸塩化物溶液と-60℃~-10℃、好ましくは-40℃~-20℃で混合させ-10℃~60℃、好ましくは10℃~30℃まで昇温させる。反応終了後、飽和塩化アンモニウム水溶液でクエンチし、ジクロロメタンで抽出後、シリカゲルクロマトグラフィーで分離精製することにより化合物a53を得ることができる。
第65工程
テトラヒドロフラン-水混合溶媒中、化合物a53に過酸化水素水と水酸化リチウム水溶液の混合液を加え、-20℃~10℃、好ましくは-10℃~10℃で反応させてカルボン酸体を得た後に、ジアゾメタン/ジエチルエーテル溶液等でエステル化することにより、化合物a44を得ることができる。
(式中、各定義は前記と同意義。)
第66工程
市販または公知の方法により調整した化合物a29-1を、濃硫酸または酢酸等の溶媒中において、硝酸、発煙硝酸等を氷冷下にて加え、-20℃~60℃、好ましくは0℃~25℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a29-2を得ることができる。また、濃硫酸中において、硝酸カリウム、硝酸ナトリウム等の金属塩を氷冷下にて加え、-20℃~60℃、好ましくは0℃~25℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることによっても得ることができる。
第67工程
ジクロロメタン、ジクロロエタン、トルエン等の溶媒中において、化合物a29-2にヨウ化亜鉛及びTMSCNを加え、-20℃~50℃、好ましくは0℃~30℃で、0.1時間~10時間、好ましくは0.5時間~2時間反応させることにより、化合物a29-3を得ることができる。また、アセトニトリルやDMF等の溶媒中において、ヨウ化亜鉛、TMSCl、シアン化ナトリウム、シアン化カリウム等の金属塩を、-20℃~50℃、好ましくは0℃~30℃で、0.1時間~10時間、好ましくは0.5時間~2時間反応させることによっても得ることができる。
第68工程
化合物a29-3のR4OH中において、濃硫酸、濃塩酸等の酸を加え、0℃~150℃、好ましくは80℃~110℃で、1時間~24時間、好ましくは6時間~12時間反応させることにより、TMS基の脱保護、ニトリル基のカルボン酸への加水分解、引き続きエステル化することにより、化合物1-4を得ることができる。
第69工程
DMF、DME、テトラヒドロフラン、アセトン、アセトニトリル等の溶媒中において、化合物a29-4に炭酸カリウム、炭酸ナトリウム、炭酸セシウム、水素化ナトリウム等の塩基、およびベンジルブロマイドまたはベンジルクロライドを加え、0℃~100℃、好ましくは20℃~50℃で、0.5時間~24時間、好ましくは1時間~5時間反応させることにより、化合物a29-5を得ることができる。また、テトラヒドロフラン、トルエンやジクロロメタン等の溶媒中、アゾジカルボン酸ジエチルやアゾジカルボン酸ジイソプロピルとベンジルアルコールを加え、0℃~100℃、好ましくは20℃~50℃で、0.5時間~24時間、好ましくは1時間~5時間反応させることによっても得ることができる。
第70工程
化合物a29-5のジクロロメタン、ジクロロエタン、クロロホルム等の溶媒中において、デスマーチン試薬、二酸化マンガン、クロロクロム酸ピリジニウム等の酸化剤を加え、0℃~80℃、好ましくは20℃~45℃で、0.5時間~5時間、好ましくは1時間~3時間反応させることにより、化合物a29-6を得ることができる。また、一般的なSwern酸化によっても得ることができる。
第71工程
化合物a29-6のベンゼン、トルエン、キシレン、ジクロロメタン、ジクロロエタン等の溶媒中において、不斉源として(R)-CBS試薬を加え、カテコールボランや9-ボラビシクロ[3.3.1]ノナン等の還元剤を順次加え、-100℃~0℃、好ましくは-78℃~-50℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a29-7を得ることができる。
第72工程
テトラヒドロフラン、DMF、トルエン等の溶媒中において、化合物a29-7に水素化ナトリウム、カリウムtert-ブトキシド、ナトリウムメトキシド等の塩基と市販または公知の方法により調整したR2’-I、R2’-Br、R2’-Cl等を加え、-20℃~100℃、好ましくは0℃~60℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物a29-8を得ることができる。
また、tert-ブチルエステル等は、酢酸tert-ブチル中において、70%過塩素酸水溶液を1~3当量加え、0℃~60℃、好ましくは15℃~30℃で、0.1時間~10時間、好ましくは0.5時間~2時間反応させることによっても得ることができる。
第73工程
メタノール、エタノール、テトラヒドロフラン等の溶媒中において、化合物a29-8に5%または10%パラジウムカーボン、水酸化パラジウム、二酸化白金等の触媒を加え、水素雰囲気下、0℃~60℃、好ましくは20℃~40℃で、0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物a29を得ることができる。
また、ジクロロメタン、ジクロロエタン、クロロホルム等の溶媒中において、トリブロモホウ素、トリメチルシリルヨーダイドを加え、-20℃~100℃、好ましくは0℃~30℃で、1時間~24時間、好ましくは3時間~12時間反応させることによっても得ることができる。
(式中、各定義は前記と同意義。)
第1工程
塩化メチレン、トルエン、THF等の溶媒中において、化合物a8に三臭化リン、臭化チオニル等を加え、-20℃~120℃、好ましくは0℃~60℃で、0.1時間~12時間、好ましくは1時間~4時間反応させることにより、化合物a54を得ることができる。
第2工程
DMF、DMSO、ジオキサン、トルエン等の溶媒中において、化合物a54にPd(PPh3)4、Pd(OAc)2、Pd(PPh3)2Cl2、PdCl2(dppf)2等のパラジウム触媒と、トリエチルアミンやN-メチルモルホリン等の塩基と、R4OHを加え、一酸化炭素雰囲気下にて、0℃~150℃、好ましくは50℃~100℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物a55を得ることができる。
第3工程
THF、ジエチルエーテル、トルエン等の溶媒中において、化合物a55にリチウムジイソプロピルアミド、カリウムヘキサメチルジシラジド、リチウムヘキサメチルジシラジド、ナトリウムヘキサメチルジシラジド等の塩基と、R2-I、R2-Br、R2-Cl等を加え、-70℃~50℃、好ましくは-20℃~20℃で、1時間~24時間、好ましくは3時間~10時間反応させることにより、化合物a56を得ることができる。
第4工程
化合物a56より、前述の「1)化合物A-1およびA-2の合成」における第12~14工程と同様の方法で、化合物A-3を得ることができる。
第5工程
化合物A-3より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-4を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5aおよびR5a’はそれぞれ独立して置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。ここで、R5aとR5a’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第1工程
DMF、DMSO、ジオキサン、トルエン等の溶媒中において、化合物a30にPd(PPh3)4、Pd(OAc)2、 Pd(PPh3)2Cl2、PdCl2(dppf)2等のパラジウム触媒、トリエチルアミンやN-メチルモルホリン等の塩基、さらにアリルアルコールを加え、一酸化炭素雰囲気下にて、0℃~150℃好ましくは50℃~100℃で、1時間~24時間好ましくは3時間~12時間反応させることにより、アリルエステル体を合成することができる。その後、エタノール、MeCN、THF等の溶媒中、モルホリンあるいはピロリジン等を加えて、Pd(Ph3P)4存在下、0℃~100℃好ましくは25℃~75℃で、0.1時間~24時間好ましくは1時間~12時間反応させることにより化合物a57を得ることができる。
第2工程
化合物a57と市販または公知の方法により調製したアミン誘導体(D)を、DMF、DMA、THF、アセトニトリル等あるいはその混合溶媒中、1-ヒドロキシ-7-アザベンゾトリアゾール若しくは1-ヒドロキシベンゾトリアゾールなど、および/またはジシクロヘキシルカルボジイミド若しくはジイソプロピルカルボジイミドなどの縮合剤、ならびにトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリンなどの塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a58を得ることができる。
第3工程
化合物a58より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-5を得ることができる。
第4工程
化合物A-5より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-6を得ることができる。
(式中、R1、R2’、R4、R6は前記と同意義。L17は水素またはフェニル。)
第5工程
ジオキサン、DMF、DME、テトラヒドロフラン、水等の溶媒あるいは混合溶媒中において、化合物a30にPd(PPh3)4、Pd(OAc)2、Pd(PPh3)2Cl2、Pd(dppf)2Cl2、Pd(dtbpf)等のパラジウム触媒と、炭酸カリウム、炭酸ナトリウム、炭酸セシウム、リン酸カリウム等の塩基と、トランスエチニルボロン酸、ビニルボロン酸エステル、ビニルトリアルキルスズ等を加え、窒素雰囲気下にて、0℃~150℃、好ましくは60℃~120℃で、0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物a57-1を得ることができる。
第6工程
ジクロロメタン、メタノールやそれらの混合溶媒中において、化合物a57-1に-100℃~0℃、好ましくは-78℃~-50℃で、0.5時間~6時間、好ましくは1時間~3時間、オゾンガスを通じ、その後、ジメチルスフィド、トリメチルフォスファイト等を加え、同温で、0.1時間~3時間、好ましくは0.5時間~1時間、撹拌することにより、化合物a57-2を得ることができる。
第7工程
アセトン、メチルエチルケトン等の溶媒中において、化合物a57-2に過マンガン酸カリウムを加え、-20℃~50℃、好ましくは0℃~20℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a57を得ることができる。またDMF溶媒中において、ニクロム酸ピリジニウムを加え、0℃~60℃、好ましくは20℃~40℃で、2時間~24時間、好ましくは6時間~12時間反応させることによっても得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5bはアルキル。Qはハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキル、アルケニル、アルキニル、ハロアルキル、ヒドロキシアルキル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルオキシアルキル、アルキルオキシアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環オキシ、非芳香族炭素環オキシ、芳香族複素環オキシ、非芳香族複素環オキシ、芳香族炭素環アミノ、非芳香族炭素環アミノ、芳香族複素環アミノ、非芳香族複素環アミノ、芳香族炭素環カルボニル、非芳香族炭素環カルボニル、芳香族複素環カルボニル、非芳香族複素環カルボニル、芳香族炭素環オキシカルボニル、非芳香族炭素環オキシカルボニル、芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、芳香族炭素環カルボニルアミノ、非芳香族炭素環カルボニルアミノ、芳香族複素環カルボニルアミノ、非芳香族複素環カルボニルアミノ、芳香族炭素環アルキル、非芳香族炭素環アルキル、芳香族複素環アルキル、非芳香族複素環アルキル、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルスルファニル、非芳香族炭素環アルキルスルファニル、芳香族複素環アルキルスルファニル、非芳香族複素環アルキルスルファニル、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルオキシアルキル、非芳香族炭素環アルキルオキシアルキル、芳香族複素環アルキルオキシアルキル、非芳香族複素環アルキルオキシアルキル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、芳香族炭素環スルファニル、非芳香族炭素環スルファニル、芳香族複素環スルファニル、非芳香族複素環スルファニル、非芳香族炭素環スルホニル、芳香族炭素環スルホニル、芳香族複素環スルホニル、または非芳香族複素環スルホニル。)
第1工程
化合物a57と市販または公知の方法により調製したフェニレンジアミン誘導体(a58)を、DMF、DMA、THF、アセトニトリル等、またはその混合溶媒中、1-ヒドロキシ-7-アザベンゾトリアゾール若しくは1-ヒドロキシベンゾトリアゾール、および/またはジシクロヘキシルカルボジイミド若しくはジイソプロピルカルボジイミドなどの縮合剤、ならびにトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリンなどの塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a59を得ることができる。
第2工程
化合物a59を、DMF、DMA、THF、アセトニトリル等、またはその混合溶媒中、水素化ナトリウム、炭酸セシウム等の塩基、および市販もしくは公知の方法により調製したハロゲン化アルキルを加え、20℃~140℃、好ましくは40℃~80℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a60を得ることができる。
第3工程
化合物a60より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-7を得ることができる。
第4工程
化合物A-7より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-8を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5cはアルキル、アルケニル、アルキニル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、または非芳香族複素環式基。)
第1工程
化合物a57より、後述の「30)化合物N-1およびN-2の合成」における第1~6工程と同様の方法で、化合物a61を得ることができる。
第2工程
化合物a61より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-9を得ることができる。
第3工程
化合物A-9より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-10を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5dは置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第1工程
化合物a30より、後述の「31)化合物O-1およびO-2の合成」における第1~5工程と同様の方法で、化合物a62を得ることができる。
第2工程
化合物a62より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-11を得ることができる。
第3工程
化合物A-9より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-12を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5eおよびR5e’はそれぞれ独立して水素原子、ホルミル、カルバモイル、カルボキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキニルカルバモイル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニル、または置換若しくは非置換の非芳香族複素環オキシカルボニル。ここで、R5eとR5e’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第1工程
ジメチルホルムアミド、ジメチルアセトアミド、テトラヒドロフラン、ジオキサンなどの溶媒中、またはそれらの混合溶媒中、化合物a30に炭酸ナトリウム、炭酸カリウム、炭酸セシウム、リン酸カリウムなどの塩基、市販または公知の方法により調製した置換アミンa63、Pd(PPh3)4、Pd(OAc)2、 Pd(PPh3)2Cl2、Pd(dppf)2Cl2、トリス(ジベンジリデンアセトン)ジパラジウムなどのパラジウム触媒、ならびに2,2’-ビス(ジフェニルホスフィノ)-1,1’-ビナフチル、キサントホスなどの配位子を加え、50℃~180℃、好ましくは70℃~150℃で、0.1時間~8時間、好ましくは0.5~2時間で反応させることにより、化合物a64を得ることができる。
第2工程
化合物a64より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-13を得ることができる。
第3工程
化合物A-13より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-14を得ることができる。
(式中、R1、R2’、R3、R4、R51、およびR6は前記と同意義。R5fは置換若しくは非置換のアルキル、置換若しくは非置換ののアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第1工程
DMF、トルエン、ベンゼン等またはそれらと水の混合溶媒中、化合物a57にジフェニルリン酸アジドと、トリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の塩基を加え、20℃~100℃、好ましくは50℃~80℃で、1時間~24時間、好ましくは2時間~6時間反応させた後、水酸化カリウム、水酸化ナトリウム、水酸化リチウム等を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a65を得ることができる。
第2工程
ジクロロメタン、ジクロロエタンやTHF等の溶媒中、化合物a65に塩基としてピリジン、トリエチルアミン、N-メチルモルホリン等を加え、市販もしくは公知の方法によって合成した酸クロライドや酸無水物等のアシル化試薬を順次加え、-20℃~50℃、好ましくは0℃~20℃で、0.1時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a66を得ることができる。
第3工程
THF、ジメチルホルムアミドやジメチルアセトアミド等の溶媒中、化合物a66にソジウムハイドライド、tert-ブトキシカリウムやリチウムジイソプロピルアミド等の塩基を加え、市販もしくは公知の方法で合成したR51-I、R51-Br、R51-Cl等を加え、0℃~50℃、好ましくは20℃~35℃で、0.1時間~3時間、好ましくは0.5時間~1時間反応させることにより、化合物a67を得ることができる。
第4工程
化合物a67より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-15を得ることができる。
第5工程
化合物A-15より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-16を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5gは置換若しくは非置換のアルキル、置換若しくは非置換ののアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。R5g’は水素原子。)
第1工程
トルエン、アセトニトリルやジクロロエタン等の溶媒中、化合物a65に市販もしくは公知の方法で合成したR5g-NCOを加え、25℃~120℃、好ましくは60℃~80℃で、0.5時間~4時間、好ましくは1時間~2時間反応させることにより、化合物a68を得ることができる。
ジクロロメタン、THFやトルエン等の溶媒中、化合物a65にトリエチルアミンやN-メチルモルホリン等の塩基を加え、トリホスゲンと反応させることより系中でイソシアネート体を合成し、反応混合物から取り出すことなく、市販もしくは公知の方法で合成したR5gNH2を加え、0℃~50℃、好ましくは20℃~35℃で、0.1時間~6時間、好ましくは0.5時間~2時間反応させることによっても、化合物a68を得ることができる。
第2工程
化合物a68より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-17を得ることができる。
第3工程
化合物A-17より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-18を得ることができる。
(式中、R1、R2’、R3、R4、R51、およびR6は前記と同意義。R5hは置換若しくは非置換のアルキル、置換若しくは非置換ののアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第1工程
ピリジンやルチジン等の溶媒中、化合物a65に市販もしくは公知の方法で合成した置換スルホニルクロライドを加え、20℃~100℃、好ましくは50℃~70℃で、1時間~24時間、好ましくは、5時間~10時間反応させることにより、化合物a69を得ることができる。
第2工程
ジクロロメタン、THFやジメチルホルムアミド等の溶媒中、化合物a69に炭酸ナトリウム、炭酸カリウムや炭酸セシウム等の塩基を加え、市販もしくは公知の方法で合成したR51-I、R51-Br、R51-Cl等を加え、0℃~80℃、好ましくは25℃~50℃で、1時間~12時間、好ましくは3時間~6時間反応させることにより、化合物a70を得ることができる。
第3工程
化合物a70より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-19を得ることができる。
第4工程
化合物A-19より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-20を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5iおよびR5i’はそれぞれ独立して水素原子、ホルミル、カルバモイル、カルボキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキニルカルバモイル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニル、または置換若しくは非置換の非芳香族複素環オキシカルボニル。ここで、R5iとR5i’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第1工程
ジクロロメタン、THF、ジメチルホルムアミド等の溶媒中、化合物a65に酢酸やトリフルオロ酢酸等の酸を加え、市販もしくは公知の方法で合成したアルデヒドまたはケトンを順次加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは、3時間~12時間攪拌したのち、NaBH4、NaBH3CN、NaBH(OAc)3などの還元剤を加えて、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは、3時間~12時間反応させることにより、化合物a71を得ることができる。
第2工程
化合物a71より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-21を得ることができる。
第3工程
化合物A-21より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-22を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。L13はハロゲン。)
第1工程
アセトニトリル、テトラヒドロフランやジメチルホルムアミド等の溶媒中、化合物a65に亜硝酸tert-ブチルや亜硝酸イソペンチル等のジアゾ化試薬を加え、塩化第二銅、臭化第二銅、ヨウ化第二銅などハロゲン化第二銅を順次加え、0℃~80℃、好ましくは20℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、それぞれ塩化物、臭化物またはヨウ化物として、化合物a72を得ることができる。
第2工程
化合物a72より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-23を得ることができる。
第3工程
化合物A-23より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-24を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
アセトニトリル、ジメチルホルムアミドやジメチルスルホキシド等の溶媒中、化合物a65に亜硝酸tert-ブチルや亜硝酸イソペンチル等のジアゾ化試薬を加え、シアン化第一銅、シアン化ナトリウム、シアン化カリウムなどシアン化物を加え、0℃~100℃、好ましくは40℃~70℃で、1時間~12時間、好ましくは3時間~6時間反応させることにより、化合物a73を得ることができる。
第2工程
化合物a73より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-25を得ることができる。
第3工程
化合物A-25より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-26を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
テトラヒドロフラン、アセトニトリルやジメチルホルムアミド等の溶媒中、化合物a65に亜硝酸tert-ブチルや亜硝酸イソペンチル等のジアゾ化試薬を加え、20℃~100℃、好ましくは50℃~70℃で、0.1時間~6時間、好ましくは1時間~3時間反応させることにより、脱アミン体として、化合物a74を得ることができる。
第2工程
化合物a74より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-27を得ることができる。
第3工程
化合物A-27より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-28を得ることができる。
(式中、R1、R2’、R3、R4、およびR6は前記と同意義。R5jおよびR5j’はそれぞれ独立して置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。ここで、R5jとR5j’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第1工程
化合物a65を、濃塩酸に懸濁させ、公知の方法に従って亜硝酸ナトリウムでジアゾ化した後、亜硫酸と塩化第一銅の酢酸溶液を加え、-20℃~20℃、好ましくは-5℃~10℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、化合物a75を得ることができる。
また、亜硫酸と塩化第一銅の酢酸溶液の代わりに塩化チオニルを用いることによっても同様に化合物a75を得ることができる。
第2工程
化合物a75を、ジクロロメタン、トルエンやテトラヒドロフラン等の溶媒中、トリエチルアミン、N-メチルモルホリンやピリジン等の塩基を加え、市販もしくは公知の方法で合成したアミンを順次加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは2時間~12時間反応させることにより、化合物a76を得ることができる。
第3工程
化合物a76より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-29を得ることができる。
第4工程
化合物A-29より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-30を得ることができる。
(式中、R1、R2’、R3、R4、R6、およびL13は前記と同意義。R5kは置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第1工程
DMF、DMA、THF、ジオキサン等またはその混合溶媒中、化合物a72に市販あるいは公知の方法により調製したR5k-OKまたはR5k-ONaを加え、20℃~200℃、好ましくは50℃~100℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a77を得ることができる。
第2工程
化合物a77より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-31を得ることができる。
第3工程
化合物A-31より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-32を得ることができる。
(式中、R1、R2’、R3、R4、R6、およびL13は前記と同意義。R5mは置換若しくは非置換の芳香族炭素環式基。)
第1工程
ジクロロメタン、テトラヒドロフランやジメチルホルムアミド等の溶媒中、化合物a72に炭酸カリウム、炭酸ナトリウムや炭酸セシウム等の塩基を加え、市販もしくは公知の方法で合成したR5mSHを順次加え、0℃~100℃、好ましくは25℃~60℃で、0.1時間~12時間、好ましくは0.5時間~3時間反応させることにより、化合物a78を得ることができる。
第2工程
ジクロロメタンやクロロホルム等の溶媒中、化合物a78にmCPBAを加え、-20℃~50℃、好ましくは0℃~25℃で、0.1時間~3時間、好ましくは0.5時間~2時間反応させることにより、化合物a79を得ることができる。
また、アセトンやテトラヒドロフラン等の溶媒と水との混合溶媒中、化合物a78にオキソンを加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは3時間~12時間反応させることによっても、化合物a79を得ることができる。
第3工程
化合物a79より、前述の「1)化合物A-1およびA-2の合成」における第32~34工程と同様の方法で、化合物A-33を得ることができる。
第4工程
化合物A-33より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物A-34を得ることができる。
第1工程
ジクロロメタン、ジクロロエタンやTHF等の溶媒中、化合物A-1または化合物A-3に塩基としてピリジン、トリエチルアミン、N-メチルモルホリン等を加え、市販もしくは公知の方法によって合成した酸クロライドや酸無水物等のアシル化試薬を順次加え、-20℃~50℃、好ましくは0℃~20℃で、0.1時間~6時間、好ましくは1時間~3時間反応させることにより、化合物B-1を得ることができる。
第2工程
化合物B-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物B-2を得ることができる。
第3工程
THF、ジメチルホルムアミドやジメチルアセトアミド等の溶媒中、化合物B-1にソジウムハイドライド、tert-ブトキシカリウムやリチウムジイソプロピルアミド等の塩基を加え、市販もしくは公知の方法で合成したR72-I、R72-Br、R72-Cl等を加え、0℃~50℃、好ましくは20℃~35℃で、0.1時間~3時間、好ましくは0.5時間~1時間反応させることにより、化合物B-3を得ることができる。
第4工程
化合物B-3より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物B-4を得ることができる。
(式中、R1、R2’、R3、R4、R5、R6、R71、R72、L2およびL3は前記と同意義。L16は置換または非置換のアルキルスルホニル。)
第5工程
ジクロロメタン、ジクロロエタン、テトラヒドロフランなどの溶媒中、またはそれらの混合溶媒中において、化合物a29にピリジン、ルチジン、トリエチルアミンなどの塩基とトリフルオロメタンスルホニルクロライド、トリフルオロメタンスルホン酸無水物、N―フェニルビストリフルオロメタンスルホンイミド等のトリフルオロメタンスルホニル化試薬またはノナフルオロブタンスルホニルクロライドやノナフルオロブタンスルホン酸無水物等のノナフラート化試薬を加え、-50℃~50℃、好ましくは-30℃~30℃で、0.1時間~4時間、好ましくは0.5時間~1時間で反応させることにより、化合物b1を得ることができる。
第6工程
化合物b1とR5-Y-L2とのカップリング反応により、化合物b2を得ることができる。該反応としては、鈴木クロスカップリング、Ullmannクロスカップリング、根岸クロスカップリング、Stilleカップリング等が例示される。
ジオキサン、DMF、DME、テトラヒドロフラン、水等の溶媒あるいは混合溶媒中において、化合物b1にPd(PPh3)4、Pd(OAc)2、Pd(PPh3)2Cl2、Pd(dppf)2Cl2やPd(dtbpf)等のパラジウム触媒と、炭酸カリウム、炭酸ナトリウム、炭酸セシウムやリン酸カリウム等の塩基と、市販または公知の方法により調整したボロン酸、ボロン酸エステル、アルキルスズやハロゲン化亜鉛を加え、窒素雰囲気下にて、0℃~150℃、好ましくは60℃~120℃で、0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物b2を得ることができる。
第7工程
メタノール、エタノール、酢酸エチル、テトラヒドロフラン等の溶媒中において、化合物b2に5%または10%パラジウムカーボン、水酸化パラジウム、二酸化白金等の触媒を加え、水素雰囲気下、1~10気圧、好ましくは2~5気圧下で、0℃~60℃、好ましくは20℃~40℃で、0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物b3を得ることができる。
また、メタノール、エタノール、テトラヒドロフラン等の有機溶媒と水との混合溶媒中において、塩酸若しくは酢酸酸性下、水酸化カリウム若しくは水酸化ナトリウムアルカリ性下、または塩化アンモニウム中性下にて、化合物b2に鉄、亜鉛、スズ等の金属を加え、0℃~120℃、好ましくは、25℃~80℃、0.1時間~24時間、好ましくは1時間~12時間反応させることによっても、化合物b3を得ることができる。
第8工程
ジクロロメタン、ジクロロエタン、アセトニトリルやDMF等の溶媒中において、化合物b3に、臭素やNBS、NCS、NISなどのハロゲン化試薬を加え、L3がブロモの場合、-30℃~50℃、好ましくは-10℃~20℃、0.1時間~10時間、好ましくは0.5時間~2時間反応することによって化合物b4を得ることができる。L3がクロロまたはヨードの場合、10℃~150℃、好ましくは60℃~120℃、0.5時間~24時間、好ましくは1時間~6時間反応することによって、化合物b4を得ることができる。
第9工程
化合物b4より、第1工程と同様の方法で、化合物b5を得ることができる。
第10工程
化合物b5より、第6工程と同様の方法で、化合物B-1を得ることができる。
第11工程
化合物B-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物B-2を得ることができる。
第12工程
化合物B-1より、第3工程と同様の方法で、化合物B-3を得ることができる。
第13工程
化合物B-3より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物B-4を得ることができる。
(式中、各定義は前記と同意義。)
第14工程
メタノール、エタノール、酢酸エチル、テトラヒドロフラン等の溶媒中において、化合物b1にトリエチルアミン、N-メチルモルホリン、DIEA等の塩基と5%または10%パラジウムカーボン、水酸化パラジウム、二酸化白金等の触媒を加え、水素雰囲気下、1~10気圧、好ましくは2~5気圧下で、0℃~60℃、好ましくは20℃~40℃で、0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物b6を得ることができる。
また、トルエン、DMF、ジオキサン等の溶媒中において、化合物b1にギ酸とトリエチルアミン、トリブチルアミン等の塩基、トリフェニルホスフィン、dppf、dppp等のリガンド、及びPd(OAc)2、Pd(PPh3)4、ビストリフェニルホスフィンパラジウムジクロライド等のパラジウム触媒を加え、20℃~200℃、好ましくは60℃~120℃で、0.1時間~24時間、好ましくは1時間~12時間反応させることによっても得ることができる。
第15工程
化合物b6より、第8工程と同様の方法で、化合物b7を得ることができる。
第16工程
化合物b7より、第6工程と同様の方法で、化合物b8を得ることができる。
第17工程
化合物b8より、第9工程と同様の方法で、化合物B-1を得ることができる。
(式中、各定義は前記と同意義。)
第18工程
化合物b9より、後述の「27)化合物K-1およびK-2(フェノール誘導体)の合成」における第5工程と同様の方法で、化合物b10を得ることができる。
第19工程
化合物b10より、前述の「1)化合物A-1およびA-2の合成」における第12工程と同様の方法で、化合物b11を得ることができる。
第20工程
化合物b11より、前述の「1)化合物A-1およびA-2の合成」における第13工程と同様の方法で、化合物b12を得ることができる。
第21工程
化合物b12より、第1工程と同様の方法で、化合物b13を得ることができる。
第22工程
化合物b13より、前述の「1)化合物A-1およびA-2の合成」における第4工程と同様の方法で、化合物B-1を得ることができる。
(式中、各定義は前記と同意義。但し、化合物A-1において、R2はOR2’であり、R2’は前記と同意義。)
第1工程
トルエン、アセトニトリルやジクロロエタン等の溶媒中、化合物A-1または化合物A-3に市販もしくは公知の方法で合成したR71-NCOを加え、25℃~120℃、好ましくは60℃~80℃で、0.5時間~4時間、好ましくは1時間~2時間反応させることにより、化合物C-1を得ることができる。
ジクロロメタン、THFやトルエン等の溶媒中、化合物A-1または化合物A-3にトリエチルアミンやN-メチルモルホリン等の塩基を加え、トリホスゲンと反応させることりより系中でイソシアネート体を合成し、反応混合物から取り出すことなく、市販もしくは公知の方法で合成したR71NH2を加え、0℃~50℃、好ましくは20℃~35℃で、0.1時間~6時間、好ましくは0.5時間~2時間反応させることによっても、化合物C-1を得ることができる。
第2工程
化合物C-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物C-2を得ることができる。
化合物A-1または化合物A-3の代わりに、後述の化合物E-1(R71=H)を用いることにより、N-R72置換ウレア誘導体を合成することができる。
前述の「18)化合物B-1、B-2、B-3、およびB-4(アミド誘導体)の合成」における第18~22工程と同様の方法(但し、該工程のうち、「18)化合物B-1、B-2、B-3、およびB-4(アミド誘導体)の合成」における第21工程は、「19)化合物C-1およびC-2(ウレア誘導体)の合成」における第1工程の方法に置き換える。)で、化合物b9より、R1およびR6がメチル、ならびにR5が-O-R5k(R5kは前記と同意義。)である化合物C-1を得ることができる。
(式中、各定義は前記と同意義。但し、化合物A-1において、R2はOR2’であり、R2’は前記と同意義。)
第1工程
ピリジンやルチジン等の溶媒中、化合物A-1または化合物A-3に市販もしくは公知の方法で合成した置換スルホニルクロライドを加え、20℃~100℃、好ましくは50℃~70℃で、1時間~24時間、好ましくは、5時間~10時間反応させることにより、化合物D-1を得ることができる。
第2工程
化合物D-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物D-2を得ることができる。
第3工程
ジクロロメタン、THFやジメチルホルムアミド等の溶媒中、化合物D-1に炭酸ナトリウム、炭酸カリウムや炭酸セシウム等の塩基を加え、市販もしくは公知の方法で合成したR72-I、R72-Br、R72-Cl等を加え、0℃~80℃、好ましくは25℃~50℃で、1時間~12時間、好ましくは3時間~6時間反応させることにより、化合物D-3を得ることができる。
第4工程
化合物D-3より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物D-4を得ることができる。
前述の「18)化合物B-1、B-2、B-3、およびB-4(アミド誘導体)の合成」における第18~22工程と同様の方法(但し、該工程のうち、「18)化合物B-1、B-2、B-3、およびB-4(アミド誘導体)の合成」における第21工程は、「20)化合物D-1、D-2、D-3、およびD-4(スルホンアミド誘導体)」における、第1工程の方法に置き換える。)で、化合物b9より、R1およびR6がメチル、ならびにR5が-O-R5k(R5kは前記と同意義。)である化合物D-1を得ることができる。
(式中、各定義は前記と同意義。但し、化合物A-1において、R2はOR2’であり、R2’は前記と同意義。)
第1工程
ジクロロメタン、THF、ジメチルホルムアミド等の溶媒中、化合物A-1または化合物A-3に酢酸やトリフルオロ酢酸等の酸を加え、市販もしくは公知の方法で合成したアルデヒドまたはケトンを順次加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは、3時間~12時間攪拌したのち、NaBH4、NaBH3CN、NaBH(OAc)3などの還元剤を加えて、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは、3時間~12時間反応させることにより、化合物E-1を得ることができる。
第2工程
化合物E-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物E-2を得ることができる。
(式中、R1、R2、R3、R4、R5、R6、およびYは前記と同意義。L14はハロゲン。但し、化合物A-1において、R2はOR2’であり、R2’は前記と同意義。)
第1工程
アセトニトリル、テトラヒドロフランやジメチルホルムアミド等の溶媒中、化合物A-1または化合物A-3に亜硝酸tert-ブチルや亜硝酸イソペンチル等のジアゾ化試薬を加え、塩化第二銅、臭化第二銅、ヨウ化第二銅などハロゲン化第二銅を順次加え、0℃~80℃、好ましくは20℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、それぞれ塩化物、臭化物またはヨウ化物として、化合物F-1を得ることができる。
第2工程
化合物F-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物F-2を得ることができる。
第1工程
アセトニトリル、ジメチルホルムアミドやジメチルスルホキシド等の溶媒中、化合物A-1または化合物A-3に亜硝酸tert-ブチルや亜硝酸イソペンチル等のジアゾ化試薬を加え、シアン化第一銅、シアン化ナトリウム、シアン化カリウムなどシアン化物を加え、0℃~100℃、好ましくは40℃~70℃で、1時間~12時間、好ましくは3時間~6時間反応させることにより、化合物G-1を得ることができる。
第2工程
化合物G-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物G-2を得ることができる。
第1工程
テトラヒドロフラン、アセトニトリルやジメチルホルムアミド等の溶媒中、化合物A-1または化合物A-3に亜硝酸tert-ブチルや亜硝酸イソペンチル等のジアゾ化試薬を加え、20℃~100℃、好ましくは50℃~70℃で、0.1時間~6時間、好ましくは1時間~3時間反応させることにより、脱アミン体として、化合物H-1を得ることができる。
第2工程
化合物H-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物H-2を得ることができる。
(式中、R1、R2、R3、R4、R5、R6、L14、およびYは前記と同意義。L15はアルキルまたはベンジル(但し、第2工程においてはベンジル)。)
第1工程
メタノール、エタノールなどのアルキルアルコールまたはベンジルアルコール、あるいはこれらのアルコールとジメチルホルムアミドやジメチルスルホキシド等の混合溶媒中、化合物F-1にトリエチルアミン、N-メチルモルホリンやピリジン等の塩基を加え、Pd(PPh3)4、Pd(OAc)2やPdCl2(dppf)等のパラジウム触媒を加え、反応混合物をよく脱気し、一酸化炭素雰囲気下、30℃~120℃、好ましくは70℃~100℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物i1を得ることができる。
第2工程
メタノール、エタノールやテトラヒドロフラン等の溶媒中、L15がベンジルである化合物i1に5%または10%パラジウムカーボン、水酸化パラジウムや二酸化白金等の触媒を加え、水素雰囲気下、0℃~60℃、好ましくは20℃~40℃で、0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物I-1を得ることができる。
第3工程
化合物i1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物I-2を得ることができる。
第1工程
ジクロロメタン、テトラヒドロフランやジメチルホルムアミド等の溶媒中、化合物I-1に1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド、ジシクロヘキシルカルボジイミド、O-(ベンゾトリアゾル-1-イル)-N,N,N’,N’-テトラメチルウロニウムヘキサフルオロリン酸塩等の縮合剤を加え、必要であれば1-ヒドロキシ-7-アザベンゾトリアゾール、1-ヒドロキシベンゾトリアゾール、N-ヒドロキシスクシンイミド等の添加剤をさらに加え、市販もしくは公知の方法で合成した置換アミン(D)を順次加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは2時間~12時間反応させることにより、化合物J-1を得ることができる。
第2工程
化合物J-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物J-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
化合物a7より、前述の「1)化合物A-1およびA-2の合成」における第12工程と同様の方法で、化合物k1を得ることができる。
第2工程
化合物k1より、前述の「1)化合物A-1およびA-2の合成」における第13工程と同様の方法で、化合物k2を得ることができる。
第3工程
化合物k2より、前述の「1)化合物A-1およびA-2の合成」における第4工程と同様の方法で、化合物k3を得ることができる。
第4工程
化合物k3を、希硫酸等の溶媒中、公知の方法に従って亜硝酸ナトリウムでジアゾ化した後、25℃~100℃、好ましくは50℃~80℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物k4を得ることができる。
第5工程
化合物k4を、テトラヒドロフラン、ジメチルホルムアミドやジメチルアセトアミド等の溶媒中、炭酸カリウム、炭酸ナトリウムやソジウムハイドライド等の塩基を加え、市販もしくは公知の方法で合成したR71-Cl、R71-Br、R71-Iなどを加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物k5を得ることができる。
第6工程
i)R2がOR2’(R2’は前記と同意義)の場合
化合物k5より、前述の「1)化合物A-1およびA-2の合成」における第7~10工程と同様の方法で、化合物K-1を得ることができる。
ii)R2がその他の場合
化合物k5を、前述の「1)化合物A-1およびA-2の合成」における第7工程と同様の方法、前述の「2)化合物A-3およびA-4の合成法」における第1~3工程と同様の方法の順により反応させることで、化合物K-1を得ることができる。
第7工程
化合物K-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物K-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
化合物k3を、濃塩酸に懸濁させ、公知の方法に従って亜硝酸ナトリウムでジアゾ化した後、亜硫酸と塩化第一銅の酢酸溶液を加え、-20℃~20℃、好ましくは-5℃~10℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、化合物l1を得ることができる。
また、亜硫酸と塩化第一銅の酢酸溶液の代わりに塩化チオニルを用いることによっても同様に化合物l1を得ることができる。
第2工程
化合物l1を、ジクロロメタン、トルエンやテトラヒドロフラン等の溶媒中、トリエチルアミン、N-メチルモルホリンやピリジン等の塩基を加え、市販もしくは公知の方法で合成したアミン(D)を順次加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは2時間~12時間反応させることにより、化合物l2を得ることができる。
第3工程
i)R2がOR2’(R2’は前記と同意義)の場合
化合物l2より、前述の「1)化合物A-1およびA-2の合成」における第7~10工程と同様の方法で、化合物L-1を得ることができる。
ii)R2がその他の場合
化合物l2を、前述の「1)化合物A-1およびA-2の合成」における第7工程と同様の方法、前述の「2)化合物A-3およびA-4の合成法」における第1~3工程と同様の方法の順により反応させることで、化合物L-1を得ることができる。
第4工程
化合物L-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物L-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
化合物l1を、テトラヒドロフラン、ジオキサンやアセトン等と水の混合溶媒中、亜硫酸ナトリウムと炭酸水素ナトリウムを加え、25℃~100℃、好ましくは50℃~80℃で、0.1時間~6時間、好ましくは1時間~3時間反応させ、室温まで冷却する。次に、市販のもしくは公知の方法で合成したR71-Cl、R71-Br、R71-Iなどを加え、10℃~100℃、好ましくは40℃~70℃で、6時間~48時間、好ましくは12時間~24時間反応させることにより、化合物m1を得ることができる。
第2工程
i)R2がOR2’(R2’は前記と同意義)の場合
化合物m1より、前述の「1)化合物A-1およびA-2の合成」における第7~10工程と同様の方法で、化合物M-1を得ることができる。
ii)R2がその他の場合
化合物m1を、前述の「1)化合物A-1およびA-2の合成」における第7工程と同様の方法、前述の「2)化合物A-3およびA-4の合成法」における第1~3工程と同様の方法の順により反応させることで、化合物M-1を得ることができる。
第3工程
化合物M-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物M-2を得ることができる。
(式中、R1、R2、R3、R4、R5、R6およびYは前記と同意義。L12はアルキル。R71aはアルキル、アルケニル、アルキニル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、または非芳香族複素環式基。)
第1工程
THF、DMF、ジクロロメタン等あるいは水、またはその混合溶媒中、化合物I-1にトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリンなどの塩基および、クロロギ酸イソブチルなどのカルボン酸誘導体またはピバロイルクロライドなどの酸クロリドなどを加え、-20℃~60℃、好ましくは-5℃~20℃で、0.5時間~24時間、好ましくは1時間~4時間反応させることにより、化合物n1を得ることができる。
第2工程
THF、DMF、DMA等、またはその混合溶媒中、化合物n1に水素化ホウ素ナトリウムや水素化ホウ素リチウム等の還元剤を加え、-20℃~80℃、好ましくは0℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物n2を得ることができる。
第3工程
THF、DMF、DMA等、またはその混合溶媒中、化合物n2およびメタンスルホン酸クロリドにトリエチルアミン、ルチジン、N-メチルモルホリン等の塩基を加え、0℃~80℃、好ましくは20℃~40℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物n3を得ることができる。
第4工程
THF、DMF、DMA等、またはその混合溶媒中、化合物n3にアジ化ナトリウムを加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物n4を得ることができる。
第5工程
エタノール、メタノール、DMF等、またはその混合溶媒中、化合物n4にパラジウム炭素を加え、水素雰囲気下、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物n5を得ることができる。
第6工程
DMF、DMA、ジクロロメタン等、またはその混合溶媒中、化合物n5および市販または公知の方法により調製した酸クロリド誘導体(B)にピリジン、ルチジン等の塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物N-1を得ることができる。
または、DMF、DMA、THF、アセトニトリル等あるいその混合溶媒中、化合物n5と市販もしくは公知の方法により調製したカルボン酸誘導体(C)に1-ヒドロキシ-7-アザベンゾトリアゾール若しくは1-ヒドロキシベンゾトリアゾールなど、および/またはジシクロヘキシルカルボジイミド若しくはジイソプロピルカルボジイミドなどの縮合剤、トリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリンなどの塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物N-1を得ることができる。
第7工程
化合物N-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物N-2を得ることができる。
(式中、R1、R2、R3、R4、R5、R6、L14、およびYは前記と同意義。R71bおよびR71cはそれぞれ独立してアルキル、アルケニル、またはアルキニル。ここで、R71bとR71cが隣接する窒素原子と一緒になって芳香族複素環式基または非芳香族複素環式基を形成しても良い。)
第1工程
DMF、DMA、THF、アセトニトリル等の溶媒中、またはそれらの混合溶媒中、化合物F-1にトリtert-ブチルホスフィン、トリシクロヘキシルホスフィン、トリフェニルホスフィン等のホスフィン、ジベンジリデンアセトンパラジウム、酢酸パラジウム、ジクロロビストリフェニルホスフィンパラジウム等のパラジウム触媒、およびN-メチルモルホリン等の塩基を加え、30℃~180℃、好ましくは50℃~150℃で、1時間~48時間、好ましくは4時間~24時間エチレンガスと反応させることにより、化合物o1を得ることができる。
第2工程
THF、アセトニトリル、アセトン、tert-ブチルアルコール等と水またはリン酸緩衝液の混合溶媒中、化合物o1にN-メチルモルフォリンオキシド、K3Fe(CN)6などの酸化剤、および触媒量の四酸化オスミウムまたはオスミン酸二カリウム二水和物を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物o2を得ることができる。
第3工程
THF、アセトニトリル、クロロホルム等と水の混合溶媒中、化合物o2に過ヨウ素酸ナトリウムを加え、0℃~100℃、好ましくは0℃~30℃で、1時間~48時間、好ましくは2時間~6時間反応させることにより、化合物o3を得ることができる。
第4工程
水素化ナトリウムのジエチルエーテル、THF等の溶媒中、またはそれらの混合溶媒中、メトキシメチルトリフェニルフォスホニウムクロライドを加え、0℃~80℃、好ましくは25℃~50℃で、0.1時間~6時間、好ましくは0.5時間~2時間攪拌したのち、化合物o3を加えて、0℃~80℃、好ましくは50℃~60℃で、1時間~48時間、好ましくは6時間~24時間反応させメトキシビニル体を得る。これを、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、塩酸、硫酸等の水溶液を加えて、0℃~100℃、好ましくは50℃~80℃で、0.1時間~6時間、好ましくは0.5時間~2時間反応させアセトアルデヒド体を得る。さらに、CrO3によるJones酸化条件下、酸化反応させることにより、化合物o4を得ることができる。
第5工程
化合物o4より、前述の「26)化合物J-1およびJ-2(逆アミド誘導体)の合成」における第1工程と同様の方法で、化合物O-1を得ることができる。
第6工程
化合物O-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物O-2を得ることができる。
(式中、R1、R2、R3、R4、R5、R6、L14、およびYは前記と同意義。R71dおよびR71eはそれぞれ独立してアルキル、アルケニル、アルキニル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、または非芳香族複素環式基。)
第1工程
化合物F-1および化合物p1より、前述の「1)化合物A-1およびA-2の合成」における第29工程と同様の方法で、化合物P-1を得ることができる。
ここで、化合物p1は、前述の「1)化合物A-1およびA-2の合成」における第40~42工程と同様の方法で得ることができる。
第2工程
化合物P-1より、前述の「1)化合物A-1およびA-2の合成」における第15工程と同様の方法で、化合物P-2を得ることができる。
(式中、R6は前記と同意義。L1’は置換若しくは非置換のアルキル)
第1工程
市販もしくは公知の方法によって合成した化合物a’1を、塩化メチレン、ジクロロエタン等の溶媒中、塩化アルミニウムなどのルイス酸存在下、塩化アセチルなどの酸ハロゲン化物または無水酢酸などの酸無水物と、0℃~150℃、好ましくは60℃~120℃で、1時間~48時間、好ましくは12時間~24時間、フリーデル・クラフツ・アシル化反応させることにより、化合物a’2を得ることができる。
第2工程
硫酸および硝酸の混酸中において、化合物a’2を-30℃~100℃、好ましくは0℃~50℃で、0.5時間~48時間、好ましくは6時間~24時間反応させることにより、化合物a’3を得ることができる。
第3工程
L1’OH中において、化合物a’3に濃硫酸、濃塩酸等の酸を加え、0℃~150℃、好ましくは80℃~110℃で、1時間~24時間、好ましくは6時間~12時間反応させることにより、化合物a’4を得ることができる。
(式中、R3、R5、R6、Y、およびL1’は前記と同意義。RAは置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。L2’はボロン酸、ボロン酸エステル、アルキルスズ、ハロゲン化亜鉛など。)
第4工程
化合物a’4とRA-L2’とのカップリング反応により、化合物a’5、a’6、a’7を得ることができる。該反応としては、鈴木クロスカップリング、Ullmannクロスカップリング、根岸クロスカップリング、Stilleカップリング等が例示される。
ジオキサン、DMF、DME、THF、水等の溶媒または混合溶媒中において、化合物a4にPd(PPh3)4、Pd(OAc)2、Pd(PPh3)2Cl2、Pd(dppf)2Cl2等のパラジウム触媒、炭酸カリウム、炭酸ナトリウム、リン酸カリウム等の塩基、市販もしくは公知の方法によって合成したボロン酸若しくはボロン酸エステル、およびアルキルスズ若しくはハロゲン化亜鉛を加え、窒素雰囲気下にて、0℃~150℃、好ましくは60℃~120℃で、0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物a’5、a’6、a’7(R3=R5=RA、Yは単結合)を得ることができる。
第5工程
化合物a’5より、第4工程と同様の方法で、化合物a’7(R3=RA)を得ることができる。
第6工程
化合物a’6より、第4工程と同様の方法で、化合物a’7(R5=RA、Yは単結合)を得ることができる。
(式中、R3、R4、R5、R6、Y、およびL1’は前記と同意義。R2’は置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニル。L3’はハロゲン。)
第7工程
塩化メチレン、ジクロロエタン、テトラヒドロフラン等の溶媒中において、化合物a’7に水素化ジイソブチルアルミニウムのトルエン溶液または水素化アルミニウムリチウムのテトラヒドロフラン溶液を加え、-100℃~50℃、好ましくは-60℃~0℃で、0.5時間~10時間、好ましくは1時間~3時間反応させ還元することにより、化合物a’8を得ることができる。
第8工程
塩化メチレン、アセトン、DMSO等の溶媒中において、化合物a’8にDess-Martin試薬、二酸化マンガン、三酸化硫黄ピリジン等の酸化剤を加え、-20℃~50℃、好ましくは0℃~30℃で、0.5時間~10時間、好ましくは1時間~3時間反応させ、酸化することにより、化合物a’9を得ることができる。
第9工程
塩化メチレン、ジクロロエタン、トルエン等の溶媒中において、化合物a’9にヨウ化亜鉛及びTMSCNを加え、-20℃~50℃、好ましくは0℃~30℃で、0.1時間~10時間、好ましくは0.5時間~2時間反応させることにより、化合物a’10を得ることができる。
第10工程
R4OH中において、化合物a’10に濃硫酸、濃塩酸等の酸を加え、0℃~150℃、好ましくは80℃~110℃で、1時間~24時間、好ましくは6時間~12時間反応させ、TMS基の脱保護、ニトリル基のカルボン酸への加水分解、引き続きエステル化することにより、化合物a’11を得ることができる。
第11工程
THF、DMF、トルエン等の溶媒中において、化合物a’11に水素化ナトリウム、カリウムtert-ブトキシド、ナトリウムメトキシド等の塩基およびR2’-I、R2’-Br、R2’-Clなどのハロゲン化物を加え、-20℃~100℃、好ましくは0℃~60℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物a’12を得ることができる。
また、tert-ブチルエステル等は、酢酸tert-ブチル中において、70%過塩素酸水溶液を1~3当量加え、0℃~60℃、好ましくは15℃~30℃で、0.1時間~10時間、好ましくは0.5時間~2時間反応させることによっても得ることができる。
第12工程
メタノール、エタノール、THF、酢酸エチル等の溶媒中において、化合物a’12に5%若しくは10%パラジウム炭素、水酸化パラジウム、二酸化白金等の触媒を加え,0℃~50℃、好ましくは15℃~25℃、0.1時間~48時間、好ましくは1時間~24時間、水素雰囲気下にて反応させることよって化合物a’13を得ることができる。
本条件において、酢酸、塩酸等の酸を添加することにより、反応が促進される場合がある。メタノール、エタノール、THF等の有機溶媒と水との混合溶媒中において、塩酸若しくは酢酸酸性下、水酸化カリウム若しくは水酸化ナトリウムアルカリ性下、または塩化アンモニウム中性下にて、化合物a’12に鉄、亜鉛、スズ等の金属を加え、0℃~120℃、好ましくは、25℃~80℃、0.1時間~24時間、好ましくは1時間~12時間反応させることによっても、化合物a’13を得ることができる。
第13工程
ジクロロメタン、THF、トルエン、アセトニトリルやDMF等の溶媒中において、化合物a’13に臭素やNBS、NCS、NISなどのハロゲン化試薬を加え、L3’がブロモの場合、-30℃~50℃、好ましくは-10℃~20℃、0.1時間~10時間、好ましくは0.5時間~2時間反応することによって、化合物a’14を得ることができる。
L3’がクロロまたはヨードの場合、10℃~150℃、好ましくは60℃~120℃、0.5時間~24時間、好ましくは1時間~6時間反応することによって、化合物a’14を得ることができる。
(式中、R2’、R3、R4、R5、R6、RA、Y、およびL3’は前記と同意義。L10’は置換若しくは非置換のアルキル。)
第14工程
DMF、DMA、THF、ジオキサン、水等の溶媒中、またはそれらの混合溶媒中、化合物a’14をK2CO3、Na2CO3、K3PO4などの塩基の水溶液および市販若しくは公知の方法で調整した(E)-3-ボラニルアクリル酸エステルを加え、50℃~150℃、好ましくは70℃~130℃で、0.1時間~8時間、好ましくは0.5~2時間で反応させることにより、化合物a’15を得ることができる。
第15工程
エタノール、メタノール、DMF、酢酸等の溶媒中、またはその混合溶媒中、化合物a’15にパラジウム炭素を加え、水素雰囲気下、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a’16を得ることができる。
第16工程
DMF、DMA、THF、アセトニトリル等の溶媒中、またはその混合溶媒中、化合物a’16に水素化ナトリウム、炭酸セシウム等の塩基、および市販または公知の方法により調整したハロアルカンを加え、20℃~140℃、好ましくは40℃~80℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物A’-1を得ることができる。
第17工程
メタノール、エタノール、THF、DMSO等の溶媒中において、化合物A’-1に水酸化カリウム、水酸化ナトリウム、水酸化リチウム等を加え,0℃~100℃、好ましくは20℃~50℃で、0.1時間~24時間、好ましくは1時間~6時間反応させることにより、化合物A’-2を得ることができる。
また、メタノール、エタノール、THF、DMSO等の溶媒中において、化合物A’-1に塩酸、TFA等を加え、0℃~100℃、好ましくは20℃~50℃で、0.1時間~24時間、好ましくは1時間~6時間反応させることによっても、化合物A’-2を得ることができる。
同様の方法により、化合物A’-3(a’16)より化合物A’-4を得ることができる。
(式中、各定義は前記と同意義。)
第18工程
化合物a’4より、第7工程と同様の方法で、化合物a’17を得ることができる。
第19工程
化合物a’17より、第8工程と同様の方法で、化合物a’18を得ることができる。
第20工程
化合物a’18より、第9工程と同様の方法で、化合物a’19を得ることができる。
第21工程
化合物a’19より、第10工程と同様の方法で、化合物a’20を得ることができる。
第22工程
ジクロロメタン、ジクロロエタン、クロロホルム等の溶媒中、化合物a’20にデスマーチン試薬、二酸化マンガン等の酸化剤を加え、0℃~80℃、好ましくは20℃~45℃で、0.5時間~5時間、好ましくは1時間~3時間反応させることにより、化合物a’21を得ることができる。
第23工程
ベンゼン、トルエン、キシレン等の溶媒中、化合物a’21に不斉源として(R)-CBS試薬を加え、カテコールボラン、9-ボラビシクロ[3.3.1]ノナン等の還元剤を順次加え、-50℃~0℃、好ましくは-35℃~-10℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a’22を得ることができる。
第24工程
化合物a’22より、第11工程と同様の方法で、化合物a’23を得ることができる。
第25工程
化合物a’23より、第4~6工程と同様の方法で、化合物a’12の光学異性体である化合物a’12’を得ることができる。
(式中、各定義は前記と同意義。)
第26工程
化合物a’20より、第11工程と同様の方法で、化合物a’24を得ることができる。
第27工程
化合物a’24より、第17工程と同様の方法で、化合物a’25を得ることができる。
第28工程
化合物a’26は、化合物a’25をR-(+)-4-ベンジル-2-オキサゾリジノン(化合物(A))のようなエナンチオピュアなキラル補助化合物と縮合してジアステレオマー混合物を生成し、シリカゲルカラムクロマトグラフィーで分離することにより合成することができる。
即ち、化合物a’25を無水ジクロロメタン、無水クロロホルム、無水THFなどの溶媒に溶解後、少量の無水DMFを添加し、-30℃~50℃、好ましくは-10℃~20℃で、塩化チオニル、塩化オキサリルなどのクロロ化試薬を滴下する。その後、-30℃~50℃、好ましくは-10℃~20℃で、0.1時間~10時間、好ましくは0.5時間~2時間攪拌したのち濃縮して得られる泡沫状固体を、無水テトラヒドロフラン、無水ジクロロメタン等に溶解する。化合物(A)の無水テトラヒドロフラン、無水ジクロロメタン等の溶液を、-100℃~-30℃、好ましくは-80℃~-60℃で攪拌し、n-BuLi/ヘキサン溶液を加え、-100℃~-30℃、好ましくは-80℃~-60℃で0.1時間~1時間、好ましくは0.1時間~0.5時間攪拌し、さらに-20℃~60℃、好ましくは0℃~30℃で、0.1時間~5時間、好ましくは0.1時間~2時間攪拌する。その後、上記調製した酸塩化物溶液と-60℃~-10℃、好ましくは-40℃~-20℃で混合させ-10℃~60℃、好ましくは10℃~30℃まで昇温させる。反応終了後、飽和塩化アンモニウム水溶液でクエンチし、ジクロロメタンで抽出後、シリカゲルクロマトグラフィーで分離精製することにより化合物a’26を得ることができる。
第29工程
テトラヒドロフラン-水混合溶媒中、化合物a’26に過酸化水素水および水酸化リチウム水溶液の混合液を加え、-20℃~10℃、好ましくは-10℃~10℃で反応させてカルボン酸体を得た後に、ジアゾメタン/ジエチルエーテル溶液等でエステル化することにより、化合物a’23を得ることができる。
(式中、R2’、R3、R4、R5、R6、RA、Y、およびL1’は前記と同意義。L4’はハロゲン。L5’はハロゲン。)
第30工程
市販もしくは公知の方法によって合成した化合物a’27を、濃硫酸、酢酸等の溶媒中において、硝酸、発煙硝酸等を氷冷下にて加え、-20℃~60℃、好ましくは0℃~25℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、ニトロ化合物を得ることができる。この化合物を塩化チオニル及びオキシ塩化りん等の溶媒中において、20℃~120℃、好ましくは80℃~100℃で、0.5時間~6時間、好ましくは1時間~3時間反応させ、溶媒を減圧濃縮することにより、粗酸塩化物を得ることができる。引き続き、L1OH溶媒中において、20℃~120℃、好ましくは50℃~80℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a’28を得ることができる。
第31工程
化合物a’28より、第4工程と同様の方法で、化合物a’29を得ることができる。
第32工程
化合物a’29より、第12工程と同様の方法で、化合物a’30を得ることができる。
第33工程
化合物a’30より、第13工程と同様の方法で、化合物a’31を得ることができる。
第34工程
化合物a’31より、第14~16工程と同様の方法で、化合物a’32を得ることができる。
第35工程
化合物a’32より、第13工程と同様の方法で、化合物a’33を得ることができる。
第36工程
化合物a’33より、第4工程と同様の方法で、化合物a’34を得ることができる。
第37工程
化合物a’34より、第7~11工程と同様の方法で、化合物A-1を得ることができる。
(式中、R2’、R3、R4、R5、R6、RA、Y、およびL3’は前記と同意義。L6’はハロゲン。L7’はハロゲン。)
第38工程
化合物a’28より、第18~24工程と同様の方法で、化合物a’35を得ることができる。
第39工程
化合物a’35より、第31工程と同様の方法で、化合物a’36を得ることができる。
第40工程
化合物a’36より、第32工程と同様の方法で、化合物a’37を得ることができる。
第41工程
化合物a’37より、第33工程と同様の方法で、化合物a’38およびa’39を得ることができる。
第42工程
Yが単結合、およびR5が水素原子の場合、化合物a’38より、第14~16工程と同様の方法で、化合物A’-1の光学異性体である化合物A’-1’を得ることができる。
第43工程
化合物a’39より、第36工程と同様の方法で、化合物a’13の光学異性体である化合物a’13’を得ることができる。
(式中、R3、R6、RA、L1’、およびL5’は前記と同意義。R5aおよびR5a’はそれぞれ独立して置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。ここで、R5aとR5a’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第44工程
DMF、DMSO、ジオキサン、トルエン等の溶媒中において、化合物a’33にPd(PPh3)4、Pd(OAc)2、 Pd(PPh3)2Cl2、PdCl2(dppf)2等のパラジウム触媒、トリエチルアミン、N-メチルモルホリン等の塩基、およびアリルアルコールを加え、一酸化炭素雰囲気下にて、0℃~150℃好ましくは50℃~100℃で、1時間~24時間好ましくは3時間~12時間反応させることにより、アリルエステル体を合成することができる。その後、エタノール、MeCN、THF等の溶媒中、モルホリン、ピロリジン等を加えて、Pd(Ph3P)4存在下、0℃~100℃好ましくは25℃~75℃で、0.1時間~24時間好ましくは1時間~12時間反応させることにより化合物a’34-2を得ることができる。
第45工程
化合物a’34-2と市販または公知の方法により調製したアミン誘導体(D)を、DMF、DMA、THF、アセトニトリル等またはその混合溶媒中、1-ヒドロキシ-7-アザベンゾトリアゾール若しくは1-ヒドロキシベンゾトリアゾールなど、および/またはジシクロヘキシルカルボジイミド若しくはジイソプロピルカルボジイミドなどの縮合剤、ならびにトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリンなどの塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a’34-3を得ることができる。
(式中、R3、R6、RA、およびL1’は前記と同意義。R5bはアルキル。L8’はハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキル、アルケニル、アルキニル、ハロアルキル、ヒドロキシアルキル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルオキシアルキル、アルキルオキシアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環オキシ、非芳香族炭素環オキシ、芳香族複素環オキシ、非芳香族複素環オキシ、芳香族炭素環アミノ、非芳香族炭素環アミノ、芳香族複素環アミノ、非芳香族複素環アミノ、芳香族炭素環カルボニル、非芳香族炭素環カルボニル、芳香族複素環カルボニル、非芳香族複素環カルボニル、芳香族炭素環オキシカルボニル、非芳香族炭素環オキシカルボニル、芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、芳香族炭素環カルボニルアミノ、非芳香族炭素環カルボニルアミノ、芳香族複素環カルボニルアミノ、非芳香族複素環カルボニルアミノ、芳香族炭素環アルキル、非芳香族炭素環アルキル、芳香族複素環アルキル、非芳香族複素環アルキル、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルスルファニル、非芳香族炭素環アルキルスルファニル、芳香族複素環アルキルスルファニル、非芳香族複素環アルキルスルファニル、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルオキシアルキル、非芳香族炭素環アルキルオキシアルキル、芳香族複素環アルキルオキシアルキル、非芳香族複素環アルキルオキシアルキル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、芳香族炭素環スルファニル、非芳香族炭素環スルファニル、芳香族複素環スルファニル、非芳香族複素環スルファニル、非芳香族炭素環スルホニル、芳香族炭素環スルホニル、芳香族複素環スルホニル、または非芳香族複素環スルホニル。)
第46工程
化合物a’34-2と市販または公知の方法により調製したフェニレンジアミン誘導体(E)を、DMF、DMA、THF、アセトニトリル等、またはその混合溶媒中、1-ヒドロキシ-7-アザベンゾトリアゾール若しくは1-ヒドロキシベンゾトリアゾール、および/またはジシクロヘキシルカルボジイミド若しくはジイソプロピルカルボジイミドなどの縮合剤、ならびにトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリンなどの塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a’34-4を得ることができる。
第47工程
化合物a’34-4を、DMF、DMA、THF、アセトニトリル等、またはその混合溶媒中、水素化ナトリウム、炭酸セシウム等の塩基、および市販もしくは公知の方法により調製したハロゲン化アルキルを加え、20℃~140℃、好ましくは40℃~80℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a’34-5を得ることができる。
(式中、R3、R6、RA、およびL1’は前記と同意義。R5cはアルキル、アルケニル、アルキニル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、または非芳香族複素環式基。L9’はアルキル。)
第48工程
THF、DMF、ジクロロメタン、水等、またはその混合溶媒中、化合物a’34-2にトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の塩基、およびクロロギ酸イソブチル、ピバロイルクロライド等を加え、-20℃~60℃、好ましくは-5℃~20℃で、0.5時間~24時間、好ましくは1時間~4時間反応させることにより、化合物a’34-6を得ることができる。
第49工程
THF、DMF、DMA等、またはその混合溶媒中、化合物a’34-6に水素化ホウ素ナトリウム、水素化ホウ素リチウム等の還元剤を加え、-20℃~80℃、好ましくは0℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a’34-7を得ることができる。
第50工程
メタンスルホン酸クロリドのTHF、DMF、DMA等、またはその混合溶媒中、化合物a’34-7にトリエチルアミン、ルチジン、N-メチルモルホリン等の塩基を加え、0℃~80℃、好ましくは20℃~40℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a’34-8を得ることができる。
第51工程
THF、DMF、DMA等、またはその混合溶媒中、化合物a’34-8にアジ化ナトリウムを加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a’34-9を得ることができる。
第52工程
エタノール、メタノール、DMF等、またはその混合溶媒中、化合物a’34-9にパラジウム炭素を加え、水素雰囲気下、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a’34-10を得ることができる。
第53工程
DMF、DMA、ジクロロメタン等、またはその混合溶媒中、化合物a’34-10に市販または公知の方法により調製した酸クロリド誘導体(B)およびピリジン、ルチジン等の塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a’34-11を得ることができる。
また、DMF、DMA、THF、アセトニトリル等またはその混合溶媒中、化合物a’34-10に市販もしくは公知の方法により調製したカルボン酸誘導体(C)、1-ヒドロキシ-7-アザベンゾトリアゾール、1-ヒドロキシベンゾトリアゾール、シクロヘキシルカルボジイミド、ジイソプロピルカルボジイミド等の縮合剤、およびトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の塩基を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることによっても、化合物a’34-11を得ることができる。
(式中、R3、R6、RA、L1’、およびL5’は前記と同意義。R5dは置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第54工程
DMF、DMA、THF、アセトニトリル等の溶媒中、またはそれらの混合溶媒中、化合物a’33にトリtert-ブチルホスフィン、トリシクロヘキシルホスフィン、トリフェニルホスフィン等のホスフィン、ジベンジリデンアセトンパラジウム、酢酸パラジウム、ジクロロビストリフェニルホスフィンパラジウム等の触媒、およびN-メチルモルホリン等の塩基を加え、30℃~180℃、好ましくは50℃~150℃で、1時間~48時間、好ましくは4時間~24時間エチレンガスと反応させることにより、化合物a’34-12を得ることができる。
第55工程
THF、アセトニトリル、アセトン、tert-ブチルアルコール等、および水若しくはリン酸緩衝液の混合溶媒中、化合物a’34-12にN-メチルモルフォリンオキシド、K3Fe(CN)6等の酸化剤、および触媒量の四酸化オスミウム若しくはオスミン酸二カリウム二水和物を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a’34-13を得ることができる。
第56工程
THF、アセトニトリル、クロロホルム等および水の混合溶媒中、化合物a’34-13に過ヨウ素酸ナトリウムを加え、0℃~100℃、好ましくは0℃~30℃で、1時間~48時間、好ましくは2時間~6時間反応させることにより、化合物a’34-14を得ることができる。
第57工程
リン酸二水素ナトリウム水溶液等の緩衝液若しくはそのTHF溶液およびtert-ブチルアルコール等との混合溶媒中、化合物a’34-14に亜塩素酸ナトリウム、および硫酸アミド、2-メチル2-ブテン等を加え、0℃~80℃、好ましくは0℃~50℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a’34-15を得ることができる。
第58工程
ジクロロメタン、テトラヒドロフラン、ジメチルホルムアミド等の溶媒中、化合物a’34-15に1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド、ジシクロヘキシルカルボジイミド、O-(ベンゾトリアゾル-1-イル)-N,N,N’,N’-テトラメチルウロニウムヘキサフルオロリン酸塩等の縮合剤を加え、必要であれば1-ヒドロキシ-7-アザベンゾトリアゾール、1-ヒドロキシベンゾトリアゾール、N-ヒドロキシスクシンイミド等の添加剤をさらに加え、市販もしくは公知の方法で合成した置換アミン(D)を順次加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは2時間~12時間反応させることにより、化合物a’34-16を得ることができる。
(式中、R3、R6、RA、L1’、およびL5’は前記と同意義。R5eおよびR5e’はそれぞれ独立して水素原子、ホルミル、カルバモイル、カルボキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキニルカルバモイル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニル、または置換若しくは非置換の非芳香族複素環オキシカルボニル。ここで、R5eとR5e’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第59工程
ジメチルホルムアミド、ジメチルアセトアミド、テトラヒドロフラン、ジオキサンなどの溶媒中、またはそれらの混合溶媒中、化合物a’33に炭酸ナトリウム、炭酸カリウム、炭酸セシウム、リン酸カリウムなどの塩基、市販または公知の方法により調製した置換アミン(F)、Pd(PPh3)4、Pd(OAc)2、 Pd(PPh3)2Cl2、Pd(dppf)2Cl2、トリス(ジベンジリデンアセトン)ジパラジウムなどのパラジウム触媒、および2,2’-ビス(ジフェニルホスフィノ)-1,1’-ビナフチル、キサントホスなどの配位子を加え、50℃~180℃、好ましくは70℃~150℃で、0.1時間~8時間、好ましくは0.5~2時間で反応させることにより、化合物a’34-17を得ることができる。
(式中、R3、R51、R6、RA、およびL1’は前記と同意義。R5fは置換若しくは非置換のアルキル、置換若しくは非置換ののアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第60工程
DMF、トルエン、ベンゼン等またはそれらと水の混合溶媒中、化合物a’34-2にジフェニルリン酸アジド、およびトリエチルアミン、ジイソプロピルエチルアミン、N-メチルモルホリン等の塩基を加え、20℃~100℃、好ましくは50℃~80℃で、1時間~24時間、好ましくは2時間~6時間反応させた後、水酸化カリウム、水酸化ナトリウム、水酸化リチウム等を加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは2時間~6時間反応させることにより、化合物a’34-18を得ることができる。
第61工程
ジクロロメタン、ジクロロエタン、THF等の溶媒中、化合物a’34-18に塩基としてピリジン、トリエチルアミン、N-メチルモルホリン等を加え、市販もしくは公知の方法によって合成した酸クロライド、酸無水物等のアシル化試薬を順次加え、-20℃~50℃、好ましくは0℃~20℃で、0.1時間~6時間、好ましくは1時間~3時間反応させることにより、化合物a’34-19を得ることができる。
第62工程
THF、ジメチルホルムアミド、ジメチルアセトアミド等の溶媒中、化合物a’34-19に水素化ナトリウム、tert-ブトキシカリウム、リチウムジイソプロピルアミド等の塩基を加え、市販もしくは公知の方法で合成したR51-I、R51-Br、R51-Cl等を加え、0℃~50℃、好ましくは20℃~35℃で、0.1時間~3時間、好ましくは0.5時間~1時間反応させることにより、化合物a’34-20を得ることができる。
(式中、R3、R6、RA、およびL1’は前記と同意義。R5gは置換若しくは非置換のアルキル、置換若しくは非置換ののアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第63工程
トルエン、アセトニトリル、ジクロロエタン等の溶媒中、化合物a’34-18に市販もしくは公知の方法で合成したR5g-NCOを加え、25℃~120℃、好ましくは60℃~80℃で、0.5時間~4時間、好ましくは1時間~2時間反応させることにより、化合物a’34-21を得ることができる。
ジクロロメタン、THF、トルエン等の溶媒中、化合物a’34-18にトリエチルアミン、N-メチルモルホリン等の塩基を加え、トリホスゲンと反応させることより系中でイソシアネート体を合成し、反応混合物から取り出すことなく、市販もしくは公知の方法で合成したR5gNH2を加え、0℃~50℃、好ましくは20℃~35℃で、0.1時間~6時間、好ましくは0.5時間~2時間反応させることによっても、化合物a’34-21を得ることができる。
(式中、R3、R51、R6、RA、およびL1’は前記と同意義。R5hは置換若しくは非置換のアルキル、置換若しくは非置換ののアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第64工程
ピリジンやルチジン等の溶媒中、化合物a’34-18に市販もしくは公知の方法で合成した置換スルホニルクロライドを加え、20℃~100℃、好ましくは50℃~70℃で、1時間~24時間、好ましくは、5時間~10時間反応させることにより、化合物a’34-22を得ることができる。
第65工程
ジクロロメタン、THF、ジメチルホルムアミド等の溶媒中、化合物a’34-22に炭酸ナトリウム、炭酸カリウム、炭酸セシウム等の塩基を加え、市販もしくは公知の方法で合成したR51-I、R51-Br、R51-Cl等を加え、0℃~80℃、好ましくは25℃~50℃で、1時間~12時間、好ましくは3時間~6時間反応させることにより、化合物a’34-23を得ることができる。
(式中、各定義は前記と同意義。)
第66工程
R5fがトリフルオロメチルである化合物a’34-20をジメチルスルホキシドに溶解し、水酸化ナトリウム、水酸化カリウム、水酸化リチウム等の塩基の水溶液を加え、30℃~150℃、好ましくは80℃~120℃で1時間~10時間、好ましくは3時間~6時間反応させることにより、化合物a’34-24を得ることができる。
(式中、R3、R6、RA、およびL1’は前記と同意義。R5iおよびR5i’はそれぞれ独立して水素原子、ホルミル、カルバモイル、カルボキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキニルカルバモイル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニル、または置換若しくは非置換の非芳香族複素環オキシカルボニル。ここで、R5iとR5i’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第67工程
ジクロロメタン、THF、ジメチルホルムアミド等の溶媒中、化合物a’34-18に酢酸、トリフルオロ酢酸等の酸、および市販もしくは公知の方法で合成したアルデヒドまたはケトンを加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは、3時間~12時間攪拌したのち、NaBH4、NaBH3CN、NaBH(OAc)3などの還元剤を加えて、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは、3時間~12時間反応させることにより、化合物a’34-25を得ることができる。
(式中、各定義は前記と同意義。)
第68工程
アセトニトリル、ジメチルホルムアミド、ジメチルスルホキシド等の溶媒中、化合物a’34-18に亜硝酸tert-ブチル、亜硝酸イソペンチル等のジアゾ化試薬、およびシアン化第一銅、シアン化ナトリウム、シアン化カリウムなどシアン化物を加え、0℃~100℃、好ましくは40℃~70℃で、1時間~12時間、好ましくは3時間~6時間反応させることにより、化合物a’34-26を得ることができる。
(式中、R3、R6、RA、およびL1’は前記と同意義。R5jおよびR5j’はそれぞれ独立して置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。ここで、R5jとR5j’が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)
第69工程
化合物a’34-18を、濃塩酸に懸濁させ、公知の方法に従って亜硝酸ナトリウムでジアゾ化した後、亜硫酸および塩化第一銅の酢酸溶液を加え、-20℃~20℃、好ましくは-5℃~10℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、化合物a’34-27を得ることができる。
また、亜硫酸と塩化第一銅の酢酸溶液の代わりに塩化チオニルを用いることによっても同様に化合物a’34-27を得ることができる。
第70工程
化合物a’34-27を、ジクロロメタン、トルエン、テトラヒドロフラン等の溶媒中、トリエチルアミン、N-メチルモルホリン、ピリジン等の塩基を加え、市販もしくは公知の方法で合成したアミンを順次加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは2時間~12時間反応させることにより、化合物a’34-28を得ることができる。
(式中、R3、R6、RA、L1’、およびL5’は前記と同意義。R5kは置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基。)
第71工程
DMF、DMA、THF、ジオキサン等またはその混合溶媒中、化合物a’33に市販または公知の方法により調製したR5k-OKまたはR5k-ONaを加え、20℃~200℃、好ましくは50℃~100℃で、1時間~48時間、好ましくは2時間~24時間反応させることにより、化合物a’34-29を得ることができる。
(式中、R3、R6、RA、L1’、およびL5’は前記と同意義。R5mは置換若しくは非置換の芳香族炭素環式基。)
第72工程
ジクロロメタン、テトラヒドロフラン、ジメチルホルムアミド等の溶媒中、化合物a’33に炭酸カリウム、炭酸ナトリウム、炭酸セシウム等の塩基を加え、市販もしくは公知の方法で合成したR5mSHを順次加え、0℃~100℃、好ましくは25℃~60℃で、0.1時間~12時間、好ましくは0.5時間~3時間反応させることにより、化合物a’34-30を得ることができる。
第73工程
ジクロロメタン、クロロホルム等の溶媒中、化合物a’34-30にメタクロロ過安息香酸を加え、-20℃~50℃、好ましくは0℃~25℃で、0.1時間~3時間、好ましくは0.5時間~2時間反応させることにより、化合物a’34-31を得ることができる。
また、アセトンやテトラヒドロフラン等の溶媒および水の混合溶媒中、化合物a’34-30にオキソンを加え、0℃~100℃、好ましくは25℃~60℃で、0.5時間~24時間、好ましくは3時間~12時間反応させることによっても、化合物a’34-31を得ることができる。
また、化合物a’5より、以上のいずれかの方法と同様の方法により化合物a’7の-Y-R5において各種置換基が導入された化合物を合成し、さらに第7~16工程と同様の方法によって、化合物A’-1において-Y-R5に各種置換基の導入が可能である。
(式中、各定義は前記と同意義。)
第74工程
化合物N’-1より、第13工程と同様の方法で、化合物a’43を得ることができる。
第75工程
tert-ブタノールと水の混合溶媒中、化合物a’43に酢酸などの酸あるいは炭酸水素ナトリウムなどの塩基と過マンガン酸カリウムを加え、0℃~100℃、好ましくは20℃~60℃で、0.25時間~24時間、好ましくは0.5時間~2時間反応させることにより、化合物a’44を得ることができる。
第76工程
化合物a’44より、第4工程と同様の方法で、化合物A’-3を得ることができる。
第77工程
化合物A’-3より、第17工程と同様の方法で、化合物A’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
塩化メチレン、トルエン、THF等の溶媒中において、化合物a’8に三臭化リン、臭化チオニル等を加え、-20℃~120℃、好ましくは0℃~60℃で、0.1時間~12時間、好ましくは1時間~4時間反応させることにより、化合物a’40を得ることができる。
第2工程
DMF、DMSO、ジオキサン、トルエン等の溶媒中において、化合物a’40にPd(PPh3)4、Pd(OAc)2、Pd(PPh3)2Cl2、PdCl2(dppf)2等のパラジウム触媒と、トリエチルアミン、N-メチルモルホリン等の塩基と、R4OHを加え、一酸化炭素雰囲気下にて、0℃~150℃、好ましくは50℃~100℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物a’41を得ることができる。
第3工程
THF、ジエチルエーテル、トルエン等の溶媒中において、化合物a’41にリチウムジイソプロピルアミド、カリウムヘキサメチルジシラジド、リチウムヘキサメチルジシラジド、ナトリウムヘキサメチルジシラジド等の塩基、およびR2-I、R2-Br、R2-Cl等のアルキルハライドを加え、-70度~50度、好ましくは-20℃~20℃で、1時間~24時間、好ましくは3時間~10時間反応させることにより、化合物a’42を得ることができる。
第4工程
化合物a’42より、前述の「33)化合物A’-1~A’-4の合成」における第12~16工程と同様の方法で、化合物A’-5を得ることができる。
第5工程
化合物A’-5より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物A’-6を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物a’14にトリエチルアミン、ジイソプロピルエチルアミンなどの塩基、および公知の方法で合成した1,3-ジベンジルオキシカルボニルアミノ-2-メチル-イソチオウレアを加え、0℃~80℃、好ましくは20℃~60℃で、0.5時間~8時間、好ましくは1~2時間で反応させることにより、化合物b’1を得ることができる。
第2工程
水素雰囲気下、メタノール、エタノール、プロパノール、ブタノールの溶媒中、またはそれらの混合溶媒中、化合物b’1にPd/Cを加え、0℃~80℃、好ましくは20℃~60℃で、1時間~8時間、好ましくは2~4時間で反応させることにより、化合物b’2を得ることができる。
第3工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物b’2にトリエチルアミン、ジイソプロピルエチルアミンなどの塩基、およびヨウ化銅を加え、50℃~200℃、好ましくは80℃~170℃で、0.5時間~8時間、好ましくは2~4時間で反応させることにより、化合物B’-1を得ることができる。
第4工程
メタノール、エタノール、プロパノール、ブタノール、水等の溶媒中、またはそれらの混合溶媒中、化合物B’-1に水酸化リチウム、水酸化ナトリウム、水酸化カリウム等を加え、20℃~100℃、好ましくは40℃~80℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物B’-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、トリメチル化合物a’14にシリルアセチレンと、Na2CO3、K2CO3、Cs2CO3、K3PO4などの塩基、ジベンジリデンアセトンパラジウム、酢酸パラジウム、ジクロロビストリフェニルホスフィンパラジウムなどの触媒、およびリ塩化リチウムまたは塩化テトラブチルアンモニウム等の添加剤を加え、20℃~150℃、好ましくは50℃~120℃で、0.5時間~8時間、好ましくは1~2時間で反応させることにより、化合物c’1を得ることができる。
第2工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物c’1にフッ化テトラブチルアンモニウムを加え、0℃~80℃、好ましくは20℃~60℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物C’-1を得ることができる。
第3工程
メタノール、エタノール、プロパノール、ブタノール、水等の溶媒中、またはそれらの混合溶媒中、化合物C’-1に水酸化リチウム、水酸化ナトリウム、水酸化カリウム等の塩基を加え、20℃~100℃、好ましくは40℃~80℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物C’-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
化合物a’7より、前述の「33)化合物A’-1~A’-4の合成」における第12工程と同様の方法で、化合物d’1を得ることができる。
第2工程
化合物d’1と、グリセリン、ニトロベンゼン、および75%硫酸水溶液を混合し、80℃~180℃、好ましくは120℃~150℃で、1時間~12時間、好ましくは2時間~6時間反応させることにより、化合物d’2を得ることができる。
第3工程
化合物d’2より、前述の「33)化合物A’-1~A’-4の合成」における第7~11工程と同様の方法で、化合物D’-1を得ることができる。
第4工程
化合物D’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物D’-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
化合物a’14より、前述の「33)化合物A’-1~A’-4の合成」における第14~15工程と同様の方法で、化合物A’-3を得ることができる。
第2工程
化合物A’-3より、後述の「40)化合物F’-1~F’-6の合成」における第1工程と同様の方法で、化合物F’-1を得ることができる。
第3工程
トルエン、アセトニトリル、クロロホルム、ジクロロメタン等の溶媒中、またはそれらの混合溶媒中、化合物F’-1に三塩化りんを加え、0度~150度、好ましくは20℃~110℃で、0.1時間~8時間、好ましくは0.5~2時間で反応させることにより、化合物d’3を得ることができる。
第4工程
化合物d’3より、前述の「33)化合物A’-1~A’-4の合成」における第4工程と同様の方法で、化合物D’-3を得ることができる。
第5工程
化合物D’-3より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物D’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
アセトン、テトラヒドロフラン、酢酸エチル等の溶媒中、化合物a’14に市販または公知の方法で合成したベンゾイルイソチオシアナートを加え、0℃~80℃、好ましくは25℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、化合物e’1を得ることができる。
第2工程
テトラヒドロフラン、ジメチルホルムアミド等の溶媒中、化合物e’1に水素化ナトリウム、カリウムtert-ブトキシド、ナトリウムメトキシド等の塩基を加え、25℃~140℃、好ましくは50℃~100℃で、0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物e’2を得ることができる。
第3工程
メタノール、エタノール、THF、DMSO等の溶媒中またはそれらの混合溶媒中において、化合物e’2に水酸化カリウム、水酸化ナトリウム、水酸化リチウム等の塩基を加え,0℃~100℃、好ましくは20℃~50℃で、0.1時間~24時間、好ましくは1時間~6時間反応させることにより、化合物E’-1を得ることができる。
第4工程
メタノール、エタノール、THF、DMSO等の溶媒中またはそれらの混合溶媒中において、化合物E’-1に水酸化カリウム、水酸化ナトリウム、水酸化リチウム等の塩基を加え,25℃~120℃、好ましくは70℃~100℃で、1時間~48時間、好ましくは2時間~12時間反応させることにより、化合物E’-2を得ることができる。
(式中、各定義は前記と同意義。)
第5工程
DMF、THF、アセトニトリル等の溶媒中、化合物E’-2に炭酸カリウム、炭酸ナトリウム、炭酸セシウム、ピリジン、トリエチルアミン等の塩基、および市販もしくは公知の方法によって合成したRA1-I、RA1-Br、RA1-Cl等のハロゲン化アルキル若しくは酸クロライド、酸無水物等のアシル化試薬を加え、-10℃~80℃、好ましくは0℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより化合物E’-3を得ることができる。
第6工程
テトラヒドロフラン、酢酸エチル等の溶媒中、化合物E’-2に市販もしくは公知の方法で合成した置換イソチオシアナートを加え、0℃~80℃、好ましくは25℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、化合物E’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
DMF、アセトン、ジオキサン、トルエン、2-プロパノール等の溶媒中において、化合物A’-3に2,3-ジクロロ-5,6-ジシアノ-p-ベンゾキノンを加え、0℃~150℃好ましくは50℃~100℃で、1時間~72時間好ましくは6時間~48時間反応させることにより化合物F’-1を合成することができる。
第2工程
化合物F’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物F’-2を得ることができる。
第3工程
化合物F’-1より、前述の「39)化合物E’-1~E’-4の合成」における第3工程と同様の方法で、化合物F’-3およびF’-5を合成することができる。
第4工程
化合物F’-3より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物F’-4を得ることができる。
第5工程
化合物F’-5より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物F’-6を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
水素雰囲気下、メタノール、エタノール、プロパノール、ブタノール等の溶媒中、またはそれらの混合溶媒中、化合物C’-1に蟻酸若しくは酢酸、およびパラジウム炭素を加え、20℃~100℃、好ましくは40℃~80℃で、1時間~24時間、好ましくは3~8時間で反応させることにより、化合物G’-1を得ることができる。
第2工程
メタノール、エタノール、プロパノール、ブタノール、水等の溶媒中、またはそれらの混合溶媒中、化合物G’-1に水酸化リチウム、水酸化ナトリウム、水酸化カリウム等の塩基を加え、20℃~100℃、好ましくは40℃~80℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物G’-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
水、テトラヒドロフランの混合溶媒中、化合物a’7にクロロ炭酸ベンジルエステル、亜鉛、および塩化アンモニウムを加え、0℃~80℃、好ましくは25℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させ、ヒドロキシアミンのN,O-ビス炭酸エステル体を得る。これをトルエン、キシレン等の溶媒中、80℃~180℃、好ましくは120℃~180℃で、0.5時間~12時間、好ましくは1時間~6時間反応させることにより化合物h’1を得ることができる。
第2工程
化合物h’1より、前述の「33)化合物A’-1~A’-4の合成」における第7~11工程と同様の方法で、化合物H’-1を得ることができる。
第3工程
化合物H’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物H’-2を得ることができる。
(式中、R2’、R3、R4、R5、R6、Y、およびL1’は前記と同意義。L11’はハロゲン。L12’はハロゲン。)
第1工程
市販もしくは公知の方法で合成した化合物i’1を、DMF、DMSO、アセトン、ジオキサン、アセトニトリル、水等の溶媒中、またはそれらの混合溶媒中、炭酸カリウム、炭酸セシウム、フッ化カリウムなどの塩基、およびジブロモメタン、ジヨードメタンなどのジハロメタンを加え、0度~150度、好ましくは20℃~100℃で、1時間~72時間、好ましくは6~24時間で反応させることにより、化合物i’2を得ることができる。
第2工程
ジクロロメタン、1,2-ジクロロエタン、THFなどの溶媒中、またはそれらの混合溶媒中、化合物i’2にピリジン、ルチジン、トリエチルアミンなどの塩基、およびトリフルオロメタンスルホン酸無水物、comin’s試薬などのトリフルオロメタンスルホニル化剤を加え、-50℃~50℃、好ましくは-30℃~30℃で、0.1時間~4時間、好ましくは0.5時間~1時間で反応させることにより、化合物i’3を得ることができる。
第3工程
化合物i’3より、前述の「34)化合物A’-5およびA’-6の合成」における第2工程と同様の方法で、化合物i’4を得ることができる。
第4工程
化合物i’4より、前述の「33)化合物A’-1~A’-4の合成」における第7~10工程と同様の方法で、化合物i’5を得ることができる。
第5工程
化合物i’5より、前述の「33)化合物A’-1~A’-4の合成」における第13工程と同様の方法で、化合物i’6を得ることができる。
第6工程
化合物i’6より、前述の「33)化合物A’-1~A’-4の合成」における第11工程と同様の方法で、化合物i’7を得ることができる。
第7工程
化合物i’7より、前述の「33)化合物A’-1~A’-4の合成」における第4~6工程と同様の方法で、化合物I’-1を得ることができる。
第8工程
化合物I’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物I’-2を得ることができる。
(式中、R2’、R3、R4、R5、R6、RA、およびYは前記と同意義。RA’はRAと同意義。)
第1工程
ベンゼン、トルエン等の溶媒中、またはそれらの混合溶媒中、化合物a’14に種々のアルキルアルデヒドとモレキュラーシーブを加え、20℃~120℃、好ましくは60℃~100℃で、1時間~8時間、好ましくは2~4時間で反応させることにより、化合物j’1を得ることができる。
第2工程
ジクロロメタン、1,2-ジクロロエタン、クロロホルム等の溶媒中、またはそれらの混合溶媒中、化合物j’1にトリエチルアミン、ジイソプロピルエチルアミン等の塩基、およびホスゲンを加え、0℃~80℃、好ましくは20℃~60℃で、0.1時間~2時間、好ましくは0.5~1時間で反応させる。さらに、種々の一級アミンを加え、0℃~80℃、好ましくは20℃~60℃で、0.1時間~2時間、好ましくは0.5~1時間で反応させることにより、化合物j’2を得ることができる。
第3工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物j’2にトリエチルアミン、ジイソプロピルエチルアミンなどの塩基、およびヨウ化銅を加え、50℃~200℃、好ましくは80℃~170℃で、0.5時間~8時間、好ましくは2~4時間で反応させることにより、化合物J’-1を得ることができる。
第4工程
メタノール、エタノール、プロパノール、ブタノール、水等の溶媒中、またはそれらの混合溶媒中、化合物J’-1に水酸化リチウム、水酸化ナトリウム、水酸化カリウム等の塩基を加え、20℃~100℃、好ましくは40℃~80℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物J’-2を得ることができる。
(式中、R2’、R3、R4、R5、R6、Y、およびL3’は前記と同意義。L13’は置換若しくは非置換のアルキル。)
第1工程
DMF、DMA、THF、ジオキサン等の溶媒中、またはそれらの混合溶媒中、化合物a’14に公知の方法で合成した2-(トリ-n-ブチルスタニル)酢酸アルキル、ZnBr2、および酢酸パラジウム、ジクロロビストリフェニルホスフィンパラジウム、ジクロロビストリオルトトルイルホスフィンパラジウムなどの触媒を加え、20℃~150℃、好ましくは50℃~120℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物k’1を得ることができる。
第2工程
化合物k’1をDMF、DMA、THF、ジオキサン等の溶媒、またはそれらの混合溶媒に溶解し、20℃~150℃、好ましくは50℃~120℃で、0.5時間~8時間、好ましくは1~4時間で攪拌することにより、化合物K’-1を得ることができる。
第3工程
化合物K’-1をメタノール、エタノール、プロパノール、ブタノール、水等の溶媒中、またはそれらの混合溶媒中、水酸化リチウム、水酸化ナトリウム、水酸化カリウム等を加え、20℃~100℃、好ましくは40℃~80℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物K’-2を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
化合物C’-2をDMF、DMA、THF、ジオキサン等の溶媒、またはそれらの混合溶媒に溶解し、ヨウ素、および水酸化リチウム、水酸化ナトリウム、水酸化カリウム等の塩基を加え、0℃~80℃、好ましくは20℃~60℃で、0.5時間~8時間、好ましくは1~4時間で攪拌することにより、化合物l’1を得ることができる。
第2工程
化合物l’1を酢酸に溶解し、酢酸銀を加え、20℃~100℃、好ましくは40℃~80℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物L’-1を得ることができる。
第3工程
メタノール、エタノール、プロパノール、ブタノール、水等の溶媒中、またはそれらの混合溶媒中、化合物L’-1に水酸化リチウム、水酸化ナトリウム、水酸化カリウム等を加え、20℃~100℃、好ましくは40℃~80℃で、0.5時間~8時間、好ましくは1~4時間で反応させることにより、化合物L’-2を得ることができる。
(式中、R2’、R3、R4、R5、R6、Y、およびL1’は前記と同意義。L14’はハロゲン。)
第1工程
DMF、THF、アセトニトリル等の溶媒あるいは混合溶媒中において、後述の化合物w’1にPd(PPh3)4、Pd(PPh3)2Cl2、Pd(dppf)2Cl2等のパラジウム触媒、ヨウ化銅、トリエチルアミン、ジイソプロピルエチルアミン等の塩基、および2-プロピン-1-オールを加え、窒素雰囲気下にて、0℃~100℃、好ましくは25℃~80℃で、0.5時間~24時間、好ましくは1時間~12時間反応させることにより、化合物m’1を得ることができる。
第2工程
メタノール、エタノール、THFや酢酸エチル等の溶媒中において、化合物m’1に5%または10%パラジウム炭素、水酸化パラジウムを加え,0℃~50℃、好ましくは15℃~25℃、0.1時間~48時間、好ましくは1時間~24時間、水素雰囲気下にて反応させることよって化合物m’2を得ることができる。
本条件において、酢酸または塩酸等を添加することにより、反応が促進される場合がある。
第3工程
ジクロロメタン、ベンゼン、THF、DMF等の溶媒中において、化合物m’2にトリフェニルホスフィンを加え、アゾジカルボン酸ジエチル、アゾジカルボン酸ジイソプロピル等のアゾ化合物を0℃~35℃、好ましくは5℃~25℃で滴下し、0℃~80℃、好ましくは15℃~35℃、0.1時間~24時間、好ましくは1時間~12時間、反応させることよって化合物m’3を得ることができる。
第4工程
化合物m’3より、前述の「33)化合物A’-1~A’-4の合成」における第7~11工程と同様の方法で、化合物M’-1を得ることができる。
第5工程
化合物M’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物M’-2を得ることができる。
第1工程
ジクロロメタン、ジクロロエタンやTHF等の溶媒中、化合物a’14に塩基としてピリジン、トリエチルアミン、N-メチルモルホリン等の塩基、およびアセチルクロライド、酢酸無水物等のアシル化試薬を順次加え、-20℃~50℃、好ましくは0℃~20℃で、0.1時間~6時間、好ましくは1時間~3時間反応させることにより、化合物n’1を得ることができる。
第2工程
化合物n’1より、前述の「47)化合物M’-1およびM’-2の合成」における第1工程と同様の方法で、化合物n’2を得ることができる。
第3工程
化合物n’2より、前述の「47)化合物M’-1およびM’-2の合成」における第2工程と同様の方法で、化合物n’3を得ることができる。
第4工程
ジクロロメタン、ジクロロエタン、THF等の溶媒中、化合物n’3にピリジン、トリエチルアミン等の塩基、塩化p-トルエンスルホニルを順次加え、-20℃~50℃、好ましくは0℃~20℃で、1時間~48時間、好ましくは6時間~12時間反応させることにより、化合物n’4を得ることができる。
第5工程
トルエン、キシレン等の溶媒中、化合物n’4に25℃~150℃、好ましくは70℃~100℃で、1時間~48時間、好ましくは6時間~12時間加熱することにより、化合物N’-1を得ることができる。
第6工程
化合物N’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物N’-2を得ることができる。
第7工程
化合物N’-1より、前述の「39)化合物E’-1~E’-4の合成」における第6工程と同様の方法で、化合物N’-3を得ることができる。
第8工程
化合物N’-3より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物N’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
ジオキサン、DMF、DMSO等の溶媒中において、化合物a’14にギ酸ナトリウム、酢酸ナトリウム等の無機塩基を加え、Pd(OAc)2、ジフェニルフォスフィノフェロセン、ジフェニルフォスフィノプロパン、PdCl2(dppf)等のパラジウム触媒存在下、一酸化炭素雰囲気下にて、50℃~150℃、好ましくは90℃~120℃で、0.5時間~24時間、好ましくは2時間~12時間、一酸化炭素挿入反応させることにより、化合物o’1を得ることができる。
第2工程
ジクロロメタン、テトラヒドロフラン等の溶媒中において、化合物o’1にピリジン、トリエチルアミン等の塩基存在下、メタンスルホニルクロライドと、-20℃~100℃、好ましくは0℃~50℃で、0.5時間~24時間、好ましくは6時間~12時間反応させることにより、化合物o’2を得ることができる。
第3工程
テトラヒドロフラン、DMF、DMA等の溶媒中において、化合物o’2に水素化ナトリウム、tert―ブトキシカリウム等の塩基存在下、市販もしくは公知の方法によって合成したRA-Cl, RA-Br、またはRA-Iを加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは6時間~12時間反応させることにより、化合物o’3を得ることができる。
第4工程
DMF、DMA等の溶媒中において、化合物o’3に水素化ナトリウム、tert―ブトキシカリウム等の塩基存在下、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは6時間~12時間反応させることにより、化合物O’-1を得ることができる。
第5工程
化合物O’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物O’-2を得ることができる。
第6工程
化合物O’-1を、メタノール、エタノール、テトラヒドロフラン等の溶媒中において、5%または10%パラジウム炭素、水酸化パラジウム等のパラジウム触媒存在下、水素雰囲気下にて、0℃~60℃、好ましくは20℃~30℃で、1時間~24時間、好ましくは2時間~12時間接触還元反応させることにより、化合物O’-3を得ることができる。
第7工程
化合物O’-3より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物O’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
ジオキサン、DMF、DME、テトラヒドロフラン、水等の溶媒またはその混合溶媒中において、化合物a’14に炭酸カリウム、炭酸ナトリウム、リン酸カリウム等の塩基、Pd(PPh3)4、Pd(PPh3)2Cl2やPdCl2(dppf)2等のパラジウム触媒およびビニルボロン酸、ビニルスズ等を加え、反応液をよく脱気した後、窒素雰囲気下にて、 0℃~150℃、好ましくは60℃~120℃で、0.5時間~24時間、好ましくは1時間~12時間カップリング反応させることにより、化合物p’1を得ることができる。
第2工程
テトラヒドロフラン、アセトニトリル、DMF等の溶媒中において、化合物p’1に臭化第一銅、臭化第二銅等と亜硝酸tert-ブチル硝酸イソアミル等のジアゾ化試薬を加え、-20℃~80℃、好ましくは0℃~25℃で、1時間~12時間、好ましくは3時間~6時間反応させることにより、化合物p’2を得ることができる。
第3工程
テトラヒドロフラン、ジオキサン等の溶媒中において、化合物p’2にボランーテトラヒドロフラン錯体、テキシルボラン、9-ボラビシクロ[3.3.1]ノナン等のボラン試薬を加え、-20℃~80℃、好ましくは0℃~25℃で、1時間~12時間、好ましくは3時間~6時間撹拌した後、30%過酸化水素水溶液と1~10mol/Lの水酸化ナトリウムまたは水酸化カリウム水溶液を加え、-20℃~80℃、好ましくは0℃~25℃で、1時間~12時間、好ましくは3時間~6時間ハイドロボレーション反応させることにより、化合物p’3を得ることができる。
第4工程
ジクロロメタン、トルエン、テトラヒドロフラン等の溶媒中において、化合物p’3にピリジン、トリエチルアミン、N-メチルモルホリン等の塩基、および塩化メタンスルホニル若しくはメタンスルホン酸無水物を加え、-20℃~60℃、好ましくは0℃~25℃で、0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物p’4を得ることができる。
第5工程
アセトン、テトラヒドロフラン、DMF等の溶媒中において、化合物p’4にアジ化ナトリウム、トリメチルシリルアジド等のアジド化試薬を加え、0℃~100℃、好ましくは20℃~50℃で、0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物p’5を得ることができる。
第6工程
メタノール、エタノール、テトラヒドロフラン等の溶媒中において、化合物p’5に5%または10%パラジウム炭素、水酸化パラジウム等のパラジウム触媒存在下、水素雰囲気下にて、0℃~60℃、好ましくは20℃~30℃で、0.5時間~24時間、好ましくは2時間~12時間接触還元反応させることにより、化合物p’6を得ることができる。
第7工程
ジクロロメタン、テトラヒドロフラン、DMF等の溶媒中において、化合物p’6に、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド、ジシクロヘキシルカルボジイミド、ヘキサフルオロリン酸(ベンゾトリアゾール-1-イルオキシ)トリピロリジノホスホニウム等の縮合剤、1-ヒドロキシベンゾトリアゾール、N-ヒドロキシスクシンイミド等の添加剤、およびトリエチルアミンやN-メチルモルホリン等の塩基を加え、0℃~100℃、好ましくは20℃~50℃で、0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物P’-1を得ることができる。
第8工程
化合物P’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物P’-2を得ることができる。
第9工程
化合物P’-1より、前述の「49)化合物O’-1~O’-4の合成」における第3工程と同様の方法で、化合物P’-3を得ることができる。
第10工程
化合物P’-3より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物P’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
後述の化合物v’1より、前述の「33)化合物A’-1~A’-4の合成」における第7~11工程と同様の方法で、化合物q’1を得ることができる。
第2工程
化合物q’1より、前述の「33)化合物A’-1~A’-4の合成」における第13工程と同様の方法で、化合物q’2を得ることができる。
第3工程
テトラヒドロフラン溶媒中において、化合物q’2にベンジル N―(2-ヒドロキシエチル)カルバメート、トリフェニルホスフィン、トリn―ブチルホスフィン、トリtert―ブチルホスフィン等のホスフィン類、N-メチルモルホリン、トリエチルアミン等の塩基、およびアゾジカルボン酸ジエチル、アゾジカルボン酸ジイソプロピル等のアゾジカルボン酸エステルを加え、0℃~60℃、好ましくは20℃~40℃で、1時間~24時間、好ましくは6時間~12時間反応させることにより、化合物q’3を得ることができる。
第4工程
化合物q’3より、前述の「49)化合物O’-1~O’-4の合成」における第6工程と同様の方法で、化合物q’4を得ることができる。
第5工程
トルエン、ジオキサンやDMF等の溶媒中において、化合物q’4にナトリウムtert―ブトキシド、カリウムtert―ブトキシド等の塩基、およびPd(dba)3、PdCl2(dppf)2等のパラジウム触媒を加え、反応液をよく脱気した後、窒素雰囲気下にて、 0℃~150℃、好ましくは60℃~120℃で、0.5時間~24時間、好ましくは1時間~12時間カップリング反応させることにより、化合物Q’-1を得ることができる。
第6工程
化合物Q’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物Q’-2を得ることができる。
第7工程
化合物Q’-1より、前述の「49)化合物O’-1~O’-4の合成」における第3工程と同様の方法で、化合物Q’-3を得ることができる。
第8工程
化合物Q’-3より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物Q’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
メタノール、エタノール等の溶媒中において、化合物o’1に水酸化ナトリウム、水酸化カリウム等の水溶液、および3~31%の過酸化水素水溶液を加え、-20℃~100℃、好ましくは0℃~50℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物r’1を得ることができる。
第2工程
ジクロロメタン、ジクロロエタン、クロロホルム等のハロゲン化溶媒中において、化合物r’1に塩化ベンジルトリエチルアンモニウム、臭化ベンジルトリエチルアンモニウム等の相間移動触媒、炭酸水素ナトリウム、炭酸水素カリウム等の無機塩基、および塩化クロロアセチル、臭化ブロモアセチル等を加え、-20℃~100℃、好ましくは0℃~50℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物r’2を得ることができる。
第3工程
化合物r’2より、前述の「49)化合物O’-1~O’-4の合成」における第6工程と同様の方法で、化合物R’-1を得ることができる。
第4工程
化合物R’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物R’-2を得ることができる。
第5工程
テトラヒドロフラン、ジエチルエーテル等の溶媒中において、化合物R’-1にボラン-テトラヒドロフラン、ボラン-ジメチルスルフィド錯体等の還元剤を加え、20℃~150℃、好ましくは50℃~100℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物R’-3を得ることができる。
第6工程
化合物R’-3より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物R’-4を得ることができる。
(式中、各定義は前記と同意義。)
第1工程
化合物q’2より、前述の「49)化合物O’-1~O’-4の合成」における第1工程と同様の方法で、化合物s’1を得ることができる。
第2工程
化合物s’1より、前述の「50)化合物P’-1~P’-4の合成」における第1工程と同様の方法で、化合物s’2を得ることができる。
第3工程
DMF、DMA、アセトニトリル等の溶媒中において、化合物s’2に炭酸カリウム、炭酸ナトリウム、炭酸セシウム等の無機塩基、および1,2―ジブロモエタン、1,2―ジヨードエタン等のハロゲン化試薬を加え、20℃~150℃、好ましくは60℃~100℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物S’-1を得ることができる。
第4工程
化合物S’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物S’-2を得ることができる。
(式中、各定義は前記と同意義。)
第5工程
ジオキサン、DMF、DME、THF、アセトン、アセトニトリル等の溶媒中、化合物s’3に炭酸カリウム、炭酸ナトリウムなどの塩基とジブロモエタンまたはジヨードエタンを加え、0℃~140℃、好ましくは50℃~120℃で、0.5時間~48時間、好ましくは6時間~24時間反応させることにより、化合物s’4を得ることができる。
第6工程
ジオキサン、DMF、DME、THF、アセトン、アセトニトリル等の溶媒中、化合物s’4に炭酸カリウム、炭酸ナトリウムなどの塩基とベンジルブロマイドまたはベンジルクロライドを加え、0℃~100℃、好ましくは20℃~50℃で、0.5時間~24時間、好ましくは1時間~5時間反応させることにより、化合物s’5を得ることができる。
第7工程
化合物s’5より、前述の「33)化合物A’-1~A-4の合成」における第7工程と同様の方法で、化合物s’6を得ることができる。
第8工程
メタノール、エタノールやテトラヒドロフラン等の溶媒中、化合物s’6に5%または10%パラジウムカーボン、水酸化パラジウムや二酸化白金等の触媒を加え、水素雰囲気下、0℃~60℃、好ましくは20℃~40℃で、0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物s’7を得ることができる。
第9工程
ジクロロメタン、1,2-ジクロロエタン、テトラヒドロフランなどの溶媒中、またはそれらの混合溶媒中、化合物s’7にピリジン、ルチジン、トリエチルアミンなどの塩基とトリフルオロメタンスルホン酸無水物、comin’s試薬などのトリフルオロメタンスルホニル化剤を加え、-50℃~50℃、好ましくは-30℃~30℃で、0.1時間~4時間、好ましくは0.5時間~1時間で反応させることにより、化合物s’8を得ることができる。
第10工程
メタノール、エタノールなどのアルキルアルコールまたはベンジルアルコール、あるいはこれらのアルコールとジメチルホルムアミドやジメチルスルホキシド等の混合溶媒中、化合物s’8にトリエチルアミン、N-メチルモルホリンやピリジン等の塩基を加え、Pd(PPh3)4、Pd(OAc)2やPdCl2(dppf)等のパラジウム触媒を加え、反応混合物をよく脱気し、一酸化炭素雰囲気下、30℃~120℃、好ましくは70℃~100℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物s’9を得ることができる。
第11工程
化合物s’9より、前述の「33)化合物A’-1~A-4の合成」における第7工程と同様の方法で、化合物s’10を得ることができる。
第12工程
化合物s’10より、前述の「33)化合物A’-1~A-4の合成」における第13工程と同様の方法で、化合物s’11を得ることができる。
第13工程
化合物s’11より、前述の「33)化合物A’-1~A-4の合成」における第8~11工程と同様の方法で、化合物S’-1を得ることができる。
第14工程
化合物S’-1より、前述の「33)化合物A’-1~A-4の合成」における第17工程と同様の方法で、化合物S’-2を得ることができる。
(式中、R2’、R3、R4、R5、R6、RA、およびYは前記と同意義。RA’はRAと同意義。)
第1工程
DMF、DMA、DMSO等の溶媒中において、化合物a’14に炭酸カリウム、炭酸セシウム等の無機塩基、臭化第一銅、ヨウ化第一銅等の触媒、およびグリシンを加え、50℃~200℃、好ましくは80℃~150℃で、1時間~24時間、好ましくは3時間~12時間反応させることにより、化合物t’1を得ることができる。
第2工程
アセトン、テトラヒドロフラン、DMF等の溶媒中において、化合物t’1に炭酸カリウム、炭酸セシウム等の無機塩基若しくはピリジン、トリエチルアミン等の有機塩基、および市販若しくは公知の方法によって合成したRA’-Cl, RA’-Br、若しくはRA’-Iを加え、0℃~100℃、好ましくは20℃~50℃で、1時間~24時間、好ましくは6時間~12時間反応させることにより、化合物t’2を得ることができる。
第3工程
化合物t’2より、前述の「49)化合物O’-1~O’-4の合成」における第3工程と同様の方法で、化合物T’-1を得ることができる。
第4工程
化合物T’-1より、前述の「33)化合物A’-1~A-4の合成」における第17工程と同様の方法で、化合物T’-2を得ることができる。
第5工程
化合物T’-1より、前述の「52)化合物R’-1~R’-4の合成」における第5工程と同様の方法で、化合物T’-3を得ることができる。
第6工程
化合物T’-3より、前述の「33)化合物A’-1~A-4の合成」における第17工程と同様の方法で、化合物T’-4を得ることができる。
(式中、R2’、R3、R4、R5、R6、RA、およびYは前記と同意義。RA’はRAと同意義。)
第1工程
ジクロロメタン、テトラヒドロフラン、酢酸エチル等の溶媒中において、化合物o’1に酢酸、トリフルオロ酢酸等の有機酸、シアノ水素化ホウ素ナトリウム、トリアセトキシ水素化ホウ素ナトリウム等の還元剤、および市販もしくは公知の方法によって合成したRA’-NH2を加え、0℃~100℃、好ましくは20℃~50℃で、0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物u’1を得ることができる。
第2工程
ジクロロメタン、テトラヒドロフラン、DMF等の溶媒中において、化合物u’1に無機塩基として水素化ナトリウム、および1-1’―カルボニルジイミダゾールを加え、0℃~100℃、好ましくは20℃~50℃で、1時間~48時間、好ましくは6時間~24時間反応させることにより、化合物u’2を得ることができる。
第3工程
化合物u’2より、前述の「49)化合物O’-1~O’-4の合成」における第3工程と同様の方法で、化合物U’-1を得ることができる。
第4工程
化合物U’-1より、前述の「33)化合物A’-1~A-4の合成」における第17工程と同様の方法で、化合物U’-2を得ることができる。
第1工程
硫酸溶媒中、化合物d’1に亜硝酸tert-ブチル、亜硝酸イソペンチル等のジアゾ化試薬を加え、0℃~100℃、好ましくは25℃~80℃で、0.5時間~12時間、好ましくは1時間~6時間反応させることにより、化合物v’1を得ることができる。
第2工程
ニトロベンゼン溶媒中、化合物v’1に塩化クロロアセチルおよび塩化アルミニウムを加え、0℃~80℃、好ましくは25℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより、化合物v’2を得ることができる。
第3工程
メタノール、エタノール、テトラヒドロフラン等の溶媒中、化合物v’2に5%または10%パラジウムカーボン、水酸化パラジウム、二酸化白金等の触媒を加え、水素雰囲気下、0℃~60℃、好ましくは20℃~40℃、1気圧~10気圧、好ましくは1気圧~6気圧、0.1時間~24時間、好ましくは1時間~12時間反応させることにより、化合物v’3を得ることができる。
第4工程
化合物v’3より、前述の「33)化合物A’-1~A’-4の合成」における第7~11工程と同様の方法で、化合物V’-1を得ることができる。
第5工程
化合物V’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物V’-2を得ることができる。
第1工程
化合物v’1より、前述の「33)化合物A’-1~A’-4の合成」における第7工程と同様の方法で、化合物w’1を得ることができる。
第2工程
ジメチルホルムアミド、ジメチルアセトアミド等の溶媒中、化合物w’1に炭酸カリウム、炭酸ナトリウム、炭酸セシウム等の塩基、および3-ブロモ-2-メチルプロペンを加え、0℃~80℃、好ましくは25℃~50℃で、0.1時間~6時間、好ましくは0.5時間~3時間反応させることにより化合物w’2を得ることができる。
第3工程
トルエン、キシレン等の溶媒中、化合物w’2にアゾビスイソブチロニトリル、水素化トリブチルスズ等、および3-ブロモ-2-メチルプロペンを加え、25℃~130℃、好ましくは80℃~110℃で、0.5時間~6時間、好ましくは1時間~3時間反応させることにより化合物w’3を得ることができる。
第4工程
化合物w’3より、前述の「33)化合物A’-1~A’-4の合成」における第7~11工程と同様の方法で、化合物W’-1を得ることができる。
第5工程
化合物W’-1より、前述の「33)化合物A’-1~A’-4の合成」における第17工程と同様の方法で、化合物W’-2を得ることができる。
本発明化合物は、HIV複製阻害作用のみならず、医薬としての有用性を備えており、好ましくは、下記いずれか、あるいは全ての優れた特徴を有している。
a)CYP酵素(例えば、CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP3A4等)に対する阻害作用が弱い。
b)高いバイオアベイラビリティー、適度なクリアランス等良好な薬物動態を示す。
c)代謝安定性が高い。
d)CYP酵素(例えば、CYP3A4)に対し、本明細書に記載する測定条件の濃度範囲内で不可逆的阻害作用を示さない。
e)変異原性を有さない。
f)心血管系のリスクが低い。
g)高い溶解性を示す。
h)耐性ウイルスに対しても強い薬効を示す。
Ac:アセチル
n-Bu:n-ブチル
t-Bu:tert-ブチル
Bn:ベンジル
DMA:N,N-ジメチルアセトアミド
DME:ジメトキシエタン
DMF:N,N-ジメチルホルムアミド
DCM:ジクロロメタン
DMSO:ジメチルスルホキシド
dppf:1,1’-ビス(ジフェニルホスフィノ)フェロセン
dppp:1,3-ビス(ジフェニルホスフィノ)プロパン
dtbpf:1,1’-ジ-tert-ブチルホスフィノフェロセン
Et:エチル
Me:メチル
MsOH:メタンスルホン酸
NBS:N-ブロモスクシンイミド
NCS:N-クロロスクシンイミド
NIS:N-ヨードスクシンイミド
Ph:フェニル
TBS:tert-ブチルジメチルシリル
THF:テトラヒドロフラン
Tf:トリフルオロメタンスルホニル
TFA:トリフルオロ酢酸
TMS:トリメチルシリル
Ts:p-トルエンスルホニル
表中にRTとあるのは、LC/MS:液体クロマトグラフィー/質量分析でのリテンションタイムを表し以下の条件で測定した。なお、移動相中で2種の異性体として存在し得る化合物については、測定ピークが2本になり得る。
(測定条件)
カラム:ACQUITY UPLC BEH C18(1.7μm、i.d.2.1x50mm)(Waters)
流速:0.8mL/分
UV検出波長:254nm
移動相:[A]は0.1%ギ酸含有水溶液、[B]は0.1%ギ酸含有アセトニトリル溶液
グラジエント:3.5分間で10%-100%溶媒[B]のリニアグラジエントを行い、0.5分間、100%溶媒[B]を維持した。
第1工程 化合物(2)の合成
化合物(1)(190g、1.19mol)をジクロロメタン(2L)に溶解し、塩化アルミニウム(313g、2.38mol)を室温で加えた。アセチルクロリド(186g、2.38mol)を室温で滴下し、16時間過熱還流した。室温まで冷却後、氷水(2L)に流入し、ジクロロメタンで抽出(1L×2回)した。有機層を飽和食塩水(1L)で洗浄後、無水硫酸ナトリウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィーで精製することにより、化合物(2)(180g、収率75%)を黄色固体として得た。
1H NMR(CDCl3)δ:2.51 (s, 3H), 2.61 (s, 3H), 7.23 (d, J=8.4Hz, 1H), 7.34(d, J=8.4Hz, 1H)
第2工程 化合物(3)の合成
化合物(2)(120g、0.594mol)を硫酸(600mL、98%)に溶解し、硝酸(120mL、70%)を氷冷下滴下し、16時間室温で攪拌した。反応終了後、氷水(3L)に流入し、不溶物をろ過した。ろ過物を酢酸エチル(1.5L)と5%水酸化ナトリウム水溶液(2L)に溶解させ、水層を1N塩酸でpH2に調整し、分液後、水層を酢酸エチルで抽出(1L×2回)した。有機層を飽和食塩水(1L)で洗浄後、無水硫酸ナトリウムで乾燥し、濃縮することにより、化合物(3)(94g、収率63%)を黄色固体として得た。
1H NMR(CDCl3)δ:2.67 (s, 3H), 8.26 (s, 1H)
第3工程 化合物(4)の合成
化合物(3)(93g、0.372mol)をメタノール(1L)に溶解し、硫酸(20mL、98%)を室温で加え、16時間過熱還流した。室温まで冷却後濃縮し、残渣を酢酸エチル(1L)に溶解し、飽和重曹水(500mL),飽和食塩水(500mL)で順次洗浄後、無水硫酸ナトリウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィーで精製することにより、化合物(4)(58.7g、収率60%)を黄色固体として得た。
1H NMR(CDCl3)δ:2.64 (s, 3H), 3.96 (s, 3H), 8.07 (s, 1H)
第4工程 化合物(5)の合成
化合物(4)(18.5g、70.1mmol)と3,4-ジメチルフェニルボロン酸(22.07g、147 mmol)をジオキサン(315mL)に溶解し、2mol/L炭酸カリウム水溶液(105mL、210mmol)を加え、脱気及び窒素置換の操作を3回繰り返し行った。Pd(PPh3)4(810mg、0.701mmol)を加え、再度脱気及び窒素置換の操作を3回繰り返し行い、100℃で22時間撹拌した。反応液を氷水(450mL)と2mol/L塩酸水溶液(150mL)に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(5)を黄色泡状物(20.06g、収率71.0%)として得た。
1H NMR(CDCl3)δ:1.85 (s, 3H), 2.27 (s, 3H), 2.29 (s, 3H), 2.30 (s, 3H), 2.31 (s, 3H), 3.64 (s, 3H), 6.80-6.98 (m, 4H), 7.15-7.21 (m, 2H), 8.08 (s, 1H).
第5工程 化合物(6)の合成
化合物(5)(20.06g、49.7mmol)をジクロロメタン(300mL)に溶解し、ドライアイス浴で内温を-78℃に冷却した。水素化ジイソブチルアルミニウムの1mmol/Lトルエン溶液(149mL、149mmol)を約1時間かけて同温で滴下した。次に内温-30℃で1時間撹拌、再度-78℃に冷却し、2mol/L塩酸水溶液(150mL)を加えしばらく撹拌した。反応液を氷水(200mL)に注ぎ、クロロホルムで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、水で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(6)を黄色泡状物(16.80g、収率90.0%)として得た。
1H NMR(CDCl3)δ:1.80 (s, 3H), 2.27 (s, 3H), 2.29 (s, 3H), 2.30 (s, 3H), 2.32 (s, 3H), 4.42 (s, 2H), 6.85-6.98 (m, 4H), 7.14-7.27(m, 2H), 7.83 (s, 1H).
第6工程 化合物(7)の合成
化合物(6)(16.80g、44.7mmol)をジクロロメタン(170mL)に溶解し、二酸化マンガン(38.9g、447mmol)を加え、70℃で2.5時間撹拌した。反応液を室温まで冷却し、セライトろ過した後、ろ液をエバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(7)を淡橙色結晶性粉末(13.95g、収率83.5%)として得た。
1H NMR(CDCl3)δ:1.91 (s, 3H), 2.28 (s, 3H), 2.30 (s, 3H), 2.32 (s, 3H), 2.35 (s, 3H),
6.90-7.03 (m, 4H), 7.17-7.25 (m, 2H), 8.18 (m, 1H), 9.65 (s, 1H).
第7工程 化合物(8)の合成
化合物(7)(13.95g、37.4mmol)をジクロロメタン(140mL)に溶解し、氷浴で内温を0℃に冷却した。ヨウ化亜鉛(12.55g、37.4mmol)、シアン化トリメチルシリル(15.65mL、112mmol)を同温で順次加えた後、氷浴を除去し、室温で1.5時間撹拌した。反応液を氷水と飽和炭酸水素ナトリウム水溶液に注ぎ、クロロホルムで抽出した。有機層を水で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。赤色泡状物として得られた化合物(8)(18.80 g)は、精製せずに次反応に用いた。
1H NMR(CDCl3)δ:0.10 (s, 3H), 0.11 (s, 3H), 1.80 (s, 3H), 2.25-2.36 (m, 12H), 5.17 (m, 1H), 6.80-7.02 (m, 4H), 7.14-7.29 (m, 2H), 8.01 (s, 1H).
第8工程 化合物(9)の合成
化合物(8)(18.80g)をメタノール(83.1mL)に溶解し、氷浴で内温を0℃に冷却した。濃硫酸(20.8mL、374mmol)を加え、氷浴を除去し、90℃で21時間撹拌した。反応液を氷水に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(9)を淡黄色泡状物(14.38g、収率88.7%(第7~8工程))として得た。
1H NMR(CDCl3)δ:1.80 (s, 3H), 2.25-2.33 (m, 12H), 3.37 (br s, 1H), 3.73 (s, 3H), 4.99 (m, 1H), 6.86-7.03 (m, 4H), 7.13-7.25 (m, 2H), 7.65 (s, 1H).
第9工程 化合物(10)の合成
化合物(9)(14.38g、33.2mmol)を酢酸tert-ブチル(144mL)に溶解し、70%過塩素酸水溶液(5.70mL、66.3mmol)を加え、室温で2時間撹拌した。反応液を氷水と飽和炭酸水素ナトリウム水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(10)を淡橙色泡状物(9.77g、収率60.2%)として得た。
1H NMR(CDCl3)δ:1.08 (s, 9H), 1.78 (s, 3H), 2.25-2.36 (m, 12H), 3.64 (s, 3H), 4.85 (m, 1H), 6.85-7.00 (m, 4H), 7.15-7.26 (m, 2H), 7.98 (m, 1H).
第10工程 化合物(11)の合成
化合物(10)(2.448g、5mmol)をメタノール(25mL)に溶解し、20重量%水酸化パラジウム(490mg)を加え、水素雰囲気下にて、室温で7時間撹拌した。反応液をセライトろ過した後、ろ液をエバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(11)を淡桃色泡状物(2.033g、収率88.5%)として得た。
1H NMR(DMSO-d6)δ:0.92-0.95 (m, 9H), 1.51-1.54 (m, 3H), 2.21 (s, 3H), 2.23 (s, 3H), 2.25 (s, 3H), 2.26 (s, 3H), 3.55 (s, 3H), 4.69 (s, 2H), 4.31 (s, 1H), 6.75-6.98 (m, 5H), 7.12-7.24 (m, 2H).
第11工程 化合物(12)の合成
化合物(11)(460mg、1mmol)をDMF(4.6mL)に溶解し、氷浴で内温を0℃に冷却した。NBS(178mg、1mmol)を加え、氷浴を除去し、室温で1.5時間撹拌した。反応液を氷水と飽和炭酸水素ナトリウム水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(12)を白色泡状物(481mg、収率89.3%)として得た。
1H NMR(DMSO-d6)δ:0.92-0.96 (m, 9H), 1.48-1.51 (m, 3H), 2.18-2.20 (m, 12H), 3.58 (s, 3H), 4.31 (s, 3H), 5.14 (br s, 1H), 6.90-7.30 (m, 6H).
第12工程 化合物(13)の合成
化合物(12)(369mg、0.685mmol)とトリメチルボロキシン(258mg、2.06mmol)をジオキサン(7.4mL)と水(0.74mL)の混合溶媒に溶解し、脱気及び窒素置換の操作を3回繰り返し行った。PdCl2(dppf)2(56.0mg、0.069mmol)を加え、再度脱気及び窒素置換の操作を3回繰り返し行い、120℃で7.5時間撹拌した。反応液を氷水に注ぎ、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(13)を白色泡状物(188mg、収率57.9%)として得た。
1H NMR(DMSO-d6)δ:0.88-0.91 (m, 9H), 1.47-1.51 (m, 2H), 2.06-2.10 (m, 2H), 2.18-2.28 (m, 12H), 3.59-3.63 (m, 3H), 3.89 (s, 2H), 4.95 (m, 1H), 6.84-7.27 (m, 6H).
第13工程 化合物(14)の合成
化合物(13)(100mg、0.211mmol)をジクロロメタン(1mL)に溶解し、氷浴で内温を0℃に冷却した。ピリジン(0.034mL、0.422mmol)とアセチルクロリド(0.023mL、0.317mmol)を順次加え、氷浴を除去し、室温で1.5時間撹拌した。反応液を氷水と2mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(14)を白色泡状物(79 mg、72.6%)として得た。
1H NMR(CDCl3)δ:0.98-1.01 (m, 9H), 1.64-1.67 (m, 3H), 1.83 (s, 3H), 2.23-3.24 (m, 15H), 3.67-3.70 (m, 3H), 5.06 (s, 1H), 6.31 (s, 1H), 6.78-7.22 (m, 6H).
第14工程 化合物I-6の合成
化合物(14)(79mg、0.153mmol)をテトラヒドロフラン(0.8mL)とメタノール(1.6mL)の混合溶媒に溶解し、2mol/L水酸化ナトリウム水溶液(0.383mL)を加え、60℃で4時間撹拌した。反応液を氷水に注ぎ、水層をジエチルエーテルで洗浄した後、2mol/L塩酸水溶液でpH≒3に調整し、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣を60℃で減圧乾燥することにより、化合物I-6を淡白色粉末(58mg、収率75.5%)として得た。
1H NMR(DMSO-d6)δ:0.90 (s, 9H), 1.55-1.60 (m, 3H), 1.66 (s, 3H), 2.15-2.29 (m, 15H), 4.92 (m, 1H), 6.77-7.27 (m, 6H). FABMS m/z [M+H]+ = 502.
第1工程 化合物(15)の合成
化合物(13)(100mg、0.211mmol)をピリジン(1mL)に溶解し、メタンスルホニルクロリド(0.025mL、0.317mmol)を加え、50℃で12時間撹拌した。反応液を氷水と2mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(15)を白色泡状物(84mg、収率72.1%)として得た。
1H NMR(CDCl3)δ:0.98-1.00 (m, 9H), 1.64-1.67 (m, 3H), 2.26-2.52 (m, 18H), 3.67-3.71 (m, 3H), 5.05 (s, 1H), 5.71 (m, 1H), 6.90-7.21 (m, 6H).
第2工程 化合物I-12の合成
実施例1の第14工程と同様の方法で、化合物(15)(85mg、0.156mmol)から化合物I-12を白色粉末(71mg、収率85.6%)として得た。
1H NMR(DMSO-d6)δ:0.88-0.90 (m, 9H), 1.57-1.61 (m, 3H), 2.01 (s, 3H), 2.21-2.40 (m, 15H), 4.91 (m, 1H), 6.85-7.25 (m, 6H), 8.43 (s, 1H). FABMS m/z [M]+ = 537.
第1工程 化合物(16)の合成
化合物(13)(100mg、0.211mmol)をトルエン(1mL)に溶解し、エチルイソシアネート(0.025 mL、0.317mmol)を加え、70℃で4時間撹拌した。反応液を氷水に注ぎ、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(16)を白色結晶性粉末(87mg、収率75.6%)として得た。
1H NMR(CDCl3)δ:0.98-1.01 (m, 9H), 1.07 (t, J = 7.2 Hz, 3H), 1.66-1.70 (m, 3H), 2.22-2.38 (m, 15H), 3.10-3.28 (m, 2H), 3.68-3.72 (m, 3H), 4.31 (br s, 1H), 5.07 (s, 1H), 5.48 (br s, 1H), 6.80-7.20 (m, 6H).
第2工程 化合物I-11の合成
実施例1の第14工程と同様の方法で、化合物(16)(82mg、0.149mmol)から化合物I-11を白色粉末(48mg、収率60.1%)として得た。
1H NMR(DMSO-d6)δ:0.88-0.91 (m, 9H), 1.17 (t, J = 7.2 Hz, 3H), 1.54-1.57 (m, 3H), 2.18-2.29 (m, 15H), 2.85-3.00 (m, 2H), 4.91 (m, 1H), 5.71 (br s, 1H), 6.75 (s, 1H), 6.80-7.25 (m, 6H). FABMS m/z [M+H]+ = 531.
第1工程 化合物(17)の合成
化合物(13)(550mg、1.61mmol)をジクロロメタン(5.5mL)に溶解し、氷浴で内温を0℃に冷却した。ピリジン(0.187mL、2.32mmol)と無水トリフルオロ酢酸(0.187mL、1.74 mmol)を順次加え、同温で1.5時間撹拌した。反応液を氷水と2mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(17)を白色泡状物(648mg、収率98.0%)として得た。
1H NMR(CDCl3)δ:1.00 (s, 9H), 1.68-1.71 (m, 3H), 2.24-2.33 (m, 15H), 3.67-3.71 (m, 3H), 5.07 (m, 1H), 6.85-7.20 (m, 7H).
第2工程 化合物(18)の合成
化合物(17)(147mg、0.258mmol)をジメチルホルムアミド(1.5mL)に溶解し、炭酸カリウム(71.3mg、0.516mmol)とヨードメタン(0.081mL、1.29mmol)を順次加え、室温で2時間撹拌した。反応液を氷水と2mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(18)を白色泡状物(121mg、収率80.3%)として得た。
1H NMR(CDCl3)δ:0.97-1.00 (m, 9H), 1.62-1.71 (m, 3H), 2.21-2.33 (m, 15H), 2.90-3.00 (m, 3H), 3.63-3.74 (m, 3H), 5.05 (m, 1H), 6.80-7.20 (m, 6H).
第3工程 化合物I-14の合成
化合物(18)(30.2mg、0.053 mmol)をジメチルスホキシド(1.0 mL)に溶解し、2mol/L水酸化ナトリウム水溶液(0.25mL)を加え、60℃で2時間、100℃で3時間撹拌した。反応液を氷水に注ぎ、2mol/L塩酸水溶液でpHを約3に調整し、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製し、化合物I-14を淡白色粉末(22mg、収率88.2%)として得た。
1H NMR(DMSO-d6)δ:0.89 (s, 9H), 1.48-1.51 (m, 3H), 2.20-2.30 (m, 15H), 2.36 (s, 3H), 4.89 (m, 1H), 6.85-7.25 (m, 6H). FABMS m/z [M+H]+ = 474.
第1工程 化合物(19)の合成
化合物(13)(30mg、0.063mmol)、シアン化銅(7.37mg、0.082mmol)をDMSO(0.6mL)に溶解させ、亜硝酸tert-ブチル(0.025mL、0.190mmol)を加えて50℃で1.5時間撹拌した。水を加え、酢酸エチルで抽出した。有機層を水と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(19)(10mg、収率33%)を得た。
1H-NMR (CDCl3) δ: 7.24-7.22 (m, 3H), 7.05-7.03 (m, 3H), 5.03 (s, 1H), 3.71 (d, J = 6.6 Hz, 3H), 2.65 (s, 3H), 2.31 (s, 12H), 1.72 (d, J = 4.5 Hz, 3H), 1.24 (s, 3H), 0.99 (s, 9H).
第2工程 化合物I-15の合成
実施例1の第14工程と同様の方法で、化合物(19)(6.0mg、0.012mmol)から化合物I-15(5.6mg、収率96%)を得た。
1H-NMR (CDCl3) δ: 7.23-7.20 (m, 3H), 7.04-6.96 (m, 3H), 5.16 (s, 1H), 2.62 (s, 3H), 2.30 (s, 12H), 1.75 (s, 3H), 1.24 (s, 3H), 1.03 (s, 9H)
化合物(20)(100g、456mmol)と濃硫酸(300mL)を塩化ナトリウム-氷浴中で攪拌し、発煙硝酸(40mL、456mmol)を0℃で滴下した。室温で2時間攪拌後、氷に反応混合物を加え析出する固体をろ過した。析出固体を酢酸エチル(500mL)に溶解し、水、食塩水で洗浄後、硫酸ナトリウムで乾燥し、濃縮乾固した。濃縮残渣を塩化チオニル(270mL)に溶解し、1時間加熱還流した後に、濃縮乾固した。さらに濃縮残渣にメタノール(400mL)をゆっくり加え、1時間加熱還流した後に、濃縮乾固した。濃縮残渣を酢酸エチルから再結晶化することにより化合物(21)(72g)を得た。
1H-NMR(CD3OD) δ:2.59(s,3H), 3.98(s,3H), 8.32(s,2H)
第2工程 化合物(22)の合成
化合物(21)(50g、183mmol)、2-(クロマン-6-イル)-4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン(57.8g、220mmol)、Cs2CO3(178g、550mmol)をジオキサン(400mL)-水(80mL)に溶解し、窒素雰囲気下、Pd(dppf)Cl2(2g、2.4mmol)を加え、90℃で14時間加熱攪拌した。室温まで冷却後、酢酸エチル、水を加え有機層を飽和食塩水で洗浄、硫酸ナトリウムで乾燥し、シリカゲルカラムクロマトグラフィー(石油エーテル:酢酸エチル=8:1)で精製することにより化合物(22)(47.2g)を得た。
LC-MS (ESI): m/z=328[M+H]+.
第3工程 化合物(23)の合成
化合物(22)(47.2g、145mmol)をメタノール(200mL)に溶解し、窒素雰囲気下で10%パラジウム炭素(20g)を加えた。反応容器を水素置換し、室温で14時間攪拌した。パラジウムをセライトろ過し、ろ液を濃縮乾固することにより、化合物(23)(42g)を得た。濃縮残渣を精製することなく次の反応に用いた。
1HNMR (CDCl3):2.04-2.06(m, 2H), 2.24(s,3H), 2.80(s,2H), 3.66(s,3H),4.23-4.25(m, 2H),6.80-6.85(m, 3H), 8.23(s,1H), 8.46 (s,1 H).
第4工程 化合物(24)の合成
化合物(23)(42g、142mmol)をDMF(200mL)に溶解し、NBS(25.2g、142mmol)のDMF(50mL)溶液を氷冷下滴下し、10分攪拌した。酢酸エチルと水を加え、有機層を飽和食塩水で洗浄し、硫酸ナトリウムで乾燥後、濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル:酢酸エチル=8:1)で精製することにより化合物(24)(23g)を得た。
LC-MS (ESI): m/z=376[M+H]+.
1HNMR (CDCl3): 2.01-2.04(m,5H), 2.75-2.78(m,2H), 3.59(s,3H), 4.19-4.21(m,2H), 6.71-6.76(m,2H), 6.85-6.89 (m,2 H).
第5工程 化合物(25)の合成
化合物(24)(36.9g、98mmol)、トリメチルボロキシン(50%、36.9g、148mmol)、Cs2CO3(96g、295mmol)をジオキサン(400mL)-水(80mL)に溶解し、窒素雰囲気下、Pd(dppf)Cl2(4g、4.9mmol)を加え、90℃で14時間加熱攪拌した。室温まで冷却後、酢酸エチル、水を加え有機層を飽和食塩水で洗浄、硫酸ナトリウムで乾燥し、シリカゲルカラムクロマトグラフィー(石油エーテル:酢酸エチル=5:1)で精製することにより化合物(25)(28.1g)を得た。
LC-MS (ESI): m/z=312[M+H]+.
第6工程 化合物(26)の合成
化合物(25)(28.1g、90mmol)にBoc2O(50mL)を加え、80℃で4時間攪拌した。濃縮残渣をシリカゲルカラムクロマトグラフィー(石油エーテル:酢酸エチル=10:1)で精製することにより化合物(26)(32.1g)を得た。
LC-MS (ESI): m/z= 429[M+18]+.
1H-NMR(CDCl3) δ:1.54(s,9H), 2.00-2.03(m,2H), 2.10(s,3H), 2.16(s,3H), 2.76-2.79(m,2H), 3.51(s,3H), 4.19-4.22(m,2H), 6.27(s,1H), 6.75-6.89(m,3H), 7.75(s,1H)
第7工程 化合物(27)の合成
化合物(26)(32.1g、78mmol)をジクロロメタン(400mL)に溶解し、-78℃で1M 水素化ジイソブチルアルミニウム/トルエン溶液(345mL、345mmol)を加え、-78℃で1.5時間、0℃で30分攪拌した。1M塩酸(500mL)を加え、1時間攪拌後、ジクロロメタンを分液し、有機層を水(500mL)、飽和食塩水(200mL)で洗浄後、硫酸マグネシウムで乾燥した。濃縮乾固することにより、化合物(27)(26.8g)を得た。
LC-MS (ESI): m/z=789[2M+Na]+.
1H-NMR(CDCl3) δ:1.53(s,9H), 2.00-2.06(m,5H), 2.34(s,3H), 2.78-2.81(m,2H), 4.22-4.24(m,2H), 4.43(s,2H), 6.29(s,1H), 6.79-6.82(m,3H), 7.59(s,1H)
第8工程 化合物(28)の合成
化合物(27)(26.8g、70mmol)をジクロロメタン(100mL)に溶解し、クロロクロム酸ピリジニウム(22.3g、104mmol)を加え、室温で3時間攪拌した。濃縮残渣をシリカゲルカラムクロマトグラフィー(石油エーテル:酢酸エチル=8:1)で精製することにより化合物(28)(23.7g)を得た。
LC-MS(ESI): m/z=785[2M+Na]+.
1H-NMR(CDCl3) δ:1.54(s,9H), 2.03-2.06(m,2H), 2.11(s,3H), 2.45(s,3H), 2.78-2.81(m,2H), 4.22-4.24(m,2H), 6.37(s,1H), 6.79-6.87(m,3H), 7.88(s,1H), 9.76(s,1H)
第9工程 化合物(29)の合成
化合物(28)(23.7g、62mmol)をジクロロメタン(300mL)に溶解し、氷冷、窒素雰囲気下、ヨウ化亜鉛(19.8g、62mmol)、TMSCN(18.4g、186mmol)を加え、室温で1時間攪拌した。ジクロロメタン(100mL)、水(200mL)を加え、分液して有機層を水、飽和食塩水で洗浄し、硫酸ナトリウムで乾燥し、濃縮乾固することにより化合物(29)(27.2g)を得た。濃縮残渣を精製することなく次の反応に用いた。
第10工程 化合物(30)の合成
メタノール(300mL)に氷冷下、ゆっくりと濃硫酸(70mL)を加え、化合物(29)(27.2g、56mmol)を加えて90℃で14時間攪拌した。氷冷下、水(300mL)で希釈し、1MNaOHで中和後、析出物をろ過した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル:酢酸エチル=3:1)で精製することにより化合物(30)(13.5g)を得た。
LC-MS (ESI): m/z=342[M+H]+ .
1H-NMR(CDCl3) δ:1.94(s,3H), 2.03-2.07(m,5H), 2.77-2.81(m,2H), 3.71(s,3H), 4.21-4.23(m,2H), 5.15(s,1H), 6.62(s,1H), 6.77-6.81(m,1H), 6.86-6.90(m,2H)
第11工程 化合物(31)の合成
化合物(30)(13.5g、39mmol)をt-ブチルアセテート(100mL)に溶解し、室温で過塩素酸(70%、6.2g、43mmol)を加えた。室温で2時間攪拌し、飽和重曹水でpH8に調整してから酢酸エチル(150mL)で抽出した。硫酸ナトリウムで乾燥後、濃縮残渣をシリカゲルカラムクロマトグラフィー(石油エーテル:酢酸エチル=5:1)で精製することにより化合物(31)(7.2g)を得た。
LC-MS (ESI): m/z=398[M+H]+.
1H-NMR(CDCl3) δ:0.98(s,9H), 1.92-2.05(m,5H), 2.2(s,3H), 2.77-2.81(m,2H), 3.64-3.67(d,3H), 4.23-4.24(m,2H), 5.03-5.05(d,1H), 6.58(s,1H), 6.76-6.89(m,2H), 6.97-7.02(m,1H).
化合物(31)(200mg、0.5mmol)、p-クロロ安息香酸(94mg、0.6mmol)、1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(144mg、0.7mmol)、1-ヒドロキシベンゾトリアゾール(100mg、0.7mmol)をジクロロメタン(10mL)に溶解し、トリエチルアミン(80mg、0.7mmol)を加えた。室温で14時間攪拌し、水(10mL)を加え、分液し、有機層を1M塩酸、飽和食塩水で洗浄し、硫酸ナトリウムで乾燥して濃縮乾固することにより化合物(32)(300mg)を得た。濃縮残渣を精製することなく次の反応に用いた。
LC-MS (ESI): m/z=476[M+H]+.
第13工程 化合物I-49の合成
化合物(32)(300mg、0.5mmol)をメタノール(5mL)に溶解し、1M水酸化ナトリウム水溶液(5mL)を加え、45℃で14時間攪拌した。1M塩酸でpH3に調整し、酢酸エチルで抽出して、HPLC分取することにより化合物I-49(20mg)を得た。
LC-MS (ESI): m/z=1065[2M+Na]+
1H-NMR(CDCl3) δ:0.94(s,9H), 1.96(s,5H), 2.19(s,3H), 2.71-2.74(m,2H), 4.17(s,2H), 5.18(s,1H), 6.77-6.79(m,2H), 7.05(s,1H), 7.39-7.48(m,3H), 7.76-7.78(m,3H).
化合物(31)(200mg、0.5mmol)をピリジン(2mL)に溶解し、メタンスルホニルクロリド(114mg、1mmol)を加え、室温で14時間攪拌した。水(10mL)を加え、1M塩酸でpH2に調整し、酢酸エチルで抽出、硫酸ナトリウムで乾燥後、濃縮乾固することにより化合物(33)(300mg)を得た。濃縮残渣を精製することなく次の反応に用いた。
LC-MS(ESI): m/z=475[M+H]+.
第2工程 化合物I-44の合成
化合物(33)(300mg)をメタノール(5mL)に溶解し、1N水酸化ナトリウム水溶液(5mL)を加え、45℃で14時間攪拌した。1M塩酸でpH3に調整し、酢酸エチルで抽出して、濃縮残渣をHPLC分取することにより化合物I-44(60mg)を得た。
.LC-MS(ESI): m/z=945[2M+Na]+.
1H-NMR(DMSO-d6) δ:0.87(s,9H), 1.95(s,5H), 2.08(s,3H), 2.55-2.70(m,2H), 3.00(s,3H), 4.18(s,2H), 4.93-4.97(d,1H), 6.80-6.99(m,3H), 7.13(s,1H), 8.97(s,1H), 12.50(s,1H)
化合物(31)(2g、5.0mmol)をメタノール(10mL)に溶解し、2M水酸化ナトリウム水溶液(10mL)を加え、45℃で14時間攪拌した。1M塩酸でpH3に調整し、酢酸エチルで抽出して、濃縮乾固することにより化合物(34)(1.5g)を得た。濃縮残渣を精製することなく次の反応に用いた。
LC-MS (ESI): m/z=384[M+H]+ .
第2工程 化合物I-76の合成
化合物(34)(200mg、0.52mmol)をピリジン(2mL)に溶解し、トリフロロメチルメタンスルホニルクロリド(189mg、1.04mmol)を加え、室温で14時間攪拌した。水(10mL)を加え、1N塩酸でpH2に調整し、酢酸エチルで抽出、硫酸ナトリウムで乾燥後、濃縮残渣をHPLC分取することにより化合物I-76(40mg)を得た。
LC-MS(ESI): m/z=1081[2M+ Na]+
1H-NMR(DMSO-d6) δ:0.87(s,9H), 1.95-1.96(m,5H), 2.29(s,3H), 2.60-2.80(m,2H), 4.18(s,2H), 4.51-4.54(m,2H), 4.93-4.97(d,1H), 6.70-6.89(m,2H), 6.90-7.10(m,1H), 7.17(s,1H), 9.63(s,1H).
化合物(34)(200mg、0.52mmol)をジクロロメタン(2mL)に溶解し、イソシアナートエタン(37mg、0.52mmol)を加え、室温で14時間攪拌した。水(10mL)を加え、ジクロロメタンで抽出し、硫酸ナトリウムで乾燥後、濃縮残渣をHPLC分取することにより化合物I-78(32mg)を得た。
LC-MS(ESI): m/z=455[M+ 1]+
1H-NMR(CDCl3) δ:1.00(s,9H), 1.10-1.14(t,3H), 2.01-2.06(m,5H), 2.25(s,3H), 2.80-2.81(m,2H), 3.26-3.29(m,2H), 4.23-4.25(t,2H), 5.22(s,1H), 6.83-6.87(m,2H), 7.13(d,1H), 7.14(s,2H)
第1工程 化合物(35)の合成
化合物(31)(200mg、0.5mmol)をピリジン(2mL)に溶解し、クロロ炭酸メチル(94mg、1mmol)を加え、室温で14時間攪拌した。水(10mL)を加え、1N塩酸でpH2に調整し、酢酸エチルで抽出、硫酸ナトリウムで乾燥後、濃縮乾固することにより化合物(35)(300mg)を得た。濃縮残渣を精製することなく次の反応に用いた。
LC-MS(ESI): m/z=933[2M+Na]+.
第2工程 化合物I-104の合成
化合物(35)(300mg、0.5mmol)をメタノール(5mL)に溶解し、1M水酸化ナトリウム水溶液(5mL)を加え、45℃で14時間攪拌した。1M塩酸でpH3に調整し、酢酸エチルで抽出して、濃縮残渣をHPLC分取することにより化合物I-104(66mg)を得た。
LC-MS(ESI): m/z=905[2M+Na]+.
1H-NMR(CDCl3) δ:0.99(s,9H), 2.01-2.06(m,5H), 2.21(s,3H), 2.74-2.81(m,2H), 3.79(s,3H), 4.21-4.24(t,2H), 5.22(s,1H), 6.47(s,1H), 6.80-6.90(m,2H), 7.12-7.15(s,1H), 7.52-7.54(s,1H).
化合物(34)(200mg、0.52mmol)をピリジン(2mL)に溶解し、氷冷下、クロロ炭酸フェニル(162mg、1.04mmol)を加え、0℃で2時間攪拌した。水(10mL)を加え、1M塩酸でpH2に調整し、酢酸エチルで抽出、硫酸ナトリウムで乾燥後、濃縮残渣をHPLC分取することにより化合物I-99(50mg)を得た。
LC-MS(ESI): m/z=1030[2M+ Na]+.
1H-NMR(CDCl3) δ:1.04(s,9H), 2.01-2.05(m,5H), 2.29(s,3H), 2.73-2.81(m,2H), 4.22-4.24(t,2H), 5.24(s,1H), 6.73-6.91(m,3H), 7.13-7.24(m,4H), 7.38-7.43(m,2H), 7.64(s,1H).
第1工程 化合物(36)の合成
化合物(35)(200mg、0.642mmol)をDMF(2mL)に溶解し、炭酸カリウム(178mg、1.29mmol)を室温で加え、室温で5分間攪拌した。4-クロロベンジルブロミド(198mg、0.964mmol)を室温で加え、14時間攪拌した。1mol/L塩酸(20mL)を加え、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(20mL)で洗浄後、無水硫酸マグネシウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製することにより、化合物(36)(281mg、収率100%)を無色油状物質として得た。
1H-NMR(CDCl3) δ: 1.24(s,9H), 2.30(s,3H), 2.32(s,3H), 3.70(s,3H), 4.89(s,2H), 5.17(s,1H), 7.32-7.37(m,4.0H), 7.53(s,1H)
第2工程 化合物(37)の合成
化合物(36)(265mg、0.608mmol)を酢酸(2.65mL)に溶解し、室温で亜鉛(199mg、3.04mmol)を加え、60度で1時間攪拌した。室温まで冷却した後、飽和炭酸水素ナトリウム水溶液(100mL)を加え、酢酸エチル(100mL)で抽出した。有機層を飽和食塩水(50mL)で洗浄後、無水硫酸マグネシウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製することにより、化合物(37)(215mg、収率87%)を茶色油状物質として得た。
1H-NMR(CDCl3) δ:1.24(s,9H), 2.20(s,3H), 2.24(s,3H), 3.67(s,3H), 3.73(s,2H), 4.79(s,2H), 5.17(s,1H), 6.80(s,1H), 7.31-7.42(m,4H)
第3工程 化合物(38)の合成
化合物(37)(201mg、0.495mmol)をDMF(2.1mL)に溶解し、氷浴で内温を0℃に冷却した。NBS(88.0mg、0.495mmol)を加え、氷浴を除去し、室温で45分間撹拌した。水(50mL)を加え、酢酸エチル(50mL)で抽出した。有機層を水(50mL×2回)、飽和食塩水(30mL)で洗浄後、無水硫酸マグネシウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製することにより、化合物(38)(173mg、収率72%)を茶色油状物質として得た。
1H-NMR(CDCl3) δ:1.22(s,9H), 2.21(s,3H), 2.37(s,3H), 3.68(s,3H), 3.76(s,2H), 4.78(s,2H), 5.94(s,1H), 7.33-7.41(m,4H)
第4工程 化合物(39)の合成
化合物(38)(166mg、0.343mmol)をピリジン(1.7mL)に溶解し、メタンスルホニルクロリド(0.133mL、1.713mmol)を加え、室温で17時間撹拌した。水(50mL)を加え、酢酸エチル(50mL)で抽出した。有機層を1mol/L塩酸(50mL)、水(50mL)、飽和炭酸水素ナトリウム水溶液(50mL)、飽和食塩水(30mL)で洗浄後、無水硫酸マグネシウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製することにより、化合物(39)(167mg、収率87%)を無色泡状物質として得た。
1H-NMR(CDCl3) δ:1.22(d,9H), 2.45(s,6H), 3.06(s,3H), 3.70(s,3H), 4.81-4.94(m,2H), 5.87(s,1H), 5.96(s,1H), 7.37-7.49(m,4H)
第5工程 化合物(40)の合成
化合物(39)(112mg、0.199mmol)をDMA(2.3mL)に溶解し、6-クロマンボロン酸(38.9mg、0.219mmol)、[1,1’-ビス(ジ-tert-ブチルフォスフィノ)フェロセン]パラジウムジクロリド(25.9mg、0.040mmol)、および2mol/L炭酸カリウム水溶液(0.199mL、0.398mmol)を加え、封緘にて110℃で1.5時間攪拌した。水(50mL)を加え、酢酸エチル(50mL)で抽出した。有機層を1mol/L塩酸(40mL×2回)、飽和食塩水(40mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製することにより、化合物(40)(62.7mg、収率51%)を茶色泡状物質として得た。
MS: m/z = 614.3 [M-H] -
第6工程 化合物I-296の合成
化合物(40)(62.0mg、0.101mmol)をエタノール(1mL)溶液に2mol/Lの水酸化ナトリウム水溶液(0.252mL、0.503mmol)を加え、加熱還流下2時間攪拌した。1mol/L塩酸(30mL)を加え、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(30mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルカラムクロマトグラフィー(クロロホルム―メタノール)で精製することにより、化合物I-296(60.2mg、収率99%)を無色泡状物質として得た。
MS: m/z = 600.3 [M-H] -
第1工程 化合物(42)の合成
化合物(41)(25.0g、166mmol)の硫酸(350mL)溶液に、氷冷下、硝酸カリウム(18.5g、183mmol)を加えた。0℃で1.5時間攪拌し、反応液を氷水の中へ注いだ。析出してきた固体をろ過し、黄色固体の化合物(42)(31.8g、98%)を得た。
1H-NMR(CDCl3、400MHz)δ:2.81(s,3H),7.88(s,1H),10.03(s,1H),10.28(s,1H)
MS(ESI) m/z: 194.30[M-H]-
第2工程 化合物(43)の合成
化合物(42)(25.0g、128mmol)のジクロロメタン(750mL)溶液に、塩化亜鉛(40.9g、128mmol)、TMSCN(51.5mL、384mmol)を氷冷下加えた。0℃で20分間攪拌し、飽和重曹水(100mL)、水(600mL)を加えた。ジクロロメタン(500mL×3)で抽出し、有機層を水、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥し濃縮することにより、茶色油状の化合物(43)の粗生成物(47g)を得た。
MS(ESI) m/z: 292.95[M-H]-
第3工程 化合物(44)の合成
化合物(43)の粗生成物(45.6g)に対して、5~10%塩化水素/メタノール溶液(456mL)、水(2.2mL、123mmol)を加え加熱還流下20時間攪拌した。減圧下メタノールを留去し、水(300mL)を加えた。酢酸エチル(300mL×3)で抽出し、有機層を水、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥し濃縮する。残渣にジイソプロピルエーテル、ヘキサンを加えることにより、固体を析出させ、ろ過することによって黄色固体化合物(44)(28.6g、91% 2steps)を得た。
1H-NMR(CDCl3,400MHz)δ:2.28(s,3H),2.50(s,3H),3.41(s,1H),3.78(s,3H),5.37(s,1H),7.33(s,1H), 9.48(s,1H)
MS(ESI) m/z: 254.05[M-H]-
第4工程 化合物(45)の合成
化合物(44)(29.0g、114mmol)のDMF(290mL)溶液に、炭酸カリウム(31.4g、227mmol)、ベンジルブロミド(14.9mL、125mmol)を加えた。室温で45分間攪拌し、2mol/L塩酸(300mL)と水(300mL)を加えた。酢酸エチル(300mL×3)で抽出し、有機層を水、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、黄色油状の化合物(45)(38.0g、97%)を得た。
1H-NMR(CDCl3,400MHz)δ:2.30(s,3H),2.32(s,3H),3.46(d,1H,J=4.3Hz),3.80(s,3H),4.93(s,2H),5.33(d,1H,J=4.3Hz),7.30(s,1H),7.37-7.44(m,5H)
第5工程 化合物(46)の合成
化合物(45)(38.0g、110mmol)のジクロロメタン(380mL)溶液に、二酸化マンガン(47.8g、550mmol)を加え加熱還流下2時間攪拌した。反応溶液をセライトろ過後、濃縮することにより、黄色固体の化合物(46)(32.9g、87%)を得た。
1H-NMR(CDCl3,400MHz)δ:2.37(s,3H),2.45(s,3H),3.98(s,3H),5.00(s,2H),7.40(s,5H),7.65(s,1H)
第6工程 化合物(47)の合成
化合物(46)(32.5g、95mmol)のジクロロメタン(325mL)溶液に、1M-(R)-CBS試薬(18.9mL、18.9mmol)、カテコールボラン(20.2mL、189mmol)を-78度に冷却下加えた。-78度で20分間攪拌し、飽和塩化アンモニウム水溶液(100mL)加え、酢酸エチル(200mL×3)で抽出し、有機層を飽和重曹水、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、黄色油状の化合物(47)(24.8g、76%)を得た。
1H-NMR(CDCl3,400MHz)δ:2.30(s,3H),2.32(s,3H),3.46(d,1H,J=4.3Hz),3.80(s,3H),4.93(s,2H),5.33(d,1H,J=4.3Hz),7.30(s,1H),7.37-7.44(m,5H)
第7工程 化合物(48)の合成
化合物(47)(24.5g、70.9mmol)の酢酸tert-ブチル(245mL)溶液に、過塩素酸(18.3mL、213mmol)を氷冷下加えた。0度で10分間攪拌し、飽和重曹水(400mL)を加え、酢酸エチル(300mL×3)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、黄色油状の化合物(48)(21、2g、74%)を得た。
1H-NMR(CDCl3,400MHz)δ:1.24(s,9H),2.31(s,3H),2.34(s,3H),3.70(s,3H),4.93(s,2H),5.17(s,1H),7.37-7.40(m,5H),7.53(s,1H)
第8工程 化合物(49)の合成
化合物(48)(21.2g、52.8mmol)の酢酸エチル(212mL)溶液に、10%wt、50%wet、Pd/C(2.12g)を加えた。室温で水素雰囲気下、6時間攪拌し、反応溶液をセライトろ過した。ろ液を濃縮後、カラムクロマトグラフィーによって精製することにより、黄色油状の化合物(49)(16.2g、99%)を得た。
1H-NMR(CDCl3,400MHz)δ:1.23(s,9H),2.29(s,3H),2.51(s,3H),3.68(s,3H),5.22(s,1H),7.60(s,1H), 9.51(s,1H)
MS(ESI) m/z: 315.35[M-H]-
第9工程 化合物(50)の合成
化合物(49)(16.2g、52mmol)のジクロロメタン(160mL)溶液に、ピリジン(8.42mL、104mmol)、トリフルオロメタンスルホン酸無水物(13.2mL、78mmol)を氷冷下加えた。0度で10分間攪拌し、飽和塩化アンモニウム水溶液(100mL)を加え、ジクロロメタン(100mL×2)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、薄いピンク色固体化合物(50)(21、2g、92%)を得た。
1H-NMR(CDCl3,400MHz)δ:1.24(s,9H),2.36(s,3H),2.47(s,3H),3.71(s,3H),5.20(s,1H),7.69(s,1H)
第10工程 化合物(51)の合成
化合物(50)(3.0g、6.77mmol)のジオキサン(101mL)溶液に、2mol/L炭酸カリウム水溶液(10.2mL、20.3mmol)を加え、脱気、窒素置換を3回繰り返した。次いで、4-クロロ-3-メチルフェニルボロン酸(1.73g、10.2mmol)、PdCl2(dppf)(553mg、0.68mmol)を加え、窒素雰囲気下、80度で5時間攪拌した。2mol/L塩酸(50mL)を加え、酢酸エチル(50mL×3)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、白色泡状の化合物(51)(1.08g、31%)を得た。
1H-NMR(CDCl3,400MHz)δ:1.27(s,9H),2.09(s,3H),2.31(s,3H),2.37(s,3H),3.73(s,3H),5.24(s,1H),6.96(d,1H,J=8.2Hz),7.05(s,1H),7.36(d,1H,J=8.2Hz),7.59(s,1H)
第11工程 化合物(52)の合成
化合物(51)(1.08g、2.57mmol)の酢酸(10.8mL)溶液に亜鉛(841mg、12.86mmol)を加えて、60度で20分間攪拌した。飽和重曹水(50mL)を加え、酢酸エチル(50mL×3)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、白色固体の化合物(52)(727mg、73%)を得た。
1H-NMR(CDCl3,400MHz)δ:1.26(s,9H),1.95(s,3H),2.20(s,3H),2,40(s,3H),3.40(s,2H),3.70(s,3H),5.24(s,1H),6.89(s,1H),7.00(d,1H,J=7.8Hz),7.10(s,1H),7.42(d,1H,J=7.8Hz)
MS(ESI) m/z: 390.10[M+H]+
第12工程 化合物(53)の合成
化合物(52)(720mg、1.85mmol)のDMF(7.2mL)溶液に、氷冷下NBS(329mg、1.85mmol)を加え、0度で30分間攪拌した。飽和重曹水(5mL)を加え、酢酸エチル(10mL×3)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、白色固体の化合物(53)(703mg、81%)を得た。
1H-NMR(CDCl3,400MHz)δ:1.25(s,9H),2.09(s,3H),2.21(s,3H),2.40(s,3H),3.40(s,2H),3.71(s,3H)6.03(s,1H),6.98(dd,1H,J=8.0,6.3Hz),7.08(d,1H,J=6.3Hz),7.44(d,1H,J=8.0Hz)
MS(ESI) m/z: 468.25[M+H]+
第13工程 化合物(54)の合成
化合物(53)(324mg、0.69mmol)のピリジン(3.2mL)溶液に、メタンスルホン酸無水物(361mg、2.08mmol)を加え80度で4時間攪拌した。2mol/L塩酸(20mL)を加え、酢酸エチル(10mL×3)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、白色泡状の化合物(54)(220mg、58%)を得た。
1H-NMR(CDCl3,400MHz)δ:1.25(s,9H),2.17(s,3H),2.42(s,3H),2.48(s,3H),2.49(s,3H),3.73(s,3H),5.55(s,0.5H),5.56(s,0.5H),6.06(s,1H),7.01(dd,1H,J=9.4,8.0Hz),7.11(d,1H,J=9.4Hz),7.44(d,1H,J=8.0Hz)
MS(ESI) m/z: 544.00[M-H]-
第14工程 化合物(55)の合成
化合物(54)(20mg、0.037mmol)のDMF(1mL)溶液に、2mol/L炭酸カリウム水溶液(0.073mL、0.15mmol)を加え、脱気、窒素置換を3回繰り返した。次いで、ボロン酸エステル(30.1mg、0.11mmol)、PdCl2(dtbpf)(4.8mg、0.007mmol)を加え、窒素雰囲気下、80度で40分間攪拌した。2mol/L塩酸(1mL)を加え、酢酸エチル(1mL×3)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、白色泡状のジアステレオマー混合物の化合物(55)(17.9mg、80%)を得た。
MS(ESI) m/z: 612.10[M-H]-
第15工程 化合物I-300およびI-301の合成
ジアステレオマー混合物の化合物(55)(120mg、0.195mmol)のエタノール(1.2mL)溶液に、2M水酸化ナトリウム水溶液(1.9mL)を加え、80度で1時間攪拌した。2mol/L塩酸(1mL)を加え、酢酸エチル(1mL×3)で抽出し、有機層を水、飽和食塩水で洗浄した。硫酸ナトリウムで乾燥し濃縮後、カラムクロマトグラフィーによって精製することにより、白色泡状の化合物I-300(64.1mg、55%)と白色泡状の化合物I-301(21.4mg、18%)を得た。
(化合物I-300)
1H-NMR(CDCl3,400MHz)δ:1.15(s,9H),1.95(s,3H),2.09-2.07(m,2H),2.49-2.53(m,9H),2.60-2.74(m,2H),4.18(t,2H,J=4.0Hz),5.67-5.80(m,1H),6.72(d,1H,J=8.0Hz),6.80-6.90(m,1H),6.99(d,0.5H,J=8.0Hz),7.10(s,1H),7.19(s,0.5H),7.43(dd,1H,J=8.0,4.0Hz)
MS(ESI) m/z: 598.10[M-H]-
(化合物I-301)
1H-NMR(CDCl3,400MHz)δ:1.05(s,9H),1.61(s,3H),1.92(s,3H),2.00-2.12(m,2H),2.42(s,3H),2.49(s,3H),2.51(s,3H),2.64(d,2H,J=6.0Hz), 4.17(t,2H,J=6.0Hz),5.68(s,0.5H),5.72(s,0.5H),6.74(d,1H,J=8.0Hz),7.00-7.24(m,3H),7,44(dd,1H,J=8.0,4.0Hz)
MS(ESI) m/z: 598.10[M-H]-
化合物(56)(10.0 g, 22.6 mmol)をエタノール(150 ml)に溶解し、10%Pd(OH)2カーボン粉末(3.17 g, 2.26 mmol)とトリエチルアミン(3.13 ml, 22.6 mmol)を加えた。5気圧の水素雰囲気下、室温で18時間攪拌した。反応液をセライトろ過し、ろ液を減圧濃縮した。粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製し、5.02 gの白色固体の化合物(57)を得た(収率84%)。
1H-NMR (CDCl3) δ:1.25(s,9H), 2.17(s,3H), 2.23(s,3H), 3.55(br s,2H), 3.66(s,3H), 5.20(s,1H), 6.47(s,1H), 6.81(s, H).
第2工程 化合物(58)の合成
化合物(57)(5.02 g, 18.9 mmol)をアセトニトリル(60 ml)に溶解し、N-ブロモスクシンイミド(3.40 g, 18.9 mmol)を0℃で加え、そのまま2時間攪拌した。反応液を水に注ぎ、酢酸エチルで抽出し、有機層を水で洗った後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製し、4.95 gの白色固体の化合物(58)を得た(収率76%)。
1H-NMR (CDCl3) δ:1.25(s,9H), 2.18(s,3H), 2.34(s,3H), 3.57(br s,2H), 3.67(s,3H), 5.95(s,1H), 6.57(s,1H).
第3工程 化合物(59)の合成
化合物(58)(500 mg, 1.45 mmol)をピリジン(5 ml)に溶解し、塩化シクロヘキシルメチルスルホニル(371 mg, 1.89 mmol)を加えて室温で48時間攪拌した。さらに塩化シクロヘキシルメチルスルホニル(143 mg, 0.726 mmol)を加えて室温で5時間攪拌した。反応液を水に注ぎ、酢酸エチルで抽出し、有機層を1規定塩酸で洗った後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製し、644 mgの無職ガム状物質の化合物(59)を得た(収率88%)。
1H-NMR (CDCl3) δ:1.04-1.33(m,5H), 1.21(s,9H), 1.63-1.96(m,6H), 2.30(s,3H), 2.43(s,3H), 2.96(dd,J = 6.1, 2.1 Hz,2H), 3.68(s,3H), 5.99(s,1H), 6.12(s,1H), 7.38(s,1H).
第4工程 化合物(60)の合成
化合物(59)(200 mg, 0.396 mmol)をN,N-ジメチルホルムアミド(2 ml)に溶解し、8-フルオロ-5-メチルクロマン-6-イルボロン酸(250 mg, 1.19 mmol)、炭酸カリウム(219 mg, 1.59 mmol)、水(0.2 ml)、1,1’-ビス(ジtert-ブチルホスフィノ)フェロセン]パラジウム(II)ジクロリド(78 mg, 0.119 mmol)を加えた。窒素雰囲気下、120度で10分攪拌した。反応液を水に注ぎ、酢酸エチルで抽出し、有機層を水で洗った後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製し、152 mgの無色泡状物質の化合物(60)を得た(収率65%)。
MS: m/z = 588 [M-H] -
第5工程 化合物I-283およびI-284の合成
化合物(60)(152 mg, 0.258 mmol)にメタノール(2 ml)、テトラヒドロフラン(1 ml)、2 mol/L水酸化ナトリウム(1.29 ml, 2.58 mmol)を加え、80℃で12時間攪拌した。反応液を1 mol/L塩酸に注ぎ、酢酸エチルで抽出し、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(クロロホルム-メタノール)で精製し、30 mgの無色泡状化合物I-283(収率20%)と5 mgの無色泡状化合物I-284(収率3%)を得た。
(化合物I-283)
MS: m/z = 574 [M-H] -
1H-NMR (CDCl3) δ:0.97-2.13(m,13H), 1.12(s,9H), 1.85(s,3H), 1.89(s,3H), 2.30(s,3H), 2.66(m,2H), 3.02(m,2H), 4.26(t,J = 4.8 Hz,2H), 5.10(s,1H), 6.13(s,1H), 6.70 (d,J = 11.4 Hz,1H), 7.39(s,1H).
(化合物I-284)
MS: m/z = 574 [M-H] -
1H-NMR (CDCl3) δ:0.93-2.14(m,13H), 1.04(s,9H), 1.92(s,6H), 2.33(s,3H), 2.65(m,2H), 3.02(m,2H), 4.23-4.29(m,2H), 5.21(s,1H), 6.13(s,1H), 7.02(m,1H), 7.37(s,1H).
第1工程 化合物(62)の合成
ラセミ体の原料を用いて化合物(58)のときと同様の方法によって得られた化合物(61)(689 mg, 2.00 mmol)をN,N-ジメチルホルムアミド(7 ml)に溶解し、クロマン-6-イルボロン酸(713 mg, 4.00 mmol)、炭酸カリウム(1.11 g, 8.01 mmol)、水(0.7 ml)、1,1’-ビス(ジtert-ブチルホスフィノ)フェロセン]パラジウム(II)ジクロリド(130 mg, 0.200 mmol)を加えた。窒素雰囲気下、120度で15分攪拌した。反応液を水に注ぎ、酢酸エチルで抽出し、有機層を水で洗った後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製し、541 mgの無色泡状物質の化合物(62)を得た(収率68%)。
MS: m/z = 398 [M+H] +
第2工程 化合物(63)の合成
化合物(62)を1,2-ジクロロエタン(1.5 ml)に溶解し、1-ナフトアルデヒド(37.2 mg, 0.238 mmol)、ナトリウムトリアセトキシボロンハイドライド(138 mg, 0.649 mmol)、酢酸(0.0120 ml, 0.126mmol)を加えて室温で3時間攪拌した。反応液を飽和炭酸水素ナトリウム水溶液に注ぎ、酢酸エチルで抽出し、有機層を飽和食塩水で洗った後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製し、121 mgの無色泡状物質の化合物(63)を得た(収率100%)。
MS: m/z = 538 [M+H] +
第3工程 化合物I-152の合成
化合物(63)(118 mg, 0.219 mmol)にメタノール(2 ml)、テトラヒドロフラン(1 ml)、2 mol/L水酸化ナトリウム(1.10 ml, 2.20 mmol)を加え、80℃で1.5時間攪拌した。反応液を飽和塩化アンモニウム水溶液に注ぎ、酢酸エチルで抽出し、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去して得られた粗生成物をシリカゲルカラムクロマトグラフィー(クロロホルム-メタノール)で精製し、33 mgの無色固体の化合物I-152を得た(収率29%)。
MS: m/z = 524 [M+H] +
1H-NMR (CDCl3) δ:1.01(s,9H), 2.06(m,2H), 2.07(s,6H), 2.71-2.85(m,2H), 4.22(s,2H), 4.76(s,2H), 5.23(s,1H), 6.71(s,1H), 6.85(m,2H), 7.18(d,J = 8.8 Hz,1H), 7.49-7.54(m,4H), 7.84(d,J = 8.1 Hz,1H), 7.91(d,J = 6.8 Hz,1H), 8.11(d,J = 6.8 Hz,1H).
第1工程 化合物(65)の合成
化合物(64)(4.43 g, 10.0 mmol)と(E)-スチリルボロン酸(2.22 g, 15.0 mmol)をジオキサン(150 mL)に溶解し、2 mol/L炭酸カリウム水溶液(15.0 mL, 30.0 mmol)を加え、脱気及び窒素置換の操作を3回繰り返し行った。PdCl2(dppf)(408 mg, 0.500 mmol)を加え、再度脱気及び窒素置換の操作を3回繰り返し行い、80℃で2.75時間撹拌した。反応液を室温まで冷却し、氷水と2 mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(65)を黄色泡状物(3.22 g, 80.9%)として得た。
1H-NMR(CDCl3)δ:1.25(s,9H), 2.31(s,3H), 2.38(s,3H), 3.70(s,3H), 5.22(s,1H), 6.72 (d,J = 16 Hz,1H), 6.91(d,J = 16 Hz,1H), 7.26-7.48(m,5H), 7.54(s,1H).
第2工程 化合物(66)の合成
化合物(65)(3.21 g, 8.08 mmol)をジクロロメタン(40.0 mL)とメタノール(20 .0 mL)の混合溶液に溶解し、ドライアイス浴で内温を-78℃に冷却した。オゾンガスを反応液の色が青くなるまで25分間バブリングした。次に、酸素ガスを反応液の青色が消失するまで10分間バブリングした。そして、ジメチルスルフィド(5.97 mL, 81.0 mmol)を加え、ドライアイスバスを除去し、室温まで昇温し、35分間撹拌した。反応液を氷水と2 mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(66)を淡黄色油状物(1.87 g, 71.5%)として得た。
1H-NMR(CDCl3)δ:1.25 (s,9H), 2.31(s,3H), 2.67(s,3H), 3.70(s,3H), 5.23(s,1H), 7.65(s,1H), 10.19(s,1H).
第3工程 化合物(67)の合成
化合物(66)(2.00 g, 6.19 mmol)をアセトン(30.0 mL)に溶解し、氷浴にて冷却し、過マンガン酸カリウム(1.47 g. 9.28 mmol)を水(15.0 mL)に溶解した水溶液を加えた。氷浴を除去し、室温で1時間40分撹拌した。反応液を亜硫酸ナトリウム水溶液に注ぎ、氷水と2 mol/L塩酸水溶液を加え、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製し、化合物(67)を白色固体(1.84 g, 87.6%)として得た。
1H-NMR(DMSO-d6)δ:1.18(s,9H), 2.22(s,3H), 2.40(s,3H), 3.63(s,3H), 5.41(s,1H), 7.63(s,1H).
第4工程 化合物(68)の合成
化合物(67)(339 mg, 1.00 mmol)をトルエン(4.00 mL)に溶解し、DPPA(0.430 g, 2.00 mmol)、トリエチルアミン(0.277 mL, 2.00 mmol)を順次加え、100℃で撹拌を開始した。1.5時間撹拌した後、シクロへキシルアミン(0.229 mL, 2.00 mmol)を加え、さらに100℃で1時間16分撹拌した。反応液を室温まで冷却し、氷水と2 mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(68)を淡黄色固体(389 mg, 89.3%)として得た。
MS(ESI) m/z:436.25 [M + H]+
第5工程 化合物(69)の合成
化合物(68)(386 mg, 0.886 mmol)をメタノール(10.0 mL)と酢酸(1.00 mL)の混合溶液に溶解し、水酸化パラジウム(249 mg)を加えた。加圧下、水素雰囲気下にて終夜で撹拌した。反応液をセライトろ過し、ろ液を氷水と飽和炭酸水素ナトリウム水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(69)を淡黄色固体(303 mg, 84.3%)として得た。
MS(ESI) m/z:406.25 [M + H]+
第6工程 化合物(70)の合成
化合物(69)(300 mg, 0.740 mmol)をDMF(6.00 mL)に溶解し、氷浴で冷却し、NBS(133 mg, 0.740 mmol)を加え、氷冷下にて1時間17分撹拌した。反応液を氷水と飽和炭酸水素ナトリウム水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(70)を茶色固体(214 mg, 59.7%)として得た。
MS(ESI) m/z:486.10 [M + H]+
第7工程 化合物(71)の合成
化合物(70)(214 mg, 0.442 mmol)をピリジン(4.00 mL)に溶解し、メタンスルホニルクロライド(0.052 mL, 0.663 mmol)を加え、室温で終夜撹拌した。反応液を氷水と2 mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(71)を淡黄色泡状物(110 mg, 44.3%)として得た。
MS(ESI) m/z:563.90 [M + H]+
第8工程 化合物(72)の合成
化合物(71)(110 mg, 0.196 mmol)と6-クロマンボロン酸(52.2 mg, 0.293 mmol)をDMF(1.10 mL)と水(0.110 mL)の混合溶液に溶解し、炭酸カリウム(108 mg, 0.782 mmol)を加え、脱気及び窒素置換の操作を3回繰り返し行った。Pd2(dtbpf)Cl2(25.2 mg, 0.0390 mmol)を加え、再度脱気及び窒素置換の操作を3回繰り返し行い、120℃で8時間撹拌した。反応液を室温まで冷却し、氷水と2 mol/L塩酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和塩化ナトリウム水溶液で順次洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製し、化合物(72)を茶色泡状物(20.0 mg, 16.6%)として得た。
MS(ESI) m/z:616.30 [M + H]+
第9工程 化合物I-313の合成
化合物(72)(20.0 mg, 0.032 mmol)をエタノール(0.648 mL)に溶解し、2 mol/L水酸化ナトリウム水溶液(0.162 mL, 0.325 mmol)を加え、100℃で2.5時間撹拌した。反応液を室温まで冷却し、氷水に注ぎ、水層を2 mol/L塩酸水溶液でpHを3前後に調整し、酢酸エチルで抽出した。有機層を飽和塩化ナトリウム水溶液で洗浄、無水硫酸ナトリウムで乾燥後、エバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製し、60℃で減圧乾燥することにより、化合物I-313を淡黄色粉末(5.00 mg, 25.6%)として得た。
MS(ESI) m/z:602.4 [M + H]+
第1工程 化合物(102)の合成
化合物(101)(220mg、0.409mmol)をアセトン(4mL)に溶解し、ベンゾイルイソチオシアネート(98%、82mg、0.490mmol)のアセトン(0.5mL)を滴下し、室温で0.5時間攪拌した。濃縮残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(102)(232mg、収率81%)を得た。
MS: m/z = 701 [M+H] +
第2工程 化合物(103)の合成
化合物(102)(50mg、0.071mmol)をDMF(1mL)に溶解し、水素化ナトリウム(60%、6.9mg、0.171mmol)を加え、100℃で3時間攪拌した。室温まで冷却後、水と酢酸エチルを加え、有機層を水、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥し、化合物(103)を含有する濃縮残渣をそのまま精製することなく、次の反応に用いた。(50mg、収率113%)
MS: m/z = 621 [M+H] +
第3工程 化合物II-2の合成
化合物(103)(50mg、0.071mmol)をTHF(0.6mL)およびメタノール(0.2mL)の混合溶媒に溶解し、5mol/Lの水酸化ナトリウム水溶液(0.14mL、0.70mmol)を加え、室温で2時間攪拌した。反応液の半量を2mol/Lの塩酸で中和後、水および酢酸エチルを加え、有機層を水、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥し、濃縮残渣を液体クロマトグラフィーで分取精製することにより化合物II-2(8.6mg)を得た。
MS: m/z = 607 [M+H] +
1H-NMR(CDCl3)δ:1.15 (s, 9H), 1.87 (d, J=2.1Hz, 3H), 2.11 (s, 3H), 2.28 (s, 3H), 2.30 (s, 3H), 2.32 (s, 3H), 5.17 (s, 1H), 6.8-7.8 (m, 11H)
第4工程 化合物II-1の合成
第3工程における残り半量の反応液を、90℃で9時間攪拌した。約半量を液体クロマトグラフィーで分取精製することにより化合物2(8.6mg)を得た。2mol/Lの塩酸で中和後、水および酢酸エチルを加え、有機層を水、飽和食塩水で洗浄後、硫酸マグネシウムで乾燥し、濃縮残渣を液体クロマトグラフィーで分取精製することにより化合物II-1(3.6mg)を得た。
MS: m/z = 503 [M+H] +
1H-NMR(CDCl3)δ:1.08 (s, 9H), 1.78 (d, J=3.6Hz, 3H), 2.28-2.31 (m, 9H), 5.04 (s, 1H), 6.8-7.4 (m, 6H)
第1工程 化合物(104)の合成
化合物(101)(200mg、0.371mmol)をDMA(2mL)に溶解し、(E)-3-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)アクリル酸エチル(126mg、0.557mmol)、[1,1’-ビス(ジ-tert-ブチルフォスフィノ)フェロセン]パラジウムジクロリド(48.4mg、0.074mmol)、および2mol/L炭酸カリウム水溶液(0.371mL、0.743mmol)を加え、封緘にて130℃で2時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(104)(143mg、収率69%)を得た。
MS: m/z = 580.4 [M+H] +.
第2工程 化合物(105)の合成
化合物(104)(140mg、0.251mmol)のテトラヒドロフラン-メタノール(1:1、3mL)溶液に10%パラジウム炭素(53.4mg、0.050mmol)を加え、水素雰囲気下、室温で1.5時間攪拌した。固体をろ過除去し、濾液を減圧留去して化合物(105)(134mg)を得た。
MS: m/z = 514.3 [M+H] +.
第3工程 化合物II-3の合成
化合物(105)(41.4mg、0.081mmol)をテトラヒドロフラン-メタノール(1:1、1mL)溶液に2mol/Lの水酸化ナトリウム水溶液(0.403mL、0.806mmol)を加え、50℃で2時間攪拌した。塩酸水溶液を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物II-3(40.3mg、収率100%)を得た。
MS: m/z = 500.4 [M+H] +.
第1工程 化合物(106)の合成
化合物(105)(400mg、0.779mmol)をDMF(4mL)に溶解し、0℃で水素化ナトリウム(46.7mg、1.17mmol)およびヨウ化メチル(0.243mL、3.89mmol)を加え、室温で2時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(106)(378mg、収率85%)を得た。
MS: m/z = 528.3 [M+H] +.
第2工程 化合物II-4の合成
化合物(106)(109mg、0.207mmol)をテトラヒドロフラン-メタノール(1:1、2mL)溶液に4mol/Lの水酸化ナトリウム水溶液(1.03mL、4.13mmol)を加え、50℃で2時間攪拌した。塩酸水溶液を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物II-4(41.2mg、収率39%)を得た。
1H-NMR (CDCl3) δ: 1.01-1.04 (m, 9H), 1.72-1.79 (m, 3H), 2.22-2.33 (m, 12H), 2.44-2.79 (m, 6H), 2.91-3.10 (m, 1H), 5.12-5.15 (m, 1H), 6.79-7.29 (m, 6H).
第1工程 化合物(107)の合成
化合物(105)(28.8mg、0.056mmol)をジオキサン(0.57mL)に溶解し、2,3-ジクロロ-5,6-ジシアノ-p-ベンゾキノン(19.09mg、0.084mmol)を加え、封緘にて120℃で13時間攪拌した。水を加え、酢酸エチルで抽出した。有機層を飽和炭酸水素ナトリウム水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(107)(12.8mg、収率45%)を得た。
MS: m/z = 512.5 [M+H] +.
第2工程 化合物II-5の合成
化合物(107)(32.0mg、0.063mmol)をテトラヒドロフラン-メタノール(1:1、1mL)溶液に2mol/Lの水酸化ナトリウム水溶液(0.313mL、0.626mmol)を加え、50℃で2時間攪拌した。塩酸水溶液を加え、酢酸エチルで抽出した。有機層を塩酸水溶液、飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥した溶媒を減圧留去して化合物II-5(31.1mg、収率100%)を得た。
1H-NMR (CDCl3) δ: 1.04 (s, 9H), 1.77-1.81 (m, 3H), 2.27-2.35 (m, 12H), 5.24-5.29 (m, 1H), 6.61-6.68 (m, 1H), 6.93-7.03 (m, 3H), 7.15-7.29 (m, 3H), 8.43-8.59 (m, 2H).
第1工程 化合物(108)の合成
化合物(101)(300mg、0.557mmol)を1,2-ジクロロエタン(3mL)に溶解し、ジイソプロピルエチルアミン(0.195mL、1.11mmol)およびトリホスゲン(83mL、0.279mmol)を加え、室温で2時間攪拌した。その後、メチルアミン-テトラヒドロフラン溶液(0.84mL、1.67mmol)を加え、さらに室温で1時間攪拌した。飽和重曹水を加え、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(108)(300mg、収率90%)を得た。
MS: m/z = 596 [M+H] +.
第2工程 化合物(109)の合成
化合物(108)(50mg、0.084mmol)をDMF(1mL)に溶解し、ジイソプロピルエチルアミン(0.022mL、0.126mmol)およびヨウ化銅(4.8mL、0.025mmol)を加え、窒素雰囲気下、封緘にて140℃で5時間攪拌した。1mol/L塩酸を加え、酢酸エチルで抽出した。有機層を飽和重曹水および飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(109)(30mg、収率69%)を得た。
MS: m/z = 515 [M+H] +.
第3工程 化合物II-6の合成
化合物(109)(30mg、0.058mmol)をメタノール(1mL)に溶解し、2mol/Lの水酸化ナトリウム水溶液(0.146mL、0.291mmol)を加え、70℃で4時間攪拌した。塩酸水溶液を加え、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄した後、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルクロマトグラフィー(酢酸エチル-メタノール)により精製して化合物II-6(21mg、収率72%)を得た。
MS: m/z = 501 [M+H] +.
1H NMR(CDCl3)δ:1.06 (s, 9H), 1.88 (s, 3H), 2.26 (s, 3H), 2.27 (s, 3H), 2.31 (s, 3H), 2.32 (s, 3H), 2.99 (s, 3H), 5.09 (s, 1H), 6.94-7.52 (m, 6H).
第1工程 化合物(111)の合成
化合物(110)の1,4-ジオキサン/水(100mL/10mL)溶液に炭酸セシウム(48.5g、149mmol),Pd(dppf)Cl2を加え、窒素置換後、化合物(110’)(15.7g、69.4mmol)を加え、85℃で14時間攪拌した。室温まで冷却後、酢酸エチル、水を加え、有機層を硫酸ナトリウムで乾燥後、濃縮残渣をシリカゲルカラムクロマトグラフィーで精製することにより化合物(111)(15.0g)を得た。
LC/MS (ESI): m/z=396 [M+H]+
第2工程 化合物(112)の合成
化合物(111)(15.0g、38mmol)をエタノール(500mL)に溶解し、10%パラジウム炭素(7g)を加え、40℃で4時間、水素雰囲気下攪拌し、さらに80℃で攪拌した。室温まで冷却後、パラジウム炭素をろ過、ジクロロメタン(200mL×3回)で洗浄して、ろ液を硫酸ナトリウムで乾燥後、濃縮乾固することにより化合物(112)(9.5g)を得た。精製することなく次の反応に用いた。
LC/MS (ESI): m/z=351 [M+H]+
第3工程 化合物(113)の合成
化合物(112)(9.5g、27mmol)をジクロロメタンに溶解し、-60℃で1M 水素化ジイソブチルアルミニウムのトルエン溶液(81mL、81mmol)を滴下し、2時間攪拌後、室温まで昇温させた。1M塩酸を加え、有機層を分液し、水層を酢酸エチル(300mL×3回)で抽出した。有機層を水、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥し、濃縮後、シリカゲルカラムクロマトグラフィーで精製することにより化合物(113)(4.8g)を得た。
LC/MS (ESI): m/z=323 [M+H]+
第4工程 化合物(114)の合成
化合物(113)(4.8g、14.9mmol)をDMSOに溶解し、2-ヨードキシ安息香酸(8.3g、29.7mmol)を加え、45℃で攪拌する。酢酸エチル、水を加え、有機層を水、飽和食塩水で洗浄後、硫酸ナトリウムで乾燥し、濃縮後、シリカゲルカラムクロマトグラフィーで精製することにより化合物(114)(3.5g)を得た。
LC/MS (ESI): m/z=321 [M+H]+
第5工程 化合物(115)の合成
化合物(114)(3.5g、10.9mmol)をジクロロメタン(200mL)に溶解し、ヨウ化亜鉛(3.5g、11.0mmol)を加え、氷冷下、TMSCN(3.3g、32.7mmol)を加え攪拌する。水(100mL)を加え、ジクロロメタン(100mL×2回)で抽出し、硫酸ナトリウムで乾燥し、濃縮乾固することにより化合物(115)(5.0g)を得た。精製することなく次の反応に用いた。
第6工程 化合物(116)の合成
化合物(115)(5g、10.9mmol)をメタノール(250mL)に溶解し、塩化水素ガスを吹き込み60℃で14時間攪拌した。室温まで冷却後、水を加え、酢酸エチル(100mL×3回)で抽出し、硫酸ナトリウムで乾燥し、濃縮乾固することにより化合物(116)(2.6g)を得た。精製することなく次の反応に用いた。
第7工程 化合物(117)の合成
化合物(116)(2.6g、6.8mmol)をtert-ブチル酢酸(100mL)に溶解し、窒素気流中、過塩素酸(70%、8.0g、80mmol)を少量づつ加え、室温で30分攪拌した。反応液を飽和食塩水に流入し、酢酸エチル(100mL×3回)で抽出し、硫酸ナトリウムで乾燥し、濃縮後、シリカゲルカラムクロマトグラフィーで精製することにより化合物(117)(2.4g)を得た。
1H-NMR (400 MHz, DMSO-d6) δ:10.01 (s, 1H), 6.88-6.73 (m, 4H), 4.95 (d, 1H, J=5.6 Hz), 4.18 (s, 2H), 3.62-3.58 (m, 3H), 3.07 (m, 1H),2.83-2.76 (m, 3H), 2.35-2.31 (m, 3H), 1.99-1.89 (m, 5H), 0.90 (s, 9H).
第8工程 化合物(118)の合成
化合物(117)(132mg、0.3mmol)をDMF(10mL)に溶解し、2-クロロメチルピリジン(100mg、0.45mmol)、炭酸セシウム(300mg、0.9mmol)を加え、40℃で14時間攪拌した。室温まで冷却し、水を加えてジエチルエーテル(20mL×2回)で抽出し、硫酸ナトリウムで乾燥し、濃縮乾固することにより化合物(118)を得た。精製することなく次の反応に用いた。
LC/MS (ESI): m/z=529 [M+H]+
第9工程 化合物II-8の合成
化合物(118)をメタノール(10mL)に溶解し、1M水酸化ナトリウム水溶液(10mL、10mM)を加え、50℃で14時間攪拌した。室温まで冷却して濃縮後、HPLC分取することにより化合物II-8(60mg)を得た。
LC/MS (ESI): m/z=515 [M+H]+
1H-NMR(DMSO-d6) δ:0.897 (s,9H), 1.85 (s,3H), 1.93-1.94 (m,2H), 2.51-2.75 (m,4H), 2.92-2.94 (m,1H), 3.16-3.20 (m,1H), 4.13-4.17 (m,1H), 4.91 (s,1H), 5.20-5.25 (m,2H), 6.76-6.96 (m,4H), 7.37-7.44 (m,2H), 7.89-7.93 (m,1H), 8.61 (d,1H)
第1工程 化合物(119)の合成
化合物(117)(600mg、1.3mmol)をTHF(10mL)に溶解し、1M BH3/THF溶液(6.8mL、6.8mmol)を加え、50℃で14時間攪拌した。室温まで冷却し、1N水酸化ナトリウム水溶液でpH7に調整して、濃縮後、HPLC分取することにより、化合物(119)(500mg)を得た。
LC-MS (ESI): m/z= 424[M+H]+.
第2工程 化合物(120)の合成
化合物(119)(60mg、0.14mmol)をピリジン(2mL)に溶解し、ブタン-1-スルホニルクロリド(0.44mg、0.28mmol)を加え、室温で5時間攪拌した。1N塩酸水溶液でpH3に調整し、酢酸エチル(10mL×3)で抽出後、硫酸ナトリウムで乾燥して濃縮乾固することにより化合物(120)(77mg)を得た。精製することなく次の反応に用いた。
LC-MS (ESI): m/z=544[M+H]+.
第3工程 化合物II-21の合成
化合物(120)(77mg、0.14mmol)をメタノール(2mL)に溶解し、1N水酸化ナトリウム水溶液(5mL、5mmol)を加え、45℃で14時間攪拌した。室温まで冷却後、1N塩酸水溶液でpH3に調整し、酢酸エチル(10mL×3)で抽出し、濃縮してHPLC分取することにより、化合物II-21(60mg)を得た。
LC-MS(ESI): m/z=528[M-H]-
1H-NMR(CDCl3) δ:0.85-0.93 (m,3H), 0.99 (s,9H), 1.39-1.45 (m,2H), 1.77-1.81 (m,2H), 1.90 (s, 1H), 2.01-2.08 (m,7H), 2.58 (s,1H), 2.75-2.81 (m, 2H), 3.02-3.11 (m,3H), 3.73-3.77 (m,2H), 4.22-4.24 (m,2H),5.23 (s,1H), 6.80-6.89 (m,2H), 7.12(s,1H), 7.52(s,1H)
第1工程 化合物(122)の合成
化合物(121)(43.0mg、0.102mmol)をDMF(1.5mL)に溶解した。氷冷下、NBS(18.1mg、0.102mmol)を加え、氷冷下で1.5時間撹拌した。水(30mL)を加え、酢酸エチル(50mL)で抽出した。有機層を水(30mL×2回)、飽和食塩水(30mL)で洗浄後、無水硫酸マグネシウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製することにより、化合物(122)(47.8mg、収率94%)を無色泡状物質として得た。
MS: m/z = 502.2, 504.2 [M+H] +
第2工程 化合物(123)の合成
化合物(122)(47.0mg、0.094mol)をtert-ブタノールと水の混合溶液(3:1、1mL)に溶解し、室温で酢酸(0.016mL、0.281mmol)および過マンガン酸カリウム(37.0mg、0.234mmol)を加え、30分間攪拌した。エタノール(9mL)および2mol/L水酸化ナトリウム水溶液(15mL)を加え、不要物をろ過により除去した。1mol/L塩酸(30mL)を加え、酢酸エチル(50mL)で抽出した。有機層を水(50mL)、飽和炭酸水素ナトリウム(50mL)、飽和食塩水(30mL)で洗浄後、無水硫酸マグネシウムで乾燥し、濃縮後シリカゲルカラムクロマトグラフィー(ヘキサン―酢酸エチル)で精製することにより、化合物(123)(13.8mg、収率29%)を無色泡状物質として得た。
MS: m/z = 516.2, 518.2 [M+H] +
第3工程 化合物(124)の合成
化合物(123)(14.0mg、0.027mmol)をDMA(0.28mL)に溶解し、3,4-ジメチルフェニルボロン酸(6.10mg、0.041mmol)、[1,1’-ビス(ジ-tert-ブチルフォスフィノ)フェロセン]パラジウムジクロリド(3.53mg、0.005mmol)、および2mol/L炭酸カリウム水溶液(0.027mL、0.054mmol)を加え、封緘にて110℃で1時間攪拌した。1mol/L塩酸(30mL)を加え、酢酸エチル(30mL)で抽出した。有機層を1mol/L塩酸(30mL)および飽和食塩水(30mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(124)(9.4mg、収率64%)を茶色泡状物質として得た。
MS: m/z = 542.3 [M+H] +
第4工程 化合物II-53の合成
化合物(124)(9.0mg、0.017mmol)をエタノール(0.8mL)に溶解した。室温で2mol/Lの水酸化ナトリウム水溶液(0.2mL、0.400mmol)を加え、加熱還流下で4時間攪拌した。1mol/L塩酸(30mL)を加え、酢酸エチル(30mL)で抽出した。有機層を飽和食塩水(30mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製して化合物II-53(7.5mg、収率86%)を無色泡状物質得た。
MS: m/z = 528.3 [M+H] +
第1工程 化合物(126)の合成
化合物(125)(12.5g、67.9mmol)をDMF(350mL)に溶解し、室温で炭酸セシウム(44.2g、136mmol)加えた。100度に加熱攪拌下、1,2-ジブロモエタン(5.87mL、68.1mmol)のDMF溶液(50mL)を50分間で滴下し、100度で6.5時間攪拌した。濃縮後、2mol/L塩酸(200mL)を加え、酢酸エチル(300mL)で抽出した。有機層を2mol/L塩酸(100mL)、飽和食塩水(100mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(126)(3.56g、収率25%)を白色固体として得た。
1H-NMR (CDCl3) δ: 3.87 (s, 3H), 4.28-4.32 (m, 2H), 4.35-4.39 (m, 2H), 5.38 (s, 1H), 7.20 (d, J=1.9 Hz, 1H), 7.23 (d, J=1.9 Hz, 1H)
第2工程 化合物(127)の合成
化合物(126)(3.34g、15.9mmol)をDMF(33.4mL)に溶解し、室温で炭酸カリウム(3.29g、23.8mmol)を加え、5分間攪拌した。室温でベンジルブロミド(2.27mL、19.1mmol)を加え、室温で2.5時間攪拌した。水(50mL)を加え、酢酸エチル(150mL)で抽出した。有機層を2mol/L塩酸(75mL×2回)、飽和食塩水(50mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後ヘキサンを加えて固化することにより化合物(127)(4.65g、収率97%)を白色固体として得た。
1H NMR-(CDCl3) δ: 3.86 (s, 3H), 4.26-4.30 (m, 2H), 4.34-4.38 (m, 2H), 5.16 (s, 2H), 7.27-7.42 (m, 5H), 7.44-7.49 (m, 2H)
第3工程 化合物(128)の合成
化合物(127)(4.64g、15.5mmol)をTHF(46mL)に溶解し、氷冷下水素化リチウムアルミニウム(1.17g、30.9mmol)を加え、氷冷下30分間攪拌した。0℃で飽和塩化アンモニウム水溶液(50mL)を加え、酢酸エチル(200mL)で抽出した。有機層を水(100mL)、飽和食塩水(50mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後、固化することにより化合物(128)(4.08g、収率97%)を白色固体として得た。
1H-NMR(CDCl3) δ: 4.24-4.28 (m, 2H), 4.29-4.34 (m, 2H), 4.52 (d, J=3.0 Hz, 2H), 5.13 (s, 2H), 6.55 (d, J=1.9 Hz, 1H), 6.58 (d, J=1.9 Hz, 1H), 7.29-7.40 (m, 3H), 7.42-7.48 (m, 2H)
第4工程 化合物(129)の合成
化合物(128)(3.75g、13.8mmol)を酢酸(37.5mL)に溶解し、10重量%水酸化パラジウム(1.47g、1.38mmol)を加え、水素雰囲気下にて、室温で16時間撹拌した。反応液をセライトろ過した後、ろ液をエバポレーターで溶媒を減圧留去した。得られた残渣をシリカゲルクロマトグラフィー(クロロホルム-メタノール)により精製し、化合物(129)(2.22g、収率97%)を白色固体として得た。
1H-NMR (CDCl3) δ: 2.21 (s, 3H), 4.25-4.28 (m, 4H), 5.21 (s, 1H), 6.27 (d, J=1.6 Hz, 1H), 6.36 (d, J=1.6 Hz, 1H)
第5工程 化合物(130)の合成
化合物(129)(2.10g、12.6mmol)をジクロロメタン(21mL)に溶解し、室温でピリジン(2.04mL、25.3mmol)を加えた。-78度に冷却し、トリフルオロメタンスルホン酸無水物(3.20mL、19.0mmol)を5分間で滴下し、-78度から-25度まで昇温しながら2.5時間攪拌した。-20℃で水(100mL)を加え、酢酸エチル(150mL)で抽出した。有機層を飽和食塩水(100mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(130)(3.99g、収率100%)を白色固体として得た。
1H-NMR (CDCl3) δ: 2.26 (s, 3H), 4.29-4.31 (m, 4H), 6.62 (s, 1H), 6.70 (s, 1H)
第6工程 化合物(131)の合成
化合物(130)(3.50g、11.7mmol)をDMF(70mL)およびメタノール(28mL)に溶解し、室温で酢酸パラジウム(263mg、1.17mmol)およびトリエチルアミン(6.13mL、58.7mmol)を加え、一酸化炭素雰囲気下(1気圧)70度で52時間攪拌した。反応液をセライトろ過した後、1mol/L塩酸(100mL)を加え、酢酸エチル(400mL)で抽出した。有機層を2mol/L塩酸(100mL)、飽和食塩水(100mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(131)(1.88g、収率77%)を黄色油状物質として得た。
1H-NMR (CDCl3) δ: 2.25 (s, 3H), 3.88 (s, 3H), 4.25-4.29 (m, 2H), 4.31-4.34 (m, 2H), 6.84 (d, J=2.0 Hz, 1H), 7.20 (d, J=2.0 Hz, 1H).
第7工程 化合物(132)の合成
水素化リチウムアルミニウム(314mg、8.26mmol)をTHF(17mL)に懸濁させ、氷冷下、化合物(131)(1.72g、8.26mmol)のTHF溶液(17mL)を滴下し、氷冷および窒素雰囲気下で30分間攪拌した。1mol/L塩酸(50mL)を加え、クロロホルム(50mL×3回)で抽出した。有機層を硫酸マグネシウムで乾燥し、濃縮後固化することで化合物(132)(1.49g、収率100%)を白色固体として得た。
1H-NMR (CDCl3) δ: 2.08 (t, J=6.4 Hz, 1H), 2.24 (s, 3H), 4.23-4.26 (m, 2H), 4.27-4.30 (m, 2H), 4.63 (d, J=6.4 Hz, 2H), 6.65 (d, J=1.9 Hz, 1H), 6.67 (d, J=1.9 Hz, 1H)
第8、9工程 化合物(134)の合成
化合物(132)(1.48g、8.24mmol)をDMF(30mL)に溶解した。氷冷下、NBS(3.08g、17.3mmol)を加え、室温に昇温しながら24時間撹拌した。水(50mL)を加え、酢酸エチル(300mL)で抽出した。有機層を1mol/L塩酸(50mL×2回)、飽和食塩水(50mL)で洗浄後、無水硫酸マグネシウムで乾燥した。濃縮後、得られた化合物(133)の粗生成物(2.87g)をDMA(30mL)に溶解し、3,4-ジメチルフェニルボロン酸(3.18g、21.2mmol)、[1,1’-ビス(ジ-tert-ブチルフォスフィノ)フェロセン]パラジウムジクロリド(553mg、0.849mmol)、および2mol/L炭酸カリウム水溶液(12.7mL、25.5mmol)を加え、封緘にて110℃で2時間攪拌した。水(150mL)を加え、酢酸エチル(150mL)で抽出した。不溶物をセライトを用いてろ去し、有機層を1mol/L塩酸(75mL×2回)および飽和食塩水(50mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(134)(2.61g、収率82%)を得た。
MS: m/z = 371.2 [M-OH] +
第10工程 化合物(135)の合成
化合物(134)(2.69g、6.92mmol)をジクロロメタン(54mL)に溶解し、氷冷下、DMP(4.54g、10.4mmol)を加えた後、室温で2時間攪拌した。水(100mL)を加え、酢酸エチル(300mL)で抽出した。有機層を飽和炭酸水素ナトリウム水溶液(100mL)、飽和食塩水(100mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(135)(1.81g、収率63%)を得た。
MS: m/z = 387.2 [M+H] +
第11、12工程 化合物(137)の合成
化合物(135)(1.75g、4.53mmol)をジクロロメタン(20mL)に溶解し、氷冷下、ヨウ化亜鉛(1.52g、4.53mmol)およびシアン化トリメチルシリル(1.90mL、13.6mmol)を加えた後、室温で2時間撹拌した。飽和炭酸水素ナトリウム水溶液(50mL)を加え、酢酸エチル(150mL)で抽出した。有機層を水(50mL)、飽和食塩水(50mL)で洗浄した後、無水硫酸ナトリウムで乾燥した。濃縮後、得られた化合物(136)の粗生成物(1.95g)をメタノール(10mL)に溶解し、室温で濃硫酸(2.14mL、40.1mmol)を加え、加熱還流下、3時間撹拌した。水(50mL)を加え、酢酸エチル(150mL)で抽出した。有機層を飽和炭酸水素ナトリウム水溶液(50mL)、飽和食塩水(50mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(137)(125mg、収率6%)を得た。
MS: m/z = 429.2 [M-OH] +
第13工程 化合物(138)の合成
化合物(137)(125mg、0.280mmol)を酢酸tert-ブチル(3.74mL)に溶解し、70%過塩素酸水溶液(0.0505mL、0.588mmol)を加え、室温で45分間撹拌した。飽和炭酸水素ナトリウム水溶液(30mL)を加え、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(30mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後シリカゲルクロマトグラフィー(ヘキサン-酢酸エチル)により精製して化合物(138)(41.7mg、収率28%)を得た。
MS: m/z = 525.2 [M+Na] +
第14工程 化合物II-52の合成
化合物(138)(40.3mg、0.080mmol)をTHF(1mL)およびメタノール(1mL)に溶解し、室温で2mol/Lの水酸化ナトリウム水溶液(0.802mL、1.60mmol)を加え、50度で3.5時間攪拌した。水(20mL)および1mol/L塩酸(10mL)を加え、酢酸エチル(50mL)で抽出した。有機層を飽和食塩水(30mL)で洗浄した後、無水硫酸マグネシウムで乾燥した。濃縮後逆相高速液体クロマトグラフィー(0.1%ギ酸アセトニトリル―水)により精製して化合物II-52(22.5mg、収率57%)を白色固体として得た。
MS: m/z = 511.2 [M+Na] +
なお、RT結果に*1~*7と記載しているものは、それぞれ以下のLC/MS測定条件またはMS測定条件に変更して測定を行った。
*1:カラム:ACQUITY UPLC BEH C18(1.7μm、i.d.2.1x50mm)(Waters)
流速:0.4mL/分
UV検出波長:200-400nm
移動相:[A]は0.1%水、[B]は0.1%ギ酸含有アセトニトリル溶液
グラジエント:8分間で10%-90%溶媒[B]のリニアグラジエントで行った。
*2:カラム:Shim-pack XR-ODS (2.2μm、i.d.50x3.0mm) (Shimadzu)
流速:1.6 mL/分
UV検出波長:254nm
移動相:[A]は0.1%ギ酸含有水溶液、[B]は0.1%ギ酸含有アセトニトリル溶液
グラジェント:3分間で10%-100%溶媒[B]のリニアグラジエントを行い、0.5分間、100%溶媒[B]を維持した。
*3:カラム:Waters X Bridge C18(3.5μm、i.d.50x4.6mm)(Waters)
流速:2.0 mL/分
UV検出波長:254nm
移動相:[A]は0.05%TFA含有水溶液、[B]は0.05%TFA含有アセトニトリル溶液
グラジェント:1.6分間で5%-100%溶媒[B]のリニアグラジエントを行い、1.4分間、100%溶媒[B]を維持した。
カラム温度:40℃
*4:FAB-MS測定のみ行った。
*5:カラム:Waters X Bridge C18(3.5μm、i.d.50x4.6mm)(Waters)
流速:2.0 mL/分
UV検出波長:254nm
移動相:[A]は0.01M NH4HCO3水溶液、[B]はアセトニトリル
グラジェント:1.6分間で5%-100%溶媒[B]のリニアグラジエントを行い、1.4分間、100%溶媒[B]を維持した。
カラム温度:40℃
*6:カラム:ACQUITY UPLC(R)BEH C18 (1.7μm i.d.2.1x50mm)(Waters)
流速:0.4 mL/分
UV検出波長:200-400nm
移動相:[A]は水[B]は0.1%ギ酸含有アセトニトリル溶液
8分間で10%-90%溶媒[B]のリニアグラジエントを行った。
*7:カラム:Waters X Bridge C18(3.5μm、i.d.50x4.6mm)(Waters)
流速:2.0 mL/分
UV検出波長:254nm
移動相:[A]は0.01M NH4HCO3水溶液、[B]はアセトニトリル
グラジェント:5分間で5%-100%溶媒[B]のリニアグラジエントを行い、1分間、100%溶媒[B]を維持した。
カラム温度:40℃
試験例1 HIV複製阻害試験
HIV(HTLV-IIIB株)持続感染ヒトT細胞株Molt-4 clone8を、10%牛胎児血清添加RPMI-1640培地で培養し、上清を濾過してウイルスの力価を測定し、-80℃で保存した。一方、各抗ヒト免疫不全ウイルス活性物質を上記の培養培地で所定の濃度になるように希釈し、96ウエルマイクロプレートに50μLずつ分注した。ついで、MT-4細胞浮遊液を100μL(2.5×104細胞)ずつ分注し、更に上記HIV含有上清を上記の培養培地で希釈したものを50μl(60pfu(plaque forming unit))ずつ加えた。
市販のプールドヒト肝ミクロソームを用いて、ヒト主要CYP5分子種(CYP1A2、2C9、2C19、2D6、3A4)の典型的基質代謝反応として7-エトキシレゾルフィンのO-脱エチル化(CYP1A2)、トルブタミドのメチル-水酸化(CYP2C9)、メフェニトインの4’-水酸化(CYP2C19)、デキストロメトルファンのO脱メチル化(CYP2D6)、テルフェナジンの水酸化(CYP3A4)を指標とし、それぞれの代謝物生成量が本発明化合物によって阻害される程度を評価した。
CYP3A4蛍光MBI試験は、代謝反応による本発明化合物のCYP3A4阻害の増強を調べる試験である。CYP3A4酵素(大腸菌発現酵素)により7-ベンジルオキシトリフルオロメチルクマリン(7-BFC)が脱ベンジル化されて、蛍光を発する代謝物7-ハイドロキシトリフルオロメチルクマリン(7-HFC)が生じる。7-HFC生成反応を指標としてCYP3A4阻害を評価した。
市販のプールドヒト肝ミクロソームと本発明化合物を一定時間反応させ、反応サンプルと未反応サンプルの比較により残存率を算出し、本発明化合物が肝で代謝される程度を評価した。
本発明化合物の溶解度は、1%DMSO添加条件下で決定した。DMSOにて10mmol/L化合物溶液を調製し、本発明化合物溶液6 μLをpH6.8人工腸液(0.2mol/L リン酸二水素カリウム試液 250mLに0.2mol/L NaOH試液118mL、水を加えて1000mLとした)594μLに添加した。25℃で16時間静置させた後、混液を吸引濾過した。濾液をメタノール/水=1/1(V/V)にて2倍希釈し、絶対検量線法によりHPLCまたはLC/MS/MSを用いて濾液中濃度を測定した。
本発明化合物の変異原性を評価した。
凍結保存しているネズミチフス菌(Salmonella typhimurium TA98株、TA100株)20μLを10mL液体栄養培地(2.5% Oxoid nutrient broth No.2)に接種し37℃にて10時間、振盪前培養する。TA98株は9mLの菌液を遠心(2000×g、10分間)して培養液を除去した。9mLのMicro F緩衝液(K2HPO4:3.5g/L、KH2PO4:1g/L、(NH4)2SO4:1g/L、クエン酸三ナトリウム二水和物:0.25g/L、MgSO4・7H20:0.1g/L)に菌を懸濁し、110mLのExposure培地(ビオチン:8μg/mL、ヒスチジン:0.2μg/mL、グルコース:8mg/mLを含むMicroF緩衝液)に添加した。TA100株は3.16mL菌液に対しExposure培地120mLに添加し試験菌液を調製した。本発明化合物DMSO溶液(最高用量50mg/mLから2~3倍公比で数段階希釈)、陰性対照としてDMSO、陽性対照として非代謝活性化条件ではTA98株に対しては50μg/mLの4-ニトロキノリン-1-オキシドDMSO溶液、TA100株に対しては0.25μg/mLの2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリルアミドDMSO溶液、代謝活性化条件ではTA98株に対して40μg/mLの2-アミノアントラセンDMSO溶液、TA100株に対しては20μg/mLの2-アミノアントラセンDMSO溶液それぞれ12μLと試験菌液588μL(代謝活性化条件では試験菌液498μLとS9 mix 90μLの混合液)を混和し、37℃にて90分間、振盪培養する。本発明化合物を暴露した菌液460μLを、Indicator培地(ビオチン:8μg/mL、ヒスチジン:0.2μg/mL、グルコース:8mg/mL、ブロモクレゾールパープル:37.5μg/mLを含むMicroF緩衝液)2300μLに混和し50μLずつマイクロプレート48ウェル/用量に分注し、37℃にて3日間、静置培養した。アミノ酸(ヒスチジン)合成酵素遺伝子の突然変異によって増殖能を獲得した菌を含むウェルは、pH変化により紫色から黄色に変色するため、1用量あたり48ウェル中の黄色に変色した菌増殖ウェルを計数し、陰性対照群と比較して評価する。変異原性が陰性のものを(-)、陽性のものを(+)として示した。
経口吸収性の検討実験材料と方法
(1)使用動物:マウスあるいはSDラットを使用する。
(2)飼育条件:マウスあるいはSDラットは、固形飼料および滅菌水道水を自由摂取させる。
(3)投与量、群分けの設定:経口投与、静脈内投与を所定の投与量により投与する。以下のように群を設定する。(化合物ごとで投与量は変更有)
経口投与 1~30mg/kg(n=2~3)
静脈内投与 0.5~10mg/kg(n=2~3)
(4)投与液の調製:経口投与は溶液または懸濁液として投与する。静脈内投与は可溶化して投与する。
(5)投与方法:経口投与は、経口ゾンデにより強制的に胃内に投与する。静脈内投与は、注射針を付けたシリンジにより尾静脈から投与する。
(6)評価項目:経時的に採血し、血漿中本発明化合物濃度をLC/MS/MSを用いて測定する。
(7)統計解析:血漿中本発明化合物濃度推移について、非線形最小二乗法プログラムWinNonlin(登録商標)を用いて血漿中濃度‐時間曲線下面積(AUC)を算出し、経口投与群と静脈内投与群のAUCから本発明化合物のバイオアベイラビリティ(BA)を算出する。
本発明化合物の心電図QT間隔延長リスク評価を目的として、human ether-a-go-go related gene (hERG)チャンネルを発現させたHEK293細胞を用いて、心室再分極過程に重要な役割を果たす遅延整流K+電流(IKr)への本発明化合物の作用を検討した。
全自動パッチクランプシステム(PatchXpress 7000A、AxonInstruments Inc.)を用い、ホールセルパッチクランプ法により、細胞を-80mVの膜電位に保持した後、+40mVの脱分極刺激を2秒間、さらに-50mVの再分極刺激を2秒間与えた際に誘発されるIKrを記録した。発生する電流が安定した後、本発明化合物を目的の濃度で溶解させた細胞外液(NaCl:135 mmol/L、KCl:5.4 mmol/L、NaH2PO4:0.3mmol/L、CaCl2・2H2O:1.8mmol/L、MgCl2・6H2O:1mmol/L、グルコース:10mmol/L、HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid、4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸):10mmol/L、pH=7.4)を室温条件下で、10分間細胞に適用させた。得られたIKrから、解析ソフト(DataXpress ver.1、Molecular Devices Corporation)を使用して、保持膜電位における電流値を基準に最大テール電流の絶対値を計測した。さらに、本発明化合物適用前の最大テール電流に対する阻害率を算出し、媒体適用群(0.1%ジメチルスルホキシド溶液)と比較して、本発明化合物のIKrへの影響を評価した。
適当な容器に本発明化合物を適量入れ、各容器にJP-1液(塩化ナトリウム2.0g、塩酸7.0mLに水を加えて1000mLとする)、JP-2液(pH6.8のリン酸塩緩衝液500mLに水500mLを加える)、20mmol/L タウロコール酸ナトリウム(TCA)/JP-2液(TCA1.08gにJP-2液を加え100mLとする)を200μLずつ添加する。試験液添加後に全量溶解した場合には、適宜、本発明化合物を追加する。密閉して37℃で1時間振とう後に濾過し、各濾液100μLにメタノール100μLを添加して2倍希釈を行う。希釈倍率は、必要に応じて変更する。気泡および析出物がないかを確認し、密閉して振とうする。絶対検量線法によりHPLCを用いて本発明化合物を定量する。
製剤例1 錠剤
本発明化合物 15mg
乳糖 15mg
ステアリン酸カルシウム 3mg
ステアリン酸カルシウム以外の成分を均一に混合し、破砕造粒して乾燥し、適当な大きさの顆粒剤とする。次にステアリン酸カルシウムを添加して圧縮成形して錠剤とする。
本発明化合物 10mg
ステアリン酸マグネシウム 10mg
乳糖 80mg
を均一に混合して粉末または細粒状として散剤をつくる。それをカプセル容器に充填してカプセル剤とする。
本発明化合物 30g
乳糖 265g
ステアリン酸マグネシウム 5g
よく混合し、圧縮成型した後、粉砕、整粒し、篩別して適当な大きさの顆粒剤とする。
Claims (36)
- 式(I):
(式中、
R1は、ハロゲン、シアノ、ニトロ、または-X-R11であり、
ここで、Xは、単結合、-O-、-S-、-NR12-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR12-CO-、-CO-NR12-、-NR12-CO-O-、-NR12-CO-NR13-、-NR12-SO2-または-SO2-NR12-であり、
R11は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R12およびR13は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルであり、
Xが-NR12-、-CO-NR12-または-SO2-NR12-の場合は、R11とR12が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良く、
R2は、それぞれ独立して、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルオキシ、置換若しくは非置換のアルケニルオキシ、置換若しくは非置換のアルキニルオキシ、置換若しくは非置換のアルキルスルファニル、置換若しくは非置換のアルケニルスルファニルまたは置換若しくは非置換のアルキニルスルファニルであり、
nは、1または2であり、
R3は、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R4は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R5は、水素原子、ヒドロキシ、ホルミル、カルボキシ、カルバモイル、カルバモイルオキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルオキシ、置換若しくは非置換のアルケニルオキシ、置換若しくは非置換のアルキニルオキシ、置換若しくは非置換のアルキルスルファニル、置換若しくは非置換のアルケニルスルファニル、置換若しくは非置換のアルキニルスルファニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換のモノアルキルカルバモイル、置換若しくは非置換のジアルキルカルバモイル、置換若しくは非置換のモノアルキルカルバモイルオキシ、置換若しくは非置換のジアルキルカルバモイルオキシ、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環オキシ、置換若しくは非置換の非芳香族炭素環オキシ、置換若しくは非置換の芳香族複素環オキシ、置換若しくは非置換の非芳香族複素環オキシ、置換若しくは非置換の芳香族炭素環スルファニル、置換若しくは非置換の非芳香族炭素環スルファニル、置換若しくは非置換の芳香族複素環スルファニル、置換若しくは非置換の非芳香族複素環スルファニル、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニル、置換若しくは非置換の非芳香族複素環オキシカルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイルまたは-NR51R52(R51、R52は、それぞれ独立して、水素原子、ホルミル、カルバモイル、カルボキシ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアルキルカルボニル、置換若しくは非置換のアルケニルカルボニル、置換若しくは非置換のアルキニルカルボニル、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキニルカルバモイル、置換若しくは非置換のアルキルオキシカルボニル、置換若しくは非置換のアルケニルオキシカルボニル、置換若しくは非置換のアルキニルオキシカルボニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルボニル、置換若しくは非置換の非芳香族炭素環カルボニル、置換若しくは非置換の芳香族複素環カルボニル、置換若しくは非置換の非芳香族複素環カルボニル、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイル、置換若しくは非置換の芳香族複素環カルバモイル、置換若しくは非置換の非芳香族複素環カルバモイル、置換若しくは非置換の芳香族炭素環オキシカルボニル、置換若しくは非置換の非芳香族炭素環オキシカルボニル、置換若しくは非置換の芳香族複素環オキシカルボニルまたは置換若しくは非置換の非芳香族複素環オキシカルボニル)であり、
Yは、単結合、アルキレン、アルケニレンまたはアルキニレンであり
但し、R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルの場合は、Yは単結合であり、
R6は、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の非芳香族炭素環式基または置換若しくは非置換のアルキルオキシであり、ならびに
R7は、ハロゲン、シアノ、ニトロ、または-Z-R71であり、
ここで、Zは、単結合、-O-、-S-、-NR72-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-であり、
R71は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
R72およびR73は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルであり、
Zが-NR72-、-CO-NR72-、または-SO2-NR72-の場合は、R71とR72が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良く、
ここで、R1とR7は、隣接する原子と一緒になって環Aを形成しても良く、
環Aは、芳香族炭素環、非芳香族炭素環、芳香族複素環または非芳香族複素環であり、1~7個のRAで置換されていてもよく、
RAは、それぞれ独立して、ハロゲン、シアノ、ニトロ、オキソまたは-XA-RA1であり、
ここで、XAは、単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、-O-CO-、-CO-O-、-NRA2-CO-、-CO-NRA2-、-NRA2-CO-O-、-CO-O-NRA2-、-O-CO-NRA2-、-NRA2-O-CO-、-CO-NRA2-O-、-O-NRA2-CO-、-NRA2-CO-NRA3-、-NRA2-SO2-または-SO2-NRA2-であり、
RA1は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基であり、
RA2およびRA3は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニルであり、
XAが-NRA2-、-CO-NRA2-、-CO-O-NRA2-、-O-CO-NRA2-、または-SO2-NRA2-の場合は、RA1とRA2が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。
但し、以下の化合物:
を除く。)
で示される化合物またはその製薬上許容される塩。 - R4が水素原子である、請求項1記載の化合物またはその製薬上許容される塩。
- nが1である、請求項1または2記載の化合物またはその製薬上許容される塩。
- R2が置換若しくは非置換のアルキルオキシである、請求項3記載の化合物またはその製薬上許容される塩。
- R1がハロゲン、シアノ、ニトロまたは-X-R11であり(Xは単結合、-O-、-S-、-NR12-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR12-CO-、-CO-NR12-、-NR12-CO-O-、-NR12-CO-NR13-、-NR12-SO2-または-SO2-NR12-;R11は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基;R12およびR13は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換のアルキニル。ここで、Xが-NR12-、-CO-NR12-、または-SO2-NR12-の場合は、R11とR12が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)、
R7がハロゲン、シアノ、ニトロまたは-Z-R71である(Zは単結合、-O-、-S-、-NR72-、-CO-、-SO2-、-O-CO-、-CO-O-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-;R71は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、または置換若しくは非置換の非芳香族複素環式基;R72およびR73は、それぞれ独立して、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、または置換若しくは非置換のアルキニル。ここで、Zが-NR72-、-CO-NR72-、または-SO2-NR72-の場合は、R71とR72が隣接する窒素原子と一緒になって置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基を形成しても良い。)、
請求項1記載の化合物またはその製薬上許容される塩。 - R4が水素原子である、請求項5記載の化合物またはその製薬上許容される塩。
- nが1である、請求項5または6記載の化合物またはその製薬上許容される塩。
- R2が置換若しくは非置換のアルキルオキシである、請求項7記載の化合物またはその製薬上許容される塩。
- R1が水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換の芳香族炭素環式基である、請求項5~8のいずれかに記載の化合物またはその製薬上許容される塩。
- R7が-Z-R71であり、Zが単結合、-O-、-NR72-、-SO2-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-である、請求項5~9のいずれかに記載の化合物またはその製薬上許容される塩。
- R71が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基または置換若しくは非置換の非芳香族炭素環式基である、請求項10記載の化合物またはその製薬上許容される塩。
- R71が置換若しくは非置換のアルケニル、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基である、請求項10記載の化合物またはその製薬上許容される塩。
- Zが単結合、-NR72-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NH-、-NR72-SO2-または-SO2-NR72-である、請求項10~12のいずれかに記載の化合物またはその製薬上許容される塩。
- Zが単結合、-NR72-、-NR72-CO-、-NR72-CO-O-、-NR72-CO-NH-または-NR72-SO2-である、請求項13記載の化合物またはその製薬上許容される塩。
- R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、およびR1が水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換の芳香族炭素環式基である、請求項5記載の化合物またはその製薬上許容される塩。
- R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、R1が水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニルまたは置換若しくは非置換の芳香族炭素環式基、R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイルまたは-NR51R52(R51は置換若しくは非置換の芳香族炭素環カルボニルまたは置換若しくは非置換の非芳香族炭素環カルボニル、R52は水素原子)、Yが単結合、R7が-Z-R71、Zが単結合、-O-、-NR72-、-SO2-、-NR72-CO-、-CO-NR72-、-NR72-CO-O-、-NR72-CO-NR73-、-NR72-SO2-または-SO2-NR72-、ならびにR3が置換若しくは非置換のフェニル、置換若しくは非置換のシクロアルケニル、置換若しくは非置換のベンゾフリル、置換若しくは非置換のベンゾジオキソリル、置換若しくは非置換のベンゾジオキサニル、置換若しくは非置換のジヒドロベンゾフリル、置換若しくは非置換のクロマニルまたは置換若しくは非置換のベンゾモルホリニルである、請求項5記載の化合物またはその製薬上許容される塩。
- R4が水素原子である、請求項17記載の化合物またはその製薬上許容される塩。
- nが1である、請求項17または18記載の化合物またはその製薬上許容される塩。
- R2が置換若しくは非置換のアルキルオキシである、請求項17~19のいずれかに記載の化合物またはその製薬上許容される塩。
- 環Aが5員環または6員環である、請求項17~20のいずれかに記載の化合物またはその製薬上許容される塩。
- 環Aが芳香族複素環または非芳香族複素環である、請求項17~21のいずれかに記載の化合物またはその製薬上許容される塩。
- mが0~4のいずれかの整数である、請求項17~22のいずれかに記載の化合物またはその製薬上許容される塩。
- RAがハロゲン、シアノ、オキソまたは-XA-RA1(XAは単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、NRA2-CO-、-CO-NRA2-、-NRA2-CO-NRA3-、-NRA2-SO2-または-SO2-NRA2-、RA1は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基、RA2およびRA3は、それぞれ独立して、水素原子または置換若しくは非置換のアルキル)である、請求項17~23のいずれかに記載の化合物またはその製薬上許容される塩。
- R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、環Aが5員環または6員環の芳香族複素環または非芳香族複素環、およびmが0~4のいずれかの整数である、請求項17記載の化合物またはその製薬上許容される塩。
- R4が水素原子、nが1、R2が置換若しくは非置換のアルキルオキシ、R6が置換若しくは非置換のアルキル、環Aが5員環または6員環の芳香族複素環または非芳香族複素環、mが0~4のいずれかの整数、R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルバモイル、置換若しくは非置換の非芳香族炭素環カルバモイルまたは-NR51R52(R51は置換若しくは非置換の芳香族炭素環カルボニルまたは置換若しくは非置換の非芳香族炭素環カルボニル、R52は水素原子)、Yが単結合、RAが、それぞれ独立して、ハロゲン、シアノ、オキソまたは-XA-RA1(XAは単結合、-O-、-S-、-NRA2-、-CO-、-SO2-、NRA2-CO-、-CO-NRA2-、-NRA2-CO-NRA3-、-NRA2-SO2-または-SO2-NRA2-、RA1は水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基、RA2およびRA3は、それぞれ独立して、水素原子または置換若しくは非置換のアルキル)、ならびにR3が置換若しくは非置換のフェニル、置換若しくは非置換のシクロアルケニル、置換若しくは非置換のベンゾフリル、置換若しくは非置換のベンゾジオキソリル、置換若しくは非置換のベンゾジオキサニル、置換若しくは非置換のジヒドロベンゾフリル、置換若しくは非置換のクロマニルまたは置換若しくは非置換のベンゾモルホリニルである、請求項17記載の化合物またはその製薬上許容される塩。
- R6が置換若しくは非置換のアルキルである、請求項1~26のいずれかに記載の化合物、またはその製薬上許容される塩。
- R5が水素原子、置換若しくは非置換のアルキル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環カルバモイルまたは-NR51H(R51は置換若しくは非置換の芳香族炭素環カルボニル)である、請求項1~27のいずれかに記載の化合物またはその製薬上許容される塩。
- R5が置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基または置換若しくは非置換の非芳香族複素環式基である、請求項28記載の化合物またはその製薬上許容される塩。
- R5が水素原子である、請求項28記載の化合物またはその製薬上許容される塩。
- R5が置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル、置換若しくは非置換のアルキルオキシ、置換若しくは非置換のアルケニルオキシ、置換若しくは非置換の芳香族炭素環式基カルボニル、置換若しくは非置換の非芳香族炭素環式基カルボニル、置換若しくは非置換の芳香族複素環式基カルボニル、置換若しくは非置換の非芳香族複素環式基カルボニルまたは置換若しくは非置換の非芳香族炭素環カルバモイルである、請求項1~27のいずれかに記載の化合物またはその製薬上許容される塩。
- Yが単結合である、請求項1~31のいずれかに記載の化合物またはその製薬上許容される塩。
- Yがアルキレンである、請求項1~31のいずれかに記載の化合物またはその製薬上許容される塩。
- R3が置換若しくは非置換のフェニル、置換若しくは非置換のシクロアルケニル、置換若しくは非置換のベンゾフリル、置換若しくは非置換のベンゾジオキソリル、置換若しくは非置換のベンゾジオキサニル、置換若しくは非置換のジヒドロベンゾフリル、置換若しくは非置換のクロマニルまたは置換若しくは非置換のベンゾモルホリニルである、請求項1~33のいずれかに記載の化合物またはその製薬上許容される塩。
- 請求項1~34のいずれかに記載の化合物またはその製薬上許容される塩を含有する医薬組成物。
- 抗HIV作用を有する、請求項35記載の医薬組成物。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US14/351,395 US9199959B2 (en) | 2011-10-25 | 2012-10-25 | HIV replication inhibitor |
| EP12844636.6A EP2772480B2 (en) | 2011-10-25 | 2012-10-25 | Hiv replication inhibitor |
| JP2013540820A JP6099149B2 (ja) | 2011-10-25 | 2012-10-25 | Hiv複製阻害剤 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011233817 | 2011-10-25 | ||
| JP2011-233817 | 2011-10-25 | ||
| JP2011-263353 | 2011-12-01 | ||
| JP2011263353 | 2011-12-01 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2013062028A1 true WO2013062028A1 (ja) | 2013-05-02 |
Family
ID=48167854
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2012/077544 WO2013062028A1 (ja) | 2011-10-25 | 2012-10-25 | Hiv複製阻害剤 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US9199959B2 (ja) |
| EP (1) | EP2772480B2 (ja) |
| JP (1) | JP6099149B2 (ja) |
| WO (1) | WO2013062028A1 (ja) |
Cited By (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014119636A1 (ja) | 2013-01-31 | 2014-08-07 | 塩野義製薬株式会社 | Hiv複製阻害剤 |
| WO2014207648A1 (en) * | 2013-06-24 | 2014-12-31 | Lupin Limited | Chromane and chromene derivatives and their use as crac modulators |
| EP2821082A1 (en) | 2013-07-05 | 2015-01-07 | Laboratoire Biodim | Method of producing an inactivated lentivirus, especially HIV, vaccine, kit and method of use |
| EP2821104A1 (en) | 2013-07-05 | 2015-01-07 | Laboratoire Biodim | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
| US8987250B2 (en) | 2012-04-20 | 2015-03-24 | Gilead Sciences, Inc. | Therapeutic compounds |
| US9006229B2 (en) | 2011-04-21 | 2015-04-14 | Gilead Sciences, Inc. | Benzothiazole compounds and their pharmaceutical use |
| US9102614B2 (en) | 2010-07-02 | 2015-08-11 | Gilead Sciences, Inc. | Naphth-2-ylacetic acid derivatives to treat AIDS |
| WO2015126743A1 (en) | 2014-02-18 | 2015-08-27 | Bristol-Myers Squibb Company | Pyrazolopyrimidine macrocycles as inhibitors of human immunodeficiency virus replication |
| WO2015126758A1 (en) | 2014-02-18 | 2015-08-27 | Bristol-Myers Squibb Company | Imidazopyrimidine macrocycles as inhibitors of human immunodeficiency virus replication |
| WO2015126751A1 (en) | 2014-02-18 | 2015-08-27 | Bristol-Myers Squibb Company | Imidazopyridine macrocycles as inhibitors of human immunodeficiency virus replication |
| WO2015147247A1 (ja) * | 2014-03-28 | 2015-10-01 | 塩野義製薬株式会社 | Hiv複製阻害作用を有する3環性誘導体 |
| US9273067B2 (en) | 2014-02-19 | 2016-03-01 | Bristol-Myers Squibb Company | Pyrazolopyrimidine macrocycles as inhibitors of human immunodeficiency virus replication |
| US9284323B2 (en) | 2012-01-04 | 2016-03-15 | Gilead Sciences, Inc. | Naphthalene acetic acid derivatives against HIV infection |
| US9296758B2 (en) | 2010-07-02 | 2016-03-29 | Gilead Sciences, Inc. | 2-quinolinyl-acetic acid derivatives as HIV antiviral compounds |
| US9376392B2 (en) | 2012-01-04 | 2016-06-28 | Gilead Sciences, Inc. | 2-(tert-butoxy)-2-(7-methylquinolin-6-yl) acetic acid derivatives for treating AIDS |
| US9725463B2 (en) | 2013-06-21 | 2017-08-08 | Lupin Limited | Substituted heterocyclic compounds as CRAC modulators |
| EP3144311A4 (en) * | 2014-05-16 | 2018-01-03 | Shionogi & Co., Ltd. | Tricyclic heterocyclic derivative having hiv replication-inhibiting effect |
| US10494380B2 (en) | 2015-05-29 | 2019-12-03 | Shionogi & Co., Ltd. | Nitrogen-containing tricyclic derivatives having HIV replication inhibitory activity |
| CN112546969A (zh) * | 2020-12-07 | 2021-03-26 | 安徽贝克联合制药有限公司 | 催化加氢连续生产装置和利托那韦中间体的制备方法 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2511273B8 (en) | 2011-04-15 | 2019-06-26 | Hivih | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
| CN104402875A (zh) * | 2014-12-25 | 2015-03-11 | 西安山川医药科技有限公司 | N-(2-氨基乙基)-n′-(6-取代-2-苯并噻唑基)脲及其盐类化合物的合成方法和用途 |
| US20210371388A1 (en) * | 2020-05-12 | 2021-12-02 | Baruch S. Blumberg Institute | Bicyclic Carboxamide with Exocyclic Urea Derivatives as Antivirals for the Treatment of HBV Infection |
Citations (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007020936A1 (ja) * | 2005-08-17 | 2007-02-22 | Daiichi Sankyo Company, Limited | 抗真菌作用二環性複素環化合物 |
| WO2007109211A2 (en) * | 2006-03-17 | 2007-09-27 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | 1-oxo-isoindoline compounds for the treatment of spinal muscular atrophy and other uses |
| WO2007131350A1 (en) | 2006-05-16 | 2007-11-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2008071587A2 (en) | 2006-12-13 | 2008-06-19 | F. Hoffmann-La Roche Ag | 2-(piperidin-4-yl)-4-phenoxy- or phenylamino-pyrimidine derivatives as non-nucleoside reverse transcriptase inhibitors |
| WO2009052319A1 (en) * | 2007-10-16 | 2009-04-23 | Northeastern University | Monoacylglycerol lipase inhibitors for modulation of cannabinoid activity |
| WO2009062289A1 (en) | 2007-11-15 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2009062308A1 (en) | 2007-11-16 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2009062285A1 (en) | 2007-11-16 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2009062288A1 (en) | 2007-11-15 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2010055911A1 (ja) | 2008-11-14 | 2010-05-20 | 大日本住友製薬株式会社 | ビフェニルアセトアミド誘導体 |
| WO2010098251A1 (ja) * | 2009-02-26 | 2010-09-02 | 国立大学法人 熊本大学 | ロキソプロフェン誘導体及びそれを含有する医薬 |
| WO2010130034A1 (en) | 2009-05-15 | 2010-11-18 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2010130842A1 (en) | 2009-05-15 | 2010-11-18 | Katholieke Universiteit Leuven | Thieno [2, 3-b] pyridine derivatives as viral replication inhibitors |
| WO2011015641A1 (en) | 2009-08-05 | 2011-02-10 | Katholieke Universiteit Leuven | Novel viral replication inhibitors |
| WO2011076765A1 (en) | 2009-12-23 | 2011-06-30 | Katholieke Universiteit Leuven | Novel antiviral compounds |
| JP2011146118A (ja) | 2011-02-07 | 2011-07-28 | Hitachi Ltd | データ記録方法および記録媒体、再生装置 |
| JP2011176630A (ja) | 2010-02-24 | 2011-09-08 | Nippon Dempa Kogyo Co Ltd | 無線センサーネットワーク端末 |
| WO2012003497A1 (en) | 2010-07-02 | 2012-01-05 | Gilead Sciences, Inc. | Napht- 2 -ylacetic acid derivatives to treat aids |
| WO2012003498A1 (en) | 2010-07-02 | 2012-01-05 | Gilead Sciences, Inc. | 2 -quinolinyl- acetic acid derivatives as hiv antiviral compounds |
| WO2012033735A1 (en) | 2010-09-08 | 2012-03-15 | Bristol-Myers Squibb Company | Inhibitors of human immunodeficiency virus replication |
| WO2012066442A1 (en) | 2010-11-15 | 2012-05-24 | Pfizer Limited | Inhibitors of hiv replication |
| JP2012095869A (ja) | 2010-11-02 | 2012-05-24 | Kao Corp | 口腔内清掃具 |
| WO2012102985A1 (en) | 2011-01-24 | 2012-08-02 | Glaxosmithkline Llc | Isoquinoline compounds and methods for treating hiv |
| WO2012137181A1 (en) | 2011-04-07 | 2012-10-11 | Laboratoire Biodim | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
| WO2012140243A1 (en) | 2011-04-15 | 2012-10-18 | Laboratoire Biodim | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1442707A (en) * | 1973-07-07 | 1976-07-14 | Yoshitomi Pharmaceutical | Substituted phenylalkanoic acids and their derivatives and pharma ceutical compositions thereof |
| US4440785A (en) | 1980-10-30 | 1984-04-03 | A. H. Robins Company, Inc. | Methods of using 2-aminobiphenylacetic acids, esters, and metal salts thereof to treat inflammation |
| US5244922A (en) * | 1990-09-04 | 1993-09-14 | Burzynski Stanislaw R | Methods for treating viral infections |
| US6849605B1 (en) * | 1999-03-05 | 2005-02-01 | The Trustees Of University Technology Corporation | Inhibitors of serine protease activity, methods and compositions for treatment of viral infections |
| JP2007008816A (ja) * | 2003-10-15 | 2007-01-18 | Ube Ind Ltd | 新規イソキノリン誘導体 |
| JP5147401B2 (ja) * | 2005-09-06 | 2013-02-20 | 塩野義製薬株式会社 | Pgd2受容体アンタゴニスト活性を有するインドールカルボン酸誘導体 |
| US20080292608A1 (en) * | 2005-11-07 | 2008-11-27 | Irm Llc | Compounds and Compositions as Ppar Modulators |
| EP1945620A2 (en) * | 2005-11-07 | 2008-07-23 | Irm Llc | Compounds and compositions as ppar modulators |
| EA200802417A1 (ru) * | 2006-06-09 | 2009-06-30 | Икос Корпорейшн | Замещенные фенилуксусные кислоты как dp-2-антагонисты |
| EP2227233B1 (en) * | 2007-11-30 | 2013-02-13 | Newlink Genetics | Ido inhibitors |
| JP2010055911A (ja) * | 2008-08-28 | 2010-03-11 | Ushio Inc | メタルハライドランプ装置 |
| CN101486650A (zh) * | 2009-02-20 | 2009-07-22 | 中国医学科学院药用植物研究所 | 具有抑制hiv活性的2-羟基苯乙酸类衍生物及其制备方法和用途 |
| RS53167B (en) * | 2009-03-31 | 2014-06-30 | Boehringer Ingelheim International Gmbh | 1-HETEROCYCLYL-1,5-DIHYDRO-PYRAZOLO [3,4-D] PYRIMIDIN-4-ONE DERIVATIVES AND THEIR APPLICATIONS AS A PDE9A MODULATOR |
| WO2013103724A1 (en) | 2012-01-04 | 2013-07-11 | Gilead Sciences, Inc. | 2- (tert - butoxy) -2- (7 -methylquinolin- 6 - yl) acetic acid derivatives for treating aids |
| US8925766B2 (en) | 2012-01-05 | 2015-01-06 | Gojo Industries, Inc. | Peroxide powered product dispensing system |
| UY34750A (es) | 2012-04-20 | 2013-11-29 | Gilead Sciences Inc | ?compuestos para el tratamiento del hiv, composiciones,métodos de preparación, intermediarios y métodos terapéuticos?. |
| EP2821104A1 (en) † | 2013-07-05 | 2015-01-07 | Laboratoire Biodim | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
-
2012
- 2012-10-25 EP EP12844636.6A patent/EP2772480B2/en active Active
- 2012-10-25 WO PCT/JP2012/077544 patent/WO2013062028A1/ja active Application Filing
- 2012-10-25 US US14/351,395 patent/US9199959B2/en not_active Expired - Fee Related
- 2012-10-25 JP JP2013540820A patent/JP6099149B2/ja not_active Expired - Fee Related
Patent Citations (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007020936A1 (ja) * | 2005-08-17 | 2007-02-22 | Daiichi Sankyo Company, Limited | 抗真菌作用二環性複素環化合物 |
| CN101500995A (zh) * | 2006-03-17 | 2009-08-05 | 美国政府卫生与公共服务部 | 用于治疗脊髓型肌萎缩和其它用途的1-氧代-异吲哚啉化合物 |
| WO2007109211A2 (en) * | 2006-03-17 | 2007-09-27 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | 1-oxo-isoindoline compounds for the treatment of spinal muscular atrophy and other uses |
| US20090312323A1 (en) * | 2006-03-17 | 2009-12-17 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Hhs | Compounds for the treatment of spinal muscular atrophy and other uses |
| JP2009530306A (ja) * | 2006-03-17 | 2009-08-27 | アメリカ合衆国 | 脊髄性筋萎縮症の治療およびその他用途のための化合物 |
| WO2007131350A1 (en) | 2006-05-16 | 2007-11-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2008071587A2 (en) | 2006-12-13 | 2008-06-19 | F. Hoffmann-La Roche Ag | 2-(piperidin-4-yl)-4-phenoxy- or phenylamino-pyrimidine derivatives as non-nucleoside reverse transcriptase inhibitors |
| WO2009052319A1 (en) * | 2007-10-16 | 2009-04-23 | Northeastern University | Monoacylglycerol lipase inhibitors for modulation of cannabinoid activity |
| WO2009062288A1 (en) | 2007-11-15 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2009062289A1 (en) | 2007-11-15 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2009062285A1 (en) | 2007-11-16 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2009062308A1 (en) | 2007-11-16 | 2009-05-22 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| KR20110086152A (ko) * | 2008-11-14 | 2011-07-27 | 다이닛본 스미토모 세이야꾸 가부시끼가이샤 | 바이페닐아세트아미드 유도체 |
| WO2010055911A1 (ja) | 2008-11-14 | 2010-05-20 | 大日本住友製薬株式会社 | ビフェニルアセトアミド誘導体 |
| CN102282124A (zh) * | 2008-11-14 | 2011-12-14 | 大日本住友制药株式会社 | 联苯乙酰胺衍生物 |
| EP2374790A1 (en) * | 2008-11-14 | 2011-10-12 | Dainippon Sumitomo Pharma Co., Ltd. | Biphenylacetamide derivative |
| KR20110137321A (ko) * | 2009-02-26 | 2011-12-22 | 고꾸리쯔다이가꾸호오진 구마모또 다이가꾸 | 록소프로펜 유도체 및 그것을 함유하는 의약 |
| EP2402305A1 (en) * | 2009-02-26 | 2012-01-04 | National University Corporation Kumamoto University | Loxoprofen derivative and pharmaceutical containing same |
| CN102333754A (zh) * | 2009-02-26 | 2012-01-25 | 国立大学法人熊本大学 | 洛索洛芬衍生物和含有其的药品 |
| JP2010195727A (ja) * | 2009-02-26 | 2010-09-09 | Kumamoto Univ | ロキソプロフェン誘導体及びそれを含有する医薬 |
| WO2010098251A1 (ja) * | 2009-02-26 | 2010-09-02 | 国立大学法人 熊本大学 | ロキソプロフェン誘導体及びそれを含有する医薬 |
| WO2010130842A1 (en) | 2009-05-15 | 2010-11-18 | Katholieke Universiteit Leuven | Thieno [2, 3-b] pyridine derivatives as viral replication inhibitors |
| WO2010130034A1 (en) | 2009-05-15 | 2010-11-18 | Boehringer Ingelheim International Gmbh | Inhibitors of human immunodeficiency virus replication |
| WO2011015641A1 (en) | 2009-08-05 | 2011-02-10 | Katholieke Universiteit Leuven | Novel viral replication inhibitors |
| WO2011076765A1 (en) | 2009-12-23 | 2011-06-30 | Katholieke Universiteit Leuven | Novel antiviral compounds |
| JP2011176630A (ja) | 2010-02-24 | 2011-09-08 | Nippon Dempa Kogyo Co Ltd | 無線センサーネットワーク端末 |
| WO2012003497A1 (en) | 2010-07-02 | 2012-01-05 | Gilead Sciences, Inc. | Napht- 2 -ylacetic acid derivatives to treat aids |
| WO2012003498A1 (en) | 2010-07-02 | 2012-01-05 | Gilead Sciences, Inc. | 2 -quinolinyl- acetic acid derivatives as hiv antiviral compounds |
| WO2012033735A1 (en) | 2010-09-08 | 2012-03-15 | Bristol-Myers Squibb Company | Inhibitors of human immunodeficiency virus replication |
| JP2012095869A (ja) | 2010-11-02 | 2012-05-24 | Kao Corp | 口腔内清掃具 |
| WO2012066442A1 (en) | 2010-11-15 | 2012-05-24 | Pfizer Limited | Inhibitors of hiv replication |
| WO2012102985A1 (en) | 2011-01-24 | 2012-08-02 | Glaxosmithkline Llc | Isoquinoline compounds and methods for treating hiv |
| JP2011146118A (ja) | 2011-02-07 | 2011-07-28 | Hitachi Ltd | データ記録方法および記録媒体、再生装置 |
| WO2012137181A1 (en) | 2011-04-07 | 2012-10-11 | Laboratoire Biodim | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
| WO2012140243A1 (en) | 2011-04-15 | 2012-10-18 | Laboratoire Biodim | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
Non-Patent Citations (9)
| Title |
|---|
| "Design of Prodrugs", 1985, ELSEVIER |
| "Isotopes in the Physical and Biomedical Sciences", vol. 1, 1987 |
| ACTA CRYSTALLOGRAPHICA, SECTION C, vol. C46, no. 12, 1990, pages 2486 - 2487 |
| AUSTRALIAN JOURNAL OF CHEMISTRY, vol. 64, no. 6, 2011, pages 757 - 765 |
| GIT FACHZEITSCHRIFT FUER DAS LABORATORIUM, vol. 27, no. 12, 1983, pages 1078 - 1080 |
| JOURNAL OF NATURAL PRODUCTS, vol. 67, no. 7, 2004, pages 1172 - 1174 |
| JOURNAL OF ORGANIC CHEMISTRY, vol. 52, no. 2, 1987, pages 296 - 298 |
| See also references of EP2772480A4 |
| SYNLETT, 1990, pages 697 - 699 |
Cited By (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9102614B2 (en) | 2010-07-02 | 2015-08-11 | Gilead Sciences, Inc. | Naphth-2-ylacetic acid derivatives to treat AIDS |
| US9296758B2 (en) | 2010-07-02 | 2016-03-29 | Gilead Sciences, Inc. | 2-quinolinyl-acetic acid derivatives as HIV antiviral compounds |
| US9006229B2 (en) | 2011-04-21 | 2015-04-14 | Gilead Sciences, Inc. | Benzothiazole compounds and their pharmaceutical use |
| US9284323B2 (en) | 2012-01-04 | 2016-03-15 | Gilead Sciences, Inc. | Naphthalene acetic acid derivatives against HIV infection |
| US9376392B2 (en) | 2012-01-04 | 2016-06-28 | Gilead Sciences, Inc. | 2-(tert-butoxy)-2-(7-methylquinolin-6-yl) acetic acid derivatives for treating AIDS |
| US8987250B2 (en) | 2012-04-20 | 2015-03-24 | Gilead Sciences, Inc. | Therapeutic compounds |
| US9096586B2 (en) | 2012-04-20 | 2015-08-04 | Gilead Sciences, Inc. | Therapeutic compounds |
| WO2014119636A1 (ja) | 2013-01-31 | 2014-08-07 | 塩野義製薬株式会社 | Hiv複製阻害剤 |
| US9725463B2 (en) | 2013-06-21 | 2017-08-08 | Lupin Limited | Substituted heterocyclic compounds as CRAC modulators |
| US9790231B2 (en) | 2013-06-24 | 2017-10-17 | Lupin Limited | Chromane and chromene derivatives and their use as CRAC modulators |
| WO2014207648A1 (en) * | 2013-06-24 | 2014-12-31 | Lupin Limited | Chromane and chromene derivatives and their use as crac modulators |
| CN105492075A (zh) * | 2013-07-05 | 2016-04-13 | 拜欧蒂姆实验室公司 | 病毒复制抑制剂、它们的制备方法和它们的治疗用途 |
| EP2821082A1 (en) | 2013-07-05 | 2015-01-07 | Laboratoire Biodim | Method of producing an inactivated lentivirus, especially HIV, vaccine, kit and method of use |
| EP2821104A1 (en) | 2013-07-05 | 2015-01-07 | Laboratoire Biodim | Inhibitors of viral replication, their process of preparation and their therapeutical uses |
| WO2015126758A1 (en) | 2014-02-18 | 2015-08-27 | Bristol-Myers Squibb Company | Imidazopyrimidine macrocycles as inhibitors of human immunodeficiency virus replication |
| WO2015126743A1 (en) | 2014-02-18 | 2015-08-27 | Bristol-Myers Squibb Company | Pyrazolopyrimidine macrocycles as inhibitors of human immunodeficiency virus replication |
| WO2015126751A1 (en) | 2014-02-18 | 2015-08-27 | Bristol-Myers Squibb Company | Imidazopyridine macrocycles as inhibitors of human immunodeficiency virus replication |
| US9273067B2 (en) | 2014-02-19 | 2016-03-01 | Bristol-Myers Squibb Company | Pyrazolopyrimidine macrocycles as inhibitors of human immunodeficiency virus replication |
| WO2015147247A1 (ja) * | 2014-03-28 | 2015-10-01 | 塩野義製薬株式会社 | Hiv複製阻害作用を有する3環性誘導体 |
| EP3144311A4 (en) * | 2014-05-16 | 2018-01-03 | Shionogi & Co., Ltd. | Tricyclic heterocyclic derivative having hiv replication-inhibiting effect |
| US9975906B2 (en) | 2014-05-16 | 2018-05-22 | Shionogi & Co., Ltd. | Tricyclic heterocycle derivatives having HIV replication inhibitory effect |
| US10494380B2 (en) | 2015-05-29 | 2019-12-03 | Shionogi & Co., Ltd. | Nitrogen-containing tricyclic derivatives having HIV replication inhibitory activity |
| US10870661B2 (en) | 2015-05-29 | 2020-12-22 | Shionogi & Co., Ltd. | Nitrogen-containing tricyclic derivatives having HIV replication inhibitory activity |
| CN112546969A (zh) * | 2020-12-07 | 2021-03-26 | 安徽贝克联合制药有限公司 | 催化加氢连续生产装置和利托那韦中间体的制备方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2772480B2 (en) | 2020-12-09 |
| EP2772480A4 (en) | 2015-04-22 |
| JP6099149B2 (ja) | 2017-03-22 |
| EP2772480A1 (en) | 2014-09-03 |
| US20140249306A1 (en) | 2014-09-04 |
| EP2772480B1 (en) | 2018-05-23 |
| US9199959B2 (en) | 2015-12-01 |
| JPWO2013062028A1 (ja) | 2015-04-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6099149B2 (ja) | Hiv複製阻害剤 | |
| JP6643773B2 (ja) | 新規アルキレン誘導体 | |
| JP6281952B2 (ja) | Hiv複製阻害剤 | |
| JP6614585B2 (ja) | Hiv複製阻害作用を有する含窒素3環性誘導体 | |
| WO2013002357A1 (ja) | Hiv複製阻害剤 | |
| WO2013157622A1 (ja) | Hiv複製阻害剤 | |
| JP6725177B2 (ja) | 9員縮合環誘導体 | |
| JP6579549B2 (ja) | Hiv複製阻害作用を有する3環性複素環誘導体 | |
| WO2013146754A1 (ja) | Trpv4阻害活性を有する芳香族複素5員環誘導体 | |
| WO2013061977A1 (ja) | Pgd2受容体アンタゴニスト活性を有するへテロ環誘導体 | |
| JP7311944B2 (ja) | 二環性含窒素複素環誘導体を含有する医薬組成物 | |
| WO2015147247A1 (ja) | Hiv複製阻害作用を有する3環性誘導体 | |
| WO2016039403A1 (ja) | 持続性hivプロテアーゼ阻害剤 | |
| JP6689013B2 (ja) | 含窒素3環性誘導体を含有する医薬組成物 | |
| WO2016098793A1 (ja) | 環状グアニジル基を有するチアゾール誘導体 | |
| JP2014080395A (ja) | アミノラクタム誘導体およびそれらを含有する医薬組成物 | |
| JP6692113B2 (ja) | 6員複素環誘導体を含有する医薬組成物 | |
| WO2013161928A1 (ja) | オキサゾロトリアゾール誘導体およびそれらを含有する医薬組成物 | |
| JP2014080394A (ja) | イミダゾイミダゾロン誘導体およびそれらを含有する医薬組成物 | |
| WO2013001830A1 (ja) | 核酸抗生物質誘導体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12844636 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2013540820 Country of ref document: JP Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 14351395 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2012844636 Country of ref document: EP |